
TORREY OLE 臨時更新和 PROSERA 第 3 階段設計 2023 年 7 月

前瞻性陳述本演示文稿包含前瞻性陳述。除本演示文稿中包含的歷史事實陳述外,所有陳述均為前瞻性陳述,包括有關我們未來的經營業績和財務狀況、業務戰略、潛在產品、產品批准、研發成本、成功的時機和可能性、未來運營的管理計劃和目標以及當前和預期產品的未來業績。在某些情況下,你可以用 “可能”、“將”、“應該”、“期望”、“計劃”、“預期”、“可以”、“打算”、“目標”、“項目”、“考慮”、“相信”、“估計”、“預測”、“潛在” 或 “繼續” 等術語或其他類似表達方式的否定詞來識別前瞻性陳述。這些陳述涉及已知和未知的風險、不確定性和其他重要因素,這些因素可能導致我們的實際業績、業績或成就與前瞻性陳述所表達或暗示的任何未來業績、業績或成就存在重大差異。這些風險、不確定性和其他因素包括但不限於:臨牀試驗的中期結果不一定代表最終結果,隨着患者入組的繼續、對數據進行更全面的審查以及越來越多的患者數據的出現,一項或多項臨牀結果可能會發生重大變化;臨牀試驗的開始、註冊、數據讀取和完成可能出現延遲;全球監管機構或美國食品藥品管理局的後期進展可能與先前的反饋有所不同這可能會改變我們計劃中的PROSERA 3期臨牀試驗設計及其啟動時間;我們計劃中的PROSERA 3期試驗可能不支持seralutinib的註冊;我們在產品製造、研究、臨牀前和臨牀測試方面對第三方的依賴;臨牀試驗和臨牀前研究的結果不一定能預測未來的結果;我們對舍拉替尼的臨牀試驗的成功尚不確定;美國的監管進展國家和外國;意想不到的不利方面seralutinib 的影響或療效不足,可能會限制其開發、監管部門批准和/或商業化,或者可能導致臨牀擱置、召回或產品責任索賠;我們獲得和維持色拉替尼知識產權保護的能力;我們履行與第三方合作協議或第三方許可知識產權的協議所規定的義務的能力;我們可能比預期的更快地使用我們的資本資源;以及我們之前描述的其他風險新聞稿以及我們向美國證券交易委員會(SEC)提交的文件,包括我們在10-K表年度報告中的 “風險因素” 標題下以及隨後向美國證券交易委員會提交的任何文件。由於前瞻性陳述本質上存在風險和不確定性,其中一些風險和不確定性無法預測或量化,有些是我們無法控制的,因此您不應依賴這些前瞻性陳述作為對未來事件的預測。我們的前瞻性陳述中反映的事件和情況可能無法實現或發生,實際結果可能與前瞻性陳述中的預測存在重大差異。除非適用法律要求,否則我們不打算公開更新或修改此處包含的任何前瞻性陳述,無論是由於任何新信息、未來事件、情況變化還是其他原因。所有前瞻性陳述均受本警告聲明的全部限制,該聲明是根據1995年《私人證券訴訟改革法》的安全港條款作出的。本演示文稿還包含獨立各方和我們提供的與市場規模和增長有關的估計值和其他統計數據,以及有關我們行業的其他數據。這些數據涉及許多假設和侷限性,提醒您不要過分重視此類估計。此外,對我們未來表現以及我們經營所在市場的未來表現的預測、假設和估計必然會受到高度的不確定性和風險的影響。2

I. TORREY 24 週數據 3
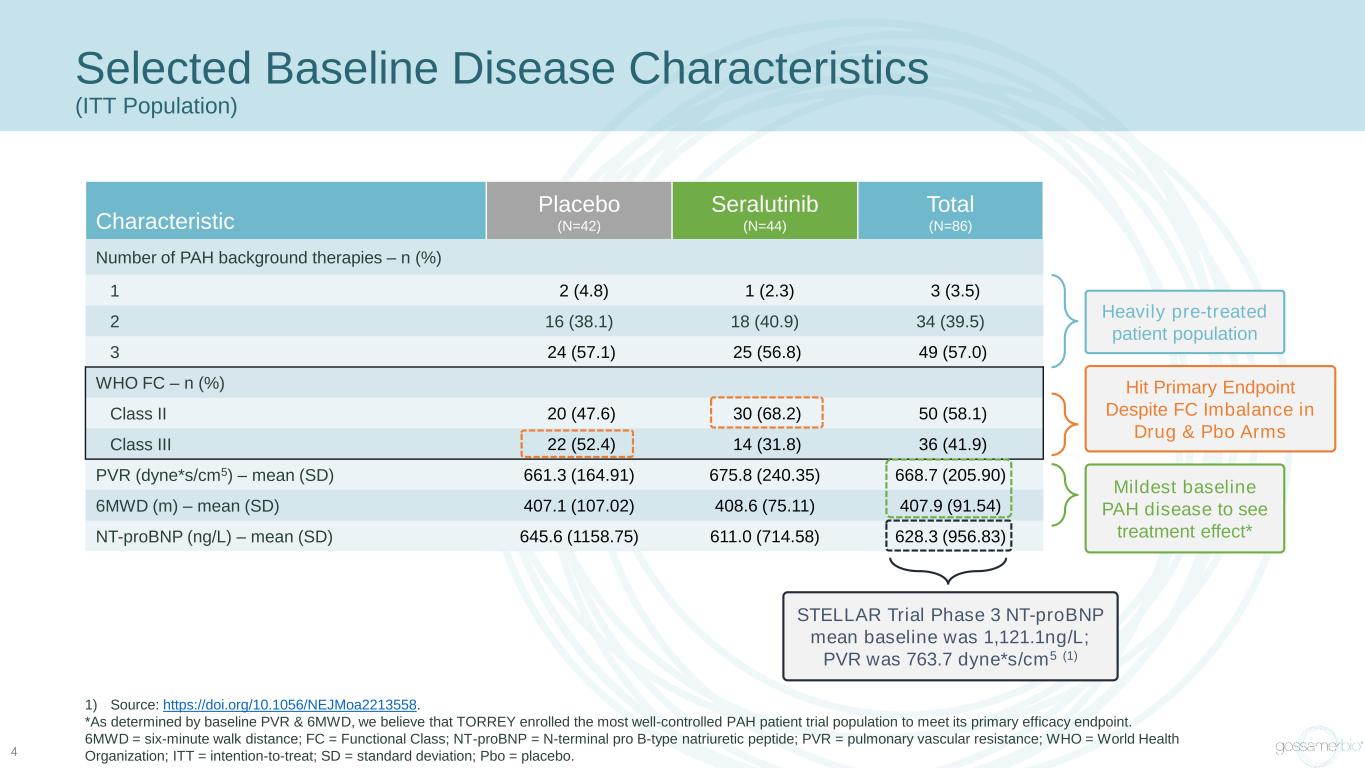
精選基線疾病特徵(ITT 人羣)4 特徵性安慰劑(N=42)Seralutinib(N=44)總計(N=86)多環芳烴背景療法數量 — n (%) 1 2 (4.8) 1 (2.3) 3 (40.9) 34 (39.5) 3 24 (57.1) 25 (57.0) WHO FC — n (%) 二級 20 (47.6) 30 (68.2) 50 (58.1) III 類 22 (52.4) 14 (31.8) 36 (41.9) PVR (dyne*s/cm5) — mean (SD) 661.3 (164.91) 665.8 (240.35) 668.7 (205.90) 6MWD (m) — mean (SD) 407.1 (107.02) 408.6 (77) 5.11) 407.9 (91.54) nt-proBNP (ng/L) — mean (SD) 645.6 (1158.75) 611.0 (714.58) 628.3 (956.83) 1)資料來源:https://doi.org/10.1056/NEJMoa2213558。*根據基線 PVR 和 6MWD 的確定,我們認為 TORREY 招募了控制最良好的多環芳烴患者試驗人羣以達到其主要療效終點。6MWD = 六分鐘步行距離;FC = 功能類別;nt-probnp = n-terminal pro B 型利鈉肽;PVR = 肺血管阻力;WHO = 世界衞生組織;ITT = 治療意圖;SD = 標準差;Pbo = 安慰劑。儘管藥物和Pbo Arms存在FC失衡,但經過大量預處理的患者羣體還是達到了主要終點,看到了治療效果最輕的基線多環芳烴疾病* STELLAR Trial 第 3 階段 nt-probnp 的平均基線為 1,121.1ng/L;PVR 為 763.7 dyne*s/cm5 (1)

• 達到主要終點:在接受大量治療的研究人羣中,PVR 在統計學上顯著降低 • 所有預先指定的亞組均顯示出持續、有利的 PVR 益處,有利於使用舍拉替尼,對疾病更嚴重的患者的效果增強§ • 血液動力學和 ECHO 終點的結果始終良好 • 耐受性良好,避免了與全身性伊馬替尼相關的副作用概況 PVR 總體研究人羣功能類 III REVEAL 2.0 風險評分 ≥ PV6 R 6MWD PVR 6MWD PVR 6MWD p = 0.0310 p = 0.5972 p = 0.0427 p = 0.0427 p = 0.0476p = 0.0134 p = 0.2482 TORREY 研究第 2 階段 Topline 結果 5 * = p 值 ≤ 0.05。除了主要終點(PVR 中的總體研究人羣增量)外,本演示文稿中的所有 p 值均為標稱值。§ 在基線上,由功能類和 REVEAL 2.0 風險評分(預先指定的子組)確定。功能性 II 類患者在安慰劑調整後的 PVR 比基線改善了 -66.9 dynes*sec*cm-5 (p = 0.2601)。-14% * +6.5m -21% * +37.3m* -23% * +21.9m 主要終點

二。新開發項目 6

Seralutinib 項目的新進展 • 迄今為止的 OLE 發現摘要:差異化療效和安全性特徵浮出水面 • PVR 降低率持續改善 • 30 名患者擁有第 72 周 PVR 數據 • 早期入組者;疾病基線比總人羣温和 • Δ6MWD 和 Δnt-probnp 持續改善 • 慢性治療有吸引力的安全性概況 • 支持單一註冊的監管反饋評估 90 毫克 BID 劑量的研究 • FDA 和 EMA 在所有關鍵方面都保持一致研究組成部分;協議最終確定 • 納入了 TORREY 學習的第 3 階段試驗,計劃於 8 月啟動 • 使用 REVEAL Lite 和 nt-probnp 作為 6MWD 成功的豐富因子 • 使用 PPD 作為 CRO 有助於降低註冊和 6MWT 行為的風險 • 允許使用抗凝劑和重要的患者安全護欄 7 OLE = 開放標籤延長;PVR = 血管阻力;6MWD = 六分鐘步行距離; nt-probnp = n-terminal pro B 型利鈉肽;BID = 每日給藥兩次;CRO = 合同研究組織;6MWT = 六個-分鐘步行測試。

三。中期 TORREY OLE 擴展結果迄今為止可用的數據 — 可能會發生變化 — 研究正在進行中。截至 2023 年 6 月 23 日。8

TORREY Open-Label 延期中期更新 • 在 80 個 TORREY 完成者(38 個 seralutinib 組,42 個安慰劑組)中,有 73 個(91.3%)選擇轉入開放標籤延期 • 在基線、第 24 周和第 72 周(OLE 大約 1 年)通過右心導管測量的 PVR • 截至中期數據截止日期,第 72 周 PVR 數據可供30名患者使用 • 16 名繼續 seraluxed 替尼,14 安慰劑交叉 9 篩查開放標籤延伸盲評估隨機化安慰劑,n = 42 Seralutinib,n = 44 Continued-seralutinib,n = 33 安慰劑交叉到色拉替尼,n = 40 名患者繼續參加 OLE 第 24 周 72Baseline 患者繼續服用 OLE OLE = 開放標籤延期;PVR = 肺血管阻力。

來自 OLE ✓ Seralutinib 治療的 Seralutinib 特徵可改善大約 60-70% 患者的血流動力學 ✓ 幾乎所有有短期益處(6 個月)的患者通過長期治療繼續改善 ✓ PVR 的持續改善以及在 TORREY 中收集的 ECHO 和 FRI 數據,支持了反向重塑作用機制 ✓ 安全性和耐受性保持相對良性,長期治療不會出現安全信號或惡化使用 ✓ 每天兩次通過 DPI 遞送藥物,廣受接受且易於整合患者的日常生活 • Seralutinib 有可能在更具侵入性/不便的療法之前使用,以及/或者具有挑戰性的安全性/耐受性特徵(例如前列環素)10 OLE = 開放標籤延伸;PVR = 肺血管阻力;ECHO = 超聲心動圖;FRI = 功能共振成像;DPI = 乾粉吸入器
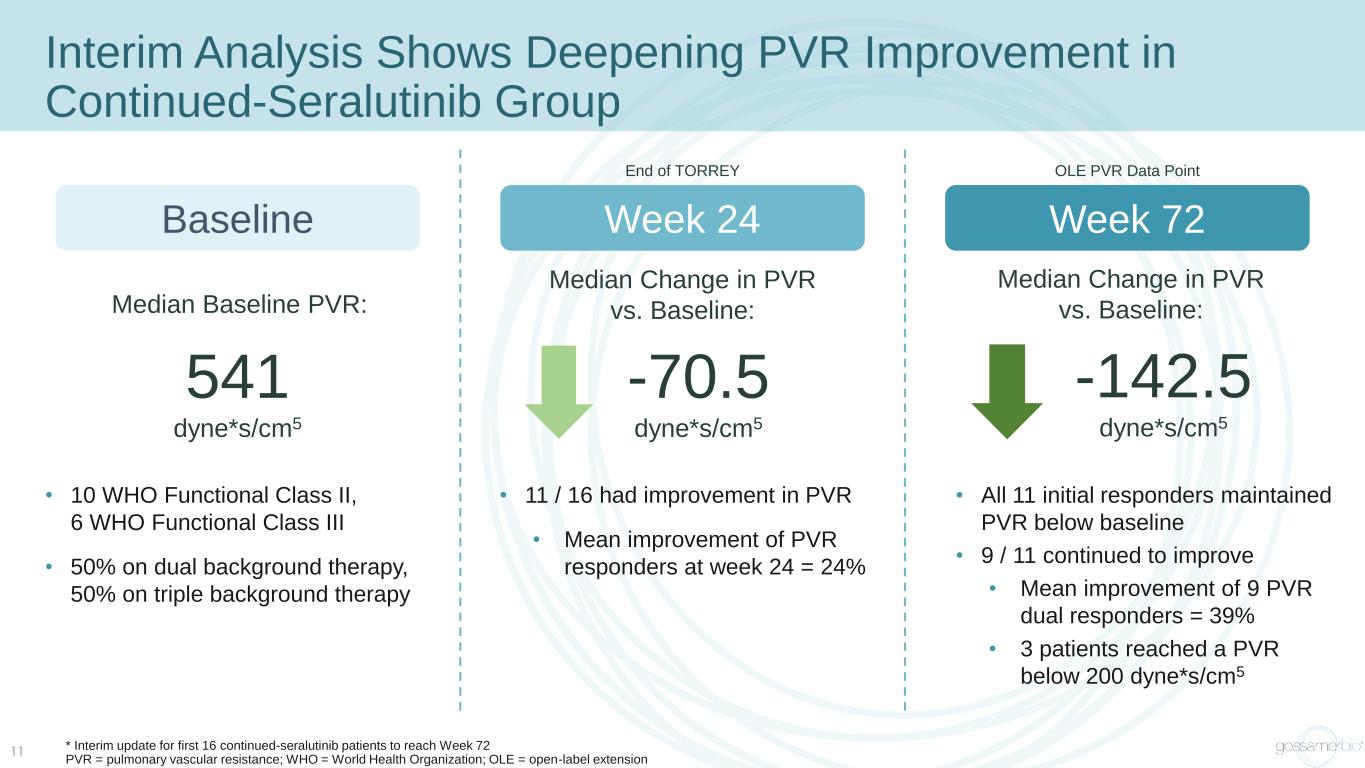
中期分析顯示,Continued-Seralutinib 組的 PVR 改善正在加深 * 前 16 名持續使用賽拉替尼患者的中期更新,達到第 72 周 PVR = 肺血管阻力;WHO = 世界衞生組織;OLE = 開放標籤延期 11 基線第 24 周 72 基線中位數 PVR:541 dyne*s/cm5 PVR 與基線的中位數變化:-70.5 dyne*s/s/s/s cm5 PVR 與基線的變化中位數:-142.5 dyne*s/cm5 • 11/16 的 PVR 有所改善 • 第 24 周 PVR 響應者的平均改善 = 24% • 所有 11 個初始值響應者將 PVR 維持在基線以下 • 9/11 繼續改善 • 9 個 PVR 雙重反應者的平均改善 = 39% • 3 名患者的 PVR 低於 200 dyne*s/cm5 • 10 名世衞組織功能等級 II,6 名世衞組織功能等級 III • 雙背景療法為 50%,三重背景療法為 50%
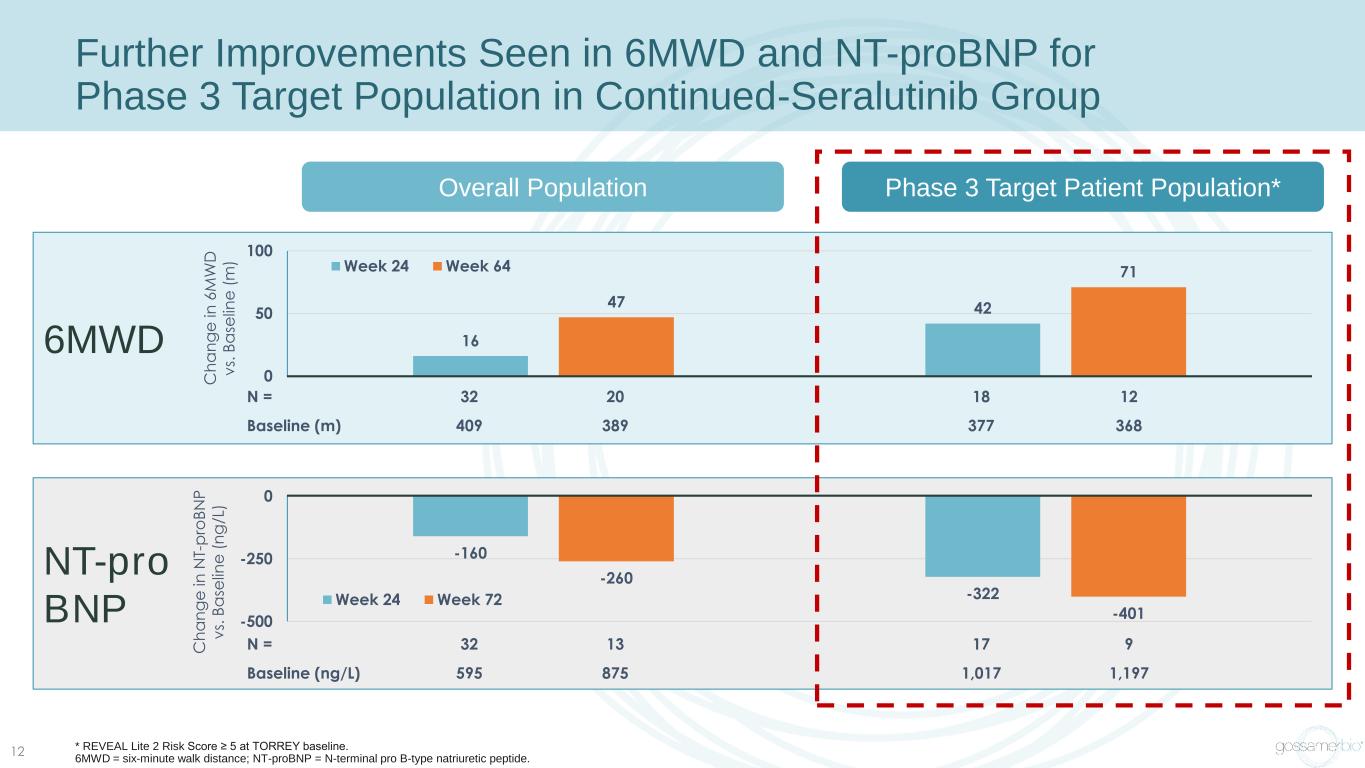
6MWD N = 32 20 18 12 基線 (m) 409 389 377 368 繼續使用色拉替尼組 12 16 4247 0 0 50 100 周 64 總人羣 3 期目標人羣的 6MWD 和 nt-probnp 有進一步改善 595 817 1,197 -160 -322 -260 -401 -500 0 第 24 周 72 C h a n g e 在 6 M W D v s. B a se lin e e (m) C h a n g e in N T-p ro B N P v s. B a se lin e (n g /L) * REVEAL Lite 2 風險分數 ≥ 5。6MWD = 六分鐘步行距離;nt-prodo bnP = N-終端 pro B 型利鈉肽。
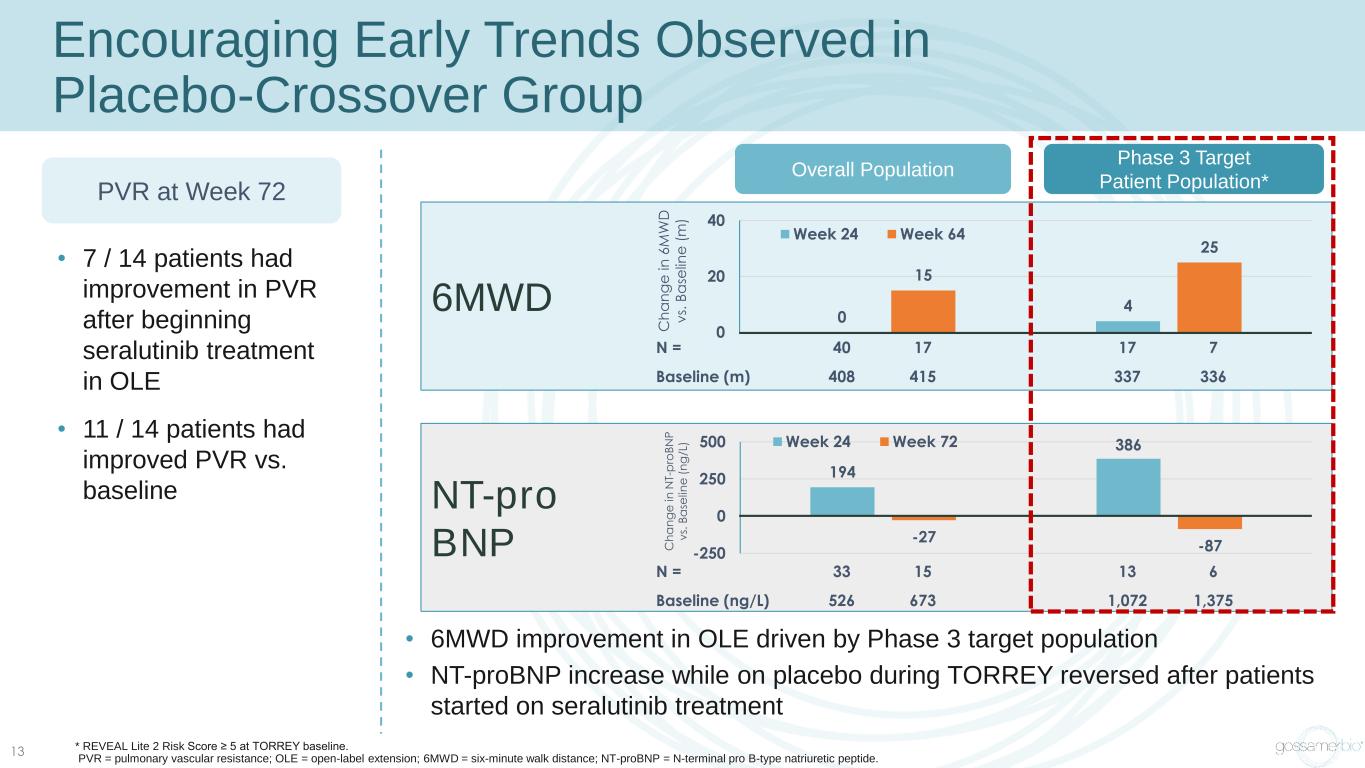
在安慰劑交叉組中觀察到的令人鼓舞的早期趨勢 • 7/14 名患者在 OLE 中開始使用舍拉替尼治療後 PVR 有所改善 • 第 72 周 11/14 名患者 PVR 與基線 PVR 相比有所改善 6MWD N = 40 40 415 337 0 0 40 周 24 周 64 總體人羣 BNP 194 目標患者羣體* nt-pro BNP 194 6 -27 -87-250 0 500 周 24 周 72 C h a n g e i n 6 M W D v s. B a se lin e e e e (m) C h a n g e i n T-p ro B N P v s. B a se lin e (n g /L) N = 33 15 13 6 基線 (ng/L) 526 673 1,375 •在3期目標人羣的推動下,OLE改善了6MWD • 在患者開始接受色拉替尼治療後,TORREY 期間服用安慰劑時的 nt-proBNP 升高逆轉 * REVEAL Lite 2 風險評分 ≥ 5 在 TORREY 基線。PVR = 肺血管阻力;OLE = 開放標籤延伸;6MWD = 六分鐘步行距離;nt-probnP = n-terminal pro B 型利鈉肽。

14 TORREY OLE 迄今為止的安全結果與對照期一致 — seralutinib 總體耐受性良好,沒有新的安全問題 • 結果支持多環芳烴患者的慢性治療 • 隨着患者習慣 DPI,咳嗽報告減少 • 迄今為止絕大多數患者已達到並保持 90 毫克 BID 劑量 • 迄今為止劑量減少有限 • 在 OLE 中觀察到的肝酶升高有限,模式與 TORREY 類似(~ 5-10% ≥ 3x ULN,類似於放置 bo rate in TORREY),這表明潛在信號在治療過程的早期很容易出現可監測 • 附錄中有安全表 OLE = 開放標籤擴展名;DPI = 乾粉吸入器;BID = 每日兩次劑量;ULN = 正常上限。

IV。PROSERA 第 3 階段概述 15

監管反饋 • FDA 和 EMA — 對第 3 階段方案的以下關鍵設計要素保持一致:• 一劑:單劑量舍拉替尼(90 mg BID);雙組研究,每組約 175 名患者 • 富集人羣:基於託裏疾病較嚴重和/或疾病進展風險較高的預先指定的亞組的目標多環芳烴人羣的資格標準,由風險評分評估、功能類別、PVR 和運動定義基線容量 • 主要終點:第 24 周為 6MWD • 其他評論:• FDA 建議考慮一項評估疾病重塑(戒斷)的第二階段研究 • EMA建議將TTCW作為關鍵次要研究 • 沒有提出任何安全問題 16 BID = 每日兩次給藥;PVR = 肺血管阻力;6MWD = 六分鐘步行距離;TTCW = 臨牀惡化的時間。
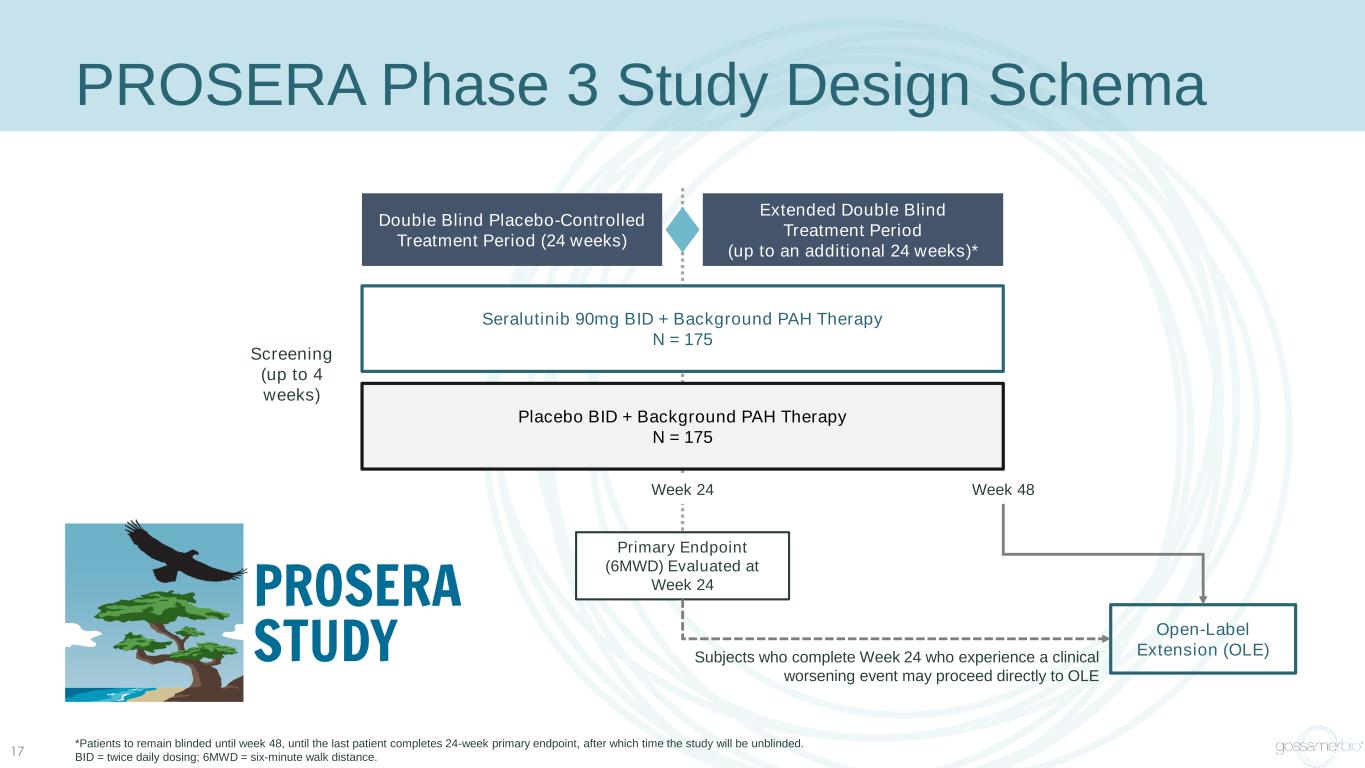
17 PROSERA 3 期研究設計架構雙盲安慰劑對照治療期(24 周)安慰劑 BID + 背景 PAH 療法 N = 175 seralutinib 90mg BID + 背景 PAH 療法 N = 175 延長雙盲治療期(最多 24 周)* 在第 24 周評估的主要終點(6MWD)第 48 周完成臨牀惡化事件的受試者可以直接進入 OLE 第 24 周篩查(最多 4 周)*患者在第 48 周之前保持失明,直到最後一位患者完成 24 周主要終點,之後研究將不失明。BID = 每天給藥兩次;6MWD = 六分鐘的步行距離。

PROSERA 研究概述設計 • 隨機、雙盲、安慰劑對照、平行組 • 長達 48 周的雙盲治療期;第 24 周評估了主要終點 • 單獨方案下的開放標籤延期選項主要終點 • 第 24 周 6MWD 與基線關鍵次要終點的變化 • 從第一劑到第一次臨牀惡化事件 (TTCW) 的時間• 在第 24 周達到臨牀改善綜合終點所有組成部分的受試者比例沒有臨牀惡化:− 世衞組織FC減少或世衞組織維持不變FC II − nt-proBNP 降低 ≥ 30% 或維持在

PROSERA 3 期研究人羣關鍵納入標準 • 成人 ≥ 18 且不超過 75 歲 • 世衞組織 1 組 PAH • 世衞組織功能類別 II 或 III • PVR ≥ 400 dyne•s/cm5 • 基線 6MWD 150-450 m* • 至少使用一種 SOC 背景療法進行穩定治療 19 * 關鍵富集標準。WHO = 世界衞生組織;PVR = 肺血管阻力;6MWD = 六分鐘步行距離;nt-probnP = n-terminal pro B 型利鈉肽;SOC = 標準護理
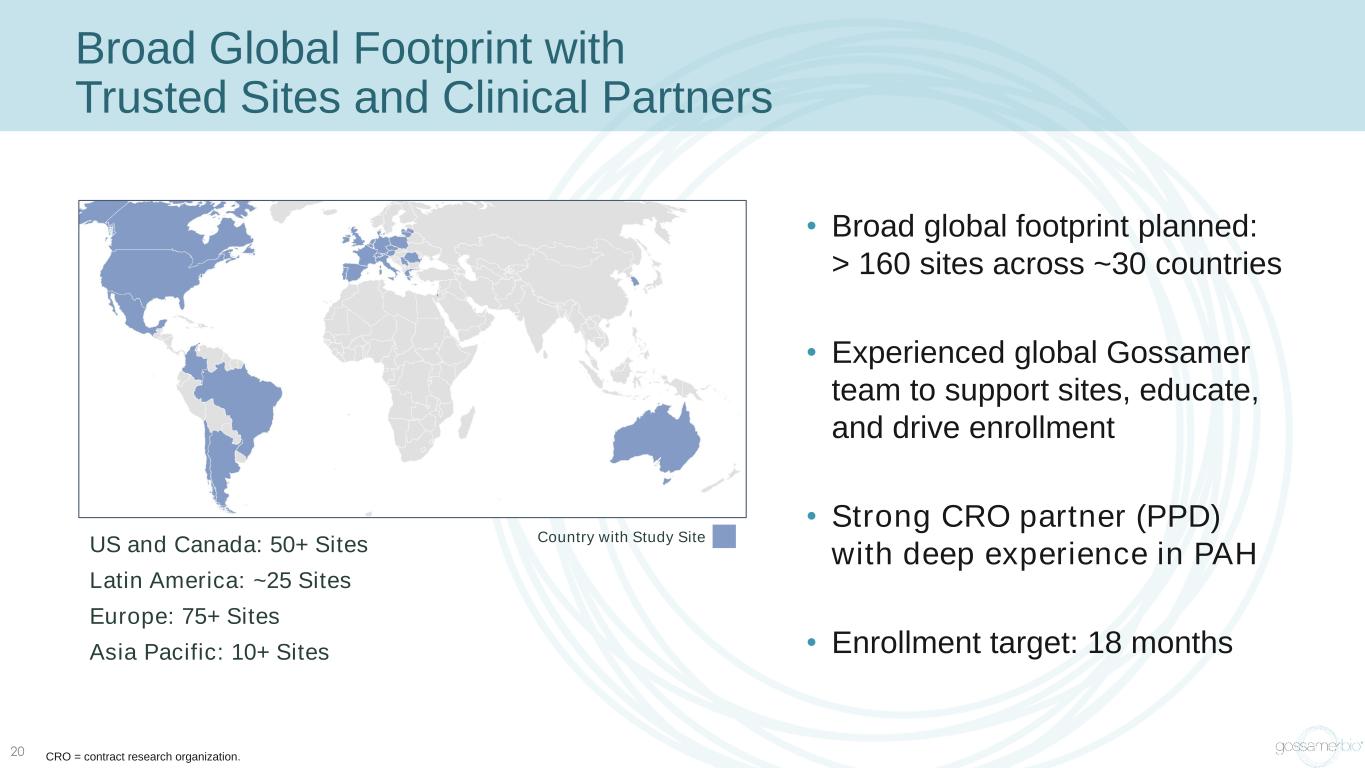
全球足跡廣泛,值得信賴的站點和臨牀合作伙伴 • 計劃在大約 30 個國家/地區開設 160 個站點 • 經驗豐富的全球 Gossamer 團隊為研究機構提供支持、教育和提高入學率 • 強大的 CRO 合作伙伴 (PPD),在 PAH 方面擁有豐富經驗 • 招生目標:18 個月 20 個美國和加拿大:50 多個地點拉丁美洲:約 25 個地點歐洲:75 多個地點亞太地區:10 多個地點擁有研究站點 CRO = 合同研究組織。
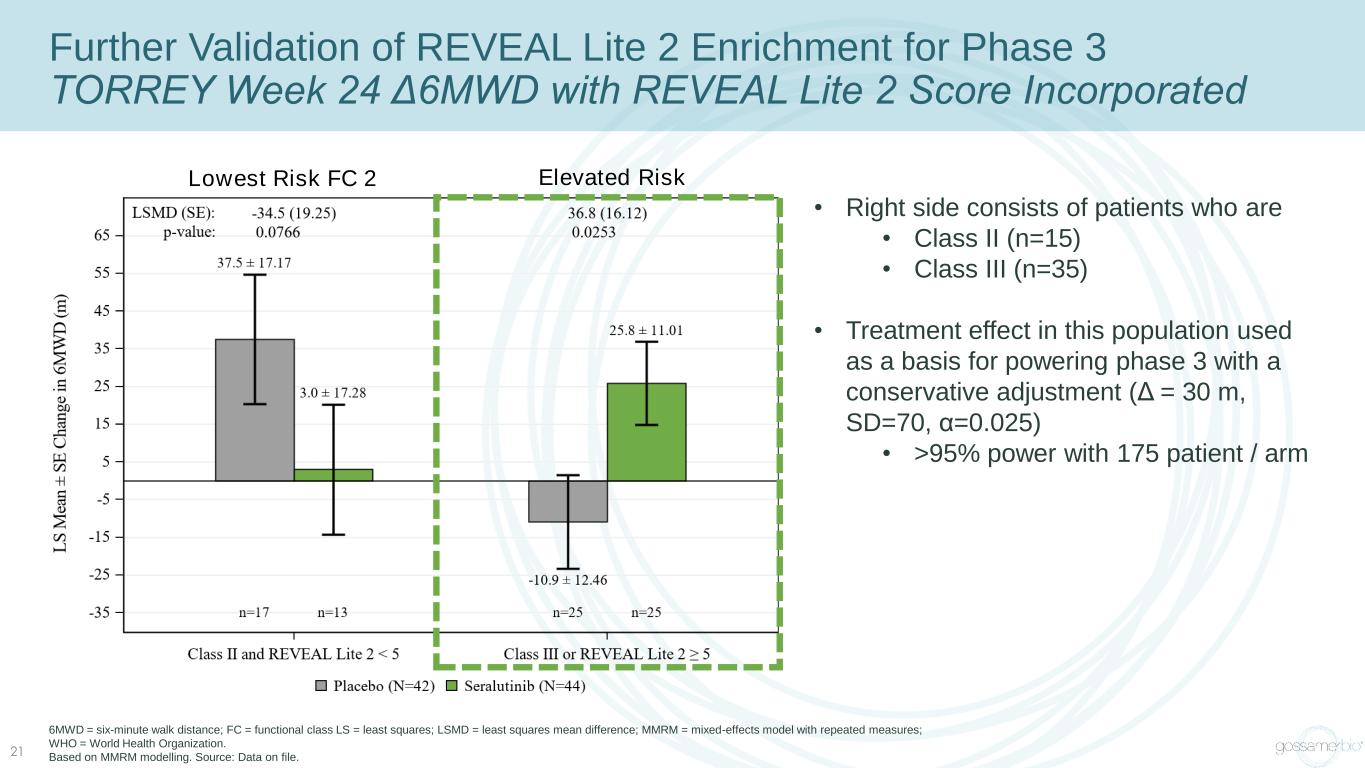
21 進一步驗證 REVEAL Lite 2 濃縮第 3 階段 TORREY Week 24 Δ6MWD 附有 REVEAL Lite 2 Score • 右側由 • II 類 (n=15) • III 類 (n=35) • 該人羣的治療效果用作通過保守調整為第 3 階段提供動力的基礎(Δ= 30 m,sd=70,α=0.025)• 175 名患者/手臂 6MWD = 功率> 95% 六分鐘步行距離;FC = 函數類 LS = 最小二乘;LSMD = 最小二乘均差;MMRM = 具有重複測量值的混合效應模型;WHO = 世界衞生組織。基於 MMRM 建模。資料來源:存檔數據。最低風險 FC 2 風險升高

附錄 I — OLE Safety 22
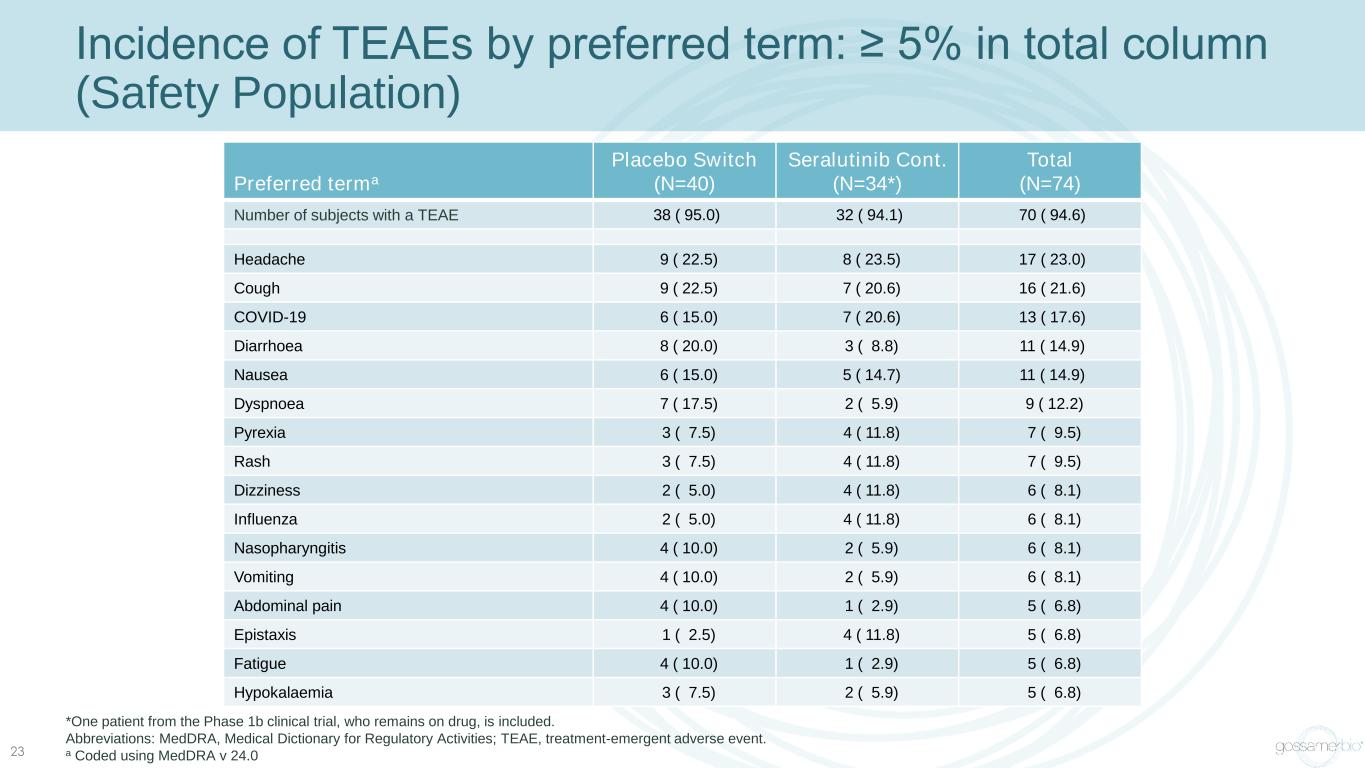
按首選術語劃分的 TEAE 發病率:總列 ≥ 5%(安全人羣)23 首選術語安慰劑開關 (N=40) Seralutinib Cont(N=34*) 總計 (N=74) 有 TEAE 的受試者人數 38 (95.0) 32 (94.1) 70 (94.6) 頭痛 9 (22.5) 17 (23.0) 咳嗽 9 (22.5) 7 (20.6) 16 (21.6) COVID-19 6 (15.0) 7 (20.6) 13 (17.6) 腹瀉 8 (20.0) 3 (8.8) 11 (14.9) 噁心 6 (15.0) 5 (14.7) 11 (14.9) 呼吸困難 7 (17.5) 2 (5.9) 9 (12.2) Pyrexia 3 (7.5) 4 (11.8) 7 (9.5) 頭暈 2 (5.0) 4 (5.0) 4 (11.8) 6 (8.1) 流感 2 (5.0) 6 (8.1) 4 (11.8) 6 (8.1)) 鼻咽炎 4 (10.0) 2 (5.9) 6 (8.1) 嘔吐 4 (10.0) 2 (5.9) 6 (8.1) 腹痛 4 (10.0) 1(2.9) 5 (6.8) Epistaxis 1 (2.5) 4 (11.8) 5 (6.8) 疲勞 4 (10.0) 1 (2.9) 5 (6.8) 低鉀血癥 3 (7.5) 2 (5.9) 5 (6.8) *包括一名仍在服藥的 1b 期臨牀試驗患者。縮寫:medDRA,監管活動醫學詞典;TEAE,治療緊急不良事件。a 使用 medDRA v 24.0 編碼
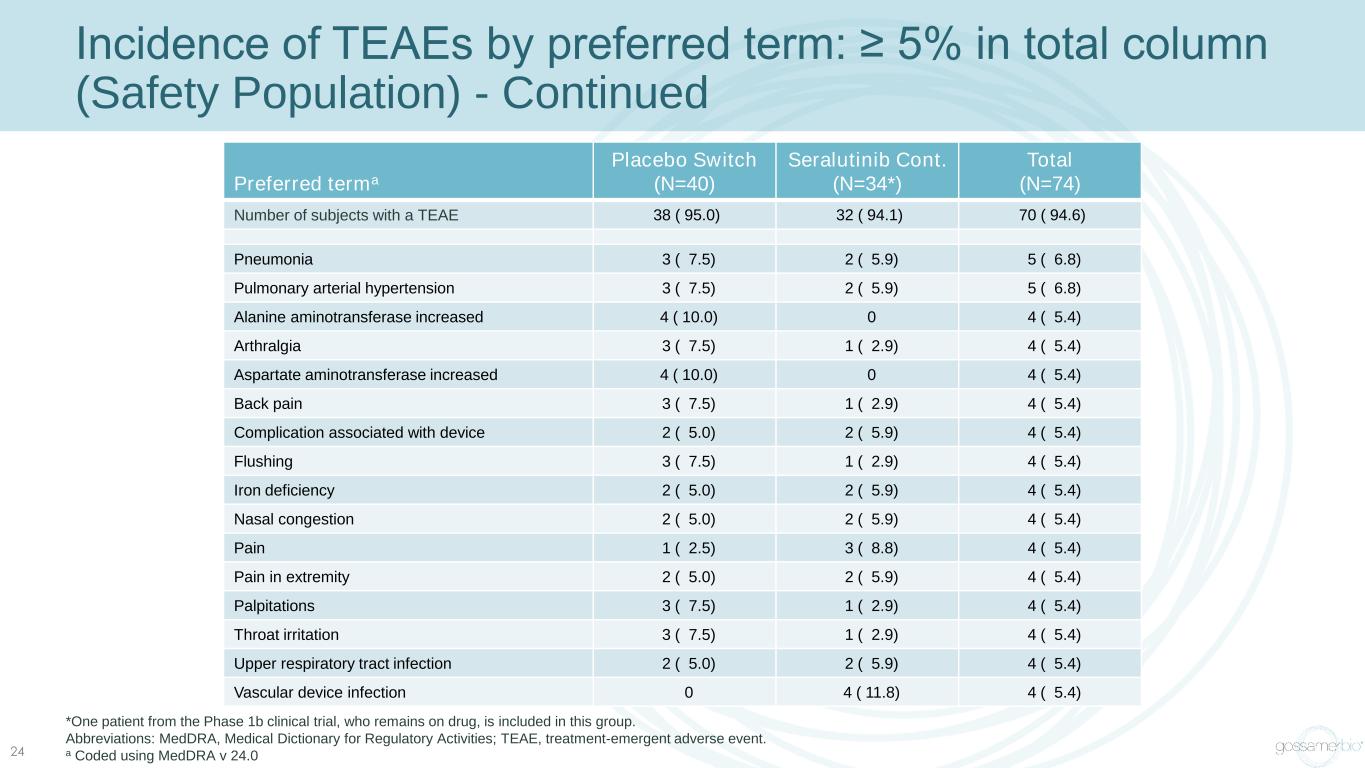
按首選術語劃分的 TEAE 發病率:總列(安全人羣)中≥ 5% ——續 24 首選術語安慰劑開關 (N=40) Seralutinib Cont(N=34*) 總數 (N=74) TEAE 38 (95.0) 32 (94.1) 70 (94.6) 肺炎 3 (7.5) 2 (5.9) 5 (6.8) 肺動脈高壓 3 (7.5) 2 (5.9) 5 (6.8) 丙氨酸轉氨酶增加 4 (10.0) 0 4 (5.4) 關節痛 3 (7.5) 1 (2.9) 4 (5.4)) 天冬氨酸轉氨酶增加 4 (10.0) 0 4 (5.4) 背痛 3 (7.5) 1 (2.9) 4 (5.4) 與設備 2 相關的併發症 (5.0) 2 (5.9) 4 (5.4) 潮紅 3 (7.5) 1 (2.9) 4 (5.4) 缺鐵 2 (5.0) 4 (5.4) 鼻塞 2 (5.0) 2 (5.4) 4 (5.4) 疼痛 1 (2.5)3 (8.8) 4 (5.4) 四肢疼痛 2 (5.0) 2 (5.9) 4 (5.4) 心悸 3 (7.5) 1 (2.9) 4 (5.4) 喉嚨刺激 3 (7.5) 1 (2.9) 4 (5.4) 上呼吸道感染 2 (5.0) 2 (5.4) 血管器械感染 0 4 (11.8) 4 (5.4) *一名來自 1b 期臨牀試驗的患者仍在服藥,包括在這一組中。縮寫:medDRA,監管活動醫學詞典;TEAE,治療緊急不良事件。a 使用 medDRA v 24.0 編碼
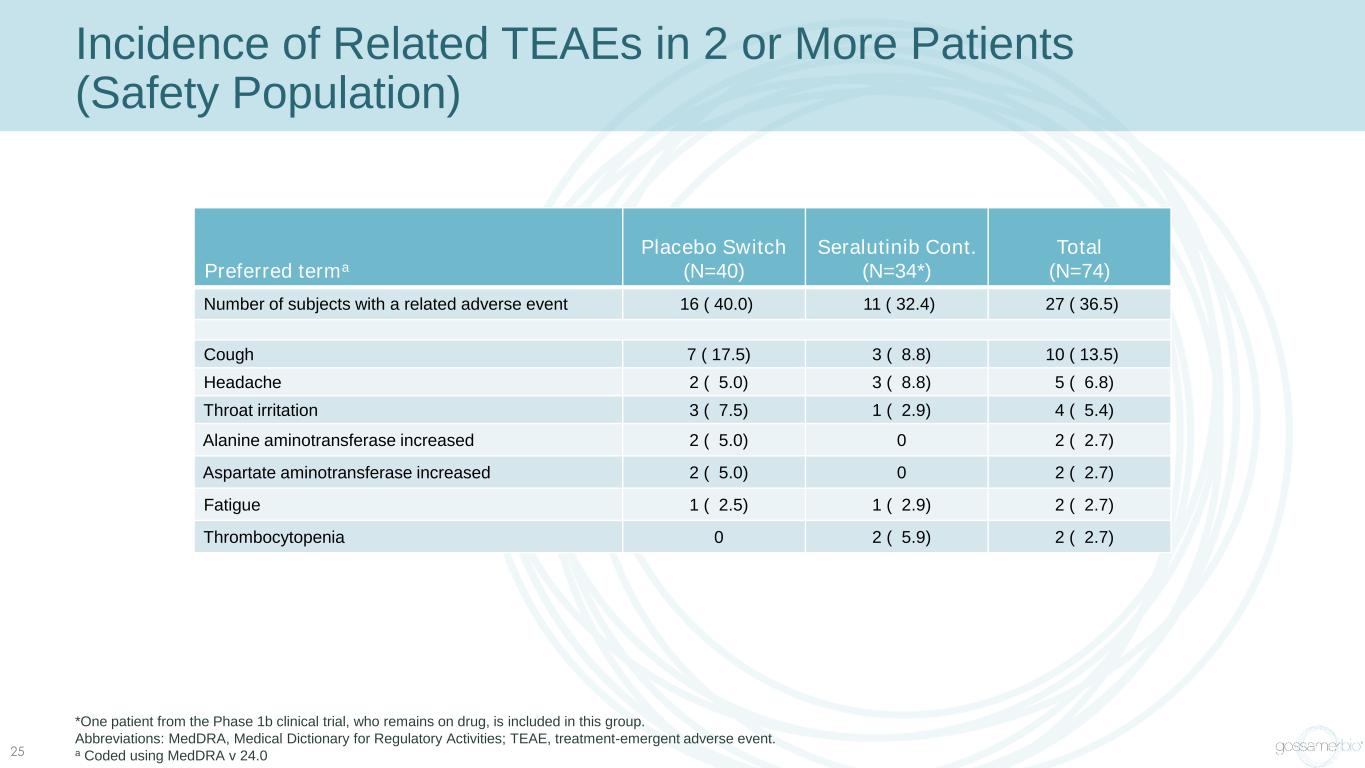
2 名或更多患者(安全人羣)中相關 TEAE 的發病率 25 首選 terma 安慰劑開關 (N=40) Seralutinib Cont(N=34*) 總數 (N=74) 發生相關不良事件的受試者人數 16 (40.0) 11 (32.4) 27 (36.5) 咳嗽 7 (17.5) 3 (8.8) 10 (13.5) 頭痛 2 (5.0) 3 (8.8) 5 (6.8) 喉嚨刺激 3 (7.5) 1 (2.9) 4 (5.4) 丙氨酸氨基轉移酶增加 2 (5.0) 0 2 (2.7) 阿斯帕特氨基轉移酶增加 2 (5.0) 0 2 (2.7) 疲勞 1 (2.5) 1 (2.9) 2 (2.7) 血小板減少症 0 2 (5.9) 2 (2.7) *該組包括一名仍在服藥的 1b 期臨牀試驗患者。縮寫:medDRA,監管活動醫學詞典;TEAE,治療緊急不良事件。a 使用 medDRA v 24.0 編碼
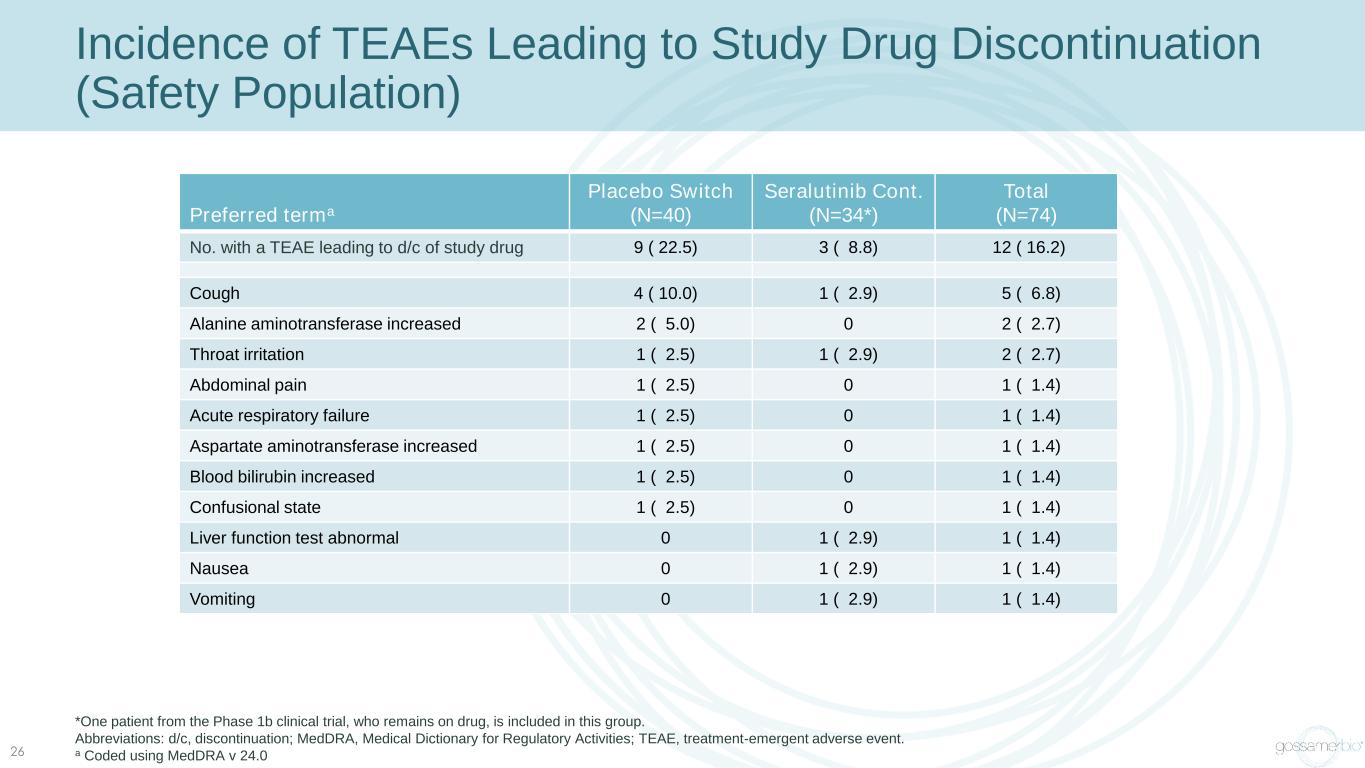
導致研究藥物停藥的TEAE的發病率(安全人羣)26 *該組包括一名正在服藥的1b期臨牀試驗患者。縮寫:d/c,停藥;medDRA,監管活動醫學詞典;TEAE,治療緊急不良事件。a 使用 medDRA v 24.0 首選術語安慰劑開關 (N=40) Seralutinib Cont 編碼(N=34*) 總計 (N=74) 有 TEAE 導致研究藥物 9 (22.5) 3 (8.8) 12 (16.2) 咳嗽 4 (10.0) 1 (2.9) 5 (6.8) 丙氨酸氨基轉移酶增加 2 (5.0) 0 2 (2.7) 喉嚨刺激 1 (2.5) 2 (2.7) 腹痛 1 (2.5) 0 1 (1.4) 急性呼吸道失敗 1 (2.5) 0 1 (1.4) 天冬氨酸氨基轉移酶升高 1 (2.5) 0 1 (1.4) 血膽紅素升高 1 (2.5) 0 1 (1.4) 混亂狀態 1 (2.5) 0 1 (1.4) 肝功能測試異常 0 1 (2.9) 1 (1.4) 噁心 0 1 (2.9) 1 (1.4)

附錄二 — FLUIDDA CT 子研究 27
FLUIDDA CT 子研究:評估接受舍拉替尼治療的患者的肺血管重塑 • 目的:提供與色拉替尼的反向重塑作用一致的證據 • 假設:seralutinib 將增加遠端肺動脈體積相對於近端肺動脈體積的體積,以 BV5A 與 BV10A 的比例(bv510aratio)表示 • 可用數據:基線和第 24 周對7名賽拉替尼治療的受試者和12名安慰劑受試者進行肺血管重建的HRCT Thin Slice cts具有肺血管分割功能在基線和第 24 周 28 CT = 計算機斷層掃描;HRCT = 高分辨率計算機斷層掃描
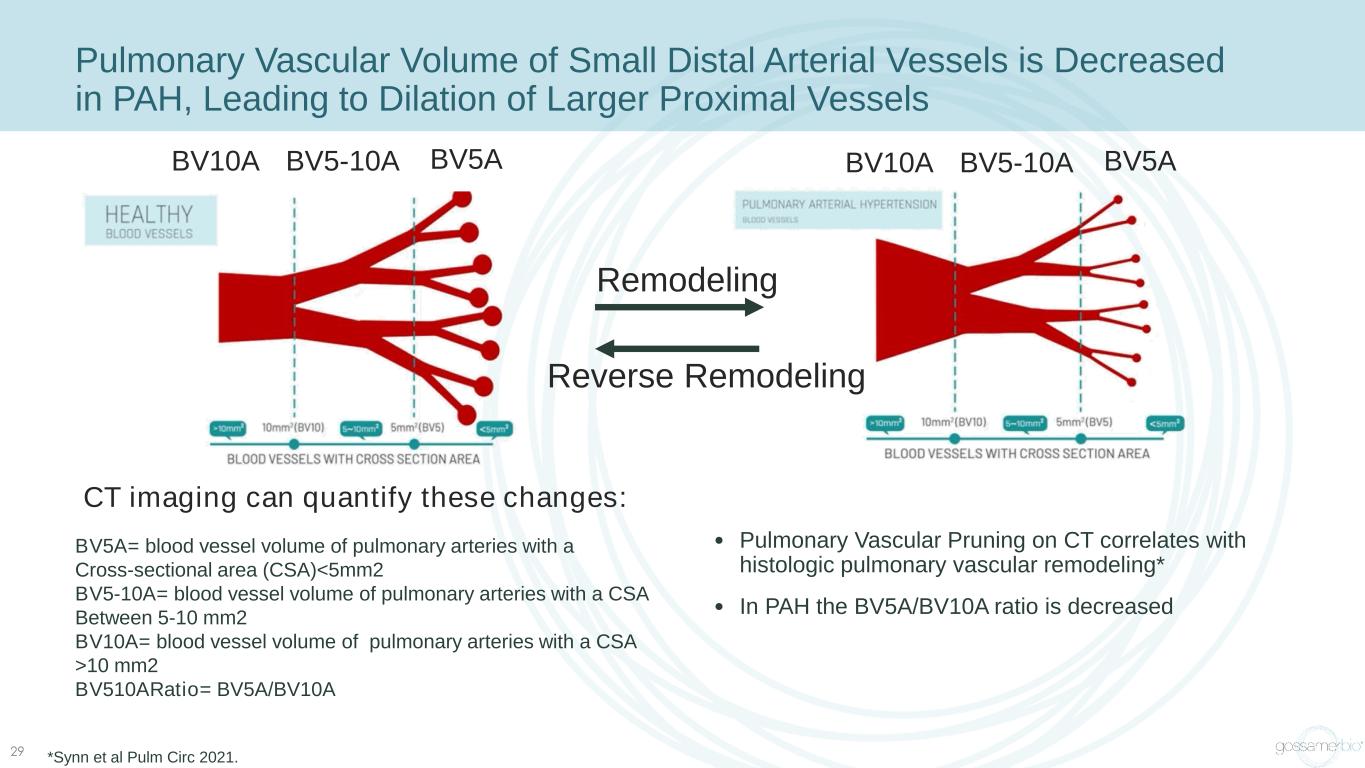
29 PAH 中小遠端動脈血管的肺血管容量減少,導致較大的近端血管擴張 BV5A= 橫截面積 (CSA) 10 mm2 bv510aratio= BV5A/BV10A BV5ABV5-10ABV10A BV5ABV5-10ABV10A 重塑反向重塑 CT 成像可以量化這些變化:• CT 上的肺血管修剪與組織學肺血管相關:• CT 上的肺血管修剪與組織學肺血管相關改造* • 在 PAH 中,BV5A/BV10A 的比率降低了 *Synn 等人 Pulm Circ 2021。
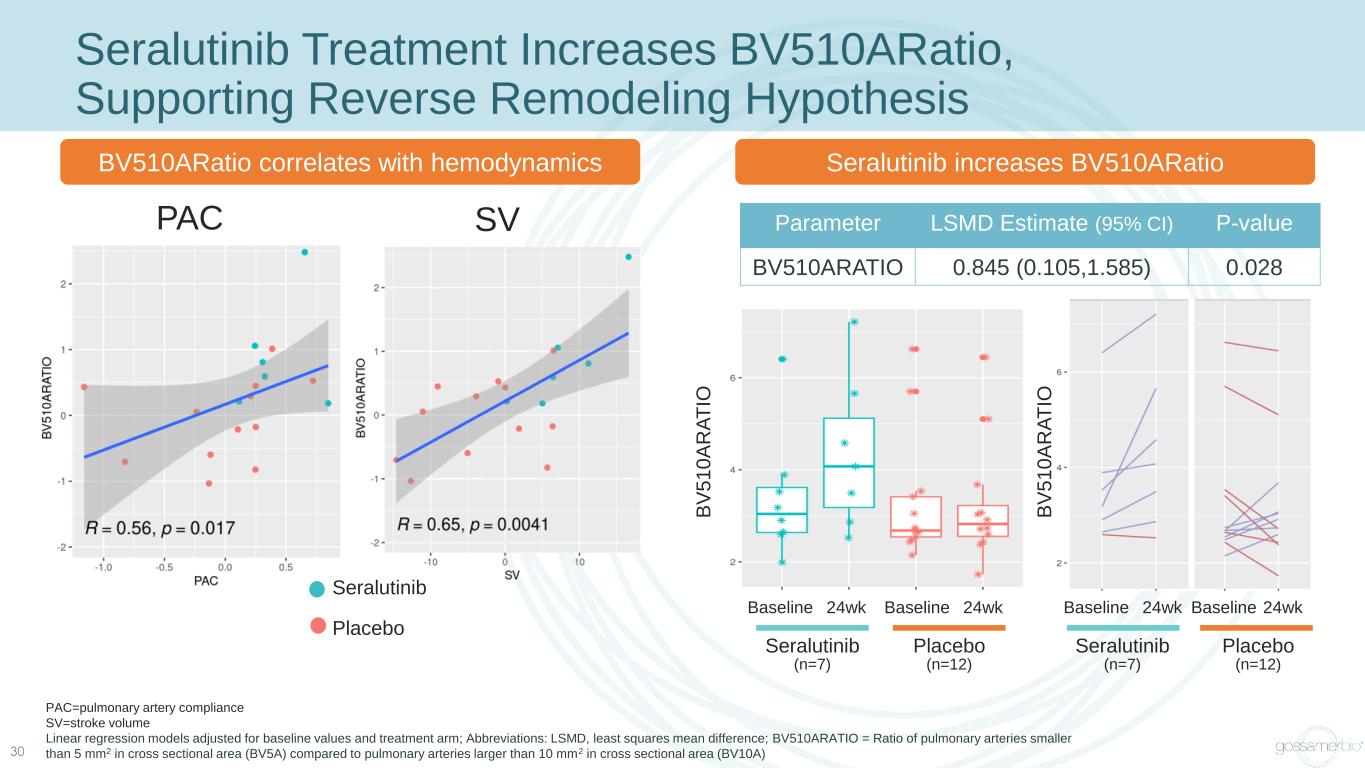
30 Seralutinib 治療增加 bv510aratio,支持逆向重塑假設參數 LSMD 估計 (95% 置信區間) P 值 BV510ARATIO 0.845 (0.105,1.585) 0.028 pac=肺動脈順應性 sv=中風體積線性迴歸模型,根據基線值和治療組進行了調整;縮寫:LSMD,最小二乘平均差;BV510ARATIO = 橫截面面積小於 5 mm2 的肺動脈比率(BV5A) 與橫截面積大於 10 mm2 的肺動脈 (BV10A) 相比,Seralutinib 增加 bv510aratiobv510aratio與血液動力學相關 PAC SV 安慰劑 (n=12) 基線 24wk Seralutinib (n=7) 基線 24wk B V 5 1 0 A R A T IO 安慰劑 (n=12) 基線 24wk Seralutinib (n=7) 基線 24wk Seralutinib 安慰劑 B V 5 1 0 A R A T IO
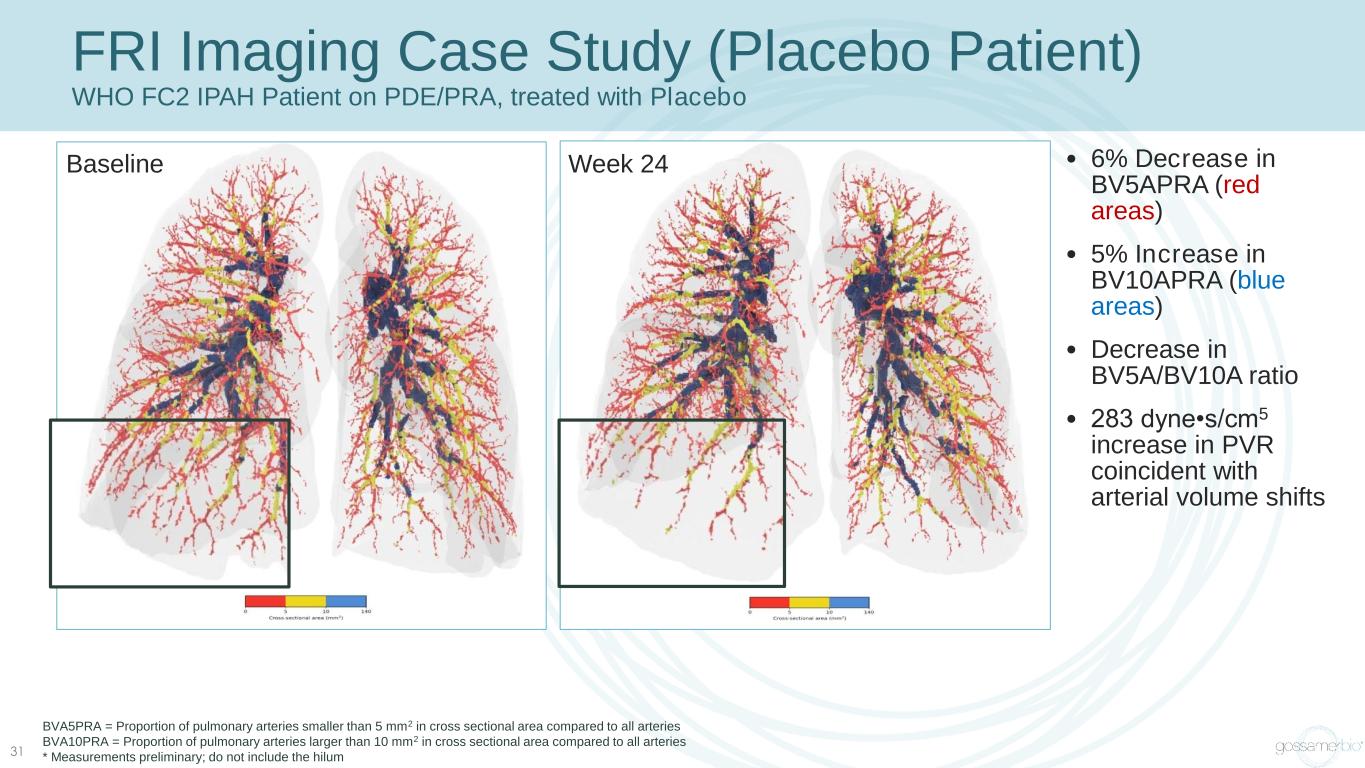
FRI 成像案例研究(安慰劑患者)WHO FC2 IPAH 患者服用 PDE/PRA,接受安慰劑治療 • BV5APRA(紅色區域)減少 6% • BV10APRA(藍色區域)增加 5% • BV5A/BV10A 比率降低 • 283 dyne•s/cm5 與動脈體積變化同時的 PVR 增加 BVA5PRA = 與所有動脈相比,橫截面積小於 5 mm2 的肺動脈比例動脈 BVA10PRA = 與所有動脈相比,橫截面積大於 10 mm2 的肺動脈比例 * 初步測量;不包括 hilum Week 24Baseline 31
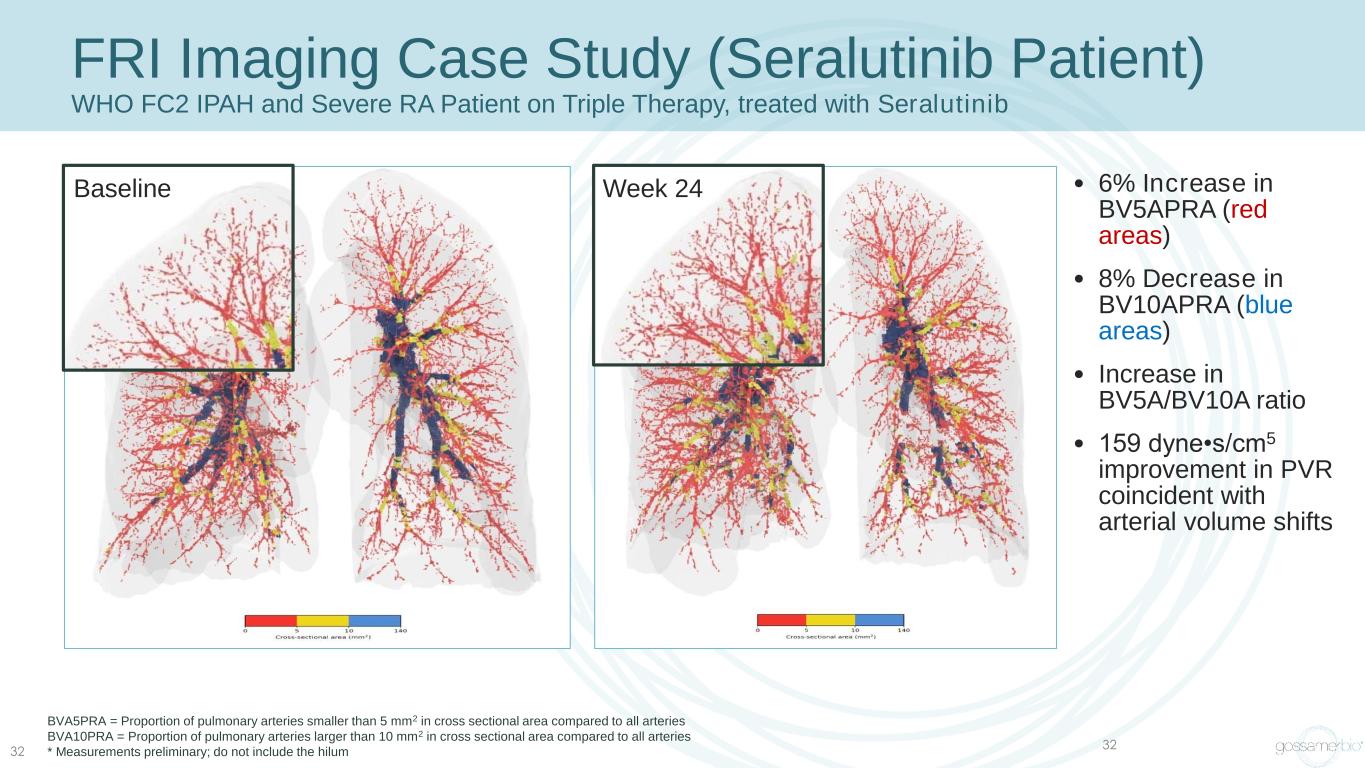
32 FRI 影像案例研究(Seralutinib 患者)世衞組織 FC2 IPAH 和重度 RA 患者接受三重療法,使用色拉替尼治療 • BV5APRA(紅色區域)增加 6% • BV10APRA(藍色區域)減少 8% • BV5A/BV10A 比率增加 • 159 dyne•s/cm5 與動脈容量變化一致 BVA5PRA = 肺動脈比例小於 5 mm2 橫截面積與所有動脈相比 BVA10PRA = 橫截面積大於 10 mm2 的肺動脈與所有動脈的比例 * 初步測量;不要包括 hilum Week 24Baseline Wek 24Baseline 32

33 FRI 分項研究和第 3 階段計劃摘要 • bv510aratio 與通過肺動脈順應性和心肺血流動力學(即中風體積)衡量的 RV-PA 耦合的重要衡量標準相關 • 遠端血管容量相對於較大血管(bv510aratio)的比率顯著改善,與色拉替尼的反向重塑作用一致 • 為了增進我們的理解關於色拉替尼對肺血管重塑的影響,計劃在第三階段進行一項FRI分項研究