

附錄 99.1
新聞稿
在特應性皮炎的2B期陽性研究中,EMBLASAKIMAB每月給藥顯示出同類最佳療法的潛力
加利福尼亞州聖馬特奧和新加坡,2023年7月6日——ASLAN Pharmicals(納斯達克股票代碼:ASLN)是一家專注於臨牀階段、以免疫學為重點的生物製藥公司,正在開發創新療法以改變患者生活。該公司今天宣佈了其針對中度至重度特應性皮炎(AD)成人患者的依巴拉單抗的2b期劑量範圍研究、TREK-AD(trials with eBLA)的正面數據 Asakimab 在特應性皮炎中的應用)研究。與安慰劑相比,Eblasakimab在第16周達到了濕疹區域和嚴重程度指數(EASI)分數與基線相比變化百分比的主要終點,在三個給藥組中具有統計學意義:每 4 周給藥一次(600mg Q4W),這是數字上表現最好的手臂,每 2 周給藥一次 400 毫克(400mg Q2W),每 2 周給藥一次 300mg(300mg Q2W)W)。
Eblasakimab是一種新型的單克隆抗體,靶向2型受體的IL‑13受體亞單位,這是導致多種過敏性炎症性疾病的關鍵途徑。據觀察,Eblasakimab的獨特作用機制可以對2型受體進行特異性阻斷,通過白介素4(IL‑4)和白介素13(IL‑13)(白介素13)(白介素13)(白介素13)(白介素13)進行信號傳導,同時保護1型受體。
俄勒岡健康與科學大學弗朗西斯·斯托爾斯醫學皮膚病學教授、TREK-AD研究首席研究員埃裏克·辛普森醫學博士説:“這是我們第一次看到每月一次的治療方案提供有競爭力的療效數據,這將改變AD患者的遊戲規則。”“自dupilumab推出以來,我們沒有看到太多進展,患者所經歷的疾病負擔仍有巨大的未得到滿足。這些結果表明,如果獲得批准,依巴沙基單抗有可能成為治療AD的領先療法。”
|
|
|

“我們很高興地宣佈來自TREK-AD研究的這些積極的頂線數據,這些數據支持了我們最近發表的轉化研究,這些研究表明,eblasakimab的獨特作用機制可以為阻斷導致過敏性炎症的2型信號傳導提供更有效、更有針對性的方法。根據這些結果,我們認為,如果獲得批准,eblasakimab可以成為AD的主要治療方法,它可以讓更多的患者服用 EASI-75 或 EASI-90,減少不必要的副作用,快速起作用,而且——獨一無二的是——每月一次的給藥方便。” ASLAN Pharmicals首席執行官卡爾·菲斯博士説。“我們期待迅速進入AD的第三階段項目,並探索我們期望這種候選藥物取得成功的廣泛適應症。我們感謝患者、研究人員和我們的團隊,他們為依巴沙基單抗的開發做出瞭如此重要的貢獻。”
主要研究結果
在TREK-AD 2b期研究中,289名患者在意向治療(ITT)人羣中以 1:1:1:1:1 的比例隨機分組接受治療,接受四劑依巴沙基單抗(300mg Q2W、400mg Q2W、400mg Q4W 和 600mg Q4W)或安慰劑中的一劑,持續16周。關鍵療效終點,包括 EASI-75 和經過驗證的特應性皮炎研究者全球評估 (Viga-ad) 得分 0/1,分別是歐洲和美國監管部門批准的相關終點,如下所示:
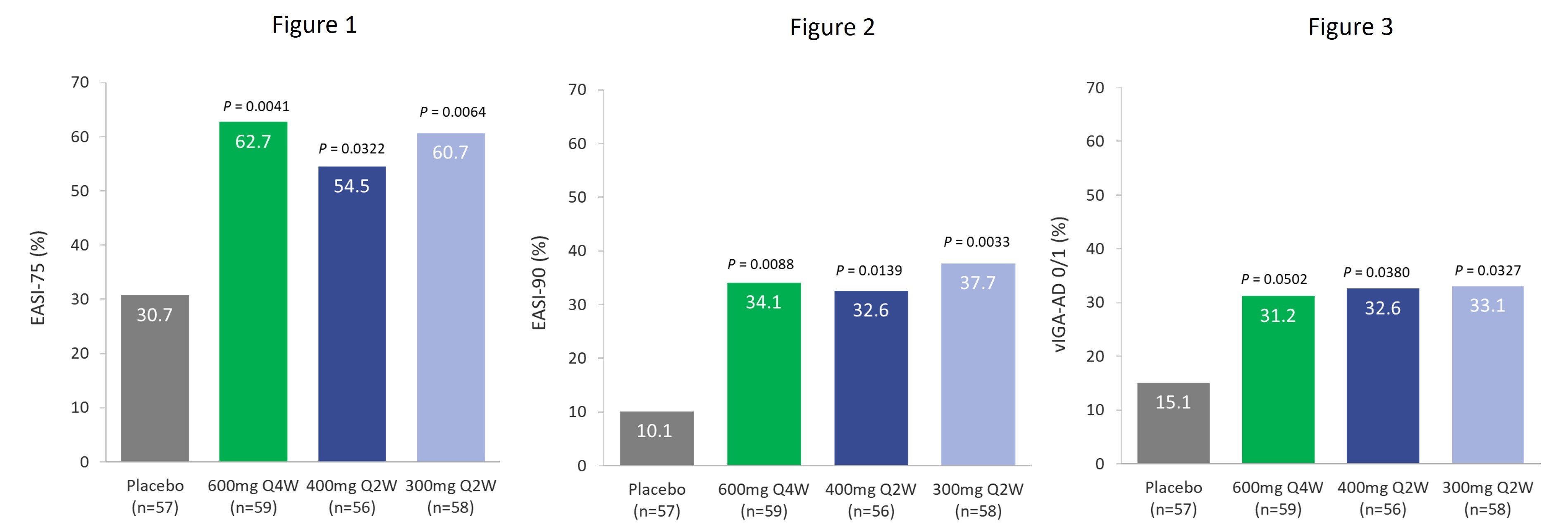
接受依巴沙基單抗600mg Q4W、400mg Q2W和300mg Q2W治療的患者在治療的最初幾周內反應迅速,到第4周,EASI評分有了統計學上的顯著改善。治療16周後,與安慰劑(n=57)相比,其他關鍵療效指標取得了具有臨牀意義的改善,包括:
Eblasakimab 600mg Q4W (n=59)
|
|
|

Eblasakimab 400mg Q2W (n=56)
Eblasakimab 300mg Q2W (n=58)
Eblasakimab 400mg Q4W (n=59)
eblasakimab 400mg Q4W 給藥組未達到具有統計學意義的主要或次要終點。
總體而言,主動治療組的停藥率相當,安慰劑組的停藥率更高。沒有發現新的安全信號,主動治療和安慰劑組的不良事件(AE)頻率相當。所有活性治療組中最常觀察到的不良反應是鼻咽炎(13.4%,安慰劑為8.8%)、特應性皮炎(8.6%,安慰劑為7.0%)、頭痛(6.9%,安慰劑為7.0%)和上呼吸道感染(6.5%,安慰劑為5.3%)。結膜炎(5.2%,安慰劑為1.8%)、注射部位反應(4.7%,安慰劑為1.8%)和皰疹感染(3.0%,安慰劑為3.5%)的發生率都很低。
來自2b期研究的更多數據,包括患者報告的結果和生物標誌物數據,預計將於2023年第四季度公佈,並提交給未來的科學大會。ASLAN計劃與美國食品藥品監督管理局會面,舉行第二階段末會議,預計將於2024年啟動依巴沙基單抗的3期臨牀開發計劃。該公司還在對有dupilumab經驗的AD患者進行Eblasakimab的TREK-DX(Eblasakimab試驗)研究,預計將在2024年第一季度公佈該研究的頭條數據。
|
|
|

關於 2b 期 TREK-AD 研究
TREK-AD(使用Eblasakimab治療特應性皮炎的試驗)研究是一項隨機、雙盲、安慰劑對照、劑量範圍的臨牀試驗,旨在評估eblasakimab作為單一療法對適合全身治療的中度至重度AD的生物天真成年患者的療效和安全性。來自美國、歐洲和亞洲的患者被隨機分組,比例相等,分別為四個活躍治療組和一個安慰劑組:
參與該研究的患者的納入標準包括至少一年的AD臨牀診斷,EASI分數大於或等於16,Viga-ad分數大於或等於3,在篩查和基線時體表面積至少為10%。在為期16周的評估期結束後,又對患者進行了12周的隨訪。
關於依巴沙基單抗
Eblasakimab是一種潛在的同類首創單克隆抗體,靶向2型受體的IL‑13受體亞單位,這是導致多種過敏性炎症性疾病的關鍵途徑。Eblasakimab的獨特作用機制能夠特異性阻斷2型受體,並有可能改進目前用於治療過敏性疾病的生物製劑。通過阻斷2型受體,eblasakimab可防止通過白介素4(IL-4)和白介素13(IL‑13)發出信號傳導,白介素是AD 炎症的關鍵驅動因素。
網絡直播
ASLAN的管理層將於美國東部時間今天(2023年7月6日)上午8點30分主持網絡直播,討論這些數據。使用以下鏈接註冊即可觀看網絡直播: https://lifescievents.com/event/aslan/。網絡直播的重播將在2023年10月4日之前播出,直播結束後將使用上述信息。
關於阿斯蘭製藥
ASLAN Pharmicals(納斯達克股票代碼:ASLN)是一家臨牀階段、以免疫學為重點的生物製藥公司,開發創新療法來改變患者的生活。ASLAN 正在開發 eblasakimab,這是一種靶向中度至重度特應性皮炎 (AD) 中 IL-13 受體的潛在同類首創抗體,有可能改進當前用於治療過敏性疾病的生物製劑,並且最近報告了一項針對中度至重度 AD 的 2b 期劑量範圍研究的積極頂線數據。ASLAN還在開發farudodstat,這是一種有效的口服二氫乳酸脱氫酶(DHODH)抑制劑,作為一種潛在的2a期概念驗證試驗中針對斑禿症(AA)的首創治療藥物,中期讀數預計將於2024年第一季度公佈。ASLAN 在加利福尼亞州聖馬特奧和新加坡都有團隊。欲瞭解更多信息,請訪問 網站或者在 ASLAN 上關注 ASLAN 領英.
|
|
|

前瞻性陳述
本新聞稿包含前瞻性陳述。這些陳述基於ASLAN Pharmicals Limited和/或其關聯公司(“公司”)管理層當前的信念和期望。這些前瞻性陳述可能包括但不限於關於公司業務戰略和臨牀開發計劃的陳述;公司開發和商業化依巴沙基單抗的計劃;eblasakimab 的安全性和有效性,包括其成為同類最佳藥物的潛力;公司在依巴沙基單抗臨牀試驗、臨牀試驗入組和臨牀試驗結果方面的計劃和預期時機;eblasakimab 作為特應性治療藥物的潛力皮炎。公司的估計、預測和其他前瞻性陳述基於管理層對未來事件和趨勢的當前假設和預期,這些事件和趨勢影響或可能影響公司的業務、戰略、運營或財務業績,並且本質上涉及重大的已知和未知風險和不確定性。由於存在許多風險和不確定性,實際結果和事件發生時間可能與此類前瞻性陳述中的預期存在重大差異,其中包括但不限於在臨牀前或臨牀研究中觀察到的意外安全性或有效性數據;早期研究和試驗的結果可能無法預測未來的試驗結果;臨牀場所激活率或臨牀試驗入組率低於預期;COVID-19 疫情或烏克蘭和俄羅斯之間持續衝突的影響公司業務和全球經濟的銀行倒閉;總體市場狀況;競爭格局的變化;以及公司獲得足夠資金為其戰略和臨牀開發計劃提供資金的能力。公司的美國證券交易委員會文件和報告(委員會文件編號001-38475)中描述了可能導致實際業績與此類前瞻性陳述中明示或暗示的業績不同的其他因素,包括公司於2023年3月24日向美國證券交易委員會提交的20-F表年度報告。除歷史事實陳述外,所有陳述均為前瞻性陳述。“相信”、“可能”、“可能”、“可以”、“將”、“目標”、“估計”、“繼續”、“預期”、“打算”、“期望”、“計劃” 或這些術語的負面詞語,以及表達未來事件或結果不確定性的類似表述旨在確定估計、預測和其他前瞻性陳述。估計、預測和其他前瞻性陳述僅代表其發表之日,除法律要求外,公司沒有義務更新或審查任何估計、預測或前瞻性陳述。
結束
媒體和投資者關係聯繫人
艾瑪湯普森 刺激溝通 電話:+65 6206 7350 電子郵件: ASLAN@spurwingcomms.com
|
艾什莉·羅賓遜 LifeSci 顧問有限公司 電話:+1 (617) 430-7577 電子郵件: arr@lifesciadvisors.com |
|
|
|