

VAX-24 第 2 階段項目結果, 包括 2023 年 4 月 17 日兩項研究的 65 歲以上成人數據和完整的六個月安全數據附錄 99.2

2023 年 4 月前瞻性陳述 本演示包含 1995 年《私人證券訴訟改革法》所指的前瞻性陳述。這些陳述包括但不限於與Vaxcyte 候選疫苗的潛在益處有關的陳述,包括覆蓋範圍和可能提供同類最佳肺炎球菌偶聯疫苗的能力;對Vaxcyte候選疫苗的需求;未來預期開發的過程和時機;肺炎球菌疫苗市場的增長和擴張;Vaxcyte 疫苗的市場機會;Vaxcyte 對頻譜覆蓋範圍的預期,監管途徑、 候選疫苗的採用速度和免疫原性;Vaxcyte 臨牀前研究、臨牀試驗和研發計劃(包括提交 IND 申請 VAX-31 和監管相互作用以及 VAX-24 成人、VAX-24 嬰兒和 VAX-31 研究數據的可用性)的啟動時間、進展和預期結果;以及其他非歷史事實的陳述。“預期”、“相信”、 “繼續”、“可能”、“設計”、“估計”、“期望”、“打算”、“可能”、“計劃”、“潛在”、“預測”、“項目”、 “應該”、“目標”、“將” 等詞語旨在識別前瞻性陳述,儘管並非所有前瞻性陳述都包含這些識別性詞語。這些 前瞻性陳述基於Vaxcyte當前的預期,由於風險和不確定性,實際業績和事件發生時機可能與此類前瞻性陳述中的預期存在重大差異,包括 但不限於與Vaxcyte產品開發計劃相關的風險,包括開發時間表、化學、製造和控制及相關製造活動的成功和時機; 獲得和維持所需的監管批准的潛在延遲或無法獲得和維持所需的監管批准因為它的疫苗候選人;臨牀前和臨牀開發過程固有的風險和不確定性;所有開發活動和臨牀試驗的成功、成本和時機; 以及支持Vaxcyte開發計劃和其他運營支出的現金和其他資金的充足性,其中任何一項都可能對Vaxcyte的業務和運營產生重大和不利影響。在Vaxcyte向美國證券交易委員會(SEC)提交的文件,包括其於2023年2月27日向美國證券交易委員會(SEC)提交的10-K表年度報告或Vaxcyte隨後向美國證券交易委員會(SEC)提交或提供給美國證券交易委員會(SEC)的其他文件中,對這些風險和其他風險進行了更全面的描述。由於新信息、未來事件或預期變化,Vaxcyte沒有責任或義務更新本新聞稿中包含的任何前瞻性陳述。

簡介和 vax-24 結果 概述 VAX-24 65 歲及以上成年人(65 歲以上)的第 2 階段研究結果性狀和人口統計學安全性和耐受性數據免疫原性數據兩項成人研究的預先指定的合併免疫原性分析兩項成人研究的完整六個月安全性 數據來自兩項成人研究項目結論、現狀和後續步驟議程 2023 年 4 月

簡介和 VAX-24 結果 2023 年 4 月概述

摘要:VAX-24 65歲以上成人研究結果 確認先前的第 2 階段結果積極結果支持 VAX-24 具有同類最佳潛力,為 3 階段的設計和進展奠定了基礎 2023 年 4 月安全:來自 65 歲以上成年人的 2 期研究和先前針對 18-64 歲成年人的 1/2 期研究 的完整六個月安全性數據顯示 VAX-24 的安全性和耐受性結果與所有研究劑量的 Prevnar 20® (PCV20) 相似免疫原性:65+ 研究實現了靶向反應針對劑量為 2.2mcg 的所有 24 種血清型,表明 VAX-24 有可能擴大覆蓋範圍和與標準護理標準相比,提高免疫原性 2 期 65 歲以上的研究結果(n~45/arm):VAX-24 符合 PCV20 常見的 18/20 個 ST 的 OPA 反應非劣質標準,並符合所有 VAX-24 VAX-24 特有的所有四個 其他 ST的優越性標準顯示,與第 2 階段的結果相比 PCV20 的免疫反應總體有所改善 VAX-24:與美國食品藥品管理局的第二階段結束會議 2H: 23;2025 年的第 3 階段關鍵免疫原性數據嬰兒:第 2 階段 PCV20 VAX-24研究招收受試者,截至 2025 年,來自初級三劑量免疫系列的主要數據 VAX-31 成人:IND 申請 提交 2H: 23;來自 2024 年 1/2 期研究的頭條數據:新數據進一步支持了我們保留載體的 PCV 特許經營權和無細胞平臺 VAX-24 處於有利於成人 3 期關鍵研究的最佳劑量 2.2mcg 被證實為進入 3 期關鍵研究的最佳劑量,其中將包括成人對兩項針對 50 歲以上(n~225/組)和 60 歲以上(n~100)的成人 2 期成人研究的 50+ 或 60+ 預先指定的彙總分析 VAX-24/group) 符合所有 20 個常見 ST 的 OPA 反應非自卑性標準,並符合另外四個 ST 的優越性標準,這是 VAX-24 第 2 階段末與 FDA 會面以確認研究規模和人羣(預計 n~750/arm)OPA = Opsonophagocytic 活性;sT = 血清型;GMR = 幾何平均比率

2023 年 4 月肺炎鏈球菌是 導致肺炎球菌病 (PD) 的最常見病原體。僅在美國,每年就有約32萬例肺炎球菌肺炎病例,導致約15萬人住院。侵入性肺炎球菌病 (IPD) 是 兩歲及以下兒童侵襲性疾病的主要原因。在美國和全球流行的PD菌株與高病死率、抗生素耐藥性和/或腦膜炎有關。肺炎球菌病的全球影響仍然很顯著由當前 PCV 以外的血清型驅動的循環 疾病 Gierke 2015 https://www.cdc.gov/pneumococcal/clinicians/clinical-features.html
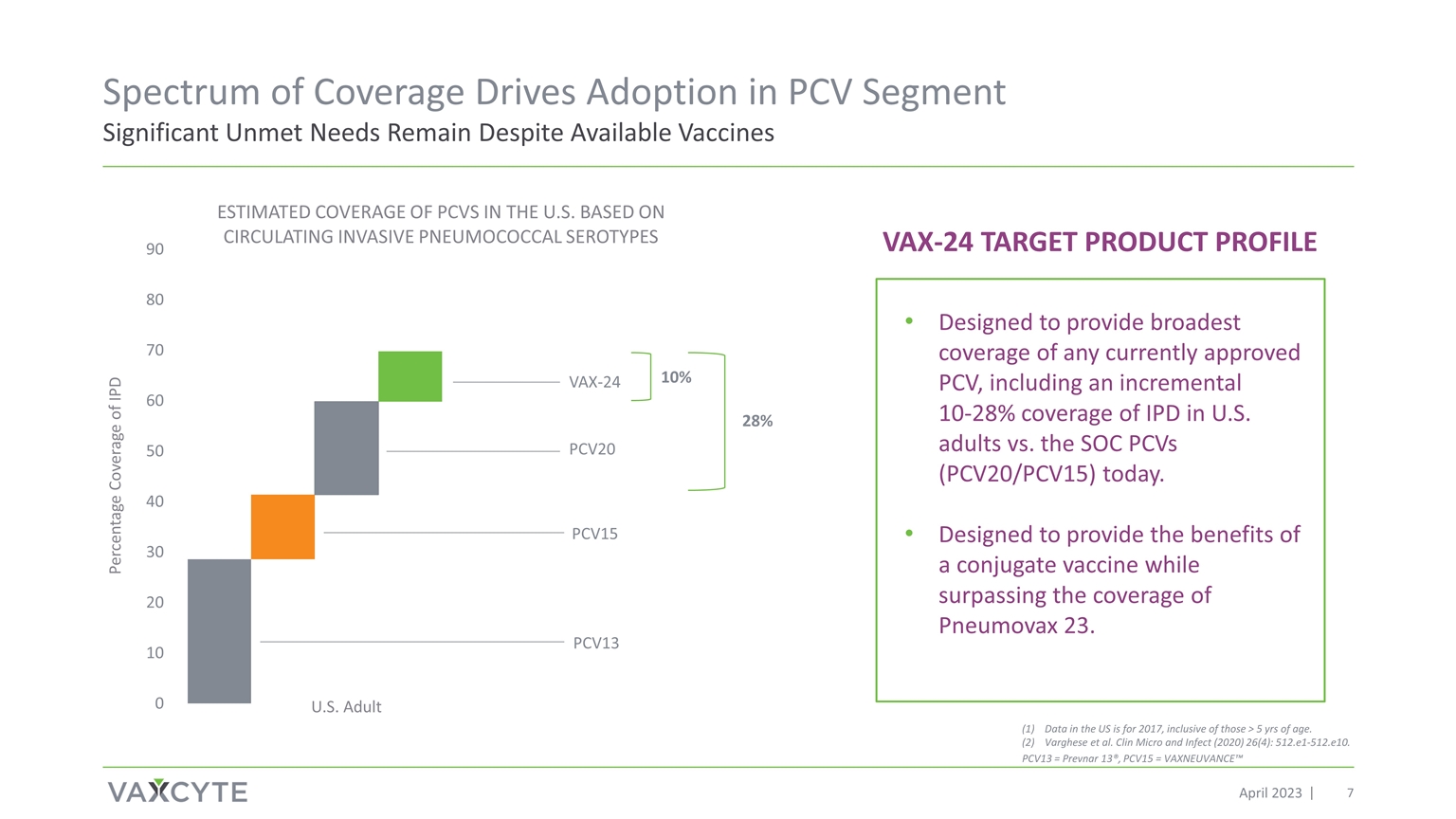
2023年4月覆蓋範圍推動PCV細分市場採用 儘管有2017年的疫苗數據,但仍有大量未滿足的需求,包括5歲以上的疫苗。Varghese 等人。Clin Micro and Infect (2020) 26 (4):512.e1-512.e10。PCV20 PCV15 PCV13 專為 提供目前批准的所有PCV中最廣泛的覆蓋範圍,包括與當今的SOC PCV(PCV20/PCV15)相比,美國成年人IPD的覆蓋率增加了10-28%。旨在提供偶聯疫苗的好處,同時超過 Pneumovax 23 的覆蓋範圍。VAX-24 目標產品概況 10% 28% PCV13 = Prevnar 13®,PCV15 = VAXNEUVANCE™
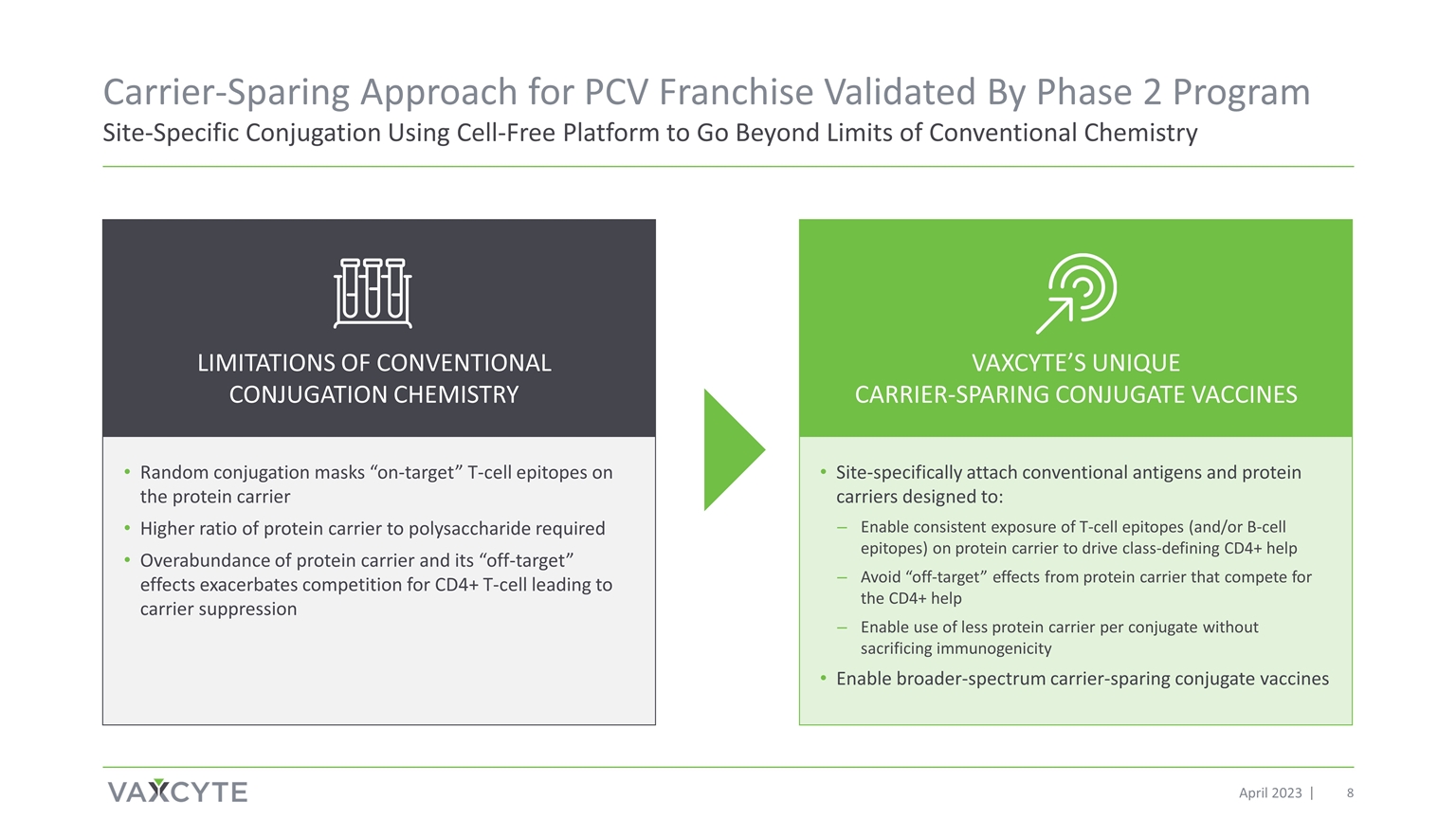
2023 年 4 月 PCV 特許經營的載體保留方法已通過第 2 階段項目位點特異性偶聯使用無細胞平臺進行驗證隨機偶聯掩膜蛋白載體上 “靶向” T 細胞表位蛋白載體與多糖的比例越高 蛋白載體與多糖的比率越高蛋白載體和其 “脱離靶標” 效應加劇了對 CD4+ T 細胞的競爭,導致載體抑制侷限性常規偶聯化學 位點特異性連接常規抗原和蛋白質載體設計用於:支持持續暴露在蛋白質載體上 T 細胞表位(和/或 B 細胞表位)以驅動定義類別的 CD4+ 幫助避免爭奪 CD4+ 的 蛋白載體產生的 “脱靶效應” 幫助在不犧牲免疫原性的前提下實現每個偶聯物使用更少的蛋白質載體啟用更廣譜的載體共軛疫苗 VAXCYTE 獨特的抗載體 CONCYTE JUGATE 疫苗
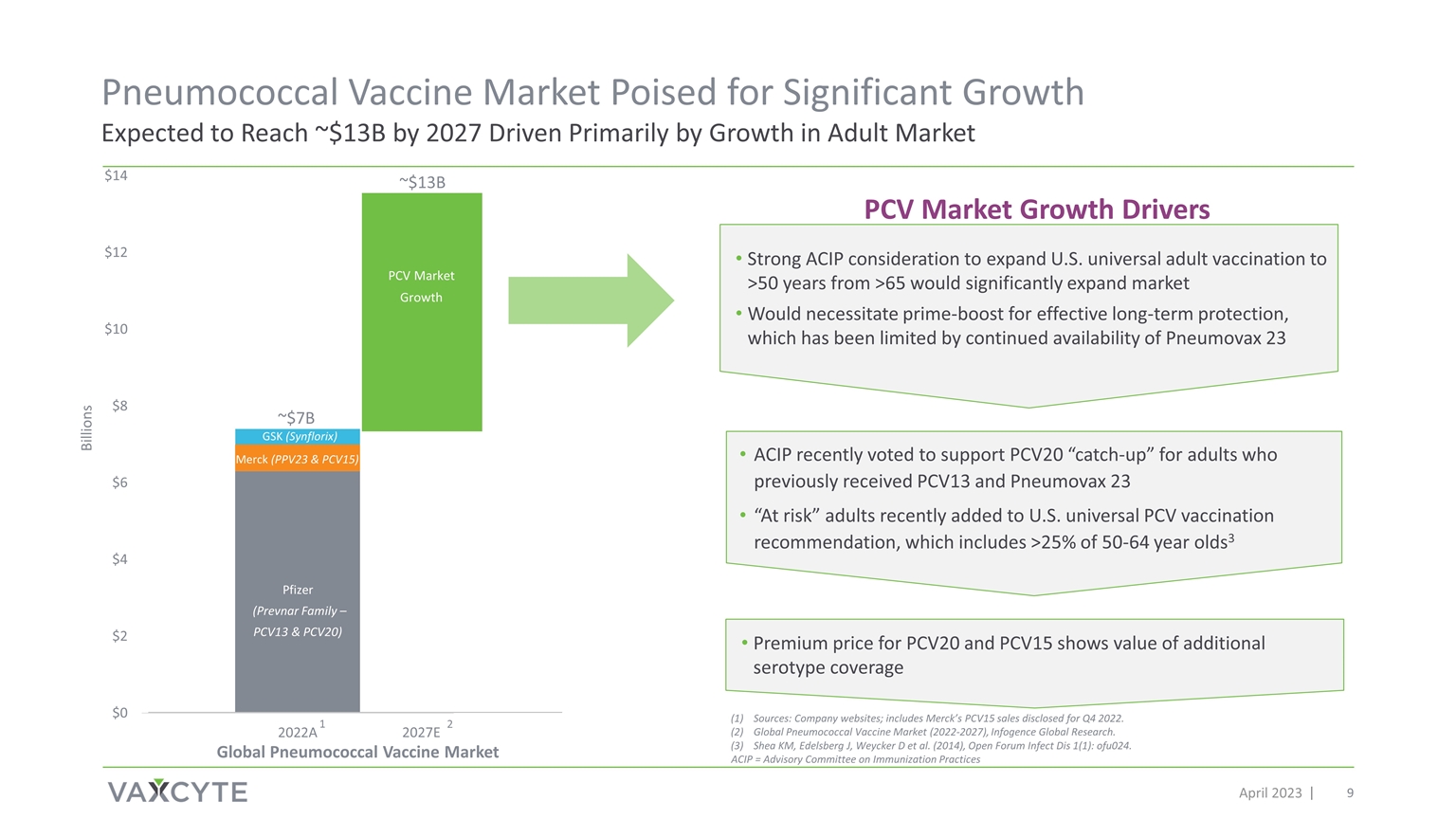
2023年4月約130億美元約70億美元市場增長 輝瑞(Prevnar Family — PCV13 和 PCV20)默克(PPV23 和 PCV15)葛蘭素史克(Synflorix)Billions 其他來源:公司網站;包括默克披露的2022年第四季度的 PCV15 銷售額。全球肺炎球菌疫苗市場(2022-2027),Infogence 全球研究。Shea KM、Edelsberg J、Weycker D 等(2014),Open Forum Infect Dis 1 (1):ofu024。ACIP 最近投票支持 PCV20 對之前接種 PCV13 和 Pneumovax 23 “處境危險” 的成年人 “迎頭趕上”。 最近加入了美國通用五氯苯疫苗接種建議,其中包括超過 25% 的 50-64 歲3 1 PCV 市場增長驅動因素 ACIP 強烈考慮將美國的全民成人疫苗接種從 65 歲擴大到 50 歲以上 將市場顯著擴張需要主要推動才能獲得有效的長期保護,這受到 Pneumovax 23 持續上市的限制 PCV20 的高級價格和 PCV15 顯示的價值為額外的血清型覆蓋範圍 2027E 2 全球肺炎球菌疫苗市場 PCV 市場增長肺炎球菌疫苗市場有望顯著增長,預計到 2027 年將達到約 13B 美元,這主要是由成人市場的增長推動的 ACIP = 免疫實踐諮詢委員會

VAX-24 針對 65 歲以上成年人的 2 期研究 2023 年 4 月

2023 年 4 月的研究設計
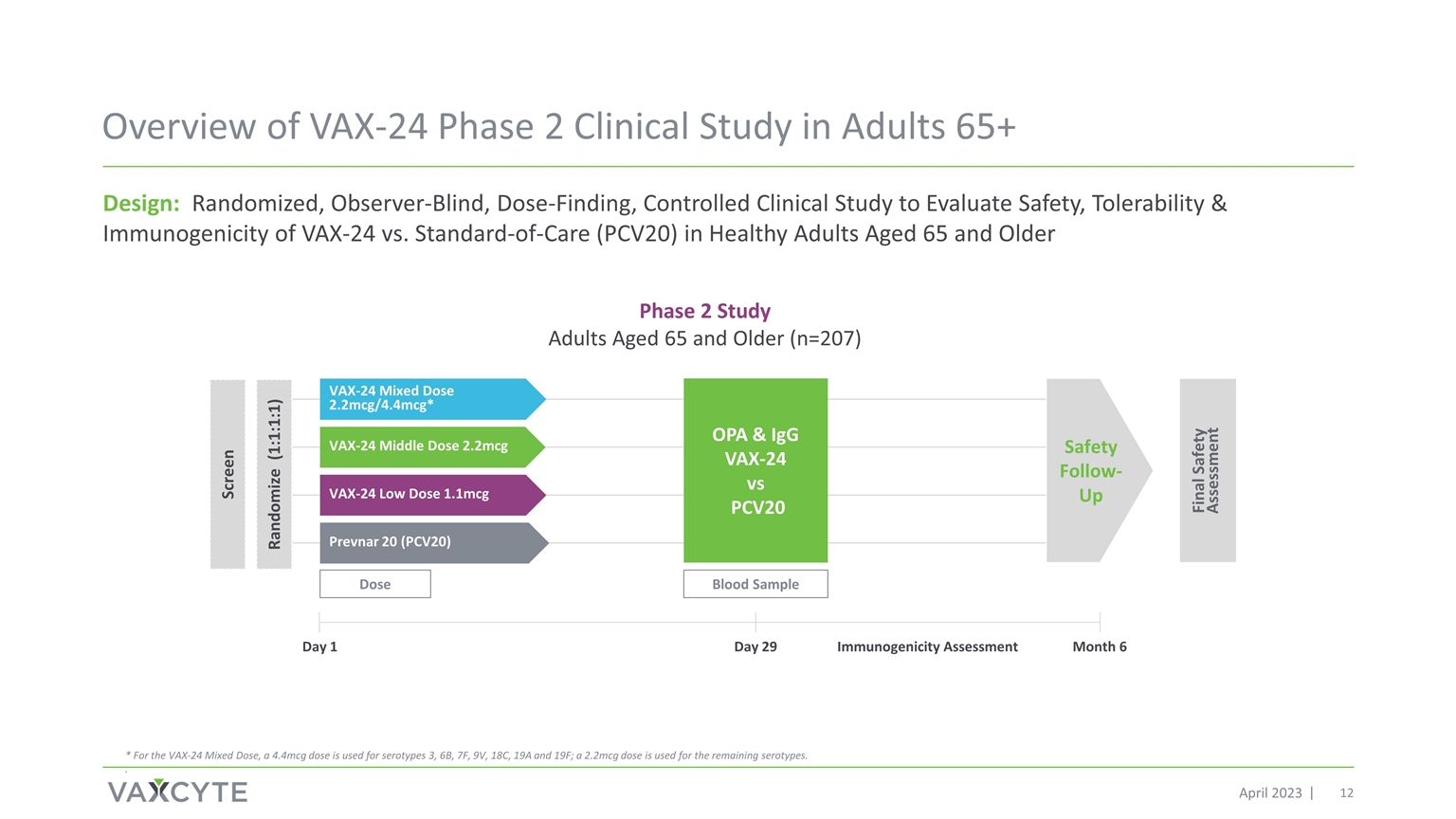
2023 年 4 月 65 歲以上成年人的 VAX-24 第 2 期臨牀 研究概述設計:隨機、觀察者失明、劑量發現、對照臨牀研究,旨在評估 65 歲及以上健康成年人 VAX-24 的安全性、耐受性和免疫原性 1 劑量 血液樣本 2 期研究 65 歲及以上成年人 (n=207) prevnar 20 (PCV20) VAX-24 低劑量 1.1mcg VAX-24 Middle Dose 2.2mcg VAX-24 混合劑量 2.2mcg/4.4mcg* OPA & IgG vs SOND 最終安全評估安全隨訪日 29 月 6 免疫原性評估隨機化 (PCV20 VAX-24 PCV201:1:1:1) 篩查 * 對於 VAX-24 混合劑量,4.4mcg 劑量用於血清型 3、6B、7F、9V、18C、19A 和 19F;2.2mcg 劑量用於其餘血清型。
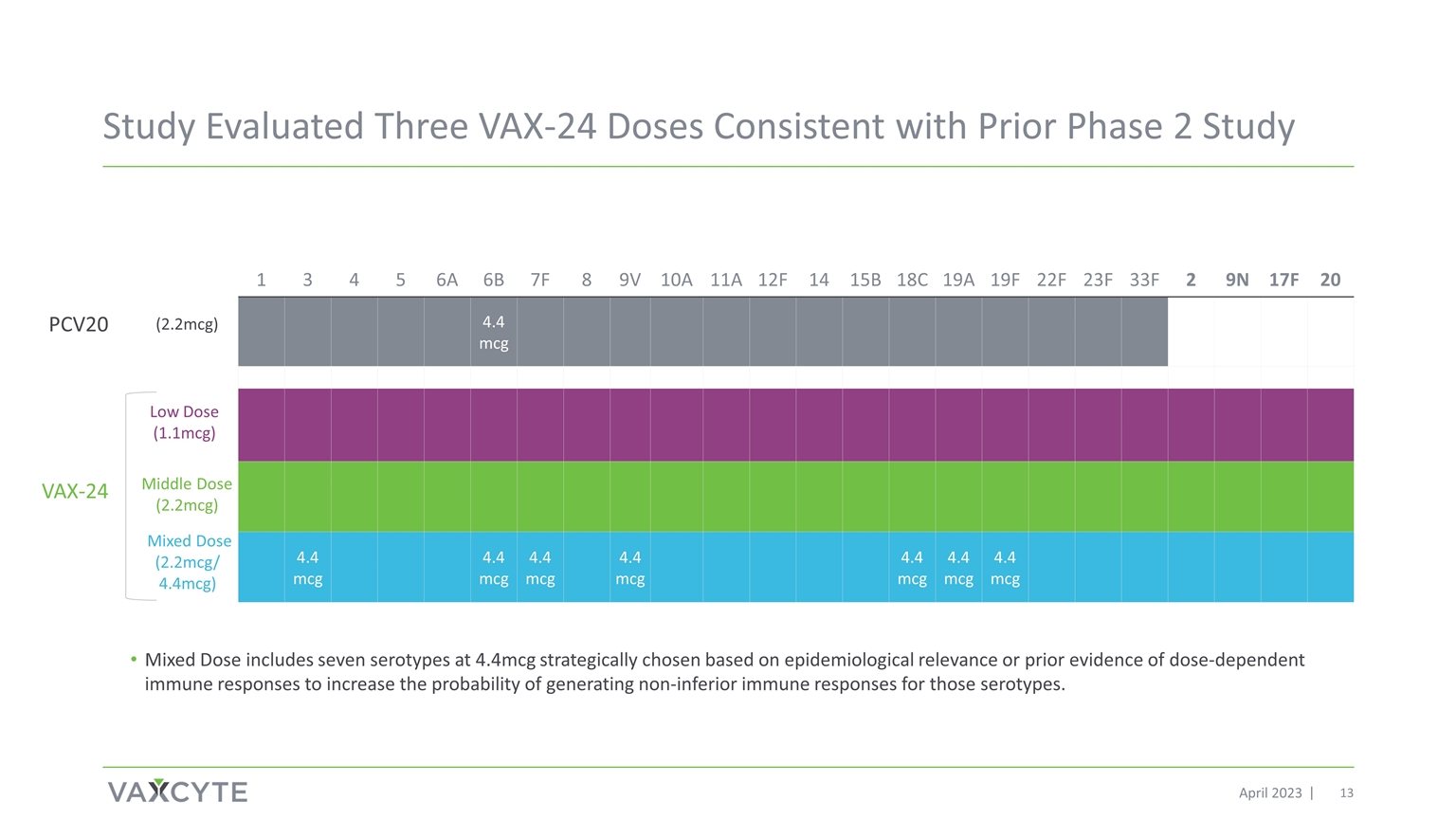
研究評估了三劑 VAX-24 劑量 與之前的 2023 年 4 月第 2 階段研究一致 1 3 4 5 6A 6B 7F 8 9V 10A 11A 12F 14 15B 18C 19F 22F 23F 2 9N 17F 20 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg 4.4 mcg) 混合劑量 (2.2mcg/ 4.4mcg) PCV20 VAX-24 (2.2mcg) 混合劑量包括七種 4.4mcg 的血清型,根據流行病學相關性或先前的劑量依賴性免疫反應證據進行戰略選擇,以增加這些血清型產生非劣質免疫 反應的可能性。
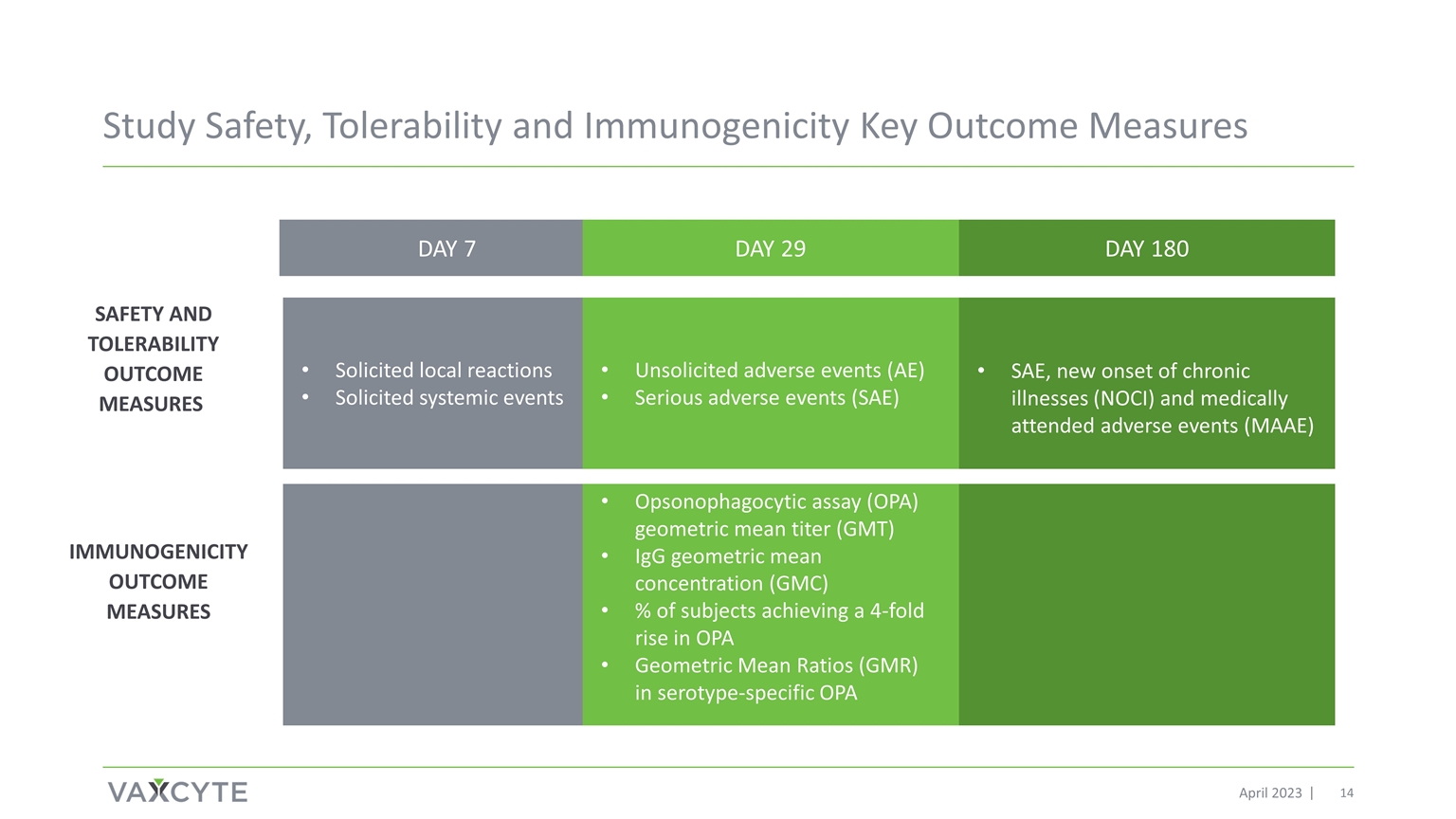
研究安全性、耐受性和 免疫原性關鍵結果衡量標準 2023 年 4 月安全性和耐受性結果衡量標準第 7 天 29 天第 180 天徵集的局部反應徵集的全身性事件未經請求的不良事件 (AE) 嚴重不良事件 (SAE)、慢性病新發 (NOCI) 和醫療輔助不良事件 (MAAE) Opsonophagocytical alsation astry (OPA) 幾何平均滴度 (GMT) 血清型特異性 OPA 幾何平均比率 (GMR) 提高了 4 倍的受試者的 IgG 幾何平均濃度 (GMC) 百分比OPA

2023 年 4 月 的配置和人口統計
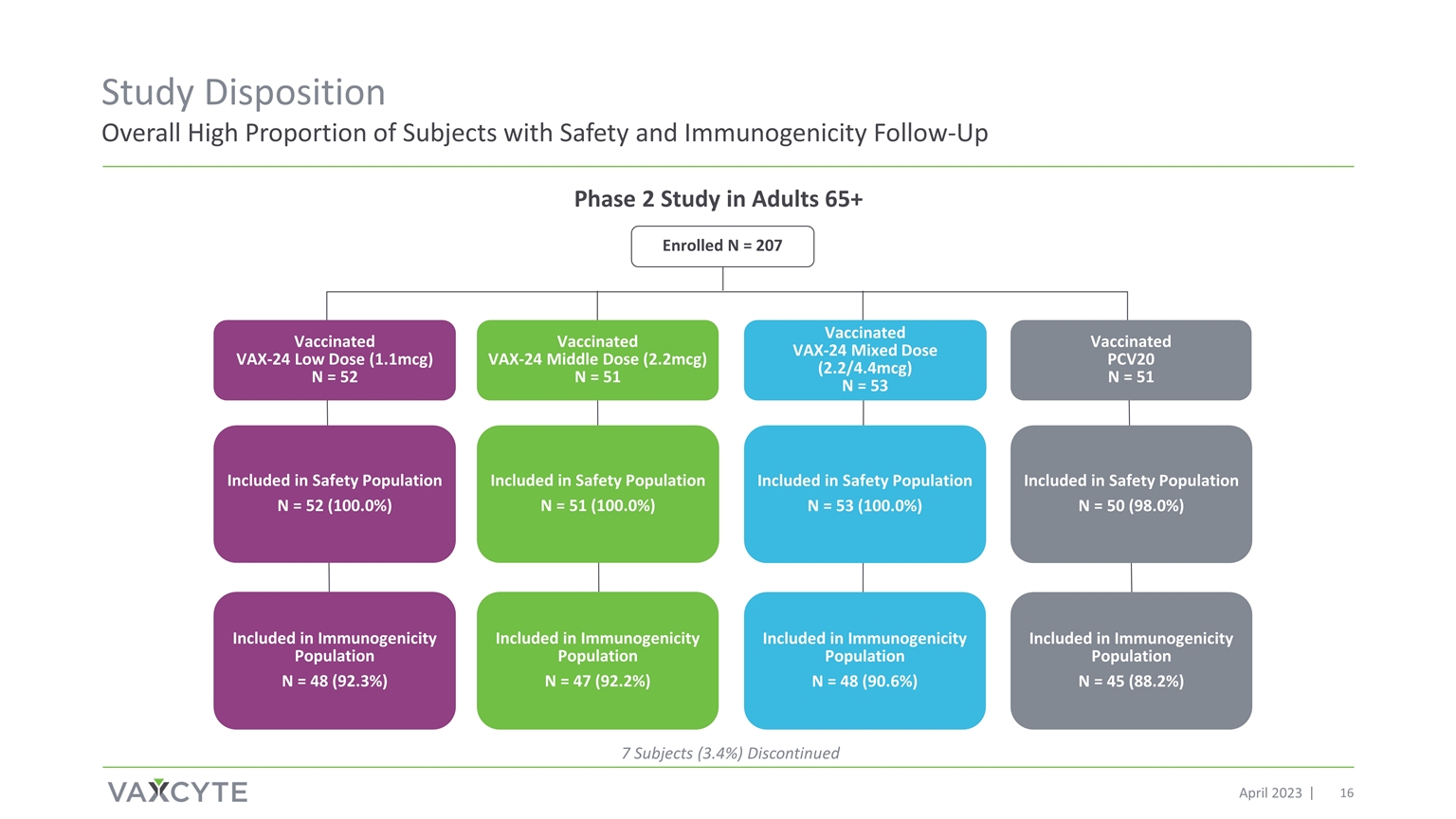
研究傾向總體較高 2023 年 4 月針對成人 65 歲以上 7 名受試者(3.4%)的第 2 階段研究 2 期研究已停止 N = 207 包含在安全人羣中 N = 50 (98.0%) 包含在安全人羣中 N = 53 (100.0%) 包含在安全人羣中 N = 51 (100.0%) 已接種疫苗 PCV20 N = 51 VAX-24 低劑量 (1.1mcg) N = 52 已接種疫苗 VAX-24 中間劑量 (2.2mcg) N = 51 已接種疫苗 VAX-24 混合劑量 (2.2/4.4mcg) N = 53 包含在免疫原性中免疫原性人羣 N = 48 (92.3%) 包含在免疫原性人羣 N = 47 (92.2%) 包含在免疫原性人羣 N = 48 (90.6%) 中 N = 45 (88.2%)
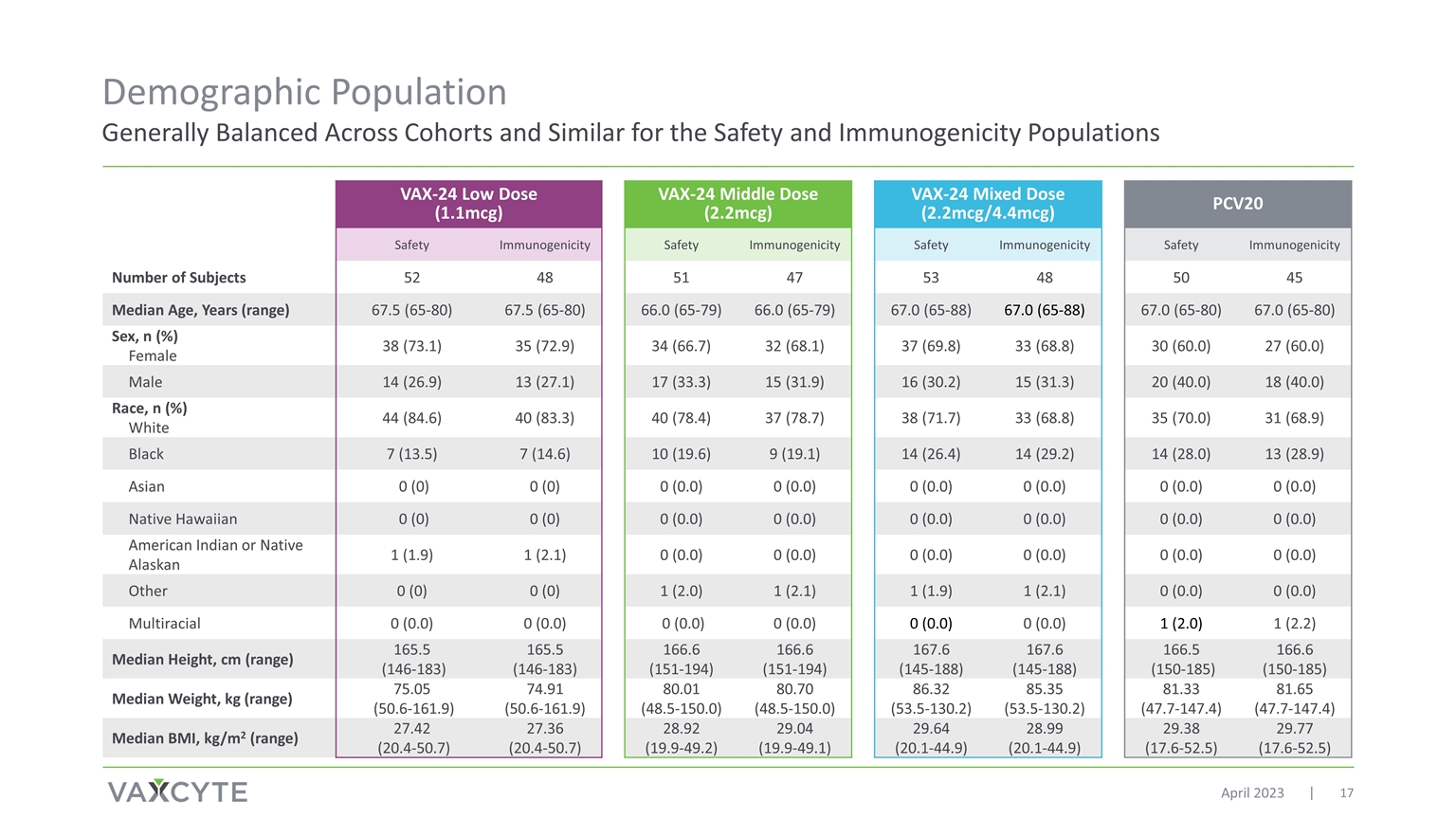
總體而言 安全性和免疫原性人羣在各組之間保持平衡 2023 年 4 月 VAX-24 低劑量 (1.1mcg) VAX-24 中劑量 (2.2mcg) VAX-24 混合劑量 (2.2mcg/4.4mcg) PCV20 安全性免疫原性安全性 免疫原性安全免疫原性受試者人數 52 48 51 47 53 48 50 45 中位年齡,歲 (range) 67.5 (65-80) 67.5 (65-80) 66.0 (65-79) 66.0 (65-79) 67.0 (65-88) 67.0 (65-88) 67.0 (65-80) 67.0 (65-80) 性別,n (%) 女 38 (73.1) 35 (72.9) 34 (66.7) 32 (68.1) 37 (69.8) 33 (68.8) 30(60.0) 27 (60.0) 男 14 (26.9) 13 (27.1) 17 (33.3) 15 (31.9) 16 (30.2) 15 (31.3) 20 (40.0) 18 (40.0) 種族,n (%) 白人 44 (84.6) 40 (83.3) 40 (78.4) 37 (78.7) 33 (68.8) 35 (70.0) 31 60 (60.0) 8.9) 黑色 7 (13.5) 7 (14.6) 10 (19.6) 9 (19.1) 14 (26.4) 14 (29.2) 14 (28.0) 13 (28.9) 亞洲人 0 (0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 美洲印第安人或原住民 阿拉斯加人 1 (1.9) 1 (2.1) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 其他 0 (0) 0 (0) 1 (2.0) 1 (1.9)1 (2.1) 0 (0.0) 0 (0.0) 多人種 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 0 (0.0) 1 (2.2) 中位身高,cm(範圍)165.5 (146-183) 165.5 (146-183) 166.6 (151-194) 166.6 (151-194) 167.6 (145-188) 167.6 (145-188) 167.6 (145-188) 167.6 (145-188) 166.5 (150-185) 166.6 (150-185) 中位重量,kg(範圍)75.05 (50.6-161.9) 74.91 (50.6-161.9) 80.01 (48.5-150.0) 86.32 (53.5-130.2) 85.35 (53.5-130.2) 81.33 (47.7-147.4) 81.65 (47.7-147.4) 81.65 (47.7-147.4) 81.65 (47.7-147.4) 體重指數中位數,kg/m2(範圍)27.42 (20.4-50.7) 27.36 (20.4-50.7) 28.92 (19.9-49.2) 29.64 (20.1-44.9) 28.99 (20.1-44.9) 29。38 (17.6-52.5) 29.77 (17.6-52.5)

2023 年 4 月 安全性和耐受性數據
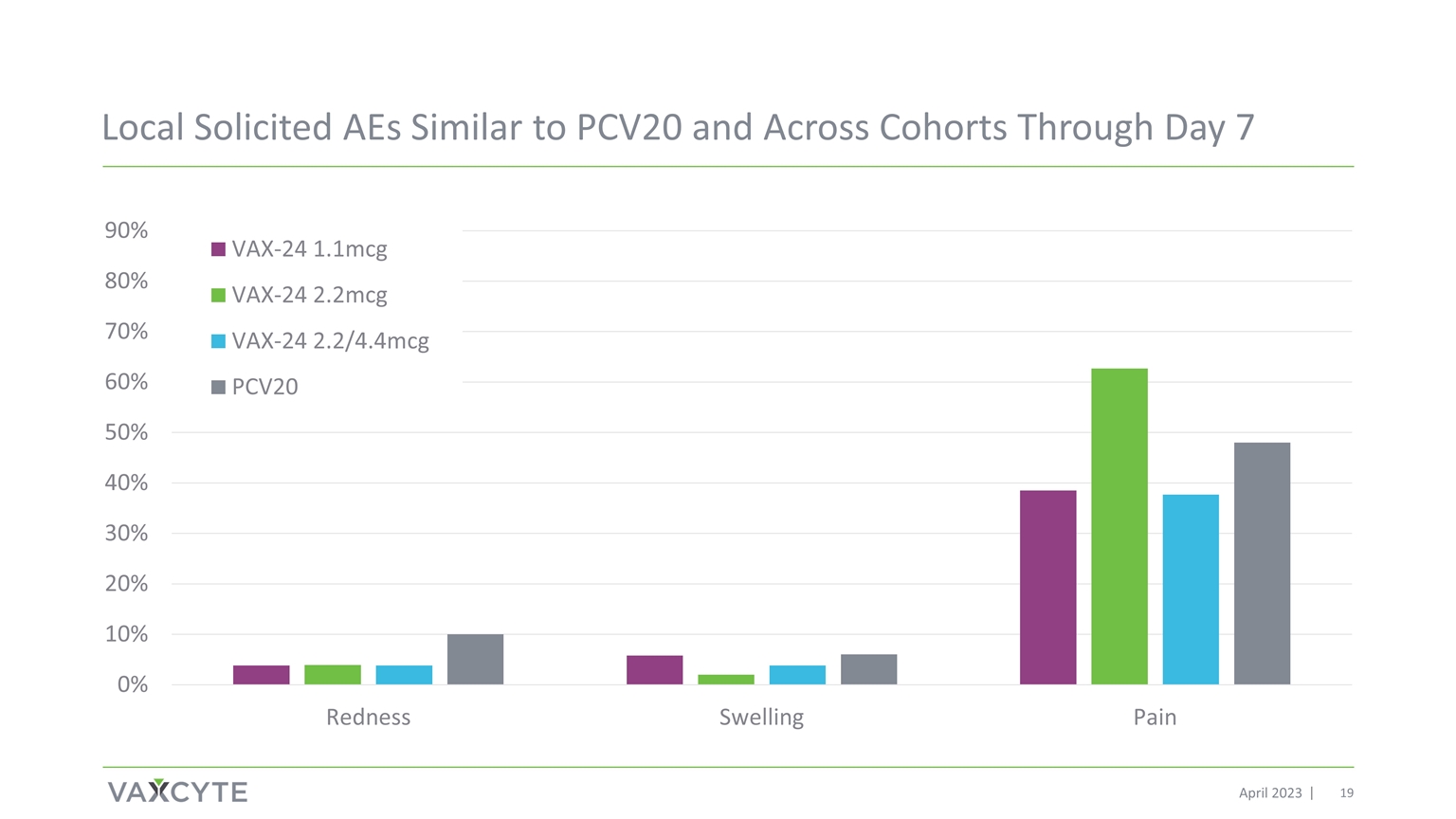
截至 2023 年 4 月 7 日,本地徵集的與 PCV20 相似的 AE 以及跨羣組的 AE
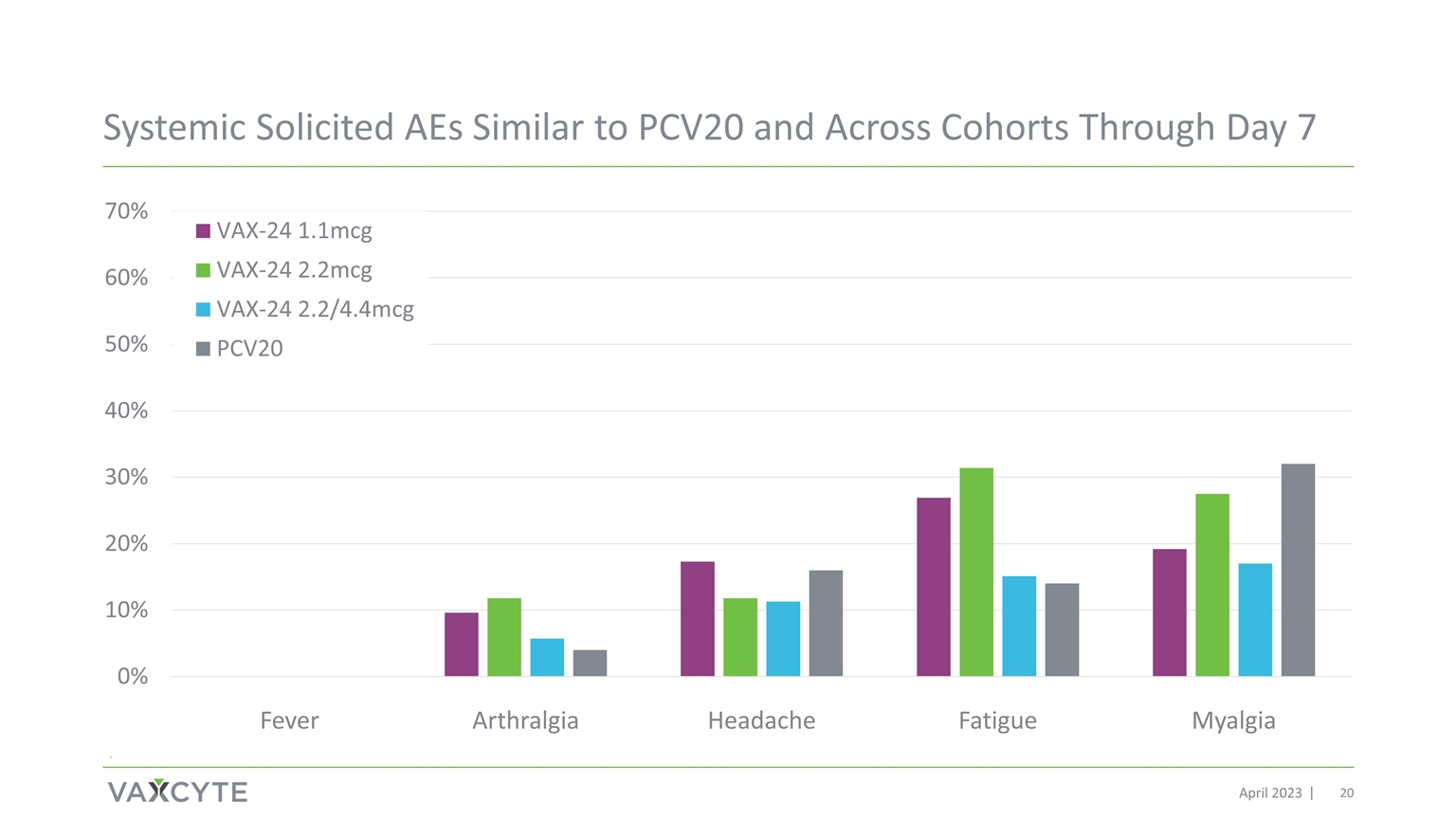
截至 2023 年 4 月 7 日,系統性徵集與 PCV20 相似的 AE 和跨羣組。

2023 年 4 月 免疫原性數據

VAX-24 中四種增量 血清型的標準:優越性:從第 1 天到第 29 天增加大於 4 倍的參與者比例差異的雙側 95% 置信區間的下限大於 10% OPA 的雙面 95% 置信區間的下限 GMR 的下限大於 2.0 對 VAX-24 和 PCV20 常見的 20 種血清型的標準:非低級:雙面 95% 置信區間的下限 OPA GMR 大於 0.5 優越性:OPA GMR 的雙面 95% 置信區間的下限大於 差值的雙面 95% 置信區間的下限從第1天到第29天增加≥4倍的參與者的比例大於02023年4月的第2/3期PCV免疫原性研究的先例監管標準 CI = 置信區間。
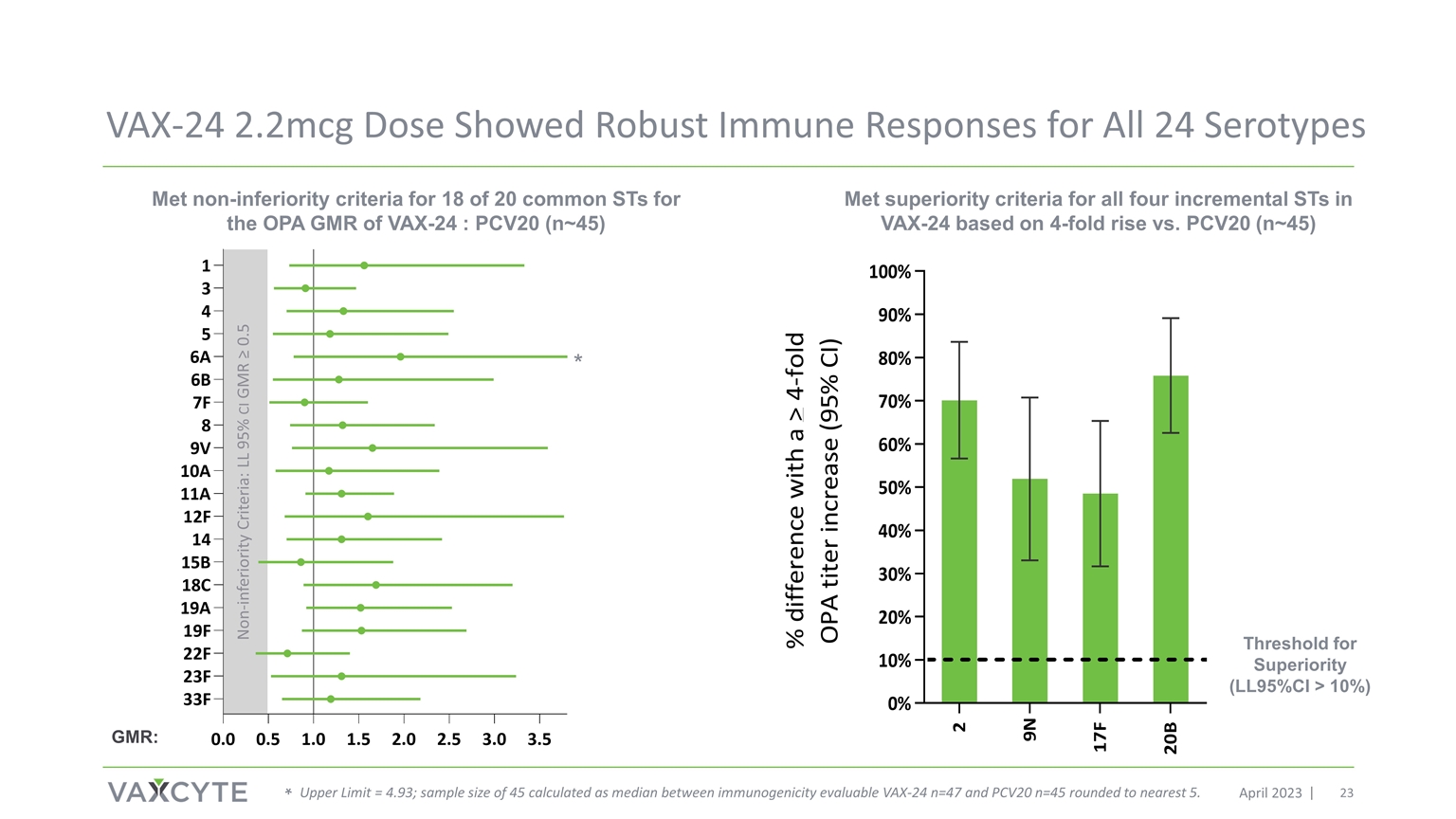
VAX-24 2.2mcg 劑量 2023 年 4 月所有 24 種血清型均顯示出強勁 免疫反應 VAX-24 OPA GMR 的 20 個常見 ST 中有 18 個符合非劣等標準:PCV20 (n~45) 與 PCV20 相比上升 4 倍(n~45) 非低級標準:LL 95% 置信區間 GMR ≥ 0.5 優勢閾值(LL 95% 置信區間 > 10%) * * 上限 = 4.93;樣本量為 45,按可評估的免疫原性 VAX-24 n=47 和 PCV20 n=45 之間的中位數計算,四捨五入到最接近的 5。VAX-24 GMR:
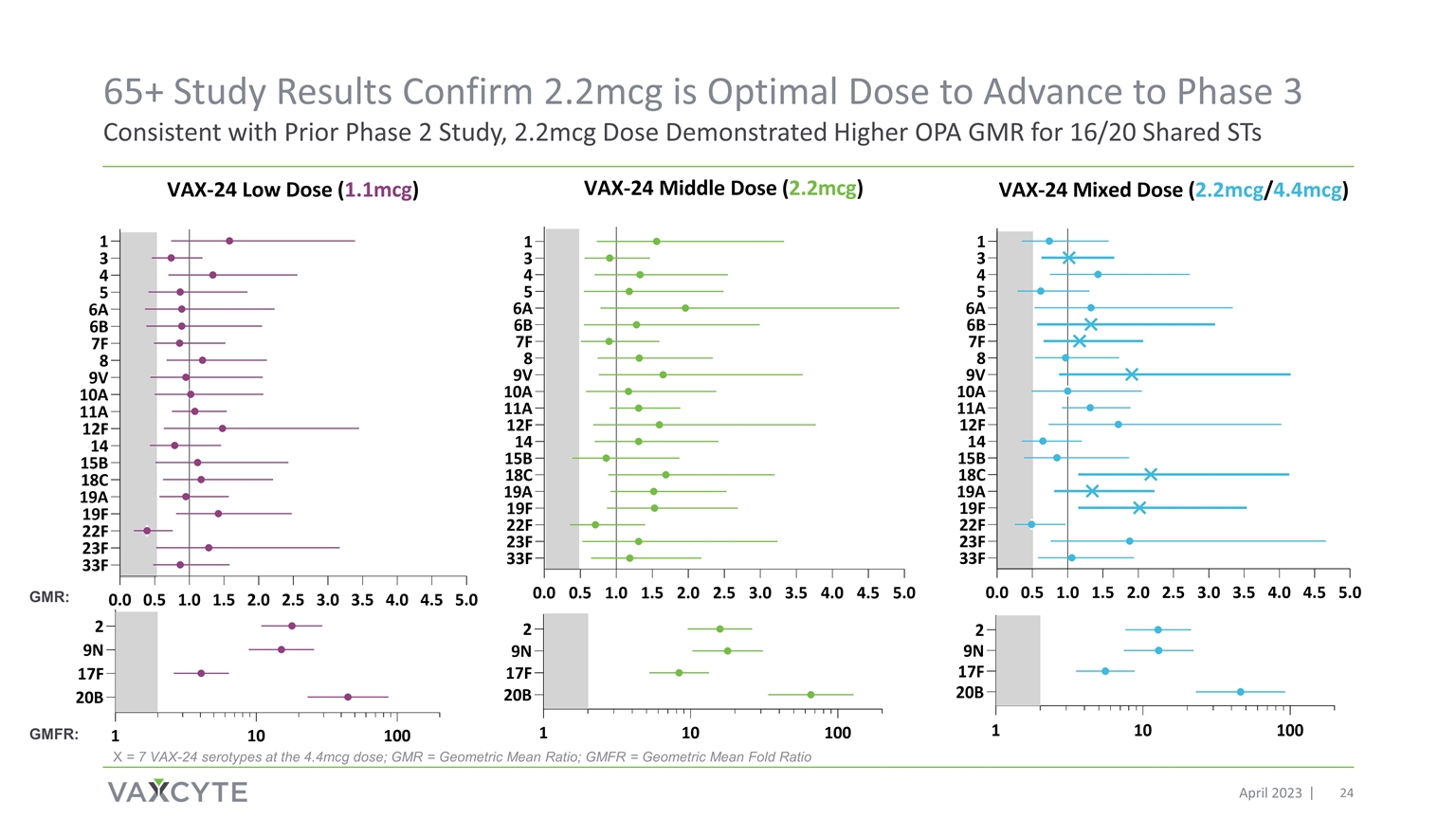
65+ 研究結果證實 2.2mcg 是 進入第 3 階段的最佳劑量,與之前的 2 期研究一致,2.2mcg 劑量顯示出 16/20 個共享 ST 的 OPA GMR 更高 X = 在 4.4mcg 劑量下為 7 個 VAX-24 血清型;GMR = 幾何平均摺疊比 GMR:GMFR:
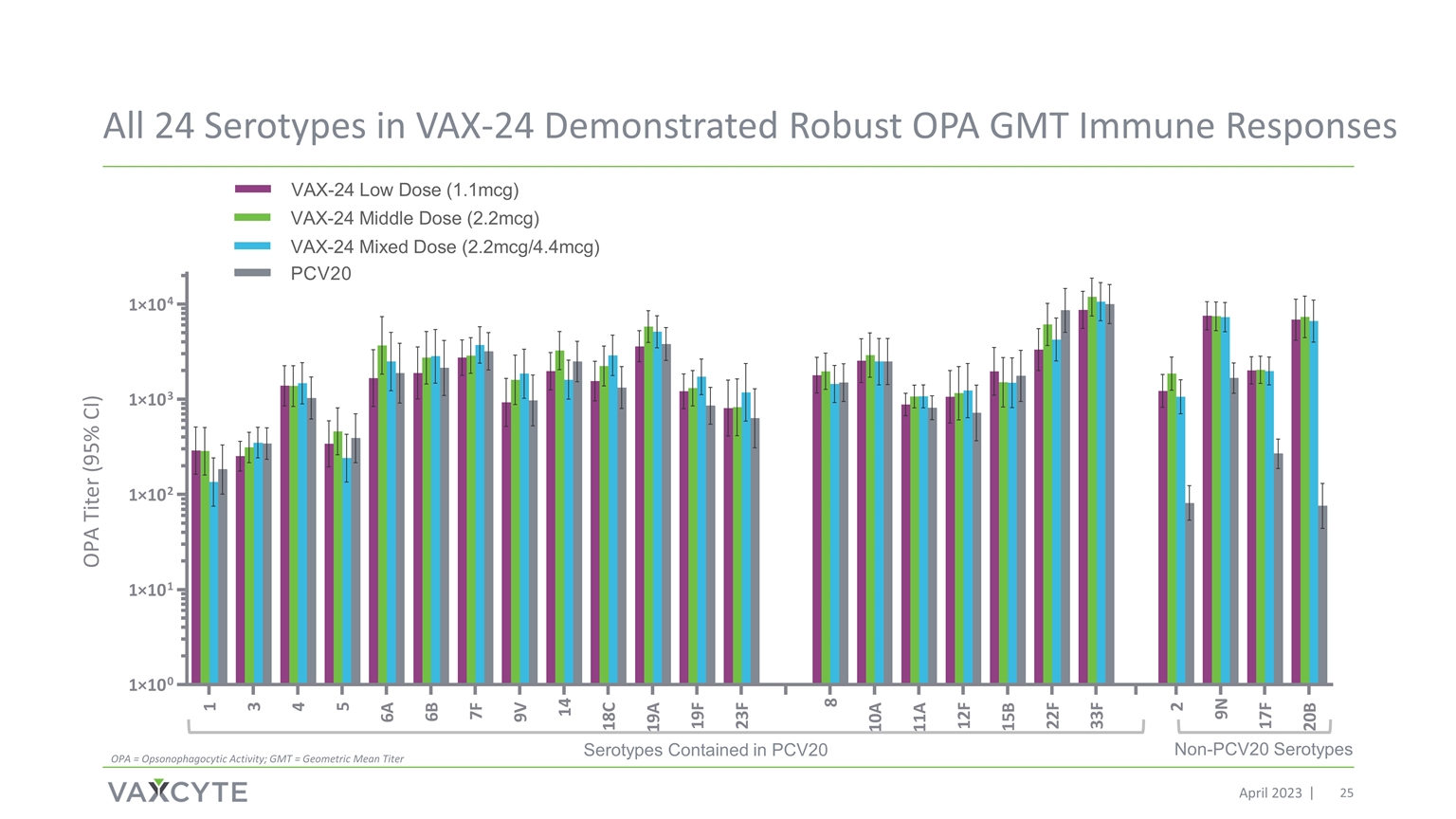
VAX-24 中的所有 24 種血清型都顯示出強大的 OPA GMT 免疫反應包含在 PCV20 中的血清型 2023 年 4 月非 PCv20 血清型 OPA = 食道細胞活性;GMT = 幾何平均滴度
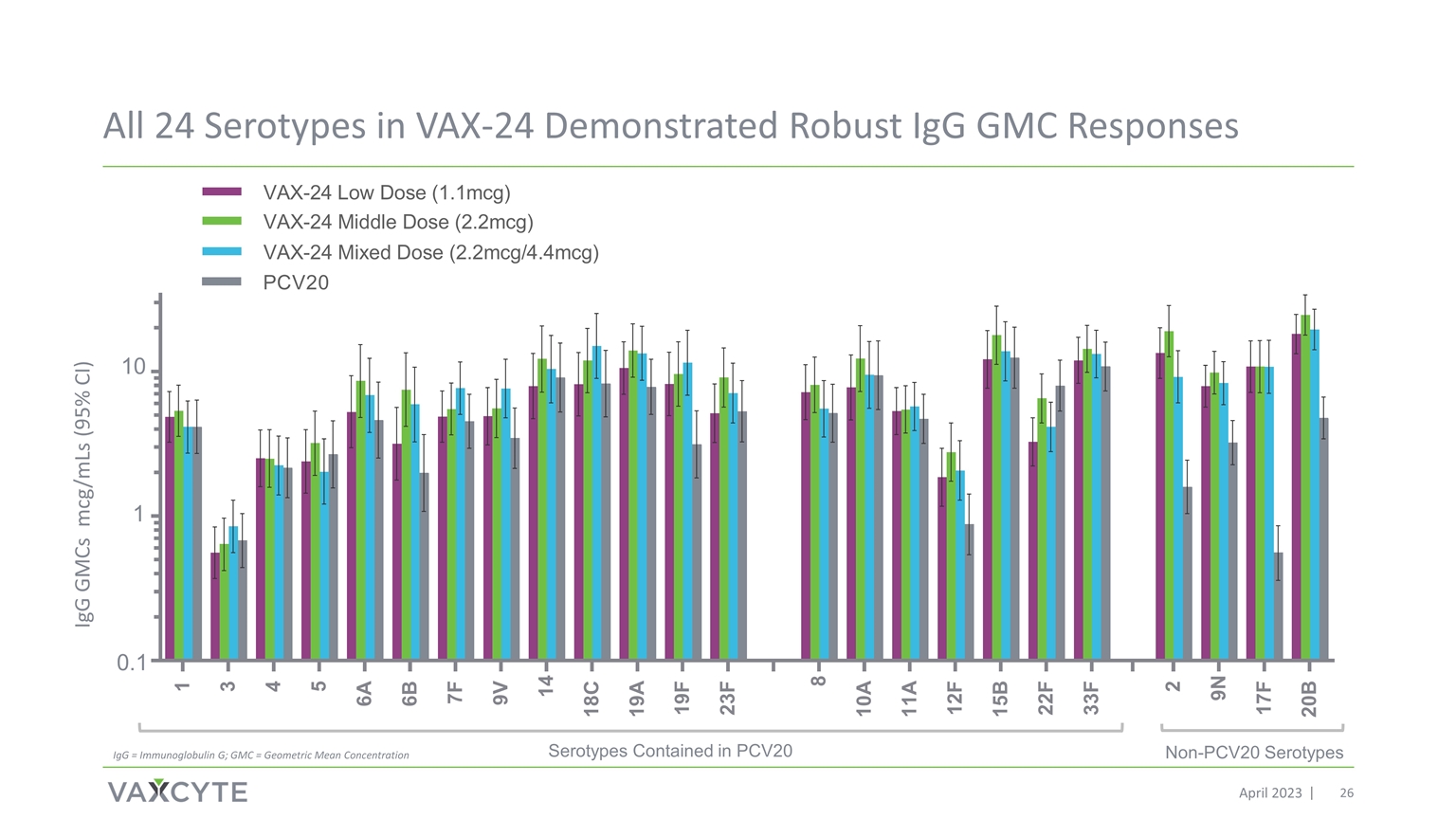
VAX-24 中的所有 24 種血清型都表現出強勁的 IgG GMC 反應 PCV20 中包含的非 PCv20 血清型血清型 2023 年 4 月 0.1 1 10 IgG GMCs mcg/MLS (95% 置信區間) IgG = 免疫球蛋白 G;GMC = 幾何平均濃度

2023 年 4 月兩項 VAX-24 第 2 期成人研究的預先指定的合併免疫原性 分析
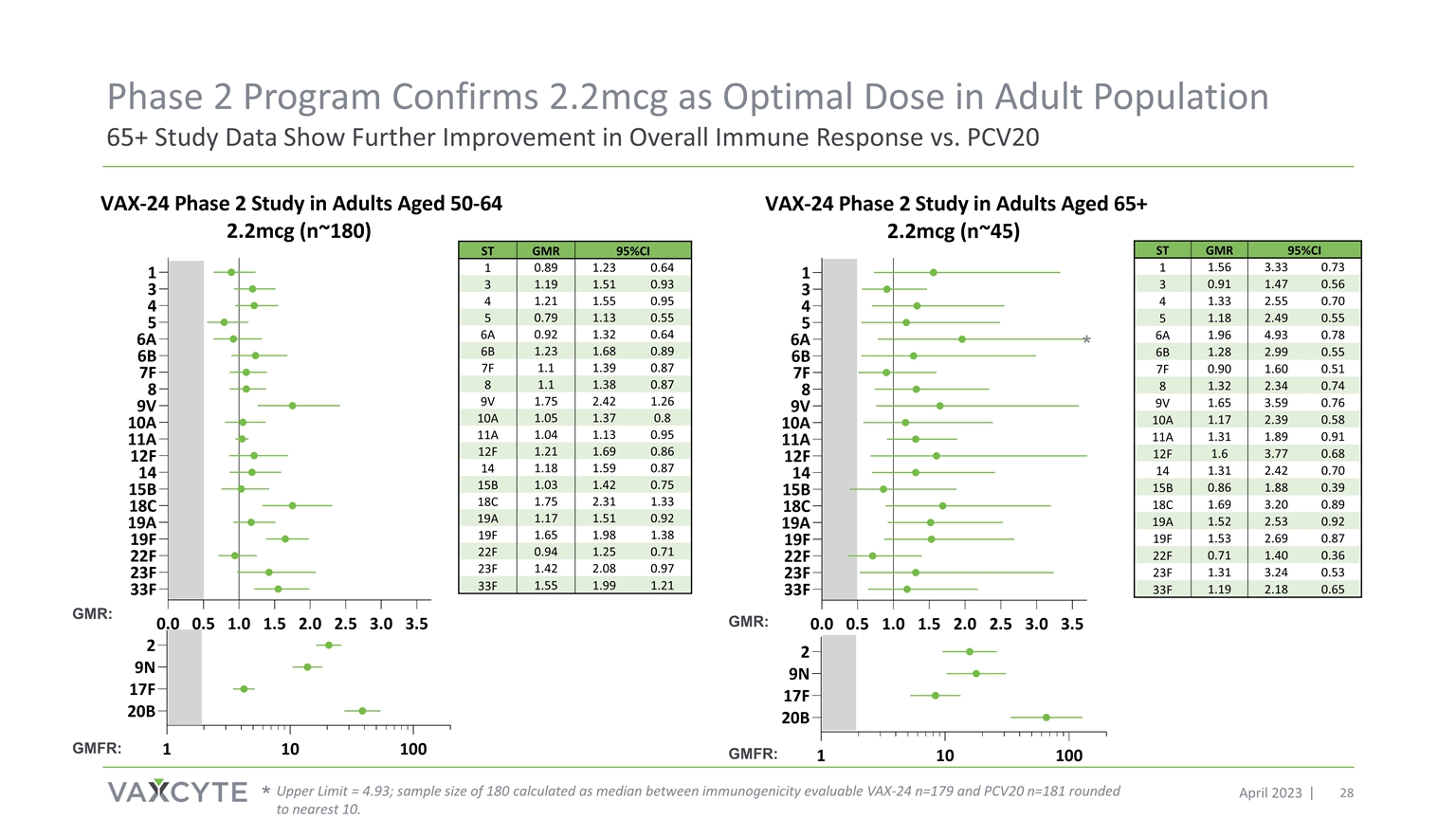
ST GMR 95% 置信區間 1 1.56 3.33 0.73 3 0.91 1.47 0.56 4 1.33 2.55 5 2.49 0.55 6A 1.96 4.93 0.89 0.55 7F 0.90 1.60 0.51 8 1.32 2.34 9V 1.65 3.59 10A 1.17 2.39 0.58 11A 1.31 1.91 12F 1.77 0.68 14 1.31 2.42 0.70 15B 0.86 1.88 0.39 18C 1.69 3.20 0.89 19A 1.53 2.53 0.92 19F 1.53 2.69 0.87 22F 0.71 1.40 0.36 23F 1.31 3.24 0.19 2.18 0.65 第二階段計劃證實 2.2mcg 是成年人羣的最佳劑量研究數據顯示,與 2023 年 4 月的 PCV20 相比,整體免疫反應進一步改善 * 上限 = 4.93;樣本180 的大小按可評估的免疫原性 VAX-24 n=179 和 PCV20 n=181 之間的中位數計算得出,四捨五入到最接近的 10。* ST GMR 95% 置信區 1 0.89 1.23 0.64 1.55 0.95 0.79 1.13 0.55 6A 0.92 0.64 6B 1.23 1.68 1.39 1.39 1.87 1.38 1.38 0.87 9V 1.75 2.42 1.26 10A 1.05 1.37 0.8 11A 1.04 1.13 0.95 12F 1.21 1.69 1.69 14 1.18 1.59 0.87 15B 1.42 0.75 2.33 1.33 1.51 1.92 19F 1.65 1.98 1.38 22F 0.71 23F 1.42 2.08 0.97 1.59 1.21 GMR:GMFR:GMR:GMFR:
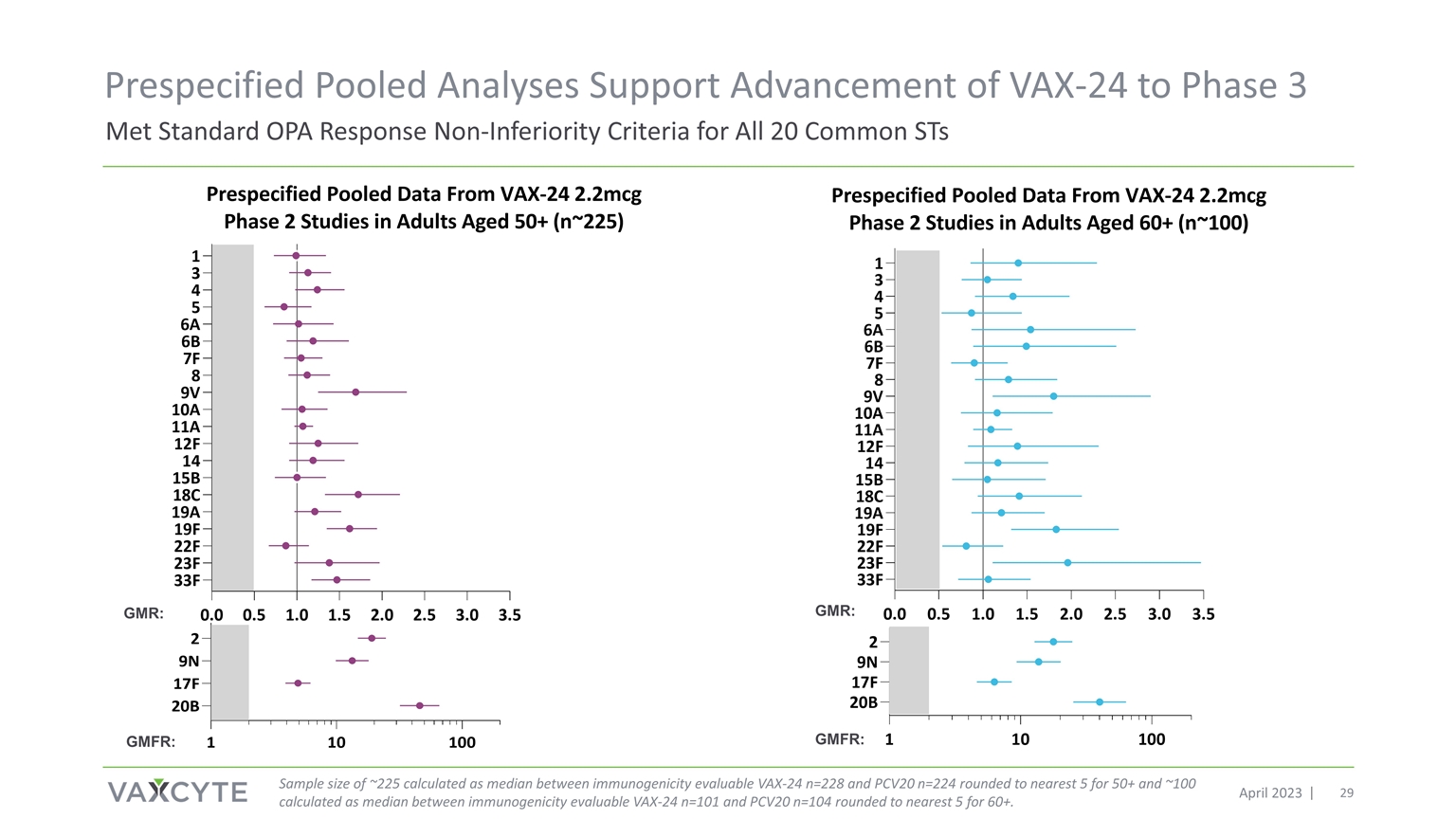
符合標準 OPA 響應 所有 20 個常見 ST 的非劣等標準預先指定的彙總分析支持將 VAX-24 推進到 2023 年 4 月 3 日樣本量約 225 的樣本量根據免疫原性可評估的 VAX-24 n=228 和 PCV20 n=224 之間的中位數四捨五入到最接近的 5 和 100 之間的中位數計算得出 60+ 的免疫原性可評估值 VAX-24 n=101 和最接近 PCV20 n=104 之間的中位數。GMR: GMFR: GMR: GMFR:

來自 2023 年 4 月兩項 VAX-24 成人研究的完整六個月安全性和 耐受性數據
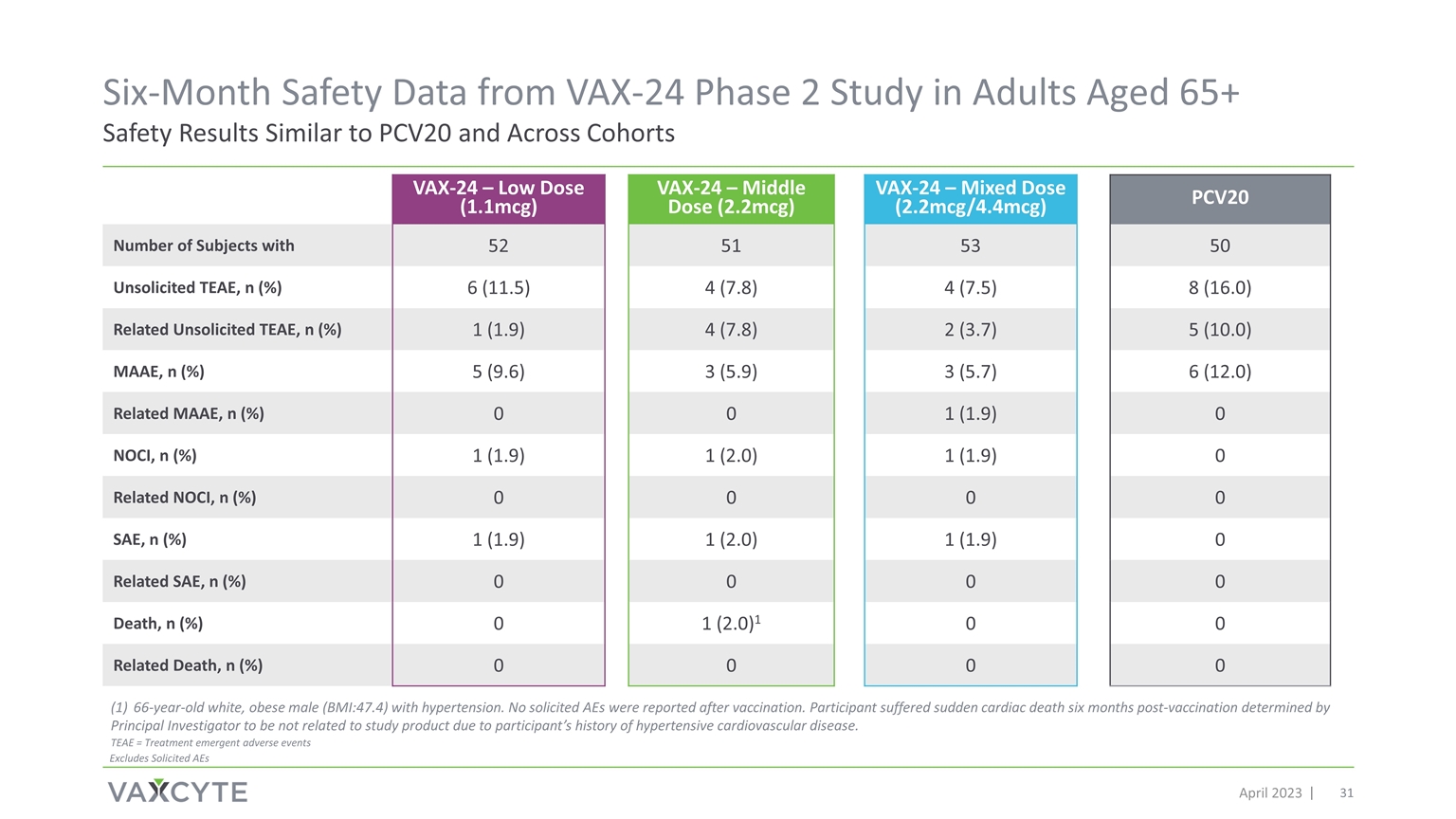
來自 65 歲以上成年人的 VAX-24 第 2 期研究的六個月安全數據 2023 年 4 月安全結果與 PCV20 相似 VAX-24 — 低劑量 (1.1mcg) VAX-24 — 中劑量 (2.2mcg) VAX-24 — 混合劑量 (2.2mcg/4.4mcg) PCV20 擁有 52 51 53 50 未經請求的 TEAE 的受試者人數,n (%) 6 (11.5) 4 (7.8) 4 (7.5) 8 (16.0)) 相關未經請求的 TEAE,n (%) 1 (1.9) 4 (7.8) 2 (3.7) 5 (10.0) MAAE,n (%) 5 (9.6) 3 (5.9) 3 (5.7) 6 (12.0) 相關 MAAE,n (%) 0 1 (1.9) NOCI,n (%) 1 (1.9) 1 (2.0) 1 (1.9) 相關的 NOCI,n (%) 0 0 0 0 SAE,n (%) 1 (1.9) 1 (2.0) 1 (1.9) 1 (1.9)0 相關 SAE,n (%) 0 0 0 死亡,n (%) 0 1 (2.0) 1 0 0 相關死亡,n (%) 0 0 0 66 歲的白人肥胖男性 (BMI: 47.4) 患有 高血壓。疫苗接種後未報告任何被徵集的 AE。由於參與者有 高血壓心血管疾病史,參與者在疫苗接種六個月後心髒性猝死,首席研究員認定該參與者與研究產品無關。TEAE = 治療緊急不良事件不包括徵集的 AE
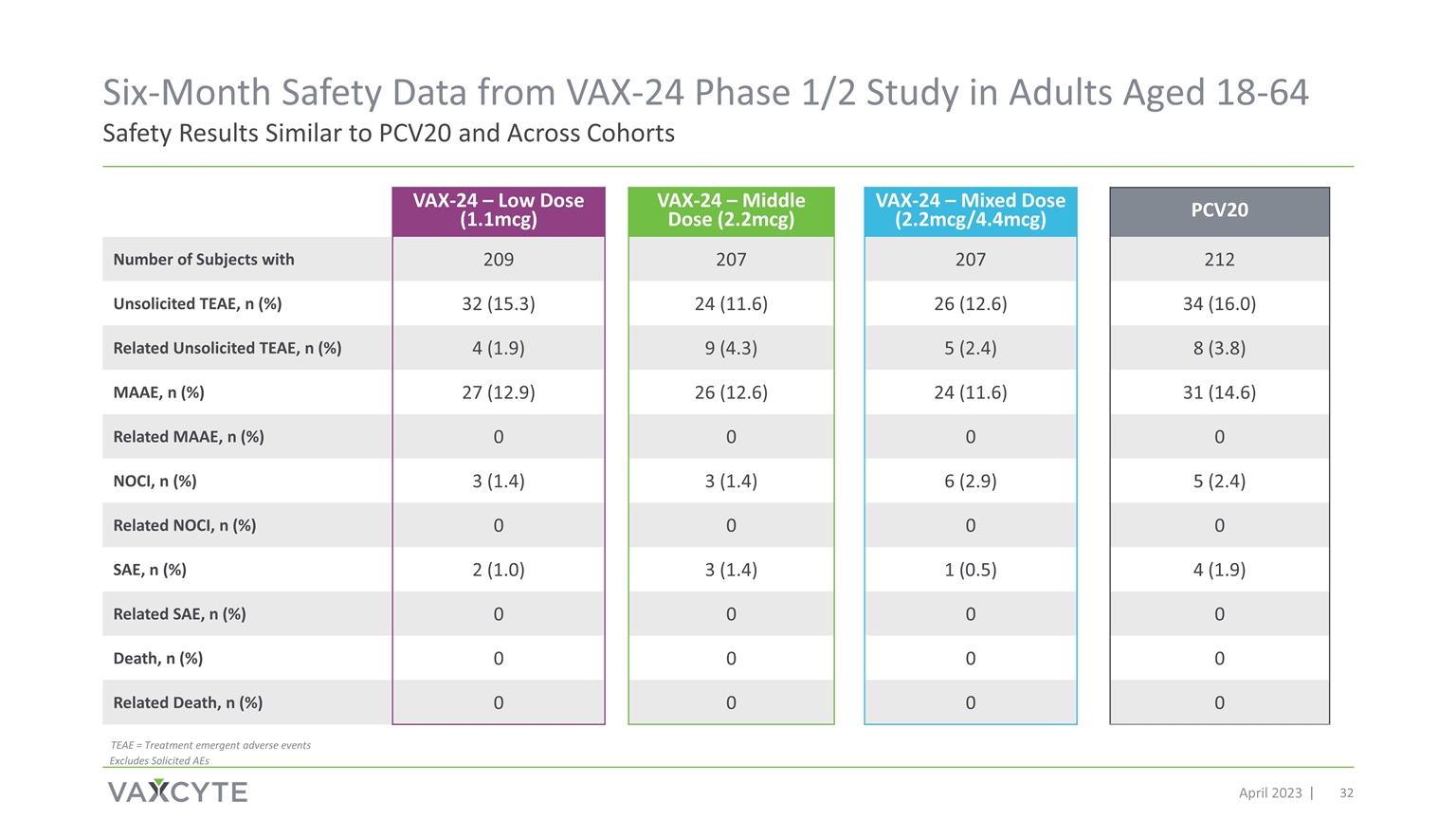
來自 VAX-24 第 1/2 期研究的六個月安全數據 2023 年 4 月針對 18-64 歲成年人的安全結果與 PCV20 相似 VAX-24 — 低劑量 (1.1mcg) VAX-24 — 中劑量 (2.2mcg) VAX-24 — 混合劑量 (2.2mcg/4.4mcg) PCV20 患有 209 207 212 未經請求的 TEAE 的受試者人數,n (%) 32 (15.3) 24 (11.6) 26 (12.6) 34 (12.6) 34 (16.0) 相關未經請求的 TEAE,n (%) 4 (1.9) 9 (4.3) 5 (2.4) 8 (3.8) MAAE,n (%) 27 (12.9) 26 (12.6) 24 (11.6) 31 (14.6) 相關 MAAE,n (%) 0 0 0 NOCI,n (%) 3 (1.4) 3 (1.4) 6 (2.9) 5 (2.4) 相關 NOCI,n (%) 0 0 0 SAE,n (%) 2 (1).0) 3 (1.4) 1 (0.5) 4 (1.9) 相關 SAE,n (%) 0 0 0 0 死亡,n (%) 0 0 0 相關死亡,n (%) 0 0 0 0 TEAE = 治療急症 不良事件不包括 AE
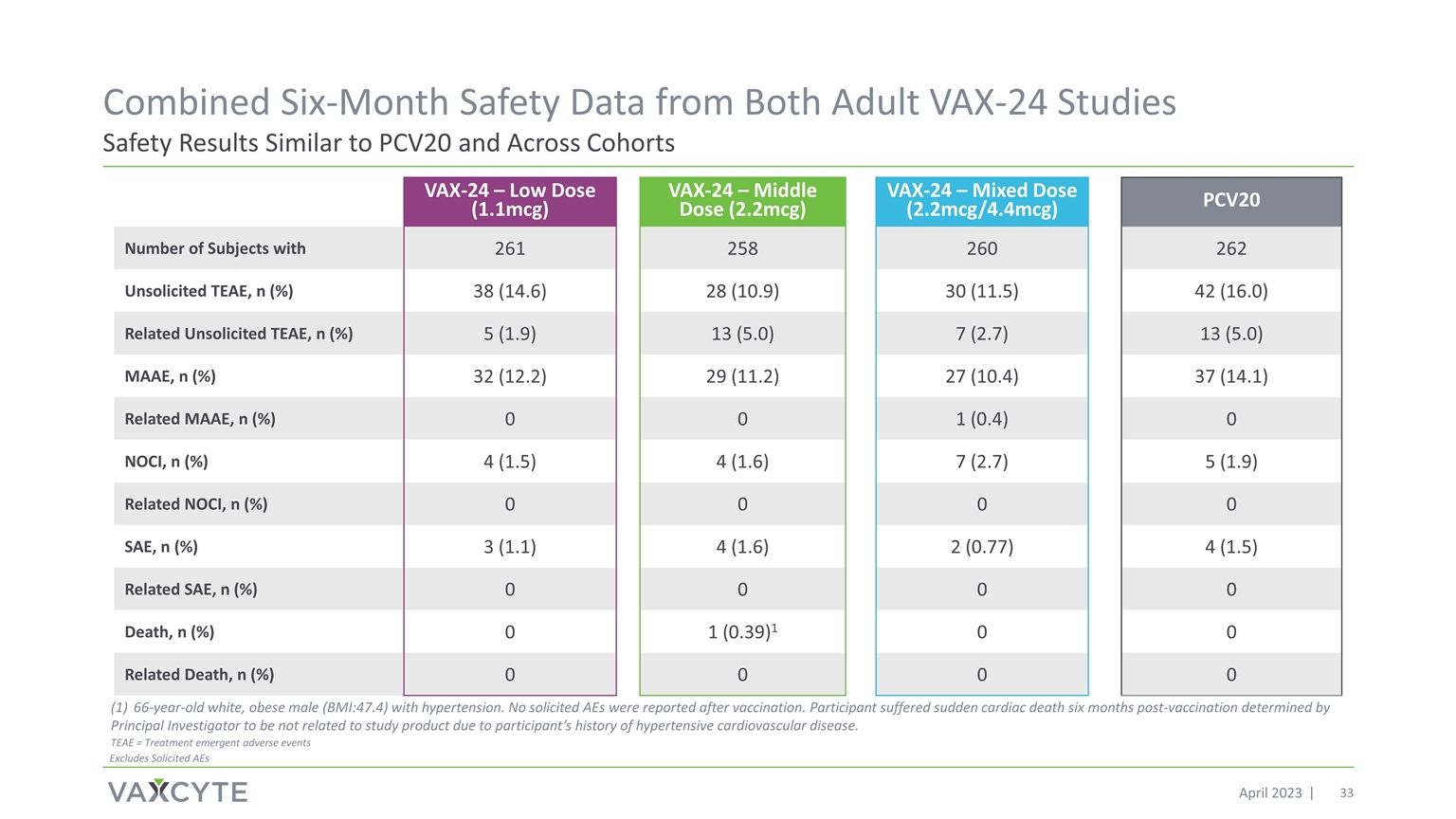
來自 的六個月綜合安全數據兩項成人 VAX-24 研究的安全結果均與 PCV20 相似 2023 年 4 月 VAX-24 — 低劑量 (1.1mcg) VAX-24 — 中劑量 (2.2mcg) VAX-24 — 混合劑量 (2.2mcg/4.4mcg) PCV20 擁有 261 258 260 262 未經請求的 TEAE 的受試者人數,n (%) 38 (14.6) 28 (10.9) 30 (11.5) 42 (16.0) 相關未經請求的 TEAE,n (%) 5 (1.9) 13 (5.0) 7 (2.7) 13 (5.0) MAAE,n (%) 32 (12.2) 29 (11.2) 27 (10.4) 37 (14.1) 相關 MAAE,n (%) 0 1 (0.4) 0 NOCI,n (%) 4 (1.5) 4 (1.6) 7 (2.7) 5 (1.9) 相關 NOCI,n (%) 0 0 0 SAE,n (%) 3 (1.1) 4 (1.6) 2 (0.77) 4 (1.5) 相關 SAE,n (%) 0 0 0 死亡,n (%) 0 1 (0.39) 1 0 0 相關死亡,n (%) 0 0 0 0 66 歲白人,肥胖男性 (BMI: 47.4) 患有高血壓。疫苗接種後未報告任何被徵集的 AE。由於參與者 有高血壓心血管疾病史,參與者在疫苗接種六個月後心髒性猝死,首席研究員認定該參與者與研究產品無關。TEAE = 治療緊急不良事件不包括徵集的 AE

第 2 階段項目結論、狀態 和後續步驟 2023 年 4 月

完整六個月的 VAX-24 數據 (n=779) 顯示安全性和耐受性結果與 PCV20 相似,免疫原性與 PCV20 相比有所改善,沒有劑量依賴性安全性和耐受性問題的證實 2.2mcg 是進入 3 期關鍵研究的最佳劑量在兩項 2 期研究中實現了所有 24 個血清型的靶免疫 反應在預先指定的彙總分析中符合所有 24 個 sT 的非劣性標準預計將在第三階段計劃(n~750/arm)中增加完善的監管途徑,有 多個批准先例基於替代免疫終點從歷史上看,第 2 階段和關鍵第 3 階段項目的一致研究設計和終點先例 3 期項目和 VAX-24 第 2 期數據支持在 終極成人年齡範圍內靈活選擇關鍵研究有積極的 2 期數據,Vaxcyte 很高興推進 VAX-24 進入第 3 階段 2 階段項目結果支持 VAX-24 具有同類最佳潛力 2023 年 4 月成功的 VAX-24 第 2 階段計劃實現了所有關鍵目標 3 關鍵計劃

預期 2023-2025 年 PCV 特許經營里程碑 Vaxcyte 正在推進 VAX-24 和 VAX-31 的臨牀開發,幾個關鍵里程碑即將到來 2023 年 4 月召開 FDA 第 2 階段結束會議,在 2025 年完成成人 3 期關鍵性非自卑研究的頂線安全性、耐受性和 免疫原性數據在 2H: 23 向美國食品藥品管理局提交成人 IND 申請宣佈安全,來自 2024 年成人 1/2 期研究的耐受性和免疫原性數據 VAX-24 成人 VAX-24 Infant VAX-31 成人宣佈截至2023年4月17日提供的2025年2期研究的初級三劑量免疫系列的主要安全性、耐受性和免疫原性數據。

2023 年 4 月 VAXCYTE 使命宣言 我們的全球使命是設計保護人類免受細菌性疾病後果的高保真疫苗。

2023 年 4 月與管理層的問答 Grant Pickering 首席執行官、董事兼創始人吉姆·瓦西爾執行副總裁兼首席運營官 Andrew Guggenhime 總裁兼首席財務官
