

附錄 99.1 推進血液系統惡性腫瘤的新療法 2023 年 5 月

前瞻性陳述本演示包含前瞻性 陳述(包括經修訂的 1934 年《證券交易法》第 21E 條和經修訂的 1933 年《證券法》第 27A 條的含義),內容涉及賽羅斯和其他事項,例如賽羅斯的臨牀開發 計劃,包括與他米巴羅汀、SY-2101 和 SY-5609 有關的陳述,賽羅斯為患者提供福利和向股東提供價值的能力,時機以及即將公佈的臨牀數據的影響,向其提交新藥 申請的時機美國食品藥品監督管理局,以及Syros的資本資源足以為其到2025年的運營支出和資本支出需求提供資金。這些陳述可以根據管理層當前的信念以及管理層做出的假設和目前可用的信息,討論未來計劃、趨勢、事件、經營業績或財務狀況等目標、意圖和期望。前瞻性陳述 通常包括本質上具有預測性且取決於或提及未來事件或條件的陳述,包括諸如 “可能”、“將”、“應該”、“將”、“期望”、“預期”、“計劃”、“可能”、“相信”、“估計”、“項目”、“打算” 等詞語以及其他類似表達方式。非歷史事實的陳述是 前瞻性陳述。前瞻性陳述基於當前的信念和假設,這些信念和假設受風險和不確定性的影響,不能保證未來的表現。由於各種因素,實際結果可能與任何前瞻性陳述中包含 的結果存在重大差異,包括但不限於 Syros 有能力:按照其在當前 和未來臨牀試驗中設定的時間表,推進包括他米巴羅汀、SY-2101 和 SY-5609 在內的項目的開發;在當前和未來的任何臨牀試驗中證明其候選藥物的必要安全性、有效性和組合性;維持其反應率和耐久性迄今為止對其候選藥物的反應可見; 成功開發出配套診斷測試以識別患有 RARA 生物標誌物的患者;獲得並維持其候選藥物的專利保護以及在第三方知識產權下的經營自由;獲得並維持 必要的監管批准;識別、簽訂和維護與第三方的合作協議;管理競爭;管理費用;籌集實現其業務目標所需的大量額外資金;吸引和 留住合格人員;成功開展業務策略。上述對可能導致實際事件與預期不同的重要因素的審查不應被解釋為詳盡無遺,應與 本文和其他地方的陳述一起閲讀,包括Syros截至2022年12月31日止年度的10-K表年度報告和賽羅斯截至2023年3月31日的季度10-Q表季度報告中包含的風險因素,每份報告均已存檔於證券和交易委員會(SEC)。除非適用法律要求,否則賽羅斯沒有義務修改或更新任何前瞻性陳述,或發表任何其他 前瞻性陳述,無論是由於新信息、未來事件還是其他原因。2

推進 血液系統惡性腫瘤一線治療的新護理標準靶向血液學產品組合在越來越多的數據支持下,針對多種血液學適應症的後期臨牀試驗有可能制定新的護理標準 3 臨牀多重近期催化劑 項目即將到來的建立勢頭和創造價值的機會,包括關鍵的 SELECT-MDS-1 數據和隨機 SELECT-AML-1 數據 FRONTLINE 建立基礎設施以靶向具有商業協同作用的患者 現有期權無法為MDS提供充分服務的人羣 APL AML STRONG 企業頭寸為2025年之前的運營提供資金的現金渠道 3
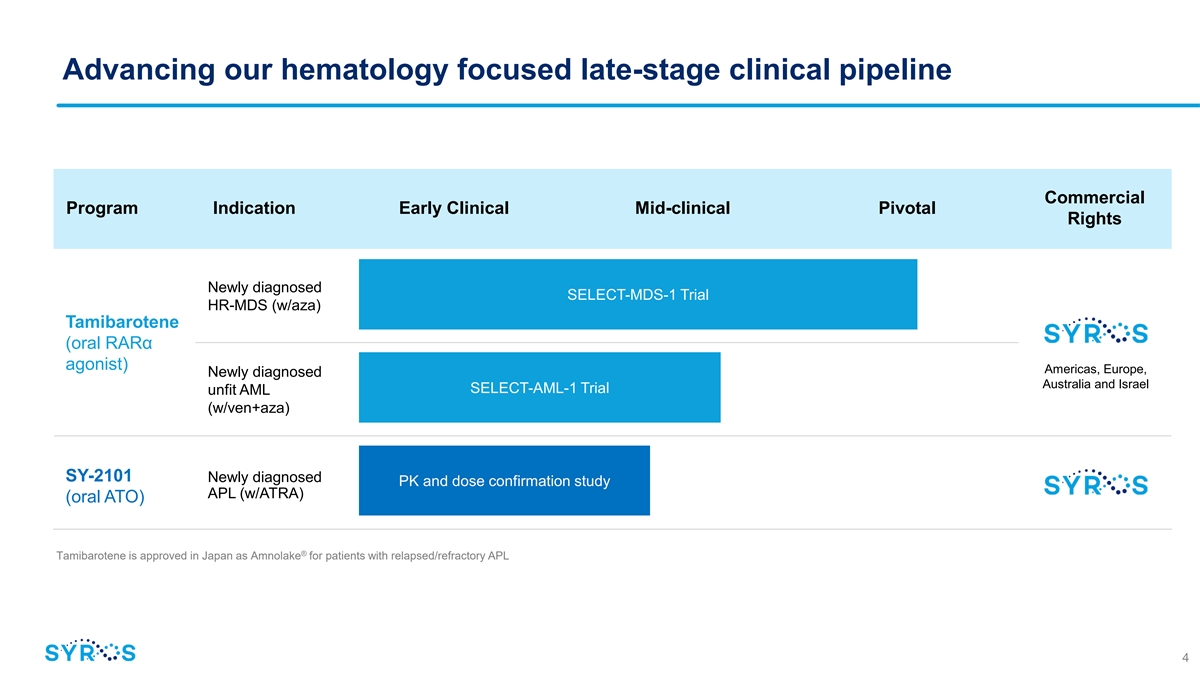
推進我們以血液學為重點的後期臨牀產品線商用 項目適應症早期臨牀中期關鍵權利新診斷的 SELECT-MDS-1 試驗 HR-MDS (w/aza) Tamibarotene(口服 rarα 激動劑)美洲、歐洲、新診斷的澳大利亞和以色列 SELECT-AML-1 試驗 unfit AML(w/ven+aza) SY-2101 新診斷的 PK 和劑量確認研究 APL (w/atra)(口服 ATO)® Tamibarotene 在日本獲得批准作為 Anmolake 用於復發/難治性 APL 4 患者

多個價值驅動里程碑最後一位患者報名參加 HR-MDS 第 3 季度 SELECT-MDS-1 3 期試驗 Tamibarotene 的關鍵 CR 數據 24 個來自 SELECT-MDS-1 3 期試驗的關鍵數據啟動隨機 SELECT-AML-1 試驗 1Q 23 Tamibarotene 的初始數據來自 AML 的 23 季度隨機 SELECT-AML-1 試驗的初始數據 來自隨機 SELECT-AML-1 試驗 2024 年的其他數據 SY-2101 關於劑量確認研究、註冊途徑和時機的最新信息 2H APL 5

Tamibarotene 有機會在 RARA 過度表達 MDS 和 AML 患者 中建立新的 SOC
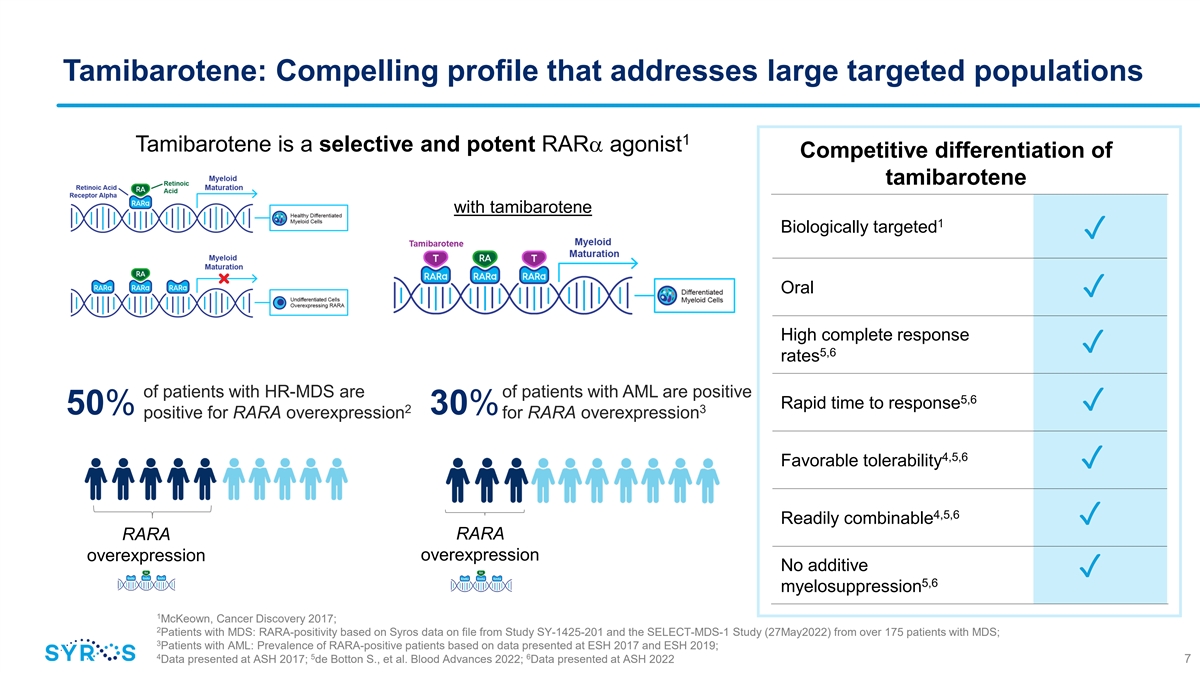
Tamibarotene:針對大型靶向 人羣的引人注目的特徵 1 Tamibarotene 是一種選擇性強效的 RARA 激動劑 tamibarotene 的競爭性分化 1 生物靶向 ✓ 口服 ✓ 高完全反應 ✓ 5,6 HR-MDS 患者的發病率為 的急性髓細胞白血病患者呈陽性 5,6 反應時間快 ✓ 2 3 50% RARA 過度表達 30% 陽性表達 4,5,6 良好的耐受性 ✓ 4,5,6 易於組合 ✓ RARA RARA 過度表達 過度表達無添加物 ✓ 5,6 骨髓抑制 1 mcKeown,2017 年 Cancer Discovery;2 名 MDS 患者:基於來自 SY-1425-201 和 SELECT-MDS-1 研究(2022 年 5 月 27 日)存檔的 Syros 數據,來自超過 175 名 MDS 患者;3 急性髓細胞白血病患者:根據 ESH 2017 和 ESH 2019 上公佈的數據,RARA 陽性患者的患病率;4 5 6 在 ASH 2017 上公佈的數據;de botton S. 等人2022 年《血液進展》;數據在 ASH 2022 7 上公佈

新診斷的 HR-MDS 的重大需求未得到滿足 • 骨髓增生異常 綜合徵 (MDS) 是一種骨髓疾病 • 高風險 MDS (HR-MDS) 和急性髓系白血病 (AML) 處於疾病連續狀態;主要以骨髓前體狀態的細胞百分比為區別 MDS HR-MDS AML 約 21,000 名新診斷的 HR-MDS 患者 mdS 在美國和歐盟中,過剩爆炸” 和 “急性髓細胞白血病” 本質上構成了 4% 的年連續值... 如果基於 MDS 表示到 2026 年將有約 33 億美元*的生物學特徵,那麼疾病分類可能更準確。” — Estey等人,2022 • HR-MDS 本質上是進展性的,預後不佳——與疾病相關的血細胞減少會導致嚴重的發病率和死亡率,超過一半的 HR-MDS 患者 5 進展為 AML 6 • 低甲基化藥物 (HMA) 阿扎西替丁是 SOC,CR 率為 17%,操作系統中位數為 18.6 個月 7-自 2006 年以來,除了 HMA 之外沒有批准任何新療法 • 老年患者尋求便捷、耐受性良好、可更好地控制疾病和維持生活質量的療法的人羣 1 2 3 4 diNardo CD 等人,《癌症》。2022;Grob T 等人,Blood。2022;Elihu Estey,等人,Blood 2022;來自 DRG 骨髓增生異常綜合徵-景觀和 2020 年預測報告 5 6 以及來自 DRG 急性髓系白血病——景觀與預測報告 2020;注意*:評估製藥市場估計包括多發性硬化症的所有風險羣體;Garcia,J 等人 7 8 al.,2021 年; deZern,AE。血液學 Am Soc Hematol Educ 項目,2015

新診斷的不適型急性髓細胞白血病 急性髓系細胞 白血病 (AML) 是骨髓中形成血細胞的癌症 1 • 大約 50% 的患者沒有資格接受強化治療,被視為 “不適合” 的前體國家 AML MDS HR-MDS 約 25,000 名新診斷的不適合 AML 新診斷的急性髓細胞白血病 新診斷的急性髓細胞白血病 新診斷的急性髓細胞白血病代表每年在美國和歐盟有 2 名患者 ~6.6BB * 到 2025 年市場 3 • 含阿扎胞苷的 Venetoclax 為 SOC,CR 率為 37%,OS 中位數為 14.7 個月 • 大約 1/3 的患者沒有反應,近 全部復發,非常快預後不佳,平均操作系統為 2.4 4 個月 1 2 Ferrara F.,Clin Lymbola Myeloma Leuk。來自 DRG 急性髓系白血病——景觀與預測報告的 2011 年流行病學預測;注意*:3 4 市場估計包括 所有急性髓細胞白血病(適合和不適合);dinardo CD 等人,2020 年《新英格蘭醫學雜誌》;Maiti A. 等人,Haema. Atologica,2021 年。9

來自多項試驗的令人鼓舞、一致的數據支持臨牀 開發戰略越來越多的臨牀證據表明 MDS 和 AML 2022 RARA 過度表達 2020 年 SELECT-AML-1 安全性前導評估了 ND 不適合 AML 患者 3 個 tami/ven/aza 2017 4/5 cr/cri 患者有 2 期數據評估了不適合高單核細胞表達 2 例急性髓細胞白血病患者評分 (MES) 在復發/R venetoclax 耐藥中使用單藥他米巴羅汀 1 HR-MDS 患者 50% cRi 33% CR 67% 72% 61% 61% 60% 83% CR 在輸血血液學中 cr/CRI cR/CRI 1 低爆炸獨立反應率子集中位反應時間:1.2 個月包括一根骨髓 CR 反應時間中位數:1.1 個月中位反應持續時間:10.8 個月完全反應者的總存活時間:18 個月 HR-MDS 中的 Tamibarotene 在 AML 1 2 3 上公佈的數據;de botton S. 等人2022 年《血液進展》;數據在 ASH 2022 上公佈 10

Tamibarotene 具有特徵良好且耐受性良好的安全特徵 安全特徵支持在 MDS 中使用他米巴羅汀與阿扎替丁聯合使用,在 AML 中與維尼托克/阿扎西替丁聯合使用 AML 中單藥在 AML 和 MDS 中使用超過 1,000 名 APL 患者接受了 4 Triplet(tami/ven/aza)治療,在 1 個 tamibaro-aza 中使用 doublet (tami/aza)tene 2,3 急性髓細胞白血病患者 33% • 作為單一藥物長期每日給藥他米巴羅汀與阿扎胞苷聯合使用已達到 CR 50% cRi 2-4 的耐受性總體良好。-沒有證據表明 毒性增加聯合使用骨髓抑制率與單藥物 2-4 阿扎胞苷相當。4 • 作為三聯體,骨髓抑制與 venetoclax + azacitidine 的報告相當。來自 SELECT-AML-1 試驗第 2 期 1-4 期隨機部分的數據 • 大多數非血液學 AE 是預計 2023 /2024 1® 2 3 4 Amnolake 上市後監測數據存檔;數據在 ASH 上公佈;de Botton S. 等人。2022 年血液進展;數據 在 ASH 2022 上公佈 11

正在對新診斷的 HR-MDS 患者 患有 RARA 過表達 Tamibarotene + 阿扎胞苷進行的 SELECT-MDS-1 3 期試驗主要終點關鍵次要終點 CR 率總存活率 (OS) 隨機化 SELECT-MDS-1 試驗 (2:1) (190 名患者)(約 550 名患者)安慰劑 + 阿扎西替丁 • 設計穩健, 雙盲、安慰劑對照研究 • 2:1 隨機分組,單面 alpha 為 0.025 Key 里程碑 • 美國食品藥品管理局的反饋支持:最後一位登記了關鍵 CR 數據的患者——重點關注 SELECT-MDS-1 第 3 階段的 RARA 過度表達人羣試驗-CR 作為批准的主要終點(完整或加速),來自 SELECT-MDS-1 第 3 階段的 Pivotal 數據支持緩解期 3Q 24 試驗的耐久性數據-阿扎西替丁作為適當的比較指標 • CR 率的主要 終點能夠檢測實驗和對照組之間的差異 • 納入操作系統關鍵次要終點將使這項單一試驗能夠在需要獲得全面批准時有效地用作確認性研究 • 按指定快速通道進行檢測 FDA 12
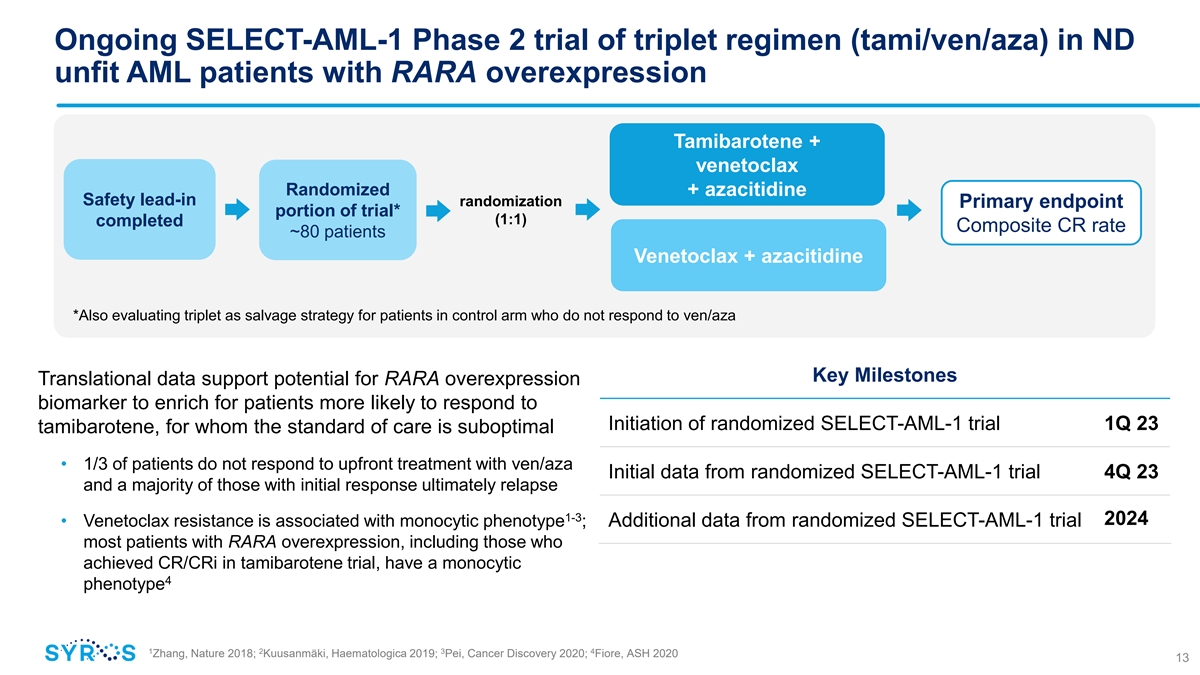
正在對 ND 不適合的急性髓細胞白血病患者進行 SELECT-AML-1 第 2 期試驗 RARA 過度表達 Tamibarotene + venetoclax Randomized + azacitidine 安全性導入隨機化試驗的主要終點部分* (1:1) 已完成複合 CR 率約 80 名患者 Venetoclax + 阿扎胞苷 *還有 正在評估三聯體作為救助策略適用於對照組中對 ven/aza Key Milestones 沒有反應的患者,轉化數據支持 RARA 過度表達生物標誌物有可能豐富更有可能對 啟動有反應的患者隨機 SELECT-AML-1 試驗 1Q 23 tamibarotene,其治療標準不理想 • 1/3 的患者對 ven/aza 的前期治療沒有反應來自隨機 SELECT-AML-1 試驗 4Q 23 的初始數據和大多數 初始反應的患者最終會復發 1-3 2024 • Venetoclax 耐藥與單核表型有關;來自隨機 SELECT-AML-1 試驗的其他數據大多數 RARA 過度表達的患者,包括那些在 tamibarotene 試驗中獲得 cR/CRI 的人,其單核 4 表型 1 2 3 4 Zhang,Nature 2018;Kuusanmaki,Haematologica 2019;Pei,《2020 年癌症發現》;Fiore,ASH 2020 13

SY-2101 與我們的血液學產品組合具有高度協同作用
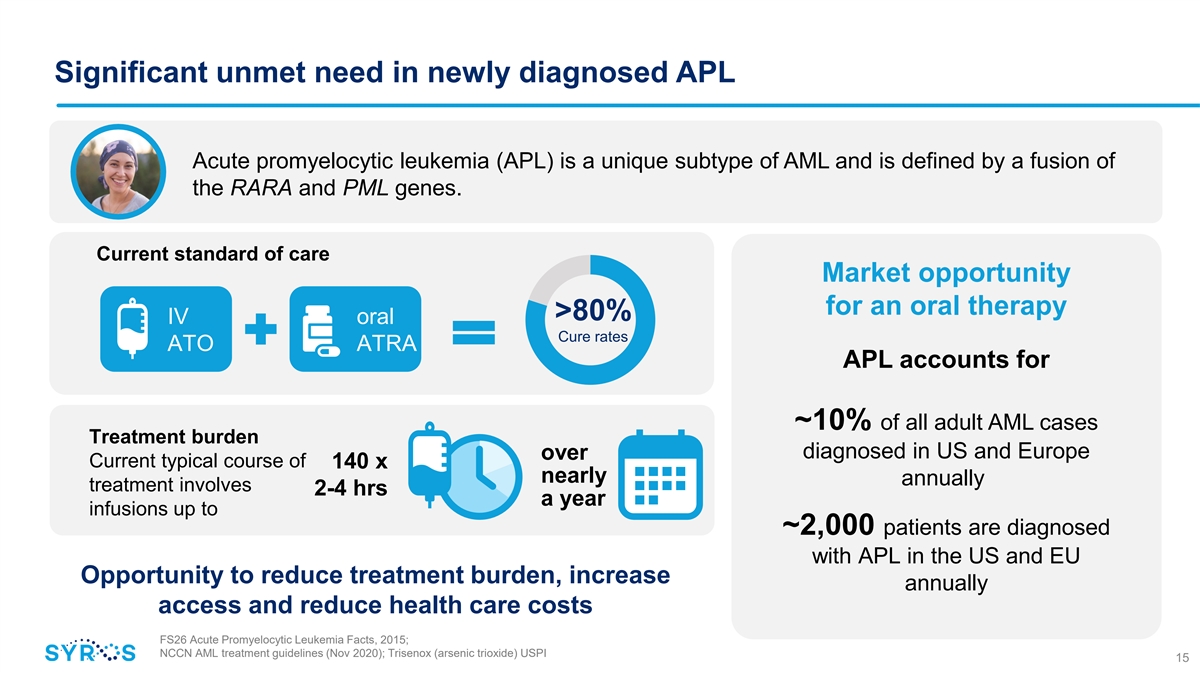
新診斷的 APL 急性早幼粒細胞 白血病 (APL) 的重大未得到滿足的需求是 AML 的獨特亞型,由 RARA 和 PML 基因的融合定義。當前的護理標準口服治療的市場機會 > 80% 靜脈注射口服治癒率 ATO ATRA APL 佔美國和歐洲診斷的所有成人急性髓細胞白血病病例的約 10% 目前典型療程 140 次每年輸液美國和歐盟有多達 2,000 名患者被診斷出患有 APL, 增加每年獲得治療的機會,減少醫療保健成本 FS26 Acute Promyeye 2015 年紅細胞白血病事實;NCCN AML 治療指南(2020 年 11 月);Trisenox(三氧化二砷)USPI 15

SY-2101 有機會在一線 APL 中成為 SOC 新型口服 形式的三氧化二砷 (ATO),有機會取代 APL ü患者的標準口服生物利用度與 IV ATO 一致 ü 前線 APL 獲得批准的明確開發路徑有可能利用 新興數據進行 ü 更有效的關鍵研究有可能在前線 APL 中快速採用,受益於專業的商業努力以及與 tamibarotene 的協同作用

前線 APL 獲得批准的明確開發路徑有可能 利用新興數據進行更有效的關鍵研究 FDA 和 EMA 在最初的 SY-2101 PK 數據背景下提供的反饋支持一項針對大約 215 名患者的單一註冊研究,以 mcR 和 EFS 作為 潛在批准的主要終點新興 PK 交叉數據直接比較 SY-2101 和 IV ATO 的批准劑量令人鼓舞 − SY-2101 顯示口服生物利用度高,約為 80%。SY-2101 的暴露量相當在 0.15 給藥的 IV ATOmg/kg 同時基於 Cmax 和 AUC 根據這些新出現的數據,可能有機會探索更有效的註冊途徑以獲得潛在批准計劃,在 2023 年下半年進一步更新劑量確認數據、監管途徑和 時間

SY-5609 高選擇性和強效口服 CDK7 抑制劑
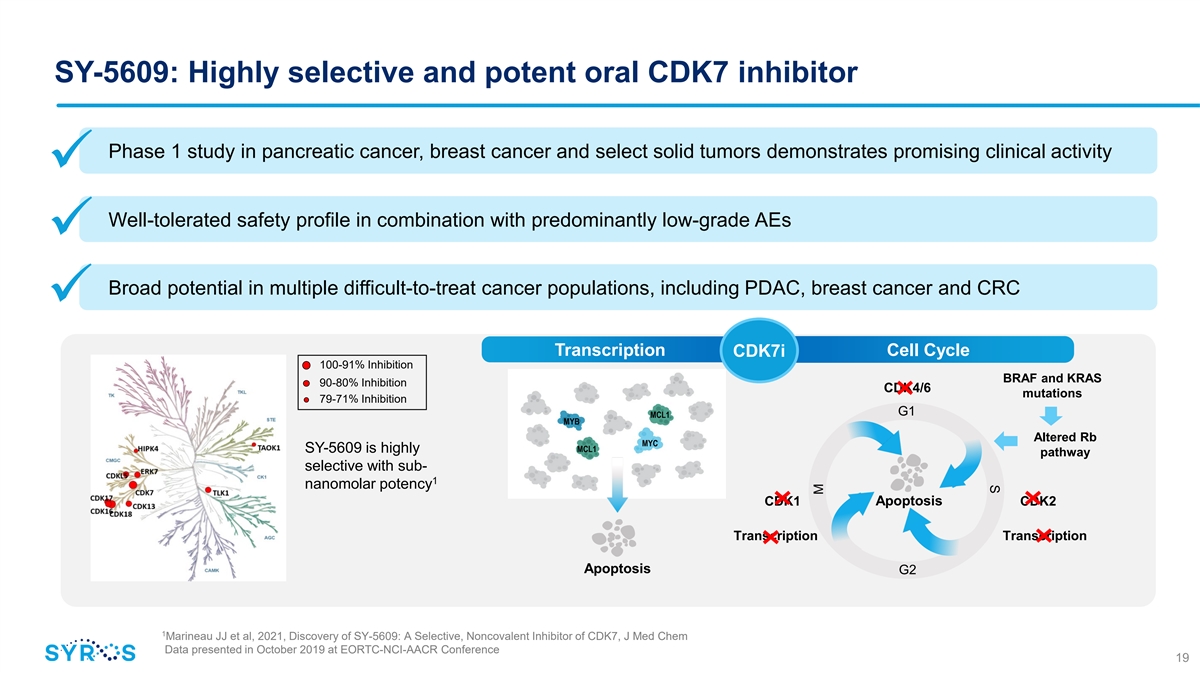
S SY-5609:針對胰腺癌、乳腺癌和特定實體瘤的高選擇性和強效口服 CDK7 抑制劑 1 期研究顯示出良好的臨牀活性 ü 與主要低級 AE 聯合使用具有良好的耐受性安全性 ü 在包括 PDAC、乳腺癌和 CRC 在內的多種難以治療的 癌症人羣中具有廣泛的潛力 ü 轉錄細胞週期 cdk7i 100-91% 抑制 BRAF 和 KRAS 90-80% 抑制 CDK4/6 突變 77 9-71% 抑制 G1 MCL1 MYB Altered Rb MYC SY-5609 具有高度的 MCL1 途徑選擇性 帶有 sub-1納米摩爾效力 CDK1 細胞凋亡 CDK2 轉錄轉錄細胞凋亡 G2 1 Marineau 等人,2021 年,SY-5609 的發現:CDK7 的選擇性、非共價抑制劑,J Med Chem 數據於 2019 年 10 月在 EORTC-NCI-AACR Conference 19 M 上公佈
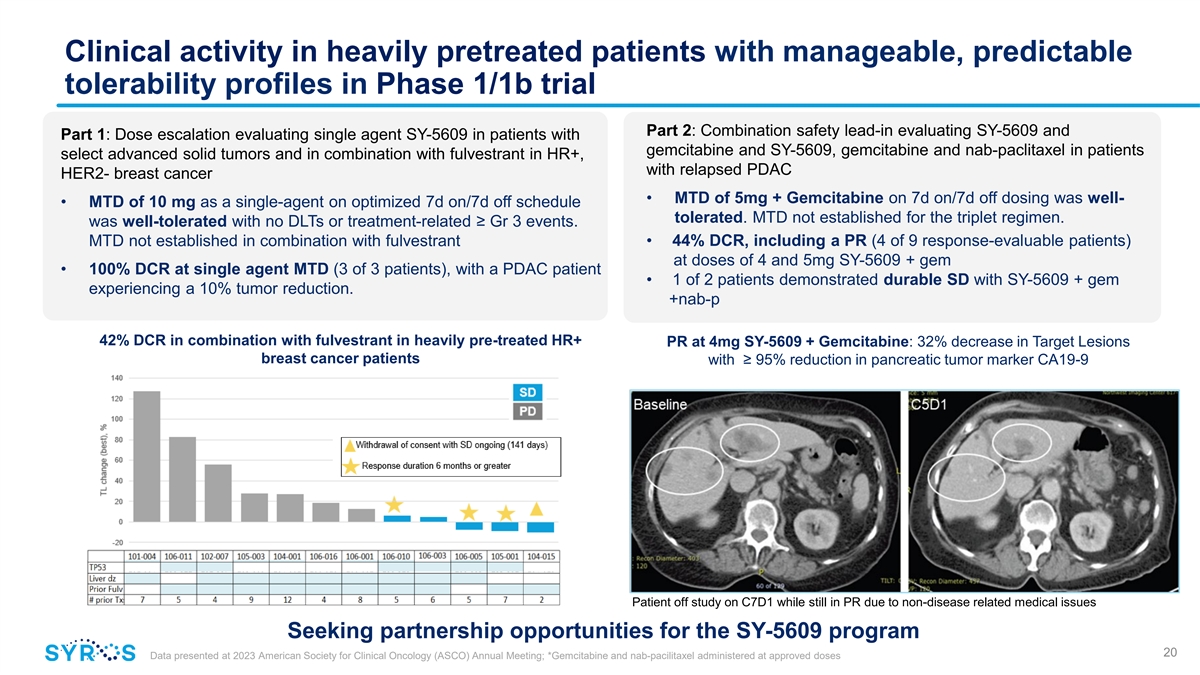
在 1/1b 期試驗中,經過大量預先治療且耐受性可控、 可預測的患者的臨牀活性第 2 部分:評估 SY-5609 的聯合安全性引導和第 1 部分:評估吉西他濱和 SY-5609、吉西他濱和 nab-paclitaxel 患者的劑量遞增評估選擇晚期實體瘤,在 HR+ 中與氟維司羣聯合使用,合併復發 PDAC HER2-乳腺癌 • 停用 7 天/7 天給藥時的 MTD 為 5mg + 吉西他濱效果不錯-• 在優化的 7d on/7d 上,作為單藥的 MTD 為 10 mg SY-5609容忍。三聯療法的 MTD 尚未確定。耐受性良好,沒有 DLT 或與治療相關的 ≥ Gr 3 事件。與氟維司羣聯合使用後未確立 MTD • 44% DCR,包括劑量為 4 和 5mg SY-5609 + gem 的 PR(9 名反應可評估的患者中的 4 名)• 單劑 MTD(3 名患者中有 3 名)的 DCR 為 100%,一名 PDAC 患者 • 2 名患者中有 1 名錶現出持久的 SD,SY-5609 + gem 的腫瘤減少了 10%。 +nab-p 42% DCR 與氟維司羣聯合使用經過大量預處理的 HR+ PR 為 4mg SY-5609 + 吉西他濱:目標病變乳腺癌患者降低 32% 胰腺腫瘤標誌物降低 ≥ 95% CA19-9 患者因非疾病相關醫療問題在 C7D1 研究期間停課 SY-5609 項目尋求合作機會 20 數據在 2023 年美國臨牀腫瘤學會 (ASCO) 年會上公佈會議;*以批准劑量給藥吉西他濱和 nab-pacilitaxel
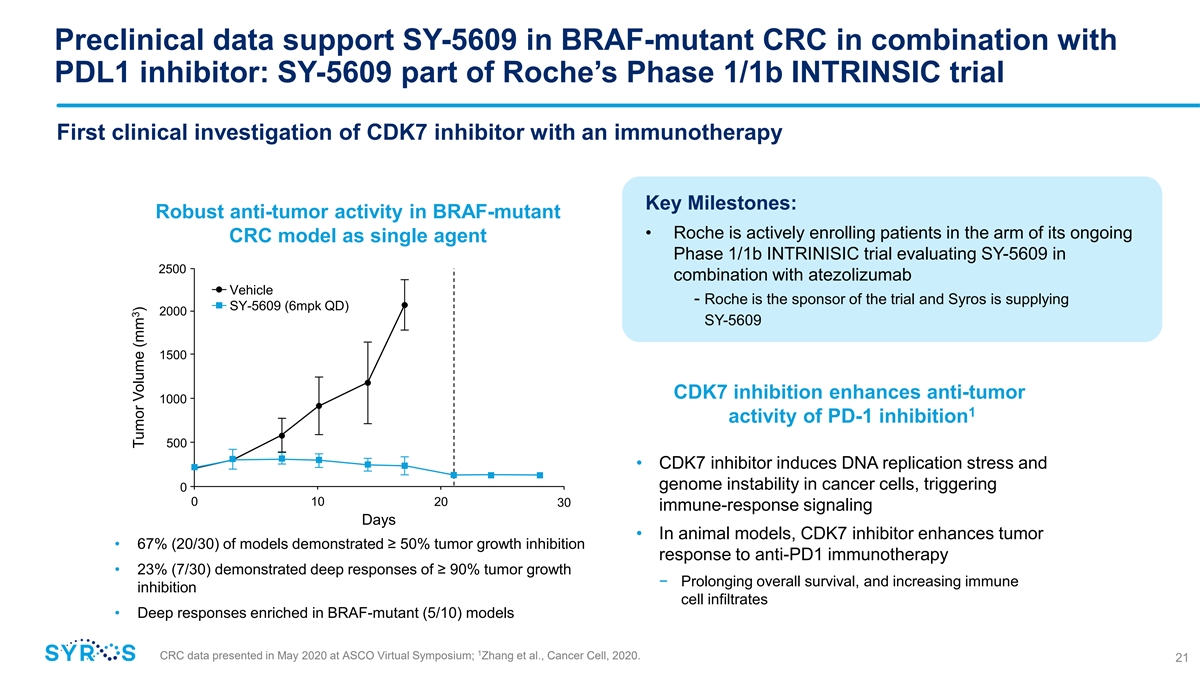
臨牀前數據支持 braf-mutant CRC 中的 SY-5609 與 PDL1 抑制劑聯合使用:SY-5609 是羅氏 1/1b 期INTRINSIC 試驗的一部分首次具有免疫療法 CDK7 抑制劑的臨牀研究關鍵里程碑:BRAF 突變體具有強勁的抗腫瘤活性 • 羅氏正在積極招募患者參加 作為單藥物 1/1b 期 INTRINISIC 試驗,將於 2500 年評估 SY-5609 與 atezolizumab Vehicle 聯合使用——羅氏是該試驗的贊助商,Syros 正在提供 SY-5609 (6mpk QD) 2000 SY-5609 1500 CDK7 抑制劑增強 PD-1 抑制的抗腫瘤 1000 1 活性 500 • CDK7 抑制劑誘導癌細胞中的 DNA 複製應激和基因組不穩定性,觸發 0 0 10 20 30 個免疫反應信號天數 • 在動物模型中,CDK7 抑制劑增強腫瘤 • 67%(20/30)的模型對抗 PD1 免疫療法表現出 ≥ 50% 的腫瘤生長抑制反應 • 23%(7/30)的模型表現出 ≥ 90% 的腫瘤生長抑制反應總體延長 − br} 存活率,增加免疫抑制細胞浸潤 • 富含 BRAF 突變體 (5/10) 模型的深度反應 1 CRC 數據2020 年 5 月在 ASCO 虛擬研討會上發表;張等人,《癌細胞》,2020。21 3 腫瘤體積(mm)

早期階段節目
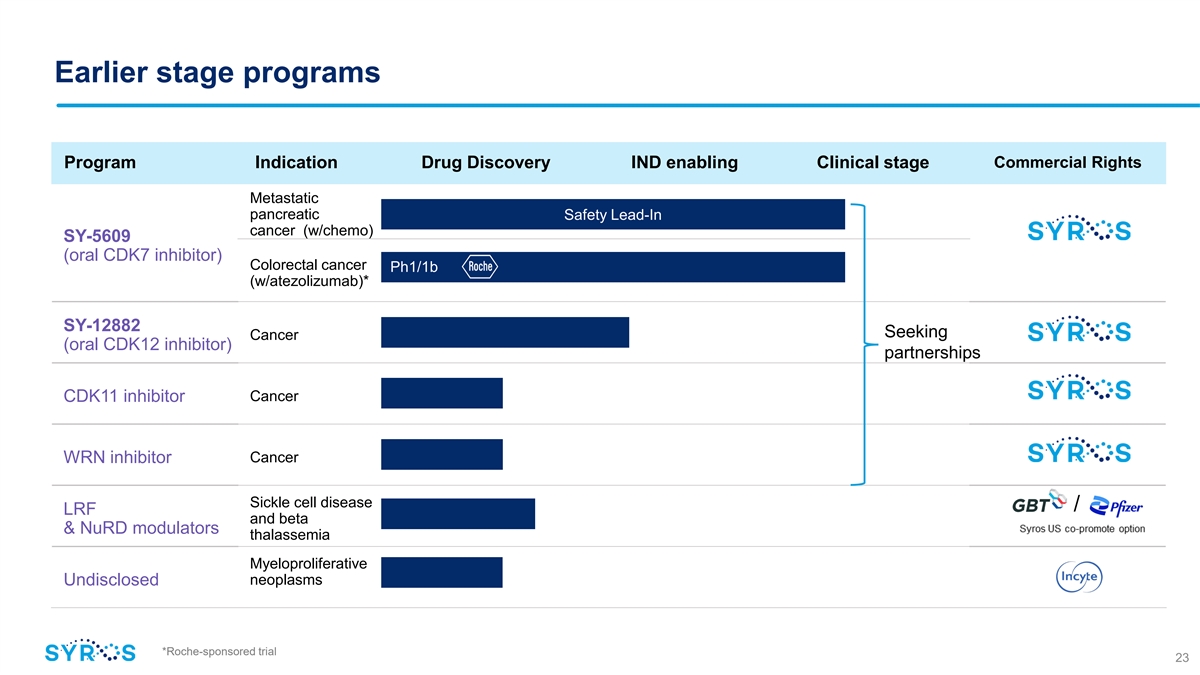
早期階段的項目商業版權計劃適應症藥物 Discovery IND 支持臨牀階段轉移胰腺安全導入式癌症(w/chemo)SY-5609(口服 CDK7 抑制劑)結直腸癌 pH1/1b(w/atezolizumab)* SY-12882 Seeking Cancer(口服 CDK12 抑制劑)合作伙伴關係 Cancer CDK11 抑制劑 Cancer wrn 抑制劑鐮狀細胞病/LRF 和 beta 和 nurD 調節劑地中海貧血 myprololative 腫瘤未公開 *羅氏贊助的試驗 23

憑藉能為癌症帶來巨大益處的 藥物快速向前邁進 Vision 商業公司現在的患者推進後期靶向血液學產品線為產品發佈和商業化做準備為 SY-5609 和發現計劃尋求合作機會 Cash runway 為計劃在 2025 年 24 年之前的運營提供資金
