目錄
第 2 項。管理層對財務狀況和經營業績的討論和分析。
您應閲讀以下關於我們財務狀況和經營業績的討論和分析,以及我們的財務報表以及本10-Q季度報告中其他地方包含的相關附註和其他財務信息。除歷史財務信息外,本討論和分析還包含基於當前預期的前瞻性陳述,涉及風險和不確定性,例如我們的計劃、目標、預期、意圖和信念的陳述。由於各種因素,包括下文第二部分第1A項下標題為 “風險因素” 的部分中列出的因素,我們的實際業績可能與這些前瞻性陳述中的預期存在重大差異。
概述和管道
我們是一家臨牀階段的遺傳藥物公司,專注於為中樞神經系統或中樞神經系統(CNS)的疾病開發變革性療法,這些疾病的治療選擇有限或沒有獲得批准的治療選擇。我們的願景是通過開發改變中樞神經系統疾病患者生活的開創性療法來兑現基因療法的承諾。遺傳醫學領域正在迅速擴大,我們相信我們在開發中樞神經系統疾病的治療方法時採用了差異化的方法,這使我們能夠選擇和推進更有可能在技術和監管方面取得成功的候選產品。我們已經與賓夕法尼亞大學(Penn)的基因療法項目(GTP)的受託人建立了戰略研究合作,該項目由遺傳藥物領域的領導者詹姆斯·威爾遜博士領導。我們還利用與賓夕法尼亞大學孤兒病中心(ODC)的密切合作關係,制定歷史和前瞻性可比的自然史患者檔案,以便與介入試驗的參與者進行比較。通過此次合作,我們組建了強大的遺傳醫學候選產品組合,我們保留了這些產品的全球版權,其詳細信息如下表所示:
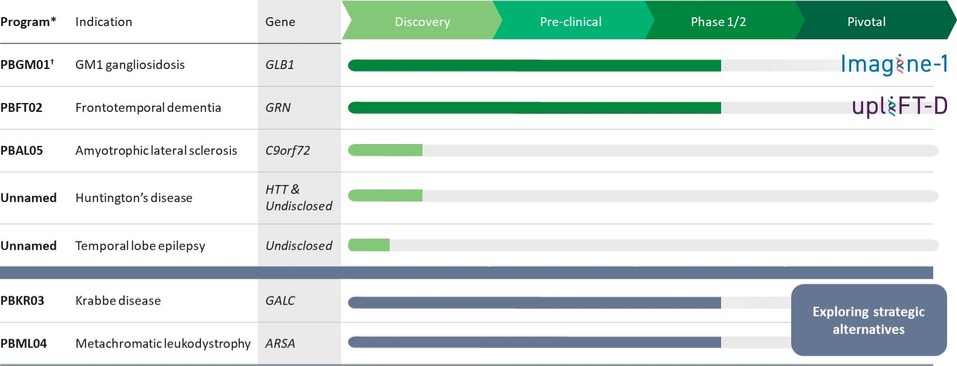
*還剩下8個額外的CNS管道許可選項;此前已行使了3種許可選項,隨後權利歸還給了賓夕法尼亞大學。
† 項目包括正在進行的對嬰幼兒和青少年 GM1 神經節苷脂症患者的自然史研究
22