目錄表
第一部分
項目1.業務
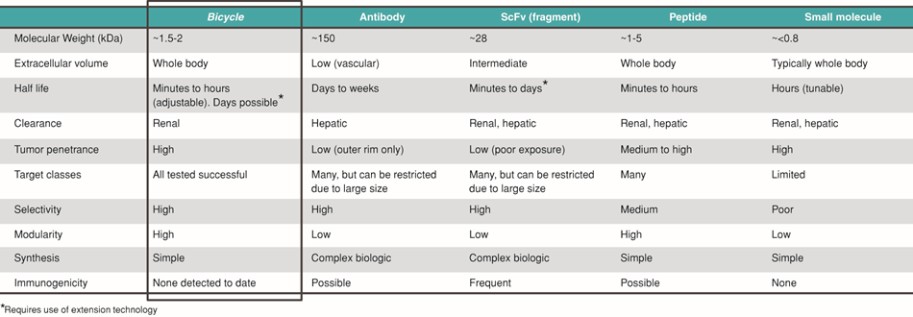
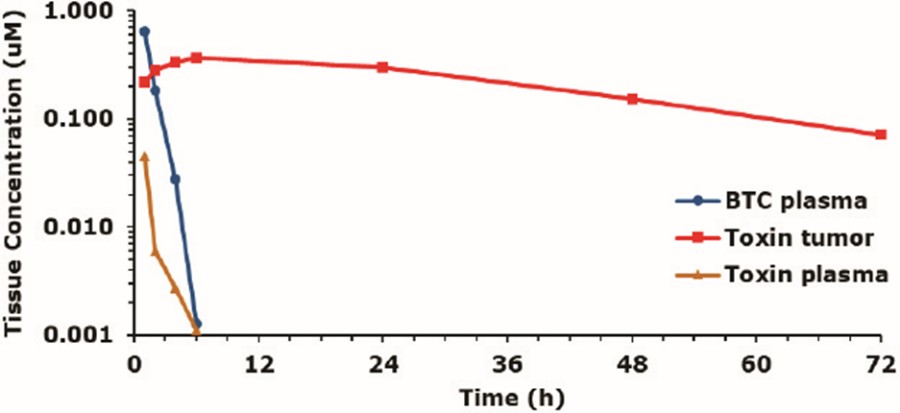
我們是一家臨牀階段的生物製藥公司,正在開發一種新型藥物,我們稱之為自行車,用於現有療法治療不足的疾病。自行車是完全合成的短肽,被限制成兩個環,從而穩定了它們的結構幾何。這種約束有助於高親和力和選擇性的靶向結合,使自行車有吸引力的藥物開發候選人。自行車是一種獨特的治療方式,結合了通常與生物相關的藥理學與小分子的製造和藥代動力學或PK特性。相對較大的表面積,由自行車允許對非生物方法歷來難以處理的靶點下藥。自行車是由腎臟而不是肝臟排泄的,到目前為止還沒有表現出免疫原性的跡象,我們認為這一特性解釋了這些分子有利的毒理學特徵。
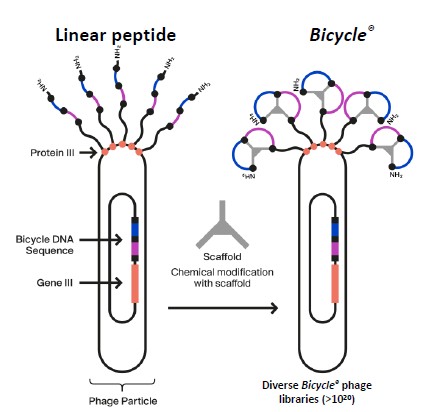
我們有一個新穎和專有的噬菌體展示篩選平臺,我們用它來識別自行車以高效的方式。該平臺最初在工程噬菌體或噬菌體的表面展示線狀多肽,然後與一系列小分子支架環化,這些小分子支架可以賦予不同的物理化學和結構特性。我們的平臺編碼了數萬億的潛力自行車可以對其進行篩選以識別用於優化潛在產品候選的分子。我們已經使用這一強大的篩查技術來確定我們目前在腫瘤學領域的候選對象組合,並打算與我們的合作者一起使用它來尋求在一系列其他疾病領域開發更多的未來候選對象。
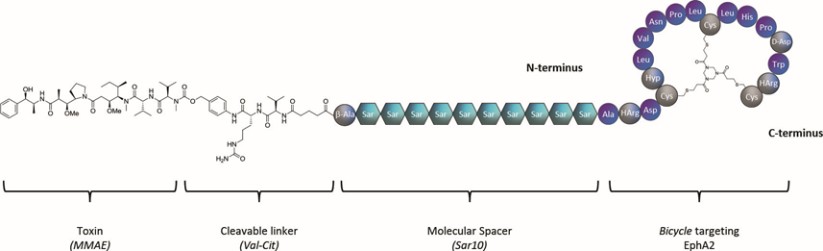
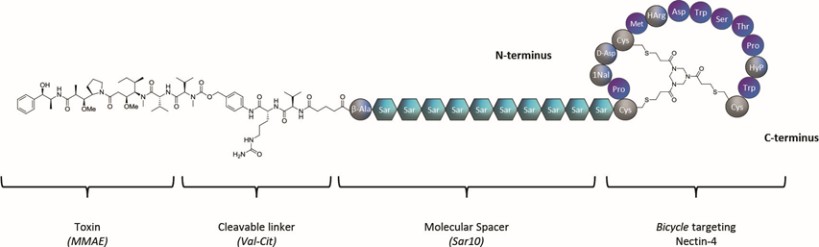
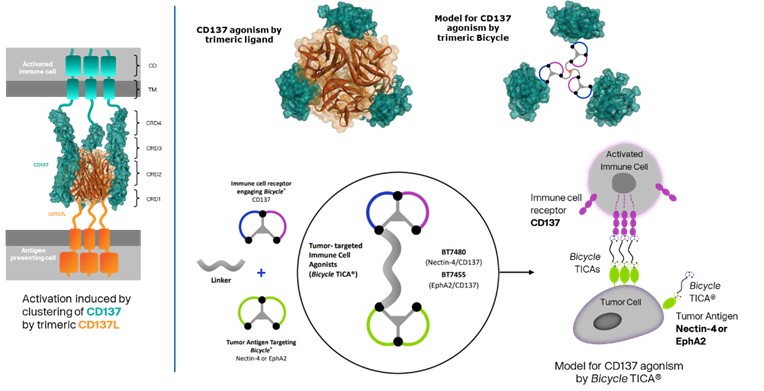
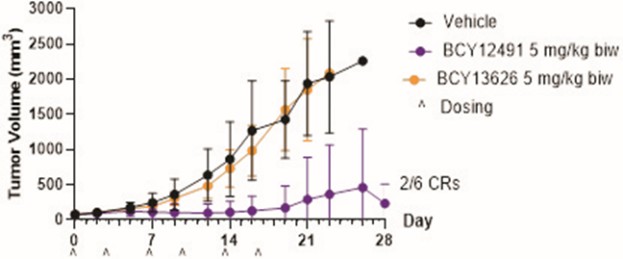
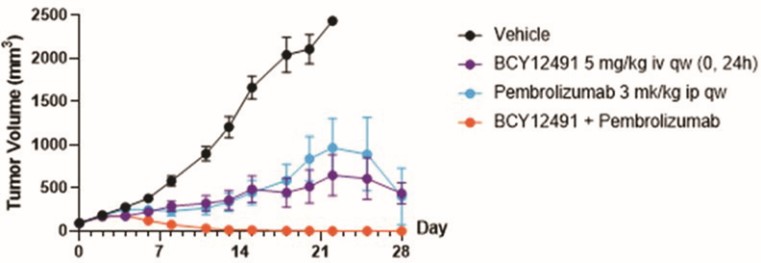
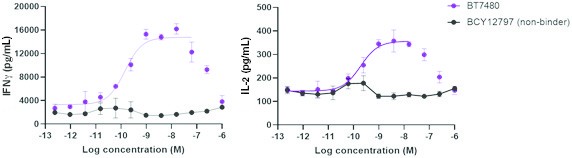
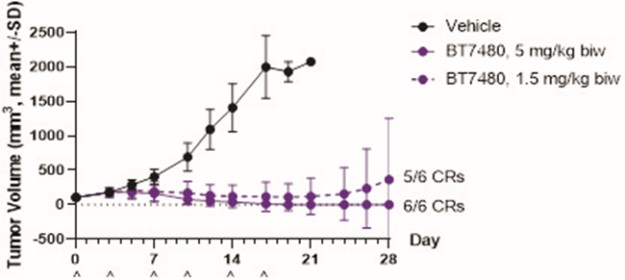
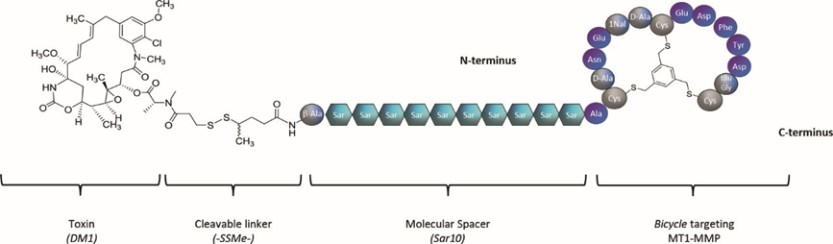
我們的候選產品BT5528、BT8009和BT1718分別是自行車®毒素結合物,或BTCTM。這些自行車在化學上附着在一種毒素上,當給藥時,這種毒素會從自行車並殺死腫瘤細胞。我們正在評估第二代BTC BT5528和BT8009,BT5528是公司贊助的I/II階段臨牀試驗中的靶向A型腎上腺素受體2或EphA2的第二代BTC,BT8009是公司贊助的I/II階段臨牀試驗中靶向Nectin-4的第二代BTC。此外,BT1718正在開發中,用於針對表達膜型1型基質金屬蛋白酶或MT1基質金屬蛋白酶的腫瘤,正在進行的I/IIa期臨牀試驗中正在研究其安全性、耐受性和有效性,該試驗由英國癌症研究藥物開發中心或英國癌症研究中心贊助和全額資助。此外,我們的其他候選產品BT7480和BT7455分別是一種針對自行車腫瘤的免疫細胞激動劑®,或自行車TICATM. A 自行車TICA與免疫細胞受體結合自行車與腫瘤抗原結合自行車。我們正在評估BT7480,一款自行車TICA靶向Nectin-4和痛苦的CD137,在公司贊助的I/II期臨牀試驗中,我們正在進行BT7455,一種EphA2/CD137的IND使能研究自行車蒂卡。我們在腫瘤學方面的發現渠道包括自行車-基於全身免疫細胞激動劑和自行車提卡斯。
除了我們全資擁有的腫瘤學產品組合,我們還在其他治療領域與生物製藥公司和組織合作,我們認為我們在這些領域擁有專利自行車篩查平臺可以確定治療有重大未得到滿足的醫療需求的疾病的療法。我們的合作項目包括在免疫腫瘤學、抗感染、心血管、眼科、痴呆症、中樞神經系統、神經肌肉和呼吸系統適應症方面的合作。
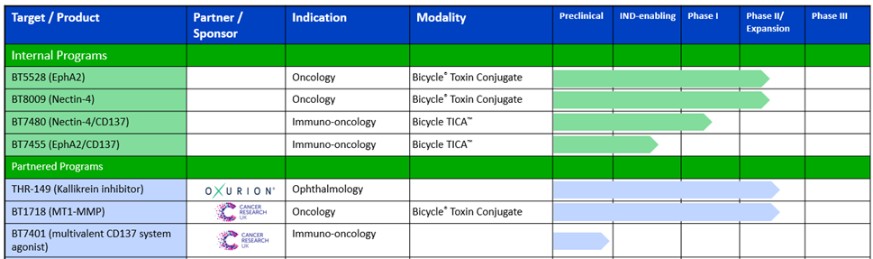
下表總結了有關我們計劃的關鍵信息:
2