目錄表
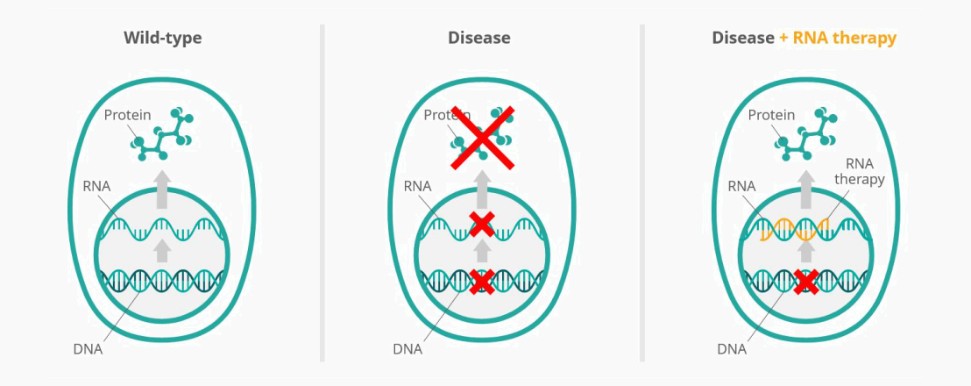
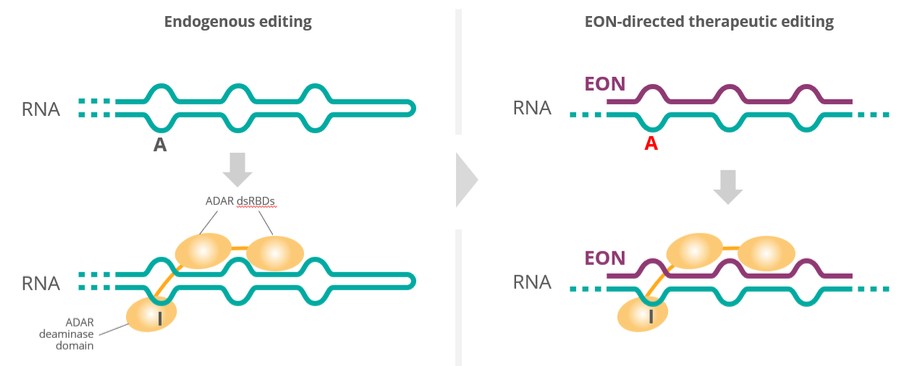
我們正在研究的RNA療法是經過化學修飾的單鏈RNA寡核苷酸,以增強穩定性和細胞攝取。我們的每一種研究RNA療法都旨在修復特定的RNA突變,我們相信,與其他治療方法相比,這種有針對性的方法在治療我們瞄準的罕見遺傳病方面可能提供幾個優勢。
Sepofarsen治療Leber先天性巨結腸10例
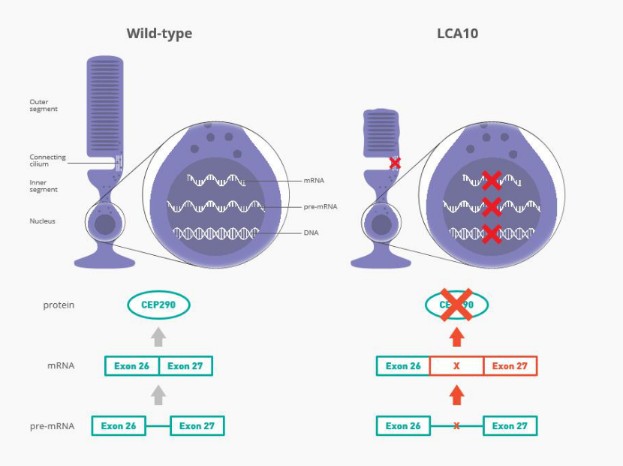
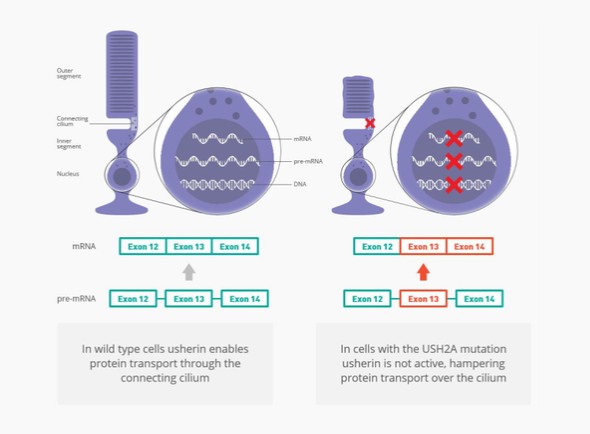
Leber先天性黑髮(LCA)是導致兒童失明的最常見遺傳原因,其中LCA10型(LCA10)是最嚴重的形式之一。患有LCA10的人通常在生命的頭幾年就會失明,目前還沒有批准的治療方法。最常見的突變是C.2991+1655A>G(也稱為p.Cys998X)CEP290吉恩。我們估計這種突變發生在西方世界大約2000名患者中。
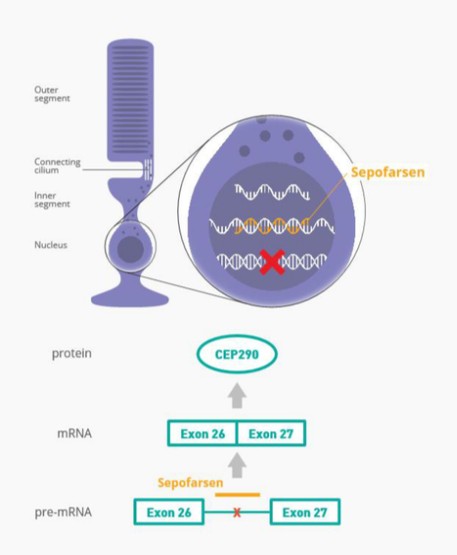
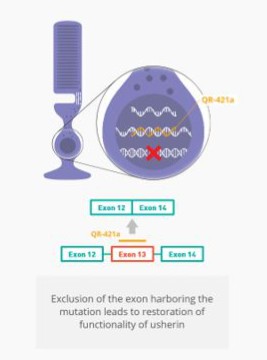
Sepofarsen正在開發中,作為一種潛在的治療方法,用於治療因p.Cys998X突變而患有LCA10的患者。Sepofarsen的目標是通過剪接糾正修復RNA中的潛在原因。這種RNA剪接校正允許生產正常的(野生型)CEP290可以恢復LCA10患者視力的蛋白質。Sepofarsen是通過玻璃體內注射在眼睛內給藥的。
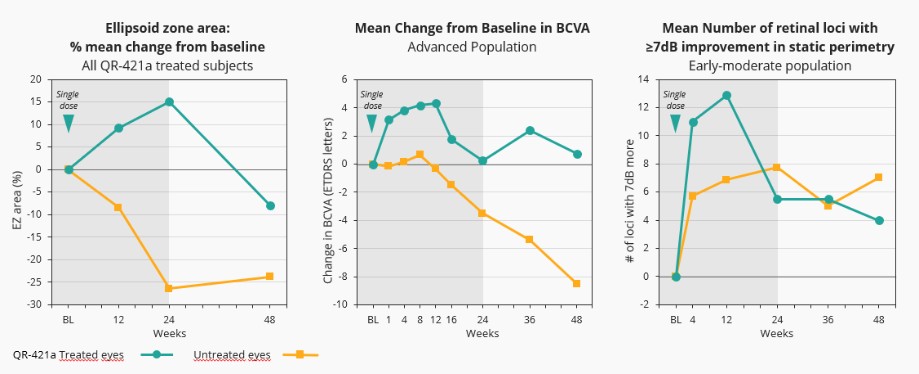
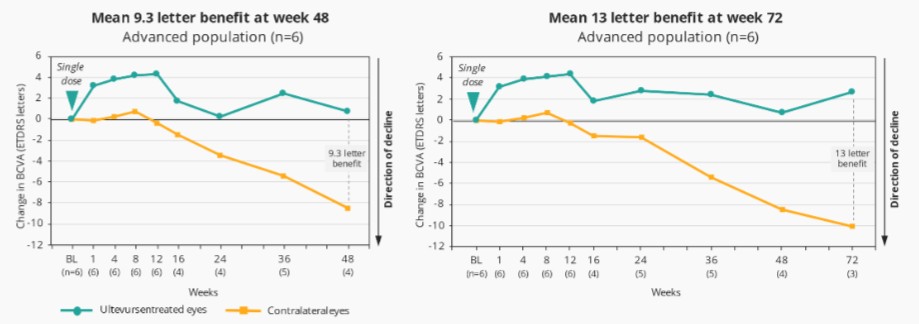
Sepofarsen對因p.Cys998X突變導致的成人和兒童LCA10的1/2期臨牀試驗已經完成。我們在2020年視覺和眼科研究協會(ARVO)年會上公佈了這項試驗的最終數據,在會上,Sepofarsen在LCA10患者中展示了臨牀概念驗證,大多數患者的視力都有了顯著、快速和持續的改善。
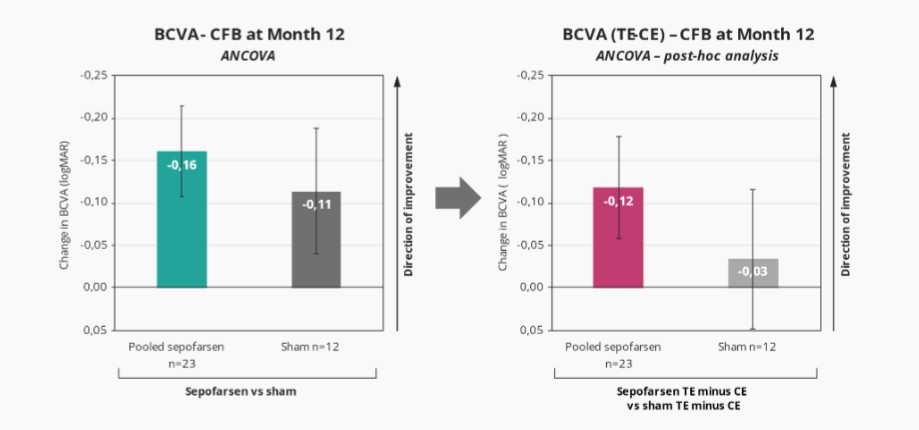
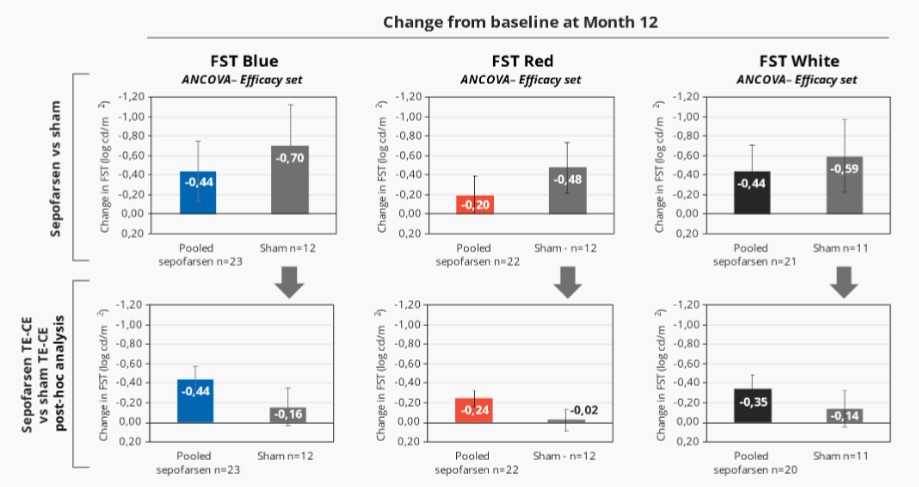
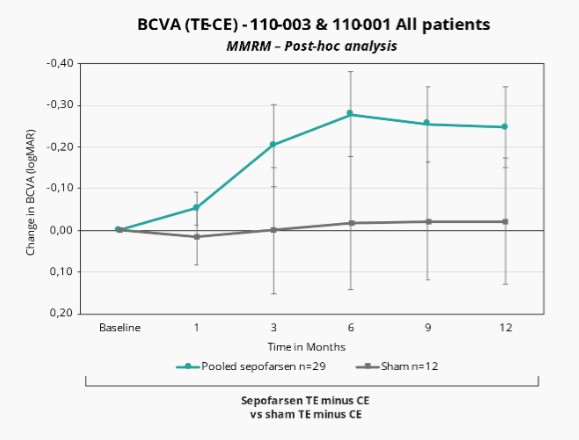
2022年2月,我們宣佈照亮,我們關鍵的Sepofarsen 2/3期試驗CEP290-LCA10,與假手術對照組相比,在12個月時沒有達到最佳矯正視力(BCVA)的主要終點。事後分析顯示,在BCVA、全場刺激測試(FST)和其他終點(包括患者報告的結果(PRO))中,將積極治療和假眼與相應的對側眼睛進行比較時,sepofarsen的療效信號與早期研究結果(以對側眼作為對照)中看到的結果更一致。我們計劃在2022年第三季度與EMA和FDA會面,討論這些數據。
數據來自照亮試驗將在2022年4月29日舉行的第七屆年度視網膜細胞和基因治療創新峯會和2022年5月1日至4日舉行的視覺和眼科研究協會(ARVO)年會上公佈。
56