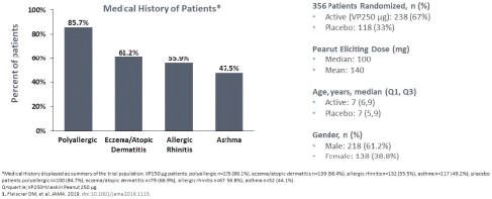
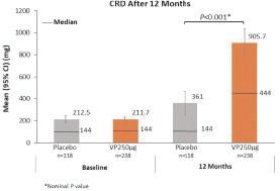
統計學上證明瞭這兩種劑量相對於安慰劑的優越性。這些結果證實了正在進行的對250名
m
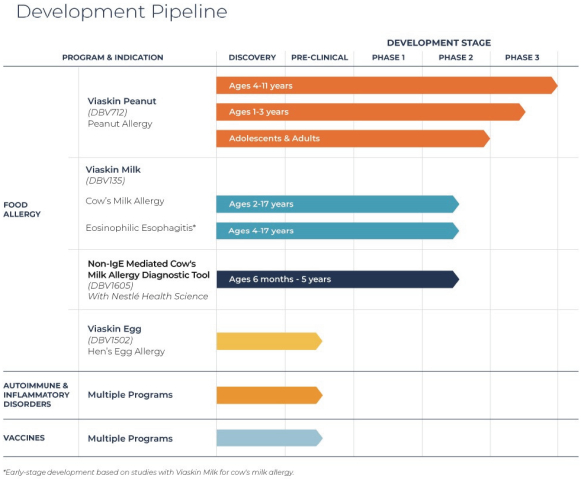
這個年齡組的G劑量,這是研究的B部分正在研究的劑量。表位B部分的註冊於2021年第一季度完成,預計2022年年中將公佈主要結果。
2020年2月,本公司宣佈結束一項全球承銷發行,發行總額為7,500,000(I)公開發售的普通股4,535,581以下列形式持有的普通股9,071,162美國存托股票(ADS)在美國、加拿大和歐洲以外的某些國家上市,公開發行價為#美元。10.25每美國存托股份(按#美元的匯率計算)1.0999=1.00歐元),以及(Ii)專門面向歐洲(包括法國)合格投資者的發售2,964,419普通股,發行價為歐元18.63每股普通股(統稱為“全球發售”)。
2020年3月,本公司宣佈,承銷商部分行使了購買選擇權338,687以以下形式增發普通股677,374美國存託憑證,發行價為$10.25根據美國存托股份,在扣除佣金和預計發售費用之前(“選項”)。該期權於2020年3月4日結束。
因此,在部分行使選擇權後,全球發售的普通股總數為7,838,687普通股,包括4,874,268以下列形式持有的普通股9,748,536美國存託憑證,使全球發行的總收益達到美元160.7百萬美元,淨收益為$150.0百萬美元。
該公司於2020年6月啟動了一項全球重組計劃,為研究用Viaskin的臨牀開發和監管審查提供運營空間
™
美國和歐盟的花生。2021年下半年完成了全組織降成本措施的全面實施。重組計劃的全面實施導致減產幅度超過
200喬布斯和剩下的全球團隊中約有
90人們致力於追求創新和科學發展的新療法。
重組成本主要包括工資支出、與重組相關的諮詢和法律費用,以及設施調整後的設施減值和使用權資產。
下表彙總了經營和全面虧損報表中包括的截至2021年12月31日和2020年12月31日的重組效果:
|
|
|
|
|
|
|
|
|
| |
|
|
|
| |
|
|
|
|
|
|
| |
|
|
(920 |
) |
|
|
19,194 |
|
| |
|
|
— |
|
|
|
2,028 |
|
| |
|
|
— |
|
|
|
2,330 |
|
| |
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|