目錄
在保留造血幹/祖細胞(或稱“HSPC”)的同時,移植細胞和LSCs。臨牀前數據在2021年12月的美國血液學會年會或“ASH會議”上公佈。結果表明,NC525(I)對急性髓系白血病幹細胞集落形成有抑制作用體外培養(Ii)在體內抑制MV4-11來源的異種移植(“CDX”)動物模型中的AML生長;(Iii)在體內限制患者來源的異種移植(“PDX”)中的AML進展。IND計劃在2022年第四季度提交。
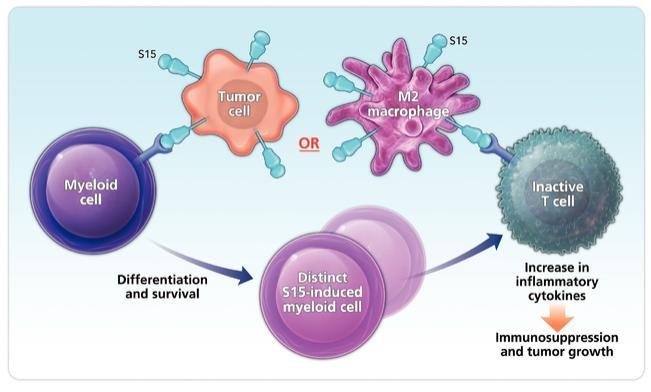
我們識別新免疫藥物靶點的方法是基於我們的Find-IO平臺。Find-IO體現了一種理性的方法來發現驅動功能性免疫反應的新的細胞表面和分泌分子。我們使用我們開發的免疫學知識、經驗、能力和工具(包括我們的Find-IO平臺)來支持我們的發現工作。我們正在努力發現新的靶點,這些靶點在調節允許腫瘤逃避免疫系統的免疫功能障礙方面發揮關鍵作用。我們尋求識別和開發能夠抵消這些結果的免疫藥物,並進一步驗證和推進我們的候選產品。我們已經使用我們的Find-IO平臺確定了多個新的目標,包括我們的某些研究項目正在設計的目標。NC318的靶點S15的免疫抑制特性是使用我們的Find-IO平臺的前身發現的。
我們的管道
我們正在利用我們對生物途徑的理解和我們的Find-IO平臺來發現、驗證和建立免疫醫學候選藥物的專有管道。下圖詳細介紹了我們的候選產品以及主要的發現和研究計劃。
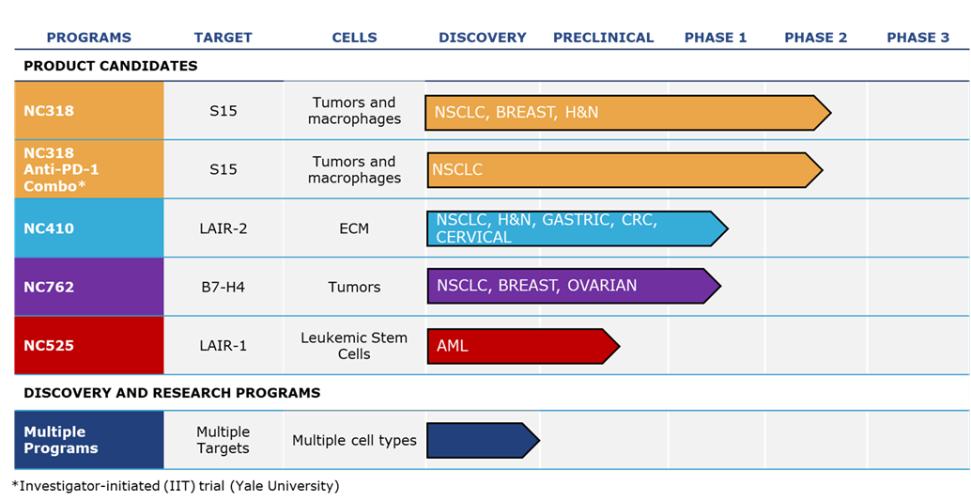
我們的戰略
我們的戰略是利用我們完全集成的發現和產品開發基礎設施,建立一條可持續的候選產品管道,以治療那些目前可用的療法沒有得到充分服務的癌症患者。我們戰略的主要內容包括:
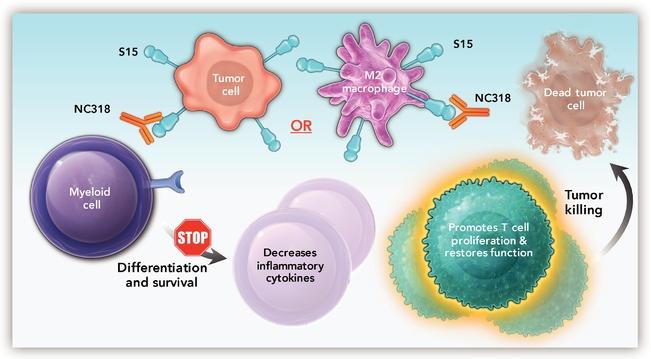
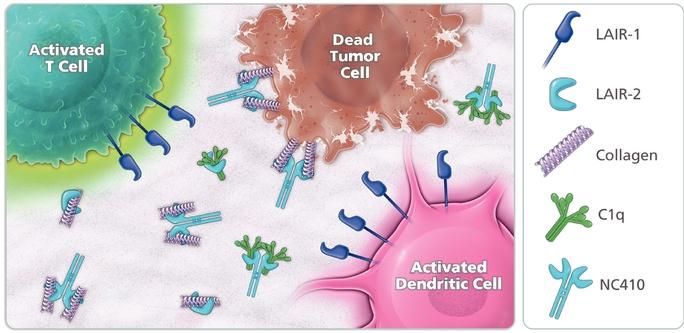
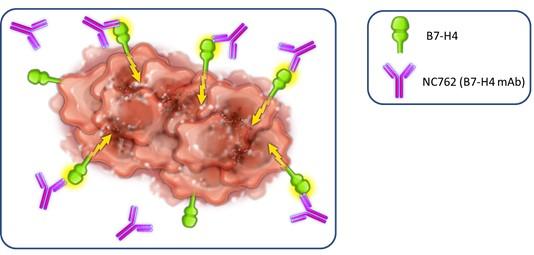
| ● | 推動我們的主要候選產品NC318、NC410和NC762的臨牀開發。2019年10月,我們開始招募患者參加1/2期臨牀試驗的第二階段,評估NC318在晚期或轉移性腫瘤患者中的應用。此外,我們相信科學證據支持NC318與抗PD-1療法的結合,耶魯大學開始了由研究者發起的NC318與Pembrolizumab聯合用於非小細胞肺癌患者的第二階段臨牀試驗。對於NC410,我們在2020年6月啟動了1/2期臨牀試驗的1期部分,並報告了臨牀前數據顯示 |
7