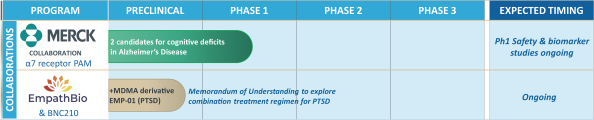
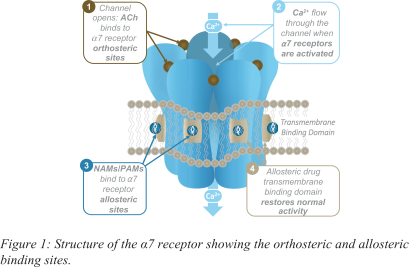
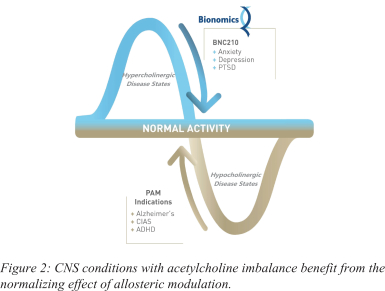
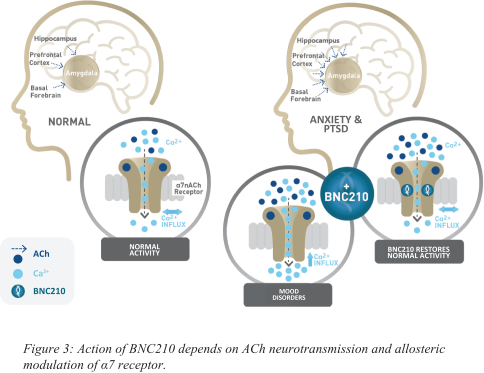
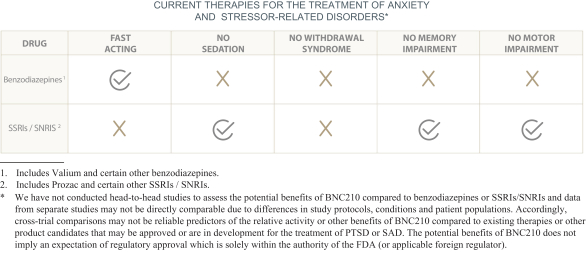
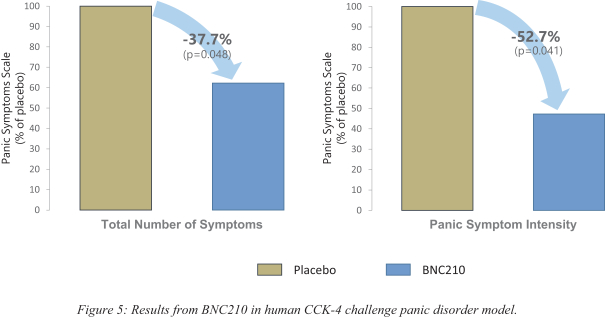
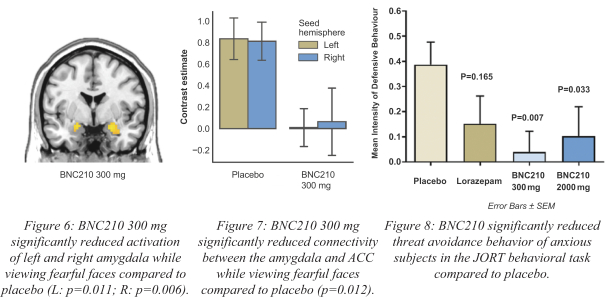
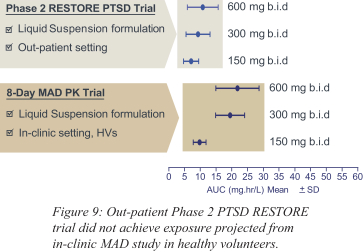
依據第424(B)(4)條提交
註冊號碼333-261280
招股説明書
1,622,000股美國存托股份
相當於291,960,000股普通股

每個美國存托股份12.35美元
這是Bionomics Limited在美國的首次公開募股。Bionomics Limited將發行美國存托股份 (美國存託憑證),每股相當於180股普通股。
我們的普通股 在澳大利亞證券交易所(ASX?)上市,代碼為?BNO。
我們的美國存託憑證已獲批 在納斯達克全球市場上市,代碼為BNOX。美國存託憑證的首次公開募股價格為每股美國存托股份12.35美元。
我們是一家新興的成長型公司,因為2012年的Jumpstart Our Business Startups Act中使用了這個詞,因此,我們受到上市公司披露標準的降低。參見招股説明書摘要以及作為一家新興成長型公司的影響 。
投資我們的美國存託憑證涉及高度風險。在購買任何美國存託憑證之前,您應仔細閲讀本招股説明書第13頁開始的 風險因素中有關重大風險的討論。
| 人均廣告 | 總計 | |||||||
| 首次公開發行(IPO)價格 |
美元 | 12.35 | 美元 | 20,031,700 | ||||
| 承保折扣和佣金 (1) |
美元 | 0.8645 | 美元 | 1,402,219 | ||||
| 扣除費用前的收益,給我們 |
美元 | 11.4855 | 美元 | 18,629,481 | ||||
| (1) | 我們已同意向承銷商報銷與此次發行相關的某些費用。請參閲 ?承保。 |
我們已授予承銷商在本招股説明書發佈之日起30天內向我們額外購買最多243,300張美國存託憑證的選擇權 。
我們的某些現有股東,包括那些與我們的董事會成員有關聯的股東,已同意在此次發行中按美國存托股份的首次公開募股(IPO)價格以及與此次發行的其他買家相同的條款購買總計約900萬美元的我們的美國存託憑證。 承銷商將從這些美國存託憑證中獲得與他們在此次發售中向公眾出售的任何其他美國存託憑證相同的承銷折扣和佣金。
美國證券交易委員會或任何其他監管機構都沒有批准或不批准這些證券,也沒有對本招股説明書的準確性或充分性作出任何判斷。任何相反的陳述都是刑事犯罪。
承銷商預計在2021年12月20日左右向投資者交付 美國存託憑證。
| Evercore ISI | 威廉·布萊爾威廉·布萊爾。 | 康託爾 | ||||||||
| 貝倫伯格 | H.C.温賴特公司(H.C.Wainwright&Co.) | |||||||||
本招股説明書的日期為2021年12月15日。