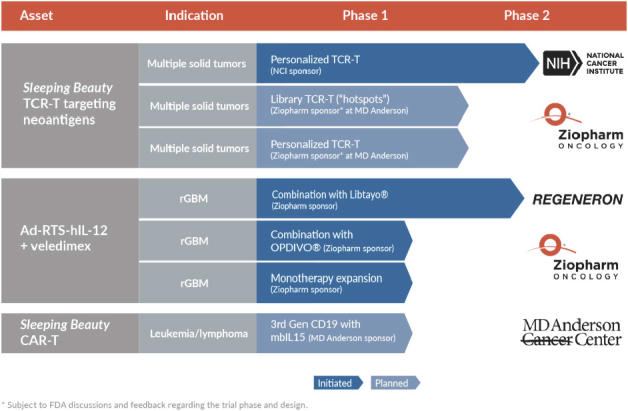
基因轉移後,靜息T細胞通過基因修飾表達Car和膜結合IL-15,即mbIL 15。我們也正與Eden biocell有限公司或Eden biocell公司共同在大中華區推廣RPM技術,我們與TriArm治療有限公司的合資公司Eden biocell將領導我們的臨牀開發和商業化。睡美人-生成 CD 19-特定的RPM CAR+ 患者來源(自體)T細胞治療複發性或難治性的 CD 19+白血病和淋巴瘤。
我們的管道
我們的戰略
我們的目標是成為一家領先的免疫腫瘤學公司,致力於開發創新的、具有成本效益的療法,主要針對未滿足的大型實體腫瘤的需求。我們戰略的關鍵要素包括:
| | 建一個端到端針對實體腫瘤的TCR 溶液。我們相信,我們與nci的研究首次代表了一種非病毒的、基因工程的tcr T細胞(Tcr)。+患者將接受治療。我們打算加強我們在針對實體腫瘤的T細胞領域的地位,為此我們將大力投資於優化和擴大我們的工藝開發和製造能力,從而創造端到端,可擴展的解決方案我們打算建造這個端到端利用(I)TCR開發 處理的解決方案+表達受體衍生(自體)TCRs的T細胞,我們稱之為我們的個性化TCR方法和(Ii)TCR+T細胞表達來自一個圖書館的第三方(異基因)TCRs,我們稱之為我們的圖書館TCR方法。我們計劃大幅度擴展我們的TCRs庫,這些TCRs來自對突變的KRAS、TP 53和EGFR有反應的第三方,作為我們致力於促進臨牀發展的一部分,以治療實體腫瘤有驅動突變的患者。 |
| | 在我們的控制的IL-12平臺的臨牀試驗中執行作為 ,既單藥,又結合免疫檢查點抑制劑。我們打算繼續在幾個臨牀上執行 |
6





