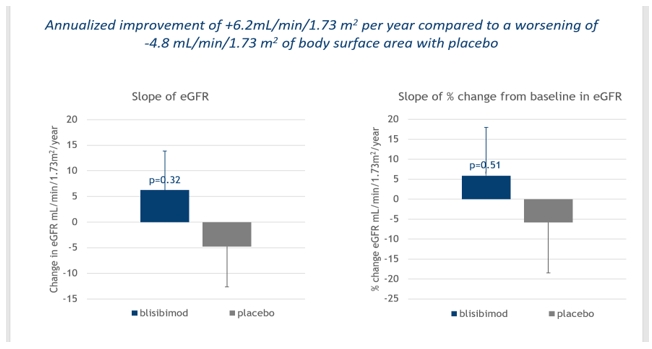
2013,我們對亞洲和東歐地區的IgA腎病患者進行了二期臨牀研究。 a Phase 2 multicenter, randomized, double-blind, placebo-controlled study to evaluate the efficacy, safety, tolerability and immunogenicity of blisibimod in IgA nephropathy. Enrollment criteria included biopsy-proven IgA nephropathy and proteinuria greater than one gram but less than six grams per 24 hours (1g-6g/24hr). Patients must have been receiving standard of care medication including angiotensin converting enzyme inhibitors and/or angiotensin receptor blockers.Patients enrolled in the BRIGHT-SC study received 300mg weekly blisibimod or placebo subcutaneously during the first 8 weeks of therapy, the induction phase, followed by a minimum of 24 weeks of 200mg weekly blisibimod or placebo, the maintenance phase. The BRIGHT-SC study enrolled 58 patients. In August 2017, we reported top line data from the completed extension of the BRIGHT-SC study in which all patients had the opportunity to complete at least 60 weeks of treatment and some patients were treated for up to two years. Throughout the treatment period and for up to one year of additional follow up off treatment, blisibimod appeared to halt disease progression as measured by the mean estimate of urinary protein:creatinine levels ("proteinuria"). Specifically, in patients treated with blisibimod, the mean change in proteinuria was stable to trending slightly downward, 此外,根據估計腎小球濾過率(“EGFR”)的個別變化率(“EGFR”),患者的腎功能有保持的趨勢,年化改善率為+6.2mL/min/1.73m。2與之相比,每年惡化的速度為-4.8mL/min/1.73m2如下圖所示,服用安慰劑。此外,血清免疫球蛋白IgA、IgG和IgM在整個治療期間均有明顯下降。
市場機會
Sollpura治療外分泌胰腺功能不全(EPI)
According to our estimate, EPI is a disease that affects an estimated 130,000 patients in the United States. The most common causes of EPI are chronic pancreatitis and cystic fibrosis, the former a longstanding inflammation of the pancreas altering the organ's normal structure and function that can result from malnutrition, heredity, or (in the western world especially), behavior (alcohol use and smoking), and the latter a recessive hereditary disease 最常見的是歐洲人和德系猶太人的分子罪魁禍首是一個改變的,cftr編碼的氯離子通道。在兒童中,另一個常見的病因是Shwachman-Bodian-Diamond綜合徵,這是一種罕見的常染色體隱性遺傳疾病,是由SBDS基因突變引起的。
水皰治療IgA腎病
根據國家罕見疾病組織的資料,原發性IgA腎病發生於任何年齡,最常見的發病時間是在生命的第二個和第三十年,大量病例最終發展為腎功能衰竭。There is also a striking geographic variation in the prevalence of IgA nephropathy throughout the world. In the United States, IgA nephropathy is considered an orphan disease as it is believed to affect approximately 130,000 people annually. In August 2017, the FDA granted orphan drug designation for blisibimod for the treatment of IgA. The prevalence of IgA nephropathy varies throughout the world, with the highest prevalence in Asia (Singapore, Japan and China), Australia, Finland and southern Europe (20 to 40% of all glomerulonephritis). In Asia, routine urinalyses are performed for school children and renal biopsies for patients with asymptomatic hematuria, and the reported prevalence of the disease is much higher. For example, in Japan, IgA nephropathy is estimated to affect over 350,000 people annually.根據國家腎臟和泌尿系統疾病信息交流中心,25%的成人IgA腎病最終發展為完全腎衰竭。
製造戰略
索爾普拉
我們於2016完成了製藥原料(“原料藥”)生產和藥品生產的技術轉讓,並估計我們將於2019完成發酵過程驗證和相關的三種酶原料藥的下游純化。同時,商業規模的膠囊和袋藥產品生產工藝驗證預計將於2019完成。
監管策略
索爾普拉
美國食品和藥物管理局(FDA)在啟動前對結果研究協議進行了審查。我們認為,設計結果能夠充分評估Sollpura的有效性和安全性,以迴應FDA的2011封完整的回覆信。研究結果還應涉及2005份EMA協議的輔助意見,這與FDA要求進行積極比較試驗的要求是一致的。預計在2018完成Sollpura的第三階段臨牀試驗(結果和簡單性研究),2019完成Sollpura原料藥和藥物產品的商業生產過程驗證,2019提交生物製劑許可證申請(“BLA”)的目標提交日期。
IGA腎病
在2013,我們會見了美國食品和藥物管理局,他同意考慮接受蛋白尿作為替代終點,在第E部分的批准下,它被批准用於治療IgA腎病。在2014,我們會見了日本藥品和醫療器械局(“PMDA”),討論我們的註冊計劃,以應對IgA腎病。在這次會議上,我們獲得了PMDA關於蛋白尿作為主要功效終點的可接受性的一致意見,以支持日本的市場認可。In December 2014 we met with the European Medicines Agency (“EMA”) as part of the scientific advice process for blisibimod, and reached agreement on the acceptability of proteinuria as the primary efficacy variable, as well as the sufficiency of a single study to support a Conditional Marketing Authorization Application (“CMAA”) provided that confirmatory evidence from a second study would be available post approval.EMA還建議該議定書提供關於所需治療時間、響應時間和再治療需要的信息。鑑於觀察到水皰病對狼瘡患者蛋白尿的影響,我們目前正在評估B細胞相關腎小球腎肽中水泡菌素的作用。
許可方的歷史臨牀研究-Sollpura
Sollpura was studied from 2002 to 2009 in seven clinical trials, in which a total of 492 unique subjects received at least 1 dose of Sollpura. Three Phase 1 trials were conducted, 1 in healthy volunteers and 2 in subjects with EPI due to CF. Two short-term trials, the Phase 2 Study TC-2A, and the Phase 3 Study 726 evaluated the efficacy of Sollpura in subjects ≥7 years of age with EPI due to CF. Two long-term Phase 3 safety and tolerability trials were also conducted: Study 767 in subjects with EPI due to CF and Study 810 in subjects with EPI due to chronic pancreatitis/pancreatectomy. Completed clinical trials demonstrated that dietary fat and nitrogen (protein) absorption are significantly increased in patients with cystic fibrosis and EPI who received Sollpura. In 2013, Eli 莉莉獲得了FDA的同意,設計了一個關鍵的試驗,以提供充分的有效性和安全性評估。
劑量範圍第一階段研究TC-1B評估了五種劑量水平的50倍範圍,從100到-5000脂肪酶單位(U)每公斤在CF-EPI受試者。在本研究中,以脂肪吸收係數(CFA)和CNA的基線變化百分比來衡量,在每餐500脂肪酶U的劑量下,營養吸收有了更大的改善。
Study TC-2A, a Phase 2, randomized, double-blind, parallel group, dose-finding trial, was conducted in 125 pediatric and adult subjects with CF-related EPI who were treated with Sollpura for 28 days in one of three dosing regimens containing 6,500 U, 32,500 U, and 130,000 U lipase administered per meal or snack. Observed mean CFAs at the end of study were 56.2%, 67.0%, and 69.7% in the 6,500, 32,500, and 130,000 U dose groups, respectively (one-way ANOVA p = 0.0032) with significant improvements in mean changes from baseline (one-way ANOVA p = 0.0005) and mean changes from baseline off-enzyme CFA to on treatment were 1.2%, 11.4% and 17.3%, respectively (1-way ANOVA p=0.0005). Pairwise comparison of the CFA values showed that statistically greater improvements were observed at the higher doses of Sollpura compared with the lowest dose of 6,500 U. 在CNA方面也觀察到了類似的改進,Sollpura在兩個最高劑量水平。
Study 726, a Phase 3, placebo-controlled, parallel design, multinational clinical, evaluated the effects of a single capsule of Sollpura (containing 32,500 U lipase, with protease and amylase in fixed ratios) or placebo administered with every meal or snack in subjects with cystic fibrosis-related EPI. Among the 138 subjects enrolled in this study, treatment with Sollpura resulted in a statistically significant improvement in the change from baseline in the CFA Sollpura組為21.2%,安慰劑組為6.0%(p=0.0011),受試者體重中位數為50 kg,相應的Sollpura劑量為650 U脂肪酶/kg/餐或零食。
本研究採用兩項為期一年的研究來評價紫蘇蘭的安全性和對營養狀況的影響。Study 810 evaluated adult subjects with EPI due to CP or after pancreatectomy. Among the 214 subjects who were treated, an average dose of 5.5 capsules (containing 32,500 U lipase, with protease and amylase in fixed ratios) of Sollpura per day maintained nutritional status as assessed by serial measurement of height and weight, including age-appropriate growth and weight gain in children.研究對象的平均體重指數z-得分隨着時間的推移而保持不變(基線時,3個月、6個月和12個月的平均體重指數z分別為-0.503、-0.637、-0.688和-0.655)。
歷史臨牀研究---大皰病
To date, five randomized, clinical studies have been conducted with blisibimod in patients with lupus: two Phase 1 dose-ranging studies by our licensor, Amgen; and two double-blind, placebo-controlled dose-ranging clinical outcomes studies, PEARL-SC (Phase 2b) and CHABLIS-SC1 (Phase 3), and a Phase 2 Open-Label Extension study (OLE) by the Company. All five clinical studies evaluated the efficacy and safety of multiple doses of subcutaneous blisibimod versus placebo in patients 明珠-SC研究於2012完成,Chablis-SC1研究於2016完成。兩項研究均未能達到主要終點,我們選擇停止治療狼瘡的水皰病的進一步發展。
In the CHABLIS-SC1 study, the primary endpoint compared the effects of blisibimod and placebo at Week 52 using the SLE Responder Index-6 (SRI-6): ≥6-point improvement in SELENA-SLEDAI, no new BILAG 1A or 2B domain scores, and 50% reduction in UPCR, and/or UPCR
研究與開發
Since our inception in 2004, we have focused primarily on developing our product candidates, which currently include Sollpura for EPI and blisibimod for IgA nephropathy and potentially other glomerulonephritides. In the years ended December 31, 2017, 2016, and 2015, we incurred $28.6 million, $46.5 million and $33.5 million, respectively, of research and development expense.
我們的戰略
我們的目標是開發和商業化我們的產品候選產品,以治療與炎症有關的嚴重疾病,包括酶替代療法和腎臟疾病。為了實現這些目標,我們打算首先側重於以下活動。
Sollpura的臨牀研究進展
我們正在推動Sollpura在與囊性纖維化相關的EPI患者的第三階段註冊項目中的發展。如果我們的第三階段臨牀研究成功,我們打算在美國將Sollpura商業化,並尋求戰略合作伙伴,其能力可以補充我們在美國以外地區推出Sollpura的能力。
尋求公司合作伙伴
我們已被指定為治療IgA腎病的孤兒藥物,我們計劃與第三方合作發展腎病和其他B細胞相關的腎小球腎炎。
開發商業策略,最大限度地發揮我們產品的市場潛力
我們的產品候選人集中在高度專業化的內科部門,如囊性纖維化專家和腎臟專家.我們相信,我們可以建立一支小型的,集中的銷售隊伍,能夠有效地銷售我們的產品在急性照顧和孤兒的跡象。
競爭
Our industry is highly competitive and subject to rapid and significant technological change. Our potential competitors include large pharmaceutical and biotechnology companies, specialty pharmaceutical and generic drug companies, academic institutions, government agencies and research institutions. Our primary competitors who market PERTs approved in the U.S. or are developing PERTs in the U.S. are described in further detail below. We believe that key competitive factors that will affect the 公司產品的開發和商業成功有:功效、安全性和耐受性、可靠性、劑量的方便性、價格和補償。
|
化合物
|
舞臺
|
公司
|
指徵
|
|
註記
|
|
Creon
|
核準
|
艾伯維
|
胰腺切除術
|
|
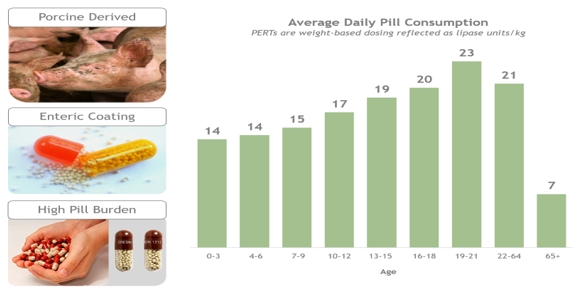
Ÿ 豬的,腸包覆的
|
|
胰腺
|
核準
|
詹森/強生
|
EPI、CF和其他
|
|
Ÿ 豬的,腸包覆的
|
|
讚佩普
|
核準
|
艾爾根
|
擴大免疫方案,CF,CP
|
|
Ÿ 豬的,腸包覆的
|
|
維奧卡
|
核準
|
艾爾根
|
成人胰腺切除術中的EPI、CP和胰腺切除術
|
|
Ÿ 豬腸包膜,與質子泵抑制劑聯合使用
|
|
佩爾茲耶
|
核準
|
芝士
|
擴大免疫方案,CF
|
|
Ÿ 豬的,腸包覆的
|
|
MS 1819
|
2a期
|
阿祖爾
|
擴大免疫方案
|
|
Ÿ 脂肪酶
|
知識產權
我們的政策是追求、維護和維護專利權利,在內部開發,並從第三方獲得許可,以保護對我們業務的發展具有商業重要性的技術、發明和改進。我們也依賴商業機密,這些祕密對我們的業務發展可能很重要。
我們的成功將在很大程度上取決於我們是否有能力:
|
· |
為我們認為對我們的業務很重要的技術、發明和改進獲得和維護專利和其他專利保護;
|
|
· |
在不侵犯第三方專利和所有權的情況下經營我們的業務。
|
索爾普拉
截至本報告發表之日,我們的Sollpura組合由Eli Lilly獨家授權專利和專利申請組成,包括:
|
· |
四項歐洲(“EP”)專利,分別在奧地利、比利時、保加利亞、塞浦路斯、捷克共和國、丹麥、愛沙尼亞、芬蘭、法國、德國、大不列顛、希臘、匈牙利、冰島、愛爾蘭、意大利、拉脱維亞、立陶宛、盧森堡、摩納哥、荷蘭、波蘭、葡萄牙、羅馬尼亞、斯洛伐克、斯洛文尼亞、西班牙、瑞典、瑞士和土耳其的一個或多個國家得到驗證;
|
|
· |
16項在澳洲、加拿大、中國、香港、印度、以色列、日本、墨西哥、俄羅斯、南韓及烏克蘭批出非EP外國專利;及
|
We hold exclusive worldwide licenses from Eli Lilly to all of these patents and patent applications. The exclusively licensed U.S. patents are currently scheduled to expire in March 2025 and July 2028. Depending upon the timing, duration and specifics of FDA approval of Sollpura, one of these U.S. patents may be eligible for a patent term restoration of up to five years under Hatch-Waxman Act.參見“監管事項-專利術語恢復和營銷獨佔性”。這可能會將選定的美國專利的有效期延後至2030或7月,這取決於恢復專利適用於哪一項專利。我們還打算繼續研究兒科專利的獨佔性,這可能會給專利期限再增加6個月。四項獲特許的環保專利現定於二月份至2025年月日屆滿。其中一項專利可獲頒發為期五年的補充保護證明書,可將有效期延長至二月2026至十月2030。
[醫]水皰
截至本報告發表之日,我們的專利組合包括:
|
· |
三項已頒發的歐洲專利,分別在阿爾巴尼亞、奧地利、比利時、塞浦路斯、丹麥、芬蘭、法國、德國、希臘、愛爾蘭、意大利、拉脱維亞、列支敦士登、立陶宛、盧森堡、摩納哥、荷蘭、葡萄牙、羅馬尼亞、斯洛文尼亞、西班牙、瑞典、瑞士、土耳其和聯合王國的一項或多項專利中得到驗證;
|
|
· |
23項非EP外國專利在澳大利亞、保加利亞、加拿大、中國、捷克共和國、愛沙尼亞、歐亞(在所有9個歐亞國家得到驗證)、香港、匈牙利、以色列、日本、墨西哥、新西蘭、挪威、菲律賓、波蘭、塞爾維亞、新加坡、斯洛伐克、韓國和南非頒發;以及
|
|
· |
巴西、香港、墨西哥和波蘭四項尚未申請的非EP外國專利申請。
|
我們擁有從安進到所有這些專利和專利申請的全球獨家許可證。此外,我們還擁有一項美國專利、一項美國非臨時專利申請、一項EP專利、一項懸而未決的EP專利申請以及50多項非EP外國專利和與一般多肽成分和配方有關的未決專利申請的全球非專利許可。
這四項專門授權的美國專利目前計劃於2022、3月和2023年月日到期。根據美國食品和藥物管理局批准該專利的時間、期限和具體情況,其中一項美國專利(或從相關專利申請中頒發的另一項專利)有望根據1984“藥品價格競爭和專利期限恢復法案”(通常稱為“哈奇-瓦克斯曼法案”)獲得最長五年的專利期限恢復。See “—Regulatory Matters— Patent Term Restoration and Marketing Exclusivity.” This could extend the expiration date of the U.S. Patent to as late as May 2027, March 2028 or November 2028, depending on which patent the term restoration is applied to. We intend to pursue pediatric exclusivity as well, which could add an additional six months to the patent term. The exclusively 獲發牌照的環保專利現定於2022年月日屆滿。其中一項專利預計可獲簽發為期五年的補充保護證明書,而該證明書可將有效期延長至2027年月日。
The U.S. patent system permits the filing of provisional and non-provisional patent applications. A non-provisional patent application is examined by the United States Patent and Trademark Office, or USPTO, and can mature into a patent once the USPTO determines that the claimed invention meets the standards for patentability. A provisional patent application is not examined, and automatically expires 12 months after its filing date. As a result, 臨時專利申請不能成熟為專利,臨時專利申請的申請條件不如非臨時專利申請的要求嚴格。除其他外,臨時申請通常用於為隨後的非臨時專利申請確定一個提前提交日期。
非臨時專利申請的提交日期被USPTO用來確定什麼是現有的技術,當它考慮一項聲稱的發明的可專利性時。如果滿足某些要求,非臨時專利申請可以要求享有較早提交的臨時專利申請的提交日期的利益。因此,臨時專利申請所規定的提交日期可以刪除否則可能妨礙一項發明的可專利性的信息。
我們知道有兩項美國第三方專利,其中包含與blys或baff結合多肽相關的廣泛要求。根據我們的分析,如果這些專利是針對我們的,我們不認為暴食會侵犯這些專利的任何有效主張。如果我們要在法庭上質疑這兩項已頒發的美國專利的有效性,我們就需要通過就無效性提出明確和令人信服的證據來克服附加於每一項美國專利的有效性推定。如果我們被要求對第三方提出的專利訴訟或我們提起的專利訴訟進行抗辯,或者如果我們提出這些訴訟,那麼如果第三方的專利被確定為有效並被解釋為涵蓋了暴雪,那麼我們的發展和商業化就會招致很大的訴訟費用。該項目可能會受到影響,使我們承擔潛在的損害賠償責任,並可能要求我們獲得許可證才能繼續銷售受影響的產品。這樣的許可可能無法以商業上可接受的條件獲得,如果有的話。
現行許可證協議
禮來公司
In July 2014, we entered into a worldwide, exclusive license agreement with Eli Lilly (the “Lilly Agreement”), to develop and commercialize Sollpura, a Phase 3 novel investigational PERT for the treatment of patients with EPI, often seen in patients with cystic fibrosis and other conditions. Under the terms of the Lilly Agreement, we were not required to make any up-front payment but are obligated to make milestone payments of up to $33.5 million for capsule products and $9.5 million for reformulated products upon the achievement of certain regulatory and commercial sales milestones, none of which have been achieved as of December 31, 2017. In addition, after sales of the licensed products exceed an aggregate of $100.0 million in the United States, we are obligated to pay tiered royalties on future net sales of products, ranging 從個位數到青少年中期的產品是開發和批准的定義在禮來協議。Our royalty obligations as to a particular licensed product will be payable, on a licensed product-by-licensed product basis, for the longer of (a) the date of expiration of the last to expire valid claim within the licensed patents that covers the manufacture, use or sale, offer to sell, or import of such licensed product by us or a sublicense in such country, or (b) 12 years after the first commercial 在適用的國家銷售適用的許可產品。
安進
In December 2007, we entered into a license agreement with Amgen, which was amended in October 2009 and November 2014 (as amended, the “Amgen Agreement”), pursuant to which we obtained an exclusive worldwide license to certain technology and compounds relating to blisibimod, as well as a non-exclusive worldwide license to technology relating to certain peptibody compositions of matter and formulations. The licensed patents included a specific 以前提交的美國和外國專利和申請,以及安進公司在執行日期後提出的任何申請,涵蓋有執照的技術。在協議期間,我們負責提交、起訴、辯護和維護所有完全許可的暴雪專利和申請。安進保留審查與上述文件,起訴,辯護和維護有關的所有文件的權利,我們被要求納入所有合理的意見或建議,安進就這些文件。
根據“安進協議”的條款,我們已向安進支付600萬美元的許可證費,用於支付冰毒。此外,我們還必須在達到某些發展、監管和商業目標後支付各種里程碑付款,包括在美國或歐洲聯盟開始進行第三階段臨牀研究時支付的費用。我們亦須在達到某些臨牀發展前發展目標時,支付高達1,000萬元,而在達到某些批准後發展里程碑時,則須繳付高達2,300萬元。此外,我們亦須按季按年向淨銷售額繳付專利費,按百分比由高個位數上升至低兩位數字,因為淨銷售額會增加。我們對某一特定國家某一產品的特許權使用費支付義務從在該國首次商業銷售該產品的第一次商業銷售之日開始,並於該國家第一次商業銷售之日或涉及該產品的製造、使用或銷售、銷售、銷售或進口的許可專利的最後有效請求的最後有效請求的有效期後10年內終止。
“安進協定”將繼續有效,直至我們選擇終止,或直至因任何一方或破產一方重大違約而終止為止。根據這些條款,如果我們不履行我們的義務,安進就可以終止協議,從而導致我們對許可技術的專有權利的喪失。
In connection with a collaborative arrangement with Zenyaku Kogyo Co., Ltd (“Zenyaku”) for the development of IgA nephropathy that was executed in December 2014 and terminated in January 2016, we amended the Amgen Agreement in November 2014 to (i) adjust certain royalty and milestone payment obligations payable to Amgen in light of our collaboration with Zenyaku and (ii) provide that the sublicense granted by us to Zenyaku shall survive the termination of the Amgen Agreement. Under this amendment, we also agreed to grant Amgen that number of shares of our common stock equal to $1.0 million divided by the volume weighted average price of our common stock for 20 trading days prior to issuance. We issued 420,751 shares of common stock to Amgen at $2.3767 per share on January 28, 2015 pursuant to a 與安進簽訂的訂閲協議,安進以放棄根據安進協議向安進支付的其他費用的形式支付的價款。
製造與供應
目前,我們在內部經理的監督下,依靠合同製造商生產臨牀研究所需的藥品和藥品。我們計劃繼續依靠合同製造商,以及潛在的合作伙伴,在美國食品及藥物管理局批准銷售的情況下,生產我們的產品候選產品的商業數量。我們的合同製造商獲得了這些藥品的原材料。以及我們臨牀研究所需的各種藥物產品。我們相信,在可預見的將來,這些原料和藥物產品的供應將足以滿足我們的需要。不過,我們並沒有就任何藥劑系統的所有成分訂立長期供應協議,因此,我們可能無法在可接受的時限內或以合理的成本,以可接受的質素,以足夠的數量採購所有所需的零件。
我們的研究和開發活動涉及控制使用潛在危險物質,包括有毒化學和生物材料。因此,我們受聯邦、州和地方法律的管轄,這些法律涉及這些材料的使用、處理和處置。我們相信,我們處理和處置這些材料的安全程序在所有重要方面都符合地方、州和聯邦法規規定的標準。
銷售與營銷
鑑於我們的發展階段,我們還沒有發展商業組織或分銷能力。我們期望,一旦我們收到第三階段的數據,考慮到fda的批准和產品候選產品的商業推出,我們就會開發這些能力。為了使我們的產品候選產品商業化,我們計劃在內部或通過與第三方合作開發這些能力。在特定的治療領域,我們認為任何經批准的產品都可以通過一支專業銷售團隊進行商業化。在一個有限和集中的醫生羣體,我們可能尋求商業化的產品候選人單獨。我們還計劃為國際市場的產品尋求商業化合作夥伴。
We intend to build the commercial infrastructure necessary to bring our product candidates to market. In addition to a specialty sales force, sales management, internal sales support and an internal marketing group, we will need to establish capabilities to manage key accounts, such as managed care organizations, group-purchasing organizations, specialty pharmacies and government accounts. We may also choose to employ medical sales liaisons personnel to support our products.
監管事項
政府監管與產品審批
Government authorities in the United States at the federal, state and local level and other countries extensively regulate, among other things, the research, development, testing, manufacture, quality control, approval, labeling, packaging, storage, record-keeping, promotion, advertising, distribution, marketing, export and import of products such as those we are developing. Our product candidates must be approved by the FDA through either the new drug application, or NDA, process, or the biologics 許可證申請,或BLA,在合法銷售之前,可能會在美國銷售。我們的藥物候選人Sollpura和Blsibimod都是生物製造的,如果在第三階段成功的話,將通過BLA程序進行審批。
美國藥物開發進程
在美國,FDA根據“聯邦食品、藥品和化粧品法”(FDCA)以及“聯邦食品、藥品和化粧品法”(FDCA)和“公共衞生服務法”(公共衞生服務法)或“公共衞生服務法”(PHSA)以及實施條例對藥品進行監管。獲得法規批准和遵守適當的聯邦、州、地方和外國法規和條例的過程需要花費大量的時間和財政資源。如果在產品開發過程、批准過程或批准之後的任何時候不遵守適用的美國要求,申請人可能會受到行政或司法制裁。這些制裁可能包括FDA拒絕批准。pending applications, withdrawal of an approval, license revocation, a clinical hold, untitled or warning letters, product recalls, product seizures, total or partial suspension of production or distribution, injunctions, fines, refusals of government contracts, restitution, disgorgement or civil or criminal penalties. The process required by the FDA before a drug or biological product may be marketed in the United States generally involves the following:
|
· |
根據實驗室良好做法條例完成臨牀前實驗室試驗、動物研究和配方研究;
|
|
· |
向FDA提交IND,在人類臨牀研究開始之前必須生效;
|
|
· |
根據良好的臨牀實踐或GCP進行充分和良好控制的人類臨牀研究,以確定擬用於其預期用途的藥物或生物製品的安全性和有效性;
|
|
· |
令人滿意地完成FDA對生產該藥物或生物製品的生產設施的檢查,以評估是否符合cGMP要求;以及
|
The testing and approval process requires substantial time, effort and financial resources and we cannot be certain that any approvals for our product candidates will be granted on a timely basis, if at all. Once a pharmaceutical or biological product candidate is identified for development, it enters the preclinical testing stage. Nonclinical tests include laboratory evaluations of product chemistry, toxicity, formulation and stability, as well as animal studies to assess its potential safety and efficacy. An IND sponsor must submit the results of the preclinical tests, together with manufacturing information, analytical data and any available clinical data or literature, to the FDA as part of the IND. The sponsor includes a protocol detailing, among other things, the objectives of the initial clinical study, dosing procedures, subject selection and exclusion criteria, the parameters to be used in monitoring safety and the effectiveness criteria to be evaluated if the initial clinical study lends itself to an efficacy evaluation. Some nonclinical testing may continue even after the IND is submitted. The IND automatically becomes effective 30 days after receipt by the FDA, unless the FDA places the clinical study on a clinical hold within that 30-day time period. In such a case, the IND sponsor and FDA必須解決任何懸而未決的問題才能開始臨牀研究。臨牀擱置也可以由FDA在臨牀研究之前或期間的任何時間,因為安全考慮或不遵守。
All clinical studies must be conducted under the supervision of one or more qualified investigators in accordance with GCP regulations. These regulations include the requirement that all research subjects provide informed consent. Further, an institutional review board, or IRB, must review and approve the plan for any clinical study before it commences at any institution. An IRB considers, among other things, whether the risks to individuals participating 在研究中儘量減少並與預期的利益相比較是合理的。IRB還批准關於臨牀研究的信息以及必須提供給每個臨牀研究對象或其法律代表的同意書,並且必須在完成之前對臨牀研究進行監督。每一項新的臨牀協議和對該協議的任何修改都必須提交給fda。以供審查,並提交獨立審查委員會批准。
人類臨牀研究通常分三個順序階段進行,這些階段可能重疊或合併:
|
· |
第一階段:該產品最初被引入健康人體,並測試安全性、劑量耐受性、吸收、代謝、分佈和排泄。對於一些針對嚴重或危及生命的疾病的產品,特別是當該產品可能具有內在毒性,無法對健康志願者進行道德管理時,最初的人體測試通常是在患者身上進行的。
|
|
· |
第二階段:對有限的患者羣體進行研究,以確定可能的不良影響和安全風險,初步評估該產品對特定目標疾病的療效,並確定劑量耐受性和最佳劑量和時間表。
|
|
· |
第三階段:臨牀研究是為了進一步評估在地理位置分散的臨牀研究地點擴大的病人羣體的劑量、臨牀療效和安全性。這些研究旨在確定產品的總體風險/效益比,併為產品標識提供充分的依據。
|
詳細説明臨牀研究結果的進度報告必須至少每年向fda提交,安全報告必須在發起人確定有資格報告嚴重和意外的可疑不良反應的信息、其他研究、動物或體外試驗的結果表明對人類有重大風險或任何臨牀上重要的風險後15天內提交給fda和調查人員。將嚴重的疑似不良反應的發生率提高到規程或調查員手冊所列的水平。贊助商還必須在贊助商收到信息後7天內將任何意外的、致命的或危及生命的可疑不良反應通知FDA。第一、第二和第三階段的測試可能無法在任何規定的時間內成功完成。fda、數據安全監察委員會或贊助機構可基於不同理由,隨時暫停或終止臨牀研究,包括髮現研究對象或病人正面臨不可接受的健康風險。同樣,如臨牀研究並非按照irb的規定進行,irb可暫停或終止對其機構的臨牀研究的批准。其要求或藥物或生物製品是否與患者有意外的嚴重危害有關。
在進行臨牀研究的同時,公司通常還必須完成額外的動物研究,還必須開發有關產品的化學和物理特性的附加信息,並根據cGMP的要求最終確定產品的商業生產過程。生產過程必須能夠持續地生產產品候選產品的高質量批次,除其他外,製造商必須開發檢驗身份的方法。最終產品的強度、質量和純度。此外,必須選擇合適的包裝並進行測試,並且必須進行穩定性研究,以證明候選產品在保質期內不會遭受不可接受的變質。
美國審查和批准程序
產品開發、臨牀前研究和臨牀研究的結果,以及對藥物或生物製品進行的生產過程、分析測試、擬議的標籤和其他相關信息的説明,作為新藥NDA的一部分提交給FDA,或作為生物製品BLA的一部分提交給FDA,請求批准該產品的市場銷售。提交NDA或BLA須支付大量用户費用;在某些有限情況下,可獲得對該費用的豁免。
In addition, under the Pediatric Research Equity Act of 2003, or PREA, as amended, an NDA or BLA or supplement to an NDA or BLA must contain data to assess the safety and effectiveness of the drug or biological product for the claimed indications in all relevant pediatric subpopulations and to support dosing and administration for each pediatric subpopulation for which the product is safe and effective.FDA可以批准推遲提交數據或全部或部分放棄。A sponsor who is planning to submit a marketing application for a drug that includes a new active ingredient, new indication, new dosage form, new dosing regimen or new route of administration is required to submit an initial Pediatric Study Plan, or PSP, within sixty days of an end-of-Phase 2 meeting or, if there is no end-of-Phase 2 meeting as early as practicable before the initiation of the Phase 3 or Phase 2/3 study.最初的PSP必須包括髮起人計劃進行的兒科研究的大綱,包括研究目標和設計、年齡組、相關終點和統計方法,或不包括這些詳細信息的理由,以及任何推遲兒科評估或完全或部分放棄提供兒科研究數據和輔助信息的要求的要求。FDA和保證人必須就PSP達成協議。如果需要根據非臨牀研究、早期臨牀試驗和/或其他臨牀發展項目收集的數據考慮兒科計劃的變化,贊助商可以在任何時候提交已商定的初步PSP的修正案。除非條例另有規定,否則PREA不適用於任何藥物或生物產品,説明是否給予孤兒稱號。
FDA對提交的所有NDAs和BLAS進行審查,以確保它們在接受備案之前足以完成實質性審查。The FDA may request additional information rather than accept a NDA or BLA for filing. In this event, the NDA or BLA must be re-submitted with the additional information. The re-submitted application is also subject to review before the FDA accepts it for filing. Once the submission is accepted for filing, the FDA begins an in-depth substantive review. The FDA reviews an NDA to determine, among other things, whether a product is safe and effective for its intended use and whether its manufacturing is cGMP- compliant to assure and preserve the product’s identity, strength, quality and purity. The FDA reviews a BLA to determine, among other things, whether the product is safe, has an acceptable purity profile and is adequately potent, and whether its manufacturing meets standards designed to assure the product’在批准NDA或BLA之前,FDA將檢查生產該產品的設施或設施。FDA將不批准申請,除非它確定製造工藝和設施符合cGMP要求,並足以確保產品在規定的規格範圍內一致生產。FDA可將NDA或BLA提交給諮詢委員會,以審查、評估和建議是否應批准申請以及在何種條件下批准申請。諮詢委員會是一個諮詢委員會。專家小組,在FDA提出要求時,就提交給FDA的重要事項提供諮詢意見和建議。FDA不受諮詢委員會建議的約束,但通常遵循這些建議。
審批過程漫長而困難,如果適用的監管標準不符合或可能需要額外的臨牀數據或其他數據和信息,FDA可能拒絕批准NDA或BLA。即使提交了這些數據和信息,FDA也可能最終決定NDA或BLA不符合批准標準。從臨牀研究中獲得的數據並不總是結論性的,FDA可能對數據的解釋不同於我們對相同數據的解釋。如果FDA決定不批准目前的NDA或BLA,FDA將發出一封完整的回覆信。完整的回覆信通常描述FDA識別的NDA或BLA中的所有具體缺陷。識別可能是次要的,例如,需要標記改變,或主要,例如,需要額外的臨牀研究。此外,完整的回覆信可能包括建議申請人採取的行動,以便將申請置於批准的條件下。如果發出完整的回覆函,申請人可以重新提交NDA或BLA,解決信中指出的所有缺陷,或者撤回申請。
如果產品獲得監管部門的批准,批准可能會被限制在特定的疾病和劑量上,或者使用的適應症可能會受到限制,從而限制產品的商業價值。此外,fda可能要求在產品標籤中包括某些禁忌症、警告或預防措施。此外,fda還可能要求進行第四階段的測試,其中包括旨在進一步推進的臨牀研究。在NDA或BLA批准後,評估藥物或生物製品的安全性和有效性,並可能需要測試和監測程序來監測已商業化的核準產品的安全性。
專利條款恢復與市場獨佔性
Depending upon the timing, duration and specifics of FDA approval of the use of our product candidates, some of our U.S. patents may be eligible for limited patent term extension under the Hatch-Waxman Amendment. The Hatch-Waxman Amendment permits a patent term restoration of up to five years as compensation for patent term lost during the FDA regulatory review process. However, patent term restoration cannot extend the remaining term 從產品批准之日起計14年以上的專利。專利期限恢復期一般為IND生效日期至NDA或BLA提交日期之間的一半時間,再加上從提交NDA之日到批准該申請之間的時間。只有一項適用於已批准藥物的專利才有資格。延期和延期申請必須在專利期滿前提交。USPTO與FDA協商,審查和批准任何延長或恢復專利期限的申請。今後,我們打算為我們目前擁有或授權的一些專利申請恢復專利條款,以延長專利有效期。取決於臨牀研究的預期時間和其他與提交相關的NDA或BLA有關的因素。
FDCA下的市場獨家條款也可能推遲某些競爭對手申請的提交或批准。The FDCA provides a five-year period of non-patent marketing exclusivity within the United States to the first applicant to gain approval of an NDA for a new chemical entity. A drug is a new chemical entity if the FDA has not previously approved any other new drug containing the same active moiety, which is the molecule or ion responsible for the action of the drug substance. During the exclusivity period, the FDA may not accept for review an abbreviated new drug application, or ANDA, or a 505(b)(2) NDA submitted by another company for another version of such drug where the applicant does not own or have a legal right of reference to all the data required for approval. However, an application may be submitted after four years if it contains a certification of patent invalidity or non-infringement. The FDCA also provides three years of marketing exclusivity for an NDA, 505(b)(2) NDA or supplement to an existing NDA if new clinical investigations, other than bioavailability studies, that were conducted or sponsored by the applicant are deemed by the FDA to be essential to the approval of the application, for example new indications, dosages or strengths of an existing drug. This three-year exclusivity covers only the conditions associated with the new clinical investigations and does not prohibit the FDA from approving ANDAs for drugs containing the original active agent. Five-year and three-year exclusivity will not delay the submission or approval of a full NDA. However, an applicant submitting a full NDA would be required to conduct or obtain a right of reference to all of the preclinical studies and adequate and well-controlled clinical studies necessary to demonstrate safety and effectiveness. The Patient Protection and Affordable Care Act provides 12 years of data exclusivity for innovator biologics. During this exclusivity period, competitors are barred from relying on the innovator’s safety and efficacy data to gain FDA approval. Therefore, a competitor seeking to obtain marketing approval during this exclusivity period would be required to conduct its own preclinical and clinical studies.
在美國,兒科排他性是另一種排他性。Pediatric exclusivity, if granted, adds an additional six months to an existing exclusivity or statutory delay in approval resulting from a patent certification. This six-month exclusivity, which runs from the end of other exclusivity protection or patent delay, may be granted based on the voluntary completion of a pediatric study in accordance with an FDA-issued “Written Request” for such a study.
孤兒藥物名稱
根據“孤兒藥物法”,美國食品和藥物管理局(FDA)可能會授予孤兒一種用於治療罕見疾病或疾病的藥物或生物製品,這種疾病或疾病通常影響美國不到20萬人,或在美國超過20萬人,而且沒有合理的預期,開發和製造一種藥物或生物的費用是不合理的。在美國可用於這種疾病或疾病的產品將從該產品的銷售中回收。在提交NDA或BLA之前,必須要求孤兒產品的指定。在FDA批准孤兒產品指定後,治療劑的身份及其潛在的孤兒用途將由FDA公開披露。孤兒產品的指定在監管審查和批准過程中沒有任何優勢,也不會縮短其持續時間。
如果被指定為孤兒的產品隨後因其指定的疾病或疾病而獲得fda的第一次批准,則該產品有權獲得孤兒產品的排他性,這意味着fda不得批准任何其他以同一指示銷售同一藥物或生物產品的申請,除非在非常有限的情況下,例如顯示其臨牀優於該產品。with orphan exclusivity by means of greater effectiveness, greater safety, or by providing a major contribution to patient care, for seven years. Competitors, however, may receive approval of different products for the indication for which the orphan product has exclusivity or obtain approval for the same product, but for a different indication for which the orphan product has exclusivity. Orphan product exclusivity could also block the approval 如果競爭對手獲得FDA定義的同一種藥物或生物製品的批准,或者如果我們的任何產品候選產品被確定包含在競爭對手的產品中,用於相同的指示或疾病。如果指定為孤兒產品的藥物或生物產品獲得市場認可,其範圍超過什麼。是指定的,它可能沒有資格獲得孤兒產品的排他性。
美國食品和藥物管理局還實施了一項臨牀研究撥款計劃,研究人員可以通過競爭資金來進行臨牀研究,以支持批准治療罕見疾病和疾病的藥物、生物製劑、醫療器械和醫療食品。一種產品不必被指定為孤兒產品才有資格獲得該項目的資助。申請孤兒補助金的申請應向以下機構提出一項單獨的臨牀研究建議:促進FDA批准該產品的罕見疾病或情況。臨牀研究可能針對一個未經批准的新產品或未經批准的新用途的產品已經在市場上。
加速發展和審查方案
fda有一個快速程序,旨在加速或促進審查旨在治療嚴重或危及生命的新藥和生物製品的過程,並顯示出解決這種疾病未得到滿足的醫療需求的潛力。快速道的指定適用於該產品的組合及其正在研究的具體指示。快速通道產品,fda可以考慮在提交完整的申請之前,在nda或bla的滾動部分上進行審查,如果保薦人提供了提交nda或bla部分的時間表,fda同意接受nda或bla的部分,並確定該時間表是可以接受的,並且保薦人在提交時支付任何所需的用户費用。NDA或BLA的第一部分。
一個快車道產品也可能符合fda旨在加速開發和審查的其他類型的項目,例如優先審查和加速批准。如果快速通道產品有可能在沒有令人滿意的替代療法的情況下提供安全有效的治療,或者在治療、診斷或預防方面與市場上的產品相比有顯著的改善,那麼它就有資格接受優先審查。產品:fda將嘗試將額外的資源用於評估指定優先審查的新藥或生物製品的申請,以便利審查。此外,快速通道產品可能有資格獲得加速審批。研究的藥物或生物產品在治療嚴重或危及生命的疾病方面的安全性和有效性,並提供有意義的治療效益。現有的治療方法可能會得到加速批准,這意味着它們可以在充分和控制良好的臨牀研究的基礎上得到批准,該研究確定該產品對替代終點有影響,而該終點有合理的可能預測臨牀效益的可能性,或者是基於對存活或不可逆轉的發病率以外的臨牀終點的影響。作為批准的條件,fda可能會要求。獲得加速批准的藥品或生物產品的主辦方進行充分和嚴格控制的營銷後臨牀研究。快速跟蹤指定、優先審查和加速批准不會改變審批標準,但可能會加快開發或批准過程。
贊助方可要求指定他們的藥物為突破療法,目的是加速開發和審查一種藥物,如果初步的臨牀證據表明,該藥物可能比現有的一種或多種臨牀治療方法有很大的改善,該藥物可單獨或與一種或多種其他藥物聯合治療嚴重或危及生命的疾病或疾病。FDA加快開發突破療法的行動包括:(A)在整個藥物開發過程中與主辦方和審查小組舉行會議,(B)就藥物開發問題向主辦方提供及時的諮詢和互動溝通,以確保開發項目能夠收集非臨牀和臨牀方面的信息。data necessary for approval is as efficient as practicable, (c) involving senior managers and experienced review staff, as appropriate, in a collaborative, cross-disciplinary review, (d) assigning a cross-disciplinary project lead for the FDA review team to facilitate an efficient review of the development program and to serve as a scientific liaison between the review team and the sponsor and (e) taking steps to ensure that the design of the clinical 在科學上合適的情況下,試驗是儘可能有效的,例如通過儘量減少接受潛在不那麼有效治療的病人的數量。
核準後要求
我們獲得FDA批准的任何藥物或生物產品都必須受到FDA的持續監管,其中包括記錄保存要求、報告產品的不良體驗、向FDA提供最新的安全和功效信息、產品取樣和分銷要求、遵守某些電子記錄和簽名要求以及遵守FDA的促銷和廣告要求。食品和藥品管理局嚴格管制市場上投放的產品的標籤、廣告、促銷和其他類型的信息。藥品和生物製品只能根據經批准的標籤的規定,才能推廣到經批准的適應症。Further, manufacturers of drugs and biological products must continue to comply with cGMP requirements, which are extensive and require considerable time, resources and ongoing investment to ensure compliance. In addition, changes to the manufacturing process generally require prior FDA approval before being implemented and other types of changes to the approved product, such as adding new indications and additional labeling claims, are also subject to further FDA review and approval.
藥品和生物製品製造商和其他參與生產和銷售已批准藥品或生物製品的實體必須向FDA和某些州機構登記其機構,並定期接受FDA和某些州機構的檢查,以遵守cGMP和其他法律。cGMP要求適用於生產過程的所有階段,包括生產、加工。藥品或生物製品的滅菌、包裝、標籤、儲存和裝運。製造商必須建立經過驗證的系統,以確保產品符合規格和管理標準,並在每批或每批產品發佈前對其進行測試。
生物製品製造商還必須向FDA報告任何可能影響分佈式產品的安全性、純度或效力的偏離cGMP的情況;或任何可能影響分佈式產品的安全性、純度或效力的意外或不可預見的事件。該條例還要求調查和糾正任何偏離cGMP的行為,並強制規定文件要求。
我們依靠,並期望繼續依賴第三方生產臨牀和商業數量的我們的產品。未來的FDA和州檢查可能會在我們的合同製造商的設施中發現可能擾亂生產或分配的合規問題,或者可能需要大量的資源來糾正。
如果不遵守監管標準,或者在產品上市後出現問題,FDA可以撤回產品批准。後來發現一個產品以前未知的問題可能會導致對產品的限制,甚至導致產品完全退出市場。此外,不遵守監管要求可能導致行政或司法行動,如罰款、警告信、擱置臨牀研究、產品召回或扣押、產品扣留或拒絕允許進口或出口產品、拒絕批准待決的申請或補充品、限制銷售或製造、禁令或民事或刑事處罰。
此外,國會還不時起草、提出和通過立法,這將大大改變FDA管制的產品的批准、製造和銷售的法定規定。
除了新的立法,FDA的法規和政策經常被FDA以可能會對我們的業務和我們的產品產生重大影響的方式進行修訂或重新解釋。不可能預測是否會頒佈或實施進一步的立法或FDA法規或政策變化,以及這些變化的影響(如果有的話)。
外國管制
除了在美國的規定外,我們在選擇在美國以外地區銷售任何產品時,也要遵守各種外國關於臨牀研究和產品的商業銷售和分銷的規定,無論我們是否獲得fda的批准,我們都必須在此之前得到外國類似的監管機構的批准。我們可以在這些國家開展臨牀研究或產品營銷。各國的批准程序各不相同,審批時間可能比FDA批准的時間更長或更短。各國對臨牀研究、產品許可、定價和報銷的要求差別很大。
在歐洲聯盟,我們的產品受到廣泛的監管要求,其中除其他外,規定除非歐洲藥品管理局或國家主管當局已發出營銷授權,否則不得將任何醫藥產品投放到歐洲聯盟成員國的市場。歐洲聯盟成員國需要得到國家主管當局的監管許可和道德操守委員會的有利意見。在臨牀研究開始之前。
根據歐洲聯盟的監管制度,我們可以按照集中或分散的程序提交營銷授權申請。中央程序規定授予對所有歐洲聯盟成員國有效的單一營銷授權。對某些生物工藝生產的藥品,即含有一種新活性物質的產品,如神經退行性疾病的治療,集中式程序是強制性的。疾病或糖尿病和被指定為孤兒醫藥產品的產品,對於那些具有高度創新性的產品或對病人有利的集中過程的產品來説是可選的。分散審批程序規定,由一個或多個其他或多個成員國對一個成員國(稱為參考成員國)的申請進行評估時,由一個或多個其他或多個成員國(稱為參考成員國)批准。批准程序:申請人在收到有效申請後120天內,向參考成員國和有關成員國提交申請或檔案和相關材料(產品特徵摘要草稿、標籤草案和包裝傳單)。參考成員國在收到有效申請後120天內編寫評估草案和相關材料草案。在收到參考成員國的評估報告後90天內,各有關成員國必須決定是否批准評估報告和相關材料。如果一個成員國以潛在嚴重危害公共健康為由無法批准評估報告和相關材料,爭議點最終可能會提交給歐盟委員會,歐盟委員會的決定對所有成員國都具有約束力。
報銷
Sales of pharmaceutical products depend significantly on the availability and adequacy of third-party reimbursement. Third-party payors include government health administrative authorities, including, at the federal and state level, managed care providers, private health insurers and other organizations. We anticipate third-party payors will provide reimbursement for our product although we cannot predict the level of reimbursement such third-party payors will provide for our products. Third-party payors are increasingly 挑戰價格,檢驗醫療產品和服務的成本效益。In addition, significant uncertainty exists as to the reimbursement status of newly approved health care products. We may need to conduct expensive pharmacoeconomic studies in order to demonstrate the cost-effectiveness of our products. Our product candidates may not be considered cost-effective. It is time consuming and expensive for us to seek reimbursement from third-party payors. Reimbursement may not be available or sufficient to allow us to 在競爭和盈利的基礎上銷售我們的產品。
In addition, the U.S. Congress and state legislatures from time to time propose and adopt initiatives aimed at cost containment, which could impact our ability to sell our products profitably. For example, the Patient Protection and Affordable Care Act, as amended by the Health Care and Education Reconciliation Act of 2010, or collectively the ACA, contains provisions that may reduce the profitability of drug products through increased rebates for 醫療補助計劃償還的藥品、將醫療補助退税擴大到醫療補助管理的保健計劃、某些醫療保險D部分受益人的強制折扣以及根據製藥公司向聯邦醫療保健項目銷售的份額計算的年費。採取一般管制和措施,加上在現有管制和措施的管轄範圍內收緊限制性政策,可能會限制藥品的付款。
“醫療補助藥品回扣計劃”要求製藥企業與衞生和人類服務部部長簽訂國家退税協議,並與之生效,以此作為各州獲得聯邦匹配資金的條件,用於向醫療補助患者提供製造商的門診藥品。Effective in 2010, the ACA made several changes to the Medicaid Drug Rebate Program, including increasing pharmaceutical manufacturers’ rebate liability by raising the minimum basic Medicaid rebate on most branded prescription drugs from 15.1% of average manufacturer price, or AMP, to 23.1% of AMP, and adding a new rebate calculation for “line extensions” (i.e., new formulations, such as extended release formulations) of solid oral dosage 品牌產品的形式,創造了一種新的方法,對吸入、注入、注入、植入或注射的藥物計算所欠回扣,並通過修改AMP的法定定義可能影響其退税責任。ACA還擴大了醫療補助的使用範圍,但要有藥品回扣,要求製藥企業從2010開始支付醫療補助管理的醫療服務使用的回扣,並增加可能有資格享受醫療補助藥物福利的人口(分階段增加2014)。定價和退税計劃也必須符合美國1990年度總括預算調節法案的醫療補助退税要求。
.
The Medicare Prescription Drug, Improvement, and Modernization Act of 2003, or the MMA, imposed new requirements for the distribution and pricing of prescription drugs for Medicare beneficiaries, and included a major expansion of the prescription drug benefit under a new Medicare Part D. Under Part D, Medicare beneficiaries may enroll in prescription drug plans offered by private entities that will provide coverage of outpatient prescription drugs. Part D prescription 藥物計劃包括單獨的處方藥福利計劃和作為醫療保險優勢計劃補充的處方藥覆蓋面。與醫療保險的A和B部分不同,D部分的覆蓋範圍沒有標準化。D部分處方藥計劃的發起者不需要支付所有涵蓋的D部分藥品,而且每個藥物計劃都可以制定自己的藥品配方,以確定它將涵蓋哪些藥物,以及在什麼層次或級別上。雖然所有的醫療保險計劃都必須至少規定一個標準的覆蓋範圍。醫療保險,D部分處方藥計劃的主辦方不需要支付所有涵蓋的D部分藥品,每個藥物計劃都可以制定自己的藥品配方,以確定它將涵蓋哪些藥物,在什麼層次或級別上。然而,D部分處方藥配方必須包括每一類治療類和一類覆蓋的D部分藥物,但不一定所有藥物都包括在每一種藥物中。類別或類別。任何D部處方藥計劃所使用的處方必須由藥房及治療委員會制訂和評審。
Government payment for some of the costs of prescription drugs may increase demand for products for which we receive marketing approval. However, any negotiated prices for our products covered by a Part D prescription drug plan will likely be lower than the prices we might otherwise obtain. Moreover, while the MMA applies only to drug benefits for Medicare beneficiaries, private payors often follow Medicare coverage policy and payment limitations in setting their own payment rates.任何由MMA導致的付款減少都可能導致非政府支付者的付款減少。
藥品產品若要根據醫療補助或醫療保險B部分計劃獲得聯邦補償,或直接出售給美國政府機構,製造商必須向有資格參加340 B藥品定價計劃的實體提供折扣。對給定產品所需的340 B折扣是根據製造商報告的AMP和醫療補助回扣金額計算的。截至2010,ACA擴大了有資格獲得340 B折扣定價的實體類型,儘管根據目前的法律狀況,這些新的合格實體(兒童醫院除外)將沒有資格獲得孤兒藥物折扣340 B價格。由於340 B藥品價格是根據AMP和醫療補助回扣數據來確定的,對上述醫療補助折扣公式和AMP定義的修正會導致340 B折價的增加。美國2009的復甦和再投資法案為聯邦政府提供資金,以比較不同治療方法對同一疾病的效果。這項研究計劃於2012由衞生和人類服務部、保健研究和質量機構以及國家衞生研究所公佈,並定期向國會提交關於研究狀況和相關支出的報告。雖然比較成效研究的結果並不是要強制規定公共或私人付款人的保險政策,但尚不清楚這項研究對我們的藥物候選人的銷售有何影響,如果有這類藥物或打算治療的條件是試驗的話。也有可能是比較有效的研究,證明在競爭對手的藥物的好處可能會對我們的藥品銷售產生不利影響。如果第三方支付者不認為我們的藥物比其他可用的療法具有成本效益,他們可能不會在批准後將我們的藥物作為他們計劃中的一項利益,或者,如果他們這樣做了,付款水平可能不足以讓我們在有利可圖的基礎上出售我們的藥物。
近年來,又有一些法律直接或間接減少了某些醫療保險提供者的報銷,其中包括:
• 2011的預算控制法案,除其他外,制定了國會削減開支的措施。一個削減赤字聯合委員會負責建議在2013至2021年間至少削減1.2萬億美元赤字,但未能達到所要求的目標,從而觸發了該立法對幾個政府項目的自動削減。這些變化包括每個財政年度向醫療保險提供者支付的總金額減少2%,該計劃將於2013年4月生效,並將持續到2025,除非國會採取進一步行動。
• 美國2012納税人減免法案,除其他外,減少了對幾個提供者的醫療保險付款,並將政府收回對提供者的多付款項的時效期限從三年延長到五年。
• The Middle Class Tax Relief and Job Creation Act of 2012 required that the Centers for Medicare & Medicaid Services reduce the Medicare clinical laboratory fee schedule by 2% in 2013, which served as a base for 2014 and subsequent years. In addition, effective January 1, 2014, CMS also began bundling the Medicare payments for certain laboratory tests ordered while a patient received services in a hospital outpatient setting.
這些法律以及未來的州和聯邦醫療改革措施可能會在未來獲得通過,其中任何一項都可能導致醫療保險和其他醫療基金的進一步削減,並以其他方式影響我們可能獲得監管機構批准的任何產品候選人的價格,或任何此類產品候選人被規定或使用的頻率。
如上文所述,如果政府和第三方付款人未能提供足夠的保險和補償,我們獲得商業銷售管理批准的任何產品的可銷售性都可能受到影響。我們預計,美國日益強調控制成本的措施將繼續增加對藥品定價的壓力。保險政策和第三方償還率在任何時候都可能發生變化.即使我們獲得監管批准的一種或多種產品獲得了有利的保險和報銷地位,今後也可能實施較低的保險政策和補償率。還有一些法律規定公司是否有資格參加醫療保險和醫療補助報銷。例如,一家公司如果被發現違反了聯邦反回扣法,可能會被禁止參與,這可能會對一家公司的經營能力產生重大影響。下文將討論這些法律。
藥品的成本繼續引起政府和第三方的巨大利益,我們預計製藥業將面臨價格壓力,原因是醫療管理的趨勢,管理下的護理機構的影響力增加,以及更多的立法建議。事實上,我們預計將繼續有一些聯邦和州的提案來實施政府的價格控制和限制醫療保健的增長。費用,包括處方藥的費用。目前,醫療保險被禁止直接與製藥公司談判藥品。然而,國會正在考慮通過立法,解除對聯邦談判的禁令,雖然我們無法預測這些立法或監管提案是否會獲得通過,但通過這些提案可能會損害我們的業務、財務狀況和運營結果。
Some third-party payors also require pre-approval of coverage for new or innovative drug therapies before they will reimburse healthcare providers that use such therapies. While we cannot predict whether any proposed cost-containment measures will be adopted or otherwise implemented in the future, the announcement or adoption of these proposals could have a material adverse effect on our ability to obtain adequate prices for our product candidates and operate profitably.
此外,在一些外國,藥品的擬議價格必須得到批准,才能合法銷售。各國對藥品定價的要求差別很大。例如,歐盟為其成員國提供選擇,限制其國家健康保險制度提供報銷的醫藥產品的範圍,並控制供人使用的醫藥產品的價格。一個成員國可以批准某一特定的藥品價格,也可以採用一種制度。在一些國家,與政府當局進行定價談判可能需要6至12個月或更長的時間。為了在某些國家獲得報銷或定價批准,我們可能需要進行臨牀試驗,比較我們的產品候選產品的成本效益與其他產品的成本效益之間的關係。。。可以使用的療法。我們不能保證任何國家對藥品實行價格控制或補償限制,將允許對我們的產品進行有利的補償和定價安排。
其他保健法
對於我們的產品和任何可能獲得監管批准並在美國銷售的產品候選人,我們與第三方支付人、醫療保健提供者和客户的安排可能會使我們受到廣泛適用的欺詐和濫用以及其他可能限制商業或金融安排和關係的醫療法律和法規的影響,通過這些安排和關係,我們可以銷售、銷售和銷售我們獲得營銷許可的任何產品。此外,我們還可能受到美國聯邦和州政府以及外國司法機構的健康信息、隱私和安全監管的約束。在美國,這些法律包括(但不限於)州和聯邦反回扣、虛假主張、醫生透明度、病人數據隱私和安全法律法規,包括但不限於以下法律和條例:
|
· |
The federal Anti-Kickback Statute makes it illegal for any person, including a prescription drug manufacturer (or a party on its behalf) to, knowingly and willfully offer, solicit, receive, or pay remuneration, directly or indirectly, in cash or in kind, that is intended to induce or reward the referral of an individual for or the purchase or recommendation of an item or for which payment may be made under federal 醫療保健計劃,如醫療保險和醫療補助計劃。違反這項法律的行為可被處以最高五年的監禁、刑事罰款、行政民事罰款和被排除在聯邦醫療保健方案之外。此外,個人或實體不需要實際瞭解法規或違反法規的具體意圖。
|
|
· |
The federal False Claims Act imposes civil penalties, including through civil whistleblower or qui tam actions, against individuals or entities (including manufacturers) for, among other things, knowingly presenting, or causing to be presented false or fraudulent claims for payment by a federal healthcare program or making a false statement or record material to payment of a false claim or avoiding, decreasing or concealing an obligation to pay money to the federal government.對違反“虛假索賠法”的處罰包括:政府承受的實際損害賠償的三倍,以及對每一項虛假索賠的強制性民事處罰10,957美元至21,916美元,被排除在聯邦醫療保健方案之外的可能性,以及各種聯邦刑事法規的潛在影響。政府可能認為製造商“導致”了虛假或欺詐性索賠的提交,例如,向客户提供不準確的賬單或編碼信息,或推銷非標籤產品。包括因違反聯邦反Kickback法規而產生的項目或服務的索賠是虛假的或欺詐性的索賠,其目的是為了“虛假索賠法”的目的。根據本法,我們未來的市場營銷和與報告批發商或我們產品估計零售價格有關的活動,用於計算醫療補助退税信息和影響我們產品的聯邦、州和第三方報銷的其他信息的價格報告,以及我們產品和任何未來產品候選人的銷售和營銷,都要受到本法的審查。
|
|
· |
Health Insurance Portability and Accountability Act of 1996, or HIPAA, which imposes criminal and civil liability for knowingly and willfully executing, or attempting to execute, a scheme to defraud any healthcare benefit program, including private payors, knowingly and willfully embezzling or stealing from a healthcare benefit program, willfully obstructing a criminal investigation of a healthcare offense, and knowingly or willfully falsifying, concealing or covering up a material fact or making 與醫療福利、項目或服務的交付或支付有關的任何重大虛假、虛構或欺詐性陳述。
|
|
· |
經2009“經濟和臨牀衞生法”(“衞生信息技術促進經濟和臨牀健康法”(“HITECH”)修訂的“衞生信息技術”及其各自的實施條例,其中除其他外,對被覆蓋實體及其商業夥伴規定了與個人可識別的健康信息的隱私和安全有關的具體要求,包括強制性合同條款和對此類信息的技術保障措施的執行。HITECH還制定了新的民事罰款等級,修訂了HIPAA,使民事和刑事處罰適用於商業夥伴,並賦予州檢察長新的權力,可就損害或禁令向聯邦法院提起民事訴訟,以執行聯邦HIPAA法律,並要求收取與提起聯邦民事訴訟有關的律師費和費用。
|
|
· |
The Physician Payments Sunshine Act, enacted as part of the ACA, as amended by the Health Care and Education Reconciliation Act of 2010, which imposed new annual reporting requirements for certain manufacturers of drugs, devices, biologics and medical supplies for which payment is available under Medicare, Medicaid or the Children’s Health Insurance Program for certain payments and other “transfers of value” provided to physicians and 教授醫院,以及醫生及其直系親屬擁有的所有權和投資權益。
|
|
· |
類似的國家和國外欺詐和濫用法律法規,如國家反回扣法和虛假債權法等,其適用範圍可能更廣,而不論受款人。這些法律由各種國家機構和私人行動執行。一些州的法律要求製藥公司遵守制藥行業的自願合規準則和相關的聯邦政府合規指南,要求製藥商向醫生和其他醫療提供者報告與付款和其他價值轉移有關的信息,並限制營銷做法或要求披露營銷支出。在某些情況下,州和外國法律也規定衞生信息的隱私和安全。這樣的數據隱私和安全法律可能在重要方面存在差異,而且常常不會被HIPAA搶佔,從而使遵從性工作複雜化。
|
這些法律的範圍和執行情況都是不確定的,尤其是在缺乏適用的先例和條例的情況下,醫療改革的當前環境會發生迅速的變化。聯邦和州的執法機構已經審查了醫療公司和醫療服務提供者之間的互動,這導致了醫療行業的一系列調查、起訴、定罪和和解。政府當局將得出結論,我們的商業慣例可能不符合現行或未來的法規、條例或判例法,涉及適用的欺詐和濫用或其他醫療保健法律和條例。If our operations are found to be in violation of any of these laws or any other related governmental regulations that may apply to us, we may be subject to significant civil, criminal and administrative penalties, damages, fines, imprisonment, disgorgement ,exclusion of drugs from government funded healthcare programs, such as Medicare and Medicaid, reputational harm, additional oversight and reporting obligations if we become subject to a corporate integrity agreement or 類似的和解,以解決關於不遵守這些法律和削減或重組我們的業務的指控。如果我們希望與之做生意的任何醫生或其他保健提供者或實體被發現不遵守適用的法律,他們可能會受到類似的行動、處罰和制裁。確保商業安排符合適用的醫療保健法,以及對政府當局可能進行的調查作出反應,可能會耗費時間和資源,並可能轉移公司對業務的注意力。
僱員
截至2017年月31,我們共有21名員工。我們所有的員工都從事行政、金融、臨牀、製造、監管和商業發展等工作。我們的員工中沒有一個是工會的代表,我們相信我們與員工的關係很好。
其他現有資料
我們受“外匯法”的信息要求的約束。因此,我們向證券交易委員會(SEC)提交定期報告、委託書和其他信息,這些信息可以通過訪問位於華盛頓特區東北街100F街的證交會公共資料室獲得,也可以通過致電美國證券交易委員會(SEC)1-800-SEC-0330獲得。此外,證券交易委員會還維持一個網站(www.sec.gov),其中包含報告、代理和信息陳述以及與電子文件的發行人有關的其他信息。
We were incorporated in Delaware in 2004. The mailing address of our headquarters is 25801 Industrial Blvd, Suite B, Hayward, CA 94545, and our telephone number at that location is 510-856-5600. Our website is www.anthera.com. Through a link on the “Investors” section of our website (under “SEC Filings” in the “Financial Information” section), we make available, free of charge, the following filings as soon as reasonably practicable after they are electronically filed with or furnished to the SEC: our Annual Reports on Form 10-K; Quarterly Reports on Form 10-Q; Current Reports on Form 8-K; and any amendments to those reports filed or furnished pursuant to Section 13(a) or 15(d) of the Exchange Act. Information contained on, or that can be accessed through, our website does not constitute 本年報的部分內容為表格10-K。
項目1A。危險因素
您應該仔細考慮下面描述的風險,以及本年度報告中關於表10-K的其他信息,包括本報告末尾出現的合併財務報表和相關附註。如果出現以下任何風險,我們的業務、財務狀況、運營結果和未來的增長前景可能會受到重大和不利的影響。
投資我們的證券涉及高度的風險。我們在一個充滿活力和迅速變化的行業中運作,涉及到許多風險和不確定性。以下所述的風險和不確定性並不是我們面臨的唯一風險和不確定性。其他風險和不確定因素,包括我們目前認為不重要的風險和不確定性,可能會損害我們的業務。如果下面討論的任何風險真的發生,我們的業務、財務狀況、經營結果或現金流量可能會受到重大的不利影響。這可能導致我們的證券價值下降,你可能會損失全部或部分投資。
與財務狀況和資本要求有關的風險
自成立以來,我們遭受了重大損失,並預計在可預見的將來,我們將遭受持續的重大損失。
我們是一家臨牀階段的生物科技公司,在臨牀研發階段擁有兩項資產。生物製藥產品開發的投資具有高度投機性,因為它需要大量的前期資本支出,而且任何潛在的候選產品都可能無法顯示出足夠的效果或可接受的安全狀況,無法獲得監管批准,並具有商業可行性。我們沒有獲準進行商業銷售的產品,也沒有生產出任何可接受的產品。任何產品銷售的收入,我們繼續承擔重大的研發和其他相關開支,我們正在進行的業務。因此,自2004成立以來,我們沒有盈利,每期都出現虧損。截至2017年月31,我們的累計赤字為434.4百萬美元。大部分虧損都是由於我們的產品開發計劃以及與我們的業務相關的一般和行政費用造成的。
我們的歷史損失,加上預期的未來虧損,已經並將繼續對我們的股東的權益和營運資本產生不利影響。此外,如果我們為我們的產品候選人獲得監管批准,我們可能會招致大量的銷售、營銷、許可和外包製造費用以及持續的產品開發費用。因此,我們期望在未來數年繼續蒙受重大損失,因為我們會繼續推動我們的產品候選人進行臨牀研究,以及我們:
|
· |
繼續開展Sollpura和Bilsibimod的臨牀研究;
|
|
· |
製造可供臨牀試驗使用的藥物產品,並支持日後的市場審批申請;及
|
我們未來的資本使用和需求取決於眾多前瞻性因素.這些因素包括:
|
· |
(二)專利申請的備案、起訴、執行或者抗辯所涉及的費用;
|
|
· |
獲取技術、產品候選和其他需要資金承諾的商業機會。
|
我們從來沒有創造任何產品收入,也可能永遠不會盈利。
我們能否創造產品收入和盈利能力,取決於我們能否獨自或與合作者合作,成功地完成產品候選產品的開發,對病人進行臨牀研究,為我們的產品候選產品獲得必要的監管批准,並將任何已批准的產品商業化。自成立以來,我們一直沒有從產品候選產品的商業銷售中獲得任何收入,也不期望產生任何收入。revenue from the commercial sales of our product candidates in the near term. However, as a result of the collaborative arrangement that we entered into with Zenyaku in December 2014 for the development of blisibimod, we began recognizing license fee revenue and collaborative revenue in 2015. The license fee revenue from the collaborative arrangement with Zenyaku was initially amortized as revenue over the performance obligation period (product development period) while reimbursement for our full-time employees (“FTEs”) was recorded as collaborative revenues as incurred. In September 2015, Zenyaku provided us a notice of its intent to terminate the Zenyaku Agreement, effective January 7, 2016. The termination was “at will” and Zenyaku alleged no breach of the Zenyaku Agreement by us. Because of an early termination of the Zenyaku Agreement, we 沒有確認2016以後根據“澤尼亞庫協議”獲得的收入。
我們的產品開發階段的商業成功將取決於許多因素,包括但不限於我們的能力。:
|
· |
為治療消化酶水平低及其他潛在疾病的患者提供了一種新的產品&Sollpura,取得了良好的效果,並促進了其發展;
|
|
· |
本產品可用於治療B細胞介導的自身免疫性疾病,包括成功開展和完成IgA腎病的臨牀研究,或其他與其發展有關的適應症;
|
|
· |
如果獲得監管批准,與第三方製造商一起開始我們的產品候選產品的商業生產;
|
|
· |
開展商業銷售,有效地推銷我們的產品候選人,無論是獨立的還是與第三方的戰略合作;
|
|
· |
獲得廣大市場的認可,我們的產品候選人在醫學界和第三方支付.
|
我們的產品候選產品面臨基於新技術的治療技術發展所固有的失敗風險。我們的產品候選產品在臨牀研究中失敗了,因為我們無法證明它們是有效的。此外,如果我們的產品候選人對我們治療的病人造成不可接受的不良影響,我們的產品候選產品可能會失敗。我們的產品候選產品在臨牀研究中的失敗將對我們創收或盈利的能力產生重大的不利影響。如果我們不能成功地獲得監管機構的批准。對於我們的產品候選人,或者是在這麼做的過程中,我們的業務將受到實質性的損害。
我們將來需要大量的額外資本來資助我們的業務。如果沒有額外的資本,我們將不得不推遲、減少或停止運作。
我們預計,截至12月31日,我們的現金和現金等價物為220萬美元,加上根據12月31,2017日後的股權購買協議進行認股權證和出售普通股所得的淨收益1,110萬美元,這些淨收入來自於我們的股票證券的第二次私人配售,以及310萬美元的認股權證和出售普通股,這些都不足以為我們今後12個月的業務提供資金。由於提交了這份報告,使人對我們是否有能力繼續作為一個持續經營的企業產生重大懷疑。情況的轉變可能會令我們消耗資金的速度大大快於我們目前的預期。如果我們沒有及時獲得足夠的資金,或根本沒有足夠的資金,我們可能需要:
|
· |
大幅度修改,縮小範圍,推遲正在進行的臨牀研究和生產活動的Sollpura;
|
|
· |
終止、減少或推遲我們(一)建立銷售和營銷能力,(二)與其他人進行與我們產品候選人的銷售、營銷和商業化有關的戰略合作,或(三)為使我們的產品候選人商業化而可能需要的其他活動,如果批准出售的話。
|
在審議了管理層減輕這種關切的計劃之後,對我們是否有能力繼續作為本報告之日的持續經營企業的重大懷疑並未得到緩解,財務報表不包括可能因這種不確定性的結果而引起的任何調整。
如果我們不能繼續作為一個有生存能力的實體,我們的股東可能會失去他們的全部投資。為了使我們繼續經營下去,超出我們目前預計的2018第二季度的現金跑道,我們將被要求從外部來源獲得資金,而且我們不能保證我們能夠以優惠的條件或任何條件這樣做。此外,任何融資的條款,都可能對我們股東的持有量或權益造成負面影響,例如,如果我們發行股票或出售債務證券來籌集額外資金,如果是可轉換的話,可能會進一步稀釋我們現有的股東;此外,如果融資條件有利的話,我們甚至可以選擇在需要之前籌集更多資金。
We plan to meet our capital requirements primarily through issuances of equity securities, potential partnerships, debt financing, and in the longer term, revenue from product sales. We may be forced to obtain funds through collaborations with potential collaborators that may require us to relinquish rights to our technologies or product candidates that we may otherwise seek to develop or commercialized independently. Failure to generate revenue or 籌集更多的資金會對我們實現預期業務目標的能力產生不利影響。
我們未來的資本需求將取決於許多因素,包括:
|
· |
我們的臨牀研究和其他產品開發活動的範圍、規模、進度、結果和成本;
|
|
· |
臨牀材料製造活動,包括支持市場批准、配方開發和產品改進申請的數據;
|
|
· |
非臨牀活動,我們可以追求與我們的臨牀研究平行;
|
|
· |
如果我們的產品候選人獲得監管機構的批准,與他們商業化相關的成本,包括開發銷售和營銷能力的成本和時間,或與其他人就產品候選產品的商業化進行戰略合作的成本;以及
|
我們要求向許可人支付的里程碑和特許權使用費的時間不確定,可能會對我們的現金流和運營結果產生不利影響。
在#date0#,我們簽訂了安進協議,根據該協議,我們獲得了與水皰病有關的某些技術和化合物的全球獨家許可證。根據安進協議,我們必須在達到任何冰毒製劑的某些發展、監管和商業目標後支付各種里程碑付款。我們在完成某些臨牀發展前里程碑時,須繳付高達1,000萬元,而在完成某些核準后里程碑時,則須支付高達2,300萬元;此外,我們亦須就淨銷售額繳付按季分層的專營權費,按百分比計算,按百分比由高個位數上升至低至10至10,000元,隨淨銷售額的增加而增加。
In July 2014, we entered into the Lilly Agreement, pursuant to which we obtained an exclusive worldwide license to certain technology and compounds relating to Sollpura. Pursuant to the Lilly Agreement, we are required to make various milestone payments upon our achievement of certain regulatory and commercial objectives for any Sollpura formulation. We are also required to make tiered royalty payments on net sales, which percentage increases from 高個位數到十幾歲左右,隨着淨銷售額的增加.
In March 2015, we received a research award of up to $3 million from Cystic Fibrosis Foundation Therapeutics Incorporated (“CFFT”) for the development of Sollpura. Under the research award agreement, we are obligated to pay royalties to CFFT as follows: i) a one-time royalty in an amount equal to the five times the award, payable in three installments between the first and second anniversaries of 產品的第一次商業銷售;(Ii)在產品淨銷售額之後,一次性的特許權使用費等於實際獎勵額,達到1億美元;以及(Iii)在產品的許可、銷售或其他轉讓或在產品商業銷售之前發生變更控制交易的情況下,一筆里程碑式的付款相當於實際獎勵的三倍。
我們完成這些活動的時間和相應的里程碑付款是由我們的許可方支付的,這取決於與我們的候選產品的臨牀、法規開發和商業化有關的相關因素,其中許多因素是我們無法控制的。在我們手頭沒有現金的情況下,我們可能有義務支付一筆里程碑付款。這可能要求我們推遲臨牀研究,限制我們的運作,縮減我們的商業化和營銷努力,尋求資金,以不利於我們的條件履行這些義務,或者我們的許可協議違約,這可能導致許可證的終止。
與產品開發和商品化相關的風險
我們在很大程度上依賴於我們的產品候選人的成功,這些產品仍在臨牀開發中。我們不能向你保證我們的產品候選人將獲得監管機構的批准或成功商業化。
到目前為止,我們還沒有獲得任何產品的市場認可、營銷、分銷或銷售。我們的業務的成功主要取決於我們成功開發和商業化產品候選人的能力。
我們的產品候選產品很容易出現藥物研發失敗的風險。在獲得藥品開發商業銷售的監管許可之前,我們必須用臨牀前和嚴格控制的臨牀研究中收集到的大量證據來證明,在美國獲得批准,令fda滿意,在其他國家獲得批准時,我們也必須證明類似的監管。這些國家的主管部門,確保產品候選產品安全有效地用於這一目標指示,並確保生產設施、工藝和控制措施充足,儘管我們作出了努力,但我們的產品候選者可能不會:
|
· |
提供治療或其他改進,比現有的,可比的治療方法;
|
在FDA批准我們的生物製劑許可證申請或BLAS之前,我們不允許在美國推銷我們的產品候選人,在我們得到這些國家的必要批准之前,我們不能在任何外國推銷我們的產品。我們沒有提交任何BLA或獲得市場批准,我們的產品候選人。
臨牀前測試和臨牀研究是一個漫長、昂貴和不確定的過程。我們可能會花費數年時間完成對任何特定產品的測試,並且在任何階段都可能出現故障。臨牀研究中的負面或非決定性結果或不良醫學事件也可能導致FDA或我們終止臨牀研究,或要求我們重複或進行額外的臨牀研究。此外,從臨牀研究中獲得的數據很容易受到不同的解釋,FDA或其他監管機構可能對我們的臨牀研究結果的解釋不如我們好。FDA和同等的外國監管機構在審批過程中擁有很大的酌處權,並可能決定我們的數據不足以支持營銷應用,並需要額外的臨牀前、臨牀或其他研究。
在我們的產品候選產品的監管審批過程中,我們不時與FDA和其他非美國監管機構就我們的開發項目的監管要求進行討論。我們可能會收到這些權威機構的非正式口頭或書面指導,這可能有助於我們的臨牀試驗設計的基礎。fda和其他非美國監管機構可能會在我們的產品候選人批准之前改變他們對這類非正式指導的立場。因此,我們無法確定非正式討論的結果是否會成為最終結果。如果我們不能有效和高效地解決和遵從fda和其他非美國監管機構的詢問和要求,我們的產品的批准。候選人可能會被推遲,他們的價值可能會降低。
任何終止或暫停或延遲開始或完成對我們產品候選產品的臨牀測試,都可能增加我們的成本,延誤或限制我們創收的能力,並對我們的商業前景產生不利影響。
延遲進行或完成臨牀測試,可能會對我們的產品開發成本造成重大影響。我們不知道計劃中的臨牀研究會否如期展開或如期完成。臨牀研究的展開和完成可能會因多個原因而延遲,包括因下列原因而出現的延誤:
|
· |
(二)取得管理批准,開始臨牀研究,或者遵守管理機關對臨牀研究的範圍或者設計規定的條件;
|
|
· |
就可接受的條件與預期的臨牀研究組織,或CRO,以及研究地點達成協議,其條款可以經過廣泛的協商,並且在不同的CRO和研究地點之間可能有很大的差異;
|
|
· |
製造,包括製造足夠數量的產品候選品或用於臨牀研究的其他材料;
|
|
· |
獲得IRB、批准或其他審查實體的批准,以便在預期地點進行臨牀研究;
|
|
· |
招募和登記病人蔘加臨牀研究的原因有多種,包括患者人數、臨牀研究方案的性質、對相關疾病的批准有效治療的可得性以及與其他臨牀研究項目競爭的類似適應症;
|
|
· |
臨牀研究中病人所經歷的嚴重或意外的藥物不良反應;以及
|
|
· |
保留已開始進行臨牀研究的患者,但可能因治療方案、治療的不良影響、治療無效、個人問題或失去進一步隨訪而退出。
|
Clinical studies may also be delayed, suspended or terminated as a result of ambiguous or negative interim results, or results that are inconsistent with earlier results. In addition, a clinical study may be suspended or terminated by us, the FDA, the IRB or other reviewing entity overseeing the clinical study at issue, at any of our clinical study sites with respect to that site, or other regulatory authorities due to a number of factors, including:
|
· |
沒有按照規範要求或我們的臨牀協議進行臨牀研究;
|
|
· |
由FDA或其他監管機構對臨牀研究作業或研究場所進行檢查,結果造成臨牀擱置;
|
|
· |
意外的安全問題或任何臨牀研究會帶來不可接受的健康風險的決定;及
|
|
· |
缺乏足夠的資金繼續進行臨牀研究,包括由於入學延誤而產生意外費用,需要進行額外的臨牀研究,以及與我們的CRO和其他第三方的服務有關的費用增加。
|
如果我們在測試或批准產品候選人方面出現延誤,或者我們需要進行比計劃更多或更大的臨牀研究,我們的產品開發成本就會增加。我們通常依靠醫療機構和醫療機構的第三方臨牀調查人員來進行臨牀研究,因此,我們可能會面臨更多超出我們控制範圍的延誤。
Additionally, changes in regulatory requirements and policies may occur and we may need to amend clinical development plans or clinical study protocols to reflect these changes. Amendments may require us to resubmit our clinical study protocols to IRBs for re-examination, which may impact the costs, timing or successful completion of a clinical study. If we experience delays in completion of, or if we, the FDA or other regulatory authorities, the IRB or other reviewing entities, or any of our clinical study sites suspend or terminate any of our clinical studies, the commercial prospects for our product candidates may be harmed and our ability to generate product revenues will be delayed. In addition, many of the factors that cause, or lead to, termination or suspension of, or a delay in the commencement or completion of, clinical studies may 此外,如果一項或多項臨牀研究被延遲,我們的競爭對手可能會在我們之前將產品推向市場,而我們的產品候選者的商業生存能力可能會大大降低。
由於臨牀前試驗或早期臨牀研究的結果不一定能預測未來的結果,因此,我們進入臨牀研究的任何產品都可能在以後的臨牀研究中沒有良好的結果或得到監管機構的批准。
臨牀前試驗和早期臨牀研究的成功並不能保證以後的臨牀研究能夠產生足夠的數據來證明一種研究藥物或生物的有效性和安全性。一些製藥和生物科技行業的公司,包括那些擁有更多資源和經驗的公司,在第三階段的臨牀研究中遭遇了重大挫折,即使在早期的臨牀研究中看到了有希望的結果。儘管在早期臨牀研究中為我們的產品候選者報告了結果,但我們不知道我們可能進行的任何第三階段或其他臨牀研究是否會顯示出足夠的有效性和安全性。如果後期臨牀研究不能產生良好的結果,我們對任何產品候選產品獲得監管批准的能力可能會受到不利影響。即使我們認為我們的產品候選人在臨牀前測試和臨牀研究中表現令人滿意,我們也可能無法獲得FDA或其他監管機構對我們產品候選人的批准。
如果我們違反了我們的產品候選人的許可協議,我們可能失去繼續我們的產品候選人的開發和商業化的能力。
We are party to the Amgen Agreement, which provides for the exclusive worldwide licenses of the compositions of matter and methods of use for blisibimod, as well as non-exclusive worldwide licenses of compositions of matter and methods of use relating to peptibodies generally. We are also party to the Lilly Agreement, which provides for an exclusive worldwide license of the compositions of matter, formulation, and methods of use patents 對於Sollpura,這些協議要求我們及時支付里程碑和特許權使用費,提供定期信息,根據協議條款對我們的許可人進行保密和賠償。
If we fail to meet these obligations, our licensors may terminate our licenses and may be able to re-obtain licensed technologies and aspects of any intellectual properties controlled by us that relate to the licensed technologies that originated from our licensors. Our licensors could effectively take control of the development and commercialization of the licensed product candidates after an uncured, material breach of our license agreements by us or 如果我們自願終止協議,雖然我們期望行使我們可以利用的一切權利和補救辦法,包括尋求補救我們的任何違約行為,並以其他方式設法維護我們在獲得許可的專利和專利申請下的權利,但我們可能無法以可接受的成本或完全不及時地這樣做。許可協議可能會導致我們的獨家權利的喪失,並可能導致我們的產品開發和任何商業化的努力完全終止我們的產品候選人。
我們的工業面臨着激烈的競爭。如果我們不能有效地競爭,我們的產品候選人可能會被變成非競爭性的或過時的.
製藥業競爭激烈,技術日新月異。我們的潛在競爭對手包括大型製藥公司和更成熟的生物技術公司、專業製藥和仿製藥公司、學術機構、政府機構和其他進行研究、尋求專利保護和建立研究、開發、製造和商業化合作安排的公共和私營研究機構。或從事製藥和生物技術的開發、製造、營銷和商業化,其中一些可能與我們目前或未來的產品候選人競爭,其中任何一個競爭對手都有可能開發技術或產品,使我們的產品候選產品過時或不具有競爭力,這可能會對我們的收入潛力產生不利影響。影響我們產品商業成功的關鍵競爭因素。候選人可能是有效,安全概況,可靠性,方便的劑量,價格和報銷。
The market for pancreatic enzyme replacement therapy is also highly competitive. There are currently several marketed products for EPI caused by cystic fibrosis in the U.S., including Creon marketed by AbbVie, Inc., Pancreaze by Janssen Pharmaceuticals, Inc., Zenpep and Viokace by Allergan, and Pertzye by Chiesi. We are also aware of companies with other products in development that are being tested for potential treatment of EPI caused 囊狀纖維化:AzurRx生物藥理學公司的MS 1819脂肪酶目前正在慢性胰腺炎患者的第二階段試驗中測試;Alcresta治療公司銷售RELiZORB,這是一種脂肪酶盒,專供通過腸管接受營養的成年人使用,他們在消化和吸收脂肪方面有困難。
Many of our potential competitors have substantially greater financial, technical and human resources than we do and significantly greater experience in the discovery and development of drug candidates, and in obtaining FDA and other regulatory approvals of products and the commercialization of those products. Accordingly, our competitors may be more successful than we may be in obtaining FDA and other regulatory approvals for drugs and achieving widespread market acceptance. 我們的競爭對手的藥物可能更有效,副作用更小,開發和製造成本更低,或者比我們可能商業化的任何產品更有效地營銷和銷售,在我們能夠收回產品候選產品開發和商業化的費用之前,可能會使我們的產品候選產品過時或缺乏競爭力。我們預計,隨着新產品的出現,我們將面臨激烈和日益激烈的競爭。藥物進入市場,先進技術也隨之出現。這些實體也可能與我們的競爭對手建立合作或許可關係。最後,針對我們針對的疾病開發新的治療方法可能會使我們的藥物失去競爭力或過時,所有這些因素都可能對我們的業務產生不利影響。
我們的產品候選產品可能會造成不良影響,或者具有其他特性,這些特性可能會延遲或阻止它們的監管批准,或者限制任何已批准的標籤的商業特性。
我們的產品候選造成的不良影響可能導致我們、IRBs或其他審查實體、臨牀研究場所或管理當局中斷、延遲或停止臨牀研究,並可能導致FDA或其他監管機構拒絕批准監管。
Sollpura是我們在7月份從禮來公司獲得許可的,它在2011年4月由禮來公司開發時,收到了美國食品和藥物管理局的一封完整的回覆信(“CRL”)。Eli Lilly試圖解決FDA在CRL中強調的材料項目,並與FDA直接合作為Sollpura開展臨牀開發項目,如果該項目成功,將導致Sollpura得到監管機構的批准。仍然有開放的項目,從CRL,我們將需要解決與FDA。雖然我們計劃做出合理的努力,以適應和解決FDA的詢問和要求,但我們無法確定CRL的最終結果。任何延遲解決CRL的滿意的FDA可能導致我們的第三階段的臨牀試驗Sollpura患者的EPI。
如果在任何第三階段臨牀研究中觀察到與我們的產品候選人有關的嚴重不良事件,我們獲得監管批准的能力可能會受到不利影響。此外,如果我們的產品候選人獲得市場認可,而我們或其他人後來在批准並在越來越多的病人中使用後發現,我們的產品可能具有限制其用途或要求其退出的不良影響簡介(無論這些療法是否在第一階段至第三階段的臨牀研究中顯示出不良影響),許多潛在的重大負面後果可能會產生,包括:
|
· |
我們可能需要改變產品的使用方式,進行額外的臨牀研究或改變產品的標籤;
|
|
· |
我們可能會被起訴,並就對病人造成的傷害承擔責任;以及
|
這些事件中的任何一個都會阻止我們獲得或維持市場對受影響產品候選人的認可和接受,並可能大大增加商業化的成本。
在完成臨牀研究後,我們無法預測是否或何時會獲得監管機構的批准,將我們的產品候選產品商業化,因此,我們無法預測未來從候選產品中獲得任何收入的時間。
即使我們預測了積極的臨牀結果並提交監管機構批准,我們也不能將任何產品的候選產品商業化,直到產生臨牀和藥品生產數據並提交適當的監管當局,並且他們已經審查和批准了該產品候選產品的申請。我們不能向您保證,監管機構將及時完成他們的審查過程,或者我們將獲得我們開發的任何產品候選產品的監管批准。監管要求的滿足通常需要多年時間,取決於產品的類型、複雜性和新穎性,並需要大量資源的支出。此外,在產品開發、臨牀研究和FDA監管審查期間,我們可能會因未來的立法或行政行動或FDA政策的改變而受到延誤或拒絕。
即使我們的產品候選人獲得監管批准,他們仍可能面臨未來的開發和監管困難。
Even if U.S. regulatory approval is obtained, the FDA may still impose significant restrictions on a product’s indicated uses or marketing or impose ongoing requirements for potentially costly post-approval studies or post-market surveillance. For example, the label ultimately approved for blisibimod or Sollpura, if any, may include restrictions on use. Further, the FDA has indicated that long-term safety data on blisibimod may need to be obtained as a post-market requirement. Our product candidates will also be subject to ongoing FDA requirements governing the labeling, packaging, storage, distribution, safety surveillance, advertising, promotion, recordkeeping and reporting of safety and other post-market information. In addition, manufacturers of drug products and their facilities are subject to continual review and periodic inspections by the FDA and other regulatory authorities for compliance with current good manufacturing procedures, or cGMP, regulations. 如果我們或監管機構發現我們的產品候選產品以前不為人所知的問題,如意外的嚴重程度或頻率的不良事件,或產品生產設施的問題,監管機構可以對產品、製造設施或我們施加限制,包括要求從市場召回或退出產品或暫停生產。我們的產品候選產品的製造設施不符合適用的監管要求,監管機構可以:
|
· |
扣押或扣留產品,拒絕允許產品進出口,或要求我們發起產品召回。
|
上述任何事件或處罰的發生,都可能妨礙我們將產品商業化和創造收入的能力。
如果我們獲得監管批准的產品候選人不能獲得廣泛的市場認可,我們從他們的銷售中獲得的收入(如果有的話)將是有限的。
我們的產品候選產品能否在商業上獲得FDA或其他監管機構的市場批准,將取決於醫學界,包括醫生、病人和醫療保健支付人對這些產品的接受程度。市場對我們批准的產品的接受程度將取決於多個因素,包括:
|
· |
相對方便,易於管理和接受的醫生和付款人,我們的產品候選人;
|
|
· |
我們或任何未來合作者的銷售和營銷策略的有效性;
|
|
· |
我們有能力從政府醫療保健計劃(包括醫療保險和醫療補助)中獲得和維持足夠的第三方保險或報銷;以及
|
如果我們的產品候選人獲得批准,但沒有得到醫生、醫療費用支付人和病人的充分接受,我們可能無法從這些產品中獲得足夠的收入,我們可能無法或保持盈利。此外,我們努力教育醫學界和第三方支付者我們的產品候選人的利益可能需要大量資源,而且可能永遠不會成功。
我們面臨潛在的產品責任風險,如果成功的索賠對我們提出,我們可能會承擔重大責任。
在臨牀研究中使用產品候選人,以及銷售任何獲得市場推廣許可的產品,都會使我們面臨產品責任索賠的風險;產品責任索賠可能是由消費者、醫療保健供應商、製藥公司或其他銷售或以其他方式接觸我們產品的人提出的,如果我們不能成功地針對產品責任索賠為自己辯護,我們可能會承擔很大的責任。此外,無論是否有價值或最終結果,產品責任索賠都可能導致:
我們為臨牀研究提供的產品責任保險可能不足以補償我們可能遭受的所有費用或損失。此外,保險範圍日益昂貴,將來我們可能無法以合理的成本或足夠的金額,保障我們免受責任所引致的損失,如果我們獲得任何產品的市場認可,我們打算擴大我們的保險範圍,將商業產品的銷售包括在內,但我們可能無法取得這方面的保障。“。。。產品責任保險,以商業上合理的條款。有時,在集體訴訟中,由於藥品產生了意想不到的不良影響,人們做出了很大的判決。成功的產品責任索賠或一系列針對我們的索賠,可能導致我們的股價下跌,如果判斷超出我們的保險範圍,可能會減少我們的現金,並對我們的業務產生不利影響。
如果我們使用危險和生物材料的方式造成損害或違反適用的法律,我們可能要承擔損害賠償責任。
我們的研究和開發活動包括控制使用潛在危險物質,包括有毒化學和生物材料。我們可能要對這些危險物質造成的任何污染、傷害或其他損害承擔責任。此外,我們的業務生產危險廢物產品。雖然第三方負責處置我們的危險廢物,但根據環境法,我們有責任對任何必要的清理工作負責。處置我們的廢物的場所。聯邦、州、外國和地方的法律和法規對這些危險材料的使用、製造、儲存、處理和處置作出了規定。如果我們在任何時候不遵守這些法律和條例,或者它們改變了,我們可能會受到刑事制裁和重大的民事責任,這可能會損害我們的業務,即使我們繼續遵守所有有關危險材料的適用法律和條例,我們也無法消除意外污染或排放的風險,以及我們對這些事故造成的任何傷害或其他損害的責任。
我們依靠第三方來進行、監督和監督我們的臨牀研究,而這些第三方的表現可能令人不滿意,例如未能在既定期限內完成這些臨牀研究,或者如果他們遭受災難性事件,可能會損害我們的業務。
我們依靠CRO、醫療機構和臨牀調查員等第三方來招募符合條件的病人,並進行、監督和監督我們的臨牀研究,我們對這些第三方的依賴減少了我們對這些活動的控制,然而,我們對這些第三方的依賴並不能免除我們的監管責任,包括確保我們的臨牀研究是按照良好的標準進行的。clinical practices, or GCP, and the investigational plan and protocols contained in the relevant regulatory application, such as the investigational new drug application, or IND. In addition, the CROs with whom we contract may not complete activities on schedule, or may not conduct our preclinical studies or clinical studies in accordance with regulatory requirements or our clinical study design. If these third parties do not successfully carry out their contractual duties or meet expected deadlines, our efforts to obtain regulatory approvals for, and to commercialize, our product candidates may be delayed or prevented. In addition, if a catastrophe such as an earthquake, fire, flood or power loss should affect one of the third parties on which we rely, our business prospects could be harmed. For example, if a central laboratory holding all of our clinical study 樣品將遭受災難性的損失,他們的設施,我們將失去我們所有的樣本,並將不得不重複我們的研究。
我們的第三方製造商的任何失敗,我們所依賴的生產我們的臨牀前和臨牀藥物供應,我們打算依賴於生產任何批准的產品候選產品的商業供應,可能會延遲或削弱我們的能力,使我們的產品候選商品化。
我們一直依賴少數第三方製造商和活性藥物成分配方商來製造用於臨牀前和臨牀測試的材料,並打算在今後繼續這樣做。如果我們成功獲得必要的監管批准,我們也希望依賴第三方生產我們的產品候選產品的商業化生產所需的材料。由於無法安排第三方製造來源,或以商業上合理的條件進行,我們可能無法完成產品的開發或銷售。
依賴第三方製造商會帶來風險,如果我們自己生產產品候選產品,包括依賴第三方進行監管和質量保證,第三方有可能因為我們無法控制的因素而違反制造協議(包括未能按照我們的產品規格合成和製造產品),以及終止生產的可能性。或者第三方根據自己的業務優先級拒絕續簽協議,這對我們來説是昂貴或有害的。此外,FDA和其他監管機構要求我們的產品候選產品必須按照cGMP和類似的外國標準生產。Any failure by our third-party manufacturers to comply with cGMP or failure to scale up manufacturing processes, including any failure to deliver sufficient quantities in a timely manner, could lead to a delay in, or failure to obtain, regulatory approval. In addition, such failure could be the basis for action by the FDA to withdraw approvals previously granted to us and for other regulatory action, including recall or seizure, 全部或部分暫停生產或強制令。
我們依靠製造商向第三方供應商購買生產用於臨牀研究的藥物產品所需的材料,有少數供應商,在某些情況下,我們生產藥品所用的某些資本設備和原材料的單一供應商,這些供應商可能不會在我們需要的時候向我們的製造商出售這些原材料和設備。或以商業上合理的條款。我們對製造商購買這些原材料和設備的過程或時間沒有任何控制。此外,我們目前沒有任何關於這些原料的商業生產的協議。雖然我們通常不會開始臨牀研究,除非我們相信我們有足夠的產品候選品來完成臨牀研究,任何因需要更換第三方製造商而嚴重延遲供應供臨牀研究之用的產品或原料成分,可能會大大延誤我們的臨牀研究、產品測試及潛在的規管審批工作。如果我們的製造商或我們在獲得規管批准後無法購買這些原料,商業推廣工作便會被延遲。。。否則,這類候選產品的供應將出現短缺,這將損害我們從銷售這類候選產品中獲得收入的能力。
由於化合物的複雜性,我們的製造商可能無法以生產商業上成功的產品所需的成本、數量或及時的方式製造我們的化合物,如果我們成功地將一種產品商品化,我們可能需要建立大規模的商業製造能力,此外,隨着我們的藥物開發管道的增加和成熟,我們將有更大的發展。對臨牀研究和商業製造能力的需要。我們沒有經驗在商業規模上製造藥品,其中一些供應商將需要擴大其生產規模,以滿足我們對商業製造的預期需求,而這些需求可能不是及時發生的。
我們的部分製造供應商位於海外,而將藥物供應輸往或從這些設施運往預期的目的地,會受到我們無法控制的某些損失和損害的風險。此外,進口及從外國進口藥物,亦須遵守海關規例,規定我們可能須支付額外的規管費用。
在開發和驗證用於商業化的藥品製造過程方面的任何拖延都可能增加我們的成本,拖延或限制我們創收的能力,並對我們的商業前景產生不利影響。
延遲開始或完成藥物製造可能嚴重影響我們將藥物產品商業化的準備工作,我們不知道計劃中的製造工序是否會成功或如期完成,而藥物製造工序的發展和驗證可能會因多個原因而延遲,包括因下列原因而出現的延誤:
|
· |
就可接受的條件與可能的化學制造組織或CMO達成協議,其條款可經廣泛談判;
|
|
· |
製造設施或分銷商之間的運輸不正常或錯誤,導致一批藥品的部分或全部損失;以及
|
|
· |
無法控制的自然力量,可能使CMO暫時或永久無法生產我們的藥物。
|
藥品生產也可能由於以下幾個因素而被推遲、暫停或改變,這是由於FDA或其他國際監管當局的建議:
|
· |
由FDA或其他監管機構對CMO進行檢查,結果造成製造擱置。
|
此外,監管要求和政策可能會發生變化,我們可能需要修改我們的生產計劃或流程,以反映這些變化。對這些流程的修改可能會影響藥品生產過程商業化的成本、時間安排或成功完成開發和驗證。如果我們在完成過程中遇到延誤,或者如果我們、FDA或其他監管機構暫停或終止任何一項,則可能會影響到藥品生產過程的成本、時間或成功完成。我們的臨牀研究,我們的產品候選產品的商業前景可能會受到損害,我們產生產品收入的能力也會被推遲。此外,導致或導致產品商業化的終止或暫停的許多因素,或產品商業化的開始或完成的延遲,也可能最終導致我們的產品候選產品不獲監管批准。此外,如果產品商業化的話。延遲後,我們的競爭對手可能會在我們之前將產品推向市場,我們的產品候選產品的商業可行性可能會大大降低。
如果我們無法建立銷售和營銷能力,或與第三方達成協議,以銷售和銷售我們的產品,我們可能無法產生任何收入。
我們目前沒有藥品的銷售、銷售和分銷機構,建立和維持這樣一個組織的成本可能超過成本效益。為了銷售任何經fda批准的產品,我們必須建立我們的銷售、營銷、管理和其他非技術能力,或者與第三方作出安排來提供這些服務。如果是這樣的話,我們必須建立我們的銷售、營銷、管理和其他非技術能力,或者與第三方作出安排來提供這些服務。我們無法建立足夠的銷售、營銷和分銷能力,無論是獨立的還是與第三方合作,我們可能無法創造產品收入,也可能無法盈利。我們將與許多目前擁有廣泛和資金充足的營銷和銷售業務的公司競爭,如果沒有一個內部團隊或第三方的支持來履行營銷和銷售職能,我們可能無法成功地與這些更成熟的公司競爭。
G各種組織發佈的條款和建議可能會對我們可能獲得監管批准的任何產品的使用產生不利影響。
政府機構會發出直接適用於我們和我們的產品候選人的規例和指引,此外,專業團體、執業管理團體、私人健康或科學基金會,以及不時涉及各種疾病的組織,亦會不時向醫患團體發表指引或建議,這些建議可能涉及產品的使用,以及有關或互相競爭的療法的使用等事宜。對這些建議或其他提倡替代療法的指導方針的修改可能導致我們可能獲得監管批准的任何產品的使用減少,這可能會對我們的手術結果產生不利影響。
最近頒佈的法律和未來的立法或監管要求,或美國和外國司法機構對醫療保健系統的改革,可能會影響我們銷售產品的能力。
新的聯邦立法或監管要求可能會影響我們的產品候選人獲得監管批准的要求,或以其他方式限制我們將任何經批准的產品商業化的能力,或將我們的產品置於更嚴格的批准後要求。新的立法和附加提案一旦通過,可能會使我們獲得產品候選人的批准變得更加困難或繁重,我們所獲得的任何批准可能會更加嚴格或更嚴格。由於我們的審批要求非常繁重,我們成功地將批准的產品商業化的能力可能會受到阻礙,我們的業務也會因此受到損害。
Our ability to commercialize our future products successfully, alone or with collaborators, will depend in part on the extent to which reimbursement for the products will be available from government and health administration authorities, private health insurers and other third-party payors. The continuing efforts of the U.S. and foreign governments, insurance companies, managed care organizations and other payors of health care services to contain or reduce health care costs 可能會對我們為我們的產品制定價格的能力產生不利影響,我們認為這是公平的,也可能影響我們創造收入、實現和保持盈利的能力。
在美國,已經並將繼續對醫療保健系統進行一些立法和監管方面的修改,這些變化可能會阻止或推遲對藥品候選人的營銷審批,限制或規範審批後的活動,並影響我們出售任何獲得營銷批准的藥品候選人的能力。例如,在2010,“病人保護和平價醫療法案”(經“衞生保健和教育和解法”、“平價醫療法案”(簡稱ACA)修訂)獲得通過,極大地改變了政府和私營保險公司為醫療保健提供資金的方式,並對美國製藥業產生了重大影響。“非加太協定”對製藥和生物技術行業的重要規定除其他外包括:
|
· |
生產或進口某些品牌處方藥和生物製劑的任何實體的年度、不可扣減的費用,由這些實體根據其在某些政府保健項目中的市場份額分攤;
|
|
· |
提高法定最低折扣,製造商必須支付醫療補助藥品回扣計劃,分別為23.1%和13%的平均製造商價格品牌和仿製藥;
|
|
· |
一個新的醫療保險部分D覆蓋差距折扣計劃,其中製造商必須同意提供50%的銷售點折扣,在適用的品牌藥品的談判價格,在他們的覆蓋面差距期間,作為製造商的門診藥品被納入醫療保險D部分的條件;
|
|
· |
將製造商的醫療補助退税責任擴大到向參加醫療補助管理護理組織的個人發放的涵蓋藥品,除非該藥品根據340 B藥品折扣計劃受到折扣;
|
|
· |
一種新的方法,用於計算製造商根據“醫療補助藥品退税計劃”對吸入、注入、注入、植入或注射的藥物所欠的回扣;
|
|
· |
擴大醫療補助方案的資格標準,除其他外,允許各州向其他個人提供醫療補助保險,併為某些收入低於聯邦貧困水平133%的個人增加新的強制性資格類別,從而有可能增加製造商的醫療補助退税責任;
|
|
· |
擴大醫療欺詐和濫用法律,包括“虛假索賠法”和“反Kickback法規”,新的政府調查權力,並加強對不遵守規定的處罰;
|
|
· |
擴大公共衞生服務藥品定價方案下有資格享受折扣的實體;
|
|
· |
根據“聯邦醫生付款陽光法”的新要求,製藥商必須報告與支付給醫生和教學醫院的付款和其他價值轉移有關的信息,以及醫生及其直系親屬擁有的所有權或投資權益;
|
|
· |
一個新的以病人為中心的結果研究所,負責監督、確定優先事項,並進行比較臨牀效果研究,併為此類研究提供資金;
|
|
· |
設立獨立支付諮詢委員會,該委員會將有權建議對醫療保險計劃作出某些修改,從而減少處方藥的付款;以及
|
|
· |
在CMS建立一個醫療保險和醫療補助創新中心,以測試創新的支付和服務提供模式,以降低醫療保險和醫療補助支出,可能包括處方藥支出。
|
然而,自“非加太法”頒佈以來,對“非加太法”的許多方面都有修改和挑戰:
|
· |
在2012,美國最高法院聽取了對個人授權的違憲性和“醫療改革法”某些條款的可行性的質疑。最高法院的裁決維持了大部分“保健改革法”,並確定,要求個人保持“最低基本”健康保險範圍或向國內税務局支付罰款屬於國會的憲法徵税權力範圍。然而,由於2017年月下旬通過的税務改革立法,個人授權已被取消。目前尚不清楚取消個別任務對非加太是否可行的長期影響。
|
|
· |
On January 20, 2017, President Trump signed an Executive Order directing federal agencies with authorities and responsibilities under the ACA to waive, defer, grant exemptions from, or delay the implementation of any provision of the ACA that would impose a fiscal burden on states or a cost, fee, tax, penalty or regulatory burden on individuals, healthcare providers, health insurers, or manufacturers of pharmaceuticals or medical devices.
|
|
· |
2017年月13日,特朗普總統簽署了一項行政命令,終止了在美國國家保險管理局下補償保險公司的費用分攤補貼。幾個州的總檢察長提起訴訟,阻止政府終止補貼,但他們提出的限制令的請求於2017年月25被加州的一名聯邦法官駁回。
|
|
· |
CMS最近提出了一些條例,允許各州在為個人和小團體市場的保險公司設定基準方面給予更大的靈活性,這樣做的效果可能是放鬆ACA對通過這些市場銷售的計劃所要求的基本健康福利。
|
在2018,與反腐敗法有關的訴訟、規章和立法可能會繼續下去,結果難以預測和不確定。法案的全面影響、任何法律的廢除、取代和/或修改該法案的內容,以及關於我們業務的任何廢除或替代立法的政治不確定性仍然不清楚。
In addition, other legislative changes have been proposed and adopted that, directly or indirectly, affect or are likely to affect, the pharmaceutical industry and the commercialization of our products, including: the Budget Control Act of 2011; the American Taxpayer Relief Act of 2012; the Medicare Prescription Drug, Improvement, and Modernization Act of 2003, also called the Medicare Modernization Act (“ MMA”); and the Middle Class Tax Relief and Job Creation Act of 2012.我們預計,任何這些措施,以及未來可能採取的任何醫療改革措施,都可能導致更嚴格的覆蓋範圍標準,並對我們獲得的任何批准產品的價格造成額外的下行壓力。醫療保險或其他政府項目的報銷額的任何減少都可能導致私人支付者的付款減少。實施成本控制措施或其他醫療改革可能會使我們無法創造收入、獲得利潤或使我們的產品商業化。
美國各州政府也越來越積極地通過立法和實施旨在控制藥品和生物製品定價的法規,包括價格或病人報銷限制、折扣、對某些產品的獲取和營銷成本披露的限制以及透明度措施,在某些情況下,旨在鼓勵從其他國家進口和批量採購。我們預計將採取更多的州和聯邦醫療改革措施。將來,任何一項措施都可能限制聯邦和州政府支付醫療保健產品和服務的金額,這可能導致對我們產品候選人的需求減少或增加定價壓力,政府和其他第三方支付方通過各種手段控制或降低醫療費用的持續努力可能限制我們的商業機會,這將是費時而昂貴的。我們要經過向醫療保險和私人付款人尋求補償的過程,我們的產品可能不具成本效益,而政府及第三者的私人健康保險保障和補償,可能無法為病人提供我們未來任何產品的保障和補償,或足以讓我們在競爭和盈利的基礎上銷售我們的產品。我們的經營結果可能會受到不利的影響。by the MMA, attempts to repeal, replace, or modify the ACA, additional prescription drug coverage legislation, and by other health care reforms that may be enacted or adopted in the future. In addition, increasing emphasis on managed care in the United States will continue to put pressure on the pricing of pharmaceutical products. Cost control initiatives could decrease the price that we or any potential collaborators could 接受我們的任何未來產品,並可能影響我們的盈利能力。
在一些外國,包括歐盟和日本的主要市場,處方藥的定價受政府管制。在這些國家,與政府當局進行定價談判可能需要6至12個月或更長時間,才能獲得產品的市場監管批准。為了在某些國家獲得報銷或定價批准,我們可能需要進行一項臨牀研究,進行比較。我們的產品的成本效益其他可用的療法。這種藥物經濟學研究可能代價高昂,結果也不確定。如果我們的產品無法得到償還,或者在範圍或數量上受到限制,或者如果定價設定在不能令人滿意的水平,我們的業務就會受到損害。
我們要遵守醫療保健法律法規,這可能會使我們受到刑事制裁、民事處罰、合同損害、名譽損害以及利潤和未來收入的減少。
如果獲得批准,醫療保健提供者、醫生和其他人員將在推薦和處方我們的產品候選人方面發揮主要作用。我們與第三方付款人的未來安排將使我們面臨廣泛適用的欺詐、濫用和其他醫療法律法規,這些法律和法規可能會限制我們通過商業或金融安排和關係來銷售、銷售和分發我們的產品候選人,如果我們獲得了市場營銷許可的話。此外,我們可能受到聯邦政府和我們開展業務的州的病人隱私條例的約束。適用的聯邦和州保健法律和條例規定的限制包括:
|
· |
The federal Anti-Kickback Statute prohibits, among other things, persons from knowingly and willfully soliciting, offering, receiving or paying remuneration, directly or indirectly, in cash or in kind, to induce or reward either the referral of an individual for, or the purchase, order or recommendation of, any good or service for which payment may be made under federal healthcare programs such as Medicare and Medicaid.
|
|
· |
The federal false claims laws impose criminal and civil penalties, including those from civil whistleblower or qui tam actions pursuant to the federal False Claims Act, against individuals or entities for knowingly presenting, or causing to be presented, to the federal government, claims for payment that are false or fraudulent or making a false statement to avoid, decrease, or conceal an obligation to pay money to the federal government.
|
|
· |
經“經濟和臨牀健康健康信息技術法”修訂的1996聯邦健康保險可攜性和問責法規定了實施欺騙任何醫療福利計劃的刑事和民事責任,並規定了義務,包括強制性合同條款,以保障個人可識別的健康信息的隱私、安全和傳輸。
|
|
· |
聯邦虛假陳述法禁止故意故意偽造、隱瞞或掩蓋重大事實,或在提供或支付醫療福利、物品或服務方面作出任何重大虛假陳述。
|
|
· |
根據“病人保護和平價醫療法案”,聯邦透明要求有時被稱為“陽光法”,要求藥品、設備、生物製品和醫療用品製造商向衞生和公共服務部報告與醫生付款和其他價值轉移以及醫生所有權和投資利益有關的信息。
|
|
· |
HIPAA, as amended by the Health Information Technology for Economic and Clinical Health Act of 2009, and their respective implementing regulations, which impose requirements on certain covered healthcare providers, health plans, and healthcare clearinghouses as well as their respective business associates that perform services for them that involve the use, or disclosure of, individually identifiable health information, relating to the privacy, security and transmission of individually identifiable health information.
|
|
· |
聯邦消費者保護和不公平競爭法,這些法律廣泛地規範市場活動和可能損害消費者的活動。
|
|
· |
Analogous state laws and regulations, such as state anti-kickback and false claims laws and transparency laws, may apply to sales or marketing arrangements and claims involving healthcare items or services reimbursed by non-governmental third-party payors, including private insurers, and some state laws require pharmaceutical companies to comply with the pharmaceutical industry’s voluntary compliance guidelines and the relevant compliance guidance promulgated by the federal government in addition to requiring 藥品製造商應向醫生和其他醫療保健提供者報告與付款或營銷支出和藥品定價有關的信息。
|
確保我們今後與第三方的業務安排符合適用的醫療保健法律和條例可能是昂貴的。政府當局可能會得出結論,我們的商業做法不符合現行或今後涉及適用的欺詐和濫用的法規、條例或判例法或其他保健法律和條例。如果我們的業務,包括預計將由我們的銷售團隊進行的活動,被發現違反了這些法律或可能適用於我們的任何其他政府法規,我們可能會受到重大的民事、刑事和行政處罰、損害賠償、罰款和被排除在政府資助的醫療項目之外,如醫療保險和醫療補助,任何這些都可能嚴重擾亂我們的業務。如果我們希望與之做生意的任何醫生或其他提供者或實體被發現不遵守適用的法律,他們可能會受到刑事、民事或行政制裁,包括被排除在政府資助的醫療保健項目之外。
我們未來的成功取決於我們是否有能力留住我們的首席執行官和其他關鍵高管,以及吸引、留住和激勵合格的人才。
We are highly dependent on Mr. Craig Thompson, our Chief Executive Officer, Dr. William R. Shanahan, our Chief Medical Officer, Ms. May Liu, our Chief Accounting Officer, Dr. Renee Martin, our Senior Vice President, Medical Sciences, and the other principal members of our executive team. The loss of the services of any of these persons might impede the achievement of our research, development and commercialization objectives. Recruiting and 留住合格的科技人才,以及可能的銷售和營銷人員,也是我們成功的關鍵。考慮到眾多製藥和生物技術公司對類似人才的競爭,我們可能無法以可接受的條件吸引和留住這些人才。我們還經歷了從大學和研究機構招聘科研人員的競爭,如果臨牀研究不成功,我們可能會因此而受到競爭。招聘和挽留合資格的科學人員更有挑戰性。此外,我們還依賴顧問和顧問,包括科學顧問和臨牀顧問,協助我們制訂研究、發展和商業化戰略。我們的顧問和顧問可能受僱於我們以外的僱主,並可能根據與其他實體簽訂的諮詢或諮詢合同承擔義務,這可能會限制我們獲得這些顧問和顧問的機會。
證券市場風險與我國普通股投資
我們受到證券訴訟,這是昂貴的,可能轉移管理層的注意力。
我們的股價一直並且可能繼續波動。那些經歷過股票市場價格波動的公司已經受到證券集團訴訟的影響。我們是這類訴訟的目標。For example, on February 13, 2017, a complaint was filed in the United States District Court for the Northern District of California captioned Brian Clevlen v. Anthera Pharmaceuticals, Inc., et al., Case No. 3:17- cv-715, on behalf of a putative class of the Company’s stockholders against the Company and certain of its current and former officers that was voluntarily dismissed, as discussed in Item 3.這類訴訟可能會導致大量的費用和管理人員注意力和資源的轉移,這可能會對我們的業務產生不利影響。在訴訟中任何不利的決定也可能使我們承擔重大責任。
我們的股價一直而且很可能會繼續波動,這可能導致你對我們的普通股或集體訴訟的投資價值下降,從而使我們和我們的管理層承擔大量費用,轉移管理層的注意力和資源。
我們的普通股的市場價格一直並且很可能繼續波動。此外,我們的普通股的市場價格可能會因若干因素而大幅波動,其中大多數因素我們無法預測或控制,包括:
|
· |
為我們的產品候選人制定計劃,取得進展和臨牀研究的結果;
|
|
· |
由我們或競爭對手宣佈新產品、服務或技術、商業關係、收購或其他事件;
|
|
· |
(二)專利權的發展,包括與被許可人所持專利申請有關的權利;
|
|
· |
我們的任何產品候選人如果獲得批准,都無法取得商業成功;
|
|
· |
財務指引或證券分析師對我們財務業績的估計發生變化;
|
|
· |
出售我們的大量普通股,包括我們的執行官員、董事和重要股東的銷售;
|
|
· |
發表有關我們或我們行業的研究報告,或證券分析師提出正面或負面建議或撤回研究範圍;
|
|
· |
討論我們或我們的股票價格由金融媒體和網上投資者社區。
|
Although our common stock is listed for trading on the Nasdaq Capital Market, our securities have been relatively thinly traded. Investor trading patterns could serve to exacerbate the volatility of the price of the stock. Accordingly, it may be difficult to sell shares of common stock quickly without significantly depressing the value of the stock. Unless we are successful in developing continued investor interest in our stock, 我們股票的出售可能導致股票價格的重大波動,此外,股票市場,特別是納斯達克資本市場,經歷了與特定公司的經營業績似乎不相關的價格和成交量的大幅波動,這些廣泛的市場波動可能導致我們普通股的交易價格下跌。過去,證券一間公司在其普通股市價波動一段時間後,經常會有人向公司提出集體訴訟,而針對我們的證券訴訟,包括在其他表格10-K中所討論的,可能導致大量開支,轉移我們管理層的注意力和資源,並可能損害我們的業務、經營業績和財務狀況。
出售股票的股東將來出售我們的普通股可能會導致我們的股票價格下跌。
公開市場出售普通股的股東出售大量普通股,或認為可能會出現這種情況,可能會壓低我們普通股的市場價格,並可能削弱我們通過出售更多股本證券籌集資金的能力,即使這種出售與我們的業務業績之間沒有任何關係。
As of February 28, 2018, there were 23,397,497 shares of our common stock outstanding. In addition, we had outstanding 2,067,522 shares of Class Y Convertible Preferred Stock that are convertible into 2,067,522 shares of common stock, and options and warrants to purchase 26,520,407 shares of our common stock that, if converted and exercised, will result in these additional shares becoming available for sale.其中很大一部分股份和未發行的股權獎勵是由少數人和投資基金持有的。這些股東或期權持有人在公開市場上出售股票,或認為這些出售可能發生,可能壓低我們普通股的市場價格,並可能削弱我們通過出售額外股本證券籌集資金的能力,即使這種出售與我們的業務業績之間沒有任何關係。
我們需要籌集更多的資金來資助我們的業務,這可能會對我們現有的股東造成稀釋,限制我們的經營,或者要求我們放棄權利。
We will need to seek additional capital through a combination of private and public equity offerings, debt financings and collaboration, strategic and licensing arrangements. To the extent that we raise additional capital through the sale of equity or convertible debt securities, your ownership interest may be diluted, and the terms may include liquidation or other preferences that adversely affect your rights as a stockholder. Debt financing, if available, 可能涉及協議,其中包括限制或限制我們採取具體行動的能力的協議,如債務負擔、資本支出或宣佈股息。如果我們通過與第三方的合作、戰略聯盟和許可安排籌集額外資金,我們可能不得不放棄對我們不利的技術或產品候選者的寶貴權利,或以對我們不利的條件授予許可。
作為一家上市公司經營增加了我們的開支和行政負擔。
作為一家上市公司,我們承擔了大量的法律、會計和其他開支,而我們作為一傢俬營公司並沒有承擔這些費用。此外,我們的行政人員還需要執行額外的任務。例如,“薩班斯-奧克斯利法案”(Sarbanes-Oxley Act of 2002)、“薩班斯-奧克斯利法案”(Sarbanes-Oxley Act),以及美國證交會(SEC)和納斯達克資本市場(Nasdaq Capital Market)隨後實施的規則,對上市公司實施了各種要求,包括建立和維持有效的披露和財務控制,以及我們還必須承擔所有內部和外部費用,按照我們根據證券法承擔的義務,編寫和分發定期公開報告。
特別是,薩班斯-奧克斯利法案要求我們對財務報告和披露控制和程序保持有效的內部控制,我們必須按照薩班斯-奧克斯利法案第404條的要求,對我們對財務報告的內部控制進行系統和程序評估和測試,以便管理層能夠報告我們對財務報告的內部控制的有效性。Our compliance with Section 404 will require that we incur substantial accounting expense and expend significant management time on compliance-related issues. Moreover, if we are not able to comply with the requirements of Section 404 in a timely manner, our stock price could decline, and we could face sanctions, delisting or investigations by The Nasdaq Capital Market, or other material adverse effects on our business, reputation, results of operations, financial condition or liquidity.
我們不打算對我們的普通股支付股息,因此任何回報都將限於我們股票的價值。
我們從未就我們的普通股申報或支付任何現金股息。我們目前預計,我們將保留未來的收益,以發展、經營和擴大我們的業務,在可預見的將來,我們也不會宣佈或支付任何現金紅利。因此,給股東的任何回報將僅限於其股票的價值。
根據我們的租船文件和特拉華州的法律,反收購條款可能會使我們的收購變得更加困難,這可能對我們的股東有利,也可能阻止我們的股東試圖取代或撤換我們的現有管理層。
本公司經修訂及重述的公司註冊證明書及經修訂及重述的附例,可能會延遲或阻止我們的收購或我們的管理方式的改變。這些規定包括:
|
· |
為我們董事會的選舉提名或提出可在股東會議上採取行動的事項規定預先通知要求;
|
|
· |
董事會未經股東同意發行優先股的能力,這將增加流通股的數量,並可能阻礙收購企圖;
|
|
· |
規定至少75%的未償普通股才能修改上述任何規定。
|
此外,由於我們是在特拉華州註冊的,我們受“特拉華普通公司法”第203條的規定管轄,該條款限制了股東擁有超過15%的未清有表決權股票的能力,以便與我們合併或合併。雖然我們認為,這些條款集體規定,通過要求潛在收購者與我們的董事會談判,使股東有機會獲得更大的價值,但即使我們董事會拒絕的提議被一些股東認為是有益的,這些條款也會適用。此外,這些規定可能會使我們的股東更難以更換負責委任我們管理層成員的董事會成員,從而挫敗或阻止我們的股東試圖更換或撤換我們目前的管理層。
我們使用淨營業虧損結轉的能力可能受到限制,並可能導致我們未來的税負增加。
Generally, a change of more than 50% in the ownership of a corporation’s stock, by value, over a three-year period constitutes an ownership change for U.S. federal income tax purposes. An ownership change may limit a company’s ability to use its net operating loss carryforwards attributable to the period prior to such change. We underwent ownership changes within the meaning of Section 382 ownership 在2012和2018年間的“國內收入法典”中,我們的淨營業虧損結轉是有限的。此外,由於聯邦税收的目的,變革前的研發税收抵免也受到限制。如果我們獲得了淨應税收入,我們利用我們的預變化淨營業虧損結轉抵消美國聯邦應税收入的能力將受到限制,這將導致我們未來的税負增加。
我們可能無法根據我們的保質期登記表發行證券,這可能會對我們的流動性產生不利影響。
We have filed a shelf registration statement on Form S-3 with the SEC. The registration statement is subject to Instruction I.B.6. of Form S-3, which imposes a limitation on the maximum amount of securities that we may sell pursuant to the registration statement during any twelve-month period. When we sell securities pursuant to the registration statement, the amount of securities to be sold plus the amount of any securities we have sold during the prior twelve months in reliance on Instruction I.B.6. may not exceed one-third of the aggregate market value of our outstanding common stock held by non-affiliates as of a day during the 60 days immediately preceding such sale, as computed in accordance with Instruction I.B.6. Based on this calculation and the current market value of our outstanding common stock, we expect that we will 根據我們在表格S-3上的有效登記聲明,僅限於出售額外的證券,除非和直到非附屬公司持有的未償還普通股的市場價值顯著增加。如果我們不能在我們的貨架下出售證券註冊,我們可能需要使用更昂貴和耗時的手段進入資本市場,這可能會對我們的流動性和現金狀況產生重大的不利影響。
與我們的知識產權有關的風險
如果我們或我們的許可人的專利地位不能充分保護我們的產品候選人或任何未來的產品,其他人可以更直接地與我們競爭,或阻止我們的產品商業化,這將損害我們的業務。
我們擁有美國眾多歐洲(“EP”)和非EP的外國專利和專利申請的許可權利,涉及到大比目魚和索爾普拉。我們的Sollpura組合由Eli Lilly的特許專利和專利申請組成,我們的專利組合包括Amgen的獨家和非特許專利和Amgen的專利申請,以及我們擁有的美國和專利合作條約(PCT)專利申請。
我們的商業成功在一定程度上取決於我們和我們的許可人是否有能力獲得更多的專利和保護我們現有的專利地位,特別是那些我們已經獲得專有權的專利,以及我們是否有能力為我們在美國和其他國家的技術、產品候選者和未來的任何產品保持對其他知識產權的充分保護。如果不充分保護我們的知識產權,競爭對手可能會使用我們的技術,侵蝕或否定我們可能擁有的任何競爭優勢,這些競爭優勢可能會對我們的業務造成實質性損害,對我們在市場上的地位產生負面影響,限制我們將產品候選產品商業化的能力,拖延或使我們無法實現盈利。一些外國的法律並沒有保護我們的所有權。與美國的法律一樣,我們在保護這些國家的所有權方面可能會遇到重大問題。
The patent positions of biotechnology and pharmaceutical companies, including our patent position, involve complex legal and factual questions, and, therefore, validity and enforceability cannot be predicted with certainty. Patents may be challenged, deemed unenforceable, invalidated or circumvented. We and our licensors will be able to protect our proprietary rights from unauthorized use by third parties only to the extent that our proprietary technologies, product candidates and any future 產品包括有效的和可執行的專利,或作為商業機密得到有效維護。
我們未來保護我們的所有權的程度是不確定的,我們不能確保:
|
· |
我們或我們的許可人是第一個提出每項待決專利申請的發明的;
|
|
· |
我們或我們的許可人是第一個為這些發明提出專利申請的;
|
|
· |
其他人將不會獨立開發類似或替代技術或複製我們的任何技術;
|
|
· |
我們或我們的許可人的任何待決專利申請將導致已頒發的專利;
|
|
· |
我們或我們的許可人的任何專利都將有效或可執行;
|
|
· |
向我們或我們的許可人和合作者頒發的任何專利將為商業上可行的產品提供基礎,為我們提供任何競爭優勢,或不會受到第三方的質疑;
|
We are aware of two third-party issued United States patents that contain broad claims related to BLyS or BAFF binding polypeptides. Based on our analyses, if these patents were asserted against us, we do not believe that blisibimod would be found to infringe any valid claim of these patents. If we were to challenge the validity of either of these issued United States patent in court, we would 需要克服對每一項美國專利的效力推定,就專利主張的無效提出明確和令人信服的證據。沒有任何保證,法院在侵權或有效性問題上會對我們有利,如果我們被要求對第三方提出的專利訴訟進行抗辯,我們可能會在訴訟中承擔大量費用。或者,如果我們提起這些訴訟。如果第三方專利被確定為有效,並被解釋為適用於水泡,這個程序的發展和商業化可能會受到影響,使我們承擔潛在的損害賠償責任,此外還可能需要我們獲得許可證才能繼續銷售受影響的產品。這樣的許可證可能無法以商業上可接受的條件獲得,如果有的話。
我們可能無法充分防止商業祕密和其他專有信息的泄露。
We rely on trade secrets to protect our proprietary know-how and technological advances, especially where we do not believe patent protection is appropriate or obtainable. However, trade secrets are difficult to protect. We rely in part on confidentiality agreements with our employees, consultants, outside scientific collaborators, sponsored researchers and other advisors to protect our trade secrets and other proprietary information. These agreements may not effectively prevent disclosure 在未經授權披露機密信息的情況下,不得提供適當的補救措施。此外,其他人可能會獨立地發現我們的商業祕密和專有信息。為了執行和確定我們的所有權範圍,可能需要昂貴和耗時的訴訟。如果不能獲得或保持商業祕密保護,競爭對手可以利用我們的專有信息開發與我們的產品競爭的產品,或對我們的競爭業務地位造成額外的、重大的不利影響。
我們從第三方所有者那裏獲得專利權。如果我們或這些業主不適當地維護或執行這些許可證的專利,我們的競爭地位和商業前景將受到損害。
We are party to a license agreement with Amgen that provides exclusive and worldwide rights to develop and commercialize the novel BAFF inhibitor blisibimod, as well as non-exclusive rights to certain technology relating to peptibody compositions and formulations. We are also a party to a license agreement with Eli Lilly and Company that provides exclusive and worldwide rights to develop and commercialize Sollpura, as well as non-exclusive rights to 與Sollpura組合物和配方有關的某些技術。
We depend in part on our licensors to protect the proprietary rights covering blisibimod and Sollpura. Our licensors are responsible for maintaining certain issued patents and prosecuting certain patent applications. We have limited, if any, control over the amount or timing of resources that our licensors devote on our behalf or the priority they place on maintaining these patent rights and prosecuting these patent applications to our advantage. Our licensors may also be notified of alleged infringement and be sued for infringement of third-party patents or other proprietary rights. We may have limited, if any, control or involvement over the defense of these claims, and our licensors could be subject to injunctions and temporary or permanent exclusionary orders in the United States or other countries. Our licensors are not obligated to defend or assist in 我們對第三方侵權主張的抗辯。如果有的話,我們對資源的數量或時間(如果有的話)的控制是有限的,如果有的話,我們的許可人會以我們的名義,或者他們把保護這種第三方侵權主張的優先權。
Our success will depend in part on the ability of us or our licensors to obtain, maintain and enforce patent protection for their intellectual property, in particular, those patents to which we have secured exclusive rights. We or our licensors may not successfully prosecute the patent applications which we have licensed. Even if patents issue in respect of these patent applications, we or our licensors may fail to 維持這些專利,可能決定不向其他侵犯這些專利的公司提出訴訟,或可能以我們的方式進行較不積極的訴訟。如果沒有我們所批出的知識產權的保障,其他公司可能會提供大致相同的產品以供出售,這可能會對我們的競爭業務地位造成不利影響,並損害我們的商業前景。
如果我們不根據“哈奇-瓦克斯曼修正案”和類似的外國立法獲得保護,以延長我們的特許專利條款和(或)我們的產品候選人沒有獲得市場排他性,我們的業務將受到重大損害。
The Drug Price Competition and Patent Term Restoration Act of 1984, referred to as the Hatch-Waxman Amendment provides for an extension of patent term for drug compounds for a period of up to five years to compensate for time spent in clinical testing and the regulatory approval process. If the USPTO grants a five-year patent term extension for Sollpura and for blisibimod and if we continue to have rights under our license agreements with respect to both, our exclusive rights to one of Sollpura’s U.S. composition of matter patents could extend until 2030 or 2033 and our exclusive rights to one of blisibimod’s U.S. composition of matter patents could extend until 2027 or 2028. In Europe, similar legislative enactments allow patent terms in the European Union to be extended for up to five years through the grant of a Supplementary Protection Certificate. If each European country where we seek such grants a five-year extension for Sollpura and for blisibimod and if we continue to have rights under our license agreements with respect to both, our exclusive rights to Sollpura’s European composition of matter patents could extend until 2026 or 2030, and our exclusive rights to blisibimod’s European composition of 在這些歐洲國家,物質專利可以延長到2027。
但是,如果我們未能在適用的最後期限內提出申請,或未能在有關專利期滿前提出申請,或未能滿足適用的要求,則可能無法在某一特定國家獲得延期。此外,延長或提供專利保護範圍的適用期限可能少於我們的要求。如果我們不能獲得專利展期或恢復任何此類展期的時間低於我們的要求,我們的競爭對手,包括非專利替代品製造商,可以在專利期滿後獲得競爭產品的批准,我們的收入可能會減少,可能是實質性的。
此外,由於Sollpura和Bilsibimod均未在美國獲得批准,因此兩者都有資格從FDA獲得12年的生物數據獨佔權。在這一數據排他期內,競爭對手不得依靠創新者的生物安全性和有效性數據獲得批准。
Similarly, the European Union provides that companies who receive regulatory approval for a new small biologic will have a 10-year period of data exclusivity for that biologic (with the possibility of a further one-year extension) in most EU countries, beginning on the date of such European regulatory approval, regardless of when the European composition of matter patent covering such biologic expires. A generic version of the approved drug may not be marketed or sold during such market exclusivity period. The law governing biologic data exclusivity in the U.S. is complex and is still being interpreted and implemented by the FDA. As a result, its ultimate impact, implementation, and meaning are subject to uncertainty. While it is uncertain when such processes intended to implement the Biologics Price Competition and Innovation Act of 2009 may be fully adopted by the FDA, any such processes could have a material adverse effect on the future commercial prospects for Sollpura or blisibimod. For example, there is a risk that the 12-year period of exclusivity could be shortened due to congressional action or otherwise, or that the FDA will not consider Sollpura or blisibimod to be a reference product for competing products, potentially creating the opportunity for competition sooner than anticipated. 此外,生物相似物一旦獲得批准,將以類似於非生物製品的傳統仿製替代品的方式取代Sollpura或Bilsibimod的程度尚不清楚,並將取決於一些仍在發展中的市場和監管因素。
There is no assurance that we will receive extensions for our patents available under the Hatch-Waxman Amendment or similar foreign legislation, or that we will receive data exclusivity or other exclusive marketing rights. If we fail to receive such extensions or exclusivities or if we receive extensions or exclusivity periods that are materially shorter than expected, our ability to prevent competitors from manufacturing, marketing and selling biosimilars of our products will be materially harmed.
我們目前的專利地位和許可組合可能不包括我們的產品候選人的充分開發和商業化所需的所有專利權。我們不能確定我們將來可能需要的專利權是否會以商業上合理的條件或根本就能獲得許可。
我們通常開發產品候選人使用的化合物,我們有許可的和原始的物質,專利和專利的組成,聲稱活動和方法,這些化合物的生產和使用的範圍,在當時已知的範圍內。As we learn more about the mechanisms of action and new methods of manufacture and use of product candidates, we may file additional patent applications for these new inventions or we may need to ask our licensors to file them. We may also need to license additional patent rights or other rights on compounds, treatment methods or manufacturing processes because we learn that we need such rights during the continuing development of our product candidates.
雖然我們的授權專利和原始專利可能會阻止他人生產、使用或銷售類似產品,但它們並不保證我們不會侵犯第三方的專利權。我們可能不知道所有的專利或專利申請可能會影響我們的產品候選產品的製作、使用或銷售能力。例如,由於我們有時在確定某一產品候選產品的物質組成和治療用途之後,確定其作用機制或分子目標,我們可能無法意識到,直到該機制或目標進一步闡明第三方是否有。一項已頒發或正在申請的專利,聲稱生物活動或目標可能涵蓋我們的產品候選。U.S. patent applications filed after November 29, 2000 are confidential in the U.S. Patent and Trademark Office for the first 18 months after such applications’ earliest priority date, and patent offices in non-U.S. countries often publish patent applications for the first time six months or more after filing. Furthermore, we may not be aware of published or granted conflicting patent rights. Any conflicts resulting from patent 其他人的申請和專利可能大大減少我們的專利覆蓋面,限制我們獲得有意義的專利保護的能力。如果其他人獲得的專利要求相互矛盾,我們可能需要獲得這些專利的許可,或者開發或獲得替代技術。
如本報告所述,我們可能無法從從事我們業務所需的第三方獲得任何許可或其他專利、技術或訣竅的權利,而且這些許可,如果有,可能無法以商業上合理的條件獲得。如果沒有獲得這些許可,我們可能會延遲或阻止我們開發或商業化我們的產品候選產品或建議的產品候選產品。損害我們的業務。如下文所述,可能必須對第三方提起訴訟或專利干涉程序,以強制執行我們的任何專利或其他所有權權利,或確定此類第三方的所有權權利的範圍、有效性或可執行性。
有關專利、專利申請和其他專利權利的訴訟可能費用昂貴,費時費力。如果我們參與這類訴訟,可能會延誤產品的上市,損害我們的經營能力。
我們的商業成功在一定程度上取決於我們是否有能力生產、使用、銷售和要約出售我們的產品候選產品和擬議的產品候選產品,而不侵犯第三方的專利或其他專有權利。雖然我們目前不知道有任何訴訟或其他訴訟或第三方聲稱與我們的產品候選人有關的知識產權侵權,但製藥業的特點是對專利進行了廣泛的訴訟。以及其他知識產權。其他當事人將來可能獲得專利,並聲稱我們的技術侵犯了這些專利要求,或者我們未經授權而使用他們的專有技術。同樣,第三方也可能質疑或侵犯我們或許可人現有或未來的專利。
涉及我們的專利或專利申請或其他專利申請的程序可能導致對我們與產品候選人有關的發明的可專利性或與我們產品候選者有關的專利的可執行性、有效性或保護範圍作出不利的決定。
即使我們在這些訴訟中取得成功,我們也可能會在進行這些訴訟時招致大量的費用,並轉移管理人員的時間和注意力。如果我們不能避免侵犯他人的專利權,我們可能需要尋求許可,為侵權行為辯護,或在法庭上質疑專利的有效性。專利訴訟費用高昂,費時費力。我們可能沒有足夠的時間。resources to bring these actions to a successful conclusion. In addition, if we do not obtain a license, develop or obtain non-infringing technology, fail to defend an infringement action successfully or have our patents declared invalid, we may incur substantial monetary damages; encounter significant delays in bringing our product candidates to market; or be precluded from participating in the manufacture, use or sale of our product candidates or methods of treatment requiring licenses.
項目1B。未解決的工作人員意見
沒有。
項目2.特性
我們租賃了位於加州海沃德的主要運營設施。根據一項於8月到期的設施轉租協議,我們佔用了大約8,000平方英尺的面積。我們相信,我們現有的設施足以滿足我們目前的需求,今後我們需要的任何額外空間都將以商業上合理的條件提供。
項目3.法律訴訟
我們不會受到任何待決法律程序的影響,我們可能會不時參與日常的法律程序,以及在正常運作過程中出現的要求、申索和訴訟威脅。For example, on February 13, 2017, a complaint was filed in the United States District Court for the Northern District of California captioned Brian Clevlen v. Anthera Pharmaceuticals, Inc., et al., Case No. 3:17-cv-715, on behalf of a putative class of the Company’s stockholders against the Company and certain of its current and former officers. The complaint asserts claims under sections 10(b) and 20(a) of the Securities Exchange Act of 1934 on behalf of all stockholders that purchased the Company’s common stock between February 10, 2015 and December 27, 2016. The complaint alleges that the Company made false or misleading statements and/or omissions with respect to the CHABLIS-SC1 trial and SOLUTION study. The complaint seeks unspecified damages, interest, attorneys’ fees, costs, and such other relief at the Court may deem just and proper. On2017,4月17日,公司的一名股東,urešomirČorak提出了一項動議,要求任命該公司的首席原告,並指定Levi&Korsinsky lp律師事務所作為訴訟的首席律師。也是在4月17,2017,一羣推定的原告。該公司的股東包括肯特·羅伯茨、肯特·羅伯茨、埃文·羅伯茨、肯特·羅伯茨的母公司FBO歐文·羅伯茨和鮑比·金。賴克拉德克利夫公司和胡佛律師事務所被任命為訴訟中的聯絡律師。2017年月18日,法院任命烏雷·奧米爾·奧拉克(UrešOmirČOrak)為首席原告,萊維·科辛斯基律師事務所(Levi&Korsinsky LLP)為訴訟的首席律師。 2017年7月17日,首席原告在不影響訴訟的情況下,提交了一份自願駁回訴訟的通知。.
截至本報告之日,我們認為,沒有任何待決的訴訟單獨或總體上對我們的業務結果或財務狀況產生重大不利影響。
項目4.礦山安全披露
不適用。
第二部分
項目5.註冊人普通股市場、股東相關事項及發行者購買權益證券
普通股價格區間
我們的普通股從首次公開募股(Ipo)到2018年月26在納斯達克全球市場上市,代號為“Anth”。自2018年月26日以來,該公司一直以“Anth”的名義在納斯達克資本市場上市,在首次公開募股之前,我們的普通股沒有公開市場。下表列出了納斯達克全球市場所報告的我國普通股的日內高、低銷售價格:
| |
|
高
|
|
|
低層
|
|
|
2016第一季度
|
|
$
|
39.20
|
|
|
$
|
18.24
|
|
|
2016第二季度
|
|
$
|
35.20
|
|
|
$
|
21.52
|
|
|
2016第三季度
|
|
$
|
32.00
|
|
|
$
|
22.40
|
|
|
第四季度2016
|
|
$
|
27.36
|
|
|
$
|
5.12
|
|
|
2017第一季度
|
|
$
|
6.24
|
|
|
$
|
3.04
|
|
|
2017第二季度
|
|
$
|
3.52
|
|
|
$
|
1.54
|
|
|
2017第三季度
|
|
$
|
1.71
|
|
|
$
|
1.20
|
|
|
第四季度2017
|
|
$
|
2.43
|
|
|
$
|
1.34
|
|
持有我們普通股的人
截至2017年月31,共有13,854,491股普通股得到發行和發行,並由55名註冊股東根據公司轉讓代理提供的信息發行和持有。股東數量可能更多的可能是“街道名稱”或實益股東,其股份由銀行、經紀商和其他金融機構持有。
股利政策
我們從未申報或支付任何現金股息的普通股。我們目前打算保留任何未來的收益,以資助我們的業務的增長和發展。因此,我們預計在可預見的將來不會宣佈或支付任何現金紅利。日後有關宣佈及支付股息的決定(如有的話),將由董事局酌情決定,並視乎當時的情況,包括我們的財務狀況、經營結果、合約限制、資本要求、業務前景及董事局認為有關的其他因素。
根據股權補償計劃獲授權發行的證券
關於根據股權補償計劃獲準發行的證券的資料載於本報告第三部分第12項。
最近出售未註冊證券
在截至#date0#12月31日的一年內,我們並沒有發行或出售任何以前在表格10-Q的季度報告或在目前的表格8-K的報告中未披露的未註冊證券。
發行人購買股票證券
在截至12月31日的季度或年度內,我們沒有回購任何證券。
項目6.選定的財務數據(以千為單位,但股票和每股數據除外)
下表反映了過去五個財政年度中每一個財政年度的選定綜合財務彙總數據,這些數據來自我們已審計的財務報表。這些數據應與本年度報告中其他表格10-K所載的第二部分第7項“管理層對財務狀況和經營結果的討論和分析”和第二部分第8項“財務報表和補充數據”一併閲讀。
| |
|
截至12月31日的年度,
|
|
| |
|
2017
|
|
|
2016
|
|
|
2015
|
|
|
2014
|
|
|
2013
|
|
| |
|
(除股票和每股數據外,以千計)
|
|
|
業務報表數據:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
收入
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
許可證收入
|
|
$
|
—
|
|
|
$
|
139
|
|
|
$
|
2,562
|
|
|
$
|
—
|
|
|
$
|
—
|
|
|
合作收益
|
|
|
—
|
|
|
|
6
|
|
|
|
623
|
|
|
|
—
|
|
|
|
—
|
|
|
總收入
|
|
|
—
|
|
|
|
145
|
|
|
|
3,185
|
|
|
|
—
|
|
|
|
—
|
|
|
營業費用
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
研發
|
|
$
|
28,594
|
|
|
$
|
46,512
|
|
|
$
|
33,498
|
|
|
$
|
21,839
|
|
|
$
|
21,684
|
|
|
一般和行政
|
|
|
7,938
|
|
|
|
11,071
|
|
|
|
7,568
|
|
|
|
6,620
|
|
|
|
6,563
|
|
|
研究獎(1)
|
|
|
(100
|
)
|
|
|
(261
|
)
|
|
|
(2,638
|
)
|
|
|
—
|
|
|
|
—
|
|
|
業務費用共計
|
|
|
36,432
|
|
|
|
57,322
|
|
|
|
38,428
|
|
|
|
28,459
|
|
|
|
28,247
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
業務損失
|
|
|
(36,432
|
)
|
|
|
(57,177
|
)
|
|
|
(35,243
|
)
|
|
|
(28,459
|
)
|
|
|
(28,247
|
)
|
|
其他收入(費用)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
其他收入(費用)
|
|
|
(85
|
)
|
|
|
(90
|
)
|
|
|
23
|
|
|
|
(96
|
)
|
|
|
(15
|
)
|
|
利息費用
|
|
|
—
|
|
|
|
—
|
|
|
|
—
|
|
|
|
(1,049
|
)
|
|
|
(2,599
|
)
|
|
權證責任公允價值的變動
|
|
|
10,243
|
|
|
|
1,744
|
|
|
|
—
|
|
|
|
—
|
|
|
|
—
|
|
|
超過以下收益的認股權證法律責任的公允價值
籌資
|
|
|
(600
|
)
|
|
|
—
|
|
|
|
—
|
|
|
|
—
|
|
|
|
—
|
|
|
其他收入(費用)共計
|
|
|
9,558
|
|
|
|
1,654
|
|
|
|
23
|
|
|
|
(1,145
|
)
|
|
|
(2,614
|
)
|
|
淨損失
|
|
$
|
(26,874
|
)
|
|
$
|
(55,523
|
)
|
|
$
|
(35,220
|
)
|
|
$
|
(29,604
|
)
|
|
$
|
(30,861
|
)
|
|
可歸因於優先股的視為股息
|
|
|
(2,503
|
)
|
|
|
(10,914
|
)
|
|
|
—
|
|
|
|
—
|
|
|
|
—
|
|
|
適用於普通股股東的淨虧損
|
|
|
(29,377
|
)
|
|
$
|
(66,437
|
)
|
|
$
|
(35,220
|
)
|
|
$
|
(29,604
|
)
|
|
$
|
(30,861
|
)
|
|
每股淨虧損-基本損失和稀釋損失(2)
|
|
$
|
(2.86
|
)
|
|
$
|
(12.87
|
)
|
|
$
|
(7.91
|
)
|
|
$
|
(10.88
|
)
|
|
$
|
(13.52
|
)
|
|
每股淨虧損中使用的加權平均股份---基本和
稀釋(3)
|
|
|
10,278,391
|
|
|
|
5,163,784
|
|
|
|
4,453,905
|
|
|
|
2,722,034
|
|
|
|
2,283,427
|
|
| |
|
十二月三十一日,
|
|
| |
|
2017
|
|
|
2016
|
|
|
2015
|
|
|
2014
|
|
|
2013
|
|
| |
|
(單位:千)
|
|
|
資產負債表數據:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
現金、現金等價物和短期投資
|
|
$
|
2,196
|
|
|
$
|
20,843
|
|
|
$
|
46,951
|
|
|
$
|
2,639
|
|
|
$
|
25,946
|
|
|
限制現金
|
|
|
—
|
|
|
|
—
|
|
|
|
—
|
|
|
|
—
|
|
|
|
10,000
|
|
|
營運資本
|
|
|
(1,520
|
)
|
|
|
12,084
|
|
|
|
39,394
|
|
|
|
(2,729
|
)
|
|
|
18,743
|
|
|
總資產
|
|
|
3,673
|
|
|
|
23,471
|
|
|
|
48,125
|
|
|
|
3,490
|
|
|
|
37,417
|
|
|
應付票據共計
|
|
|
—
|
|
|
|
—
|
|
|
|
—
|
|
|
|
—
|
|
|
|
17,875
|
|
|
負債總額
|
|
|
9,168
|
|
|
|
10,624
|
|
|
|
8,468
|
|
|
|
5,751
|
|
|
|
22,659
|
|
|
緊急可贖回和可轉換優先
[br]股
|
|
|
—
|
|
|
|
377
|
|
|
|
—
|
|
|
|
—
|
|
|
|
—
|
|
|
可轉換優先股
|
|
|
333
|
|
|
|
8,614
|
|
|
|
—
|
|
|
|
—
|
|
|
|
—
|
|
|
普通股及額外繳入資本
|
|
|
428,600
|
|
|
|
411,410
|
|
|
|
391,688
|
|
|
|
314,550
|
|
|
|
301,965
|
|
|
累積赤字
|
|
|
(434,428
|
)
|
|
|
(407,554
|
)
|
|
|
(352,031
|
)
|
|
|
(316,811
|
)
|
|
|
(287,207
|
)
|
|
股東權益總額(赤字)
|
|
|
(5,495
|
)
|
|
|
12,470
|
|
|
|
39,657
|
|
|
|
(2,261
|
)
|
|
|
14,758
|
|
|
(1) |
在2015月份,我們因開發Sollpura而從CFFT獲得了高達300萬美元的研究獎金。該研究獎在完成授予協議中規定的某些里程碑後可由該公司接收。截至12月31日,2017年度,整個獎項已經收到,並被確認為截至12月31日、2017、2016和2015年度的運營費用的一個組成部分。
|
|
(2) |
每股攤薄收益(EPS)與基本每股收益(EPS)相同,因為普通股等值股份不包括在內,因為它們的效果是反稀釋的。
|
|
(3) |
加權平均每股基本股和稀釋股的淨虧損已經調整,以反映1比8反向股票分割,由公司在4月28日,2017。
|
項目7.管理層對財務狀況及經營成果的探討與分析
下列討論和分析應與我們的合併財務報表和“項目8”下的有關説明一併閲讀。合併財務報表和補充數據“。這一討論包含前瞻性的聲明,反映了我們目前的期望,其中涉及風險和不確定性。關於與這些聲明相關的不確定性、風險和假設的討論,見“關於前瞻性陳述的特別説明”。由於許多因素,包括“風險因素”和本報告其他部分所述的因素,實際結果和事件發生的時間可能與我們前瞻性發言中討論的結果大不相同。
概述
Anthera Pharmaceuticals, Inc. is a biopharmaceutical company focused on advancing the development and commercialization of innovative medicines that benefit patients with unmet medical needs. We currently have two compounds in development, Sollpura and blisibimod. We licensed Sollpura from Eli Lilly & Co (“Eli Lilly”) in July 2014. Sollpura is a novel non-porcine investigational Pancreatic Enzyme Replacement Therapy (“PERT”) intended 用於治療外分泌胰腺功能不全(“EPI”),常見於囊性纖維化等疾病。(“安進”)在去年12月。它的目標是B細胞激活因子(Baff),在多種B細胞介導的自身免疫性疾病中,包括免疫球蛋白A腎病和其他疾病中,B細胞激活因子被證明是升高的。
我們公司成立於2004,我們已將大量資源投入到產品的研發上。We have not generated any revenue from the commercial sales of our product candidates, and since inception we have funded our operations through equity offerings, private placements of convertible debt, debt financing, equity investment and cost reimbursement from a former collaborative partner, Zenyaku Kogyo Co., Ltd (“Zenyaku”), and a research award from Cystic Fibrosis Foundation Therapeutics Incorporated ("CFFT"). We will need substantial additional financing to 繼續發展我們的產品候選人,獲得監管機構的批准,併為運營費用提供資金,我們將尋求通過公共或私人股本或債務融資、與第三方的合作或其他安排或通過其他資金來源籌集這些資金。我們不能保證這樣的資金將以對我們有利的條件提供,如果有的話。除了與藥物開發公司有關的正常風險外,我們可能永遠無法成功地完成產品候選產品的開發,為我們的技術獲得足夠的專利保護,為我們的產品候選產品獲得必要的政府監管批准,或為任何獲得批准的產品候選人實現商業可行性。此外,即使我們成功地將我們的產品候選產品商業化,我們也可能無法盈利。.
在3月份,我們因開發Sollpura而獲得了CFFT高達300萬美元的研究獎金。我們保留開發和商業化Sollpura的權利,並將在合作下批准和商業化的任何藥物的淨銷售額上向CFFT支付特許權使用費。The funding is to be disbursed by CFFT to us upon our achievement of milestones specified in the agreement. At our discretion, we may choose to fund a particular stage of the Sollpura development plan without CFFT funds. Any CFFT funds not expended on the development program of Sollpura must be returned to CFFT and, upon such return, the amounts of such returned funds will not be included as part of the research award for the purpose of calculating royalties or other amounts owed by us to CFFT. To the extent CFFT provides or makes available any information, expertise, know-how or other intellectual property related to cystic fibrosis or the treatment, prevention or cure thereof (“CFFT Know-How”) to us, CFFT grants to us a non-exclusive, transferrable, sub licensable, worldwide rights and license under CFFT在這類CFFT知識中的所有權利---幫助我們研究、開發、商業化、製造或製造、使用、銷售、銷售、提供銷售、進口、出口和以其他方式開發產品。.
我們在EPI中開發Sollpura的第三階段
In May 2017, we initiated a Phase 3 study of Sollpura ("RESULT") in patients with EPI due to cystic fibrosis. The RESULT study is a randomized, open-label, assessor-blind, non-inferiority, active-comparator study evaluating the non-inferiority of Sollpura with respect to Coefficient of Fat Absorption (“CFA”) compared to a commercially available PERT in a population of porcine-derived PERT responders. The RESULT study’s design is modified from a previous Phase 3 study’s (“SOLUTION”) design to incorporate learnings from that study by 1) starting Sollpura dosing at 125% of the pre-study PERT dose, 2) allowing for a more “real life” dose adjustment, as needed, based on signs and symptoms throughout the first three weeks of the primary treatment phase of the study, and 3) providing a shorter primary treatment duration of 4 weeks, with 3 weeks of dose optimization and 1 week of stable dosing before measuring CFA. Patients are then followed in a 20-week extension period for the collection of longer term safety and efficacy (e.g., growth, maintenance of body weight) data. The RESULT study design was discussed with the FDA prior to initiation. Furthermore, the study had been approved by the 囊性纖維化基金會治療發展網絡(CFFTDN)協議審查委員會和歐洲囊性纖維化協會臨牀試驗網絡執行委員會。
The RESULT study enrolled 140 patients in North America, Eastern and Western Europe and Israel. In December 2017 and January 2018, pre-specified interim futility analyses of the RESULT study were conducted by a Data Monitoring Committee (“DMC”) comprised of experts appointed by the CFFTDN when approximately 25% and 50% of patients had completed the 4-week primary treatment period; in each instance, the committee recommended the study to continue to completion as planned.
A second, smaller Phase 3 study (“SIMPLICITY”) aimed at expanding the treatment age of patients to include patients age from 28 days to seven years old, and potentially enabling marketing approval for the sachet presentation of Sollpura, was initiated in the second quarter of 2016. The SIMPLICITY study utilizes sachets containing Sollpura powder for oral solution. The study is designed in two parts (Part A and Part B). Part A which evaluated the safety and general usability of Sollpura powder for oral solution in 15 patients ≥7 years of age, was completed in the fourth quarter of 2016. On December 9, 2016, an independent Data Monitoring Committee evaluated the data from Part A and approved progression to Part B, which will enroll pediatric subjects below 7 years of age. Assuming 結果研究是成功的,在我們開始進行B部分之前,我們計劃修改簡單性研究,採用類似於結果研究的劑量法,並在2018第二季度開始在B部分進行註冊。
Furthermore, during the third quarter of 2016, we initiated the EASY study, which provides continued access to Sollpura for patients in the Sollpura arm who completed the SOLUTION study. We have amended this study to also allow Sollpura-assigned patients completing the RESULT study at a lipase dose greater than 10,000 units/kg/day to have continued access until the Biological License Application (“BLA”) for Sollpura is approved by the FDA.
Lastly, prior to the RESULT study, we conducted another Phase 3 study (“SOLUTION”) in patients with EPI. The SOLUTION study was also a randomized, open-label, assessor-blind, non-inferiority, active-comparator study evaluating the efficacy and safety of Sollpura. This pivotal study enrolled 128 patients in North America, Europe and Israel. Top line data announced in December 2016 showed that the study narrowly missed the CFA non-inferiority margin of the primary mITT analysis by one percent; however, by additional pre-specified analyses of CFA (mITT-Baseline Observation Carried Forward and Per Protocol), Sollpura met the non-inferiority criterion. The study also demonstrated that the ratio of the three enzymes in Sollpura provided an appropriate response in CNA. In March 2017, we announced data from the extension phase of the study, which showed that Sollpura demonstrated comparable maintenance 在身高、體重和體重指數的關鍵測量中,除了在整個12周的延長期內都能很好地耐受。
我們相信,我們的Sollpura研究可能會提供一些潛在的機會,與目前市場上銷售的豬源性PERTS相比,包括:
|
· |
利用生物技術衍生的高純度酶,這些酶是通過發酵過程而不是從哺乳動物器官中提取產生的,從而避免了病毒傳播的標籤警告;
|
|
· |
能夠以固定比例製造脂肪酶、蛋白酶和澱粉酶,類似於人胰腺分泌的酶;
|
|
· |
使用一種新的、化學修飾的脂肪酶藥物,在胃pH值下對降解具有抗藥性,從而避免了腸道包衣的需要;
|
|
· |
由於缺乏腸內塗層,與豬的PERTS相比,可能更少、更小、更容易吞嚥膠囊,具有等效單位劑量強度和足夠的儲存穩定性;以及
|
|
· |
一種口服液中含有Sollpura粉的小袋製劑,可以很容易地溶入水中,最終為病人,特別是年輕的兒童患者,提供了一種易於吞嚥的劑量選擇。
|
IgA腎病水皰病治療的第二階段進展
2013,我們對亞洲和東歐地區的IgA腎病患者進行了二期臨牀研究。 a Phase 2 multicenter, randomized, double-blind, placebo-controlled study to evaluate the efficacy, safety, tolerability and immunogenicity of blisibimod in IgA nephropathy. Enrollment criteria included biopsy-proven IgA nephropathy and proteinuria greater than one gram but less than six grams per 24 hours (1g-6g/24hr). Patients must have been receiving standard of care medication including angiotensin converting enzyme inhibitors and/or angiotensin receptor blockers.Patients enrolled in the BRIGHT-SC study received 300mg weekly blisibimod or placebo subcutaneously during the first 8 weeks of therapy, the induction phase, followed by a minimum of 24 weeks of 200mg weekly blisibimod or placebo, the maintenance phase. The BRIGHT-SC study enrolled 58 patients. In August 2017, we reported top line data from the completed extension of the BRIGHT-SC study in which all patients had the opportunity to complete at least 60 weeks of treatment and some patients were treated for up to two years. Throughout the treatment period and for up to one year of additional follow up off treatment, blisibimod appeared to halt disease progression as measured by the mean estimate of urinary protein:creatinine levels ("proteinuria"). Specifically, in patients treated with blisibimod, the mean change in proteinuria was stable to trending slightly downward, 此外,根據估計腎小球濾過率(“EGFR”)的個別變化率(“EGFR”),患者的腎功能有保持的趨勢,年化改善率為+6.2mL/min/1.73m。2與之相比,每年惡化的速度為-4.8mL/min/1.73m2如下圖所示,服用安慰劑。此外,血清免疫球蛋白IgA、IgG和IgM在整個治療期間均有明顯下降。
收入
We have not generated any revenue from the commercial sales of our product candidates since our inception and do not expect to generate any revenue from the commercial sales of our product candidates in the near term. However, because of the collaborative arrangement that we entered into with Zenyaku in December 2014 for the development of blisibimod, we began recognizing license fee revenue and collaborative revenue in 2015. The license fee from the collaborative arrangement with Zenyaku was initially amortized as revenue over the performance obligation period (product development period) while reimbursement for our FTEs was recorded as collaborative revenues as incurred. In September 2015, we received a termination notice from Zenyaku to terminate the collaborative arrangement, effective January 7, 2016. Consequently, we revised the amortization period of our deferred revenue to correspond with the shortened collaboration 截至2016年月7日,我們的遞延收入已全部攤銷。
研發費用
自成立以來,我們的活動一直集中在我們的產品候選人的開發計劃。我們花費研究和開發成本,因為它們是發生的。Research and development expenses consist of personnel costs, including salaries, benefits and stock-based compensation, clinical studies performed by contract research organizations, or CROs, manufacturing and distribution of clinical drugs, and overhead allocations consisting of various administrative and facilities-related costs. Clinical study expenses are separated into two main categories: clinical development and pharmaceutical development. Historically, our clinical development costs have included costs for preclinical and clinical studies.我們預計會為持續的發展引起大量的臨牀開發費用。藥品開發費用包括與臨牀研究和產品配方及製造有關的費用。
我們正在並行地開發我們的產品候選人,我們通常在多個項目中使用我們的員工和基礎設施資源。因此,我們的部分研究及發展成本,並非由個別命名的計劃承擔,這些未分配費用包括薪金、股票補償費用及僱員的“附帶福利”費用(例如工人補償及健康保險費用)、顧問費及旅費。
下表顯示了我們2017、2016和2015(千)的研究和開發費用總額:
| |
截至12月31日的年度,
|
|
| |
2017
|
|
2016
|
|
2015
|
|
|
分配的費用:
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
水皰(1)
|
|
$
|
3,396
|
|
|
$
|
13,222
|
|
|
$
|
21,082
|
|
|
索爾普拉
|
|
|
18,265
|
|
|
|
26,113
|
|
|
|
6,682
|
|
|
未分配費用
|
|
|
6,933
|
|
|
|
7,177
|
|
|
|
5,734
|
|
|
研究和開發費用總額
|
|
$
|
28,594
|
|
|
$
|
46,512
|
|
|
$
|
33,498
|
|
|
(1) |
在截至#date0#12月31日的一年中,根據Zenyaku協議,暴雪的費用包括了總計150萬美元的開發費用。
|
我們預計,我們未來的研究及發展開支中,有很大一部分會用於支持我們目前及未來的臨牀發展及製造活動,而這些開支在完成時間及成本方面會受到很多不明朗因素的影響,包括:
|
· |
製造方面的挑戰包括原材料的成本、設備的購買和維護以及與藥品質量計量有關的費用。
|
我們的產品候選人中沒有一個獲得fda或外國監管機構的營銷批准。為了獲得營銷批准,fda或外國監管機構必須得出結論,臨牀數據確定了我們產品候選產品的安全性和有效性,並且我們的生產設施、流程和控制是足夠的。儘管我們作出了努力,但我們的產品候選產品可能無法提供治療或其他改進,而不是現有的、可比的藥物。安全有效的臨牀研究,或符合適用的監管標準。
由於上文討論的不確定因素,我們無法確定我們開發項目的持續時間和完成費用,也無法確定何時以及在多大程度上,我們將從核準的產品候選產品的商業化和銷售中獲得現金流入(如果有的話)。
一般費用和行政費用
一般和行政費用主要包括僱員的一般報酬和行政職能,包括行政、財務和商業發展。其他重大費用包括法律服務的專業費用,包括與獲得和維持專利有關的法律服務,以及作為上市公司經營的費用。作為一家上市公司,我們將繼續承擔大量的一般和行政費用,包括保險費、聘用額外人員的費用、向外部顧問、律師和會計師支付的費用,以及遵守公司治理、內部控制和適用於上市公司的類似要求的費用。
關鍵會計政策和估計
我們管理層對我們的財務狀況和經營結果的討論和分析是基於我們的合併財務報表,這些報表是根據美國公認的會計原則(GAAP)編制的。在編制這些綜合財務報表時,我們必須作出影響所報告的資產、負債和支出數額的估計和判斷。在持續的基礎上,我們評估這些估計和判斷,包括以下所述的估計和判斷。我們的估計是基於我們的歷史經驗和其他各種我們認為在當時情況下是合理的假設。這些估計和假設構成了對其他來源不太明顯的資產和負債的賬面價值作出判斷的基礎。實際結果和經驗可能與這些估計數大不相同。
雖然我們的重要會計政策在本年度10-K表截至2017年度的年度報告中所附的合併財務報表附註中得到了更全面的描述,但我們認為,以下會計政策是幫助您充分理解和評估我們報告的財務結果的最關鍵因素,並影響到我們在編制合併財務報表時使用的更重要的判斷和估計。
股票補償
We account for stock options and stock purchase rights related to our equity incentive plans under the provisions of ASC 718 which requires the recognition of the fair value of stock-based compensation. The fair value of stock options is estimated using a Black-Scholes option valuation model. This model requires the input of subjective assumptions including expected stock price volatility, expected life and estimated forfeitures of each award. 以股權為基礎的獎勵的公允價值按規定的服務期按比例攤銷。由於我們可以獲得的歷史數據數量有限,特別是在股票價格波動、員工行使模式和沒收方面,實際結果可能與我們的假設不同。
兼具權益與負債特徵的金融工具公允價值
大 公司已發行了某些金融工具,包括購買普通股的認股權證,這些工具兼具負債和股本的特點。認股權證等被歸類為負債的金融工具在發行時是公允價值的,在隨後的報告期內按公允價值重新計量,由此產生的公允價值變化記錄在其他收入/(費用)中。認股權證的公允價值是使用估值模型估算的。需要輸入主觀假設,包括股票價格波動、預期壽命、未來股票組合事件的概率及其對行使價格的影響。.
累積臨牀費用
我們根據當時我們所知道的事實和情況,對合並財務報表中每個資產負債表日期的應計臨牀費用作出估計。這一過程涉及審查未結合同和定購單,與我們適用的人員溝通,以確定代表我們執行的服務,並估計在我們尚未收到發票或以其他方式通知實際費用時所執行的服務水平和所產生的相關費用。我們的大多數服務供應商至少每月向我們開具所提供的服務的欠款。我們定期與服務提供商確認我們的估算的準確性,並在必要時進行調整。估計應計臨牀費用的例子包括:
|
· |
就臨牀研究資料的製作向合約製造商支付的費用;及
|
我們與臨牀研究及製造有關的開支,是根據與多間研究機構、臨牀研究機構、合約製造機構及其他服務提供者所簽訂的合約所獲得的服務及所付出的努力的估計而計算出來的,這些合約的財務條款須視乎合約而定,並會因合約而異,可能會造成不均衡的付款流動。一般來説,這些協議列明瞭工作範圍。按固定費用或單價支付。合同規定的付款主要由這些服務提供者支付的時間和材料驅動,與臨牀研究和製造活動有關的費用是根據服務提供者發生的時間和材料並按照合同計算的。如果時間表或合同是根據要執行的工作範圍進行修改的,我們將相應地修改我們的應計費用估計數。
業務結果
截至十二月三十一日、2017及2016年度之比較
收入
下表彙總了截至12月31日、2017和2016年度的收入(以千計,百分比除外):
| |
|
2017
|
|
|
2016
|
|
|
$Change
|
|
|
%變化
|
|
|
許可證收入
|
|
$
|
—
|
|
|
$
|
139
|
|
|
$
|
(139
|
)
|
|
|
(100
|
)%
|
|
合作收益
|
|
|
—
|
|
|
|
6
|
|
|
|
(6
|
)
|
|
|
(100
|
)%
|
|
總收入
|
|
$
|
—
|
|
|
$
|
145
|
|
|
$
|
(145
|
)
|
|
|
(100
|
)%
|
我們在2015開始確認收入來自我們與一個合作伙伴在2014年12月為開發暴雪而達成的合作安排。在2016月份,我們共錄得10萬元的收入,用以攤銷牌照費收入及償還電訊管理局的費用。這項合作安排已由2016年月7日起終止,終止後並無任何合作收益被確認。.
研發費用
下表彙總了截至12月31日、2017和2016年度的研究和開發費用(千,百分比除外):
| |
2017
|
|
2016
|
|
$Change
|
|
%變化
|
|
|
研發費用
|
|
$
|
28,594
|
|
|
$
|
46,512
|
|
|
$
|
(17,918
|
)
|
|
|
(39
|
)%
|
在截至12月31日的一年中,研究和開發費用從2016下降了2017,主要是由於解決方案和Chablis研究在2016基本完成,以及自2016以來簡單性研究暫停而降低了臨牀開發費用。2017年間完成了布萊特和查布利斯7.5項研究,2017啟動了對囊性纖維化外分泌胰腺功能不全患者的研究。臨牀發展活動的改變使費用減少了1 620萬美元。
一般費用和行政費用
下表彙總了截至12月31日、2017和2016年度的一般開支和行政開支(千,百分比除外):
| |
2017
|
|
2016
|
|
$Change
|
|
%變化
|
|
|
一般和行政費用
|
|
$
|
7,938
|
|
|
$
|
11,071
|
|
|
$
|
(3,133
|
)
|
|
|
(28
|
)%
|
在截至12月31日的一年中,一般和行政開支從2016下降了2017,主要是由於在2017實施的行政人員人數減少了大約三分之一,減少了340萬美元的工資和基於股票的補償費用。
研究獎
下表彙總了截至12月31日、2017和2016年度的研究成果(千,百分比除外):
| |
2017
|
|
2016
|
|
$Change
|
|
%變化
|
|
|
研究獎
|
|
$
|
(100
|
) |
|
$
|
(261
|
) |
|
$
|
(161
|
)
|
|
|
(62
|
)%
|
在截至12月31日的一年中,研究獎從2016下降到2017,主要是由於達到獎勵協議中規定的某些里程碑的時間。我們在2017充分認可了這個研究獎項。
其他收入(費用)
下表彙總了截至12月31日、2017和2016年度的其他收入(支出)(千,百分比除外):
| |
|
2017
|
|
|
2016
|
|
|
$Change
|
|
|
%變化
|
|
|
其他收入(費用)
|
|
$
|
(85
|
)
|
|
$
|
(90
|
)
|
|
$
|
5
|
|
|
|
6
|
%
|
|
超過融資收益的權證負債的公允價值
|
|
|
(600
|
)
|
|
|
—
|
|
|
|
(600
|
)
|
|
|
(100
|
)%
|
|
權證責任公允價值的變動
|
|
|
10,243
|
|
|
|
1,744
|
|
|
|
8,499
|
|
|
|
487
|
%
|
|
其他收入(費用)共計
|
|
$
|
9,558
|
|
|
$
|
1,654
|
|
|
$
|
7,904
|
|
|
|
478
|
%
|
截至12月31日,2017年度的其他收入(費用)主要包括與3月份我們的普通股和認股權證直接發行有關的權證負債公允價值的1,020萬美元的變動。與認股權證有關的負債的初始公允價值為1,470萬元,截至12月31日,公允價值下降至450萬元,主要是由於該等認股權證股份的普通股公允價值減少,而在截至12月31日的一年內,減少1,020萬元被確認為非營業收入的一部分。. 在截至#date0#12月31日的一年中,我們記錄了170萬美元的權證責任公允價值的變化,這些變化與我們在9月份執行的優先股和認股權證的直接發行有關。在發行之日,我們不知道認股權證的行使價格和數量。在某些假設下,認股權證負債的初始公允價值為370萬美元。在2016月份,認股權證的行使價格和普通股數目變得固定,公司重估認股權證的公允價值,並衍生出公允價值為190萬美元,減少170萬美元被確認為截至12月31日的非營業收入的一部分。
截至十二月三十一日、2016及2015年度之比較
收入
下表彙總了截至12月31日、2016和2015年度的收入(以千計,百分比除外):
| |
|
2016
|
|
|
2015
|
|
|
$Change
|
|
|
%變化
|
|
|
許可證收入
|
|
$
|
139
|
|
|
$
|
2,562
|
|
|
$
|
(2,423
|
)
|
|
|
(95
|
)%
|
|
合作收益
|
|
|
6
|
|
|
|
623
|
|
|
|
(617
|
)
|
|
|
(99
|
)%
|
|
總收入
|
|
$
|
145
|
|
|
$
|
3,185
|
|
|
$
|
(3,040
|
)
|
|
|
(96
|
)%
|
截至12月31日,2016年度的收入下降主要是由於與Zenyaku的合作伙伴關係終止。We began to recognize revenues in 2015 as a result of the collaborative arrangement that we entered into with Zenyaku in December 2014 for the development of blisibimod. During the year ended December 31, 2015, we recorded $2.6 million for the amortization of the license fee and $0.6 million for the reimbursement of FTEs. License fee from the collaborative arrangement was amortized over the period of performance (product development period) while reimbursement for our FTEs was recorded as collaborative revenue. In September 2015, we received a termination notice from Zenyaku to terminate the collaborative arrangement, effective January 7, 2016. Consequently, we revised the amortization period of our deferred revenue to correspond with the shortened collaboration period and fully amortized the deferred revenue as of January 7, 2016.
研發費用
下表彙總了截至12月31日、2016和2015年度的研究和開發費用(千,百分比除外):
| |
2016
|
|
2015
|
|
$Change
|
|
%變化
|
|
|
研發費用
|
|
$
|
46,512
|
|
|
$
|
33,498
|
|
|
$
|
13,014
|
|
|
|
39
|
%
|
研究和開發費用從2015增加到2016,主要是由於加快了生產規模的時間表,包括為Sollpura™生產商業發射規模的示範和註冊批次。此外,由於啟動了三項新的臨牀研究,即嚴重狼瘡患者的Chablis-7.5研究,單純使用Sollpura的袋製劑研究,以及為開展溶液臨牀研究的患者提供持續使用Sollpura™的簡易研究,因此,臨牀開發費用也比前一年有所增加。
一般費用和行政費用
下表彙總了截至12月31日、2016和2015年度的一般開支和行政開支(千,百分比除外):
| |
2016
|
|
2015
|
|
$Change
|
|
%變化
|
|
|
一般和行政費用
|
|
$
|
11,071
|
|
|
$
|
7,568
|
|
|
$
|
3,503
|
|
|
|
47
|
%
|
一般和行政費用從2015增加到2016,主要是由於2016確認的非現金股票補償費用較高,這是由於2016發行的期權和支持公司成長的專業服務費用增加。
研究獎
下表彙總了截至12月31日、2016和2015年度的研究成果(千,百分比除外):
| |
2016
|
|
2015
|
|
$Change
|
|
%變化
|
|
|
研究獎
|
|
$
|
(261
|
) |
|
$
|
(2,638
|
) |
|
$
|
(2,377
|
)
|
|
|
(91
|
)%
|
研究獎從2015下降到2016,主要是由於達到了授予協議中規定的某些里程碑的時間。我們在2015年度取得了大部分里程碑,因此,在CFFT為截至12月31日,2015年度獲得的300萬美元研究獎中,我們獲得了260萬美元。
其他收入(費用)
下表彙總了截至12月31日、2016和2015年度的其他收入(支出)(千,百分比除外):
| |
|
2016
|
|
|
2015
|
|
|
$Change
|
|
|
%變化
|
|
|
其他收入(費用)
|
|
$
|
(90
|
)
|
|
$
|
23
|
|
|
$
|
(113
|
)
|
|
|
(491
|
)%
|
|
權證責任公允價值的變動
|
|
|
1,744
|
|
|
|
—
|
|
|
|
1,744
|
|
|
|
100
|
%
|
|
其他收入(費用)共計
|
|
$
|
1,654
|
|
|
$
|
23
|
|
|
$
|
1,631
|
|
|
|
7,092
|
%
|
2016年度記錄的其他收入(費用)包括認股權證負債公允價值的變化、我們現金和現金等價物的利息收入以及外匯匯率波動造成的已實現損益的淨影響。根據2016年9月簽訂的出售可轉換優先股的認購協議,我們向某些機構投資者發行普通股認股權證。與這些認股權證有關的負債的初始公允價值為370萬美元,當認股權證的普通股數目在2016年月日固定時,公允價值降至190萬美元。認股權證公允價值的變化在截至2016年月31年度的業務報表中得到確認。2015年度的其他收入(費用)主要是由於我們的現金和現金等價物所賺取的利息以及外匯匯率波動造成的實際損益的淨影響。
流動性與資本資源
To date, we have funded our operations primarily through private placements of preferred stock and common stock, convertible debt, debt financings and public offerings of common stock, equity investment and cost reimbursement from a collaborative partner, and a research award from CFFT. As of December 31, 2017, we had cash and cash equivalents of approximately $2.2 million. In January 2018, we completed the second closing of a 私募是在2017年10月以1,110萬美元的淨收入執行的,在2018年2月,我們根據股權購買協議從認股權證和出售普通股中獲得了310萬美元的淨收入。
我們的主要流動資金需求主要是為了滿足我們的營運資本需求、支持正在進行的業務活動、研究和開發以及我們的資本支出需求。
In March 2016, we filed a universal shelf registration statement with the SEC on Form S-3 for the proposed offering from time to time of up to $100.0 million of our securities, including common stock, preferred stock, debt securities and/or warrants. Between April 2016 and February 2018, we issued $3.3 million of our common stock (including shares issued for commitment fee) pursuant to equity purchase agreements with Lincoln Park Capital under the registration statement. In September 2016, we sold $22.1 million of our preferred stock to institutional investors in a registered direct offering. In March 2017 we sold $15.0 million of common stock and warrants to purchase common stock with an aggregate exercise price of $31.5 million. After completion of these offerings, up to a maximum offering price of $17.4 million of our common stock, preferred stock, debt securities, warrants and/or units remain available under our shelf registration statement on Form S-3. Pursuant to Instruction I.B.6 to Form S-3, we may not sell more than the equivalent of one-third of our public float during any 12 consecutive months so long as our public float is less than $75 million, which will limit our ability to raise funds using our shelf registration statement.
如果我們的臨牀試驗成功,我們將需要大量額外資金來繼續開發我們的產品候選人,獲得監管許可,併為商業準備做好準備。我們相信,我們目前的資本僅足以為我們的2018第二季度的運營計劃提供資金。我們目前還沒有獲得額外融資的安排。任何此類融資都很難在有利的條件下獲得。從本報告發表之日起,我們是否有能力繼續作為一個持續經營的企業,在考慮了管理層減輕此類擔憂的計劃後,這一點並未得到緩解。財務報表不包括可能因這種不確定性的結果而引起的任何調整。如果沒有足夠的資金,我們可能需要推遲開發項目。This would include, amongst other things, eliminating or reducing the scope of one more of our clinical trials, delaying BLA submission for Sollpura, delaying manufacturing activities, and reducing headcount. Even if we raise additional funds by issuing equity or equity-linked securities, such financings may only be available on unattractive terms and, in such event, the market price of our common stock may decline and further dilution to our existing 此外,由於我們發行可轉換為股票的證券,對未來稀釋的預期可能會導致我們的股價下跌。
現金流量
截至十二月三十一日、2017及2016年度之比較
截至12月31日、2017和2016年度的現金流量如下(千):
| |
|
2017
|
|
|
2016
|
|
|
用於業務活動的現金淨額
|
|
$
|
(36,900
|
)
|
|
$
|
(48,919
|
)
|
|
用於投資活動的現金淨額
|
|
|
—
|
|
|
|
(766
|
)
|
|
籌資活動提供的現金淨額
|
|
|
18,253
|
|
|
|
23,577
|
|
|
現金和現金等價物淨減額
|
|
$
|
(18,647
|
)
|
|
$
|
(26,108
|
)
|
During the year ended December 31, 2017, our operating activities used cash of $36.9 million, compared to $48.9 million in 2016. The decrease in cash used for operating activities in 2017 was mainly attributable to lower research and development expense due to the completion of our Phase 3 CHABLIS-SC1 clinical study by the end of 2016 and discontinuation of our Phase 3 CHABLIS-7.5 in early 2017. The CHABLIS 在亞洲、歐洲和拉丁美洲,有400多名系統性紅斑狼瘡(“SLE”)患者參加了研究。
在截至#date0#12月31日的一年中,沒有現金用於投資活動,而2016年度為80萬美元。2016年度用於投資活動的現金較高,主要原因是購買了支持Sollpura發展的生產活動的資本設備。
During the year ended December 31, 2017, cash provided by financing activities was $18.3 million, compared to $23.6 million in 2016. Proceeds raised in 2017 are comprised of mainly $14.1 million from the sale of our common stock through a direct offering in March, $2.2 million from the first closing of a private placement of our securities in October and $1.8 million from the sale of common stock 根據2017股權購買協議,2016募集的收益主要包括出售優先股和認股權證所得的1,680萬美元,以及根據2015股權購買協議和H.C.Wainwright自動取款機協議出售普通股所得的淨收益640萬美元。
截至十二月三十一日、2016及2015年度之比較
截至12月31日、2016和2015年度的現金流量如下(千):
| |
|
2016
|
|
|
2015
|
|
|
用於業務活動的現金淨額
|
|
$
|
(48,919
|
)
|
|
$
|
(30,907
|
)
|
|
用於投資活動的現金淨額
|
|
|
(766
|
)
|
|
|
(80
|
)
|
|
籌資活動提供的現金淨額
|
|
|
23,577
|
|
|
|
75,299
|
|
|
現金和現金等價物淨增(減少)額
|
|
$
|
(26,108
|
)
|
|
$
|
44,312
|
|
During the years ended December 31, 2016 and 2015, our operating activities used cash of $48.9 million and $30.9 million, respectively. The increase in cash used for operating activities in 2016 was mainly attributable to higher research and development expense due to costs associated with acceleration of the manufacturing scale-up timeline, the purchase and installation of manufacturing equipment at our contract manufacturers, and the initiation of three new clinical studies in 2016.
在截至#date0#12月31日的一年中,用於投資活動的現金為80萬美元,這主要是由於購買了支持Sollpura發展的生產活動的資本設備。在截至12月31日的2015年度,用於投資活動的現金並不重要。
During the year ended December 31, 2016, cash provided by financing activities was $23.6 million, which was driven by net proceeds received from the sale of our common stock pursuant to an equity purchase agreement, sale of common stock pursuant to at-the-market (“ATM”) sales agreements, and sale of preferred stock and warrants to purchase our common stock pursuant to a subscription agreement. During the year ended December 31, 2015, cash provided by financing activities was $75.3 million, which was driven by net proceeds of $12.1 million received from the sale of our common stock through an ATM program, $53.9 million received from the sale of our common stock through two public offerings, and $9.0 million from the sale of our common stock at a 30% premium to a collaborative partner.
合同義務和承諾
我們有兩個經營設施的經營租約,分別於5月和7月到期。下表彙總了截至2017年月31的估計未來最低合同義務和承諾(以千計):
| |
按期付款
|
|
|
|
|
合同義務
|
|
|
1至3年
|
|
3-5歲
|
|
>5年
|
|
共計
|
|
|
設施租賃
|
|
$
|
191
|
|
|
$
|
106
|
|
|
$
|
—
|
|
|
$
|
—
|
|
|
$
|
297
|
|
在2月份,該公司提前終止了其樂天辦事處的租賃協議,並將其未來的租金減少了大約42,000美元。
上述金額不包括根據我們的許可協議向許可人支付的潛在款項,這些付款是基於我們產品候選方在開發過程中的進展情況,因為這些付款是無法確定的。
Under the Amgen Agreement, we are obligated to make additional milestone payments upon the achievement of certain development, regulatory and commercial objectives. We are also obligated to pay royalties on future net sales of products that are developed and approved as defined by this collaboration. Our royalty obligations as to a particular licensed product will be payable on a country-by-country basis and licensed on a product-by-licensed-product basis, for (A)由我們或分持牌人在該國家制造、使用或出售、要約出售或進口該等持牌產品的持牌專利內最後屆滿的有效申索屆滿日期較長,或(B)在適用國家首次商業出售適用的持牌產品後10年。
Under the Lilly Agreement, we are obligated to make milestone payments upon the achievement of certain regulatory and commercial sales milestones. In addition, after sales of the licensed products exceed an aggregate of $100.0 million in the United States, we are obligated to pay tiered royalties on future net sales, ranging from the single digits to the mid-teens, for products that are developed and approved as defined in the Lilly Agreement.Our royalty obligations as to a particular licensed product will be payable, on a licensed product-by-licensed product basis, for the longer of (a) the date of expiration of the last to expire valid claim within the licensed patents that covers the manufacture, use or sale, offer to sell, or import of such licensed product by the Company or a sublicense in such country, or (b) 12 years after the first 在適用的國家銷售適用的許可產品。
Under the research award agreement with CFFT, we are obligated to pay royalties to CFFT as follows: i) a one-time royalty in an amount equal to five times the actual award, payable in three installments between the first and second anniversaries of the first commercial sale of a product; ii) a one-time royalty in an amount equal to the actual award after net product sales reaches $100 million; and iii) 如果產品的許可、銷售或其他轉讓,或在產品商業銷售前發生變更控制交易,則里程碑付款相當於實際獎勵的三倍。
供資需求
自成立以來,我們一直是一家臨牀階段的公司,並沒有從產品銷售中獲得任何收入。隨着我們繼續推進產品候選,我們預計在未來幾年內將承擔大量費用併產生重大的運營虧損。我們未來的資本使用和需求取決於眾多前瞻性因素。這些因素包括:
|
· |
(二)專利申請的備案、起訴、執行或者抗辯所涉及的費用;
|
|
· |
獲取技術、產品候選和其他需要資金承諾的商業機會。
|
截至#date0#12月31日,該公司的現金餘額為220萬美元,加上第二次私募股權結算所得的淨收益1,110萬美元,以及根據在12月31,2017之後的股權購買協議行使認股權證和出售普通股所得的310萬美元,預計將為該公司2018年頭半年度的業務提供資金。Therefore, there is substantial doubt about the Company’s ability to continue as a going concern within one year after the date the financial statements are issued. The Company’s current cash position is sufficient to enable it to complete its Phase 3 clinical study of Sollpura (the “RESULT” study) in patients with exocrine pancreatic insufficiency due to cystic fibrosis, which study’s topline data is expected in March 2018.如果研究結果符合其主要終點,該公司計劃在研究報告公佈後籌集足夠的資金,並將所得資金用於為Sollpura編寫其生物製劑許可證申請(“BLA”)、繼續生產藥品和通用公司用途。
本公司無法確定任何未來的融資是否會以對公司有利的條件提供,如果有的話。財務報表不包括任何可能因這種不確定性的結果而產生的調整。如果沒有足夠的資金,該公司將需要推遲其開發計劃,這將包括,除其他外,取消或縮小我們的臨牀試驗的範圍,推遲索爾普拉的BLA提交,推遲生產活動,以及減少人員數量。該公司計劃在未來12個月內主要通過發行股票證券、潛在的合夥企業和債務融資來滿足其資本要求。不籌集額外資本將對公司實現其預期業務目標的能力產生不利影響。
表外安排
我們目前沒有、也從未與未合併的實體或金融合作夥伴建立任何關係,例如通常稱為結構化金融或特殊目的實體的實體,其目的是促進表外安排或其他合同範圍狹窄或有限的目的。此外,我們不從事涉及非交易所交易合同的交易活動。
項目7A.市場風險的定量和定性披露
我們對市場風險的主要風險是利率敏感性,利率敏感性受美國利率總體水平變化的影響。我們面臨與利率和市場價格波動有關的市場風險。然而,由於我們的大部分投資都投資於流動性極強的貨幣市場基金,我們不認為我們受到任何實質性市場風險敞口的影響。截至2017,12月31日,我們還沒有任何實質性的衍生金融工具。截至12月31日,我們的現金和現金等價物的公允價值為220萬美元。
項目8.合併財務報表和補充數據
本項目所要求的合併財務報表從本報告第15項開始列明,並以參考的方式列入本報告。
項目9.會計和財務披露方面的變化和與會計師的分歧
不適用。
項目9A.管制和程序
對披露控制和程序的評估
我們的管理層在我們的首席執行官和首席會計官的參與下,評估了截至2017年度12月31日我們的披露控制和程序的有效性。The term “disclosure controls and procedures,” as defined in Rules 13a-15(e) and 15d-15(e) under the Securities and Exchange Act of 1934, means controls and other procedures of a company that are designed to ensure that information required to be disclosed by a company in the reports that it files or submits under the Securities Exchange Act of 1934 is recorded, processed, summarized, and reported within the time 證券交易委員會規則和表格中規定的期限。披露控制和程序包括(但不限於)旨在確保一家公司根據“1934證券交易法”提交或提交的報告中所要求披露的信息的控制和程序,並酌情向該公司管理層,包括其首席執行官和主要財務官員通報,以便及時作出關於所需披露的決定。管理層認識到,任何控制和程序,無論設計和操作多麼好,都只能為實現其目標提供合理的保證,而管理層在評估可能的控制和程序的成本效益關係時,必然要運用自己的判斷。
我們在管理層(包括我們的首席執行官和首席會計官)的監督和參與下,評估了截至本報告所述年底,我們的披露控制和程序的設計和運作是否有效。基於上述情況,我們的首席執行官和首席會計官得出結論:截至2017年月31,我們披露控制和程序在合理的保證水平上是有效的。
管理層關於財務報告內部控制的報告
管理層負責建立和維持對財務報告的適當內部控制,因為“外匯法”第13a-15(F)條和第15d-15(F)條對這一術語作了界定。對財務報告的內部控制是一個由一個實體的董事會、管理層和其他人員實施的過程,目的是為財務報告的可靠性提供合理的保證,並根據公認會計原則為外部目的編制綜合財務報表。對財務報告的內部控制包括與保存記錄有關的政策和程序,這些政策和程序以合理的細節準確和公正地反映資產的交易和處置情況;提供合理的保證,證明交易記錄是必要的,以便能夠根據公認會計原則編制合併財務報表;提供合理的保證,證明收入和支出只是根據管理層和董事會的授權;並就防止或及時發現可能對我們合併財務報表產生重大影響的未經授權的獲取、使用或處置我們的資產,提供合理的保證。由於其固有的侷限性,對財務報告的內部控制可能無法防止或發現合併財務報表中的重大錯誤。此外,對我們對今後各期財務報告的內部控制效果的任何評價都有可能因條件的變化而變得不充分,因為遵守我們的政策和程序的程度可能會惡化。
管理層,包括我們的首席執行官和首席會計官,評估了我們對財務報告的內部控制的有效性,截至#date0#12月31日。在進行評估時,管理部門採用了特雷德韋委員會(“COSO”)贊助組織委員會(COSO)提出的標準。內部控制-綜合框架(2013). 根據我們的評估結果,我們的管理層得出結論,我們對財務報告的內部控制在2017年月31生效。我們與董事會的審計委員會審查了管理層的評估結果。
在截至#date0#12月31日的一年中,我們獨立註冊的公共會計師事務所(BDO USA,LLP)沒有被要求報告財務報告的內部控制的有效性,原因是2009“華爾街改革和消費者保護法”允許較小的報告公司獲得豁免。
財務報告內部控制的變化
在截至12月31日的最近一個季度,我們對財務報告的內部控制沒有發生任何變化,這些變化對我們財務報告的內部控制產生了重大影響或相當可能產生重大影響。
項目9B.其他資料
沒有。
第III部
項目10.
公司現任高管和董事的姓名、截至2018年月31的年齡以及關於他們的某些其他信息列示如下(除非在本報告的其他部分列出)。
|
姓名
|
|
年齡
|
|
位置
|
|
執行幹事
|
|
|
|
|
|
克雷格·湯普森
|
|
51
|
|
總裁、首席執行官和主任
|
|
作者聲明:William R.Shanahan,M.D.
|
|
69
|
|
首席醫務官
|
|
劉梅
|
|
42
|
|
高級副總裁,財務和行政
|
|
蕾妮·馬丁博士。
|
|
49
|
|
醫學高級副總裁
|
|
非僱員董事
|
|
|
|
|
|
保羅·特魯克斯
|
|
49
|
|
理事會執行主席
|
|
布倫特·弗爾斯(2)(3)
|
|
49
|
|
導演
|
|
Christopher S.Henney博士(1)(2)
|
|
76
|
|
導演
|
|
Brian R.Mueller(2)
|
|
44
|
|
導演
|
|
戴維·湯普森(1)(3)
|
|
70
|
|
導演
|
|
菲利普·薩格(Philip T.Sager),M.D.(1)(3)
|
|
62
|
|
導演
|
執行幹事
克雷格·湯普森。湯普森先生被任命為公司總裁,自2016年月7日起擔任公司董事會成員,並從2016年月6日起擔任公司的首席執行官。湯普森先生在製藥開發和商業化方面有20多年的經驗。最近的一次是他在2014至2015年12月擔任四相製藥公司的首席運營官。where he oversaw the development and implementation of the commercial strategy as well as the business development and commercial manufacturing. Prior to Tetraphase Pharmaceuticals, from January 2011 to December 2014, Mr. Thompson served as the Chief Commercial Officer for Trius Therapeutics resulting in the acquisition of Trius by Cubist Pharmaceuticals for over $700 million. Prior to Trius Therapeutics, Mr. Thompson held various positions of increasing responsibility with Pfizer from November 2003 to December 2010, with his last position as Vice President of Marketing, Specialty Care. Prior to Pfizer he held various positions of increasing responsibility at Merck and Co, Inc. from April 1993 to November 2003. Mr. Thompson holds a Bachelor's degree in Commerce from McMaster University and a Master’s degree in Business Administration from the University of Notre Dame.
William R.Shanahan,M.D..Shanahan博士自2016年8月起擔任首席醫務官,在2004至2016年間擔任Arena製藥公司首席醫務官,並於2010至2016 6月擔任首席副總裁。沙納漢博士還於2004至2010年間擔任Arena製藥公司副總裁。他於2000至2004年間擔任Tanox公司首席醫務官,並於1994至2000年間擔任Isis製藥公司藥品開發副總裁。在此之前,他曾擔任輝瑞中心研究公司臨牀研究部主任,負責1990至1994年間的新型抗炎藥物的臨牀開發。在Searle研發公司,他擔任副主任和臨牀研究主任。此外,在康涅狄格大學醫學院,他在風濕病學系擔任各種職位,包括全職教授助理教授職位和自願和兼職的臨牀副教授職位。Shanahan博士擁有達特茅斯學院的A.B.學位、舊金山加利福尼亞大學的博士學位和芝加哥Loyola大學的法學學位。
劉梅。劉女士從2013開始擔任我們的財務和行政高級副總裁,並從2013開始擔任我們的首席會計官。Prior to that, she served as our Vice President, Finance from January 2011 to June 2013, and as our Corporate Controller from October 2007 to January 2011. Ms. Liu joined us as our Director of Finance in April 2007. Prior to joining us, Ms. Liu served as SEC Reporting and Technical Accounting Manager at Renovis, Inc., a clinical-stage pharmaceutical company, from October 2005 to March 2007. Ms. 自2007以來,劉一直是一名註冊會計師,並於2000至2005年間成為安永會計師事務所(Ernst&Young LLP)審計和擔保業務的一部分,主要專注於生命科學行業。劉女士擁有工商管理學士學位,並在舊金山州立大學(San Francisco State University)攻讀會計學學士學位。
蕾妮·馬丁博士。Dr. Martin served as our Senior Vice President, Medical Sciences since April 2016 and as our Vice President, Nonclinical and Translational Sciences from November 2011 to March 2016. Prior to that, she served as our Senior Director of Clinical and Translational Sciences in March 2010 to October 2011. Prior to joining Anthera, Dr. Martin spent over 14 years from October 1996 to March 2010 at Roche Pharmaceuticals in 馬丁博士在羅氏公司擁有超過24年的製藥業經驗,包括從1992到1996年間在英國威康/葛蘭素史康研究實驗室的4年研究生研究職位。馬丁博士擁有英國劍橋大學自然科學學士學位和英國倫敦國王學院藥理學博士學位。
非僱員董事
我們的註冊證書規定董事會分為三類,分為第一類、第二類和第三類。每堂課的學期是三年,一段時間後就會錯開。第一類由湯普森先生、弗斯先生和湯普森先生組成;第二類由薩格博士組成;第三類由特魯克斯先生和穆勒先生及亨尼博士組成。
作者聲明:Paul F.Truex.特魯埃克斯先生自2016年月日起擔任董事會執行主席。Mr. Truex previously served as our Director, Chief Executive Officer and President from our inception in September 2004 until January 2016 and as our Director and Chief Executive Officer from September 2004 to December 2016. He was responsible for negotiating our product licenses for both blisibimod, our anti-BAFF peptibody program from Amgen, Inc. and Sollpura™ (liprotamase), a novel enzyme product, from Eli Lilly and Company. Prior 在創建Anthera之後,Truex先生擔任半島製藥公司的創始人、董事、總裁和首席執行官。在此期間,特魯埃克斯先生與Shionogi&Co.有限公司談判了半島公司的兩項產品協議。(Doribax,Doripenem)和Takeda化學工業(Teflaro,頭孢塔拉啉)。半島公司被約翰遜和約翰遜以2.45億美元的全部現金交易收購。The remaining entity, Cerexa was subsequently acquired for $480 million in cash by Forest Laboratories. Prior to Peninsula, Mr. Truex was Vice President of Commercial Development for Versicor, Inc. (acquired by Pfizer) from April 2000 to September 2001 where he directed early commercial efforts for Versicor’s infectious disease portfolio and participated in Versicor’s initial public offering. From July 1997 to April 2000, Mr. Truex 在Eli Lilly and Company(“Eli Lilly”)工作,在為初級保健醫生市場推出三種不同產品(Actos‘Evista’和Humalog 75/25)期間,他擔任各種營銷和銷售角色。他的業務發展經歷包括禮來ICOS有限責任公司(Lilly ICOS LLC)的兩大產品剝離和眾多小型研究合作。特魯克斯在印第安納大學獲得營銷和金融MBA學位,滑鐵盧大學(University Of Waterloo)獲得經濟學學士學位。Mr. Truex is currently the Chairman and a director of Milestone Pharmaceuticals, Inc., and a director at CymaBay Therapeutics Inc., (Nasdaq: CBAY). He previously served on the board of directors of Trius Therapeutics Inc (acquired by Cubist Pharmaceuticals, Inc. in July 2013), LQT Therapeutics, and Protagonist Therapeutics, Inc (Nasdaq: PTGX) and Eiger BioPharmaceuticals (Nasdaq: EIGR).
布倫特·弗爾斯。弗斯先生自2016以來一直是我們董事會的成員。弗斯先生擁有超過25年的醫療保健商業領導經驗,在銷售和營銷、商業產品推出和夥伴關係等領域有豐富的經驗。弗爾斯目前擔任Geno,LLC的總裁和首席執行官,該公司是一家生物製藥公司,正在為急症治療醫院市場開發新產品。Prior to GeNo, he served as President of Cardiorentis AG, an acute care cardiovascular company, from 2000 to 2015 Mr. Furse served as Executive Vice President and Chief Operational Officer at The Medicines Company (Nasdaq: MDCO). Prior to The Medicines Company, he worked in the cardiovascular divisions of Schering-Plough and Bristol-Myers Squibb and for the National Center for Chronic Disease Prevention at the Centers for Disease Control. Mr. Furse擁有基涅索州立大學的理學士學位和美世大學的碩士學位。
克里斯托弗·S·亨尼博士。亨尼博士從2008到2016年間一直擔任我們的董事會主席,並自2005年4月起成為我們董事會的成員。亨尼博士從1995一直擔任他共同創立的生物技術公司Dendreon公司的董事長和首席執行官,直到他於2004退休。Henney博士創建了免疫公司和ICOS公司,並擔任兩家公司的執行官員和董事。Henney博士目前是Cascadian治療公司(原Oncohyreon公司)的董事長和董事。(納斯達克市場代碼:CASC),從2016到2016年間,他一直擔任公司的臨時總裁和首席執行官。Henney博士也是Cyclacel製藥公司的副董事長和董事.(納斯達克代碼:CYCC),Prothena公司(納斯達克代碼:PRTA)董事。Dr. Henney served as a director of AVI BioPharma Inc. from March 2009 until June 2010, and as a director of Mymetics Corporation from March 2012 until November 2012. Dr. Henney holds a B.Sc. with honors in medical biochemistry, a Ph.D. in experimental pathology and a D.Sc. for contributions to the field of immunology, all from the University of Birmingham, England. In 2012, Dr. Henney was elected to the International Biotechnology CEOs Hall of Fame.
布萊恩·穆勒。穆勒先生自2014以來一直擔任我們的董事會成員,目前擔任集團副總裁、公司財務總監和BioMarin製藥公司首席會計官。(Nasdaq: BMRN). From March 2009 to March 2014, Mr. Mueller served as BioMarin’s Vice President, Corporate Controller. Prior to joining BioMarin in 2002, Mr. Mueller spent a combination of seven years in public accounting with Arthur Andersen, LLP and KPMG, LLP in the audit and business advisory services practices of both firms.穆勒先生在伊利諾伊州德卡爾布的北伊利諾伊大學獲得會計學學士學位,是美國註冊會計師協會的成員。
本文作者聲明:by John T.Sager;Dr. Sager was appointed to serve on our Board in June 2014. Dr. Sager is a Fellow of the American College of Cardiology, a Fellow of the American Heart Association and a Fellow of the Heart Rhythm Society. Dr. Sager has been a member of the International Conference on Harmonization (“ICH”) E14 Discussion Group since 2014, a full voting member of the United States Food and Drug Administration Cardiovascular and Renal Drugs Advisory Committee from 2011 until July 2016 and has been the Chair of such Committee since 2016. Dr. Sager has also been a member of the Executive Committee of the Cardiac Safety Research Consortium since 2016, and served as Chair of the Scientific Programs Committee and Scientific Oversight Committee at various times. Dr. Sager has served as a Consulting or Adjunct Professor of Medicine at the Stanford University School of Medicine since 2013 and provided pharmaceutical device and diagnostics consulting service independently since 2010. From 2009 through 2010, Dr. Sager was Vice President, Clinical Research and Head, CV/Metabolic Development for Gilead Sciences, a biotechnology company. Dr. Sager holds an M.D. from Yale University School of Medicine and B.S. degrees in chemistry and biology from the Massachusetts Institute of Technology.
大衞·E·湯普森。湯普森先生自2005以來一直是我們董事會的成員。湯普森先生從2001年月起擔任禮來公司的公司戰略業務發展副總裁,直到他在2005年月退休。此後,他在2006至2008年間擔任VantagePointVenturePartners的合夥人。湯普森先生擁有密歇根州立大學的學士學位和碩士學位。
我們的董事或行政人員之間沒有家庭關係。
董事會在風險管理中的作用
董事會全面負責監督公司的風險管理過程,旨在支持實現組織目標,包括戰略目標,以提高長期組織績效和提高股東價值。風險管理不僅包括瞭解公司特有的風險和管理措施來管理這些風險,而且還包括對公司可接受和合適的風險水平。管理層負責制定我們的業務戰略,識別和評估相關風險,並實施適當的風險管理做法。董事會審查我們的業務戰略和管理層對相關風險的評估,並與管理層討論公司的適當風險水平。例如,董事會至少每季度與管理層舉行會議,就戰略業務風險、訴訟風險和與公司收購戰略有關的風險等進行審查、諮詢和指導管理。審計委員會還將監督工作委託給委員會各委員會,以監督下文所述的某些風險因素。
董事會將日常管理和解釋“公司商業行為和道德守則”的責任委託給公司的首席會計官作為合規幹事。我們的書面商業行為和道德準則適用於我們的所有董事和僱員,包括我們的首席執行官、首席財務官、首席會計官或控制人或履行類似職能的人。“道德守則”可在我們的網站http://www.anthera.com“公司治理”下的投資者部分查閲。
作為監督公司財務報告程序和審計公司財務報表的一部分,我們的審計委員會負責審查財務風險風險,包括監測公司財務報表的質量和完整性、對財務報告進行內部控制的有效性、遵守法律或法規要求、履行內部審計職能和業績以及公司獨立註冊會計師事務所的獨立性,以及審計委員會章程規定的其他職責。審計委員會定期收到公司財務部門的內部控制和相關評估。此外,我們的審計委員會通過監督我們的“商業行為和道德守則”和員工反饋熱線,確保公司的業務按照適用的法律和條例以最高的道德行為標準進行,審計委員會定期與管理層討論公司的其他風險評估和風險管理政策。
我們的薪酬委員會參與了薪酬結構的設計,以創造激勵措施,鼓勵符合公司業務戰略的風險承擔行為。
我們的提名和公司治理委員會負責監督與治理相關的風險,與管理層合作制定並向董事會推薦適用於公司的公司治理準則,就董事提名人選和董事會委員會成員提出建議,並監督董事會和管理層的年度評估。
補償計劃風險評估
作為其監督職能的一部分,我們的董事會,特別是我們的賠償委員會,特別是我們的管理團隊,在審查和批准各種薪酬計劃,包括高管薪酬時,都考慮到潛在的風險。根據這項檢討,我們的董事局認為,這類薪酬計劃,包括行政人員薪酬,並不會鼓勵冒風險,以致有可能對我們或我們的運作造成實質上的不利影響。
董事會和董事會委員會
在2017年間,董事會共舉行了8次會議。所有董事在其任職於董事局或該等委員會期間,出席的董事會會議及委員會會議的總數,至少有75%是由所有董事出席的。
董事會已確定下列每一位現任董事都是“獨立董事”,“納斯達克規則”第5605(A)(2)條和“交易所法”第10A條對這一術語作了定義:Truex先生、Furse先生、Mueller先生、David Thompson先生、Henney博士和Sager博士。
董事會設有常設審計委員會、薪酬委員會和提名和公司治理委員會。我們的每個審計委員會、薪酬委員會以及提名和公司治理委員會都完全由獨立董事組成,按照目前的納斯達克上市標準。此外,我們的審計委員會符合2002薩班斯-奧克斯利法案(Sarbanes-OxleyAct)和證交會相關規則制定的強化獨立性標準。董事會進一步確定,董事會審計委員會主席Brian R.Mueller是“審計委員會財務專家”,因為證券交易委員會頒佈的條例S-K第407(D)(5)項界定了這一術語。我們的審計委員會、提名和公司治理委員會以及賠償委員會章程和公司治理準則的副本可在我們的網站上免費查閲:http://www.anthera.com。
審計委員會。審計委員會指定、批准獨立註冊會計師事務所的報酬,評估獨立註冊會計師事務所的獨立性,並預先批准由我國獨立註冊會計師事務所提供的審計和允許的非審計服務以及這些服務的條款。審計委員會還負責與管理層和獨立註冊會計師事務所審查和討論我們的年度和季度財務報表及相關披露,並編寫“證交會規則”要求列入我們年度委託書的報告。審計委員會還協調監督和審查我們對財務報告的內部控制是否充分,併為接收和保留與會計有關的投訴和關切制定政策和程序。目前,審計委員會由穆勒先生(主席)、亨尼博士和弗斯先生組成,在2017年間,審計委員會舉行了五次會議。
賠償委員會。薪酬委員會每年審查和批准我們與首席執行官薪酬有關的目標和目標,根據這些目標對我們的首席執行官進行評估,並確定我們首席執行官的薪酬。薪酬委員會亦會檢討和批准所有其他人員的薪酬,監察及管理我們的激勵薪酬及股權計劃,並就董事薪酬向董事局提出建議。薪酬委員會亦會就行政人員的薪酬編制一份週年報告,以便納入我們的委託書內。目前,賠償委員會由Furse先生(主席)、David Thompson先生和Philip Sager博士組成。2017年間,賠償委員會舉行了五次會議。
提名和公司治理委員會。提名和公司治理委員會負責制定並推薦我們的董事會成員提名為董事和委員會成員。這包括制定確定和評價董事候選人(包括股東推薦的人選)的程序。提名和公司治理委員會還負責制定並向我們的董事會推薦公司治理準則,並監督對我們董事會、董事會各委員會和管理層的評價。目前,提名和公司治理委員會由薩格博士(主席)、亨尼博士和大衞·湯普森先生組成。在2017年間,提名和公司治理委員會舉行了一次會議。
董事會領導
董事會執行主席和首席執行幹事的職位目前已離職,主席和首席執行官的職位歷來在安瑟拉離職。將這些職位分開,使我們的首席執行官能夠專注於我們的日常業務,同時允許董事會執行主席領導董事會發揮其向管理層提供諮詢和獨立監督的基本作用。我們的董事會認識到首席執行官必須投入時間、精力和精力在當前的商業環境中擔任他的職位,並認識到擔任執行主席所需的承諾,特別是在董事會監督責任不斷增加的情況下。我們的董事會還認為,這一結構確保獨立董事在監督我們公司方面發揮更大的作用,並確保獨立董事積極參與制定議程和確定我們董事會工作的優先事項和程序。我們的董事會認為,其風險監督職能的管理並未影響其領導結構。
雖然我們的章程和公司治理準則不要求我們的主席和首席執行官職位分開,但我們的董事會認為,有單獨的職位和一名獨立的外部董事擔任主席是我們目前適當的領導結構,表明我們對良好的公司治理的承諾。我們分離的主席和首席執行官職位因我們的7名董事中的6名獨立,以及我們的三個完全獨立的董事會委員會在上述領域提供適當監督而得到加強。在獨立董事的執行會議上,這些董事在沒有首席執行官或其他行政人員在場的情況下,坦率地就任何利益問題發言。獨立董事們在2016年間舉行了五次會議,但管理層都沒有出席。我們相信這個架構對我們的管理層和公司提供了一致和有效的監督。
賠償委員會聯鎖及內幕參與
在上一個財政年度內,賠償委員會的任何成員都不是公司的高級人員或僱員。賠償委員會的成員中沒有一人曾是該公司的高級人員。在上一個財政年度,我們的執行幹事中沒有一人擔任過任何其他實體的董事會或賠償委員會成員,任何其他實體都有一名或多名執行幹事擔任我們的董事會或賠償委員會的成員。
第16(A)節受益所有權報告遵守情況
“交易法”第16(A)條要求我們的高級官員和董事,以及擁有10%以上註冊類別證券的人,向證券交易委員會提交所有權和所有權變動報告(表格3、4和5)。高級人員、董事及超過10%的股東須向我們提供他們提交的所有該等表格的副本。
據我們所知,僅根據我們對此類報告的審查或某些報告人的書面陳述,我們認為適用於我們的高級人員、董事、大於10%的實益所有人和其他受“外匯法”第16條管轄的人的所有申報要求在截至#date0#12月31日的年度內都得到了遵守。
項目11.行政薪酬
董事補償
自2017年月1日起,我們的非僱員董事每年收取40,000美元的酬金,而不是每次會議的費用。In consideration for their services, the Executive Chairman of the Board receives an additional $60,000, the Chairman of our Board of Directors receives an additional $40,000, the Chairman of our Audit Committee receives an additional $15,000, the Chairman of our Compensation Committee receives an additional $14,000, and the Chairman of our Nominating and Corporate Governance Committee receives an additional $8,000, each on an annual basis. Other members of the Audit Committee, Compensation Committee, and Nominating and Corporate Governance Committee each receives additional annual cash retainers of $7,500, $6,000 and $4,000, respectively. In addition, our director compensation program provides for the grant of non-qualified stock options to our non-employee directors in amounts based on the aggregate fair value of such grants. Pursuant to the program, each new non-employee director receives a non-qualified stock option, which vests monthly over 三年,每月分期付款相等,購買普通股價值約為15萬美元。In addition, each non-employee director receives an annual grant of non-qualified stock options, which vest monthly over one year with equal monthly installments, to purchase shares of our common stock equal in value to approximately $120,000. The number of shares subject to such options are determined based on the aggregate fair value, divided by the fair value per share, calculated using the Black-Scholes option pricing model on the grant 所有董事會成員均有資格獲得出席董事會會議所需旅費的全額報銷。
2017董事薪酬表
下表列出了我們的非僱員董事在截至12月31日的財政年度(2017)期間所獲得的薪酬信息。
|
姓名
|
|
所賺取的費用或
以現金支付(美元)
(1)
|
|
|
期權獎勵
($)(2)
|
|
|
共計(美元)
|
|
|
Paul Truex(執行主席)(3)
|
|
$
|
100,000
|
|
|
$
|
—
|
|
|
$
|
100,000
|
|
|
Brent V.Furse(4)
|
|
$
|
56,833
|
|
|
$
|
—
|
|
|
$
|
56,833
|
|
|
Christopher S.Henney博士(5)
|
|
$
|
51,500
|
|
|
$
|
—
|
|
|
$
|
51,500
|
|
|
Brian R.Mueller(6歲)
|
|
$
|
55,000
|
|
|
$
|
—
|
|
|
$
|
55,000
|
|
|
菲利普·薩格(Philip T.Sager),M.D.(7)
|
|
$
|
54,000
|
|
|
$
|
—
|
|
|
$
|
54,000
|
|
|
David E.Thompson(8歲)
|
|
$
|
50,000
|
|
|
$
|
—
|
|
|
$
|
50,000
|
|
|
史蒂文·B·恩格爾(9歲)
|
|
$
|
17,550
|
|
|
$
|
—
|
|
|
$
|
17,550
|
|
|
(1)
|
這一欄反映了2017年度的留言費。董事的留言費一般是以拖欠的形式支付的。然而,2017第四季度的費用是在2017的第四季度支付的。
|
| |
|
|
(2)
|
在截至#date0#12月31日的一年中,由於公司2013股票期權和股權激勵計劃中可供授予的股票期權不足,沒有授予董事任何期權。
|
| |
|
|
(3)
|
截至2017年月31,特魯克斯持有83,032股股票作為股票期權的標的。
|
| |
|
|
(4)
|
截至2017年月31,福爾斯持有股票期權基礎的9,381股。
|
|
(5)
|
截至2017年月31,Henney博士持有30296股股票作為股票期權的基礎。
|
|
(6)
|
截至2017年月31,穆勒持有12998股股票作為股票期權的標的。
|
|
(7)
|
截至2017年月31,薩格爾博士持有14248股股票作為股票期權的基礎。
|
|
(8)
|
截至2017年月31,湯普森持有24614股股票作為股票期權的基礎。
|
| |
|
|
(9)
|
截至2017年月31,恩格爾持有14248股基礎股票期權,在2017年度股東大會上不參選,自2017年月27起退出董事會。
|
下表提供了截至2017財政年度,我們現任首席執行官和另外兩名薪酬最高的執行幹事以各種身份提供的服務的報酬總額。我們將這些官員稱為我們指定的執行幹事。
|
名稱和主要職位
2017年月31
|
年
|
|
薪金$
|
|
|
獎金($)
(2)
|
|
|
股票
獎勵(美元)
|
|
|
期權
獎勵(美元)
(3)
|
|
|
非股權
激勵計劃
補償
($)
|
|
|
所有其他
補償(美元)
|
|
|
共計(美元)
|
|
|
克雷格·湯普森
|
2017
|
|
$
|
460,000
|
|
|
$
|
255,300
|
|
|
$
|
—
|
|
|
$
|
173,077
|
|
|
$
|
—
|
|
|
$
|
—
|
|
|
$
|
888,377
|
|
|
首席執行官兼董事
|
2016
|
|
$
|
397,538
|
|
|
$
|
136,017
|
|
|
$
|
—
|
|
|
$
|
1,786,299
|
|
|
$
|
—
|
|
|
$
|
—
|
|
|
$
|
2,319,854
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
William R.Shanahan,M.D.,SVP.
|
2017
|
|
$
|
400,000
|
|
|
$
|
152,460
|
|
|
$
|
—
|
|
|
$
|
111,295
|
|
|
$
|
—
|
|
|
$
|
—
|
|
|
$
|
663,755
|
|
|
首席醫務官。(1)
|
2016
|
|
$
|
151,515
|
|
|
$
|
44,439
|
|
|
$
|
—
|
|
|
$
|
957,921
|
|
|
|
|
|
|
$
|
—
|
|
|
$
|
1,153,875
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
蕾妮·馬丁博士。
|
2017
|
|
$
|
298,636
|
|
|
$
|
99,222
|
|
|
$
|
—
|
|
|
$
|
98,365
|
|
|
$
|
—
|
|
|
$
|
—
|
|
|
$
|
496,223
|
|
|
醫學專業副學士
|
2016
|
|
$
|
278,750
|
|
|
$
|
72,336
|
|
|
$
|
—
|
|
|
$
|
417,115
|
|
|
$
|
—
|
|
|
$
|
—
|
|
|
$
|
768,201
|
|
|
(1)
|
沙納漢博士於2016年8月15日加入該公司。
|
|
|
|
|
|
|
|
|
(2)
|
根據個人和公司發展成就和公司目標,在各自年度獲得年度業績現金獎金。
|
|
|
|
|
|
|
|
|
(3)
|
在2017和2016年間,我們將股票期權授予了我們指定的執行官員,並根據FASB ASC 718計算了授予日期的公允價值。關於在確定期權授標估價時所作假設的討論,請參見我們的財務報表附註10,2017截止12月31日的年度報告。
|
|
|
摘要補償表的敍事披露
基本工資。我們指定的執行幹事的基薪主要是根據其職責範圍和業績確定的,考慮到我們的薪酬顧問提供的可比公司數據,以及我們的薪酬委員會對支付給類似情況的高管的薪酬的理解,並根據需要對其進行調整,以徵聘或保留具體個人。我們通常每年檢討我們指定執行主任的基薪。我們指定的行政人員的薪金如下:
|
指定執行幹事
|
|
年度基地
薪酬有效
截至2017年月31
|
|
|
Craig Thompson,首席執行官兼董事
|
|
$
|
460,000
|
|
|
William R.Shanahan,M.D.,首席醫務官
|
|
$
|
400,000
|
|
|
Renee Martin博士,醫學高級副總裁
|
|
$
|
315,000
|
|
現金獎金。董事會通過了公司的行政獎勵獎金計劃,或獎金計劃,該計劃適用於由薪酬委員會推薦並由董事會選定的某些關鍵高管或高管。The Bonus Plan provides for bonus payments based upon the attainment of performance targets established by the Board and related to financial and operational metrics with respect to the Company or any of its subsidiaries, or the Performance Goals, which would include the achievement of clinical study or operational milestones, results of clinical studies and achievement of specified financial metrics or objectives. Each Executive is given a targeted bonus opportunity set for each performance period.根據獎金計劃支付給行政人員的最高獎金為行政人員獎金機會的125%。業績目標是在公司財務報告公佈後或董事會決定的其他適當時間後的每個會計年度結束時衡量的。如果業績目標得到實現,則在此後30天內付款,如果上一會計年度不遲於3月31日,則支付。
股權激勵補償我們一般會為僱員提供股票期權,包括我們指定的行政人員,因為他們最初受僱於我們。我們也通常每年提供股票期權,作為員工年度業績評估的一部分。賠償委員會在行使其酌情權,決定每筆向董事會推薦的補助金數額時,一般都會考慮到每個人為實現公司年度目標所作的貢獻。
其他補償。 We currently maintain broad-based benefits that are provided to all employees, including health insurance, life and disability insurance, dental insurance and a 401(k) plan. As discussed below in “Employment Agreements with Certain Executive Officers,” we have entered into employment agreements with certain executive officers providing for benefits upon termination of their employment, including the acceleration of vesting of restricted stock and options. Our 提供遣散費福利的目標是提供足夠的現金連續性保護,使我們的管理人員將全時專注於業務的需求,而不是各自職位的潛在影響。我們更希望能確定在某些情況下,有多少遣散費可能會支付給指定的行政人員,而不是在指定行政人員的職位終止時,就遣散費進行談判。
財政年度末傑出股權獎
下表列出了截至#date0#12月31日有關我們指定的執行官員的未償股權裁決的某些信息。
| |
|
|
|
|
期權獎勵
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
姓名
|
|
數目
證券
底層
未行使
備選方案
可鍛鍊
(#)
|
|
|
數目
證券
底層
未行使
備選方案
不可鍛鍊的(#)
|
|
|
股權激勵
計劃獎:
數目
證券
底層
未行使
未掙
備選方案(#)
|
|
|
選項練習
價格(美元)
|
|
期權
有效期
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
克雷格·湯普森
|
|
|
22,760
|
(1)
|
|
|
24,740
|
(1)
|
|
—
|
|
|
$
|
29.60
|
|
1/7/2026
|
|
|
|
|
—
|
|
|
|
|
|
|
|
21,250
|
(2)
|
|
$
|
28.16
|
|
6/9/2026
|
|
|
|
|
6,250
|
(3)
|
|
|
18,750
|
(3)
|
|
|
—
|
|
|
$
|
11.76
|
|
12/6/2026
|
| |
|
|
3,125
|
(4)
|
|
|
9,375
|
(4)
|
|
|
—
|
|
|
$
|
5.12
|
|
3/3/2027
|
|
|
|
|
33,853
|
(5)
|
|
|
47,397
|
(5)
|
|
|
—
|
|
|
$
|
1.63
|
|
5/20/2027
|
| |
|
|
|
|
|
|
|
|
|
|
—
|
|
|
|
|
|
|
|
威廉·沙納漢
|
|
|
16,250
|
(6)
|
|
|
32,501
|
(6)
|
|
|
—
|
|
|
$
|
25.36
|
|
8/15/2026
|
|
醫學博士。
|
|
|
31,250
|
(5)
|
|
|
43,750
|
(5)
|
|
|
—
|
|
|
$
|
1.63
|
|
5/20/2027
|
| |
|
|
|
|
|
|
|
|
|
|
—
|
|
|
|
|
|
|
|
蕾妮·馬丁博士。
|
|
|
20,312
|
(5)
|
|
|
28,438
|
(5)
|
|
|
—
|
|
|
$
|
1.63
|
|
5/20/2027
|
| |
|
|
2,031
|
(7)
|
|
|
17,469
|
(7)
|
|
|
—
|
|
|
$
|
1.60
|
|
7/18/2027
|
| (1) |
該股票期權在四年內歸屬如下:25%的股票期權應歸屬於歸屬開始日期後一年,其餘75%的股票期權歸屬於36期相等的每月分期付款。歸屬生效日期為2016年月七日。
|
| (2) |
該期權的期限應為兩年,其歸屬如下:10,625股股票將在交易完成後歸屬,預期實際價值至少為1億美元;10,625股剩餘股份應在完成至少2億美元的預期實際價值的交易完成後歸屬。
|
| (3) |
該股票期權在四年內歸屬如下:25%的股票期權應歸屬於歸屬開始日期後一年,其餘75%的股票期權歸屬於36期相等的每月分期付款。歸屬生效日期為2016年月6日。
|
| (4) |
這種股票期權每月分期付款48次。歸屬生效日期為2016年月6日。
|
| (5) |
此股票期權每月分期付款36次。本期權25%的歸屬應根據公司結果第三階段臨牀試驗登記的75%患者的臨時數據加速進行,兩者以較早者為準。在期權加速歸屬後,剩餘的未歸屬期權應在剩餘的歸屬期內每月分期付款相等,使整個裁決從歸屬開始之日起36個月內完全歸屬。歸屬開始日期為2017,05月20日。
|
| (6) |
該股票期權在四年內歸屬如下:25%的股票在歸屬開始日期後一年內歸屬,其餘75%則歸屬於36期相等的每月分期付款。歸屬生效日期為2016年8月15日。
|
| (7) |
這種股票期權每月分期付款48次。歸屬開始日期為2017,07月18日。
|
與某些執行幹事簽訂的僱用協議
On January 25, 2016, we entered into employment agreements with Craig Thompson and May Liu. On January 5, 2018, we amended the employment agreement with Mr. Thompson and Ms. Liu (the “Amended Agreement”) and also entered into employment agreements (together with the Amended Agreement, the “Agreements”) with Drs. William Shanahan and Renee Martin, and Patrick Murphy, who was appointed to serve 作為公司的高級副總裁,於2018年月1日(統稱為“執行人員”)。
這些協定規定每年基薪(“基薪”),但須經審計委員會確定的年度審查和增加。此外,每名高管不時被認為是獎金目標,其數額最高可達當時高管基本工資的一個百分比(“獎金百分比”),並有資格參加公司的長期激勵權益計劃,並獲得董事會確定的年度股權贈款。
根據這些協議,每個行政長官的工作都是自願的.如行政機關以合理理由終止行政人員的職位,或公司無因由(如下文所界定)終止僱用,行政人員將有權領取(I)截至終止之日其應累算但未支付的基薪及未付及有文件記錄的開支償還額,(Ii)行政人員根據任何規定可享有的任何既得利益。employee benefit plan, which shall be paid in accordance with the terms of such employee benefit plans, as of the date of termination, (iii) continued payment of the Executive’s Base Salary for a period following such termination (the “Severance Period”) plus his or her annual target incentive compensation for such Severance Period, (iv) acceleration of vesting of all equity awards that would have vested within twelve months following such termination, (v) continuation of health benefits for twelve months after termination, and (vi) outplacement services, in the case of each of (iii), (iv), (v), and (vi), subject to the execution of a separation agreement and release. The receipt of any severance payments or benefits is subject to the Executive not violating such Executive’s post-employment contractual obligations.
The employment agreements define “Cause” as the: (i) commission by the Executive of any felony or certain misdemeanors, or conduct that would reasonably expected to cause the Company or any of its subsidiaries and affiliates any material injury or reputational harm if the Executive’s employment continued; (ii) willful disclosure of trade secrets or other confidential information relating to the Company; (iii) continued failure by the Executive to perform his or her duties after demand by the Board (other than as a result of incapacity); (iv) conduct by the Executive constituting a material act of misconduct in connection with the performance of the Executive’s duties, including without limitation, misappropriation of funds or property of the Company or any of its subsidiaries or affiliates, or participation in releasing false or materially misleading financial statements or submission of false certifications to the Securities and Exchange Commission (the “SEC”); (v) breach by the Executive of any of the provisions contained in the employment agreements or any other agreement between the parties; (vi) material violation by the Executive of the Company’s written employment practices; or (vii) failure to cooperate with internal, regulatory or law enforcement investigations after demand by the Board, or the 銷燬或未保存與此類調查有關的文件。
The employment agreements define Good Reason as the Executive’s compliance with certain procedures specified in the Agreements, including notice and a cure period, after the occurrence of any of the following events: (i) a substantial reduction in the Executive’s duties, responsibilities, or authority or a title change, each without the Executive’s consent; (ii) a material reduction in the Base Salary or Bonus Percentage; (iii) 在某些情況下公司辦事處的搬遷;或(Iv)公司重大違反協議的行為。
目前每位行政人員的基薪如下:湯普森先生46萬美元;沙納漢博士40萬美元;劉女士30萬美元。馬丁博士和墨菲先生的基本工資是315,000美元。
目前每位高管的獎金百分比如下:湯普森先生(50%);沙納漢博士(35%);劉女士和馬丁博士(30%)。墨菲先生的獎金百分比是25%。
對湯普森而言,經修訂的協議將交易期限從9個月增加到12個月,劉女士則從6個月增加到9個月。其他每名高管的清算期為9個月。
項目12.
某些受益所有人的擔保所有權和管理
下表列出了截至2018年1月31日有關下列人員對我們普通股的實際所有權的某些資料:
|
|
●
|
據我們所知,每個人擁有我們普通股的5%以上;
|
|
|
●
|
我們每一位指定的執行幹事;
|
|
|
●
|
每名董事;及
|
|
|
●
|
我們所有的執行官員和董事都是一個整體。
|
除非下表腳註另有説明,否則表中所列的每一人都有唯一的表決權和投資權。我們每一位指定的執行官員和董事的地址是Anthera製藥公司,25301工業大道,B套房,海沃德,CA。在2018年月31日後60天內可行使或可行使的認股權、認股權證或其他權利的普通股股份,在計算股票所有權和持有期權、認股權證或其他權利的股東的百分比時,被視為有權實益和未清償的,但對於計算任何其他股東的百分比,則不視為未清償股份。截至2018年月31,我們已發行普通股21,507,862股。
|
實益擁有人的姓名或名稱及地址
|
數量和性質
受益所有權
|
佔階級的百分比
|
|
|
|
|
|
任命的執行幹事和董事
|
|
|
|
Craig Thompson(1)
|
634,783
|
2.95%
|
|
William R.Shanahan,M.D.(2)
|
220,703
|
1.03%
|
|
Renee Martin博士(3)
|
128,398
|
*
|
|
Paul F.Truex(4)
|
167,448
|
*
|
|
Christopher S.Henney博士(5)
|
125,223
|
*
|
|
布倫特弗爾斯(6)
|
98,953
|
*
|
|
Brian R.Mueller(7歲)
|
105,865
|
*
|
|
菲利普·薩格(Philip T.Sager),醫學博士(8)
|
105,865
|
*
|
|
David E.Thompson(9歲)
|
118,381
|
*
|
|
所有指定的執行幹事和董事作為一個團體
(9人)
|
1,705,619
|
7.36%
|
|
|
|
|
|
擁有超過我們普通股5%的所有者
|
|
|
|
|
|
生物技術價值基金、LP和相關實體
(10)
|
2,408,029
|
11.20%
|
|
683資本管理、有限責任公司和相關實體
(11)
|
2,603,191
|
11.48%
|
|
(1)
|
包括(I)19,848股普通股,及(Ii)購買614,935股普通股的期權,該等股份可在2018年月31日後60天內行使,由湯普森先生持有。
|
|
(2)
|
包括購買20703股普通股的期權,該普通股可在2018年月31日後60天內行使,由沙納漢博士持有。
|
|
(3)
|
包括(I)3,118股普通股及(Ii)購買125,280股普通股的期權,該等股份可在2018年月31日後60天內行使,由馬丁女士持有。
|
|
(4)
|
包括(I)16,793股普通股,所有股份均由2005 Truex家族信託U/D/T 04/20/2005持有,(Ii)購買額外150,655股普通股的期權,可在2018年1月31日起60天內行使,由Truex先生擁有。
|
|
(5)
|
包括(I)3163股普通股及(Ii)購買額外122,060股普通股的期權,該等股份可在2018年月31日後60天內行使,並由Henney博士持有紀錄。
|
|
(6)
|
包括購買98953股普通股的期權,這些股票可在2018年月31日後60天內行使,由弗斯先生持有。
|
|
(7)
|
包括(I)1250股普通股和(Ii)購買104615股普通股的期權,這些股票可在2018年月31日後60天內行使,由穆勒先生持有。
|
|
(8)
|
包括購買105,865股普通股的期權,這些普通股可在2018年月31日後60天內行使,由薩格爾博士持有。
|
|
(9)
|
包括(I)2003股普通股及(Ii)購買116,378股普通股的期權,該等股份可在2018年月31日後60天內行使,並由湯普森先生持有紀錄。
|
| |
|
|
(10)
|
Includes (A)(i) 110,276 shares of common stock underlying warrants issued in connection with a subscription agreement dated September 6, 2016 and held by Biotechnology Value Fund, L.P., (ii) 72,078 shares of common stock underlying warrants issued in connection with a subscription agreement dated September 6, 2016 and held by Biotechnology Value Fund II, L.P., (iii) 21,455 shares of common stock underlying warrants issued in connection with a subscription agreement dated September 6, 2016 and held by Biotechnology Value Trading Fund OS, L.P., and (iv) 34,230 shares of common stock underlying warrants issued in connection with a subscription agreement dated September 6, 2016 and held by MSI BVF SPV, LLC; (B)(i) 249,024 shares of common stock underlying warrants issued on March 17, 2017 and held by Biotechnology Value Fund, L.P., (ii) 162,901 shares of common stock underlying warrants issued on March 17, 2017 and held by Biotechnology Value Fund II, L.P., (iii) 42,652 shares of common stock underlying warrants issued on March 17, 2017 and held by Biotechnology Value Trading Fund OS, L.P., (iv) 51,458 shares of common stock underlying warrants issued on March 17, 2017 and held by Investment 10, LLC, and (v) 43,964 shares of common stock underlying warrants issued on March 17, 2017 and held by MSI BVF SPV, LLC; and (C)(i) 422,263 shares of common stock underlying warrants issued on January 9, 2018 and held by Biotechnology Value Fund, L.P., (ii) 285,911 shares of common stock underlying warrants issued on January 9, 2018 and held by Biotechnology Value Fund II, L.P., (iii) 75,296 shares of common stock underlying warrants issued on January 9, 2018 and held by Biotechnology Value Trading Fund OS, L.P., (iv) 44,677 shares of 普通股於2018年月9日發行,由投資公司10有限責任公司持有;(V)53879股普通股,於2018年月9日發行,由MSI BVF SPV持有。Excludes (i) 301,461 shares of common stock underlying warrants issued on October 27, 2017 and held by Biotechnology Value Fund, L.P., (ii) 204,117 shares of common stock underlying warrants issued on October 27, 2017 and held by Biotechnology Value Fund II, L.P., (iii) 53,754 shares of common stock underlying warrants issued on October 27, 2017 and held by Biotechnology Value Trading Fund OS, L.P., (iv) 31,893 shares of common stock 標的認股權證於2017年月27日發行,由投資公司10有限責任公司持有,及(V)38,463股普通股認股權證,該認股權證於2017年月27日發行,由MSI BVF SPV,LLC持有。
|
|
(11)
|
683資本管理有限責任公司(“683 LLC”)可被視為有權受益者的普通股股份數完全基於代表資本管理公司於1月8日提交的附表13G中披露的信息。截至1月18日,2018,683資本合夥公司(“683 LP”)可被視為有權享有1,440,000股普通股和1,163,191股普通股的認股權證。683有限責任公司,作為683 LP的投資經理,可被視為有權享有683 LP有權受益者擁有的1,440,000股普通股股份。作為683 LLC的管理成員,Ari Zweiman可被視為有權受益地擁有683 LLC有權受益者擁有的1,440,000股普通股。不包括830,427股普通股的認股權證於2017年月27日發行,由683 LP持有。
|
權益補償計劃資訊
下表提供了我們的股權補償計劃的信息,該計劃於2017年月31生效。
|
計劃類別
|
|
數目
證券
發於
行使
突出
各種選擇,
認股權證和
權利
|
|
加權
平均
行使價格
成
突出
各種選擇,
認股權證和
權利
|
|
數目
證券
剩餘
可供使用
未來發行
低於權益
補償
計劃(不包括在內)
證券
引用
(A)欄
|
|
|
|
|
(a)
|
|
(b)
|
|
(c)
|
|
|
證券持有人批准的權益補償計劃:
|
|
|
|
1,066,121
|
|
|
$
|
10.04
|
|
|
|
242,481
|
|
|
證券持有人未批准的權益補償計劃
|
|
|
|
n/a
|
|
|
|
n/a
|
|
|
|
n/a
|
|
|
共計
|
|
|
|
1,066,121
|
|
|
$
|
10.04
|
|
|
|
242,481
|
|
項目13.
歐盟委員會的規定界定了要求披露的相關人交易包括任何交易、安排或關係,自1月1日起,涉及的金額超過12萬美元的較低數額,即我們曾或將要參與的年底的總資產平均數的1%,而相關人員有或將有直接或間接的重大利益。A related person is: (i) an executive officer, director or director nominee of the Company, (ii) a beneficial owner of more than 5% of our common stock, (iii) an immediate family member of an executive officer, director or director nominee or beneficial owner of more than 5% of our common stock, or (iv) any entity that is owned or controlled by any of the foregoing persons or in which any 上述人員擁有相當大的所有權、權益或控制權。
從2017年月1日至本報告之日,以下為我們與某些相關人員之間的某些交易或一系列交易。有關公司及其行政人員與董事薪酬所訂立的僱傭協議的資料,可在“行政薪酬”標題下查閲。
私人安置
On October 23, 2017, the Company entered into a securities purchase agreement with a group of 21 accredited investors (the “Purchasers”), pursuant to which the Company issued shares of its common stock, Class Y Convertible Preferred Stock, and warrants to purchase shares of common stock for gross proceeds of approximately $15,000,000 in a private offering with two closings (the “Private Placement”).私人安置的購買者包括與生物技術價值基金、L.P和683資本管理有限責任公司有關的實體。
獨立董事
我們對董事獨立性的決定是根據納斯達克股票市場上市標準中“獨立”的定義作出的。根據向每一位董事索取的資料,董事會確定,Furse先生、Mueller先生和D.Thompson先生以及Henney博士和Sager博士在這類規則的意義上都是獨立的。
“特拉華普通公司法”(DGCL)第145條授權一家公司賠償其董事和高級人員因其曾擔任或目前擔任法團董事或高級官員而被提起或威脅成為一方的訴訟、訴訟和法律程序所產生的責任。該彌償可包括董事或高級人員在任何該等訴訟、訴訟或法律程序中實際及合理地招致的開支(包括律師費)、判決、罰款及為和解而支付的款額。第145條允許公司在最後處置此類訴訟、訴訟或訴訟程序之前支付董事和高級官員的費用(包括律師費)。此外,第145條規定,法團有權代表其董事和高級人員購買和維持保險,以防止他們以董事或高級人員的身份對他們提出並招致的任何法律責任,或因其作為董事或高級人員的身份而產生的保險,不論該公司是否有權根據第145條就該等法律責任向董事或高級人員作出彌償。
我們在重新聲明的註冊證書中通過了一些條款,並在DGCL允許的範圍內對董事的個人責任加以限制或消除,並對其進行了修訂和重申,這是目前存在的,也可能是今後可能修改的。因此,董事將不對我們或我們的股東對作為董事的金錢損害或違反信託責任承擔個人責任,但下列責任除外:
|
|
•
|
任何違反董事對我們或股東忠誠義務的行為;
|
|
|
•
|
任何不誠信的行為或不作為,或涉及故意不當行為或明知違反法律的行為或不行為;
|
|
|
•
|
任何與股息或非法購買股票、贖回或其他分配有關的非法付款;或
|
|
|
•
|
董事從中獲得不正當的個人利益的任何交易。
|
這些責任限制不會改變聯邦證券法規定的董事責任,也不會影響公平補救辦法的提供,例如強制令或撤銷。
|
|
•
|
我們會在DGCL所容許的範圍內,向我們的董事、高級人員,以及在董事局的酌情權下,向某些僱員提供補償,因為該等僱員現時已存在或將來可能會作出修訂;及
|
|
|
•
|
我們會將合理的開支(包括律師費),包括律師費,交予董事,以及在董事局酌情決定的情況下,支付給我們的高級人員及某些僱員,與他們為我們服務或代我們服務的法律程序有關,但有限度的例外情況除外。
|
我們已與我們的每一位董事及某些行政人員簽訂彌償協議。這些協議規定,我們將在特拉華州法律允許的最充分範圍內,向我們的每一位董事、某些執行官員以及有時向他們的附屬公司提供賠償。我們會預付費用,including attorneys’ fees (but excluding judgments, fines and settlement amounts), to each indemnified director, executive officer or affiliate in connection with any proceeding in which indemnification is available and we will indemnify our directors and officers for any action or proceeding arising out of that person’s services as a director or officer brought on behalf of the Company or in furtherance of our rights.此外,我們的某些董事可享有某些權利,以獲得由其附屬公司提供的彌償、費用預支或保險,而補償涉及並可能適用於因該董事的服務而引起的與本條例所提述的董事相同的法律程序。儘管如此,我們在賠償協議中已經同意,公司對這些董事的義務是第一位的,而這些董事的附屬公司預支費用或為這些董事承擔的費用或責任提供賠償的任何義務都是次要的。我們亦維持一般責任保險單,涵蓋本公司董事及高級人員因其董事或高級人員的作為或不作為而引起的某些法律責任,包括經修訂的“1933證券法”所規定的法律責任。
項目14.首席會計師費用及服務
以下是英國BDO美國有限責任公司在截至2017和2016財政年度的收費摘要:
|
英國BDO美國公司收取的費用
|
|
2017
|
|
|
2016
|
|
|
|
|
|
|
|
|
|
|
審計費(1)
|
|
$
|
391,308
|
|
|
$
|
491,272
|
|
|
與審計有關的費用
|
|
|
—
|
|
|
|
—
|
|
|
税費
|
|
|
—
|
|
|
|
—
|
|
|
所有其他費用
|
|
|
—
|
|
|
|
—
|
|
|
共計
|
|
$
|
391,308
|
|
|
$
|
491,272
|
|
|
|
(1)
|
包括與我們的財務報表的年度審計、中期財務報表的審查以及與登記報表有關的同意書和安慰函的發放有關的服務費。
|
第IV部
項目15.展覽和合並財務
報表附表
下列文件作為本報告的一部分提交:
| |
頁
|
|
獨立註冊會計師事務所報告
|
73 |
|
合併資產負債表
|
74 |
|
綜合業務報表
|
75 |
|
X系列可轉換優先股合併報表和股東權益(赤字)
|
76 |
|
現金流動合併報表
|
77 |
|
合併財務報表附註
|
78 |
所有其他附表都被省略,因為它們不需要,或者所要求的信息包括在合併財務報表或附註中。
所附展覽索引中所列的展品作為本報告的一部分以參考書的形式存檔或合併。
項目16.表格10-K摘要
沒有。
獨立註冊會計師事務所報告
股東和董事會
安瑟拉制藥公司
海沃德,加利福尼亞
關於合併財務報表的意見
We have audited the accompanying consolidated balance sheets of Anthera Pharmaceuticals, Inc. (the “Company”) as of December 31, 2017 and 2016, the related consolidated statements of operations, Series X Convertible Preferred Stock and Stockholders’ Equity (Deficit), and cash flows for each of the three years in the period ended December 31, 2017 and the related notes (collectively referred to as the consolidated financial statements).我們認為,合併財務報表在所有重要方面公允地列報了公司在12月31日、2017和2016年月日的財務狀況,以及在截至12月31日的這三年中,它們的經營結果和現金流量。,符合美利堅合眾國普遍接受的會計原則。
持續經營不確定性
所附的合併財務報表是假定公司將繼續作為持續經營企業而編制的。如合併財務報表附註1所述,該公司因經營而遭受經常性虧損,淨資本不足使人對其作為持續經營企業繼續經營的能力產生重大懷疑。管理當局在這些事項上的計劃也在附註1中説明。合併財務報表不包括這種不確定性的結果可能產生的任何調整。
意見依據
這些合併財務報表是公司管理層的責任。我們的責任是根據我們的審計,就公司的合併財務報表發表意見。我們是一家在美國上市公司會計監督委員會(PCAOB)註冊的公共會計師事務所,根據美國聯邦證券法和美國證券交易委員會(SEC)和PCAOB的適用規則和條例,我們必須獨立於該公司。
我們的審計工作是按照PCAOB的標準進行的。這些準則要求我們規劃和進行審計,以獲得合理的保證,以確定合併財務報表是否存在重大錯報,無論是由於錯誤還是欺詐。該公司不需要對其財務報告的內部控制進行審計,我們也沒有進行審計。作為我們審計的一部分,我們必須瞭解財務報告的內部控制,但不是為了對公司財務報告內部控制的有效性發表意見。因此,我們不表示這種意見。
我們的審計包括執行評估合併財務報表重大錯報風險的程序,無論是因為錯誤還是欺詐,以及執行應對這些風險的程序。這些程序包括在測試的基礎上審查關於合併財務報表中的數額和披露情況的證據。我們的審計還包括評價管理部門使用的會計原則和重大估計數,以及綜合財務報表的總體列報方式。我們相信,我們的審計為我們的意見提供了合理的依據。
自2013以來,我們一直擔任公司的審計師。
2018年3月5日
安瑟拉制藥公司
合併資產負債表
(單位:千,除每股數據外)
| |
|
|
|
|
|
|
| |
|
十二月三十一日,
|
|
| |
|
2017
|
|
|
2016
|
|
|
資產
|
|
|
|
|
|
|
|
流動資產:
|
|
|
|
|
|
|
|
現金和現金等價物
|
|
$
|
2,196
|
|
|
$
|
20,843
|
|
|
預付費用和其他流動資產
|
|
|
995
|
|
|
|
1,865
|
|
|
流動資產總額
|
|
|
3,191
|
|
|
|
22,708
|
|
|
財產和設備-淨額
|
|
|
482
|
|
|
|
763
|
|
|
共計
|
|
$
|
3,673
|
|
|
$
|
23,471
|
|
| |
|
|
|
|
|
|
|
|
|
負債和股東權益(赤字)
|
|
|
|
|
|
|
|
|
|
流動負債:
|
|
|
|
|
|
|
|
|
|
應付帳款
|
|
$
|
1,832
|
|
|
$
|
4,782
|
|
|
應計臨牀費用
|
|
|
1,785
|
|
|
|
3,884
|
|
|
應計薪金
|
|
|
1,066
|
|
|
|
1,845
|
|
|
其他應計負債
|
|
|
28
|
|
|
|
113
|
|
|
流動負債總額
|
|
|
4,711
|
|
|
|
10,624
|
|
|
認股權證責任
|
|
|
4,457
|
|
|
|
—
|
|
|
負債總額
|
|
|
9,168
|
|
|
|
10,624
|
|
|
承付款和意外開支(附註8)
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
意外可贖回的X系列可轉換優先股,面值0.001美元
截至2017及12月31日為止,已發行及發行的股票價值分別為0及487股
分別為2016
|
|
|
—
|
|
|
|
377
|
|
| |
|
|
|
|
|
|
|
|
|
股東權益(赤字):
|
|
|
|
|
|
|
|
|
|
系列X可轉換優先股,面值0.001美元,5,000,000股
截至2016年12月31日已發行並已發行並已發行併發行的股份9012股,
分別
|
|
|
333
|
|
|
|
8,614
|
|
|
普通股,面值0.001美元,授權股票100,000,000股;13,854,491股和
截至2016年12月31日,已發行和發行股票5,745,536股,
分別
|
|
|
14
|
|
|
|
6
|
|
|
額外實收資本
|
|
|
428,586
|
|
|
|
411,404
|
|
|
累積赤字
|
|
|
(434,428
|
)
|
|
|
(407,554
|
)
|
|
股東權益總額(赤字)
|
|
|
(5,495
|
)
|
|
|
12,470
|
|
|
共計
|
|
$
|
3,673
|
|
|
$
|
23,471
|
|
見所附合並財務報表附註。
安瑟拉制藥公司
綜合業務報表
(單位:千,除每股數據外)
| |
|
截至12月31日的年份,
|
|
| |
|
2017
|
|
|
2016
|
|
|
2015
|
|
|
收入:
|
|
|
|
|
|
|
|
|
|
|
許可證收入
|
|
$
|
—
|
|
|
$
|
139
|
|
|
$
|
2,562
|
|
|
合作收益
|
|
|
—
|
|
|
|
6
|
|
|
|
623
|
|
|
總收入
|
|
|
—
|
|
|
|
145
|
|
|
|
3,185
|
|
|
業務費用:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
研發
|
|
$
|
28,594
|
|
|
$
|
46,512
|
|
|
$
|
33,498
|
|
|
一般和行政
|
|
|
7,938
|
|
|
|
11,071
|
|
|
|
7,568
|
|
|
研究獎
|
|
|
(100
|
)
|
|
|
(261
|
)
|
|
|
(2,638
|
)
|
|
業務費用共計
|
|
|
36,432
|
|
|
|
57,322
|
|
|
|
38,428
|
|
|
業務損失
|
|
|
(36,432
|
)
|
|
|
(57,177
|
)
|
|
|
(35,243
|
)
|
|
其他收入(費用):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
其他收入(費用)
|
|
|
(85
|
)
|
|
|
(90
|
)
|
|
|
23
|
|
|
超過融資收益的權證負債的公允價值
|
|
|
(600
|
)
|
|
|
—
|
|
|
|
—
|
|
|
權證責任公允價值的變動
|
|
|
10,243
|
|
|
|
1,744
|
|
|
|
—
|
|
|
其他收入(費用)共計
|
|
|
9,558
|
|
|
|
1,654
|
|
|
|
23
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
淨損失
|
|
$
|
(26,874
|
)
|
|
$
|
(55,523
|
)
|
|
$
|
(35,220
|
)
|
|
可歸因於優先股的視為股息
|
|
|
(2,503
|
)
|
|
|
(10,914
|
)
|
|
|
—
|
|
|
適用於普通股股東的淨虧損
|
|
$
|
(29,377
|
)
|
|
$
|
(66,437
|
)
|
|
|
(35,220
|
)
|
|
適用於普通股股東的每股淨虧損-基本損失和稀釋損失(1)
|
|
$
|
(2.86
|
)
|
|
$
|
(12.87
|
)
|
|
$
|
(7.91
|
)
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
加權-每股計算中使用的股票平均數.基本和稀釋(1)
|
|
|
10,278,391
|
|
|
|
5,163,784
|
|
|
|
4,453,905
|
|
見所附合並財務報表附註。
| (1) |
公司在所有期間發行和發行的普通股的每股金額和股份均已追溯調整,以反映自2017年月28起生效的“八分之一”反向股票分割。
|
安瑟拉制藥公司
X系列可轉換優先股和股東權益合併報表(赤字)
(除股份和每股數額外,以千計)
| |
|
意外可贖回的X系列可轉換優先股
|
|
|
系列X可轉換優先股
|
|
|
普通股(1)
|
|
|
|
|
|
|
|
| |
|
股份
|
|
|
金額
|
|
|
股份
|
|
|
金額
|
|
|
股份
|
|
|
金額
|
|
|
額外
已付
資本
|
|
|
累積
赤字
|
|
|
共計
股東‘
權益
(赤字)
|
|
|
2014年月31結餘
|
|
|
-
|
|
|
$
|
-
|
|
|
|
-
|
|
|
$
|
-
|
|
|
|
2,875,652
|
|
|
$
|
3
|
|
|
$
|
314,547
|
|
|
$
|
(316,811
|
)
|
|
$
|
(2,261
|
)
|
|
在限制釋放後發行普通股
股票單位
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
64
|
|
|
|
-
|
|
|
|
3
|
|
|
|
-
|
|
|
|
3
|
|
|
根據股票期權和員工股票購買計劃發行普通股
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
17.583
|
|
|
|
-
|
|
|
|
410
|
|
|
|
-
|
|
|
|
410
|
|
|
根據股權購買協議發行普通股,扣除發行費用60美元
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
7,417
|
|
|
|
-
|
|
|
|
75
|
|
|
|
-
|
|
|
|
75
|
|
|
根據市場發行銷售協議發行普通股,扣除發行成本379美元
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
401,066
|
|
|
|
1
|
|
|
|
12,057
|
|
|
|
-
|
|
|
|
12,058
|
|
|
發行普通股現金,平均每股5.62美元,扣除發行成本3 744美元
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
1,277,778
|
|
|
|
1
|
|
|
|
53,755
|
|
|
|
-
|
|
|
|
53,756
|
|
|
向合作伙伴發行普通股以換取現金
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
368,351
|
|
|
|
3
|
|
|
|
6,300
|
|
|
|
-
|
|
|
|
6,300
|
|
|
發行普通股以結清許可費義務
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
52,594
|
|
|
|
-
|
|
|
|
1,000
|
|
|
|
-
|
|
|
|
1,000
|
|
|
與股權獎勵有關的股份補償
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
3,536
|
|
|
|
-
|
|
|
|
3,536
|
|
|
淨損失
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
(35,220
|
)
|
|
|
(35,220
|
)
|
|
2015年月31結餘
|
|
|
-
|
|
|
$
|
-
|
|
|
|
-
|
|
|
$
|
-
|
|
|
|
5,000,505
|
|
|
$
|
5
|
|
|
$
|
391,683
|
|
|
$
|
(352,031
|
)
|
|
$
|
39,657
|
|
|
根據股票期權和員工股票購買計劃發行普通股
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
16,909
|
|
|
|
-
|
|
|
|
304
|
|
|
|
-
|
|
|
|
304
|
|
|
與股權獎勵有關的基於股份的薪酬
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
6,880
|
|
|
|
-
|
|
|
|
6,880
|
|
|
根據市場發行銷售協議發行普通股,扣除發行成本277美元
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
187,623
|
|
|
|
-
|
|
|
|
4,850
|
|
|
|
-
|
|
|
|
4,850
|
|
|
根據股權購買協議發行普通股,扣除發行費用87美元
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
64,354
|
|
|
|
-
|
|
|
|
1,579
|
|
|
|
-
|
|
|
|
1,579
|
|
|
發行X系列可轉換優先股,扣除發行成本156美元
|
|
|
17,000
|
|
|
|
16,844
|
|
|
|
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
投資者購買X-1系列可轉換優先股的權利
|
|
|
-
|
|
|
|
(3,583
|
)
|
|
|
-
|
|
|
|
3,583
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
3,583
|
|
|
將系列X可轉換優先股從臨時股權改敍為永久股權
|
|
|
(16,513
|
)
|
|
|
(9,206
|
)
|
|
|
16,513
|
|
|
|
9,206
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
9,206
|
|
|
X系列可轉換優先股轉換為普通股
|
|
|
|
|
|
|
-
|
|
|
|
(7,501
|
)
|
|
|
(5,456
|
)
|
|
|
476,145
|
|
|
|
1
|
|
|
|
5,455
|
|
|
|
-
|
|
|
|
-
|
|
|
X系列可轉換優先股的有利轉換特性
|
|
|
-
|
|
|
|
(8,831
|
)
|
|
|
|
|
|
|
(802
|
)
|
|
|
-
|
|
|
|
-
|
|
|
|
9,633
|
|
|
|
-
|
|
|
|
8,831
|
|
|
可歸屬於第X系列可轉換優先股的視為股息
|
|
|
-
|
|
|
|
8,831
|
|
|
|
-
|
|
|
|
2,083
|
|
|
|
-
|
|
|
|
-
|
|
|
|
(10,914
|
)
|
|
|
-
|
|
|
|
(8,831
|
)
|
|
與第十系列可轉換優先股有關的認股權證的發行和重新分類
|
|
|
-
|
|
|
|
(3,678
|
)
|
|
|
-
|
|
|
|
|
|
|
|
-
|
|
|
|
-
|
|
|
|
1,934
|
|
|
|
-
|
|
|
|
1,934
|
|
|
淨損失
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
(55,523
|
)
|
|
|
(55,523
|
)
|
|
2016年月31結餘
|
|
|
487
|
|
|
$
|
377
|
|
|
|
9,012
|
|
|
$
|
8,614
|
|
|
|
5,745,536
|
|
|
$
|
6
|
|
|
$
|
411,404
|
|
|
$
|
(407,554
|
)
|
|
$
|
12,470
|
|
|
根據員工股票購買計劃發行普通股
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
39,386
|
|
|
|
-
|
|
|
|
80
|
|
|
|
-
|
|
|
|
80
|
|
|
根據認股權證的行使發行普通股
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
100,834
|
|
|
|
-
|
|
|
|
190
|
|
|
|
-
|
|
|
|
190
|
|
|
與股權獎勵有關的基於股份的薪酬
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
4,379
|
|
|
|
-
|
|
|
|
4,379
|
|
|
根據股權購買協議發行普通股,扣除發行費用316美元
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
1,336,320
|
|
|
|
1
|
|
|
|
1,693
|
|
|
|
-
|
|
|
|
1,694
|
|
|
發行普通股和現金認股權證,每股4.00美元,扣除權證負債14 700美元
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
3,750,000
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
發行普通股和現金認股權證,每股1.25美元,扣除發行成本694美元
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
2,306,737
|
|
|
|
2
|
|
|
|
626
|
|
|
|
-
|
|
|
|
628
|
|
|
就普通股的私人發行發行認股權證
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
1,561
|
|
|
|
-
|
|
|
|
1,561
|
|
|
將系列X可轉換優先股從臨時股權改敍為永久股權
|
|
|
(487
|
)
|
|
|
(377
|
)
|
|
|
487
|
|
|
|
377
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
377
|
|
|
X系列可轉換優先股轉換為普通股
|
|
|
-
|
|
|
|
-
|
|
|
|
(9,069
|
)
|
|
|
(11,161
|
)
|
|
|
575,678
|
|
|
|
5
|
|
|
|
11,156
|
|
|
|
-
|
|
|
|
-
|
|
|
可歸屬於第X系列可轉換優先股的視為股息
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
2,503
|
|
|
|
-
|
|
|
|
-
|
|
|
|
(2,503
|
)
|
|
|
-
|
|
|
|
-
|
|
|
淨損失
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
-
|
|
|
|
(26,874
|
)
|
|
|
(26,874
|
)
|
|
2017年月31結餘
|
|
|
-
|
|
|
$
|
-
|
|
|
|
430
|
|
|
$
|
333
|
|
|
|
13,854,491
|
|
|
$
|
14
|
|
|
$
|
428,586
|
|
|
$
|
(434,428
|
)
|
|
$
|
(5,495
|
)
|
|
(1) |
公司在所有期間發行和發行的普通股的每股金額和股份均已追溯調整,以反映自2017年月28起生效的“八分之一”反向股票分割。
|
安瑟拉制藥公司
現金流量表
(單位:千)
| |
|
截至12月31日的年度,
|
|
| |
|
2017
|
|
|
2016
|
|
|
2015
|
|
|
業務活動現金流量:
|
|
|
|
|
|
|
|
|
|
|
淨損失
|
|
$
|
(26,874
|
)
|
|
$
|
(55,523
|
)
|
|
$
|
(35,220
|
)
|
|
調整數,將淨損失與用於業務活動的現金淨額對賬:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
折舊
|
|
|
281
|
|
|
|
266
|
|
|
|
285
|
|
|
股票補償費用
|
|
|
4,379
|
|
|
|
6,739
|
|
|
|
3,541
|
|
|
權證責任公允價值的變動
|
|
|
(10,243
|
)
|
|
|
(1,744
|
)
|
|
|
—
|
|
|
超過融資收益的權證負債的公允價值
|
|
|
600
|
|
|
|
—
|
|
|
|
—
|
|
|
經營資產和負債的變化:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
應收賬款
|
|
|
—
|
|
|
|
326
|
|
|
|
(326
|
)
|
|
預付費用和其他流動資產
|
|
|
870
|
|
|
|
(1,280
|
)
|
|
|
(202
|
)
|
|
應付帳款
|
|
|
(2,950
|
)
|
|
|
(477
|
)
|
|
|
3,027
|
|
|
應計臨牀費用
|
|
|
(2,099
|
)
|
|
|
2,507
|
|
|
|
138
|
|
|
應計薪金
|
|
|
(779
|
)
|
|
|
390
|
|
|
|
527
|
|
|
其他應計負債
|
|
|
(85
|
)
|
|
|
15
|
|
|
|
(113
|
)
|
|
遞延收入
|
|
|
—
|
|
|
|
(138
|
)
|
|
|
(2,564
|
)
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
用於業務活動的現金淨額
|
|
|
(36,900
|
)
|
|
|
(48,919
|
)
|
|
|
(30,907
|
)
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
投資活動的現金流量:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
財產和設備採購
|
|
|
—
|
|
|
|
(766
|
)
|
|
|
(80
|
)
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
用於投資活動的現金淨額
|
|
|
—
|
|
|
|
(766
|
)
|
|
|
(80
|
)
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
來自籌資活動的現金流量:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
發行優先股、認股權證和期權的淨收益
|
|
|
—
|
|
|
|
16,844
|
|
|
|
—
|
|
|
根據股權購買協議發行普通股的淨收益
|
|
|
1,694
|
|
|
|
1,579
|
|
|
|
75
|
|
|
根據市場發行銷售協議發行普通股的淨收益
|
|
|
—
|
|
|
|
4,850
|
|
|
|
12,058
|
|
|
根據股票發行普通股和認股權證的淨收益
|
|
|
16,289
|
|
|
|
—
|
|
|
|
—
|
|
|
根據股票發行普通股的淨收益
|
|
|
—
|
|
|
|
—
|
|
|
|
53,756
|
|
|
向合作伙伴發行普通股的淨收益
|
|
|
—
|
|
|
|
—
|
|
|
|
9,000
|
|
|
根據認股權證發行普通股的淨收益
|
|
|
190
|
|
|
|
—
|
|
|
|
—
|
|
|
根據股票期權發行普通股的淨收益
和員工股票購買計劃
|
|
|
80
|
|
|
|
304
|
|
|
|
410
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
籌資活動提供的現金淨額
|
|
|
18,253
|
|
|
|
23,577
|
|
|
|
75,299
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
現金和現金等價物淨增(減少)額
|
|
|
(18,647
|
)
|
|
|
(26,108
|
)
|
|
|
44,312
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
現金和現金等價物,期初
|
|
|
20,843
|
|
|
|
46,951
|
|
|
|
2,639
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
現金和現金等價物,期末
|
|
$
|
2,196
|
|
|
$
|
20,843
|
|
|
$
|
46,951
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
補充現金流信息
|
|
|
|
|
|
|
|
|
|
|
根據股權購買協議發行普通股作為承付費用
|
|
$
|
316
|
|
|
$
|
87
|
|
|
$
|
60
|
|
|
發行普通股以結清許可費義務
|
|
$
|
—
|
|
|
$
|
—
|
|
|
$
|
1,000
|
|
|
就註冊直接發售而發出的認股權證的公允價值
|
|
$
|
14,700
|
|
|
$
|
3,678
|
|
|
$
|
—
|
|
見所附合並財務報表附註。
安瑟拉制藥公司
合併財務報表附註
組織
安瑟拉制藥有限公司(“該公司”)是一家生物製藥公司,致力於促進創新藥物的開發和商業化,使醫療需求未得到滿足的患者受益。該公司目前有兩個化合物正在開發中,Sollpura和Bilsibimod。該公司於2014從禮來公司(“禮來公司”)獲得了Sollpura許可證。Sollpura是一種新型的非豬研究用胰酶替代療法(Pert),用於治療外分泌型胰腺功能不全(EPI),常見於囊性纖維化等疾病。該公司從安進公司獲得了許可。(“安進”)於12月2007。B細胞活化因子(BAFF)在多種B細胞介導的自身免疫性疾病中均有升高,如免疫球蛋白A腎病或IgA腎病。
流動性和額外資本需求
公司計劃的主要業務是獲得產品和技術權利、籌集資金和開展研發活動。公司目前正在進行治療EPI和IgA腎病的研究和開發活動。公司的活動受到重大風險和不確定性的影響。成功完成公司的發展計劃,並最終實現有利可圖的業務,取決於未來的活動,除其他外,包括其進入潛在市場的能力;獲得資金;發展客户羣;吸引、留住和激勵合格人員;以及發展戰略聯盟。
自2004成立以來,該公司一直通過股票發行、私人發行可轉換債券、債務融資、股權投資和一位前合作伙伴償還成本的方式,以及由氰基纖維化基金會治療有限公司(CfFT)頒發的研究獎,為其業務提供資金。On April 21, 2016, the Company entered into an At Market Issuance Sales Agreement with H.C. Wainwright & Co., LLC (“H.C. Wainwright ATM Agreement”) to create an at-the-market equity program under which the Company from time to time may offer and sell shares of its common stock, par value $0.001 per share, having an aggregate offering price of up to $25 million through H.C Wainwright, as 代理,於2017,與林肯公園資本有限責任公司簽訂的股權購買協議(“2017股權購買協議”)有關(定義如下)。(“LPC”),公司根據H.C.Wainwright ATM協議,提交了一份補充招股説明書,暫停了所有的產品。
On June 19, 2017, the Company entered into the 2017 Equity Purchase Agreement LPC, pursuant to which the Company has the right, at its discretion, to sell up to an aggregate of $10.0 million in shares of the Company’s common stock and issue up to 181,708 shares of the Company’s common stock as a commitment fee to LPC. As of February 28, 2018, the Company 已以310萬美元的淨收益出售了總計1870 411股普通股,並向lpc總共發行了139 848股普通股作為承諾費,並根據納斯達克規則5635(D)(2)將其能夠出售給lpc的普通股數量最大化。
2017年月23,該公司與某些認可投資者簽訂了一項與私募股權證券(“私人配售”)有關的最終協議,總收益高達1,500萬美元。“私人安置”的結構為兩次結束。第一次關閉發生在2017年月27日(“首次結束”),淨收入約為270萬美元。第二次關閉(“第二次結束”)以公司根據納斯達克規則5635(D)獲得必要的股東批准為條件,該規則於2018年月5日獲得。第二次收市發生在2018年月9日,淨收入增量達1,110萬美元。
The Company’s cash balance of $2.2 million as of December 31, 2017, together with the net proceeds of $11.1 million from the Second Closing of the Private Placement and $3.1 million from warrant exercises and sale of common stock pursuant to an equity purchase agreement subsequent to December 31, 2017 is expected to fund the Company’s operations through the first half of 2018. Therefore, there is substantial doubt about the Company’s ability to continue as a going concern within one year after the date the financial statements are issued. The Company’s current cash position is sufficient to enable it to complete its Phase 3 clinical study of Sollpura (the “RESULT” study) in patients with exocrine pancreatic insufficiency due to cystic fibrosis, which study’s topline data is expected in March 2018.如果研究結果符合其主要終點,該公司計劃在研究報告公佈後籌集足夠的資金,並將所得資金用於為Sollpura編寫其生物製劑許可證申請(“BLA”)、繼續生產藥品和通用公司用途。
本公司無法確定任何未來的融資是否會以對公司有利的條件提供,如果有的話。財務報表不包括任何可能因這種不確定性的結果而產生的調整。如果沒有足夠的資金,公司將被要求推遲其發展計劃。這將包括,除其他外,取消或縮小我們的臨牀試驗的範圍,推遲提交索爾普拉的BLA,推遲生產活動,以及減少人員數量。該公司計劃在未來12個月內主要通過發行股票證券、潛在的合夥企業和債務融資來滿足其資本要求。不籌集額外資本將對公司實現其預期業務目標的能力產生不利影響。
提出依據
所附合並財務報表是按照美國普遍接受的會計原則或公認會計原則編制的。
2017年月28日,該公司對其已發行的普通股實行了八比一的反向拆分,使其發行和發行的普通股總額從80,609,310股減少到10,076,164股,並對公司普通股的所有股東產生了同樣的影響。公司普通股和優先股的票面價值保持不變,每股0.001美元,而普通股和優先股的授權股數分別保持不變,分別為100,000,000股和5,000,000股。所有提及普通股股份、股票期權、購買普通股的認股權證、優先股的轉換率以及在所附財務報表及其附註中提出的反向股票拆分之前所有期間的每股未清償數據,都作了調整,以反映反向股票分割的追溯性,在反映反向拆分後,所有股票信息被四捨五入至最接近的整股。, 除非另有説明。
公司對資產負債表日期之後的事件和交易進行了評估,並披露了在資產負債表日期之後但在提交本年度10-K表報告之前發生的需要在綜合財務報表中予以確認或披露的所有事項或交易。
收入確認
在2015年間,公司與Zenyaku高句麗有限公司合作。(“Zenyaku”) which provided for various types of payments from Zenyaku, including development milestones, sales milestone, royalty, and reimbursement for a portion of the Company’s internal and external costs. All payments from Zenyaku are nonrefundable. The collaborative arrangement was on a best-efforts basis, did not require scientific achievement as a performance obligation and provided for payment to be made when costs were incurred 2016,根據Zenyaku公司給公司的終止通知,合作於1月7日終止。
關於與Zenyaku的合作安排,該公司按照財務會計準則委員會(“FASB”)編碼或ASC 605確認收入。收入確認“,副標題ASC 605-25”多元安排下的收入“及副標題ASC 605-28”收入識別-里程碑法”, which provide accounting guidance for revenue recognition for arrangements with multiple deliverables and guidance on defining the milestone and determining when the use of the milestone method of revenue recognition for research and development transactions is appropriate, respectively. For multiple-element arrangements, each deliverable within a multiple deliverable revenue arrangement is accounted for as a separate unit of accounting if both of the following criteria are met: (1) 交付的一個或多個項目對客户具有獨立價值;(2)對於包含相對於交付項目的一般返回權的安排,未交付項目的交付或履行被認為是可能的,並且基本上由公司控制。
The deliverables under the Zenyaku agreement had been determined to be a single unit of accounting and as such any license fees received were recorded as deferred revenue and recognized ratably over the term of the estimated performance period under the agreement, which was the product development period. As a result of an early termination of the Zenyaku agreement, the Company revised the amortization period of its deferred revenue 與2015第三季度縮短的合作期相一致,並於2016年月7日全部攤銷了遞延收入。
就合作研究活動而言,公司有權從Zenyaku獲得償還其內部人員費用的費用,按預先確定的全時當量(“FTE”)費率計算,與FTE服務有關的收入被確認為在相關業績期間提供的研究服務。公司必須按照合作協議的規定進行研究和開發活動。收到的款項不予退還,是根據項目工作的每一FTE的合同償還率計算的。對FTE費用的償還記作已發生的協作收入。
估計數的使用
根據公認會計原則編制這些綜合財務報表要求我們作出影響所報告的資產、負債、費用和相關披露數額的估計和判斷。管理層在持續的基礎上評估其評估,包括關鍵的會計政策或與臨牀試驗權責發生制、税收準備、基於股票的補償、權證負債和計算受益轉換特徵有關的估計。該公司的估計依據的是歷史經驗和它認為在當時情況下是合理的其他特定市場和其他有關假設,這些假設的結果構成了對其他來源不太明顯的資產和負債的賬面價值作出判斷的基礎。實際結果可能與這些估計有很大不同。
兼具股權與負債特徵的金融工具
公司已發行了某些金融工具,包括購買普通股的認股權證,這些金融工具具有負債和股本的特點,如認股權證等被歸類為負債的金融工具在發行時是公允價值的,並在隨後的報告期內按公允價值重新計量,從而在其他收入/(費用)中記錄公允價值的變化。認股權證的公允價值是使用以下估值模型估算的:需要輸入主觀假設,包括股票價格波動、預期壽命和未來股票發行的概率。.
現金及現金等價物
本公司認為所有在購買之日原始到期日或剩餘期限為三個月或以下的高流動性票據均為現金等價物。現金等價物主要包括現金貨幣和貨幣市場基金,其賬面金額是公允價值的合理估計數。現金等價物按公允價值確認。
財產和設備-淨額
財產和設備按成本減去累計折舊。折舊是在估計的各資產的使用壽命內計算的,這些資產的使用年限為3至5年,採用直線法計算。修理和保養費用按所發生的費用支出。租賃權的改進按成本計算,並在租賃期限或相關資產的使用期限內使用直線法攤銷,以較短的為準。
長壽資產
公司的長期資產和其他資產在發生事件或情況變化時,如果表明資產的賬面金額可能無法收回,則對其進行減值審查。要持有和使用的資產的可收回性是通過將資產的賬面金額與預計資產產生的未來未貼現現金流進行比較來衡量的。如果該資產被視為受損,則應以該資產的賬面金額超過其公允價值的數額來衡量應確認的減值。截至2017年月31,該公司的長期資產未遭受重大減值損失.
累積臨牀研究
與臨牀研究有關的開支,是根據與多間研究機構、臨牀研究機構及其他代我們進行及管理臨牀研究的服務提供者所簽訂的合約而作出的估計,而這些合約的財務條款須經談判,並會因合約而異,並可能導致不均衡的付款流動。按固定費用或單價支付的工作範圍。根據合同支付的費用主要由這些服務提供者支付的時間和材料驅動。與臨牀研究有關的費用一般是根據服務提供者發生的時間和材料並按照合同計算的。這一過程涉及審查未結合同和定購單,並與適用人員進行溝通。確定已代表公司提供的服務,並在公司尚未收到發票或以其他方式通知其實際成本時,估算服務所執行的服務水平和相關費用。大多數服務供應商的發票至少每月拖欠所做的服務。公司定期向服務提供商確認估算的準確性在有需要時作出調整。估計應計臨牀費用的例子包括:
|
· |
與臨牀研究有關的向合同研究組織或CRO支付的費用;
|
|
· |
向合同製造商支付的與生產臨牀研究材料有關的費用。
|
研究和開發費用
Research and development expenses consist of personnel costs, including salaries, benefits and stock-based compensation, clinical studies performed by CROs, materials and supplies, and overhead allocations consisting of various administrative and facilities related costs. Clinical study expenses are further separated into two main categories: clinical development and pharmaceutical development. Clinical development costs include costs for Phase 1, 2 and 3 clinical studies. Pharmaceutical development costs consist of expenses 與生產活動、產品配方和化學分析有關的費用。
本公司在發生時收取研發費用,包括臨牀研究費用。臨牀研究費用是研究和開發費用的重要組成部分。公司的所有臨牀研究均由第三方CRO進行。公司根據服務提供者的時間和材料計算臨牀費用。
所有重要合同可由公司在書面通知後終止,公司一般只對服務提供者實際花費的努力和在任何終止點發生的某些不可取消的費用負責。
所得税
The Company accounts for income taxes in accordance with the liability method whereby deferred tax asset and liability account balances are determined based on differences between the financial reporting and tax bases of assets and liabilities and are measured using the enacted tax rates and laws that will be in effect when the differences are expected to reverse. The Company provides a valuation allowance, if necessary, to reduce deferred tax assets to their estimated realizable value.
段段
公司只在一個部門運作,管理部門以現金流量為主要手段來管理其業務,而不是將其業務劃分為內部報告或決策。公司的長期有形資產主要由公司購買並由其合同製造廠商安裝的機器組成。該機器用於公司的所有產品製造活動。
股票補償
The Company uses the Black-Scholes option pricing model as the method for determining the estimated fair value for all stock-based awards, including employee stock options, and rights to purchase shares under the Company’s Employee Stock Purchase Plan, and recognizes the costs in its consolidated financial statements over the employees’ requisite service period. The Black-Scholes option pricing model requires the use of highly subjective and complex 以股票為基礎的獎勵的公允價值的假設,包括期權的期望值和標的股票的價格波動。此外,公司還必須包括在計算補償成本時將喪失的獎勵數量的估計數,這些獎勵在裁決的必要服務期內以直線方式確認。
預期期限-公司的期望值是指公司以股票為基礎的獎勵預計未付的期間,並採用簡化方法確定,該方法是以加權歸屬期和合同壽命的算術平均值計算的。
預期波動率-預期波動率是根據公司的歷史股票價格估算的。
預期股息-Black-Schole期權定價模型要求以單一預期股利收益率作為投入,公司從未支付過股息,也沒有支付股息的計劃。
無風險利率-布萊克-斯科爾斯期權定價方法中使用的無風險利率是基於美國國債在批出時發行的與預期期權期限相對應的零利率。
估計沒收-估計的沒收率是根據公司迄今的歷史沒收率確定的。公司監測實際沒收情況,並定期更新估計數。
向非僱員發行的權益票據按FASB提供的指導原則確定的公允價值入賬,並在相關服務期間作為權益工具歸屬和確認為支出而定期重新估值。
最近的會計公告
2017年7月,金融會計準則委員會發行了2017至11歐元,每股收益(專題260),負債與股本的區分(主題480),衍生工具和套期保值(主題815):I.某些具有向下回合特徵的金融工具的會計核算;對某些非公有實體的強制可贖回金融工具和某些強制可贖回的非控制權益(ASU 2017-11)的不確定延期的替代(ASU 2017-11)本更新的第一部分討論了某些具有向下循環特徵的金融工具會計的複雜性。下一輪特徵是某些與股權相關的工具(或嵌入式特徵)的特徵,這些特徵導致基於未來股票發行定價的罷工價格降低。目前的會計準則為發行金融工具(如認股權證和可轉換票據)的實體創造了成本和複雜性,這些實體具有需要對整個工具進行公允價值計量或轉換選項的低周特性。本更新的第二部分討論了由於FASB會計準則編纂中存在大量未決內容,難以瀏覽主題480,即區分負債與權益。這一未決內容是對某些非公有實體的強制贖回金融工具和某些強制可贖回的非控制權權益的會計要求的無限期推遲的結果。本更新第二部分的修正不具有會計效力。本會計準則適用於財政年度,以及從2018年月15以後開始的這些年內的過渡時期。該公司目前正在評估採用ASU 2017-11對其財務報表和相關披露的潛在影響,但預計不會產生重大影響。
2014年5月,國際會計準則委員會發布了第2014-09號“會計準則更新”(“ASU”),與客户簽訂合同的收入(ASC Topic 606). The standards update outlines a single comprehensive model for entities to utilize to recognize revenue when it transfers goods or services to customers in an amount that reflects the consideration that will be received in exchange for the goods and services. Additional disclosures will also be required to enable users to understand the nature, amount, timing and uncertainty of revenue and cash flows arising from contracts with customers.2016,財務會計準則委員會發布了會計準則更新,以解決實施問題,並澄清了確定業績義務、許可證和確定一家公司是否是收入安排中的委託人或代理人的指導方針。2015年8月,美國金融服務委員會發布了2015-14期,與客户簽訂合同的收入(主題606):推遲生效日期,將ASU 2014-09的生效日期推遲。公司強制採用ASC 606的日期現在是2018年月1號。允許採用的方法有兩種,一種是“完全”追溯收養,另一種是“修改後的”追溯收養。該公司計劃在修訂的追溯基礎上採用新規則,適用於2018年月一日存在的所有合同。其中的指導意見不會對我們的合併財務報表產生重大影響。
在二月份,聯邦會計準則委員會發布了第2016-02號ASU,租賃(專題842)。ASU 2016-02 impacts any entity that enters into a lease with some specified scope exceptions. This new standard establishes a right-of-use (ROU) model that requires a lessee to record a ROU asset and a lease liability on the balance sheet for all leases with terms longer than 12 months. Leases will be classified as either finance or operating, with classification affecting the pattern of expense recognition in the 操作聲明。指南更新並取代主題840,租約。對於公共實體,ASU 2016-02適用於財政年度,並允許從2018年月15以後的中期開始,並允許儘早採用。在財務報表中提出的最早的比較期開始時,如果有一些實際的權宜之計,則需要修改後的追溯過渡方法。公司預計採用這一標準不會對其財務報表產生重大影響。.
2017年月一日起,公司採用ASU編號2016-09,薪酬-股票薪酬(主題718):改進員工股票支付會計。除其他要求外,新的指導原則要求所有與結算時的股票支付(或到期)相關的税收影響都要通過損益表記錄下來。以前,超過補償成本的税收福利(“意外之財”)記錄在股本中,税收缺陷(“短缺”)記錄在權益中,以以往意外之財為限,然後計入損益表。根據要求,這一變化前瞻性地適用於結算所產生的所有超額税收優惠和税收缺陷。根據新的指引,意外收入免税額會在出現時予以記錄,但須視乎正常的估價免税額因素而定。按規定,這一變動是在經修改的追溯基礎上適用的,有30萬美元的未確認遞延税款資產可歸因於先前未確認的超額税收福利,因為該公司沒有減少應付的所得税。採用ASU 2016-09號的累積調整對淨權益沒有影響,因為遞延增税資產被相應增加的遞延税資產估價免税額完全抵消。ASU第2016-09號處理現金流量表上支付的僱員税的列報問題。公司現在必須將從僱員處扣繳的股份的成本作為現金流量表上的一項融資活動,而不是作為經營現金流動的一項籌資活動,以支付僱員的所得税負債。This change is applied on a retrospective basis, as required, but did not impact the statement of cash flows for the year ended December 31, 2017. ASU No. 2016-09 also permits entities to make an accounting policy election related to how forfeitures will impact the recognition of compensation cost for stock-based compensation to either estimate the total number of awards for which the requisite service period will not be 根據目前的要求,或對發生的沒收作出解釋。公司在被採納後,選擇不對現行的沒收會計政策作出任何修改。
在3月份,該公司因公司開發Sollpura而獲得了CFFT高達300萬美元的研究獎金。該公司保留開發Sollpura並將其商業化的權利,並將在該合作下批准和商業化的任何藥物候選人的淨銷售額上向CFFT支付特許權使用費。The funding is disbursed by CFFT to the Company upon the Company’s achievement of milestones specified in the grant agreement. At its discretion, the Company may choose to fund a particular stage of the Sollpura development plan without CFFT funds. Any CFFT funds not expended on the development program of Sollpura must be returned to CFFT and, upon such return, the amounts of such returned funds will not be included as part of the research award for the purpose of calculating royalties or other amounts owed by the Company to CFFT. To the extent CFFT provides or makes available any information, expertise, know-how or other intellectual property related to cystic fibrosis or the treatment, prevention or cure there-of (“CFFT Know-How”) to the Company, CFFT grants to the Company a non-exclusive, transferrable, 在CFFT所擁有的所有權利下的可分許可、全球範圍的權利和許可---如何幫助公司研究、開發、商業化、製造或製造、使用、銷售、銷售、提供銷售、進口、出口和以其他方式開發該產品。
In consideration for CFFT’s research award and any licenses of intellectual property granted by CFFT, the Company agrees to pay royalties to CFFT as follows: i) a one-time royalty in an amount equal to five times the actual award, payable in three installments between the first and second anniversaries of the first commercial sale of a product; ii) a one-time royalty in an amount equal to the actual 產品銷售淨額後的獎勵達到1億美元;以及(3)如果產品在商業銷售前獲得許可、銷售或其他轉讓或變更控制交易,一筆里程碑付款相當於實際獎勵的三倍。
截至2017年月31,該公司已完全認可該研究獎項。.
根據公允價值計量會計準則及其隨後的更新,公允價值被界定為在計量日市場參與者之間有序交易中出售資產或為轉移負債(即“退出價格”)而收取的價格。會計準則確立了計量公允價值所用投入的層次結構,通過要求在可用時使用可觀測的市場數據,儘量減少使用不可觀測的投入。可觀察的投入是市場參與者在根據活躍的市場數據為資產或負債定價時使用的投入。不可觀測的投入是指反映市場參與者在根據情況下現有最佳信息為資產或負債定價時使用的假設的投入。
公允價值等級分為以下三個投入級別:
|
§ |
一級-估值以活躍市場相同資產或負債的報價為基礎,我們在報告日期隨時可獲得。使用一級投入的資產和負債的例子是某些貨幣市場基金、美國國債和活躍市場上報價的證券交易。
|
|
§ |
2級-根據在活躍市場上可直接或間接觀察到的活躍市場的報價以外的投入進行估值。利用二級投入的資產和負債的例子有:美國政府機構債券、公司債券、商業票據、存單和場外衍生品。
|
|
§ |
三級-基於無法觀察的投入的估值,其中幾乎沒有或根本沒有市場數據,這就要求公司制定自己的假設。
|
下表列出了公司所有金融資產(包括現金和現金等價物)的公允價值等級,按按公允價值計算的主要證券類別,以千計,截至12月31日、2017和2016(千):
| |
|
2017年月31
|
|
| |
|
估計值
公允價值
|
|
|
一級
|
|
|
2級
|
|
|
三級
|
|
|
資產:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
貨幣市場基金
|
|
$
|
2,097
|
|
|
$
|
2,097
|
|
|
$
|
—
|
|
|
$
|
—
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
負債:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
認股權證責任
|
|
$
|
4,457
|
|
|
$
|
—
|
|
|
$
|
—
|
|
|
$
|
4,457
|
|
| |
2016年月31
|
|
| |
估計值
公允價值
|
|
一級
|
|
2級
|
|
三級
|
|
|
資產:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
貨幣市場基金
|
|
$
|
19,416
|
|
|
$
|
19,416
|
|
|
$
|
—
|
|
|
$
|
—
|
|
該公司採用市價來確定現金等價物的公允價值,這些現金等價物由貨幣市場基金組成,因此被歸入公允價值等級的第1級,在截至12月31日的一年中,沒有在第1級、第2級或第3級之間轉移。
行使價格可調整的認股權證被記作負債,公允價值的變動包括在各自期間的淨損失中,因為對估值模型的某些投入不是不可觀察的,或者主要不是通過相關或其他方式從可觀測的市場數據中得到或由可觀測的市場數據得到證實的,因此權證負債在公允價值層次中被列為三級。
下表概述截至十二月三十一日、2017及2016年度公司三級認股權證負債的變動情況(單位:千):
| |
|
2017年月31
|
|
|
期初餘額
|
|
$
|
—
|
|
|
在發出與直接有關的認股權證時,認股權證責任的公允價值以外
2017年3月普通股發行
|
|
|
14,700
|
|
|
2017年4月1日至12月31日期間認股權證負債的公允價值減少
|
|
|
(10,235
|
)
|
|
在行使認股權證時將餘額重新歸類為額外的已付資本
|
|
|
(8
|
)
|
|
期末餘額
|
|
$
|
4,457
|
|
| |
|
2016年月31
|
|
|
期初餘額
|
|
$
|
—
|
|
|
在發出與直接有關的認股權證時,認股權證責任的公允價值以外
2016年9月發行優先股
|
|
|
3,678
|
|
|
在確定行使價格及認股權證的股份數目後公允價值的變動
|
|
|
(1,744
|
)
|
|
餘額重新分類為額外已付資本
|
|
|
(1,934
|
)
|
|
期末餘額
|
|
$
|
—
|
|
在截至12月31日、2017和2016的年份中,1級、2級或3級之間沒有任何轉移。
Pursuant to an underwriting agreement entered into in March 2017, the Company issued warrants to purchase 30,000,000 shares of common stock at an initial exercise price of $0.55 per share (“Tranche 1 Warrants”) and warrants to purchase 30,000,000 shares of common stock at an initial exercise price of $0.50 per share (“Tranche 2 Warrants”) to certain investors. On April 28, 2017, the Company implemented a one-for-eight reverse split of its outstanding common stock. The Reverse Stock Split did not change the number of authorized shares of common stock, which remained at 100,000,000, but did increase the number of authorized but unissued shares of common stock, resulting in sufficient authorized shares of common stock to settle the warrants. After giving effect to the Reverse Stock Split, the number of shares issuable upon exercise and the exercise price of the Tranche 1 Warrants were 3,750,007 and $4.40, respectively, and the number of shares issuable upon exercise and the exercise price of the Tranche 2 Warrants were 3,750,007 and $4.00, respectively. The Tranche 1 Warrants will expire on April 28, 2022 and the Tranche 2 Warrants expired on October 28, 2017.
The exercise price of the Tranche 1 Warrants and Tranche 2 Warrants are subject to adjustment in the event of a stock combination, reverse split, or similar transaction involving common stock (each, a “Stock Combination Event”) if the average volume weighted average price (“VWAP") of the common stock for the five lowest trading days during the 15 consecutive trading day period ending and including the trading day immediately preceding the 16第四股票合併事件發生後的交易日低於認股權證的行使價格。在這種情況下,權證的行使價格調整到平均VWAP。由於反向拆分股票,第1期和第2批認股權證的行使價格分別調整到1.8918美元。
公司根據ASC 815主題對權證進行了核算,衍生工具和套期保值(“ASC 815”)根據下列特點:
|
1. |
在發行之日,認股權證不被視為與其自己的股票掛鈎,因為在股票組合事件中,行使價格會受到調整,因此基本工具並不是“固定的”。
|
|
2. |
認股權證允許持有人要求公司在發生包括出售業務在內的基本交易時,以相當於權證的Black-Schole價值的金額結算認股權證。
|
At the end of each reporting period, the changes in fair value during the period are recorded as a component of non-operating income (expense) in the consolidated statement of operations. The initial fair value of the liability associated with these warrants was $14.7 million. The Tranche 2 Warrants expired on October 28, 2017 on which date the warrants were out of the money and had a fair value of zero. As of December 31, 2017, the fair value of the liability associated with the Tranche 1 Warrants was $4.5 million. The decrease of $10.2 million in fair value of the warrant liability was recorded as non-operating income during the year ended December 31, 2017. The Company estimated the fair value of the warrants using the Monte Carlo simulation model, which combines expected cash outflows with 根據市場對風險調整收益率、股票價格波動和未來可能發生的股票組合事件數量的假設,在發行日期和2017年月31日對每一批股票進行估值時使用的投入如下:
|
發行日期
|
|
第1檔
|
|
|
第2檔
|
|
|
普通股價格
|
|
$
|
3.44
|
|
|
$
|
3.44
|
|
|
鍛鍊價格
|
|
$
|
4.40
|
|
|
$
|
4.00
|
|
|
預期波動率
|
|
|
112.5
|
%
|
|
|
112.5
|
%
|
|
股利收益率
|
|
|
0
|
%
|
|
|
0
|
%
|
|
無風險利率
|
|
|
2.03
|
%
|
|
|
2.03
|
%
|
|
預期任期(年份)
|
|
|
5.0
|
|
|
|
0.5
|
|
|
潛在的未來股票組合事件數
|
|
|
1.57
|
|
|
|
0.03
|
|
|
2017年月31
|
|
第1檔
|
|
|
|
|
|
|
普通股價格
|
|
$
|
1.65
|
|
|
|
|
|
|
鍛鍊價格
|
|
$
|
1.89
|
|
|
|
|
|
|
預期波動率
|
|
|
97.8
|
%
|
|
|
|
|
|
股利收益率
|
|
|
0
|
%
|
|
|
|
|
|
無風險利率
|
|
|
2.13
|
%
|
|
|
|
|
|
預期任期(年份)
|
|
|
4.33
|
|
|
|
|
|
|
潛在的未來股票組合事件數
|
|
|
1.43
|
|
|
|
|
|
為確定公允價值,公司根據每日價格觀察結果計算出與權證預期期限相對應的歷史波動率。所有估值日期的預期期限均以認股權證的其餘合同條款為依據。The risk-free interest rates were the U.S. Treasury bond rate as of the valuation months and years. The probability of future Stock Combination Events is based on the number of potential reverse stock splits that is determined on simulated stock price under a trigger price of $1.00 for 30 consecutive days. The number of potential future Stock Combination Event is the average of reverse splits from all the simulation trials.
6.協作協議
In December 2014, the Company entered into an exclusive license agreement with Zenyaku (“Zenyaku Agreement”) for the development and commercialization of blisibimod in Japan and potentially other countries throughout Asia, while the Company retained full development and commercialization rights of blisibimod for all other global territories including North America and the European Union. The Zenyaku Agreement was mutually terminated in January 2016. Consequently, the 公司加快了遞延收入的攤銷期,並於2016年月7日全部攤銷。
7. 財產和設備
財產和設備包括以下(千):
| |
|
十二月三十一日,
|
|
| |
|
2017
|
|
|
2016
|
|
|
實驗室設備
|
|
$
|
1,877
|
|
|
$
|
2,013
|
|
|
計算機和軟件
|
|
|
115
|
|
|
|
115
|
|
|
辦公室傢俱和固定裝置
|
|
|
140
|
|
|
|
140
|
|
|
租賃改良
|
|
|
206
|
|
|
|
206
|
|
|
財產和設備共計
|
|
|
2,338
|
|
|
|
2,474
|
|
|
減去累計折舊和攤銷
|
|
|
(1,856
|
)
|
|
|
(1,711
|
)
|
|
財產和設備,淨額
|
|
$
|
482
|
|
|
$
|
763
|
|
截至12月31日、2017、2016和2015年度,該公司的折舊和攤銷費用分別為281,000美元、266,000美元和285,000美元。
租賃
The Company leases its main operating facility in Hayward, California. The lease was for approximately 14,000 square feet and the lease agreement was due to expire in September 2017. On July 20, 2017, the Company terminated the lease agreement and concurrently entered into a sublease agreement for approximately 8,000 square feet of the same facility. The sublease agreement will expire on August 31, 2019. In 今年4月,該公司租賃了位於加利福尼亞州普萊森頓的第二個運營設施,租期約為1,200平方英尺,租賃協議將於2019年月日到期。
在截至12月31日、2017、2016和2015的年度中,該公司的租金支出分別為211,000美元、195,000美元和222,000美元。
截至2017年月31,不可撤銷經營租契下的未來最低租金如下(千元):
|
2018
|
|
$
|
191
|
|
|
2019
|
|
|
106
|
|
|
共計
|
|
$
|
297
|
|
在2月份,該公司提前終止了其樂天辦事處的租賃協議,並將其未來租金總額減少了大約42,000美元。
其他承諾
在2007,該公司和安進公司簽訂了一項全球性的獨家許可協議(“安進協議”),開發和商業化任何適應症,包括治療系統性紅斑狼瘡(“狼瘡”)。根據安進協議的條款,該公司支付了600萬美元的預付許可證費。由於該技術沒有未來的替代用途,該公司在2007年間支付了研發費用。根據安進協議的條款,該公司有義務在達到某些發展和管理里程碑後,向安進支付高達3 300萬美元的額外里程碑付款。該公司還有義務為今後產品的淨銷售支付分級的版税,從高個位數到低兩位數不等,這些產品是根據本合作關係的定義開發和批准的。The Company’s royalty obligations as to a particular licensed product will be payable, on a country-by-country and licensed product-by-licensed product basis, for the longer of (a) the date of expiration of the last to expire valid claim within the licensed patents that covers the manufacture, use or sale, offer to sell, or import of such licensed product by the Company or a sublicense in such country or (b) 適用許可產品首次在適用國家商業銷售10年後。
On July 11, 2014, the Company and Eli Lilly and Company (“Eli Lilly”) entered into a worldwide, exclusive license agreement (the “Lilly Agreement”), to develop and commercialize Sollpura, a Phase 3 novel investigational Pancreatic Enzyme Replacement Therapy (“PERT”), for the treatment of patients with Exocrine Pancreatic Insufficiency, or EPI, often seen in patients with cystic fibrosis and other conditions.Under the terms of the Lilly Agreement, the Company was not required to make any up-front payment but is obligated to make milestone payments of up to up to $33.5 million for capsule products and $9.5 million for reformulated products upon the achievement of certain regulatory and commercial sales milestones, none of which have been achieved as of December 31, 2017. In addition, after sales of the licensed products 在美國,該公司的總銷售額超過了100.0美元,該公司有義務為未來產品的淨銷售支付分級版税,這些產品從個位數到十幾歲左右,都是根據禮來協議的定義開發和批准的。The Company’s royalty obligations as to a particular licensed product will be payable, on a licensed product-by-licensed product basis, for the longer of (a) the date of expiration of the last to expire valid claim within the licensed patents that covers the manufacture, use or sale, offer to sell, or import of such licensed product by the Company or a sublicense in such country, or (b) 12 years 在適用國家首次商業銷售適用許可產品之後。
請參閲附註3---“研究獎”,以討論與CFFT頒發的研究獎有關的承諾和意外情況.
優先股
公司已授權5,000,000股面值為0.001美元的優先股。公司董事會有權指定公司發行的任何優先股的條款和條件,而不需普通股股東採取進一步行動。公司指定其授權和未發行優先股中的17 000股股份為X系列可轉換優先股,並提交了一份修正和恢復的指定證書。特拉華州國務卿關於第十系列可轉換優先股的優惠、權利和限制。
2016年9月,該公司與某些機構投資者簽訂了一項認購協議,在一次登記的直接發行(“認購協議”)中,以每單位1,000美元的價格出售了17,000套X系列股份,每個單位包括第X系列可轉換優先股的一股股份和購買15.87股普通股的認股權證。註冊直接發行的總收益為1,700萬美元。第X系列可轉換優先股的持有者沒有任何表決權,也沒有選舉董事會任何成員的權利。The Series X Convertible Preferred Stock has a contingent redemption clause. The Company is not required to issue any shares of common stock upon conversion of any shares of Series X Convertible Preferred Stock to the extent that (i) the aggregate issuance of common stock will be greater than 1,048,229 shares or 19.99% of the total outstanding shares of the Company (the “Threshold Amount”) and (ii) the conversion has not been approved by the Company’s stockholders in accordance with the stockholder approval requirements of Nasdaq Marketplace Rule 5635(d) (a “Blocked Conversion”). Due to the contingent redemption feature related to Nasdaq conversion limits that could result in a potential redemption for cash, the Company initially classified the 17,000 shares of Series X Convertible Preferred Stock in the mezzanine section (between equity and liabilities) on the date of issuance. On November 16, 2016, the conversion price became fixed at $15.7536 and therefore, the Series X Convertible Preferred Stock became convertible into 1,079,119 shares of common stock, which exceeded the aggregate number of common stock permitted for conversion by 30,890 shares of common stock, or 487 shares of Series X Convertible Preferred Stock. As such, the 487 shares of Series X Convertible Preferred Stock remained contingently redeemable until shareholder approval was obtained for the conversion of these shares; while the remaining 16,513 shares of Series X Convertible Preferred Stock ceased to be redeemable and were reclassified from the mezzanine section to equity as of December 31, 2016. On April 27, 2017, shareholder approval was obtained to convert the 487 shares of Series X Convertible Preferred Stock into common stock, and consequently 第X系列可轉換股票的487股股份不再可由持有人贖回,並在股東權益表中從臨時權益轉為永久權益。
The conversion price of the shares of Series X Convertible Preferred Stock was less than the fair value of the Company’s common stock at the date of issuance and therefore the in-the-money conversion feature (Beneficial Conversion Feature, or BCF) requires separate financial statement recognition and was measured at the intrinsic value (i.e., the amount of the increase in value that preferred stockholders would realize upon conversion based on the value of the conversion shares on the issuance date). A BCF of $8.8 million was recorded as a discount to the contingently redeemable Series X Convertible Preferred Stock in mezzanine and was immediately accreted as a deemed preferred stock dividend and, accordingly, an adjustment to net loss to arrive at net loss applicable to common stockholders. Furthermore, in December 2016, certain holders converted 7,501 shares of Series X Convertible Preferred Stock into 476,145 shares of common stock. The conversion was reflected as a reduction in Series X Convertible Preferred Stock in permanent equity. The unamortized discount was recognized as a deemed dividend of $2.1 million in connection with the conversion of the Series X Convertible Preferred Stock. For the year ended December 31, 2016, the Company recorded a total deemed dividend of $10.9 million. During the year ended December 31, 2017, 9,069 shares of Series X Convertible Preferred Stock were converted into 575,678 shares of common stock and concurrent with the conversion, the Company recorded $2.5 million in deemed dividend. As of December 31, 2017, an aggregate of 16,570 shares of Series X Convertible Preferred Stock have been converted into an aggregate of 1,051,823 shares of common stock, leaving a balance of 430股X系列可轉換優先股已發行、流通並可轉換為27,296股普通股。
普通股
In March 2016, the Company filed a universal shelf registration statement with the SEC on Form S-3 for the proposed offering from time to time of up to $100.0 million of its securities, including common stock, preferred stock, debt securities and/or warrants. As of December 31, 2017, the Company has registered a total of $82.6 million under this registration statement, leaving a balance of $17.4 million available for future issuance under the registration statement.
The S-3 registration statement is subject to Instruction I.B.6. of Form S-3, which imposes a limitation on the maximum amount of securities that the Company may sell pursuant to the registration statement during any twelve-month period. When the Company sells securities pursuant to the registration statement, the amount of securities to be sold plus the amount of any securities the Company has sold during the prior twelve months in reliance on Instruction I.B.6. may not exceed one-third of the aggregate market value of its outstanding common stock held by non-affiliates as of a day during the 60 days immediately preceding such sale, as computed in accordance with Instruction I.B.6. Based on this calculation, the Company expects it will be significantly limited to sell securities pursuant to its effective registration statement on Form S-3 for a period of twelve 從3月16日到2017,除非和直到公司非附屬公司持有的未發行普通股的市值增加到7,500萬美元以上。如果公司不能在其貨架登記下出售證券,公司可能需要使用成本更高、時間更長的進入資本市場的手段,這可能會對其流動性和現金狀況產生實質性的不利影響。
In March 2017, the Company entered into an underwriting agreement with H.C. Wainwright, pursuant to which the Company sold an aggregate of 3,750,000 shares of its common stock and issued warrants to purchase shares of the Company’s common stock. The financing transaction resulted in proceeds of $14.1 million. The warrants were recorded as liabilities upon issuance due to price protection, as discussed in Note 5. 這些認股權證發行時的公允價值估計為1 470萬美元,超過了1 410萬美元的收益,認股權證的公允價值與現金收益之間的60萬美元盈餘在2017第一季度支出。
在2017,該公司與林肯公園資本有限公司簽署了一項股權購買協議。(“lpc”)(“2017股權購買協議”)向lpc出售總計1 000萬美元的普通股股份,並在30個月內發行價值30萬美元的普通股中多達181 708股作為承付費用。截至2018年月28日,該公司已以310萬美元的淨收益出售了總計1870411股普通股,並向LPC發行了總計139,848股普通股作為承諾費,並根據納斯達克規則第5635(D)(2)條將其能夠出售給lpc的普通股數量最大化。
2017年月23,該公司與一批經認可的投資者(“買家”)簽訂了一份私募股權購買協議(“SPA”)。“私人安置”的結構是由兩個結束部分組成的。根據“最低抵押協議”,在2017年初收盤價結束時,購買者以每股1.25美元的價格購買了公司普通股的2,306,737股,每股普通股都有認股權證,以每股1.55美元的行使價格購買公司的另外3.0股普通股。第二次關閉需要股東根據納斯達克規則5635(D),該規則是在1月5日,2018。At the Second Closing, the Purchasers purchased 7,625,741 shares of the Company’s common stock at $1.25 per share and 2,067,522 shares of the Company’s non-voting Class Y Convertible Preferred Stock (the “Class Y Preferred Stock”) at $1.25 per share, convertible into 2,067,522 shares of Company common stock upon certain conditions.每一股普通股或Y類優先股均獲發認股權證,可立即行使其認股權證,以每股1.25美元的行使價格購買公司普通股的1.0股,扣除承銷商佣金和法律費用後,淨收益為220萬美元。在收到股東批准的情況下,發行Y級優先股和認股權證的義務所代表的金融工具屬於股權分類。2017年初收盤日,普通股和認股權證的公允價值分別為390萬美元和980萬美元,公司根據相對公允價值法分配淨收益,結果分別將60萬美元和160萬美元分配給普通股和認股權證截至2017年月31,由於股東在2018日前未獲得股東批准,完成第二次收盤價的條件未得到滿足。
在2017年月31日,本公司已預留下列股份作日後發行之用,但不包括根據第二次私募股權而發行的任何證券:
|
可轉換系列X優先股
|
|
|
27,296
|
|
|
普通股期權未償還
|
|
|
1,066,121
|
|
|
普通股認股權證
|
|
|
10,940,206
|
|
|
可根據股票期權計劃獲得未來贈款的普通股期權
|
|
|
242,481
|
|
|
根據ESPP計劃可用於未來贈款的普通股
|
|
|
449
|
|
|
共計
|
|
|
12,276,553
|
|
認股權證
In connection with a venture debt financing executed in March 2011, the Company issued a seven-year warrant to the lender for the purchase of 5,022 shares of the Company’s common stock at an exercise price of $384.00 per share. The warrant was immediately exercisable and expires in March 2018. As of December 31, 2017, the warrants remained outstanding and exercisable. These warrants are classified 公司合併資產負債表上的永久權益。
與2016年9月發行X系列可轉換優先股有關,該公司向某些機構投資者發行認股權證,以購買公司普通股。#date0#11月16日,認股權證的行使價格和普通股數量分別定為18.90美元和269,779美元。認股權證可在2017年月13以後隨時行使,並將於2019年月13日到期。截至2017年月31,這些認股權證仍未到期,可行使。這些認股權證在公司的綜合資產負債表上列為永久權益。
Pursuant to the underwriting agreement for the sale of common stock and warrants in March 2017, the Company issued 30,000,000 warrants (“Tranche 1 Warrants”) at an initial exercise price of $0.55 per share and 30,000,000 (“Tranche 2 Warrants”) at an initial exercise price of $0.50 per share to the investors to purchase shares of the Company’s common stock. The Company did not have sufficient authorized but unissued common stock to issue the warrants at the time the underwriting agreement was executed. On April 28, 2017, with shareholders’ approval, the Company effectuated a one-for-eight reverse split of its outstanding common stock. Subsequent to the Reverse Stock Split, the Tranche 1 Warrant shares and exercise prices were adjusted to 3,750,007 and $4.40, respectively, and the Tranche 2 Warrants shares and exercise price were adjusted to 3,750,007 and $4.00, respectively. Effective as of May 22, 2017, the Tranche 1 and Tranche 2 Warrants’ exercise price were further adjusted to $1.8918 pursuant to Section 2(c) of the warrant agreements, which was the average VWAP of the five (5) lowest trading days during the fifteen (15) consecutive trading days following the April 28, 2018 reverse stock split. A total of 96,021 Tranche 2 Warrants were exercised on October 5, 2017 and the remaining 3,653,986 Tranche 2 Warrants expired on October 28, 2017. A total of 4,813 Tranche 1 warrants were exercised on November 11, 2017, leaving a balance of 3,745,194 Tranche 1 Warrants outstanding and exercisable as of December 31, 2017 with an expiry date of April 28, 2022. These warrants are 在認股權證行使或到期之前,在公司的綜合資產負債表上列為負債,見附註5。
Pursuant to the Private Placement for the sale of common stock and warrants in October 2017, the Company issued warrants to certain institutional investors to purchase shares of the Company’s common stock. The Private Placement was structured with two closings. The Initial Closing occurred on October 27, 2017, which resulted in the Company issuing 6,920,211 warrants to the investors at an exercise price of $1.55 per 認股權證第一批認股權證將在首次結算六個月零一天時開始行使,有效期五年零六個月。第一批認股權證按ASC主題815,ASC主題480所規定的會計準則分類為股權認股權證。區分負債 從公平和ASC 825金融工具-登記付款安排.該公司根據下列假設,在發行日期使用Black-Schole期權定價模型衡量第1批認股權證的公允價值:
|
普通股價格
|
|
$
|
1.72
|
|
|
鍛鍊價格
|
|
$
|
1.55
|
|
|
預期波動率
|
|
|
110
|
%
|
|
股利收益率
|
|
|
0
|
%
|
|
無風險利率
|
|
|
1.98
|
%
|
|
預期任期(年份)
|
|
|
5.50
|
|
為確定公允價值,公司根據每日價格觀察結果計算了歷史波動率,這一時期相當於第1批認股權證的預期期限。預期期是以第1批認股權證的合約期為根據,而無風險利率是截至估值月份及年度的美國國債利率。截至2017年月31,第1批認股權證仍未發行,但不能行使。
2013計劃
2013年月25日,公司董事會通過了“2013股票期權激勵計劃”(“2013計劃”),該計劃也得到了公司股東在2013年度股東大會上的批准。公司最初保留其普通股218,750股,用於根據2013計劃發放獎勵,再加上根據公司2010股票期權和獎勵計劃(“2010計劃”)可獲得的所有剩餘股份,再加上根據2010計劃或2013計劃返還的任何額外股份,原因是取消、沒收或其他終止(行使除外)根據“2010計劃”或“2013計劃”發放的獎勵,在任何情況下都必須進行調整,包括重組、資本重組、重新分類、股票紅利、股票拆分、反向股權分割或公司股本的其他類似變化。2015年5月,該公司股東批准增發其普通股223,852股,用於根據2013計劃發行獎勵。在2013計劃保留髮行的普通股中,以激勵期權、非限定期權或股票增值權的形式在任何日曆年內向任何個人參與者發行的股份將不超過93 750股。2013計劃允許向符合條件的僱員、董事和顧問授予獎勵和非法定股票期權、限制性和不受限制的股票獎勵、限制性股票單位、股票增值權、業績股票獎勵、現金獎勵和相當於股息的權利。根據2013計劃授予的期權的期權行使價格不得低於股票期權授予之日公司普通股股份公平市場價值的100%。根據2013計劃提供的期權最長期限為10年,一般超過4年。此外,對於某些大股東,激勵期權的最低行使價格必須等於授予之日公平市場價值的110%,最長期限以五年為限。在符合整體計劃限制的情況下,以激勵期權形式發行的普通股的最高總數目不得超過781,250股普通股。2013計劃不允許期權持有人在轉歸前行使其選擇權。.
下表彙總了截至12月31日、2017、2016和2015年底的股票期權活動。:
| |
|
數目
備選方案
|
|
|
加權-
平均
運動
價格
|
|
|
加權-
平均
剩餘
契約性
生活在
年數
|
|
|
骨料
內稟
價值
|
|
|
2014年月31結餘
|
|
|
380,073
|
|
|
$
|
29.57
|
|
|
|
8.92
|
|
|
$
|
—
|
|
|
授予期權
|
|
|
174,065
|
|
|
$
|
56.78
|
|
|
|
|
|
|
|
|
|
|
行使選擇權
|
|
|
(10,029
|
)
|
|
$
|
29.95
|
|
|
|
|
|
|
|
|
|
|
期權被沒收
|
|
|
(7,327
|
)
|
|
$
|
31.63
|
|
|
|
|
|
|
|
|
|
|
選項過期
|
|
|
(4,768
|
)
|
|
$
|
47.15
|
|
|
|
|
|
|
|
|
|
|
2015年月31結餘
|
|
|
532,014
|
|
|
$
|
38.27
|
|
|
|
8.44
|
|
|
$
|
4,330
|
|
|
授予期權
|
|
|
370,019
|
|
|
$
|
26.14
|
|
|
|
|
|
|
|
|
|
|
行使選擇權
|
|
|
(14,599
|
)
|
|
$
|
17.61
|
|
|
|
|
|
|
|
|
|
|
期權被沒收
|
|
|
(101,063
|
)
|
|
$
|
57.71
|
|
|
|
|
|
|
|
|
|
|
選項過期
|
|
|
(36,854
|
)
|
|
$
|
43.17
|
|
|
|
|
|
|
|
|
|
|
2016年月31結餘
|
|
|
749,517
|
|
|
$
|
29.82
|
|
|
|
8.19
|
|
|
$
|
—
|
|
|
授予期權
|
|
|
727,265
|
|
|
$
|
1.68
|
|
|
|
|
|
|
|
|
|
|
行使選擇權
|
|
|
—
|
|
|
$
|
—
|
|
|
|
|
|
|
|
|
|
|
期權被沒收
|
|
|
(350,638
|
)
|
|
$
|
31.18
|
|
|
|
|
|
|
|
|
|
|
選項過期
|
|
|
(60,023
|
)
|
|
$
|
32.35
|
|
|
|
|
|
|
|
|
|
|
2017年月31結餘
|
|
|
1,066,121
|
|
|
$
|
10.04
|
|
|
|
8.68
|
|
|
$
|
18
|
|
|
截至2017年月31
|
|
|
501,337
|
|
|
$
|
13.44
|
|
|
|
8.14
|
|
|
$
|
8
|
|
|
既得利益及預期將於2017年月31歸屬
|
|
|
993,495
|
|
|
$
|
10.27
|
|
|
|
8.64
|
|
|
$
|
17
|
|
截至2017年月31,共有242,481股股份可根據2013計劃獲批出。2018年月五日,該公司採用2018股期權及激勵計劃(“2018計劃”),2018計劃取代2013計劃。詳情請參閲附註14。
布萊克-斯科爾斯期權定價模型中對股票期權進行估值的假設如下:
| |
|
截至12月31日的年份,
|
|
| |
|
2017
|
|
|
2016
|
|
|
2015
|
|
|
預期波動
|
|
|
132
|
%
|
|
|
98
|
%
|
|
|
94
|
%
|
|
股息收益率
|
|
|
0
|
%
|
|
|
0
|
%
|
|
|
0
|
%
|
|
無風險利率
|
|
|
1.90
|
%
|
|
|
1.51
|
%
|
|
|
1.70
|
%
|
|
預期任期(年份)
|
|
|
6.13
|
|
|
|
5.90
|
|
|
|
5.92
|
|
|
加權平均公允價值
|
|
$
|
1.51
|
|
|
$
|
2.53
|
|
|
$
|
5.40
|
|
股票期權的內在價值是指股票期權的行使價格與當天我國股票市場價格的差額。與我們的股票期權有關的其他信息概述如下(除每股信息外,以千計):
| |
截至12月31日的年份,
|
|
| |
2017
|
|
|
2016
|
|
|
2015
|
|
|
行使期權的內在價值
|
$
|
—
|
|
|
$
|
177
|
|
|
$
|
140
|
|
|
行使股票期權所得收益
|
$
|
—
|
|
|
$
|
257
|
|
|
$
|
299
|
|
截至2017年月31,共有260萬美元與非歸屬賠償金相關的經調整的賠償費用,預計將在1.89年的加權平均剩餘時間內以直線方式攤銷。
截至2017年月三十一日,有關未償還、已獲轉歸及可行使的股票期權的資料如下:
| |
|
備選方案---傑出
|
|
|
可予行使的期權
|
|
|
運動價格範圍
|
|
股份數目
|
|
|
加權平均
剩餘
契約壽命
(數年)
|
|
|
股份數目
|
|
|
加權平均
剩餘
契約壽命
(數年)
|
|
|
$ 1.00 - $10.00
|
|
|
694,509
|
|
|
|
9.38
|
|
|
|
264,636
|
|
|
|
9.32
|
|
|
$ 10.01 - $20.00
|
|
|
113,943
|
|
|
|
7.39
|
|
|
|
81,665
|
|
|
|
7.10
|
|
|
$ 20.01 – $30.00
|
|
|
180,790
|
|
|
|
7.91
|
|
|
|
80,711
|
|
|
|
7.32
|
|
|
$ 30.01 - $40.00
|
|
|
74,003
|
|
|
|
6.19
|
|
|
|
71,548
|
|
|
|
6.11
|
|
|
$ 40.01 - $600.00
|
|
|
2,876
|
|
|
|
2.26
|
|
|
|
2,777
|
|
|
|
2.07
|
|
|
共計
|
|
|
1,066,121
|
|
|
|
8.68
|
|
|
|
501,337
|
|
|
|
8.14
|
|
2010員工股票購買計劃
從2010開始,根據ESPP的條款,符合條件的公司僱員可以授權公司從他們的補償中扣除金額,這些金額用於使僱員能夠購買公司普通股的股份。The Company initially reserved 1,562 shares of common stock for issuance thereunder on January 1, 2011, and on each January 1 thereafter, the number of shares of stock reserved and available for issuance under the Plan shall be cumulatively increased by the lesser of (i) one percent (1%) of the number of shares of common stock issued and outstanding on the immediately preceding December 31 or (ii) 3,906 shares of common stock. On January 1, 2017, in accordance with the ESPP’s annual increase provisions, the authorized shares in the ESPP increased by 3,906. On April 27, 2017, the Company’s shareholders approved a one-time increase to the ESPP pool by 27,344 shares and increase the number of shares available for issuance under the Plan by the lesser of (i) one percent (1%) of the number 在緊接12月31日或(Ii)31,250股普通股之前發行和發行的普通股,自2018年月1日起。
根據ESPP,符合資格的公司僱員可以授權公司從他們的補償中扣除金額,這些金額用於使僱員能夠購買公司普通股的股份。每股購買價格為適用的半年期購買期的第一個日期或終止日期的普通股公允市場價值的85%,以較少者為準(“回首規定”)。15%的折扣和回頭客補償。下表彙總了截至12月31日、2017、2016和2015年度的espp活動(除股票和每股信息外,以千計)。:
| |
|
數目
備選方案
|
|
|
加權-
平均
購買
價格
|
|
|
2014年月31發行的股票
|
|
|
10,642
|
|
|
|
—
|
|
|
年度增加準備金
|
|
|
3,906
|
|
|
|
—
|
|
|
已發行股份
|
|
|
(7,556
|
)
|
|
$
|
14.62
|
|
|
2015年月31結餘
|
|
|
6,992
|
|
|
|
—
|
|
|
年度增加準備金
|
|
|
3,906
|
|
|
|
—
|
|
|
已發行股份
|
|
|
(2,313
|
)
|
|
$
|
21.01
|
|
|
2016年月31發行的股票
|
|
|
8,585
|
|
|
|
—
|
|
|
年度增加準備金
|
|
|
3,906
|
|
|
|
—
|
|
|
一次增加
|
|
|
27,344
|
|
|
|
—
|
|
|
已發行股份
|
|
|
(39,386
|
)
|
|
$
|
2.04
|
|
|
2017年月31發行的股票
|
|
|
449
|
|
|
|
—
|
|
採用Black-Soles期權定價模型對員工的股票購買權進行了價值評估。在截至12月31日、2017、2016和2015的年度內,股票購買權的估值採用了以下加權平均假設:
| |
|
截至12月31日的年份,
|
|
| |
|
2017
|
|
|
2016
|
|
|
2015
|
|
|
預期波動
|
|
|
147
|
%
|
|
|
97
|
%
|
|
|
82
|
%
|
|
股息收益率
|
|
|
0
|
%
|
|
|
0
|
%
|
|
|
0
|
%
|
|
無風險利率
|
|
|
0.64
|
%
|
|
|
0.38
|
%
|
|
|
0.08
|
%
|
|
預期任期(年份)
|
|
|
0.50
|
|
|
|
0.50
|
|
|
|
0.50
|
|
|
加權平均授予日期---每項權利的公允價值
|
|
$
|
0.57
|
|
|
$
|
1.50
|
|
|
$
|
1.04
|
|
股票補償費用
以股票為基礎的賠償費用總額,包括ESPP記錄的費用如下(千):
| |
截至12月31日的年份,
|
|
| |
2017
|
|
|
2016
|
|
|
2015
|
|
|
研究與開發(1)
|
$
|
2,234
|
|
|
$
|
1,795
|
|
|
$
|
1,453
|
|
|
一般和行政(2)
|
|
2,145
|
|
|
|
4,944
|
|
|
|
2,088
|
|
|
員工股票薪酬總額
|
$ |
4,379
|
|
|
$
|
6,739
|
|
|
$
|
3,541
|
|
|
(1) |
包括在2017的研究和開發費用大約是944,000美元的非現金股票的補償與取消股票期權。
|
|
(2) |
包括在2017和2016的一般和行政費用約44萬美元和150萬美元的非現金股票為基礎的補償與取消股票期權。
|
每股普通股股東的基本淨虧損是通過將普通股股東(分子)可獲得的收入除以當期流通的普通股的加權平均數量(分母)來計算的。在此期間發行的股票和在該期間重新獲得的股份按其未發行期間的份額加權。每股攤薄收益或每股收益的計算與基本每股收益的計算相似,但分母增加,以包括如果發行稀釋的潛在普通股會發行的額外普通股數。此外,在計算可轉換證券的稀釋效應時,分子被調整以添加任何可轉換優先股紅利。稀釋每股收益與基本每股收益是相同的,因為它們的效果是反稀釋的,所以一般的等值股被排除在計算範圍之外。
下表彙總了公司對每股淨虧損的計算(除股票和每股金額外,以千計):
| |
|
截至12月31日的年度,
|
|
| |
|
2017
|
|
|
2016
|
|
|
2015
|
|
|
每股淨虧損
|
|
|
|
|
|
|
|
|
|
|
分子
|
|
|
|
|
|
|
|
|
|
|
淨損失
|
|
$
|
(26,874
|
)
|
|
$
|
(55,523
|
)
|
|
$
|
(35,220
|
)
|
|
可歸屬優先股的當作股息
|
|
|
(2,503
|
)
|
|
|
(10,914
|
)
|
|
|
—
|
|
|
適用於普通股股東的淨虧損
|
|
$
|
(29,377
|
)
|
|
$
|
(66,437
|
)
|
|
$
|
(35,220
|
)
|
|
分母
|
|
|
|
|
|
|
|
|
|
|
|
|
|
加權平均普通股
|
|
|
10,278,391
|
|
|
|
5,163,784
|
|
|
|
4,453,905
|
|
|
每股基本和稀釋淨虧損
|
|
$
|
(2.86
|
)
|
|
$
|
(12.87
|
)
|
|
$
|
(7.91
|
)
|
在計算稀釋後的每股淨損失時,排除了下列未償還的潛在稀釋證券,因為將其包括在內會起到反稀釋作用:
| |
|
截至12月31日的年度,
|
|
| |
|
2017
|
|
|
2016
|
|
|
2015
|
|
|
購買普通股的期權總額
|
|
|
1,066,121
|
|
|
|
749,517
|
|
|
|
532,014
|
|
|
購買普通股的認股權證總額
|
|
|
10,940,206
|
|
|
|
274,801
|
|
|
|
5,022
|
|
|
系列X可轉換優先股
|
|
|
27,296
|
|
|
|
572,083
|
|
|
|
—
|
|
|
受限制股票單位共計
|
|
|
—
|
|
|
|
—
|
|
|
|
117
|
|
|
共計
|
|
|
12,033,623
|
|
|
|
1,326,621
|
|
|
|
537,153
|
|
該公司維持一個明確的貢獻401(K)計劃,或401(K)計劃。僱員的供款是自願的,由個人決定,受聯邦税務條例允許的最高數額的限制。在2011之前,公司沒有為401(K)計劃繳納任何款項,在2012年12月,公司修改了401(K)計劃,規定由公司自行決定非選擇性的僱主供款。在截至#date0#12月31日止的年度內,僱員的401(K)户口並無任何非選任僱主供款,在截至12月31日、2016及2015的年度內,公司在僱員的401(K)户口內,分別繳付了約264,000元及284,000元的非選任僱主供款。
該公司在截至12月31日、2017、2016和2015的年度扣除所得税前的損失分別為2 940萬美元、6 640萬美元和3 520萬美元。
本公司自成立以來,已錄得淨營運虧損。公司在所附的合併財務報表中沒有反映這種淨營業損失結轉帶來的任何好處,並已對其遞延税金資產確定了全額估價備抵額。
截至12月31日、2017、2016和2015年度的所得税(福利)準備金構成部分如下(千):
|
|
|
十二月三十一日,
|
|
|
|
|
2017
|
|
|
2016
|
|
|
2015
|
|
|
目前:
|
|
|
|
|
|
|
|
|
|
|
聯邦制
|
|
$
|
—
|
|
|
$
|
—
|
|
|
$
|
—
|
|
|
國家
|
|
|
1
|
|
|
|
1
|
|
|
|
1
|
|
|
外國
|
|
|
—
|
|
|
|
—
|
|
|
|
—
|
|
|
總電流
|
|
|
1
|
|
|
|
1
|
|
|
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
推遲:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
聯邦制
|
|
|
27,228
|
|
|
|
(20,942
|
)
|
|
|
(11,080
|
)
|
|
國家
|
|
|
1,703
|
|
|
|
8,936
|
|
|
|
(3,250
|
)
|
|
外國
|
|
|
—
|
|
|
|
—
|
|
|
|
—
|
|
|
遞延共計
|
|
|
28,931
|
|
|
|
(12,006
|
)
|
|
|
(14,330
|
)
|
|
估價津貼
|
|
|
(28,931
|
)
|
|
|
12,006
|
|
|
|
14,330
|
|
|
所得税準備金總額
|
|
$
|
—
|
|
|
$
|
—
|
|
|
$
|
—
|
|
遞延所得税反映了以下因素對税收的淨影響:(A)用於財務報告目的的資產和負債的賬面金額與用於所得税目的的數額之間的臨時差額;(B)業務損失和税收抵免結轉額。
截至12月31日、2017和2016年度,公司遞延税資產的重要組成部分如下(千):
|
|
|
十二月三十一日,
|
|
|
|
|
2017
|
|
|
2016
|
|
|
遞延税款資產:
|
|
|
|
|
|
|
|
淨營運虧損結轉
|
|
$
|
31,086
|
|
|
$
|
44,909
|
|
|
税收抵免
|
|
|
4,394
|
|
|
|
4,084
|
|
|
無形資產
|
|
|
745
|
|
|
|
1,470
|
|
|
資本化研發
|
|
|
26,661
|
|
|
|
40,297
|
|
|
其他
|
|
|
729
|
|
|
|
1,677
|
|
|
遞延税款資產共計
|
|
|
63,615
|
|
|
|
92,437
|
|
|
遞延税款負債
|
|
|
—
|
|
|
|
—
|
|
|
估價津貼
|
|
|
(63,615
|
)
|
|
|
(92,437
|
)
|
|
遞延税金淨額
|
|
$
|
—
|
|
|
$
|
—
|
|
公司持續經營所得的實際税率(虧損)與截至2017、2016和2015的法定税率之間的調節如下:
|
|
|
2017
|
|
|
2016
|
|
|
2015
|
|
|
法定費率
|
|
|
34
|
%
|
|
|
34
|
%
|
|
|
34
|
%
|
|
國家税
|
|
|
(4
|
)%
|
|
|
(9
|
)%
|
|
|
6
|
%
|
|
税收抵免
|
|
|
3
|
%
|
|
|
1
|
%
|
|
|
2
|
%
|
|
當作股息及認股權證負債重估
|
|
|
8
|
%
|
|
|
(4
|
)%
|
|
|
—
|
%
|
|
股票補償
|
|
|
(7
|
)%
|
|
|
(4
|
)%
|
|
|
(1
|
)%
|
|
估價津貼
|
|
|
98
|
%
|
|
|
(18
|
)%
|
|
|
(41
|
)%
|
|
382項限制導致税收屬性失效
|
|
|
(21
|
)%
|
|
|
—
|
%
|
|
|
—
|
%
|
|
因聯邦法定利率變動而重新計量
|
|
|
(111
|
)%
|
|
|
0
|
%
|
|
|
0
|
%
|
|
有效税率
|
|
|
0
|
%
|
|
|
0
|
%
|
|
|
0
|
%
|
On December 22, 2017, new U.S. income tax reform measures known as the Tax Cuts & Jobs Act (TCJA) were enacted. As a result of the TCJA, the federal income tax rate for all corporations was permanently changed to 21% from 34%. Consequently, the Company’s deferred tax assets are required to be measured using the new enacted tax rate. As a result of the remeasurement, 該公司的遞延税項資產減少了3,270萬元,而遞延税項資產的減少則被估值免税額相等的減少所抵銷,因此對所得税開支並無影響。
淨營業虧損、臨時差額和貸項結轉帶來的税收利益作為一種資產入賬,前提是管理層認為實現的可能性“大於不可能”。未來税收優惠的實現取決於公司能否在結轉期內產生足夠的應税收入。由於公司經營虧損的歷史,管理層認為上述未來税收優惠所產生的遞延税資產目前不太可能實現,因此提供了全額估價津貼。估價津貼淨額在2017減少2 890萬美元,2016增加1 200萬美元,2015增加1 430萬美元。
截至2017年度12月31日,營業淨虧損和納税申報額抵免結轉如下(千):
| |
|
金額
|
|
有效期
|
|
淨經營損失-聯邦
|
|
$
|
126,090
|
|
從2024開始
|
|
淨營業損失-狀態
|
|
$
|
65,975
|
|
從2028開始
|
|
退税抵免-聯邦
|
|
$
|
2,028
|
|
從2032開始
|
|
退税抵免-州
|
|
$
|
2,995
|
|
不過期
|
國內NOL和税收抵免遠期的使用可能受到很大的年度限制,因為可能已經發生或將來可能發生的所有權變化限制,如“國內收入法典”第382節以及類似的州規定所要求的那樣。一般而言,代碼所定義的“所有權變動”是指在三年內的一項交易或一系列交易,導致某些股東或公共集團對公司的未發行股票進行50%以上的所有權變動。任何限制都可能導致全部或部分NOL或税收抵免結轉在使用前到期。公司在2012和2015年度發生了382項所有權變更,因此,公司的淨運營虧損結轉額受到限制。此外,由於聯邦税收的目的,預變更的R&D税收抵免也受到限制。2012和2015條款382項限制導致公司淨營業損失159.9百萬美元和公司研發信貸1 260萬美元的核銷。. As of December 31, 2017, the Company has federal net operating losses of $126.1 million, of which $57.0 million are not subject to limitation and the remaining $69.1 million are subject to annual limitations due to the aforementioned ownership change in 2012 and 2015. The state R&D credits are not subject to limitation as they are carried forward indefinitely. Furthermore, on January 9, 2018, the Company 發生了另一項382條款的所有權變更,因此,公司的淨運營虧損結轉將在未來進一步受到限制。由於所有權的改變,截至12月31日的聯邦和州淨營運虧損結轉額將分別降至750萬美元和640萬美元。此外,所有聯邦研發信貸將於2007年1月9日被註銷。2017年月日之後,聯邦和州的淨運營虧損將分別降至750萬美元和640萬美元。
截至2017年月31,該公司有170萬美元的未獲確認的税收福利,所有這些目前都不會影響公司的實際税率,如果該公司的遞延税收資產被估價免税額完全抵消,公司的實際税率就不會受到影響。由於2018年月討論的2018節的限制,公司預計未確認的税收利益餘額不會有任何重大變化。未確認的税收優惠的調節如下(千):
|
|
|
金額
|
|
|
截至2014年月31的結餘
|
|
|
999
|
|
|
根據與上一年有關的税額增加的税額
|
|
|
—
|
|
|
根據與本年度有關的税種增加的税額
|
|
|
269
|
|
|
截至2015年月31的結餘
|
|
$
|
1,268
|
|
|
根據與上一年有關的税額增加的税額
|
|
|
(27
|
)
|
|
根據與本年度有關的税種增加的税額
|
|
|
420
|
|
|
截至2016年月31的結餘
|
|
$
|
1,661
|
|
|
根據與上一年有關的税額扣減
|
|
|
(378
|
)
|
|
根據與本年度有關的税種增加的税額
|
|
|
392
|
|
|
截至2017年月31的結餘
|
|
$
|
1,675
|
|
在截至#date0#12月31日的一年中,與前幾年的狀況有關的未確認的免税額減少40萬美元,原因是上文第382節所述的限制。
如果適用的話,公司將對所得税費用中的不確定税額的利息和罰款進行分類。截至2017年12月31日,未獲確認的税務優惠並無利息開支或罰款。2004至2017課税年度仍可接受公司所受的一個或多個主要課税地區的審查。
該公司預計,未確認的税收優惠總額將在2018年底前發生重大變化。
On January 5, 2018, the Company obtained stockholders’ approval to complete the Second Closing of a private placement of securities transacted in October 2017. Pursuant to the Second Closing, the Company issued 7,625,741 shares of the Company’s common stock, par value $0.001, at $1.25 per share and 2,067,522 shares of the Company’s non-voting Class Y Convertible Preferred Stock, par value $0.001 (the “(第Y級優先股),按每股1.25元計算,在某些條件下可轉換為公司普通股的2,067,522股。每股普通股或Y級優先股均獲發認股權證,可立即行使其認股權證,以每股1.25元的行使價格購買公司普通股的1.0股。第二次結算時發出的認股權證,自發行之日起,為期五年。第二次關閉於2018年月9日完成,公司扣除了安置代理費用和專業費用後,淨收益約為1,110萬美元。第二次關閉導致了第382條所有權變更。請參閲附註13所得税,以討論對公司f的影響。Ederal和州淨營運虧損結轉和聯邦研發信貸.
On November 16, 2017, the Company’s board of directors adopted the 2018 Stock Option and Incentive Plan (the “2018 Plan”), which was approved by the Company’s stockholders at a Special Stockholders meeting on January 5, 2018. Upon adoption of the 2018 Plan, the Company reserved 6,000,000 shares of its common stock for the issuance of awards, plus all shares remaining available for grant under the Company’s 2013 Plan, plus any additional shares returned under all previous stock option plans, the 2013 Plan as a result of the cancellation, forfeiture or other termination (other than by exercise) of awards issued pursuant to those plans, subject in all cases to adjustment including reorganization, recapitalization, reclassification, stock dividend, stock split, reverse stock split or other similar change in the Company’s 股本。在2018計劃預留髮行的普通股中,在任何日曆年內,以激勵期權、非合資格期權或股票增值權的形式,向任何個別參與者發行的股份不得超過2,000,000股;根據2018計劃獲授權發行的股份總數,不得超過10%,並以不受限制的股票獎勵形式批出;及以激勵股票期權的形式發行的股票不得超過600萬股。根據2018計劃可發行的股票可經授權,但未發行的股票或公司重新獲得的股份。
2018年月5日,公司股東批准了對2010 ESPP的修訂(I)將根據該等股份獲批准發行的股份的最高數目增加500,000股;及(Ii)將任何參與者就任何購買期可購買的股份的最高數目修訂為:(A)將該參與人在購買期最後一天的累積薪金扣除額除以每股的買入價格所釐定的股份數目最少。股票,(B)12,500股或(C)管理人確定的較少的最高股份數.
在2017年月31之後,通過提交本報告,公司根據認股權證發行了1,308,180股普通股,並根據股權購買協議向lpc出售了666,000股普通股,從而獲得了310萬美元的淨收益。
簽名
根據1934“證券交易法”第13或15(D)節的要求,登記人已正式安排由下列簽名人代表其簽署本報告,並正式授權。
| |
安瑟拉制藥公司
|
|
| |
|
|
|
| |
|
|
|
| |
通過:
|
/J.克雷格·湯普森
|
|
| |
|
克雷格·湯普森
|
|
| |
|
|
|
| |
|
首席執行官
|
|
| |
|
(特等行政主任)
|
|
日期:2018.3.5
授權書
We, the undersigned officers and directors of Anthera Pharmaceuticals, Inc., hereby severally constitute and appoint Craig Thompson and May Liu, and each of them singly (with full power to each of them to act alone), our true and lawful attorneys-in-fact and agents, with full power of substitution and resubstitution in each of them for him or her and in his or her name, place and stead, and in any and all capacities, to sign for us and in our names in the capacities indicated below any and all amendments to this report, and to file the same, with all exhibits thereto and other documents in connection therewith, with the Securities and Exchange Commission, granting unto said attorneys-in-fact and agents, and each of them, full power and authority to do and perform each and every act and thing requisite or necessary 在該處所內及附近進行,並盡他或她本人可能或可做到的全部意圖及目的,在此批准及確認所有上述的事實代理人、代理人、代理人或代理人,或其替代者,可憑藉本協議合法作出或安排作出的一切。
根據1934“證券交易法”的要求,以下人員代表登記人,並在指定的日期簽署了本報告。
|
簽名
|
標題
|
日期
|
| |
|
|
|
/J.克雷格·湯普森
|
首席執行幹事兼主任(特等執行幹事)
|
2018年3月5日
|
|
克雷格·湯普森
|
|
|
| |
|
|
|
S/S/劉梅
|
高級副總裁,財務及行政(校長)
會計幹事)
|
2018年3月5日
|
|
劉梅
|
|
|
| |
|
|
|
/s/Paul F.Truex
|
董事會主席
|
2018年3月5日
|
|
保羅·特魯克斯
|
|
|
| |
|
|
|
S/Christopher S.Henney
|
導演
|
2018年3月5日
|
|
克里斯托弗·亨尼
|
|
|
| |
|
|
|
/S/Brian R.Mueller
|
導演
|
2018年3月5日
|
|
布賴恩·穆勒
|
|
|
| |
|
|
|
S/David E.Thompson
|
導演
|
2018年3月5日
|
|
戴維·湯普森
|
|
|
| |
|
|
|
/S/Brent V.Furse
|
導演
|
2018年3月5日
|
|
布倫特·弗爾斯
|
|
|
| |
|
|
|
/S/Philip T.Sager
|
導演
|
2018年3月5日
|
|
菲利普·薩格
|
|
|
展覽索引
|
數
|
|
描述
|
|
|
|
|
|
3.1
|
|
第五次經修訂及重訂的法團證書(1)
|
|
|
|
|
|
3.2
|
|
2012(2)年月12日提交的第五次修訂及重訂法團證書修訂證明書
|
|
|
|
|
|
3.3
|
|
2013年月12及2013(3)年月日起生效的第五次經修訂及重訂的法團證書修訂證明書
|
|
|
|
|
|
3.4
|
|
2017(4)年月28提交的第五次修訂及恢復註冊的法團證書修訂證明書
|
|
|
|
|
|
3.5
|
|
2016(5)月15日提交的“第X系列可轉換優先股的指定權、權利和限制證書”經修正和恢復
|
|
|
|
|
|
3.6
|
|
2016(6).9月12日提交的系列X-1可轉換優先股的指定優惠、權利和限制證書的形式
|
|
|
|
|
|
3.7
|
|
經修訂的附例,並於5月21日修訂,2015(7)
|
|
|
|
|
|
3.8
|
|
Y類可轉換優先股的指定優惠、權利和限制證書,日期:2017(8)
|
|
|
|
|
|
4.1
|
|
證明普通股股份的證明書樣本(9)
|
|
|
|
|
|
4.2
|
|
樣本系列X可轉換優先股證(10)
|
|
|
|
|
|
4.3
|
|
2010(11)年9月20日公司及其購買者根據該證券購買協議出售的保證書格式
|
|
|
|
|
|
4.4
|
|
截至2011(12)年3月25日的授權書格式
|
|
|
|
|
|
4.5
|
|
2016(13)年9月6日公司及其購買者根據該認購協議出售的授權書的格式
|
|
|
|
|
|
4.6
|
|
2017(14)年10月23日公司及其購買者根據該證券購買協議出售的保證書格式
|
|
|
|
|
|
4.7
|
|
Y類可轉換優先股證樣本(15)
|
|
|
|
|
|
#10.1
|
|
2005股權激勵計劃及其協議(16)
|
|
|
|
|
|
#10.2
|
|
修訂及重整2010份股票期權及激勵計劃(17)
|
|
|
|
|
|
#10.3
|
|
修訂及重整2010股票期權及激勵計劃的修訂證明書(18)
|
|
|
|
|
|
#10.4
|
|
Anthera製藥公司員工不合格股票期權協議的形式。2010股票期權及激勵計劃(19)
|
|
|
|
|
|
#10.5
|
|
Anthera製藥公司非僱員董事非合格股票期權協議的形式。2010股票期權及激勵計劃(19)
|
|
|
|
|
|
#10.6
|
|
Anthera製藥公司的激勵股票期權協議的形式。2010股票期權及激勵計劃(19)
|
|
|
|
|
|
#10.7
|
|
Anthera製藥有限公司下的限制性股票獎勵協議的形式。2010股票期權及激勵計劃(19)
|
|
|
|
|
|
#10.8
|
|
根據Anthera製藥公司簽訂的限制性股票單位獎勵協議。2010股票期權及激勵計劃(20)
|
|
數
|
|
描述
|
|
|
|
|
|
#10.9
|
|
2010員工股票購買計劃(21)
|
|
|
|
|
|
#10.10
|
|
第1號修訂至2010僱員股票購買計劃(22)
|
|
|
|
|
|
#10.11
|
|
修訂第2號至2010僱員股票購買計劃(23)
|
|
|
|
|
|
#10.12
|
|
修訂第3號至2010僱員股票購買計劃(24)
|
|
|
|
|
|
#10.13
|
|
2013股票期權及激勵計劃(25)
|
|
|
|
|
|
#10.14
|
|
2013股票期權激勵計劃下公司職工非合格股票期權協議的格式(26)
|
|
|
|
|
|
#10.15
|
|
2013股票期權與激勵計劃下非職工董事不合格股票期權協議格式(26)
|
|
|
|
|
|
#10.16
|
|
2013股票期權激勵方案下的激勵股票期權協議形式(26)
|
|
|
|
|
|
#10.17
|
|
2013股票期權及激勵計劃下的限制性股票獎勵協議形式(26)
|
|
|
|
|
|
#10.18
|
|
2013股票期權及激勵計劃下的限制股獎勵協議形式(26)
|
|
|
|
|
|
#10.19
|
|
經修訂及恢復補償協議的格式(27)
|
|
|
|
|
|
+10.20
|
|
安進公司與該公司之間的許可證協議,截止日期為2007(28)年12月18日
|
|
|
|
|
|
10.21
|
|
安進公司與該公司之間的許可證協議第1號修正案,日期為2009(29)年10月16日
|
|
|
|
|
|
+10.22
|
|
“安進公司與該公司許可證協議”第2號修正案,日期為2014(30)年11月26日
|
|
|
|
|
|
10.23
|
|
公司與MEPTMountEden有限責任公司之間的租約,日期為2011(31)5月4日
|
|
|
|
|
|
10.24
|
|
公司與美泰山伊甸園有限責任公司之間的契約修訂,日期為2013(32)年11月13日
|
|
|
|
|
|
+10.25
|
|
公司與禮來公司之間的許可證協議,日期為2014,2014(33)
|
|
|
|
|
|
#10.26
|
|
公司與保羅·特魯克斯公司之間的遞延薪酬選舉表格,自2015(34)年月28起生效
|
|
|
|
|
|
#10.27
|
|
公司與保羅·特魯克斯先生簽訂的僱傭協議,日期為2016(35)年1月25日
|
|
|
|
|
|
#10.28
|
|
公司和JamesPenington博士之間的聘書,日期為2016,2016(36)
|
|
|
|
|
|
10.29
|
|
該公司與Anthera製藥公司和與生物技術價值基金、L.P.和RockSprings基本建設總基金LP有關聯的購買者之間的認購協議,日期為2016(37)
|
|
|
|
|
|
10.30
|
|
2017(38)年3月14日該公司與H.C.Wainwright&Co.有限責任公司之間的市場發行銷售協議修正案
|
|
|
|
|
|
10.31
|
|
公司與林肯公園資本基金的購買協議,日期:2017(39)
|
|
|
|
|
|
10.32
|
|
公司與新RT公司簽訂的轉租協議,日期:2017(40)
|
|
|
|
|
|
10.33
|
|
2017(41)年10月23日公司與買方簽訂的證券購買協議(日期:2017(41))
|
|
|
|
|
|
10.34
|
|
公司及其購買者之間的註冊權利協議,日期為2017(42)年10月23日
|
|
|
|
|
|
#10.35
|
|
該公司與克雷格·湯普森於2018年月5日修訂並恢復僱傭協議
|
|
|
|
|
|
#10.36
|
|
2018年月5日公司與劉五月日修訂並恢復僱傭協議
|
|
|
|
|
|
#10.37
|
|
公司與M.D.WilliamShanahan簽訂的僱傭協議,日期為2018,01月5日。
|
|
|
|
|
|
#10.38
|
|
公司與雷尼·馬丁博士簽訂的僱傭協議,日期:2018。
|
|
|
|
|
|
#10.39
|
|
公司與帕特里克墨菲簽訂的僱傭協議,日期為2018.
|
|
|
|
|
|
#10.40
|
|
2018股票期權及激勵計劃(43)
|
|
|
|
|
|
#10.41
|
|
2018年月28日終止普萊桑頓辦公租約
|
|
|
|
|
|
14.1
|
|
道德守則(44)
|
|
|
|
|
|
21.1
|
|
Anthera製藥公司的子公司(45)
|
|
數
|
|
描述
|
|
|
|
|
|
23.1
|
|
英國BDO美國有限責任公司、獨立註冊公共會計師事務所的同意
|
|
|
|
|
|
24.1
|
|
委託書(包括在此簽名頁)
|
|
|
|
|
|
31.1
|
|
根據經修訂的“1934證券交易法”規則13a-14(A)或規則15d-14(A)認證首席執行官
|
|
|
|
|
|
31.2
|
|
根據經修訂的“1934證券交易法”規則13a-14(A)或規則15d-14(A)認證首席財務官
|
|
|
|
|
|
32.1
|
|
根據經修正的“1934證券交易法”第13a-14(B)條和根據2002“薩班斯-奧克斯利法”第九0六條通過的“美國法典”第18條第1350節認證首席執行官
|
|
|
|
|
|
32.2
|
|
根據經修正的“1934證券交易法”第13a-14(B)條和根據2002“薩班斯-奧克斯利法”第906條通過的“美國法典”第18條第1350款認證首席財務官
|
| + |
根據保密處理的要求,本展覽的某些規定已被省略。
|
| (1) |
在表格S-1/A(檔案編號333-#number0#)上作為表3.6提交給註冊人的登記聲明,於2010年2月3日提交證交會,並以參考的方式在此合併。
|
| (2) |
作為同一編號的證物提交給註冊人的10-K表格的年度報告,於2013年月26日提交給證交會,並以參考的方式在此合併。
|
| (3) |
作為表3.1提交給註冊人當前的表格8-K報告,於2013年月16日提交給SEC,並以參考的方式納入本報告。
|
| (4) |
作為表3.1提交給註冊人當前的表格8-K報告,於2017年月28提交給SEC,並以參考的方式納入本報告。
|
| (5) |
作為表3.1的註冊人的表格8-K在9月15日向SEC提交,2016,並在此以參考的方式納入其中。
|
| (6) |
作為表3.2提交給註冊人當前的表格8-K報告,於2016年月12提交給SEC,並以參考的方式納入本報告。
|
| (7) |
2015年月10向證交會提交的10-Q表格的註冊人季度報告的表3.4,並以參考方式納入本報告。
|
| (8) |
作為表3.1的註冊人的表格8-K提交給證交會,2017,000,000,000,000,000,000,000,000,000,000,000。
|
| (9) |
將同一編號的證物提交給註冊人對錶格S-1(檔案編號333-#number0#)的註冊聲明的第3號修正案,於2010年月29日提交證交會,並以參考的方式在此合併。
|
| (10) |
作為表4.2提交給註冊人當前的表格8-K,於2016年月12日提交證交會,並以參考的方式納入本報告。
|
| (11) |
作為表4.1提交給註冊人目前關於表格8-K的報告,於2010年月22提交證交會,並以參考的方式納入本報告。
|
| (12) |
作為表10.2提交給註冊人目前關於表格8-K的報告,於2011年月29日提交給證交會,並以參考的方式納入其中。
|
| (13) |
作為表4.1提交給註冊人目前的8-K表格報告,於2016年月6日提交證交會,並以參考書形式納入本報告。
|
| (14) |
作為表10.3提交給註冊人的8-K表格,於2017年月25提交給SEC,並以參考的方式在此註冊。
|
| (15) |
作為表3.1提交給註冊人當前的表格8-K,於2017年月25提交給SEC,並以參考的方式在此合併。.
|
| (16) |
在表格S-1(檔案編號333-#number0#)上,作為同一編號的證物提交給註冊人,於2009年月15日提交證交會,並以參考的方式在此合併。
|
| (17) |
作為附錄A的註冊人的最終代理聲明,在附表14A,提交給美國證交會於6月8日,2010,並在此以參考文件。
|
| (18) |
作為表10.2提交給註冊人的第10-Q表季度報告,於2011年月12向SEC提交,並以參考的方式納入本報告。
|
| (19) |
註冊人在表格S-1(檔案編號333-#number0#)上的註冊聲明的第4號修正案(見表10.2),於2010年月3日提交證交會,並以參考的方式在此註冊。
|
| (20) |
作為表10.1提交註冊人的季度報告的表10-Q,提交給證交會,於2010,000,000,000,000,000,000,000,000,000,000,000,000,000
|
| (21) |
作為附錄B的註冊人的最終代理聲明,在附表14A,提交給美國證交會於6月8日,2010,並在此以參考文件。
|
| (22) |
作為表10.42提交給註冊人的10-K表格的年度報告,於2011年月7日提交證交會,並以參考的方式納入本報告。
|
| (23) |
作為表10.34提交給註冊人的10-K表格的年度報告,於2013年月26日提交證交會,並以參考書形式納入其中。
|
| (24) |
作為附件F的註冊人的表格14A在12月7日,2017,000提交美國證交會,並在此以參考文件。
|
| (25) |
在附表14A中作為附件B提交給註冊人的最終委託書,於2013年月5向SEC提交,並以參考的方式在此註冊。
|
| (26) |
作為同一編號的證物提交給註冊人的10-K表格的年度報告,於2014年月28提交給證交會,並以參考的方式在此合併。
|
| (27) |
在表格S-1(檔案編號333-#number0#)上作為表10.3提交給註冊人的註冊聲明,於2009年月15日提交給SEC,並以參考的方式在此合併。
|
| (28) |
作為表10.10提交給登記人在表格S-1(檔案編號333-#number0#)上的登記聲明,於2009年月15日提交證交會,並以參考的方式在此合併。
|
| (29) |
註冊人表格S-1(檔案編號333-#number0#)的註冊聲明第1號修正案(表10.18),於2009年月19提交證交會,並在此引用。
|
| (30) |
作為表10.23提交給註冊人的10-K表格的年度報告,於2015年月16日提交證交會,並以參考書形式納入本報告。
|
| (31) |
作為表10.4提交註冊人的季度報告表10-Q,提交給證交會,於2011,000,000,000,000,000,000,000,000,000,000,000,000,000,000
|
| (32) |
作為表10.27提交給註冊人的10-K表格的年度報告,於2014年月28提交證交會,並以參考書形式納入本報告。
|
| (33) |
作為表10.1提交註冊人的季度報告的10-Q/A,提交給美國證交會,於12月12日,2014,000,並在此以參考文件。
|
| (34) |
作為表10.33提交給註冊人的10-K表格的年度報告,於2016年月14日提交證交會,並以參考的方式納入本報告。
|
| (35) |
作為表10.35提交給註冊人的10-K表格的年度報告,於2016年月14日提交證交會,並以參考的方式納入本報告。
|
| (36) |
作為表10.1提交註冊人的季度報告表10-Q,提交給證交會,於2016,000,000,000,000,000,000,000,000,000,000,000,000,000,
|
| (37) |
作為表10.1提交給註冊人的表格8-K於2016年月12日提交給美國證交會,並以參考的方式在此註冊。
|
| (38) |
作為表10.1提交給註冊人的表格8-K於2017年月16日提交給美國證交會,並以參考的方式在此註冊。
|
| (39) |
作為表1.1的註冊人的表格8-K提交給證交會,於2017,000,000,000,000,000,000,000,000,000,000,000,000
|
| (40) |
作為表10.2提交給註冊人的10-Q表格,於2017年月9日提交給美國證交會,並以參考的方式在此註冊。
|
| (41) |
作為表10.1提交給註冊人的表格8-K於2017年月25提交給美國證交會,並以參考的方式在此註冊。
|
| (42) |
作為表10.2的註冊人的表格8-K於2017年月25提交給美國證交會,並以參考的方式在此註冊。
|
| (43) |
作為附件E的註冊人的表格14A提交美國證交會於12月4日,2017,並在此以參考文件。
|
| (44) |
作為同一編號的證物提交給註冊人的10-K表格的年度報告,於2011年3月7日提交證交會,並以參考的方式在此合併。
|
|
(45)
|
作為同一編號的證物提交給註冊人的10-K表格的年度報告,於2012年月14日提交給證交會,並以參考的方式在此合併。
|
項目16.表格10-K摘要
沒有。