bhvn-2024063000019359792024Q2偽--12-31エクセルリ:シェアISO 4217: 米ドルISO 4217: 米ドルエクセルリ:シェアbhvn: 投資エクセルリ:ピュアbhvn:プロドラッグbhvn:クレームしてくださいbhvn: 期間00019359792024-01-012024-06-3000019359792024-08-0600019359792024-06-3000019359792023-12-3100019359792024-04-012024-06-3000019359792023-04-012023-06-3000019359792023-01-012023-06-3000019359792022-12-3100019359792023-06-300001935979米国会計基準:米国財務省証券会員2024-06-300001935979US-GAAP: 国内企業債務証券会員2023-12-310001935979US-GAAP: 外国企業債務証券会員2023-12-310001935979米国会計基準:米国財務省証券会員2023-12-310001935979米国会計基準:現金および現金同等物メンバー2024-06-300001935979米国会計基準:現金および現金同等物メンバー2023-12-310001935979BHVN:市場性のある証券現在のメンバー2024-06-300001935979BHVN:市場性のある証券現在のメンバー2023-12-310001935979米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:公正価値測定経常委員US-GAAP: マネー・マーケット・ファンド・メンバー2024-06-300001935979米国会計基準:公正価値インプットレベル2メンバー米国会計基準:公正価値測定経常委員US-GAAP: マネー・マーケット・ファンド・メンバー2024-06-300001935979米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:公正価値測定経常委員US-GAAP: マネー・マーケット・ファンド・メンバー2024-06-300001935979米国会計基準:公正価値測定経常委員US-GAAP: マネー・マーケット・ファンド・メンバー2024-06-300001935979米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:公正価値測定経常委員米国会計基準:米国財務省証券会員2024-06-300001935979米国会計基準:公正価値インプットレベル2メンバー米国会計基準:公正価値測定経常委員米国会計基準:米国財務省証券会員2024-06-300001935979米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:公正価値測定経常委員米国会計基準:米国財務省証券会員2024-06-300001935979米国会計基準:公正価値測定経常委員米国会計基準:米国財務省証券会員2024-06-300001935979米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:公正価値測定経常委員2024-06-300001935979米国会計基準:公正価値インプットレベル2メンバー米国会計基準:公正価値測定経常委員2024-06-300001935979米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:公正価値測定経常委員2024-06-300001935979米国会計基準:公正価値測定経常委員2024-06-300001935979米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:プットオプションメンバー米国会計基準:公正価値測定経常委員2024-06-300001935979米国会計基準:公正価値インプットレベル2メンバー米国会計基準:プットオプションメンバー米国会計基準:公正価値測定経常委員2024-06-300001935979米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:プットオプションメンバー米国会計基準:公正価値測定経常委員2024-06-300001935979米国会計基準:公正価値測定経常委員米国会計基準:プットオプションメンバー2024-06-300001935979米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:公正価値測定経常委員US-GAAP: マネー・マーケット・ファンド・メンバー2023-12-310001935979米国会計基準:公正価値インプットレベル2メンバー米国会計基準:公正価値測定経常委員US-GAAP: マネー・マーケット・ファンド・メンバー2023-12-310001935979米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:公正価値測定経常委員US-GAAP: マネー・マーケット・ファンド・メンバー2023-12-310001935979米国会計基準:公正価値測定経常委員US-GAAP: マネー・マーケット・ファンド・メンバー2023-12-310001935979米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:公正価値測定経常委員米国会計基準:米国財務省証券会員2023-12-310001935979米国会計基準:公正価値インプットレベル2メンバー米国会計基準:公正価値測定経常委員米国会計基準:米国財務省証券会員2023-12-310001935979米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:公正価値測定経常委員米国会計基準:米国財務省証券会員2023-12-310001935979米国会計基準:公正価値測定経常委員米国会計基準:米国財務省証券会員2023-12-310001935979米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:公正価値測定経常委員US-GAAP: 国内企業債務証券会員2023-12-310001935979米国会計基準:公正価値インプットレベル2メンバー米国会計基準:公正価値測定経常委員US-GAAP: 国内企業債務証券会員2023-12-310001935979米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:公正価値測定経常委員US-GAAP: 国内企業債務証券会員2023-12-310001935979米国会計基準:公正価値測定経常委員US-GAAP: 国内企業債務証券会員2023-12-310001935979米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:公正価値測定経常委員US-GAAP: 外国企業債務証券会員2023-12-310001935979米国会計基準:公正価値インプットレベル2メンバー米国会計基準:公正価値測定経常委員US-GAAP: 外国企業債務証券会員2023-12-310001935979米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:公正価値測定経常委員US-GAAP: 外国企業債務証券会員2023-12-310001935979米国会計基準:公正価値測定経常委員US-GAAP: 外国企業債務証券会員2023-12-310001935979米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:公正価値測定経常委員2023-12-310001935979米国会計基準:公正価値インプットレベル2メンバー米国会計基準:公正価値測定経常委員2023-12-310001935979米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:公正価値測定経常委員2023-12-310001935979米国会計基準:公正価値測定経常委員2023-12-310001935979BHVN:先渡契約責任2025年追加考慮事項メンバー2024-01-012024-06-300001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:先渡契約およびデリバティブ負債メンバー2024-05-010001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:先渡契約およびデリバティブ負債メンバー2024-05-022024-06-300001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:先渡契約およびデリバティブ負債メンバー2024-06-300001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:先渡契約およびデリバティブ負債メンバー米国会計基準:測定インプット予想タームメンバー2024-06-300001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:先渡契約およびデリバティブ負債メンバー米国会計基準:測定インプット予想タームメンバー2024-05-010001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:先渡契約およびデリバティブ負債メンバー米国会計基準:測定インプット価格ボラティリティメンバー2024-06-300001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:先渡契約およびデリバティブ負債メンバー米国会計基準:測定インプット価格ボラティリティメンバー2024-05-010001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:先渡契約およびデリバティブ負債メンバー米国会計基準:測定入力割引率メンバー2024-06-300001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:先渡契約およびデリバティブ負債メンバー米国会計基準:測定入力割引率メンバー2024-05-010001935979BHVN:先渡契約およびデリバティブ負債メンバー2024-01-012024-06-300001935979米国会計基準:土地および建築物関連メンバー2024-06-300001935979米国会計基準:土地および建築物関連メンバー2023-12-310001935979米国会計基準:リースホールド改善メンバー2024-06-300001935979米国会計基準:リースホールド改善メンバー2023-12-310001935979米国会計基準:コンピュータ機器メンバー2024-06-300001935979米国会計基準:コンピュータ機器メンバー2023-12-310001935979米国会計基準:オフィス機器メンバー2024-06-300001935979米国会計基準:オフィス機器メンバー2023-12-310001935979米国会計基準:家具および備品会員2024-06-300001935979米国会計基準:家具および備品会員2023-12-310001935979BHVN:減価償却可能な不動産プラントおよび設備メンバー2024-06-300001935979BHVN:減価償却可能な不動産プラントおよび設備メンバー2023-12-310001935979米国会計基準:建設中メンバー2024-06-300001935979米国会計基準:建設中メンバー2023-12-310001935979米国会計基準:普通株式会員2023-12-310001935979米国会計基準:追加払込資本構成員2023-12-310001935979米国会計基準:利益剰余金メンバー2023-12-310001935979米国会計基準:その他の包括利益の累計メンバー2023-12-310001935979米国会計基準:親会員2023-12-310001935979米国会計基準:利益剰余金メンバー2024-01-012024-03-310001935979米国会計基準:親会員2024-01-012024-03-310001935979米国会計基準:普通株式会員2024-01-012024-03-310001935979米国会計基準:追加払込資本構成員2024-01-012024-03-310001935979米国会計基準:その他の包括利益の累計メンバー2024-01-012024-03-310001935979米国会計基準:普通株式会員2024-03-310001935979米国会計基準:追加払込資本構成員2024-03-310001935979米国会計基準:利益剰余金メンバー2024-03-310001935979米国会計基準:その他の包括利益の累計メンバー2024-03-310001935979米国会計基準:親会員2024-03-310001935979米国会計基準:利益剰余金メンバー2024-04-012024-06-300001935979米国会計基準:親会員2024-04-012024-06-300001935979米国会計基準:普通株式会員2024-04-012024-06-300001935979米国会計基準:追加払込資本構成員2024-04-012024-06-300001935979米国会計基準:その他の包括利益の累計メンバー2024-04-012024-06-300001935979米国会計基準:普通株式会員2024-06-300001935979米国会計基準:追加払込資本構成員2024-06-300001935979米国会計基準:利益剰余金メンバー2024-06-300001935979米国会計基準:その他の包括利益の累計メンバー2024-06-300001935979米国会計基準:親会員2024-06-300001935979米国会計基準:普通株式会員2022-12-310001935979米国会計基準:追加払込資本構成員2022-12-310001935979米国会計基準:利益剰余金メンバー2022-12-310001935979米国会計基準:その他の包括利益の累計メンバー2022-12-310001935979米国会計基準:親会員2022-12-310001935979米国会計基準:利益剰余金メンバー2023-01-012023-03-310001935979米国会計基準:親会員2023-01-012023-03-310001935979米国会計基準:普通株式会員2023-01-012023-03-310001935979米国会計基準:追加払込資本構成員2023-01-012023-03-310001935979米国会計基準:その他の包括利益の累計メンバー2023-01-012023-03-310001935979米国会計基準:普通株式会員2023-03-310001935979米国会計基準:追加払込資本構成員2023-03-310001935979米国会計基準:利益剰余金メンバー2023-03-310001935979米国会計基準:その他の包括利益の累計メンバー2023-03-310001935979米国会計基準:親会員2023-03-310001935979米国会計基準:利益剰余金メンバー2023-04-012023-06-300001935979米国会計基準:親会員2023-04-012023-06-300001935979米国会計基準:普通株式会員2023-04-012023-06-300001935979米国会計基準:追加払込資本構成員2023-04-012023-06-300001935979米国会計基準:その他の包括利益の累計メンバー2023-04-012023-06-300001935979米国会計基準:普通株式会員2023-06-300001935979米国会計基準:追加払込資本構成員2023-06-300001935979米国会計基準:利益剰余金メンバー2023-06-300001935979米国会計基準:その他の包括利益の累計メンバー2023-06-300001935979米国会計基準:親会員2023-06-300001935979BHVN:購入契約KNOPP修正メンバー2024-05-012024-05-310001935979BHVN:購入契約KNOPP修正メンバー2024-05-010001935979米国会計基準:普通株式会員2024-04-222024-04-220001935979米国会計基準:普通株式会員2024-04-220001935979BHVN:ピラミッド・バイオサイエンス株式会社メンバー2024-01-072024-01-070001935979BHVN:ピラミッド・バイオサイエンス株式会社メンバー2024-01-072024-06-300001935979BHVN:ピラミッド・バイオサイエンス株式会社メンバー2024-01-012024-03-310001935979BHVN:ピラミッド・バイオサイエンス株式会社メンバー2024-01-012024-06-300001935979米国会計基準:普通株式会員2023-10-310001935979米国会計基準:普通株式会員BHVN:株式分配契約メンバー2023-10-012024-06-300001935979米国会計基準:普通株式会員米国会計基準:後任イベントメンバーBHVN:株式分配契約メンバー2024-07-012024-08-090001935979米国会計基準:普通株式会員米国会計基準:後任イベントメンバーBHVN:株式分配契約メンバー2023-10-012024-08-090001935979米国会計基準:累積純未実現投資利益損失メンバー2024-03-310001935979米国会計基準:累積純未実現投資利益損失メンバー2023-12-310001935979米国会計基準:累積純未実現投資利益損失メンバー2024-04-012024-06-300001935979米国会計基準:累積純未実現投資利益損失メンバー2024-01-012024-06-300001935979米国会計基準:累積純未実現投資利益損失メンバー2024-06-300001935979米国会計基準:累積翻訳調整メンバー2024-03-310001935979米国会計基準:累積翻訳調整メンバー2023-12-310001935979米国会計基準:累積翻訳調整メンバー2024-04-012024-06-300001935979米国会計基準:累積翻訳調整メンバー2024-01-012024-06-300001935979米国会計基準:累積翻訳調整メンバー2024-06-300001935979米国会計基準:その他の包括利益の累計メンバー2024-01-012024-06-300001935979米国会計基準:累積純未実現投資利益損失メンバー2023-03-310001935979米国会計基準:累積純未実現投資利益損失メンバー2022-12-310001935979米国会計基準:累積純未実現投資利益損失メンバー2023-04-012023-06-300001935979米国会計基準:累積純未実現投資利益損失メンバー2023-01-012023-06-300001935979米国会計基準:累積純未実現投資利益損失メンバー2023-06-300001935979米国会計基準:累積翻訳調整メンバー2023-03-310001935979米国会計基準:累積翻訳調整メンバー2022-12-310001935979米国会計基準:累積翻訳調整メンバー2023-04-012023-06-300001935979米国会計基準:累積翻訳調整メンバー2023-01-012023-06-300001935979米国会計基準:累積翻訳調整メンバー2023-06-300001935979米国会計基準:その他の包括利益の累計メンバー2023-01-012023-06-300001935979米国会計基準:研究開発費メンバー2024-04-012024-06-300001935979米国会計基準:研究開発費メンバー2023-04-012023-06-300001935979米国会計基準:研究開発費メンバー2024-01-012024-06-300001935979米国会計基準:研究開発費メンバー2023-01-012023-06-300001935979米国会計基準:一般管理費メンバー2024-04-012024-06-300001935979米国会計基準:一般管理費メンバー2023-04-012023-06-300001935979米国会計基準:一般管理費メンバー2024-01-012024-06-300001935979米国会計基準:一般管理費メンバー2023-01-012023-06-300001935979米国会計基準:従業員ストックオプションメンバー2024-01-012024-06-300001935979米国会計基準:RSU 加盟国の制限付株式単位2024-06-300001935979米国会計基準:RSU 加盟国の制限付株式単位2024-01-012024-06-300001935979米国会計基準:RSU 加盟国の制限付株式単位2024-04-012024-06-300001935979米国会計基準:RSU 加盟国の制限付株式単位2023-12-310001935979米国会計基準:従業員ストックオプションメンバー2024-01-012024-06-300001935979米国会計基準:従業員ストックオプションメンバー2023-01-012023-06-300001935979米国会計基準:ワラントメンバー2024-01-012024-06-300001935979米国会計基準:ワラントメンバー2023-01-012023-06-300001935979BHVN:制限付株式ユニットとパフォーマンス・シェアユニットのメンバー2024-01-012024-06-300001935979BHVN:制限付株式ユニットとパフォーマンス・シェアユニットのメンバー2023-01-012023-06-300001935979BHVN:イェール大学会員BHVN:イェール大学コラボレーションアレンジメントメンバー2024-06-300001935979BHVN:イェール大学会員BHVN:イェール大学コラボレーションアレンジメントメンバー2019-05-012019-05-310001935979BHVN:イェール大学会員BHVN:イェール大学コラボレーションアレンジメントメンバー2024-01-012024-06-300001935979BHVN:イェール大学会員BHVN:イェール大学コラボレーションアレンジメントメンバー2023-04-012023-06-300001935979BHVN:イェール大学会員BHVN:イェール大学コラボレーションアレンジメントメンバー2024-04-012024-06-300001935979BHVN:イェール大学会員BHVN:イェール大学コラボレーションアレンジメントメンバー2023-01-012023-06-300001935979BHVN:イェール大学会員BHVN:イェールモード協定メンバー2021-01-012021-01-310001935979BHVN:イェール大学会員BHVN:イェールモード協定メンバー2024-06-300001935979BHVN:イェール大学会員BHVN:イェールモード協定メンバー2024-04-012024-06-300001935979BHVN:イェール大学会員BHVN:イェールモード協定メンバー2024-01-012024-06-300001935979BHVN:イェール大学会員BHVN:イェールモード協定メンバー2023-01-012023-06-300001935979BHVN:イェール大学会員BHVN:イェールモード協定メンバー2023-04-012023-06-300001935979BHVN:ALSバイオファーマとフォックスチェースケミカルダイバーシティセンター株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2015-08-012015-08-310001935979BHVN:ALSバイオファーマとフォックスチェースケミカルダイバーシティセンター株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2024-06-300001935979BHVN:ALSバイオファーマとフォックスチェースケミカルダイバーシティセンター株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2023-01-012023-06-300001935979BHVN:ALSバイオファーマとフォックスチェースケミカルダイバーシティセンター株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2024-04-012024-06-300001935979BHVN:ALSバイオファーマとフォックスチェースケミカルダイバーシティセンター株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2024-01-012024-06-300001935979BHVN:ALSバイオファーマとフォックスチェースケミカルダイバーシティセンター株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2023-04-012023-06-300001935979BHVN: BMSメンバーbhvn: タルデフグローブパルファライセンス契約メンバー2024-06-300001935979BHVN: BMSメンバー2023-04-012023-06-300001935979BHVN: BMSメンバー2024-04-012024-06-300001935979BHVN: BMSメンバー2023-01-012023-06-300001935979BHVN: BMSメンバー2024-01-012024-06-300001935979米国会計基準:ライセンス契約メンバーBHVN:ハイライト LLファーマシューティカル株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2023-03-310001935979BHVN:ハイライト LLファーマシューティカル株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2023-10-012023-12-310001935979BHVN:ハイライト LLファーマシューティカル株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2024-06-300001935979BHVN:ハイライト LLファーマシューティカル株式会社メンバー2023-04-012023-06-300001935979BHVN:ハイライト LLファーマシューティカル株式会社メンバー2023-01-012023-06-300001935979BHVN:ハイライト LLファーマシューティカル株式会社メンバー2024-04-012024-06-300001935979BHVN:ハイライト LLファーマシューティカル株式会社メンバー2024-01-012024-06-300001935979BHVN:その他の契約メンバー2024-04-012024-06-300001935979BHVN:その他の契約メンバー2023-04-012023-06-300001935979BHVN:その他の契約メンバー2024-01-012024-06-300001935979BHVN:その他の契約メンバー2023-01-012023-06-300001935979BHVN:購入契約KNOPP修正メンバー2024-05-012024-05-010001935979BHVN:購入契約ノップ修正2025追加検討メンバー2024-05-032024-05-030001935979米国会計基準:先渡契約メンバー2024-05-030001935979BHVN:購入契約KNOPP修正メンバー2024-05-012024-05-310001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:デリバティブ責任 2024年追加考慮事項メンバー2024-05-030001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:2024追加の考慮事項トゥルーアップメンバー2024-05-012024-06-300001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:先渡契約責任2025年追加考慮事項メンバー2024-05-010001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:先渡契約責任2025年追加考慮事項メンバー2024-05-012024-06-300001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:2025年追加考慮事項トゥルーアップメンバー2024-05-030001935979米国会計基準:フェアバリューインプットレベル3メンバーBHVN:2025年追加考慮事項トゥルーアップメンバー2024-05-012024-06-300001935979BHVN:開発と規制のマイルストーン第一資産メンバーBHVN:ピラミッド・バイオサイエンス株式会社メンバーBHVN:主要資産会員2024-06-300001935979BHVN:開発と規制のマイルストーンセカンドアセットメンバーBHVN:ピラミッド・バイオサイエンス株式会社メンバーBHVN:セカンド・アセット・メンバー2024-06-300001935979BHVN:商業販売ベースのマイルストーンメンバーBHVN:ピラミッド・バイオサイエンス株式会社メンバー2024-06-300001935979bhvn:ピッツバーグセンターアベニューリース契約メンバー2024-03-310001935979bhvn:ピッツバーグセンターアベニューリース契約メンバーSRT: 最低メンバー数2024-06-300001935979bhvn:ピッツバーグセンターアベニューリース契約メンバーSRT: 最大メンバー数2024-06-300001935979米国会計基準:研究開発アレンジメントメンバー2024-01-012024-06-300001935979米国会計基準:ライセンス契約メンバーbhvn:モダファーマシューティカルズ合同会社のメンバーBHVN:モーダ協定メンバー2021-01-012021-01-010001935979bhvn:モダファーマシューティカルズ合同会社のメンバーBHVN:モーダ協定メンバー2021-01-012021-01-010001935979BHVN:モーダ協定メンバー2023-08-012023-08-310001935979bhvn:モダファーマシューティカルズ合同会社のメンバー2024-01-012024-06-300001935979bhvn:モダファーマシューティカルズ合同会社のメンバー2023-01-012023-06-300001935979bhvn:モダファーマシューティカルズ合同会社のメンバー2023-04-012023-06-300001935979BHVN:イェール大学会員BHVN:2023年イェール大学のスポンサー研究契約メンバー2023-05-012023-05-310001935979米国会計基準:関連当事者メンバーBHVN:イェール大学会員2024-04-012024-06-300001935979米国会計基準:関連当事者メンバーBHVN:イェール大学会員2024-01-012024-06-300001935979米国会計基準:関連当事者メンバーBHVN:イェール大学会員2023-04-012023-06-300001935979米国会計基準:関連当事者メンバーBHVN:イェール大学会員2023-01-012023-06-300001935979米国会計基準:関連当事者メンバーBHVN:イェール大学会員2024-06-30 米国
証券取引委員会
ワシントンDC 20549
フォーム10-Q
(マークワン)
☒1934年の証券取引法のセクション13または15 (d) に基づく四半期報告書
四半期終了時 2024年6月30日に
または
☐1934年の証券取引法のセクション13または15(d)に基づく移行レポート
コミッションファイル番号: 001-41477
バイオヘイブン株式会社
(憲章に明記されている登録者の正確な名前)
| | | | | | | | |
| イギリス領バージン諸島 | | 該当なし |
(州またはその他の管轄区域)
法人または組織) | | (IRS) 雇用主
識別番号) |
| | |
| /o バイオヘブンファーマシューティカルズ株式会社 | | |
215 チャーチストリート、 ニューヘイブン、 コネチカット州 | | 06510 |
| (主要執行機関の住所) | | (郵便番号) |
(203) 404-0410
(登録者の電話番号、市外局番を含む)
N/A
(前回の報告以降に変更された場合、以前の名前、以前の住所、および以前の会計年度)
同法第12条 (b) に従って登録された証券:
| | | | | | | | |
| 各クラスのタイトル | トレーディングシンボル | 登録された各取引所の名前 |
| 普通株式、額面なし | BHVN | ニューヨーク証券取引所 |
登録者が(1)1934年の証券取引法のセクション13または15(d)によって提出が義務付けられているすべての報告を過去12か月間(または登録者がそのような報告を提出する必要があったほど短い期間)提出したかどうか、および(2)過去90日間にそのような提出要件の対象であったかどうかをチェックマークで示してください。はい☒ いいえ ☐
登録者が、過去12か月間(または登録者がそのようなファイルを提出する必要があったほど短い期間)に、規則S-Tの規則405(この章の§232.405)に従って提出する必要のあるすべてのインタラクティブデータファイルを電子的に提出したかどうかをチェックマークで示してください。 はい☒ いいえ ☐
登録者が大規模な加速申告者、加速申告者、非加速申告者、小規模な報告会社、または新興成長企業のいずれであるかをチェックマークで示してください。取引法規則12b-2の「大規模加速申告者」、「加速申告者」、「小規模報告会社」、「新興成長企業」の定義を参照してください。
| | | | | | | | | | | | | | | | | | | | |
| 大型加速フィルター | ☒ | | アクセラレーテッド・ファイラー | ☐ | |
| 非加速ファイラー | ☐ | | 小規模な報告会社 | ☐ | |
| | | | 新興成長企業 | ☐ | |
新興成長企業の場合は、登録者が取引法第13条 (a) に従って規定された新規または改訂された財務会計基準を遵守するために延長された移行期間を使用しないことを選択したかどうかをチェックマークで示してください。☐
登録者がシェル会社(取引法の規則12b-2で定義されている)であるかどうかをチェックマークで示してください。はい ☐ いいえ ☒
2024年8月6日現在、登録者は 94,542,253 普通株式、1株あたりの額面価格なし、発行済みです。
| | | | | | | | |
| | 目次 | |
| | ページ |
| パート I | 財務情報 | |
アイテム 1: | 要約連結財務諸表(未監査) | 1 |
| 要約連結貸借対照表 | 3 |
| 要約連結営業報告書および包括損失計算書 | 3 |
| 要約連結キャッシュフロー計算書 | 4 |
| 要約連結財務諸表の注記 | 5 |
アイテム 2: | 経営陣による財政状態と経営成績に関する議論と分析 | 27 |
アイテム3: | 市場リスクに関する定量的・質的開示 | 47 |
アイテム 4: | 統制と手続き | 48 |
| | |
| | |
| パート 2 | その他の情報 | |
アイテム 1: | 法的手続き | 49 |
アイテム1A: | リスク要因 | 49 |
アイテム 2: | 持分証券の未登録売却および収益の使用 | 49 |
| アイテム 5. | その他の情報 | 49 |
アイテム 6: | 展示品 | 50 |
| 署名 | 51 |
パートI-財務情報
アイテム 1.未監査の要約連結財務諸表
バイオヘイブン株式会社
要約連結貸借対照表
(千単位の金額、株式の金額を除く)
| | | | | | | | | | | | | | |
| | 2024年6月30日に | | 2023年12月31日 |
| | (未監査) | | |
| 資産 | | | | |
| 流動資産: | | | | |
| 現金および現金同等物 | | $ | 239,147 | | | $ | 248,402 | |
| 市場性のある証券 | | 197,801 | | | 133,417です | |
| | | | |
| | | | |
| 前払い経費 | | 59,532 | | | 35,242 | |
| 所得税の売掛金 | | 7,522 | | | 13,252 | |
| | | | |
| その他の流動資産 | | 7,266 | | | 12,133 | |
| 流動資産合計 | | 511,268 | | | 442,446 | |
| 資産および設備、純額 | | 18,665 | | | 17,191 | |
| | | | |
| | | | |
| | | | |
| 無形資産 | | 18,400 | | | 18,400 | |
| グッドウィル | | 1,390 | | | 1,390 | |
| | | | |
| その他の非流動資産 | | 32,918 | | | 33,785 | |
| 総資産 | | $ | 582,641 | | | $ | 513,212 | |
| 負債と株主資本 | | | | |
| 現在の負債: | | | | |
| | | | |
| 買掛金 | | $ | 17,259 | | | $ | 15,577 | |
| | | | |
| 未払費用およびその他の流動負債 | | 57,728 | | | 39,846 | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
先渡契約とデリバティブ負債 | | 81,220です | | | — | |
| 流動負債合計 | | 156,207 | | | 55,423 | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
非流動オペレーティングリース負債 | | 26,193 | | | 27,569 | |
| | | | |
| | | | |
デリバティブ負債、非流動負債 | | 12,180 | | | — | |
| その他の非流動負債 | | 4,321 | | | 2,245 | |
| 負債総額 | | 198,901 | | | 85,237 | |
コミットメントと不測の事態(注11) | | | | |
| | | | |
| | | | |
| 株主資本: | | | | |
| | | | |
優先株式、 いいえ 額面価格; 10,000,000 承認済み株式、 いいえ 2024年6月30日および2023年12月31日現在の発行済株式数 | | — | | | — | |
普通株式、 いいえ 額面価格; 2億,000 2024年6月30日および2023年12月31日の時点で承認された株式。 92,346,332 そして 81,115,723 2024年6月30日および2023年12月31日の時点でそれぞれ発行済み株式と発行済み株式 | | 1,298,553 | | | 887,528 | |
| その他の払込資本 | | 83,832 | | | 39,804 | |
| | | | |
| 累積赤字 | | (998,567) | | | (499,292) | |
その他の包括損失の累計 | | (78) | | | (65) | |
| | | | |
| | | | |
| 株主資本の総額 | | 383,740 | | | 427,975 | |
| 負債総額と株主資本 | | $ | 582,641 | | | $ | 513,212 | |
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
バイオヘイブン株式会社
要約連結損益計算書および包括損失
(千単位の金額、1株あたりの金額を除く)
(未監査)
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | 6月30日に終了した3か月間 | | 6月30日に終了した6か月間 |
| | | 2024 | | 2023 | | 2024 | | 2023 |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| 営業経費: | | | | | | | | |
| | | | | | | | |
| 研究開発 | | $ | 314,819 | | | $ | 79,490です | | | $ | 470,791 | | | $ | 142,951 | |
一般と管理 | | 18,953 | | | 14,521 | | | 46,221 | | | 28,842 | |
| 営業費用の合計 | | 333,772 | | | 94,011% | | | 517,012 | | | 171,793 | |
| 事業による損失 | | (333,772) | | | (94,011%) | | | (517,012) | | | (171,793) | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
その他の収益、純額 | | 14,178 | | | 5,842 | | | 18,483 | | | 14,071 | |
所得税引当前損失 | | (319,594) | | | (88,169%) | | | (498,529) | | | (157,722) | |
所得税引当金 | | 177 | | | 2,177 | | | 746 | | | 3,116 | |
| 純損失 | | $ | (319,771) | | | $ | (90,346) | | | $ | (499,275) | | | $ | (160,838) | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
1株当たりの純損失 — 基本損失、希薄化後 | | $ | (3.64) | | | $ | (1.32) | | | $ | (5.93) | | | $ | (2.36) | |
加重平均発行済普通株式—基本株と希薄化後普通株式 | | 87,766,069 | | | 68,248,023 | | | 84,174,099 | | | 68,227,564 | |
| 包括的損失: | | | | | | | | |
| 純損失 | | $ | (319,771) | | | $ | (90,346) | | | $ | (499,275) | | | $ | (160,838) | |
その他の包括利益(損失)(税引後) | | 28 | | | (146) | | | (13) | | | (264) | |
| | | | | | | | |
| | | | | | | | |
包括的損失 | | $ | (319,743) | | | $ | (90,492) | | | $ | (499,288) | | | $ | (161,102です) | |
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
バイオヘイブン株式会社
要約連結キャッシュフロー計算書
(千単位の金額)
(未監査)
| | | | | | | | | | | | | |
| 6月30日に終了した6か月間 | | |
| 2024 | | 2023 | | |
| 営業活動によるキャッシュフロー: | | | | | |
| 純損失 | $ | (499,275) | | | $ | (160,838) | | | |
| 純損失を営業活動に使用された純現金と調整するための調整: | | | | | |
| 減価償却と償却 | 3,400です | | | 3,480 | | | |
現金以外の株式ベースの報酬 | 47,109 | | | 8,460 | | | |
IPR&D資産の取得のための支払いとしての普通株式の発行 | 10,793 | | | — | | | |
ライセンスおよびその他の契約に基づく支払いとしての普通株式の発行 | 71,618 | | | — | | | |
ライセンス契約に基づく先渡契約とデリバティブ負債の公正価値 | 102,529 | | | — | | | |
先渡契約とデリバティブ負債の公正価値の変動 | (9,129) | | | — | | | |
ライセンス契約に基づく令状の発行 | 3,340 | | | — | | | |
その他の現金以外の商品、純額 | (3,129) | | | (3,682) | | | |
買収の影響を差し引いた営業資産と負債の変動: | | | | | |
前払い費用およびその他の流動資産と非流動資産 | (13,491) | | | 39,283 | | | |
| 買掛金 | (60) | | | 1,336 | | | |
未払費用およびその他の流動負債、非流動負債 | 15,860 | | | (10,070) | | | |
| 営業活動に使用された純現金 | (270,435) | | | (122,031) | | | |
| 投資活動によるキャッシュフロー: | | | | | |
有価証券の満期による収入 | 182,364 | | | 124,977 | | | |
有価証券の売却による収入 | — | | | 4,920 | | | |
| 有価証券の購入 | (243,266) | | | (53,372) | | | |
| 資産および設備の購入 | (3,389) | | | (1,330) | | | |
IPR&D資産の取得により取得した現金 | 391 | | | — | | | |
| | | | | |
投資活動によって提供された純現金(使用量) | (63,900) | | | 75,195です | | | |
| 財務活動によるキャッシュフロー: | | | | | |
普通株式の発行による収入 | 318,520 | | | — | | | |
発行費用の支払い | (800) | | | — | | | |
| 元親会社による制限付現金の変更 | — | | | 5,203 | | | |
株式インセンティブプランと従業員株式購入プランからの収入 | 4,568 | | | 1,126 | | | |
その他の財務活動、純額 | 2,258 | | | — | | | |
財務活動による純現金 | 324,546 | | | 6,329 | | | |
| 現金、現金同等物、制限付現金に対する為替レートの影響 | (13) | | | (147) | | | |
現金、現金同等物、制限付現金の純減額 | (9,802) | | | (40,654) | | | |
| 現金、現金同等物、および期首制限付現金 | 252,120 | | | 242,604 | | | |
| 現金、現金同等物、および期末制限付現金 | $ | 242,318 | | | $ | 201,950 | | | |
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
1。 ビジネスの性質とプレゼンテーションの基礎
Biohaven Ltd.(「私たち」、「私たち」、「私たち」、「Biohaven」または「当社」)は、2022年5月にイギリス領バージン諸島のトルトラ島に設立されました。Biohavenは、免疫学、神経科学、腫瘍学などの主要な治療分野における人生を変える治療法の発見、開発、商品化に焦点を当てたバイオ医薬品企業です。同社は、実績のある医薬品開発経験と複数の独自の医薬品開発プラットフォームを活用して、革新的な治療ポートフォリオを発展させています。バイオヘブンの広範な臨床および前臨床プログラムには、てんかんや気分障害のためのKv7イオンチャネル調節、免疫疾患のための細胞外タンパク質分解、片頭痛と神経障害性疼痛に対する一過性受容体電位メラスタチン3(「TRPM3」)拮抗作用、神経炎症に対するチロシンキナーゼ2/ヤヌスキナーゼ1(「TYK2/JAK1」)阻害などがあります。障害; 強迫性障害(「OCD」)と脊髄小脳失調症(「SCA」)のグルタミン酸調節、脊髄性筋萎縮症を含む神経筋および代謝性疾患に対するミオスタチン阻害(「SMA」)と肥満、そしてがんのための抗体動員二重特異性分子(「ARM」)と抗体薬物複合体(「ADC」)。
当社は、バイオテクノロジー業界の企業に共通するリスクと不確実性の影響を受けています。これには、競合他社による新しい技術革新の開発、主要人材への依存、専有技術の保護、政府規制の遵守、事業資金を調達するための追加資本の確保などが含まれますが、これらに限定されません。現在開発中の製品候補は、商品化する前に、前臨床試験、臨床試験、規制当局の承認など、大幅な研究開発努力を必要とします。これらの取り組みには、追加の資本、追加の人員とインフラストラクチャ、およびさらなる規制やその他の機能が必要になる場合があります。会社の製品開発努力が成功したとしても、いつ会社が製品販売から大きな収益を得るかは定かではありません。
バイオヘイブン製薬持株会社からの分離
2022年10月3日、バイオヘイブン製薬持株会社株式会社(「元親会社」)は、バイオヘイブン株式会社の発行済み普通株式すべての普通株式の普通株式の保有者への分配(「分配」)とバイオヘイブン株式会社のスピンオフを完了しました。
修正されたフォーム10のバイオヘブンの登録届出書の別紙99.1として添付されているバイオヘブンの情報声明に記載されている元親会社(「スピンオフ」)から(Reg.番号 001-41477)。Form 10-Qのこの四半期報告書全体にわたる配布とスピンオフを総称して「分離」と呼んでいます。分離の結果、Biohaven Ltd. は2022年10月3日に独立した上場企業となり、2022年10月4日にニューヨーク証券取引所(「NYSE」)で「BHVN」のシンボルでレギュラーウェイ取引を開始しました。このレポートで過去の事業活動を説明する場合、あたかも元親会社のそのような資産や負債に関連する活動が会社によって行われていたかのように記述しています。
プレゼンテーションの基礎
添付の要約連結財務諸表は、米国で一般に認められている会計原則(「GAAP」)およびSECの規則および規制に従って作成されています。添付の要約連結財務諸表には、Biohaven Ltd. および当社の完全子会社の口座が含まれています。連結により、重要な会社間残高と取引はすべて削除されました。
ゴーイング・コンサー
会計基準体系化(「ASC」)205-40、Going Concernに従い、当社は、要約連結財務諸表が発行された日から1年以内に継続企業として継続できるかどうかについて、全体として考慮した結果、当社が継続企業として存続できるかどうかについて大きな疑問を投げかける条件や事象があるかどうかを評価しました。
2024年8月9日まで、当社は主に元親会社からの資金調達、普通株式の売却による収入、および分離時に元親会社から受け取った現金拠出金で事業資金を調達してきました。当社は創業以来経常損失を被っており、当面の間、営業損失が発生し続けると予想しています。
これらの要約連結財務諸表の発行日現在、当社は、これらの財務諸表の発行日から少なくとも1年は、既存の現金、現金同等物、および有価証券が、営業および財務上のコミットメント、およびその他の現金要件を満たすのに十分であると予想しています。
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
1。ビジネスの性質とプレゼンテーションの基礎(続き)
事業計画を実行するために、会社は継続的な事業を支援し、成長戦略を追求するための資金を必要とします。当社は、製品の販売やロイヤルティから大きな収益を生み出すことができるようになるまで、もしあれば、パブリックエクイティまたはプライベートエクイティの売却、債務融資、または他社とのコラボレーションやその他の戦略的取引を含むその他の資本源を通じて事業資金を調達する予定です。会社は、許容できる条件で融資を得ることができないか、まったく得られないかもしれません。資金調達の条件は、会社の株主の持ち株や権利に悪影響を及ぼす可能性があります。会社が資金を得ることができない場合、研究開発プログラム、製品ポートフォリオの拡大、または商品化の取り組みの一部またはすべてを延期、削減、または廃止せざるを得なくなり、事業見通しに悪影響を及ぼしたり、事業を継続できなくなったりする可能性があります。
2。 重要な会計方針の要約
当社の重要な会計方針は、2023年12月31日に終了した年度のフォーム10-kの年次報告書(「2023フォーム10-K」)に含まれる連結財務諸表の注記2「重要な会計方針の要約」に記載されています。当社の会計方針の更新については、この注記2で後述します。
未監査の中間要約連結財務情報
添付の未監査要約連結財務諸表は、中間財務情報としてGAAPに従って作成されています。添付の未監査の要約連結財務諸表には、完全な連結財務諸表のためにGAAPが要求する情報や脚注がすべて含まれているわけではありません。添付の年末要約連結貸借対照表は監査済み財務諸表から導き出されたものですが、アメリカ合衆国で一般に認められている会計原則で要求されるすべての開示は含まれていません。未監査の中間要約連結財務諸表は、監査済みの年次連結財務諸表と同じ基準で作成されており、経営陣の意見では、2024年6月30日現在の当社の財政状態、2024年および2023年6月30日までの3か月および6か月の経営成績、および6か月間のキャッシュフローの公正な計算に必要な、通常の定期的な調整のみを含むすべての調整が反映されています 2024年および2023年6月30日に終了しました。2024年6月30日までの3か月と6か月の業績は、必ずしも期待される結果を示すものではありません
2024年12月31日に終了する年度、その他の中間期間、または将来の年または期間。ここに含まれる財務情報は、2023年12月31日に終了した年度のフォーム10-kの会社の年次報告書の財務諸表および注記と併せて読む必要があります。
再分類
前期の要約連結財務諸表の特定の項目は、当年度の表示に合わせて再分類されました。
見積もりの使用
GAAPに準拠した要約連結財務諸表を作成するには、経営陣は、報告された資産と負債の金額、要約連結財務諸表の日付における偶発資産と負債の開示、および報告期間中の報告された費用額に影響する見積もりと仮定を行う必要があります。これらの要約連結財務諸表に反映されている重要な見積もりや仮定には、研究開発費の発生、先渡契約およびデリバティブ負債の評価が含まれますが、これらに限定されません。さらに、会社が継続企業として存続できるかどうかを経営陣が評価するには、将来の現金の流入と流出の金額と時期を見積もる必要があります。見積もりは、状況、事実、経験の変化に照らして定期的に見直されます。見積もりの変更は、判明した時期に記録されます。実際の結果はそれらの見積もりとは異なる可能性があります。
制限付き現金
要約連結貸借対照表の他の流動資産に含まれる制限付現金は、主に当社の発行済み株式の将来の購入のために保有されている会社の従業員株式購入計画への従業員の拠出金で構成されます。
要約連結貸借対照表の他の非流動資産に含まれる制限付現金は、ペンシルベニア州ヤードレーのリースオフィススペースに関連して発行された信用状(「LOC」)およびマサチューセッツ州ケンブリッジとペンシルベニア州ピッツバーグのリースオフィスおよびラボスペースに関連して発行されたLOCのために銀行が保有する担保です。不動産リースに関する追加情報については、注記11「コミットメントと不測の事態」を参照してください。
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
2。重要な会計方針の要約(続き)
以下は、要約連結貸借対照表の現金および現金同等物を、それぞれ要約連結キャッシュフロー計算書における2024年6月30日および2023年6月30日の現在の現金、現金同等物および制限付現金の合計と調整したものです。
| | | | | | | | | | | | | | |
| | 2024年6月30日現在 | | 2023年6月30日現在 |
| 現金および現金同等物 | | $ | 239,147 | | | $ | 147,612 | |
| 元親に代わって保有している制限付現金 | | — | | | 40,415です | |
| 制限付現金(他の流動資産に含まれています) | | 156 | | | 11,574 | |
| 制限付現金(他の非流動資産に含まれています) | | 3,015 | | | 2,349 | |
| 要約連結キャッシュフロー計算書における期末の現金、現金同等物、制限付現金の合計 | | $ | 242,318 | | | $ | 201,950 | |
先渡契約とデリバティブ負債
当社は、特定の財務取引および事業開発取引を評価して、それらの取引で発行される株式連動商品の会計分類を決定します。当社はまず、独立型の株式連動商品が、ASC 480-10「負債を株式から区別する」および「ASC 815-40 デリバティブとヘッジング-企業の自己資本契約」に従って負債分類を満たしているかどうかを評価します。ASC 480-10では、証券が強制的に償還可能な場合、発行者に現金やその他の資産を支払って証券または原株を決済するよう義務付けられている場合、または可変数の株式を発行して決済する必要がある場合、または決済を要求する可能性がある場合、証券は負債分類とみなされます。
商品がASC 480-10に基づく負債分類を満たさない場合、当社はASC 815-40の要件を評価します。この要件では、純現金決済を必要とする、または必要とする可能性のある契約は、公正価値で記録された負債であると規定されています。証券がASC 815-40に基づく負債分類を必要としない場合、株式分類を結論付けるために、会社はその商品が普通株式にインデックスされているかどうか、またその商品がASC 815-40またはその他の該当するGAAPに基づいて株式として分類されているかどうかを評価します。
ASC 815-40に従って会計処理された株式連動商品は、公正な時点で要約連結貸借対照表に負債として報告されます
値。各測定期間で決定される公正価値の変動は、その他の収益(費用)の構成要素として、要約連結営業報告書と包括損失を差し引いて計上されます。公正価値の変動は、先渡契約とデリバティブ負債の公正価値の変動として、要約連結キャッシュフロー計算書に報告されます。
当社は、ASC 815に基づくデリバティブ負債としてKnopp Biosciences、LLC(「Knopp」)と締結した2022年2月24日付けの会員持分購入契約(「購入契約」)の2024年5月1日付けの改正(「Knopp改正」)に関連して合意された特定の対価を計上しました(注記4「金融資産および負債の公正価値」を参照)。アビリティ」と10、「ライセンス、買収、その他の契約」)。
ワラント
当社は、ワラント契約の特定の条件に応じて、ASCトピック480「負債と資本の区別」(「ASC 480」)および/またはASCトピック815「デリバティブとヘッジング」(「ASC 815」)に従って、株式商品、負債、またはデリバティブ負債のいずれかとして発行されたワラントを評価します。
当社は、2024年5月にKnoppに発行されたワラント(「Knoppワラント」)を評価し、ASC 480およびASC 815に基づく株式分類の基準を満たしていると結論付けました。したがって、Knopp新株予約権は、発行時に要約連結貸借対照表に追加払込資本の範囲内で計上されており、再測定の対象にはなりません。Knoppワラントの詳細については、注記6「株主資本」を参照してください。
公正価値測定
会社の特定の資産と負債は、GAAPに基づいて公正価値で計上されています。公正価値とは、測定日の市場参加者間の秩序ある取引において、資産として受け取る交換価格、または資産または負債の元本市場または最も有利な市場で負債を譲渡するために支払われる交換価格(出口価格)と定義されます。公正価値の測定に使用される評価手法は、観察可能なインプットを最大限に活用し、観察不可能なインプットの使用を最小限に抑える必要があります。公正価値で保有される金融資産と負債は、公正価値の次の3つのレベルのいずれかに分類および開示されます
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
2。重要な会計方針の要約(続き)
階層。最初の2つは観察可能で、最後の2つは観察できないと見なされます。
•レベル1-同一の資産または負債の活発な市場における相場価格。
•レベル2—類似の資産または負債の活発な市場での相場価格、同一または類似の資産または負債の活発ではない市場の相場価格、または観察可能な市場データによって裏付けられるその他のインプットなど、観察可能なインプット(レベル1の相場価格以外)。
•レベル3—資産または負債の公正価値を決定する上で重要な、ほとんどまたはまったく市場活動によって裏付けられている、観察できないインプット。価格設定モデル、割引キャッシュフローの方法論、および同様の手法が含まれます。
その他の流動資産、買掛金、未払費用の帳簿価額は、これらの資産と負債の短期的な性質により、公正価値に近いものです。
当社は、Knopp改正に関連して合意された特定の対価を先渡契約負債として計上しています。これらの対価は、要約連結貸借対照表に公正価値で記録されています。各測定期間に決定される公正価値の変動は、その他の収益(費用)の構成要素として、要約連結営業報告書と包括損失を差し引いて計上されます。先渡契約負債の公正価値は、市場では観察できない重要な情報に基づいて決定されるため、公正価値階層におけるレベル3の測定値となります。評価は、会社の株価のモンテカルロシミュレーションに基づいています。これには、会社の株価のボラティリティに関する判断と仮定が必要です
Biohavenの株価は、リスクフリーレートにBiohaven固有の信用リスクを加えたものを使用して現在価値に割引されています。これは、さまざまな株式数で支払われるためです。(注記4「金融資産および負債の公正価値」および10「ライセンス、買収、その他の契約」を参照してください)。
最近発行された会計上の宣言
2023年11月、FaSBはASU第2023-07号「セグメント報告—報告対象セグメント開示の改善」を発行しました。これは、主に多額のセグメント費用に関する開示を強化することにより、報告対象セグメントの開示要件を改善するものです。ASU第2023-07号の改正は、報告対象セグメントが1つしかない公的機関にも適用され、2023年12月15日以降に開始する会計年度および2024年12月15日以降に開始する会計年度内の中間期間に有効で、早期採択が認められています。当社は現在、ASU番号2023-07が連結財務諸表に与える影響を評価しています。
2023年12月、FaSBはASU第2023-09号「所得税(トピック740):所得税開示の改善」を発行しました。これは、税率調整と支払われる所得税を管轄区域ごとに分類して、一貫したカテゴリーと情報をより細分化することで、所得税開示の透明性を高めるためです。ASUには、所得税開示の有効性を高めるためのその他の改正も含まれています。ASU 2023-09の改正は、2024年12月15日以降に開始する会計年度に有効で、年次財務諸表がまだ発行されていない、または発行可能になっていない場合は、早期採用が許可されています。当社は現在、ASU番号2023-09が連結財務諸表に与える影響を評価しています。
要約連結財務諸表の索引
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
3。 市場性のある証券
2024年6月30日および2023年12月31日における証券の種類別の償却費用、未実現持株利益総額、未実現持株損失総額、および売却可能な負債証券の公正価値は次のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 償却コスト | | 信用損失引当金 | | 純償却費用 | | 未実現総利益 | | 未実現損失総額 | | 公正価値 |
| 2024年6月30日に | | | | | | | | | | | | |
債務証券 | | | | | | | | | | | | |
| | | | | | | | | | | | |
| | | | | | | | | | | | |
| | | | | | | | | | | | |
米国財務省短期証券 | | $ | 234,748 | | | $ | — | | | $ | 234,748 | | | $ | 2 | | | $ | (5) | | | $ | 234,745 | |
| | | | | | | | | | | | |
| | | | | | | | | | | | |
| | | | | | | | | | | | |
| 2023年12月31日 | | | | | | | | | | | | |
債務証券 | | | | | | | | | | | | |
米国社債 | | $ | 46,228 | | | $ | — | | | $ | 46,228 | | | $ | 7 | | | $ | (24) | | | $ | 46,211です | |
外国社債 | | 7,180 | | | — | | | 7,180 | | | — | | | (7) | | | 7,173 | |
| | | | | | | | | | | | |
米国財務省短期証券 | | 113,908 | | | — | | | 113,908 | | | 27 | | | — | | | 113,935 | |
| | | | | | | | | | | | |
| 合計 | | $ | 167,316 | | | $ | — | | | $ | 167,316 | | | $ | 34 | | | $ | (31) | | | $ | 167,319 | |
要約連結貸借対照表の分類別の売却可能な債務証券の公正価値は次のとおりです。
| | | | | | | | | | | | | | | | |
| | 2024年6月30日に | | 2023年12月31日 | | |
| 現金および現金同等物 | | $ | 36,944 | | | $ | 33,902 | | | |
| 市場性のある証券 | | 197,801 | | | 133,417です | | | |
| 合計 | | $ | 234,745 | | | $ | 167,319 | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
2024年6月30日および2023年12月31日に売却可能な負債証券の正味償却費用と公正価値は、契約満期ごとに以下に示されています。有価証券は再編、募金、前払いの場合や、会社が満期前に証券を売却する予定であるため、実際の満期は契約上の満期とは異なる場合があります。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2024年6月30日に | | 2023年12月31日 |
| | 純償却費用 | | 公正価値 | | 純償却費用 | | 公正価値 |
| 成熟しているため: | | | | | | | | |
| 1 年未満 | | $ | 234,748 | | | $ | 234,745 | | | $ | 167,316 | | | $ | 167,319 | |
| | | | | | | | |
| | | | | | | | |
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
3。有価証券(続き)
以下は、2024年6月30日および2023年12月31日に当社が保有していた未実現損失のポジションにあった売却可能な債務証券を、投資がそのポジションにあった期間で集計したものです。
| | | | | | | | | | | | | | | | | | | | |
| | 12 か月未満 |
| | 証券の数 | | 公正価値 | | 未含み損失 |
| 2024年6月30日に | | | | | | |
| 債務証券 | | | | | | |
| | | | | | |
| | | | | | |
| 米国財務省短期証券 | | 11 | | | $ | 133,504 | | | $ | (5) | |
| | | | | | |
| | | | | | |
| | | | | | |
| 2023年12月31日 | | | | | | |
| 債務証券 | | | | | | |
| 米国社債 | | 6 | | | $ | 29,537 | | | $ | (24) | |
| 外国社債 | | 1 | | | 7,173 | | | (7) | |
| | | | | | |
| | | | | | |
| | | | | | |
| 合計 | | 7 | | | $ | 36,710 | | | $ | (31) | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
会社がやった いいえ2024年6月30日または2023年12月31日の時点で、12か月以上継続して未実現損失のポジションにある投資をしています。
当社は上の表の有価証券を検討し、外部の格付け機関が行った調査に基づく投資証券の信用の質や、投資の現在の回復見通しに基づく証券の帳簿価額の実現の見通しなどの要素を考慮して、これらはパフォーマンス資産であると結論付けました。2024年6月30日現在、当社はこれらの有価証券を売却するつもりはなく、償却原価ベースの予想回収前にこれらの有価証券を売却する必要が生じる可能性は低いと考えていました。
純投資収入
総投資収益には、売却可能な債務証券、マネーマーケットファンド、現金、制限付現金からの収入が含まれます。 2024年および2023年6月30日までの3か月および6か月間のその他の収益に含まれる純投資収益、要約連結営業報告書の純額、および包括損失は次のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 6月30日に終了した3か月間 | | 6月30日に終了した6か月間 |
| | 2024 | | 2023 | | 2024 | | 2023 |
負債証券(実現損失を含む) | | $ | 3,000 | | | $ | 2,225 | | | $ | 5,069 | | | $ | 5,634 | |
その他の投資 | | 2,140 | | | 1,941 | | | 4,402 | | | 2,727 | |
総投資収入(実現損失を含む) | | 5,140 | | | 4,166% | | | 9,471 | | | 8,361 | |
投資費用 | | (40) | | | (68) | | | (70) | | | (138) | |
| 純投資収入 | | $ | 5,100 | | | $ | 4,098 | | | $ | 9,401 | | | $ | 8,223 | |
実現損益の計算には、特定の識別方法を使用します。 2024年6月30日および2023年6月までの3か月および6か月間の売却可能な債務証券の売却による収益と関連する総実現資本損失は次のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 6月30日に終了した3か月間 | | 6月30日に終了した6か月間 |
| | 2024 | | 2023 | | 2024 | | 2023 |
| 販売による収入 | | $ | — | | | $ | 2,464 | | | $ | — | | | $ | 4,920 | |
| | | | | | | | |
| 総実現資本損失 | | $ | — | | | $ | 17 | | | $ | — | | | $ | 39 | |
目次
バイオヘイブン製薬持株会社株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
4。 金融資産と負債の公正価値
GAAPに従って当社の要約連結財務諸表を作成するには、特定の資産と負債を公正価値で反映し、その他は調整後の履歴原価基準などの別の基準に反映する必要があります。このノートでは、当社は金融資産と負債の公正価値と、それがそれらの公正価値をどのように決定するかについての詳細を述べています。
要約連結貸借対照表で公正価値で測定された金融商品
会社の特定の資産は、GAAPに基づいて公正価値で保有されています。公正価値とは、測定日の市場参加者間の秩序ある取引において、資産として受け取る交換価格、または資産または負債の元本市場または最も有利な市場で負債を譲渡するために支払われる交換価格(出口価格)と定義されます。公正価値の測定に使用される評価手法は、観察可能なインプットを最大限に活用し、観察不可能なインプットの使用を最小限に抑える必要があります。公正価値で保有される金融資産と負債は、公正価値階層の次の3つのレベルのいずれかに分類され、開示されます。最初の2つは観察可能で、最後の2つは観察不可能と見なされます。
•レベル1 — 同一の資産または負債の活発な市場における相場価格。
•レベル2 — 類似の資産または負債の活発な市場での相場価格、同一または類似の資産または負債の活発でない市場の相場価格、または観察可能な市場データによって裏付けられるその他のインプットなど、観察可能なインプット(レベル1の相場価格以外)。
•レベル3 — 資産または負債の公正価値を決定する上で重要な、ほとんどまたはまったく市場活動によって裏付けられている、観察できないインプット。価格設定モデル、割引キャッシュフローの方法論、および同様の手法が含まれます。
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
4。金融資産と負債の公正価値(続き)
2024年6月30日および2023年12月31日の要約連結貸借対照表で定期的に公正価値で測定された金融資産と、2024年6月30日の要約連結貸借対照表で定期的に公正価値で測定された金融負債は次のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 公正価値の測定方法: |
| 貸借対照表分類 | | 楽器の種類 | | レベル 1 | | レベル 2 | | レベル 3 | | 合計 |
| 2024年6月30日に | | | | | | | | | | |
| 資産: | | | | | | | | | | |
| 現金および現金同等物 | | マネー・マーケット・ファンド | | $ | 113,379 | | | $ | — | | | $ | — | | | $ | 113,379 | |
現金および現金同等物 | | 米国財務省短期証券 | | — | | | 36,944 | | | — | | | 36,944 | |
| | | | | | | | | | |
| 市場性のある証券 | | 米国財務省短期証券 | | 29,701 | | | 168,100 | | | — | | | 197,801 | |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
| その他の非流動資産 | | マネー・マーケット・ファンド | | 2,515 | | | — | | | — | | | 2,515 | |
| 総資産 | | | | $ | 145,595 | | | $ | 205,044 | | | $ | — | | | $ | 350,639 | |
| | | | | | | | | | |
| 負債: | | | | | | | | | | |
先渡契約とデリバティブ負債 | | 先渡契約、現在および書面によるプットオプション、現在 | | $ | — | | | $ | — | | | $ | 81,220です | | | $ | 81,220です | |
| | | | | | | | | | |
デリバティブ負債、非流動負債 | | 書面によるプットオプション、非現行 | | — | | | — | | | 12,180 | | | 12,180 | |
| | | | | | | | | | |
| 負債総額 | | | | $ | — | | | $ | — | | | $ | 93,400% | | | $ | 93,400% | |
| | | | | | | | | | |
| 2023年12月31日 | | | | | | | | | | |
| 資産: | | | | | | | | | | |
| 現金および現金同等物 | | マネー・マーケット・ファンド | | $ | 59,199 | | | $ | — | | | $ | — | | | $ | 59,199 | |
| 現金および現金同等物 | | 米国財務省短期証券 | | — | | | 27,901 | | | — | | | 27,901 | |
| 現金および現金同等物 | | 米国社債 | | — | | | 6,001です | | | — | | | 6,001です | |
| 市場性のある証券 | | 米国財務省短期証券 | | 9,874 | | | 76,160 | | | — | | | 86,034 | |
| 市場性のある証券 | | 米国社債 | | — | | | 40,210 | | | — | | | 40,210 | |
| 市場性のある証券 | | 外国社債 | | — | | | 7,173 | | | — | | | 7,173 | |
| その他の非流動資産 | | マネー・マーケット・ファンド | | 1,900 | | | — | | | — | | | 1,900 | |
| 総資産 | | | | $ | 70,973 | | | $ | 157,445 | | | $ | — | | | $ | 228,418 | |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | |
| | | | | | | | | | |
2023年12月31日の要約連結貸借対照表では、当社には定期的に公正価値で測定される金融負債はありませんでした。
2024年または2023年6月30日に終了した3か月から6か月の間、レベル3に譲渡された証券やレベル3から譲渡された証券はありませんでした。
以下は、定期的に公正価値で測定される金融資産について、評価方法を含めて説明したものです。
現金同等物
現金同等物は、短期マネーマーケットファンドに投資された現金と、購入日の当初の満期が90日以下の負債証券で構成されていました。満期が3か月未満なので、現金同等物の帳簿価額は公正価値とほぼ同じです。活発な市場で見積価格が入手可能な場合、現金同等物は公正価値階層のレベル1に分類されます。活発な市場で定期的に取引されない現金同等商品の公正価値はレベル2に分類されます。
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
4。金融資産と負債の公正価値(続き)
有価証券およびその他の非流動資産
活発な市場における同一資産の相場価格はレベル1と見なされ、運用中の米国債とマネーマーケットファンドで構成されます。会社のレベル2債務証券の公正価値は、同様の特性を持つ債務証券の相場市場価格、非アクティブな市場における同一資産の見積もり価格、または公正価値を推定するための割引キャッシュフローから得られます。
先渡契約とデリバティブ負債
Knopp改正に関連して、Knoppは、契約で定義されているとおり、2024年12月に会社に1回限りの現金払いを要求することができます(「2024年追加対価確定」)。また、会社はおおよその金額の会社の普通株式をKnoppに追加発行することにも同意しました75,000 クノップ改正(「2025年追加考慮事項」)の施行1周年から60日以内。さらに、Knoppは、契約で定義されているように、2025年12月に会社に1回限りの現金払いを要求することができます(「2025年追加対価の確定」)。詳細については、注記10「ライセンス、買収、その他の契約」を参照してください。
次の表は、2024年6月30日までの3か月間の当社の先渡契約およびデリバティブ負債の公正価値の繰越を示しています。公正価値は、レベル3のインプットによって決定されます。
| | | | | | | | | | |
| | 運送価額 | | |
2024年5月1日現在の公正価値 | | $ | 93,290% | | | |
その他の収益(費用)におけるデリバティブの公正価値の変動、純額 | | 110 | | | |
2024年6月30日の公正価値 | | $ | 93,400% | | | |
Knopp修正条項に関連して認識された先渡契約およびデリバティブ負債の公正価値は、市場では観察できない重要な情報に基づいて決定されたため、公正価値階層におけるレベル3の測定値です。評価は、バイオヘイブンの株価のモンテカルロシミュレーションに基づいています。これには、バイオヘイブンの株価の変動性に基づく判断と仮定が必要です。2025年の追加対価では可変数の株式で支払われるか、2024年の追加対価調整と2025年の追加対価調整では現金で支払われる可能性があるため、リスクフリーレートにバイオヘブン固有の信用リスクを加えたものを現在価値に割り引いて現在価値に割り引いています。 2024年6月30日および2024年5月1日現在のノップ修正に関連する当社の先渡契約およびデリバティブ負債の測定に使用された、観察できないインプット(レベル3のインプット)の概要は次のとおりです。加重平均ベースで示されています。
| | | | | | | | | | | | | | |
| | 2024年6月30日現在 | | 2024年5月1日現在 |
| | | | |
支払いまでの時間と支払いの可能性(年) | | 0.91 | | 1.08 |
ボラティリティ(年間) | | 70.0 | % | | 80.0 | % |
割引率 | | 15.6 | % | | 14.8 | % |
報告日におけるバイオヘブンの株価のボラティリティに対する私たちの予想は、実際の将来のボラティリティとは大きく異なる可能性があります。もしそうなら、推定公正価値は、決定された公正価値よりも大幅に高いまたは低くなる可能性があることを意味します。当社は、先渡契約の公正価値は約$になると予想しています75,000 ノップ改正の1周年記念日に。デリバティブの報告日から決済日までの間に、2024年の追加対価調整と2025年の追加対価償却に関連するデリバティブ負債が増加すると、会社の財務実績に重大な悪影響を及ぼします。
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
5。 貸借対照表の構成要素
資産および設備、純額
資産および設備、純額は以下のとおりです。
| | | | | | | | | | | | | | | | |
| | 2024年6月30日現在 | | 2023年12月31日現在 | | |
| 建物と土地 | | $ | 14,078 | | | $ | 11,728 | | | |
借地権の改善 | | 824 | | | 802 | | | |
| コンピューターのハードウェアとソフトウェア | | 875 | | | 875 | | | |
| オフィスとラボの機器 | | 11,027 | | | 9,961 | | | |
| 家具と備品 | | 1,793 | | | 1,550 | | | |
| | $ | 28,597 | | | $ | 24,916 | | | |
| 減価償却累計 | | (10,201) | | | (8,283) | | | |
| | 18,396 | | | 16,633% | | | |
| 機器はまだ使用されていません | | 269 | | | 558 | | | |
| 資産および設備、純額 | | $ | 18,665 | | | $ | 17,191 | | | |
減価償却費は $977 と $1,918 2024年6月30日に終了した3か月と6か月については、それぞれ800 と $1,564 それぞれ2023年6月30日に終了した3か月と6か月間です。
まだ稼働していない機器は、主に2024年6月30日と2023年12月31日の時点で使用を開始していない実験装置でした。
その他の非流動資産
その他の非流動資産は次のもので構成されていました。
| | | | | | | | | | | | | | | |
| | 2024年6月30日現在 | | 2023年12月31日現在 | |
| | | | | |
| | | | | |
| | | | | |
| オペレーティングリースの使用権資産 | | $ | 29,903 | | | $ | 31,385 | | |
| その他 | | 3,015 | | | 2,400 | | |
| その他の非流動資産 | | $ | 32,918 | | | $ | 33,785 | | |
未払費用およびその他の流動負債
未払費用およびその他の流動負債は、以下で構成されていました。
| | | | | | | | | | | | | | |
| | 2024年6月30日現在 | | 2023年12月31日現在 |
| | | | |
| 未払従業員報酬と福利厚生 | | $ | 10,845 | | | $ | 837 | |
| 未払いの臨床試験費用 | | 36,446 | | | 29,501 | |
| | | | |
| | | | |
| | | | |
| | | | |
| | | | |
オペレーティングリース負債-当期分 | | 3,550 | | | 3,308 | |
| その他の未払費用およびその他の流動負債 | | 6,887 | | | 6,200% | |
| 未払費用およびその他の流動負債 | | $ | 57,728 | | | $ | 39,846 | |
要約連結財務諸表の索引
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
6。 株主資本
2024年6月30日および2023年6月30日に終了した3か月と6か月間の株主資本の変動は次のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 普通株式 | | | | | | | | | | |
| | 株式 | | 金額 | | | | 追加払込資本 | | 累積赤字 | | その他の包括損失の累計 | | 株主資本の合計 |
| 2023年12月31日現在の残高 | | 81,115,723 | | | $ | 887,528 | | | | | $ | 39,804 | | | $ | (499,292) | | | $ | (65) | | | $ | 427,975 | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| 純損失 | | — | | | — | | | | | — | | | (179,504) | | | — | | | (179,504) | |
IPR&D資産の取得のための支払いとしての普通株式の発行 | | 242,958 | | | 10,347 | | | | | — | | | — | | | — | | | 10,347 | |
ライセンスおよびその他の契約に基づく支払いとしての普通株式の発行 | | 97,233 | | | 5,637 | | | | | — | | | — | | | — | | | 5,637 | |
| 2022年の株式インセンティブプランに基づく普通株式の発行 | | 351,307 | | | 7,452 | | | | | (5,296) | | | — | | | — | | | 2,156 | |
| 現金以外の株式ベースの報酬費用 | | — | | | — | | | | | 34,877 | | | — | | | — | | | 34,877 | |
| その他の包括損失 | | — | | | — | | | | | — | | | — | | | (41) | | | (41) | |
| 2024年3月31日現在の残高 | | 81,807,221 | | | 910,964 | | | | | 69,385 | | | (678,796) | | | (106) | | | 301,447 | |
| 純損失 | | — | | | — | | | | | — | | | (319,771) | | | — | | | (319,771) | |
| 募集費用を差し引いた普通株式の発行 | | 8,544,951 | | | 317,720 | | | | | — | | | — | | | — | | | 317,720 | |
| IPR&D資産の取得のための支払いとしての普通株式の発行 | | 10,452 | | | 446 | | | | | — | | | — | | | — | | | 446 | |
| ライセンスおよびその他の契約に基づく支払いとしての普通株式の発行 | | 1,872,874 | | | 65,981 | | | | | — | | | — | | | — | | | 65,981 | |
| 2022年の株式インセンティブプランと2022年の従業員株式購入プランに基づく普通株式の発行 | | 110,834 | | | 3,442 | | | | | (1,125) | | | — | | | — | | | 2,317 | |
| ライセンス契約に基づく支払いとしてのワラントの発行 | | — | | | — | | | | | 3,340 | | | — | | | — | | | 3,340 | |
| 現金以外の株式ベースの報酬費用 | | — | | | — | | | | | 12,232 | | | — | | | — | | | 12,232 | |
| その他の包括利益 | | — | | | — | | | | | — | | | — | | | 28 | | | 28 | |
| 2024年6月30日現在の残高 | | 92,346,332 | | | $ | 1,298,553 | | | | | $ | 83,832 | | | $ | (998,567) | | | $ | (78) | | | $ | 383,740 | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
6。株主資本(続き)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 普通株式 | | | | | | | | | | |
| | 株式 | | 金額 | | | | 追加払込資本 | | 累積赤字 | | その他の包括利益の累計 | | 株主資本の合計 |
2022年12月31日現在の残高 | | 68,190,479です | | | $ | 615,742 | | | | | $ | 13,869 | | | $ | (91,124) | | | $ | 284 | | | $ | 538,771 | |
| 純損失 | | — | | | — | | | | | — | | | (70,492) | | | — | | | (70,492) | |
| 2022年の株式インセンティブプランに基づく普通株式の発行 | | 22,000 | | | 504 | | | | | (172) | | | — | | | — | | | 332 | |
現金以外の株式ベースの報酬費用 | | — | | | — | | | | | 3,765 | | | — | | | — | | | 3,765 | |
| その他の包括損失 | | — | | | — | | | | | — | | | — | | | (118) | | | (118) | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
2023年3月31日現在の残高 | | 68,212,479 | | | 616,246 | | | | | 17,462 | | | (161,616です) | | | 166 | | | 472,258 | |
| 純損失 | | — | | | — | | | | | — | | | (90,346) | | | — | | | (90,346) | |
| 2022年の株式インセンティブプランと2022年の従業員株式購入プランに基づく普通株式の発行 | | 104,474 | | | 1,264です | | | | | (470) | | | — | | | — | | | 794 | |
| 現金以外の株式ベースの報酬費用 | | — | | | — | | | | | 4,695 | | | — | | | — | | | 4,695 | |
| その他の包括損失 | | — | | | — | | | | | — | | | — | | | (146) | | | (146) | |
2023年6月30日現在の残高 | | 68,316,953 | | | $ | 617,510 | | | | | $ | 21,687 | | | $ | (251,962) | | | $ | 20 | | | $ | 387,255です | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
クノップ改正
2024年5月、当社はKnopp修正条項を締結しました。これにより、両当事者は、会員購入契約に基づく承継ベースの支払いおよびロイヤルティ支払い義務を改訂することに合意しました。対価として、会社は発行しました 1,872,874 Knoppのバイオヘブン株、価値は約$です65,981 2024年5月に。
Knopp改正案における相続に基づく支払いおよびロイヤルティ支払い義務の改正に関するさらなる検討として、当社はKnoppに購入ワラントを発行しました 294,195 購入価格が$の当社の普通株式の67.98、特定の開発マイルストーンと、会社が特定の時価総額を達成することを条件とします。
ワラントは当初の公正価値である$で記録されました3,340 2024年6月30日現在の要約連結貸借対照表の追加払込資本の範囲内であり、再測定の対象にはなりません。Knopp修正条項の詳細については、注記10を参照してください。
2024年4月の公募増資
2024年4月22日、当社は引受公募を終了しました 6,451,220です 普通株式の。これには、引受人が$の価格で追加株式を購入するオプションを全額行使することが含まれます41.00 一株当たり。引受割引とBiohavenが支払うべきオファリングの費用を差し引いた後のオファリングで調達された純収入は約$でした247,830。会社は使用するつもりです
一般的な企業目的でのオファリングから受け取った純収入。
ピラミッド買収
2024年1月、当社はピラミッド契約に基づいてピラミッドを買収しました。ピラミッドの買収の対価として、Biohavenは前払いを行いました 255,794 会社の普通株式、価値は約$です10,894。2024年6月30日の時点で、 253,410 これらの普通株式のうちは当社が発行したものです。
2024年の第1四半期に、当社はドルを記録しました5,689 要約された連結営業報告書の研究開発費と、ピラミッド契約に基づいて支払期日が到来した開発マイルストーンの包括的損失の 98,129 会社の普通株式。2024年6月30日の時点で、 97,233 これらの普通株式のうちは当社が発行したものです。Pyramidの買収の詳細については、注記10「ライセンス、買収、その他の契約」を参照してください。
株式分配契約
2023年10月、当社は株式分配契約を締結しました。この契約に基づき、当社は総募集価格が最大$の普通株式を提供および売却することができます150,000 時々、代理人または主体の役割を果たす販売代理店を通じて、または販売代理店に(「株式分配契約」)。当社の普通株式の売却は、もしあれば、「市場での提供」とみなされる売却で行われます。販売代理店は特定の金額を売る必要はありません
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
6。株主資本(続き)
証券ですが、販売代理店と会社の間で相互に合意した条件に基づき、通常の取引および販売慣行に沿った商業的に合理的な努力を払って、会社の販売代理店としての役割を果たします。当社は現在、普通株式の市場での募集による純収入を一般的な企業目的に使用する予定です。
2024年6月30日現在、当社は売却・発行しています 2,093,731 株式分配契約に基づく普通株式、純収入は約$です69,890。2024年6月30日以降、当社は追加のものを発行して販売しました 2,154,857 純収入$の普通株式76,360%。このレポートの日付である2024年8月9日現在、当社が発行および販売した合計は 4,248,588 株式分配契約に基づく普通株式の総純収入は146,250%、そしてまだ発行可能な株式はありません。
7。 その他の包括利益(損失)の累計
株主資本には、2024年6月30日までの3か月および6か月間のその他の包括利益(損失)の累計に次の活動が含まれていました。
| | | | | | | | | | | | | | |
| | 2024年6月30日に終了した3か月間 | | 2024年6月30日に終了した6か月間 |
| | | | |
| 未実現投資純利益(損失): | | | | |
| 期首残高 | | $ | (32) | | | $ | 3 | |
| | | | |
| | | | |
その他の包括利益 (損失) (1) (2) | | 29 | | | (6) | |
| 期末残高 | | (3) | | | (3) | |
| | | | |
| 外貨換算調整: | | | | |
| 期首残高 | | (74) | | | (68) | |
その他の総合損失(1) | | (1) | | | (7) | |
| | | | |
| 期末残高 | | (75) | | | (75) | |
| | | | |
期首累計その他の包括損失の合計 | | (106) | | | (65) | |
その他の包括利益 (損失) の合計 | | 28 | | | (13) | |
期末累計その他の包括損失の合計 | | $ | (78) | | | $ | (78) | |
| | | | |
(1) ありました いいえ その他の包括損失に対する税金で、期間中のその他の包括利益(損失)の累積から再分類された金額はありません。
目次
バイオヘイブン製薬持株会社株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
7。その他の包括利益(損失)の累積(続き)
株主資本には、2023年6月30日までの3か月および6か月間のその他の包括利益(損失)の累計に次の活動が含まれていました。
| | | | | | | | | | | | | | |
| | 2023年6月30日までに終了した3か月間 | | 2023年6月30日までの6か月間 |
| | | | |
| 未実現投資純利益(損失): | | | | |
| 期首残高 | | $ | (278) | | | $ | (145) | |
再分類前のその他の包括的損失(1) | | (1) | | | (156) | |
その他の包括損失の累積から再分類された金額(1)(2) | | 17 | | | 39 | |
その他の包括利益 (損失) (1) | | 16 | | | (117) | |
| 期末残高 | | (262) | | | (262) | |
| | | | |
| 外貨換算調整: | | | | |
| 期首残高 | | 444 | | | 429 | |
その他の総合損失(1) | | (162) | | | (147) | |
| | | | |
| 期末残高 | | 282 | | | 282 | |
| | | | |
期首累計その他の包括利益の合計 | | 166 | | | 284 | |
その他の包括損失の合計 | | (146) | | | (264) | |
期末累計その他の包括利益の合計 | | $ | 20 | | | $ | 20 | |
| | | | |
(1) ありました いいえ その他の包括利益(損失)に対する税金、および期間中のその他の包括利益(損失)の累積から再分類された金額に対する非重要税金。
(2) 特定債務証券のその他の包括利益(損失)の累積から再分類された金額は、要約連結損益計算書および包括損失を差し引いたその他の収益(費用)に含まれます。
8。 現金以外の株式ベースの報酬
現金以外の株式ベースの報酬費用
当社は、付与日に報奨の公正価値に基づいて非現金株式ベースの報酬を測定し、現金以外の株式ベースの報酬は、報奨の必要なサービス期間にわたる費用として認識しています(一般的に 三年)直線方式を使います。 株式オプション、制限付株式ユニット(「RSU」)、パフォーマンス・シェア・オプション、および従業員株式購入制度(「ESPP」)の費用で構成される、現金以外の株式ベースの報酬費用は、要約連結営業報告書および包括損失で次のように分類されています。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 6月30日に終了した3か月間 | | 6月30日に終了した6か月間 |
| | 2024 | | 2023 | | 2024 | | 2023 |
研究開発費 | | $ | 7,071 | | | $ | 2,457 | | | $ | 28,362 | | | $ | 4,698 | |
一般管理費 | | 5,161 | | | 2,238 | | | 18,747 | | | 3,762 | |
| 現金以外の株式ベースの報酬費用の総額 | | $ | 12,232 | | | $ | 4,695 | | | $ | 47,109 | | | $ | 8,460 | |
シェアオプション
すべての株式オプションの付与は、付与日に公正価値で授与されます。株式オプションの公正価値は、Black-Scholesオプション価格モデルを使用して見積もられます。ストックオプションは通常期限切れになります 10 付与日から数年後。
株式オプションの総本質的価値は、2024年6月30日の当社の普通株式の公正価値よりも行使価格が低い株式オプションの行使価格と当社の普通株式の公正価値との差として計算されます。
2024年6月30日現在、未確定株式オプションに関連する未認識の報酬費用の総額は90,206これは、加重平均期間にわたって評価されると予想されます 2.33何年も、支配権の変更の影響を考慮していません。2024年6月30日および2023年6月30日までの6か月間に当社の株式オプションプランに基づいて付与された株式オプションの1株あたりの加重平均付与日公正価値は、$でした30.76 と $10.16それぞれ。会社は期待しています
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
8。現金以外の株式ベースの報酬(続き)
おおよそ 7,978,678 必要なサービス期間にわたって権利が確定する未確定ストックオプションの。
次の表は、2024年6月30日までの6か月間の当社の株式オプション活動の概要です。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | の数 株式 | | 加重 平均 エクササイズ 価格 | | 加重 平均 残り 契約上 期間 | | 集計 固有の 価値 |
| | | | | | | (年単位) | | |
2023年12月31日時点で未処理です | | 11,379,429 | | $ | 11.48 | | | | | |
| 付与されました | | 2,500,161 | | $ | 42.05 | | | | | |
| 運動した | | (295,890) | | $ | 9.00 | | | | | |
| 没収 | | (38,684) | | $ | 20.38 | | | | | |
2024年6月30日の時点で未処理です | | 13,545,016 | | $ | 17.15 | | | 8.68 | | $ | 256,022 | |
2024年6月30日に行使可能なオプション | | 5,566,338 | | $ | 13.44 | | | 8.54 | | $ | 122,803 | |
2024年6月30日の時点で権利が確定し、権利が確定する見込みです | | 13,545,016 | | $ | 17.15 | | | 8.68 | | $ | 256,022 | |
制限付株式単位
会社のRSUは非既得株式報奨と見なされ、従業員からの支払いは必要ありません。各RSUについて、従業員は受け取ります 一 権利確定期間終了時の普通株式。従業員は受け取るかどうかを選択できます 一 税金を差し引いた普通株式、または別途税金を払って全株を受け取ります。報酬費用は、付与日の当社の普通株式の市場価格に基づいて計上され、必要なサービス期間にわたって定額法で計上されます。
2024年6月30日の時点で、$がありました9,405 権利が確定すると予想される会社のRSUに関連する、認識されていない報酬費用の総額の。これらの費用は、加重平均期間にわたって計上されると予想されます 2.53 何年も、支配権の変更の影響を考慮していません。2024年6月30日までの3か月と6か月間に権利が確定したRSUの公正価値の合計は3,770。
次の表は、2024年6月30日までの6か月間のRSU活動の概要です。
| | | | | | | | | | | | | | |
| | 株式数 | | 加重平均付与日公正価値 |
2023年12月31日時点で権利が確定していません | | — | | | $ | — | |
付与されました | | 356,011 | | | $ | 42.34 | |
没収 | | (3,280です) | | | $ | 41.93 | |
既得 | | (89,059) | | | $ | 42.34 | |
2024年6月30日の時点で権利が確定していません | | 263,672 | | | $ | 42.34 | |
要約連結財務諸表の索引
バイオヘイブン製薬持株会社株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
9。 一株当たり純損失
Biohavenの普通株主に帰属する基本および希薄化後の1株当たり純損失は次のように計算されました。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | 6月30日に終了した3か月間 | | 6月30日に終了した6か月間 |
| | 2024 | | 2023 | | 2024 | | 2023 |
| 分子: | | | | | | | | |
| | | | | | | | |
| 純損失 | | $ | (319,771) | | | $ | (90,346) | | | $ | (499,275) | | | $ | (160,838) | |
| 分母: | | | | | | | | |
加重平均発行済普通株式—基本株と希薄化後普通株式 | | 87,766,069 | | | 68,248,023 | | | 84,174,099 | | | 68,227,564 | |
| 1株当たりの純損失 — 基本損失、希薄化後 | | $ | (3.64) | | | $ | (1.32) | | | $ | (5.93) | | | $ | (2.36) | |
当社の潜在的な希薄化有価証券には、1株当たりの純損失が減少する効果があるため、希薄化後の1株当たり純損失の計算から除外されている株式オプションが含まれます。したがって、当社の普通株主に帰属する基本および希薄化後の1株当たり純損失の計算に使用される発行済み普通株式の加重平均数は同じです。 当社は、各期末の発行額に基づいて提示された以下の潜在的な普通株式を、示された期間の普通株主に帰属する希薄化後の1株当たり純損失の計算から除外しました。それらを含めると、希薄化防止効果が生じるためです。
| | | | | | | | | | | | | | |
| | | 6月30日現在、 |
| | | 2024 | | 2023 |
| 普通株式を購入するオプション | | 13,545,016 | | | 9,639,557 | |
| 普通株式を購入するワラント | | 294,195 | | | — | |
制限付株式単位 | | 263,672 | | | — | |
| 合計 | | 14,102,883 | | | 9,639,557 | |
10。 ライセンス、買収、その他の契約
当社は、特定のノウハウ、技術、特許権に対する権利を会社に提供するさまざまなライセンス契約、開発契約、買収契約を締結しています。契約には通常、前払い料金、開発、規制、商業、販売に関する特定のマイルストーンの達成時のマイルストーンの支払い、および販売が含まれます。
ロイヤリティに基づいています。パーセンテージは契約によって異なります。
ライセンスおよびその他の契約
2024年6月30日現在、当社は、ライセンスおよびその他の契約に基づき、開発、規制、および商業上のマイルストーンの支払いを予定しています。最大約$です140,650, $641,975、および $2,150,450それぞれ。これらの契約の詳細な説明については、以下を参照してください。当社は、これらの潜在的な偶発的対価の支払いを負債として添付の要約連結貸借対照表に記録していません。これは、マイルストーン支払いのきっかけとなる将来の事象のいずれも、2024年6月30日に発生する可能性は考えられなかったためです。
イェール大学契約
2013年9月、当社はイェール大学と独占ライセンス契約(「イェール契約」)を締結し、一般的な不安障害、心的外傷後ストレス障害、うつ病などのさまざまな神経疾患の治療におけるリルゾールの使用に関連する、それらの特許権の開発から生じる製品およびプロセスの商業的開発、製造、流通、使用、販売に関する特定の特許権のライセンスを取得しました。
イェール協定は2019年5月に修正され、改訂されました。2024年6月30日現在、修正されたイェール大学協定に基づき、当社には規制当局の条件付承認マイルストーン支払いが最大$まで残っています2,000 そして、ライセンス特許またはトリリルゾールをベースにした製品からのリルゾールベースの製品の純売上高に基づいて、一桁台前半の低い割合の年間ロイヤリティ支払いを行います。修正および改訂された契約では、ロイヤリティレートは元の契約と比較して引き下げられます。さらに、修正および改訂された契約に基づき、当社はリルゾールまたはトリルゾールをベースにした製品を開発する場合があります。修正され改訂された契約では、最低年間ロイヤルティは最大$です1,000 契約に基づく製品の最初の販売後から、1年につき。会社がイェール大学契約に基づいてサブライセンス権を付与する場合、受け取るサブライセンス収入のうち、イエール大学に1桁という低い割合を支払わなければなりません。
2024年と2023年6月30日に終了した3か月と6か月の間、当社は いいえイェール大学契約に基づく重要なマイルストーンやロイヤリティの支払いを記録します。
2021年1月、当社はイェール大学と世界規模の独占ライセンス契約を締結しました
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
10。ライセンス、買収、その他の契約(続き)
新しい細胞外タンパク質の分子分解剤(「MoDE」)プラットフォーム(「エールモード協定」)の開発と商品化のための大学。このプラットフォームは、多機能分子を使用してリソソーム分解の対象とすることで、病気の原因となるタンパク質やその他の生体分子を除去するためのものです。Yale MoDe契約には、最低年間最大$のロイヤルティを支払う義務が含まれています1,000 年間、そしてライセンス製品の純売上高に対する一桁台前半のロイヤリティ。会社がイェールモード契約に基づいてサブライセンス権を付与する場合、受け取るサブライセンス収入のうち、イェール大学に1桁という低い割合を支払わなければなりません。2024年6月30日現在、イェールモード協定に基づき、当社は偶発的な開発および商業マイルストーンの支払いを最大$まで残しています650 と $2,950それぞれ。イェールモード協定は、次の日付で終了します 二十年 発効日から、 二十年 ライセンス製品の最初の治験中の新薬申請の提出日から、またはライセンス特許の最後の有効期限が切れる日から。
会社がやった いいえ2024年6月30日までの3か月間の、イェールモード契約に基づく重要なマイルストーンやロイヤリティの支払いを記録します。2024年6月30日までの6か月間、当社は$の研究開発費を計上しました150 イェールモード協定に基づく開発上のマイルストーンの達成に関するものです。2023年6月30日までの3か月と6か月の間、当社は いいえイェールモード契約に基づく重要なマイルストーンやロイヤリティの支払いを記録します。
ALS バイオ医薬品契約
2015年8月、当社はALSバイオファーマおよびフォックスチェースケミカルダイバーシティセンター株式会社(「FCCDC」)と契約(「ALSバイオファーマ契約」)を締結しました。これに基づき、ALSバイオファーマとFCCDCは、当社の世界特許権を複数の家族に譲渡しました 300 トリリルゾールを含むグルタミン酸調節剤のプロドラッグ、およびその他の革新的な技術。ALSバイオ医薬品契約に基づき、当社は特許製品の商業化と市場開拓に商業的に合理的な努力を払う義務があります。2024年6月30日現在、ALSバイオ医薬品契約に基づき、当社には規制当局の条件付承認マイルストーンの支払いが最大で残っています4,000また、ALSバイオ医薬品契約に基づいてライセンスされた製品の純売上高に基づく、一桁台前半という低い割合のロイヤリティの支払いも四半期ごとに支払われます。
ALSバイオ医薬品契約は、最後の特許権が失効すると国ごとに終了します
そのような国のそれぞれで。会社が対象となるすべての製品の開発、研究、ライセンス、または販売を放棄した場合 一 またはALSバイオファーマ契約に基づいて譲渡された特許または特許出願に対するその他の請求、または会社が事業を停止した場合、該当する特許権をALSバイオファーマに再譲渡することに同意しました。
2024年と2023年6月30日に終了した3か月と6か月の間、当社は いいえALSバイオ医薬品契約に基づく重要なマイルストーンやロイヤリティの支払いを記録します。
タルデフグローベップアルファ使用許諾契約
2022年2月、知的財産の譲渡を受けて、当社は、フェーズ3対応の新規抗ミオスタチンアドネクチンであるタルデフグローベップアルファ(BMS-986089としても知られています)の開発および商品化権について、BMSとワールドワイドライセンス契約を締結したと発表しました(「タルデフグロベップアルファライセンス契約」)。
2024年6月30日現在、Taldefgrobep Alfaライセンス契約に基づき、会社には規制当局の条件付承認マイルストーン支払いが最大で残っています20万、また、10代前半から20代前半までの段階的な売上ベースのロイヤリティパーセンテージもあります。Taldefgrobep Alfaライセンス契約に関連して、BMSへの前払いや偶発的な支払いはありませんでした。
2024年と2023年6月30日に終了した3か月と6か月の間、当社は いいえTaldefgrobep Alfaライセンス契約に基づく重要なマイルストーンやロイヤリティの支払いを記録します。
杭州ハイライトル製薬株式会社との契約株式会社。
2023年3月、当社と杭州ハイライトル製薬有限公司Ltd.(「Highlightll」)は、世界的に(中華人民共和国とその領土および所有物を除く)独占的なライセンス契約(「Highlightll契約」)を締結しました。これに基づき、BiohavenはHighlightllの脳浸透性デュアルTYK2/JAK1阻害剤プログラムの研究、開発、製造、および商品化の権利を取得しました。Highlightll契約に関連して、会社はHighlightllに$を現金で支払う義務がありました10,000 そして 721,136 クロージング後の特定の業務が完了すると、普通株式(総称して「ハイライト前払い」)。2023年12月、当社はHighlightll契約の第2改正を締結しました。これにより、開発中の選択的TYK2阻害剤について、独占的な選択肢と最初に拒否する権利が当社に与えられました
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
10。ライセンス、買収、その他の契約(続き)
Highlightllまたはその関連会社によって、または代理して、Highlightllの前払いの支払いを規定しました。その結果、会社は$を稼ぎました10,000 現金での支払いと発行 721,136 株式、価値はドルです21,814 2023年第4四半期のハイライト。これは、2023年の第4四半期に研究開発費として計上されました。
2024年6月30日現在、Highlightll契約に基づき、当社には偶発開発、規制当局の承認、および最大$の商業マイルストーンの支払いが残っています75,000, $37,500、および $837,500それぞれ。さらに、当社は、純売上高に対するロイヤリティの支払いを一桁台半ばから始まり、ピーク時には10桁台前半までという段階的なロイヤリティの支払いを行うことに合意しました。ロイヤリティ期間中、当社が中国国家医療製品管理局に提出するのに十分な中国の臨床施設を第3相試験に含めることを提案し、Highlightllが独自の裁量で同意した場合、Highlightllは承認時に中国での販売について下位10桁のロイヤリティを当社に支払います。
Highlightll契約は、ロイヤルティ期間の満了時に国ごとに終了し、重大な違反や破産などの特定の出来事が発生した場合にも終了できます。
2024年と2023年6月30日に終了した3か月と6か月の間、当社は いいえHighlightll契約に関連する重要なマイルストーンやロイヤリティの支払いを記録します。
その他の契約
上記の契約に加えて、当社は他のさまざまなライセンス契約や開発プログラムを締結しています。当社は、マイルストーンやその他の支払い(研究契約のための資金調達を含む)を、これらの契約に基づいて研究開発費と包括的損失を要約した連結営業報告書に記録しています。 この期間に記録された金額は次のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | |
| | | 6月30日に終了した3か月間 | 6月30日に終了した6か月間 |
| | | 2024 | | 2023 | 2024 | | 2023 |
マイルストーン支払い | | $ | 375 | | | $ | — | | $ | 1,875 | | | $ | — | |
| | | | | | | |
2024年6月30日および2023年6月30日に終了した3か月と6か月間、当社はこれらの契約に基づく前払いを行いませんでした。
買収
Kv7プラットフォームの買収
2022年4月、当社は、2022年2月24日付けの購入契約に基づき、KnoppのKv7チャネルターゲティングプラットフォームの資産を所有するKnoppの完全子会社であるChannel Biosciences、LLC(「Channel」)からの買収(「Kv7プラットフォームの買収」)を完了しました。
購入契約に基づき、当社は、主要資産であるBHV-7000(以前はKb-3061として知られていました)の米国、ヨーロッパ、中東、アジア(「EMEA」)と日本での承認、その他の適応症および追加の国の承認におけるKv7パイプライン開発の開発および規制上のマイルストーン、および商業販売ベースのマイルストーンを通じて、開発および規制上のマイルストーンに基づいて成功に基づく支払いを行うことに合意しました。BHV-7000の。さらに、当社は、BHV-7000とパイプラインプログラムのロイヤルティ支払いを現金で段階的に行うことに合意しました。パーセンテージは1桁台前半から始まり、BHV-7000では10桁台前半でピークに達し、パイプラインプログラムでは一桁台半ばから始まり、10桁台前半でピークに達しました。
2024年5月、当社はKnopp改正案を締結しました。これにより、両当事者は、BHV-7000およびパイプラインプログラムについて、1桁台の高額から10代前半までのロイヤルティ支払い義務を、一桁台半ばの定額ロイヤリティ支払いに置き換えることに合意しました。両当事者はまた、購入契約に基づいて支払われる成功ベースの支払い額を減らすことにも合意しました。当社は、バイオヘイブンの選挙時に、これらの偶発的なマイルストーン支払いを現金または当社の普通株式で支払うことができます。ただし、会社が会社の普通株式で支払うことを選択した場合も同じ増額が適用されます。2024年6月30日現在、修正された購入契約に基づき、会社の成功に基づく支払いの残額は、(i) から最大$まででした185,000 BHV-7000の米国およびEMEAの規制当局の承認に基づいており、(ii)最大$の追加料金が適用されます60,000 他のKv7パイプラインプログラムに関する米国の規制当局の承認に基づいています。
相続に基づく支払いおよびロイヤルティ支払い義務の改訂を考慮して、当社はKnoppに発行することに同意しました 1,872,874 会社の普通株式、価値は約$です75,000、Knopp改正(「2024年追加対価」)の施行日から60日以内の私募と、おおよその価値の追加の会社普通株式75,000 実行1周年記念日から60日以内に
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
10。ライセンス、買収、その他の契約(続き)
クノップ改正(「2025年追加考慮事項」)。同社はまた、Knoppが2024年の追加対価を表す当社の普通株式を引き続き保有し、当該株式の価値が下落した場合(「2024年のKnopp True-Up」)、およびKnoppが引き続き当社を保有している場合に備えて、2024年12月に当社に1回限りの現金決済を要求するオプションもKnoppに与えました。2025年の追加対価を表す普通株式とその価値が下落した(「2025 Knopp True-Up」)。いずれの場合も、特定の条件が適用されます。
当社は、2024年の追加対価を将来の日に発行するという合意は、ASC 815に基づく固定先渡契約であると結論付けました。そして、ノップ修正の施行日の要約連結貸借対照表では、その約束を先渡契約負債として分類しました。同社は当初、2024年の追加対価に関連する先渡契約の公正価値を$で測定しました75,220これは、2024年6月30日までの3か月間の研究開発費として、要約連結営業報告書と包括損失に記録されました。2024年5月、当社は2024年追加対価を発行しました。金額はおおよその金額です。65,981 $を認識しました9,239 2024年6月30日までの3か月間の先渡契約の決済時利益、要約連結損益計算書を差し引いたもの、および包括損失を差し引いたもの。2024年の追加対価の決済利益は、バイオヘブンの株価の下落により、執行日から発行日にかけて2024年の追加対価の公正価値が下落したことによるものです。詳細については、注記4「金融資産および負債の公正価値」および注記6「株主資本」を参照してください。
2024年の追加対価調整は、正味現金決済の書面によるプットオプションで、定期的に公正価値で測定されます。当社は、2024年の追加対価調整は、当社の株式に対する純現金決済の書面によるプットオプションであり、ASC 815に基づく独立したデリバティブ負債であると結論付けました。したがって、当社は、2024年の追加対価償却額を要約連結貸借対照表の現在のデリバティブ負債として分類しました。当社は当初、2024年の追加対価調整案を公正価値$で記録しました15,540これは、2024年6月30日までの3か月間の研究開発費として、要約連結営業報告書と包括損失に記録されました。その後、会社はデリバティブの公正価値を再測定します
責任を負い、その他の収益(費用)による利益または損失(要約連結損益計算書を差し引いたもの)と包括損失を計上します。会社は$の経費を認識しました590 2024年の追加考慮事項の確約に関連して、2024年6月30日に終了した3か月間です。詳細については、注記4「金融資産および負債の公正価値」を参照してください。
当社は、2025年の追加対価を将来の日付に発行する契約は、ASC 480に基づいて可変数の株式数で決済可能な先渡契約であると結論付け、その約束を要約連結貸借対照表の現在の先渡契約負債として分類しました。同社は当初、2025年の追加対価を公正価値として$で測定していました63,940これは、2024年6月30日までの3か月間の研究開発費として、要約連結営業報告書と包括損失に記録されました。その後、当社は先渡契約負債の公正価値を再測定し、その他の収益(費用)による利益または損失を、要約連結営業報告書と包括損失で差し引いて計上します。会社は$の経費を認識しました1,150% 2025年の追加検討事項に関連して、2024年6月30日までの3か月間です。詳細については、注記4「金融資産および負債の公正価値」を参照してください。
当社は、2025年の追加対価調整は、当社の株式に対する純現金決済の書面によるプットオプションであり、ASC 815に基づく独立したデリバティブ負債であると結論付けました。したがって、当社は、2025年の追加対価償却額を要約連結貸借対照表の非流動デリバティブ負債として分類しました。当社は当初、2025年の追加考慮事項の確定申告を公正価値$で記録しました13,810これは、2024年6月30日までの3か月間の研究開発費として記録されました。その後、当社はデリバティブ負債の公正価値を再測定し、その他の収益(費用)による利益または損失を要約した連結営業報告書と包括損失を差し引いて計上します。会社は$の利益を認識しました1,630 2025年の追加考慮事項の確約に関連して、2024年6月30日に終了した3か月間です。詳細については、注記4「金融資産および負債の公正価値」を参照してください。
Knopp改正案における相続に基づく支払いおよびロイヤルティ支払い義務の改正に関するさらなる検討として、当社はKnoppに購入保証書(「ワラント」)を発行しました。 294,195 1株あたりの購入価格が$の会社の普通株式67.98、
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
10。ライセンス、買収、その他の契約(続き)
特定の開発マイルストーンがあり、会社が特定の時価総額を達成することを条件とします。詳細については、注記6「株主資本」を参照してください。
2024年6月30日の時点で、マイルストーン支払いのきっかけとなる将来の事象はいずれも発生する可能性はなかったため、当社は、Knoppへの残りの偶発的対価の支払いを負債として添付の要約連結貸借対照表に記録していません。
ピラミッド買収
2024年1月、当社は、2024年1月7日付けの契約および合併計画(「ピラミッド合意」)に基づき、ピラミッド・バイオサイエンス株式会社(「ピラミッド」)を買収しました。ピラミッドの買収の対価として、Biohavenは前払いを行いました 255,794 会社の普通株式、価値は約$です10,894。
取得した総資産の公正価値のほぼすべてが単一の識別可能な資産であるIPR&Dに集中していたため、当社はこの購入を資産取得として計上しました。IPR&D資産は将来の代替用途はなく、主にBHV-1510に関するものです。買収で取得した他の資産や負債には重要な価値が割り当てられていませんでした。そのため、上記の前払い金は、添付の要約連結営業報告書に、2024年3月31日に終了した3か月間の研究開発費および包括損失に対する費用として計上されました。
2024年6月30日現在、ピラミッド契約に基づき、会社には (i) 最大$までの成功に基づく支払いが残っています5,000 主要資産であるBHV-1510(以前はPBI-410と呼ばれていました)の開発および規制上のマイルストーンに基づいて、(ii)最大追加$まで30,000 2つ目の資産(以前はPBI-200と呼ばれていました)と(iii)の開発および規制上のマイルストーンに基づいて40,000 BHV-1510の商業販売ベースのマイルストーン用です。開発および規制上の偶発的なマイルストーンの支払いは、バイオヘブンの選挙時に現金またはバイオヘブンの普通株式で支払うことができ、商業販売ベースのマイルストーンは現金で支払う必要があります。
2024年6月30日の時点で、マイルストーン支払いのきっかけとなる将来の事象はいずれも発生する可能性はなかったため、当社は残りの偶発的対価の支払いを負債として添付の要約連結貸借対照表に記録していません。
2024年の第1四半期に、当社はドルを記録しました5,689 要約された連結営業報告書の研究開発費と、ピラミッド契約に基づいて支払期日が到来した開発マイルストーンの包括的損失の 98,129 会社の普通株式。ピラミッド契約の一環として発行される普通株式の説明については、注記6「株主資本」を参照してください。
11。 コミットメントと不測の事態
リース契約
会社は特定のオフィスと研究室のスペースをリースしています。下記のピッツバーグ・センター・アベニュー・リースを除いて、2023年フォーム10-kに含まれる連結財務諸表の注記11「コミットメントと不測の事態」に開示されているリース債務からの重要な変更はありません。
ピッツバーグセンターアベニューリース契約
2024年3月、当社はペンシルベニア州ピッツバーグでラボスペースのリース契約(「ピッツバーグセンターアベニューリース」)を締結しました。これは、当社のイオンチャネルプラットフォームの研究開発を支援し、ピッツバーグでの当社の現在のオペレーティングリースの代わりに使用されます。リースは、建物の大幅な改修が完了した後、2025年半ばに開始される予定で、期間は 122 数か月、延長することもできます 一 追加期間の 60 ヶ月。同社は、ピッツバーグ・センター・アベニュー・リースをオペレーティング・リースとして記録する予定です。当社のピッツバーグ・センター・アベニュー・リースに関する年間契約額は、$からとなります。1,859 に $2,373、基本賃料を引き上げるような追加のテナント改善手当は除きます。
研究への取り組み
当社は、複数の委託製造機関(「CMO」)および委託研究機関(「CRO」)と、当社の前臨床研究および臨床試験に関連する製品とサービスを提供する契約を結んでいます。2024年6月30日現在、当社は いいえ 1年を超える残りの最大研究コミットメント。
補償契約
通常の事業過程において、当社は、特定の事項について、ベンダー、貸主、ビジネスパートナー、その他の当事者にさまざまな範囲と条件の補償を提供する場合があります。これには、そのような契約の違反または以下による知的財産権侵害の申し立てから生じる損失が含まれますが、これらに限定されません
目次
バイオヘイブン株式会社
要約連結財務諸表の注記
(千単位の金額、1株あたりの金額を除く)
(未監査)
11。コミットメントと不測の事態(続き)
第三者。さらに、当社は、取締役会のメンバーおよび執行役員と補償契約を締結しています。この契約では、とりわけ、その地位または勤続によって発生する可能性のある特定の負債に対して補償することを会社に要求しています。これらの補償契約に基づいて会社が将来支払う必要がある可能性のある最大支払い額は、多くの場合、無制限です。会社の修正および改訂された覚書と定款には、特定の状況における取締役および役員の補償も規定されています。これまでのところ、そのような補償条項の結果として、会社に材料費は一切発生していません。当社は、補償契約に基づく請求の結果が自社の財政状態、経営成績、またはキャッシュフローに重大な影響を与えるとは考えていません。また、2024年6月30日または2023年12月31日現在の要約連結財務諸表には、そのような債務に関連する負債は発生していません。
ライセンス、買収、その他の契約
当社は、さまざまな当事者とライセンス契約、開発契約、買収契約を締結しており、その契約に基づき、偶発的支払いと非偶発的支払いを行う義務があります(注記10「ライセンス、買収、その他の契約」を参照)。
その他の契約
モーダ契約
2021年1月1日、当社はModa Pharmaceuticals LLC(以下「Moda」)とコンサルティングサービス契約(「Moda契約」)を締結しました。これは、当社が所有または管理する技術、創薬プラットフォーム(Yale Mode契約に基づいてライセンスされた技術を含む)、製品候補および関連する知的財産の科学的進歩を促進することを目的としています。
モーダ契約に基づき、会社はモーダに$の前払いを現金で支払いました2,700 そして 37,836 約$相当の元親会社の株式3,243。さらに、Modaは最大$の追加開発および規制マイルストーン支払いを受け取る資格があります81,612 と最大$の商業マイルストーンの支払い30,171。モーダ協定の期間は 四年間 また、特定の状況下では、会社またはModaによって早期に終了される場合があります。たとえば、会社がModeプラットフォームに関する調査を中止したり、デフォルトになったりした場合などです。2023年8月、当社はモーダとモーダ協定の改正を締結しました。改正により、Modaは開発を受ける資格があり、
規制上のマイルストーンの支払い額は最大$です25,200% と最大$の商業マイルストーンの支払い23,000、上記のマイルストーンに加えて。
当社は、2024年6月30日までの3か月間、モーダ契約に関連する重要なマイルストーン支払いを記録しませんでした。2024年6月30日までの6か月間、当社は$の研究開発費を記録しました850 モーダ協定に基づく開発上のマイルストーンに関連しています。2023年6月30日までの3か月と6か月の間、当社は いいえモーダ契約に関連する重要なマイルストーンの支払いを記録します。
法的手続き
時々、通常の事業過程において、会社は訴訟や規制上の審査のほか、情報収集要求、問い合わせ、調査の対象となります。2024年6月30日現在、会社の財務に重大な影響を与えるような問題はありませんでした 結果。
12。 所得税
次の表は、2024年6月30日および2023年6月までの3か月と6か月における当社の所得税規定と実効所得税率の比較概要を示しています。
| | | | | | | | | | | | | | | | | | | | | | | |
| | 6月30日に終了した3か月間 | 6月30日に終了した6か月間 |
| | 2024 | | 2023 | 2024 | | 2023 |
所得税規定 | | $ | 177 | | | $ | 2,177 | | $ | 746 | | | $ | 3,116 | |
| 実効所得税率 | | 0.1 | % | | 2.5 | % | 0.1 | % | | 2.0 | % |
2024年6月30日までの3か月と6か月間の所得税引当金が2023年の同時期と比較して減少したのは、主に当社が2023年の第3四半期に米国内国歳入庁によって発行された規則制定案の通知(「通知」)に含まれるガイダンスを採用したためです。この通知により、当社は、米国で発生し、当社の外国の親会社から払い戻された特定の研究開発費を直ちに控除することができます。以前は、これらの支出は、2022年1月1日以降に開始する課税年度に有効だった減税・雇用法に基づいて資産計上する必要がありました。
13。 関連当事者取引
前の親との関係
2022年10月3日の分離の発効により、元親会社は会社の関係者ではなくなりました。
2022年10月3日、当社は元親会社と別居に関連して、移行サービス契約を含む契約を締結しました。元親会社と締結した契約の詳細については、2023年フォーム10-kに含まれる連結財務諸表の注記14「関連当事者取引」を参照してください。会社はしました じゃない 2024年6月30日までの3か月および6か月間に元親会社に提供された移行サービスの重要な収入を記録してください。2023年6月30日までの3か月と6か月間、会社は$を記録しました1,674 と $5,559それぞれ、元親会社に提供された移行サービスを反映したその他の収入に。
関連当事者契約
イェール大学とのライセンス契約
2013年9月30日、当社はイェール大学とイェール協定を締結しました(注記10を参照)。当社の最高経営責任者は、当社がイェール大学からライセンスを受けた特許の発明者の1人であり、そのため、イェール大学との契約に基づいてイェール大学が受け取る可能性のあるグルタミン酸製品関連のロイヤルティ収入の一定の割合を受け取る権利があります。
2021年1月、当社はイェール大学とイェールモード協定を締結しました(詳細は注記10を参照してください)。ライセンス契約に基づき、当社はイェール大学のMoDeプラットフォーム向け知的財産の全世界独占権を取得しました。イェールモード契約に基づき、当社はエールモードSRA(詳細については注記10を参照)を締結しました。これには最大$の資金提供が含まれます4,000 契約期間全体にわたって。2023年5月、当社はイェール大学と追加のスポンサー付き研究契約(「2023年イェールSRA」)を締結しました。これには最大$の資金提供が含まれます612 契約期間中。
2024年6月30日までの3か月と6か月間、当社は$を記録しました582 と $1,027それぞれ、イェールモード協定、イェール合意、および2023年のイェールSRA(総称して「エール協定」)に関連する、特定の管理費を含む研究開発費です。2023年6月30日までの3か月と6か月間、会社は$を記録しました947 と $1,699それぞれ、研究開発費では、
イェール協定に関連する特定の管理費を含みます。2024年6月30日の時点で、当社は じゃない イェール大学にどんな金額でも借りています。
アイテム 2.経営陣による財政状態と経営成績に関する議論と分析
当社の財政状態と経営成績に関する以下の説明と分析は、証券取引委員会(「SEC」)に提出された2023年12月31日に終了した年度のフォーム10-Qの四半期報告書およびフォーム10-kの年次報告書(「2023フォーム10-K」)の他の場所に記載されている要約連結財務諸表と関連事項と併せてお読みください。この議論と分析に含まれている、または当社の事業の計画と戦略に関する情報を含め、フォーム10-Qのこの四半期報告書の他の部分に記載されている記述の一部は、改正された1933年の証券法のセクション27Aおよび改正された1934年の証券取引法のセクション21E(「取引法」)の意味における将来の見通しに関する記述を構成します。これらの将来の見通しに関する記述は、将来の出来事に関する現在の期待と予測に基づいています。以下の情報および将来の見通しに関する記述は、このForm 10-Qの四半期報告書やその他のSECへの提出書類に記載されている要因に照らして検討する必要があります。
当社の実際の結果や特定の出来事のタイミングは、将来の見通しに関する記述に記述、予測、予想、または示された結果とは大きく異なる場合があります。将来の見通しに関する記述は将来の業績を保証するものではなく、当社の実際の業績、財務状況と流動性、および当社が事業を展開する業界の発展などは、とりわけ、フォーム10-Qのこの四半期報告書に含まれる将来の見通しに関する記述と大きく異なる可能性があることを警告します。ここに記載されている記述は、このForm 10-QをSECに提出した日現在のものであり、それ以降の日付では信頼できません。当社の経営成績、財政状態と流動性、および当社が事業を展開する業界の発展が、このフォーム10-Qの四半期報告書に含まれる将来の見通しに関する記述と一致していても、将来の業績や発展を予測できない場合があります。当社は、法律およびSECの規則で特に義務付けられている場合を除き、当社の期待、そのような記述の基礎となる出来事、条件、状況の変化を反映するため、または実際の結果が将来の見通しに関する記述に記載されているものと異なる可能性に影響を与える可能性のある変化を反映するために、そのような記述を公に更新または改訂する義務を一切負いません。
私たちは、私たちの将来の見通しに関する記述は、作成された日付の時点でのみ述べられているので、過度に信頼しないように読者に警告しています。
[概要]
私たちは、免疫学、神経科学、腫瘍学などの主要な治療分野における人生を変える治療法の発見、開発、商品化に焦点を当てたバイオ医薬品企業です。私たちは、実績のある医薬品開発経験と複数の独自の医薬品開発プラットフォームを活用して、革新的な治療ポートフォリオを発展させています。私たちの広範な臨床および前臨床プログラムには、てんかんや気分障害のためのKv7イオンチャネル調節、免疫疾患のための細胞外タンパク質分解、片頭痛と神経障害性疼痛に対する一過性受容体電位メラスタチン3(「TRPM3」)拮抗作用、神経炎症性疾患のチロシンキナーゼ2/ヤヌスキナーゼ1(「TYK2/JAK1」)阻害が含まれます。強迫性障害(「OCD」)と脊髄小脳失調症(「SCA」)のグルタミン酸調節。脊髄性筋萎縮症(「SMA」)を含む神経筋および代謝性疾患に対するミオスタチン阻害と肥満、そしてがんのための抗体動員二重特異性分子(「ARM」)と抗体薬物複合体(「ADC」)。
バイオヘイブン製薬持株会社からの分離
2022年10月3日、バイオヘブン製薬持株会社株式会社(「元親会社」)は、修正されたフォーム10の登録届出書に別紙99.1として添付されたバイオヘブンの情報声明に記載されているバイオヘイブン株式会社の発行済み普通株式の普通株式の所有者への分配(「分配」)と、バイオヘブン株式会社の前親会社からのスピンオフ(「スピンオフ」)を完了しました(「スピンオフ」)。登録。番号 001-41477)。Form 10-Qのこの四半期報告書全体にわたる配布とスピンオフを総称して「分離」と呼んでいます。分離の結果、Biohaven Ltd. は2022年10月3日に独立した上場企業となり、2022年10月4日にニューヨーク証券取引所(「NYSE」)で「BHVN」のシンボルでレギュラーウェイ取引を開始しました。このレポートで過去の事業活動を説明する場合、あたかも元親会社のそのような資産や負債に関連する活動が会社によって行われていたかのように説明します。
臨床段階のマイルストーン
私たちの臨床段階のマイルストーンには以下が含まれます:

グルタミン酸調節プラットフォーム
当社のグルタミン酸受容体拮抗薬プラットフォームの最も先進的な製品候補はトロリルゾール(以前はトリグリルゾールとBHV-4157と呼ばれていました)で、現在OCDの2件の第3相試験が行われており、そのために脊髄小脳失調症3型(「SCA3」)の新薬申請(「NDA」)を米国食品医薬品局と販売承認機関に提出しました。欧州医薬品庁(「EMA」)への申請(「MAA」)。トリリルゾールは、膠芽腫適応型グローバル革新学習環境(「GbM」)の一環として、世界適応研究連合(「GCAR」)によっても評価されています。NCT03970447(「GbM AGILE」)は、新たに診断され再発した膠芽腫(「GBM」)の患者を対象に複数の治療法をテストする、革新的な患者中心の登録用適応型プラットフォーム試験です。他の製品候補には、グルタミン酸N-メチル-D-アスパラギン酸(「NMDA」)受容体のアンタゴニストであるBHV-5500とその経口プロドラッグBHV-5000があります。
トロリルゾール
脊髄小脳失調症
SCAは、主に小脳、脳幹、脊髄の萎縮を特徴とする、超まれで優性遺伝性の神経変性疾患のグループです。SCAの病気の経過は何年にもわたって絶え間なく進行するものであり、必然的に運動機能の臨床的悪化、頻繁な転倒による歩行不均衡、重度の言語障害、嚥下困難、早期死亡につながります。SCAは病原的に関連していると考えられていますが、病気の経過や脳領域の病変はさまざまであることが知られています
異なる遺伝子型の間で。マシャド・ジョセフ病としても知られるSCA3は最も一般的な遺伝子型で、北米では最大6,000人、欧州連合(「EU」)と日本では最大4,600人の患者が罹患しており、世界中のSCAの約30%から50%を占めています。現在、SCAの対症療法や神経保護療法が承認されていません。
2022年5月、当社は、SCA患者を対象とした治験薬であるトリルゾールの有効性と安全性を評価する第3相臨床試験(研究 BHV4157-206)のトップライン結果を発表しました。主要評価項目である運動失調の評価と評価のための修正機能尺度(「f-SARA」)のベースラインから48週目への変化は、研究期間中にプラセボ群の疾患進行が予想よりも少なかったため、SCA集団全体で統計的有意性には達しませんでした。遺伝子型別の有効性測定の事後的事後分析により、SCA3遺伝子型の患者における治療効果が示唆されました(p=0.045、プラセボとのlSMの違い)。転倒のリスク低下は、SCA3集団だけでなく、すべてのSCA遺伝子型でも観察されました。トリリルゾールは、プラセボと同様の有害事象プロファイルを示し、忍容性が良好でした。
さらに実施されたさらなる分析の結果とSCAの衰弱作用に基づいて、2023年5月に、SCA3の治療薬であるトリリルゾールの新薬申請(「NDA」)をFDAに提出したことを発表しました。2023年7月、FDAは、最近提出されたトリリルゾールのNDA申請書が試験の主要評価項目を満たしておらず、したがってトリリルゾールが許可されないことを理由に審査しない旨を通知しました
実質的な見直し。NDA申請に関する規制上の決定のフォローアップとして、SCAデータに関してFDAとフォローアップミーティングを開催しました。
私たちは、SCA3のNDA申請に関する以前に出された提出拒否決定における規制上の懸念に対処するために、SCA開発プログラムと将来の潜在的なデータ分析について、引き続きFDAと建設的な対話を続けています。規制上の相互作用の結果、BiohavenはSCAで3年間治療した後のトリリルゾールの有効性を評価する新しいプロトコルを設計しました。この新しいプロトコルであるBHV4157-206-RWE(NCT06529146)は、現実世界のデータ(「RWD」)ソースを使用して有効性に関する現実世界の証拠(「RWD」)を使用し、最長3年間の治療後のSCAにおけるトリルゾールの治療効果を、米国のSCA自然史コホート(「CRC-SCA」)から収集された外部対照被験者と比較して調べます。データ分析には、以前は入手できず、前回のFDA提出では分析されていなかった新しい患者データが組み込まれます。BHV4157-206-RWEの主要なアウトカム指標は、f-SARAのベースラインからの変化です。このプロトコルは、FDAの業界向けガイダンス「医薬品および生物製剤の規制上の意思決定を支援するための現実世界のデータと現実世界の証拠の使用に関する考慮事項」と一致するように設計されました。プロトコルとSAPは、新たに入手可能な3年間のデータをデータベースロックする前に、FDAによって提出され、審査されました。このプロトコルのトップラインデータは2024年の後半に発表される予定で、陽性であれば、FDAへの新薬申請の基礎となる可能性があります。このトピックに関する今後の規制上の相互作用の結果から引き続き前向きな進展が見込まれる場合は、SCA開発プログラムの最新情報を提供します。
2023年10月、欧州医薬品庁(「EMA」)から、SCAの治療薬としてのトロリルゾール(ダズルマ)の販売承認申請(「MAA」)が検証され、現在EMAのヒト用医薬品委員会(「CHMP」)による審査中であると通知されました。
現在、この非常にまれな遺伝性疾患の治療法が承認されていないため、私たちは引き続き保健当局と緊密に協力してSCA患者にトリルゾールを提供することに全力を注いでいます。
強迫性障害
2017年12月に、OCDの成人を対象としたトリリルゾールの有効性を評価するために、第2/3相二重盲検ランダム化比較試験を開始しました。第2/3相試験の結果は2020年6月に発表されました。標準治療への反応が不十分なOCD患者に補助療法として1日1回投与されたトリリルゾール200mgは、すべての研究時点(4週目から12週目)でイェールブラウン強迫性尺度(Y-BOCS)でプラセボと比較して一貫した数値改善を示しましたが、12週目には主要なアウトカム指標を満たしませんでした。トリルゾール治療を受けた被験者(n = 111)は、4週目にプラセボ治療(n = 115)被験者の-2.9に対してベースラインから-3.4ポイントのY-BOCS改善を示しました [差-0.5、p値 = 0.451]、プラセボ治療を受けた被験者(n = 108)の-3.6に対して-5.1ポイント(n = 96)[差
8週目は-1.5で、p値は0.041]、12週目はプラセボ治療(n = 102)の被験者では-5.9ポイント(n = 99)対-4.9ポイント(n = 99)です [差が-1.0で、p値= 0.220]。トリリルゾールの安全性プロファイルは、その活性代謝物であるリルゾールに関する過去の臨床試験の経験と概ね一致していました。治療で発生した有害事象(「TEAE」)は、ほとんどが軽度であると報告されました。トリリルゾール群の患者の少なくとも5%に発生し、プラセボ群よりもトリリルゾール群の方が頻繁に発生したTEAEは、頭痛、めまい、疲労、眠気、吐き気、鼻咽頭炎でした。
フェーズ2/3の概念実証研究での強いシグナルと、フェーズ2の終了会議でFDAからフィードバックを受けた後、2020年12月にフェーズ3のプログラムへの登録を開始しました。フェーズ3プログラムでは、各試験の総参加者が最大700人になると推定され、主要評価項目は、4、8、10週目のY-BOCS合計スコアのベースラインからの変化です。OCDの第3相プログラムを構成する2つの第3相ランダム化二重盲検プラセボ対照試験が現在進行中です。
2024年1月、OCDに関する2つの第3相試験のうちの最初の試験で、有効性を評価するために事前に計画された中間分析(「IA」)を実施する計画を発表しました。IAは、一次分析対象集団の被験者の約70%が主要評価項目に達した後、独立したデータ監視委員会によって実施される予定でした。データ監視委員会は2024年の第2四半期にIAを検討するために召集され、調査が継続される可能性があることを会社に通知しました。そのため、私たちは引き続きOCDの最初の第3相試験に患者を登録しており、この研究は2025年の第1四半期に完全に登録される予定です。2025年前半に、OCDの最初の第3相調査のトップラインデータを報告する予定です。
OCDの第2相第3相試験のためにも、同様に設計されたIAが事前に計画されています。このIAのトップライン結果は2024年の後半に発表される予定です。
神経膠芽腫
2021年12月、GCARはGbMアジャイルの評価対象としてトリリルゾールを選択しました。gBM AGILEは、最も致命的な脳腫瘍であるGbMと新たに診断され再発した患者を対象に、複数の治療法をテストする、革新的な患者中心の適応型プラットフォーム試験です。トリリルゾールは、新たに診断されたメチル化MgMT、新たに診断された非メチル化MgMT、再発性gBMを含む、試験のすべての患者サブグループで評価されます。トリリルゾールは、GbM単位のグルタミン酸の規制緩和を示す説得力のある証拠に基づいて、GbM AGILEに含めるために選択されました。gBmおよびその他の腫瘍学の適応症におけるトリリルゾールの治療の可能性は、トリリルゾールとその活性部分を用いて実施された最近のいくつかの臨床研究およびトランスレーショナルリサーチ研究によって裏付けられています。
2022年7月、当社とGCARは、GbMアジャイルへの登録が開始されたことを発表しました
トリリルゾールの評価。調査への登録は継続中です。
ミオスタチンプラットフォーム
タルデグローベップアルファ (BHV-2000)
2022年2月、新しいフェーズ3対応抗ミオスタチンアドネクチン、タルデフグローブアルファ(BMS-986089とも呼ばれ、現在はBHV-2000と呼ばれています)の開発および商品化権について、BMSとワールドワイドライセンス契約を結んだことを発表しました。ミオスタチンは骨格筋の成長を制限する天然タンパク質です。骨格筋は健康な筋肉の発達において重要なプロセスであり、除脂肪体重の改善や脂肪組織の喪失につながります。神経筋疾患患者の場合、活性ミオスタチンは、発達および機能上のマイルストーンを達成するために必要な成長を著しく制限する可能性があります。ミオスタチン阻害は、さまざまな小児および成人の神経筋疾患における筋肉量と筋力を高めるための有望な治療戦略です。さらに、前臨床および初期の臨床データから、骨格筋の受容体を介したミオスタチンと下流のシグナル伝達を遮断すると、体脂肪を減らし、除脂肪筋肉量を増やしながら体脂肪を減らしたり、インスリン感受性を改善したりするなど、オーバーウェイトや肥満の人にとって重要な身体的および代謝的変化が生じる可能性があることが示唆されています。Taldefgrobepの新しい作用機序と体組成への独特の影響は、単独療法として、または他の抗肥満薬と組み合わせて使用できることを示唆しています。
脊髄性筋萎縮症
2022年7月、脊髄性筋萎縮症(「SMA」)におけるタルデフグロベップアルファの有効性と安全性を評価するBHV-2000の第3相臨床試験への登録を開始しました。SMAはまれで進行的に衰弱させる運動ニューロン疾患で、発症します
そして筋肉量の増加が損なわれ、進行性の衰弱と筋萎縮、運動機能の低下、生活の質の低下、そしてしばしば死に至ります。第3相プラセボ対照二重盲検試験は、すでに安定した用量のヌシネルセンまたはリスディプラムを服用している参加者、または発芽遺伝子abeparvovec-xioi(Zolgensma)による治療歴がある参加者を対象に、補助療法としてのタルデフグロベックの有効性と安全性をプラセボと比較して評価することを目的としています。この研究は、外来状態やSMAの分類に基づく患者に限定されるものでもなく、この無作為化二重盲検プラセボ対照グローバル試験で約180人の患者をランダム化することを目的としています。現在進行中のSMAの第3相試験に登録された集団のベースライン特性が報告され、対象となる臨床集団とよく一致していることが確認されました。この研究の主要評価項目である32項目の運動機能測定は、SMAの臨床的に意味のある効果を測定するための信頼性が高く検証済みのエンドポイントです。第3相調査のトップラインデータを2024年後半に報告する予定です。
2023年2月、私たちはSMAの治療薬であるタルデフグローベップアルファのファストトラック指定をFDAから受けました。2022年12月、私たちはSMAの治療薬であるタルデフグローベップのオーファンドラッグの指定をFDAから受けました。2023年7月、私たちはSMAの治療薬であるタルデフグロベップアルファのオーファンドラッグの指定を受けました。
2024年4月、FDAがタルデフグロベップアルファに「希少小児疾患」の指定を付与したことを発表しました。この指定により、最終的にSMAの表示が承認された場合、taldefgrobepは優先審査券(「PRV」)を受け取る可能性があります。
代謝障害
肥満は、脂肪組織の過剰および/または異常な沈着による病気であり、現在の世界的な公衆衛生上の危機です。2030年までに、米国の成人の50%、思春期の人口の25%を含め、約10億人が肥満を抱えて生活すると予想されています。肥満関連の罹患率と死亡率の主な要因は、代謝的に活性な内臓脂肪組織と、それに伴う心臓、肝臓、腎臓、筋肉などの臓器内および周囲の脂肪組織の沈着です。
前臨床および臨床データから、抗ミオスタチン療法は、除脂肪筋肉量を増加させながら、総体脂肪や内臓脂肪の減少、インスリン感受性と骨塩密度の改善など、太りすぎや肥満のある人に非常に重要な身体的および代謝的変化をもたらす可能性があることが示されています。
2023年10月、タルデフグローブアルファが肥満マウスモデルで除脂肪量を増加させながら脂肪量を大幅に減らす能力を実証する前臨床データを発表しました。食事誘発肥満のマウスモデルでは、未治療のマウスは脂肪量が31%増加しましたが、タルデフグロベップアルファで治療されたマウスは、車両(プラセボ)で治療したマウスと比較して、除脂肪量がベースラインから25%増加し(p≤.0.001)、ベースライン脂肪の11%を失いました(p≤.0.001)。タルデフグロベップアルファで治療したマウスのインスリンとレプチンのレベルは、未治療のマウスと比較して一貫して低かったです。エネルギー摂取量の減少に一貫して関連しているインクレチン模倣薬(セマグルチドなど)で観察されていることとは逆に、タルデフグローベップアルファと未処理のマウスでは、経時的な食物摂取量の違いはありませんでした。
2024年5月、食事誘発肥満マウスモデルの前臨床データを発表しました。タルデフグロベップアルファとグルカゴン様ペプチド-1(「GLP-1」)アゴニストを併用すると、GLP-1単独の治療と比較して、体重と脂肪量が大幅に減少し、除脂肪筋肉量が大幅に増加することが示されました(下の図を参照)。
2024年の後半に、代謝疾患の管理におけるタルデフグローベップの第2相臨床試験を開始する予定です。この研究では、オーバーウェイトや肥満を抱える成人を対象に、標準治療であるGLP-1療法の補助として、引き締まった筋肉を維持するタルデフグローベップの能力を評価します。規模や主要評価項目、副次評価項目など、潜在的な臨床試験デザインを評価中ですが、まだ確定していません。
イオンチャネルプラットフォーム
Kv7
BHV-7000
2022年4月、2022年2月24日付けの会員権購入契約(「購入契約」)に基づき、ノップのKv7チャネルターゲティングプラットフォームの資産を所有するKnoppの完全子会社であるChannel Biosciences、LLCのKnopp Biosciences LLC(「Knopp」)からの買収を完了しました。Kv7チャネルターゲティングプラットフォームの買収により、拡大を続ける神経科学ポートフォリオにイオンチャネル変調の最新の進歩が加わりました。Kv7プラットフォームの主要資産であるBHV-7000(旧称Kb-3061)は、ニューロンのシグナル伝達とてんかんの過興奮状態の調節に関与する重要なイオンチャネルであるKv7.2/Kv7.3の活性化因子です。
2022年の第2四半期に、BHV-7000の臨床試験申請がカナダ保健省によって承認され、その後、第1相臨床開発が開始されました。ヒト初の単回上昇投与(「SAD」)と複数回上行投与(「MAD」)の研究は終了しました。BHV-7000はどちらの研究でも、すべての用量レベルで良好な耐容性を示し、SAEも用量制限毒性もありませんでした。
2023年に、健康な成人のボランティアにBHV-7000(10、25、または50 mg)を単回投与した後のEEGスペクトルパワーのベースラインからの変化に対するBHV-7000の影響を評価するために設計されたフェーズ1のオープンラベル脳波(「EEG」)研究を開始しました。BHV-7000は、研究したすべての用量で耐容性が高く、EEGデータでは、デルタ周波数帯域での電力増加が最小限で、アルファ、ベータ、およびガンマ周波数帯域でのスペクトルパワーの増加が最も高く、用量依存的に脳のスペクトルパワーが増加することが示されました。BHV-7000がより低い頻度(つまり、デルタ)に与える影響が最小限であることは、BHV-7000の第1相SAD/MAD試験で見られた中枢神経系(「CNS」)の有害事象、特に眠気の発生率が低いことと一致しています。研究結果から、予測された治療濃度でのBHV-7000の中枢神経系活性が確認されています。
脳波研究の結果とSAD/MAD試験の安全性プロファイル、および新しい1日1回の徐放性(「ER」)製剤のPkデータに基づいて、バイオヘブンは、てんかんと気分障害の第2/3相臨床試験で、1日1回のBHV-7000(25mg、50mg、75mg)の3つの経口投与レベルを検討する予定です。Kv7活性化剤を使用したこの投与アプローチにより、これまでこのクラスの薬剤では不可能だった非臨床モデルで有効だったEC50薬物濃度以上またはそれ以下の幅広い範囲にわたる異なる目標濃度の評価が可能になります。
てんかん
てんかんは、私たちがKv7プラットフォームの活性化剤で最初にターゲットにしている病気です。世界保健機関(「WHO」)によると、てんかんは、約350万人のアメリカ人、つまり米国では成人の1.2%以上、子供の0.6%以上、そして世界中で5000万人以上の患者が罹患しています。これは4番目に多い神経疾患であり、多くの患者が発作からの解放に苦労しています。3分の1以上の患者がてんかんを管理するために2つ以上の薬を必要としています。抗けいれん薬の使用には用量制限の副作用が伴うことがよくありますが、私たちの臨床候補であるBHV-7000は、GABAA受容体の関与なしにKv7カリウムチャネルのサブタイプを標的とするように特別に設計されています。GABAA-R活性の欠如は、BHV-7000の治療期間を広げる可能性があり、その結果、副作用プロファイルが改善され、抗けいれん薬を服用している患者によく見られる眠気や疲労が制限されると予想されます。BHV-7000をパイプラインに追加することで、このカリウムチャネルモジュレーターを、現在の治療法では制御できないてんかん患者への潜在的な解決策として提供することを目指しています。
2024年1月、私たちは第3相試験に進むためのFDAとの第2相終了会議を終了し、2つの局所てんかん試験のうちの最初の試験で110を超える世界の臨床施設が選択されたことを発表しました。フェーズ2/3プログラムへの登録は、2024年の第1四半期に開始されました。難治性限局性てんかんにおけるBHV-7000の有効性を評価する2つの重要な研究は、局所てんかんの成人を対象とした28日間の平均発作頻度のベースラインから主要評価項目を変更した、8週間および12週間のランダム化二重盲検プラセボ対照試験として計画されています。限局性てんかん研究の1つではBHV-7000の25mgと50mgの用量を評価し、2番目の研究ではBHV-7000の50mgと75mgの用量を評価します(下の図を参照)。
局所てんかんプログラムに加えて、2024年の第2四半期に特発性全身性てんかん(「IGE」)におけるBHV-7000の第2/3相試験を開始しました。IGEによるBHV-7000の有効性を評価する重要な研究が計画されています
IGEの成人および青年を対象とした2回目の全身性発作までの時間を主要エンドポイントとする、24週間のイベントまでの時間を無作為化、二重盲検、プラセボ対照の24週間のイベント期間試験です(下の図を参照)。
気分障害
米国の成人の約5人に1人が神経精神疾患を患っており、それが今度は不適切な治療、生活の質の低下、障害、および多額の直接的および間接的な費用に関連しています。臨床効果、低い奏効率、重大なリスクと副作用への潜伏期間の長さに限定されない、新しく効果的な治療法の選択肢に対するニーズは未だに満たされていません。動物モデルや臨床試験からの証拠が増えています。Kv7.2/7.3標的薬は、大うつ病性障害(「MDD」)や双極性障害などの気分障害を含むがこれらに限定されない、これらの神経精神疾患の範囲を治療する可能性があることを示唆しています。
大うつ病性障害
2024年の第2四半期に、MDDの治療を目的としたBHV-7000の第2相臨床試験を開始しました。この研究は、約300人の被験者を対象とした6週間の無作為化二重盲検プラセボ対照試験で、主要評価項目はモンゴメリー・アスバーグうつ病評価尺度(「MADRS」)の測定です。トライアルのデザインについては下の図を参照してください。
双極性障害
また、2024年の第2四半期に、双極性障害の治療を目的としたBHV-7000の第2/3相臨床試験を開始しました。この研究は、約256人の被験者を対象とした3週間の無作為化二重盲検プラセボ対照試験で、主要評価項目はヤングマニア評価尺度(「YMRS」)での測定です。トライアルのデザインについては下の図を参照してください。
KCNQ2発達性てんかん性脳症
私たちは現在、KCNQ2遺伝子のドミナントネガティブ変異に起因するまれな小児てんかん性脳症であるKCNQ2発達てんかん性脳症(「KCNQ2-DEE」)の潜在的な治療法としてBHV-7000を模索しています。BHV-7000は、KCNQ2-DEEの治療薬として、米国食品医薬品局(「FDA」)から希少小児疾患指定を受けています。
神経障害性疼痛
私たちは現在、神経障害性疼痛の複数の前臨床モデルにおける当社独自の選択的Kv7.2/7.3活性化剤シリーズのBHV-7000およびその他の化合物の活性を評価しています。
片頭痛
私たちは現在、片頭痛の潜在的な治療法としてBHV-7000を模索しています。Kv7.2/7.3オープナーは、片頭痛の皮質拡散抑制モデルで有意な活性を示しています。
TRPM3イオンチャネル拮抗薬
2022年1月、私たちはルーベンカトリック大学(「KU Leuven」)と、世界中で増加している慢性疼痛疾患患者の割合に対応するために、TRPM3アンタゴニストを開発および商品化するための独占ライセンスおよび研究協力契約を締結しました(「KUルーベン協定」)。TRPM3アンタゴニストプラットフォームは、ルーベン大学の創薬デザイン・創薬センターとイオンチャネル研究室で発見されました。KU Leuven契約に基づき、KU Leuvenの小分子TRPM3アンタゴニストのポートフォリオを開発、製造、商品化する独占的なグローバル権利を取得します。ポートフォリオには有力候補が含まれています。今後はBHV-2100と呼ばれます。
BHV-2100さん
BHV-2100は経口で生体利用可能なTRPM3の小分子アンタゴニストです。TRPM3は、痛みと片頭痛に関連するヒトの組織タイプで発現しており、前臨床モデルとヒト遺伝学の両方で、TRPM3が痛みと片頭痛に関係していることが示されています。
2024年5月、BHV-2100で完了した第1相試験の薬物動態および安全性データが陽性であることを報告しました。その結果、20分で治療用濃度の迅速な吸収が達成されました。500mgまでの単回投与での良好な耐容性プロファイルは、予想される治療用量を上回り、EC90濃度をはるかに上回っています。これらの知見に基づいて、2024年の後半に、BHV-2100を片頭痛の急性期治療の第2相試験と痛みの概念実証研究に進める予定です。
片頭痛
2024年の後半に急性片頭痛を対象としたBHV-2100の第2相試験を開始する予定です。私たちは評価中ですが、試験の規模、予定されている臨床試験の主要評価項目と副次評価項目を含む臨床試験のデザインはまだ完成していません。
神経障害性疼痛
BHV-2100は、神経障害性疼痛の潜在的な非オピオイド治療薬としても開発されています。私たちは、化学療法誘発を含む、神経障害性疼痛のいくつかの前臨床モデルにわたって、疼痛行動を軽減するBHV-2100の能力を評価しています
ニューロパシー、糖尿病性ニューロパシー、神経損傷。同社は、2024年の後半に神経障害性疼痛の概念実証研究を実施する予定です。
TRPM3媒介疾患に関するその他の研究
ルーベン大学協定に基づき、Biohavenは、疼痛やその他の疾患におけるTRPM3の役割に関するルーベン大学でのさらなる基礎研究およびトランスレーショナルリサーチを支援しています。BHV-2100に加えて、TRPM3を介した末梢神経系および中枢神経系の疾患に対して他のリード化合物を最適化しています。
炎症と免疫学プラットフォーム
ティク2/ジャク1
杭州ハイライトル製薬株式会社との契約株式会社。
2023年3月、私たちは杭州ハイライトル製薬株式会社と世界的に(中華人民共和国とその領土と所有物を除く)独占的なライセンス契約を締結しました。株式会社(「Highlightll」)は、これに基づき、Highlightllの脳浸透性デュアルTYK2/JAK1阻害剤プログラムの研究、開発、製造、商品化の権利を取得しました(「Highlightll契約」)。
BHV-8000
免疫系の調節不全は、パーキンソン病、多発性硬化症、アルツハイマー病、筋萎縮性側索硬化症、自己免疫性脳炎など、いくつかの神経変性疾患や神経炎症性疾患に関係しています。慢性的な神経炎症を引き起こす免疫細胞とミクログリアが過剰に活動すると、サイトカインが放出され、白血球が活性化され、神経細胞の損傷、死、神経膠症、脱髄の原因になると考えられています。TYK2とJAK1のシグナル伝達経路は、高度に補完的な免疫シグナル伝達イベントと炎症シグナル伝達イベントを仲介します。TYK2またはjAkキナーゼを阻害する標的を絞った小分子療法は、自己免疫疾患、皮膚疾患、胃腸疾患において個別に強力な有効性が実証されています。TYK2は、FDAの承認を得た最近の末梢薬プログラムからも明らかなように、検証済みの免疫標的であり、臨床開発中の非CNS末梢プログラムも複数あります。TYK2/JAK1の脳浸透阻害剤は、この検証済みの免疫標的を脳疾患にもたらす可能性があります。
現在、脳障害の治療薬として承認されている脳浸透性の選択的二重TYK2/JAK1阻害薬はありません。2023年5月、正常に健康なボランティアを対象とした第1相試験で、BHV-8000(以前のTLL-041)の投与を開始しました。2024年5月、健康な被験者を対象としたBHV-8000を使用した第1相単回および複数回の上昇投与試験の肯定的な結果を報告しました。これには、安全で忍容性の高いプロファイルとともに、ターゲットエンゲージメントの証拠が含まれます。第1相試験では、BHV-8000の脳脊髄液(「CSF」)への曝露も確認されました
CNS内でのバイオマーカーターゲットの関与の証拠。また、2回のFDA会議が無事に終了したことを発表しました。好意的なフィードバックにより、パーキンソン病と新しい適応症であるARIAの予防の登録プログラムが可能になりました。
アルツハイマー病、アルツハイマー病、パーキンソン病、多発性硬化症のアミロイド関連画像異常(「ARIA」)を含む可能性のある神経炎症状態を対象とした、BHV-8000の第2/3相臨床試験を2024年後半に開始する予定です。規模や主要評価項目、副次評価項目など、潜在的な臨床試験デザインを評価中ですが、まだ確定していません。
モード・デグラダーズ
細胞外タンパク質の二重特異性分子分解剤
細胞外タンパク質の分子分解物質(「MODE」)は、病的な循環タンパク質を標的とし、エンドリソソーム経路で分解するために肝臓に誘導する二重特異性分子です。私たちのMoDeプラットフォームは、免疫介在性疾患、がん、その他の疾患の適応症を含む、幅広い治療分野での使用が検討されています。MODESは静脈内または皮下製剤として投与する予定です。2024年には、分解剤プログラムの治験新薬または外国同等物(「IND」)の申請を合計4件開始する予定です。
BHV-1300
BHV-1300はIgG分解剤で、当初は関節リウマチ(「RA」)の治療用に開発中です。関節リウマチは、世界人口の1〜2%が罹患していると推定される慢性の自己免疫疾患です。関節リウマチは主に関節に影響を及ぼし、痛み、腫れ、こわばり、機能喪失を引き起こします。
カニクイザルにおけるBHV-1300の単回投与と複数回投与の効果を評価しました。2023年9月、単回投与の2日後にIgGレベルが75〜80%低下し、3回投与後にIgGレベルが90%以上低下したことを示す確認研究のデータを報告しました。
カニクイドリでは、FcRN阻害剤全体の最大低下は、それぞれ単回投与または複数回投与の開始後約7〜21日以内に60〜80%です。対照的に、BHV-1300の単回投与は、約2日後にIgGを約75〜80%低下させ、3回の急速投与後に90%以上低下させます。BHV-1300への大量曝露期間は、FcRN阻害剤に必要な継続的な曝露と比較して、投与間隔内で約1日です。低アルブミン血症や高コレステロール血症など、動物や人間に見られるFcRN阻害薬のメカニズム関連の負債は予想外で、カニクイコのBHV-1300では発生しません。下降の速度と深さをFCrN阻害剤と比較した下の図を参照してください。
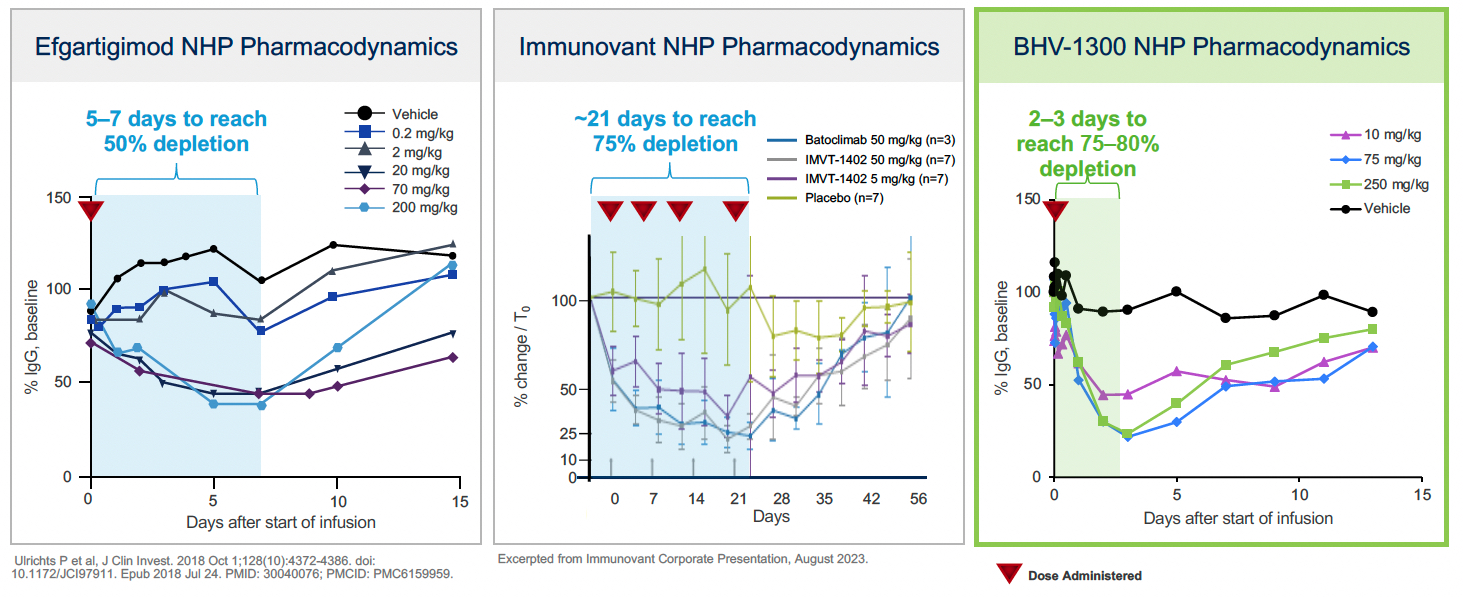
2024年1月、BHV-1300の前臨床薬力学的単回投与データを報告しました。これにより、Biohaven IgG分解技術によりFC含有生物製剤との同時投与が可能になることが実証されました。Humira® のPkは、BHV-1300投与の12時間後に投与しても変化しませんでした(下の図を参照)。
| | |
|
| * BLA 761154、IND 116471、研究番号 r-fkb327-01から改作されました |
BHV-1300を調査する第1相試験は、2024年の第1四半期に開始され、現在も継続中です。2024年5月、BHV-1300の第1相調査の暫定結果を報告しました。健康な被験者を対象としたこれらの結果は、BHV-1300が用量依存的にIgGを迅速かつ選択的に低下させることを報告しました
現在までに完了した最初の4つのコホートです(下の図を参照)。暫定的なIgG低下データはモデリングと一致しており、初期の低用量コホートでも用量および時間依存的なIgG低下が観察されました。一部の被験者は、ベースラインの50〜70%という低いIgG減少を経験しました。BHV-1300は、LFT、アルブミン、LDLコレステロール、その他の血清検査に大きな影響を与えることなく、IgGの減少を示しました。BHV-1300はこれまで安全で耐容性が高く、重篤または重度の有害事象はありません。ほとんどのAEは軽度で、治験薬とは無関係と見なされ、自然に解消しました。IgGに対する分子の選択性から予想されるように、プラセボと比較した場合、投与後の1週間で平均IgA、IgM、またはIgEレベルの有意な低下はありませんでした。バイタルサインや心電図に不利な傾向は見られません。モデルによると、第1相試験のコホートを追加すると、皮下投与と互換性のある用量を利用してIgGを70%以上低下させることができることが示唆されています。
第1相試験では、BHV-1300の静脈内投与と皮下投与も比較されました。BHV-1300の皮下投与は、注射部位反応のない用量同等の静脈内製剤と比較して、予想よりも平均で約44%高い曝露を示しました。この新しいヒトデータは、実現可能性を裏付けています
患者の自己投与型皮下自動注射器によるBHV-1300の便利な投与に関する同社の計画の。同社は、2024年末までに、BHV-1300開発プログラムの最新情報を提供する予定です。
BHV-1310です
BHV-1310は、IgG1、IgG2、IgG4に対してBHV-1300と同じ特異性を持つ次世代の二重特異性IgG分解剤で、当初は全身性重症筋無力症(「gMg」)などの希少疾患や、潜在的に他の急性または慢性疾患、または急性の悪化やフレアを伴う慢性疾患の治療のために開発されました。
MGは神経筋障害で、米国では約36,000〜60,000人が罹患していると推定されています。gMGの患者は、神経細胞と筋細胞の接合部にある重要なシグナル伝達受容体タンパク質を攻撃する抗体を開発し、神経と筋肉の間のコミュニケーションを阻害し、骨格筋の衰弱を引き起こします。
2024年1月、単回投与後にIgGを大幅に削減できるBHV-1310による分解技術の最適化を実証しました(下図を参照)。観察された急激な減少は、BHV-1310が急性期に応用できる可能性があることを示唆しています。2024年の後半にBHV-1310の第1相試験を開始する予定です。規模や主要評価項目、副次評価項目など、潜在的な臨床試験デザインを評価中ですが、まだ確定していません。
BHV-1400です
BHV-1400は、IgA腎症の治療にGD-IgA1を標的とするために開発中の選択的モードです。病原性のGD-IgA1とそれに関連する循環免疫複合体を特異的に除去し、正常なIgAを保存することで、感染リスクを招くことなく寛解できる可能性があります。ASGPRを発現する細胞株を用いたエンドサイトーシスアッセイで、キメラ抗体-ASGPRリガンドコンジュゲートが、通常のIgA1やIgA2とは対照的に、GD-IgA1のエンドサイトーシスを特異的に介在させたこと、そしてMoDe分解剤がこれらの免疫複合体をうまく内在化および分解することを示す予備データを共有しました。私たち
2024年の後半にBHV-1400の第1相試験を開始する予定です。規模や主要評価項目、副次評価項目など、潜在的な臨床試験デザインを評価中ですが、まだ確定していません。
BHV-1600
BHV-1600は、肝臓のASGPR結合と肝細胞分解を通じて、心筋のβ1アドレナリン受容体(「β-1 AR」)に対するすべてのアイソタイプとサブクラスの循環アゴニスト抗体を除去するように設計された選択的モードです。この分子は、β-1 ARに対する自己抗体を持つほとんどの患者に共通する抗原エピトープを模倣するペプチドを使用して作成されました。このペプチドはネイティブを模倣しています
循環している抗体が効率的に捕捉され、その後、ASGPR受容体を介した肝エンドサイトーシスによって除去されるような配列。
拡張型心筋症の治療用にBHV-1600を開発しています。拡張型心筋症は、心筋の収縮が弱くなり、心腔が肥大して心壁が薄くなる状態です。これは心臓弁膜機能不全、不整脈、血栓症、心不全につながる可能性があります。2024年の後半にBHV-1600の第1相試験を開始する予定です。規模や主要評価項目、副次評価項目など、潜在的な臨床試験デザインを評価中ですが、まだ確定していません。
その他の分解剤
現在、2025年にINDsに移行する追加のモード分解剤を開発中です。これらには、抗インスリンおよび抗プロインスリン自己抗体を標的とする当社の分解剤による1型糖尿病の潜在的な治療法、特発性膜性腎症用のホスホリパーゼA2受容体(「PLA2R」)抗体を標的とする分解剤による腎疾患、IgG4を介した希少疾患を標的とするIgG4特異的分解剤、中和抗体を標的とする当社の分解剤による遺伝子治療管理の最適化が含まれますアデノ随伴ウイルス血清型9(「AAV9")。
オンコロジープラットフォーム
CD-38
BHV-1100さん
2021年の第4四半期に、細胞表面タンパク質CD38を発現する多発性骨髄腫細胞を標的にして殺すために、抗体動員分子BHV-1100を自家サイトカイン誘導メモリー様ナチュラルキラー細胞および免疫グロブリンと組み合わせて使用して、多発性骨髄腫患者を対象とした第1相試験/10万試験を開始しました。BHV-1100は、ペプチドリーム株式会社(「ペプチドリーム」)(TYO:4587)との戦略的提携により開発されたバイオヘブンの抗体回収分子(「ARM™」)プラットフォームの主要な臨床資産です。この非盲検単一施設フェーズ1a/10億試験では、自家幹細胞移植(「ASCT」)前の1回目または2回目の寛解で最小残存病変(「MRD+」)の検査で陽性反応を示した、新たに多発性骨髄腫と診断された患者の安全性と忍容性、および探索的有効性のエンドポイントを評価します。新たに多発性骨髄腫と診断された30人の患者を登録する予定です。主なアウトカム指標は、併用製品投与後の用量制限毒性(期間:併用製品投与後100日)と、併用製品に関連する副作用の発生率と重症度(期間:併用製品投与後90〜100日)です。
抗体薬物コンジュゲート
BHV-1510
2024年1月、私たちはピラミッド・バイオサイエンス社(「ピラミッド」)を買収し、BHV-1510を買収しました。
BHV-1510は次世代の栄養膜細胞表面抗原2(「TROP-2」)指向型ADCで、Trop2を発現する癌を対象として、新しいリンカーペイロードと酵素的な部位特異的接合を備えた最適化された次世代コンストラクトを採用しています。がん腫は上皮由来の悪性新生物を指します。がん腫はすべてのがん症例の80〜90%を占め、いくつかの例はADCによる治療に成功しています。豊富なTROP-2の発現は、多くのがんサブタイプで報告されています。
前臨床のTROP-2を発現する腫瘍モデルでは、BHV-1510は、血漿安定性の向上、より強力なin vitro細胞毒性、優れたバイスタンダー効果、および新しいTopoixペイロードによる免疫原性細胞死の増加に加えて、他のTROP-2指向ADCと比較して抗腫瘍活性が向上していることを示しています。カニクイザルのGLP毒性学研究では、安全性の向上と差別化が見られ、幅広い治療指数が示唆されています。BHV-1510は、当社独自のMATEコンジュゲーション技術と同様の好ましい特性を持っています。これにより、非常に安定した部位特異的コンジュゲーションが可能になり、Pk、毒性、製造可能性のプロファイルが良好になります。
BHV-1510用のINDは、2024年1月に米国食品医薬品局によって承認されました。進行した固形腫瘍の患者を対象としたBHV-1510を評価するヒト初の第1/2相試験は、2024年の第2四半期に開始されました。この試験は、標準治療に進行した、または標準治療に耐えられない進行した不治のがんの患者を対象とした、フェーズ1の用量の漸増とフェーズ2の用量拡大の2つの部分で構成されています。フェーズ1の主な目的は安全性です。拡張の推奨用量(「RDE」)または最大耐量を特定することです。フェーズ1の用量漸増は、ベイズの最適間隔設計に基づいて実施され、最低用量は単一の患者コホートとして開始されます。患者は徐々に増えていくコホートで投与され、投与計画は3週間ごとに静脈内投与される予定です。この研究の第2相用量拡大の部分は、特定の腫瘍タイプによって定義される、ランダム化されていない有効性発見拡大コホートで構成され、RDEで治療されてBHV-1510の抗腫瘍活性を推定します。最大約170人の被験者が評価される予定です。
前臨床的には、BHV-1510は細胞毒性、傍観者を殺すこと、免疫原性細胞死を増強した結果、単剤療法としての有効性が向上し、抗PD-1療法との併用で相乗効果が得られることが示されました。INDを可能にする研究では、BHV-1510は、肺毒性がないなど、より進行したTrop-2 ADCと比較して治療マージンが広いことも示しました。これは、臨床効果と安全性プロファイルの向上につながる可能性があります。2024年5月、私たちはリジェネロンファーマシューティカルズ株式会社(「リジェネロン」)と臨床供給契約を締結したことを発表しました。この契約に基づき、計画されている併用臨床試験のスポンサーと資金提供を行い、リジェネロンはLibtayo® を提供します。Libtayo® は、免疫チェックポイント受容体でプログラムされた細胞死タンパク質-1(「PD-1」)を標的とする完全ヒトモノクローナル抗体です。
BHV-1500
BHV-1500は、バイオヘブン独自の部位特異的コンジュゲーション(MATE試薬)を採用した次世代のCD30指向型ADCで、ホジキン病や他のリンパ腫などのCD30発現腫瘍とMMAEペイロードを対象としています。ホジキン病やその他のCD30発現リンパ腫は、悪性リンパ球またはリンパ芽球の制御されない増殖を特徴としています。アドセトリスはホジキンリンパ腫の治療に効果があることが実証されています。
前臨床CD30を発現するマウス腫瘍モデルでは、BHV-1500はアドセトリス(ブレンツキシマブベドチン)と比較して抗腫瘍活性が向上し、サルの安全性、血漿安定性、薬物動態が大幅に改善されたことが示されました。2025年にBHV-1500のINDを提出する予定です。
最近の開発
Knopp購入契約の改正
2024年5月、私たちはKnoppと購入契約の修正(「Knopp改正」)を締結しました。Knopp改正案に基づき、両当事者は、BHV-7000とパイプラインプログラムについて、1桁台の高額から10代前半までのロイヤルティ支払い義務を、一桁台半ばの一律のロイヤリティ支払いに置き換えることに合意しました。両当事者はまた、BHV-7000の米国およびEMEAでの規制当局の承認に基づいて、最大5億6,250万ドルの商業販売ベースのマイルストーンをすべて削除し、開発および規制上のマイルストーン(最大5億7,500万ドルが支払われている)を最大2億1,000万ドルに引き下げることで、購入契約に基づいて支払われる成功ベースの支払いを減らすことに合意しました。他のKv7パイプラインプログラムについては、米国の規制当局の承認に基づいて6,000万ドルです。これらの偶発的なマイルストーンの支払いは、選挙時に現金またはバイオヘブン株で支払うことができます。ただし、バイオヘブン株で支払うことを選択した場合も同じ増額が適用されます。
成功に基づく支払いおよびロイヤルティ支払い義務の改訂を考慮して、ノップ改正(「2024年追加対価」)の実施日から60日以内に、約7,500万ドル相当のバイオヘブン株式1,872,874株を私募により発行し、ノップ修正の実施1周年から60日以内に約7,500万ドル相当のバイオヘブン株式を追加発行することに合意しました。(「2025年に関するその他の考慮事項」)。また、ノップが2024年の追加対価を表すバイオヘイブン株を引き続き保有し、当該株式の価値が下落した場合に備えて、2024年12月に1回限りの現金決済を要求するオプションをKnoppに与えました。また、Knoppが2025年の追加対価を表すバイオヘブン株を引き続き保有していて、そのような株式の価値が下落した場合は、2025年12月に当社に1回限りの現金化支払いを要求するオプションも与えました、いずれの場合も、件名
特定の条件まで。2024年5月、私たちは2024年の追加対価を約6,600万ドルで発行しました。
Knopp改正案における承継ベースの支払いおよびロイヤルティ支払い義務の改訂に関するさらなる検討事項として、特定の開発マイルストーンおよび当社が特定の時価総額を達成することを条件として、294,195株のBiohaven株を1株あたり67.98ドルの購入価格で購入するワラント(「ワラント」)をKnoppに発行しました。
ノップ改正の詳細については、このフォーム10-Qに含まれる添付の要約連結財務諸表の注記4「金融資産および負債の公正価値」、注記6「株主資本」、および注記10「ライセンス、買収、その他の契約」を参照してください。
当社の経営成績の構成要素
収入
現在まで、製品販売による収益は得られておらず、近い将来、製品販売から収益が得られる見込みもありません。製品候補の開発努力が成功し、規制当局の承認や第三者との追加ライセンス契約が結ばれれば、将来、製品販売から収益を上げることができます。
営業経費
研究開発費用
研究開発(「R&D」)費用は、主に製品候補の開発に関連して発生する費用で構成されています。研究開発費は発生に応じて支出します。これらの費用には以下が含まれます:
•受託研究機関(「CRO」)または委託製造機関(「CMO」)、ならびに当社の臨床試験、前臨床研究、その他の科学開発サービスを実施する調査施設やコンサルタントとの契約に基づいて発生する費用。
•製造スケールアップ費用と、製造検証バッチを含む、前臨床および臨床試験材料と市販材料の取得と製造のコスト。
•研究開発業務に従事する従業員の給与、福利厚生、旅費、および現金以外の株式ベースの報酬費用を含む従業員関連費用。
•規制要件の遵守に関連する費用。
•製品候補の規制当局の承認前に発生した開発マイルストーンの支払い。
•リースされたラボ施設と機器にかかる家賃と運営費。そして
•製品候補の規制当局の承認前に、第三者のライセンス契約またはその他の契約に基づいて、現金、株式、またはその他の対価で支払いが行われました。
私たちは、臨床担当者からの見積もりとサービスプロバイダーから提供された情報を使用して、特定のタスクの完了までの進捗状況を評価して、外部開発コストを見積もります。
当社の外部直接研究開発費は、製品候補についてプログラムごとに追跡され、主に、前臨床開発、プロセス開発、製造、臨床開発活動に関連して外部コンサルタント、CRO、CMO、中央研究所に支払われる手数料などの外部費用で構成されています。プログラム別の直接的な研究開発費には、ライセンス契約に基づいて発生する料金や特定の開発マイルストーンも含まれています。従業員費用やその他の間接費を特定のプログラムに割り当てることはありません。これらの費用は複数のプログラムに分散され、個別に分類されないからです。私たちは主に研究開発を監督し、前臨床開発、プロセス開発、製造、臨床開発活動を管理するために内部リソースを使用しています。
臨床開発の後期段階にある製品候補は、主に後期段階の臨床試験の規模と期間が長くなるため、一般的に臨床開発の初期段階の製品候補よりも開発コストが高くなります。人件費を増やし、後期段階の臨床試験を実施し、製品候補の規制当局への提出書類を準備しているため、研究開発費は今後数年間は多額の費用が続くと予想しています。また、製品候補の権利を取得するためのライセンス契約を締結した第三者に支払うマイルストーンに関連する追加費用が発生することも予想されます。
製品候補の開発と商品化が成功するかどうかは非常に不確実です。現時点では、いずれかの製品候補の前臨床および臨床開発を完了するために必要な取り組みの性質、時期、費用、またはもしあれば、当社の製品候補のいずれかから実質的な純キャッシュインフローがいつ始まるかを合理的に見積もったり知ることはできません。この不確実性は、製品の開発と商品化に関連する多くのリスクと不確実性によるものです。その中には、次のような不確実性があります。
•当社の前臨床開発活動、臨床試験、その他の研究開発活動の範囲、進捗状況、成果、費用
•IND有効化研究による適切な安全性プロファイルの確立
•臨床試験への患者登録の成功、および臨床試験の開始と完了。
•該当する規制当局からの販売承認の時期、受領、条件。
•商業生産能力の確立、または第三者メーカーとの取り決め。
•当社の臨床試験や市販開始に使用できる商用グレードの製剤の開発とタイムリーな提供。
•特許請求やその他の知的財産権の取得、維持、防御、執行。
•重要かつ変化する政府規制。
•承認された場合、単独で、または他の企業と共同で、製品候補の商業販売を開始する。そして
•承認後も、製品候補の許容可能な安全プロファイルを継続的に維持します。
一般管理費
一般管理費(「G&A」)は、主に人件費(役員、財務、事業、企業開発、その他の管理機能の給与、福利厚生、旅費)と、現金以外の株式ベースの報酬費用で構成されています。一般管理費には、賃貸料、減価償却費、施設の維持費、保険、消耗品の維持費など、施設費およびその他の関連費用、および知的財産の特許保護を追求するための法的費用を含む広報、監査、税務、法務サービスも含まれます。
研究開発活動を引き続きサポートし、製品候補の開発と承認が成功すれば、製品候補の商品化に備えるため、給与や関連費用を含む一般管理費は今後も多額の費用になると予想しています。また、会計や法務サービス、取締役や役員の保険料、施設やその他の企業インフラに関連する費用、情報技術費などのオフィス関連費用、独立した公開企業としての地位を確立するための特定の費用、独立した上場企業として運営することに関連する継続的な追加費用など、一般業務に関連する費用の増加も予想しています。
その他の利益、純額
その他の収益、純利益は、主に当社の先渡契約およびデリバティブ負債の公正価値の変動と純投資収益で構成されています。
クノップ修正条項に関連して認められた先渡契約とデリバティブ負債の公正価値は、評価される各商品のそれぞれの期間と期間における当社の株価のモンテカルロシミュレーションを使用して決定されます。評価項目と方法論の詳細については、このフォーム10-Qに含まれる添付の要約連結財務諸表の注記4「金融資産と負債の公正価値」を参照してください。これらの負債の公正価値は、要約連結貸借対照表に記録され、公正価値の変動はその他の収益に記録され、要約連結損益計算書と包括損失に差し引かれます。
純投資収益は、実現損益に加えて、利息収入と投資の純増減および償却で構成されます。当社の投資の詳細については、このフォーム10-Qに含まれる添付の要約連結財務諸表の注記3「有価証券」を参照してください。
所得税引当金
要約連結財務諸表の所得税費用は、別の申告方法で計算され、あたかも会社の事業が分離までそれぞれの法域の別々の納税者であったかのように表示されています。現金払い、未収所得税、繰延税金は、評価引当金を差し引いた額で、分離前後の実際の税残高を反映しています。
英領バージン諸島に設立された会社として、私たちは主に英領バージン諸島の課税対象となります。の下に
英領バージン諸島の現行法、当社、および当社がBVIに居住していない人に支払うすべての配当、利息、賃料、ロイヤリティ、報酬、その他の金額、およびBVIに居住していない人が会社の株式、債務、またはその他の有価証券に関して実現するキャピタル?$#@$ンは、BVIの所得税条例のすべての規定から免除されます。
私たちはこれまで、バイオヘイブンファーマシューティカルズ社(「BPI」)とのマスターサービス契約に基づき、プログラムの研究と臨床開発をすべて外部委託してきました。この契約に基づいてサービスを提供した結果、BPIは2024年6月30日と2023年6月30日に終了した3か月と6か月間利益を上げました。当社の子会社であるバイオヘブン・バイオサイエンス・アイルランド・リミテッド(「BBIL」)も同様の取り決めの下で事業を行っています。両社とも、それぞれ米国とアイルランドで課税対象です。そのため、各報告期間の税規定には、BPIとBBILの経営成績の影響が含まれています。
2024年6月30日および2023年12月31日の時点で、当社は、繰延税金資産が実現しない可能性が高いという経営陣の評価に基づいて、主に研究開発税額控除の繰越と純営業損失の繰越で構成される純繰延税金資産に対して引き続き全額評価引当金を維持しました。
当社の所得税規定は、主に、米国とアイルランドにおける子会社の収益性の高い事業に関連する連邦税と州税を表しています。
業務結果
2024年6月30日と2023年6月30日に終了した3か月間の比較
次の表は、2024年および2023年6月30日までの3か月間の当社の経営成績をまとめたものです。
| | | | | | | | | | | | | | | | | | | | |
| | 6月30日に終了した3か月間 | | |
| | | 2024 | | 2023 | | 変更 |
| 数千で | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| 営業経費: | | | | | | |
| | | | | | |
| 研究開発 | | $ | 314,819 | | | $ | 79,490です | | | $ | 235,329 | |
| 一般と管理 | | 18,953 | | | 14,521 | | | 4,432 | |
| 営業費用の合計 | | 333,772 | | | 94,011% | | | 239,761 | |
| 事業による損失 | | (333,772) | | | (94,011) | | | (239,761) | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
その他の収益、純額 | | 14,178 | | | 5,842 | | | 8,336 | |
所得税引当前損失 | | (319,594) | | | (88,169) | | | (231,425) | |
所得税引当金 | | 177 | | | 2,177 | | | (2,000) | |
| 純損失 | | $ | (319,771) | | | $ | (90,346) | | | $ | (229,425) | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
研究開発費用
| | | | | | | | | | | | | | | | | | | | |
| | 6月30日に終了した3か月間 | | |
| | | 2024 | | 2023* | | 変更 |
| 数千単位で | | |
| プログラム別の直接研究開発費: | | | | | | |
BHV-4157(トリルゾール) | | $ | 17,076 | | | $ | 19,141 | | | $ | (2,065) | |
BHV-2000(タルデグローベップアルファ) | | 17,748 | | | 11,078 | | | 6,670 | |
BHV-7000 & BHV-7010 (Kv7) | | 199,250% | | | 9,904 | | | 189,346 | |
BHV-2100(TRPM3アンタゴニスト) | | 4,272 | | | 1,311です | | | 2,961 | |
BHV-8000 (タイプ2/ジャク1) | | 2,675 | | | 1,115です | | | 1,560です | |
BHV-1300(ジグデグレーダー) | | 7,358 | | | 4,220 | | | 3,138 | |
BHV-1310(ジグ・ディグレーダー) | | 3,938 | | | — | | | 3,938 | |
BHV-1400(ギガデグレーダー) | | 7,612 | | | — | | | 7,612 | |
| | | | | | |
BHV-1510 (トロップ 2) | | 3,043 | | | — | | | 3,043 | |
| 他のプログラム | | 1,473 | | | 3,175% | | | (1,702) | |
| 未配分の研究開発費: | | | | | | |
| 人事関連(現金以外の株式ベースの報酬を含む) | | 24,960 | | | 19,280 | | | 5,680 | |
| | | | | | |
| 前臨床研究プログラム | | 18,091 | | | 6,514 | | | 11,577% | |
| その他 | | 7,323 | | | 3,752 | | | 3,571 | |
| 研究開発費の合計 | | $ | 314,819 | | | $ | 79,490です | | | $ | 235,329 | |
*前年の特定の金額が、今年度の表示に合わせて再分類されました
現金以外の株式ベースの報酬費用を含む研究開発費は、2023年6月30日までの3か月間で3億1,480万ドルでしたが、2023年6月30日までの3か月間は7,950万ドルでした。2億3530万ドルの増加は、一部には、2024年6月30日までの3か月間に認められた、BHV-7000およびより広範なKv7プラットフォームに関連するマイルストーンのマイルストーンのためにKnoppに支払われた1億7,190万ドルの一時的な非現金費用と、2024年6月30日までの3か月間に認められたロイヤルティの買い戻しによるものです(この買い戻しにより、将来のマイルストーン支払い額が8億6,750万ドル減少し、高額な金額に取って代わりました)。一桁から10代前半のロイヤリティ支払い義務、一律のロイヤリティ支払い(Kv7プログラムの場合は1桁半ば)。研究開発費の増加は、BHV-7000のフェーズ3の5回の開始、それに続くKv7資産、前臨床研究プログラム、複数の臨床開発プログラムの追加および推進のための直接プログラム支出の増加など、6つの臨床プラットフォームを発展させたことによるものです。このフォーム10-Qに含まれる要約連結財務諸表の注記10「ライセンス、買収、その他の契約」に含まれるKnopp修正の詳細な説明を参照してください。費用の増加は、BHV-7000の5回の第3相開始、その後のKv7資産、前臨床研究プログラムを含む6つの臨床プラットフォームの前進にも関連していました。また、2024年6月30日までの3か月間における複数の臨床開発プログラムの追加および推進のための直接プログラム支出が前年同期と比較して増加したことにも関連しています。
2024年6月30日までの3か月間の現金以外の株式ベースの報酬費用は710万ドルで、2023年の同時期と比較して460万ドル増加しました。現金以外の株式ベースの報酬費用は、主に2023年の第4四半期と2024年の第1四半期に付与された年次株式インセンティブ報奨により、2024年に増加しました。
一般管理費
2023年6月30日までの3か月間の一般管理費は1,900万ドルでしたが、2023年6月30日までの3か月間は1,450万ドルでした。440万ドルの増加は、主に現金以外の株式ベースの報酬費用の増加によるものです。2024年6月30日までの3か月間の現金以外の株式ベースの報酬費用は520万ドルで、2023年の同時期と比較して290万ドル増加しました。現金以外の株式ベースの報酬費用は、主に2023年の第4四半期と2024年の第1四半期に付与された年次株式インセンティブ報奨により、2024年に増加しました。
その他の利益、純額
その他の収益(純利益)は、2023年6月30日までの3か月間の純利益が1,420万ドルでしたが、2023年6月30日までの3か月間の純利益は580万ドルでした。この増加は主に、Knopp修正条項に基づいて発行された2024年の追加対価の先渡契約債務の決済時に記録された920万ドルの利益と、投資収益の増加によるものです。これは他の人の減少によって部分的に相殺されました
2024年6月30日までの3か月間に計上された収入を、前の親会社と締結した移行サービス契約に関連する2023年の同時期との比較。Knopp修正に関連して記録された先渡契約およびデリバティブ負債の説明については、このフォーム10-Qに含まれる添付の要約連結財務諸表の注記4「金融資産および負債の公正価値」を参照してください。
所得税引当金
2024年6月30日までの3か月間、20万ドルの所得税引当金を計上しましたが、
2023年6月30日までの3か月間の220万ドルの所得税引当金。2024年6月30日までの3か月間の所得税支出が2023年と比較して減少したのは、主に、2023年の第3四半期に米国内国歳入庁が発行した規則制定案の通知(「通知」)に含まれるガイダンスを採用したためです。このフォーム10-Qに含まれる要約連結財務諸表の注記12「所得税」にある通知の詳細を参照してください。
2024年6月30日と2023年6月30日に終了した6か月間の比較
次の表は、2024年および2023年6月30日までの6か月間の当社の経営成績をまとめたものです。
| | | | | | | | | | | | | | | | | | | | |
| | 6月30日に終了した6か月間 | | |
| | 2024 | | 2023 | | 変更 |
| 数千単位で | | |
| | | | | | |
| | | | | | |
| | | | | | |
| 営業経費: | | | | | | |
| | | | | | |
| 研究開発 | | $ | 470,791 | | | $ | 142,951 | | | $ | 327,840 | |
| 一般と管理 | | 46,221 | | | 28,842 | | | 17,379 | |
| 営業費用の合計 | | 517,012 | | | 171,793 | | | 345,219 | |
| 事業による損失 | | (517,012) | | | (171,793) | | | (345,219) | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
その他の収益、純額 | | 18,483 | | | 14,071 | | | 4,412 | |
所得税引当前損失 | | (498,529) | | | (157,722) | | | (340,807) | |
所得税引当金 | | 746 | | | 3,116 | | | (2,370) | |
純損失 | | $ | (499,275) | | | $ | (160,838) | | | $ | (338,437) | |
| | | | | | |
| | | | | | |
| | | | | | |
研究開発費用
| | | | | | | | | | | | | | | | | | | | |
| | 6月30日に終了した6か月間 | | |
| | 2024 | | 2023* | | 変更 |
| 数千単位で | | |
| プログラム別の直接研究開発費: | | | | | | |
BHV-4157(トリルゾール) | | $ | 34,163 | | | $ | 37,543 | | | $ | (3,380) | |
BHV-2000(タルデグローベップアルファ) | | 28,876 | | | 17,933 | | | 10,943 | |
BHV-7000 & BHV-7010 (Kv7) | | 224,053 | | | 17,773 | | | 206,280です | |
BHV-2100(TRPM3アンタゴニスト) | | 8,892 | | | 2,026 | | | 6,866 | |
BHV-8000 (タイプ2/ジャク1) | | 6,924 | | | 1,161 | | | 5,763 | |
BHV-1300(ジグデグレーダー) | | 16,583 | | | 4,475 | | | 12,108% | |
BHV-1310(ジグ・ディグレーダー) | | 7,199 | | | — | | | 7,199 | |
BHV-1400(ギガデグレーダー) | | 11,704 | | | — | | | 11,704 | |
BHV-1510 (トロップ 2) | | 22,629 | | | — | | | 22,629 | |
| その他のプログラム | | 1,522 | | | 3,780 | | | (2,258) | |
| 未配分の研究開発費: | | | | | | |
| 人事関連(現金以外の株式ベースの報酬を含む) | | 65,565 | | | 36,959 | | | 28,606 | |
| 前臨床研究プログラム | | 30,717です | | | 13,803 | | | 16,914 | |
| その他 | | 11,964 | | | 7,498 | | | 4,466 | |
| 研究開発費の合計 | | $ | 470,791 | | | $ | 142,951 | | | $ | 327,840 | |
*前年の特定の金額が、今年度の表示に合わせて再分類されました
現金以外の株式ベースの報酬費用を含む研究開発費は、2023年6月30日までの6か月間で4億7,080万ドルでしたが、2023年6月30日までの6か月間は1億4,300万ドルでした。3億2,780万ドルの増加は主に、2024年6月30日までの3か月間に承認されたBHV-7000およびより広範なKv7プラットフォームに関連するマイルストーンのためにKnoppに支払われた1億7,190万ドルの非現金費用と、2024年6月30日までの3か月間に承認されたロイヤルティの買い戻しによるものです(この買い戻しにより、将来のマイルストーン支払い予定額が8億6,750万ドル減少し、1桁台前半から10代前半にスケーリングされました)一律のロイヤリティ支払いが一桁半ば(Kv7プログラムの場合)のロイヤリティ支払い義務。このフォーム10-Qに含まれる要約連結財務諸表の注記10「ライセンス、買収、その他の契約」に含まれるKnopp修正の詳細な説明を参照してください。費用の増加は、BHV-7000の5回の第3相開始、それに続くKv7資産、前臨床研究プログラム、および2024年の複数の臨床開発プログラムの追加および推進のための直接プログラム支出の増加など、6つの臨床プラットフォームを推進したことにも関連していました。BHV-1510の経費が2,260万ドル増加したのは、主にピラミッド買収によるもので、その結果、2024年6月30日までの6か月間に1,090万ドル(現金以外)の費用が研究開発に計上され、150万ドルのマイルストーン支払いが2024年の第1四半期に支払期日となり、570万ドルの非現金マイルストーン支払いが2024年の第1四半期に支払期限となりました。
2024年6月30日までの6か月間の現金以外の株式ベースの報酬費用は2,840万ドルで、2023年の同時期と比較して2,370万ドル増加しました。現金以外の株式ベースの報酬費用は、主に2023年の第4四半期と2024年の第1四半期に付与された年次株式インセンティブ報奨により、2024年に増加しました。
一般管理費
現金以外の株式ベースの報酬費用を含む一般管理費は、2023年6月30日までの6か月間で4,620万ドルでしたが、2023年6月30日までの6か月間は2,880万ドルでした。1740万ドルの増加は、主に現金以外の株式ベースの報酬費用の増加によるものです。2024年6月30日までの6か月間の現金以外の株式ベースの報酬費用は1,870万ドルで、2023年の同時期と比較して1,500万ドル増加しました。現金以外の株式ベースの報酬費用は、主に2023年の第4四半期と2024年の第1四半期に年間株式インセンティブが付与されたため、2024年に増加しました。
その他の収益、純額
その他の収益(純利益)は、2023年6月30日までの6か月間の純利益が1,850万ドルでしたが、2023年6月30日までの6か月間の純利益は1,410万ドルでした。この増加は主に、発行された2024年追加対価の先渡契約負債の決済時に記録された920万ドルの利益によるものです
ノップ改正により、投資収益が増加しました。これは、2024年6月30日までの6か月間に認識されたその他の収益が、前の親会社と締結した移行サービス契約に関連する2023年の同時期と比較して560万ドルの減少によって一部相殺されました。Knopp修正に関連して記録された先渡契約およびデリバティブ負債の説明については、このフォーム10-Qに含まれる添付の要約連結財務諸表の注記4「金融資産および負債の公正価値」を参照してください。
所得税引当金
2024年6月30日までの6か月間の所得税引当金は70万ドルでしたが、2023年6月30日までの6か月間の所得税引当金は310万ドルでした。2024年6月30日までの6か月間の所得税費用が2023年と比較して減少したのは、主に当社が通知を採択したためです。このフォーム10-Qに含まれる要約連結財務諸表の注記12「所得税」にある通知の詳細を参照してください。
流動性と資本資源
創業以来、私たちは収益を上げておらず、多額の営業損失と事業からのマイナスのキャッシュフローを被っています。臨床開発が無事に完了し、製品候補の規制当局の承認を得ない限り、製品販売から収益を上げることはありません。製品候補を発見から前臨床開発、臨床試験まで進め、規制当局の承認を求め、承認された製品候補の商品化を進めるにつれて、少なくとも今後数年間は多額の費用が発生すると予想しています。さらに、製品候補のいずれかについてマーケティング承認を取得した場合、製品の製造、マーケティング、販売、流通に関連する多額の商品化費用が発生すると予想されます。さらに、ライセンス供与や追加の製品候補の取得に関連して費用が発生する場合があります
歴史的に、私たちは主に分離時に元親会社から受け取った現金拠出金と普通株式の売却による収益で事業資金を調達してきました。私たちは創業以来経常損失を被っており、当面の間は営業損失が発生し続けると予想しています。
2024年6月30日現在、当社の現金および現金同等物は2億3,910万ドル、有価証券は1億9,780万ドルでした。当面の必要額を超える現金は、流動性と資本保全の観点から、市場性のある証券やマネーマーケットファンドに投資されます。私たちは、運転資金のニーズ、資本支出の要件、将来の投資または買収を継続的に評価しています。
キャッシュフロー
次の表は、表示されている各期間のキャッシュフローをまとめたものです。
| | | | | | | | | | | | | | | | | | | | | | |
| | 6月30日に終了した6か月間 | | | | |
| | | 2024 | | 2023 | | 変更 | | |
| 数千単位で | | | | | | |
| 営業活動に使用された純現金 | | $ | (270,435) | | | $ | (122,031) | | | $ | (148,404) | | | |
投資活動によって提供された純現金(使用量) | | (63,900) | | | 75,195です | | | (139,095) | | | |
財務活動による純現金 | | 324,546 | | | 6,329 | | | 318,217 | | | |
| 現金、現金同等物および制限付現金に対する為替レートの変動の影響 | | (13) | | | (147) | | | 134 | | | |
現金、現金同等物、制限付現金の純額(減少) | | $ | (9,802) | | | $ | (40,654) | | | $ | 30,852 | | | |
営業活動
営業活動に使用された純現金は、2024年6月30日までの6か月間で2億7,040万ドル、2023年6月30日までの6か月間で1億2,200万ドルでした。2024年6月30日までの6か月間の営業活動に使用された純現金が1億4840万ドル増加したのは、主に、BHV-7000のフェーズ3の5回の開始、それに続くKv7資産、前臨床研究プログラム、および2024年の複数の臨床開発プログラムの追加および推進のための直接プログラム支出が前年同期と比較して増加したことによるものです。この期間の研究開発費には、BHV-1510とBHV-1300のマイルストーン支払い250万ドルが含まれています。
投資活動
2024年6月30日までの6か月間の投資活動に使用された純現金は6,390万ドルでしたが、2023年6月30日までの6か月間の投資活動によって提供された純現金は7,520万ドルでした。2024年6月30日までの6か月間、投資活動に使用された純現金が1億3,910万ドル増加したのは、主に当面の必要額を超える現金を含む有価証券の購入が増加したことによるもので、有価証券(詳細については、要約連結財務諸表の注記3「有価証券」を参照)の満期の増加によって一部相殺されました。
資金調達活動
資金調達活動によって提供された純現金は、2023年6月30日までの6か月間は3億2,450万ドルでしたが、2023年6月30日までの6か月間は630万ドルでした。終了した6か月間の財務活動による純現金の3億1,820万ドルの増加
2024年6月30日の主な要因は、2023年4月の公開株式公開および株式分配契約による普通株式の発行による収益が、いずれも2024年の第2四半期に、前年同期と比較して増加したことによるものです。
2024年4月の公募増資
2024年4月22日、当社は6,451,220株の普通株式の引受公募を終了しました。これには、引受人が1株あたり41.00ドルの価格で追加株式を購入するオプションを全額行使することが含まれていました。引受割引および当社が支払うべきオファリングの費用を差し引いた後のオファリングで調達された純収入は、約2億4,780万ドルでした。このオファリングから受け取った純収入は、一般的な企業目的に使用する予定です。
株式分配契約
2023年10月、私たちは株式分配契約を締結しました。この契約に基づき、総募集価格が最大1億5,000万ドルの普通株式を、当社の代理人または主体である販売代理店を通じて、または販売代理店を通じて随時募集および売却することができます(「株式分配契約」)。当社の普通株式の売却は、もしあれば、「市場での売却」とみなされる売却で行われます。販売代理店は、特定の金額の有価証券を売却する必要はありませんが、販売代理店と当社の間で相互に合意した条件に基づき、通常の取引および販売慣行に沿った商業的に合理的な努力を払って、販売代理店として行動します。私たちは現在、普通株式の市場での募集による純収入を一般的な企業目的に使用する予定です。
2024年6月30日現在、株式分配契約に基づいて2,093,731株の普通株式を売却および発行しており、純収入は約69,890ドルです。2024年6月30日以降、純収入76,360ドルで、さらに2,154,857株の普通株式を発行して売却しました。このレポートの日付である2024年8月9日現在、当社は株式分配契約に基づいて合計4,248,588株の普通株式を発行および売却し、純収入は合計146,250ドルですが、発行可能な株式はまだありません。
クノップ改正
2024年5月、私たちはKnopp改正案を締結しました。これにより、将来のマイルストーン支払い額が8億6,750万ドル削減され、Kv7プログラムでは、1桁台の高額から10代前半までのロイヤリティ支払い義務を、一桁台半ばの一律のロイヤリティ支払いに置き換えました。対価として、2024年の追加対価と2025年の追加対価をKnoppに発行することに合意しました。どちらも現金ではない普通株式の支払いであり、2024年の追加対価と2025年の追加対価の両方について1回限りの現金化にも合意しました。Knopp修正に関する追加情報については、このフォーム10-Qの最新報告書の他の箇所の「最近の動向」を参照してください。
5月30日、2024年の追加対価に関連する先渡契約上の負債を決済するために、6,600万ドル相当の1,872,874株の普通株式をKnoppに発行し、決済により920万ドルの非現金利益を計上しました。クノップ改正に従い、2025年6月30日までに2025年の追加対価を表す普通株式を発行する予定です。
Knoppが2024年12月1日と2025年12月1日に、それぞれ2024年の追加対価と2025年の追加対価を表す当社の普通株式を引き続き保有し、市場価格がそれぞれの参考価格に対して下落した場合、その差額に等しい金額を現金で支払う責任があります。
ノップワラント
Knopp改正に基づくさらなる検討事項として、特定の開発マイルストーンおよび当社が特定の時価総額を達成することを条件として、当社の普通株式294,195株を購入価格67.98ドルで購入するワラントをKnoppに発行しました。
2024年6月30日現在、権利確定条件が満たされておらず、令状はまだ未処理です。
資金要件
私たちは、特に前臨床活動、臨床試験、および製品候補の潜在的な商品化を進めたり拡大したりするにつれて、継続的な活動に関連して費用が増加すると予想しています。次のように、コストも増加します。
•ディスカバリープログラムと臨床段階のアセットの開発を引き続き進め、拡大してください。
•長期安全性研究、薬物間相互作用研究、前臨床毒物学、発がん性研究など、製品候補の規制当局の承認に必要なその他の補助研究を引き続き開始し、進めていきます。
•現在の製品候補および当社が追求する可能性のある将来の製品候補について、追加の適応症について前臨床試験と臨床試験を開始する。
•追加の製品候補または技術の取得またはライセンス供与を通じて、製品候補のポートフォリオを構築し続けます。
•知的財産ポートフォリオの開発、維持、拡大、保護を続けてください。
•臨床試験を無事に完了させた現在および将来の製品候補について、規制当局の承認を求めます。
•マーケティングの承認を得る可能性のある将来の製品候補を商品化するために、販売、マーケティング、流通のインフラストラクチャを確立してサポートします。そして
•臨床、医療、商業、開発の人材を追加で雇います。
フォーム10-Qのこの四半期報告書の日付の時点で、当社の現金、現金同等物、および有価証券は、1年以上にわたる営業および財務上のコミットメント、およびその他の現金要件を満たすのに十分であると予想しています。利益が出るまで、追加の資本を調達する必要があると予想しています。パブリックエクイティまたはプライベートエクイティファイナンス、デットファイナンス、戦略的関係、アライアンス、ライセンス契約、またはそれらの組み合わせによって追加の資本が調達されない場合、運用コストと運転資金のニーズを賄うために、研究開発活動やその他の一般管理費に関連する分野への裁量支出を延期、制限、または削減することがあります。
これらの見積もりは、間違っていると判明する可能性のある仮定に基づいており、利用可能な資本資源を予想よりも早く活用できました。他の製品候補のライセンス取得や買収を行うには、追加の資本が必要になると予想しています。製品候補について規制当局の承認を受けた場合、どこで商品化するか、共同で商品化するか単独で商品化するかによって、製品の製造、販売、マーケティング、流通に関連する商品化費用が発生することが予想されます。
医薬品候補の研究、開発、商品化には数多くのリスクと不確実性があるため、必要な運転資金の正確な金額を見積もることはできません。私たちの将来の資金調達要件は、次のような多くの要因に左右され、その結果として大幅に増加する可能性があります。
•製品候補の研究と開発、および前臨床研究と臨床試験の実施の範囲、進捗状況、結果、費用。
•製品候補の規制審査の費用、時期、結果。
•当社の継続的な成長を支えるための新入社員の雇用にかかる費用と時期
•特許出願の準備、出願、手続き、知的財産権の維持と行使、および知的財産関連の請求の弁護にかかる費用。
•他の製品候補や技術を取得またはライセンス供与する範囲
•売上、またはそれに関連するマイルストーンの支払い、またはロイヤリティのタイミング、受領、金額
現在または将来の製品候補があれば、そして
•その他の資本支出、運転資金要件、およびその他の一般的な企業活動。
収益性を達成するのに十分な製品収益を生み出すことができるようになるまでは、パブリックエクイティとプライベートエクイティの提供、デットファイナンス、その他の第三者資金調達、戦略的提携、ライセンス契約、またはマーケティングと流通の取り決めを組み合わせて、必要な現金資金を調達したいと考えています。株式または転換社債の売却を通じて追加資本を調達する場合、既存の株主の所有権は希薄化され、これらの有価証券の条件には、既存の株主の権利に悪影響を及ぼす清算またはその他の優遇措置が含まれる場合があります。デットファイナンスと優先エクイティファイナンスは、可能であれば、追加債務の発生、資本支出、配当の申告など、特定の行動を取る能力を制限または制限する契約を含む契約が含まれる場合があります。その他の第三者資金調達、戦略的提携、ライセンス契約、またはマーケティングと販売の取り決めを通じて追加の資金を調達した場合、当社の技術、将来の収益源、研究プログラム、または製品候補に対する貴重な権利を放棄するか、または当社にとって不利な条件でライセンスを付与しなければならない場合があります。
契約上の義務とコミットメント
フォーム10-Qのこの四半期報告書の項目1「未監査要約連結財務諸表」に含まれる要約連結財務諸表の注記11「コミットメントと不測の事態」に記載されている場合を除き、2023年フォーム10-kに含まれる監査済み連結財務諸表に含まれる契約上の義務とコミットメントに重要な変更はありませんでした。
重要な会計方針と重要な判断と見積もり
私たちは、米国で一般に認められている会計原則(「GAAP」)に従って、要約連結財務諸表を作成しました。要約連結財務諸表を作成するには、要約連結財務諸表の日付における報告された資産、負債、費用、および関連する開示額に影響する見積もり、仮定、判断を行う必要があります。私たちは見積もりや判断を継続的に評価しています。私たちは、過去の経験や、その状況下では妥当であると私たちが考えるその他のさまざまな要因に基づいて見積もりをしています。その結果は、他の情報源からはすぐにはわからない資産や負債の帳簿価額を判断するための基礎となります。したがって、実際の結果は大きく異なる可能性があります
これらの見積もりから、さまざまな仮定や条件のもとで。
以下の説明を除いて、2024年6月30日までの6か月間、2023年フォーム10-kに含まれる年次連結財務諸表に報告されているように、当社の重要な会計方針に重要な変更はありませんでした。
先渡契約とデリバティブ負債の評価
私たちは、Knopp改正に関連して合意された特定の対価を、先渡契約およびデリバティブ負債として計上しました。これらの負債の公正価値は、バイオヘイブンの株価のモンテカルロシミュレーションに基づいて決定されています。これには、当社の株価のボラティリティに関する判断と仮定が必要です。リスクフリーレートに、現金または可変数の株式で支払われるため、バイオヘブン固有の信用リスクを加えたものを使用して現在価値に割り引かれます。
報告日におけるバイオヘブンの株価のボラティリティに対する私たちの予想は、実際の将来のボラティリティとは大きく異なる可能性があります。もしそうなら、推定公正価値は、決定された公正価値よりも大幅に高いまたは低くなる可能性があることを意味します。
最近発行された会計上の宣言
必要に応じて、当社の財政状態と経営成績に影響を与える可能性のある、最近発行された会計上の声明の説明は、フォーム10-Qのこの四半期報告書の冒頭に記載されている要約連結財務諸表の注記2に開示されています。
アイテム 3.市場リスクに関する量的および質的開示
外貨翻訳
当社の事業には、米国以外の国での活動が含まれます。そのため、当社の財務結果は、外貨為替レートの変動や事業を展開する海外市場の景気低迷などの要因の影響を受けます。貸借対照表の金銭的エクスポージャーは、2024年6月30日現在の財政状態にとって現在のところ重要ではありません。
外貨為替レートの変動に対するヘッジ活動は一切行っていません。
金利リスク
2024年6月30日現在、私たちは超過現金残高を高格付けの金融機関の有価証券と投資適格債務証書に投資しています。私たちは投資を多様化し、個々の機関、満期、投資タイプごとに投資の集中量を制限するよう努めています。当社の有利子証券のほとんどは金利リスクの対象であり、金利が変動すると価値が下落する可能性があります。保有している有価証券の種類に基づいて、
金利の変動が当社の財務諸表に重大な影響を与えるとは考えていません。金利が1.00%増減した場合、投資ポートフォリオの公正価値はそれぞれ約40万ドルと40万ドル増加(減少)します。
金利の変動に対するヘッジ活動は一切行っていません。
株価リスク
私たちは、Knopp改正に基づく潜在的な1回限りの現金化支払いに関連するデリバティブ負債の形で金融負債を保有しています。これらは公正価値で測定され、要約連結営業報告書の純利益(損失)と包括損失で計上されます。これらのデリバティブ負債の公正価値を左右する主な要因は、契約で定義されている参考価格に対する当社の20日間の出来高加重平均株価(「VWAP」)です。参考価格と比較して20日間のVWAPが下がると、負債の公正価値が上がります。
定期的に公正価値で測定されるこれらの金融負債の公正価値、およびこれらの金融負債の評価に使用される観察不可能なインプットに関する詳細情報は、このフォーム10-Qに含まれる添付の要約連結財務諸表の注記4「金融資産および負債の公正価値」および注記10「ライセンス、買収、その他の契約」に記載されています。
信用リスク
会社を信用リスクの集中にさらす可能性のある金融商品には、現金、現金同等物、および短期債務証券があります。当社は、政府の保険限度額を超える現金預金の一部を政府の被保険機関に預けています。当社は、信用の質が高く、そのような口座で損失が発生していないと考えられる金融機関に現金を預けています。当社の現金管理方針は、米国連邦政府および連邦政府機関の証券、社債またはコマーシャル・ペーパー、超国家債およびソブリン債券、特定の適格金融市場投資信託、特定の買戻し契約への投資を許可し、種類および発行体別の信用格付け、満期、集中度に制限を設けています。政府の保険限度額を超えて現金を保有する金融機関による債務不履行や、現金同等物および短期債務証券への投資を保有する企業や政府による債務不履行の場合、要約連結貸借対照表に記録されている範囲で、会社は信用リスクにさらされます。
現金、現金同等物、および短期債務証券に関連する信用損失は発生しておらず、信用損失引当金も計上していません。
アイテム 4.統制と手続き
開示管理と手続きの評価
取引法の規則13a-15(e)および15d-15(e)で定義されている「開示管理と手続き」という用語は、企業が取引法に基づいて提出または提出する報告書で開示する必要のある情報が、SECの規則とフォームで指定された期間内に記録、処理、要約、および報告されることを保証するために設計された管理と手続きを指します。開示管理と手続きには、必要な開示に関する迅速な決定を可能にするために、そのような情報が蓄積され、必要に応じて最高執行責任者や最高財務責任者を含む企業の経営陣に確実に伝達されるように設計された管理と手続きが含まれますが、これらに限定されません。
当社の開示管理と手続きを設計および評価するにあたり、経営陣は、開示管理と手続きは、どんなにうまく構想され運用されても、開示管理と手続きの目的が満たされているという絶対的な保証ではなく、合理的な保証しか提供できないことを認識しています。さらに、開示管理と手続きを設計するにあたり、当社の経営陣は、可能な開示管理と手続きの費用対効果の関係を評価する際に必ず判断を下す必要がありました。統制システムの設計も、将来起こる可能性に関する特定の仮定に一部基づいており、将来起こり得るあらゆる状況下で、どのような設計でも定められた目標を達成するという保証はありません。時間が経つにつれて、状況の変化により統制が不十分になったり、方針や手続きの遵守度が低下したりする可能性があります。制御システムには固有の制限があるため、エラーや詐欺による虚偽表示が発生し、検出されない場合があります。
2024年6月30日現在の当社の開示管理と手続きの評価に基づいて、当社の最高経営責任者兼最高財務責任者は、2024年6月30日現在、当社の開示管理と手続きは妥当な保証レベルで有効であったと結論付けました。
財務報告に関する内部統制の変更
2024年6月30日までの3か月間、財務報告に対する当社の内部統制(取引法の規則13a-15(f)および15d-15(f)で定義されているとおり)に、財務報告に対する当社の内部統制に重大な影響を及ぼした、または重大な影響を与える可能性が合理的に高い変更はありませんでした。
パート II — その他の情報
アイテム 1.法的手続き
時々、私たちは通常の業務過程で生じる訴訟や請求の対象となることがあります。現在、当社はいかなる重要な法的手続きの当事者でもありません。また、当社の事業、業績、キャッシュフロー、または財務状況に重大な悪影響を及ぼす可能性があると考えられる、係属中の、または脅迫されている法的手続きの当事者ではありません。
アイテム1A。リスク要因
当社の事業は、リスクや事象の影響を受けやすく、万が一発生した場合、当社の財政状態や経営成績、証券の取引価格に悪影響を及ぼす可能性があります。当社のリスク要因は、「パートI、項目1A」に記載されているものと大きく変わっていません。2024年2月29日にSECに提出された2023年12月31日に終了した会計年度のフォーム10-kの年次報告書の「リスク要因」。
アイテム2。株式の未登録売却、収益の使用、および発行者による株式の購入
ピラミッド契約
2024年1月、2024年1月7日付けの契約および合併計画(「ピラミッド合意」)に基づき、ピラミッド・バイオサイエンス株式会社(「ピラミッド」)を買収しました。Pyramidの買収の対価として、255,794株の普通株式を前払いしました。2024年6月30日現在、これらの普通株式のうち253,410株が当社が発行しており、そのうち10,452株は2024年の第2四半期に発行されました。また、特定の規制上のマイルストーンの達成時に、成功に応じて追加の支払いを行うことにも同意しました。現金または普通株式での支払いを選択できます。2024年1月、ピラミッド契約に基づく開発上のマイルストーンの達成に関連して、ピラミッドへの支払いがピラミッドに支払われることになりました。私たちは、98,129株の普通株式で支払うことにしました。2024年6月30日現在、これらの普通株式のうち97,233株が当社が発行しています。これら両方の支払いに関連する株式は、発行時に証券法に基づいて登録されておらず、その後、株式の一部はフォームS-3の登録届出書に基づいて登録されました。
ピラミッドは、とりわけ、証券法規則Dの規則501(a)で定義されている機関認定投資家であることを表しています。前述の株式は、証券法のセクション4(a)(2)で規定されている私募免除に基づいて発行されるものとします。この取引の詳細については、このレポートの他の場所に記載されている要約連結財務諸表の注記10「ライセンス、買収、その他の契約」を参照してください。
Knopp購入契約の改正
2024年5月、ロイヤリティの支払い義務と成功に基づく支払いに特定の変更を加えるために、2022年2月24日付けの既存の会員利息購入契約の修正(「修正」)をKnopp Biosciences LLC(「Knopp」)と締結しました。修正に関する追加情報については、項目5「その他の情報」を参照してください。
修正に関連して、当社は、修正の実施日から60日以内に、約7,500万ドル相当の1,872,874株の普通株式を私募によりKnoppに発行しました(「2024年追加対価」)。また、修正案の実行1周年(「2025年追加考慮事項」)から60日以内に、約7,500万ドル相当の普通株式を追加発行することにも合意しました。さらに、特定の開発マイルストーンに従い、特定の時価総額を達成することを条件として、294,195株の普通株式を1株あたり67.98ドルで購入するワラント(「ワラント」)を発行しました。
修正条項およびワラントの執行に関連する前述の当社の普通株式の発行および売却は、1933年の証券法(「証券法」)または州の証券法に基づいて登録されていません。私たちは、公募を伴わない発行体による取引については、証券法のセクション4(a)(2)に基づく登録要件の免除に頼ってきました。
アイテム 5.その他の情報
ルール10b5-1 トレーディングプラン
2024年6月30日に終了した四半期中に、 無し の取締役または役員が規則S-kの項目408で定義されている「規則10b5-1取引契約」または「非規則10b5-1取引契約」を採用または終了しました。
アイテム 6.展示品
| | | | | | | | |
展示品番号。 | | 説明 |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
2.1# | | 2024年5月1日付けの、当社、BTL、BPI、およびKnoppによる会員権益購入契約の改正。 |
4.1# | | 2024年5月1日付けの、当社とKnoppによる令状。 |
| 31.1 | | サーベンス・オクスリー法第302条に基づく最高執行役員の認定。 |
| 31.2 | | サーベンス・オクスリー法第302条に基づく最高財務責任者の認定。 |
| 32.1‡ | | サーベンス・オクスリー法第906条に基づく最高執行役員および最高財務責任者の資格。 |
| 101 | | 2024年6月30日までの会計四半期のフォーム10-Qの登録者四半期報告書の以下の資料は、iXBRL(インライン拡張ビジネス報告言語)でフォーマットされています。(i)要約連結貸借対照表、(ii)要約連結営業報告書および包括損失、(iii)要約連結キャッシュフロー計算書、(iv)要約連結財務諸表の注記は、ブロックとしてタグ付けされていますテキストと詳細なタグを含みます。 |
| 104 | | 表紙インタラクティブデータファイル(別紙101のiXBRL形式)。 |
___________________________________________________
# この展示品の一部(アスタリスクで表示)は、(i)重要ではなく、(ii)公開すると登録者に競争上の損害を与える可能性があるため、省略されています。
‡ これらの証明書は、米国商務省第18条第1350条に従い、この四半期報告書に添付するためにのみ提供されており、改正された1934年の証券取引法の第18条の目的のために提出されたものではありません。また、本書の日付より前または後に行われたかどうかにかかわらず、そのような提出における一般的な組み込み言語に関係なく、登録者の提出書類に参照として組み込むことはできません。
署名
1934年の証券取引法の要件に従い、登録者は署名者に代わってこの報告書に正式に署名させ、正式に権限を与えられました。
| | | | | | | | |
| | バイオヘイブン株式会社 |
| 日付:2024年8月9日 | |
| | 作成者: | /s/ ヴラッド・コーリック.D. |
| | | ヴラッド・コリック万.D. |
| | | 最高経営責任者 |
| | | (登録者に代わって、また最高執行責任者として) |
| | | |
| | 作成者: | /s/ マシュー・ブテン |
| | | マシュー・ビューテン |
| | | 最高財務責任者 |
| | | (最高財務責任者) |