アニー-20240331偽2024--12-31Q100011786700.003494136026100011786702024-01-012024-03-3100011786702024-04-26エクセルリ:シェア00011786702024-03-31ISO 4217: 米ドル00011786702023-12-31ISO 4217: 米ドルエクセルリ:シェア0001178670米国会計基準:プロダクトメンバー2024-01-012024-03-310001178670米国会計基準:プロダクトメンバー2023-01-012023-03-310001178670Alny: コラボレーションメンバー2024-01-012024-03-310001178670Alny: コラボレーションメンバー2023-01-012023-03-310001178670米国会計基準:ロイヤリティ会員2024-01-012024-03-310001178670米国会計基準:ロイヤリティ会員2023-01-012023-03-3100011786702023-01-012023-03-310001178670米国会計基準:普通株式会員2023-12-310001178670米国会計基準:追加払込資本構成員2023-12-310001178670米国会計基準:その他の包括利益の累計メンバー2023-12-310001178670米国会計基準:利益剰余金メンバー2023-12-310001178670米国会計基準:普通株式会員2024-01-012024-03-310001178670米国会計基準:追加払込資本構成員2024-01-012024-03-310001178670米国会計基準:その他の包括利益の累計メンバー2024-01-012024-03-310001178670米国会計基準:利益剰余金メンバー2024-01-012024-03-310001178670米国会計基準:普通株式会員2024-03-310001178670米国会計基準:追加払込資本構成員2024-03-310001178670米国会計基準:その他の包括利益の累計メンバー2024-03-310001178670米国会計基準:利益剰余金メンバー2024-03-310001178670米国会計基準:普通株式会員2022-12-310001178670米国会計基準:追加払込資本構成員2022-12-310001178670米国会計基準:その他の包括利益の累計メンバー2022-12-310001178670米国会計基準:利益剰余金メンバー2022-12-3100011786702022-12-310001178670米国会計基準:普通株式会員2023-01-012023-03-310001178670米国会計基準:追加払込資本構成員2023-01-012023-03-310001178670米国会計基準:その他の包括利益の累計メンバー2023-01-012023-03-310001178670米国会計基準:利益剰余金メンバー2023-01-012023-03-310001178670米国会計基準:普通株式会員2023-03-310001178670米国会計基準:追加払込資本構成員2023-03-310001178670米国会計基準:その他の包括利益の累計メンバー2023-03-310001178670米国会計基準:利益剰余金メンバー2023-03-3100011786702023-03-31alny: 製品0001178670Alny: ポンパトロのメンバー国:米国2024-01-012024-03-310001178670Alny: ポンパトロのメンバー国:米国2023-01-012023-03-310001178670SRT: ヨーロッパメンバーAlny: ポンパトロのメンバー2024-01-012024-03-310001178670SRT: ヨーロッパメンバーAlny: ポンパトロのメンバー2023-01-012023-03-310001178670ALNY: 米国以外のヨーロッパ会員Alny: ポンパトロのメンバー2024-01-012024-03-310001178670ALNY: 米国以外のヨーロッパ会員Alny: ポンパトロのメンバー2023-01-012023-03-310001178670Alny: ポンパトロのメンバー2024-01-012024-03-310001178670Alny: ポンパトロのメンバー2023-01-012023-03-310001178670Alny: アムヴトラのメンバー国:米国2024-01-012024-03-310001178670Alny: アムヴトラのメンバー国:米国2023-01-012023-03-310001178670SRT: ヨーロッパメンバーAlny: アムヴトラのメンバー2024-01-012024-03-310001178670SRT: ヨーロッパメンバーAlny: アムヴトラのメンバー2023-01-012023-03-310001178670ALNY: 米国以外のヨーロッパ会員Alny: アムヴトラのメンバー2024-01-012024-03-310001178670ALNY: 米国以外のヨーロッパ会員Alny: アムヴトラのメンバー2023-01-012023-03-310001178670Alny: アムヴトラのメンバー2024-01-012024-03-310001178670Alny: アムヴトラのメンバー2023-01-012023-03-310001178670Alny: ジブラアリメンバー国:米国2024-01-012024-03-310001178670Alny: ジブラアリメンバー国:米国2023-01-012023-03-310001178670SRT: ヨーロッパメンバーAlny: ジブラアリメンバー2024-01-012024-03-310001178670SRT: ヨーロッパメンバーAlny: ジブラアリメンバー2023-01-012023-03-310001178670Alny: ジブラアリメンバーALNY: 米国以外のヨーロッパ会員2024-01-012024-03-310001178670Alny: ジブラアリメンバーALNY: 米国以外のヨーロッパ会員2023-01-012023-03-310001178670Alny: ジブラアリメンバー2024-01-012024-03-310001178670Alny: ジブラアリメンバー2023-01-012023-03-310001178670Alny: オクスルーモ会員国:米国2024-01-012024-03-310001178670Alny: オクスルーモ会員国:米国2023-01-012023-03-310001178670SRT: ヨーロッパメンバーAlny: オクスルーモ会員2024-01-012024-03-310001178670SRT: ヨーロッパメンバーAlny: オクスルーモ会員2023-01-012023-03-310001178670Alny: オクスルーモ会員ALNY: 米国以外のヨーロッパ会員2024-01-012024-03-310001178670Alny: オクスルーモ会員ALNY: 米国以外のヨーロッパ会員2023-01-012023-03-310001178670Alny: オクスルーモ会員2024-01-012024-03-310001178670Alny: オクスルーモ会員2023-01-012023-03-310001178670米国会計基準:プロダクトメンバー2024-03-310001178670米国会計基準:プロダクトメンバー2023-12-310001178670アルニー:ロシュ・メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2024-01-012024-03-310001178670アルニー:ロシュ・メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2023-01-012023-03-310001178670Alny: リジェネロン製薬株式会社会員US-GAAP: コラボレーティブ・アレンジメント・メンバー2024-01-012024-03-310001178670Alny: リジェネロン製薬株式会社会員US-GAAP: コラボレーティブ・アレンジメント・メンバー2023-01-012023-03-310001178670Alny: ノバルティスのメンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2024-01-012024-03-310001178670Alny: ノバルティスのメンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2023-01-012023-03-310001178670Alny: その他のコラボレーションメンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2024-01-012024-03-310001178670Alny: その他のコラボレーションメンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2023-01-012023-03-310001178670US-GAAP: コラボレーティブ・アレンジメント・メンバー2024-01-012024-03-310001178670US-GAAP: コラボレーティブ・アレンジメント・メンバー2023-01-012023-03-310001178670US-GAAP: コラボレーティブ・アレンジメント・メンバー2024-03-310001178670US-GAAP: コラボレーティブ・アレンジメント・メンバー2023-12-310001178670アルニー:ロシュ・メンバーAlny: 臨床試験および製造メンバー2024-01-012024-03-310001178670アルニー:ロシュ・メンバーAlny: 外部サービスメンバー2024-01-012024-03-310001178670アルニー:ロシュ・メンバーAlny: その他のメンバー2024-01-012024-03-310001178670アルニー:ロシュ・メンバーAlny: 臨床試験および製造メンバー2023-01-012023-03-310001178670アルニー:ロシュ・メンバーAlny: 外部サービスメンバー2023-01-012023-03-310001178670アルニー:ロシュ・メンバーAlny: その他のメンバー2023-01-012023-03-310001178670Alny: 臨床試験および製造メンバーAlny: リジェネロン製薬株式会社会員2024-01-012024-03-310001178670Alny: 外部サービスメンバーAlny: リジェネロン製薬株式会社会員2024-01-012024-03-310001178670Alny: その他のメンバーAlny: リジェネロン製薬株式会社会員2024-01-012024-03-310001178670Alny: 臨床試験および製造メンバーAlny: リジェネロン製薬株式会社会員2023-01-012023-03-310001178670Alny: 外部サービスメンバーAlny: リジェネロン製薬株式会社会員2023-01-012023-03-310001178670Alny: その他のメンバーAlny: リジェネロン製薬株式会社会員2023-01-012023-03-310001178670Alny: その他のコラボレーションメンバーAlny: 臨床試験および製造メンバー2024-01-012024-03-310001178670Alny: 外部サービスメンバーAlny: その他のコラボレーションメンバー2024-01-012024-03-310001178670Alny: その他のメンバーAlny: その他のコラボレーションメンバー2024-01-012024-03-310001178670Alny: その他のコラボレーションメンバーAlny: 臨床試験および製造メンバー2023-01-012023-03-310001178670Alny: 外部サービスメンバーAlny: その他のコラボレーションメンバー2023-01-012023-03-310001178670Alny: その他のメンバーAlny: その他のコラボレーションメンバー2023-01-012023-03-310001178670Alny: 臨床試験および製造メンバー2024-01-012024-03-310001178670Alny: 外部サービスメンバー2024-01-012024-03-310001178670Alny: その他のメンバー2024-01-012024-03-310001178670Alny: 臨床試験および製造メンバー2023-01-012023-03-310001178670Alny: 外部サービスメンバー2023-01-012023-03-310001178670Alny: その他のメンバー2023-01-012023-03-310001178670アルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバー2023-07-212023-07-210001178670Alny: ロシュ・コラボレーション&ライセンス契約メンバー2023-07-212023-07-21エクセルリ:ピュア0001178670Alny: ロシュ・コラボレーション&ライセンス契約メンバー2023-07-21alny: 履行義務0001178670アルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバー2024-03-310001178670アルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバーAlny: マイルストーンメンバー2024-01-012024-03-310001178670アルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバーAlny: ライセンス義務メンバー2024-03-310001178670アルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバーAlny: ライセンス義務メンバー2024-01-012024-03-310001178670アルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバーAlny: ライセンス義務メンバー2023-01-012023-03-310001178670Alny: 開発サービス義務メンバーアルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバー2024-03-310001178670Alny: 開発サービス義務メンバーアルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバー2024-01-012024-03-310001178670Alny: 開発サービス義務メンバーアルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバー2023-01-012023-03-310001178670ALNY: 技術移転義務会員アルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバー2024-03-310001178670ALNY: 技術移転義務会員アルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバー2024-01-012024-03-310001178670ALNY: 技術移転義務会員アルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバー2023-01-012023-03-310001178670アルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバー2024-01-012024-03-310001178670アルニー:ロシュ・メンバーAlny: ロシュ・コラボレーション&ライセンス契約メンバー2023-01-012023-03-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員2019-01-012019-12-310001178670SRT: 最大メンバー数Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員2019-01-012019-12-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員Alny: マイルストーンメンバー2023-01-012023-12-310001178670Alny: 偶発マイルストーン会員Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員2023-01-012023-12-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員2023-01-012023-12-31alny: ターゲット0001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員ALNY: プログラム開始メンバーでの資金調達2023-12-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員Alny: 主任候補識別メンバーでの資金提供2023-12-310001178670ALNY: ディスカバリーの年間会員への資金提供Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員2019-12-310001178670SRT: 最大メンバー数Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員2019-12-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員Alny: リサーチサービス義務メンバー2019-04-300001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員Alny: C5ライセンス義務メンバー2019-04-300001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員アルニー:C5ココ・オブリゲーション・メンバー2019-04-300001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員2019-04-300001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員2024-03-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員2024-01-012024-03-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員Alny: リサーチサービス義務メンバー2024-03-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員Alny: リサーチサービス義務メンバー2023-12-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員Alny: C5ライセンス義務メンバー2024-03-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員Alny: C5ライセンス義務メンバー2023-12-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員アルニー:C5ココ・オブリゲーション・メンバー2024-03-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員アルニー:C5ココ・オブリゲーション・メンバー2023-12-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員2023-12-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員Alny: リサーチサービス義務メンバー2024-01-012024-03-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員Alny: リサーチサービス義務メンバー2023-01-012023-03-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員Alny: C5ライセンス義務メンバー2024-01-012024-03-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員Alny: C5ライセンス義務メンバー2023-01-012023-03-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員アルニー:C5ココ・オブリゲーション・メンバー2024-01-012024-03-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員アルニー:C5ココ・オブリゲーション・メンバー2023-01-012023-03-310001178670Alny: グローバル・ストラテジック・コラボレーションのメンバーAlny: リジェネロン製薬株式会社会員2023-01-012023-03-310001178670Alny: ノバルティサグ会員Alny: 2013年のザ・メディシンズ・カンパニーのコラボレーションメンバーAlny: プロダクト・アライアンス・メンバー2013-02-012024-03-310001178670Alny: ノバルティサグ会員Alny: 2013年のザ・メディシンズ・カンパニーのコラボレーションメンバーAlny: プロダクト・アライアンス・メンバーSRT: 最低メンバー数2024-03-310001178670SRT: 最大メンバー数Alny: ノバルティサグ会員Alny: 2013年のザ・メディシンズ・カンパニーのコラボレーションメンバーAlny: プロダクト・アライアンス・メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員US-GAAP: マネー・マーケット・ファンド・メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル1メンバーUS-GAAP: マネー・マーケット・ファンド・メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:公正価値インプットレベル2メンバーUS-GAAP: マネー・マーケット・ファンド・メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル3メンバーUS-GAAP: マネー・マーケット・ファンド・メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:米国財務省証券会員2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:米国財務省証券会員2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:公正価値インプットレベル2メンバー米国会計基準:米国財務省証券会員2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:米国財務省証券会員2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:コマーシャル・ペーパー・メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:コマーシャル・ペーパー・メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:公正価値インプットレベル2メンバー米国会計基準:コマーシャル・ペーパー・メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:コマーシャル・ペーパー・メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:米国政府支援企業債務証券会員2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:米国政府支援企業債務証券会員米国会計基準:フェアバリューインプットレベル1メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:米国政府支援企業債務証券会員米国会計基準:公正価値インプットレベル2メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:米国政府支援企業債務証券会員米国会計基準:フェアバリューインプットレベル3メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:企業債務証券メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:企業債務証券メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:企業債務証券メンバー米国会計基準:公正価値インプットレベル2メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:企業債務証券メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル1メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:公正価値インプットレベル2メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル3メンバー2024-03-310001178670米国会計基準:公正価値測定経常委員US-GAAP: マネー・マーケット・ファンド・メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル1メンバーUS-GAAP: マネー・マーケット・ファンド・メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:公正価値インプットレベル2メンバーUS-GAAP: マネー・マーケット・ファンド・メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル3メンバーUS-GAAP: マネー・マーケット・ファンド・メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:米国財務省証券会員2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:米国財務省証券会員2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:公正価値インプットレベル2メンバー米国会計基準:米国財務省証券会員2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:米国財務省証券会員2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:コマーシャル・ペーパー・メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:コマーシャル・ペーパー・メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:公正価値インプットレベル2メンバー米国会計基準:コマーシャル・ペーパー・メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:コマーシャル・ペーパー・メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:企業債務証券メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:企業債務証券メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:企業債務証券メンバー米国会計基準:公正価値インプットレベル2メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:企業債務証券メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:米国政府支援企業債務証券会員2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:米国政府支援企業債務証券会員米国会計基準:フェアバリューインプットレベル1メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:米国政府支援企業債務証券会員米国会計基準:公正価値インプットレベル2メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:米国政府支援企業債務証券会員米国会計基準:フェアバリューインプットレベル3メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:預金証書メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:預金証書メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:預金証書メンバー米国会計基準:公正価値インプットレベル2メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:預金証書メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル1メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:公正価値インプットレベル2メンバー2023-12-310001178670米国会計基準:公正価値測定経常委員米国会計基準:フェアバリューインプットレベル3メンバー2023-12-310001178670米国会計基準:米国財務省証券会員2024-03-310001178670米国会計基準:米国政府支援企業債務証券会員2024-03-310001178670米国会計基準:企業債務証券メンバー2024-03-310001178670米国会計基準:コマーシャル・ペーパー・メンバー2024-03-310001178670米国会計基準:米国財務省証券会員2023-12-310001178670米国会計基準:米国政府支援企業債務証券会員2023-12-310001178670米国会計基準:企業債務証券メンバー2023-12-310001178670米国会計基準:コマーシャル・ペーパー・メンバー2023-12-310001178670米国会計基準:預金証書メンバー2023-12-310001178670米国会計基準:その他の資産メンバー2024-03-310001178670米国会計基準:その他の資産メンバー2023-12-310001178670ALNY:合弁事業メンバーの投資による累積損失2023-12-310001178670米国会計基準:累積確定給付制度調整メンバー2023-12-310001178670米国会計基準:累積純未実現投資利益損失メンバー2023-12-310001178670米国会計基準:累積翻訳調整メンバー2023-12-310001178670ALNY:合弁事業メンバーの投資による累積損失2024-01-012024-03-310001178670米国会計基準:累積確定給付制度調整メンバー2024-01-012024-03-310001178670米国会計基準:累積純未実現投資利益損失メンバー2024-01-012024-03-310001178670米国会計基準:累積翻訳調整メンバー2024-01-012024-03-310001178670ALNY:合弁事業メンバーの投資による累積損失2024-03-310001178670米国会計基準:累積確定給付制度調整メンバー2024-03-310001178670米国会計基準:累積純未実現投資利益損失メンバー2024-03-310001178670米国会計基準:累積翻訳調整メンバー2024-03-310001178670ALNY:合弁事業メンバーの投資による累積損失2022-12-310001178670米国会計基準:累積確定給付制度調整メンバー2022-12-310001178670米国会計基準:累積純未実現投資利益損失メンバー2022-12-310001178670米国会計基準:累積翻訳調整メンバー2022-12-310001178670ALNY:合弁事業メンバーの投資による累積損失2023-01-012023-03-310001178670米国会計基準:累積確定給付制度調整メンバー2023-01-012023-03-310001178670米国会計基準:累積純未実現投資利益損失メンバー2023-01-012023-03-310001178670米国会計基準:累積翻訳調整メンバー2023-01-012023-03-310001178670ALNY:合弁事業メンバーの投資による累積損失2023-03-310001178670米国会計基準:累積確定給付制度調整メンバー2023-03-310001178670米国会計基準:累積純未実現投資利益損失メンバー2023-03-310001178670米国会計基準:累積翻訳調整メンバー2023-03-310001178670米国会計基準:転換社債メンバーALNY:転換可能なシニアノート初期金額会員2022-12-310001178670米国会計基準:転換社債メンバーALNY:コンバーチブル・シニアノート会員2022-01-012022-12-310001178670米国会計基準:転換社債メンバーALNY:コンバーチブル・シニアノート追加金額会員2022-09-130001178670米国会計基準:転換社債メンバーALNY:コンバーチブル・シニアノート会員2022-09-132022-09-130001178670米国会計基準:転換社債メンバーALNY:コンバーチブル・シニアノート会員2022-09-130001178670米国会計基準:転換社債メンバーALNY:コンバーチブル・シニアノート会員2022-09-152022-09-150001178670ALNY: 借金転換条件一会員米国会計基準:転換社債メンバーALNY:コンバーチブル・シニアノート会員2022-09-152022-09-15アルニー:日0001178670Alny: メンバーへの債務転換条件米国会計基準:転換社債メンバーALNY:コンバーチブル・シニアノート会員2022-09-152022-09-150001178670米国会計基準:転換社債メンバーALNY:コンバーチブル・シニアノート会員2022-09-120001178670ALNY:借金転換条件3メンバー米国会計基準:転換社債メンバーALNY:コンバーチブル・シニアノート会員2022-09-152022-09-150001178670米国会計基準:転換社債メンバーALNY:コンバーチブル・シニアノート会員2024-03-310001178670米国会計基準:転換社債メンバーALNY:コンバーチブル・シニアノート会員2024-01-012024-03-310001178670米国会計基準:転換社債メンバーUS-GAAP: コールオプションメンバー2022-09-12ISO 4217: 米ドルAlny: ユニット0001178670米国会計基準:転換社債メンバーALNY:コンバーチブル・シニアノート会員2022-09-122022-09-120001178670Alny: ブラックストーングループ株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2020-04-300001178670Alny: ブラックストーングループ株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2020-04-012020-04-300001178670Alny: ブラックストーングループ株式会社メンバーSRT: シナリオ予測メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2030-01-010001178670Alny: ブラックストーングループ株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2024-03-310001178670Alny: ブラックストーングループ株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2023-12-310001178670Alny: ブラックストーングループ株式会社メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバー2024-01-012024-03-310001178670Alny:ヴトリ・イランとジル・ベシランのメンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバーAlny: ブラックストーン・ライフサイエンス会員2020-08-012020-08-310001178670Alny: Helios B第3相臨床試験メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバーAlny: ブラックストーン・ライフサイエンス会員2020-08-012020-08-310001178670Alny: ALNAGT 第2相臨床試験メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバーAlny: ブラックストーン・ライフサイエンス会員2020-08-012020-08-310001178670Alny: ALNAGT 第3相臨床試験メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバーAlny: ブラックストーン・ライフサイエンス会員2020-08-012020-08-310001178670US-GAAP: コラボレーティブ・アレンジメント・メンバーAlny: ブラックストーン・ライフサイエンス会員Alny: ヴトリ・イラン会員2020-08-012020-08-310001178670Alny: 開発マイルストーンメンバーAlny: ブラックストーン・ライフサイエンス会員2023-09-012023-09-300001178670Alny: ALNAGT 第2相臨床試験メンバーUS-GAAP: コラボレーティブ・アレンジメント・メンバーAlny: ブラックストーン・ライフサイエンス会員2023-09-012023-09-300001178670Alny: ブラックストーン・ライフサイエンス会員2024-03-310001178670米国会計基準:デリバティブメンバー2023-12-310001178670米国会計基準:デリバティブメンバー2024-01-012024-03-310001178670米国会計基準:デリバティブメンバー2024-03-310001178670米国会計基準:研究開発費メンバー2024-01-012024-03-310001178670米国会計基準:研究開発費メンバー2023-01-012023-03-310001178670米国会計基準:一般管理費の売上メンバー2024-01-012024-03-310001178670米国会計基準:一般管理費の売上メンバー2023-01-012023-03-310001178670米国会計基準:従業員ストックオプションメンバー2024-01-012024-03-310001178670米国会計基準:従業員ストックオプションメンバー2023-01-012023-03-310001178670米国会計基準:制限付株式会員2024-01-012024-03-310001178670米国会計基準:制限付株式会員2023-01-012023-03-310001178670米国会計基準:転換社債メンバー2024-01-012024-03-310001178670米国会計基準:転換社債メンバー2023-01-012023-03-3100011786702022-07-12アルニー:特許alny: 訴訟00011786702023-08-09alny: 係争中の用語00011786702023-08-2100011786702023-08-302023-08-3000011786702023-05-2600011786702023-09-30アニー:ケース0001178670Alny: イボンネル。グリーンストリートのメンバー2024-01-012024-03-310001178670Alny: イボンネル。グリーンストリートのメンバー2024-03-310001178670Alny: エイミー・W・シュルマンメンバー2024-01-012024-03-310001178670Alny: エイミー・W・シュルマンメンバー2024-03-31 米国
証券取引委員会
ワシントンD.C. 20549
________________________________________
フォーム 10-Q
________________________________________
| | | | | |
| ☒ | 1934年の証券取引法のセクション13または15 (d) に基づく四半期報告書 |
四半期終了時 2024年3月31日です
または
| | | | | |
| ☐ | 1934年の証券取引法第13条または第15条 (d) に基づく移行報告書 |
___________から___________への移行期間について
コミッションファイル番号 001-36407
__________________________________________
アルナイラム・ファーマシューティカルズ株式会社
(憲章に明記されている登録者の正確な名前)
__________________________________________
| | | | | |
デラウェア州 (州またはその他の管轄区域) 法人または組織) | 77-0602661 (IRS) 雇用主 識別番号) |
| | | | | |
675ウェストケンドールストリート、 アンリ・A・テルメール広場 ケンブリッジ、 MA (主要執行機関の住所) | 02142 (郵便番号) |
(617) 551-8200
(登録者の電話番号、市外局番を含む)
__________________________________________
同法第12条 (b) に従って登録された証券:
| | | | | | | | | | | | | | | | | | | | |
| 各クラスのタイトル | | トレーディングシンボル | | 登録された各取引所の名称 | |
| 普通株式、1株あたり額面0.01ドル | | だらしな | | ナスダック・ストック・マーケットLLC | |
登録者が(1)1934年の証券取引法のセクション13または15(d)によって提出が義務付けられているすべての報告を過去12か月間(または登録者がそのような報告を提出する必要があったほど短い期間)提出したかどうか、および(2)過去90日間にそのような提出要件の対象であったかどうかをチェックマークで示してください。はいx いいえ ☐
登録者が、過去12か月間(または登録者がそのようなファイルを提出する必要があったほど短い期間)に、規則S-Tの規則405(この章の§232.405)に従って提出する必要のあるすべてのインタラクティブデータファイルを電子的に提出したかどうかをチェックマークで示してください。はいx いいえ ☐
登録者が大規模な加速申告者、加速申告者、非加速申告者、小規模な報告会社、または新興成長企業のいずれであるかをチェックマークで示してください。取引法規則12b-2の「大規模加速申告者」、「加速申告者」、「小規模報告会社」、および「新興成長企業」の定義を参照してください。
| | | | | | | | | | | |
| 大型加速フィルター | x | アクセラレーテッド・ファイラー | ☐ |
| 非加速ファイラー | ☐ | 小規模な報告会社 | ☐ |
| 新興成長企業 | ☐ | | |
新興成長企業の場合は、登録者が取引法第13条 (a) に従って規定された新規または改訂された財務会計基準を遵守するために延長された移行期間を使用しないことを選択したかどうかをチェックマークで示してください。☐
登録者がシェル会社(証券取引法の規則12b-2で定義されている)かどうかをチェックマークで示してください。はい☐いいえ x
2024年4月26日の時点で、登録者は 126,491,778 普通株式、1株あたり額面0.01ドル、発行済みです。
アルナイラム・ファーマシューティカルズ株式会社
四半期報告書(フォーム10-Q)
目次
| | | | | |
| ページ
番号 |
パートI。財務情報 | |
| |
アイテム 1.財務諸表(未監査) | |
| |
2024年3月31日および2023年12月31日現在の要約連結貸借対照表 | 5 |
2024年および2023年3月31日に終了した3か月間の要約連結営業報告書と包括損失 | 6 |
2024年および2023年3月31日に終了した3か月間の株主赤字の要約連結計算書 | 7 |
2024年および2023年3月31日に終了した3か月間の要約連結キャッシュフロー計算書 | 8 |
要約連結財務諸表の注記 | 9 |
| |
アイテム 2.経営陣による財政状態と経営成績の議論と分析 | 26 |
| |
アイテム 3.市場リスクに関する定量的および質的開示 | 37 |
| |
アイテム 4.統制と手続き | 37 |
| |
パート2。その他の情報 | |
| |
アイテム 1.法的手続き | 38 |
| |
アイテム 1A.リスク要因 | 38 |
| |
アイテム 5.その他の情報 | 73 |
| |
アイテム 6.展示品 | 74 |
| |
署名 | 75 |
「Alnylam」、ONPATTRO®、AMVUTTRA®、GIVLAARI®、OXLUMO®、Alnylam Act®、IKARIA™ は、Alnylam Pharmaceuticals, Inc.の商標および登録商標です。当社のロゴ、商標、およびサービスマークはAlnylamの所有物です。このForm 10-Qの四半期報告書に記載されているその他すべての商標またはサービスマークは、それぞれの所有者に帰属します。
将来の見通しに関する記述に関する注意事項
このフォーム10-Qの四半期報告書には、連邦証券法、改正された1933年の証券法のセクション27A、および改正された1934年の証券取引法のセクション21Eの意味における将来の見通しに関する記述が含まれています。私たちは、これらの将来の見通しに関する記述を、1995年の民間証券訴訟改革法に含まれる将来の見通しに関する記述のセーフハーバー条項の対象とすることを意図しており、これらのセーフハーバー条項を遵守する目的でこの記述を含めています。フォーム10-Qのこの四半期報告書に含まれる歴史的事実の記述以外のすべての記述は、将来の見通しに関する記述です。場合によっては、将来の見通しに関する記述を、「かもしれない」、「するだろう」、「できる」、「期待する」、「予定」、「計画」、「意図」、「意図」、「予想する」、「信じる」、「見積もり」、「予測」、「可能性」、「続行」などの用語や、これらの用語や他の同等の用語の否定的表現を識別できます。これらの将来の見通しに関する記述には、以下に関する記述が含まれますが、これらに限定されません。
•ONPATTRO、AMVUTTRA、GIVLAARI、OXLUMO、Leqvio®(インクリシラン)、フィトゥシラン、ジレベシランなど、承認され治験中のRNAi治療薬の可能性に関する私たちの見解。
•グローバルな規制当局への追加申請と、ONPATTRA、AMVUTTRA、GIVLAARI、OXLUMOの継続的な製品発売の計画、およびレクビオに関する協力者の計画。
•ヴトリシランのHELIOS-B第3相臨床試験の潜在的な結果と、心筋症を伴うATTRアミロイドーシスの治療薬としてAMVUTTRA(ヴトリシラン)の規制当局の承認を得る将来の可能性。
•ONPATTRO、AMVUTTRA、GIVLAARI、OXLUMO、Leqvio、または将来の製品の潜在的な市場規模と商品化の成功に関する私たちの期待。
•ONPATTRO、AMVUTTRA、GIVLAARI、OXLUMO、または将来の製品の規制当局の承認と価格設定と償還を取得して維持する当社の能力、およびレクビオとフィトゥシランに関する協力者の能力。
•希少疾患と流行病の両方のプログラムを含む、研究開発プログラムの進捗状況。
•IKARIAプラットフォームや、肝外組織を含むように製品エンジンを拡張する機能など、当社の新技術により、製品プロファイルが改善される可能性が生まれます。
•現在および今後予定されている臨床試験、およびこれらの試験からのデータの報告に関する期待
•規制当局への申請のタイミング、規制当局とのやり取り、またはそれらの措置や助言は、臨床試験の設計、開始、タイミング、継続および/または進行に影響を与えたり、追加の前臨床試験や臨床試験が必要になったり、規制当局の承認のタイミングや可能性が生じたりする可能性があります。
•当社の製造業務の状況、およびONPATTRO、AMVUTTRA、GIVLAARI、OXLUMOまたは当社の製品候補品(または当社の協力者が開発および商品化している他の製品または製品候補)の製造および供給における遅延、中断、または障害、または当社または当社の協力者によるもの
•将来のパンデミックや公衆衛生上の緊急事態が、とりわけ、当社の財務実績、事業と運営(製造、サプライチェーン、研究開発活動、パイプラインプログラムを含む)に与える影響、および当社の事業へのその他の潜在的な影響。
•ウクライナと中東で進行中の紛争のあらゆる影響(臨床試験の中断を含む)
•グローバルな商業インフラの構築と活用を続けている私たちの進歩。
•競合製品が、ONPATTRO、AMVUTTRA、GIVLAARI、OXLUMO、および当社の製品候補の商業的成功に与える可能性のある影響、および私たち、またはLeavioまたはfitusiranに関しては、当社の協力者がそのような製品との競争能力に与える可能性のある影響。
•成長と営業経費を管理する当社の能力。
•5年間のAlnylam P5x25戦略に関する私たちの見解と計画、および2025年末までに一流のバイオテクノロジー企業になるなど、この戦略に関連する指標を達成するという私たちの意図、およびAlnylam P5x25戦略を成功裏に実行する当社の能力。
•現在の現金残高により、将来のエクイティファイナンスを必要とせずに自立的なプロファイルを実現できるはずだという私たちの信念。
•現在の現金、現金同等物、および有価な株式および負債証券が、現在の事業計画に基づいて当社の事業を支える期間に関する当社の期待
•製品の開発、製造、流通を第三者に依存しています。
•将来のライセンス料、既存または将来の契約に基づくマイルストーンおよびロイヤルティの支払いを含む、企業コラボレーションに関する私たちの期待。
•知的財産を取得、維持、保護する当社の能力。
•資格のある主要管理職や科学者、開発、医療、商業スタッフ、コンサルタント、アドバイザーを引き付けて維持する当社の能力。
•ファイザー社、BionTech SE、Moderna社に対する当社の特許侵害訴訟を含む訴訟の結果、またはその他の法的手続きや政府調査の結果。
•米国、または米国、および海外における規制の動向。
•法律や規制の影響。
•競合他社や業界に関連する開発。
•必要な範囲で、支払い義務を履行し、転換社債を含む当社の債務の利息を返済したり、債務を借り換えたり、転換社債の転換に関連して現金で支払いを行ったりする当社の能力。そして
•キャップコール取引の影響と、オプション取引相手および/またはそれぞれの関連会社の予想される市場活動に関する当社の期待。
上記のリスクはすべてを網羅しているわけではありません。フォーム10-Qのこの四半期報告書の他のセクションには、当社の事業および財務実績に悪影響を及ぼす可能性のあるその他の要因が含まれている場合があります。さらに、私たちは非常に競争が激しく、急速に変化する環境で事業を行っています。新しいリスク要因は随時出現し、経営陣がすべてのリスク要因を予測することは不可能です。また、すべてのリスク要因が当社の事業に与える影響や、何らかの要因や要因の組み合わせによって実際の結果が将来の見通しに関する記述に含まれるものと大きく異なる可能性がある程度を評価することもできません。フォーム10-Qのこの四半期報告書の将来の見通しに関する記述は、将来の出来事、当社の事業および将来の財務実績に関する当社の現在の見解を反映しており、当社の実際の業績、業績、または成果が、これらの将来の見通しに関する記述によって表明または暗示される将来の結果、業績、または成果と大きく異なる原因となる既知および未知のリスク、不確実性、およびその他の要因を含みます。実際の結果が現在の予想と大きく異なる原因となる要因には、とりわけ、フォーム10-Qのこの四半期報告書のパートII、項目1A、「リスク要因」などに記載されているものが含まれます。これらの不確実性を考えると、これらの将来の見通しに関する記述に過度に依存するべきではありません。法律で義務付けられている場合を除き、将来新しい情報が入手可能になったとしても、理由の如何を問わず、これらの将来の見通しに関する記述を更新または改訂する義務を負わないものとします。ただし、証券取引委員会(SEC)に提出した報告書でさらに開示する場合は、それを確認することをお勧めします。
目次
第I部。財務情報
アイテム 1.財務諸表(未監査)
アルナイラム・ファーマシューティカルズ株式会社
要約連結貸借対照表
(千単位、1株あたりの金額を除く)
(未監査)
| | | | | | | | | | | |
| 2024年3月31日 | | 2023年12月31日 |
| 資産 | | | |
| 流動資産: | | | |
| 現金および現金同等物 | $ | 681,879 | | | $ | 812,688です | |
| 市場性のある債務証券 | 1,678,147 | | | 1,615,516 | |
| 市場性のある株式証券 | 11,256 | | | 11,178 | |
| 売掛金、純額 | 321,377 | | | 327,787 | |
| インベントリ | 93,988 | | | 89,146 | |
| 前払費用およびその他の流動資産 | 201,960 | | | 126,382 | |
| | | |
| 流動資産合計 | 2,988,607 | | | 2,982,697 | |
| 不動産、プラント、設備、純額 | 523,460 | | | 526,057 | |
| オペレーティングリースの使用権資産 | 195,468 | | | 199,732 | |
| 制限付き投資 | 49,390 | | | 49,391 | |
| その他の資産 | 67,461 | | | 72,003 | |
| 総資産 | $ | 3,824,386 | | | $ | 3,829,880 | |
| 負債と株主の赤字 | | | |
| 現在の負債: | | | |
| 買掛金 | $ | 78,148 | | | $ | 55,519 | |
| 未払費用 | 698,865 | | | 713,013 | |
| オペレーティング・リースの負債 | 41,672 | | | 41,510 | |
| 繰延収益 | 76,850 | | | 102,753 | |
| 将来のロイヤリティの売却に関連する責任 | 46,174 | | | 54,991 | |
| 流動負債合計 | 941,709 | | | 967,786 | |
オペレーティング・リースの負債、当期分を差し引いたもの | 237,829 | | | 243,101です | |
| 繰延収益、当期分を差し引いたもの | 185,506 | | | 188,175 | |
| 転換社債 | 1,021,732 | | | 1,020,776 | |
| 将来のロイヤリティの売却に関連する負債(現在の部分を差し引いたもの) | 1,336,892 | | | 1,322,248 | |
| その他の負債 | 319,990 | | | 308,438 | |
| 負債総額 | 4,043,658 | | | 4,050,524 | |
コミットメントと不測の事態(注13) | | | |
| 株主赤字: | | | |
優先株式、$0.01 1株あたりの額面価額、 5,000 承認された株式と いいえ 2024年3月31日および2023年12月31日の時点で発行済みおよび発行済みの株式 | — | | | — | |
普通株式、$0.01 1株あたりの額面価額、 250,000 承認された株式; 126,463 2024年3月31日現在の発行済株式数 125,794 2023年12月31日現在の発行済株式数 | 1,265 | | | 1,259 | |
| その他の払込資本 | 6,881,977 | | | 6,811,063 | |
| その他の包括損失の累計 | (26,988) | | | (23,375) | |
| 累積赤字 | (7,075,526) | | | (7,009,591) | |
| 株主総赤字 | (219,272) | | | (220,644です) | |
| 負債総額と株主赤字 | $ | 3,824,386 | | | $ | 3,829,880 | |
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結営業明細書
と総合損失
(千単位、1株あたりの金額を除く)
(未監査)
| | | | | | | | | | | | | | | |
| 3 か月が終了
3月31日、 | | |
| 2024 | | 2023 | | | | |
| 運用明細書 | | | | | | | |
| 収益: | | | | | | | |
| 純製品収入 | $ | 365,163% | | | $ | 276,328 | | | | | |
| コラボレーションによる純収入 | 118,548 | | | 36,462 | | | | | |
| ロイヤリティ収入 | 10,622% | | | 6,500 | | | | | |
| 総収入 | 494,333 | | | 319,290 | | | | | |
| 運用コストと経費: | | | | | | | |
| 売上原価 | 54,613 | | | 41,432 | | | | | |
| コラボレーションの費用とロイヤリティ | 11,363 | | | 13,437 | | | | | |
| 研究開発 | 260,995 | | | 230,569 | | | | | |
| 販売、一般および管理 | 210,797 | | | 183,659 | | | | | |
| 運用コストと経費の合計 | 537,768 | | | 469,097 | | | | | |
事業による損失 | (43,435) | | | (149,807) | | | | | |
| その他 (費用) 収入: | | | | | | | |
| 支払利息 | (35,253) | | | (28,955) | | | | | |
| 利息収入 | 29,645 | | | 18,655です | | | | | |
| その他の費用、純額 | (14,544です) | | | (12,255) | | | | | |
| | | | | | | |
| その他の費用合計、純額 | (20,152) | | | (22,555) | | | | | |
税引前損失 | (63,587) | | | (172,362) | | | | | |
所得税引当金 | (2,348) | | | (1,739) | | | | | |
純損失 | $ | (65,935) | | | $ | (174,101です) | | | | | |
| | | | | | | |
普通株式1株あたりの純損失-基本および希薄化後 | $ | (0.52) | | | $ | (1.40) | | | | | |
| | | | | | | |
| | | | | | | |
普通株式1株あたりの基本および希薄化後の純損失の計算に使用される加重平均普通株式 | 126,138 | | | 124,111 | | | | | |
| | | | | | | |
| | | | | | | |
包括損失計算書 | | | | | | | |
純損失 | $ | (65,935) | | | $ | (174,101です) | | | | | |
その他の包括的(損失)収入: | | | | | | | |
市場性のある有価証券の未実現利益(損失) | (3,568) | | | 4,125 | | | | | |
外貨換算(損失)利益 | (78) | | | 1,410 | | | | | |
| 確定給付年金制度、税引後 | 33 | | | (5) | | | | | |
その他の包括利益(損失)総額 | (3,613) | | | 5,530 | | | | | |
包括的損失 | $ | (69,548) | | | $ | (168,571) | | | | | |
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
目次
アルナイラム・ファーマシューティカルズ株式会社
株主赤字の要約連結計算書
(千単位)
(未監査)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 普通株式 | | [追加]
支払い済み
資本 | | 累積
その他
包括的
損失 | | 累積
赤字 | | 合計
株主の
赤字 |
| 株式 | | 金額 | | | | |
| 2023年12月31日現在の残高 | 125,794 | | | $ | 1,259 | | | $ | 6,811,063 | | | $ | (23,375) | | | $ | (7,009,591) | | | $ | (220,644です) | |
| 源泉徴収税控除後の普通ストックオプションの行使 | 223 | | | 2 | | | 24,763 | | | — | | | — | | | 24,765 | |
| 株式プランに基づく普通株式の発行 | 446 | | | 4 | | | (4) | | | — | | | — | | | — | |
| 株式ベースの報酬手数料 | — | | | — | | | 46,155 | | | — | | | — | | | 46,155 | |
その他の包括損失 | — | | | — | | | — | | | (3,613) | | | — | | | (3,613) | |
| 純損失 | — | | | — | | | — | | | — | | | (65,935) | | | (65,935) | |
| 2024年3月31日現在の残高 | 126,463 | | | $ | 1,265 | | | $ | 6,881,977 | | | $ | (26,988) | | | $ | (7,075,526) | | | $ | (219,272) | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 普通株式 | | [追加]
支払い済み
資本 | | 累積 その他 包括的 損失 | | 累積
赤字 | | 合計 株主の 赤字 |
| 株式 | | 金額 | | | | |
| 2022年12月31日現在の残高 | 123,925です | | | $ | 1,240 | | | $ | 6,454,540 | | | $ | (44,654) | | | $ | (6,569,349) | | | $ | (158,223) | |
| 源泉徴収税控除後の普通ストックオプションの行使 | 269 | | | 3 | | | 26,415です | | | — | | | — | | | 26,418 | |
| 株式プランに基づく普通株式の発行 | 47 | | | — | | | — | | | — | | | — | | | — | |
| 株式ベースの報酬手数料 | — | | | — | | | 41,136 | | | — | | | — | | | 41,136 | |
その他の包括利益 | — | | | — | | | — | | | 5,530 | | | — | | | 5,530 | |
| 純損失 | — | | | — | | | — | | | — | | | (174,101です) | | | (174,101です) | |
| 2023年3月31日現在の残高 | 124,241 | | | $ | 1,243 | | | $ | 6,522,091 | | | $ | (39,124) | | | $ | (6,743,450です) | | | $ | (259,240です) | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
| | | | | | | | | | | |
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結キャッシュフロー計算書
(千単位)
(未監査)
| | | | | | | | | | | |
| 3月31日に終了した3か月間 |
| 2024 | | 2023 |
| 営業活動によるキャッシュフロー: | | | |
| 純損失 | $ | (65,935) | | | $ | (174,101です) | |
| 純損失を営業活動に使用された純現金と調整するための非現金調整: | | | |
| 減価償却と償却 | 13,517です | | | 14,065 | |
| オペレーティングリースに関連する償却と利子増加 | 11,969 | | | 12,014 | |
| 将来のロイヤリティの売却に関連する負債にかかる現金以外の利息費用 | 31,565 | | | 25,275 | |
株式ベースの報酬費用 | 45,347 | | | 39,947 | |
市場性のある株式の実現損失と未実現(利益)損失 | (78) | | | 2,267 | |
| | | |
| 開発デリバティブ負債の公正価値の変動 | 8,586 | | | 6,471 | |
| | | |
| その他 | (5,188) | | | (6,276) | |
| 営業資産および負債の変動: | | | |
| 売掛金、純額 | 410 | | | 19,153 | |
| インベントリ | 22 | | | (403) | |
| 前払費用およびその他の資産 | (75,462) | | | (1,235) | |
| 買掛金、未払費用およびその他の負債 | (4,865) | | | (81,975) | |
| オペレーティング・リースの負債 | (12,840) | | | (12,827) | |
| 繰延収益 | (28,563) | | | (8,850) | |
営業活動に使用された純現金 | (81,515) | | | (166,475) | |
| 投資活動によるキャッシュフロー: | | | |
| 不動産、プラント、設備の購入 | (12,973) | | | (13,891) | |
| 有価証券の購入 | (420,115さん) | | | (435,746) | |
| 有価証券の売却と満期 | 365,468 | | | 373,420 | |
| 制限付投資の満期からの収入 | 39,975 | | | 49,225 | |
| 制限付投資の購入 | (39,975) | | | (49,225) | |
| | | |
投資活動に使用された純現金 | (67,620) | | | (76,217) | |
| 財務活動によるキャッシュフロー: | | | |
| ストックオプションおよびその他の種類の株式の行使による収入、純額 | 25,859 | | | 42,371 | |
| | | |
開発デリバティブからの収入、純額 | 3,052 | | | 4,000 | |
| | | |
| | | |
| 財務活動による純現金 | 28,911 | | | 46,371 | |
| 現金、現金同等物および制限付現金に対する為替レートの変動の影響 | (9,941) | | | 2,176 | |
現金、現金同等物および制限付現金の純減少 | (130,165) | | | (194,145) | |
| 現金、現金同等物および制限付現金、期初 | 814,884 | | | 868,556 | |
| 現金、現金同等物および制限付現金、期末 | $ | 684,719 | | | $ | 674,411 | |
| キャッシュフローの補足開示: | | | |
| 利息として支払われた現金 | $ | 30,945 | | | $ | 13,912 | |
| | | |
| | | |
| | | |
| | | |
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
1。 ビジネスの性質
Alnylam Pharmaceuticals, Inc.(当社、当社、または当社)は、リボ核酸干渉(RNAi)に基づく新しい治療法の開発と商品化を目指すバイオ医薬品企業として、2002年6月14日に事業を開始しました。私たちは、将来の成長に向けたRNAi治療薬の深く持続可能な臨床パイプラインと、持続可能なイノベーションと患者への影響の大きな可能性のための強固で有機的な研究エンジンを備えた、多製品でグローバルな商業バイオ医薬品企業を構築するという企業戦略の推進に取り組んでいます。創業以来、私たちはRNAi分野における強力な知的財産権の確立と維持、大手製薬会社やライフサイエンス企業との戦略的コラボレーションの確立、ライセンス契約による収益の創出、そして最終的には独立して、または戦略的協力者と共同でRNAi治療薬をグローバルに開発および商品化することにより、RNAi治療薬の発見、開発、商品化に注力してきました。私たちは、事業計画、研究、開発、製造、商業活動、知的財産権の取得、出願、拡大、経営陣や技術スタッフの募集、資金調達にほぼすべての努力を注いできました。
2021年の初めに、私たちはAlnylam P5x25戦略を開始しました。これは、2025年末までに一流のバイオテクノロジー企業に移行する計画に焦点を当てています。Alnylam P5x25では、優れた財務実績を提供しながら、持続可能なイノベーションを通じて世界中の患者に変革をもたらす希少疾病用医薬品や流行病治療薬を提供することを目指しています。
2024年3月31日現在、私たちは 五 市販製品、以下を含む 一 共同開発製品、および潜在的な商品化に向けて進んでいる複数の後期段階の治験プログラム。私たちは現在、世界中で製品収益を生み出しています 四 オンパトロ、AMVUTTRA、GIVLAARI、OXLUMOなどの商品化された製品、主に米国、または米国、ヨーロッパで.
2。 プレゼンテーションの基礎と連結の原則
添付のAlnylamの要約連結財務諸表は未監査であり、米国で一般に認められている中間期間に適用される会計原則(GAAP)に従って作成されています。経営陣の意見では、報告された期間の経営成績を公正に述べるために必要な、通常および定期的な調整がすべて含まれています。当社の要約連結財務諸表も、2024年2月15日に証券取引委員会に提出されたフォーム10-Kの年次報告書に含まれていた2023年12月31日に終了した年度の監査済み連結財務諸表と実質的に一致する基準に基づいて作成されており、併せて読む必要があります。年末の要約連結貸借対照表データは、当社の監査済み財務諸表から導き出されたものですが、GAAPで要求されるすべての開示が含まれているわけではありません。任意の中間期間の当社の業績は、必ずしも他の中間期間または会計年度全体の業績を示すものではありません。
添付の要約連結財務諸表は、Alnylamと当社の完全子会社の事業を反映しています。会社間口座と取引はすべて廃止されました。
当社の重要な会計方針は、2023年12月31日に終了した年度のForm 10-Kの年次報告書に含まれる連結財務諸表注記の注記2に記載されています。
見積もりの使用
GAAPに準拠した財務諸表を作成するには、経営陣は、要約連結財務諸表の日付における報告された資産と負債の金額、偶発資産と負債の開示、および報告期間中の報告された収益と費用の金額に影響する見積もりと仮定を行う必要があります。当社の要約連結財務諸表では、在庫評価額および関連準備金、将来のロイヤルティの売却に関連する負債、開発デリバティブ負債、所得税、繰延税金資産評価引当金、収益認識、研究開発費、株式ベースの報酬に関する見積もりと仮定を使用しています。私たちは、歴史的経験や、合理的だと思うその他のさまざまな仮定に基づいて見積もりをしています。実際の結果はそれらの見積もりとは異なる可能性があります。見積もりの変更は、判明した時期に報告される結果に反映されます。
流動性
現在の事業計画に基づくと、2024年3月31日現在の現金、現金同等物、および有価証券は、フォーム10-Qのこの四半期報告書の提出日から少なくとも今後12か月間は、運転資本と営業ニーズを満たすのに十分であると考えています。
最近の会計上の宣言
2023年12月、財務会計基準審議会(FASB)は、会計基準更新2023-09「所得税開示の改善」を発表しました。これにより、企業はその有効性について細分化された情報を開示する必要があります
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
税率の調整と、管轄区域によって支払われる所得税に関する詳細情報。開示要件は将来的に適用され、遡及的に適用することもできます。この基準は、2024年12月15日以降に開始する会計年度に有効で、早期採用が許可されています。現在、この新しい基準に関連する開示要件を検討しています。
2023年11月、FASBは会計基準更新2023-07「セグメント報告(トピック280):報告対象セグメント開示の改善」を発表しました。これは、主に重要なセグメント費用に関する追加開示を通じて、報告対象セグメントの開示要件を改善することを目的としています。この基準は、2023年12月15日以降に開始する会計年度と、2024年12月15日以降に開始する会計年度内の中間期間に有効で、早期採用が許可されています。修正は、財務諸表に記載されている過去のすべての期間に遡及的に適用する必要があります。現在、この新しい基準に関連する開示要件を検討しています。
3。 純製品収入
製品が販売されている地域に基づいて分類された純製品収益は、次のもので構成されます。
| | | | | | | | | | | | | | | |
| 3 か月が終了
3月31日、 | | |
| (千単位) | 2024 | | 2023 | | | | |
| オンパトロー | | | | | | | |
| 米国 | $ | 16,539 | | | $ | 29,817 | | | | | |
| ヨーロッパ | 44,690 | | | 59,678 | | | | | |
| その他の地域 | 7,988 | | | 12,998 | | | | | |
| 合計 | 69,217% | | | 102,493 | | | | | |
| | | | | | | |
| アムブットラ | | | | | | | |
| 米国 | 130,238 | | | 79,013 | | | | | |
| ヨーロッパ | 43,733% | | | 6,768 | | | | | |
| その他の地域 | 21,270 | | | 15,987 | | | | | |
| 合計 | 195,241 | | | 101,768 | | | | | |
| | | | | | | |
| ギブラリさん | | | | | | | |
| 米国 | 38,731 | | | 30,291 | | | | | |
| ヨーロッパ | 15,315です | | | 14,471 | | | | | |
| その他の地域 | 4,010 | | | 3,144 | | | | | |
| 合計 | 58,056 | | | 47,906 | | | | | |
| | | | | | | |
| オクスルモさん | | | | | | | |
| 米国 | 13,332 | | | 9,057 | | | | | |
| ヨーロッパ | 21,427 | | | 13,309 | | | | | |
| その他の地域 | 7,890 | | | 1,795 | | | | | |
| 合計 | 42,649 | | | 24,161 | | | | | |
| | | | | | | |
| 製品の総純収入 | $ | 365,163% | | | $ | 276,328 | | | | | |
次の表は、当社の純製品収益に関連する売掛金の残高を示しています。
| | | | | | | | | | | |
| (千単位) | 3月31日の時点で、
2024 | | 12月31日現在、
2023 |
| 「売掛金、純額」に含まれる売掛金 | $ | 239,975 | | | $ | 210,097 | |
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
4。 コラボレーションによる純収入
コラボレーションによる純収益は以下のとおりです。
| | | | | | | | | | | | | | | |
| 3月31日に終了した3か月間 | | |
| (千単位) | 2024 | | 2023 | | | | |
ロッシュ | $ | 74,680 | | | $ | — | | | | | |
| リジェネロンファーマシューティカルズ | 26,764 | | | 19,990 | | | | | |
| ノバルティスAG | 14,516 | | | 14,933 | | | | | |
| その他 | 2,588 | | | 1,539 | | | | | |
| 合計 | $ | 118,548 | | | $ | 36,462 | | | | | |
次の表は、当社のコラボレーション契約に関連する売掛金、契約資産、契約負債の残高を示しています。
| | | | | | | | | | | |
| (千単位) | 2024年3月31日現在 | | 2023年12月31日現在 |
| 「売掛金、純額」に含まれる売掛金 | $ | 66,344です | | | $ | 99,576 | |
「前払費用およびその他の流動資産」に含まれる契約資産 | $ | 65,000 | | | $ | — | |
| 「繰延収益」に含まれる契約負債 | $ | 262,248 | | | $ | 290,763 | |
$の収益を認識しました20.4 百万と $15.4 2024年3月31日と2023年3月31日に終了した3か月間でそれぞれ100万件で、期初の契約負債残高に含まれていました。
契約負債からその期間に計上された収益を決定するには、まず、収益がその残高を超えるまで、期間の初めに未払いの個々の契約負債残高に収益を割り当てます。その後の期間にそれらの契約について追加の対価が受領された場合、報告期間に計上されたすべての収益は、その期間の新しい対価に適用される部分ではなく、最初に開始契約負債に適用されるものと仮定します。
次の表は、当社のコラボレーション契約に直接帰属する、純収益として当社が認識している研究開発費の種類別を、コラボレーター別に示しています。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 3月31日に終了した3か月間 |
| 2024 | | 2023 |
| (千単位) | 臨床と製造 | | 外部サービス | | その他 | | 臨床と製造 | | 外部サービス | | その他 |
ロッシュ | $ | 14,135 | | | $ | 3,612 | | | $ | 334 | | | $ | — | | | $ | — | | | $ | — | |
| リジェネロンファーマシューティカルズ | 10,789 | | | 3,741 | | | 4,173% | | | 8,516 | | | 1,240 | | | 9,363 | |
| その他 | 2,106 | | | — | | | 707 | | | 312 | | | 126 | | | 360 | |
| 合計 | $ | 27,030 | | | $ | 7,353 | | | $ | 5,214 | | | $ | 8,828 | | | $ | 1,366 | | | $ | 9,723 | |
上記の表に含まれる契約により発生する研究開発費は、(i)臨床および前臨床製品の製造を含む臨床および前臨床費用、(ii)コンサルティングサービスおよびラボ用品およびサービスを含む外部サービス、および(iii)専門サービス、施設、諸経費配分を含むその他の費用、および取引相手に請求される報酬および関連費用の合理的な見積もりで発生する費用で構成され、当社が認識していますコラボレーションによる純収入。2024年3月31日と2023年3月31日に終了した3か月間、コラボレーション契約に関連する材料販売、一般管理費は発生しませんでした。
製品コラボレーション
ロッシュ
2023年7月21日、つまり発効日に、私たちはF. Hoffmann-La Roche Ltd. およびジェネンテック株式会社、または総称してロシュと、コラボレーションおよびライセンス契約、またはロシュ契約を締結しました。これに基づき、私たちとロシュは、zilebesiranの共同開発のための世界規模の戦略的協力を確立しました。Zilebesiranは、肝臓で発現したアンギオテンシノーゲンを標的とする治験中の低分子干渉RNA(siRNA)で、現在、高血圧症の治療薬として第2相臨床開発中です。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
ロシュ契約に基づき、私たちは (i) ジレベシランを世界中で開発し、共同商業化地域と呼ばれる米国でジレベシランを商品化する共同独占権、(ii) ロシュ準州と呼ばれる米国外でジレベシランを商品化する独占権、(iii) 開発と商業化のためのジレベシランを製造する非独占権をロシュに付与しましたロシュテリトリーのジレベシランの。ロシュ契約に関連して、ロシュは前払い、返金不可の$を支払いました310.0百万。
私たちはジレベシランのグローバルな臨床開発をリードしています。私たちは40パーセントを担当しています(40%) そして残りの60パーセントはロシュが担当しています (60世界中のzilebesiranの規制当局の承認を支援する開発活動の実施で発生した開発費の%)。私たちとロシュは同じように共有しています(50/50)ジレベシランの規制当局の承認を支援するために実施される開発活動に関連して発生するすべての費用は、段階的な開発活動が必要な場合にのみ、共同商業化地域でのみ行われます。主にロシュ準州の規制当局の承認を支援するために実施される開発活動の実施で発生するすべての費用は、ロシュが単独で負担します。規制当局の承認を得た場合、ロシュはロシュ準州でジレベシランを商品化する独占権を有し、適用されるロイヤリティ期間中、国ごとのジレベシランの純売上高に基づいて、段階的な下位2桁のロイヤリティを当社に支払います。私たちとロシュは、共同商業化地域でzilebesiranを共同商品化し、平等に共有します(50/50)利益と損失(商品化費用を含む)。
ロシュは、事前の書面による通知により、理由の如何を問わず、またはまったく理由なしにロシュ契約を終了する権利を有します。ただし、終了通知が最初の開発マイルストーンの達成後、3番目の開発マイルストーンの達成前に行われた場合、ロシュは当社に$の解約手数料を支払う必要があります50.0百万。さらに、いずれの当事者も、相手方当事者による重大な違反または破産を理由に、是正期間を条件としてロシュ契約を終了することができます。その条件に従って早期に終了しない限り、ロシュ契約は発効日に開始され、国ごとに失効するまで有効です。(a) ロシュ準州では、該当する国で適用されるロイヤルティ期間の満了時に、(b) 共同商業化の取り組み期間の満了時に、(b) 共同商業化地域では。
医薬品開発の不確実性と、一般的に医薬品開発に伴う過去の失敗率が高いため、ロシュ契約に基づいてロシュからマイルストーン、ロイヤリティ、または利益配分の支払いを受けられない場合があります。
私たちはロシュ契約を評価し、ロシュ契約にはASC 606「顧客との契約による収益」とASC 808「共同契約」の範囲内の要素が含まれていると結論付けました。
発効日現在、私たちはロシュ協定でASC 606の範囲内で評価された次の約束を特定しました。(i)ジレベシランを世界中で開発し、共同商業化地域内でジレベシランを商業化するための共同独占ライセンス、ロシュ準州でのジレベシランの開発と商業化のみを目的とした、ロシュ準州でジレベシランを製造するための非独占ライセンスの提供、そしてロシュ準州でzilebesiranを商品化するための独占ライセンス、総称してロシュ・ライセンスと呼ばれます義務、(ii)ジレベシランの規制当局の承認を支援する臨床用品の製造を含む開発サービス(ロシュ開発サービス義務と呼ばれる)、および(iii)ジレベシランの既存の製造プロセスの技術移転(ロシュ技術移転義務と呼ばれる)。その 三 ロシュ契約に基づく履行義務は、総称してロシュ履行義務と呼ばれます。
また、ロシュ契約に概説されている特定のオプションが、履行義務を生じさせる重要な権利であるかどうかを評価し、どのオプションもロシュに重要な権利を譲渡するものではないため、ロシュ契約では個別の履行義務とは見なされないという結論に達しました。
上記の約束を評価した結果、ロシュのライセンス義務、ロシュ開発サービス義務、およびロシュの技術移転義務はベンダーと顧客の関係を反映したものであり、したがってASC 606の範囲内の履行義務であると判断しました。ロシュのライセンス義務は機能的な知的財産と見なされ、契約に基づく他の約束とは異なりました。ロシュは、ライセンス単独で、またはすぐに利用できる他のリソースと組み合わせてライセンスから利益を得ることができるからです。ライセンスは同時に引き渡されたため、契約開始時には履行義務の1つと見なされていました。ロシュの開発サービス義務は、契約の開始時に当社が譲渡したライセンスとともに開発サービスの恩恵を受けることができるため、ロシュは明確と見なされました。zilebesiranは契約開始時に第2相臨床開発段階にあったため、開発サービスが当初の知的財産を大幅に変更またはカスタマイズすることは期待されていません。ロシュの技術移転義務は明確でした。ロシュは、RNAiプラットフォームが進歩し、ジレベシランを製造するために第三者の受託製造組織を利用しているため、契約の開始時に譲渡された製造ライセンスからロシュが恩恵を受けることができるということです。したがって、それぞれが契約開始時のASC 606の範囲における顧客との契約における個別の履行義務となります。
私たちとロシュはどちらも商品化活動に積極的に参加しているので、米国でのzilebesiranの共同商業化に関連する共同活動は、ASC 808の範囲内の別の会計単位であると考えています。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
そして、契約に含まれる活動の商業的成功に依存する重大なリスクと見返りにさらされています。
ロシュ協定の開始時に、ASC 606に基づく取引価格は$であると判断しました857.0百万、合計は310.0百万の前払いと $547.0ロシュの履行義務に関連する開発・製造サービスおよび技術移転による費用償還による変動対価が100万件追加されました。私たちは、認識された累積収益額の大幅な逆転は起こりそうもないと断言できないと判断したため、これらの潜在的な支払いには高い不確実性とリスクがあるため、開発や規制上のマイルストーンに関連する変動対価は、開始時に完全に制約され、当初の取引価格から除外されたと判断しました。また、ロイヤルティと販売マイルストーンは知的財産のライセンスのみに関係するため、ASC 606の販売または使用量ベースのロイヤルティの例外に基づき、取引価格から除外されていることもわかりました。
私たちは、ロシュの履行義務ごとに、当該品目を単独で定期的に販売する場合の売却価格を決定することを目的として、開始時の推定スタンドアロン販売価格を作成しました。私たちは、主に、基礎となる各ライセンスまたは活動に関連する将来の予想キャッシュフローの確率加重現在価値に基づいて、ロシュ・ライセンス債務のスタンドアロン売却価格の推定値を算出しました。このような見積もりを作成する際には、適用される市況と関連する事業体固有の要因、成功の確率、ジレベシランの開発に必要な時間、割引率を考慮して、予測収益を決定する際に判断を下しました。ロシュ開発サービス義務とロシュ技術移転義務に含まれるサービスおよび臨床用品の推定単体販売価格は、主に、サービスの実施に必要な努力の度合いと、フルタイム相当の従業員にかかる費用と期待されるリソースに妥当なマージンを加えたものを基に算出しました。
変動支払の条件は、特に履行義務を果たすための当社の取り組みに関連するものであり、変動費のみをそれぞれの履行義務に割り当てることは、契約のすべての履行義務と支払い条件を検討する際のASC 606の配分目的と一致するため、ロシュ開発サービス債務とロシュ技術移転債務の見積もり償還額に関連する変動対価を各履行義務に割り当てました。$の固定前払い対価を割り当てました310.0固定対価の合計額として、固定対価の価値として、残りの開発および規制上のマイルストーン、販売ベースのマイルストーン、およびロイヤルティの期待値(これらはすべて、現在開始時に制約されているか、販売または使用量に基づくロイヤルティの例外の対象となっています)を合わせると、ロシュライセンス義務の単独販売価格に近似します。したがって、固定前払い対価をすべてロシュ・ライセンス義務に割り当てることは、契約に含まれるすべての履行義務と支払い条件を考慮したときのASC 606の配分目的と一致しています。
ロシュのライセンス義務は、ライセンスがロシュに移管された時点で履行されました。ライセンスの管理は発効日に移管され、ロシュはライセンスの使用を開始し、その恩恵を受けることができました。ロシュ開発サービス債務については、四半期ごとに、かかる労力の割合を、支出が見込まれる総労力の割合として算出することで、債務の推定総費用に対する発生した費用に基づくインプットメソッドを使用して、時系列に比例したパフォーマンスを測定します。この比率は、債務に割り当てられた取引価格に適用されます。経営陣は、見積もりを作成する過程で重要な判断を下しました。各報告期間の終了時点で取引価格を再評価します。
2024年3月31日現在、取引価格の合計は$と決定されました922.0百万、$の増加65.02023年12月31日から百万です。2024年3月31日に終了した3か月間で、KARDIA-3の第2相試験で最初に患者さんに投与したときに、開発マイルストーンとして支払われる可能性が最も高い金額は65.0100万で、この開発のマイルストーンが実現する可能性が高かったということです。したがって、私たちは$を認識しました65.0開発マイルストーンとしてのコラボレーションによる純収益は、特に発効日に行われたロシュへのライセンスの譲渡に関するものです。2024年4月には、65.0KARDIA-3の第2相試験で最初の患者に投与したときに、100万の開発マイルストーンが達成されました。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
次の表は、期間中の収益活動に加えて、各履行債務に割り当てられた取引価格の概要を千単位で示しています。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | | | 期間中に認識された収益 |
| | 割り当てられた取引価格 | | | | 3月31日に終了した3か月間 | | |
| 履行義務 | | 2024年3月31日現在 | | | | 2024 | | 2023 | | | | |
ロシュのライセンス義務 | | $ | 375,000 | | | | | $ | 65,000 | | | $ | — | | | | | |
ロシュ開発サービス義務 | | 545,000 | | | | | 7,151 | | | — | | | | | |
ロシュの技術移転義務 | | 2,000 | | | | | — | | | — | | | | | |
| | $ | 922,000 | | | | | $ | 72,151 | | | $ | — | | | | | |
2024年3月31日現在、未履行だったロシュの履行債務に割り当てられた取引価格の合計額は515.9 100万ドル。これは、ロシュ契約の期間を通じてサービスの実施時に計上される予定です。
リジェネロン・ファーマシューティカルズ株式会社
2019年、私たちはリジェネロンとグローバルで戦略的な協力を締結しました。これは、リジェネロンコラボレーションと呼ばれる、肝臓で発現する特定の数の標的に加えて、眼や中枢神経系(CNS)で発現する治療標的に取り組むことで、幅広い疾患に対するRNAi治療薬を発見、開発、商品化することです。リジェネロンコラボレーションは、リジェネロンマスター契約と呼ばれる基本契約によって管理されています。リジェネロン基本契約に関連して、私たちとリジェネロンは、(i)C5補体媒介性疾患向けに現在開発中のC5 siRNAであるセムディシランの単剤療法としての継続的な開発を対象とする協調協力契約、またはC5協調協力契約、および(ii)C5補体培地用の抗C5抗体-siRNAの組み合わせを評価するためのライセンス契約を締結しましたリジェネロンのポゼリマブとセムディシランの併用の評価、またはC5ライセンス契約を含む病気。
リジェネロンコラボレーションの条件に基づき、私たちはリジェネロンと独占的に眼と中枢神経系疾患のRNAi治療薬を発見しています。初期研究期間は約 五年これを初期研究期間と呼んでいます。Regeneronには、初期研究期間(研究期間延長期間と呼ばれ、初期研究期間と合わせて研究期間)を最大でさらに延長するオプションがあります。 五年、$の研究期間延長料で300.0 百万。リジェネロンのコラボレーションは、肝臓で発現する遺伝子を標的とするように設計された一部のRNAi治療プログラムも対象としています。これには、慢性肝疾患の非アルコール性脂肪性肝炎に対するRNAi治療薬を特定するために以前に発表した、リジェネロンとの共同研究が含まれます。私たちは、提携していない他のすべての肝臓向け臨床および前臨床パイプラインプログラムに対する幅広いグローバル権利を保持しています。Regeneron Collaborationは、各政党の同数の代表者で構成される合同運営委員会によって運営されています。
リジェネロンは、眼疾患を対象としたすべてのプログラムの開発と商品化を主導しており(限られた例外はありますが)、当事者間で合意されたライセンス契約の条件に従って、特定のマイルストーンやロイヤルティの支払いを受けることができます。私たちとリジェネロンは、リジェネロンコラボレーションの対象となる中枢神経系と肝臓プログラムについて交代でリーダーシップをとり、主導者はグローバルな開発と商業的責任を引き継いでいます。このような中枢神経系および肝臓プログラムでは、私たちとリジェネロンは、有力候補者選考時に、協働契約を締結することができます。協同協業契約は、当事者間で合意された形式で、両社はプログラムに基づくすべての開発および商業化活動の費用と利益を平等に分担します。非主導当事者が特定のCNSまたは肝臓プログラムに関して共同協力契約を締結しないことを選択した場合、私たちとリジェネロンはそのプログラムに関してライセンス契約を締結し、主導当事者はライセンス契約の目的の「ライセンシー」になります。CNSまたは肝臓プログラムの主要当事者が協働契約を締結しないことを選択した場合、私たちとリジェネロンはそのプログラムに関してライセンス契約を締結し、プログラムの指導者は相手方に譲渡され、元非主導当事者がライセンス契約の目的の「ライセンシー」になります。
C5補体媒介性疾患を対象としたプログラムに関しては、私たちはセムディシラン単剤療法の開発を管理しており、リジェネロンは併用療法製品の開発を主導しています。C5 co-coコラボレーション契約に従い、Regeneronは2022年11月に、セムディシラン単剤療法のさらなる開発と商業化をオプトアウトする権利を行使する決定を私たちに通知しました。その結果、Regeneronは、単剤療法プログラムの費用や将来の潜在的な利益を私たちと共有しなくなりました。私たちは引き続き契約に基づく義務を果たし、すべての開発および商品化費用を単独で負担します。Regeneronは、純売上高に対して2桁の段階的なロイヤリティを受け取る資格があります。C5ライセンス契約では、cemdisiranをコンビネーション製品の一部として使用する場合、開発および商品化の費用はすべてRegeneronが単独で負担し、低額の2桁のロイヤルティと最大$の商業マイルストーンを受け取ります325.0 組み合わせ可能な製品の売り上げは100万です。C5 co-coコラボレーション契約、C5ライセンス契約、およびRegeneron基本契約は、会計上の目的でまとめられ、1つの契約として扱われています。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
リジェネロン基本契約に関連して、リジェネロンは$の前払いをしました400.0 百万。2023年に、私たちは$を受け取りました100.0当社のCNSプログラム、ミベルシラン(旧ALN-APP)の初期臨床開発中の基準を満たすと、100万マイルストーンの支払いが行われます。また、最大$の追加を受け取る資格もあります100.0 眼科プログラムの初期臨床開発中に特定の基準を達成した際に、100万件のマイルストーン支払いを行います。私たちとリジェネロンは、最大を対象としたプログラムを進める予定です 30 最初のターゲット 五年 初期研究期間中は、リジェネロンコラボレーションの下で。各プログラムについて、Regeneronは私たちに$を提供します2.5 プログラム開始時に100万の資金と追加の$2.5 有力候補の特定で100万ドル、潜在的には約$です30.0 リジェネロンコラボレーションが定常状態に達するにつれて、年間100万ユーロのディスカバリー資金が提供されています。
リジェネロンは、以下の場合に都合上、リジェネロン基本契約を終了する権利を有します 90日間'通知。リジェネロン基本契約の終了は、その時点で有効なライセンス契約または協業契約の期間には影響しません。さらに、いずれの当事者も、相手方当事者による重大な違反または破産を理由に、リジェネロン基本契約を終了することができます。Regeneronマスター契約は、その条件に従って早期に終了されない限り、(a) 当該プログラムが終了したプログラムになるか、(b) 当事者が当該プログラムに関してライセンス契約または共同コラボレーション契約を締結するまで、各プログラムに関して有効であり続けます。リジェネロンの基本契約には、さまざまな表明、保証、契約、紛争のエスカレーションと解決のメカニズム、補償、およびこの種の取引に慣習的なその他の規定が含まれています。
その後締結されるライセンス契約については、通常、コラボレーション製品の開発と商品化に関連して発生した費用と費用は、ライセンシーが負担します。ライセンシーは、ライセンサーに特定の開発および/または商品化のマイルストーンの支払いを合計で$まで支払います150.0 コラボレーション製品ごとに100万個です。さらに、ライセンス契約に基づいて該当するコラボレーション製品を初めて商業的に販売した後、ライセンシーは、2桁台という低い金額から、段階的にロイヤリティを支払う必要があります。 20コラボレーション製品の年間総売上高に基づいて、ライセンサーに%、慣習的に減額されます。
その後締結される協同組合契約については、開発および商品化活動のすべての費用と利益を私たちとリジェネロンが平等に分担します。当社の費用の払い戻しは、要約された連結損益計算書で研究開発費の削減と包括損失として計上されます。ある当事者がオプトアウト権を行使した場合、該当するco-coコラボレーション契約に基づくコラボレーション製品の開発と商品化に関連して発生したすべての費用と経費は、定められたポイントを通じて継続的に費用を分担することを条件として、主導当事者が負担します。協同組合契約に基づいて該当するコラボレーション製品を初めて商業的に販売した後に、ある当事者がオプトアウト権を行使する場合、主導当事者は一定の段階的なロイヤリティの支払いを行う必要があります。ロイヤリティの支払いは、2桁台という低い金額から 20%、コラボレーション製品の年間総売上高とオプトアウト権の行使のタイミングに基づいて、相手方に。慣習的な削減とオプトアウト移行費用の削減を条件とします。
医薬品開発の不確実性と、一般的に医薬品開発に伴う過去の失敗率が高いため、オプトアウト権を行使した場合でも、リジェネロンマスター契約、C5ライセンス契約、将来のライセンス契約、または協同組合契約に基づき、リジェネロンから追加のマイルストーンやロイヤリティの支払いを受け取れない場合があります。
リジェネロンコラボレーションに基づく当社の義務には、(i) 研究ライセンスおよび研究サービス(総称して「研究サービス義務」といいます)、(ii)併用療法および製造・供給および開発サービスに関するセムディシランへのワールドワイドライセンス(総称してC5ライセンス義務)、および(iii)Cemdisiran単剤療法の開発、製造、商品化活動が含まれます。5 協同組合の義務。
研究ライセンスは研究サービスと区別できないと判断しました。これは主に、リジェネロンが単独で、または合理的に利用可能な他のリソースでは利益を得ることができなかったためです。ライセンスは専門知識へのアクセスを提供するものであり、特にリジェネロンコラボレーションが実施された時点では市場には利用できなかったRNAi技術に関するものです。同様に、併用療法のセムディシランへの世界的なライセンスは、製造、供給、開発サービスの義務と区別がありませんでした。リジェネロンは、供給を受け取らなければライセンスの価値から利益を得ることができないからです。
これとは別に、2022年11月にリジェネロンがセムディシラン単剤療法のさらなる開発と商業化をオプトアウトする権利を行使することを決定する前は、私たちとリジェネロンはどちらも開発および製造活動に積極的に参加しており、契約活動の商業的成功に依存する重大なリスクと見返りにさらされていたため、C5 co-coコラボレーション契約はASC 808の範囲内でした。契約からオプトアウトする権利を行使するというRegeneronの決定により、Regeneronの役割が変わり、取り決めに基づく重大なリスクと報酬にさらされることになりました。その結果、この取り決めはもはや協力的な取り決めではないと判断しました。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
この取り決めは、当社が契約に基づく開発および製造活動を提供する義務を果たしているため、ASC 606に基づくベンダーと顧客の関係を表すものになりました。C5 Co-Coの債務勘定単位に割り当てられた取引価格は、当社が支出すると予想される総労力の割合として発生した労力の割合を決定することにより、特定された履行義務の推定総費用と比較して発生した費用に基づくインプットメソッドを使用して長期にわたって計上されます。
取引価格の合計は、$で構成されます400.0 研究サービス義務とC5ライセンス義務に関連する研究、開発、製造、供給活動に関連する100万ドルの前払いと追加の変動対価。これらの活動に対する償還額を決定するために、期待価値法を用いました。コンビネーションセラピーのセムディシランへのワールドワイドライセンスに関連する売上ベースのロイヤルティやマイルストーンに関連する変動する対価はすべて制約があると見なされ、したがって取引価格から除外されたと判断しました。さらに、眼科プログラムの初期臨床開発中に特定の基準を達成すると、将来のマイルストーン支払いを受け取る資格があります。また、特定の目、中枢神経系、または肝臓ターゲットの将来の商用販売に対してロイヤルティを受け取る資格があります。ただし、これらの金額は、医薬品候補が特定された後にライセンス契約の形態が締結され、リジェネロンにライセンスが付与された場合にのみそのような金額を受け取る資格があるため、リジェネロンコラボレーションの変動対価から除外されます。このような後に付与されたライセンスは、ASC 606に基づく個別の取引となります。
当社は、該当する会計ガイダンスに基づいて、初期取引価格を各口座単位に次のように割り当てました。単位は千です。
| | | | | | | | | | | | | | | | |
| 履行義務 | | スタンドアロン販売価格 | | 割り当てられた取引価格 | | |
| 研究サービスの義務 | | $ | 130,700 | | | $ | 183,100 | | | |
| C5ライセンス義務 | | $ | 97,600% | | | 92,500 | | | |
| C5 協同組合の義務 | | $ | 364,600% | | | 246,000 | | | |
| | | | $ | 521,600% | | | |
取引価格は、経営陣がかなりの判断を下した各債務の相対的な推定独立売却価格に基づいて債務に割り当てられました。研究サービス義務とC5ライセンス義務に含まれるライセンスの推定スタンドアロン販売価格は、主に、それぞれの特定のプログラムに関連する各ライセンスに関連する将来の予想キャッシュフローの確率加重現在価値に基づいて作成しました。このような見積もりを作成する際には、適用される市況と関連する事業体固有の要因、各ライセンスの下で追求されると予想されるターゲットまたは適応症の数、成功の確率、関連するライセンスに従って製品候補を開発するのに必要な時間、および割引率を考慮して、予測収益を決定する際に判断を下しました。私たちは、主に、実施するサービスおよび/または製造される商品の性質と関連費用の見積もりに基づいて、該当する場合、各債務に含まれるサービスおよび/または製造および供給の推定独立販売価格を作成しました。C5 Co-Co債務のスタンドアロン売却価格の推定値は、リジェネロンが受け取る資格がある将来の予想キャッシュフローの現在価値を見積もって算出されました。このような見積もりを作成するにあたり、私たちは追求する兆候、そのような指標の予測収益、成功確率、割引率を決定する際に判断を下しました。
ASC 606で計上されている研究サービス義務、C5ライセンス義務、およびC5 Co-Co義務については、四半期ごとに、支出すると予想される総労力の割合として発生した労力の割合を決定することにより、特定された各債務の見積もり総費用と比較して発生した費用に基づくインプット方法を使用して、時系列に比例した業績を測定します。この比率は、各債務に割り当てられた取引価格に適用されます。経営陣は、見積もりを作成する過程で重要な判断を下しました。これらの見積もりに変更があった場合は、変更された期間に累積的なキャッチアップとして認識されます。各報告期間の終了時点で取引価格を再評価し、2024年3月31日現在、合計取引価格は$と決定されました676.3 百万、 重要ではありません 2023年12月31日からの増加です。2024年3月31日現在、取引価格は、前払い金と、開発、製造、供給活動に関連する変動対価で構成されています。本契約に基づいて計上された収益は、コラボレーション収益として計上されます。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
次の表は、該当する会計ガイダンスに基づいて各勘定単位に割り当てられた取引価格と、期間中の収益活動と貸借対照表日現在の繰延収益(千単位)の概要を示しています。
| | | | | | | | | | | | | | | | | | | | | | |
| | 割り当てられた取引価格 | | 繰延収益 | | |
| 履行義務 | | 3月31日の時点で、
2024 | | 3月31日の時点で、
2024 | | 12月31日現在、
2023 | | |
| 研究サービスの義務 | | $ | 305,680 | | | $ | 48,700 | | | $ | 63,400% | | | |
| C5ライセンス義務 | | 124,600% | | | 26,100 | | | 27,500 | | | |
| C5 協同組合の義務 | | 246,000 | | | 185,500 | | | 186,200% | | | |
| | $ | 676,280です | | | $ | 260,300ドル | | | $ | 277,100 | | | |
| | | | | | | | | | | | | | | | | | | | |
| | 期間中に認識された収益 | | |
| | 3月31日に終了した3か月間 | | | | |
| 履行義務 | | 2024 | | 2023 | | | | | | |
| 研究サービスの義務 | | $ | 14,700 | | | $ | 10,700 | | | | | | | |
| C5ライセンス義務 | | 1,700 | | | 2,200ドル | | | | | | | |
| C5 協同組合の義務 | | 700 | | | 2,500 | | | | | | | |
| | $ | 17,100 | | | $ | 15,400です | | | | | | | |
2024年3月31日現在、未払いの研究サービス債務、C5ライセンス義務、およびC5 Co-Co債務に割り当てられた取引価格の合計額は$でした318.1100万ドル。これは、リジェネロンコラボレーションの期間を通じて、サービスが実施されるにつれて認識される見込みです。Regeneron Collaborationに関連する繰延収益は、収益が計上されると予想される期間に基づいて、要約連結貸借対照表で流動収益と非流動収益のいずれかに分類されます。
ノバルティスAG
2013年、ザ・メディシンズ・カンパニーとのコラボレーション
2013年2月、私たちとThe Medicines Company(MDCO)は、ライセンスおよびコラボレーション契約を締結しました。これに基づいて、高コレステロール血症およびインクリシランを含むその他のヒトの疾患の治療を目的とした、プロプロテイン転換酵素サブチリシン/ケキシン9型を標的とするRNAi治療薬の開発、製造、および商品化に関する独占的な世界的ライセンスをMDCOに付与しました。本契約の日付までに修正された本契約を、MDCOライセンス契約と呼びます。2020年、ノバルティスAG、またはノバルティスはMDCOの買収を完了し、MDCOライセンス契約に基づくMDCOの権利と義務をすべて引き継ぎました。
2024年3月31日現在、私たちは$を稼いでいます120.0何百万ものマイルストーンがあり、さらに$を受け取る資格があります60.0100万個の商品化マイルストーン。さらに、私たちは次のようなロイヤリティを受け取る権利があります 10% まで 20%は、ノバルティス、その関連会社、およびサブライセンシーによるライセンス製品の全世界の年間純売上高に基づいており、特定の状況下では減額される場合があります。ノバルティスのLeqvioの将来の商業販売は不確実であるため、MDCOライセンス契約に基づいて追加のマイルストーン支払いを受け取ることができず、将来のロイヤリティの支払いが予想よりも少なくなる可能性があります。
その他
上記のコラボレーション契約に加えて、現時点で当社の業績や財政状態にとって個別に重要ではないさまざまなコラボレーション契約を結んでいます。これらの契約の条件に従い、将来のさまざまな出来事(たとえば、さまざまな開発および商業上のマイルストーンの達成など)の発生に応じて、合計すると多額の追加金額を支払う必要がある場合や、追加の金額を受け取る場合があります。また、多額の研究開発費が発生したり、払い戻されたりする場合もあります。さらに、これらのコラボレーションに関連する製品の販売が承認された場合、今後の販売に対してロイヤリティの支払いを求められたり、受け取ったりすることがあります。ただし、これらの金額の支払いまたは受領は、今後のさまざまなイベントの発生を条件としています。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
5。 公正価値測定
次の表は、定期的に公正価値で測定される当社の金融資産と負債に関する情報を示しており、そのような公正価値を決定するために当社が利用した評価手法の公正価値階層を示しています。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| (千単位) | | 2024年3月31日現在 | | 活発な市場での相場価格
(レベル 1) | | 重要な観察可能な入力
(レベル 2) | | 観察できない重要なインプット
(レベル 3) |
| 金融資産 | | | | | | | | |
| 現金同等物: | | | | | | | | |
| マネー・マーケット・ファンド | | $ | 126,550% | | | $ | 126,550% | | | $ | — | | | $ | — | |
| 米国財務省証券 | | 47,797 | | | — | | | 47,797 | | | — | |
| コマーシャル・ペーパー | | 8,971 | | | — | | | 8,971 | | | — | |
| | | | | | | | |
| 市場性のある債券: | | | | | | | | |
| 米国財務省証券 | | 913,875 | | | — | | | 913,875 | | | — | |
| 米国政府が後援する企業証券 | | 427,513 | | | — | | | 427,513 | | | — | |
| コーポレートノート | | 263,468 | | | — | | | 263,468 | | | — | |
| コマーシャル・ペーパー | | 73,291 | | | — | | | 73,291 | | | — | |
| | | | | | | | |
| | | | | | | | |
| 市場性のある株式証券 | | 11,256 | | | 11,256 | | | — | | | — | |
| 制限付現金(マネーマーケットファンド) | | 1,214 | | | 1,214 | | | — | | | — | |
| 金融資産総額 | | $ | 1,873,935 | | | $ | 139,020 | | | $ | 1,734,915 | | | $ | — | |
| 金融負債 | | | | | | | | |
| 開発デリバティブ賠償責任 | | $ | 336,579 | | | $ | — | | | $ | — | | | $ | 336,579 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| (千単位) | | 2023年12月31日現在 | | 活発な市場での相場価格
(レベル 1) | | 重要な観察可能な入力
(レベル 2) | | 観察できない重要なインプット
(レベル 3) |
| 金融資産 | | | | | | | | |
| 現金同等物: | | | | | | | | |
| マネー・マーケット・ファンド | | $ | 166,059 | | | $ | 166,059 | | | $ | — | | | $ | — | |
| 米国財務省証券 | | 30,712 | | | — | | | 30,712 | | | — | |
| | | | | | | | |
| コマーシャル・ペーパー | | 2,685 | | | — | | | 2,685 | | | — | |
| | | | | | | | |
| コーポレートノート | | 762 | | | — | | | 762 | | | — | |
| 市場性のある債券: | | | | | | | | |
| 米国財務省証券 | | 862,022 | | | — | | | 862,022 | | | — | |
| 米国政府が後援する企業証券 | | 441,341 | | | — | | | 441,341 | | | — | |
| コーポレートノート | | 252,350です | | | — | | | 252,350です | | | — | |
| コマーシャル・ペーパー | | 56,216 | | | — | | | 56,216 | | | — | |
| 預金証書 | | 3,587 | | | — | | | 3,587 | | | — | |
| | | | | | | | |
| 市場性のある株式証券 | | 11,178 | | | 11,178 | | | — | | | — | |
| 制限付現金(マネーマーケットファンド) | | 1,210 | | | 1,210 | | | — | | | — | |
| 金融資産総額 | | $ | 1,828,122 | | | $ | 178,447 | | | $ | 1,649,675% | | | $ | — | |
| 金融負債 | | | | | | | | |
| 開発デリバティブ賠償責任 | | $ | 324,941 | | | $ | — | | | $ | — | | | $ | 324,941 | |
2024年と2023年3月31日に終了した3か月間には、 いいえ レベル3の金融資産または負債への転送、またはレベル3の金融負債からの送金。現金、売掛金、純資産、その他の流動資産、買掛金および未払費用の要約連結貸借対照表に反映されている帳簿価額は、短期満期による公正価値に近いものです。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
6。 市場性のある負債証券
私たちは超過現金残高を市場性のある債務証券に投資し、提示された各貸借対照表の日付で、負債証券への投資はすべて、現在の事業に利用可能な資金の投資を表すため、売却可能資産および流動資産として分類しています。2024年または2023年3月31日に終了した3か月間、有価債務証券に関連する減損費用は一切記録しませんでした。
次の表は、当社の有価負債証券をまとめたものです。
| | | | | | | | | | | | | | | | | | | | | | | |
| 2024年3月31日現在 |
| (千単位) | 償却済み
費用 | | 未実現総利益 | | 未実現損失総額 | | 公正価値 |
| 米国財務省証券 | $ | 963,082 | | | $ | 74 | | | $ | (1,484) | | | $ | 961,672 | |
| 米国政府が後援する企業証券 | 427,918 | | | 200 | | | (605) | | | 427,513 | |
| コーポレートノート | 263,673 | | | 208 | | | (413) | | | 263,468 | |
| コマーシャル・ペーパー | 82,262 | | | — | | | — | | | 82,262 | |
| | | | | | | |
| | | | | | | |
| 合計 | $ | 1,736,935 | | | $ | 482 | | | $ | (2,502) | | | $ | 1,734,915 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2023年12月31日現在 | | | | |
| (千単位) | 償却済み
費用 | | 未実現総利益 | | 未実現損失総額 | | 公正価値 | | | | |
| 米国財務省証券 | $ | 892,237 | | | $ | 1,085 | | | $ | (588) | | | $ | 892,734 | | | | | |
| 米国政府が後援する企業証券 | 440,915 | | | 1,000 | | | (574) | | | 441,341 | | | | | |
| コーポレートノート | 252,487 | | | 945 | | | (320) | | | 253,112 | | | | | |
| コマーシャル・ペーパー | 58,901 | | | — | | | — | | | 58,901 | | | | | |
| 預金証書 | 3,587 | | | — | | | — | | | 3,587 | | | | | |
| | | | | | | | | | | |
| 合計 | $ | 1,648,127 | | | $ | 3,030 | | | $ | (1,482) | | | $ | 1,649,675% | | | | | |
要約連結貸借対照表の分類別の有価証券の公正価値は次のとおりです。
| | | | | | | | | | | |
| (千単位) | 2024年3月31日現在 | | 2023年12月31日現在 |
| 市場性のある債務証券 | $ | 1,678,147 | | | $ | 1,615,516 | |
| 現金および現金同等物 | 56,768 | | | 34,159 | |
| 合計 | $ | 1,734,915 | | | $ | 1,649,675% | |
7。 その他の貸借対照表の詳細
インベントリ
インベントリの構成要素は次のように要約されます。
| | | | | | | | | | | |
| (千単位) | 2024年3月31日現在 | | 2023年12月31日現在 |
| 原材料 | $ | 25,401 | | | $ | 23,346 | |
作業中 | 76,071 | | | 76,963 | |
| 完成品 | 24,819 | | | 25,123 | |
在庫合計 | $ | 126,291 | | | $ | 125,432 | |
2024年3月31日と2023年12月31日の時点で、私たちのお金は32.3 百万と $36.3 通常の営業サイクルを超えて消費されると予想されるため、それぞれ100万件の長期在庫が要約連結貸借対照表の他の資産に含まれています。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
現金、現金同等物および制限付現金
次の表は、当社の要約連結貸借対照表に報告された現金、現金同等物および制限付現金を、要約連結キャッシュフロー計算書に示されている金額の合計と調整したものです。
| | | | | | | | | | | |
| 3月31日の時点で、 |
| (千単位) | 2024 | | 2023 |
| 現金および現金同等物 | $ | 681,879 | | | $ | 672,245 | |
| その他の資産に含まれる制限付現金の総額 | 2,840 | | | 2,166% | |
要約連結キャッシュフロー計算書に表示されている現金、現金同等物、制限付現金の合計 | $ | 684,719 | | | $ | 674,411 | |
その他の包括利益(損失)の累計
次の表は、その他の包括利益(損失)の累計額の推移を構成要素別にまとめたものです。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| (千単位) | 合弁事業への投資損失 | | 確定給付年金
計画 | | 負債による未実現(損失)利益 証券 | | 外貨翻訳
調整 | | 累積合計その他 包括的損失 |
| 2023年12月31日現在の残高 | $ | (32,792) | | | $ | (2,753) | | | $ | 1,548 | | | $ | 10,622% | | | $ | (23,375) | |
再分類前のその他の包括損失 | — | | | — | | | (6) | | | (78) | | | (84) | |
その他の包括損失から再分類された金額 | — | | | 33 | | | (3,562) | | | — | | | (3,529) | |
その他の包括的純損失 | — | | | 33 | | | (3,568) | | | (78) | | | (3,613) | |
| 2024年3月31日現在の残高 | $ | (32,792) | | | $ | (2,720) | | | $ | (2,020) | | | $ | 10,544です | | | $ | (26,988) | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| (千単位) | 合弁事業への投資損失 | | 確定給付年金
計画 | | 負債による未実現(損失)利益 証券 | | 外貨翻訳
調整 | | その他の包括損失の累積合計 |
| 2022年12月31日現在の残高 | $ | (32,792) | | | $ | (1,092) | | | $ | (9,470) | | | $ | (1,300です) | | | $ | (44,654) | |
再分類前のその他の包括利益 | — | | | — | | | (9) | | | 1,410 | | | 1,401 | |
その他の包括利益から再分類された金額 | — | | | (5) | | | 4,134です | | | — | | | 4,129 | |
その他の純包括利益 | — | | | (5) | | | 4,125 | | | 1,410 | | | 5,530 | |
| 2023年3月31日現在の残高 | $ | (32,792) | | | $ | (1,097) | | | $ | (5,345) | | | $ | 110 | | | $ | (39,124) | |
その他の包括利益(損失)の累積から再分類された金額は、有価証券の決済および年金債務の償却に関するもので、これらはその他の費用に計上され、要約連結営業報告書と包括損失に差し引かれます。
8。 転換社債
2027年満期転換社債
2022年に、私たちは$のプライベートオファリングを開始しました900.0元本の総額は百万です 12027年満期の転換社債の%、またはイニシャルノート。2022年9月13日、このサービスの最初の購入者は、追加のドルを購入するオプションを行使しました135.0私たちの元本総額 12027年満期の転換社債の割合、または追加手形、および初期手形を総称して債券と呼びます。これにより、債券の元本総額はドルになります1.0410億。債券は、2022年9月15日付けのインデンチャー、またはインデンチャーに従って発行されました。インデンチャーには慣習的な契約が含まれており、債券の期限が過ぎると直ちに支払期日を宣言して支払うことができる特定の債務不履行事由が定められています。また、会社が関与する特定の種類の破産または債務不履行事由が定められており、その後、手形は自動的に支払期日となり支払われるようになります。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
紙幣は、以前に換算、償還、または買い戻されない限り、2027年9月15日に満期になります。紙幣には、2022年9月15日から、次の利率で利息がかかります 12023年3月15日から、毎年3月15日と9月15日に半年ごとに延滞して支払われる年間の割合。紙幣は、2027年6月15日以降、ノートホルダーの選択により転換可能です。2027年6月15日より前の債券は、以下の状況でのみ転換可能です。(1) 2022年12月31日に終了する暦四半期以降に始まる任意の暦四半期中(および当該暦四半期中のみ)、もし最後に報告された当社の普通株式の売却価格が 20 期間中の取引日数(連続しているかどうかにかかわらず) 30 直前の暦四半期の最終取引日に終了する連続取引日が、以下と同等かそれ以上である 130該当する各取引日の転換価格の%。(2)その間 五 あとは営業日の期間 十 その日の各取引日の債券の元本1,000ドルあたりの取引価格を示す連続取引日期間 十 連続した取引日の期間は 98前回報告された当社の普通株式の売却価格とその取引日の債券の換算レートの積の割合、(3)債券の一部または全部を償還対象とするかどうか、または(4)債券を管理するインデンチャーに定められている特定の企業イベントの発生時。当社は、当社の選挙時に、必要に応じて、現金、当社の普通株式、または現金と普通株式の組み合わせを支払いまたは引き渡すことで、債券の転換を決済します。
ノートの転換率は、当初、ノートの元本1,000ドルあたり3.4941株の普通株式で、これは当初の転換価格約$に相当します286.20 普通株式1株当たり。ノートの当初の転換価格は、おおよそのプレミアムに相当します 35% が $ を超えています212.00 2022年9月12日に最後に報告された1株当たりの普通株式の売却価格。換算レートは、特定の状況下ではインデンチャーの条件に従って調整される場合があります。
2025年9月20日より前に手形を引き換えることはできません。以下の金額の現金と引き換えることができます 1002025年9月20日以降、2025年9月20日以降に償還された債券の元本の割合に、当社の選択により、債券の全部または一部の未払利息を加えたもの(最後に報告された当社の普通株式の売却価格が少なくとも 130少なくともその時点で有効であるコンバージョン価格の% 20 任意の取引日(連続しているかどうかにかかわらず) 30 連続取引日期間。手形には減価償却資金は用意されていないため、定期的に手形を償還したり償却したりする必要はありません。
インデンチャー契約で定義されているように、当社が根本的な変更を受けた場合、一定の条件の下で、保有者は当社に対し、債券の全部または一部を、以下と同等の基本変更買戻し価格で現金で買い戻すよう要求することができます 100買い戻される債券の元本金額に未払利息と未払利息を加えた割合です。さらに、特定の企業イベントが満期日より前に発生した場合、または償還通知を発行した場合、そのような企業イベントに関連して手形を転換することを選択した保有者の換算レートを事前に設定した金額だけ引き上げます。今四半期は、債券の保有者が転換できる条件が満たされませんでした。
2024年3月31日現在、債券は発行費用を差し引いた長期負債に分類されています19.2 要約連結貸借対照表には百万です。2024年3月31日現在、債券の推定公正価値は約$でした979.4百万。公正価値は、2024年3月31日に終了した3か月間(レベル2)の債券100ドルあたりの最後にアクティブに取引された価格に基づいて決定されました。債券は額面通りに発行され、債券の発行に関連する費用は、債券の契約期間中の利息費用として償却されます。2024年3月31日現在、債券の実効金利は1%。
上限付きコールトランザクション
2022年に、初期ノートの価格設定と初回購入者による追加ノートの購入オプションの行使に関連して、私たちは個人的に交渉したキャップコール取引、またはキャップドコール取引を締結しました。キャップ・コール・トランザクションは当初、通常の希薄化防止調整を条件として、債券の基礎となる普通株式の数を対象としています。キャップド・コール・トランザクションの上限価格は、当初は$です424.00 1株当たり、これはプレミアムに相当します 100最後に報告された普通株式の売却価格$を%上回っています212.00 2022年9月12日の1株当たりで、キャップド・コール取引の条件に基づく特定の調整の対象となります。
9。 将来のロイヤリティの売却に関連する責任
2020年4月、私たちはBX Bodyguard Royalty L.P.(ブラックストーングループ社の関連会社)またはBlackstone Royaltyesと売買契約、または購入契約を締結しました。この契約に基づき、ブラックストーン・ロイヤリティは当初設定されていた支払われるロイヤルティの一定割合、つまりロイヤリティ利息を取得しました 50MDCO、その関連会社またはサブライセンシーによる、Inclisiran(またはブランド医薬品、Leqvio)およびMDCOライセンス契約に基づくその他のライセンス製品の純売上高に関する%、および 75MDCOライセンス契約に基づいて支払われる商業マイルストーン支払いの割合と、ロイヤルティ利息、購入利息を合わせます。ブラックストーン・ロイヤルティズが2029年12月31日までにロイヤリティ利息に関する支払いを受け取らない場合、少なくともドルに相当します1.0010億円です。ブラックストーンのロイヤリティは 55% は2030年1月1日から始まります。購入した利息の売却と引き換えに、ブラックストーンのロイヤルティは私たちに$を支払いました1.0010億。
当社は、Inclisiranのすべての知的財産権を引き続き所有または管理し、購入権の生成に関連する特定の継続的な製造および供給義務に責任を負います。私たちの継続的な関与により、
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
引き続き、MDCOライセンス契約に基づいて当社に支払うべきロイヤルティと商業上のマイルストーンを、要約連結営業報告書の収益と包括損失として計上し、この取引による収益を、決算費用を差し引いた負債として要約連結貸借対照表に記録します。
将来のロイヤリティの売却に関連する負債の償却額を決定するには、購入契約期間中のBlackstoneロイヤルティへの将来の支払い総額を見積もる必要があります。ザ・$1.00契約の締結時に記録された10億の負債は、購入契約期間中の利息費用として、これらのロイヤルティと商業マイルストーンの支払いの合計に加算されます。2024年3月31日現在、この総支払利息の見積もりでは、実効年利は 9%。これらの見積もりには、実行時に記録される金額と、将来の期間に計上される支払利息の両方に影響する仮定が含まれています。
Blackstoneのロイヤリティへの支払いが完了すると、負債の残高は購入契約の存続期間にわたって実質的に返済されます。返済の正確なタイミングと金額は、報告期間ごとに変わる可能性があります。Leqvioのグローバル純収益の大幅な増減は、将来のロイヤルティの売却に関連する負債、支払利息、および返済期間に重大な影響を及ぼします。Blackstone Royaltiesへの予想支払額を定期的に評価し、その金額または支払時期が当初の見積もりと大きく異なる場合は、将来のロイヤリティおよび関連する支払利息の売却に関連する負債の償却を見越して調整します。
2024年3月31日現在、将来のロイヤリティの売却に関連する負債の帳簿価額はドルでした1.3810億、クロージングコストを差し引いたもの9.8百万。将来のロイヤルティの売却に関連する負債の帳簿価額は、2024年3月31日現在の公正価値に近似しており、契約期間中にブラックストーン・ロイヤリティに支払われると予想される将来のロイヤルティと商業マイルストーンの現在の見積もりに基づいています。これらはレベル3のインプットとみなされます。
次の表は、将来のロイヤリティの売却に関連する負債に関する活動を千単位で示しています。
| | | | | | | | |
2023年12月31日現在の帳簿価額 | | $ | 1,377,239 | |
| 支払利息が認識されました | | 31,565 | |
| 支払い | | (25,738) | |
2024年3月31日現在の帳簿価額 | | $ | 1,383,066 | |
10。 開発デリバティブ賠償責任
2020年8月、私たちはBXLS V Bodyguard — PCP L.P. およびBXLS ファミリー・インベストメント・パートナーシップV — ESC L.P.(総称してブラックストーン・ライフサイエンス)と、資金調達契約と呼ばれる共同開発契約を締結しました。これに基づき、ブラックストーン・ライフサイエンスは最大$を提供します150.0私たちの心臓代謝プログラムの2つであるヴトリシランとジレベシランの臨床開発に100万ドルの資金を提供しました。vutrisiranに関しては、ブラックストーンライフサイエンスは最大$を提供することを約束しました70.0HELIOS-B第3相臨床試験に関連する開発費に充てられます。2021年11月、ブラックストーンライフサイエンスは、zilebesiranの第2相臨床試験への資金提供を選択し、一定の患者登録基準を満たした場合に、最大$までの資金提供を行うことを約束しました。26.0百万。さらに、ブラックストーンライフサイエンスは最大$の資金を調達する権利がありますが、義務ではありません54.0百万ドルは、ジレベシランの第3相臨床試験に関連する開発費です。ブラックストーン・ライフサイエンスが最終的に提供する資金額は、各臨床試験に関して特定の開発マイルストーンを達成するかどうかにかかっています。ブラックストーンと当社の間では、ヴトリシランとジレベシランの両方の開発と商品化については当社が単独で責任を負います。
ブラックストーン・ライフサイエンスがブトリシランの臨床開発費を賄うための対価として、ブラックストーン・ライフサイエンスに支払うことに合意しました 1AMVUTTRA(ヴトリシラン)の純売上高に対するロイヤリティの% 10 年間 ATTR型心筋症に対するヴトリシランの規制当局の承認後、最初の商業販売から始まる期間、および最大額の固定支払い 2.5 投資額を a で乗算します 二年間 特定の国でのATTR型心筋症に対するヴトリシランの規制当局の承認を受けた時点。ただし、強制リコール後にヴトリシランが市場から撤退した場合を除きます。ブラックストーン・ライフサイエンスがジレベシランの第2相臨床開発費を賄うための対価として、ブラックストーン・ライフサイエンスに最大限の固定支払いを支払うことに合意しました 3.25 フェーズ2への投資を掛けて 4 年間 ジレベシランの継続的な開発に影響する特定の規制上の事象が発生しない限り、ジレベシラン第2相臨床試験が無事に完了した時点までの期間です。2023年9月、私たちはジレベシランに関するKARDIA-1フェーズ2調査の肯定的な結果を発表し、$という開発マイルストーンの達成のきっかけとなりました84.5四半期ごとの16回の支払いで、ブラックストーンに100万円が支払われます 四年間。ブラックストーン・ライフ・サイエンスがジレベシランの第3相臨床開発費を賄うための対価として、ブラックストーン・ライフサイエンスに最大で定額を支払うことに合意しました 4.5 フェーズ3への投資を掛けて 4 年間 特定の国でzilebesiranが規制当局の承認を受けた時点までの期間。ただし、強制リコール後に市場から撤退する場合を除きます。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
資金調達契約に基づく当社の支払い義務は、特定の例外を除いて、当社が所有するvutrisiranとzilebesiranに関連する知的財産の担保権と、資金の入金が行われる銀行口座の担保権によって担保されます。
私たちとブラックストーン・ライフサイエンスはそれぞれ、相手方の破産または同様の手続きが発生した場合に、資金提供契約を完全に終了する権利を有します。当社とBlackstone Life Sciencesはそれぞれ、相手方による未治癒の重大な違反が発生した場合、または特定の患者の健康と安全上の理由により、または特定の主要市場国の規制当局の承認が製品の臨床試験の完了後に製品について規制当局の承認が得られなかった場合に、資金提供契約全体またはいずれかの製品に関する資金提供契約を終了することができます。さらに、Blackstone Life Sciencesは、契約に基づく支払い能力、製品の開発または商品化に影響する特定の事象が発生した場合、または当社の支配権が変更された場合に、資金提供契約を完全に終了する権利を有します。Blackstone Life Sciencesは、合同運営委員会がその製品の開発プログラム全体を終了することを選択した場合、その製品で特定の臨床的エンドポイントが達成されなかった場合、またはヴトリシランのみに関して、特許侵害の疑いで特定の主要市場でヴトリシランを開発または商品化する当社の権利が禁止された場合に、製品に関する資金提供契約を終了することがあります。特定の解約状況では、ブラックストーン・ライフ・サイエンスから受け取った開発資金と同額またはその倍額をブラックストーン・ライフ・サイエンスに支払う義務があります。特定の状況下では、ATTRのzilebesiranまたはvutrisiranの規制当局の承認を得た場合、上記のブラックストーン・ライフサイエンスに支払いをするか、AMVUTTRAの場合は上記のロイヤルティを支払う義務があります終了後に心筋症を伴うアミロイドーシス。
当社は、ASC 815の「デリバティブおよびヘッジング」に基づく資金調達契約を、Blackstone Life Sciencesへの支払いのタイミングに応じて、当社の要約連結貸借対照表の未払費用またはその他の負債に記録される、公正価値で測定されるデリバティブ負債として計上します。開発デリバティブ負債の再測定による公正価値の変動は、当社の要約連結営業報告書および包括損失にその他の費用として計上されます。
2024年3月31日現在、デリバティブ負債は公正価値階層のレベル3の金融負債に分類されています。評価方法には、(i)ブラックストーン・ライフサイエンスから支払いを受けるために定められた開発マイルストーンを達成する確率と時期、(ii)規制当局の承認とブラックストーン・ライフサイエンスへの支払いが得られる確率と時期、(iii)ATTRアミロイドーシスの規制当局の承認を前提として、AMVUTTRAの純売上高に対して支払われるロイヤルティの金額と時期の見積もりなど、観察不可能なレベル3の主要なインプットが組み込まれています。心筋症の場合、(iv)私たちの借入費用(11%)、および (v) ブラックストーン・ライフサイエンスの借入費用 (6%).
次の表は、開発デリバティブ負債に関する活動を千単位で示しています。
| | | | | | | | |
2023年12月31日現在の帳簿価額 | | $ | 324,941 | |
| 資金調達契約に基づいて受け取った金額 | | 8,333 | |
資金調達契約に基づいて支払われた金額 | | (5,281) | |
| 開発デリバティブ負債の公正価値の変動 | | 8,586 | |
2024年3月31日現在の帳簿価額 | | $ | 336,579 | |
11。 株式ベースの報酬
次の表は、要約された連結営業報告書の営業費用および費用に含まれる株式ベースの報酬費用と、当社の要約連結株主赤字計算書の追加払込資本に含まれる株式ベースの報酬費用をまとめたものです。
| | | | | | | | | | | | | | | |
| | 3月31日に終了した3か月間 | | |
| (千単位) | 2024 | | 2023 | | | | |
| 研究開発 | $ | 19,215 | | | $ | 16,232 | | | | | |
| 販売、一般および管理 | 26,132 | | | 23,715 | | | | | |
株式報酬費用の総額 | 45,347 | | | 39,947 | | | | | |
資本化された株式ベースの報酬費用 | 808 | | | 1,189 | | | | | |
株式ベースの報酬費用の合計 | $ | 46,155 | | | $ | 41,136 | | | | | |
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
12。 普通株式1株あたりの純損失
普通株式1株あたりの基本純損失は、純損失を発行済普通株式の加重平均数で割って計算します。普通株式1株あたりの希薄化後の純損失を、その期間中に発行された普通株式と希薄化後の潜在的な普通株式同等物の加重平均数で割って計算します。希薄化後の1株当たり純損失の計算では、純損失は転換社債の支払利息を差し引いて調整されます。潜在的な普通株式には、制限付株式ユニットの権利確定、ストックオプションの行使(その収益は、自己株式法による発行済み株式の買い戻しに使用されたものとみなされます)、および期間中に発行された転換社債の転換時(報告された最も早い時期または発行日以降に転換社債が転換されることを前提として、転換後の方法で計算)に発行可能な株式で構成されます。。潜在的な普通株式を含めると、純損失が発生する期間には希薄化防止効果があるため、普通株式1株あたりの希薄化後の純損失は、普通株式1株あたりの基本純損失と同じです。
次の表は、普通株式1株あたりの純損失の計算から除外される潜在的な普通株式(自己株式の検討前、または転換後の方法の場合)を示しています。それらを含めると希薄化防止になります。
| | | | | | | | | | | | | | | |
| 3 か月が終了
3月31日、 | | |
| (千単位) | 2024 | | 2023 | | | | |
| 業績連動型ストックオプションを含む、普通株式の購入オプション | 7,538 | | | 8,428 | | | | | |
| 権利確定していない制限付株式ユニット(業績ベースの制限付株式ユニットを含む) | 3,150 | | | 2,547 | | | | | |
| 転換社債 | 3,616 | | | 3,616 | | | | | |
| 合計 | 14,304です | | | 14,591 | | | | | |
13。 コミットメントと不測の事態
テクノロジーライセンスとその他のコミットメント
私たちは、研究プロセスや当社が開発する可能性のあるその他の製品で特定の技術と情報を使用する権利を第三者からライセンスしています。関連するライセンス契約または技術契約に従い、さまざまな契約条件に基づいて、ライセンサーまたはライセンサーの被指名人に特定の固定支払いを行う必要があります。これらの契約条件の多くは、私たちがライセンスした基礎となる知的財産の存続期間と一致しています。2024年3月31日現在、既存のライセンス契約に基づく固定支払いとキャンセル可能な支払いを行うという今後5年間にわたる私たちの約束は重要ではありませんでした。
法務事項
時々、私たちは事業過程において、以下に説明する事項を含め、訴訟、仲裁、またはその他の法的手続きの当事者になることがあります。私たちが関与する可能性のある請求や法的手続きには、当社の製品または製品候補に関連する特許の範囲、有効性、または執行可能性に対する異議申し立て、他者が保有する特許の範囲、有効性、または執行可能性に対する当社による異議申し立てが含まれます。これらには、当社が自社の特許を侵害している、またはそのような第三者とのライセンスやその他の契約に違反しているという第三者からの申し立てが含まれます。そのような法的手続きの結果は、そのメリットにかかわらず、本質的に不確実です。さらに、訴訟や関連事項は費用がかかり、他の活動に従事していたはずの経営陣やその他のリソースの注意がそらされる可能性があります。そのような法的手続きで勝訴できなかった場合、当社の事業、経営成績、流動性、財政状態に悪影響を及ぼす可能性があります。訴訟費用の発生に関する当社の会計方針は、そのような費用が発生したことを認識することです。
特許侵害訴訟
2022年3月、私たちは (1) ファイザー社とその子会社であるファーマシア・アンド・アップジョン社に対して、米国デラウェア州地方裁判所に個別の訴訟を提起しました。LLC(総称してファイザー)、(2)モデルナ社とその子会社であるModernaTX、Inc.、Moderna US社(総称してModernaと呼びます)。訴訟は、ファイザーとモデルナによるメッセンジャーRNA、またはmRNA、COVID-19ワクチンの製造および販売における米国特許第11,246,933号、または'933特許の侵害に対する損害賠償を求めています。この特許は、mRNA COVID-19ワクチンの成功の基礎となる当社の生分解性カチオン性脂質に関するものです。
私たちは、ファイザーとモデルナのそれぞれが'933特許を侵害しているという判決と、その侵害を補償するのに十分な損害賠償を求めていますが、ファイザーとモデルナが特許取得済みの脂質を無許可で使用したことに対する妥当なロイヤルティと、裁判所が裁定する可能性のある利息と費用を求めています。提出された苦情に記載されているように、私たちはこれらの訴訟において差止命令による救済を求めていません。
目次
アルナイラム・ファーマシューティカルズ株式会社
要約連結財務諸表の注記
(未監査)
2022年5月23日、モデルナは第1498(a)条に基づく肯定的抗弁を主張して、一部却下の申立てを提出しました。私たちは2022年5月27日に、モデルナは政府以外で多額の売却を行っており、政府との契約は2022年4月に終了したと主張する彼らの申し立てに反対しました。モデルナは2022年6月13日に、第1498(a)条に基づく販売請求を却下する一部の申立てを要求しました。
2022年5月27日、ファイザーは当社の苦情に対する回答を提出し、申し立てを否定し、無効および非侵害の抗弁を主張しました。さらに、ファイザーは訴訟にBioNTech SEを追加し、当社の特許が無効であるという宣言的判決を求める反訴と、特許の悪用により当社の特許が無効であると主張する2番目の請求を追加しました。私たちは、彼らの抗弁と反訴には何のメリットもないと信じており、2022年6月10日に、私たちの主張の有効性と彼らの特許悪用請求にはメリットがないという実質的な議論で回答しました。
2022年7月12日、ファイザーとモデルナによるmRNA COVID-19ワクチンの製造および販売における米国特許第11,382,979号、または'979特許(特許)の侵害に対する損害賠償を求める追加の訴訟をファイザーとモデルナのそれぞれに対して提起しました。両当事者は、合併することに合意しました 二 の特許 一 モデルナとファイザー/バイオエヌテックのそれぞれに対して別々に訴訟を起こしてください。
2023年2月8日、米国特許庁から、2023年2月28日に米国特許第11,590,229号、つまり'229特許として3番目の特許が発行されるという通知を受け取りました。これもファイザーとモデルナのCOVID-19ワクチンが侵害していると考えています。2023年2月15日、私たちはファイザーとモデルナに対する既存の訴訟にこの特許を追加するよう裁判所に申し立てました。2023年4月26日、裁判所は公聴会を開き、第1498(a)条に基づく販売請求を却下するというモデルナの部分的な申立と、当時発生していた訴訟に「229特許」を追加するという当社の申立と、特定の無効を追加するためにモデルナが提出した申立てを却下しました私たちのケースでファイザーが行った議論は、以前に行われたモデルナの無効性に関する議論を補足するものです。
2023年5月26日、私たちはデラウェア州のファイザーとモデルナに対して、'229特許の侵害に対する損害賠償を求める追加の訴訟を提起しました。この特許に加えて、ファイザーとモデルナの両方に対して最近提起された訴訟では、米国特許番号11,633,479と11,633,480を追加し、ファイザーのみに対しても米国特許第11,612,657号を追加しました。
2023年8月9日、米国デラウェア州地方裁判所で、マークマンの意味を検討するマークマン公聴会が開催されました 三 '933と'979の特許で使用されている係争中の用語。2023年8月21日、裁判所は次の解釈命令を出しました 二 の 三 条件を満たし、3期目の判決を証拠審問まで延期しました。証拠審問は2024年1月4日に開催され、最終判決は2024年7月11日から12日に予定されている追加の証拠審問の結果が出るまで保留されています。その後、私たちとModernaは共同で、非侵害の最終判決に合意しました 二 当社の特許について、そしてそのような判決は2023年8月30日に裁判所によって下され、2023年9月7日、Modernaに対する最初の訴訟において、クレーム構築判決を連邦巡回控訴裁判所に控訴しました。クレームコンストラクションの判決は影響しませんでした 一 2023年5月26日にModernaに対して提起された訴訟の特許のうち、その訴訟は裁判所が定める予定で進行中です。
の 二 ファイザーに対する個別の訴訟は、3回目の請求期間の判決を条件として進行中です。2023年9月、私たちとファイザーは、2022年と2023年の訴訟を統合することに合意しました。 一 裁判日を2024年11月から2025年前半に繰り替える必要があり、最終的なスケジュールは裁判所が決定することになります。
損害賠償
知的財産権を取得するために企業と締結するライセンス契約に関連して、契約に基づいてライセンスされた知的財産権に関連して生じる特定の損害について、そのような企業に補償するよう求められる場合があります。このような契約の下では、ライセンス契約または基礎となる知的財産権に関連する訴訟の費用を、ライセンスされた知的財産に関する特定の訴訟に関連する費用を含め、当社が負担する場合があります。また、私たちは通常の事業過程で締結された多くの契約の当事者でもあります。これらの契約には、訴訟やその他の法的手続きを含む特定の事象が発生した場合に、そのような契約の他の当事者に補償することを義務付ける一般的な条項が含まれています。さらに、役員または取締役が当事者として関与していた、現在または関与する予定の、脅迫されている、係属中の、または完了した訴訟手続きに関連して支払われた経費、判決、罰金、罰金、消費税、および和解金額について、役員または取締役としての地位のため、または役員または取締役がとった措置を理由に、役員および取締役に支払われた費用、判決、罰金、罰金、消費税、和解金額を役員および取締役に補償することに同意しましたそのような立場で行動している間は、一定の制限があります。これらの補償費用は、販売費、一般管理費に充てられます。
このような補償条項に基づく当社の将来の最大責任額は不明です。このようなすべての補償条項に基づく当社の潜在的な負債の推定総公正価値は、最小限であると判断しました。2024年3月31日現在、そのような補償条項に関連する負債は記録されていません。
アイテム 2.経営陣による財政状態と経営成績の議論と分析
[概要]
私たちは、リボ核酸干渉(RNAi)に基づく新しい治療法を開発している世界的な商業段階のバイオ医薬品企業です。RNAiは、配列特異的なサイレンシングと遺伝子発現の調節のための、細胞内に自然に存在する生物学的経路です。RNAi経路を利用することで、RNAi治療薬と呼ばれる新しいクラスの革新的な医薬品を開発しました。RNAi治療薬は、病気の原因や経路に関係するタンパク質をコードするメッセンジャーRNA(mRNA)を強力にサイレンシングして作られないようにすることで、従来の薬の上流で機能する低分子干渉RNA(siRNA)で構成されています。これは、希少疾患や流行病患者のケアを変える可能性を秘めた革新的なアプローチだと考えています。現在までに、この革新的なアプローチを推進するための私たちの取り組みにより、オンパトロ®(パティシラン)、AMVUTTRA®(ヴトリシラン)、GIVLAARI®(ギボシラン)、OXLUMO®(ルマシラン)、レックビオ®(インクリシラン)の5つのファーストインクラスのRNAiベースの医薬品が承認されました。
私たちの研究開発戦略は、人間の病気の原因や経路に関係している遺伝的に検証された遺伝子をターゲットにすることです。私たちはN-アセチルガラクトサミン(GalNAC)コンジュゲートアプローチまたは脂質ナノ粒子(LNP)を利用して、siRNAの肝臓への送達を可能にします。中枢神経系、またはCNS、および眼への送達(眼球送達)には、親油性リガンドとしてヘキサデシル(C16)部分に基づく代替コンジュゲートアプローチを採用しています。また、心臓、骨格筋、脂肪組織へのsiRNA送達のアプローチも進めています。私たちは、まだ満たされていないニーズが高い臨床適応症、遺伝子的に検証された標的、第1相臨床試験における臨床活性の評価のための早期バイオマーカー、および医薬品開発、規制当局の承認、患者へのアクセス、商品化のための明確な道筋を示すことに重点を置いています。
2021年の初めに、私たちはAlnylam P5x25戦略を開始しました。これは、2025年末までに一流のバイオテクノロジー企業に移行する計画に焦点を当てています。Alnylam P5x25では、優れた財務実績を実現しながら、持続可能なイノベーションを通じて、革新的な希少疾病用医薬品、特殊医薬品、一部の流行病用医薬品を世界中の患者に提供することを目指しています。
現在、5つの製品と10以上の臨床プログラムを販売しています。そのうちのいくつかは開発後期段階にあり、希少適応症、特殊適応症、一部の流行適応症を対象としています。
ONPATTROは、成人の遺伝性トランスサイレチン媒介アミロイドーシス(hATTR)アミロイドーシスのポリニウロパチーの治療薬として、米国食品医薬品局(FDA)によって承認されています。また、1期または2期のポリニウロパチーの成人患者のhATTRアミロイドーシスの治療については、欧州連合(EU)でも承認されています。多発神経障害を伴うトランスサイレチン(TTR)型家族性アミロイドーシスの治療を受けている日本、およびブラジルを含む複数の国では。2022年8月、心筋症のATTRアミロイドーシスの患者を対象としたパティシラン(ONPATTROのブランド名ではない)に関するAPOLLO-B第3相試験の肯定的な結果を報告しました。2022年12月、心筋症を伴うATTRアミロイドーシスの潜在的な治療法として、パティシランの補足新薬申請(SNDa)をFDAに提出しました。2023年9月13日、FDAの心臓血管・腎薬諮問委員会(CRDAC)は、心筋症を伴うトランスサイレチンアミロイドーシス、またはATTRアミロイドーシスの治療において、パティシランの利点がリスクを上回ると9対3で投票しました。それにもかかわらず、2023年10月6日、FDAは完全回答書(CRL)を発行しました。これは、心筋症を伴うATTRアミロイドーシスに対するパティシランの臨床的意義の証拠が確立されていないため、パティシランのSnDAは現在の形では承認できないことを示しています。CRLは、臨床安全性、研究実施、医薬品の品質、製造に関する問題を特定しませんでした。Patisiranは、心筋症を伴うATTRアミロイドーシスの治療薬であるONPATTROについて、現在もブラジル保健規制庁(ANVISA)の規制審査を受けています。
AMVUTTRAは、米国では成人のhATTRアミロイドーシスの治療、EU、英国、英国では、ステージ1または2のポリニウロパチーの成人患者のhATTRアミロイドーシスの治療、日本ではポリニウロパチーを伴うTTR型家族性アミロイドーシスの治療、その他複数の国で承認されています。規制当局への提出は、現在審査中または2024年以降に提出が予定されている他の地域でも継続されています。私たちは現在、ヴトリシラン(AMVUTTRAの非ブランド薬名)のHELIOS-B第3相臨床試験を実施しています。これは、心筋症を伴うATTRアミロイドーシス患者の心臓症状を治療するためのヴトリシランの可能性を調査しています。HELIOS-B調査のトップライン結果は、2024年6月下旬または7月上旬に発表される予定です。
GIVLAARIは、米国では急性肝性ポルフィリン症(AHP)の成人の治療、EU、12歳以上の成人および青年のAHPの治療薬として、その他いくつかの国で承認されています。他の地域でのジボシラン(GIVLAARIの非ブランド薬名)の規制当局への申請は、2024年以降に保留中または計画されています。
OXLUMOは、小児および成人患者の尿中および血漿シュウ酸塩濃度を低下させる原発性高シュウ酸尿症1型(PH1)の治療薬として米国で、EUと英国ではすべての年齢層のPH1の治療薬として承認されています。OXLUMOは他のいくつかの国でも承認されており、2024年以降には、他の地域での規制当局への提出が保留中または予定されています。
5番目の製品であるLeqvio(inclisiran)は、当社の協力者であるノバルティスAG(ノバルティス)によって開発および商品化されており、成人の治療薬として欧州委員会(EC)から販売承認を受けています
低密度リポタンパク質コレステロール(LDL-C)をさらに下げる必要があるヘテロ接合性家族性高コレステロール血症(hEFH)、または臨床的アテローム性動脈硬化性心血管疾患(ASCVD)の成人の治療のための食事療法と最大耐容性のスタチン療法の補助としての高コレステロール血症または混合性脂血症、およびFDAによる食事療法と最大耐容性のスタチン療法。2023年7月、FDAは、LDL-Cが高く、心臓病のリスクが高い成人の治療を含むように、Leqvioの適応を拡大することを承認しました。2023年の第3四半期に、レクビオは中国と日本で承認され、2024年3月末の時点で、レクビオは90か国以上で承認されています。
市販の製品に加えて、商品化に向けた後期段階の治験プログラムが複数あります。これらのプログラムには、心筋症を伴うATTRアミロイドーシス(野生型または遺伝性)の治療のためのvutrisiran(AMVUTTRAの非ブランド薬名)や、私たちの協力者であるGenzyme Corporation、サノフィ社、またはサノフィによって推進されている血友病治療用のfitusiranという当社の完全所有プログラムが含まれます。補体媒介性疾患の治療のためのセムディシラン。私たちの協力者であるリジェネロンファーマシューティカルズ社(リジェネロン)は、重症筋無力症の第3相試験で、セムディシランとポゼリマブの併用を進めています。発作性夜行性ヘモグロビン尿症。
Alnylam P5x25戦略の一環として、流行病を治療するための革新的な医薬品の開発など、将来の成長を牽引する複数のドライバーがあります。レクビオに加えて、私たちは高血圧症の治療を目的として、アンギオテンシノーゲン(AGT)を標的とする治験中の皮下投与RNAi治療薬、ジレベシランを開発中です。2023年に、F. Hoffmann-La Roche Ltd.、ジェネンテック社、または総称してロシュと、コラボレーションおよびライセンス契約、またはロシュコラボレーションおよびライセンス契約を締結しました。これに基づいて、zilebesiranの共同開発と商業化のための世界規模の戦略的コラボレーションを確立しました。2024年3月、KARDIA-2臨床試験の肯定的な結果が報告されました。この試験は、標準治療の降圧薬で血圧が適切に制御されていない患者を対象に、併用療法として隔年投与されるジレベシランの安全性と有効性を評価することを目的としています。2024年4月、私たちはKARDIA-3臨床試験の最初の患者に投与しました。これは、標準治療薬である2〜4種類の標準治療降圧薬で治療したにもかかわらず、心血管リスクが高く、高血圧を制御できない成人患者を対象に、追加療法として使用されるジレベシランの有効性と安全性を評価することを目的としています。
また、アルツハイマー病と脳アミロイド血管症の治療薬として開発中のアミロイド前駆体タンパク質を標的とする治験中のRNAi治療薬であるミベルシラン(旧ALN-APP)も開発中です。2023年に、早期発症のアルツハイマー病患者を対象としたミベルシランに関する第1相試験の継続的な単回投与の部分から、肯定的な中間結果が報告されました。これらの結果は、中枢神経系送達用の当社独自のC16-siRNAコンジュゲートプラットフォームの最初のヒト翻訳を確立し、RNAi治療薬を用いたヒトの脳における遺伝子サイレンシングの最初の臨床実証でもあります。
Alnylam P5x25戦略をさらに支援し、リスクプロファイルの変化を考慮して、主要市場での執行に向けたグローバル構造の最適化、当社の価値観に沿った業績の強化、文化の継続的な強化などの主要な目標を含め、グローバルインフラストラクチャの継続的な進化に引き続き注力しています。私たちは、AlnylamのP5x25戦略を考慮して、その進化と強化を推進するために、グローバルなコンプライアンスプログラムを構築し続けています。当社のコンプライアンスプログラムは、当社のグローバルなビジネス行動規範と倫理規範に基づいて構築されており、従業員や協力する人々が、当社の価値観に従い、適用法や規制を遵守して当社の戦略を実行できるようにし、リスクを軽減することを目的としています。リスク評価と監視、ポリシー、手順、ガイダンス、トレーニングとコミュニケーション、専門リソース、第三者との関係、調査、是正などの活動を支援するシステムとプロセスなどの要素で構成されています。当社のプログラムと関連統制は、グローバル事業全体にわたるビジネスプロセス、構造、統制を強化し、倫理的な意思決定を強化するために構築されています。
RNAi治療に関する専門知識と幅広い知的財産権に基づいて、ロシュ、リジェネロン、サノフィ、ノバルティス(2020年に協力者であるThe Medicines Company、またはMDCOを買収)などの大手製薬会社やライフサイエンス企業と協力して開発と商品化の取り組みを支援してきました。
2002年に事業を開始して以来、多額の損失を被っており、2024年3月31日現在、累積赤字は70.8億ドルでした。歴史的に、私たちは主に研究開発活動、知的財産権の取得、申請、拡大に関連する費用、販売、一般管理費に関連する費用から損失を被ってきました。当社の研究プラットフォーム、臨床試験や製造コストを含む医薬品開発プログラム、グローバルな商業事業を含む後期段階の臨床および商業能力の確立、特許ポートフォリオの継続的な管理と成長、コラボレーション、および一般的な企業活動に関連する研究開発活動への計画的な支出の結果として、さらなる営業損失が発生すると予想されます。2019年は営業損失のピーク年だったと考えていますが、年間営業損失は引き続き発生すると予想しており、RNAi治療薬の発見、開発、商品化への取り組みを拡大し、2025年末までに財政的自立を達成することを目指しているため、今後数年間は多大なリソースが必要になります。当面の間、当社の業績は変動し続けると予想しています。したがって、期間ごとの比較を将来の業績の予測として信頼すべきではありません。
現在、多くの治療分野に焦点を当てたプログラムを実施しており、2024年3月31日現在、主に米国とヨーロッパで、オンパトロ、AMVUTTRA、GIVLAARI、OXLUMOの4つの商品から世界中で製品収益を上げています。ただし、進行中の開発努力が成功せず、他の製品の販売を開始できない場合や、既存の商品化製品やその他の承認された製品のマーケティングと販売が成功しない場合があります
将来の製品。近年の総収益のかなりの部分は、ロシュ、リジェネロン、ノバルティスとのコラボレーションによる収益です。承認された製品の商業販売や将来の製品の販売による収益に加えて、今後数年間の潜在的な資金源の一部は、既存および新規の戦略的コラボレーションから引き続き得られると予想しています。このようなコラボレーションには、ライセンス料やその他の費用、資金提供を受けた研究開発、マイルストーンの支払い、ライセンサーによる製品販売に対するロイヤリティ(協力者のノバルティスが行ったLeqvioの販売に対するロイヤルティを含む)、および株式または負債の売却による収益が含まれますが、将来含まれる可能性があります。
研究開発
創業以来、私たちは創薬と開発プログラムに注力してきました。開発後期段階の複数のプログラムを含む臨床開発プログラムの幅広いパイプラインに反映されているように、研究開発費は当社の総運営費のかなりの割合を占めています。
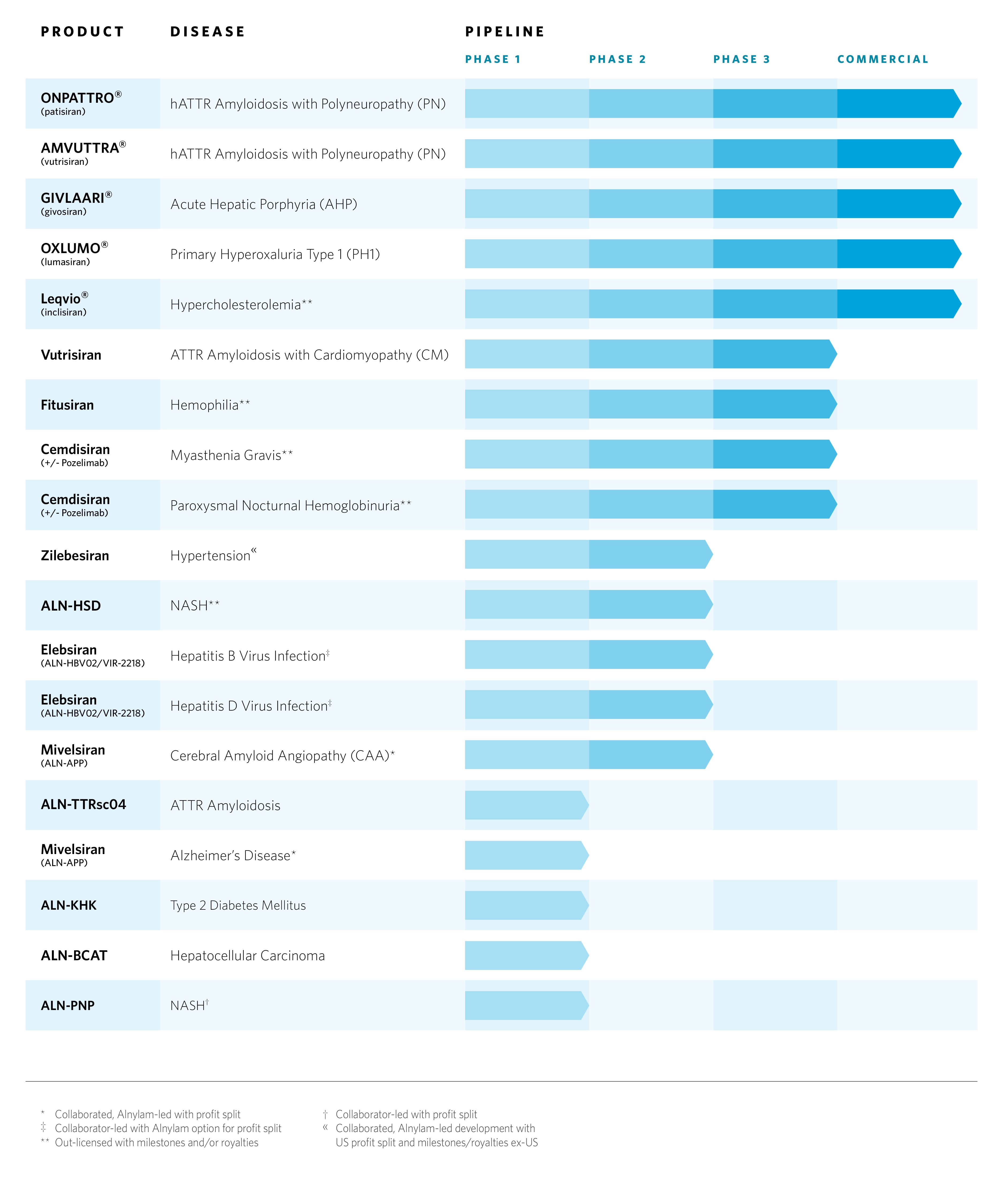
当社の製品パイプライン
5つの承認済み製品と複数の後期および初期段階の治験中のRNAi治療薬を含む当社の幅広いパイプラインは、いくつかの疾患分野で満たされていないニーズに対応しており、希少疾患、専門疾患、特定の流行疾患の適応症にまたがっています。私たちの商業段階と臨床段階のパイプラインについては、以下で詳しく説明します。以下に説明する治験薬は、臨床開発のさまざまな段階にあり、これらの治療法に関する科学的情報は暫定的かつ研究的なものです。これらの治験薬はいずれも、FDA、EMA、またはその他の保健当局によって承認されておらず、これらの治験薬の安全性または有効性に関して結論を出すことはできませんし、また導くべきでもありません。
以下の表は、2024年5月1日現在の当社の商用製品と後期および初期段階の開発プログラムを示しています。
2024年の第1四半期と最近の間に、商業的に承認された製品と後期段階の臨床プログラムに関する以下の更新を報告しました。
コマーシャル
合計TTR:オンパトロとアムブットラ
•2024年の第1四半期に、オンパトロとAMVUTTRAのグローバル純製品収益は、それぞれ6,920万ドルと1億9,520万ドルでした。
トータルレア:ジブラリとオクスルモ
•2024年第1四半期のGIVLAARIとOXLUMOのグローバル純製品収益は、それぞれ5,810万ドルと4,260万ドルでした。
後期段階の臨床開発
•心筋症のATTRアミロイドーシス患者を対象としたヴトリシランのHELIOS-B第3相試験の統計分析計画の更新を発表しました。これには、主要評価項目と副次評価項目、および分析期間の調整が含まれます。トップラインの結果は、6月下旬または7月上旬に報告される予定です。
•私たちは、心血管リスクの高い患者の高血圧を治療するために開発中の治験中のRNAi治療薬であるジレベシランを引き続き進歩させました。
◦高血圧のコントロールが不十分な患者を対象とした標準治療抗高血圧薬に追加されたジレベシランに関するKARDIA-2第2相投与試験の陽性結果が報告されました。
◦標準治療薬の降圧薬を2〜4種類投与しているにもかかわらず、心血管リスクが高く、高血圧がコントロールされていない成人患者を対象としたジレベシランのグローバルKARDIA-3フェーズ2試験を開始しました
どの創薬プログラムや開発プログラムでも、さまざまな理由で収益が得られないリスクがあります。たとえば、製品候補の安全性と有効性を十分に実証できなかったり、規制当局から製品候補の承認や希望する表示を得られない可能性があります。さらに、RNAiなど、創薬の新しい分野には固有の不確実性があります。ONPATTRO、AMVUTTRA、GIVLAARI、OXLUMO、または私たちが開発する他の製品候補の成功は非常に不確実です。医薬品の開発には数多くのリスクが伴うため、潜在的な製品候補や適応症の開発を完了するために必要な努力の性質、時期、推定費用、または承認された製品や適応症から実質的な純キャッシュインフローが開始される期間(ある場合)を合理的に見積もったり知ったりすることはできません。潜在的な製品または拡張適応症が承認された製品の開発のいずれかの段階を適時に完了しなかったり、商業的に承認された製品の立ち上げ、マーケティング、販売が成功しなかったりすると、当社の事業、財政状態、流動性に重大な悪影響を及ぼす可能性があります。計画されたスケジュール内に、またはまったく完了しないことに関連するリスクと不確実性のいくつか、および完了しなかった場合の潜在的な結果についての議論は、後述のパートII、項目1Aの「リスク要因」という見出しの下に記載されています。
戦略的コラボレーション
私たちの事業戦略は、希少疾患、特殊疾患、特定の流行病に変革をもたらすことを目的とした、RNAi治療製品の幅広いパイプラインを開発し、商品化することです。この戦略の一環として、治験中のRNAi治療プログラムを推進するための資源、能力、資金を調達する手段として、コラボレーションおよびライセンス契約を締結しました。将来的には追加の契約を締結する可能性があります。
以下は、私たちの主要なコラボレーションの簡単な説明です。
ロシュさん。2023年7月、私たちはロシュのコラボレーションおよびライセンス契約を締結しました。これに基づき、ロシュとロシュは、ジレベシランを含む医薬品の共同開発に関する世界的かつ戦略的コラボレーションを確立しました。ロシュのコラボレーションおよびライセンス契約に基づき、私たちはロシュに(i)米国でジレベシランを開発および商品化する共同独占権と、(ii)米国外でジレベシランを開発および商品化する独占権を付与しました。ロシュは3億1,000万ドルの前払いを行いました。2024年4月、私たちはKARDIA-3第2相試験で最初に投与された患者に関連する開発マイルストーンを達成しました。これにより、ロシュから6,500万ドルの開発マイルストーン支払いを受けることができました。さらに、特定の開発、規制、および販売に基づくマイルストーンの達成に基づいて、最大24億5000万ドルの追加報酬を受け取る資格があります。Zilebesiranの世界的な規制当局の承認を支援する開発活動の実施で発生する開発費の40%(40%)は私たちが負担し、ロシュは残りの60%(60%)を負担します。私たちとロシュは、主に米国におけるジレベシランの規制当局の承認を支援するために実施される開発活動に関連して発生したすべての費用を等しく(50/50)分担し、ロシュは米国外でのzilebesiranの商品化に関連して発生した費用を単独で負担し、ある国でのzilebesiranの純売上高に基づいて、段階的に下位2桁のロイヤリティを支払います。
ロイヤリティ期間中の米国外の国別基準。私たちとロシュは、米国におけるジレベシランの利益と損失(商品化費用を含む)を均等に(50/50)分担します。
リジェネロン。2019年4月、私たちはリジェネロンとグローバルな戦略的協力を締結しました。これは、リジェネロンコラボレーションと呼ばれる、肝臓で発現する特定の数の標的に加えて、眼や中枢神経系で発現する治療標的に取り組むことで、幅広い疾患に対するRNAi治療薬を発見、開発、商品化することです。リジェネロンコラボレーションは、2019年5月に発効したリジェネロン基本契約と呼ばれる基本契約によって管理されています。2019年8月、私たちとリジェネロンは、(i)セムディシランの継続的な開発、現在IgANの単剤療法として第3相準備が整っているC5 siRNA、および(ii)リジェネロンのポゼリマブとセムディシランの組み合わせの評価を含む、C5補体媒介性疾患に対する抗C5抗体-siRNAの組み合わせの評価を対象とするライセンス契約を締結しました。。
リジェネロンコラボレーションの条件に基づき、私たちはリジェネロンと独占的に眼と中枢神経系疾患のRNAi治療薬を発見しています。最初の5年間の研究期間は、さらに最大5年間、または初期研究期間まで延長される場合があります。リジェネロンのコラボレーションは、肝臓で発現する遺伝子を標的とするように設計された一部のRNAi治療プログラムも対象としています。これには、慢性肝疾患NASHのRNAi治療薬を特定するための以前に発表されたリジェネロンとのコラボレーションが含まれます。私たちは、連携していないすべての肝臓向け臨床および前臨床パイプラインプログラムに対する幅広いグローバル権利を保持しています。
リジェネロンは、眼疾患を対象としたすべてのプログラムの開発と商品化を主導しており(限られた例外はありますが)、当事者間で合意されたライセンス契約の条件に従って、特定のマイルストーンやロイヤルティの支払いを受けることができます。私たちとリジェネロンは、中枢神経系と肝臓プログラムで交代でリーダーシップをとり、主導党はグローバルな開発と商業的責任を引き継いでいます。
私たちとリジェネロンは、最初の研究期間中に、リジェネロンコラボレーションの下で最大30のターゲットに向けたプログラムを進める予定です。2020年7月、リジェネロンは、私たちが主導している遺伝性脳アミロイド血管症と常染色体優性アルツハイマー病の治療のために開発中の治験用RNAi治療薬であるミベルシランについて、共同開発/共同商品化オプションを行使しました。また、リジェネロンでは他にも複数のプログラムを進めています。
サノフィ。私たちは2014年にサノフィと幅広い戦略的提携を結びました。2018年1月、私たちとサノフィは2014年のコラボレーションを修正し、独占TTRライセンスと呼ばれる独占ライセンス契約を締結しました。この契約に基づき、ONPATTRO、AMVUTTRA、およびバックアップ製品を含むすべてのTTR製品のさらなるグローバル開発と商品化を追求する独占権と、サノフィは、AT3ライセンス条件と呼ばれるALN-AT3グローバルライセンス条項(AT3ライセンス条件と呼ばれる)を締結しました。fitusiranおよびあらゆるバックアップ製品のさらなるグローバル開発と商品化を追求する独占権。2019年4月、私たちとサノフィは、2014年のサノフィとのコラボレーションをさらに修正して、調査とオプションの段階を終了し、AT3ライセンス条件を修正して特定のビジネス条件を変更することに合意しました。fitusiranのマテリアルコラボレーション条件は変更されていません。修正および改訂されたAT3ライセンス条件に基づき、サノフィ、その関連会社、およびそのサブライセンシーによるfitusiranの世界の年間売上高に基づいて、15%から30%の段階的なロイヤルティを受け取る資格があります。
ノバルティス。2013年2月、私たちはMDCOと独占的なワールドワイドライセンスを締結しました(2020年1月にノバルティスAGが取得)。これにより、MDCOは、高コレステロール血症やLeqvioを含むその他のヒトの病気の治療を目的として、プロプロテイン転換酵素サブチリシン/ケキシン9型を標的とするRNAi治療薬を開発、製造、および商品化する権利を付与されました。
また、RNAiの分野で知的財産権を取得するためのライセンス契約も締結しました。さらに、RNAi治療薬の提供は歴史的に私たちの研究活動の重要な目的であったため、さまざまなLNPデリバリー技術を含むデリバリー技術にアクセスするために、他の企業や学術機関とさまざまな協力やライセンス契約を締結してきました。将来、製品や技術にアクセスするためにそのような契約を締結する可能性があります。
重要な会計方針と見積もり
当社の重要な会計方針は、2024年2月15日にSECに提出した2023年12月31日に終了した年度のフォーム10-Kの年次報告書の「経営陣による財政状態と経営成績に関する議論と分析」セクションに記載されています。今年度の初めから、当社の重要な会計方針に大きな変更はありません。
業務結果
以下のデータは、当社の事業の結果をまとめたものです。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 3月31日に終了した3か月間 | | |
| (パーセンテージを除く千単位) | 2024 | | 2023 | | $ 変更 | | % 変更 | | | | | | | | |
| 総収入 | $ | 494,333 | | | $ | 319,290 | | | $ | 175,043 | | | 55 | % | | | | | | | | |
運用コストと経費 | $ | 537,768 | | | $ | 469,097 | | | $ | 68,671です | | | 15 | % | | | | | | | | |
| 事業による損失 | $ | (43,435) | | | $ | (149,807) | | | $ | 106,372 | | | (71) | % | | | | | | | | |
| | | | | | | | | | | | | | | |
| 純損失 | $ | (65,935) | | | $ | (174,101) | | | $ | 108,166% | | | (62) | % | | | | | | | | |
経営成績についての議論
収入
総収益は以下のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 3月31日に終了した3か月間 | | |
| (パーセンテージを除く千単位) | 2024 | | 2023 | | $ 変更 | | % 変更 | | | | | | | | |
| 純製品収入 | $ | 365,163% | | | $ | 276,328 | | | $ | 88,835 | | | 32 | % | | | | | | | | |
コラボレーションによる純収入 | 118,548 | | | 36,462 | | | 82,086 | | | 225 | % | | | | | | | | |
| ロイヤリティ収入 | 10,622% | | | 6,500 | | | 4,122 | | | 63 | % | | | | | | | | |
| 合計 | $ | 494,333 | | | $ | 319,290 | | | $ | 175,043 | | | 55 | % | | | | | | | | |
|
純製品収入
製品の純収益は、製品別、地域別で以下のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 3月31日に終了した3か月間 | | |
| (パーセンテージを除く千単位) | 2024 | | 2023 | | $ 変更 | | % 変更 | | | | | | | | |
| オンパトロー | | | | | | | | | | | | | | | |
| 米国 | $ | 16,539 | | | $ | 29,817 | | | $ | (13,278) | | | (45) | % | | | | | | | | |
| ヨーロッパ | 44,690 | | | 59,678 | | | (14,988) | | | (25) | % | | | | | | | | |
| その他の地域 | 7,988 | | | 12,998 | | | (5,010) | | | (39) | % | | | | | | | | |
| 合計 | 69,217% | | | 102,493 | | | (33,276) | | | (32) | % | | | | | | | | |
| | | | | | | | | | | | | | | |
| アムブットラ | | | | | | | | | | | | | | | |
| 米国 | 130,238 | | | 79,013 | | | 51,225です | | | 65 | % | | | | | | | | |
| ヨーロッパ | 43,733% | | | 6,768 | | | 36,965 | | | * | | | | | | | | |
| その他の地域 | 21,270% | | | 15,987 | | | 5,283 | | | 33 | % | | | | | | | | |
| 合計 | 195,241 | | | 101,768 | | | 93,473 | | | 92 | % | | | | | | | | |
| | | | | | | | | | | | | | | |
| ギブラリさん | | | | | | | | | | | | | | | |
| 米国 | 38,731 | | | 30,291 | | | 8,440 | | | 28 | % | | | | | | | | |
| ヨーロッパ | 15,315です | | | 14,471 | | | 844 | | | 6 | % | | | | | | | | |
| その他の地域 | 4,010 | | | 3,144 | | | 866 | | | 28 | % | | | | | | | | |
| 合計 | 58,056 | | | 47,906 | | | 10,150% | | | 21 | % | | | | | | | | |
| | | | | | | | | | | | | | | |
| オクスルモさん | | | | | | | | | | | | | | | |
| 米国 | 13,332 | | | 9,057 | | | 4,275 | | | 47 | % | | | | | | | | |
| ヨーロッパ | 21,427 | | | 13,309 | | | 8,118 | | | 61 | % | | | | | | | | |
| その他の地域 | 7,890 | | | 1,795 | | | 6,095 | | | 340 | % | | | | | | | | |
| 合計 | 42,649 | | | 24,161 | | | 18,488 | | | 77 | % | | | | | | | | |
| | | | | | | | | | | | | | | |
| 製品の総純収入 | $ | 365,163% | | | $ | 276,328 | | | $ | 88,835 | | | 32 | % | | | | | | | | |
* 一定期間の変化率が 500% 大きいことを示します。 |
2024年3月31日に終了した3か月間の純製品収益は、2023年の同時期と比較して増加しました。これは、患者需要の増加と、GIVLAARIおよびOXLUMO療法を受ける患者の増加に牽引されたAMVUTTRAの力強い成長によるものです。
コラボレーションによる純収益とロイヤリティ収入
コラボレーションによる純収益とロイヤリティ収入は以下のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 3月31日に終了した3か月間 | | |
| (パーセンテージを除く千単位) | 2024 | | 2023 | | $ 変更 | | % 変更 | | | | | | | | |
ロッシュ | $ | 74,680 | | | $ | — | | | $ | 74,680 | | | N/A | | | | | | | | |
| リジェネロンファーマシューティカルズ | 26,764 | | | 19,990 | | | 6,774 | | | 34 | % | | | | | | | | |
| ノバルティスAG | 14,516 | | | 14,933 | | | (417) | | | (3) | % | | | | | | | | |
| | | | | | | | | | | | | | | |
| その他 | 2,588 | | | 1,539 | | | 1,049 | | | 68 | % | | | | | | | | |
コラボレーションによる総純収入 | $ | 118,548 | | | $ | 36,462 | | | $ | 82,086 | | | 225 | % | | | | | | | | |
| | | | | | | | | | | | | | | |
ロイヤリティ収入 | $ | 10,622% | | | $ | 6,500 | | | $ | 4,122 | | | 63 | % | | | | | | | | |
|
2024年3月31日に終了した3か月間は、2023年の同時期と比較して増加しました。これは、ロシュとのコラボレーションおよびライセンス契約に基づいて計上された収益です。これには、zilebesiran KARDIA-3臨床試験の最初の患者への投与に関連する6,500万ドルのマイルストーン収益と、当社での活動の増加の結果として認識されたリジェネロンコラボレーションに関連して認識された収益の増加が含まれます研究サービスの手配とライセンスプログラム。
2024年3月31日に終了した3か月間のロイヤリティ収入は、2023年の同時期と比較して増加しました。これは、当社の協力者であるノバルティスが、Leqvioの世界的な純売上高から得られるロイヤリティの増加によるものです。
コラボレーションによる純収益とロイヤリティ収益を合わせた場合の認識は、コラボレーターから支払われる仕事のレベル、コラボレーション契約に基づくマイルストーンの達成、Leqvioの販売に関連するロイヤルティなど、さまざまな要因によって決まります。コラボレーションによる純収益とロイヤリティ収入は、主にロシュとのコラボレーションおよびライセンス契約に基づいて認識された収益の減少により、2023年と比較して2024年には減少すると予想しています。私たちの協力者であるノバルティスによるLeqvioの世界的な純売上高から得られるロイヤリティの継続的な増加により、2024年には2023年と比較してロイヤリティ収入が増加すると予想しています。
運用コストと経費
運営費と経費は以下のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 3月31日に終了した3か月間 | | |
| (パーセンテージを除く千単位) | 2024 | | 2023 | | $ 変更 | | % 変更 | | | | | | | | |
| 売上原価 | $ | 54,613 | | | $ | 41,432 | | | $ | 13,181 | | | 32 | % | | | | | | | | |
| | | | | | | | | | | | | | | |
| 純製品収益に対する売上原価の割合 | 15.0 | % | | 15.0 | % | | | | | | | | | | | | |
| | | | | | | | | | | | | | | |
| コラボレーションの費用とロイヤリティ | 11,363 | | | 13,437 | | | (2,074) | | | (15) | % | | | | | | | | |
| 研究開発 | 260,995 | | | 230,569 | | | 30,426 | | | 13 | % | | | | | | | | |
販売、一般および管理 | 210,797 | | | 183,659 | | | 27,138 | | | 15 | % | | | | | | | | |
| 合計 | $ | 537,768 | | | $ | 469,097 | | | $ | 68,671です | | | 15 | % | | | | | | | | |
売上原価
2024年3月31日に終了した3か月間、純製品収益に占める売上原価の割合は、2023年の同時期と比較して一定でした。これは主に、AMVUTTRAの販売量の増加に関連したロイヤルティの増加によるもので、ONPATTROの製造キャンセル料の削減による一時的好調によって一部相殺されました。
当社の売上原価は、主に純製品売上の増加とロイヤルティの増加が予想されるため、2023年と比較して2024年には増加すると予想しています。
コラボレーションの費用とロイヤリティ
2024年3月31日に終了した3か月間で、2023年の同時期と比較してコラボレーションの費用とロイヤルティが減少しました。これは主に、協力者が材料の自主生産に移行するにつれて、特定の製品製造をサポートするために協力者に供給されるGalNAc材料の需要が減少したためです。
協力者がGalNACを独自に製造するようになった結果、2023年と比較して、コラボレーションとロイヤルティの費用は2024年中も減少し続けると予想しています。
研究開発
研究開発費には次のものが含まれます。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 3月31日に終了した3か月間 | | |
| (パーセンテージを除く千単位) | 2024 | | 2023 | | $ 変更 | | % 変更 | | | | | | | | |
| 臨床研究と外部サービス | $ | 125,510 | | | $ | 111,597 | | | $ | 13,913 | | | 12 | % | | | | | | | | |
| 報酬と関連 | 77,209 | | | 64,720 | | | 12,489 | | | 19 | % | | | | | | | | |
| 占有率とその他すべての費用 | 39,061 | | | 38,020 | | | 1,041 | | | 3 | % | | | | | | | | |
| 株式ベースの報酬 | 19,215 | | | 16,232 | | | 2,983 | | | 18 | % | | | | | | | | |
| 合計 | $ | 260,995 | | | $ | 230,569 | | | $ | 30,426 | | | 13 | % | | | | | | | | |
2024年3月31日に終了した3か月間、2023年の同時期と比較して研究開発費が増加したのは、主に次の理由によるものです。
•KARDIA-2およびKARDIA-3の臨床研究における主にジレベシランに関連する臨床研究費の増加。
•HELIOS-B調査に関連する費用の増加は、主に2024年6月下旬または7月上旬にトップラインデータを読み出すまでの費用と手数料の増加によるものです。
•研究開発パイプラインの拡大を続けるにつれて、前臨床活動、特にCNSプログラムに関連するコストが増加しました。そして
•研究開発パイプラインと開発費を支える人員が増えた結果、報酬と関連費用が増加しました。
2024年3月31日と2023年3月31日に終了した3か月間、コラボレーション契約に基づく活動の推進に関連して、主に臨床製品の製造を含む外部開発および臨床サービスに関連する研究開発費が発生しました。
次の表は、当社のコラボレーション契約に直接帰属する、当社が純収益と認識している研究開発費を、協力者別にまとめたものです。
| | | | | | | | | | | | | | | |
| 3月31日に終了した3か月間 | | |
| (千単位) | 2024 | | 2023 | | | | |
ロッシュ | $ | 18,081 | | | $ | — | | | | | |
| リジェネロンファーマシューティカルズ | 18,703 | | | 19,119 | | | | | |
| その他 | 2,813 | | | 798 | | | | | |
| 合計 | $ | 39,597 | | | $ | 19,917 | | | | | |
販売、一般および管理
販売費、一般管理費は以下のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 3月31日に終了した3か月間 | | |
| (パーセンテージを除く千単位) | 2024 | | 2023 | | $ 変更 | | % 変更 | | | | | | | | |
| 報酬と関連 | $ | 91,209 | | | $ | 74,326 | | | $ | 16,883 | | | 23 | % | | | | | | | | |
| コンサルティングと専門サービス | 56,759 | | | 50,688です | | | 6,071 | | | 12 | % | | | | | | | | |
| 占有率とその他すべての費用 | 36,697 | | | 34,930 | | | 1,767 | | | 5 | % | | | | | | | | |
| 株式ベースの報酬 | 26,132 | | | 23,715 | | | 2,417 | | | 10 | % | | | | | | | | |
| 合計 | $ | 210,797 | | | $ | 183,659 | | | $ | 27,138 | | | 15 | % | | | | | | | | |
2024年3月31日に終了した3か月間、販売費、一般管理費が2023年の同時期と比較して増加したのは、主にTTR療法のプロモーションに関連するマーケティング投資の増加と、当社の戦略的成長を支える人員やその他の投資の増加によるものです。
プラットフォームとパイプラインの推進と開発、共同プログラムを含む製品候補の後期開発段階への進展、規制当局への提出準備、グローバルな商業およびコンプライアンスインフラストラクチャの構築、規制当局の承認を前提とした商用およびコンプライアンスインフラストラクチャの構築、および商用製品の追加市場への投入を続け、研究開発費と販売費、一般管理費を合わせた研究開発費は、2023年と比較して2024年も増加し続けると予想しています。ただし、特定の費用は、製造バッチのタイミング、臨床試験の登録と結果、製品候補とプログラムの規制当局による審査、および業績ベースの報奨の権利確定に関する当社の決定による株式ベースの報酬費用によって変動すると予想しています。
その他の(費用)収入
その他の(費用)収入は以下のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 3月31日に終了した3か月間 | | |
| (パーセンテージを除く千単位) | 2024 | | 2023 | | $ 変更 | | % 変更 | | | | | | | | |
| 支払利息 | $ | (35,253) | | | $ | (28,955) | | | $ | (6,298) | | | 22 | % | | | | | | | | |
| 利息収入 | 29,645 | | | 18,655です | | | 10,990です | | | 59 | % | | | | | | | | |
| その他の費用、純額 | | | | | | | | | | | | | | | |
| 市場性のある株式の実現損失と未実現損失 | 78 | | | (2,267) | | | 2,345 | | | (103) | % | | | | | | | | |
| 開発デリバティブ負債の公正価値の変動 | (8,586) | | | (6,471) | | | (2,115) | | | 33 | % | | | | | | | | |
| その他 | (6,036) | | | (3,517) | | | (2,519) | | | 72 | % | | | | | | | | |
| 合計 | $ | (20,152) | | | $ | (22,555) | | | $ | 2,403 | | | (11) | % | | | | | | | | |
|
2024年3月31日に終了した3か月間のその他の費用の合計は、2023年の同時期と比較して減少しました。これは主に、有価証券の市場金利の上昇による利息収入の増加によるものですが、2023年と比較して2024年に増加した負債残高に対する利息の増加、特に将来のロイヤルティの売却に関連する負債に関連する利息費用の増加によって一部相殺されました。
流動性と資本資源
次の表は、当社のキャッシュフロー活動をまとめたものです。
| | | | | | | | | | | |
| 3月31日に終了した3か月間 |
| (千単位) | 2024 | | 2023 |
提供した純現金(使用量): | | | |
| 営業活動 | $ | (81,515) | | | $ | (166,475) | |
| 投資活動 | $ | (67,620) | | | $ | (76,217) | |
| 資金調達活動 | $ | 28,911 | | | $ | 46,371 | |
| | | |
| | | |
| | | |
| | | |
営業活動
営業活動に使用された純現金は、2024年3月31日に終了した3か月間で2023年の同時期と比較して減少しました。これは主に、運転資本の支払いに関連する現金支出の減少に加えて、製品販売の増加による現金収入の増加によるものです。
投資活動
投資活動に使用された純現金は、主に当社の有価証券に関連する純活動により、2024年3月31日に終了した3か月間で2023年の同時期と比較して減少しました。
資金調達活動
財務活動によって提供された純現金は、主にストックオプションの行使に関連する普通株式の発行による純収入が減少したことにより、2024年3月31日に終了した3か月間で2023年の同時期と比較して減少しました。
その他の資本要件
現在、多くの治療分野に焦点を当てたプログラムを実施しており、2024年3月31日現在、規制当局の承認を受け、4つの製品を商業的に発売しています。ただし、当社の継続的な開発努力は成功しない可能性があり、将来、他の製品の販売を開始したり、AMVUTTRAを含む承認製品の適応を拡大したりできなくなる可能性があります。さらに、当社の研究プラットフォーム、臨床試験や製造コストを含む医薬品開発プログラムに関連する研究開発活動、グローバル事業を含む後期段階の臨床、製造、商業およびコンプライアンス機能の確立、特許ポートフォリオ、コラボレーション、一般的な企業活動を含む知的財産の継続的な管理と成長の結果として、引き続き損失が発生すると予想しています。
予想される運転要件およびその他の資本要件は、2023年次報告書のフォーム10-Kの「パートII、項目7」に記載されています。経営陣による財政状態と経営成績の議論と分析。」2024年3月31日現在、フォーム10-Qのこの四半期報告書の「要約連結財務諸表の注記」および「流動性と資本資源」のセクションで開示されている変更を除いて、フォーム10-Kの2023年次報告書に記載されているように、予想される運転要件やその他の資本要件に他に重要な変更はありません。
現在の事業計画に基づき、2024年3月31日現在の当社の現金、現金同等物および有価証券は、製品販売および現在の提携により生み出されると予想される現金と合わせて、フォーム10-Qのこの四半期報告書の提出日から少なくとも今後12か月間は、当面の資本および営業ニーズを満たすのに十分であると考えています。ただし、フォーム10-Qのこの四半期報告書のパートII、項目1A、「リスク要因」というキャプションに詳細に説明されている多くの要因により、承認された製品の商品化を継続し、追加の製品候補を開発、臨床試験の実施、製造、および承認された場合は商品化するために、現在の予想よりも大幅に早い追加資金が必要になる場合があります。
アイテム 3.市場リスクに関する定量的および質的開示
金利に関連する金融市場のリスクは、2023年12月31日に終了した年度のForm 10-Kの年次報告書に記載されています。2024年3月31日現在、2023年12月31日現在、記載されている金融市場リスクに大きな変化はありません。現在、金融市場のリスク・エクスポージャーの性質、またはそのようなリスクの管理に関する経営陣の目的と戦略において、短期的には他に変化はないと予想しています。
アイテム 4.統制と手続き
開示管理と手続き
当社の経営陣は、最高経営責任者(最高経営責任者)と執行副社長、最高財務責任者(最高財務責任者)の参加を得て、2024年3月31日現在の当社の開示管理と手続きの有効性を評価しました。「開示管理と手続き」という用語は、取引法の規則13a-15(e)および15d-15(e)で定義されているように、企業が取引法に基づいて提出または提出する報告書で開示する必要のある情報が、SECの規則とフォームで指定された期間内に記録、処理、要約、および報告されることを保証するように設計された会社の管理およびその他の手続きを意味します。開示管理と手続きには、会社が取引法に基づいて提出または提出する報告書で開示する必要のある情報が、必要な開示に関するタイムリーな決定を可能にするために、必要に応じて蓄積され、最高執行責任者や最高財務責任者を含む会社の経営陣に確実に伝達されるように設計された管理と手続きが含まれますが、これらに限定されません。経営陣は、どのような統制や手続きも、それがどれほどうまく設計され運用されても、その目的を達成するための合理的な保証しか提供できないことを認識しており、経営陣は、可能な統制と手順の費用対効果の関係を評価する際に必ずその判断を下します。2024年3月31日現在の当社の開示管理と手続きの評価に基づいて、当社の最高経営責任者兼執行副社長兼最高財務責任者は、現在のところ、当社の開示管理と手続きは妥当な保証レベルで有効であると結論付けました。
内部統制の変更
2024年3月31日に終了した四半期に、財務報告に対する当社の内部統制に重大な影響を及ぼした、または財務報告に対する内部統制に重大な影響を与える可能性がかなり高い変更はありませんでした。
第二部その他の情報
アイテム 1.法的手続き
係争中の重要な法的手続きについての議論については、フォーム10-Qのこの四半期報告書のパートI、項目I「財務諸表(未監査)」に含まれる要約連結財務諸表の注記13「コミットメントと不測の事態」を参照してください。この項目は参考としてこの項目に組み込まれています。
アイテム 1A.リスク要因
当社の証券への投資には高いリスクが伴います。当社および当社の事業を評価する際には、要約された連結財務諸表、関連メモ、および「財政状態と経営成績に関する経営陣の議論」など、フォーム10-Qのこの四半期報告書に記載または参照により組み込まれているその他の情報に加えて、以下のリスク要因を慎重に検討する必要があります。次のリスクのいずれか、または現在私たちが知らない、または現在重要ではないと見なしている追加のリスクが実際に発生した場合、当社の事業、見通し、経営成績、または財政状態に重大かつ悪影響が及ぶ可能性があります。このような状況では、当社の普通株式の取引価格が下落し、投資の全部または一部を失う可能性があります。
私たちの事業に関連する重大なリスクの概要
私たちのビジネスは多くのリスクと不確実性の影響を受けます。詳細は次のセクションで説明します。これらのリスクには、とりわけ次の主要なリスクが含まれます。
ビジネス関連のリスク — 当社の決算に関連するリスク
•当社の承認済み製品または将来の製品のマーケティングと販売は、成功しなかったり、予想よりも成功しなかったりする可能性があり、AMVUTTRAの承認された適応を拡大できない場合があります。
•私たちには損失の歴史があり、決して利益を上げることはできず、今後も利益を上げ続けることはできません。
•研究、開発、商品化活動を継続するには、多額の資金が必要になります。
•Leqvioに関連するマイナスの展開は、将来のロイヤルティとマイルストーンの支払いの受領に重大な悪影響を及ぼす可能性があります。
第三者への依存に関連するリスク
•特定の製品候補の開発と商品化のためのビジネス上および科学的能力と資金を提供できる他社と、既存のコラボレーションを維持したり、新たに開始したりできない場合があります。
•協力者が当社との契約に基づく義務を大幅に修正、終了、または履行しなかった場合、特定の製品候補の開発と商品化が遅れたり、終了したりする可能性があります。
•私たちは製造能力とリソースを拡大し続けることを期待しており、この専門知識を開発するために多額の費用を負担したり、製品の製造を第三者に依頼したりする必要があります。
•私たちは臨床試験の実施を第三者に頼っています。そのような第三者が義務を果たせなかった場合、私たちの開発計画に悪影響を及ぼす可能性があります。
事業管理に関連するリスク
•資格のあるキーマネジメントや科学者、開発、医療、商業スタッフ、コンサルタント、アドバイザーを引き付けて維持できない場合、事業計画の実施能力に悪影響を及ぼす可能性があります。
•主に創薬、前臨床試験、臨床開発に携わる米国とヨーロッパを拠点とする企業から、アジア、ラテンアメリカ、中東を含む複数の地域で複数の医薬品を開発および商品化するグローバル企業へと進化し続けるにつれて、事業を成功裏に拡大することが困難になる可能性があります。
業界関連のリスク —製品候補の開発、臨床試験、規制当局の承認、および承認された製品の商品化に関連するリスク
•私たちまたは私たちの協力者が開発する製品候補は、開発が失敗したり、そのような製品候補が商業的に実行可能にならないほど遅れたりする可能性があります。
•私たちまたは私たちの協力者は、私たちまたは私たちの共同製品候補について米国または外国の規制当局の承認を得ることができず、その結果、私たちまたは私たちの協力者がそのような製品候補を商品化できない場合があります。
•私たちまたは私たちの協力者が規制当局の承認を得たとしても、私たちの製品は継続的な規制監督の対象となります。
•未承認の製品候補に関して商業活動を行っている、または適用規制に違反する方法で商業的に承認された製品を宣伝していると執行当局が主張または判断した場合、当社は重大な責任を負う可能性があります。
•私たちまたは私たちの協力者が製品候補を販売するための規制当局の承認を受けたとしても、市場がそのような製品候補を商業的に導入したときに受け入れられない可能性があり、それが私たちの収益化を妨げる可能性があります。
•私たちは複数の製品を扱う企業であり、マーケティング、販売、市場アクセス、流通能力を構築し続け、グローバルなインフラストラクチャをさらに確立するために、引き続き多額の財務および管理リソースを投資する予定ですが、私たちの取り組みは成功しない可能性があります。
•現在販売している、または将来開発する可能性のある製品はすべて、不利な価格規制、第三者の償還慣行、または医療改革の取り組みの対象となり、当社の事業に悪影響を及ぼす可能性があります。
特許、ライセンス、企業秘密に関連するリスク
•発見した製品に対する特許保護を取得して実施できなければ、製品候補を開発して商品化する当社の能力が損なわれます。
•私たちは第三者の所有者からの特許権をライセンスしています。そのような所有者が、そのようなライセンスの基礎となる特許を適切に、または首尾よく取得、維持、または行使しないと、当社の競争力が損なわれる可能性があります。
•他の企業や組織が当社の特許権に異議を申し立てたり、製品の開発や商品化を妨げる特許権を主張したりすることがあります。
•ファイザー社、ファイザー社、モデルナ社、モデルナ社に対して現在進行中の特許侵害訴訟を含む、知的財産訴訟やその他の権利決定に関連する手続きに当社が関与した場合、多額の費用と費用が発生する可能性があり、そのような訴訟または訴訟の場合、多額の損害賠償責任を負うか、製品の停止を求められる可能性があります開発と商品化の取り組み。
•ライセンスまたは関連契約に基づく義務を遵守しなかった場合、損害賠償を求められ、リボ核酸干渉(RNAi)技術の開発、商品化、保護に必要なライセンスまたはその他の権利を失う可能性があります。
競争に関するリスク
•医薬品市場は競争が激しいです。私たちまたは私たちの協力者が既存の薬、新しい治療法、新しい技術と効果的に競争できない場合、私たちまたは私たちの協力者は、私たちまたは私たちの協力者が開発した薬をうまく商品化できない可能性があります。
•私たちと私たちの協力者は、私たちと同様の技術を使用して新薬や技術プラットフォームの開発に取り組んでいる他の企業や、新しい技術を利用している企業との競争に直面しています。
当社の普通株式に関するリスク
•当社の株価はこれまでも、そして将来も変動する可能性があり、普通株式への投資は価値が下落する可能性があります。
•当社および当社の共同研究者の臨床開発活動および競合他社の臨床開発活動の結果は、引き続き定期的に発表され、その結果、当社の普通株式の価格が大幅に変動する可能性があると予想しています。
当社の転換社債に関連するリスク
•負債を支払うのに十分な事業キャッシュフローがない可能性があります。
•2027年満期の 1% 転換社債または債券の現金転換のための決済に必要な資金を調達したり、根本的な変化により債券を現金に買い戻したりすることができない場合があります。
•ノートの条件付き換算機能が作動した場合、当社の流動性に悪影響を及ぼす可能性があります。
事業に関するリスク
当社の決算に関連するリスク
当社の承認済み製品または将来の製品のマーケティングと販売は、成功しなかったり、予想よりも成功しなかったりする可能性があります。また、AMVUTTRAを含む特定の商用製品の承認適応を拡大できない場合があります。
私たちは4つの製品を商業的に発売しましたが、承認された製品のマーケティングと販売が成功するのか、それとも以下を含む特定の商用製品の承認された適応範囲を拡大できるのかは予測できません
アムブットラ。たとえば、2022年8月と9月に、パティシランを対象としたAPOLLO-B第3相臨床試験の安全性と有効性の肯定的な結果を報告しました。この試験は、心筋症のATTRアミロイドーシス患者の機能的能力と生活の質に対するパティシランの影響を評価するために設計および実施されました。12か月後のAPOLLO-Bの結果は、心筋症を伴うATTRアミロイドーシスの患者の潜在的な治療法としてTTRを標的とするRNAi治療薬の治療仮説を裏付けていると考えていますが、2023年10月、FDAは、心筋症を伴うATTRアミロイドーシスの治療薬であるパティシランのSNdAのCRLを発行しました。これは、パティシスの臨床的意義を示しています心筋症を伴うATTRアミロイドーシスに対するranの治療効果は確立されていなかったため、SNDaは提出されたフォームでは承認されませんでした。
2025年末までに収益性の高い一流のバイオテクノロジー企業を構築し、Alnylam P5x25戦略とそれに関連する指標を達成するという事業計画を実行するには、承認された製品のマーケティング、販売、承認済み適応症の拡大を成功させることに加えて、次のことを成功させる必要があります。
•製品開発活動を行い、RNAiと、肝臓、中枢神経系、眼、肺、脂肪、筋肉などの関連する組織や細胞へのsiRNAの送達の両方に関連する新技術を引き続き活用します。
•強力な知的財産ポートフォリオを構築し、維持する。
•製品候補の開発と商品化について規制当局の承認を得て、承認された製品および当社が商品化するその他の製品の販売を成功させます。
•当社製品の顧客を引き付け、維持します。
•成功したコラボレーションを開始し、維持します。そして
•臨床試験、規制当局の承認、商品化によりコストや経費が増加しても、支出を管理してください。
上記の目標を達成できなかった場合、製品候補の開発、承認された製品または将来の製品の商品化の成功、必要に応じて資金調達、債務の返済、財政的自立の達成、または事業の継続ができなくなる可能性があります。
私たちには損失の歴史があり、決して利益を上げることはできず、今後も利益を上げ続けることはできません。
創業以来、大きな営業損失を被っています。2024年3月31日現在、当社の累積赤字は70.8億ドルでした。現在までに、米国、EU、その他世界のさまざまな国で4つの製品を発売しており、2024年以降にはさらに多くの国で商業的に承認された製品を発売する予定ですが、事業から収益性やプラスのキャッシュフローを達成することは決してないかもしれません。2024年3月31日に終了した3か月間、オンパトロ、アムブトラ、ジヴラーリ、オクスルモの売上高は3億6,520万ドルの純製品収益を記録しました。2019年は営業損失のピーク年だったと考えていますが、年間営業損失は引き続き発生すると予想しており、RNAi治療薬の発見、開発、商品化への取り組みを拡大し、2025年末までに財政的自立を達成することを目指しているため、今後数年間は多大なリソースが必要になります。私たちは、現在の現金、現金同等物、市場性のある株式および負債証券、ならびに製品販売および既存のコラボレーションの下で生み出されると予想される収益(Leqvio販売のマイルストーンやロイヤルティを含む)により、将来のエクイティファイナンスを必要とせずに自立的なプロファイルを達成できると考えていますが、この目標を達成するには、製品、コラボレーション、ロイヤルティの収益を生み出す能力が必要です。現在および将来、商業的に承認された製品(ある場合)の販売から得られる収益に加えて、今後数年間に生み出される収益の一部は、ロシュ、リジェネロン、サノフィ、ノバルティスなどの製薬企業やバイオテクノロジー企業とのコラボレーションによるものと予想しています。既存のコラボレーションの維持、新しいコラボレーションの確保と維持、コラボレーション契約に基づく義務の履行、または既存または新規のコラボレーションの下で支払いを受けるために達成または達成する必要のあるマイルストーンを達成できるかどうかは定かではありません。さらに、ノバルティスを含む私たちの協力者が、私たちの協力契約に基づく義務を引き続き首尾よく果たし、協力とロイヤルティの収益を私たちに生み出すかどうかは定かではありません。
収益性を高め、収益性を維持するには、市場に大きな可能性を秘めた新製品候補の発見、開発、商品化を成功させる必要があります。そのためには、継続的なプラットフォームイノベーション、開発の前臨床試験と臨床試験段階、規制当局の承認と新製品候補の償還の取得、承認された製品の製造、マーケティング、販売など、さまざまなやりがいのある活動における成功をさらに発展させる必要があります。収益性を達成するのに十分な収益を生み出すことは決してないかもしれませんし、たとえ収益性を達成したとしても、四半期または年間ベースで収益性を維持または向上させることができない可能性があります。収益を上げることができず、一貫して利益を維持できなければ、普通株式の市場価格が下落する可能性があります。さらに、資金調達、事業拡大、追加製品候補の開発、または事業の継続ができない場合があります。
研究、開発、商品化活動を継続するには多額の資金が必要になります。また、見積もりよりも多くの資金が必要な場合は、特定の活動を大幅に制限したり、大幅に縮小したり、中止したりする必要があるかもしれません。
私たちはRNAi技術の開発に多額の資金を使用してきましたが、製品候補の前臨床試験や臨床試験を含むさらなる研究開発活動の実施や、承認された4つの製品と商業販売が承認されたその他の製品の製造、マーケティング、販売には、多額の資金が必要になります。
製品候補の開発を成功させるための期間や活動範囲は、予想よりも長い場合があるため、製品候補の開発と商品化に必要な実際の資金を見積もることはできません。
2019年は営業損失のピーク年であったと信じており、現在の現金、現金同等物、有価株および負債証券、ならびに製品販売および現在のコラボレーションの下で生み出されると予想される収益(Leqvioの販売でノバルティスから受け取ると予想されるマイルストーンやロイヤルティを含む)により、将来の株式融資を必要とせずに自立的な財務プロファイルを実現できると考えています。それでも、当社の将来の資本要件と、既存のリソースが当社の事業を支える期間は、現在の予想とは異なる可能性があります。私たちは次のような多くの要因に基づいて期待していますが、その多くは予測が難しいか、私たちの制御が及ばないものです。
•希少疾患と流行病の両方を対象としたプログラムを含む、研究開発プログラムの進捗状況と、これらのプログラムを進めるために規制当局が要求する可能性のあること。
•現在および将来の協力者からのマイルストーン、ロイヤリティ、その他の支払い(ある場合)の時期、受領および金額(ある場合)。これには、zilebesiranの開発と商業化に関するロシュからのマイルストーンおよびロイヤルティの支払い、およびLeqvioの商業化に関連するノバルティスからのマイルストーンおよびロイヤルティの支払いが含まれます。
•追加のコラボレーションや新しいビジネスイニシアチブを維持および確立する当社の能力。
•当社の新技術と、肝外組織へのデリバリー取り組みを成功裏に進める能力から、製品プロファイルが改善される可能性が生まれます。
•前臨床研究と臨床研究の成功と開始、規制当局の承認の取得、製品候補のグローバルな商品化の準備、および第三者の知的財産のライセンスの取得と維持に必要なリソース、時間、コスト。
•自社の製造施設をタイムリーかつ費用対効果の高い方法で設立、維持、運営する能力。
•臨床試験用の製品候補および商業販売用の当社製品を製造する当社の能力、または製造に関する第三者との契約能力。
•将来のパンデミックや公衆衛生上の緊急事態、または中東とウクライナで進行中の紛争が、前臨床研究または臨床試験の開始または完了、および当社の製品や製品候補の供給に与える影響。
•特許請求の準備、申請、審理、維持、執行に必要なリソース、時間、費用。
•当社の事業活動の過程で発生する、訴訟や政府の調査を含む法的活動に関連する費用、およびそのような法的紛争や調査において勝訴または満足のいく結果を得るための当社の能力。
•承認された製品および潜在的な製品からの販売マイルストーンとロイヤリティ(もしあれば)のタイミング、受け取り、金額(承認された場合)。そして
•Leqvioを含め、当社がロイヤルティを受け取る資格のある製品の規制審査プロセスと商業的成功の結果。
これらの要因に関する見積もり、予測、および財務ガイダンスが正しくない場合、事業計画を変更する必要があり、将来、追加の資金調達を求められる可能性があります。私たちは、共同契約、公開株式またはプライベートエクイティの提供、デットファイナンス、ロイヤルティやその他の収益化取引、またはこれらの資金源の1つまたは複数の組み合わせを通じてこれを行う場合があります。追加の資金は、許容できる条件で入手できない場合や、まったく利用できない場合があります。
将来私たちが追求しなければならない資金調達の条件は、私たちの株主の持ち株や権利に悪影響を及ぼす可能性があります。株式を発行して追加の資金を調達すると、既存の株主がさらに希薄化することになります。さらに、当社に追加資金を提供する条件として、将来の投資家は、既存の株主よりも優れた権利を要求したり、付与されたりする可能性があります。
追加の資金が必要で、そのような資金を適時に調達できない場合、1つ以上の研究開発プログラムを大幅に延期または縮小するか、グローバルな商業インフラのさらなる開発を延期または縮小せざるを得なくなり、長期的な戦略的目標を達成する能力が遅れたり低下したりする可能性があります。また、協力者などとの取り決めを通じて資金を求める必要があり、そうしないと自分たちで追求することになる当社の技術、製品候補、または製品の一部に対する権利を放棄しなければならない場合もあります。
ノバルティスによるLeqvioのグローバル販売によるロイヤリティストリームと商業マイルストーンの一部を売却しましたが、Leqvioに対する将来のロイヤルティと商業マイルストーンの支払いの残りの部分を留保する権利があり、Leqvioに関連するマイナスの進展は、それらの支払いの受領に重大な悪影響を及ぼす可能性があります。
2020年4月、私たちはBX Bodyguard Royalty L.P.(ブラックストーングループ社の関連会社)またはブラックストーンに、ノバルティス、その関連会社またはLeqvioのサブライセンシーによる純売上高に関して当社に支払われるロイヤルティの50%と、MDCO契約に基づいて当社に支払われる商業マイルストーンの支払いの 75% を売却しました。2029年12月31日までにLeqvioの世界売上高が少なくとも10億ドルに相当するロイヤリティの支払いをブラックストーンが受け取らない場合、2030年1月1日より、Leqvioのロイヤリティに対するBlackstoneの持分は 55% に増加します(当社の利息は 45% に減少します)。その結果、Leqvioの売上に悪影響を及ぼす要因はすべて、この期間に1,000億ドルの返済基準額を満たすことができず、ひいては当社が保持できるLeavioのロイヤリティストリームの割合に悪影響を及ぼす可能性があります。
Leqvioの売上に悪影響を及ぼす可能性のある要因は次のとおりです。
•hEFHとASCVDの新しい治療法または代替製剤の開発に取り組んでいる企業。
•患者、医学界、または第三者の支払者によるLeqvioの受け入れの欠如。
•安全性、有効性、償還の問題など、Leqvioに関連するあらゆるネガティブな発展。
•特許、所有権に関する紛争、またはライセンス契約やコラボレーション契約に基づく紛争。
•外貨為替レートの変動。そして
•Leqvioの使用制限やリスク管理プログラムの強化を含む安全関連のラベルの変更など、Leqvioの販売を制限または禁止する規制または立法上の不利な発展。
Leqvioの販売によって生み出された収益が予想よりも低い場合、現在予想している金額の商業マイルストーンの支払いやロイヤルティを受け取ることができず、当社の事業、見通し、経営成績、財政状態に重大かつ悪影響が及ぶ可能性があります。
ロシアとウクライナの間で進行中の軍事紛争に関連する地政学的リスクは、当社の事業、見通し、経営成績、および臨床試験を含む財政状態に悪影響を及ぼす可能性があります。
ロシアのウクライナ侵攻、および米国、EU、その他の国による制裁措置を含む世界的な対応は、世界的なビジネスの混乱と経済のボラティリティをもたらし、臨床試験を含む当社の事業に悪影響を及ぼす可能性があります。制裁による報復的サイバー攻撃が世界経済と市場に及ぼす潜在的な影響を含め、ウクライナでの紛争に起因する敵対行為の性質、規模、期間が不確実なため、市場のボラティリティと不確実性が高まり、当社の事業と事業に影響を与える可能性のあるマクロ経済的要因に引き続き悪影響を及ぼす可能性があります。
さらに、ウクライナで続いている紛争により、特定の委託研究機関(CRO)がウクライナの特定の場所で臨床試験を実施することができなくなっています。この紛争が予定通りに臨床試験を実施し完了する能力に及ぼす全体的な影響は定かではありません。ただし、臨床試験が中断されると、臨床開発計画や製品候補の承認または承認が大幅に遅れる可能性があり、コストが増加し、製品候補の商品化を成功させる能力が損なわれる可能性があります。
財務諸表や予測ガイダンスを作成する際に私たちが行う見積もり、または依拠する仮定が不正確であることが判明した場合、実際の結果は予測や見越額に反映されているものと異なる場合があります。
当社の要約連結財務諸表は、米国で一般に認められている会計原則(GAAP)に従って作成されています。これらの要約連結財務諸表を作成するには、報告された当社の資産、負債、収益および費用の金額、当社が発生した費用の額、および偶発資産と負債の関連する開示に影響する見積もりと判断を行う必要があります。私たちは、歴史的経験や、その状況下では合理的であると私たちが考えるさまざまな仮定に基づいて見積もりをしています。しかし、私たちの見積もりやその基礎となる仮定が正しいことを保証することはできません。
さらに、製品販売、コラボレーション、ロイヤルティ収益の合計、およびGAAPと非GAAPを合わせた研究開発と販売、一般管理費に関する予想に関する財務ガイダンスを随時発行しています。これらのガイダンスは、見積もりと経営陣の判断に基づいています。何らかの理由で、当社の製品の売上、収益、および/または費用が当社のガイダンスと大きく異なる場合、公に発表された財務ガイダンスを調整しなければならない場合があります。たとえば、2022年4月に、純製品収益の合計に関する2022年のガイダンス範囲を狭め、2022年10月に、コラボレーションとロイヤリティ収益のガイダンス範囲を減らしました。公開されている財務ガイダンスやその他の事業に関する期待に応えられなかった場合、またはいずれかの要素を変更または更新する必要がある場合、株価が下落する可能性があります。
当社の現金、現金同等物、および有価証券の投資には、損失を引き起こしたり、これらの投資の流動性に影響を与えたりするリスクがあります。
2024年3月31日現在、当社には23億7,000万ドルの現金、現金同等物、および有価証券がありました。私たちはこれまで、資本の保護に焦点を当てた投資方針の基準を満たす高級社債、コマーシャルペーパー、米国政府が発行または後援する証券、預金証券、およびマネーマーケットファンドにこれらの金額を投資してきました。社債には、米ドル建ての外国債券も含まれる場合があります。これらの投資には、信用、流動性、市場、金利に関する一般的なリスクがあります。これらの投資の公正価値の損失またはこれらの投資の完全な損失に気付く可能性があり、それが当社の財政状態に悪影響を及ぼす可能性があります。さらに、投資によって支払いが中止されたり、支払われる利息の額が減ったりすると、利息収入は減少します。当社の投資ポートフォリオに関連する市場リスクは、当社の業績、流動性および財政状態に悪影響を及ぼす可能性があります。
外貨為替レートの変動は、当社の業績に重大な悪影響を及ぼす可能性があります。
米国外からの収益は、当社の製品が当社または当社の協力者によって商品化されるかどうかにかかわらず、そのような管轄区域での販売承認が得られるにつれて増加すると予想されます。私たちの主な外貨エクスポージャーは、日本円、ユーロ、英国ポンドの変動に関するものです。米ドルが特定の外貨に対して下落した場合、当社の収益は増加し、純利益にプラスの影響を与えますが、全体的な費用は増加し、マイナスの影響を及ぼします。逆に、特定の外貨に対して米ドルが上昇した場合、収益は減少し、純利益に悪影響を及ぼしますが、全体的な経費は減少し、プラスの影響があります。たとえば、2022年にドルが特定の外貨に対して上昇し、為替レートが当社の国際収益に悪影響を及ぼしました。為替レートの継続的な変動は、引き続き当社の業績と財政状態に影響を与える可能性があります。
税法の変更は、当社の事業、見通し、経営成績、財政状態に悪影響を及ぼす可能性があります。
当社の事業は、税制や税制の変更、税率の変更、新しい税法、改正税法の解釈など、当社の業績に悪影響を及ぼす可能性のある多くの国際法、連邦法、州法、その他の政府法、規則、規制の対象となっており、個別に、または組み合わせて、当社の実効税率が上昇する可能性があります。米国では、連邦、州、地方の所得税に関する規則は、立法手続きの関係者、内国歳入庁、米国財務省によって常に見直されています。税法の変更(変更が遡及的に適用される場合があります)は、当社または当社の普通株式の保有者に悪影響を及ぼす可能性があります。近年、このような変更が数多く行われており、今後も変化が続く可能性があります。将来の税法の変更は、当社の事業、見通し、経営成績、財政状態に重大な悪影響を及ぼす可能性があります。
さらに、経済協力開発機構(OECD)、OECD、EC、および当社とその関連会社が事業を行っている個々の課税管轄区域は、最近、多国籍企業の課税に関連する問題に焦点を当てています。OECDは、塩基浸食と利益移転対策のための合意された一連の国際ルールを作成する包括的な計画を発表しました。さらに、OECD、EC、および個々の国は、デジタル経済を検討している国間の課税権の配分方法の変更を検討しています。その結果、米国および当社および当社の関連会社が事業を行うその他の国の税法は、将来的または遡及的に変更される可能性があり、そのような変更は、当社の事業、見通し、経営成績、および財政状態に重大な悪影響を及ぼす可能性があります。
当社の事業に関連して、追加の納税義務が発生する可能性があります。
私たちは、米国および当社が事業を展開する外国の管轄区域で所得税の対象となっています。当社の全世界の納税義務を決定する際には慎重な判断が必要であり、当社の実効税率は適用される法定税率と各課税管轄区域の相対所得から導き出されます。私たちは、法の適用に関して経営陣が重大な判断を下す必要がある、不確実な税務上の地位に対する負債を記録します。国内外の税務当局は、当社および子会社の事業に適用される税法の解釈や、納税申告書における特定の税務問題に関して当社がとる可能性のある立場に異議を唱える場合があります。したがって、財務諸表の作成時に見積もった未収額を超える税務査定または判断は、報告された実効税率またはキャッシュフローに重大かつ悪影響を及ぼす可能性があります。さらに、国ごとの収益性構成の変化、株式ベースの報酬(株式の価格に一部依存するため、当社の制御が及ばない)の税効果、税法または規制の変更など、他の要因が当社の実効税率に悪影響を及ぼす可能性があります。たとえば、OECDグローバル反基地侵食モデルは、最低税の実施など、当社が事業を展開している国の税法に影響を与えています。これらまたは他の法律や規制、またはその解釈の変更は、当社の実効税率またはキャッシュフローに重大かつ悪影響を及ぼす可能性があります。
今後、パンデミックや公衆衛生上の緊急事態が発生すると、直接的または間接的に当社の事業、経営成績、財務状況に悪影響を及ぼす可能性があります。
将来、パンデミックや公衆衛生上の緊急事態による混乱が発生し、承認された製品の商品化を成功させる能力など、当社の事業や運営に影響を与える可能性があり、その結果、商業販売に関する期待に応えられなくなる可能性があります。さらに、パンデミックや公衆衛生の結果として、現在または将来の患者が治療を延期することを決定した場合、承認された製品に対する患者の需要が減少する可能性もあります。
緊急。人員不足、原材料やその他のサプライチェーンの不足、生産の鈍化、配送システムの混乱など、パンデミックや公衆衛生上の緊急事態による事業の中断も、承認された製品を十分に製造し、必要な量の製品候補を生産するために私たちまたは私たちの協力者が頼りにしている米国外の第三者に悪影響を及ぼす可能性があり、その結果、当社の商品化の取り組み、研究開発活動、および当社製品候補の商品化の可能性。
さらに、前臨床活動をタイムリーに完了し、計画された臨床試験を開始できるかどうかは、たとえば、前臨床試験施設や臨床試験施設、研究者や治験責任者、募集や登録が可能な患者または健康なボランティアの被験者、パンデミックや公衆衛生上の緊急事態などの世界的な健康問題によって悪影響を受ける可能性のある規制機関の職員などの空き状況によって決まります。私たちは、新型コロナウイルスの影響を受けた、または再び影響を受ける可能性のある地域で、医薬品候補の前臨床活動と臨床試験を実施しており、COVID-19のパンデミックとその変異の再発、または将来のパンデミックや公衆衛生上の緊急事態の出現は、進行中の臨床試験のさまざまな側面、および2024年に開始する予定の臨床試験と前臨床研究に影響を与える可能性があります。
世界中の健康規制機関も、パンデミックや将来の公衆衛生上の緊急事態の結果として、業務に支障をきたす可能性があり、それが審査、検査、承認のタイムラインに影響を与える可能性があります。新型コロナウイルスのパンデミックにより、海外および国内の施設検査がほとんど保留になった2020年3月以来、FDAは、定期的なサーベイランス、バイオリサーチモニタリング、事前承認検査など、パンデミック前のレベルの検査活動を再開するよう取り組んできました。FDAが、マーケティング申請の承認には検査が必要で、旅行の制限により審査サイクル中に検査を完了できないと判断し、リモートインタラクティブ評価が適切であるとFDAが判断した場合、FDAは通常、状況に応じて、完全な回答書を発行するか、検査が完了するまで申請に対する措置を延期する予定であると述べています。
パンデミックや公衆衛生上の緊急事態が当社の事業に及ぼす最終的な影響は不明ですが、このようなパンデミックや公衆衛生上の緊急事態による悪影響は、単独で、または他のものと組み合わせると、ここで説明する他のリスク要因を悪化させる可能性があります。パンデミックや公衆衛生上の緊急事態が、当社の事業、財務実績、株価にどの程度悪影響を及ぼすかは、非常に不確実で予測できない将来の動向に左右されます。
第三者への依存に関連するリスク
既存のコラボレーションを維持できない場合、または製品候補の開発と商品化のためのビジネス上および科学的能力と資金を提供できる他の企業と新しいコラボレーションを開始できない場合、当社の事業、見通し、経営成績、財政状態に悪影響を及ぼす可能性があります。
現在、増え続けるRNAi治療薬のパイプラインから生じるすべての機会を促進するための十分な能力や能力はありません。そのため、特定の地域や特定の製品候補でそのような能力や能力を提供できると思われる第三者の協力者と協力関係を締結しました。将来的にはこのような協力関係をさらに開始する予定です。具体的には、現在、ロシュ、リジェネロン、サノフィ、ノバルティスなどと積極的に協力して、パイプラインにあるさまざまな製品や製品候補に取り組んでいます。
このようなコラボレーションでは、現在の、そして将来的に期待される協力者が、臨床開発、規制業務、および/またはマーケティング、販売、流通においてかなりの能力を提供することを期待しています。特定のコラボレーションでは、協力者が特定の地域または世界で、特定の製品候補を開発、マーケティング、および/または販売することを期待していますが、これらの協力者の開発、販売、マーケティング、流通活動に対する管理は限られているか、まったくありません。私たちの将来の収益は、これらの第三者の努力の成功に大きく依存する可能性があります。たとえば、私たちは、(i) 眼疾患を対象としたすべてのプログラム (限られた例外はありますが) や、場合によっては他の中枢神経系や肝臓プログラムの開発と商品化はリジェネロンに、(ii) レクビオの世界的な開発と商品化はノバルティス、(iii) フィツシランの世界的な開発と商品化はサノフィに、(iv) ジレベスの商業化はロシュに全面的に頼ります。米国外では。上記(i)-(iv)の条項で言及されている各コラボレーションの場合、私たちはロイヤルティを受け取る権利があり、場合によってはロイヤルティを受け取る権利があります該当する製品の販売に関する商業マイルストーンの支払い。私たちの協力者が開発や商品化の取り組みで成功しなかった場合、関連する製品または製品候補からの将来の収益に悪影響が及ぶ可能性があります。たとえば、2020年12月、ノバルティスはFDAから、第三者製造施設での検査関連の状況が未解決のため、FDAはPDUFA措置日までにNDAを承認できないという完全な回答書を受け取りました。Leqvioは2021年12月にFDAによって最終的に承認されましたが、完全な回答書が解決されたため、承認マイルストーンと潜在的な米国ロイヤルティの支払いが遅れました。上で説明したように、ブラックストーンとの契約に基づき、Leqvioの売上に関してブラックストーンが当社から受け取ったロイヤルティによって生み出された収益が2029年末までに一定レベルに達しない場合、ブラックストーンは2030年からより高いロイヤルティ率を受け取る権利があり、2030年以降のロイヤルティ収入に悪影響を及ぼします。
IKARIAプラットフォームを含む新技術による製品プロファイルの改善を実証する能力、特定の組織や疾患領域のヒトを対象に当社の技術の概念実証を成功させる能力、特定の製品候補の安全性と有効性を実証する能力、RNAi治療薬を製造または第三者に製造させる能力、強みなど、さまざまな要因により、将来的に有利な条件でコラボレーションを開始できない可能性があります。私たちの知的財産のポートフォリオおよび/または課題に関する懸念、または
私たちの知的財産ポートフォリオに対する潜在的な課題。そのような新しいコラボレーションの確保に成功したとしても、たとえば、製品候補の開発や承認が遅れたり、知的財産の有効性や範囲に関して課題が提起されたり、支払者から十分な償還を得られなかったり、承認された医薬品の売上が予想を下回ったり、協力者が戦略的焦点を変更したりした場合、それらを維持できない可能性があります。
さらに、新しいコラボレーション契約の締結が遅れると、特定の製品候補の開発と商品化が妨げられたり遅れたり、製品候補が最終的に市場に出た場合の競争力が低下したりする可能性があり、ひいては当社の事業、見通し、経営成績、財政状態に悪影響を及ぼす可能性があります。
特定の製品候補については、ロシュ、リジェネロン、サノフィ、ノバルティスとのコラボレーションなど、医薬品開発と商品化の費用の全部または一部を賄うためのコラボレーションを結んでいます。ただし、他の特定のプログラムでは追加のコラボレーションを結ぶことができない場合があり、私たちが確保したコラボレーション契約の条件が私たちにとって有利ではない場合があります。1つまたは複数の製品候補に関して将来のコラボレーション契約を締結する取り組みが成功しなかった場合、これらの製品候補や他の製品候補を社内で開発したり、そのような製品候補を市場に投入したりするのに十分な資金やその他のリソースがない可能性があります。このような状況では、これらの製品候補から収益を生み出すことができず、当社の事業、見通し、経営成績、財政状態に重大な悪影響を及ぼします。
協力者が当社との契約に基づく義務を大幅に修正、解除、または履行しなかった場合、製品候補の開発と商品化が遅れたり、終了したりする可能性があります。
能力と資金を協力者に依存しているため、協力者が当社とのコラボレーション契約を大幅に修正または終了したり、その契約に基づく義務を履行しなかったりした場合、当社の事業に悪影響が及ぶ可能性があります。私たちの現在または将来のコラボレーションは、もしあれば、科学的または商業的に成功しない可能性があります。今後、協力者と共同開発した技術または製品の権利の所有権に関して紛争が発生する可能性があり、影響を受ける製品候補を開発および商品化する当社の能力に悪影響を及ぼす可能性があります。現在のコラボレーションでは、いずれの当事者が相手方による重大な違反を理由にコラボレーションを終了することも可能であり、今後のコラボレーションでも可能になると予想しています。さらに、当社の協力者は、特定の状況下で、コラボレーションまたはコラボレーションに基づく特定のプログラムに関して、便宜上、追加の解約権を持っている場合があります。たとえば、世界中のインクリシランの開発と商業化に関するノバルティスとの契約は、4か月前の書面による通知によりいつでもノバルティスによって終了される場合があります。ただし、ノバルティスが便宜上、契約を終了した場合、ノバルティスは、契約に基づく自社(またはMDCO)の活動の過程で開発された特定の技術に基づくライセンスを当社に付与する必要があります。ただし、ノバルティスとの間で交渉されるロイヤルティを条件としますパーティー。さらに、MDCOライセンス契約に関してノバルティスが不利な行動をとったり、MDCOライセンス契約に関してノバルティスと紛争を起こしたりすると、ブラックストーンとの契約に基づく義務を遵守する当社の能力に悪影響を及ぼす可能性があります。商品化の協力者を失うと、新しい協力者を引き付けるか(既存の協力者ほど有利ではない条件で)、社内で販売、流通、マーケティングの能力を拡大する必要があります。そのためには、多額の財源と経営資源を投資する必要があります。
さらに、技術の所有権やその他の問題について協力者と紛争が生じた場合、または協力者が違反の有無を理由に当社との協力を終了した場合、または影響を受ける製品や製品候補の研究、開発、商品化を行わないことを決定した場合、製品候補の開発が遅れ、製品候補を開発するための追加の企業リソースが必要になったり、販売拡大のために時間とリソースを費やす必要が生じたりする可能性があります。より迅速なマーケティング機能タイムラインは、私たちが新しい協力者を引き付けることをより困難にし、ビジネス界や金融界における私たちの認識に悪影響を及ぼす可能性があります。
さらに、協力者、または協力者の支配権が変更されたり、協力契約が第三者に譲渡されたりした場合、MDCOやノバルティスの場合のように、後継者または譲受人は、次のことが自分の利益になると判断できます。
•代替技術を追求するか、自社で、または他の企業と共同で、当社と提携している製品と競合するか、または当社とのコラボレーションへの取り組みに影響を与える可能性のある代替製品を開発します。
•優先度の高いプログラムを追求したり、開発プログラムの焦点を変更したりすると、協力者の私たちへのコミットメントに影響を与える可能性があります。または
•マーケティングの権利がある場合は、当社なしで開発された製品候補よりも、マーケティングが承認されている製品候補のマーケティングに費やすリソースを減らすことを選択してください。
これらのいずれかが発生した場合、1つまたは複数の製品または製品候補の開発と商品化が遅延、削減、または中止される可能性があります。これは、そのような開発と商品化を当社だけで継続するための十分な財源または能力がない可能性があるためです。
私たちは製造能力とリソースを拡大し続けることを期待しており、この専門知識を開発したり、製品の製造を第三者に依頼したりするには、多額の費用を負担する必要があります。
私たちは製造能力を拡大してきました。承認された製品の商品化を継続し、現在の製品候補を開発し続け、規制当局の承認を申請し、承認された場合は将来の製品を商品化するには、社内の製造能力を引き続き開発したり、必要な外部製造能力を契約したり、その他の方法で手配したりする必要があります。歴史的に、当社の社内製造能力は、in vitroおよびin vivo実験用の材料の小規模生産に限定されていました。そのような材料は、現在の適正製造基準基準(cGMP)の下で製造する必要はありませんでした。2012年に、私たちは後期臨床試験用および商業供給用のパティシラン製剤バルク医薬品の製造のためのcGMP機能とプロセスを開発しました。さらに、2020年には、マサチューセッツ州ノートンにあるcGMP製造施設の建設と認定を完了しました。そこでは、初期段階の臨床開発用の原薬を製造しており、将来的には後期段階の臨床開発や商業利用のための原薬を製造する可能性があります。
現時点では、限られた量の臨床試験原薬を自社で製造する能力しかありません。それ以外の場合は、追加の原薬の製造は引き続き第三者のCMOに頼り、臨床および商業用の医薬品要件はすべて第三者のCMOに頼っています。私たちのsiRNA治療薬を製造する専門知識を持つCMOは世界中に限られており、現在、製品や製品候補の製造を北米、ヨーロッパ、アジアの限られた数のCMOに頼っています。医薬品製造には、CMOが納期要件を満たす能力、またはニーズを満たすのに十分な量の材料を提供する能力に影響を与えるリスクが内在しています。CMOがこれらのことを怠ると、臨床試験が遅れ、商業供給が危険にさらされる可能性があり、その結果、追加費用が発生する可能性があります。将来の要件を満たすには、追加のCMOとの契約が必要になる可能性があります。そのような代替サプライヤーは限られているか、すぐに入手できない場合や、合理的な条件でタイムリーに契約を結ぶことができない場合や、まったくない場合があります。
合成siRNAの製造に加えて、LNPやコンジュゲート、その他のドラッグデリバリー技術など、siRNAを関連する細胞や組織に送達するために必要な技術に関連する追加の製造要件がある場合があります。場合によっては、私たちが利用する配送技術は高度に専門化されているか、独自のものであり、技術的および/または法的な理由により、そのような配送技術の潜在的なメーカーは1社または限られた数にしかアクセスできない場合があります。さらに、当社の配送技術のスケールアップは非常に困難だったり、かなりの時間がかかったりする可能性があります。また、このようなスケールアップや製造の経験も限られているため、限られた数の第三者に頼る必要があります。第三者はタイムリーに納品できない場合や、まったく提供できない場合があります。メーカーが当社のデリバリーテクノロジーを適切に製造したり、配送用のsiRNAを配合したりしないと、製品が使用できなくなったり、供給が遅れたり、医薬品が不足したりする可能性があります。さらに、他の会社のメーカーからの供給をめぐる競争、そのようなメーカーによる契約上の義務の違反、またはそのようなメーカーとの紛争は、私たちの発見と開発の取り組みが遅れるだけでなく、私たちに追加の費用もかかります。
独自の製造施設を建設して製造能力を開発するにあたり、多額の支出が発生しましたが、将来的には多額の追加支出が発生すると予想されます。また、施設にスタッフを配置する資格のある従業員を募集、雇用、訓練しなければならず、今後もそうする必要があるでしょう。十分な量の材料を製造できない場合、または将来施設で問題が発生した場合は、代替サプライヤーを確保する必要があり、そのような代替サプライヤーが利用できないか、合理的な条件でタイムリーに契約を結ぶことができないか、まったくない可能性があります。当社の商用製品と臨床候補品の供給は限られた数のCMOに依存しており、自社施設を継続的に利用していることを考えると、製品の製造に遅延や停滞があると、継続的な臨床および商業的供給が妨げられ、当社の事業、見通し、経営成績、または財政状態に重大かつ悪影響を及ぼす可能性があります。さらに、私たちまたは私たちの協力者が製品候補の供給をCMOに頼っている限り、供給の遅延や中断は、私たちや協力者の製品候補の研究開発活動や潜在的な商品化に重大な悪影響を及ぼす可能性があります。
当社製品および当社が開発する可能性のあるその他の製品候補の製造プロセスは、FDAおよび外国の規制当局の承認プロセスの対象であり、適用されるすべてのFDAおよび外国の規制当局の要件を継続的に満たす必要があり、満たすことができるCMOと契約する必要があります。CMOが必要な規制当局の要件を満たさないと、規制申請の提出が遅れたり、当社または現在または将来の協力者の製品候補の規制当局の承認の取得が遅れたりする可能性があります。たとえば、2022年4月、第三者の二次包装および表示施設での保留中の検査分類に対応するために、提出したvutrisiran NDAが修正されたため、FDAはNDAの審査期間を延長しました。さらに、いずれかの製品候補について必要な規制当局の承認を受けた場合、商業的供給に必要な材料の製造を、商業的協力者を含む第三者に依頼することも期待しています。
さらに、2024年1月には、下院でのバイオセキュリティ法(H.R. 7085)の導入や上院での実質的に同様の法案(S.3558)の導入など、議会の活動が行われました。これらの法案が成立するか、同様の法律が可決されれば、私たちのような米国のバイオ医薬品企業が、米国政府との契約やその他の方法で米国政府からの償還を受ける能力を失うことなく、特定の中国の「懸念されるバイオテクノロジー企業」からサービスや製品を購入したり、その他の方法で協力したりすることが厳しく制限される可能性があります。私たちはと取引しています
中国の企業、および一部の契約相手は、上記の法律の影響を受ける可能性があります。
前臨床試験、臨床または商業供給のための材料供給または製品候補または製品の製造を委託している第三者が、何らかの理由でそうすることをやめた場合、代替のサプライヤーまたはメーカーを特定して認定する間、これらの前臨床試験や臨床試験の進行が遅れたり、商業供給が中断されたりする可能性があります。また、当社にとって有利な条件で代替品を入手できない、またはまったく入手できない可能性があります。当社の製品候補や製品、またはそれらの製造に使用される物質の十分な供給が得られない場合、当社の事業、見通し、経営成績、または財政状態に重大かつ悪影響を及ぼす可能性があります。
当社が第三者と既存の製造契約を結んでいる、または将来締結する限り、品質管理や品質保証に関連するものを含め、契約上および規制上の要件に従い、それらの義務を適時に履行することをこれらの第三者に依存しており、今後もそうなるでしょう。CMOが期待どおりに義務を果たせなかったり、製品候補の全部または一部を自社で製造している限り、製造要件を履行しなかったりすると、次のようなさまざまな方法で当社のビジネスに悪影響を及ぼす可能性があります。
•当社または現在または将来の協力者は、開発中の製品候補の臨床試験を開始または継続できない場合があります。
•当社または現在または将来の協力者は、製品候補の規制申請の提出または規制当局の承認の受け取りが遅れる可能性があります。
•協力者の協力を失う可能性があります。
•当社の施設、CMOの施設、および当社の製品は、規制当局による検査の対象となり、それが悪影響をもたらし、供給遅延につながる可能性があります。
•製品の一部またはすべてのバッチの配布を停止またはリコールしたり、臨床試験施設から臨床試験資料を回収するための措置を講じたりする必要がある場合があります。そして
•最終的には、当社の製品候補や製品に対する臨床的および商業的要求を満たすことができない場合があります。
私たちは臨床試験の実施を第三者に頼っています。そのような第三者が義務を果たせなかった場合、私たちの開発計画に悪影響を及ぼす可能性があります。
私たちは、独立した臨床研究者、CRO、その他の第三者サービスプロバイダーに、臨床試験の管理、モニタリング、その他の実施を支援してもらっています。私たちは、サイトの選択、登録、監視、監査、データ管理サービスなどの特定のサービスを提供するために、特定の第三者と契約しており、今後も契約していく予定です。これらの調査員やCROは当社の従業員ではなく、彼らが私たちのプログラムに費やす時間とリソースを私たちがコントロールできることは限られています。これらの第三者は、他の事業体(競合他社を含む)と契約関係を結んでいる場合があり、その結果、当社のプログラムから時間とリソースを奪われる可能性があります。私たちはこれらの当事者に大きく依存していますが、その活動の限られた側面しか管理していないため、これらの第三者が規制やその他の法的要件、および当社の内部方針と手続きに従って、当社に対する契約上の義務をすべて適切に履行するとは保証できません。それでも、私たちは各研究が該当するプロトコル、法律、規制、科学的基準に従って実施されていることを確認する責任があり、第三者に頼っても規制上の責任が軽減されることはありません。当社とCROは、該当する優良臨床基準(GCP)の要件を遵守する必要があります。これは、臨床開発における当社の製品候補について、FDAおよび同等の外国の規制当局によって施行されている規制とガイドラインであり、コンプライアンス違反に対処するためのタイムリーな是正措置を実施する必要があります。規制当局は、マーケティング申請の審査を含め、治験依頼者、主任研究者、治験実施施設を定期的に検査することにより、これらのGCP要件を実施しています。当社または当社のCROのいずれかが適用されるGCP要件を遵守しなかった場合、またはそのような是正措置を講じなかった場合、当社の臨床試験で生成された臨床データは信頼できないと見なされる可能性があり、FDA、EMA、PMDA、またはその他の外国の規制当局は、当社のマーケティング申請を承認する前に、追加の措置を講じるか、追加の臨床試験を実施するよう当社に要求する場合があります。将来、特定の規制当局による検査の結果、その規制当局が当社の臨床試験のいずれかがGCP規制に準拠していると判断することを保証することはできません。
当社の第三者サービスプロバイダーが何らかの理由で当社に対する義務を適切かつタイムリーに履行できない場合、または当該第三者サービスプロバイダーが当社のプロトコルまたは規制要件を遵守しなかったために当社の臨床試験データの質と正確性が損なわれた場合、またはそのような第三者サービスプロバイダーが期限に間に合わなかった場合、当社の開発計画および/またはマーケティング承認に関する規制審査が遅れたり終了したりすることがあります。その結果、当社の事業、見通し、経営成績、財政状態が損なわれ、株価に悪影響が及ぶ可能性があります。
他の法域でのIND用途または同様の用途をサポートするために、製品候補の安全性と有効性をヒトで実証するための臨床試験を実施する前に、動物研究を含む前臨床試験を完了する必要があります。さらに、このような前臨床研究のための特定の資料の調達は、第三者のサービスプロバイダーに頼っています。前臨床試験を完了できるかどうかは、とりわけ、そのような研究の実施に必要な動物やその他の物資を調達できるかどうかにかかっています。そのような物資を入手できない場合、そのような準備を完了できない可能性があります
臨床研究を適時に行うか、まったく行わないか。たとえば、私たちのINDを可能にする毒物学やその他の研究の中には、中華人民共和国とカンボジアから慣習的に輸入されている特定の非ヒト霊長類を必要とするものがあり、これらの非ヒト霊長類の供給は、2022年にさまざまな要因により制限されました。前臨床研究を実施するのに十分な量のヒト以外の霊長類の供給が遅れると、前臨床研究を完了する能力が損なわれ、他の法域でのIND申請書や同様の申請書の提出が遅れる可能性があり、影響を受ける製品候補の開発スケジュールに悪影響を及ぼします。
事業管理に関連するリスク
資格のあるキーマネジメントや科学者、開発、医療、商業スタッフ、コンサルタント、アドバイザーを引き付けて維持できない場合、事業計画の実施能力に悪影響を及ぼす可能性があります。
私たちは、上級管理職と科学、臨床、販売、医療のスタッフに大きく依存しています。上級管理職のいずれかのメンバーのサービスを失うと、製品開発や商品化、その他の事業目標の達成が大幅に遅れたり妨げられたり、株価に悪影響を及ぼす可能性があります。当社の主要人材との雇用契約は、予告なしに終了することがあります。私たちは、どの従業員にもキーパーソン生命保険に加入していません。
私たちは過去数年間で従業員を大幅に増やし、将来的にはさらに従業員が増えると予想しています。また、数多くの製薬会社やバイオテクノロジー企業、大学、政府機関、その他の研究機関から、資格のある人材をめぐる激しい競争に直面しています。その多くは、資格のある人材を引き付けて報奨するためのリソースを、私たちよりも大幅に多く持っています。さらに、承認された製品の商品化が成功しなければ、優秀な販売およびマーケティングの専門家を引き付けて維持することができず、資格のある販売およびマーケティングの専門家を引き付けて維持することができなければ、承認された製品や将来の製品を商品化する当社の能力に悪影響を及ぼします。したがって、増え続ける研究、開発、グローバルな商業化の取り組みやイニシアチブを支援するために、適切な資格を持つ人材を引き付けて維持することができない場合があります。そうしないと、将来の事業計画を実施する能力に悪影響を及ぼす可能性があります。
主に創薬、前臨床試験、臨床開発に携わる米国およびEUを拠点とする企業から、複数の製品を開発および商品化するグローバル企業へと進化し続けるにつれて、事業拡大を成功させることが困難になる可能性があります。
承認された製品の商業的発売を続け、開発中の製品候補の数を増やすにつれて、米国での事業を拡大し続け、EUやアジアやラテンアメリカを含む他の地域での事業をさらに発展させる必要があります。現在までに、4つの製品について規制当局の承認を受けており、それらは世界中の複数の地域で発売されており、規制当局への提出や発売をさらに進めることで、これらの製品の対象範囲を拡大し続けています。
私たちは過去数年間で従業員を大幅に増やしました。承認された製品の商品化とAlnylam P5x25戦略の達成に注力するにつれて、将来的には世界中でさらに従業員が増えると予想しています。この成長は、当社の管理および運営インフラに負担をかけています。その結果、当社の成長を支え、米国、EU、日本、中南米、その他の地域でグローバル事業を行うための追加のスペースを確保するために、追加および/または新しいインフラストラクチャと機能を引き続き開発する必要があります。そのような追加インフラを開発したり、成長に対応するための十分なスペースをタイムリーに、商業的に合理的な条件で確保できなかったりすると、当社の事業に悪影響が及ぶ可能性があります。承認された製品の商品化を続け、開発する製品候補が臨床試験に入って進歩するにつれて、グローバルな開発、規制、製造、品質、コンプライアンス、マーケティングおよび販売能力を拡大し続けるか、他の組織と契約してこれらの機能を提供する必要があります。さらに、事業が拡大し続けるにつれて、さまざまな協力者、サプライヤー、流通業者、その他の組織とのさらなる関係をうまく管理する必要があります。事業を管理する能力と将来の成長により、運営、財務、管理の統制とシステム、報告システムとインフラストラクチャ、倫理とコンプライアンス機能、ポリシーと手順を引き続き強化する必要があります。管理情報や統制システムの強化を効率的かつタイムリーに実施できない場合や、既存のシステムや統制に欠陥があることに気付く場合があります。
ソーシャルメディアの使用にはリスクと課題があります。
ソーシャルメディアは、当社の臨床開発プログラムや、治験中のRNAi治療薬が開発されている疾患について伝えるために使用されており、承認された製品の商品化努力に関連して適切と思われるソーシャルメディアを利用しています。承認されれば、将来の製品でも同じことを行う予定です。バイオ医薬品業界におけるソーシャルメディアの慣行は進化し続けており、そのような使用に関する規制や規制ガイダンスは進化しており、常に明確であるとは限りません。このような変化は、当社の事業に適用される規制の不確実性と違反のリスクを生み出し、その結果、当社に対して規制措置が取られる可能性があります。また、適応外マーケティングやその他の禁止行為に関連する訴訟の可能性もあります。たとえば、臨床段階の候補者の場合、患者はソーシャルメディアチャネルを使用して、進行中の盲検臨床試験での自分の経験についてコメントしたり、疑わしい有害事象(AE)を報告したりできます。このような開示が行われると、研究登録に悪影響が出たり、適用されるAE報告義務の監視と遵守を怠ったり、政治的な問題に直面して事業を守れなくなったりするリスクがあります
そして、私たちの治験薬について私たちが言うことができる内容の制限により、ソーシャルメディアによって生じた市場圧力。また、インターネット上のブログやウェブサイト上の投稿など、あらゆるオンラインプラットフォームで、機密情報の不適切な開示や、当社に関する否定的または不正確な投稿やコメントが急速に配信され、当社の評判に悪影響を及ぼすリスクもあります。これらの出来事のいずれかが発生した場合、または適用される規制を遵守しなかった場合、責任を負ったり、規制措置に直面したり、事業にその他の損害を被ったりする可能性があります。
システム障害や、システムへの不正または不適切な使用やアクセスが発生した場合、当社の事業と運営が損なわれる可能性があります。
私たちのビジネスのために、情報技術システムとインフラストラクチャへの依存度がますます高まっています。私たちは、知的財産を含む機密情報、機密性の高い臨床試験データを含む専有のビジネス情報、および事業運営に関連する個人情報を収集、保管、送信します。この情報を安全に管理することは、当社の事業と事業戦略にとって重要です。この情報の中には、組織犯罪グループ、「ハクティビスト」、患者グループ、不満を抱いている現在または以前の従業員などを含む、幅広い動機と専門知識を持つ第三者による犯罪攻撃や不正アクセスや不正使用の対象となるものがあります。サイバー攻撃はますます高度化しており、セキュリティ対策を講じていても、当社の情報技術とインフラストラクチャは、このような攻撃に対して脆弱であったり、従業員のミスや不正行為などにより侵害されたりする可能性があります。
サイバーセキュリティインシデント全般の蔓延とサイバー犯罪のリスクは複雑で、進化し続けています。私たちは情報システムのセキュリティと完全性を維持するために多大な努力を払っており、セキュリティ侵害や混乱のリスクを管理するためのさまざまな対策を模索していますが、私たちのセキュリティへの取り組みと対策が効果的であること、またはセキュリティ侵害や混乱の試みが成功しなかったり損害を与えたりするという保証はありません。セキュリティ対策が講じられているにもかかわらず、当社の内部コンピューターシステムおよび請負業者、コンサルタント、協力者のコンピューターシステムは、コンピューターウイルス、不正または不適切なアクセスまたは使用、自然災害、パンデミックまたは公衆衛生上の緊急事態、テロ、戦争(ウクライナと中東で進行中の紛争を含む)、電気通信および電気障害による損傷または中断に対して脆弱です。このような出来事は、当社の事業を中断させる可能性があります。たとえば、製品候補の前臨床試験データや、完了した臨床試験や進行中の臨床試験のデータが失われると、規制当局への提出や開発作業が遅れたり、製品の商品化が遅れたり、コストが大幅に増加したりする可能性があります。システムの中断、セキュリティ侵害、不正または不適切な使用やアクセスにより、データが失われたり損傷したり、患者、従業員、ベンダーの情報を含むがこれらに限定されない機密情報や専有情報が不適切な開示になったりした場合、影響を受ける個人や政府機関への通知義務、患者、協力者、従業員、株主、その他の第三者からの訴訟の可能性を含む責任が発生する可能性があります。そして、外国法、連邦法、州法に基づく責任個人情報のプライバシーとセキュリティを保護するため、製品候補の開発と商品化が遅れる可能性があります。
さらに、クラウドテクノロジーの使用が増えると、第三者やその他の運用上のリスクが高まります。クラウドやその他のテクノロジーサービスプロバイダーがシステムを適切に保護し、サイバー攻撃を防止しないと、当社の業務が中断され、機密情報や専有情報の不正流用、破損、損失が発生する可能性があります。従業員がリモートで仕事をすると、サイバー攻撃のリスクが高まります。リモートワークは、フィッシング攻撃やその他のセキュリティ脅威などのサイバーセキュリティ関連のイベントに対して脆弱になるリスクを高めます。
私たちの業界に関連するリスク
製品候補品の開発、臨床試験、規制当局の承認、および承認された製品の商品化に関連するリスク
私たちや私たちの協力者が開発する製品候補は、開発に失敗したり、そのような製品候補が商業的に存続できなくなるまで延期されたりする可能性があります。
製品候補の商業的流通について規制当局の承認を得る前に、自社費用で広範な非臨床試験と臨床試験を実施して、製品候補のヒトにおける安全性および/または有効性を実証する必要があります。非臨床試験と臨床試験は費用がかかり、設計と実施が難しく、完了するまでに何年もかかることがあり、結果が不確実であり、製品候補の不合格率は歴史的に高いです。現在、第3相開発の社内プログラムや共同プログラム、初期段階の臨床プログラムなど、複数の臨床開発プログラムを実施しています。ただし、臨床試験や規制当局の承認を経て、製品候補をさらに発展させることができない場合があります。
当社が臨床試験を開始する場合、ある製品候補の非臨床試験または初期段階または後期臨床試験の結果が、その製品候補または他の製品候補のその後の被験者またはその後のヒト臨床試験で得られる結果を予測できない場合があります。たとえば、私たちはブトリシランのHELIOS-B第3相臨床試験を実施しています。これは、心筋症を伴うATTRアミロイドーシス患者の心臓疾患症状を治療するためのヴトリシランの可能性を調査しています。vutrisiranは多発神経障害を伴うhATTRアミロイドーシスの患者で肯定的な結果を示していますが、HELIOS-Bの結果が陽性になるかどうか、またはHELIOS-Bの結果が心筋症のATTRアミロイドーシス患者の治療に対するヴトリシランの承認を支持するかどうかは定かではありません。臨床研究中の薬の失敗率は高いです。製薬とバイオテクノロジーの多くの企業
以前の研究で有望な結果を達成した後でも、業界は臨床開発において大きな挫折に見舞われてきました。ヴトリシランに関するものを含め、私たちの臨床開発におけるそのような挫折は、当社の事業、見通し、経営成績、財政状態に重大な悪影響を及ぼす可能性があります。さらに、当社の承認済み製品と現在の製品候補は、インクリシランを除いて、まだヒトの臨床試験で広く評価されておらず、安全で効果的であることが証明されていない新しいデリバリー技術を採用しています。
さらに、計画中および進行中の臨床試験のいくつかは、「非盲検」試験デザインを採用しています。「非盲検」臨床試験とは、患者が治験薬候補を投与されているのか、それとも既存の承認薬またはプラセボを投与されているのかを患者と治験責任医師の両方が知る臨床試験です。最も一般的な、非盲検臨床試験では、治験薬候補のみを試験し、場合によっては異なる用量レベルで試験することもあります。オープンラベル臨床試験にはさまざまな制限があり、治療効果が誇張されることがあります。オープンラベル臨床試験の患者は治療を受けているときに気づいているからです。したがって、オープンラベル臨床試験は、実験的治療を受けたことを認識しただけで症状が改善したと患者が感じる「患者バイアス」の影響を受ける可能性があります。さらに、オープンラベル臨床試験は「研究者バイアス」の影響を受ける可能性があります。臨床試験の生理学的結果を評価およびレビューする人は、どの患者が治療を受けたかを知っており、この知識があれば治療を受けたグループの情報をより好意的に解釈する可能性があります。非盲検試験の結果は、プラセボまたはアクティブコントロールを用いて盲検対照群の盲検対照環境で試験した場合、当社の製品候補のいずれかに関する将来の臨床試験の結果を予測できない可能性があります。
さらに、私たち、FDA、その他の該当する規制当局、機関審査委員会、IRB、または同様の外国の審査委員会または委員会は、健康なボランティア被験者またはそのような試験に参加している患者が容認できない健康上のリスクにさらされていると私たちまたは彼らが信じる場合など、さまざまな理由で、製品候補の臨床試験の開始をいつでも延期または中止することができます。とりわけ、製品候補または関連製品が健康なボランティアの被験者または臨床試験の患者に及ぼす有害な副作用により、私たち、またはFDAまたは外国の規制当局の決定により、臨床試験の中断または中止が決定されたり、規制当局の場合は、特定の製品候補の使用適応の一部またはすべての適応症に対する承認が拒否されたりする可能性があります。
新製品候補の臨床試験には、製品候補が治療しようとしている疾患に苦しんでいて、他の適格基準を満たす患者を含め、十分な数の患者を登録する必要があります。患者の登録率は、患者集団の規模、患者の年齢と状態、疾患の病期と重症度、同じ疾患または状態に対する他の治験薬の臨床試験の有無、プロトコルの性質、患者の臨床施設への近さ、関連疾患に対する効果的な治療法の利用可能性、臨床試験の適格基準など、多くの要因の影響を受けます。私たちや私たちの共同研究者は、既存の承認された治療法や開発中の他の治験薬が利用できるため、臨床試験への登録が難しい場合があります。たとえば、2018年11月に、採用上の課題のため、非定型溶血性尿毒症症候群におけるセムディシランの第2相試験を中止し、セムディシランの臨床開発努力を別の適応症に集中させることを発表しました。患者登録が遅れたり困難になったり、既存の承認された治療法やその他の治験薬が利用可能になったり、パンデミックやその他の公衆衛生上の緊急事態の影響を含む安全上の懸念があったりして、治験参加者の定着が困難になったりすると、費用の増加、開発期間の延長、または臨床試験の終了につながる可能性があります。
私たちのRNAi治療薬は、これまでの臨床試験で概ね耐容性が良好ですが、新しい安全性知見が出てくるかもしれません。重篤な有害事象、SAE、および/または有害事象(AE)が発生すると、当社、当社の協力者、FDA、または外国の規制当局による製品候補の臨床試験の中断または中止につながり、影響を受ける製品候補の臨床および/または規制スケジュールに悪影響を及ぼす可能性があります。たとえば、2016年10月にレブシランプログラムを中止し、2017年9月に、第2相OLE試験でフィツシランを投与されていた患者に発生した致命的な血栓性SAEのさらなるレビューを待つ間、進行中のすべてのフィツシラン研究への投与を一時的に停止したことを発表しました。さらに最近では、2020年10月、サノフィは、ATLAS第3相プログラムに参加している患者の致死的でない血栓性イベントの報告を評価するために、進行中のすべてのフィツシラン臨床試験の投与を自主的に一時停止しました。入手可能なデータを評価し、規制当局と連携した結果、進行中の臨床研究で修正されたプロトコールに基づいて患者がフィツシランの使用を再開し、2021年10月、サノフィは、進行中の第3相試験で改訂された投与計画が導入されたため、フィツシランの申請予定日を2024年に延期したと発表しました。さらに、SAEおよび/またはAEが発生すると、FDAまたは外国の規制当局が、特定の製品候補の使用適応症の一部または全部を承認することを拒否したり、承認された製品のラベルが制限されたりする可能性もあります。
さらに、SAEおよび/またはAEが発生すると、FDAまたは外国の規制当局が、特定の製品候補の使用適応症の一部または全部を承認することを拒否したり、承認された製品のラベルが制限されたりする可能性もあります。
臨床試験には、IRBの審査、監督、承認が必要です。また、米国以外では、臨床研究を継続的に見直し、被験者の権利と福祉を保護する独立した倫理委員会が必要です。IRBまたは倫理委員会の承認を得られないか、取得が遅れると、臨床試験の開始と完了が妨げられたり、遅れたりする可能性があります。FDAまたは外国の規制当局は、場合によっては、IRBまたは倫理委員会の初期および継続的な審査と承認の対象とならない臨床試験から得られたデータや情報を、マーケティング申請の裏付けとして検討しないことを決定する場合があります。
臨床試験中に問題が発生して、当社、IRB、倫理委員会、または規制当局がこれらの臨床試験を延期、中断、または中止したり、これらの臨床試験のデータ分析を遅らせたり混乱させたりする可能性のある製品候補です。製品候補にこのような問題が発生した場合、影響を受ける製品候補または他の製品候補の開発を継続するために必要な財源がない可能性があります。また、影響を受ける製品候補または他の製品候補のコラボレーション契約が失われるか、締結できなくなる可能性があります。
当社の臨床試験の1つまたは複数の失敗は、試験のどの段階でも発生する可能性があります。私たちは、非臨床試験や臨床試験プロセスの最中、またはその結果として、臨床開発期間を延長し、規制当局の承認や製品候補の商品化を遅らせたり妨げたりする可能性のある予期しない出来事が数多く発生することがあります。これには以下が含まれます。
•当社の非臨床試験または臨床試験では、陰性または決定的でない結果が得られる可能性があり、当社は、追加の非臨床試験または臨床試験を実施することを決定したり、規制当局から要求されたり、有望な可能性のあるプロジェクトを中止したりする場合があります。
•IND申請または同等の外国出願の提出が遅れたり、将来治験実施施設で臨床試験を開始するために規制当局やIRB/倫理委員会から必要な承認を得るのが遅れたりしなかったり、開始後の臨床試験の中断または終了があったり。
•治験の範囲または設計に関して、IRBまたは倫理委員会、またはFDAまたは同等の外国の規制当局から課せられた条件。
•治験審査員または倫理委員会に臨床試験の監督を依頼する際の問題、または治験のIRBまたは倫理委員会の承認を得たり維持したりする際の問題
•COVID-19パンデミック、将来のパンデミックまたは公衆衛生上の緊急事態、ウクライナで進行中の紛争などにより、患者やボランティアの臨床試験への登録が遅れ、臨床試験に参加できる患者とボランティアの数と種類にばらつきがある。
•人為的災害、自然災害、パンデミック、伝染病、公衆衛生上の緊急事態、その他の事業の中断による混乱。
•臨床試験に参加している患者やボランティアのドロップアウト率が高い。
•当社と同様の製品候補に関する当社の臨床試験または他の臨床試験の結果が否定的または決定的でない。
•当社の臨床試験の実施に必要な製品候補材料やその他の材料の供給や品質が不十分、またはCOVID-19や将来のパンデミックや公衆衛生上の緊急事態による臨床供給の中断または遅延。
•臨床試験の費用が予想よりも高い。
•当社の承認された製品を服用している患者、当社の臨床試験の参加者、または当社の製品または製品候補と類似した薬を使用している個人が経験する重篤で予期しない薬物関連の副作用。
•臨床試験中の当社製品候補の有効性が低い、または期待外れでした。
•不利なFDAまたはその他の規制当局による臨床試験施設または臨床または非臨床研究の記録の検査とレビュー。
•第三者の請負業者または調査員が、GCPやcGMPを含む規制要件を遵守しなかったり、契約上の義務を適時に履行しなかったり、まったく履行しなかったり。
•政府または規制による遅延や、規制要件、方針、ガイドラインの変更(臨床検査全般、特に当社の技術に関する追加の規制監督の強制を含む)。または
•FDAおよび当社とは異なる同様の外国の規制機関によるデータの解釈。
製品候補の臨床試験を無事に完了したとしても、特定の製品候補が、検査対象疾患に対する安全で効果的な治療法ではない場合があります。
私たちまたは私たちの協力者は、私たちまたは私たちの共同製品候補について米国または外国の規制当局の承認を得ることができず、その結果、私たちまたは私たちの協力者がそのような製品候補を商品化できない場合があります。
当社および当社の共同製品候補は、医薬品の研究、試験、開発、製造、安全性、有効性、承認、記録管理、報告、表示、保管、価格設定、マーケティング、流通などに関する広範な政府規制の対象となります。新薬が市販される前に、厳格な非臨床試験と臨床試験、および広範な規制当局の承認プロセスを米国および多くの外国の法域で正常に完了する必要があります。これらやその他の規制要件を満たすには、費用がかかり、時間がかかり、不確実で、予期しない遅延が発生する可能性があります。私たちや私たちの協力者が開発している製品候補が、私たちや私たちの協力者が販売を開始するために必要な規制当局の承認を得られない可能性があります、あるいは、ヴトリシランの場合は、取得しない可能性があります
規制当局の承認は、現在承認されている適応症よりも幅の広い適応症を対象として販売されます。また、FDAやその他の規制当局が、製品候補の臨床試験で生成されたデータが、規制当局の承認申請の承認を裏付けるのに十分ではないと判断する可能性もあります。たとえば、心筋症のATTRアミロイドーシス患者を対象としたパティシランに関するAPOLLO-B第3相試験の肯定的な結果を報告し、FDAのCRDACから、パティシランの利点が心筋症を伴うATTRアミロイドーシスの治療のリスクを上回るという9対3の投票を受けましたが、2023年10月、FDAはそれに応じてCRLを発行しましたパティシラン向けのSNDaに。これは、SnDaが現在の形では承認できなかったことを示しています。
FDAやその他の規制当局の承認を得るのに必要な時間は予測できませんが、製品候補の種類、複雑さ、新規性にもよりますが、臨床試験の開始後には通常何年もかかります。FDAや海外の対応機関が私たちを規制する際に使用する基準は、常に予測可能または統一された方法で適用されるわけではなく、時間の経過とともに変化する可能性があります。非臨床および臨床活動のデータについて当社が行う分析はすべて、規制当局による確認と解釈の対象となり、規制当局の承認が遅れたり、制限されたり、妨げられたりする可能性があります。私たちや私たちの協力者は、新しい政府規制、たとえば将来の法律や行政措置、または製品開発、臨床試験、FDA規制審査期間中のFDAポリシーの変更などにより、予期せぬ遅延やコストの増加に直面する可能性があります。法改正が制定されるかどうか、FDAや外国の規制、ガイダンス、解釈が変更されるかどうか、あるいはそのような変更によってどのような影響が出るかを予測することは不可能です。
私たちまたは私たちの協力者が開発している製品候補は新しいクラスの医薬品であるため、FDAと外国の対応機関は、これらの薬に関する決定的な方針、慣行、またはガイドラインをまだ確立していません。ポリシー、慣行、またはガイドラインがないと、私たちまたは私たちの協力者が提出する可能性のある規制当局への提出書類のFDAによる審査が妨げられたり、遅れたりする可能性があります。さらに、FDAは、私たちや私たちの協力者が予想していなかったかもしれない要件を定義して、これらの提出に応えることがあります。このような対応は、当社または当社の共同製品候補の開発を大幅に遅らせ、コストを増大させる可能性があります。さらに、心筋症を伴うATTRアミロイドーシスの治療薬であるブトリシランなど、私たちまたは私たちの協力者が承認を求める可能性のある一部の疾患に対して承認された治療法や、私たちまたは私たちの協力者が承認を申請するまでに承認された開発中の治療法が規制当局の承認を受けるためには、規制当局の承認を受けるために、私たちまたは共同研究者がこれらの疾患を治療するために開発する製品候補が次のものであることを臨床試験を通じて実証する必要がある場合があります安全で効果的なだけでなく、既存の承認よりも安全かつ/または効果的です製品。FDA、EMA、および同等の外国の規制機関の業務の中断または遅延は、当社または当社が協力する製品候補の審査、検査、承認のスケジュールに影響を与える可能性があります。COVID-19の公衆衛生上の緊急事態の間、FDAは、ユーザー料金のパフォーマンス目標に沿って医療製品の申請をタイムリーに審査するよう努め、製造施設がFDAの品質基準に準拠していることを確認するために国内外のミッションクリティカルな検査を実施しました。さらに、COVID-19の公衆衛生上の緊急事態の間、FDAが申請に必要な検査を完了できなかったため、多くの企業が完全な回答書の受領を発表しました。2020年12月、FDAはノバルティスのインクリシランに対するNDAに関するCRLを発行しました。これは、施設検査に関連する状況が未解決のため、PDUFAの措置日までにNDAを承認できなかったことを記載しています。2021年7月、ノバルティスは、完全な回答書を記載したインクリシランNDAをFDAに再提出することを発表し、FDAは2021年12月にレクビオ(インクリシランが米国で販売されている商品名)を承認しました。Leqvioの承認が遅れたため、マイルストーンとロイヤリティ収入が遅れました。FDA、EMA、または同等の外国の規制当局による同様の中断または遅延は、当社または当社の協力者の製品候補について規制当局の承認を得ようとする当社または当社の協力者の努力に重大な悪影響を及ぼす可能性があり、当社の事業、見通し、経営成績、または財政状態に重大な悪影響を及ぼす可能性があります。たとえば、FDAは、当社または当社の協力者の製品候補の規制当局による審査に関連して、追加の臨床データやその他のデータまたは情報を要求する場合があります。これには、当社または当社の協力者が追加の臨床データやその他のデータを提出することを要求したり、施設検査が必要な場合を含め、当社または当社の協力者のNDA申請の最終承認を得るために満たさなければならないその他の条件を課したりする完全な回答書を発行することが含まれます。そのようなデータや情報が提出されたり、検査が完了したりしても、FDAは最終的にNDAが承認基準を満たしていないと判断することがあります。
当社の製品候補または共同製品候補に必要な承認の取得が遅れたり失敗したりすると、当社または当社の協力者が将来承認を求める可能性のある製品候補から収益を生み出す能力に重大な悪影響を及ぼす可能性があります。たとえば、心筋症を伴うATTRアミロイドーシスの治療薬としてのPatisiranのSNDaに対応して、FDAが最近CRLを出した結果、パティシランの製品収益を生み出す当社の能力は悪影響を受けます。さらに、製品の販売に関する規制当局の承認は、当社または当社の協力者が製品またはラベルを販売する承認された用途の制限、またはその他の制限の対象となる場合があります。これにより、各製品の市場機会が制限され、当社の事業、見通し、経営成績、財政状態、株価に悪影響を及ぼす可能性があります。さらに、FDAには、NDAの審査の一環として、または承認後に、リスク評価および軽減戦略(REMS)計画を要求する権限があります。これにより、承認された医薬品の流通または使用にさらなる要件または制限が課される場合があります。たとえば、専門的なトレーニングを受けた特定の医師または医療センターへの処方の制限、特定の安全な使用基準を満たす患者への治療の制限、治療を受けた患者の治療開始など、承認された医薬品の流通または使用にさらなる要件または制限が課される場合があります。レジストリに登録します。EUでは、当社または当社の協力者は、リスク管理計画と呼ばれる同様の計画の採用を求められる場合があり、当社の製品は、処方と供給の制限、市販後の安全性または有効性に関する研究の実施、患者および/または処方者教育の提供など、特定のリスク最小化措置の対象となる場合があります。
材料。いずれの場合も、これらの制限や制限により、当社製品の市場規模が制限され、第三者の支払者による償還に影響する可能性があります。
また、臨床試験の実施、製造販売の承認、価格設定、第三者への償還など、多くの外国の規制要件の対象となっています。外国の規制当局の承認プロセスは国によって異なり、上記のFDA承認に関連するすべてのリスクと、外国の法域における現地の規制の満足に起因するリスクが含まれます。FDAの承認は、米国外の規制当局による承認を保証するものではなく、その逆も同様です。
私たちまたは私たちの協力者が規制当局の承認を得たとしても、私たちが販売する製品は継続的な規制監督の対象となります。私たちまたは私たちの協力者が米国および外国の継続的な要件に従わなかった場合、私たちの承認は制限されたり取り消されたりする可能性があり、他の罰則の対象となる可能性があり、そのような場合には私たちのビジネスは深刻な被害を受けることになります。
当社または当社の協力者が開発する可能性のある製品(承認された4つの製品を含む)が最初に規制当局に承認された後は、当社の医薬品が市販された後に報告される副作用の経験や臨床結果のレビューを含む、継続的な規制監督の対象となります。これには、当社が承認した製品、または承認の条件として必要とされる、または当社が同意したその他の製品の安全性と有効性を監視するための市販後のテストまたはサーベイランスの結果が含まれます。ONPATTRO、AMVUTTRA、GIVLAARI、OXLUMOについて当社が受ける規制当局の承認、および当社の製品候補について当社が受ける規制当局の承認も、AMVUTTRAの拡張ラベルを含め、製品の販売に使用できる承認された用途に制限が適用される場合があります。その他の継続的な規制要件には、とりわけ、安全性やその他の市販後の情報とレポートの提出、登録と上場、承認後に実施する臨床試験のcGMP要件やGCP要件を含むグッドプラクティス品質ガイドラインと規制の継続的な遵守が含まれます。さらに、私たちは製品候補の臨床試験を実施しており、今後も実施する予定であり、米国以外の法域で製品候補を販売するための承認を求める予定であるため、それらの法域の規制要件の対象となり、遵守する必要があります。
FDAには、新しい安全性情報に基づいて表示の変更を要求する権限や、製品の使用に関連する重大な安全上のリスクを評価して製品を市場から撤退させるために市販後の研究や臨床試験を要求する権限など、市販後の重要な権限があります。FDAには、承認後にREMSプランを要求する権限もあります。これにより、承認された製品の流通や使用にさらなる要件や制限が課せられる場合があります。私たちの承認された製品は商業的に使用されているため、私たちや他の人が、これまで知られていなかった副作用や、既知の副作用が臨床研究や市販後の早い時期よりも頻繁または重度であることが確認される可能性があります。その場合:
•承認された製品の売上高は、当初の予想よりも低くなる可能性があります。
•当社が承認した製品の規制当局の承認が制限されたり、取り消されたりすることがあります。
•私たちは、医師、薬剤師、病院に製品警告書やフィールドアラートを送ることを決定したり、義務付けたりすることがあります。
•追加の非臨床または臨床研究、表示の変更、REMS計画の採用、または製造プロセス、仕様、および/または施設の変更が必要になる場合があります。および/または
•政府の調査や訴訟(集団訴訟を含む)が私たちに対して提起されることがあります。
上記のいずれかが発生すると、承認された製品の販売が減少または廃止され、経費が増加し、これらの製品の1つまたは複数の商品化を成功させる能力が損なわれる可能性があります。
ケンブリッジ工場、ノートン施設、アジレントや他のCMOの施設など、承認済み製品の製造に使用しているCMOや製造施設、および現在の製品候補の一部も、FDAやその他の規制機関による定期的な審査と検査の対象となります。たとえば、アジレントとケンブリッジに拠点を置く当社の施設は、ONPATTROとGIVLAARIの規制当局承認申請の審査に関連してFDAとEMAによる規制検査の対象となり、その後、他の地域で提出された1つ以上の当社製品の規制当局承認申請に関連して同様の検査の対象となる可能性があります。当社または当社のCMOの製造プロセスまたは施設に新たな、またはこれまで知られていなかった問題が発見された場合、承認が遅れたり、将来的には製品が市場から撤退したりするなど、医薬品またはCMOまたは施設が制限を受ける可能性があります。たとえば、CMO施設でのFDAによる定期検査の結果、検査分類が保留になったため、ヴトリシランに関する規制当局への提出を修正したため、PDUFAの目標日とAMVUTTRAのFDA承認が遅れました。私たちは、パティシラン製剤の商業用バルク医薬品の製造のためのcGMP機能とプロセスを開発し、2020年には臨床用、そして最終的には商業用の原薬のcGMP製造施設の建設を完了しましたが、将来、より広い商業規模で材料を製造する能力や能力がなくなる可能性があります。臨床試験材料を製造する場合もあれば、第三者にこの材料の製造を委託する場合もあります。CMOへの依存には、規制遵守のために該当するCMOに頼るなど、自社で製品を製造した場合は対象とならないリスクが伴います。
私たちまたは私たちの協力者、CMO、またはサービスプロバイダーが、私たちが製品の販売を試みている米国または外国の法域で適用される継続的な規制要件を遵守しない場合、私たちまたは彼らは、とりわけ、以下の措置の対象となる可能性があります。
罰金、警告書、臨床試験の保留、FDAまたは外国の規制当局による保留中の申請または承認された申請への補足の承認の拒否、規制当局の承認の一時停止または撤回、製品のリコールと差し押さえ、製品の輸出入許可の拒否、運営制限、差止命令、民事罰および刑事訴訟。
当社が未承認の製品候補に関して商業活動を行っている、または適用規制に違反する方法で商業的に承認された製品を宣伝していると執行当局が主張または判断した場合、当社は重大な責任を負う可能性があります。
医師は、製品のラベルに記載されておらず、FDAやその他の該当する規制機関によって承認された用途とは異なる用途に、承認された医薬品を処方する裁量権があります。適応外使用は、医療専門分野全体で一般的です。医薬品を承認するFDAやその他の規制機関は、医師の医療行為や治療法の選択を規制していませんが、FDAやその他の規制機関は、適応外使用に関する製造業者のコミュニケーションを規制し、適応外宣伝、ならびに虚偽または誤解を招くようなラベルや販促資料の流布を、その代理人によるものを含め、禁止しています。製造業者とその代理店は、適応外用途の医薬品を宣伝したり、承認された表示と一致しない医薬品の販売促進における情報を提供したりすることはできません。たとえば、現在、米国ではONPATTROやAMVUTTRAを、成人の多発神経障害を伴うhATTRアミロイドーシスの治療以外の適応症に使用することを推奨していません。FDAやその他の規制当局や執行機関は、適応外使用の宣伝や、販売承認が得られていない製品の宣伝を禁止する法律や規制を積極的に施行しています。将来、当社の商用製品のいずれかを不適切に販売または宣伝したことが判明した場合、そのような商品の販売促進活動に関連する差止命令の救済を含む、幅広い民事、行政、刑事上の罰則の対象となる可能性があります。罰金または罰則、およびその他の法的または衡平法上の制裁。不利な判決、認定、申し立て、または執行または規制上の裁量の行使は、当社の事業、見通し、経営成績、および財政状態に害を及ぼす可能性があります。その結果、その他の内部または政府の調査、または法的または規制上の手続き(私的訴訟当事者による訴訟を含む)も続く可能性があります。
製品の販売促進に関する規制にかかわらず、FDAやその他の規制当局は、企業が自社製品について真実で、誤解を招くことなく、宣伝もしない科学的交流を行うことを許可しています。私たちは、すべての適用法および規制ガイダンスに従って、医学教育活動を行い、医療提供者と連絡を取り合うつもりです。とはいえ、FDA、その他の該当する規制当局、競合他社、およびその他の第三者は、当社がそのような規制を遵守していないという立場をとる可能性があり、そのような違反が証明された場合、当社の評判を傷つけたり、財務および管理資源を中核事業からそらしたりする可能性があり、当社の事業、見通し、経営成績、または財政状態に重大な悪影響を及ぼす可能性があります。さらに、脅迫されたり、実際に政府による執行措置や訴訟が行われたりすると、不利な評判が生じる可能性があり、その結果、当社製品の需要が減少し、そうでなければビジネスの他の側面で生産的に使用できる多大なリソースを投入する必要があります。
医学教育の取り組みに加えて、商業的に承認された製品で治療を受けている患者を支援する患者サポートサービスも提供しています。そのようなサービスを通じて医師や患者に違法な誘因が提供され、メディケア、メディケイド、その他の政府プログラムを通じた政府資源の不適切な利用につながっているという申し立てに基づいて、製造業者が患者支援プログラムに関する政府の調査の対象となることが増えています。連邦反キックバック法や連邦虚偽請求法(FCA)などの法律に違反したことが判明した企業は、民事上および行政上の罰則、刑事制裁、政府プログラムへの参加からの除外など、重大な責任を負います。
以下に説明するように、私たちは引き続き、適用法に従ってこれらのプログラムや活動を実施できるように設計されたグローバルなコンプライアンスプログラムに注力しています。
当社または当社の協力者が当社の製品候補を販売するための規制当局の承認を受けたとしても、当社の製品候補が商業的に導入された時点で市場が受け入れられない可能性があり、それが当社の事業、見通し、経営成績、および財政状態に悪影響を及ぼす可能性があります。
私たちが開発している製品候補は、新しい技術や治療アプローチに基づいています。医師、第三者支払者、消費者など、医薬品市場の主要な参加者は、RNAi技術に基づく治療結果の改善を目的とした製品を受け入れない場合があります。その結果、医学界や第三者の支払者に当社の製品を受け入れて使用するよう説得したり、有利な払い戻しを提供したりすることがより困難になる可能性があります。
当社製品の市場での受け入れに大きな影響を与えると私たちが考えるその他の要因には、次のものがあります。
•当社がマーケティング承認を受けた時期、承認の条件、承認が取得された国
•臨床試験で実証された当社の製品候補の安全性と有効性、および代替治療がある場合は代替治療との比較
•製品候補の相対的な利便性、投与計画、管理のしやすさ。
•潜在的に新しい投与経路や、新しいまたは異なる治療アプローチや作用機序を受け入れる患者の意欲。
•私たちの医師教育プログラムの成功。
•政府および第三者の支払者への適切な払い戻しがあるかどうか。
•当社製品の価格設定、特に代替治療との比較、そのような価格に対する市場での認識、および将来実施する可能性のある値上げについて。そして
•私たちが開発した製品候補が治療を目的としている疾患に対する代替の効果的な治療法の入手可能性と、それらの治療法の相対的なリスク、利益、費用。
たとえば、ONPATTROは、医師や患者がすぐに採用できない可能性のある前投薬による静脈内投与方法を利用しており、成人の多発神経障害を伴うhATTRアミロイドーシスの治療では、他の利用可能な選択肢と競合しない可能性があります。イオニスがいくつかの国で販売している皮下投与のイノテルセンや、タファミディスが販売しているタファミディスを含みます。いくつかの国ではファイザーですが、錠剤の形をしています。さらに、fitusiranは血友病を治療するための新しいアプローチですが、医師、患者、およびその介護者には簡単には受け入れられないかもしれません。HELIOS-B第3相臨床試験の肯定的な結果を仮定すると、vutrisiranは、心筋症を伴うATTRアミロイドーシスの治療薬として承認されれば、市場での受け入れにおいて同様の課題に直面する可能性があります。
私たちは複数の製品を扱う企業であり、マーケティング、販売、市場アクセス、流通能力を構築し続け、グローバルなインフラストラクチャをさらに確立するために、引き続き多額の財務および管理リソースを投資する予定です。これらの機能の開発と拡大を続けることができなければ、現在および将来の製品をうまく商品化できない可能性があります。
私たちは2018年8月に最初の製品承認を受け、過去数年にわたってマーケティング、販売、市場アクセス、流通の能力を確立してきました。現在、承認されれば、特定の地域での製品候補の発売と販売を第三者に依頼する予定です。しかし、私たちはONPATTRO、AMVUTTRA、GIVLAARI、OXLUMOを商品化しており、承認されれば、他の製品候補を世界中の主要市場で自社で商品化するつもりです。したがって、私たちはコア製品戦略の一環として、最初は米国、ヨーロッパ、日本で内部マーケティング、販売、市場アクセス、流通機能を開発しました。その後、グローバルに拡大を続けていますが、これには多大な財務および管理リソースが必要であり、今後も必要になります。ONPATTRO、AMVUTTRA、GIVLAARI、OXLUMOなど、当社がマーケティング、販売、市場アクセス、流通機能を自社で行う製品、および開発および商品化の権利を保持している将来の開発に成功する製品については、次のような多くの追加リスクに直面する可能性があります。
•グローバルな販売、マーケティング、管理のインフラと能力を拡大し、維持します。
•世界中の人材の採用、訓練、管理、監督。
•既存のマーケティングまたは営業部隊をさらに発展させたり、活用したりするための費用。特定の製品や特定の地域での収益を考慮すると正当化できない場合があります。そして
•私たちの直接販売とマーケティングの取り組みは成功しないかもしれません。
現在および将来の製品について、独自のグローバルマーケティング、販売、市場アクセス、流通機能を引き続き開発および拡大できなければ、第三者に頼らずに製品の商品化を成功させることはできません。
多発神経障害、AHP、PH1を伴うhATTRアミロイドーシスに罹患している患者集団は少なく、正確な結果は得られていません。これらの疾患に罹患している実際の患者数が予想よりも少ない場合、またはこれらの疾患に対する意識を高めずに診断が改善されない場合、当社の事業、見通し、経営成績、財政状態に悪影響を及ぼす可能性があります。
ONPATTRO、AMVUTTRA、GIVLAARI、OXLUMOまたは当社が商品化を開始した時点での将来の製品の潜在的な市場規模に関する当社の見積もりは、規制当局によって承認された表示の結果を含め、実際の市場規模と大きく異なる可能性があります。これにより、当社の事業計画が大幅に変更され、当社の事業、見通し、経営成績、財政状態に重大な悪影響を及ぼす可能性があります。ほとんどの希少疾患がそうであるように、これらの疾患に対する意識を高め、診断を改善することができなければ、当社の事業、見通し、経営成績、または財政状態に重大な悪影響を及ぼし、収益性を達成することがより困難または不可能になります。
私たちが現在販売している、または将来開発する可能性のある製品はすべて、不利な価格規制、第三者の償還慣行、または医療改革の取り組みの対象となり、それによって当社の事業、見通し、経営成績、財政状態に悪影響を及ぼす可能性があります。
新薬の販売承認、適用範囲、価格設定、償還を規定する規制は国によって大きく異なり、変更されることがあります。国によっては、医薬品の販売価格を確認しないと販売できません
市販されています。多くの国では、価格審査期間は、販売承認または製品ライセンスの承認が得られた後に始まります。一部の海外市場では、最初の承認が得られた後も、処方薬の価格設定は引き続き政府の管理の対象となります。承認された製品をマーケティングして販売したり、いくつかの製品候補が開発の後期段階に入ったりするにつれて、これらの規制を積極的に監視しています。しかし、当社の製品候補の多くは現在開発の初期段階にあり、このような規制やそのような開発プログラムへの変更の影響を数年間評価することはできません。また、特定の国で1つまたは複数の承認済み製品を含む製品の規制当局の承認を得ても、価格規制や価格統制の対象となり、製品の商業的発売が遅れたり、参考価格により、その国や場合によっては他の国での製品の販売から生み出せる収益に悪影響を及ぼしたりします。
私たちは、医療費を抑えたり削減したりするための政府や第三者支払者の取り組みや、医療の利用可能性を広げるための立法上および規制上の提案は、製薬会社やバイオ医薬品企業の事業と財務状況に引き続き影響すると考えています。米国では、医薬品の価格設定は政府と公的機関の両方の監視の対象であり、改革が求められています。米国政府は、コストを管理するための立法上および規制上の変更に引き続き注力しています。具体的には、最近、処方薬に関する米国議会の調査がいくつかあり、とりわけ、医薬品の価格設定の透明性を高め、メディケアに基づく処方薬のコストを削減し、価格設定と製造元の患者プログラムの関係を見直し、医薬品に対する政府プログラムの償還方法を改革することを目的とした連邦および州の法律や規制が提案および制定されました。これらの進展は、直接的または間接的に、ONPATTRA、AMVUTTRA、GIVLAARI、OXLUMO、または将来の製品を、承認されれば有利な価格で販売する能力に影響を与える可能性があります。
たとえば、連邦レベルでは、インフレ削減法(IRA)には、さまざまな程度で当社の事業に影響を与えるいくつかの条項が含まれています。たとえば、メディケアのパートBまたはパートDの薬の費用をインフレ率よりも早く引き上げる場合、IRAはリベートの支払いを要求することがあります。さらに、メディケアパートDの対象となる承認済み製品に対する当社の費用分担責任は、新しく設計されたパートDの給付体系では、IRA以前の給付設計と比較して大幅に大きくなる可能性があります。IRAの価格交渉プログラムでは、シュタルガルト病の治療薬としてヴトリシランがFDAに承認されると、メディケアの価格交渉によるAMVUTTRAの孤児免除が失われます。その結果、2022年10月に、シュタルガルト病の治療薬としてヴトリシランを研究する第3相臨床試験を行わないことを発表しました。IRAに従わない製造業者は、民事罰金や潜在的な物品税など、さまざまな罰則の対象となる可能性があります。IRAが当社の事業や医療業界全般に与える影響は拡大し続けており、当社や業界にさらに悪影響を及ぼす可能性があります。IRAは製薬業界に大きな影響を与えると予想されており、とりわけ、請求できる価格や製品に対して受け取ることができる払い戻し額を下げる可能性があります。
さらに、バイデン政権は処方薬価格の引き下げが優先事項であることを示していますが、処方薬の価格を下げるためにバイデン政権が制定した政策の影響はわかりません。たとえば、メディケアとメディケイドイノベーションセンターは、メディケアとメディケイドに基づく医薬品費用の削減を目的とした新しいモデルを開発しています。これには、FDAの迅速承認経路で承認された医薬品の新しい支払い方法の設計、パートDの自己負担費用が1医薬品あたり月額2ドルに制限されるジェネリック医薬品のリストの作成、細胞および遺伝子治療の結果ベースの契約を管理するための新しいアプローチの確立が含まれます。バイデン政権が処方薬の価格を下げるためにどのような追加措置を講じる可能性があるのか、またそのような措置の影響はわかりません。これらの措置やその他の提案されている措置の多くは、発効するために追加の法律による承認を必要とする場合があり、現在の米国大統領府はこれらの措置を取り消すか変更するかもしれませんが、現在の米国大統領府と議会の両方が、薬価を管理するための新しい措置を引き続き模索することを示しています。
州レベルでは、政府は医薬品の価格を管理するための法律の可決や規制の実施にますます積極的になっています。これらの措置には、価格、払い戻し、割引、製品アクセス、マーケティングの制限、医薬品の価格、費用、マーケティングの開示と透明性の要件の制定、他国からの輸入の許可、一括購入の奨励などがあります。たとえば、2024年1月5日、FDAはフロリダ州保健管理局の医薬品輸入提案を承認しました。これは、フロリダ州がカナダからの特定の処方薬の輸入を促進するための第一歩です。カナダおよび最恵国待遇(最恵国待遇)モデルからの医薬品の輸入は、商業的に承認された製品のいずれかで受け取る価格に重大かつ悪影響を及ぼす可能性があります。さらに、地域の医療当局や個々の病院では、処方薬やその他の医療プログラムにどの医薬品やサプライヤーを含めるかを決定するために、入札手続きを採用することが増えています。これらの措置は、承認されれば、当社の製品に対する最終的な需要を減らしたり、製品の価格に圧力をかけたりする可能性があります。米国やその他の外国で将来、どのような医療改革の取り組みが採用されるかは予測できません。連邦、州、および外国の立法および規制のさらなる進展が見込まれ、米国での継続的な取り組みにより、医薬品の価格設定への圧力が高まると予想されます。このような改革は、当社が開発に成功し、規制当局の承認を得る可能性のある、1つまたは複数の承認済み製品またはその他の製品候補からの予想収益に重大かつ悪影響を及ぼす可能性があり、当社の事業、見通し、経営成績、財政状態、および医薬品候補の開発能力に影響を与える可能性があります。
承認された製品や将来の製品をうまく商品化できるかどうかは、これらの製品および関連する待遇の補償と償還が第三者の支払者からどの程度受けられるかにかかっています。
政府の保健管理当局、民間の健康保険会社、その他の組織など。当社の承認された1つまたは複数の製品、およびマーケティング承認を得ることができるその他の製品は、医学的に必要または費用対効果が高いとは見なされない場合があり、払い戻し額は、そのような製品や将来の製品を競争的に販売したり、製品開発への投資から適切な利益を得たりするには不十分な場合があります。新たに承認された医薬品の補償を受けるのが大幅に遅れる可能性があり、補償範囲は、その薬がFDAまたは外国の規制当局によって承認された目的よりも限定されることがあります。さらに、補償を受ける資格があるからといって、すべての場合において、研究、開発、製造、販売、流通を含む当社の費用をカバーするレート、または特定のプロバイダーの製品購入費用をカバーするレートで医薬品が払い戻されるわけではありません。新薬の中間支払い(該当する場合)でも、当社の費用を賄うのに十分ではなく、恒久的に支払えない場合があります。償還は、すでに市販され、補償され、償還されている低価格の医薬品に基づいて行われる場合や、他のサービスの既存の支払いに組み込まれ、予算上の制約やデータの不完全性を反映している場合があります。医薬品の正味価格は、政府の医療プログラムや個人支払者が必要とする強制的な割引やリベート、および現在、米国よりも低価格で販売されている可能性のある国からの医薬品の輸入を制限している法律の今後の緩和によって引き下げられる可能性があります。特に、EU、英国、日本、中国などの特定の市場の政府は、ポイントオブケアで消費者に低い(またはゼロの)直接費用で医療を提供しています。大規模な単一支払者として、価格を規制したり、その他のコスト管理メカニズムを課したりする大きな権限を持っています。さらに、米国ではマネージドケアへの注目が高まっており、医薬品の価格には引き続き下落圧力がかかると予想されます。補償ポリシー、第三者償還率、医薬品の価格規制はいつでも変更される可能性があります。規制当局の承認を受けた1つ以上の製品で有利な補償範囲と償還状況が得られたとしても、将来的にはあまり不利な補償方針や償還率が実施される可能性があります。
政府や民間の保険プランなど、患者や医療提供者に払い戻しを行う第三者支払者が、製薬会社に定価から事前に決められた割引を提供するよう求め、医薬品に請求される価格や払い戻される金額を減らそうとする傾向がますます高まっています。米国では、40を超える価値に基づく契約(VBA)を締結しており、追加のVBAを商業健康保険会社と交渉しています。これらの契約の目的は、当社の商業的に承認された製品が、当社の臨床試験で実証されたものと同等の結果を現実世界でもたらす能力に基づいて報酬が支払われるようにすることです。また、契約は、承認された製品の実際の使用における性能を金銭的条件と結び付けるように構成されています。これらの契約で支払者と提携することは、当社の製品の価値に対する信頼を高め、患者の補償範囲を迅速に決定できるようにすることも目的としています。当社の製品に対して受け取る支払い、またはそのような製品に対する払い戻しが、当社の多額の開発費やその他の費用を考慮して不十分であったり、払い戻しが拒否されたりすると、投資収益率が悪影響を受ける可能性があります。さらに、私たちは、勝手な価格上昇ではなく、継続的な科学革新を通じて成長する意向であることを公に表明しました。具体的には、都市部の消費者の消費者物価指数(現在約3.5%)で決定されるインフレ率よりも、マーケティングの承認を受けた製品の価格を、重要な価値要因がない限り、インフレ率を上回って引き上げることはないと述べています。私たちの患者アクセス理念は、将来、1つまたは複数の製品の販売から生み出せる収益に悪影響を与える可能性もあります。
保険会社は、医薬品へのアクセスを制限し、患者の自己負担費用を増やすプログラムやポリシーを採用することが増えています。米国では、患者さんが当社の承認製品にアクセスして購入できるようにするために、患者支援プログラムや対象となる患者向けの自己負担クーポンプログラムなど、患者を支援するプログラムを利用する場合があります。自己負担クーポン(自己負担額アキュムレータやマキシマイザープログラムなど)や患者支援プログラム(代替資金プログラムなど)に関する保険会社の方針の変更、および/または新しい法律や規制措置の導入や制定により、これらの自己負担クーポンプログラムや患者支援プログラムが制限されたり、悪影響が及んだりする可能性があります。その結果、影響を受ける製品を使用する患者が少なくなり、その結果、当社の販売、事業、および財政状態に重大な悪影響を及ぼす可能性があります。
私たちは、米国および特定の外国の輸出入規制、制裁、禁輸措置、腐敗防止法、およびマネーロンダリング防止法および規制の対象となっています。これらの法的基準に従わないと、国内および国際市場での競争力が損なわれる可能性があります。違反した場合、刑事責任やその他の重大な結果に直面し、事業に損害を与える可能性があります。
私たちは、米国輸出管理規則、米国税関規制、米国財務省の外国資産管理局が管理するさまざまな経済および貿易制裁規制、および改正された1977年の米国海外腐敗行為防止法、18 U.S.C. § 201、米国旅行法、米国旅行法に含まれる米国国内贈収賄防止法を含む腐敗防止法を含む輸出管理および輸入法および規制愛国者法、2010年英国贈収賄防止法、およびその他の適用される贈収賄防止法およびマネーロンダリング防止法。腐敗防止法は広く解釈されており、企業とその役員、取締役、従業員、代理人、請負業者、およびその他の第三者の代表者が、公共または民間部門の受取人の行為や決定に不適切に影響を及ぼしたり、事業を獲得または維持するためのその他の不適切な利益を確保したりするために、直接的または間接的に承認、約束、提供、提供、勧誘、または支払いやその他の価値のあるものを許可したり、約束したり、提供したり、勧誘したり、受け取ったりすることを禁じています。時々、米国外で臨床試験を実施したり、製品を海外に販売したり、必要な許可、ライセンス、特許登録、その他の規制当局の承認を取得したりするために、第三者を雇うことがあります。私たちは、政府機関または政府系病院、大学、その他の組織の職員や従業員と直接的または間接的に交流しています。腐敗した人やその他の違法行為に対して、私たちは責任を問われる可能性があります
代理人、請負業者、および当社に代わって行動する第三者の代理人の活動。ただし、そのような活動について当社が明示的に許可していなかったり、実際にそのことを知らなかったりする場合でも同様です。上記の法律や規制に違反すると、多額の罰金や罰則、風評被害、その他の悪影響が及ぶ可能性があります。
私たちはこれらの法律とそれらが規制する活動に引き続き注力し、以下に詳述するように、私たちの事業がその要件を遵守して運営できるように設計されたグローバルなコンプライアンスプログラムを維持しています。
米国以外の政府は厳格な価格統制を課す可能性があり、それが当社の収益に悪影響を及ぼす可能性があります。
処方医薬品の価格設定は、米国以外でも政府の管理下にあります。これらの国では、製品の規制当局の承認を受けた後、政府当局との価格交渉にかなりの時間がかかることがあります。一部の国では、償還や価格設定の承認を得るために、製品候補の費用対効果を他の利用可能な治療法と比較する臨床試験を実施する必要がある場合がありますが、これには時間と費用がかかります。製品の払い戻しが利用できない、範囲や金額が限られている場合、または価格設定が不十分な場合は、収益を生み出し、収益を上げる能力が損なわれる可能性があります。
EU加盟国や日本を含む一部の国では、処方薬の価格が政府の管理下にある場合があります。処方薬の価格設定に同様のアプローチを採用している国もあります。そのような国では、政府当局との価格交渉は、製品の規制当局の承認を受けてからかなりの時間がかかることがあります。さらに、政府やその他の利害関係者は、費用抑制措置の一環として、価格や償還水準にかなりの圧力をかける可能性があります。さらに、政治的、経済的、規制上の発展により価格交渉がさらに複雑になる可能性があり、補償や償還が受けられた後も価格交渉が継続する可能性があります。さまざまな国で使用されている参考価格と並行配布、または低価格国と高価格国の間の裁定取引により、さらに価格を下げることができます。そのような価格や払い戻しが私たちや私たちの協力者に受け入れられるかどうかはわかりません。第三者の支払者または当局が割引を公表すると、公表国や他の国の価格や償還水準にさらなる圧力がかかる可能性があります。価格設定が不十分なレベルに設定されている場合、または当社製品の払い戻しが利用できない、または範囲や金額が限られている場合、当社または協力者による販売による収益と、それらの国における承認された製品または将来の製品の潜在的な収益性が悪影響を受けます。また、特許やその他の独占権の有効期限が切れると、より安価なジェネリック製品やバイオシミラー製品との競争が激化するため、価格統制の強化の影響を受ける可能性があります。特定の政府は、コストを削減するために処方された製品をジェネリック版に切り替える方針を採用しています。
私たちまたは私たちの協力者、CMO、またはサービスプロバイダーが医療法や規制、プライバシー、データ保護、情報セキュリティに関連する法的義務を遵守しない場合、私たちまたは彼らは執行措置の対象となる可能性があります。その結果、当社の製品の開発、マーケティング、販売能力に悪影響を及ぼし、当社の評判を傷つける可能性があります。
医療提供者、医師、第三者支払者は、当社が販売承認を得たあらゆる製品の推奨と処方において主要な役割を果たします。第三者の支払者および顧客との既存および将来の取り決めにより、広く適用される詐欺や乱用、その他の医療法規制にさらされる可能性があり、その結果、当社が製品をマーケティング、販売、流通する際の事業上または財務上の取り決めや関係を制限する可能性があります。適用される連邦および州の医療法および規制に基づく制限には次のものがあります。
•米国連邦反キックバック法は、とりわけ、個人または団体が、購入、リース、注文、取り決めを誘発したり、見返りとして、直接的または間接的に、あからさまにまたはひそかに、現金または現物で、故意に報酬(キックバック、賄賂、リベートを含む)を勧誘したり、受け取ったり、提供したり、支払うことを禁じています。メディケアやメディケイドプログラムなど、連邦医療プログラムのもとで全部または一部が支払われる商品、施設、商品、またはサービスの推薦。個人や団体が連邦反キックバック法について実際に知っていることや、違反する意図が具体的になっていなくても、違反を犯したことになります。違反すると、民事および刑事上の罰金、罰則、懲役、政府の医療プログラムからの除外の対象となります。さらに、政府は、連邦反キックバック法の違反に起因する商品やサービスを含む請求が、連邦FCAまたは連邦民事罰の対象となる虚偽または詐欺的な請求であると主張する場合があります。
•FCAを含む米国連邦虚偽請求法は、とりわけ、個人または団体が、虚偽または詐欺的なメディケアやメディケイドなどの政府資金によるプログラムによる支払い請求、虚偽の記録または陳述資料の作成、使用、使用または使用を意図的に行うことを禁止しています。また、連邦政府への虚偽または詐欺的な請求や、連邦政府への支払い義務を回避、軽減、または隠蔽するための虚偽の陳述。製造業者は、政府の支払者に直接請求を提出しなくても、虚偽または詐欺的な請求を「引き起こした」と見なされた場合、FCAの下で責任を負う可能性があります。FCAはまた、「内部告発者」として行動する個人が、FCA違反を主張して連邦政府に代わって訴訟を起こしたり、金銭的回収に参加したりすることを許可しています。罰金は、問題の請求額の3倍に民事罰金を加えたものです。
•連邦民事罰法。メディケアまたはメディケイドの受益者への報酬の提供または移転に対して、特に民事罰金を科します。その人がメディケアまたはメディケイドの受益者に影響を与える可能性があることを知っている、または知っているはずの場合に民事罰金を科します
例外が適用される場合を除き、メディケアまたはメディケイドが償還できるサービスの特定の提供者、開業医、またはサプライヤーの受益者による選択。
•1996年の連邦健康保険の相互運用性と説明責任に関する法律(HIPAA)は、とりわけ、医療給付プログラムを詐欺するスキームを故意かつ故意に実行したり、実行しようとしたりすることを禁止する連邦刑法を制定しました。また、虚偽または詐欺的なふり、表明、約束によって、所有または管理下にある金銭や財産を取得したりすることを禁止する連邦刑法が制定されましたまたは、支払者(公的か私的かに関係なく)に関係なく、あらゆる医療給付プログラムの管理、および医療給付に関連するすべての事項についてプログラム、医療給付、商品、サービスの提供や支払いに関連して、何らかのトリックや仕掛けによって重要な事実を故意に改ざん、隠ぺいすること、または重大な虚偽の陳述を行うこと。連邦反キックバック法と同様に、個人または団体は、法律を実際に知らなくても、または違反する特定の意図がない限り、HIPAA違反の罪で有罪判決を受ける可能性があります。
•HIPAAは、個人を特定できる健康情報のプライバシー、セキュリティ、および送信に関する要件を課す施行規則を含め、経済的および臨床的健康のための医療情報技術法によって改正され、個人を特定できる健康情報の特定のセキュリティ違反について、影響を受ける個人および規制当局への通知を要求しています。
•メディケア、メディケイド、または小児健康保険プログラム(特定の例外を除く)に基づいて支払いが可能な場合、医薬品、デバイス、生物学、および医療用品メーカーに課される連邦の「サンシャイン」要件は、オープンペイメントプログラムに基づいて保健福祉サービスに毎年報告し、医師(医師、歯科医、眼科医、足病医を含むと定義されています)に行われ、支払または配布されたその他の「価値の移転」に関する情報をオープンペイメントプログラムに基づいて保健福祉サービスに毎年報告する必要がありますとカイロプラクター)、医師などの特定の非医師提供者助手、ナースプラクティショナー、教育病院、ならびに医師とその近親者が保有する所有権と投資持分。タイムリーで正確かつ完全な情報を提出しないと、民事罰則が科せられる可能性があります。
•連邦価格報告法。製造業者は複雑な価格設定指標を計算して政府のプログラムに報告する必要があります。そのような報告価格は、承認された製品の払い戻しや割引の計算に使用される場合があります。
•連邦政府機関への製品の価格設定と販売に適用される連邦法および規制要件。
•市場活動や消費者に危害を与える可能性のある活動を広く規制する連邦消費者保護法および不正競争法。
•上記の各連邦法に匹敵する州法および外国法。これには、医療従事者に当社製品の処方を促す目的で現物での贈り物や特典を提供することを禁止するEU法、医療従事者および医療機関への支払いの公開を義務付ける国の透明性に関する法律、およびデータプライバシー法、ならびに商業保険会社およびその他の非連邦支払者に適用される反キックバック法および虚偽請求法、必須の企業規制遵守プログラムの要件が含まれます。とに関連する法律政府の償還プログラム、患者データのプライバシーとセキュリティ。
•一般データ保護規則、またはEU GDPR として知られる規則2016/679や、英国の法律に置き換えられたEU GDPR、英国のGDPR(総称してGDPR)、電子プライバシー指令(2002/58/EC)、およびそれぞれを実施する国内法、英国の公共および電子通信規則2003とプライバシー法を含む欧州のプライバシー法日本、ブラジル、その他の地域の。
•2020年のカリフォルニア州プライバシー権法、または総称してCCPAによって改正された2018年のカリフォルニア州消費者プライバシー法は、カリフォルニア州居住者に個人情報へのアクセス、訂正、ポータビリティ、削除の権利、およびさまざまなオプトアウト権を与えるものです。CCPAはまた、プライバシー通知の維持、合理的なセキュリティ慣行の実施、データ処理者との契約における特定の条件の記載など、規制対象の企業にさまざまな義務を課しています。CCPAはまた、CCPAを実施(規則制定を含む)および実施する権限を与えられた新しい州機関を設立しました。CCPAは、違反に対する民事罰のほか、データ侵害に対する限定的な私的訴訟権を規定しています。
•さらに、CCPAに似た包括的なプライバシー法が他の10以上の州で制定され、他のいくつかの州でも提案されています。さらに、3つの州が「消費者健康データ」を規制する法律を制定しました。これにより、消費者の健康データの特定の収集と共有について個別の同意を得ること、消費者の健康データを販売する許可を得ること、消費者の健康データのプライバシーポリシーを維持することなど、州の包括的なプライバシー法に加えて規制対象事業体に追加の義務が課されます。消費者の健康データを規制するワシントンの法律には、私的な訴訟権が含まれています。CCPAやその他の州のプライバシー法の影響は潜在的に重大であり、規制当局や訴訟への対応やリスクを高めるために、データ収集または処理の慣行とポリシーを変更したり、多額の費用や費用を負担したりする必要がある場合があります。
一部の州法では、製薬会社が製薬業界の自主的なコンプライアンスガイドラインと連邦政府によって公布された関連するコンプライアンスガイダンスを遵守することを義務付けているほか、製造業者に医師やその他の医療提供者への支払いやマーケティング支出や価格情報に関する情報を報告するよう義務付けています。健康情報のプライバシーとセキュリティには、州法と外国法も適用されますが、その多くは大きく異なり、HIPAAによって優先されないことが多いため、コンプライアンスへの取り組みが複雑になっています。
当社の事業が前述の要件のいずれかに違反していることが判明した場合、民事上または刑事上の罰則(個人の投獄を含む)、刑事訴訟、金銭的損害、事業の縮小または再編、または政府契約、医療費の償還、またはメディケアやメディケイドを含むその他の政府プログラムへの参加の除外、または強制措置などの罰則の対象となる場合があります保健社会福祉省監察庁との企業倫理契約サービス、またはOIG。いずれも、当社の事業、見通し、経営成績、または財政状態に重大かつ悪影響を及ぼす可能性があります。過去4年間に米国、EU、その他複数の地域で4つの製品が商業的に発売された後も、規制当局の承認を前提として、他の国でも製品発売の準備をしている間も、引き続きグローバルなコンプライアンスインフラの強化に注力しています。効果的なコンプライアンスプログラムがあれば、これらの法律違反の調査や訴追のリスクを軽減できますが、これらのリスクを完全に排除することはできません。追加情報については、「未承認の製品候補に関して商業活動を行っている、または適用規制に違反する方法で商業的に承認された製品を宣伝していると執行当局が主張または判断した場合、当社は重大な責任を負う可能性があります」というリスク要因を参照してください。違反の疑いまたは疑いを理由に当社に対して訴訟を起こすと、多額の法的費用が発生し、たとえ弁護が成功したとしても、経営陣の注意を事業運営からそらす可能性があります。さらに、適用される法律や規制の遵守を達成し、維持することは、費用、時間、リソースの面でコストがかかる可能性があります。
私たちまたは私たちの協力者、CMO、またはサービスプロバイダーが、適用される連邦、州、または外国の法律や規制に従わない場合、執行措置の対象となり、承認された製品や将来の製品の開発、マーケティング、販売に影響を及ぼし、当社の評判を損ない、市場での製品の受け入れを減らす可能性があります。これらの執行措置には、とりわけ、民事および刑事罰のほか、罰金を伴う刑事訴訟、医療費償還プログラムからの除外、および懲役が含まれます。
さらに、連邦、州、および外国の法律や規制は変更される可能性があり、私たち、私たちの協力者、CMO、および/またはサービスプロバイダーは現在準拠しているかもしれませんが、解釈、一般的な業界標準、または法的構造の変化により、コンプライアンスから外れる可能性があります。
企業から財政的支援を受ける第三者の患者支援プログラムは、政府や規制当局の厳しい監視の対象となっています。OIGは、医薬品メーカーがメディケア患者に自己負担支援を提供する慈善団体に寄付することは合法であることを示唆するガイドラインを定めています。ただし、そのような団体は、とりわけ善意の慈善団体であり、メーカーから完全に独立しており、メーカーによって管理されておらず、一貫した財務基準に従って申請者に援助を提供し、援助を寄付者の製品の使用に結び付けない場合に限ります。しかし、患者支援プログラムへの寄付は否定的な評判を受けており、他のより安価な代替品よりもブランド医薬品の宣伝に使用されたという申し立てに関連して、複数の政府執行措置の対象となっています。具体的には、近年、さまざまな連邦法および州法に基づく患者支援プログラムの合法性に異議を唱える政府の請求により、複数の和解が成立しています。私たちは、経済的に困窮している患者の保険料、自己負担、共同保険の義務を支援する独立した慈善団体に助成を行ってきましたが、今後も助成を続ける可能性があります。そうした場合、そして私たちまたは私たちの寄付受取人が関連する法律、規制、または進化する政府のガイダンスに違反しているとみなされた場合、私たちは損害賠償、罰金、罰則、またはその他の刑事、民事、または行政上の制裁または執行措置の対象となる可能性があります。
私たちは、プライバシー、データ保護、情報セキュリティに関連する政府規制やその他の法的義務の対象となります。また、当社のマーケティング慣行を規制し、不公正または欺瞞的な行為や慣行を禁止する消費者保護法の対象でもあります。そのような義務を実際に履行しなかったか、その疑いがあると、当社の事業に損害を与える可能性があります。
GDPRは、EEAと英国に居住するデータ主体の健康、生体認証、遺伝情報を含む「特別カテゴリデータ」に対する特別な保護を含む、個人データの管理者および処理者に厳しい要件を課しています。さらに、GDPRは、健康データ、遺伝データ、生体認証データの処理に関する法律など、補足的な国内法を制定する幅広い権利をEEA加盟国に提供しています。これにより、そのようなデータの使用と共有の能力がさらに制限されたり、コストが増加したり、ビジネスや財政状態に悪影響が及ぶ可能性があります。
GDPRおよびEEA加盟国および英国の関連する国内データ保護法の要件に従わないと、GDPRからわずかに逸脱する可能性があり、世界の年間総収益の最大4%、または2,000万ユーロ(英国のGDPRでは1750万ユーロ)のいずれか大きい方の罰金が科せられる可能性があり、そのような罰金に加えて、訴訟および/または不利な措置の対象となる可能性があります宣伝は、私たちの評判とビジネスに重大な悪影響を及ぼす可能性があります。GDPRの実施に伴い、データ保護制度の遵守を確保するためにいくつかの対策を講じる必要があります。GDPR(i)は、私たちが個人データをどのように処理し、どのように権利を行使できるかをデータ主体に知らせることを義務付けています。(ii)個人データを処理するための有効な法的根拠があることを確認することを要求しています(これが同意であれば、
同意を得るための要件にはより高い基準があります)、(iii)機密性の高い個人データ(健康データなど)が大規模に処理される場合はデータ保護責任者を任命する必要があります。(iv)EEAと英国全体でデータ侵害の通知要件を義務付けています、(v)処理のリスクが高い場合は、処理活動の記録を維持し、データ保護影響評価を文書化することを要求します。(vi)当社に追加の義務を課しますサービスプロバイダーと契約している、(vii) 適切な技術が必要および個人データを保護するための組織的対策を講じる必要があり、(viii) ポリシー、手順、トレーニング、データ監査を含む適切なプライバシーガバナンスを採用する必要があります。
重要なことに、GDPRは、EEAや英国から、「適切な」プライバシー保護が提供されていないと見なされている米国またはその他の地域への個人データの転送に厳しい規則を課しています。これまで、米国の企業はEU-米国、英国-米国、スイス-米国に頼ることができました。EUと英国から米国への個人データの合法的な移転の基礎となるプライバシーシールドの枠組み。2020年7月、欧州連合司法裁判所(CJEU)は、C-311/18事件(データ保護委員会対Facebookアイルランドおよびマクシミリアン・シュレムス、またはシュレムスII)の訴訟で、EU-米国間の取引を無効にしました。プライバシーシールドは、プライバシーシールドが米国に転送されたEUの個人データを適切に保護しなかったという理由によるものです。CJEUは、同じ決定で、ECが発行した標準契約条項(SCC)が有効であると判断しました。しかし、CJEUは、受取国の法律が移転された個人データを保護するためにEUと「本質的に同等の」保護を提供していることを確認するために、SCCに従って行われた移転はケースバイケースで評価する必要があると判断し、そのような基準が満たされない場合は企業に補足措置を講じるよう求めました。その後、2021年6月に欧州データ保護委員会(EDPB)が発行したガイダンスでは、そのような補足措置がどうあるべきかが説明され、補足措置がない場合に同等の保護が提供されない場合、企業は個人データの転送を回避または中止すべきであると述べています。2021年6月4日、ECはSCCの新バージョンを発表しました。これは、CJEUのSchrems II決定によって特定された問題に対処し、新しいSCCを実施する際に当事者が実施する必要のある移転評価に関する詳細を提供することを目的としています。しかし、SCCやその他のメカニズムがさらなる課題に直面するかどうかについては引き続き懸念があります。同様に、2020年9月、スイスのデータ保護当局はスイスと米国の対立を決定しました。プライバシーシールドフレームワークは、もはやスイスから米国へのデータ転送の有効なメカニズムではなく、スイスから個人データを転送するメカニズムとしてのSCCの有効性について疑問が生じました。SCCは、EUと米国のデータフローに関するプライバシーシールド認証の代替手段を提供しますが、この決定(およびそれに続いて発行された特定の規制ガイダンス)は、EUと米国のデータフロー全般の合法性に疑問を投げかけています。適用されるデータ保護法に従って個人データをEUから米国に転送できない、または移転する能力に負担のかかる制限があると、臨床試験を実施する当社の能力が妨げられ、当社の事業、見通し、経営成績、財政状態に悪影響を及ぼす可能性があります。英国はECの新しいSCCの対象ではありませんが、英国からの転送を可能にする独自の移転メカニズム、国際データ転送協定または国際データ転送補遺を公開しています。2022年3月25日、ECと米国は、無効になったプライバシーシールドに代わる新しい「大西洋横断データプライバシーフレームワーク」に関する政治的合意を発表しました。この枠組みは、CJEUがSchrems IIで提起した懸念に対処するために、新しい拘束力のある保障措置を導入しました。2023年7月10日、ECは、EU-米国というラベルの付いたそのデータプライバシーフレームワークの妥当性決定を採択したと発表しました。データプライバシーフレームワーク。妥当性判断では、米国は新しい枠組みの下でEUから米国企業に転送される個人データに対して適切なレベルの保護を確保していると結論付けました。ECは、その結果、追加のデータ保護対策を講じることなく、個人データがEUからフレームワークに参加している米国企業に安全に流れることができると述べました。EU-米国データプライバシーフレームワークは、ECが他のヨーロッパのデータ保護当局および米国当局とともに定期的な見直しの対象となります。最初の見直しは、妥当性決定が採択されてから1年以内に行われます。EUと米国の間の有効性に異議を唱える訴訟がEU裁判所に提起され、現在も係属中です。データプライバシーフレームワーク。
EEA加盟国は、GDPRを実施するために施行国内法を採用していますが、これはGDPRから部分的に逸脱する可能性があり、EEA加盟国の管轄当局はGDPRの義務の解釈が国によって若干異なる場合があり、EUで統一された法的環境で事業を行うことは期待していません。さらに、英国政府は現在、データ保護およびデジタル情報法案、または英国法案を英国の立法プロセスに導入しています。英国法案の目的は、英国のEU離脱後の英国のデータ保護制度を改革することです。英国法案の最終版が可決されれば、英国とEEAのデータ保護制度の類似点がさらに変わる可能性があります。2024年に予定されている英国総選挙により、英国法案の可決が延期される可能性があります。
私たちは、EEAまたは英国の個人の行動を監視している(つまり、臨床試験を実施している)管轄区域の現地のデータ保護当局の監督下にあります。私たちは、サービスの提供に関して多くの第三者に依存しています。その多くは、私たちに代わってEUおよび/または英国の個人の個人データを処理しています。そのような各プロバイダーと、プロバイダーが当社の指示に従ってのみ個人データを処理することを契約上の義務とする契約上の取り決めを締結するか、締結する予定です。また、プロバイダーが十分な技術的および組織的なセキュリティ対策を講じていることを確認するために細心の注意を払っています。
また、電子マーケティングとクッキーに関するヨーロッパのプライバシー法の改正にもさらされています。EUは、電子プライバシー指令(2002/58/EC)を、規制という形をとる新しい一連の規則に置き換える過程にあります。この規則は、さらなる制定を必要とせずに、各欧州加盟国の法律で直接施行されます。電子プライバシー規則は当初、2018年5月25日に(GDPRと並行して)採択される予定でしたが、まだヨーロッパの立法手続きを経ています。規則草案は、EU理事会の常任代表委員会によって却下されました
2019年11月22日。新しい規制がいつ採用されるか、あるいは採用されるかどうかは明確ではありません。また、カナダなど、他の国の現在および今後制定されるプライバシー法の対象でもあります。
米国および国際的なデータ保護法および規制を遵守するには、契約でより厄介な義務を負う必要があり、データを収集、使用、開示する能力を制限し、場合によっては、特定の法域での事業能力に影響を与えます。これらの法律や規制に従わないと、政府の執行措置(民事、刑事、行政上の罰則を含む可能性があります)、私的訴訟、および/または不利な評判につながり、当社の業績と事業に悪影響を及ぼす可能性があります。さらに、当社または当社の潜在的な協力者が個人情報を取得する臨床試験被験者、従業員、その他の個人、およびこの情報を当社と共有するプロバイダーは、情報を収集、使用、開示する当社の能力を制限する場合があります。当社が個人のプライバシー権を侵害した、データ保護法を遵守しなかった、または契約上の義務に違反したという申し立ては、たとえ責任を負わなくても、弁護に費用と時間がかかり、不利な評判につながり、事業に悪影響を及ぼす可能性があります。
連邦政府からサービス、償還、または資金提供を受ける能力は、連邦政府の支出とサービスの削減によって影響を受ける可能性があり、そのような変化に効果的に適応できないと、当社の事業、見通し、経営成績、財政状態に重大な影響を与える可能性があります。
2011年の予算管理法に基づき、議会が2013年から2021年にかけて少なくとも1.2兆ドルの赤字削減措置を制定しなかったため、ほとんどの連邦政府のプログラムが自動的に削減されました。これらの削減には、2013年から、医療提供者へのメディケア支払いを会計年度あたり合計で最大2%削減することが含まれていました。これらの自動削減の一部が実施された結果、医師、病院、その他の医療提供者へのメディケアの支払いなどが削減されました。2018年の超党派予算法など、法律を改正する法律により、これらの削減は、議会で追加の措置が取られない限り、2030年まで有効です。コロナウイルス援助、救済、経済安全保障法およびその後の法律に従い、新型コロナウイルスのパンデミックのため、これらの削減は2020年5月1日から2021年12月31日まで停止されました。停止後、2022年4月1日から 1% の支払い減額が開始され、2022年6月30日まで続きました。2% の支払い減額は、2022年7月1日に再開されました。2012年の米国納税者救済法は、とりわけ、複数の医療提供者へのメディケアの支払いを減らし、政府が医療提供者への過払いを回収するための時効期間を3年から5年に延長しました。これらの新しい法律により、メディケアやその他の医療費がさらに削減されたり、承認された製品や規制当局の承認を得る可能性のある製品候補の入手価格、または当社の製品や将来の製品が処方または使用される頻度が影響を受ける可能性があります。
支出を削減するために議会が以前に取った措置、政府の資金水準、高水準の政府債務に関する議会での意見の相違、および現在の構造におけるプログラムの持続可能性に関するメディケア管財人の警告は、関連するプログラムへの資金提供の中断または継続的な増加が保証されていないことを示唆しています。連邦政府の助成金や契約に割り当てられた金額は、減額または廃止される場合があります。これらの削減は、関連機関が医薬品の研究開発、製造、マーケティング活動を適時に見直して承認する能力にも影響を及ぼし、承認された製品や当社が開発する可能性のあるその他の製品の開発、マーケティング、販売が遅れる可能性があります。
340B医薬品価格プログラムまたはその他の米国政府の価格設定プログラムに基づく義務を遵守しなかった場合、追加の償還要件、罰則、制裁、罰金の対象となる可能性があり、当社の事業、見通し、経営成績、財政状態に重大な悪影響を及ぼす可能性があります。
私たちは、特定の政府の医療プログラムで当社製品の補償を受けるために、340B医薬品価格プログラム、メディケイド医薬品リベートプログラム、および米国内の他の連邦政府および州政府の価格設定プログラムに参加しています。これらのプログラムでは、通常、これらのプログラムの受益者に当社の製品が配布されるときに、特定の支払者に割引を提供するか、リベートの支払いを行う必要があります。これらのプログラムは、特定の価格報告要件など、他の要件を課す場合もあります。これらの政府価格設定プログラムに基づく当社の義務の変更は頻繁に発生し、プログラムの要件はしばしば曖昧です。これらのプログラムに基づく義務を遵守しなかった結果、ペナルティの対象となることがあります。これには、政府へのタイムリーで正確な情報の提供、適切なリベートの支払い、または適切な割引価格の提供を怠った場合が含まれます。これらのプログラムの順守、およびこれらのプログラムの将来の変更は、費用とリソースを大量に消費し、当社の事業、見通し、経営成績、および財政状態に重大な悪影響を及ぼす可能性があります。
私たちのビジネスには、製造物責任請求のリスクがかなりあります。十分な保険に加入できない場合、当社に対する製造物責任請求は、当社の事業、見通し、経営成績、財政状態に悪影響を及ぼす可能性があります。
私たちの事業は、ヒト治療薬の開発、試験、製造、販売に内在する重大な製造物責任リスクにさらされています。製造物責任の申し立てにより、当社の臨床開発プログラムの完了が遅れたり、完了できなくなったりする可能性があります。このような請求は、製造物賠償責任保険で完全にカバーされていない可能性があります。さらに、製造物責任の申し立てにより、承認された製品、製造プロセスと施設、またはマーケティングプログラムの安全性と有効性についてFDAが調査され、製品のリコールまたはより深刻な執行措置、承認された使用目的の適応症の制限、承認の一時停止または撤回につながる可能性があります。メリットや最終的な結果にかかわらず、賠償請求は、当社製品の需要の減少、評判の低下、関連する訴訟の弁護費用、経営陣の時間とリソースの流用など、実質的な結果につながる可能性があります
試験参加者または患者への金銭的報酬、および当社の株価の下落。現在、承認された製品のマーケティングや販売など、私たちの開発段階に適していると思われる製造物賠償責任保険に加入しています。私たちが加入している、または取得する可能性のある保険は、潜在的な負債に対して十分な補償を提供しない場合があります。さらに、臨床試験と製造物責任保険はますます高価になっています。その結果、当社の事業に重大な悪影響を及ぼす可能性のある製造物責任請求によって生じる損失から当社を保護するために、妥当な費用で十分な保険に加入できない場合があります。
当社の従業員は、規制基準や要件の違反、インサイダー取引違反など、不正行為やその他の不適切な活動を行う可能性があり、その結果、当社の事業、見通し、経営成績、財政状態に重大な損害を与える可能性があります。
私たちは、従業員詐欺やその他の不正行為のリスクにさらされています。従業員による不正行為には、医療詐欺や乱用、米国外の反キックバック法や規制など、政府の規制を意図的に遵守しなかったり、財務情報やデータを正確に報告しなかったり、不正な活動を当社に開示しなかったりすることが含まれます。特に、ヘルスケア業界における販売、マーケティング、および事業上の取り決めは、詐欺、不正行為、キックバック、自己取引、その他の虐待行為を防止することを目的とした広範な法律や規制の対象となります。「私たちまたは私たちの協力者、CMO、またはサービスプロバイダーが医療法や規制、またはプライバシー、データ保護、情報セキュリティに関連する法的義務を遵守しない場合、私たちまたは彼らは執行措置の対象となり、製品の開発、マーケティング、販売能力に悪影響を及ぼし、当社の評判を損なう可能性があります」というリスクファクターで説明されているように、これらの法律や規制は幅広い価格設定や割引を制限または禁止する可能性があります、マーケティングとプロモーション、販売手数料、顧客インセンティブプログラム、その他ビジネスアレンジメント。従業員の不正行為には、臨床研究の過程で得られた情報に基づく不適切な取引など、不適切な使用も含まれる可能性があり、規制上の制裁措置を受けたり、当社の評判に重大な損害を与える可能性があります。私たちはグローバルなコンプライアンスプログラムを維持し、その進化と強化に引き続き注力しています。私たちのプログラムには、リスク評価や監視、従業員や第三者が誠意を持って質問や懸念を提起することを奨励する発言文化の醸成、申し立てや特定された潜在的な懸念事項を検討して是正するための明確なプロセスとシステムなどの取り組みが含まれています。ただし、従業員の不正行為を特定して阻止することが常に可能というわけではなく、このような行為を検出して防止するために講じた予防措置は、未知または管理されていないリスクや損失を管理したり、これらの法律や規制に従わなかったことに起因する政府の調査やその他の行動や訴訟から私たちを保護したりするのに効果的ではない場合があります。当社に対してそのような訴訟が提起され、当社が自社の弁護や権利の主張に成功しなかった場合、それらの措置は、多額の罰金やその他の制裁措置を含め、当社の事業、見通し、経営成績、および財政状態に重大な影響を与える可能性があります。
環境、健康、人間の安全の保護を規制する法律を遵守しないと、当社の事業、見通し、業績、財政状態に悪影響を及ぼす可能性があります。
私たちの研究、開発、製造には、有害物質、化学物質、さまざまな放射性化合物を使用しています。ケンブリッジとノートンの施設では、研究、開発、製造活動に必要なさまざまな可燃性で有毒な化学物質を大量に管理しています。私たちは、これらの危険物の使用、製造、保管、取り扱い、廃棄を管理する連邦、州、地方の法律や規制の対象となります。ケンブリッジとノートンの施設でこれらの資料を保管、取り扱い、廃棄する手順は、ケンブリッジ市、ノートンの町、マサチューセッツ州、および米国労働省の労働安全衛生局の関連ガイドラインに準拠していると考えています。これらの材料の取り扱いと廃棄に関する当社の安全手順は、適用される規制で義務付けられている基準に準拠していると考えていますが、これらの材料による偶発的な汚染や怪我のリスクを排除することはできません。事故が発生した場合、その結果生じた損害に対して当社が責任を負う可能性があり、その額は相当なものになる可能性があります。また、検査手順、血液媒介病原体への暴露、バイオハザード物質の取り扱いなど、環境、健康、職場の安全に関する多くの法律や規制の対象となっています。
私たちは、これらの材料の使用により従業員が怪我をしたために被る可能性のある費用と費用をカバーするために労働者災害補償保険に加入していますが、この保険は潜在的な責任に対して十分な補償を提供しない場合があります。私たちは、生物的、危険な、または放射性物質の保管または廃棄に関連して当社に対して請求される可能性のある環境責任または有毒不法行為請求に対する保険に加入していません。今後、当社の事業に影響する連邦、州、地方の法律や規制が新たに採用される可能性があります。これらの法律や規制のいずれかに違反した場合、遵守するには多額の費用がかかり、多額の罰金や罰則が科せられる可能性があります。
特許、ライセンス、企業秘密に関連するリスク
発見した製品に対する特許保護を取得して実施できなければ、製品候補を開発して商品化する私たちの能力が損なわれます。
私たちの成功は、他者が私たちの発明や専有情報を違法に使用することを防ぐために、米国およびその他の国の特許法およびその他の知的財産法に基づいて開発した独自の構成、方法、技術を保護する能力に一部依存しています。ただし、提案した製品の製造と商品化に必要な一部の特許の所有権を保有していない場合があります。2000年11月29日より前に提出された出願や、その日以降に提出された出願など、特定の米国特許出願は特許が発行されるまで機密扱いになるからです
これは海外では出願されません。第三者が出願中の特許出願の対象となる主題について、私たちがそれらの出願を認識せずに特許出願を提出した可能性があり、当社の特許出願がそれらの出願よりも優先されない場合があります。このような理由やその他の理由により、希望する特許権を確保できず、希望する独占権が失われる可能性があります。さらに、私たちまたは私たちの協力者は、私たちまたは私たちの協力者が承認した1つ以上の製品を販売したり、将来の製品をさらに開発して商品化したり、私たちや私たちの協力者が開発中のパイプラインで製品候補を開発し続けたりするために、第三者特許に基づくライセンスを取得する必要がある場合があります。当社がライセンスを利用できない場合、または合理的な条件で利用できない場合、当社または当社のライセンシーは、影響を受ける製品を販売したり、希望する活動を行ったりできない可能性があります。
私たちの戦略は、発見したものを迅速に特定して特許保護を求める能力にかかっています。さらに、コラボレーションの一環として共同開発した専有技術に関する特許出願を、第三者の協力者に依頼する場合があります。特許保護を取得するプロセスには費用と時間がかかります。私たちまたは現在または将来の協力者が、必要かつ望ましいすべての特許出願を妥当な費用で適時に提出および手続きしなかった場合、当社の事業に悪影響が及ぶ可能性があります。私たちの財産権を保護するための私たちの努力や協力者の努力にもかかわらず、権限のない第三者が私たちが専有と見なす情報を入手して使用できる可能性があります。発行された特許は有効と推定されますが、だからといって、その特許が有効性異議申し立て後も存続したり、法的強制力があることが保証されるわけではありません。当社が取得した、または将来取得する特許は、当社の知的財産を中心に設計しようとする当事者によって、異議を申し立てられたり、無効にされたり、執行不能と判断されたり、回避されたりする可能性があります。さらに、第三者または米国特許商標庁(USPTO)が、当社の特許または特許出願に関する干渉手続きを開始する場合があります。当社の特許または特許出願に対する法的強制力のない、無効または回避の認定に異議申し立てを行うと、費用がかかり、経営陣の多大な時間と注意が必要になり、第三者のライセンサーから当社へのマイルストーンおよび/またはロイヤルティの支払いが削減または廃止され、当社の事業に重大な悪影響を及ぼす可能性があります。
出願中の特許出願でも、特許が発行されない場合があります。私たちを含む製薬会社やバイオテクノロジー企業の特許的立場は一般的に不確実であり、複雑な法的および事実上の考慮事項を伴います。USPTOや外国の対応機関が特許を付与するために使用する基準は、常に予測どおりに、または一律に適用されるわけではなく、変更されることもあります。同様に、米国および海外で、私たちを含むバイオテクノロジーの発明に与えられる最終的な保護の程度は依然として不明であり、特許庁、裁判所、および議員によって決定される保護の範囲によって異なります。さらに、米国議会や国際法域では、特許法のさまざまな側面の修正について定期的に議論されています。たとえば、America Invents Act(AIA)には、米国の特許法に対する多くの変更が含まれていました。制定された変更のいずれかが、多額の損害賠償を求めて特許の侵害者を追及する能力を含め、発見に対する十分な保護を提供しない場合、当社の事業に悪影響を及ぼす可能性があります。2013年3月に施行されたAIAの1つの主要な条項により、米国の特許慣行が先発明制から先出願制に変更されました。競合他社が同じ発明について出願する前に発明を出願しなかった場合、競合他社の出願日より前に当社が発明を保有していたという証拠を提出できなくなり、したがって私たちの発明の特許保護を受けることができなくなります。また、医薬品やバイオテクノロジーの特許で認められた、または許容される請求の主題と範囲に関する統一された世界規模のポリシーもありません。
したがって、私たちの所有権が将来どの程度保護されるか、または私たちや他の人に発行される特許で認められるクレームの幅はわかりません。また、競争力を維持するために、特許で保護されていない企業秘密、ノウハウ、技術にある程度依存しています。特許で保護されていない企業秘密、ノウハウ、その他の技術が競合他社に開示されたり、競合他社が独自に開発したりした場合、当社の事業、見通し、業績、財政状態に重大な悪影響が及ぶ可能性があります。
幅広い特許範囲と利用可能なすべての規制上の独占権を取得および維持し、当社の製品候補と製品を対象とする特許の特許期間の回復または延長を最大化しないと、独占権が失われ、ジェネリック医薬品への参入が発生し、市場シェアや収益が失われる可能性があります。
私たちは第三者所有者からの特許権をライセンスしています。そのような所有者がそのようなライセンスの基礎となる特許を適切または首尾よく取得、維持、または行使しない場合、当社の競争力や事業、見通し、経営成績、財政状態が損なわれる可能性があります。
私たちは、私たちのビジネスに必要または有用な第三者の知的財産に対する権利を与える多くのライセンスの当事者です。特に、Ionis、Arbutus、Dicernaなどからライセンスを取得しています。また、将来的には第三者の知的財産の追加ライセンスを締結する予定です。
私たちの成功は、ライセンスされた知的財産、特に私たちが独占権を確保している特許の特許を取得、維持、実施するライセンサーの能力に一部かかっています。私たちのライセンサーは、私たちがライセンスした特許出願をうまく処理できないかもしれません。これらの特許出願に関して特許が発行されたとしても、当社のライセンサーがこれらの特許を維持できなかったり、これらの特許を侵害している他の企業に対して訴訟を起こさないことを決定したり、当社ほど積極的に訴訟を起こさない場合があります。私たちがライセンスする知的財産を保護しないと、他社が実質的に同一の製品を販売する可能性があり、それが当社の競争力に悪影響を及ぼし、当社の事業、見通し、業績、財政状態に悪影響を及ぼす可能性があります。さらに、私たちはさまざまな第三者のライセンスに基づいて私たちの権利を協力者にサブライセンスしています。これらのサブライセンスされた権利が損なわれると
その結果、コラボレーション契約に基づく収益が減少したり、1人以上の協力者による契約の終了につながったりします。
他の企業や組織が当社の特許権に異議を申し立てたり、製品の開発や商品化を妨げる特許権を主張したりすることがあります。
RNAiは比較的新しい科学分野で、その商業的利用により、この分野で特許保護を求めている組織や個人から、さまざまな特許や特許出願が行われています。私たちはRNAi特許の付与と発行を取得し、これらの特許の多くを独占的に第三者からライセンスしています。当社が所有またはライセンスしている米国および世界中の主要市場での発行済み特許および出願中の特許は、RNAi治療薬の発見、開発、製造、商品化に関連するさまざまな方法、組成、プロセスを主張しています。
具体的には、治療薬としての使用を含むsiRNAの構造と用途の基本的な側面、およびRNAi関連のメカニズムの基本的な側面、治療やその他の用途への適合性を高めるsiRNAの化学修復、特定の病気の治療として特定の標的に向けられたsiRNA、炭水化物コンジュゲートの分野などのデリバリー技術などをカバーする特許、特許出願、その他の知的財産のポートフォリオがあります。カチオン性リポソーム、および当社の特定の開発のあらゆる側面候補者。
RNAi治療薬の分野が成熟するにつれて、特許出願は世界中の各国の特許庁によって完全に処理されています。どの特許が発行されるのか、発行される場合は、いつ、誰に、どのような請求権で発行されるのかは不明です。RNAi分野の特許権に関連して、さまざまな特許庁で重大な訴訟やその他の手続き(干渉、再審および異議申立手続き)、付与前および付与後の審査手続が行われる可能性があります。さらに、第三者が当社の特許の有効性に異議を申し立てる場合があります。たとえば、第三者が欧州特許庁(EPO)に、当社が所有する特許EP 2723758に対して、RNAiの組成とANGPTL3をサイレンシングする方法に関する請求で、認められた請求は無効であると主張して異議を申し立てました。2021年2月の口頭審理の後、特許は取り消されました。EPOの決定に対する控訴通知は2021年6月に提出され、2023年11月の口頭審理の後、控訴は却下され、特許は取り消されたままになりました。2022年3月、第三者が当社が所有する特許EP3105332に対して、RNAiの組成とケトヘキソキナーゼをサイレンシングする方法に関する特許EP3105332に対して、特許の取り消しを求めてEPOに異議を申し立てました。さらに、2023年2月、第三者が、当社が所有する特許EP 3366775に対して、「改変RNA剤」というタイトルで、特許の取り消しを求めてEPOに異議を申し立てました。これらの手続きにおける口頭審問は、時にはEPOによって決定される予定です。さらに、インクリシランに関連する2つの中国特許(ZL201380063930.5とZL201810143112.0)の有効性について、中国の第三者から異議申し立てを受けました。中国国家知識産権管理局は最近、その特許番号を確認する決定を発表しました。ZL201380063930.5は全体として有効で、特許番号は引き続き有効です。ZL201810143112.0は、私たちが提出した請求の修正版に基づいても引き続き有効です。EPOやその他の場所でさらに異議申立が提起され、ポートフォリオ内の他の特許や特許出願に関連して他の課題が提起されると予想しています。多くの場合、当社または異議申立人のどちらかに上訴する可能性があり、特定の法域でこれらの特許に関して上訴できない最終的な判決が下されるまでには数年かかる場合があります。これらの手続きやその他の手続きのタイミングと結果は不確実であり、出願中および出願中の特許請求の特許性と範囲の弁護に失敗した場合、当社の事業、見通し、経営成績、財政状態に悪影響を及ぼす可能性があります。私たちの権利に直接異議を唱えなくても、紛争は知的財産権の弱体化につながる可能性があります。第三者による当社の知的財産権の回避または無効化の試みに対する当社の防御は、当社にとって費用がかかる可能性があり、経営陣に多大な時間と注意を必要とし、当社の事業、見通し、経営成績、財政状態、およびRNAiの分野で成功する競争力に重大な悪影響を及ぼす可能性があります。
当社またはライセンシーが販売する当社のsiRNA製品、zilebesiranやfitusiranなどの後期段階の治療薬候補を開発している後期段階の治療薬候補、およびその他のパイプライン製品に必要なオリゴヌクレオチドの化学および修飾の側面を主張する多くの特許が発行済みおよび出願中です。また、私たちが開発したいsiRNA薬に関連する可能性のある遺伝子または遺伝子の一部を標的としていると主張する特許も多数発行されています。さらに、当社のsiRNA治療薬候補や市販製品、将来の製品をさらに開発および商品化するため、または当社または当社の協力者が開発中の候補をパイプラインで引き続き開発するために、そのような特許が必要である可能性があるという主張当事者の考えに基づいて、裁判所で当社に対して不利に主張される可能性のある特許出願が発行または出願中の場合があります。したがって、1つまたは複数の組織が、ライセンスが必要な特許権を保有していたり、当社に対して主張される可能性のある特許権を保有したりする可能性があります。それらの組織が合理的な条件で、またはまったくそのような特許権のライセンスを当社に付与することを拒否した場合、および/または裁判所が、当社に対して主張されているそのような特許権が必要であると判断した場合、ONPATTRO、AMVUTTRA、GIVLAARI、OXLUMOなどの当社製品を販売したり、そのような特許の対象となる研究開発やその他の活動を行うことができなくなる可能性があります。たとえば、2017年から2018年にかけて、Silence Therapeutics, plc(サイレンス)は、イングランドとウェールズの高等裁判所を含む複数の法域で訴訟を提起し、当社と完全子会社のAlnylam UK Ltd. を共同被告として指名しました。Silenceは、ONPATTROが1つまたは複数のSilenceの特許を侵害したということを含め、さまざまな主張をしていました。また、この知的財産紛争に関連して、当社またはサイレンスが提起した関連訴訟もいくつかありました。2018年12月、私たちはサイレンスと和解およびライセンス契約を締結し、解決しました
特許侵害、特許無効、契約違反などに関して、世界中で進行中のすべての請求、行政手続き、および規制手続き。
知的財産訴訟や権利の決定に関連するその他の手続きに関与した場合、多額の費用と費用が発生し、そのような訴訟や当社に対する訴訟や訴訟の場合、多額の損害賠償責任を負ったり、製品開発や商品化の取り組みの中止を求められたりする可能性があります。
第三者は、特許権を侵害したとして当社を訴える可能性があります。たとえば、2017年10月、私たちまたはMDCOが開発していたONPATTROやその他の治験中のRNAi治療薬が、1つ以上のサイレンスの特許を侵害しているとして、サイレンスは英国で私たちを訴えました。2018年12月、私たちとSilenceは、私たちの間で進行中のすべての訴訟を解決しました。第三者から、私たちがその機密情報や専有情報を不適切に取得または使用したと主張する場合もあります。
さらに、第三者が当社の特許またはライセンス特許の発明者に異議を申し立てる場合があります。たとえば、2011年3月、ユタ大学は、ユタ州の教授が唯一の発明者、または共同発明者であるとして、マックス・プランク、ホワイトヘッド、マサチューセッツ大学、マックス・プランク・イノベーションとともに、マックス・プランク、ホワイトヘッド、マサチューセッツ大学に対して訴状を提出しました。当社のライセンス特許の一部。ユタ州は、Tuschl特許の発明者の是正、不特定の損害賠償、その他の救済を求めていました。数年にわたる裁判手続きと証拠開示の後、裁判所は略式判決を求める私たちの申立てを認め、ユタ州の州法による損害賠償請求を却下しました。この訴訟および以下に説明するDicerna訴訟の係属中に、私たちは多額の費用を負担し、いずれの場合も、訴訟により、そうでなければ他の活動に従事していたであろう経営陣やその他のリソースの注意がそらされました。
当社に発行またはライセンスされた特許を執行したり、他者の所有権の範囲と有効性を判断したり、当社の専有情報や企業秘密を保護したりするために、訴訟に訴える必要があるかもしれません。たとえば、2015年の第2四半期に、メルク・シャープ・アンド・ドーム社、またはメルクから購入したRNAi資産の権利を保護するために、Dicernaに対して企業秘密の不正流用訴訟を起こしました。2018年4月、私たちとDicernaは、私たちの間の訴訟におけるすべての請求を解決しました。2022年3月、私たちは、米国デラウェア州地方裁判所に、米国特許第11,246,933号、または両当事者によるメッセンジャーRNA、またはmRNA、COVID-19ワクチンの製造および販売における'933特許)の侵害に対する損害賠償を求める訴訟をファイザーとモデルナに対して個別に提起したことを発表しました。ファイザーはBioNTech SE、またはBioNTech(バイオエヌテック)に加わり、反訴を提起しました。2022年7月、私たちは米国デラウェア州地方裁判所に、ファイザー/バイオテックとモデルナのそれぞれに対して、米国特許第11,382,979号、または'979号特許の侵害に対する損害賠償を求める追加の訴訟を提起しました。裁判所は、ファイザー/バイオエヌテック、または2022年の訴訟、モデルナのそれぞれの2つの特許を1件の訴訟にまとめ、それぞれの審理日を2024年11月に設定しました。2023年5月26日、米国デラウェア州地方裁判所に、米国特許第11,590,229号の侵害に対する損害賠償を求めて、デラウェア州のファイザーとモデルナ社に対して追加の訴訟を提起しました。この特許に加えて、ファイザーとモデルナの両方に対して最近提起された訴訟では、米国特許番号11,633,479と11,633,480を追加し、ファイザーのみに対しても米国特許第11,612,657号を追加しました。2023年8月9日、米国デラウェア州地方裁判所で、'933と'979の特許で使用されている3つの係争中の用語の意味を検討するマークマン聴聞会が開催されました。2023年8月21日、裁判所は3つの用語のうち2つを解釈する命令を出し、2020年1月4日に開催された証拠審問が行われるまで、3期目の判決を延期しました。2024年7月11日から12日に予定されている追加の審理の結果が出るまで、最終判決は延期されました。その後、私たちとModernaは、2つの特許の非侵害に関する最終判決に共同で合意し、その判決は2023年8月30日に裁判所によって下され、2023年9月7日、Modernaに対する2022年の訴訟において、クレーム構築判決を連邦巡回控訴裁判所に控訴しました。2023年5月26日にModernaに対して提起された訴訟では、クレームコンストラクションの判決はいずれの特許にも影響しませんでした。その訴訟は、2025年の後半に審理予定日を迎える予定で進行中です。2023年9月、私たちとファイザー/バイオエヌテックは、2022年の訴訟と2023年の訴訟を1つの訴訟にまとめることに合意しました。そのためには、裁判日を2024年11月から2025年の前半に延期し、最終的なスケジュールは裁判所が決定することになります。2024年1月4日、ファイザー/バイオエヌテックの統合訴訟の審理が行われ、最終判決が保留中の最終請求期間が決定されました。前述の特許は、mRNA COVID-19ワクチンの成功の基礎となる当社の生分解性カチオン性脂質に関するものです。
訴訟やその他の手段を通じて当社の知的財産権を保護する際、第三者から、当社が権利を不適切に主張したと主張することがあります。たとえば、2017年8月、Dicernaは上記の企業秘密訴訟で、当社の訴訟がプロセスの乱用であり、事業への不法干渉であると主張して、当社に対する反訴を追加することに成功しました。さらに、2017年8月、Dicernaは、シャーマン独占禁止法に基づく当社による独占未遂を理由に、米国マサチューセッツ州地方裁判所に当社に対する訴訟を提起しました。上記のように、2018年4月に、私たちとDicernaは、私たちの間の訴訟におけるすべての請求を解決しました。
さらに、特定のライセンス契約やコラボレーション契約に関連して、知的財産権または契約の主題に関する訴訟に関連して発生した特定の費用について、特定の第三者に補償することに同意しました。そのような知的財産権に関連する訴訟やその他の手続きの費用は、たとえ私たちに有利に解決されたとしても、多額の費用がかかる可能性があり、訴訟は経営陣の努力をそらすことになります。競合他社の中には、はるかに多くのリソースを持っているため、複雑な特許訴訟の費用を私たちよりも効果的に支えられるものもあります。訴訟や法的手続きの開始と継続に起因する不確実性により、研究、開発、商品化の取り組みが遅れ、事業を継続する能力が制限される可能性があります。
当社独自の技術の作成または使用が自社の知的財産権を侵害している、またはその他の方法で侵害していると主張した当事者がいる場合、そのような当事者の特許権を故意に侵害したことが判明した場合、私たちは損害賠償金を支払うことを余儀なくされる可能性があります。私たちが支払わなければならない損害賠償に加えて、裁判所は、侵害行為を停止するか、請求者からライセンスを取得するよう求める差し止め命令を出すことがあります。特許で要求されるライセンスは、商業的に合理的な条件で提供されないことも、まったく提供されないこともあります。さらに、そのようなライセンスは多くの場合非独占的であるため、競合他社は私たちにライセンスされているのと同じ技術にアクセスできる可能性があります。必要なライセンスを取得できず、特許を中心に設計できない場合、当社の技術や製品の一部を効果的に売り込むことができず、収益創出や収益性の達成が制限され、事業を維持するのに十分な収益を生み出すことができなくなる可能性があります。さらに、多くのコラボレーションにより、当社の知的財産のライセンスに対して支払われるロイヤルティが、関連分野で競合または優れた知的財産の地位を持つ第三者に協力者が支払う金額で相殺される場合があり、その結果、コラボレーションを通じて開発された製品からの収益が大幅に減少する可能性があると予想しています。
ライセンスまたは関連契約に基づく義務を遵守しなかった場合、損害賠償を求められ、当社のRNAi技術、承認された製品や製品候補の開発、商品化、保護に必要なライセンスまたはその他の権利を失う可能性があります。
現在のライセンスは、開発、商品化、資金調達、マイルストーン、ロイヤリティ、ディリジェンス、サブライセンス、保険、特許の出願と執行、およびその他の義務を私たちに課すものであり、今後締結する可能性のあるライセンスもあります。当社がこれらの義務のいずれかに違反した場合、または当社にライセンスされた知的財産を不正に使用した場合、損害賠償を求められる場合があり、ライセンサーはライセンスを終了するか、ライセンスを非独占的にする権利を有する場合があります。その結果、ライセンス技術の対象となる製品の開発、製造、販売、販売ができなくなったり、競合他社がライセンス技術にアクセスしたりできなくなる可能性があります。さらに、多額の費用や事業の中断を招き、ライセンサーが申し立てたそのようなライセンス違反から身を守るために経営陣の注意をそらす可能性があります。たとえば、2018年6月、Ionisは、2018年1月にサノフィとのコラボレーション契約および関連する独占TTRライセンスおよびAT3ライセンス条件の再構築の結果として、修正および改訂された2回目の戦略的コラボレーションおよびライセンス契約に基づく支払い義務があるという通知を送りました。Ionisは、サノフィのリストラに関連して付与された権利と支払われた金額に基づいて、テクノロジーアクセス料金(TAF)を支払う義務があると主張しました。Ionisは後に、とりわけ契約違反を理由に、米国仲裁協会のボストン事務所に当社に対する仲裁請求を提出しました。2020年第2四半期、2020年10月に仲裁プロセスが完了すると、当社に追加情報を求めた仲裁委員会から部分的な裁定が下されました。仲裁委員会は2020年12月に最終裁定を下しました。この判決は、当社がサノフィのリストラで受領したと判断した特定の権利に関するIonisのTAFの申請に有利な判決を下しました(ただし、Ionisが求めるTAFの金額は却下されました)。また、同じリストラで当社が受け取ったマイルストーン支払いに関するTAFの要求を却下したことについては当社に有利な判決を下しました。パネルの最終裁定では、判決前の利息と弁護士費用のIonisの要求も却下されました。パネルの最終賞に従い、2021年1月にIonisに4,120万ドルを支払いました。
さらに、私たちのライセンサーは、私たちにライセンスされていない知的財産を所有または管理している可能性があり、その結果、そのメリットに関係なく、私たちがライセンサーの権利を侵害している、またはその他の方法で侵害しているというクレームの対象となる可能性があります。さらに、現在のところ、承認された各製品または将来の製品の販売に対して支払う必要のあるロイヤリティ債務の金額を決定することはできませんが、もしあれば、その金額は多額になる可能性があります。当社の将来のロイヤルティ義務額は、そのような製品に使用する技術と知的財産によって異なります。したがって、製品の開発と商品化に成功したとしても、収益性を達成または維持できない可能性があります。
従業員などとの秘密保持契約では、企業秘密やその他の専有情報の開示を十分に防止できない場合があります。
独自の技術とプロセスを保護するために、協力者、従業員、コンサルタント、科学顧問、CMO、外部の科学協力者や委託研究者、その他の顧問との機密保持契約に一部依存しています。これらの契約は、機密情報の開示を効果的に防ぐことはできず、機密情報の不正開示が発生した場合の適切な救済策を提供しない場合があります。さらに、他の第三者が独自に企業秘密や専有情報を発見する可能性があり、その場合、私たちはそのような第三者に対して企業秘密の権利を主張することはできません。当社の所有権の行使と範囲を決定するには、費用と時間のかかる訴訟が必要になる可能性があり、企業秘密保護を取得または維持しないと、当社の事業、見通し、経営成績、財政状態に悪影響を及ぼす可能性があります。
競争に関するリスク
医薬品市場は競争が激しいです。私たちまたは私たちの協力者が既存の薬、新しい治療法、新しい技術と効果的に競争できない場合、私たちまたは私たちの協力者は、私たちまたは私たちの協力者が開発した薬をうまく商品化できない可能性があります。
医薬品市場は競争が激しく、急速に変化しています。多くの大手製薬会社やバイオテクノロジー企業、学術機関、政府機関、その他の公的および民間の研究機関が、私たちがターゲットにしている、またはターゲットにすると予想されているのと同じ疾患に対する新薬の開発を進めています。競合他社の多くは、
•私たちよりも大幅に多くの財務、技術、人的資源。
•前臨床試験、臨床試験の実施、規制当局の承認の取得、医薬品の製造、マーケティング、販売におけるより広範な経験。
•以前にテストされた、または受け入れられた技術に基づいた製品候補。
•承認された、または開発の後期段階にある複数の製品。そして
•ターゲット市場における大手企業や研究機関との共同契約。
私たちは、医薬品を開発する可能性のある疾患の治療薬として、医学界ですでに承認され受け入れられている薬との激しい競争に直面します。さらに、現在開発中で、将来市販される可能性のある薬もたくさんあります。薬の開発を試みる可能性のある病気の治療薬です。これらの薬は、私たちが開発し商品化するどの製品よりも、より効果的で、安全で、より安価で、より便利で、より便利で、より効果的に投与され、より効果的に市販され販売されるかもしれません。
たとえば、HELIOS-Bフェーズ3の臨床および規制当局の承認で肯定的な結果が得られたと仮定すると、心筋症を伴うATTRアミロイドーシスの治療薬として開発中の当社のRNAi治療薬であるヴトリシランは、現在この病気の治療薬として承認されているファイザーが販売しているVYNDAQEL/VYNDAMAX(タファミディス)と競合することになります。さらに、BridgeBioは、2023年7月に心筋症を伴うATTRアミロイドーシスを対象としたTTR安定剤であるアコラミディスの第3相臨床試験の肯定的な結果を発表し、2024年2月にFDAが2024年11月29日のPDUFA措置日でNDA申請を受け入れたことを発表しました。BridgeBioはまた、欧州医薬品庁が販売承認申請を受け入れ、2025年に決定が下される予定であり、今後さらにグローバルな規制当局への提出が予定されていることを発表しました。心筋症を伴うATTRアミロイドーシスの治療薬として、開発の初期段階にある製品候補もあります。たとえば、インテリア・セラピューティクス社とリジェネロンが開発中で、第3相臨床開発段階にあるNTLA-2001、ノボ・ノルディスクが開発中で、第2相臨床開発段階にあるNNC-6019、Neurimmune AGとアストラゼンが開発中のNI006などです。eca plcと現在臨床開発フェーズ3に入っています。心筋症を伴うATTRアミロイドーシスの患者を治療するために市場に参入するこれらの新薬や、潜在的に他の新薬との競争に直面することが予想されます。
ONPATTROとAMVUTTRAは、特定の法域で多発神経障害を伴うhATTRアミロイドーシス患者の治療薬として承認されています。IonisがAstraZeneca plcと共同で開発したWAINUA(eplontersen)、Vyndaqel/Vyndamax(タファミディス)、Ionisが開発・販売しているTEGSEDI(inotersen)など、この病気の治療に使用される他の承認済み製品も知っています。また、多発神経障害のhATTRアミロイドーシス患者の治療薬として、臨床開発のさまざまな段階にある製品候補もあります。ONPATTROとAMVUTTRAは、多発性神経障害を伴うhATTRアミロイドーシスの患者の治療において、競争力のある製品プロファイルを持っており、今後も維持すると考えていますが、ONPATTROやAMVUTTRAは、これらの製品や候補製品などと有利に競争できず、その結果、商業的成功を収められない可能性があります。
私たちまたは私たちの協力者が製品候補の開発に成功し続け、承認を得ると、私たちと協力者は次のようなさまざまな要因に基づく競争に直面することになります。
•代替療法と比較した当社または当社の協力企業の製品の安全性と有効性(もしあれば)
•当社または当社の協力会社の製品の投与のしやすさ、および患者が比較的新しい投与経路を受け入れる度合い
•これらの製品の規制当局による承認の時期と範囲。
•製造、マーケティング、販売機能の可用性とコスト。
•承認された代替療法と比較した当社または提携企業の製品の価格。
•償還補償、そして
•特許ポジション。
私たちは、PH1の治療薬として米国とEUで承認された当社のRNAi治療薬であるOXLUMOと競合する、臨床開発のさまざまな段階にある製品候補を知っています(Novoを含む)
ノルディスクの製品RIVFLOZA(ネドシラン)は、2023年9月にPH1の治療薬として承認され、2024年に発売される予定です。RIVFLOZAは、Dicernaが開発した月に1回の皮下RNAi療法です。2020年4月、私たちとDicernaは、lumasiranとDicernaのネドシランに関連するそれぞれの知的財産の非独占的なクロスライセンスを互いに付与しました。さらに、ブリッジバイオ、チヌーク・セラピューティクス社、バイオマリン・ファーマシューティカル社など、いくつかの企業がPH1の治療のための治験薬を臨床開発中です。
競合他社は、上記の要因のいずれかまたはその他の要因に基づいて、当社または協力者が開発する製品よりも大幅に有利な製品を開発または商品化する可能性があります。さらに、競合他社は、大規模な製薬会社やバイオテクノロジー企業とコラボレーションを展開したり、資金提供を受けたりして、私たちや私たちの協力者よりも優位に立つ可能性があります。したがって、競合他社は、私たちや協力者よりも自社製品の商品化に成功する可能性があり、それが当社の競争力や事業、見通し、経営成績、財政状態に悪影響を及ぼす可能性があります。競合製品により、製品候補の開発と商品化の費用を回収する前に、当社または当社の協力者が開発した製品が時代遅れになったり、競争力がなくなったりする可能性があります。このような競合他社は当社の従業員を採用する可能性もあり、それが当社の専門知識レベルや事業計画の実行能力に悪影響を及ぼす可能性があります。さらに、私たちと私たちの協力者は、高度な医療機器の使用など、薬の必要性を減らしたり排除したりする既存および新しい治療法との競争にも直面しています。私たちや私たちの協力者が対象としている病気のための新しい医療機器やその他の治療法の開発は、私たちや私たちの協力者の製品候補を競争力を失ったり、時代遅れになったり、不経済になったりする可能性があります。
私たちと私たちの協力者は、私たちと同様の技術を使用して新薬や技術プラットフォームの開発に取り組んでいる他の企業や、新しい技術を利用している企業との競争に直面しています。これらの企業が私たちや私たちの協力者よりも早く医薬品を開発したり、デリバリー技術を含む彼らの技術の方が効果的だったりすると、私たちや私たちの協力者が製品の商品化を成功させる能力に悪影響が及ぶ可能性があります。
一般的に競合薬との競争に直面していることに加えて、私たちと私たちの協力者は、自社とより直接的に競合する技術を使用して新薬の開発に取り組んでいる他の企業との競争にも直面しています。RNAi治療薬の開発に取り組んでいる他の会社がいくつかあることを私たちは知っています。これらの企業の中には、私たちと同じように、化学合成されたsiRNAを医薬品として開発しようとしているところもあります。また、細胞内でsiRNAのような分子を生成するように設計された合成の外因的に導入された遺伝子で患者を治療することを目的として、遺伝子治療アプローチを採用している人もいます。化学合成siRNAに取り組んでいる企業には、アローヘッドとその共同研究者である武田薬品株式会社、ヤンセンファーマシューティクス株式会社、グラクソ・スミスクライン社、アムジェン株式会社、クォークファーマシューティカルズ株式会社、ロシュ、サイレンス・セラピューティクス社とその協力者であるアストラゼネカ社、江蘇ハンソー製薬が含まれますが、これらに限定されません株式会社マリンクロット社、マリンクロット社、アービュートス、サイレンティス、ノボノルディスクとその協力者であるベーリンガーインゲルハイムとイーライリリーアンドカンパニー。さらに、Ionis、Benitec Biopharma Ltd.、Arrowhead、Arrowhead、Arbutus、Quark、Sylentis、およびその他の企業に、これらの企業が限られた数の標的に対するRNAi治療薬を独自に開発できるライセンスまたはライセンスオプションを付与しました。これらの企業のどれでも、私たちよりも迅速かつ効果的にRNAi技術を開発する可能性があります。さらに、私たちが締結した契約の結果、武田薬品は非独占的なライセンスを取得し、アローヘッドはノバルティスの譲受人として、当社の技術の特定の側面へのアクセスを含む30の遺伝子ターゲットの特定の独占ライセンスを取得しました。
私たちと私たちの協力者は、アンチセンスベースの薬の開発に取り組んでいる企業とも競合しています。RNAi治療薬と同様に、アンチセンス薬はmRNAを標的として特定の遺伝子の活性を抑制します。Ionisの完全子会社であるAkcea Therapeutics, Inc. は、ステージ1または2のポリニウロパチーの成人hATTrアミロイドーシス患者を治療するためのアンチセンス薬、イノテルセンの販売承認を受けました。Ionisが開発したいくつかのアンチセンス薬が承認され、現在市販されています。Ionisは臨床試験で複数のアンチセンス製品候補を用意しています。Ionisは、当社からライセンスを受けたリガンド共役GalNAc技術を使用したアンチセンス薬も開発しています。これらの薬は、そのような認可を受けたGalNAc技術を使用しないアンチセンス薬と比較して、臨床および前臨床試験で低用量で効力が増加することが示されています。アンチセンス薬とアンチセンス技術の開発は、mRNAを標的として特定の遺伝子をサイレンシングする薬の好ましい技術になるかもしれません。
RNAiや特定の製品に関する競争に加えて、関連する細胞や組織にsiRNAを送達するための安全で効果的な手段を発見し開発するために、私たちは激しい競争に直面しています。競合他社が関連する細胞や組織にsiRNAを送達するための安全で効果的な手段を開発した場合、競合製品の商品化を成功させる私たちの能力に悪影響を及ぼします。さらに、民間企業や学術研究所を含め、第三者は、関連する細胞や組織にsiRNAを送達する安全で効果的な手段を発見し開発するために多大なリソースを費やしています。競合他社の中には、私たちよりもはるかに多くのリソースを持っているものもあります。競合他社が第三者が開発したデリバリーソリューションへの独占アクセスを交渉した場合、私たちは製品候補をうまく商品化できない可能性があります。
当社の普通株式に関するリスク
当社の株価はこれまでも、そして将来も変動する可能性があり、普通株式への投資は価値が下落する可能性があります。
私たちの株価はこれまで変動しており、将来も変動する可能性があります。株式市場全般、特にバイオテクノロジー企業の市場では、特定の企業の業績とは無関係なことが多く、価格や出来高が極端に変動しています。将来の当社の普通株式の市場価格は、次のような多くの要因によって大きく悪影響を受ける可能性があります。
•四半期決算発表に含まれる情報。これには、当社または当社の協力者の商品化された製品または製品候補に関する最新情報、当社の純製品およびコラボレーションの収益、完了した期間の営業費用、および将来の期間に関する財務ガイダンスに関する最新情報が含まれます。
•既存または新規の競合製品または技術の成功。
•当社または当社の協力者の製品または製品候補に関する規制措置。
•当社または競合他社による、重要な買収、コラボレーション、合弁事業、コラボレーション、または資本コミットメントの発表。
•当社または当社の協力会社の他の製品候補の臨床試験のタイミングと結果。
•当社の開発プログラムのためのコラボレーションの開始または終了
•当社または当社の協力者の開発プログラムのいずれかの失敗または中止。
•競合他社の製品候補の臨床試験の結果。
•米国およびその他の国における規制または法的動向。
•特許出願、発行された特許、またはその他の所有権に関する開発または紛争。
•主要人員の採用または離職。
•当社の製品候補または臨床開発プログラムに関連する費用の水準。
•追加の製品候補または製品を開発するための当社または当社の協力者の努力の結果。
•決算または開発スケジュールの実際のまたは予想される変化。
•さらなる資金調達努力の発表または期待。
•当社、インサイダー、その他の株主による当社の普通株式の売却。
•当社の財務結果の変動、または当社と類似していると認識されている企業の業績の変動。
•当社を担当する証券アナリストによる見積もりまたは推奨の変更。
•医療費支払いシステムの構造の変化。
•製薬およびバイオテクノロジーセクターの市況。
•一般的な経済、産業、市場の状況。そして
•この「リスク要因」セクションに記載されているその他の要因。
これまで、証券の市場価格の下落を受けて、企業に対して証券集団訴訟が提起されることがよくありました。このリスクは、近年株価が大幅に変動しているバイオ医薬品企業にとって特に重要です。たとえば、2019年9月に、私たち、現在および以前の取締役および役員、および2017年11月の株式公開の引受者の一部が、連邦証券法違反を理由に集団訴訟で訴えられたとされています。この件はようやく解決しましたが、将来、この種の訴訟がさらに発生する可能性があります。当社に対する証券訴訟は、多額の費用が発生し、経営陣の注意と資源がそらされ、当社の事業、見通し、業績、財政状態に深刻な損害を与える可能性があります。私たちは賠償責任保険に加入しています。ただし、訴訟に関連する費用や経費が保険の適用範囲を超えると、これらの費用や費用の一部または全部を直接負担せざるを得なくなり、多額の費用がかかる可能性があります。さらに、特定の訴訟に関連して、当社の役員、証券提供の取締役、引受人を含む第三者に補償する義務があり、それらの義務は保険でカバーされない場合があります。
当社、当社の役員、取締役、または重要な株主を含め、当社の普通株式のかなりの数の株式を公開市場に売却すると、当社の普通株式の価格が下落する可能性があります。
少数の株主が当社の普通株式のかなりの額を受益的に所有しています。2024年3月31日現在、当社の8大株主は、発行済みの普通株式の50%以上を受益所有しています。もし私たち、私たちが
役員、取締役、または当社の重要な株主が公開市場で当社の普通株式を大量に売却する場合、またはそのような売却が行われる可能性があるとの認識がある場合、当社の普通株式の市場価格に悪影響が及ぶ可能性があります。当社の重要株主による普通株式の売却により、将来、当社が適切と考える時期と価格で株式または株式関連証券を売却して資金を調達することがより困難になる可能性があります。
当社の準拠文書およびデラウェア州法に基づく買収禁止条項により、株主にとって有益な当社の買収がより困難になり、株主が現在の経営陣や取締役会のメンバーを交代または解任しようとする試みが妨げられる可能性があります。
当社の設立証明書および付則の規定により、当社の買収、または現在の経営陣または取締役会のメンバーの変更が遅れたり、妨げられたりする場合があります。とりわけ、これらの規定:
•取締役会の全メンバーが一度に選出されないように、機密扱いの取締役会を設置してください。
•書面による同意を得て、株主による行為の禁止を定めます。
•株主の承認なしに優先株を発行することを取締役会に許可します。これにより、潜在的な敵対的買収者の株式所有権を希薄化し、取締役会の承認を受けていない買収を効果的に防ぐことができる「毒薬」を仕掛けることができます。
•取締役会の決議によってのみ、承認された取締役の人数を変更することを許可します。
•特別株主総会を招集できる人を制限します。
•当社の憲章または細則の特定の条項を改正または廃止するには、すべての株主が訴訟を起こす権利がある議決権の少なくとも75%の議決権者の承認を要求します。
•株主が取締役会から取締役を解任できる方法を制限します。そして
•取締役会への選任および株主総会で審議できる事項を提案するための事前通知要件を定めます。
さらに、当社はデラウェア州に設立されているため、デラウェア州一般会社法の第203条の規定が適用されます。この規定では、所定の方法で合併または合併が承認されない限り、発行済み議決権株式の15%を超える株式を取得した取引日から3年間、当社との合併または合併を禁止しています。これらの規定は、合併または買収の提案が一部の株主にとって有益であると見なされる場合でも適用されます。
当社および当社の共同研究者の臨床開発活動および競合他社の臨床開発活動の結果は、引き続き定期的に発表され、その結果、当社の普通株式の価格が大幅に変動する可能性があると予想しています。
当社および当社の協力者の製品、製品候補、競合製品、または潜在的に競争力のある製品候補に関する新しい情報は、当社の将来の見通しに関する投資家の認識に大きな影響を与える可能性があります。私たち、私たちの協力者、および競合他社は、通常はプレスリリース、電話会議、医学会議でのプレゼンテーションを通じて、医薬品開発プログラムに関する最新情報を定期的に提供しています。これらの定期的な更新には、多くの場合、当社または競合他社が実施した臨床試験の中間または最終結果、規制当局への提出や提出、ならびに当社の製品や製品候補、競合製品、または潜在的に競合する製品候補の将来の臨床開発に関する当社または競合他社の期待に関する情報が含まれます。医薬品開発プログラムに関する情報を当社が公開するタイミングは、多くの場合、当社の制御が及ばず、臨床試験のデータを受け取るタイミングや、製薬会社が医学会議で臨床データを開示するという一般的な傾向の影響を受けます。さらに、当社の臨床試験または競合他社の臨床試験について開示される情報は、最終データではなく暫定データに基づいている場合があり、解釈が困難で、いずれにせよ最終結果を正確に予測できない場合があります。このような情報が公開されると、当社の普通株式の価格が変動する可能性があります。たとえば、2021年後半、BridgeBioが心筋症を伴うATTRアミドーシスの治療のためのアクラミディスの第3相臨床試験のパートAの結果を公開した後、当社の株価はマイナスの影響を受けました。
当社の転換社債に関連するリスク
私たちの事業から得た負債を支払うのに十分なキャッシュフローがないかもしれません。
2024年3月31日現在、未払いの債券の元本総額は10億2000万ドルです。債券の金利は年率1.00%に固定されており、2023年3月15日から毎年5月15日と9月15日に半年ごとに延滞して支払われます。元本の定期支払い、手形を含む負債の利息の支払いまたは借り換え、または債券の転換に関連する現金での支払いは、経済的、財政的、競争的、および当社の制御が及ばないその他の要因の影響を受ける将来の業績に左右されます。私たちの事業は、将来、負債を返済し、必要な資本支出を行うのに十分なキャッシュフローを事業から生み出せない可能性があります。そのようなキャッシュフローを生み出すことができない場合は、資産の売却、負債の再編、面倒な条件や希薄化率の高い条件での追加のデットファイナンスや自己資本の取得など、1つ以上の代替案を採用する必要があるかもしれません。私たちの
将来の債務を借り換えることができるかどうかは、その時点での資本市場と私たちの財政状態によって異なります。これらの活動のいずれにも従事できない場合や、望ましい条件でこれらの活動を行うことができない場合があり、その結果、債務不履行に陥る可能性があります。
さらに、私たちの負債は、他の金銭的義務や契約上の約束と相まって、他の重要な結果をもたらす可能性があります。たとえば、次のようになります。
•米国および世界の経済、産業、競争環境における不利な変化や、政府規制の不利な変化に対して、私たちをより脆弱にします。
•私たちのビジネスや業界の変化に対する計画や対応における私たちの柔軟性を制限します。
•負債の少ない競合他社と比較して、私たちを不利な立場に置きます。
•買収資金、運転資金、その他の一般的な企業目的のために追加金額を借りる能力を制限します。そして
•当社の買収の魅力を低下させたり、より困難にしたりします。
これらの要因のいずれかが、当社の事業、見通し、経営成績、財政状態に悪影響を及ぼす可能性があります。さらに、追加の負債が発生すると、当社の事業に関連するリスクと、債務の返済または返済能力が高まります。
当社は、債券の現金転換のための決済に必要な資金を調達したり、根本的な変更があった場合に手形を現金に買い戻したりすることができない場合があります。
債券の保有者は、(債券を管理する契約で定義されているとおり)根本的な変更が発生した場合に、買い戻す債券の元本の100%に、未払利息および未払利息(ある場合)を加えた額に等しい買戻し価格で、当社に手形を買い戻すよう要求する権利があります。債券の転換時に、そのような転換の決済のために普通株式のみを引き渡すことを選択しない限り(端数株式の引き渡しの代わりに現金を支払うことを除く)、転換される債券に関しては現金で支払う必要があります。引き渡された手形や転換中の手形を買い戻す必要がある時点で、十分な現金がないか、融資を受けることができない可能性があります。さらに、債券の買い戻し、または債券の転換時に現金で支払う能力は、法律、規制当局、または将来の債務を管理する契約によって制限される場合があります。当該債券を管理するインデンチャーによって買戻しが義務付けられているときに当社が債券を買い戻さなかった場合、または当該インデンチャーで義務付けられている債券の将来の転換時に支払うべき現金を支払わなかった場合、当該契約に基づく債務不履行となります。債券を管理する契約に基づく債務不履行または根本的な変更自体も、当社の将来の債務を管理する契約に基づく債務不履行につながる可能性があります。関連する債務の返済が、該当する通知または猶予期間の後に繰り上げられる場合、債務を返済して債券を買い戻したり、転換時に現金で支払ったりするのに十分な資金がない可能性があります。
ノートの条件付き換算機能が作動した場合、当社の流動性に悪影響を及ぼす可能性があります。
債券の条件付き換算機能が有効になった場合、債券の保有者は、指定期間中いつでも自分の選択により手形を転換する権利があります。1人以上の保有者が手形を転換することを選択した場合、当社が普通株式のみを引き渡して転換義務を果たすことを選択しない限り(端数株式の引き渡しの代わりに現金を支払うことは除く)、転換義務の一部または全部を現金の支払いで決済する必要があり、流動性に悪影響を及ぼす可能性があります。さらに、保有者が手形を転換することを選択しなかった場合でも、適用される会計規則により、債券の未払い元本の全部または一部を長期負債ではなく流動負債として再分類するよう求められる可能性があり、その結果、当社の純運転資本が大幅に減少します。
債券に関連する取引は、当社の普通株式の価値に影響を与える可能性があります。
債券の一部または全部を転換すると、既存の株主の所有権が希薄化されます。これは、当該債券の転換時に当社の普通株式を引き渡すことにより、転換義務を果たす範囲です。紙幣は、特定の状況下では、保有者の選択により将来転換可能になる可能性があります。債券の保有者が手形を転換することを選択した場合、私たちはかなりの数の普通株式を彼らに引き渡すことで転換義務を決済する可能性があります。これにより、既存の株主が希薄化することになります。
さらに、債券の発行に関連して、特定の金融機関またはオプション取引相手とキャップコールを締結しました。Capped Callsは通常、債券の転換または決済時に当社の普通株式が希薄化する可能性を減らしたり、転換された債券の元本を超えて支払う必要のある現金支払いを相殺したりすることが期待されます。そのような減額および/または相殺には上限が適用されます。
Capped Callsの最初のヘッジを確立することに関連して、オプション取引相手またはそれぞれの関連会社は、債券の価格設定と同時に、またはその直後に、当社の普通株式および/または購入した普通株式に関してさまざまなデリバティブ取引を締結しました。
オプション取引相手またはその関連会社は、債券の満期前に流通市場取引で当社の普通株式に関するさまざまなデリバティブ取引を開始または解約したり、当社の普通株式やその他の有価証券を流通市場取引で購入または売却したりして、ヘッジポジションを変更することがあります(そうする可能性が高い)
ノートの転換後、ファンダメンタルチェンジによる債券の買い戻し日、償還日、または当社が債券を廃止するその他の日(いずれの場合も、キャップコールの関連部分を終了するオプションを行使した場合)。この活動により、当社の普通株式の市場価格の下落および/またはボラティリティが高まる可能性があります。
上記の取引が債券または当社の普通株式の価格に及ぼす可能性のある影響の方向や大きさについて、いかなる表明や予測も行いません。さらに、オプション取引相手がこれらの取引を行うことや、いったん開始された取引が予告なしに中止されないことについて、いかなる表明も行いません。
Capped Callsに関しては、カウンターパーティリスクにさらされています。
オプション取引相手は金融機関であり、その一部またはすべてがCapped Callsの下でデフォルトするリスクにさらされます。オプション取引相手の信用リスクに対する当社のエクスポージャーは、いかなる担保によっても担保されません。過去の世界的な経済状況により、多くの金融機関が実際に破綻したり、財政難に陥ったりしています。オプション取引相手が破産手続の対象となった場合、当社はその手続において無担保債権者となり、当該オプション取引先とのキャップドコールに基づくその時点での当社のエクスポージャーと同等の請求額を請求することになります。私たちのエクスポージャーは多くの要因に左右されますが、一般的に、エクスポージャーの増加は、市場価格の上昇と普通株式のボラティリティの上昇と相関しています。さらに、オプション取引相手による債務不履行により、当社は税制上の不利な影響を受け、普通株式に関して現在予想しているよりも希薄化が進む可能性があります。オプション取引相手の財務の安定性や存続可能性については保証できません。
手形など、現金で決済できる転換社債証券の会計方法は、報告された財務結果に大きな影響を与える可能性があります。
当社の要約連結貸借対照表に手形を反映させ、債券の支払利息を計上し、当社の普通株式の原株を報告された希薄化後の1株当たり利益に反映するための会計方法は、報告された収益と財政状態に悪影響を及ぼす可能性があります。
2020年8月、財務会計基準審議会はASU 2020-06と呼ばれる会計基準の更新を発表しました。これにより、転換社債に適用される特定の会計基準が簡略化されました。ASU 2020-06は、2022年1月1日から有効になりました。
ASU 2020-06に従い、債券は当社の要約連結貸借対照表に負債として反映されます。初期帳簿価額は、発行費用を差し引いた債券の元本と等しくなります。発行費用は、会計上の目的で負債割引として扱われ、債券の期間中の支払利息として償却されます。この償却の結果、会計目的で手形に計上されると予想される支払利息は、手形に支払う現金利息よりも多くなり、その結果、報告純利益が減少したり、報告純損失が増加したりする場合があります。
さらに、債券の基礎となる普通株式は、ASU 2020-06に従い、「転換された場合」方式で希薄化後の1株当たり利益に反映されます。この方法では、希薄化後の1株当たり利益は通常、すべての債券が報告期間の初めに普通株式のみに転換されたと仮定して計算されます。ただし、結果が希薄化防止効果になる場合を除きます。転換後の1株当たり利益を適用すると、報告されている希薄化後の1株当たり利益が、将来的に利益を上げることができる範囲で減少する可能性があります。また、会計基準が将来変更され、希薄化後の1株当たり利益に悪影響を及ぼす可能性があります。
さらに、債券の転換可能性に関する条件のいずれかが満たされている場合、適用される会計基準に基づき、債券の負債帳簿価額を長期負債ではなく流動負債として再分類するよう求められる場合があります。この再分類は、実際に手形を転換する保有者がいない場合でも必要になる可能性があり、報告された運転資本を大幅に削減する可能性があります。
アイテム 5.その他の情報
10b5-1の採用 取引計画 当社の役員や取締役によって
2024年3月31日に終了した会計四半期中に、一部の役員(証券取引法に基づく規則16a-1(f)で定義されているとおり)および取締役が、重要な非公開情報に基づく証券取引の責任に対する積極的な防御を目的として、取引法の規則10b5-1(c)に規定されている条件を満たすことを目的として、当社の有価証券の購入または売却に関する契約、指示、または書面による計画を締結しました。私たちはこれらの契約、指示、および書面による計画を「ルール10b5-1取引計画」と呼び、それぞれを「ルール10b5-1取引計画」と呼んでいます。これらのルール10b5-1取引プランの重要な条件を以下に説明します。
イボンヌ・L・グリーンストリート、経営学修士、経営学修士、 最高経営責任者兼取締役
オン 2024年3月12日、イボンヌ・L・グリーンストリート、MBChB、MBA、当社の最高経営責任者、 ルール10b5-1の取引計画に入りました つまり、グリーンストリート博士はブローカーを通じて行動し、合計で売却する可能性があるということです 37,241 私たちの株式
株式分割、株式合併、株式配当、その他の当社の普通株式への同様の変更による調整を条件として、株式インセンティブ報酬としてグリーンストリート博士に付与された報奨の決済時に受領される普通株式。このプランに基づく株式の売却は、2024年6月19日から2025年3月7日までの間に当社の普通株式の市場価格が指定価格を上回った場合にのみ可能です。本プランは2025年3月7日に終了する予定です。ただし、プランの対象となる全株式の売却、Greenstreet博士またはブローカーによる解約時、または本プランのその他の規定により、早期に終了することを条件とします。
エイミー・W・シュルマン、 ディレクター
オン 2024年2月28日、エイミー・W・シュルマン、私たちの取締役会の議長、 ルール10b5-1の取引計画に入りました つまり、シュルマンさんはブローカーを通じて、合計で売却する可能性があるということです 30,200% 取締役報酬としてシュルマン氏に付与されたオプションの行使時に受領した当社の普通株式は、株式分割、株式結合、株式配当、およびその他の同様の当社の普通株式の変更による調整を条件とします。このプランに基づく株式の売却は、2024年5月29日から2024年11月15日までの間に当社の普通株式の市場価格が指定価格を上回った場合にのみ可能です。本プランは、2024年11月15日に終了する予定です。ただし、シュルマン氏またはブローカーによる解約時、またはプランに別段の定めがある場合には、プランの対象となる全株式の売却時に、早期に解約されます。
アイテム 6.展示品
| | | | | |
10.1#† | 2019年4月8日付けのマスターコラボレーション契約の2024年3月7日付けで、登録者とリジェネロンファーマシューティカルズ社との間で締結された修正第2号 |
| 31.1# | 1934年の証券取引法(改正版)に基づいて公布された規則13a-14(a)に基づく最高執行役員の証明書 |
| 31.2# | 1934年の証券取引法(改正版)に基づいて公布された規則13a-14(a)に基づく最高財務責任者の認定 |
| 32.1#+ | 1934年の証券取引法(改正版)および米国法典第18章第63章第1350条に基づいて公布された規則13a-14(b)に基づく最高執行役員の証明書 |
| 32.2#+ | 1934年の証券取引法(改正版)および米国法典第18章第63章第1350条に基づいて公布された規則13a-14(b)に基づく最高財務責任者の認定 |
| 101.SCH | インライン XBRL タクソノミー拡張スキーマドキュメント |
| 101.CAL | インライン XBRL タクソノミー拡張計算リンクベースドキュメント |
| 101.LAB | インライン XBRL タクソノミー拡張ラベルリンクベースドキュメント |
| 101.PRE | インライン XBRL タクソノミー拡張プレゼンテーションリンクベースドキュメント |
| 101.DEF | インライン XBRL タクソノミー拡張定義リンクベースドキュメント |
| 104 | カバーページのインタラクティブデータファイル(別紙101*に記載されている該当する分類拡張情報を含むインラインXBRLとしてフォーマットされています) |
| |
|
|
| # | ここに提出しました。 |
| † | この別紙の一部(アスタリスクで表示)は、証券取引委員会の規則に従って省略されています。そのような情報は(i)重要ではなく、(ii)公に開示された場合、登録者に競争上の損害を与える可能性があるためです。 |
| + | この証明書は、改正された1934年の証券取引法のセクション18または取引法の目的で「提出された」とは見なされず、そのセクションの責任の対象となるわけでもありません。そのような証明書は、1933年の証券法(改正後)または証券取引法に基づく出願に参照によって組み込まれたとはみなされません。ただし、当該申告書に参照により具体的に組み込まれている場合を除きます。 |
署名
1934年の証券取引法の要件に従い、登録者は、正式に承認された署名者が本報告書に代理で署名するよう正式に依頼しました。
| | | | | | | | |
| | アルナイラム・ファーマシューティカルズ株式会社 |
| | |
| 日付:2024年5月2日 | | /s/ イボンヌ・L・グリーンストリート、MBChB、MBA |
| | イボンヌ・L・グリーンストリート、MBChB、MBA
最高経営責任者
(最高執行役員) |
| | |
| 日付:2024年5月2日 | | /s/ ジェフリー・V・ポールトン |
| | ジェフリー・V・ポールトン
執行副社長、最高財務責任者
(最高財務会計責任者) |