ユナイテッド 州
証券 と交換手数料
ワシントン、 ワシントンD.C. 20549さん
フォーム
| 四半期ごと 1934年の証券取引法のセクション13または15 (d) に基づく報告 |
にとって
四半期期間が終了しました
| 移行 1934年の証券取引法のセクション13または15 (d) に基づく報告 |
にとって ____________から___________への移行期間。
手数料
ファイル番号:
(正確です 登録者の名前(憲章に明記されています)
(州 または他の管轄区域 法人化 または組織) |
(IRS 雇用主 身分証明書 いいえ。) | |
| (住所 (主要なエグゼクティブオフィスの) | (郵便番号 コード) |
(登録者の 電話番号、市外局番を含む)
証券 法のセクション12 (b) に従って登録されました:
| タイトル 各クラスの | 取引 シンボル (s) | 名前 登録された各取引所の | ||
| ザ・リクシ・
|
示してください
登録者(1)が、証券取引所のセクション13または15(d)で提出する必要のあるすべての報告を提出したかどうかをチェックマークしてください
過去12か月間(または登録者がそのような報告を提出する必要があったほど短い期間)の1934年の法律と(2)は
過去90日間、このような提出要件の対象となっていました。
示してください
登録者が、規則に従って提出する必要のあるすべてのインタラクティブデータファイルを電子的に提出したかどうかをチェックマークしてください
過去12か月間(または登録者が行った非常に短い期間)の規則S-T(この章の§232.405)の405
そのようなファイルを提出する必要がありました)。
示してください チェックマークで、登録者が大規模アクセラレーテッドファイラー、アクセラレーテッドファイラー、非アクセラレーテッドファイラー、小規模レポーティングのいずれであるかをチェックマークしてください 会社、または新興成長企業。「大型アクセラレーテッドファイラー」、「アクセラレーテッドファイラー」の定義を参照してください。 証券取引法第12b-2条の「小規模な報告会社」と「新興成長会社」(1つチェックしてください):
| 大きいです アクセラレーテッドファイラー | ☐ |
| 加速しました ファイラー | ☐ |
| ☒ | |
| 小さい 報告会社 | |
| 新興国 成長会社 |
もし 新興成長企業。登録者がコンプライアンスのために延長された移行期間を使用しないことを選択した場合は、チェックマークで示してください 証券取引法のセクション13(a)に従って規定された、新規または改訂された財務会計基準と一緒に。☐
示してください
登録者がシェル会社(証券取引法の規則12b-2で定義されている)であるかどうかをチェックマークしてください。はい ☐ いいえ
優れた 株式
として 2024年5月7日の、登録者は 発行済普通株式。
テーブル 目次の
ページ | ||
| パートI — 財務情報 | ||
| アイテム 1。 | 財務諸表 | 3 |
| アイテム 2。 | 経営陣による財政状態と経営成績に関する議論と分析 | 23 |
| アイテム 3。 | 市場リスクに関する量的および質的開示 | 40 |
| アイテム 4。 | 統制と手続き | 40 |
| パートII—その他の情報 | ||
| アイテム 1。 | 法的手続き | 40 |
| アイテム 1A。 | リスク要因 | 40 |
| アイテム 6。 | 展示品 | 42 |
| 2 |
一部 I — 財務情報
アイテム 1.財務諸表
リポシン株式会社と子会社
要約連結貸借対照表
| 3月31日、 | 12月31日 | |||||||
| 2024 | 2023 | |||||||
| 資産 | ||||||||
| 流動資産: | ||||||||
| 現金および現金同等物 | $ | $ | ||||||
| 市場性のある投資証券 | ||||||||
| 未収利息収入 | ||||||||
| プリペイドおよびその他の流動資産 | ||||||||
| 流動資産合計 | ||||||||
| 資産および設備、累積減価償却費を差し引いた金額 | ||||||||
| その他の資産 | ||||||||
| 総資産 | $ | $ | ||||||
| 負債と株主資本 | ||||||||
| 現在の負債: | ||||||||
| 買掛金 | $ | $ | ||||||
| 未払費用 | ||||||||
| 保証責任 | ||||||||
| 流動負債合計 | ||||||||
| 負債総額 | ||||||||
| コミットメントと不測の事態(注7、8、9、10) | - | - | ||||||
| 株主資本: | ||||||||
| 普通株式、額面価格 $ 一株あたり、 承認された株式; 発行されて 優れた | ||||||||
| その他の払込資本 | ||||||||
| 自己株式(原価計算) 株式 | ( | ) | ( | ) | ||||
| その他の包括利益(損失)の累計 | ( | ) | ||||||
| 累積赤字 | ( | ) | ( | ) | ||||
| 株主資本の総額 | ||||||||
| 負債総額と株主資本 | $ | $ | ||||||
見る 要約連結財務諸表の添付メモ
| 3 |
リポシン株式会社と子会社
凝縮しました 連結営業報告書と包括利益(損失)
| 3月31日に終了した3か月間 | ||||||||
| 2024 | 2023 | |||||||
| 収益: | ||||||||
| ライセンス収入 | $ | $ | ||||||
| ロイヤリティ収入 | - | |||||||
| 総収入 | ||||||||
| 営業経費: | ||||||||
| 研究開発 | ||||||||
| 一般と管理 | ||||||||
| 営業費用の合計 | ||||||||
| 営業利益 (損失) | ( | ) | ||||||
| その他の収入 (費用): | ||||||||
| 利息と投資収入 | ||||||||
| 保証責任の未実現利益(損失) | ( | ) | ||||||
| その他の収益合計、純額 | ||||||||
| 所得税費用控除前利益(損失) | ( | ) | ||||||
| 所得税費用 | ( | ) | ( | ) | ||||
| 当期純利益 (損失) | ( | ) | ||||||
| シリーズB優先株配当の発行 | - | ( | ) | |||||
| 普通株主に帰属する純利益(損失) | $ | $ | ( | ) | ||||
| 普通株式に帰属する1株当たりの基本利益(損失) | $ | $ | ( | ) | ||||
| 加重平均発行済普通株式、基本株式 | ||||||||
| 普通株式に帰属する希薄化後の1株当たり利益(損失) | $ | $ | ( | ) | ||||
| 希薄化後の加重平均発行済普通株式 | ||||||||
| 総合損失: | ||||||||
| 当期純利益 (損失) | $ | $ | ( | ) | ||||
| 市場性のある投資有価証券の純未実現利益(損失) | ( | ) | ||||||
| 包括利益 (損失) | $ | $ | ( | ) | ||||
要約連結財務諸表に添付されている注記を参照してください
| 4 |
リポシン株式会社と子会社
要約連結株主資本変動計算書
2024年および2023年3月31日に終了した3か月間
| メザニン・エクイティ | 株主資本 | |||||||||||||||||||||||||||||||||||||||
| シリーズ B 優先株式 | 普通株式 | 自己株式 | [追加] | 累積その他 | 合計 | |||||||||||||||||||||||||||||||||||
| 株式数 | 金額 | 株式数 | 金額 | 株式数 | 金額 | 払込資本金 | 総合利益(損失) | 累積赤字 | 株主資本 | |||||||||||||||||||||||||||||||
| 2022年12月31日現在の残高 | - | $ | - | $ | $ | ( | ) | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||||||||||||||
| 純損失 | - | - | - | - | - | - | - | - | ( | ) | ( | ) | ||||||||||||||||||||||||||||
| - | ||||||||||||||||||||||||||||||||||||||||
| 市場性のある投資有価証券の未実現純利益 | - | - | - | - | - | - | - | - | ||||||||||||||||||||||||||||||||
| - | ||||||||||||||||||||||||||||||||||||||||
| 株式ベースの報酬 | - | - | - | - | - | - | - | - | ||||||||||||||||||||||||||||||||
| - | ||||||||||||||||||||||||||||||||||||||||
| シリーズB優先株配当の発行 | - | - | - | - | - | ( | ) | - | ||||||||||||||||||||||||||||||||
| シリーズB優先株式の償還 | - | - | - | - | - | - | - | - | - | - | ||||||||||||||||||||||||||||||
| オプション行動 | - | - | - | - | - | - | - | - | - | - | ||||||||||||||||||||||||||||||
| - | ||||||||||||||||||||||||||||||||||||||||
| ATMの提供に関連する費用 | - | - | - | - | - | - | ( | ) | - | - | ( | ) | ||||||||||||||||||||||||||||
| 2023年3月31日時点の残高 | $ | $ | $ | ( | ) | $ | $ | $ | ( | ) | $ | |||||||||||||||||||||||||||||
| メザニン・エクイティ | 株主資本 | |||||||||||||||||||||||||||||||||||||||
| シリーズ B 優先株式 | 普通株式 | 自己株式 | [追加] | 累積その他 | 合計 | |||||||||||||||||||||||||||||||||||
| 株式数 | 金額 | 株式数 | 金額 | 株式数 | 金額 | 払込資本金 | 総合利益(損失) | 累積赤字 | 株主資本 | |||||||||||||||||||||||||||||||
| 2023年12月31日現在の残高 | - | $ | - | $ | $ | ( | ) | $ | $ | $ | ( | ) | $ | |||||||||||||||||||||||||||
| 純利益 | - | - | - | - | - | - | - | - | ||||||||||||||||||||||||||||||||
| 市場性のある投資有価証券の未実現純損失 | - | - | - | - | - | - | - | ( | ) | - | ( | ) | ||||||||||||||||||||||||||||
| 株式ベースの報酬 | - | - | - | - | - | - | - | - | ||||||||||||||||||||||||||||||||
| ATMの提供に関連する費用 | - | - | - | - | - | - | ( | ) | - | ( | ) | |||||||||||||||||||||||||||||
| 2024年3月31日現在の残高 | - | $ | - | $ | $ | ( | ) | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||||||||||||||
見る 要約連結財務諸表の添付メモ
| 5 |
リポシン株式会社と子会社
要約連結キャッシュフロー計算書
| 3月31日に終了した3か月間 | ||||||||
| 2024 | 2023 | |||||||
| 営業活動によるキャッシュフロー: | ||||||||
| 当期純利益 (損失) | $ | $ | ( | ) | ||||
| 純利益(損失)を営業活動によって提供された(使用された)現金と調整するための調整: | ||||||||
| 減価償却費 | ||||||||
| 株式ベースの報酬費用 | ||||||||
| 保証責任の公正価値の変動による現金以外の損失(利益) | ( | ) | ||||||
| 市場性のある投資有価証券の割引償却 | ( | ) | ( | ) | ||||
| 営業資産および負債の変動: | ||||||||
| 未収利息収入 | ( | ) | ||||||
| プリペイドおよびその他の流動資産 | ( | ) | ||||||
| 買掛金 | ( | ) | ||||||
| 未払費用 | ( | ) | ||||||
| 営業活動によって提供された(使用された)現金 | ( | ) | ||||||
| 投資活動によるキャッシュフロー: | ||||||||
| 資産および設備の購入 | - | ( | ) | |||||
| 市場性のある投資証券の購入 | ( | ) | ( | ) | ||||
| 市場性のある投資有価証券の満期 | ||||||||
| 投資活動によって提供された(使用された)純現金 | ( | ) | ||||||
| 財務活動によるキャッシュフロー: | ||||||||
| ATMの提供に関連する費用 | ( | ) | ( | ) | ||||
| 資金調達活動に使用された現金 | ( | ) | ( | ) | ||||
| 現金および現金同等物の純増加 | ( | ) | ||||||
| 現金および現金同等物の期首残高 | ||||||||
| 現金および現金同等物の期末残高 | $ | $ | ||||||
| キャッシュフロー情報の補足開示: | ||||||||
| 支払った所得税 | $ | - | ||||||
| 非現金投資および資金調達活動の補足開示: | ||||||||
| 売却可能有価証券の純未実現利益(損失) | $ | ( | ) | $ | ||||
| シリーズB優先株の発行 | $ | - | $ | |||||
見る 要約連結財務諸表の添付メモ
| 6 |
リポシン 株式会社。
メモ 要約連結財務諸表へ
(未監査)
(1) プレゼンテーションの基礎
その ここに含まれる添付の未監査の要約連結財務諸表は、Lipocine Inc.(「Lipocine」)が作成したものです。 または「会社」)は、米国証券取引委員会(「SEC」)の規則と規制に従います。 未監査の要約連結財務諸表は、Lipocineとその子会社の財務諸表で構成されています。 総称して会社と呼びます。経営陣の見解では、提示されている暫定財務データにはすべての調整が含まれています 公正なプレゼンテーションに必要です(通常の繰り返し表示される項目のみで構成されています)。会社間口座と取引はすべて廃止されました。 米国の一般に認められた会計原則(「米国会計基準」)で要求される特定の情報が要約または省略されています SECの規則と規制に従って。2024年3月31日に終了した3か月間の経営成績は必ずしもそうではありません 将来の任意の期間、または2024年12月31日に終了する年度に予想される結果を示しています。
これら 未監査の要約連結財務諸表は、会社の監査済み連結財務諸表と併せて読む必要があります 2023年12月31日に終了した年度の明細書とそのメモ。
ザ・ 未監査の要約連結財務諸表を作成するには、経営陣は関連する見積もりと仮定を行う必要があります これらの要約連結を準備するための資産と負債の報告と偶発資産と負債の開示へ 財務諸表と、米国会計基準に準拠した報告期間中の報告された収益と費用の金額。実際の 結果はこれらの見積もりとは異なる可能性があります。
の 会社は、既存の資本資源とそれに対する利息が相まって、予想される事業を遂行するのに十分であると考えています 少なくとも2025年5月9日までの要件。会社はこの見積もりは、間違っていると判明する可能性のある仮定に基づいており、会社は 現在の予想よりも早く、利用可能な資本リソースを活用できました。会社は十分な流動性があると考えていますが そして、少なくとも2025年5月9日までに予測される事業要件に資金を提供するための資本リソースについては、当社はさらに資金を調達する必要があります ある時点で、株式市場や債券市場を通じて、あるいは事業を支援するためのアウトライセンス活動を通じて、資本が調達されます。もし会社が 追加資本の調達に失敗すると、継続企業として存続できることがリスクになります。さらに、同社の 事業計画は変更される可能性があり、会社は運営上のニーズと製品開発の資本要件を満たすために追加の資金を必要とする場合があります。 規制遵守と臨床試験活動が予定より早まりました。さらに、会社の資本資源が消費される可能性があります LPCN 1154、LPCN 2101、LPCN 2203、LPCN 2401、LPCN 1148、LPCN 1144、またはLPCNに関する追加の臨床研究を進めれば、より迅速に 1107です。逆に、会社が経費を削減し、活動の数を減らせば、会社の資本資源はより長く続く可能性があります 現在その運用計画の下で検討されている、または中止したり、設計を変更したり、進行中の臨床研究を中断したりします。
オン 2024年1月12日、当社はゴードン・シルバー・リミテッド(「GSL」)とライセンス契約(「ライセンス契約」)を締結しました とベリティファーマシューティカルズ株式会社(「ベリティファーマ」)、これに基づいて当社はGSL(ベリティの関連会社)に譲渡しました 製薬)は、会社のTLANDO® 製品を商品化するための、ロイヤリティを伴うサブライセンス可能な独占的な権利とライセンス 内因性テストステロンの欠乏または欠如に関連する状態に対する男性のテストステロン補充療法に関して、 NDA第208088号、クラインフェルター症候群の治療、およびテストステロン補充療法に関連する小児の適応症に示されているように 男性の場合、内因性テストステロン(「フィールド」)の欠乏または欠損に関連する状態、いずれの場合も 米国とカナダ。ライセンス契約は、GSLにTLANDO XRを開発して商品化するためのライセンスも提供します。 テストステロン補充療法の潜在的な1日1回の経口製品候補。同社は開発と商品化を続けています 米国とカナダ以外でのTLANDOとTLANDO XRの権利、および国内でのフィールド外の申請に関する権利 または米国とカナダ以外では。
アポン
ライセンス契約の締結時に、GSLは会社に$のライセンス料を支払うことに同意しました
| 7 |
オン
2023年5月10日、会社の取締役会は承認しました
その 添付の連結財務諸表と連結財務諸表の注記は、その逆に遡及的な効力を示します 提示されたすべての期間の株式分割。株式併合を行っても、普通株式またはその授権株式数は変わりませんでした 額面金額です。
(2) 収入
その 会社は収益の大部分をライセンスとロイヤリティの取り決めから生み出しています。各契約の開始時に、会社は 顧客に約束された商品やサービス、および明確な履行義務を伴うそれぞれの商品やサービスは、 変動対価を含む取引価格は、取引価格を個別の履行義務に配分し、 ある時点で顧客に制御を移すのか、それとも時間の経過とともに移転するのかを決定します。取引には変動対価が含まれています 認識された累積収益額の大幅な逆転が起こらない可能性が高い範囲での価格 変動対価に関連する不確実性は、その後解決されます。会社は変動準備金を再評価します 各報告日に検討し、必要に応じて調整を行います。これにより、いずれかの期間の収益と収益に影響が出る可能性があります そのような変化が知られるようになります。
見る Verity Pharma社(「Verity」)とのライセンス契約(「Verityライセンス契約」)の説明については、注7を参照してください。 関連当事者であるSpriasoとの契約の説明については、注記11を参照してください。
ライセンス 手数料
にとって 個別のライセンス履行義務、前払いのライセンス料は、会社が基礎となる履行義務を果たしたときに認識されます。 これらのライセンスに基づく履行義務(会社独自の技術を使用する権利を含む)は履行されます ライセンシーへの基盤となる技術的権利の引き渡しに対応する時点で、通常は譲渡時です 顧客にライセンスされた技術/製品の。さらに、ライセンスの取り決めには、偶発的なマイルストーンの支払いが含まれる場合があります。 ライセンシーが特定の販売または規制上のマイルストーンを達成した後に期限があり、ライセンシーおよび/または会社が履行します これらのマイルストーンを達成する前のその履行義務。マイルストーンの達成が不確実なため、および/または ライセンシーの販売への依存、偶発的なマイルストーンのためのさまざまな対価は完全に制限されており、認識されていません ライセンシーがマイルストーンを達成するまでの収益として、回収可能性が合理的に確実な範囲で。
ロイヤリティ
ロイヤリティ 収益は、当社製品のライセンス契約に基づいて獲得した売上ベースの最低ロイヤリティで構成されます。販売ベースのロイヤリティ収入 ライセンス契約に基づく対価は変動し、顧客が以下を含む製品を販売する期間に認識されます 会社のライセンス技術/製品。当社は、報告のたびに、稼いだが未払いの売上ベースのロイヤリティ収益を見積もっています ライセンシーから提供された情報を使用する期間。会社のライセンス契約では、最低限のロイヤルティが規定されている場合もあります。 当社は、基礎となる履行義務の履行時に認識しています。これは通常、原資産の引き渡し時に発生します ライセンシーの技術権。販売ベースの最低ロイヤリティは通常、各四半期の終了後45日以内にお支払いください。 彼らはそれを稼いでいます。
収入 集中力
A
主要なパートナーは、以下を含むパートナーとみなされます
| 8 |
ベーシック 1株当たりの利益(損失)は、普通株主が利用できる純利益(損失)を加重平均数で割って計算されます 期間中に発行された普通株式の。希薄化後の1株当たり利益(損失)は、普通株式の加重平均数に基づいています 発行済株式に加えて、該当する場合、希薄化オプションに関連して発行されたはずの追加の潜在普通株式 新株予約権および権利確定していない制限付株式ユニット(当該株式が希薄化される場合に限ります)。
| 3月31日に終了した3か月間 | ||||||||
| 2024 | 2023 | |||||||
| 普通株式に帰属する1株当たりの基本利益(損失): | ||||||||
| 分子 | ||||||||
| 純利益 (損失) | $ | $ | ( | ) | ||||
| 分母 | ||||||||
| 加重平均発行済普通株式 | ||||||||
| 普通株式に帰属する1株当たりの基本利益(損失) | $ | $ | ( | ) | ||||
| 普通株式に帰属する希薄化後の1株当たり利益(損失): | ||||||||
| 分子 | ||||||||
| 純利益 (損失) | $ | $ | ( | ) | ||||
| 希薄化有価証券が純利益(損失)に与える影響: | ||||||||
| 普通新株予約権 | ( | ) | ||||||
| 希薄化後の純利益(損失)を計算するための総純利益(損失) 普通株式1株あたり | $ | $ | ( | ) | ||||
| 分母 | ||||||||
| 加重平均発行済普通株式 | ||||||||
| 希薄化有価証券の加重平均効果: | ||||||||
| ストック・オプション | - | |||||||
| 制限付株式単位 | - | |||||||
| 普通株式1株あたりの希薄化後純損失を計算するための株式総数 | ||||||||
| 普通株式に帰属する希薄化後の1株当たり損失 | $ | $ | ( | ) | ||||
| 9 |
| 3月 31、 | ||||||||
| 2024 | 2023 | |||||||
| ストック・オプション | ||||||||
| 権利が確定していない制限付株式 単位 | - | |||||||
| ワラント | ||||||||
(4) 市場性のある投資証券
その 会社は自社の有価投資証券を売却可能な有価証券として分類しています。これらはすべて負債証券です。これら 有価証券は公正価値で保有され、未実現持株損益は、関連する税効果を差し引いた額を累計額に含めます 実現までの株主資本におけるその他の包括利益(損失)。投資証券取引の利益と損失 特定の識別方法について報告されています。配当収入は配当落ち日に計上され、利息収入は計上されます 発生主義で。償却費用、未実現持株利益総額、未実現持株損失総額、および売却可能な場合の公正価値 2024年3月31日および2023年12月31日現在の主要証券タイプおよび証券クラス別の有価証券は次のとおりです。
| 2024年3月31日 | 償却コスト | 未実現持株利益総額 | 未実現持株損失総額 | 公正価値の合計 | ||||||||||||
| 政府財務省短期証券 | $ | $ | - | $ | ( | ) | $ | |||||||||
| 米国政府機関の証券 | - | ( | ) | |||||||||||||
| $ | $ | - | $ | ( | ) | $ | ||||||||||
| 2023年12月31日 | 償却コスト | 未実現持株利益総額 | 未実現持株損失総額 | 公正価値の合計 | ||||||||||||
| 政府財務省短期証券 | $ | $ | $ | - | $ | |||||||||||
| 米国政府機関の証券 | - | ( | ) | |||||||||||||
| $ | $ | $ | ( | ) | $ | |||||||||||
| 10 |
満期 2024年3月31日現在、売却可能証券として分類されている債務証券は次のとおりです。
| 2024年3月31日 | 償却コスト | 公正価値の合計 | ||||||
| 期限 1 年以内 | $ | $ | ||||||
| $ | $ | |||||||
そこに
でした
(5) 公正価値
その 会社は、観察可能なインプットを最大限に活用し、観察不可能なインプットの使用をある程度最小限に抑える評価手法を利用しています 可能です。会社は、市場参加者が資産または負債の価格設定に使用するであろう仮定に基づいて公正価値を決定します 主要な、または最も有利な市場で。公正価値の測定における市場参加者の仮定を検討する場合、次の点に注意してください 公正価値階層は、観察可能な入力と観察不可能な入力を区別します。これらは次のレベルのいずれかに分類されます。
| ● | レベル 1 インプット:活発な市場における同一の商品の相場価格。 | |
| ● | レベル 2 インプット:活発な市場における類似商品の相場価格、市場における同一または類似商品の相場価格 それはアクティブではなく、すべての重要なインプットと重要な価値ドライバーが観察できるモデル派生評価です 活発な市場。 | |
| ● | レベル 3 インプット:1つ以上の重要なインプットまたは重要なバリュードライバーが観察できない評価手法から導き出されたバリュエーション。 |
すべて 当社の金融商品のうち、活発な市場での相場価格またはその他の観察可能なインプットに基づいて評価されています。にとって 未収利息収入、前払金およびその他の流動資産、買掛金、未払費用、帳簿価はおおよその金額です 価値があるのは、これらの商品の満期が短いからです。次の表は、資産の公正価値階層における位置を示しています と、2024年3月31日および2023年12月31日の時点で定期的に公正価値で測定される負債:
| 報告日における公正価値の測定値を使用して | ||||||||||||||||
| 2024年3月31日 | レベル1の入力 | レベル2の入力 | レベル3の入力 | |||||||||||||
| 資産: | ||||||||||||||||
| 現金同等物-マネーマーケットファンド | $ | $ | $ | - | $ | - | ||||||||||
| 政府財務省短期証券 | - | - | ||||||||||||||
| 私たち。政府機関の証券 | - | - | ||||||||||||||
| $ | $ | $ | - | $ | - | |||||||||||
| 負債: | ||||||||||||||||
| 保証責任 | $ | $ | - | $ | - | $ | ||||||||||
| $ | $ | $ | - | $ | ||||||||||||
| 11 |
| 報告日における公正価値の測定値を使用して | ||||||||||||||||
| 2023年12月31日 | レベル1の入力 | レベル2の入力 | レベル3の入力 | |||||||||||||
| 資産: | ||||||||||||||||
| 現金同等物-マネーマーケットファンド | $ | $ | $ | - | $ | - | ||||||||||
| 政府財務省短期証券 | - | - | ||||||||||||||
| 米国政府機関の証券 | - | - | ||||||||||||||
| $ | $ | $ | $ | - | ||||||||||||
| 負債: | ||||||||||||||||
| 保証責任 | $ | $ | - | $ | - | $ | ||||||||||
| $ | $ | $ | $ | |||||||||||||
その 以下の方法と仮定を使用して、公正価値で記録された各クラスの資産と負債の公正価値を決定しました 貸借対照表に:
現金 同等物:現金同等物は、主に格付けの高いマネーマーケットファンドと当初の満期の財務省短期証券で構成されています 生後3か月以内の会社で、指定された利回り率で額面価格で毎日購入されます。マネーマーケットに関連する現金同等物 資金と国債は、相場市場価格で評価されるため、公正価値階層のレベル1に分類されます。 または類似資産のブローカーまたはディーラーの見積もり。
政府 財務省証券:当社は、これらの投資を評価するために第三者価格設定サービスを利用しています。米国財務省短期証券は機密扱いです 同一資産の活発な市場における相場市場価格を使用して評価されるため、公正価値階層のレベル1以内です と報告可能な取引。
私たち。 政府機関の証券:当社は、これらの投資を評価するために第三者価格設定サービスを利用しています。米国政府機関の証券 ブローカー/ディーラーの相場、入札とオファー、ベンチマークを使用して評価されるため、公正価値階層のレベル2に分類されます 利回り、クレジットスプレッド、その他の観察可能なインプット。
令状 責任:ワラント責任(普通株式を購入するワラントに関する) は、各報告期間に市場投入され、公正価値の変動は添付の明細書にその他の収益(費用)に記録されます ワラントが行使される、失効するまでの業務、またはその他の事実と状況により、ワラント責任が再分類される 株主資本へ。ワラント責任の公正価値は、Black-Scholesのオプション価格モデルを使用して見積もられます。重要な 2024年3月31日現在のワラント負債を評価するためのオプション価格モデルを作成する際に使用される仮定には、(i)ボラティリティが含まれます の %、(ii) リスクフリー金利 %、(iii) $の行使価格、(iv)普通株式の公正価値、そして (v) が期待されます の人生 何年も。12月現在のワラント責任を評価するためのオプション価格モデルを作成する際に使用された重要な前提条件 31、2023、(i)のボラティリティを含めてください %、(ii) リスクフリー金利 %、(iii) $の行使価格、(iv)普通株の公正価値 $の株式、と(v)の期待寿命 何年も。
その 会社の会計方針は、事象または変更の日に公正価値階層のレベル間の移転を認識することです 転送の原因となった状況で。3月に終了した3つの期間、レベル1、レベル2、またはレベル3への異動はありませんでした 31、2024年。
(6) 所得税
その 暫定期間の税引当金は、調整後の通年の会社の実効税率の見積もりを使用して決定されます 該当期間に考慮される個別の項目がある場合は、その項目についてです。四半期ごとに、会社は見積もりを更新します 年間の実効税率、および推定税率が変更された場合、会社は累積調整を行います。
で 2024年3月31日と2023年12月31日に、当社は、繰延税金資産に対して、予想される逆転を差し引いた額の全額評価引当金を計上しました 既存の繰延税金負債について。これらのメリットが実現しない可能性が高いと考えているためです。
| 12 |
(7) 契約上の合意
| (a) | アボット プロダクツ株式会社 |
オン
2012年3月29日、当社はソルベイ・ファーマシューティカルズ社(後にアボット・プロダクツに買収)との協力契約を終了しました。
TLANDOの場合はInc.)。解約の一環として、当社はアボットから知的財産権を再取得しました。すべての義務
以前のライセンス契約では、リポシンがアボットに永久契約を結ぶことを除いて
| (b) | アンタレス ファーマ株式会社 |
オン 2021年10月14日、当社はアンタレスとアンタレスライセンス契約を締結しました。これに基づいて当社はアンタレスにライセンスを供与しました TLANDO® の最終承認を得た上で、開発と商品化のための独占的でロイヤリティのある、サブライセンス可能な権利とライセンス 米国食品医薬品局(「FDA」)、テストステロン代替品に関する当社のTLANDO製品 新薬申請書に示されているように、内因性テストステロンの欠乏または欠如に関連する状態に対する男性の治療 (「NDA」)第208088号、クラインフェルター症候群の治療、およびテストステロン補充療法に関連する小児の適応症 男性の場合、内因性テストステロンの欠乏または欠如に関連する状態、いずれの場合も アメリカ合衆国。トランランドは2022年3月29日にFDAの承認を受けました。
アポン
Antaresライセンス契約の締結により、Antaresは会社に最初の$を支払いました
ザル
会社は約$の収益を認識しました
| (c) | ベリティファーマシューティカルズ株式会社 |
オン 2024年1月12日、当社はゴードン・シルバー・リミテッド(「GSL」)とライセンス契約(「ライセンス契約」)を締結しました とVerity。これに基づき、当社はGSL(Verity Pharmaの関連会社)に、独占的でロイヤリティが適用される、サブライセンス可能なものを付与しました 男性の症状に対するテストステロン補充療法に関して、当社のTLANDO製品を商品化する権利とライセンス NDA第208088号「クラインフェルター症候群の治療」に示されているように、内因性テストステロンの欠乏または欠如に関連して、 そして、欠乏症または欠損症に関連する男性のテストステロン補充療法に関連する小児の適応症 内因性テストステロン(「フィールド」)、いずれも米国とカナダ国内で。ベリティライセンス契約 また、GSLに、当社の潜在的な1日1回限りの経口製品であるTLANDO XR(LPCN 1111)を開発および商品化するためのライセンスを提供します テストステロン補充療法の候補です。当社は、フィールド外の申請におけるTLANDOとTLANDO XRの権利を保持します そして、米国とカナダ以外の分野での開発と商品化の権利へ。
アポン
Verityライセンス契約の締結により、GSLは会社に$のライセンス料を支払うことに同意しました
その 会社は、Verityライセンス契約と併せて計上されたライセンス収入はASC 606の要件を満たしていると結論付けました。 顧客との契約による収入。会社は報告期間ごとに進捗状況を評価し、必要に応じて調整します 業績とそれに関連する収益認識の尺度。将来受け取る予定の支払いによるライセンス収入が計上されます Verityライセンス契約の条件に基づいてライセンスの支払いを受ける可能性が高い場合。
| 13 |
中に
2024年3月31日に終了した3か月間で、当社は$を認識しました
| (d) | 受託研究開発 |
その
同社は、前臨床、臨床、分析、製造を行うさまざまな契約組織と契約を締結しています
会社だけでなく、多くの独立請負業者、主に臨床研究者に代わって開発作業を行っています
会社の顧問として。会社は$の費用を負担しました
(8) リース
その 同社は、ユタ州ソルトレイクシティのオフィススペースと研究施設のオペレーティングリースをキャンセル不可にしています。リース期間 は、2025年2月28日まで延長されました。
未来 2024年3月31日現在のキャンセル不可のオペレーティングリースに基づく最低リース料は次のとおりです。
| 運営しています | ||||
| リース | ||||
| 12 月 31 日に終了する年度: | ||||
| 2024 | $ | |||
| 2025 | ||||
| 最低リース料総額 | $ | |||
ザル
会社の家賃費用は $でした
(9) 株主資本
オン
2023年5月10日、会社の取締役会は承認しました
すべて 当社の普通株式データおよび1株当たりの価格データは、2023年5月11日に発効した株式併合を反映しています。
の 会社には最大で発行する権限があります その普通株式の株式、額面価格 $。
| (a) | 発行 普通株の |
オン
2017年3月6日、当社はカンター・フィッツジェラルド&カンパニーと販売契約(「販売契約」)を締結しました。(「カントール」)
これに基づき、当社は随時、総募集価格の普通株式を発行および売却することができます
募集の基準となる有効な登録届出書に会社が登録した金額を上限とします。会社
現在、$まで登録しています
| 14 |
その 売買契約に基づいて売却された当社の普通株式は、登録届出書に従って売却および発行されます 以前に証券取引委員会によって発効が宣言されたフォームS-3(ファイル番号333-250072)、および関連する 目論見書と1つまたは複数の目論見書補足。当社は、売却に基づいて普通株式を売却する義務はありません 契約。売買契約に基づく普通株式の募集は、売買契約の終了時に終了します。 そこで許可されています。
として
2024年3月31日に、当社は総額を売却しました 加重平均販売価格が$の株式 以下の1株当たり
アット・ザ・マーケット・オファリング(「ATMオファリング」)の総収入は
オン 2024年4月24日、カンターとの販売契約は終了し、アライアンス・グローバル・パートナーズと新たな販売契約が締結されました (「A.G.P.」)は、注記13「その後のイベント」に記載されているとおり、2024年4月26日です。
| (b) | シリーズ B 優先株 |
オン 2023年3月7日、会社の取締役会は1000分の1(1,000分の1/1,000)の配当を宣言しました番目の)シリーズBプリファードの1株の 株式、額面価格 $ 1株当たり(「シリーズB優先株式」)、当社の普通株式の発行済1株につき、 2023年3月24日に登録されている株主に。シリーズB優先株式の指定証明書(「指定証明書」) デラウェア州務長官に提出され、2023年3月10日に発効しました。
ザル
配当金は、2023年3月24日の発行済み普通株式の数に基づいており、その結果 シリーズBの優先株式
発行されています。
すべて 2023年の年次総会直前の時点で、直接または代理で出席していなかったシリーズB優先株式の株式 投票の開始時(「初回償還期間」)は自動的に引き換えられました 会社またはシリーズB優先株式の保有者側によるさらなる措置なしに、会社によって(「イニシャル」) 償還」)。初回償還では償還されなかったシリーズB優先株式の残りの株式は償還されました 株式併合を実施する設立証明書の修正が有効になると自動的に行われます(「続行」 償還」)。
| 15 |
ザル シリーズB優先株は、他のクラス、シリーズの株式、またはその他の証券に転換したり、他の証券と交換したりすることはできませんでした 会社の。シリーズB優先株には満期が明記されておらず、シンキングファンドの対象にもなりませんでした。シリーズB優先株 支払いが滞っている間は、会社による株式の償還または買戻しには何の制限も受けませんでした 配当金またはシンキングファンドの分割払いについて。
その 年次株主総会の前は、会社がシリーズB優先株式の株式の償還だけを管理してい?$#@$ではありません なぜなら、上記の株式併合に関して議決権を行使するかどうかは、保有者が決めることができたからです。 特定の保有者のシリーズB優先株式が、初回償還または後続償還のどちらで償還されたか。 シリーズB優先株式の償還は会社だけが管理してい?$#@$ではないので、シリーズB優先株式の株式は 当社の未監査連結株主資本計算書ではメザニンエクイティに分類されていました。アポン シリーズB優先株の発行、株式は償還額で測定されました。2023年5月10日現在、シリーズBの全株式が優先されています 株式は会社によって償還されました。
| (c) | 権利 契約 |
オン 2015年11月13日、当社と権利代理人であるアメリカン・ストック・トランスファー・アンド・トラスト・カンパニーLLCは、権利契約を締結しました。 また、2015年11月12日に、会社の取締役会は優先株1株の購入権を承認し、配当を宣言しました (それぞれが「権利」、総称して「権利」)は、会社の各発行済み普通株式に対する。その 配当金は、2015年11月30日の営業終了時点で登録株主に支払われ、登録株主には以下の権利が与えられます シリーズAのジュニア参加優先株式の全額払込済評価対象外株式の1000分の1を会社から購入します 会社の価格は $です 1000株当たり(「購入価格」)。権利は一般的に行使可能になります (i) 個人またはグループが所属または関連会社であることを公表してから10営業日のうち早いほうに発生する場合 個人が買収者(以下に定義)または(ii)10営業日(または訴訟により決定される場合はそれ以降)になりました 以下のように、関係者や関連者の個人またはグループが買収者になる前に、取締役会の 公開買付けまたは交換買付けの開始または意思の発表で、その完了により 個人またはグループによる、会社の発行済み普通株式の15%以上の受益所有権。特定の状況を除いて、 関係者や関係者の個人またはグループは、受益所有権を取得すると「買収者」になります 当社の普通株式の発行済み株式の 15% 以上。
に 一般的に、ある人が買収者になった場合、その買収者が所有していない各権利がその所有者に帰属します シリーズAジュニア参加優先株式の代わりに、右派の当時の現在の行使価格で会社から購入すること 株式、市場価値が購入価格の2倍の会社の普通株式。また、もし誰かが買収者になったら 個人、(a)会社が合併またはその他の企業結合により買収された、または(b)会社の資産または資産の50%以上が 収益力の50%以上を占め、売却、リース、交換、またはその他の方法で譲渡されている(1つ以上の取引で) 権利の各保有者(取得者、その関連会社および関連会社を除く)および特定の権利保有者がいるように、適切な規定を設ける必要があります その譲渡人(権利が無効になった)は、その後、購入のために買収企業から購入する権利を持つものとします。 価格、買収した法人の普通株式で、その取引の時点で市場価値があるはずの株式の数 購入価格の2倍です。
ザル 会社は$で権利を償還する権利があります 権利1件につき、取得者がその権利を取得する前の任意の時点で。その 権利の条件は権利契約に定められています。権利契約は、日付の付いたフォーム8-Kの最新報告書にまとめられています。 2015年11月13日。権利プランは当初、2018年11月12日に期限切れになる予定でしたが、2018年11月5日に理事会が承認しました 有効期限が2021年11月5日、そして再び11月に延長された、修正され改訂された権利契約 2021年2月2日、当社は第2次修正および改訂権利契約を採択し、それに従って有効期限が11月に延長されました 1、2024、当社が権利を以前に償還または交換した場合を除きます。
| 16 |
| (d) | シェアベース 支払い |
その 会社は、ストックオプション特典、制限付株式ユニット、制限付株式の付与に関する株式ベースの報酬費用を以下のように認識しています 付与日に基づく、会社の取締役会の従業員、非従業員、非従業員に対する会社のインセンティブプラン それらの賞の公正価値。アワードの付与日の公正価値は、通常、アワードに対する報酬費用として認識されます 必要なサービス期間。さらに、当社は業績連動型ストックオプション報奨と制限付株式ユニットを付与しています。 会社が特定の業績条件を満たすことに基づいて決定されます。付与日に測定された潜在的な報酬費用に関連する これらのパフォーマンスオプションが認められるのは、会社がこれらのオプションまたはユニットが権利確定すると見積もった場合と、そのタイミングで は、当社が業績条件が達成可能であると考えているかどうかに基づいています。会社による見積もり 権利が確定する業績ベースのオプションまたはユニットの数は、必要に応じて、次の期間に修正されます。
その 会社はブラック・ショールズモデルを使用して、ストックオプション報奨の推定公正価値を計算しています。このモデルを使用して、公正価値が計算されます (i) 会社の普通株価の予想変動率、(ii) 一定期間に関する仮定に基づいています 行使(予定任期)前にどの従業員と取締役会のメンバーがオプションを保持することが期待されるか、(iii)予想されます 普通株式の配当利回り、および(iv)リスクフリー金利。株式ベースの報酬費用には見積もりも含まれています。 は、授与時に授与されます、失効が予想される賞の数のうち。この見積もりは、必要に応じて、後で修正されます 実際の没収額がその見積もりと異なる場合は、その期間。の明細書で計上された株式ベースの報酬費用 業務額は約 $ と $それぞれ、2024年3月31日および2023年3月31日に終了した3か月間、 とは次のように割り当てられます。
| 3月31日に終了した3か月間 | ||||||||
| 2024 | 2023 | |||||||
| 研究開発 | $ | $ | ||||||
| 一般と管理 | ||||||||
| 合計 | $ | $ | ||||||
の 会社が発行しました そして 2024年3月31日および2023年3月31日に終了した3か月間、それぞれストックオプション。
キー 付与されるストックオプションの公正価値の決定に使用される前提条件は次のとおりです。
期待されます 期間: 予想期間は、株式ベースの報奨が未払いになると予想される期間を表します。予定期間は推定されました ストックオプションの契約期間と権利確定期間の平均を使用します。業績条件付きの賞については、 パフォーマンス条件を満たすための契約期間があり、その契約期間が使用されました。
リスクフリー 金利: 使用されたリスクフリー金利は、米国財務省発行で現在利用可能なインプライド利回りに基づいていました 同等の残存期間。
期待されます 配当: 予想配当の前提は、会社の予想に対する経営陣の現在の予想に基づいています 配当政策。当社は、当面の間、配当を申告する予定はありません。
期待されます ボラティリティ: ボラティリティ・ファクターは、会社の取引履歴のみに基づいています。
| 2024 | 2023 | |||||||
| 予定期間 | 何年も | 何年も | ||||||
| リスクフリー金利 | % | % | ||||||
| 予想配当利回り | — | — | ||||||
| 予想されるボラティリティ | % | % | ||||||
| 17 |
その 会社は、権利が確定すると予想されるオプションの部分に対する報酬費用を認識しています。したがって、会社は見積もりを適用しました 過去の従業員の解雇行動から導き出された没収率。実際の没収件数がそれと異なる場合 経営陣による見積もりですが、将来の期間に報酬費用の追加調整が必要になる可能性があります。
として 2024年3月31日の、おおよその金額は 未確定ストックオプション報酬に関連する未認識の報酬費用の総額の 会社のストックオプションプランに基づいて付与されます。その費用は、加重平均期間にわたって計上されると予想されます 何年も そして、その後の没収見込み額の変更に合わせて調整されます。さらに、2024年3月31日現在、$がありました 合計の 時間ベースまたは業績ベースの権利確定がある権利確定されていない制限付株式ユニットに関連する、認識されていない報酬費用。
| (e) | 株式 オプションプラン |
に 2014年4月、取締役会は、株主の承認を条件として、2014年の株式およびインセンティブ制度(「2014年計画」)を採択しました。 2014年6月に。2014年のプランでは、非適格およびインセンティブのストックオプション、株式評価権、制限付の付与が規定されています 株式単位、制限付株式、および配当同等物。の集計 株式は2014年プランに基づいて発行が承認されました。 さらに、 2011年の株式インセンティブ制度(「2011年計画」)に基づく残りの授権株式は、以下の条件で発行可能でした 2014年のプランが採択された時点の2014年のプラン。2016年6月に株主の承認を受けて、2014年計画は修正され、改訂されました 2014年プランに基づいて付与されたすべてのアワードに基づいて発行可能な当社の普通株式の授権数を増やすこと に 。さらに、2018年6月に株主の承認を受けて、2014年計画はさらに修正され、次のように修正されました 2014年プランに基づいて付与されたすべてのアワードに基づいて発行可能な会社の普通株式の授権数を増やしてください に 。最後に、2020年6月に株主の承認を受けて、2014年計画はさらに修正され、内容が向上するように修正されました 2014年プランに基づいて付与されたすべてのアワードに基づいて発行可能な当社の普通株式の授権数 に 。 取締役会は、オプションごとに、付与されるオプションの株式数、行使価格、期間、権利確定期間を決定します。 一般的に付与されるオプションには -年の契約期間。当社は、オプションの行使時に普通株式を発行します それらの普通株式の出所は、新しく発行された株式または自己保有の株式のいずれかです。の集計 株式 の普通株式が2014年計画に基づいて発行が承認されています。 2024年3月31日現在、付与可能な株式は残っています。
| 優れたストックオプション | ||||||||
| 株式数 | 加重平均行使価格 | |||||||
| 2023年12月31日現在の残高 | $ | |||||||
| オプションが付与されました | ||||||||
| 行使したオプション | - | - | ||||||
| オプションは没収されました | - | - | ||||||
| オプションがキャンセルされました | ( | ) | ||||||
| 2024年3月31日現在の残高 | ||||||||
| 2024年3月31日に行使可能なオプション | ||||||||
| 18 |
| 未解決のオプション | 行使可能なオプション | |||||||||||||||||||||||||||
| 未処理数 | 加重平均残存契約期間(年) | 加重平均行使価格 | 本質的価値の総計 | 行使可能な番号 | 加重平均残存契約期間(年) | 加重平均行使価格 | 本質的価値の総計 | |||||||||||||||||||||
| $ | $ | $ | $ | - | ||||||||||||||||||||||||
その ストックオプションの本質的価値は、現在の市場価値と行使価格の差として定義されます。ありました ストックオプションは、それぞれ2024年3月31日と2023年3月31日に終了した3か月間に行使されました。
| (f) | 制限されています 株式単位 |
| 権利が確定していない制限付株式ユニットの数 | ||||
| 2023年12月31日現在の残高 | - | |||
| 付与されました | ||||
| 既得 | - | |||
| キャンセルされました | - | |||
| 2024年3月31日現在の残高 | ||||
その
2024年3月31日に終了した3か月間に授与された制限付株式ユニットの加重平均付与日の公正価値は 一株当たり。
| (g) | 共通 新株予約権 |
その 会社はASC 480に基づいて普通株式新株予約権を会計処理しています。 負債と資本の区別、それにはどんな財務も必要です 発行済株式以外の、開始時に発行者の株式を買い戻す義務を具体化した商品、 またははそのような債務と連動しており、発行者に資産を譲渡して債務を決済し、分類することを要求したり、要求したりすることがあります 負債として。ASC 480によると、2019年11月の募集における当社の未払いの新株予約権は次のように分類されます 負債。負債は各報告期間で公正価値に調整され、公正価値の変動は利益(損失)として認識されます 会社の連結営業報告書における保証責任の公正価値の変化について。で発行されたワラント 2019年11月のオファリングにより、ワラント保有者は、特定の支配権変更が発生した場合に、同額の現金を受け取ることができます 特定の前提条件のもと、Black-Scholesオプション価格モデルに従って決定された新株予約権の価値を 基本的な取引時に。
として 2024年3月31日の、会社は 2019年11月の同数の購入募集から発行された普通新株予約権 普通株式の2024年3月31日と2023年12月31日のこれらのワラントの公正価値は、ブラックショールズを使用して決定されました 次のレベル3のインプットを含むオプション価格モデル(2019年11月のオファリングで定義されているとおり):
| 2024年3月31日 | 2023年12月31日 | |||||||
| 期待寿命(年数) | ||||||||
| リスクフリー金利 | % | % | ||||||
| 配当利回り | — | — | ||||||
| ボラティリティ | % | % | ||||||
| 株価 | $ | $ | ||||||
| 19 |
中に
2024年3月31日に終了した3か月間で、当社は約$の非現金損失を記録しました
| 保証責任 | ||||
| 2023年12月31日現在の残高 | $ | |||
| 普通株式新株予約権の公正価値の変動 | ||||
| 2024年3月31日現在の残高 | $ | |||
さらに、 2020年2月のオファリングで、当社は 普通株新株予約権。しかし、これらの令状は令状を提供していないからです 保有者はワラントを会社に戻すオプションがあり、ワラントは株式として分類されます。2024年および2023年3月31日の時点で、そこには でした 2020年2月のオファリングで発行された未払いのワラント。
ザ・ 次の表は、発行済普通株式新株予約権の数と加重平均行使価格をまとめたものです。
| ワラント | 加重平均行使価格 | |||||||
| 2023年12月31日時点で未払い | $ | |||||||
| 発行済み | - | - | ||||||
| 運動した | - | - | ||||||
| 期限切れ | - | - | ||||||
| キャンセルされました | - | - | ||||||
| 没収 | - | - | ||||||
| 2024年3月31日現在の残高 | $ | |||||||
そこに でした 普通株式新株予約権は、2024年3月31日または2023年3月31日に終了した3か月間に行使されました。
ザ・ 次の表は、2024年3月31日に発行された普通株式新株予約権に関する情報をまとめたものです。
| 未払いのワラント | ||||||||||||
| 行使可能な番号 | 加重平均残存契約期間(年) | 加重平均行使価格 | 本質的価値の総計 | |||||||||
| $ | $ | - | ||||||||||
| 20 |
(10) コミットメントと不測の事態
訴訟
その 会社は、通常の業務過程で発生するさまざまな訴訟、請求、その他の法的問題に随時関与しています ビジネス。会社は、特定の不測の事態が発生する可能性が高く、予測可能な場合に負債を記録します。
オン
2019年11月14日、当社とその役員の一部が、株主集団訴訟とされる訴訟の被告として指名されました。
ソロモン・アバディ対リポシン社他、2:19-CV-00906-PMWは、ユタ州連邦地方裁判所に提訴されました。苦情
被告が虚偽および/または誤解を招くような発言をした、および/または会社の提出書類を開示しなかったという申し立て
TLANDOのFDAへのNDAには不備が含まれていたため、私たちの事業と事業に関する被告の声明は
虚偽で誤解を招く、および/または連邦証券法に違反する合理的な根拠の欠如。訴訟では、としての認定を求めました
集団訴訟(2019年3月27日から2019年11月8日までの間に当社の証券を購入したとされる種類の人が対象)、代償
不特定の金額の損害賠償、および不特定の衡平法または差止命令による救済。会社はこのような請求をカバーする保険に加入しています
自然。会社の方針に基づいて会社が支払うべき留保額は$です
その 会社は現在、個別または全体として、当社の財務に重大な悪影響を及ぼす可能性のある問題を認識していません 状態、流動性、または経営成績。
保証 と補償
に 通常の事業方針として、会社はリース契約、ライセンス契約、臨床試験契約などの契約を締結します。 および標準保証および/または補償条項を含む特定のサービス契約。さらに、会社は補償しました デラウェア州の法律で許可されている最大限の範囲で、その取締役および役員を派遣します。
(11) スプリアーゾ合同会社との契約
その
会社は、特定の現役および元取締役が過半数を所有する関連当事者であるSpriasoとライセンスおよびサービス契約を結んでいます
リポシン社とその関連会社の。ライセンス契約に基づき、会社は会社のすべてをSpriasoに譲渡し、譲渡しました
咳止めや寒冷地用の製品を開発するための知的財産権、所有権、および利益。さらに、Spriasoは受け取りました
当社と第三者との製品開発契約に基づくすべての権利と義務。引き換えに、会社は
のロイヤリティを受け取る
| 21 |
(12) 最近の会計上の宣言
会計 出された宣言はまだ採用されていません
に 2023年11月、財務会計基準審議会(FASB)は、会計基準更新(ASU)2023-07、セグメント報告(トピック)を発表しました 280): 報告対象セグメントの開示の改善。これにより、トピック280に基づく報告要件が強化されます。強化された情報開示 要件には、最高執行意思決定者(CODM)の役職と地位、CODMに提供される多額のセグメント経費が含まれます。 特定の年次開示を暫定期間にまで拡大し、報告対象セグメントの事業体がASC 280を全面的に適用しなければならないことを明確にして、 また、特定の状況下でセグメントの利益または損失の複数の指標を報告することができます。この変更は次の場合に有効です 2023年12月15日以降に始まる会計年度と、2024年12月15日以降に始まる中間期間。この変更は遡及的に適用されます 表示されているすべての期間に。経営陣は現在、このASUの採用が財務諸表に与える影響を評価しています 会社。
(13) 後続イベント
オン 2024年4月24日、当社はカンターとの売買契約を終了し、2024年4月26日、当社は販売契約を締結しました とA.G.P.(「A.G.P. 売買契約」)に基づき、当社は随時、以下の株式を発行および売却することができます 会社が有効な登録届出書に登録した金額までの総募集価格の普通株式 これに基づいて提供が行われています。会社は現在$を登録しています 売却用普通株式 修正されたフォームS-3の登録届出書(ファイル番号333-275716)(「フォームS-3」)に基づく販売契約 会社の販売代理店としてA.G.P. を通じて。A.G.P. は、法律で認められる任意の方法で、会社の普通株式を売却することができます 証券法の規則415(a)(4)で定義されている「市場での提供」(または直接行われた販売を含む)であること ナスダック・キャピタル・マーケットまたはその他の既存の普通株式取引市場を通じて、市場価格での交渉による取引 販売時の優勢、実勢市場価格に関連する価格、または法律で認められているその他の方法で優勢。A.G.P. は使います 通常の取引および販売慣行、および販売に適用される法律および規制に沿った商業的に合理的な取り組みです A.G.P. 売買契約に基づく株式。会社はA.G.P. を支払います。 以下の株式の各売却による総収入総額の割合 A.G.P. 販売契約。さらに、当社はA.G.P. に通常の補償権も提供しています。
その A.G.P. 売買契約に基づいて売却される当社の普通株式は、フォームS-3に従って売却および発行されます。 証券取引委員会によって以前に発効が宣言された修正版、および関連する目論見書と、または その他の目論見書の補足。
その 会社は、A.G.P. 売買契約に基づいて普通株式を売却する義務はありません。に基づく普通株式の募集 にA.G.P. 販売契約は、そこで許可されているように、A.G.P. 販売契約の終了時に終了します。会社と A.G.P. はそれぞれ、10日前に通知することで、いつでもA.G.P. 売買契約を解除することができます。
| 22 |
Iチーム 2。経営陣による財政状態と経営成績の議論と分析
その 当社の財政状態と経営成績に関する以下の議論は、未監査の要約と併せて読む必要があります 連結財務諸表とそれに関連する注記、およびこのレポートの他の部分に含まれるその他の財務情報。にとって 当社の財政状態と経営成績を理解するための追加のコンテキストについては、経営陣の議論を参照してください と、2024年3月7日にSECに提出されたフォーム10-Kに含まれる分析、および含まれている財務諸表と関連メモ そこに。
として 以下の説明で使われる「私たち」、「私たち」、「私たち」とは、リポシンを指します。
将来を見据えた ステートメント
これ このレポートのセクションやその他の部分には、証券法のセクション27Aの意味における将来の見通しに関する記述が含まれています 1933年(改正版)、および1934年の証券取引法の第21E条(改正版)には、リスクと不確実性が伴います。将来を見据えています 声明には、特定の仮定に基づいた将来の出来事に対する現在の予想が示され、直接的にはそうではない記述も含まれます あらゆる歴史的または現在の事実に関連しています。将来の見通しに関する記述には、製品、製品の利点、前臨床などの事項が含まれる場合があります および臨床開発スケジュール、臨床および規制上の期待と計画、規制措置への期待される対応、予想されること 財務実績、将来の収益または収益、事業展望、予想される事業、新製品とサービス、予想される市場 業績、予想される研究開発およびその他の費用、流動性と資本資源のニーズに対する将来の期待、 同様の問題。「かもしれない」、「するだろう」、「期待する」、「続行」、「見積もる」などの言葉、 「プロジェクト」、「意図」、および同様の用語や表現は、将来の見通しに関する記述を識別することを目的としています。 将来の見通しに関する記述は将来の業績を保証するものではなく、実際の結果は結果と大きく異なる可能性があります 将来の見通しに関する記述で説明されています。このような違いを引き起こす可能性のある要因には、説明されているものが含まれますが、これらに限定されません 2024年3月7日にSECに提出されたフォーム10-KのパートI、項目1A(リスク要因)で。適用法で義務付けられている場合を除き、仮定します 理由の如何を問わず、将来の見通しに関する記述を改訂または更新する義務はありません。
概要 私たちのビジネスの
私たち は、当社独自のLip'ralプラットフォームを活用して差別化された製品を開発することに重点を置いたバイオ医薬品企業です 中枢神経系(「CNS」)障害の治療に焦点を当てた、以前は送達が困難だった分子の経口送達です。 当社独自のデリバリーテクノロジーは、経口治療オプションを通じて患者のコンプライアンスと安全性を向上させるように設計されています。 私たちの主な開発プログラムは、バイオアベイラビリティーの低い薬剤用の経口デリバリーソリューションに基づいています。私たちは差別化されたポートフォリオを持っています 神経や精神の中枢神経系障害、肝臓疾患、ホルモンに対する未だ満たされていない高いニーズをターゲットとする革新的な製品候補です 男性と女性のためのサプリメント。
オン 2024年1月12日、開発と商品化のためのライセンス契約(「Verityライセンス契約」)を締結しました 当社の承認製品、TLANDO® は、ウンデカン酸テストステロンからなる経口テストステロン補充療法(「TRT」)です (「TU」)、ベリティ・ファーマシューティカルズ株式会社(「Verity」または「当社の「ライセンシー」)と共に、これに基づいて当社が付与しました To Verityは、TRT向けのTLANDO製品を開発および商品化するための独占的でロイヤリティのある、サブライセンス可能な権利とライセンスです 米国とカナダ。FDAが必要とする市販後の研究も、ライセンシーであるVerityの責任となります。2022年3月28日に、 FDAは、内因性テストステロン欠乏症(別名:)に関連する成人男性のTRTとしてTLANDOを承認しました 性腺機能低下症。2022年6月7日、私たちの元商業パートナーであるアンタレス(Halozymeの完全子会社)がコマーシャルを発表しました 欠乏症に伴う成人男性のテストステロン補充療法の適応となる経口治療薬、TLANDOの発売です または内因性テストステロンの欠如(原発性または性腺刺激低下性性性腺機能低下症)。
追加です 臨床開発パイプラインの候補には、産後うつ病(「PPD」)用のLPCN 1154、てんかん用のLPCN 2101、LPCNなどがあります。 本態性振戦には2203、慢性の体組成改善のためのインクレチン模倣薬の補助療法としてLPCN 2401を 体重管理。臨床開発製品の候補に加えて、私たちにはパートナーシップを模索することが期待される資産があります 北米以外の地域向けのTLANDO、テストステロンの新しいプロドラッグを含むLPCN 1148など、さらなる発展を可能にするために そして、非代償性肝硬変の管理のためのラウリン酸テストステロン(「TL」)、アンドロゲン受容体の経口プロドラッグ、LPCN 1144 第2相試験を完了した非肝硬変性非アルコール性脂肪性肝炎(「NASH」)の治療用モジュレーター。 とLPCN 1107は、再発防止を目的とした最初の経口ヒドロキシプロゲステロンカプロン酸(「HPC」)製品です 早産(「PTB」)。妊婦を対象とした用量決定臨床試験が完了し、オーファンドラッグが承認されました FDAによる指定。
| 23 |
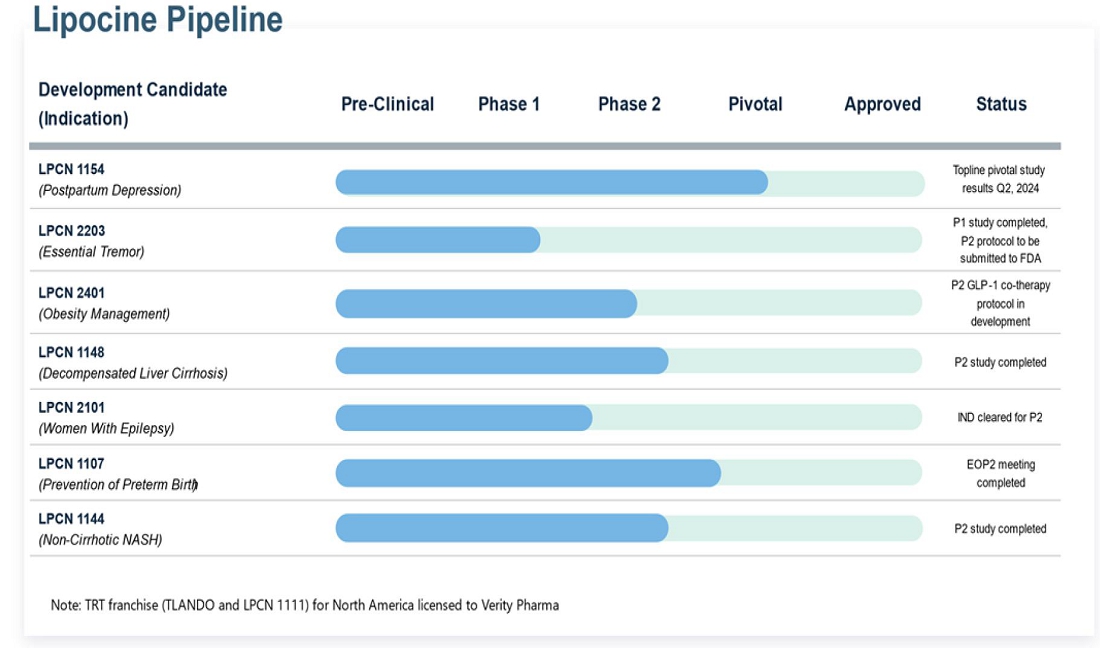
その 次の表は、当社の製品候補開発および提携プログラムの状況をまとめたものです。

コーポレート 戦略
私たちの 目標は、当社独自のLip'ralドラッグデリバリー技術プラットフォームを活用することに焦点を当てた大手バイオ医薬品企業になることです 以前は送達が困難だった中枢神経系障害の分子の経口投与による差別化された製品を開発すること。主要コンポーネント 私たちの戦略のうち、
アドバンス LPCN 1154およびその他のCNS製品の候補です。私たちは内因性神経活性ステロイド(「NAS」)の開発に焦点を当てるつもりです さまざまな中枢神経系疾患の治療に幅広く適用でき、当社の技術プラットフォームを活用して高度に差別化された疾患を開発することができます 経口治療薬。私たちの優先事項は、産後うつ病(「PPD」)に対する速効型経口抗うつ薬、LPCN 1154の開発です。 外来での使用の可能性もあります。
サポート 当社のライセンシーが当社のライセンス付き経口TRTオプションの商品化を行っています。TRT市場には、差別化された便利な経口薬が必要だと考えています オプション。私たちは、米国とカナダでのTLANDOの商業化について、TLANDOに独占的にライセンスする権利をVerityに与えています。私たちはサポートする予定です 患者さんがTLANDOを効果的にタイムリーに利用できるようにするためのライセンシーの取り組みは、受け取るだけでなく Verityライセンス契約で合意されたTLANDOの商品化に関連するマイルストーンとロイヤリティの支払いです。
開発します パイプライン資産を引き続き発展させるためのパートナーシップ。私たちは常にリソースを優先して探すよう努めています パイプライン資産のパートナーシップ。私たちは現在、治療の候補である肝臓プログラム(LPCN 1144)のパートナーシップを模索しています。 非肝硬変性NASHとLPCN 1148を、顕性肝硬変の再発防止を含む非代償性肝硬変の管理に 脳症、および慢性的な体重管理における体組成改善の補助としてのインクレチン模倣薬の補助療法としてのLPCN 2401は、 とLPCN 1107は、早産防止の候補です。また、LPCN 1021(として知られている)のライセンスの可能性も模索しています TLANDO(米国の場合)、LPCN 1111は米国とカナダ以外の第三者へ。ただし、ライセンス契約はありません 会社によって締結されました。
| 24 |
私たちの パイプライン製品候補者
私たちの 臨床開発候補のパイプラインには、PPD用のLPCN 1154、てんかん用のLPCN 2101、エッセンシャル・トレマー用のLPCN 2203、LPCNが含まれます 2401は慢性的な体重管理における体組成改善の補助として、LPCN 1148は体の管理のためのアンドロゲン療法です 肝硬変。私たちは、ニーズがかなり満たされていない中枢神経系適応症を対象とする他の製品開発候補を引き続き探っていきます。 また、LPCN 1144の継続的な開発および/またはマーケティングのために、パートナーシップ契約を結ぶ努力を続けます。 LPCN 1148、LPCN 2401、LPCN 1107、および米国外のTRT資産(TLANDOとLPCN 1111)については、 カナダ。
私たちの 製品は、当社独自のLip'ralドラッグデリバリー技術プラットフォームに基づいています。Lip'ralに拠点を置くTLANDOは 2022年3月に、米国食品医薬品局。Lip'ralテクノロジーは、最適な分散相を形成する脂質組成に基づく特許技術です 胃腸環境に置いて、不溶性薬物の吸収を促進します。薬剤を充填した分散相は、可溶化相を示します 吸収部位(消化管膜)で効率的に薬物を投与することで、吸収プロセスを改善し、薬剤の量を減らします 希釈、胃腸のpH、吸収に対する食物の影響などの生理学的変数に依存します。リプラールベースの製剤 可溶化の改善と薬剤充填能力の向上を可能にします。これにより、バイオアベイラビリティの向上、投与量の削減、迅速化につながります。 吸収の一貫性の向上、ばらつきの減少、食品効果に対する感受性の低下、患者のコンプライアンスの向上、リンパ管の標的化 適切な場所に配達。
オーラル CNS障害のためのプログラム
いくつか 中枢神経系に存在する好ましい内因性または天然に存在するNASは、ポジティブなアロステリックモジュレーター(「PAM」)として機能します ガバのA 抑制性神経伝達物質のγ-アミノ酪酸(「GABA」)の主要な生物学的標的である受容体A」)。 これらのモジュレーター、内因性GABAのいくつかの合成NAS誘導体の経口送達を改善するためにA レセプターPAMは 過去数十年に治療用に開発されました。
私たち 当社独自の技術を利用することで、内因性GABAの効果的な経口送達が可能になるかもしれないと信じていますA 歴史的に経口では生体利用できないと考えられていた受容体PAM。新薬クラスとして、NASはかなりの評価を受けています うつ病、運動障害、てんかんなど、さまざまな神経精神疾患を治療できる可能性があるため注目されています。 不安、神経変性疾患。私たちは、3つのリードのそれぞれについて第1相薬物動態(「PK」)研究を実施しました 有望なPK結果、安全性、耐容性を示したNAS候補で、CNSに焦点を当てた未公開のものをさらに検討中です 候補者。
LPCN 1154: PPDの製品候補です
私たちの 最も進んだNAS候補はLPCN 1154です。これは、神経活性ステロイドであるブレキサノロンの非侵襲的で即効性のある経口製剤です 私たちはPPDの治療のために開発しています。FDAは最近、以下を通じてLPCN 1154の有効性を確立するという私たちの提案に同意しました 505(b)(2)NDA申請による承認済みの点滴ブレキサノロンへの重要なPKブリッジです。同社は臨床口頭PK研究を完了しました パイロットの食品効果調査とパイロットPKブリッジ研究を含みます。さらに、LPCN 1154ピボタル研究の前置きとして、複数回投与します 必要なスケールアップされた「市販予定」の製剤を使用して、重要な研究のための投与計画を確認する研究が行われました NDA申請用です。2024年3月、私たちは重要なPK研究の登録を完了し、最初の患者コホートに投与しました。私たちは持っていることを期待しています 2024年第2四半期のピボタル調査のトップライン結果。
PPD
PPD、 妊娠中または出産後4週間以内に発症する大うつ病性障害の一種で、うつ病が続くことを指します 出産後12ヶ月まで。PPDは、症状の重症度と併存疾患の有無によって臨床的に分類できます。 てんかん。米国だけで約8人に1人の母親がPPDに苦しんでいます。これは約50万人の女性が 毎年PPDの影響を受けます。
病気 概要-PPD
| ● | PPD は、「ベビーブルース」とは異なります。これは、新米の母親の約70%が 経験;「ベイビーブルース」は、短命に終わる傾向がある感情状態です 日常の活動を妨げないでください。 |
| ● | 症状 のPPDには、悲しみ、抑うつなど大うつ病の特徴が含まれますが、これらに限定されません 気分、興味の喪失、食欲の変化、不眠症、寝過ぎ、疲労、困難 考える/集中する、過度に泣く、赤ちゃん/自分自身を傷つけることへの恐れ、および/または思考 死または自殺の。 |
| 25 |
| ● | 中に 妊娠すると、内因性NASのレベルはプロゲステロンのレベルとともにかなり増加します。 しかし、産後は急激に低下します。急速な周産期という仮説が立てられています 内因性NASの循環レベルの低下は、PPDの発症に関与している可能性があります。 PPDの治療法として最初に承認された選択肢は、内因性NASを含む注射剤でした。 |
| ● | うつ病 出産後も長く続く可能性があります。さらに、女性の約40%が再発します その後の妊娠、またはその他の機会に。 |
| ● | 精神医学 てんかん患者には併存疾患がよくみられます。てんかん患者はリスクが高いです 大うつ病性障害とPPD用です。報告されているPPD発生率は、てんかんの女性の方が高い 一般人口よりも。 |
関連しています リスク要因
| ● | 遺伝学: 家族歴および/またはうつ病やその他の気分障害の以前の経験 |
| ● | 生理学的: 性ホルモン、ストレスホルモン、甲状腺ホルモンレベルの期間中および投与後の急激な変化 配達 |
| ● | 環境: ストレスの多いライフイベント、家庭や職場での人間関係の変化、家族との関係の欠如 サポートします |
満たされていません 医療ニーズ
私たち 便利で即効性のある経口療法がないため、PPDの女性のニーズはかなり満たされていないと思います。選択的 セロトニン再取り込み阻害薬(「SSRI」)は、重度のPPDを持つ女性にとって伝統的に第一選択薬であり、 効力の発現には数週間かかります。したがって、作用の開始が早い経口治療オプションの必要性は、依然として大きな未解決のままです PPDの治療、特に有害な行動を起こしやすい中等度から重度のうつ病の母親に必要です。
注射可能 ブレキサノロン(Zulresso™、Sage Therapeutics)は、産後うつ病の治療薬として初めてFDAに承認されました。しかし、多数あります 投与方法、費用、安全上の懸念などの要因により、注射用ブレキサノロンの使用が制限されます。ズレッソに加えて、 SAGE Therapeuticsは、2023年8月にズラノロン(ブランド名ZURZUVAE™)のFDA承認を受け、ズルズバエは商業的に発売されました 2023年12月に。合成神経活性ステロイド誘導体であるズラノロンは、産後うつ病の14日間の経口治療薬です。 そして、産後うつ病の治療薬としてFDAによって承認された最初の経口薬です。端子の半減期が長いほか、ラベル1枚あたり 約19.7〜24.6時間で、CYP3A4モジュレーターとの併用には用量の変更が必要です、警告、注意事項 中枢神経系抑制作用、運転やその他の潜在的に危険な活動に従事する能力の低下、胎児毒性などがあります。
私たち LPCN 1154は、便利な経口療法による48時間の治療期間で、強力で迅速な緩和という現在の満たされていないニーズを対象としていると思います 耐容性の良い生体同一性NAsを含む候補です。
LPCN 2101: てんかんのためのNAS
私たち 現在、てんかん(「WWE」)の女性を対象とした、追加のNAS候補であるLPCN 2101を検討中です。前臨床を完了しました とLPCN 2101の第1相試験では、有望なPK結果、安全性、耐容性が実証されました。2022年7月、私たちのINDが承認されました てんかんの成人を対象としたLPCN 2101についてはFDAによるもので、評価のためのIND開始概念実証試験の第2相を開始する予定です LPCN 2101の安全性、耐容性、有効性は、リソースの優先順位に左右されます。
病気 概要 — てんかん
てんかん は、1)24時間以上の間隔で少なくとも2回の非誘発発作の発生、2)1回の非誘発発作の発生、によって定義されます そして、今後10年間にさらに発作が起こる確率、および/または3)てんかん症候群と診断される確率。てんかん患者 発作の直接的な影響(てんかん状態、自動車事故など)や間接的な影響により、死亡リスクが高まっています 発作(例:自殺、心血管系への影響)。
てんかん は、発作を引き起こし、人の身体的、精神的、社会的幸福に影響を与える脳の障害であり、関連するものです 死亡率は一般人口の2〜3倍です。てんかんの約60〜65%は特発性で、約30%です の患者が難治性(つまり、現在入手可能な抗けいれん薬(「ASM」)ではてんかんがうまく管理されていません。てんかん 妊娠中の最も一般的な神経障害です。
| 26 |
それ は、米国では約90万人の出産可能な(「CB」)年齢の女性が活動性てんかんに苦しんでいると推定されています。CB州の女性 てんかんを患う年齢は、ホルモンが発作活動と内分泌機能全体に及ぼす影響のため、他にも多くの課題に直面しています 生殖周期のさまざまな段階。エストロゲンの上昇またはプロゲステロンレベルの低下は、発作の頻度を悪化させる可能性があります。しばしば、 これらの女性は、コントロールに影響を与えるASMの血中濃度の変動と相まって、ホルモンや内因性のNASの不均衡を経験しています 発作、経口避妊薬の効能、併発する不安神経症や抑うつ、および関連する睡眠障害について。てんかん 患者はうつ病を発症する可能性が5〜20倍高くなります。
臨床 セグメンテーションは、てんかんの種類、併存疾患、患者サブグループ別に分類できます。限局性てんかんの分類、一般化 てんかん、限局性てんかんと全身性の複合てんかん、未知のてんかんが、ASMの選択の指針となります。以下を含む特別な患者サブグループ CB年齢のWWEと高齢の患者は、てんかんの特別なケアと管理が必要です。うつ病や不安神経症などの併存症は てんかんに使用されるASMとの薬物相互作用のない発作を悪化させない治療法と併用してください。一方、最低 有効投与量と単剤療法が好ましく、てんかん患者の管理は、発作の抑制、有害事象の回避に重点を置いています イベント、そして生活の質の維持。ASMにはさまざまな種類がありますが、てんかん患者の約30%は依然としてASMに失敗しています 治療に効果的に反応します。てんかんの女性は、発作、ASM、そして ホルモンの変動。
女性たち てんかんはかつて妊娠を避けるように勧められていましたが、てんかんはもはや妊娠の禁忌とは見なされていません。介護者 WWEが妊娠前の段階で、家族を作るつもりがある(妊娠を計画している)か、予定外のことを防ぐために避妊薬を使っている人のために 妊娠は、発作抑制効果と、ASMおよびASM関連リスクの選択と投与量のバランスを取る上で大きな課題に直面しています 他のリスクの中でも、胎児・新生児毒性、避妊不全、精神医学的副作用などです。
いくつか ASMは、発育中の胎児に催奇形性作用を及ぼすことが知られています(レジストリ研究からの収束した証拠によると、催奇形性は リスクはバルプロ酸が最も高く、カルバマゼピンとトピラメートがそれに続きます)。古い世代を含む、他の一般的に処方されているASM フェノバルビタールやフェニトインなどの薬剤は、ラモトリジン、レベチラセタム、クロナゼパムと比較してリスクが高いとされています とガバペンチン(ヴァイダら、2014年、ヴォイネスクとペネル、2015年)。さらに、ASMに関連するリスクは妊娠初期にはかなりあります。 したがって、CB年齢のWWEは、なる前にカウンセリング、モニタリング、および最も適切なASMへの調整を受ける必要があります 妊娠しています。CB年齢のWWEは、受胎前の少なくとも6か月間、発作のコントロールについて医師と話し合うことが望ましいです。 可能であれば、てんかんの種類と、てんかんの種類に応じて、ASM療法を中止するか、最低有効量の抗けいれん薬を使用してください ASMの胎児毒性。不安、抑うつ、ASM遵守の欠如、および/または避妊失敗は、次のような女性が経験する可能性があります 予定外の妊娠を心配している、または予定外の妊娠の確認が遅れている。ASMは経口の効能を低下させる可能性があります 避妊薬は、この問題を悪化させています。
コンプレックス、 女性ホルモン、発作、ASMの間には多方向の相互作用が存在します。ほとんどのホルモンはNASとして働き、脳を調節することができます 興奮性。内因性または外因性のホルモンレベルの変化は、直接またはPKを介して発作の発生に影響を与える可能性があります ASMの血漿レベルを変更する相互作用(Harden、2008年)。経口避妊薬とASMのPK相互作用は双方向です (ジョンストンとクロフォード、2014年)。CYP-P450酵素誘導ASMを服用している女性では、ホルモン避妊薬の効果が低下する可能性があります。 てんかんは避妊薬が禁忌の病状ではありません。おそらくASMに関連する避妊障害は WWEでは予定外の妊娠の4人に1人(WWEの全妊娠の約12.5%)が原因であるのに対し、健康な女性では1%の割合です。
満たされていません CB時代のWWEを治療する必要があります
それ 米国では約900,000人のCB年齢の女性が活動性てんかんに苦しんでいると推定されています。てんかんを患っているCB年齢の女性は多くいます 発作のさまざまな段階における発作活動や内分泌機能に対するホルモンの影響など、その他の課題もあります 生殖周期、およびてんかん患者の約30%は、利用可能なASMを考慮しても効率的に制御できません 新しい薬理学的治療法の開発オプションが重要です。
管理します WWEでのCB年齢の制御不能な発作は、受胎前、妊娠、産後の段階の主な目的です。したがって、妥協のない 許容できるばらつきがあり、薬物間相互作用がほとんどまたはまったくないASMの有効性は、可能な限り低い単剤療法用量で達成されました 胎児毒性の懸念は、依然として非常に満たされていないニーズです。さらに、ブレークスルー発作の予防を含む発作のコントロールは重要です 妊娠を計画するとき、また妊娠中に、望まない転倒や自動車事故につながり、自由を危うくする可能性があるため ドライブに。
選択してください ASMは、避妊障害、生殖ホルモンの不均衡、不安、うつ病を引き起こす可能性があります。まだ満たされていないものが残っています 前述の欠点がなく、胎児と新生児への毒性が低く、授乳の心配がないASMが必要です また、関連する併存疾患を治療する可能性もあります。
| 27 |
一方 米国ではてんかんの治療薬として30種類以上の分子が承認されていますが、WWE用に特別に承認されたてんかん薬はありません CB年齢の。私たちは内生NASをGABAだと信じていますA PAMは、発作抑制という目標を掲げていますが、可能性も秘めています 精神障害の併存症(不安神経症や抑うつなど)や睡眠障害のその他のメリットのために。さらに、これら 経口内因性NASは、WWEにおける予定外妊娠または計画妊娠に関連する胎児毒性の懸念の一部に対処できる可能性があります。 (1)
(1) 参照:S.Bangarら。機能神経学 2016; 31 (3): 127-134; ライマーズら発作。2015年5月; 28:66-70。
LPCN 2203: エッセンシャル・トレモアの管理のための経口製品
LPCN 2203は、生体同一性GABA調節NASを含む本態性振戦の管理の経口候補です。無事終了しました 生体同一性GABA調節NASを用いた経口薬物動態学で、概念実証第2相試験のためのプロトコールを提出する予定です ET用です。
病気 概要-エッセンシャル・トレマー
必需品 振戦(「ET」)は、米国で最も一般的な運動障害の1つで、米国では推定700万人が罹患しています 米国。ET患者の場合、手、頭、声、脚の揺れが制御不能になると、食べたり、着替えたり、書いたり、追求したりするのが困難になります その他の日常業務。ETの病因はほとんどわかっていませんが、GABAが減少していますA 受容体レベルとGABA作動性活動の低下 ETで観察されています。
一方 ETは人口の高齢化を伴うことが多く、ETは人生のずっと早い時期に始まり、最終的には進行性の疾患経過をたどることがあります ケアパートナーが必要です。ET患者では、震えの重症度が高まるにつれて、社会不安や抑うつ症状が現れることがあります。 患者さんの仕事や趣味の遂行能力に悪影響を及ぼす可能性があります。ET患者とケアパートナーを対象としたインタビュー調査では、 日常生活活動への最も一般的な影響は、液体を注ぐこと、書くこと(100%)、身だしなみ/衛生、飲酒、着替え、 食べることと読書(80-85%)。全体として、参加者の90%がETの感情的な影響を指摘し、75%が震えに関連する心配を報告しました。 または不安。
その FDAが承認したETの薬理学的治療のみが50年以上前に承認され、ETの患者の大多数はETの経験があります 標準治療では最適とは言えない反応で、日中の効能など、ケアにおける満たされていない多くの切実なニーズが浮き彫りになります 耐容性の向上、PRN(プロレナタ)または「必要に応じて」オプション、優れたベネフィット・トゥ・リスク・プロファイル。(1) (2)
(1) 参照:ルイ・ED、オットマン・R・トレマーその他キパーキネット・ムーブ(NY)。2014; 4:259。
(2) 参照:ゲルバシら本態性振戦の患者体験:定性調査を用いて、機能的影響を既存の測定値にマッピングします。 2023年です。
TRTフランチャイズ — トランド、LPCN 1111 (トランド XR)
トランド: テストステロン補充療法用の経口製品
として 前述のとおり、Verityライセンス契約に基づき、2024年1月にVerityに独占的でロイヤリティのかかるサブライセンス可能なものを付与しました 2024年2月1日より、TRT向けの製品であるTLANDOを米国とカナダで開発し商品化する権利とライセンス。アトランド 2022年3月28日にFDAの承認を受けました。特定の市販後調査を実施するというFDAの要求は、すべてFDAの責任となります あなたのライセンシー、ベリティ。
概念実証 TLANDOは2006年に最初に設立され、その後2009年にTLANDOはソルベイ・ファーマシューティカルズ社にライセンスされました。 その後、アボットプロダクツ株式会社(「アボット」)に買収されました。のスピンオフに関連するポートフォリオレビューに続いて AbbVie Inc. は2011年にアボットによって買収され、TLANDOの権利は当社によって再取得されました。以前のライセンス契約に基づくすべての義務は 完了しましたが、リポシンはTLANDOの純売上高に対してアボットに恒久的に1%のロイヤリティを支払う義務があります。このようなロイヤリティは100万ドルに制限されています 製品発売後の最初の2暦年間。その期間を過ぎると、ロイヤリティに上限がなくなり、合計金額の上限もありません。 そのような製品のジェネリック版が導入された場合、ロイヤリティは 50% 減額されます。TLANDOは6月7日に商業的に発売されました。 2022。2024年3月31日と2023年3月31日に終了した3か月間に、それぞれ約5,000ドルと4,000ドルのロイヤリティ費用が発生しました。 Antaresライセンス契約の下で。
| 28 |
以来 TLANDOはFDAの完全な承認を受けました。Verityライセンス契約の条件に基づき、Verityは安全性と有効性を評価する必要があります 小児研究公平法で義務付けられているように、小児患者のTLANDOについてです。FDAは特定の市販後調査を要求する場合もあります 実施される予定ですが、これもVerityの責任となります。
アポン Verityライセンス契約の締結により、Verityは私たちに250万ドルの初期支払いを支払いましたが、これはライセンスの署名時に受領されました 契約と2024年2月1日に受領した500万ドル。Verityは250万ドルの追加支払いも必要です 2025年1月1日までに私たちに、2026年1月1日までに100万ドルの追加支払いをしてください。マイルストーンを受け取る資格もあります 1暦年における特定の販売マイルストーンの達成にもよりますが、合計で最大2億5900万ドルの支払い、または Verityライセンス契約に基づいてVerityによってライセンスされた製品に関する開発マイルストーン。さらに、段階的に受け取ります のVerityライセンス契約に基づいてライセンスされたすべての製品の純売上高の12%から18%の範囲でのロイヤリティの支払いです 米国とカナダ。2024年3月31日に終了した3か月間に、約4,000ドルのロイヤルティ費用が発生しました Verityライセンス契約。
私たち LPCN 1021(米国ではTLANDOとして知られています)を米国外の第三者にライセンス供与する可能性を模索しています とカナダ。ただし、当社はライセンス契約を締結していません。パートナーと契約が結ばれたら、 取り決めは、現地の規制当局の承認を得ることが部分的に条件となる可能性があります。どんなライセンスでも保証できません 契約が締結されるか、契約が締結されれば、そのような契約は私たちにとって有利な条件で行われるでしょう。
LPCN 1111: TRT用の次世代長時間作用型経口製品候補
として 前述の通り、Verityライセンス契約の条項に基づき、私たちは開発権と商品化権をライセンスしました 米国のLPCN 1111(TLANDO XR)へ、カナダのベリティへ。LPCN 1111とサードを提携する可能性を引き続き模索していきます 米国とカナダ以外の当事者。ただし、当社は提携契約を締結していません。保証はありません 北米以外のすべてのライセンス契約が締結されること、または契約が締結されている場合はそのような契約が締結されることを前提としています 私たちにとって有利な条件になるでしょう。
LPCN 1111は、当社独自のデリバリーを使用するテストステロントリデカノエートからなる次世代の新しいテストステロンエステルプロドラッグです 溶解性を高め、全身吸収を改善する技術。性腺機能低下症の男性を対象としたフェーズ2bの用量測定試験を完了しました 2016年の第3四半期。フェーズ2b臨床試験の主な目的は、LPCN 1111のフェーズ3の開始用量を決定することでした 性腺下部に単回または複数回経口投与した後のLPCN 1111とその代謝産物の安全性と耐容性と一緒に 男性。第2b相試験では、試験した用量範囲にわたって良好な用量反応関係が観察されました。さらに、目標のフェーズ3 用量は一次エンドポイントとセカンダリエンドポイントを満たしました。全体として、LPCN 1111は耐容性が高く、薬物関連の重度または重篤な有害事象はありませんでした フェーズ2bの調査で報告されました。米国とカナダでのLPCN 1111の将来の開発と商品化はすべて責任です 私たちのライセンシーの、Verityの。
その他 パイプライン候補者
私たち 継続的な発展のための提携契約および/または開発協定の機会を追求し続けます および/またはPCN 1148、PCN 1144、PCN 2401、およびPCN 1107のマーケティング。現在、これ以上の重要な実施は予定していません パートナーの参加なしで、これらの製品および製品候補に関する開発活動を行います。あり得ません 私たちにとって有益な、またはまったく有益な条件で提携契約を特定したり、締結したりできることを保証します。たとえ 私たちは提携契約を結んでいますが、そのような取り決めだけではこれらの製品の開発と商品化を成功させるには不十分な場合があります。
LPCN 1148: 非代償性肝硬変の管理のための経口製品候補
私たち 現在、非代償性肝硬変の管理のためのラウリン酸テストステロン(「TL」)を含むLPCN 1148を評価しています。 LPCN 1148は、肝硬変患者の生活の質の向上など、肝硬変患者の満たされていないニーズを対象としていると考えています 肝移植の待機リスト、肝性脳症などの新たな代償不全イベントの予防または低減 (「HE」)、そして肝移植後の生存率の向上(結果と費用を含む)。私たちは、LPCN 1148の開発および/またはマーケティングのために第三者と提携する可能性を模索しています。 会社は提携契約を結んでいませんが。どんな提携契約でもそうなるという保証はありません 完了しました。または、契約が締結された場合、そのような契約は私たちにとって有利な条件で行われるということです。
私たち 治療効果を評価するために、肝硬変の男性被験者を対象に第2相概念実証(「POC」)研究(NCT04874350)を実施しました サルコペニアの管理におけるLPCN 1148の可能性。第2相POC試験は、プロスペクティブ、多施設、無作為化、プラセボ対照試験でした 男性のサルコペニア性肝硬変患者を対象とした研究。被験者は最初、2群のうち1:1から1にランダム化されました。治療群は経口投与でした LPCN 1148で、2番目の群はそれに合ったプラセボでした。バックグラウンドセラピーに関して患者に制限はありませんでしたが、 現在の標準治療、食事、運動を含みます。主要評価項目は、24週目の骨格筋指数の変化でした 肝虚弱指数の変化、HE突破率、全原因を含む順番待ちイベントの数などの副次的評価項目 死亡率。総治療期間は52週間で、24週間のプラセボ対照治療を受けた被験者は、28週間の非盲検投与でLPCN 1148を受けました。 調査期間を52週目までの延長(「OLE」)フェーズ。
に 2023年7月私たちは、第2相試験が研究の主要評価項目であるプラセボと比較して骨格筋指数(L3-SMI)が増加したことを発表しました (P<.01)肝硬変患者を対象としています。この研究では、入院率、入院率、患者報告など、新たな代償不全イベントの予防などの臨床転帰の改善も示されました。LPCNは、プラセボと同様の耐容性の高い有害事象の重症度で、死亡率も示さなかった治療群で、薬物誘発性肝障害の症例もありませんでした。>
に 2024年3月、LPCN 1148の介入を52週間にわたって行い、24週間にわたるL3-SMIの増加が維持され、プラセボ患者を発表しました 調査のオープンラベル延長期間中にLPCN 1148に切り替えた人は、L3-SMIが増加しました。さらに、明らかな肝性脳症が少ない (「OHE」)イベントはLPCN 1148の治療を受けた患者で観察され、OHEイベントが最初に再発するまでの時間は治療を受けた患者の方が長かったです。 LPCN 1148は耐容性が高く、AE発生率と重症度はプラセボと同等で、重篤または重度の有害症状を経験した参加者は少なかった プラセボからLPCN 1148に切り替えられ、治療中の患者の入院日数が減ったときのイベント。タイプCをリクエストする予定です 2024年半ばにLPCN 1148の臨床開発計画について話し合うためにFDAと会います。
病気 概要 — 肝硬変
そこに 世界中で200万件を超える肝硬変の症例があり、米国では50万人以上が非アルコール性肝硬変を患っています 脂肪肝疾患は、肝移植の最も急速に増加している適応症です。肝移植を受けた人の62%(「LT」) 順番待ちリストは男性で、経済的負担(移植1回あたり約812,500ドル)は高く、増え続けています。毎年約半分 LTの順番待ちリストに載っている米国の約17,000人のうち、移植を受けていますが、3,000人近くの患者が死亡または退去しています 彼らは「病気で移植できなかった」ので、リストから。
| 29 |
肝臓 肝硬変は、線維帯に囲まれた再生結節の組織学的発達と定義されています。肝硬変の患者は通常 肝機能が低下し、門脈圧が上昇するまで、何年にもわたって、無症候性の無症候期(代償性肝硬変)が続いています 症状が現れる段階(非代償性肝硬変)に入っている患者。非代償性肝硬変への移行は、臨床上の出来事によって特徴づけられます 腹水、脳症、黄疸、および/または静脈瘤出血を含みます。代償不全の被験者の平均生存期間は2年未満です。 肝硬変の一般的な原因には、アルコール性肝疾患、非アルコール性脂肪性肝疾患(「NAFLD」)、慢性肝炎などがあります BとC、原発性胆汁性肝硬変(「PBC」)、原発性硬化性胆管炎(「PSC」)、そして一部の患者は 原因不明の肝疾患(原因不明)。
共通 肝硬変患者の合併症には、肝機能障害、門脈圧亢進症、内臓を伴う消化管静脈瘤などがあります。 出血、浮腫、腹水、肝性脳症、移植後の急性拒絶反応リスクを伴う免疫障害、高ナトリウム濃度、 ビリルビンの増加、アルブミン値の低下、末梢でのブドウ糖摂取障害を伴うインスリン抵抗性、うつ病、筋肉の加速 サルコペニア、筋脂肪症、エネルギー低下を伴う虚弱、骨疾患(骨粗しょう症など)、高アルカリ性などの障害 ホスファターゼ(「ALP」)、悪液症、栄養失調、体重減少(> 5%)、毛の分布異常などの性腺機能低下症の症状、 貧血、性機能障害、精巣萎縮、筋消耗、疲労、骨粗しょう症、女性化乳房、サイトカインの上昇を伴う炎症、 そして、入院や死につながる感染リスク。
彼、 肝硬変患者の重大な代償不全は、肝機能不全および/または全身門脈によって引き起こされる脳機能障害です シャンティング。損傷した肝臓は(肝硬変のように)正常に機能できないため、アンモニアなどの神経毒は十分に除去されません 体循環から脳に移動し、そこで神経伝達に影響を与えます。これにより、HEの発症が起こる可能性があり、その症状が現れることもあります 軽度から重度までの意識、認知、行動の変化です。顕性HEは患者の 30% から 40% に発生します 病気の臨床過程のある時点で肝硬変を患っています。慢性肝疾患と肝硬変の負担が増えるにつれて、 HEの頻度も増えています。
LPCN 1144:NASHの治療のための生体同一性テストステロン製品の経口プロドラッグ
私たち パートナー契約は締結されていませんが、LPCN 1144のために第三者と提携する可能性を模索しています 会社によって。ライセンス契約が締結されるという保証はありません。また、契約が締結された場合でも、そのような契約が締結されるという保証はありません 合意は私たちにとって有利な条件になるでしょう。
病気 概要 — ナッシュ
ナッシュ は、肝硬変または肝不全に進行する可能性のある非アルコール性脂肪性肝疾患(「NAFLD」)の進行状態です。 肝移植が必要で、肝細胞がん/肝臓がん、そして死に至る可能性があります。NASHの末期肝臓への進行 病気は、肝移植を必要とする肝不全の主な原因の1つです。重要なのは、これらの危機的な状況を超えて、 NASHとNAFLDの患者はさらに心血管リスクが高く、心血管イベントで死亡する頻度は、心血管イベントによる死亡率よりも心血管イベントで死亡する頻度が高くなります 肝臓病。NAFLD/NASHは、成分を含む肥満やメタボリックシンドロームとの強い相関関係により、ますます一般的になりつつあります 糖尿病、心血管疾患、高血圧などのメタボリックシンドロームについてです。米国の人口の20%から30%と推定されています NAFLDに苦しみ、そのグループの15%から20%の大部分が、効果的な治療法のないNASHに進行しています。ナッシュ は、米国では数百万人が罹患しているサイレントキラーです。診断数は増加傾向にあり、米国では劇的に増加すると予想されています 次の10年。NASH患者の約 50% は成人男性です。男性、特にNAFLD/NASHに関連する併存疾患のある男性、テストステロン 欠乏症は、内臓脂肪組織の蓄積の増加とインスリン抵抗性と関連していますが、これが要因かもしれません NAFLD/NASHに貢献しています。いくつかの薬剤候補がありますが、現在、NASHの治療に承認された治療法はありません 現在開発中で、その多くが臨床的に失敗しています。
その NASHの発症と進行の根底にある重要な病態生理学的メカニズムには、脂質を扱う能力の低下、増加などがあります インスリン抵抗性、肝細胞損傷、肝細胞損傷による肝線維症。NASH患者は過剰に蓄積しています 主にエネルギーの必要量を上回るカロリー摂取から生じる肝臓の脂肪です。健康な肝臓の脂肪は 5% 未満です。 しかし、NASHの人の肝臓には、20%以上の脂肪が含まれていることがあります。この異常な肝臓脂肪は、肝臓であるNASHへの進行に寄与します 線維症とも呼ばれる瘢痕化につながり、場合によっては肝硬変や肝不全に進行する可能性のある壊死炎症状態。
| 30 |
現在の ステータス
私たち を完了しました リフト 生検で確認された非肝硬変のNASH被験者を対象とした第2相臨床試験です。ザ・ リフト 臨床研究 生検で性腺下部を対象とした、プロスペクティブ、多施設、無作為化、二重盲検、プラセボ対照の多群研究でした グレードF1-F3の線維症で、NAFLD活動スコアが4以上で、治療期間が36週間の真性生殖腺男性NASH被験者。その リフト 臨床研究には、生検でNASHが確認された56人の男性被験者が登録されました。被験者は1:1:1で3つの治療群のいずれかにランダム化されました(治療 Aは142 mgのテストステロン相当量を1日2回経口投与し、治療Bは142 mgのテストステロン相当量を1日2回経口投与しました 217mgのd-α-トコフェロール相当量を配合し、3番目の投与群は1日2回(プラセボ)でした。
その の主要エンドポイント リフト 臨床研究では、MRI-PDFFによる肝脂肪率の変化と探索的肝脂肪/マーカー末端 12週間の治療後のポイント。さらに、36週間の治療後の主要な副次的評価項目には、組織学的評価が含まれていました NASHの解像度および/または線維症の改善(生検)、および肝臓脂肪データ(MRI-PDFF)の変更。その リフト 臨床研究 どの副次的エンドポイントの統計的有意性も評価できませんでした。その他の重要なエンドポイントは次のとおりです。 肝障害マーカー、擬人化測定値、脂質、インスリン抵抗性、炎症/線維症マーカーの変化。 患者が報告した結果。
トリートメント 12週間の治療の後、LPCN 1144と一緒に リフト MRI-PDFFによる評価によると、研究の結果、肝臓の脂肪が大幅に減少しました。 肝障害マーカーの改善を示しましたが、耐容性の問題は見られませんでした。
肝臓 生検はベースライン(「BL」)と36週間の治療後(「EOS」)に実施されました。事前に指定された生検分析 NASH臨床研究ネットワーク(「CRN」)スコアリングと連続ペア(「ペアテクニック」)を含み、 デジタル技術(「デジタル技術-フィブロネスト」)。生検分析はすべて同じスライドと読み取りで行いました 3つのテクニックは独立して行われました。分析セットには、NASH解像度セット(BLとEOS生検を受けたすべての被験者)が含まれていました BL [NASが4以上、小葉炎症スコアが1以上、肝細胞バルーニングスコアが1以上](n=37))、生検セット (ベースラインとEOS生検を受けたすべての被験者(n=44))、およびセーフティセット(すべてランダム化された被験者(n=56))。
両方 LPCN 1144の治療群は、NASH決議の事前に指定された迅速承認規制エンドポイントである統計的有意性を示しました NASH CRNスコアに基づくと、線維症の悪化は見られませんでした。さらに、どちらの治療群も観察された値の大幅な改善を示しました 脂肪症、炎症、バルーニングにおけるNASH活性。
中に 36週間の治療期間中、LPCN 1144は耐容性が高く、全体的な安全性はプラセボと同等でした。さらに、主題 オープンラベル拡張(「OLE」)調査を通じてLPCN 1144にアクセスできるオプションが与えられました。エクステンションスタディは有効になりました 最大合計72週間の治療に関するLPCN 1144に関する追加データの収集、および36週間の治療に関するデータの収集 プラセボで服用している被験者 リフト 研究。OLE調査の主な結果は次のとおりです。
| ● | LPCN 1144は72週間にわたる暴露に十分耐えられ、安全性の兆候は見られませんでした。 |
| ● | 肝臓 LPCN 1144の長期治療により、傷害マーカーが減少し、維持されました。そして |
| ● | 観察しました 肝臓の組織学の改善はさらなる発展をサポートします。 |
に 2021年11月、FDAは非肝硬変性NASHの治療薬としてLPCN 1144にファストトラック指定を付与しました。ファスト・トラック・プログラムは設計されています 重篤な疾患の治療を目的としたLPCN 1144などの製品の開発を加速し、レビューを迅速に行うためです。 医療ニーズが満たされていない人。
私たち 2022年1月にFDAと開発経路について話し合うためのLPCN 1144 Type C会議について、FDAから書面のみの回答がありました PCN 144で転送してください。FDAは、LPCN 1144のNDA提出が505(b)2規制経路を介して行われることを認め、同意しました NDAの提出を裏付ける追加の非臨床研究は必要ないということです。FDAは、LiFT研究でその被験者を認めました 被験者は、成人を対象にLPCN 1144を36週間治療した後、NASHの組織病理学に関連する主要要素の改善を達成しました 男性で、提案された多成分の一次サロゲートエンドポイントは、アクセラレーテッドの下で承認を求めるのに受け入れられることに同意しました 承認経路。FDAは、提案されている主要な多成分代替エンドポイントである線維症の悪化を伴わないNASHの解決に同意しました。 は、迅速承認経路の下で承認を求めるのに適しており、FDAは研究期間を設けた第3相試験を推奨しました 72週間です。2022年7月、リポシンはNASHのLPCN 1144に関するフェーズ2の終了会議をFDAと開催しました。FDAはフェーズ2を推奨しました ピボタル研究を実施する前に、最適な用量を特定するために用量範囲調査を実施してください。FDAは提案されたユニークに同意しました テストステロンエステル、ラウリン酸テストステロン、将来の臨床研究用。
| 31 |
LPCN 2401:慢性的な体重管理における体組成改善のためのインクレチン模倣薬の補助療法
LPCN 2401は、アナボリックアンドロゲン受容体アゴニストと抗酸化物質であるα-α-トコフェロールを独自に組み合わせた経口製剤です 代謝調節剤。前臨床研究と臨床研究のデータは、LPCN 2401が脂肪を減らしながら除脂肪体重を増やす可能性を裏付けています 質量。インクレチン模倣薬の補助療法として、LPCN 2401は体重の反発を抑え、筋肉の減少を改善する可能性があります 体重、筋肉の質と機能の改善、体組成の改善による脂肪量の減少の促進、体重の維持、「脂肪」の予防 オーバーシュート」と、インクレチン模倣の中止後、筋肉の回復を加速させます。FDAとの面談を依頼して話し合う予定です LPCN 2401の概念実証第2相試験の研究デザイン。第三者と提携する可能性を模索するかもしれませんが、 会社は提携契約を結んでいませんが。ライセンス契約が締結される保証はありません。 または、契約が締結された場合、そのような契約は私たちにとって有利な条件で行われるということです。
病気 概要 — 肥満管理
おおよそ 20歳以上の米国成人の74%が肥満またはオーバーウェイトで、米国の成人人口の推定30%がBMIが30 kg/m以上です2。 肥満は、過剰な体脂肪によって定義される慢性的な再発性の健康リスクです。体脂肪が多すぎると、死亡や主要な併存疾患のリスクが高まります 2型糖尿病、高血圧、脂質異常症、心血管疾患、変形性膝関節症、睡眠時無呼吸、一部のがんなど (ケーターソンとハバードら2004年、カレとトゥーンら1999年)。伝えられるところによると、約2400万人(フリンら。モルガン・スタンレー、2024年2月27日(肥満) 高齢者は筋肉量の減少に最も弱いです。
その 承認された体重管理薬で観察される急激な体重減少には、望ましくない除脂肪量の減少が含まれ、患者の最大40%を占めます 総体重が減りました。さらに、これらの治療法を中止すると、体重が急速に回復することがよくあります。リーンマスの損失は 衰弱/疲労、脂肪量の回復の原因となる新陳代謝の低下、脂肪量の低下など、健康への複数の悪影響 神経筋機能、感情や心理状態への潜在的な影響、怪我のリスクの増加。
いくつか 最近の研究では、体組成、特に除脂肪体重(筋肉)が患者の生存に独立した役割を果たす可能性があることが示されました がんや心血管疾患などの病気で(DH LeeとEL Giovannucci、Exp Biol Med. 2018)。したがって、体に焦点を当てています 除脂肪体重を維持しながら持続的に脂肪量を減らすための肥満管理における構成は、重要な目標であるべきです。
そこに 慢性肥満/体重管理のための経口で効果的な筋肉の維持/増強オプションに対する大きなニーズは満たされていません GLP-1/GIPアゴニスト治療に伴うLMの減少は、より質の高い減量につながります。さらに、必要なのは インクレチン模倣療法の中止時に体重を維持し、脂肪/体重の回復を防ぐための慢性的な長期薬物療法の選択肢です 「オーバーシュート」し、筋肉の回復の遅れを最小限に抑えて、側副肥育を防ぎます。
LPCN 1107: 早産防止の経口製品候補
私たち 提携はしていませんが、LPCN 1107の開発および/またはマーケティングのために第三者と提携する可能性を模索しています 契約は会社によって締結されました。提携契約が締結される保証はありません。また、もしも そのような契約は私たちにとって有利な条件で行われるという合意が完了しました。
| 32 |
私たち LPCN 1107は、カプロン酸ヒドロキシプロゲステロン(「HPC」)の経口投与薬として初めて示される可能性があると思います 単胎妊娠で自然発生歴のある女性のPTB(出産37週間未満)のリスクの軽減 PTB。米国の全妊娠の約11%が新生児の主な原因であるPTBに至っているため、PTBの予防は満たされていない重要なニーズです 死亡率と罹患率。
現在の ステータス
私たち 妊婦を対象とした複数回投与のPK用量選択試験を完了しました。複数回投与のPK選択研究の目的は、評価することでした 適切なLPCN 1107フェーズ3の用量を特定するためのHPC血中濃度。複数回投与のPK用量選択試験は非盲検試験でしたが、 LPCN 1107とIM HPCを3回投与した妊婦を対象とした、4期間、4回の治療、ランダム化、単回投与、複数回投与、PK研究 (マケナ®)。この研究には、在胎週数が約16歳から19歳の健康な妊婦(平均年齢27歳)12人が登録されました。 週間。被験者は、3つの用量レベルのLPCN 1107(400ミリグラムBID、600ミリグラムBID、または800ミリグラムBID)をランダム化クロスオーバー方式で投与されました 最初の3回の治療期間を経て、4回目の治療期間中は毎週5回HPCの注射を受けました。各LPCN中に 1107の治療期間、被験者は1日目にLPCN 1107を1回投与され、2日目から1日2回投与されました。 8。LPCN 1107の3回の治療期間とウォッシュアウト期間の終了後、すべての被験者に週5回のHPC注射を受けました。 この研究の結果は、LPCN 1107の3回の投与すべてで平均定常状態HPCレベル(Cavg0-24)が同等かそれ以上であることを示しました 注射用HPCよりも。さらに、LPCN 1107の3回投与では、1日の投与量の関数としてのHPCレベルは直線的でした。また、とは違って 注射可能なHPC、定常状態での曝露は、LPCN 1107の3回投与すべてで7日以内に達成されました。
A 対象となる患者集団を対象とした従来のPK/PDベースの第2相臨床試験は、開始前に必要ないと予想されます フェーズ3。そのため、複数回投与のPK試験の結果に基づいて、フェーズ2の終了ミーティングとその後のガイダンスミーティングを行いました。 FDAと協力して、LPCN 1107の重要なフェーズ2b/3開発計画を定義します。ただし、これらのディスカッションは最近の内容に基づいて更新される可能性があります CovisのMakena® を使った開発は以下の通りです。投与計画を明らかにするための食品効果研究を完了しました 重要な研究のために、私たちは重要な臨床研究プロトコルをFDAに提出しました。
その FDAは、患者ケアへの多大な貢献に基づいて、LPCN 1107にオーファンドラッグの指定を与えました。希少児の指定はリポシンとみなされます 適格な臨床試験に対する税額控除や処方薬使用者の免除など、さまざまな開発上の優遇措置のため NDAを提出するときに手数料を払います。
最近 コンペティションの最新情報
オン 2020年10月5日、FDAの医薬品評価研究センター(「CDER」)は、Makenaを撤退させることを提案しました PROLONG試験ではMakenaの臨床的利点は検証できず、入手可能なエビデンスでは検証されないと結論付けられたため、市場に出ています Makenaが承認された使用法で有効であることを示しています。
の CDERは、当時NDA保持者だったAMAG Pharmaceuticalsに、承認を取り下げるための聴聞機会通知(「NOOH」)を発行しました のMakenaについて、AMAG Pharmaceuticalsは、ヒアリングを依頼し、会社の立場についての詳細を提供することで回答しました。 臨床医による10年にわたるMakena治療の使用と、承認を取り消すことによる公衆衛生上の影響。FDAコミッショナー 2022年10月17日から19日までCovisとの公聴会を開催し、その結果、14対1の投票で製品の削除が推奨されました 市場から。2022年10月31日、CovisはCDERに連絡し、撤退のきっかけとなる秩序ある撤退の計画の概要を説明しました。 現在の患者が治療コースを完了するのに十分な時間枠です。CDERはこの提案を拒否しました。2023年3月6日に、 Covisは、Makenaを市場から自発的に撤退させる計画を発表し、CDERに最低21週間の契約終了の要請を提出しました。 2023年4月6日、FDAはマケナの承認を取り下げ、マケナといくつかの承認されたジェネリック医薬品の即時撤回を命じました 医薬品の変種で、その医薬品を米国で販売することは違法となっています。FDAは、ニーズが満たされていないことを踏まえて、 早産を防ぎ、新生児の転帰を改善するための治療法です。医学界や科学界では 効果的な治療法を見つけるための努力を強化し、Makenaを撤回する決定がさらに活気を取り戻すのに役立つことへの希望を表明しました 研究。FDAはさらに、患者、研究者、医薬品開発者と協力して進歩させることへのコミットメントを表明しました 早産防止の治療として緊急に必要とされている、安全で効果的な治療法の開発。
金融 業務概要
収入
に 日付、私たちは製品販売から何の収益も生み出しておらず、製品候補の1つが承認されるまで収益を上げる予定はありません FDAから。これまでの収益は、主にライセンス料、ロイヤルティ、マイルストーンの支払い、研究支援から生み出されてきました ライセンシーから。創業から2024年3月31日まで、さまざまなライセンスの下で4,950万ドルの収益を上げてきました とコラボレーションの取り決めと政府の助成金から。収益が見込めるVerityライセンス契約を締結しました 将来のマイルストーンやロイヤルティからですが、私たちの臨床または前臨床開発プログラムのいずれからも収益を得ることはできないかもしれません またはライセンス製品。規制当局の承認を得たり、これらの製品候補を商品化したりすることは決してできない可能性があるためです。
| 33 |
研究 と開発費
研究 開発費は主に給与、福利厚生、株式ベースの報酬、関連する人件費、支払われる手数料で構成されています 委託研究機関や委託製造機関などの外部サービスプロバイダー、契約上の義務 臨床開発、臨床現場、後期臨床試験の製造とスケールアップ、臨床医薬品の調合のため、 と規制当局への提出に関連する費用。研究開発費には、間接費の配分も含まれます。 研究のための直接労働時間の比率に基づく施設、事務費、設備の減価償却費など 開発担当者は、すべての担当者の直接労働時間の合計です。研究開発費は発生に応じて支出します。以来 創業以来、2024年3月31日までに研究開発費として約1億5,010万ドルを費やしてきました。
私たち CNS製品候補を含む他の製品候補を開発するにつれて、引き続き多額の費用がかかると予想されます LPCN 1148による肝硬変の男性被験者を対象とした第2相POC研究の終了、および将来のパイプラインの開発 製品候補です。
に 一般的に、臨床試験の費用は、臨床開発の不確実性の結果として、プロジェクトの全期間にわたって大幅に変動する可能性があります。 とりわけ:
| ● | の 試験に参加したサイトの数。 | |
| ● | の 適切な科目を登録するのに必要な時間。 | |
| ● | の 件名のフォローアップの期間。 | |
| ● | の 試験結果の収集、分析、報告に必要な時間。 | |
| ● | の 規制審査の費用、時期、結果。そして | |
| ● | 潜在的な 臨床試験とNDA申請要件におけるFDAによる変更。 |
未来 研究開発費は、完成までの時期と費用に関して、次のような多くの不確実性の影響を受けます。 その他:
| ● | の 製品候補に対する規制当局への申請とFDAの審査と措置のタイミングと結果。 | |
| ● | 私たちの 満足のいく完成品の製造を第三者メーカーに依存 当社の製品のいずれかで規制当局の承認が得られた場合の登録と発売用 候補者; | |
| ● | の 当社の製品候補の将来のライセンス契約または共同プロモーション契約の可能性 そのような取り決めは、もしあったとしても、そしてそのような取り決めはどの程度確保されるのでしょうか 私たちの将来の計画と資本要件に影響を与えます。そして | |
| ● | の FDAまたはその他の規制当局が講じた措置が当社の製品開発活動に与える影響 当局。 |
A 製品開発候補の開発に関して、これらの変数のいずれかが結果を変えると、かなり大きな意味を持つ可能性があります これらの取り組みに関連するコストとタイミングの変化により、追加の資金調達が必要になる可能性があり、削減が必要になる場合があります オペレーション。
与えられた 臨床開発段階と、臨床開発、製造、および臨床に内在する重大なリスクと不確実性 規制当局の承認プロセスでは、LPCN 1154の開発を完了するまでの時間や費用を確実に見積もることはできません。 PCN 2101、PCN 2203、PCN 2401、PCN 1148、PCN 1144、PCN 1111、PCN 1107、およびその他の製品候補です。臨床開発タイムライン、 成功の確率や開発コストは予想と大きく異なる可能性があり、私たちの臨床試験の結果はそうではないかもしれません 好意的になりましょう。LPCN 1154、LPCN 2101、LPCN 2203、またはその他の将来の製品候補を後の段階に進めることに成功した場合 開発には、追加の資本が必要になります。これらの製品の将来の研究開発費の金額と時期 候補者は、現在の開発活動と潜在的な開発の両方の前臨床および臨床的成功によって決まります 新製品候補のほか、そのような活動の商業的可能性の継続的な評価も行っています。私たちは努力を続けます LPCN 1144、LPCN 1148、LPCN 2401、LPCN 1107の継続的な開発および/またはマーケティングのためのパートナーシップ契約を締結し、 北米以外のトランドとPCN 1111です。
| 34 |
私たち 以下を含む継続的な臨床研究を完了するにつれ、今後も多額の研究開発費が発生すると予想されます CNS製品候補の研究、および将来の臨床研究を実施する際の研究(フェーズ2臨床を実施する時期と実施するかどうかを含む) 当社の開発製品候補に関する研究、およびLPCN 1144、LPCN 1148、およびLPCNで第3相臨床試験を実施する時期と実施かどうか 1107です。また、まだ参入していませんが、LPCN 1144、LPCN 1148、LPCN 2401、LPCN 1107のライセンスを取得する可能性も模索しています ライセンス契約を結び、ライセンス契約が締結される保証はありません。また、契約が締結されている場合は、 そのような合意は私たちにとって有利な条件で行われるだろうと。追加の資本を調達できない、または希薄化しない資金調達が得られない場合は、 継続企業として存続するために、研究開発費を削減する必要があるかもしれません。
将軍 と管理費
将軍 そして、管理費は主に給与とそれに関連する福利厚生で構成されています。これには、当社の役員に関連する株式ベースの報酬も含まれます。 財務、事業開発、管理支援機能。その他の一般管理費には、家賃や光熱費が含まれます。 旅費、監査、税金、法律、その他のさまざまなサービスの専門家費用。
将軍 および管理費には、特許出願の準備、記入、手続き、および維持費も含まれます。 知的財産関連の請求の執行と弁護を行います。
私たち 上場企業として存続するにつれて、一般管理費は今後も増加すると予想しています。これらの費用には法務費が含まれます とコンサルティング料、会計および監査手数料、取締役報酬、取締役および役員の保険料、投資家への手数料 リレーションシップサービス、強化されたビジネスおよび会計システム、訴訟費用、専門家費用、その他の費用。しかし、もし私たち 追加の資本を調達することができません。事業を継続するために、一般管理費を削減する必要があるかもしれません 行商事として。
その他 収入と支出
その他の 収益と費用は、主に、当社の現金、現金同等物、および有価な投資有価証券から得られる利息収入(帰属)で構成されます 2023年のAntaresライセンス契約に基づく最低ロイヤリティに対する利息、および当社の保証責任の損失(利益)。
結果 オペレーションの
比較 2024年3月31日に終了した3か月間のうち
その 次の表は、2024年および2023年3月31日に終了した3か月間の当社の経営成績をまとめたものです。
| 3つ 3月31日に終了した月数 | ||||||||||||
| 2024 | 2023 | 差異 | ||||||||||
| 収入 | $ | 7,617,174 | $ | 54,990です | $ | 7,562,184 | ||||||
| 研究開発費用 | 2,818,926 | 3,106,310 | (287,384) | ) | ||||||||
| 一般と行政 費用 | 1,575,719 | 1,287,313 | 288,406 | |||||||||
| 利息と投資収入 | 331,364 | 370,469 | (39,105) | ) | ||||||||
| 未実現利益(損失) 保証責任 | (40,072 | ) | 98,134 | (138,206) | ) | |||||||
| 所得税費用 | (200) | ) | (200) | ) | - | |||||||
収入
私たち 760万ドルの認識収益は、主に3年間にVerityライセンス契約から受け取ったライセンス収入で構成されています 2024年3月31日に終了した3か月間、および2023年3月31日に終了した3か月間のライセンス収入はそれぞれ55,000ドルでした。
研究 と開発費
その 2024年3月31日に終了した3か月間の研究開発費が、3月に終了した3か月間と比較して減少しました 2023年31日には、受託研究機関の費用と、完了に関連する外部コンサルティング費用が853,000ドル削減されました 2023年に実施したLPCN 1148の調査では、人件費が89,000ドル減少し、LPCN 1111費用が6万ドル減少しましたが、542,000ドルで相殺されました LPCN 1154の臨床研究に関連する費用の増加、TLANDOの製造関連費用の128,00ドルの増加、および44,000ドル その他の研究開発関連費用の増加。
| 35 |
将軍 と管理費
その 2024年3月31日に終了した3か月間の一般管理費が、3月に終了した3か月間と比較して増加しています 2023年31日には、事業開発費が521,000ドル増加し、その他のさまざまな一般管理費が39,000ドル増加します 費用。これらの増加は、さまざまな管理コンサルティング費用の115,000ドルの削減、および企業の83,000ドルの減少によって相殺されます 保険費用、人員の給与と福利厚生の43,000ドルの削減、弁護士費用の31,000ドルの削減。
興味 と投資収入
その 2024年3月31日に終了した3か月間の利息および投資収益が、その期間中の利息および投資収益と比較して減少しました 2023年3月31日に終了した3か月間は、現金と市場性のある投資有価証券の残高が減少したことに加えて 2024年3月31日に終了した3か月間のAntaresライセンス契約契約契約資産への帰属利息。
利得 保証責任について
私たち 3月に終了した3か月間に、約40,000ドルの損失と約98,000ドルのワラント負債の利益を記録しました それぞれ31日、2024年、2023年は、11月に発行された発行済みの普通株式新株予約権の公正価値の変動に関連しています 2019年のオファリング。2024年の損失は、主に期末の株価の上昇による新株予約権の公正価値の上昇によるものでした 2024年の第1四半期の、2023年の第4四半期末の株価と比較したものです。2023年の利益は計り知れません 主にその減少により、2022年12月31日と比較して2023年3月31日現在の発行済新株予約権の公正価値が減少したこと に、2023年第1四半期末の当社の株価を2022年第4四半期末の株価と比較したもの、さらに より高い金利へ。2019年11月のオファリングからの普通株式ワラントは、3月に終了した3か月間は行使されませんでした 2024年31日、または2023年3月31日に終了した3か月間。令状に含まれる条項により、令状は負債として分類されます ワラント保有者がワラントの価値と同額の現金を受け取ることを選択できるワラント契約 Black-Scholesオプション価格モデルに従って決定され、支配権の変更時には一定の前提条件が適用されます。の 保証責任は、現在の株価を含むブラック・ショールズモデルへのインプットに基づいて、今後も変動し続けます。 新株予約権の残存期間、株価の変動性、リスクフリー金利、普通株式新株の数 優れた。
流動性 と資本資源
以来 私たちの創業以来、私たちの事業は、主に当社の株式、証券、負債、および当社の下で受領した支払いによって賄われてきました ライセンスとコラボレーションの取り決め。私たちは、ディスカバリーを含む研究開発プログラムへの資金提供にリソースを費やしてきました 研究、前臨床および臨床開発活動。創業以来、ほとんどの年に営業損失を被っており、私たちは LPCN 1154、LPCN 2101の臨床開発を進めるにつれて、当面の間は営業損失が発生し続けると予想されます。 LPCN 2203、LPCN 2401、および継続的な研究努力を含むその他の将来の製品候補。
として 2024年3月31日現在、無制限の現金、現金同等物、および有価な投資有価証券は、22.0ドルに対し、2,460万ドルでした 2023年12月31日時点で百万です。
オン 2024年1月12日、私たちはVerityとVerityライセンス契約を締結しました。これに基づき、Verityに独占的でロイヤリティを伴うライセンスを付与しました。 米国およびカナダにおけるTRTに関して、TLANDO製品を開発および商品化するサブライセンス可能な権利とライセンス。実行時に 2024年1月のVerityライセンス契約、および2月のTLANDOの商業化がアンタレスからベリティに移行したとき 2024年、Verityは私たちにそれぞれ250万ドルと500万ドルの初期支払いを支払いました。Verityは追加の支払いを行うことにも同意しています 2025年1月1日以前は250万ドル、2026年1月1日までに100万ドルの私たちに。Verityライセンス契約にはVerityも含まれています TLANDO XR(LPCN 1111)を開発し、商品化するライセンスを持っています。これは当社の潜在的な次世代製品で、1日1回限りの経口製品です 米国とカナダでトリデカン酸テストステロン(「TT」)からなるテストステロン補充療法の候補です。私たちは また、特定の開発の成果にもよりますが、合計で最大2億5900万ドルのマイルストーン支払いを受ける資格があります Verityライセンス契約に基づいてVerityによってライセンスされたすべての製品に関する、1暦年内のマイルストーンと販売マイルストーン。 さらに、Verityにライセンスされているすべての製品の純売上高の12%から18%の範囲で、段階的なロイヤリティの支払いを受けます アメリカとカナダ。マイルストーンやロイヤリティの支払いなど、Verityライセンス契約から得られるメリットを実現する当社の能力 は、多くのリスクにさらされています。マイルストーンやロイヤリティの支払いが予定額に達しないか、まったく実現しない場合があります。
| 36 |
オン 2017年3月6日、私たちはカンター・フィッツジェラルド&カンパニーと販売契約(「販売契約」)を締結しました。(「カントール」) これに従い、売買契約に基づいて最大5,000万ドルの売却を登録した普通株式を売却しました。 販売代理店であるCantorを通じて、フォームS-3(「フォームS-3」)の登録届出書に。私たちは作る義務はありませんでした 売買契約に基づく当社の普通株式の売却。2024年3月31日に終了した3か月間、私たちは株式を売却しませんでした 売買契約に基づく当社の普通株式。2017年3月6日以降、および2024年3月31日現在、私たちは普通株式964,711株を売却しました 販売契約に基づくと3,330万ドルで、販売契約に基づいて約4,080万ドルが販売可能でした。
その 売買契約に基づく当社の普通株式の提供は、許可されている限り、売買契約の終了時に終了する可能性があります その中でいつでも10日前に通知し、2024年4月24日に、当社はCantorとの販売契約を終了しました。 2024年4月26日、当社はA.G.P. と販売契約(「A.G.P. 販売契約」)を締結しました。これに従って 当社は、時々、募集総額が次の金額までの普通株式を発行して売却することがあります 募集の基準となる有効な登録届出書に記載されている会社。同社は現在 フォームS-3の登録届出書に従い、売買契約に基づいて10,616,169ドルの普通株式を売却用に登録しました。 修正済み(ファイル番号333-275716)(「フォームS-3」)、会社の販売代理店であるA.G.P. を通じて。A.G.P. は売るかもしれません 規則415(a)(4)で定義されている「市場での提供」とみなされる法律で認められている方法による会社の普通株式 証券法の(ナスダック・キャピタル・マーケットまたはその他の既存の取引市場での直接またはそれを通じた販売を含む) 普通株式、売却時の実勢市場価格または実勢市場価格に関連する価格での交渉取引では、 または法律で認められているその他の方法。A.G.P. は、通常の取引や販売と同様に、商業的に合理的な努力をします A.G.P. 売買契約に基づく株式売却の慣行と適用法および規制。会社はその金額の A.G.P. 3.0% を支払います A.G.P. 売買契約に基づく各株式売却による総収入の合計。さらに、会社はA.G.P. も提供しています。 慣習的な補償権付き。
その A.G.P. 売買契約に基づいて売却される当社の普通株式は、フォームS-3に従って売却および発行されます。 証券取引委員会によって以前に発効が宣言された修正版、および関連する目論見書と、または その他の目論見書の補足。
その 会社は、A.G.P. 売買契約に基づいて普通株式を売却する義務はありません。に基づく普通株式の募集 にA.G.P. 販売契約は、そこで許可されているように、A.G.P. 販売契約の終了時に終了します。会社と A.G.P. はそれぞれ、10日前に通知することで、いつでもA.G.P. 売買契約を解除することができます。
私たち 私たちの既存の資本資源は、それに対する利息と合わせて、私たちの予想される運営要件を満たすのに十分だと思います 少なくとも2025年5月9日まで。これには、LPCN 1154および/またはLPCN 2101の進行中の臨床研究と研究開発活動が含まれます と規制要件の遵守。この見積もりは、間違っていると判明するかもしれない仮定に基づいており、活用することができます 新しい臨床研究を含む追加の活動が当社によって実施された場合、現在の予想よりも早く利用可能な資本リソースが得られます PCN 2203、PCN 1148、PCN 1144、PCN 2401、PCN 1111、および/またはPCN 1107の場合。私たちは十分な流動性と資本があると信じていますが 少なくとも2025年5月9日までに予測される運用要件を賄うためのリソース。ある程度で追加の資本を調達する必要があります 2025年5月9日以前またはそれ以降に、株式市場や債券市場、あるいはその他のアウトライセンス活動を通じて、サポートすべき点を指摘してください 私たちの事業。必要に応じて追加資本を調達できなかった場合、継続企業として継続できるのは 限られています。さらに、当社の事業計画は変更される可能性があり、運営上のニーズと資本要件を満たすために追加の資金が必要になる場合があります 予定より早い製品開発、規制遵守、臨床試験活動のため。さらに、私たちの資本資源 LPCN 1154、LPCN 2101、LPCN 2203、LPCN 2401、LPCN 1148、LPCNについてさらに臨床研究を進めれば、もっと早く消費されるかもしれません 114、および/またはPCN 107です。逆に、経費を削減し、現在の活動数を減らせば、資本資源はより長く続く可能性があります 私たちの運営計画に基づいて、または進行中の臨床研究を中止、変更、または中断した場合に検討されています。以下に従って資本を調達できます AGP売買契約に加入しますが、当社の市場価格が低すぎて当社の裁量でそのような売却を正当化できない場合は、普通株式を発行しないことを選択できます。 の開発、およびFDAの承認を条件として、商品化には多くのリスクと不確実性があります 私たちの製品候補です。当社が第三者とのコラボレーションを行う能力に影響を与えるリスクや不確実性は数多くあります 当社の製品候補の開発と潜在的な商品化に参加します。正確に見積もることはできません 予定されている、または予期しない臨床研究に関連する資本支出と営業支出の増加額、および 継続的な開発努力です。これらすべての要因が、追加の資本資源の必要性に影響します。将来の運営資金を調達するために、私たちは 最終的には追加資金を調達する必要があり、私たちの要件は次のような多くの要因に左右されます。
| ● | の 臨床研究、前臨床試験の範囲、進捗率、結果と費用 LPCN 1154、LPCN 2101を含む、すべての製品候補に関するその他の関連活動 PCN 2203、PCN 2401、PCN 1148、PCN 1144、PCN 1107; | |
| ● | の 当社製品の臨床用品の製造および商業用品の確立にかかる費用 候補品や私たちが開発する可能性のあるあらゆる製品。 |
| 37 |
| ● | の 販売、マーケティング、流通能力を確立するための費用と時期(もしあれば) | |
| ● | の コラボレーション、ライセンス、和解、その他の取り決めの条件と時期 設立するかもしれません。 | |
| ● | の 私たちが追求している製品候補の数と特徴。 | |
| ● | の 規制当局の承認の費用、時期、結果 | |
| ● | の 販売時期、領収書と金額、利益分配、マイルストーン、またはロイヤリティ(ある場合)から 私たちの潜在的な製品; | |
| ● | の 特許請求やその他の準備、出願、訴訟、抗弁および執行にかかる費用 知的財産権; | |
| ● | の 私たちが事業、製品、または技術を買収または投資する範囲。ただし 現在、これらの種類の取引に関する約束や契約はありません。 と | |
| ● | の 従業員数または事業範囲がどの程度大幅に増加したか。 |
資金調達 有利な条件で利用できない場合もあれば、まったく利用できない場合もあります。また、市場の状況により、負債や自己資本にアクセスできない場合があります 売買契約による当社の普通株式の売却を含む市場。必要なときに十分な資金を調達できない場合は、 1つまたは複数の臨床研究、研究開発プログラム、またはもしあれば、延期、対象範囲の縮小、または中断しなければならない場合があります の製品候補がFDAの承認を受け、商品化に取り組んでいます。必要な追加資本を調達するかもしれません 売買契約、デットファイナンス、コラボレーション、戦略など、公開株式または非公開株式の提供を組み合わせて アライアンス、ライセンス契約、その他のマーケティングと流通の取り決め。これらの手配は私たちでは利用できないかもしれませんし 私たちに有利な条件で利用可能です。マーケティングと流通の取り決めを通じて追加資本を調達する範囲で、その他 第三者とのコラボレーション、戦略的提携、またはライセンス契約では、製品に対する貴重な権利を放棄しなければならない場合があります 候補者、将来の収入源、研究プログラム、製品候補、または私たちにとって不利な条件でのライセンスの付与。 パブリックエクイティまたはプライベートエクイティの募集を通じて追加の資本を調達した場合、既存の株主の所有権は 希薄化され、これらの有価証券の条件には、清算またはその他の優先、新株予約権、または悪影響を及ぼすその他の条件が含まれる場合があります 株主の権利、または将来の追加資本の調達がさらに複雑になります。を通じて追加の資本を調達した場合 債務融資。追加措置など、特定の行動を取る能力を制限または制限する契約の対象となる場合があります 借金、資本支出をしたり、配当を申告したりします。何らかの理由で、必要な資金を調達できない場合は、 コスト削減、研究開発プログラムの延期、資産の清算、権利の処分、製品または製品候補の商品化 予定より早く、希望よりも不利な条件で、または事業を削減または中止します。
情報源 と現金の使い方
その 次の表は、2024年および2023年3月31日に終了した3か月間の当社のキャッシュフローの概要を示しています。
| 3つ 3月31日に終了した月数 | ||||||||
| 2024 | 2023 | |||||||
| 現金が提供されました 営業活動によって(使われる) | $ | 2,407,519 | $ | (3,928,057 | ) | |||
| によって提供された(使われた)現金 投資活動 | (4,089,840 | ) | 5,554,757 | |||||
| 資金調達活動に使用された現金 | (8,100 | ) | (6,016) | ) | ||||
ネット 営業活動による現金
中に 2024年3月31日に終了した3か月間、営業活動によって提供された純現金は240万ドルで、3月に終了した3か月間は 2023年31日、営業活動に使用された純現金は390万ドルでした。
ネット 2024年3月31日に終了した3か月間の営業活動によって提供された現金は、主に 750万ドルのVerityライセンス契約は、研究開発を含む継続的な事業を支援するために必要な現金を上回りました 440万ドルの経費と一般管理費。終了した3か月間の営業活動に使用された純現金 2023年3月31日は主に、肝硬変の男性被験者を対象とした第2相POC研究に関連する活動によるものです PCN 1148とLPCN 1154に関連する臨床研究。
| 38 |
ネット 投資活動による現金
中に 2024年3月31日に終了した3か月間、投資活動に使用された純現金は410万ドルで、3月に終了した3か月間は 2023年31日、投資活動によって提供された純現金は560万ドルでした。
ネット 2024年3月31日に終了した3か月間に投資活動に使用された現金は、主に市場性のあるものの購入によるものでした 投資証券、410万ドルの純額。2023年3月31日に終了した3か月間の投資活動によって提供された純現金 主に、560万ドルを差し引いた市場性のある投資有価証券の満期の結果でした。資本はありませんでした 2024年3月31日に終了した3か月間の支出、および3か月間の約4,000ドルの資本支出 2023年3月31日に終了しました。
ネット 財務活動による現金
中に 2024年3月31日と2023年3月31日に終了した3か月間、財務活動に使用された純現金は、それぞれ約8,000ドルと6,000ドルでした。
ネット 2024年3月31日および2023年3月31日に終了した3か月間の資金調達活動に使用された現金は、当社のATMに関連する費用に関連していました カンターでの提供。
契約上の コミットメントと不測の事態
購入します 義務
私たち 通常の業務の中で、臨床研究機関と臨床試験に関する契約を締結し、発注書を発行します そして、臨床用および商業用品の製造、および前臨床研究、研究用品、その他のサービスのベンダーとの連携 と運用目的の製品。これらの契約は通常、通知による解約を規定しており、キャンセル可能な義務です。
運営しています リース
に 2004年8月、ユタ州ソルトレイクシティにあるオフィスと研究室のスペースからなる施設をリースする契約を締結しました。 当社の本社の役割を果たします。2024年1月24日、リースを変更し、2025年2月28日まで延長しました。
クリティカル 会計方針と重要な判断と見積もり
私たちの 私たちの財政状態と経営成績に関する経営陣の議論と分析は、私たちの財務諸表に基づいています これは、米国の一般に認められた会計原則(米国会計基準)に従って作成しました。財務諸表を作成するにあたり、私たちは 報告された資産と負債の金額、開示に影響する見積もりと仮定を行う必要があります 財務諸表の日付における偶発資産と負債、および財務諸表作成中の報告された収益と費用の金額 報告期間。私たちの見積もりは、私たちの歴史的経験と、私たちが信じるその他のさまざまな要因に基づいています 状況下では合理的で、その結果が資産の帳簿価額を判断するための基礎となり、 他の情報源からはすぐには明らかにならない負債。実際の結果は、これらの見積もりとは異なる場合があります 前提条件または条件。Verityライセンス契約と併せて計上されたライセンス収入は要件を満たしていると結論付けました ASC 606「顧客との契約による収益」に基づいています。報告期間ごとに進捗状況を評価し、必要に応じて調整します 業績と関連する収益認識の尺度。将来受け取る予定の支払いによるライセンス収入が計上されます Verityライセンス契約の条件に基づいてライセンスの支払いを受ける可能性が高い場合。
この3年の間、私たちの重要な会計方針に大きな重要な変更はありませんでした 2024年3月31日に終了した月と、「経営陣による財務の議論と分析」で開示された月との比較 フォーム10-Kの「重要な会計方針と重要な判断と見積もり」の状況と運用結果 2024年3月7日に提出されました。
会計 発行された基準は採用されていません
に 2023年11月、財務会計基準審議会(FASB)は、会計基準更新(ASU)2023-07、セグメント報告(トピック)を発表しました 280): 報告対象セグメントの開示の改善。これにより、トピック280に基づく報告要件が強化されます。強化された情報開示 要件には、最高執行意思決定者(CODM)の役職と地位、CODMに提供される多額のセグメント経費が含まれます。 特定の年次開示を暫定期間にまで拡大し、報告対象セグメントの事業体がASC 280を全面的に適用しなければならないことを明確にして、 また、特定の状況下でセグメントの利益または損失の複数の指標を報告することができます。この変更は次の場合に有効です 2023年12月15日以降に始まる会計年度と、2024年12月15日以降に始まる中間期間。この変更は遡及的に適用されます 表示されているすべての期間に。経営陣は現在、このASUの採用が財務諸表に与える影響を評価しています 会社。
| 39 |
アイテム 3。市場リスクに関する量的および質的開示
私たち 市場金利や価格の不利な変動から生じる潜在的な損失を含む、さまざまな市場リスクにさらされています。 金利。私たちは、取引や投機目的でデリバティブやその他の金融商品を取引しません。
そこに 2024年の最初の3か月間、会社の市場リスクに重大な変化はありませんでした。会社の話し合いに 市場リスクへの暴露については、パートII、項目7A、「定量的および」に記載されている当社の市場リスク開示を参照してください 2023年フォーム10-Kの「市場リスクに関する定性的な開示」
アイテム 4。統制と手続き
評価 開示管理と手続きの
私たち 1934年の証券取引法の規則13a-15(e)の意味の範囲内で「開示管理と手続き」を維持し、 改正されたもの、または取引法。当社の開示管理と手続き、または開示管理は、情報を確実に保護するように設計されています このForm 10-Qの四半期報告書など、取引法に基づいて提出または提出する報告書で開示が義務付けられているのは 米国証券取引委員会で指定された期間内に記録、処理、要約、報告されました ルールとフォーム。当社の開示管理には、そのような情報を確実にするために設計された管理と手続きが含まれますが、これらに限定されません が蓄積され、必要に応じて最高経営責任者や最高財務責任者を含む当社の経営陣に伝えられます 必要な開示に関してタイムリーな決定を下せるようにするためです。
として フォーム10-Qのこの四半期報告書の対象期間の終わりに、設計と運用の有効性を評価しました 私たちの開示管理は、監督のもと、最高経営責任者を含む経営陣の参加を得て行われました 役員および当社の最高財務責任者。統制評価に基づいて、当社の最高経営責任者および最高財務責任者は 当社の開示管理は2024年3月31日に発効したと結論付けました。
変更 財務報告の内部統制
そこに 期間中、財務報告に関する当社の内部統制(証券取引法の規則13a-15(f)で定義されているとおり)に変更はありませんでした このレポートの対象となった直近の会計四半期で、当社に重大な影響を及ぼした、または重大な影響を与える可能性がかなり高いもの 財務報告に関する内部統制。
パート III—その他の情報
アイテム 1。法的手続き
お願いします 注10を参照してください — コミットメントと不測の事態 このレポートに含まれる要約連結財務諸表へ 私たちの法的手続きに関する特定の情報については。私たちは現在、重大な訴訟やその他の重要な法的訴訟の当事者ではありません 議事録。私たちは時々、通常の事業活動から生じるさまざまな法的手続きに関与することがあります。 そして、当社はこのような性質の請求をカバーする保険に加入していますが、これらの問題のいずれかが不利に解決されると、重大な可能性があります 将来の経営成績、キャッシュフロー、または財政状態に影響を与えます。
アイテム 1A。リスク要因
に このレポートに記載されている他の情報に加えて、パート1「項目1A」で説明されているリスク要因を検討してください。リスク要因」 2024年3月7日にSECに提出された2023年12月31日に終了した年度のフォーム10-Kで提出された会社の年次報告書には 当社の事業、財政状態、または将来の業績に重大な影響を与える可能性があります。前述のレポートに記載されているリスクは 会社が直面している唯一のリスク。現在会社に知られていない、または現在知られていないと見なされるその他のリスクと不確実性 重要ではありません。また、会社の事業、財政状態、および/または経営成績に重大な悪影響を及ぼす可能性があります。
その 以下は、12月に終了した年度のForm 10-Kに含まれるリスク要因から大幅に変化したリスク要因です 2023年31日、2024年3月7日に証券取引委員会に提出されました:
| 40 |
リスク 当社の普通株式の所有権に関連します
その 2019年11月のオファリングから発行された新株予約権の価値は、変動に基づいて大幅に増減する可能性があります その他の要因の中でも特に、当社の普通株式の価格です。
に 2019年11月、普通株式および普通株式を購入するための新株予約権の公募(「2019年11月の募集」)を完了しました。 2019年11月のオファリングからの総収入は約600万ドルでした。2019年11月のオファリングでは、当社は (i) 614,706を売却しました クラスAユニット。各クラスAユニットは、普通株式1株と普通株式1株を購入するための普通株式ワラントで構成されています 株式、および(ii)91,177のクラスBユニット。各クラスBユニットは、普通株式1株を購入するための1つの事前積立ワラントで構成されています そして、普通株式1株をクラスAユニットあたり8.50ドル、クラスBユニットあたり8.4998ドルの価格で普通株式1株を購入する普通株式ワラント1株です。 事前に出資された新株予約権は、購入者が一定の受益所有権を超えないようにするために、普通株式の代わりに発行されました 制限事項。事前に出資されたワラントは、調整を条件として、1株あたり0.0017ドルの行使価格で直ちに行使可能でした。さらに、 普通株式新株予約権は1株あたり8.50ドルの行使価格で直ちに行使可能で、2024年11月17日に失効します。現在 2024年3月31日、2019年11月の募集による64,362件のワラントが未払いでした。
私たち 普通新株予約権をデリバティブ商品として計上し、新株予約権の公正価値の変動はその他の項目に含まれています 各報告期間の会社の営業報告書の収益(費用)。2024年3月31日現在の公正価値の合計 当社の連結貸借対照表に含まれる保証負債のうち、約57,000ドルでした。私たちはブラック・ショールズを使います ワラントの公正価値を決定するためのオプション価格モデル。その結果、オプション価格モデルでは複数の入力が必要です 株価のボラティリティ、株価、リスクフリー金利などの前提条件。これらの仮定の変更は、重大な影響を与える可能性があります 公正価値の見積もりに影響します。責任はその時点での支配権の変更によってのみ生じる可能性がありますが、最終的にはそうなる可能性があります 帳簿価額と大幅に異なる金額が発生します。
私たちの 経営陣と取締役は、私たちの業務に影響を与えることができます。
として 2024年3月31日現在、当社の執行役員および取締役は、当社の普通株式の約6.1%を受益所有していました。これらの株主、 彼らが一緒に行動すれば、私たちの経営や事務、および重要なものを含め、株主の承認を必要とするすべての事項に影響を与える可能性があります 企業取引。このような所有権の集中は、支配権の変更を遅らせたり妨げたりする効果があり、影響を与える可能性があります 私たちの普通株式の市場価格。
ザル 当社の普通株式の市場価格は、過去1年間変動しており、今後も変動する可能性があります。
ザ・リクシ・ 当社の普通株式の市場価格と取引量は過去1年間変動しており、今後も変動する可能性があります。以上に 昨年、当社の普通株は1株あたり2.36ドルと高値で取引されました。私たちは普通の価格を予測することはできません 株式は将来取引され、下落する可能性があります。当社の普通株式の取引価格は大きく変動する可能性があり、 当社の業績、業界全体に影響を及ぼす発展、一般経済、産業など、多くの要因の影響を受けます。 市場の状況、お客様、普通株式市場の深さと流動性、当社の事業に対する投資家の認識、 業界アナリストによる報告、投資家、競合他社、当社を含む他の市場参加者による発表 お客様、当社の事業に影響を及ぼす規制措置、および本書および年次報告書に記載されているその他の「リスク要因」の影響 2024年3月7日にSECに提出されたフォーム10-Kのレポート。さらに、当社の普通株式の取引価格の変動には一貫性がない可能性があります 私たちの業績と見通しと一緒に。当社の普通株式の市場価格の変動は、当社の事業と相容れない可能性があります 結果と展望。普通株式の市場価格の変動は、投資家の購入能力に悪影響を及ぼす可能性があります または私たちの普通株式を売ってください。
リスク 私たちの財政状態と資本要件に関連して
私たち 創業以来、ほとんどの年に多額の営業損失を被っており、今後も損失が続くと予想しています 近い将来。
私たち 私たちの取り組みのかなりの部分をTLANDOの開発に集中させてきましたが、最近ではLPCN 1154、LPCN 1148、LPCN 1144に集中しています。私たちは 当社の株式、証券、負債、およびライセンスとコラボレーションの下で受領した支払いを通じて、これまでの事業に資金を提供してきました 取り決め。私たちは創業以来、ほとんどの年に損失を被ってきました。2024年3月31日現在、私たちの累積赤字は196.3ドルでした 百万。当社の営業損失のほとんどすべてが、研究開発プログラムに関連して発生した費用によるものでした そして、私たちの事業に関連する一般管理費から。これらの損失は、将来予想される損失と合わせて そして、株主資本と運転資本に引き続き悪影響を及ぼします。今後も多額の損害を被ると予想しています LPCN 1154、および潜在的にはLPCN 2101、LPCNに関連する臨床試験に関連する研究開発費 2203、PCN 2401です。PCN 1148、PCN 1144、LPCN 1107、さらに臨床試験が開始されれば。その結果、私たちはこれからもそうなることを期待しています LPCN 1154、LPCN 2101、LPCNのさらなる臨床開発を評価しているため、当面の間、重大な営業損失が発生します 他のプログラムと継続的な研究努力に加えて、2203、LPCN 2401、そしておそらくLPCN 1148、LPCN 1144、LPCN 1107です。なぜなら 医薬品の開発に関連する数多くのリスクと不確実性のうち、その程度を予測することはできません 将来の損失、または利益が出る時期(もしあれば)
| 41 |
アイテム 6。展示品
索引 展示品へ
| 示す | 法人化 参考までに | |||||||||
| 番号 | 展示 説明 | フォーム | SEC ファイル番号。 | 示す | ファイリング 日付 | |||||
| 3.1 | 改正および改訂された細則 | 8-K | 333-178230 | 3.3 | 2013年7月25日 | |||||
| 3.2 | Lipocine Inc.の修正および改訂された細則の改正 | 8-K | 001-36357 | 3.1 | 3/10/2023 | |||||
| 3.3 | 修正および改訂された法人設立証明書 | 8-K | 333-178230 | 3.2 | 2013年7月25日 | |||||
| 3.4 | シリーズAジュニア参加優先株式の指定証明書。 | 8-K | 001-36357 | 3.1 | 2015 年 12 月 1 日 | |||||
| 3.5 | シリーズAジュニア参加優先株式の増加証明書 | 8-K | 001-36357 | 3.1 | 2021年11月1日 | |||||
| 3.6 | Lipocine Inc.の修正および改訂された法人設立証明書の修正証明書 |
8-K | 001-36357 | 3.1 | 2022年6月28日 | |||||
| 3.7 | シリーズB優先株式の指定証明書 | 8-K | 001-36357 | 3.2 | 3/10/2023 | |||||
| 3.8 | Lipocine Inc.の修正および改訂された法人設立証明書の修正証明書 | 8-K | 001-36357 | 3.1 | 5/11/2023 | |||||
| 31.1* | 認定 2002年のサーベンス・オクスリー法第302条に基づく最高執行役員 | |||||||||
| 31.2* | 認定 2002年のサーベンス・オクスリー法第302条に基づく最高財務責任者 | |||||||||
| 32.1* | 認定 2002年のサーベンス・オクスリー法、18U.S.C. 1350(1)の第906条に基づく最高執行責任者 | |||||||||
| 32.2* | 認定 2002年のサーベンス・オクスリー法、18U.S.C. 1350(1)の第906条に基づく最高財務責任者 | |||||||||
| 101.インチ* | XBRL インスタンスドキュメント-XBRLタグがインタラクティブデータファイルに埋め込まれているため、インスタンスドキュメントはインタラクティブデータファイルに表示されません インライン XBRL ドキュメント。 | |||||||||
| 101.SCH* | インライン XBRL タクソノミー拡張スキーマ文書 | |||||||||
| 101.CAL* | インライン XBRLタクソノミー拡張計算リンクベースドキュメント | |||||||||
| 101.DEF* | インライン XBRL タクソノミー拡張定義リンクベース文書 | |||||||||
| 101.LAB* | インライン XBRL タクソノミー拡張ラベルリンクベースドキュメント | |||||||||
| 101.PRE* | インライン XBRL タクソノミー拡張プレゼンテーションリンクベースドキュメント | |||||||||
| 104 | カバー ページインタラクティブデータファイル(インラインXBRLとしてフォーマットされ、別紙101に含まれています) | |||||||||
| * | ここに提出 |
| ** | 管理 契約または報酬プランまたは取り決め |
| + | 特定のものに関しては機密扱いが認められています この展示の一部。省略された部分は、証券取引委員会に個別に提出されています |
| (1) | この証明書は、関連するフォーム10-Qに添付されています。 は証券取引委員会に提出されたとは見なされず、登録者の提出書類に参照として組み込むことはできません 証券法または証券取引法(フォーム10-Qの日付より前か後に作成されたかを問わない)に基づいて、一般的な法人化は関係ありません そのような申告書に含まれる言語。 |
| 42 |
署名
に従って 1934年の証券取引法の要件に従い、登録者は、登録者に代わってこの報告書に正式に署名させました 署名した人は正式に承認されました。
| リポシン 株式会社。 | |
| (登録者) | |
| 日付: 2024年5月9日 | /s/ マヘシュ・V・パテル |
マヘシュ V. Patel、社長兼チーフ エグゼクティブ 役員 (校長 執行役員兼最高財務責任者) | |
| 日付: 2024年5月9日 | /s/ クリスタ・フォガティ |
クリスタ フォガティ、コーポレートコントローラー (校長) 会計責任者) |
| 43 |