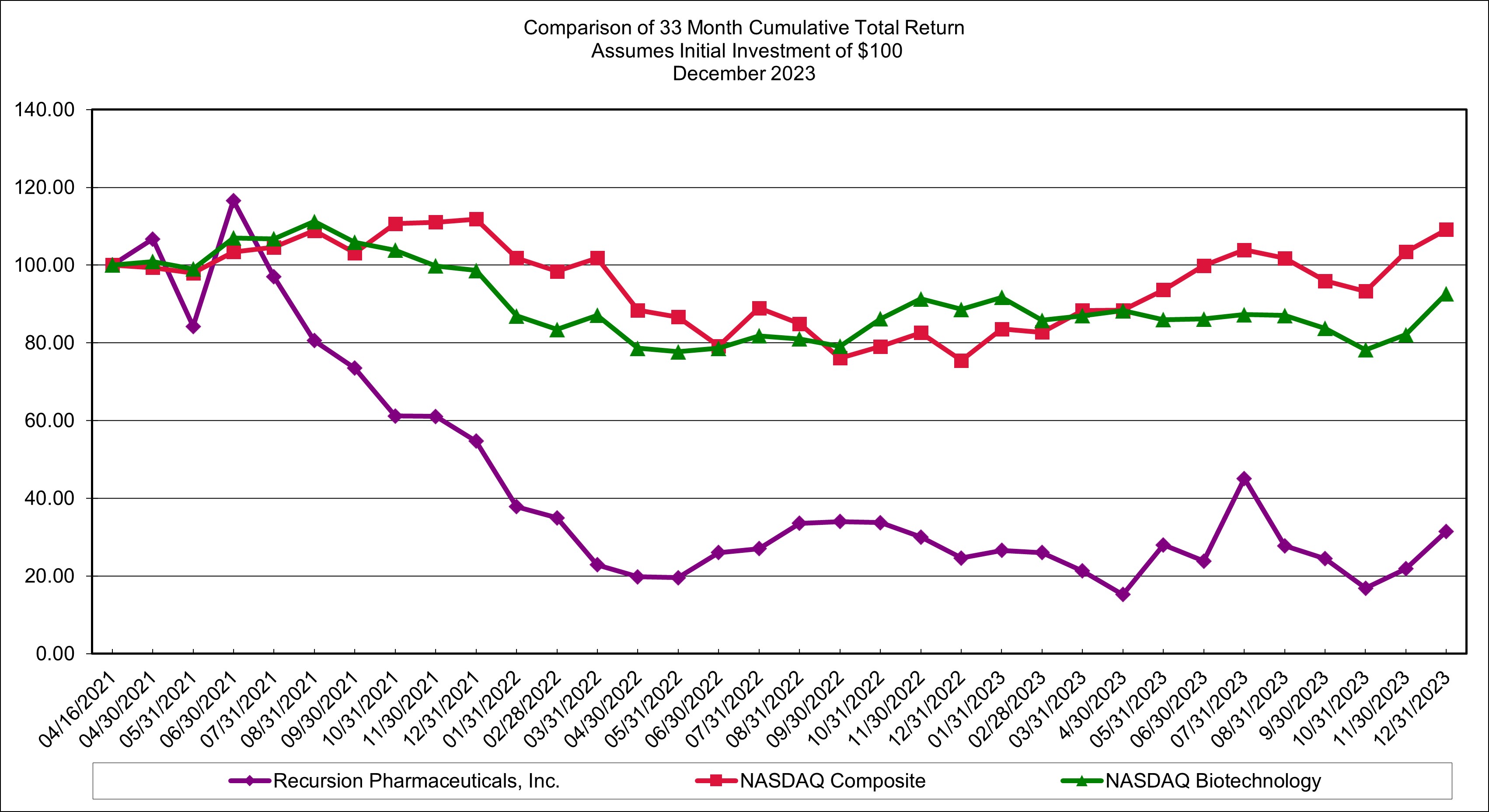
rxrx — 202312310001601830虚像2023会計年度P 7 D10010010043500016018302023-01-012023-12-3100016018302023-06-30iso4217: USD0001601830アメリカ-公認会計基準:公共カテゴリメンバー2024-01-31xbrli: 株式0001601830アメリカ-公認会計基準:公共カテゴリメンバー2024-01-3100016018302023-12-3100016018302022-12-31iso4217: USDxbrli: 株式0001601830アメリカ-公認会計基準:公共カテゴリメンバー2022-12-310001601830アメリカ-公認会計基準:公共カテゴリメンバー2023-12-310001601830アメリカ-公認会計基準:公共カテゴリメンバー2022-12-310001601830アメリカ-公認会計基準:公共カテゴリメンバー2023-12-310001601830rxrx: 交換可能ストックメンバー2023-12-310001601830rxrx: 交換可能ストックメンバー2022-12-310001601830US-GAAP:ライセンスとサービスメンバー2023-01-012023-12-310001601830US-GAAP:ライセンスとサービスメンバー2022-01-012022-12-310001601830US-GAAP:ライセンスとサービスメンバー2021-01-012021-12-310001601830アメリカ-公認会計基準:メンバーに授与2023-01-012023-12-310001601830アメリカ-公認会計基準:メンバーに授与2022-01-012022-12-310001601830アメリカ-公認会計基準:メンバーに授与2021-01-012021-12-3100016018302022-01-012022-12-3100016018302021-01-012021-12-3100016018302020-12-310001601830アメリカ-アメリカ公認会計基準:普通株式メンバー2020-12-310001601830US-GAAP:AdditionalPaidInCapitalMembers2020-12-310001601830アメリカ-公認会計基準:前払いメンバーを保留2020-12-310001601830アメリカ公認会計原則:他の総合収入メンバーを累計2020-12-310001601830アメリカ-公認会計基準:前払いメンバーを保留2021-01-012021-12-310001601830アメリカ公認会計原則:他の総合収入メンバーを累計2021-01-012021-12-310001601830アメリカ-アメリカ公認会計基準:普通株式メンバー2021-01-012021-12-310001601830US-GAAP:AdditionalPaidInCapitalMembers2021-01-012021-12-310001601830米国-GAAP:転換可能な第一選択株メンバー2021-01-012021-12-310001601830アメリカ-アメリカ公認会計基準:普通株式メンバーrxrx: シリーズ A とシリーズ B ワラントメンバー2021-01-012021-12-310001601830US-GAAP:AdditionalPaidInCapitalMembersrxrx: シリーズ A とシリーズ B ワラントメンバー2021-01-012021-12-310001601830rxrx: シリーズ A とシリーズ B ワラントメンバー2021-01-012021-12-3100016018302021-12-310001601830アメリカ-アメリカ公認会計基準:普通株式メンバー2021-12-310001601830US-GAAP:AdditionalPaidInCapitalMembers2021-12-310001601830アメリカ-公認会計基準:前払いメンバーを保留2021-12-310001601830アメリカ公認会計原則:他の総合収入メンバーを累計2021-12-310001601830アメリカ-公認会計基準:前払いメンバーを保留2022-01-012022-12-310001601830アメリカ公認会計原則:他の総合収入メンバーを累計2022-01-012022-12-310001601830アメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-12-310001601830US-GAAP:AdditionalPaidInCapitalMembers2022-01-012022-12-310001601830アメリカ-アメリカ公認会計基準:普通株式メンバー2022-12-310001601830US-GAAP:AdditionalPaidInCapitalMembers2022-12-310001601830アメリカ-公認会計基準:前払いメンバーを保留2022-12-310001601830アメリカ公認会計原則:他の総合収入メンバーを累計2022-12-310001601830アメリカ-公認会計基準:前払いメンバーを保留2023-01-012023-12-310001601830アメリカ-アメリカ公認会計基準:普通株式メンバー2023-01-012023-12-310001601830US-GAAP:AdditionalPaidInCapitalMembers2023-01-012023-12-310001601830アメリカ-アメリカ公認会計基準:普通株式メンバーrxrx: TempusAgreementMember2023-01-012023-12-310001601830US-GAAP:AdditionalPaidInCapitalMembersrxrx: TempusAgreementMember2023-01-012023-12-310001601830rxrx: TempusAgreementMember2023-01-012023-12-310001601830アメリカ-アメリカ公認会計基準:普通株式メンバー2023-12-310001601830US-GAAP:AdditionalPaidInCapitalMembers2023-12-310001601830アメリカ-公認会計基準:前払いメンバーを保留2023-12-310001601830アメリカ公認会計原則:他の総合収入メンバーを累計2023-12-310001601830rxrx: TempusAgreementMember2022-01-012022-12-310001601830rxrx: TempusAgreementMember2021-01-012021-12-3100016018302021-04-012021-04-30xbrli: 純粋00016018302021-04-30rxrx: class0001601830アメリカ-アメリカ公認会計基準:普通株式メンバー2021-04-012021-04-30rxrx: financial_institutional0001601830アメリカ-GAAP:OfficeEquipmentMembers2023-12-310001601830rxrx: 研究室機器メンバー2023-12-310001601830アメリカ-公認会計基準:リース改善メンバー2023-12-3100016018302022-01-010001601830rxrx: TempusLabsIncMember2023-11-012023-11-300001601830SRT:最小メンバ数rxrx: TempusLabsIncMember2023-11-300001601830rxrx: TempusLabsIncMemberSRT:最大メンバ数2023-11-300001601830米国-公認会計基準:その他の現在の資産メンバー2023-01-012023-12-310001601830rxrx: 研究室機器メンバー2022-12-310001601830アメリカ-公認会計基準:リース改善メンバー2022-12-310001601830アメリカ-GAAP:OfficeEquipmentMembers2022-12-310001601830アメリカ公認会計基準:資産建設メンバー2023-12-310001601830アメリカ公認会計基準:資産建設メンバー2022-12-310001601830rxrx: BioHiveSupercomputerMember2023-01-012023-12-310001601830米国-GAAP:NoteesPayableOtherPayableメンバー2023-01-012023-01-310001601830米国-GAAP:NoteesPayableOtherPayableメンバー2023-01-310001601830米国-GAAP:NoteesPayableOtherPayableメンバー2023-12-310001601830米国-GAAP:NoteesPayableOtherPayableメンバーrxrx: Station41LeaseMember2018-01-012018-12-310001601830米国-GAAP:NoteesPayableOtherPayableメンバーrxrx: Station41LeaseMember2018-12-310001601830米国-GAAP:NoteesPayableOtherPayableメンバーrxrx: Station41 リースメンバー2023-12-310001601830rxrx: ValenceDiscoveryIncMemberアメリカ-公認会計基準:公共カテゴリメンバー2023-05-162023-05-160001601830rxrx: ValenceDiscoveryIncMemberrxrx: 交換可能ストックメンバー2023-05-162023-05-160001601830rxrx: ValenceDiscoveryIncMember米国-公認会計基準:従業員株式オプションメンバー2023-05-162023-05-160001601830rxrx: ValenceDiscoveryIncMemberアメリカ公認会計基準:従業員ストックメンバー2023-05-162023-05-160001601830rxrx: ValenceDiscoveryIncMember2023-05-162023-05-160001601830rxrx: ValenceDiscoveryIncMember2023-05-160001601830rxrx: ValenceDiscoveryIncMemberUS-GAAP:技術ベース無形資産メンバ2023-05-160001601830rxrx: ValenceDiscoveryIncMember2023-01-012023-12-310001601830rxrx: CyclicaIncMemberアメリカ-公認会計基準:公共カテゴリメンバー2023-05-252023-05-250001601830rxrx: CyclicaIncMember米国-公認会計基準:従業員株式オプションメンバー2023-05-252023-05-250001601830rxrx: CyclicaIncMemberアメリカ-公認会計基準:公共カテゴリメンバー2023-12-312023-12-310001601830rxrx: CyclicaIncMember2023-05-252023-05-250001601830rxrx: CyclicaIncMemberアメリカ公認会計基準:従業員ストックメンバー2023-05-252023-05-250001601830rxrx: CyclicaIncMember2023-05-250001601830US-GAAP:技術ベース無形資産メンバrxrx: CyclicaIncMember2023-05-250001601830rxrx: CyclicaIncMember2023-01-012023-12-310001601830rxrx: RecursionValenceAndCyclicaMember2023-01-012023-12-310001601830rxrx: RecursionValenceAndCyclicaMember2022-01-012022-12-310001601830SRT:最小メンバ数2023-12-310001601830SRT:最大メンバ数2023-12-310001601830rxrx: TorontoLeaseMember2022-05-012022-05-31Utr:SQFT0001601830rxrx: TorontoLeaseMember2022-05-3100016018302023-10-27rxrx: claimrxrx: 投票0001601830アメリカ-公認会計基準:公共カテゴリメンバーrxrx: AtTheMarketOffering プログラムメンバー2023-08-082023-08-080001601830rxrx: NVDIAPrivatePlacementMemberアメリカ-公認会計基準:公共カテゴリメンバー2023-07-112023-07-110001601830アメリカ-公認会計基準:公共カテゴリメンバー2023-07-110001601830アメリカ-公認会計基準:公共カテゴリメンバー2023-07-112023-07-110001601830アメリカ-公認会計基準:公共カテゴリメンバー2023-05-160001601830rxrx: 交換可能ストックメンバー2023-01-012023-12-310001601830アメリカ-公認会計基準:公共カテゴリメンバーrxrx: A2022PrivatePlacementMember2022-10-012022-10-310001601830アメリカ-公認会計基準:公共カテゴリメンバーrxrx: A2022PrivatePlacementMember2022-10-310001601830rxrx: NVDIAPrivatePlacementMember2023-07-310001601830rxrx: NVDIAPrivatePlacementMemberSRT:最大メンバ数2023-07-310001601830rxrx: NVDIAPrivatePlacementMember2023-12-310001601830rxrx: ValenceDiscoveryIncMember2023-05-012023-05-3100016018302022-10-310001601830米国-GAAP:IPOメンバー2021-04-202021-04-200001601830米国-GAAP:IPOメンバー2021-04-200001601830rxrx: ChristopherGibsonAndAffiliates メンバー2023-12-310001601830アメリカ-公認会計基準:連携性手配メンバーrxrx: RocheAndGenentech メンバー2022-01-310001601830アメリカ-公認会計基準:連携性手配メンバーrxrx: PhenomapsCreationMemberrxrx: RocheAndGenentech メンバー2022-01-012022-01-31rxrx : phenomap0001601830アメリカ-公認会計基準:連携性手配メンバーrxrx: PhenomapsRawImagesMemberrxrx: RocheAndGenentech メンバー2022-01-012022-01-310001601830アメリカ-公認会計基準:連携性手配メンバーrxrx: RocheAndGenentech メンバーrxrx: 開発および商用化プログラムメンバー2022-01-012022-01-31rxrx: program0001601830アメリカ-公認会計基準:連携性手配メンバーrxrx: RocheAndGenentech メンバー2022-01-012022-01-31rxrx: performance_obligation0001601830アメリカ-公認会計基準:連携性手配メンバーrxrx: RocheAndGenentech メンバーrxrx: 消化管がんメンバー2022-01-012022-01-310001601830アメリカ-公認会計基準:連携性手配メンバーrxrx: 神経科学メンバーrxrx: RocheAndGenentech メンバー2022-01-012022-01-310001601830アメリカ-公認会計基準:連携性手配メンバーrxrx: Bayer AGMember2020-10-012020-10-310001601830アメリカ-公認会計基準:連携性手配メンバーrxrx: BayerAGMember2020-10-310001601830アメリカ-公認会計基準:連携性手配メンバー2023-12-310001601830アメリカ-公認会計基準:連携性手配メンバーrxrx: RocheAndGenentech メンバー2023-12-310001601830US-GAAP:顧客集中度リスクメンバー米国-GAAP:SalesRevenueNetMembersrxrx: TwoCustomersMember2022-01-012022-12-310001601830US-GAAP:顧客集中度リスクメンバー米国-GAAP:SalesRevenueNetMembersrxrx: TwoCustomersMember2023-01-012023-12-310001601830US-GAAP:顧客集中度リスクメンバーrxrx : OneCustomerMember米国-GAAP:SalesRevenueNetMembers2021-01-012021-12-310001601830rxrx: A2021 株式インセンティブプランメンバー2021-04-300001601830rxrx: A2021 株式インセンティブプランメンバー2023-12-310001601830米国-GAAP:販売コストメンバー2023-01-012023-12-310001601830米国-GAAP:販売コストメンバー2022-01-012022-12-310001601830米国-GAAP:販売コストメンバー2021-01-012021-12-310001601830米国-公認会計基準:研究·開発費メンバー2023-01-012023-12-310001601830米国-公認会計基準:研究·開発費メンバー2022-01-012022-12-310001601830米国-公認会計基準:研究·開発費メンバー2021-01-012021-12-310001601830アメリカ-公認会計基準:一般と行政費用メンバー2023-01-012023-12-310001601830アメリカ-公認会計基準:一般と行政費用メンバー2022-01-012022-12-310001601830アメリカ-公認会計基準:一般と行政費用メンバー2021-01-012021-12-310001601830アメリカ公認会計基準:従業員ストックメンバー2023-01-012023-12-310001601830米国-公認会計基準:従業員株式オプションメンバー2023-01-012023-12-310001601830米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310001601830米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001601830米国-GAAP:制限株式単位RSUメンバー2021-04-012021-04-300001601830米国-公認会計基準:制限された株式メンバー2022-12-310001601830米国-公認会計基準:制限された株式メンバー2023-01-012023-12-310001601830米国-公認会計基準:制限された株式メンバー2023-12-310001601830米国-GAAP:国内/地域メンバー2023-12-310001601830米国-GAAP:国内/地域メンバー2022-12-310001601830アメリカ-公認会計基準:州と地方法律法規のメンバー2023-12-310001601830アメリカ-公認会計基準:州と地方法律法規のメンバー2022-12-310001601830アメリカ-公認会計基準:外国人メンバー2023-12-310001601830米国-GAAP:国内/地域メンバーアメリカ-公認会計基準:研究メンバー2023-12-310001601830アメリカ-公認会計基準:州と地方法律法規のメンバーアメリカ-公認会計基準:研究メンバー2023-12-310001601830米国-GAAP:国内/地域メンバーアメリカ-公認会計基準:研究メンバー2022-12-310001601830アメリカ-公認会計基準:州と地方法律法規のメンバーアメリカ-公認会計基準:研究メンバー2022-12-310001601830rxrx: OrphanDrugCreditCarryforwardMember2023-12-310001601830rxrx: OrphanDrugCreditCarryforwardMember2022-12-310001601830米国-公認会計基準:従業員株式オプションメンバー2023-01-012023-12-310001601830米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310001601830米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001601830rxrx: TempusAgreementMember2023-01-012023-12-310001601830rxrx: TempusAgreementMember2022-01-012022-12-310001601830rxrx: TempusAgreementMember2021-01-012021-12-310001601830米国-GAAP:転換可能な第一選択株メンバー2023-01-012023-12-310001601830米国-GAAP:転換可能な第一選択株メンバー2022-01-012022-12-310001601830米国-GAAP:転換可能な第一選択株メンバー2021-01-012021-12-310001601830アメリカ公認会計基準:保証メンバー2023-01-012023-12-310001601830アメリカ公認会計基準:保証メンバー2022-01-012022-12-310001601830アメリカ公認会計基準:保証メンバー2021-01-012021-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:MoneyMarketFundsMembers2023-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2023-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2023-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:MoneyMarketFundsMembersアメリカ-公認会計基準:公正価値投入レベル3メンバー2023-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定する2023-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2023-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:MoneyMarketFundsMembers2022-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2022-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2022-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:MoneyMarketFundsMembersアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001601830アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001601830アメリカ-公認会計基準:その他の部分公正価値公正価値開示メンバー米国-GAAP:NoteesPayableOtherPayableメンバー2023-12-310001601830アメリカ-公認会計基準:その他の部分公正価値公正価値開示メンバー米国-GAAP:NoteesPayableOtherPayableメンバー2022-12-310001601830US-GAAP:EstimateOfFairValueFairValueDisclosureMember米国-GAAP:NoteesPayableOtherPayableメンバー2023-12-310001601830US-GAAP:EstimateOfFairValueFairValueDisclosureMember米国-GAAP:NoteesPayableOtherPayableメンバー2022-12-310001601830アメリカ-公認会計基準:その他の部分公正価値公正価値開示メンバー2023-12-310001601830アメリカ-公認会計基準:その他の部分公正価値公正価値開示メンバー2022-12-310001601830US-GAAP:EstimateOfFairValueFairValueDisclosureMember2023-12-310001601830US-GAAP:EstimateOfFairValueFairValueDisclosureMember2022-12-310001601830rxrx: LondonLeaseMemberアメリカ公認会計基準:副次的事件メンバー2024-01-012024-01-310001601830rxrx: LondonLeaseMemberアメリカ公認会計基準:副次的事件メンバー2024-01-3100016018302023-10-012023-12-310001601830rxrx: クリストファー · ギブソンメンバー2023-01-012023-12-310001601830rxrx: クリストファー · ギブソンメンバー2023-10-012023-12-310001601830rxrx: クリストファー · ギブソンメンバー2023-12-31 | | |
アメリカです アメリカ証券取引委員会 ワシントン D. C. 20549
形式 10-K
(マーク1) ☒ 1934 年証券取引所法第 13 条または第 15 条 ( d ) に基づく年次報告書 本財政年度末まで十二月三十一日, 2023 あるいは…。 ☐ 1934 年証券取引所法第 13 条または第 15 条 ( d ) に基づく移行報告書 移行期間中から へ 委員会ファイル番号 : 001-40323
再帰製薬会社です。 (登録者の正確な氏名はその定款に記載)
デラウェア州___________________________________________________ 46-4099738 (登録設立又は組織の国又はその他の管轄区域)______________________(国際税務局雇用主身分証明書番号)
41 S リオグランデストリート ソルトレイクシティ、UT!84101 (主な行政事務室住所)(郵便番号) (385) 269 - 0203 (登録者の電話番号、市外局番を含む) |
| | | | | | | | |
同法第12条(B)に基づいて登録された証券: |
| クラスごとのタイトル | 取引コード | 登録された各取引所の名称 |
| クラス A 普通株式、額面価値 $0.00001 | RXRX | ナスダック世界ベスト市場 |
| | |
同法第12条(G)に基づいて登録された証券:なし
_____________________________________________________________________________________________________ (クラス名)
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください はい x 違います。 o 登録者がこの法第13節または第15節(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示す。 はい o 違います。 x
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す。 はいxありません。☐
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す はいxありません。☐
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
|
| | | | | | | | | | | | | | |
| 大型加速ファイルサーバ | x | | 非加速ファイルサーバ | ☐ |
| ファイルマネージャを加速する | ☐ | | 規模の小さい報告会社 | ☐ |
| | | 新興成長型会社 | ☐ |
| | |
新興成長企業の場合は、登録者が取引法第 13 条 ( a ) に基づき提供される新しいまたは改訂された財務会計基準を遵守するために延長移行期間を使用しないことを選択したかどうかをチェックマークで示します。 ☐
登録者が、 Sarbanes—Oxley 法 ( 15 U. S.C. ) のセクション 404 ( b ) に基づく財務報告に関する内部統制の有効性に関する経営陣の評価に関する報告書および証明書を提出したかどうかをチェックマークで示します。監査報告書を作成または発行した登録公認会計士事務所による 7262 ( b ) 。 ☒
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する☐
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す
登録者がシェル会社であるかどうかをチェックマークで示します ( 取引法規則 12 b—2 で定義 ) 。 はい ☐ありません。☒
登録者が最近完成した第2財期(2023年6月30日)の最終営業日までに,登録者非関連会社が保有する124,546,642株A類普通株総時価はナスダックの終値で$と計算される930.41000万ドルです
2024年1月31日までに227,143,401そして 7,509,871登録者のA類とB類普通株の額面はそれぞれ流通株1株当たり0.00001ドルである。 |
引用で編入された書類
以下では,登録者2024年株主総会に関連する最終委託書の一部を引用して本報告の第3部に組み込む。 |
| | | | | | | | |
| | |
私たちからの手紙 共同創業者兼最高経営責任者 尊敬する現職または潜在的な株主: 再帰は2023年にその10周年を祝い、過去10年間の建設を振り返り、次の10年を展望すると、私たちが巨大な技術と人工知能駆動の社会転換の中にいることをますますはっきりと感じるようになった。 知識型従業員の仕事は大規模な変革の瀬戸際にある;今日プロセス、システムと交付に埋め込まれた大部分の苦労はより高い効率、より多くの創造力と賢明な冒険精神に位置することになり、新しいツールは迅速かつ深い実験と迅速な失敗を可能にする。多くの人にとって、このような変化する仕事の構造を抱きしめることは動揺するだろうが、技術がもたらす可能性に開放的な人にとっては、エキサイティングな新しい未来が彼らを待っている。 過去の社会のすべての重大な変化のように、私たちはますます多くの新しいツールのリスクと機会を受け入れるので、私たちは多くの新しい挑戦と障害に直面するだろう。これらのツールはますます入手しやすくなっている。 バイオテクノロジーの今後10年間のTechBioへの変化に伴い、社会の広範な変革は生命科学に反映される。生物化学のデジタル化は地図やナビゲーションの方法を予測することができ、より良い薬を発見するのではなく、より少ない失敗でより速く設計できるようになるだろう。実験室自動化、生物学的ツール、およびヒトの健康に関する進歩を定量化することは、人工知能駆動の洞察改変生命科学を支援するヒトの健康および疾患に関する膨大なデータセットの出現を可能にするであろう。 もちろん,人工知能“ブラックボックス”が今後12−24カ月以内に新たな療法を大規模に発売するという考え方は間違っていると考えられ,このようなスクランブルに悩まされないように気をつけなければならない。薬物発見は複雑すぎ,手順が多すぎ,フィードバック回路が長すぎて,そのような“一晩”のローテーションには適していない。しかし、私たちがどれだけ遠くに行ったか、そして私たちが今日見た複合的な改善を振り返ってみると、私は私たちの業界が今後10年でこれまで以上に大きな変化が起こると信じている。 |
| | |
| | |
| | 懐疑者のよく見られる論点の1つは,生物学が複雑すぎ,医療が複雑すぎて,このような破壊的な技術変革は不可能であることである。しかし、これまでの産業革命のように、1つ(または複数)の新技術は、私たち自身の分野を含む様々な分野を推進する力と仮定を根本的に再構築する潮流を開始している。以下にこのような変化が起きていることを示すいくつかの事実を示す データと計算: •過去24ヶ月間世界で発生したデータはこれまでの人類史上のすべてのデータよりも多いです •過去12ヶ月で世界は人類の歴史よりも多くの計算周期を消費しました 生物学的ツール: •CRISPRに基づく遺伝子編集は過去5年間で初めて全ゲノムの遺伝画面を実現しました •多能性幹細胞の革新を誘導することで高品質で分化したヒト細胞を大規模に生産することができます 自動化と試薬: •ロボット実験室システムとソフトウェアは、高度な標準化と品質制御された高スループットスクリーニングを実現し、大規模化に関するデータを生成することができる |
| |
| |
この24ヶ月で世界はより多くのデータを生み出しましたこれまでの人類の歴史よりもずっと多いです | |
| |
| |
| | | | | | | | |
| | |
| | |
| | さらに重要なのは私たちの業界では人工知能のポイントソリューションを有効にする兆しが多いということです •蛋白質折り畳み •タンパク質−リガンド相互作用のスケール予測 •処理しやすい目標のための化学創成人工知能 •FDAはLLMSを用いたプロジェクト審査を検討している •大手製薬会社はLLMSのINDSのような規制文書を作成している これらの事実は1つの明確な未来を描き出し、現在多くの人工知能が支持している点式解決策の効率と改善は統合された“技術スタック”とワークフローに結合し始め、これは私たちが歴史上使用できない薬物の目標に対して薬物治療を行う能力を総合的に改善し、より高い忠実度で潜在的な生物学ネットワークを理解し、新しい検証された生物学を迅速に追跡し、ますます強力な方法で疾病の特徴を記述し、最終的に患者にもっと多く、より良い薬物を提供して大規模化の苦痛を軽減する。問題はもうそのような未来が私たちの前にあるかどうかではなく、いつ、誰がそれをリードするのかということだ。 2023年までを振り返ると 2013年末にRecursionが成立した時の状況と私たちがどれだけ遠くに行ったかを振り返ってみると、私たちの今日の業績を見るのは信じられないし、驚くべきことでもない。Recursionは当時ユタ州に本社を置くスタートアップ企業で、大学院生2人と教授1人によって設立された。私たちの最初のオフィスは近くの大学研究パークの会議室で、私たちの最初の実験室は改装された貯蔵室です。今日,Recursionは国際臨床段階の会社であり,バイオテクノロジーのTechBioへの移行をリードしている。我々は500人以上の従業員,5つの臨床段階計画,世界最大の生物·化学データセットの1つ,およびロ氏/遺伝子テークとバイエルとの2つの業界最大の発見協力を有している。 2023年、前方のチャンス感覚は2013年よりずっと大きく、いくつかの点で、私たちはまだ始まったばかりだと感じている。実際、内部的に見ると、2023年は私たちの歴史上最高の年の一つのように感じられる。2023年、私たちは多くの重要なマイルストーンを達成しました。私たちは建設に努力してきました。場合によっては、本当に大きく前進し始めたようです パイプ.パイプ •複数のデータの5つの第2段階臨床計画が発表される予定であり,2024年第3四半期頭綿状奇形(CCM)のREC−994,2024年第4四半期神経線維腫症(NF 2)のREC−2282,2025年上半期家族性腺腫性ポリープ症(FAP)のREC−4881,および2025年上半期AXIN 1またはAPC変異実体腫瘍のREC−4881が予定されている •健康ボランティアの中でREC-3964の第一段階の研究を完成し、クロストリジウム感染の治療の可能性があり、良好な安全性と耐性を持っている •相同組換え熟練卵巣癌と他の固形腫瘍におけるRBM 39計画をINDイネーブル研究に進めた •バイエルとの線維化協力から生まれたプロジェクト(Target Epsilon)は、線維化疾患を治療する新しい方法を代表する許可を得ており、納得できる早期データを有する |
| |
| |
| |
| |
5つの第2段階臨床プログラム発表される複数のデータ読み取りが予定されています | |
| |
| |
| | | | | | | | |
| | |
| | |
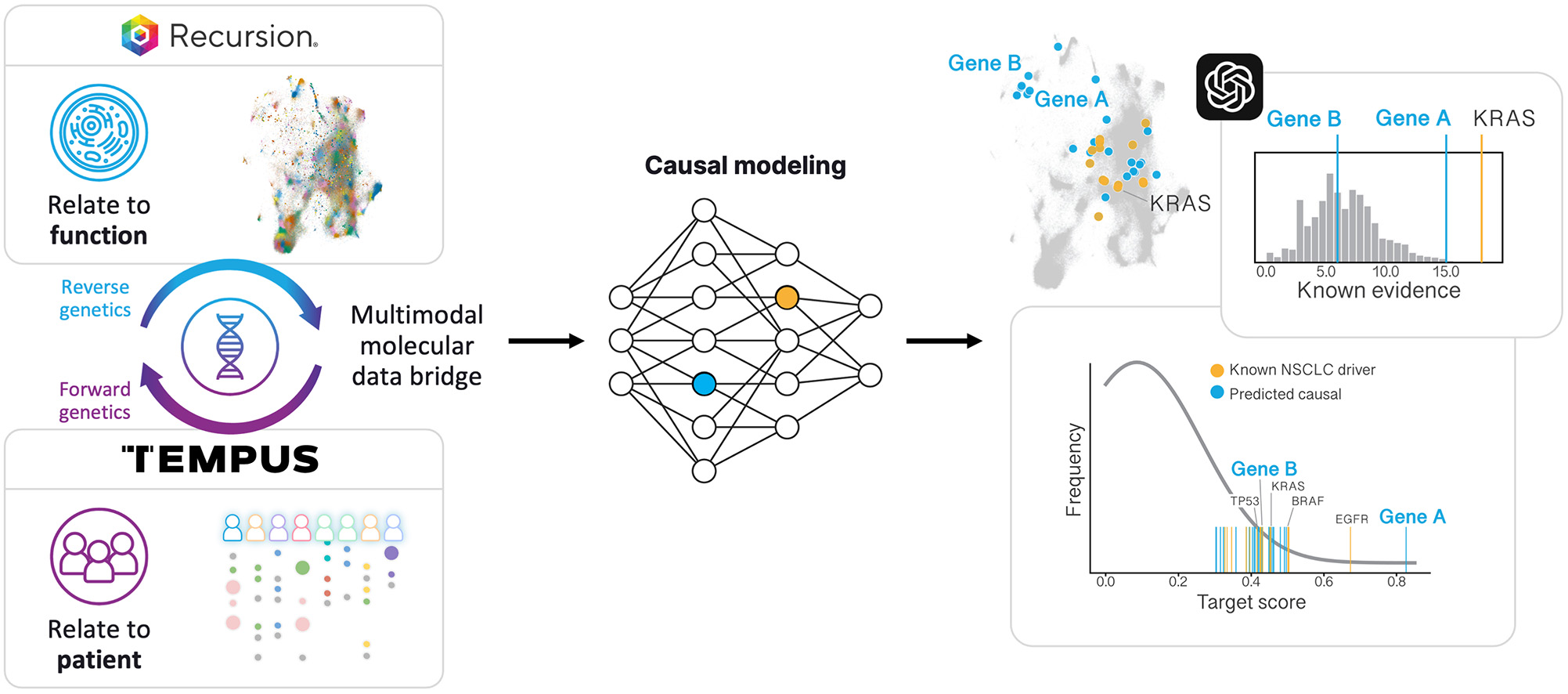
| 私たちの協力者は | | 仲間関係 •我々の羅氏や遺伝子テークとの協力では,羅氏がその小分子を行使してHITオプションを検証することを含め,胃腸腫瘍学と神経科学において大きな進展を得ており,さらに消化管腫瘍学における我々の最初の協力計画を進めている •私たちはバイエルとの協力を更新し、より高い計画のマイルストーン支払いにふさわしい腫瘍学的適応に挑戦することに集中しました •NVIDIAと協力して生物と化学の基礎モデルの構築,最適化,展開を加速し,NVIDIAの薬物発見プラットフォームBioNeMo上にRecursionにより構築された計算とデータツールをホストする−また,NVIDIAは私募によりRecursionに5000万ドルを投資した •Tempusと協力して、Recursionが20 PBを超える独自、識別されていないマルチモード患者腫瘍学データにアクセスできるようにし、因果人工知能モデルを訓練し、新しい治療仮説、バイオマーカー策略、患者キュー選択を発見することを目的とした •Enamineとパートナーシップを構築し,Recursionのタンパク質−リガンド相互作用予測を用いて豊富なスクリーニングライブラリーを生成し,Enamineの約360億個の化合物にまたがる膨大なライブラリーを予測した 再帰的オペレーティングシステム •薬物発見プロセス全体の高度な自動化を実現し、最も完全な全スタックTechBio解決策の一つを作成するために、多種のツールと技術を構築、拡張、工業化した •複雑な薬物発見タスクを簡略化するために、Recursion OSの湿式実験室と乾燥実験室コンポーネントを自然言語インタフェースを用いて接続するLOWE(大型言語モデル協調ワークフローエンジン)を作成した •大型言語モデル(LLM)を展開し,我々内部から派生した独自地図に合わせて科学文献地図を作成し,満たされていない需要分野を自律的に認識する新たな機会 •Phenom-1を導入した視覚変換器であり,数億個のパラメータを用いて我々の独自データ中の数十億個の生体画像を訓練しており,これは現在世界最大のエピジェネティクス基礎モデルであると考えられる •新たなデジタル化学ツールを展開し,Enamine実空間における約360億種類の化合物のリガンド−タンパク質相互作用を予測し,この空間が最大の合成可能化学ライブラリーであることが報告されている •2022年以来1兆個を超えるヒト誘導多能性幹細胞(HiPSC)由来の神経細胞が生産され,Recursionを世界最大の神経細胞メーカーの一つにする可能性がある •因果人工知能モデルの訓練を開始し,Tempusからの20 PBを超えるマルチモード精密腫瘍学患者データを用いて潜在的なバイオマーカーの豊富な治療法の大規模発見を支援した |
| |
| |
ロー氏と遺伝子テーク バイエル インヴィディア タンプス エナミン | |
| |
| |
LOWE(大型言語モデル協調のワークフローエンジン) 複雑な薬物発見タスクを簡略化するために,自然言語インタフェースを用いてRecursion OSの湿式実験室と乾燥実験室コンポーネントを接続している | |
| |
| |
| |
| |
| |
>1兆 ヒト誘導多能性 幹細胞2022年以降に発生した(HiPSC)由来の神経細胞 | |
| |
| |
| | | | | | | | |
| | |
| | |
CyclicaとValence発見支援を買収したデジタル化学と生成性人工知能能力 | | 会社ビル •デジタル化学と生成性人工知能能力を支援するためにCyclicaとValence Discoveryを買収しました •ソルトレイクシティとモンテレアルでの業務を拡大し、トロントにカナダ本部を開設し、私たちの機械学習とデジタル化学チームの発展に専念しました •私たちのスーパーコンピュータBioHave-1の能力を2倍にして、私たちのパイプ、パートナー関係、基礎モデルの構築を支援するために努力しています。生物、化学、患者を中心とした多様なデータモデルに関連しています。この拡張は、私たちのスーパーコンピュータをTOP 500ランキングのどの業界の上位50位のスーパーコンピュータにするべきだと信じています Recursionは,先行するTechBio社の1つとして,業界全体で新たなTechBioツールの採用を推進する速度と規模に重要な役割を果たしている。私は私たちのチームが2023年に達成したことをとても誇りに思っていますが、今年の私たちの業務の最も重要な転換は私たちの壁の外で発生しました。我々はついにTechBioに埋め込まれたアイデアを見つけ,特に人工知能が我々の業界で実用的であるという信念を見出し,その分野のより大きく,より伝統的な会社の主流支持を見出した. この分野に大きな短期変動が生じることは間違いないが,BioPharmaのリーダーはMLと人工知能が今後10年で非常に重要な役割を果たすと一致してきている。私たちの前には信じられない仕事がありましたが、風に向かって航行しなくなったような気がしましたが、今は風が私たちの背中を向い始めています。世界にはこのような新しい環境の中で迅速に航行することができ、今後数年間、多くの競争相手との差を縮め続けることができるチームはないと信じている。 2024年以降を展望する 数年前と比較して、今年初めのモルガン大通ヘルスケア会議でTechBioをめぐる感情の変化を味わうことができます。いくつかの疑いが盛んになっているにもかかわらず、慎重で楽観的な変化が私たちの分野で最も強力な会社の役員チームや取締役会に漂っており、その疑いはほとんどのところで優位に立っていない。 2023年にNVIDIAとのパートナーシップを発表した後、私たちはモルガン·チェース会議で彼らと共同で活動を主催した。私たちは、世界最大のバイオ製薬会社の役員チームや取締役会のメンバー、多くのリードするTechBio社の最高経営責任者、大手科学技術会社の幹部、そしてこのような融合した投資家やアナリスト、あるいはそうしたい投資家やアナリストを集めています。 その夜,参加者はスコット·ゴトリブ,アヴィフ·レグフ,エイミー·アバネシーなどの生命科学の著名人や英ウェダ最高経営責任者延森·Huangの発言を聞いた。彼らはこれらのリーダーから,MLや人工知能の傾向が我々の業界の将来の信念にどのように影響するかについて聞いた.一番面白いのはチームの技術リーダーがバイオ製薬の言語を流暢に話していることに気づきましたバイオ製薬業界のリーダーは彼らよりも“技術”を流暢に話せると言うつもりだ。これはバイオ製薬にリスクをもたらしているが,RecursionのようにTechBioの先頭と位置づけられている会社にとっては機会である。 |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| |
| | | | | | | | |
| | |
| | |
| | しかし,私たちの空間は興奮しているにもかかわらず,私たちはこの業界の一部であり,患者に新しい,より良い薬をもたらすことで苦痛を軽減することが使命である。これが私たちが最終的に私たちの影響を測定する方法だ。私が今後18ヶ月を展望するにつれて、私たちは私たちの最初の4つの第2段階研究を読み上げたので、この目標に向かって有意義な一歩を踏み出すだろう。 これは私たちが目標サービスの患者への効果を示すのは初めての機会だから信じられない興奮だ。しかし同様に重要なのは,これらの初期読み出し数に入る際に,それらがどのように我々のプラットフォームの学習や調整を支援するかに重点を置いていることである 今年発表される試用版は、私たちの再帰的オペレーティングシステムの最初のバージョンから来ます。これらは,siRNAなどの挑戦的なツールを用いてまれな遺伝疾患をモデル化する再利用機会を表している。私たちの新しい世代のオペレーティングシステムは、ますます強力な生物ツール、化学ツール、人工知能ツールを使用して、私たちをよりエキサイティングなプログラムを識別し、推進しており、その中のいくつかは臨床に移っている。 第2段階読み取りの業界平均成功率は約20-30%である。このことは,我々が来る4つの読み取りのうち1つが有用なシグナルを示していれば,患者のために意味のある潜在的治療法を開発する正しい軌道を歩んでいることを示している。より良いことをしたいと思っていますが,治療のすべての患者の利益を求めるために,長期的には,個々のデータを利用して,積極的でも消極的であっても,Recursion OSに学習してフィードバックし,長期的な影響を最大限に発揮できるようにします。 重要なのは、私たちは少数の薬を提供するプラットフォームを設立した会社ではなく、私たちはプラットフォームを構築している会社であり、時間が経つにつれて、多くの薬を提供するプラットフォームを構築していることを理解しなければならない。もし我々の論点が成立すれば,時間の経過とともに,我々のシステムは後期失敗率の低下とともに改善されるはずである.私たちは、私たち自身のパイプライン内でも、その業界の他のパートナーとも、多くの薬物を発見し開発することができるオペレーティングシステムを構築したと信じています。 私たち全員が私たちが短期的に私たちの初代プログラムから学んだことに興奮しているほか、私たちは業界の他の人がツールや技術を採用して、私たちのオペレーティングシステムの強力な機能を身につけるのを助けることに興奮しています。 我々は,JPモルガン会議でLOWE(大型言語モデル協調ワークフローエンジン)をライブソフトウェアプレゼンテーションにより発表した.著者らは視聴者と共に模擬腫瘍学プロジェクトを開始し、Recursionの独自データを用いて腫瘍学における興味のある目標を識別し、目標を設計と発注する潜在的な小分子調節器まで、そして私たちのプラットフォーム上に後続実験を配置して、最初のSAR周期中の分子を評価した。本プレゼンテーションのバージョンと私たちのソフトウェアツールLOWEをここで見ることができますHttp://www.youtube.com/watch?v=Hf 1 bb 9 rPQtE これはJPMが視聴者と相互作用する面白くてエキサイティングな方法であるが、LOWEを様々な潜在的なパートナーに提供し、彼ら自身の研究開発エンジンに展開することを積極的に検討している。Loweの未来がどうなるかはわかりませんが、Recursionにとってはエキサイティングな新しい機会であり、私たちのRecursionOSの部分をその分野の他社のエンジンに統合することで、業界の加速とTechBioのより広範な採用を助けることができます。 |
| |
| |
| |
| “私たちはプラットフォームを作る会社で、時間が経つにつれて多くの薬を提供します” | |
| |
| | | | | | | | |
| | |
| | |
| “私たちの考えでは、二つの重要な駆動要素がこのコンテストの勝敗を決定するだろう:データと実行” | | 変わった点はデータと実行です 私たちの視野を最近と今後10年まで延長して、私たちはTechBioの一部の非常に強力な会社が私たちが今日言ったバイオテクノロジーの大部分を代替するかもしれないと思います。これは可能であり、さらには可能です。この会社は誰でしょう?彼らはどうやって勝つのでしょうか? 現在コンピュータの供給が限られているにもかかわらず、それは今日のように豊富になったことはない。次の数年間、このコンテストの賭けは、専門的な計算と強力なML/AIとソフトウェア工学チームを獲得することになるだろう。それが再帰会社が私たちの内部スーパーコンピュータであるバイオハチの巣-1に投資し続けた理由です我々は2023年末にNVIDIAとのパートナーがこのコンピュータを拡張することを発表し,地球上のすべてのバイオ製薬会社(すべての大手バイオ製薬会社を含む)が完全に所有·運営する最速のスーパーコンピュータとなる可能性がある。このコンピュータを利用してオペレーティングシステムの発展を推進するために取り組んでいる信じられないほど才能のあるML研究者とエンジニアチームがあります私たちはこれらのグループで有機的な成長を達成し、必要に応じて買収を通じて成長を実現した。しかし、私が言ったように、これらはすべてテーブルの上の賭けだ。 私たちの観点から見ると、二つの重要な駆動要素がこのコンテストの勝者を決定するだろう:データと実行。 どのようなデータを使用するかについては、各方面の意見が分かれている。薬物発見や開発における最大の問題を解決するために必要な多くのデータは,今日公開されているか,大手製薬会社に握られていると考えている人もいる。この考えを支持するいくつかの証拠がある;例えば、タンパク質フォールディングにおける信じられない進歩は、タンパク質データベース(PDB)に適用される複雑な計算によって推進され、PDBは開示されて利用可能なデータセットである。しかし,我々のデータ分野では,PDBのように有力かつ詳細にアノテーションされている例は少ない.実際,発表された文献の多くのデータは他の実験室では要約できないことが知られている. 大手製薬会社に転向し,長期にわたる薬物発見·開発業務から大量のデータを得ていることは明らかであり,より多くの向かい風を発見している。まず,これらの大型データセットは機械学習の目的のために構築されたものは少ない.これは機械学習や人工知能が有用なツールにならないことを意味するわけではないが,これらのソースデータの単峰性や実験間制御に乏しく,特に臨床前や臨床面から十分な価値を抽出することを困難にする。さらに、インターネットを介して訓練された大型言語モデルの成功と、私たちが見始めたコンテンツプロバイダのその後の訴訟は、これらのモデル(例えば、https://www.nytimes.com/2023/12/27/Business/media/new-york-Times-open-ai-microsoft-lawsuit.html)を訓練するために使用されるべきであり、これらのデータを共有する際に慎重でなければならないことを大手製薬会社に明確に示すべきである。 以上のすべての理由から,Recursionでは,大規模,反復的なマルチモードデータの生成と集約が,我々の復号生物学的使命を実現する最も速い方法であると信じてきた。我々は現在,複数のグループ学モデルで2億個以上の実験を行っている.Tempusと最初のデータアグリゲーションパートナーシップに署名しましたそこでは現在10万人以上の腫瘍患者のDNAとRNAシークエンシングデータにアクセスすることができますこれらのデータで因果AIモデルを訓練することができます私たちの各層のデータは強力ですが、それらを結合して、より汎用的な生物学的モデルを訓練すると、大量の細胞組織学データ、動物グループ学データ、人間患者グループ学データを含む真の魔力が発見されます。私たちはこれを信じています。あなたは私たちが引き続き深く投資し、新しい層にデータを構築し、私たちの長期的な抱負の鍵と考えられる独自のデータセットを協力して集約することを期待することができます。 |
| |
| |
| |
| |
| |
| | | | | | | | |
| | |
| | |
| | 最後に、実行が私たちの空間の異なる要素になることは明らかですが、実行のタイプと意思決定の観点はここで非常に重要です。私たちの前に置かれた機会は非常に大きく、Recursionが意思決定をしています。これらの意思決定は成功の可能性を高める可能性が最も高いと思います。私たちは汎用的で実用的な生物学的人工知能モデルを構築した最初の会社です。すなわち,生物学を復号することで我々の使命を実現することで,任意の摂動がヒト細胞だけでなく,ヒト患者にも影響を与えることを予測あるいはシミュレーションすることができる。この使命を実現するにはあと10年か20年かかるかもしれないが,1つの会社がその分野の他の会社や他の一部の会社と一緒にこの目標を達成するためには,生物製薬価値数兆ドルの大部分を1社または数社に集中させる機会があり,今日バイオ製薬分野で見たように価値のある会社が広く分布している(例えば,本稿を執筆した時点で,約12社の上場生物製薬会社の時価は1000億ドル以上で安定している)。したがって、私たちは私たちが中期的に成功する可能性を増加させるのではなく、私たちがこの分野の少数の大勝者の一つになる可能性を増加させたと思う決定を下すだろう。 生物製薬にとって、次の10年は絶対に信じられないことであり、変化の速度は私たちが過去のいつよりもずっと速いだろう。より多くの仕事がありますが、前の創造的な破壊を最大限に利用するために、これを受け入れ、試合に勝つ準備ができている他のチームがあるとは思いません。 ありがとうございます クリス·ギブソン博士 共同創業者兼最高経営責任者 |
カタログ
| | | | | | | | |
| | ページ |
第1部 | | |
| 第1項 | 業務.業務 | 10 |
| 第1 A項。 | リスク要因 | 98 |
| 項目1 B。 | 未解決従業員意見 | 146 |
| プロジェクトICです。 | ネットワーク·セキュリティ | 146 |
| 第二項です | 属性 | 147 |
| 第三項です | 法律訴訟 | 147 |
| 第四項です。 | 炭鉱安全情報開示 | 147 |
第II部 | | |
| 五番目です。 | 登録者普通株式の市場、関連株主事項及び株式証券の発行者購入について | 148 |
| 第六項です | [保留されている] | 150 |
| 第七項 | 経営陣の財務状況と経営成果の検討と分析 | 152 |
| 第七A項。 | 市場リスクの定量的·定性的開示について | 161 |
| 第八項です。 | 財務諸表と補足データ | 164 |
| 第九項です。 | 会計 · 財務情報開示に関する会計士との意見の相違 | 196 |
| 第9条 | 制御とプログラム | 196 |
| プロジェクト9 B | その他の情報 | 197 |
| プロジェクト9 Cです。 | 検査妨害に関する外国司法管区の開示 | 197 |
第三部 | | |
| 第10項 | 役員·幹部と会社の管理 | 198 |
| 第十一項。 | 役員報酬 | 198 |
| 第十二項 | 特定実益所有者の担保所有権及び管理職及び関連株主の事項 | 198 |
| 十三項。 | 特定の関係及び関連取引及び取締役の独立性 | 198 |
| 14項です | 最高料金とサービス | 198 |
第IV部 | | |
| 第十五項 | 展示品と財務諸表の付表 | 199 |
| 第十六項 | 表格10-Kの概要 | 201 |
| サイン | 202 |
PART I
リスク要因の概要
以下は,再帰製薬会社(再帰会社,我々,我々または我々の)普通株にリスクや投機的な要因を投資させる要約である.この結論は私たちが直面しているすべての危険を解決していない。以下に概説するリスクおよび私たちが直面している他のリスクの他の議論は、“プロジェクト1 A”と題する節で見つけることができる。リスク要因“は本年度報告の10−K表にある
私たちの限られた運営履歴、財務状況、追加資本需要に関連するリスク
◦私たちは臨床段階のバイオテクノロジー会社であり、運営歴史が限られており、規制機関の承認を得て商業販売を行っていない製品であり、現在と将来の業務見通しを評価することが困難になる可能性がある
◦設立以来、重大な運営損失が発生しており、予測可能な将来も赤字が続くと予想されている。
◦私たちは多くの追加資金を集める必要があるだろう。もし私たちが必要な時に資金を調達できない場合、私たちは製品開発計画、業務発展計画、戦略投資、潜在的な商業化努力の少なくとも一部の延期、減少、または廃止を余儀なくされ、運営を停止する可能性がある。
◦追加資本の調達と追加証券の発行は、私たちの株主に希釈し、私たちの運営を制限し、私たちの技術または候補薬物に対する権利を放棄し、私たちのコア業務に対する管理層の注意を移すことを要求するかもしれない。
◦私たちは戦略的協力を行っており、候補薬物の臨床開発や商業化を含め、より多くの協力を求めている。もし私たちが商業的に合理的な条項や全く協力を構築できない場合、あるいは現在と未来の協力が成功しなければ、私たちの開発と商業化計画を変えなければならないかもしれない。
◦私たちは商業販売を許可された製品もなく、製品販売から何の収入も得ていない。私たちまたは私たちの現在と未来のパートナーは、私たちの候補薬剤の開発と商業化に決して成功しないかもしれませんが、これは、私たちの運営結果と私たちの業務運営を継続する能力に負の影響を与えます。
◦もし私たちが将来の買収や戦略協力に従事すれば、これは私たちの資本金要求を増加させ、私たちの株主権益を希釈し、私たちに債務を発生させたり、負債を抱えたり、他のリスクに直面させたりする可能性がある。
候補薬物の発見と開発に関するリスク
◦私たちの薬物発見方法は唯一無二であり、様々な理由で、成功した薬物製品を招くことはないかもしれませんが、これらに限らず、私たちの候補者のための行動機構の挑戦を決定します。
◦我々の候補薬物は臨床前あるいは臨床開発段階にあり、これは長くて高価な過程であり、結果は不確定であり、実質的な遅延が出現する可能性がある。
◦もし私たちが臨床試験の患者登録過程で遅延や困難に遭遇した場合、必要な規制承認を受けることは延期または阻止される可能性がある。
◦私たちが計画した臨床試験、あるいは私たちの現在と未来の潜在的協力者の臨床試験は、成功しないかもしれない、あるいは私たちの臨床前または非臨床研究に見られない重大な不良事件を明らかにする可能性があり、これは安全状況を招く可能性があり、規制部門の許可または市場が私たちの任意の候補薬物を受け入れることを阻害する可能性がある。
◦米国以外では候補薬物の臨床試験を行っており,FDAや類似の外国規制機関はこのような試験のデータを受け入れていない可能性がある。
◦我々の候補薬物の目標患者群の発病率と流行率を正確に決定することは困難である。もし私たちの候補薬物の市場機会が私たちが推定したものよりも小さい場合、または私たちが得た任意の承認が患者集団のより狭い定義に基づいている場合、私たちの収入と利益を達成する能力は不利な影響を受け、実質的な可能性がある。
◦私たちは私たちの薬物発見協力で資源と現金投資の見返りを絶対に達成しないかもしれない。
◦私たちは激しい競争に直面しており、これは他の人たちが私たちよりも早く、あるいは成功的に製品を発見、開発、商業化することにつながるかもしれない。
◦我々は複数の計画や候補薬が開発されており,様々な標的適応や治療法が求められているため,特定の候補薬を追求するために限られた資源を利用する可能性があり,より利益や成功の可能性の高い開発機会や候補薬を利用できない可能性がある。
私たちのプラットフォームやデータに関連するリスクは
◦私たちはすでに研究開発に投資して、私たちの薬物発見プラットフォームをさらに強化することは、私たちの使命に重要です。もしこれらの投資のリターンが私たちの期待や発展速度よりも遅くなれば、私たちの業務と経営業績は影響を受ける可能性があります。
◦私たちの情報技術システムやインフラが故障したり、セキュリティホールや事故に遭遇したりする可能性があり、私たちの業務や運営に悪影響を与え、責任を負わせる可能性があります。
◦サーバシステムの利用可能性は、またはインターネットまたはクラウドベースのサービスとの通信中断、またはそのようなシステムに格納されたデータのセキュリティ、セキュリティ、アクセス可能性、または完全性を維持することができず、私たちのトラフィックを損なう可能性がある。
◦我々の解決策は第三者オープンソースソフトウェア(OSS)を使用しており,これによるリスクは我々の業務に悪影響を与え,可能な訴訟に直面する可能性がある.
◦私たちの製品で人工知能や機械学習を使用することに関する問題は、私たちの業務や運営結果に悪影響を及ぼす可能性があります。
私たちの運営·商業化に関連するリスク
◦我々が開発した任意の候補薬が市場承認を得ても,医師,患者,医療支払者,医学界の他の人がビジネス成功に必要な市場受容度を達成できない可能性がある。
◦販売およびマーケティング能力を確立することができない場合、または我々が開発する可能性のある任意の候補薬剤を販売およびマーケティングするために第三者と合意できない場合、これらの候補薬剤が承認された場合、商業化に成功することができないかもしれない。
◦我々の内部施設や外部サービスプロバイダの実体やデジタルインフラは、規制や運営リスクに関連するリスクに直面している。
私たちの知的財産権に関するリスクは
◦私たちの成功は私たちが十分な範囲の特許を獲得し、維持できるかどうかに大きく依存し、私たちの独自技術と候補薬物製品をカバーしている。特許資産の獲得と維持自体は挑戦的であり、私たちの保留と将来の特許出願は、もしあれば、私たちが必要な範囲で発行されないかもしれない。
◦我々の現在のいくつかの候補薬物製品に対する特許地位は、競合他社または他の第三者が同じ候補薬剤を同じまたは異なる用途に使用することを防止するのに十分ではない可能性があるこれらの候補医薬製品の成分、製造関連方法、製剤および/または使用方法を含む、私たちが所有または許可している特許出願に依存する。
◦私たちは世界各地で私たちの知的財産権と固有の権利を保護できないかもしれない。
◦もし私たちが開発可能な候補薬物のために特許期間延長とデータ排他性を獲得しなければ、私たちの業務は実質的に損害を受ける可能性がある。
◦第三者から何らかの知的財産権の許可を得る必要があるかもしれませんが、このような許可は得られないかもしれませんし、商業的に合理的な条項では得られない可能性もあります。
◦米国特許法の変化は特許の全体的な価値を低下させ、製品を保護する能力を弱める可能性がある。
◦法廷または米国または海外の行政機関で疑問が提起された場合、私たちの候補薬剤および私たちが開発または将来開発可能なノウハウに関連する発行された特許は、無効または強制的に実行できないことが発見される可能性がある。
政府の規制に関連するリスク
◦私たちの候補薬剤がFDAや他の規制機関の承認を得ても、持続的な規制義務および他の条件の制約を受けることになり、これらの義務および条件は巨額の追加費用を招く可能性があり、意外な安全問題が発見された場合、承認された製品をリコールまたは撤回する可能性がある。
◦私たちはいくつかの候補薬の孤児薬の称号を与えられたにもかかわらず、私たちは潜在的な市場排他性を含む、そのような称号に関連する利点を維持できないかもしれない。
◦私たちはプライバシー、データ保護、データセキュリティに関する米国と外国の法律に制約されており、これらの法律は巨額のコンプライアンスコストをもたらす可能性があり、守らないことは私たちに重大な責任を負わせるかもしれない。
◦人工知能の使用に関する規制や立法発展は、製品、サービス、ビジネスでこのような技術を使用することに悪影響を及ぼす可能性があります。
他のリスク
◦私たちの一部の研究および臨床前試験を実行するか、または私たちの臨床試験を行う第三者が満足できない可能性があり、または彼らのプロトコルが終了される可能性がある。
◦臨床前開発、臨床試験、および将来の商業化のために我々の候補薬剤を生産する第三者は、許容可能なコストで十分な数の私たちの候補薬剤または製品を提供することができない可能性があり、これは、私たちの開発または商業化努力を延期、損害、または阻害する可能性がある。
◦私たちは買収のすべての期待された結果と利益を達成しないかもしれない。
◦私たちの未来の成功は私たちが肝心な幹部と経験豊富な科学者を維持する能力、及び合格者を吸引、維持と激励する能力にかかっている。
◦私たちは財務報告書の内部統制に重大な欠陥があることを発見した。
前向き陳述に関する注意事項
このForm 10-K年度報告書には、改正された1933年証券法第27 A節および改正された1934年証券取引法第21 E節の意味に適合する、私たちと私たちの業界に関する“前向きな陳述”が含まれている。歴史的事実以外のすべての陳述は前向きな陳述だ。場合によっては、前向き陳述は、“可能”、“会議”、“はず”、“予想”、“予想”、“計画”、“予想”、“可能”、“意図”、“目標”、“プロジェクト”、“考慮”、“信じる”、“推定”、“予測”、“潜在的”または“継続”またはこれらの用語の否定または他の同様の表現によって識別することができる。本報告に記載されている展望的陳述は、以下の態様を含むことができるが、これらに限定されない
•私たちの研究開発計画は
•現在と未来の臨床前と臨床研究の開始、時間、進度、結果とコストは、研究と関連準備の設計、起動と完成の時間及び研究結果がどのくらいの時間で得られるかに関する声明を含む
•私たちの臨床試験は候補薬の安全性と有効性、その他の積極的な結果を証明することができます
•私たちの協力者は私たちの開発候補薬や研究薬物に関する研究と開発活動を継続する能力と意志がある
•将来的には第三者と私たちの研究薬や他の承認された製品の商業化について合意します
•調査新薬申請および米国食品医薬品局(FDA)が現在の候補薬物および任意の他の将来の候補薬の最終承認の時間、および私たちがこのような承認を維持する能力を含む、届出および承認の時間、範囲および可能性を規制する
•外国の規制機関が提出し、承認する時間、範囲、または可能性は、私たちがこのような承認を維持する能力を含む
•TechBio社の潜在的な市場機会の大きさ
•私たちの候補薬の潜在的な市場機会の大きさは、私たちの目標疾患を患っている患者数の推定を含む
•臨床開発のために実行可能な新薬候補薬を決定する能力と、推論や他の方法でこれらの候補薬の速度を決定することを期待しています
•私たちは私たちに最大の価値をもたらす資産は私たちが未来に私たちのデータセットとツールを使用して識別する資産だと予想しています
•私たちは現在の候補薬や計画を開発し推進し臨床研究を成功させることができます
•従来の薬物発見モデルと比較して、時間やコストを減らしたり、研究開発に成功する可能性を高めることができます
•インフラ、データセット、生物学、技術ツール、および薬物発見プラットフォームにおいて改善された能力と改善された速度、およびこれらの改善から利益を達成する能力
•私たちは薬物開発過程で機械学習と人工知能の能力を有効に使用しています
•私たちは最近買収で得られた資産を利用して私たちの技術支援の薬物発見過程を拡大し、デジタル化学能力を加速させることができます
•私たちは私たちの協力とパートナーシップを利用して私たちの製品を開発し、私たちの業務を発展させることができます
•私たちの期待は私たちのバイオハチの巣-1スーパーコンピュータ、再帰的オペレーティングシステム、およびデジタル化学プラットフォームの性能と利点に関連しています
•私たちは薬物発見協力で資源と現金投資の見返りを達成することができます
•私たちは可能な資産を売却し、得られた資金を長期戦略に再投資することができる
•技術会社のように規模を拡大し毎年パイプラインでより多くのプロジェクトを増やすことができます
•競争の激しい市場で競争に成功する能力は
•私たちの製造商業化マーケティング能力戦略
•私たちは候補薬物の商業化に関する計画(承認されれば)、重点地域と販売戦略を含む
•候補薬の承認と他の薬との併用への期待は
•私たちの現在の候補薬(承認されれば)と私たちが開発可能な他の候補薬の市場受容度と臨床的実用性の速度と程度
•私たちの競争地位と既存または獲得可能な競争方法の成功
•臨床試験で登録される患者数と登録時間の推定を行います
•私たちの候補薬物の有益な特徴、安全性、有効性、治療効果
•私たちが求める可能性のあるより多くの適応を含む候補薬の計画をさらに開発しました
•私たちは、私たちの現在の候補薬剤と私たちが開発する可能性のある他の候補薬剤のための知的財産保護範囲の確立と維持ができる知的財産権保護範囲、特許保護の受け入れ、既存の特許条項の延長、第三者が保有する知的財産権の有効性、私たちの商業秘密の保護、および私たちが侵害しない、流用、または他の方法で任意の第三者知的財産権を侵害する能力を含む、私たちの知的財産権およびノウハウを十分に保護し、実行する能力
•知的財産権紛争の影響と、知的財産権侵害、流用またはその他の知的財産権侵害のクレームに対して抗弁する能力
•私たちには新しい技術の発展に追いつくことができます
•私たちは第三者オープンソースソフトウェアとクラウドベースのインフラを利用することができます
•私たちの保険証書が十分であるかどうかとその保証範囲
•大流行、流行病或いは伝染病の爆発(例えば新冠肺炎)或いは自然災害、全世界の政治不安定或いは戦争の潜在的な影響、及びこのような爆発或いは自然災害、全世界の政治不安定或いは戦争が私たちの業務と財務業績に与える影響;
•私たちはすべての業務で温室効果ガスの純ゼロ排出を実現する能力があります
•私たちはエラー、遅延、またはネットワークセキュリティホールを回避するために技術運営インフラを維持します
•私たちは引き続き第三者に依存して私たちの候補薬物に対して追加の臨床試験を行い、臨床前研究と臨床試験のために私たちの候補薬物を製造した
•私たちは、任意の協力、許可、または他の可能性のある研究、開発、製造、または商業化、私たちのプラットフォームおよび候補薬物に必要または望ましい協力、許可、または他の手配を得ることができ、有利な条項について交渉することができる
•承認されれば現在の候補薬と私たちが開発する可能性のある他の候補薬の価格設定と精算
•費用、将来の収入、資本需要、追加融資需要の推定
•私たちの財務業績は
•私たちの既存の現金と現金等価物は、私たちの将来の運営費用と資本支出需要の期間を支払うのに十分であると予想される
•私たちは多くの追加資金を集めることができます
•現在と未来の法律法規の影響と、私たちが受けているまたは受ける可能性のあるすべての法規を遵守する能力
•より多くの人を雇用し、これらの人々を引き付けて維持する能力が必要だ
•これらの訴訟は、通常の業務中に発生し、弁護費用が高い可能性がある現在または未来の訴訟のいずれかの影響を受ける
•雇用法案に基づいて新興成長型企業になる資格があることへの期待
•財務報告および開示制御およびプログラムに対して効果的な内部統制の能力を維持する能力は、財務報告の内部統制の重大な弱点を救済する能力を含む
•私たちの既存資源の使用と最初の公募株の純収益
•他のリスクと不確実性には、“リスク要因”というタイトルの部分に列挙されたリスクと不確実性が含まれる
私たちのこれらの展望的な陳述は、主に、私たちの現在の業務、私たちが経営している業界、および私たちの業務、財務状況、運営結果、および将来性に影響を与える可能性があると考えられる財務傾向の予想と予測に基づいている。このような展望的な陳述は未来の業績や発展の保証ではない。これらの陳述は,本報告日までに,“リスク要因”と題する節や本報告の他の部分で述べたいくつかのリスク,不確定要因,仮説の影響を受ける可能性があることを示している。展望性陳述は、リスクおよび不確実性の影響を固有に受けているので、いくつかのリスクおよび不確実性は予測または定量化できないので、未来のイベントの予測として、これらの前向き陳述に依存してはならない。著者らの展望性陳述に反映された事件と状況は実現できない或いは発生できない可能性があり、実際の結果は展望性陳述中の予測結果と大きく異なる可能性がある。法律が適用されて別の要求がない限り、私たちは、任意の新しい情報、未来のイベント、または他の理由による、本明細書に含まれる任意の前向きな陳述を更新または修正する義務がありません
また、“私たちが信じている”という声明と類似した声明は、関連テーマに対する私たちの信念と意見を反映している。このような陳述は本報告日までに私たちが把握した情報に基づいて作成された。私たちはこれらの情報がこのような声明の合理的な基礎を構成していると考えているが、これらの情報は限られているか不完全である可能性があり、私たちの声明は私たちがすべてのことを理解していることを示すように読まれてはいけない
潜在的に利用可能な関連情報。このような陳述は本質的に不確実であり、それらに過度に依存しないように想起させる。
プロジェクト1.ビジネス
業務の概要
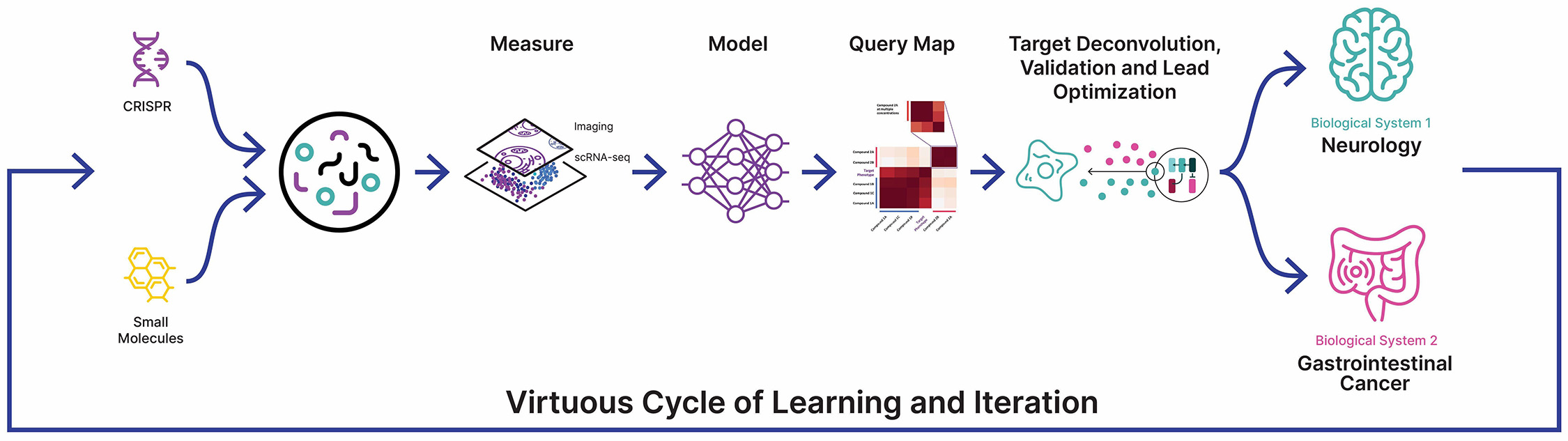
再帰はTechBio社が生物学を復号して薬物発見産業化を実現するリード的な臨床段階である。我々の中心的なタスクは,50 PBを超える独自のデータに生物,化学,患者を中心とした数兆個の関係を描画·ナビゲーションできるように,複数の技術にまたがって構築されたプラットフォームである再帰的オペレーティングシステム(OS)である。我々は物理とデジタルコンポーネントのこのような統合フレームワークを反復ループとし,その中で,大規模化された“湿実験室”生物,化学と患者を中心とした実験データを“幹実験室”計算ツールで組織し,治療見解を識別,検証,変換する。Recursionが偏らず、データ駆動の生物学を理解する方法は、より高い規模とより低いコストで患者により多く、更新され、より良い薬をもたらすと信じている。
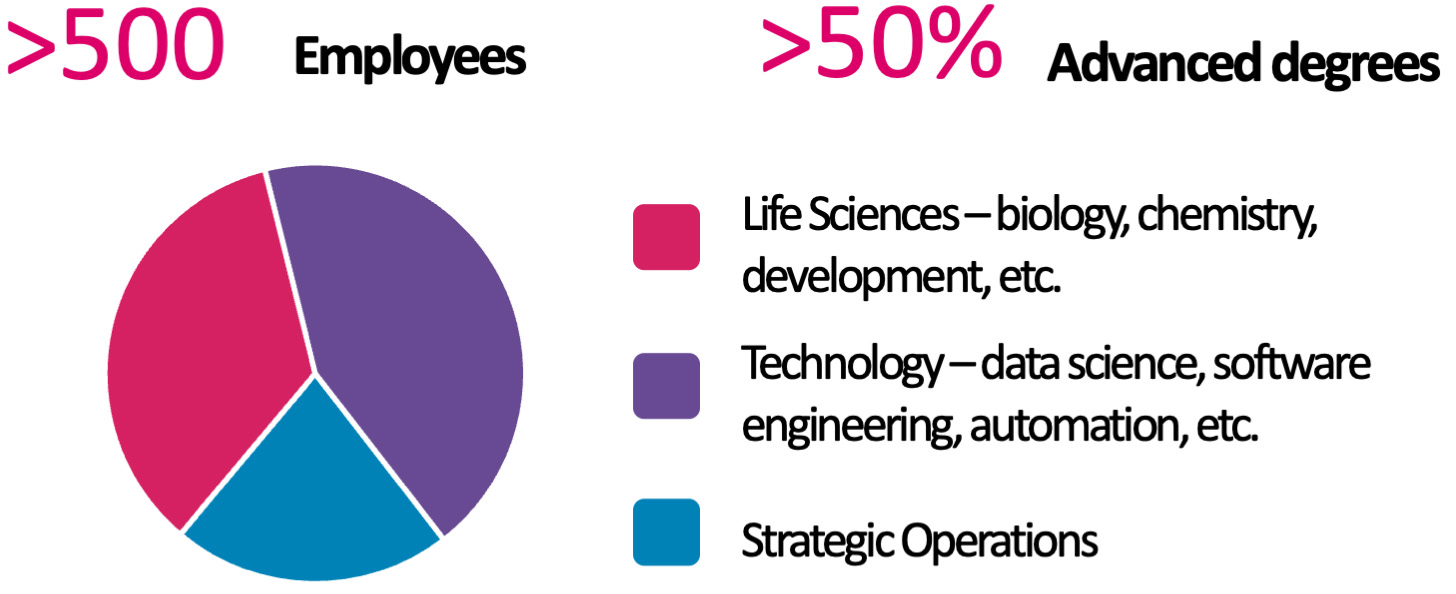
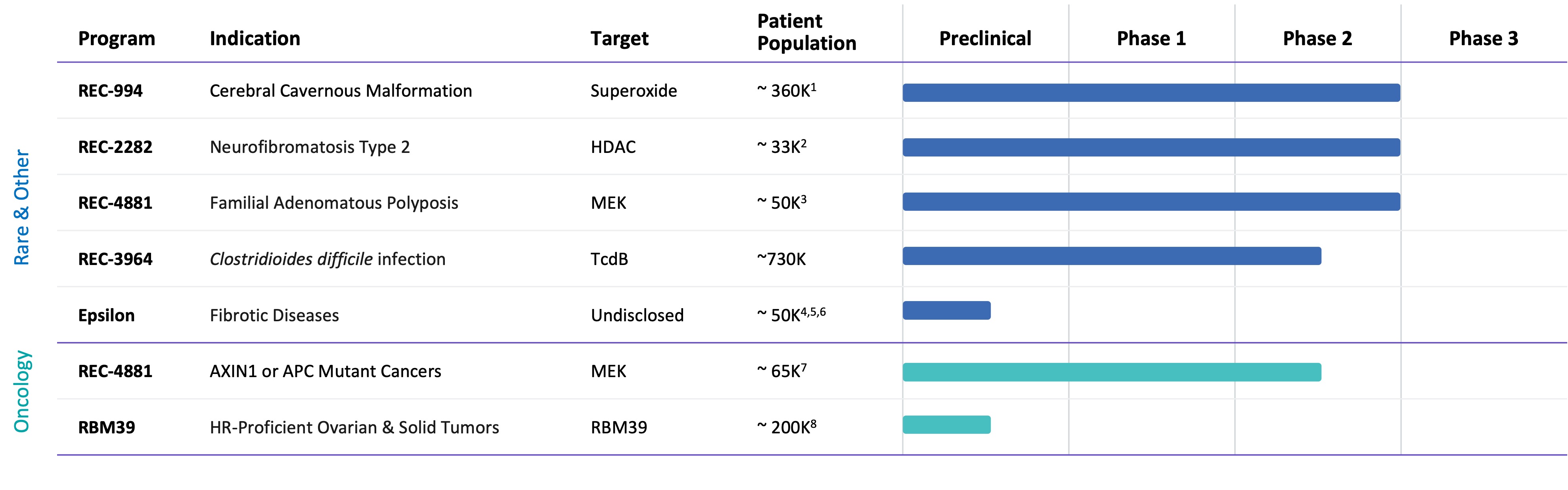
Recursionには3つの重要な価値駆動要因があります
•寛大なパイプ.パイプ内部開発の臨床と臨床前プロジェクトの重点は精確な腫瘍学と遺伝子駆動の稀な疾病であり、これらのプロジェクトは重大な満足されていない需要と市場機会を持っており、場合によっては年間売上高が10億ドルを超える可能性がある
•転換する協力パートナーシップ有力な生物製薬や技術会社とともに生物の厄介な分野を作成·ナビゲーションし,新たな標的を識別し,先進的な計算とデータ資源を用いて潜在的な新薬を開発する
•業界がリードするデータセット 意図的に コンピューティングツールを活用し、パイプライン、パートナーシップ、テクノロジー製品を通じて生み出される価値を加速するように設計されています。
2023 年の主な成果
パイプ.パイプ
•2024 年第 3 四半期における脳海綿状奇形に関する REC—994 、 2024 年第 4 四半期における神経線維腫症 2 型に関する REC—2282 、 2025 年上半期における家族性腺腫性ポリーポ症に関する REC—4881 、 2025 年上半期における REC—4881 を含む、複数のデータ読取りが予定されている 5 つのフェーズ 2 臨床段階プログラム。 AXIN1あるいは…装甲運搬車H1 2025 の変異型固形腫瘍
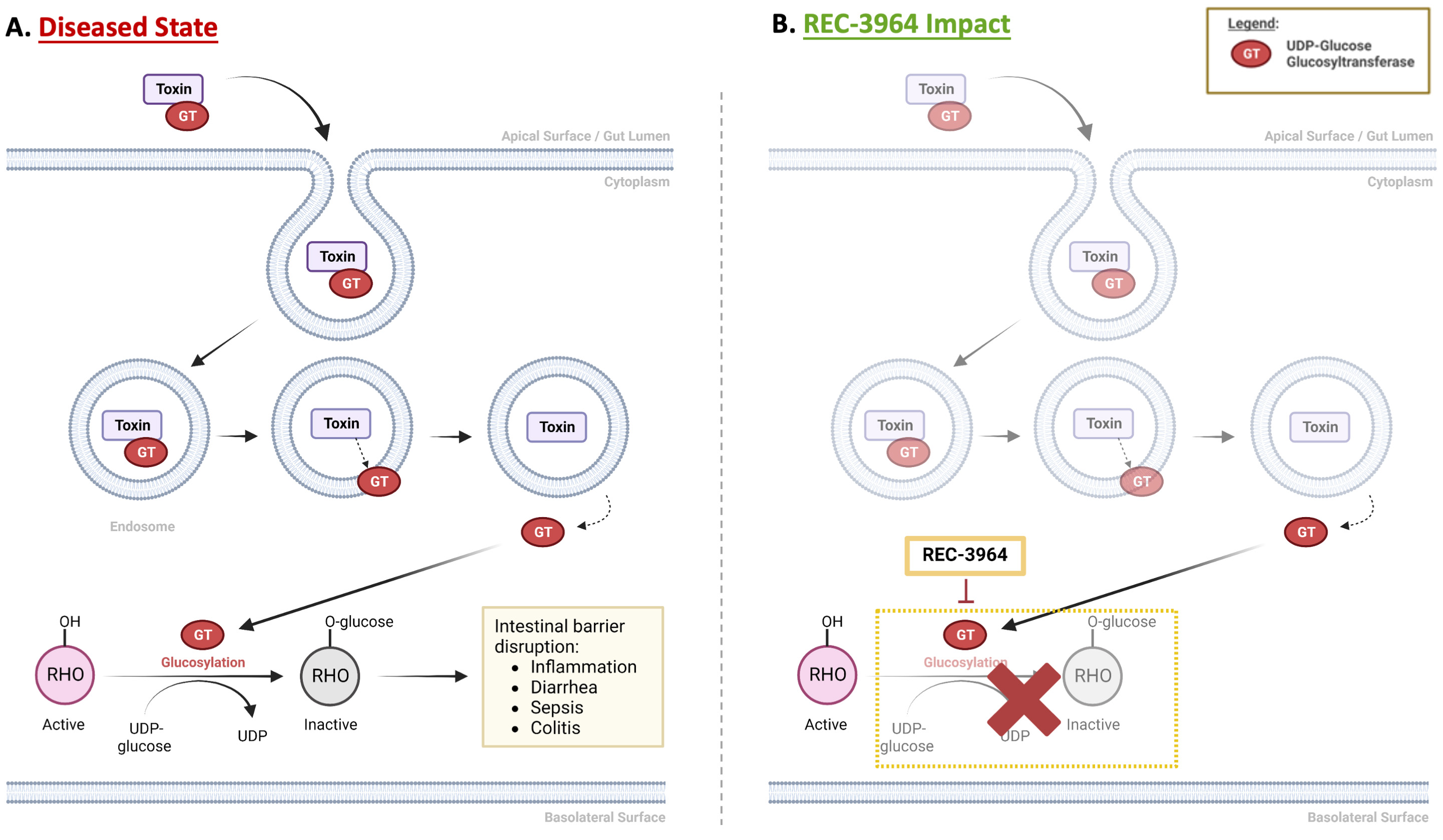
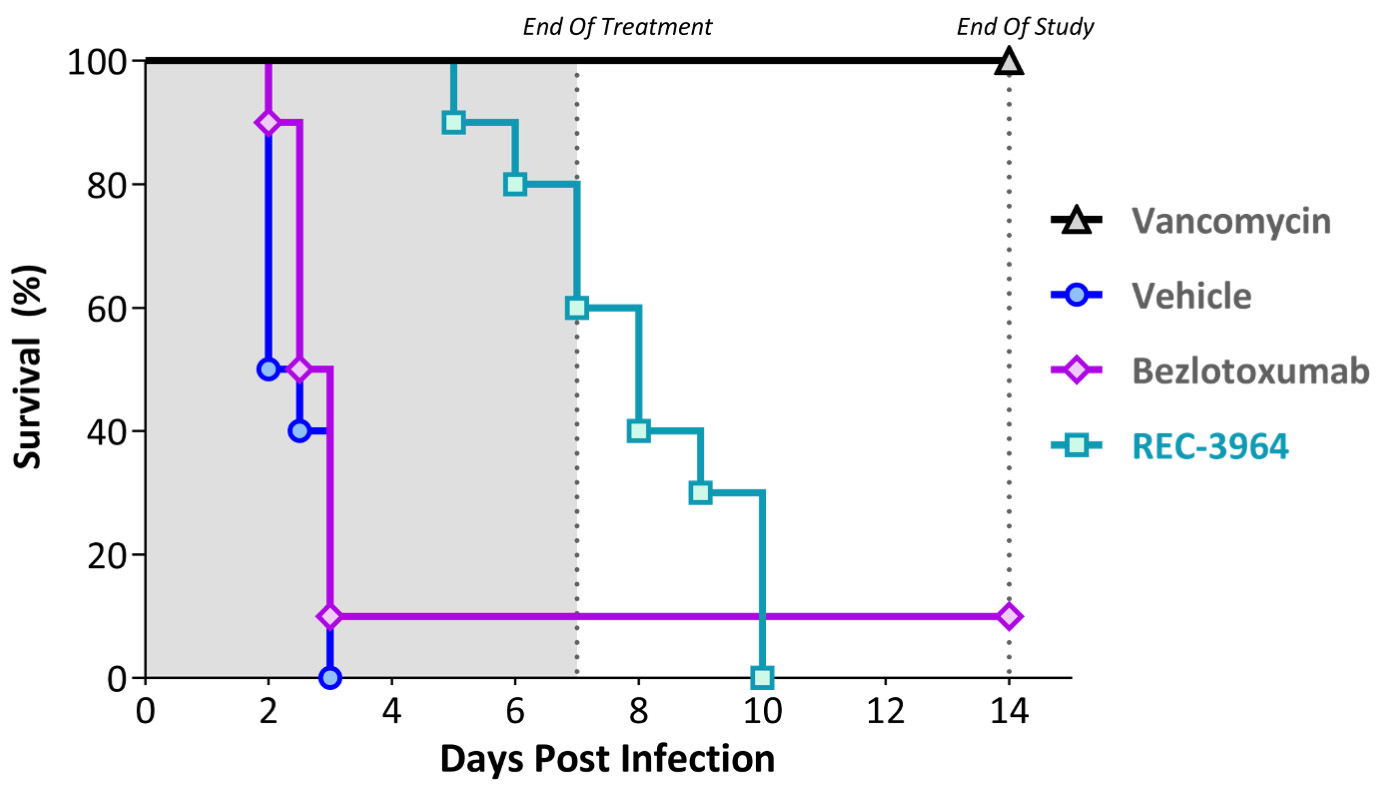
•健康なボランティアを対象とした REC—3964 の第 1 相試験を完了しました。 クロストリジウム·クロストリジウム (クロストリジウム·クロストリジウム) 良好な安全性と忍容性プロファイルを持つ感染
•相同組換え熟練卵巣癌と他の固形腫瘍におけるRBM 39計画をINDイネーブル研究に進めた
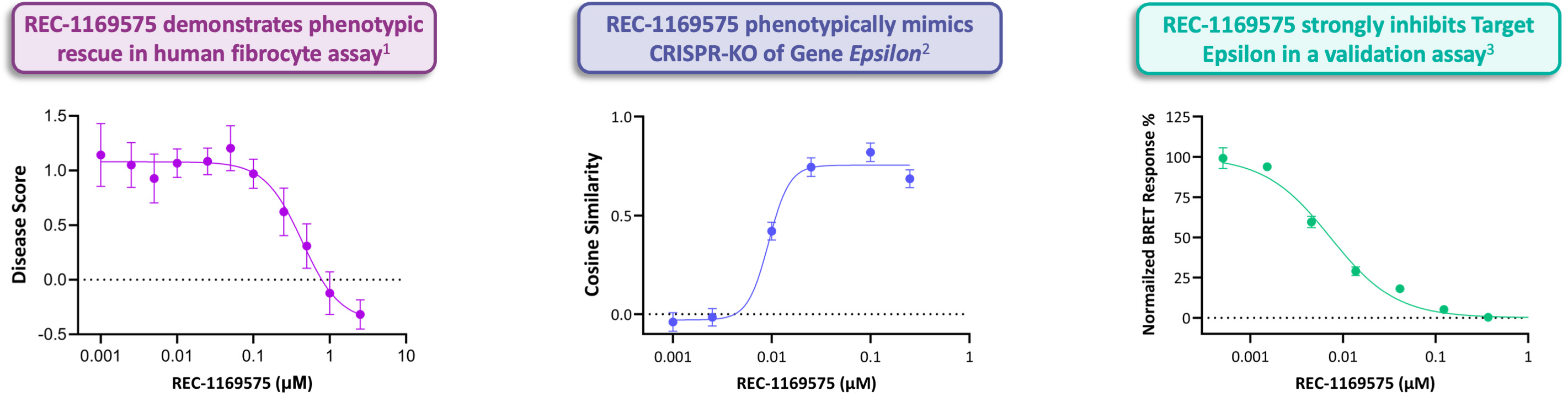
•バイエルとの線維化協力から生まれたプロジェクト(Target Epsilon)は、線維化疾患を治療する新しい方法を代表する許可を得ており、納得できる早期データを有する
仲間関係
•ロシュとジェネンテックとのコラボレーションにおいて、消化器腫瘍学および神経科学の両方で大きな進展を遂げました。ロシュは、消化器腫瘍学における最初のパートナーシッププログラムをさらに推進するための小分子検証ヒットオプションを行使しました。
•バイエルとのコラボレーションを更新し、プログラムあたりのマイルストーン支払額を高め、ニーズが満たされていない困難な腫瘍学的適応症に焦点を当てました。
•生物学と化学の基礎モデルの構築、最適化、展開を加速するだけでなく、 BioNeMo ( NVIDIA の創薬プラットフォーム ) 上で Recursion が構築した計算およびデータツールをホストするために NVIDIA とのコラボレーションを締結しました。
•Tempusと協力して、Recursionが20 PBを超える独自の識別、マルチモード患者腫瘍学データにアクセスできるようにし、因果人工知能モデルを訓練し、新しい治療仮説、バイオマーカー策略と患者列選択を発見することを目的とした
•Enamineとパートナーシップを構築し,Recursionのタンパク質−リガンド相互作用予測を用いて豊富なスクリーニングライブラリーを生成し,Enamineの約360億個の化合物にまたがる膨大なライブラリーを予測した
再帰的オペレーティングシステム
•薬物発見プロセス全体の高度な自動化を実現し、最も完全な全スタックTechBio解決策の一つを作成するために、多種のツールと技術を構築、拡張、工業化した
•複雑な薬物発見タスクを簡略化するために、Recursion OSの湿式実験室と乾燥実験室コンポーネントを自然言語インタフェースを用いて接続するLOWE(大型言語モデル協調ワークフローエンジン)を作成した
•大型言語モデル(LLM)を展開し,我々内部から派生した独自地図に合わせて科学文献地図を作成し,満たされていない需要分野を自律的に認識する新たな機会
•Phenom-1を導入した視覚変換器であり,数億個のパラメータを用いて我々の独自データ中の数十億個の生体画像を訓練しており,これは現在世界最大のエピジェネティクス基礎モデルであると考えられる
•新たなデジタル化学ツールを展開し,Enamine実空間における約360億種類の化合物のリガンド−タンパク質相互作用を予測し,この空間が最大の合成可能化学ライブラリーであることが報告されている
•2022年以来1兆個を超えるヒト誘導多能性幹細胞(HiPSC)由来の神経細胞が生産され,Recursionを世界最大の神経細胞メーカーの一つにする可能性がある
•因果人工知能モデルの訓練を開始し,Tempusからの20 PBを超えるマルチパターン精密腫瘍学患者データを用いて潜在的なバイオマーカーの豊富な発見療法を支援した
会社ビル
•デジタル化学と生成性人工知能能力を支援するためにCyclicaとValence Discoveryを買収しました
•ソルトレイクシティとモンテレアルでの業務を拡大し、トロントにカナダ本部を開設し、私たちの機械学習とデジタル化学チームの発展に専念しました
•私たちのスーパーコンピュータBioHave-1の能力を2倍にして、私たちのパイプ、パートナー関係、基礎モデルの構築を支援するために努力しています。生物、化学、患者を中心とした多様なデータモデルに関連しています。この拡張は、私たちのスーパーコンピュータをTOP 500ランキングのどの業界の上位50位のスーパーコンピュータにするべきだと信じています
ビジョン、使命、人物、文化
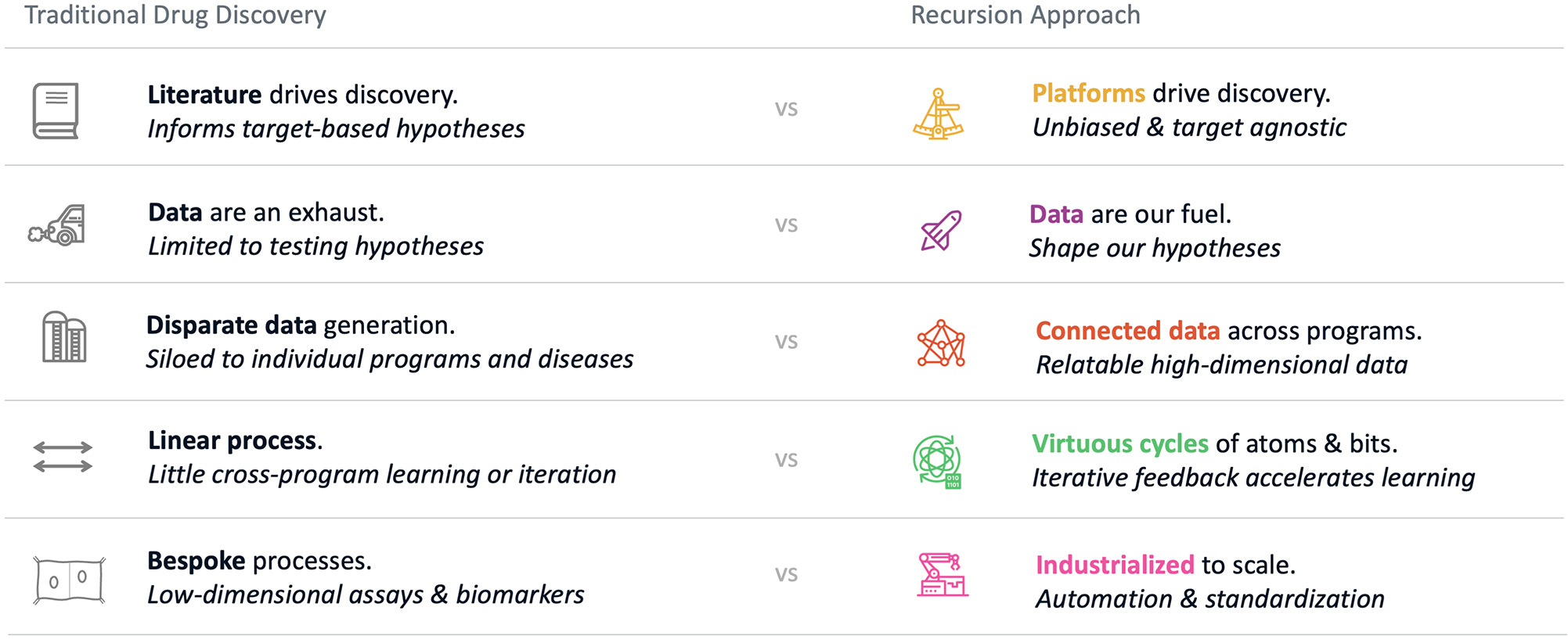
人間生物学は信じられないほど複雑なシステムであり、人間の知能だけではそれを完全に理解するには不十分である。自動化,計算,機械学習(ML)や人工知能(AI)の非凡な進歩に基づいて,我々の世界は次の産業革命に移行している.この進歩は,LLMS,プロダクション人工知能,ChatGPTなどのアクセス可能なアプリケーションの急速な台頭によって明らかである.2023年に科学技術と生物製薬会社及び監督機構と政策制定者の観念が著しく転換したことは間違いなく、彼らは新しい標的発見から次世代製造までの広範な薬物発見と開発における人工知能/MLの効用を強調した
しかし、多くの他の業界からの重要な教訓の1つは、計算の複雑さだけで破壊的な変化を作るのに十分ではないということだ。計算の複雑さが正しいデータとペアリングされるとき、一般に、常に学習、予測、および改善された反復過程において、大きな変化が生じる。
[図1]図1.技術産業において複雑なシステムを描画およびナビゲーションするために簡単な公式を使用する図であるまず、高次元データを生成し、集約し、組織してデジタル表現を作成する。そして,AI/MLアルゴリズムはこのシステムを予測し,これらの予測を現実にテストすることができる.その結果,学習と反復の好循環である.
再帰的に成立したのは2013年であり,計算と機械学習の進歩の融合を利用して,薬物発見や開発効率の低下を解決することを目指している。この機会はMLやAIが最も積極的に影響を与える応用の1つを表していると信じている.我々のビジョンは,薬物開発過程を発見から設計に移行するために,生物,化学,患者を中心とした結果を技術を用いて描画し,ナビゲートすることである。先進的な計算方法,膨大なデータセット,人間の知能にかかわらず,薬物発見や開発の効率曲線を根本的に変えることはできないと考えられ,逆に,複雑な計算ツールでチームを増強し,正しいデータセットの生成と重合に深く集中している会社が顕著な利点を持つと考えられる。私たちの成功と発展したTechBio部門の成功約束は今後数十年でより高い規模とより低い価格で患者により多く、更新され、より良い薬を提供する。私たちはこの分野をリードするために努力しているだけでなく、それを定義している。
図2.eRoomの法則では、長年の技術の進歩は多くの過程を速く、安くしてきたにもかかわらず、薬物発見はより遅く、より高価になっていることが観察されている.1,2 再帰的発生は,これらの分野間の不連続性を利用し,技術革新を加速させる力を利用して薬物発見と開発の効率を向上させるためである。
私たちは再帰的なタスクで解読生物学は根本的に生活を改善します,私たちの視野から自然に流れてきた。私たちは私たちの使命を広く解釈し、それが私たちのチームの持続的な方向とインスピレーションの源泉だと信じている。著者らは10年以上前から開拓、拡大と産業化表現学(細胞構造画像に基づくデータ)を開始したが、著者らは薬物発見は多くのステップから構成されており、1、2つのステップに対する点解決方案は全過程で効率を産生するのに十分ではないことを認識した。生物学を解読するためには、著者らは多くの複雑なワークフローを統合と産業化できる全スタック技術プラットフォームを構築しなければならない。生物学を解読することに成功したことは私たちがそれを制御する方法を予測することができるということを意味する。予測可能な生物学的ナビゲーション能力は、私たち自身であるか、パートナーであるか、または両者を兼ねている広い薬物導管を構築することができるかもしれない。この仕事の一部として,私たちが提供してくれた薬から利益を得ることができる患者の生活を根本的に改善するだけでなく,これらの患者の世話をしている人の生活を改善し,従業員やその家族の生活を改善し,当社のコミュニティを運営していきたいと考えている。
1Scanell、Jら(2012年)が原作。薬物開発効率低下の原因を診断したNAT Rev薬品発見, 11, 191-200.
2Roser,Mらが原作である.(2013年)。技術的変革ですOurWorldInData.org.
図3:再帰的作成原則と価値は私たちの野心的な使命を支持するこれらの要素は共同でRecursionの文化を形成し、私たちの従業員に影響力のある意思決定と行動を誘導する。
私たちは再帰的な文化で意図的に私たちの使命に燃料を提供した。私たちは文化が伝達を駆動していると信じている。私たちの背景の下で生物学を解読する鍵は再帰的な心理状態であり、新しい工業化方法を開拓することによって、かつてない規模で影響を実現する堅固な約束である。生物学を解読するために、私たちは複数の業界の信じられない広い分野から人材を探す意図がある。私たちのすべての従業員たちにとって、再帰は新しい会社だ。私たちの従業員にTechBioへの移行に成功し、私たちの使命を実現することを教えるガイドラインは、私たちの基本原則と価値観です。彼らは私たちの文化の基本的な形態だ。私たちの基本原則は私たちの使命を推進するために科学的で技術的な決定をするように指導してくれる。私たちの価値観は私たちの使命を推進する日常的な行動を定義する
図4.再帰的チームは、多くの異なるフィールドのインターフェース上で動作する必要がある。TechBio社を構築するには多くの学科と分野のインタフェースで滑らかに運営する必要があるが,これらの学科や分野は従来のように伝統的な生物製薬のように密接に協力していなかった。
再帰がどのように薬物発見過程を産業化しているか
伝統的な薬物発見と開発過程の特徴は巨大な財務リスクが存在し、研究開発プロジェクトの長期資本支出は絶えず増加しているが、これらのプロジェクトはよくマーケティング製品として患者の手元に到達できない。歴史的に見ると,薬物発見プロジェクトを早期発見から承認された治療法に転換するのに10年以上を要し,1種類あたりの承認薬物の平均資本化研究開発コストは約20億ドルである。このような生産性の結果,バイオ製薬業界の内部収益率が急速に低下した。
図5.生物製薬業界の歴史研究開発指標。新薬の発見と開発のコストの主な駆動要因は臨床失敗である。スタートした薬物発見計画では,4%未満の薬物のみが承認された治療法であり,新薬を発売するごとのリスク調整コストは約18億~26億ドルであった。3,4,5,6,7
大量の投資と才能あふれる科学者がいるにもかかわらず、これらの指標はもっと有効な薬物発見過程を進化させ、そして新しいツールを探索する必要があることを表明した。伝統的な薬物発見は科学界の基礎研究発見に依存し、疾病に関連する経路と問い合わせの目標を解明する。さらに生物学的に信じられない複雑さに加えて、この方法はこの業界を複雑な疾病の肝心な駆動要素の簡略化論的仮説に依存させ、多くの限られた数の治療目標を追う時、このような仮説は“羊の群れ心理”を引き起こす可能性がある。人の偏見(例えば、偏見や沈没コストの誤りを確認する)がこの状況を悪化させている。この問題を強調したのは,現在の薬物発見活動の順序的性質と,プロジェクト,チームと部門にまたがるデータ重合と関連性の挑戦により,作業が頻繁に繰り返され,このような仮説の科学的リスクを解消するのに長い時間を要することである。数十年の知識を蓄積したにもかかわらず、結果は薬物発見が無意識に革新のために障害を作った。
それと同時に、科学技術業界の推進の下で、計算速度の指数レベルの向上とデータ保存コストの低下に加え、大型言語モデル、生成式人工知能と他のMLツールの急速な台頭に加え、すでに複雑な業界をメディアから交通から電子商取引にまで拡大している。歴史的に見ると、生物製薬業界がこのような革新を受け入れる速度はずっと遅い。過去18ケ月の間に、科学技術と生物製薬会社及び監督管理機関と政策制定者の見方は著しく転換し、彼らは新しい標的発見から次世代製造までの広範な薬物発見と開発における人工知能/MLの効用を強調した。これらの技術の急速な加速と採用は,AI/MLが薬物発見の実質的な飛躍の触媒であるという共通認識が多くなってきていると考えられる。
Recursionでは、著者らは率先して生物、化学、自動化、データ科学と工学領域の革新を統合し、1つの全面的な解決方案の中で薬物発見の工業化を実現しており、この解決策は薬物の発見と開発の数十個の肝心な仕事の流れと過程をカバーしている。例えば、高含有量顕微鏡の進歩とアレイCRISPRゲノム編集技術を組み合わせることで、厳密に解析することができます 複数のヒト細胞環境の中で大量の高次元生物と化学マイクロバンクを構築し、ヒト生物学のデジタル“地図”を作成する。 大規模計算の進歩を利用して,数十億種類の化合物のタンパク質標的を予測する大規模な仮想スクリーンを行うことができる。同様に,我々の自動化DMPKモジュールとInVivologyプラットフォームで生成されたデータは,ADME特性と毒性信号をそれぞれ予測することができ,従来手法よりもはるかに速い。技術の進歩を利用して薬物発見の産業化を実現することにより,科学研究者がこれまで述べていなかった新たな生物学的知見を得,発見生物学に固有の人間バイアスの影響を減少させ,プロジェクト開始時に翻訳リスクを低減することができると信じている。
3周森とジョンソン、R.(2018)。薬が成功する確率Alacritaコンサルティング会社、1-42
4Steedman MとTaylor K.(2020)。10年が過ぎた:薬物革新の見返りを測定する徳勤. 1-44.
5DiMasiら。(2016)。製薬業界の革新:研究開発コストの新しい見積もり“衛生経済学誌”. 47, 20-33.
6Paulらの研究成果。(2010年)。どのように研究開発生産性を向上させるか:製薬業界の重大な挑戦ネイチャー誌は薬の発見を振り返っています. 9,203-214
7マーティンらです。(2017年)。業界が努力したにもかかわらず、臨床試験周期時間は増加し続けているネイチャー誌は薬の発見を振り返っています. 16, 157
[図6]再帰的薬物発見方法。我々は,拡張可能,信頼性,関連データセットを構築する権利に関する我々の基本原則を用いて,新たな生物学的および化学的知見を解明し,薬物発見過程を工業化した。
2023年末までに私たちは世界最大の生物、化学、患者を中心としたデータセットの1つを生成、重合、統合しており、データ量は50 PBを超えている。このデータセットは、固有の表現型グループ学、転写グループ学、予測されたタンパク質-リガンド結合作用、InVivology、ADMEデータ、および多くの生物と化学背景下のより多くのデータ、およびTempusから20 PBを超えるマルチモード腫瘍学患者データの第一選択アクセス権限を獲得することを含む。また,Recursion OSには5兆個を超える予測の生物と化学関係を認識した独自のソフトウェアアプリケーションを構築した.私たちの方法では、薬物発見を探索問題にするために努力し、私たちは偏りのない方法で生物学を作成し、ナビゲーションし、新しい知見を発見し、それらを潜在的な大規模新薬に変換する
ビジネス戦略と価値駆動要因
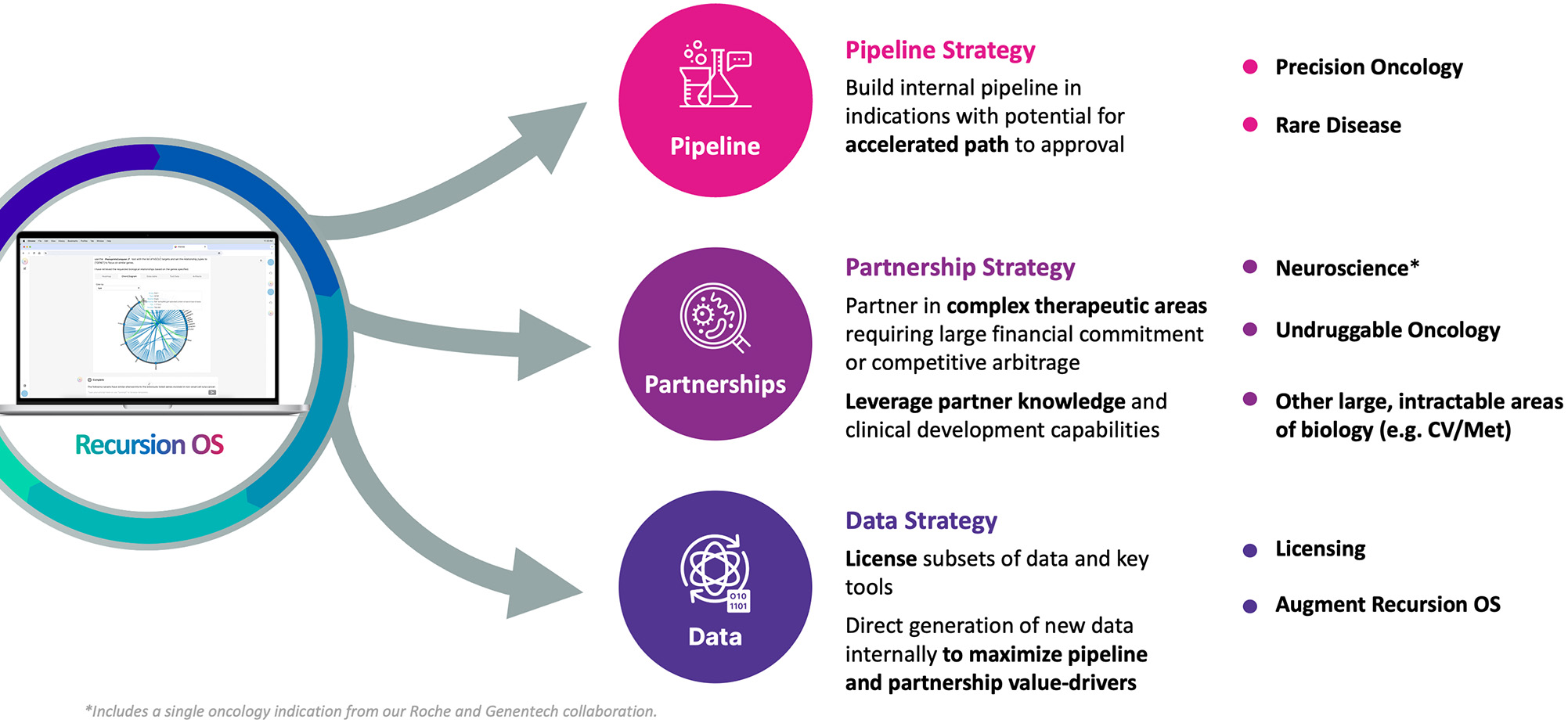
中小生物製薬会社の多くは一部の生物学的あるいは単一治療分野に集中しているが,Recursion OSは生物学分野での大規模な発見と翻訳を可能にしている。しかし,疾患領域の専門知識を確立することは,特に臨床開発において重要であることを認識している。我々は,鍵となる価値駆動要因に焦点を当て,時間の経過とともにRecursion OSの開発に投資し続けることができるように,多管的で効率的な業務モデルを開発し,長期的な価値創造のエンジンであると信じている.我々の描画やナビゲーションツールは可塑性を持ち,治療分野やモデルに適用可能であるが,我々の業務モデルは,我々の3つの価値駆動要因(内部管,変革的パートナー関係,用途に適した独自生物,化学,患者を中心としたデータ)に関する市場と規制動態の性質に基づいて,価値と経済的効率的な推進計画を最大限に実現するためにカスタマイズされている
図7.我々は,我々の再帰的オペレーティングシステムの価値と規模を利用するために,資本の効率的な業務戦略を使用する我々の業務戦略は,(I)資本効率の高い治療分野の内部開発計画,(Ii)資源集約型治療分野の協力計画,および(Iii)独自の用途に適したデータとモデルに分類される。*我々羅氏および遺伝子テークが協力した単一腫瘍学的適応を含む。
価値駆動因子1−資本高効率治療分野の内部開発計画
私たちは今日どのバイオテクノロジー会社の主要な通貨も臨床段階の資産だと思う。生物製薬生態系における利害関係者は様々なモデルを用いてこれらの計画を評価することができ,最も重要なのは,これらの計画が重要な患者の需要を満たす潜在力を持っていることである。Recursionにとって、これらの資産には、(I)Recursion OSの重要な要素を検証すること、(Ii)臨床開発における私たちの専門知識を増加させること、および(Iii)監督機関との円滑な相互作用を促進し、薬品を市場に投入するための内部プロセスを確立することが多くの追加的な利点がある。再帰的オペレーティングシステムが設計通りに発展する場合、未来のプログラムは、今日のプログラムよりも斬新で、潜在的に価値があるかもしれないように、より多くの反復とともに改善されるであろう。垂直に統合されたTechBio社として運営されており,標的発見から臨床開発(さらにはマーケティングや流通)までの各ステップが技術を利用しており,我々の利益関係者(投資家や患者を含む)に最も有利な長期ビジネスモデルである可能性がある。資産が重要な価値転換の節目に達した後、私たちは私たちの長期戦略に再投資できるように、売却可能な資産に対して日和見主義的な態度をとるかもしれない。
価値駆動因子2−資源集約型治療分野の協力計画−
私たちは現在の形で、私たちの再帰的オペレーティングシステムが今日私たちが単独で誘導したよりも多くの治療的見解を提供できると信じている。そこで,我々はバイエル,ロー氏,遺伝子テークなどの経験豊富なトップクラスの生物製薬会社と協力し,厄介な資源集約型生物学分野を探索することを選択した。これらのパートナーシップの主な利点は,(I)潜在的価値を有形価値に変換するRecursion OSを展開することができ,これらの分野では単独で挑戦的であること,(Ii)これらの大規模な治療分野の臨床開発道路は通常資源集約型で高度に複雑であること,および(Iii)これらのトップ企業の同僚から学ぶことができ,長期的に業界競争優位を得ることができることである。この戦略はまた,大手製薬会社の発見過程に溶け込み,別の長期ビジネスモデルを生み出し,多くのこのような会社の貴重なパートナーとなった。現在の私たちの業界全体の価値帰属によると、このモデルだけでは私たちの業務影響を最大限に発揮することはできません。しかし,バイオ製薬業界内部の転換により,我々のこの一部のビジネスモデルには一定の潜在力があり,長期的に顕著な価値を生み出すことができると考えられる。
価値駆動要因3−独自の用途に適したトレーニングデータとモデル
多くの他の業界に示されているように、独自データセットを作成することは、価値駆動要因および競争優位性を生成することができる。Recursionでは,地球上最大と考えられる用途,関連生物,化学,患者を中心としたデータセットの1つが生成されている。複数のグループ技術と200万以上の独自の実験により,Recursionが50 PBを超えるデータを生成,集約,統合する根本的な目的は,機械学習モデルを訓練することである.Recursionは,密な内部作業により,これらのデータと我々自身のモデル,アルゴリズム,ソフトウェアを用いて我々自身の内部薬物パイプライン(価値駆動因子1)を進め,我々の協力者と連携して他の発見計画(価値駆動因子2)を推進する.著者らの領域が薬物発見における技術駆動の革命の潜在力をますます認識するに伴い、著者らのデータは直接に価値を推進する潜在力はますます大きくなっている。選択されたモデルとデータサブセットをますます多くの協力者に許可する潜在力がますます見られてきており,これらの協力者にとって内部作業は最も少ないが,価値が大きい可能性がある.
競争構造と差別化
Recursionは他の技術支援の薬物発見会社とは異なるいくつかの重要な要素がある。
1.再帰的利用多くの生物、化学、および患者を中心とした独自のデータセットとモジュール化ツール薬物発見を産業化し、他の大多数の競争相手会社は点式解決方案によって薬物発見中の重要なステップを解決する。薬物発見は多くのステップから構成されており,点解決策は全過程で効率を生じるのに十分ではないことが認識された。生物学を解読するためには、著者らは多くの複雑なワークフローを統合と産業化できる全スタック技術プラットフォームを構築しなければならない。ある程度,RecursionのLOWE(LLM-Orchestrated Workflow Engine)はワークフロー自動化の自然な発展である.Recursion OSは,将来的には,大規模な人口遺伝学データセットや支払者やヘルスケアシステムからのデータを利用して,患者のためにより高い効率とより正確な医療解決策を推進すると信じている。
2.再帰的統合湿式実験室および乾式実験室能力 内部.内部繰り返しの良い循環を作ることができます用途に適した湿式実験室実験データを乾燥実験室デジタルツールからシリコン片仮説と検証可能な予測は、逆により多くの湿式実験室データを生成し、その中からより良い予測を行うことができる。同様の段階の会社と比較して、再帰は有利な位置にあり、湿潤実験室(従来のバイオテクノロジーまたは製薬会社)のみに集中するか、乾燥実験室のみに集中するか(迅速に商品化されたアルゴリズムと非独自データで区別する課題に直面している)。
3.再帰はすでに実現した顕著な規模科学的、技術的、そして商業的な努力について。5つの臨床段階計画、エキサイティングな臨床前プロセス、羅氏/遺伝子テークとバイエルと生物製薬業界で構築した2つの最大の発見パートナー関係及び3つの技術に集中したパートナー関係を通じて、Recursionは他のTechBio社にはない規模、集成レベルと段階を実現した
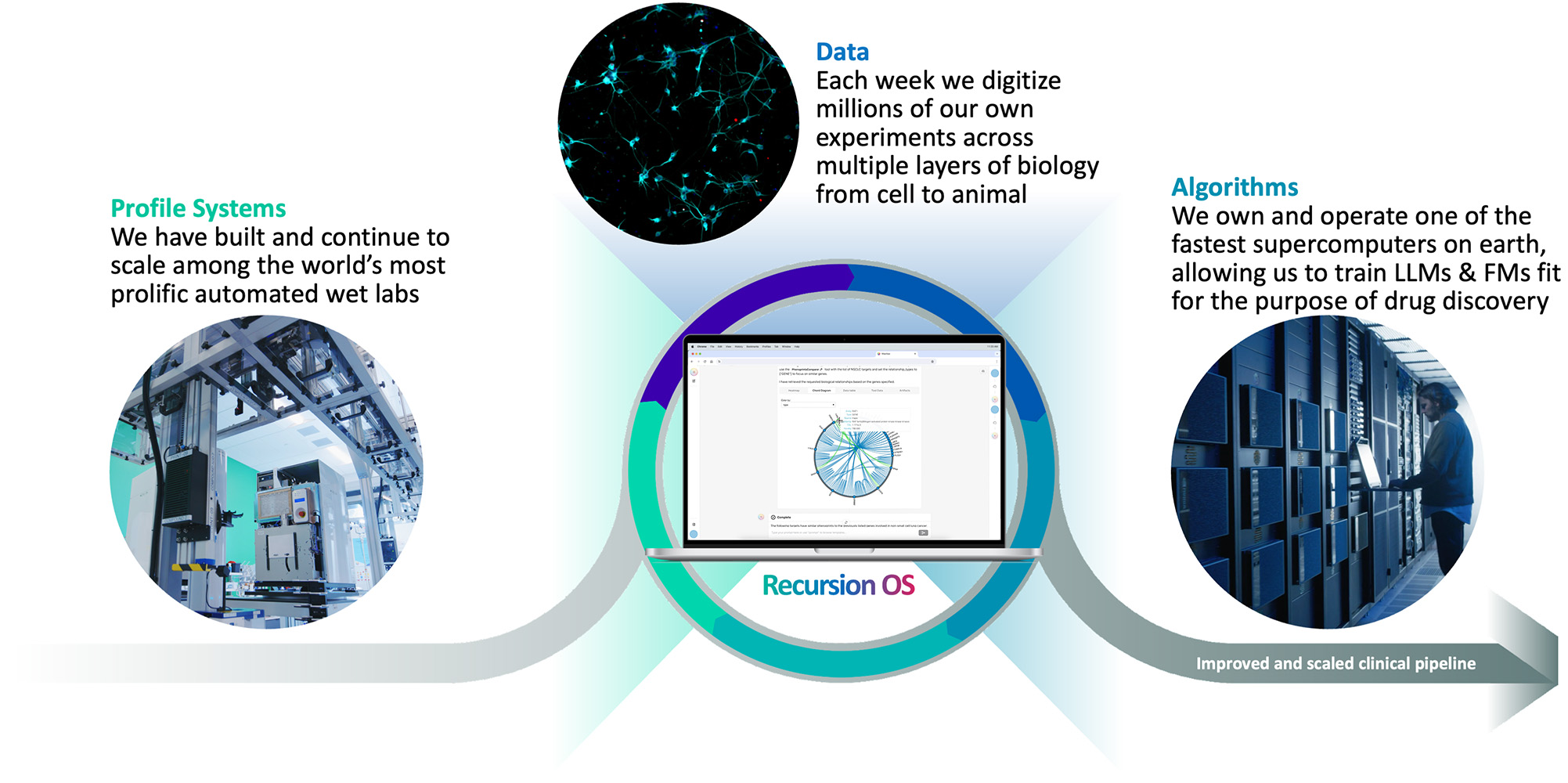
再帰的オペレーティングシステム
物理実験と実験の好循環を作り出すシリコン片バイオ製薬以外の多くの業界のリーダーにとって、モデルは競争優位であった。薬物発見において、実験(湿実験室分析)と機械学習(幹実験室予測)の好循環は、比類のない規模と効率で生物と化学を効率的に描画し、ナビゲーションする方法である。重要なのは、反復的な方法で湿潤実験室と乾燥実験室を緊密に統合することによって、人々は良い学習のサイクルを作ることができ、その中で用途に適した大型湿潤実験室データセットはより良いことを支持することであるシリコン片モデルを生成し、より的確な未来湿実験室実験を支持した
図8.湿式実験室および乾燥実験室の再帰的好循環(1)大量、高品質の経験データを生成するために、表現型グループ学、転写グループ学、英生グループ学、ADMEを含む、自動化を使用して少量のデータ豊富な分析を規模化するために生物および化学システムを記述するステップと、(2)様々な内部ソフトウェアツールを使用して結果データを収集および分析するステップと、 および(3)独自のソフトウェアツールを用いて生物と化学との関係を推定するための描画とナビゲーション。これらの推定の関係は,化学や生物摂動を用いて生物状態間をナビゲートする能力をどのように予測するかの基礎であり,自動化実験室で検証し,学習と反復の好循環を達成することができる。
再帰操作システムは多くの湿式と乾式実験室モジュールからなる。各モジュールは機能であり,標準化されたワークフローでもあり,場合によってはこれらのワークフローは高度な拡張と自動化が行われている.効率を向上させるために,これらのモジュールは,我々の内部パイプラインや大型製薬パートナーシップに関連する薬物発見や開発活動に挿入できるように工業化されている。標準化ワークフローを接続することは、モジュール化プログラミングに類似していると考えられるが、生物学的および化学的環境では。工業化のための偏見のない薬物発見と開発のための汎用連結モジュールフレームワークは再帰的オペレーティングシステムである。
図9.再帰的オペレーティングシステムは、工業化、偏見のない薬物発見および開発のために一緒に接続することができる多くの乾湿実験室モジュールからなる各モジュールは機能であり,標準化されたワークフローでもあり,場合によってはこれらのワークフローは高度な拡張と自動化が行われている.
[図10]再帰的オペレーティングシステムは、複数の学習および反復周期によって薬物発見および開発プロセスの工業化を達成することを意図しているRecursion OSは湿実験室と乾燥実験室モジュールの生物ローカル周期に基づいて、表現型グループ学、転写グループ学とInVivグループ学を利用して目標と化合物の発見と検証を推進し、ADMEの化学ローカル周期を予測して最適化検証のヒットを推進し、人類の臨床試験に適した候補開発を開発する。
ウェットラボ(物理)
大規模かつ関連するデータセットを作成するためには,標準化と大規模化が自動化によって最も実現できる2つの重要な要求である.標準化は、毎回、日々、毎年一貫して実験が実行されることを意味し、任意の偏差を検出、追跡、および量子化することができる。それは細かいメタデータ収集、展望性/遡及性試験実行分析、標準結果保存、定量品質管理などを含む。これにともない,週数百万回の実験を行う大規模では,高速かつ密な協調処理を行う多段解析が必要となる.正確な重複、高速と大量の結合は訓練された科学者ではなく、ロボットに依存することに有利であり、彼らの時間は特定の背景の問題によりよく使われる。また,大規模高次元実験読み取りの自動化は,大型高次元デジタルデータセットのコストを低減することができ,これらのデータセットは,現在の機械学習分野の先端機会を支えることができる.
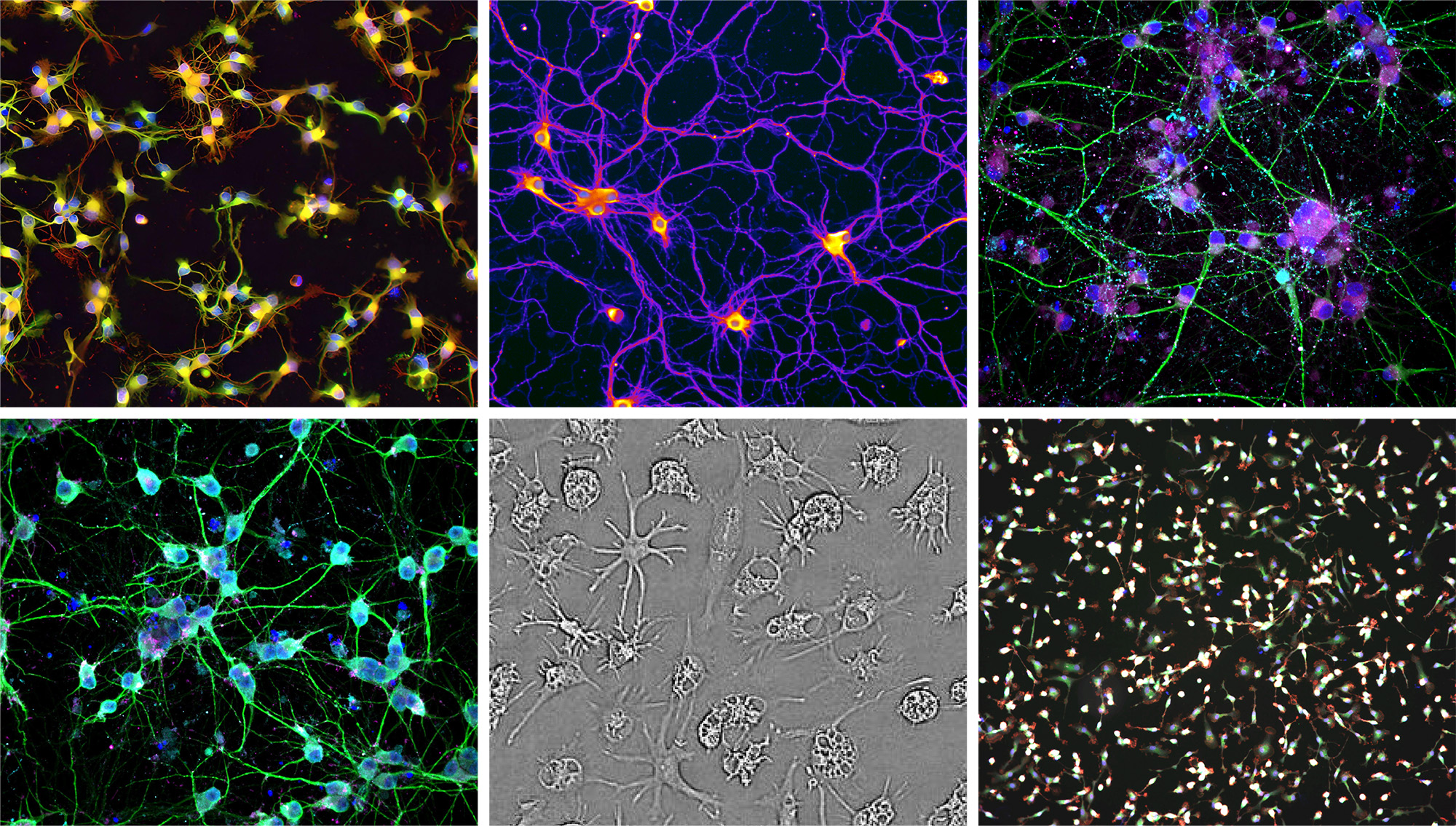
Recursion OSが使用するデータは,染色と多時間生細胞表現型グループ学(Brightfield),転写グループ学,プロテオミクス,InVivology,ADME分析および予測されたタンパク質−リガンド関係を含む。Recursionはまた、100万種類以上の新しい化学物質(NCE)起点物質、道路標識として使用可能な大型既知化学実体バンク、および我々の協力者に属する50万種類以上の化合物を含む170万種類以上の化合物を含む物理ライブラリを有する。さらに、Recursionは、カスタマイズされた全ゲノムアレイCRISPR指導ライブラリを生成する。これらのツールを組み合わせて、Recursionは私たち自身の湿った実験室で数百万種類の異なる生物摂動を探索することができるようにした。著者らはすでに多種のヒト細胞タイプの異なる生物と化学環境において2億個を超える表現型グループ学と700,000個を超える完全な転写グループ学実験を行った。2023年には,我々の自動化DMPKモジュールの完成にともない,我々は現在数万のADME実験を行っている.我々の組織培養施設では50種類以上のヒト細胞タイプを大規模に生産し,連合培養と複雑なIPSC由来細胞タイプの大規模化を可能にしている。例えば,Recursionは2022年以来,羅氏や遺伝子テークとの協力のために1兆個を超えるHiPSC由来の神経細胞を創出してきた−世界で他社には少ない規模である
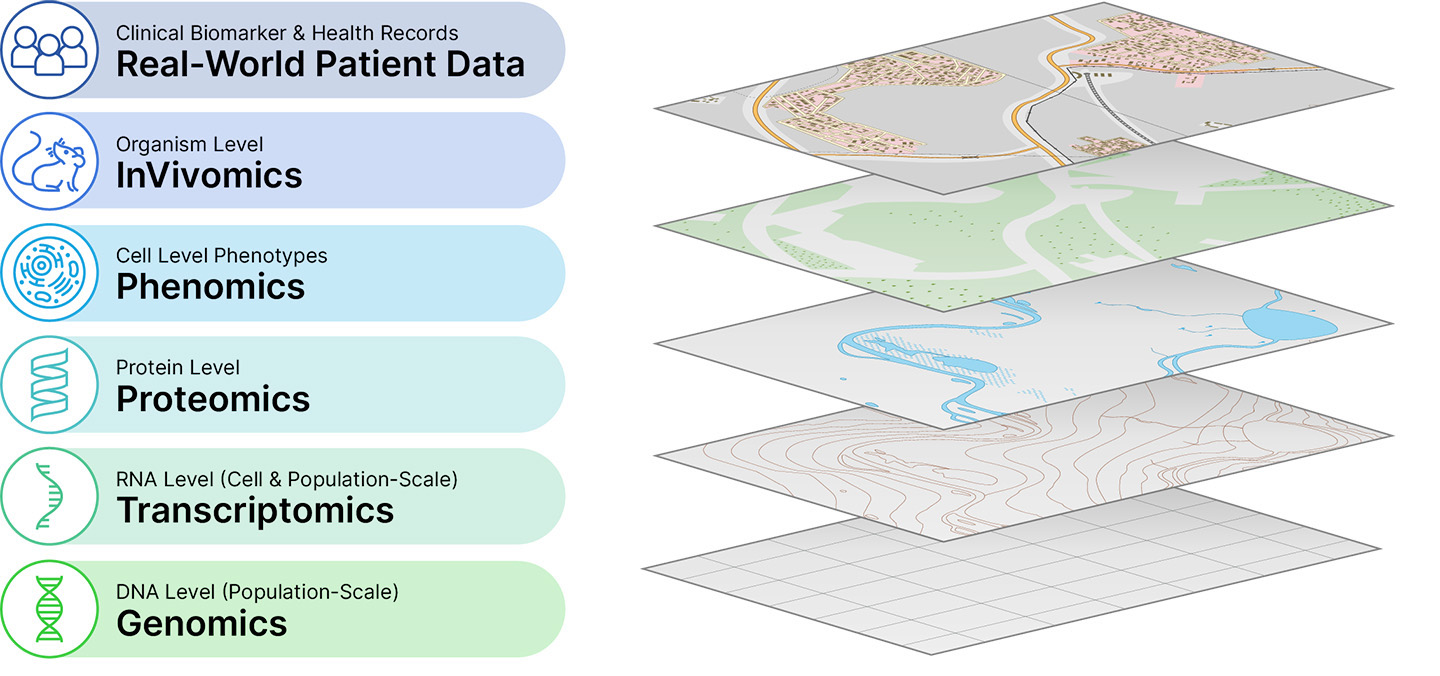
図11.再帰的オペレーティングシステムによって利用される様々なデータセットは、強い相補性を有し、地球デジタル地図の異なる層のような有用な背景を増加させる。複数のデータパターンは、レイヤ内とレイヤとの間の接続を識別することを容易にし、それにより、規模で生物を復号することができる
オートメーション
私たちは自分がハードウェア革新者だとは思わないが、私たちは強力な自動化科学者チームを利用して、先進的であるが広く利用可能なロボットアセンブリ、例えば液体分配器、洗浄機、孵化ステーション、自動高速液体クロマトグラフ、質量分析計、自動顕微鏡撮像システムを組み立て、同期して、任意の所与の時間に1つの小チームだけが全プロセスを監督し、それによって様々な豊富なデータ出力の数百万個の実験を効率的に実行する。これらのロボットシステムは設計上モジュール化されており,複雑で可変なワークフローを作成することが容易に構成できる.また,我々は最近,我々の主な実験ワークフローにおけるすべてのステップで鋼板を連続的に処理する完全に統合されたシステムを動作させた.この完全に統合されたシステムは、既存のバッチ作業ユニットと相互動作することができるが、私たちのオペレータにより多くの検査免除時間を提供し、より小さい敷地面積でより大きなスループットを提供する
図12.私たちの高スループット自動化プラットフォームは、生物研究開発実験室ではなく、私たちの実験室を複雑な製造施設のように見えるようにした。我々の高スループット表現型グループ学プラットフォーム(TOP)は毎週220万個もの高品質の実験を実行し、下流分析を実現することができる。私たちは再帰的な多くの他の分析をますます自動化している。
細胞培養と細胞分化ツール
静脈、腎臓、肺、肝臓、皮膚、免疫細胞サブセットなどの高品質の一次哺乳類細胞、幹細胞由来細胞株、がん細胞株を一貫して生産する最先端の細胞培養施設を構築しています。合計で 50 種類以上のセルが当社のハイスループット検出システムに搭載されています。2022 年には、ヒト誘導多能性幹細胞 (hiPSC) 株を活用した細胞培養施設を大きく拡大しました。具体的には、 CRISPR ゲノム編集技術を用いてノックアウトラインまたはノックインラインを生成するプロトコルを開発しました。3 次元および 2 次元分化法を用いて hiPSCs をいくつかの異なる細胞型に分化するプロトコルを開発した。さらに、標準化および部分自動化法を用いてこれらの細胞を特性化する内部能力を開発しました。最後に、週に 500 ~ 1000 億個の目的細胞を生産し、アッセイ準備の凍結形式で細胞を凍結保存するためのスケーラブルなプラットフォームを開発しました。2022 年以降、私たちのチームは 1 兆兆以上の hiPSC 由来の興味のある細胞を生産し、様々な進行中のプロジェクトをサポートしています。
図 13 。再帰によるフェノミクスアッセイのための様々な細胞を社内で大規模に培養しました。これらの細胞は、神経科学研究を支援する iPSC 由来のさまざまな神経細胞タイプを表しています。
表現型グループ学
細胞形態は細胞状態に対する全体的な測定であり、それは細胞生物学的底層の変化を含み、遺伝子発現、蛋白質の生産と修飾及び細胞シグナルを含み、1つの強力な読み取りに統合する。画像ベースのグループは、データ密度が他のグループデータよりも2~4桁高いデータとすることができ、1ドル当たりの密度は、他のグループデータセットよりもこれらに近い読み取りに集中し、1ドル当たりのデータをより多く生成することができ、私たちの薬物発見作業に情報を提供することができる。現在、私たちは週に220万回もの実験を通じて1320万枚もの画像や110 TBの新しいデータを生成しています。私たちの表現型グループ学的方法は、最近技術業界によって過去10年間推進された強力なコンピュータ視覚とML方法の爆発的な増加に基づいている。現代MLツールは、これらの特徴が人間の目に見えなくても、予め選択された疾患固有のテーマ専門知識に依存することなく、画像の最も顕著な特徴を識別するように訓練されることができる。これらのツールを用いて,病原性摂動や治療的摂動によるポリマー細胞反応を捕捉し,これらの変化を公正な方法で定量化し,ヒトの偏見から抜け出すことができる。対照的に,従来の薬物発見は,想定された標的仮説とカスタマイズされた生物シグナル分析に依存し,これらの分析は狭い,あらかじめ決められた生物学のみを捕捉し,生物探索の範囲を制限している。
図14.AI/MLモデルは人間の目では区別できない細胞表現型を検出することができる.我々の画像の多くの形態の違いは微妙すぎて人間の目では知覚できないが,我々のRecursion OSに配備されているPhenom-1のような人工知能モデルは容易に分けることができる.ここで示したこれらの画像の学習埋め込み間の類似性熱図は明らかな分離を示しており,訓練された細胞生物学者や病理学者でも一致した違いを記述することは困難である。
我々が生成した撮像データは、カスタマイズされた一度の撮像読み取り値のデータ島を作成するのではなく、様々な生物学的および化学的環境に広く一貫して使用されて、大量の関連データセットを作成することができる。これまで私たちの表現型グループデータの多くは複合体を捕捉する蛍光顕微鏡画像を含んでいました
細胞形態の変化。このプロトコルは、6つのサブ細胞染料によって6つの異なるチャネルで画像化され、実験室条件下で培養および妨害することができる壁付きヒト細胞タイプのほぼ任意の広範な生物を捕捉することができる最適化されている。2023年には、表現型グループデータを収集する方法を拡張し、Brightfieldイメージングを使用して私たちの細胞から動的時点情報の捕捉を開始しました。この技術の利点は、同じ井戸内で経時的および分析にわたるデータを捕捉することができることである(例えば、同じ実験井から転写終点を捕捉することができ、同じ実験井では、関心のある摂動後に時間の経過とともに細胞をイメージングすることができる)。Brightfield画像はますます著者らの表現型グループ学実験に取り入れられ、複数の時点とモードにまたがる画像分析をより速く、もっと費用効果があるようにした。これらの広範な適用方法により、小分子による表現型変化、遺伝機能の獲得と喪失、毒素、分泌因子、サイトカイン、感染性因子、またはこれらの任意の組み合わせを含む一連の関心生物および薬理学的現象の影響を捉えることができる
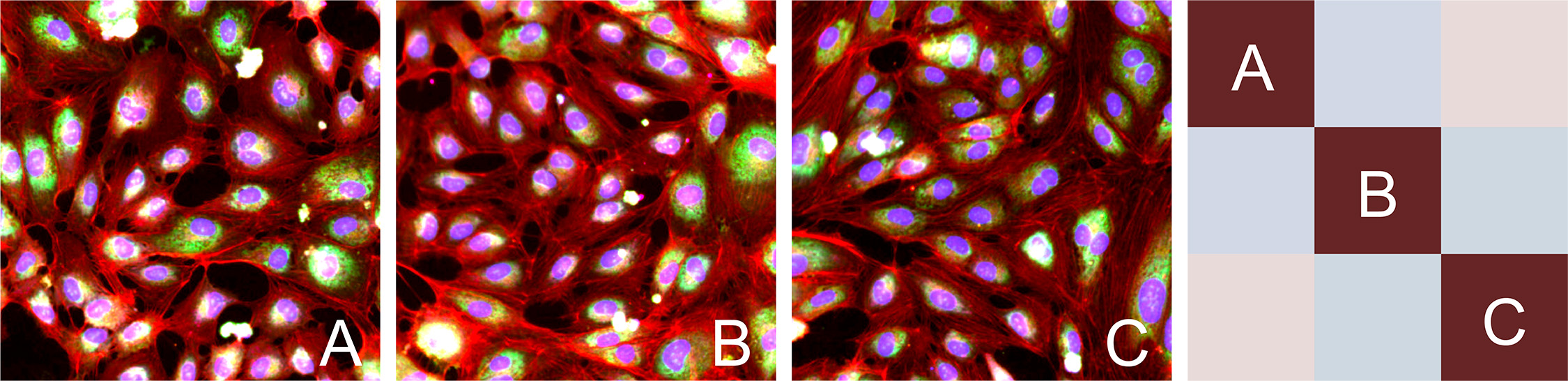
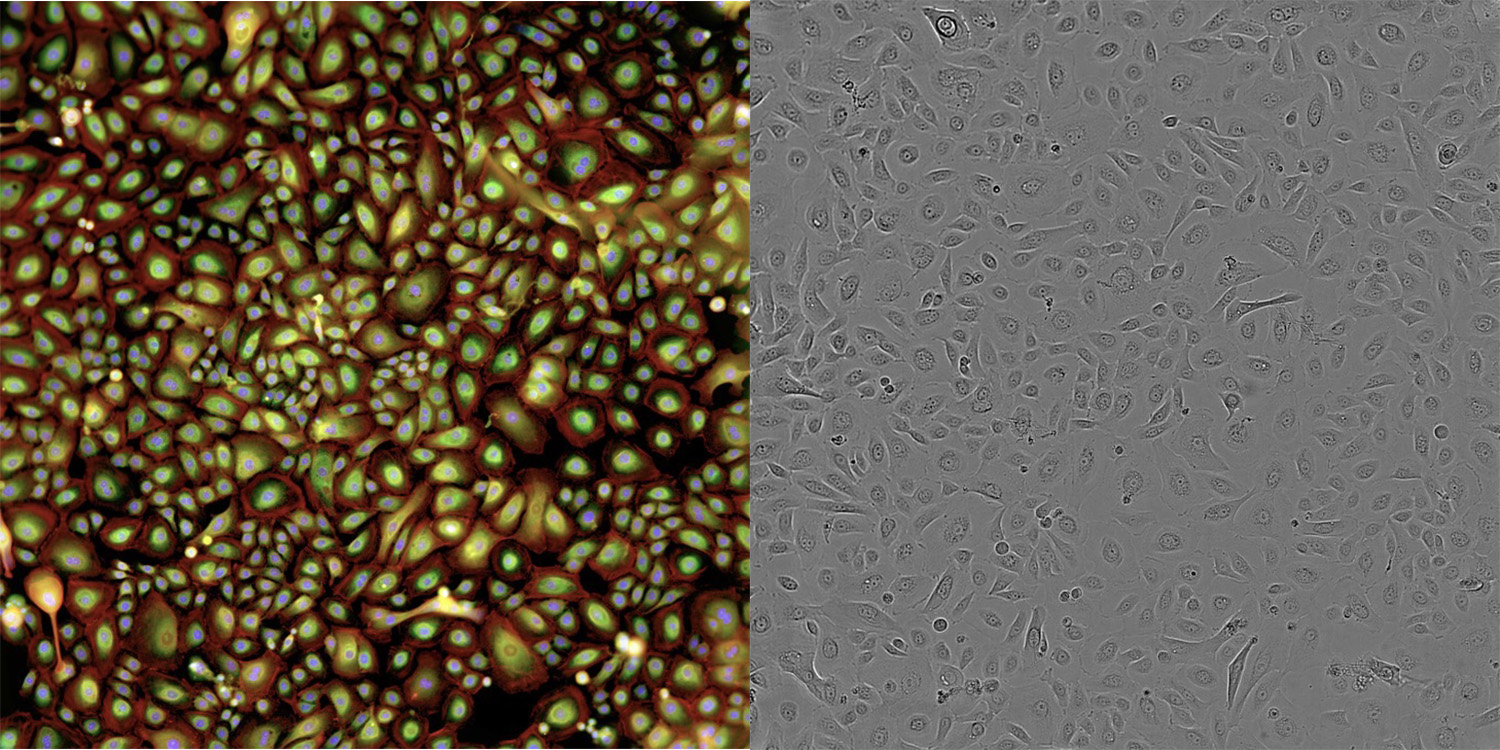
図15.我々の蛍光染色レジメンを用いた細胞画像(左)とBrightfield細胞画像(右)を比較すると,両者とも細胞状態に関する複数の階層の情報を捕捉しているBrightfield画像はますます著者らの表現型グループ学実験に取り入れられ、複数の時点とモードにまたがる画像分析をより速く、もっと費用効果があるようにした。
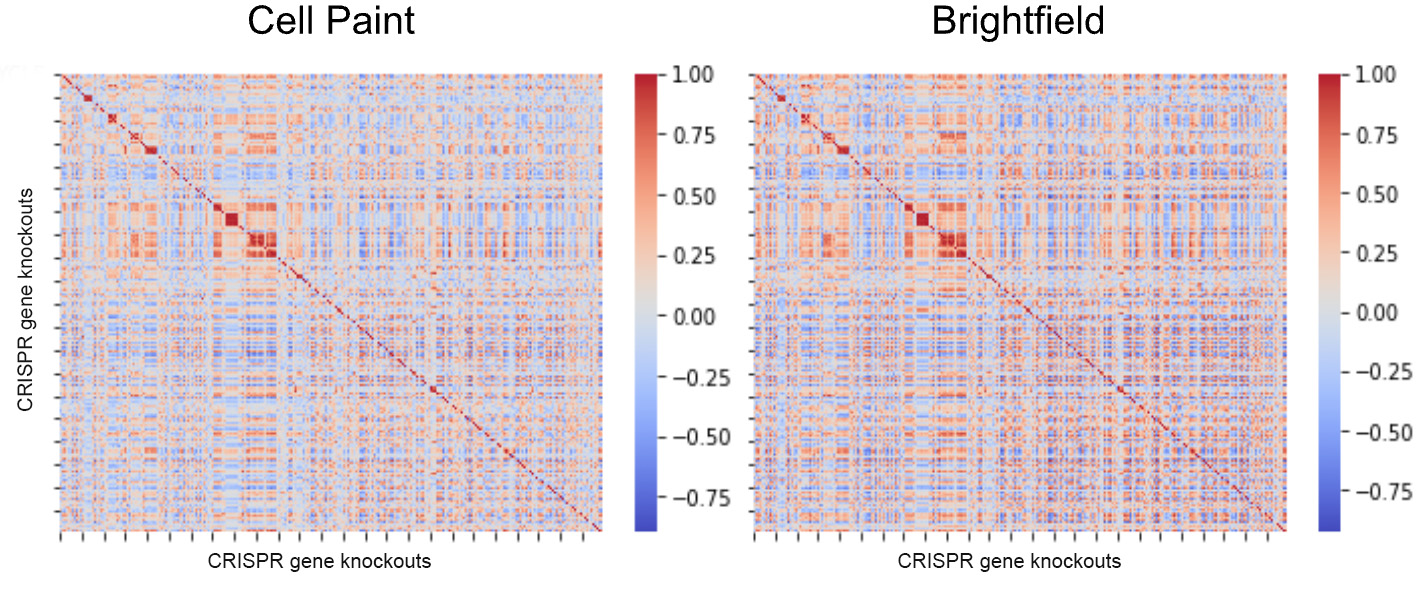
図16.Cell PaintとBrightfield技術からの表現型グループデータを用いて作成した地図は,高度に類似した結果を示している熱図は様々な根拠のある細胞系にまたがる遺伝子間の関係を示している。
転写学
歩行自動化とボタンデジタルデータ処理を備えた内部転写学実験室プラットフォームを開発し,毎週25,000個までのサンプルを分析することができ,任意の生体モジュールから抽出したサンプル中の20,000個近くの遺伝子の発現をカバーした。2023年末、私たちは私たちのトランスクリプトームプラットフォームを用いて700,000個を超える個々のトランスクリプトームサンプルをシークエンシングして、多くのプロジェクトに対する生物学的理解を高め、私たちの表現型グループ画像データを補充するために別の直交生物マップデータを作成し始めた。2024年には,我々の表現型グループプラットフォームから識別されたより多くのクリックが直交転写読み出しを用いて確認できるように,我々の工業化計画生成ワークフローの一部として,このデータ層でも全ゲノム規模のレンダリングが可能となるように,さらにこの能力を拡張して自動化する予定である.この方法はRecursion OSからの高次元、大規模データ層を結合し、表現型グループ学と転写グループ学を越えて、著者らは科学者の後続仕事に対してどのような見解を優先する自信を増加させることができ、同時にコストと人力資源を最低に下げることができる。我々が補足表現学を拡張して転写グループ学を拡張した方式と同様に、プロテオミクス、代謝グループ学、脂質グループ学など、他のデータタイプを拡張する予定である。
図17:調整された転写切断実験プロセスを再帰的に利用して業界標準のシークエンシングシステムを利用して、各サンプルのコストを大幅に低減する。
英活の組学
生体内研究は完全、複雑な生体システム全体において化合物の有効性と安全性を評価する重要なツールである。薬の発見や開発の他のステップと同様に伝統的な体内にある研究はヒトバイアスに満ちており測定する研究後のエンドポイントには制限があります当社の In Vivo データ収集インフラストラクチャ ( 当社が InVivomics と呼ぶ ) を使用して、連続ビデオフィードとセンサー技術 ( 例 : 、家庭環境で中断されることなく動物を監視し、数日間、数週間、さらには数ヶ月にわたって進行中の研究を通じてライブ読み取り値を分析します。
2023年には1000個以上のデジタルマウスケージユニットで構成されていますこれらはデジタル耐性研究を支持し、著者らは異なる毒性モード特有の表現型反応を識別でき、そして治療効果研究においてどの化合物と投与量を使用すべきかを確定する。著者らはまた体内治療効果の研究を行い、全動物のデジタル観察に基づいて治療効果を早期に評価する。われわれのInVivology耐性研究をラットに拡張し,全動物デジタル観察の優位性を利用して探索的な非GLP毒理学研究を開始した
図18.私たち独自の拡張可能なスマート住宅システム体内にある研究はすべてのケージからのビデオとセンサデータを自動的に収集し分析した。
ADMEデータ
2023年、Recursionカスタマイズされた高スループットロボットADME実験プラットフォームが生産された。厳格に設計された標準制御と品質管理指標に基づいて、高品質、再現可能なデータを評価し、データ品質を確保する。これらのデータは我々が実験データを接続する倉庫システムに含まれている.著者らはこの急速に増加したデータセットを用いて、微小体安定性、血漿蛋白結合、ミクロソーム蛋白結合と受動透過性結果の予測モデルを構築する。これらの予測モデルは,最終的に高品質化合物の獲得をRecursion集合に優先して我々の計画を加速させることを目的としている。私たちはまた分析実験室を設立し、最先端の液-質結合設備を備えている。私たちの分析化学チームは、私たちのプロジェクトの全ライフサイクルにわたって、化合物の特性と純度を評価して品質管理を行い、血漿および組織試料中の化合物濃度の生物学的分析を含む私たちの仕事を支援しています体内にある臨床前と臨床翻訳を支援するために、バイオマーカー識別と検証活動を研究、バイオマーカー識別と検証活動
図19.Recursionの自動化DMPKモジュールは大規模と人類とげっ歯類細胞中で血漿蛋白結合、ミクロソーム安定性と細胞透過性研究を自動化分析実行することを可能にし、プログラムを推進する同時にMLとAIアルゴリズムの開発のために最先端の訓練データを生成するこのシステムは、追加のモジュールのような自動ワークフローに新しいモジュールを潜在的に追加することを意図している体外培養吸収、分布、代謝、排泄と毒性(ADMET)試験.
化学
我々の内部化学ツールには,物理化合物収集,最先端の化合物貯蔵·処理インフラ,高精度分析装置がある。物理能力は我々の先端の計算とデジタル化学プラットフォームと結合し、効力と性能最適化の良性循環を通じてHIT識別と進展を加速し、差別化された候補薬物を提供する。私たちは、商業、半特許、独自、およびパートナー源からの170万個以上の小分子を含む内部化学ライブラリーを有し、このライブラリーを使用して、発見活動の化学的出発点を決定する。これらの化合物のうち100万種類以上がRecursionの新しい化学実体バンクに存在し、著者らの計算と薬物化学者によって管理され、高い薬物可能な化学特性を設計し、同時に悪い溶解性と透過性などの不良な化学特性を回避する。このライブラリーの構築は化学多様性を最大限に向上させるためであるが,早期HITの緊急SARの認識を支援し,HITを入手しやすい類似物に迅速に拡張できるように,多くの化合物コアを含むいくつかの類似体を確保している。また,公共フォーラムや文書から約10,000種類の臨床期と臨床前化合物を選び,約1,000種類の独自の作用機序をカバーしており,現在多くの既存データや注釈が存在している。これらの良好な特性を有する分子は,我々の作業においてツール化合物としてよく用いられており,再帰OSが独自の従来開示されていない生物活性を示していれば,治療プログラムとして進められる可能性がある。
[図20]我々の最先端の複合ストレージおよび処理インフラストラクチャこれらのツールは6000万種類までの化合物(めっきフォーマット)を現場に保存する潜在力を提供している。
2023年12月、私たちはイナミンと協力して、世界の薬物発見業界のために豊富な化合物ライブラリーを生成し、設計した。Recursionの仲人AIモデル(Recursionが2023年にCyclicaを買収してRecursionに添加した製品)を用いてEnamine Real Spaceにおいて高価値目標に結合すると予想される化合物を認識することにより,薬物発見目的のためにより強力な化合物バンクを生成できると考えられる。再帰的に我々の化学ライブラリを拡張しており,MatchMakerやRecursionによって開発された他の予測MLモデルを用いて,処理しやすい起点を表し,我々の表現型グループプラットフォーム上で生物活性の可能性の増加を示す化合物を選択している。私たちの内部化学庫の総規模は、いくつかの大手製薬会社が管理している化学庫の規模に匹敵すると信じている。我々は,今後数年間,自動化化学マイクロ合成への協力と投資により,新たな生物と化学関係をより十分に知るために,我々のNCEライブラリーの規模と多様性を大幅に増加させる予定である。私たちが最近完成した湿式実験室の拡張に伴い、私たちは現在6000万種類もの化合物(平板形式)を現場に保存する可能性がある
図21である.我々の仲人技術はEnamine Real Spaceにおける約360億種類の化合物のタンパク質標的(S)を予測し,この空間は世界最大の検索可能化学ライブラリであることが報告されている。我々は我々の多組学データセットの補完データ層として予測された相互作用を用いて,我々の湿実験室からの機械的予測を磨き,我々の内部パイプラインと我々のパートナーのより良い予測によってSAR周期を加速させる.
患者を中心としたゲノムデータ
2023年、著者らはTempusと協力して、Recursionが数十万の癌患者の診断ファイルから収集したDNAとRNA腫瘍シークエンシングデータ、イメージングと健康記録を含む20 PBを超える独自の識別、マルチモード患者の腫瘍学データにアクセスできるようにした。これらのデータはRecursionに独特な機会を提供し、著者らの湿式実験室プラットフォームの“逆遺伝学”方法(特定の遺伝摂動に関連する細胞表現型を識別する)を患者を中心とした“順方向遺伝学”データセット(癌タイプ、進行、反応および生存を含むがこれらに限定されない疾患関連表現型に関連する遺伝子タイプを識別する)と融合させると信じている。特に,このデータセットを用いて因果人工知能モデルを訓練し,患者データと再帰的独自実験データを用いて,患者データ中の単純な相関や関連を超えて,優れた治療標的とキャリブレーションの良好な群を識別することで,われわれの腫瘍学的臨床試験を加速させ,腫瘍学的治療開発の速度,精度,規模を向上させる予定である。
図22である.再帰逆遺伝学とTempus順方向遺伝学データの統合。肺癌では駆動因子以外の新たな潜在的原因結節が知られている。右上、肺癌潜在遺伝子標的の分布は文献証拠に基づいて優先順位付けを行った。右下では,我々の因果発見ワークフローを用いてRecursion−Tempus連合証拠を用いてこれらの遺伝子を再配列し,いくつかの新たな標的を発見し,その治療効果は既知の非小細胞肺癌駆動因子に匹敵する可能性がある。
乾燥実験室
処理とデータ保存インフラ
Recursion OSは、高度な拡張可能で柔軟なコア技術スタック上に構築されています。我々は,環境と我々のニーズに応じて公共雲インフラと私有雲インフラの利点を利用するハイブリッドクラウド戦略を採用した。
公共雲。パブリック·クラウドは、私たちが作業負荷とアプリケーションを生産するためのデフォルトの選択です。公共クラウドコンピューティングプロバイダが提供する規模、計算、ストレージの弾力性、規模経済は、私たちの戦略を経済的に効率的に実行することができます。私たちはクラウドサービスプロバイダの大量の資本と投資から利益を得て、規模の大きい技術を利用して、そうでなければ、私たち自身がこれらの技術を構築するコストが高くなります。
私有雲。私たちは持っているインフラを利用して私たちの実験室での活動を調整し、公共クラウドにデータを送信します。我々はまた,GPUに基づく高性能計算を持ち運営し,我々の最先端の機械学習モデルを訓練している.GPU利用可能性が高止まりし続ける場合、このインフラストラクチャを所有することは、回復能力(ローカルラボ)および利用可能性(GPU)の両方に重要である
BioHave-1とプライベートクラウドにおける高性能計算。我々のディープラーニングモデル訓練や研究の大部分は,我々のBioHave-1という世界的なスーパーコンピュータ上で行われている.BioHave-1はNVIDIAのDGXスーパーゴンドラアーキテクチャに構築され,2023年11月現在,世界最強のスーパーコンピュータ500強ランキングで157位にランクインしている.2023年11月には,NVIDIAと協力してBioHave-1を拡張し,計算能力を4倍以上向上させることを約束した.BioHave-1は、完成とベンチマークテスト後、世界のどの業界でも最も強力な50台のスーパーコンピュータ(TOP 500ランキングによる)にランクインし、任意のバイオ製薬会社が所有·運営する最も強力なスーパーコンピュータになると予想される。計算,データ,人材の結合は,業界をリードするAI/ML基礎モデルを訓練できると信じている
図23.生物蜂巣1号は薬物発見に取り組む最も強力なスーパーコンピュータの一つであると信じている。2023年11月、我々は、既存の300個以上のNVIDIA A 100テンソルコアグラフィックスプロセッサに基づいて、500個以上のNVIDIA H 100テンソルコアグラフィックスプロセッサを増加させることを約束し、これにより、我々の計算能力を4倍以上に増加させる。
再帰データ宇宙
現代の薬物発見方法は、固有、許可、および開示を含む構造化および非構造化形態の重要なデータセットおよび様々なソースからのデータセット上に確立される。再帰的に構造化データのための現代Data Lake/Warehouseツールと大量の非構造化データを管理するための独自ツールを組み合わせることで,データ世界にアクセスすることができる.これらのデータソースは、以下のデータセットを含む再帰的データ宇宙の一部として再帰的に結合される
•専有·非構造化:これは、私たちの表現型グループ分析からの高解像度画像、私たちのトランスクリプトーム分析の配列読み取り数、DMPKモジュールからの質量分析データ、および私たちのInVivology分析からのビデオデータを含む、私たちの科学プラットフォームから生成されたデータを表す
•専有·構造化:これらすべてのデータにアクセスできるように,Recursionは我々の実験結果に関する重要なメタデータと構造化データを保持している.これには,我々の深さ学習モデルの埋め込み出力と,我々の解析データの様々な解析が含まれる.我々は,我々の分析における高次元読み取りを唯一無二に用いて,他の方式で工業的に不可能な方式で時間の経過とともに比較することができる.
•許可、構造化、非構造化:2023年、Tempusと協力し、Recursionが20 PBを超える独自の識別、患者を中心としたマルチモード腫瘍学データへのアクセスを許可し、因果AIモデルを訓練した。私たちはこれらのデータを私たちのデータ宇宙に追加し、私たちの薬物発見ワークフローでより多くのデータ層を有効にしている。
•公共構造化された:私たちは再帰的データ宇宙の一部として共通データセットをよく使用して、生物と化学の理解を拡大します。資料源はマサチューセッツ工科大学とハーバード大学からのイギリス生物バンク、TCGA、DepMapを含む。
洞察力と成果を向上させるために描画とナビゲーションを行います
再帰データ宇宙は多くのPBの生物,化学,患者を中心としたデータにまたがっており,数年にわたる実験実行とデータタイプを関連付けることができる。我々はまた,これらのデータを処理して高速に操作可能な知見に変換するための急速に増加した内部ソフトウェアアプリケーションを構築した.これらのツールとデータは、薬物発見プロジェクトを迅速に起訴するために、自動化されたワークフローにますます参加している
再帰データ宇宙の中心部分は私たちの生物と化学地図ですシリコン片私たちの物理的分析(例えば表現型グループ学)やシリコン片モデル(例えば仲人)。我々の地図は関係と相互作用を予測し,再帰が与えられた薬物発見機会の優先研究において非常に有効であることを可能にしている。異なる技術パターンまたは異なる生物学的または化学的空間からの異なる地図を階層化することによって、偏見のない方法でレイヤを見ることによって洞察力(例えば、表現型グループ学、トランスクリプトーム、リガンド-標的結合)をさらに強化し、理解する薬物発見“図セット”を作成した体外培養そして 体内にあるADMETなど)
全体的に,我々の表現型画像は,MLツールによって生成された5兆個を超える無人バイアスの推定関係を含み,遺伝的摂動および大量の小分子と巨大分子摂動にまたがる.我々は表現型図中の任意の摂動間の関係を調べることができ,薬物発見を反復的な試行錯誤過程から計算駆動の探索問題に変換することができる。従来の高スループットスクリーニングとは異なり,従来の高スループットスクリーニングでは,多くの化合物が一度に1つの目標に対する活性が描かれているが,我々のマッピングやナビゲーション方法は,我々が記述した各化合物を分析することができ,単一の目標に対する活性を分析するだけでなく,その推定された1つの目標に対する活性を分析することができる可能なすべての目標私たちが配列したCRISPRライブラリでは、私たちが以前に分析したすべての化合物との類似性は、生物学的および化学的関係において超線形成長を生み出している。
図24に示す。マッピングとナビゲーションは同時に全ゲノムスクリーニングを行うことができる伝統的な製薬高スループットスクリーニング方法(左)は同時に単一の目標に対して数千から数百万種類の化合物をスクリーニングするが、他の目標に関する情報は少ないか、あるいは全くない。再帰的マッピングおよびナビゲーション方法(右)は、単一の実験において、我々のアレイCRISPRノックアウトスクリーン中のすべての潜在的目標に対する化合物の活性を推定することを可能にする。
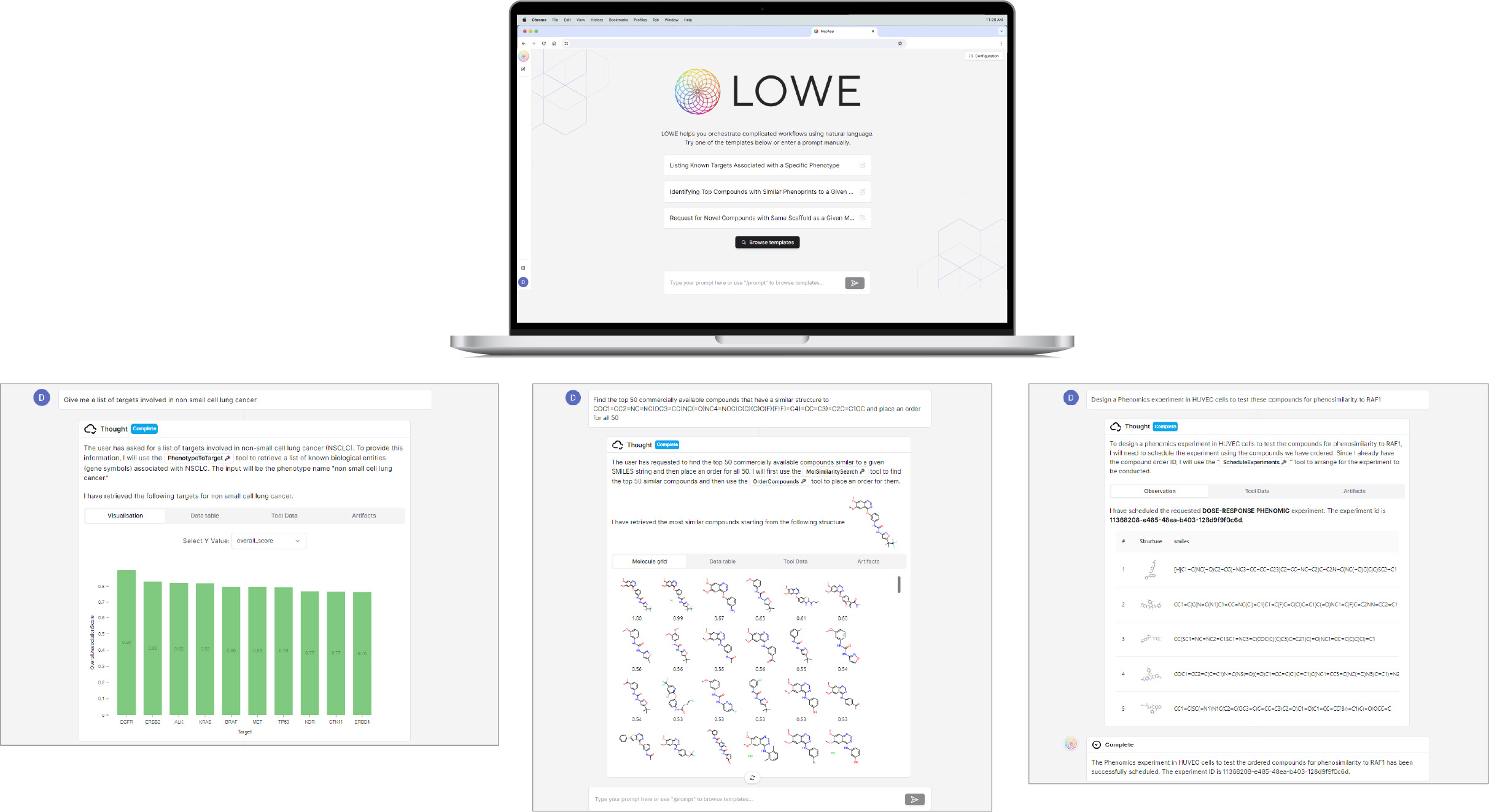
LOWE:マクロ言語モデル(LLM)協調のワークフローエンジン
再帰的会社のますます多くの人工知能ツールとデータセット-多くの接続可能な湿式実験室と乾燥実験室モジュールからなる-私たちの早期薬物発見ワークフローの複雑さを増加させる。さらに,各モジュールは通常,特定の専門知識を必要とし,訓練されたデータ科学者や機械学習エンジニアのみがアクセスすることができる.LOWEは,自然言語インタフェースを用いて複雑な薬物発見ワークフローを協調させることを目的としたLLMエージェントである.これらのワークフローは,様々なステップとツールをリンクし,Recursionの生物や化学地図で重要な関係を見つけることから,新たな化合物を生成し,それらを配置して合成と実験を行っている。その自然言語インターフェースと相互作用図形を通じて、Loweは最も先進的な人工知能ツールをRecursionの各薬物発見科学者に簡単かつ拡張可能な方法で提供した
LoweはRecursion OSの次の発展を表しているだけでなく,今後5年から10年以内にどのように各社が薬物発見を行うと信じているかを表している。今日、ローウェイは科学者によって指導され、彼らは仮説を立てて問題を提起した。将来的には,Loweはより多くの人工知能エージェントと結合し,仮説を立てて結果から学習し,生物学者や化学者のように効率的に考えることができると信じている.LOWEは自主的な“人工知能科学者”を発展させて治療発見を行う第一歩である。
図25である.Loweは自然言語を使用して湿実験室と乾燥実験室の複雑な薬物発見タスクを調整することができる上記の例では、Lowe i)は、非小細胞肺癌に関連する標的リストを決定し、ii)最初のHitと類似した構造を有する最初の50種類の商業的に利用可能な化合物を決定し、iii)所与の標的に対するこれらの化合物の表現型類似性を試験するために、表現型グループ学的実験を設計した。
LOWEはWebベースのアプリケーションで展開されるため,最新バージョンのデータやモジュールが自動的に伝播されて使用されるため,バージョン制御は問題ではない.Recursionでは,一連の薬物発見モジュールとドッキングすることができ,人間科学者に一連の潜在的な計画を検討させ,さらに発展させる自律エージェントを開発している。LOWEは,人手による提示でも自律的に動作しても,発行されたコマンド,呼び出されたデータやモジュールのバージョン,伝達された結果を正確に記録し,将来的にワークフローをコピーし,計算と実験結果を収集することができ,我々の内部パイプ,外部パートナー,あるいは規制グループの計画進展の証拠とする.
他の支援ソフトウェアツールとLLM
他の内部ソフトウェアツールは、5兆個を超える予測された生物と化学関係にまたがるデータを作成とナビゲーションすることができ、疾病、目標と複合機会の優先順位を決定し、大型実験レイアウトを設計し、実験方案を自動的に実行と持続的に監視し、効率を向上させることができる。例えば地図アプリ科学者がいくつかの可視化、統計測定とデータ層を用いて関係を探索することができ、化合物に関する既知情報或いは遺伝子と疾病との既知関係を含み、新しい知見を迅速に区別することができる。他のツールは現場試薬のリアルタイム供給を監視し,一致した制御戦略を実現し,毎週のデータを一定期間関連付けるように基準を設計した。また,これらのツールは,期待される品質要求に達していないことやプロセス中のある点で停滞している実験やプロセスを自動的にマーキングし,適切な人員に通知する.
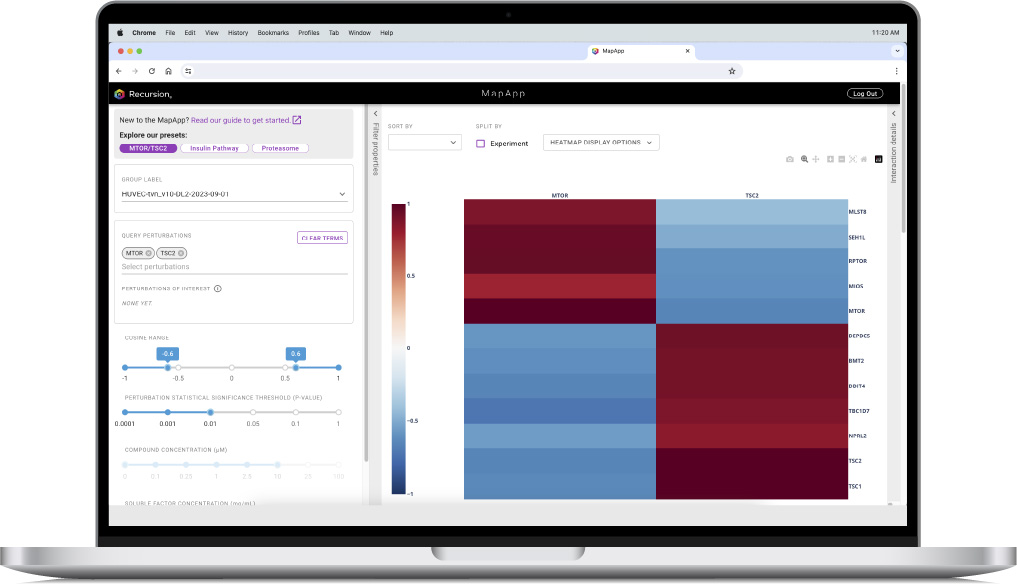
図26に示す。私たちのMapAppツールは科学者が遺伝子と化合物の間の様々な関係を同時に見ることを可能にする。
科学文献の大言語モデル(LLM)編目我々のバイオマップからプログラムを効率的に起動するために,LLMを結合した独自のインターワークフローを用いた.この自動化手法は,地図中の大量の洞察力の中から最も有望な機会を高速に探索し,その優先順位を決定することができる.この過程にサービスするために,我々の内部から派生した独自の地図に照らして科学文献コーパスを作成し,キーデータセットを自動的に浮上させるLLMSを展開した.これらのLLMからの科学文献地図を我々の独自地図に階層化することにより,業界の他の人が注目している一般的かつ高度に競争する疾患や目標ではなく,新規かつ新興の生物,化学,患者を中心とした機会に仕事を重点にすることができる。
生物学における計算ツールと基礎モデル
新しいデータまたは既存のデータを理解、探索、関連させるためには、これらのデータを標準化、変換、分析しなければならない。我々の層のツール管理は,我々のデータを適切な公共雲と私有雲に大規模に転送し,我々の内部独自の基礎モデルを介してデータを数学表現に変換し,ユーザの要求に応じて我々のデータの分析を行う.異常な状況は迅速に解決するためにグループにマークされるだろう。
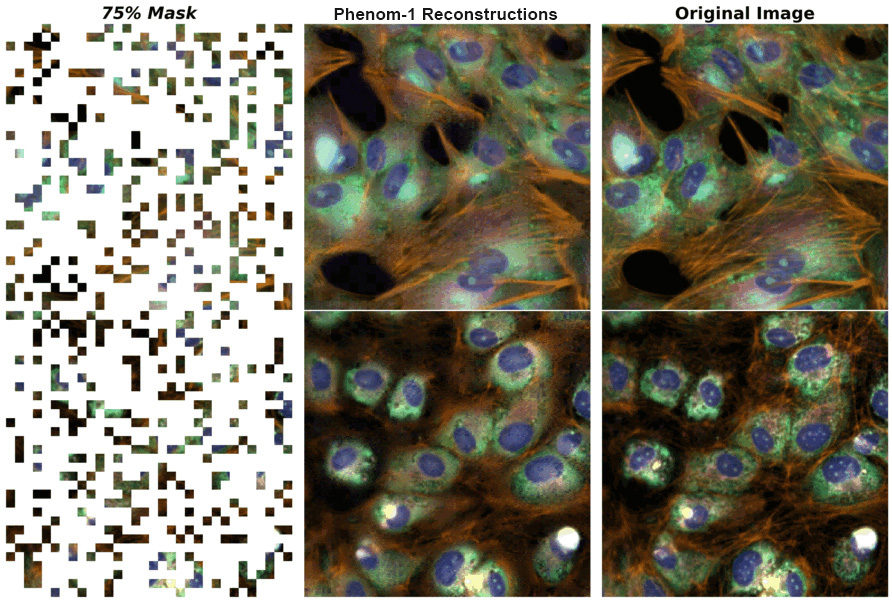
表現型-1私たちは表現型グループ学の基礎モデルPhenom-1に基づいて、私たちの独自の表現型グループ学ライブラリー中の数億個のパラメータを用いて数十億個の細胞画像を訓練する大型視覚変換器である。Penom-1は,より大きなデータセットで訓練されたより大きなモデルが性能向上をもたらすという割合仮説を生物学的背景で証明している.また,Phenom-1は既知の生物学的関係を要約する上で28%と高い表現を示した.8
8Kraus、Oら。(2023年)。モントレー自動エンコーダは細胞形態の伸縮可能な学習者である.NeurIPS 2023生成的人工知能と生物学(GenBio)シンポジウム
図27である.画像再構成タスクは,我々の見かけの組織学的基礎モデルPhenom-1の印象的な視覚結果を示した部分的に遮蔽された画像を再構成することは、このモデルが薬物発見タスクにおいて生物関係を検出するなどの緊急能力を有するようにする訓練タスクである。
順方向と逆遺伝学的因果人工知能モデル著者らはTempusとの協力を通じて患者に関する前向き遺伝学データを統合し、Recursion OSの翻訳潜在力の深化に投資した。再帰的生物学的スペクトルは一種の“逆遺伝学”戦略を表し、この策略の中で、私たちは遺伝と化学摂動による細胞表現型を識別し、それを互いに関連させる。Tempusのような患者ゲノムデータ集は1種の“順方向遺伝学”策略を代表し、患者の表現型に関連する遺伝要素を編目し、癌タイプ、進展と更に多くの健康記録から確定できる要素を含む。私たちはこれらの順方向遺伝学データセットを再帰的な実験能力と組み合わせて因果関係AIモデルはどのプランが患者に治療利益をもたらす可能性があり、どの患者がこのような治療から利益を得る可能性があるかをよりよく予測することができる
他の基礎モデルですTempusからの大量の患者を中心としたデータと私たち自身が増加している独自の多組学データセットがあり、私たちは生物学、化学と翻訳にまたがる大型言語モデルを含むより多くの基礎モデルを構築し、応用する予定である。特定の基礎モデルが結合した場合、1つの壮大な規範基礎モデルは入院患者の因果結果を通じて細胞内の知見を結合することができ、生物学、化学と患者を中心とした看護のより確実性と全体性の理解を推進できると信じている。これらの複雑化したモデルは、より高い規模とより低い患者コストでより多く、更新され、より良い薬物を開発することができると信じている。
図28に示す.現象−1は,スケール仮説が生物系で成り立つことを示しているこの拡張図は、計算能力(X軸)がどのように向上するかを示している必要なのはデータセットのサイズとモデルの複雑さの面で、モデルが既知の生物関係(Y軸)を要約する能力を改善した。このような観察された改善は,訓練の一部ではなく,モデルスケーリングの結果として現れた
化学における計算ツールと基礎モデル
2023年5月にCyclicaとValenceを買収し、Recursionの既存の小分子薬物発見能力にデジタル化学、機械学習、人工知能分野の業界リード能力を増加させた。私たちはこのような能力を利用して私たちの内部と協力薬物発見計画を推進している
仲人Cyclicaの買収中に買収したツールであり、AlphaFold 2構造と相同モデルを用いてプロテオミクス中小分子の多重薬理学を予測する人工知能を支援するディープラーニングエンジンである。我々はMatchMakerを用いて360億個の化合物Enamine Real Space集合を含むいくつかの商業的に利用可能なライブラリーのタンパク質標的相互作用を予測することに成功した。360億個の分子を予測するプロテオミクスは大規模な計算学習でありIn-ilicon o2.8兆個以上の分子標的対を評価しましたこの仕事を完成することはタンパク質世界と化学世界の間のギャップを埋める重要な一歩であり、巨大な化学バンクを知能的に検索して分子を識別し、私たちの湿式実験室プラットフォーム上で分析を行うことができるようにした。
ムーア再帰的な内部で開発された自己監視の化学基礎モデルですMoleは化合物の要約可能な図形ベースの表現を学習し,それらを微調整によってロバストでタスク固有のMLモデルに変換する.微調整のモルモデルは薬物の有効性と安全性に関する終点を越えている。モグラモデルはRecursionの表現学とDMPKプラットフォームから生成された膨大なデータを含む広範な公共とプライベートデータセット上で訓練を行っている。9
私たちのデジタル化学プラットフォームはRecursionソフトウェア生態系の核心部分であり、統合された独自と商業ツールを含み、私たちの薬物と計算化学チームがHITから候補プロジェクトへの拡張と推進を可能にする。このプラットフォームの主な側面は,(1)化学構造と化学データの統一的なアクセスと可視化,内部生成の高次元または低次元化学データ,外部生成を含む体外培養あるいは…体内にあるデータとADMEデータ,(Ii)総合予測モデリング,化学探索と計算化学能力,(Iii)分子設計と連携。我々は,3つの分野で予測とデジタル化学能力にさらに投資する予定である:(I)化学を中心としたMLモデル開発,(Ii)化学を中心としたデータ生成,および(Iii)デジタルと物理化学プロセス開発,化学最適化の設計−製造−テスト−分析サイクルをより効率的に推進するために,化学と生物分析手順を自動統合する工業化ワークフローの発売を含む。
9Méndez-Lucio、Oら。(2022年)。モル:薬物発見の分子基礎モデル。NeurIPS 2022に展示されている。
再帰的オペレーティングシステムを利用して洞察力をプログラム改善に結びつける
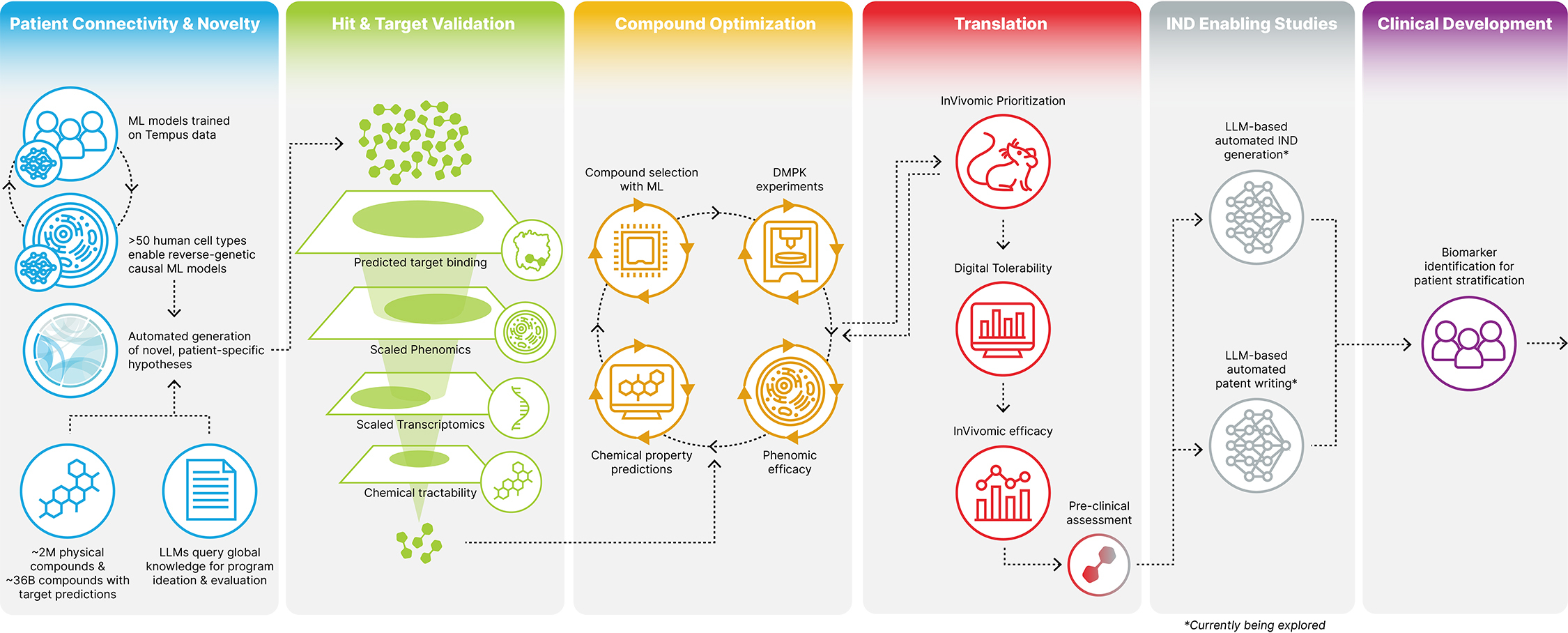
再帰的オペレーティングシステムは、反復のための統合された多面的なシステムであるマッピングするそして ナビゲーション病原性摂動と潜在的治療性化合物との間の数兆個の推定関係を含む膨大な生物学的および化学データセット。全体的に、Recursion OSのコンポーネントはモジュール化方式で結合し、迅速、経済的かつ効率的に広範な新しい治療方案の組み合わせを識別、検証、推進し、人為的介入と工業化に偏った薬物発見を最大限に減少させることができる。私たちは標準化、自動化されたワークフローを用いて計画を決定し、薬物発見と開発過程の重要な段階でこれらの計画を推進した
•患者接続性と新規性(すなわち計画起動)
•命中と目標検証
•複合最適化
•訳す
•IND付与研究
•臨床発展
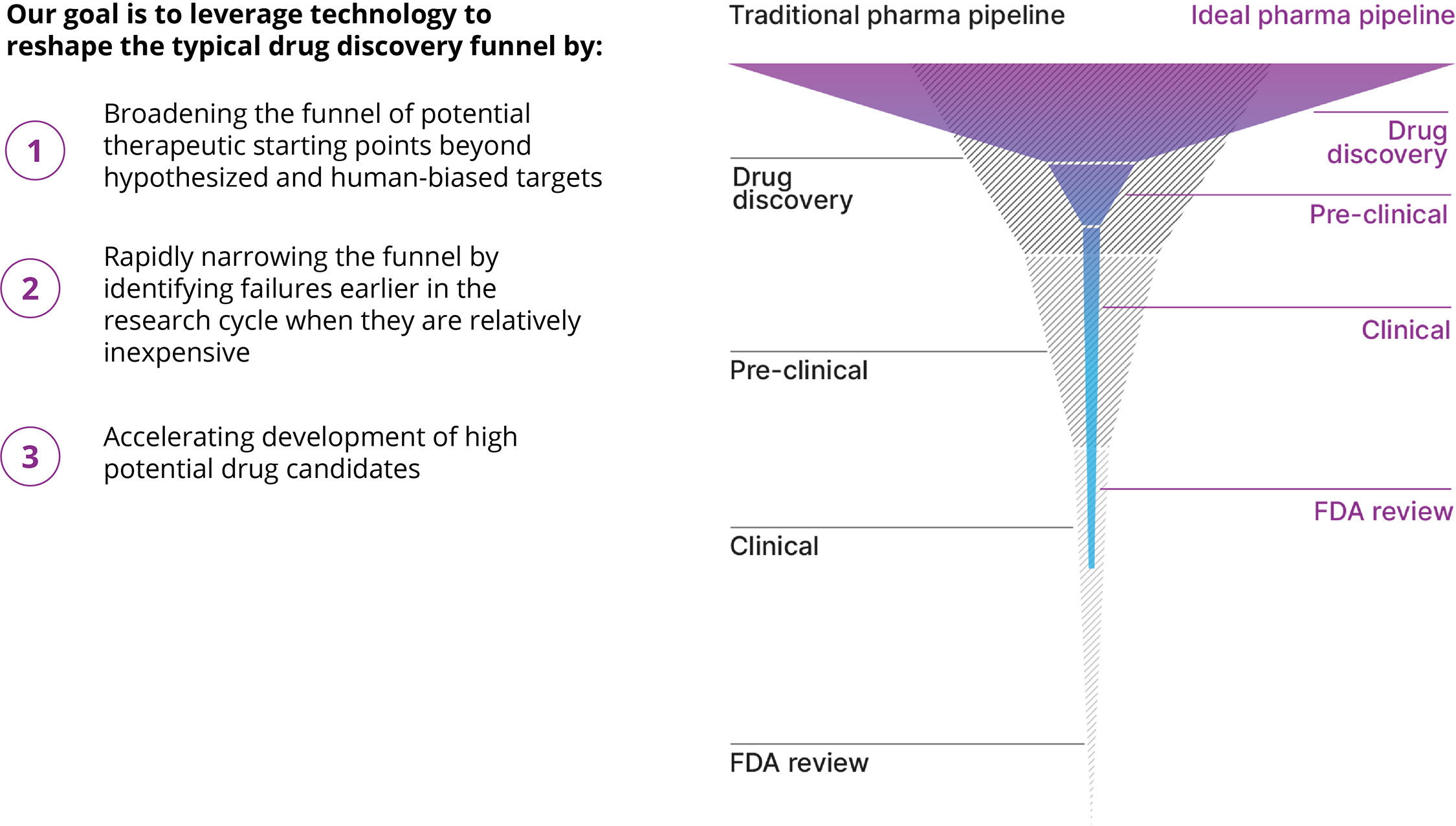
現在の薬物研究開発モードにおいて、末期臨床失敗はコストの主要な駆動要素である。コストの高い後期失敗率を下げ、HITから臨床候補薬物へのスケジュールを加速し、より持続可能な研究開発モデルを創造する。このより持続可能なモデルを実現するために,理想的な状態では,薬物発見漏斗は形状像Vから文字Tのような形状に変化し,一連の可能な治療法は最適な候補薬剤に迅速に縮小することができ,損失を招くことなく,このプロセスの後続ステップを迅速に通過すると考えられる。再帰的な目標は,典型的な薬物発見漏斗を技術を用いて理想的な状態に再構築することであり,失敗を早期に漏斗を急速に縮小する範囲に移し,最も成功確率の高いプログラムとする方法である
図29に示す。薬の発見の漏斗を再構築します再帰的な目標は,典型的な薬物発見漏斗を技術を用いて理想的な状態に再構築することであり,失敗を早期に漏斗を急速に縮小する範囲に移し,最も成功確率の高いプログラムとする方法である
従来の薬物発見漏斗の再構築では次のような進展があったと信じています
•治療の起点の漏斗を広げる。私たちの柔軟で拡張可能なマッピングツールとインフラは、私たち自身の湿実験室からの真の経験データに基づいて、ヒト細胞疾患モデルと候補治療レジメンとの間の数兆関係を推定することができるようにしている。
•コストが比較的低い場合には早期に故障を発見する.私たちの独自のナビゲーションツールは、より多くの異なる仮説を迅速に検証するために、大量の生物、化学、患者を中心としたデータセットを探索することができるようにしています。この戦略は早期自然減員の増加を招いているが,高次元システムの生物学的データを背景に探索されているため,下流で成功する可能性の高い項目を迅速に優先順位付けするように設計されている。時間の経過とともに,我々のオペレーティングシステムの改善に伴い,パイプラインでのより早期の移行失敗は,薬物開発の全体的なコストをより低くすることが予想される。
•臨床に高い潜在力のある候補薬物を提供することを加速する。Recursion OSには,化学空間の効率的な探索を可能にする化学ツールと,頑強性と実用性を向上させる翻訳ツールが含まれている体内にある研究します。
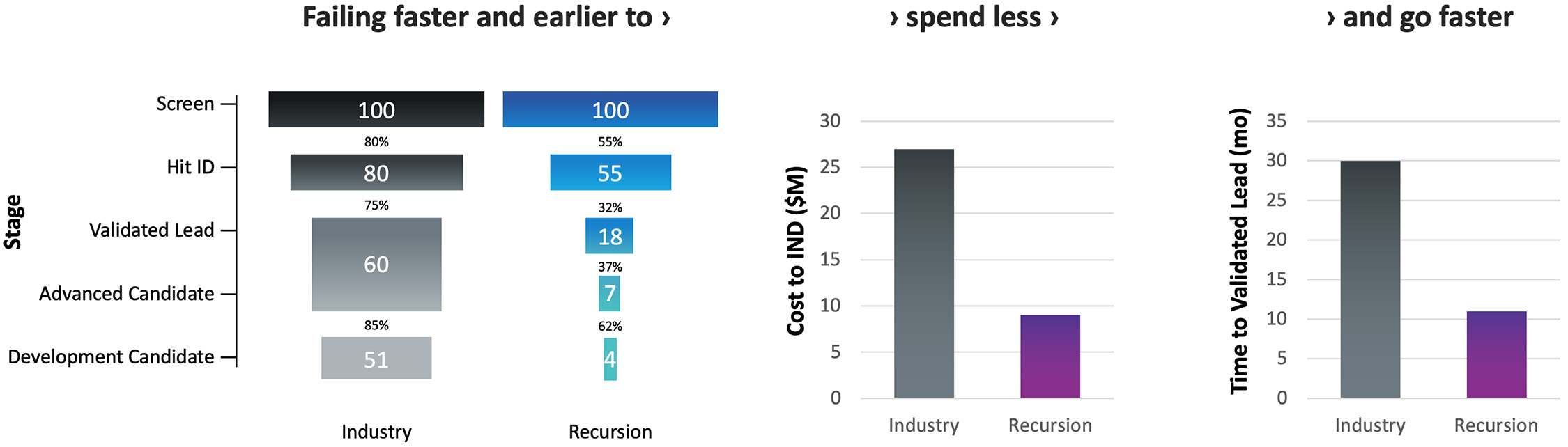
我々の再帰的オペレーティングシステムを利用して我々の計画を探索し推進することにより,従来の薬物発見過程と比較して,特にコストと時間の面で優れた改善指標を示している。2017年末から2023年までのすべての再帰計画において,検証販売手がかり段階に達した平均時間は約11カ月であった。2024年末までに、私たちは再帰計画が約半分以下の時間で検証の先行段階に達する可能性があると信じている。最終的に,再帰オペレーティングシステムの将来の反復はより大きな改善を実現し,総ドル重み付け失敗を最小限にし,成功の可能性を最大化すると信じている
図30。私たちの薬物発見漏斗の軌跡は“理想”の薬物発見漏斗を反映している私たちの方法は、業界平均と比較して、(I)研究周期の早期に低実行可能性計画を決定すること、(Ii)各計画の支出を減少させること、および(Iii)計画を検証された先行候補に迅速に進めることができると信じている。すべての産業データはPaulらによって改編されたネイチャー誌は薬の発見を振り返っていますそれは.(2010)9,203-214。INDのコストはすでに米国消費者物価指数(CPI)を用いてインフレ調整を行っている。示した過渡段階と有効販売手がかり時間の再帰データは,2017年末から2023年までの全再帰計画の平均値である。表示されたINDコスト再帰的データは、新しい化学物質がINDに到達する実際のコストと予想コストとに関連する
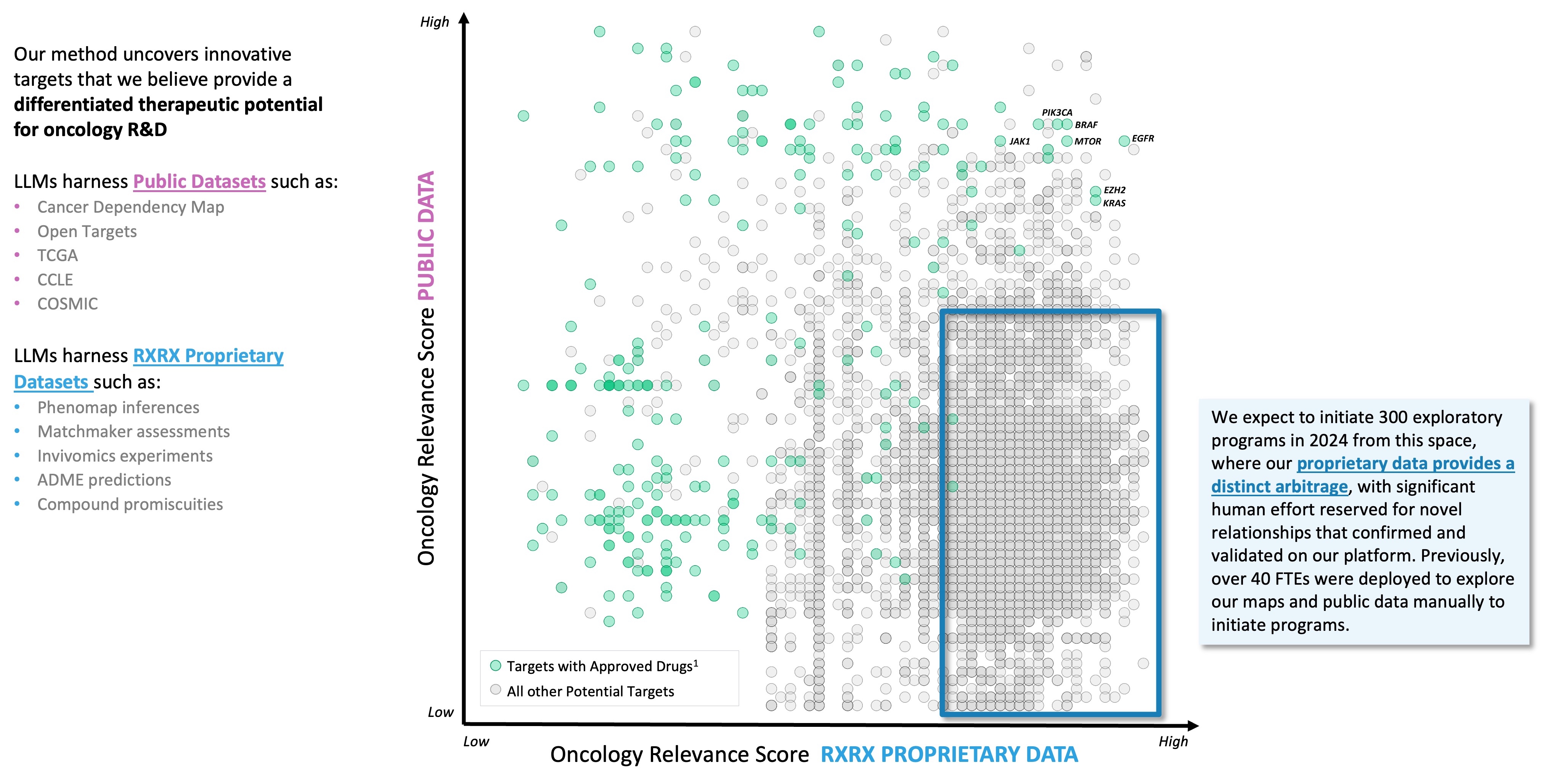
再帰的オペレーティングシステムは,速度やコストを向上させるだけでなく,限られた数の類似した目標仮説を同時に追求することが多いため,新たな目標を探索するように誘導される可能性がある.以下では,(I)の強力な遺伝子駆動を持つ生物学的証拠と(Ii)差別化された新しい生物学的項目を優先順位付けする定量化評価基準をどのように示すかが分かる
図31.我々は,LLMを用いて共有データと我々自身の独自データとソフトウェアツールにおける関係を組織し,我々のすべての内部プランの起点を決定する.我々は我々の独自のデータに焦点を当てて独自の裁定の目標を提供することにより,計画を規模優先順位付けし,腫瘍学において新たな目標の識別と選択を推進できることを示した。各円は1つの遺伝子を表し,再帰的操作システムにより複数の生物や薬理学的要因を探索することができる。緑色の円は、特定の疾患を治療し、Ochoa、D.らの薬剤を改編するために規制部門によって承認された目標を示している核酸研究。 (2023).
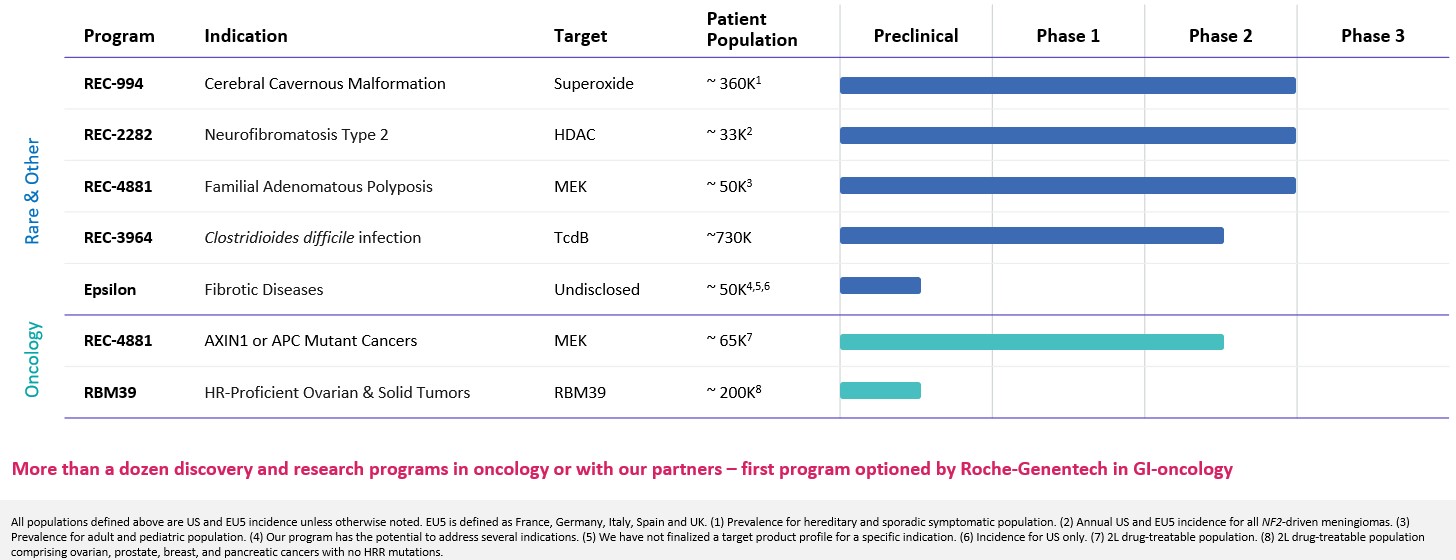
私たちのパイプは
我々の内部チャネル中のすべての計画はRecursion OSを通じて出現した独特な生物学的知見に基づいており、その中で:(I)疾病の病因は明確に定義されているが、疾病の後続影響は一般的に明確ではなく、主要な標的は通常治療不可能と考えられているか、あるいは主要な標的は特定の疾病と関連して広く認識されており、(Ii)高度に満たされていない医療需要、承認されていない治療方法、あるいは既存の治療方法の重大な制限である。私たちのいくつかの内部チャネルプロジェクトは年間売上高が10億ドルを超える潜在的な市場機会を持つかもしれない。私たちは現在5つのプロジェクトが第2段階の臨床研究を開始するか計画しており、2024年下半期に第6プロジェクトのINDを提出しようとしている。われわれの臨床段階計画に加えて,数十の臨床前·発見計画を積極的に開発している
臨床案
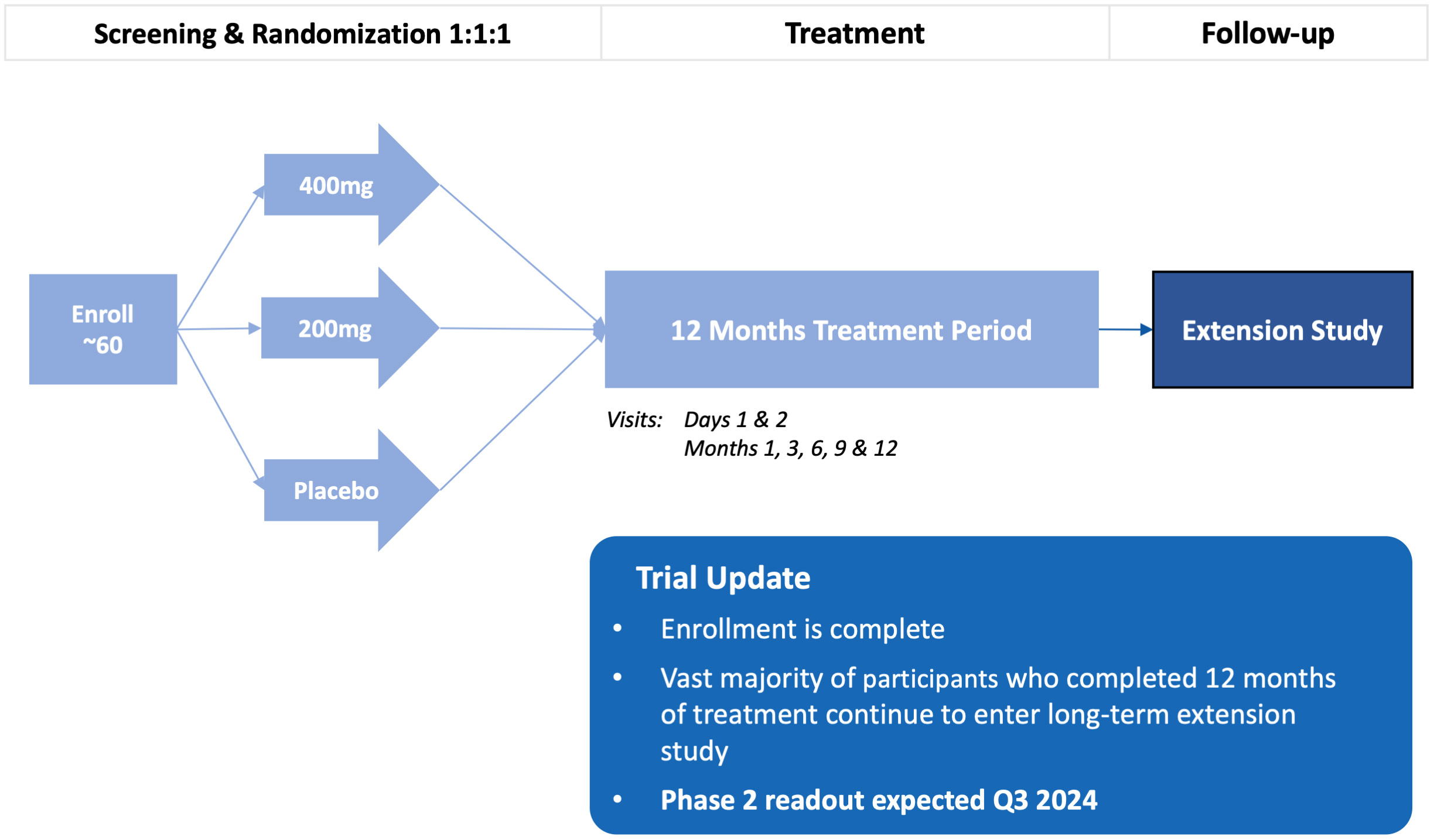
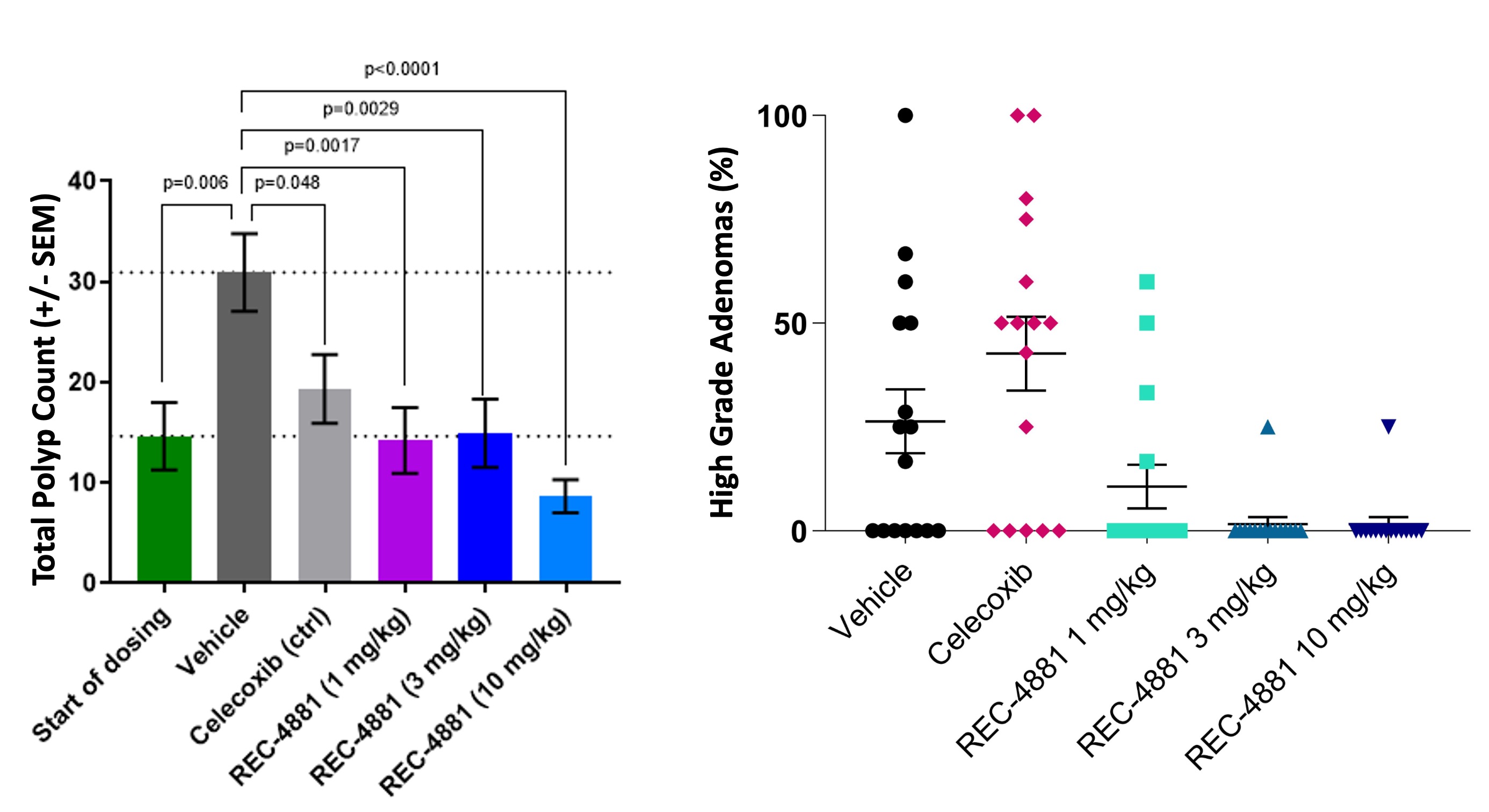
•REC-994は潜在的な脳綿状血管奇形或いはCCM-Sycamoreの治療に用いられ、1つの2期無作為、二重盲検、プラセボ対照、安全性、耐性と探索的治療効果の研究が行われている。アメリカと連合は孤児薬の称号を承認した。私たちは2024年第3四半期に第2段階のデータを共有する予定だ。この試験は2023年6月に完全に組み入れられ、12ケ月の治療を完成した大多数の参加者は引き続き長期延長研究に参加することを選択した。
•2型神経線維腫症、またはNF 2-PALARの潜在的治療にREC-2282が使用されており、適応性の2/3期ランダム多中心研究が行われている。第2段階の登録は2024年上半期に完了する予定だ。米国とEUの孤児薬物指定および米国の高速チャネル指定が承認された。私たちは2024年第4四半期に第2段階の安全性と初歩的な治療効果データを共有する予定だ。
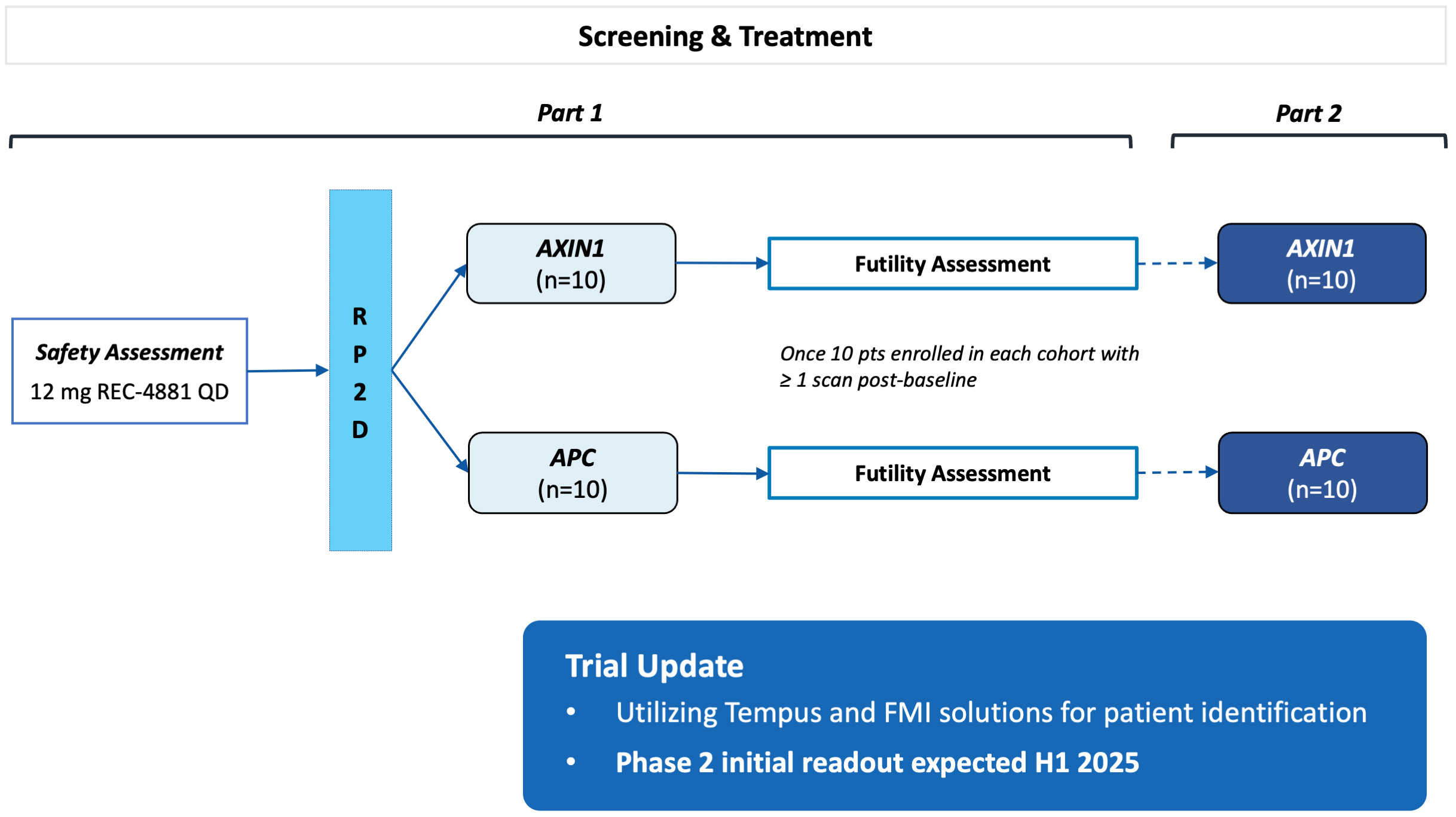
•REC−4881は家族性腺腫性ポリープ症の潜在的治療に用いられているか,あるいはFAP−Tupelo,1 b/2期,開放ラベル,マルチセンター研究が行われており,第1部が完成している。第2部のFPIは2024年上半期に実施される予定である。米国とEUの孤児薬物指定および米国の高速チャネル指定が承認された。私たちは2025年上半期に第2段階の安全性と初歩的な治療効果データを共有する予定だ。
•REC-4881潜在的治療のためのAXIN1あるいは…装甲運搬車突然変異癌-丁香酸、第二段階開放ラベルの固形腫瘍多中心研究は、2023年末にスタートし、2024年第1四半期にFPIを行う予定である。私たちは2025年上半期に第2段階の安全性と初歩的な治療効果データを共有する予定だ。
•再発予防REC−3964クロストリジウム·クロストリジウム感染-健康ボランティアの第1段階研究は2023年第3四半期に完成した。REC−3964耐性は良好であり、深刻な副作用(SAE)の報告は見られなかった。私たちは2024年に第2段階研究を開始する予定だ。
私たちは、私たちの再帰的オペレーティングシステムを使用して生成できる潜在的なプログラムの数は、より多くの検証されたプログラムが価値を創造する可能性があるため、わが社の未来に重要であると信じている。また、私たちの多くの潜在的な計画は私たちを大手製薬会社の魅力的なパートナーにすると信じている。いくつかの大手製薬会社の研究開発産出レベルは停滞或いは絶えず低下し、新プロジェクトに対する持続的な需要を表明し、その製品ラインを維持している。
図32に示す。私たちの膨大な治療パイプラインは私たちの再帰的オペレーティングシステムの強さを証明する。別の説明がない限り,上記の定義のすべての集団はUSおよびEU 5発症率であった。EU 5はフランス、ドイツ、イタリア、スペイン、イギリスと定義されている。1遺伝性と散発性症状群の罹患率。2アメリカとヨーロッパの5カ国で毎年発症していますNF 2脳膜腫によって引き起こされる。3大人と子供の流行率です私たちの計画はいくつかの適応を解決する可能性がある。4私たちは特定の適応の目標製品プロファイルを最終的に決定していない。5アメリカでだけ起きています62 Lの薬物は人の群れを治療することができる。7 卵巣癌、前立腺癌、乳癌、および膵臓癌を含む2 Lの医薬治療可能な集団であって、HRR変異を有さない、2 L医薬治療可能な集団。8
REC−994頭綿状血管奇形の治療−2期−
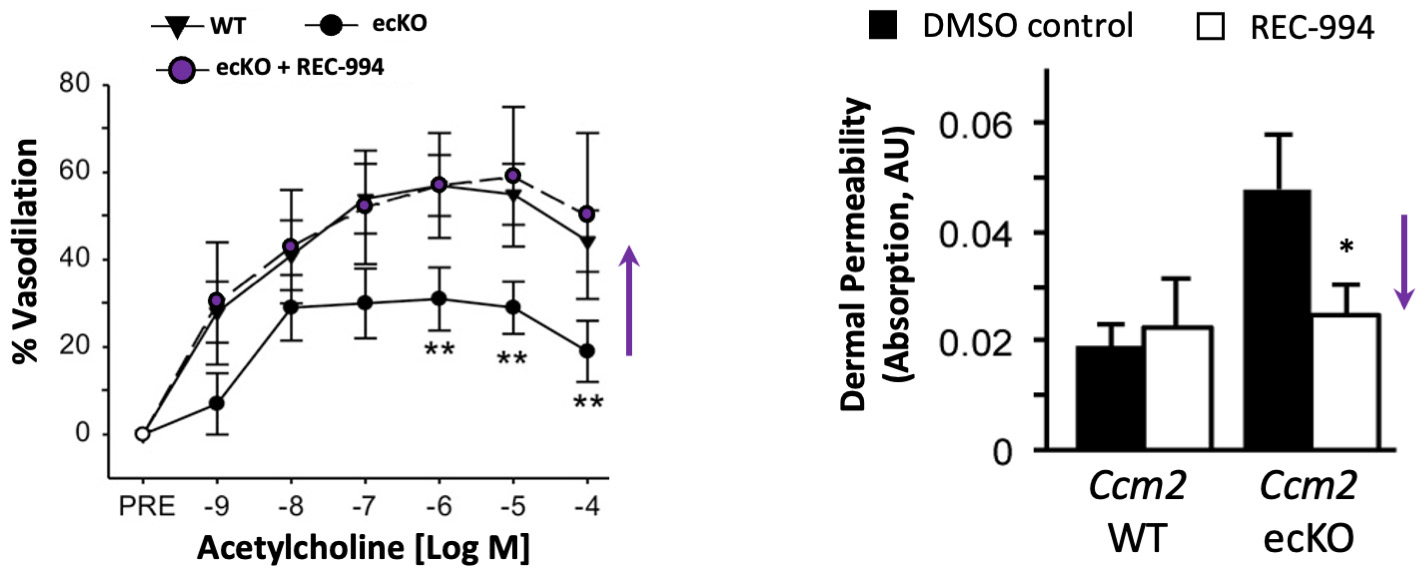
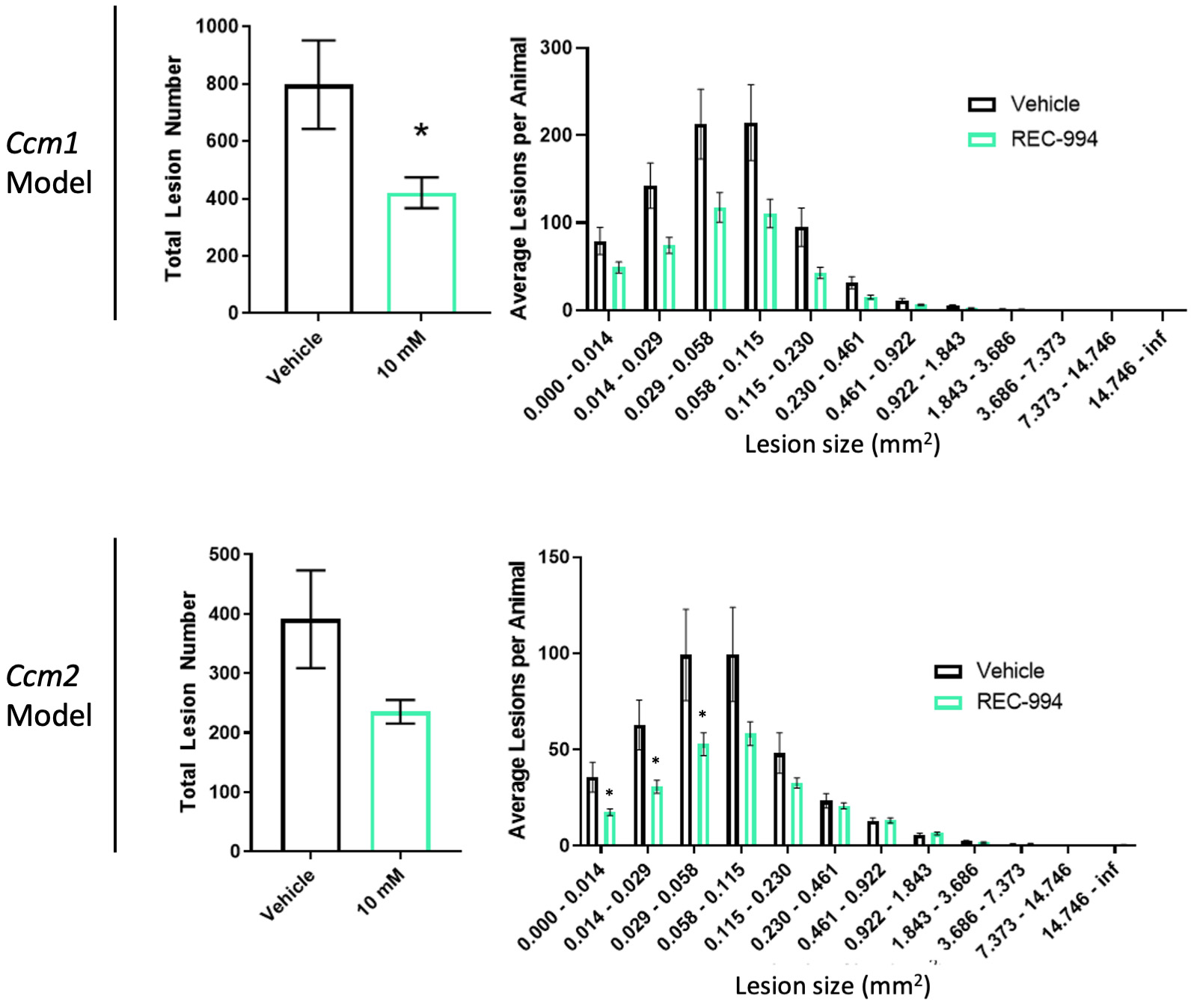
Rec−994は経口生物利用型スーパーオキシドスカベンジャー小分子であり,現在開発中であり,症候性CCMの治療に用いられている。CCMは最大のまれな疾患機会の一つであり,これまで承認されていない治療法である。REC−994は、Recursionによって指導および実行された健康ボランティアの1期SADおよびMAD試験において極めて良好な耐性および慢性用量適合性を示した。Sycamoreは2期無作為、二重盲検、プラセボ対照、安全性、耐性と探索性治療効果の研究であり、すでにアメリカとEUで孤児薬物の指定を獲得した。私たちは2024年第3四半期に第2段階のデータを共有する予定だ。この試験は2023年6月に完全に組み入れられ、12ケ月の治療を完成した大多数の参加者は研究の長期延長部分に入ることを選択した。
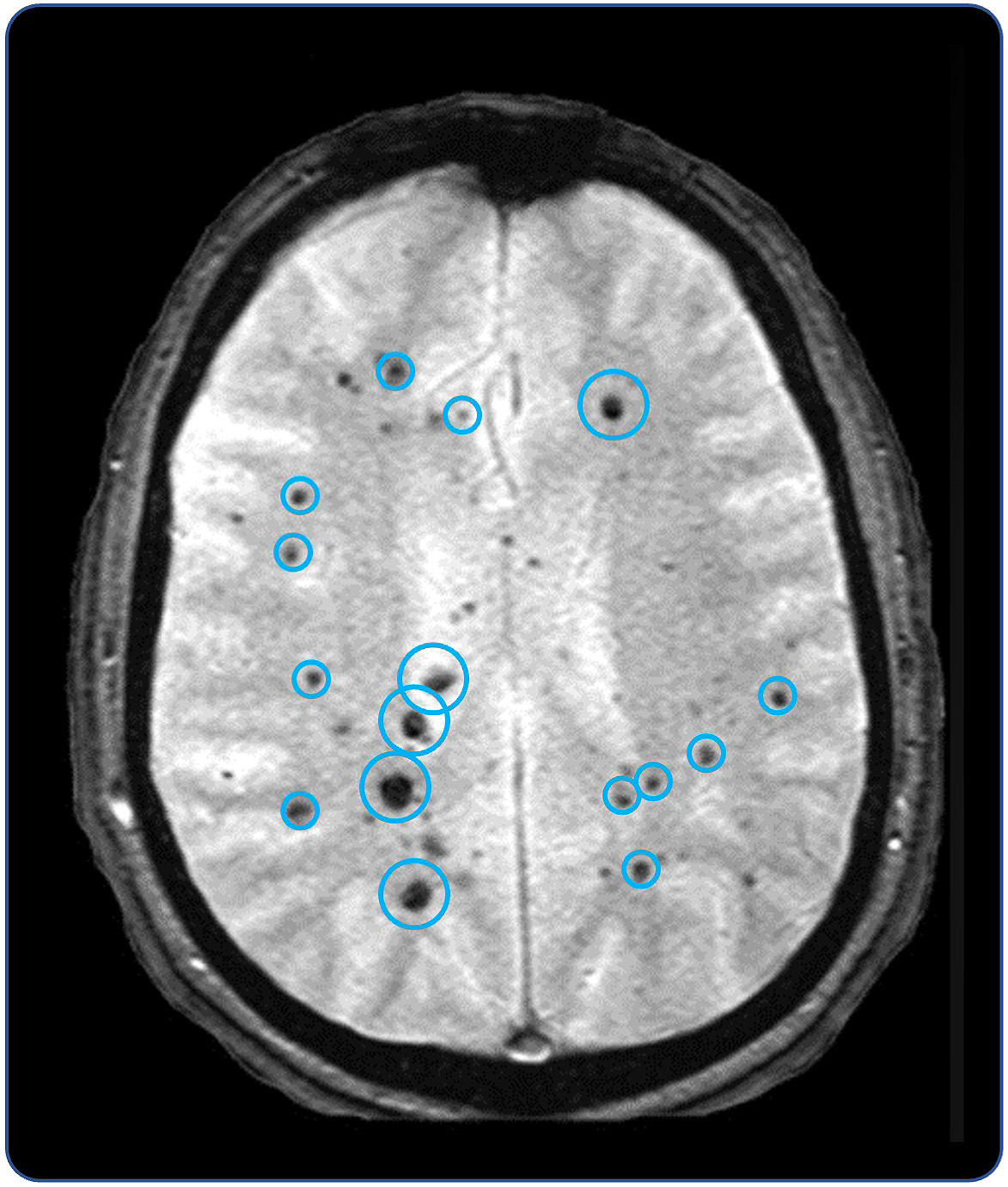
病気の概要
CCMは神経血管疾患であり,米国やEU 5カ国では約360,000人の症状のある人が影響を受けている。しかし、約30%の患者のみが明らかな症状を示し、この疾患は深刻に過小評価され、100万人以上の患者に影響を与える可能性がある。CCMは内皮機能に関連する3つの遺伝子のいずれかに由来する遺伝子変異:CCM 1、CCM 2、あるいは…CCM 3約20%の患者が常染色体優性遺伝方式で家族性CCMを遺伝している。残りの集団における散発性疾患は同一遺伝子に出現する体細胞変異によるものである。CCMは脊髄と脳の血管奇形を示し,毛細血管腔が異常に増大し,脳実質を妨害しないことを特徴とする。CCM障害を有する患者はてんかん発作、頭痛、進行性神経機能障害、および潜在的な致命的出血性脳卒中のリスクが大きい。現在の非薬物治療は顕微手術切除と立体定位放射線外科手術を含む。与えられた
これらの介入措置は侵襲性とリスクがあるため、これらの選択肢は明らかな症状および/または接触しやすい病変の一部の患者にのみ保持されている。再出血と治療の他の負の後遺症はさらにこれらの介入措置の有効性を制限した。現在承認されていない薬物治療はCCM病変の成長速度あるいはその出血あるいは他の方法で症状を引き起こす傾向に影響する。そのため、CCMは依然として深刻な健康状況であり、進行性神経機能障害と出血性脳卒中死亡の高いリスクを招く。
図33.CCM患者の脳血管奇形(海綿状細胞腫)。10
再帰的オペレーティングシステムからの洞察
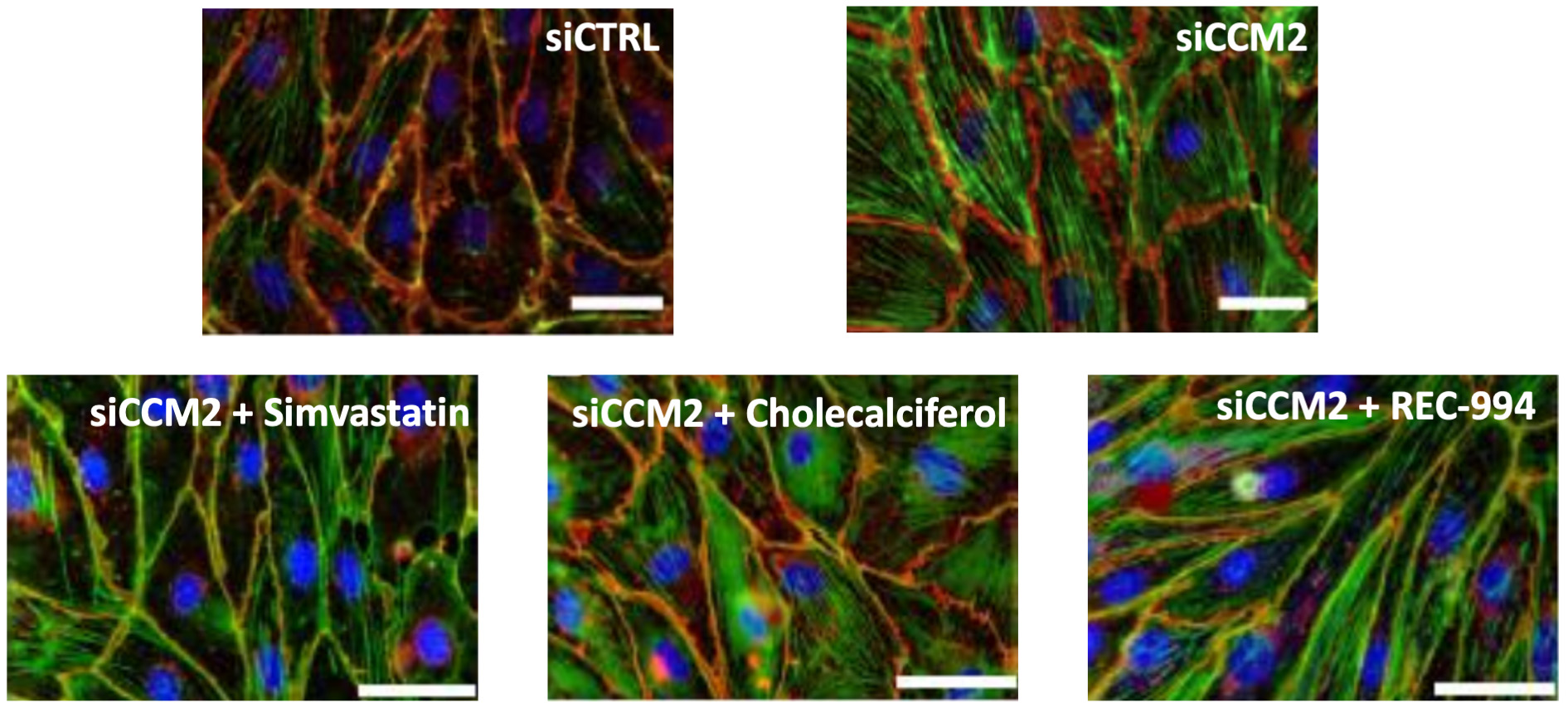
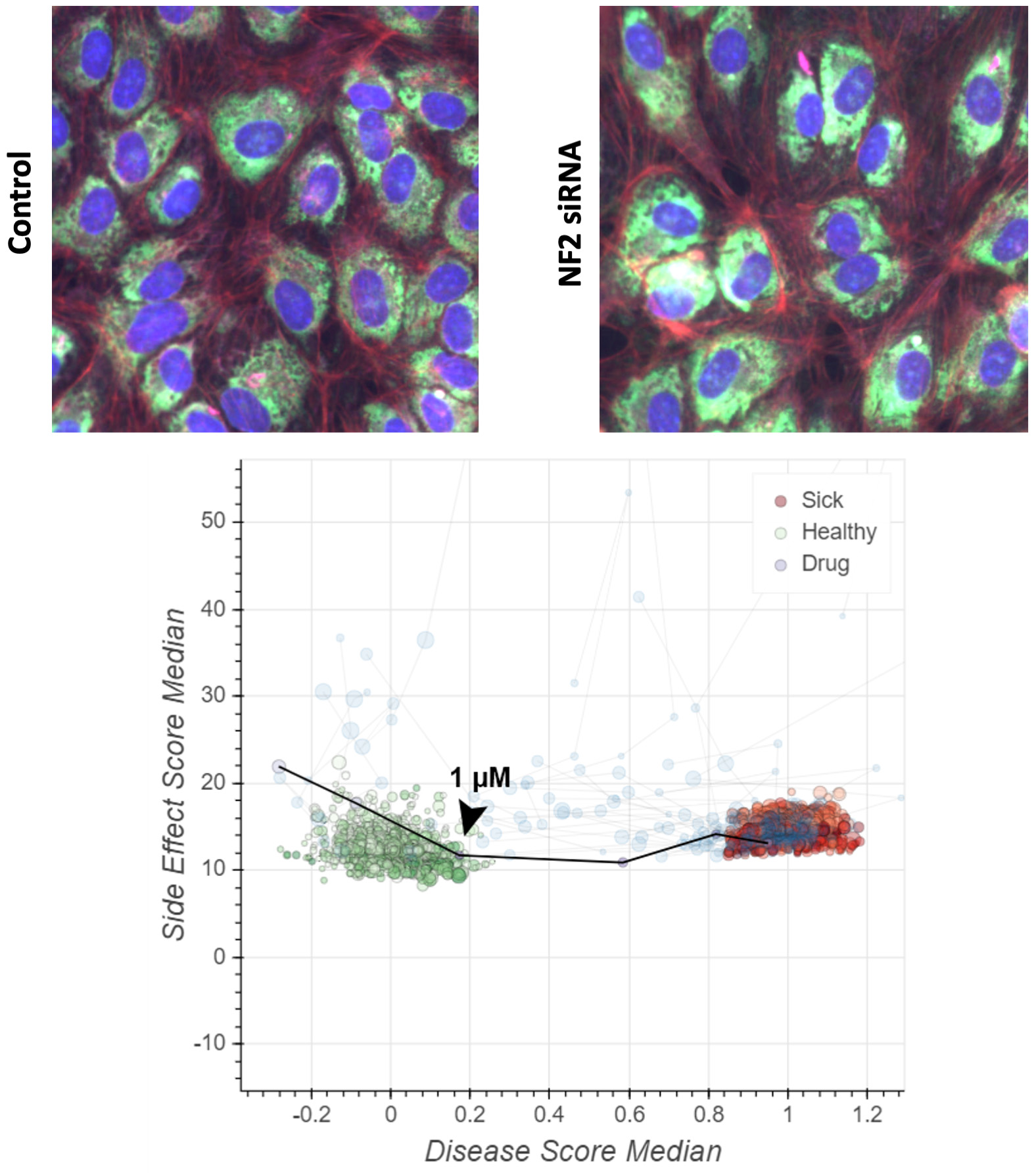
CCM 2ヒト内皮細胞のノックアウトは健康細胞とは異なる顕著な構造と機能表現型を示した。これらの観察された構造変化は,偏見のない薬物発見を実現するために利用できると仮定する。蛍光顕微鏡と自動化細胞定量とスペクトルソフトウェアは高スループット分析を可能にした。このライブラリーのヒット結果に基づいて、2000以上の商業的に利用可能かつ既知の化学物質を迅速に評価するために、この戦略を使用して、臨床の仮定により迅速に変換することができる。CCMのためのREC−994の新規な使用は、このような早期形態の再帰的オペレーティングシステムを使用して発見される。この新規で偏見のない方法が興奮する点は、その後の直交スクリーニングにおいて、自動ソフトウェア分析を用いて選択された候補薬剤の表現が、人工分析によって選択された候補薬剤よりも優れていることである。
図34:損失に関する構造表現型を救うCCM 2. SiCTRL,siCCM 2またはREC−994,シンバスタチンまたはコレステリンで処理したsiCCM 2で処理した内皮細胞の免疫蛍光画像は,DNA(青色),アクチン(緑色)およびVE−カルアドヘシン(赤色)を示す。画像訓練に対する機械学習分類器により,REC-994は画像による救援を示した.
10クーパー紀元。彼らの研究を待っています(2008年)。家族性頭綿状血管奇形の磁化率強調画像神経科71歳 382.
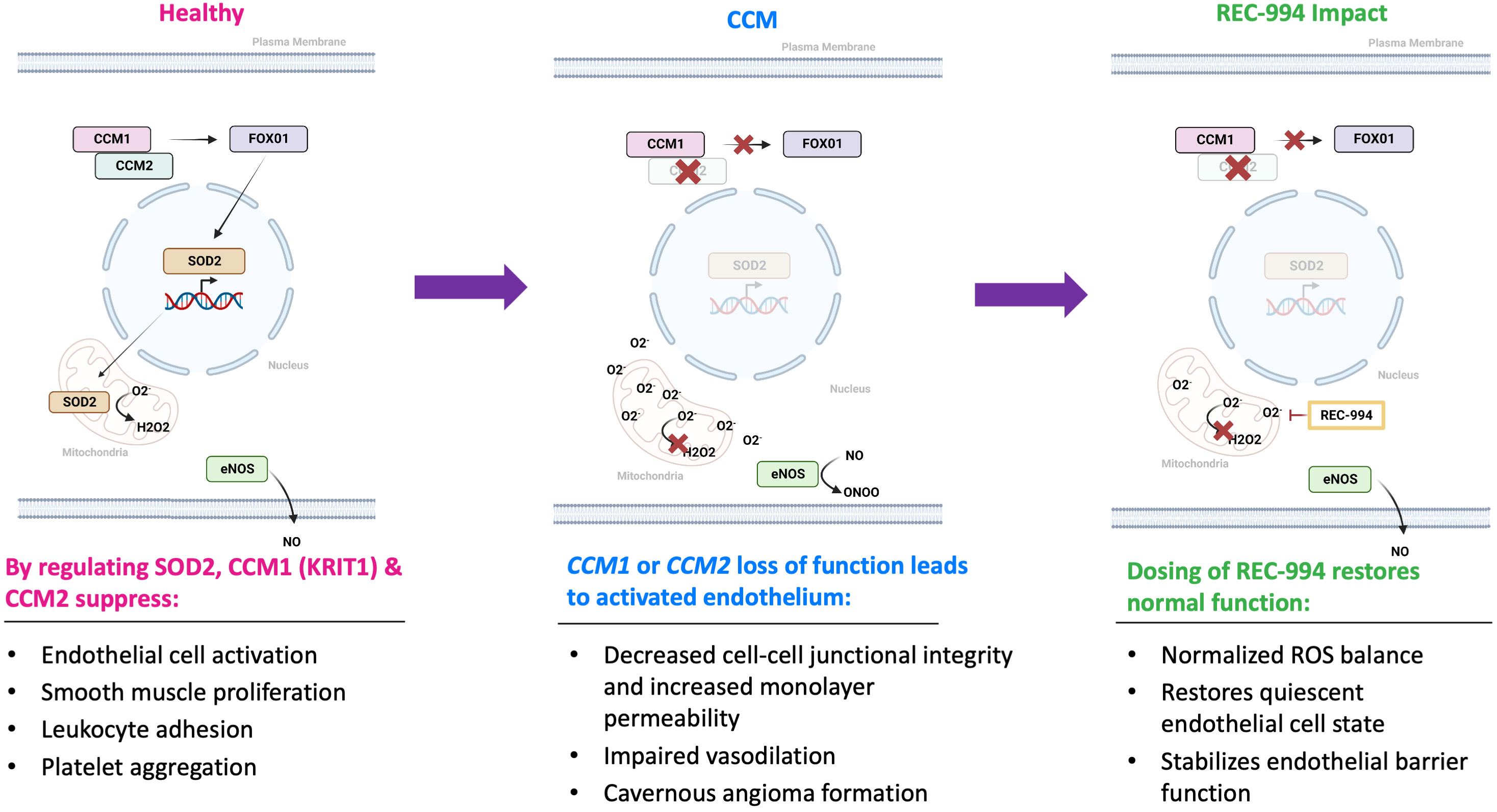
REC-994はCCMに関連する神経症状を緩和し、新しい病変の蓄積を潜在的に減少させることを目的とした小分子療法である。REC-994は経口生物使用可能なスーパーオキシドスカベンジャーであり、薬物動態学的支持を有し、人体内で1日1回投与される。REC-994の作用機序は,活性酸素を減少させ,酸化ストレスを低下させることにより,内皮バリア機能を安定させる可能性がある。さらに,REC−994は抗炎症特性を示し,疾患関連病態の減少に寄与する可能性がある
図35.REC-994の作用機序と潜在的な治療効果。
臨床前
REC-994は、潜在的な治療CCMとしての活性が直交機能分析において、および急性および慢性疾患においてさらに実証されている体内にあるモデルたち。REC-994は急性から亜急性疾患に関連する血流動力学パラメーター、例えば血管動力学と血管透過性の面で利点を示した。REC-994を長期服用しても2種類の内皮特異性ノックアウトマウスモデルでテストを行い、2種類の最もよく見られる遺伝原因を探したCCM 1そして CCM 2それは.これらのマウスモデルはヒト疾患の中枢神経系海綿状奇形を忠実に再現している。REC−994処置マウスは,賦形剤処理対照群と比較して病変数および/または大きさの減少を示した。この国の24時間循環血漿中のREC-994レベルは注目に値する体内にある実験は人間の1日200 mg用量の曝露と一致した
図36である.REC-994はCCM 2内皮細胞特異性ノックアウトマウスのアセチルコリン誘導の血管拡張欠陥と真皮透過性欠陥を救うことができる。11
図37に示す。REC-994は慢性CCM病マウスモデルの病変の重症度を下げることができる。REC−994で治療したマウスは小型病変数が統計的に有意に減少し,中型病変数が減少傾向を示した。11
臨床.臨床
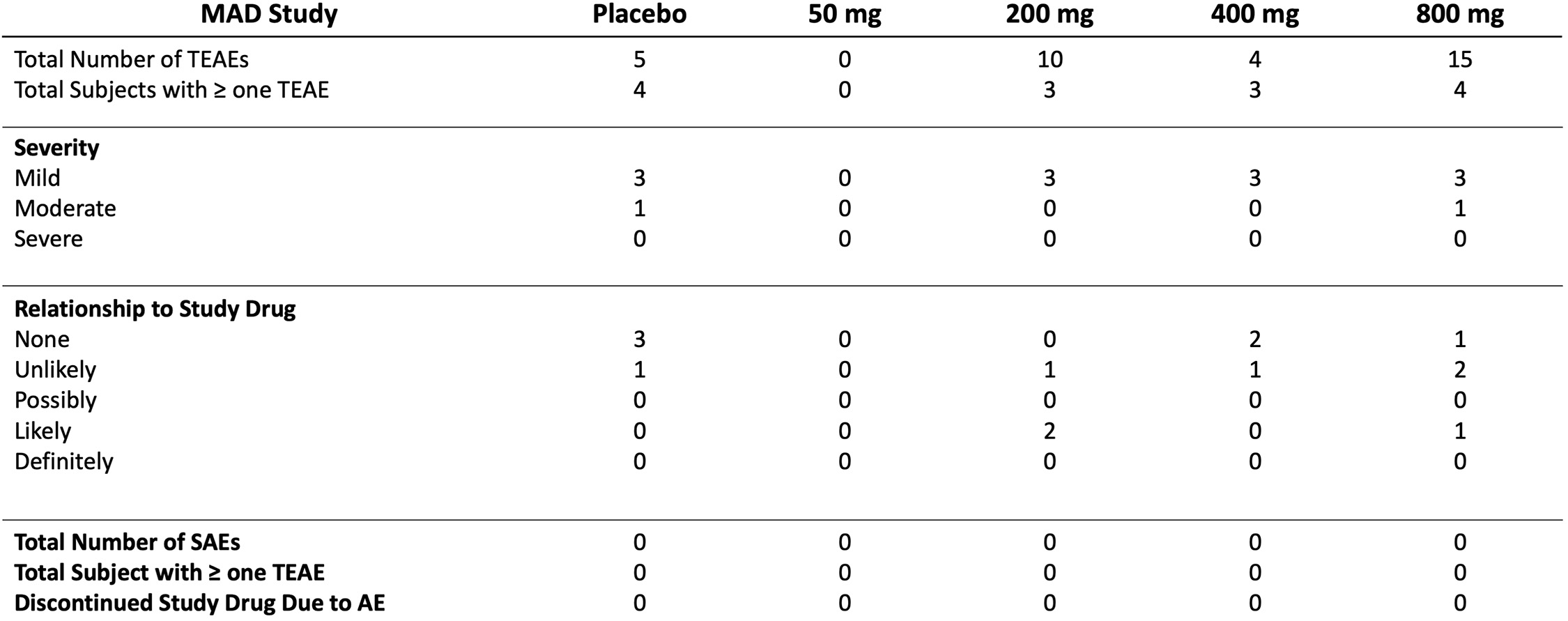
著者らは32名の健康ボランティアの中で一期単回漸増用量(SAD)の研究を行い、ボトル粉末剤(PIB)剤形中に賦形剤の活性薬物成分を含まない。その結果全身暴露(C)最大値AUC)は一般にREC-994用量に比例して増加し、単回用量でも複数回用量でも増加する。中央値T最大値とt1/2投与量とは関係がないようだ。この研究では死亡やSAEは報告されておらず,TEAEによる被験者の研究撤退も報告されていない。このようなデータは健康ボランティアのためのクレイジーな研究を支持する。
11Gibsonら。(2015)。脳綿状血管奇形の再利用薬物を治療する策略を確定した。発行部数は、131(3)、289-99である。
その後、52名の健康ボランティアの中で一期多用量漸増用量(MAD)の研究を行い、REC-994多用量経口の安全性、耐性とPKを研究し、PIB剤形から錠剤剤形に移行し、単回経口投与後の食物のPKへの影響を評価することを目的とした。全体的に、本研究の各用量レベルで、健康な男性と女性被験者のREC-994の複数回経口投与に対する耐性は良好であった。TEAE,バイタルサイン,心電図,脈拍血酸素飽和度,健康診断結果や神経学的所見には用量相関の傾向はないようであった。薬物動態学結果は錠剤を毎日1回経口投与することを支持する。
表1.第1段階多用量漸増研究の有害事象の概要AE=有害事象;MAD=複数回の増量投与量;SAE=深刻な不良事件;TEAE=治療-緊急不良事件。
Sycamore研究を再帰的に開始し、これは2022年第1四半期にCCM患者で行われた2つの第2段階試験である。第1の部分は、12ヶ月間の治療期間中に、プラセボと比較して、1日用量のREC-994(200 mgおよび400 mg)とプラセボとの安全性、有効性、およびPKを検討する無作為、二重盲検、プラセボ対照試験である。第2の部分は、第1の部分研究を完了した参加者のために、REC-994(200 mgおよび400 mg)を毎日服用するオプションの二重盲検長期延長(LTE)研究である。現在、CCM薬物開発の監督管理の前例或いは登録経路はまだない。現在行われている第2段階研究の結果,FDAの指導の下でキーとなる試験設計に情報を提供する予定である
図38に示す。REC−994の第2段階研究案である。第二段階試験設計は、症状のあるCCM患者におけるREC-994の有効性と安全性を評価する。入選基準は核磁気共鳴で確定診断された病変(S)、家族性或いは散発性CCMと診断され、CCMと直接関連する症状がある。主な結果の測定基準は安全性と耐性だ。副次的な措置は治療効果に重点を置き、臨床医師が測定した結果、CCM病変の画像、急性脳卒中採点と患者報告の結果を含む。 この試験は2023年6月に完全に組み入れられ、12ケ月の治療を完成した大多数の参加者は引き続き長期延長研究に入った。
競争相手
我々の知る限り,REC−994計画はCCM臨床試験における最初の業界スポンサーによる治療計画である。承認されれば,REC−994はCCMに対する最初の薬物疾患修正療法となり,CCMはまれな疾患領域の中で最大の満たされていない需要領域の一つである。現在,CCMの臨床開発には他にも3つの活発なプロジェクトがある。
•OVID治療会社のROCK 2阻害剤OV−888は現在第1段階であり,2024年下半期にシグナル発現試験を開始する予定である。
•NRL−1049はNeurelis由来の岩石阻害剤であり,BioAxone BioSciencesから許可を得ており,現在第1段階である。
•アトルバスタチンは競争的なHMG−CoA還元酵素阻害剤であり,最近症候性出血歴のあるCCM患者に対する1/2期研究が後援されている。
REC−2282 2型神経線維腫症の治療−2/3期
REC−2282は小分子HDAC阻害剤であり,現在開発中であり,治療に用いられているNF 2−変異型髄膜腫。これまでの臨床試験では,長年服用している患者に含まれる分子の耐性が良好であった。REC−2282は、承認されたHDAC阻害剤と比較して、中枢神経系透過性であり、経口バイオアベイラビリティでもある。適応的な2/3段階ランダムマルチセンター研究が行われており,第2段階の登録は2024年上半期に完了する予定である。米国とEUの孤児薬物指定および米国の高速チャネル指定が承認された。私たちは2024年第4四半期に第2段階の安全性と初歩的な治療効果データを共有する予定だ。
病気の概要
2型神経線維腫症(NF 2)は常染色体優性遺伝性稀な腫瘍症候群であり、複数の神経系腫瘍に罹患しやすく、その中で最もよく見られるのは両側前庭神経鞘腫、頭蓋内脳膜腫、脊髄脳膜腫および他の脊椎腫瘍、例えば室管膜腫である。
NF 2患者の約半分は脳膜腫を有しており,その多くは多発性髄膜腫を有する。NF 2患者の中で、脳膜腫の発病率は年齢の増加に従って増加し、生涯リスクは75%に達する可能性がある。つまり,NF 2駆動髄膜腫は毎年米国やヨーロッパ5カ国で約3.3万人の患者が発生していると考えられる。NF 2患者は通常10代または20代前半で聴力損失と診断され,発症時には通常片側聴力損失,局所性神経機能障害,頭蓋内圧上昇に関与する症状である。
大多数の脳膜腫は良性であるが、それらの位置はよく完全切除を維持できず、その後NF 2患者は聴力喪失、顔面麻痺、バランス不良と視覚困難を経験する。脊椎腫瘍は虚弱や障害を招き、一部の患者は車椅子に縛られる。多くの多腫瘍疾患を有する患者は成人初期に亡くなった。疾患の悲劇的性質と非手術治療の選択が乏しいため,新たな治療法,特に腫瘍負担軽減に対する方法が必要である
再帰的オペレーティングシステムからの洞察
我々はNF 2プログラムとしてREC-2282を選択し、蛮力方法を適用して高含有量の表現型スクリーニングを開発し、HUVEC細胞におけるsiRNAによるNF 2遺伝子の下方制御に関連する細胞と構造変化を決定した。すでにトランスフェクションしたNF 2-欠陥細胞を数千種類の化合物で処理し,NF 2損失に関連する構造欠陥を修復する分子を発見した。REC−2282は4つの独立したスクリーニングにおいてこの複雑な細胞表現型を健康状態(野生型)に逆転し,濃度は0.1~1μMであり,われわれの前臨床実験における有効濃度レベルと一致した。また,REC−2282は数百の他の腫瘍抑制因子や癌ノックアウトモデルの評価で同じレベルの用量依存救援を示すことができず,さらに特定の背景で選択的に作用する証拠を提供したNF 2機能が失われる。つまり,これらの実験は疾患関連環境における強力かつ再現性のある活性を示し,REC−2282の治療への潜在力を示しているNF 2-突然変異腫瘍。
図39に示す。REC-2282はNF 2の損失を救った.A)siRNA対照またはsiRNA NF 2で処理されたヒト内皮細胞の免疫蛍光画像。B)REC−2282は高次元疾患表現型を救命し,疾患から健康状態への左移動が証明された。HUVEC、ヒト臍帯静脈内皮細胞;NF 2、神経線維腫症2型;siRNA、小干渉RNA
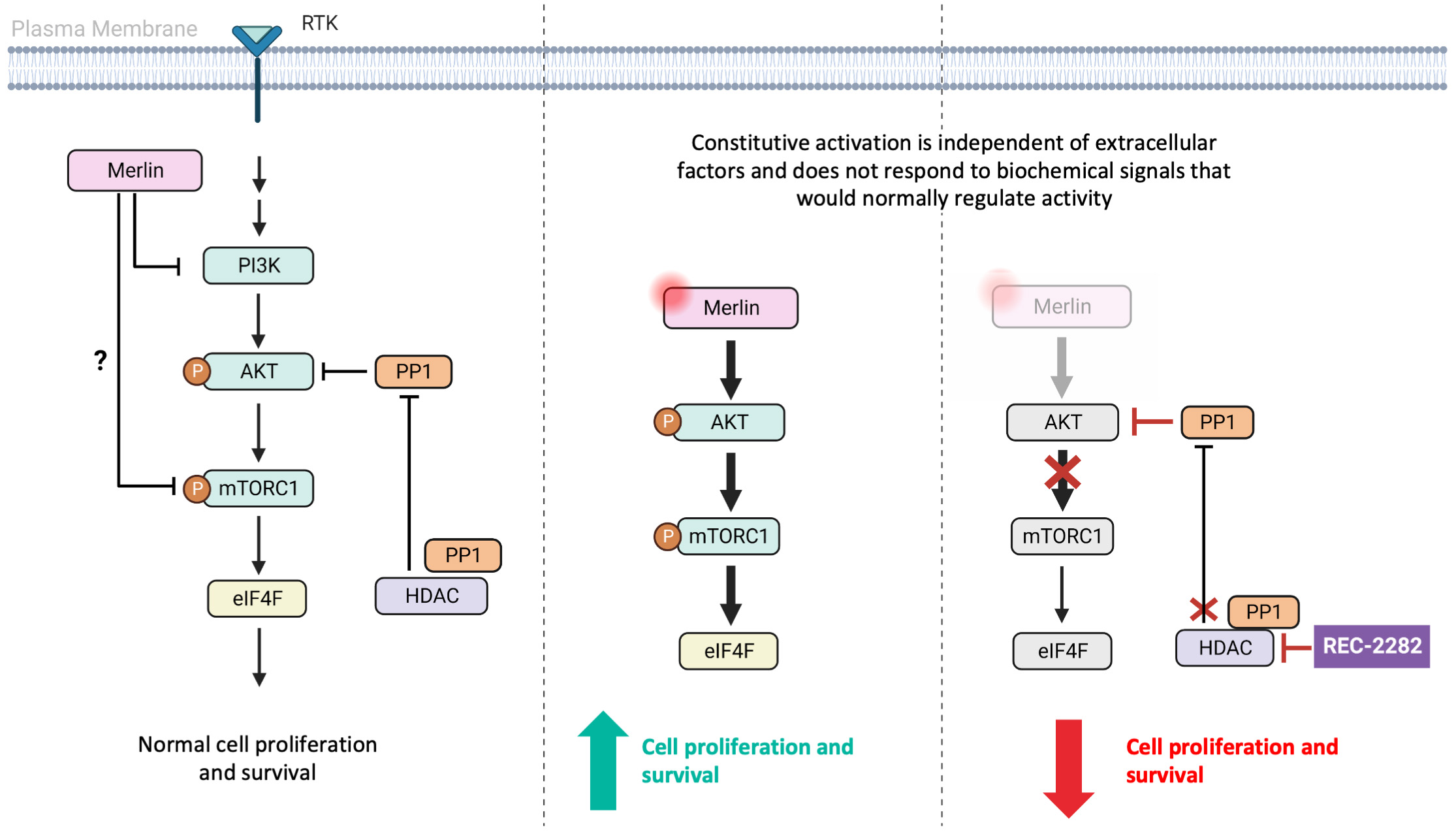
REC-2282は経口生物利用型、中枢神経系を貫通する汎ヒストン脱アセチル化酵素或いはHDAC阻害剤であり、PI 3 K/AKT/mTOR経路調節活性を有する。市販のHDAC阻害剤と比較して、REC-2282は特にNF 2とNF 2患者に適しているNF 2経口バイオアベイラビリティ、中枢神経系曝露、および現在まで記録されていない心血管疾患のための変異中枢神経系腫瘍。
図40です。REC-2282はNF 2脳膜腫を潜在的に治療する1種類のHDAC阻害剤になる。REC−2282は,経口バイオアベイラビリティやCNS曝露のため,他のHDAC阻害剤と比較してNF 2に非常に適していると考えられる。12,13,14
NF 2疾患は遺伝子変異によるものであるNF 2この遺伝子は重要な細胞シグナル調節因子Merlinをコードする。Merlinの欠損は多くのシグナル経路の活性化を招き,これらのシグナル経路はPI 3 K/AKT/mTORなどの経路に収束し,細胞増殖を促進する。HDAC阻害剤、例えばREC-2282は、主にプロテインホスファターゼ1(PP 1)-HDAC相互作用を破壊し、その後、PI 3 K/AKTシグナルを抑制して癌細胞の成長停滞とアポトーシスを引き起こすことによって抗腫瘍作用を発揮すると考えられている。
12Sborov、D.Wら。(2017)多発性骨髄腫およびT細胞およびB細胞リンパ腫患者におけるHDAC阻害剤AR-42の1期試験。Leukリンパ腫、58(10), 2310-2318.
13Collier Kaら。(2021年)。神経線維腫症2型関連腫瘍と末期固形悪性腫瘍患者におけるヒストン脱アセチル化酵素阻害剤AR-42の1期試験抗がん化学薬です。87(5)、 599-611.
14Vorinostat/Belinostat/Romidessinの処方情報。
図41に示す。Rec-2282は腫瘍の発生発展過程において重要な作用を発揮し、腫瘍細胞の成長を抑制するNF 2におけるREC−2282の潜在的作用機序。15
臨床前
我々のプラットフォームを用いてREC−2282のNF 2への新たな用途を発見した後,この分子をよりよく理解し,疾患に関連する臨床前モデルでその活性を検証するための文献検索を行った。Rec-2282は様々なヒト癌細胞系とヒト癌異種移植モデルにおいて薬理活性を有することが証明されている。REC-2282は抑制できることが証明されています体外培養AKT不活化に関連する用量では,細胞周期停滞やアポトーシスを誘導することにより前庭神経鞘腫や髄膜腫細胞の増殖を促進する。臨床前モデルでは,REC−2282は原世代VSとNF 2−欠損マウス神経鞘腫細胞、および初代患者由来の脳膜腫細胞および良性脳膜腫細胞株Ben-Men-1。
NF 2動物モデルではREC−2282が抑制されている体内にある鼻咽頭癌の腫瘍成長NF 2−欠損マウス前庭神経鞘腫同種移植。また,REC−2282も抑制された体内にある25 mg/kg/d REC−2282 45日間投与したヒト前庭神経鞘腫マウス移植腫瘍モデルの腫瘍成長。マウス原位脳膜腫モデルでは,REC−2282も髄膜腫細胞の成長を抑制したNF 2ルシフェラーゼを発現するBen-Men-1脳膜腫細胞を含む欠損脳膜腫。これらの動物データは著者らのプラットフォームの研究結果の機能性と直交性検証である。
15ペトリリーとフェルナンデス·ワレが原作です。(2016)。Merlin/NF 2の腫瘍生物学における不活化の役割癌遺伝子、35(5), 537-48.
図42に示す。REC−2282 SCID−ICRマウス前庭神経鞘腫移植腫を縮小し、腫瘍の成長と再成長を防止するNF 2−欠損脳膜腫マウスモデル(A)対照マウス当たりのVS腫瘍体積変化は、平均6%増加した。(B)REC-2282は、VS異種移植されたSCID-ICRマウスVS腫瘍体積の平均サイズを約28%有意に減少させた。表示されたエラーバーは95%CIであった.P=0.006である.C)腫瘍生物発光検出により,REC−2282はBen−Men−1−LucB移植腫瘍の成長も抑制した。16,17
臨床.臨床
調査員が支援した4つのREC-2282(従来AR-42と呼ばれていた)実験(IST)が完了した.AR−42−001研究では,REC−2282を単一治療として投与した。他の3つの試験では,REC−2282はそれぞれ抗腫瘍薬であるジシタビン(AR−42−002),パゾパニ(AR−42−003)およびポアマイド(AR 42 004)と併用した。これらの研究では,固形あるいは血液系悪性腫瘍を有する77名の患者がREC−2282を服用し,投与量は20 mgから80 mgまで様々であり,週3回,連続3週間,その後4週間を周期として1週間中止した。多数の患者は60 mg投与量でこの用量方案を用いて長年治療し、記録中の40 mg投与量での最長治療コースは4.4年であった。有害事象の多くは一過性の細胞減少であり,用量の減少や投与中止を招くことはない。固形腫瘍患者のMTDは60 mgであった。悪性血液病と固形腫瘍患者のREC-2282血漿暴露量は一般的に投与量の増加に従って増加する。19日間の投与期間中,REC−2282が血漿中に蓄積し,血液病患者と固形腫瘍患者間のPKにも有意差は認められなかった。
オハイオ州立大学で行われたもう一つの早期1期薬効ISTでは,REC−2282は腫瘍切除を受けた成人患者前庭神経鞘腫におけるERK,AKT,S 6経路の異常活性化を抑制しているようである。これらの結果はALKやMEKの単経路阻害剤では困難である可能性がある。
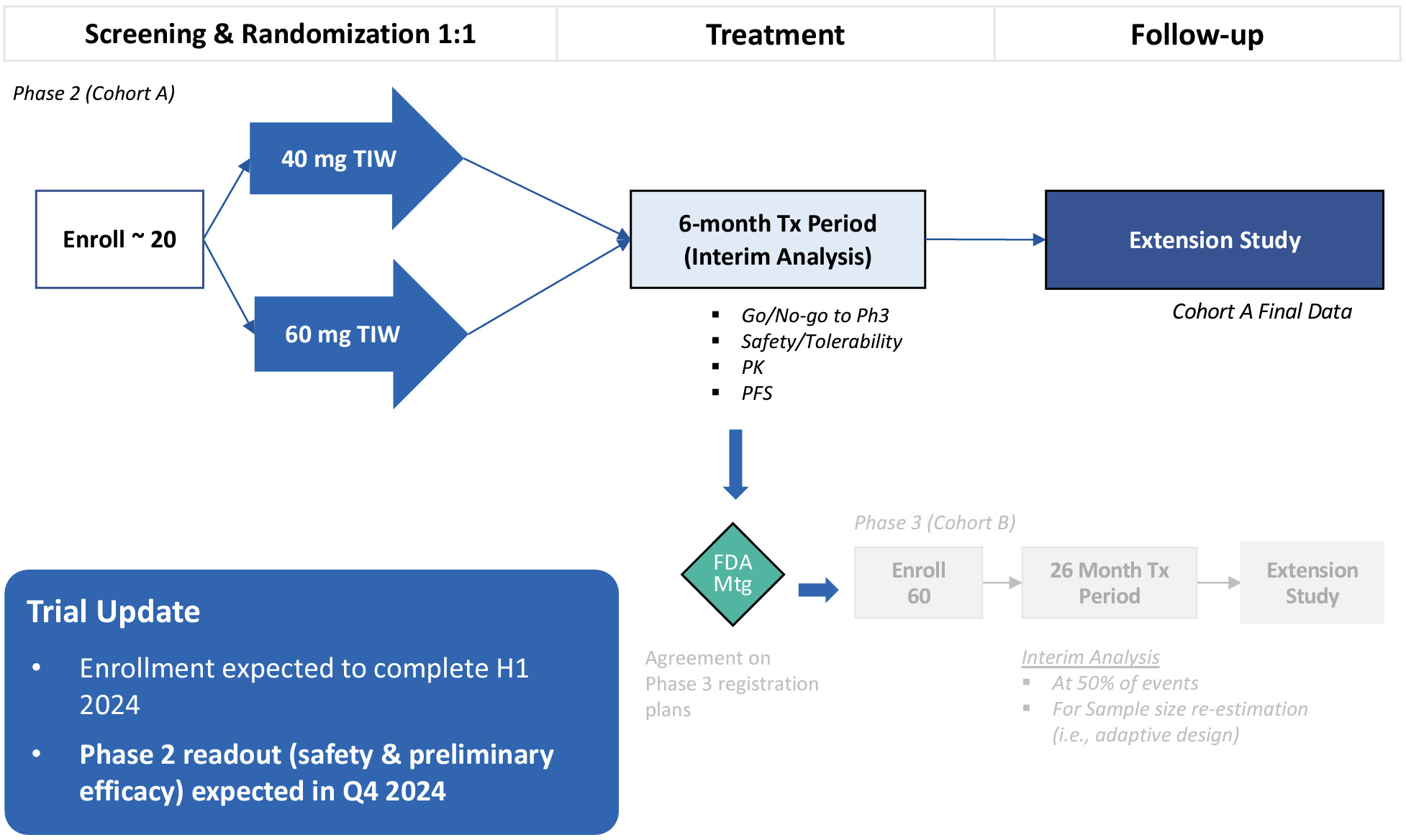
Recursionは現在Pplarで患者を募集しており、これは適応性の2/3期ランダム多中心研究であり、進行性糖尿病患者におけるREC-2282の治療効果と安全性を評価することを目的としているNF 2−潜在的なNF 2疾患を伴う変異脳膜腫および記録された散発性髄膜腫NF 2突然変異です。この研究は、第2段階が完全に完了する前に検証的第3段階研究を開始することを可能にすることによって、潜在的製品登録の道を加速させることを目的としている。これは、2段階に分けた第2/3段階であり、登録は2つの部分に分けて達成される。列Aは第2段階を探す信号であり、この段階では、20人の成人被験者と最大9人の青少年被験者が2つの有効用量の武器を使用して治療を開始する。被験者の安全性は、指示に従って投与量の修正および中止規則を適用する独立したデータ監視委員会によって監視される。全20名の成人被験者が6カ月の治療を完了した後、1)B群の決定または第3段階の進行/非標準の決定、2)継続投与量の選択(S)、3)計画中の第3段階のサンプル量の再推定、および4)FDAが第3段階の開始に同意することを目的とした中期分析を行う。第2段階の被験者は、合計26カ月まで治療を継続し、その後、拡張研究への参加を選択することができる。第3段階は現在、26ヶ月にわたる治療を受ける60人の被験者(成人被験者および可能な青少年被験者)を再募集する必要がある。計画の主な終点は無進行生存(PFS)である。
16Jacob Aらが原作。(2012年)。Triology学会論文AR 42は、1種の新型ヒストン脱アセチル化酵素阻害剤であり、前庭神経鞘腫の治療の臨床前検証に用いられる喉頭鏡、122(1), 174-189.
17Burns SSらです。(2013年)。ヒストン脱アセチル化酵素阻害剤AR-42は脳膜と脳膜腫瘍細胞の細胞周期輸送に異なる影響を与え、NF 2欠損の脳膜腫成長を有効に抑制する癌資源;73(2), 792-803.
図43に示す。REC-2282の段階2/3研究案。2/3期の二段階研究設計、進行期患者におけるREC-2282の安全性、耐性と初歩的な治療効果を評価するNF 2-脳膜腫変異。入選基準はMRIで確定診断された進展性脳膜腫と(1)散発性脳膜腫を含むNF 2突然変異あるいは(2)NF 2病と診断された。この研究の第二段階の主な結果の測定基準は6ケ月の無進展生存率(PFS)である。
競争相手
現在臨床開発目標には8つの計画がありますNF 2-脳腫瘍を引き起こす。
•Brigatinibは武田製薬会社が許可した非小細胞肺癌を治療するALK阻害剤であり、現在NF 2病脳膜腫、前庭神経鞘腫、室管膜腫を治療する第二段階にある。
•Neratinibはビュアー馬生物技術会社がトラツズマブに基づいてHER 2+乳癌を治療した後に許可されたHER 2阻害剤であり、現在NF 2病脳膜腫、前庭神経鞘腫と室管膜腫の第二段階にある
•クリゾチニブはALK/ROS 1阻害剤であり,研究者によって後援されたNF 2患者の進行性前庭神経鞘腫に対する第二段階研究が行われている。
•アスリカンのMEK阻害剤selumetinibは第2段階研究を行っているNF 2腫瘍に関連しています
•GSK 2256098はグラクソ·スミスクラインのFAK阻害剤であり、バスケット2期脳膜腫研究を行っており、各種の標的治療と遺伝子改変を採用しているNF 2突然変異です。
•Ikena OncologyからのTead阻害剤IK-930は、カバシグナル駆動のための末期固形腫瘍のためのバスケット1期研究を行っているNF 2突然変異です。
•VT−3989はVivace TreeuticsのTEAD阻害剤であり,進行悪性中皮腫やその他に有用なバスケット1期研究が行われているNF 2脳膜腫を含む変異。
•ノワール社のTEAD阻害剤IAG 933は進行悪性中皮腫やその他の有するバスケット1期研究を行っているNF 2脳膜腫を含む変異。
REC-4881家族性腺腫性ポリープ症(FAP)-1 b/2期の治療
Rec−4881は経口生物利用型,非ATP競合的なMEK 1とMEK 2アロステリック小分子阻害剤であり,ポリープ負担軽減やFAP患者の腺癌進展のために開発されている。REC−4881は以前の臨床研究で耐性が良好であり,用量依存性の曝露と薬理活性の増加を示した。再帰は現在Tupeloで患者を募集しており,1 b/2期開放ラベルのマルチセンター研究であり,2024年上半期に第2部でFPIを行う予定である。米国とEUの孤児薬物指定および米国の高速チャネル指定が承認された。私たちは2025年上半期に第2段階の安全性と初歩的な治療効果データを共有する予定だ
病気の概要
FAPはまれな腫瘍感受性症候群であり,米国とヨーロッパ5カ国では約50,000名の患者が承認されていない治療法である。FAPは遺伝性疾患であり、結腸腺腫性ポリープ症(装甲運搬車)遺伝子。♪the the the装甲運搬車遺伝子は腫瘍抑制遺伝子であり、Wntシグナル経路をコードする負の制御因子である
FAPの特徴は下部消化管の数百個の腺腫性ポリープの進行性発展であり、主に結腸と直腸であり、治療しなければ、40歳までに結腸直腸癌に罹患する生涯リスクは100%に達する。FAP患者に対する標準看護は青少年後期に結腸切除術を行うことである。手術介入がなければ、影響を受けた患者は成年早期に結腸直腸癌に発展する。結腸切除術後,持続的な進行リスクを考慮して,6−12カ月ごとに内視鏡モニタリングを受け,疾患進展をモニタリングした
主要な危険臓器を切除したにもかかわらず,約50%の患者が新直腸に腺腫病変を発症する。内視鏡治療が十分でなくなると,追加の外科手術が必要となる。同様に,これらの患者も十二指腸(特に壷腹)腺腫に進展し,内視鏡治療も必要である。大きな腺腫と癌の証拠が存在する場合、患者は根治性ホイップル手術を含む追加の局所手術を必要とする。FAPの治療法は現在のところ承認されていない。
再帰的オペレーティングシステムからの知見
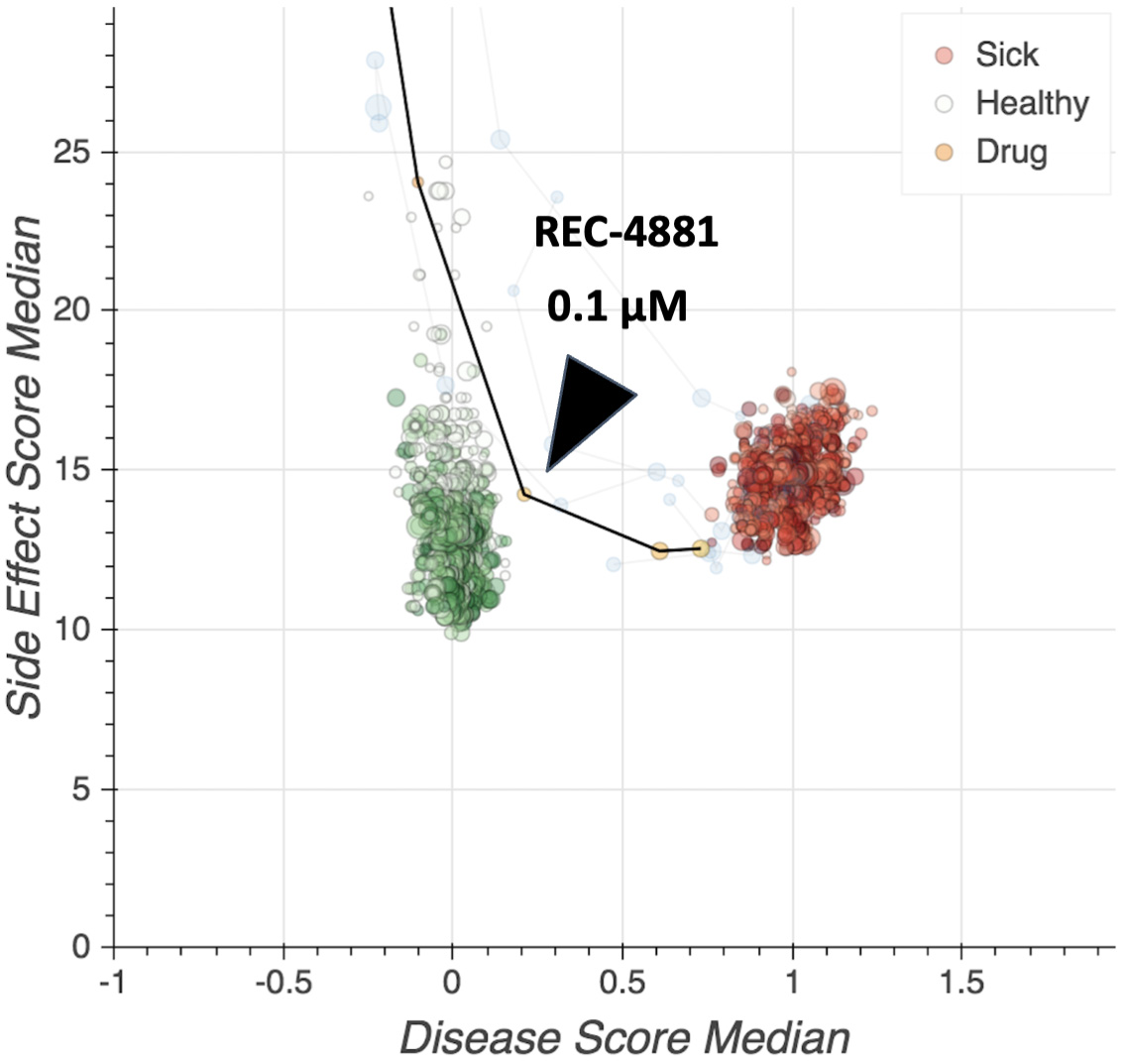
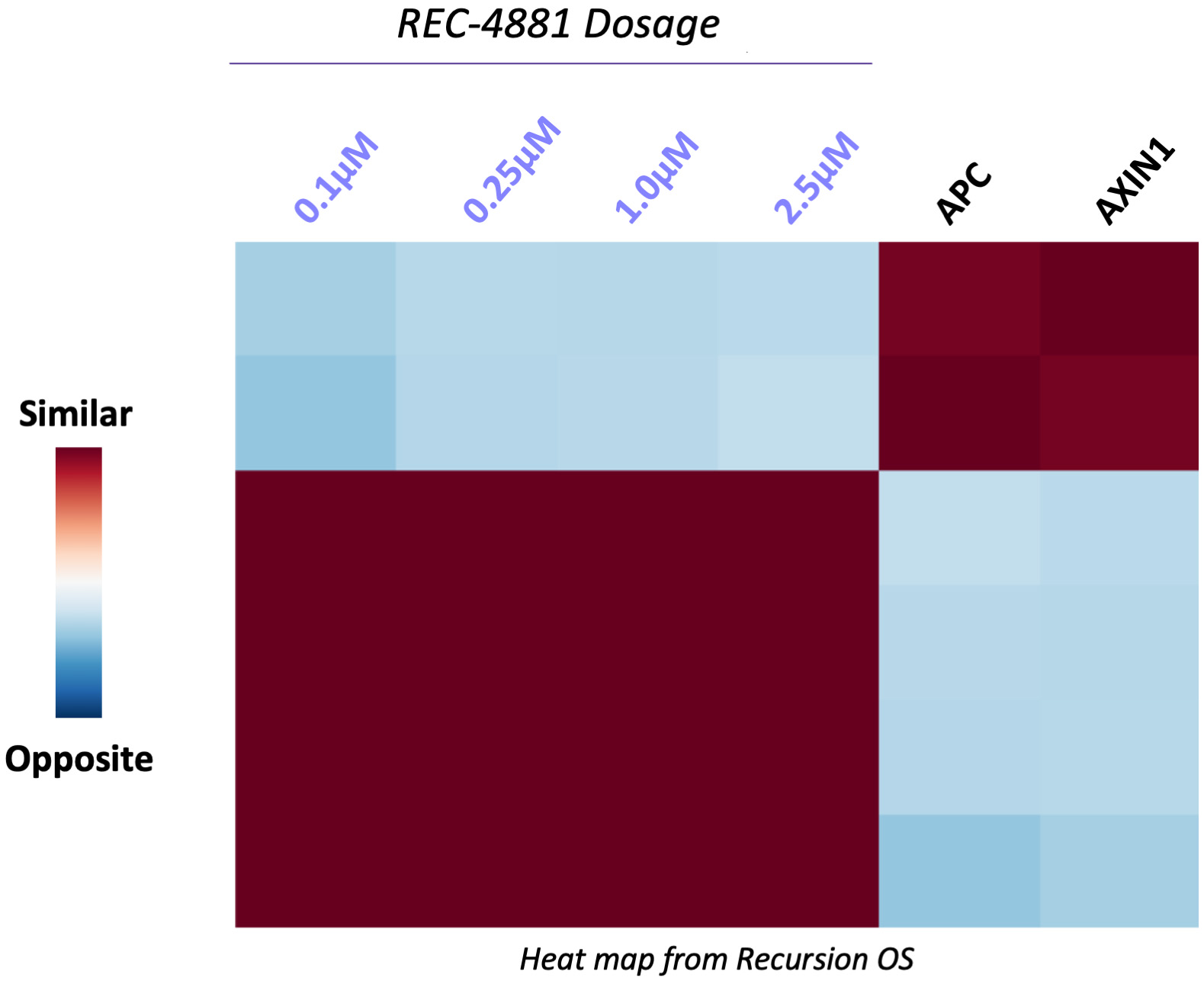
FAPのためのREC−4881の新しい使用は、再帰的OSを用いてヒト細胞においてFAP疾患遺伝子APCを下方制御することによって発見される。Recursionは、FAPを治療する潜在的薬物としてREC-4881を選択するために、小干渉RNA(SiRNA)を用いて骨肉腫U 2 OS細胞中のAPCをノックアウトすることに関連する細胞および構造変化を決定するために、高含有量の表現型スクリーニングを開発した。Recursionは機械視覚と自動分析ソフトウェアを用いて数百個の装甲運搬車相手を倒す。この複雑な表現型は、3000種類以上の既知の薬物および生物活性化合物の化学スクリーニングの基礎として使用され、REC-4881を含むいくつかのRAFおよびMEK阻害剤を示し、それは損失と逆転した装甲運搬車それは.REC−4881はMEK阻害剤selumetinibやbinimetinibと比較して高度な特異性と強い細胞表現型逆転作用を示した。
図44に示す。REC-4881細胞表現型欠陥を救う装甲運搬車相手を倒す。REC-4881は、数千の他の試験分子と比較して、表現型欠陥の修復がはるかに良い(他のMEK阻害剤よりも良い修復を含む)APC-特定のノックダウン。
Rec−4881は経口生物利用型,非ATP競合的MEK 1とMEK 2のアロステリック小分子阻害剤(IC 50はそれぞれ2−3 NMと3−5 NM)であり,FAP患者のポリープ負担の軽減や腺癌への進展を軽減するために開発されている
FAPは機能を失って駆動されます装甲運搬車β−カテニン破壊複合体の重要な成分であり,Wnt経路の異常活性化を引き起こす。このWnt-On状態はRAS安定を招くことができ、RAS/ERK経路を活性化し、MYCを活性化し、細胞増殖と生存-FAPに見られる腺腫の成長を含む。REC−4881はMEK 1/2を抑制し,ERK活性化を抑制し,MYC活性を低下させ,細胞を閉鎖状態に回復させ,細胞増殖を抑制する。
FAPへのMEK阻害剤の使用をさらに支持し,ERKシグナルは線維芽細胞や血管内皮細胞を含む腺腫上皮細胞や腫瘍基質細胞で活性化されることが示唆された。そのほか、マイトジェン活性化プロテインキナーゼシグナル変化を招くゲノムイベント、例えばKRASの活性化突然変異は、FAP腺腫の成長を促進する頻繁な身体イベントである。全体的に,FAP腺腫における異常なMAPKシグナルをREC−4881で抑制することは,腫瘍成長を駆動するコア経路に作用することにより,これらの腫瘍の成長を逆転または緩和する可能性がある
図45である.REC-4881抑制装甲運搬車−突然変異は、FAP背景下で細胞増殖を阻止するMAPKシグナルを誘導する機能的変異欠損細胞におけるREC−4881の作用機序APCです。18
臨床前
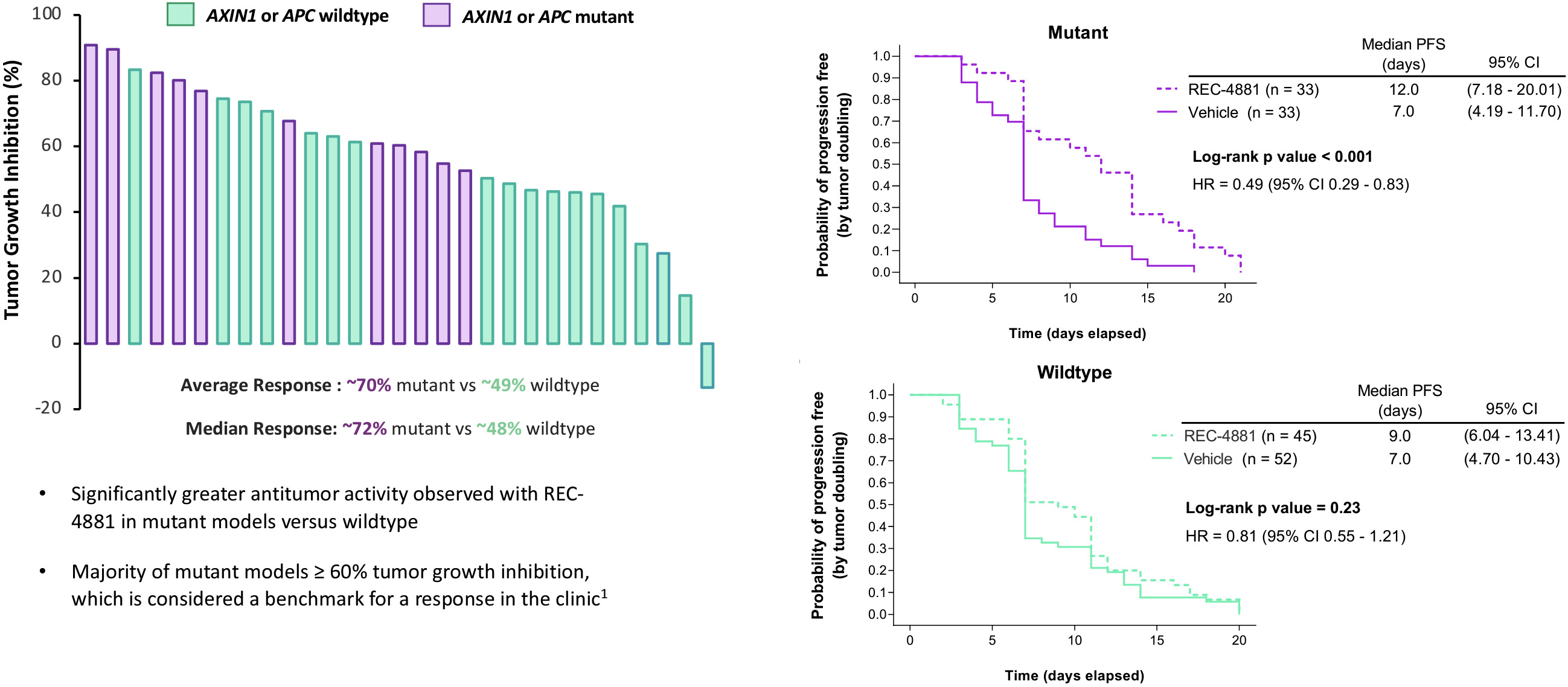
ヒトの上皮性腫瘍細胞から分離された腫瘍細胞系とヒト上皮性腫瘍細胞から成長した球体を用いて最初の表現型スクリーニング結果を検証した装甲運搬車それは.これらのモデルでは,Rec−4881は球体の成長や組織を抑制し,腫瘍細胞系には含まれている装甲運搬車突然変異です
その後,FAPの疾患関連臨床前モデルでREC−4881を評価した。切断されたマウスをかくまうAPCあるいは、あるいはAPC最小8週間の間、REC-4881またはセレキシブ(対照として)を毎日多用量服用した。セレキシブ治療マウスは、賦形剤治療マウスより約30%減少したが、1 mg/kgまたは3 mg/kg REC-4881で治療されたマウスは、賦形剤治療マウスポリープより約50%減少した。REC-4881を10 mg/kg服用したマウスは、試験の最高用量である総ポリープの約70%の減少を示した
FAPでは,遺伝子変異によるポリープ装甲運搬車追加の突然変異を蓄積することによって高レベル腺腫に進展し、最終的に悪性腫瘍に発展する可能性がある。良性ポリープと進行腺腫におけるREC−4881の活性を評価するために,REC−4881で処理したマウス胃腸組織を組織学的に評価し,ポリープを良性と高度腺腫に分類した。セレキシブはモデル中の良性ポリープの成長を減少させたが,ほとんどの残存ポリープは発育不良であった。これに対し,REC−4881の治療は良性ポリープを特効的に減少させただけでなく,前癌ハイレベル腺腫も減少しており,潜在的な翻訳意義があることが分かった
18Jon WJらです(2018)。Wnt/β-cateninとRAS-ERK経路の間の相互作用及び標的β/β-catenin経路を通じてRas-cateninとRASを分解する抗癌策略。NPJは腫瘍学に正確であり、2(5)。
図46。REC−4881消化管ポリープ数の減少と高レベル腺腫APC最小FAPマウスモデルREC-4881、セレキシブまたは賦形剤対照群の指定された用量を経口投与した8週間後、胃腸ポリープ数(左図)および高レベル腺腫のパーセンテージ(右図)。投与開始時のポリープ計数は,研究開始時(15週大)に犠牲になった動物を反映していた。P
臨床.臨床
ミレニアル製薬会社が以前51名の非血液系悪性腫瘍患者に対して行った第一段階の用量増加研究(C 20001研究)において、TAK-733(REC-4881)の投与量範囲は0.2 mg/日から22 mg/日までの21日間であった。最大耐容量(MTD)は16 mg,qdであった。この研究では、REC 4881曝露は用量割合よりも低い方法で増加した
最もよく見られる副作用は皮疹であり,34名の参加者(67%)が任意のタイプの皮疹を報告し,皮疹や何らかの皮膚状態で薬物治療を中止した参加者7名中4名であった。14人の参加者(27%)は、少なくとも1回の治療後に出現したSAEを経験し、1人を超える参加者の中で発生した唯一のSAEは、転移性黒色腫(3名;6%)、肺血栓(2名;4%)、および貧血(2名;4%)であった。5人の参加者が研究中に死亡した;すべての死亡は病気の進行によるものだ。
REC−4881−101は、REC−4881とTAK−733との比較可能性を確認するために、健康ボランティアにおけるRecursionによる安全性およびPK研究である。25人の健常対象者は、単剤REC-4881 4 mgおよび8 mg(食事および絶食条件下)および単剤REC-4881 12 mg(絶食条件下)の2群に分けられた。各コホートは3つの研究周期内に単用量の研究薬を受け、1周期当たり14日間隔で行った。
REC−4881は全体的に耐性が良好であった。研究期間中,死亡やSAEの報告はなかった。この2つのキューの場合、REC−4881およびプラセボ治療を受けた参加者は、TEAEのパーセンテージが同等であることを報告する。REC−4881の投与量や食物条件に有意な関係は認められなかった。1例(REC−4881/FED 4 mg使用による視力不明瞭報告)を除き,すべてのTEAEは調査者により1級重症度と評価された。他の2名の参加者は治療に関連した眼疾患(REC 8 mg−4881/Fastedを服用した参加者1名は両眼視力不明瞭,REC−4881/Fasted 12 mgを服用した参加者1名に硝子体蚊が出現した)を報告した。すべての場合、症状は緩和された。これらの健常被験者にはQTcF異常(ベースラインからの変化または延長)は認められなかったことに注意されたい。
Recursionは現在Tupeloへの患者の参加を募集しており、これは1 b/2期開放ラベルの多中心研究であり、FAP患者におけるREC-4881の有効性、安全性、薬物動態と薬効学を評価することを目的としている。この研究は2つの部分に分けて行われる.第1の部分は、REC−4881単回および複数回投与後のFAP参加者のPK、安全性、耐性、およびPDを評価した。FAP患者5例は単剤と14日間の投与を受けた
Rec−4881,1日4 mg,1日1回。4 mg qdは一般的に耐性が良好であり、安全性は他のMEK阻害剤と一致した。初歩的なPDデータにより、4 mg投与量はFAP患者に対して薬理活性を有する可能性があることを表明した。第2部では,FAP参加者に対する1日1回用量のREC−4881の有効性,安全性,PK,PDを評価し,これらの参加者は以前に結腸切除/直腸切除を受け,生殖系が確認されている装甲運搬車突然変異です。研究薬品使用は経口投与であり,治療コースは3カ月であった。
[図47]FAPにおけるREC−4881の1 b/2段階研究案古典的FAP患者におけるREC-4881の有効性、安全性、および薬物動態を評価するための1 b/2期臨床研究。登録基準は、(1)確認されたことを含む装甲運搬車突然変異;(2)55歳;(3)結腸/直腸切除術後;(4)胃腸癌なし;(5)十二指腸ポリープ(壷腹および/または直腸/バルーンを含む)。観察指標:PK、安全性、耐性、初歩的な治療効果(ポリープ負担変化、組織学分類、硬線維腫病変程度)。
競争相手
現在行われているFAP臨床開発プロジェクトは3つある。
•アルファは,SLA Pharma由来のエイコサペンタエン酸とも呼ばれ,現在FAP患者の第3段階にあり,これらの患者は病原性を運搬している装甲運搬車遺伝子が変異し,結腸切除術を行ったことがある
•FlynpoviはPanbela社製CPP−1 Xとシュリン酸の組み合わせであり,現在FAP患者の第3段階にあり,下部消化管疾患に重点を置いている。2024年下半期に将来の規制経路についてさらなる指導を提供する予定だ
•ERapaはmTORC 1阻害剤であり,Emtora Biosciencesとも呼ばれるラパマイシンカプセルであり,現在FAP患者の第2段階にある
AXIN 1またはAPC変異癌のREC−4881−2期
REC−4881は経口生物利用型,非ATP競合的MEK 1とMEK 2アロステリック小分子阻害剤であり,治療に開発されているAXIN 1あるいは…装甲運搬車変異した癌ですREC−4881は以前の臨床研究で耐性が良好であり,用量依存性の曝露と薬理活性の増加を示した。再帰的起動のクローブ,2期研究AXIN 1あるいは…装甲運搬車2023 年末に突然変異がんを発症し、 FPI は 2024 年第 1 四半期に予想されます。2025 年上半期に安全性および予備有効性データを共有する予定です。
病気の概要
AXIN 1 と APC は、ベータカテニン破壊複合体の一部を形成する重要な腫瘍抑制剤として機能し、細胞内のベータカテニンおよび RAS レベルをそれぞれ直接および間接的に調節する。不活性化変異による Wnt および RAS 経路の異常活性化 AXIN1あるいは…装甲運搬車米国と EU 5 の推定 65,000 人の患者が第 2 ラインの治療を受ける資格を持つさまざまなヒトがんに頻繁に現れます。これらの腫瘍はしばしば臨床的に侵攻性であり、化学療法および / または免疫療法による治療に感受性が低く、耐火性の高い集団を表すと考えられる。したがって、遺伝子変異を有する患者に対する治療法の開発が必要である。 AXIN1あるいは…装甲運搬車これらの変異は不治であると考えられています特に承認された治療法はない。 AXIN1あるいは…装甲運搬車ミュータント癌
再帰的オペレーティングシステムからの洞察
REC — 4881 プログラム AXIN1あるいは…装甲運搬車突然変異癌は私たちの推理探索方法に完全に基づいて指名された私たちの最初の番組だ。われわれのHUVECプロファイルでは,REC−4881は臨床関連用量とノックアウトとの間に逆の関係が認められたAXIN1先に開示されたものを除いて装甲運搬車それは.この関係をこの分子をめぐる2つ目の新しい知見と解釈し,REC−4881を用いても以下の要因によって駆動される生物学的結果を回復する可能性があるAXIN1あるいは…装甲運搬車失われ、多くの癌で発見された
他の2つの見解はこの説明をより説得力にしています
•AXIN 1とAPCはβ−カテニン破壊複合体の中心成分である。この破壊複合体は生理的に細胞中のβ-カテニンとRASのレベルを調節する。AXIN 1とAPCは複合体に同時に存在するため,機能に関与していると考えられる。われわれのマップはノックアウトされた2つの遺伝子間に強い表現型類似性があることを示しているAXIN1そして 装甲運搬車このことは生物学のこの軸が我々の高次元埋め込み空間で再現されていることを示している
•FAPにおけるREC−4881に対する1 b/2段階計画は,我々の蛮力スクリーニング法を用いて開始され,U 2 OS細胞タイプでは,モデル化された疾患状態(siRNAノックアウトAPC遺伝子)からモデル化された健康状態(野生型)への細胞の回復が濃度に依存することが分かった。我々の画像は,類似した表現型効果をHUVECにおけるREC−4881濃度に起因させ,暴力的手法と推論探索手法との一致を示している。これらの発見は,2つの異なる細胞背景から,異なる時点で行われ,異なる条件下で行われ,我々の解釈を強く検証した。
図48に示す。再帰的オペレーティングシステムからの知見ですREC−4881は臨床関連用量とノックアウトの間に表現型とは逆の関係を示したAXIN1そして 装甲運搬車HUVEC にて
臨床前
REC—4881 を、 HCC と卵巣腫瘍に焦点を当てた 2 つの PDX マウス試験に進めました。PDX 臨床試験は、 PDX モデルを用いた集団試験であり、前臨床環境で治療に対する有効性を評価し、奏効者を予測するために使用できる。合計 29 の PDX モデルにおいて、単剤 REC—4881 による治療は有意に改善した。 AXIN1あるいは…装甲運搬車変異型モデルと野生型モデルこれらの応答は、 PFS ( ベースラインからの腫瘍倍増時間としてモデル化された ) において有意な利益をもたらしました。 AXIN1あるいは…装甲運搬車バイオマーカー駆動効果のさらなる証拠を提供する変異モデルです
図 49 29 PDX マウスモデルにおける腫瘍増殖阻害と PFS 。REC—4881 はマウスモデルで活性を高める AXIN1あるいは…装甲運搬車変異した腫瘍ですスケールを用いてランダムにグループ分けした後、毎週3回腫瘍体積を測定し、計算式は:V=(L×W×W)/2であり、その中にVは腫瘍体積であり、Lは腫瘍長(最長腫瘍次元)、Wは腫瘍幅(Lに垂直な最長腫瘍次元)である。すべてのマウスのTGI(Wong,H,など)を式%TGI=(TV Vehicle-TV Treatment)/(TV Vehicle-TV Initial)*100で計算した臨床癌残留物., 2012, 18(14): 3846-3855).
臨床.臨床
紫丁香は2期開放ラベルの多中心研究であり、選定した腫瘍タイプの中で2023年末に起動し、2024年第1四半期にFPIを行う予定である。この2期開放ラベル多センター研究はREC-4881の安全性、耐性、PK、PDと初歩的な抗腫瘍活性を評価することを目的とし、経口投与(PO)の初期投与量(PO)は12 mgであり、毎日1回(QD)であり、局部末期或いは転移性切除できない癌患者に応用するAXIN 1あるいは…装甲運搬車突然変異です。参加者は試験に参加する資格があるため、少なくとも1つの以前の治療経路で進展しなければならない
この研究には、2つの部分-AXIN 1キューとAPCキュー、および2つの部分が含まれる。第1部では、各支店は最大20名の参加者を1:1の割合で登録する。第2部では,1腕あたり最大20名の患者を募集することができる。最初の6人の累積参加者が第1の部分に登録されると、登録は一時的に一時停止され、安全審査委員会は、研究薬の4週間前の完了状況を検討するために安全性評価を行うであろう。この研究では,ベイズ設計に従い,上位10名の参加者が実験の各グループに入った後に無効な解析を行う.研究薬物の使用期間は最長2年に達する。疾患状況は24週前に8週間ごとに評価され,治療中止または治療中止まで12週ごとに評価される。この研究の主要な終点は安全性、耐性と客観反応率(OOR)によって測定した初歩的な抗腫瘍活性である。私たちは2025年上半期に安全性と初歩的な治療効果データを共有する予定だ
図50である.REC−4881の第2段階研究案AXIN1あるいは…装甲運搬車変異した癌です慢性閉塞性肺疾患患者におけるREC-4881の有効性、安全性および薬物動態を評価する2期開放ラベル多センター臨床研究AXIN1あるいは…装甲運搬車変異した癌です入選基準は,(1)切除できない,局所末期または転移性癌,(2)55歳,(3)確定診断であるAXIN1あるいは…装甲運搬車NGS ( 組織または血液 ) による変異; ( 4 ) 初回投与後 2 ヶ月以内に MEK 阻害剤治療なし; ( 5 ) 1 以上の既行治療; および ( 6 ) ECOG PS 0 — 1 。主要エンドポイントは、安全性、忍容性、および客観奏効率によって測定される予備的抗腫瘍活性である。
競争相手
現在、 3 つの臨床開発プログラムが実施されています。 AXIN 1あるいは…装甲運搬車変異した癌です
•FogPharma 製の TCF 遮断 β— カテニン阻害剤である FOG—001 は、 Wnt 活性化変異を有する局所進行または転移性固形腫瘍患者を対象とした第 1 相試験で検討されています。 AXIN 1あるいは…装甲運搬車.
•Iterion Therapeutics 社の TBL 1 阻害剤であるペナビビントは、いずれかの変異を有する進行性肝細胞がん患者におけるペンブロリズマブとの併用で第 1 相試験中です。 CTNNB1あるいは…AXIN1 です。
•Leap Therapeutics 社の抗 DKK 1 モノクローナル抗体である DKN—01 は、 Wnt 活性化変異を有する進行または再発子宮内膜がん患者におけるペンブロリズマブとの併用第 2 相試験で検討されています。 AXIN 1あるいは…APCです。
クロストリジウム感染症のREC−3964−2期
REC−3964は経口生物利用型小分子薬物阻害剤であるクロストリジウム·クロストリジウムグルコシルトランスフェラーゼ。この分子は疾病の再発を予防する潜在力があり、そしてハイリスク患者の二次予防治療に応用できるクロストリジウム·クロストリジウム感染は抗生物質による下痢の主要な原因であり、発病率と死亡率の主要な原因でもある。健康ボランティアに対する第1段階の研究は2023年第3四半期に完成し、REC-3964耐性が良好であり、深刻な不良事件(SAE)の報告がないことを証明した。私たちは2024年に第2段階研究を開始する予定だ
病気の概要
クロストリジウムは誘導性下痢は抗生物質による下痢の主な原因であり,結腸内正常細菌叢の破壊によるものである。この細菌が分泌する毒素A或いはTcdAとB或いはTcdBはかなりの発病率を招き、深刻な下痢、大腸炎、毒性巨大結腸、敗血症、入院時間の延長、甚だしきに至っては死亡する可能性がある。米国では毎年730,000人を超える患者が確定診断され,EU 5カ国では毎年5人の患者が確定診断されている。標準看護治療を受けた患者のうち,疾患再発の割合は20%−30%であった。標準的な看護には抗生物質治療が含まれており、これは腸内細菌叢をさらに損害し、再発を招く可能性がある。
洞察再帰的オペレーティングシステム
REC-3964は新しい化学物質であり、私たちの強力な方法によって同定され、表現型グループ学を用いて鉛接触による病理変化に関連する上皮細胞の細胞および構造変化を同定するクロストリジウム·クロストリジウム毒素です。再帰OS駆動構造-活性-関係(SAR)により,以下の原因による構造欠陥を修復する構造系列を認識するクロストリジウム·クロストリジウム毒素の影響。REC−3964は選択的拮抗作用を有するベンゾジアゼジオン構造系から同定されたクロストリジウム·クロストリジウム毒素は我々のプラットフォーム上でナノモル効力の影響を有し、ヒト内皮細胞において用量依存性細胞がシミュレーションされた健康状態に回復する
図51である.REC-3964人の上皮細胞表現型を救うクロストリジウム·クロストリジウム毒素です。REC−3964はHUVEC細胞において濃度反応を示す救出作用を示すと同定されたクロストリジウム·クロストリジウムRecursionの表現型グループ学プラットフォーム上の毒素B。
臨床前
Rec-3964は、電気細胞-基質インピーダンス感知(ECIS)を含む直交機能分析において検証され、毒素を介したバリア破壊を遮断する上で濃度依存的活性を示す
標的に基づく実証試験では,REC−3964が毒素の固有グルコース転移酵素(IC 50=4.7−9 nM)を選択的に抑制することが示唆され,毒素誘導を抑制する宿主細胞におけるRho−GTP酵素のグリコシル化が最も可能な作用パターンであることが示唆された。REC-3964は無視可能な非標的活性を有し、宿主に対するグルコーストランスフェラーゼではなく、経口投与後に良好な腸管および血漿曝露レベルを産生し、変異がなかった。さらに1つは体内にあるハムスターモデルクロストリジウム·クロストリジウムREC-3964治療は、フェノキシマブおよび賦形剤対照群と比較して、動物の生存時間を有意に延長した。
図52に示す。REC-3964ブロッククロストリジウム·クロストリジウム毒素Bを介した内皮バリア破壊HUVECを10 ng/mLTcdBと共同培養した後、ECISは内皮細胞の内皮貫通抵抗を定量的に測定したクロストリジウム·クロストリジウムREC−3964が存在する場合。バリア抵抗は正規化スケールで示し,0%はRES 3964なしでの抵抗,100%は毒素Bに曝露されていない健康単層の抵抗を示し,データは平均値±走査電子顕微鏡,N 3独立実験を示した。
図53に示す。 クロストリジウム·クロストリジウムREC−3964で感染を治療したモデルハムスターは,薬物で治療した動物よりも生存時間が長かった。Rec-3964は、賦形剤群およびバンコマイシン群(50 mg/kg、qd)と共に胃に投与され、1日2回、連続5 dであった。未処理およびバンコマイシン処理動物N=5、賦形剤およびREC−3964処理動物N=10
図54に示す。REC−3964は毒素固有のUDP−グルコーストランスフェラーゼを選択的に抑制する。(A)自動触媒イベント放出クロストリジウム·クロストリジウム毒素のグルコーストランスフェラーゼドメインは感染細胞に入り,RhoファミリーGTP酵素を不活性状態にロックする。Rho GTP酵素の不活化は細胞骨格動力学を変化させ、細胞アポトーシスを誘導し、バリア機能を損害し、それによって推進するクロストリジウム·クロストリジウム感染します。(B)REC-3964は、宿主タンパク質に影響を与えることなく、毒素固有のグルコシルトランスフェラーゼの触媒活性を結合し、遮断する。19
図55である。ヒト疾患関連CDIハムスターモデルにおいて、REC-3964はベロキシマブ治療標準の生存時間を有意に延長したRec-3964は200 mg/kgの用量で胃に投与し、毎日2回、連続7 d、賦形剤とバンコマイシン50 mg/kg、qdを同時に投与した。ベロキシマブは接種2日前に10 mg/kgで1日2回投与したクロストリジウム·クロストリジウム(株630)。N=ハムスター1群当たり10匹。0日目から7日目まで臨床観察を行い、生存動物は14日目までモニタリングした。治療終了時、REC-3964はベロキシマブと比較して生存確率に有意差が認められた(P
19アワード、MMら。(2014)。クロストリジウム毒力因子:嫌気性芽胞形成病原体に対する洞察腸内微生物です5(5), 579-593.
臨床.臨床
プラセボと比較して経口投与量が増加した場合のREC−3964の安全性、耐性、およびPKを評価するために、第1段階の健康ボランティア研究を行った。計90名の健康被験者がこの研究に参加し、その中の48名の被験者は単回漸増用量(SAD)研究に参加し、42名の被験者は複数回の漸増用量(MAD)研究に参加した。SAD研究は1組の健康な老年被験者(年齢>65歳)を含む。REC-3964単回治療は安全かつ耐性が良好であり、単剤用量は1200 mg(SAD)を超えず、多用量(MAD)は900 mg以下である
SAD研究で最もよく報告されているREC−3964を有するTEAEは接触皮膚炎(4名,11.1%)である。すべてのTEAEは軽微であり,REC−3964に関与していると考えられる唯一のTEAEは単一の疲労TEAEであった。中止を招く重篤な有害事象(SAE),死亡あるいはTEAEは発生しなかった。MAD研究において,REC−3964で最もよく見られるTEAEは疲労と頭痛(各6名,17.6%)であった。いずれのTEAEも重症度は軽度であった。REC−3964治療を受けた被験者のうち,11.8%(n=4)の患者は,腹部膨満感(3例)と腹部膨満感(1例)を含む治療に関与していると考えられた。プラセボ治療を受けた被験者のうち,25%(n=2)の被験者の腹部膨満感も研究薬に関与していると考えられた。中止を招く重篤な有害事象(SAE),死亡あるいはTEAEは発生しなかった
PK分析では,試験された用量範囲で曝露(AUC)はほぼ用量割合で増加し,半減期は約7~10時間であった。健康な高齢者被験者および65歳の被験者のピークは、REF 3964と全身接触した場合と同様であった。したがって,BID用量は目標谷底濃度に達することが期待される。
単量或いは多用量でREC-3964を応用した後、患者の血液学と生化学指標は臨床意義の変化傾向或いは臨床顕著な異常がなく、心電図パラメータ(QTcFを含む)或いはバイタルサインにも臨床関連影響がなかった。
著者らは2024年に第2段階開放ラベルマルチセンター研究を開始し、REC-3964の安全性、耐性、有効性とPKを評価し、投与量は250 mgまたは500 mgであり、1日2回経口(PO)し、28日間持続し、バンコマイシン初期治癒後の観察列と比較する予定である。この研究の主要な終点は安全性、耐性と再発率評価による初歩的な治療効果であるクロストリジウム·クロストリジウム感染(RCDI)。
表2.第1段階多用量漸増研究の有害事象の概要。AE=有害事象;MAD=複数回の増量投与量;SAE=深刻な不良事件;TEAE=治療-緊急不良事件。
図56である。REC−3964 RCDI予防計画第2段階研究プログラムそれは.2期開放ラベルマルチセンター臨床研究では、2つの用量レベルにおけるREC-3964の安全性、耐性、PK、および有効性を評価した。学生募集基準には,(1)RCDIの高リスク,(2)クロストリジウム·クロストリジウム関連下痢と毒素陽性確認(3)爆発性CDIがない;(4)他の原因の慢性下痢の病歴がない。主な終点は安全性、耐性と有効性であり、バンコマイシン臨床初歩的治癒後のRCDIの減少率によって決定される。
競争相手
治療や予防に使用できる多くの承認された薬がありますクロストリジウム·クロストリジウム感染します。
•抗生物質はこの病気を治療する主要な方法であるクロストリジウム·クロストリジウム最もよく処方される2つの薬剤はバンコマイシンと非ダクソミシンである。深刻な場合はメトロニダゾールを処方することも可能である。しかし,抗生物質治療の効果は再発ごとに低下した
•ベロキシマブはヒト由来抗腫瘍モノクロナル抗体であるクロストリジウム·クロストリジウムCDI の再発リスクが高い抗生物質を投与中の患者における CDI の再発を減らすために承認された毒素 B 。
•糞便由来マイクロバイオーム製品は再発を防ぐために使用される クロストリジウム·クロストリジウムRBX 2660 および SER—109 による感染は、再発 CDI に対する抗生物質治療の後、この適応症で承認されました。
現在、再発予防のための臨床開発中の 2 つのプログラムがあります。 クロストリジウム·クロストリジウム感染します。
•Vedanta Biosciences の経口微生物叢治療薬である VE 303 は、再発集団の高リスクを含む CDI の既往発 1 回以上を有する患者を対象とした第 3 相試験で試験中です。
•LMN—201 は、 Lumen Bioscience の経口生物学的薬であり、抗生物質治療を予定している CDI の新規診断患者を対象とした第 2 相試験で研究されています。
私たちの知る限り、 REC—3964 は最初の経口生体利用可能な非抗生物質です。 クロストリジウム·クロストリジウム細菌毒素を標的としながら宿主を守る毒素阻害剤です
選択した前臨床プログラム
•HR 効率の高い卵巣がんおよびその他の固形腫瘍の治療の可能性のための新規 CDK 12 隣接標的である RBM 39 ( 以前はターゲットガンマとして同定 ) 。
•線維症の未開示の適応症の治療のための潜在的第一級新規化学実体 ( ターゲット Epsilon )
HR 優良性卵巣がんおよびその他の固形腫瘍 ( 以前に標的ガンマとして同定 )
推論探索を用いて、 RBM 39 を阻害し、フェノコピーの喪失を阻害する化合物を同定した。 CDK 12でもそうじゃないCDK 13それは.著者らは更にこれらの分子を最適化し、経口バイオアベイラビリティが相同組換え熟練(HR熟練)卵巣癌と他の固形腫瘍において単一の薬物活性を有する候補先導薬物を産生する。アメリカとヨーロッパでは、毎年約20万人の薬物治療可能な患者の腫瘍は相同組換え修復(HRR)経路に突然変異が不足し、しかも第一線の治療方面で進展を得た。PARP阻害剤はHR欠乏癌患者の予後を著しく改善したが、HR熟練した腫瘍患者の予後は比較的に悪く、予後は不良であった。私たちは2024年下半期にこの計画のINDを提出する予定だ。
病気の概要
DNA修復経路の突然変異とゲノムの不安定は癌の基本的な特徴である。大規模なゲノムデータベースは卵巣癌、乳癌、前立腺癌、膵臓癌、非小細胞肺癌と小細胞肺癌など、DDR修復ネットワークに分子変化が存在する癌を強調している。DDR経路中に遺伝子改変癌、例えば相同組換え(HR)があり、通常DDR阻害剤、例えばPARP阻害剤で治療することができる。しかし、HR熟練した腫瘍患者はPARP阻害剤から顕著な臨床利益を得ることができない。そのため、卵巣癌を含むHR熟練した癌を治療するためにDNA修復機序を調節できる治療法を開発することは、高度に満足されていない需要である
再帰的オペレーティングシステムからの洞察
研究により、CDK 12の遺伝子欠損或いは薬物欠損は同源組換え修復経路中のBRCA 1とBRCA 2などの遺伝子の発現を低下させ、それによってBRCA様表現型とDDR反応を招くことができる。したがって,CDK 12はHRの熟練した癌の治療標的や腫瘍バイオマーカーとしてかなり注目されている。機能的冗長性の報告にもかかわらず,CDK 12のノックアウトはCDK 13の表現型と有意に区別できることが観察された。MAPに基づく推論を使用して細胞表現型を表現および関連させ、RBM 39はCDK 13の代替標的ではなくCDK 12損失を選択的にシミュレートする代替標的であることを決定し、CDK 13が産生する可能性のある任意の毒性を回避しながら、CDK 12生物学を標的とする新しい方法を提供した。その後、REC-1170204はCDK 12およびRBM 39の表現型損失と非常に類似しているが、CDK 13の表現型損失ではないRBM 39分子ゲル降下剤であることを発見した。機能的には,REC−1170204治療は全世界的に多くのDDR遺伝子の発現に影響するが,CDK 12独立した方法でこれを行う。
図57:推定された写像関係CDK 12、CDK 13、RBM 39REC-1170204です高度な表現型の類似性を示す地図表示CDK 12, RBM 39複数の濃度のrEC−1170204CDK 13機能的にはほとんど似ていないCDK 12, RBM 39REC-170204のいずれかの濃度でもよい。
製品概念
我々の目標は、HRの熟練した腫瘍の最初から感受性を駆動するために、新しい経口生物使用可能な小分子を発見し、開発することである。CDK 12を治療標的とする生物学と臨床証拠を支持することは有望であるが、CDKsの高度な相同性は単一ホモログを標的化することを困難にし、標的外毒性を産生しやすい。代替の新しい標的によるCDK 12抑制の効果をシミュレーションすることはHRの熟練した腫瘍を治療する1つの経路であるかもしれない。我々の主要候補をHRに精通した卵巣癌やHRに精通した他の固形腫瘍を治療する可能性のある単一薬剤として位置づける予定である
臨床前
体内治療効果の研究は単一薬物としてREC-1170204及びニトロプリルと連合してOV 0273 OV 0273に応用した治療効果を評価し、OV 0273は卵巣BRCA熟練患者由来の異種移植モデルである。単剤REC−1170204と併用では,ニトロプリブや車両投与と比較して統計学的に有意な反応が観察された。REC−1170204は単一療法として,あるいは最後の服薬後30日以上にニトロプリルと併用しても有意な生存益を示した。Tempusと戦略的に連携した結果,すべての腫瘍タイプのゲノムデータを用いて患者規模を拡大した臨床バイオマーカーを決定している。我々はINDを有効にする研究で主要候補を進めており,2024年下半期にINDを提出する予定である
図58である。REC−1170204±niraparib OV 0273 PDXマウスモデル腫瘍成長抑制OV 0273 PDXモデルでは,代表的な鉛分子REC−1170204(100 mg/kg,Bid,PO)±niraparib(40 mg/kg,qd,PO)を28 d治療した。REC-1170204単独またはニトロプリブとの併用は、統計学的に有意な反応を生じることができる
Niraparibまたは車両アームであって、腫瘍体積の減少が対数スケール(y軸)を使用してプロットされる、車両アーム。また,最終服薬後30日以上の生存率は統計学的に有意に改善した。*第
肝線維化の不開示適応−標的Epsilon−
ヒト末梢血単球の表現型スクリーニングは、疾患状態の線維細胞の表現型特徴を健康状態の細胞の表現型特徴に逆転させる新たかつ構造多様な小分子を同定するために使用される。再帰的オペレーティングシステムの強力な機能は、小分子衝突と繊維化疾患に影響を与える可能性のある新しい標的との関係を明らかにした。実証実験では,最も有望なヒット化合物がこの新しい標的(Target Epsilon)の有効な阻害剤として確認された。最適化されたHit化合物は体内にあるマウス肝線維化モデル。この計画は現在INDを支援する研究段階に入っている
病気の概要
線維性疾患は高い臨床需要を有し,満足が得られないことが多く,すべての主要臓器に影響を与える。繊維化疾病の適応症を越えた患者は繊維化の発病機序を推進する共通経路と細胞の調節に参与することから利益を得る可能性がある。免疫細胞,特に単球由来細胞群は,コラーゲン産生筋線維芽細胞と密接に関連する線維細胞を含み,損傷修復に必要な線維化反応を駆動することができる。単球由来の細胞は増殖因子を産生し,間葉系細胞群の持続活性化を促進する。このような免疫-間葉系界面を調節する分子は分解と組織修復に有利な反応に変化させる可能性がある。これらの細胞タイプは繊維化過程において重要な役割を果たしているが、現在、これらの病原性細胞群の凝集と分化を有効に標的とする有効な治療方法はない。治療選択が限られているため、2種類の承認された抗繊維化薬物は、患者はこの負担に対応するためにもっと大きな治療効果が必要である。
再帰的オペレーティングシステムからの洞察
単球由来の免疫細胞が繊維化疾患において発揮する重要な作用を考慮して、著者らはhPBMC由来の繊維細胞から表現型スクリーニングを行う方法を開発し、この重要な細胞タイプの疾病の重要な特徴を捕捉することができる。ヒト組換えペンタペプチド−2(PTX−2)1種の構造、抗炎症、先天性免疫の血漿蛋白であり、その循環レベルは慢性ヒト繊維化疾患において低下する。PTX-2単球の線維細胞やマクロファージへの分化に関与し,組織修復を誘導し,線維化を減少させる。Recursionの表現型スクリーニングプラットフォームを利用して、著者らは多種の構造多様化と斬新な小分子を同定し、それらは表現型でhPBMC由来の繊維細胞とマクロファージに対するPTX-2の形態影響をシミュレーションすることができる。HPBMC−線維細胞逆試験は、同定された化合物を最適化するためにも使用される。RecursionのHUVEC表現図を用いた推定探索は,可能な小分子結合標的(Epsilon)を決定し,その後,分離蛋白との生化学結合解析により明らかになった。確定した標的は繊維化中の免疫間葉系細胞群を調節する新しい方法を代表する
図59:表現型スクリーニング試験。ヒトPBMCの繊維細胞への分化は1種の組織修復蛋白-2によって逆転され、健康状態をシミュレーションすることができる。小分子が認識され,疾患状態を健康状態に戻す。
図60:Target Epsilonに関連するターゲットおよび化合物識別および検証(2)EBウイルスノックアウトとREC-1169575遺伝子との間のコサイン類似度は、高次元空間における2つのベクターのなす角の余弦である。1.0に近い値は、摂動間の角度が0°に近いことを示し、方向の見かけの類似と解釈され、(3)標的Epsilon NanoBRET分析。
製品概念
我々の目標は,経口生物用免疫間葉系調節剤を発見·開発し,線維炎症性疾患の治療に新たな作用機序を提供することである。線維芽細胞,線維化マクロファージ,適応免疫細胞を調節することで線維化を逆転させる単一の薬効を有する小分子を目標としている。Recursionの見かけのグループ学的プラットフォームを用いて,我々のリーダー分子は両方の点で希望を示していることが分かった体外培養そして 体内にある繊維化モデルは、それは標的免疫と間葉系細胞群を通じて免疫間葉系動態バランスと組織完全性を回復する可能性があることを表明した。それは独特な輪郭を示し、多種の細胞タイプに対して免疫調節作用があり、そして抗繊維化作用を示し、現在の治療方案と区別する可能性がある。
臨床前
著者らは複数の構造の異なる小分子を同定し、それらは必要な繊維細胞疾患モデルの表現型救命を提供することができる。REC-1169575は代表的な鉛分子であり、ECを含む強力な化合物である50繊維細胞反転実験における0.40ミクロンとIC50目標Epsilonの12 nmに位置する。デジタル耐性では,REC−1169575は全用量(30,200および300 mg/kg/d,PO×6日)のC 57 BL/6マウスで良好であった。REC-1169575はマウスの体重、呼吸数、運動または体温に有意な影響を与えなかった。げっ歯動物体内で有効な線維化モデルでは,REC−1169575はコラーゲンを有意に減少させ,線維化の重要な組織学的マーカーである
図61:REC-1169575は、線維化マウスモデルにおけるコラーゲンを減少させる。我々の代表的な先導分子REC−1169575(50 mg/kg,BID,PO)と線維化を阻害することが知られている対照分子SB 525334では,線維化誘導賦形剤治療マウスと比較してコラーゲン比率(線維化マーカー)コラーゲン比率が統計的に有意に低下した。*第
治療協力パートナーシップ
我々はすでに未来に第三者と協力して、異なる疾患領域(例えば繊維化、神経科学、腫瘍学、免疫学と炎症)を広く探索して、新しい標的見解と潜在的な治療方法を決定する可能性があり、その中に小分子、巨大分子、遺伝子治療と細胞治療を含む可能性がある。我々はまた,我々の事象図の検索結果をパートナーに付与する公共資産タイプ戦略を探索することができる
それぞれのパートナーシップの目標は治療法を作ることであるが、方法には様々な形態があるかもしれない
•新しい治療法それは.何の仮定もない標的仮説の場合,我々のヒト細胞生物学的地図における大型化合物ライブラリを迅速に評価することで差別化療法を識別することができる。
•新しい標的それは.私たちのプラットフォーム上で様々な生物学的摂動(例えば遺伝的要因)を分析することによって、新しい薬物標的を識別することができるかもしれません。そして、パートナーと一緒にこれらの標的を利用して治療候補薬を産生することができるかもしれません。
羅氏社と遺伝子技術会社との協力と許可協定
2021年12月5日、著者らはGenentech、Inc.とF.Hoffmann-La Roche Ltdと協力と許可協定を締結し、協定に基づいて、著者らのイメージング技術と独自の機械学習アルゴリズムを用いて、特定の細胞環境中の摂動表現型間の関係を推定する独特な地図を構築し、羅氏と遺伝子テークと共にマルチモードモデルと地図を作成し、この推定関係をさらに拡張と詳細化し、両方の場合、いずれの場合も消化管癌適応と神経科学の重要な領域で治療性小分子プログラムの発見と開発を目指している
前金で払います2022年1月、羅氏は私たちに1.5億ドルの前払い現金を支払った。
事象図の作成、受け入れ、アクセス。協力プロトコルによると、私たちは各独占分野で一定数の事象図を作成する責任があります。私たちはまた羅氏に私たちの以前に存在したヒト臍帯静脈内皮細胞(HUVEC)表現型マッピングにアクセスする機会を提供する。羅氏は、発見または治療製品の開発をもたらす可能性のある新しい推定を生成するために、事象マップに照会またはアクセスする特定の権利を有するであろう。
事象図に関する選択肢羅氏が要求し、Recursionによって作成された各事象図は、起動料、受信料、または両方を支払う必要がある可能性がある。16(16)個の受け入れられた事象図の場合、そのような費用は2.5億ドルを超える可能性がある。また、ロー氏が何らかの事象マップを受信してからしばらくの間、ロー氏は、これらの事象図の作成中に生成された元の画像を協調以外に使用する権利を得る権利があるであろう。羅氏がすべての12(12)個の条件を満たす事象図に対して外部使用選択権を行使すれば,羅氏がRecursionに支払う関連行費は2.5億ドルを超える可能性がある.
協力計画と羅氏オプション。羅氏社と再帰会社は協力して事象図によって生成された小分子や標的に関するいくつかの新しい推論を選択し、協力計画としてさらなる検証と最適化を行う。ロ氏と再帰帰還は,ロ氏の配列決定データセットと再帰的事象図を結合し,新たなアルゴリズムを連携して生成し,マルチモーダル図を生成し,その中からより多くの連携計画を起動することができる.潜在的治療用小分子または確認標的を成功的に識別する各協力計画について、羅氏は、このような潜在的治療用小分子を開発および商業化するために、または適用可能な排他的領域でこのような標的を開発および商業化するために、独占的許可証を得る権利があるであろう。2023年10月、羅氏はその小分子検証HITオプションを行使し、消化管腫瘍学における著者らの初の協力計画をさらに推進した
ロ氏が協力計画の選択権を行使すれば、支払う。この協力により、羅氏は40(40)もの小分子協力計画を開始するかもしれない。各小分子協力プロジェクトは,羅氏が開発と商業化を選択し成功すれば,Recursionの研究,開発,商業化,純販売マイルストーンに3.00億ドルを超える収入と,純売上高の中上位桁分級印税をもたらす。再帰的には羅氏が選択した目標協力計画の研究、開発、商業化、純販売マイルストーンを獲得する資格もある。
再帰的手順それは.ロ氏が何らかの協力プロジェクトについて“協力協定”の選択権を行使していなければ、羅氏が事前に同意した場合、限られた数のこのようなプロジェクトの中で独立して製品を検証、開発、商業化することができるが、合意されたマイルストーンと羅氏に支払う特許権使用料を遵守することができる。羅氏は通知を出して羅氏がこのような計画選択権を行使する際に適用される選択費と経済性を超えた費用を支払うことで、このような製品の開発の独占的な許可を得る権利がある。
排他的である。協力協定の発効日以降の合意期間内に,我々は排他的領域内で化合物や目標について何らかの研究や開発活動を行う能力を制限している排他的条項の制限を受けているが,ロ氏との協力は除外されている.しかし,協力協定が発効した日から,専属分野で製品の研究·開発を継続する可能性がある。
終了します。協力協定には、重大な違約または破産に対する条項と、羅氏の便宜のための標準的な終了条項が含まれる。いくつかの終了権利は、特定の排他的領域または排他的許可および協調プロトコル全体に対して行使することができる。
図62に示す。私たちは羅氏遺伝子技術会社との協力の下で、新たな目標と起点を解明するために、細胞生物学のマルチモード地図を作成している。
バイエル株式会社は研究協力とオプション協定を改訂と再署名しました
2020年8月28日,Recursionとバイエルは研究協力とオプション協定を締結し,その後2021年12月1日に拡大し,一定数の線維化に関するプロジェクトについて研究と協力を行った。2023年11月8日、双方は最初のバイエル協定を修正し、再確認し、協力を再調整し、バイエルが腫瘍学に重点を置く戦略転移と一致させた。その結果,各当事者は線維化における共同作業を終了し,線維化領域に関する排他性も終了した。
再署名されたプロトコルによると、Recursionは元のプロトコル(いくつかの研究活動を達成するために最大2年延長可能)の残りの5年間にバイエルと協力し、最大7つの腫瘍学プロジェクトを開始する。Recursionは、協力期間内のいくつかの合意期間内に、単独または第三者と共に協力以外に、いくつかの決定された腫瘍学関連遺伝子についていくつかの研究および開発活動を行うことを禁止される。しかし、Recursionは、その遺伝子を同定する前に起動された任意のこのような同定遺伝子の研究および開発活動を継続することができる。
各腫瘍学プロジェクトの下で、Recursionはベイヤと協力し、潜在的なリード開発候補を決定する。再署名された合意によれば、バイエルは、許可潜在候補の第1の選択権を有し、各許可は、オプション使用料および開発および商業マイルストーンのRecursionへの支払いをもたらす可能性があり、許可の総価値は約2.1億ドルに達し、各プログラムが許可された場合、約15億ドルに達し、そのような各許可の階層的特許権使用料は、ビジネスの成功に依存して、下位から中央値までの範囲の売上百分率をもたらす。各ライセンスの使用料期間は、国/地域に基づいており、各ライセンスの継続期間は、各国/地域の特許または規制排他的期限にリンクされている(各国/地域の最短期間は10年である)。
ベイヤが指定された期間内に主要候補についてその選択権を行使しない場合、または他の方法でプロジェクトを終了する場合、Recursionは、バイエルがプロジェクトに関連する任意のリード系列およびその関連予備化合物の権益に基づいて独占的に許可され、バイエル背景下でこれらの化合物に関連するプロジェクト結果を使用するために必要な非独占的許可を得るために、バイエルと誠実に交渉することができる。
バイエルはいつでも理由なく協力を終わらせるかもしれない。どちらも相手の実質的な違約によって合意を終了することができる。各ライセンス契約の期限は、(A)当該製品をカバーするライセンス特許が当該国/地域における有効な権利要件の最後の満了時まで、(B)当該製品が当該国/地域の任意の適用される規制の排出期間が満了するまで、及び(C)当該製品が当該国/地域で初めて商業販売された後10年まで、個々の製品及び国/地域に基づいて継続される。バイエルはいつでもこのようなすべての許可協定を理由なく終わらせることができる。いずれも他方が治癒していない実質的な違約により,このような許可協定を終了することができる。
技術的パートナーシップ
私たちはRecursionデータ宇宙の生成と利用に焦点を当てて、私たちのパイプラインとパートナー価値駆動要素を最大化すると同時に、私たちのプラットフォームの技術とデータ協力を強化するために、小型、精選されたデータ層と基礎モデルを外部で利用できるようにする方法を模索しています。人工知能モデルを訓練するために生成された大きなデータセットはまれであり,価値もあり,特に生物や化学では,生物や化学の分野では生成されたデータの多くが孤立しているため,実験環境では関連できない.再帰的オペレーティングシステムは、基礎モデルを訓練するための高い相関および信頼性の高いデータセットを生成し、生成し続けるであろう。NVIDIA,Tempus,Enamineとの連携は,データ,基礎モデル,計算がTechBio空間や再帰領域に不可欠な価値駆動要因であることを明らかにした
インヴィディア
2023年7月、我々はNVIDIAと戦略的協力を達成し、我々のスーパーコンピュータBIOHIVE-1とNVIDIA DGXクラウド優先アクセスを用いて、私たちの先駆的な生物と化学人工知能基盤モデルの開発を加速した。可能な商業許可やBioNeMoへの配布に加えて,これらのモデルを内部で最適化して配布する予定であり,BioNeMoはNVIDIAのクラウドサービスであり,薬物発見における生成的人工知能に用いられている。モルガン·チェースでは
2024年ヘルスケア大会でNVIDIA,Phenom-BetaとBioNeMoプラットフォームで発表しましたPhenom-Betaは上で議論したPhenom-1モデルのより小さいがまだ強力なバージョンだ。2023年11月には,NVIDIAと協力してBioHave-1を拡張し,計算能力を4倍以上向上させることを約束した.BioHave-1は、完成とベンチマークテスト後、世界のどの業界でも最も強力な50台のスーパーコンピュータ(TOP 500ランキングによる)にランクインし、任意のバイオ製薬会社が所有·運営する最も強力なスーパーコンピュータになると予想される
タンプス
2023 年 11 月、私たちは Tempus とコラボレーションを行い、 DNA 、 RNA 、健康記録などにまたがる、世界最大の専有、非特定、患者中心の腫瘍学データセットへの優先アクセスを獲得し、因果 AI モデルのトレーニングを通じて、大規模な潜在的なバイオマーカー強化治療薬の発見を支援しました。Tempus のフォワードジェネティクスアプローチと Recursion のリバースジェネティクスアプローチを組み合わせることによって、腫瘍学における治療開発のスピード、精度、スケールアップの機会があると考えています。
エナミン
2023 年 12 月には、世界の創薬業界向けにリッチ化合物ライブラリを作成 · 設計するために、 Enamine とのコラボレーションを締結しました。Recursion の AI モデルである MatchMaker を活用して、高価値の標的と結合すると予測される Enamine REAL Space の化合物を同定することで、創薬目的でより強力な化合物ライブラリを生成できると考えています。Enamine は、結果として得られるライブラリをお客様に購入できるように提供し、 Enamine と Recursion の MatchMaker の商標の両方でライブラリを共同ブランドします。このコラボレーションは、選択したデータレイヤーが新しい方法で価値を駆動する方法の一例です。
人と文化
TechBioをリーダーと定義する鍵は,化学者や生物学者などの生命科学者(約35%の従業員)やデータ科学者やソフトウェアエンジニア(約40%の従業員)などの計算や技術専門家からなる500人以上のRecursionautsからなるチームである。この機能バランスは意図的に伝統的なバイオテクノロジー会社とは対照的だ。私たちのグループは共同で環境を作りましたこのような環境では、私たちが解決した問題は、経験データ、統計的厳密性、創造的思考を利用することができます。私たちが共通の使命に団結すると解読生物学は根本的に生活を改善します私たちの利点は私たちの違いにある:専門知識、性別、人種、規律、経験、視点。このような文化を意図的に建設して育成することは私たちの大胆な目標を達成するために必須的だ
図63に示す。Recursionの500人以上の従業員の生命科学、技術、戦略運営の細分化
RecursionのTechBioのリードを支持する最も重要な要素の一つは、私たちが呼ぶ再帰的な心理状態である--自動化、システム思考、アルゴリズムとデータを通じて私たちの使命を実現し、工業化に対する確固たる信念と約束である。全体的に、会社では、このような心理状態を使って煩雑さと非効率を解消し、私たちの創造力のために空間を作り、再帰的に最も解決しにくい問題にエネルギーを向けましょう。再帰的な心理状態は私たちの基本原則によって表現され、私たちの文化と価値観の支持を得る。私たちの基本原則は私たちが技術と科学的な意思決定を行う道しるべだ。私たちの価値観は私たちの文化の核心的な行動を定義することであり、私たちがどのように使命を達成するかの最も簡単な定義でもある。それらは結合して私たちの文化を形作り、私たちの使命を実現する道で薬を作る方法を改めて想像するように導いてくれます
。再帰の基本原理ですこの6つの創設原則は私たちの方法をほとんどの他の生物製薬会社と区別させ、私たちがTechBioを指導し、Recursion教授と豊富な心理状態に基礎を築くことができるようにした。
図65である.再帰的な値。この5つの価値観は私たちの創設原則を支持し、再帰的に私たちの文化を指導する。
多様性公平性包括性帰属感
Recursionで、私たちは多様な道徳と商業的理由を信じている。研究に基づく証拠は曖昧ではなく、異なる視点でより良い複雑な意思決定を支持し、より大きな革新を促進し、最終的により良い会社の業績と成功をもたらすことを表明した。求人漏斗の先端の多様性を最大限に増やすことで、採用過程全体の客観的な意思決定によって偏見を軽減し、最も優秀な人材を探すことができます。私たちは候補者たちと職員たちのために包容的な環境を作って、私たちの間の違いを釈放する。最後に,社会的不公正と不平等の広汎性を認識し,我々はすべての人の中で公平と公平を追求した結果であるプログラミングによる決定を行い,分析の支持を得た.
従業員の募集、発展、訓練
私たちは再帰的な従業員体験を構築するために設計思考の方法をとる。これは目標に適したシステムであり、トップレベルの人材を発見、育成、維持し、私たちの使命を実現することができる。私たちの人々は使命を志向し、謙虚で、明るく、寛大で、現状に建設的な不満を持っている。著者らは的確な方法を用いて、生物、化学、データ科学、機械学習、工学、ロボット、臨床開発などを含むハイテク科学学科の異なる従業員を確定、誘致と採用した。私たちは工業化に対する私たちの約束に適した人を探しています。これは私たちの再帰的思考によって定義されています。これは私たちの創設原則と価値観に現れています。
文化的に、私たちは絶えず学習と教育を行い、再帰のように早く成長することを追求する期待を注ぎ込んだ。最も注目すべきは、Decoding Recursionと呼ばれる年間全従業員に提供される2日間の体験である。これは上級指導者と密接に交流する機会であり、彼らは物語を通じて再帰的思考を伝授する。私たちの業績システムでは、学習の需要が強化され、これは私たちの学習、交付、他人への影響に対する責任が生じる。
人々がRecursionに残るのは世界に影響を与える機会があるからで、彼らが挑戦、支持、つながりを感じる場所で成長する。従業員体験全体の中で、私たちは雄心を刺激し、貢献と成長を奨励し、帰属感を育成する時、儀式、計画、空間を作った
従業員の健康と安全
私たちは職業健康と安全、安全訓練と負傷、疾病と事故報告を管理するための専門的な標準操作手順を持っている。すべての職員たちはこのような手続きと政策が遵守されることを確実にする責任がある。私たちは理解と遵守を保障するための幅広い訓練を提供する。職業安全と健康管理局の実験室危険化学品標準の要求に基づいて、すべての実験室従業員は守らなければならない。我々の共同創業者兼最高経営責任者は会社の公共安全部門の役員であり,組織内の化学衛生に最終的な責任がある。我々の化学衛生主任と実験室マネージャーは監督機構の化学衛生の日常管理を担当している。
Recursionの最新の環境、社会、ガバナンス報告書で、私たちが従業員にどのように投資し、私たちの使命を実現するかに関する情報をより多く知ることができ、この報告は当社のサイトで得ることができます。
施設
本部.本部
私たちのアメリカ本部はユタ州ソルトレイクシティの中心部にあります。そこで105,419平方フィートのオフィスと実験室空間を借りました。この空間の賃貸契約は2028年5月に満期になる。2022年11月、2032年5月に期限が切れる賃貸契約に基づき、本社の近くに103,634平方フィートのオフィスと実験室空間を拡大しました。私たちの現代化された本部は地元、国内、そして国際人材を誘致した。
図66である。私たちの本部はユタ州ソルトレイクシティ市の中心にあります私たちは生物ハチの巣の創設メンバーで、これはユタ州生命科学センターのブランド努力です。州や自治体と協力して、私たちの本社を中心とした市中心部の会社クラスターを中心に盛んな生命科学生態系を作るのを手伝っています。
衛星オフィスと施設
トロントとモントレーそれは.2023年6月、私たちは私たちの28,110平方フィートのトロント工場の開業を祝いました。ここはRecursion Canadaの本部です。この空間の賃貸契約は2032年11月に満期になる。新しいサイトはカナダでのRecursionの著しい成長と現地経済への持続的な投資を代表する。Cyclicaを買収した後、私たちはトロントに本部を置くチームを新しい本部に統合する。Recursionカナダ本部以外にもモントレーには半自動人工知能研究エンジンValence Labsがあります世界的に有名な人工知能と機械学習センターMilaにあります
図67に示す。再帰会社の衛星オフィスと施設です左図:ケベック人工知能研究所MILAは人工知能への大きな貢献により世界的に認められている.右の図:政府とバイオテクノロジー指導者は私たちのトロント事務所の開業を祝います。ここはRecursionカナダ本部の所在地であり、ユタ州ソルトレイクシティの世界本部以外の最大の場所でもあります。このサイトはMilaモントリオール事務所とともに、データ科学と機械学習にまたがる多学科センターとなっている
デジタル隔壁です。 私たちは齧歯動物の個室としての不動産を借りた。本レンタル契約は2028年5月に満期になります。この施設を用いて薬物発見を行い,薬物動態,薬効学,探索的安全性研究を可能にした。この施設は独自のデジタル化ケージ技術を備えている
企業社会的責任
私たちの使命を達成するためには私たちの目標の会社のように行動してこれは私たちが良い企業市民にならなければならないということを意味する。Recursionは,環境,社会,ガバナンス管理における我々の卓越した約束を表彰するために,2023年に機関株主サービス(ISS)によるESG表現の良質な評価を得た。ISS ESG会社の格付けは、会社の環境、社会、およびガバナンス活動の評価を提供する。良質な格付けは、ESGが特定の業界の敷居よりも高い性能を示す会社に付与され、ISSは“絶対同種最良”と定義される。また、Recursionは2024年1月現在、朝星持続可能な開発会社900社以上(約2%)で16位にランクインしている20それはある会社のESG表現を深く分析し、業界の同業者と比較した。この名前はRecursionを持続可能な開発会社の2024年に最も人気のあるESG会社のリストに登録した。
これまで、私たちは、(I)多様性、公平性、および技術およびバイオテクノロジー分野の包括性(例えば、Recursion財団が2020年に異なる医療起業家のために標高実験室を発売し、生命科学インキュベーターおよび加速器である)と、(Ii)私たちの現地生命科学と技術生態系の成長と持続可能性(例えば、Recursionはユタ州生命科学集団BioHaveの創設メンバーのうちの1つである)を含む、私たちの価値観と私たちの利点に一致する影響力のある分野にコミュニティを集中させてきた。(Iii)持続可能な環境実践の促進(例えば、Recursionの目標は、2030年までに私たちのすべての業務において温室効果ガスの純ゼロ排出を実現することである)。私たちは、このようなコミュニティ参加の原則を通じて、私たちが生活を根本的に改善する使命を私たちのコミュニティの人々に延長することができると信じている。
Recursionの環境、社会、そしてガバナンス報告書で私たちがどのようにこの信念を実現するかについてのより多くの情報を読む。
20著作権すべて2023朝星の持続可能な発展。すべての権利を留保する。本部分には,持続可能な開発会社(www.constainalytics.com)によって開発された情報が含まれている.このような情報およびデータは、参照のために、持続可能な開発会社および/またはその第三者プロバイダ(第三者データ)のすべてである。それらはいかなる製品或いはプロジェクトに対する認可を構成しないし、投資提案を構成することもなく、その完全、適時、正確或いは特定の目的に適することを保証しない。これらの使用は,以下のサイトで得られる条件に依存する:https://www.constainalytics.com/Legal-Discreates
商業化する
私たちは私たちのいくつかの候補薬に重要な開発と商業的権利を維持するかもしれない。市場の承認が得られれば、私たちは自分たちまたはパートナーとアメリカや他の地域で私たちの候補薬物を商業化することができるかもしれない。私たちは現在販売、マーケティング、または商業製品の流通能力を持っていない。このようなインフラと能力を確立する決定は、私たちの候補薬物がさらに進歩した後に行われ、競争優位性を持つ必要な能力とインフラの能力の評価に基づいている。臨床データ、アドレス指定可能な患者群の規模、商業インフラの規模、製造需要及びこの業界がどのように価値を蓄積する主要な傾向は著者らの商業化計画に影響或いは変更する可能性がある
製造業
我々は現在,我々のパイプライン内の資産を支援するために,契約開発と製造組織を利用して薬物物質や研究用薬物製品を生産している。これまで、私たちは第三者契約メーカーから私たちの候補薬物のために薬物物質と薬物製品を獲得しました。私たちは私たちの開発需要に基づいて、プロジェクトごとに私たちの各候補薬のために私たちのサプライチェーンを発展させています
戦略的合意
私たちの使命を実現するために、私たちは有力なバイオテクノロジー会社、製薬会社、学術研究機関と協力して、データセット、分子、または他の知的財産権を取得することができるかもしれません。
Tempusマスタープロトコル
2023年11月3日、Recursion PharmPharmticals,Inc.または当社は、Tempus Labs,Inc.またはTempusとマスタープロトコルまたはTempusプロトコルを締結し、このプロトコルによれば、Tempusは、当社にいくつかのサービスおよび配信コンテンツを提供することができ、および/または当社にいくつかのデータを許可することができる。“ダンプス協定”の期限は“ダンプス協定”が発効した日から5年。
Tempusプロトコルの条項によれば、会社は、製品開発目的のための会社機械学習/人工知能モデルの派生作品を開発、トレーニング、改善、修正、および作成することを含む、Tempusの独自データベースにアクセスすることができる限られた権利を付与される。当社は、いつでも最も多くの目的で認識された記録をダウンロードすることが許可されていますが、期間内にダウンロード可能な独自記録総数の上限に制限され、ダウンロード日から各ダウンロードされた記録を180日間保持することができます。180日の期限後、会社は、追加条項や追加料金を支払う場合には、その等のダウンロードされた記録をより長時間許可することを選択することができる。
これらの権利の交換として、当社はTempusに22,000,000ドル相当の初期許可料、または期限内の初期許可料と年間許可料を支払い、22,200,000,000ドルから42,000,000ドルの範囲で、初期許可料とともに全期間で合計160,000,000ドルに達するが、当社は早期終了(主契約発効日の3周年後にのみトリガ可能)、および当社は早期終了料を支払う必要がある(以下さらに議論する)。初期許可料および年間許可料は、会社が(X)現金、(Y)会社A類普通株または(Z)現金とA類普通株との組み合わせで支払うことを選択し、割合は会社が自ら決定しなければならない。ただし、(A)当社が本契約に基づいて支払うことができるすべての金について発行できるA類普通株式総数は、2023年11月2日またはダンプズ協定により発行されたいずれかのA類普通株の日付前日に発行されたA類普通株および当社B類普通株式総数の19.9%を超えてはならない(“株式上限”)。
初期許可料又は任意の年度許可料の全部又は任意の部分がA類普通株の形態で支払われる場合、会社は株式上限の場合、Tempusにいくつかを発行しなければならない
A類普通株は、(1)支払金額を(2)納付日まで(含む)5営業日までの1取引日までの7取引日におけるA類普通株の出来高加重平均価格(いずれもこのように発行された株式を“Tempus株式”と呼ぶ)に相当する。
当社は、可能な範囲内でできるだけ早く(ただし、ダンプス協定に従ってダンプス株式を毎回発行してから30日以内に遅れてはならない)米国証券取引委員会に登録説明書(またはS-3 ASR表の有効登録説明書の募集説明書の補編を作成および提出することに同意した。この説明書は、規則462(E)条に基づいてダンプズに提出された後に自動的に発効する)、商業的に合理的な努力を尽くすことに同意したが、いずれにしても最初の提出から30日以内(または米国証券取引委員会を全面的に審査すれば最大90日)に登録説明書を発効させることに同意した。このような登録後、当社は、登録声明に含まれるすべてのダンプス株が当該登録声明に従って販売されているか、または規則第144条に従って無制限または数量制限なく販売されるまで、商業的に合理的な努力で当該登録声明を有効に維持することに同意し、この規則は、改正された1933年の証券法に基づいて米国証券取引委員会によって公布される。
Tempusプロトコルはまた、Tempusによって維持された臨床、分子、および他の健康データを表示および分析することを可能にするTempusのレンズソフトウェアにアクセスおよび使用する権利を付与する。同社はこのようなソフトウェアを使用する期限内にTempusに6桁の年間許可料を支払う。
Tempus協定違反を是正できなかったために終了する権利がある場合を除き、当社は3年後に90日の通知を出した後、便宜上Tempusプロトコルを終了することができ、ただし、当社は(A)終了前にダウンロードされた各独自レコードに相当する金額から、(B)終了前に支払われた任意の年間許可料の金額を差し引いて、Tempusプロトコルが予想する年間許可料総額を早期に支払う必要があり、ダウンロードしたTempusプロトコルの下で提供されるすべての記録を限度とする。
いずれもTempusプロトコルでの権利を限られた制限の下で譲渡することができるが,提案された譲受人が大手製薬会社であれば,当社はTempusの同意なしにTempusプロトコルを譲渡することはできない。
REC-994:ユタ大学研究財団協定
2016年2月、私たちはユタ大学研究財団(UURF)と改訂および再署名された許可協定を締結し、この協定によると、いくつかの特許下の独占的許可および特定の独自技術における非独占的許可を取得し、各ケースにおいて、UURFによって制御され、脳綿状血管奇形(CCM)を治療するために、世界的に製造、製造、使用、販売、販売、輸入、および流通するために、薬物tempolorまたはREC-994に関連している。私たちはライセンス権の一部対価格として、わが社でのUURFの株式を発行しました。また、特許権の提出、保守、起訴に関連する特定の費用の一部をUURFに償還することに同意します。改正および再署名されたライセンス協定は、適用国·地域の特許権の範囲内で最後に満了した特許が満期になった後、国·地域ごとに失効する。もし私たちが製品またはサービスの開発または商業化の商業的努力を停止したり、私たちの破産または資金が債務を返済しない場合、UURFは治癒されていない実質的な違約によって合意を終了する可能性がある。
REC-2282:オハイオ州立革新財団ライセンスで
2018年12月、オハイオ州立革新財団(OSIF)と独占ライセンス契約を締結し、いくつかの特許の下で独占的、再許可可能、譲渡不可能、印税の許可を得、特定の独自技術の下で全額、印税免除、非独占許可を取得し、それぞれの場合、これらの許可はOSIFによって制御され、一般的なヒストン脱アセチル化酵素阻害剤OSU-HDAC 42またはREC-2282に関連して、世界的にOSU-HDAC 42を含む製品を開発、製造、製造、使用、販売、提供、輸入した。OsifはAR−42と呼ばれる薬物成分に関連する何らかの資産を割り当てている。OSIFは使用の権利を保持し、他の学術、非営利、および政府機関が許可された知的財産権を研究、非商業、および教育目的に使用することを可能にする。著者らの事前書面の同意を得ず、OSIFはいかなる臨床目的のために従事し、すでにこのような保留権利を従事或いは譲渡してはならず、許可協定締結時に現有の臨床試験を完成しなければならない。我々は,NF 2を治療するためのREC−2282を開発しており,我々のプラットフォームを用いて他の疾患状態でのこの化合物の実用性を評価している。
協定によると、著者らは商業上の合理的な努力で特許製品を商業化し、協定調印後2年以内にいくつかの職務遂行調査マイルストーンを達成することを要求され、臨床試験の開始を含む。許可協定はまた、“ベハ-ドール法案”を含む政府のいくつかの権利と法規の制限と制約を受けている。
ライセンスの対価格として、Osifに200万ドルの前金を支払い、Osifに合計2000万ドルに達するいくつかのマイルストーンと、ライセンス製品の純売上高の1桁中央値印税を支払う義務があります。また,第2段階臨床試験前の任意の非特許権使用料再許可費用の25%,あるいは第2段階臨床試験開始後のこのような再許可費用の15%を借りており,マイルストーン支払いがこれらの再許可費用から差し引かれることを前提としている。2022年,REC−2282によるNF 2治療の第2段階研究では,OSIFに100万ドルを支払った
この協定は,ライセンス特許内の最後の有効な権利要件が満了したときに失効する。私たちは90日前にOSIFに本契約を終了するように書面で通知することができます。いずれも60日前に他方が治癒していない実質的な違約を書面で通知したり、他方の破産または資金を債務せずに合意を終了したりすることができる。
REC-4881:武田ライセンス契約
2020年5月には,武田薬業株式会社や武田とライセンス契約,あるいは武田In−ライセンスを締結し,これにより,武田の臨床段階化合物TAK−733に関する技術や材料を世界的に独占的に取得し,ある条件下で再許可可能で譲渡可能な,印税を負担する武田のある特許,武田の臨床段階化合物TAK−733に関連する技術や材料を開発,製造,商業化し,TAK−733はMEK 1とMEK 2の非ATP競争的アロステリック阻害剤であり,非独占,印税免除,撤回不可能,全額支払い制限を受けている。許可を武田に戻し,許可された化合物を非臨床研究目的に用いる。FAPや自発性心疾患患者の治療のための化合物REC−4881を開発している装甲運搬車-突然変異腫瘍。私たちはまた私たちのプラットフォームを使用して他の病気の状態でのこの化合物の効果を評価している。
我々は、(A)米国、(B)少なくとも以下の3つの欧州諸国(イギリス、フランス、ドイツ、イタリア、スペイン)および(C)日本の各国で少なくとも1つのライセンス製品を開発および商業化するために、商業的に合理的な努力を要求されている。
協定締結後、武田に150万ドルの前金を支払った。武田許可により、特定開発·規制マイルストーン事件が実現した際に武田マイルストーンに合計3950万ドルの金額を支払う義務がある。また,我々,我々の関連会社や分被許可者によるライセンス化合物を含む製品の純売上高の1桁以下の特許権使用料を武田に支払う義務があるが,指定された減額で支払わなければならない。武田が許可した製品をカバーする最後の特許が満了し、製品の任意の規制専門期間が満了し、その製品が国/地域で初めて商業販売されてから10年になるまで、国/地域に印税の支払い義務を継続する。本書類が提出された日まで、私たちは武田に何のマイルストーンや特許権使用料も支払っていません。
もう一方の重大な違約、資本不履行あるいは破産については、双方とも許可協定を終了する権利がある。さらに、2023年5月以降の任意の時間に契約を理由なく終了することができ、許可化合物または許可化合物を含む任意の製品の開発または商業化を支援するための実質的な活動を展開していなければ、このような化合物または製品の開発に12ヶ月連続で商業的に合理的な努力をしていることが証明されていなければ、武田は合意を終了する可能性があり、このような失敗は、合理的に制御できない事件によるものではない。また,ライセンス特許の有効性や実行可能性を疑問視すれば,武田はライセンスプロトコルを終了する可能性がある.武田がライセンス契約に違反した以外のいかなる理由でも終了した場合には、武田の要求に応じて、武田が協定の有効期間内に開発した何らかの技術下でのライセンス条項及び条件を120日以内に誠実に協議する義務があり、許可化合物及びライセンス化合物を含む製品の開発、商業化又はその他の方法で開発することを目的とする。
目標Epsilon:バイエル許可プロトコル
2023年12月、私たちはバイエルと“バイエル許可協定”を締結し、これにより、(A)主に線維化に関連するいくつかの化合物、技術的ノウハウおよび発明の譲渡、および(B)線維化に関連するいくつかのプロジェクトノウハウの下の独占的、再許可可能、および特許権使用料を支払うことができる許可を得て、世界のすべての分野で独立した研究ツールとして研究開発、製造、商業化された製品を取得したが、この許可を得たプロジェクト独自技術のみを内部研究目的に使用するためには、バイエルに独占的でない特許権使用料の許可を返還しなければならない
我々は、(A)米国、(B)日本、または(C)EU諸国のうちの1つで少なくとも1つの製品を開発および商業化するための商業的合理的な努力を要求されている
バイエル許可協定によると,特定の開発,規制,販売マイルストーンを実現する際にバイエルに合計約3400万ドルのマイルストーン金額を支払う義務がある.また,我々,我々の付属会社や分被許可者によるある化合物を含む製品の純売上高の下位桁の特許権使用料をバイエルに支払う義務があるが,具体的な規定では減少しなければならない。(A)私たち、私たちの付属会社、または再許可者が提出した製品をカバーする最後の満期特許の満了、および(B)その製品が国/地域で初めて商業販売されてから10年になるまで、製品および国/地域に印税を支払う義務を継続します。この書類が提出された日まで、私たちはバイエルにマイルストーンや特許使用料を支払っていません
もう一方が治癒していない重大な違約については,双方とも許可協定を終了する権利がある。しかも、私たちは理由もなく合意を終わらせることができる。著者らの無断中止或いはベイヤが著者らの違約によって終了した時、ベイヤはいくつかの指定された独自技術を使用、実践、開発と利用(再許可を含む)する権利があり、ベイヤの内部研究と開発目的にのみ使用される。
競争
これまで,我々の努力はいくつかの臨床段階の計画,早期発見と臨床前開発における差別化計画の拡張パイプ,大手製薬·技術会社とのいくつかのパートナー関係,特許,商標,ソフトウェア,商業秘密を含む知的財産権の組合せを生み出してきた。私たちは私たちの差別化方法が私たちに顕著な競争優位性を提供すると信じている。私たちは混合会社であり、製薬、バイオテクノロジー、および技術業界の複数のカテゴリで競争しており、これらの業界の企業は、同様に、急速に発展した技術を彼らの薬物発見および開発活動に統合するために努力しており、および/または拡張可能な科学プラットフォームを作成している。注目すべき競争相手は
•科学技術生物会社ですこれらの会社は、新しい洞察力をロック解除するために、またはバリューチェーン内の異なる点の薬物発見および開発を加速するために計算ツールを適用する。代表的な例としては,Relay Treeutics,ExScience a,アイソフォーム実験室,シュレーディンガー,AbCelleraがある。
•拡張可能なプラットフォーム会社. これらの会社は新しい科学的方法を応用したり、新しい治療モデルを設計したりしており、大量の候補治療薬を育成する可能性がある。これらの会社は私たちの小分子療法を中心としたパイプラインと直接競争するかもしれない。代表的な会社はModerna,BioNTech,ロイバンテ科学会社である。
•伝統的な生物製薬会社はそれは.これらの会社は主に後期臨床開発と製品商業化に従事しているが、ますます多くの薬物発見と開発価値チェーンの中でMLと先進計算ツールの応用に自分の投資を行っている。このような投資は他のバイオテクノロジー会社とのパートナーシップ(Recursionを含む)を含むことができ、私たちはそこから利益を得ることができる。代表的な会社には楊森(ジョンソンの子会社)、メルク、ファイザーが含まれる。
•大手テクノロジー会社です。大手科学技術会社は絶えず成長の機会を求めている。技術に基づく薬物発見はこれらの会社にとって納得できる機会である可能性があり、その中には薬物発見に専念する研究グループや子会社を持っており、他の会社はバイオ製薬会社と大型技術パートナー関係に署名している。代表的な会社はAlphabet、マイクロソフト、アマゾンを含む。
知的財産権
著者らの知的財産権の重点は表現型グループ学の産業化であり、これは新型のグループ学データクラスであり、これまで、著者らは業界知識を応用して各種の他の先端技術を引き続き構築と拡張した。また,我々は動作中にアルゴリズム,ソフトウェア,統計的知見を生成した.新興の科学技術薬物発見分野では、特許と商業秘密の組み合わせによって私たちの革新を保護することを求めており、私たちが開発したすべての新しい技術や改善について、適切な知的財産権保護過程を考慮します。
私たちのビジネスの成功は、私たちが現在および未来の候補薬剤およびその使用方法、薬物開発および製品開発技術のための私たちの所有または許可を獲得、維持、強制、および擁護する能力、および他人の知的財産権および独自の権利を侵害、流用、または他の方法で侵害することなく、他の人の侵害、流用、または他の方法での私たちの知的財産権および独自の権利の侵害を防止する方法を知ることにある程度依存する。私たちは、私たちのビジネスの発展と実施に非常に重要な米国および外国特許を提出し、私たちのノウハウ、発明、改善に関連する特許出願などの方法を提出することで、私たちの独自の地位を保護することを求めています。私たちはまた、商標、商業秘密、技術ノウハウ、持続的な技術革新、潜在的な許可内の機会に依存して、私たちの独自の地位を発展させ、維持しています。
当社が開発 · 商業化しようとしている現在および将来の医薬品候補については、物質組成および治療法の使用特許、製剤特許、新規適応症に関する治療使用特許、および現在または将来の医薬品候補の関連側面について、入手可能な場合には、今後も追求していきます。また、当社の独自の創薬プラットフォームと創薬技術に関する特許を取得しており、今後も引き続き実施していきます。また、協力契約に基づき、単独または協力者と共同で特許保護を継続することがあります。
私たちは、オープンソース科学の利点と、オープンソースのデータ共有が私たちと社会全体にとって価値を駆り立てることを信じています。例えば、 COVID—19 に関するプラットフォームから得られた重要な知見やデータセットは、データが世界的なパンデミックとの闘いに役立つことを期待して、誰でもデータを利用できるように設計された条件で公開されています。また、世界最大のオープンソースの生物学的データセットのいくつかを、幅広い学術的および非商用的な使用を可能にする条件でリリースしました。
特許
2024年2月現在、我々は現在、米国および他の戦略市場における170件以上の発行された特許または許可された特許出願を含む少なくとも300件の特許または特許出願を世界で所有しており、プラットフォームIPおよび計画IPを含む当社の業務の様々な面をカバーしている。
•プラットフォームIP:我々が世界的に所有または許可している特許および特許出願のうち、約3分の1はRecursionプラットフォームに関連しており、Recursion OS IPに関連する特許および出願、ならびに細胞摂動、遺伝子編集、薬物発見、薬物開発、およびハードウェア解決策に関連する多くの他の発明を含む。Cyclica Inc.を買収することにより,薬物発見に関する約4つの特許シリーズを獲得した。私たちはまた、実験設計、私たちの実験室内の操作、データ収集、および分析(ディープラーニング洞察を含む)から、私たちのプロセス全体の中でより小さい離散発明のための特許保護を求める戦略を遂行している
•再帰プランIP:我々のプランIPの組合せの内訳は以下のとおりである
▪REC-2282:OSIFがOSIFからREC-2282に関連する特許および特許出願の権利を取得することを独占的に許可し、これらの特許および特許出願は、REC-2282の物質組成および使用方法に関する。現在、REC-2282に関連する許可発行された特許は、一般に2024年から2035年の間に満了することが予想されており、特許期間の延長または他の特許期間の実現メカニズムは含まれておらず、適切なメンテナンス、更新、年金、または他の政府費がすべて支払われると仮定している。NF−2については,孤児薬の米国での独占経営権は発売認可から7年間続く
▪REC-994:REC-994を使用してUURFのCCMを治療または予防することに関連する特許および特許出願におけるUURFの権益を独占的に許可する。今のところ、私たちの証明書を持っている人は
発行されたREC−994に関連する特許は、一般に2035年に満了し、特許期間延長または特許期間を達成する他のメカニズムは含まれておらず、すべての適切なメンテナンス、継続期間、年金、または他の政府費用が支払われると仮定する。CCMについては,米国における孤児薬物独占経営権は発売認可から7年間続く
▪REC−4881:我々は、REC−4881の物質組成および使用方法に関する特許出願、または武田の特許における権益および武田の特許出願を独占的に許可している。現在、私たちが許可しているREC-4881に関連する特許は、一般に2029年に満了すると予想されており、特許期間の延長または他の特許期間の実現メカニズムは含まれておらず、すべての適切なメンテナンス、更新、年金、または他の政府費用が支払われると仮定している。FAPについては,米国の孤児薬物独占経営権は発売認可から7年間続く
▪REC-3964:REC-3964の物質組成および使用方法に関する許可された米国特許出願を含む特許出願を有する。発行されると、これらの特許出願によって生成される特許は、特許期限調整または特許期限延長、または特許期限を実現する他のメカニズムを含まず、2042年の満了よりも早くなると予想され、適切なメンテナンス、継続期間、年金、または他の政府費がすべて支払われると仮定する。
私たちのような会社の特許地位は通常不確実であり、複雑な法律と事実の問題に関連している。バイオテクノロジー分野特許で許容される権利要件の範囲については,米国やヨーロッパなどでは一致した政策が出現していない。特許法律や規則の変化は、他の国の立法、司法裁決、または規制解釈によっても、私たちの発明を保護し、私たちの知的財産権を実行する能力を弱める可能性があり、より広く言えば、私たちの知的財産権の価値に影響を与える可能性がある。特に、私たちは、第三者が私たちの任意の特許発明を直接または間接的に製造、使用、販売、提供、販売、輸入、または他の方法で商業化することを阻止する能力があるかどうかは、私たちが私たちの技術、発明、および改善をカバーする特許主張を成功的に獲得、擁護、実行できるかどうかにかかっている。許可および会社のすべての知的財産権については、私たちの任意の未解決特許出願または将来提出された任意の特許出願が特許を得ることを保証することはできず、私たちの任意の既存特許または将来私たちに付与される可能性のある任意の特許が、私たちのプラットフォームおよび候補薬物を保護し、それらを製造するための方法において商業的用途を有することを保証することはできません。また、私たちが発行した特許と将来発行される可能性のある特許は、私たちの候補薬物製品の商業化において私たちの技術を実践する権利があることを保証できないかもしれない。バイオテクノロジーにおける特許や他の知的財産権分野は、多くのリスクと不確実性を有する発展している分野であり、これは、私たちの候補薬物や将来の候補薬物を商業化し、私たちの独自技術を実践することを阻止するかもしれない。
私たちが発行した特許および将来発行される可能性のある特許は、挑戦、縮小、回避、または失効される可能性があり、これは、競争相手のマーケティング関連プラットフォームまたは候補薬物を阻止する能力を制限するか、または候補薬物、将来の候補薬物、およびプラットフォームに対する私たちの特許保護期間を制限するかもしれない。さらに、発行された任意の特許によって付与された権利は、同様の技術を有する競合他社と比較して完全な保護または競合優位性を提供してくれない可能性がある。また,我々の競争相手は類似した技術を独立に開発し,類似した結果を実現する可能性があるが,方法は異なる.このような理由で、私たちは候補薬物の側面で競争するかもしれない。また、我々の候補製品の開発、テスト、規制審査に要する時間は、商業化後の有効特許保護の時間を短縮する可能性がある。私たちのノウハウ、発明、改善、プラットフォーム、および候補薬剤に関連するこのリスクおよび他のリスクについては、“リスク要因--私たちの知的財産権に関連するリスク”というタイトルの節を参照されたい
私たちのビジネスの成功はまた第三者の知的財産権と独自の権利を侵害しないことにある程度依存するだろう。いかなる第三者特許を発行することが、私たちの製品やプロセスの開発または商業戦略を変更することを要求するかどうか、あるいは許可証を取得する必要があるかどうか、またはいくつかの活動を停止する必要があるかどうかはまだ確定されていません。私たちはいかなるライセンス契約に違反したり、私たちの将来の製品を開発または商業化するために必要な独占権許可を得ることができず、私たちに悪影響を及ぼすかもしれません。もし第三者が米国で準備して提出した特許出願も権利の技術を要求する場合、私たちは発明の優先権を決定するために、米国特許商標局の干渉または派生プログラムに参加しなければならないかもしれない。詳しくは“リスク要因-私たちの知的財産権に関連するリスク”を参照されたい
私たちのアメリカでのいくつかの未解決特許出願は臨時特許出願です。仮特許出願は、1つ以上の関連する仮特許出願を提出してから12ヶ月以内に非仮特許出願を提出しない限り、発行された特許となる資格がない。もし私たちがいかなる非臨時特許出願を直ちに提出しなければ、私たちは私たちの臨時特許出願に関する優先日と、私たちの臨時特許出願に開示された発明に対する任意の特許保護を失う可能性がある。我々は,我々の仮特許出願に関連する非仮特許出願をタイムリーに提出する予定であるが,このような特許出願がいかなる競争優位を提供してくれる特許の発行につながるかどうかは予測できない.
個別特許の期限は特許を取得した国の法的期限に依存する。私たちが出願したほとんどの国では,特許期間は,その特許に関連する非臨時特許出願が提出された最初の日から20年である。しかしながら、特許によって提供される実際の保護は、製品によって異なり、特許のタイプ、そのカバー範囲、規制に関連する延長の利用可能性、特定の国の法的救済措置の利用可能性、および特許の有効性および実行可能性を含む多くの要因に依存する。場合によっては、米国特許は、USPTOからの特許取得の遅延を補償するために、特許期限調整、すなわちPTAを得ることもできる。場合によっては、そのような特許協定は、米国特許期間を、米国特許に関連する非臨時特許出願を提出する最初の日から20年以上延長させる可能性がある。また、米国では、FDAが承認した薬物をカバーする米国特許の期限も特許期間延長(PTE)を得る資格がある可能性があり、これにより、FDA規制審査中に失われた特許期間の補償として特許期限の回復が可能となる。しかしながら、FDA規制審査期間によって付与された特許期間の延長については、回復期間は5年を超えてはならず、回復期間を含む総特許期間はFDA承認後14年を超えてはならず、各規制審査期間は、その規制審査期間に適用される特許を延長することしかできず、承認された薬剤またはその使用方法に関する発行された権利要件を延長することしかできない。もし私たちがテスト段階や監督審査過程で職務調査を行うことができず、適用の最終期限内に出願を提出できなかった場合、関連特許の満了前に出願を提出できなかった場合、または適用の要求を満たすことができなかった場合、延期されない可能性がある。しかも、延期の長さは私たちが要求したものより短いかもしれない。私たちがどんな特許期間の延長や有利な調整から利益を得るか保証されない。
米国や他の地域で急速に発展している特許法は、私たちの特許が許容または実行される可能性のある権利要件の広さを予測することを困難にしている。さらに、特許庁は、特許出願に例示された特定の革新のみをカバーするために、製薬および/またはバイオテクノロジー関連発明に関連する特許出願を制限または大幅に縮小することを要求することができ、それにより、競合挑戦のための保護範囲を制限することができる。したがって、私たちが特許を得ることができても、特許範囲は予想されたよりはるかに狭いかもしれない。
当社の医薬品候補、その使用方法、およびその他の独自の技術に関する知的財産および独占的地位を維持し、防衛する能力は、有効な請求を取得し、許可された請求を執行する成功に依存します。当社は、第三者から出願またはライセンス供与する特許出願のいずれかが特許の発行につながるかどうかを知りません。当社が所有し、将来受領する可能性のある発行された特許、または第三者からのライセンスは、異議申し立て、無効化、執行不能、狭窄または迂回される可能性があります。発行された特許の下で付与された権利は、競合他社を含む類似の技術を持つ第三者に対する独自の保護または競争優位性を提供しない可能性があります。さらに、競合他社を含む第三者が、当社の特許を侵害することなく、類似の医薬品や製品を独自に開発 · 販売したり、当社の技術、ビジネスモデルまたは戦略を複製したりすることがあります。
商標
2024 年 2 月現在、当社の商標ポートフォリオは、世界中で 70 以上の登録商標または有効な商標出願を含み、その中で米国では「 Recursion 」および「 Recursion Pharmaceuticals 」の商標を発行しています。
商業秘密
私たちの発明、候補薬物とプロジェクトは特許保護に依存する以外に、私たちは商業秘密、技術ノウハウ、秘密保護協定と持続的な技術革新に依存して、私たちの競争地位を発展させ、維持します。例えば製造過程のいくつかの要素や独自の分析は
投与および患者の管理方法、ならびに計算−生物学的アルゴリズム、ならびに関連するプロセスおよびソフトウェアなどの技術およびプロセス、臨床経験によって得られた知識は、開示されていない特許を取得していないビジネス秘密およびノウハウに基づいている。私たちは、従業員、コンサルタント、コンサルタントとの契約を含む、私たちの固有の情報やビジネス秘密を保護する措置を取っていますが、これらの合意は違反される可能性があり、私たちはどんな違反にも対応する十分な救済策がないかもしれません。さらに、サードパーティは、実質的に同じ独自の情報および技術を独立して開発することができ、または他の方法で私たちのビジネス秘密を取得したり、私たちの技術を開示したりすることができる。したがって、私たちは私たちの商業秘密を意味的に保護することができないかもしれない。私たちの政策は、私たちの従業員、コンサルタント、外部科学協力者、協賛研究者、および他のコンサルタントに、私たちとの雇用や相談関係を開始する際に秘密協定を実行することを要求します。これらの合意は、当方との関係過程において、関係個人又は実体に開示されたすべての当方の業務又は財務に関連する機密情報を秘密にしなければならず、特定の場合を除き、第三者に開示してはならないと規定している。従業員の場合、合意は、個人が雇用されている間に構想されている、私たちの現在または計画中の業務または研究および開発に関連しているか、または合理的な能力を有しているか、または使用されているすべての発明が私たちの固有財産であることを規定している。また、第三者が私たちのノウハウを盗用することを防止するために、物理的および技術的セキュリティ対策のような他の適切な予防措置を講じている。しかし、そのような合意と政策は違反される可能性があり、私たちはこのような違反に対応するための十分な救済策がないかもしれない。我々の知的財産権に関連するリスクに関するより多くの情報は、“リスク要因-私たちの知的財産権に関連するリスク”を参照されたい
政府の監督管理
アメリカ連邦、州と地方各級及びその他の国の政府当局はその他の以外に、薬品と生物製品の研究、開発、テスト、製造、品質管理、承認、ラベル、包装、貯蔵、記録保存、普及、広告、流通、承認後のモニタリングと報告、マーケティングと輸出入などの方面に対して監督管理を行う。一般的に、1つの新薬が発売される前に、その品質、安全性と有効性を証明するデータを大量に獲得し、各監督管理機関特有のフォーマットに組織し、審査を提出し、関連する監督管理機関の許可を得なければならない
アメリカの薬物開発
米国では,FDAは連邦食品,薬物,化粧品法案(FDCA)に基づいて薬物を規制している。薬品はまた他の連邦、州、そして地方の法律法規によって制限されている。規制の承認を得て、その後、適切な連邦、州、地方、外国の法規と条例を遵守する過程には、多くの時間と財政資源が必要だ。製品開発過程,承認過程又は上場後のいずれかの場合,出願人が適用される米国の要求を遵守しなければ,行政又は司法制裁を受ける可能性がある。他の行動に加えて、これらの制裁は、FDAが未解決の申請の承認の拒否、承認の撤回、臨床棚上げ、無見出しまたは警告状、製品のリコールまたは市場撤回、製品の差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金、政府契約の拒否、原状回復、返還、返還、および民事または刑事罰を含むことができる。どんな機関や司法法執行行動も私たちに実質的な悪影響を及ぼすかもしれない
•我々の候補薬物は小分子薬物と考えられ,新薬申請やNDAプログラムによりFDAの承認を得なければ,米国で合法的に発売されなければならない。この過程は一般的に、良好な実験室実践またはGLPによる研究を含む、適用法規に基づいて広範な臨床前研究を完成することに関する
•米国がヒト臨床試験を開始する前に発効しなければならない研究用新薬またはIND申請をFDAに提出する
•各臨床試験が開始される前に、各臨床試験場所の独立機関は、委員会または倫理委員会の承認を審査する
•適用されたIND法規、良好な臨床実践或いはGCP要求及びその他の臨床試験に関連する法規に基づいて十分かつ制御された人体臨床試験を行い、各提案適応に対する研究製品の安全性と有効性の確実な証拠を確定する
•食品医薬品局に秘密保持協定を提出し
•FDAは機密協定を受け取ってから60日以内に再審申請を受けることを決定した
•施設、方法、および薬物の特性、強度、品質、および純度を維持するのに十分な制御を保証するために、cGMP要件に適合するかどうかを評価するために、医薬品を製造する1つまたは複数の製造施設の承認前検査を良好に完了させることが好ましい
•FDAは、NDA申請をサポートするデータを生成する臨床前研究および/または臨床試験場所を監査することができる
•FDAがNDAの使用料を審査するために支払う
•薬物が米国で任意の商業マーケティングまたは販売を行う前に、FDAの任意の諮問委員会の意見を考慮することを含むNDAの審査および承認
•リスク評価 · 緩和戦略を実施する潜在的な要件や承認後調査を実施する潜在的な要件を含む、承認後要件への遵守。
NDA をサポートするために必要なデータは、前臨床段階と臨床段階の 2 つの異なる開発段階で生成されます。前臨床および臨床試験および承認プロセスには、多大な時間、労力および財源が必要であり、現在および将来の医薬品候補の承認がタイムリーに、または全く認められるかどうかは確信できません。
臨床前研究とIND
人体で任意の候補薬物をテストする前に、候補薬物は厳格な臨床前テストを経なければならない。臨床前研究の進行はGLPとICHの安全/毒理学研究に関する法規を含む連邦法規と要求の制約を受けている。臨床前開発段階は通常薬物化学、製剤と安定性の実験室評価、及び後続の臨床試験を支持する動物毒性評価研究を含む。スポンサーは,臨床前研究の結果を,生産情報,分析データ,任意の利用可能な臨床データや文献,提案された臨床案とともにINDの一部としてFDAに提出しなければならない。INDはFDAがヒトに研究製品の使用を許可する要求であり,ヒト臨床試験が開始される前に発効しなければならない
臨床前研究には製品化学と処方の実験室評価があります体外培養動物研究と、有害事象の可能性を評価し、場合によっては治療使用の理由を確立する。臨床前研究の進行はGLPの安全/毒理学研究に関する法規を含む連邦法規と要求の制約を受けている。INDスポンサーは,臨床前試験の結果を生産情報,分析データ,任意の利用可能な臨床データや文献,臨床研究計画などとともにFDAに提出し,INDの一部としなければならない。いくつかの長期的な臨床前試験、例えば生殖不良事象や発ガン性の動物試験は、IND提出後も継続する可能性がある。INDは、FDAが1つまたは複数の提案された臨床試験に対して懸念または問題を提起しない限り、FDAが受信してから30日後に自動的に有効になり、試験を保留する。この場合,INDスポンサーやFDAは臨床試験開始前に未解決の問題を解決しなければならない。したがって,INDの提出はFDAが臨床試験の開始を許可することを招くことはない可能性があり,これは通常FDAがNDAを承認するために必要である。製品開発中に行われた各後続の臨床試験,およびその後の研究計画の任意の変更も,既存のINDに単独で提出しなければならない。生殖不良事象や発ガン性の動物試験などの長期的な非臨床試験は、IND提出後も継続する可能性がある。
臨床試験
臨床開発段階は、合格研究者の監督の下で、GCP要求に基づいて、研究製品を健康ボランティアや患者に服用することに関連し、合格した調査者は通常、試験スポンサーまたは試験スポンサーの制御下に雇われた医師ではなく、その中にはすべての研究対象を要求することが含まれている
彼らがどんな臨床試験に参加するかにインフォームドコンセントを提供する。臨床試験は,臨床試験の目標,用量プログラム,被験者の選択と排除基準,および被験者の安全性をモニタリングし,治療効果を評価するためのパラメータを詳細に説明した場合に行われる。INDの一部として、すべての議定書とその後の議定書のいかなる修正もFDAに提出されなければならない。また,各臨床試験は,臨床試験を行う各機関の内部審査委員会によって審査·承認されなければならず,臨床試験に参加する個人が直面するリスクが最小限に減少することを保証し,期待される利益については合理的である。IRBはまた、各臨床試験対象またはその法律代表に提供されなければならないインフォームドコンセントを承認し、完成まで臨床試験を監視しなければならない。行っている臨床試験や完成した臨床試験結果を公的登録機関に報告することも求められている
米国国外で臨床試験を行うスポンサーはFDAの認可を得ることができるが,INDによる臨床試験を希望している。外国の臨床試験がINDで行われていなければ,スポンサーはNDAを支援するために臨床試験のデータをFDAに提出することができる。試験がGCPやGMP要求に基づいて行われれば,FDAは通常設計が良好で良好な外国臨床試験を受け,試験がGCPやGMP要求に沿って行われ,必要であればFDAは現場検査でデータを検証することができ,外国の医学実践は米国と一致する
米国では,臨床試験は通常3つの連続段階で行われ,第1段階,第2段階,第3段階と呼ばれ,重なる可能性がある
•第一段階の臨床試験は、一般に、一部の健康ボランティアまたは疾患の影響を受ける患者に関連し、彼らは最初に単剤に接触し、その後、多剤候補薬物に接触する。これらの臨床試験の主な目的は,薬物の新陳代謝,薬理作用,耐性および安全性,および用量増加に関連する副作用を評価し,可能な場合に有効性の早期証拠を得ることである
•第二段階の臨床試験は、予想される利益を産生するために必要な投与量および投与量計画を決定するために、疾患の影響を受ける患者を研究することに関する。同時に、安全性と更なる薬物動態学と薬効学情報を収集し、可能な副作用と安全リスクを識別し、そして初歩的な治療効果の評価を行った
•第三段階臨床試験は、通常、必要なデータを提供して、その予期される用途に対する製品の有効性、使用中の安全性を証明し、製品の全体的な利益/リスク関係を確立し、製品の承認に十分な基礎を提供することを目的としている複数の場所の大量の患者に関連する。これらの試験は、プラセボおよび/または他の対照治療との比較を含むことができる。治療の持続時間が常に延長され、製品のマーケティング期間中の実際の使用をシミュレートする
承認後試験は,4期臨床試験と呼ばれることがあり,最初の上場承認後に行われる。これらの試験は,治療適応が予想される患者の治療から追加的な経験を得るために用いられている。場合によっては,FDAはNDAを承認する条件として4期臨床試験を強制的に実行することができる
その他の情報に加えて,臨床試験結果を詳細に説明する進捗報告は少なくとも毎年FDAに提出されなければならない。スポンサーはまた、深刻かつ予期せぬ疑わしい有害事象の報告を含む書面のIND安全報告書の提出を担当しており、他の研究は、この薬物に接触することがヒトに重大なリスクがあるという報告、動物または動物からのものであることを示している体外培養テストにより、人類被験者に対して重大なリスクがあり、及び方案或いは研究者マニュアルに記載されたテストと比べ、臨床上深刻な不良反応の疑いの発生率はすべて明らかに増加した
第1段階、第2段階、および第3段階の臨床試験は、もしあれば、任意の指定された時間で成功しない可能性がある。FDA或いはスポンサーはいつでも様々な理由で臨床試験を一時停止或いは中止することができ、研究対象或いは患者が受け入れられない健康リスクに直面していることを発見することを含む。同様に、1つの臨床試験が委員会の要求に従って行われない場合、または薬剤が患者に予期せぬ深刻な傷害を与えた場合、IRBは、その所在機関の臨床試験の承認を一時停止または終了することができる。さらに、いくつかの臨床試験は、データ安全監視委員会または委員会と呼ばれる臨床試験スポンサーによって組織された独立した合格専門家グループによって監督される。このグループは,実験のあるデータへのアクセスにより,許可試験が指定されたチェックポイントで行えるかどうかを決定する
臨床試験と同時に、会社は通常追加の動物安全性研究を完成し、薬物化学と物理特性に関する追加情報を開発し、cGMP要求に基づいて最終的に商業量産製品のプロセスを決定しなければならない。製造工場で実行される製造プロセスは,高品質の候補薬物ロットを継続的に生産できる必要がある。また,適切な包装を選択·試験し,我々の候補薬物がその標識された棚期間で受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない
守秘契約審査の流れ
臨床試験が完了した後、研究製品が提案された1つまたは複数の指示用途に対して安全に有効であるかどうかを評価するために、データを分析する。臨床前研究および臨床試験の結果は、その後、NDAの一部としてFDAに提出され、製品品質および他の関連データを確保するために、提案されたラベル、化学および製造情報が提供される。簡単に言うと、NDAは、米国でこの薬剤を販売するための1つまたは複数の適応を指定する承認要求であり、薬物の安全性および有効性証明を含まなければならない
申請には,臨床前研究と臨床試験の陰性とファジィ結果,陽性結果が含まれなければならない。データは、製品使用の安全性および有効性を試験するために、または研究者によって開始された研究を含む多くの代替源からの臨床試験からのものである可能性がある。上場承認を支持するためには、提出されたデータは研究製品の安全性と有効性を確定し、FDAを満足させるために、品質と数量で十分でなければならない。薬物が米国で合法的に販売される前に、NDAに対するFDAの承認を得なければならない
改正された“処方薬使用料法案”(PDUFA)によると、秘密協定ごとに使用料が添付されなければならない。FDAは毎年PDUFAユーザ料金を調整する。PDUFAは市販されているヒト薬物ごとに年間計画費を徴収している。場合によっては、小企業が初めて出願した出願料を免除することを含む、費用を免除または減免することができる。また,孤児薬として指定された製品については,NDAに対して使用料を評価せず,非孤児適応も含まれていない限りである
FDAは、提出されたすべてのNDA出願を受け入れる前にそれを検討し、NDA出願を受け入れるのではなく、より多くの情報の提供を要求する可能性がある。FDAは受信後60日以内にNDA届出を受け入れるかどうかを決定しなければならない。提出された申請が受け入れられると、FDAはNDAの深い審査を開始する。FDAがPDUFAで合意した目標および政策によると、FDAは、新しい分子実体NDAの予備審査を完了し、出願人に応答し、優先審査を行う新しい分子実体NDAの提出日から6ヶ月間、FDAが10ヶ月の時間を持っている。FDAは、常にそのPDUFA標準および優先NDAの目標日を達成するわけではなく、審査プロセスは、FDAがより多くの情報を提供または明確にすることを要求することによって延長されることが多い
NDAを承認する前に、FDAは、それらがcGMP要件に適合しているかどうかを決定するために、新製品の製造施設を承認前に検査する。FDAは、製造プロセスおよび施設がcGMP要件に適合していることを決定し、要求された仕様の下で製品が一貫して生産されることを保証するのに十分でない限り、この製品を承認しないであろう。FDAはまた、GCP要求に適合することを確保するために、臨床試験のデータを監査することが可能である。さらに、FDAは、新薬または医薬製品の出願を諮問委員会に提出することができ、一般に、申請が承認されるべきかどうか、およびどのような条件下で(あれば)申請を承認すべきかを審査、評価および提案するための臨床医および他の専門家を含むグループである。FDAは諮問委員会の提案に制限されていないが、承認決定を下す際にこれらの提案を考慮する。FDAは臨床試験データを再分析する可能性があり,FDAや出願人の審査過程で広く議論される可能性がある。FDAは、NDAを評価した後、承認状または完全な返信を発行する。この薬物の商業マーケティングを許可し、特定の適応の具体的な処方情報を提供する。完全な返信は、申請の審査期間が終了し、現在の申請が承認されないことを示している。完全な応答文は、一般に、FDAによって決定されたNDA内のすべての特定の欠陥を記述する。完全な返信は、追加の臨床データ、追加の重要な段階3期臨床試験(S)、および/または臨床試験、臨床前研究および/または生産に関連する他の重要かつ時間の要求を必要とする可能性がある。完全な返信が発行された場合、出願人は、秘密協定を再提出し、手紙で決定されたすべての不足点を解決するか、または出願を撤回することができる。このようなデータや情報を提出しても,FDAはNDAを決定することが可能である
承認基準を満たしていません。臨床試験から得られたデータはつねに決定的ではなく,FDAのデータ解釈は我々の同じデータに対する解釈とは異なる可能性がある
“小児科研究公平法”によると、新薬または新薬補充剤は、すべての関連小児科亜群で薬物が主張する適応の安全性と有効性を評価し、薬物に対して安全かつ有効な各小児科亜群の投与量および投与を支持するためのデータを含まなければならない。FDAは、提出されたデータの全部または一部を免除または延期することができる。
小児最適医薬品法案、またはBPCAは、いくつかの条件が満たされる場合、任意の薬物の排他的-特許または非特許-であるNDA保持者に6ヶ月の延長を提供する。排他的条件は、FDAが小児科集団における新薬の使用に関連する情報がその集団の健康に利益をもたらす可能性があることを決定すること、FDAが小児科研究の書面請求を提出すること、および申請者が法定時間の枠組み内で要求された研究を行うことに同意し、報告することを含む。BPCA下の出願は優先出願とみなされ,与えられたすべての利点を指定することができる.
孤児薬
孤児医薬品法によれば、FDAは、米国では20万人未満または米国で20万人を超える影響を与える疾患または疾患であることが一般的であり、米国ではこのような疾患または疾患を治療する製品を開発および提供するコストが製品の販売から回収されるという合理的な期待がない、まれな疾患または疾患の治療のための医薬または生物製品に孤児の称号を付与することができる
秘密保持協定を提出する前に、指定孤児薬を申請しなければならない。FDAが孤児薬物指定を承認した後、FDAは、治療薬の識別およびその潜在的な孤児の使用を開示する。指定孤児薬は、規制審査と承認過程でいかなる利点も伝達されず、規制審査と承認過程の持続時間を短縮することもない
孤児として指定された製品がその後、このような指定された疾患または状況を有するFDAの最初の承認を得た場合、この製品は、孤児薬物排他性を得る権利があり、これは、FDAが承認日から7年以内に、限定された場合、例えば、より効果的で、より安全な方法によって孤児に対して排他的な製品に対する臨床的利点を示すか、または医薬品供給問題において患者ケアに大きな貢献をしない限り、同じ適応に対して同じ薬物を販売する任意の他の出願を許可しないことを意味する。しかしながら、競合他社は、同じ適応の異なる製品または異なる適応の同じ製品の承認を得る可能性があるが、これらの製品は、ラベル外で孤立した適応に使用することができる。もし競争相手が私たちの前にFDAで定義された同じ製品の承認を得た場合、すなわち私たちが承認を求めている同じ適応、または候補薬剤が競争相手の製品範囲に含まれると決定された場合、孤立薬物排他性も7年以内に私たちの製品の承認を阻止する可能性がある。もし私たちの孤児薬に指定された製品が発売承認された場合、その適応範囲は指定されたものよりも広く、孤児薬の独占経営権を得る資格がない可能性がある。EUの孤児薬の地位は似たような要求と利益を持っているが、同じではない
開発と審査計画を加速する
FDAはある基準を満たす新薬の審査過程を加速または促進することを目的とした高速チャネル計画を持っている。具体的には、新薬が深刻な或いは生命に危害を及ぼす疾患の治療を目的とし、臨床前或いは臨床データがこのような疾病が満たされていない医療需要を解決する可能性があることを示した場合、高速道路指定を受ける資格がある。高速チャネル指定は製品にも,検討中の特定の適応にも適用可能である。スポンサーは、NDAの承認を得る前の任意の時間に、FDAに製品を高速チャネル状態に指定することを要求することができるが、NDA前のFDAとの会議よりも遅くないことが好ましい
迅速チャネル計画に従って、優先審査および承認の加速など、FDAの開発および審査を加速するための他のタイプの計画に参加する資格がある可能性があるFDA上場製品を提出する任意のもの。重篤または生命に危険な疾患を治療する製品は、優先審査を受ける資格があり、承認されれば、既存の療法と比較して、安全性および有効性の面で有意な改善を提供するであろう
製品が重篤または生命に危険な疾患を治療し、通常、既存の療法よりも有意な利点を提供する場合、加速承認を得る資格もある。さらにそれを示す必要があります
臨床的利益の代替終点を合理的に予測することができ、または不可逆的発病率または死亡率またはIMMよりも早く測定することができる臨床終点において、IMMはIMMまたは他の臨床的利益への影響を合理的に予測することができる。承認の一つの条件として,FDAは承認を加速させた薬物のスポンサーに十分かつ良好に制御された上場後臨床試験を要求する可能性がある。検証性発売後に試験が臨床的利益を検証できなかった場合、或いは薬物に関連するリスクを証明するのに十分な臨床利益が証明されていない場合、FDAは薬物の承認を撤回するか、或いは薬物のラベル適応の変更を要求する可能性がある。FDAが,流通や使用が制限されている場合にのみ,有効であることが証明された薬物を安全に使用できると結論すれば,必要と考えられる発売後の制限を行い,その製品の安全使用を確保することが要求される可能性がある
さらに、1つの薬剤が単独で、または1つまたは複数の他の薬剤または生物学的製品と組み合わせて、深刻または生命に危険な疾患を治療するために使用され、初期臨床証拠は、製品が1つまたは複数の臨床的に重要な終点で現在承認されている療法よりも実質的に改善されている可能性があることを示している場合、薬剤は突破的療法として指定される資格がある可能性がある。画期的な治療指定の利点には,迅速チャネル指定と同様の利点と,有効な薬物開発計画を確保するためのFDAの密な指導がある。迅速チャネル指定、優先審査、加速承認、および画期的な治療指定は、承認の基準を変更することはありませんが、開発または承認プロセスを加速させる可能性があります
承認後に要求する
新製品が承認された後、製造業者および承認された製品は、監視および記録保存要件、有害事象を報告する要求、および宣伝および広告要件を遵守することを含むFDAによって持続的に規制され、未承認用途または患者集団のための薬物の普及、いわゆる“ラベル外普及”の制限、および業界支援の科学的および教育活動の制限が含まれる。医師はラベル外の用途のために合法的な薬品を処方するかもしれないが、製造業者はこのような用途を販売または普及させない可能性がある。処方薬宣伝材料は初回使用時にFDAに提出されなければならない。さらに、薬物が適応、ラベルまたは製造プロセスまたは施設の変化を含む任意の修正がある場合、出願人は、新しいNDAまたはNDAサプリメントの承認を得るために提出および提出を要求される可能性があり、これは、追加のデータまたは臨床前研究および臨床試験を開発する必要があるかもしれない
FDAはまた、製品の安全な使用を保証するために、REMSの要件を含む承認時に他の条件を追加することができる。REMSは、制限された分配方法、患者登録、および他のリスク最小化ツールのような薬物ガイドライン、医師のコミュニケーション計画、または安全な使用を確保する要素を含むことができる。承認またはマーケティングに関するこれらの制限は、製品の商業普及、流通、処方、または配布を制限する可能性がある。製品承認は、規制基準を満たしていないことや、初期マーケティング後に問題が発生したことで撤回される可能性があります
FDAの規定は,製品は特定の承認された施設で生産され,cGMP規定に適合しなければならないことを要求している。メーカーはcGMP法規を遵守しなければならず、これらの法規は品質管理と品質保証、記録とファイルの維持を要求し、cGMPから外れたいかなる状況も調査·是正する義務がある。医薬品の生産·流通承認に関与するメーカーおよび他のエンティティは、FDAおよびある州機関にその機関を登録し、cGMP要求および他の法律を遵守することを保証するために、FDAおよびいくつかの州機関の定期的な抜き打ち検査を受けなければならない。そのため、メーカーはcGMPコンプライアンスを維持するために、生産や品質管理の分野で時間、お金、労力をかけ続けなければならない。違反条件を発見することは、cGMP規定を満たしていないことを含み、法執行行動を招く可能性があり、承認後に製品問題を発見することは、リコールを含む製品、その製造業者またはNDA保有者への制限を招く可能性がある。
規制要件や基準が守られていない場合、あるいは製品発売後に問題が発生した場合、FDAは承認を撤回する可能性がある。その後、製品には、予期されない深刻度または頻度の不良事象、または生産プロセス、または規制要件を遵守できなかったことを含む、以前に未知の問題が存在することが発見され、新しいセキュリティ情報を追加するために承認されたラベルの改訂につながる可能性がある;新しい安全リスクを評価するために発売後研究または臨床研究を実施するか、または流通制限またはREMS計画下の他の制限を実施することができる。他の他の潜在的な結果には
•製品の販売や製造を制限し、製品を市場から完全に撤退させたり、製品をリコールしたりする
•罰金、警告状、または承認後の臨床研究の一時停止
•FDAは、承認保留申請または承認済み申請の追加を拒否する
•製品の承認を一時停止または撤回する
•製品は差し押さえられたり差し押さえられたりします
•製品の輸出入を許可することを拒否する
•民事または刑事処罰を禁令または適用する
FDA は、市場に投入される製品のマーケティング、ラベル表示、広告、プロモーションを厳格に規制しています。医薬品は、承認された適応症のためにのみ、承認されたラベルの規定に従って販売することができます。FDA やその他の機関は、非表示使用の促進を禁止する法令を積極的に執行しており、非表示使用を不適切に促進した企業が重大な責任を負う可能性があります。
コンパニオン診断の FDA 規制
治療薬の安全かつ効果的な使用は体外培養その治療に反応する可能性が高い患者を選択するために使用するコンパニオン診断ですIf a 体外培養診断は治療製品の安全かつ有効な使用に重要であり、製造業者が補助診断としてそのような診断を販売または配布することを望む場合、FDAは、治療製品の補助診断としての診断の単独承認または承認を要求する。FDAの指導によれば、薬物の臨床試験において治療決定を行うための未承認または未承認の随伴診断装置は、一般に、装置が承認または承認された予期される使用のために使用されない限り、研究医療装置とみなされる。患者選択のような重要な治療決定を行うために使用される場合、FDAの調査デバイス免除またはIDE法規に従って、診断デバイスは、一般に重大なリスクデバイスとみなされる。診断装置のスポンサーは、研究性診断装置に関する臨床研究に関するIDEの規定を遵守することが要求される。ガイドラインによれば、診断装置および薬剤がそれぞれの承認を支援するために一緒に研究される場合、試験がIDE法規およびIND法規の要求を同時に満たす場合、これら2つの製品は、同じ臨床試験で研究することができる。このガイドラインは、臨床試験プログラムの詳細、研究製品(S)および関連する対象に基づいて、スポンサーがIDEを単独で提出することを求めることができる(例えば、薬剤がFDA承認を受け、その承認されたラベルと一致して使用されている場合)、またはINDおよびIDEを同時に提出することができる
FDAのAN承認·クリアを求める体外培養セット診断が必要な発売前通知とも呼ばれ、510(K)承認、または発売前承認、またはPMA、または当該診断の最初から分類される。診断に伴う審査はFDA装置や放射線健康センターとの審査協調に関連している
510(K)承認プロセス
510(K)承認を得るためには、提案された装置が以前に承認された510(K)装置または1976年5月28日以前に商業販売中であった装置に実質的に相当することを証明する上場前通知をFDAに提出する必要があり、FDAはPMA申請の提出を要求していない。FDAの510(K)承認プロセスは、申請が提出されてFDAに提出された日から3~12ヶ月を要する可能性があるが、FDAがより多くの情報の提供を要求する場合、および他の理由では、より長い時間を要する可能性がある。場合によっては、FDAは、臨床データ支持の実質的な同等性を要求する可能性がある。審査発売前に通知が提出された場合、FDAは追加の情報の提供を要求する可能性があり、これは審査過程を著しく延長する可能性がある。このようなすべての要求にもかかわらず、通関は絶対に保障されない
デバイスが510(K)許可を取得した後、デバイスの任意の後続の修正は、そのセキュリティまたは有効性に著しく影響を与える可能性がある場合、またはその予期される用途に大きな変化を構成する場合、新しい510(K)の許可を必要とするか、またはPMAを必要とするであろう。さらに、FDAは、どのデバイスが510(K)の許可を得る資格があるかを含む業界要件を実質的に変更する可能性があり、これは、このプロセスに大きな影響を与える可能性がある
初めから過程を分類する
新しい医療機器が510(K)発売前の通知フローに適合していない場合、それと実質的に同等の述語機器が決定できないので、この機器は自動的にIII類に分類される。1997年の“食品·医薬品局現代化法案”は、述語機器の不足によりIII類に自動的に分類される低中リスク医療機器のために、“自動III類指定の評価要求”と呼ばれる異なる発売経路を確立し、または最初から分類する過程である。このプロセスは、その新しいデバイスがクラスIIIに自動的に分類される製造業者が、そのデバイスが低または中リスクが存在することに応じて、PMAの提出および承認を必要とすることなく、その医療デバイスをクラスIまたはクラスIIに格下げすることを要求することを可能にする。製造業者がクラスIIに再分類することを求める場合、製造業者は、医療機器の安全性と有効性を合理的に保証するために必要な特別な制御の提案草案を含まなければならない。FDAが510(K)計画に適した合法的に市販されている述語デバイスを決定した場合、またはデバイスが低~中リスクであり、PMAを必要としないと判断した場合、または一般的な制御措置がリスクを制御するのに不十分であり、特別な制御措置を開発することができない場合、FDAは再分類申請を拒否する可能性がある
FDAのマーケティング許可を取得し、最初から降格したり、医療機器を許可することは高価で不確定であり、数年かかるかもしれず、通常大量の科学と臨床データを必要とする
PMAプロセス
臨床および非臨床データの収集、およびFDAおよびFDAへの審査の提出を含むPMAプロセスは、数年またはそれ以上を要する可能性がある。出願人は、装置設計、製造、およびラベルなどを含む装置およびその構成要素に関する情報を含む装置の安全性および有効性の合理的な保証を準備してFDAに提供しなければならない。PMA申請は申請料を払わなければなりません。さらに、医療機器のPMASは、一般に、FDA承認を求める各適応に対する装置の安全性および有効性を決定するために、広範な臨床前および十分かつ制御された良好な臨床試験の結果を含まなければならない。特に,診断については,出願人はその診断が重複可能な結果を生じたことを証明しなければならない。PMA審査の一部として、FDAは通常、メーカーの施設が品質体系法規(QSR)に適合しているかどうかを検査し、この法規は広範なテスト、制御、文書と他の品質保証とGMP要求を規定している
設備が市場に投入された後、それは依然として厳格な規制要求を受けている。他の要件に加えて、医療機器は、それらが承認または承認された用途および適応にしか使用できず、機器製造業者は、FDAに登録および機器リストを確立しなければならず、医療機器メーカーの製造プロセスおよびその供給者の製造プロセスは、医療機器の設計、テスト、生産、プロセス、制御、品質保証、ラベル、包装および輸送の方法および文書をカバーする品質システム法規(QSR)の適用部分に準拠しなければならない。米国食品·薬物管理局は定期的に国内工場の記録や製造プロセスを不定期に検査しており,FDAも米国に製品を輸出する外国工場を検査する可能性がある。
他のアメリカの規制事項
•私たちの現在と将来の医療保健提供者、第三者支払者、顧客、その他の人との手配は、私たちがマーケティングの承認を得た任意の製品の業務または財務配置と関係を制限する可能性があり、広範に適用される詐欺と乱用、および他の医療法律法規に直面する可能性があります。私たちの運営能力に影響を与える可能性のある適用連邦、州、および外国の医療保健法律および法規は、限定される訳ではないが、処方薬または医療機器メーカー(またはそれを代表する側)を含む任意の人、処方薬または医療機器メーカー(またはそれを代表する側)を含む連邦反減税法規、またはそれに限定されないが、これらの報酬は、連邦医療保険または連邦医療補助計画に従って支払われる可能性があり、これは不法である。また、“反リベート法”(定義は後述)によると、“民事虚偽申告法”については、連邦“反リベート条例”違反による物品やサービスのクレームが虚偽または詐欺的クレームを構成することを含むと政府は断言できる
•連邦刑事虚偽申告法及び民事経済処罰法、及び一般市民が民事告発者又は準訴訟により強制執行可能な民事虚偽申告法は、個人又は個人を禁止する
実体は、連邦政府に虚偽または詐欺的な支払い要求を意図的に提出するか、または連邦政府に資金を支払う義務を回避、減少または隠蔽するために虚偽の陳述を行うか、および/または連邦医療計画から除外され、および/またはそのような禁止された行為に従事する当事者を処罰する
•1996年の“連邦健康保険移行性責任法案”(HIPAA)は、他の事項に加えて、詐欺の任意の医療福祉計画の計画または医療保健事項に関する虚偽陳述の実行または実行を禁止または試みた
•“健康情報技術促進経済·臨床健康法”改正された“健康情報技術促進経済·臨床健康法”及びその実施条例は、医療保険計画、医療保健情報交換所及びある医療保健提供者及びそのそれぞれの業務パートナー等の被覆実体は、個人が健康情報を識別できるプライバシー、安全及び伝送を保護する上で義務があり、強制契約条項を含むことが規定されている
•市場活動を広く規制し、消費者の活動を損なう可能性がある連邦消費者保護法と不正競争法
•医薬品、生物製品および医療機器への偽またはニセ物の混入が禁止されている“食品および薬物規制法”
•連邦医師支払陽光法案は、連邦医療保険、医療補助または児童健康保険計画に基づいて費用を支払うことを要求する保険薬品、機器、生物製品および医療用品の適用メーカーは、医師および教育病院への何らかの支払いおよび他の価値移転に関する情報、および医師およびその直系親族が保有する所有権および投資権益に関する情報を毎年連邦医療保険および医療補助サービスセンター(CMS)に報告することを要求する
•同様の州および外国の法律、例えば、販売またはマーケティング手配および非政府第三者支払人(私営保険会社を含む)の精算に関連する医療プロジェクトまたはサービスのクレームに適用可能な州反リベートおよび虚偽請求法は、バイオテクノロジー業界の自発的コンプライアンス基準および連邦政府によって発行された関連コンプライアンスガイドラインの州法律に準拠するようにバイオテクノロジー会社に要求する。州と地方の法律は薬品製造業者に医者と他の医療保健提供者への支払いと他の方法での価値或いはマーケティング支出に関する情報を報告することを要求し、そしてその販売代表の登録を要求し、州法律は生物技術会社にある薬品の定価情報を報告することを要求し、そしてある場合の健康情報のプライバシーと安全を管理する州と外国の法律は、その中の多くの法律は重大な面で互いに異なり、しかもしばしばHIPAAによって先制されず、それによってコンプライアンス仕事を複雑化させる
定価と返却計画は,米国の1990年の“総合予算調節法”の医療補助帰点要求と,2010年に“医療·教育調節法”(総称して“ACA”と呼ぶ)で改正された2010年の“平価医療法案”の最新の要求に適合しなければならない。総務省連邦供給スケジュールの許可されたユーザに製品を提供する場合は、他の法律および要求が適用される。製造、販売、販売促進、その他の活動はまた、連邦と州消費者保護および不正競争法によって制限される可能性がある。さらに、医薬品および/または医療機器製品の流通は、許可されていない医薬品および/または医療機器製品の広範な記録保存、許可、貯蔵、および安全要件を防止するための他の要求および条例を遵守しなければならない。製品は米国の“毒物防止包装法”に適用される児童保護包装要求及びその他の適用される消費者安全要求に適合しなければならない
これらの法律または規制要件のいずれかを守らない場合、会社は可能な法律または規制行動に直面するだろう。場合によっては、適用される規制要件を満たすことができないことは、損害賠償、罰金、返還、監禁、政府援助に参加する医療計画(例えばMedicareおよびMedicaid)から除外されること、誠実な監督と報告義務、契約損害、名声損害、利益減少および将来の収益、禁止、リコール請求、製品の差し押さえ、生産の完全または部分的な一時停止、製品の承認の拒否または撤回、政府契約を含む会社の供給契約の締結許可を含む重大な民事、刑事および行政処罰をもたらす可能性がある。
アメリカの特許期限回復と市場排他性
FDAが将来の候補薬を承認する時間、持続時間、詳細によると、私たちのいくつかの米国特許は、ハッジ·ワックスマン法に基づいて限られた特許期間を延長する資格がある可能性がある。ハッジ·ワックスマン法は、製品開発およびFDA規制審査中に失われた特許期間の補償として、最長5年間の特許期間の回復を可能にする。しかしながら、特許期限の回復は、特許の残り期間を製品承認日から合計14年間延長することはできない。特許期間回復期は、一般に、特許出願の発効日または特許の発行日(遅いものを基準とする)と秘密保護協定を提出した日との間の時間の半分であり、秘密協定の提出日または特許の発行日(遅い基準)と承認された出願との間の時間を加えるが、審査期限は、出願人が職務調査を行っていない任意の時間を短縮しなければならない。承認された薬物,使用方法または製造方法に適用される特許は1つのみ延期する資格があり,延期出願は特許が満了する前に提出しなければならない。米国特許商標局はFDAと協議し,任意の特許期間の延長または回復の出願を審査·承認する。将来,我々の製品がFDAの承認を得た場合,臨床試験の期待長や関連秘密協定の提出に関連する他の要因に基づいて,現在保有または許可されている特許出願のために特許期間を回復させ,特許期間を現在の期限後まで延長する資格のある製品を含む可能性がある。ヨーロッパおよび他のいくつかの管轄区域にも同様の規定があり、承認された薬物をカバーする特許の期限を延長する。私たちは、任意の管轄区域で私たちの発行または許可された特許の延長を求めることができます。しかし、米国のFDAを含む適用当局が保証することはできません。このような延長を承認すべきかどうか、承認された場合、そのような延長の期間の評価に同意します
FDCAにおける市場排他性条項はまた、いくつかの申請の提出や承認を延期する可能性がある。FDCAはNCE守秘協定の承認を得た最初の申請者に5年間のアメリカ国内の非特許マーケティング独占経営期間を提供した。FDAが以前に同じ活性部分を含む他の新薬を承認していなければ,薬物はNCEであり,活性部分は薬物物質の作用を担う分子やイオンである。排他期間内に、FDAは、出願人が合法的な参照承認に必要なすべてのデータを所有していない場合、新規新規出願またはANDAまたは505(B)(2)NDAを、他の会社が薬剤の模倣バージョンのために提出した簡略化された新薬出願またはANDAまたは505(B)(2)NDAを受け入れない場合がある。しかしながら、出願が特許無効または非侵害の証明を含む場合、4年後に提出することができる。FDAが、出願人が行っているまたは後援する新しい臨床研究(バイオアベイラビリティ研究を除く)が承認申請に不可欠であると考えている場合、FDCAはまた、NDA、505(B)(2)NDAまたは既存のNDAの補充のために、既存の薬剤の新しい適応、用量または強度のような3年間の市場排他性を提供する。この3年間の排他性には,新たな臨床研究に関する使用条件のみが含まれており,FDAが原始活性物質を含む薬物のANDAを承認することは禁止されていない。5年と3年の排他性は完全な秘密協定の提出や承認を延期したり承認したりしないだろう。しかしながら、完全なセキュリティプロトコルを提出する出願人は、安全かつ有効であるか、またはそのようなデータを自ら生成するために必要であることを証明するために、すべての臨床前研究および十分かつ良好に制御された臨床試験を参照する権利を行うか、または得ることを要求されるであろう。
EU薬物開発
アメリカと類似して、EUの臨床前と臨床研究の各段階は重要な監督管理によって制御されている。EU臨床試験指令2001/20/ECはEU臨床試験監督管理枠組みを調整し、EU臨床試験の制御と許可のために共通規則を制定したが、EU加盟国は異なる方法でこの指令の条項を交換と応用した。これは会員国制度の大きな変化を招いた。現在の制度では、臨床試験を開始する前に、各EU諸国で承認されなければならず、これらの国では、試験は2つの異なる機関によって行われる:国家主管機関、NCA、および1つ以上の道徳委員会、またはEC。現行制度によると,臨床試験期間中に調査された薬物に対して発生するすべての疑わしい意外重篤な副作用は,これらの反応が発生した加盟国の国家薬品管理局と欧州薬品監督管理局に報告しなければならない
EUの臨床試験立法は現在移行を行っており、主な目的は臨床試験の許可を調整と簡略化し、不良事件報告プログラムを簡略化し、臨床試験の監督を改善し、その透明性を増加させることである。最近公布された臨床試験法規EU第536/2014号
連合で臨床試験が行われることを確実にする規則は同じだろう。同時に、臨床試験指令2001/20/ECはEUで行われたすべての臨床試験を管理し続けている
EUの薬品審査と承認
欧州連合 28 カ国と欧州自由貿易連合 3 カ国 ( ノルウェー、アイスランド、リヒテンシュタイン ) から構成される欧州経済領域 ( EEA ) では、医薬品は販売許可を取得した後にのみ販売することができます。マーケティング承認には 2 種類あります。
•共同体 MA は、 EMA のヒト用医薬品委員会の意見に基づいて、欧州委員会によって中央手続を通じて発行され、 EEA の全領域で有効です。バイオテクノロジー医薬品、孤児医薬品、遺伝子療法、体細胞療法、組織工学医薬品などの先進治療薬、 HIV 、エイズ、がん、神経変性疾患、糖尿病、自己免疫およびその他の免疫機能不全およびウイルス疾患の治療に適応された新しい活性物質を含む医薬品など、特定の種類の製品に対して、集中式手順は必須です。中央集権手続は、 EEA でまだ承認されていない新規活性物質を含む製品、または重要な治療、科学的または技術的革新を構成する製品、または EU の公衆衛生の利益に資する製品についてはオプションです。
•欧州経済圏加盟国主管当局によって発行された、それぞれの領土のみをカバーする国MAは、集中プログラムの強制的な範囲に属さない製品に使用することができる。1つの製品が欧州経済地域の1つの加盟国で販売されることが許可されている場合、その国MAは、相互承認手続きによって別の加盟国で認められることができる。この製品が申請時にどの加盟国でも国MAを取得していない場合、分散プロセスによって異なる加盟国で同時に承認を得ることができる。分権手続きに従って、MAを求める各加盟国の主管当局に同じ書類を提出し、申請者はそのうちの1つを参考加盟国、またはRMSとして選択する。RMSの主管当局は、評価報告草案、製品特性概要草案またはSOPCおよびラベルおよび包装チラシ草案を作成し、他の加盟国(関係加盟国と呼ぶ)に承認を送付する。関連加盟国が公衆健康に対する潜在的に深刻な危害に基づいて、RMSによって提起された評価、SOPC、ラベル、またはパッケージに異議を唱えなかった場合、製品はその後、すべての加盟国(すなわち、RMSおよび関連加盟国)で国MAを取得する
上記の手順により、MAを付与する前に、EMA又は欧州経済区加盟国主管当局は、製品の品質、安全性及び有効性に関する科学的基準に基づいて、製品のリスク−利益バランスを評価する。米国特許用語−回復と同様に、保護証明書、またはSPCを補完し、欧州では特許権の延長として最長5年に達する。SPCは、規制市場の承認を得る前に長い試験および臨床試験が必要となるために失われた特許保護を相殺するために、特定の製薬製品に適用される。
保証と精算を請け負う
私たちの製品の販売は、政府医療計画、商業保険、管理医療組織のような第三者支払者のカバーをどの程度受けるかにある程度依存します。第三者支払者のカバー範囲や新承認製品の精算に関する不確実性が大きい。例えば、米国では、新製品の精算に関する主な決定は通常CMSによって行われる。CMSは新製品がどの程度連邦医療保険の下でカバーと精算されるかを決定するが、個人第三者支払者は通常CMSのカバーと精算に関する決定に大きく従う。しかし、薬品のカバーと精算には統一された政策がない。したがって、私たちのどの製品の保険範囲や精算金額に関する決定は支払者ごとに決定されます
ますます多くの第三者支払人は製薬会社に価格に基づいて所定の割引を提供し、医療製品の定価に挑戦することを要求している。また,これらの支払者は価格に挑戦し,医療の必要性を審査し,候補医療薬の費用対効果を審査することが増えている。新しい保険と補償を受ける上で特に大きな遅延がある可能性があります
承認された薬。第三者支払者は、承認されたリスト上の特定の候補薬剤、いわゆる処方表にカバー範囲を制限することができ、FDAによって承認された特定の適応のすべての薬剤を含まない可能性がある。私たちは私たちの製品の医療の必要性と費用効果を証明するために、高価な薬物経済学的研究を行う必要があるかもしれない。そのため、保証範囲の決定過程は通常時間がかかり、高価な過程であり、各支払人にそれぞれ私たちの製品を使用する科学的かつ臨床的な支持を提供する必要があり、保証と十分な補償を得ることができない
そのほか、セット診断テストは単独で保証と精算を受ける必要があり、しかもそのセットの薬品或いは生物製品の保証と精算を含まない。医薬品や生物製品に適用される保険獲得や精算に適した類似課題は随伴診断にも適用される
また、大多数の外国の国では、薬品の提案価格は許可されなければならず、合法的に発売されることができる。各国の薬品定価と精算に対する要求は大きく異なる。例えば、欧州連合は、その国の健康保険制度が補償を提供する医療製品の範囲を制限し、人が使用する医療製品の価格を制御するために、その加盟国に様々な選択を提供している。加盟国は医薬製品の具体的な価格を承認することができ、医薬製品を市場に投入する会社の収益力に対して直接或いは間接的に制御制度をとることもできる。薬品に対して価格制御や精算制限を実行する国が私たちのいかなる製品にも有利な精算と定価手配を許可することは保証されません。歴史的に見ると、EUで発売された製品はアメリカの価格構造に従わず、通常価格ははるかに低くなることが多い。
医療改革
2003年の“連邦医療保険処方薬、改善と現代化法案”(MMA)は連邦医療保険D部分計画を創立し、連邦医療保険受益者に自発的な処方薬の福祉を提供した。D部によると、連邦医療保険受益者は、個人実体が提供する処方薬計画に参加することができ、これらの計画は外来処方薬の保険を提供する。連邦医療保険A部やB部と異なり,D部のカバー範囲は標準化されていない。すべての連邦医療保険薬物計画は少なくとも連邦医療保険が設定した標準保険レベルを提供しなければならないが、D部分の処方薬計画発起人はすべての保険を受けたD部分の薬物に費用を支払う必要はなく、各薬物計画は自分の薬物処方を開発し、それがどの薬物および被覆のレベルまたはレベルをカバーするかを決定することができる。しかしながら、D部分処方薬処方は、必ずしも各カテゴリまたはカテゴリのすべての薬剤を含むとは限らないにもかかわらず、各治療カテゴリおよびカバーされたD部分薬剤カテゴリの薬剤を含む必要がある。D部分の処方薬計画に使用されるどの処方も薬局と治療委員会が開発·審査しなければならない。政府が処方薬の費用の一部を支払うことは、私たちが発売許可を得た製品に対する需要を増加させる可能性がある。しかし、D部分の処方薬計画がカバーしている私たちの製品のいかなる交渉価格も私たちが獲得する可能性のある価格を下回るかもしれません。また,MMAは連邦医療保険受益者の薬品福祉にのみ適用されるが,個人第三者支払者は自分の支払率を設定する際に連邦医療保険カバー政策や支払制限に従うことが多い
アメリカ政府、州立法機関と外国政府はコスト制御計画の実施に大きな興味を示し、政府が支払う医療コストの増加を制限し、価格制御、精算制限とブランド処方薬の代わりに模造薬を要求することを含む。例えば、2010年に医療·教育調整法案が改正された2010年の患者保護·平価医療法案、あるいは総称してACAと呼ばれて可決され、政府や民間保険会社がヘルスケアに資金を提供する方法を大きく変更し、米国の製薬業に大きな影響を与えた。ACAに含まれる条項は,医療補助計画で精算された薬品のリベートを増やし,医療補助リベートを医療補助管理保健計画に拡大し,ある連邦医療保険Dの一部の受益者を強制的に割引し,製薬会社の連邦ヘルスケア計画における販売シェアに応じて年会費を徴収することで薬品の収益性を低下させる可能性がある。医療補助薬品還付計画は,製薬業者が米国衛生·公衆サービス部(HHS)部長と全国税金還付協定を締結し発効させることを要求し,各州が医療補助患者に提供する外来薬物の連邦マッチング資金を獲得する条件としている。ACAは医療補助薬品還付計画に対していくつかの変更を行い、大多数のブランド処方薬の最低基本医療補助税金還付をメーカーの平均価格の15.1%からAMPの23.1%に引き上げ、製薬業者の税金還付責任を増加させ、ブランド製品の固体経口剤形の“シリーズ延長”(即ち徐放製剤などの新製剤)の還付計算を増加させ、AMPの法定定義を修正することによってその還付責任に影響を与える可能性がある。ACAは医療補助の範囲も拡大している
製薬業者に医療補助管理を要求する医療使用による還付金の支払いと,医療補助薬品福祉を受ける資格のある潜在人口を拡大することにより,薬品使用の還付を行う。さらに、MedicaidまたはMedicare Part B計画に従って連邦補償を獲得するか、または米国政府機関に直接販売する薬品については、メーカーは340 B薬品定価計画に参加する資格のあるエンティティに割引を提供しなければならない。製品を与えるのに必要な340 B割引は,メーカーから報告されたAMPと医療補助返金金額から計算される
議会はACAの全部または一部を廃止または廃止し、代替する立法を考慮した。国会はまだ全面的な廃止立法を通過していないが、ACAの次の特定の税収実施に影響を与える2つの法案が可決された
2020年11月20日、衛生·公衆サービス部監察長弁公室(“OIG”)は最終規則を発表し、連邦反バックル法規がメーカーに対してMedicare Part D計画発起人、Medicaidホスト看護組織とこれらの実体の薬局福祉マネージャーに支払うリベートの安全港を廃止し、消費者の薬品コストをさらに低減することを目的とした。OIGは、処方薬製品のいくつかの販売時点の値下げおよびいくつかの薬局福祉マネージャーサービス料のための2つの安全港を作成する。2020年12月2日、OIGとCMSはそれぞれ1つの最終規則を発表し、それぞれ連邦反バックル法規、民事経済懲罰法と医師自己転診法(あるいはスタック法)を改正し、価値に基づく看護手配の規制障害を除去した。CMSの最終規則はまた、Stark法律法規全体に出現するいくつかの長期的に存在する用語を明確にし、更新する。
ACAが公布されて以来、アメリカはまた他の立法改正を提案し、採択した。これらの変化には、2013年4月1日から、各年度に提供者に支払われる連邦医療保険総額が2%にまで減少することが含まれており、その後の立法改正により、国会が追加行動をとらない限り、この削減は2029年まで続く。2012年の“米国納税者救済法”は、いくつかの医療サービス提供者に支払う連邦医療保険を減らし、政府が提供者に多額の金を取り戻す訴訟時効を3年から5年に延長する法律に署名した。これらの法律は連邦医療保険や他の医療資金のさらなる減少を招く可能性があり,承認されれば,我々医薬品の顧客および我々の財務運営に実質的な悪影響を及ぼす可能性がある。
そのほか、政府は最近薬品メーカーがその上場製品の価格設定の方式に対して更に厳格な審査を行い、国会が数回の調査を行い、そして連邦と州立法を提出し、製品定価の透明性を高め、定価とメーカー患者計画との関係を審査し、政府の薬品に対する計画精算方法を改革することを提出し、公布した。例えば、2022年8月16日に署名された連邦インフレ低減法案には、承認された場合、これらの条項は、連邦医療保険下の処方薬のコストを低減するための条項を含むので、収入を創出し、利益を達成し、または候補薬物を商業化する能力に悪影響を及ぼす可能性がある。アイルランド共和軍の連邦薬品精算への直接的な影響に加え、この法規は個人支払者の支払いのような減少を招く可能性がある。今回の米国議会の複数の議員は、薬品価格を下げることは依然として立法と政治上の優先事項であり、一部の議員は他の薬品定価に対する提案も提出した。同様に、州レベルでは、立法機関は、価格または患者の精算制限、割引、特定の製品へのアクセスの制限、およびマーケティングコスト開示および透明性措置を含む、医薬品および生物製品の価格設定を制御するための法規を立法および実施するようになっており、場合によっては、他の国からの輸入および一括購入を奨励することを目的としている
利用可能な情報
私たちの主な実行事務室はテキサス州ソルトレイクシティSグランデ街四十一号、郵便番号:八四一零一です。私たちの電話番号は(385)269-0203です
我々の10-K表年次報告、10-Q表四半期報告、8-K表の現在の報告、および1934年の証券取引法第13(A)または15(D)節または取引法に基づいて提出または提出されたすべての報告修正案は、米国証券取引委員会に電子的に提出または提供された後、合理的で実行可能な範囲内でできるだけ早く私たちのウェブサイトで無料で取得することができる。私たちのサイトはwww.recursion.comです。投資家や他の人は、投資家関係サイト(http://ir.recursion.com/)、米国証券取引委員会の届出ファイル、プレスリリース、公開電話会議、ネットワーク放送を介して投資家に重要な財務およびその他の情報を発表することに注意すべきである。これを使って
様々なチャンネルやソーシャルメディアやブログを通じて、私たちの利害関係者や公衆と私たちの会社、私たちのサービス、その他の問題について交流します。私たちがソーシャルメディアやブログで発表した情報は実質的な情報と考えられるかもしれない。そこで、投資家、メディア、当社に興味を持っている他の人が、投資家関係サイトにリストされているソーシャルメディアチャネルやブログで発表されている情報を見ることを奨励します。我々のサイトに含まれている,あるいは我々のサイトを介してアクセス可能な情報は,本報告の一部ではなく,本報告にも組み込まれていない.
本報告書は、学術および業界研究、出版物、調査および研究を含む第三者発表された情報への引用を含む。私たちはこれらの情報が信頼できると信じているが、私たちはこれらの情報を単独で確認しておらず、これらの情報は本報告の一部ではなく、本報告にも含まれていない。
第1 A項。リスク要因です
私たちの普通株に投資決定を下す前に、以下に説明するリスクおよび不確実性、および本Form 10-K年次報告および米国証券取引委員会に提出された他の公開文書に含まれるすべての他の情報をよく考慮しなければなりません。以下に説明する危険は私たちが直面している唯一の危険ではない。以下のいずれかのリスクが発生したり、私たちが現在未知であるか、または現在重要ではないと考えている追加的なリスクおよび不確実性が発生し、私たちの業務、見通し、経営業績、および財務状況が実質的かつ不利な影響を受ける可能性がある。
私たちの限られた運営履歴、財務状況、追加資本需要に関連するリスク
私たちは臨床段階のバイオテクノロジー会社であり、運営歴史が限られており、規制機関の承認を得て商業販売を行っていない製品であり、現在と将来の業務見通しを評価することが困難になる可能性がある。
2013年11月の設立以来、私たちのほとんどの努力と財務資源は私たちの薬物発見プラットフォームの構築と私たちの最初の候補薬物の開発に集中している。私たちのすべての候補薬物はまだ発見、臨床前開発或いは臨床段階にある。私たちの候補薬物を商業化することができる前に、他のステップに加えて、それらは臨床成功;内部または外部製造能力とマーケティングの専門知識を発展させ、アメリカ食品医薬品局(FDA)および他の適用司法管轄区域の規制承認を得る必要がある。私たちは商業販売のための製品を承認されていません。私たちは将来規制部門の承認を得て、どんな薬物製品をマーケティングして販売するか保証できません。したがって、私たちは薬品販売から何の収入も得たことがなく、予測可能な未来にも薬品販売から何の収入も得られないと予想される。私たちが候補薬の開発に成功し、それを商業化するまで(これは決して起こらないかもしれない)、株式発行、債務融資、戦略的協力、または同様の手配の組み合わせによって、私たちの運営に資金を提供することが予想される。バイオ製薬製品開発は投機性の強い仕事であり、大きなリスクに関連している。本リスク要因の一部の他の部分で議論されているこれらや他の理由により、現在の業務および私たちの将来性を評価することは困難である可能性がある
設立以来、重大な運営損失が発生しており、予測可能な将来も赤字が続くと予想されている。
設立以来、私たちは毎年純損失を出している。2023年12月31日現在、我々の累計赤字は9.676億ドルです。我々のほとんどの運営損失は,研究開発事業(臨床研究を含む)に関するコストと,我々の運営に関する一般的かつ行政的コストによるものである。我々が研究·開発に投資し続けることや,既存と将来の候補薬物の臨床試験の開始と継続に伴い,我々の運営費用は大幅に増加することが予想される。上場企業として、私たちは運営に関する追加コストを招き続けている。そのため、予測可能な未来には、引き続き大量かつ増加していく運営損失を受けることが予想される。私たちのこれまでの損失は、予想された将来の赤字に加え、株主赤字や運営資本に悪影響を与え続けるだろう。医薬製品や新技術の開発に関連する多くのリスクと不確実性のため、将来の損失の程度やいつ利益を達成するかを予測することはできない(あれば)。私たちが本当に利益を達成したとしても、私たちは四半期や年度の収益性を維持したり向上させることができないかもしれない。
私たちは多くの追加資金を集める必要があるだろう。もし私たちが必要な時に資金を調達できない場合、私たちは製品開発計画、業務発展計画、戦略投資、潜在的な商業化努力の少なくとも一部の延期、減少、または廃止を余儀なくされ、運営を停止する可能性がある。
私たちの使命は、生活を根本的に改善するための生物学の解読であり、広範で達成に高価であり、将来的にはかなりの追加資本が必要になります。当社は、臨床、前臨床、後期発見、早期発見を含む開発段階全体にプログラムを実施しています。現在の医薬品候補の研究開発、臨床試験の開始、および潜在的に販売承認を求める継続的な活動に関連して、当社の経費が増加すると予想しています。前臨床試験および臨床試験は高価で、何年もかかるため、これらの事業を完了するには追加的な資金が必要になります。薬剤候補が最終的に
規制当局の承認を得れば、製品の立ち上げと商業化には大幅な追加資金が必要になります。
当社の将来の資本要件は、以下を含むがこれらに限定されない多くの要因に依存し、その結果として大幅に増加する可能性があります。
•追求する新薬候補の数とその開発要件
•現在および将来の前臨床試験および臨床試験の範囲、進捗状況、結果およびコスト
•医薬品候補の規制審査のコスト、タイミング、結果
•もし私たちが現在または未来の候補薬物の発売許可を得たら、製品販売、マーケティング、製造、流通に関連する費用;
•私たちは有利な条件下で協力、許可および他の戦略計画の能力、およびこのような協力、許可、および戦略計画の成功を確立し、維持する
•グローバル·サプライチェーン問題または他の不可抗力事件による任意の業務中断が、私たちが計画している臨床試験参加者のスケジュールおよび登録を含む、私たちの運営または私たちのメーカー、サプライヤー、または他のサプライヤーの運営に与える影響
•私たちは企業や製品や技術に投資しています
•私たちの知的財産権に関する特許および他の出願の準備、提出、起訴のコスト、私たちの知的財産権の維持、保護、実行、および第三者の知的財産権に関連するクレームを弁護するコスト;
•新しい地域への参入や買収を通じて、従業員の増加と関連コストを含む業務運営と研究開発活動の拡大に伴い、
•賃金と賃金を増加させ、合格者を引き留め、吸引し、激励するために必要な福祉を延長する
•私たちの業務に必要な部品コストの増加
•インフレになる
•2030年までに炭素中性および他の環境、社会、およびガバナンス目標を達成するための任意の約束のコスト;
•上場企業の運営コストとして。
歴史的に、私たちは主に私たちの株式を私募することで、私たちの初公募株と私たちとJefferies LLC(販売エージェント)との公開市場販売協定(“販売契約”)の下の“市場ごと”に発行された純収益を通じて私たちの業務に資金を提供し、時おり30000百万ドルのA類普通株を発売、発行、販売することを規定している。本年度報告Form 10-Kの日までに、私たちの既存の現金状況および短期投資は、少なくとも今後12ヶ月の運営費用および資本支出を支払うのに十分であると予想されます。しかし、潜在的な候補薬物を確定し、臨床前開発テストと臨床試験を行うことは時間がかかり、高価と不確定な過程であり、数年の時間をかけて完成する必要があり、しかも著者らは永遠に発売許可を獲得し、製品販売を実現するために必要なデータ或いは結果を生成できないかもしれない。しかも、私たちの候補薬は承認されても商業的に成功しないかもしれない。少なくとも数年以内に、私たちの商業収入(あれば)は製品販売から来ないと予想しています。したがって、私たちは引き続き追加融資に依存して私たちの業務目標を達成する必要があり、私たちは予想よりも早く大量の追加資金を調達する必要があるかもしれない。
これまで、私たちが相当な収入を生み出すことができれば、私たちは私募と公共株式発行と債務融資の組み合わせ、そして戦略的協力、パートナー関係、許可手配によって私たちの現金需要を満たすことができると予想される。武田製薬株式会社(武田)、バイエル株式会社(バイエル)が遺伝子技術会社、F·ホフマン·ラロ氏株式会社(総称して羅氏遺伝子技術社と総称する)に基づいて協力協定に基づいて支払うべき金額を除き、外部資金源は何も承諾していない。新冠肺炎やその他の潜在的流行病、米国の債務上限と予算赤字懸念、その他の地政学的問題(例えば、ウクライナ/ロシア衝突、イスラエル-ハマス戦争、および大中国地域の政治·貿易不確定性)による全体的な金融市場の中断により、株式や債務融資の難度が増加する可能性がある。私たちは未来の融資が十分な金額を持っているかどうか、もしあれば私たちが受け入れられる条項を確信できない。もし私たちが株式や債務融資、あるいは戦略的協力や同様の計画を通じて、タイムリーで満足できる条項で追加資金を調達できない場合、私たちは私たちの1つまたは複数の研究および開発計画または任意の候補薬剤の将来の商業化を大幅に削減、延期、または停止することを要求されるかもしれません、または私たちの業務を拡大したり、他の方法で利用することができないかもしれません
我々のビジネスチャンスは望みどおりである.これらの状況のいずれも、我々の業務および運営結果に実質的な悪影響を及ぼす可能性がある 行動を停止させる可能性があります
追加資本の調達と追加証券の発行は、私たちの株主に希釈し、私たちの運営を制限し、私たちの技術または候補薬物に対する権利を放棄し、私たちのコア業務に対する管理層の注意を移すことを要求するかもしれない。
私たちが獲得した任意の融資条項は、私たちの株主の持株や権利に悪影響を及ぼす可能性があり、追加の証券を発行し、株式でも債務でも、そのような証券を発行する可能性があり、私たちの株式の市場価格を下落させる可能性があります。ある程度、私たちはA種類の普通株またはA種類の普通株に交換可能な証券を売却することによって、追加資本を調達したり、追加証券を発行したりすることによって、私たちの株主の所有権権益は希釈される
例えば、2022年10月には1530万株のA系普通株を発行し、総収益は1.5億ドル、2023年7月には770万株のA系普通株を発行し、総収益は5000万ドルとなった。また、2023年8月には、時おり総額3.0億ドルに達するA類普通株を“市場”方式で発売、発行、売却する販売協定を締結した。融資発行のほか、2023年5月にCyclica Inc.(Cyclica)とValence Discovery Inc.(Valence)の買収に関連して、A類普通株またはA類普通株に転換または交換可能な証券1240万株、および2023 年 11 月に Tempus Labs , Inc. に 320 万株のクラス A 普通株式を発行しました。( Tempus ) 当社と Tempus の間で締結された特定のマスター契約 ( Tempus 契約 ) の条件に基づく初期ライセンス料の支払いとして、 Tempus 契約に基づき将来的に追加株式を発行することがあります。 私たちが発行したA類普通株の相当数の株はいつでも公開市場で販売される可能性があります。これらの売却、あるいは市場では我々A類普通株の大量保有者が株を売却しようとしているとの見方は、我々普通株の市場価格を低下させる可能性がある
さらに、将来の投資家は、追加資金を提供する条件として、清算、特典、配当支払い、投票権、または普通株主権利に重大な悪影響を及ぼす他の特典を含む可能性がある優遇条件を要求する可能性がある。債務融資が可能であれば、固定支払い義務の増加につながるだろう。さらに、私たちはいくつかの制限的な条約に同意することを要求されるかもしれないが、これは私たちが資本支出を行うこと、配当金を発表すること、または他の方法で業務を展開する能力に悪影響を及ぼすかもしれない。私たちはまた、予想よりも早い段階で、第三者との追加の戦略的協力、パートナーシップ、または許可手配によって資金を調達する必要があるかもしれない。そのような配置は、私たちのいくつかの技術または候補薬、将来の収入源または研究プロジェクトに対する権利を放棄すること、または他の方法で私たちに不利な条項に同意することを要求するかもしれない。資金調達努力は、私たちの経営陣のコア業務への関心を移したり、相互競争の優先順位を作ったりする可能性があり、私たちの候補薬物や技術を開発·商業化する能力に悪影響を及ぼす可能性があります
私たちは戦略的協力を行っており、候補薬物の臨床開発や商業化を含め、より多くの協力を求めている。もし私たちが商業的に合理的な条項や全く協力を構築できない場合、あるいは現在と未来の協力が成功しなければ、私たちの開発と商業化計画を変えなければならないかもしれない。
私たちの製品開発計画と候補薬物の潜在的な商業化には費用を支払うために多くの追加の現金が必要になるだろう。これまで,我々の運営収入は主に羅氏遺伝子技術会社,武田社,バイエル社との研究開発援助協定に由来してきた。例えば、2021年12月、私たちは羅氏遺伝子技術会社と協力と許可協定(羅氏遺伝子技術協定)を締結し、神経科学の重要な領域と腫瘍適応の潜在力を有する小分子候補薬を発見し、この協定によると、私たちは2022年1月に払い戻しできない1.5億ドルの前払いを受け、2023年10月に300万ドルの腫瘍学単分子検証計画のオプション費用を受け取った。私たちは製薬やバイオテクノロジー会社とより多くの戦略的協力、パートナーシップ、許可手配を求めるつもりだ。短期的には、わが社の価値は、私たちの交渉の協力と類似手配の数量と品質にある程度依存するだろう。私たちが協力について最終的な合意に到達するかどうかは、協力者の資源と専門知識の評価、協力の条項と条件の提案、および潜在的な協力者の多くの要素の評価に依存する。これらの要素には他にも(I)私たちの技術と能力が含まれているかもしれません
これらの要因は、(I)候補薬物、(Iii)臨床試験の設計または結果、(Iv)FDAおよび米国国外類似規制機関の許可を得る可能性、(V)候補薬物の潜在的市場、(Vi)潜在的競争製品、および(Vii)業界および市場状況を含む。また、大手製薬会社間の大量の業務合併は、将来協力できる潜在的なパートナーの数を減少させた。
協力と似たような計画は複雑で時間のかかる交渉と記録だ。私たちは、私たちの候補製品、知的財産権、または将来の収入流に対する貴重な権利を放棄しなければならないかもしれないし、私たちに不利な条項で許可を付与したり、独占的な開発と商業化の権利を保留して、私たちにより有利な場合に許可を付与しなければならないかもしれないW協力協定によれば、Eは制限される可能性があり、いくつかの条項で他の潜在的な協力者と将来の合意を締結することはできない。また、私たちと協力者との関係を管理するには、(I)私たちの管理チームが多くの時間と労力を払うこと、(Ii)私たちのマーケティングと研究開発計画と私たちの協力者のマーケティングと研究開発の重点を調整すること、および(Iii)複数のプロジェクトで私たちの資源を効率的に分配することが必要である。
協力および同様の配置は、候補薬物の成功的な開発または商業化、または販売収入をもたらすことができない可能性がある。このような計画の成功は私たちの協力者の努力と活動に大きく依存するだろう。協力者は通常、これらの協力の努力と資源に適用することを決定する上で大きな裁量権を持っており、彼らは私たちの最大の利益に合った方法で協力候補薬の開発と商業化を追求したり、優先したりしないかもしれない。協力による製品収入は、私たちの直接マーケティングと販売製品の収入よりも低いかもしれない。協力者との臨床開発或いは商業化問題における相違は適用候補薬物の開発過程或いは商業化過程の遅延を招く可能性があり、場合によっては、協力手配を中止することもある。もし双方が最終決定権を持っていなければ、このような相違は解決しにくいかもしれない。協働プロトコルは、通常、協力者によって終了することができ、そのような終了または満了は、私たちの財務に悪影響を与え、私たちの商業的名声を損なう可能性がある。もし私たちが私たちの任意の協力者と仲裁や訴訟に巻き込まれれば、これは時間がかかり、運営管理資源を移転し、私たちの名声を損ない、未来の協力協定を達成する能力に影響を与え、さらにこれらの紛争を解決するために私たちの協力者に巨額のお金を支払うことにつながるかもしれない
私たちはタイムリーに、受け入れ可能な条件で、またはより多くの戦略的協力および同様の計画を確立することができず、これらの協力と計画を維持し、成功させることができないかもしれない。第三者との協力関係は、私たちに大量の資源を費やし、財務的リターン保証なしに大量の業務リスクを招く可能性があります。私たちが私たちに有利な条項で戦略的協力や同様の計画を構築または維持し、これらの協力計画の期待的な利益を達成できなければ、私たちの研究開発努力と収入創出の潜在力は制限される可能性があり、私たちの業務と運営結果は実質的で不利な影響を受ける可能性がある。
私たちは商業販売を許可された製品もなく、製品販売から何の収入も得ていない。私たちまたは私たちの現在と未来のパートナーは、私たちの候補薬剤の開発と商業化に決して成功しないかもしれませんが、これは、私たちの運営結果と私たちの業務運営を継続する能力に負の影響を与えます。
私たちの収益性は私たちの支出を相殺するために十分な収入を作る能力があるかどうかにかかっている。2023年12月31日現在、限られた支出収入と羅氏遺伝子技術協定を含む協力協定の下での支払いを除いて、私たちはまだ私たちの候補薬物や技術から何の収入も得ていない。私たちは近い未来に、私たちの収入の大部分が協力から続くと予想している。私たちは、私たちの候補薬を臨床試験に合格させ、私たちの1つ以上の候補薬の発売承認を得て販売を開始するか、あるいは協力して大量の許可や他の支払いを得ない限り、相当な収入は発生しないと予想される。私たちの候補薬が市場で承認されても、そのうちの1つ以上は商業的に成功できないかもしれない。
私たちの候補薬の商業化は多くの要素に依存していますが能力に限られていません
•臨床前研究を順調に完成させた
•FDAの研究用新薬(IND)申請の承認及びアメリカ以外の類似規制の承認を得て、臨床試験を開始できるようにした
•被験者を募集し臨床試験を完成させることに成功しました
•規制機関に適用される規制の承認を得る
•商業製造能力を確立するか、または第三者製造業者と臨床供給と商業製造の手配を行う
•私たちの候補薬物のために特許と商業秘密保護または規制排他性を獲得し、このような知的財産権を維持、保護、保護、実行した
•単独または他の各方面と協力して、私たちの薬品の商業販売を開始します
•患者、医学界、第三者支払者の私たちの薬物製品に対する受容度を獲得し、維持し、他の治療法と効率的に競争する
•医療保険提供者が承認した場合、私たちの薬品の保険範囲と適切な精算を獲得し、維持する
•発売承認後の薬品の持続可能な安全状況を示した。
もし私たちがこれらの要素のうちの1つまたは複数をタイムリーにまたは根本的に達成できなければ、私たちは重大な遅延に遭遇したり、私たちの候補薬物を商業化することに成功できなくなり、これは私たちの業務に実質的な損害を与えるだろう
私たちの現在または未来の協力者は、候補薬物の開発に成功するために、協力者に関連しているので、上記の活動で効果を発揮する必要がある。私たちと彼らは候補薬を開発して商業化することで決して成功しないかもしれない。私たちがそうしても、私たちは利益を達成するのに十分な収入を生むことができないかもしれない;あるいは私たちの協力者がそうしても、私たちは私たちが利益を達成するのに十分なオプション費用、マイルストーン支払い、または特許使用料を得ることができないかもしれない。私たちが利益を達成しても、私たちは四半期や年度の収益性を維持したり向上させることができないかもしれない。私たちは実現して利益を維持することができず、最終的に私たちの価値を低くし、資金調達、業務拡大、研究開発努力の維持、候補薬物パイプラインの開発、協力、さらには運営を継続する能力を弱める可能性がある。
私たちの四半期と年度の経営業績は様々な要素によって大幅に変動する可能性があり、私たちの予想や投資家や証券アナリストの予想を下回る可能性があり、これは私たちの株価の変動や下落を招く可能性がある。
私たちの将来の赤字額と私たちがいつ利益を達成するかは不確定で、私たちの四半期と年度の経営業績は様々な原因で大幅に変動する可能性があります
•候補薬物に関する研究と開発活動のタイミングと私たちの投資レベル
•臨床試験者が配備し登録した時間と状況
•私たちの候補薬物の臨床試験結果は、私たちの候補薬物に予期せぬ健康或いは安全問題が存在するかどうか、そして私たちが発売許可を得たかどうかを含む
•競争候補薬物の商業化または私たちの業界の競争構造の他の変化は、私たちの競争相手またはパートナー間の統合を含む
•私たちの候補薬を作る時間とコスト
•キーパーソンの増減
•もし私たちの候補薬が承認されれば、彼らの需要レベルは大きく異なるかもしれない
•環境や市場や全体的な経済状況の変化を規制する
•賃金と賃金を増加させ、合格者を引き留め、吸引し、激励するために必要な福祉を延長する
•私たちの業務に必要な部品コストの増加と
•インフレです
これらまたは他の要因のうちの1つまたは複数の出現は、我々の四半期および年間経営業績に大きな変動および予測不可能をもたらす可能性がある。したがって、異なる時期に私たちの経営業績を比較することは意味がないかもしれない。このような変化性および予測不可能性はまた、私たちが市場に提供する任意の予測、または業界、金融アナリスト、または投資家の任意の時期に対する予想を満たすことができない可能性がある。そのうちの1つ以上の事件が発生すれば、私たちA類普通株の価格は大幅に下落する可能性がある
もし私たちが将来の買収や戦略協力に従事すれば、これは私たちの資本金要求を増加させ、私たちの株主権益を希釈し、私たちに債務を発生させたり、負債を抱えたり、他のリスクに直面させたりする可能性がある。
我々は、相互補完製品、知的財産権、技術、または業務の許可または買収を含む買収および戦略的パートナーシップに将来的に参加することが可能になった。買収または戦略的パートナーシップは、以下のリスクを含むが、これらに限定されない多くのリスクをもたらす可能性がある
•業務費と現金需要が増加した
•借金や負債を抱えています
•私たちの株式証券を発行することで、私たちの株主資本が希釈されるだろう
•買収された会社の業務、知的財産権、製品と候補薬物の吸収、新規人員の統合の困難
•このような提案された取引を達成できなくても、管理職の既存の製品計画と計画への関心を移す
•私たちは重要な従業員を維持し、重要な業務関係を維持することができる
•そのような取引の他方に関連する不確実性は、その当事者およびその既存製品または候補薬剤の将来性、および規制承認を得る能力を含む;
•私たちは得られた知的財産権、技術、および/または製品から私たちの目標を達成するのに十分な収入を得ることができず、関連する取引と維持コストを相殺することさえできない。
また、このような取引を行うと、債務を負担したり、巨額の使い捨て費用を発生させたり、無形資産を買収したりする可能性があり、将来の巨額の償却費用を招き、私たちの経営業績に悪影響を及ぼす可能性がある。
私たちの業務に必要な材料コストはもっと速く上昇して、私たちの純損失が増加するかもしれません。
近年、我々の業務に必要な材料コストが上昇しており、需要の緊張を受けてコストが上昇し続ける可能性がある。競争と固定価格契約は私たちが既存の運営利益率を維持する能力を制限するかもしれない。コスト増加速度が市場価格より速いことは、私たちの純損失を増加させる可能性があり、私たちの業務と運営結果に大きな悪影響を及ぼす可能性があります。
候補薬物の発見と開発に関するリスク
私たちの薬物発見方法は唯一無二であり、様々な理由で、成功した薬物製品を招くことはないかもしれませんが、これらに限らず、私たちの候補者のための行動機構の挑戦を決定します。
細胞を画像化し,疾患細胞の薬物に対する反応,あるいはいつ正常を示すかどうかを細胞形態を用いて理解した。細胞の形状、構造、形態、および大きさを研究することが、疾患をよりよく理解する正確な方法ではないことが証明された場合、または私たちの予想される生物学的知見または実行可能な候補薬剤をもたらすことができない場合、私たちの薬物発見プラットフォームは、有用でないかもしれないし、成功した医薬製品をもたらす可能性があり、または私たちは新しいビジネスモデルに転換しなければならない可能性があり、いずれも私たちの名声および運営結果に悪影響を及ぼす可能性がある。もし候補薬物の作用機序が未知であれば、治療効果の角度から最適な先導化合物を選択して最適化を行い、そして安全性に影響する可能性のある潜在的な非標的副作用を避けるかもしれない。このような不確実性は、後期臨床試験に関連する費用が潜在的な治療効果および/または安全性問題に関連するリスクレベルを増加させ、FDAまたは他の規制機関がINDおよび/または新薬申請(NDA)を承認することに挑戦する可能性があるため、大型製薬会社とのパートナーシップを確立することをより困難にする可能性がある。
我々の候補薬物は臨床前あるいは臨床開発段階にあり、これは長くて高価な過程であり、結果は不確定であり、実質的な遅延が出現する可能性がある。
私たちの現在の候補薬物は臨床前あるいは臨床開発段階にある。私たちはすべての候補薬物を市場に投入する前に、臨床前研究を成功させ、適切な規格に従って候補薬物を生産し、広範な臨床試験を行い、人体上の安全性と有効性を証明し、FDAと他の適切な監督管理機関の上場許可を得なければならないが、私たちはまだこれをする能力があることを証明していない。臨床試験は費用が高く,設計と実施が困難であり,完成まで数年かかる可能性があり,結果はまだ確定していない。臨床試験の失敗はテストのどの段階でも起こる可能性がある。臨床前開発試験と早期臨床試験の結果は今後の成功を予測できない可能性がある
臨床試験と臨床試験の中期結果は必ずしも最終結果を予測できるとは限らない。我々は,第一段階臨床試験を行うとともに,動物試験による検証結果や動物試験での結果の検証を必要とすることなく,我々の薬物発見プラットフォームにおける細胞モデルから患者への直接の開発を加速することができる。もし私たちのいくつかの候補薬がヒト試験前に動物で試験されていなければ、この方法は私たちの成功に追加のリスクをもたらすかもしれない。
いくつかの臨床段階の候補薬剤があり,これらの候補薬剤の第1段階または第2段階研究に適したIND申請がFDAや他の規制機関に提出される予定である。私たちは予想された時間内にこのようなINDまたは任意の他の候補薬剤のINDを提出することができず、そのような研究を開始することができず、どのような遅延も任意の追加の製品開発スケジュールに影響を与える可能性がある。さらに,INDの提出がFDAや他の規制機関にさらなる臨床試験の開始を許可することをもたらすか,あるいは開始されると,これらの試験の一時停止または終了を要求するという問題は生じない。これらの臨床試験の開始のいずれもFDAや他の規制機関との検討に基づいて最終的に試験設計を決定する必要がある。これらの規制機関によって適用される要求またはその管理法規は、いつでも変更される可能性があり、これは、現在予想されているよりも厳しい承認条件および/または追加またはより長い臨床試験を達成する必要がある可能性がある。我々の臨床試験の成功は,NDAをFDAに提出するための前提条件であり,欧州医薬品局(EMA)と医薬品·保健製品規制機関(MHRA)に各候補薬剤のマーケティング許可申請(MAA)を提出し,最終的に各候補薬剤を承認してビジネスマーケティングを行うための前提条件でもある。私たちの将来の臨床試験が時間通りに始まるかどうか、あるいは予定通りに完成するかどうかはわからない。
私たちは、将来、私たちの臨床試験を完成する前に研究を開始したり、臨床試験を開始したり、完成したりする上で遅延に遭遇する可能性があり、または任意の臨床試験中または任意の臨床試験の結果として多くの予測不可能なイベントが発生する可能性があり、これらのイベントは、追加のコストを発生させる必要があるか、または上場承認を得ることを遅延または阻止するか、または私たちの候補薬剤を商業化する能力を含むが、以下の1つまたは複数に関連するものに限定されない
•規制機関、機関審査委員会(IRBs)または道徳委員会は、私たちまたは私たちの研究者が臨床試験を開始するか、または予想される試験場所で臨床試験を行うことを許可してはならない
•私たちは、予想される試験地点および予期される契約研究機関(CRO)と許容可能な条項について合意または合意できない可能性があり、その条項は、広範な交渉を必要とする可能性があり、異なるCROと試験地点との間に有意な差がある可能性がある
•私たちの候補薬物の臨床試験に必要な参加者の数は私たちの予想より多いかもしれません。これらの臨床試験の登録速度は私たちが予想していたより遅いかもしれません。あるいは参加者は臨床試験を脱退したり、私たちが予想以上の速度で戻ってきて治療後のフォローアップを行うことができないかもしれません
•私たちまたは私たちの第三者請負業者は法規の要求を守らないかもしれません。彼らの契約義務をタイムリーにまたは根本的に履行せず、臨床試験案から外れたり、試験を脱退したりすることは、新しい臨床試験場所や研究者を増やす必要があるかもしれません
•候補薬物の供給や品質、あるいは候補薬物の臨床試験を行うために必要な他の材料が不足している可能性があり、遅延または不足している可能性がある
•私たちの候補薬の生産過程に遅延がありました
•報告は、我々の候補薬剤の安全性、有効性、または他の懸念を向上させる他の療法の臨床前または臨床試験に由来する可能性がある
•臨床試験は、候補薬剤が副作用または他の予期しない特徴を有することを決定することを含む、我々の候補薬剤に対して不確定、混合または否定的な結果をもたらす可能性があり、この場合、私たちは、私たちの調査者または監督機関、IRBsまたは道徳委員会が、試験の一時停止または終了を要求することを決定するかもしれない。
私たちが開発段階を経験する過程で、私たちは時々公表し、未来に私たちの臨床試験の一時的な頂線あるいは初歩的なデータを公表する予定である。臨床試験の中期データは、参加者登録の継続とより多くのデータの獲得に伴い、1つまたは複数の臨床結果が実質的に変化する可能性があるというリスクに直面している。初期または最も重要なデータも監査と確認手続きを受けなければならず、これは最終データが以前に公表された予備データと大きく異なる可能性がある。したがって、最終データを得る前に、中期と予備データを慎重に見なければならない。初期または中期データと最終データとの間の不利な違いは、私たちのビジネスの将来性を深刻に損なう可能性があります。
もし私たちがテストや規制承認に遅延があったら、私たちの製品開発コストは増加するだろう。われわれの将来の臨床試験が計画通りに開始されるかどうかは不明であり,現在あるいは将来の臨床試験が再構成が必要かどうか,あるいは予定通りに完成するかどうかも分からない。もし私たちが決めたり
臨床試験を中断または終了する必要がある場合は、そのプログラムの製品開発を放棄することができます。また、前臨床試験または臨床試験の大幅な遅延は、当社の医薬品候補を独占的に商業化する期間を短縮したり、競合他社が当社よりも早く製品を市場に投入させたり、当社の医薬品候補の商業化を成功させる能力を損なう可能性があります。当社の前臨床開発プログラムまたは臨床開発プログラムの遅延または好ましくない結果は、当社の事業、業績および見通しに著しい損害を与える可能性があります。
もし私たちが臨床試験の患者登録過程で遅延や困難に遭遇した場合、必要な規制承認を受けることは延期または阻止される可能性がある。
米国外の FDA または同様の規制当局が要求するように、これらの試験の適格な参加者を十分に特定し、タイムリーに登録できない場合、現在または将来の医薬品候補に対する臨床試験を開始、継続、完了することができない場合があります。潜在的な参加者を探すプロセスは、現在予想されているよりも費用がかかる可能性があり、以下の要因を含むがこれらに限定されないため、適格な参加者を登録する能力が制限されたり、登録が予想よりも遅くなる可能性があります。
•調査中の病気の重症度は
•参加者が特定の特徴や疾患を有していることなど、当該臨床試験の適格基準。
•適切なゲノムスクリーニングテストの利用可能性
•研究を受けた候補薬の既知のリスクと利益
•臨床研究を完成させるのに十分な数の参加者を特定し、募集することは困難である
•私たちは適切な能力と経験を持つ臨床試験研究者を募集することができます
•医師の転職のやり方
•競争相手が私たちと同じ適応の候補薬を治療するための臨床試験や、競争療法の有用性と有効性を行っているかどうか
•私たちは試験期間と実験後に参加者を十分に監視し、参加者のインフォームドコンセントとプライバシーを維持することができる
•潜在的参加者の臨床試験地点の近似性と利用可能性
•新冠肺炎の大流行、自然災害、全世界の政治不安定、戦争または他の外部事件のような流行病または他の公衆衛生危機は、参加者、主要な研究者、研究者、または臨床場所の利用可能性を制限する可能性がある;
•登録された参加者たちは臨床試験の危険を達成できない。
もし個人が何らかの理由で私たちの学習に参加したり、完成したりしたくない場合、あるいは私たちが登録または参加の面で他の困難に遭遇した場合、参加者を募集し、研究を行い、監督部門の潜在的な製品の承認を得る時間が遅れる可能性がある。
私たちが計画した臨床試験、あるいは私たちの現在と未来の潜在的協力者の臨床試験は、成功しないかもしれない、あるいは私たちの臨床前または非臨床研究に見られない重大な不良事件を明らかにする可能性があり、これは安全状況を招く可能性があり、規制部門の許可または市場が私たちの任意の候補薬物を受け入れることを阻害する可能性がある。
どの製品の商業販売の規制承認を得る前に、私たちの候補薬物は各目標適応において安全かつ有効であることを臨床前研究と臨床試験を通じて証明しなければならない。臨床試験では,いつでも失敗する可能性がある。著者らの候補薬物の臨床前研究と早期臨床試験の結果は後期臨床試験の結果を予測できない可能性があり、臨床試験の初歩的な成功はこれらの試験が完成した後に得られる結果を予測できないかもしれない。臨床試験を行ったところ,候補薬物の失敗率は極めて高かった。非臨床研究と初歩的な臨床試験で進展が得られたが、臨床試験後期段階の候補薬物も期待される安全性と有効性を示すことができない可能性がある。生物製薬業界のいくつかの会社は高級臨床試験で重大な挫折を受け、早期の試験で良好な結果を得たが、治療効果の不足或いは受け入れられない安全性の問題が存在する。大多数の臨床試験を開始する候補薬物は発売が許可されたことがなく、著者らの現在或いは未来のいかなる臨床試験が最終的に成功或いは著者らの任意の候補薬物の更なる臨床開発を支持することを保証することができない。
多くのまれな疾患や他の疾患を治療する方法のように,我々の候補薬を使用することで副作用が生じており,将来副作用がある可能性が高い。現在または将来の候補薬において重大な有害事象または他の副作用が観察された場合、臨床試験で参加者を募集することは困難である可能性があり、彼らは私たちの試験を脱退するか、または1つ以上の候補薬の試験または開発を完全に放棄することを要求される可能性がある。また,候補薬物を1つまたは複数の疾患療法と組み合わせて開発すると,副作用を正確に予測することはより困難である可能性がある。我々、FDA、他の適用可能な規制機関、またはIRBは、そのような試験の対象が許容できない健康リスクまたは副作用に直面していると考えることを含む、様々な理由で候補薬剤の臨床試験を随時一時停止または終了することができる。生物技術業界で開発されたいくつかの潜在療法は最初に早期試験で治療の将来性を示したが、その後それらが副作用を産生し、それらの更なる発展を阻害することを発見した。副作用が製品の発売承認の獲得や保持を妨げなくても,他の療法と比較して耐性があるため,副作用は承認された製品への市場の受け入れを阻害する可能性がある。どのような事態の発展も、私たちの業務、経営業績、見通しに実質的な損害を与える可能性があります。
米国以外では候補薬物の臨床試験を行っており,FDAや類似の外国規制機関はこのような試験のデータを受け入れていない可能性がある。
私たちはすでにアメリカ以外の場所で臨床試験を行いました。イギリスとオランダを含めて、将来的にはアメリカ以外の場所でより多くの臨床試験を行うことを選択するかもしれません。場所はオーストラリア、ヨーロッパ、アジア、あるいは他の管轄区域を含むかもしれません。FDAは米国国外で行われた臨床試験の試験データを受け入れ、FDAのすべての臨床試験要求を満たすことが要求されている。また、米国国外で行われた臨床試験のデータが米国での上場承認の唯一の根拠となろうとしている場合、FDAは通常、(I)このデータが米国の人口および米国の医療実践に適用されない限り、外国データのみに基づいて申請を承認することはない。(I)この試験は公認能力を有する臨床研究者によって行われる。および(Iii)データは、FDAによる現場検査を必要とすることなく、有効であると考えることができ、または、FDAがこのような検査を行う必要があると考える場合、FDAは、現場検査または他の適切な手段でデータを検証することができる。多くの外国監督管理機関は似たような承認要求を持っており、このような外国裁判は裁判を行う外国司法管轄区に適用される現地法律の制約を受ける。FDAや同様の外国規制機関が米国や適用司法管轄区域以外で行われた試験データを受け入れることは保証されない。FDAや同様の外国の規制機関がこのようなデータを受け入れない場合、追加の試験が必要になり、これは高価で時間がかかり、私たちの業務計画の様々な側面が遅延し、私たちの候補薬が適用司法管轄区域で商業的な承認や許可を得ることができない可能性がある。
英国が2020年1月31日にEUから離脱し、2020年12月31日の移行期間が終了するにつれて、EUとイギリスは、特定の商品やサービスを保証するゼロ関税貿易を含む将来の関係のいくつかの側面を規範化する貿易·協力合意に達した。イギリスの薬品に対する監督管理枠組みはEU指令と法規に由来するため、イギリスの離脱はイギリスの未来の製品と候補薬物に適用される監督管理制度に実質的な影響を与える。長期的には、イギリスはEUとは異なる独自の立法を制定する可能性があり、これは、1つまたは2つの司法管轄区域での私たちの候補薬の上場承認を延期または排除する可能性がある。
我々の候補薬物の目標患者群の発病率と流行率を正確に決定することは困難である。もし私たちの候補薬物の市場機会が私たちが推定したものよりも小さい場合、または私たちが得た任意の承認が患者集団のより狭い定義に基づいている場合、私たちの収入と利益を達成する能力は不利な影響を受け、実質的な可能性がある。
商業販売のために承認されても、私たちの候補薬物の総潜在的市場は、最終的に(I)最終ラベルに含まれる適応および診断基準、(Ii)医学界の受容の程度、および(Iii)患者の参入、製品定価、および第三者支払者の精算に依存する。私たちの候補薬物の目標患者数は予想を下回る可能性があり、患者は私たちの製品治療を受け入れられないかもしれない、あるいは新しい患者はますます識別や接触が困難になる可能性があり、これらはすべて私たちの運営結果および業務に悪影響を及ぼすだろう。私たちの限られた資源と資金を得る方法や他の理由で、私たちはいくつかの候補薬を優先的に開発しなければならない。これは間違った選択であることが証明され、私たちの業務に悪影響を及ぼす可能性がある。
現在開発中の候補薬以外に他の治療機会を探索しようとしているが,様々な理由で可能な新薬候補を見つけて臨床開発を行うことができない可能性がある。
我々の既存と計画中の候補薬物を開発してより多くの適応を獲得し、新しい候補薬物と疾病標的を決定するために、研究計画は最終的に成功するかどうかにかかわらず、大量の技術、財政と人的資源を必要とする。例えば,羅氏遺伝子技術プロトコルによると,我々は羅氏遺伝子技術会社と協力して,小分子候補薬の発見に関する様々な項目を開発しており,これらの候補薬物は神経科学や腫瘍学の“重要な分野”を治療する可能性がある。この方法を用いて潜在的な標的を見つけることは保証されず,目標条件が治療可能であるか,あるいは臨床試験が成功することは保証されない。われわれの研究計画は当初,潜在的適応および/または候補薬物の決定に希望を示す可能性があったが,様々な原因で臨床開発結果が得られなかったが,以下のような原因を含むが,これらに限定されない
•使用された研究方法は、我々のデータベースに提示される限られた患者サンプル、および特定の細胞背景からの洞察に基づいて他のより関連する細胞背景の推定に適用できない可能性のある有効性を含む、潜在的適応および/または候補薬剤の識別に成功しない可能性がある
•さらなる検討の後、潜在的な候補薬剤は、それらが有効な製品である可能性が低いことを示す有害な副作用または他の特徴を有することが証明される可能性がある;または
•私たちの候補薬のためにより多くの治療機会を探すこと、あるいは内部研究計画を通じて適切な潜在的候補薬を開発することは、私たちが分配したより多くの人力と財力資源を必要とする可能性があり、それによって、私たちの開発、多様化、製品の組み合わせを拡大する能力を制限する。
私たちの財力と人的資源が限られているため、私たちはいくつかの研究項目、候補薬物と標的適応を優先し、集中しなければならず、他の項目を放棄しなければならない。したがって、私たちは、他の候補薬または後に、より大きな商業的潜在力またはより大きな成功可能性を有する他の適応を求める機会を求める機会を放棄または延期することができるかもしれない。私たちの資源配分決定は私たちが実行可能な商業製品や利益のある市場機会を利用できないかもしれない。
したがって、私たちの候補薬のためにより多くの治療機会を決定することができる保証はなく、あるいは内部研究計画を通じて適切な潜在的候補薬を開発することができ、これは私たちの将来の成長と将来性に実質的な悪影響を与える可能性がある。
もし私たちがアメリカや他の管轄区域で私たちの候補薬物のために必要な規制承認を得ることができない場合、あるいは承認が制限された場合、私たちはこれらの管轄区域の候補薬物を商業化することができない、あるいは商業化の面で遅延または制限され、私たちの収益能力は深刻な損害を受ける可能性がある。
私たちの候補薬物とその開発と商業化に関連する活動-それらの設計、テスト、製造、安全性、有効性、記録保存、ラベル、貯蔵、承認、広告、販売促進、販売、流通、輸入、輸出を含めて、米国FDAと他の規制機関、および他の国の類似機関によって全面的に規制されている。私たちがどんな候補薬を商業化することができる前に、私たちは発売承認を受けなければならない。2023年12月31日まで、私たちのすべての候補薬は開発中で、私たちはまだ私たちの候補薬物の発売に対する司法管轄区域の監督部門の許可を受けていません。私たちの現在と未来の候補薬は絶対に規制と発売承認を受けないかもしれない
私たちの規制機関への提出と支援申請の経験は限られており、この過程でCROおよび/または監督コンサルタントに依存して助けてくれると予想される。監督部門の承認を得るためには,各監督機関に広範な臨床前と臨床データおよび支持情報を提出し,候補薬物の安全性と有効性を決定する必要がある。また、関連規制機関に製品製造過程に関する情報を提出し、製造施設を検査することも求められている。私たちが私たちのプラットフォームを使用してデータを生成する薬物発見の新しい方法を考慮すると、規制機関は私たちのプラットフォームから派生したいかなる候補薬物も承認しないかもしれない。彼らはまた、私たちのプラットフォームと施設、製造と研究実践を検査することを選択することができ、これは、研究や市場許可を行う前に解決し、修復しなければならない規制欠陥を発見することができるかもしれない。
米国でも海外でも、規制の承認を得る過程は高価であり、長年の時間を要することが多い。FDAまたは同様の外国の規制機関が追加の臨床前または臨床試験を要求した場合、承認が本当に承認された場合、承認が遅れる可能性がある。FDAと他の国の同様の規制機関は、承認過程において大きな自由裁量権を有しており、任意の申請を受け入れることを拒否することができ、または彼らは、追加の臨床前、臨床、または他の研究を行うために、私たちのデータが承認されるのに十分ではないと決定するかもしれない。私たちの候補薬は、以下の理由を含むが、以下の理由に限定されないが、多くの理由で規制部門の承認を遅らせるか、または承認されない可能性がある
•FDAまたは同様の外国の規制機関は、私たちの臨床試験の設計または実施に同意しないかもしれない
•臨床研究で十分な数の患者を募集することはできないかもしれません
•私たちは、候補薬がその提案に対する適応が安全かつ有効であること、または関連する随伴診断が適切な患者集団を識別するのに適していることをFDAまたは同様の外国の規制機関に証明することができないかもしれない
•薬剤候補は適度にしか効果がないか、望ましくないまたは意図しない副作用、毒性、またはその他の特性を有する可能性があります。
•臨床試験結果はアメリカ食品薬品監督管理局或いは類似の外国監督管理機関が許可した統計的意義レベルに符合しない可能性がある
•薬剤候補の臨床およびその他の利益が安全性リスクを上回っていることを実証できない場合
•FDAまたは同様の外国の規制機関は、前臨床研究または臨床試験データの解釈に同意しないかもしれない
•当社の医薬品候補の臨床試験から収集されたデータが、 NDA またはその他の提出を裏付ける、または米国またはその他の国における規制当局の承認を得るのに十分または十分な質ではない場合。
•FDAまたは同様の外国規制機関は、臨床および商業供給における私たちまたは契約を締結した第三者製造業者の製造プロセスまたは施設に欠陥があるか、または承認されていないことを発見する可能性がある
•FDAや同様の外国の規制機関の承認政策や規制は大きく変化する可能性があり、私たちの臨床や製造データは承認を得るのに十分ではない。
私たちが承認されても、規制部門は私たちの任意の候補薬を承認することができ、その適応は私たちが要求するものよりも少ないか、あるいは限られており、それによって候補薬の商業的潜在力を縮小する。さらに、規制当局は、高価な発売後の臨床試験の表現に基づいて承認されるか、または候補薬物の商業化に必要または必要なラベル宣言を含まない候補薬物を承認する可能性がある
もし私たちが入手できない場合、あるいはアメリカや他の管轄区域の私たちの現在と未来の候補薬物の承認を得ることに遅延がある場合、あるいは承認が制限された場合、候補薬物の商業的な将来性が損なわれる可能性があり、私たちの名声と創造能力は実質的に損なわれる可能性がある。
私たちは私たちの薬物発見協力で資源と現金投資の見返りを絶対に達成しないかもしれない。
我々は同時に薬物発見と開発に従事する協力者のために薬物発見活動を行い、その中には商業前生物技術会社と大手製薬会社が含まれている。これらの協力の下で、私たちは通常、他の資源に加えて、1つ以上の指定された標的に活性を有する分子を認識する私たちの薬物発見プラットフォームおよびプラットフォームの専門家の利点を提供する。この点を考慮すると、私たちは、将来的に(I)株式投資、(Ii)前払い費用、および/または(Iii)オプション費用を得る権利があり、薬物発見目標の特定の開発、規制または商業販売マイルストーンが達成されたときに現金マイルストーン支払い、および潜在的な特許使用料を得る権利があると予想されている。私たちの薬物発見協力から費用と支払いを得ることができず、リターンを実現する能力は、以下のリスクを含むが、これらに限定されないいくつかのリスクの影響を受ける
•私たちの協力者は、候補薬物の開発と商業化を完成または達成できない場合、予期しないコストや遅延が生じる可能性がある
•協力者は、彼らが私たちの協力の努力と資源の数と時間に適用することを決定する上で大きな裁量権を持ち、現在予想されているように彼らの義務を履行しないかもしれない
•協力者は、臨床試験または他の研究の結果、協力者の戦略的重点または利用可能な資金の変化を含む候補薬物の開発または商業化を行わないことを決定する可能性があり、彼らは、私たちの候補薬物と直接または間接的に競争する製品を開発する願望、または資源を移転したり、競争優先順位を創造する外部要素(例えば、買収または業界の減速)を含む
•既存の協力者と潜在的な未来の協力者は、特に内部薬物発見計画を推進する時、私たちと既存の協力を続けたり、新しい協力に入りたくないかもしれないので、私たちをより一般的に競争相手と見なし始めるかもしれない
•協力者は候補薬物または製品の開発、製造、流通またはマーケティングに関する適用法規要件を遵守できない可能性がある
•知的財産権または特許権、契約解釈または第一選択の開発プロセスにおける分岐を含む協力者との分岐は、候補薬物の研究、開発または商業化の遅延または終了、または訴訟または仲裁を引き起こす可能性がある
•協力者が私たちの知的財産権または固有の権利を正確に取得、維持、強制実行、保護することができないかもしれない、または彼らが私たちの固有の情報を使用する方法は、私たちまたは彼らの知的財産権または固有の権利を危険にさらしたり、無効にするための紛争や法的手続きを引き起こす可能性がある
•協力者は、第三者の知的財産権または独自の権利を侵害、流用、または他の方法で侵害する可能性があり、これは、私たちを訴訟および潜在的な責任に直面させる可能性がある
•薬物発見協力は私たちがどんな重要な価値を受ける前に終わるかもしれない。
さらに、私たちは私たちのパートナーに過度に依存して、私たちが許可した分子に情報を提供するか、あるいはそれらを保護した物質組成特許が満期になったので、これらの分子はこれ以上よく保護されていないかもしれない。また,候補薬剤のための活性薬剤成分(API)の品質や数を得ることが困難である可能性があり,あるいは分子の安定性が確保できない可能性があり,これらは臨床試験や候補薬剤を市場に出すために必要である。私たちが他の指示のために用途を変更しようとしている分子については、私たちのパートナーは十分なデータを持っていないかもしれないし、質の悪いデータがないかもしれないし、データの説明を助けてくれないかもしれません。どちらも私たちの協力に失敗する可能性があります。
もし私たちが参加した任意の薬物発見協力が薬物製品の成功と商業化を引き起こさず、それによって私たちにオプション費用、マイルストーン支払い、特許権使用料、または他の支払いを支払うことにつながった場合、私たちがこのような協力で投資した資源は十分な見返りが得られない可能性があり、これは私たちの業務、運営結果、および将来性に悪影響を及ぼすだろう。さらに、私たちは、私たちの協力候補薬剤の開発および商業化に関するいくつかの情報を取得または開示することができないか、または制限される可能性があり、したがって、このような協力下のオプション費用、マイルストーン支払いまたは特許権使用料の状況および可能性を株主に通報する能力は限られている可能性がある。
私たちは激しい競争に直面しており、これは他の人たちが私たちよりも早く、あるいは成功的に製品を発見、開発、商業化することにつながるかもしれない。
バイオ製薬や関連業界の新製品開発と商業化競争が激しい。これまで臨床試験で調査されていなかった新しい化学物質(NCE)や/または以前に調査された既知の化学物質(KCE)を識別·開発するために,技術支援に注力している会社もある。競争力のある会社の中には私たちの方法と同じか似たような科学的方法を採用しており、他の会社では全く異なる方法を使用している。これらの会社には世界各地の大手製薬会社、専門製薬会社、様々な規模のバイオテクノロジー会社が含まれている。規模が小さいか早い段階にある会社も重要な競争相手になる可能性があり、特に大手老舗会社との協力で手配されている。潜在的な競争相手はまた学術機関、政府機関、その他の公共と個人研究組織を含む。私たちと競争あるいは未来に競争する可能性のある多くの会社は製品の研究開発、製造、臨床前テスト、臨床試験を行い、監督管理の承認とマーケティング承認を得る方面で私たちよりずっと多くの財務資源と専門知識を持っている。彼らはまた合格した科学と管理者を募集と維持し、臨床試験場を構築し、臨床試験のために患者を募集し、著者らの計画と相補的或いは必要な技術を獲得する上で私たちと競争する可能性がある。
技術的に支援されている薬物発見の分野では、私たちの方法は湿実験室生物学の組み合わせを用いて独自のデータセットを生成すると信じていますシリコン片我々の閉ループシステムでは,これらのツールが我々を目立たせ,薬物開発計画の開始と推進に競争優位を提供してくれた。さらに,我々の業務の主な競争要因は,(I)我々の計算と予測の正確性,(Ii)実験と計算能力を統合する能力,(Iii)研究計画を臨床開発に成功させる能力,(Iv)資金を調達する能力,および(V)我々のプラットフォーム,パイプ,業務の拡張性を含むと考えられる。
我々が開発·商業化に成功した任意の候補薬剤は,現在承認されている療法や製薬,バイオテクノロジー,その他の関連業界から将来発売される可能性のある新しい療法と競争するであろう。承認されれば、私たちのすべての候補薬物の成功に影響を与える重要な競争要素は、(I)それらの有効性、安全性、利便性および価格、(Ii)非模倣薬および模倣薬競争のレベル、および(Iii)政府医療保健計画、商業保険計画、および他の第三者支払者の獲得可能かつ精算金額である可能性がある。もし競争相手の製品が私たちまたは私たちの協力者が開発する可能性のある製品よりも効果的で、副作用が少なく、より深刻ではなく、より便利で、あるいは競争相手が私たちよりも早くFDAや他の規制機関の承認を得て、私たちまたは私たちの協力者が市場に入ることができる前に強力な市場地位を確立することができれば、私たちのビジネス機会は減少または消滅する可能性がある
私たちの独自のツール、技術、および他の競争優位性が変わらず、将来的に適切に参入障壁に発展することができない場合、または私たちと私たちの協力パートナーが他の方法で既存および潜在的な競争相手と効果的に競争できなければ、私たちの業務および運営結果は実質的な悪影響を受ける可能性がある。
我々は複数の計画や候補薬が開発されており,様々な標的適応や治療法が求められているため,特定の候補薬を追求するために限られた資源を利用する可能性があり,より利益や成功の可能性の高い開発機会や候補薬を利用できない可能性がある。
我々は現在,治療法や特定の標的適応を考慮することなく,候補薬物の開発に集中している。私たちの財力と人的資源が限られているため、私たちは潜在的な標的適応や候補薬を追求する機会を放棄または延期する可能性があり、これらの機会は後に、私たちの現在と計画中の開発計画や候補薬よりも大きなビジネス潜在力を持っていることが証明された。私たちの資源配分決定は私たちが実行可能な商業製品や利益のある市場機会を利用できないかもしれない。現在および将来の研究開発計画および他の特定の適応の将来の候補薬への支出は、商業的に実行可能な未来の候補薬を生成しないかもしれない。
私たちと私たちの協力者は、私たちまたは彼らが発表した時間範囲で予想される発見と開発マイルストーン、および他の予想された重要なイベントを達成できないかもしれません。これは私たちの業務に悪影響を与え、私たちの株価を下落させる可能性があります。
著者らは時々公開声明を発表し、いくつかのマイルストーンと重要な事件の予想時間、例えば著者らの内部薬物発見計画中の臨床前と臨床研究の開始と完成、及び著者らの協力下の発展とマイルストーンを説明した。我々の協力者、例えば羅氏遺伝子技術会社も、私たちと協力したプロジェクト開発期待について公開声明を発表し、将来的に彼らが私たちと協力する目標と期待についてより多くの声明を発表する可能性がある。多くの要因のため、これらの活動の実際の時間は、(I)私たちまたは私たちの現在および未来の協力者の薬物発見および開発計画の遅延または失敗、(Ii)私たちと私たちの現在および未来の協力者が投入する時間、努力、および資源の数、および(Iii)薬物開発過程に固有の多くの不確実性のような大きな違いがあるかもしれない。したがって、私たちまたは私たちの現在と未来のパートナーの計画が私たちまたは彼らが発表または予想された時間範囲内で推進または完了することを保証することはできない。もし私たちまたは任意のパートナーがこれらのマイルストーンのうちの1つまたは複数または他の重要なイベントを計画的に達成し、発表できなかった場合、私たちの業務と名声は実質的な悪影響を受ける可能性がある。
私たちのプラットフォームやデータに関連するリスクは
私たちはすでに研究開発に投資して、私たちの薬物発見プラットフォームをさらに強化することは、私たちの使命に重要です。もしこれらの投資のリターンが私たちの期待や発展速度よりも遅くなれば、私たちの業務と経営業績は影響を受ける可能性があります。
私たちの薬物発見プラットフォームは生物、化学、自動化、データ科学と工学にまたがる技術革新を統合することで生物学の使命を復号する核心である。このプラットフォームは、独自の生物学的および化学的データセットを生成するための高度なインフラストラクチャ層と、カスタマイズソフトウェア、アルゴリズム、および機械学習ツールのセットである再帰的地図とを含む。私たちのプラットフォームは、私たちのソフトウェア、ハードウェア、データベース、および関連ツールおよび機能の持続的、効率的かつ信頼性の動作、および私たちのデータの完全性に依存します。私たちが候補薬物を開発し、収入を増加させる能力は、私たちのプラットフォームの能力を強化し、改善することに大きくかかっている。我々のプラットフォームの任意の改善が成功するかどうかは、(I)ハードウェア解決策の革新、(Ii)計算記憶および処理能力の増加、(Iii)より先進的なアルゴリズムの開発、および(Iv)重要および新興用例を識別し、これらの用例に必要なデータに対応するために新たな効果的な革新を迅速に開発するような追加の生物学的および化学的データを生成することに依存する
私たちはすでに投資しており、私たちのプラットフォームをさらに強化するために、研究開発、買収、許可協定に投資し続ける予定です。これらの投資は、任意の新しいソフトウェアまたはハードウェア強化、または被買収会社または第三者許可者からのソフトウェアまたはハードウェア統合が、タイムリーまたはコスト効果のある方法では発売できない可能性があり、技術発展のペースについていけない可能性があり、または大量の収入を生成するために必要な機能を実現できない可能性があるなど、大量の時間、リスク、および不確実性を含む可能性がある
私たちの独自のソフトウェアツール、ハードウェア、そしてデータセット自体が複雑だ。私たちは時々私たちのソフトウェアとハードウェアで欠陥、脆弱性、または他のエラーを発見します。これらのエラーは私たちが新しい候補薬物を発見するためのデータセットを生成し、将来私たちのソフトウェアとハードウェアにおける新しいエラーを検出するかもしれません。新しいソフトウェアまたはハードウェアが初めて導入されるか、または既存のソフトウェアまたはハードウェアの新しいバージョンが実装されるか、または強化されると、エラーのリスクは特に顕著である。当社の独自のソフトウェアおよびハードウェアツールと、私たちのデータまたはサード·パーティシステムおよびデータとのインターフェースは、エラーを引き起こす可能性もあります
もし私たちが私たちの薬物発見プラットフォームを強化することに成功しなかった場合、あるいはもし私たちのプラットフォームに何かの欠陥や中断があって、適時に解決されなかった場合、私たちは新しい革新を開発し、最終的に私たちの製品と発見に対する市場の受容度を得る能力は実質的な悪影響を受ける可能性があり、私たちの名声、業務、運営結果、将来性は実質的な損害を受ける可能性がある。
私たちの情報技術システムやインフラが故障したり、セキュリティホールや事故に遭遇したりする可能性があり、私たちの業務や運営に悪影響を与え、責任を負わせる可能性があります。
我々は,データとハードウェアインフラストラクチャがサポートするソフトウェアツールの複雑さの著しい増加を経験した.私たちは、当社または第三者プロバイダによって所有され維持されている情報技術システムおよびインフラに大きく依存して、機密および固有情報およびデータ(知的財産権、独自サービス情報および個人情報を含むがこれらに限定されないが含まれる)を生成、収集、格納、送信し、当社のビジネスを運営しています。また、業務要素を第三者にアウトソーシングし、第三者から製品およびサービスを取得し、第三者と協力して薬物発見を行い、それぞれが私たちの機密または独自の情報を取得することができるか、または取得することができる
私たちは、私たちの情報技術システム、インフラ、データのリスクを低減するために、一連の技術とプログラム制御を展開し、実行し、私たちのデータの可用性、セキュリティ、完全性を維持するために努力しており、このような検出と予防作業は引き続き大きなコストを発生させることが予想される。これらの措置にもかかわらず、私たちの情報技術および他の内部インフラシステムは、故障、中断、セキュリティホールおよび事故のリスク、または様々な原因や出所からの他の被害に直面しており、機密または独自の情報を共有する私たちの第3の側面と同様のリスクに直面し、私たちに大きな影響を与える類似の事件を経験する可能性がある。これらの原因またはソースは、以下の点を含むが、これらに限定されない
•サービスが中断する
•システムの故障
•コンピュータウイルスや他の悪意のあるコード
•自然災害
•世界的な政治は不安定です
•戦争
•電気通信や電気の故障
•私たちの従業員または第三者提供者の不注意または意図的な行動;
•悪意のある第三者のネットワーク攻撃は、脅迫ソフトウェアおよびマルウェアの配備、サービス拒否攻撃、社会工学、および他の手段を含み、サービスの信頼性に影響を与え、情報の機密性、完全性、および利用可能性を脅かす。
サイバー攻撃に関しては,サイバー犯罪者が使用する技術はしばしば変化し,開始前には認識されない可能性があり,組織犯罪分岐機関,テロ組織,敵対する外国政府や機関など,様々な動機(工業スパイ活動を含む)や専門知識を持つ外部団体や個人を含む様々な出所から来ている可能性がある.このような危険はロシアとウクライナの間の紛争などの地政学的事件と関連があるかもしれない。我々にとっては,実際かつ疑わしいネットワークセキュリティ違反や事件を調査·緩和するコストが高い可能性がある.私たちはすべての種類の安全脅威を予見できないかもしれないし、このようなすべての脅威に対して効果的な予防措置を取ることもできないかもしれない。さらに、モバイルデバイスを使用することを含む遠隔で作業が行われている。これは,我々のネットワークセキュリティリスクを増加させ,データアクセス可能性の問題をもたらし,通信中断の影響を受けやすくなる可能性がある.
私たちは、2023年12月31日まで、重大な中断または事件を経験していないにもかかわらず、ネットワーク攻撃、セキュリティホール、およびイベント、および他のシステム障害を経験し続ける可能性がある。私たちのデータの損失、破損、利用不可能、または破損は、私たちのプラットフォームから得られた知見を妨害し、破壊し、私たちの臨床試験データの完全性を損なう可能性があり、規制の遅延を招き、あるいは私たちの候補薬物を承認させることができない。もし私たちが私たちのインフラ需要と故障を正確に予測して識別し、適時に私たちのインフラを強化することができなければ、あるいは私たちの救済努力が成功しなければ、私たちのビジネス運営と開発計画が実質的に破壊され、私たちの商業秘密、個人情報、または他の独自または敏感なデータの紛失や不正流出を含むかもしれない。不正取得、開示、または他の方法で私たちの知的財産権または他の固有情報を処理するセキュリティホールまたはイベントは、競争相手が私たちとより効率的に競争できるように、私たちの知的財産権に影響を与える可能性もあります。同様に,我々は第三者に依存して候補薬を生産して臨床試験を行っているため,彼らのシステムや操作に関連する類似事件も我々の業務に重大な悪影響を与え,規制機関の行動につながる可能性がある
さらに、任意のセキュリティホールまたは他のイベントは、臨床試験対象、請負業者、役員または従業員に関する個人情報を含む、紛失、不正アクセス、開示、または他の方法で個人情報を処理し、または、このような状況が発生したと考えて、私たちの名声を損なう可能性があり、連邦および/または州通知法および外国と同等の法律を遵守させ、強制的な是正措置の制約を受け、他の方法で個人情報のプライバシーおよび安全を保護する法律法規下の責任を負わせる可能性がある。より多くの情報については、“リスク要因-私たちは、プライバシー、データ保護、データセキュリティに関する米国や外国の法律によって制約されており、これは、遵守することなく、巨額のコンプライアンスコストを招き、大きな責任を負う可能性があります”を参照されたい。
障害、中断、セキュリティホールおよびイベント、ネットワーク攻撃、および当社の業務で処理または維持されているデータまたは当社の業務で使用されている情報技術システムまたはインフラに影響を与える有害事象は、私たちの情報技術システムまたはインフラの損失または破損、または機密、独自または個人情報を損失または不適切な取得、開示、または他の方法で処理し、またはこれらの情報が発生したと考えられ、失われた、法執行措置、規制機関の調査、訴訟および他の行動、処罰、罰金、賠償要求、訴訟、潜在的な民事または刑事責任、協力者が自信を失うリスクに直面する可能性があります。私たちの名声と他の結果を損なうことは、私たちの業務と運営結果に実質的な悪影響を及ぼすかもしれない。私たちは、情報技術システムの障害または違反に関連するいくつかの費用および責任に保険を提供していますが、そのようなイベントに関連するすべての損失をカバーするのに十分ではないかもしれません。しかも、私たちは未来に満足できる条項や全くそのような保険を受けることができないかもしれない。また,我々と業務往来のある第三者の情報科学技術システムが妨害,警備ホールや事故の影響を受けていれば,十分な追跡権がない可能性がある.
サーバシステムの利用可能性は、またはインターネットまたはクラウドベースのサービスとの通信中断、またはそのようなシステムに格納されたデータのセキュリティ、セキュリティ、アクセス可能性、または完全性を維持することができず、私たちのトラフィックを損なう可能性がある。
我々は、Google CloudやAmazon Web Servicesなどのクラウドインフラストラクチャサービスを含む第三者データセンターや電気通信ソリューションに依存し、私たちの技術プラットフォームの大部分を管理し、私たちの業務運営をサポートしています。私たちは、単一の第三者またはその運営への依存を最大限に減らすことでリスクを低減しようとしているにもかかわらず、これらのクラウドベースのサービスまたは他の第三者プロバイダに対して制御権を持っていない。インフラ変更、人為的またはソフトウェアエラー、ウェブサイトホスト中断、および容量制限を含む様々な要因のため、私たちは、将来、再びシステム中断、中断、または遅延を経験する可能性があると予想されています。クラウドベースの解決策に影響を与える長期的なサービス中断は、私たちの名声を損なうか、または他の方法で私たちの業務に実質的な損害を与える可能性があります
さらに、第三者データセンターやクラウドインフラストラクチャプロバイダのセキュリティ対策がネットワーク攻撃や他の方法で破壊され、私たちの情報技術システムやデータに不正なアクセスが行われた場合、私たちの運営中断、独自または機密情報の損失を招く可能性があり、これは私たちの名声を損なう可能性があり、巨額のコストを発生させ、私たちの資源を他の任務から移転させ、私たちを重大な法律や財務リスクおよび責任に直面させ、いずれも私たちの業務、運営結果、将来性に実質的な悪影響を及ぼす可能性がある。このような第三者プロバイダはまた、自然災害、世界的な政治不安定、戦争、停電、電気通信障害、または他の破壊的事件の影響を受ける可能性があり、これらのイベントは、私たちの業務に負の影響を与える可能性があり、代替的なクラウドベースの解決策を得るために巨額のコストを発生させることを要求する。さらに、我々が使用するサード·パーティ·プロバイダ·サービスレベルまたは機能の任意の変化または当社のプロトコルの終了は、私たちのトラフィックに悪影響を及ぼす可能性もあります。
我々の解決策は第三者オープンソースソフトウェア(OSS)を使用しており,これによるリスクは我々の業務に悪影響を与え,可能な訴訟に直面する可能性がある.
我々の解決策には,オープンソース許可の下で第三者から許可を得るソフトウェアが含まれており,将来的にはこのようなオペレーティングシステムを我々の解決策に取り入れていきたい.OSSの使用を効果的に監視し、このようなソフトウェアの品質やソースを検証したり、適用されたオープンソースライセンスの条項や私たちの政策やプログラムを遵守していることを保証することはできません。オープンソースコードソフトウェアの使用は、一般に、侵害クレームまたはコード品質に関するサポート、更新または保証、または他の契約保護を提供しないので、第三者商業ソフトウェアを使用するよりも大きなリスクをもたらす可能性がある。OSSはまたセキュリティホールの影響を受けやすいかもしれない。第三者OSSプロバイダは、それが提供するアプリケーションおよびサービスに関連するサービス中断、データ損失、プライバシー漏洩、ネットワーク攻撃、および他のイベントに遭遇する可能性があり、これは、これらのサービスの効用を低減し、私たちのトラフィックを損なう可能性がある。私たちはまた、許可されたOSSがこれらの側の知的財産権を侵害したと考えていると主張する第三者の訴訟を受ける可能性があり、これは私たちにとって高価な弁護である可能性があり、私たちの解決策を変えるために追加の研究開発資源を投入することを要求します
私たちの製品で人工知能や機械学習を使用することに関する問題は、私たちの業務や運営結果に悪影響を及ぼす可能性があります。
我々は,人工知能と機械学習(“AI”)解決策を我々のプラットフォームに統合し,アプリケーションは我々の運営や薬物発見の流れに重要である.人工知能を利用することには重大なリスクがある。人工知能や機械学習などを使用して発展していく新しい技術に関連する問題は、ブランドや名声の損害、競争損害、法的責任、および新たなまたは強化された政府または規制審査を経験させる可能性があり、これらの問題を解決するための追加コストが生じる可能性があります。現在、人工知能の既知のリスクは不正確、偏見、毒性、知的財産権侵害或いは流用、データプライバシーとネットワークセキュリティ問題、及びデータ源論争を含む。人工知能の使用に関連する知覚または実際の技術、法律、コンプライアンス、プライバシー、安全、道徳、または他の問題は、人工知能に対する大衆の信頼を破壊する可能性があり、これは、私たちの顧客が人工知能を使用した製品およびサービスを採用するのを遅らせる可能性がある。また、人工知能の使用に関連する訴訟や政府規制も、人工知能を使用した製品を開発·提供する能力に悪影響を及ぼす可能性があり、そのようなコストや複雑さを増加させる。“人工知能使用に関連する規制および立法発展は、製品、サービス、および業務においてこのような技術を使用することに悪影響を及ぼす可能性がある”というタイトルの節を参照されたい。このようなシステムに関連する計算コストの性質により、人工知能システムの開発、テスト、配備はまた、私たちの製品のコストプロファイルを増加させる可能性があり、これは私たちのプロジェクト利益率に影響を与え、私たちの業務や運営結果に悪影響を及ぼす可能性があります。また,人工知能は検出しにくい誤りや不足が生じている可能性がある.人工知能を訓練するために使用されるデータまたは人工知能アプリケーションが、生成された内容、分析または提案に欠陥がある、不正確、不完全、広すぎる、または偏見がある場合、私たちの業務、財務状態、および運営結果は悪影響を受ける可能性がある。人工知能を使用した法律構造とその後の法的保護はまだ不確定であり、この分野の法律の発展は、私たちが独占権を実行したり、権利侵害から保護する能力に影響を与える可能性がある。収集や使用に十分な権利がなければ
私たちの人工知能が依存するデータまたは人工知能アプリケーションによって生成される出力については、いくつかの法律、第三者プライバシー権、オンラインサービス条項、または私たちまたはデータプロバイダが参加する他の契約に違反する疑いがあるために責任を招く可能性があります。将来、人工知能アプリケーションを使用することは、顧客や患者の個人データに関連するネットワークセキュリティイベントを引き起こす可能性もある。人工知能アプリケーションを使用することに関連するこのようなネットワークセキュリティイベントは、私たちの名声や運営結果に悪影響を及ぼす可能性があります。
私たちの運営·商業化に関するリスク
我々が開発した任意の候補薬が市場承認を得ても,医師,患者,医療支払者,医学界の他の人がビジネス成功に必要な市場受容度を達成できない可能性がある。
上場許可を得た私たちの候補薬物の商業成功は彼らが医師、患者、第三者支払人と医学界の他の人に受け入れられる市場程度に依存する。市場の受け入れ度は多くの要素に依存するが、以下の要素を含むが、これらに限定されない
•それらの有効性と安全性は肝心な臨床試験で証明され、同業者評議の定期刊行物に発表された
•代替療法を含む任意の類似した非特許療法と比較して、それらの潜在力および知覚優位性
•副作用や有害事象の流行率や重症度
•競争力のある価格でこれらの製品の販売を提供することができます
•私たちは自己援助のような適切な患者面会計画を提供することができます
•代替療法と比較して,投与や投与の利便性と簡便性;
•候補薬物がFDAまたは同様の規制機関によって承認された臨床適応;
•FDAまたは他の外国規制機関のような製品ラベルまたは製品挿入要件は、任意の制限、禁忌症または警告を含む;
•製品がどのように流通するかの制限
•製品が市場に投入されるタイミングを競う
•これらの製品や競合製品や治療法の宣伝
•マーケティングや流通支援の実力
•有利な第三者がカバーして十分な精算をする。
医療製品の販売はまた医者が私たちの薬物製品で治療処方を出したいかどうかに依存しており、これはこれらの医師が製品が安全で、治療が有効であり、コスト効果があると判断した可能性が高い。また,異なる医師団体が作成した治療ガイドラインや,影響力のある医師の観点から製品を取り入れたり排除したりすることは,他の医師が我々の薬物製品を用いて治療を行う意思に影響を与える可能性がある。医師、医師組織、病院、他の医療提供者、政府機関、あるいは個人保険会社が、私たちが開発する可能性のあるどの製品も競争相手の治療法と比較して安全で、治療効果が高く、費用効果が高いかどうかを予測することはできません。もし私たちが開発したすべての候補薬が十分な受容度に達していなければ、私たちは著しい製品収入が生じないかもしれませんし、利益を上げることができないかもしれません。
販売およびマーケティング能力を確立することができない場合、または我々が開発する可能性のある任意の候補薬剤を販売およびマーケティングするために第三者と合意できない場合、これらの候補薬剤が承認された場合、商業化に成功することができないかもしれない。
私たちは販売やマーケティングインフラがなく、医薬製品の販売、マーケティング、流通の面ではほとんど経験がありません。販売およびマーケティングの責務を保持する任意の承認された製品をビジネスに成功させるためには、販売およびマーケティング組織を構築し、販売およびマーケティングソフトウェア解決策を開発するか、またはこれらの機能を第三者にアウトソーシングしなければならない。将来、私たちの候補薬が承認されれば、私たちは私たちの候補薬をマーケティングして販売するために、集中的な販売、マーケティング、および商業支援インフラを確立することを選択するかもしれない。特定の候補薬、適応または地理的地域(米国以外の地域を含む)の商業化活動に参加するために、第三者との協力または戦略的パートナーシップを構築することも選択することができるが、これらの計画を達成できることは保証されていない。
私たち自身のビジネス能力の確立と第三者とのこれらのサービス提供の合意はリスクに関連している。例えば販売員の募集や訓練や精算は
専門家は高価で時間がかかり、どんな製品の発表も延期されるかもしれない。販売チームを募集し、マーケティングや他の商業化能力を確立する候補薬剤の商業発売が何らかの理由で延期または発生していない場合、これらの商業化費用を早期または不必要に発生させる。これは費用がかかるかもしれないし、もし私たちが商業化者を維持したり再配置できなければ、私たちの投資は損失するだろう。承認された製品を自ら商業化することを阻害する可能性があるが、以下の要因を含むが、これらに限定されない
•十分な数の有効な販売、マーケティング、精算、顧客サービス、医療事務、その他の支援者を募集し、維持することはできない
•販売員またはソフトウェアツールは、医師に接触することができないか、または未来に承認された製品を開くのに十分な数の医師を説得することができない
•精算専門家は、処方箋の取得、精算、支払人の他の引受手配について交渉することはできない
•十分かつ魅力的な利益水準を達成するために、十分な価格点を製品価格にすることはできない
•流通ルートが制限されたり閉鎖されたりして、私たちの製品が一部の患者集団に流通しにくくなった
•販売者が提供するセット製品の不足は、より広い製品ラインを持つ会社と比較して競争劣勢になる可能性がある
•独立した商業化組織の作成に関連した予見不可能なコストと費用。
もし私たちが第三者と合意して、販売、マーケティング、商業支援、流通サービスを行えば、彼らも上述した多くの挑戦を経験するかもしれない。また、私たちの製品収入や製品収入の収益性は、私たちが内部で開発する可能性のある任意の製品をマーケティングして販売することよりも低いかもしれません。私たちはそのような計画を成功的に達成できないかもしれないし、私たちは私たちや彼らに有利な条件でそうすることができないかもしれない。私たちはまた、このような第三者に対して制御権がほとんどないかもしれません。彼らのいずれか一方は、必要な資源や注意を投入して、私たちの製品を効果的に販売し、マーケティングすることができないかもしれません。あるいは、彼らは、処方薬製品の販売および普及に関する規制要件および制限(ラベル外販売促進を制限する要求および制限を含む)に従わないために、法律および規制リスクに直面する可能性があります。もし私たちが商業化能力を確立することに成功できなければ、私たち自身も第三者と協力しても、未来に承認された候補薬を商業化することに成功しないだろう。
我々の内部施設や外部サービスプロバイダの実体やデジタルインフラは、規制や運営リスクに関連するリスクに直面している。
ユタ州ソルトレイクシティにある私たちの施設は、FDAのような規制機関の審査や事前承認を経ていない。FDAの検査は私たちがデータを生成し、候補薬物を開発する能力を乱すかもしれない。我々の実験室施設は、著しいレベルの設備自動化を統合し、複数のデジタルシステムを統合し、研究操作の効率を向上させることを目的としている。私たちは業界標準に対する研究操作の高いレベルのデジタル化を実現しようと努力している。これは、運用効率を向上させることを目的としているが、設計問題、システム互換性、または潜在的なネットワークセキュリティホールを含むが、これらに限定されない内部または外部要因のため、追加のデバイス障害リスク、さらにはシステム全体の障害または停止をもたらす可能性がある。これは潜在的な候補薬物識別の遅延や私たちの施設の閉鎖につながるかもしれない。私たちのデータ生成能力のいかなる中断も、新しい候補薬剤をパイプラインに押し上げること、既存の計画を推進すること、または私たちのプラットフォームの能力を強化すること(私たちのデータを拡張することを含む)の遅延をもたらす可能性があり、これらの状況の発生は、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。
将来、私たちの施設で臨床前および臨床使用のための薬物物質や製品を生産することができ、私たちは私たちの限られた以前の製造能力と経験によるリスクに直面するかもしれない。
現在、当社は、前臨床、臨床、または商業用途のための医薬品または製品を製造するインフラまたは能力を内部に持っていません。将来、前臨床および臨床用途の医薬品や製品の製造を決定した場合、適切な施設やインフラの開発や適切な製造プロセスの実施にかかるコストが予想以上に高まる可能性があります。また、施設の完全な稼働状態を実施することが困難であり、前臨床または臨床供給の遅れ、または第三者のサービスプロバイダーに依存する必要があり、計画外の費用が発生することがあります。
自然災害により、リキュレーションまたは当社が依存する第三者が悪影響を受ける可能性があり、当社の事業継続計画や保険が不十分である可能性があります。
私たちの現在の業務はユタ州ソルトレイクシティ、カリフォルニア州ミルピタスとカナダモントリオールにあります。洪水、火災、爆発、地震、極端な天気条件、大流行(新冠肺炎を含む)、電力不足、電気通信故障、世界的な政治不安定、戦争または人為的事件など、自然災害または他の深刻な計画外事件は、私たちの施設を十分に利用できないこと、私たちの候補薬物の開発遅延、業務運営中断、または意外に増加したコストを招く可能性があり、これらはすべて私たちの業務に実質的な悪影響を及ぼす可能性がある。私たちの提携パートナー、そして私たちまたは私たちのパートナーのサプライヤー、ならびに私たちの第三者サービスプロバイダとプロバイダは、同様にこのようなイベントの一部または全部の影響を受けています。自然災害、停電、または他の事件が発生した場合、(I)本社またはデータセンターの全部または大部分を使用することを阻止する;(Ii)私たちの研究施設や第三者契約製造業者の製造施設のような重要なインフラまたは私たちの設備を破損する場合、または(Iii)他の方法で運営を深刻に中断することは、難しいかもしれないし、場合によってはかなり長い間私たちの業務を継続することはできないかもしれない
さらに、深刻な災害や同様の事件が発生した場合、我々の既存の災害復旧および業務連続性計画は十分ではないことが証明される可能性がある。我々の災害復旧と業務連続計画の性質が限られているため、巨額の費用、業務中断、私たちの研究開発計画への損害を招く可能性があります。私たちのリスク管理政策の一部として、ビジネス的に合理的な条項で得られている限り、保険範囲を私たちの業務に適していると思うレベルに維持します。しかし、これらの施設で事故や事故が発生した場合、保険金額は私たちのすべての損害と損失をカバーするのに十分ではないかもしれない
しかも、私たちはユタ州ソルトレイクシティにある施設は忙しい都心に位置している。私たちは私たちの運営が周囲の地域に安全であることを確保するために必要なステップを取っていると信じているが、私たちの施設で可燃性化学品や材料の使用を含む危険材料の研究を行えば、公衆にリスクをもたらす可能性がある。もし周囲のコミュニティが私たちの施設が安全ではないと思ったら、私たちの名声、運営、そして将来性に実質的な悪影響を及ぼすかもしれない。
もし私たちが環境、健康、安全、あるいは他の法律法規を守らなければ、私たちは罰金、処罰、人身傷害あるいは財産損失を受けるかもしれない。
私たちは多くの環境、健康と安全、その他の法律と法規の制約を受けて、それらの研究室の手続きと危険材料と廃棄物の処理、使用、貯蔵、処理と処理を管理する法律と法規を含む。私たちの行動は化学物質、生物学的、そして放射性物質を含む危険で燃えやすい材料の使用に関するものだ。私たちの業務はまた危険な廃棄物製品を発生させるだろう。私たちは一般的に第三者と契約を結び、このような材料と廃棄物を処理する。私たちはこのような材料が汚染や傷害をもたらす危険を除去することができない。もし私たちが危険な材料を使用して汚染や傷害をもたらした場合、私たちは人身または財産による重大な損害に責任を負い、民事または刑事罰金と処罰を要求されるかもしれない。危険材料の使用により従業員が負傷した費用や費用を支払うために労働者賠償保険を維持しているにもかかわらず、この保険はこのようなすべての潜在的な責任を支払うのに十分ではない可能性がある。
私たちの保険証書は高くて、いくつかの商業リスクから私たちだけを保護して、これは私たちを重大な未保険債務に直面させます。
私たちは私たちの業務が直面する可能性のあるすべての種類のリスクに保険をかけておらず、保険範囲はますます高くなっている。私たちは私たちが将来既存の保険を維持し、十分な保険範囲を持つことができるかどうか分からないが、私たちが将来購入したいかなる責任保険も、私たちが受ける可能性のあるいかなる支出や損失を補償するのに十分ではないかもしれない。もし私たちまたは私たちの協力者のために開発可能な任意の候補薬が市場の承認を得たら、商業製品販売を含む保険を購入するつもりですが、商業的に合理的な条項や十分な金額でこのような保険を得ることができないかもしれません。私たちの保険証は現在維持されている保険範囲や保険限度額では十分ではないかもしれません。もし私たちの損失が私たちの保険範囲を超えたら、私たちの財政状況は不利な影響を受けるだろう。私たちの任意の候補薬物の臨床試験や規制承認が一時停止される可能性があり、これは、私たちまたは私たちの協力者が決定する可能性のある任意の候補薬剤の開発および商業化を阻止または制限することを含む、私たちの運営および業務結果に悪影響を及ぼす可能性がある。また上場企業として運営されています
私たちにとっては、役員や上級管理職責任保険を購入する費用がもっと高いです。私たちが十分な役員や上級管理職責任保険レベルを維持していなければ、適格な個人を私たちの取締役会や役員チームでサービスすることはもっと難しいかもしれません。
私たちの純営業損失の繰越といくつかの他の税務属性を利用する能力は限られているかもしれません。
私たちは大量の連邦純営業損失(NOL)を繰り越しています。予想される課税損失が生じ続ける場合、未使用損失は、このような未使用損失が満了するまで、将来の課税収入(あれば)を相殺するために繰り越されるが、2018年度期間およびその後に生成された連邦NOLは無期限繰越される。改正後の1986年の国税法第382条によると、ある会社が“所有権変更”を経験した場合、変更前のNOL繰り越しや何らかの変更前の税収属性(例えば税収控除を検討する)を用いて変更後の収入を相殺する能力が年間制限される可能性がある。所有権変更“は、一般に、1つまたは5%以上の株主が3年以内に会社の持分の所有権を価値で計算して50%を超える変化として定義される。この年次制限は私たちのNOL繰り越しの一部を活用する前に満期になる可能性があります。私たちは過去に382条で指摘された所有権の変化を経験したことがあり、将来私たちは私たちの株式所有権の後続の変化のために、例えば私たちの後続の発行または私たちの株式所有権の後続の変化を経験することができるかもしれない(その中のいくつかの変化は私たちがコントロールできるものではない)。私たちはまだ所有権が変化しているかどうかを評価する研究を行っていない。将来の立法や規制の変化は、NOL繰り越しや他の税金属性を利用する能力にも悪影響を及ぼす可能性がある。州税法の規定はまた、NOLと累積州税収属性を使用する能力を一時停止または他の方法で制限する可能性がある。したがって、もし私たちが利益を達成すれば、私たちは私たちのNOL繰り越しや他の税金属性の全部または実質的な部分を連邦および州の税収目的に使用することができないかもしれません。これは税金負担を増加させ、私たちの将来のキャッシュフローに悪影響を及ぼす可能性があります。
私たちに不利な税金法律または法規の変化は、私たちの業務、キャッシュフロー、財務状況、または経営結果に大きな悪影響を及ぼすかもしれません
新しい収入、販売、使用、または他の税金法律または法規はいつでも公布される可能性があり、これは私たちの税務状況と私たちの業務と財務業績に影響を与える可能性があります。さらに、既存の税金法律、法規、規則、法規または条例は、私たちに解釈、変更、修正、または適用される可能性がある。例えば、2017年の減税·雇用法案(TCJA)は、現在の研究開発支出を差し引く選択を廃止し、納税者に法典174条に基づいて、2022年から5年または15年以内に研究開発支出を資本化·償却することを要求している。また、2022年の“インフレ低減法案”(IRA)などの変化により、2023年1月1日以降に行われた株式買い戻しには1%の消費税が徴収される。私たちに不利な税金法律または法規のさらなる変化は、私たちの業務、キャッシュフロー、財務状況、または経営結果に重大な悪影響を及ぼす可能性があります
重要な会計政策の見積もりや判断が正しくないことが証明されたり、財務報告基準や解釈が変化したりすれば、私たちの経営結果は悪影響を受ける可能性がある。
アメリカ公認会計原則(アメリカ公認会計原則)に従って財務諸表を作成し、経営陣に合併財務諸表と付記中の報告金額に影響を与える推定と仮定を行うことを要求する。我々の推定は、“経営陣の財務状況および経営結果の議論および分析--重要な会計政策および推定の使用”に記載されているような、歴史的経験、既知の傾向および事件、およびこのような場合に合理的と考えられる様々な他の要因に基づいている。これらの見積りの結果は資産や負債の帳簿価値を判断する基礎を構成しており,これらの資産や負債の帳簿価値は他のソースからは明らかではないように見える.私たちの連結財務諸表を作成する際に使用される重要な仮定と推定には、株に基づく報酬と、早期のバイオテクノロジー会社への株式投資の推定値が含まれています。もし私たちの仮説が変化したり、実際の状況が私たちの仮定と違っていたら、私たちの経営結果は不利な影響を受けるかもしれません。
また、私たちは定期的に財務報告基準の適用に対する遵守状況を監視し、私たちに関連する新しい公告と草案を検討します。新しい基準、既存の基準の変化、またはその解釈の変化のために、私たちは私たちの会計政策を変更し、私たちの経営政策を変更し、新しいまたは強化されたシステムを実施して、新しいまたは修正された財務を反映するために必要かもしれない
報告基準、または私たちが公表した財務諸表の再記述を要求される可能性があり、これは私たちの財務状況や名声に悪影響を及ぼす可能性があります。
製品責任訴訟は、私たちが大きな責任を負うことを招き、私たちが開発する可能性のある任意の候補薬物の商業化を制限することができるかもしれない。
ヒト臨床試験における候補薬物試験に関連する製品責任曝露の固有のリスクに直面しており,我々が開発可能な任意の薬物を商業的に販売すれば,より大きなリスクに直面するであろう。もし私たちが私たちの候補薬や薬物による傷害のクレームを自己弁護することに成功できなければ、私たちは重大な損害賠償や和解責任を招くかもしれない。責任クレームは、是非曲直または最終結果にかかわらず、以下の態様を含むが、これらに限定されない悪影響をもたらす可能性がある
•私たちが開発する可能性のある任意の候補薬や療法の需要が減少しています
•私たちの名声とメディアの深刻な否定的な関心を損なう
•臨床試験参加者の脱退
•訴訟を正当化するための巨額の費用
•実験参加者や患者に多額の報酬を与え
•収入の損失
•私たちの候補薬を商業化することはできない。
私たちが後援する臨床試験の保険を含む製品責任保険を維持しているにもかかわらず、私たちが生じる可能性のあるすべての責任をカバーするのに十分ではないかもしれません。より多くの臨床試験を開始するにつれて,任意の候補薬を商業化することに成功すれば,保険カバー範囲を増やす必要があると予想される。保険カバー市場は挑戦性があるかもしれません。私たちの臨床プロジェクトの規模の拡大に伴い、保険カバーのコストは増加します。私たちは可能なすべての責任とすべての責任を満たすために、合理的な費用と十分な限度額で保険範囲を維持できないかもしれない。
私たちが第三者に依存するリスクは
私たちの一部の研究および臨床前試験を実行するか、または私たちの臨床試験を行う第三者が満足できない可能性があり、または彼らのプロトコルが終了される可能性がある。
著者らは現在依存しており、引き続き第三者に依存してある方面の研究、臨床前試験と臨床試験を行う予定である。第三者にはCRO、臨床データ管理組織、医療機関、主要な調査者が含まれる。これらの第三者のいずれかは、最終期限内に研究、テストまたは試験を完了できなかったこと、または私たちまたは彼らが私たちとの契約を終了する可能性があることを含む、その契約義務を履行できないかもしれない。もし私たちがこのような第三者とのいかなる関係も終わらなければ、私たちは商業的に合理的な条項で代替の第三者と合意できないかもしれない。もし私たちが代替計画を達成する必要があれば、そのような交渉は製品開発活動を延期するかもしれない。
我々の第三者研究開発活動への依存は,これらの活動に対する我々の制御を減少させたが,我々の責任を軽減していない.例えば,われわれはそれぞれの臨床試験が試験の全体的な研究計画や案,適用された法律,法規,科学基準に従って行われることを確保する責任がある。現在行われている臨床試験を登録し,完了した臨床試験の結果を一定時間範囲で政府後援のデータベースに発表することも求められている。また、FDAと類似の外国監督機関は、データと報告の結果が信頼性、再現性と正確性を確保し、そして試験参加者の権利、完全性と機密性を保護するために、臨床試験結果を行う、記録と報告する良好な臨床実践(GCP)ガイドラインを遵守することを要求している。監督管理機関は定期的に試験スポンサー、主要な調査人員と試験地点を検査することによってGCPコンプライアンスを実行する
私たちまたは任意の第三者が適用されるGCP法規を遵守できない場合、私たちの臨床試験で生成された臨床データの一部または全部は信頼できないと考えられる可能性があり、FDAまたは同様の外国の規制機関は、追加の非臨床試験または臨床試験を要求するか、または私たちのマーケティング申請を承認する前により多くの患者を募集することができる。さらに、私たちまたは第三者が臨床試験中に私たちが声明した合意または適用された法律法規を遵守できなかった場合、私たちまたは第三者はFDAおよび同様の外国規制機関の警告状や法執行行動を受ける可能性があり、これは民事罰や刑事起訴を招き、私たちの業務の否定的な宣伝を損なう可能性がある
もし第三者が私たちが規定した規程や法規に従って契約職責の履行に成功し、期待期限を満たしたり、臨床試験を行うことができない場合、私たちも私たちが開発する可能性のある任意の候補薬物の上場承認を得ることができないか、または遅延する可能性がある。したがって、私たちは私たちの候補薬物を商業化することを延期したり、成功できないかもしれない。
臨床前開発、臨床試験、および将来の商業化のために我々の候補薬剤を生産する第三者は、許容可能なコストで十分な数の私たちの候補薬剤または製品を提供することができない可能性があり、これは、私たちの開発または商業化努力を延期、損害、または阻害する可能性がある。
私たちは現在どんな製造施設も持っていないし、製造者もいない。私たちは依存し、引き続き第三者に依存して私たちの臨床試験に薬物供給を提供し、私たちの多くの候補薬物の生産は臨床前開発と臨床試験のために使用され、そして私たちの任意の候補薬物が発売承認されれば、私たちの製品の商業製造に使用される。私たちは第三者製造業者と必要な合意を作ったり、許容できる条項でそうすることができないかもしれない。このような第三者への依存は、私たちが十分な数の候補薬剤または製品を持っていないリスクを増加させ、または十分な数の許容可能なコストまたは品質の薬剤を有さず、これは、私たちの開発または商業化努力を延期、損害、または阻害する可能性がある。
また、私たちの契約メーカーが私たちの候補薬を生産するための施設はFDAが承認前検査に基づいて検査しなければならず、承認前検査はFDAにマーケティング申請を提出した後に行われます。私たちは、近い、中期、または長期にわたって私たちの契約製造業者の生産プロセスを制御することを望んでいないし、私たちの契約メーカーが私たちの候補薬物を生産する際に現在の良好な生産実践ガイドライン(CGMP)に完全に依存することもない。もし私たちの契約製造業者が私たちの規範およびFDAまたは他の機関の厳格な規制要件(cGMPガイドを含む)に適合する材料を生産するのに十分な品質管理および合格者を維持できない場合、彼らは規制検査および/またはその製造施設の規制適合性を維持することができないだろう。
FDA または同等の外国の規制当局が、当社の医薬品候補の製造のためのこれらの施設の欠陥を発見し、承認しない、または承認を取り消した場合、当社は代替製造施設を見つける必要がある場合があります。c GMP 規制の下で動作し、当社のために製造できる可能性のあるメーカーは限られています。当社が開発する医薬品候補およびその他の製品は、製造施設または生産能力へのアクセスについて他社の医薬品候補および承認製品と競合する可能性があります。
さらに、当社または当社の第三者メーカーが適用される規制を遵守しなかった場合、臨床的停止、罰金、差し止め、民事罰、承認の遅延、停止または撤回、ライセンスの取り消し、承認される可能性のある医薬品候補または製品の押収またはリコール、運営制限、刑事訴追を含む制裁が課される可能性があります。いずれも当社の事業候補薬の供給と見通しに著しく悪影響を及ぼす可能性があります
第三者製造業者と合意できても、第三者製造業者に依存することは、以下の点を含むが、以下の点を含む追加のリスクをもたらす
·第三者の規制コンプライアンスおよび品質保証への依存を減少させる
•第三者は製造協定に違反する可能性がある
•私たちのビジネス秘密およびノウハウを含む私たちの固有情報を盗用する可能性があります
•第三者は、費用が高い場合、または私たちに不便をもたらした場合に、プロトコルを終了または更新しない可能性がある。
•
私たちの既存または将来の第三者製造業者の任意の性能障害は、臨床開発またはマーケティング承認を延期する可能性があります。このような第三者製造業者を交換する必要がある場合、任意の代替製品を決定し、同定する際に追加コストおよび遅延が生じる可能性があります。さらに、私たちの流通業者のどんな業績ミスも、私たちが開発または商業化を求める可能性のある任意の候補薬物の臨床開発またはマーケティング承認を延期し、追加の損失をもたらし、私たちの製品収入を奪う可能性があります。
私たちの候補薬物や製品を製造·流通する際の他者への依存は、私たちの将来の利益率と、上場承認された製品の商業化をタイムリーかつ競争力的に得る能力に悪影響を及ぼす可能性があることを現在と期待しています。
著者らの薬物開発ルートの成熟に伴い、もし私たちが第三者サプライヤーから十分な臨床と商業用品、設備と活性薬物成分(API)を得ることができなければ、私たちの業務は深刻な損害を受ける可能性がある。
私たちは第三者サプライヤーから私たちのプラットフォームを調達し、運営し、私たちの候補薬物を開発するために必要な原材料、コンポーネント、部品、消耗材、試薬と設備を調達します。私たちはまた第三者サプライヤーに依存して品質テストを行う。我々のプラットフォームが直面している特別なリスクは第三者設備と機器サプライヤー及び消耗品と試薬サプライヤーへの依存を含む。著者らが薬物製品の開発に力を入れ、臨床テストと商業化を開始することに伴い、著者らはサプライチェーン全体の生産能力を拡大する必要がある。私たちは製品の調達と品質検査サービスの面でリスクに直面しています。以下のリスクを含むが、これらに限定されません
•供給者およびサービスプロバイダは、需要を満たすためにその能力を向上させることができず、米国からの需要であっても、他の薬品製造業者からの需要であっても、特に技術支援の薬物発見分野が拡大し続けている場合には、その能力を高めることができない
•サードパーティとのプロビジョニングおよびサービスプロトコルは、私たちに代価または損害を与える方法で、または時間的に終了または更新されない
•我々の業務または運営とは無関係な条件によるこれらの供給者およびサービスプロバイダの運営中断は、公衆衛生危機、世界的な政治不安定、自然災害、サプライチェーン問題または戦争のような供給者またはサービスプロバイダの倒産または不可抗力事件を含む
•規制当局による第三者施設の検査は否定的な結果をもたらす可能性があり、私たちの要求を満たす能力を遅延または終了させる可能性がある。
しかも、私たちのいくつかの専用設備と私たちの候補薬で使用されている原料薬は単一源の供給業者から得られた。私たちは私たちの候補薬物の開発に成功し、最終的に市場需要を満たすために十分な数量の商業製品を提供することができるかどうかは、ある程度私たちが法規の要求に基づいてこれらの製品の設備と原料薬を獲得する能力があるかどうかに依存し、そして臨床試験と商業化に十分な数量がある。私たちは現在、私たちの既存のいかなるサプライヤーも失敗した場合、または私たちの要求を満たすことができない場合に、余分なまたは第2のソースの任意のそのようなデバイスまたは成分を提供するように手配されていません。私たちの単一ソースサプライヤーは過去に通常私たちの製品に対する需要を適時に満たすことができますが、私たちは彼らが私たちの未来の需要を満たすことができるかどうかを確定しません。上記のいかなる要素、私たちとこれらのサプライヤーとの合意の性質、私たちとこれらのサプライヤーとの限られた経験、私たちの顧客としての相対的な重要性、あるいは他のいかなる原因でも、私たちはこれらのサプライヤーとの限られた経験、私たちの顧客としての相対的な重要性、あるいは他の任意の理由である。私たちのすべての候補薬剤について、私たちは、NDAおよび/またはMAAをFDAおよび/またはMAAに提出する前に、他のサプライヤーおよび製造業者がそのような装置および原料薬を提供する資格を可能な限り決定し、同定することを意図しており、これは、追加の規制検査または承認を必要とし、さらなる遅延をもたらす可能性がある。
部品、材料、専用設備、原料薬、および品質検出源の任意の中断または遅延を許容可能な価格でタイムリーに供給することは、私たちの開発努力を阻害、遅延、制限、または阻止する可能性があり、これは私たちの業務、運営結果、および将来性を損なう可能性がある
私たちの知的財産権に関するリスクは
私たちの成功は私たちが十分な範囲の特許を獲得し、維持できるかどうかに大きく依存し、私たちの独自技術と候補薬物製品をカバーしている。特許資産の獲得と維持自体は挑戦的であり、私たちの保留と将来の特許出願は、もしあれば、私たちが必要な範囲で発行されないかもしれない。
私たちのビジネス成功は、私たちの能力、および私たちのライセンシーおよび協力者が米国および他の国で特許保護および他の知的財産権を取得し、維持する能力に大きく依存しており、これらの特許保護および他の知的財産権は、私たちの候補薬剤および私たちの業務の発展および実施に重要な私たちのコアノウハウに関連している
特許訴訟は複雑で高価で長い過程であり、特許が適時に発表されるか、または全く発表されないことを保証することはできず、特許の範囲が十分に広く、私たちの候補薬物や独自技術を保護する保証もない。また、特許を取得·維持する法律·法規は、関連する司法管轄区域の立法または司法行動によって変化する可能性がある。製薬、バイオテクノロジー、医療業界の特許地位
特に他の生命科学会社は,非常に不確実である可能性があり,複雑な法律や事実問題に関連しており,その重要な法律原則はまだ解決されていない。これまで,米国ではバイオテクノロジー特許で許容される特許請求の範囲の広さに関する一貫した政策はなく,すべての技術における特許請求の範囲を決定するための特許可能性の試験も変化している。アメリカ以外の製薬、バイオテクノロジー、その他の生命科学特許法律法規はもっと不確定かもしれない。米国特許商標局(USPTO)および他の管轄地域の特許庁は、特許出願に示される特定の革新のみをカバーするために、製薬および/またはバイオテクノロジー関連発明に関連する特許出願を制限または大幅に縮小することを要求することが多く、競合挑戦に対する保護範囲を制限する。
特許の発行は,その発明性,範囲,有効性,または実行可能性に対して決定的ではなく,我々が所有し許可している特許は,米国や海外の特許庁や裁判所で挑戦される可能性がある。第三者は、私たちの特許権と重複または衝突する方法で、彼ら自身の特許を発明、発表または提出することができる。さらに、挑戦されていなくても、私たちが持っている特許の組み合わせと私たちが許可している任意の特許の組み合わせは、私たちの特許声明をめぐる競争相手の設計を阻止し、類似または代替技術または製品を非侵害的に開発することによって、私たちの所有または許可された特許を回避することができないかもしれません。例えば、第三者は、私たちの1つまたは複数の候補薬剤と同様の利点を提供する競争力のある製品を開発することができるが、製品は、私たちの特許保護範囲内ではない異なる成分を有する。しかも、特許の寿命は限られている。米国では、特許の自然失効時間は、通常、その最初の有効な非臨時出願日の20年後であり、開発、試験、および規制審査に要する時間を考慮すると、候補薬物を保護する特許は、候補薬物の商業化前または直後に満了する可能性がある。各政府特許機関はまた、広範な規則と課金義務を遵守することを要求している。場合によっては、そうしないと、特許出願を放棄したり、特許権を終了したりする可能性がある。特許または特許出願が放棄または失効する可能性のある規定を遵守しないイベントには、規定された期限内に公式行動に応答できなかったこと、費用が支払われていなかったこと、および適切に合法化されず、正式な文書が提出されなかったことが含まれる。
私たちはアメリカ特許商標局と他の特許庁で特許出願を待っています。私たちは未来に新しい出願を提出する予定です。特許庁は、米国特許商標局によって発見された以前の技術または第三者によって提出された材料に基づいて、私たちの権利要件を大幅に縮小することを要求するかもしれない。さらに、協力者と人が可能かもしれない手配によると、私たちはいつも許可特許と出願の準備、提出、起訴、そして維持を制御する権利があるわけではない。私たちはプログラム上の課題に直面するかもしれません各方面間審査は、これは、私たちの特許権または私たちのライセンシーの特許権を縮小または廃止することにつながる可能性があります。これは、私たちが他人が類似または同じ技術および製品を自由に使用することを阻止したり、それを商業化する能力を制限したり、私たちの技術および候補薬物の特許保護期間を制限するかもしれない。このような挑戦は、第三者特許権を侵害することなく、私たちの候補薬物を製造または商業化することができない可能性もあります。さらに、特許出願を提出する前に、私たちの発明を意図的または意図的に開示することは、いくつかの司法管轄区で特許保護を得ることができなくなり、将来的にもそうである可能性がある。私たちはまた、特許保護を得るために、私たちの技術と研究開発成果の可能な特許面をタイムリーに識別できないかもしれない。
私たちは現在も多くのアメリカ臨時特許出願を持っている。私たちが1つ以上の関連する臨時特許出願を提出してから12ヶ月以内に非臨時特許出願を提出しない限り、これらの臨時出願は許可された特許になる資格がない。もし私たちがいかなる非臨時特許出願を直ちに提出しなければ、私たちは私たちの臨時特許出願に関連する優先日と、そのような出願に開示された発明に対する任意の特許保護を失う可能性がある。
私たちの現在の特許の組み合わせは、限られた数の特許および特許出願を含み、その中のいくつかは、第三者から許可されており、私たちの候補薬剤およびその使用方法に関連している。私たちは現在、発行されたREC-994またはREC-3964の米国Composal of Matter特許を持っていない。REC-4881およびREC-2282のComposure of Matter特許は許可されているが、これらの特許は商業発売前に満了することが予想される。私たちまたは私たちの許可者が提出する可能性のある任意の非一時的特許出願が、REC-994、REC-2282、REC-4881、およびREC-3964の組成を含む発行された特許請求の範囲をもたらすとは確信できない。
私たちまたは私たちの許可者の任意の未解決または未来の特許出願が発表されるか、または発表された特許に成熟した任意の未解決または未来の特許出願が、私たちの候補薬剤を競争から保護するのに十分な範囲を有する権利要件を含むことを保証することはできません。もし私たちが十分な知的財産権保護を獲得し、維持できなければ、私たちの業務に重要ないかなる技術、発明、あるいは改善をカバーして、あるいは獲得した特許保護範囲が十分に広くなければ、第三者を阻止できないかもしれない
私たちの製品の模造バージョンを発売して、私たちのノウハウを使うことで、あるいは私たちとよく似ているか同じ製品を販売することで。もし私たちの特許や特許出願によって提供される保護の広さや強度が脅かされていれば、会社が私たちと協力して、現在または未来の候補薬物の許可、開発、または商業化を阻止するかもしれない。これは、私たちの技術や製品を商業化することに成功した能力と、私たちの業務、運営結果、将来性に実質的な悪影響を及ぼすかもしれません。
我々の現在のいくつかの候補薬物製品に対する特許地位は、競合他社または他の第三者が同じ候補薬剤を同じまたは異なる用途に使用することを防止するのに十分ではない可能性があるこれらの候補医薬製品の成分、製造関連方法、製剤および/または使用方法を含む、私たちが所有または許可している特許出願に依存する。
物質組成特許保護は、特定の使用方法または製造方法または処方を考慮することなく、保護を提供するため、医薬品に対して望ましいと考えられる。私たちがパートナーから許可を得たいくつかの分子については、これらの特許の期限が満了したり、期限が切れたりするため、物質に依存して特許保護を構成することはできない。
使用方法特許は、特定の方法のための製品の使用を保護し、処方特許は、療法を提供する処方を含む。我々は,開発中の適切な時間に我々のプログラムの使用方法に関する出願を提出したが,これらの出願が将来発表される任意の特許における特許要件が競合用途におけるすべての商業関連分子アプリケーションをカバーするかどうかを決定することはできない.これらのタイプの特許は、競争相手または他の第三者が特許方法の範囲外であることを示す開発、マーケティングまたは商業化または同様の製品、または特許処方範囲外の異なる処方を開発することを阻止しない。さらに、使用方法特許に関しては、競合他社または他の第三者が、私たちが特許を取得する可能性のある的確な適応または用途に対して彼らの製品を積極的に宣伝していなくても、医師は、ラベルの外でこれらの製品を使用することを患者に提案するか、または患者自身がそうすることを提案することができる。タグ外使用は使用方法特許の侵害を侵害または助長する可能性があるにもかかわらず,このような侵害タイプは予防や実行が困難であることが一般的である.さらに、商業に関連するいくつかの司法管轄区域は、他の既知の分子をカバーする新しい方法の特許の使用を許可しない。したがって、私たちは第三者がアメリカや海外で私たちの発明を実施することを阻止できないかもしれません。これは私たちの業務に実質的な悪影響を及ぼすかもしれません。
私たちは世界各地で私たちの知的財産権と固有の権利を保護できないかもしれない。
私たちの候補薬物製品、または私たちが世界のすべての国で開発する可能性のある他の独自技術に関連する特許は、申請、起訴、維持、保護されるだろうし、外国の法律はアメリカの法律のように私たちの権利を保護できないかもしれない。したがって、私たちは、米国以外のすべての国/地域で第三者が私たちの発明を実施したり、米国または他の管轄区域で私たちの発明を使用して製造された製品を販売または輸入することを阻止することができないかもしれない。競争相手は私たちが特許保護を受けていない司法管轄区域で私たちの技術を使用して自分の製品を開発することができ、また、他の侵害製品を私たちが特許保護を持っている地域に輸出することもできるが、法執行力はアメリカに及ばない。これらの製品は私たちの製品と競争するかもしれませんが、私たちの特許権や他の知的財産権は彼らの競争を効果的にまたは阻止するのに十分ではないかもしれません
多くの会社は外国の管轄区域の知的財産権の保護と保護に重大な問題に直面している。特定の発展途上国のような特定の国の法律制度は、特許、商業秘密、および他の知的財産権保護、特にバイオテクノロジー製品に関する保護の実行に賛成しないことは、私たちの特許権の侵害を阻止したり、私たちの知的財産権および独占権を侵害する方法で競争製品を販売することを困難にする可能性がある。さらに、欧州、日本、および中国などのいくつかの司法管轄区域の特許可能性基準は、例えば、元の特許出願において請求項が字面的なサポートを有することを要求することと、元の特許出願に存在しないサポートデータの使用を制限することとを含む、米国よりも高い可能性がある。これらのより高い特許性要件によると、米国や他の管轄地域でも同じまたは同様の特許保護を受けることができる特定の司法管轄区で十分な特許保護を得ることができない可能性がある
外国の管轄区域で私たちの知的財産権と独自の権利を強制的に執行する訴訟手続きは、巨額のコストを招き、私たちの努力と注意を私たちの業務の他の側面から移転させる可能性があり、私たちの特許権を無効または狭い解釈されるリスクに直面させる可能性があり、私たちの所有または認可内の特許出願が発表できないリスクに直面し、第三者が私たちにクレームを提起する可能性がある。私たちは私たちが起こしたどんな訴訟でも勝てないかもしれないし、判決された損害賠償や他の救済措置(もしあれば)は商業的な意味がないかもしれない。だから私たちの
私たちの知的財産権および独自の権利を世界各地で強制的に実行する努力は、私たちが開発または許可した知的財産権から顕著なビジネス的優位性を得るのに十分ではないかもしれません
多くの国に強制許可法があり,これらの法律により特許権者は第三者に強制的に許可を付与される可能性がある。また、多くの国は政府機関や政府請負業者に対する特許の実行可能性を制限している。これらの国では,特許権者の救済措置は限られている可能性があり,このような特許の価値を大幅に低下させる可能性がある。もし私たちまたは私たちの任意の許可者が第三者に私たちの業務に関連する任意の特許の許可を付与することを余儀なくされた場合、私たちの競争的地位が損なわれる可能性があり、私たちの業務、財務状況、運営結果、および見通しは不利な影響を受ける可能性があります。
2012年、欧州特許パッケージまたはEU特許パッケージ法規が採択され、欧州特許に関連する訴訟に単一の汎欧州統一特許と新しい欧州統一特許裁判所(UPC)を提供することを目標とした。EU特許セットの実施は2023年6月に始まり,当時UPCが開業した。UPCによれば、すべての欧州特許は、欧州特許パッケージを承認する前に発表された特許を含み、デフォルトでは自動的にUPCの管轄に分類される。UPCは私たちの競争相手に新しいフォーラムを提供し、私たちの欧州特許を集中的に撤回し、競争相手が汎ヨーロッパ禁止を獲得する可能性を可能にすることができる。UPCが認める特許権の範囲と提供される特許救済措置の力を知るのに数年かかるだろう。EU特許セットによると、私たちは裁判所が存在する7年前に私たちの特許をUPCから脱退することを選択する権利があるが、そうすることは私たちが新しい統一裁判所の利点を達成することを阻止するかもしれない。
もし私たちが開発可能な候補薬物のために特許期間延長とデータ排他性を獲得しなければ、私たちの業務は実質的に損害を受ける可能性がある。
我々が開発する可能性のある任意の候補薬剤の上場承認の時間、持続時間、および詳細によれば、我々の1つまたは複数の米国特許は、1984年の“薬品価格競争および特許期限回復行動”(Hatch-Waxman修正案と略称する)に従って限られた特許期間延長を得る資格がある可能性がある。ハッジ·ワックスマン修正案は、FDA規制審査過程で失われた特許期間の補償として、特許展期間を最長5年とすることを許可している。特許期間の延長は,製品承認日から14年間の残存期限を超えてはならない。特許は1つしか延長できず、承認された薬剤、その使用方法、または製造方法に関する特許請求の範囲を延長することのみができる。しかし,テスト段階や規制審査中に職務調査を行うことができなかったこと,適用の最終期限内に出願できなかったこと,関連特許の満了前に出願を提出できなかったこと,適用要件を満たしていなかったことなどにより延期が得られなかった可能性がある.しかも、特許保護の適用期間や範囲は私たちが要求しているものよりも短いかもしれない。もし私たちが特許期間の延長を得ることができない場合、あるいはこのような延長の期限が私たちが要求したものよりも短い場合、私たちの競争相手は私たちの特許が満期になった後に競争製品の承認を受ける可能性があり、私たちの業務、財務状況、運営結果、見通しは実質的に損なわれる可能性がある。
第三者から何らかの知的財産権の許可を得る必要があるかもしれませんが、このような許可は得られないかもしれませんし、商業的に合理的な条項では得られない可能性もあります。
私たちのビジネスの成長は、第三者知的財産権および独自の権利を取得、許可、または使用する能力にある程度依存するかもしれません。第三者は私たちの製品開発に非常に重要または必要な知的財産権を持っているかもしれない。第三者の特許やノウハウを用いて私たちの製品を商業化する必要があるかもしれませんが、この場合、これらの第三者の許可を得ることが求められます。例えば,パートナーや他の第三者が持つ分子の使用を変更することを探索した場合,これらの分子を使用する権利を獲得した.さらに、私たちの候補薬物製品は、有効に機能するために特定の処方が必要である可能性があり、私たちの化合物および既存の医薬化合物を含む候補製品を開発することができ、またはFDAまたは同様の外国規制機関は、私たちの候補製品と組み合わせた1つ以上の診断試験を提供することを要求することができ、いずれも、第三者が所有する知的財産権を使用する権利を得ることを要求する可能性がある。さらに、私たちが第三者と共同で所有する可能性のある任意の特許または他の知的財産権については、この特許または他の知的財産権に対するこれらの共同所有者の権益を許可する必要があるかもしれない。私たちは、当社の業務運営に必要または重要であると考えられる任意の成分、使用方法、プロセス、または他の第三者知的財産権を第三者から得ることができないかもしれません。さらに、私たちは合理的な費用や商業的に合理的な条項でこのような許可証を得ることができないかもしれない。このような状況が発生した場合、これらの第三者知的財産権がカバーする成分や方法の使用を停止する必要がある可能性があり、侵害、流用、または他の方法でこれらの知的財産権に違反する代替方法の開発を求める必要がある可能性があり、このような方法を開発することができても、追加のコストと開発遅延を招く可能性がある
代替案は、これが実行可能ではないかもしれない。たとえ我々が許可を得ることができても,それは非排他的である可能性があり,これは,我々の競争相手も我々に許可された同じ技術へのアクセス権を得ることが可能であることを意味する.この場合、私たちは代替技術を開発または許可するために多くの時間と資源を必要とするかもしれない
もし私たちが許可を得ることができない場合、または第三者知的財産権の予期される用途をカバーするために、商業的に合理的な条項と十分な広さで許可を得ることができない場合、私たちの業務は実質的な損害を受ける可能性がある。
第三者知的財産権の許可や買収は競争分野であり、私たちよりも成熟しているかもしれないし、より多くの資源を持っている会社も、私たちの候補製品を商業化するために必要または魅力的だと思う第三者知的財産権許可または買収戦略を実施しているかもしれません。より成熟した会社は私たちより競争優位があるかもしれません。彼らの規模、資源、そしてより強い臨床開発と商業化能力のためです。しかも、私たちを競争相手と思っている会社は私たちに権利を譲渡したり許可したりしたくないかもしれない。これらのタイプの交渉を成功させ、最終的に開発や販売を求める可能性のある製品や候補製品に関する知的財産権を得ることができる保証はありません。もし私たちが必要な第三者知的財産権を得ることに成功したり、私たちの既存の知的財産権を維持することができなければ、私たちはいくつかのプロジェクトの開発を放棄しなければならないかもしれません。私たちの業務、財務状況、運営結果、見通しは影響を受ける可能性があります。
米国特許法の変化は特許の全体的な価値を低下させ、製品を保護する能力を弱める可能性がある
米国特許法または特許法解釈の変化は、特許出願をめぐる起訴および発行された特許の実行または弁護の不確実性およびコストを増加させる可能性がある。特許性の他の要件が満たされていると仮定すると,2013年3月までに,米国では,まず発明により保護された発明を発明した者が特許を取得する権利があり,米国以外では,最初に特許出願を提出した者が特許を取得する権利がある。2013年3月以降、2011年9月に公布された“ライシー·スミス米国発明法”(“米国発明法”)によれば、米国は第1の発明者から出願制に移行し、この制度の下で、他の特許性要件が満たされたと仮定すると、第1の特許出願を提出した発明者は、第三者が第1の発明によって要求された発明であるか否かにかかわらず、発明の特許を取得する権利がある。2013年3月以降に米国特許商標局に特許出願の第三者を提出したが、我々の前に、当該第三者が発明を行う前に本発明を作成したとしても、我々の発明をカバーする特許を付与することができる。これは私たちが発明から特許出願までの提出時間を認識することを要求するだろう。米国および他のほとんどの国/地域の特許出願は、通常、出願後18ヶ月または発行後に発表されるか、または場合によっては全く発表されないので、(I)私たちの治療および診断プログラムおよび私たちが開発する可能性のある他のノウハウに関連する特許出願を最初に提出するか、または(Ii)発明が我々が所有または許可する特許出願に要求される任意の発明の会社であることを決定することはできない
米国の発明法にはいくつかの重大な変化も含まれており、これらの変化は特許出願の起訴方法に影響を与え、特許訴訟に影響を与える可能性もある。これらの措置には、第三者が特許訴訟中に米国特許商標局に以前の技術を提出することを可能にすることと、米国特許商標局によって管理されたライセンス後のプログラム(ライセンス後審査を含む)が特許有効性を攻撃することを可能にする追加のプログラムとが含まれる各方面間審査と派生手続き。USPTO手続きの証拠基準は、米国連邦裁判所が特許請求の無効を宣言するために必要な証拠基準よりも低いため、第三者は、USPTO手続において、USPTOが権利請求を無効にするのに十分な証拠を提供する可能性があり、同じ証拠が最初に地域裁判所訴訟で提出された場合には、権利請求を無効にするのに十分ではない。したがって,第三者は米国特許商標局の手続きを用いて我々の特許主張の無効を宣言しようとする可能性があり,第三者が地域裁判所訴訟で最初に被告として疑問を提起すれば,我々の特許主張は無効ではない.したがって、米国発明法およびその実施は、私たちの所有または許可された特許出願をめぐる起訴およびこれらの特許出願に対して発行される特許の実行または保護の不確実性およびコストを増加させる可能性があり、これらすべては、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある
また、薬品研究開発と商業化における企業の特許地位は特に不確定である。米国最高裁判所の最近の裁決は、場合によっては入手可能な特許保護範囲を縮小し、場合によっては特許所有者の権利を弱める。例えばアメリカの最高裁の判決はアンはセノフィを訴えた598“アメリカ最高裁判所判例集”594,143 S。1243(2023)、共通の特許請求の範囲を有する十分な化合物が提供されていない場合、医薬品の物質組成をカバーするいくつかの特許請求の範囲に制限される可能性がある。だから私たちが手に入れる保証はありません
候補薬品。これらの事件や他の類似事件は,特許取得後の有効性と実行可能性の面で不確実性をもたらしている。米国議会、連邦裁判所、USPTOの将来の行動により、特許を管理する法律や法規は予測不可能な方法で変化する可能性がある。また,近年ヨーロッパ特許法の複雑性や不確実性も増加している。上記のいずれも、私たちが所有し、許可された特許の組み合わせ、および私たちの将来の知的財産権を保護し、実行する能力に実質的な悪影響を及ぼす可能性がある。
法廷または米国または海外の行政機関で疑問が提起された場合、私たちの候補薬剤および私たちが開発または将来開発可能なノウハウに関連する発行された特許は、無効または強制的に実行できないことが発見される可能性がある
私たちの特許権は優先権、有効性、発明権、そして実行可能な論争を受ける可能性がある。知的財産権クレームに関連する法律手続きは、法的根拠があるかどうかにかかわらず、予測不可能であり、通常コストが高く、時間がかかり、私たちの核心業務から大量の資源を移転し、私たちの管理層と科学者の正常な責任を分散させ、通常私たちの業務を損害する可能性がある。もし私たちまたは私たちのライセンシーがこれらの訴訟のいずれかで成功しなければ、これらの特許および特許出願は縮小される可能性があり、無効であるか、または実行不可能とみなされる可能性があり、私たちは第三者から許可を得ることを要求される可能性があり、これらのライセンスは、商業的に合理的な条項または根本的に得られないかもしれない、または私たちの候補製品の開発、製造、または商業化の停止を要求されるかもしれない。上記のいずれも、当社の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
私たちまたは私たちの許可者のうちの1つが第三者に対して法的訴訟を提起して、私たちの候補薬物製品またはその使用方法または私たちが開発する可能性のある他の独自技術をカバーする特許を強制的に執行する場合、被告はその特許を無効または強制的に実行できないと反訴することができる。米国の特許訴訟では,被告が無効または実行不可能と主張する反訴が一般的である。有効性を疑問視する理由は、新規性の欠如、明らかな、または実施できないことを含む、いくつかの法定要件のいずれかを満たしていないと言われているからかもしれない。主張を実行できない理由は,特許起訴に関連する者が起訴中に米国特許商標局に関連情報を隠蔽したり,誤った声明をしたりしたためかもしれない.第三者は米国や海外の行政機関に特許の有効性や実行可能性を疑問視することができ,訴訟範囲外でも同様である。この仕組みには再審査、贈与後審査、各方面間審査、派生手続き、外国司法管轄区の同等の手続き(例えば、反対手続き)。このような訴訟は、私たちの候補薬剤またはその使用方法、および私たちが開発する可能性のある他のノウハウをカバーしないように、私たちの特許権を撤回、キャンセル、または修正することをもたらす可能性がある。法的に無効と実行不可能と断言された後の結果は予測できない。例えば、有効性の問題については、私たちは無効な以前の技術がないことを確認することはできないが、私たちまたは私たちの許可パートナーと特許審査員は起訴中にこれを知らない。もし第三者が無効または強制不可能な法的主張を獲得した場合、私たちは、私たちの候補薬物製品またはその使用方法、または私たちが開発する可能性のある他の独自技術の特許保護の少なくとも一部、さらには全てを失うだろう。このような特許保護の喪失は、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすだろう。
私たちが所有しているまたは許可内の特許権や他の知的財産権の発明権のクレームが問われるかもしれません
私たちは、発明者または共同発明者として、元従業員、協力者、または他の第三者から、私たちの特許権、商業秘密、または他の知的財産権の利益について告発される可能性がある。例えば、私たちは、私たちの治療および診断プログラムの開発に参加し、私たちが開発する可能性のある他のノウハウのコンサルタントや他の人の義務衝突によって在庫紛争が生じる可能性があります。訴訟は、これらおよび他の挑戦発明権または我々の特許権、商業秘密、または他の知的財産権のクレームに対抗するために必要である可能性がある。もし私たちがこのようなクレームを正当化することができなければ、金銭的損害賠償の支払いに加えて、私たちの治療および診断手続き、私たちが開発する可能性のある他の独自技術の非常に重要な知的財産の独占所有権または使用権のような貴重な知的財産権を失う可能性がある。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、私たちの経営陣や他の従業員の注意を分散させる可能性がある。上記のいずれも、当社の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
知的財産権はすべての潜在的な脅威を解決できるとは限らない。
我々の知的財産権、特に特許からの知的財産権は、将来提供される保護の程度は不確定であり、これらの権利には限界があるため、私たちの業務を十分に保護することができないか、または競争優位性を維持することができるかもしれない。私たちの知的財産権は、私たちの競争優位性をさらに向上させないかもしれないが、以下の点を含むが、これらに限定されない
•他の人は、私たちの特許を侵害する方法で同様の技術を複製または利用することができるかもしれないが、特許権を取得または取得または実行できない司法管轄区域内では検出できないか、またはそうすることができる
•私たち、または私たちのライセンスパートナーまたは協力者は、私たちが所有または許可する現在または未来の特許出願をカバーする最初の発明ではないかもしれない
•私たち、または私たちの許可パートナーまたは協力者は、私たちまたは彼らの発明に関する最初の特許出願を提出した人ではないかもしれない
•他の会社は、私たちが持っているまたは許可された知的財産権を侵害することなく、類似または代替技術を開発したり、私たちのいかなる技術を複製したりすることができる
•私たちが現在または将来所有または許可している特許出願は、発行された特許を生成しない可能性がある
•当社が所有またはライセンス供与している現在または将来の特許出願から発行された特許は、競合他社またはその他の第三者による法的異議の結果を含め、無効または執行不能とされたり、競争優位性を提供しない可能性があります。
•私たちの競争相手や他の第三者は、特許権のない国で研究や開発活動を行い、これらの活動から得られた情報を利用して競争力のある製品を開発し、私たちの主要な商業市場で販売するかもしれない
•当社または当社のライセンサーの特許を無効にする可能性のある事前の公開がある場合。
•私たちは他の特許を申請できる独自技術を開発しないかもしれない
•他者の特許または出願中または将来の特許出願が発行された場合、当社の事業に害を及ぼすおそれがあること。
•いくつかの商業秘密またはノウハウを保護するために、私たちは特許を出願しないことを選択することができ、第三者はその後、これらの知的財産権をカバーする特許を提出する可能性がある。
これらの事件のいずれかが発生した場合、私たちの業務、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。
もし私たちが私たちの商業秘密とノウハウの機密性を保護できなければ、私たちの業務と競争地位は損なわれるかもしれない。
特許提供の保護に加えて、私たちは、私たちの特許が含まれていない独自技術、情報、および技術を保護するために、商業秘密保護および契約手配に依存する。我々のデータや小分子データベースを管理することについては,ビジネス秘密や技術ノウハウが我々の主要な知的財産権であると考えられる.商業秘密およびノウハウを含む非特許専有権は、保護が困難である可能性があり、そのセキュリティが失われたり、第三者によって独立して開発されたりすると、価値を失う可能性がある。
私たちは、私たちの協力者、科学顧問、従業員、コンサルタントを含む、これらの技術およびプロセスにアクセスする権利のある当事者と秘密保持および秘密協定を締結することによって、私たちのノウハウとプロセスを保護することを求めています。私たちは私たちが可能であるか、または私たちの商業秘密またはノウハウとプロセスに接触したすべての当事者とこのような合意に到達したことを保証することができない。私たちの従業員やコンサルタントとの合意はまた、彼らが私たちのために働いてくれた発明に対する私たちの所有権を認め、譲渡によってこの所有権を改善することを要求します。しかし、私たちはこのような合意または他の予防措置を通じて、私たちの商業秘密または他の機密情報の不正開示または使用を阻止できないかもしれない。さらに、我々の競争相手を含む第三者は、同じまたは実質的に同じ商業秘密およびノウハウを独立して開発および合法的に使用することができる。強制執行側が商業秘密を不正に開示したり流用したりする主張は困難であり、高価で時間がかかり、結果は予測できない。しかも、米国国内外のいくつかの裁判所は商業秘密をあまり望んでいないか、または保護したくない。もし私たちの任意の商業秘密が競争相手または他の第三者によって合法的に取得または独立して開発された場合、私たちは彼らがその技術や情報を使用して私たちと競争することを阻止する権利がないだろう。ビジネス秘密保護または他の非特許固有の権利の喪失は、私たちのビジネス、運営結果、財務状態、および将来性を損なう可能性があります。
私たちは第三者が私たちの商業秘密に対して所有権利益を持っているというクレームを受けるかもしれない。例えば、私たちの候補製品の開発に参加している従業員、コンサルタント、あるいは他の人の義務衝突によって紛争が生じる可能性があります。これらと他のクレームを弁護するために訴訟を提起する必要があるかもしれない
私たちの商業秘密の所有権に挑戦する。もし私たちがこのようなクレームを弁護することができなかった場合、私たちは金銭的損害賠償を支払うことに加えて、私たちの治療手続きおよび私たちが開発する可能性のある他の独自技術の非常に重要な商業秘密の独占所有権や使用権のような貴重な商業秘密権利を失う可能性がある。このような結果は私たちの業務に実質的な悪影響を及ぼすかもしれない。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、私たちの経営陣や他の従業員の注意を分散させる可能性がある。上記のいずれも、当社の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
関連する第三者特許を識別できないか、または第三者特許の関連性、範囲、または満了時間を誤って解釈することができない可能性があり、これは、私たちの候補薬物製品を開発およびマーケティングする能力に悪影響を及ぼす可能性がある
私たちは、関連特許の識別、特許請求の範囲、または関連特許の満了を含めて、私たちのいかなる特許検索または分析も保証することはできず、私たちは、米国および海外が現在および未来の製品および候補製品の商業化に関連しているか、または必要なすべての第三者特許および未解決特許出願を識別していることを保証することもできない。特許請求の範囲は、法律の解釈、特許における書面開示、および特許の起訴履歴に依存する。特許または係属特許出願の関連性または範囲の説明は正しくない可能性があり、これは私たちの製品を販売する能力に負の影響を与えるかもしれない。私たちは、候補薬剤が第三者特許によって保護されていないかどうかを誤って決定するか、または第三者が係属中の特許出願が関連範囲の特許請求を提出するかどうかを誤って予測する可能性がある。私たちが関連する任意のアメリカまたは海外特許の満期日の決定は正しくない可能性があり、私たちは第三者特許が無効で強制的に実行できないと誤って結論を出すかもしれない。私たちは関連特許を識別し、正確に解釈することができず、私たちの候補薬物製品を開発し、マーケティングする能力に負の影響を与えるかもしれない。上記のいずれも、当社の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
私たちは、私たちまたは私たちの従業員が第三者のいわゆる商業秘密を誤って使用または開示したり、第三者との競争禁止または入札協定に違反したりした疑いを受けるかもしれない。
私たちは、私たちの従業員およびコンサルタントが、私たちのために働いているときに、他人の知的財産権、独自情報、ノウハウまたは商業秘密を使用しないか、または適用可能なスポーツ禁止またはスポーツ禁止協定に違反しないようにするために努力しています。しかしながら、私たちは将来、私たちまたはこれらの個人が、第三者(元雇用主または競争相手を含む)のいわゆる商業秘密または他の固有情報を無意識にまたは他の方法で使用または開示するか、または、従業員または請負業者が第三者と締結した競業禁止または競争禁止協定の条項に違反することを引き起こすという疑惑を受ける可能性がある。また、私たちの政策は、知的財産権のアイデアや開発に参加する可能性のある私たちの従業員と請負業者が合意に署名し、このような知的財産権を私たちに譲渡することを要求しているにもかかわらず、このような合意を得ることができないか、権利を譲渡することができないかもしれません。
訴訟は、これらのクレームを抗弁または実行するために必要である可能性があり、これは高価である可能性があり、経営陣の注意を分散させ、不確実な結果を有する可能性がある。もし私たちが第三者の独自情報の開示または乱用に責任があることが発見された場合、または従業員または請負業者が開発した知的財産権の権利を確保できない場合、裁判所は、損害賠償金を含むか、またはそのような独自の情報を含むか、またはそのような独自の情報を含む、私たちの候補薬剤に重要である可能性のある技術または機能の使用を禁止するかもしれない。さらに、このようないかなる訴訟も、私たちが従業員または請負業者を雇用または維持する能力に悪影響を及ぼす可能性がある。もし私たちが私たちの貴重な知的財産権を確立したり、キーパーソンを維持することができなければ、この失敗は私たちの候補薬物の商業化に成功し、私たちの業務、財務状況、運営結果に不利な影響を与えるかもしれない。
我々または我々の協力者の知的財産権侵害、流用または他の侵害行為に対する第三者クレームに対して抗弁する訴訟、または我々の知的財産権または我々協力者の知的財産権の訴訟を実行することには、多くのリスクが存在する。
バイオテクノロジーと製薬業界の特徴は特許と他の知的財産権に関する訴訟が広く頻繁であることである。知的財産権訴訟や他の法的手続きは,正当な理由の有無にかかわらず,通常高価で時間がかかり,技術や管理に注意を分散させる可能性がある
人員は,不確実な結果の影響を受ける.私たちはそのような訴訟や法的手続きを適切に行うのに十分な財政的または他の資源がないかもしれない。私たちのいくつかの競争相手は、彼らがより多くの財政資源とより成熟して発展した知的財産権の組み合わせを持っているので、このような訴訟や法的手続きの費用を私たちよりも効率的に負担するかもしれない。
私たちのビジネス成功は、第三者の知的財産権または独自の権利を侵害、流用、または他の方法で侵害することなく、私たちおよび私たちの協力者の開発、製造、マーケティング、および私たちの候補薬物製品の販売、および私たちの独自技術を使用する能力に依存する。私たちの技術分野の特許数が膨大で増加していることを考慮して、私たちは既存の特許を侵害していないか、あるいは未来に付与された特許を侵害しないかを確認することはできない。私たちは将来、私たちの競争相手または他の第三者が提起した訴訟または対抗訴訟の当事者になるか、またはこれらの訴訟または対抗訴訟の脅威を受け、これらの訴訟または訴訟手続きは、私たちの製品または技術が彼らの特許によって保護されていると主張するかもしれない。
多くの会社は、人工知能および深度学習、技術支援の薬物発見、CRISPR、高スループットスクリーニング、およびこれらの分野の任意またはすべての分野の組み合わせを含む、我々の業務に重要な分野で特許を取得しているか、または特許出願を提出している。例えば,我々は特許供給者からCRISPR−Cas 9遺伝子編集技術の再許可を得ており,我々の薬物発見過程に依存する重要なツールを提供している。CRISPR−Cas 9遺伝子編集は特許出願が非常に活発な分野であり,この技術に関連する所有権と許可権については,第三者間に継続的な紛争があり,我々はその一方ではない。CRISPRおよびCAに関連する大量の特許出願は、この技術をカバーする可能性のある関連特許および係属中の出願の全面的な範囲を評価することを困難にし、第三者特許または将来発行される可能性のある権利の未解決特許出願が存在する可能性があり、CRISPR-Cas 9の使用をカバーする。
もし私たちまたは私たちの協力者が第三者の特許または他の知的財産権を侵害していることが発見された場合、このような決定は、損害賠償および故意侵害または特許使用料の3倍の弁護士費を含む重大な損害賠償および費用をもたらす可能性がある。もし私たちまたは私たちの協力者に対する権利侵害クレームが成功すれば、私たちは侵害製品や技術を再設計しなければならないかもしれないし、それは不可能かもしれないし、大量の時間とお金の支出が必要かもしれない。さらに、私たちは、商業的に合理的な条項または全く得られない可能性がある、または権利侵害技術または候補医薬製品の開発および商業化を完全に停止するために、第三者からライセンスを取得して、私たちの候補医薬製品または他の独自技術の開発およびマーケティングを継続することを要求される可能性がある。私たちの候補薬物製品を商業化したり、いくつかの業務運営を停止させられたりすることを阻止された場合、この制限は私たちの名声を深刻に損なう可能性があり、私たちの業務、運営結果、将来性に重大な悪影響を及ぼす可能性がある。
もし私たちが競争相手または他の第三者が場合によっては私たちの知的財産権または私たちの協力者の知的財産権を侵害、流用、または他の方法で侵害したと思う場合、私たちは私たちの特許および他の知的財産権を保護または強制するために訴訟を提起したり、反訴したりする可能性がある。私たちの知的財産権または私たちの協力者の知的財産権を強制的に実行する能力は、相手が私たちに反訴する可能性と、いくつかの国/地域におけるこれらの権利の保護および実行可能性の不確実性を含む訴訟リスクの影響を受ける。もし私たちが私たちの特許または私たちの協力者の特許を強制的に実行しようとするなら、私たちはこれらの特許が偏狭に解釈されなければならず、関連技術を含まない、またはこれらの特許は無効であるか、強制的に実行できないことが発見されるかもしれない。もし私たちが私たちの知的財産権や私たちの協力者の知的財産権を強制的に実行して保護することができない場合、またはそれらが迅速な技術変化によって回避され、無効になったり、時代遅れになったりすれば、これは私たちの競争地位、業務、財務状況、および見通しに悪影響を及ぼすかもしれない。
競合製品はまた、私たちの特許カバー範囲に存在しない可能性があり、またはそれほど強力でない可能性がある他の国/地域で販売される可能性がある。一部の国の法制度は特許や他の知的財産権の強制執行を支持しておらず、他の司法管轄区域の特許所有者に対する強制執行権は限られている可能性がある。これは私たちが他の国で私たちの特許を侵害したり、私たちの他の知的財産権を流用することを阻止することを難しくするかもしれない。したがって、特許が侵害された場合、これらの国/地域における私たちおよび私たちのライセンシーまたは協力者の救済措置は限られている可能性があり、または私たちまたは私たちのライセンス者は、第三者にライセンスを付与することを余儀なくされる可能性があり、これは、これらの特許の価値を大幅に低下させ、私たちの潜在的な収入機会を制限する可能性がある。また、競争相手は私たちの技術を利用して自分の製品を開発するかもしれません。私たちは特許保護を受けていない、あるいは私たちは特許保護を持っていますが、執行権が限られている司法管轄区で私たちと競争しています。したがって、これらの国で知的財産権を保護するための私たちの努力は、私たちが所有または許可している知的財産権から顕著な商業的優位性を得るのに十分ではないかもしれない。
解決策が私たちに有利であっても、上記のプログラムは非常に高価かもしれません。特に私たちのような規模の会社にとっては時間がかかります。このような訴訟は、私たちの運営損失を大幅に増加させ、開発活動または任意の将来の販売、マーケティング、または流通活動に使用できる資源を減少させる可能性があります。私たちはこのような手続きを十分に展開するための十分な財政や他の資源がないかもしれない。私たちのいくつかの競争相手は訴訟や行政訴訟の費用に耐えることができるかもしれない。
もし私たちが第三者と協力したり、第三者から知的財産権許可を取得する合意の義務を履行できなかった場合、許可が終了すれば、これらの許可に関する紛争が発生したり、私たちの協力者と人が可能な業務関係が妨害された場合、私たちは私たちの業務に重要な権利を失うかもしれません。
私たちは、私たちの業務に非常に重要ないくつかの知的財産権を許可し、将来的には、貴重な知的財産権や技術の許可を提供するために、他の協定を締結するかもしれません。私たちの現在の許可協定は私たちに強要され、私たちは将来の許可協定が許可を維持するために、様々な開発、勤勉、商業化、その他の義務を課すことを予想している。我々の努力にもかかわらず,許可側は,我々が実質的にライセンス契約下の義務に違反していると結論し,合意を終了させ,我々が開発·商業化プロトコルにカバーする製品や技術の能力を廃止または制限しようとしている可能性がある.これらのライセンス内の製品が終了した場合、またはその許可された基本特許権に基づいて予想される排他性を提供できなかった場合、競争相手または他の第三者は、規制部門の承認を求め、私たちと同じ製品を市場に出す権利があり、いくつかの候補薬剤の開発および商業化を停止することを要求される可能性がある。上記のいずれも、我々の競争地位、業務、財務状況、経営結果、および見通しに重大な悪影響を及ぼす可能性がある。
さらに、ライセンス契約に関連する知的財産権紛争が発生する可能性があるが、これらに限定されない
•ライセンス契約に従って付与された権利範囲および解釈に関連する他の問題;
•私たちの技術および技術が侵害されているかどうか、流用または他の方法で許可協定に拘束されていない許可側の知的財産権を侵害するかどうか、および侵害の程度
•私たちの協力開発関係に基づいて、特許と他の権利を再許可する
•私たちのライセンス契約の下での義務と、どのような活動がこれらの職務義務を満たしていますか
•私たちの許可者と私たちおよび私たちのパートナーが知的財産権を共同で創造または使用することによって生成された発明およびノウハウの発明および所有権;
•私たちはライセンス契約を譲渡または譲渡する権利;および
•特許技術発明の優先権。
知的財産権や技術を第三者に許可するプロトコルは複雑であり、将来のプロトコルも複雑である可能性があり、このようなプロトコルのいくつかの条項は様々な解釈の影響を受ける可能性がある。可能性のある契約解釈の相違の解決は、関連する知的財産権または技術に対する私たちの権利と考えられる範囲を縮小するかもしれません、または関連協定の下での私たちの財務または他の義務を増加させる可能性があります。これらのいずれも、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性があります。また、私たちが許可している知的財産権をめぐる紛争が、商業的に許容可能な条項で許可スケジュールを維持する能力を阻害したり、損害を与えたりすれば、影響を受ける候補薬剤の開発や商業化に成功できない可能性があり、これは、私たちの業務、財務状況、運営結果、および将来性に大きな悪影響を及ぼす可能性がある。
我々の連携プロトコルでは,例えばベイヤプロトコルやロ氏遺伝子技術プロトコルでは,これらと類似した問題が生じる可能性がある.バイエル協定とロ氏遺伝子技術協定は私たちの2つの重要な協力であり、これらの協力が現在の条項の後に有利な条項や根本的に存在しないことを保証することはできず、協力が発効したいつでも、双方が合意の下で作動することを保証することはできない
私たちの知的財産権のいくつかはすでに発見されており、将来的には政府が援助するプロジェクトによって発見される可能性があるので、“進行権”、いくつかの報告要件、およびアメリカ会社の選好など、連邦法規の制約を受ける可能性があり、これらの法規を遵守することは、私たちの独占権と非アメリカ製造業者との契約能力を制限するかもしれない。
私たちの知的財産権は1つ以上の第三者の権利によって維持されるかもしれない。例えば、私たちが許可を得たか、または将来許可を得る可能性のある知的財産権は、米国政府の資金を使用することによって生成される。したがって、アメリカ政府は、私たちの現在または未来のプロセスおよび関連製品やサービスに具現化された知的財産権に対していくつかの権利を持っているかもしれない。米国政府のこれらの権利は、任意の政府の目的のために発明を使用する非排他的、譲渡不可能、撤回不可能な世界的許可を含む。また、ある限られた場合、米国政府が、(1)発明を商業化し、政府援助を実現する技術の実用化に十分なステップを講じていないと判断した場合、(2)政府が公衆衛生または安全需要を満たすように行動している場合、米国政府は、許可者にこれらの発明のいずれかを第三者に独占的、部分的、または非独占的に許可することを要求する権利がある。(3)政府は、連邦法規の公衆使用に対する要求を満たすために行動しなければならない、または(4)連邦法規の要求を満たすことができなかった(総称して“デモ権利”とも呼ばれる)。
もし私たちまたは私たちのライセンシーが政府に発明を開示できなかった場合、または所定の期限内に知的財産権登録申請を提出できなかった場合、米国政府もこれらの発明の所有権を得る権利がある。このような権利はアメリカ政府が第三者に私たちの機密情報を開示することを可能にするかもしれない。さらに、このような発明に対する私たちの権利は、そのような発明を含む製品を米国で製造するための要件によって制限される可能性がある。政府が援助するプロジェクトの下で発生する知的財産権もいくつかの報告要求によって制約されており、この要求を守るには大量の資源が必要かもしれない。
米国政府のこのような権利のいかなる行使も、私たちの競争地位、業務、経営結果、財務状況、および見通しに実質的な悪影響を及ぼす可能性がある。
もし私たちの商標と商号が十分に保護されていなければ、私たちは興味のある市場で知名度を作ることができないかもしれません。私たちの業務は悪影響を受けるかもしれません。
我々の登録または未登録商標または商号は、挑戦、侵害、回避、汎用商標として発表されるか、または他の商標を侵害していると判断される可能性がある。私たちはこれらの商標と商品名に対する私たちの権利を保護できないかもしれません。私たちは私たちが関心のある市場における潜在的な協力者や顧客の中で知名度を確立するために必要です。時々、競争相手は私たちと似たような商品名や商標を採用して、ブランド表示を確立する能力を阻害し、市場の混乱を招く可能性があります。さらに、他の商標または商標の所有者は、我々の登録または未登録商標または商号の変異体を含む商号または商標侵害クレームを提起することができる。長期的には、私たちの商標や商号に基づいて名称を確立することができなければ、効果的に競争できない可能性があり、私たちの業務は悪影響を受ける可能性があります。私たちの知的財産権に関連する固有の権利を実行または保護する努力は無効になる可能性があり、巨額のコストおよび資源移転を招く可能性があり、私たちの業務、財務状況、運営結果、および見通しに悪影響を及ぼす可能性があります。
買収に関連するリスク
私たちは買収のすべての期待された結果と利益を達成しないかもしれない。
私たちが2023年5月にCyclicaとValenceを買収し、将来の任意の買収は、予想される成長機会とコスト相乗効果を達成する能力にある程度依存するだろう。私たちがこれらの成長機会とコスト相乗効果を成功させるかどうか、そしてこれを実現するタイミングは、CyclicaとValence、および任意の将来の買収目標、業務と運営と私たちの業務と運営の成功との統合にかかっている。私たちの業務をCyclicaおよびValenceの業務とうまく統合することができても、このような統合は、予想された時間枠内で、または現在期待されている結果と利益、成長機会、およびコスト相乗効果を達成できない可能性がある。また,我々はすでに発生しており,CyclicaやValenceの業務と我々の業務統合に関連した追加的な巨額の費用が発生すると予想される.何らかの費用が発生すると予想されていますが、これらの費用は正確に見積もることが難しく、現在の見積もりを超える可能性があります。
したがって,CyclicaやValenceを買収した結果や収益は,会社の統合過程で生じるコストや遅延によって相殺される可能性があり,予想される結果や収益が不正確または実現できなくなる可能性がある.
為替レートの変動は重大な外貨損益を招き、私たちの業務業績に影響を与える可能性がある。
CyclicaとValenceの業績はカナダドルで報告されているので、私たちはカナダドルをドルに変換して、私たちの連結財務諸表に含まれているので、私たちは買収によってより大きな通貨両替リスクに直面しています。したがって、外国為替レート間の変化、特にカナダドルとドルとの間の変化は、外国資産、負債、収入、費用記録の金額に影響を与え、私たちの財務業績にマイナスの影響を与える可能性がある。私たちは現在、外貨変動の影響をできるだけ減らすためのヘッジスケジュールを締結していません。
政府の規制に関連するリスク
私たちの候補薬剤がFDAや他の規制機関の承認を得ても、持続的な規制義務および他の条件の制約を受けることになり、これらの義務および条件は巨額の追加費用を招く可能性があり、意外な安全問題が発見された場合、承認された製品をリコールまたは撤回する可能性がある。
FDAまたは同様の外国の規制機関が私たちの任意の候補薬物を承認したとしても、製品の製造過程、ラベル、包装、流通、有害事象報告、貯蔵、広告、販売促進、および記録は、広範かつ持続的な規制要件の制約を受けるだろう。これらの要求には、安全および他の上場後の情報および報告の提出、機関の登録および上場、および生産過程を継続的に遵守するcGMPおよび承認後に行われる任意の臨床試験のGCPが含まれる。私たちの候補薬物のために得られた任意の規制承認は、製品が発売される可能性のある承認の指示用途または承認条件によって制限される可能性があり、またはそれらは、薬物製品の安全性および有効性を監視するために、潜在的に高価な発売後の研究および監視の要求を含む可能性がある
規制要件を遵守できなかった場合、または薬品に以前に未知の問題が存在することが発見された場合、予期しない重症度または頻度を含む有害事象、または我々の第三者製造業者または製造プロセスと発生したいかなる場合も、以下の結果をもたらす可能性がある
•医薬品の販売または生産を制限し、市場から製品をリコールするか、または自発的または強制的に製品をリコールすること
•臨床試験が有効である
•罰金、警告状、または他の規制された法執行行動;
•FDAは、処理すべき出願または私たちが提出した承認された出願の追加を拒否する
•製品の差し押さえまたは差し押さえ、または薬品の輸出入を許可することを拒否するもの;
•民事または刑事処罰を禁令または適用する。
手術結果と将来性展望。
私たちはいくつかの候補薬の孤児薬の称号を与えられたにもかかわらず、私たちは潜在的な市場排他性を含む、そのような称号に関連する利点を維持できないかもしれない。
私たちのビジネス戦略の一部として、私たちは私たちのいくつかの候補薬のために孤児薬の指定を求め、将来的に他の候補薬のためにそうするかもしれない。米国やヨーロッパを含むいくつかの管轄区の規制機関は、患者数が比較的少ない薬物を孤児薬に指定する可能性がある。薬物がまれな疾患または疾患の治療を意図している場合、FDAはそれを孤児薬として指定する可能性がある。米国では,孤児薬を指定することで一方が臨床試験費用,税収割引,ユーザ費用減免のために贈与資金を提供する機会などの財政的インセンティブを得る権利がある。
同様に、ヨーロッパでは、欧州委員会は、EMA孤児薬物製品委員会の提案に基づいて、生命を脅かす、深刻な虚弱または深刻かつ慢性疾患の診断、予防または治療のための薬剤に孤児薬物の称号を付与し、インセンティブ措置がなければ、ヨーロッパでの販売は、薬剤を開発するための必要な投資が合理的であることを証明するのに十分ではない可能性が高い
FAPおよびREC−994はCCMの潜在的治療に使用されているが,我々は将来の他の候補薬剤では成功しない可能性がある。
一般に、孤児の薬物名を有する薬物がその後、そのような名称の適応を有する最初の発売許可を得た場合、この薬物は、限られた場合でなければ、FDAまたはEMAが、限られた場合を除いて、同じ薬物および適応の別の発売申請を承認することができないようにする。適用期間はアメリカでは7年、ヨーロッパでは10年。薬物が孤児薬物指定の基準に適合しなくなった場合、またはその薬剤の利益が十分に高く、市場排他性を得る理由がなくなった場合、ヨーロッパの排他的期間は6年に短縮されることができる。
我々が薬物の孤児薬物排他性を獲得しても,この排他性は競合から効果的に保護できない可能性があり,異なる薬物が同じ条件で承認される可能性があるからである。孤児薬が承認された後であっても、FDAが、より安全で、より有効であることが証明され、または患者ケアに重大な貢献をしているため、後の薬剤が臨床的に良いと結論した場合、FDAはその後、同じ疾患に対して異なる薬剤を承認することができる。また,指定された孤児薬物が孤児指定の適応を得るよりも広い用途で許可されていれば,孤児薬物排他性を得ることはできない。さらに、FDAが指定された要求に重大な欠陥があると後に判断した場合、または製造業者が稀な疾患または疾患を有する患者の需要を満たすのに十分な数の薬剤を保証できない場合、または同じ分子活性部分を有する別の薬剤がより安全で、より効果的であると判定された場合、または患者ケアに重大な貢献をした場合、米国における孤児薬の独占営業権を失う可能性がある。孤児薬物指定は薬物の開発時間や監督審査時間を短縮することもなく、薬物が監督審査或いは承認過程においていかなる優勢を持たせることもない。私たちは私たちの候補薬のために孤児薬の指定を求めるかもしれないが、私たちは決してそのような指定を受けないかもしれない。たとえ私たちがそのような称号を受け取ったとしても、私たちがこのような称号の利点を享受するという保証はない。
一つの管轄区域で私たちの候補薬物の規制承認を獲得し、維持することは、私たちが他の管轄区域で私たちの候補薬物の規制承認を得ることに成功するという意味ではない。
例えば、これまで、私たちの試験は非常に小さい患者集団しかなく、いくつかの国際監督申告はより大きな患者集団または追加の非臨床研究または臨床試験を必要とする可能性がある。
外国の監督管理の承認を得て、外国の規制要求を遵守することは、私たちに重大な遅延、困難、コストをもたらす可能性があり、私たちの製品がある国/地域で発売されることを延期または阻止する可能性がある。もし私たちが国際市場の規制要求を遵守できず、および/または適用された上場承認を得られなかった場合、私たちの目標市場は減少し、候補薬物市場の潜在力を十分に発揮する能力は損なわれるだろう。
1つの管轄区域で私たちの候補薬物の規制承認を獲得し、維持することは、1つの管轄区域で規制承認を得ることができないか、または規制承認を得ることができないにもかかわらず、他の管轄区の規制承認過程に悪影響を及ぼす可能性があるにもかかわらず、他の管轄区域で規制承認を得ることができるか、または維持できる保証はない。例えば、FDAが候補薬物の発売を許可しても、外国司法管轄区の比較可能な監督管理機関は候補薬物のこれらの国での製造、マーケティング、普及を許可しなければならない。
米国以外での事業拡大に伴い、世界的な規制環境に関する様々なリスクに直面することになる。
私たちはカナダに業務を拡張し、アメリカ以外の多くの地域のサービスプロバイダを利用しており、今後私たちの海外活動が増加すると予想されています。もし私たちがアメリカ以外の業務を拡大し続けるなら、私たちは他の国の活動を管理するアメリカの法律と、私たちが事業を展開する各司法管轄区域の多くの法律と法規、例えばアメリカ外国のような多くの資源を投入しなければなりません
“反腐敗法”(FCPA)および米国と外国の反マネーロンダリング、輸出規制、制裁、その他の貿易法律法規(総称して貿易法と呼ぶ)
“反海外腐敗法”を遵守することは高価で困難であり、特に腐敗は公認問題である国である。また、海外腐敗防止法は製薬業に特別な挑戦をもたらしており、多くの国では病院が政府によって運営されているため、医師や他の病院従業員は外国人官僚とされている。臨床試験やその他の仕事に関連して病院に支払われた何らかの金は、政府関係者に支払われた不正金と考えられ、“海外腐敗防止法”の法執行行動につながった。
貿易法違反は重大な結果を招くかもしれない。私たちは政府機関や政府付属病院、大学または他の組織の役人や従業員と直接または間接的な相互作用を持っている。我々は、第三者を招いて臨床試験および/または必要な許可、許可、特許登録、および他の規制承認を得ることを計画しており、私たちは、このような活動を明確に許可していなくても、事前にそのような活動を知っていても、私たちの人員、代理またはパートナーの腐敗または他の不正活動に責任を負わなければならないかもしれない。
国際ビジネス慣行の持続的な変化、不一致または相互衝突を管理する法律、規則と条例、および解釈と適用における曖昧さは、不確実性と挑戦をもたらしている。このような法律や法規を遵守しない場合、重大な民事·刑事罰を受け、政府請負契約を一時停止または禁止する可能性がある。米国証券取引委員会は、発行者が海外腐敗防止法の会計規定に違反したため、発行者の米国取引所での証券取引を一時停止または禁止する可能性もある。
いくつかの候補薬剤の優先審査指定を得ているにもかかわらず、このような指定は、より速い規制審査や規制承認過程をもたらすことがなく、将来的により多くの候補薬剤のそのような指定を得ることができない可能性がある。
FDAが候補薬剤が重篤な疾患を治療する方法を提供すると判断し、承認された場合、医薬製品は安全性または有効性の面で有意な改善を提供するであろう場合、FDAは候補薬剤を優先的に検討するように指定する可能性がある。FDAは候補薬物の優先審査地位を与えるか否かについて広範な裁量権を有しているため,特定の候補薬がこのような指定や地位を得る資格があると考えても,FDAは付与しないことを決定する可能性がある。FAPの潜在的治療のためにREC−4881の優先審査指定を得ているが、優先審査指定は必ずしも規制審査や規制承認過程の加速につながるとは限らず、従来のFDA手続きではなく、規制承認上のいかなる利点も与えるとは限らない。FDAの優先審査を受けることは、規制部門が6ヶ月の審査期間内に承認されることを保証することができない、あるいは全くできない。私たちは時々他の候補薬の優先的な検討を要求するかもしれない
FDAの画期的な薬物指定と迅速なチャネル指定は、私たちの任意の候補薬物を付与しても、より速い開発、規制審査、または規制承認過程をもたらすことができず、各指定は、私たちのいかなる候補薬物が米国で発売承認される可能性を増加させることはない。
私たちは私たちのいくつかの候補薬のための画期的な治療指定を求めるかもしれない。画期的な治療法は、1つまたは複数の他の薬剤と単独でまたは1つまたは複数の他の薬剤と組み合わせて重篤または生命を脅かす疾患または状態を治療することを意図した薬剤として定義され、初歩的な臨床証拠は、1つまたは複数の臨床的に重要な終点において、臨床開発早期に観察される実質的な治療効果のような既存の療法よりも有意な改善を示す可能性があることを示す。画期的な治療法として指定された薬物に対して,FDAと試験スポンサーとの相互作用やコミュニケーションは,臨床開発の最も有効な経路を決定するのに役立つとともに,無効対照案中の患者数を最小限にすることができる。FDAで画期的な治療法に指定されている薬物も優先審査や加速承認を受ける資格がある可能性がある。画期的療法に指定されたのはFDAの裁量権である。したがって,われわれの候補薬の一つが画期的療法として指定された基準に適合していると考えても,FDAは同意せず,このような指定を行わないことにした可能性がある。いずれの場合も,FDAの従来のプログラムによる承認を考慮した療法と比較して,候補薬物に対する画期的な療法指定を受けることは,より速い開発過程,審査または承認につながらない可能性があり,FDAの最終承認を確保することもできない。また,われわれの1つまたは複数の候補薬が画期的な治療法となる資格があっても,FDAが後でこれらの候補薬が資格条件を満たしていないことを決定したり,FDAの審査や承認を決定する時間帯は短縮されない可能性がある。
私たちは時々私たちのいくつかの候補薬のための迅速な通路指定を求めるかもしれない。候補薬剤が深刻または生命に危険な疾患の治療に使用される場合、候補薬剤がこのような疾患が満たされていない医療需要を解決する潜在力を示す場合、薬物スポンサーは迅速なチャネル指定を申請することができる。FDAは広範な裁量権を有しており,この称号を付与するかどうかを有しているため,特定の候補薬がこの称号を獲得する資格があると考えても,FDAが付与を決定することは確実ではない。私たちが迅速なチャネル認証を受けたとしても、従来のFDAプログラムと比較して、より速い開発過程、規制審査、または規制承認を経験しないかもしれない。FDAが我々の臨床開発プロジェクトのデータが高速チャネルの指定をサポートしなくなったと考える場合,その指定を撤回する可能性がある。高速チャネル指定だけではFDA優先審査プログラムに適合する資格は保証されない。
FDA、EMA、および他の規制機関は、私たちの候補薬物の開発と商業化に追加的な法規や制限を実施するかもしれない。
FDA,連邦,州レベルの他の機関,米国議会委員会は小分子製薬業界をさらに規制する興味を示しており,他国のEMAや規制機関も同様である。そのような行動は私たちのいくつかまたはすべての候補薬物の商業化を延期または阻止するかもしれない。他の人が行った臨床試験の不利な発展は、FDAまたは他の監督機関が私たちの任意の候補薬物に対する規制承認要求を変更することを招く可能性がある。これらの規制審査機関や委員会、ならびに彼らが公表した任意の新しい要求やガイドラインは、規制審査過程を延長し、追加の研究や試験を行うことを要求し、私たちの開発コストを増加させ、規制の立場や解釈の変化を招き、候補薬物の規制承認と商業化を延期または阻止し、あるいは重大な承認後の制限または制限を招く可能性がある。私たちが私たちの候補薬を推進する時、私たちはこれらの規制機関と協議し、適用される規制要求とガイドラインを遵守することを要求されるだろう。もし私たちがこれをできなかったら、私たちはこのような候補薬の開発を延期または停止することを要求されるかもしれない。このような追加的な手続きは私たちが予想していたより長く検討と承認過程を招くかもしれない。より厳格あるいはより長い規制承認過程による遅延、あるいは私たちの候補薬物開発のさらなる制限により、高い代価を支払う可能性があり、私たちの臨床試験を適時に完成し、私たちの現在と未来の候補薬物を商業化する能力に負の影響を与える可能性がある。
米国や国外の医療立法改革措置、例えば医療支出や政策の変化は、私たちの業務、運営結果、将来性に実質的な悪影響を及ぼす可能性がある。
私たちは、高度に規制された業界で運営されており、規制機関または裁判所は、医療可用性および医療製品およびサービスの交付または支払い方法に関連する新しい法律法規または新しい法律法規の解釈が、私たちの業務に悪影響を及ぼす可能性がある。米国および多くの外国司法管轄区域は、医療システムに影響を与える立法および規制改革を公布または提案しており、これは、私たちの臨床試験に影響を与える可能性がある;現在または将来の候補薬物の上場承認を阻止または延期すること、潜在的な承認後活動を制限または規制すること、および/または上場承認を得た薬物製品を収益的に販売する能力に影響を与える。これらの法律および法規は、例えば、(I)私たちの生産スケジュールを変更すること、(Ii)医薬製品ラベルを追加または修正すること、(Iii)私たちの医薬製品の生産をリコールまたは停止すること、および/または(Iv)追加の記録保存およびデータ転送要件を要求する可能性がある市販承認された候補薬剤のいずれかについて。
米国連邦と州および国外では、医療の獲得性を増加させ、医療コストをコントロールまたは低減することを目的とした立法と規制提案が継続されている可能性がある。例えば、“平価医療法案”(ACA)は、米国政府や民間保険会社が医療保健に資金を提供する方式を大きく変え、製薬業に大きな影響を与えている。ACAは他の事項に加えて、(I)生物製品を低コストの生物模倣薬の潜在的な競争を受ける;(Ii)新しい方法を解決し、この方法に基づいて、吸入、輸液、点滴、移植または注射の薬物に対して、メーカーがMedicaid薬品リベート計画の下で不足しているリベートを計算する;(Iii)Medicaid薬品リベート計画の下でメーカーの最低医療補助リベートを増加させ、リベート計画をMedicaid管理の看護組織に登録された個人に拡大する;(Iv)あるブランド処方薬のメーカーに対して年会費と税収を確立する。そして(V)新しいMedicare Part D保証ノッチ割引計画を作成し、この計画によると、メーカーは保証期間内に条件を満たす受益者にブランド薬品交渉価格を適用する特定の販売時点割引を提供することに同意しなければならず、メーカーの外来薬としてMedicare Part Dの条件に組み込まれている。ACAが公布されて以来、国会、行政命令、裁判所判決は法律のいくつかの側面を修正し続けている.
米国議会も調査を行い、連邦と州立法を提出し、(I)特殊薬品の価格設定を含む薬品定価の透明性を高めることを目的とした;(Ii)連邦医療保険(Medicare)下の処方薬のコストを下げ、これは個人支払者の支払いの同様の減少を招く可能性がある;(Iii)価格決定とメーカー患者計画との関係を審査し、(Iv)政府計画薬品の精算方法を改革する。例えば、最近公布された連邦インフレ低減法案(IRA)に含まれる条項は、連邦医療保険下の処方薬のコストを低減するための条項が含まれている場合、承認された場合、収入を創出し、利益を達成し、または候補薬物を商業化する能力に悪影響を及ぼす可能性がある。アイルランド共和軍の連邦薬品精算への直接的な影響に加え、この法規は個人支払者の支払いのような減少を招く可能性がある。政府、保険会社、医療組織および他の医療サービス支払者を管理し、医療コストの制御または低減、および/または価格制御の実施に努力し続けることは、悪影響を及ぼす可能性がある
•もし私たちが規制部門の承認を得たら、私たちの現在または未来の候補薬の需要
•私たちは私たちの薬品に公平だと思う価格を設定することができます
•医薬品の保険と償還承認を得る能力
•私たちは収入を作ったり利益を達成したり維持したりします
•私たちが払わなければならない税金レベル
•資金の入手可能性。
このような立法またはその他の改革措置、ヘルスケア支出および政策の変更は、当社のコストの増加、現在または将来の医薬品候補に対する需要の減少、および追加の価格圧力を生じ、当社の事業、業績および見通しに重大な悪影響を及ぼす可能性があります。
医療サービス提供者、他の顧客、および第三者支払者との関係は、適用されるリベート、詐欺、乱用、および他の医療法律法規の制約を受けることになり、これは、私たちを刑事制裁、民事処罰、政府医療計画から除外され、契約損害、名声損害、利益、および将来の収入の減少に直面させる可能性がある。
私たちは現在何の薬品も発売されていませんが、私たちの候補薬を商業化し始めると、追加の医療法律と法規の要求、連邦政府と私たちが業務を行っている州と外国政府の法執行を受けます。医療提供者、医師、第三者支払人は、私たちが市場の承認を得た任意の候補薬物の推薦と処方の中で主要な役割を果たしている。私たちの将来の第三者支払者や顧客との手配は、広く適用される詐欺や乱用、その他の医療法律や法規に直面する可能性があり、これらの法律と法規は、私たちのマーケティング、販売、流通が上場承認された候補薬物の業務または財務的手配と関係を制限するかもしれません。適用される連邦·州医療保健法律·法規の制限は、“反リベート法規”、“虚偽クレーム法案”、“健康保険携帯性·責任法案”(HIPAA)および“2009年健康情報技術促進経済·臨床健康促進法案”(HITECH法案)を含むが、これらに限定されない
将来的に第三者の業務配置と適用される医療法律や法規に適合することを確保するためには、巨額のコストがかかる可能性があり、他の政策や措置を講じたり実施したりする必要があるかもしれません。私たちは、個人当事者のクレームおよび訴訟、ならびに政府当局のクレーム、調査および他の訴訟に直面する可能性があり、私たちの業務行為は、適用される詐欺および乱用、プライバシーまたはデータ保護、または他の医療保健法律および法規または判例法に関する告発に適合していない可能性があり、裁判所または政府当局は、それらを遵守していないと結論する可能性があり、または、そのような任意のクレームまたは他の訴訟を必要または適切に解決する必要があると考えられるかもしれない。このような任意のクレーム、訴訟、または和解について、私たちは、重大な民事、刑事および行政処罰、損害賠償、罰金、他の損害賠償、監禁、MedicareおよびMedicaidのような政府援助の医療計画から除外され、私たちの業務を削減または再構築することに直面する可能性がある。もし私たちがそれと業務を展開することを期待している任意の医師または他の提供者または実体が適用されない法律に適合していないことが発見された場合、彼らは政府の援助された医療計画から除外されることを含む刑事、民事または行政制裁を受ける可能性がある。
私たちはプライバシー、データ保護、データセキュリティに関する米国と外国の法律に制約されており、これらの法律は巨額のコンプライアンスコストをもたらす可能性があり、守らないことは私たちに重大な責任を負わせるかもしれない。
私たちが事業を展開または将来展開する可能性のある米国、ヨーロッパ、その他の管轄地域では、プライバシー、データ保護、データセキュリティが重要な問題となっている。健康および他の個人情報の収集、使用、保護、共有、移転の規制枠組みは世界的に急速に変化しており、予測可能な未来に変化し続ける可能性がある。私たちに適用されるか、または私たちに適用される可能性のある法律の範囲と解釈はしばしば不確定であり、異なる管轄区域間の異なる解釈の影響を受ける。
米国では、HITECH法案によって改正されたHIPAAは、保険エンティティに対して、個人が健康情報を識別できるプライバシー、セキュリティ、および伝送に関するいくつかの要求を加えている。この立法はまた、違反行為を評価する可能性のある民事と刑事処罰を増加させ、州総検察長に連邦裁判所に民事訴訟を提起して、HIPAAの規定を執行することを許可した。また,米国で行われている臨床試験では,収集されたどの個人情報も連邦保護ヒト被験者政策のさらなる規制を受けている。州レベルでも、カリフォルニア州の重要な新しい立法である“カリフォルニアプライバシー権法案”によって改正された“カリフォルニア消費者プライバシー法”を含むプライバシー法が公布または審議されている。現在HIPAAと臨床試験法規に制約されている保護された健康情報には例外があるが、これらと他の州プライバシー法は私たちの商業活動に影響を与える可能性があり、しかもこれらの法律がどのように解釈と実行するかはまだ不確実性が存在する。他の州では、CCPAのような一般的なプライバシー立法や、ワシントンの私の健康、私のデータ法案などのプライバシー立法が採択されており、これらの立法は私たちのビジネス活動にも影響を与える可能性があり、今後さらに多くの州が似たような立法を評価している
欧州連合(EU)または他の管轄区域で被験者を臨床試験に参加させるか、またはこれらの司法管轄区域個人の個人データを取得または処理する場合、これらのデータの収集、使用、保存、送信、および他の処理に関する追加的な制限および義務を受ける可能性がある。例えば、欧州経済地域(EEA)の臨床試験活動はEU一般データ保護条例(GDPR)によって規制されている
私たちは、このような制限と義務を遵守するために、新しい契約交渉や、国境を越えた個人データの移動に関連する私たちの政策ややり方を修正するなど、より多くのステップを取る必要があるかもしれない。より広く言えば、世界の多くの他の国にはプライバシーやデータ保護を管理する法律法規があり、これらの法律(発展·拡大中)は複雑で一致しない可能性のある義務を生み出し、私たちの業務に影響を与える可能性がある
プライバシー、データ保護、データセキュリティに関する米国と他の国の現行と将来の法律法規の数、複雑性、潜在的な不一致は、私たちのコンプライアンス義務をより困難かつ高価にしている。われわれの研究活動や臨床試験により得られた医療データや他の個人情報については,特にそうである。私たちが適用された法律法規に準拠できなかった場合、または個人情報の不正開示を招くセキュリティホールに遭遇した場合、または個人情報を共有してくれたり、そのような情報を処理してくれた第三者が適用された要求を遵守できなかったり、セキュリティホールや事件に遭遇したりした場合、またはそのような状況が報告されたり、発生したと考えられたりする場合、政府の調査、法執行行動および他の訴訟、および私たちに対する民事クレームおよび訴訟を引き起こす可能性がある。私たちはこのようなクレームや訴訟を弁護するために巨額の費用を発生する可能性があり、巨額の罰金、罰金、金銭判決の責任を要求される可能性もある。上記のいずれも、我々の業務、運営結果、名声、および将来性に実質的な悪影響を及ぼす可能性がある。
人工知能の使用に関する規制や立法発展は、製品、サービス、ビジネスでこのような技術を使用することに悪影響を及ぼす可能性があります。
私たちは私たちの薬物発見過程と技術に含まれる業務全体で人工知能を使用している。人工知能(生成性人工知能を含む)の規制枠組みの変化に伴い、私たちの業務、財務状況、運営結果は不利な影響を受ける可能性がある。人工知能と似たような技術の規制枠組みは急速に変化している。米国と非米国の管轄区域では新しい法律法規が採用される可能性があり、あるいは既存の法律法規の解読方式は、私たちの薬物発見プラットフォームとデータ分析の運営、人工知能と類似技術を使用する方式に影響を与える可能性がある。私たちはこれらの変化する法律と法規に十分に予測したり、応答することができないかもしれません。適用される法的枠組みが異なる管轄区域の間で一致しなければ、いくつかの管轄区域での私たちの製品を調整するために追加の資源が必要かもしれません。さらに、これらの技術自体は高度に複雑で迅速に発展しているため、これらの技術の使用に関連するすべての法律または規制リスクを予測することは不可能である。また、これらの法律や法規を遵守するコストが高くなり、私たちの運営費用が増加する可能性があり、これは私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性があります。
例えば、欧州では、2023年12月8日、欧州議会理事会と欧州委員会が人工知能法案改正草案について臨時合意に達し、2024年初めに公布される予定だ。現在の人工知能法案草案が可決されれば、EU市場で運営されているか、使用されている高リスク人工知能システムを監督するためのリスクに基づくガバナンス枠組みが構築される。人工知能法案はEUに直接存在しなくても、私たちの製品、業務、人工知能の使用に影響を及ぼすかもしれない。この枠組みは,“受け入れられない”,“高い”,“限られた”リスクが生じるように,人工知能システムの期待目的に関するリスクに基づいて人工知能システムを分類する.人工知能法案はまだ公布または実行されていないが、私たちの現在または未来の人工知能ソフトウェアやアプリケーションは、“高”リスクまたは“限られた”リスクに分類される可能性があり、人工知能法案の適用要件を遵守させることは、追加コストをもたらし、私たちの責任リスクを増加させ、あるいは私たちの業務に悪影響を及ぼす可能性がある。例えば、“高”リスク人工知能システムは、開発および訓練において、テスト、技術ロバスト性、透明性、人間監視、およびネットワークセキュリティに関連するいくつかの基準を満たすことを含む、いくつかのリスクおよび品質管理システムを実施し、維持し、いくつかの適合性およびリスク評価を行い、適切なデータ管理および管理アプローチを使用する必要がある。我々の人工知能システムが“高”リスクに分類されなくても,我々は“低”リスク人工知能システムプロバイダの追加的な透明性や他の義務に制約される可能性がある.人工知能法案は、前年禁止された人工知能システムまたはデータ管理の提供に関連する違反に対して3500万ユーロまたは世界の年商の7%の罰金を科すこと、“高”リスク人工知能システムが要求する違反には1500万ユーロまたは前年の世界年商の3%の罰金、EUおよび加盟国当局に不正確、不完全または誤った情報を提供する違反には750万ユーロまたは前年の世界年商の1.5%の罰金を科すことを含むいくつかの処罰を規定している。このような形態または同様の形態で発行されれば、この規制枠組みは、EUが人工知能を規制する方法に実質的な影響を与えることが予想され、この分野の指導および/または決定を制定するとともに、人工知能の使用およびサービスを提供し、改善する能力に影響を与える可能性があり、追加のコンプライアンス措置を採用し、私たちの運営およびプロセスを変更することを要求し、コンプライアンスコストの増加を招き、私たちに対する民事クレームを増加させ、私たちの業務、財務状況、および運営結果に悪影響を及ぼす可能性がある。
私たちの従業員、独立請負業者、コンサルタント、サプライヤーは、規制基準と要求およびインサイダー取引法律を遵守しないことを含む、不適切な行為または他の不適切な活動に従事する可能性があり、これは私たちに重大な責任をもたらし、私たちの名声を損なう可能性があります。
私たちは従業員、独立請負業者、CRO、コンサルタント、サプライヤーの詐欺または他の不適切な行為のリスクに直面している。これらの各方面の不正行為は故意、無謀或いは不注意な行為を含む可能性があり、私たちはFDA法規或いは外国の監督管理機関の類似法規、薬品製造基準及び医療詐欺と乱用法律を遵守できなかった。このような不正行為はまた、臨床試験過程で得られた情報の不正使用と、GDPRを含む米国と他の司法管轄区のHIPAAと他のプライバシー法に違反する可能性がある。私たちはまた従業員や私たちと関連のある他の人たちがインサイダー取引に違反する可能性があるリスクに直面している。従業員や他の個人の不適切な行為を識別して阻止することはいつも可能ではない。私たちがこのような活動を検出し、防止するための予防措置は、未知または未管理のリスクまたは損失を効果的に制御することができないか、または適用される法律、基準、法規または行動基準を遵守しないことによる政府の調査または他の行動または訴訟から私たちを保護することができないかもしれない。正当な理由の有無にかかわらず、私たちにこのような訴訟を提起した場合、私たちが自分の権利を弁護したり、維持することに成功しなかった場合、損害賠償、罰金、その他の制裁を招く可能性があり、私たちの業務、運営結果、名声に実質的で不利な影響を与える可能性があります。
私たちは従業員、独立請負業者、CRO、コンサルタント、サプライヤーの詐欺または他の不適切な行為のリスクに直面している。これらの当事者の不正行為には、故意、無謀、および/または不注意な行為が含まれている可能性があり、FDAの規定または同様の外国規制機関の同様の規定を遵守することができず、FDAまたは同様の外国規制機関に正確な情報を提供し、製造基準を遵守し、連邦および州医療詐欺および乱用法律法規および同様の外国規制機関によって制定および実行された類似の法律および法規を遵守し、財務情報またはデータを正確に報告したり、許可されていない活動を開示したりすることができる。従業員の不当行為はまた臨床試験過程で得られた情報を不当に使用する可能性があり、これは規制制裁と著者らの名声に深刻な損害を与える可能性がある。これには、HIPAA、他のアメリカ連邦、州法律、およびGDPRを含む外国司法管轄区域の要求が含まれる可能性がある。私たちはまた、借り手が質押人が重大な非公開情報を把握しているときに質権株式を売却するなど、従業員または私たちに関連する他の人の任意のインサイダー取引違反に関連するリスクに直面している。
従業員の不正行為を常に識別し、阻止できるわけではなく、このような行為を発見し、防止するための予防措置は、未知または未管理のリスクまたは損失を効果的に制御することができない可能性があり、または、このような法律、基準、法規、ガイドラインまたは行動基準に準拠できないことによる政府の調査または他の行動または訴訟から私たちを保護することができるかもしれない。また、私たちは、このような詐欺や他の不正行為を告発する可能性があり、発生していなくても、私たちの従業員は時々雇用問題で私たちに訴訟を提起する可能性があり、傷害、差別、賃金および工数紛争、セクハラ、敵対的な労働環境、または他の雇用問題を含むリスクに直面している。もし私たちにこのような訴訟を提起し、私たちが私たちの権利を弁護または維持することに成功しなかった場合、これらの訴訟は、民事、刑事および行政処罰、損害賠償、罰金、連邦医療保険、医療補助および他の連邦医療保健計画から除外される可能性があり、契約損害、名声損害、利益および将来の収益の減少、および私たちの業務削減を含むかもしれません。いずれも、私たちの業務運営能力、運営結果、財務状況、名声、見通しに悪影響を及ぼす可能性があります。
気候変動に関連するリスクと不確実性、および気候変動に対応する法律または規制措置は、私たちの運営結果、財務状況および/または名声に悪影響を及ぼす可能性がある。
私たちはますます多くの気候関連のリスクと不確実性に直面しており、その中の多くのリスクと不確実性は私たちがコントロールできない。気候変化はより頻繁な悪天候事件、降水パターンの潜在的な変化、および天気パターンの極端な変動を招く可能性があり、これは私たちおよび私たちのサプライヤー、サプライヤーと協力者の運営を乱す可能性がある。
より低い温室効果ガス排出技術への移行、炭素価格の影響、公衆感情、法規、税収、公共権限または要求の変化、および気候関連訴訟、保険料の増加、およびよりロバストな災害復旧および業務連続計画を実施することは、運営の維持または回復、または私たちが行った任意の持続可能な開発約束を実現するコストを増加させる可能性があり、これは私たちの運営結果に負の影響を与えるだろう。
私たちはまた他の環境、社会、そして統治目標を達成するために努力している。未来の約束や目標の実行と達成は危険と不確実な要素の影響を受ける。
従業員の事務と管理成長に関するリスク
私たちの未来の成功は私たちが肝心な幹部と経験豊富な科学者を維持する能力、及び合格者を吸引、維持と激励する能力にかかっている。
著者らは著者らの幹部、管理、科学、技術と臨床チームの研究開発、臨床と業務発展の専門知識に高度に依存している。私たちは私たちの幹部と雇用協定を締結しましたが、彼らの誰もが私たちとの雇用関係をいつでも終わらせたり、未来に私たちが必要なサービスを履行できないかもしれません
合格した科学研究、臨床、製造、販売とマーケティング人員を募集と維持することも著者らの成功のキーポイントである。例えば、私たちは従業員に頼って私たちの設備の操作と修理を助け、コンサルタントとコンサルタントに依存して、科学と臨床コンサルタントを含めて、私たちの研究開発と商業化戦略の制定を助けてくれます。私たちの業務は専門的な科学的性質であるため、私たちは合格した科学、技術と管理者を誘致と維持することに高度に依存している。後継者と潜在的な人材ニーズを決定する組織人材審査プログラムの構築により,既存従業員の潜在的流出の影響を減らす努力をしているが,製薬やバイオテクノロジー分野では合格者への激しい競争が存在している。したがって、私たちは業務の持続的な発展に必要な合格者を引き付けて維持することができないかもしれない。既存の人員のサービスを失い、より多くの重要な科学者を募集し、訓練することができなかった
技術と管理者がタイムリーでなければ、私たちの業務、運営結果、財務状況、将来性を損なう可能性があります。
役員や他の重要な従業員やコンサルタントのサービスを失うことは、業務戦略を成功させる能力を阻害する可能性があります。幹部と肝心な従業員を交換することは困難かもしれないが、私たちの業界では開発に成功し、監督部門の許可を得て薬品を商業化するために必要な技能と経験を持っている個人数が限られているため、多くの製薬と生物技術会社の間の類似者に対する競争があるからである。さらに、私たちのコンサルタントやコンサルタントは、他のエンティティとの相談やコンサルティング契約で約束やeスポーツ禁止義務を負うことができ、彼らを得る機会を制限することができます。私たちはまた、大学や研究機関から科学や臨床人を募集する困難に直面する可能性がある。もし私たちの1つ以上の臨床試験が成功しなければ、合格した科学者を募集し、維持することはもっと挑戦的になるかもしれない。
また、賃金や賃金の増加、個人休暇やその他の休暇政策の延長、他の労働力コストに影響を与える政府法規、および失業率が低下した場合の潜在的合格者バンクの減少は、私たちの労働コストを著しく増加させ、合格者を引き留め、吸引、激励することをより困難にする可能性があり、これは私たちの業務、財務業績、現金備蓄に実質的な悪影響を与える可能性がある。インフレ圧力と他の措置により、私たちの純損失は増加する可能性があり、私たちは予想よりも早く資金を調達する必要があるかもしれない。私たちが大量の労働力を雇用しているため、いかなる追加の昇給や昇給、および/または福祉任務の拡大は、私たちの労働コストに特に大きな影響を与えるだろう。私たちのサプライヤー、請負業者、および業務パートナーも同様に賃金と福祉コストの上昇の影響を受けており、多くの人はすでに商品、建築、サービスの価格を高めて、彼らの上昇している労働力コストを相殺している。
私たちが将来雇用したいかもしれない何人かの従業員はユタ州ソルトレイクシティや私たちが業務を持っている他の地域に住んでいないかもしれません。移転したくないかもしれません。また、私たちと合格人材を競争している多くの他の製薬やバイオテクノロジー会社は、より多くの財務や他の資源、異なるリスク状況、および私たちよりも長い業界歴史を持っている。それらはまた職業発展にもっと多様な機会とより良い機会を提供するかもしれない。
もし私たちが高い素質の高級管理者と人員を採用、維持、激励することができなければ、候補薬物の速度と成功率、成長戦略を実施する能力、そして私たちの業務は不利な影響を受ける可能性があることを発見し、開発した。
私たちは私たちの開発と規制能力を拡大し、販売、マーケティング、流通能力を実施する可能性があると予想されているので、私たちは成長を管理する上で困難になるかもしれません。これは私たちの運営を混乱させる可能性があります。
私たちは従業員の数と業務範囲が増加すると予想している。私たちが予想している将来の成長を管理するためには、私たちの管理、運営、財務システムを継続して実施し、改善し、私たちの施設を拡大し、より多くの合格者を募集し、訓練し続けなければならない。私たちの財務資源が限られていることと、私たちの管理チームがこのような成長を期待している会社を管理する上での経験が限られているため、私たちの業務の拡張を効果的に管理したり、より多くの合格者を募集したりすることができないかもしれません。私たちの業務の拡張は巨大なコストを招き、私たちの管理と業務発展資源を移転する可能性があります。成長を管理できないどんな状況も、私たちの業務計画の実行を延期したり、私たちの運営を妨害したりする可能性がある。
私たちは、より多くの業務や製品を買収し、戦略連合を形成したり、第三者と合弁企業を設立したりする可能性があり、これらは既存の業務を補完または拡大すると考えられます。将来性のある市場や技術のビジネスを買収すれば、既存の運営や会社文化と組み合わせることに成功できなければ、これらの事業を買収するメリットは実現できないかもしれません。私たちは戦略連合や買収によって生まれた任意の新製品を開発、製造、マーケティングする時に多くの困難に直面する可能性があります。これらの新製品は私たちが期待した利益を達成したり、私たちの業務を強化したりすることを延期したり阻止したりすることができます。このような買収の後、取引が合理的であることを証明するために、予想される相乗効果を達成することは確実ではない。
証券市場とA類普通株所有権に関するリスク
私たち普通株の二重株式構造は投票権の集中に影響を与え、これは、私たちの会社の登録証明書と定款の改正、および任意の合併、合併、私たちの基本的なすべての資産の売却、または他の重大な会社取引を含む、私たちのA種類の普通株主が私たちの株主に提出した承認事項の結果に影響を与える能力を制限します。
私たちのA類普通株、ナスダックに上場している普通株の種類は、一株当たり一票、私たちのB類普通株、一株当たり十票です。2023年12月31日現在、私たちの最高経営責任者兼取締役会のギブソン博士とその付属会社は、私たちA類普通株の343,704株および私たちB類普通株のすべての発行済み株式と発行済み株を持っており、私たちの発行した株式投票権の約25%を占めており、ギブソン博士が株式奨励を行使したり付与したりするにつれて、投票権は時間とともに増加する可能性がある。もし2023年12月31日までに、ギブソン博士が保有しているすべてのこのような株式奨励が行使または帰属され、Bクラス普通株に交換された場合、ギブソン博士およびその付属会社は、私たちが発行した株式の約26%の投票権を保有するだろう。
したがって、ジブソン博士は、私たちの取締役会を選出し、私たちの会社の登録証明書や定款の改正、任意の合併、合併、販売、私たちのすべての資産、または他の重大な会社取引を承認することを含む、私たちの株主の承認を必要とするいかなる行動にも大きな影響を与えることができるかもしれません。ギブソン博士は私たちA種類の普通株主とは異なる利益を持っているかもしれませんし、私たちA類株主が同意しない方法で投票するかもしれません。これは私たちA類株主の利益に不利になるかもしれません。ギブソン博士の集中制御は、わが社の支配権の変更を遅延、防止、阻止する可能性があり、わが社の株主がわが社を売却する際に配当金の割増を得る機会を奪う可能性があるため、私たちA類普通株の市場価格に影響を与える可能性があります。
B類普通株保有者の将来の譲渡は、一般にこれらの株をA類普通株に自動的に変換するが、ある遺産計画譲渡のような限られた例外がある。B類普通株の譲渡や交換は、A類普通株を追加発行する可能性があり、この発行は、私たちA類普通株の保有者を希釈します。さらに、1株当たりB類普通株は、以下のより早い日にA類普通株に自動的に変換される:(I)2028年4月16日、(Ii)66 2.3%を保有していた当時発行されていたB類普通株の所有者が書面で同意または協議で指定した日、(Iii)ギブソン博士が私たちの高級管理者または取締役の任意の職に就くことを停止した後9ヶ月、または(Iv)ギブソン博士の死去または障害後9ヶ月。改訂および再記載された会社登録証明書の条項に基づき、すべてのB類普通株発行済み株式の最終転換日を最終転換日と呼ぶ。
私たちの主要株主と経営陣は私たちのかなりの割合の株を持っており、株主の承認が待たれる事項に大きな制御を加えることができるだろう。
2023年12月31日現在、私たちの役員、役員、私たちの5%以上の株を持っている人、および彼らのそれぞれの関連会社は、ギブソン博士とその関連会社を含み、実益が所有する株式は私たちの投票権の50%以上を占めています。これらの株主は、取締役を選挙することを含む株主の承認を必要とする事項に影響を与えることができるかもしれないし、私たちの組織文書を修正すること、私たちのすべてまたはほとんどの資産を合併、売却すること、または他の重大な会社取引を承認することができるかもしれない。この集中制御はまた、他の株主がこれが彼らの最適な利益であると考えている可能性があるため、我々の株式に対する能動的な買収提案や要約を抑止、延期、または防止する効果がある可能性がある。このような株主の利益は常にお互いの利益や他の株主の利益と一致するわけではなく、このような株主の行動方式は、必ずしも他の株主の全体的な利益ではなく、彼らの普通株のためのプレミアムを求めることを含む、その最大の利益を促進する可能性があり、これは私たちの普通株の市場価格に影響を与える可能性がある。
私たちA種類の普通株の価格は大きく変動する可能性があり、これは私たちの普通株の保有者に大きな損失をもたらす可能性がある。
我々が初めて公募して以来、我々A類普通株の取引価格は安定しておらず、将来的に価格が大幅に変動する可能性がある。株価は多くの要素の影響を受ける可能性があり、その中のいくつかの要素は制御できないが、これらの要素は以下のいくつかを含むが、これらに限定されない
•競争力のある製品や技術の成功
•私たちの候補薬や競争相手の臨床試験結果
•アメリカや他の国の法規や法律の発展
•特許出願、発行された特許または他の固有の権利に関連する開発または紛争;
•キーパーソンの採用や退職
•私たちの任意の候補薬や臨床開発計画に関連する費用レベル
•私たちはより多くの候補薬や医薬製品の結果を発見し開発し、得るために努力している
•財務結果、発展スケジュール、または証券アナリストの提案に関する推定の実際または予想変化;
•私たちの財務業績や私たちと似ていると思われる会社の財務業績の違い
•医療支払い制度の構造を変え
•インフレ、サプライチェーン問題、世界的な政治不安定、あるいは戦争
•全体的な株式市場の表現、特にバイオテクノロジー会社の株式表現、および全体的な経済状況
•“リスク要因”の節で述べた他の要因。
このような変動により、私たちA種類の普通株の保有者は、彼らが最初に支払った価格よりも高い価格で彼らの株を売ることができない可能性があり、これは彼らの一部または全部の投資損失を招く可能性がある。
私たちA種類の普通株を公開市場で売っている大量の株は私たちの株価を下落させる可能性があります。
私どものA類普通株の大量株はいつでも公開市場で販売される可能性があります。これらの売却、あるいは市場で1人以上の大量の株を持っていると思っている人が彼らの株を売却しようとしていることは、私たちA類普通株の市場価格を下落させる可能性がある。
また、未償還オプション及び引受権証の制約を受けたA類普通株、又は我々の持分補償計画に基づいて将来発行のために予約されたA類普通株は、各種帰属スケジュールの規定及び証券法第144条及び第701条で許可された範囲内で、公開市場で販売する資格がある。私たちA類普通株の保有者の一部は、B類普通株転換後に発行し、発行可能なA類普通株の保有者は、証券法に基づいて彼らの株式を登録する権利がある。証券法によるこれらの株の登録は、これらの株が自由に取引できるようになり、証券法の制限を受けず、付属会社が購入した株を除く。
将来、私たちはいかなる融資、投資、あるいは買収に関連する証券を発行することも可能であり、発行された株式数は私たちが当時発行した普通株の重要な部分を構成するかもしれない。例えば2023年5月のValence買収については私たちはValenceのある株主と登録権協定を締結し、株主に約810万株の私たちA類普通株の転売を許可する登録声明を準備して提出することを要求した。このような転売募集説明書の付録は2023年5月30日に提出される2023年5月のCyclica買収と関係がありますCyclicaのある株主と登録権協定を締結し、2022年5月10日に提出された自動棚上げ登録声明を追加し、株主に約600万株の私たちのA類普通株の転売を許可する転売目論見書を準備して提出することを要求した。このような転売募集説明書の付録は2023年6月9日に提出される。私たちは2023年7月の私募について、私たちは私募投資家と登録権協定を締結し、2022年5月10日に提出した自動棚上げ登録声明の転売募集説明書補足書類を準備して提出することを要求し、私募投資家が約770万株の私たちのA類普通株の転売を許可することを要求した。このような転売募集説明書の付録は2023年8月8日に提出される。2023年12月には,2022年5月10日に提出された自動棚登録声明の募集説明書補編を提出し,Tempusプロトコル条項での初期許可料を支払うために,Tempusに発行したA類普通株約320万株を登録転売した。
上記のいずれの場合または他の場合には、いつでも我々A類普通株の大量株を公開市場で売却するか、またはこれらの株が売却される可能性があると考えても、我々A類普通株の市場価格に大きな悪影響を及ぼす可能性がある。この場合、私たちA種類の普通株の保有者は、彼らが最初に支払った価格よりも高い価格で彼らの株を売ることができない可能性があり、これは彼らの一部または全部の投資損失を招く可能性がある。
私たちは会社の登録証明書を改訂して再説明し、改訂と再記述の定款はデラウェア州衡平裁判所を特定のタイプの訴訟と指定します
私たちの株主によって開始される可能性のある訴訟は、私たちまたは私たちの役員、上級管理者、従業員または代理人との紛争において有利な司法フォーラムを得る能力を制限することができます。
私たちは、デラウェア州衡平裁判所とアメリカ合衆国連邦地域裁判所は、私たちと私たちの株主とのほとんどの紛争の独占法廷であり、これは、私たちの株主が私たちまたは私たちの役員、役員、または従業員との紛争が有利な司法フォーラムを得る能力を制限する可能性があるという定款を改正し、再記載します。
我々の改正及び重述の附例規定は、デラウェア州衡平裁判所、又は衡平裁判所に管轄権がない場合、デラウェア州の他の州裁判所又はデラウェア州地区の連邦地域裁判所は、次の事件の専属裁判所であるが、当該裁判所が当該裁判所の管轄権の管轄を受けない不可欠な一方のクレームが存在すると認定した場合を除き、かつ不可欠な一方は、このような裁決を下してから10日以内に当該裁判所の属人管轄権に同意せず、当該裁判所は当該裁判所以外の裁判所又は裁判所の排他的管轄権に属する、又は当該裁判所が当該裁判所に対して標的管轄権を有さないことを認定する
•私たちが提起した任意の派生訴訟や法的手続きを代表する
•受託責任に違反するいかなる訴訟も主張する
•デラウェア州会社法に基づいて、私たちが改訂し、再説明した会社証明書、または私たちが改正して再説明した定款に基づいて、私たちにクレームを提起した任意の訴訟;
•内政原則によって管轄されている私たちのクレームに対するいかなる行為も主張する。
この規定は、 1934 年の証券取引法 ( 以下「取引法」 ) によって生じる義務または責任を執行するために提起された訴訟、または米国連邦裁判所が排他的管轄権を有するその他の請求には適用されません。当社の改正および再制定された細則は、さらに、米国連邦地方裁判所が、証券法に基づいて生じる訴訟の原因を主張する苦情を解決するための排他的フォーラムとなることを規定しています。
元は排他的裁判所条項は,司法裁判所で株主が有利と思われるクレームを出す能力を制限する可能性がある私たちまたは私たちの役員、上級管理職、または他の従業員との紛争は、株主のクレームのコスト増加を招く可能性があり、すべてのクレームは、私たちと私たちの役員、上級管理者、および他の従業員に対する訴訟を阻止する可能性があります。任意の個人またはエンティティが、私たちの任意の証券の任意の権益を購入または他の方法で取得することは、これらの規定に了承され、同意されたとみなされるべきである。裁判所がこれらの規定を強制執行するかどうかには不確実性があり,他の定款文書では選択のような裁判所条項の実行可能性が法的手続きで疑問視されている。裁判所は、これらのタイプの条項が適用されないか、または実行できないことを発見する可能性があり、もし裁判所が私たちの改正および再記載された法律における排他的な裁判所条項が訴訟で適用されないか、または実行できないことを発見した場合、私たちは他の管轄区域での紛争解決に関連する追加費用を発生する可能性があり、これは私たちの業務を深刻に損なう可能性がある。
当社の会社登録証明書の改正と再記述、改正と再記述の法律とデラウェア州法律の条項は、わが社の支配権の変更や私たちの経営陣の変更を阻止、延期、阻止する可能性があり、それによって私たちA類普通株の市場価格を下げることができます。
私たちが改訂して再記述した会社登録証明書および改訂と再記述された定款に含まれる条項は、これらの条項がわが社の支配権の変更を阻止、延期、または阻止する可能性があり、あるいはわが社の株主が有利と思う経営陣の変更を阻止、遅延または阻止する可能性があるため、私たちA類普通株の市場価格を低下させる可能性があります。他にも、これらの規定には、
•私たちの取締役会のすべてのメンバーが選挙で生まれないように分類された取締役会を作ります
•取締役会が取締役数を確定し、取締役会の空きを埋めることだけを許可する
•“空白小切手”優先株の発行を許可し、我々の取締役会は株主権利計画(“毒丸”とも呼ばれる)を実施することができる
•株主が株主特別会議を開催する能力を廃止し
•株主の書面同意による行動を禁止することは、すべての株主の行動が私たちの株主会議で行われなければならないことを要求する
•累積投票を禁止する
•当社の取締役会に会社の定款を修正することを許可した
•取締役会への指名又は株主が年次株主総会で行動可能な事項を規定する事前通知要求;
•上記のいくつかの条項を修正するためには株主の絶対多数票が必要だ。
また、デラウェア州一般会社法(DGCL)第203条は、取引日後3年以内にデラウェア州上場企業が利害関係のある株主(通常、その関連会社と所有しているか、過去3年以内に議決権株を有する者)との商業合併を禁止しており、当該商業合併が所定の方法で承認されない限り、商業合併を行うことを禁止している。
私たちが改訂し、再記載した会社登録証明書、改訂および再記載された定款またはDGCLのいずれの遅延または制御権変更を防止する条項は、私たちの株主が彼らが持っているA類普通株から割増の機会を得ることを制限する可能性があり、一部の投資家が私たちの株式に支払いたい価格に影響を与える可能性もある。
私たちの実際の運営結果は私たちが提供したどんな指導意見と大きく違うかもしれない。
私たちは時々私たちの四半期収益報告書で私たちの将来の業績に関する指導を提供するかもしれません。これらの指導は発表日までの私たちの経営陣の見積もりを表しています。この指導は私たちの経営陣が準備した予測に基づいて前向きな陳述を含むだろう。私たちの公認会計士、他の独立した専門家、または外部の人たちはこのような予測を作成したり検討したりしません。したがって、この人たちは予測について何の意見も発表したり、他の形態の保証をしないだろう。
予測は、いくつかの仮定および推定に基づいており、これらの仮説および推定は、数字の特殊性で示されているが、本質的には、重大な商業、経済、および競争不確実性および予期しないイベントの影響を受け、その多くは、将来の業務決定に関する特定の仮定に基づいており、その中のいくつかは変化するであろう。私たちが指針を発表した主な理由は、アナリストや投資家と私たちの業務の見通しを議論するために、私たちの経営陣に基礎を提供することです。このような第三者が発表したいかなる予測や報告書についても、私たちは何の責任も負わない。指導意見は必然的に投機的であり,我々が提供するどの指導意見に基づいている部分やすべての仮説が現実にならないか,あるいは実際の結果とは大きく異なることが予想される.したがって、私たちの指導は管理職が発表日までに達成可能だと思っている見積もりに過ぎない。実際の結果は私たちの指導とは違うかもしれないし、変化は実質的かもしれない。
上場企業として、適切かつ効果的な財務報告開示統制·内部統制制度を策定·維持する責任がある。このシステムやこれらの内部統制を維持できなかった十分性は、投資家がわが社の自信に悪影響を与え、わがA類普通株の価値に影響を与える可能性がある。
我々は“取引所法案”、“サバンズ-オキシリー法案”、およびナスダックが上場基準を適用する規則と法規の報告要件を遵守しなければならない。私たちはこのような規制の要求が私たちの法律、会計、そして財務コンプライアンスコストを増加させ続けるだろう;いくつかの活動をより困難にし、時間と費用を増加させ、私たちの人員、システム、そして資源に大きな圧力をもたらすと予想する
“サバンズ-オキシリー法”(Sarbanes-Oxley Act)は、私たちに効率的な開示制御と手続きと財務報告に対する内部統制を維持することを要求する。我々は、米国証券取引委員会に提出された報告で開示を要求した情報が、米国証券取引委員会規則及び表に指定された期間内に記録、処理、集計及び報告されることを確実にし、取引所法案に基づいて報告書に開示された情報が蓄積され、我々の主要幹部及び財務官に伝達されることを確実にするために、我々の開示制御及び他の手続きを継続して整備している。私たちはまた財政報告書に対する内部統制を改善し続けている。財務報告書の開示制御および手続きおよび内部統制に対する私たちの有効性を維持し、向上させるために、会計に関連するコストおよび重要な管理監視を含む大量の資源が引き続きかかることが予想される
私たちの現在の統制と私たちが開発したどんな新しい制御も私たちの業務条件の変化によって十分ではないかもしれません。また、会計原則や解釈の変化は、私たちの内部統制に挑戦する可能性もあり、このような変化に適応するために新しいビジネスプロセス、システム、および制御を確立することが求められています。上場企業の運営に必要な制度や制御の実施には経験が限られており、以下の点で会計原則や解釈の変化を採用している
関連する規制機関。私たちの最高財務官は、私たちが初めて公募して以来、上場会社の最高財務官しか担当しておらず、私たちの最高経営責任者は自己初公募以来、上場企業の最高経営責任者を務めたことがあります。両社とも上場企業の長期運営には関与していない。さらに、これらの新しいシステム、制御または基準、および関連するプロセスの変化が、私たちの予想されるメリットをもたらしていない場合、または予想通りに動作していない場合、私たちの財務報告システムおよびプロセス、タイムリーで正確な財務報告を作成する能力、または財務報告の内部統制の有効性に悪影響を及ぼす可能性がある。また、任意の新しいシステムや制御の問題に遭遇した場合、発生する可能性のある任意の実施後の問題を修正するコストを遅延させたり、私たちの業務が損なわれる可能性があります。
サバンズ·オキシリー法第404条の規定によると、財務報告書の内部統制に関する報告書を管理職が提出しなければならない。この評価は財務報告書の内部統制で発見された経営陣の重大な弱点を開示することを含まなければならない。私たちの内部統制を評価する際に、私たちの財務報告内部統制に1つ以上の重大な弱点があることが発見された場合、私たちの財務報告内部統制が有効であるとは断言できないだろう。例えば、2023年12月31日現在と2023年12月31日現在の年度の総合財務諸表を監査したところ、当社の経営陣や監査人は、その収入許可協定に関連する収入を算定するためのコスト過程における会社の大きな弱点を発見した。見てください“-私たちは財務報告書の内部統制の重要な弱点を発見した。有効な内部統制を維持できなければ、財務諸表をタイムリーかつ正確に作成できない可能性があり、財務報告書の内部統制が無効であり、投資家の信頼と私たちの株価に悪影響を及ぼす可能性があると結論するかもしれない。私たちはあなたにこのような重大な欠陥を補うことができるか、あるいは私たちが未来に財務報告書の内部統制に重大な欠陥や重大な欠陥が発生しないということを保証することはできません。
財務報告書の効率的な開示制御および内部統制を維持できなかったいかなる場合も、我々の財務状況や運営結果を正確に報告する能力を深刻に抑制する可能性がある。いつでも、財務報告の開示統制や内部統制に有効であるという結論を得ることができない場合、あるいは私たちの独立公認会計士事務所が私たちの財務報告の内部統制に重大な弱点や重大な欠陥があると思っている場合、または既存の弱点や不足をタイムリーまたは根本的に是正できない場合、私たちは財務報告の正確性と完全性に投資家の信頼を失う可能性があり、私たちAクラスの普通株の市場価格は下落する可能性があり、私たちはナスダック株式市場、米国証券取引委員会、または他の規制機関の制裁や調査を受ける可能性がある。財務報告の内部統制のいかなる重大な欠陥を補うことができなかったり、上場企業に必要な他の効果的な制御システムを実施または維持できなかったりすることは、将来的に資本市場に参入する機会を制限する可能性もある。
私たちは財務報告書の内部統制に重大な欠陥があることを発見した。もし私たちがこの重大な弱点を補うことができない場合、あるいは未来により多くの重大な弱点があることを発見したり、効果的な内部統制を維持できなかったりすれば、タイムリーかつ正確な財務諸表を作成できない可能性があり、これは私たちの投資家の自信と私たちの株価に悪影響を及ぼすかもしれない。
2023年12月31日までおよび2023年12月31日までの年度の総合財務諸表を監査したところ、経営陣は、見積もりコストと完了時間、および当社のライセンス契約に関連する収入と未収入を計算するための情報の完全性と正確性を検証するための制御において、会社経営層の審査過程に関する大きな弱点を発見した。重大な欠陥とは、財務報告の内部統制に欠陥或いは欠陥の組み合わせが存在し、私たちの年度或いは中期合併財務諸表の重大な誤報が合理的な可能性があり、適時に防止或いは発見できないようにすることである。
財務報告書の内部統制を改善し、これらの重大な弱点を是正するための措置を講じているにもかかわらず、私たちがこれまで取ってきた措置は、将来の潜在的な重大な弱点を回避するのに十分であることを保証することはできません。
もし私たちの財務報告の内部統制に新たな重大な弱点があることが発見された場合、サバンズ·オクスリ法案404条の要求を遵守できなければ、私たちの財務報告の内部統制が有効であるという結論が得られなければ、あるいは私たちの独立公認会計士事務所が財務報告の内部統制に対して今後一定期間有効な意見を表現できなければ、投資家は私たちの財務報告の正確性と完全性に自信を失う可能性があり、私たちの普通株の市場価格は負の影響を受ける可能性がある。このような失敗により、私たちはナスダック、アメリカ証券取引委員会、あるいは他の規制機関の調査の対象となり、投資家と株主が訴訟を提起する対象となる可能性もあります
私たちの名声や財務状況を損なうか、または私たちの正常な業務活動から財務·管理資源を移転する可能性がある。
一般リスク
不利な世界経済状況は私たちの業務に悪影響を及ぼすかもしれない。
私たちの経営業績は世界経済と世界金融市場の全体的な状況の悪影響を受ける可能性があります。例えば、世界の政治不安定、サプライチェーン問題、インフレは米国と国際市場で大きな変動と不確実性をもたらしている。連邦政府債務上限や関連予算問題における米国の不確実性は、世界市場の変動や不確実性を招く可能性もある。深刻または長期的な経済低迷は、候補薬剤に対する需要の低下、必要に応じて許容可能な条件で追加資本を調達する能力の損傷など、私たちの業務に様々なリスクをもたらす可能性がある。経済の疲弊や下落はまた私たちの供給者に圧力を与えたり、供給中断を招く可能性がある。上記のいずれも私たちの業務を損なう可能性があり、現在の経済環境および金融市場状況が、私たちの業務、経営結果、財務状況、および見通しに悪影響を及ぼす可能性のあるすべての方法を予見することはできません。
私たちは通常の業務過程で起こりうる訴訟のリスクに直面しており、これは高価で時間のかかる訴訟や弁護である可能性がある。
私たちは、商業または契約紛争、知的財産権、雇用問題、製品責任またはデータプライバシーに関連する訴訟またはクレームのような、正常な業務プロセス中に生じる法的訴訟またはクレームに定期的、将来的にも参加する可能性がある
上場企業として、私たちと私たちの役員や上級管理職も証券集団訴訟を受ける可能性があります。特に私たちA類普通株の市場価格が変動すれば。全体的に、株式市場、特にナスダック上場会社と生物技術会社は、時々重大な価格と出来高の変動を経験し、このような変動は往々にしてこれらの会社の経営業績と関係がないか比例しない。過去には,株価変動を経験した会社が証券集団訴訟を受け,将来的にはこのような訴訟の目標となる可能性がある.
訴訟は、価値があるかどうかにかかわらず、高価な訴訟または弁護である可能性がある;経営陣の注意をそらすこと;損害賠償、禁止救済、処罰、罰金をもたらす不利な判決;そして私たちの業務と名声を損なう。 Sいくつかの第三者は彼らがより多くの資源を持っているので、私たちよりも効率的に訴訟費用を負担するかもしれない。保険はすべてのクレームを含まないかもしれません。あるいは私たちの費用と損失の一部だけをカバーする可能性があり、私たちが受け入れられる条項で保険を提供し続けることができないかもしれません
もし証券アナリストが私たちの業務に関する研究や報告を発表しなければ、あるいは彼らが私たちの株に対するマイナス評価を発表したら、私たちの株価は下落するかもしれません。
私たちA類普通株の取引市場は、業界または金融アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存している。もし一部のアナリストだけが私たちの報告書を維持すれば、私たちの株の取引価格は下がるかもしれない。もし私たちの株を追跡したアナリストが私たちの株に対する彼らの評価を下げたら、私たちの株価は下落するかもしれない。もしこのようなアナリストの一人以上が私たちの株を追跡しなければ、私たちは市場での私たちの株の可視性を失うかもしれないし、これは逆に私たちの株価を下落させるかもしれない。
項目1 B。未解決の従業員のコメント。
ない。
プロジェクト1 C。ネットワークセキュリティです。
私たちはネットワークセキュリティが私たちの企業のリスク管理機能の重要な構成要素だと信じている。私たちの情報セキュリティ戦略(“InfoSec”)は、全面的、能動的、持続可能なリスクに基づく方法を含み、戦略、運営、財務、名声の面から会社が構成するリスクを評価する。私たちはこのようなリスクを持続的に減少させるために適切な予防、検出、そして対応措置を取った。
リスク管理プロセス
再帰会社のInfoSec方法は、会社のInfoSecリスクの評価とInfoSec能力の実施に方向と指導を提供し、組織業務目標に関連する分野の進展測定基準を提供する広範な標準フレームワークである国家基準と技術研究所(“NIST”)ネットワークセキュリティフレームワーク(“CSF”)によって情報を提供する。
リスク識別と評価
我々は、第三者InfoSecコンサルタントを含む様々なソースからの脅威情報を定期的に検討し、既知の脅威や脅威参加者の行動や戦略の会社への適用性を評価し、これらの脅威が会社にリスクになるかどうかを評価する専門のInfoSecチームを持っている。次に、InfoSecチームは、適切なビジネス環境においてこれらのリスクを軽減および低減し、適切な場所でこれらの制御を適用するために、潜在的な適切な管理、技術、および物理的制御を評価する。また、第三者サービスプロバイダの使用に関連するネットワークセキュリティ脅威によるリスクを識別し、緩和するためのプログラムを実施した
これらの緩和措置は会社のInfoSec路線図に詳しく説明されている。経営陣や会社監査委員会とともに、本路線図の進捗状況および潜在的なイベントを検討します。
リスク保障
我々のInfoSecチームは、AICPAによって承認された独立監査師によって準備された報告を含む業界標準認証をテストし、維持します
また、浸透テストのようなネットワークセキュリティ演習を定期的に行い、私たちの制御措置の有効性をテストします。我々は,これらの学習の結果を用いてInfoSec路線図から潜在的な改善領域の優先順位を決定し,評価し,決定する
結果を軽減する
また,第三者が協力するデスクトップ演習により,会社のInfoSecのイベント応答制御の有効性をテストした.これらの演習は、ネットワークセキュリティ事件の影響を減らすことを目的として、会社がサイバーセキュリティ事件を適時に検出し、対応する能力を試練した。これらの学習により,我々のInfoSecポリシー,プロセス,プログラムは完全性と正確性テストを経ている.我々は,これらの学習の結果を用いて,InfoSec路線図によって決定された潜在的改善領域の優先順位を決定し,評価し,決定する.
現在の環境のどの科学技術会社と同様に,我々は過去にもサイバーセキュリティ事件を経験したが,我々はまだ重大な事件と決定されたサイバーセキュリティ事件を経験したことがない.ネットワークセキュリティ脅威が当社の企業に実質的な影響を与える可能性があるかどうかに関する他の情報は、当社の業務戦略、運営結果、または財務状況を含み、“当社のプラットフォームおよびデータに関連するリスク”と題するリスク要因が含まれている本10-K表年次報告の第1 A項“リスク要因”を参照されたい
サイバーセキュリティ·ガバナンス
私たちのサイバーセキュリティ手続きは取締役会監査委員会によって監視される。監査委員会はその定款を通じて会社のネットワークセキュリティの流れ、制御とプログラムを明確に監督し、会社の緩和努力を監視と審査する。監査委員会受け取りました
上級指導部は,我々の首席情報セキュリティ官を含め,情報セキュリティリスク,戦略およびInfoSec計画の有効性と進展について四半期ブリーフィングを行った。監査委員会はまた、管理層と共に、この期間の重大な情報セキュリティイベントおよび関連する救済計画、ならびに新たなまたは新たに出現した情報セキュリティリスクを検討する。取締役会はまた、四半期ごとに会社のネットワークセキュリティリスク、プロセス、緩和措置に関する最新の状況を獲得した。
会社のネットワークセキュリティプロセスの実行は、私たちの首席情報セキュリティ官、首席財務官、首席運営官、総法律顧問、および首席技術官を含む委員会によって監督される。この委員会はネットワークセキュリティ戦略全体を担当し、InfoSec路線図を含むネットワークセキュリティプロセス、ポリシー、プログラムを承認する。その委員会は定期的にInfoSec戦略、リスク、そして緩和努力に関する報告を受けている。また、任意の潜在的な報告可能な情報セキュリティイベントを通知され、影響の評価と修復計画の承認、監査委員会または取締役会への報告を担当する。ネットワークセキュリティ戦略の全面的な実施は,RecursionのInfoSecチームが企業全体で実行され,このチームは首席情報セキュリティ官が監督する.
項目2.財産
再帰会社の本社はユタ州ソルトレイクシティSグランド街41号にあり、郵便番号は84101で、私たちは99,172平方フィートのオフィス、乾湿実験室空間を借りました。これらの実験室には薬物研究のための伝統的な実験室と自動化実験室が含まれている。私たちの現在のレンタル期間は2028年5月に満期になります。2032年5月に満期になる賃貸契約によると、当社は、本社の近くにある追加103,634平方フィートのオフィス、研究、および実験室空間の賃貸契約を締結しました
再帰会社のカナダ業務本部はトロントCA M 5 V 2 a 2皇后街西336号にあります。私たちはそこにいます 28,110平方フィートのオフィススペースをレンタルします。今回の任期は2032年11月に満了する予定だ。トロントのカナダ本部以外に、モントリオールに二つのレンタル契約があります。その中には半自動人工知能エンジンValence Labsが含まれています。Valence Labsはカリフォルニア州モントリオールサンウルバン6666号にある8367平方フィートのオフィスと乾燥した実験室空間をレンタルしました 2029年3月に満期となるH 2 S 3 H 1。Valenceは世界的に有名な人工知能や機械学習センターMilaにも研究休憩室を設置している.この事務空間には学術研究者が収容されている
私たちは私たちの施設が十分で、私たちの現在の必要に適していると信じています。もし必要であれば、私たちは私たちの業務を収容するために適切な追加または代替空間を提供します
項目3.法的訴訟
当社は通常の業務過程に現れる様々な法的手続きに時々触れている可能性があります。このような問題の不利な解決は、会社の将来の財務状況、経営業績、あるいはキャッシュフローに重大な影響を与える可能性がある。法律手続に関するより多くの情報は、第2部、第8項、付記7、“承諾及び又は有事項”を参照して本明細書に組み込まれる。
第4項鉱山安全情報開示
該当しない。
パート II
第五項登録者普通株式市場、関連株主事項及び発行者が株式証券を購入する。
主体市場
再帰的A類普通株の主要市場はナスダック世界精選市場(コード:RXRX)である。私たちの普通株は2021年4月16日に取引を開始します。その前に、私たちの普通株は市場を公開しなかった。
再帰会社のB類普通株と交換可能普通株はどの証券取引所にも上場せず、いかなる公開市場でも取引されない
株式表現グラフ
次の図は、再帰、ナスダック総合指数、ナスダックバイオテクノロジー指数の2021年4月16日(ナスダック世界精選市場での普通株の初取引日)から2023年12月31日までの累積総リターンを比較したものである。この図は100ドルと配当金の再投資(あれば)を投資していると仮定している.次の図に示す比較は履歴データに基づいており,必ずしも将来の業績を示唆しているとは限らない.
この業績グラフは提供されており、米国証券取引委員会または改正された1934年証券取引法第18節の制約を受けたものとみなされてはならず、改正された1933年証券法に基づいてRecursionに引用されて提出されたいかなる文書ともみなされてはならない。
株主.株主
2024年1月31日現在、再帰A類普通株株主74人がいる。我々A類普通株の実株主数は,実益所有者であるがその株が街頭名義で仲介人や他の被命名者が保有する株主を含むこの記録保有者の数を超えている.
配当政策
私たちは私たちの株のどんな現金配当金も発表したり支払ったりしたことがない。私たちは現在どんな未来の収益も維持し、予測可能な未来には何の配当も支払わないと予想している。将来現金配当を発表する任意の決定は、私たちの取締役会が適用される法律に基づいて適宜行われ、多くの要素に依存して、私たちの財務状況、経営結果、資本要求、契約制限、一般業務条件、および私たちの取締役会が関連すると考える可能性のある他の要素は、私たちの現在と未来の債務ツールの制限、私たちの未来の収益、資本要求、財務状況、見通しと適用されるデラウェア州法律を含み、この法律は配当金が黒字または現在の純利益からしか支払うことができないことを規定している
株式補償計画に基づいて発行された証券
本年度報告書10-K表第3部第12項における当社の株式報酬計画に関する情報は、ここに組み込まれて参考になります。
近いうちに 未登録の証券を売却する
(A)非登録証券の売却
買収する
2023年5月、当社はCyclica買収で合意した。Cyclica買収の前払い総代償には、再帰A類普通株580万株、現金支払い、Cyclica持分奨励所有者が保有する株式オプションを行使することで発行できる100万株、繰延負債が含まれる。2023年12月31日現在、上記A類普通株対価格のうち約18.2万株が発行されていない。入札説明書補足登録声明(第333-264845号文書)は、その後、2023年6月9日に規則424(B)に従って提出され、いくつかのそのような株式の転売およびそのような株式オプションを行使した後に発行可能な株式の発行を登録する。また,2023年5月30日にS-8表(文書番号333-272282)の登録声明を提出し,このような株式オプションを行使する際に発行可能な株式の発行を登録した.
同じく2023年5月、同社はValenceを買収することで合意した。Valence買収の総前払い代償は、再帰A類普通株220万株、再帰子会社440万株、再帰A類普通株と交換可能な株式、Valence株権を行使して所有者が保有する株式オプションと繰延負債を奨励することで発行可能な7.92億株である。続いて2023年5月30日にS-3 ASRフォームの登録声明(第333-272281号書類)を提出し、当該等株式の転売を複数登録し、当該等購入株式行使後に発行可能な株式及び交換可能株式を複数登録した場合に発行可能な株式の発行を行う。また,2023年5月18日にS-8表(文書番号333-272027)の登録声明を提出し,何らかの株式オプションを行使する際に発行可能な株式の発行を登録した.
NVIDIA私募
当社は2023年7月11日、1株6.49ドルの買い取り価格でNVIDIA CorporationにA類普通株計770万株(以下、“NVIDIA株”)を配向増発し、純収益は約4,990万ドル(以下、“NVIDIA指向増発”)とした。今回の売却は,証券法第4(A)(2)節に記載した登録免除に基づいて行った.NVIDIA指向増発については,当社とNVIDIA Corporationは2023年7月11日に登録権協定を締結し,NVIDIA株式の登録転売について規定している。募集説明書補足登録声明(第333-264845号文書)はその後、2023年8月8日に規則424(B)に従って提出され、NVIDIA CorporationがNVIDIA株を転売したことを登録する。
ダンプス私募
2023年11月、当社はTempus Labs,Inc.(“Tempus”)とメインプロトコル(“Tempusプロトコル”)を締結し、このプロトコルにより、Tempusは当社にいくつかのサービスを提供し、成果を提供し、および/または当社にいくつかのデータの使用を許可する。Tempusプロトコルによると、当社は、Tempusの予備許可料22,000,000ドルを現金の代わりにTempusに支払うために、Tempusプロトコルに従って当社に付与された権利(“Tempus私募”)と引き換えに、2023年11月30日にTempusに合計320万株のA類普通株式(“Tempus株”)を発行する。この取引はすでに成約した
証券法第4(A)(2)条に記載されている登録免除。ダンプス協定の条項によると、当社はその後、2023年12月15日に規則第424(B)条に基づいて目論見補充登録声明(第333-264845号文書)を提出し、ダンプスのダンプス株の転売を登録する。
株式オプション権
2023年12月31日までの年度内に、私たちは、私たちのキーパーソン激励株式計画に基づいて、株式オプションを行使する際に、証券法第701(B)(2)条に規定されている免除、または証券法第4(A)(2)条に基づいて発行された発行者が公開発行された取引に関与しない免除について、登録を免除するために、証券法第701(B)(2)条に規定されている242,000株A類普通株を発行する。
(B)発行者による株式証券の購入
ない。
第六項です[保留されている]
第7項:経営陣の財務状況と経営成果の検討と分析。
以下は華為の財務状況の検討と分析である再帰製薬会社(再帰、会社、私たち、または私たち)私たちの行動の結果です本レビューは、項目8“財務諸表”における連結財務諸表および付記と併せて読まなければなりません。今回の議論は、特に、本年度報告Form 10-Kにおける“展望的陳述に関する説明”というタイトルで述べたように、我々の将来の経営結果や財務状況、業務戦略および将来の経営の管理計画および目標に関する情報、特に展望的陳述を含む。あなたは、私たちの実際の結果がこれらの前向きな陳述で予想されているのとは大きく異なる重要な要素をもたらす可能性があるために、私たちの年間報告書Form 10-Kの“リスク要因”のタイトルで開示を確認しなければなりません
概要
再帰はTechBio社が生物学を復号して薬物発見産業化を実現するリード的な臨床段階である。我々の使命の核心は再帰的オペレーティングシステム(OS)であり,50 PBを超える独自データに生物,化学,患者を中心とした数兆個の関係を描画·ナビゲーションできるように,多様な技術にまたがって構築されたプラットフォームである。著者らは物理とデジタルコンポーネントのこのような統合を反復循環と見なし、その中の規模の“湿実験室”生物、化学と患者を中心とした実験データは“乾燥実験室”計算ツールによって組織され、治療見解を識別、検証と変換する。Recursionが偏らず,データ駆動の生物学を理解する方法は,患者により多く,更新,より良い薬物をもたらし,規模が大きく,コストが低いと信じている
Recursionには3つの重要な価値駆動要因があります
1.寛大なパイプ.パイプ内部開発の臨床と臨床前プロジェクトの重点は精確な腫瘍学と遺伝子駆動の稀な疾病であり、これらのプロジェクトは重大な満足されていない需要と市場機会を持っており、場合によっては年間売上高が10億ドルを超える可能性がある
2.転換する協力パートナーシップ有力な生物製薬や技術会社とともに生物の厄介な分野を作成·ナビゲーションし,新たな標的を識別し,先進的な計算とデータ資源を用いて潜在的な新薬を開発する
3.業界がリードするデータ集計算ツールを活用し、私たちのルート、パートナー関係、技術製品を通じて価値の創造を加速することを目的としています
著者らはRecursion OSを拡張し、利用することにより、50 PBを超えるデータを生成、重合、統合し、これらのデータは大型言語モデルから派生した疾患関連性と標的化合物の関係、予測された約360億種類の化合物のタンパク質-リガンド結合相互作用、2億個を超える総染色と多時間点生細胞(Brightfield)表現型実験、70万個を超える完全転写学実験、著者らの自動化DMPKモジュールを用いて行った数万個のADME実験、InVivグループ学とマルチモード精密腫瘍学患者データをカバーした。このデータセットは50種類以上のヒト細胞タイプを用いて整理されており,我々の細胞製造施設は
2022年以来1兆個以上のHiPSC由来神経細胞が生産されており、我々の内部化学バンクには170万種類以上の化合物が含まれているシリコン片1兆個以上の小分子と他の能力を持っているライブラリです我々はRecursion OSに独自のソフトウェアアプリケーションとAI/MLモデルを構築し,5兆を超える生物と化学関係を予測·ナビゲーションすることができる.私たちの方法と500人以上のRecursionautsからなるチームは、生命科学者と計算と技術の専門家の間でバランスを取り、私たちは薬物発見を検索問題にするために努力し、私たちは見解をより多く、更新され、より良い薬物に変換するために、公正な方法で生物学を作成し、ナビゲーションし、より規模が大きく、患者コストが低い。
業務のハイライトの概要
ホーム.ホーム
•因果AIモデリングと他のデータセット:著者らは因果人工知能モデルを訓練し、Tempusからの20 PBを超えるマルチモード精確腫瘍学患者データを利用して、潜在的なバイオマーカーの豊富な治療法の大規模発見を支持してきた。Tempusの順方向遺伝学的手法とRecursionの逆遺伝学的手法を組み合わせることにより,腫瘍学的治療開発の速度,精度,規模を向上させる機会があると信じている。この仕事はすでに大規模腫瘍学適応における1種の新しい遺伝子/疾患関係に対する指向性腫瘍学計画を招いた。再帰は、データ生成器でもあり、マルチモードデータアグリゲータでもある。将来的には,我々のデータセットを拡大し,種系遺伝データ,有機系技術,自動化ナノ合成技術を用いてRecursion OSを磨く予定である.
•LOWE(大型言語モデル-協調ワークフローエンジン):LOWEはLLMエージェントであり,再帰的オペレーティングシステムの次世代発展を表す.LOWEは自然言語提示により複雑な乾湿実験室ワークフローを協調させ,薬物発見計画を支援する。これらのワークフローは,再帰的オペレーティングシステムで利用可能なステップとツールであり,生物,化学と患者を中心としたデータとの間に重要な関係を見つけることから,新たな化合物を生成し,それらを配置して合成や実験を行う。その自然言語インタフェースとインタラクション図形により,LOWEは最先端の人工知能ツールを各薬物発見科学者の手に握ることができる。
パイプ.パイプ
•頭綿状血管奇形(CCM)(REC-994):著者らのSycamore第二段階臨床試験は無作為、二重盲検、プラセボ対照、安全性、耐性と探索的治療効果のREC-994のCCM参加者に対する研究である。この試験は2023年6月に完全に導入され、62名の参加者があり、12ケ月の治療を完成した大多数の参加者は引き続き長期拡張研究への参加を選択した。私たちは2024年第3四半期に第2段階のデータを共有する予定だ。
•神経線維腫症2型(NF 2)(REC-2282):著者らの適応性2/3期楊樹臨床試験はランダムで、2つの部分に分けたREC-2282の進展性NF 2突然変異脳膜腫参加者における研究である。この研究の第1部は,約23名の成人と9名の成人での2剤REC−2282の使用を模索している
青少年、成人入学は2024年上半期に完成する予定だ。私たちは2024年第4四半期に第2段階の安全性と初歩的な治療効果データを共有する予定だ。
•家族性腺腫性ポリープ症(FAP)(REC-4881): 我々の1 b/2期Tupelo臨床試験は開放ラベル、多中心、両部分のREC-4881のFAP参加者における研究である。第1部は完了し,第2部のFPIは2024年上半期に完成する予定である。私たちは2025年上半期に第2段階の安全性と初歩的な治療効果データを共有する予定だ。
•AXIN 1あるいは…装甲運搬車変異癌(REC-4881):著者らの2期丁香酸臨床試験は開放ラベルの多中心REC-4881研究であり、研究対象は切除できない、局部末期或いは転移性癌患者であるAXIN 1あるいは…装甲運搬車突然変異です。この研究は2023年末にスタートし、2024年第1四半期に実施される予定だ。私たちは2025年上半期に第2段階の安全性と初歩的な治療効果データを共有する予定だ
•クロストリジウム·クロストリジウム感染症(REC-3964):プラセボと比較して経口投与量を増加させた場合のREC−3964の安全性、耐性、およびPKを評価するために、第1段階の健康ボランティア研究を行った。REC−3964は安全であり、耐性は良好であり、深刻な有害事象、死亡、または無効化をもたらすTEAEはない。REC-3964は一流ですクロストリジウム·クロストリジウム毒素阻害剤とRecursionによって開発された最初の新しい化学物質は,関連モデルに有望な臨床前治療効果データ(ベロキシマブより優れている)が見られた。私たちは2024年に第2段階研究を開始する予定だ
•RBM 39 HR-熟練した卵巣癌と他の固形腫瘍:RBM 39は、再帰的オペレーティングシステムによって識別される新しいCDK 12近接標的である。我々の主要候補をHRに精通した卵巣癌やHRに精通した他の固形腫瘍を治療する可能性のある単一薬剤として位置づける予定である。Tempusと戦略的に連携した結果,すべての腫瘍タイプのゲノムデータを用いて患者規模を拡大した臨床バイオマーカーを決定している。我々はINDを有効にする研究で主要候補を進めており,2024年下半期にINDを提出する予定である
•線維化の不開示適応(Target Epsilon):ヒト末梢血単球の表現型スクリーニングは、疾患状態の線維細胞の表現型特徴を健康状態の細胞の表現型特徴に逆転させる新しいかつ構造多様な小分子を決定した。最も有望な化合物は、新しい繊維化標的の有効な阻害剤であることが証明された。この計画は,我々がバイエルとの最初の線維化協力に起源し,それ以来,バイエルからこの計画のすべての権利を獲得し,現在IND支援研究に入っている
仲間関係
•変革的な協力:われわれは引き続きわれわれの戦略パートナーと努力し,非薬物腫瘍学(バイエル)および神経科学と胃腸腫瘍学の単一適応(羅氏−遺伝子テーク)領域に潜在的な新しい療法を発見した。短期的には,パートナーシップ計画に関する選択肢練習,地図構築計画やデータ共有に関する選択肢練習,生物や技術革新などの重大で困難な分野でより多くのパートナー関係を構築する可能性がある
•Enamine:2023年12月、私たちはイナミンと協力して、世界の薬物発見業界のために豊富な化合物ライブラリーを生成し、設計した。再帰人工知能モデルMatchMakerを用いてEnamine Real Space中の化合物(約360億種類の化合物)を認識することにより,高価値目標との結合が予想され,薬物発見目的のためにより強力な化合物バンクを生成できると考えられる。Enamineは、生成されたライブラリをお客様に提供して購入し、EnamineとRecursionの商標を組み合わせて任意のライブラリを使用する可能性があります。このような連携は,精選データ層がどのように新しい方法で価値を創造するかの一例である.
融資と運営
私たちは2013年11月に登録が成立した。はい2021年4月私たちは初公募株(IPO)を完成させて発行しました2790万A類普通株は、1株18.00ドルで、純収益を募集します4億624億ドルそれは.最初の公募前に資金を集めました4億489億ドル投資家から株式融資を受けました3000万ドル私たちはバイエル株式会社(バイエル)との協力から前金を獲得しました。はい2022年1月前金を受け取りました1億5千万ドル羅氏との協力から来ました連携に関するより多くの情報は,連結財務諸表付記9,“連携開発契約”を参照されたい。2022年10月、私たちは2022年方向性増発で1株9.80ドルの買い取り価格で合格機関の買い手と機関投資家(買い手)に1530万株のA類普通株を発行し、費用と発売コスト660万ドルを差し引いた純収益は1.437億ドルだった。2023年7月、1株6.49ドルの買い取り価格で合計770万株のA類普通株を発行した
NVIDIA社の純収益は約5,000万ドルである。方向性増発に関するより多くの情報は、連結財務諸表付記8、“普通株”を参照されたい。Recursionは2023年12月31日までの年間でOに入るJefferies LLC(“販売エージェント”)と締結されたPENマーケティングプロトコル(“販売プロトコル”)2023年12月31日までの年度協定によると、同社は1200万株を売却し、純収益は7820万ドルだった販売契約に関するより多くの情報は、連結財務諸表付記8、“普通株”を参照されたい。
私たちは私たちが調達した資本を使って、プラットフォーム研究運営、薬物発見、臨床開発、デジタルとその他のインフラ、私たちの知的財産権組合と行政支援の運営と投資活動を作るために資金を提供します。私たちは商業販売のための製品は何も承認されておらず、製品販売から何の収入も得られていない2023年12月31日現在、私たちは3億916億ドルの現金と現金等価物を持っている私たちの現在の運営計画によると、私たちは私たちの現金と現金等価物が私たちの運営に少なくとも今後12ヶ月の資金を提供するのに十分だと信じている
設立以来、私たちは重大な運営損失が発生した。2023年、2022年、2021年12月31日までの年間の純損失はそれぞれ3.281億ドル、2.395億ドル、186.5ドルだった。2023年12月31日現在、我々の累計赤字は9.676億ドルです
私たちは将来、承認された候補製品の潜在的な商業化を含む、私たちの運営を支援するためにより多くの資金を集める必要があると予想している。これまで、私たちが相当な製品収入を生成することができれば、私たちは、私たちの既存の現金および現金等価物、任意の未来の株式または債務融資、および現在または未来の許可または協力協定に従って受信された前金、マイルストーン、および特許使用料(もしあれば)を使用して、私たちの運営に資金を提供する予定です。私たちは私たちが受け入れられる条項で追加的な資本を調達することができないかもしれないし、全くできないかもしれない。もし私たちが必要な時に追加の資本を集めることができなければ、私たちの業務、経営業績、財務状況は不利な影響を受けるかもしれない。
経営成果
次の表は私たちの行動結果をまとめています
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| (百分率を除いて千単位) | 十二月三十一日までの年度 | | 2023年は2022年と比較して | 2022年は2021年と比較して |
| 2023 | 2022 | 2021 | | $ | % | $ | % |
| 収益 | | | | | | | | |
| 営業収入 | $ | 43,876 | | $ | 39,681 | | $ | 10,000 | | | $ | 4,195 | | 10.6 | % | $ | 29,681 | | >100% |
| 奨学金収入 | 699 | | 162 | | 178 | | | 538 | | >100% | (16) | | (9.0) | % |
| 総収入 | 44,575 | | 39,843 | | 10,178 | | | 4,733 | | 11.9 | % | 29,665 | | >100% |
| | | | | | | | |
| 運営コストと支出 | | | | | | | | |
| 収入コスト | 42,587 | | 48,275 | | — | | | (5,688) | | (11.8) | % | 48,275 | | N/m |
| 研究 · 開発 | 241,226 | | 155,696 | | 135,271 | | | 85,530 | | 54.9 | % | 20,425 | | 15.1 | % |
| 一般と行政 | 110,822 | | 81,599 | | 57,682 | | | 29,224 | | 35.8 | % | 23,917 | | 41.5 | % |
| 総運営コストと費用 | 394,635 | | 285,570 | | 192,953 | | | 109,066 | | 38.2 | % | 92,617 | | 48.0 | % |
| | | | | | | | |
| 運営損失 | (350,060) | | (245,727) | | (182,775) | | | (104,333) | | 42.5 | % | (62,952) | | 34.4 | % |
| その他の収入(赤字),純額 | 17,932 | | 6,251 | | (3,704) | | | 11,681 | | >100% | 9,955 | | N/m |
| 所得税割引前損失 | (332,128) | | (239,476) | | (186,479) | | | (92,652) | | 38.7 | % | (52,997) | | 28.4 | % |
| 所得税割引 | 4,062 | | — | | — | | | 4,062 | | N/m | — | | N/m |
| 純損失 | $ | (328,066) | | $ | (239,476) | | $ | (186,479) | | | $ | (88,590) | | 37.0 | % | $ | (52,997) | | 28.4 | % |
N/M=意味がない
要約.要約
2023年12月31日までの年度の財務パフォーマンス2022年と比較して、我々の能力の拡大とアップグレードにより増加したプラットフォームコストによる研究開発コストの増加を含め、また、12月31日までの年度には、我々の戦略的パートナーシップの支出と収入コストの再分配により、2022年のプラットフォームコストが低下する
私たちの財務業績は2022年12月31日までの年度と2021年との比較には、(I)プラットフォーム研究開発費の減少が含まれている我々の戦略的パートナーシップの支出と収入コストの再分配,(Ii)我々と羅氏とのパートナーシップにより確認された収入増加,および(Iii)我々の戦略的パートナーシップによる収入コスト。さらに、私たちの財務業績は、私たちの新興の早期および中期パイプライン資産を支援するための追加資金を反映している
収益
次の表は私たちの収入構成をまとめています
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | 2023年は2022年と比較して | 2022年は2021年と比較して |
| (百分率を除いて千単位) | 2023 | 2022 | 2021 | | $ | % | $ | % |
| 収益 | | | | | | | | |
| 営業収入 | $ | 43,876 | | $ | 39,681 | | $ | 10,000 | | | $ | 4,195 | | 10.6 | % | $ | 29,681 | | >100% |
| 奨学金収入 | 699 | | 162 | | 178 | | | 538 | | >100% | (16) | | (9.0) | % |
| 総収入 | $ | 44,575 | | $ | 39,843 | | $ | 10,178 | | | $ | 4,733 | | 11.9 | % | $ | 29,665 | | >100% |
運営収入は、私たちが顧客のために研究開発活動を行うパートナー関係によって生まれた。一般に,これらの配置は,我々の顧客にこれらの研究や開発活動の結果に関するいくつかの権利を提供する.私たちはまたこのような活動の結果と関連したいくつかの権利を維持することができる。これまで,我々の収入は主に時間の経過とともにパートナーシップ開始時に受け取った金額を確認することに関係してきた.しかも、いくつかのマイルストーンが達成されるにつれて、私たちは違う考慮事項を得る権利がある。収入確認の時間は現金収入の時間と直接関係ありません。
2023年12月31日までの1年間で、収入が前年に比べて増加したのは、羅氏とのパートナー関係で収入が確認されたためであり、この作業は、主要な細胞タイプ評価作業から推論に基づく現象図構築および追加的な細胞タイプ評価作業に発展したからである。上には2022年12月31日までの年度前年比増益は、同年から開始されたロシュとのパートナーシップによる収益認識によるものです。 2022年1月.
収入コスト
以下の表は、収益コストを要約します。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| (百分率を除いて千単位) | 十二月三十一日までの年度 | | 2023年は2022年と比較して | 2022年は2021年と比較して |
| 2023 | 2022 | 2021 | | $ | % | $ | % |
| 収入総コスト | $ | 42,587 | | $ | 48,275 | | $ | — | | | $ | (5,688) | | (11.8) | % | $ | 48,275 | | N/m |
N/M=意味がない
収益のコストは、会社のコストから構成されます。 パートナーシップ顧客とのパフォーマンス義務に基づく医薬品発見サービスを提供しますこれらは主に材料費、従業員のサービス時間、財産 · 設備の減価償却を含みます。
2023 年 12 月 31 日期における収益コストの前年比減少は、バイエルとのパートナーシップによるものであり、残酷な作業が必要とされませんでした。 2022 年 12 月 31 日を末日とする年度の増加は 前年と比較した収益コストは戦略的パートナーシップによるものですこの年度までに
2021 年 12 月 31 日現在、収益コストは微小であり、連結業績計算書の「研究開発」に含まれています。
研究と開発
研究開発費の構成要素を以下の表にまとめたものです。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| (百分率を除いて千単位) | 十二月三十一日までの年度 | | 2023年は2022年と比較して | 2022年は2021年と比較して |
| 2023 | 2022 | 2021 | | $ | % | $ | % |
| 研究開発費 | | | | | | | | |
| ホーム.ホーム | $ | 96,796 | | $ | 41,765 | | $ | 55,959 | | | $ | 55,031 | | >100% | $ | (14,194) | | (25.4) | % |
| 発見 | 62,142 | | 52,358 | | 48,984 | | | 9,784 | | 18.7 | % | 3,374 | | 6.9 | % |
| 臨床.臨床 | 57,564 | | 46,820 | | 21,841 | | | 10,744 | | 22.9 | % | 24,979 | | >100% |
| 株に基づく報酬 | 22,761 | | 10,524 | | 4,979 | | | 12,237 | | >100% | 5,545 | | >100% |
| 他にも | 1,963 | | 4,229 | | 3,508 | | | (2,266) | | (53.6) | % | 721 | | 20.6 | % |
| 研究開発費総額 | $ | 241,226 | | $ | 155,696 | | $ | 135,271 | | | $ | 85,530 | | 54.9 | % | $ | 20,425 | | 15.1 | % |
研究開発費は、当社の営業費のかなりの割合を占めています。これらの費用は、お客様との契約に基づき実施されていない研究開発活動から生じるものです。研究開発費は発生したまま認識します。研究開発費用は、以下の活動にかかる費用で構成されます。
•プラットフォームの開発と運用にかかる費用
•研究資料や外部研究を含む開発候補につながる可能性のある発見努力の費用
•試験用製品の臨床開発費用
•有効医薬品、前臨床試験および臨床試験のための試験用医薬品の製造に関連する材料および消耗品の費用。
•研究開発業務に従事する従業員の給与、福利厚生、ボーナス、株式報酬を含む人事関連費用
•デジタルインフラストラクチャの運用に関連するコスト
•研究·開発活動により発生した他の直接·分配済み費用は、施設、減価償却、償却、保険費用を含む
私たちは第三者契約サービスに関連する費用を確認します。第三者との契約を終了する際に、私たちの財務義務は、通常、これまでに発生または承諾した費用に限定される。契約に従って将来の研究および製品開発活動において使用または提供される任意の貨物またはサービスの任意の前払いは、そのような貨物またはサービスを提供する前に前払い費用として分類される
研究開発費の重要な構成要素は,プラットフォーム,主にHITにより製品候補者を選別する費用,Discovery,主に開発候補者によるHIT識別の費用,および臨床では,主に候補者開発やその他に関する費用を指す開発段階に割り当てられた費用を含む
2023年12月31日までの年度まで、研究開発費は前年より増加し、主に著者らのプラットフォーム能力を拡大及び向上させ、著者らの化学技術、機械学習及び転写分析プラットフォームを含むため、プラットフォームコストを増加させた
2022年12月31日までの1年間で研究·開発費が前年に比べて増加したのは,主に研究の進展に伴い臨床コストが増加したためである。同社は2022年に3つの第2段階または第2/3段階研究と2つの第1段階研究を開始し、その中にREC-4881に対する第1段階研究を含む。これらの増加は、私たちの戦略的パートナーシップの支出が収入コストに再分配されたため、プラットフォームコストの低下によって相殺された
一般と行政費用
次の表は私たちの一般と管理費用をまとめています
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| (百分率を除いて千単位) | 十二月三十一日までの年度 | | 2023年は2022年と比較して | 2022年は2021年と比較して |
| 2023 | 2022 | 2021 | | $ | % | $ | % |
| 一般と行政費用総額 | $ | 110,822 | | $ | 81,599 | | $ | 57,682 | | | $ | 29,223 | | 35.8 | % | $ | 23,917 | | 41.5 | % |
私たちは発生した費用によって一般費用と行政費用を支払います。一般的で行政費用は主に賃金を含む;従業員福祉と株式ベースの補償を含む。一般および行政費用には、施設、減価償却、情報技術、監査、税務専門費用、会社や特許事務の法律費用、保険料も含まれる
2023年12月31日までの1年間で,前年と比較して一般·行政費の増加は,主に賃金と賃金の1240万ドルの増加および法律,ソフトウェア,減価償却費用の増加によるものである。
2022年12月31日までの1年間で、前年と比較して一般·行政費用が増加したのは、賃金·賃金の1430万ドルの増加、固定資産の280万ドルの減額、レンタル料の240万ドルの増加、増加している会社の運営に関連する他の行政コストの増加を含む会社の業務規模の増加によるものである
その他の収入(赤字),純額
次の表は私たちの純他の収入(損失)の構成要素をまとめています
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| *(単位は千、百分率を除く) | 十二月三十一日までの年度 | | 2023年は2022年と比較して | 2022年は2021年と比較して |
| 2023 | 2022 | 2021 | | $ | % | $ | % |
| 利子費用 | $ | (97) | | $ | (55) | | $ | (2,952) | | | $ | (43) | | 78.4 | % | $ | 2,897 | | (98.1) | % |
| 利 子 収入 | 19,116 | | 6,254 | | 73 | | | 12,862 | | >100% | 6,181 | | >100% |
| 債務返済損失 | — | | — | | (827) | | | — | | N/m | 827 | | (100.0) | % |
| 他にも | (1,087) | | 52 | | 2 | | | (1,139) | | (2174.7) | % | 51 | | >100% |
| その他の収入(赤字),純額 | $ | 17,932 | | $ | 6,251 | | $ | (3,704) | | | $ | 11,680 | | >100% | $ | 9,956 | | N/m |
N/M=意味がない
2023 年 12 月 31 日に終了した年度は、 その他収益 ( 損失 ) の増加、純と比較前年比は、マネーマーケットファンドの現金および現金等価物利益に関連する利息収入の増加によるものです。.
2022 年 12 月 31 日期については、その他の利益 ( 損失 ) の増加、 比較ネット貸付決済による利息費用の減少と、マネーマーケットファンドの現金および現金等価物利益による利息収入の増加によるものです。
流動性と資本資源
流動資金源
当社は、まだ製品を発売しておらず、少なくとも数年間は製品候補の販売から収益を生み出すとは思っていません。2023 年 12 月 31 日時点の現金および現金同等額はそれぞれ 3 億 9160 万ドルと 5 億 4990 万ドルである。
当社は、営業赤字及び営業キャッシュフローがマイナスとなっており、少なくとも当面は引き続き赤字が発生すると予想しています。当社の純損失は、 2023 年 12 月 31 日、 2022 年、 2021 年 12 月 31 日にそれぞれ 3 億 2,810 万ドル、 2 億 3,950 万ドル、 1 億 8,650 万ドルとなりました。2023 年 12 月 31 日現在の累積赤字は 9 億 6760 万ドルでした。
私たちは非公開優先株の配給とA類普通株の発行を通じて私たちの業務に資金を提供します。2023年12月31日現在、優先株売却の純収益4.489億ドル、A類普通株発行の純収益7.342億ドルを受け取っている。A類普通株発行の詳細については、連結財務諸表付記8“普通株式”を参照されたい。また、2023年12月31日現在、私たちは戦略的パートナーシップから1億83億ドルの収益を得ています。パートナーシップのより詳細については、連結財務諸表付記9、“協力開発契約”を参照されたい。
キャッシュフロー
次の表はキャッシュフロー表のまとめです
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| (単位:千) | 2023 | 2022 | 2021 |
| 経営活動用の現金 | $ | (287,780) | | $ | (83,524) | | $ | (158,614) | |
| 投資活動によって提供される現金 | (10,228) | | 193,249 | | (271,744) | |
| 融資活動で提供された現金 | 140,133 | | 154,345 | | 458,540 | |
経営活動
2023年12月31日までの1年間に、羅氏との戦略的パートナーシップが2022年12月31日までの1年間に1億5千万ドルの前金を受け取ったため、経営活動に使用される現金が増加した
2022年12月31日までの1年間に、経営活動に使用された現金には、羅氏との戦略的パートナーシップに1.5億ドルの前金が含まれている。現金流入は、収入コスト、研究開発、および一般的で行政費用のための現金によって相殺される
年間経営活動に使われている現金2021年12月31日までの年度前年に比べて増加しているのは,以下の項目による費用の増加が原因である会社の発展による研究開発と一般および行政支出。
投資活動
2023年12月31日までの1年間、投資活動で使用される現金は、主にBioHaveスーパーコンピュータをアップグレードするためのプロジェクトと実験室設備の購入を含む1200万ドルの財産および設備を購入することが含まれている。ある企業を買収した際に得られた180万ドルの純現金は、使用した現金の一部を相殺した。
2022年12月31日までの1年間に、投資活動が提供した現金は2.306億ドルの投資販売と満期日から、3710万ドルの財産と設備の一部が購入されて相殺された
年内の投資活動に使う現金2021年12月31日までの年度主に3.011億ドルの投資購入と3980万ドルの財産およびデバイス購入が含まれており、Dell EMCスーパーコンピュータを購入するために1790万ドルが使用されています。現金流出部分は投資販売と満期で得られた6920万ドルで相殺された
融資活動
2023年12月31日までの1年間に、融資活動が提供する現金には、主に普通株発行による1億281億ドルが含まれている。資金流入には株式インセンティブ計画の収益1280万ドルも含まれている
2022年12月31日までの1年間に、融資活動が提供する現金には、主に2022年の私募募集の1兆437億ドルの純収益が含まれている。キャッシュフロー融資には1070万ドルの持分インセンティブ計画収益も含まれている
年内融資活動で提供された現金2021年12月31日までの年度主にIPO純収益4.624億ドルを含む。融資キャッシュフローには、長期債務返済のための1,270万ドルの流出も含まれている
重要な会計見積もりと政策
我々の経営陣の財務状況と経営結果の検討と分析は、米国公認会計原則(GAAP)に基づいて作成された我々の財務諸表に基づいている。私たちの総合財務諸表と関連開示を作成する際には、財務諸表に報告されている資産、負債、費用金額に影響を与える推定と仮定を行う必要があります。我々は,歴史的経験,既知の傾向や事件,および当時の状況で合理的と考えられる様々な他の要因に基づいて推定し,これらの要因の結果は資産や負債の帳簿価値の判断の基礎を構成しているが,これらの資産や負債の帳簿価値は他の源から容易に見られるものではない.私たちは持続的な基礎の上で私たちの推定と仮定を評価する。異なる仮定や条件の下で、私たちの実際の結果はこれらの推定とは異なる可能性がある。
私たちの主な会計政策は、私たちの総合財務諸表付記により詳細に説明されていますが、以下の会計政策は、私たちの総合財務諸表の作成に使用される判断と推定に最も重要であると考えられます
収入確認
私たちはパートナーとの契約から収入を得た。我々のパートナーシップは、一般に、研究開発サービス、ライセンス、開発権および商業化権利を取得するオプション、およびより多くの研究開発サービスを取得するオプションを含む複数の構成要素を含む。このような手配は、前払い費用、技術、開発、規制および商業マイルストーン支払い、許可料、オプション使用料、および製品販売の特許使用料およびマイルストーン支払いを含む様々なタイプのお金を支払うことを規定することができます。これらのパートナーシップの収入をどのように確認するかは、約束された貨物およびサービスが互いに異なるかどうか、または総合履行義務として入金されるべきかどうか、履行義務のための様々な支払いフローをどのように推定し、分配するか、および各履行義務の業績をどのように測定するかの判断に関する。これらの判断により、支払いは収入確認の時間に合わないことが多い
私たちの運営収入は主に研究開発協定から来ている。研究開発契約からの収入は、会社が承諾したサービスを顧客に移転することで義務を履行していることが確認された。会社は顧客に約束したサービスに基づいて、適切な投入や産出方法を用いて、関連履行義務の完全履行の進捗状況を測定することで、一定期間の収入を確認する。このような収入確認方法は、仕事完了の進捗を決定するために会社に見積もりを求めている。これらの推定数の大きな変化は、今後の期間中に確認された収入の時間や金額に大きな影響を与える可能性がある。
商業権と無形資産の価値評価
再帰的には、業務統合に関連する大量の無形資産および営業権が獲得され、継続される可能性がある。無形資産および商業権に割り当てられた金額は、公正価値推定に基づいている。私たちは合理的と思われる仮説と市場参加者の仮説に基づいて公正価値を推定する。これらの推定は,既存の履歴情報および将来の予想に基づいており,推定自体は不確実である.代替推定および仮定の使用は、推定公正価値、確認可能な無形資産買収に割り当てられた金額、将来の償却費用、および営業権価値を増加または減少させる可能性がある
研究と開発費用を計算すべきである
財務諸表作成過程の一部として,サプライヤーや臨床研究機関との契約に基づく義務による費用を見積もる必要がある。これらの契約の財務条項は交渉が必要であり、これらの条項は契約によって異なり、支払い条項はこのような契約提供材料やサービスの期限と一致しない可能性がある。私たちの目標は、これらの費用をサービスの提供と努力の時間に合わせることで、私たちの財務諸表に適切な費用を反映させることです。著者らは費用の各方面のスケジュールに基づいてこれらの費用に対して会計処理を行い、適用者と外部サービスプロバイダと臨床試験の進展或いは完成したサービスについて討論することを考慮して、推定すべき計数を確定した。1つの過程で
臨床試験期間中に,実際の結果が推定結果と異なる場合には,臨床費用確認を調整する。私たちは、私たちが当時知っていた事実と状況に基づいて、各貸借対照表の日付までの課税費用を推定した。著者らの臨床試験収益は契約研究組織と他の第三者サプライヤーの適時かつ正確な報告に依存する。実際に発生した金額と実質的に異なることはないと予想されるが、提供されたサービスの実際の状態および時間に対する提供サービスの予想状態および時間の理解が異なる可能性があり、報告された金額が任意の特定の時期に高すぎるまたは低すぎる可能性がある。
株に基づく報酬
従業員、取締役、非従業員に付与された公正価値に基づいて、従業員、取締役及び非従業員に付与された株式オプション及びその他の株式ベースの奨励を測定し、必要なサービス期間内の補償費用を確認する。没収が発生した場合、株ベースの補償費用への影響を没収することを認識している。私たちは一般的に費用確認の直線法を採用して奨励します。
株式オプションの付与日公正価値は、Black-Scholesオプション定価モデルを用いて推定され、このモデルは、オプションの期待期限、株価変動性、配当収益率、および無リスク金利を入力する必要がある。ブラック·スコアーズオプション定価モデルで使用される任意の仮定が大きく変化した場合、将来の報酬の株式補償は、以前に付与された報酬と実質的に異なる可能性がある。
契約義務
同社の重要な現金需要には、以下の契約義務が含まれている
同社は2023年12月31日までに110万ドルの未済債務を抱えている。この残高はテナント改善手当支払手形やスーパーコンピュータアップグレードプロジェクトの融資合意と関係がある。付記2を参照して、“要約重大会計政策“詳細については、総合財務諸表をご覧ください.
As Of 同社は2023年12月31日までに6620万ドルの将来賃貸約束を持っている。今後の賃貸約束の詳細については、連結財務諸表付記5“レンタル”を参照されたい
As Of 2023年12月31日、会社には229.3,000,000ドルの将来購入義務があり、そのうち9,130万ドルは次の年以内に支払う予定です。このような約束は主に研究開発活動の第三者研究サービス、材料、そして用品に関するものだ
近く発表·採択された会計公告
注2を見て、“重要会計政策の概要“最近発表·採択された会計声明に関する情報を含む連結財務諸表
プロジェクト7 a。市場リスクに関する定量的で定性的な開示。
金利リスク
私たちは私たちの現金と現金等価物ポートフォリオの金利変化に関する市場リスクに直面している。私たちの現金と現金等価物は2023年12月31日まで通貨市場基金で構成されている。私たちの市場リスクに対する主な開口は利息収入感度であり、これはアメリカの金利変化の影響を受ける。2023年12月31日に金利が100ベーシスポイント低下したと仮定すると、来年の純損失への影響は大きくない
外貨両替リスク
私たちの従業員と業務は主にアメリカとカナダにあります。私たちの費用は普通ドルとカナダ元で計算します。私たちはまた研究開発サービスサプライヤーと数量の限られた契約を締結しました。これらのサービスの基本支払い義務は外貨建てです。私たちは外貨建ての契約で外貨取引収益や損失の影響を受けています。今まで、外貨取引損益は私たちの財務諸表にとって重要ではなく、私たちも正式な外貨ヘッジ計画はありませんでした。10%の増加または
現在の為替レートの低下は、2023年、2022年、2021年12月31日までの年間の財務業績に実質的な影響を与えない。
項目8.財務諸表と補足データ
独立公認会計士事務所報告
再帰製薬会社の株主と取締役会に向けて。
財務諸表のいくつかの見方
添付の再帰製薬会社(当社)が2023年12月31日まで,2023年12月31日と2022年12月31日までの総合貸借対照表,2023年12月31日までの各年度の関連総合経営表,全面赤字,転換可能優先株と株主権益およびキャッシュフロー,および関連付記(総称して“総合財務諸表”と呼ぶ)を監査した。総合財務諸表は,すべての重要な面で,2023年12月31日,2023年12月31日,2022年12月31日の財務状況,および2023年12月31日までの3年度の経営結果とキャッシュフローを公平に反映しており,米国公認会計原則に適合していると考えられる。
また、米国上場企業会計監督委員会(PCAOB)の基準に基づき、テレデビル委員会協賛組織委員会が発表した内部統制-総合枠組み(2013枠組み)で確立された基準と2024年2月29日の報告に基づき、会社が2023年12月31日までの財務報告内部統制を監査した これに反対意見を表明した。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている
重要な監査事項
以下に述べる重要な監査事項とは、監査委員会に伝達または要求が監査委員会に伝達された当期財務諸表監査によって生じる事項である:(1)財務諸表に対して重大な意義を有する勘定または開示に関するものであり、(2)特に挑戦的で主観的または複雑な判断に関するものである。重要監査事項の伝達は、総合財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、以下の重要な監査事項を伝達することによって、重要な監査事項またはそれに関連する勘定または開示について個別の意見を提供することはない。
| | | | | | | | |
| | 収入確認--営業収入
|
関係事項の記述 | | 同社が羅氏や遺伝子テークと研究開発サービスの展開について合意した協力と許可協定については,収入は研究開発サービスを展開することによるコストと期待総コストの比で確認された。予想される契約コストを決定するための重要な入力には、必要な時間長、会社員が実行するサービス時間、および材料コストが含まれる。協議の会計計算は判断に関連し、特に仕事範囲と歴史経験などの要素から発生する総費用を推定することに関連している。
総コストを見積もるのに必要な判断を考慮すると、一定期間内に合意により確認された収入額を算出する重要な要因であり、監査会社の総コスト推定には大量の監査作業が必要である。
|
私たちが監査でどのようにこの問題を解決したのか | | 会社の総コストの見積もりをテストするために、合意を獲得し、契約下の会社義務の性質を知るために、条項と条件を評価した。私たちは会社のプロジェクト科学者や財務アナリストと確実な問い合わせを行うことで、経営陣の総コストの見積もりを得て評価した。私たちは収入計算のために発生するコストの数学的正確性をテストした。見積り費用と実際に発生した費用を比較することで,総見積費用ベースとなる費用が合理的であるかどうかをテストする. |
/s/ 安永法律事務所
2017年以来、当社の監査役を務めてきました。
ユタ州ソルトレークシティ
2024年2月29日
独立公認会計士事務所報告
再帰製薬会社の株主と取締役会に向けて。
財務報告の内部統制については
テレデビル協賛組織委員会が発表した“内部統制-総合枠組み(2013年枠組み)”(COSO基準)で確立された基準に基づき、再帰製薬株式会社の2023年12月31日までの財務報告内部統制を監査した。我々の考えでは、以下に述べる重大な弱点が制御標準目標の実現に及ぼす影響により、Recursion PharmPharmticals,Inc.(当社)は2023年12月31日までCOSO規格に基づいて財務報告に対して有効な内部統制を維持していない。
重大な欠陥とは、財務報告の内部統制に欠陥或いは欠陥の組み合わせが存在し、会社の年度或いは中期財務諸表の重大な誤報が合理的な可能性があり、適時に防止或いは発見できないようにすることである。以下の重大な欠陥が管理層の評価に盛り込まれていることが明らかになった。経営陣は、会社の収入と未稼ぎ収入の流れに関する内部統制に重大な欠陥があることを発見しました.
添付されている経営陣財務報告内部統制年度報告が示すように、経営陣の財務報告の内部統制の有効性に対する評価と結論はValence Discovery Inc.とCyclica Inc.の内部統制を含まず、この2社は当社の2023年の総合財務諸表に含まれ、2023年12月31日までにそれぞれ総資産と純資産の14%と19%を占め、当年の収入と純損失の2%と4%を占めている。当社の財務報告の内部統制監査には、Valence Discovery Inc.およびCyclica Inc.の財務報告内部統制の評価も含まれていない。
我々はまた、米国上場会社会計監督委員会(PCAOB)の基準に従って、会社の2023年12月31日まで、2023年と2022年12月31日までの総合貸借対照表、2023年12月31日までの3年度の関連総合経営報告書、全面赤字、転換可能な優先株と株主権益及び現金流量、及び関連する付記を監査した。2023年の連結財務諸表監査に適用される監査テストの性質、時間、範囲を決定する際に、この重大な弱点が考慮されており、本報告は2024年2月29日の報告に影響を与えず、この報告について保留のない意見を発表している。
意見の基礎
当社経営陣は、効果的な財務報告内部統制を維持し、添付されている“経営陣財務報告内部統制年次報告”における財務報告内部統制の有効性を評価する責任がある。私たちの責任は私たちの監査に基づいて、会社の財務報告書の内部統制に意見を述べることです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務報告の有効な内部統制がすべての重要な面で維持されているかどうかを決定するために、合理的な保証を得るために監査を計画し、実行することを要求する。
我々の監査には,財務報告の内部統制を理解すること,重大な弱点があるリスクを評価すること,評価されたリスクテストに基づいて内部統制の設計·運用有効性を評価すること,および状況下で必要と考えられる他のプロセスを実行することが含まれる。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
財務報告の内部統制の定義と限界
財務報告に関する会社の内部統制は、一般に認められている会計原則に従って、財務報告の信頼性および外部目的のための財務諸表の作成について合理的な保証を提供するために設計されたプロセスである。財務報告に関する会社の内部統制には、 ( 1 ) 合理的な詳細で、
( 2 ) 取引が一般的に認められている会計原則に従って財務諸表の作成を可能にするために必要に応じて記録され、会社の収支が経営陣および取締役の権限に従ってのみ行われていることを合理的に保証すること。( 3 ) 財務諸表に重大な影響を与える可能性のある会社の資産の不正取得、使用、または処分を防止または適時に検出することについて合理的な保証を提供すること。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
/S/安永法律事務所
ユタ州ソルトレークシティ
2024年2月29日
株式会社リカシオンファーマシューティカルズ
合併貸借対照表
(単位は千で、1株当たりおよび1株当たりの金額は含まれていない) | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | 2022 |
| 資産 | | |
| 流動資産 | | |
| 現金 · 現金同等物 | $ | 391,565 | | $ | 549,912 | |
| 制限現金 | 3,231 | | 1,280 | |
| その他売掛金 | 3,094 | | 2,753 | |
| その他流動資産 | 40,247 | | 15,869 | |
| 流動資産総額 | 438,137 | | 569,814 | |
| | |
| 制限された現金、非流動現金 | 6,629 | | 7,920 | |
| 財産と設備、純額 | 86,510 | | 88,192 | |
| 経営的リース使用権資産 | 33,663 | | 33,255 | |
| 無形資産、純額 | 36,443 | | 1,306 | |
| グッドウィル | 52,056 | | 801 | |
| 他の非流動資産 | 261 | | — | |
| 総資産 | $ | 653,699 | | $ | 701,288 | |
| | |
| 負債と株主権益 | | |
| 経常負債 | | |
| 売掛金 | $ | 3,953 | | $ | 4,586 | |
| 費用とその他の負債を計算すべきである | 46,635 | | 32,904 | |
| 未収入を稼ぐ | 36,426 | | 56,726 | |
| 支払手形 | 41 | | 97 | |
| リース負債を経営する | 6,116 | | 5,952 | |
| 流動負債総額 | 93,171 | | 100,265 | |
| | |
| 未得収入、非経常 | 51,238 | | 70,261 | |
| 支払手形、非流動手形 | 1,101 | | 536 | |
| 非流動経営賃貸負債 | 43,414 | | 44,420 | |
| 繰延税金負債 | 1,339 | | — | |
| 負債総額 | 190,263 | | 215,482 | |
| | |
| コミットメントと不測の事態 ( 注 7 ) | | |
| | |
| 株主権益 | | |
普通株、$0.00001額面価値2,000,000,000株式 ( クラス A 1,989,032,117B類と10,967,883) 2023 年 12 月 31 日および 2022 年 12 月 31 日時点で承認された。 234,270,384株 ( クラス A 226,264,764クラスB7,544,871交換可能 460,749)と191,022,864(クラスA)183,209,655B類と7,813,209交換可能な —) 2023 年 12 月 31 日、 2022 年 12 月 31 日現在発行および残高。 | 2 | | 2 | |
| 追加実収資本 | 1,431,056 | | 1,125,360 | |
| 赤字を累計する | (967,622) | | (639,556) | |
| 株主権益総額 | 463,436 | | 485,806 | |
| | |
| 総負債と株主権益 | $ | 653,699 | | $ | 701,288 | |
連結財務諸表の注記を参照してください。
株式会社リカシオンファーマシューティカルズ
連結業務報告書
(単位は千で、1株当たりおよび1株当たりの金額は含まれていない)
| | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| | 2023 | 2022 | 2021 |
| 収益 | | | | |
| 営業収入 | | $ | 43,876 | | $ | 39,681 | | $ | 10,000 | |
| 奨学金収入 | | 699 | | 162 | | 178 | |
| 総収入 | | 44,575 | | 39,843 | | 10,178 | |
| | | | |
| 運営コストと支出 | | | | |
| 収入コスト | | 42,587 | | 48,275 | | — | |
| 研究 · 開発 | | 241,226 | | 155,696 | | 135,271 | |
| 一般と行政 | | 110,822 | | 81,599 | | 57,682 | |
| 総運営コストと費用 | | 394,635 | | 285,570 | | 192,953 | |
| | | | |
| 運営損失 | | (350,060) | | (245,727) | | (182,775) | |
| その他の収入(赤字),純額 | | 17,932 | | 6,251 | | (3,704) | |
| 所得税割引前損失 | | (332,128) | | (239,476) | | (186,479) | |
| 所得税割引 | | 4,062 | | — | | — | |
| 純損失 | | $ | (328,066) | | $ | (239,476) | | $ | (186,479) | |
| | | | |
| 1株当たりのデータ | | | | |
| クラス A 、 B 及び交換可能普通株式の 1 株当たり純損失 ( 基本 · 希釈 ) | | $ | (1.58) | | $ | (1.36) | | $ | (1.49) | |
| 加重平均株 ( クラス A 、 B 、交換可能 ) 発行済、基本、希釈 | | 207,853,702 | | 175,537,487 | | 125,348,110 | |
連結財務諸表の注記を参照してください。
株式会社リカシオンファーマシューティカルズ
合併全面損失表
(単位:千)
| | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| | 2023 | 2022 | 2021 |
| 純損失 | | $ | (328,066) | | $ | (239,476) | | $ | (186,479) | |
| | | | |
| 投資が実現していない収益 | | — | | 87 | | (162) | |
| 投資の純実績損失を純損失に再分類 | | — | | 39 | | 36 | |
| その他全面収益(赤字) | | — | | 126 | | (126) | |
| 総合損失 | | $ | (328,066) | | $ | (239,350) | | $ | (186,605) | |
連結財務諸表の注記を参照してください。
株式会社リカシオンファーマシューティカルズ
転換可能優先株と株主権益合併報告書
(単位は千で、シェアは含まれていない)
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| 転換可能優先株 | 普通株 ( クラス A 、 B および交換可能 ) | 追加実収資本 | 積算 赤字.赤字 | その他の総合損失を累計する | 株主の 株式会社 |
| 株 | 金額 | 株 | 金額 |
| 2020年12月31日の残高 | 112,088,065 | | $ | 448,312 | | 22,314,685 | | — | | $ | 7,312 | | $ | (213,601) | | $ | — | | (206,289) | |
| 総合損失 | — | | — | | — | | — | | — | | (186,479) | | (126) | | (186,605) | |
| 発行原価を差し引いた新規株式公開普通株式発行 | — | | — | | 27,878,787 | | 1 | | 462,353 | | — | | — | | 462,354 | |
| 優先株を普通株に転換する | (112,088,065) | | (448,312) | | 115,598,018 | | 1 | | 448,311 | | — | | — | | 448,312 | |
| ストックワラントの行使 | — | | — | | 343,609 | | — | | 3,512 | | — | | — | | 3,512 | |
| ストックオプションの行使等 | — | | — | | 4,137,363 | | — | | 6,812 | | — | | — | | 6,812 | |
| 株に基づく報酬 | — | | — | | — | | — | | 14,842 | | — | | — | | 14,842 | |
| 2021年12月31日現在の残高 | — | | — | | 170,272,462 | | 2 | | 943,142 | | (400,080) | | (126) | | 542,938 | |
| 総合損失 | — | | — | | — | | — | | — | | (239,476) | | 126 | | (239,350) | |
| 公開普通株式発行 ( 発行コストを差し引いた ) | — | | — | | 15,336,734 | | — | | 143,711 | | — | | — | | 143,711 | |
| ストックオプションの行使等 | — | | — | | 5,413,668 | | — | | 10,598 | | — | | — | | 10,598 | |
| 株に基づく報酬 | — | | — | | | | 27,909 | | — | | — | | 27,909 | |
| 2022年12月31日現在の残高 | — | | — | | 191,022,864 | | 2 | | 1,125,360 | | (639,556) | | — | | 485,806 | |
| 総合損失 | — | | — | | — | | — | | — | | (328,066) | | — | | (328,066) | |
| ストックオプションの行使等 | — | | — | | 9,058,817 | | — | | 12,831 | | — | | — | | 12,831 | |
| 株に基づく報酬 | — | | — | | — | | — | | 53,503 | | — | | — | | 53,503 | |
| 発行原価を差し引いた普通株式販売発行額 | — | | — | | 19,658,963 | | — | | 128,093 | | — | | — | | 128,093 | |
| 買収発行普通株式 · ストックオプション | — | | — | | 11,303,838 | | — | | 89,269 | | — | | — | | 89,269 | |
| Tempus 契約の発行普通株式 | — | | — | | 3,225,902 | | — | | 22,000 | | — | | — | | 22,000 | |
| 2023年12月31日現在の残高 | — | | $ | — | | 234,270,384 | | 2 | | $ | 1,431,056 | | $ | (967,622) | | $ | — | | $ | 463,436 | |
連結財務諸表の注記を参照してください。
株式会社リカシオンファーマシューティカルズ
統合現金フロー表
(単位:千) | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| | 2023 | 2022 | 2021 |
| 経営活動のキャッシュフロー | | | |
| 純損失 | $ | (328,066) | | $ | (239,476) | | $ | (186,479) | |
| 純損失と経営活動で使用される現金純額の調整: | | | |
| 減価償却 · 償却 | 24,402 | | 11,756 | | 8,405 | |
| 株に基づく報酬 | 53,503 | | 27,909 | | 14,842 | |
| 資産減価 | 1,188 | | 2,806 | | — | |
| レンタル料 | 8,063 | | 7,730 | | — | |
| 債務返済損失 | — | | — | | 827 | |
| その他、純額 | 3,387 | | 830 | | 4,097 | |
| 営業資産 · 負債の変動 | | | |
| その他の債権 · 資産 | (7,756) | | (2) | | (5,376) | |
| 未収入を稼ぐ | (41,076) | | 110,320 | | (10,000) | |
| 売掛金 | (987) | | 1,767 | | 1,745 | |
| 発生開発費 | 2,705 | | 522 | | 561 | |
| 費用とその他の流動負債を計算しなければならない | 6,719 | | (576) | | 12,764 | |
| リース負債を経営する | (9,862) | | (7,110) | | — | |
| 経営活動のための現金純額 | (287,780) | | (83,524) | | (158,614) | |
| | | |
| 投資活動によるキャッシュフロー | | | |
| 事業買収に伴う純現金および制限現金 | 1,844 | | — | | — | |
| 財産と設備を購入する | (11,955) | | (37,059) | | (39,798) | |
| 無形資産の購入 | (597) | | (300) | | — | |
| 購入投資 | — | | — | | (301,137) | |
| 投資販売と満期日 | 480 | | 230,608 | | 69,191 | |
| 投資活動提供の現金純額 | (10,228) | | 193,249 | | (271,744) | |
| | | |
| 融資活動によるキャッシュフロー | | | |
| 普通株式の発行収益 ( 発行費用を差し引いたもの ) | 128,093 | | 143,711 | | 462,901 | |
| 株式インセンティブ · ワラントの収益 | 12,806 | | 10,724 | | 8,437 | |
| 長期債務を償還する | (766) | | (90) | | (12,798) | |
| 融資活動が提供する現金純額 | 140,133 | | 154,345 | | 458,540 | |
| | | |
| 現金、現金等価物および限定現金に及ぼす為替レート変動の影響 | 188 | | (307) | | — | |
| | | |
現金、現金等価物、および限定的な現金純変化 | (157,687) | | 263,763 | | 28,182 | |
| 期初現金、現金等価物、および限定現金 | 559,112 | | 295,349 | | 267,167 | |
| 現金、現金等価物、制限された現金、期末 | $ | 401,425 | | $ | 559,112 | | $ | 295,349 | |
| | | |
| 非現金投融資情報を補足開示する | | | |
| 事業買収のための株式発行 | $ | 89,269 | | $ | — | | $ | — | |
| Tempus 契約の株式発行について | 22,000 | | — | | — | |
| 使用権資産の追加 · 変更 | 4,968 | | 3,950 | | — | |
| 課税財産と設備 | 2,439 | | 591 | | 7,749 | |
| 優先株を普通株に転換する | — | | — | | 448,312 | |
| 持分に計上される繰延発行コスト | — | | — | | 547 | |
| | | |
| キャッシュフロー情報を補足開示する | | | |
| 賃貸経営のための現金 | $ | 9,862 | | $ | 7,110 | | $ | — | |
| 利子を支払う現金 | 96 | | 55 | | 680 | |
連結財務諸表の注記を参照してください。
再帰製薬会社です。
連結財務諸表付記
注1.取引記録業務記述
再帰製薬会社(Recursion,The Company,We or Our)は最初に有限責任会社として設立された
2013年11月4日、会社はRecursion PharmPharmticals、LLCと改称した。2016年9月、同社はデラウェア州の会社に転換し、Recursion PharmPharmticals,Inc.と改名した。
再帰はTechBio社が生物学を復号して薬物発見産業化を実現する臨床段階である。再帰オペレーティングシステム(OS)は多種の技術にまたがって構築されたプラットフォームであり、会社は再帰データ宇宙中の数兆個の生物と化学関係を描画し、ナビゲーションすることができ、再帰データ宇宙は世界最大の独自生物と化学データセットの一つである。同社は物理とデジタルコンポーネントを原子とビットの反復循環に集合し、湿式実験室生物と化学データを良性循環に組織し、計算ツールを用いて高速変換を行うシリカゲルの中で仮説を有効な知見と斬新な化学に変換する
2023年12月31日現在、会社の累計赤字はドルだ967.6百万ドルです。同社は将来的に巨額の運営損失が予想され,その候補薬物の発展を進めるための追加資本が必要となる。会社がその子会社や第三者と協力して重大な薬物開発マイルストーンを成功させるまで,会社は大量の収入が生じないと予想され,数年かかると予想されている。その候補薬物を商業化するためには、同社或いはそのパートナーは臨床開発を完成し、全面的な監督管理要求を遵守する必要がある。同社は、臨床試験結果の不確実性、追加資金の不確実性、運営損失の歴史など、生物技術業界内の他の規模と同じ規模の多くの会社と類似したリスクと不確定要素に直面している
追加資本を集めるためには再帰が必要かもしれない。もし会社が必要な時に追加資金を得ることができない場合、それはその製品の開発を継続できないかもしれないし、会社はその開発計画およびその他の業務の一部または全部を延期、削減または放棄することを要求される可能性がある
再帰的会社は、会社の既存の現金と現金等価物は、会社が少なくとも今後12ヶ月の運営費用と資本支出に資金を提供するのに十分であると考えている。
注2重要会計政策の概要
予算の使用
実際の結果はこれらの金額とは異なるかもしれない。重大な推定と仮定は、記録収入の履行義務の履行の推定進展、商業権と無形資産の推定値、計算すべき研究と開発費用、および株式発行に基づく奨励の公正価値を含む。
陳述の基礎
連結財務諸表には、当社が制御するRecursionとその完全子会社の勘定が含まれている。会社間残高と取引はすでに合併中に販売されている.
入り 2021年4月に会社が完成しました1.5−普通株式および変換可能優先株の1対1長期株式分割。これらの連結財務諸表に記載されているすべての株式は、列報の全期間の長期株式分割を反映するように調整されている。
入り 2021年4月会社の取締役会が許可しました二つA類普通株とB類普通株あるA類株とB類普通株は1つは-1を基本とする。B類普通株の設立と発行はA類またはB類株のどの時期の1株当たり損失にも影響しない。同社は2021年の1株当たり純損失額を列報し、まるでライセンスと交換が2021年の報告期間開始時に発生したかのように報告した。ライセンス前に提出されたすべての株式金額をA類普通株と呼ぶ.その他の詳細は付記8、“普通株式”を参照
市場情報を細分化する
再帰は単一の操作セグメントとして実行される.会社の最高経営決定者は最高経営責任者で、総合的なレベルで資源を割り当て、業績を評価している。
信用リスクが集中する
会社を集中的な信用リスクに直面させる可能性のある金融商品には、現金と現金等価物が含まれる。これらの金融商品は二つ経営陣は信用の質の高いアメリカの金融機関だと思っている。再帰的な主要銀行口座は連邦保険の限度額を大きく超えている
同社は第三者サプライヤーに依存していくつかの研究と開発活動を行い、臨床前と臨床試験を含む。特に、同社はこれらのサプライヤーの一部に依存し、引き続き依存すると予想される。これらの活動は再帰会社の第三者サプライヤーの深刻な中断の不利な影響を受ける可能性があり、会社の臨床前と臨床テストの遅延及びある消耗性製品と化合物の供給を含む。
現金、現金等価物、および限定現金
現金および現金等価物には、小切手口座および通貨市場基金における銀行預金が含まれる。購入時満期日が3ヶ月以下である短期高流動性投資は、現金と現金等価物に分類される。
会社は担保口座に現金残高を維持して、会社のクレジットカードの安全を確保するように要求されている。また、同社はモルガン·チェースが発行した未返済信用状に関する制限された現金を持っており、この信用状はテナント改善に関するある会社の義務を確保するために得られた。ビルとメリンダ·ゲイツ財団の寄付に関連した制限された現金を差し戻す。
財産と設備
財産と設備は購入コストから減価償却累計を引いて入金される。財産や設備に関する正常、日常的または定期的な修理·保守活動の費用は、発生時に費用を計上する
減価償却は資産の推定耐用年数をもとに直線法で計算される資産別に推定される使用寿命は、一般に以下のようになる
| | | | | |
| 事務設備 | 5年間 |
| 実験室装置 | 7年間 |
| 賃借権改善 | 副次的な15レンタル期間または賃貸契約の残り時間 |
物件及び設備はすでに以下の長期資産減値の項目で検討した減値に従って審査を行った。
長期資産減価
事件や環境変化が1つの資産の額面が回収できない可能性があることを示す場合、当社は、潜在的な減値が存在するかどうかを決定するために、長期資産(営業権および償却の影響を受けない無形資産を除く)の帳簿価額を検討する。回収可能能力を評価する際に、再帰的に、グループに関連する識別可能なキャッシュフローが他の資産および負債のキャッシュフローから大きく独立しているように、資産および負債を最低レベルにグループ化する。そして、当社は、当該資産又は資産グループの帳簿金額と、当該資産又は資産グループが発生する見込み未割引将来のキャッシュフローとを比較する。減値が存在する場合、減価費用は資産または資産グループに計上される帳簿金額が公正価値の金額を超える。
営業権の減価
当社は毎年その営業権の減値をテストし、まず定性要素を評価して、公正価値がその帳簿価値より少ない可能性があるかどうかを確定する。評価で考慮したいくつかの要素は一般的なマクロ経済状況、業界と市場の具体的な状況、コスト要素、全体の財務表現及び会社の株価が持続的に下落しているかどうかを含む。当社が報告単位の公正価値がその額面より少ない可能性が高いと判断した場合、量子化減値テストを行う
定量化減値テストを行う際には,会社は将来のキャッシュフローを見積もる法を採用しており,将来の数量,収入と費用成長率,運営資金使用の変化,適切な割引率の選択,その他の仮定と推定について大きな判断が必要である。使用された見積もりと仮定は、会社の業務計画と市場参加者の観点と一致する。代替推定および仮定を使用して、予想される現金流量を増加または減少させ、公正価値を推定することができる。
企業合併
被買収会社の経営結果はそれぞれの買収日までの経営再帰結果に計上される。各買収の買い入れ価格は、買収日の公正価値の推定に基づいて、買収した純資産に分配される。これらの純資産を超えるいかなる購入価格も商業権として記録されている。場合によっては、購入価格の分配は、取得日から最長1年になる可能性がある公正価値の測定期間内の最終決定に基づいて修正される可能性がある。法律コスト、職務調査コスト、業務推定コスト、その他のすべての業務買収コストは発生時に費用を計上する。
研究と開発費用と臨床試験の課税プロジェクト
同社は,財務諸表作成過程の一部として,サプライヤーや臨床研究機関との契約に負う義務による費用を見積もる必要がある。これらの契約の財務条項は交渉が必要であり、これらの条項は契約によって異なり、支払い条件がこのような契約で規定されている材料やサービス期限と一致しない可能性がある。当社の政策は、サービスの提供と努力の間にこれらの費用を記録することです。同社は,臨床試験の進展や完成したサービスについて適用者や外部サービスプロバイダとの検討を考慮することで,算定すべき計数を決定している。臨床試験中に,実際の結果がその推定結果と異なれば,同社はその臨床費用確認を調整する。当社は、当時知られていた事実と状況に基づいて、連結貸借対照表毎の日付までの計上費用を推定します。実際の支出は計算された金額とは違うかもしれない
賃貸借証書
当社は賃貸契約に基づきレンタル施設を経営し、レンタル期間中に直線法で賃貸料支出を確認しています。ある賃貸契約には、テナントによる手当の改善、レンタル休暇の改善、定期的な賃上げ、継続選択権が含まれる。賃貸料支出の決定には賃貸料祝祭日と予定されている賃貸料上昇が含まれている。いくつかのレンタルには、維持費、保険料、税金、使用量に応じた可変レンタル料が含まれていますが、これらに限定されません。再帰的にこれらのコストが発生した場合にそれらを確認する
使用権資産及びリース負債はリース開始日レンタル期間内のリース支払い現在値で確認します。レンタル中に暗黙的な金利が確定しにくい場合、現在値は、増分借入金金利を使用して決定される逓増借款金利は、Recursionが類似期間内に担保方式で借金するために必要な支払金利に等しく、その金額は、経済環境下での賃貸支払いに相当する継続期間は、レンタル開始日に行使されると判断されない限り、レンタル期間の決定に計上されない。当社は賃貸料支出を確認し、当社がレンタルスペースの使用及び制御の法定権利を取得した日から計算しますリースをリース開始日に経営的または融資的賃貸に分類することを再帰的に行う。すべての未完成賃貸は約運営賃貸である。
当社は、Recursionが12ヶ月未満の期間の賃貸について賃貸負債と使用権資産を確認しないという実際の便宜策を採用することを選択しました。同社はまた、契約にレンタルを含む契約を含まないレンタルと非レンタル部分との単独対価格を選択している。使用権資産およびリース負債は、いくつかの再計量イベント時に、残りの賃貸支払いの現在値およびレンタル修正時の推定増額借入金金利を使用して再計量される当社がテーマ842を採用する前に開始した経営リースについては、2022年1月1日までの増額借入金利を再帰的に使用して賃貸負債と使用権資産を測定する。
収入確認
営業収入は主に研究開発協定によって生成される(付記9参照 “共同開発契約”は、より詳細を知る)。研究開発契約の収入は,会社が承諾したサービスを顧客に移転することで義務を履行していることが確認された。会社は顧客に約束したサービスに基づいて、適切な投入や産出方法を用いて、関連履行義務の完全履行の進捗状況を測定することで、一定期間の収入を確認する。このような収入確認方法は,完了進捗を決定するために,履行義務達成に要する作業量を会社に推定することを求めている。これらの推定数の大きな変化は、今後の期間中に確認された収入の時間や金額に大きな影響を与える可能性がある
また、当社は、パートナーが将来的にリキュレーションに追加サービスの提供を要求できるオプションを契約において提供する場合があります。再帰は、これらのオプションが契約開始時に物質的権利かどうかを評価します。オプションが重要な権利であると当社が判断した場合、リカシションはオプションを別個の履行義務とみなします。歴史的に、当社は、将来的にライセンスまたは追加サービスを提供するために付与されたオプションは、これらのアイテムは発生しない可能性のある将来の事象に偶発的であり、大幅な割引で価格設定されていないため、物質的権利ではないと結論付けました。
収入コスト
収益コストは、パートナー顧客とのパフォーマンス義務の下で要求される創薬サービスの提供にかかる費用で構成されます。これには、主に材料費、従業員の勤務時間、財産 · 設備の減価償却が含まれます。業績義務を履行するために購入した消耗品は、消費されるまで連結貸借対照表に計上されます。
研究と開発
研究開発費には,顧客との契約による研究開発活動以外の研究開発活動によるコストが含まれており,薬物発見·開発研究,外部研究,実験室用品の購入が含まれている。同社は,適用契約に規定されている活動完了状況に基づいて第三者契約サービスに関する費用を確認している。第三者との契約を終了する際には、会社の財務義務は、一般にこれまでに発生または承諾した費用に限られる。将来の研究および製品開発活動において使用または提供される任意の商品またはサービスの任意の前払いは、商品またはサービスが提供されるまで前払い料金に分類される。
株に基づく報酬
会社は、通常、株式オプションおよび制限株式単位(RSU)の形態で、従業員および非従業員に株式ベースの報酬を支給する。同社の株式奨励の大部分は従業員に支給されている
付与日の公正価値に応じて持分報酬の報酬支出を計量し、必要なサービス期間内の報酬支出を確認することは、通常、直線的に基づいている。業績条件を有する株式報酬については、業績条件の可能な結果に基づいて株式に基づく報酬費用を再帰的に確認する。賞は通常授与されます4 年従業員にとっては。没収が発生した場合に株式ベースの報酬支出に対する没収の影響を再帰的に確認する
株式オプションの付与日公正価値は、Black-Scholesオプション定価モデルを用いて推定され、このモデルは、オプションの期待期限、株価変動性、配当収益率、および無リスク金利を入力する必要がある。当社には期待期間を見積もるのに十分な履歴行使データがないため、期待期限は簡略化方法に基づいている。変動率はオプション期待期間内の同業者の平均履歴変動率に基づく。期待配当収益率はゼロRecursionは配当金を支払ったことがないため、現在も配当金を支払う計画はない。無リスク金利は、ゼロ金利米国政府債券を付与した場合の金利に基づいており、残り期限はオプションの期待期限に等しい
付与日RSUの公正価値は、付与日会社普通株の市場価格に基づいて決定される。市場条件のある株式奨励については,付与日公允価値はモンテカルロシミュレーションを用いて決定し,株式補償費用は隠れサービス期間内の加速帰因法を用いて確認した。暗黙的サービス期間の終了前の期間内に市場条件が満たされた場合、任意の残りの未確認補償コストが確認される。株式ベースの報酬は、従業員の役割に応じて収入コスト、研究開発費、一般·行政費を計上する。
所得税
所得税は貸借対照法で計算される。連邦、州、外国所得税の支出は現行税法で報告された税前損失に基づいて計算される。繰延税項は、定められた税率で一時的な差異の将来の税務結果について確認し、一時的な差異とは、資産及び負債及びそのそれぞれの課税基礎の財務諸表と繰り越した税項利益との間の差異である。既存の情報に基づいて、繰延税金資産の全部または一部が現金化されない可能性が高い場合には、推定準備を確立または維持する
不確定な税務頭寸については、引当は頭寸の技術価値に基づいて、頭寸が審査後にさらに続く可能性があるかどうかを決定する。確認の可能性が高い税務状況に該当するものは、最終決済時に50%以上になる可能性のある最大金額で総合財務諸表で計量·確認します。
最近の会計公告
2023年12月、財務会計基準委員会(FASB)は会計基準更新(ASU)第2023-9号を発表した所得税(話題740)それは.新しい基準は、所得税税率台帳においてより多くの情報を提供することを主に要求し、支払われた所得税に関する追加情報の開示を要求する会計基準編纂(ASC)740の開示要件を更新する。本基準は,2025年12月31日までの年次期間からの再帰に適用される。まだ発表されていない年次財務諸表については、早期採用を許可する。修正案は展望性や追跡性に基づいて適用されることができる。この基準を採用することは、再帰的会社の総合貸借対照表や経営報告書に影響を与えない
2023年11月、FASBはASU 2023-7を発表した分部報告(主題280)それは.この基準は、クラス別に重大な部門費用を開示することと、単一の報告可能な部門を有する会社にすべてのASC 280を開示することを要求することと、ASC 280の開示の頻度を増加させることを要求することとを含む、ASC 280に関連する新しい開示を必要とする。再帰は以前に提出されたすべての報告期間に修正遡及を適用しなければならない。本基準は,2024年12月31日までの年次期間からの再帰に適用される。早期養子縁組を許可する。この基準を採用することは、再帰的会社の総合貸借対照表や経営報告書に影響を与えない
2022年1月1日、RecursionはASU 2016-02号を通過したレンタル(テーマ842)それは.指導意見はまたレンタル手配の開示要求を拡大した。会社はASC 842を採用し,改正トレーサビリティ法を採用している。以下の実用的な方便を再帰的に選択した
2021年12月31日以降の報告期間の結果は標準的に記載されているが、前の期間の結果は調整されず、再帰的な歴史会計報告に従って継続される。2022年1月1日の賃貸使用権を記録した資産と賃貸負債の調整は#ドルに調整された32.91000万ドルと300万ドルです47.82億5千万ドルと2億5千万ドルです合併業務表やキャッシュフローへの影響は大きくない。
注3.取引記録財務情報を補充する
タンプス協定
入り 2023年11月渡して入りました5年制Tempus Labs,Inc.(Tempus)と合意し,患者を中心としたマルチモード腫瘍学データ記録へのアクセス権を購入し,治療開発目的に使用権を用いた。これらのデータはRecursionの人工知能や機械学習モデルの訓練に用いられ,Recursionの薬物発見プロセスの加速が期待できる。再帰は年に1回支払います範囲は$です22.01000万ドルと300万ドルです42.01000万ドルで最高300万ドルになります160.0 総額 100 万ドルは、現金または会社のオプションで株式でテンパスに支払われます。株式価値は、 7人— 支払日の 5 営業日前の日付の直前日に終了する再帰クラス A 普通株式の取引日期間のドル量加重平均価格。
再帰は、レコード購入を連結営業計算書において「研究開発費」として支出するものです。テンパスへの回収支払額が記録購入額を上回る場合、回収は連結貸借対照表に該当する金額を「その他の流動資産」または「発生費用およびその他の負債」にそれぞれ計上します。2023 年 12 月 31 日現在、 Recursion は $16.0 財務諸表の「その他の経常資産」に含め、テンパス契約に関連した連結貸借対照表に記載されている。
財産と設備
| | | | | | | | |
| 十二月三十一日 |
| (単位:千) | 2023 | 2022 |
| 実験室装置 | $ | 60,096 | | $ | 47,524 | |
| 賃借権改善 | 45,929 | | 41,872 | |
| 事務設備 | 22,126 | | 20,164 | |
| 建設中の工事 | 3,231 | | 8,747 | |
| 財産と設備、毛額 | 131,382 | | 118,307 | |
| 減算:減価償却累計 | (44,872) | | (30,115) | |
| 財産と設備、純額 | $ | 86,510 | | $ | 88,192 | |
財産と設備の減価償却費用は#ドルです15.9百万、$11.4百万ドルとドル8.82023 年 12 月 31 日期間の 100 万ドル2022 年、 2021 年、それぞれです。当社は $の減損を計上しました。1.21000万ドルと300万ドルです2.8 2023 年 12 月 31 日期と 2022 年 12 月 31 日期には、当社が使用する予定ではないため、リース改善のための建設事業に関連して、それぞれ 100 万ドルを支払いました。減損は連結業績計算書の「一般および管理」に計上された。
2023年12月31日までの年度Vtの..同社は、 $BioHive スーパーコンピュータをアップグレードするプロジェクトを開始し、完了しました。1.7 百万だスーパーコンピュータは上記の表でオフィス機器に分類された。前年比の研究設備の増強は、本社拡張でいくつかの研究室が完成したことによるものです。残高の大半は、前年度の建設中であった。
For the 2022年12月31日までの年度前年比での実験機器の増加は、同社の化学技術、機械学習、トランスクリプトミクスプラットフォームへの投資によるものです。前年比リース保有改善の増加は、主に本社拡張完了によるものです。建設中のバランスは、主に建設中のラボ機器に関連しています。
費用とその他の負債を計算すべきである
| | | | | | | | |
| 十二月三十一日 |
| (単位:千) | 2023 | 2022 |
| 補償すべきである | $ | 22,888 | | $ | 20,433 | |
| 開発費発生 | 6,077 | | 3,372 | |
早期発見費用の発生 | 2,570 | | 3,192 | |
累積建設 | 2,439 | | 591 | |
未請求の受領材料 | 2,432 | | 2,028 | |
| その他の費用を計算しなければならない | 10,229 | | 3,288 | |
| 費用とその他の負債を計算すべきである | $ | 46,635 | | $ | 32,904 | |
支払手形
2023 年 1 月、当社は $を借入するための資金調達契約を締結しました。1.9 スーパーコンピュータアップグレードプロジェクトの一環として 100 万ドル負債は a で返済されます。 3年制period at a 7金利率% 。2023 年 12 月 31 日現在、残高は $606 千人だ
2018 年には、同社は $を借りた。992 リース契約の一部としてテナントの改善に使用していた紙幣は a で返済されます 10年間は 8金利率% です。2023 年 12 月 31 日現在、残高は $536数千ドルです。
利子収入,純額
| | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| (単位:千) | | 2023 | 2022 | 2021 |
| 利子費用 | | $ | (97) | | $ | (55) | | $ | (2,952) | |
| 利 子 収入 | | 19,116 | | 6,254 | | 73 | |
| 利子収入,純額 | | $ | 19,019 | | $ | 6,199 | | $ | (2,879) | |
2023 年 12 月 31 日期および 2022 年 12 月 31 日期における利息収入は、主にマネーマーケットファンドの現金および現金等価物に対する利益に関連しています。2021 年 12 月 31 日に終了した年度の利子費用は、主にシリーズ A および B ワラントの公正価値の変化に関連しています。利息収入および費用は連結営業計算書の「その他の純利益 ( 損失 ) 」に計上しました。
注4買収する
Valence Discovery Inc.
Recursionは2023年5月16日、プライベート持株の機械学習(ML)/人工知能(AI)デジタル化学社Valence Discovery Inc.(Valence)のすべての未償還株式を買収した。Valenceを人工知能に基づく化学エンジンをRecursionのオペレーティングシステムに統合し,Recursionがその技術支援の薬物発見過程を拡大できるようにする.これはRecursionのデジタル化学能力とその薬物発見過程を加速させるだろう
Valenceの買収には業務合併入金として会計買い入れ法を採用した。Valenceを買収する前払い金には2.2再帰A類普通株は1.2億株4.41つの子会社に渡す1,000万株は
再帰的なA類普通株は792Valence持分奨励所有者が保有する株式オプションと繰延負債を行使して追加対価格を得る場合には1000株を発行することができる。2023年12月31日現在、上記少量対価格株式は発行されていません。最終発行数はまだ決まっていないため、変化する可能性があります
次の表はすべての考慮事項をまとめた
| | | | | |
| (単位:千) | |
| 再帰A類普通株の公正価値 | $ | 11,096 | |
| 交換可能株の公正価値 | 22,473 | |
| Valance持分奨励所有者に支給される持分奨励の公正価値 | 1,933 | |
| 割増繰延負債 | 396 | |
| 総掛け値 | $ | 35,898 | |
次の表は、購入日までの購入資産と負担する負債の公正価値をまとめたものである
| | | | | |
| (単位:千) | |
| 現金 | $ | 4,235 | |
| その他売掛金 | 536 | |
| 無形資産--技術 | 15,000 | |
| 売掛金と売掛金 | (872) | |
| 所得税を繰延する | (3,265) | |
| 純資産総額が確認できます | $ | 15,634 | |
| グッドウィル | 20,264 | |
| 買収した総資産と負担した負債 | $ | 35,898 | |
この無形資産はValenceのMLやAIデジタル化学プラットフォームと関係がある.無形資産の推定公正価値はコスト法を用いて決定される。この推定技術は開発技術の総コストの見積もりに基づいて、資産の公正な価値を提供した。総コストを決定するための重要な入力は、必要な時間長、会社員によって実行されるサービス時間数、および推定された廃棄率を含む。この技術無形資産は直線に基づいて4年制有用な寿命。
営業権とは、移転の対価格が純資産を確認した部分を超えることを指す。確認された営業権は、集約された労働力および予想される相乗効果を表し、(I)再帰的トラフィックにおいてValenceのデジタル化学プラットフォームを利用すること、(Ii)ValenceのMLおよび人工知能能力を利用すること、(Iii)RecursionのデータおよびオペレーティングシステムをValenceのプラットフォームに統合すること、および(Iv)Recursionのパイプラインを加速させることを含む。営業権はまた、買収のための確認可能な無形資産の繰延税金負債の決定の影響を受けており、これらの資産には納税基盤がない。営業権は納税時に控除できません。
再帰会社の2023年12月31日までの年度総合業務報告書には違います。純収入と1ドル6.8Valenceの運営に関する百万ユーロの運営損失。買収が2023年5月に発生したため、会社は買収価格と買収した個人資産と負担する負債の配分を最終的に決定している。今期の貸借対照表に記載されている購入価格の配分は経営陣の最適見積もり数に基づいて行われており、初歩的であり、変化する可能性がある。変動の主要分野は無形資産、その他の売掛金、繰延税項の推定値に関連している。経営陣の配属に協力するために、会社は外部専門家を招いた。分析完了に必要な情報を取得した後、会社は最終的に確認した金額を確定します。同社はこれらの金額をできるだけ早く決定する予定だが、買収日から1年遅くはない。
Cyclica Inc.
2023年5月25日、RecursionはCyclica Inc.(Cyclica)のすべての未償還持分を買収し、Cyclicaは個人持株会社であり、所望の目標達成作用に応じて畳み込みおよび生成化学提案のメカニズムを除去することができるデジタル化学ソフトウェアキットを構築した。Cyclicaのプラットフォームは,再帰的化合物の有効性最適化を強化するとともに,生成的機械学習手法により負債を最小限に抑えることが予想される
Cyclicaの買収には会計買収法を採用し、業務合併として入金する。Cyclica買収の前期総対価格には5.82000万株の再帰A普通株現金支払い1.0Cyclica持分を行使して、保有者が保有している株式オプションと繰延負債を奨励して、追加対価格後に発行可能な株を得る。大ざっぱに1822023 年 12 月 31 日現在、上記のクラス A 普通株式の 1000 株が発行されていない。
次の表はすべての考慮事項をまとめた
| | | | | |
| (単位:千) | |
| 再帰A類普通株の公正価値 | $ | 49,915 | |
| 現金 | 6,505 | |
| サイクリカ株式賞受賞者に発行された株式賞の公正価値 | 3,852 | |
| 割増繰延負債 | 344 | |
| 総掛け値 | $ | 60,617 | |
次の表は、購入日までの購入資産と負担する負債の公正価値をまとめたものである
| | | | | |
| (単位:千) | |
| 現金 | $ | 2,429 | |
| 制限現金 | 1,685 | |
| その他売掛金 | 741 | |
| 投資する | 1,000 | |
| その他流動資産 | 385 | |
| 無形資産 — テクノロジー | 28,000 | |
| 売掛金と売掛金 | (579) | |
| 未収入を稼ぐ | (1,754) | |
| 所得税を繰延する | (2,075) | |
| その他の負債、現在 | (66) | |
| 他の非流動負債 | (139) | |
| 純資産総額が確認できます | $ | 29,627 | |
| グッドウィル | 30,990 | |
| 買収した総資産と負担した負債 | $ | 60,617 | |
このような無形資産はCyclicaのデジタル化学プラットフォームと関連がある。無形資産の推定公正価値はコスト法を用いて決定される。この推定技術は開発技術の総コストの見積もりに基づいて、資産の公正な価値を提供した。総コストを決定するための重要な入力は、必要な時間長、会社員によって実行されるサービス時間数、および推定された廃棄率を含む。これらの技術無形資産は直線に基づいて3年制役に立つ生活です。
営業権とは、移転の対価格が純資産を確認した部分を超えることを指す。認められた営業権は、(I)RecursionのトラフィックにおいてCyclicaを利用するデジタル化学プラットフォーム、(Ii)Cyclicaを利用したMLおよび人工知能能力、(Iii)RecursionのデータおよびオペレーティングシステムをCyclicaのプラットフォームに統合する能力、および(Iv)Recursionのパイプラインを加速させる能力を含む、集約された労働力および予期される相乗効果を表す。営業権はまた、買収のための確認可能な無形資産の繰延税金負債の決定の影響を受けている。営業権は納税時に控除できません。
再帰会社の2023年12月31日までの年度総合経営報告書には、無形純収入と9.6Cyclicaの運営に関連した百万ドルの運営損失。買収が2023年5月に発生したため、会社は買収価格と買収した個人資産と負担する負債の配分を最終的に決定している。今期の貸借対照表に記載されている購入価格の配分は経営陣の最適見積もり数に基づいて行われており、初歩的であり、変化する可能性がある。変動の主要分野は無形資産、その他の売掛金、繰延税項の推定値に関連している。経営陣の配属に協力するために、会社は外部専門家を招いた。分析完了に必要な情報を取得した後、会社は最終的に確認した金額を確定します。同社はこれらの金額をできるだけ早く決定する予定だが、買収日から1年遅くはない。
形式財務情報
次の表はRecursion、Valence、Cyclica業務の未監査予想合併結果を示しており、買収は2022年1月1日に発生しているようです
| | | | | | | | |
| 十二月三十一日までの年度 |
| (単位:千) | 2023 | 2022 |
| 純収入 | $ | 44,861 | | $ | 40,517 | |
| 純損失 | (336,603) | | (273,889) | |
監査を受けていない予備財務情報は会計買収法を用いて作成され、再帰、価格と周期の歴史財務情報に基づいている。要求に応じて買収が2022年1月1日に発生した状況を反映するために、監査されていない予備財務情報は、買収された識別可能な無形資産の公正価値に基づいて生じる増額償却費用、買収に関連する株式補償に関する追加株式補償費用の発行、および2023年12月31日から2022年12月31日までの年度に発生する買収コストの再分類を反映する調整を含む。監査を受けていない備考財務情報は、買収が2022年1月1日に完了すれば、合併後の運営結果は何になるかを必ずしも表明していない。また、監査を受けていない予備財務情報は合併後の会社の未来の経営結果に対する予測ではなく、買収に関連するいかなるコスト節約或いは協同効果の期待実現も反映していない。
注5.取引記録賃貸借証書
会社は各種の長期不動産賃貸契約を締結し、主に事務、研究開発と経営活動に関連している。その会社の賃貸借契約の残り条項は1へ 9年、いくつかのレンタル契約には、Recursionにレンタル期間を延長する能力を提供するオプションが含まれています5年それは.オプションが行使されると合理的に決定された場合、オプションはレンタル期間に含まれる
2023年12月31日までの年度末までに、引渡し借款改定により、使用権資産および賃貸負債が増加した#ドル3.4百万ドルです。これらの修正は総合業務報告書に影響を与えない。2022年12月31日までに、繰越契約借款改定により、使用権資産と賃貸負債が減少した#ドル2.71000万ドルと300万ドルです2.82億5千万ドルと2億5千万ドルですこれらの修正が連結業務報告書に与える影響は大きくない
2022年5月、当社はオンタリオ州トロントと約28,1102平方フィート(“トロント借約”)。空間部分の期待用途に応じて、このレンタルは複数のレンタル構成要素に分類される。その中のいくつかの構成要素について、使用権は2022年5月に資産統制権を獲得した時から始まる。残りの部分の使用権は2023年6月に始まり、当時は資産の支配権を獲得した。各コンポーネントのトロントレンタル条項は以下の通りです10年1つを使う5年制オプションを更新する。トロント賃貸契約には、増加しているレンタル料と#ドルまでのテナント改善手当が含まれています1.6百万ドルです。固定支払総額は約#ドルと予想される11.1百万ドル、建築費用を含めた追加可変費用
工業リースに関する情報は、付記7を参照して、“引受金及び又は有事項”を参照されたい。
レンタル料の構成は以下のとおりである
| | | | | | | | |
| 十二月三十一日までの年度 |
| (単位:千) | 2023 | 2022 |
リースコストを経営する | $ | 8,144 | | $ | 7,793 | |
可変リースコスト | 2,116 | | 1,070 | |
短期賃貸コスト | 139 | | — | |
レンタル料 | $ | 10,399 | | $ | 8,863 | |
リース期間と割引率は以下の通りです。
| | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2023 | 2022 |
| 賃貸借契約を経営する | | |
| 加重平均残存賃貸年限(年) | 6.7 | 7.6 |
| 加重平均割引率 | 7.8 | % | 7.3 | % |
賃貸負債満期日を経営する2023年12月31日その中には:
| | | | | |
| (単位:千) | 賃貸借契約を経営する |
| 2024 | $ | 10,059 | |
| 2025 | 10,399 | |
| 2026 | 10,526 | |
| 2027 | 10,769 | |
| 2028 | 7,397 | |
| その後 | 17,014 | |
| 賃貸支払総額 | 66,164 | |
| 差し引く:推定利息 | (16,634) | |
| 賃貸負債現在価値 | $ | 49,530 | |
総賃料は $6.42021 年 12 月 31 日に終了した年度の 100 万ドル。
略称は 6 。 商誉と無形資産
グッドウィル
以下の表は、営業日帳金額の変動状況をまとめたものである
| | | | | |
| (単位:千) | |
2022年12月31日現在の残高 | $ | 801 | |
| 買収による追加収益 | 51,255 | |
2023年12月31日現在の残高 | $ | 52,056 | |
商誉の追加は、 2023 年 12 月 31 日に終了した年度における Cyclica と Valence の買収に関連しています。詳細は注釈 4 「取得」を参照。存在しました 違います。2022 年 12 月 31 日および 2021 年 12 月 31 日を末日とする会計年度における親善の残高の変更。 違います。2023 年 12 月 31 日、 2022 年、 2021 年 12 月 31 日を末尾とする年度に親善減損が計上されました。
無形資産、純額
次の表は無形資産をまとめています
| | | | | | | | | | | | | | | | | | | | | | | |
| 2023年12月31日 | | 2022年12月31日 |
| (単位:千) | 総帳簿金額 | 累計償却する | 帳簿純額 | | 総帳簿金額 | 累計償却する | 帳簿純額 |
| 寿命が確定した無形資産 | $ | 44,426 | | $ | (8,969) | | $ | 35,457 | | | $ | 1,211 | | $ | (809) | | $ | 402 | |
| 生きた無限無形資産 | 986 | | — | | 986 | | | 904 | | — | | 904 | |
| 無形資産、純額 | $ | 45,412 | | $ | (8,969) | | $ | 36,443 | | | $ | 2,115 | | $ | (809) | | $ | 1,306 | |
2023 年 12 月 31 日期における無形資産残高は、当社の買収により増加しました。取得した無形資産の詳細については注釈 4 「取得」を参照。
償却費用を$とする8.51000万、$3791万5千ドル304 2023 年 12 月 31 日、 2022 年 12 月 31 日、 2021 年 12 月 31 日までの各年度に償却費は連結営業計算書の「研究開発」に含めました。有期限無形資産の償却費用は、翌年程度に計上します。 2.8何年もです
2023 年 12 月 31 日時点で計上された無形資産の償却費の推定額は以下のとおりです。
| | | | | | | | | | | | | | | | | |
| (単位:千) | 2024 | 2025 | 2026 | 2027 | 2028 |
| 年間償却費の推計額 | $ | 13,379 | | $ | 13,116 | | $ | 7,672 | | $ | 1,283 | | $ | 7 | |
普通不定無形資産は主に当社が購入した再帰ドメイン名を代表します違います。2023年12月31日まで、2022年および2021年12月31日までに無形資産減価費用を計上した。
注7引受金とその他の事項
賠償する
当社は、ある事件や事故について上級職員及び役員に賠償することに同意していますが、当該高級社員又は取締役は現在又は当社の要求に応じて上記のような身分でサービスしています。当社は取締役と上級管理職責任保険を購入し、当社への保証義務の償還を規定しており、その賠償義務に応じて支払われた任意の金額の一部を回収できるように当社のリスク開放を制限することを目的としています。その会社は所有している違います。2023年12月31日現在と2022年12月31日までにこれらの合意に記録された負債は、可能な金額がないためである
従業員協議
当社はすでにいくつかの重要な従業員と雇用協定を締結しており、このような合意に基づいて、例えば当社のコントロール権変更後に当該などの従業員の採用を終了し、このような従業員は株式激励の加速を含むいくつかの福祉を得る権利がある
法律事務
当社は通常の業務過程に現れる様々な法的手続きに時々触れている可能性があります。このような問題の不利な解決は、会社の将来の財務状況、経営業績、あるいはキャッシュフローに重大な影響を与える可能性がある
当社は2021年2月にIndustry Office SLC,LLC(所有者)と実験室およびオフィス会場賃貸協定(業界リース)を締結した。2023年3月、同社は所有者に書簡を送り、多くの施工遅延と規格外の点、欠陥及び適用構造図との偏差を詳細に説明した
および/または建築規範が適用される条件を満たしていない。2023年6月23日、大家は当社を提訴した(産業事務室SLC、LLCは再帰製薬会社を訴えている。ユタ州塩湖県第三地区裁判所(裁判所)、事件番号230904627)、期待拒否と違約を告発する。原告は金銭賠償と弁護士費を要求した。2023年7月、同社は却下動議を提出した。Recursionは2023年9月に却下動議を承認され、裁判所は大家が2023年10月23日までに却下された訴えを修正して再提起することを規定した。2023年10月23日、大家は、予想拒否、違約、誠実信用と公平取引違反の黙示契約(修正された起訴状)を告発し、金銭賠償と弁護士費を要求する修正された起訴状を再提起した。2023年11月、同社は修正された訴えを却下するよう動議を提出した。裁判所は会社の却下の動議について公聴会を行った2024年3月29日. 2023年12月31日まで会社が所有しています違います。これらの事象の負債は不利な結果として記録される可能性は低い。
当社は、インダストリーリースに関連して、 2023 年 9 月に、契約違反および詐欺的な虚偽表示などを主張する家主に対して裁判所に請求 ( 反訴 ) を提起しました。2023 年 10 月、家主は回答を提出し、反訴で主張された会社の主張を否定した。当社と家主は現在、発見に従事しています。オン 2023 年 10 月 27 日, 当社は、その 1 つの判決を求め、嘆願書の一部判決の動議を提出しました。 4 人反訴だ裁判所は、同社の嘆願書に関する部分的な判決の動議について審理を予定しました。 2024年3月29日当社は、反請求に関連する可能性のある金額または金額の範囲を見積もることはできません。
注8普通株
クラス A 普通株式の各株式は、保有者に 1つは1 株当たり議決権およびクラス B 普通株式の各株式は、保有者に 10会社の株主の投票に付されるすべての事項について、 1 株当たり 1 票。普通株主は、会社の取締役会が宣言する配当を受け取る権利があります。2023 年 12 月 31 日および 2022 年 12 月 31 日現在、 違います。配当金は既に発表された
市場で製品を提供する
入り 2023年8月当社は,Jefferies LLC(“販売エージェント”)と公開市場販売プロトコル(“販売プロトコル”)を締結し,発売,発行および売却総額最高$に達することを規定している300.0そのA類普通株のうち時々2000万株が市場(ATM)で発行されている。2023年12月31日までの金額は219.4販売協定によると、未来の販売に100万ドルがまだ使用されている。その会社はすでに売却された12.02000万株、純収益$を獲得した78.22023年12月31日まで、合意項目の400万ドル。販売契約によると、追加株式を売却するには再帰する必要はありません。会社が販売代理に払う手数料は最高です3A類普通株はすべて販売して得られた総収益の割合。販売契約は、販売契約の下ですべての利用可能な株式またはいずれか一方が書面通知を出して終了するまで有効に継続する。今回のATM発売は,日付2023年8月8日の目論見書補編と,我々のS−3 ASR用紙自動発効棚登録声明(登録番号333−264845)に基づいて米国証券取引委員会に提出された関連入札説明書に基づいて行われた
NVIDIA私募
RecursionとNVIDIA Corporationは2023年7月に私募について株式購入契約(2023年私募)を締結し、この合意に基づき、当社は合算で販売した7.72000万株のA類普通株、価格は$6.491株当たりの純収益は約$である49.9万万.
Valenceが交換可能株を買収する
2023年5月、Valenceの買収について、当社は最大発行する契約を締結しました5.9A類普通株1,000,000株(“取引所株式”)は、Recursion子会社の交換可能株式を交換、撤回または償還する際に発行することができる。再帰的子会社の交換可能株式は所有者に権利を持たせる1つは-再帰的Aクラスの普通株式の1対1ベース。これらの株式は、Recursionが発表した配当金と経済的に等しい配当金を得る権利があり、投票権がなく、株式分割や他の再編の慣例によって調整されている。さらに、会社は、発行されたすべての交換可能株式を、ある事件が発生した場合と、7周年後のいつでも同等の数のA類普通株に交換することを要求することができる
Valenceの買収を完了する。交換可能株式は、経済的にはA類株とほぼ同等であり、会社の株主権益における普通株に分類される。当社が計算した加重平均流通株には交換可能株式が含まれています。2023年12月31日までに3.61.5億株交換可能株はA類株に償還された
2022年私募
2022年10月、Recursionが発表15.32000万株会社A類普通株、買い取り価格は$9.80私募1株(2022年私募)を適格機関バイヤーと機関認可投資家(購入者)に売却し、純収益は$143.7百万ドル、費用と発売コストを差し引いて$6.6百万ドルです
登録権協定
タンプス協定
2023年11月、当社は、ダンプズ協定に基づいて発行された又は発行すべきA種類普通株式の登録説明書(又は有効登録説明書の目論見補充S-3 ASR表を、規則第462(E)条に基づいて提出してから自動的に発効する)を米国証券取引委員会に提出することに同意した。募集説明書補充登録声明(第333-264845号書類)はその後#年に提出されます2023 年 12 月Tempusプロトコルにより初期許可料でTempusに発行された株式を登録して転売に供する
Tempusプロトコルに従ってTempusに発行された任意の株式を登録した後、当社は、登録声明に含まれるTempusに発行されたすべての株式が販売されたか、または登録日を必要とすることなく、証券法第144条に基づいて公開販売することができるように、商業的に合理的な努力をして、その登録宣言を有効に維持することに同意した。
NVIDIA私募
入り 2023 年 7 月当社は2023年にNVIDIAとの私募について、当該取引で発行されたA類普通株株式を転売に登録することを規定する登録権契約を締結した。募集説明書補充登録声明(第333-264845号書類)はその後#年に提出されます2023年8月NVIDIAに発行されたA類普通株株式の転売を登録する.当社は、この合意の下ですべての登録証券が販売される日まで、商業的に合理的な努力で登録声明を有効に継続することに同意した。持株者が場合によっては登録声明が無効でその株式を売却できない場合は,会社は当日以降毎月流通株を保有する各株主に金を支払わなければならない1総価格の%を購入して、最高支払金額は5総価格の%を購入します。2023年12月31日までに違います。この合意に関連した負債は、支払いが必要となる可能性が低いため、計算されなければならない。
買収する
入り 2023 年 5 月Valenceの買収については,当社は登録プロトコルを締結し,その等の取引で発行または発行可能なA類普通株および取引所株式について転売のために登録する.S-3 ASRフォームの登録声明(文書番号333-272281)を提出し、株式保有者転売を登録した。登録声明の有効期限は以上でなければなりません3年.
入り 2023 年 5 月Cyclicaの買収について、当社は、当該取引で発行されたA類普通株株式を転売に登録することを規定する登録契約を締結した。募集説明書補充登録声明(第333-264845号書類)はその後#年に提出されます2023 年 6 月株式を登録し,所有者の転売に供する.登録声明は、登録声明に従ってすべての株式が販売されたか、または登録された日の早い者を必要とせずに、証券法第144条に従って公開販売することができるまで有効に継続されなければならない
2022年私募
2022年10月私は2022年の方向性増発について、当社は当該取引で発行されたA類普通株株式を転売に登録することを規定する登録権協定を締結した。募集説明書補充登録声明(第333-264845号書類)はその後#年に提出されます2022年10月登録買付人はA類普通株を転売する。協定がカバーする登録可能な証券が所有者またはすべての人によって公開されるまで、合意は有効に維持されなければならない
株はもはや登録可能な証券ではない。持株者が何らかの事情により合意が無効になってその株式を売却できない場合、会社は当日およびその後の毎月流通株を保有する各株主に配当金を支払わなければならない1所有者が支払う総購入価格の%は、プロトコルが解除されるまで制限されない。2023年12月31日までに違います。この合意に関連した負債は、支払いが必要となる可能性が低いため、計算されなければならない。
初公募株
2021 年 4 月 20 日、当社は閉店しました。 株式公開 ( IPO )発表されました27.9 クラス A 普通株式の 100 万株を18.001株当たりの収益純額は$462.4引受割引と手数料を差し引いた後 100 万ドル35.1百万ドルのその他の提供費用4.3百万ドルです
IPO に先立ち、当社は様々な資金調達イベントの一環として優先株式を発行してきました。2021 年 4 月、可転換優先株の発行済株式をすべて 115.6 クラス A の 100 万株IPO の一部として普通株式ですThere was 違います。転換優先株の発行済 2023 年、 2022 年、 2021 年 12 月 31 日。 違います。2023 年 12 月 31 日、 2022 年、 2021 年 12 月期に発行された転換優先株。
会社の転換可能優先株は総合貸借対照表で株主権益以外のカテゴリに分類され、場合によっては清算とみなされる場合が発生した場合、その株式の所有者は清算権を有しており、この清算は完全に会社の制御範囲内ではないため、当時発行されていなかった転換可能な優先株を償還する必要があるからである。転換可能な優先株は清算とみなされる事件が発生しない限り償還できない
クラスAとクラスBの普通株式ライセンス
入り 2021年4月会社の取締役会が許可しました二つA類普通株とB類普通株A類とB類普通株保有者の権利は同じであるが、投票権と転換権は異なる。A類普通株は1株当たり権利がある1つは株ごとに投票する。B類普通株は1株当たり権利がある101株当たりの投票権は随時1つはA類普通株株。
すべてのB類普通株は、会社の最高経営責任者(CEO)クリストファー·ギブソン博士またはその付属会社が保有している。ジブソン博士とその付属会社は2023年12月31日現在、B類普通株流通株を保有しており、約半数を占めている25会社流通株投票権の%です。ジブソン博士が未返済の株式を並行して奨励することに伴い、投票権は時間とともに増加する可能性がある。もし2023年12月31日までに、ギブソン博士が持っているすべての交換可能な株式奨励が完全に帰属し、行使し、B類普通株に交換した場合、ギブソン博士とその付属会社は約を保有する26会社流通株投票権の%です。したがって、ジブソン博士は、取締役会を選挙することを含む、再帰的株主の承認を必要とする任意の行動に重大な影響を与えることができ、会社の登録証明書および定款の改正によって、任意の合併、合併、売却会社のすべてまたはほとんどの資産または他の重大な会社取引を承認することができる。
注:9共同開発契約
ロー氏と遺伝子テーク
説明する
Recursionは2021年12月、ロ氏と遺伝子テーク(総称して羅氏と呼ぶ)と協力および許可協定を締結した。再帰社は同社のイメージング技術と独自の機械学習アルゴリズムを用いて,胃腸癌適応と神経科学の重要な領域で治療的小分子プログラムを発見·開発することを目的とした特定の細胞環境における摂動表現型間の推定関係の独自の地図を構築している。羅氏社とRecursion社は協力し、Phenommapから生成された小分子や標的に関するいくつかの新しい推論を選択し、協力計画としてさらなる検証と最適化を行う。ロ氏と再帰帰還は,ロ氏の配列決定データセットと再帰的事象図を結合し,新たなアルゴリズムを連携して生成し,マルチモーダル図を生成し,その中からより多くの連携計画を起動することができる.潜在的治療用小分子または確認標的を成功的に識別する各協力計画について、羅氏は、このような潜在的治療用小分子を開発および商業化するために、または適用可能な独自の領域でそのような標的を開発および商業化するために、独占的許可証を得る権利があるであろう。
定価
2022年1月Recursionは$を受け取りました150.0会社と羅氏の協力から得られた100万払戻不可能な前金。再帰的には、協調の業績進行に応じて追加のマイルストーン支払いを得る資格がある。羅氏が要求し、Recursionによって作成された各事象図は、起動料、受信料、または両方を支払う必要がある可能性がある。このような費用は$を超えるかもしれません250.0100万ドルを使って16見かけ上のスタンプを受け取っていますまた,羅氏が何らかの事象地図を受け取ってからしばらくの間,羅氏は使用料を支払う場合には,これらの事象地図の作成過程で生成された原画像を連携以外に使用する権利を得る権利がある.もし羅氏がすべての人に対して外部使用選択権を行使すれば12条件を満たすPhenommap,羅氏がRecursionに支払う関連行費は$を超える可能性がある250.0百万ドルです。協力によって羅氏は最も多くのことを始めるかもしれない40プロジェクトは、開発と商業化に成功すれば、各プロジェクトは$を超えることができます300.0Recursionの開発,商業化と純収入マイルストーン,および純収入への階層的特許権使用料である
会計計算
本プロトコルは、クライアントとの取引を表すので、ASC 606に従って入金されなければならない。再帰はすでに確定しています三つ義務を果たす1つは消化管癌と二つ神経科学の面ではこれらの業績義務は羅氏に研究開発サービスを提供し、標的と薬物を確定することである。義務を履行することはまた知的財産権に関連した潜在的な許可を含む。同社は,契約中のライセンスは研究開発サービスと変わらず,研究開発サービスが潜在ライセンスに与える影響が大きいため,相互に関連していると結論している。いかなる追加サービスも顧客選択とみなされ、会計目的のために別個の契約とみなされる。
同社は取引価格を$と決定しました150.0プリペイドが含まれた初期履行義務のための百万ドル。再帰は、発展段階と、各マイルストーンを達成するために必要な残りの発展との関連リスクを考慮して、潜在的マイルストーンから受信される可変対価格の数を完全に制限する。再帰的に各報告期間で取引価格が再評価されるだろう
取引価格は、期待コストプラス利益法を用いて決定された各履行債務の推定相対独立販売価格に基づいて履行債務に割り当てられる。時間の経過とともに、同社は、研究·開発サービスの実行予想総コストに対して発生したコストに基づいて収入を確認した。この方法を再帰的に決定することは、制御権をクライアントに転送するプロセスを実際に説明する。このような収入確認の方法は,履行義務を提供するために必要なサービスの総コストを会社に見積もることを求めている。総コストを決定するための重要な入力には、必要な時間長、会社員が実行するサービス時間、および材料コストが含まれる。これらの推定数の大きな変化は、今後の期間中に確認された収入の時間や金額に大きな影響を与える可能性がある。2026年までに履行義務を達成することを再帰的に見積もる。
バイエル株式会社
説明する
2020年8月,当社はバイエル株式会社(バイエル)と研究協力と選択協定(バイエル協定)を締結し,この合意に基づき,当社とバイエルは複数の臓器システム(肺,肝臓,心臓を含む)の線維化に関する研究プロジェクトを開始した。協定によると、同社はその専門バンク中の化合物に貢献し、バイエルはその専門バンク中の化合物に貢献し、協力過程全体で科学専門知識に貢献した。同社はバイエルと協力し、潜在的な開発候補を決定した。協定によると、バイエルは潜在候補者に許可証を発行する第一選択権を持っている
定価
2020年10月に同社はドルを受け取りました30.0700万ドルで、前金は返金されません。すべてのこのような許可証は、会社へのオプション使用料と開発と商業マイルストーンの支払いを招く可能性があり、総価値は約$に達する100.02000万ドル(手がかりシリーズ用オプション)または最高約$120.02000万ドル(開発候補のオプション)、および各ライセンスの階層的特許使用料は、ビジネスの成功に依存して、売上の下位から中央のビット数パーセントまでの範囲である。
会計計算
その会社はすでに1つは合意で定められた履行義務,すなわちバイエルに研究開発サービスを提供する.再帰的に取引価格を$に決定する30.01000万ドルで、その中には前金が含まれています。会社はこのお金を単一の契約履行義務に割り当てた。同社は履行義務達成の進捗状況を測ることで、時間の経過とともに収入を確認した。このような収入確認の方法は,履行義務に要求されるサービスを提供する総時間を会社に見積もることを求めている.2021年12月31日までの1年間に、本協定にサービスを提供するコストはわずかであり、総合経営報告書の“研究·開発”に盛り込まれている。2023年にその履行義務サービスを完了することを再帰的に行う。
追加収入開示
両顧客からの収入は総収入の10%を超えており、この2つの顧客は主にRecursionの2023年12月31日と2022年12月31日までの年間の全運営収入を代表している。1つの顧客の収入は総収入の10%を超え、この顧客は2021年12月31日までの年間のRecursionの全運営収入を代表している
2023年12月31日までの年度確認収入には、主に2022年12月31日までの未稼ぎ収入残高が含まれている。2022年12月31日までの年間で確認された収入は10.02021年12月31日現在、100万ドルは未稼ぎ収入残高に計上されている。確認された収入は、関連契約開始時に受け取った前金からであり、これは最初に確認された未稼ぎ収入を減少させた。2023年12月31日現在、同社は9.8“その他の流動資産”内で連結貸借対照表上の契約を履行することによる百万コスト
未収益は、連結貸借対照表において、今後 12 ヶ月間に計上される収益の見積もりに基づいて、短期および長期に分類されました。
注10株に基づく報酬
2021 年 4 月、取締役会および株主により、 2021 年株式インセンティブ · プラン ( 以下「 2021 年計画」 ) を採択しました。2021 年の計画では、 16.2 100 万株のクラス A 普通株が予約されました。さらに、前回の 2016 年計画におけるすべての優秀賞に対して株式を予約しました。当社は、株式オプション、制限付き株式単位、株式増価権、制限付き株式報酬およびその他の株式報酬を付与することがあります。
2023年12月31日までに10.9 100 万株のクラス A 普通株式が付与可能でした。
連結営業計算書における従業員および非従業員の株式報酬費用の分類は、次の表で示します。
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2023 | 2022 | 2021 |
収入コスト | $ | 5,326 | | $ | 2,755 | | $ | — | |
| 研究 · 開発 | 21,992 | | 10,065 | | 4,841 | |
| 一般と行政 | 24,361 | | 14,052 | | 8,989 | |
| 総額 | $ | 51,679 | | $ | 26,872 | | $ | 13,830 | |
株式オプション
ストックオプションは、主に会社の経営陣に付与されます。 4 年遅くとも失効する 10授与の日から数年2023 年 12 月 31 日期におけるストックオプションの活動は以下の通りでした。
| | | | | | | | | | | | | | |
(in株式および 1 株当たりの金額を除く数千 ) | 株価.株価 | 加重平均運動 値段 | 加重平均残存契約年数 ( 年 ) | 骨材 固有の 価値がある |
| 2022年12月31日現在の未返済債務 | 16,154,924 | | $ | 5.10 | | 7.5 | $ | 67,997 | |
| 授与する | 5,083,268 | | 6.23 | | | |
| キャンセルします | (1,460,517) | | 8.67 | | | |
| 鍛えられた | (4,820,058) | | 2.20 | | | 32,621 | |
| 2023年12月31日現在の未返済債務 | 14,957,617 | | $ | 6.13 | | 7.0 | $ | 72,416 | |
| 2023年12月31日から行使可能 | 9,844,841 | | $ | 5.07 | | 6.3 | $ | 59,144 | |
従業員に付与されたオプションの公正価値は、ブラック · スコーズオプション評価モデルを使用して付与日に計算されます。2023 年 12 月 31 日、 2022 年および 2021 年に付与されたストック · オプションの加重平均付与日の公正価値は、 $5.64, $6.57そして$7.66それぞれ。
ストックオプションの付与日の公正価値の算出には、以下の加重平均を仮定しました。
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| | 2023 | 2022 | 2021 |
予想期限(年単位) | 5.8 | 6.2 | 6.3 |
予想ボラティリティ | 66 | % | 63 | % | 65 | % |
期待配当収益率 | — | | — | | — | |
リスクフリー金利 | 3.6 | % | 1.9 | % | 1.1 | % |
2023年12月31日までにドル32.6ストックオプションに関連する未計上補償費用 100 万ドルは、約次の期間にわたって費用として認識される見込みです。 2年..
RSU
従業員に付与される株式報酬は主に RSU で構成され、一般的に 4 年. RSU の付与日の加重平均公正価値は、一般的に、付与されたユニット数と、付与日の Recursion の普通株式の上場価格に基づいて決定されます。
以下の表は、 2023 年 12 月 31 日に終了した年度における Recursion の RSU の活動をまとめたものです。
| | | | | | | | |
| 在庫単位 | 加重平均は日公正価値を付与する |
| 2022年12月31日現在の未返済債務 | 6,894,525 | $ | 8.17 | |
| 授与する | 14,332,216 | 8.61 |
| 既得 | (3,385,863) | 8.52 |
| 没収される | (2,617,114) | 8.29 |
| 2023年12月31日現在の未返済債務 | 15,223,764 | $ | 8.39 | |
RSU の公正市場価値は $26.92023 年 12 月 31 日に終了した年度の 100 万人。2023 年 12 月 31 日現在、119.5RSU に関する未認識補償費用の 100 万ドルは、約次の年にわたって費用として認識される見込みです。 3年.
注11従業員福祉計画
当社は、適格な従業員に対して特定拠出給付制度を維持します。プランでは、一般的に従業員は報酬の特定の割合まで拠出することができます。当社は一般的に貢献しています 4従業員基本給与の% ( マッチング ) 100最初の割合は4各従業員が拠出する年間基本給与の% 。また、当社は、その年度中に当社に勤務した従業員に対して、定額拠出制度に拠出します。雇用主費用は $3.8百万、$3.6百万ドルとドル2.1 2023 年 12 月 31 日、 2022 年 12 月 31 日、 2021 年 12 月 31 日
注12所得税
所得税の引当金は、以下の構成要素で構成されています ( すべて延期 ) 。
| | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| *(単位:千) | 2023 | 2022 | 2021 |
| 連邦制 | $ | (82,707) | | $ | (61,225) | | $ | (47,138) | |
| 状態.状態 | (54,634) | | (3,188) | | 684 |
| 外国 | (4,564) | | (471) | | (149) | |
| 評価免除額を変更する | 137,843 | | 64,884 | | 46,603 | |
| 税金優遇措置総額 | $ | (4,062) | | $ | — | | $ | — | |
当社の実際の税率は12023 年 12 月 31 日に終了した年度の% と 02022 年 12 月 31 日および 2021 年 12 月 31 日までの年度の% は、米国法定連邦金利とは以下のように異なります。
| | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| | 2023 | 2022 | 2021 |
| 法定税率 | 21.0 | % | 21.0 | % | 21.0 | % |
| R & D クレジット創出 | 3.1 | % | 3.7 | % | 3.2 | % |
| 孤児薬物クレジット創出 | 2.1 | % | 1.1 | % | 1.1 | % |
| 州税 | 16.4 | % | — | % | — | % |
| 株に基づく報酬 | (0.1) | % | 0.8 | % | 0.6 | % |
| 不確定税収状況 | (0.8) | % | (0.3) | % | (0.4) | % |
| 他にも | 1.0 | % | (0.8) | % | (0.2) | % |
| 評価免除額を変更する | (41.5) | % | (25.5) | % | (25.3) | % |
| 実際の税率 | 1.2 | % | — | % | — | % |
繰延税金資産と負債の重要な構成要素は以下のとおりである
| | | | | | | | |
| | 十二月三十一日 |
| *(単位:千) | 2023 | 2022 |
| 繰延税金資産 | | |
| 純営業損失が繰り越す | $ | 117,877 | | $ | 89,951 | |
| 研究と開発資本化 | 105,503 | | 39,095 | |
| 税金の繰り越しを免除する | 50,293 | | 30,965 | |
| 未収入を稼ぐ | 23,007 | | — | |
| リース負債 | 13,208 | | 11,442 | |
| 準備金と課税項目 | 4,744 | | 3,622 | |
| 株に基づく報酬 | 5,080 | | 2,231 | |
| 確定無形物 | — | | 969 | |
| 他にも | 485 | | 433 | |
| 繰延税項目総資産 | 320,197 | | 178,708 | |
| 推定免税額 | (304,618) | | (166,775) | |
| 繰延税項目純資産 | 15,579 | | 11,933 | |
| 繰延税金負債 | | |
| 使用権資産 | (8,942) | | (9,982) | |
| 確定無形物 | (5,272) | | — | |
| 減価償却可能資産 | (2,704) | | (1,951) | |
| 繰延税金負債 | (16,918) | | (11,933) | |
| 繰延税金純負債 | $ | (1,339) | | $ | — | |
当社の所得税引当金の決定、繰延税金資産に対する評価手当の計上、および当社の不確実な税務ポジションの評価には、重要な判断が必要です。当社は、設立以来の純損失および繰延税金資産の実現の不確実性により、純繰延税金資産ポジションのすべての事業体に対して完全な評価引当金を有しています。当社は、当社が正の利益を生み出し、かつ、合理的な確実性をもって、継続的に正の利益を生み出すと予想される範囲において、今後、評価引当金の全部または一部を放出することがあります。このリリースにより、当社の繰延税金資産の全部、または一部が計上され、そのリリースが行われる期間の所得税費用が減少します。2023 年 12 月 31 日および 2022 年 12 月 31 日現在、同社の評価手当は $304.6百万ドルとドル166.8それぞれ100万ドルで約ドル増加しました137.8百万ドルとドル64.72023年12月31日と2022年12月31日までの年間で、それぞれ100万ドル
純営業損失(NOL)及び税項相殺繰越はアメリカ国税局(“IRS”)の審査及び調整を受ける必要があり、過去の所有権変更或いは改正された国税法第382節及び類似の国家条文により後日発生する可能性のある所有権変更によって年間制限を受ける可能性がある。これらの所有権の変化は、将来の課税所得額を相殺するために毎年使用できる繰越金額を制限する可能性がある。一般に、第382条の定義によれば、所有権変更とは、3年以内にある株主又は公衆団体の会社株における所有権を50%以上増加させた取引の結果をいう。当社は設立以来所有権変更が発生したかどうか、あるいは複数回の所有権変更が発生したかどうかを評価する研究を行っている。当社が設立以来の任意の時間に所有権変更(第382条で定義されている)を経験した場合、繰り越しの純営業損失又は研究開発税収繰越の使用は、まず所有権変更時に会社株の価値に適用される長期免税率を乗じて決定され、必要に応じて追加調整される第382条に規定される年次制限を受ける。いかなる制限も繰越の一部の純営業損失や研究開発税収相殺が使用前に満期になる可能性がある。しかも、ある研究が完了して制限があることを知るまで、不確定な税金状況として記載されていない額はない
同社の連邦NOL繰越金額は2023年12月31日、2023年12月31日現在、$となっている412.0百万ドルとドル414.4課税所得を減らすために100万ドルがあります#ドル18.62036年から100万ドルが満期になります393.4百万ドルは期限が切れません。同社の国NOL繰越金額は$398.6百万ドルとドル61.5百万人まで
それぞれ2023年12月31日と2022年12月31日に、将来の国の課税所得額を削減するために使用することができます334.02031年から100万ドルが満期になります64.6百万ドルは期限が切れません。同社の海外でのNOL繰越額は$19.52023年12月31日現在、将来の外国課税収入の100万ドル削減に利用可能であり、これらの収入は2032年に満期となる
2023年12月31日現在、同社は連邦と州の研究開発信用繰越$を持っている30.3百万ドルとドル6.9それぞれ百万ドルです。2022年12月31日現在、会社は連邦と州の研究開発信用繰越金額を持っています$21.3百万ドルとドル5.6それぞれ100万ドルです連邦研究開発信用繰越は2036年から満期になり、州信用繰越は2030年から満期になる。同社は連邦孤児薬物信用限度額を持っている$17.9百万ドルとドル6.8それぞれ2023年12月31日と2022年12月31日まで、2039年に満期が始まる。
繰越免除の不確定税収状況に対する準備金は以下のとおりである
| | | | | | | | |
| 十二月三十一日 |
| *(単位:千) | 2023 | 2022 |
| 期初残高 | $ | 2,762 | | $ | 1,944 | |
| 今年度はポストが増える | 1,726 | | 818 | |
| 前年度はポストが増えた | 929 | | — | |
| 期末残高 | $ | 5,417 | | $ | 2,762 | |
当社は税務頭寸の利益を確定していないことを確認し、当該等頭寸が審査を経てその技術的価値のみに基づいて維持される可能性があれば、当該頭寸は最終決済時に顕在化する可能性のある最大金額利益である。同社の政策は、所得税に関する罰金や利息支出を他の収入(損失)の構成要素とし、必要に応じて純額を計上することである
同社はアメリカ、カナダ、イギリス、ユタ州、カリフォルニア州、マサチューセッツ州で所得税申告書を提出した。同社は現在、上記のいずれの管轄区でも審査を受けていない。2016年の納税申告書以来、当社はすべての連邦申告書に対して所得税審査を行わなければなりません。
注131株当たり純損失
Recursionは,2023年,2022年,2021年12月31日までの年度に,A類,B類,交換可能普通株の1株当たり純損失を2種類の方法で計算した。1株あたりの基本純損失は,期間中の発行済み株式の加重平均を用いて計算される.1株当たりの純損失は加重平均株式数と期間内の潜在的希薄化証券の影響を用いて計算した。潜在的希薄化証券は株式オプションと他のまたは発行された株を含む。当社が純損失を報告している期間内には、潜在的に薄くなっている株はすべて逆になっているため、計算には含まれていません。2023年,2022年,2021年12月31日までの年度では,会社は純損失を報告しているため,1株当たりの基本損失は希釈後の損失と同じである。
会社A類、B類、交換可能普通株式保有者の権利は、清算権と配当権を含み、交換可能普通株と同じだが、投票権は除外される。したがって、期間毎の未分配収益は、その期間の収益が割り当てられているように、A類普通株とB類普通株および交換可能普通株の契約参加権に基づいて割り当てられる。清算権と配当権が同じであるため,未分配収益は比例して分配され,2023年12月31日,2022年と2021年12月31日までの年度で,A類,B類と交換可能普通株の1株当たり収益額は同じである
以下の表に2023年、2022年と2021年のA類、B類と交換可能普通株の基本と希釈後の1株当たり純損失の計算方法を示す
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
(in数千人 株価を除く) | 2023 | 2022 | 2021 |
| 分子: | | | |
| 純損失 | (328,066) | | (239,476) | | (186,479) | |
| 分母: | | | |
| 加重平均普通株式発行済み | 207,853,702 | | 175,537,487 | | 125,348,110 | |
| 1株当たり基本と希釈して純損失 | $ | (1.58) | | $ | (1.36) | | $ | (1.49) | |
当社は、下記の潜在普通株式を含めると希釈効果を抑制するため、当該期間における 1 株当たり希釈純損失の計算から除外しました。
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| | 2023 | 2022 | 2021 |
| 株に基づく報酬 | 9,848,141 | | 10,966,651 | | 15,381,210 | |
| タンプス協定 | 1,073,834 | | — | | — | |
| 転換可能優先株 | — | | — | | 34,615,890 | |
| 株式承認証 | — | | — | | 151,745 | |
| 総額 | 10,921,975 | | 10,966,651 | | 50,148,845 | |
注14公正価値計量
公正価値階層構造は以下の3つの階層からなる:
•レベル 1— 会社がアクセスできる同一資産について、アクティブ市場における未調整のクォート価格に基づく評価。
•レベル 2— アクティブ市場における類似商品のクォート価格、アクティブでない市場における同一または類似商品のクォート価格、および市場においてすべての重要なインプットが観察可能なモデルベースの評価に基づく評価。
•レベル 3— 市場では観察できない重要なインプットを使用した評価であり、市場参加者が資産または負債の価格設定に使用する仮定に関する会社の経営陣による判断の使用を含む。
以下の表は、公正価値で定期的に計量される当社の資産と負債をまとめたものです。
| | | | | | | | | | | | | | |
| | 公正価値計量基礎 |
| (単位:千) | 2023年12月31日 | レベル一 | レベル 2 | レベル 3 |
| 資産 | | | | |
| 現金等価物: | | | | |
| 貨幣市場基金 | $ | 322,653 | | $ | 322,653 | | $ | — | | $ | — | |
| 制限現金 | 9,860 | | 9,860 | | — | | — | |
| 総資産 | $ | 332,513 | | $ | 332,513 | | $ | — | | $ | — | |
| | | | | | | | | | | | | | |
| | 公正価値計量基礎 |
| (単位:千) | 2022年12月31日 | レベル一 | レベル 2 | レベル 3 |
| 資産 | | | | |
| 現金等価物: | | | | |
| 貨幣市場基金 | $ | 404,613 | | $ | 404,613 | | $ | — | | $ | — | |
| 制限現金 | 9,200 | | 9,200 | | — | | — | |
| 総資産 | $ | 413,813 | | $ | 413,813 | | $ | — | | $ | — | |
連結貸借対照表において適正価額で計上されている金融商品のほか、当社は、償却原価または適正価額以外の基準で計上されている金融商品を有しています。これらの商品の繰り越し金額は、その近似公正価値を表すものとみなされます。
以下の表は、公正価値で計量されていない当社金融商品をまとめたものです。
| | | | | | | | | | | | | | | | | |
| 書籍の価値 | | 公正価値 |
| (単位:千) | 2023年12月31日 | 2022年12月31日 | | 2023年12月31日 | 2022年12月31日 |
| 負債.負債 | | | | | |
| 支払手形の当期分 | $ | 41 | | $ | 97 | | | $ | 41 | | $ | 97 | |
| 支払手形,当期分を差し引く | 1,101 | | 536 | | | 1,101 | | 536 | |
| 負債総額 | $ | 1,142 | | $ | 633 | | | $ | 1,142 | | $ | 633 | |
注15後続事件
2024 年 1 月、当社はオフィススペースのリースを約 6,7922平方フィート(“ロンドンレンタル”)。ロンドンのレンタル期間は5年それは.賃貸契約には賃貸料支払いを段階的に増加させる条項が含まれている。固定賃貸支払い総額は約#ドルと予想される7.9百万ドルです。しかも可変費用があります。レンタル関連の建築サービス料が含まれています。
第9項.会計士との変更と食い違い
ない。
第9条。制御とプログラムです
当社は、取引法に基づいて当社が提出又は提出した報告書に開示すべき情報が、米国証券取引委員会規則及び表で指定された期間内に記録、処理、まとめ及び報告され、最高経営者(私たちの最高経営責任者)及び最高財務官(私たちの最高財務官)を含む管理層に蓄積及び伝達されるために、1934年に改正された証券取引法(取引法)第13 a-15(E)及び15 d-15(E)規則によって定義された開示制御及び手続を確立している。また、開示制御およびプログラムの設計は、管理層に、そのコストに対する可能な制御およびプログラムの利益を評価する際に判断することが要求されるリソース制限が存在するという事実を反映しなければならない。
情報開示制御とプログラムの評価
我々の経営陣は、CEOと財務官の参加の下、本報告で述べた期間終了までの開示制御及び手順(“取引所法”第13 a−15(E)及び15 d−15(E)条に定義されている)の有効性を評価した。管理者は、管理者がその判断を用いて、可能な制御とプログラムのコスト-利益関係を評価しなければならないので、どのような制御およびプログラムがどんなに設計および動作が良好であっても、予想される制御目標を達成するために合理的な保証を提供することしかできないことを認識している。私たちの開示統制と手続きはその目標を達成するための合理的な保証を提供することを目的としている。この評価に基づき、私たちの最高経営責任者と最高財務責任者は、2023年12月31日現在、私たちの収入と未稼ぎ収入プロセスに関連する内部統制に大きな弱点があるため、私たちの開示統制と手続きは無効であると結論した。この重大な欠陥にもかかわらず、経営陣は、本報告に含まれる総合財務諸表が、本報告でカバーされている期間の財務状況、運営結果、現金流量をすべての重要な面で公平に反映していると結論し、我々の外部監査人は、2023年12月31日までの年度および2023年12月31日までの総合財務諸表について無保留意見を発表した
経営陣財務報告内部統制年次報告書
我々の経営陣は、財務報告書の十分な内部統制を確立·維持する責任がある(取引法第13 a-15条(F)条で定義されている)。我々の財務報告に対する内部統制は、財務報告の信頼性と米国公認会計原則(米国公認会計原則)に基づいて外部目的の財務諸表の作成に合理的な保証を提供することを目的としている。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来の間にどのような有効性評価を行うかの予測には,条件の変化により制御が不十分になる可能性や,政策遵守の程度が悪化する可能性があるというリスクがある.
経営陣は、2023年12月31日までの財務報告内部統制の有効性を評価した。この評価を行う際には、経営陣は、テレデビル委員会後援組織委員会が発表した“内部統制--総合枠組み(2013年)”の枠組みを使用した。2023年に買収した企業を、2023年12月31日の連結財務諸表に含まれる財務報告書の内部統制の有効性の評価から除外しました。2023年12月31日までの年度の総資産、総負債、総純損失はそれぞれRecursion社の総合財務諸表の14%、3%、4%を占めている。“内部統制-統合フレームワーク(2013)”の枠組みでの評価によると、経営陣は、財務報告の内部統制に大きな弱点があることを発見し、推定コストおよび完了時間の管理審査制御、およびエンティティ(IPE)によって生成された情報の完全性および正確性を検証するための制御に関し、2023年12月31日までのライセンス契約に関連する収入および収入を計算するために使用される。これは私たちが以前に報告された財政的業績を修正しなかったことを招く
安永会計士事務所は独立公認会計士事務所であり、2023年12月31日までの財務報告書の内部統制に対する有効性を監査し、本報告の第2部第8項“財務諸表及び補足データ”に含まれる報告書に記載されている不利な報告書を発表した
物質的欠陥の救済
以上のように、我々が2023年12月31日までの年次財務諸表を監査したところ、収入や未稼ぎ収入の流れに関する制御不力に関する大きな弱点が発見された。財務報告書の内部統制の実質的な弱点を全面的に整備する。私たちはこの重大な弱点をもたらすすべての問題を明らかにし、救済計画を立てている。
財務報告の内部統制の変化
経営陣は、統合計画活動の一環として、2023年12月31日現在、買収された業務の内部統制をRecursionの既存業務に統合している。2023年12月31日までの年度内に、上述した重大な弱点が発見された以外に、他の財務報告変動はない(“取引法”第13 a-15(F)及び15 d-15(F)条参照)は、当社の財務報告内部統制に重大な影響を与えるか、または合理的に重大な影響を与える可能性がある。
プロジェクト9 Bその他の情報.
開ける2023年12月27日, クリストファー·ギブソン, CEO兼取締役会のメンバー, 通過するルール10 b 5-1の取引スケジュールは、ルール10 b 5-1(C)対販売が最も多いことを目的としている620,0152025年3月6日現在、会社A類普通株の株式。
プロジェクト9 Cです。検査を妨害する外国司法管轄区域を開示する。
該当しない。
第三部
プロジェクト10.取締役、行政、企業管理
本プロジェクトに要求される情報はここに組み込まれ,2024年株主総会に関する依頼書に含まれる情報を参考にして,我々の財政年度終了後120日以内に証券取引委員会にこの声明を提出する予定である
第11項.行政職報酬
本プロジェクトに要求される情報はここに組み込まれ,2024年株主総会に関する依頼書に含まれる情報を参考にして,我々の財政年度終了後120日以内に証券取引委員会にこの声明を提出する予定である
第12項:特定の実益所有者の保証所有権及び管理職及び関連株主事項。
本プロジェクトに要求される情報はここに組み込まれ,2024年株主総会に関する依頼書に含まれる情報を参考にして,我々の財政年度終了後120日以内に米国証券取引委員会にこの声明を提出する予定である
第十三条特定関係及び関連取引及び取締役独立性。
本プロジェクトに要求される情報はここに組み込まれ,2024年株主総会に関する依頼書に含まれる情報を参考にして,我々の財政年度終了後120日以内に証券取引委員会にこの声明を提出する予定である
プロジェクト14.チーフ会計士費用とサービス
当社の独立した公認会計事務所は、 Ernst & Young LLP 、ソルトレイクシティ、ユタ州、 PCAOB 監査人 ID 000 です。42.
本プロジェクトに要求される情報はここに組み込まれ,2024年株主総会に関する依頼書に含まれる情報を参考にして,我々の財政年度終了後120日以内に証券取引委員会にこの声明を提出する予定である
第4部
プロジェクト15.証拠品および財務諸表の添付表
(a)このフォーム 10—K の一部として提出された文書。
(1)財務諸表: 財務諸表のリストは、第 8 号「財務諸表及び補足資料」を参照してください。
(2)財務諸表のスケジュール :省略されたすべてのスケジュールは適用できません。または、必要な情報は連結財務諸表またはその注記に記載されています。
(3)規制 S—K の第 601 項で要求される書類 : このパラグラフで要求される情報は、以下の第 15 項 ( b ) に記載されています。
(b)展示インデックス :
| | | | | | | | | | | | | | | | | | | | |
| | 引用で編入する |
| 展示品番号 | 説明する | 表 | 書類番号. | 証拠品番号: | 提出日 | 同封のアーカイブ/提供 |
| 3.1 | 株式会社リカシオン製薬株式会社の設立証明書の修正 · 改定 | 8-K | 001-40323 | 3.1 | 2021年4月21日 | |
| 3.2 | 株式会社リカレッション医薬品の定款の改正 · 改定について | 8-K | 001-40323 | 3.1 | 2024年1月31日 | |
| 4.1 | 標本クラス A 登録者の普通株式証明書。 | S-1/A | 333-254576 | 4.2 | 2021年4月15日 | |
| 4.2 | 証券説明。 | | | | | X |
| 4.3 | 2023 年 5 月 8 日付の交換可能株式支援契約。 | S-3 ASR | 333-272281 | 4.2 | 2023年5月30日 | |
| 4.4 | 当社と購入者との間の 2022 年 10 月 24 日付の登録権利契約。 | 8-K | 001-40323 | 10.2 | 2022 年 10 月 25 日 | |
| 4.5 | 2023 年 5 月 16 日付の登録契約書、登録者 Valence Discovery , Inc. による登録契約書、Valence Discovery , Inc. の特定の株主 | S-3 ASR | 333-272281 | 4.3 | 2023年5月30日 | |
| 4.6 | 2023 年 5 月 25 日付の登録契約書、登録者による、 Recursion Canada Inc. 、Cyclica Inc. の特定の株主 | 8-K | 001-40323 | 4.1 | 2023年6月9日 | |
| 4.7 | 2023 年 7 月 11 日付の登録者および NVIDIA 間の登録権利契約。 | 8-K | 001-40323 | 10.2 | 2023年7月12日 | |
| 10.1 | 登録者とその各役員と行政者との間の賠償協定フォーマット。 | S-1/A | 333-254576 | 10.1 | 2021年4月15日 | |
| 10.2+ | 2016 年度株式インセンティブプラン ( 修正版 ) 及びその下での契約形態。 | S-1/A | 333-254576 | 10.2 | 2021年4月15日 | |
| 10.3+ | 2021 年のエクイティ · インセンティブ · プランとその契約形態。 | 10-K | 001-40323 | 10.3 | 2023年2月27日 | |
| 10.4+ | 2021 年の従業員株式購入計画とその契約形態。 | S-1/A | 333-254576 | 10.4 | 2021年4月15日 | |
| 10.5 | 株式会社サイクリカ第 2 回株式オプション計画修正および再修正。 | S-8 | 333-272282 | 4.4 | 2023年5月30日 | |
| 10.6 | ヴァレンスディスカバリー株式会社2018 年 4 月 17 日付のストック · オプション · プランは、 2021 年 11 月 16 日に修正され、改定されました。 | S-8 | 333-272027 | 4.4 | 2023年5月18日 | |
| 10.7 | 役員は報酬計画を奨励する。 | S-1/A | 333-254576 | 10.20 | 2021年4月15日 | |
| 10.8+ | CEO の統制 · 解雇方針の変更 | S-1/A | 333-254576 | 10.21 | 2021年4月15日 | |
| 10.9+ | 管理 · 解雇計画における役員変更 ( CEO 以外の役員 ) 。 | S-1/A | 333-254576 | 10.10 | 2021年4月15日 | |
| 10.10+ | 役員報酬政策外。 | S-1/A | 333-254576 | 10.11 | 2021年4月15日 | |
| 10.11+ | 登録者とクリストファー · ギブソン博士との間の雇用確認書。 | S-1/A | 333-254576 | 10.5 | 2021年4月15日 | |
| 10.12+ | 登録者とティナ · マリオット · ラーソンとの間の雇用確認書。 | S-1/A | 333-254576 | 10.7 | 2021年4月15日 | |
| | | | | | | | | | | | | | | | | | | | |
| 10.13+ | 登録者と Michael Secora の間の雇用確認書。 | S-1/A | 333-254576 | 10.8 | 2021年4月15日 | |
| 10.14+ | 雇用オファーレター , 日付 5 月 19,2023 , 登録者と博士 David Mauro , M. D. ,Ph. D. | 10-Q | 001-40323 | 10.1 | 2023年8月8日 | |
| 10.15+ | 登録者と Shafique Virani の間の雇用確認書。 | S-1/A | 333-254576 | 10.9 | 2021年4月15日 | |
| 10.16+ | 登録者間の交換契約のフォーム, クリストファーギブソン, Ph. D.,ギブソン博士と関係する団体。 | S-1/A | 333-254576 | 10.22 | 2021年4月15日 | |
| 10.17+ | 登録者間の株式交換権協定の形式、クリストファー · ギブソン、 Ph. D. 、ギブソン博士と関係する団体。 | S-1/A | 333-254576 | 10.23 | 2021年4月15日 | |
| 10.18 | Vestar Gateway , LLC と登録者との間のオフィスリース、 2017 年 11 月 13 日付、 2022 年 12 月まで修正。 | 10-K | 001-40323 | 10.8 | 2023年2月27日 | |
| 10.19# | バイエル AG と登録者との間の研究協力およびオプション契約 ( 2020 年 8 月 28 日付 ) 。 | S-1/A | 333-254576 | 10.14 | 2021年4月15日 | |
| 10.20# | 2021 年 12 月 1 日付のバイエル協力拡大契約。 | 10-K | 001-40323 | 10.11 | 2022 年 3 月 23 日 | |
| 10.21# | バイエル AG と登録者との間の研究協力およびオプション契約の修正および改定 ( 2023 年 11 月 8 日付 ) 。 | | | | | X |
| 10.22# | 登録者とユタ大学研究財団との間のライセンス契約を修正し、 2016 年 2 月 9 日付。 | S-1/A | 333-254576 | 10.15 | 2021年4月15日 | |
| 10.23# | オハイオ州立イノベーション財団と登録者との間の排他的ライセンス契約、 2018 年 12 月 21 日付。 | S-1/A | 333-254576 | 10.16 | 2021年4月15日 | |
| 10.24# | 2020 年 5 月 1 日付の、武田製薬株式会社と登録者との間のライセンス契約。 | S-1/A | 333-254576 | 10.17 | 2021年4月15日 | |
| 10.25# | 2021 年 12 月 5 日付のロシュ協力ライセンス契約。 | 10-K | 001-40323 | 10.25 | 2022 年 3 月 23 日 | |
| 10.26# | 2023 年 11 月 3 日付の当社と Tempus Labs , Inc. とのマスターアグリーメント。 | 10-Q | 001-40323 | 10.4 | 2023年11月9日 | |
| 10.27^ | 当社と購入者との間で、 2022 年 10 月 24 日付の株式購入契約。 | 8-K | 001-40323 | 10.1 | 2022 年 10 月 25 日 | |
| 10.28^ | 2023 年 7 月 11 日付の登録者と NVIDIA 間の株式購入契約。 | 8-K | 001-40323 | 10.1 | 2023年7月12日 | |
| 10.29^ | 登録者と Jefferies LLC による 2023 年 8 月 8 日付の公開市場販売契約. | 10-Q | 001-40323 | 10.6 | 2023年8月8日 | |
| 21.1 | 子会社リスト。 | | | | | X |
| 23.1 | エルンスト & ヤングの同意 | | | | | X |
| 24.1 | 委任状 ( Form 10—K のこの年次報告書の署名ページに含まれる ) | | | | | X |
| 31.1 | 2002年のサバンズ·オキシリー法第302節で可決された1934年の証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて発行された首席執行幹事証明書。 | | | | | X |
| 31.2 | 2002年サバンズ−オキシリー法第302節で可決された1934年証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて首席財務幹事が認証された。 | | | | | X |
| 32.1* | 18 U. S.C. に基づく最高経営責任者および最高財務責任者の認定。^ a b c d e f g h 『官報』第 1350 号、 2002 年サーベンス · オックスリー法第 906 条に基づく。. | | | | | X |
| 97.1 | 株式会社リカシオンファーマシューティカルズ補償回収方針 | | | | | X |
| 101.INS | XBRLインスタンスドキュメント | | | | | X |
| 101.書院 | XBRL分類拡張アーキテクチャドキュメント | | | | | X |
| 101.カール | XBRL分類拡張計算リンクライブラリ文書 | | | | | X |
| | | | | | | | | | | | | | | | | | | | |
| 101.def | XBRL分類拡張Linkbase文書を定義する | | | | | X |
| 101.介護会 | XBRL分類拡張タグLinkbaseドキュメント | | | | | X |
| 101.PRE | XBRL分類拡張プレゼンテーションLinkbaseドキュメント | | | | | X |
| 104 | 表紙相互データファイル(添付ファイル101に含まれるイントラネットXBRLのフォーマット) | | | | | X |
| | | | | | |
| + | 契約または補償計画を管理すること。 |
| # | 括弧とアスタリスクでマークされた展示品の一部 [***], 省略された情報は重要ではなく、 ( i ) 公に開示された場合、登録者に競争上の害を引き起こす可能性が高いため省略されているか、 ( ii ) 登録者が個人または機密として扱う情報である。 |
| ^ | 特定のスケジュールおよび展示物は、規則 S—K の項目 601 ( a ) ( 5 ) に従って省略されています。省略されたスケジュールおよび / または展示物のコピーは、要請に応じて SEC に提供されます。 |
| * | 付属書 32.1 に記載されている証明書は、フォーム 10—K のこの年次報告書に付属するものとみなされ、修正された 1934 年証券取引法第 18 条の目的のために「提出」されたものとみなされません。このような証明書は、 1933 年の証券法 ( 改正 ) または 1934 年の証券取引法 ( 改正 ) に基づく書類に参照によって組み込まれるとみなされません。 |
項目16.表格10-Kの概要
なし
サイン
1934 年証券法第 13 条または第 15 条 ( d ) の要件に基づき、 Recursion Pharmaceuticals Inc. は2024 年 2 月 29 日にユタ州ソルトレイクシティにおいて、下記の署名者によって、この報告書に署名された。
| | | | | | | | |
| 株式会社レカッション製薬株式会社 |
| |
| 投稿者: | | /s / クリストファー · ギブソン |
| | クリストファー·ギブソン |
| | 最高経営責任者 |
授権書
以下に署名された各人が、クリストファー · ギブソンおよびマイケル · セコラのそれぞれを、完全な代理権を有する、その真かつ合法的な代理人および代理人として構成し、任命することを、その名義、場所および代理人に代わって、フォーム 10—K に関するこの年次報告書のすべての修正に署名し、それを提出することを、これらの提示によって、すべての人に知ること。証券取引委員会に対し、当該代理人及び代理人に、当該代理人及び代理人に対して、上記代理人または代理人が本法に基づいて合法的に行うまたは行うことをすべて批准し確認します
本授権書の署名日は本授権書の署名日であることを証明した。
1934 年の証券法の要件に従い、この報告書は、以下の者によって、記載された能力及び日付に署名されました。
| | | | | | | | | | | | | | |
| サイン | | タイトル | | 日取り |
| | |
/s / クリストファー · ギブソン クリストファー·ギブソン | | 取締役CEO兼最高経営責任者(首席行政主任) | | 2024年2月29日 |
| | |
/ s / マイケル · セコラ マイケル · セコラ | | 首席財務官(首席財務会計官) | | 2024年2月29日 |
| | |
/S/ザクリ·ボグ ザカリー·ボグ | | ディレクター | | 2024年2月29日 |
| | |
/ s / ブレイク · ボルジェソン ブレイク · ボルジェソン | | ディレクター | | 2024年2月29日 |
| | |
/ s / テリー = アン · バレル テリー = アン · バレル | | ディレクター | | 2024年2月29日 |
| | |
/ s / R.マルティン · チャベス R 。マーティン · チャベス | | 取締役会議長 | | 2024年2月29日 |
| | |
/ s / Zavain Dar ザヴァン · ダル | | ディレクター | | 2024年2月29日 |
| | |
/ s / ロバート · ハーシュバーグ ロバート · ハーシュバーグ | | ディレクター | | 2024年2月29日 |
| | |
/ s / Dean Li 李学長 | | ディレクター | | 2024年2月29日 |