イノ —20231231誤り2023会計年度00010557260.0833330.083333Http://Fasb.org/us-GAAP/2023#Account StandardsUpdate 20 2006メンバー0.083333P 3 Y0.083333500.08333300010557262023-01-012023-12-3100010557262023-06-30ISO 4217:ドル00010557262024-03-01Xbrli:共有00010557262023-10-012023-12-3100010557262023-12-3100010557262022-12-310001055726米国-公認会計基準:非関連側メンバー2023-12-310001055726米国-公認会計基準:非関連側メンバー2022-12-310001055726米国-公認会計基準:関連側メンバー2023-12-310001055726米国-公認会計基準:関連側メンバー2022-12-31ISO 4217:ドルXbrli:共有0001055726アメリカ公認会計基準:副次的事件メンバー2024-01-242024-01-24Xbrli:純00010557262022-01-012022-12-3100010557262021-01-012021-12-310001055726アメリカ-公認会計基準:第一選択株式メンバー2020-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバー2020-12-310001055726US-GAAP:AdditionalPaidInCapitalMembers2020-12-310001055726アメリカ-公認会計基準:前払いメンバーを保留2020-12-310001055726アメリカ公認会計原則:他の総合収入メンバーを累計2020-12-3100010557262020-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバー2021-01-012021-12-310001055726US-GAAP:AdditionalPaidInCapitalMembers2021-01-012021-12-310001055726アメリカ-公認会計基準:前払いメンバーを保留2021-01-012021-12-310001055726アメリカ公認会計原則:他の総合収入メンバーを累計2021-01-012021-12-310001055726アメリカ-公認会計基準:第一選択株式メンバー2021-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバー2021-12-310001055726US-GAAP:AdditionalPaidInCapitalMembers2021-12-310001055726アメリカ-公認会計基準:前払いメンバーを保留2021-12-310001055726アメリカ公認会計原則:他の総合収入メンバーを累計2021-12-3100010557262021-12-310001055726SRT:累計調整有効期限調整メンバUS-GAAP:AdditionalPaidInCapitalMembers2021-12-310001055726アメリカ-公認会計基準:前払いメンバーを保留SRT:累計調整有効期限調整メンバ2021-12-310001055726SRT:累計調整有効期限調整メンバ2021-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-12-310001055726US-GAAP:AdditionalPaidInCapitalMembers2022-01-012022-12-310001055726アメリカ-公認会計基準:前払いメンバーを保留2022-01-012022-12-310001055726アメリカ公認会計原則:他の総合収入メンバーを累計2022-01-012022-12-310001055726アメリカ-公認会計基準:第一選択株式メンバー2022-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバー2022-12-310001055726US-GAAP:AdditionalPaidInCapitalMembers2022-12-310001055726アメリカ-公認会計基準:前払いメンバーを保留2022-12-310001055726アメリカ公認会計原則:他の総合収入メンバーを累計2022-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバー2023-01-012023-12-310001055726US-GAAP:AdditionalPaidInCapitalMembers2023-01-012023-12-310001055726アメリカ-公認会計基準:前払いメンバーを保留2023-01-012023-12-310001055726アメリカ公認会計原則:他の総合収入メンバーを累計2023-01-012023-12-310001055726アメリカ-公認会計基準:第一選択株式メンバー2023-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバー2023-12-310001055726US-GAAP:AdditionalPaidInCapitalMembers2023-12-310001055726アメリカ-公認会計基準:前払いメンバーを保留2023-12-310001055726アメリカ公認会計原則:他の総合収入メンバーを累計2023-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバーino: セールス契約メンバー2023-01-012023-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバーino: セールス契約メンバー2022-01-012022-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバーino: セールス契約メンバー2021-01-012021-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバーino: UnderwrittenPublicOffering メンバー2021-01-012021-12-31ino: segment0001055726SRT:最小メンバ数2023-12-310001055726SRT:最大メンバ数2023-12-3100010557262023-07-012023-09-300001055726ino: Bioject メンバー2023-04-012023-06-300001055726米国-公認会計基準:従業員株式オプションメンバー2023-01-012023-12-310001055726米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310001055726米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001055726ino: ServiceBasedRestrictedStockUnitsMember2023-01-012023-12-310001055726ino: ServiceBasedRestrictedStockUnitsMember2022-01-012022-12-310001055726ino: ServiceBasedRestrictedStockUnitsMember2021-01-012021-12-310001055726米国-GAAP:制限株式単位RSUメンバー2023-01-012023-12-310001055726米国-GAAP:制限株式単位RSUメンバー2022-01-012022-12-310001055726米国-GAAP:制限株式単位RSUメンバー2021-01-012021-12-310001055726米国-GAAP:転換可能な第一選択株メンバー2023-01-012023-12-310001055726米国-GAAP:転換可能な第一選択株メンバー2022-01-012022-12-310001055726米国-GAAP:転換可能な第一選択株メンバー2021-01-012021-12-310001055726ino: A6.50 コンバーチブルシニアノート期限 2024 メンバーアメリカ公認会計基準:転換可能債務証券メンバー2023-01-012023-12-310001055726ino: A6.50 コンバーチブルシニアノート期限 2024 メンバーアメリカ公認会計基準:転換可能債務証券メンバー2022-01-012022-12-310001055726ino: A6.50 コンバーチブルシニアノート期限 2024 メンバーアメリカ公認会計基準:転換可能債務証券メンバー2021-01-012021-12-310001055726ino: 従業員および取締役メンバー米国-公認会計基準:従業員株式オプションメンバー2023-01-012023-12-310001055726ino: 従業員および取締役メンバー米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310001055726ino: 従業員および取締役メンバー米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001055726ino: 非従業員メンバー米国-公認会計基準:従業員株式オプションメンバー2023-01-012023-12-310001055726ino: 非従業員メンバー米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310001055726ino: 非従業員メンバー米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001055726ino: アポロバイオコーポレーションメンバー2023-01-012023-12-310001055726米国-GAAP:顧客と契約した収入ino: アポロバイオコーポレーションメンバーUS-GAAP:顧客集中度リスクメンバー2023-01-012023-12-310001055726ino: アポロバイオコーポレーションメンバー2022-01-012022-12-310001055726米国-GAAP:顧客と契約した収入ino: アポロバイオコーポレーションメンバーUS-GAAP:顧客集中度リスクメンバー2022-01-012022-12-310001055726ino: アポロバイオコーポレーションメンバー2021-01-012021-12-310001055726米国-GAAP:顧客と契約した収入ino: アポロバイオコーポレーションメンバーUS-GAAP:顧客集中度リスクメンバー2021-01-012021-12-310001055726ino: Plumbline ライフサイエンス株式会社メンバー2023-01-012023-12-310001055726米国-GAAP:顧客と契約した収入ino: Plumbline ライフサイエンス株式会社メンバーUS-GAAP:顧客集中度リスクメンバー2023-01-012023-12-310001055726ino: Plumbline ライフサイエンス株式会社メンバー2022-01-012022-12-310001055726米国-GAAP:顧客と契約した収入ino: Plumbline ライフサイエンス株式会社メンバーUS-GAAP:顧客集中度リスクメンバー2022-01-012022-12-310001055726ino: Plumbline ライフサイエンス株式会社メンバー2021-01-012021-12-310001055726米国-GAAP:顧客と契約した収入ino: Plumbline ライフサイエンス株式会社メンバーUS-GAAP:顧客集中度リスクメンバー2021-01-012021-12-310001055726ino: DoD メンバー2023-01-012023-12-310001055726ino: DoDMember米国-GAAP:顧客と契約した収入US-GAAP:顧客集中度リスクメンバー2023-01-012023-12-310001055726ino: DoDMember2022-01-012022-12-310001055726ino: DoDMember米国-GAAP:顧客と契約した収入US-GAAP:顧客集中度リスクメンバー2022-01-012022-12-310001055726ino: DoDMember2021-01-012021-12-310001055726ino: DoDMember米国-GAAP:顧客と契約した収入US-GAAP:顧客集中度リスクメンバー2021-01-012021-12-310001055726ino: AllOtherCustomersMember2023-01-012023-12-310001055726ino: AllOtherCustomersMember米国-GAAP:顧客と契約した収入US-GAAP:顧客集中度リスクメンバー2023-01-012023-12-310001055726ino: AllOtherCustomersMember2022-01-012022-12-310001055726ino: AllOtherCustomersMember米国-GAAP:顧客と契約した収入US-GAAP:顧客集中度リスクメンバー2022-01-012022-12-310001055726ino: AllOtherCustomersMember2021-01-012021-12-310001055726ino: AllOtherCustomersMember米国-GAAP:顧客と契約した収入US-GAAP:顧客集中度リスクメンバー2021-01-012021-12-310001055726米国-GAAP:顧客と契約した収入US-GAAP:顧客集中度リスクメンバー2023-01-012023-12-310001055726米国-GAAP:顧客と契約した収入US-GAAP:顧客集中度リスクメンバー2022-01-012022-12-310001055726米国-GAAP:顧客と契約した収入US-GAAP:顧客集中度リスクメンバー2021-01-012021-12-310001055726ino: AdvaccineMemberアメリカ-公認会計基準:連携性手配メンバー2023-01-012023-12-310001055726ino: AdvaccineMemberアメリカ-公認会計基準:連携性手配メンバー2022-01-012022-12-310001055726ino: AdvaccineMemberアメリカ-公認会計基準:連携性手配メンバー2021-01-012021-12-310001055726ino: ApolloBioMemberアメリカ-公認会計基準:連携性手配メンバー2023-01-012023-12-310001055726ino: ApolloBioMemberアメリカ-公認会計基準:連携性手配メンバー2021-01-012021-12-310001055726ino: ApolloBioMemberアメリカ-公認会計基準:連携性手配メンバー2022-01-012022-12-310001055726ino: LassaFeverAndMERSVaccine メンバーアメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2018-04-012018-04-300001055726アメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2023-01-012023-12-310001055726アメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2022-01-012022-12-310001055726アメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2021-01-012021-12-310001055726ino: LassaFeverAndMERSVaccine メンバーアメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2023-12-310001055726ino: LassaFeverAndMERSVaccine メンバーアメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2022-12-310001055726ino: SARSCoV2COVID19 ワクチンメンバーアメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2020-01-012020-01-310001055726アメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2020-04-012020-04-300001055726ino: CELLECTRA3PS 専用スマートデバイスメンバーアメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2020-04-012020-04-300001055726ino: INO4800 メンバーアメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2020-04-012020-04-300001055726ino: SARSCoV2COVID19 ワクチンメンバーアメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2023-01-012023-12-310001055726ino: SARSCoV2COVID19 ワクチンメンバーアメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2022-01-012022-12-310001055726ino: SARSCoV2COVID19 ワクチンメンバーアメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2021-01-012021-12-310001055726ino: SARSCoV2COVID19 ワクチンメンバーアメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2023-12-310001055726ino: SARSCoV2COVID19 ワクチンメンバーアメリカ-公認会計基準:連携性手配メンバーino: Coalition for EpidemicPreparednessInnovations メンバー2022-12-310001055726ino: DNA エンコードモノクローナル抗体技術メンバーino: ビル & メリンダ · ゲイツ財団メンバーアメリカ-公認会計基準:連携性手配メンバー2018-10-012018-10-310001055726ino: DNA エンコードモノクローナル抗体技術メンバーino: ビル & メリンダ · ゲイツ財団メンバーアメリカ-公認会計基準:連携性手配メンバー2019-08-012019-08-300001055726ino: DNA エンコードモノクローナル抗体技術メンバーino: ビル & メリンダ · ゲイツ財団メンバーアメリカ-公認会計基準:連携性手配メンバー2023-01-012023-12-310001055726ino: DNA エンコードモノクローナル抗体技術メンバーino: ビル & メリンダ · ゲイツ財団メンバーアメリカ-公認会計基準:連携性手配メンバー2022-01-012022-12-310001055726ino: DNA エンコードモノクローナル抗体技術メンバーino: ビル & メリンダ · ゲイツ財団メンバーアメリカ-公認会計基準:連携性手配メンバー2021-01-012021-12-310001055726ino: DNA エンコードモノクローナル抗体技術メンバーino: ビル & メリンダ · ゲイツ財団メンバーアメリカ-公認会計基準:連携性手配メンバー2023-12-310001055726ino: DNA エンコードモノクローナル抗体技術メンバーino: ビル & メリンダ · ゲイツ財団メンバーアメリカ-公認会計基準:連携性手配メンバー2022-12-310001055726ino: CELLECTRA3PS 専用スマートデバイスメンバーino: DepartmentOfDefenceMemberアメリカ-公認会計基準:連携性手配メンバー2020-06-012020-06-300001055726ino: DepartmentOfDefenceMemberアメリカ-公認会計基準:連携性手配メンバー2023-01-012023-12-310001055726ino: DepartmentOfDefenceMemberアメリカ-公認会計基準:連携性手配メンバー2022-01-012022-12-310001055726ino: DepartmentOfDefenceMemberアメリカ-公認会計基準:連携性手配メンバー2021-01-012021-12-310001055726ino: CELLECTRA3PS 専用スマートデバイスメンバーino: DepartmentOfDefenceMemberアメリカ-公認会計基準:連携性手配メンバー2022-01-012022-01-310001055726ino: DepartmentOfDefenceMemberアメリカ-公認会計基準:連携性手配メンバー2023-12-310001055726ino: DepartmentOfDefenceMemberアメリカ-公認会計基準:連携性手配メンバー2022-12-310001055726ino: DepartmentOfDefenceMemberアメリカ-公認会計基準:連携性手配メンバー2021-12-310001055726ino: MutualFunds メンバー2023-12-310001055726US-GAAP:アメリカReasuryBillSecuritiesMembers2023-01-012023-12-310001055726US-GAAP:アメリカReasuryBillSecuritiesMembers2023-12-310001055726アメリカ公認会計基準:預金メンバー資格認証SRT:最大メンバ数2023-01-012023-12-310001055726アメリカ公認会計基準:預金メンバー資格認証2023-12-310001055726アメリカ-GAAP:抵当ローン認可証券はアメリカ政府スポンジ企業から発行されたメンバー2023-12-310001055726ino: MutualFunds メンバー2022-12-310001055726アメリカ公認会計基準:預金メンバー資格認証SRT:最大メンバ数2022-01-012022-12-310001055726US-GAAP:アメリカReasuryBillSecuritiesMembers2022-12-310001055726アメリカ公認会計基準:預金メンバー資格認証2022-12-310001055726アメリカ-GAAP:抵当ローン認可証券はアメリカ政府スポンジ企業から発行されたメンバー2022-12-31イノ: ポジション0001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するino: MutualFunds メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するino: MutualFunds メンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバーino: MutualFunds メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバーino: MutualFunds メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ証券メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:アメリカ証券メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ-公認会計基準:アメリカ証券メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバーアメリカ-公認会計基準:アメリカ証券メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:預金メンバー資格認証2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:預金メンバー資格認証アメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ公認会計基準:預金メンバー資格認証2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバーアメリカ公認会計基準:預金メンバー資格認証2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-GAAP:抵当ローン認可証券はアメリカ政府スポンジ企業から発行されたメンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-GAAP:抵当ローン認可証券はアメリカ政府スポンジ企業から発行されたメンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-GAAP:抵当ローン認可証券はアメリカ政府スポンジ企業から発行されたメンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-GAAP:抵当ローン認可証券はアメリカ政府スポンジ企業から発行されたメンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定する2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2023-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するino: MutualFunds メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するino: MutualFunds メンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバーino: MutualFunds メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバーino: MutualFunds メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ証券メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:アメリカ証券メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ-公認会計基準:アメリカ証券メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバーアメリカ-公認会計基準:アメリカ証券メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:預金メンバー資格認証2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:預金メンバー資格認証アメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ公認会計基準:預金メンバー資格認証2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバーアメリカ公認会計基準:預金メンバー資格認証2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-GAAP:抵当ローン認可証券はアメリカ政府スポンジ企業から発行されたメンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-GAAP:抵当ローン認可証券はアメリカ政府スポンジ企業から発行されたメンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-GAAP:抵当ローン認可証券はアメリカ政府スポンジ企業から発行されたメンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-GAAP:抵当ローン認可証券はアメリカ政府スポンジ企業から発行されたメンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001055726アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001055726アメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001055726アメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001055726ino: McDermidVinovioPharmaceuticalsIncAndJJosephKim メンバー2022-07-310001055726ino: McDermidVinovioPharmaceuticalsIncAndJJosephKim メンバー2022-01-012022-12-310001055726ino: McDermidVinovioPharmaceuticalsIncAndJJosephKim メンバー2023-03-310001055726ino: BehestiVKimEtAl メンバー2023-07-012023-07-310001055726アメリカ-公認会計基準:リース改善メンバー2023-12-310001055726アメリカ-GAAP:OfficeEquipmentMembers2023-12-310001055726アメリカ-GAAP:家具と固定機器のメンバー2023-12-310001055726米国-GAAP:PropertyPlantAndEquipmentOtherTypesMember2023-12-310001055726アメリカ-公認会計基準:リース改善メンバー2022-12-310001055726アメリカ-GAAP:OfficeEquipmentMembers2022-12-310001055726アメリカ-GAAP:家具と固定機器のメンバー2022-12-310001055726米国-GAAP:PropertyPlantAndEquipmentOtherTypesMember2022-12-310001055726US-GAAP:ライセンスプロトコルのメンバーSRT:重み平均メンバ2023-12-310001055726US-GAAP:ライセンスプロトコルのメンバー2023-12-310001055726US-GAAP:ライセンスプロトコルのメンバー2023-01-012023-12-310001055726US-GAAP:ライセンスプロトコルのメンバー2022-12-310001055726ino: Bioject メンバー2023-12-310001055726ino: Bioject メンバー2023-01-012023-12-310001055726ino: Bioject メンバー2022-12-310001055726アメリカ公認会計基準:その他無形資産メンバーSRT:重み平均メンバ2023-12-310001055726アメリカ公認会計基準:その他無形資産メンバー2023-12-310001055726アメリカ公認会計基準:その他無形資産メンバー2023-01-012023-12-310001055726アメリカ公認会計基準:その他無形資産メンバー2022-12-310001055726SRT:重み平均メンバ2023-12-310001055726ino: A6.50 コンバーチブルシニアノート期限 2024 メンバーアメリカ公認会計基準:転換可能債務メンバー2019-02-190001055726ino: A6.50 コンバーチブルシニアノート期限 2024 メンバーアメリカ公認会計基準:転換可能債務メンバー2019-03-010001055726ino: A6.50 コンバーチブルシニアノート期限 2024 メンバーアメリカ公認会計基準:転換可能債務メンバー2019-02-192019-03-010001055726ino: A6.50 コンバーチブルシニアノート期限 2024 メンバーアメリカ公認会計基準:転換可能債務メンバーアメリカ公認会計基準:副次的事件メンバー2024-03-012024-03-010001055726ino: A6.50 コンバーチブルシニアノート期限 2024 メンバーアメリカ公認会計基準:転換可能債務メンバー2023-12-310001055726アメリカ公認会計基準:転換可能債務メンバー2023-12-310001055726アメリカ-公認会計基準:会計基準更新202006年メンバー2022-01-010001055726ino: A6.50 コンバーチブルシニアノート期限 2024 メンバー2023-12-310001055726ino: A6.50 コンバーチブルシニアノート期限 2024 メンバーアメリカ公認会計基準:転換可能債務メンバー2023-01-012023-12-310001055726ino: A6.50 コンバーチブルシニアノート期限 2024 メンバーアメリカ公認会計基準:転換可能債務メンバー2022-01-012022-12-310001055726ino: A6.50 コンバーチブルシニアノート期限 2024 メンバーアメリカ公認会計基準:転換可能債務メンバー2021-01-012021-12-310001055726アメリカ-公認会計基準:シリーズCPreferredStockMember2022-12-310001055726アメリカ-公認会計基準:シリーズCPreferredStockMember2023-12-310001055726アメリカ-公認会計基準:シリーズCPreferredStockMember2021-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバーino: A2021 販売契約メンバー2021-11-092021-11-090001055726アメリカ-アメリカ公認会計基準:普通株式メンバーino: A2021 販売契約メンバー2023-01-012023-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバーino: A2021 販売契約メンバー2022-01-012022-12-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバーino: A2021 販売契約メンバー2023-12-310001055726ino: A2023 インセンティブプランメンバー2023-05-160001055726ino: A2023 インセンティブプランメンバー2023-12-310001055726ino: A2023 インセンティブプランメンバー2023-01-012023-12-310001055726ino: A2016 インセンティブプランメンバー2023-01-012023-12-310001055726ino: A2016 インセンティブプランメンバー2023-12-310001055726ino: A2022 誘導プランメンバー2022-06-240001055726ino: A2022 誘導プランメンバー2023-12-310001055726ino: A2007 インセンティブプランメンバー2023-12-310001055726ino: A2007 インセンティブプランメンバー2023-01-012023-12-310001055726米国-公認会計基準:研究·開発費メンバー2023-01-012023-12-310001055726米国-公認会計基準:研究·開発費メンバー2022-01-012022-12-310001055726米国-公認会計基準:研究·開発費メンバー2021-01-012021-12-310001055726アメリカ-公認会計基準:一般と行政費用メンバー2023-01-012023-12-310001055726アメリカ-公認会計基準:一般と行政費用メンバー2022-01-012022-12-310001055726アメリカ-公認会計基準:一般と行政費用メンバー2021-01-012021-12-310001055726米国-GAAP:制限株式単位RSUメンバー2023-12-310001055726米国-GAAP:制限株式単位RSUメンバー2022-12-310001055726米国-GAAP:制限株式単位RSUメンバー2023-01-012023-12-310001055726米国-GAAP:制限株式単位RSUメンバー2022-01-012022-12-310001055726アメリカ-GAAP:ShareBasedPaymentArrangementNonEmployeMembers2023-01-012023-12-310001055726アメリカ-GAAP:ShareBasedPaymentArrangementNonEmployeMembers2022-01-012022-12-310001055726アメリカ-GAAP:ShareBasedPaymentArrangementNonEmployeMembers2021-01-012021-12-310001055726アメリカ-GAAP:ShareBasedPaymentArrangementNonEmployeMembers2023-12-310001055726ino: RangeOfExercisePricesOneMember2023-01-012023-12-310001055726ino: RangeOfExercisePricesOneMember2023-12-310001055726ino: RangeOfExercise 価格ツーメンバー2023-01-012023-12-310001055726ino: RangeOfExercise 価格ツーメンバー2023-12-310001055726ino: RangeOfExercisePricesThreeMember2023-01-012023-12-310001055726ino: RangeOfExercisePricesThreeMember2023-12-310001055726ino: 運動の範囲価格四人2023-01-012023-12-310001055726ino: 運動の範囲価格四人2023-12-310001055726ino: RangeOfExercise 価格 5 メンバー2023-01-012023-12-310001055726ino: RangeOfExercise 価格 5 メンバー2023-12-310001055726ino: RangeOfExercise 価格 6 メンバー2023-01-012023-12-310001055726ino: RangeOfExercise 価格 6 メンバー2023-12-310001055726米国-GAAP:制限株式単位RSUメンバー2021-01-012021-12-310001055726米国-GAAP:制限株式単位RSUメンバーino: 元社長兼最高経営責任者役員メンバー2023-01-012023-12-310001055726ino: サンディエゴカリフォルニア州メンバー2023-01-012023-12-31Utr:SQFT0001055726ino: プリマスミーティングペンシルベニア州メンバー2023-01-012023-12-3100010557262023-11-012023-11-30ino: リース0001055726ino: サンディエゴカリフォルニア州メンバー2023-11-012023-11-300001055726ino: サンディエゴカリフォルニア州メンバー2023-11-300001055726ino: プリマスミーティングペンシルベニア州メンバー2023-07-012023-09-300001055726ino: プリマスミーティングペンシルベニア州メンバー2023-10-012023-12-3100010557262019-10-012019-12-31ino: 契約0001055726ino: プリマスミーティングペンシルベニア州メンバー2019-10-012019-12-310001055726ino: McDermidVinovioPharmaceuticalsIncAndJJosephKim メンバー2023-01-310001055726ino: BehestiVKimEtAl メンバー2020-04-012020-04-30ino : 被告人0001055726アメリカ公認会計基準:国際収入サービスIRSMメンバー2023-12-310001055726ino: CaliforniaIncomeTaxAuthority メンバー2023-12-310001055726ino: ペンシルベニア州所得税当局メンバー2023-12-310001055726アメリカ公認会計基準:国際収入サービスIRSMメンバー2018-12-310001055726ino: 韓国国家所得税当局メンバー2022-12-310001055726アメリカ-公認会計基準:研究メンバーアメリカ公認会計基準:国際収入サービスIRSMメンバー2023-12-310001055726アメリカ-公認会計基準:州と地方法律法規のメンバーアメリカ-公認会計基準:研究メンバー2023-12-310001055726米国-GAAP:国内/地域メンバー2023-12-310001055726アメリカ-公認会計基準:州と地方法律法規のメンバー2023-12-310001055726アメリカ-公認会計基準:外国人メンバー2023-12-310001055726米国-GAAP:国内/地域メンバーアメリカ-公認会計基準:研究メンバー2023-12-310001055726ino: Plumbline ライフサイエンスメンバー2022-12-310001055726ino: Plumbline ライフサイエンスメンバー2023-12-310001055726SRT:関連エンティティメンバino: LicensewithAffiliatedEntitiesMember2023-01-012023-12-310001055726SRT:関連エンティティメンバino: LicensewithAffiliatedEntitiesMember2022-01-012022-12-310001055726SRT:関連エンティティメンバino: LicensewithAffiliatedEntitiesMember2021-01-012021-12-310001055726SRT:関連エンティティメンバino: Plumbline ライフサイエンスメンバー2023-12-310001055726SRT:関連エンティティメンバino: Plumbline ライフサイエンスメンバー2022-12-310001055726SRT:関連エンティティメンバ2016-03-012016-03-310001055726SRT:関連エンティティメンバino: TheWistarInstitute メンバー2020-01-012020-03-310001055726ino: TheWistarInstitute メンバー2021-01-012021-12-310001055726SRT:関連エンティティメンバino: TheWistarInstitute メンバー2021-01-012021-12-310001055726SRT:関連エンティティメンバino: TheWistarInstitute メンバー2022-12-012022-12-310001055726SRT:関連エンティティメンバ2023-01-012023-12-310001055726SRT:関連エンティティメンバ2022-01-012022-12-310001055726SRT:関連エンティティメンバino: TheWistarInstitute メンバー2023-01-012023-12-310001055726SRT:関連エンティティメンバino: TheWistarInstitute メンバー2022-01-012022-12-310001055726SRT:関連エンティティメンバino: TheWistarInstitute メンバー2023-12-310001055726SRT:関連エンティティメンバino: TheWistarInstitute メンバー2022-12-310001055726ino: 株式会社ジェネオスセラピューティクス会員2021-01-012021-03-310001055726ino: 株式会社ジェネオスセラピューティクス会員2021-03-310001055726ino: シリーズ AOnePreferredStockMemberino: 株式会社ジェネオスセラピューティクス会員2021-01-012021-03-310001055726アメリカ-アメリカ公認会計基準:普通株式メンバーino: 株式会社ジェネオスセラピューティクス会員2021-03-310001055726アメリカ-公認会計基準:第一選択株式メンバーino: 株式会社ジェネオスセラピューティクス会員2021-01-012021-03-310001055726アメリカ-公認会計基準:第一選択株式メンバーino: 株式会社ジェネオスセラピューティクス会員2021-03-310001055726ino: 株式会社ジェネオスセラピューティクス会員2021-02-280001055726アメリカ-公認会計基準:第一選択株式メンバーino: 株式会社ジェネオスセラピューティクス会員2022-03-012022-03-310001055726ino: 株式会社ジェネオスセラピューティクス会員2022-03-310001055726ino: SeriesA2OnePreferredStockMember2022-03-012022-03-310001055726ino: SeriesA2OnePreferredStockMember2022-03-310001055726ino: 株式会社ジェネオスセラピューティクス会員2023-12-310001055726アメリカ公認会計基準:副次的事件メンバーino: A2021 販売契約メンバー2024-01-012024-03-060001055726アメリカ公認会計基準:副次的事件メンバーino: A2021 販売契約メンバー2024-03-06 アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表10-K
| | | | | |
| ☒ | 1934年証券取引法第13又は15(D)節に基づいて提出された年次報告 |
本財政年度末まで十二月三十一日, 2023
あるいは…。
| | | | | |
| ☐ | 1934年証券取引法第13又は15(D)節に提出された移行報告書 |
移行期間のために TO について
コミッションファイルいいえ。 001-14888
株式会社イノビオ製薬株式会社
( 憲章に記載されている登録者の正確な氏名 )
| | | | | | | | |
| デラウェア州 | | 33-0969592 |
(明またはその他の司法管轄権
会社や組織) | | (税務署の雇用主
識別番号) |
| | |
660 位。ジャーマンタウンパイク, 110番のスイートルーム プリマス会合, ペンシルバニア州 | | 19462 |
| (主にオフィスアドレスを実行) | | (郵便番号) |
登録者の電話番号 ( 市外局番を含む ) : (267) 440-4200
法律のセクション 12 ( B ) に従って登録された証券 :
| | | | | | | | |
| クラスごとのタイトル | 取引コード | 登録された各取引所の名称 |
| 普通株式、 $0.001 パーバリュー | 井上 | ナスダック世界ベスト市場 |
法第 12 条 ( G ) に従って登録された有価証券 : なし
登録者が証券法第405条規則で定義されている有名な経験豊富な発行者であるかどうかをチェックマークで示す¨ 違います。 x
登録者が法案の第13節又は第15節(D)節に基づいて報告書を提出する必要がない場合は,複選マークで示してください¨ 違います。 x
登録者が ( 1 ) 1934 年証券取引法第 13 条または第 15 条 ( d ) により提出されるすべての報告書を過去 12 ヶ月間 ( または登録者がそのような報告書を提出することが求められたそれより短い期間 ) に提出しており、 ( 2 ) 過去 90 日間にそのような提出要件の対象となっていたかどうかをチェックマークで示します。 はい、そうです x いいえ! ¨
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条に従って提出された各相互作用データファイルを電子的に提出したかどうかを示すはい、そうです x*¨
登録者が大規模な加速申請者、加速申請者、非加速申請者、小規模報告会社、または新興成長企業であるかどうかをチェックマークで示します。取引法第 12b—2 条の「大規模加速申請者」、「加速申請者」、「小規模報告会社」、「新興成長会社」の定義を参照してください。( 1 つをチェック ) :
| | | | | | | | | | | | | | |
| 大型加速ファイルサーバ | ¨ | | 加速ファイルマネージャ | ¨ |
| | | | |
| 非加速ファイルサーバ | x | | 規模の小さい新聞報道会社 | x |
| | | 新興成長型会社 | ¨ |
新興成長型企業であれば、登録者が取引法第13(A)節に従って提供された任意の新しいまたは改正された財務会計基準を遵守するために、延長された移行期間を使用しないことを選択するかどうかを再選択マークで示す。☐
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる。☐
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する☐
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(同法第12 b-2条で定義される)☐*x
2023 年 6 月 30 日現在、登録者の非関連会社が保有する議決権および議決権のない普通株式 ( 普通株式のみで構成される ) の総市場価値は約 $でした。119.71 株当たり 5.40 ドルに基づく、登録者の普通株式のその日の終値 ( 2024 年 1 月に有効となった 12 対 1 の逆株式分割に遡及的に効力を生じます ) のナスダックグローバルセレクト市場 ( 2023 年 11 月にナスダックキャピタルマーケットに移管される前 ) における。
登録者の普通株式の発行済株式の数、 $0.001 の額面価値は、 23,370,3652024 年 3 月 1 日現在。
引用で編入された書類
登録者の 2024 年次株主総会に関連して規則 14A に従って欧州委員会に提出される登録者の最終的な委任状 ( 「委任状」 ) の一部は、この報告書の第 III 部に参照により組み込まれています。そのような代理人声明は、遅くとも 12 月 31 日に終了する登録者の会計年度の終了後 120 日以内に欧州委員会に提出されます。
カタログ
| | | | | |
第1部 | 2 |
第2項:業務 | 2 |
プロジェクト1 Aリスク要因 | 23 |
項目1 B。未解決従業員意見 | 51 |
プロジェクト1 C。ネットワーク·セキュリティ | 51 |
項目2.財産 | 52 |
項目3.法的手続き | 52 |
プロジェクト4.鉱山安全情報開示 | 54 |
第II部 | 55 |
項目5.登録者普通株式市場、関連株主事項、発行者による株式証券の購入 | 55 |
第6項[保留されている] | 56 |
プロジェクト7.経営陣の財務状況と経営成果の検討と分析 | 57 |
プロジェクト7 A。市場リスクの定量的·定性的開示について | 63 |
項目8.財務諸表と補足データ | 64 |
項目9.会計·財務開示における会計担当者の変化と相違 | 64 |
プロジェクト9 Aです。制御とプログラム | 64 |
プロジェクト9 B。その他の情報 | 73 |
プロジェクト9 Cです。検査妨害に関する外国司法管区の開示 | 73 |
第三部 | 67 |
プロジェクト10.取締役、上級管理者、および企業管理 | 67 |
第11項.役員報酬 | 67 |
プロジェクト12.特定の実益所有者および経営陣の保証所有権および株主に関する事項 | 67 |
第十三項:特定の関係及び関連取引、並びに取締役の独立性 | 67 |
プロジェクト14.総会計士料金とサービス | 67 |
第4部 | 68 |
項目15.展示品と財務諸表の添付表 | 68 |
項目16.表格10-Kの概要 | 71 |
サイン | 72 |
連結財務諸表 | F-1 |
第1部
第1項:商業銀行業務
このForm 10-K年次報告(財務状況および経営結果に関する管理職の議論および分析に関する以下の部分を含む)または本年度報告には、我々の業務、財務状況、経営結果および見通しに関する前向きな陳述が含まれている。“予想”、“予想”、“意図”、“計画”、“信じる”、“求める”、“推定する”などの語、およびそのような語の類似表現または変形は、前向き陳述を識別することを意図しているが、本年度報告において前向き陳述を識別する唯一の手段ではない。また、将来の事項に関する陳述は、当社の業務、当社の財務状況、当社製品の研究·開発に関する陳述、および非歴史的事項に関する他の陳述を含み、前向きな陳述である
本年度報告書の前向きな陳述は、我々の経営陣の善意の判断を反映しているにもかかわらず、このような陳述は、私たちが現在知っている事実と要素にしか基づいていない。そのため、展望性陳述は固有にリスクと不確定要素の影響を受け、実際の結果と結果は展望性陳述中の討論或いは期待の結果と大きく異なる可能性がある。このような結果および結果の違いをもたらすか、または促進する可能性のある要因には、以下の“リスク要因”のタイトルで議論される要因と、本年度報告の他の部分的に議論される要因とが含まれるが、これらに限定されない。読者はこれらの前向き陳述に過度に依存しないでください。これらの前向き陳述は本年度報告発表の日にのみ発表されます。私たちは、本年度の報告日後に起こりうる任意のイベントや状況を反映するために、いかなる前向きな陳述を修正または更新する義務はありません。著者らは読者に本年報で開示された各資料を慎重に検討し、これらの資料は興味のある人に意見を提供し、当社の業務、財務状況、経営業績及び将来性に影響する可能性のあるリスクと要素を説明することを目的としている
本年度報告書には、Inovio PharmPharmticals,Inc.の商標および登録商標が含まれる。本年度報告で言及されている他社の製品またはサービス名は、それぞれの所有者の商標または登録商標である可能性がある。本文で言及した“私たち”、“インノーバー”または“会社”とは、インノーバー製薬会社とその合併した子会社を指す。ここでいう“DNA薬”とは,我々が開発しているヒトパピローマウイルス(HPV),癌,感染症に関連する疾患の候補品である。
リスク要因をまとめる
私たちの業務は、私たちの業務目標の達成を阻害したり、私たちの業務、財務状況、運営結果、キャッシュフロー、将来性に悪影響を及ぼす可能性があるリスクを含む多くのリスクに直面しています。これらのリスクは第1部1 A項“リスク要因”でより十分に議論されている。これらのリスク要因は以下の点を含むが,これらに限定されない
•私たちは近年重大な損失が発生しており、予測可能な未来に重大な純損失が発生し、永遠に利益を上げない可能性がある
•私たちの収入源は限られており、私たちの成功は私たちがDNA薬と独自の設備技術を開発する能力にかかっている
•私たちは私たちのDNA薬や独自の設備技術を開発するために多くの追加資金が必要になるだろう。これらの技術は入手が難しいことやコストが高いことが証明されているかもしれない
•私たちの候補DNA薬は販売が許可されていません。私たちは商業的に成功したDNA医薬製品を開発しないかもしれません
•DNA薬は病気を治療し予防する新しい方法であり私たちの細胞は®投与装置は新しい投与方法であり、私たちが開発した任意の研究薬または私たちの装置の有効性、安全性または耐性に対する否定的な見方は、私たちの業務を展開し、私たちの研究薬物を推進し、あるいは規制承認を得る能力に悪影響を及ぼす可能性がある
•もし私たちと私たちが依存している契約製造業者が私たちの要求に応じて私たちの独自設備および候補DNA薬をタイムリーに生産できなかった場合、またはこれらの請負業者が私たちの義務または厳格な規制を履行できなかった場合、私たちは私たちの独自設備およびDNA薬物候補の開発および商業化に遅延に直面する可能性がある
•もし私たちが協力者やパートナーを失ったり、獲得できなかったり、あるいは私たちの協力者やパートナーが彼らと私たちとの関係に十分な資源を適用していなければ、私たちの製品開発と収益性は影響を受けるだろう
•私たちは政府機関と合意して、これらの合意は終了されるかもしれないし、未来の資金も不確実だ。援助の終了または停止は、いくつかの候補製品を開発する能力に悪影響を与え、および/または候補製品を推進するための代替資金源を探すことを要求する
•もしわが社の再編計画とコスト低減の努力が予想された結果に達しなかったり、不良な結果をもたらしたりすれば、私たちの経営業績は損なわれる可能性があります
•私たちは現在訴訟を受けており、追加的な訴訟に直面している可能性があり、これは私たちの業務、財務状況、名声を損なうかもしれない
•私たちは激しい競争とますます激しい競争、そして私たちの競争相手が取った措置に直面しています。例えば、新しい破壊的技術の導入は、私たちのDNA薬物の開発と商業化を阻害するかもしれません。
•我々はすでに中国会社と協力関係を築き,中国製の臨床材料に依存して開発している。中国の法律、規則、法規の解釈と実行、貿易戦争、政治的動揺、あるいは中国の不安定な経済状況に関する不確定性は、私たちの業務、財務状況、経営業績に重大な悪影響を及ぼす可能性がある
•私たちの知的財産権と私たちのノウハウを生成して保護することは難しくて高価で、私たちはそれらの保護を保障できないかもしれない
•もし私たちが第三者の知的財産権侵害を起訴されたら、これは高価で時間がかかり、訴訟の不利な結果は私たちの業務に実質的な悪影響を及ぼすだろう
•データのプライバシーおよびセキュリティに関連する法律、法規、契約、自律計画、通知、およびその他の義務(セキュリティイベントを含む)を遵守できなかったか、または遵守できなかったと考えられることは、私たちの業務を損なう可能性があります。コンプライアンスまたは実際または予想されているこのような義務を履行できないことは、私たちのコストを増加させ、他の方法で私たちの経営業績および業務に負の影響を与える可能性があります
会社の概要
著者らは臨床段階の生物技術会社であり、DNA薬物の開発と商業化に専念し、ヒトパピローマウイルス(HPV)、癌と伝染病に関連する疾患から人々を治療と保護することを助ける。著者らのプラットフォームは体内蛋白質生産の力を利用して、DNA薬物の設計と交付を最適化し、人体に自分の抗病ツールの製造を教えた
我々は特許技術を用いてDNAプラスミドを設計し、これは小さな環状DNA分子であり、その動作原理は人体細胞がダウンロードできるソフトウェアのように、特定のタンパク質を産生し、標的と抗疾患を産生する。我々の独自調査CELLECTRA®送達装置は私たちのDNA薬が人体細胞に入り、最適な効果を得るのを助ける
我々の主要な候補薬剤は、再発性気道乳頭腫症の治療、またはRRPと呼ばれるINO-3107であり、HPV感染によって引き起こされるまれで衰弱した呼吸器疾患である。われわれが完成したINO−3107治療HPV−6とHPV−11関連RRPの1/2期臨床試験では,81.3%の患者がINO−3107使用後の1年間で治療前年と比較して手術回数が減少した
2023年2月、私たちは2022年10月に第1のキューのデータを発表した後、私たちの1/2期臨床試験の第2のキューのデータを公表した。第2群では,11名の患者が探査側口針によりINO−3107治療を受け,そのうち10名(91%)が最初の治療後1年間で手術介入が減少し,測定は試験治療開始0日目からであった。この10名中4名は手術を必要としなかった。治療後1年と治療前1年を比較すると、3種類の手術干与措置の中央値は統計学的に有意に低下した。第2の列の患者では,INO−3107耐性および免疫原性が良好であった。第2のキューの安全性および有効性の結果は、2022年10月に発表された第1のキューの結果と一致する
2023年第4四半期、この完了した試験のデータは、FDAの加速承認計画による審査のためにバイオライセンス申請(BLA)の提出をサポートするために使用可能であるという米国食品医薬品局(FDA)からフィードバックを受けた。加速計画に基づいて我々のBLAを提出する一部として,FDAのすべての届出要求を満たし,BLAを提出する前に検証的臨床試験を開始する必要がある
INO-3107の開発に加えて、我々はHPV関連肛門異型増殖および中咽頭扁平上皮癌、多形性神経膠芽腫、致命的な脳癌、およびエボラウイルスを予防するための潜在的なワクチン増強剤を含む他の適応のためのDNA薬剤の開発または開発を積極的に計画している。われわれは以前,HPVに関連する子宮頚高度扁平上皮内病変(HSIL)を治療する候補DNA薬の臨床試験を行っていたが,2023年8月に米国でのこの適応の開発を中止することを発表した。しかし、我々のパートナーであるアポロバイオ社は、中国でこの候補者の3期臨床試験を継続し、同管轄区で規制部門の承認を求め、その候補者を商業化する可能性がある
DNA薬の特徴
DNA薬物は最適なDNAプラスミドであり,タンパク質をコードする遺伝子を含み,これらのプラスミドが細胞に入るとタンパク質が発現する。特定の免疫反応を引き起こす抗原や特定の病原体に対するモノクロナル抗体を含む広範なタンパク質の産生をヒト細胞に教えるためのプラスミドを設計することができる。これらのDNAは
薬物は適応によって抗原標的の体液と細胞免疫反応を産生することができ、抗原特異的細胞毒性或いはキラーT細胞反応を含むことができ、これは抗癌とウイルス感染に対して非常に重要である。私たちのDNA薬の特徴は
a.T細胞反応:DNA薬物は,高レベルのT細胞(CD 4+,CD 8+と記憶)反応および抗体反応を産生することが証明されている。CD 8+T細胞反応は腫瘍やウイルス感染細胞の除去に重要な役割を果たしていると考えられている。
b.許容性: 複数の疾患目標を評価した場合,臨床試験参加者はDNA薬に対する耐性が良好であった。これまでに私たちのDNA薬は5000人以上の参加者の中で15,000回以上使用されてきた。
c.再管理の能力:DNA薬は臨床試験に使用されており,反復投与により免疫反応を増強し,反復投与による免疫反応の増強に可能性を提供している。
d.多機能性:我々のDNA医薬技術は、癌、ウイルス感染またはタンパク質欠乏症などの様々なヒト疾患の治療または予防に重要なタンパク質または抗原をインビボで産生するために使用することができる
e.製品の安定性:デオキシリボ核酸薬は凍結保存や輸送を必要としない。
f.デザインと製造:DNA薬物は迅速な設計と大規模化ができ、製造の簡便性は潜在的なコストメリットを提供する。
g.交付メカニズム:我々独自の電気穿孔装置は細胞の摂取を増加させ,細胞膜構成の障害を克服し,これらの障害はDNAプラスミドのような高分子の進入を阻害する可能性がある
私たちのDNA薬物プラットフォームの概要は
我々のDNA薬物プラットフォームはDNAプラスミドと我々のCELLECTRA装置からなり,これらの装置はDNAプラスミドを細胞に輸送するためのものである。この2つの構成要素を結合して多機能プラットフォームを作成し、多種の疾病と状況を対象とする可能性がある
SynCon®-DNAプラスミド設計技術
著者らが工夫したDNAプラスミドは環状二本鎖DNAであり、著者らの特許技術とアルゴリズムを用いて最適化を行い、タンパク質を発現した。我々のプラスミドは、ヒト細胞が特定の免疫反応を引き起こす抗原、特定の病原体に対するモノクロナル抗体、または体内欠陥または欠失タンパク質を置換する治療用タンパク質を含む広範なタンパク質を産生できるように設計することができる。例えば,HPV関連疾患の分野では,発現するタンパク質はHPVに対抗するために抗原特異的T細胞反応を誘導する抗原である。我々はまず1つまたは複数の抗原を決定し,これらの抗原はHPVに対する免疫系を誘導する最適な標的であると考え,我々のSynCon設計過程を用いて,複数のウイルス株からの選定抗原の遺伝子組成を解析した
各抗原について、標的抗原のヌクレオチド一致配列を表す新しい遺伝子配列を作成する。このようにすることにより、免疫系が標的抗原と潜在的な標的抗原変異をよりよく認識するのを助けるために、差別化された配列を作成することができると信じている。ヒト臨床試験において、著者らはすでにSynConが設計した各種の腫瘍関連抗原に対するDNA薬物及びある伝染病に対する異なる菌株を用いて免疫反応を産生し、CD 4+、CD 8+と記憶T細胞を含む。エンジニアリングシーケンスは、元のシーケンスと実質的に類似しているが、完全に一致していないので、特許を出願可能であると考えられる
SynCon配列が設計·合成されると,自己プロモーターを持つ環状DNAプラスミドに挿入される。DNA薬物が細胞に入ると、プロモーターはタンパク質発現を“促進”する上で重要な役割を果たしている。我々の技術を用いて,我々のDNAプラスミドは我々独自の遺伝子最適化アルゴリズムによりヒト細胞で高発現できるように最適化されており,目標と呼ばれている。これらの設計能力は、適切な免疫系機序に対して、伝統的な方法よりも高いレベルのタンパク質発現を産生し、必要な免疫反応を誘導する全体能力を潜在的に増強することができると信じている
そして、拡張可能な製造技術を用いて細菌発酵過程でプラスミドを製造する。私たちは最近高生産性の製造プロセスを開発し、それを使って私たちのDNA薬を生産する予定です。製造されたDNA薬は、注射前に超低温または凍結保存または解凍を必要とせず、2~8℃の冷蔵庫で安定しており、これが分配および投与の重要な要素である
細胞系®技術を渡す
DNA薬は効果的に働くために細胞に入る経路が必要だ。比較的大きなDNAプラスミドが細胞膜を通過するのを助けるために,我々独自のCELLECTRA送達技術を用いた。筋肉(IM)や皮内(ID)にDNA薬物を注射した後,CELLECTRA装置は電気穿孔(EP)や短い電気パルスを用いて細胞膜上に可逆的に小孔を開き,DNAプラスミドの進入を許可する。この過程で細胞は
従来法と比較してDNAベクターの摂取能力が著しく向上した体内にあるDNAプラスミド群を単独で投与した。これまで,この改善した細胞摂取は,われわれの臨床試験で観察された免疫反応や奏効率の結果を可能にしてきた
著者らのCELLECTRA設備の組み合わせは現在2種類のモデル(CELLECTRA 5 PSPとCELLECTRA 3 PSP)と1種の主に早期臨床試験に応用する設備(CELLECTRA 2000)から構成されている。これらの装置は,目的疾患に応じて我々のDNA候補薬物の輸送を最適化するために設計されている。我々のCELLECTRA 5 PSPモデルは筋肉内EPを提供し,癌とHPV関連前癌病変の候補者を解決するために設計されている。あらかじめ充填されたカートリッジを用いて,DNA薬物とEPを患者に送達し,商業用途のために設計した。CELLECTRA 5 PSPはわれわれの子宮頸部HSILの3期試験(REVEAL 1/REVEAL 2)に用いられ,われわれが計画したINO−3107の実証試験に用いられ,INO−3107はわれわれのRRP候補DNA薬である。我々のCELLECTRA 3 PSPモデルは,米国国防省,防疫革新センター,ビルとメリンダ·ゲイツ財団の支援の下で開発され,皮内注射EPに用いられている。この小型手持ち設計は大規模管理や商業用途のためのものであり,主に感染症対策の受験生に用いられる。CELLECTRA 3 PSPは単独のDNA薬を皮膚に注入した後にのみEPを提供する。EPは皮内注射部位周囲に輸送される
CELLECTRA設備は現在の良好な製造規範(CGMP)に従って検証と製造を行っている。我々はすでに全世界の人体臨床試験にCELLECTRA設備を使用している。CELLECTRA 5 PSPモデルはすでにEUでCEフラグ認証を取得しました
われわれのDNA薬物の管理の流れを以下の図に示す
DNA薬とHPV関連疾患
HPVは持続的なウイルス感染を引き起こす可能性がある。HPV感染の約90%は自然に除去されており,疾患を引き起こすことはない。しかし,ウイルスを自然駆除できない人にとって,持続感染は癌や他の生活の質に影響を与える虚弱で生命にかかわる疾患を引き起こす可能性がある
一般にHPVタイプは2つに分類される。低リスクのHPV(例えばHPV 6とHPV 11)は良性成長(いぼ或いは乳頭腫)を招き、それによってRRPなどの状況に発展する可能性がある。ハイリスク(HR)HPV(例えばHPV 16とHPV 18)は細胞変化と病変(即ち前癌異常増殖症)を引き起こす可能性があり、それによって悪性になり、子宮頸癌を招く可能性がある。HPVはほとんどの子宮頸癌及び多くの膣癌、膣癌、陰茎癌、肛門癌、直腸癌と中咽頭癌を招く
現在HPV感染を予防するワクチンは使用可能であるが、受容度、可及性と患者コンプライアンスの面での挑戦は多くのワクチン資格に符合する人がまだワクチンを接種しておらず、リスクにある。米国でも50%−60%の合格人口しかHPVワクチンを接種していないと推定されている。また,現在の予防的HPVワクチンは,同じHPV遺伝子型に感染している人を治療あるいは保護することはできない。そのため,既存の感染を治療しHPV関連疾患の進行を防止できるHPV療法の開発が急がれている。現在、多くのHPV関連疾患の治療基準は手術であり、RRPと多くの癌を含む。これらの手術は侵襲的である可能性があり,潜在的なHPV感染が除去されていないため反復が必要かもしれない。手術に加えて,免疫チェックポイント阻害剤の使用や他の免疫療法など,HPV関連疾患の治療の他の選択が模索されている
以下の表にHPV関連疾患の治療に重要であると考えられるDNA薬の主な特徴を示す
私たちのDNA薬は開発中です
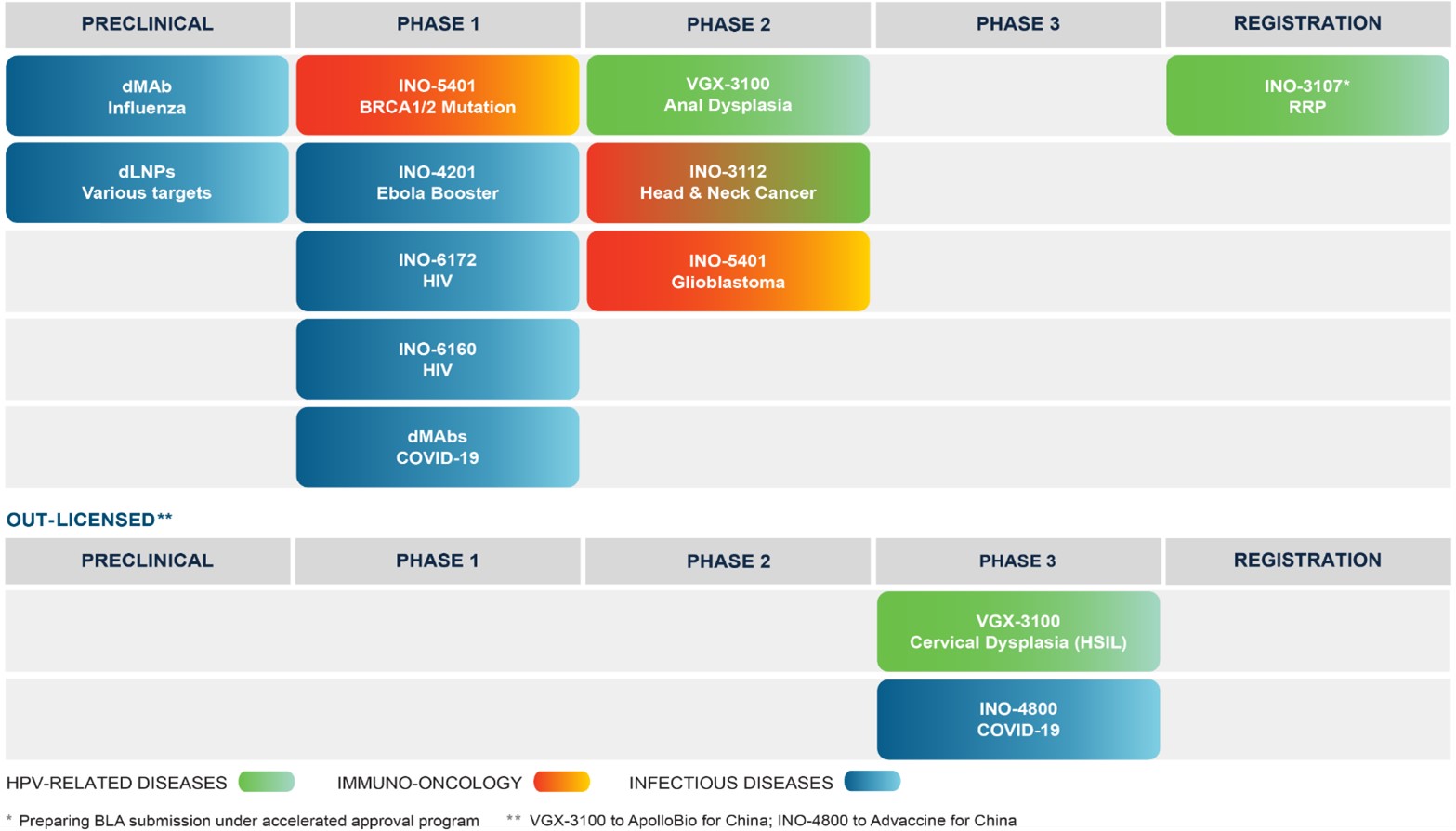
次のグラフは私たちのDNA薬物パイプラインを概説しています2023年、私たちはルートの優先順位を再調整し、私たちの努力と資源を最も市場に参入する潜在力があると考えられる候補製品に集中した。グラフで決定されたプログラムは、以下でより詳細に説明される
HPV関連RRP用INO−3107
RRPは一生まれな疾患であり、呼吸器内で主にHPV-6及び/又はHPV-11遺伝子による小腫瘍或いは乳頭腫の成長を特徴とする。大多数は良性であるが、これらの乳頭腫は深刻で、時々生命を脅かす気道閉塞と気道合併症を招くことができる。RRPの顕著な特徴の1つは乳頭腫が手術切除後に再発する傾向である。RRPが肺に進展すると,影響を受けた人は反復発作の肺炎,慢性肺疾患(気管支拡張症)を経験し,最終的に進行性肺不全をきたす可能性がある。ごく少数の場合(約2%),RRPは扁平上皮癌に進展する。RRPの他の症状としては,嗄声,睡眠と嚥下困難,慢性咳嗽がある。RRP症状は通常
子供は大人より多い。RRPの標準看護は手術である。アメリカで最も広く引用されている疫学データは1995年に発表され、成人と青少年の中に1.4万例の活発な病例があると推定され、毎年成人10万人当たり約1.8例の新しい病例がある
我々は,HPV−6とHPV−11に関連するRRPを治療するための主要候補製品INO−3107を開発している。INO−3107はHPV−6とHPV−11抗原をコードするプラスミドおよびヒトインターロイキン12(IL−12)からなる。2023年5月、マサチューセッツ州ボストンで開催された合同耳鼻咽喉科春季会議(COSM)において、オープンタグのマルチセンター1/2期試験(NCT:04398433)が、32名のHPV 6および/またはHPV 11関連RRP患者に対する我々の主導製品候補INO-3107の有効性、安全性、耐性、および免疫原性を評価し、結果が米国気管支学-食道学協会(ABEA)プロジェクトで公表された。この試験は第1グループの21名の患者が標準注射針を使用し、第2グループの11名の患者が探査性側孔注射針を使用することを含む。私たちは私たちが計画した検証性試験に標準針を使用する予定で、承認されれば、商業製品の交付に使用する予定です。試験の2つのキューでは,我々独自のCELLECTRA 2000電気穿孔装置が候補製品を提供するために使用された
この試験は,INO−3107初回使用後の1年間で,治療前年と比較して手術介入回数の減少を評価した。この試験では,成人患者はまず乳頭腫の手術切除を受け,次いで最大四剤INO−3107を受け,3週間に1回行った。この実験の主な終点は安全性と耐性である。検討開始時(0日目)にはRRP組織の手術切除が可能であったが,投与窓口0日目以降に行ったいずれの手術も奏効率の終点とした
試験では,81.3%(26/32)の患者はINO−3107使用後の1年間で手術介入回数が前年より減少し,そのうち28.1%(9/32)の患者は投与ウィンドウ中または後に手術介入を必要としなかった。試験中の患者の服薬前年の中位範囲は4回の手術(全体範囲は2−8回)であった。投与後、3種類の手術干与措置の中央値低下は統計学的有意差があった(95%信頼区間:-3~-2)。実験では,INO−3107治療は強い免疫反応を産生し,活性化CD 4 T細胞と活性化した溶解能を有するCD 8 T細胞を誘導した。52週にもT細胞反応が観察され、持続的な細胞記憶反応が示唆された。試験参加者のINO-3107に対する耐性は非常に良く、大多数の低レベル(レベル1)の治療-注射部位の痛みと疲労などの副作用を引き起こした。これらの結果は2023年に科学誌“喉頭鏡”に発表された
FDAは2020年7月にINO-3107孤児薬物指定(ODD)を許可し、2023年8月に突破治療指定を授与した。欧州委員会はまたINO-3107孤児薬物の称号を授与し、著者らのCELLECTRA 5 PSP設備もCE標識を獲得し、これは1種の監督管理標準であり、製品がEUが消費者の安全、健康と環境標準を確保したことを証明した
Ino−3112 HPV関連口咽頭扁平上皮癌の治療
INO-3112はHPV 16/18を標的とするDNA候補薬物であり、ヒトIL-12をコードするDNAプラスミドと結合し、免疫活性化剤として使用される。2019年に“臨床癌研究”に発表された1/2 a期臨床試験結果によると、INO−3112単独で22例のHPV陽性の頭頸部扁平上皮癌患者に使用され、T細胞応答の観察と+T細胞の頭頸部腫瘍への浸潤を含む。2023年初め、INO-3112とアスリコンPD-L 1免疫検査点阻害剤Durvalumabを併用した1 b/2 a期臨床癌研究は最新の結果を発表し、29名の評価可能な患者の総有効率(OOR)は27.6%(4例の完全緩和(CR)と4例の部分緩和(PR))であり、末梢HPV特異性T細胞と腫瘍CD 8+T細胞は増加した。さらに、INO-3112とデュバシズマブの併用の治療効果は、平均総生存期間(OS)が29ケ月を超えることをもたらした。これは免疫チェックポイント遮断治療単独または他のHPV治療性ワクチンとの併用履歴データより改善された。また,類似した患者群では,単一療法Durvalumabの履歴OSデータのほぼ3倍であった。CRSを含む客観的な反応はPD−L 1の発現に関係なく,ドゥバスタチンの履歴データとは対照的である
2024年1月、著者らはINO-3112とLOQTORZI(toripalimab-Tpzi)の併用治療の局部末期、ハイリスク、HPV 16/18陽性の中咽頭扁平上皮癌患者に対する潜在的治療作用を評価するために、Coherus BioSciences,Inc.と臨床協力と供給合意を達成することを発表した。供給契約の条項によると、CoherusはLOQTORZIを提供するTMInovioによる3期臨床試験を計画し,FDAとの研究設計の一致を待っている
VGX-3100治療HPV関連子宮頚HSIL
2023年8月、我々はHPV関連子宮頸部HSILを治療するための米国でのVGX-3100開発計画を中止することを発表した。この決定は,我々の第3段階実験REVEAL 2のデータを最終的に分析したものである.この試験では,病変消退とウイルス除去の終点については,バイオマーカー選択を検討した群では統計学的有意差は得られなかった。しかし、すべての参加者の中で、病変消退とウイルス除去の終点は統計学的意義がある
REVEAL 2はVGX−3100を用いて行った第2の3期試験である。2021年3月には、VGX-3100がその主要終点に達していないことを示した最初の3期試験REVEAL 1の結果を発表しました。2022年4月、REVEAL 2の試験計画は、VGX-3100治療により反応する可能性の高い女性を識別する可能性があるREVEAL 1の結果の以前の分析に基づくバイオマーカー選択集団を主要集団として使用するように修正された。バイオマーカー陽性群からの結果は,VGX−3100の潜在的上場申請を承認するのに十分ではないことがFDAから通知されているため,この試験は重要な試験とみなされなくなり,バイオマーカー選択群のBLA申請にもつながらないことが発表された。FDAは探索的試験としてREVEAL 2を用いることを提案しており,バイオマーカー選択群でさらに1~2つの良好な制御試験を行うことで,潜在的な上場申請の承認を支援する証拠を提供することが可能である
REVEAL 2の試験参加者は18歳以上の女性203名を含み、彼女たちは組織学的に子宮頚HSILがHPV-16及び/又はHPV-18と関係があることを確認したが、他の方面はすべて健康であった。参加者は、0、4、および12週にVGX−3100またはプラセボ(ランダム2:1)を受けた。改訂後の主な終点は、バイオマーカーを選択した参加者の子宮頚HSIL消退および子宮頚HPV-16および/またはHPV-18ウイルス学的除去のパーセンテージである。副次的な終点は、すべての参加者の回帰とウイルス学的除去のパーセンテージである
試験的バイオマーカー選択群では,終点に達した参加者の割合は治療群で28.6%(6/21)であったのに対し,プラセボ群では0%(0/4)(p=0.115;95%信頼区間:−24.6%~50.4%)であり,統計学的に有意ではなかった
203名のすべての参加者(治療群134名の参加者、プラセボ群69名)の結果に対して統計学的有意差があり、治療群27.6%(37/134)の参加者は終点に達し、プラセボ群は8.7%(6/69)(p=0.001;95%信頼区間:7.8%~28.6%)であった
特に,REVEAL 2の全参加者群では,治療群で37.3%(50/134)のウイルス駆除が認められたが,プラセボ群では8.7%(6/69)であった。HPV関連疾患の根本的な原因除去におけるウイルス除去の重要性から,このデータはわれわれの他のHPV関連項目に積極的な影響を与える可能性がある。私たちはこれらのデータを同業者評議の定期刊行物に提出する予定です
REVEAL 1とREVEAL 2の結果に対して行った特別な総合治療効果の分析により、バイオマーカーとすべての参加者を選択した人群の中で、病変消退とウイルス除去に統計学的意義があることを表明した。92名の参加者(治療群68名、プラセボ群24名)の総合バイオマーカー選択群では、主要終点に適合する参加者の割合は54.4%(37/68)であり、プラセボ群は12.5%(3/24)(p=であった
REVEAL 1とREVEAL 2では,CELLECTRA 5 PSP装置が提供するVGX−3100耐性が良好であった。治療に関連する重篤な有害事象はなく,多くの有害事象は軽微から中等度と考えられている
この統合されたデータセットは、将来的にVGX−3100に関する任意の規制されたインタラクションにおける支持データとして使用されるであろう。我々のパートナーであるApolloBio社は中国でVGX-3100 VGX-3100による子宮頚HSIL治療の3期臨床試験を行っており、この司法管轄区で監督部門の承認を求め、この候補薬物を商業化する可能性がある
VGX−3100による肛門または肛門周囲HSILの治療
HPV-16とHPV-18は肛門癌前病変(肛門HSIL)を引き起こすことができる。治療を行わなければ肛門型HSILは癌に進展する可能性がある。約20%の患者に肛門HSILの自発消退を認めた。1種以上のハイリスクHPV遺伝子タイプに持続的に感染することは大部分の肛門癌を招く原因である。米国では肛門HSIL症例の約55%から80%がHPV−16/18に関連しており,世界的には肛門HSIL症例の約80%がHPV−16/18に関与している。米国では90%以上の肛門癌がHPVに関与しており,約87%のHPV肛門癌がHPV−16/18に関与している
肛門型HSILのスクリーニング提案に対して、現在まだ有効なスクリーニング試験或いは普遍的な共通認識がない。治療は通常重複アブレーションを含み、最もよく見られるのは高周波アブレーション(RFA)、切除或いはレーザー治療である。しかし、再発率は非常に高く、治療1年後の再発率は49%に達し、アブレーション術は潜在的なHPV感染を除去できないため、医療需要が満たされない
HPV−16および/またはHPV−18に関連するHIV陰性,肛門または肛門周囲HSILまたは肛門上皮内腫瘍(AIN)の参加者のVGX−3100を評価するために2期臨床試験(HPV−203)を行った。このオープンタグ試験は24名の参加者を募集し,我々のCELLECTRA 5 PSPデバイスから三剤VGX-3100を受けた.試験の主要な終点は高度レベル病変の組織学的除去と肛門/肛門周囲組織サンプル中のHPV-16/18ウイルスのウイルス学的除去である。2020年12月、私たちはこの試験の第二段階の治療効果結果を発表した
VGX−3100治療を受けた参加者の半数(11/22)は治療開始後6カ月でHPV−16/18関連肛門HSILの消失を示した。CELLECTRA−5 PSP装置が提供したVGX−3100は試験で耐性が良好であった
上記の2期肛門HSIL試験に加えて,エイズ悪性コンソーシアム(AMC−103研究)によってスポンサーされたもう1つの2期試験は,HPV−16および/またはHPV−18が陽性に関与していることが組織学的に確認された肛門または肛門周囲HSILの参加者にVGX−3100を評価している。このオープンタグのシングルアーム試験計画は約90名の参加者を募集し,CELLECTRA 5 PSPから提供される最大4剤VGX−3100を得る。試験の主な終点は高レベルの肛門病変の組織学的退化が低レベルのSIL或いは正常組織学である。この研究は進行中です
VGX−3100治療外陰HSIL
2023年には,我々のパイプラインの再調整の一部として,潜在的な外陰HSIL治療法としてVGX−3100の開発を中止した
Ino−5401による多形性膠芽腫の治療
多形性神経膠芽腫、あるいはGBMは、最もよく見られる侵襲性脳癌である。米国では,確定診断時の中位年齢は65歳であり,その後発症率が増加する。予後は極めて悪く,過去10年間に承認された新療法数は限られており,米国患者の平均生存率は8カ月と低く,全年齢層の5年生存率を合わせると6.9%と報告されている。世界各地のGBMの総発病率はそれぞれ異なり、北米、オーストラリアと北欧と西欧の発病率は最も高い。アメリカでは、GBMの平均年齢調整発病率は10万人当たり3.19例であった
著者らの候補製品INO-5401は免疫療法であり、3種類の腫瘍関連抗原をコードする三つのDNAプラスミドから構成されている:ヒトテロメラーゼ逆転写酵素(HTERT)、Wilms腫瘍遺伝子-1(WT 1)と前立腺特異性膜抗原(PSMA)
新たに診断されたGBM参加者におけるINO-5401およびINO-9012(IL-12プラスミド)の1/2期免疫腫瘍学的試験を完了し、cymplimab(Libtayo)を併用した®Regeneron製薬会社によって開発されたPD-1免疫チェックポイント阻害剤。このオープンタグ試験は2018年に始まり,新たに診断されたGBM参加者52名を募集した。主な終点は安全性と耐性であり,この試験は全体生存率とOS率に基づいて免疫原性と有効性を評価した
2022年5月,われわれは2022年米国臨床腫瘍学会(ASCO)でこの試験のOSデータを示した。非メチル化MGMTプロモーターの患者(行列A)の中位OS持続期間は17.9カ月であり,歴史的比較(14.6カ月から16カ月)と比較して有利であった。MGMTメチル化プロモーター(キューB)患者の中位OSデータは32.5カ月であり,歴史比較(23.2~25カ月)と比較しても有利であった。全体的に、新しく診断されたGBM患者の中で、INO-5401+INO-9012はLibtayoとRT/TMZ(放射とチモゾラミド)の連合応用の耐性は良好である。治療の投与も免疫原性が認められ,抗原特異的T細胞を励起し,GBM腫瘍に浸透する可能性がある。2023年末までに,試験中の2名のGBM患者は依然として薬物治療を受けている。我々は現在研究報告を完了し,我々の協力者RegeneronとINO−5401のさらなる開発について検討している
BRCA 1/2変異群癌予防用Ino−5401
Inovio社はペンシルバニア大学と協力して、BRCA 1またはBRCA 2変異を有する成人癌および非癌患者におけるINO-5401またはINO-5401の併用によるINO-9012の併用によるBRCA 1またはBRCA 2変異を有する成人癌および非癌患者における耐性および免疫原性を評価するための1 b段階試験を行っている。この裁判は進行中だ
すべてのヒトはBRCA 1とBRCA 2遺伝子を持っているが,ある人は生まれつきそのうちの1つの遺伝子の誤りや変異を持っている。BRCA 1或いはBRCA 2遺伝子突然変異の人は乳癌、卵巣癌、前立腺癌と膵臓癌を含むいくつかの癌に罹患するリスクがもっと高い。これらの遺伝子変異は男性や女性から子供に遺伝することができる
感染症候補製品
新冠肺炎用INO−4800型
2/3期臨床試験−連帯試験ワクチン(STV)
INO-4800は世界保健機関が開始した団結試験ワクチンの2つの初期候補新冠肺炎ワクチンの一つであり、この試験ワクチンはリードした科学者と専門家からなる独立ワクチン優先顧問グループが選択した候補ワクチンの有効性と安全性を評価することを目的としている。STVの行為は完全にWHOの制御下にあり,この試験に関するいかなる公告もWHOによって発表される
中国にあるINO-4800
私たちの協力者Adaccineは、その200人の参加者の相同と267人の参加者の異種強化ワクチン試験の中国での登録を完了した。これらの試験は、ワクチンとしてINO-4800の安全性、耐性、および免疫原性を評価することを目的としている
INO-4800が一次ワクチンとして投与され、異種助剤として投与され、不活化ワクチンが一次ワクチンとして投与される、相同増強剤
新冠肺炎DNAコードのモノクロナル抗体®)
我々の目標アルゴリズム技術を用いて,特定のモノクロナル抗体(MAbbs)コードに対する精密に設計されたDNAプラスミドを作成することができた。私たちはこれらのDNAプラスミドを私たちのdMAb候補製品とし、それらを注入の組換えモノクロナル抗体と区別した。著者らは我々のCELLECTRA送達システムを用いてプラスミドを直接人体細胞に輸送し、電気穿孔細胞を体内(即ち身体自体)でこれらのDNAコードのモノクロナル抗体を製造することができ、伝統的な組換えモノクロナル抗体技術のように体外で製造する必要がない。この方法は設計が簡単で、実行速度が速く、生産コストが低いという点で潜在的な優位性があると信じている。著者らはdMAb製品候補を設計し、現在伝統的な組換えmAbsでは解決できない新しい疾病標的だけでなく、現有の商業mAb製品の標的にも対応したい
2020年12月、私たちはウィスタール研究所、アスリカン、ペンシルバニア大学、インディアナ大学からの科学者チームと共に、アメリカ国防総省とJPEO-CBRNDの研究開発機関であるアメリカ国防高等研究計画局から3760万ドルの寄付を得て、私たちのdMAb技術を利用してSARS-CoV-2に対する特異的なdMAbを開発し、新冠肺炎の治療と予防を行った
2022年7月、Wistarは、我々の2種類のmAb候補製品の安全性、耐性および薬物動態特性を評価するために、第1段階開放ラベル、単中心、用量漸増試験の第1回参加者の用量を発表し、健康な成人(NCT 05293249)において直ちに我々のCELLECTRA 2000装置を使用して、1および2用量レジメン(0日目および3日目)で筋注および電気穿孔を行った。この研究は進行中です
エボラウイルス病を治療するIno-4201
エボラウイルスは最も致命的なウイルス性疾患の一つを招き、病死率は平均約50%であるが、過去に衛生保健が未発達或いは未発達な地区で爆発した病例の中で、病死率は90%に近い。エボラウイルスは、感染者の血液、分泌物、器官または体液、および感染者の汚染された液体を含む表面または材料、例えば寝具や衣服に直接接触することによって、人と人の間に伝播することができる。それは曝露後2~21日以内に死亡を招くことができる。2019年11月、初めて条件付きで承認されたエボラウイルス予防ワクチンが承認された。これはヨーロッパ医薬品局(EMA)のERVEBOワクチンの承認です®それは.同月、WHOはこのワクチンに対して資格予審を行い、ハイリスク国家の使用に供した。次の一ヶ月間、FDAはこのワクチンを承認した。しかし,ERVEBOは再投与が許可されておらず,米国では現在のところ強化ワクチンは承認されていない。
2021年12月、我々のDNA候補薬剤INO-4201は、ERVEBOを以前に接種した健康ボランティアにおける異種強化剤として評価された46人の参加者の1 b段階試験(NCT 04906629)の完了を宣言した。2023年2月,1 b段階試験の結果を発表した。INO−4201耐性は良好であり,治療を受けた参加者では100%(36/36)で体液反応が向上した。著者らと著者らの協力者は同業者評議の定期刊行物でこれらのデータを発表し、INO-4201の次の最新状況を提供する予定である
HIV用INO-6160
INO−6160はDNA薬物候補薬であり,ヒト免疫不全ウイルス(HIV)を予防するためのワクチンが開発されている。INO-6160はHIV三量体とヒトIL-12をコードするプラスミドからなる。INO-6160は、国家アレルギー·感染症研究所(NIAID)の外部支援と援助による第1段階試験の評価を受けている。この試験は、INO-6160の安全性および免疫原性を検査するために、ランダム、20人の参加者、オープンタグの第1段階試験である。
DNA放出ナノ粒子(DLNPs)
InovioとWistar研究所の我々の協力者は,DNAワクチン開発における我々の経験を次世代DNA薬物技術の開発に応用しており,DNA放出ナノ粒子であるdLNPを研究し,最初に感染症ワクチンを対象としていた。INO−6172はInovioの最初の臨床試験に入ったdLNPであり,NIAIDによる助成と助成の第1段階試験にある。INO-6172は2つのプラスミドを含み、一方はdLNPをコードし、もう1つはヒトIL-12をコードする。この試験は、HIVに感染していない成人におけるINO-6172の安全性および免疫原性を検査するためのランダムで45人の参加者のオープンタグの第1段階試験である。試験はまだ行われており,dLNP技術や他の候補ワクチンの臨床前作業も行われている
協力と連合
私たちは現在ApolloBio社と協力している以外に、私たちの他のパートナーと協力者はAdvenant BiopPharmticals蘇州会社、アスリコン、ビルとメリンダ·ゲイツ財団(ゲイツ)、疫病防止革新連盟(CEPI)、Coherus生物科学会社、国防高級研究計画局(DARPA)、アメリカ国防省(DoD)、HIVワクチン試験ネットワーク、国際ワクチン研究所(IVI)、カーネギー
これらの研究機関は,ヨーロッパ製薬会社,国家癌研究所,国家衛生研究院,国家アレルギー·感染症研究所,垂直生命科学研究所,Regeneron製薬会社,Richter−Helm生物製薬会社,Thermo Fisher Science社,ペンシルバニア大学,Walterヨシ陸軍研究所,ウィスタール研究所である
2017年12月、北京アポロ土星生物科学技術有限公司(中国またはアポロ生物会社の法律に基づいて設立された会社)と、2023年6月14日に改正された改正および再署名された許可·協力協定(改正後は“許可·協力協定”)を締結した。本許可及び協力協定の条項により、著者らはApolloBioに独占的権利を付与し、中国大区(中国、香港、マカオと台湾と定義)内で著者らのDNA免疫療法候補製品VGX-3100を開発と商業化し、HPVによる前癌病変の治療に用いた。協力の一部として、ApolloBioは許可地域内のすべての臨床開発コストに資金を提供する
私たちは、許可と協力協定に基づいて、規制部門のVGX-3100の承認に関連する指定されたマイルストーンを実現する際に、合計2000万ドルから必要な収入、源泉徴収、または他の税金を差し引く権利がある。VGX 3100が大中華区中国市場での販売を許可された場合、年間純売上高の等級別パーセンテージに基づく特許権使用料を得る権利があり、この割合はミドルクラスであるが、特定の地域で模造薬競争が発生した場合には減少する。ApolloBioが特許使用料を支払う義務は、特定の地域の最初の商業販売後10年間続き、もっと遅い場合は、特定の地域の特許製品をカバーする最後の満期特許が満了するまで続く。ある地域で上場承認された後、ApolloBioに残りの印税義務がないまで、許可と協力協定は引き続き有効になるだろう。2021年12月、ApolloBioは、中国(HPV-303 CHN)の別の第3段階試験において、最初の参加者に薬物を投与した
競争
私たちが開発し、最終的に私たちの候補製品を商業化することを求めていることに伴い、私たちは私たちが求めている疾患に対する一連の既存または開発段階の薬物と免疫療法の競争に直面し続けていく。主要生物製薬会社を含む複数の老舗企業がワクチン/免疫療法の研究·開発に広く従事していることが知られている。これらの会社には、エバービー、アスリコン、BioNTech、百時美施貴宝、グラクソ·スミスクライン、ヤンソン製薬(ジョンソンの一部)、メルク、Moderna、ノワール、ファイザー、ロー氏、セノフィ-アンバンテが含まれている。様々な開発段階のバイオテクノロジー会社も異なるワクチンや免疫治療技術に関与しており,Agenus,AIVITA,Barinose BioTreateutics(従来のVaccitech),BL Corp,Entos Pharma,Frantz Virus Treateutics,Immunocore,Imunon,ImVax,Iovance,Gritstone Bio,Genexine,Hookipa,Mimivax,Nektar,Northwest Treatetics,Novavax,Nykode,Precigen,PapiVaxを含むがこれらに限定されない。もしこれらの会社が彼らの技術開発に成功すれば、私たちの業務と私たちの将来の成長見通しに実質的な悪影響を及ぼすかもしれない
メルクとグラクソ·スミスクラインはすでにHPVに対する予防性ワクチンを商業化し、子宮頸癌を予防する。一部の会社も早期HPV感染の治療を求めている。Precigenは、HPVサブタイプ6および11によるRRPについて、ゴリラアデノウイルスベクターに基づく候補製品PRG−2012を開発している。Precigenは、2024年に彼らのPRG-2012に従ってRRPを治療する1/2期試験に従ってBLAを提出することが予想され、BLAの提出を支援するために追加のランダム、プラセボ対照試験を必要としないことを開示している。他社はNykode,メルク,Cytovationを含むRRPを疾患標的とすることを模索し始めている。頭頸部癌に対しては,アスリコンは局所末期頭頸部扁平上皮癌のためのPD−1とTIGITに対する二重特異性抗体を開発しているが,米国国立癌研究所ではHPV陽性中咽頭癌免疫療法nivalumab(百時美施貴宝に対するOpdivo)の3期研究を行っている。他の会社は前癌と私たちの目標癌を治療するための異なる方法を求めている
我々はまた、様々な疾患を予防または治療するために、電気穿孔または他の送達技術(例えば、ウイルスベクターまたは脂質送達)を用いて送達される抗原コードDNAを使用して、インビボで産生される抗原産生および免疫反応を誘導することを求める会社とより具体的な競争を行う。これらの競争力のある技術は希望を示しているが、それらはまた克服しなければならない独自の障害を持っている
ウイルスベクターに基づくワクチン送達
この技術はウイルスをベクターやベクターとして利用し,遺伝物質を標的細胞に輸送する。この方法は免疫療法抗原の伝達に有効であり,真のウイルス感染を模倣する利点があるため,受容者は免疫療法に対して広範な免疫反応を生じる。この技術の潜在的限界は,ウイルスベクター自体の成分に対する不必要な免疫反応の問題に起因しており,重複投与が困難になっている
脂質ナノ粒子DNA/RNA送達
デオキシリボ核酸免疫療法の効果を高める脂質製剤が多く開発されており,その中で最も顕著なのは新冠肺炎遺伝子ワクチンである。これらの作用は,細胞のDNA/RNA摂取を増加させるか,アジュバントとして免疫系に注意するかである
電気穿孔技術を用いたDNA免疫治療
電気穿孔の知的財産権と設備を持っている他の会社もある。電気穿孔に集中している他の会社に比べて競争優位があると信じています
•著者らは電気穿孔とDNA薬物の併用を最適化する方法と設備の開発において豊富な歴史と経験を持っている。この経験は,DNA薬物治療癌や感染症の臨床試験を評価する複数組のデータから検証されている
•私たちは広範な電気穿孔機器製品ラインを持っていて、私たちの皮内と筋肉内設備を含むDNA輸送を実現することを目的としています
•私たちは積極的に特許を出願し、より多くの特許を取得し、許可して、私たちの世界的な特許資産を拡大してきた
もし私たちの競争相手が開発した製品の有効性や安全性が私たちの候補製品より明らかに優れていれば、私たちの製品を商業化できないかもしれません。私たちのいかなる商業化製品の販売も損なわれる可能性があります。私たちのいくつかの競争相手と潜在的な競争相手は私たちよりも多くの製品開発能力と財務、科学、マーケティング、人材を持っています。競争相手はより早く製品を開発し、FDAの承認をより早く得るか、あるいは私たちが開発している製品よりも効率的な製品を開発するかもしれない。私たちは競争力を維持するために私たちの技術能力を拡大することを求めます;しかし、他の人の研究と開発は、私たちの技術や製品を時代遅れにしたり、競争力を欠いたり、治療や治療法が私たちよりも優れている可能性があります
我々の競争地位は,我々の競争相手に対する我々の候補製品の疾患適応,これらの製品が市場に参入するタイミング,およびこれらの疾患適応に対する他の技術の開発段階の影響を受ける。私たちと私たちの競争相手にとって、特許技術、適時に臨床試験を完成し、期待結果を得る能力、及び適時に監督部門の許可を得てこれらの候補製品を市場に出す能力は、重要な競争要素であるかもしれない。他の重要な競争要因は、効果、安全性、使いやすさ、製品の信頼性、獲得性および価格、および技術構想および商業販売中に運営に資金を提供する能力を含むであろう
FDAおよび他の規制機関は、DNAベースの製品開発データを現在公開開示する要求を拡大する可能性があり、これは、類似の適応のためのDNAベースの製品を開発する外国および米国会社との競争的地位を損なう可能性がある
商業化と製造
我々の技術の広範な潜在的応用により,我々は自ら製品を開発して商業化する予定であり,我々の協力者や許可側による開発と商業化を行う予定である.我々は,明確に定義された専門市場で製品を開発し,HPV関連疾患,感染症,癌などを商業化する予定である。適切な状況で、私たちは戦略的マーケティングと流通連合に依存するつもりだ。2023年、FDAから報告された1/2期RRP患者試験データが、加速承認計画に従ってBLAに提出された後、米国におけるINO-3107の商業化計画の開発を加速し始めた
すべてのプラスミドに適用した統一発酵と加工方法により,我々のプラスミドは商業的に量産できると信じている。私たちはすべての予見可能な臨床研究に十分なプラスミドを供給できると信じている
知的財産権
特許と他の固有の権利は私たちの業務に必須的だ。私たちは私たちの技術、発明、そして私たちの発明の改善を保護するために特許出願を提出し、これらの発明は私たちの業務発展に重要だと思います。私たちはアメリカと重要な外国市場で広く特許登録を申請している。私たちの特許出願には、成分、製造方法、および使用を含む、我々の製品および候補製品の様々な機能に関する特許が含まれているが、私たちの特許は、競合製品の開発のための完全な保護または保証を提供することはできません。しかも、私たちのいくつかのノウハウと技術は特許を申請することができない。そのため、私たちはまた、ビジネス秘密、技術ノウハウ、持続的な技術革新と許可機会に依存して、私たちの競争地位を発展させ、維持している。また、従業員、コンサルタント、コンサルタント、および協力者にセキュリティ協定を締結することを要求していますが、このような合意は、私たちのビジネス秘密、技術的ノウハウ、または他の独自の情報に限られた保護を提供する可能性があります
2023年12月31日現在、我々の特許組み合わせは、約120件の発行された米国特許および約100件の米国特許出願、および約1,100件の発行された外国対応特許および約800件に対応する外国特許出願を含む。これらの措置の一部には:
•RRP治療のための1つの米国特許、4つの米国特許出願、および約40の対応する外国特許出願;
•GBM治療のための7つの米国特許および4つの米国特許出願、および約80件の外国対応特許および約30件の外国対応特許出願;
•約100件の米国特許および約80件の米国特許出願、および約850件の外国対応特許および約590件の対応する外国特許出願、ならびに私たちの他の早期候補製品のための;
•我々の設備交付システムに対して、4つの米国特許と6つの米国特許出願、および約160件の海外特許および約50件の海外特許出願を取得した
RRP治療に対する我々の未解決特許出願が発行されれば,約2040年から2043年の間に満了する。私たちが発行したGBM治療の特許は2027年から2037年の間に満期になり、私たちが審理している特許出願が発表されれば、2027年から2040年頃に満期になります。私たちが他の候補製品に発行する特許は2027年から2036年頃に満期になりますが、私たちの未解決の特許出願が発行されれば、2027年から2042年頃に満期になります。私たちの設備交付システムに対する発行された特許は2024年から2036年頃に満期になり、私たちが審理している特許出願が発表されれば、2024年から2042年頃に満期になります
特許出願の提出日、特許発行日及び特許が特許を取得した国における法定期限により、個別特許期間の延長時間はそれぞれ異なる。私たちが特許出願を提出したほとんどの国では,米国を含め,特許期間は最初に優先が要求された非臨時特許出願が提出された日から20年である。場合によっては、特許期間は、特許期間の延長または特許期間の調整のような場合に延長することができ、または、例えば、米国では、1つの特許が以前に提出された特許によって最終的に放棄された場合、特許期間を短縮することができる。特許によって提供される保護は、製品によって異なり、国によって異なり、特許のタイプ、そのカバー範囲、規制に関連する延長の利用可能性、特定の国の法的救済措置の利用可能性、および特許の有効性および実行可能性を含む多くの要因に依存する
もし私たちが私たちの知的財産権を十分に保護できなければ、私たちの競争相手は私たちの技術を得るかもしれないので、私たちの業務は損なわれるだろう。しかも、私たちの知的財産権を保護するには大きな代価を払わなければならないかもしれない。私たちのどんな知的財産権も他の人たちによって挑戦されたり、行政手続きや裁判所訴訟によって無効になる可能性がある。さらに、私たちの特許、または将来私たちに発行されるかもしれない他の特許は、私たちにいかなる競争優位性を提供してくれないかもしれないし、第三者の挑戦を受けるかもしれない。また,知的財産権の有効性,実行可能性,保護範囲に関する法的基準も確定していない.私たちが事業を展開しているすべての国/地域では、有効な特許、商標、著作権、商業秘密保護を得ることができないかもしれません。一部の外国の法律は知的財産権の保護は米国の法律に及ばない可能性があり、これらの国が知的財産権を執行する国内と国際メカニズムは十分ではないかもしれない。したがって、私たちは努力したにもかかわらず、私たちは第三者が私たちの知的財産権を侵害したり、流用したり、他の方法で私たちの技術を得ることを防ぐことができないかもしれない。私たちは私たちの知的財産権を監視して保護するために多くの資源が必要かもしれない。私たちは私たちの固有の権利を侵害することについて第三者にクレームや訴訟を提起したり、私たちの固有の権利の有効性を証明するかもしれない。このような訴訟は、最終的に私たちに有利な解決が得られるかどうかにかかわらず、巨額の費用をもたらし、私たちの技術と管理者のエネルギーを分散させるだろう
提出されたがまだ発表されていない申請を含む私たちが知らない権利があるかもしれないが、発行されると、私たちに不利になるかもしれない。これらの第三者は私たちにクレームをつけるかもしれません。これは私たちに巨額の費用を発生させ、勝訴すれば、巨額の損害賠償を支払うことになるかもしれません。また,特許侵害訴訟を起こした場合,訴訟の対象となる製品や生物候補薬物の研究,開発,製造,販売の停止または延期を余儀なくされる可能性がある。特許侵害請求のため、または潜在的なクレームを回避するために、第三者に許可を求めることを選択または要求される可能性がある。このようなライセンスは許容可能な条項で提供されないかもしれないし、全く提供されないかもしれない。私たちが許可を得ることができても、許可は私たちに許可料や印税、あるいは両方を支払うことを要求する可能性が高く、私たちに与えられた権利は非排他的である可能性があり、これは私たちの競争相手が同じ知的財産権を得ることをもたらす可能性がある。最終的に、実際または脅威の特許侵害クレームにより、許容可能な条項で許可を得ることができない場合、製品の商業化を阻止されたり、何らかの態様の業務運営を停止させられたりする可能性がある。上記のすべての問題はまた私たちの協力者に影響を及ぼす可能性があり、これはまた協力の成功に影響を与え、私たちに影響を与えるだろう
米国や米国以外の他の重要な市場,例えばヨーロッパや日本では,ワクチンを含む生物製品や加工方法に対する特許保護の程度や範囲は解決が待たれている。外国市場はアメリカの特許制度と同じレベルの特許保護を提供しないかもしれない。私たちは私たちと他の人たちの特定の固有の権利の有効性と範囲を決定するために訴訟または行政訴訟が必要かもしれないということを認識している。このような訴訟や訴訟は、将来的に大量の資源を投入することをもたらす可能性があり、運営を中断させ、私たちの製品またはプロセスを再設計させるか、または許可協定を交渉する可能性があり、これらはすべて私たちの収入に悪影響を及ぼすかもしれない。また,特許法の変化又は異なる解釈
特許法は他の人が私たちの発見や開発した製品を使用して商業化することを可能にする可能性がある
私たちは私たちが獲得した特許や私たちが持っている非特許技術が私たちに重要な商業保護を提供するという保証はない
政府の監督管理
アメリカ連邦、州と地方各級及びその他の国の政府当局は生物製品、生物製品と医療器械の研究、開発、テスト、製造、品質管理、承認、ラベル、包装、貯蔵、記録保存、販売促進、広告、流通、承認後の監督と報告、マーケティングと輸出入などの方面に対して広範な監督を行った。一般に,新しい生物や医療機器が発売される前に,その品質,安全性,有効性を証明するデータを大量に取得し,各規制機関固有のフォーマットに組織し,審査を提出し,規制機関の承認を得なければならない。監督管理機関は絶えずこれらの要求を更新して、科学、製造と潜在的な新しい脅威、例えばネットワークセキュリティ面の懸念に対応する
アメリカでの共同製品の審査と承認
いくつかの製品は、通常、異なるタイプの監督管理機関によって規制される成分から構成される可能性があり、通常はFDAの異なる中心によって規制される。これらの製品は組合せ製品と呼ばれている。具体的には、FDAが発表した法規によると、組合せ製品は以下のようになる可能性がある
•物理的、化学的、または他の方法で組み合わせまたは混合され、単一の実体として製造される2つ以上の規制された成分からなる製品
•1つのパッケージに包装されているか、または1つのユニットとして、医薬品および器具製品からなる2つ以上の別個の製品;
•個々に包装された医薬、装置または生物物品であって、その研究計画または提案されたラベルに従って、承認された個別に指定された薬物、装置または生物学的製品のためにのみ使用され、両方が予期される用途、適応または効果を達成するために必要であり、提案された製品が承認された後、承認された製品のラベルが、例えば、予期される用途、剤形、濃度、投与経路の変化または用量の大きな変化を反映するために変更される必要があるであろう
•その提案されたラベルによれば、個別に包装された任意の研究用医薬、装置または生物製品は、別の個別に指定された研究用薬剤、装置または生物製品と共にしか使用できないが、これら2つの薬剤、装置または生物製品は、所望の使用、適応、または効果を達成する必要がある
私たちの候補製品は生物を輸送するための電気穿孔装置を含む組合せ製品です。連邦食品、薬物と化粧品法案(FDCA)によると、FDAは主要な管轄権を持つ中心或いは牽引センターの分配を担当し、組合せ製品の審査を行う。この決定は組合せ製品に基づく“主要な作用パターン”であり,これは全体的な期待治療効果に最大の貢献を期待する作用モデルを意味する。したがって、デバイス-生物学的組み合わせ製品の主要な作用パターンが生物製品に起因する場合、すなわち、ウイルス、治療用血清、毒素、抗毒素、ワクチン、血液、血液成分または誘導体、感作製品または同様の製品によって機能する場合、生物製品の発売前の審査を担当するFDAセンターは、この組み合わせ製品に対して主要な管轄権を有するであろう。私たちは私たちのすべての候補品が生物学的に主要な役割モデルを持つと信じている
アメリカの生物製品開発
米国では,FDAはFDCAと公衆衛生サービス法(PHSA)とその実施条例に基づいて生物製品の規制を行っている。生物製品はまた他の連邦、州、そして地方法規によって制限されている。規制の承認を得て、その後、適切な連邦、州、地方、外国の法規と条例を遵守する過程には、多くの時間と財政資源が必要だ。製品開発過程,承認過程又は承認後のいずれかの場合,出願人が適用される米国の要求を遵守できない場合には,行政又は司法制裁を受ける可能性がある。他の行動に加えて、これらの制裁は、FDAが未解決の申請の承認の拒否、承認の撤回、臨床的保留、無見出しまたは警告状、製品のリコールまたは市場からの撤回、製品の差し押さえ、生産または流通禁止の完全または部分的な一時停止、罰金、政府契約の拒否、原状回復、返還、返還、または民事または刑事罰を含むことができる。どんな機関や司法法執行行動も私たちに実質的な悪影響を及ぼすかもしれない
私たちの候補製品は生物製品許可証申請やBLAプログラムを通じてFDAの承認を得なければなりません。その後、アメリカで合法的に発売されることができます。FDAが米国でバイオ医薬品を発売する前に必要なプログラムには、一般に以下のような態様が含まれる
•適用法規により、FDAの良好な実験室規範或いはGLP法規を含み、広範な非臨床試験を完成し、時々臨床前実験室試験、臨床前動物研究と調合研究と呼ばれる
•ヒト臨床試験が開始される前に有効でなければならないINDをFDAに提出する
•適用されたINDと他の臨床試験関連法規(良好な臨床実践或いはGCPと呼ばれることがある)に基づいて十分かつ制御された人体臨床試験を行い、提案候補製品の安全性と有効性を決定し、その提案適応を決定する
•食品医薬品局にBLAを提出しました
•設備、方法、および製品の特性、強度、品質、純度および効力を維持するのに十分な制御を保証するために、FDAの現在の良好な製造仕様またはcGMP要件に適合するかどうかを評価するために、製造製品の1つまたは複数の製造施設に対するFDAの承認前検査が満足的に完了する
•FDAは、BLAをサポートするデータを生成する臨床前および/または臨床試験場所を監査することができる
•FDAは、米国で任意の商業マーケティングまたは製品販売を行う前に、BLAの審査および承認を行う
血乳酸を支持するために必要なデータは2つの異なる発展段階で産生された:臨床前と臨床。臨床前開発段階は通常薬物化学、製剤と安定性の実験室評価、及び後続の臨床試験を支持する動物毒性評価研究を含む。臨床前研究の進行はGLPを含む連邦法規に適合しなければならない。スポンサーは,臨床前研究の結果を,生産情報,分析データ,任意の利用可能な臨床データや文献,提案された臨床案とともにINDの一部としてFDAに提出しなければならない。INDはFDAが研究薬物製品の使用をヒトに許可する要求である。INDが提出した文書の中心的な焦点は人体試験の全体調査計画と案である(S)。INDはFDAが提案された臨床試験に対して懸念または問題を提起しなければ、FDAが受信後30日以内に自動的に発効し、30日以内にINDを臨床保留状態に置かなければならない。この場合,INDスポンサーやFDAは臨床試験開始前に未解決の問題を解決しなければならない。FDAはまた、臨床試験の前または期間のいつでも、安全考慮または規定に適合しない理由で、候補製品に対して臨床保留を実施することができる。したがって,INDの提出によりFDAが臨床試験の開始を許可するか,あるいは開始すると試験の一時停止や終了を招く可能性があるという問題は生じないと判断できない
GCPによれば、臨床開発段階は、合格調査者の監督の下で健康参加者に候補製品を服用することに関連し、合格調査者は通常、試験スポンサーまたは試験スポンサーの制御下に雇われていない医師であり、すべての研究参加者に任意の臨床試験への参加についてインフォームドコンセントを提供することを要求することを含む。臨床試験は臨床試験の目標、投与手順、参加者の選択と排除基準及び参加者の安全性のモニタリングと治療効果を評価するためのパラメータなどの方案に基づいて行われる。INDの一部として、すべての議定書とその後の議定書のいかなる修正もFDAに提出されなければならない。さらに、各臨床試験は、臨床試験を行う各機関に位置するか、またはサービスする独立した機関審査委員会またはIRBによって審査および承認されなければならない。IRBは試験参加者の福祉や権利の保障を担当し,臨床試験に参加する個人のリスクが最低に低下するかどうか,期待利益と比較して合理的かどうかなどの項目を考慮している。IRBはまた、各臨床試験参加者またはその法律代表に提供されなければならないインフォームドコンセントを承認し、完成まで臨床試験を監視しなければならない
行っている臨床試験や完成した臨床試験結果を公的登録機関に報告することも求められている。FDAによって規制された製品(生物製品を含む)のいくつかの臨床試験のスポンサーは、www.Clinicaltrials.gov上で公開して得ることができる特定の臨床試験情報を登録して開示しなければならない。そして,登録の一部として,製品,患者群,調査段階,試験地点と調査者および臨床試験の他に関する情報が公開されている。FDAはスポンサーに試験完了後に大多数(すべてではない)試験の結果を開示することを求めている
臨床試験は通常3つの重複可能な連続段階で行われ、第1段階、第2段階、第3段階の臨床試験と呼ばれる。第一段階の臨床試験は一般的に一部の健康ボランティアに関連し、彼らが最初に接触したのは候補製品である。これらの臨床試験の主な目的は,候補製品の作用,副作用耐性,安全性を評価することであり,可能であれば有効性に関する早期エビデンスを得ることである。第二段階臨床試験は、一般に、予想される利益をもたらすために必要な用量を決定するために、患者を研究することに関連する。同時にその安全性を評価し、治療効果に対して初歩的な評価を行った。第3段階臨床試験は、通常、複数の国、複数の場所の大量の患者(数百人から数千人)に関連し、必要なデータを提供して、製品の予期される用途の有効性、使用中の安全性を証明し、製品の全体的な利益/リスク関係を確立し、製品承認に十分な基礎を提供することを目的としている。3期臨床試験は、プラセボおよび/または他の薬剤との比較を含むことができる
比較器処理。治療の持続時間が常に延長され、製品のマーケティング期間中の実際の使用をシミュレートする。通常,FDAはBLAを承認するために2つの十分かつ制御の良好な3期臨床試験を必要とする
承認後試験は,4期臨床試験と呼ばれることがあり,最初の上場承認後に行われる可能性がある。これらの試験は,治療適応が予想される患者の治療から追加的な経験を得るために用いられている。場合によっては、FDAは、BLAの承認後に生物の安全性および有効性をさらに評価するために、スポンサーが追加の臨床試験、例えばこれらの承認された試験を行うことに同意する条件でBLAを承認することができる
臨床試験結果の進展報告を詳しく説明するには少なくとも毎年FDAに提出しなければならず、書面IND安全報告はFDAと調査人員に提出しなければならず、深刻と意外な疑わしい副作用を理解し、その他の研究結果はこの薬物に暴露された人類に対して重大なリスクがあることを表明し、動物或いは体外試験結果は人類に対して重大なリスクがあることを表明し、及びいかなる臨床上重要な深刻な疑わしい副作用の発生率は方案或いは研究者マニュアルに列挙された比率より高いことを表明した。第1段階、第2段階、および第3段階の臨床試験は、もしあれば、任意の指定された時間で成功しない可能性がある。FDA、IRB、またはスポンサーは、研究参加者が受け入れられない健康リスクに曝露されていることを発見することを含む、様々な理由で臨床試験を随時一時停止または終了することができる。同様に、1つの臨床試験が委員会の要求に従って行われない場合、または薬剤が患者に予期せぬ深刻な傷害を与えた場合、IRBは、その所在機関の臨床試験の承認を一時停止または終了することができる。さらに、いくつかの臨床試験は、データ安全監視委員会または委員会と呼ばれる臨床試験スポンサーによって組織された独立した合格専門家グループによって監督される。このグループは,実験のあるデータへのアクセスにより,許可試験が指定された時間間隔で行えるかどうかを決定する.私たちはまた、変化するビジネス目標および/または競争環境に応じて臨床試験を一時停止または終了することができる。臨床試験と同時に、会社は通常追加の動物研究を完成し、候補製品の化学的および物理的特性に関する追加情報を開発し、cGMP要求に基づいて商業量産製品のプロセスを最終的に決定しなければならない。製造過程は一貫して高品質の候補製品ロットを生産することができなければならず、特に最終製品の特性、強度、品質と純度をテストする方法を開発しなければならない。また,適切な包装を選択·テストし,候補製品が賞味期限内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない
BLAとFDA審査プログラム
試験完了後,試験データを分析して安全性と有効性を評価した。臨床前研究と臨床試験の結果はその後,BLAの一部としてFDAに提出され,製品の提案ラベルとともに製品品質を確保するための製造プロセスや施設の情報,候補製品の化学成分の分析試験結果,その他に関する情報がある。BLAは、適用可能な場合に生物学的製剤を1つまたは複数の指定された適応のために結合することを承認することを承認する要求であり、広範な臨床前および臨床試験によって証明された安全性、純度、効力、および有効性を含む必要がある。この応用には,臨床前と臨床試験の陽性結果および不明確または陰性の結果が含まれる。データは、製品の安全性および有効性を試験するために、または研究者によって開始された研究を含む多くの代替源からの臨床試験から来る可能性がある。上場承認を支持するためには、提出されたデータは研究製品の安全性と有効性を確定し、FDAを満足させるために、品質と数量で十分でなければならない
改正された“処方薬使用料法案”(PDUFA)によると、BLAごとに相当な使用料を伴わなければならず、この費用は毎年調整されている。PDUFAは承認された製品にも年度計画費を徴収する。場合によっては、小企業が最初に申請した申請料を免除すること、または孤児の薬物状態に応じて費用を免除することを含む費用を免除または減少させることができる
BLAが届出を受けると、BLA提出から60日後に本当に発生した場合、FDAの目標は、標準審査申請日の10ヶ月以内または優先的に申請日の6ヶ月以内にBLASを審査することであり、申請が深刻または生命に危険な場合の製品である場合、その製品が承認された場合、安全性または有効性の面で著しく改善されるであろう。FDAはより多くの情報を提供したり、明確にすることを要求し、審査過程はしばしば大幅に延長される。申請が受け入れられない場合、スポンサーはBLAを再提出し、最初の60日間の審査を含むFDAの審査手続きを再開し、申請が十分に完全であるかどうかを決定し、実質的な審査を可能にしなければならない
FDAはまた,その加速承認計画に基づいて提出されたBLAを受け入れることが可能であり,代替終点に基づく重篤な疾患の治療と満たされていない医療需要を満たす薬剤のより早期の承認を可能にするために設立されている。代替終点は1種のマーカーであり、例えば実験室測定、放射画像、バイタルサイン或いは他の臨床利益を予測できると考えられる指標であるが、それ自体は臨床効果の最終的な測定基準ではないかもしれない。代替終点を使用することは、FDA承認を得るまでに要する時間を大幅に短縮することができる。会社はまだ期待された臨床的利益を確認するために研究を要求されている。検証性試験が薬剤が臨床的利益を提供することを確実に示す場合、FDAはその薬剤の一時的な承認を承認するであろう。検証性試験がこの薬物が臨床的利益を有することを示さなければ、FDAはすでに監督管理プログラムを制定し、この薬物を市場から上下させる可能性がある
報告のためにBLAの提出を受けた後、FDAは、提案された候補製品がその予期される用途に対して安全に有効であるかどうかを決定するためにBLAを審査し、候補製品がcGMPに従って生産されて候補製品の識別、強度、品質、純度、および効力を保証および保持するかどうかを決定する。FDAは、新薬候補または安全性または有効性の問題を提起する薬剤候補の申請を諮問委員会に提出することができ、一般に、申請を承認すべきかどうか、どのような条件下で承認すべきかを審査、評価および提案するための臨床医および他の専門家を含むグループである。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を慎重に考慮するだろう。FDAは臨床試験データを再分析する可能性があり,FDAと我々の審査過程で広く議論される可能性がある。FDAによるBLAの審査や評価は広く時間がかかり,最初の計画よりも長い時間がかかる可能性があり,申請者は速やかに承認を得ることができない可能性があり,あれば
BLAを承認する前に、FDAは、それらがcGMPに適合するかどうかを決定するために、新製品の製造施設を承認前に検査する。FDAは、製造プロセスおよび施設がcGMP要件に適合していることを決定し、要求された仕様の下で製品が一貫して生産されることを保証するのに十分でない限り、この製品を承認しないであろう。また,BLAを承認する前に,FDAは臨床試験のデータを監査し,GCP要求に適合することを確保することも可能である。FDAが申請、製造プロセス、および製造施設を評価した後、それは承認状または完全な返信を発行する可能性がある。承認書は、製品の商業マーケティングを許可し、特定の適応に関する具体的な処方情報を提供する。完全な返信は、申請の審査期間が終了し、申請が現在の形で承認されないことを示している。完全な応答文は、一般に、FDAによって決定されたBLA内のすべての特定の欠陥を記述する。完全な返信は、追加の臨床データおよび/または追加の重要な3期臨床試験(S)、および/または臨床試験、臨床前研究または生産に関連する他の重要かつ時間の要求を必要とする可能性がある。完全な返信が発行された場合、出願人は、BLAを再提出し、手紙で決定されたすべての不足点を解決するか、または出願を撤回することができる。このようなデータや情報を提出しても,FDAは最終的にBLAが承認基準を満たしていないと決定する可能性がある.臨床試験から得られたデータはつねに決定的ではなく,FDAのデータ解釈は我々の同じデータに対する解釈とは異なる可能性がある
FDAが最終的に1つの製品の米国での発売を承認することは保証されず、申請者は審査過程で重大な困難やコストに直面する可能性がある。ある製品が発売承認された場合、承認は特定の人々、アレルギーの重症度および用量に明らかに限定される可能性があり、または使用適応が制限される可能性があり、これは製品の商業的価値を制限する可能性がある。さらに、FDAは、いくつかの禁忌症、警告または予防措置を製品ラベルに含めることを要求することができ、または提案されたラベルの他の変更、十分な制御および規範の作成、または発売後の試験または臨床試験および監視を行って、承認製品の効果をBLAを承認する条件として監視することができる。例えば、FDAは、製品の安全性および有効性をさらに評価することを目的とした臨床試験を含む第4段階試験を要求することができ、商業化された承認製品の安全性を監視するために試験および監視計画を要求する可能性がある。FDAはまた、製品の安全な使用を保証するために、リスク評価および緩和策を要求すること、またはREMSを含む、承認時に他の条件を追加することができる。FDAがREMSが必要であると結論した場合,BLAのスポンサーは提案したREMSを提出しなければならない。必要であれば、FDAは承認されていないREMSでBLAを承認しないだろう。REMSは、制限された分配方法、患者登録、および他のリスク最小化ツールのような薬物ガイドライン、医師のコミュニケーション計画、または安全な使用を確保する要素を含むことができる。承認またはマーケティングに関するこれらの制限は、製品の商業普及、流通、処方、または配布を制限する可能性がある。製品承認は、規制基準を満たしていないことや、初期マーケティング後に問題が発生したことで撤回される可能性があります
発売後要求
新製品が承認された後、製造業者および承認された製品は、監視および記録保存活動を含むFDAの監督管理を継続し、適用される規制機関に製品の副作用を報告し、規制機関に最新の安全および効果情報を提供し、製品のサンプリングおよび流通要求、および宣伝および広告要求を遵守することを含み、その中には、他に加えて、消費者向けの広告基準、製品承認のためのラベルに記載されていない用途や患者集団に制限された製品の普及、ラベル外使用、業界賛助の科学的および教育活動の制限、インターネットに関連した販促活動への要求もあります医師が合法的に得られた薬品および生物製品をラベル外用途のために処方する可能性があるが、メーカーはこのようなラベル外用途を販売または普及させてはならない。製品またはそのラベルの修正または強化、または生産場所の変更は、通常、FDAおよび他の規制機関の承認を得る必要があり、これは受信されないかもしれないし、または長い審査プロセスをもたらす可能性がある。処方薬宣伝材料は初回使用時にFDAに提出されなければならない
米国では,製品が承認されると,その生産はFDAの全面的かつ持続的な規制を受ける。FDAの規定は,製品は特定の承認された施設で生産され,cGMPに適合しなければならないことを要求している。さらに、組合せ製品の構成要素は、例えば、生物学的または装置として、その規制された地位を維持しており、したがって、以下の態様に適用される品質システム法規またはQSRに適用される追加の要求を受ける可能性がある
設計制御、調達制御、是正と予防措置などの医療機器。私たちは依存し、第三者がcGMP法規に従って私たちの製品を生産する臨床と商業数に依存し続けることが予想される。CGMPは,他の事項のほかに,品質管理と品質保証およびそれに応じた記録やファイルメンテナンスが要求され,cGMPと一致しない場合を調査·是正する義務があると規定している.承認製品の製造·流通に参加するメーカーおよび他のエンティティは、FDAおよびある州機関にその工場を登録し、cGMPおよび他の法律を遵守することを確実にするために、FDAおよび特定の州機関の定期的な抜き打ち検査を受けなければならない。そのため、メーカーはcGMPコンプライアンスを維持するために、生産と品質管理に時間、お金、労力をかけ続けなければならない。これらの条例はまた製造と品質保証活動に対して特定の組織、手続き、そして文書要求を規定する。契約メーカー、実験室または包装業者を使用するBLA所有者は、合格した会社を選択し、監督することを担当し、場合によっては、これらの会社の合格サプライヤーも担当する。これらの会社およびそのサプライヤーは、(適用された場合)FDAの検査を随時受け、cGMPに適合しないことを含む違反条件を発見し、法執行行動がそのような施設の運営または販売を中断する可能性があり、それによって製造、加工または試験された製品の能力を中断する可能性がある。承認後に製品が発見された問題は、製品のリコールまたは市場からの撤回を含む製品、製造業者、または承認されたBLA所有者の制限をもたらす可能性がある
FDAはまた、承認製品の影響を監視するために、または承認に製品の流通または使用を制限する可能性のある条件を適用するために、第4段階試験、REMS、および上場後監視と呼ばれる承認後試験を要求する可能性がある。製品が以前に未知の問題を発見し、あるいは適用されたFDA要求を遵守できなかったことは、負の結果をもたらす可能性があり、負の宣伝、司法或いは行政法執行、FDAの警告状、強制要求の是正広告或いは医師とのコミュニケーション、民事或いは刑事罰などを含む。新たに発見または開発された安全性または有効性データは、新たな警告や禁忌症を増加させることを含む製品承認のラベルを変更する必要がある場合があり、他のリスク管理措置を実施する必要がある可能性もある。また、新しい立法による要求、またはFDAの政策が変更される可能性がある新しい政府要求を確立することが可能であり、規制部門が私たちが開発している製品を承認することを延期または阻止する可能性がある
保証と精算を請け負う
米国や他の地域では、患者は通常、処方薬やワクチンに関連する費用の一部または全部を第三者支払者に頼って精算される。そのため、製薬会社がその製品の商業化に成功する能力は、私営健康保険会社、他の第三者支払人及び連邦医療保険と医療補助を含む政府当局がその製品候補と関連治療のために適切な保険と補償レベルを確立する程度にある程度依存する。保証と精算のハードルとして、第三者支払人は通常、製品がFDAの承認を得て初めて発売されることを要求している
より成熟またはより低コストの治療代替案が利用可能な場合、カバー決定は新製品に不利である可能性がある。製品やサービス保険を取得する流れと関連精算を得る流れは分かれている。精算水準は医師や患者の製品やサービスの採用に影響を与える。また,医療プログラムに関連する製品は単独で精算されない可能性があるが,そのコストは提供者がプログラムのために受け取った支払いの一部として束ねられる可能性がある。製品やその製品を使用した治療や手続きは単独では精算できない可能性がある
薬品とワクチンの保証範囲と精算政策は支払人によって異なり、米国には統一された第三者支払い側の薬品の保証と精算政策がないからである。保険および補償を決定するプロセスは、しばしば時間がかかり、高価であるため、保険および補償を得る上で重大な遅延が生じる可能性があり、これは、保険または適切な補償が得られることを保証することなく、各支払者にこの製品を使用する科学的および臨床的支援をそれぞれ提供する必要がある可能性がある
アメリカの医療産業と他の地域の重要な傾向の一つはコスト統制だ。第三者支払者は、特定の製品やサービスのカバー範囲や精算金額を制限することでコストを抑制しようとしている。第三者決済者たちは医療製品とサービスの有効性と料金にますます挑戦している。また、アメリカ政府、州立法機関と外国政府実体はコスト制御計画の実施に大きな興味を示し、政府が支払う医療コストの増加を制限し、価格制御、精算とカバー範囲の制限、ブランド処方薬の代わりに模造薬を要求することを含む
医療改革
米国とある外国司法管轄区では、医療システムはすでにいくつかの立法と監督管理の変化が発生し続けており、これらの変化は医薬製品を販売する収益力に影響を与えている。米国では、連邦政府は“衛生保健·教育和解法案”によって改正され、または総称して“ACA”と呼ばれる“患者保護·平価医療法案”を公布した。他の事項を除いて,ACAは最低水準を向上させた
ブランド薬品メーカーが支払うべき医療補助リベート;医療補助管理保健組織が支払う薬品に必要なリベート;メーカーにカバーギャップ割引計画に参加することを要求し、この計画によると、メーカーはそのカバーギャップ期間中に条件を満たす受益者にブランド薬品交渉価格を適用する販売時点割引(2019年1月1日から発効)を提供することに同意しなければならず、メーカーの外来薬物として連邦医療保険D部分カバーの条件に組み入れられる。特定の連邦政府プロジェクトにある“ブランド処方薬”を販売する製薬業者或いは輸入業者に差し引くことのできない年会費を徴収し、新しい方法を実施し、吸入、注入、点滴、移植或いは注射の薬品計算メーカーの医療補助薬品リベート計画の下でのリベートを計算し、340 B薬品割引計画に符合する実体タイプを拡大する;医療補助計画の資格基準を拡大する;新しい患者を中心とした結果研究所を作成し、監督、優先事項を確定し、臨床治療効果の比較研究を行い、そしてこのような研究に資金を提供する。そして、連邦医療保険と医療補助サービスセンター(CMS)に医療保険革新センターを設立し、革新的な支払いとサービス交付モードをテストし、連邦医療保険と医療補助支出を低減し、処方薬支出を含む可能性がある
ACAのいくつかの側面は司法と議会の挑戦を受けている。国会はまだ全面的な廃止立法を通過していないが、ACAのいくつかの条項を改正し、例えば2019年1月1日から、ACAを遵守していない個人の許可、すなわち1年の全部または一部の期間に合格医療保険を提供する罰則を廃止する。また,2020年1月1日から2020年の連邦支出計画が永久に廃止され,ACAが規定している雇用主支援の高コスト医療保険や医療機器税に対する“キャデラック”税や,2021年1月1日からも医療保険会社税が廃止された。米国最高裁は2021年6月17日、“個人強制令”が国会で廃止されたため、“平価医療法案”全体が違憲と弁明する手続き理由に基づく挑戦を却下した。また、2022年8月16日、総裁·バイデンは2022年インフレ削減法案に署名し、個人がACA市場で医療保険を購入する強化補助金を2025年に延長した。2025年からアイルランド共和軍は,受益者の最大自己負担コストの著しい低減と新たに構築されたメーカー割引計画の作成により,連邦医療保険D部分計画下の“ドーナツの抜け穴”を解消した。このような挑戦やバイデン政府の医療改革措置がACAと我々の業務にどのように影響するかは不明である。さらに、ACAが公布されて以来、他の立法改正も提案され、採択された
2011年8月2日、2011年の予算制御法が署名され、医療保険提供者に支払われる医療保険支払いを前期ごとに2%削減することが含まれ、2013年4月1日に施行され、国会がさらに行動しない限り、2032年まで有効となる法案の後続立法改正案が可決された。また、総裁·バイデンは2021年3月11日に“2021年米国救援計画法案”に署名し、2024年1月1日から単一源と革新多源薬に対する法定医療補助薬品還付上限を廃止し、現在この上限は薬品メーカー平均価格の100%である。2013年1月2日、2012年の“米国納税者救済法”が法律に署名し、病院を含むいくつかの医療サービス提供者に支払う医療保険を減らし、政府が提供者に追加金を取り戻す訴訟時効を3年から5年に延長した
また、処方薬や生物製品のコストが上昇していることを受けて、米国政府は薬品定価のやり方の審査を強化した。このような審査は最近のいくつかの国会調査を招き、製品価格の透明性の向上、価格設定とメーカー患者計画との関係の審査、政府計画の製品精算方法の改革を目的とした連邦と州立法を提案し、採択した。連邦レベルでは、2021年7月、バイデン政府は“米国経済における競争を促進する”という行政命令を発表し、その中には処方薬に対する条項が複数ある。バイデン行政命令への対応として、2021年9月9日、アメリカ衛生·公衆サービス部(HHS)は高薬価に対応する総合計画を発表し、その中で薬品定価改革の原則を概説し、国会が取ることができる各種の潜在立法政策を列挙し、これらの原則を推進した。また、アイルランド共和軍は、他の事項を除いて、(I)HHS交渉連邦医療保険カバーのいくつかの高支出、単一由来の薬物および生物製品の価格、および(Ii)連邦医療保険B部分およびD部分に基づいてリベートを徴収し、インフレを超える価格上昇を処罰するように指示した。このような規定は2023年度から段階的に施行される。2023年8月29日、HHSは、連邦医療保険薬品価格交渉計画が現在法的挑戦を受けているにもかかわらず、価格交渉を受ける上位10種類の薬物のリストを発表した。アイルランド共和軍がどのように実施されるかは不明だが、製薬業に大きな影響を及ぼす可能性がある。バイデン政府の2022年10月の行政命令に応答するため、衛生·公衆サービス部は2023年2月14日に報告を発表し、CMS革新センターによってテストされた3種類の新しいモデルを概説し、これらのモデルはそれらの薬物コストを下げ、獲得性を促進し、医療の質を高める能力に基づいて評価を行う。これらのモデルが将来の任意の医療改革措置で使用されるかどうかは不明である。また、2023年12月7日、バイデン政府は“ベハ·ドール法案”下の参入権を使用することで処方薬の価格を制御するイニシアチブを発表した。2023年12月8日、米国国家標準·技術研究所は、権限行使を考慮した機関間指導枠組み草案を発表し、その中で初めて製品価格を機関が進行権を行使する際に使用できることを決定する要因とした。これまでデモの権利を行使したことはなかったが、新たな枠組みの下で、この権利が継続するかどうかは定かではない。州レベルでは、立法機関はますます立法して実施されている
価格または患者精算制限、割引、特定の製品参入およびマーケティングコスト開示の制限および透明性措置を含む医薬品および生物製品の価格設定を制御するための法規は、場合によっては、他の国からの輸入および大量調達を奨励することを目的としている
医療保険法
詐欺および乱用、透明性、患者の権利およびプライバシーに関連するいくつかの連邦、州、地方、および外国の医療保健法律および法規は、製薬会社の業務に適用される。製薬会社の経営能力に影響を与える可能性のある法律には
•連邦医療保健計画は、他の事項に加えて、人々が要求、受け入れ、または報酬を提供することを禁止し、個人の推薦を直接または間接的に誘導または奨励し、あるいは物品、商品、施設またはサービスを購入、注文またはレンタルし、これらの費用は連邦医療保険または医療補助などの連邦医療計画によって支払うことができる
•個人または実体が虚偽または詐欺的な医療保険、医療補助、または他の第三者支払人の支払い請求の提出を意図的にまたは提出することを禁止する民事虚偽請求法案を含む連邦民事および刑事虚偽請求法
•1996年の連邦健康保険携行性および責任法案、またはHIPAAは、他にも、詐欺の任意の医療福祉計画の計画を実行したり、医療事項に関する虚偽陳述を行うことを禁止している
•HIPAAは、“経済と臨床健康を促進する衛生情報技術法”及びその実施条例の改正により、ある個人と実体のプライバシー、安全と個人識別可能な健康情報の伝送に対していくつかの要求を提出した
•ACAによって作成された“医師支払い陽光法案”によれば、いくつかの薬品、器具、バイオ製品および医療用品の製造業者が、医師(医師、歯科医師、視光師、足科医師および脊椎マッサージ師を含むと定義される)および他の医療専門家(例えば、医師アシスタントおよび看護師従事者)および教育病院への支払いまたは他の方法での価値移転に関する情報、ならびに医師およびその直系親族が所有する所有権および投資権益を医師に報告することを要求するACAによって作成された“医師支払い陽光法案”による
•その他の事項以外に、FDCAは薬品マーケティングを厳格に管理し、メーカーがラベル以外の用途に薬品を販売することを禁止し、薬品サンプルの配布を管理する
•米国の“海外腐敗防止法”は、米国で株を発行した会社が政府契約やその他の業務のために外国人官僚への贈賄を禁止している
•州法は、例えば、任意の第三者支払人(商業保険会社を含む)が精算する物品やサービスに適用可能な逆リベートおよび虚偽精算法、医薬品販売および医療代表の登録を要求する州および地方法律、および場合によっては健康情報のプライバシーおよび安全を管理する州法に相当し、多くの法律は互いに大きく異なり、HIPAAによって先制されず、コンプライアンスの作業を複雑にすることが多い
•カリフォルニア州およびマサチューセッツ州の法律のような他の州および地方法律は、コンプライアンス計画の実施、業界道徳規範および支出制限の遵守、およびバーモント州、メイン州、ミネソタ州の法律などの他の州と地方法律の実施を要求し、州政府に医師のプレゼント、補償、およびその他の報酬を報告することを要求する
製薬会社は、第三者の業務配置に適用される医療法律や法規に適合することを確保するために、多大な時間とお金がかかるであろう。これらの法律の広さと使用できる法定例外と安全港の狭窄を監督するため、厳格に遵守して保護を提供する必要があるため、政府当局は結論を出す可能性があり、その業務やり方は現在或いは未来に医療保健法を適用する法規、法規、機構指導或いは判例法に符合しない。製薬会社の運営が、上述した任意の法律または同社に適用される任意の他の政府法規に違反していることが発見された場合、行政、民事および刑事罰、損害、罰金、返還、連邦医療保険、医療補助および他の連邦医療保健計画から除外される可能性があり、監禁、誠実および/または他の監督義務、契約損害、名声損害、および削減または再編業務を含む重大な処罰を受ける可能性がある
その他の規則
我々はまた各種の連邦、州と地方の法律、法規と提案の制約を受け、これらの法律、法規と提案は安全な作業条件、実験室と製造実践、動物の実験使用、および放射性化合物と伝染病製剤を含む危険または潜在的な危険物質の使用と処置に関する
研究します。未来のいかなる立法や行政行動によって引き起こされる可能性のある政府の規制の程度は正確に予測できない
重要な顧客と研究開発
2023年12月31日までの1年間、私たちの収入の29%はApolloBioから来た。2022年12月31日までの1年間、私たちの収入の94%は、2020年6月に国防総省と締結した調達契約から来ている。2021年12月31日までの1年間で、私たちの収入の43%は国防総省との調達契約から、14%の収入は私たちの協力者垂直生命科学会社からで、私たちは同社の約19%の株式を持っています
我々の設立以来,我々のほとんどの活動には,我々の電気穿孔技術や免疫療法の開発に関する研究と開発が含まれている。研究開発費用には,賃金や福祉,施設やその他の管理費用,臨床試験,契約サービス,その他の外部費用が含まれる研究開発活動を行う費用が含まれる。我々の研究開発費は2023年に8670万ドル、2022年に1兆877億ドル、2021年に2.492億ドルとなる
地理情報
2023年12月31日、2022年、2021年12月31日までの年間、私たちのすべての収入はアメリカから来ています。私たちのすべての長期資産はアメリカに位置している。
企業情報
私たちの会社の本社は660 W.Germantown Pike、Suite 110、プリマス会議、ペンシルバニア州19462にあり、私たちの主な電話番号は(267)440-4200です
利用可能な情報
私たちのサイトはwww.inovio.comです。本年度報告に含まれている情報のほかに、私たちのサイトで私たちに関する情報を見つけることができます。私たちのウェブサイトとウェブサイトに含まれているか、またはリンクされている情報は、本年度報告の構成要素ではありません
我々は、10-K表の年間報告、10-Q表の四半期報告、8-K表の現在の報告、および1934年の“証券取引法”または“取引法”13(A)または15(D)節に提出または提供された報告書の修正案を、米国証券取引委員会または米国証券取引委員会に電子的にアーカイブまたは提供した後、合理的な可能な範囲内でできるだけ早く私たちのサイトで無料で提供する。米国証券取引委員会は、報告書、依頼書、情報声明、および我々を含む米国証券取引委員会に電子的に文書を提出する発行者に関する他の情報を含むインターネットサイト(www.sec.gov)を保持している
当社の監査委員会、指名及びコーポレートガバナンス委員会及び報酬委員会の規約、私たちのビジネス行動及び道徳基準、当社のコーポレートガバナンス基準、及び当社の取締役会に連絡する情報を含む会社ガバナンスに関する情報は、当社のサイトで見つけることができます
私たちのビジネス行動と道徳基準は、私たちの最高経営責任者と財務責任者に適用される道徳的基準を含み、彼らも私たちの最高会計官である。法律の適用要件に応じて、“道徳的規則”の任意の修正または免除は、当社のウェブサイトまたは8-Kフォームの報告書に直ちに発表されます
従業員と人的資本
2024年2月14日まで、私たちは122人をフルタイムで雇用した。総数の中で、90個は製品研究であり、研究開発、品質保証、臨床、工程と製造を含み、32個は一般と行政機能であり、会社発展、情報技術、法律、商業、投資家関係、財務と会社管理を含む。私たちの労働力の約半分は女性で構成され、約半分は異なる民族的背景を持つ個人で構成されている。しかも、私たちの取締役会の8人のメンバーのうち4人が女性だ。私たちの職員たちは皆集団交渉協定によって制限されていない。私たちは私たちが従業員と仲がいいと思う
私たちは競争の激しいバイオテクノロジー産業で競争を展開している。研究、品質保証、臨床、工事、製造とその他の職場の人材を誘致、育成と維持することは、著者らの戦略と著者らの有効な競争能力を実行するために重要である。私たちがこれらの人材を募集し、維持する能力はいくつかの要素に依存しており、給与と福祉、人材発展と職業機会及び労働環境を含む。これのために、私たちは従業員たちに投資して、理想的な雇用主にする
従業員敬業度
私たちの努力が医療の提供方法に影響を与えることに伴い,私たちの従業員が知って参加することが重要であると信じている。私たちは様々なコミュニケーションを通じて従業員と頻繁かつ透明なコミュニケーションを行っています。ビデオと書面コミュニケーション、市庁会議、従業員調査、社内ネットワーク、
いくつかの奨励と表彰活動を通じて、会社の成功に対する個人の貢献を表彰する。私たちは、これらの敬業は従業員に私たちの戦略、文化、趣旨を理解させ、最大限の努力をするように激励すると信じている
健康、安全、健康
従業員の健康、財務的健康、生活バランス、心理的健康は私たちの成功に重要だ。私たちは財政的、身体的、精神的健康を含む全社的な包括的な健康計画を持っている
私たちの環境、健康、安全チームは、現地、地域、世界的に注目されている問題と傾向と同期し、職場の傷害と安全リスクを減らすために安全手順を確保している。従業員は実験室や製造施設の様々なセキュリティプログラム訓練を完了し、特定の作業職責に基づいて専門的なセキュリティ訓練を完了しなければならない。指定されたセキュリティ官と応答チームは、セキュリティ関連の取り組みを監視し、セキュリティ委員会は、セキュリティ手順、実践、および政策に関する意見を提供する。従業員はその特定の仕事の職責に関連する個人保護装備を着用しなければならない。歴史的に、私たちの職場の職業的ダメージは低く、どんな環境や他の変化も実施する必要があるかどうかを確認するために調査されてきた
プロジェクト1 A.様々なリスク要因の評価
本年度報告書に含まれる情報については、以下の要素を慎重に考慮しなければなりません。以下に説明するリスクと不確実性は私たちが直面している唯一の危険と不確実性ではない。私たちは今知らないか、あるいは私たちが現在どうでもいいと思っている他のリスクと不確実性はまた私たちの業務運営を損なう可能性がある。実際に以下のいずれかのリスクが発生すれば、我々の業務、財務状況、経営業績は重大な悪影響を受ける可能性がある。
私たちの財務状況と追加資本需要に関連するリスク
私たちは近年重大な損失が発生しており、予測可能な未来に重大な純損失が発生し、永遠に利益を上げない可能性がある。
ここ数年間、私たちは深刻な運営損失を経験した。2023年12月31日現在、私たちの累計赤字は16億ドルです。私たちが発生した収入は限られていて、主にライセンス収入、贈与資金、そして利息収入を含む。少なくとも今後数年以内に,われわれの臨床試験や研究開発活動の推進に伴い,大量の追加的な運営損失を招き続けることが予想される。私たちは私たちの候補DNA薬物または独自の設備技術を商業化することに決して成功しないかもしれないので、将来の収入は決してないかもしれないし、利益を達成して維持することもできないかもしれない。
私たちの収入源は限られており、私たちの成功は私たちがDNA薬と独自の設備技術を開発する能力にかかっている
私たちは現在製品の商業販売から何の収入も得ていません。私たちの将来の収入創出能力は次のような成功に大きく依存しています
•DNA候補薬物の臨床試験の監督部門の承認を確保することを含む、私たちのDNA薬物候補薬物の開発と確保のために、アメリカおよび/または外国の監督部門の許可を得ることを含む
•独自の技術を開発し
•FDAと外国規制機関の承認を受けたどんな製品も商業化されるだろう
私たちの特許設備とDNA薬物候補は広範な追加の臨床研究と評価、複数の司法管轄区域の監督許可、大量の投資と重大なマーケティング努力を必要とし、その後、私たちは製品販売から任意の収入を得ることができる。FDAなどの外国規制機関の規制承認を得るまで、私たちの特許装置やDNA候補薬のマーケティングや普及は許可されていません。規制部門の承認を得て事業化に成功しなければ、独自設備やDNA薬物製品の販売から何の収入も得られず、運営を続けることができないかもしれない
少数の許可パートナーと政府の契約は私たちの収入の大きな部分を占めている
過去、私たちの収入の大部分は、限られた数のライセンスパートナーと政府の贈与や契約から来ており、私たちの候補製品を商業化することができない限り、私たちの収入の大部分は、限られた数のライセンスパートナーおよび/または政府からの贈与と契約を継続すると予想されています。収入は大きく変動する可能性があり、これは前金とイベントベースの支払いの時間と完了した仕事に依存する。もし私たちが主要ライセンスパートナーや政府とより多くの未来の契約に署名できなかった場合、契約が延期または延期された場合、または既存の契約が満期になったり、キャンセルされたりした場合、私たちは新しい業務で契約を代替できなかった場合、私たちの収入は悪影響を受けるだろう
私たちは私たちのDNA薬や独自の設備技術を開発するために多くの追加資金が必要になるだろう。これらの技術は入手が難しいことやコストが高いことが証明されているかもしれない
高価で時間のかかる研究、臨床前研究と臨床テストを行い、監督部門の許可を得て、そして著者らのDNA候補薬物と独自設備技術を市場に投入し、私たちの現在の資本以外の大量の資金を必要とする。私たちの将来の資本需要は多くの要素に依存するだろう
•私たちの既存と新製品開発計画の進捗状況
•私たちの臨床前と臨床試験の進行、範囲、結果
•規制部門の承認を得るのに必要な時間とコスト
•DNA候補薬を作るコストは
•特許侵害主張および他の知的財産権の費用の起訴、執行および抗弁;
•債務義務を果たす
•競争し合う技術と市場の発展
•私たちは、当社の製品を潜在的に市場に出すのを助けるために、第三者と連携および他の手配の能力および関連コストを確立し、維持します
受け入れ可能な条項で追加的な資金調達を受けることができないかもしれないし、根本的にできないかもしれない。国内·国際資本市場はしばしば激しい変動を経験し、特に地政学的動揺、インフレ、金利上昇の場合、株式証券の発行による資金調達の難しさが増加していることが多い。資本市場の変動はまた信用コストと可獲得性に負の影響を与える可能性があり、信用市場の流動性の不足を引き起こし、信用利差を拡大する。市場全体の安定性と取引相手の実力に対する懸念は、特に多くの貸手や機関投資家の減少を招き、場合によっては借り手への資金提供を停止する場合がある。私たちが株式証券を売却することで追加資本を調達できる限り、あるいは将来の別の取引で証券を発行することができれば、既存の株主の所有権地位は大幅に希釈される可能性がある。優先株または債務証券の発行によってより多くの資金が調達される場合、これらの証券は、私たちの普通株よりも優先的な権利、優遇、特権を持つ可能性があり、巨額の費用、利息支出、制限契約、および私たちの資産に付与された保証権益に関連する可能性がある。金利上昇はまた私たちが獲得する可能性のあるいかなる債務融資の費用を増加させるかもしれない。私たちの知的財産権に関する他の取引を許可することで資金を調達するには、短期流動性と引き換えに、貴重な知的財産権を放棄し、長期的な価値を犠牲にする必要があるかもしれない。
もし私たちが持続的な流動性要求を満たすことに成功できなければ、私たちの業務に大きな否定的な影響を及ぼすだろう。もし私たちが必要な時に受け入れ可能な条件で追加資本を得ることができない場合、私たちはいくつかの技術や製品機会に対する私たちの権利を放棄し、私たちの臨床試験を延期したり、運営を縮小したり、停止したりすることを含む、私たちの業務、私たちの株価、および将来のキャッシュフローを実現する能力に悪影響を及ぼす行動をとる必要があるかもしれない
製品開発,製造,規制承認に関するリスク
もし私たちの候補製品がFDAの承認を得られなければ、私たちはアメリカでそれを商業化することができないだろう。
アメリカで私たちの特許装置と候補DNA薬を販売する前に、私たちはFDAの承認が必要だ。もし私たちがFDAの承認を得て私たちの独自の設備と候補DNA薬を販売できなければ、私たちはアメリカで私たちの製品を販売することができなくなり、これは私たちがどんな収入を創出する能力を深刻に弱めるだろう。
この規制審査および承認プロセスは、我々の製品の前臨床研究および臨床試験の評価、および私たちの製造プロセスおよび私たちの第三者契約製造業者施設の評価を含み、長く、高価で不確実である。承認を得るためには,厳格に制御された臨床試験を通じて大量の証拠を提供し,我々の特許装置やDNA薬物候補が承認を求める各適応に対して安全かつ有効であることを証明しなければならない。もし私たちの候補DNA薬が複数の場所でまたは異なるプロセスを使用して生産された場合、私たちはまた規制部門の承認を得るために生産ロットの比較可能性を証明する必要がある。承認要求を満たすには通常数年を要し,製品のタイプ,複雑さ,新規性によって,これらの要求を満たすのに要する時間が大きく異なる可能性がある.私たちは私たちの独自の設備と現在開発されている任意のDNA候補薬がいつ規制部門の承認を受ける可能性があるかどうか分からない。また,われわれが得たいかなる承認にも,われわれが承認を求めているすべての臨床適応を含まない場合や,使用条件に関連する狭窄適応,警告,予防措置,禁忌症などの形態の重大な制限が含まれている可能性がある。この場合、私たちがこのような製品から収入を創出する能力は大幅に低下し、私たちの業務は損害を受けるだろう。
FDAは承認過程において大きな裁量権を有しており,我々の実質的な審査申請を拒否することができ,我々のデータを審査した後に意見を形成することもでき,我々の申請は我々の独自設備やDNA候補薬を承認するのに不十分であると考えられる.FDAが私たちの申請を考慮または承認しなければ、追加の臨床、臨床前、または生産検証研究を要求し、データを提出し、その後、私たちの申請を再検討することができるかもしれない。これらまたは他の研究の範囲によると、私たちが提出した任意の申請の承認は数年遅れるかもしれないし、私たちが利用できる資源よりも多くの資源を使う必要があるかもしれない。他の研究が行われて完了すれば、FDAは成功しないかもしれないし、私たちの申請を承認するのに十分ではなく、私たちの申請を承認するのに十分ではないと考える可能性もある。上記のいずれかの場合、私たちは1つ以上の承認申請を放棄することを余儀なくされる可能性があり、これは私たちの業務と将来性を深刻に損なう可能性があります。
私たちの候補製品や私たちが将来開発を求めるかもしれないどんな製品も、私たちまたは私たちの協力者が製品販売を開始するために必要な適切な規制承認を得られないかもしれません。適用された規制承認を得るか得られないかのいずれの遅延も、製品の商業化、収入の創出、収益性の実現と維持を阻止するだろう
さらに、私たちの候補製品は、生物を送達するための電気穿孔装置を含む組合せ製品であるので、薬物-デバイス複合製品の組み合わせに関連する複雑さのために、規制機関による私たちの候補製品の承認を得るために追加の時間が必要となる可能性がある。さらにFDAと同様に
もし規制機関が私たちの送達デバイスを承認しなければ、私たちはそのようなデバイスを介した送達に依存するDNA薬物を市場に出すことができないだろう。このような遅延や私たちの設備の承認を得られなかったことは、私たちの業務に大きな損害を与えるだろう
INO-3107や私たちの他の候補製品の承認を加速させることを求めれば、より速い開発や規制審査や承認過程を招くことはなく、私たちの候補製品が上場承認される可能性も増加しないかもしれません
私たちは私たちの候補製品INO-3107の承認を加速する予定で、将来的に私たちの1つまたは複数の他の候補製品の承認を加速するかもしれない。FDAの加速承認計画によれば、FDAは、深刻または生命を脅かす疾患または状態のための医薬または生物学的製剤を承認することができ、医薬または生物学的製剤は、臨床的利益を合理的に予測することが可能な代替終点に基づいて、または不可逆的発症率または死亡率よりも早く測定可能な臨床的終点に基づいて、既存の療法と比較して有意な利点を有する医薬または生物学的製剤を提供することができる。加速的な承認を得た薬物或いは生物製品に対しては、不可逆的な発病率或いは死亡率或いは他の臨床利益に対する期待効果を検証し、記述するために、市販後の検証性試験を行う必要がある。これらの検証試験は、職を尽くした調査の下で達成されなければならず、FDAは、承認前に設計、起動、および/または完全に試験に組み込むことを要求する可能性がある
治療またはRRPのためのINO-3107の加速承認、または別の疾患または状態のための将来の候補製品を求める場合、私たちは、疾患または状態に基づいて利用可能な治療方法がないか、または私たちの候補製品が既存の治療法よりも良い利点を提供するであろう。もし私たちが加速承認を得る前に、私たちが承認を加速する疾患または疾患の薬物または生物学的試験を求めている場合、私たちのいかなる競争相手も完全に承認された場合、その疾患または状況はもはや利用可能な治療法の資格に適合せず、利用可能な治療法に対する利益を示さなければ、候補製品は加速承認を得られないだろう。FDAが成功した検証性試験に基づいて承認を完全承認に転換することに伴い、治療構造は迅速に変化する可能性がある
我々は、RRPを治療したINO−3107による1/2期臨床試験のデータを使用して、加速承認計画に従ってBLAの審査のためにBLAを提出することを支援するためにFDAからフィードバックを受けたが、任意の試験が加速承認経路でFDA承認を得るのに十分であるかどうかは、このような試験の安全性および有効性の結果に依存し、FDAによって提出されたBLAを検討した後にのみ決定される
さらに、FDAは、INO−3107または加速承認経路に従って承認された任意の将来の候補製品の承認を撤回することができる
•私たちの候補製品の予期される臨床的利益を検証するために必要な1つまたは複数の試験は、そのような製品に関連するリスクを証明するために、そのような利点を検証することができなかったか、またはそのような製品に関連するリスクを証明するのに十分な臨床的利益を示さなかった
•他の証拠によると、私たちの候補製品は使用条件で安全でないか効果的ではない
•私たちは候補製品に対して必要な承認後の実験をしていません
•私たちは関連する候補製品に関連した虚偽や誤解された販売促進材料を散布する。
さらに、FDAは、承認手続きの加速を終了するか、承認を加速させるための考慮および承認の基準を変更して、承認手続きを加速させることに関する公衆の圧力または他の懸念に応答することができる。承認計画の変更や終了を加速することは、任意の臨床開発計画の加速承認を得る能力を阻止または制限する可能性がある
私たちの製品がアメリカで規制されて承認されても、私たちは決してアメリカ以外で承認されたり、私たちの製品を商業化したりすることはできません。同じリスクは、アメリカ以外で承認された製品にも適用されます。アメリカの規制承認に関連しています。
米国国外で任意の独自設備および候補DNA薬を販売するためには、安全性と有効性に関する他の国の多くの規制要件を確立し、遵守しなければならない。 承認手続きは国によって異なり、追加の製品テストと追加の行政審査期限が関連する可能性があります。他国で承認を得るのに要する時間は、FDA承認を得るのに要する時間とは異なる可能性があり、他国の規制承認過程には、米国でFDAが承認した上記のすべてのリスクおよび他のリスクが含まれている可能性がある。また、一方の国の規制承認は他の国の規制承認を確保することはできないが、一方の国で規制承認を得られなかったり、遅延したりすることは、他の国の規制過程に悪影響を及ぼす可能性がある。他の国の規制承認を得ることができなかったか、またはそのような承認を得る上での任意の遅延または挫折は、上述した米国におけるFDAの承認と同様の悪影響を及ぼす可能性がある。これらの影響には,我々のDNA薬物候補薬がすべての要求された適応で承認されない可能性があるリスクが含まれており,これは我々のDNA薬物候補薬の使用を制限し,その商業的潜在力に悪影響を及ぼすか,あるいは高価な発売後の後続研究が必要である可能性がある
臨床試験は長くて高価な過程に関連し、結果は不確定であり、早期研究と試験の結果は未来の試験結果を予測できないかもしれない。
臨床試験費用は高く,完成までに数年かかる可能性があり,その結果も確定していない。臨床試験では,いつでも失敗する可能性がある。著者らの候補製品の臨床前研究と早期臨床試験の結果は後期臨床試験の結果を予測できないかもしれない。一つの研究の結果は類似した研究結果の反映や支持を得られない可能性がある。動物研究の結果は人間の研究の結果を代表できないかもしれない。臨床試験の後期段階で、人類が使用した設備とDNA薬物候補は期待された安全性と有効性の特徴を示すことができないかもしれないが、すでに臨床前研究と初歩的な臨床テストを通じて進展を得た。FDAや類似外国当局の承認を得るのに要する時間は予測できないが,通常臨床試験開始後数年が必要であり,これは多くの要因に依存する。また,承認政策,法規,あるいは承認を得るために必要な臨床データのタイプや数が変化する可能性がある。私たちはまだ誰も製品を使用する規制部門の承認を得ていない。
私たちの候補製品は様々な原因で臨床試験過程を完成できないかもしれません
•私たちの独自の設備または候補製品がどの適応に対しても安全かつ有効であることをFDAまたは同様の外国の規制機関に証明することはできないかもしれない
•臨床試験結果はアメリカ食品薬品監督管理局或いは類似の外国監督機関が許可した臨床或いは統計学的意義レベルに符合しない可能性がある
•FDAまたは同様の外国の規制機関は、私たちの臨床試験の設計または実施に同意しないかもしれない
•臨床試験に参加するのに十分な数の参加者を募集することはできないかもしれません
•私たちの特許装置やDNA薬物候補の臨床的および他の利点が彼らの安全リスクを超えていることを証明できないかもしれません
•私たちの特許装置または候補製品がFDAがプラセボ対照試験を要求する任意の適応において既存の療法またはプラセボよりも優れていることを証明することはできないかもしれない
•FDAまたは同様の外国の規制機関は、前臨床研究または臨床試験データの解釈に同意しないかもしれない
•私たちの候補DNA薬の臨床試験から収集されたデータは、新薬申請または他の提出をサポートするのに不十分であるか、または米国または他の場所の規制承認を得るのに十分ではないかもしれない
•FDAまたは同様の外国の規制機関は、私たちまたは私たちの協力者が臨床および商業供給契約を締結する第三者メーカーの製造プロセスまたは施設を承認できない可能性がある
•FDAなどの外国規制機関の承認政策や法規は大きく変化する可能性があり、私たちの臨床データは承認を得るのに十分ではない
臨床試験の開始、進行、または完了を遅延させることは、私たちのコストを増加させ、私たちの収入を創出する能力を遅延または制限するかもしれない。
臨床試験の開始,進行あるいは完了の遅延は我々の製品開発コストに著しく影響する可能性がある。計画中の臨床試験が時間どおりに開始されるかどうか,あるいは予定通りに完了するかどうかは分からない。また,行われている臨床試験は予定通りに完了できない可能性があり,あるいは全く達成できない可能性があり,様々な原因で規制機関に棚上げされる可能性がある。臨床試験の開始と完成は様々な原因で延期される可能性があり、以下に関連する遅延を含む
•規制部門の承認を得て臨床試験を開始した
•遺伝子に基づく療法に関する第三者臨床試験の不良結果とその規制反応
•予想されるCROと裁判場所で受け入れられる条項と合意し、その条項は広範な交渉を行うことができ、異なるCROと裁判場所の条項は大きく異なる可能性がある
•将来的に遺伝子に基づく治療の臨床試験により厳しい基準を適用することを禁止または適用する
•臨床試験のために十分な数の特許装置とDNA候補薬を生産し
•所望の場所で臨床試験を行うために、内部審査委員会またはIRBの承認を得る
•様々な原因により、患者の臨床試験への参加募集と登録速度は期待より遅く、類似適応からの他の臨床試験計画の競争を含む
•監督部門の許可を得て、国際的に臨床試験を行い、国際標準を達成した
•すでに臨床試験を開始したが、治療副作用、治療効果の不足或いは個人問題のため退出する傾向がある患者、或いは更なるフォローアップにより連絡を失った患者を保留する
•私たちの臨床試験データを収集し検討し分析し
•世界的な動揺は、ロシアや中国などからの地政学的リスク、世界的な病原体の爆発や流行、テロ活動、イスラエルとハマスの間の衝突、銀行の倒産、その他の経済や他の私たちがコントロールできない外部要因を含む。
まれな疾患候補品の臨床試験,例えばわれわれが計画しているINO−3107による再発性気道乳頭腫症(RRP)の実証試験は,この疾患の患者数が少ないため,十分な数の患者を募集することが困難である可能性がある。RRPは特定のHPVタイプ6型および11型によるものであり、発音困難、呼吸窮迫、または他の乳頭腫に関連する症状が出現しない限り、標準的なRRP患者の診断/スクリーニングレジメンはないため、INO−3107が潜在的な治療法の患者である可能性があることを識別および診断することは困難である可能性がある
臨床試験も中期結果の不明確あるいは負のため延期される可能性がある。さらに、我々、FDA、関連臨床試験を監視するIRB、当サイトに関連する任意の臨床試験サイト、または他の規制機関は、様々な要因によって臨床試験を一時停止または終了する可能性がある
•臨床試験は法規の要求や私たちの臨床方案に従って行われていない
•FDA或いはその他の監督機関による臨床試験操作或いは試験地点の検査は、臨床一時停止を招く
•予測不可能な安全問題
•臨床試験を継続するのに十分な資金が足りない。
もし私たちがどんな臨床試験の完了を遅延または終了すれば、私たちの独自の設備と候補DNA薬の商業的な将来性が損なわれる可能性があり、私たちが製品収入を作る能力は延期または完全に除去されるだろう。さらに、臨床試験の開始または完了遅延をもたらす多くの要因は、最終的に候補製品の規制承認が拒否される可能性もある。また,臨床試験の開始,進行あるいは完了の遅延はわれわれ普通株の取引価格に悪影響を及ぼす可能性がある。
私たちの候補DNA薬は販売が許可されていません。私たちは商業的に成功したDNA医薬製品を開発しないかもしれません。
著者らのDNA薬物計画は異なる研究と開発段階にあり、現在発見、臨床前研究と1、2、3期臨床試験中のDNA薬物候補を含む。従来のワクチンと比較して、DNA薬物候補薬物の治療効果データは限られており、FDAまたは任意の類似の外国規制機関が私たちの任意のDNA薬物候補薬を承認する前に、多くの追加的な研究と開発を行わなければならない。様々な理由で、候補DNA薬の開発と商業化の努力が延期されたり失敗したりする可能性がある。例えば、私たちは製品開発と臨床試験で遅延に遭遇するかもしれない。私たちの候補DNA薬物は無効または安全ではないことが発見されるか、あるいはさらなる臨床開発を行うか、あるいは上場を許可するために必要な監督管理許可を得ることができない可能性がある。私たちの製品は、規制部門に安全で効果的だと思われても、大規模な生産や市場に経済的ではない、あるいは私たちの競争相手がより速く、より効率的により良い製品を開発したり、彼らの競争製品をより効率的に販売することができないかもしれません
また,ワクチンや免疫療法候補薬や投与技術に関連する有害事象や有害事象の見方は,ビジネス成功製品を開発する能力に悪影響を及ぼす可能性がある。例えば、製薬会社はずっといくつかの小児科ワクチンの使用による人身傷害の告発を受けており、脳損傷、中枢神経系損傷と自閉症を含む。これらおよび他の声明は、ワクチンおよび免疫療法製品の使用に対する公衆の見方に影響を与える可能性があり、政府のより厳しい規制、より厳しいラベル要件、および私たちの潜在的製品のテストまたは承認可能な規制遅延をもたらす可能性がある。
私たちはこれまで新冠肺炎候補ワクチンの開発に多くの資源を費やしてきた。我々は現在,第三者との協力による一次および異種強化ワクチンの開発のみを求めているが,我々の候補ワクチンがどの国でも規制部門の承認を得ることは保証されておらず,一次ワクチンや強化ワクチンとして,緊急使用許可でも他の方法でも保証されていない。
2020年から,われわれは新冠肺炎候補ワクチンINO−4800の臨床開発に大量の資源を投入した。われわれはこれまでInnovateと呼ばれるINO−4800の2/3期臨床試験を行っていた。監督管理フィードバックと新冠肺炎ワクチンの競争構造に基づいて、著者らは2022年に革新試験を停止し、そして他の一次ワクチンを接種した後、著者らの新冠肺炎ワクチンを潜在的な異種増強剤として開発する戦略を取った。現在の世界の新冠肺炎ワクチンに対する需要、規制スケジュールと要求の変化、政府財政支援の減少、および以下の機会に関する全体的な不確実性を評価した後
異種強化ワクチンでは,2022年第4四半期に新冠肺炎異種強化ワクチンとしての内部援助によるINO−4800の開発努力を停止した
私たちはINO-4800に対して積極的な臨床試験を行わなくなり、米国で規制部門の承認を得ることは決してないと予想される。私たちの協力者Adaccineは、その200人の参加者の相同と267人の参加者の異種強化ワクチン試験の中国での登録を完了した。彼らは、INO-4800を異種推進剤として使用するための緊急使用許可またはEUAを中国およびアジアの他の国の規制機関に求めることができる。しかしながら、そのような決定はいずれもAdvaccineによって行われ、AdvaccineがEUAまたは他の同様の許可を申請することを保証することはできない、またはそれが実際に適用される場合、Adaccineはこのような許可を得ることができるであろう。各国が公衆衛生上の緊急事態になっていなければ,EU合意を得ることができない可能性があり,この場合には包括的な承認を求める必要がある
私たちは私たちの新冠肺炎候補ワクチンが世界保健機関連帯試験ワクチンに参加した結果を待っている。この試験の結果,米国以外の国では候補ワクチンのためにEUAを求める戦略をとることも可能である。最終的にEUAまたは他の許可を得ても、私たちは、適用される規制機関の政策および指導に依存して、私たちの候補ワクチンのマーケティングおよび販売に関連するこのような方法で許可されたワクチンを管理する。もしこれらの政策および指導が意外におよび/または実質的に変化した場合、または私たちがそれらを誤解した場合、私たちの製品の潜在的な販売は不利な影響を受ける可能性がある。もし私たちの製品に安全問題や他の懸念が発生した場合、または私たちまたはAdaccineが許可条件を遵守できなかった場合、規制機関はEUAを終了することもできる。もし私たちまたはAdaccineが米国以外の規制機関にEUAまたは同様の許可を申請した場合、そのような許可を得ることができなかった場合、またはそのような許可を終了することができなかった場合(取得された場合)、私たちおよびAdaccineが私たちの新冠肺炎ワクチンをマーケティングおよび販売する能力に悪影響を及ぼす。
DNA薬は病気を治療し予防する新しい方法であり私たちの細胞は®投与装置は新しい投与方法であり、私たちが開発した任意の研究薬または私たちの装置の有効性、安全性または耐性に対する否定的な見方は、私たちの業務を展開し、私たちの研究薬物を推進し、あるいは規制承認を得る能力に悪影響を及ぼす可能性がある。
これまで,DNA薬はEUA承認やFDA承認を得ていない。我々の研究薬物の臨床試験または類似製品を開発する他の臨床試験における有害事象およびそれによって生じる宣伝、ならびにDNA薬物分野の任意の他の有害事象、またはRNAワクチン、遺伝子療法または遺伝子編集などの他の核酸ベースのワクチンに関連する製品のようなDNA薬物と類似していると考えられる他の製品は、私たちの1つまたは複数の計画の予想される利益の減少、規制審査の強化、患者および臨床試験協力者の私たちの研究薬物に対する信頼の低下、および私たちが開発する可能性のある任意の製品に対する需要の減少をもたらす可能性がある。私たちの候補DNA薬剤は、予期しない深刻な副作用、他の報告すべき負の臨床結果、報告可能なイベントまたは重大な臨床イベントを製造することを含むより多くの報告可能な有害事象を引き起こす可能性があり、これらのイベントまたは重大な臨床イベントは、臨床遅延またはFDAまたは適用される規制機関によって放置または他の臨床遅延をもたらす可能性があり、これらのいずれも、私たちの1つまたは複数の計画の認知および私たちの全体的な業務に負の影響を与える可能性がある。さらに、米国、州、または外国政府の公衆否定的な見方に対する反応は、新たな立法または法規をもたらす可能性があり、任意の研究薬物の開発を制限したり、任意の承認された製品を商業化したり、監督管理の承認を得たり、または他の方法で利益を達成する能力を制限したりする可能性がある。より厳格な法律制度、政府法規、または否定的な世論は、私たちの業務、財務状況、運営結果、および将来性に悪影響を与え、私たちの研究薬物の開発および任意の承認された製品の商業化、または私たちが開発する可能性のある任意の製品の需要を遅延または損害する可能性がある。
また,我々CELLECTRAの新規性は®投与装置は,この投与システムがDNA薬物の適切な方法であることを医師や第三者支払者に証明することが困難であり,現在の看護基準と比較した利点を提供する可能性がある。また、私たちまたは私たちの商業化と協力パートナーが医師、患者、第三者支払者にCELLECTRAを伝えることに成功しなかったら®もし私たちまたは私たちの商業化および協力パートナーが医師が私たちのDNA薬の注文と使用を拒否し、十分な精算を提供しなければ、第三者支払者は私たちのDNA薬に有用な治療結果を提供しないかもしれない
もし私たちと私たちが依存している契約製造業者が私たちの要求された数量で私たちの独自設備およびDNA候補薬を生産できなかった場合、またはこれらの請負業者が彼らの私たちの義務または厳格な法規を履行できなかった場合、私たちは私たちの独自設備とDNA候補薬の開発と商業化の面で遅延に直面するかもしれない。
私たちは、私たちの独自デバイスのいくつかのコンポーネントを製造し、契約製造業者のサービスを利用して、これらのデバイスの残りのコンポーネントを製造します。私たちはまた、第三者契約メーカーに依存して、私たちの臨床試験に使用するためのDNA候補薬を生産し、任意の候補製品が規制機関の承認を得られれば、商業流通にも使用される可能性がある。これらの設備と私たちの候補DNA薬物の製造には、先進的な製造技術とプロセス制御の開発を含む大量の専門知識と資本投資が必要である。メーカーは生産で困難に直面することが多く、特に商業生産規模の拡大に直面している
これらの問題は生産コストと生産量方面の困難、品質管理方面の困難、設備とDNA候補薬物の安定性と品質保証テスト、合格者の不足、及び厳格に実行された連邦、州と外国法規の遵守を含む
もし私たちまたは私たちのメーカーがこれらの困難に遭遇した場合、あるいは私たちのメーカーが他の方法で彼らの義務を履行できなかった場合、私たちのパートナーに私たちの独自の装置を提供し、臨床試験に候補DNA薬を提供したり、製品を商業的に発売する能力が脅かされるだろう。例えば,我々は以前VGXIに依存して我々のDNA薬物候補対象のためのDNAプラスミドを作製し,その後彼らは製造能力が乏しいため必要なプラスミドを産生できなかった。結果的に、私たちはいくつかの追加的な第三者契約製造業者を招聘しなければならない。しかし、私たちは商業的に合理的な条件で私たちの任意の候補DNA薬のために十分な追加的な製造能力を確保できるという保証はない。十分な製造能力を確保できない、あるいは必要な製造技術を第三者に譲渡することができないことは、私たちの商業化計画に悪影響を与え、私たちの名声を損なう可能性もあります。
また,われわれのDNA候補薬に臨床試験用品を提供するいかなる遅延や中断も,われわれの臨床試験の完了を遅らせる可能性があり,われわれの臨床試験計画の維持に関連するコストを増加させ,遅延した期間に応じて,顕著な追加費用で新たな試験を開始するか,または試験を完全に終了することが求められる
また,我々の製品のすべてのメーカーはFDAがその施設検査計画で実行したcGMP要求を遵守しなければならない。これらの要求には、他にも、品質管理、品質保証、および記録およびファイルの生成および保守が含まれる。私たちの製品のメーカーはこれらのcGMP要求やFDA、州、外国の他の規制要求を遵守できないかもしれません。私たちは私たちの製造業者がこのような規制と基準を遵守しているかどうかをほとんど統制できない。これらの要件を遵守しないことは、罰金や民事処罰、生産停止、製品承認の一時停止または延期、製品の差し押さえまたはリコール、または製品承認の撤回につながる可能性があります。もし私たちまたは私たちの製造業者が適用法や他の理由に従わなかったことによって製品の安全が損なわれた場合、私たちは規制機関の私たちの製品の承認を得ることができないか、または商業化に成功できない可能性があり、それによるいかなるダメージにも責任を負わなければならないかもしれない。これらの要素のいずれも、私たちの製品の臨床試験、規制提出、承認または商業化の遅延を招き、コスト上昇を招いたり、私たちの製品を効果的に商業化できなくなったりする可能性がある。また、私たちのメーカーが提供された仕様と商業合理的な価格に基づいて必要な商業数量をタイムリーに渡すことができない場合、私たちの製品に対する需要を満たすことができず、潜在的な収入を損失する可能性があります。
私たちの候補製品は“公衆衛生サービス法”と“連邦食品、薬品と化粧品法”に適合する生物と機器法規の組み合わせ製品です。第三者メーカーは、FDA薬品cGMP法規の適用条項、品質体系法規に体現された設備cGMP要件または米国以外の類似法規要件を含むcGMP法規、生物/設備組合せ製品に適用される法規を遵守できない可能性がある。私たちまたは私たちの第三者製造業者が適用された法規を遵守できなかったことは、臨床封印、罰金、禁止、民事処罰、遅延、許可の一時停止または撤回、許可証の取り消し、候補製品の差し押さえまたはリコール、運営制限、刑事起訴を含む制裁を加える可能性があり、いずれも候補製品の供給に深刻な影響を与える可能性がある
私たちは単一ソースのサプライヤーに依存して、私たちの候補製品と研究薬物で使用されているいくつかのコンポーネントと材料、そして開発に必要なプロセスを提供します。
私たちは現在、単一源のサプライヤーに依存して、私たちの候補製品と薬物を研究するために必要ないくつかのコンポーネントと材料、そして開発と商業化に必要な製造プロセスを提供している。私たちは、これらのサプライヤーやサービスプロバイダが経営を継続し、私たちの需要を満たすのに十分な能力や供給を持っていることを保証することができず、私たちの競争相手や他の関心がないかもしれない他の会社によって購入されないことを保証することはできません。私たちは原材料、部品、肝心な工程と完成品の単一ソースサプライヤーを使用して、供給中断、価格上昇あるいは納品遅延を含むいくつかのリスクに直面させます。一般的に、代替部品の代替供給源は比較的少ない。これらのサプライヤーは未来の臨床試験或いは商業販売に対する私たちの需要を満たすことができないか、或いは満足したくないかもしれない。これらの構成要素、材料、およびプロセスのための追加または置換仕入先を確立するには、多くの時間が必要となる可能性があり、法規要件に適合する代替仕入先を確立することは困難である可能性がある。任意の単一ソース供給者またはサービスプロバイダからの任意の供給中断は、供給遅延または中断をもたらす可能性があり、これは、私たちのトラフィック、財務状態、運営結果、および将来性を損なうことになる。
もし私たちがサプライヤーを交換しなければならない場合、私たちの候補製品や研究薬の製造と交付は長い間中断する可能性があり、これは私たちの業務に悪影響を及ぼす可能性がある。必要に応じて、私たちの候補製品または研究薬物で使用される任意の構成要素またはプロセスのための追加または代替供給者を確立することは、すぐには完了しないかもしれない。代替サプライヤーを見つけることができれば、代替サプライヤーは合格を必要とし、追加の規制機関の承認が必要になる可能性があり、これはさらなる遅延を招く可能性がある。単一の供給源部品と材料の在庫を十分に維持することを求めていますが
私たちの候補製品、構成要素、または材料供給の中断または遅延、または代替源から受け入れ可能な価格でコンポーネントまたは材料をタイムリーに得ることができず、研究用薬物を供給する能力を損なう可能性があります。
私たちのこれらのサプライヤー、サービスプロバイダ、および製造業者への依存は、私たちの名声、業務、および財務状況を損なう可能性がある一連のリスクに直面させます
•私たちの開発候補や研究薬の開発スケジュールを延期します
•仕入先業務の変更または中断による供給中断;
•未修正の欠陥、信頼性の問題、または部品上のサプライヤーの変化による製品出荷遅延;
•私たちのサプライヤーとの重要な部品の長期供給スケジュールが不足しています
•十分な供給をタイムリーに得ることができない、あるいは商業的に合理的な条件で十分な供給を得ることができない
•代替サプライヤーの難しさとコストをタイムリーに探して決定します
•代替サプライヤーからの部品に関する生産遅延、および対応する規制資格を評価およびテストすること
•私たちのサプライヤーは他のお客様の注文を優先しているため、納品が遅れています
•供給者が生産した欠陥部品が私たちの名声に与えた損害;
•当社やその他のお客様のニーズが変化するため、当社の仕入先の納品量に変動が生じています。
これらのリスクのいずれかが現実になれば、コストが大幅に増加する可能性があり、製品の需要を満たす能力が影響を受ける可能性がある。
私たちの製品が規制部門の承認を得ても、それらは未来の発展と規制面の困難に直面する可能性がある。
米国の監督管理機関の承認を得ても、監督管理機関は製品の指示用途やマーケティングに重大な制限を加えたり、費用が高い可能性の高い承認後の研究に持続的な要求を提出したりする可能性がある。このような政府の規制は遺伝子に基づく治療法に対して特に厳しいかもしれない。当社の製品はまた、ラベル、包装、保存、広告、販売促進、記録保存、およびセキュリティおよび他の発売後の情報の提出に関するFDAの継続的な要求を遵守します。例えば、FDAは医療製品を販売促進する可能性があるという声明を厳格に規制している。特に、製品は、当該製品が承認されたラベルに反映されるように、FDA承認されていない用途に使用されてはならない。一方,医師は非ラベル用途のための製品を開発する可能性がある。FDAおよび他の規制機関は、医師が独立した医療判断において行う薬物治療選択を規範化していないが、彼らは、マーケティング許可が発行されていない製品のラベル外用途に関連する会社またはその販売者からの販売促進情報を制限している。しかしながら、場合によっては、会社は、FDAによって承認された製品ラベルと一致する真で誤解されない情報を共有するかもしれない。また、医薬品メーカーおよびその施設は、現在の良好な生産実践またはcGMP法規に適合することを確実にするために、FDAおよび他の規制機関の持続的な審査と定期検査を受けなければならない。もし私たちまたは監督管理機関がある製品に以前に未知の問題、例えば意外な深刻性や頻度の不良事件、あるいはその製品の生産施設に問題があることを発見した場合、監督管理機関は製品、製造業者、または私たちに制限を加える可能性があり、製品が市場から撤退したり、生産を一時停止したりすることを含む。もし私たち、私たちの候補DNA薬、あるいは私たちの候補DNA薬の製造施設が適用される規制要求を遵守できなければ、規制機関は:
•警告状や無見出しの手紙を出す
•民事または刑事罰を加える者
•規制承認を一時停止する
•進行中の臨床試験を一時停止します
•処理すべき申請の承認または私たちが提出した申請の追加を拒否する;
•コストの高い新しい製造要件を含む運営に制限を加える;または
•製品を差し押さえたり差し押さえたり、私たちに製品のリコールを開始するように要求します
我々は臨床経験のほとんどない疾患を治療するために,我々のいくつかの研究DNA薬を開発し,新たな終点や方法を用いて治療している。したがって,FDAや他の規制機関はわれわれの臨床試験の終点を考慮して臨床的に意義のある結果を提供しない可能性がある。
現在承認されていない薬物療法は,現在解決あるいは将来解決可能な多くの疾患の根本的な原因を治療しようとしている。これらのまれな疾患を治療する薬剤を開発する臨床試験経験は限られており,どの登録試験が一つの試験につながったのかは不明である
これらの病気を治療する薬ですいくつかの歴史上の他の薬物に対する試験があり、これらの薬物は臨床終点を利用しているかもしれないが、これらの終点は著者らの潜在的欠陥を解決する努力にあまり適していない。したがって,これらの疾患や他の疾患を設計·治療する研究薬の臨床試験には,より長い時間,よりコストがかかる可能性があり,あるいはこれらの疾患開発の新規性の一部として効果が悪い可能性がある。例えば、私たちの候補製品INO-3107はRRPのために開発されており、これはまれな疾患であり、承認されていない非外科的治療である
FDAが我々の成功基準が十分な検証と臨床的意義を得ていることを確実に発見しても、私たちあるいは私たちの戦略パートナーが私たちの計画のために行う可能性のあるいかなる重要な或いは他の臨床試験においても、私たちは事前に指定された終点に到達できず、ある程度の統計的意義を達成することができないかもしれない。また,あらかじめ指定された基準を達成しても,われわれの実験では予測不可能な結果が生じたり,試験におけるより伝統的な奏効率の終点の結果と一致しない可能性がある。FDAは他の治療効果の終点が主要な終点よりも高いすべてを圧倒する重みを与えることができ,この終点で統計的に顕著な結果が得られても,われわれの副次的な治療効果の終点でそうしていなければ。FDAは製品の利益とリスクもトレードオフし,FDAは安全性を背景に治療効果結果を不支持と見なす可能性がある。ヨーロッパと他の国の他の規制機関はこのような端末に対して似たような結論を下すかもしれない。
私たちは私たちのDNA薬物候補の中の一つについて孤児薬物の称号を得た。私たちの業務戦略の一部として、私たちはより多くのDNA候補薬のための孤児薬物指定を求め続け、私たちは新しい指定を得ることができないかもしれないし、可能な孤児薬物排他性を含む孤児薬物指定に関する利点を得ることができないか、または維持できない可能性がある。
我々はRRPを治療するINO−3107の孤児薬名をFDAから取得した。私たちはこれに成功できないかもしれないが、私たちはこれを成功させることができないかもしれないが、私たちは私たちの1つ以上の他の候補DNA薬の指定を求め続けているかもしれない。米国やヨーロッパを含むいくつかの管轄区の規制機関は、患者数が比較的少ない薬物を孤児薬に指定する可能性がある。孤児医薬品法によれば、1つの薬剤がまれな疾患または疾患を治療するための薬剤である場合、FDAは孤児薬として指定することができる。米国では、まれな疾患または疾患の定義は、通常、患者数が20万人未満であること、または米国では患者数が20万人を超えることを意味するが、米国では、米国の販売から薬剤開発コストを回収することができる合理的な期待はない。米国では,孤児薬物指定は,税収割引やユーザ料金減免などの経済的インセンティブを当事者に与える権利がある。まれな疾患を治療する薬剤の臨床試験も,これらの薬剤が孤児として使用されているか否かにかかわらず,臨床試験費用の贈与資金を得る機会がある可能性がある。さらに、孤児薬物指定を有する製品がその後、このような指定された疾患に対するFDAの最初の承認を得た場合、この製品は、孤児薬物排他性を得る権利があり、これは、FDAが限られた場合に限り、同じ適応で同じ製品を販売するために、7年以内に他の出願を承認しない可能性があることを意味する
RRP治療のためのINO−3107の孤児薬の称号を得ているにもかかわらず,特定の適応で他の候補DNA薬の称号を獲得しても,医薬品開発に関する不確実性のため,これらの孤児が適応を指定したDNA薬物候補薬の発売承認を得た最初の会社ではないかもしれない。競合他社の製品がFDAによって我々の候補DNA薬と同じと決定され,我々がこれまで求めていたのと同じ適応の発売承認を得,孤児薬の独占経営権を得た場合,候補製品が臨床的に優れていることが証明できない限り,排出期間が終了するまで候補製品は承認されない可能性がある。承認された後であっても、私たちの製品を販売する能力は制限される可能性がある。さらに、孤児によって指定された適応よりも広い適応の承認を求める場合、またはFDAが指定要求に重大な欠陥があると後に決定した場合、または製造業者がまれな疾患または疾患を有する患者の需要を満たすのに十分な数の製品を保証できない場合、米国での独占営業権が制限される可能性がある。また,異なる主要な分子構造の特徴を持つ異なる薬物が同じ条件のために承認されるため,製品の孤児薬物排他性を獲得しても,この排他性は競合から効果的に保護できない可能性がある。孤児製品が承認された後であっても、FDAが後の薬剤がより安全で、より有効で、または患者ケアに重大な貢献があると結論した場合、FDAはその後、同じ疾患に対して同じ主要な分子構造特徴を有する同じ薬剤を承認することができる。孤児薬物指定は薬物の開発時間や監督審査時間を短縮することもなく、監督審査或いは承認過程において薬物にいかなる利点をもたらすこともない。しかも、私たちは私たちのいくつかのDNA薬物候補のために孤児薬物の称号を求めるかもしれないが、私たちは決してそのような称号を得ないかもしれない
薬物に対するFDAの突破的な治療指定または迅速なチャネル指定は、より速い開発や規制審査または承認過程を招くことがなく、市販承認を得る可能性も増加しない可能性がある。
私たちはINO-3107の画期的な治療指定を得ており、この指定を私たちの1つ以上の他の研究薬に求めることができる。画期的な治療法は、1つまたは複数の他の薬剤と単独でまたは1つまたは複数の他の薬剤と組み合わせて重篤または生命を脅かす疾患または状態を治療することを意図した薬剤として定義され、初歩的な臨床証拠は、1つまたは複数の臨床的に重要な終点において、臨床開発早期に観察される実質的な治療効果のような既存の療法よりも有意な改善を示す可能性があることを示す。そのようなものは
画期的な治療法として、FDAと試験スポンサー間の相互作用とコミュニケーションは臨床開発の最も有効な方法を確定することができ、同時に無効なコントロール方案中の患者数を最低に下げることができる。FDAから画期的な治療法に指定されている薬物は,規制提出時に臨床データの支持を得ていれば,優先審査を行う資格もある。
FDAはそれを画期的な治療法に指定する権利がある。したがって,われわれの研究薬の1つが画期的療法として指定された基準に適合していると考えても,FDAは同意せず,このような指定を行わないことにした可能性がある。いずれの場合も、FDAの従来の手順に従って承認を考慮した薬物と比較して、1つの薬物の画期的な治療指定を受けることは、より速い開発プロセス、審査または承認をもたらすことができず、FDAの最終承認を保証することもできないかもしれない。私たちがアメリカや他の管轄区域で同様の方法で加速的な承認を得ることに成功したとしても、私たちは私たちの見通しに悪影響を及ぼす要求と制限に直面する可能性がある。例えば,非常に限られた適応でのみ承認される可能性があり,必要な承認後試験に成功できない可能性があり,このような試験ではわれわれの薬物の臨床効果が確認できないか,あるいはその薬剤の承認が撤回される可能性がある。さらに、たとえ我々の1つまたは複数の研究薬が突破療法の条件を満たしていても、FDAはこの研究薬がもはや資格条件に適合していないことを後で決定するか、またはFDAの審査または承認の期間を短縮しないことを決定する可能性がある。
第三者依存に関するリスク
もし私たちが協力者やパートナーを失ったり、獲得できなかったり、あるいは私たちの協力者やパートナーが彼らと私たちとの関係に十分な資源を適用していなければ、私たちの製品開発と収益性は影響を受けるだろう
私たちは、私たちの製品に関連する開発、製造、販売、マーケティング、その他の商業化活動について流通、共同販売促進、パートナー関係、賛助研究、およびその他の手配を継続することができます。例えば、過去には、規制部門の特定の適応候補DNA薬の承認を得て、米国以外の司法管轄区域を含めて商業化するための許可と協力協定を締結してきた。私たちの協力者が適用する資源の数と時間は私たちの制御範囲内ではない
私たちの現在または未来の任意のパートナーが私たちの合意を違反または終了したり、私たちの協力活動をタイムリーに展開できなかったりすれば、私たちの製品の商業化は減少または完全に阻止される可能性がある。もし私たちのパートナーが製品をタイムリーにあるいは全く開発しないことができなければ、私たちは私たちの協力合意に基づいて事件に基づく支払い、マイルストーン支払い、または印税支払いを受けないかもしれません。協力者は彼らの戦略的重点を変え、代替技術を求めたり、代替製品を開発したりして、彼ら自身も他の人とも協力するかもしれない。しかも、私たちは以前私たちの協力者によって援助されたプロジェクトに資金を提供することを余儀なくされるかもしれないし、私たちは必要な資金を持っていないか、得られないかもしれない。私たちの製品のマーケティングにおける私たちのパートナーの有効性(あれば)は、私たちの収入と収益にも影響を与えるだろう。
私たちは新しい協力合意に到達することを望んでいる。しかし、私たちは追加的な協力計画を交渉することに成功できないかもしれません。もし構築されれば、これらの関係は科学的または商業的に成功しないかもしれません。我々の今後の成功は,我々が戦略的に他の組織と合意できるかどうかにある程度かかっている.これらの組織に内部的で外部的な制限が加えられているため、これは難しいかもしれない。一部の組織は十分な管理や関連インフラがなく,複数の会社と同時に連携できない可能性があり,開発,交渉,実施,連携実行に要する時間を延長する可能性がある.医学界が協力可能な議論に関する情報を知ると、そのメッセージが正確であるか否かにかかわらず、協力協定またはエンティティが別のエンティティとの協力を宣言しなければ、私たちに対する不利な推測を招き、それによって私たちの名声および業務を損なう可能性がある
私たちと私たちの既存または未来の協力者との間にも、財務および知的財産権の問題や私たちの合意下の他の義務を含む様々な問題で議論が生じる可能性がある。これらの紛争は高価で時間がかかり、私たちの製品の開発と商業化の遅延を招く可能性があり、あるいはパートナーとの関係を損なう可能性がある
私たちは政府機関と合意して、これらの合意は終了されるかもしれないし、未来の資金も不確実だ。援助の終了または停止は、いくつかの候補製品を開発する能力に悪影響を与え、および/または候補製品を推進するための代替資金源を探すことを要求する
我々はすでに国家衛生研究院の国家アレルギー·感染症研究所,DARPA,CBRN医学防御連盟や国防総省化学,生物,放射線·核防御(DoD)共同プロジェクト実行事務室などの政府機関と合意しており,今後も政府機関とこのような合意を締結していく予定である。私たちの業務は、これらの機関とそのプロジェクトのための十分な持続的な資金を提供することを含む、これらの政府機関がこれらの合意の下での役割を継続することにある程度依存している。政府機関がこれらの合意に投入される可能性のある資源や資金を制御することはできません。これらの合意は毎年更新される可能性があり、通常、政府機関はいつでもこれらの合意を終了する可能性があります。例えば、2021年、国防総省は私たちの新冠肺炎候補製品の第3段階試験への援助を停止し、これは私たちの支出を増加させた。
政府機関はこれらの合意の下での責任を履行しない可能性があり、これは政府機関によって中止される可能性がある。しかも、私たちはこのような合意の下で私たちの責任を履行できないかもしれない。私たちの多くの政府合意は監査を受けなければならず、監査は監査に関連した期限が過ぎた数年後に行われるかもしれない。もし監査が重大な許容されない費用を発見したら、私たちは私たちの収益に重大な費用を発生させたり、私たちの現金を減らしたりするかもしれない。したがって、私たちは未来の政府協定に加入することができないか、または加入する資格がないかもしれない
私たちと私たちの協力者は第三者に依存して臨床試験を行った。もしこれらの第三者が彼らの契約義務を成功的に履行できなかったり、予想された最終期限までに完了しなかったら、私たちと私たちの協力者は規制部門の私たちの候補DNA薬の承認を得られないかもしれないし、それを商業化することができる。
私たちと私たちの協力者はCROと合意し、私たちが行っている臨床プロジェクトにモニタと管理データを提供しました。私たちと私たちの独自の設備と候補DNA薬物のための臨床試験を行うCROは、現在の良好な臨床実践、あるいはFDAが私たちの臨床開発中のすべての製品に対して実行しているGCP、法規、ガイドラインを遵守しなければならない。FDAは試験スポンサー,主要調査者,試験地点を定期的に検査することでGCPを実行している。もし我々が候補DNA薬の臨床試験を行ったCROが適用されたGCPを遵守できなかった場合,臨床試験で生成された臨床データは信頼できないと考えられる可能性があり,FDAは任意の上場申請を承認する前に追加の臨床試験を要求する可能性がある
CROとの任意の関係が終了した場合、私たちまたは私たちの協力者は、代替CROと合意できないかもしれません。また,これらの第三者CROは我々の従業員ではなく,我々が行っている臨床プロジェクトに十分な時間や資源を投入したり,効率的に試験を行ったりすることは制御できない。これらのCROはまた、我々の競争相手を含む他の商業実体と関係がある可能性があり、彼らはまた、これらの実体のための臨床研究または他の薬物開発活動を行っている可能性があり、これは私たちの競争地位を損なう可能性がある。もしCROがその契約の職責または義務を成功裏に履行できなかった場合、あるいは予想された期限内に達成できなかった場合、もしCROが交換する必要がある場合、あるいは彼らが得た臨床データの品質或いは正確性が私たちの臨床方案、監督要求或いはその他の原因を遵守できなかった場合、私たちの臨床試験は延長、延期或いは終了される可能性があり、私たちは監督部門の著者らの候補DNA薬物の承認或いは商業化に成功することができないかもしれない。したがって、私たちの財務業績と候補DNA薬のビジネス見通しが損なわれ、私たちのコストが増加する可能性があり、私たちが収入を生み出す能力が延期される可能性がある。私たちのCROのコストが超過したり、私たちとの紛争が私たちの費用を著しく増加させるかもしれません。
私たちは正常な業務過程で各種の契約を締結して、これらの契約の中で私たちは 賠償契約の反対側に同意します。もし私たちがこれらの賠償条項に基づいて義務を履行しなければならなければ、私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼすかもしれない。
正常な業務過程で、私たちは定期的に学術、商業、サービス、協力、許可、相談、その他の賠償条項を含む協定を締結します。私たちの学術的および他の研究協定については、私たちは、私たちが許可された合意に基づいて、使用、販売、または実行された製品、プロセスまたはサービスのクレーム、および私たちまたは私たちの二次被許可者が合意下の権利を行使することによって生じる賠償機関および関係者に一般的に同意する。私たちのビジネス合意について、私たちは、製品の生産、使用、または消費によって当社のサプライヤーがもたらす可能性のある任意の第三者製品責任クレーム、および第三者が任意の特許または他の知的財産権を侵害する疑いのあるクレームを賠償することに同意します。コンサルタントに関して、私たちは一般的に彼らがサービスを誠実に履行することで提起されたクレームを補償することに同意する。
もし私たちが賠償条項の下での義務が適用された保険範囲を超えた場合、あるいは私たちが保険範囲内にないことを拒否された場合、私たちの業務、財務状況、経営結果は悪影響を受ける可能性があります。同様に、私たちが協力者または他の第三者に依存して私たちを賠償し、協力者または他の第三者が保険の保証を拒否された場合、あるいは私たちを賠償するための資産がない場合、私たちの業務、財務状況、および運営結果は悪影響を受ける可能性があります。
私たちのDNA候補薬の商業化に関するリスクは
私たちは現在小さなマーケティング組織しかありません。販売組織はありません。マーケティングと販売能力を確立できない場合、あるいは第三者と合意して私たちの製品をマーケティングして販売することができなければ、承認されれば、製品収入を生み出すことができないかもしれません。
私たちは現在、特許装置やDNA候補薬のビジネス前活動(承認されれば)を支援する小型商業組織しかありませんが、私たちはまだ販売組織を持っていません。INO-3107または規制によって承認される可能性のある他の任意の製品の商業化に成功するためには、私たちのマーケティング、販売、流通、管理および他の非技術的能力を確立するか、または第三者とこれらのサービスを実行するように手配しなければならない。私たちは自分の販売チームを作ったり、第三者パートナーを探して私たちの製品を販売することを考えています。販売チームを設立し、発展させることは、私たち自身も第三者との協力も、高価で時間がかかり、どの製品の発表も遅れる可能性があり、私たちはこの能力の開発や獲得に成功できないかもしれない。私たちはまた他の製薬やバイオテクノロジー会社と競争して、採用、採用、訓練、
市場と販売員を引き留める。ある程度、私たちは第三者に依存して私たちが承認した製品を商業化し、もしあれば、私たちが得た収入は私たち自身が商業化したこれらの製品の収入よりも低いだろう。もし私たちが自分のマーケティングや販売チームを成功させたり、第三者マーケティングや販売組織と協力したりすることができなければ、私たちの候補DNA薬を商業化することができなくなり、製品収入を作る能力にマイナスの影響を与えるだろう
もし私たちが規制機関の承認を得た製品が広い市場で受け入れられなければ、私たちがそれらの販売から生じる収入は限られるだろう。
FDAまたは他の規制機関から上場承認を得た私たちの特許設備とDNA候補薬物の商業成功は、医学界と患者集団のこれらの製品に対する受容の程度に依存する。第三者支払者(政府支払人を含む)による我々のDNA薬物候補対象のカバーと精算も通常最適なビジネス成功に必要である。私たちが承認したどの製品に対する市場の受け入れ度は多くの要素に依存するだろう
•私たちは受け入れられる安全性と有効性の証拠を提供する能力;
•医療界が私たちの独自の設備を受け入れて使用することを含めてお互いに便利で管理しやすい
•実際にまたは認識された副作用の発生率と重症度
•FDAによって承認された製品ラベルに含まれる制限または警告、例えば、潜在的な“ブラックボックス”警告を含む;
•代替治療法があるかどうか
•価格と費用対効果
•私たちまたは未来のパートナーの販売およびマーケティング戦略の有効性
•新しい治療法に対する潜在的な公衆の見方とこの業界が直面している薬品コストと関連する名声挑戦
•私たちは十分な第三者保険と十分な補償を得ることができる
•患者は第三者保険なしで自腹を切る意思がある
もし私たちの特許装置とDNA候補薬が承認されたが、医師、医療支払者、患者が十分に受け入れられるレベルに達していなければ、私たちはこれらの製品から十分な収入を得ることができず、利益を達成したり維持することができないかもしれない。また,医学界や第三者支払者に我々のDNA薬物候補者の利点を理解するように教育する努力は大量の資源を必要とする可能性があり,決して成功しないかもしれない
私たちは保険や精算政策に関連する不確実性の影響を受けており、これらの政策が私たちのDNA薬物候補者に不利であれば、私たちの製品の商業成功を阻害したり阻止したりする可能性がある
米国や他の地域では、患者は通常、処方薬や医療に関連する費用の一部または全部を精算するために第三者支払者に依存している。そのため、著者らは著者らの専用設備とDNA候補薬物の商業化に成功できるかどうかは、ある程度政府当局に依存し、MedicareとMedicaid、個人健康保険会社と他の第三者支払人が私たちのDNA薬物候補と関連治療のために適切な保険と精算レベルを確立する程度を含む。保険と精算のハードルとして、米国の第三者支払人は通常、薬品とワクチンがFDAの発売許可を得ていることを要求している
私たちが規制承認を受ける可能性のあるどの製品のカバー範囲や精算状態にも、大きな不確実性がある。すでにより成熟またはより低コストの治療代替製品がある場合、カバー決定は新製品に不利である可能性がある。特定の製品の保険を受けても,患者が受け入れられないほど受け入れられないほど高い共同支払いを発見する必要があるかもしれない。患者が私たちの薬品の全部あるいは大部分のコストを支払うのに十分でなければ、私たちの製品を使用することはあまりできません。私たちが私たちの製品のために保険を受けても、発生した収入は研究開発、知的財産権、製造、販売、流通を含む私たちのコストを支払うのに十分ではないかもしれません。
しかも、私たちのいくつかの製品は、承認されれば、医師の監督の下で提供されるだろう。医療プログラムに使用する場合,我々のDNA薬物候補者は単独で精算されない可能性があるが,彼らの費用は提供者がプログラムのために受け取った支払いの一部として縛られる可能性がある。製品自体や私たちの製品を使用した治療やプログラムについては、単独での精算は提供されない可能性があります。第三者支払者が私たちの候補DNA薬や私たちの候補DNA薬を使用するプログラムの保証や単独精算をしないことを決定すれば、承認されると、医師の私たちの製品への使用が減少する可能性があります。
製品の保証範囲や精算政策は支払人によって異なり、米国の第三者支払側には統一された製品引受と精算政策がないからだ。重大なことがあるかもしれない
保険および補償を決定するプロセスは、しばしば時間がかかり、高価であるため、保険および補償を得るための遅延は、保険または十分な補償を受けることを保証することなく、私たちの製品を使用するために、各支払者にそれぞれ科学的および臨床的支援を提供することが要求されるであろう。政府当局と第三者支払人が私たちの製品の保険や精算についてどのように決定するか予測するのは難しいです。
アメリカの医療産業と他の地域の重要な傾向の一つはコスト統制だ。第三者支払者は、特定の製品やサービスのカバー範囲や精算金額を制限することでコストを抑制しようとしている。第三者決済者たちは医療製品とサービスの有効性と料金にますます挑戦している。また、アメリカ政府、州立法機関と外国政府実体はコスト制御計画の実施に大きな興味を示し、政府が支払う医療コストの増加を制限し、価格制御、精算とカバー範囲の制限、ブランド処方薬の代わりに模造薬を要求することを含む。私たちは第三者支払人が私たちの製品の全部または一部を保証したり精算したりすることができないかもしれません。
従業員や運営に関わるリスク
もしわが社の再編計画とコスト低減の努力が予想された結果に達しなかったり、不良な結果をもたらしたりすれば、私たちの経営業績は損なわれる可能性があります。
2022年7月から2023年1月までの間に会社再編を行い、従業員総数を25%以上減少させ、私たちの大部分の請負業者も減少しました。2023年8月、私たちは約30%のさらなるリストラを発表した。そのため、私たちの全従業員数は2022年初めの300人以上から現在の約122人に減少している。 再編計画は、予想以上にリストラされた自然減員や従業員の士気低下など、予期せぬ結果をもたらす可能性があり、リストラの影響を受けていない従業員が代替仕事を探すことになる可能性がある。2022年下半期に、初めての兵力削減を行った後、自発的な減員の増加を経験した。追加的な自然減員は、私たちの運営目標を達成する能力を阻害する可能性があり、これは私たちの財務業績に実質的な悪影響を及ぼす可能性がある。しかも、私たちの労働力が減少したので、私たちはもっと大きな雇用訴訟のリスクに直面するかもしれない
さらに、これらの再編計画に関連する職が廃止されたり、キャンセルされる従業員は、私たちの競争相手の中で将来の仕事を求めることができます。私たちのすべての従業員は雇用時に私たちと秘密協定を締結する必要があるにもかかわらず、将来の雇用過程で、私たちの固有情報の機密性が維持されるかどうかを確認することはできない。私たちは、私たちの任意の再構成努力が成功するかどうか、または私たちの現在または任意の未来の再構成計画からコスト節約や他の期待的な利益を達成できるかどうかを決定することができない。さらに、私たちがリストラを継続すれば、私たちがどんな新しい成長や収入機会にも迅速に対応する能力に悪影響を及ぼすかもしれない。私たちが行っているどんな再構成活動にも予想以上の時間が必要かもしれませんし、私たちが実施できない業務の変化が必要かもしれません。もし私たちが私たちのコスト節約計画と再構成計画を成功的に実施できなかったら、あるいは私たちの予想結果を実現しなければ、私たちの運営業績とキャッシュフローは不利な影響を受けるかもしれません。
私たちは現在訴訟を受けており、追加的な訴訟に直面している可能性があり、これは私たちの業務、財務状況、名声を損なうかもしれない。
株主は過去の取引、私たちの株価の変化、あるいは他の事項について私たちを提訴するかもしれない。例えば、2020年から、多くの株主集団訴訟と株主派生苦情が私たちに対して提起され、私たちおよび私たちの役員と幹部を被告とし、私たちが重大な虚偽と誤解性の陳述をし、連邦証券法に違反したことを告発する。私たちはこのような訴訟を解決したが、私たちが未来に似たようなクレームの影響を受けないという保証はない
私たちの業務活動のせいで、私たちはまた第三者と訴訟する側になるかもしれない。2020年、私たちは私たちの契約製造業者に訴訟を起こし、そのメーカーはその後、私たちが彼らとの契約に違反し、他のクレームを違反したと反訴した。私たちが最終的に本報告書に記載されている進行中の訴訟事項で勝利するか、または将来の訴訟事項で勝利する保証はない。これらと未来の私たちに対するどんな潜在的な行動も大きな被害をもたらす可能性があり、これは私たちの財務状況、流動資金、または運営結果に大きな悪影響を及ぼすかもしれない。たとえ私たちに対する訴訟が解決されなくても、訴訟に関連する不確定性と費用は私たちの業務、財務状況と名声を損なう可能性があり、訴訟は往々にしてコストが高く、時間がかかり、業務運営に妨害を与えるからである。私たちの既存かつ潜在的な将来の訴訟を弁護することは、私たちの経営陣の時間と注意を業務運営から移行させる可能性もあり、これは私たちの業務を損なう可能性があります。
私たちはいつでも私たちとの協力を終了する可能性のある重要な人員に依存して、私たちは資金を獲得し、協力を求めたり、私たちの候補DNA薬を開発したり、マーケティングするために、より多くの合格者を雇う必要があるかもしれない
著者らの業務戦略の成功は重要な管理、技術と科学者の持続的なサービスに大きく依存し、そして私たちは臨床試験、政府監督、製造、マーケティングとその他の領域の専門知識を持つ人員を含む、より多くの合格者と管理人員を吸引と維持する能力に依存する。会社、学術機関、他の組織との間の人材競争は非常に激しい。もし私たちが肝心な人と顧問を引き付けることができなければ、私たちの成功した開発、テスト、商業化と私たちの製品と候補DNA薬物をマーケティングする能力に負の影響を与えるかもしれない
私たちの業務は衛生流行病の影響を受けるかもしれない。
新冠肺炎疫病に対応するため、2020年、アメリカの大部分の地区は著者らのオフィス、実験室、臨床試験場所と著者らが依存している第三者を含むいくつかの政府命令とその他の公共衛生指導措置を実施した。その結果,我々が期待していた臨床開発スケジュールは負の影響を受けた。同様のイベントは、将来のビジネスおよび製造中断をもたらす可能性があり、または運営減少を招く可能性があり、いずれも、私たちの業務、財務状況、および運営結果に大きな影響を与えるでしょう。新型肺炎の流行はまた全世界のサプライチェーンの中断と供給不足を招く。そのため、著者らは臨床用品、製造用品と部品の獲得に遅延と中断に遭遇し、より高い価格である用品と部品のために新しいサプライヤーを獲得せざるを得なかった。私たちが未来に似たような困難に遭遇しないという保証はない。
未来の衛生疫病は著者らの臨床試験運営に不利な影響を与える可能性があり、著者らは予想スケジュールに従って開始と計画試験を行う能力、及び参加者、主要な調査人員と現場スタッフを募集と維持する能力を含み、これらの人員は医療保健提供者として、その地理的位置で疫病が発生すれば、暴露を増加する可能性がある。試験参加者は医療施設に安全に入ることができない可能性があり,これはわれわれの臨床試験のためにデータサンプルを収集·完了するために必要である。また、未来の流行病は著者らの臨床試験の遅延を招く可能性があり、原因は病院資源の疾病に対する優先的な処理、旅行制限、参加者が試験に参加したくない可能性があり、参加者は登録後に感染疾病或いはその他の健康状況のため試験を脱退することを含む。また、私たちは独立した臨床研究者、契約研究組織、その他の第三者サービスプロバイダに依存して、私たちの臨床前研究と臨床試験を管理、監視、その他の方法で実行するのを助けることができ、疫病は彼らが私たちの計画のために十分な時間と資源を投入したり、現場に行って私たちのために仕事を実行してくれる能力に影響を与える可能性がある
私たちは激しい競争に直面しており、私たちの競争相手は、新しい破壊的技術を導入するなど、私たちのDNA薬物の開発と商業化の能力を阻害する可能性がある
もし私たちの競争相手が開発した製品の有効性や安全性が私たちの候補製品よりも明らかに良く、新しい破壊的な技術を導入すれば、候補製品の開発や商業化を達成できない可能性があり、いかなる商業化製品の販売も損なわれる可能性がある。私たちのいくつかの競争相手と潜在的な競争相手は私たちよりも多くの製品開発能力と財務、科学、マーケティング、人材を持っています。競争相手はより早く製品を開発し、FDAの承認をより早く得るか、あるいは私たちが開発している製品よりも効率的な製品を開発するかもしれない。私たちは競争力を維持するために私たちの技術能力を拡大することを求めるつもりだ;しかし、他の人たちの研究と開発は私たちの技術や候補製品を時代遅れにしたり、競争力を欠いたり、私たちよりも良い治療や治療をもたらすかもしれない。
私たちの競争相手と潜在的な競争相手には、Janssen PharmPharmticals(ジョンソンの一部)、セノフィ-アンバンテ、グラクソ·スミスクライン、メルク、ファイザー、ロー氏、エバーヴィ、ノファ、百時美施貴宝とアスリコン、CureVac、Dyavax、Genexine、Hookipa、Iovance、Nektar、Nykode、Precigen、Zydus、Vir Biotechなど、ワクチン/免疫治療の研究と開発に広く従事している大手製薬会社が含まれている。これらの会社は研究開発の面で私たちよりずっと多くの財政とその他の資源及び更に多くの専門知識を持っていて、政府契約と贈与を獲得して、研究開発仕事、製造、臨床前と臨床試験、監督管理の許可とマーケティングを支持する。これは彼らが私たちよりも新しいまたは持続的に変化する機会、技術、または市場需要に迅速に反応することを容易にするかもしれない。その中の多くの競争相手は資金が十分な大型研究と開発プロジェクトを経営しており、承認されたり開発されたりしている重要な製品を持っている
メルクとグラクソ·スミスクラインはすでにHPVに対する予防性ワクチンを商業化し、子宮頸癌を予防する。一部の会社は早期HPV感染或いは低度子宮頚発育不良の治療を求めている。環状電気切除術、通称LEEPと呼ばれ、1種の外科手術であり、現在高度な子宮頚発育不良を治療する標準看護である。Precigenは、HPVサブタイプ6および11によるRRPにおいて、ゴリラアデノウイルスベクターに基づくRRP潜在的治療法を開発しており、2024年に完成した1/2期研究に基づいてBLAに提出する予定であることを開示している。したがって、Precigenは、私たちが規制部門のINO-3107の承認を得る前に、そのRRP候補製品について市場で承認される可能性があり、これは私たちをこの指標で競争的に不利にするかもしれない。Advaxis,Genexine,Gilead Sciencesは子宮頸癌治療の候補品が開発されている。多くの会社は前癌と私たちの目標癌を治療するための異なる方法を求めている
我々はまた、様々な疾患を予防または治療するために、電気穿孔または他の送達技術(例えば、ウイルスベクターまたは脂質ベクター)を用いて伝達される抗原コードDNAを用いて、インビボで産生される抗原産生および免疫反応を誘導することを求める会社とより具体的な競争を行う
小型バイオテクノロジー会社も重要な競争相手であることが証明される可能性があり、特に大手製薬会社との協力を通じて、あるいは買収や知的財産権の開発を行うことができる。私たちの潜在的な競争相手はまた学術機関、政府機関と他の公共と個人研究組織を含み、これらの組織は研究を行い、特許保護を求め、そして製品と臨床開発とマーケティングのための協力手配を確立する。他の人たちの研究と開発は私たちの技術や製品を時代遅れにしたり、競争力を欠いたりしようとするかもしれない
もし私たちがより多くの候補製品や承認された製品を獲得、開発、販売することに成功できなければ、私たちの成長能力を弱めるだろう。
私たちは他の製品と候補製品を買収、許可、開発、および/またはマーケティングするかもしれない。これらの行動の成功は、有望な候補製品や製品を識別、選択、獲得する能力にある程度依存する
候補製品や承認された製品を提案、交渉、実施し、許可する過程は長く複雑である。他の会社には、より多くの財務、マーケティング、販売資源を有する会社が含まれており、候補製品や承認された製品の許可または買収を競合する可能性がある。私たちの資源は限られており、第三者製品、業務、技術の買収や許可を識別して実行し、現在のインフラに統合することはできません。また、未完成の潜在的買収に資源を投入する可能性があるかもしれませんが、そうでなければ、このような努力の予想されるメリットを実現できないかもしれません。私たちは私たちが受け入れられると思う条項で他の候補製品の権利を得ることができないかもしれないし、全く得られないかもしれない
さらに、将来の買収は、多くの運営と財務リスクをもたらす可能性がある
•未知の借金への開放
•私たちの業務を混乱させ、私たちの経営陣が製品や技術を開発する時間と注意を移す
•買収のために発生した巨額の債務や希釈発行された証券;
•買収と統合コストは予想以上だった
•償却費が増える
•買収された企業の業務および人員を私たちの業務および人員と合併する困難およびコスト
•経営陣および所有権の変化により、買収された任意の企業の主要なサプライヤーまたは顧客との関係が減少した
•買収された企業の重要な従業員を引き止めることはできない
さらに、我々が得た任意の候補製品は、商業販売の前に、広範な臨床試験およびFDAおよび適用される外国規制機関の承認を含む追加の開発作業が必要となる可能性がある。すべての候補製品は典型的な製品開発失敗リスクが出現しやすく、候補製品は十分な安全かつ有効であることが証明されない可能性があり、監督管理機関の承認を得ることができない可能性がある
FDAや他の政府機関の資金の変化は、新製品のタイムリーな開発や商業化を阻止する可能性があり、これは私たちの業務にマイナスの影響を与える可能性がある。
FDAが新製品を審査·承認する能力は、政府予算と資金レベル、肝心な人員の雇用と維持及びユーザー費用の支払いを受ける能力、及び法律、法規と政策の変化を含む様々な要素の影響を受ける可能性がある。したがって、その機関の平均検討時間は近年変動している。また,他の研究開発活動を援助する政府機関への政府の援助は政治過程の影響を受けており,この過程は本質的に不安定で予測不可能である。
FDAや他の機関の中断も、新薬が必要な政府機関によって審査および/または承認されるのに要する時間を遅らせる可能性があり、これは私たちの業務に悪影響を及ぼすだろう。例えば、近年、アメリカ政府は何度も閉店し、FDAなどのある規制機関はFDAのキー従業員を休暇させ、キー活動を停止せざるを得ない。政府が長期的に停止すれば、FDAが私たちが提出した規制文書を適時に審査して処理する能力に深刻な影響を与える可能性があり、これは私たちの業務に実質的な悪影響を及ぼす可能性がある。
もし私たちの情報技術システムや私たちが依存している第三者のシステムまたは私たちのデータが破壊された場合、私たちは規制を含むが、規制に限定されないこのような損害による不利な結果を経験するかもしれない
調査と行動;訴訟;罰金と処罰;私たちの業務運営の中断、名声損害、収入と利益損失、その他の不利な結果。
私たちは、複雑な情報技術システムに大きく依存して、第三者またはそのサプライヤーのための管理、ホスト、提供、および/または使用されるシステムのうちのいくつかを運営する。我々は、大量の機密、独自、または他の敏感な情報(個人情報および仮名情報を含む)を収集し、格納し、送信し、このような情報の機密性、利用可能性、および完全性を適宜維持するために、一連の技術およびプログラム制御を展開し、実行する。私たちの従業員、私たちのシステムにアクセスする権利のある他の人、または許可されていない者による重要な情報技術システムまたはインフラの深刻な故障、侵入、腐敗、破壊、中断、または利用できないことは、運営に悪影響を及ぼす可能性があります。我々が開発または第三者から取得したハードウェア、ソフトウェア、またはアプリケーションは、設計または製造上の欠陥または他のサプライチェーン問題を含む可能性があり、これらの問題は、意外にも私たちの情報およびネットワークセキュリティを脅かす可能性があります
クラウドベースの技術を含む技術の継続的な使用および発展は、我々または我々の第三者プロバイダのシステム、携帯メディア、または記憶装置に格納された情報を漏洩するための機会を創出する。サイバー攻撃、インターネットに基づく悪意のある活動、オンラインとオフラインの詐欺、その他の類似した活動は、私たちの情報·情報技術システム、および私たちが依存する第三者のシステムを脅かしている。このような脅威は一般的であり、上昇し続けており、その出所はますます困難になっており、その出所は、伝統的なコンピュータ“ハッカー”、脅威行為者、“ハッカー活動家”、組織的犯罪脅威行為者、人員(例えば、ミスや汚職)、複雑な民族国家および民族国家支援行為者(例えば、軍事衝突に関連する)など様々である。戦争と他の重大な衝突の間、私たちはこのような攻撃の高い危険を受けやすいかもしれない。我々および私たちが依存する第三者は、業務中断、情報損失、情報盗難、または産業スパイ攻撃、マルウェアまたは他のネットワーク攻撃(恐喝ソフトウェアを含む)、社会工学攻撃(深さ偽装およびネットワーク釣り攻撃を含む)、悪意コード(例えば、ウイルスおよびワーム)、サービス拒否攻撃、証明書充填攻撃、証拠取得、人員不正またはエラー、サプライチェーン攻撃、ソフトウェア脆弱性、サーバ障害、ソフトウェアまたはハードウェア障害、電気通信障害、自然災害および他の同様の脅威による名声被害を含むが、これらに限定されない様々な脅威を受けている。その中のどれも私たちのシステムインフラを危険にさらしたり、データ漏れを招く可能性がある。特に、深刻な恐喝ソフトウェア攻撃はますます一般的になっており、私たちの運営の深刻な中断、データ損失、名声被害、資金移転を招く可能性がある。恐喝支払いは恐喝ソフトウェア攻撃のいくつかの否定的な影響を軽減するかもしれないが、私たちはこのようなお金を望んでいないか、支払うことができないかもしれない。遠隔作業もより一般的になり,我々の情報技術システムやデータへのリスクも増加している.将来的または過去のビジネス取引(例えば、買収または統合)は、我々のシステムが、買収または統合エンティティのシステムおよび技術において憎む脆弱性の負の影響を受ける可能性があるので、より多くのネットワークセキュリティリスクおよび脆弱性に直面する可能性がある。また,これらの買収や統合されたエンティティを調査している間に発見されなかったセキュリティ問題が発見される可能性があり,これらのエンティティを我々の計画に統合することは困難である可能性がある
我々は、クラウドベースのインフラストラクチャ、担当者電子メール、データホスティング、および他の機能を含むが、これらに限定されない様々な環境において敏感な情報を処理するために、サービスプロバイダおよび第三者技術に依存して重要なビジネスシステムを実行する。これらの第三者の情報セキュリティアプローチを監視する能力は限られており、これらのサービスプロバイダには十分な情報セキュリティ対策がない可能性がある。もし私たちのサービス提供者が安全事件や他の中断に遭遇したら、私たちは悪い結果に直面するかもしれない。もし私たちのサービスプロバイダがプライバシーや安全に関する義務を履行できなかった場合、損害賠償を受ける権利があるかもしれませんが、いかなる情報や私たちはこのような賠償を取り戻すことができないかもしれません。
我々は,我々のデータや情報技術システムを保護するための措置を実施しているが,我々の努力が有効であることは保証されていない(サービス中断やセキュリティイベントの防止は含まれているが限定されない).私たちは、私たちの情報システム(例えば、私たちのハードウェアおよびソフトウェア、私たちが依存する第三者のハードウェアおよびソフトウェアを含む)における脆弱性を検出、軽減、修復するためのステップをとります。しかし、私たちはこのようなすべての抜け穴をタイムリーにまたは効果的に検出して修復することができないかもしれない。抜け穴は利用されてセキュリティ事件を招く可能性がある。私たちのシステムのこのような中断または破壊は、私たちのビジネス運営に悪影響を及ぼす可能性があり、および/または、キーまたは敏感な機密情報または知的財産権の損失をもたらし、財務、法律、ビジネス、および名声の損害をもたらす可能性があります。また,情報セキュリティ,データ収集と使用,プライバシーに関する規制環境が厳しくなってきていることや,我々の業務に適した新たで変化している要求にともない,これらの要求を遵守することは追加的なコストを招く可能性もある.私たちは大量の資源を費やしたり、私たちの業務活動(私たちの臨床試験活動を含む)を修正したりして、安全事故を防止しようとするかもしれない。特定のデータプライバシーとセキュリティ義務は、特定または合理的なセキュリティ対策を実施して維持することを要求するかもしれません。
適用されるデータプライバシーおよびセキュリティ義務は、影響を受けた個人、規制機関、および他の利害関係者を含むセキュリティイベントを関連利害関係者に通知することを要求する可能性がある。このような開示は費用が高く、そのような要求を開示または遵守しないことは悪い結果をもたらすかもしれない。もし私たち(または私たちが依存する第三者)がセキュリティ事件を経験した場合、またはセキュリティ事件を経験したと考えられる場合、私たちは政府の法執行行動(例えば、調査、罰金、処罰、監査、および)のような不利な結果を経験するかもしれない
これらの損害は、検査)、追加の報告要件および/または監視、敏感な情報(個人データを含む)を処理するための制限、訴訟(集団クレームを含む)、賠償義務、負の宣伝、名声損害、通貨基金移転、管理層の注意の移転、私たちの業務中断(データの利用可能性を含む)、財務損失、および他の同様の損害を含む
当社は、当社の保険が、当社のプライバシーおよびセキュリティ慣行から生じる責任から当社を保護または軽減するのに適切または十分であること、そのような保険が商業的に合理的な条件で引き続き利用可能であること、またはそのような保険が将来の請求を支払うことを確信することはできません。
当社は潜在的な製造物責任エクスポージャーに直面しており、請求が成功した場合、実質的な責任を負う可能性があります。
臨床試験における当社独自のデバイスおよび DNA 医薬品候補の使用、および販売承認を得た製品の販売は、当社が製造物責任請求のリスクにさらされます。消費者、ヘルスケア提供者、製薬会社、または当社の製品を販売または接触する他者によって、当社に対して製品責任請求が提起される可能性があります。例えば、製薬会社は、一部の小児用ワクチンの使用により、脳損傷、中枢神経系の損傷、自閉症などの人身傷害が発生したという主張の対象となっており、これらの主張を弁護するために物的費用を負担しています。製造物賠償責任の請求に対して防御できない場合、実質的な責任を負う可能性があります。さらに、メリットや最終的な結果にかかわらず、製造物責任請求は以下の結果をもたらす可能性があります。
•DNA医薬候補者の需要が減少しています
•私たちのビジネス的名声を損なうことは
•臨床試験参加者の脱退
•関連訴訟費用
•私たちの主な業務に対する管理職の関心を分散させる
•患者や他のクレーム者に巨額のお金の報酬を提供し
•収入の損失
•私たちの製品を商業化することはできない
私たちはすでに私たちの臨床試験のために製品責任保険を受けましたが、私たちの保険範囲は私たちが受ける可能性のあるいかなる費用や損失を補償するのに十分ではないかもしれません。また、保険範囲はますます高くなっており、将来的には、責任による損失から私たちを保障するために、合理的なコストや十分な金額で保険範囲を維持することができないかもしれない。予期せぬ副作用を持つ製品に基づく集団訴訟では,多額の判決が下されることがある。成功した製品責任クレームや一連の私たちに対するクレームは私たちの株価を下落させる可能性があります。もし私たちの保険範囲を超えていると判断すれば、私たちの業務に悪影響を及ぼすかもしれません
医療改革措置は私たちの製品の商業的成功を阻害したり阻止したりするかもしれない
米国や一部の外国司法管轄地域では、医療システムが多くの立法や規制の変化を続けており、いずれの製品を販売する収益性にも影響を与える可能性がある。アメリカでは、連邦政府は医療改革立法、すなわち患者保護と平価医療法案を公布し、医療保健と教育和解法案によって改正され、あるいは総称してACAと呼ばれる。その他の事項を除いて、ACAはブランド薬品メーカーが支払うべき医療補助リベートの最低レベルを高めた;医療補助管理の医療保健組織が支払う薬品に対するリベートを要求した;メーカーにカバーギャップ割引計画に参加することを要求し、この計画によると、彼らはカバー間隔期間内に条件を満たす受益者にPOS割引(2019年1月1日から70%まで向上)を提供することに同意しなければならず、メーカーの外来薬物として連邦医療保険D部分カバーの条件に組み入れた。指定された連邦政府プロジェクトである“ブランド処方薬”を販売する製薬業者或いは輸入業者に差し引くことのできない年会費を徴収し、吸入、注入、点滴、移植或いは注射の薬品計算メーカーの医療補助薬品バックル計画の下でのリベートを計算し、340 B薬品割引計画に符合する実体タイプを拡大する;医療補助計画の資格基準を拡大する;新しい患者を中心とした結果研究所を作成し、監督、優先事項を確定し、臨床治療効果の比較研究を行い、このような研究に資金を提供する。そして、CMSに医療保険革新センターを設立し、革新的な支払いとサービス交付モードをテストし、医療保険と医療補助支出を低減し、処方薬支出を含む可能性がある。
ACAのいくつかの側面は行政、司法、そして国会の挑戦を受けている。国会はまだ全面的な廃止立法を通過していないが、ACAを遵守しない個人権限を1年の全部または一部で合格医療保険を提供する処罰を廃止するなど、ACAのいくつかの条項を改正した法律が制定されている。また、ACAが雇用主に賛助する高コスト医療保険に徴収する“キャデラック”税は
健康保険会社税とともにキャンセルされました。2021年6月17日、米国最高裁は、ACAが“個人権限”が国会で廃止されたため、全体的に違憲だと弁明する手続き理由に基づく挑戦を却下した。2022年8月16日、総裁·バイデンは2022年インフレ削減法案に署名し、個人がACA市場で医療保険を購入する強化補助金を2025年に延長した。2025年からアイルランド共和軍は,受益者の最大自己負担コストの著しい低減と新たなメーカー割引計画の作成により,連邦医療保険D部分計画下の“ドーナツ脆弱性”を解消した。これらの挑戦やバイデン政府の医療改革措置がACAやわれわれの業務にどのように影響するかは不明である。また、総裁·バイデンは2021年3月11日に“2021年米国救援計画法案”に署名し、2024年1月1日から単一源と革新多源薬に対する法定医療補助薬品還付上限を廃止し、現在この上限は薬品メーカー平均価格の100%である
さらに、ACAが公布されて以来、他の立法改正も提案され、採択された。2011年の予算統制法では、国会が行動しない限り、財政年度ごとに医療保険提供者に支払う医療保険費用は2%減少すると規定されており、その後の立法改正により、2032年まで有効となる。2012年の“米国納税者救済法”は,病院を含むいくつかの医療サービス提供者に支払う医療保険費用を削減し,政府が医療サービス提供者に多額の金を取り戻す訴訟時効期間を3年から5年に延長した。
処方薬や生物製品価格の上昇を受けて、米国政府も薬品定価の見直しを強化している。このような審査は最近のいくつかの国会調査を招き、製品価格の透明性の向上、価格設定とメーカー患者計画との関係の審査、政府計画の製品精算方法の改革を目的とした連邦と州立法を提案し、採択した。例えば、連邦レベルでは、2021年7月、バイデン政府は“米国経済における競争を促進する”という行政命令を発表し、その中には処方薬に対する条項が複数ある。バイデン行政命令への対応として,2021年9月9日,HHSは高薬価に対応した総合計画を発表し,その中で薬品定価改革の原則を概説し,国会がとりうる様々な潜在立法政策と,HHSがとりうる潜在行政行動がこれらの原則を推進することを示した。また、アイルランド共和軍は、他の事項を除いて、(I)HHS交渉連邦医療保険カバーのいくつかの高支出、単一由来の薬物および生物製品の価格、および(Ii)連邦医療保険B部分およびD部分に基づいてリベートを徴収し、インフレを超える価格上昇を処罰するように指示した。このような規定は2023年度から段階的に施行される。2023年8月29日、HHSは、連邦医療保険薬品価格交渉計画が現在法的挑戦を受けているにもかかわらず、価格交渉を受ける上位10種類の薬物のリストを発表した。アイルランド共和軍がどのように実施されるかは不明だが、製薬業に大きな影響を及ぼす可能性がある。バイデン政府の2022年10月の行政命令に応答するため、衛生·公衆サービス部は2023年2月14日に報告を発表し、CMS革新センターによってテストされた3種類の新しいモデルを概説し、これらのモデルはそれらの薬物コストを下げ、獲得性を促進し、医療の質を高める能力に基づいて評価を行う。これらのモデルが将来の任意の医療改革措置で使用されるかどうかは不明である。また、2023年12月7日、バイデン政府は“ベハ·ドール法案”下の参入権を使用することで処方薬の価格を制御するイニシアチブを発表した。2023年12月8日、米国国家標準·技術研究所は、権限行使を考慮した機関間指導枠組み草案を発表し、その中で初めて製品価格を機関が進行権を行使する際に使用できることを決定する要因とした。これまでデモの権利を行使したことはなかったが、新たな枠組みの下で、この権利が継続するかどうかは定かではない。州レベルでは、立法機関は、価格または患者の精算制限、割引、特定の製品参入の制限、マーケティングコスト開示および透明性措置を含む、医薬品および生物製品の価格設定を制御するための法規を立法および実施することが増えており、場合によっては、他の国からの輸入および大量購入を奨励することを目的としている
政府、保険会社、管理医療組織、その他の医療サービス支払者は、医療改革の制定と実施に引き続き努力しており、以下の点に悪影響を及ぼす可能性がある
•私たちは私たちの製品に公平だと思う価格を設定することができます
•私たちは収入を作ったり利益を達成したり維持したりします
•資金の入手可能性
•私たちの製品がタイムリーに承認される能力
もし私たちが適用された医療法規を遵守できなければ、私たちは巨額の処罰に直面する可能性があり、私たちの業務、運営、財務状況は不利な影響を受ける可能性がある
詐欺および乱用、透明性、患者の権利およびプライバシーに関連するいくつかの連邦、州、地方、および外国の医療保健法律および法規は、私たちの業務に適用される。私たちの運営能力に影響を与える可能性のある法律には
•連邦医療計画は、他のものを除いて、人々が報酬を要求、受け取り、または提供することを禁止し、直接または間接的に個人の推薦を誘導または奨励し、または連邦医療によって支払うことができる物品、商品、施設またはサービスを注文またはレンタルすることを禁止する
医療保険や医療補助などの計画です。連邦医療保健計画の反リベート法規下の意図基準はACAによってより厳しい基準に改訂されているため、個人や実体は実際に法規やこの法規に違反する特定の意図を知る必要がなく、違反を実施することができる。また、ACAは民事虚偽請求法の目的に基づいて、連邦医療保健計画の反リベート法規違反による物品やサービスのクレームが虚偽または詐欺的クレームを構成することを含む判例法を編纂した
•個人または実体が虚偽または詐欺的な医療保険、医療補助、または他の第三者支払人の支払い請求の提出を意図的にまたは提出することを禁止する民事虚偽請求法案を含む連邦民事および刑事虚偽請求法
•HIPAAは,他にも,任意の医療福祉計画を詐欺する計画や医療保健事項に関する虚偽陳述を行うことを禁止している。連邦医療計画のような反リベート法規は、個人または実体がこの法規または法規違反の具体的な意図を実際に理解する必要がなく、違反を実施することができる
•“経済と臨床衛生情報技術法”によって修正された“衛生情報技術促進経済と臨床衛生法”及び関連条例は、その中である個人と実体の個人が健康情報のプライバシー、安全と伝送を識別できることに対していくつかの要求を提出した
•ACAによって作成された“医師支払い日光法案”によれば、いくつかの薬品、器具、生物製品、および医療用品の製造業者が、医師(医師、歯科医師、視光師、足科医師および脊椎マッサージ師を含む)、他の保健専門家(例えば、医師アシスタントおよび看護師従業員)および教育病院、ならびに医師およびその直系親族が所有する所有権および投資権益に関する支払いまたは他の価値移転に関する情報をCMSに毎年報告することを要求する“医師支払い陽光法案”によれば、
•その他の事項以外に、FDCAは薬品マーケティングを厳格に管理し、メーカーがラベル以外の用途に薬品を販売することを禁止し、薬品サンプルの配布を管理する
•米国の“海外腐敗防止法”は、米国で株を発行した会社が政府契約やその他の業務のために外国人官僚への贈賄を禁止している
•州法は、例えば、任意の第三者支払人(商業保険会社を含む)が精算する物品やサービスに適用可能な逆リベートおよび虚偽精算法、医薬品販売および医療代表の登録を要求する州および地方法律、および場合によっては健康情報のプライバシーおよび安全を管理する州法に相当し、多くの法律は互いに大きく異なり、HIPAAによって先制されず、コンプライアンスの作業を複雑にすることが多い
•カリフォルニア州およびマサチューセッツ州の法律のような他の州および地方法律は、コンプライアンス計画の実施、業界道徳規範および支出制限の遵守、およびバーモント州、メイン州、ミネソタ州の法律などの他の州と地方法律の実施を要求し、州政府に医師のプレゼント、補償、およびその他の報酬を報告することを要求する
変化する規制環境、および異なるコンプライアンスおよび/または報告要件を有する複数の司法管轄区域の要求を遵守することは、1つまたは複数の法律と衝突する可能性を増加させる。
私たちは、私たちが第三者の業務配置と適用される医療法律や法規に適合することを確実にするために、多くの時間とお金をかけることが要求されるだろう。これらの法律の広さ、及び法定例外と安全港を監督することができる狭いため、厳格に遵守して保護を提供する必要があるため、政府当局は結論を出す可能性があり、著者らの業務やり方は現在或いは未来に医療保健法の適用に関連する法規、法規、機構指導或いは判例法に符合しない。もし私たちの運営が上記の任意の法律または私たちに適用される任意の他の政府法規に違反していることが発見された場合、私たちは、行政、民事および刑事罰、損害、罰金、返還、連邦医療保険、医療補助および他の連邦医療保健計画から除外される可能性があり、監禁、誠実および/または他の監督義務、契約損害、名声損害、および私たちの業務を削減または再編することを含む重大な処罰を受ける可能性がある。このようなどんな処罰も私たちの業務運営能力と財務業績に悪影響を及ぼす可能性がある。これらの法律に違反して私たちにとった行動は、たとえ私たちが弁護に成功しても、巨額の法的費用を招き、私たちの経営陣の業務運営への注意をそらす可能性があります
私たちの業務は危険材料の使用に関連しており、私たちと私たちの第三者製造業者は環境法律と法規を守らなければなりません。これは高価かもしれませんし、私たちの業務方式を制限しています
私たちと私たちの第三者製造業者の活動は、私たちのDNA候補薬物の成分および他の危険化合物を含む、危険材料の制御された貯蔵、使用、および処置に関する。私たちと私たちのメーカーはこれらの危険材料を使用、製造、貯蔵、運搬、処分する時、連邦、州と現地の法律法規を守らなければならない。事故時には州や連邦当局がこれらの使用を制限する可能性があります
材料や業務運営を中断していますもし私たちまたは私たちの第三者製造業者が危険材料の活動に関連して私たちにどんな責任も負わなければ、私たちの業務と財務状況は不利な影響を受ける可能性がある
我々はすでに中国会社と協力関係を築き,中国製の臨床材料に依存して開発している。中国の法律、規則、法規の解釈と実行、貿易戦争、政治的動揺、あるいは中国の不安定な経済状況に関する不確定性は、私たちの業務、財務状況、経営業績に重大な悪影響を及ぼす可能性がある。
私たちは中国に本社を置くApolloBio社と許可と協力協定に調印し、この協定によると、ApolloBio社は中国、香港、マカオ、台湾地区でVGX-3100を開発·商業化する独占的な権利を持っている。中国の法制度は成文法規に基づく民法制度である。一般法制度と異なり,従来の裁判所判決は参考になるが,その先例価値は限られている。また、中国の法律体系はある程度政府政策と内部規則に基づいており、その中のいくつかは適時に公表されておらず、さらには全く公表されておらず、追跡力を持っている可能性がある。したがって、私たちは違反が発生してから、私たちがこのような政策と規則に違反していることを認識しなければならないかもしれない。中国のいかなる行政訴訟と裁判所訴訟も長引く可能性があり、巨額のコストと資源の分流と管理注意力の移転をもたらす可能性がある。中国の行政と裁判所当局は法定と契約条項の解釈と実行に大きな自由裁量権を持っているため、行政と裁判所訴訟の結果および私たちが享受する法的保護レベルを評価することは、より発達した法制度よりも難しいかもしれない
また、米国や中国政府の政策が変化し、中国の政治的動揺や不安定な経済状況が発生すれば、我々の研究開発活動は妨害される可能性がある。例えば、中国の“ゼロコロナウイルス感染”政策は、著者らが彼らとの協力の下で、Adaccineが中国で行ったINO-4800臨床試験の遅延を招き、これは逆にINO-4800の安全性と潜在的な治療効果を評価するための臨床データの獲得を遅延させる。また、中国のバイオ製薬業界は中国政府の厳しい規制を受けている。バイオ製薬会社に影響を与える中国法規や政府政策の変化は予測できず、ApolloBioやAdaccineに実質的な悪影響を与える可能性があり、これは私たちの業務、財務状況、運営結果、将来性に悪影響を及ぼす可能性がある。中国の公衆衛生、経済、政治と社会条件の絶え間ない変化、および中国と他の政府との関係をめぐる不確定性は、米国と中国との貿易戦争の脅威を含み、私たちの発展努力に必要な中国製臨床材料のサプライチェーンの中断やコスト増加を招く可能性がある。このような中断や失敗は私たちの候補DNA薬の商業化を阻害し、私たちの競争的地位を損なうかもしれない。中国では、私たちはまた現地通貨価値の変動の影響を受けるかもしれない。これらの不確実性は、私たちが締結した契約を実行する能力と、私たちが研究開発活動を継続する能力を阻害し、私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性があります
私たちの従業員、首席調査員、コンサルタントは、規制基準と要求を守らないこと、インサイダー取引を含む不適切な行為や他の不適切な活動に従事する可能性があります。
私たちは職員たち、主な調査者たち、そしてコンサルタントの詐欺や他の不適切な行為のリスクに直面している。これらの当事者の不正行為は、FDA法規またはEUおよび他の司法管轄区域に適用される法規を故意に遵守しないこと、FDA、EMAおよび他の規制機関に正確な情報を提供すること、米国および海外の医療詐欺および法律法規を遵守すること、または財務情報またはデータを正確に報告すること、または不正な活動を開示することを含むことができる。このような不正行為はまた、臨床試験過程中あるいはFDA或いは他の監督機関との相互作用過程で得られた情報の不適切な使用に関連する可能性があり、これは規制制裁を招き、著者らの名声に深刻な損害を与える可能性がある。医療保健業界の販売、マーケティングと商業手配は広範な法律法規の制約を受け、詐欺、不当行為、リベート、自己取引とその他の濫用行為を防止することを目的としている。これらの法律法規は、広範な定価、割引、マーケティングと販売促進、販売手数料、顧客激励計画などの業務手配を制限または禁止している。我々はすべての従業員に適用される行動基準を採択したが、常に従業員の不正行為を識別し、阻止できるわけではなく、このような行為を発見し防止するための予防措置は、未知または未管理のリスクや損失を効果的に制御できない可能性があり、またはこれらの法律や法規を遵守できないことによる政府の調査または他の行動や訴訟から私たちを保護することができるかもしれない。もし私たちにこのような行動を取って、私たちが自分の権利を弁護したり、維持することに成功しなかったら、これらの行動は、巨額の罰金や他の制裁を加えることを含む、私たちの業務、財務状況、運営結果、将来性に大きな影響を及ぼすかもしれない。
従業員訴訟と否定的な宣伝は私たちの未来の業務に否定的な影響を及ぼすかもしれない。
私たちの従業員は時々傷害、敵意を作る職場、差別、給料と工数紛争、セクハラや他の雇用問題について私たちを訴訟するかもしれません。近年、差別と嫌がらせクレームの数は全体的に増加している。加えて、ソーシャルメディアプラットフォームと類似設備の拡張により、個人が広範な受け手に接触できるようになり、これらの言い方はいくつかの企業に重大なマイナス影響を与えた。雇用や嫌がらせに関する訴訟に直面している会社は
経営者又は他の要人を解雇し、名声被害を受け、その業務に負の影響を与える。もし私たちが雇用関連のクレームに直面したら、私たちの業務は否定的な影響を受けるかもしれない。
私たちの知的財産権に関するリスクは
私たちの知的財産権と私たちのノウハウを生成して保護することは難しくて高価で、私たちはそれらの保護を保障できないかもしれない
私たちのビジネス成功は、当社の独自デバイスおよびDNA候補薬剤に関連する特許、商標、商業秘密および他の知的財産権保護の獲得と維持、およびこれらの知的財産権を第三者の挑戦から保護することにある程度依存するであろう
製薬と生物技術会社の特許地位は非常に不確定である可能性があり、複雑な法律と事実問題に関連し、重要な法律原則はまだ解決されていない。バイオテクノロジー特許で許容される特許請求の広さに関する法律法規は近年変化し,米国や海外での審査·改正を継続している。国によっては、米国以外のバイオテクノロジー特許状況はさらに不確実になる可能性がある。米国や他国の特許法または特許法解釈の変化は,我々の知的財産権の価値を低下させる可能性がある。したがって、私たちは、私たちのライセンス特許、私たちの特許、または第三者特許において許容または強制執行される可能性のある権利要件の広さを予測することができず、私たちの特許が特許有効性挑戦において生き残っている可能性を予測することもできない
法的決定が予測できない可能性があるため、限られた保護をもたらすことがあり、それは私たちの権利を十分に保護したり、私たちの競争優位性を獲得したり、維持したり、特許を無効にしたり、実行できない可能性があるので、未来の私たちの知的財産権の保護の程度は不確定だ。例えば:
•私たち、または私たちがそれから入手できるかもしれない特許権の当事者は、基礎特許出願またはそのような特許がカバーする最初の発明を作成した最初の人ではないかもしれない
•私たちが許可または取得した特許または特許出願の発明者または共同発明者の名前が正しくない可能性があり、これは発明権および所有権の挑戦を引き起こす可能性がある
•他の人は、類似または代替の技術を開発したり、設計を含む私たちの任意の製品または技術を複製したりすることができます
•未完成の特許出願は、発行された特許を生成してはならない
•私たちの製品や技術をカバーする特許は、競争優位性や商業的価値を提供してくれないかもしれません
•発行された特許は、疑問視され、無効に宣言されるか、または強制的に実行できないようにされる可能性がある
•アメリカや海外の政府は私たちのワクチンの特許を阻止するかもしれません競争相手をこれらの市場から排除することを阻止するかもしれません
•発行された特許は再審査される可能性があり、これは、特許不可と認定された特許請求の範囲を縮小またはキャンセルさせる可能性がある
•特許可能な追加の独占技術を開発または取得することはできません
•当社の商標が無効であるか、第三者の事前使用の対象となる場合
•我々が特許権を行使する能力は,侵害行為を発見する能力に依存し,巨額の財務コスト,資源移転および有利な結果や裁決の予測不可能性により,特許権を執行する訴訟を提起しない可能性がある
私たちは私たちの知的財産権の一部を保護するために私たちの許可者と協力者にある程度依存している。この場合、私たちのライセンシーおよび協力者は、主にまたは全部が、私たちの重要な業務分野に関連する特許出願の維持および起訴を担当することができる。もしどちらか一方がこれらの製品を特許取得することを十分に保護できなければ、私たちの業務と将来性は深刻な損害を受けるだろう
私たちはまた、特に特許保護が適切でないか、または入手不可能だと思う場合に、商業秘密に依存して私たちの技術を保護することができる。しかし、商業秘密は保護することが難しい。私たちのビジネス秘密を保護するために合理的に努力しているにもかかわらず、私たちの従業員、コンサルタント、請負業者、外部科学協力者、および他のコンサルタントは、競争相手に私たちのビジネス秘密を意図的にまたは故意に漏らしてしまうかもしれません。第三者エンティティに我々のいかなる商業秘密を不正に取得して使用することを強制するかは高価で時間がかかり、結果的に予測不可能である。しかも、アメリカ以外の裁判所は商業機密を保護することをあまり望まないこともある。また,我々の競争相手は同等の知識,方法,ノウハウを自主的に開発することができる
もし私たちまたは私たちの許可者が私たちのDNA候補薬や私たちの技術のために特許保護または商業秘密保護を獲得または維持できなかった場合、第三者は私たちの固有の情報を使用するかもしれません。これは私たちの市場での競争能力を弱化させ、私たちの収入を創出し、利益を達成する能力に悪影響を及ぼすかもしれません
アメリカと他の政策立案者は時々彼らの国の特許法律と法規の改革を提案します。2011年9月、“米国発明法”(“発明法”)が法律に署名された。この法案は,現行の“最初の発明”制度を,特許付与出願可能な特許発明の“最初の発明者”に変更する。同法はまた,ライセンス後のプログラムと新たな当事者間再審プログラムにより特許庁で新たに発行された特許に挑戦するプログラムを策定している。これらの変化は、競争相手が私たちの特許に挑戦しやすくなる可能性があり、これは競争の激化を招き、私たちの製品販売、業務、運営結果に実質的な悪影響を及ぼす可能性がある。これらの変化はまた、第三者特許への挑戦をより困難にし、1つの発明について特許出願を提出した最初の発明者となることをより重視する可能性がある
もし私たちが第三者の知的財産権侵害を起訴されたら、これは高価で時間がかかり、訴訟の不利な結果は私たちの業務に実質的な悪影響を及ぼすだろう
他の会社は私たちに強制的に施行される可能性のある知的財産権を持っているか、または得ることができる。もし彼らがそうすれば、私たちは私たちの技術を変更して、許可料を支払ったり、活動を停止することを要求されるかもしれない。もし私たちの製品や技術が他人の知的財産権を侵害した場合、彼らは私たちまたは私たちのライセンシーまたは協力者に損害賠償を要求し、彼らの知的財産権を侵害すると思ういかなる活動も禁止しようとすることができる
特許出願が発表されるまでには数年の時間がかかる可能性があり、まだ公開されていない期間があるため、現在未知の未解決の出願が存在する可能性があり、または再発行される可能性があり、これらの出願は、私たちの製品または技術が発行された特許を侵害する可能性がある。私たちが私たちの製品や技術が侵害する可能性があることを知らない既存の特許も存在するかもしれない。さらに、第三者が特許出願を提出するか、または係属中の出願または発行された特許においても保護された製品または技術を要求する特許を取得する場合、発明の優先権または派生を決定するために、米国特許商標局の干渉または派生プログラムに参加しなければならない可能性がある。第三者が外国で反対すれば、私たちが提出した外国特許出願の特許性を守るために、外国裁判所の反対手続きに参加しなければならないかもしれない
もし第三者が私たちがその知的財産権を侵害していると主張すれば、私たちの業務が様々な面で影響を受ける可能性があります
•私たちは時間と費用のかかる訴訟に巻き込まれるかもしれません。たとえクレームに根拠がなくても、第三者の特許が無効であっても、私たちは侵害していません
•もし裁判所が私たちの技術が第三者の特許を侵害したと判断した場合、私たちは過去の侵害行為に対して実質的な損害賠償責任を負うかもしれない
•裁判所は、私たちに、商業的に許容可能な条項では得られないかもしれない、または巨額の使用料を支払うことを要求するか、または私たちの特許に交差許可を付与することを要求することができるかもしれない特許所有者の許可なしに製造、販売を停止することを命令するかもしれない
•私たちは、他人の特許権を侵害しないように、私たちの製品を再設計しなければならないかもしれません。それは不可能かもしれません。あるいは大量の投資や時間が必要かもしれません
もしこれらの事件のいずれかが発生すれば、私たちの業務は影響を受ける可能性があり、私たちの普通株の市場価格は下落する可能性がある
私たちはまだ私たちのすべての潜在市場に私たちの商標を登録していません。これらの登録を得ることができなければ、私たちの業務に悪影響を及ぼすかもしれません。
当社の商標出願は登録が認められない場合があり、登録商標の維持または執行はできません。商標登録手続き中、却下を受ける場合があります。その拒絶に応える機会を与えられたとしても、それを克服できないかもしれません。さらに、 USPTO や多くの外国の同等の機関では、第三者が係争中の商標出願に反対し、登録商標の取り消しを求める機会が与えられています。当社の商標に対して異議申立または取り消し手続が提起され、当社の商標はそのような手続を存続しない場合があります。当社が商標の登録を確保しない場合、第三者に対して商標を強制することが困難になる可能性があります。
当社普通株式への投資に伴うリスク
私たちの普通株の活発な取引市場は持続できないかもしれない。
当社の普通株式はナスダック · キャピタル · マーケットに上場していますが、当社の株式の活発な取引市場が持続するかどうかは確信できません。当社普通株式の活発な市場が持続しない場合、当社普通株式の投資家は、株式の市場価格を下げることなく株式を売却したり、株式を売却したりすることが困難になる可能性があります。
当社普通株式の価格は、これまで、今後も変動する可能性があります。また、当社普通株式への投資は、大幅な価値下落する可能性があります。
私たちの規模が小さく、資源が限られていること、および私たちのビジネスや業界の不確実性やリスクに影響を与える可能性があることを考慮して、私たちの株価は高度に変動し続ける可能性があり、将来的に大幅な下落を受ける可能性があり、さらには私たちの業務の情報に影響を与えることなく。期間間の比較は
未来の表現を示しています本報告で述べた他のリスク要因、および私たちの普通株取引量が低い可能性があることを除いて、以下の要素は詳細ではなく、私たちの普通株の市場価格に重大な影響を与える可能性があり、その中のいくつかの要素は私たちの制御範囲を超えている
•研究開発、臨床試験、製造、マーケティング努力、または協力に関する発展
•ワクチンや他の候補DNA薬の潜在力に対する公衆や科学の関心の変動は
•私たちが発表した重大な買収、戦略協力、合弁企業、または資本約束
•私たちの経営業績の変動は
•技術革新の公告
•私たちや競争相手が提供する新製品やサービス
•医療支払い制度の構造を変え
•知的財産権および/または訴訟事項の開始、進行および/または結果;
•財務または他の推定における証券アナリストまたは私たちの業務の他の審査者または評価者の変化
•生物製薬や他の保健産業の状況や傾向
•アメリカや他の国の規制動向は
•遺伝子に基づく治療の見方
•他のバイオテクノロジーや医療機器会社の経済表現および/または市場推定値の変化
•キーパーソンの増減
•普通株の販売や他の取引に関連しています
•資本構造の変化
•執行者または役員は、私たちの普通株の販売または他の取引に関する
•会計原則の変化
•世界的な動揺には、ロシアや中国などの地政学的リスク、テロ、イスラエルとハマスの間の衝突、銀行倒産などの経済やその他の外部要因が含まれている
•悲劇的な天気と/または世界的な病気が大流行している
株式市場では時々大きな価格や出来高が変動するのが一般的だ。特に,規模の小さいバイオテクノロジーや医療機器会社の証券市場価格は急激な変動を経験しており,これらの変動はこれらの会社の経営業績に関係なくあるいは比例しないことが多い。持続的な市場変動は私たちの普通株価格の極端な変動を招く可能性があり、これは私たちの普通株の価値を低下させる可能性がある。しかも、私たち普通株の取引量がまだ限られていたり、低下したりすれば、価格変動が増加するかもしれない。
私たちは私たちの現金、現金等価物、投資を使用する上で広範な裁量権を持っており、それらを有効に使用できないかもしれない。
私たちの経営陣は、私たちの現金、現金等価物、投資を運用する上で広範な裁量権を持っており、収益を私たちの運営結果を改善しない方法や私たちの普通株価値を向上させる方法に使うことができます。例えば、2020年から2022年にかけて、我々の新冠肺炎ワクチンプロジェクトの開発と製造活動により、私たちの運営費用が大幅に増加し、2022年第4四半期にこのプロジェクトへの内部援助を停止しました。私たちは既存の資本資源を効果的に構成できないかもしれない。私たちの経営陣が私たちの資金を有効に使用できなかった場合、財務損失を招く可能性があり、これは私たちの業務に実質的な悪影響を与え、私たちの普通株価格を下落させ、候補製品の開発を延期する可能性があります。使用する前に、私たちは収入や価値を失わない方法で私たちの現金、現金等価物、および投資に投資するかもしれない。
私たちの定款文書とデラウェア州法律の反買収条項は制御権の変更を延期または阻止する可能性があり、これは私たちの普通株の市場価格を制限するかもしれません
私たちが修正して再記述した会社登録証明書には、会社の制御権変更や取締役会変更を遅延または阻止する可能性のある条項が含まれており、これらの条項は私たちの株主から有利だと思われるかもしれません。いくつかの規定には
•当社取締役会は、株主の承認を必要とすることなく、非指定優先株を発行し、これらの株式の権利、優先、特権を決定する権利がある
•すべての株主行動は、書面による同意ではなく、正式に開催された株主会議で行われなければならない
•累積投票制を廃止する
さらに、私たちは、株主が議決権付き株式の15%以上を発行している特定の企業の合併を禁止することができるデラウェア州会社法第203条の規定によって管轄されています。当社の会社登録証明書の改訂と再記述、改正と再記述の定款およびデラウェア州法律のこれらおよび他の条項は、株主または潜在的な買収者が私たちの取締役会に対する支配権を得ることを困難にしたり、わが社に関連する合併、買収要約または代理権競争を延期または阻害することを含む当時の取締役会反対の行動を開始する可能性があります。制御権の変更、取引、取締役会の変動を遅延または阻止することは、私たちの普通株の市場価格の下落を招く可能性がある
私たちは私たちの普通株に現金配当金を支払ったことがなく、私たちは予測可能な未来にも配当金を支払わないと予想している
今まで、私たちはまだ私たちの普通株に現金配当金を支払っていません。私たちは今私たちの将来の収益を保留するつもりです。もしあれば、私たちの業務の発展と成長に資金を提供します。しかも、未来の債務や信用手配の条項は、私たちが任意の配当金を支払う能力を排除したり制限したりするかもしれない。したがって、予測可能な未来には、私たちの普通株の資本付加価値(あれば)が潜在収益の唯一の源になるだろう
私たちの純営業損失の繰越といくつかの他の税務属性を利用する能力は限られているかもしれません。
改正された1986年の国税法第382条及び383条又は同法によると、ある会社が“所有権変更”を経験した場合(一般にある大株主が3年間スクロール期間中にその持分に対する所有権変動が50ポイントを超えると定義される)、当該会社は変動前純営業損失繰越及び他の変動前税収属性を用いて変動後の収入及び税収項目を相殺する能力が制限される可能性がある。私たちは過去にこのような所有権の変化を経験したことがありますが、将来私たちは株式の変化のために所有権の変化を経験するかもしれません。その中のいくつかの変化は私たちの制御範囲内ではありません。純営業損失と他の税務属性を使用する能力が所有権変更によって制限されれば、純営業損失と他の税務属性の大部分を利用して、私たちの将来の課税収入を相殺することができないかもしれません。また、法律や法規の変化、例えば最低税額の代替や純営業損失の一時停止、または他の予見できない理由により、私たちの既存の純営業損失は満期になる可能性があり、または他の方法では将来の所得税負債を相殺できないリスクもある。
一般リスク因子
私たちの四半期の経営業績は大きく変動するかもしれません。
私たちの経営業績は四半期変動の影響を受けると予想されています。私たちの純損失と他の経営業績は様々な要素の影響を受けます
•私たちの独自の設備、候補DNA薬、または将来の開発計画に関連する費用レベルの変化
•完全に完了していない取引を含む会社取引に関する費用
•臨床試験や助成金を増やしたり中止したり
•私たちが巻き込まれる可能性のある知的財産侵害訴訟は
•私たちや私たちのどんな役人にも法的請求があるかもしれません
•私たちの特許装置やDNA候補薬や競争相手の規制発展に影響を与えます
•債務義務を果たす
•私たちの投資の公正な価値の変化は、関連実体への投資を含む
•私たちは、任意の協力、許可、または同様の手配、およびそのような手配に基づいて支払いまたは請求される時間を実行する
•もし私たちの任意の候補DNA薬が規制部門の承認を得たら、私たちの製品に対する潜在的な需要レベルです
もし私たちの四半期の経営業績が投資家や証券アナリストの予想を下回れば、私たちの普通株の価格は大幅に低下する可能性がある。また、私たちの経営業績のどの四半期の変動も、私たちの株価を大幅に変動させる可能性があります。私たちの財務業績を四半期比較することは必ずしも意味があるわけではなく、私たちの将来の業績としての指標に依存すべきではないと考えられます
私たちの経営結果と流動性需要は市場変動と全体的な経済状況の大きな影響を受ける可能性があります
私たちの運営結果はアメリカや世界の他の地域の普遍的な経済状況の大きな影響を受けるかもしれません。インフレ、金利上昇、エネルギーコスト、地政学的問題、世界的な病原体の爆発または流行病、および信用の獲得可能性とコストに対する懸念は過去にあり、成長を推進し続ける可能性がある
変動性と経済と市場の未来に対する期待は弱まっている。市場の動揺は私たちに不利な影響を及ぼすかもしれない。もし市場が不景気なら、私たちの経営業績は不利な影響を受けるかもしれない。私たちの将来の株式や債務資本コスト、資本市場に入る機会は不利な影響を受ける可能性があり、私たちの株価は下落する可能性がある。私たちの第三者請負業者とサプライヤーの表現は中断または遅延される可能性がある。もし私たちの請負業者、サプライヤー、そしてパートナーが彼らの契約約束を履行できなければ、私たちの業務は影響を受けるかもしれない。さらに、私たちは1つ以上の金融機関で連邦保険限度額を超える大量の現金と現金等価物を持っており、私たちはこれらの預金によって損失を受ける可能性がある
金融サービス業の不利な事態の発展に影響を与え、例えば流動資金に係る実際の事件又は懸念は、我々の業務·財務状況及び運営結果に悪影響を及ぼす可能性がある。
流動性が限られているか、金融サービス業または金融サービス業の他の不利な発展に影響を与える実際の事件、またはそのような事件または他の同様のリスクに関する懸念または噂は、過去および未来に市場全体の流動性問題を引き起こす可能性がある。例えば、2023年には、いくつかの銀行機関が連邦預金保険会社によって閉鎖または接収され、より広範な金融サービス業に深刻な流動性懸念が生じている
2023年の不利な事態の影響を受けたどの銀行にも預金はありませんが、金融機関で預金を維持しており、経営業務の一部として、再び似たような事件が発生すれば、これらの業務はリスクに直面する可能性があります。私たちが行っている現金管理戦略は、大規模な金融機関での預金口座の大部分を保持することですが、この戦略が成功する保証はありません。銀行の倒産や救済、銀行業界の潜在的により広い影響と潜在的な系統的リスクを含む米国や国際金融システムへの懸念が高まっており、資本獲得の機会に悪影響を及ぼす可能性がある。他のリスクに加えて、利用可能な資金または現金および流動性資源の減少は、私たちが資本需要を満たし、将来の成長のために資金を提供したり、他の義務を履行する能力を制限したり、財務および/または契約義務に違反したりする可能性がある。上記のいずれの影響、または上記要因または他の関連または類似要因による任意の他の影響は、我々の業務、財務状況および経営業績に重大な悪影響を及ぼす可能性がある。
株式研究アナリストが我々、我々の業務又は我々の市場に関する研究又は報告を発表しない場合、又は不利な研究又は報告を発表しなければ、我々の株価及び取引量は低下する可能性がある。
私たちの普通株の取引市場は株式研究アナリストが発表した私たちと私たちの業務に関する研究と報告の影響を受けており、株式研究アナリストの私たちの研究報告は限られている。株式研究アナリストは私たちの普通株の研究報告を開始しないか、あるいは引き続き提供することを選択する可能性があり、このような研究報告の不足は私たちの普通株の市場価格に不利な影響を与える可能性がある。たとえ私たちが株研究アナリストの報告書を持っていても、私たちはアナリストや彼らの報告書に含まれている内容と観点を制御することができない。1つ以上の株式研究アナリストが私たちの株式格付けを引き下げたり、他の不利なコメントや研究を発表したりすれば、私たちの株価は下落する可能性がある。1つ以上の株式研究アナリストがわが社への報道を停止したり、私たちに関する報告書を定期的に発表できなかったりすれば、私たちの株に対する需要が減少する可能性があり、逆に私たちの株価や取引量を低下させる可能性がある。
融資、買収、投資、私たちの株式インセンティブ計画またはその他の側面に関連する追加株式の発行は、他のすべての株主の権益を希釈する。
わが社の登録証明書は、私たちが最大600,000,000株の普通株と最大10,000,000株の優先株を発行することを許可しており、その権利と優先権は私たちの取締役会によって決定される可能性があります。適用規則および法規を遵守する場合、融資、買収、投資、私たちの株式インセンティブ計画、または他の側面のために、普通株または普通株に変換可能な証券を時々発行することができる。このような発行は、私たちの既存株主の大量希釈を招き、私たち普通株の取引価格を低下させる可能性がある。
上場企業として、大きなコストと経営陣への要求を招いた。
米国に上場する上場企業として、私たちは大量の法律、会計、その他のコストを負担しており、これらのコストは私たちの財務業績にマイナス影響を与える可能性がある。また、米国証券取引委員会と証券取引所が実施する規定を含む、会社のガバナンスと開示に関する法律、法規、標準の変化は、法律と財務コンプライアンスコストを増加させ、いくつかの活動をより時間をかける可能性がある。これらの法律,条例,基準には異なる解釈があるため,規制機関や理事機関が新たな指導を提供するにつれて,実践における適用は時間とともに変化する可能性がある。変化する法律、法規、基準を遵守するために資源を投入する予定であり、この投資は一般的かつ行政費用の増加を招き、経営陣の時間と注意を創設活動からコンプライアンス活動に移す可能性がある。私たちは新しい法律、法規、基準を遵守しようと努力しているにもかかわらず、私たちが守らなければ、規制機関は私たちに法的訴訟を提起し、私たちの業務は損害を受けるかもしれない。
これらの規則を守らないことは、取締役や上級者責任保険を含むいくつかのタイプの保険を得ることを難しくする可能性もあります。私たちは、同じまたは類似した保険を得るために、減少した保険限度額や保険範囲を受け入れさせられたり、同じまたは類似した保険を得るためにより高い費用を発生させたりする可能性があります。これらの事件の影響はまた、私たちの取締役会、取締役会委員会、または上級管理職メンバーに合格した人を引き付け、維持することを難しくするかもしれない。
税法の変化は私たちの業務と財政状況に悪影響を及ぼすかもしれない。
私たちが支配されたり、その下で運営されたりする税金制度は不安定で、大きな変化が起こるかもしれない。2017年には、減税·雇用法案や税法と一般的に呼ばれる税法が公布され、改正された1986年の国内受入法が大きく改正された。その他の事項を除いて、“税法”は会社税に対して重大な改革を行い、会社税率を35%の最高限界税率から21%の統一税率に引き下げ、利息支出の減税を調整後の収益の30%(ある小企業を除く)に制限し、純営業損失の減税を今年度の課税収入の80%に制限し、純営業赤字の繰越を廃止し、海外収益に対して一度に減税を行い、それらが国内に送金されるかどうかにかかわらず、時間の経過とともに減価償却費用を差し引くのではなく、直ちにある新しい投資を差し引く。多くの業務控除および控除(いくつかのまれな疾患または疾患の薬物試験において発生するいくつかの臨床試験費用を減少させる営業税控除を含む)を修正または廃止する。各州がどの程度連邦税法を遵守するかはまだ確定されていない。税法に関連した追加規制や会計指導、あるいは提案または実施された立法変更を発表することは、我々の納税義務や有効税率に大きな影響を与える可能性がある。
ソーシャルメディアプラットフォームの使用はますます多くなり、新たなリスクと挑戦をもたらしている。
ソーシャルメディアは,我々の研究,候補薬物の開発,研究薬の開発,候補開発薬の開発,治療に用いる疾患の研究にますます利用されている。バイオ製薬業界のソーシャルメディア実践は発展し続けており,このような使用に関する法規は常に明確ではない。この変化は不確実性と私たちの業務に適用される法規を遵守しないリスクをもたらし、それによって私たちに対する規制行動を招く可能性がある。例えば、参加者は、進行中の盲目的臨床試験における彼らの経験をレビューするためにソーシャルメディアチャネルを使用して、またはいわゆる有害事象を報告することができる。このような開示が発生した場合、適用される有害事象報告義務を監視し、遵守できないリスクがあり、またはソーシャルメディアによって生じる政治的および市場的圧力の下で、私たちの業務または公衆の合法的な利益を守ることができない可能性があります。これは、私たちの開発候補薬や研究薬に対する私たちの発言が制限されているからです。いずれのSNSにおいても、敏感な情報または否定的または不正確な投稿またはコメントを不適切に開示するリスクがある。もしこのような事件が発生したり、私たちが適用された法規を遵守できなかった場合、私たちは責任を負い、規制行動に直面したり、私たちの業務に他の損害を与える可能性があります。
私たちは厳格で変化しているアメリカと外国の法律、法規と規則、契約義務、業界基準、政策、その他のデータプライバシーとセキュリティに関する義務を受けています。私たちが実際にまたはそのような義務を履行できなかったと考えられることは、規制調査または行動、訴訟(集団クレームを含む)および大規模な仲裁要求、罰金および処罰、私たちの業務運営中断、名声損害、収入または利益損失、および他の不利な業務結果をもたらす可能性がある。
通常のビジネスプロセスでは、専用および機密の商業データ、商業秘密、知的財産権、敏感第三者データ、商業計画、取引、および財務情報(総称して敏感データと呼ぶ)を含む個人データおよび他の敏感な情報を収集、受信、格納、処理、生成、使用、送信、開示、アクセス可能、保護、保護、処置、送信および共有(総称して処理と呼ぶ)する。
私たちのデータ処理活動は、様々な法律、法規、ガイドライン、業界基準、外部および内部プライバシーおよびセキュリティポリシー、契約要件、およびデータプライバシーおよびセキュリティに関連する他の義務のような多くのデータプライバシーおよびセキュリティ義務を負担することを要求します
米国では、連邦、州、地方政府は、データ漏洩通知法、個人データプライバシー法、消費者保護法(例えば、連邦貿易委員会法案第5条)、および他の同様の法律(例えば、盗聴法)を含む多くのデータプライバシーおよびセキュリティ法律を公布している。過去数年間、米国の多くの州-カリフォルニア州、バージニア州、コロラド州、コネチカット州、ユタ州を含めて全面的なプライバシー法が公布され、プライバシー通知に具体的な開示を提供し、その個人データに関するいくつかの権利を住民に提供することを含む、カバーされた企業にいくつかの義務が加えられた。適用可能であれば、そのような権利は、特定の個人データにアクセス、訂正または削除する権利、および指向性広告、分析、および自動決定のような特定のデータ処理活動から退出する権利を選択する権利を含むことができる。このような権利の行使は私たちの業務と製品とサービスを提供する能力に影響を及ぼすかもしれない。いくつかの州はまた、敏感な情報を含むいくつかの個人データを処理することに対して、データプライバシー影響評価を行うなど、より厳しい要求を提出している。この州の法律は規定を守らない行為に法的罰金を科すことを許可している。例えば“2018年カリフォルニア消費者プライバシー法”(CCPA)は
消費者、商業代表、およびカリフォルニア州住民従業員は、特定の企業にプライバシー通知において具体的な開示を提供し、このような個人が特定のプライバシー権を行使する要求を尊重することを要求する。CCPAは、故意違反のたびに最高7500ドルの罰金を科すことができ、あるデータ漏洩の影響を受けた個人訴訟当事者が巨額の法定損害賠償を取り戻すことを許可すると規定している。他のいくつかの州と連邦と地方の各レベルも似たような法律を考慮しており、私たちは今後もっと多くの州が似たような法律を通過することを予想している。これらの開発はコンプライアンス作業をさらに複雑化させ、私たちと私たちが依存する第三者の法的リスクとコンプライアンスコストを増加させるかもしれない
米国以外では、ますます多くの法律、法規、業界基準がデータプライバシーとセキュリティを管理する可能性がある。例えば,EUの“一般データ保護条例”,イギリスの“一般データ保護条例”,ブラジルの“一般データ保護法”(第13,709/2018法律),中国の“個人情報保護法”は個人データの処理に厳しい要求をしている。例えば、GDPRによれば、会社は一時的または最終的なデータ処理および他の是正行動の禁止に直面する可能性があり、EU GDPRによると、会社は最高2000万ユーロの罰金に直面する可能性があり、イギリスGDPRによると、会社は最高1750万ポンドの罰金に直面する可能性があり、またはそれぞれの場合、会社は個人データの処理に関連する個人訴訟に直面する可能性があり、これらの罰金は、法的権限によってその利益を表す様々なデータ主体または消費者保護組織によって提起された、または世界の年収の4%を基準としている。
また、データの現地化要求や国境を越えたデータの流れの制限により、個人データをヨーロッパや他の司法管轄区域から米国や他の国に移すことができない可能性がある。ヨーロッパと他の司法管轄区は、データの現地化または他の国への個人データの移転を制限するための法律を公布した。特に,欧州経済圏(EEA)やイギリス(UK)は,米国や他のプライバシー法が不足していると一般的に考えられている国への個人データの移転を大きく制限している。他の司法管轄区域はそのデータ現地化と国境を越えたデータ転送法に対して類似の厳格な解釈を行う可能性がある。現在、欧州経済地域の標準契約条項、イギリスの国際データ転送プロトコル/付録、EU-米国データプライバシーフレームワークおよびそのイギリス拡張(自己認証コンプライアンスへの移行を許可し、このフレームワークに参加する関連米国組織)には、法律によって個人データを欧州経済地域およびイギリスから米国に移転するための様々なメカニズムがあるが、これらのメカニズムは法的挑戦を受けており、これらの措置が個人データを合法的に米国に移転することができるか、または依存できる保証はない。もし私たちが合法的な方法で個人データをヨーロッパ経済区、イギリスまたは他の司法管轄区域からアメリカに移すことができない場合、あるいは合法的な移転の要求が煩雑すぎる場合、私たちの業務中断または降格、巨額の費用で私たちの業務または全部の業務またはデータ処理活動を他の管轄区域(例えば、ヨーロッパ)に移す必要があり、より多くの規制行動に直面し、巨額の罰金と処罰、データの転送ができないこと、パートナー、サプライヤーおよび他の第三者との協力、私たちの業務に必要な個人データの処理または移転を禁止することを含む重大な不利な結果に直面する可能性がある。また,個人データをヨーロッパ経済区やイギリスから他の司法管轄区,特に米国に移転した会社は,規制機関,個人訴訟者,活動団体のより厳しい審査を受けることになる。一部の欧州規制機関は、これらの会社がGDPRの国境を越えたデータ転送制限に違反している疑いがあるため、いくつかの企業に特定の個人データの欧州への移転を一時停止または永久停止するよう命じている
データプライバシーとセキュリティ法律に加えて、契約上、業界組織が採用している業界基準に制約される可能性があります。私たちはまた、データプライバシーやセキュリティに関する他の契約義務の制約を受けており、これらの義務を守る努力は成功しないかもしれません。プライバシーポリシー、マーケティング資料、およびデータプライバシーとセキュリティに関する他の声明を発表します。もしこのような政策、材料、または声明が私たちの接近に欠陥があることが発見された場合、透明性の欠如、詐欺的、不公平または不実であれば、私たちは調査、規制機関の法執行行動、または他の不利な結果を受けるかもしれない
データプライバシーやセキュリティ(および消費者のデータプライバシー期待)に関する義務は急速に変化しており,ますます厳しくなり,不確実性をもたらしている.さらに、これらの義務は、法ドメイン間で不一致または衝突する可能性がある異なる適用および解釈される可能性がある。これらの義務を準備して遵守するには、私たちが大量の資源を投入する必要があり、私たちのサービス、情報技術、システム、やり方、および個人データを処理する任意の第三者を代表するサービス、情報技術、システム、およびやり方を変更する必要があるかもしれません
私たちは、私たちのデータプライバシーやセキュリティ義務を守る努力に失敗することがある(または失敗したと考えられる)。また、私たちが努力しているにもかかわらず、私たちが依存している人や第三者がこのような義務を履行できない可能性があり、これは私たちの業務運営に悪影響を及ぼす可能性があります。もし私たちまたは私たちが依存している第三者が適用されるデータプライバシーおよびセキュリティ義務を履行していないとみなされていない場合、私たちは、政府の法執行行動(例えば、調査、罰金、監査、検査、および同様の行動)、訴訟(集団訴訟クレームを含む)および大規模な仲裁要件、追加の報告要件および/または監督、個人データの処理を禁止し、個人データの廃棄または使用を命令することを含む重大な結果に直面する可能性がある。特に,原告は集団クレームや大規模仲裁要求を含むプライバシーに関するクレームを積極的に会社に提起してきた.その中のいくつかのクレームは毎回違反した上で法定損害賠償を取り戻すことを許可し、実行可能であれば、巨大な法定損害賠償をもたらす可能性があり、具体的にはデータ量と違反数量に依存する。これらの事件のいずれも私たちの名声、業務、または財務に実質的な悪影響を及ぼす可能性がある
これらの状況は、個人データを処理できないか、または特定の司法管轄区域で運営できないこと、私たちの製品を開発すること、またはそれを商業化する能力が限られていること、時間と資源をかけて任意のクレームや調査を弁護すること、否定的な宣伝、または私たちのビジネスモデルや運営の重大な変化を含むが、これらに限定されない
項目1 B:未解決の作業者の意見を処理する
ない。
項目1 C:ネットワークセキュリティに関する問題
リスク管理と戦略
我々は、我々の重要なコンピュータネットワーク、第三者ホストサービス、通信システム、ハードウェアおよびソフトウェア、および私たちのキーデータ(知的財産権、独自、戦略的または競争性を有する機密情報、および臨床試験データを含む)からなるネットワークセキュリティ脅威の重大なリスク(総称して“情報システムおよびデータ”と総称する)を識別、評価および管理するための様々な情報セキュリティプロセスを実施し、維持した
我々の情報技術部門(“IT部門”)は、サービスプロバイダの支援の下、企業のネットワークセキュリティ脅威やリスクの識別、評価、管理を支援している。IT部門は、様々な方法を用いて我々の脅威環境や会社のリスク状況を監視·評価し、ネットワークセキュリティ脅威からのリスクを識別·評価している。例えば、これらの方法は、手動および自動ツール、ネットワークセキュリティ脅威を識別する報告およびサービスの購読、脅威および脅威行為者報告の分析、脅威環境スキャン、法執行調整、監査、脅威評価、および脆弱性評価を含む
環境に応じて、我々は、我々の情報システムおよびデータがネットワークセキュリティ脅威によって生じる重大なリスク、例えば、セキュリティイベント応答戦略、セキュリティイベントを検出および対応するためのツール、データ暗号化戦略、アクセス制御、物理セキュリティ制御、資産管理戦略、システム監視、人員訓練、浸透テスト、およびネットワークセキュリティ保険を管理および低減するために、様々な技術、物理および組織措置、プロセス、基準および政策を実施し、維持する
ネットワークセキュリティ脅威の重大なリスクの評価と管理は、私たちの全体的なリスク管理プロセスに組み込まれている。例えば、IT部門は経営陣と協力し、リスク管理プロセスの優先順位を決定し、より我々の業務に実質的な影響を与える可能性のあるネットワークセキュリティ脅威を緩和し、我々の経営陣は、我々の全体的な業務目標に基づいてネットワークセキュリティ脅威からの重大なリスクを評価し、後者が我々の全体的な企業リスクを評価することを取締役会監査委員会に報告する
私たちは、専門サービス会社(法律顧問を含む)、ネットワークセキュリティコンサルタント、ネットワークセキュリティソフトウェアプロバイダ、ホスト·ネットワーク·セキュリティサービスプロバイダ、および浸透試験会社のような、ネットワークセキュリティ脅威による重大なリスクを時々識別、評価、管理するためにサービスプロバイダを使用する。
我々は、サービスプロバイダを使用して、アプリケーションプロバイダ、ホスト·プロバイダ、および契約研究組織のようなサービス全体にわたって様々な機能を実行する。提供されるサービスの性質に基づいて、あるプロバイダのネットワークセキュリティプロセスを分析するために、その内部セキュリティ評価報告および認証(ある場合)を検討する。
我々に大きな影響を与える可能性のあるネットワークセキュリティ脅威のリスクとそれらがどのように行われているかの説明については,第1部1 A項のリスク要因を参照されたい.このForm 10-K年次報告書では、リスク要因には、特にタイトルが含まれている“私たちの情報技術システムまたは私たちが依存する第三者のシステムまたは私たちのデータが破壊された場合、私たちは規制調査と行動に限定されないが、規制された調査と行動を含むが、訴訟、罰金と処罰、私たちの業務運営の中断、名声損害、収入および利益損失、および他の不利な結果を含むこのような損害を経験する可能性がある”
統治する
私たちの取締役会は私たちのネットワークセキュリティリスク管理をその一般的な監督機能の一部としている。取締役会監査委員会は、ネットワークセキュリティ脅威からのリスクを監督し、緩和することを含む、我々のネットワークセキュリティリスク管理プロセスを監督する責任がある
我々のネットワークセキュリティリスク評価·管理プロセスは、IT部門の上級取締役を含む当社の経営陣の一部のメンバーが実施·維持しています。この人はこれまで他の組織のネットワークセキュリティ担当者,ネットワークセキュリティコンサルタント,情報セキュリティの専門家を務めてきた.この人員は、認証情報システムセキュリティ専門家を含むネットワークセキュリティに関する複数の認証を有する
IT部門は我々の最高財務官(CFO)に報告し,CFOはIT部門が適切な人員を募集するのを支援し,ネットワークセキュリティリスクを我々の全体リスク管理戦略に取り入れ,関係者に重要な優先事項を伝えることを担当している。IT部門の上級取締役は、予算を承認し、ネットワークセキュリティイベントの準備を支援し、ネットワークセキュリティプロセスを承認し、セキュリティ評価やその他のセキュリティに関する報告書を審査する
我々のネットワークセキュリティイベント応答と脆弱性管理プロセスは、状況に応じて、最高財務官を含むいくつかのネットワークセキュリティイベントを管理層メンバーに報告することを目的としている。IT上級役員と最高財務官は私たちのイベント応答チームと協力して、彼らの緩和と修復を助けます
通知されます。さらに、私たちのイベント応答および脆弱性管理プロセスは、取締役会監査委員会にいくつかのネットワークセキュリティイベントを報告することを含む
上記のように、監査委員会は、 IT シニアディレクターまたはその他の指定者から、重大なサイバーセキュリティの脅威やリスク、およびそれらに対処するために実施したプロセスに関する報告を受けます。また、監査委員会は、サイバーセキュリティの脅威、リスク、軽減に関する様々な報告書、サマリー、プレゼンテーションを受け取ります。また、監査委員会は定期的に取締役会にサイバーセキュリティ問題に関する報告を行っています。
項目2.所有財産の管理
当社は不動産を所有しておらず、今後も不動産を取得する予定はありません。
サンディエゴ · リース
2023 年 11 月には、カリフォルニア州サンディエゴにおける研究開発スペースのリース契約 ( New San Diego Lease ) を締結しました。ニューサンディエゴリースの総面積は約 5,563 平方フィートである。 新サンディエゴリースの期間は 2024 年 2 月 10 日に開始され、当初の期間は 4.3 年間です。
基本レンタル料は新しいサンディエゴレンタル期間中に定期的に調整されます。 新しいサンディエゴ賃貸契約に基づいて支払われるレンタル料には、光熱費、不動産税、保険、メンテナンスを含むいくつかの施設費用での私たちのシェアを支払うための基本賃貸料と追加の月謝が含まれます。しかも、私たちは33,000ドルの保証金を支払った
2013年、私たちはカリフォルニア州サンディエゴでオフィススペース賃貸契約、つまり最初のサンディエゴ賃貸契約を締結した。サンディエゴ賃貸契約の最初の初期期限は2023年11月までです。2015年6月、私たちは最初のサンディエゴ賃貸契約を改訂し、レンタル総面積を31207平方フィートに増加させ、建物全体を占有した。2023年11月、私たちは第1回サンディエゴ賃貸契約の期限を2024年2月29日に延長した。
2016年、私たちはオフィスビル賃貸契約、つまり2つ目のサンディエゴ賃貸契約を締結し、カリフォルニア州サンディエゴの2つ目の不動産を購入した。第二のサンディエゴ借約の総面積は約51,000平方フィートです。私たちはこの施設を事務、製造、そして研究開発目的に使用する。2件目のサンディエゴリースのレンタル期間は2017年6月から2027年5月まで続いています。
基本レンタル料は二回目のサンディエゴレンタル期間内に定期的に調整します。2023年12月31日まで、二番目のサンディエゴ賃貸契約に基づいて支払われる賃貸料には、基本賃貸料と追加の月費が含まれており、光熱費、物流税、保険、メンテナンスを含むいくつかの施設費用のシェアを支払います。しかも、私たちは95000ドルの保証金を支払った
プリマス会議レンタル
2014年、私たちはペンシルベニア州プリマス会議にある会社本社のためにプリマス会議のレンタル契約を締結しました。私たちはプリマス会議レンタルを何度も改訂し、レンタル総面積を57,361平方フィートに増加させ、レンタル期間を2029年12月31日まで延長した。
基本賃貸料はプリマス会議期間中に定期的に調整されます。2023年12月31日現在、プリマス会議レンタルに基づいて支払われる賃貸料には、光熱費、物業税、保険、メンテナンスを含むいくつかの施設費用における当社のシェアを支払うための基本賃貸料と追加月費が含まれています。さらに、私たちは合計12.4万ドルの保証金を支払った
私たちはすでに4つの協定を締結して、私たちのプリマス会議本部の面積は全部で約25,000平方フィートの面積を転貸します。そのうちの1つは2025年3月31日まで、2つの転貸期間は2026年12月31日まで、もう1つは月ごとに転貸します
私たちは私たちの現在と未来に計画された施設が予測可能な未来での私たちの運営需要を満たすのに十分だと信じている。もし私たちがもっと多くの空間が必要なら、私たちは私たちが商業的に合理的な価格でより多くの空間を得ることができると信じている。
プロジェクト3.法的訴訟の展開
証券訴訟
証券集団訴訟
2020年3月、米ペンシルベニア州東区地方裁判所は、同社とその元最高経営責任者総裁と最高経営責任者を被告としたいわゆる株主集団訴訟であるマクデミードがインノー·ビオ製薬会社とJ.ジョセフ·キングを訴えた。訴訟によると、同社は重大な虚偽と誤解性の陳述を行い、ある連邦証券法に違反した。原告は指定されていない金銭損害賠償を要求した
推定された階級を代表して、合理的な弁護士費を含む費用と費用を判決する。原告の起訴状は後に改正され、同社のある他の高級職員を被告とした。事件で追加の動議が提出された後、2022年6月、双方は原則として株主集団訴訟を決着させる合意に達し、裁判所は2023年1月にこの合意を承認した。和解協定によると、私たちはすべての未解決クレームを終わらせるために、3,000万ドルの現金と1,400万ドルの普通株を支払うことに同意した。私たちの保険会社は和解協定の現金3000万ドル分を支払った。2023年3月31日までの3カ月間、証券集団訴訟和解協定に基づいて760,083株の普通株を発行した。
株主派生訴訟
2020年4月、米ペンシルベニア州東区地方裁判所は、同社の現職8人と前任取締役8人を被告にしたいわゆる株主派生訴訟であるBehestiがKimらを訴えた事件を起こした。この訴訟は州と連邦政府のクレームを主張し、上記株主集団訴訟と同様の告発された不実陳述に基づいている。訴訟告発会社の取締役会は私たちの管理、政策、やり方と内部統制に対して合理的かつ慎重な監督を行うことができなかった。原告は会社を代表して指定されていない金銭賠償と管理改革を要求した。2020年6月から2020年8月までの間に,裁判所はより多くの株主派生商品苦情を提出し,その後合併を行った
2022年3月、デラウェア州衡平裁判所はまた1件の株主デリバティブ訴訟を提起し、合併した派生商品訴訟中のクレームと基本的に似ていると主張した。2022年5月、デラウェア州衡平裁判所は訴訟の棚上げを宣言した
2023年3月、双方は平衡平裁判所に共同状況報告を提出し、双方は原則的に和解に同意し、その中で合併の派生訴訟とある株主要求を解決することも規定されていると報告した
2023年4月、合併派生訴訟の原告はペンシルベニア州東区米国地区裁判所に和解を予備承認する動議を提出した。提案された和解規定は合併の派生訴訟、デラウェア州衡平裁判所で解決された派生訴訟とある株主要求を解決する。
2023年6月、裁判所は和解の規定に基づき、提案された派生商品債権和解を初歩的に承認した。和解条項は、和解審問及び裁判所が最終的に和解を承認した後、和解条項に記載されているいくつかの企業管理改革を実施することを期待している。予備命令はまた和解通知の形式と方法を承認した。 和解の一環として、2023年7月、原告弁護士に120万ドルの費用と支出を支払った。2023年10月、裁判所は和解を承認する命令と最終判決を下し、2023年11月に発効した。“コーポレート·ガバナンス規定”の規定に基づき、会社はコーポレートガバナンス改革を実施した。
VGXI訴訟
2020年6月、私たちはVGXI、Inc.およびGeneOne Life Science,Inc.,Inc.およびVGXI,Inc.(総称してVGXIと呼ぶ)が私たちと彼らとの供給協定に深刻に違反したことを告発するために、ペンシルバニア州モンゴメリ県一般プライス裁判所に提訴した。訴状はVGXIに宣言的判決、具体的な合意履行、禁止救済、会計、損害賠償、弁護士費、利息、費用とその他の救済を要求した。2020年6月、同社は予備禁止の嘆願書を提出したが、却下された。
私たちが控訴した後、VGXIは2020年7月に供給協定に違反し、商業秘密と不当な利益を流用したとして、私たちに反訴した。反訴は私たちに禁止救済、損害賠償、弁護士費、利息、費用、その他の救済を提供することを要求する。VGXIはまた,Oology Bioservices,Inc.に対して第三者訴えを行い,同社は我々が招聘した代理製造組織であり,VGXIが提供するサービスと類似したサービスを提供している.我々はVGXI反訴に対する回答を提出し,これらの告発とVGXIが提出した文書からのクレームに異議を唱えた.2020年10月、私たちはペンシルベニア州高等裁判所に控訴中止通知を提出した。この訴訟の裁判日はまだ確定されていない。
私たちはVGXIの訴えに提起された告発を積極的に起訴し、VGXIの反訴に対して大いに自分を弁護するつもりだ。
GeneOne訴訟
GeneOneは2020年12月、GeneOneとの間のCELLECTRAデバイス許可協定または合意に違反したとして、ペンシルバニア州モンゴメリー県一般裁判所に提訴しました。私たちは2020年10月にこの合意を終了した。起訴状は違約、宣言的判決、不正競争と不当所得に対するクレームを主張した。起訴状は強制救済、会計、損害賠償、
私たちから利益、弁護士費、利息、その他の救済を返してください。私たちは訴えに初歩的な反対意見を出したが、却下された。2021年9月、私たちは不満、新しい事項、そして反訴に答えた。私たちの反訴はGeneOneが合意に違反したことを告発し、契約違反と宣言的判決のクレームを主張する。反訴は損害賠償、利息、費用、弁護士費と費用を要求する。2021年10月18日、GeneOneは私たちの反訴と新しい質問に対する答えを提出した。この訴訟の裁判日はまだ確定されていない。
私たちはGeneOneの反訴に対する私たちのクレームを積極的に起訴し、GeneOneの苦情に対する私たちのクレームを強力に弁護するつもりだ
プロジェクト4.炭鉱の安全状況の開示
適用されません。
第II部
第五項:登録者普通株、関連株主事項及び発行者が株式証券を購入する市場を構築する
市場情報
私たちの普通株は、1株当たり0.001ドルの価値があり、2014年9月15日にナスダック全世界の精選市場で取引を開始し、コードは“INO”で、これまでニューヨーク証券取引所MKT取引所で取引したことがある。2023年11月2日、私たちの普通株はナスダック資本市場に移転した。
2024年1月24日、普通株に対して12株1株の逆株式分割を実施した。2024年3月1日現在、私たちは約58人の登録されている普通株株主です。実際の株主数はこの記録保持者の人数を超えており、受益者である株主を含むが、その株式は仲介人や他の被命名者が街頭名義で保有している。この数の登録所有者は、その株式が他のエンティティが信託形式で保有する可能性のある株主も含まれていない。
ナスダック資本市場によると、2024年3月1日、私たちの普通株の終値は1株9.55ドルだった。
配当をする
私たちの普通株式のどんな配当金の支払いも私たちの取締役会の自由裁量に含まれている。私たちは普通株に対して現金配当金を支払ったことがなく、取締役会は予測可能な未来にも普通株の現金配当金を発表しないと予想している。
[パフォーマンスチャート]
次の図は,我々の普通株の表現をニューヨーク証券取引所米国指数,S超時価バイオテクノロジー指数とナスダック総合指数の2023年12月31日までの5年間の表現と比較したものである。このグラフは、2018年12月31日に私たちの普通株式と各指数に100ドルを投資し、すべての配当金(あれば)を再投資すると仮定しています。
*配当再投資を含む株式または指数100ドルに12/31/18に投資します。
12月31日までの会計年度。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 12/18 | | 12/19 | | 12/20 | | 12/21 | | 12/22 | | 12/23 |
| Inovio製薬会社: | 100.00 | | | 82.50 | | | 221.25 | | | 124.75 | | | 39.00 | | | 12.75 | |
| ニューヨーク証券取引所アメリカ証券取引所 | 100.00 | | | 110.19 | | | 104.83 | | | 134.55 | | | 129.34 | | | 131.60 | |
| ナスダック複合体 | 100.00 | | | 136.69 | | | 198.10 | | | 242.03 | | | 163.28 | | | 236.17 | |
| S&普華永道生物科学技術指数 | 100.00 | | | 116.98 | | | 128.56 | | | 142.49 | | | 161.98 | | | 167.26 | |
この図に含まれる株価表現は,必ずしも未来の株価表現を示唆しているとは限らない.業績グラフは、本Form 10-K年次報告と共に提供されるのみであり、このForm 10-Kを参照によって1933年証券法(改訂本)または1934年証券法(改訂本)によって提出された任意の文書の一般的な声明に統合したものとみなされるべきではなく、引用によってこのような情報が特に含まれていない限り、このような法案による提出とみなされてはならない。
最近売られている未登録証券
ない
発行者および関連先による持分証券の購入
ない
プロジェクト6.予算を保留する
プロジェクト7.経営陣の財務状況と経営成果の検討と分析
本報告には前向き陳述が含まれており,改正後の1933年“証券法”第27 A節と改正された1934年“証券取引法”第21 E節が定義されている。このような陳述は未来の事件や私たちの未来の財政的表現と関連がある。場合によっては、前向き陳述は、“可能”、“可能”、“会議”、“すべき”、“予想”、“計画”、“予想”、“信じ”、“推定”、“予測”、“潜在的”または“継続”などの用語によって識別されることができる。これらの声明はただ予測に過ぎない。実際の事件や結果は大きく違うかもしれない。
私たちは、私たちの現在の予想と予測に基づいて、展望性陳述に反映された予想は合理的だと考えているが、私たちは未来の結果、活動レベル、業績或いは成果を保証することができない。しかも、私たちまたは他の誰も展望的陳述の正確性と完全性に責任を負わない。私たちは、これらの陳述が実際の結果または私たちが予想している変化と一致するように、本年度報告書を提出した後に任意の前向き陳述を更新する義務はありません。
以下、我々の財務状況及び経営結果の検討は、我々の総合財務諸表及び本年度報告における他の部分に関する付記と他の財務情報と一緒に読まなければならない。著者らも読者に当社が行った各開示を慎重に検討してもらい、これらの開示は当社の業務に影響する要素について利害関係のある各方面に意見を提供することを目的としており、本年報第I部分第1 a項“リスク要因”による開示を含むが、これらに限定されない
実際の結果と展望性陳述に含まれる結果とは異なるリスク要因は、これらに限定されないが、これらに限定されない。私たちは規制部門の承認を得た製品が不足している。臨床試験と製品開発計画に固有の不確定性は、以下の事実を含むが、これらに限定されない:臨床前と臨床結果は他の試験或いは他の適応で達成可能な結果を表明しない可能性があり、研究或いは試験は成功しない或いは期待された結果に達することができない可能性があり、臨床前研究と臨床試験は予想された時間帯内に開始せず、十分な登録或いは完成がある可能性があり、1つの研究の結果は必ずしも他の類似研究の結果の反映或いは支持を得るとは限らない可能性があり、動物研究の結果は人体研究において達成できる結果を表明しない可能性があり、臨床試験は高価であり、長年を要する可能性がある。どの臨床試験の結果も不確定であり、臨床試験過程中にいつでも失敗が発生する可能性があり、著者らの特許設備技術と候補DNA薬物は臨床試験において期待される安全性と有効性特徴を示すことができない可能性がある。資金の獲得可能性;私たちの候補DNA薬物の製造能力;私たちまたは私たちの協力者が対象とする疾患に対する代替療法または療法の利用可能性または潜在的利用可能性は、私たちおよび私たちの協力者が開発することを望む任意の療法または療法よりも有効または費用効果的である可能性のある代替療法を含む;私たちは、協力協定に従って開発、規制および商業化イベント支払いを得る能力、私たちの専門権が実行可能かどうか、弁護可能かどうか、他人の権利を侵害するか、または無効なクレームに耐えられるかどうか、および政府医療法律および提案の影響に耐えることができるかどうか。
概要
著者らは臨床段階の生物技術会社であり、DNA薬物の開発と商業化に専念し、ヒトパピローマウイルス(HPV)、癌と伝染病に関連する疾患から人々を治療と保護することを助ける。著者らのプラットフォームは体内蛋白質生産の力を利用して、DNA薬物の設計と交付を最適化し、人体に自分の抗病ツールの製造を教えた
我々は特許技術を用いてDNAプラスミドを設計し、これは環状の小DNA分子であり、その動作原理は人体細胞がダウンロードできるソフトウェアのように、特定のタンパク質を産生し、標的と抗疾患を産生する。我々の独自調査CELLECTRA®送達装置は私たちのDNA薬が人体細胞に入り、最適な効果を得るのを助ける。
我々の主要な候補薬剤は、再発性気道乳頭腫症の治療、またはRRPと呼ばれるINO-3107であり、HPV感染によって引き起こされるまれで衰弱した呼吸器疾患である。われわれが完成したINO−3107治療HPV−6とHPV−11関連RRPの1/2期臨床試験では,81.3%の患者がINO−3107使用後の1年間で治療前年と比較して手術回数が減少した
2023年2月、私たちの1/2期臨床試験の第2のキューのデータを公表しました。これは、2022年10月に第1のキューを発表した後のデータです。探索的側孔注射針によりINO−3107を投与した11名の第2群患者のうち,10名(91%)が最初の治療後1年間で手術介入が減少し,試験治療開始0日目から測定した。この10名中4名は手術を必要としなかった。治療後1年と治療前1年を比較すると、3種類の手術干与措置の中央値は統計学的に有意に低下した。第2のキューの患者では,INO−3107耐性は良好であり,免疫原性を有していた。第2のキューの安全性および有効性の結果は、2022年10月に発表された第1のキューの結果と一致する
2023年第4四半期、この完了した試験のデータは、FDAの加速承認計画による審査のためにバイオライセンス申請(BLA)の提出をサポートするために使用可能であるという米国食品医薬品局(FDA)からフィードバックを受けた。加速計画に基づいて我々のBLAを提出する一部として,FDAのすべての届出要求を満たし,BLAを提出する前に検証的臨床試験を開始する必要がある
INO-3107の開発に加えて、我々はHPV関連肛門異型増殖および中咽頭扁平上皮癌、多形性神経膠芽腫、致命的な脳癌、およびエボラウイルスを予防するための潜在的なワクチン増強剤を含む他の適応のためのDNA薬剤の開発または開発を積極的に計画している。われわれは以前,HPVに関連する子宮頚高度扁平上皮内病変(HSIL)を治療する候補DNA薬の臨床試験を行っていたが,2023年8月に米国でのこの適応の開発を中止することを発表した。しかし、我々のパートナーであるアポロバイオ社は、中国でこの候補者の3期臨床試験を継続し、同管轄区で規制部門の承認を求め、その候補者を商業化する可能性がある
私たちのパートナーと協力者はAdvenant生物製薬会社(蘇州)、ApolloBio社、アスリコン社、ビルとメリンダ·ゲイツ財団(ゲイツ)、防疫革新連盟、Coherus生物科学会社、アメリカ国防高等研究計画局、アメリカ国防総省、HIVワクチン試験ネットワーク、国際ワクチン研究所、カーネギーヨーロッパ会社、国家癌研究所、国家衛生研究院、国家アレルギー·感染症研究所、鉛直生命科学会社、再生製薬会社、Richter-Helm生物製薬会社、Thermo Fisher、ペンシルバニア大学、Walter研究所、ウィスタール研究所とです
私たちのすべての候補DNA薬は研究と開発段階にある。私たちはいかなる製品の販売からも何の収入も得ておらず、INO-3107と私たちの他の候補製品のマーケティング承認を得て商業化に成功しない限り、何の実質的な収入も生じないと予想される。私たちはライセンス料とマイルストーン収入と協力研究開発協定と契約から収入を稼いでいる。著者らのDNA薬物候補は広範な臨床前と臨床テストを含む大量の追加の研究と開発努力が必要である。我々が臨床試験に進めてきたすべての候補DNA薬は,商業使用前に規制部門の承認を得る必要があり,大量の商業化コストが必要となる。私たちの研究開発努力は成功しないかもしれません。私たちは決して十分な製品収入を生み出して利益を上げないかもしれません。
2023年12月31日現在、私たちの累計赤字は16億ドルです。著者らの研究開発計画に対する承諾、臨床前研究、臨床試験と監督活動の資金、及び一般と行政活動のコストにより、将来も引き続き重大な運営損失を受けることが予想される
重要な会計政策と試算
米国証券取引委員会は、重要な会計政策を、経営陣から見て私たちの財務状況や経営結果を記述するために重要であり、管理職が判断する必要がある政策と定義している。私たちの財務状況と経営結果の討論と分析は、アメリカ公認会計基準に基づいて作成された監査された総合財務諸表に基づいています。本報告に掲載されている総合財務諸表付記2は、我々の主要な会計政策について概説した。
これらの連結財務諸表を作成する際には、資産、負債、収入、費用報告金額に影響を与える推定と判断を行う必要がある。我々は経験とその時点で合理的であると考えられる様々な仮説を推定し,これらの仮定の結果が資産や負債の帳簿価値を判断する基礎を構成しているが,これらの資産や負債の帳簿価値は他のソースからは明らかではないように見える.実際の結果はこれらの推定とは異なる可能性がある。以下の会計政策は、連結財務諸表を作成する際に使用される判断と推定に重要であると考えられます
連携協定と収入確認
著者らは、我々の協力協定が会計基準編纂(“ASC”)テーマ808:協力手配(“テーマ808”)の制約を受けているかどうかを評価し、それらが共同経営活動に関連しているかどうか、及び双方が積極的に手配に参加し、重大なリスクとリターンに直面しているかどうかに基づいている。ある程度、このスケジュールはトピック808の範囲に属し、私たちのパートナーは顧客ではなく、このような支払いを研究および開発費用の減少として表すと結論した。パートナーが顧客に支払った金額が顧客の対価格を表す場合、会計基準更新(“ASU”)2014-09年度の“顧客との契約収入”(“主題606”)の範囲でこれらの支払いを計算します
研究と開発費用−臨床試験対策プロジェクト
我々の活動は主に独自の設備技術,DNA候補薬物,dMABの開発に関する研究と開発を含む。臨床試験費用の場合、計算すべき費用を推定するための判断は、参加者登録、研究完了、および他のイベントに基づいて生じる総コストの推定に依存する。蓄積された臨床試験コストは試験の進展とともに改訂される可能性がある。改正は、改正された事実が知られている間に費用を計上する。歴史的に見ると、改訂は研究開発費用の実質的な変化を招くことはないが、臨床試験方案の修正や試験の廃止は著者らの運営結果に費用を発生させる可能性がある
最近の会計公告
最近の会計声明に関する資料は連結財務諸表付記2に掲載され、本報告の他の部分に掲載されている。
経営成果
2023 年 12 月期、 2022 年 12 月期、 2021 年 12 月期連結決算は、以下の表に示し、その後の議論ではこれらの期間の結果を使用しています。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | 増加 / ( 減少 ) 2023 年 vs. 2022 年 | | 増加 / ( 減少 ) 2022 年 vs. 2021 年 |
| 2023 | | 2022 | | 2021 | | $ | | % | | $ | | % |
| | | | | | | | | | | | | |
| | | | | | | | | | | | | |
| | | | | | | | | | | | | |
| | | | | | | | | | | | | |
提携契約その他の契約 ( 関連会社を含む ) による収益
| $ | 832,010 | | | $ | 10,262,268 | | | $ | 1,774,758 | | | $ | (9,430,258) | | | (92) | % | | $ | 8,487,510 | | | 478 | % |
| 運営費用: | | | | | | | | | | | | | |
| 研究開発 | 86,676,563 | | | 187,650,503 | | | 249,240,324 | | | (100,973,940) | | | (54) | | | (61,589,821) | | | (25) | |
| 一般と行政 | 47,582,104 | | | 90,185,285 | | | 53,752,353 | | | (42,603,181) | | | (47) | | | 36,432,932 | | | 68 | |
| 営業権の減価 | 10,513,371 | | | — | | | — | | | 10,513,371 | | | 100 | | | — | | | — | |
| | | | | | | | | | | | | |
| 総運営費 | 144,772,038 | | | 277,835,788 | | | 302,992,677 | | | (133,063,750) | | | (48) | | | (25,156,889) | | | (8) | |
| 運営損失 | (143,940,028) | | | (267,573,520) | | | (301,217,919) | | | 123,633,492 | | | 46 | | | 33,644,399 | | | 11 | |
| 利子収入 | 8,133,290 | | | 4,782,030 | | | 3,363,080 | | | 3,351,260 | | | 70 | | | 1,418,950 | | | 42 | |
| 利子支出 | (1,222,789) | | | (1,253,952) | | | (1,936,447) | | | 31,163 | | | (2) | | | 682,495 | | | (35) | |
| | | | | | | | | | | | | |
| | | | | | | | | | | | | |
| 関連会社への投資利益 ( 損失 ) | 773,145 | | | (1,899,654) | | | (553,570) | | | 2,672,799 | | | * | | (1,346,084) | | | * |
| 売却可能株式有価証券の純未実現損益 | 5,850,626 | | | (7,846,172) | | | (3,222,838) | | | 13,696,798 | | | * | | (4,623,334) | | | * |
| その他の収入,純額 | (4,711,596) | | | (3,861,584) | | | 343,371 | | | (850,012) | | | * | | (4,204,955) | | | * |
| | | | | | | | | | | | | |
| | | | | | | | | | | | | |
| | | | | | | | | | | | | |
| Geneos の純損失分前純損失 | (135,117,352) | | | (277,652,852) | | | (303,224,323) | | | 142,535,500 | | | 51 | | | 25,571,471 | | | 8 | |
| | | | | | | | | | | | | |
| Geneos の純損失分 | — | | | (2,165,213) | | | (434,387) | | | 2,165,213 | | | * | | (1,730,826) | | | * |
| 純損失 | $ | (135,117,352) | | | $ | (279,818,065) | | | $ | (303,658,710) | | | $ | 144,700,713 | | | (52) | % | | $ | 23,840,645 | | | (8) | % |
| | | | | | | | | | | | | |
| | | | | | | | | | | | | |
*意味がない
2023年12月31日までと2022年12月31日までの年次比較
収入.収入
収入は主に協力手配と他の契約から来て、付属実体との間の手配を含む2023年12月31日そして2022それは.収入が940万ドル減少したのは、2022年にすべての業績義務を履行したため、国防総省との調達契約に収入がなかったからだ。
研究と開発費
研究開発費には、研究開発活動を展開するために発生する費用が含まれ、フルタイムの研究開発者の給与と福祉、施設費用、管理費用、実験室用品費用、臨床試験および関連臨床製造費用、契約研究機関および他のコンサルタントに支払う費用、および外部費用が含まれる。私たちは労働報告システムを使って従業員を記録します
プロジェクトごとに報酬を支払う。割り当てられていない研究開発費には、特定の項目に割り当てられない工事および設備関連費用、株式ベースの報酬、特定の項目とは無関係な他の従業員関連費用、および施設および減価償却費用が含まれる
研究·開発コストは発生時に費用を計上する。今後受け取った研究·開発活動のための貨物やサービスの前払金は返金せず、資本化する。資本化金額は関連貨物の納入またはサービス提供時に費用を計上する。
下表に本年度までの研究と開発費用を候補製品別にまとめた2023年12月31日そして2022:
| | | | | | | | | | | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 | | (減少を)増やす |
| (千ドル) | 2023 | | 2022 | | $ | | % |
| INO-4800と他の新冠肺炎 | $ | 8,869 | | | $ | 93,464 | | | $ | (84,595) | | | (91) | % |
| VGX-3100 | 4,748 | | | 15,989 | | | (11,241) | | | (70) | |
| INO-3107 | 17,841 | | | 8,133 | | | 9,708 | | | 119 | |
| INO-5401と他の免疫腫瘍学 | 8,372 | | | 2,775 | | | 5,597 | | | 202 | |
| その他の研究·開発計画(A) | 8,472 | | | 6,227 | | | 2,245 | | | 36 | |
| | | | | | | |
| 工事と設備に関する | 8,863 | | | 25,187 | | | (16,324) | | | (65) | |
| 株に基づく報酬 | 4,606 | | | 9,059 | | | (4,453) | | | (49) | |
| その他未分配費用(B) | 24,906 | | | 26,817 | | | (1,911) | | | (7) | |
| 研究開発費 | $ | 86,677 | | | $ | 187,651 | | | $ | (100,974) | | | (54) | % |
(A)贈与契約から受け取った寄付純額は、販売研究·開発費と記す。
(B)2023年第2四半期に記録された200万ドルの無形資産減価を含む。
研究·開発費が前年比1.01億ドル減少した要因は、
•2022年第4四半期にINO-4800計画を停止した後、INO-4800に関連する薬物製造、臨床研究費用、外部サービス、支出在庫は6140万ドル減少した
•INO-4800の開発を中止した後、他の新冠肺炎研究に関連する薬物製造と臨床研究費用は1,790万ドル減少した
•従業員とコンサルタントの報酬は1500万ドル減少し、株式給与を含む、主な原因は2023年のリストラである
•CELLECTRA 3 PSPデバイスおよびアレイ自動化プロジェクトに関連する低コスト在庫および外部サービスのための940万ドル
•私たちは2023年第3四半期にこの候補製品の開発を中止したため、VGX-3100に関連する免疫学、臨床研究費用、外部サービスは840万ドル減少した
•ビスタールによる新冠肺炎dMAbへの二次贈与に関連する440万ドルの低投与量
これらの減少幅は以下のような部分で相殺される
•贈与契約記録の低い反研究·開発費は1,770万ドル
•580万ドルの他の薬品製造コストが上昇した。
2023年12月31日まで、2023年12月31日まで、2022年12月31日までの年間で、現在の贈与協定から逆研究·開発費として受け取って記録されている寄付金は、それぞれ680万ドルと2450万ドルです。前年比低下の主な原因は、Wistarによって主にDARPA新冠肺炎dMAbに使用された子贈与が770万ドル減少し、国防部3 PSP設備開発贈与が610万ドル減少し、CEPI LASAとMERS贈与が500万ドル減少したことである。広告ワクチンの精算は240万ドル増加し、これらの減少を相殺した。
一般と行政費用
2023年12月31日までの1年間、一般と行政費用は、業務発展費用、無形資産償却、特許費用を含めて4760万ドルですが、2022年は9020万ドルです。総額が前年比42.6ドル減少した要因は:
•集団訴訟証券訴訟の和解に関する費用の純額は1400万ドルで、2022年に計算されるが、2023年に支払われる
•法的費用は1130万ドル減少し、主に2023年に訴訟が終了した結果である
•2022年には2023年には発生しなかった株式奨励修正に関する420万ドルの株式報酬支出を含む、元総裁と最高経営責任者の分離に関する690万ドルの使い捨て費用
•従業員の報酬は590万ドル減少し、従業員やコンサルタント株の報酬を含め、2023年のリストラの結果となった
•保険料を190万ドル削減し
•我々が生産停止したINO-4800およびVGX-3100計画に関連する他の外部サービスは140万ドル減少した。
営業権の減価
2023年9月、私たちの株価と関連する時価の持続的な下落と、バイオテクノロジー業界の株式価値が一般的に低下したため、私たちの名声は損なわれたと結論した。この分析に基づき、2023年9月30日までの3ヶ月間で、1050万ドルの非現金税引前営業権減価費用を確認した。詳細は付記8-を参照商誉 無形資産があります本報告書に記載されている連結財務諸表を調整した。
株に基づく報酬
従業員株式給与コストは、付与された日に奨励の公正価値をもとに計量し、従業員に必要なサービス期間の費用を確認する。2023年12月31日と2022年12月31日までの年間の従業員株式給与総コストは1,040万ドルと2,220万ドルであり、そのうち450万ドルと880万ドルは研究開発費に含まれ、590万ドルと1,340万ドルはそれぞれ一般および行政費用に含まれている
利子収入
2022年と比較して、2023年12月31日までの年間の利息収入が340万ドル増加したのは、主に私たちの現金残高がより高い金利を稼いだためだ。
利子支出
2022年と比較して、2023年12月31日までの年間の利息支出は3.1万ドル減少した。私たちの転換可能な優先手形は2024年3月1日に満期になって全額返済されるため、2024年の利息支出は大幅に低下すると予想される
関連企業への投資損益
関連実体への投資収益(赤字)は,2023年,2023年および2022年12月31日までの年度まで,連営実体への投資に等しい公平市価がそれぞれ773,000ドルおよび190万ドルであったためである。我々は、株の資産負債表毎の韓国新取引所市場における終値に基づいて、その時価記録に基づいて、当社の同社への投資を記録し、価値の変化を総合経営報告書に反映させる。
持分証券の売却が純収益を実現していない
2023年12月31日現在、2023年12月31日現在、2022年12月31日までの年度の株式売却可能証券の未実現純収益(損失)はそれぞれ590万ドルと780万ドルであり、これは投資の公平な市場価値が変化したためである。
その他(費用)収入,純額
2023年12月31日現在、2023年12月31日現在、2022年12月31日までの年度のその他(支出)収入純額はそれぞれ470万ドルと390万ドルであり、主にこれらの期間に売却された短期投資の実現損失と関係がある。
Geneosの純損失でのシェア
Geneosの純損失シェアは2022年のGeneosの損失における私たちのシェアを代表する。本報告書総合財務諸表付記15で述べたように、私たちは2022年3月にGeneosへの投資の帳簿価値をゼロにし、Geneosのさらなる純損失における私たちのシェアを記録しない。なぜなら、私たちはその運営に資金を提供する義務がないからだ。
所得税
成立以来、営業赤字が発生したため、いずれの期間の米国所得税についても準備金を計上していない。1986年に改正された国税法(IRC)で規定されている所有権変更制限により、純営業損失と税収控除の使用がかなり年間制限されている。2023年12月31日現在、米国連邦、カリフォルニア州、ペンシルベニア州の所得税用途の純営業損失は、それぞれ10.133億ドル、2億514億ドル、1.026億ドルであり、IRC第382条で満期となる純営業損失は含まれていない
制限する。私たちはまたアメリカ連邦と州の研究開発税収控除があり、それぞれ4160万ドルと610万ドルで、IRC第383条の制限により満期になった連邦研究開発控除を差し引く。純営業損失と信用は2023年に満期になります。
2022年12月31日までと2021年12月31日までの年次比較
2022年12月31日までの年度と2021年12月31日までの年度比較については、2023年3月1日に米国証券取引委員会に提出した2022年12月31日現在の年次報告10-K表第2部第7項を参照されたい。
流動性と資本資源
我々の現金の主な用途は,我々のDNA薬物候補者の進歩のための臨床試験活動を含む研究と開発活動を援助することである。私たちは主に株式証券、債務と贈与、政府契約を売ることで私たちの現金需要を満たしています。
運営資金と流動性
2023年12月31日まで、私たちの現金と短期投資は1.453億ドル、運営資本は1.105億ドルですが、2022年12月31日まで、私たちの現金と短期投資はそれぞれ2.53億ドルと2.184億ドルです
キャッシュフロー
経営活動
2023年12月31日と2022年12月31日までの年度の経営活動で使用された純現金はそれぞれ1億244億ドルと2.162億ドルだった。差異が生じる主な原因は運転資金残高の時間スケジュールと変化であるが、業務費用の減少によって相殺される。
投資活動
2023年、2023年、2022年12月31日までの年間、投資活動が提供する現金純額はそれぞれ8740万ドルと1.096億ドルだった。この違いは主に短期投資購入,販売,満期日の時間差によるものである。
融資活動
融資活動が提供する現金純額は、2023年、2023年、2022年12月31日までにそれぞれ500万ドルと8180万ドルとなった。差が生じた要因は,2023年に販売プロトコル(以下定義)による普通株売却の純収益が550万ドルであったのに対し,2022年の間に受け取った純収益は8300万ドルであったからである
普通株の発行
2021年11月9日ATM持分発行協定に合意しましたSM販売契約、又は外部販売付き販売契約Sエージェント,あるいは総称して販売エージェントと呼び,販売エージェントによって,吾らはつねに販売エージェントを通して総収益が3,000,000,000ドルに達する普通株を適宜発売および販売することができる.
“販売契約”の条項および条件の制約の下で、販売エージェントは、法的に許容される任意のものを“市場”として発売される方法で普通株を販売することができる。販売エージェントは、私たちの指示に基づいて、任意の価格、時間または大きさの制限、または私たちが適用する可能性のある他の習慣的なパラメータまたは条件を含む商業的に合理的な努力を時々行い、販売エージェントに販売契約によって販売された任意の普通株販売総収益の最高3%(3.0%)の手数料を販売エージェントに支払い、いくつかの賠償権利を販売エージェントに提供する年.年2023年12月31日まで私たちは販売合意に基づいて1株6.33ドルの加重平均価格で875,305株の普通株を売却し、総純収益は550万ドルだった。2022年12月31日までの年間で,販売協定により2,870,478株の普通株を売却し,純収益総額は8,300万ドルであった。2024年1月1日から本報告日まで、販売協定に基づいて543,620株の普通株を追加売却し、純収益は520万ドルだった。
2023年12月31日までの年間では,株式オプションは行使されず,純価値に関する税金467,000ドルが支払われたRSU裁決の和解である2022年12月31日までの1年間に,9891株の普通株を購入する株式オプションを行使し,純収益は合計283,000ドルであり,これらの収益はRSUが奨励した株式純額決済に関する税金140万ドルで相殺された。2021年12月31日までの1年間に、109,188株の普通株を購入する株式オプションを行使し、純収益は合計670万ドルであり、これらの収益はRSUが奨励した株式純額決済に関する税金460万ドルで相殺された。
2023年3月31日までの3ヶ月間に、本報告に掲載されている総合財務諸表付記11で述べたように、証券集団訴訟和解協定に基づいて760,083株の普通株を発行した。
資金源 要求する
2023年12月31日現在、私たちの累計赤字は16億ドルで、近いうちに赤字運営を続ける予定です。私たちが累積した赤字額は引き続き増加するだろう。なぜなら、研究と開発を続けることは高価になるからだ。私たちの現在の現金資源は、S項の普通株を売却することで得られる金額を含んでいますALESプロトコルは、任意の候補製品の臨床開発を完了するのに不十分であり、規制部門の承認を得た任意の候補製品の開発を完了し、販売から収入を得るために追加の資金が必要になると予想される。もしこれらの活動が成功すれば、私たちがFDAの承認を得て、私たちの候補DNA薬をマーケティングすることができれば、承認された製品や設備をマーケティングして販売するための追加の資金を集める必要があるだろう。資本を調達するために株式や債務証券を発行する可能性があるほか、私たちの運営に資金を提供する別の方法として、潜在的な協力を評価している。私たちの現在の現金と短期投資は、本報告日から少なくとも今後12ヶ月の計画運営資金需要を満たすのに十分だと信じている
2023年の間、私たちは複数回のリストラを含めて支出を減らす措置を取った。これらの行動,およびFDAフィードバックが我々INO−3107臨床開発計画に及ぼす影響を考慮すると,我々のキャッシュ滑走路はさらなる融資活動に影響を与えることなく2025年第2四半期まで延長されることが予想される。
契約義務
2023年12月31日現在、私たちの契約義務に基づき、将来支払うべき最低支払いは次の表に示されています。私たちは手元の現金で短期的で長期的にこのような義務を履行することを望んでいる。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 期限どおりの支払い |
| 合計する | | 少ないです
1年 | | 1歳-3歳 | | 3年から5年 | | 超過
5年間 |
| 変換可能優先チケット(1) | $ | 16,948,000 | | | $ | 16,948,000 | | | $ | — | | | $ | — | | | $ | — | |
| 経営リース義務(2) | $ | 17,665,000 | | | $ | 3,247,000 | | | $ | 7,021,000 | | | $ | 5,265,000 | | | $ | 2,132,000 | |
| 製造業承諾(3) | $ | 4,489,000 | | | $ | 4,489,000 | | | $ | — | | | $ | — | | | $ | — | |
(1)2024年3月1日、これらの転換可能優先手形が満期になり、既存の現金で債務を全額返済する。より多くの情報は、本報告書の連結財務諸表に9“転換可能債務”を付記している。
(2)施設の運営リースを締結しており,レンタル期間は2024年から2029年であり,オフィス設備の運営テナントは2024年に満期となる。私たちはプリマス会議会社本社の一部の施設に対して4つの有効な転貸があり、レンタル期間は2025年3月31日、2つは2026年12月31日、もう1つは毎月。2023年12月31日現在、転貸契約期間内に、合計130万ドルの将来最低賃貸支払い(未割引)を受け取る予定で、予想支払いは上の表に含まれていません
(3)契約メーカーとの供給契約から得られる調達義務。
正常な業務過程において、私たちは様々な合意の側であり、これらの合意により、相手に賠償する義務があるかもしれません。我々の義務の条件的性質や特定のプロトコルごとに関連する独自の事実や状況により,このようなプロトコルで将来支払う可能性の高い金額は予測できない.歴史的に見て、私たちがこのような合意に基づいて支払ったお金は、私たちの業務、総合経営業績、あるいは財務状況に実質的な影響を与えません。
第7 A項には、市場リスクに関する定量的かつ定性的な開示が含まれる
金利リスク
私たちの市場リスクに対する主な開口は金利感受性であり、金利敏感性はアメリカの金利全体の水準変化の影響を受けている。私たちの現在の政策によると、私たちは金利デリバティブを使用して金利変動によるリスクを管理しない。私たちは違約リスク、市場リスク、再投資リスクを制限することで、私たちが投資する元本資金の安全性と維持性を向上させようとしている。私たちは短期投資級証券に投資することで違約リスクを下げる。2022年の大部分と2023年12月31日までの1年間で、米国の現行金利は2022年上半期に比べて著しく全体的に上昇し、2023年12月31日までのポートフォリオ時価総額は390万ドルの赤字を達成しなかった。
2023年12月31日現在、我々の債務金利は固定されており、金利変動の影響を受けない。2024年3月1日まで、私たちは負債を持っていない。
外貨リスク
私たちは主にアメリカで運営していますが、2023年12月31日までの1年間、ほとんどの取引はドルで行われています。そのため、私たちは外貨為替レートの変動に大きなリスクはありませんが、韓国で持っているいくつかのウォン建ての現金と現金等価物と、私たちがウォン建てでドルに換算したPLS株式投資の推定値は除外します
ある取引は主に外貨建てで、ウォン、ユーロ、ポンドとカナダ元を含みます。これらの取引はドル以外の通貨建ての通貨資産と負債を生み出した。これらの貨幣資産や負債の価値は、取引開始から現金で決済されるまでの時間が通貨レート変化の影響を受ける。そのため、私たちの財務業績は、外貨為替レートの変化や、私たちが業務を展開している外国市場の疲弊経済状況などの要因の影響を受ける可能性があります。
我々はデリバティブ金融商品を投機目的に使用せず、為替レートのヘッジに従事せず、取引目的のために外貨契約を保有したり発行したりしない
インフレリスク
インフレは一般的に私たちの労働コストを増加させることで私たちに影響を及ぼす。近年米国のインフレは一般的に上昇しているにもかかわらず、インフレが2023年12月31日までの年間の業務、財務状況、あるいは運営結果に実質的な影響を与えるとは考えられない
項目8.財務諸表と補足データの作成
本プロジェクトに要求される情報は、本報告第F−1ページから、我々の総合財務諸表と独立公認会計士事務所の報告を参考にして組み込まれる。
項目9.報告会計·財務開示面の変化と会計担当者との相違
ない。
項目9 A:管理制御とプログラム
情報開示制御とプログラムの評価
我々は、1934年の証券取引法(改正)に基づいて提出または提出された報告書で開示を要求した情報が、米国証券取引委員会規則および表に指定された期間内に記録、処理、集約および報告されることを保証し、必要に応じて、必要な開示に関する決定を迅速に行うために、そのような情報を蓄積し、私たちの管理層に伝達することを目的としている開示制御および手続きを維持する
我々の開示制御およびプログラムを設計·評価する際、管理層は、開示制御およびプログラムの構想や動作がどのように整備されていても、絶対的な保証ではなく合理的な保証しか提供できず、開示制御およびプログラムの目標が達成されることを確保することしかできないことを認識している。また、開示制御およびプログラムを設計する際には、我々の管理層は、その判断を用いて、可能な開示制御とプログラムの費用対効果関係を評価しなければならない。任意の制御システムの設計も、将来のイベント可能性のいくつかの仮定に部分的に基づいており、任意の設計がすべての潜在的な将来の条件でその目標を成功的に達成する保証はなく、時間の経過とともに、制御が条件の変化によって不十分になる可能性があり、またはポリシーまたはプログラムを遵守する程度が悪化する可能性がある。制御システム固有の制限により、エラーや詐欺によるエラー陳述が発生し、検出されない可能性がある。
本年度報告でカバーされている期間終了時に行われた評価によると、我々の経営陣(我々のCEOおよびCEOを含む)の監督·参加の下で、我々のCEOおよびCEOは、この期間が終了するまで、開示制御および手順(1934年証券取引法規則13 a-15(E)および15 d-15(E))が2023年12月31日に合理的な保証レベルで有効であると結論している。
財務報告の内部統制
公認会計士事務所財務報告及び認証報告に関する経営陣の内部統制報告
1934年の証券取引法第13 a-15(F)及び15 d-15(F)条の規定によると、我々の経営陣は財務報告の十分な内部統制の確立·維持を担当している。我々の財務報告書の内部統制は、私たちの最高経営責任者とCEOの監督の下で設計されたプロセスであり、提供するために
アメリカが公認している会計原則に基づいて、財務報告の信頼性と外部目的のために作成した財務諸表を合理的に保証する。
経営陣は、2023年12月31日現在、最高経営責任者と最高財務責任者の参加のもと、テレデビル委員会後援組織委員会が発表した“内部統制-総合枠組み”で確立された財務報告有効内部統制基準(2013年枠組み)に基づいて、財務報告の内部統制の有効性を評価した。評価によると、経営陣は、2023年12月31日現在、財務報告に対して有効な内部統制を維持していると判断した。
本年度報告には,2002年の“サバンズ−オキシリー法案”第404(B)条の要求に基づいて財務報告に対する内部統制の有効性を証明する我々の公認会計士事務所の証明報告は含まれていない。米国証券取引委員会がより小さい報告会社が本年報で経営陣報告のみを提供することを許可する規則によれば、経営層の報告は我々の公認会計士事務所に認証される必要はない。
財務報告の内部統制の変化
2023年12月31日までの会計年度第4四半期において、財務報告の内部統制には何の変化もなく、これらの変化は財務報告の内部統制に大きな影響を与えたり、合理的な可能性が重大な影響を与えたりしている。
プロジェクト9 B。*その他の情報
取引計画
規則16 a-1(F)で定義されているように、2023年12月31日までの財政四半期内に、我々の上級管理者または取締役は、通過する修正、または終了しました“ルール10 b 5−1取引スケジュール”または“ルール10 b 5−1取引スケジュール”は、S−K条例408項で定義されている。
解散費計画と参加協定
2024年3月4日、当社取締役会は、当社のいくつかの合資格の主管(“引保主管”)に解散費を提供する当社の離職計画及び概要計画説明(以下、“計画”と略す)を承認し、これらの主管(“引保主管”)は、引保主管が本計画で定義されていない理由で吾等の雇用を終了した場合や、承保主管が正当な理由(本計画で定義したように)により辞任した場合(いずれもこのように終了し、“承保終了”)である。
我々の最高経営責任者であるJacqueline Shea,我々の首席科学者Laurent Humeau,我々の首席医療官Michael Sumnerはこの計画の参加者であり,参加協定を締結した。以下に述べる計画条項は、一般に、これらの役人が我々と締結した任意の既存の雇用協定に規定されている任意の解散費及び統制権福祉の変更に代わるものとなる。私たちの最高財務責任者Peter Kiesはその計画の参加者ではなく、彼の既存の雇用協定の条項は引き続き適用されるだろう
この計画の条項によると、保険終了の場合、保険幹部は、(A)保険役員参加協定に規定されている適用月数内に基本給を継続して受給し(Shea博士は18ヶ月、Humeau博士とSumner博士は12ヶ月)、私たちの定期給与表では等額分割払いで支払う資格がある。(B)会社は保険引受役員が我々の福祉計画の下で保険を継続して支払うコブラ保険料であるが,コブラのタイムリーな選挙に応じて決定され,期間は保証役員参加協定に規定されている月数(または保険幹部が類似の福祉を持つ仕事を受けるまで)
支配権変更後1年以内に(1)年内にこのような終了が発生した場合(我々の2023年総合インセンティブ計画で定義されているように)、保証幹部は、以下の支配権変更解散費福祉を得る資格がある:(A)保証役員参加協定に規定されている適用月数内に基本給の支払いを継続し(Shea博士は24ヶ月、Humeau博士とSumner博士は18ヶ月)、会社の通常賃金計画では均等分割払いで支払う。(B)額は上記引当終了年度の目標年度配当に備保行政人員参加協定に記載されている適用配当の倍数(Shea博士は2倍、Humeau博士とSumner博士は1.5倍)に等しい;(C)準備行政者が当時支払わなかった各持分奨励(業績奨励を除く)は、予備保険執行者の参加協定に規定された持分奨励が占める未帰属株式のパーセンテージに従って帰属を加速し、行使することができる(Shea博士、Humeau博士、Sumner博士はそれぞれ100%);及び(D)会社は、保険を受ける行政者が当社の福祉計画の下で継続して保険を継続するために支払うコブラ保険料(コブラの適時選挙に応じて決定される)、金額は保険を受ける行政者が合意に規定する月数(Shea博士は24ヶ月、Humeau博士とSumner博士は18ヶ月)である(あるいは保険を受けた行政者が類似の福祉の就職を受けるまで)。
引受幹部が障害により雇用を終了した場合(本計画で定義されているように)、当該保険幹部は、(A)保証役員参加協定に規定されている適用月数内に基本給を継続して受給し(Shea博士は18カ月、Humeau博士とSumner博士は12ヶ月)、会社の正常賃金計画では等額分割払いで支払う資格がある。(B)保険受け行政者が会社の福祉計画の下で保険を継続する会社が支払うコブラ保険料は、“コブラ”の適時選挙に応じなければならない。保険料金額は、保険行政者が協定に規定する月数(Shea博士は18カ月、Humeau博士とSumner博士は12カ月)である(または保険を受けた行政者が類似の福祉を受けるまで)。(C)時間的帰属をカバーする行政者が当時完成していなかった株式奨励(業績奨励を除く)によって制限され、これらの奨励は、最初の帰属日に引き続き帰属し、行政者が所有する任意の表現奨励は未補償状態を維持し、適用履行期間終了までの実際の表現に基づいて帰属する資格がある
もし引保行政人員が亡くなったために雇用を終了した場合、この等の保険行政人員が当時行使していなかった持分奨励(業績奨励を除く)は、保険行政人員が協議に参加した持分奨励に規定された未帰属株式パーセンテージに従って帰属と行使を加速しなければならないが、引保行政人員が持っているいかなる業績奨励は未補償状態を維持し、そして会社が適用履行期間終了までの実際の表現によって帰属を行う資格がある。
本計画に従って任意の解散費福祉を取得する保証行政者の条件として、当該保険行政者は、退職協定に署名し、その発効を許可しなければならない。その中には、当社およびその子会社および関連会社に有利なすべてのクレーム(以下、“発行”と呼ぶ)を免除すること、保証行政者が任意の独自の情報および発明協定を遵守し続けること、および保証行政者と私たちとの間の任意の制限的な契約協定を含む。♪the the the
本計画の下で提供される福祉は、一般に、支配権、解散費福祉計画、または私たちと保証幹部との間の合意の任意の他の変更を代替する。保護された幹部と私たちの間の既存の奨励に規定されているいかなる優先加速権利も本計画に参加することによって影響を受けない
以上の“計画”の完全な記述は“計画”全文に基づいており,その写しを本年度報告の証拠品アーカイブ,および“個人参加プロトコル”とした.Shea博士,Humeau博士,Sumner博士の参加協定も本年度報告の証拠として提出された
プロジェクト9 Cです。検査妨害に関する外国司法管区の開示
適用されません。
第三部
プロジェクト10.取締役会、役員、および企業管理
本第10項で要求される情報は、“役員選挙”及び“役員その他の情報”と題する第14 A条に基づいて、2023年度終了後120日以内に提出される当社の最終委託書に引用される
項目11.役員報酬の増加
11項目の要求された情報は、参照によって本明細書に組み込まれ、この依頼書は、“役員報酬”および“役員報酬”という名称で、条例第14 A条に従って2023年度終了後120日以内に提出される。
プロジェクト12.特定の実益所有者および管理職の保証所有権および関連株主事項の検討
本第12項に要求される情報は、“特定の利益所有者及び経営陣の保証所有権”および“持分補償計画情報”というタイトルで、2023年度終了後120日以内に提出される当社の最終委託書に参照される
第十三項:特定の関係及び関連取引の確立、並びに取締役の独立性
取締役独立性および本条項13に要求される他の情報は、参照によって本明細書に組み込まれ、この依頼書は、“特定の関係および関連者取引”および“取締役選挙”と題する2023年度終了後120日以内に、第14 A条に従って提出される
項目14.総会計士費用とサービス料を支払う
本条項14に要求される情報は、“独立公認会計士事務所の任命承認”というタイトルで、2023年度終了後120日以内に第14 A条に従って提出される当社の最終委託書に組み込まれている
第4部
項目15.リスト、展示品、財務諸表の添付表
1.財務諸表
本報告書が提出を要求する連結財務諸表は、本報告第F−1ページから始まる。
2.財務諸表明細書
本明細書に記載されていない付表は省略されている。リストが要求される情報は、適用されないか、または財務諸表または付記に含まれているからである。
3.陳列品
本年度報告の10−K表の一部として,以下の証拠を提出した
| | | | | | | | | | |
展示品 番号をつける | | 書類説明 | | |
| | | | |
3.1 | | 2023年12月31日までのすべての改訂された会社登録証明書(2014年7月23日に提出された登録者表S-3登録説明書添付ファイル3.1を参照して編入)。 | | |
| | | | |
3.2 | | 会社登録証明書修正証明書は、2024年1月24日から発効する(添付ファイル3.1を参照して登録者が2024年1月25日に提出した現在の8-K表報告書に組み込まれる)。 | | |
| | | | |
3.3 | | 2011年8月10日に改訂および再改訂されたInovio PharmPharmticals,Inc.規約(2011年8月12日に提出された登録者リスト8-K現在の報告書の添付ファイル3.2を参照して編入)。 | | |
| | | | |
4.1 | | 契約は、日付が2019年2月19日であり、登録者と受託者である米国銀行全国協会との間の契約である(登録者を引用して2019年2月20日に米国証券取引委員会の現在8-K表報告書の添付ファイル4.1を統合して作成される)。 | | |
| | | | |
4.2 | | 代表登録者2024年満期の6.50%は、(添付ファイル4.1である契約添付ファイルAに含まれる)優先チケットのチケットフォーマットを変換することができる。 | | |
| | | | |
4.3 | | 改正された1934年“証券取引法”第12節に登録された登録者証券説明書(添付ファイル4.9を参照して登録者が2020年3月12日に米国証券取引委員会に提出された10-K表年次報告書の添付ファイル4.9). | | |
| | | | |
10.1† | | 2005年12月19日にGanial免疫療法会社とVGX PharmPharmticals,Inc.によって署名され、VGX PharmPharmticals,Inc.によって改訂された研究開発連合協定は、VGX PharmPharmticals,Inc.,Ganial免疫治療,Inc.とOncoNOxの間の革新と改訂プロトコルによって改訂された(添付ファイル710.31を参照することによって組み込まれ、この協定は登録者が2009年4月27日に提出したS-4表登録声明(文書番号:333-156035)と共に合併された)。 | | |
| | | | |
10.2† | | VGX International,Inc.およびVGX PharmPharmticals,Inc.が2006年12月18日に署名した研究開発協力および許可協定は、2007年10月31日の第1修正案によって改正され、2008年8月4日の第2改正案(2009年4月27日に登録者登録説明書とともに提出されたS−4表の添付ファイル10.39(文書番号:333-156035)を参照して改訂される)。 | | |
| | | | |
10.3† | | ペンシルバニア大学受託者とVGX PharmPharmticals,Inc.は、2008年6月12日の第1修正案によって改正された2007年4月27日に締結され、相互に締結された特許許可協定(統合時には、2009年4月27日に登録者登録説明書に従って提出されたS-4表(文書番号:333-156035)の添付ファイル10.50を参照)。 | | |
| | | | |
10.4† | | ベイラー大学とVGX PharmPharmticals,Inc.が2007年5月9日に締結したライセンス契約(2009年4月27日に登録者登録声明S-4表(文書番号:333-156035)に従って提出された添付ファイル110.34を参照して統合された)。 | | |
| | | | |
10.5 | | ATM株発売SM2021年11月9日Inovio PharmPharmticals,Inc 米国銀行証券会社、カナダロイヤル銀行資本市場有限責任会社、奥本ハイマー社(2021年11月9日に登録者に提出された10-Q四半期報告書の表10.1を参照して合併した)。 | | |
| | | | | | | | | | |
| | | | |
10.6† | | Inovio PharmPharmticals,Inc.とVGX International,Inc.が2010年3月24日に署名した許可および協力協定(2010年5月17日に提出された登録者の2010年3月31日までのForm 10-Q四半期報告書の添付ファイル10.2を参照して統合された)。 | | |
| | | | |
10.7† | | VGX International,Inc.とInovio PharmPharmticals,Inc.が2011年10月7日に締結した協力開発·許可協定は、2013年8月21日の第1修正案と2013年10月7日の第2改正案を経て改正された(2011年11月7日に提出された登録者が2011年9月30日までのForm 10-Q四半期報告書の添付ファイル10.1を引用して合併する)。 | | |
| | | | |
10.8 | | 2016年3月14日にペンシルベニア州連邦非営利会社Wistar解剖·生物学研究所とInovio製薬会社(登録者が2016年5月9日に提出した2016年3月31日現在のForm 10-Q四半期報告書提出添付ファイル10.1を引用して合併した)による協力研究合意。 | | |
| | | | |
10.9 | | 2016年3月14日にペンシルベニア州連邦非営利会社Wistar解剖·生物学研究所とInovio製薬会社(登録者が2016年5月9日に提出した2016年3月31日現在のForm 10-Q四半期報告書提出表10.2を引用して合併した)による協力研究合意。 | | |
| | | | |
10.10† | | Inovio PharmPharmticals,Inc.と北京アポロ土星生物科学技術有限会社との間で2017年12月29日に署名された許可および協力協定(2018年3月14日に提出された登録者を引用して2017年12月31日までのForm 10-K年度報告書の添付ファイル10.12を合併することにより)が改訂され、再署名された。 | | |
| | | | |
10.11 | | Inovio製薬会社と北京アポロ土星バイオテクノロジー有限公司は、2023年6月14日に再署名された許可と協力協定の第1改正案(提出)を改訂した。 | | |
| | | | |
| | | | |
| | | | |
10.12 | | 6759 Mesa Ridge Road Holdings,LLCとInovio PharmPharmticals,Inc.との間で2016年10月10日に締結されたオフィス賃貸契約(2016年11月9日に提出された登録者が2016年9月30日までのForm 10-Q四半期報告書の添付ファイル10.1を参照して統合された)。 | | |
| | | | |
10.13 | | Acolade,Inc.とInovio PharmPharmticals,Inc.との間の転貸日は2017年6月21日である(登録者が2017年8月8日に提出した2017年6月30日までのForm 10-Q四半期報告書の添付ファイル10.2合併を参照)。 | | |
| | | | |
10.14+ | | 2010年12月27日現在、Inovio PharmPharmticals,Inc.とPeter Kiesとの間の雇用協定(添付ファイル10.5を参照して登録者が2011年3月16日に提出した2010年12月31日現在のForm 10−K報告書に組み込まれている)。 | | |
| | | | |
10.15+ | | Inovio PharmPharmticals,Inc.とPeter Kiesが2012年12月31日に署名した雇用協定第1改正案(2013年3月18日に提出された登録者が2012年12月31日までのForm 10-K年度報告添付ファイル10.42を参照して統合された)。 | | |
| | | | |
10.16+ | | Inovio PharmPharmticals,Inc.とPeter Kiesの間で2014年11月7日に締結された雇用協定第2修正案(2014年11月10日に提出された登録者が2014年9月30日までのForm 10-Q四半期報告の添付ファイル10.2を参照して統合された)。 | | |
| | | | |
10.17+ | | Inovio PharmPharmticals,Inc.解散計画と概要計画説明(同封アーカイブ). | | |
| | | | |
10.18+ | | ジャクリーン·シェイ離職計画下の参加協定(同封アーカイブ)。 | | |
| | | | |
10.19+ | | ローレント·フモ離職計画下の参加協定(同封アーカイブ) | | |
| | | | |
10.20+ | | マイケル·サムナ離職計画下の参加協定(z提出)。 | | |
| | | | |
10.21+ | | Inovio PharmPharmticals,Inc.取締役および上級管理者賠償プロトコル表(2009年8月19日に提出された登録者表10-Q四半期報告添付ファイル10.1を参照して登録者表10-Q四半期報告書に組み込まれる)。 | | |
| | | | |
| | | | | | | | | | |
10.22+ | | 改訂された2007年総合インセンティブ計画が改正され、再起動された(添付ファイル10.12を参照して登録者が2016年3月14日に提出した2015年12月31日までのForm 10−K報告書の添付ファイル10.12)。 | | |
| | | | |
10.23+ | | 2007年総合株式インセンティブ計画下のインセンティブおよび非制限株式オプション授権表(2007年5月14日に提出されたS-8登録者登録説明書添付ファイル4.4)。 | | |
| | | | |
10.24+ | | Inovio PharmPharmticals,Inc.2016総合インセンティブ計画は、これまでに改訂されている(添付ファイル10.1を参照して登録者が2019年5月10日に提出した8-K表に組み込まれている)。 | | |
| | | | |
10.25+ | | 2016総合インセンティブ計画下のインセンティブ株式オプション協定表(登録者が2017年3月15日に提出した2016年12月31日現在のForm 10-K年度報告書の添付ファイル10.55と合併することにより) | | |
| | | | |
10.26+ | | 2016年総合インセンティブ計画下の不適格株式オプション協定表(登録者が2017年3月15日に提出した2016年12月31日現在のForm 10-K年度報告書の添付ファイル10.56を参照して編入) | | |
| | | | |
10.27+ | | 2016年総合インセンティブ計画下の制限株式奨励協定表(登録者が2017年3月15日に提出した2016年12月31日現在のForm 10-K年次報告書の添付ファイル10.54を参照して編入する) | | |
| | | | |
10.28+ | | インノビオ製薬株式会社2022年誘導計画(2022年6月30日に提出された登録者S-8表登録説明書添付ファイル99.1に合わせて)。 | | |
| | | | |
10.29+ | | 2022年インセンティブ計画下のオプション付与パッケージテーブル(2022年6月30日に提出された登録者S-8フォーム登録説明書第99.2号添付ファイルと組み合わせて)。 | | |
| | | | |
10.30+ | | 2022年誘導計画下の南洋理工大学助成金セット表(登録者が2022年6月30日に提出したS-8表登録説明書第99.3号添付ファイルを参照して編入)。 | | |
| | | | |
10.31+ | | Inovio製薬会社2023年総合インセンティブ計画(添付ファイル10.1を参照して登録者が2023年5月18日に提出した現在の8−K表報告書に組み込まれる)。 | | |
| | | | |
10.32+ | | 2023年総合インセンティブ計画下のオプション報酬スキーム表(添付ファイル10.2を参照して登録者が2023年8月9日に提出したタブ10-Qの四半期報告書に組み込まれる)。 | | |
| | | | |
10.33+ | | 2023年総合奨励計画下のRSU助成スキーム表(添付ファイル10.3を参照して登録者が2023年8月9日に提出したForm 10-Q四半期報告書に組み込まれる)。 | | |
| | | | |
21.1 | | 登録者の子会社(同封届出)。 | | |
| | | | |
23.1 | | 独立公認会計士事務所同意書(ズアーカイブ)。 | | |
| | | | |
24.1 | | 授権書(署名ページに含まれる)。 | | |
| | | | |
31.1 | | 2002年の“サバンズ-オキシリー法案”第302節に基づいて発行された首席執行幹事証明書(現提出)。 | | |
| | | | |
31.2 | | 2002年のサバンズ·オクスリ法第302条に基づく首席財務官の証明(現提出)。 | | |
| | | | |
32.1^ | | 2002年にサバンズ·オクスリ法案第906節で可決された“米国法典”第18編第1350条に規定する首席執行幹事及び首席財務官証明書(付状提供)。 | | |
| | | | |
97.1 | | 奨励補償補償政策は,2023年11月14日に採択された(届出まで). | | |
| | | | |
| | | | |
| | | | |
| 101.INS | | XBRLインスタンス文書(このインスタンス文書は、そのXBRLタグがイントラネットXBRL文書に埋め込まれているので、対話データファイルには現れない)。 | | |
| | | | | | | | | | |
| | | | |
| 101.書院 | | XBRL分類拡張アーキテクチャドキュメント。 | | |
| | | | |
| 101.カール | | XBRL分類拡張はリンクベース文書を計算する. | | |
| | | | |
| 101.def | | XBRL分類拡張はLinkbase文書を定義する. | | |
| | | | |
| 101.介護会 | | XBRL分類拡張タグLinkbase文書. | | |
| | | | |
| 101.Pre | | XBRL分類拡張プレゼンテーションLinkbaseドキュメント. | | |
| | | | |
| 104 | | 表紙相互データファイル(添付ファイル101に含まれるイントラネットXBRLのフォーマット) | | |
| | | | | |
| † | 1934 年証券取引法 ( 改正 ) の規則 24 b—2 に基づき、この資料から省略された特定の部分 ( アスタリスクで示されます ) については、機密扱いが与えられています。この展示の機密部分は、証券取引委員会に別途提出されています。 |
| †† | 特定された機密部分は重要ではなく、登録者がプライベートまたは機密として扱うタイプであるため、この展示物の特定の機密部分 ( アスタリスクで示される ) は省略されました。 |
| | | | | |
| ^ | これらの証明書は、 18 U. S.C. に従ってこの年次報告書に添付するものです。第 1350 条、 1934 年証券取引法第 18 条 ( 改正 ) の目的のために提出されておらず、登録者の提出書類に参照によって組み込まれるべきではありません。 |
項目16.表格10-Kの概要
適用されません。
サイン
1934 年証券取引法第 13 条または第 15 条 ( d ) の要件に従い、登録者は、 2024 年 3 月 6 日に正式に承認された下記者によって、この報告書に署名するよう正当に促しました。
| | | | | | | | |
| イノビオ製薬株式会社 |
| | |
| 差出人: | / s / ジャックライン E.シェア |
| | ジャクリーン E 。シェイ
代表取締役社長兼取締役社長 (On登録者の代理人 ) |
授権依頼書
以下に署名されている各人が Jacqueline E を構成し、任命することを、これらの提示によりすべての人に知らせる。Shea 及び Peter Kies 、並びにそれぞれが、 1934 年証券取引法及び規則に基づき必要または推奨されると認めるすべての事項を行い、すべての文書を実行するために、その名義、場所及び代替に署名する代替及び再代替の権限を有する真の合法的な弁護士である。フォーム 10—K の年次報告書およびそのすべての修正に関連した米国証券取引委員会の規則および要件を、本人が行うことができるすべての意図および目的のために完全に遵守し、ここに単独で行動するすべての前述の弁護士および代理人を批准し確認します。またはその代理人または代理人は合法的にこれによって行うことができます
本報告は、1934年の証券取引法の要求に基づき、以下の登録者によって登録者として指定日に署名された。
| | | | | | | | | | | | | | |
| サイン | | タイトル | | 日取り |
| | | | |
| / s / ジャックライン E.シェア | | 取締役CEO社長(最高経営責任者) | | 2024年3月6日 |
| ジャクリーン E 。シェイ | | | | |
| | | | |
| / s / サイモン X 。ベニト | | 取締役会議長 | | 2024年3月6日 |
| サイモン Xベニト | | | | |
| | | | |
| / s / ピーター · キース | | 最高財務責任者 ( 主席会計責任者、最高財務責任者 ) | | 2024年3月6日 |
| ピーター · キース | | | | |
| | | | |
| / s / ロジャー D 。ダンセイ | | 役員.取締役 | | 2024年3月6日 |
| ロジャー D 。ダンシー | | | | |
| | | | |
| / s / ANN C 。ミラー | | 役員.取締役 | | 2024年3月6日 |
| アン C 。ミラー | | | | |
| | | | |
| / s / ジェイ · シェパード | | 役員.取締役 | | 2024年3月6日 |
| ジェイ · シェパード | | | | |
| | | | |
| / s / デイヴィッド B 。ワイナー | | 役員.取締役 | | 2024年3月6日 |
| デイヴィッド B 。ワイナー | | | | |
| | | | |
| / s / ウェンディ L 。ヤルノ | | 役員.取締役 | | 2024年3月6日 |
| ウェンディ·L·アーノ | | | | |
| | | | |
| / s / LOTA S 。ゾート | | 役員.取締役 | | 2024年3月6日 |
| ロタ·S·ゾース | | | | |
株式会社イノビオ製薬株式会社
連結財務諸表索引
| | | | | |
| | ページ |
独立公認会計士事務所報告(PCAOB ID:42) | F-2 |
合併貸借対照表 | F-4 |
連結業務報告書 | F-5 |
合併全面損失表 | F-6 |
株主権益合併報告書 | F-7 |
統合現金フロー表 | F-8 |
連結財務諸表付記 | F-9 |
独立公認会計士事務所報告
Inovio製薬会社の株主と取締役会に
財務諸表のいくつかの見方
Inovio PharmPharmticals,Inc.(“当社”)2023年12月31日まで,2023年12月31日と2022年12月31日までの総合貸借対照表,2023年12月31日までの各年度の関連総合経営表,全面赤字,株主権益と現金流量および関連付記(総称して“総合財務諸表”と呼ぶ)を監査した。総合財務諸表は,すべての重要な点で,会社の2023年12月31日まで,2023年12月31日と2022年12月31日までの財務状況,および2023年12月31日までの3年度の運営結果とキャッシュフローを公平に反映しており,米国公認会計原則に適合していると考えられる。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性に対する意見を表明するためではありません。したがって、私たちはそのような意見を表現しない
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項とは、監査委員会に伝達または要求が監査委員会に伝達された当期財務諸表監査によって生じる事項である:(1)財務諸表に対して重大な意義を有する勘定または開示に関するものであり、(2)特に挑戦的で主観的または複雑な判断に関するものである。重要監査事項の伝達は、総合財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、以下の重要な監査事項を伝達することによって、重要な監査事項またはそれに関連する勘定または開示について個別の意見を提供することはない。
| | | | | | | | |
| 臨床試験費用の応算 |
関係事項の記述 | 2023年には8670万ドルの研究·開発費が発生し、2023年12月31日現在、臨床研究費は240万ドルに計上されている。同社が行っている研究·開発活動の大部分は,臨床研究機関(CRO)を含む第三者サービスプロバイダによって行われている。CROに支払われる外部費用は、署名された合意によって達成された実際の作業に基づいて提案され、支出される
監査管理層は、臨床人員と第三者サービスプロバイダとの間で交換される大量のデータと入力、例えば活性化されたサイト数、登録された患者数、および患者受診回数の評価に依存するので、累積臨床研究コストの計算は特に挑戦的であり、これらのデータおよび入力は電子フォームおよび他のエンドユーザ計算プログラムで追跡される。
|
私たちが監査でどのようにこの問題を解決したのか | 著者らは、管理層が推定すべき臨床研究コストを測定する過程、例えば患者登録とこれまで第三者から発生した総コストなど、計算すべき臨床試験費用の会計処理を理解した。
会社が蓄積した臨床試験費用の完全性をテストするために,重要な臨床試験の患者登録とこれまでの直接サービスコストの確認を第三者から得た。著者らは会計人員と臨床プロジェクトマネージャーと一緒に内部臨床試験とプロジェクト状態会議に参加し、重大な臨床試験活動の状況を理解した。累積臨床試験費用の適切な測定方法を評価するために、著者らはサプライヤー契約サンプルの肝心な条項、完成スケジュール、活動とコストを検査し、これらを管理層がサービス契約の進展を追跡する際に使用する分析と比較した。私たちはまた、後続支払いのサンプルをテストし、領収書を元の計算項目と一致させ、領収書支払いを銀行の請求書と一致させた
|
| | | | | |
/s/ 安永法律事務所 | |
| 2002年以来、私たちは同社の監査役を務めてきた。 | |
| |
| カリフォルニア州サンディエゴ | |
| 2024年3月6日 | |
イノビオ製薬株式会社
合併貸借対照表
| | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 |
| 資産 | | | |
| 流動資産: | | | |
| 現金と現金等価物 | $ | 14,310,862 | | | $ | 46,329,359 | |
| 短期投資 | 130,982,913 | | | 206,669,397 | |
| 売掛金 | — | | | 1,701,726 | |
| 関連法人債権 | 2,405,228 | | | 10,036,490 | |
| 前払い費用と他の流動資産 | 5,393,665 | | | 50,130,481 | |
| 関連事業者の前払い費用等経常資産 | 20,432 | | | 375,227 | |
| | | |
| 流動資産総額 | 153,113,100 | | | 315,242,680 | |
| | | |
| 固定資産、純額 | 4,960,986 | | | 7,727,997 | |
| 関連法人への投資 | 2,780,287 | | | 2,007,142 | |
| | | |
| 無形資産、純額 | — | | | 2,129,861 | |
| 商誉 | — | | | 10,513,371 | |
| 経営的リース使用権資産 | 9,491,735 | | | 10,228,207 | |
| その他の資産 | 605,315 | | | 684,044 | |
| 総資産 | $ | 170,951,423 | | | $ | 348,533,302 | |
| 負債と株主権益 | | | |
| 流動負債: | | | |
| 売掛金と売掛金 | $ | 19,847,744 | | | $ | 79,686,885 | |
| 関連会社に対する買掛金及び未払い費用 | 1,070,519 | | | 1,220,439 | |
| 臨床試験費用を計算しなければならない | 2,365,382 | | | 10,594,073 | |
| | | |
| | | |
| | | |
| リース負債を経営する | 2,406,522 | | | 2,803,973 | |
| 助成金負債 | 87,489 | | | 2,475,031 | |
| 関連会社からの助成金債務 | 21,918 | | | 87,673 | |
| 転換可能優先手形 | 16,770,654 | | | — | |
| 流動負債総額 | 42,570,228 | | | 96,868,074 | |
| | | |
| | | |
| 転換可能優先手形 | — | | | 16,614,840 | |
| | | |
| | | |
| | | |
| | | |
| 賃貸負債を経営し,当期分を差し引く | 11,032,066 | | | 12,655,586 | |
| 繰延税金負債 | — | | | 32,046 | |
| | | |
| | | |
| 総負債 | 53,602,294 | | | 126,170,546 | |
| 引受金とその他の事項 | | | |
| イノビオ製薬株式会社株主資本 : | | | |
優先株価 $0.001; 認可株式 : 10,000,000発行済株式および発行済株式 : 92023 年 12 月 31 日と 2022 年 | — | | | — | |
普通株式額 $0.001; 認可株式 : 600,000,0002023 年 12 月 31 日および 2022 年 12 月 31 日時点で発行済みおよび残高 : 22,793,0752023年12月31日と21,090,9382022 年 12 月 31 日 (1) | 22,792 | | | 21,090 | |
| 追加実収資本 | 1,740,954,074 | | | 1,710,888,191 | |
| 赤字を累計する | (1,622,965,136) | | | (1,487,847,784) | |
| その他の総合損失を累計する | (662,601) | | | (698,741) | |
| トータルイノビオ製薬株式会社株主持分 | 117,349,129 | | | 222,362,756 | |
| | | |
| | | |
| 総負債と株主権益 | $ | 170,951,423 | | | $ | 348,533,302 | |
(1)当社は、 2024 年 1 月 24 日に発行済普通株式の逆分割を実施し、発行済普通株式 12 株につき普通株式 1 株に転換しました。 逆分割の結果として分割後の分数株式は現金で支払われた。当社の株主は、 2024 年 1 月 12 日に開催された特別株主総会において、取締役会に対し逆分割の承認を承認しました。 発行済株式の金額は、すべての期間について遡及的に逆分割を反映するために修正されています。
付記はこれらの連結財務諸表の構成要素である。
イノビオ製薬株式会社
連結業務報告書
| | | | | | | | | | | | | | | | | |
| | 2013年12月31日までの年間 |
| | 2023 | | 2022 | | 2021 |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| 提携契約その他の契約 ( 関連会社を含む ) による収益 | $ | 832,010 | | | $ | 10,262,268 | | | $ | 1,774,758 | |
| 運営費用: | | | | | |
| 研究開発 | 86,676,563 | | | 187,650,503 | | | 249,240,324 | |
| 一般と行政 | 47,582,104 | | | 90,185,285 | | | 53,752,353 | |
| 営業権の減価 | 10,513,371 | | | — | | | — | |
| | | | | |
| 総運営費 | 144,772,038 | | | 277,835,788 | | | 302,992,677 | |
| 運営損失 | (143,940,028) | | | (267,573,520) | | | (301,217,919) | |
| その他の収入(支出): | | | | | |
| 利子収入 | 8,133,290 | | | 4,782,030 | | | 3,363,080 | |
| 利子支出 | (1,222,789) | | | (1,253,952) | | | (1,936,447) | |
| | | | | |
| | | | | |
| 関連会社への投資利益 ( 損失 ) | 773,145 | | | (1,899,654) | | | (553,570) | |
| 売却可能株式有価証券の純未実現損益 | 5,850,626 | | | (7,846,172) | | | (3,222,838) | |
| その他の収入,純額 | (4,711,596) | | | (3,861,584) | | | 343,371 | |
| | | | | |
| | | | | |
| | | | | |
| Geneos の純損失分前純損失 | (135,117,352) | | | (277,652,852) | | | (303,224,323) | |
| | | | | |
| Geneos の純損失分 | — | | | (2,165,213) | | | (434,387) | |
| 純損失 | $ | (135,117,352) | | | $ | (279,818,065) | | | $ | (303,658,710) | |
| | | | | |
| | | | | |
| 1株当たり純損失 | | | | | |
ベーシックと希釈 (1) | $ | (6.09) | | | $ | (14.07) | | | $ | (17.45) | |
| | | | | |
| 加重平均普通株式発行済数 | | | | | |
ベーシックと希釈 (1) | 22,173,662 | | | 19,885,182 | | | 17,402,483 | |
| | | | | |
(1)1 株および 1 株当たりの金額は、 2024 年 1 月に実施された 12 株に対する 1 株の逆分割を反映して、提示されたすべての期間に遡及的に修正されています。
付記はこれらの連結財務諸表の構成要素である。
イノビオ製薬株式会社
総合総合損失表
| | | | | | | | | | | | | | | | | |
| | 2013年12月31日までの年間 |
| | 2023 | | 2022 | | 2021 |
| 純損失 | $ | (135,117,352) | | | $ | (279,818,065) | | | $ | (303,658,710) | |
| その他の全面的な損失: | | | | | |
| | | | | |
| 外国通貨換算 | (3,920) | | | (25,556) | | | (30,134) | |
| 短期投資の未実現利益 ( 損失 ) ( 税抜 ) | 40,060 | | | (390,949) | | | 4,048 | |
| 総合損失 | $ | (135,081,212) | | | $ | (280,234,570) | | | $ | (303,684,796) | |
| | | | | |
| | | | | |
付記はこれらの連結財務諸表の構成要素である。
イノビオ製薬株式会社
合併株主権益報告書
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 優先株 | | 普通株(1) | | その他の内容
支払い済み
資本 | | 積算
赤字.赤字 | | 積算
他にも
全面的に
損 | | | | 合計する
株主の
株権 |
| | 番号をつける
株式です | | 金額 | | 番号をつける
の株 | | 金額 | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| 2020年12月31日残高 | 9 | | | — | | | 15,570,957 | | | $ | 15,571 | | | $ | 1,367,578,149 | | | $ | (906,196,812) | | | $ | (256,150) | | | | | $ | 461,140,758 | |
| 資金調達コストを差し引いた現金普通株式の発行 | — | | | — | | | 2,275,861 | | | 2,276 | | | 209,439,134 | | | — | | | — | | | | | 209,441,410 | |
| 2019 年 12 月の社債の普通株式への転換 | — | | | — | | | 84,120 | | | 84 | | | 4,377,808 | | | — | | | — | | | | | 4,377,892 | |
| 現金に対するストックオプションの行使及び RSU の付与 ( 納税を除く ) | — | | | — | | | 184,299 | | | 184 | | | 2,057,209 | | | — | | | — | | | | | 2,057,393 | |
| 株に基づく報酬 | — | | | — | | | — | | | — | | | 26,336,764 | | | — | | | — | | | | | 26,336,764 | |
| 純損失 | — | | | — | | | — | | | — | | | — | | | (303,658,710) | | | — | | | | | (303,658,710) | |
| 短期投資の未実現利益 ( 税抜 ) | — | | | — | | | — | | | — | | | — | | | — | | | 4,048 | | | | | 4,048 | |
| 外貨換算 | — | | | — | | | — | | | — | | | — | | | — | | | (30,134) | | | | | (30,134) | |
| 2021年12月31日の残高 | 9 | | | — | | | 18,115,237 | | | $ | 18,115 | | | $ | 1,609,789,064 | | | $ | (1,209,855,522) | | | $ | (282,236) | | | | | $ | 399,669,421 | |
| ASU 採用による累積調整 2020 — 0 6 | — | | | — | | | — | | | — | | | (3,294,019) | | | 1,825,803 | | | — | | | | | (1,468,216) | |
| 資金調達コストを差し引いた現金普通株式の発行 | — | | | — | | | 2,870,478 | | | 2,870 | | | 82,952,441 | | | — | | | — | | | | | 82,955,311 | |
| 現金に対するストックオプションの行使及び RSU の付与 ( 納税を除く ) | — | | | — | | | 105,223 | | | 105 | | | (1,114,714) | | | — | | | — | | | | | (1,114,609) | |
| 株に基づく報酬 | — | | | — | | | — | | | — | | | 22,555,419 | | | — | | | — | | | | | 22,555,419 | |
| 純損失 | — | | | — | | | — | | | — | | | — | | | (279,818,065) | | | — | | | | | (279,818,065) | |
| 短期投資は赤字を達成せず,税引き後純額 | — | | | — | | | — | | | — | | | — | | | — | | | (390,949) | | | | | (390,949) | |
| 外貨換算 | — | | | — | | | — | | | — | | | — | | | — | | | (25,556) | | | | | (25,556) | |
| 2022年12月31日の残高 | 9 | | | $ | — | | | 21,090,938 | | | $ | 21,090 | | | $ | 1,710,888,191 | | | $ | (1,487,847,784) | | | $ | (698,741) | | | | | $ | 222,362,756 | |
| 法的決済のための普通株式の発行 | — | | | — | | | 760,083 | | | 760 | | | 13,999,240 | | | — | | | — | | | | | 14,000,000 | |
| 資金調達コストを差し引いた現金普通株式の発行 | — | | | — | | | 875,305 | | | 875 | | | 5,460,870 | | | | | | | | | 5,461,745 | |
| RSU の譲渡 ( 納税額を除く ) | — | | | — | | | 66,749 | | | 67 | | | (466,713) | | | — | | | — | | | | | (466,646) | |
| 株に基づく報酬 | — | | | — | | | — | | | — | | | 11,072,486 | | | — | | | — | | | | | 11,072,486 | |
| 純損失 | — | | | — | | | — | | | — | | | — | | | (135,117,352) | | | — | | | | | (135,117,352) | |
| 短期投資の未実現利益 ( 税抜 ) | — | | | — | | | — | | | — | | | — | | | — | | | 40,060 | | | | | 40,060 | |
| 外貨換算 | — | | | — | | | — | | | — | | | — | | | — | | | (3,920) | | | | | (3,920) | |
| 2023年12月31日の残高 | 9 | | | $ | — | | | 22,793,075 | | | $ | 22,792 | | | $ | 1,740,954,074 | | | $ | (1,622,965,136) | | | $ | (662,601) | | | | | $ | 117,349,129 | |
(1)この列のすべての株式額は、普通株式と追加資本金の適切な再分類を含む、 2024 年 1 月に実施された 12 対 1 の逆分割を反映するために、提示されたすべての期間に遡及的に再記載されています。
付記はこれらの連結財務諸表の構成要素である。
| | | | | | | | | | | | | | | | | |
| | 2013年12月31日までの年間 |
| | 2023 | | 2022 | | 2021 |
| 経営活動のキャッシュフロー: | | | | | |
| 純損失 | $ | (135,117,352) | | | $ | (279,818,065) | | | $ | (303,658,710) | |
| 純損失と経営活動で使用される現金純額の調整: | | | | | |
| 減価償却 | 2,621,649 | | | 3,656,713 | | | 3,040,096 | |
| 無形資産の償却 | 145,417 | | | 496,494 | | | 520,415 | |
| 経営的リース使用権資産の償却 | 736,472 | | | 1,342,819 | | | 1,170,270 | |
| 営業権の減価 | 10,513,371 | | | — | | | — | |
| 無形資産減価準備 | 1,984,444 | | | — | | | — | |
| 税金を繰延する | (32,046) | | | — | | | — | |
| 非現金株報酬 | 11,072,486 | | | 22,555,419 | | | 26,336,764 | |
| シニア転換社債の非現金利子 | 155,814 | | | 186,977 | | | 858,644 | |
| 投資 ( 割引 ) 保険料の償却 | (4,686,144) | | | (1,320,546) | | | 1,633,286 | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| 短期投資の売上損失の実現 | 4,805,804 | | | 4,029,961 | | | 5,397 | |
| | | | | |
| | | | | |
| Geneos への投資の再測定による利益 | — | | | (165,215) | | | — | |
| 固定資産処分純損失 | 317,997 | | | 1,074,830 | | | — | |
| | | | | |
| 関連会社への出資 ( 利益 ) 損失 | (773,145) | | | 1,899,654 | | | 553,570 | |
| ジェネオスの純損失の割合 | — | | | 2,165,213 | | | 434,387 | |
| | | | | |
| | | | | |
| 売却可能株式の純未実現損失 ( 利益 ) | (5,850,626) | | | 7,846,172 | | | 3,222,838 | |
| | | | | |
| 外貨建て債務の未実現取引 ( 利益 ) 損失 | — | | | — | | | (176,927) | |
| 経営性資産と負債変動状況: | | | | | |
| 関連会社を含む売掛金 | 9,332,988 | | | (3,706,172) | | | 11,031,705 | |
| | | | | |
| 関連会社を含む前払い費用およびその他の経常資産 | 39,020,611 | | | (5,336,525) | | | (6,343,632) | |
| | | | | |
| | | | | |
| その他の資産 | 78,729 | | | 741,750 | | | 24,531,654 | |
| 関連会社に対する支払金及び未払い費用を含む | (45,989,061) | | | 32,606,581 | | | 26,140,970 | |
| 臨床試験費用を計算しなければならない | (8,228,691) | | | 267,807 | | | 375,921 | |
| | | | | |
| 関連会社を含む繰延収益 | — | | | (85,989) | | | (39,853) | |
| | | | | |
| | | | | |
| 経営的リース使用権資産と負債純額 | (2,020,971) | | | (2,603,956) | | | (2,329,394) | |
| 関連会社を含む助成金債務 | (2,453,297) | | | (2,034,517) | | | (2,973,089) | |
| | | | | |
| その他負債 | — | | | (14,826) | | | (42,837) | |
| 経営活動のための現金純額 | (124,365,551) | | | (216,215,421) | | | (215,708,525) | |
| 投資活動によるキャッシュフロー: | | | | | |
| 購入投資 | (203,475,052) | | | (248,528,843) | | | (348,953,236) | |
| 投資の売却または満期による収益 | 284,932,562 | | | 361,083,850 | | | 174,839,758 | |
| 資本資産の買入れ | (320,898) | | | (969,153) | | | (1,231,006) | |
| 資本資産を売却して得られる収益 | 6,219,263 | | | — | | | — | |
| | | | | |
| | | | | |
| ジェネオスへの投資 | — | | | (1,999,998) | | | — | |
| | | | | |
| 投資活動提供の現金純額 | 87,355,875 | | | 109,585,856 | | | (175,344,484) | |
| 資金調達活動のキャッシュフロー: | | | | | |
| | | | | |
| | | | | |
| 普通株を発行して得られる収益は,発行コストを差し引く | 5,461,745 | | | 82,955,311 | | | 209,441,410 | |
| 株式オプションを行使して得られる収益 | — | | | 283,022 | | | 6,668,741 | |
| 配当金の株式純額決済に関する支払済み税 | (466,646) | | | (1,397,631) | | | (4,611,348) | |
| | | | | |
| | | | | |
| 融資活動が提供する現金純額 | 4,995,099 | | | 81,840,702 | | | 211,498,803 | |
| 為替レート変動が現金及び現金同等物に与える影響 | (3,920) | | | (25,556) | | | (30,134) | |
| 現金と現金等価物の減少 | (32,018,497) | | | (24,814,419) | | | (179,584,340) | |
| 期初現金及び現金等価物 | 46,329,359 | | | 71,143,778 | | | 250,728,118 | |
| 期末現金と現金等価物 | $ | 14,310,862 | | | $ | 46,329,359 | | | $ | 71,143,778 | |
| | | | | |
| 補足開示: | | | | | |
| | | | | |
| 固定資産買入れの未払い額 | $ | — | | | $ | 108,181 | | | $ | 204,815 | |
| 支払の利子 | $ | 1,066,975 | | | $ | 1,066,975 | | | $ | 1,077,803 | |
| 固定資産に関する前払い費用とその他の流動資産の変化 | $ | — | | | $ | 6,071,000 | | | $ | 7,709,337 | |
| 訴訟和解の一部として普通株を発行する | $ | 14,000,000 | | | $ | — | | | $ | — | |
| | | | | |
| | | | | |
付記はこれらの連結財務諸表の構成要素である。
イノビオ製薬株式会社
連結財務諸表付記
1. 会社(The Company)
Inovio製薬会社(“会社”あるいは“Inovio”)は臨床段階の生物技術会社であり、DNA薬物の開発と商業化に集中し、ヒト乳頭腫ウイルス(HPV)、癌と伝染病に関連する疾患から人々を治療と保護することを助ける。Inovioのプラットフォームは体内蛋白質生産の力を利用して、DNA薬物の設計と交付を最適化し、人体に自分の抗病ツールの製造を教えた
Inovioは特許技術を使用してDNAプラスミドを設計し、これは小さな環状DNA分子であり、その動作原理はヒト細胞がダウンロードできるソフトウェアと類似しており、特定のタンパク質を産生して標的および疾患に対抗する。同社独自の研究CELLECTRADNA送達デバイスはその薬物が人体細胞に入るのを助け、最適な効果を得る
Inovioの主要な候補薬はINO−3107であり,再発性気道乳頭腫症(RRP)の治療に用いられ,HPV感染によるまれで衰弱した気道疾患である。その完成したINO−3107治療HPV−6とHPV−11関連RRPの1/2期臨床試験では,81.3%の患者がINO−3107使用後の1年間で治療前年と比較して手術回数が減少した
Inovioは、INO-3107の開発に加えて、HPV関連肛門発育不良および中咽頭扁平上皮癌(OPSCC)、致命的な脳癌多形性神経膠芽腫(GBM)、およびエボラウイルスを潜在的に予防するワクチン増強剤を含む他の適応のためのDNA薬剤の開発または開発を積極的に計画している。同社はこれまでHPV関連の子宮頚高度扁平上皮内病変(HSIL)を治療する候補DNA薬の臨床試験を行ってきたが,2023年8月に米国での開発中止を発表している。しかし,その協力者であるアポロバイオ社は中国でこの候補者の3期臨床試験を継続し,同管轄区で規制部門の承認を求める予定であり,その候補者を商業化する可能性がある
该公司的合作伙伴和合作者包括Advenant生物制药公司(苏州)、ApolloBio公司、阿斯利康公司、比尔和梅琳达·盖茨基金会(盖茨)、防疫创新联盟、Coherus生物科学公司、美国国防高级研究计划局、美国国防部、艾滋病毒疫苗试验网络、国际疫苗研究所、卡内卡·欧正达公司、国家癌症研究所、国家卫生研究院、国家过敏和传染病研究所、铅垂生命科学公司、Regeneron制药公司、Richter-Helm生物制药公司、Thermo Fisher公司、宾夕法尼亚大学、Walter研究所、美国国家卫生研究院、国家过敏和传染病研究所、铅垂生命科学公司、Regeneron制药公司、Richter-Helm生物制品公司、Thermo Fisher公司、宾夕法尼亚大学、Walter研究所、美国国家卫生研究院、国家过敏和传染病研究所、铅垂生命科学公司、Regeneron制药公司、Richter-Helm生物制药公司、Thermo Fisher公司、宾夕法尼亚大学、Walter研究所、国家癌症研究所、国家卫生研究院、国家过敏和传染病研究所、铅垂生命科学公司、Regeneron制药公司、Richter-Helm生物制品公司、Thermo Fisher、宾夕法尼亚大学、Walter研究所、国家癌症研究所、国家卫生研究院、国家过敏和传染病研究所、铅垂生命科学公司、Regeneron制药公司、Richter-Helm生物制品公司、Thermo Fisher、宾夕法尼亚大学、Walter研究所、国家癌症研究所、国家卫生研究院、国家过敏和传染病研究所、铅笔生命科学公司、Regeneron制药公司、Richter-Helm生物制药公司、Thermo Fisher、宾夕法尼亚大学、Walter研究所、国家疫苗研究所、国家癌症研究所、国家卫生研究院、ウィスタール研究所とです
Inovioは2001年にデラウェア州に登録設立され、その主な実行事務所はペンシルバニア州のプリマス会議に設置された。
2. 重要会計政策の概要
列報基礎と流動資金
同社は#ドルの純損失が発生した135.12023年12月31日までの年間は百万ドル。会社の運営資金は#ドルです110.5100万ドルの累積赤字は$1.62023年12月31日まで。設立以来,同社は毎年赤字を計上しており,予想される将来,その候補製品の研究,臨床前や臨床開発に関する費用や運営損失は引き続き大幅に増加すると予想される。会社の現金、現金等価物、短期投資は#ドルです145.32023年12月31日までの100万ドルは、これらの財務諸表を発表した日から少なくとも12ヶ月間の会社の運営をサポートするのに十分です
将来の研究開発活動に資金を提供し続けるためには、同社は追加の資本を求める必要があるだろう。これは、市場で株式を販売する販売プロトコル(“販売プロトコル”)に従って行うことを含む、戦略連合および許可手配、付与プロトコル、および/または将来の公共またはプライベート債務または持分融資を介して行うことができる。同社は純収益#ドルを含む債務と株式融資を行った歴史がある5.51000万、$83.01000万ドルと300万ドルです47.7それぞれ2023年,2022年,2021年12月31日までの年度内に,販売契約に基づいて株式発行を行い,162.12021年1月に販売を受けた普通株式が公開発行される。しかしながら、将来的には十分な資金がない可能性があり、またはある場合、条件は既存の株主の権利を深刻に希釈するか、または他の方法で既存の株主の権利に悪影響を及ぼす可能性がある。十分な資金がない場合、会社は、その1つまたは複数の臨床および/または臨床前計画を延期、縮小または棚上げする必要があるかもしれない。
当社は現在および将来的に正常な業務過程で生じる様々な法的手続きや請求の影響を時々受ける可能性があります。当社は、連結財務諸表における潜在的な計上項目の可能性の程度及び可能な損失範囲を決定するために、又はある事項を評価する。負債が発生する可能性が高く、損失金額を合理的に推定することができる場合、連結財務諸表に損失または事項を推定すべきである。訴訟、政府調査、法執行行動など、法的手続きは物質コストを招く可能性があります
大量の管理資源を占有し、会社が最終的に勝訴しても、民事と刑事罰を受ける。上記のいずれの結果も、会社の業務、経営業績、財務状況に深刻な損害を与える可能性がある。
株を逆分割する
2024年1月24日、同社はデラウェア州州務卿にその会社の登録証明書を改訂する証明書を提出し、先の改訂に従って、私たちの普通株に対して12株1株の逆株式分割(“逆株式分割”)を行った。逆株式分割の結果、会社普通株の12株当たり発行済み株式と発行済み株が自動的に1株発行および発行済み普通株に統合される。逆株分割は2024年1月25日の寄り付きからナスダック資本市場に反映され始めた。したがって,貸借対照表と株主権益変動表では,逆株式分割による減保有株式額面に相当する金額が“追加実収資本”から“普通株”に再分類される.逆株式分割により生じる任意の分割された断片的な株式は、現金を支払うことによりその断片的な株式の価値を交換することにより除去される。逆株式分割の結果として,当社Cシリーズ累計転換可能優先株の既発行株式オプションと既発行株および当社持分インセンティブ計画により発行可能な普通株数,および会社発行済み株の数,行使または転換価格を比例調整した。株式逆分割は、会社普通株の額面や会社普通株の法定株式数を変えていない。本年度報告に開示された10-K表に開示されたすべての株式金額および1株当たりの金額は、遡及に基づいて提案されたすべての期間の逆株式分割を反映するために再記載されている。
整固する
連結財務諸表はInovio製薬会社とその完全子会社Inovio Asia LLCの勘定を含む。
細分化市場報告
経営分部は企業の構成要素として確認され、その独立した離散財務情報は、首席運営決定者が資源配分に関する意思決定と業績評価を行う際に評価することができる。その会社はその運営と管理業務を1つは主にアメリカ国内で運営されている細分化市場。
予算の使用
米国公認会計原則に基づいて連結財務諸表を作成することは、経営陣に推定および仮定を要求し、これらの推定および仮定は、連結財務諸表の日付の資産および負債の報告金額、または有資産および負債の開示および報告期間内の収入および費用報告金額に影響を与える。実際の結果はこれらの推定とは異なる可能性がある。
信用リスクが集中する
会社を集中的な信用リスクに直面させる可能性のある金融商品には主に現金と短期投資が含まれている。同社は現金と投資を高信用品質の金融機関に置くことで、直面している信用損失を制限している。また,同社はその投資の多様化とその満期日についてガイドラインを策定し,元本の維持と流動性の最大限の向上を目指している。
付記3で述べたように、同社がそのある顧客と締結した契約は、会社の総収入の10%以上を占めている。
公正価値計量
公正価値計量に関する指導意見は三級公正価値レベルを確立し、公正価値を計量する際に使用する投入を優先順位付けした。これらのレベルは、測定日に取得可能なアクティブ市場のオファーのような観察可能な入力として定義されるレベル1と、直接または間接的に観察可能なアクティブ市場のオファー以外の入力として定義されるレベル2と、市場データが少ないか、またはない場合が存在する観察不可能な入力として定義されるレベル3と、したがって、エンティティが自分の仮定を作成する必要がある。
会社の金融商品には、現金等価物、短期投資、関連実体への投資、売掛金、前払い費用および他の資産、売掛金および売掛金、および転換可能優先手形が含まれる。これらの手形の短期満期日により,現金等価物,売掛金,前払い費用と他の資産,売掛金と売掛金の帳簿価値は関連公正価値に近い。短期投資は現在の市場推定値を基礎として、公正価値によって日常的に記録されている。当社はその総合貸借対照表の中で額面から未償却債務割引及び発行コストを差し引いて交換可能な優先株手形を掲載し、この等の交換可能手形の公正価値は開示のためにのみ使用される。
現金と現金等価物
現金等価物は当社が購入した日から三ヶ月以下の原始満期日に購入した高流動性投資とみなされます。現金および現金等価物には、2023年12月31日現在、2023年12月31日現在、および2022年12月31日までのいくつかの共通基金および米国債が含まれる。
短期投資
同社は投資を、いつでも現金に変換できるか、または売却可能な株式投資に分類できる収益証券と定義している。投資には、共同基金、米国国庫券、預金証書、米国機関担保融資支援証券、および2023年12月31日と2022年12月31日に同社付属実体PLSへの株式投資が含まれる
短期投資は現在の市場推定値を基礎として、公正価値によって入金される。会社短期債務投資の未実現収益と損失は収益に含まれず、実現前に他の全面赤字の単独構成要素として報告されている。権益証券の売却済損益と未実現損益を年度営業外その他の収入(費用)に計上する 総合経営報告書および特定の確認方法を用いて証券売却コストを特定する。
売掛金
売掛金は領収書の金額に応じて入金され,利息は計算されない.同社は顧客の財務状況を継続的に信用評価している。信用は顧客が必要だと思う時に発行され、通常は担保を必要としない。経営陣は、会社の顧客の品質や財務状況により、損失リスクが大きく低下していると考えている。あったことがある違います。計算によると、2023年12月31日と2022年12月31日までの潜在的信用損失の不良債権準備。
固定資産
固定資産には財産と設備、そして賃貸改善が含まれる。財産や設備は一般に資産の推定耐用年数に応じてコスト別に記載したり減価償却したりするのが一般的です三つ至れり尽くせり5年それは.リース改善関連賃貸契約の残り期限または改善された推定経済使用年数の中で短い時間で償却する。修理費と維持費は発生時に計上されます。
当社は長期資産(固定資産および使用権資産を含む)の帳簿価値を評価し、減価を計上し、いつ事件や状況が変化しても資産の帳簿価値を完全に回収できない可能性がある。2023年12月31日および2022年12月31日までに、長期資産に関する減価損失は確認されていない。
商誉と無形資産
営業権とは、買収コストが買収された企業の純資産公正価値を超える部分である。営業権は少なくとも年に1回減価審査が行われ、減値が発生する可能性があることを示すイベントが発生した場合、より頻繁に審査が行われる。事件や環境変化が無形資産の帳簿価値を回収できない可能性があることを示した場合、当社は無形資産の減値を評価します
営業権減価審査の間、当社は定性要素を評価して、その報告単位の公正価値がその帳簿価値(営業権を含む)を下回る可能性があるかどうかを決定する可能性がある。定性要素はマクロ経済状況、業界と市場要素、会社全体の財務表現を含むが、これらに限定されない。これらすべての品質要因を評価した後、当社はその報告単位の公正価値がその帳簿価値よりも少なくない可能性が高いと考えていれば、追加的な評価を行う必要はない。そうでなければ、当社は減値テストを行い、報告単位の公正価値とその帳簿価値を比較し、帳簿金額が報告単位の公正価値を超える金額(あれば)を減値費用に計上する
報告単位、資産グループ、および単一資産の公正価値を計算することは、重大な推定および仮定に関するものである。これらの推定と仮定には,予想される将来のキャッシュフロー,リスク調整による割引率,将来の経済と市場状況,および適切な市場比較性の決定がある。これらの要因や用いた仮定の変化は,資産が減値とされている期間に確認された減値損失金額に大きな影響を与える可能性がある.
2023年、会社の株価が下落し続けたため、会社の時価は低下した。この継続的な低下はトリガーイベントと考えられ、経営陣に2023年9月30日までに営業権減価数量化テストを行うことが求められている。同社はまずその長期資産の減価テストを行った。当社はその長期資産減価評価について、物件及び設備、賃貸権改善及び使用権資産を含むすべての長期資産を決定し、1つの資産グループを代表する。当社の結論は、長期資産は減値しておらず、その帳簿価値はその公正価値を超えていないからである。次に、会社はその報告単位の公正価値がその帳簿価値よりも低いことを決定し、営業権減価損失#ドルを記録した10.51000万ドルです
2023年には当社も減価費用#ドルを記録しました2.02016年にBioject Medical Technologiesから買収された無形資産の余剰帳簿価値の研究開発費を支払うためのものであり、同社にはこの技術をさらに開発または利用する計画がないためである
営業権及び無形資産の詳細については、付記8を参照.
所得税
当社が繰延税金資産と負債を確認したのは、会社の資産と負債の財務報告基礎と納税基礎との一時的な違いと、純営業損失と税収控除の繰越が原因であることを確認した。当社はその繰延税金資産計に対して、帳簿純価値をより現金化の可能性があると考えられる金額に下げるための推定準備金を提出した。当社がその繰延税金資産について推定値を設定または減少させる準備をしている場合、その所得税支出は特定期間にそれぞれ増加または減少する。
会社の繰延税金資産の評価免除額は#ドル327.5百万ドルとドル299.1それぞれ2023年、2023年、2022年12月31日に100万に達した。推定免税額の変動は、所得税計上で確認されれば、推定年度の実質税率の構成要素に計上される。
連携協定と収入確認
同社はその協力協定が共同経営活動に関連しているかどうか及び双方が積極的に手配に参加し、重大なリスクとリターンに直面しているかどうかに基づいて、その協力協定が会計基準編纂(“ASC”)テーマ808:協力手配(“テーマ808”)の制約を受けているかどうかを評価する。このスケジュールが主題808の範囲に属し、当社がパートナーが顧客ではないと結論した場合、当社はこのような支払いを研究·開発費用の削減として提示する。パートナーが会社に支払ったお金が顧客の対価格を表す場合、会社は会計基準更新(ASU)2014-09年度の範囲でこれらの支払いを会計処理し、顧客との契約収入(“主題606”)を行う。
贈与金
当社は958-605小題の寄付指導の下で各種贈与協定を計算した非営利団体-収入確認これは、企業に資金を提供する政府機関が寄付金の互恵的な価値を受けていないため、主題606の範囲を超えている。現在の贈与契約から受け取ったすべての寄付金は、合併業務報告書上の収入ではなく、研究·開発費として入金されます。
外貨取引
当社の機能通貨と届出通貨はドルです。機能通貨以外の通貨建ての取引記録は、取引発生日に為替レートによる初期確認を行う。初歩的な確認の後、外貨建ての貨幣資産と負債は、各報告期間終了時にその日の為替レートで機能通貨に換算される。累計換算調整は株主権益表内に他の全面収益(損失)を積算する。為替差額は総合経営報告書の一般と行政費用に計上される。コストで計量された非貨幣的資産と負債は取引当日の為替レートで再計量される。
可変利益エンティティ(VIE)
当社は、非完全所有エンティティの所有権、契約権益及びその他の権益を評価して、当該等のエンティティがVIEであるか否かを決定し、そうであれば、当社がVIEの主要な受益者であるか否かを決定する。当社がVIEの主な受益者であるかどうかを決定するために,VIEを統合する必要がある場合には,定性的な方法を用いて,(1)VIE活動を指導する権限があるかどうか,VIEの経済業績に最大限影響を与えるかどうか,および(2)VIEの損失を担うか,あるいはVIEからVIEに大きな影響を与える可能性のある利益を得る権利があるかどうかを決定する。当社は、既存の関係や将来の取引の変化がVIEの合併または合併解除につながる可能性があるため、この評価を継続します。
株式投資
ASCトピック321では株式証券に投資し当社は公正価値に基づいて権益投資(権益法で入金された権益投資、被投資先に合併された権益投資とある他の投資を除く)を計量し、総合経営報告書の中で公正価値のいかなる変化も確認しなければならない。会社は、決定が容易な公正な価値を有さず、ASCテーマ820の実際の便宜を満たしていない株式投資のための計量代替案を選択することができる公正価値計測1株当たりの純資産価値(またはその等価物)を使用して公正価値を推定する。当社の株式投資は、随時決定可能な公正価値を有しておらず、資産純資産値の実際の需要に適合しておらず、公正価値を推定するためには、コストから任意の減少値を減算し、同一発行者の識別可能または同様の投資の秩序ある取引において観察されることができる価格変化を加えてまたは減算することによって生じる変化である。
研究と開発費用−臨床試験対策プロジェクト
同社の活動には,そのノウハウや候補DNA薬物の開発に関する研究と開発が主に含まれている。臨床試験費用の場合、計算すべき費用を推定するための判断は、参加者登録、研究完了、および他のイベントに基づいて生じる総コストの推定に依存する。蓄積された臨床試験コストは試験の進展とともに改訂される可能性がある。改正は、改正された事実が知られている間に費用を計上する。歴史的には,改訂は研究や開発費用の実質的な変化を招くことはないが,臨床試験案の改正や試験の廃止は会社の運営結果への費用を招く可能性がある。
1株当たり純損失
1株当たり基本純損失の算出方法は,この年度の純損失をその年度に発行された普通株の加重平均株式数で割る。1株当たり純損失は、発行済み株式オプション及び制限株式単位(“RSU”)の在庫株方法に基づいて計算され、証券や他の普通株を発行する契約が行使されたり、普通株に変換されたりする際に発生する可能性のある償却を反映する。当社が発行した未償還手形(付記9項参照)の希薄化の影響は“割引のような”方法で考慮されている1株当たり純損失を希釈する際には、報告期間内に対象株式の平均市価がオプションや他の証券の使用価格を超え、当該等証券を行使するとその期間の1株当たり純損失に希釈されると推定される場合には、その期間の分子から当該証券の公正価値変動を除去するように計算に使用する純損失を調整する必要がある。同様に,分母を調整し,関連する希釈株式(あれば)を反映する必要がある2023年12月31日まで,2022年12月31日および2021年12月31日までは,1株当たり基本および償却純損失は同じであり,株式オプション,RSUおよび手形転換時に発行可能な潜在的希薄化株式が逆薄となると仮定しているためである。
次の表は、その逆希釈作用により希釈1株当たり純損失計算から除外された潜在的普通株をまとめた
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 | | 2021 |
| 普通株購入オプション | 1,128,864 | | | 1,018,095 | | | 874,082 | |
| | | | | |
| サービス型限定株式単位 | 274,794 | | | 212,964 | | | 204,005 | |
| 業績に基づく限定株式単位 | — | | | 9,328 | | | 55,279 | |
| 転換可能優先株 | 275 | | | 275 | | | 275 | |
| 転換可能な手形 | 254,165 | | | 254,165 | | | 254,165 | |
| | | | | |
| | | | | |
| 合計する | 1,658,098 | | | 1,494,827 | | | 1,387,806 | |
賃貸借証書
長期経営賃貸については、当社はその総合貸借対照表で経営リース使用権資産と経営賃貸負債を確認した。賃貸負債は将来の賃貸支払いの現在値であり、当社は賃貸開始日に担保基準で同値資金を借り入れて支払う推定金利を決定する。使用権資産は、任意の前払いまたは繰延賃貸料調整された負債に基づいている。当社は継続選択権および終了選択権が合理的に行使されるかどうかを考慮して、開始日のレンタル期間を決定します
当社がリースを経営する固定賃貸料支出はリース期間内に直線法で確認し,総合経営報告書の経営支出に計上する。レンタル経営費用を含む可変リース支払いは発生したと記録されている。
株に基づく報酬
同社はRSUや株式オプションに関する株式ベースの報酬支出を発生させている。制限性株の公正価値は、付与された日にナスダック世界精選市場で発表された会社の普通株の終値によって決定される。同社はブラック·スコアーズオプション定価モデルを用いて付与された株式オプションの公正価値を推定している。ブラック·スコアーズオプション定価モデルは、取引オプションの公正価値を推定するために開発されており、これらのオプションは帰属制限がなく、完全に譲渡することができる。また,オプション定価モデルは,期待株価変動率と期待オプション寿命を含む主観的仮定を入力する必要がある.当社は奨励の必要な帰属期間中に奨励の公正価値を直線的に販売します。予想変動率は履歴変動率に基づいている。付与されたオプションの期待寿命は歴史的期待寿命に基づく。無リスク金利は、付与時に有効な米国債収益率に基づいている。配当収益率は、歴史的に配当金が支払われていないという事実に基づいており、予測可能な未来にも支払われないと予想されている会社は没収行為が発生した場合に確認します。
ブラック·スコイルズモデルにおける従業員と取締役にオプションを付与するための加重平均は以下のように仮定される
| | | | | | | | | | | | | | | | | |
| | 2013年12月31日までの年度 |
| | 2023 | | 2022 | | 2021 |
| 無リスク金利 | 4.05% | | 2.05% | | 0.91% |
| 予想変動率 | 100% | | 94% | | 93% |
| 所期寿命 | 5.5 | | 5.7 | | 6 |
| 配当率 | — | | — | | — |
| | | | | |
ブラック·スコイルズモデルにおける非従業員にオプションを付与するための加重平均は以下のように仮定される
| | | | | | | | | | | | | | | | | |
| | 2013年12月31日までの年度 |
| | 2023 | | 2022 | | 2021 |
| 無リスク金利 | 3.90% | | 1.96% | | 1.45% |
| 予想変動率 | 89% | | 87% | | 87% |
| 所期寿命 | 10 | | 10 | | 10 |
| 配当率 | — | | — | | — |
最近の会計公告
以下の最近の会計声明は、会社の財務諸表に大きな影響を与える可能性があります。不検討は、会社の財務状況、経営結果、または関連開示に影響を与えないか、またはそれとは無関係な最近の会計声明を検討しない。
ASU番号2023-07です2023年11月、財務会計基準委員会(FASB)は会計基準更新(ASU)2023-07を発表した分部報告(テーマ280):改善可能報告分部開示それは.ASUは,公共実体の支部開示範囲を拡大し,首席運営意思決定者(CODM)が定期的に審査し,各報告の支部損益測定指標に含まれる重大な支部費用,他の支部項目の金額とその構成説明,および報告分部の損益や資産の中間開示に対応することを求めている。アメリカ公認会計原則と最も一致する測定基準以外に、ASUはCODMが部門業績を評価し、どのように資源を分配するかを決定する時に使用する他の部門損益測定基準を開示することを許可した。ASU 2023−07に規定されるすべての開示要件は、単一の報告可能な部分を有する共通エンティティにも適用される。ASUは,2023年12月15日以降の会計年度と2024年12月15日以降の会計年度内の移行期間に遡及効力を有し,早期採用を許可している。同社は現在、この基準がその連結財務諸表と開示に及ぼす影響を評価している。
ASU番号2023-09ですFASBは2023年12月にASU 2023-09を発表しました所得税(話題740):所得税開示の改善。ASU 2023-09は、報告エンティティの有効税率入金に関する分類情報および所得税が支払われた情報を提供することを要求する。ASU 2023-09は年度期間が2024年12月15日以降の公共エンティティに有効であり,早期採用を許可している.同社は現在、この指導が連結財務諸表に及ぼす影響を評価している。
3. 収入確認と信用リスク集中
会社は、2023年、2023年、2022年、2021年12月31日までの年間で、各種許可やその他の合意の収入を確認した次の表は、任意の単一顧客との総収入が10%を超える割合を示している
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| お客様 | 2023年の収入 | | 世界全体の%を占めています
収入.収入 | | 2022年の収入 | | 世界全体の%を占めています
収入.収入 | | 2021年の収入 | | 世界全体の%を占めています
収入.収入 |
| | | | | | | | | | | |
| | | | | | | | | | | |
| ApolloBio社は | $ | 245,056 | | | 29 | % | | $ | — | | | — | % | | $ | — | | | — | % |
| Plebline生命科学会社(付属実体) | — | | | — | | | 33,596 | | | — | | | 245,310 | | | 14 | |
| アメリカ国防総省 | — | | | — | | | 9,591,778 | | | 94 | | | 754,853 | | | 43 | |
| 他にも付属実体が含まれています | 586,954 | | | 71 | | | 636,894 | | | 6 | | | 774,595 | | | 43 | |
| 総収入 | $ | 832,010 | | | 100 | % | | $ | 10,262,268 | | | 100 | % | | $ | 1,774,758 | | | 100 | % |
違います。2023年12月31日までの年度内に確認された収入は,2022年12月31日までの繰延収入である。2022年12月31日までの年間で、会社が確認した収入は14,000これは2021年12月31日の繰延収入に含まれる。履行義務は一般に最初の契約締結日から12ヶ月以内に履行される
2023年12月31日現在、会社には売掛金残高がありません。2022年12月31日現在、会社のすべての売掛金はCEPI MERS贈与によるものです。売掛金の短期的な性質、入金履歴、その規模と財務状況により、会社の顧客の信用リスクが最も小さい。したがって、当社は潜在的な信用損失を売掛金に計上する予定はありません。
4. 協力協定
蘇州エヴィ生物製薬有限会社
2020年12月31日、当社はエビソン生物製薬蘇州有限公司(“エビソン”)と協力と許可協定を締結し、2021年6月7日に改訂され、再記述された(改訂および再記述された“エビソン協定”)。広告ワクチン協定の条項によると、当社は広告ワクチンに独占的権利を付与し、中国、台湾、香港及びマカオ(総称して“大中国”)地域及びアジアの他の33カ国で自社の候補ワクチンINO−4800を開発、製造及び販売する。2021年6月の改正案は,同社とAdaccineとの協力に関連し,計画中のINO−4800臨床試験の世界第3段階を共同で行っている。双方は共同で試験に参加し,同社がINO−4800を供給する製造コストを含めて試験のグローバル開発コストを平均的に分担した。アドビソンは、その費用と発生した費用を含む中国大区での試験を完全に担当することに同意した。同社は2022年第4四半期に、INO-4800を新冠肺炎異種強化ワクチンとして開発するための内部援助の努力を停止した。広告ワクチン協定の条項によれば、広告ワクチンは、独自の資源を利用してINO−4800を開発し続ける
2021年6月の改訂については、会社は合意の世界第3段階試験部分が顧客との契約ではなく協力であることを決定したため、2021年6月の改訂をASCテーマ808で説明した。広告ワクチンの精算は,合併業務報告書における逆研究·開発費として確認され,いったん稼いで回収できることが確保された。 次の年度まで2023年12月31日、2022年12月31日、2021年12月31日、会社は資金を獲得する$3.61000万、$1.21000万ドルと300万ドルです4.5それぞれが記録されているトランス-研究開発費です
ApolloBio社は
2017年12月29日、当社は改訂および再署名された許可および協力協定(“ApolloBio協定”)を締結した ApolloBio社(“ApolloBio”)と協力し、2023年6月14日に改訂された。ApolloBio協定の条項によると、同社はApolloBioが合意した地域でVGX-3100を開発し商業化する独占的権利を付与した。VGX-3100は、HPVによる前癌病変の治療を目的としたApolloBioのDNA免疫療法製品候補品である。
その会社は総額$に達する権利がある20.0ApolloBioプロトコルによると、規制承認VGX-3100に関連する特定のマイルストーンを実現する際に、必要な収入、源泉徴収、または他の税金を差し引く。VGX-3100が上場を許可された場合、同社は、10代から10代の間に、特定の地域で模造薬競争が発生した場合、減少する可能性がある年間純売上高の等級別パーセンテージに基づいて特許権使用料支払いを得る権利がある。ApolloBioが特許使用料を支払う義務は続くだろう10特定地域での最初の商業販売から数年後、又は、遅い場合には、特定地域ライセンス製品をカバーする最後の満了特許が満了するまで
2023年12月31日までの年間で、会社は資金$を受け取ります245,000ApolloBioプロトコルから、収入として記録されている。12月31日までの年度 2022年と2021年にはいくつありますか違います。ApolloBio協定によると、巨額の計画費用を精算することができる。
防疫革新連盟
同社はこれまでCEPIと協定を締結しており,これらの合意に基づき,ラシャ熱とMERS候補ワクチンを開発しようとしている。CEPIは双方の手配の一部として、総額#ドルまでの資金を提供することに同意した561年以上の間に5年制臨床前研究の期限,および計画の第1段階と第2段階の臨床試験は,会社と協力者が行い,CEPIが決定したマイルストーンの成果に基づいて資金を提供する2022年11月、同社は、同社が行い、CEPIによって援助された研究データを予備分析した後、ラシャ熱およびMERSに対するこれらの候補製品の開発を停止すると発表した会社は2023年、2023年、2022年、2021年12月31日までの年間で資金を獲得する$1.8百万、$6.7百万ドルとドル10.0このお金はそれぞれこれらの贈与と関連があり、これらの支払いを逆の研究と開発費用として記録する。2023年、2023年、2022年12月31日まで、会社は売掛金残高は#ドルです0そして$1.7これらのCEPI贈与に関する総合貸借対照表では,それぞれ2,000万ドルであった2023年12月31日現在、同社は2.21000万ドルは負債として記録されています2022年12月31日現在 $0CEPI贈与に関する総合貸借対照表には繰延贈与資金と記されている。
2020年1月、CEPIは#ドルまでの贈与を同社に付与した9.0万万アメリカで第一段階の人体テストが行われるまで、INO-4800の臨床前と臨床開発を支持する。2020年4月にCEPIは同社に $6.9万万国際ワクチン研究所(IVI)や韓国国立衛生研究所(KNIH)と協力し,韓国でINO−4800の臨床試験を行った $5.0同社の次世代皮内電気穿孔装置CELLECTRA 3 PSPの開発を加速し、皮内投与INO-4800のために、1ドルの贈与を提供します1.3100万ドルでINO-4800の大規模製造をサポートしています2023年12月31日までの年間で2022年と2021年同社は#ドルの資金を獲得しました330,000, $1.1百万ドルとドル6.9CEPIはそれぞれINO−4800にこれらの贈与に関する100万ドルを提供し,逆研究や開発費用などの金額を記録した。2023年12月31日現在、同社は2.11000万ドルは負債として記録されています2022年12月31日現在 $2.3万万合併貸借対照表では繰延贈与資金と記載されており,INO−4800に関するCEPI贈与に関係している。
ビルとメリンダ·ゲイツ財団は
2018年10月、ゲイツは同社に#ドルの贈与を授与し、支援しました2.2感染症予防および治療上の問題を解決するために、dMAbの開発を推進するための1億ドル。この技術はインフルエンザとHIVの制御に高い相関がある。このようなモノクロナル抗体を提供する次世代方法は、低所得国および中所得国がこの技術を得ることを可能にするであろう。2019年8月ゲイツはまた資金を援助しました1.1このプロジェクトに100万ドルを提供しました当社は2023年、2023年、2022年および2021年12月31日まで年度を収録しています70,000, $233,000そして$182,000ゲイツdMAb贈与に関する逆研究と開発費とした。同社は2023年12月31日と2022年12月31日まで87,000そして$153,000それぞれ贈与に関する総合貸借対照表に繰延贈与資金として入金する。
国防省(DoD)
2020年6月に、当社はCELLECTRAの開発努力を支援するため、米国防総省と別のプロトタイプ協定(“OTA協定”)を締結しました®新冠肺炎に対してINO−4800を交付する際に使用される3 PSP装置および関連アレイ。オンライン旅行会社協定によると会社に提供される資金総額は$54.51000万ドルです。同社は以下の条項に基づいてオンライン旅行会社の合意を考慮すべきだと決定したテーマ958-605に分けて、非営利団体-収入確認これは、当社に資金を提供する政府機関が寄付金の互恵的な価値を受け取っていないため、特集606の範囲を超えている当社は関連費用が発生した同期に、総合経営報告書に逆研究と開発費用を計上した。当社は2023年、2023年、2022年および2021年12月31日まで年度を収録しています0, $6.1百万ドルとドル27.1それぞれOTAプロトコルに関する逆研究と開発費用とした.
また、2020年6月、会社は米国防総省から皮内CELLECTRAを購入する固定価格契約(“調達契約”)を取得した®2000台のデバイスと付属品。調達契約の下での調達総価格は#ドルです16.81000万ドルです。♪the the the会社は、調達契約は、顧客と締結されているので、ASC特別テーマ606の範囲に属し、会社はその手配の義務を履行することができると認定している。調達契約の履行義務には,所定数のCELLECTRAの交付が含まれている®2000台のデバイスと付属品。総取引価格は,決定された設備と添付ファイルの独立販売価格に応じて各履行義務に割り当てられる.2021年、米国防総省は同社INO-4800臨床試験の第3段階への資金提供を停止し、2022年1月、調達契約下の総調達価格を1ドルに低下させると発表した10.71000万ドルです。2022年12月31日までの年度内に、調達契約に規定されているすべての履行義務が履行されている。次の年度まで2023年12月31日、2022年、2021年同社が記録した収入は$0, $9.61000万ドルと300万ドルです755,000購買契約書からそれぞれ削除します。
5. 短期投資と公正価値計測
以下は、2023年12月31日まで、2023年、2022年までに販売可能な証券の概要です
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 2023年12月31日まで |
| | 契約書
期日(10年単位) | コスト | | 未実現毛収入
収益.収益 | | 未実現毛収入
損 | | 公正市場価値 |
| 共同基金 | --- | | $ | 55,389,289 | | | $ | — | | | $ | (3,522,888) | | | $ | 51,866,401 | |
| アメリカ国債 | 少ないです1 | | 75,164,782 | | | 24,938 | | | — | | | 75,189,720 | |
| | | | | | | | | |
| 預金証書 | 少ないです1 | | 2,978,917 | | | 11,709 | | | (300) | | | 2,990,326 | |
| アメリカ機関担保ローン支援証券 | * | | 1,340,439 | | | — | | | (403,973) | | | 936,466 | |
| | | | | | | | | |
| | | $ | 134,873,427 | | | $ | 36,647 | | | $ | (3,927,161) | | | $ | 130,982,913 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 2022年12月31日まで |
| | 契約書
期日(10年単位) | コスト | | 未実現毛収入
収益.収益 | | 未実現毛収入
損 | | 公正市場価値 |
| 共同基金 | --- | | $ | 117,036,232 | | | $ | — | | | $ | (9,373,514) | | | $ | 107,662,718 | |
| アメリカ国債 | 少ないです1 | | 95,001,209 | | | 7,567 | | | (44,266) | | | 94,964,510 | |
| | | | | | | | | |
| 預金証書 | 少ないです1 | | 2,977,564 | | | 13,664 | | | (320) | | | 2,990,908 | |
| アメリカ機関担保ローン支援証券 | * | | 1,435,592 | | | — | | | (384,331) | | | 1,051,261 | |
| | | $ | 216,450,597 | | | $ | 21,231 | | | $ | (9,802,431) | | | $ | 206,669,397 | |
* 満期日はありません。
当社は、2023年、2023年及び2022年12月31日までの年間記録グロス実現 GA投資額は $1,000そして$21,000総投資損失は $1,00 でした。4.8百万ドルとドル4.1それぞれ 100 万人です2023 年 12 月 31 日及び 2022 年 12 月 31 日を末日とする会計年度において、当社は販売可能株式の純未実現損益を $5.92000万ドルと$(7.8)はそれぞれ1.8億ドル2023 年 12 月 31 日、 2022 年および 2021 年 12 月期における累積その他の包括損失からの再分類は行っていません。売却可能に分類される投資に対する利子及び配当は、連結営業計算書において利子収入に含まれています。2023 年 12 月 31 日現在、当社は 21 未実現損失ポジションの売却可能証券のうち 20未実現損失の総額は $3.9100 万人が 12 ヶ月以上そのような立場にいました
当社は、信用損失その他の潜在的な評価上の懸念により投資が損なわれるかどうかを判断するため、販売可能な債務証券のポートフォリオを定期的に見直します。当社は、投資の適正価額が償却原価ベースを下回る債務有価証券については、投資の性質、信用格付けの変化、金利変動、業界アナリストの報告、減損の深刻さなど、様々な定量的要因を個別担保レベルで評価しています。2023 年 12 月 31 日時点における売却可能債権の未実現損失は、主に金利変動によるものです。 特定の有価証券に伴う信用リスクの増加によるものではありません当社は、未実現損失のポジションにある売却可能な債券の信用質、およびこれらの有価証券から回収される将来のキャッシュフローの当社の見積もりに基づいて、未実現損失は信用損失ではないと考えています。したがって、 2023 年 12 月 31 日現在、当社は、売却可能債券に関する信用損失引当金を計上していません。
以下の表は、 2023 年 12 月 31 日現在、以下のインプットを用いて決定された、定期的な公正価値で計測された当社の資産を示しています。
| | | | | | | | | | | | | | | | | | | | | | | |
| 公正価値に応じて計量する |
| | 2023年12月31日 |
| | 合計する | | オファー
活発な市場で
(一級) | | 意味が重大である
その他観測不能
入力量
(二級) | | 意味が重大である
見えない
入力量
(第3級) |
| | | | | | | |
| | | | | | | |
| | | | | | | |
| | | | | | | |
| 短期投資 | | | | | | | |
| 中国投資互恵基金 | $ | 51,866,401 | | | $ | 51,866,401 | | | $ | — | | | $ | — | |
| アメリカ合衆国国債 | 75,189,720 | | | 75,189,720 | | | — | | | — | |
| | | | | | | |
| 預金証券 | 2,990,326 | | | — | | | 2,990,326 | | | — | |
| 米国機関住宅ローン担保証券 | 936,466 | | | — | | | 936,466 | | | — | |
| | | | | | | |
| 短期投資総額 | 130,982,913 | | | 127,056,121 | | | 3,926,792 | | | — | |
| | | | | | | |
| 関連会社への投資 | 2,780,287 | | | 2,780,287 | | | — | | | — | |
| 公正価値に応じて計量された総資産 | $ | 133,763,200 | | | $ | 129,836,408 | | | $ | 3,926,792 | | | $ | — | |
以下の表は、 2022 年 12 月 31 日現在、以下のインプットを用いて決定された、定期的な公正価値で測定された当社の資産を示しています。
| | | | | | | | | | | | | | | | | | | | | | | |
| 公正価値に応じて計量する |
| | 2022年12月31日 |
| | 合計する | | オファー
活発な市場で
(一級) | | 意味が重大である
その他観測不能
入力量
(二級) | | 意味が重大である
見えない
入力量
(第3級) |
| | | | | | | |
| | | | | | | |
| | | | | | | |
| | | | | | | |
| 短期投資 | | | | | | | |
| 中国は互恵基金に投資する | $ | 107,662,718 | | | $ | 107,662,718 | | | $ | — | | | $ | — | |
| *米国債の購入 | 94,964,510 | | | 94,964,510 | | | — | | | — | |
| | | | | | | |
| 中国は銀行預金証書を発行した | 2,990,908 | | | — | | | 2,990,908 | | | — | |
| **米国機関担保ローン支援証券の購入 | 1,051,261 | | | — | | | 1,051,261 | | | — | |
| 短期投資総額 | 206,669,397 | | | 202,627,228 | | | 4,042,169 | | | — | |
| | | | | | | |
| 関連実体への投資 | 2,007,142 | | | 2,007,142 | | | — | | | — | |
| | | | | | | |
| 公正価値に応じて計量された総資産 | $ | 208,676,539 | | | $ | 204,634,370 | | | $ | 4,042,169 | | | $ | — | |
| | | | | | | |
| | | | | | | |
| | | | | | | |
| | | | | | | |
2023年12月31日現在、2023年12月31日現在、2022年12月31日までの一次資産には、当社が保有する市場見積額に応じた共同基金と米国債、およびその関連実体PLSへの当社の投資が含まれている。会社の以下の方面での投資入金597,808適用される貸借対照表日付韓国証券取引所市場における株式終値に基づく株式普通株。当社権益証券の未実現損益は総合財務諸表に列報する売却可能な持分証券としての未実現収益または損失の配給あるいは関連実体への投資の収益や損失として
2023年12月31日、2023年12月、2022年12月までの二次資産には、会社が保有する預金と米国機関担保融資支援証券が含まれており、これらの証券は最初に取引価格で評価され、その後、各報告期間終了時に値を推定し、通常市場で観察できるデータを利用する。当社は、同じまたは比較可能なツールの市場オファー、または直接または間接的に観察可能なオファー以外の投入を使用することができる専門定価サービス機関からその二次資産の公正価値を得ることができる。専門的な価格設定サービスは、様々な業界データ提供者からの見積市場価格および観察可能な入力を収集する。当社の二級金融商品の公正価値を計量するための推定技術は、観察可能な市場データ、類似ツールの見積市場価格或いは定価モデル(例えば、割引キャッシュフロー法)によって実証された非拘束性市場共通認識価格に由来する。会社は主要定価サービスの会社ポートフォリオ残高に対する公正価値の評価と独立源から得た会社ポートフォリオ残高の公正価値を比較することによって、主要定価サービスが提供する市場オファーを検証する。
2023年12月31日または2022年12月31日現在、3級資産を保有していない。
6. ある貸借対照表項目
2023年12月31日まで、2023年、2022年12月31日までの前払い資産およびその他の流動資産は、
| | | | | | | | | | | |
| 2023 | | 2022 |
| 保険追討(A) | $ | — | | | $ | 30,000,000 | |
| 製造費を前払いする | 1,486,638 | | | 1,401,028 | |
| その他前払い費用 | 3,907,027 | | | 18,729,453 | |
| | | |
| $ | 5,393,665 | | | $ | 50,130,481 | |
2023年12月31日現在、2023年12月31日現在、2022年12月31日現在の売掛金と売掛金には、
| | | | | | | | | | | |
| 2023 | | 2022 |
| 売掛金 | $ | 3,577,826 | | | $ | 19,862,487 | |
| 補償すべきである | 9,837,104 | | | 12,574,921 | |
| 訴訟に応じて和解する | — | | | 44,000,000 | |
| その他課税費用(B)(C) | 6,432,814 | | | 3,249,477 | |
| $ | 19,847,744 | | | $ | 79,686,885 | |
(a)当社は2022年7月に集団証券訴訟について和解了解覚書を締結しようとしている(付記11参照)。和解の最終司法命令は2023年1月に発表された。和解金額は$である30.02000万ドルの現金とドル14.0すべての未解決クレームを終わらせるために、2,000,000株の会社普通株。同社の保険会社は、2022年12月31日現在、和解協議における現金部分を提案しており、これらの金額は第三者信託の形で存在している。その会社の保険会社は$を支払った252,000和解協定の一部として、これらの金額は保険会社の現金約束から相殺される。2023年3月31日までの3ヶ月間、第三者信託から和解した現金部分を解除し、当社は発行しました760,083普通株は証券集団訴訟によって和解する。
(B)2023年3月、当社は和解提案株主派生訴訟について和解条項を締結した(付記11参照)。2023年6月、裁判所は提案された和解案を初歩的に承認した。和解の一環として、2023年7月、同社は$を支払った1.2原告弁護士に彼らの費用と支出を支払う。2022年12月31日現在、この金額は“その他の課税費用”内に計上されている。2023年10月12日、裁判所は命令と最終審判決を下し、和解を承認し、2023年11月13日に発効した。
(C)2023年12月31日残高は#ドルを含む4.3未使用の贈与資金のために100万ドルの債務を負担する。
7. 固定資産
2023年12月31日現在、2023年12月、2022年12月までの固定資産には、
| | | | | | | | | | | | | | | | | |
| コスト | | 積算
減価償却
そして
償却する | | ネットブック
価値がある |
| 2023年12月31日まで | | | | | |
| 賃借権改善 | $ | 15,917,596 | | | $ | (11,753,081) | | | $ | 4,164,515 | |
| | | | | |
| 研究開発設備 | 3,538,698 | | | (3,078,165) | | | 460,533 | |
| オフィス家具及び固定装置 | 2,827,476 | | | (2,816,577) | | | 10,899 | |
| コンピュータ機器その他 | 3,529,129 | | | (3,204,090) | | | 325,039 | |
| $ | 25,812,899 | | | $ | (20,851,913) | | | $ | 4,960,986 | |
| 2022年12月31日まで | | | | | |
| 賃借権改善 | $ | 15,803,108 | | | $ | (10,036,080) | | | $ | 5,767,028 | |
| 研究開発設備 | 5,300,104 | | | (4,295,217) | | | 1,004,887 | |
| オフィス家具及び固定装置 | 2,827,476 | | | (2,803,800) | | | 23,676 | |
| コンピュータ機器その他 | 5,360,712 | | | (4,428,306) | | | 932,406 | |
| $ | 29,291,400 | | | $ | (21,563,403) | | | $ | 7,727,997 | |
2023年12月31日現在、2022年と2021年12月31日までの年度減価償却費用は2.6百万、$3.7百万ドルとドル3.0それぞれ 100 万人です当社は、当該期間中に固定資産の帳簿価額が減損していないと判断しました。2023 年 12 月 31 日を末日とする会計年度において、当社は純帳簿価額のない固定資産を売却し、利益を上げました。148,000純帳簿価額 $ の固定資産を処分しました466,000. 2022 年 12 月 31 日を末日とする会計年度において、当社は純帳簿価値 $の固定資産を売却しました。6.1 純帳簿価値の固定資産を処分しました1.11000万ドルです。
8. 商誉と無形資産
2023年9月30日までの3ヶ月以内に、会社の株価と関連する時価の持続的な下落、及び生物技術業界の株式価値が普遍的に低下したため、会社はその営業権と長期資産に対して減値評価を行った。
その業務及び報告構造によると、同社は単一の報告単位として運営されている。営業権に対して、市場法を用いて数量化減値評価を行い、会社の権益公正価値とその帳簿価値を比較した。株式の公正価値は、当社の時価と、当社の隠れた商業企業価値に適用される割増価格の合理的な範囲の推定に基づいて得られます。制御割増は、比較可能市場取引で観察された制御割増に基づいて推定される。これは第2レベルの非日常的公正価値計測を代表する.この分析によると、会社は非現金、税引前営業権減価費用が#ドルであることを確認しました10.52023年9月30日までの3ヶ月間でそのため、2023年9月30日まで、営業権は完全に減少した。
営業権減価評価を完了する前に、当社はまずその長期資産に対して減値テストを行った。9月9日現在、会社は無期限の無形資産を持っていない2023年2月30日。当社はその長期資産減価評価について、物件及び設備、賃貸権改善及び使用権資産を含むすべての長期資産を決定し、1つの資産グループを代表する。当社の結論は、長期資産は減値しておらず、その帳簿価値はその公正価値を超えていないからである。
2023年6月30日までの四半期に、会社は減価費用$を記録した2.02016年にBioject Medical Technologiesから買収された無形資産の余剰帳簿価値の研究開発費を支払うためのものであり、同社にはこの技術をさらに開発または利用する計画がないためである
以下、主要資産別に営業権および無形資産を列挙します
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 2023年12月31日 | | 2022年12月31日 |
| | 加重平均有用値
命
(年) | 毛収入 | | 積算
償却する | | 減損する | | ネットブック
価値がある | | 毛収入 | | 積算
償却する | | ネットブック
価値がある |
| 無期限生存 : | | | | | | | | | | | | | | | |
| 商誉 | | | $ | 10,513,371 | | | $ | — | | | $ | (10,513,371) | | | $ | — | | | $ | 10,513,371 | | | $ | — | | | $ | 10,513,371 | |
| 定住: | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | |
| 許可証 | 10 | | — | | | — | | | — | | | — | | | 1,323,761 | | | (1,323,761) | | | — | |
| | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | |
| バイオジェクト | — | | 5,100,000 | | | (3,115,556) | | | (1,984,444) | | | — | | | 5,100,000 | | | (2,988,889) | | | 2,111,111 | |
| その他(A) | 18 | | 4,050,000 | | | (4,050,000) | | | — | | | — | | | 4,050,000 | | | (4,031,250) | | | 18,750 | |
| 無形資産総額 | 11 | | 9,150,000 | | | (7,165,556) | | | (1,984,444) | | | — | | | 10,473,761 | | | (8,343,900) | | | 2,129,861 | |
| 商業権と無形資産総額 | | | $ | 19,663,371 | | | $ | (7,165,556) | | | $ | (12,497,815) | | | $ | — | | | $ | 20,987,132 | | | $ | (8,343,900) | | | $ | 12,643,232 | |
(a)その他の無形資産は、取得した知的財産の推定公正価値です。
無形資産の償却費は $145,000, $496,000そして$520,0002023年12月31日まで,2022年12月31日と2021年12月31日までである
いくつありますか違います。欠陥や欠陥指標が存在し違います。2022年12月31日と2021年12月31日までの年間で赤字を計上した。
9. 転換債
転換可能優先手形
2019年2月19日と2019年3月1日、会社は指向性増発を完了した78.5100万ドルのITS元金総額6.502024年に満了した転換可能優先手形の割合(“手形”)。改正された1933年証券法第144 A条によると、これらの債券は不公開発行の形で適格機関の買い手に売却される。今回発行された純収益は$75.7百万ドルです。
この債券は当社の優先無担保債務であり、利息は半年ごとに現金で支払い、毎年3月1日及び9月1日に延滞し、利息率は6.50年利率です。債券は2024年3月1日に満期になり,会社は当時残っていたドルを支払った16.9全額債務は、課税利息を含む。
最初に,発行手形を計上する際には,会社は手形を負債部分と権益部分に分類する.負債部分の帳簿金額は、類似債務ツールの公正価値を計量することによって計算され、これらの債務ツールには関連する転換可能な特徴はない。手形変換選択権を代表する権益部分額面は$16.3300万ドルを債務割引と記録し、#%の実金利で利息支出を償却する13.1%です。また、同社は$を割り当てました592,000債務発行費用は株式部分に計上され、残りの債務発行費用は#ドルである2.21000万ドルは負債部分に割り当てられ、実際の金利法により利息支出に償却される。
2022年1月1日、当社は、ASU第2020-06号、債務転換およびその他のオプション(主題470-20)およびエンティティ自己持分派生ツールおよびヘッジ契約(主題815-40):エンティティ自己持分変換可能ツールおよび契約の会計(“ASU 2020-06”)を採択した。ASUは、ASC 470-20の現金変換機能モード、転換債務、および他のオプションをキャンセルし、これらのモードは、いくつかの変換可能な債券の発行者が、埋め込まれた変換機能を株式の構成要素として個別に計算することを要求する。逆に、変換機能が何らかの基準を満たさない限り、同社はこれらの証券を単一の会計単位として会計処理を行う。会社は新基準を採用し、改正トレーサビリティ法を採用し、累計純損失は#ドル減少した1.82000万ドルで追加の実収資本に減少しました3.31000万ドル、転換可能な優先チケットはドルを増加させます1.5 会計変更の影響を反映するために 100 万ドルですその後、デリバティブとしての分岐や認識を必要としないため、償却原価で測定される単一の負債として計上されました。
2023 年 12 月 31 日時点の債券残高は以下のとおりです。
| | | | | |
| 元金金額 | $ | 78,500,000 | |
| 普通株式に換算される元本額 | (62,085,000) | |
| |
| 未償却債務発行コスト | — | |
| 応算利息 | 355,654 | |
| 純キャバリング金額 | $ | 16,770,654 | |
2023 年、 2022 年、 2021 年 12 月 31 日を末日とする会計年度について、当社は1.2百万、$1.31000万ドルと300万ドルです1.9 債券に関連する利子費用はそれぞれ 100 万ドルです1.1契約上の利子クーポンに関連して毎年 100 万ドルです
10. 株主権益
優先株
| | | | | | | | | | | | | | | | | | | | | | | |
| | | | | | 発行済株式数
十二月三十一日 |
| | 授権株 | | 既発行株 | | 2023 | | 2022 |
| | | | | | | |
| | | | | | | |
シリーズ C 優先株、パー $0.001 | 1,091 | | | 1,091 | | | 9 | | | 9 | |
| | | | | | | |
シリーズ C 優先株式の 1 株または 1 株の保有者は、いつでも、当該保有者の選択により、当該保有者の優先株式の全部または一部を、全額支払済および評価不能な普通株式に転換する権利を有する。2021 年 12 月 31 日現在、換算値 w$として326.401 株あたりシリーズ C 優先株式の発行済株式は以下の合計に転換可能であった 275普通株です。
普通株の発行
2021 年 11 月 9 日、当社は ATM 株式公開に参入しました。SM外部販売代理店 ( 以下、「販売代理店」といいます ) との販売契約 ( 以下、「 2021 年販売契約」といいます ) を締結し、その普通株式の総募集価格を $以内とする募集および販売を行うこと。300.0 百万だ2021 年の販売契約では、販売代理店は以下の金額の補償を受ける権利があると規定しています。 3.02021 年販売契約に基づき販売代理店を通じて販売された普通株式の売上総利益の% 。2023 年 12 月 31 日期および 2022 年 12 月 31 日期において、当社は 875,305そして2,870,4782021 年販売契約に基づく普通株式のそれぞれを保有します売上高は加重平均価格 $で行われました。6.33そして$29.341 株当たりそれぞれ、合計純利益は $5.51000万ドルと300万ドルです83.0 それぞれ 100 万人です2023 年 12 月 31 日現在、 $161.8 2021 年の販売契約に基づく残存容量 100 万ドル
2023 年 3 月期 3 ヶ月間、当社は 760,083注釈 11 に記載されている証券集団訴訟決済に基づく普通株式。
株式オプションと制限株式単位
会社取締役会は2023年3月24日に“2023年総合インセンティブ計画”(“2023年計画”)を採択し、この計画によると、会社は従業員、取締役、コンサルタントに株式オプション、制限株式奨励、RSUおよびその他の株式ベースの奨励または短期現金奨励を付与することができる
2023年5月16日、株主は2023年計画を承認した。2023年計画により発行可能な会社普通株の株式総数は超えない1,166,6662023年5月16日、2016年総合インセンティブ計画(改訂された“2016計画”)が満期になり、2016年計画の下で支払われていない奨励金を終了、または没収するため、時々戻る可能性のある任意の株式を取得する。2023年12月31日に当社は1,334,0122023年計画で将来付与可能な普通株式1,875発行されたが帰属していないRSUと3,1502023年計画に基づき普通株の発行済み基礎オプションを購入する。2023年計画によると、将来の贈与に利用可能な奨励金は通常授与されます3年最高契約期間があります10年それは.2023年計画は2033年3月24日に満期になる。
2023年12月31日に当社は262,641発行されたが帰属していないRSUの標的株式と未償還のオプション961,4992016年に計画された普通株式。2016年計画に基づいて授与された未解決の賞は一般的に授与される3年最高契約期間があります10年それは.“2023年計画”を採択した後、“2016年計画”に基づいてどの賞も授与することはできないが、懸案の賞は既存の条項によって管轄されている
2022年6月24日、会社取締役会は株式に基づくインセンティブ計画(“2022年インセンティブ計画”)を採択し、個人に対して非法定株式オプション、株式付加価値権、制限性株式奨励、RSU奨励、業績奨励などの奨励を適宜付与し、入社就職の実質的なインセンティブとすることを規定した。2022年インセンティブ計画により発行可能な会社の普通株式総株式数は超えない166,666株式です。2023年12月31日までに会社は125,5752022年のインセンティブ計画によると将来付与できる普通株は10,278未投資 RSU および買取オプションの発行済株式 27,7592022 年の誘導計画に基づく普通株式。2022 年誘導計画は、当社の取締役会によっていつでも終了することができます。
2007 年 3 月 31 日に採択された 2007 年オムニバス · インセンティブ · プラン ( 以下、「 2007 年インセンティブ · プラン」という。2023 年 12 月 31 日現在、当社は買取オプションの残高を有しています。 136,4562007 年のインセンティブ · プランに基づく普通株式。2007 年のインセンティブプランで授与された賞は、一般的に 3年最高契約期間があります10年.
2023 年 12 月 31 日期、 2022 年 12 月 31 日期、 2021 年 12 月 31 日期連結業績計算書で計上された従業員および取締役の株式報酬費用の総額は $でした。10.4百万、$22.2百万ドルとドル25.0それぞれ100万ドルです4.5百万、$8.8百万ドルとドル13.4100 万ドルが研究開発費に含まれ5.9百万、$13.4百万ドルとドル11.6総経費と管理費にはそれぞれ 100 万ドルが含まれています
2023 年と 2022 年 12 月 31 日には、 $がありました。4.3百万ドルとドル10.5未投資ストックオプションに関する未認識報酬費用の総額は、加重平均期間にわたって認識される見込みです。 1.3年和1.6それぞれ数年です。
2023 年と 2022 年 12 月 31 日には、 $がありました。3.5百万ドルとドル7.2未投資 RSU に関する未認識報酬費用の総額は、加重平均期間にわたって認識される見込みです。 1.5年和1.7年々です
非従業員に付与されるストックオプションの公正価値は、ブラック · ショールズ価格モデルを用いて推定された。2023 年 12 月 31 日、 2022 年、 2021 年 12 月 31 日を末日とする年度の非従業員に付与されたストックオプションおよび RSU の株式報酬費用の総額は $でした。669,000, $1.3百万ドルとドル1.4それぞれ 100 万人です2023 年 12 月 31 日現在、購入オプション 61,808非従業員に付与された普通株式は残高でした
2023 年 12 月 31 日時点のストックオプション残高の概要は以下のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | 未完成オプション | | 行使可能なオプション |
| 行権価格 | | 原価株式オプション
卓越した | | 加重平均
残り
契約期限
(単位:年) | | 重みをつける
平均値
価格を行使する | | 原価株式オプション
練習可能である | | 重み付け 平均数
行権価格 |
$4.32-$18.00 | | 283,472 | | | 9.2 | | $ | 14.11 | | | 66,918 | | | $ | 14.45 | |
$18.01-$39.00 | | 264,108 | | | 7.3 | | $ | 35.69 | | | 141,600 | | | $ | 34.99 | |
$39.01-$52.00 | | 156,505 | | | 4.5 | | $ | 44.93 | | | 156,271 | | | $ | 44.93 | |
$52.01-$90.00 | | 129,681 | | | 4.2 | | $ | 76.82 | | | 121,124 | | | $ | 77.75 | |
$90.01-$130.00 | | 136,716 | | | 4.2 | | $ | 100.15 | | | 131,640 | | | $ | 100.00 | |
$130.01-$233.28 | | 158,382 | | | 5.4 | | $ | 140.27 | | | 129,250 | | | $ | 141.78 | |
| | 1,128,864 | | | 6.4 | | $ | 58.76 | | | 746,803 | | | $ | 72.11 | |
2023 年 12 月 31 日時点で、残高オプションの本質的価値の総額は $でした。2,000行使可能なオプションの総本質的価値は $でした1,000行使可能なオプションの加重平均残存契約期間は 5.5何年もです。
2023 年 12 月 31 日時点で、未投資 RSU の総本質的価値は $でした。1.72023 年 12 月 31 日を末日とする会計年度に付与された RSU の固有価値の総額は1.3百万ドルです。
2023 年 12 月 31 日現在、購入オプション 1,128,864普通株と普通株274,794RSU はベストが予想された。
2023 年 12 月 31 日を末日とする年度における当社の株式インセンティブ計画に基づくストックオプションの行使は以下の通りです。
| | | | | | | | | | | |
| 量
株 | | 加重平均
行権価格 |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| バランス、2022年12月31日 | 1,018,095 | | | $ | 75.32 | |
| 授与する | 339,019 | | | 14.23 | |
| 鍛えられた | — | | | — | |
| キャンセルします | (228,250) | | | 66.47 | |
| バランス、2023年12月31日 | 1,128,864 | | | $ | 58.76 | |
2023 年 12 月 31 日を末日とする年度における当社の株式インセンティブ計画に基づく制限付き株式単位の活動は以下の通りです。
| | | | | | | |
| 量
株 | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| バランス、2022年12月31日 | 212,964 | | | |
| 授与する | 194,747 | | | |
| 既得 | (99,420) | | | |
| キャンセルします | (33,497) | | | |
| バランス、2023年12月31日 | 274,794 | | | |
1 株あたりの加重平均行使価格は $でした。38.86上には9,3572023 年 12 月 31 日を末日とする年度に満了したオプション $101.64上には6,4372022 年 12 月 31 日を末日とする年度に満了したオプションと $54.72上には5832021 年 12 月 31 日を末日とする会計年度に満了したオプション。
1 株あたりの加重平均付与日公正価値は $でした。11.19, $28.08そして$91.322023 年 12 月 31 日、 2022 年 12 月 31 日、 2021 年 12 月 31 日に付与されたオプションについて
加重平均助成日の公正価値は $でした。10.34, $37.44そして$124.442023 年 12 月 31 日、 2022 年 12 月 31 日、 2021 年 12 月 31 日を末日とする年度に付与された RSU の 1 株当たり
違います。ストックオプションは 2023 年 12 月 31 日を末日とする会計年度に行使されました。 会社は $を受け取った。283,000そして$6.72022 年 12 月 31 日を末日とする年度と 2021 年 12 月 31 日を末日とする年度におけるストックオプションの行使による収益がそれぞれ 100 万ドルです行使されたオプションの総本質的価値は $でした。81,000そして$7.02022 年 12 月 31 日と 2021 年 12 月 31 日を末日とする年度はそれぞれ
11. 引受金とその他の事項
賃貸借証書
その会社は約56,600カリフォルニア州サンディエゴにあるオフィス、研究所、製造スペースの平方フィートと 57,360ペンシルベニア州プリマス · ミーティングにある様々なキャンセル不可のオペレーティング · リース契約に基づき、 2023 年 12 月 31 日現在の残りのリース期間を締結しています。 3.4数年前6.0年数、すなわち賃貸借契約のキャンセル不可期間。将来の賃貸支払いを計算する際には、この等選択権が合理的に行使されることが確定していないため、当社は延期選択権をそのレンタル条項から除外している。同社の賃貸支払いには、主にリース期間内の基本賃貸資産使用権の固定賃貸料支払いと、公共地域維持·行政サービスの支払いが含まれる。同社は、テナント改善や賃料減免期間を補償するなど、オーナーから常習的なインセンティブを得て、これらのテナントの総賃貸料支払いを効果的に削減した。
2023年11月、当社は改訂しました1つはそのレンタル契約は31,207レンタル期間は2023年11月に満期となるオフィスと実験室スペースで、レンタル期間を2024年2月29日まで延長する。
当社は2023年11月、カリフォルニア州サンディエゴ研究開発実験室スペースのレンタル契約(“新サンディエゴレンタル”)を締結しました。新しいサンディエゴ賃貸契約によると、総空間は約5,563二平方フィートです。新サンディエゴリースのレンタル期間は2024年2月10日に開始され、初期レンタル期間は4.3何年もです。
基本レンタル料は新しいサンディエゴレンタル期間中に定期的に調整されます。新しいサンディエゴ賃貸契約によって支払われるレンタル料は基本レンタル料を含めて、年ごとに約増加します三つ%と、光熱費、不動産税、保険、メンテナンスを含むいくつかの施設費用における会社のシェアを支払います。また、会社は#ドルの保証金を支払った33,000.
同社はASCテーマ842に基づいて顧客やサプライヤーとの契約を評価し、上述した不動産賃貸と各種コピー機リースを除いて、その他の契約には使用権資産が含まれていないことを確定した。
総合貸借対照表上の経営リース使用権資産と負債は、残りリース期間内の余剰賃貸支払いの現在値である。いくつかの施設料金における会社のシェアを支払うために追加月額を支払うことは、経営リース使用権資産や負債には含まれない。賃貸契約中の暗黙的な金利は確定しにくいため、会社はその増加借入金金利を使用してそのレンタル支払いの現在値を計算する。
2023年12月31日までの会社経営賃貸負債満期日は以下の通り
| | | | | |
| 十二月三十一日までの年度 | |
| 2024 | $ | 3,247,000 | |
| 2025 | 3,466,000 | |
| 2026 | 3,555,000 | |
| 2027 | 2,955,000 | |
| 2028 | 2,310,000 | |
| その後… | 2,132,000 | |
| *残りのレンタル支払総額 | 17,665,000 | |
| 減算:現在値調整 | (4,226,000) | |
| --レンタル総負債を経営しています | 13,439,000 | |
| マイナス:現在の部分 | (2,407,000) | |
| 長期経営賃貸負債 | $ | 11,032,000 | |
| |
| 加重平均残余レンタル期間 | 5.3年.年 |
| 加重平均割引率 | 8.9 | % |
2023年、2023年、2022年、2021年12月31日までの総合経営報告書に経営費を計上した賃貸費用は#ドルです3.5百万、$3.4百万ドルとドル3.4それぞれ100万ドルです経営リースコストは,経営リース負債に含まれる固定リース支払いからなり,リース期間内に直線法で入金される。可変レンタル費用は発生したと記録されている。
2023年第3期と第4期に、当社は転貸契約を締結して契約しました4,400そして7,000プリマス会議本部でそれぞれ1平方フィートを借りて、いずれの場合も2026年12月31日まで転貸条項があります。
2019年第4四半期に当社は契約を締結しました二つ転貸契約を合約する13,500プリマス会議本部の面積は1平方フィートで、1部は2025年3月31日まで、もう1部は月ごとにレンタルされている。
正常な業務過程において、会社は各種協議の一方であり、これらの合意により、会社は他方を賠償する義務がある可能性がある。会社債務の条件の性質や特定のプロトコルごとに関連する独自の事実や状況により,このようなプロトコルで将来支払う可能性の高い金額は予測できない.歴史的に見ると、同社がこのような合意に基づいて支払った金は、その業務、総合経営業績または財務状況に実質的な影響を与えていない。
法律訴訟
証券訴訟
2020年3月、米ペンシルベニア州東区地方裁判所は、同社とその元最高経営責任者総裁と最高経営責任者を被告としたいわゆる株主集団訴訟であるマクデミードがインノー·ビオ製薬会社とJ.ジョセフ·キングを訴えた。訴訟によると、同社は重大な虚偽と誤解性の陳述を行い、ある連邦証券法に違反した。原告代表は推定された種別が示されていない金銭損害賠償を要求し、合理的な弁護士費を含む賠償費用と費用を要求する。原告の起訴状は後に改正され、同社のある他の高級職員を被告とした。事件で追加の動議が提出された後、2022年6月、双方は原則として株主集団訴訟を決着させる合意に達し、裁判所は2023年1月にこの合意を承認した。和解協定によると,同社は$の支払いに同意した30.02000万ドルの現金とドル14.0すべての未解決クレームを終わらせるために2000万株の普通株式がある。その会社の保険会社は$を支払った30.0和解協定の400万ドルの現金部分。2023年3月31日までの3ヶ月以内に、当社は発送します760,083普通株は証券集団訴訟によって和解する
株主派生訴訟
2020年4月、米ペンシルベニア州東区地方裁判所は株主派生訴訟を起こし、BehestiはKimらを訴えた8人当社の現職および前任役員は被告です。この訴訟は州と連邦政府のクレームを主張し、上記株主集団訴訟と同様の告発された不実陳述に基づいている。訴訟は会社の取締役会が会社の管理、政策、やり方と内部統制に対して合理的かつ慎重な監督を行うことができなかったことを告発した。原告は不明示のを求めた
会社を代表して通貨損害賠償と管理改革を行う。2020年6月から2020年8月までの間に,裁判所はより多くの株主派生商品苦情を提出し,その後合併を行った
2022年3月、デラウェア州衡平裁判所はまた1件の株主デリバティブ訴訟を提起し、合併した派生商品訴訟中のクレームと基本的に似ていると主張した。2022年5月、デラウェア州衡平裁判所は訴訟の棚上げを宣言した
2023年3月、双方は平衡平裁判所に共同状況報告を提出し、双方は原則的に和解に同意し、その中で合併の派生訴訟とある株主要求を解決することも規定されていると報告した
2023年4月、合併派生訴訟の原告はペンシルベニア州東区米国地区裁判所に和解を予備承認する動議を提出した。提案された和解規定は合併の派生訴訟、デラウェア州衡平裁判所で解決された派生訴訟とある株主要求を解決する
2023年6月、裁判所は和解の規定に基づき、提案された派生商品債権和解を初歩的に承認した。和解条項は、和解審問及び裁判所が最終的に和解を承認した後、当社は和解条項に記載されたいくつかの会社管理改革を実施することを期待している。予備命令はまた和解通知の形式と方法を承認した。和解の一環として、2023年7月、同社は$を支払った1.2原告弁護士に彼らの費用と支出を支払う。2023年10月、裁判所は和解を承認する命令と最終判決を下し、2023年11月に発効した。“コーポレート·ガバナンス規定”の規定に基づき、会社はコーポレートガバナンス改革を実施した。
VGXI訴訟
2020年6月、同社はペンシルバニア州モンゴメリー県一般法裁判所にVGXI,Inc.およびGeneOne Life Science,Inc.,またはGeneOne,Inc.,およびVGXI,Inc.,総称してVGXIと呼ばれ、VGXIが当社とそれらの供給協定に深刻な違反を犯したことを告発した。訴状はVGXIに宣言的判決、具体的な合意履行、禁止救済、会計、損害賠償、弁護士費、利息、費用とその他の救済を要求した。2020年6月、同社は予備禁止の嘆願書を提出したが、却下された。
当社が上訴した後、VGXIは2020年7月に当社を反訴し、当社が供給協定違反を告発し、商業秘密と不当な利益を流用した。反訴は会社に禁止救済、損害賠償、弁護士費、利息、費用、その他の救済を要求する。VGXIはまた、Oology Bioservices,Inc.に対して第三者訴えを行い、同社はVGXIが提供するサービスと類似したサービスを提供するように招聘した。同社はVGXI反訴に対する回答を提出し,これらの告発とVGXIが提出した文書からのクレームに異議を唱えた。2020年10月、当社はペンシルベニア州高等裁判所に控訴中止通知を提出した。この訴訟の裁判日はまだ確定されていない。
同社はVGXIに対するクレームを積極的に起訴し、VGXIの反クレームに対して積極的に自己弁護をしようとしている。
GeneOne訴訟
GeneOneは2020年12月、CELLECTRA設備許可協定、すなわち会社とGeneOneとの合意違反を告発するため、ペンシルベニア州モンゴメリー県一般裁判所に提訴した。当社は2020年10月にこの合意を終了します。起訴状は違約、宣言的判決、不正競争と不当所得に対するクレームを主張した。起訴状は、会社に禁止救済、会計処理、損害賠償、利益返還、弁護士費、利息及びその他の救済を要求する。同社は訴えに初歩的な異議を申し立てたが、裁判所に却下された。2021年9月、同社は苦情、新事項、反訴に対する回答を提出した。同社の反訴によると、GeneOneは合意に違反し、契約違反と宣言的判決のクレームを出した。 反訴は損害賠償、利息、費用、弁護士費と費用を要求する。 この訴訟の裁判日はまだ確定されていない。
同社はGeneOneの反訴で提起されたクレームを積極的に起訴し、GeneOneの起訴状のクレームを有力に弁護しようとしている
その他の事項
当社は時々、訴訟を含めて、その正常な業務過程における経営に起因するクレームに関する紛争に関与する可能性がある。これらのクレームのいずれも、会社に高い法的費用を負担させる可能性があり、会社は、多くの異なるタイプの債務をカバーするのに十分な保険があると一般的に考えられているが、その保険会社は保証を拒否する可能性があり、またはその保険限度額は、いかなる損害賠償または和解を完全に満たすのに十分ではない可能性がある。もしこれが
このような状況が発生すれば、どのような賠償の支払いも、会社の総合経営業績や財務状況に重大な悪影響を及ぼす可能性がある。さらに、このようなクレームは、成功するか否かにかかわらず、会社の名声や業務を損なう可能性がある。上述した以外に、当社はいかなる法的手続きにも関与していないが、経営陣は個別または全体の不利な結果が当社の総合経営業績や財務状況に重大な悪影響を及ぼすと考えている。
12. 所得税
所得税会計基準によると、繰延税項資産又は負債は、財務諸表と資産及び負債の税ベースとの差額に基づいて決定され、この差額は制定された税率で計量され、これらの差額が返送されたときに発効する。既存の証拠に基づいて、繰延税金資産が現金化される可能性が高い場合を除いて、当社は繰延税金資産純額について評価支出を提供します。
営業税前損失の構成は以下のとおりである
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 | | 2021 |
| 中国はアメリカ国内の一員です | $ | (134,979,579) | | | $ | (277,440,803) | | | $ | (302,614,003) | |
| * | (137,772) | | | (211,249) | | | (610,320) | |
| 営業税前損失 | $ | (135,117,351) | | | $ | (277,652,052) | | | $ | (303,224,323) | |
あったことがある違います。2023年、2022年、2021年12月31日終了年度の所得税の支給または利益を受ける
2023年12月31日、2023年12月31日、2022年12月31日、2021年12月31日に21%の法定税率を採用し、法定税率で計算される持続可能な経営による所得税と所得税優遇の照合は以下の通りである
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 | | 2021 |
| 法定税率で所得税を納める | $ | (28,375,000) | | | $ | (58,307,000) | | | $ | (63,677,000) | |
| 州所得税、連邦福祉を差し引いた純額 | (3,922,000) | | | (3,601,000) | | | (3,447,000) | |
| | | | | |
| 評価免除額を変更する | 28,394,000 | | | 61,065,000 | | | 77,424,000 | |
| | | | | |
| 研究開発税収控除 | (2,139,000) | | | (7,534,000) | | | (16,523,000) | |
| | | | | |
| 株に基づく報酬 | 2,099,000 | | | 2,913,000 | | | 483,000 | |
| 不確定税収状況 | 861,000 | | | 2,291,000 | | | 6,509,000 | |
| 営業権の減価 | 1,962,000 | | | — | | | — | |
| 有効期限の NOL とクレジット | 1,352,000 | | | 1,459,000 | | | 616,000 | |
| 限定 NOL とクレジット | (997,000) | | | (1,337,000) | | | (542,000) | |
| 税率の変化 | 365,000 | | | (187,000) | | | — | |
| 海外税率の違い | (4,000) | | | (8,000) | | | (24,000) | |
| 他にも | 404,000 | | | 3,246,000 | | | (819,000) | |
| $ | — | | | $ | — | | | $ | — | |
2023 年 12 月 31 日および 2022 年 12 月 31 日時点における当社の繰延税金資産および負債の重要な構成要素は以下のとおりです。
| | | | | | | | | | | |
| 12月31日まで |
| 2023 | | 2022 |
| 繰延税金資産: | | | |
| 資本化研究費 | $ | 50,143,000 | | | $ | 41,252,000 | |
| 繰り越ししない | 235,624,000 | | | 212,768,000 | |
| 研究開発やその他の税金控除 | 27,734,000 | | | 26,442,000 | |
| 収入を繰り越す | 22,000 | | | 538,000 | |
| | | |
| 株に基づく報酬 | 3,683,000 | | | 3,945,000 | |
| 獲得性無形資産 | 907,000 | | | 559,000 | |
| | | |
| | | |
| 関連会社への投資 | 1,406,000 | | | 1,569,000 | |
| リース責任 | 2,822,000 | | | 3,247,000 | |
| 固定資産 | 337,000 | | | 57,000 | |
| 他にも | 6,808,000 | | | 11,062,000 | |
| 329,486,000 | | | 301,439,000 | |
| 推定免税額 | (327,493,000) | | | (299,124,000) | |
| 繰延税金資産総額 | 1,993,000 | | | 2,315,000 | |
| 繰延税金負債: | | | |
| 獲得性無形資産 | — | | | (199,000) | |
| | | |
| 使用権資産 | (1,993,000) | | | (2,148,000) | |
| | | |
| | | |
| | | |
| 繰延税金負債総額 | (1,993,000) | | | (2,347,000) | |
| 繰延税金純負債 | $ | — | | | $ | (32,000) | |
2023 年 12 月 31 日現在、当社は連邦税、カリフォルニア税、その他の州の税金繰越純営業損失を $1,013.3百万、$251.4百万ドルとドル102.6IRC セクション 382 の制限により失効する純営業損失を差し引いたものです2018 年以降に発生した連邦純営業損失の総額は $719.3100 万ドルは無期限に繰り越し将来の課税所得の最大 80% を毎年相殺することができます連邦の NOL 繰越しは 2023 年に失効し始め、カリフォルニア州と他の州の NOL 繰越しは、以前に利用されていない限り、それぞれ 2028 年と 2023 年に失効し始めます。
同社はまた、韓国の NOL キャリーフォワードを $持っていました。1.12023 年 12 月 31 日現在 100 万人韓国の NOL は、将来の課税所得の最大 60% を相殺することができ、以前に利用していない限り、 2035 年に失効し始めます。
さらに、 2023 年 12 月 31 日現在、当社は連邦および州の研究開発 ( R & D ) 税額控除の繰り越し額 $を有しています。41.6百万ドルとドル6.1それぞれ 100 万人です連邦税額控除のキャリーフォワードは 2029 年に失効し始めます。カリフォルニア州の研究税控除は失効しません。
法規によると、連邦と州の損失と信用は以下のように満期になると予想される(百万計)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 満期日: | 連邦NOL | | 国家NOL | | 外国NOL | | 連邦研究開発 | | 国家研究開発 |
| | | | | | | | | |
| | | | | | | | | |
| 2024 | $ | 18.9 | | | $ | 9.1 | | | $ | — | | | $ | — | | | $ | — | |
| 2025 | 13.7 | | | 5.2 | | | — | | | — | | | — | |
| 2026 | 12.2 | | | 7.1 | | | — | | | — | | | — | |
| 2027年とその後 | 249.2 | | | 332.0 | | | 1.1 | | | 41.6 | | | — | |
| 不定である | 719.3 | | | 0.6 | | | — | | | — | | | 6.1 | |
| $ | 1,013.3 | | | $ | 354.0 | | | $ | 1.1 | | | $ | 41.6 | | | $ | 6.1 | |
米国国税法(IRC)第382条及び383条によると、所有権が3年以内に累計変更されて50%を超える場合、会社NOL及び研究開発信用繰越の年間使用が制限される可能性がある。当社は2023年12月31日までのNOLと研究開発信用繰越制限に関するIRC第382/383節の分析を完了した。分析結果によると、当社は約#ドルと見積もられています7.3NOLおよび研究開発繰越に関連する数百万の税金優遇が未使用で満期になる。そのため、関連するNOLと研究開発信用の繰越はすでに繰延税金資産から除去され、推定値の相応の減少に伴う
小遣い。推定免税額の存在により、米国における会社の業務に関する現在と将来の所有権変更(ある場合)による制限は、実際の税率に影響を与えない。任意の追加的な所有権変更は、NOLの使用と研究開発繰越の能力をさらに制限する可能性がある。
2017年の減税·雇用法案は、米国の株主にある外国子会社が稼いだ世界無形低税収入(GILTI)に課税することを求めている。FASBスタッフの質疑応答、主題740、第5号、世界無形低税収入会計は、一時的な差額の繰延税金項目を確認するために会計政策を選択することができることを指摘し、今後数年以内にGILTIとして販売されるか、または期間費用として発生した当時のGILTIに関連する税金支出のみに準備することができることを指摘している。当社はGILTIに関する税金支出を期間支出のみとして抽出することを選択しました。2023年、2022年、2021年には、その外国子会社の損失により、同社は何のGILTIも発生していない。
以下の表は、会社が確認していない税収割引に関する活動をまとめています
| | | | | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| | 2023 | | 2022 | | 2021 |
| 年初残高 | $ | 21,139,000 | | | $ | 18,819,000 | | | $ | 12,210,000 | |
| 今年度の税収状況に関する増加 | 1,816,000 | | | 2,902,000 | | | 6,602,000 | |
| 前年度の納税状況に関する増加(減少) | (841,000) | | | (582,000) | | | 7,000 | |
| | | | | |
| 年末の残額 | $ | 22,114,000 | | | $ | 21,139,000 | | | $ | 18,819,000 | |
確認·実現すれば、実際の税率に影響を与える未確認税収割引額は#ドルとなる20.5百万、$19.7百万ドルとドル17.42023年12月31日まで、2022年12月31日、2021年12月31日まで、それぞれ100万ユーロであり、推定手当の制限を受けている。当社は未確認税額割引を計上した後も純営業損失を継続しているため、当社では税項頭寸について利息や罰金は一切記録されていません。当社は未確認の税収割引総額が報告日後12ヶ月以内に大幅に増加または減少することはないと予想しています。
同社とその子会社は米国連邦所得税及び複数の州と外国司法管轄区の所得税を納めなければならない。ごく少数の例外を除いて、当社は2020年までに米国連邦所得税審査を受けなくなり、2019年までは州や地方所得税審査を受けなくなった。しかし,法律で許可されている範囲では,税務機関は以前に発生·決算営業損失が発生した期間を検査し,NOL繰越額に応じて調整する権利がある。それによると、同社は現在、米国国税局(IRS)、州、地方、または外国の税務審査を受けていない。
13. 401(K)計画
同社は401(K)利益共有計画を採択し、ほぼすべての従業員をカバーした。固定支払計画は従業員が毎年一定の割合の給与を支払うことを可能にする。その会社は現在50従業員の支払いの割合は最大で6彼らの年収の%です。会社の入金は添付されている総合業務報告書に費用として入金され、総額は#ドルです1.4百万、$1.8百万ドルとドル1.52023年、2022年、2021年12月31日までの年度はそれぞれ100万ドル。
14. 関係者取引
Plebline生命科学社は
T彼の会社は597,8082023年12月31日現在のPLS普通株式と20221つの方法を表しています17.8%和18.7%の所有権です。1つは会社役員の一人David·B·ウェナー博士がPLSの顧問を務めている。
PLSから確認された収入にはマイルストーン費用,許可費,特許料が含まれている。当社は2023年,2023年,2022年および2021年12月31日までにPLSからの収入を確認した0, $34,000そして$245,000それぞれ。2023 年 12 月 31 日および 2022 年 12 月 31 日時点で、当社は売掛金残高 $でした。0そして$59,000それぞれ、 PLS に関連しています。
ウィスター · インスティチュート
同社の取締役である David B 。ウィーナーは、ウィスター研究所のワクチンセンター ( 「ウィスター」 ) の所長である。Weiner 博士は、 Wistar のエグゼクティブバイスプレジデントでもあります。
2016 年 3 月、同社は協同組合に入りました。 ウィスターとの予防および治療用 DNA ベースの免疫療法の応用およびウィナー博士とウィスターががんや感染症の治療のために開発した製品に関する研究契約。契約の条件に基づき、当社は Wistar に発生したすべての直接および間接費用を補償しました。
共同研究の実施において $を超えないように3.1百万ドル5年制契約の条件です 2016 年 3 月の契約満了に伴い、 2021 年 3 月にはウィスターと同じ条件で新たな共同研究契約を締結しました。 当社は、本契約に基づいて開発された新しい知的財産をインライセンスする独占的権利を有します。
2020 年には、同社は $を受け取った。10.7 Wistar を通じて 100 万ドルの補助金を提供し、 2021 年に修正されました。 $13.6300万ドルですCOVID—19 対策としての dMAb の前臨床開発および翻訳研究のための資金調達 ( 2024 年 8 月まで延長 ).サブグラントには、追加の $のオプションも含まれます。1.6 2025 年 9 月までに 100 万ドル
2022年12月に同社はドルを受け取りました1.22023年11月までにWistarを介して100万円のプレゼントを提供し、追加提供$を選択することができます5.42027年11月までに、資金は1億2千万ドルに達するだろう。同社はWistar牽引財団が合成DNA放出ナノ粒子(DLNPs)を研究·開発し,HIV感染予防のためのワクチンの開発を支援する。
Wistarから逆研究·開発費として確認され記録された繰延贈与資金は、会社が研究下請け協議で行った仕事と関係がある。当社は2023年、2023年及び2022年12月31日まで年度を収録しています1.0百万ドルとドル8.7Wistarの逆の研究開発費として100万ドルです
Wistar記録からの研究と開発費用は,主にゲイツやCEPIに関する協力研究プロトコルと下請けプロトコルに用いられている(付記4参照)。Wistarの2023年,2023年,2022年,2021年12月31日までの年間記録の研究開発費は1.8百万、$1.4百万ドルとドル2.92億5千万ドルと2億5千万ドルです2023年、2023年、2022年12月31日現在、会社の売掛金残高は#ドルです2.4百万ドルとドル9.9売掛金と売掛金残高は#ドルである1.1百万ドルとドル1.2それぞれ100万人がWistarと関連している。会社の前払い費用残高は2023年12月31日、2023年12月31日、2022年12月31日まで20,000そして$375,000$と記録しています22,000そして$88,000それぞれWistarに関する連結貸借対照表上の繰延贈与資金とする。
15. Geneos治療会社は
同社は2016年、新抗原に基づく個人化癌療法を開発し、商業化するGeneosを設立した。Geneosは可変利益エンティティ(VIE)とされており、会社はそのエンティティの主要な受益者である。同社の首席科学官Laurent Humeau博士はGeneosの取締役会メンバーである。同社の取締役CEO David·B·ウェナー博士はギニオス科学諮問委員会の議長である。
2020年6月までの一連の融資取引の後、当社は普通株に転換した基準で計算すると、Geneosが発行した株の大部分に満たず、当社が持株権を保有しなくなったため、VIE再考を引き起こした。会社の評価によると、Geneosは依然としてVIEであり、十分なベンチャーキャピタルがないため、追加の付属財務支援なしにその活動に資金を提供する。しかし、同社はGeneosの経済パフォーマンスに最も影響を与える活動を指導する権限がないため、Geneosの主な受益者ではない。そこで、当社は2020年にGeneosへの投資を解除しました
合併解除後、同社はGeneosの普通株投資に対して会計処理を行ったが、この点で、会社は支配権に欠けているが、株式方法を用いて運営や財務政策に大きな影響を与える能力があることは確かである。一般に,投資家が被投資会社の20%を超える投票権権益を持っている場合には,大きな影響を与える能力があると推定される.重大な影響を行使する能力が制限されていることを示す具体的な事実や状況により,この推定は覆される可能性がある.会社の権益法投資は、報告期間ごとに減値指標に基づいて審査され、非一時的な価値損失を示す証拠があれば、公正価値に減記されます。会社投資の帳簿価値とGeneos純資産中の関連権益とのいかなる差額も、それに応じて収入または支出に償却されます。償却の解除が必要な合併日まで、確定的な基準差はありません。
合併解除後、当社は公正価値に基づいてその投資を記録します。当社はGeneosの投資に容易に公正な価値がないと判断したため、ASC 321の計量代替案を選択し、コストから任意の減値と、同一発行者の同じまたは類似の投資が秩序取引に見られる価格変動による正負の変動によって投資を記録した。公正価値が可視化されるようになった場合、当社の投資は秩序取引に見られる価格変動に基づいて公正価値を計上する。合併日を解除して以来、価格変動や減値は見られない
2021年3月31日までの3ヶ月間のGeneos純損失における会社のシェアは$1.51000万ドルですが1ドルしかありません434,000Geneosへの会社の総投資を#ドルに減らしたことを記録しています0それは.総金額のうち、$819,000権益法投資に割り当てられ、残高は#ドルに減少した02021年3月31日まで。残りの$4.2会社はGeneosのAシリーズとA-1シリーズ優先株投資で授業税額に応じて100万ドルの損失を割り当て、残高を#ドルに減少させた02021年3月31日まで。
2021年2月、GeneosはA-1シリーズの優先株融資の2回目の終了を完了し、同社は参加しなかった今回の取引後、当社は約を持っています35発行済み株式の%は、普通株式に変換した上で。
2022年3月、GeneosはA-2シリーズの優先株融資の終了を完了した。その会社は$を投資した2.0A-2シリーズの優先株融資では、外部投資家が先頭に立つ。この取引の完了日はVIE再議イベントとして決定された;会社の評価によると、Geneosは、追加の付属財務サポートなしにその活動に資金を提供するのに十分なリスク株がないため、VIEであり続ける。当社は依然としてGeneosの主要な受益者ではなく、Geneosの経済表現に最も影響を与える活動を指導する権限がないため、Geneosを合併すべきではない。今回の取引後、当社は約を持っています28発行済み株式の%は、普通株式に変換した上で。そこで、同社は引き続きGeneosの普通株投資をASC 323項下の権益方法投資とその優先株投資としてASC 321項の権益証券として会計処理を行っている。
GeneosのA-2シリーズ優先株の公正価値は第三者投資家が支払った1株当たり価格に基づいている。当社の結論は,そのA-2シリーズ優先株投資はそのA-1シリーズ優先株と類似した金融商品であるため,A-2シリーズ優先株価格でA-1シリーズ優先株投資の帳簿価値を再計測し,収益#ドルを再計量することになった165,000.
同社はGeneos純損失における現在と累積シェアを#ドルと記録している2.21000万ドル、GeneosのシリーズA-1とシリーズA-2への優先株投資に割り当てられ、残高を#ドルに減少させます02022年3月31日まで。
2022年3月31日以降、当社はGeneosにさらなる投資を行っていません。その会社はその投資を$以下に減少させない0また,Geneosのさらなる純損失におけるシェアは記録されないが,当社にはGeneosに資金を提供する義務がないからである.
2023年、GeneosはA-3シリーズの優先株融資の終了を完了し、会社は参加しなかった。今回の取引後、当社は約を持っています23普通株に変換した上で、Geneosが発行した株の割合を占める
同社はSynConを独占的に許可し続けている® 免疫治療と細胞免疫®Geneosの技術プラットフォームは個性化された新しい抗原に基づく癌治療領域に使用される。ライセンス契約は、Geneosがライセンス技術を使用した任意の製品を商業化すれば、会社に特許使用料を支払う可能性があると規定している。その会社はGeneosの未来の運営に資金を提供するためにそのいかなる資産も使用する義務がない。
16. 後続事件
2024年1月24日、当社は、付記2に記載の12株1株の逆分割を実施した。本報告に含まれるすべての株式情報は、添付されている連結財務諸表と脚注を含めて、逆分割の影響を反映するように遡及調整されている。
2024年1月1日から本財務諸表の日まで、当社で販売しております543,6202021年販売契約項の普通株、純収益は#ドル5.21000万ドルです。この取引の加重平均価格は1ドルです9.76一株ずつです。
2024年3月1日、会社の転換可能優先手形が満期になり、会社は$を支払いました16.9100万ユーロの借金を全額返済する。