目次
米国
証券取引委員会
ワシントンD.C. 20549
フォーム
| (マークワン) | ||
| | ||
| 1934年の証券取引法の |
四半期終了時について
または
| 1934年の証券取引法の | ||
|
___________から___________への移行期間について |
コミッションファイル番号:
キャッサバ・サイエンス株式会社
(憲章に明記されている登録者の正確な名前)
| | | ||
| (州) または その他の 管轄 の | (I.R.S. 雇用主 | ||
| 法人化 または 組織) | 身分証明書 番号) |
(
(登録者の住所(郵便番号を含む)'の主要執行機関と
電話番号、市外局番を含む)
同法第12条 (b) に従って登録された証券:
| 各クラスのタイトル | 取引 シンボル (複数可) | 登録された各取引所の名前 | ||
| | | | ||
登録者が (1) 1934年の証券取引法第13条または第15条 (d) 条により提出が義務付けられているすべての報告書を過去12か月間(または登録者がそのような報告を提出する必要があったほど短い期間)に提出したかどうか、および(2)過去90日間にそのような申告要件の対象であったかどうかをチェックマークで示してください。
登録者が過去 12 か月間(または、登録者がそのようなファイルの提出を求められたほど短い期間)に、規則 S-T の規則 405(本章の §232.405)に従って提出する必要のあるすべてのインタラクティブデータファイルを電子的に提出したかどうかをチェックマークで示してください。
登録者が大規模な加速申告者、加速申告者、非加速申告者、小規模な報告会社、または新興成長企業のいずれであるかをチェックマークで示してください。取引法規則12b-2の「大規模加速申告者」、「加速申告者」、「小規模報告会社」、および「新興成長企業」の定義を参照してください。
| | アクセラレーテッド・ファイラー ☐ | |
| ノンアクセラレーテッドファイラー ☐ | 小規模な報告会社 | |
| 新興成長企業 |
新興成長企業の場合は、登録者が取引法第13条 (a) に従って規定された新規または改訂された財務会計基準を遵守するために延長された移行期間を使用しないことを選択したかどうかをチェックマークで示してください。☐
登録者がシェル会社(取引法の規則12b-2で定義されている)であるかどうかをチェックマークで示してください。はい
発行可能な最新の日付現在の、発行者の各クラスの普通株式の発行済み株式数を記載してください。
| 普通株式、額面0.001ドル | | ||
| 2024年5月8日現在の発行済株式 |
キャッサバ・サイエンス株式会社
目次
| ページ番号 |
||
| 第一部。 |
財務情報 |
|
| アイテム 1. |
財務諸表 |
|
| 要約された連結貸借対照表 — 2024年3月31日と2023年12月31日 |
3 |
|
| 要約された連結営業報告書 — 2024年および2023年3月31日に終了した3か月間 |
4 |
|
| 株主資本の変動に関する要約連結計算書-2024年および2023年3月31日に終了した3か月間 |
5 |
|
| 要約連結キャッシュフロー計算書 — 2024年および2023年3月31日に終了した3か月間 |
6 |
|
| 要約連結財務諸表の注記 |
7 |
|
| アイテム 2. |
経営陣による財政状態と経営成績に関する議論と分析 |
20 |
| アイテム 3. |
市場リスクに関する定量的・質的開示 |
42 |
| アイテム 4. |
統制と手続き |
43 |
| 第二部 |
その他の情報 |
|
| アイテム 1. |
法的手続き |
43 |
| アイテム 1A |
リスク要因 |
43 |
| アイテム 2. |
持分証券の未登録売却および収益の使用 |
43 |
| アイテム 3. |
シニア証券のデフォルト |
43 |
| アイテム 4. |
鉱山の安全に関する開示 |
43 |
| アイテム 5. |
その他の情報 |
43 |
| アイテム 6. |
展示品 |
44 |
| 署名 |
45 |
|
第I部。財務情報
アイテム 1. 財務諸表
キャッサバ・サイエンス株式会社
要約連結貸借対照表
(未監査、千単位、株式と額面金額のデータを除く)
| 2024年3月31日 | 2023年12月31日 | |||||
| 資産 | ||||||
| 流動資産: | ||||||
| 現金および現金同等物 | $ | $ | ||||
| 前払費用およびその他の流動資産 | ||||||
| 流動資産合計 | ||||||
| 資産および設備、純額 | ||||||
| 無形資産、純額 | ||||||
| 総資産 | $ | $ | ||||
| 負債と株主資本 | ||||||
| 現在の負債: | ||||||
| 買掛金と未払費用 | $ | $ | ||||
| 未払いの開発費 | ||||||
| 未払報酬と福利厚生 | ||||||
| 保証責任 | ||||||
| その他の流動負債 | ||||||
| 流動負債合計 | ||||||
| コミットメントと不測の事態(注記9、10、11) | ||||||
| 株主資本: | ||||||
| 優先株式、額面0.001ドル、承認済株式10,000株、発行済株式なし | ||||||
| 普通株式、額面0.001ドル、承認済株式120,000株、2024年3月31日と2023年12月31日にそれぞれ発行済み株式43,248,416株と42,236,919株です | ||||||
| 追加払込資本 | ||||||
| 累積赤字 | ( | ) | ( | ) | ||
| 株主資本の総額 | ||||||
| 負債総額と株主資本 | $ | $ | ||||
要約連結財務諸表の添付注記を参照してください。
キャッサバ・サイエンス株式会社
要約連結営業明細書
(未監査、千単位、一株あたりのデータを除く)
| 3 か月が終わりました |
||||||||
| 3 月 31 日 |
||||||||
| 2024 |
2023 |
|||||||
| 営業経費: |
||||||||
| 研究開発 |
$ | $ | ||||||
| 一般と管理 |
||||||||
| 営業費用の合計 |
||||||||
| 営業損失 |
( |
) | ( |
) | ||||
| 利息収入 |
||||||||
| その他の収益、純額 |
||||||||
| ワラント負債の公正価値の変動による利益 |
||||||||
| 当期純利益 (損失) |
$ | $ | ( |
) | ||||
| 1株当たりの純利益(損失)の計算に使用される株式、基本 |
||||||||
| 1株当たり純利益(損失)、基本利益 |
$ | $ | ( |
) | ||||
| 分子、希釈: |
||||||||
| 当期純利益 (損失) |
$ | $ | ( |
) | ||||
| ワラント負債の公正価値の変動の調整 |
( |
) | ||||||
| 調整済み分子、希釈 |
$ | ( |
) | $ | ( |
) | ||
| 希薄化後の1株当たり純損失の計算に使用される株式 |
||||||||
| 希薄化後の1株当たり純損失 |
$ | ( |
) | $ | ( |
) | ||
要約連結財務諸表の添付注記を参照してください。
キャッサバ・サイエンス株式会社
要約連結株主資本計算書
(未監査、千単位、株式データを除く)
| 合計 |
||||||||||||||||||||
| 普通株式 |
[追加] |
累積 |
株主の |
|||||||||||||||||
| 株式 |
額面価格 |
払込資本金 |
赤字 |
公平 |
||||||||||||||||
| 2022年12月31日現在の残高 |
$ | $ | $ | ( |
) | $ | ||||||||||||||
| 株式ベースの報酬: |
||||||||||||||||||||
| 従業員向けストックオプション |
— | |||||||||||||||||||
| 非従業員向けのストックオプション |
— | |||||||||||||||||||
| ストックオプションの行使に基づく普通株式の発行 |
||||||||||||||||||||
| 純損失 |
— | ( |
) | ( |
) | |||||||||||||||
| 2023年3月31日現在の残高 |
$ | $ | $ | ( |
) | $ | ||||||||||||||
| 2023年12月31日現在の残高 |
$ | $ | $ | ( |
) | $ | ||||||||||||||
| 株式ベースの報酬: |
||||||||||||||||||||
| 従業員向けストックオプション |
— | |||||||||||||||||||
| 非従業員向けのストックオプション |
— | |||||||||||||||||||
| ワラントの発行 |
— | ( |
) | ( |
) | |||||||||||||||
| 新株予約権の行使に基づく普通株式の発行 |
||||||||||||||||||||
| ワラント行使時のワラント責任の認識解除 |
— | |||||||||||||||||||
| 純利益 |
— | |||||||||||||||||||
| 2024年3月31日現在の残高 |
$ | $ | $ | ( |
) | $ | ||||||||||||||
要約連結財務諸表の添付注記を参照してください。
キャッサバ・サイエンス株式会社
要約連結キャッシュフロー計算書
(未監査、千単位)
| 3月31日に終了した3か月間 | ||||||||
| 2024 | 2023 | |||||||
| 営業活動によるキャッシュフロー: | ||||||||
| 当期純利益 (損失) | $ | $ | ( | ) | ||||
| 純損失を営業活動に使用された純現金と調整するための調整: | ||||||||
| 株式ベースの報酬 | ||||||||
| ワラント負債の公正価値の変動による利益 | ( | ) | ||||||
| 減価償却 | ||||||||
| 無形資産の償却 | ||||||||
| 営業資産および負債の変動: | ||||||||
| プリペイドおよびその他の流動資産 | ( | ) | ||||||
| オペレーティングリースの使用権資産および負債 | ( | ) | ||||||
| 買掛金と未払費用 | ( | ) | ||||||
| 未払いの開発費 | ( | ) | ||||||
| 未払報酬と福利厚生 | ||||||||
| その他の負債 | ( | ) | ( | ) | ||||
| 営業活動に使用された純現金 | ( | ) | ( | ) | ||||
| 投資活動によるキャッシュフロー: | ||||||||
| 資産および設備の購入 | ( | ) | ||||||
| 投資活動に使用された純現金 | ( | ) | ||||||
| 財務活動によるキャッシュフロー: | ||||||||
| 普通新株予約権の行使による収入、行使費用を差し引いたもの | ||||||||
| ストックオプションの行使による普通株式の発行による収入 | ||||||||
| 財務活動による純現金 | ||||||||
| 現金および現金同等物の純増額(減少) | ( | ) | ||||||
| 現金および現金同等物の期首残高 | ||||||||
| 現金および現金同等物の期末残高 | $ | $ | ||||||
| 補足キャッシュフロー情報: | ||||||||
| 現金以外の資金調達活動 | ||||||||
| ワラント債務の承認につながるワラントの発行 | ||||||||
| ワラント行使時のワラント責任の認識解除 | ( | ) | ||||||
要約連結財務諸表の添付注記を参照してください。
キャッサバ・サイエンス株式会社
要約連結財務諸表の注記
(未監査)
注記 1. 一般と流動性
キャッサバ・サイエンシズ社とその完全子会社(総称して「当社」といいます)は、次のような独自の医薬品候補を発見して開発しています。 かもしれない 患者と医療従事者に大幅な改善をもたらします。同社は通常、神経系の障害に発見と製品開発の取り組みを集中させています。
添付の当社の未監査要約連結財務諸表は、中間財務情報として米国で一般に認められている会計原則(「GAAP」)に従い、またフォームに関する四半期報告書の指示に従って作成されています 10-Qと記事 10 の規制 S-X。 連結により、会社間取引と残高はすべて削除されました。したがって、要約連結財務諸表は じゃない GAAPが完全な連結財務諸表に必要なすべての情報と脚注を含めてください。会社の経営陣の意見では、公正なプレゼンテーションのために必要と考えられる、通常の定期的な調整を含むすべての調整が含まれています。の経営実績 三 月が終わりました 2024年3月31日です です じゃない 必ずその結果を示します かもしれない 他の中間期間または今年中に予想されます 2024。 詳細については、当社の年次報告書に記載されている連結財務諸表とその脚注を参照してください10終了した年度は-K 2023年12月31日です。
流動性
会社は創業以来、多額の純損失とマイナスのキャッシュフローを被っており、その結果、累積赤字はドルになりました
注記 2.重要な会計方針
見積もりの使用
当社は、GAAPに準拠した要約連結財務諸表を作成する際に、見積もりと仮定を行います。これらの見積もりと仮定は、要約連結財務諸表の日付における報告された資産と負債の金額と偶発資産と負債の開示、および報告期間中に報告された収益と発生した費用の金額に影響します。当社は、普通株式ワラント負債、臨床試験、製造契約に関連する見積もりを含め、継続的に見積もりを評価しています。実際の結果は、これらの見積もりや仮定とは異なる可能性があります。
現金および現金同等物と信用リスクの集中
同社は現金および現金同等物に投資しています。当社は、当初の満期の、流動性の高い金融商品を検討しています 三 現金同等物であれば月以内。現金同等物と見なされる流動性の高い投資には、マネーマーケット口座とファンド、預金証書、米国財務省証券が含まれます。当社は、現金および現金同等物を以下の方法で管理しています 一 金融機関。
公正価値測定
当社は、金融資産と負債の公正価値の測定と開示に関する権威あるガイダンスに従って金融商品を認識しています。このガイダンスは、公正価値を定義し、GAAPに従って公正価値を測定するための枠組みを確立し、公正価値測定に関する開示を拡大します。このガイダンスでは、次のことも定めています 三-公正価値の測定に使用されるインプットを優先する段階的な公正価値階層。これらの層には以下が含まれます:
| ● | レベル 1 活発な市場での相場価格を含みます。 |
| ● | レベル 2 同一または類似の証券の相場価格など、観察可能な重要なインプットや、類似証券の観察可能な市場データによって裏付けられる観察可能なその他のインプットを含みます。同社は、市場価格やその他の観察可能な市場インプットを使用しています 三番-パーティプロバイダー。入札価格を使って公正価値を確定します。落札価格が表示されます。会社はしています じゃない 公正価値がレベルに基づいて決まる金融商品はありますか 2 入力。 |
| ● | レベル 3 ほとんどサポートされていない観察不可能な入力を含みます いいえ 市場活動。会社はしています じゃない 公正価値がレベルに基づいて決まる金融商品はありますか 3 入力。 |
金融商品が階層のさまざまなレベルにあるインプットを使用する場合、その商品は公正価値計算にとって重要なインプットの最下位レベルに基づいて分類されます。現金および現金同等物の公正価値は、レベルに基づいていました 1 での入力 2024年3月31日です そして 2023年12月31日です。普通新株予約権の公正価値はレベルに基づいていました 1 での入力 2024年3月31日です ワラントは公開市場で活発に取引されていたからです。公正価値は、以下のワラントのナスダック終値を使用して決定されました 2024年3月29日、 その前の最後の取引日 2024年3月31日です。
普通新株予約権の公正価値は、分配時に決定されました 2024年1月3日 ワラントがモンテカルロだったので、モンテカルロの評価モデルを使用していますじゃない 公開市場で取引されました 2024年1月3日。 レベルに関する定量的情報 3 普通株式新株予約権の公正価値の測定値は次のとおりです。
| ワラント1件あたりの行使価格 | $ | |||
| 転換率-ワラントあたりの普通株式 | ||||
| 普通株式の終値 | $ | |||
| ボラティリティ | % | |||
| リスクフリー金利 | % | |||
| オプションの期待寿命(年単位) | ||||
| 配当利回り | ゼロ | |||
ビジネスセグメント
会社は、事業部門またはセグメントの業績を社内でどのように評価しているかに基づいてセグメント情報を報告します。会社の事業は次のものに限定されています
株式報酬制度
当社は、すべてのストックオプションおよびその他の株式ベースの報奨の公正価値として、現金以外の費用を計上しています。当社は、ブラック・ショールズオプション評価モデルを使用して、単一オプション報奨アプローチと定額帰属法を用いて、ストックオプションの公正価値を計算しています。このモデルでは、各特典の予想株価の変動性、予想耐用年数、推定没収額など、主観的な仮定を入力する必要があります。これらの仮定は、本質的に不確実な将来の市況の見積もりで構成されているため、経営陣の判断に委ねられます。付与されたすべてのオプションについて、結果として生じる公正価値は、それぞれのストックオプションの権利確定期間(通常は4年間)にわたる定額ベースの費用として認識されます。
当社は、特定の業績基準の達成に基づいて付与される株式ベースの報酬(「業績賞」)を授与しています。当社は、パフォーマンス・アワードの数に、付与日の普通株式の公正価値を掛けて、各アワードの公正価値を計算します。各アワードのパフォーマンス基準を達成するための暗黙のサービス期間を推定しています。当社は、業績基準を達成する可能性が高いと結論付けた時点で、結果として生じる公正価値を暗黙のサービス期間における費用として認識します。暗黙のサービス期間の見積もりや業績基準の達成に関する結論を定期的に見直し、必要に応じて更新しています。業績賞の権利と普通株式は、業績基準の達成時に発行されます。
1株当たりの純利益(損失)
普通株式1株あたりの基本純利益(損失)は、普通株主が利用できる純利益(損失)を、その期間中に発行された普通株式の加重平均数で割って計算されます。普通株式1株あたりの希薄化後の純利益(損失)は、普通株主が利用できる純利益(損失)を、自己株式法を使用して、その期間中に発行された普通株式と希薄化する可能性のある有価証券の加重平均数で割って計算されます。希薄化の可能性のある有価証券は、希薄化防止効果が見込まれる場合、希薄化後の1株当たり利益の計算から除外されます。純損失により、希薄化の可能性のあるすべての有価証券は希薄化防止になります。希薄化する可能性のある普通株式には、発行済みの普通ストックオプション、新株予約権、業績報奨が含まれます。あります いいえ 会社の純利益(損失)と包括純利益(損失)の差。基本および希薄化後の1株当たり純損失の計算における分子と分母は次のとおりです(1株当たり純損失のデータを除く千単位)。
| 3 か月が終わりました | ||||||||
| 3 月 31 日 | ||||||||
| 2024 | 2023 | |||||||
| 分子、基本: | ||||||||
| 当期純利益 (損失) | $ | $ | ( | ) | ||||
| 分母、基本: | ||||||||
| 加重平均発行済普通株式 | ||||||||
| 1株当たり純利益(損失)、基本利益 | $ | $ | ( | ) | ||||
| 分子、希釈: | ||||||||
| 当期純利益 (損失) | $ | $ | ( | ) | ||||
| ワラント負債の公正価値の変動の調整 | ( | ) | ||||||
| 調整済み分子、希釈 | $ | ( | ) | $ | ( | ) | ||
| 分母、希釈: | ||||||||
| 加重平均発行済普通株式 | ||||||||
| 普通新株予約権の希薄化効果 | ||||||||
| 加重平均希薄化普通株式 | ||||||||
| 希薄化後の1株当たり純損失 | $ | ( | ) | $ | ( | ) | ||
| 1株当たりの純損失から除外された希薄化型普通株式オプション、希薄化後 | ||||||||
| 希薄化後の1株当たり純損失から除外された、希薄化後の業績報酬 | ||||||||
当社は、終了した期間に発行された普通株式オプションと業績報奨を除外しました 2024年3月31日です そして 2023 希薄化後の1株当たり純損失の計算から。未払いのオプションと業績報奨を含めると、希薄化防止効果があったからです。終了した期間の希薄化後の1株当たり純損失の計算には、新株予約権が含まれていました 2024年3月31日です 各令状が1人に対して行使可能であると仮定すると 一-普通株式の半分。
保証責任
当社は、ワラントの特定の条件を評価し、財務会計基準審議会(「FASB」)の会計基準体系化(「ASC」)に従って、ワラントを株式分類または負債分類の商品として計上しています。 480, 「負債と株式の区別」(「ASC 480」)、そしてASC 815、 「デリバティブとヘッジング」(「ASC 815」)。査定では、ワラントがASCに基づく独立型金融商品であるかどうかを検討します 480, ASCに基づく責任の定義を満たしています 480, そして、ワラントがASCに基づく株式分類の要件をすべて満たしているかどうか 815、 新株予約権が自社株に連動しているかどうか、その他の株式分類の条件を含みます。この査定には専門家の判断が必要で、ワラントの発行時と、ワラントが未処理である間のその後の各四半期期間の終了日に行われます。
株式分類の基準をすべて満たす発行または修正されたワラントについては、発行時に追加払込資本の一部としてワラントを記録する必要があります。次のような内容の発行または変更されたワラントについては じゃない 株式分類の基準をすべて満たしているため、新株予約権は発行日の初期公正価額と、発行後の各貸借対照表日付で記録する必要があります。責任分類ワラントの推定公正価値の変動は、営業報告書では現金以外の利益または損失として認識されます。デリバティブ負債に分類されるワラントの発行に関連する費用は、ワラントが発行されたときに事業に請求されます。
金融商品の公正価値
金融商品には、買掛金、未払費用、未払開発費、その他の負債が含まれます。特定の金融商品の推定公正価値 かもしれない 入手可能な市場情報やその他の適切な評価方法を使用して決定されます。ただし、公正価値の見積もりを作成するために市場データを解釈する際には、かなりの判断が必要です。したがって、見積もりは じゃない 必ず現在の市場取引所で実現可能な、または支払われる予定の金額を示します。さまざまな市場仮定や見積もり方法を使用した場合の影響 かもしれない 推定公正価値額にとって重要です。買掛金、未払費用、未払開発費、およびその他の負債の帳簿価額は原価であり、これらの商品の満期が短いため、公正価値に近い金額です。
研究契約、前払金、見越金
同社は、研究機関などとさまざまな研究開発契約を締結しています 三番-パーティーベンダー。これらの契約は通常キャンセル可能です。関連する支払いは、発生した研究開発費として計上されます。会社は、継続的な研究費の見積もりについて、前払い金と見越額を記録しています。前払い費用と未払負債の妥当性を評価する際、会社は、イベントの段階や完了、受け取った請求書、契約費用など、調査の進捗状況を分析します。報告期間の終了時に、前払い残高と未払残高を決定する際には、重要な判断と見積もりが下されます。実際の結果は、会社の見積もりとは異なる可能性があります。当社の過去の前払金および発生額の見積もりは じゃない 実際の費用とは大きく異なりました。
インセンティブボーナスプラン
に 2020年、 会社は設立しました 2020 プラン参加者にインセンティブを与える現金インセンティブボーナスプラン(「プラン」)。本プランに基づく報奨は、ASCでは賠償責任報奨として計上されます718 」株式報酬制度」。各プランアワードの公正価値は、付与日が来ると決定され、報告期間ごとに再評価されます。プランに関連する報酬費用は、パフォーマンス条件(以下に定義)が満たされる可能性が高いと判断されたときに、各プランアワードの予想達成期間にわたって計上されます。メモを参照してください 10 プランについてさらに話し合うために。
リース
当社は、リースから生じる資産と負債を認識しています。オペレーティングリースの場合、当社は、当初はリース期間中のリース支払いの現在価値で測定された使用権資産とリース負債を、要約連結貸借対照表に計上する必要があります。当社は、対象となるすべてのリースについて、短期リース承認免除を選択しました。つまり、対象となるリースについて、会社は じゃない 使用権資産またはリース負債を認識します。会社のリースと同じように じゃない 暗黙の利率を指定し、リース料の現在価値を決定する際に、開始日に入手可能な情報に基づいた段階的な借入金利を使用します。リース料の支払いにかかるリース費用は、リース期間を通じて定額計上されます。
資産と設備
資産と設備は、減価償却累計額を差し引いた原価で計上されます。減価償却費は、資産の推定耐用年数にわたって定額法で記録されます。所有建物および関連する改良施設の推定耐用年数は
事象や状況の変化により資産の帳簿価額が明らかになった場合、資産と設備は減損されていないか審査されます かもしれない じゃない 回復可能です。財産や設備が損なわれていると見なされた場合、減損損失が計上されます。
無形資産
取得した無形資産は、取得日に公正価値で計上され、主にリースインプレース契約とリース手数料で構成されます。無形資産は、リースインプレース契約の推定有効期間、つまり約
無形資産の減損は、毎年、またその価値が減少または減損したと信じるに足る理由がある場合に見直されます。無形資産が減損していると見なされると、減損損失が計上されます。
保険の回収
損失が発生した場合、保険契約からの収益を記録します。収益は見積もることができ、回収される見込みがあります。保険料の回収額と受け取った収益は、一般管理費の控除として計上されます。およそ $がありました
所得税
会社は資産負債法で所得税を計上しています。繰延税金資産および負債は、財務諸表の既存の資産および負債の帳簿価額とそれぞれの課税基準との差異に起因する将来の推定税務上の影響として計上されます。繰延税金残高は、現在制定されている税法に基づいて税率を反映するように調整されます。この税法は、一時的な差異が逆転すると予想される年に有効になります。当社は、純営業損失と税額控除の繰越による税務上の影響、および財務報告上の資産負債の帳簿価額と所得税目的で使用される金額の一時的な差異を反映して、多額の繰延税金資産を蓄積しています。特定の繰延税金資産の実現は、将来の収益に左右されます。当社は、将来の収益の時期と金額について確信が持てません。したがって、当社はこれらの繰延税金資産を評価引当金で相殺します。
当社は、ASCに従って不確実な税務上のポジションを考慮しています 740、 「所得税」は、税務上の不確実性の会計処理を明確にします。これらの規定では、会社の要約連結財務諸表における税務上の地位の影響を認識することが義務付けられています。その可能性が次の場合に限ります。 じゃない 役職の技術的メリットに基づいて、税務当局による審査を受けても支給されません。不確実な税務状況に関連する利息や罰金は、所得税費用の一部として反映されます。
最近発行された会計上の宣言
に 2023年11月、 FASBが発行した会計基準更新、またはASU、 いいえ。 2023-07、 セグメントレポート(トピック) 280): 報告対象セグメントの開示の改善。この基準では、重要なセグメント経費およびその他のセグメント項目を報告対象セグメントごとに開示する必要があります。ASUは、年度から始まる年間期間に有効になります 2024 との中間期間 2025。 当社は、この基準を採用することによる連結財務諸表と開示への影響を評価しています。
に 2023年12月、 FASBはASUを発行しました いいえ。 2023-09、 所得税 (トピック) 740): 所得税開示の改善。この基準は、税率の調整や支払った所得税に関する情報など、所得税に関する開示を強化します。ASUが発効します 2025年1月1日。当社は、この基準を採用することによる連結財務諸表と開示への影響を評価しています。
注記 3。 前払い費用とその他の流動資産
前払い費用およびその他の流動資産 2024年3月31日です と 2023年12月31日です 次の内容で構成されていました(単位:千):
| 3 月 31 日 |
12月31日 |
|||||||
| 2024 |
2023 |
|||||||
| プリペイド保険 |
$ | $ | ||||||
| 委託研究機関とその他の預金 |
||||||||
| 売掛金 |
||||||||
| その他 |
||||||||
| 前払費用とその他の流動資産の合計 |
$ | $ | ||||||
委託研究機関やその他の預金は、発生した費用を超えてベンダーに支払われる現金です。
注記 4。 不動産とその他の収入、費用
会社は所有しています 二-テキサス州オースティンにオフィスコンプレックスを建設し、その一部が本社となっています。この物件は、今後数年間に予想される会社の成長と事業拡大に対応することを目的としています。メンテナンス、物理的設備、リース、資産管理、および財産所有権に関連するその他の重要な責任は、専門の不動産管理者に外注されています。オフィスコンプレックスはおよそ
会社は、建物の運営とリースによる純利益をその他の収益として記録しています。純利益は、リースと同じです じゃない 会社の事業の中核。建物の減価償却とスペースの償却 じゃない 会社が占めている金額は、一般管理費に含まれています。建物の減価償却費と会社が占めるスペースの償却費は、一般管理費と研究開発費の間に配分されます。提示された期間のその他の収益(純額)の構成要素は次のとおりです(千単位)。
| 3 か月が終わりました |
||||||||
| 3 月 31 日 |
||||||||
| 2024 |
2023 |
|||||||
| リース収入 |
$ | $ | ||||||
| 不動産運営費用 |
( |
) | ( |
) | ||||
| その他の収益、純額 |
$ | $ | ||||||
注記 5。 資産と設備
資産と設備の構成要素、合計、現在 2024年3月31日ですそして 2023年12月31日です 次のとおりでした(千単位):
| 3 月 31 日 |
12月31日 |
|||||||
| 2024 |
2023 |
|||||||
| 土地 |
$ | $ | ||||||
| 建物 |
||||||||
| サイトの改善 |
||||||||
| テナントの改善 |
||||||||
| 家具と備品 |
||||||||
| 総資産および設備 |
$ | $ | ||||||
| 減価償却累計 |
( |
) | ( |
) | ||||
| 資産および設備、純額 |
$ | $ | ||||||
資産と設備の減価償却費は $
注記 6。 無形資産
無形資産の構成要素、純額、現在 2024年3月31日です と 2023年12月31日です 次のとおりでした(千単位):
| 3 月 31 日 |
12月31日 |
|||||||
| 2024 |
2023 |
|||||||
| リースインプレース契約 |
$ | $ | ||||||
| リース手数料とその他 |
||||||||
| 無形資産総額 |
$ | $ | ||||||
| 累積償却額 |
( |
) | ( |
) | ||||
| 無形資産、純額 |
$ | $ | ||||||
無形資産の償却費は $
現在の有限無形資産の償却費用 2024年3月31日です 次のようになることが予想されます(単位:千):
| 12月31日に終了する年度については、 |
||||
| 2024 |
$ | |||
| 2025 |
||||
| 償却総額 |
$ |
注記 7。 株主資本と株式ベースの報酬費用
普通株式ワラントの分配
メモを参照してください 2 そして 12 普通株式新株予約権の分配について 2024年1月3日。
市場での普通株式の募集
オン 2023年5月1日、 当社は、時々、総募集価格が最大$の会社の普通株式を売却するために、市場での募集プログラム(「ATM」)を締結しました。
あった
に 2020年3月、 同社は市場での提供プログラムを開始しました(「2020 プログラム」)は、時々、総募集価格が最大$の会社の普通株式を売却します
でのストックオプションと業績報奨活動 2024
の間に 三 月が終わりました 2024年3月31日です、当社のストックオプションプランに基づいて発行されているストックオプションおよび権利確定されていないパフォーマンスアワードは、次のように変更されました。
| ストックオプション |
パフォーマンスアワード |
|||||||
| 2023年12月31日時点で未処理です |
||||||||
| オプションが付与されました |
||||||||
| 行使したオプション |
||||||||
| オプションは没収/キャンセルされました |
||||||||
| 2024年3月31日時点で未払い |
||||||||
発行済オプションの1株あたりの加重平均行使価格 2024年3月31日です は $
の間に 三 月が終わりました 2024年3月31日です、ありました
の間に 三 月が終わりました 2023年3月31日です あった
での株式ベースの報酬費用 2024
の間に 三 月が終わりました 2024年3月31日です そして 2023、当社の株式ベースの報酬費用は以下の通りです(千単位):
| 3 か月が終わりました |
||||||||
| 3 月 31 日 |
||||||||
| 2024 |
2023 |
|||||||
| 研究開発 |
$ | $ | ||||||
| 一般と管理 |
||||||||
| 株式報酬費用の総額 |
$ | $ | ||||||
2018年 株式インセンティブプラン
会社の管理を担当するのは、会社の取締役会(「取締役会」)または取締役会の指定委員会です 2018年 改正されたオムニバスインセンティブプラン( 「2018 プラン」)で、付与される各オプションの条件を、その条件に従って決定します 2018年 プラン。会社の従業員、取締役、コンサルタントは、以下の賞を受ける資格があります 2018年 ストックオプションや業績賞の付与を含むプラン。株式ベースの特典は通常、付与日から10年で失効します。ザ・ 2018年 プランは、修正されました 2022年5月5日、 最大の発行を規定しています
ストックオプションまたはパフォーマンスアワードが行使価格と税金を差し引いて行使された場合、発行された株式数は、アワード受領者が支払うべき税額に等しい株式数だけ減額され、その数の株式は取り消されます。その後、会社はその現金を使って、受賞者が、または受賞者に代わって支払うべき法定税額を税務当局に支払います。
注記 8。 所得税
会社は、その間、所得税を規定していませんでした 三 月が終わりました 2024年3月31日です、通年の課税対象純損失を見込んでいるからです 2024これについては、評価引当金の増加によって利益が相殺されます。また
注記 9。 コミットメント
使用権、資産と負債
同社はおおよその期間オペレーティングリースを契約していました
あった
あった
その他のコミットメント
当社は、社内プログラムと共同プログラムを組み合わせて製品の研究開発プログラムを実施しています。その中には、大学、受託研究機関、臨床研究施設との取り決めなどが含まれます。当社はこれらの組織とキャンセル可能な契約を結んでいます。これらの契約に基づく会社の義務は、主に実施されたサービスに基づいています。
メモ10。 2020 現金インセンティブボーナスプラン
に 2020年8月、 理事会は計画を承認しました。このプランは、会社の時価総額の大幅な増加に合わせて、プラン参加者に追加の現金報酬を提供する「リスクのある」キャッシュボーナスプログラムを作成することにより、会社の長期的な成功を促進するために設立されました。プランは「リスクがある」と見なされます。なぜなら、プランの参加者はじゃない 会社の時価総額が大幅に増加し、プランで指定された他の特定の条件が満たされない限り、現金ボーナスを受け取ります。具体的には、プランの参加者はじゃない以下の場合を除き、現金ボーナスはすべて支払われます1)会社が、会社またはその資産の所有権の売却(「合併取引」)を構成する合併または買収取引を完了する(「合併取引」)または(2)取締役会の報酬委員会(「報酬委員会」)は、プランで定義されているように、会社が手元に十分な現金を持っていると判断します。これらの要件には固有の裁量と不確実性があるため、当社は、プランの付与日は じゃない の時点で発生しました 2024年3月31日です。
合併取引が発生した場合、プラン参加者には獲得したすべての現金ボーナスが支払われます。
現在 2022年12月31日に、 会社の独立取締役が本プランの参加者でした。しかし、効果的です 2023年3月16日、 取締役会は、本プランの参加者であるすべての独立取締役を解任するようにプランを修正し、独立取締役はそのような解任に同意しました。本プランに基づく潜在的な利益のうち、独立取締役が持っていた分は完全に会社に没収され、 じゃない プランに基づいて他の参加者に割り当てられます。会社の独立取締役は じゃない プランに基づく支払いを受けましたが、そのような修正の結果、受け取ることはありません。
本プランの対象となる会社の時価総額は、次のいずれかに基づいて決定されます(1) の終値 一 ナスダック・キャピタル・マーケットにおける当社の普通株式の株式に、発行済株式および当社の株式購入オプションの総額を掛けたもの、または(2)合併取引において会社の証券保有者に支払われる対価の総額。未払いの新株予約権は時価総額の決定から除外されます。これは、該当する会計ガイダンスに基づく市況を構成します。
このプランは、会社の時価総額が最大額まで大幅に増加するたびに、潜在的な現金ボーナスを発生させます5 ドル時価総額10億です。プランでは次のことを明記しています
会社が1ドルを超えると
本プランは賠償責任報奨として計上されます。各評価マイルストーンアワードの公正価値は、付与日が来ると決定され、報告期間ごとに再評価されます。本プランに関連する報酬費用は、各プランの予想達成期間にわたって計上されます
に 2020 年 10 月、 会社は達成しました 最初評価マイルストーン。続いて 2020年、 報酬委員会は$の現金ボーナス支給の可能性を承認しました
終了した年度中 12月31 2021年、 会社は達成しました
いいえ 評価マイルストーンは終了した年度中に達成されました 2023年12月31日ですそして 2022 または 三 月が終わりました 2024年3月31日です。
注記 11。 不測の事態
会社は、そして時々、会社です かもしれない 米国政府の調査、調査、およびFDAに提出された市民請願を含む、訴訟やその他の法的手続きや請求に関与しています。さらに、当社は、随時、受け取りました かもしれない 通常の業務から生じる事項に関する政府当局からの問い合わせを受け付けます。これらの手続きの結果は本質的に不確実です。結果がどうであれ、法的手続きは、弁護および和解費用、経営資源の流用、その他の要因により、会社に悪影響を及ぼす可能性があります。この時、 いいえ 予想される結果や、その結果が会社にとって重要かどうかについて評価することができます。当社は、現在入手可能な情報に基づくと、法的事項に関する規定の総額は十分であると考えています。
政府調査
オン 2021年11月15日、 同社は、特定の政府機関が会社に企業情報と書類の提供を依頼したことを明らかにしました。これらは機密の要求でした。当社は自発的に協力しており、今後もこれらの問い合わせに協力していくつもりです。 いいえ 政府機関は、会社またはその役員、従業員、または取締役による研究上の不正行為または不正行為の証拠を発見したことを会社に通知しました。 いいえ 政府機関は、これらの問い合わせに関連して何らかの請求または告訴を行っています。政府機関かどうかも含めて、これらの進行中の問題の結果や影響を予測することはできません かもしれない 会社または他者に対して執行措置をとる。
証券集団訴訟と株主デリバティブ訴訟
の間 2021年8月27日 そして 2021年10月26日、 当社と特定の指名された役員による連邦証券法違反を理由に、推定される4件の集団訴訟が提起されました。訴状は、FDAに提出された市民請願書に含まれる申し立てに基づいており、シムフィラムに関して被告が行ったさまざまな陳述が実質的に虚偽で誤解を招くものであると主張しています。その後、市民の請願はすべてFDAによって却下されました。これらの訴訟は、テキサス州西部地区連邦地方裁判所に提起されました。訴状は、特定の購入者とされる種類の購入者に代わって、不特定の補償的損害賠償およびその他の救済を求めています。
オン 2022年6月30日に、 連邦判事は4つの集団訴訟を1つの訴訟にまとめ、主任原告と主任弁護士を任命しました。主任原告は、統合修正訴状を提出しました 2022年8月18日 以下の会社の有価証券の推定購入者を代表して 2020年9月14日 そして 2022年7月26日。 オン 2023年5月11日、 裁判所は、当社の元最高医療責任者で会社の取締役でもある被告のナダブ・フリードマン博士に対する原告の請求を偏見をもって却下しましたが、それ以外は被告の却下の申立てを却下しました。被告は、統合修正訴状に対する回答を提出しました 2023年7月3日。 オン 2024年2月22日、 原告は、訴状を補足して、推定クラス期間を次の期間まで延長するよう申し立てました 2023年10月12日。 会社はその動議に反対しました。
オン 2021年11月4日、 米国証券法および州の受託者責任法に基づき、特定の指名役員および会社の取締役会メンバーに対する請求を主張して、関連する株主デリバティブ訴訟が、当社に代わって米国テキサス州西部地区地方裁判所に提起されました。この苦情は、FDAに提出された(そしてその後却下された)市民請願でなされた申し立てに基づいています。訴状は、とりわけ、個々の被告人が、米国証券法に違反し、会社に対する受託者責任に違反して、実質的に虚偽で誤解を招くような発言をさせて、会社を不特定の損害賠償と証券法の責任にさらしたと主張しています。デリバティブ訴訟は、とりわけ、個々の被告の不法行為の疑いで生じた不特定の補償的損害を会社に代わって回収することを目指しています。このデリバティブ事件の原告は じゃない 会社に対して救済を求める場合、会社は個々の被告に対して一定の補償義務を負っています。の間に 2021年11月4日 そして 2023年6月20日、
オン 2024年2月2日、 会社と特定の指名された役員による連邦証券法違反を理由に、会社に代わって推定される集団訴訟が提起されました。苦情の根拠は 2023年10月12日 ニューヨーク市立大学の当社の科学協力者による、科学的不正行為の疑いに関するリークされたとされる報告を説明する記事。訴状は、シムフィラムに関して被告が行ったさまざまな発言が、この記事によって実質的に虚偽で誤解を招くものであると主張しています。この訴訟は、イリノイ州北部地区連邦地方裁判所に提起されました。訴状は、不特定の補償的損害賠償およびその他の救済を求めています 2022年8月18日 そして 2023年10月12日。
から始めて 2024年3月18日、
当社は、前述の主張には何のメリットもないと考えており、これらの訴訟に対しては精力的に弁護するつもりです。当社は、これらの訴訟に関連して発生する可能性のある損失または損失の範囲(もしあれば)を見積もることはできません。
オン 2022年8月19日、 会社の代理として、デラウェア州チャンスリー裁判所に、特定の指名された役員および会社の取締役に対する州の受託者責任法に基づく請求を主張する株主デリバティブ訴訟が提起されました。訴状は、とりわけ、個々の被告人が承認したことで受託者責任に違反したと主張しています 2020 の現金インセンティブボーナスプラン 2020 年 8 月。 訴状は、不特定の補償的損害賠償およびその他の救済を求めています。オン 2023年1月6日、 原告は修正訴状を提出しました。被告は、修正された訴状に対して部分的な回答を提出しました 2023年3月10日、 修正された苦情を部分的に却下しました 2023年3月14日。
オン 2024年1月25日、 両当事者は、この訴訟に関して拘束力のある和解条件書を締結しました。和解には、和解規定の提出や裁判所の最終承認など、特定の条件が適用されます。提案された和解案は、会社と個々の被告人に対して提起された請求を解決するもので、和解には次の条項が含まれます じゃない 被告によるあらゆる種類の過失、責任、または不正行為の承認、譲歩、または認定を構成します。あるかもしれません いいえ 最終的な和解契約が締結されること、またはそのような合意が裁判所によって承認されることの保証。
注記 12。 ワラント配当の配分
オン 2024年1月3日、 当社は、普通株式を購入するための新株予約権者に、新株予約権者への新株の分配を行いました。営業終了時点での当社の普通株式の記録上の各保有者 2023年12月22日 すべてに対して4つのワラントを受け取りました
各ワラントは、所有者の単独費用と独占的選択により、所有者が$の行使価格で購入する権利を保有者に与えました
オン 2024年4月15日、 当社は、未払いのワラントをすべて償還すると発表しました 2024年5月7日(「償還日」)。償還価格は$の1/10でした
ワラントは、日付が付けられたワラント契約(ワラントの形態を含む)の条件の対象でした 2024年1月3日、 キャッサバ・サイエンシズ株式会社、コンピューターシェア株式会社、コンピューターシェア株式会社、コンピューターシェア信託会社(N.A.)の間で、最新報告書のフォームに提出されました 8-SECがオンの状態でOKです 2024年1月3日。 新株予約権は、当社の普通株式とは別にナスダック・キャピタル・マーケットに「SAVAW」という銘柄で上場され、取引されました。
から 2024年1月3日 に 2024年3月31日、 合計はおよそ
に続いて 2024年3月31日です そして償還日までの合計は約 3.15 100万件のワラントが行使され、その結果、会社への総収入は約 104.0ドルです百万。会社が発行したおおよそ
の総収入 2024 ワラント分配金の合計は約$でした
その後 最初 $
ワラント配布の費用は合計で約$です
未払いの新株予約権は、ASCに従って負債として分類されます 480 と ASC 815、 そのためには、ワラントを当初の公正価値で測定する必要があります 2024年1月3日その後の各報告期間に、公正価値の変動が当社の連結損益計算書で現金以外の利益または損失として認識されます。
普通株式新株予約権の分配からの期間中 2024年1月3日 に 2024年3月31日、 当社の普通株式新株予約権の負債と発行済新株予約権の変動は次のとおりです(千単位)。
| 普通株式新株の数 |
普通株式保証責任 |
|||||||
| 普通株式新株予約権の分配 |
16,895 |
$113,363 |
||||||
| ワラントの行使 |
(674) |
(4,954) |
||||||
| ワラント負債の公正価値の変動による利益 |
— |
(43,041) |
||||||
| 2024年3月31日現在の残高 |
16,221 |
65,368ドル |
||||||
「メモ」を参照 2 普通株式新株予約権および関連する保証責任に関する追加情報については。
アイテム 2. マネジメント's 財政状態と経営成績に関する議論と分析
この議論と分析は、Cassava Sciences, Inc.(以下「当社」、「当社」)の要約連結財務諸表およびフォーム10-Qのこの四半期報告書の他の部分に含まれる付随する注記と併せて読む必要があります。経営成績は、必ずしも将来の業績を示すものではありません。
将来の見通しに関する記述と通知
このフォーム10-Qの四半期報告書には、1995年の民間証券改革法の意味における将来の見通しに関する記述と見なされる特定の記述が含まれています。私たちは、そのような声明は、それによって作られたセーフハーバーによって保護されることを意図しています。将来の見通しに関する記述は、歴史的事実ではない事項に関する期待、信念、予測、将来の計画と戦略、予想される出来事や傾向、および同様の表現に関するものです。場合によっては、将来の見通しに関する記述を、「予想する」、「信じる」、「できる」、「見積もる」、「期待する」、「意図する」、「可能性がある」、「計画する」、「可能性」、「すべき」、「意志」、「するだろう」、「するだろう」などの用語、またはこれらの用語やその他の類似用語の否定的な言葉で区別できます。
将来の見通しに関する記述は、現在入手可能なすべての情報を考慮に入れて、将来の業績に対する当社の信念、仮定、期待に基づいています。将来の見通しに関する記述にはリスクと不確実性が伴い、実際の結果とイベントのタイミングは、将来の見通しに関する記述で説明されている結果とは大きく異なる場合があります。このような将来の見通しに関する記述の例には、以下に関する記述が含まれますが、これらに限定されません。
| ● |
現在進行中の第3相試験でアルツハイマー病患者に対するシムフィラムの期待される安全性プロファイルまたは治療上の利点(ある場合)。 |
|
| ● |
すべての臨床試験と非臨床試験を実施し、第3相臨床プログラムの医薬品を大規模に供給するために、第三者の請負業者に頼っている、または予定通りまたは予算内でそれを行うことができるか。 | |
| ● |
アルツハイマー病患者を対象としたシムフィラムに関する2年間の安全性研究の3つの臨床段階のいずれかの結果からのデータ解釈には、ランダム化比較試験の臨床結果と比較して限界があります。 | |
| ● |
アルツハイマー病の試験における認知や健康を評価するための臨床尺度の能力。 |
|
| ● |
アルツハイマー病患者を対象としたシムフィラムに関する現在進行中の第3相試験のデザインに重要な変更を加える可能性のある、または行う予定の重要な変更はありますか。 | |
| ● |
アルツハイマー病やその他の神経変性疾患を対象とした製品候補を使用して、追加の臨床試験および非臨床試験を開始、実施、分析する当社の能力。 | |
| ● |
前臨床所見が製品候補の開発能力に与える影響。 | |
| ● |
第1相試験や第2相試験など、当社の前臨床試験または初期臨床試験の結果の解釈 |
|
| ● |
治験中の血液ベースの診断薬候補であるSavADXをさらに開発する計画です。 | |
| ● |
アルツハイマー病以外にもシムフィラムの治療適応を拡大する能力または意欲。 |
|
| ● | 当社の製品候補の安全性、有効性、または潜在的な治療上の利点。 | |
| ● | 当社の臨床研究における安全性に関連しない探索的な「研究用途のみ」のバイオマーカーの使用 | |
| ● |
当社の製品候補を申請し、規制当局の承認を得る能力 |
|
| ● |
私たちの戦略と、承認されれば、あらゆる製品候補を商品化するためのインフラを確立する能力。 |
|
| ● |
製品候補の将来の潜在的な収益(承認され商品化された場合)。 |
|
| ● |
製品候補の市場での受け入れ(承認され商品化された場合) |
|
| ● |
製品候補の価格設定と払い戻し(承認され商品化された場合)。 |
|
| ● |
私たちの知的財産の保護の有用性、または十分性 |
|
| ● |
アルツハイマー病の治療における私たちの潜在的な競合他社または競合製品。 |
|
| ● |
事業を継続するため、または事業を拡大するために、時々新しい資本を調達する必要があります。 |
| ● |
主力製品候補の臨床研究および非臨床研究を実施するために、臨床研究機関(「CRO」)を含む複数の第三者ベンダーおよび協力者を利用しています。 |
|
| ● |
企業秘密、技術革新、ライセンス契約、特定の事業機能のアウトソーシングに関する期待 |
|
| ● |
予期せぬコスト超過、インフレ、不完全な予測、活動範囲の拡大、その他の原因により、予算額を大幅に超えて増加した経費または発生費用。 |
|
| ● |
当社の財務または経営成績の変動。 |
|
| ● |
当社の営業損失、予想される営業および資本支出、および法的費用 |
|
| ● |
株式報酬報酬に基づく従業員または取締役への普通株式、オプション、またはその他の株式の発行に関する期待(雇用税控除後) |
| ● | 現金で行使される発行済新株予約権の保有者への普通株式の発行に関する期待 | |
| ● |
社内の情報システムとインフラストラクチャの開発と保守。 |
|
| ● | 情報システムとインフラにおけるサイバーセキュリティ上の不利なインシデントの可能性と影響を最小限に抑える私たちの能力。 | |
| ● |
追加の人材を雇う必要性と、そのような人材を引き付けて維持する当社の能力。 |
|
| ● |
米国および当社が事業を展開するその他の管轄区域における既存または新たな規制と規制の進展。 |
|
| ● |
事業の規模と範囲を拡大する計画です。 |
|
| ● |
事業資金を引き続き賄うのに十分な現金資源 |
|
| ● |
製品候補の商品化に関連する、第三者との将来の潜在的な合意 |
|
| ● |
経費、資本要件、および追加融資の必要性に関する見積もりの正確さ。 |
|
| ● |
株式ベースの報酬に関する開示に使用された仮定と見積もり。 |
|
| ● |
係争中または将来の訴訟、またはその他の法的手続きや請求の費用、時期、結果(米国政府の調査を含む)。そして |
|
| ● |
当社または当社の協力者に対する申し立てから生じる可能性のある訴訟、請求、またはその他の不確実性。 |
また、2023年12月31日に終了した会計年度のフォーム10-Kの年次報告書の「リスク要因」というタイトルのセクションも参照してください。このようなリスク要因は、米国証券取引委員会(「SEC」)に提出された報告書で定期的に修正、更新、または修正される可能性があるため、当社に影響を及ぼすこれらのリスクおよびその他のリスクに関する詳細情報を入手してください。
将来の業績は、将来の見通しに関する記述によって明示または暗示されるものと大きく異なる可能性があるため、将来の見通しに関する記述に過度に依存しないように注意してください。法律で義務付けられている場合を除き、このForm 10-Qの四半期報告書に記載されている事項に関連する将来の見通しに関する記述は、書面または口頭を問わず、更新するつもりはありません。
このフォーム10-Qには、当社の独立コンサルタントから、または業界の出版物やその他の公開されている情報に基づいて受け取った統計データや医薬品情報も含まれている場合があります。私たちは、これらのデータソースや情報に含まれるデータの正確性や完全性を独自に検証していません。したがって、私たちはそのようなデータや情報の正確性や完全性についてはいかなる表明もしません。そのようなデータや情報を過度に重視しないように注意してください。
神経変性に関する私たちの研究プログラムは、歴史的に国立衛生研究所(「NIH」)からの科学的および財政的支援の恩恵を受けてきました。フォーム10-Qのこの四半期報告書の内容は当社の責任であり、必ずしもNIH、保健社会福祉省、米国政府の他の機関、または当社のベンダー、協力者、または無関係な第三者の公式見解を表すものではありません。
[概要]
Cassava Sciences, Inc. は、テキサス州オースティンを拠点とする臨床段階のバイオテクノロジー企業です。私たちの使命は、アルツハイマー病などの神経変性疾患を検出して治療することです。私たちの新しい科学は、アルツハイマー病の脳内の重要なタンパク質を安定させることに基づいていますが、除去することではありません。私たちの主要な治療薬候補であるシムフィラムは、第3相臨床試験で提案されているアルツハイマー病認知症の治療法の臨床評価中です。
12年以上にわたり、私たちは最先端の技術と神経生物学の新しい洞察を組み合わせて、アルツハイマー病やその他の神経変性疾患の新しいソリューションを開発してきました。私たちの戦略は、独自の科学/臨床プラットフォームを活用して、アルツハイマー病などの神経変性疾患を治療するためのクラス初のプログラムを開発することです。アルツハイマー病は脳の変性疾患で、病気が進行し、患者が軽度から中等度、そして最終的には重度のアルツハイマー病に移行するにつれて、患者の認知機能と健康機能が時間とともに低下します。
現在、開発中のバイオ医薬品資産は2つあります。
| ● |
私たちの主要な治療薬候補であるシムフィラムは、アルツハイマー病、認知症の新しい経口治療薬です。そして |
|
| ● |
私たちの主要な治験診断製品候補であるSavAdXは、少量の血液サンプルからアルツハイマー病の存在を検出する新しい方法です。 |
アルツハイマー病の治療に対する私たちの科学的アプローチは、同時にアルツハイマー病を抑制することを目指しています 両方 神経変性と神経炎症。私たちは、脳内の複数の重要な機能を改善できる可能性があるということは、アルツハイマー病に対処するための新しい、これまでとは異なる、重要なアプローチだと考えています。
私たちの主力製品候補であるシムフィラムは、独自の小分子薬です。Simufilamは社内で発見、設計され、2008年頃から現在まで行われた研究活動の中で、私たちの学術協力者によって特徴づけられました。
シムフィラムは、アルツハイマー病の脳にあるフィラミンA(FLNA)と呼ばれるタンパク質の形態を変化させたものを標的としています。公表された研究では、FLNAの改変型が神経機能障害、神経変性、神経炎症を引き起こすことが示されています。具体的には、シムフィラムは、アルツハイマー病における当社の薬の主要な作用機序の根底にあるα7ニコチン性アセチルコリン受容体(α7nAChR)へのアミロイド結合を破壊すると考えています。最近のデータでも、mTORシグナル伝達に対するシムフィラムの有意な影響が示唆されています。mTORは加齢に伴う細胞の変化に寄与するため、インスリン感受性の改善と同時にシムフィラムによるmTORの過剰活性化の抑制は、特定の老化プロセスを遅らせ、この病理学的特徴を弱め、アルツハイマー病や加齢における脳の機能と記憶に役立つ可能性があります。
私たちは、第三者へのロイヤルティ義務なしに、自社の医薬品、診断資産、および関連技術に対する独占的な世界的権利を所有しています。シムフィラムとアルツハイマー病やその他の神経変性疾患に対するシムフィラムの使用に関する当社の特許保護は、現在2039年まで有効で、9件の米国特許が発行されています。米国での申告のそれぞれについて、対応する外国申告が行われています。
現在、アルツハイマー病、認知症の患者を対象に、経口シムフィラムのランダム化プラセボ対照第3相臨床試験を2回実施しています。どちらの試験も完全に登録されています。この試験では、ベースライン時に合計約1,900人の軽度から中等度のアルツハイマー病患者をランダム化しました。フェーズ3プログラムの有効性データはすべて非表示のままです。有効性の結果に関する中間分析はありません。
RETHINK-ALZと呼ばれる私たちの最初の第3相試験は、シムフィラム100mg錠とプラセボ錠の安全性と有効性を52週間にわたって評価することを目的としています(NCT04994483)。52週間にわたる第3相調査の主な結果は、2024年末頃に発表される予定です。
REFOCUS-ALZと呼ばれる2回目の第3相試験は、経口シムフィラムの100mgと50mg錠の安全性と有効性を76週間にわたってプラセボと比較して評価することを目的としています(NCT05026177)。76週間にわたる第3相調査の主な結果は、2025年の半ば頃に発表される予定です。
リスクは医薬品開発プロセスの基本です
私たちは新薬の発見と開発を行っています。私たちの研究開発活動は長く、複雑で、費用がかかり、高いリスクを伴います。当社の普通株式の保有者は、フォーム10-Qのこの四半期報告書と、「項目1A」を含め、フォーム10-Kの2023年次報告書全体を注意深くお読みください。リスク要因」 なぜなら、リスクは創薬のプロセスの基本であり、 開発では、投資した資金を完全に失う覚悟がない限り、当社の上場証券に投資しないように注意してください。
アルツハイマー病について
アルツハイマー病は、認知、機能、行動に影響を与える脳の変性疾患です。時間が経つにつれて、病気が悪化するにつれて、患者の認知機能と健康機能は低下します。病気が進行するにつれて、患者は軽度から中等度、そして最終的には重度のアルツハイマー病に移行します。認知機能の低下は、病気の進行した段階ではより顕著になり、おそらく治療がより困難になります。
アルツハイマー協会によると、2023年には65歳以上の推定670万人のアメリカ人がアルツハイマー型認知症を患っていました。同じ情報源によると、2011年に、アメリカの人口史上最大の人口統計世代であるベビーブーム世代が65歳に達し始めました。2030年までに、65歳以上の米国人口は大幅に増加し、7400万人の高齢のアメリカ人が全人口の20%以上を占めると予測されています。年齢はアルツハイマー型認知症の危険因子としてよく知られているため、高齢のアメリカ人の増加に伴い、アルツハイマー型認知症の新規症例数は増加すると予想されます。
私たちの科学的アプローチは違います
アルツハイマー病の研究と医薬品開発におけるバイオ医薬品業界の厳しい実績を考えると、この病気と闘うための革新的なアプローチを早急に検討する必要があると考えています。
12年以上にわたり、私たちはアルツハイマー病などの神経変性疾患の治療と診断のための新しく有望な科学的アプローチを開発してきました。重要なのは、私たちは脳からアミロイドを取り除こうとはしていません。むしろ、私たちの新しい科学は、脳内の重要なタンパク質を安定させることに基づいていますが、除去することではありません。
私たちの科学的アプローチは、FLNAと呼ばれる足場タンパク質の変化した形を標的にして神経変性を治療することです。何年にもわたる基礎研究を通じて、私たちと学術共同研究者は、FLNAをアルツハイマー病の脳の神経変性と神経炎症経路を可能にする構造的に変化したタンパク質であることを確認しました。FLNAの改変型はアルツハイマー病の脳に蔓延していて、健康な対照脳では本質的に検出できないことを示しました。
科学的な洞察と実験技術を駆使して、このタンパク質の機能障害を解明したと思います。この研究を通じて、改変されたFLNAがアルツハイマー病に重要な役割を果たすという実験的証拠が得られました。私たちは、この構造的に変化したタンパク質を標的とし、正常な形と機能を取り戻すために、高親和性の小分子のファミリーを設計しました。私たちの主要な治療薬候補であるシムフィラムを含むこの小分子ファミリーは、社内で設計され、学術協力者によって特徴付けられました。
私たちの主薬候補であるシムフィラムは、新しい作用機序を持つ小分子(経口)薬です。シムフィラムの標的は、私たちが安定させようとしている脳内の構造的に変化したタンパク質である改変FLNAです。重要なのは、シムフィラムには独自の作用機序があるため、その潜在的な治療効果は、アルツハイマー病認知症の既存の薬物治療と相加的または相乗効果がある可能性があるということです。
私たちの科学は、脳内の重要なタンパク質を安定させることに基づいています
タンパク質は事実上すべての生物学的プロセスに関与するため、細胞機能に不可欠です。たんぱく質の機能が損なわれると、健康に壊滅的な影響が及ぶ可能性があります。医療における技術の進歩とライフスタイルの改善は、私たちの寿命を延ばしています。しかし、年齢とともに、遺伝子変異やその他の要因が健康な細胞を阻害し、タンパク質が変化します。時々、細胞は変化したタンパク質を自分で取り除くことができます。しかし、病気によって重要なタンパク質の形や機能が変化すると、下流の複数のプロセスが損なわれます。タンパク質が構造的に変化し、細胞、組織、臓器の正常な機能を損ない、病気につながる臨床状態はたくさんあります。逆に、改変されたタンパク質を健康に戻すこと(プロテオスタシスと呼ばれる)は、臨床医学で広く受け入れられている治療戦略です。
100年以上にわたり、科学者たちはさまざまな神経変性疾患を、誤って折りたたまれて病的になるタンパク質に起因すると考えてきました。アルツハイマー病では、アミロイドやタウなどの特定のタンパク質が正常な形や機能を失います。このような誤って折りたたまれたタンパク質は、分解または凝集して塊になり、脳内でプラークやもつれを形成する可能性があります。神経シナプスの破壊、ニューロンの死の加速、脳支持細胞の機能不全はすべて、誤って折りたたまれたタンパク質の直接的な結果であると広く信じられています。
FLNAは、脳に多く存在する足場タンパク質です。健康な足場タンパク質は、複数のタンパク質をまとめ、それらの相互作用を調整します。しかし、アルツハイマー病の脳には、変化した形のFLNAタンパク質があります。私たちの実験的証拠は、FLNAタンパク質の変化がニューロンの正常な機能を破壊し、神経変性と脳の炎症を引き起こすことによってアルツハイマー病の一因となることを示しています。私たちの製品候補であるシムフィラムは、脳内の変化した有毒なFLNAに対抗し、この重要なタンパク質の正常な機能を回復させることを目的としています。
1つの薬、複数の効果
シムフィラムは、非常に高い(フェムトモル)親和性で変化したFLNAに結合します。シムフィラムは、変化したFLNAを元の健康なコンフォメーションに戻すことで脳の健康を改善し、変化したFLNAによる下流の毒性作用に対抗すると考えています。この薬効果は、アルファ7ニコチン性アセチルコリン受容体、N-メチル-D-アスパラギン酸(NMDA)受容体、インスリン受容体など、主要な脳受容体の正常な機能を回復させます。これらの受容体は、脳細胞の生存、認知、記憶において極めて重要な役割を果たします。さらに、最近のデータでは、mTORシグナル伝達に対するシムフィラムの有益な影響が示唆されています。
シムフィラムで変化したFLNAを回復させることで脳の健康が改善されるという実験的証拠を生成して公開しました。動物モデルでは、シムフィラムによる治療により、アミロイドとタウ沈着の減少、受容体のシグナル伝達の改善、学習と記憶の改善など、脳の健康が劇的に改善されました。さらに、シムフィラムには、脳内の炎症性サイトカインを大幅に減少させるというもう1つの有益な治療効果があります。病気の動物モデルでは、シムフィラムで治療するとIL-6のレベルが大幅に低下し、TNF-αレベルとIL-1βレベルがそれぞれ86%と80%抑制されました。これは強力な抗神経炎症効果を示しています。
私たちのアプローチは、複数の受容体の機能を回復させ、強力な抗炎症作用を発揮することで、患者のアルツハイマー病の進行を遅らせる可能性があると考えています。また、私たちの科学的アプローチは、この複雑な病気に対して可能な治療アプローチの範囲を広げる可能性があると考えています。
私たちの科学は、複数の査読付きジャーナルに掲載されています。さらに、私たちの研究は、複数の研究助成金でNIHの支援を受けています。各助成金は、その分野の外部専門家からなるパネルによる、科学的および技術的メリットに対する当社のアプローチについて、ピアレビューを経て詳細に評価された後に授与されました。
シムフィラムの作用機序を確認する出版物
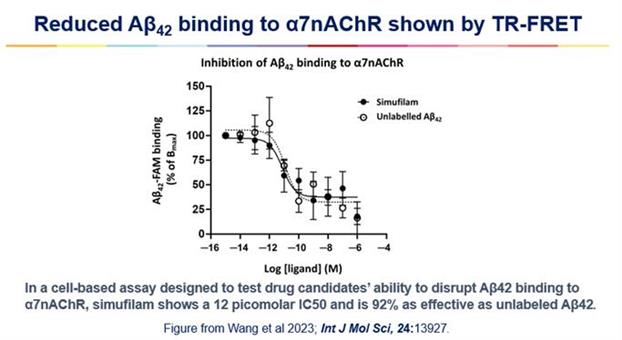
2023年9月、シムフィラムの生物活性を確認する新しい研究の発表を発表しました。コーチン研究所(フランス、パリ)の研究者は、TR-FRETに基づく高精度の細胞ベースのアッセイを使用して、シムフィラムがα7ニコチン性アセチルコリン受容体(α7nAChR)へのアミロイド結合を遮断することを示しました。α7nAChRへのアミロイド結合の破壊が、アルツハイマー病におけるシムフィラムの主要な作用機序の根底にあると私たちは信じています。この研究論文は、ニューヨーク市立大学のホアウ・ヤン・ワンとゼ・ペイ、コーチン研究所のエリカ・セコン、ジュリー・ダムとラルフ・ジョッカーズ、キャッサバ・サイエンスのリンゼイ・バーンズが共同執筆し、スペシャルに掲載されました の問題です 国際分子科学ジャーナル、 査読付きジャーナル。図1を参照してください。
図 1.パリ市立大学コーチン研究所のエリカ・セコンが、彼女が開発したアッセイで行った実験:Cecon et al 2019; バー J ファーマコール; 176:3475-3488。表示されているデータは、4つの別々の実験±SEMからプールされたデータの平均です。

Simufilamが過活動mTORを抑制することを示す出版物
2023年6月、ラパマイシンの機構標的(mTOR)に対するシムフィラムの効果を示す新しい研究の発表を発表しました。科学文献によると、mTORの過剰活動は、加齢、アルツハイマー病、その他の症状に重要な役割を果たします。正常に機能しているとき、mTORは携帯電話のニーズを監視し、インスリンによって活性化されます。新たに発表された研究では、健康な対照と比較して、アルツハイマー病患者から採取した血液から分離されたリンパ球ではmTORが過剰活動であることが示されています。シムフィラム100mgを1日2回、アルツハイマー病患者に28日間経口投与した後、リンパ球はmTOR活性を正常化し、インスリンに対する感受性を回復しました。
これらのデータは、mTORシグナル伝達に対するsimufilamの有意義な影響を示唆しています。過活動mTORシグナル伝達の抑制とインスリンに対する反応性の改善は、可溶性アミロイドの病原性シグナル伝達経路の破壊以外に、シムフィラムの機構上の利点を表しています。mTORシグナル伝達におけるこれらの改善は、インスリンが結合してシグナル伝達を開始すると、FLNAがインスリン受容体から解離できるようになり、FLNAのコンフォメーションが逆転したことによる場合もあります。mTORは加齢に伴う細胞の変化に寄与するため、インスリン感受性の改善と同時にシムフィラムによるmTORの過剰活性化の抑制は、特定の老化プロセスを遅らせ、アルツハイマー病のこの病理学的特徴を弱め、アルツハイマー病や加齢における脳機能と記憶に役立つ可能性があります。このmTORの研究論文は、ニューヨーク市立大学のホアウ・ヤン・ワン、ゼ・ペイ、クオ・チェ・リー、臨床試験プロトコルの研究者であるボリス・ニコロフ、タマラ・ドーナー、ジョン・プエンテ、キャッサバ・サイエンスのリンゼイ・バーンズが共同執筆し、掲載されました 高齢化の最前線、査読付きジャーナル。
シムフィラム医薬品開発
FDAへのINDの提出、初期臨床研究における医薬品の安全性
10年以上にわたり、安全性薬理学、毒物学、遺伝毒性、生物分析法に関する必要な研究を含め、基礎研究、体外研究、前臨床試験を実施してきました。これには、シムフィラムに関するFDAへの治験薬(IND)申請の成功を支援してきました。2017年、私たちはシムフィラムのINDをFDAに提出しました。
2017年にFDAが当社のINDを承認した後、健康なヒトボランティアにおけるシムフィラムの安全性、投与量、薬物動態プロファイルを調査しました。ヒト初の第1相試験の設計は、規制上のフィードバック、臨床的および科学的根拠、および以前に実施された前臨床試験と体外試験の観察結果に基づいていました。第1相試験では、24人の健康なヒトボランティア(18人のシムフィラム、6人のプラセボ)を対象に、米国の1か所でシムフィラムの安全性、耐容性、薬物動態を評価しました。研究対象には、50、100、または200 mgのシムフィラムまたはプラセボを単回経口投与しました。この薬は安全で耐容性が高いようです。重要なのは、simufilamは治療に関連した副作用も用量を制限する安全性の所見も示さなかったということです。薬物動態学的測定により、小分子であるシムフィラムが急速に吸収されることが示されました。50〜200mgの全用量範囲で用量の比例が観察されました。
フェーズ2の臨床研究
2019年、私たちはNIHの一部門である国立老化研究所(NIA)からの多大な支援を受けて、米国でシムフィラムの最初の入院患者、臨床的概念実証、非盲検第2a相試験を完了しました。軽度から中等度のアルツハイマー病の患者13人を対象としたこの小規模な研究では、シムフィラムを28日間投与したところ、アルツハイマー病の病理、神経変性、神経炎症の特定の探索的バイオマーカーが大幅に改善されました(p
2020年9月、アルツハイマー病におけるシムフィラムを用いた第2b相試験の最終結果を報告しました。NIHが資金提供したこの臨床研究では、50mgまたは100mgのシムフィラムを1日2回28日間治療したアルツハイマー病患者は、統計的に有意な結果を示しました(p
私たちの第1相または第2相試験には観察可能な用量制限効果がなく、強力な科学的根拠と複数の査読済みの出版物および研究助成金賞を考慮して、シムフィラムはアルツハイマー病の治療のための治験薬としてのさらなる評価にとって好ましい原理実証を示したと判断しました。
24か月間の臨床安全性調査
24か月にわたる臨床安全性研究の戦略的価値の多くは、simufilamの患者さんの長期的な安全性プロファイルをサポートすることです。私たちは、適切に設計された、長期にわたる安全性調査は、慎重なリスク管理であると信じています。大規模で費用のかかる第3相臨床試験プログラムを実施している間、臨床結果は、医薬品開発に内在するリスクと不確実性の情報提供と管理に役立つ場合があります。
2020年3月、アルツハイマー病患者を対象に、主薬候補であるシムフィラムの臨床安全性試験を開始しました(NCT04388254)。この研究は、NIHからの研究助成金によって部分的に資金提供されました。この研究は、24か月にわたるアルツハイマー病患者のシムフィラムの長期的な臨床安全性と耐容性を評価するために設計されました。この研究には、アルツハイマー病の臨床研究で広く使用されている認知尺度であるADAS-Cog11スコアの平均変化という、事前に指定された探索的有効性エンドポイントが含まれていました。この研究では、米国の16の臨床施設から200人以上の軽度から中等度のアルツハイマー病(ミニメンタルステート検査(MMSE)16-26)の患者を登録しました。アルツハイマー病は進行性疾患で、病気の重症度は通常MMSEスコアで評価されます。この研究では、軽度の患者はMMSE 21-26で、中等度の患者はMMSE 16-20です。
24か月にわたる安全性調査を3つの連続フェーズで実施しました。
| ● |
12か月間の非盲検治療フェーズ、その後 |
| ● |
6か月間のランダム化プラセボ対照離脱期(以前は「認知維持研究」またはCMSと呼ばれていました)、その後 |
| ● |
さらに6ヶ月の非盲検治療。 |
研究参加者は、非盲検治療段階でシムフィラム経口錠100mgを1日2回投与され、ランダム化離脱期にはシムフィラムまたはそれに対応するプラセボが投与されました。非盲検試験デザインでは、医療提供者と患者の両方が、薬物治療が行われていることを知っています。
12か月間の非盲検シムフィラム治療を完了したすべての研究参加者は、6か月のランダム化プラセボ対照離脱期に参加する資格がありました。同様に、ランダム化プラセボ対照離脱段階を完了したすべての研究参加者は、さらに6か月間の非盲検治療を受ける資格がありました。
12か月間の非盲検治療段階の研究結果
2023年1月、安全性研究の12か月間の非盲検治療フェーズの肯定的な結果を発表しました。事前に指定された探索的有効性エンドポイントは、アルツハイマー病の臨床研究で広く使用されている認知尺度であるADAS-Cog11のベースラインの変化でした。その他の探索的エンドポイントには、認知障害ごとに病期を評価するミニメンタルステート検査(MMSE)、認知症関連の行動を評価する神経精神医学インベントリ(NPI)、老人性うつ病尺度(GDS)などがあります。エンドポイントはベースライン(研究開始)と12か月目に測定されました。
トップラインの結果 — 平均スコア、12か月目までのベースライン(MMSEを除いて、低いほど良いです):
| ● |
ADAS-Cog11のスコアが19.1(±9.2)から19.6(±13.3)に変更されました |
| ● |
MMSEスコアは21.5(±3.6)から20.2(±6.4)に変更されました |
| ● |
NPI10のスコアが3.2 (±4.6) から2.9 (±4.6) に変更されました |
| ● |
GDSスコアは1.8(±1.8)から1.4(±1.9)に変更されました |
回答分析 — 12か月目までのベースライン
| ● |
ADAS-coGスコアは47%の患者で改善しました。このグループの平均変化は-4.7(±3.8)ポイントでした(低いほど良い)。 |
| ● |
さらに23%の患者で、ADAS-coGの低下は5ポイント未満でした。このグループの平均変化は2.5(±1.4)ポイントでした。 |
| ● |
NPI10スコアがゼロの患者は 42% から 54% に増加し、シムフィラムを1年間服用した後に認知症関連の神経精神症状が減少したことを示しています。 |
有効性エンドポイントの統計分析には、完全分析セット(FAS)集団(N=216)が使用されました。軽度サブグループと中等度サブグループでは、12か月目までのベースラインでADAS-COGの平均スコアの変化に顕著な違いが見られました(低いほど良い)。
| ● |
で マイルドサブグループ(MMSE 21-26)では、ADAS-COGの平均スコアが15.0(±6.3)から12.6(±7.8)に向上しました |
| ● |
で 中程度サブグループ(MMSE 16-20)では、ADAS-COGの平均スコアが25.7(±9.2)から30.1(±13.1)に悪化しました |
シムフィラムを服用している軽度の患者におけるADAS-coGの1年間の改善は、他の多くの研究で予想されていた過去のプラセボ減少率の予想範囲をはるかに超えていると考えています。図2:初期疾患(MCI+軽度)および軽症におけるADAS-coGの歴史的な低下。
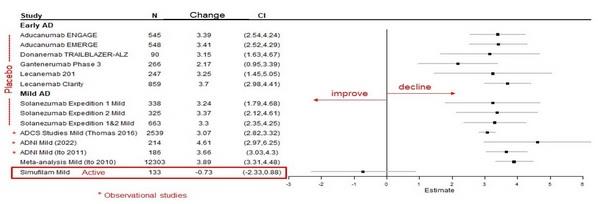
図 1: シムフィラムの統計モデルと、初期疾患および軽症におけるADAS-coGの過去1年間のプラセボ減少との比較。独立した生物統計学者であるペンタラ社による森林プロット。データは、早期(MCI+軽度)および軽度のアルツハイマー病患者を対象に他のスポンサーが実施した非ランダム化研究(ADNIなど)およびランダム化比較試験から得られました'の病気。
安全性データ-シムフィラム100mg錠を1日2回、非盲検試験のこの治療段階では、安全で耐容性も良好であることがわかりました。薬物関連の重篤な有害事象はありませんでした。COVID-19(12%)、尿路感染症(10%)、頭痛(9%)の3つの治療に伴う有害事象(TEAE)が研究対象患者の 7% 以上で発生しました。報告されているTEAEは、少なくとも1回の薬物投与を受けたすべての治験患者に基づいています。
バイオマーカーデータ-この非盲検治療段階では、ベースライン時と6か月の治療後に腰椎穿刺を受けることに同意した25人の患者から収集したCSFから、探索的バイオマーカーを分析しました。CSFサンプルは、ニューヨーク市立大学の共同研究員によって盲目的に分析されました。
以下に示すP値は、ベースラインレベルとペアT検定による6か月のレベルとの比較です。
| ● |
疾患病理学のCSFバイオマーカー、t-タウとp-tau181は、それぞれ 38% と 18% 減少しました(両方ともp |
| ● |
神経変性、ニューログラニン、ニューロフィラメント軽鎖(NfL)のCSFバイオマーカーは、それぞれ 72% と 55% 減少しました(どちらもp |
| ● |
神経炎症のCSFバイオマーカー、STRem2とYKL-40は、65%と44%減少しました(どちらもp |
6か月間のランダム化離脱研究フェーズ(「認知維持研究」)の研究結果
2021年5月、私たちは、以前は「認知維持研究」またはCMSと呼ばれていた24か月の安全性調査の無作為化離脱段階を開始しました。CMSには、無作為化された離脱試験デザインがあります。国際ヒト用医薬品の技術要件調和評議会(ICH)は、無作為化離脱試験で次のように説明しています。 」テストを受ける被験者 指定された期間の治療は、試験治療による継続治療またはプラセボ(つまり、積極的な治療の中止)にランダムに割り当てられます。 ...継続的な治療を受けているグループとプラセボにランダム化されたグループの間に何らかの違いがあれば、積極的な治療の効果が発揮されます。。」
この研究の無作為化離脱期の設計は、薬物治療を続けるアルツハイマー病患者と薬物治療を中止した患者の認知と健康状態に対するシムフィラムの効果を評価することを目的としていました。これは、軽度から中等度のアルツハイマー病患者を対象としたシムフィラムの二重盲検、無作為化、プラセボ対照試験でした。治験患者は、6か月間、シムフィラムまたはプラセボにランダム化(1:1)されました。CMSに登録するには、患者は以前にシムフィラムによる非盲検治療を12か月以上完了している必要があります。最終登録者は157人でした。図3を参照してください。
図 3.ランダム出金フェーズ(CMS)の設計

トップライン結果-6ヶ月間のシムフィラム治療は、軽度から中等度のアルツハイマー病(MMSE 16-26)患者の認知機能低下をプラセボと比較して38%遅らせました。プラセボ群はADAS-COGで1.5ポイント低下し、この群はすべての測定時点で低下しました。シムフィラム群はADAS-COGで0.9ポイント下落し、6か月目には薬剤の支持率が 38% 低下しました(95%CI、— 2.1~1.0、サンプルサイズでは有意ではありません)。表1とグラフ1を参照してください。
表1:ランダム化離脱研究の結果—認知変化、フル分析セット(FAS)
| フル分析セット |
シムフィラム 100 mg (N = 78) |
プラセボ (N = 77) |
数値 違い |
パーセント差 |
| 6ヶ月の変更 ADAS-COG |
0.9ポイント 辞退します |
1.5ポイント 辞退します |
—0.6 |
38% は薬物に賛成です |
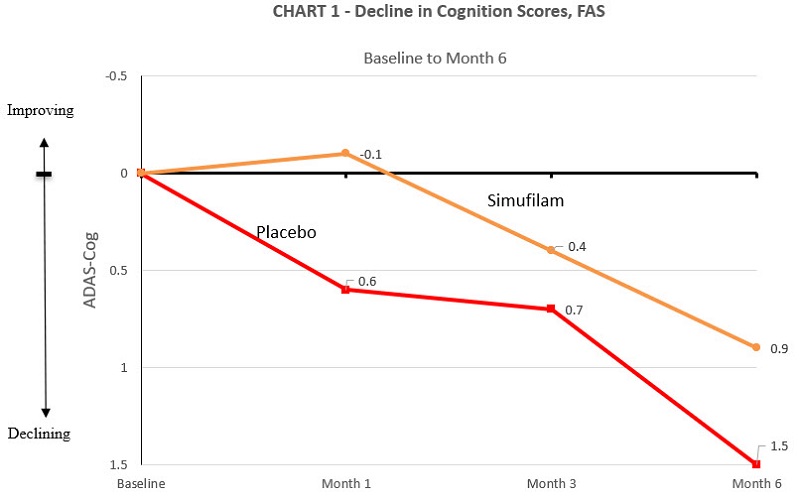
無作為化離脱期にランダム化したところ、ベースラインのMMSEスコアは、シムフィラム群とプラセボ群でそれぞれ18.6と18.1でした。ベースラインのADAS-coGスコアの平均ベースラインスコアは、シムフィラム群とプラセボ群でそれぞれ19.3と21.9でした。
軽度のアルツハイマー病患者に有利なシムフィラムの薬物効果'の病気 — Simufilamを6か月間治療すると、軽度のアルツハイマー病では、プラセボと比較して認知機能の低下が200%以上遅くなりました。プラセボを服用している軽度のアルツハイマー病(MMSE 21-26)の患者は、グループ全体で6か月にわたってADAS-COGの投与量が0.6ポイント減少しました。シムフィラムを服用している軽度のアルツハイマー病患者は、グループで6か月で0.6ポイント改善し、薬剤の方が205%の差がありました(95%CI、— 2.6〜0.4、サンプルサイズでは有意ではありません)。表2とグラフ2を参照してください。
表2:ランダム化離脱試験の結果-認知の変化、軽度の患者
| 軽度の患者 |
シムフィラム 100 mg (N= 40) |
プラセボ (N= 36) |
数値 違い |
パーセント差 |
| の 6 か月間の変更 ADAS-COG |
0.6ポイント 改善 |
0.6ポイント 辞退します |
—1.1 |
205% は薬に賛成です |
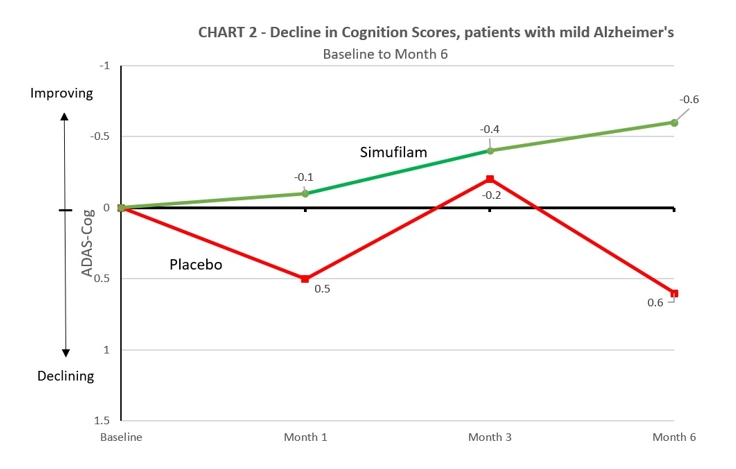
研究の無作為化離脱期にランダム化したところ、軽度の患者の平均ベースラインMMSEスコアは、シムフィラム群とプラセボ群でそれぞれMMSE 24.0とMMSE 24.1でした。軽症患者のベースラインADAS-COGスコアの平均ベースラインスコアは、シムフィラム群とプラセボ群でそれぞれ11.0と11.2でした。
シムフィラムを18か月間使用すると、軽度のアルツハイマー病の認知が安定しました'の病気 — 非盲検シムフィラムを12か月間服用した後、軽度のアルツハイマー病(MMSE 21-26)の76人の患者が無作為化離脱期に登録し、シムフィラム(N=40)またはプラセボ(N=36)のいずれかを6か月間投与するようにランダム化されました。CMSでシムフィラムにランダム化された軽度の患者は、グループで18か月間、ADAS-coGスコアに実質的な低下は見られませんでした。これは、認知が安定していることを示しています。無作為化離脱期にプラセボにランダム化された(そのため、シムフィラム治療を6か月間中止した)軽度の患者は、グループで18か月間でADAS-CoGで0.8ポイント減少しました。図4を参照してください。
図 4.アルツハイマー病(MMSE 20-30)では、プラセボ群とシムフィラム治療を比較した結果、18か月間のADAS-coGの歴史的な減少が見られました。
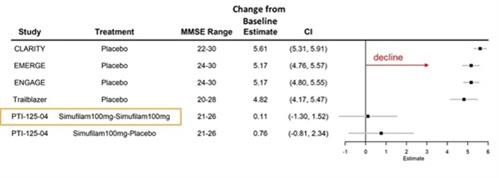
図4:独立系生物統計学者であるペンタラ社による森林プロット。データは、アルツハイマー病について他のスポンサーが実施したモノクローナル抗体のランダム化比較試験(MMSE 20-30)のプラセボグループから提供されました。示されている結果は、レカネマブのCLARITY P3試験、アデュカヌマブに関するEMERGEおよびENGAGE P3試験、ドナネマブのTRAILBLAZER P3試験、この図では、無作為化離脱期を「PTI-125-04」試験と呼んでいます。「シムフィラム100MG-シムフィラム100mg」は、両方のオープンでシムフィラムを投与された患者を指します標識段階とランダム化離脱期。「Simufilam100MG-プラセボ」とは、オープンラベル段階でシムフィラムを、ランダム化離脱期にプラセボを投与された患者を指します。
安全性データ— シムフィラム100mg錠を1日2回投与したところ、24か月の安全性試験の6か月にわたる無作為化の中断期に安全で耐容性が良好であることが示されました。
ディスカッション—12か月間の非盲検シムフィラム治療を完了した患者は、無作為化離脱段階に参加するよう招待されました。非盲検シムフィラムによる12か月間の治療で、長引く薬物効果がある場合は、それを取り除くためにどれくらいのウォッシュアウト期間が必要かは不明です。軽度から中等度のアルツハイマー病患者を対象としたこの小規模なランダム化離脱試験の段階では、シムフィラムは薬の安全性も良好で、ADAS-CoGの認知機能低下を6か月にわたって38%遅らせました(統計的に有意ではありません)。影響は軽度の患者で顕著でした。各アームのサイズが小さいことを考えると、ベースラインのMMSEとADAS-COGの平均スコアはほぼバランスが取れていました。
24か月の安全性調査の調査結果
2024年2月、私たちは24か月にわたる臨床安全性研究のトップライン結果を報告しました。24か月目までのベースラインのADAS-COGスコアの平均変化は、次のことを示しています。
| ● |
シムフィラム治療を2年間継続して受けた(n=47)軽度のアルツハイマー病患者は、グループ全体でADAS-COGスコア(±1.51 SE)が低下しませんでした。 |
| ● |
シムフィラム治療を非継続的に受けた(n=40)軽度のアルツハイマー病患者は、グループ全体でADAS-COG(±1.65 SE)で1ポイント減少しました。非継続治療は、非盲検薬で1年間、プラセボで6か月、非盲検薬で6か月間でした。 |
| ● |
軽度のアルツハイマー病患者では、継続治療群と非継続治療群の分離が最も大きかったのは、6か月の無作為化プラセボ対照離脱期の終わりでした。 |
| ● |
シムフィラム治療を2年間継続して受けた(n=32)中等度のアルツハイマー病患者は、グループ全体でADAS-COG(±1.91 SE)で11.05ポイント減少しました。 |
軽度のアルツハイマー病(n=87)の患者は、10件の例外を除いて、MMSE 21-26で24か月の研究を開始しました。中等度のアルツハイマー病の患者は、MMSE 16-20で24か月間の研究を開始しました。1人の患者がMMSE 15で治療を受けました。
事前に指定された認知エンドポイントは、臨床試験結果の複雑な統計分析を専門とする独立系コンサルティング会社によって、フル分析セット(FAS)で分析されました。FAS集団は、少なくとも1回の治療を受け、ベースライン評価とベースライン後の評価の両方を受けたすべての研究参加者で構成されています。(FASデータは研究の各フェーズに固有であるため、24か月の研究のFASは他の研究フェーズのFASとは異なる場合があります)。
シムフィラムを24か月連続(n=47)投与された軽度の患者は、グループで24か月目までのベースラインであるADAS-CoG11(±1.51 SE)で平均0.07ポイントの変化を示しました。
12か月間の非盲検シムフィラムの投与後、6か月のランダム化プラセボ対照離脱期にプラセボを投与し、続いてさらに6か月間の非盲検シムフィラム(n=40)を受けた軽度のアルツハイマー病患者は、24か月目までのベースラインであるADAS-Cog11(±1.65 SE)で平均1.04ポイント減少しました。図 4Bを参照してください。
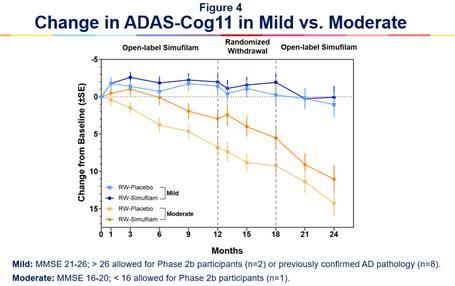
ベースライン時の平均ADAS-COGスコアは、継続的投与と非継続投与を受けた軽度のアルツハイマー病患者のグループでほぼバランスが取れていました(それぞれ15.2と14.6)。
安全性データ— この研究では、シムフィラム100mg錠を1日2回経口投与しても安全で耐容性が高いことが示されました。薬物関連の重篤な有害事象はありませんでした。最も一般的な治療による有害事象(TEAE)は、Covid-19と尿路感染症でした。
フェーズ2(EOP2)の終了:FDAとのミーティング
2021年1月、米国食品医薬品局(FDA)とシムフィラムのフェーズ2(EOP2)終了会議を開催しました。このEOP2会議の目的は、アルツハイマー病認知症を治療するための重要な第3相プログラムの重要な要素について一般的な合意を得ることでした。FDAの出席者には、臨床科学担当副センター長兼新薬局上級顧問のロバート・テンプル医学博士、神経科学局長のビリー・ダン医学博士、神経科部長のエリック・バスティングス医学博士などが含まれていました。
2021年2月、私たちはEOP2会議が無事終了したことを発表しました。公式の議事録は、私たちとFDAがシムフィラムの第3相臨床プログラムの重要な要素について意見が一致していることを確認しています。FDAは、アルツハイマー病におけるシムフィラムの臨床的有効性の証拠を示すには、完成した第2相プログラムと、継続的かつ明確に定義された第3相臨床プログラムで十分であることに同意しました。認知力を評価するために別々の臨床尺度を使用することについても合意がありました(ADAS-COG)1) と機能 (ADCS-ADL)2)は有効性の適切なエンドポイントです。IADR3 は、ADAS-CogとADCS-ADLのスコアを組み合わせた有効性エンドポイントで、認知と健康機能の単一の複合測定値を提供します。他のエンドポイントにはNPIが含まれます4。
1 ADAS-COG = アルツハイマー'の疾病評価尺度 — 認知サブスケール、認知の尺度
2 ADCS-ADL = アルツハイマー'の疾病共同研究 — 健康機能の尺度、日常生活の活動
3iADR = 統合型アルツハイマー'の疾病評価尺度、認知と健康機能の複合尺度
4NPI = 認知症関連行動の有無と重症度を評価する臨床ツール、神経精神医学インベントリ
特別プロトコルアセスメント
2021年8月、私たちは両方の第3相試験について特別プロトコル評価(SPA)の下でFDAと合意に達したと発表しました。これらのSPA契約は、アルツハイマー病患者の治療のためのシムフィラムの第3相試験プロトコルの主要な設計上の特徴をFDAが検討し、合意したことを文書化しています。
SPA契約は、プロトコル設計全体の特定の重要な要素(エントリー基準、用量の選択、エンドポイントなど)の妥当性と受容性についてFDAが同意していることを示しています。これらの要素は、私たちが計画しているアルツハイマー病におけるシムフィラムの第3相試験を確実に実現するために重要です
将来の規制当局への提出およびマーケティング申請の裏付けとなる適切で十分に管理された研究と見なされる可能性があります。
SPAの下での最初の臨床研究プロトコルのタイトルは」軽度から中等度のアルツハイマー病の被験者を対象としたシムフィラムの1回投与の安全性と有効性を評価する第3相、無作為化、二重盲検、プラセボ対照、並行グループ、52週間の研究'の病気。」
SPAの下での2番目の臨床研究プロトコルのタイトルは」軽度から中等度のアルツハイマー病の被験者を対象としたシムフィラムの2回投与の安全性と有効性を評価するフェーズ3、無作為化、二重盲検、プラセボ対照、並行グループ、76週間の研究'の病気。」
フェーズ3臨床プログラムの概要
私たちの第3相プログラムは、軽度から中等度のアルツハイマー病認知症の患者を対象としたシムフィラムの2件の大規模二重盲検ランダム化プラセボ対照試験で構成されています。どちらの研究も、治療期間中の認知と機能の変化を測定するように設計されています。この臨床プログラムのいくつかのハイライトを図5にまとめています。
プレミア・リサーチ・インターナショナルは、当社の第3相臨床プログラムの実施を支援するCROです。私たちの第3相臨床施設は現在、米国、カナダ、プエルトリコ、オーストラリア、韓国にあります。
図 5.第3相臨床プログラムのまとめ

リシンク・アルツとリフォーカス・アルツ
2021年秋に、軽度から中等度のアルツハイマー病認知症を対象としたシムフィラムに関する2つの第3相試験の開始を発表しました。2023年11月、私たちは両方の第3相試験への患者登録の完了を発表しました。合計で約1,900人の患者がこれらの研究にランダム化されています。ランダム化された患者の約70%が、軽度のアルツハイマー病(MMSE 20〜27)の第3相試験に参加しました。
RETHINK-ALZと呼ばれる最初の第3相試験は、シムフィラム100mgの経口投与の安全性と有効性を52週間にわたって評価することを目的としています(NCT04994483)。RETHINK-ALZの第3相試験の詳細は次のとおりです。
| ► |
この研究には約800人の患者がランダム化されています。 |
| ► |
患者は、100mg錠のシムフィラムまたはそれに対応するプラセボを1日2回ランダム化(1:1)されます。 |
| ► |
患者は52週間治療されます。 |
| ► |
有効性のエンドポイントは、認知尺度であるADAS-Cog12、機能的尺度であるADCS-ADLとIADR(ADAS-CogとADCS-ADLのスコアの組み合わせ)です。3つの臨床測定値はすべて、アルツハイマー病の試験における標準的な心理測定評価ツールです。 |
| ► |
その他のエンドポイントには、疾患の血漿バイオマーカーや、認知症関連行動の有無と重症度を評価する臨床ツールであるNPIなどがあります。 |
|
| ► |
有効性の中間分析は予定されていません。 |
REFOCUS-ALZと呼ばれる私たちの2番目の第3相試験は、100mgと50mgの経口シムフィラムの安全性と有効性を76週間にわたって評価することを目的としています(NCT05026177)。REFOCUS-ALZの第3相試験の詳細は次のとおりです。
| ► |
この研究には約1,100人の患者がランダム化されています。 |
| ► |
患者は、1日2回、100mg錠、50mg錠、または対応するプラセボをシムフィラムに無作為化(1:1:1)されます。 |
| ► |
患者は76週間治療されます。 |
| ► |
有効性のエンドポイントは、認知尺度であるADAS-Cog12、機能的尺度であるADCS-ADLとIADR(ADAS-CogとADCS-ADLのスコアの組み合わせ)です。3つの臨床測定値はすべて、アルツハイマー病の試験における標準的な心理測定評価ツールです。 |
| ► |
その他のエンドポイントには、疾患のバイオマーカー、MRI画像、認知症関連行動の有無と重症度を評価する臨床ツールであるNPIなどがあります。 |
| ► |
有効性の中間分析は予定されていません。 |
フェーズ3のエントリー基準
私たちの第3相臨床試験では、適格基準は患者が研究に参加するために満たさなければならない要件です。これらの要件は、年齢、病気や病期、一般的な健康状態、その他の重要な要素などの特定の要因に関して、研究参加者がグループとして実質的かつ緊密に一致していることを確認するのに役立ちます。適格基準には、研究に参加するために必要な選択基準と、参加を妨げる除外基準があります。図 5Aを参照してください。

プラズマリン酸化タウ181(p‐tau181)の使用
血漿p‐tau181はアルツハイマー病の神経病理学のバイオマーカー修飾因子だと私たちは信じています。RETHINK-ALZとREFOCUS-ALZの第3相試験では、軽度から中等度のアルツハイマー病患者を認定するために、安全性に関連しない「研究用途のみ」の探索的p-tau181プラズマアッセイを使用します。私たちが使用しているプラズマアッセイは、年齢、APOE遺伝子の状態、複雑なアルゴリズムに頼って結果を出しません。P-Tau181のテストは、独立した商業研究所によって実施されました。
データおよび安全監視委員会(DSMB)
2024年3月、私たちはDSMBの別の定例会議で、両方の第3相試験を変更せずに計画どおりに継続することが推奨されたと発表しました。これは、2023年9月のDSMB会議の調査結果と一致していました。DSMBは患者の安全のみを確認しました。薬の効能は評価しませんでした。
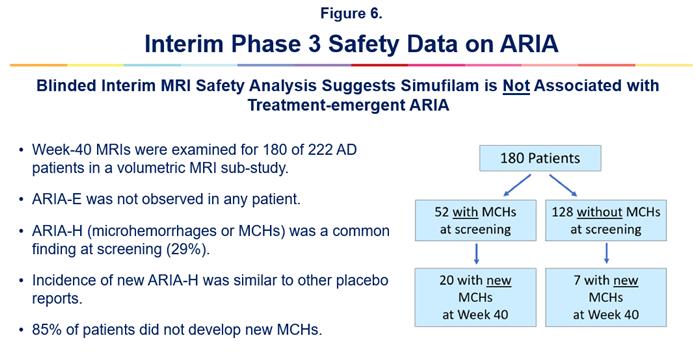
暫定MRI安全性データ
2023年10月、シムフィラムの第3相臨床試験に登録されているアルツハイマー病患者の暫定的な磁気共鳴画像法(MRI)脳データに基づく、潜在的に重要な安全性の発見を発表しました。これらのMRIデータは、シムフィラムが治療によって誘発されたアミロイド関連の画像異常、またはARIAとは関連していないことを示唆しています。MRIはすべて、独立した理事会認定の神経放射線科医によってARIAの分析を受けました。
ARIAは、脳の腫れや脳出血など、さまざまな脳MRI画像異常を表すために使用される医学用語です。ARIAは、アミロイドに対するモノクローナル抗体と呼ばれる種類の薬を服用しているアルツハイマー病患者の既知の危険因子です。そのクラスの薬とは対照的に、シムフィラムは低分子(経口)薬の候補です。
新しい安全性の知見は、軽度から中等度のアルツハイマー病を対象としたシムフィラムの76週間にわたる第3相臨床試験であるREFOCUS-ALZに登録された180人のアルツハイマー病患者を対象とした盲検サブスタディで、40週目に行われた脳MRIの独立した暫定的な神経放射線学的評価に基づいています。最終的なMRIデータは、この第3相試験の終了時に発表される予定です。図 6を参照してください。
フェーズ3臨床プログラムの状況
私たちの第3相試験では、ベースライン時点で軽度から中等度のアルツハイマー病患者を合計約1,900人(MMSE 16-27)にランダム化しました。52週間の研究(RETHINK-ALZ)では約800人の患者がランダム化され、76週間の研究(REFOCUS-ALZ)では約1,100人の患者がランダム化されました。
私たちの第3相試験に登録された患者の約70%が軽度のアルツハイマー病(MMSE 20-27)と診断され、残りの患者は中等度の病気(MMSE 16-19)で研究に参加します。これらの試験でランダム化された患者の分布は数値的に軽度の患者に偏っているため、医薬品の安全性と有効性を評価するには、主に軽症患者の結果に頼ることが予想されます。
435人以上の患者さんが52週間にわたるRETHINK-ALZ試験を完了しました。300人以上の患者が76週間にわたるREFOCUS-ALZ試験を完了し、合計で735人以上が修了しました。
フェーズ3プログラムの有効性データはすべてブラインドされたままです。有効性の結果に関する中間分析はありません。
52週間にわたる調査(RETHINK-ALZ)では、2024年末頃にトップラインのデータが表示されると予想しています。
76週間にわたる調査(REFOCUS-ALZ)のトップラインデータの読み出しは、2025年の半ば頃になると予想しています。
私たちは、統計分析計画(SAP)を最終決定するためにFDAと話し合いを開始しました。これは、第3相試験で収集された有効性データに関して、独立した生物統計学者が行う詳細な分析を定義する正式な文書です。SAPには、対象となる臨床試験分析、使用される統計的手法とモデル、分析対象の母集団、分析するデータ変数、欠落しているデータを考慮する方法、統計モデルに含める共変量の説明、およびその他の統計的要因に関する詳細な技術的詳細と説明、および説明が含まれています。これらはすべて、有効性の結果を明らかにする前に、将来的に定義、文書化、最終化されます。
フェーズ3プログラムのオープンラベル・エクステンション・スタディ
2022年10月、私たちはフェーズ3プログラムのオープンラベル延長研究の開始を発表しました。この研究は、シムフィラムの第3相試験を無事に完了し、他の入国基準を満たすアルツハイマー病患者に、最大1年間経口シムフィラムの無料アクセスを提供することを目的としています。
この非盲検延長試験により、52週間にわたって1日2回、経口シムフィラム100mgの長期臨床安全性データがさらに得られると予想しています。患者や医師が非盲検延長試験に参加する義務はありません。各臨床試験施設と各患者は、この非盲検延長試験に参加するかどうかを選択します。
この研究への患者登録は2022年11月に始まりました。現在までに、655人以上の患者が非盲検延長試験に参加しました。
フェーズ3の医薬品供給
エボニックインダストリーズ社とシムフィラム用の医薬品供給契約を結んでいます。この契約に基づき、エボニックは臨床グレードの大規模なシムフィラムを供給しており、今後も供給していく予定です。エボニックは、医薬品原料の世界最大級の受託開発・製造会社です。他のベンダーは、第3相医薬品供給のための添加剤、完成した剤形(シムフィラム錠など)、医薬品包装、パッケージラベル、およびサプライチェーンのその他の重要なコンポーネントを供給しています。
サヴァドX
私たちの治験薬候補であるSavAdXは、少量の血液サンプルからアルツハイマー病の存在を検出することに焦点を当てた初期段階のプログラムです。ビジネス、技術、人事上の理由から、私たちは引き続き、新しい診断候補であるSavadXよりも、新薬候補であるシムフィラムの開発を優先しています。SavADXは研究用途のみで、安全性に関連しない探索的バイオマーカーです。SavADXに関連する開発活動は、私たちの研究予算の1%未満しか占めていません。
SavADXの規制経路には、最終的には、さまざまな健康患者や疾患のある患者集団における感受性、特異性、その他の変数の証拠を裏付ける正式な分析検証研究や臨床研究が含まれる可能性があります。私たちはそのような調査を行っておらず、2024年にそのような調査を実施する予定もありません。
SavADXは現在、抗体ベースの変化フィラミンA(FLNA)検出システムとして設計されています。第三者と協力して、FLNAを検出するための質量分析法の使用、つまり抗体を使用しない方法を評価しています。これらの評価は継続中です。
私たちの科学を他の適応症への拡大
タンパク質のミスフォールディングは、さまざまな生物学的プロセスや病気で発生します。私たちは、神経変性と神経炎症に関する科学的洞察と、分子生物学、生化学、画像学の高度なツールを活用して、科学を他の疾患にも拡大するかもしれません。新しい適応症と新薬開発アプローチは、アルツハイマー病への当初の焦点を補完するかもしれません。
前臨床プログラムは常に先見の明があり、時には革新的で、多くの場合生物医学的可能性が高い。定義上、このようなプログラムは探索的で危険です。ほとんどの前臨床プログラムは、費やされた労力やリソースに関係なく、科学的な理由やその他の理由で失敗します。これらの理由から、製品候補のパイプラインにとって重要になるまで、前臨床プログラムを開示するつもりはありません。
私たちは神経変性プログラムの全世界の権利を所有しています
私たちは、米国およびその他の国の特許、特許出願、技術、企業秘密、ノウハウなどの知的財産を所有しています。私たちが所有またはライセンスしている特許、意匠、商標、その他の所有権の保護は、私たちの成功と競争力にとって重要です。私たちは、特許やその他の知的財産権の全体的な保護は重要であると考えており、これらの権利を侵害から保護するよう努めています。
私たちは、とりわけ、当社の技術と製品、およびそれらの用途に関する米国および外国の特許および特許出願を出願し、手続きすることにより、当社の技術を保護しようとしています。私たちの特許戦略の焦点は、神経変性治療プログラムの技術に対する知的財産権を確保し、維持することです。
Simufilamは社内で発見、設計され、2008年頃から現在まで行われた研究活動の中で、私たちの学術協力者によって特徴づけられました。SavADXは、外部の協力者と共同で社内で開発されています。私たちは、第三者へのロイヤルティ義務なしに、これらの医薬品、診断資産、および関連技術に対する独占的な全世界的権利を所有しています。シムフィラムとアルツハイマー病やその他の神経変性疾患に対するシムフィラムの使用に関する当社の特許保護は、現在2039年まで有効で、9件の米国特許が発行されています。さらに、2033年まで続く特定のがんの治療に使用するシムフィラムに関しては特許保護を受けています。私たちの特許遺産には、さらに、関連する化合物や治療に関する特許と特許出願が含まれています。米国での申告のそれぞれについて、対応する外国申告が行われています。
財務概要
私たちはまだ製品販売から収益を上げていません。2024年3月31日現在、当社の累積赤字は3億5,570万ドルです。これらの損失は主に、研究開発活動に関連して発生した費用、給与、その他の人件費および一般的な企業経費によるものです。研究開発活動には、当社の製品候補に関連する臨床用品だけでなく、臨床試験や前臨床試験の費用も含まれます。給与やその他の人件費には、ストックオプションに関連する株式ベースの報酬や、従業員および非従業員に付与されるその他の株式報奨が含まれます。当社の業績は、製品候補の臨床試験の登録率、前臨床活動のタイミング、および臨床用品の必要性の結果として、期間ごとに大きく変動する可能性があります。
今後数年間、事業に多額の現金資源を使い続けると予想しています。営業活動や資本支出に必要な現金要件は、今後次の理由で増加する可能性があります。
| ● |
現在進行中のフェーズ3プログラムをsimufilamで継続してください。 |
|
| ● |
シムフィラム用の大規模サプライ品の製造。 |
|
| ● |
製品候補について他の前臨床研究や臨床研究を実施します。 |
|
| ● |
製品候補の規制当局の承認を求める。 |
|
| ● |
製品候補の開発、製剤、製造、商品化を行います。 |
|
| ● |
追加の内部システムを実装し、新しいインフラストラクチャを開発します。 |
|
| ● |
追加の製品や技術を取得またはライセンス供与したり、当社の技術の使用を拡大したりします。 |
|
| ● |
私たちの知的財産の維持、保護、範囲の拡大を行います。 |
|
| ● |
米国政府からの問い合わせを含む、法的手続きや請求に関連する費用が発生します。そして |
|
| ● |
追加の人員を雇います。 |
製品の収益は、製品候補の規制当局の承認を受け、成功裏にマーケティングできるかどうかにかかっています。私たちの開発努力が規制当局の承認と製品候補の商品化に成功した場合、医薬品の直接販売による収益や、将来の協力者に医薬品のライセンス供与を行う場合は、ライセンス製品の販売によるライセンス料とロイヤルティの受領から収益を生み出すことを期待しています。私たちは、社内プログラムと共同プログラムを組み合わせて研究開発プログラムを実施しています。私たちは、製品開発活動の大部分を、大学、特定の協力者、受託開発製造機関(CDMO)、CRO、臨床研究施設との取り決めに頼っています。
私たちは研究開発活動のほとんどすべてをシムフィラムの開発に集中させています。治験薬候補であるSavADXの研究開発費は、提示された期間の研究開発費総額の1%未満でした。次の表は、研究開発費をカテゴリ別にまとめたものです(千単位)。
| 3 か月が終わりました |
||||||||
| 3 月 31 日 |
||||||||
| 2024 |
2023 |
|||||||
| 臨床試験 |
$ | 11,292 | $ | 18,264 | ||||
| 前臨床プロジェクト |
1,132 | 1,070 | ||||||
| 化学、製造、管理コスト(「CMCコスト」) |
795 | 714 | ||||||
| 人事関連 |
1,645 | 1,425 | ||||||
| 株式ベースの報酬 |
973 | 389 | ||||||
| その他 |
396 | 258 | ||||||
| $ | 16,233 | $ | 22,120 | |||||
臨床試験費用には、当社のCROの費用が含まれます。CMCの費用には、当社の受託開発および製造組織に関連する費用が含まれます。研究開発費には、報酬、請負業者の手数料、消耗品のほか、設備などの割り当てられた一般的な費用が含まれます。
製品候補の臨床開発の完了日と開発完了までの費用を見積もることは、非常に投機的で主観的です。医薬品は、研究、開発、商品化にかなりの時間がかかります。新薬開発の臨床研究部分だけでも、通常は数年に及びます。第3相臨床試験への患者のスクリーニングと登録が完了したため、第3相プログラムへの支出が減少した結果、研究開発費は2024年には緩やかに減少すると予想しています。フェーズ3のプログラム費用の減少は、オープンラベル調査への登録数の増加と株式ベースの報酬費用の増加によって部分的に相殺されると予想されます。現在の研究開発活動から受け取ったデータを確認した上で、将来の研究開発計画を再評価する予定です。将来の研究開発活動のコストとペースは関連しており、変更される可能性があります。
重要な会計上の見積もり
当社の財政状態と経営成績に関するこの議論と分析は、米国会計基準に従って作成された要約連結財務諸表に基づいています。これらの要約連結財務諸表を作成するには、要約連結財務諸表の日付における報告された資産と負債の金額と偶発資産と負債の開示、ならびに報告期間中に発生した報告費用と純損失に影響する見積もりと仮定を行う必要があります。私たちの見積もりは、私たちの歴史的経験と、その状況下では妥当であると私たちが考えるその他のさまざまな要因に基づいており、その結果は、他の情報源からはすぐにはわからない資産や負債の帳簿価額を判断するための基礎となります。実際の結果は、仮定や条件が異なると、これらの見積もりと異なる場合があります。
普通株式ワラント負債の評価
普通株式ワラント負債の公正価値は、モンテカルロ評価モデルを使用して2024年1月3日のワラント分配日に決定されました。適切な公正価値モデルを決定し、普通株式新株予約権の公正価値を計算するには、かなりの判断が必要です。使用した見積もりに何らかの変更があると、値が報告された値よりも高くなったり低くなったりする可能性があります。普通新株予約権は、分配後、ナスダック・キャピタル・マーケットで「SAVAW」という取引シンボルで取引されました。2024年3月31日現在の普通株式ワラント負債の公正価値は、その日の普通株式新株予約権の終値を使用して決定されました。公正価値の変動はすべて、各報告期間の営業報告書に記録されます。公正価値の変動は財務諸表に記録されているものと大きく異なる場合があります。これは、判断の仕方と、ワラント分配日である2024年1月3日の初期評価におけるこれらの商品の公正価値の見積もりに内在する不確実性によるものです。
上記以外に、2024年3月31日に終了した3か月間の重要な会計上の見積もりに、2024年2月28日に提出された2023年12月31日に終了した年度のフォーム10-Kの年次報告書に含まれている「経営陣による財政状態と経営成績の議論と分析」に記載されているものと大幅に変更されていません。
経営成績 — 2024年および2023年3月31日に終了した3か月間
研究開発経費
研究開発費は、主に製品候補に関連する医薬品開発作業の費用で構成されます。これには以下が含まれます。
| ● |
臨床試験、 |
|
| ● |
前臨床試験、 |
|
| ● |
臨床用品と関連する製剤とデザインのコスト、そして |
|
| ● |
報酬およびその他の人件費関連費用。 |
2024年3月31日と2023年3月31日に終了した3か月間の研究開発費は、それぞれ1,620万ドルと2,210万ドルでした。この 27% の減少は、主に患者のスクリーニングが完了し、2023年秋に第3相臨床プログラムに登録されたためです。
第3相臨床プログラムへの患者のスクリーニングと登録が完了したので、研究開発費は今後緩やかに減少すると予想しています。フェーズ3のプログラム費用の減少は、オープンラベル調査への登録数の増加と、2023年の新しい助成金授与による株式ベースの報酬費用の増加によって部分的に相殺されると予想されます。
一般管理費
一般管理費には、人件費、割り当てられた経費、および法務、人事、監査、会計サービスを含む外部の専門サービスにかかるその他の費用が含まれます。人件費は、給与、賞与、福利厚生、株式ベースの報酬で構成されています。配分された費用は、主に、テキサス州オースティンにある当社所有のオフィスコンプレックスの施設費です。リースされているが会社が占有していないオフィススペースの減価償却費は、一般管理費に含まれています。会社が占めるオフィススペースの減価償却費は、一般管理費と研究開発費の間に配分されます。また、追加の弁護士費用、SECとナスダックの規則と規制の遵守に関連する費用、追加の保険および監査費用、投資家向け広報活動、サーベンス・オクスリー法遵守費用、その他の管理費および専門サービスなど、上場企業としての運営に関連する費用も発生します。
2024年3月31日および2023年3月31日に終了した3か月間の一般管理費は、それぞれ370万ドルと440万ドルでした。16%の減少は主に、当社が2023年第4四半期に保険控除額を満たし、2024年3月31日に終了した3か月間に約300万ドルの保険金回収を記録したため、訴訟費用が170万ドル減少したためです。この減少は、2023年の新たな助成金授与による株式ベースの報酬費用の110万ドルの増加によって一部相殺されました。
保険収入が、進行中の証券集団訴訟、デリバティブ訴訟、政府調査に関連する法的および専門的費用の増加を相殺すると予想されるため、2024年の一般管理費は2023年と比較して減少すると予想しています。訴訟費用の減少は、株式ベースの報酬費用の増加によって一部相殺されると予想されます。
利息収入
2024年3月31日および2023年3月31日に終了した3か月間の利息収入は、それぞれ180万ドルと210万ドルでした。
利息収入の減少は、事業で現金を活用しているため、現金残高が前期と比較して減少したためです。
キャッシュポジションと現在の金利環境を考慮すると、利息収入は歴史的に高い水準にとどまると予想しています。
ワラントの公正価値の変更
2024年3月31日に終了した3か月間のワラントの公正価値の変動は4,300万ドルでした。2023年3月31日に終了した3か月間、発行された普通株式新株予約権または新株予約権の公正価値の変動はありませんでした。2024年の変動は、2024年1月3日から2024年3月31日に分配された当社の負債分類ワラントの公正価値の変動による利益によるものです。公正価値の変動は主に、2024年3月31日の公開市場取引における普通新株予約権の終値が、分配時のモンテカルロシミュレーションによって決定された公正価値から下落したことによるものです。
その他の収益、純額
リースは会社の事業の中核ではないため、所有する建物のオフィススペースを第三者にリースすることに関連する活動を、その他の純利益として計上しています。2024年3月31日および2023年3月31日に終了した3か月間のその他の純利益は、それぞれ16万ドルと19万ドルでした。2024年の空室率が前年同期と比較して高かったため、2024年3月31日に終了した3か月間のその他の純利益は減少しました。空室率の上昇により賃貸収入がさらに減少すると予想されるため、2024年にはその他の純収益が減少すると予想しています。
オフィスコンプレックスの減価償却費は、一般管理費、研究開発費に含まれるため、その他の純利益には反映されません。
流動性と資本資源
創業以来、私たちは主に公募および非公開の株式公開、コラボレーション契約に基づいて受け取った支払い、および現金および現金同等物の残高から得られる利息を通じて事業の資金を調達してきました。私たちは、研究開発活動、資本支出、運転資金要件、およびその他の一般的な企業目的に資金を提供するために、引き続き資本リソースを使用するつもりです。2024年3月31日現在、現金および現金同等物は1億2,420万ドルでした。
2024 普通株式新株予約権の分配
2024年1月3日、当社は、2023年12月22日の営業終了時点で、当社の普通株式を購入するための約1,690万株のワラントを当社の普通株式の登録保有者に分配しました。
各ワラントにより、保有者は、所有者の単独費用および独占的選択により、ワラント1株あたり33.00ドルの行使価格で、普通株式1.5株(端数株式は切り捨て)を購入することができます。新株予約権の行使時の普通株式の支払いは現金でなければなりません。
2024年4月15日、当社は、未払いのワラントはすべて2024年5月7日(「償還日」)に償還されることを発表しました。償還価格は、ワラント1枚あたりの0.01ドルの1/10に等しくなければなりません。ワラントは、2024年1月3日から償還日の前営業日まで、いつでも行使できました。
2024年1月3日から2024年3月31日まで、合計約674,000件のワラントが行使され、その結果、当社への純収入は約2,230万ドルになりました。当社は、2024年3月31日までの新株予約権の行使により、約100万株の普通株式を発行しました。
2024年3月31日以降、償還日までに合計約315万件のワラントが行使され、その結果、当社への総収入は約1億400万ドルになりました。当社は、2024年3月31日から償還日までの新株予約権の行使により、約470万株の普通株式を発行しました。
2024年のワラント分配による総収入は、約570万株の普通株式を1株あたり22.00ドルで発行したことによる約1億2630万ドルでした。ワラント分配の純収入総額は、推定行使費用を差し引いた後、約1億2350万ドルでした。
最初の2,000万ドルの総収入の後、当社は、ワラント行使による普通株式の売却による総収入の2.5%を、ワラント分配のために会社のファイナンシャルアドバイザーに支払う義務がありました。償還日までのワラント行使の総費用は約280万ドルでした。
市場での普通株式の募集
2023年5月1日、当社は、2023年5月1日にSECに提出され、提出後すぐに発効した棚登録届出書に従って、時々、総募集価格が最大2億ドルの普通株式を売却する時価総額が最大2億ドルの普通株式を売却する時価公開プログラム(「ATM」)を開始しました。私たちは、募集中の普通株式の売却による総収入の最大3%の手数料を支払う義務があります。募集中の株式を売却する義務はありません。
2024年3月31日に終了した3か月間、ATMでの普通株式の売却はありませんでした。ATMでは最大2億ドルの普通株式が残っています。
2020年3月、当社は、2020年5月5日にSECによって発効が宣言された棚登録届出書に従い、総募集価格が最大1億ドルの普通株式を売却する市場での募集プログラム(「2020年プログラム」)を開始しました。2023年4月26日に発効し、2023年5月1日に発効した2020年プログラムの終了を通知しました。2020年プログラムの終了まで、普通株式の売却はありませんでした。
2020年の現金インセンティブボーナスプランの債務
2020年8月、当社の取締役会(「取締役会」)は、2020年の現金インセンティブボーナス制度(「プラン」)を承認しました。このプランは、会社の時価総額の大幅な増加に合わせて、プラン参加者に追加の現金報酬を提供する「リスクのある」キャッシュボーナスプログラムを作成することにより、会社の長期的な成功を促進するために設立されました。会社の時価総額が大幅に増加し、プランに指定されたその他の特定の条件が満たされない限り、プラン参加者は現金ボーナスを受け取ることができないため、プランは「リスクがある」と見なされます。具体的には、(1) 会社が会社またはその資産の所有権の売却となる合併または買収取引を完了するか(「合併取引」)、または(2)報酬委員会がプランで定義されているように十分な現金を手元に持っていると報酬委員会が判断しない限り、現金ボーナスは支払われません。合併取引が発生した場合、プラン参加者には獲得したすべての現金ボーナスが支払われます。
2022年12月31日現在、当社の独立取締役が本プランに参加しています。しかし、2023年3月16日付けで、取締役会はプランの参加者であるすべての独立取締役を解任するようにプランを修正し、独立取締役はそのような解任に同意しました。本プランに基づく潜在的な利益のうち、独立取締役が負担していた分は、会社に完全に没収され、本プランに基づく他の参加者には配分されません。当社の独立取締役は、本プランに基づく支払いを受け取っておらず、そのような修正の結果、今後も受け取ることはありません。
すべての発行済みストックオプションを含む当社の時価総額は、2020年8月の本プラン開始時点で8,940万ドルでした。会社が20取引日以上連続して時価総額が50億ドルを超え、上記の支払い条件が満たされた場合、プランのすべてのマイルストーンが達成されたとみなされます。この場合、現金ボーナスの総額は、最低1億1,140万ドルから仮想上の最大2億8,970万ドルまでさまざまです。未払いの新株予約権は時価総額の決定から除外されます。
2020年に会社の時価総額で1つのプランマイルストーンを達成したことに基づくと、2024年3月31日のプラン参加者に対する当社の潜在的な財務債務は、合計650万ドルでした(2023年3月のプラン修正を考慮した後)。会社がプランに基づいて支払われる金額に必要なすべての条件をまだ満たしていないため、どのプラン参加者にも実際の現金ボーナスの支払いは行われていません。2021年12月31日に終了した年度中に、当社の時価総額は大幅に増加しました。これらの増加により、さらに11のプランマイルストーンが達成されました。まとめると、このようなマイルストーンの達成により、プラン参加者に対する潜在的な会社の債務は、最低7,490万ドルから架空の最高額2億230万ドルまで及ぶ可能性があります。正確な金額は報酬委員会によって決定され、将来の業績条件が満たされるかどうかが条件となります。
2023年12月31日と2022年に終了した年度または2024年3月31日に終了した3か月間には、評価マイルストーンは達成されませんでした。
2024年3月31日現在、またはフォーム10-Qのこの四半期報告書の提出日まで、プランに基づく参加者への実際の現金支払いは承認も行われていません。
現金の使用
2024年3月31日に終了した3か月間の営業活動に使用された純現金は、主に2,500万ドルの純利益と230万ドルの株式ベースの報酬費用から1,910万ドルでしたが、ワラントの公正価値の変動、4,300万ドルの買掛金および未払費用の減少、100万ドルの買掛金および未払費用の減少、120万ドルの未払開発費の減少により相殺されました 130万ドルのプリペイドおよびその他の流動資産。
2023年3月31日に終了した3か月間の営業活動に使用された純現金は1,330万ドルでしたが、これは主に2,430万ドルの純損失によるものです。これは、買掛金および未払費用の460万ドルの増加、未払開発費の300万ドルの増加、前払金およびその他の流動資産の270万ドルの減少、および株式ベースの報酬費用の70万ドルの減少によって一部相殺されました。
2024年3月31日に終了した3か月間、投資活動に現金は使用されませんでした。
2023年3月31日に終了した3か月間の投資活動に使用された純現金は、本社の改修と備品の最終支払いが行われたため、40万ドルでした。
2024年3月31日に終了した3か月間の財務活動によって提供された純現金は、新株予約権の行使による純収入の2,220万ドルでした。
2023年3月31日に終了した3か月間の資金調達活動によって提供された純現金は、ストックオプションの行使により10万ドルでした。
不動産とリース
私たちはテキサス州オースティンにオフィスコンプレックスを所有しており、その一部が当社の本社となっています。この物件は、今後数年間に予想される事業の成長と拡大に対応することを目的としています。メンテナンス、物理的設備、リース、資産管理、および財産所有権に関連するその他の重要な責任は、専門の不動産管理者に外注されています。オフィスコンプレックスの賃貸可能面積は約90,000平方フィートです。2024年3月31日時点で、私たちは物件の約25%を占有し、残りはリースされているか、第三者にリースされています。事実上すべての既存のテナントリースは2024年に期限切れになります。2024年に期限が切れるテナントリースは、有効期限を超えて延長、更新、または再リースされない可能性が高いと考えています。その場合、そのようなオフィススペースの賃貸料の支払いや共有費用の払い戻しは受けられなくなります。
2024年4月に期限が切れるテキサス州オースティンのキャンセル不可のオペレーティングリースに基づいて、約6,000平方フィートのオフィススペースをリースしました。2023年2月22日に、継続義務なしにこのリースを終了しました。
その他のコミットメント
2024年3月31日現在、当社の累積赤字は3億5,570万ドルです。今後、私たちの現金要件はかなり大きくなると予想しています。将来の現金要件の金額と時期は、医薬品候補の規制や市場での受け入れ、製品の研究開発、製剤、製造、商品化、サポート、その他の企業ニーズに費やすリソースによって異なります。現在の現金および現金同等物は、少なくとも今後12か月間は事業資金を調達するのに十分であると考えています。将来、公的または民間の資金調達を通じて、そのような資金が利用可能で、私たちが受け入れられる条件で追加の資金を求めるかもしれません。しかし、追加の融資が有利な条件で利用可能になるという保証はありません。また、まったくありません。
アイテム 3. 市場リスクに関する定量的・質的開示
私たちは通常の事業過程において、主に金利感応性に関連する市場リスクにさらされています。また、程度は低いものの、米国外での臨床事業に関連する通貨変動に関連する市場リスクにさらされています。
金利感度
私たちは金利の変動に関連する市場リスクにさらされています。2024年3月31日現在、当社の現金および現金同等物は1億2420万ドルで、主に米国財務省証券とマネーマーケット口座で構成されています。
私たちの投資活動の主な目的は、事業資金を調達するための資本を確保することです。また、重大なリスクを想定することなく、投資からの収益を最大化するよう努めています。目標を達成するために、取締役会が承認した投資方針に従い、信用の質が高く短期間の投資手段を維持しています。このような利息獲得商品には、ある程度の金利リスクが伴います。ただし、当社の現金同等物は一般的に短期満期であり、リスクが低いため、提示された期間のいずれかで金利が100ベーシスポイント増減しても、要約連結財務諸表では、年間純損失は130万ドル未満しか増減しません。
アイテム 4. 統制と手続き
開示管理と手続きの評価。 当社の経営陣は、最高経営責任者と最高財務責任者の参加を得て、フォーム10-Qのこの四半期報告書の対象期間の終了時点での開示管理と手続きの有効性を評価しました。この評価に基づいて、当社の最高経営責任者(最高経営責任者)と最高財務責任者(最高財務責任者)は、1934年の証券取引法(改正された「取引法」)に基づいて提出または提出する報告書で開示する必要のある情報が、SECの規則とフォームで指定された期間内に記録、処理、要約、報告されることを保証するには、当社の開示管理と手続きが有効であると結論付けました。そのような情報が蓄積され、伝えられること必要な開示について適時に決定できるように、適切な管理を行います。
経営陣は、どのような統制や手続きも、どんなにうまく設計・運用されても、目的を達成するための合理的な保証しか提供できないことを認識しており、可能な統制と手順の費用対効果の関係を評価する際には、必ずその判断を下します。2024年3月31日現在の当社の開示管理と手続きの評価に基づいて、当社の最高経営責任者兼最高財務責任者は、その日付の時点で、当社の開示管理と手続きは妥当な保証レベルで有効であると結論付けました。
財務報告に関する内部統制の変更。 2024年3月31日に終了した3か月間に、財務報告に対する当社の内部統制(証券取引法の規則13a-15(f)で定義されているとおり)に、財務報告に対する当社の内部統制に重大な影響を及ぼした、または重大な影響を与える可能性が合理的に高い変更はありませんでした。
パート II — その他の情報
アイテム 1. 法的手続き
私たちは、米国政府の調査、調査、およびFDAに提出された市民請願を含む、訴訟やその他の法的手続きや請求に関与しています。さらに、通常の業務から生じる問題について、政府当局から問い合わせを受けており、また受けることもあります。これらの手続きの結果は本質的に不確実です。結果がどうであれ、法的手続きは、弁護や和解の費用、経営資源の流用、その他の要因により、当社に悪影響を及ぼす可能性があります。現時点では、予想される結果や、その結果が私たちにとって重要であるかどうかについての評価はできません。現在入手可能な情報に基づくと、法的事項に関する当社の全規定は十分であると考えています。当社の法的手続きに関する追加情報は、「不測の事態」と題された要約連結財務諸表の注記11にあるフォーム10-Qのこの四半期報告書に含まれています。
アイテム 1A. リスク要因
当社のリスク要因には、以下で開示されているものと比べて重大な変化はありません 」リスク要因」 フォーム10の2023年次報告書のパートI、項目1Aで-K. 2023年に記載されているリスクと不確実性 フォーム10の年次報告書-私たちが直面しているのは私だけではありません。現在当社が把握していない、または現在重要ではないと判断しているその他のリスクや不確実性も、当社の事業、財政状態、または経営成績に重大な悪影響を及ぼす可能性があります。
アイテム 2. 持分証券の未登録売却および収益の使用
[なし]。
アイテム 3. シニア証券のデフォルト
[なし]。
アイテム 4. 鉱山の安全に関する開示
該当しません。
アイテム 5。 その他の情報
終了した四半期中に 2024年3月31日です、私たちの取締役や役員(規則で定義されているとおり)の誰もいません 16a-1取引法の(f)から、「規則」の採択または終了が通知されました 10b5-1 取引アレンジメント」または「ルールなし」 10b5-1 取引契約」、これらの用語は規則S-K、Itemで定義されています 408。
アイテム 6. 展示品
このレポートには、次の資料が添付されています。
| によって法人化されました |
|||||||||
| リファレンス |
|||||||||
| 示す |
説明 |
ファイリング |
示す |
提出 |
|||||
| いいえ。 |
フォーム |
日付 |
いいえ。 |
これで |
|||||
| 3.1 |
修正および改訂された法人設立証明書。 |
10-Q |
2005 年 7 月 29日 |
3.1 |
|||||
| 3.2 |
修正された法人設立証明書の修正証明書。 |
8-K |
5/8/2017 |
3.1 |
|||||
| 3.3 |
修正された法人設立証明書の修正証明書。 |
10-K |
2019 年 3 月 29日 |
3.3 |
|||||
| 3.4 |
キャッサバ・サイエンス社の細則の修正および改訂版 |
8-K |
9/13/2023 |
3.4 |
|||||
| 4.1 | 2024年1月3日付けの、キャッサバ・サイエンス社、コンピューターシェア株式会社、およびN.A. コンピューターシェア信託会社との間のワラント契約(ワラント形式を含む) | 8-K | 1/3/2024 | 4.1 | |||||
| 31.1 |
2002年のサーベンス・オクスリー法第302条に基づく最高経営責任者の認定 |
X |
|||||||
| 31.2 |
2002年のサーベンス・オクスリー法第302条に基づく最高財務責任者の認定 |
X |
|||||||
| 32.1+ |
2002年のサーベンス・オクスリー法第906条に従って採択された、米国合衆国法第18条第1350条に基づく最高経営責任者および最高財務責任者の認定。 |
X |
|||||||
| 101.インチ |
インラインXBRLインスタンスドキュメント-(インスタントドキュメントは、XBRLタグがインラインXBRLドキュメントに埋め込まれているため、インタラクティブデータファイルには表示されません)。 |
X |
|||||||
| 101.SCH |
インライン XBRL タクソノミー拡張スキーマドキュメント |
X |
|||||||
| 101.CAL |
インライン XBRL タクソノミー拡張計算リンクベースドキュメント。 |
X |
|||||||
| 101.DEF |
インライン XBRL タクソノミー拡張定義リンクベースドキュメント。 |
X |
|||||||
| 101.LAB |
インライン XBRL タクソノミー拡張ラベルリンクベースドキュメント |
X |
|||||||
| 101.PRE |
インライン XBRL タクソノミー拡張プレゼンテーションリンクベースドキュメント。 |
X |
|||||||
| 104。 |
表紙インタラクティブデータファイル —(インラインXBRLとしてフォーマットされ、別紙101に含まれています)。 |
X |
|||||||
+本書の別紙32.1に記載されている証明書は、フォーム10-Qのこの四半期報告書に添付されているものとみなされ、1934年の取引法の第18条の目的で「提出」されたとはみなされません。そのような証明書は、会社が特に参照により組み込んでいる場合を除き、改正された1933年の証券法または証券取引法に基づく提出書類に参照によって組み込まれたとはみなされません。
署名
1934年の証券取引法の要件に従い、登録者は署名者に代わってこの報告書に正式に署名させ、正式に権限を与えられました。
| キャッサバ・サイエンス株式会社 |
|
| (登録者) |
|
| /s/ レミ・バルビエ |
|
| レミ・バルビエ、 |
|
| 取締役会の議長、 |
|
| 社長兼最高経営責任者 |
|
| 日付:2024年5月10日 |
(最高執行役員) |
| /s/ エリック・J・ショーン |
|
| エリック・J・ショーン、 |
|
| 最高財務責任者 |
|
| 日付:2024年5月10日 |
(最高財務会計責任者) |