米国
証券取引委員会
ワシントンD.C. 20549
フォーム
(マークワン)
四半期終了時の
または
からへの移行期間について
コミッションファイル番号:
(憲章に明記されている登録者の正確な名前)
|
||
(州またはその他の管轄区域) 法人または組織) |
|
(IRS) 雇用主 識別番号) |
|
|
|
|
|
|
(主要執行機関の住所) |
|
(郵便番号) |
(
(登録者の電話番号、市外局番を含む)
同法第12条 (b) に従って登録された証券:
各クラスのタイトル |
トレーディングシンボル |
登録された各取引所の名前 |
登録者が、(1)1934年の証券取引法の第13条または第15条(d)で提出が義務付けられているすべての報告書を過去12か月間(または登録者がそのような報告を提出する必要があったよりも短い期間)に提出したかどうか、および(2)過去90日間にそのような提出要件の対象であったかどうかをチェックマークで示してください。
登録者が、過去12か月間(または登録者がそのようなファイルの提出を求められたより短い期間)に、規則S-Tの規則405(本章の§232.405)に従って提出が義務付けられているすべてのインタラクティブデータファイルを電子的に提出したかどうかをチェックマークで示してください。
登録者が大規模な加速申告者、加速申告者、非加速申告者、小規模な報告会社、または新興成長企業のいずれであるかをチェックマークで示してください。取引法規則12b-2の「大規模加速申告者」、「加速申告者」、「小規模報告会社」、「新興成長企業」の定義を参照してください。
大型加速フィルター |
|
|
アクセラレーテッド・ファイラー |
|
|
|
|
|
|
|
|
|
☒ |
小規模な報告会社 |
|
||
|
|
|
|
|
|
新興成長企業 |
|
|
|
|
新興成長企業の場合は、登録者が取引法第13条 (a) に従って規定された新規または改訂された財務会計基準を遵守するために延長された移行期間を使用しないことを選択したかどうかをチェックマークで示してください。☐
登録者がシェル会社(証券取引法の規則12b-2で定義されている)かどうかをチェックマークで示してください。☐ はい
2024年5月6日現在、登録者は
キュー・バイオファーマ株式会社
目次
第I部。財務情報 |
|
|
|
アイテム 1.財務諸表 (未監査) |
6 |
|
要約連結貸借対照表 |
6 |
|
要約連結営業報告書と包括損失 |
7 |
|
要約連結株主資本計算書 |
8 |
|
要約連結キャッシュフロー計算書 |
9 |
|
要約連結財務諸表の注記(未監査) |
10 |
|
アイテム 2.経営陣による財政状態と経営成績に関する議論と分析 |
25 |
|
アイテム 3.市場リスクに関する定量的・質的開示 |
41 |
|
アイテム 4.統制と手続き |
41 |
第二部その他の情報 |
|
|
|
アイテム 1.法的手続き |
42 |
|
アイテム 1A.リスク要因 |
42 |
|
アイテム 2.持分証券の未登録売却および収益の使用 |
42 |
|
アイテム 3.シニア証券のデフォルト |
42 |
|
アイテム 4.鉱山の安全に関する開示 |
42 |
|
アイテム 5.その他の情報 |
42 |
|
アイテム 6.展示品 |
43 |
2
将来の見通しに関する記述と業界データに関する注意事項
このフォーム10-Qの四半期報告書には、改正された1933年の証券法のセクション27Aおよび改正された1934年の証券取引法のセクション21Eの意味における「将来の見通しに関する記述」が含まれています。特定の仮定に基づいており、当社の将来の計画、戦略、期待を説明する将来の見通しに関する記述は、一般的に「信じる」、「期待する」、「期待する」、「できる」、「する」、「できる」、「求める」、「意図する」、「計画」、「目標」、「プロジェクト」、「見積もり」、「予想する」などの将来の見通しに関する用語を使用することで識別できます。」「戦略」、「未来」、「可能性が高い」、または他の同等の用語。当社の戦略、将来の事業、将来の財政状態、将来の収益、予測費用、見通し、計画、経営目標に関する記述を含め、フォーム10-Qのこの四半期報告書に含まれる歴史的事実の記述を除くすべての記述は、将来の見通しに関する記述です。
このForm 10-Qの四半期報告書の将来の見通しに関する記述には、とりわけ以下に関する記述が含まれます。
将来の見通しに関する記述は、歴史的事実でも将来の業績を保証するものでもありません。代わりに、それらは私たちの事業の未来、将来の計画と戦略、予測、予想される出来事と傾向、経済やその他の将来の状況に関する私たちの現在の信念、期待と仮定のみに基づいています。将来の見通しに関する記述は将来に関するものであるため、固有の不確実性、リスク、および予測が困難な状況の変化の影響を受けやすく、その多くは当社の管理外です。当社の実際の業績と財政状態は、将来の見通しに関する記述に示されているものと大きく異なる場合があります。したがって、これらの将来の見通しに関する記述はどれも信用しないでください。当社の実際の業績と財政状態が将来の見通しに関する記述に示されているものと大きく異なる原因となる可能性のある重要な要因には、以下の「リスク要因の概要」という見出しで説明する要因や、2023年12月31日に終了した年度のフォーム10-K年次報告書のパートIの項目1A.「リスク要因」で詳しく説明されているリスク要因が含まれます。
このレポートには、業界の出版物や第三者が実施した調査、調査、調査から得た統計データやその他の業界および市場データ、および独自の見積もりが含まれています。このレポートで使用されているすべての市場データには、いくつかの仮定と制限があります。そのようなデータを過度に重視しないように注意してください。業界の出版物や第三者の調査、調査、調査では、通常、それらの情報は信頼できると思われる情報源から入手されたことが示されていますが、そのような情報の正確性や完全性を保証するものではありません。医薬品候補の潜在的な市場機会の見積もりには、業界知識、業界出版物、第三者調査、その他の調査に基づくいくつかの重要な仮定が含まれていますが、これらはサンプルサイズが小さく、市場機会を正確に反映していない可能性があります。社内の仮定は妥当だと思いますが、そのような仮定を検証した独立した情報源はありません。
3
このForm 10-Qの四半期報告書に記載されている将来の見通しに関する記述は、現在入手可能な情報のみに基づいており、作成された日付の時点でのみ述べられています。私たちは、新しい情報、将来の動向、またはその他の結果として、随時作成される可能性のある将来の見通しに関する記述を、書面または口頭を問わず、公に更新する義務を負いません。
リスク要因のまとめ
当社の証券への投資にはリスクが伴います。2024年3月28日に証券取引委員会に提出されたフォーム10-Kの年次報告書のパートIの項目1A、「リスク要因」に詳しく記載されているリスク、およびこのレポートに含まれるその他の情報に加えて、以下の要約を慎重に検討してください。私たちが直面しているリスクと不確実性は、以下に説明するリスクと不確実性だけではありません。現在私たちが知らない、または現在それほど重要ではないと判断している追加のリスクや不確実性も、当社の事業運営に支障をきたす可能性があります。
次のリスクのいずれかが発生した場合、当社の事業、財政状態、経営成績、および将来の成長見通しは重大かつ悪影響を受ける可能性があり、このレポートで将来の見通しに関する記述がなされている事項の実際の結果は、そのような将来の見通しに関する記述で予想されるものと大きく異なる可能性があります。
4
5
第I部。財務情報
アイテム 1.財務諸表
キュー・バイオファーマ株式会社
要約連結貸借対照表
(未監査)
(千単位、1株あたりの金額を除く)
|
|
3 月 31 日 |
|
|
12月31日 |
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金および現金同等物 |
|
$ |
|
|
$ |
|
||
売掛金 |
|
|
|
|
|
|
||
前払費用およびその他の流動資産 |
|
|
|
|
|
|
||
流動資産合計 |
|
|
|
|
|
|
||
資産および設備、純額 |
|
|
|
|
|
|
||
オペレーティングリースの使用権資産 |
|
|
|
|
|
|
||
預金 |
|
|
|
|
|
|
||
制限付き現金 |
|
|
|
|
|
|
||
その他の長期資産 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
負債と株主資本 |
|
|
|
|
|
|
||
現在の負債: |
|
|
|
|
|
|
||
買掛金 |
|
$ |
|
|
$ |
|
||
未払費用 |
|
|
|
|
|
|
||
研究開発契約負債、現在の部分 |
|
|
|
|
|
|
||
オペレーティングリース負債、流動負債 |
|
|
|
|
|
|
||
長期負債の現在の部分、純額 |
|
|
|
|
|
|
||
流動負債合計 |
|
|
|
|
|
|
||
オペレーティングリース負債、非流動負債 |
|
|
|
|
|
|
||
長期債務、純額 |
|
|
|
|
|
|
||
負債総額 |
|
$ |
|
|
$ |
|
||
コミットメントと不測の事態(注11) |
|
|
|
|
|
|
||
株主資本: |
|
|
|
|
|
|
||
優先株式、$ |
|
|
|
|
|
|
||
普通株式、$ |
|
|
|
|
|
|
||
追加払込資本金 |
|
|
|
|
|
|
||
累積赤字 |
|
|
( |
) |
|
|
( |
) |
株主資本の総額 |
|
|
|
|
|
|
||
負債総額と株主資本 |
|
$ |
|
|
$ |
|
||
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
6
キュー・バイオファーマ株式会社
要約連結営業報告書および包括損失計算書
(未監査)
(千単位、1株あたりの金額を除く)
|
|
3 か月が終了 |
|
|
|||||
|
|
2024 |
|
|
2023 |
|
|
||
コラボレーション収益 |
|
$ |
|
|
$ |
|
|
||
営業経費: |
|
|
|
|
|
|
|
||
一般と管理 |
|
|
|
|
|
|
|
||
研究開発 |
|
|
|
|
|
|
|
||
営業費用の合計 |
|
|
|
|
|
|
|
||
事業による損失 |
|
|
( |
) |
|
|
( |
) |
|
その他の収入 (費用): |
|
|
|
|
|
|
|
||
利息収入 |
|
|
|
|
|
|
|
||
支払利息 |
|
|
( |
) |
|
|
( |
) |
|
その他の収益(費用)の合計、純額 |
|
|
|
|
|
|
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
売却可能な有価証券による未実現利益 |
|
|
|
|
|
|
|
||
包括的損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
普通株式1株当たりの純損失 — 基本および希薄化後 |
|
$ |
( |
) |
|
$ |
( |
) |
|
加重平均発行済普通株式 — 基本株式と希薄化後普通株式 |
|
|
|
|
|
|
|
||
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
7
キュー・バイオファーマ株式会社
要約連結株主資本計算書
(未監査)
(千単位、1株あたりの金額を除く)
|
|
|||||||||||||||||||||||
|
|
普通株式 |
|
|
[追加] |
|
|
累積 |
|
|
|
|
|
合計 |
|
|||||||||
|
|
株式 |
|
|
同等語 |
|
|
支払い済み |
|
|
包括的 |
|
|
累積 |
|
|
株主の |
|
||||||
残高、2022年12月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||
株式ベースの報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
ストックオプションの行使 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
売却可能な有価証券による未実現利益 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
バランス、2023年3月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
残高、2023年12月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
|
||||
ATM発行による普通株式の発行(控除後) |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
株式ベースの報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
残高、2024年3月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
8
キュー・バイオファーマ株式会社
要約連結キャッシュフロー計算書
(未監査)
(千単位)
|
|
3月31日に終了した3か月間 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
営業活動によるキャッシュフロー |
|
|
|
|
|
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
純損失を営業活動に使用された現金と調整するための調整: |
|
|
|
|
|
|
||
減価償却と償却 |
|
|
|
|
|
|
||
株式ベースの報酬 |
|
|
|
|
|
|
||
使用権資産の帳簿価額の減少 |
|
|
|
|
|
|
||
不動産および設備の売却益 |
|
|
|
|
|
( |
) |
|
購入した有価証券の保険料/割引の償却 |
|
|
|
|
|
( |
) |
|
債務発行費用の償却 |
|
|
|
|
|
|
||
タームローンでの最終支払いの増加 |
|
|
|
|
|
|
||
営業資産および負債の変動: |
|
|
|
|
|
|
||
売掛金 |
|
|
|
|
|
( |
) |
|
前払費用およびその他の流動資産 |
|
|
( |
) |
|
|
( |
) |
預金 |
|
|
|
|
|
|
||
買掛金 |
|
|
|
|
|
( |
) |
|
未払費用 |
|
|
|
|
|
( |
) |
|
研究開発契約責任 |
|
|
( |
) |
|
|
|
|
オペレーティング・リースの負債 |
|
|
( |
) |
|
|
( |
) |
営業活動に使用された純現金 |
|
|
( |
) |
|
|
( |
) |
投資活動によるキャッシュフロー |
|
|
|
|
|
|
||
資産および設備の購入 |
|
|
( |
) |
|
|
|
|
不動産や設備の売却から受け取った現金 |
|
|
|
|
|
|
||
有価証券の償還 |
|
|
|
|
|
|
||
投資活動によって提供された純現金(使用量) |
|
|
( |
) |
|
|
|
|
財務活動によるキャッシュフロー |
|
|
|
|
|
|
||
ATM提供による収入、販売代理店を差し引いたもの |
|
|
|
|
|
|
||
タームローンの支払い |
|
|
( |
) |
|
|
|
|
ストックオプションの行使による収入 |
|
|
|
|
|
|
||
財務活動による純現金 |
|
|
|
|
|
|
||
現金、現金同等物、および制限付現金の純増加(減少) |
|
|
( |
) |
|
|
|
|
現金、現金同等物、および期首制限付現金 |
|
|
|
|
|
|
||
現金、現金同等物、および期末制限付現金 |
|
$ |
|
|
$ |
|
||
非現金投資および財務活動の補足開示: |
|
|
|
|
|
|
||
利息として支払われた現金 |
|
$ |
|
|
$ |
|
||
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
9
キュー・バイオファーマ株式会社
要約連結財務諸表の注記
(未監査)
Cue Biopharma, Inc.(以下「当社」)は、患者の体内で直接疾患特異的T細胞を選択的に調節する新しいクラスの治療用生物製剤を開発している臨床段階のバイオ医薬品企業です。同社のビジョンは、疾患特有のT細胞を選択的に調節する新しいクラスのT細胞エンゲージ剤を生成することにより、自然の信号、つまり「手がかり」をタンパク質治療薬に変換することです。同社の本社と研究施設はマサチューセッツ州ボストンにあります。
添付の財務諸表は、通常の事業過程における資産の実現と負債とコミットメントの履行を考慮した継続企業ベースで作成されています。同社は発展段階にあり、創業以来、経常損失と事業からのマイナスキャッシュフローを被っています。2024年3月31日現在、当社の現金および現金同等物は$です
プレゼンテーションの基礎
添付の2024年3月31日現在、および2024年3月31日および2023年3月31日に終了した3か月間の未監査の要約連結財務諸表は、証券取引委員会(「SEC」)の規則と規制、および財務情報に関する米国で一般に認められている会計原則(「米国会計基準」)に従って作成されています。この原則では、すべての重要な会社間口座および口座での取引を排除することが規定されています当社とその完全子会社であるキュー・バイオファーマ証券株式会社は2018年12月にマサチューセッツ州に法人化されました。経営陣の見解では、これらの財務諸表には、提示された期間における会社の財政状態と経営成績の公正な記述に必要なすべての調整が反映されています。これらの財務諸表は、2024年3月28日にSECに提出されたフォーム10-Kの会社の年次報告書に含まれる財務諸表とその注記と併せて読む必要があります。
2024年3月31日に終了した3か月間の中間業績は、必ずしも2024年12月31日に終了する会計年度または将来の期間に予想される業績を示すものではありません。
公募です
2021年10月、当社は、代理人であるジェフリーズ合同会社(「ジェフリーズ」)と公開市場売却契約(「2021年10月のATM契約」)を締結しました。これにより、会社の普通株式を総収入総額は最大$で売却します。
10
統合
添付の要約連結財務諸表には、当社とその完全子会社であるキュー・バイオファーマ証券株式会社が含まれます。当社は、すべての会社間取引を排除しました。
見積もりの使用
米国会計基準に従って財務諸表を作成するには、経営陣は、財務諸表の日付における報告された資産と負債の金額と、報告期間中の報告された費用の金額に影響する見積もりと仮定を行う必要があります。重要な見積もりには、コラボレーション収益、潜在的な負債と未払費用の会計処理、サービスに対して発行される株式ベースの報酬の評価に使用される前提条件、繰延税金資産の実現、および長期資産と無形資産の耐用年数に関する見積もりが含まれます。実際の結果はそれらの見積もりとは異なる可能性があります。
現金集中
当社は、金融機関との現金残高を連邦保険口座に保管しており、定期的に保険限度額を超える現金残高がある場合があります。当社は、信用格付けの高い金融機関に口座を開設しています。当社はこれまでのところ、これらの金融機関への預金による損失は経験しておらず、現金に対する重大な信用リスクにさらされていないと考えています。
現金および現金同等物
当社は、購入日に満期が3か月以内の流動性の高い投資はすべて現金同等物と見なしています。同社は現在、利用可能な現金をマネーマーケットファンドに投資しています。
市場性のある証券
有価証券とは、当初の満期が90日を超え、会社の要約連結貸借対照表の日付から1年未満の投資で構成されています。当社は、すべての投資を売却可能な有価証券として分類しています。したがって、これらの投資は、相場市場価格に基づく公正価値で計上されます。未実現損益は、特定の識別に基づいて認識および決定され、包括損失に含まれます。実現損益は特定の識別基準に基づいて決定され、要約連結営業報告書のその他の収益と包括損失に含まれます。割引や保険料の償却と増額は利息収入に計上されます。会社は持っていました
制限付き現金
会社は$を持っていました
資産と設備
資産と設備は原価で計上されます。大幅な改善は資産計上され、メンテナンスと修理は発生した費用として計上されます。資産と設備の処分による損益は、実現時の収益と費用に含まれます。賃貸借契約改善の償却は、リース期間または原資産の耐用年数のどちらか短い方を対象に、定額法を使用して提供されます。
実験室用機器 |
|
|
コンピューター機器 |
|
|
家具と備品 |
|
当社は、減価償却費を、会社の事業活動における各カテゴリーの資産および設備の利用方法に応じて、一般管理費、研究開発費、要約連結営業報告書および包括損失として計上しています。
11
商標
商標は、世界中のCUE BIOLOGICSマークおよびCUEを組み込んだデリバティブマークに対する当社の権利、権原、利益、およびそれらに付随するすべての関連するのれんおよび慣習法上の権利で構成されます。これには、会社名、会社名、事業名、名前、商号、DBA、ドメイン名、またはCUEを組み込んだその他のソース識別子に関する権利、権原、利益が含まれますが、これらに限定されません。
当社は、商標を他の長期資産の一部として分類しており、耐用年数は
債務発行費用
債務発行費用は繰り延べられ、長期債務の控除額として提示されます。債務発行費用は、ローン期間中、実効金利法を使用して償却されます。繰延債務発行費用の償却は、要約連結営業報告書の支払利息と包括損失に含まれています。
収益認識
当社は、会計基準体系化(「ASC」)、トピック606、顧客との契約による収益(「ASC 606」)の範囲内にある会社の特定のライセンスおよびコラボレーション契約に基づくコラボレーション収益を認識しています。当社の顧客との契約には、通常、知的財産権と研究開発サービスのライセンスに関する約束が含まれています。会社の知的財産に対するライセンスが、契約で特定されている他の履行義務と異なると判断された場合、当社は、ライセンスがライセンシーに譲渡され、ライセンシーがライセンスを利用して利益を得ることができるときに、ライセンスに割り当てられた返金不可の前払い料金からの収益を認識します。他の約束とバンドルされているライセンスについては、当社は判断力を利用して複合履行義務の性質を評価し、複合履行義務が時間の経過とともに履行されるのか、ある時点で履行されるのかを判断し、時間の経過とともに履行される場合は、返金不可の前払い料金からの収益を認識する目的で進捗状況を測定する適切な方法を用います。したがって、取引価格は通常、契約開始時に支払われる固定料金と、特定のイベントの達成時に支払われるマイルストーン支払いという形での変動対価、および顧客がライセンス製品の純売上高を認識したときに獲得できる段階的なロイヤルティで構成されます。会社は、約束された商品やサービスを顧客に譲渡することと引き換えに受け取ることができると予想される対価額に基づいて取引価格を測定します。当社は、「期待価値法」法を利用して変動対価の額を見積もり、1回のオープン契約で受けることができる対価額を予測しています。変動対価の金額は、変動対価に関連する不確実性がその後解消されても、認識された累積収益額の大幅な逆転は起こらない可能性が高い範囲で、取引価格に含まれています。開発や規制上のマイルストーンの支払いを含む各取り決めの開始時に、会社は関連する出来事が達成される可能性があるかどうかを評価し、期待価値法を使用して取引価格に含まれる金額を見積もります。
研究開発費
研究開発費は、主に報酬費用、コンサルタント、外部のサービスプロバイダーや組織(大学の研究機関を含む)に支払われる手数料、施設費、および会社の医薬品候補に関する開発および臨床試験費用で構成されています。
契約に基づいて発生する研究開発費は、マイルストーンの達成、契約作業の完了、またはその他の情報により、異なる業績パターンの方が適切であることが示されない限り、基礎となる契約の存続期間にわたって比例的に支出されます。その他の研究開発費は、発生した事業費に計上されます。
返金不可の前払いは、関連サービスの実施時に費用として認識されます。会社は、四半期末と年末の報告日にサービスが提供される予定かどうかを評価します。会社がサービスの提供を期待していない場合、前払いは費用として請求されます。研究開発サービスの返金不可の前払い金は、会社の要約連結貸借対照表の前払金およびその他の流動資産に含まれています。返金不可の前払いが、報告日から12か月以内に行われる契約サービスの場合、そのような前払金は流動資産に含まれます。それ以外の場合、そのような前払金は非流動資産に含まれます。
当社は、四半期末および年末の報告日ごとに、研究開発契約と契約の状況、および関連する資産と負債の帳簿価額を評価し、必要に応じて会社の要約連結貸借対照表の帳簿価額とその分類を調整します。
12
特許費用
当社は、国内外の多数の特許を世界で独占的にライセンスしており、特許出願中です。当社の研究努力と関連する特許出願に基づいて、1つまたは複数の商業的に実行可能な医薬品候補の開発が成功することには大きな不確実性があるため、特許関連の訴訟費用、出願手数料、その他の費用を含むすべての特許費用は、発生した一般管理費に請求されます。2024年3月31日と2023年3月31日に終了した3か月間の特許費用は
ライセンス料と費用
ライセンス料と費用は主に、関連するロイヤリティ、維持費、マイルストーンの支払い、製品開発費など、アルバート・アインシュタイン医科大学(「アインシュタイン」)とのライセンス契約の取得に関連する費用で構成されています。ライセンス料と費用は、発生した研究開発費に計上されます。
長期資産
リース
当社はASC 842に基づいてリースを計上しています。リースでは、借手はほとんどのリース契約について、使用権資産とそれに対応するリース負債を会社の要約連結貸借対照表に記録する必要があります。この基準では、財務諸表の利用者がリースから生じるキャッシュフローの金額、時期、不確実性を評価できるように、リース契約に関する重要な情報の開示が義務付けられています。
株式ベースの報酬
当社は、提供されたサービスに対して、役員、取締役、従業員、科学・臨床諮問委員会メンバー、コンサルタントに定期的に株式ベースの賞を発行しています。このような発行は、発行日に定められた条件に従って権利が確定し、失効します。
役員、取締役、従業員、科学・臨床諮問委員会メンバー、コンサルタントへの株式ベースの支払い(従業員向けストックオプションの付与を含む)は、付与日の公正価値に基づいて財務諸表で計上されます。ストックオプションの付与は、通常は期限付きですが、付与日に公正価値が測定され、サービス期間(通常は権利確定期間)にわたって定額ベースで事業に請求されます。また、当社は定期的に会社の役員に業績に応じた賞を授与しています。当社は、業績条件が達成される可能性が高いと当社が判断した場合に、必要な勤続期間における業績報奨に関連する報酬費用を計上します。
ストックオプションと制限付株式ユニットの公正価値は、ブラック・ショールズオプション価格モデルを利用して決定されます。これは、リスクフリー金利、予想配当利回り、株式報奨の期間、付与日の普通株式の公正価値と比較したストックオプションの行使価格、株式報奨期間における普通株式の推定ボラティリティなど、いくつかの変数の影響を受けます。
13
当社は、株式報奨の受領者が提供するサービスの種類に応じて、当社の要約連結営業報告書および包括損失において、一般管理費、研究開発費における株式報酬の公正価値を認識しています。当社は、没収が発生した時点でその旨を把握しています。
包括利益 (損失)
純利益または純損失を含む包括利益または損失の構成要素は、それらが認識された期間の財務諸表に報告されます。その他の包括利益または損失とは、非所有者からの取引やその他の出来事や状況による期間中の資本の変動として定義されます。純利益(損失)およびその他の包括利益(損失)は、関連する税効果を差し引いて報告され、包括利益(損失)になります。包括利益(損失)には、純利益(損失)のほか、株主との取引や経済的出来事から生じる株主資本の変動が含まれます。提示された期間におけるその他の包括利益(損失)のうち、当社の唯一の要素は、売却可能な有価証券の未実現利益または損失でした。
1株当たりの利益(損失)
当社の各期間の1株当たり利益(損失)(「EPS」)の計算には、基本EPSと希薄化後EPSが含まれます。基本EPSは、普通株主に帰属する収益(損失)を、その期間の発行済み普通株式の加重平均数で割ったものです。希薄化後のEPSは基本EPSと似ていますが、発行済みのストックオプションと新株予約権の行使から生じる潜在的な普通株式の希薄化効果を、あたかも提示された期間の初め、またはそれより後の場合は発行日に行使されたかのように示します。希薄化防止効果のある潜在的な普通株式(つまり、1株当たり利益が増加したり、1株当たり損失が減少したりする株式)は、希薄化後EPSの計算から除外されます。発行済みのストックオプションとワラントはすべて希薄化防止剤であるため、普通株式1株あたりの基本損失と希薄化後の損失は、提示されたすべての期間で同じです。
ASC 260-10-45-13によると、ほとんどまたはまったく対価なしで発行可能な株式は、基本EPSに使用される発行済み株式数に含める必要があります。財務会計基準審議会(「FASB」)は、ほとんどまたはまったく費用をかけずに行使できるワラントまたはオプション(「ペニーワラント」と呼ばれることもあります)を、それ以上の権利確定条件や不測の事態がなくなったら、基本EPS(したがって希薄化後のEPS)の分母に含めることを提案しました。会社が含まれています
2024年3月31日および2023年3月31日の時点で、当社は、保有者に普通株式を取得する権利を与える以下に要約される発行済み有価証券をEPSの計算から除外しました。その影響は希薄化防止効果をもたらすためです。
|
|
3 月 31 日 |
|
||||
|
|
2024 |
|
2023 |
|
||
普通新株予約権 |
|
|
|
|
|
||
一般的なストックオプション |
|
|
|
|
|
||
合計 |
|
|
|
|
|
||
金融商品の公正価値
公正価値に関する権威あるガイダンスでは、公正価値の測定に使用される評価手法へのインプットを3つのレベルに優先順位付けする公正価値階層が確立され、公正価値で保有される資産と負債は、以下に示す3つのカテゴリのいずれかに分類および開示することが義務付けられています。
レベル1。測定日時点で会社がアクセスできる、同一の資産または負債の活発な市場における相場価格などの観察可能なインプット。レベル1のインプットを活用する金融資産と負債には、アクティブな上場証券と取引所ベースのデリバティブが含まれます。
レベル2。レベル1に含まれる相場価格以外の、資産または負債について直接観察できる、または観察可能な市場データによる裏付けによって間接的に観察できるインプット。レベル2のインプットを活用する金融資産と負債には、債券、非為替ベースのデリバティブ、投資信託、および公正価値ヘッジが含まれます。
レベル3。資産または負債の市場データがほとんどまたはまったくなく、報告主体が独自の仮定を立てる必要がある、観察不可能なインプット。レベル3のインプットを活用する金融資産と負債には、取引頻度が低い非取引所ベースのデリバティブや混合投資ファンドが含まれ、現在価値価格モデルを使用して測定されます。
14
会社は、公正価値測定全体にとって重要な最低レベルのインプットに基づいて、各公正価値指標が全体として当てはまる公正価値階層のレベルを決定します。適切な水準を決定するにあたり、会社は各報告期間終了時に資産と負債の分析を行います。
会社は$を持っていました
金融商品(現金、預金証書、負債、買掛金、未払報酬、未払費用からなる)の帳簿価額は、それらの商品の短期的な性質上、それぞれの公正価値を表すものとみなされます。
最近の会計上の宣言
2023年12月、FASBは会計基準更新(「ASU」)第2023-09号「所得税(トピック740):所得税開示の改善(「ASU 2023-09」)を発表しました。ASU 2023-09のガイダンスでは、税率調整と支払われる所得税の情報が管轄区域ごとに細分化され、所得税の開示の透明性が向上しています。この基準は、2024年12月15日以降に開始する会計年度の上場企業に有効で、早期採用が許可されています。当社は現在、ASU 2023-09の採用が要約連結財務諸表に与える影響を評価しています。
経営陣は、最近発行されたがまだ有効ではない信頼できるガイダンスが現在採用されている場合、それが会社の財務諸表の表示または開示に重大な影響を与えるとは考えていません。
当社は、公正価値測定を使用して金融資産と負債を計上しています。権威ある会計ガイダンスは、公正価値を定義し、米国会計基準に基づく公正価値測定の枠組みを確立し、公正価値測定に関する開示を強化します。公正価値とは、測定日の市場参加者間の秩序ある取引において、資産として受け取る交換価格、または資産または負債の元本市場または最も有利な市場で負債を譲渡するために支払われる交換価格(出口価格)と定義されます。
次の表は、2024年3月31日および2023年12月31日の時点で定期的に公正価値で測定されている会社の資産に関する情報を示し、そのような公正価値を決定するために使用される公正価値階層のレベルを示しています。
|
|
2024年3月31日現在の公正価値の測定値 |
|
|||||||||||||
|
|
(千単位) |
|
|||||||||||||
|
|
レベル 1 |
|
|
レベル 2 |
|
|
レベル 3 |
|
|
公正価値 |
|
||||
現金同等物 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
合計 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
2023年12月31日現在の公正価値の測定値 |
|
|||||||||||||
|
|
(千単位) |
|
|||||||||||||
|
|
レベル 1 |
|
|
レベル 2 |
|
|
レベル 3 |
|
|
公正価値 |
|
||||
現金同等物 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
合計 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
2024年3月31日現在、会社の資産は
15
2024年3月31日および2023年12月31日現在の資産と設備は以下のとおりです。
|
|
3 月 31 日 |
|
|
12月31日 |
|
||
|
|
(千単位) |
|
|||||
実験室用機器 |
|
$ |
|
|
$ |
|
||
家具と備品 |
|
|
|
|
|
|
||
コンピューター機器 |
|
|
|
|
|
|
||
借地権の改善 |
|
|
|
|
|
|
||
資産と設備総額 |
|
|
|
|
|
|
||
減価償却累計額が少ない |
|
|
( |
) |
|
|
( |
) |
資産と設備、純額 |
|
$ |
|
|
$ |
|
||
減価償却費は $
2022年2月15日(「締切日」)に、当社はシリコンバレー銀行を貸し手(「SVB」)として融資担保契約(「ローン契約」)を締結しました。会社は$を集めました
タームローンには、プライムレート(ウォールストリートジャーナルのマネーレートセクションに掲載されている)の(A)にプラスした額の(A)の大きい方の金額に等しい変動金利で利息がかかります。
タームローンは、2024年2月15日までに全額前払いすることができます。
ローン契約に基づくタームローンおよび関連債務は、ローン契約に基づく否定的な誓約の対象となる知的財産を除き、実質的にすべての会社の財産、権利、資産によって担保されています。
ローン契約には、慣習的な表明、保証、債務不履行事由、および契約が含まれています。これには、会社がSVBの会社の口座に、会社のすべての現金またはドルのいずれか少ない方の金額に等しい金額を、無制限かつ担保なしの現金として維持するという要件が含まれます。
2024年3月31日と2023年3月31日に終了した3か月間に、当社はタームローンに関連する支払利息を$計上しました
16
次の表は、2024年3月31日現在の長期債務の総満期(千単位)を示しています。 |
|
|||
|
|
|
|
|
年 |
|
|
|
|
2024 |
|
$ |
|
|
2025 |
|
|
||
合計 |
$ |
|
||
|
|
|
|
|
次の表は、2024年3月31日現在の長期負債と現在の負債部分(千単位)を示しています。 |
|
|||
|
|
|
|
|
長期債務 |
|
$ |
|
|
最終支払いの増加 |
|
|
||
控除:未償却債務発行費用 |
|
|
( |
) |
長期債務、純額 |
$ |
|
||
長期債務の現在の部分 |
|
$ |
|
|
控除:未償却債務発行費用 |
|
|
( |
) |
長期負債の現在の部分、純額 |
$ |
|
||
債務発行費用
債務発行費用は繰り延べられ、長期債務の控除額として提示されます。債務発行費用は、ローン期間中、実効金利法を使用して償却されます。繰延債務発行費用の償却は、要約連結営業報告書の支払利息と包括損失に含まれています。
会社は$を負担しました
未払費用は以下のとおりです。
|
|
3 月 31 日 |
|
|
12月31日 |
|
||
(千単位) |
|
2024 |
|
|
2023 |
|
||
従業員と取締役会の報酬 |
|
$ |
|
|
$ |
|
||
受託研究サービス |
|
|
|
|
|
|
||
プロフェッショナルサービス |
|
|
|
|
|
|
||
受託製造サービス |
|
|
|
|
|
|
||
合計 |
|
$ |
|
|
$ |
|
||
オン
17
アインシュタインライセンスに基づき、当社は、アインシュタインライセンスの対象となる特許を使用するすべての製品、プロセス、およびサービス(これに関連してアインシュタインから受け取った特定の技術を含む)をサブライセンス、輸入、製造、製造、使用、提供、販売の申し出および販売する権利を有する独占的な世界的ライセンスを保有しています。Einstein Licenseでは、会社は次のことを義務付けられています。
当社は、2024年と2023年3月31日の時点で、アインシュタイン・ライセンスに基づく義務を遵守していました。
アインシュタインライセンスは、特定のライセンス製品に関して支払期日となる可能性のあるアインシュタインへのロイヤリティの支払いという会社の最後の義務の満了時に失効します。その義務は、その条項に基づいて早期に終了されない限り、特定のライセンス製品に関して支払われる可能性があります。Einstein Licenseには、会社がそれに基づく義務を履行しなかった場合の特定の解約条項が含まれています。
アインシュタインライセンスに従って、会社はアインシュタインに発行されました
当社は、ASC 730「研究開発」に従って、アインシュタインライセンスに関連して発生するライセンス料を計上しています。注10コラボレーション収益を参照してください。
ストックオプション評価
2024年3月31日および2023年3月31日に終了した3か月間の価値評価が必要なストックオプションについて、各ストックオプションアワードの公正価値は、以下の仮定に基づいてブラック・ショールズオプション価格モデルを使用して見積もられました。
|
|
2024年3月31日 |
リスクフリー金利 |
|
|
予想配当利回り |
|
|
予想されるボラティリティ |
|
|
期待寿命 |
|
|
|
|
|
|
|
2023年3月31日 |
リスクフリー金利 |
|
|
予想配当利回り |
|
|
予想されるボラティリティ |
|
|
期待寿命 |
|
18
2024年3月31日に終了した3か月間のストックオプション活動の概要は次のとおりです。
|
|
の数 |
|
|
加重 |
|
|
加重 |
|
|||
2023年12月31日に発行されているストックオプション |
|
|
|
|
$ |
|
|
|
|
|||
付与されました |
|
|
|
|
|
|
|
|
— |
|
||
運動した |
|
|
|
|
|
|
|
|
— |
|
||
キャンセルされました |
|
|
( |
) |
|
|
|
|
|
— |
|
|
2024年3月31日に発行されているストックオプション |
|
|
|
|
|
|
|
|
|
|||
2024年3月31日に行使可能なストックオプション |
|
|
|
|
$ |
|
|
|
|
|||
当社は$を認めました
2024年3月31日現在、認識されていない株式ベースの報酬費用の総額は
2023年3月31日現在、認識されていない株式ベースの報酬費用の総額は
株式ベースの報酬
2024年3月31日および2023年3月31日に終了した3か月間の株式ベースの報酬費用は、次のように当社の要約連結営業報告書および包括損失に含まれていました。
|
|
3 か月が終了 |
|
|
|||||
(千単位) |
|
2024 |
|
|
2023 |
|
|
||
一般と管理 |
|
$ |
|
|
$ |
|
|
||
研究開発 |
|
|
|
|
|
|
|
||
株式報酬費用の総額 |
|
$ |
|
|
$ |
|
|
||
2022年11月16日、当社は合計で行使可能なワラントを発行しました
2022年11月のワラントは、ASC 480「負債と資本の区別」およびASC 815「デリバティブとヘッジング」に基づいて評価され、当社は株式分類が適切であると判断しました。当社は、新株予約権と事前積立新株予約権の両方について、株式分類を決定しました。これらの新株は、当社が株式を買い戻す義務を具体化しておらず、保有者が行使時に一定数の普通株式を受け取ることを許可していないためです。ASC 815-40-25によると、当社は保有者に固定または保証付きリターンを提供しないため、当社はワラントと事前積立ワラントを株式として計上しています。
19
当社は、ASC 606の範囲内にある会社の特定のライセンスまたはコラボレーション契約に基づくコラボレーション収益を認識しています。当社の顧客との契約には、通常、知的財産権と研究開発サービスのライセンスに関する約束が含まれています。会社の知的財産に対するライセンスが、契約で特定されている他の履行義務と異なると判断された場合、当社は、ライセンスがライセンシーに譲渡され、ライセンシーがライセンスを利用して利益を得ることができるときに、ライセンスに割り当てられた返金不可の前払い料金からの収益を認識します。他の約束が同梱されているライセンスについては、当社は総合履行義務の性質を評価し、複合履行義務が時間の経過とともに履行されるのか、ある時点で履行されるのか、また、時間の経過とともに、返金不可の前払い料金からの収益を認識する目的で進捗状況を測定する適切な方法があるかどうかを判断するために判断します。会社の契約には、追加の商品やサービスを取得するオプションが含まれている場合があります。
お客様との当社の契約条件には、通常、(i) 返金不可の前払いおよび研究活動に関連するパススルー費用、(ii) 開発、規制、および商業上のマイルストーンの支払い、(iii) 将来のオプション、および (iv) ライセンス製品の純売上高に対するロイヤルティのうちの1つまたは複数の支払いが含まれます。したがって、取引価格は通常、契約開始時に支払われる固定手数料と、パススルー費用と特定のイベントの達成時に支払われるマイルストーンの支払い、および顧客がライセンス製品の純売上高を認識したときに獲得できる段階的なロイヤルティという形での変動対価で構成されます。会社は、約束された商品やサービスを顧客に譲渡することと引き換えに受け取ることができると予想される対価額に基づいて取引価格を測定します。当社は、「期待価値法」法を利用して変動対価の額を見積もり、1回のオープン契約で受けることができる対価額を予測しています。変動対価の金額は、変動対価に関連する不確実性がその後解消されても、認識された累積収益額の大幅な逆転は起こらない可能性が高い範囲で、取引価格に含まれています。規制当局の承認を受けている場合など、当社またはライセンシーの管理下にないマイルストーン支払いは、トリガーイベントが発生するまで達成される見込みはありません。各報告期間の終わりに、会社は各マイルストーンの達成確率と関連する制約を再評価し、必要に応じて、全体的な取引価格の見積もりを調整します。このような調整はすべて累積キャッチアップベースで記録され、調整期間の収益と純損失に影響します。
一定水準の製品販売の達成に基づくマイルストーン支払いを含む、売上ベースのロイヤルティを含む取り決めの場合、当社は、(i) 関連する売上が発生したとき、または (ii) 支払いの一部または全部が配分された履行義務が履行された(または部分的に履行された)ときのどちらか遅い方で収益を認識します。現在までに、当社は、コラボレーション契約から生じた開発、規制、商業上のマイルストーンやロイヤルティ収益を確認していません。オプションの商品やサービスの対価は、契約開始時に取引価格から除外されます。
会社は、該当する場合、相対的な独立販売価格ベースで、契約で特定された各履行債務に取引価格を割り当てます。ただし、変動対価の特定の要素は、次の基準の両方が満たされる限り、契約における1つ以上の特定の履行義務に具体的に割り当てられます。(i)支払い条件は、履行義務を果たすか、個別の商品またはサービスを譲渡するための努力に特に関連しており、(ii)変動対価を履行義務または個別商品またはサービスに完全に割り当てることは、基準の配分目的と一致します。割り当てられているのは約束された商品やサービスの譲渡と引き換えに、企業が受けることができると予想される対価の金額。会社は、各契約で定められている各履行義務の独立売却価格を決定するための判断を必要とする仮定を立てます。各履行義務の単独売却価格を決定する際に使用される主な前提条件には、予測収益、開発スケジュール、推定研究開発コスト、割引率、行使の可能性、技術的および規制上の成功確率などがあります。
収益は、約束された商品やサービスを顧客に譲渡することによって履行義務が履行されたとき、または履行時にそれぞれの履行義務に割り当てられる取引価格の金額に基づいて計上されます。時間の経過とともに履行される履行義務については、関連する商品やサービスの支配権を顧客に移管した際の実績を示す単一の進捗状況を測定して、履行義務の完全な履行に向けた進捗状況を測定することで収益を認識します。当社は、インプットメソッドを使用して、時間の経過とともに履行される履行義務の完全な履行に向けた進捗状況を測定します。当社は、報告期間ごとに進捗状況を評価し、必要に応じて、業績指標と関連する収益認識を調整します。このような調整はすべて累積キャッチアップベースで記録され、調整期間の収益と純損失に影響します。会社は、努力が費やされるにつれて、履行義務の履行に向けた進捗状況を測定します。
LG化学とのコラボレーション契約
2018年11月6日、当社はLG化学株式会社(「LG化学」)と、以下の分野に焦点を当てた当社の免疫スタットの開発に関する協力契約(「LG化学協力契約」)を締結しました。
20
腫瘍学。LG化学協力契約に基づき、当社はLG化学に、特定のアジア諸国(総称して「LG化学地域」)において、当社の主力製品であるCUE-101と、さらに2つのがん抗原に対してT細胞を標的とするイムノスタットを開発、製造、商品化する独占ライセンスを付与しました。2021年4月30日、2019年12月18日に当社とLG化学との間で締結され、2020年11月5日に修正されたグローバルライセンスおよびコラボレーション契約(「グローバルライセンスおよびコラボレーション契約」)に基づくLG化学のオプションは失効し、したがって当社はグローバルライセンスおよびコラボレーション契約に基づく重要な義務を負わなくなりました。2021年6月、追加された2つのがん抗原のうち2つ目の抗原の選択について継続的に話し合った結果、LG化学と当社は、2つ目の抗原を選択せずに選択期間を満了させることに合意しました。当社は、LG化学協業契約に含まれるすべての資産を、米国およびLG化学地域以外の世界市場で開発および商品化する権利を保有しています。LG Chemコラボレーション契約に基づいてLG化学に付与されたライセンスやその他の権利と引き換えに、LG化学は$を稼ぎました
2019年5月16日、LG化学は会社に1ドルを支払いました
2020年12月7日、当社は$を稼ぎました
2021年11月23日、会社は1ドルを稼ぎました
$は別として
小野とのコラボレーションとオプション契約
2023年2月22日、当社は小野製薬株式会社(「小野」)と戦略的協力契約(「小野製薬協定」)を締結しました。これは、CUE-401をさらに開発し、CUE-401を臨床に向けて前進させるのに役立つ専用のリソースと能力を提供するためです。小野コラボレーション&オプション契約の条件に基づき、小野は会社に前払い金を支払い、指定されたオプション期間を通じてCUE-401に関連するすべての研究活動に全額資金を提供することに同意しました。このオプション期間中、当社はCUE-401の研究開発を担当します。小野がCUE-401のライセンスオプションを行使すると、当社はオプション行使金を受け取り、開発および商業マイルストーンの支払いを合計で$を上限として受け取る資格があります。
21
販売について。そのような行使により、小野はCUE-401を開発および商品化する全世界の権利を取得し、当社はその権利を留保します
小野コラボレーション&オプション契約の条件に基づき、当社は24か月という指定されたオプション期間(「研究期間」)を通じてCUE-401に関連する研究活動を行います。この研究期間中、当社は、CUE-401を潜在的なINDおよび規制当局の承認に向けて前進させることを目的とした、科学的調査、非臨床、前臨床、および臨床薬の研究開発活動(これらの活動、総称して「研究開発」と呼びます)の実施を担当します。小野は、当社が実施する研究開発活動の資金調達を担当しています。契約に基づき、当社が実施する研究開発活動の対価として、小野(i)は1回限りの、返金不可、クレジット不可の前払いをしました
$は別として
アインシュタイン使用許諾契約
2015年、当社はT細胞の活性、精度、免疫調節薬候補を制御する生物製剤のエンジニアリングのための当社のコア技術プラットフォームと、共刺激シグナル伝達分子(リガンド)とT細胞標的ペプチドの発見を可能にする2つの支援技術に関連する特定の特許権について、アインシュタインとEinsteinライセンスを締結しました。当社は、2017年7月31日に、2018年10月に修正および改訂されたライセンス契約を締結しました。これにより、アインシュタインライセンスに基づく当事者の特定の義務が変更されました。アインシュタインライセンスは、2024年1月13日にさらに改正されました。2024年および2023年3月31日に終了した3か月間、会社はドルを負担しました
アインシュタイン・ライセンスに関する当社の残りのコミットメントは、将来のマイルストーンの達成に基づいています。Einstein Licenseに基づいて行われたマイルストーン支払いの総額は、最大で$になることがあります
LG化学とのコラボレーション契約
注記10のLG化学協力協定の説明を参照してください。
小野とのコラボレーション契約
注記10の小野コラボレーションおよびオプション契約の説明を参照してください。
22
不測の事態
当社は、その負債の可能性と推定が可能な範囲で、偶発負債を計上します。当社の要約連結財務諸表には、偶発債務の見越額はありません。
当社は、事業の一環として、時折、さまざまな法的手続きの対象となることがあります。2024年3月31日現在、当社は法的手続きまたは脅迫された法的手続きの当事者ではありません。これらの不利な結果は、個別に、または全体として、その事業、財政状態、または経営成績に重大な悪影響を及ぼします。
2022年3月28日、当社はMIL 40G, LLC(以下「ライセンサー」)とライセンス契約(「ライセンス」)を締結しました。これに従って会社はおよそリースします
会社は$の資産の使用権を認めました
ライセンスの期間は2022年4月15日(「期間開始日」)に始まり、2026年4月14日(「期間」)に失効します。ライセンスの月額レンタル料は $です
2022年5月3日、当社はライセンサーとライセンスの第1修正(「修正第1条」)を締結しました。これに従い、2022年7月15日からライセンスは追加の部屋を含むように拡張されました。憲法修正第1条を考慮して、敷金はドルから増額されました
2022年5月31日に、当社は、2022年12月1日から2024年12月1日までの期間、マサチューセッツ州ボストンのゲストストリート40番地にある追加の実験室スペースのオペレーティングリース(「40G追加実験室リース」)を締結しました。40Gの追加ラボリースでは、リース期間中の支払いが急増します。40Gの追加研究室リースに基づく月額レンタル料は
2022年9月9日、当社はマサチューセッツ州ケンブリッジのラボスペースリースをMIL 21E, LLCで終了しました。解約日は2022年12月6日です。当社は、ASC 360の減損および放棄のガイダンスに基づいて、この解約の会計上の影響を分析しました。2022年12月31日に終了した年度中に、当社は残りのリース負債および使用権資産を差し引くためのエントリを記録しました
2024年3月31日に終了した3か月間、当社はドルを記録しました
23
2024年3月31日時点で、オペレーティングリースの使用権資産は $でした
2023年3月31日および2023年12月31日現在、保証金の金額は
2024年3月31日現在のこれらのリースに基づく将来の最低リース支払い額は次のとおりです。
|
(千単位) |
|
|
2024(残りの9か月) |
|
|
|
2025 |
|
|
|
2026 |
|
|
|
リース料総額 |
|
|
|
控える:帰属 |
|
( |
) |
リース料の現在価値 |
$ |
|
|
$の家賃費用
加重平均残存リース期間と会社のリースに関連する割引率は次のとおりです。
|
|
|
|||||
|
3 月 31 日 |
|
|
12月31日 |
|
||
加重平均残存リース期間 (年) |
|
|
|
|
|
||
加重平均割引率 |
|
% |
|
|
% |
||
24
アイテム 2.経営陣による財政状態と経営成績に関する議論と分析
Cue Biopharma, Inc. およびその子会社(「Cue Biopharma」、「私たち」、「当社」)の財政状態と経営成績に関する以下の経営陣の議論と分析は、フォーム10-Qのこの四半期報告書に含まれる当社の財務諸表および付随する注記、および終了した会計年度の財務諸表とそれに付随する注記と併せて読む必要があります 2023年12月31日、および関連する経営陣による財政状態と経営成績に関する議論と分析は、当社の年次報告書に記載されています10-Kは、2024年3月28日に証券取引委員会(SEC)または2023年の年次報告書に提出されました。
[概要]
私たちは臨床段階のバイオ医薬品企業で、患者の体内で直接疾患特異的T細胞を選択的に調節する新しいクラスの治療用生物製剤を開発しています。私たちのビジョンは、疾患特有のT細胞を選択的に調節する新しいクラスのT細胞エンゲイガーを生成することにより、自然のシグナル、つまり「手がかり」をタンパク質治療薬に変換することです。
以下で説明するように、当社独自のイムノスタット(T細胞の選択的標的化と変化)プラットフォームと誘導体分子により、がんの場合は広範な免疫活性化、自己免疫疾患の場合は広範な免疫抑制による有害な副作用を回避しながら、患者自身の免疫システムが健康を回復する可能性を高めることができると考えています。私たちの選択的免疫調節アプローチは、人間の衰弱させる苦しみと死を引き起こす2つの主要な病気、すなわち癌と自己免疫疾患の治療に採用される可能性があります。
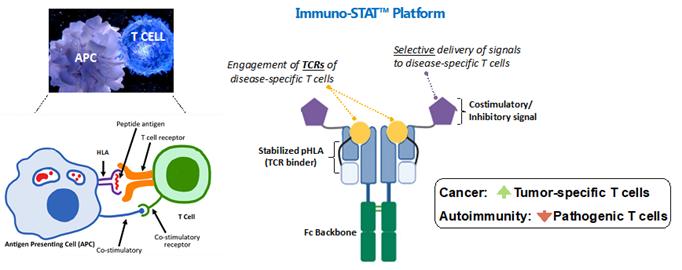
がんと自己免疫疾患は、世界中の多くの人々が罹患し、罹患した人々の平均余命を短くする主要な疾患領域です。毎年、世界中で約2,000万件のがんの新規診断があり、そのうち、米国、または米国だけでも約200万件です。これらの新しい症例のうち、約50%が再発性転移性疾患に進行し、最終的には死に至ります。さらに、世界人口の約4%が自己免疫疾患と診断されており、米国だけで約2,400万件の症例が発生しています。免疫系の重砲であるT細胞は、抗原提示細胞との相互作用を通じて、選択性の高い「指揮統制」命令プロセスによって制御されていることを認識し、この「指揮統制」システムをエミュレートするImmuno-Statプラットフォームを設計しました。
特異性、つまり「コマンド・アンド・コントロール」システムの制御は、右下の図の黄色い丸で示されている特定の標的エピトープと、右下の図では紫色の五角形で示されているインターロイキン2やIL-2などの「コマンド」共刺激信号に結合するT細胞受容体(TCR)によって実現されます。これら2つの「手がかり」、つまり信号は、当社のイムノスタットの場合のように同時に作用すると、標的となる腫瘍特異的T細胞を選択的に活性化して「ダイヤルイン」して、潜在的に有害なT細胞の広範な免疫活性化を回避しながらがんを攻撃することができます。逆に、自己免疫では、当社の自己免疫薬候補は、他の病気への感受性を高める可能性のある広範な免疫抑制を回避しながら、抑制シグナルを発して自己反応性T細胞を選択的に弱めるように設計されています。下の左の図は、自然界に見られる抗原提示細胞(APC)と特定のT細胞との相互作用を示しています。
イムノスタットプラットフォーム:自然の選択性をエミュレートします

25
最初の2つの腫瘍薬候補であるCUE-101とCUE-102は、IL-2ベースのCUE-100シリーズの模範的なプログラムであり、HLA-A02対立遺伝子の代表です。HLA-A02対立遺伝子は、米国および西ヨーロッパ地域、つまり患者集団の約 50% で優勢であり、頻度は低いものの、他の世界集団でも流行しています。私たちは前臨床的に追加のHLA対立遺伝子を開発しました。これにより、患者の対象範囲を世界的に拡大できる可能性があります。CUE-101 HLA-A02は、ヒトパピローマウイルス陽性、またはHPV+、頭頸部扁平上皮がん(HNSCC)の治療用に設計されており、上の図の黄色い円で示されているエピトープ9アミノ酸配列を変更することで、ウィルムス腫瘍1タンパク質、またはオンコフェットであるWT1を標的とするCUE-102 HLA-A02が得られます 20種類以上のがんで過剰発現することが知られている抗原です。これまでの臨床観察に基づいて、当社のImmuno-Statプラットフォームは、患者自身の免疫系を選択的に活性化してがんと闘うことにより、幅広いがんに展開できることを実証したと考えています。また、患者の体を攻撃する自己反応性T細胞を抑えたり抑制したりすることで、幅広い自己免疫疾患に対処するように設計された医薬品候補も開発しました。私たちは、制御性T細胞(Tregs)の誘導と増殖による幅広い自己免疫疾患の潜在的な治療薬であるCUE-401の開発に焦点を当てて、小野製薬株式会社(Ono)と戦略的コラボレーションを行っています。さらに、最近、CUE-501を使用して、ループスなどのB細胞誘発性自己免疫疾患を標的とする医薬品候補を開発しました。これにより、B細胞アブレーションで自己反応性B細胞を破壊し、その後自然に再増殖させ、免疫バランスを回復できる可能性があります。
私たちの医薬品候補は、臨床および前臨床開発のさまざまな段階にあります。CUE-101とCUE-102の臨床データの継続的な生成と、CUE-401とCUE-501の新たな前臨床データにより、がんや自己免疫疾患に苦しむ患者の臨床転帰を向上させるための潜在的なブレークスルーとなる「免疫バランスの回復」のためのモジュール式アプローチを開発したという私たちの信念は引き続き強まっています。
私たちのパイプライン
下のパイプラインチャートは、私たちが現在注力している腫瘍学および自己免疫資産のポートフォリオと、それらの開発段階の詳細を示しています。腫瘍学では、IL-2ベースのCUE-100シリーズのCUE-101およびCUE-102プログラムにリソースを優先し、戦略的に重点を置いてきました。また、CUE-100シリーズのプログラムをさらに発展させるための第三者サポートの選択肢を積極的に評価しています。
私たちは、前臨床IL-2/トランスフォーミング成長因子ベータ(TGF-ベータ)ベースの自己免疫疾患治療薬候補であるCUE-401の開発に向けて、小野との戦略的協力を引き続き進めています。その独自の作用機序から、CUE-401はTregsの誘導と拡大のための高度に分化した分子になる可能性があり、この分野で研究されている他のIL-2変異体とは一線を画していると考えています。
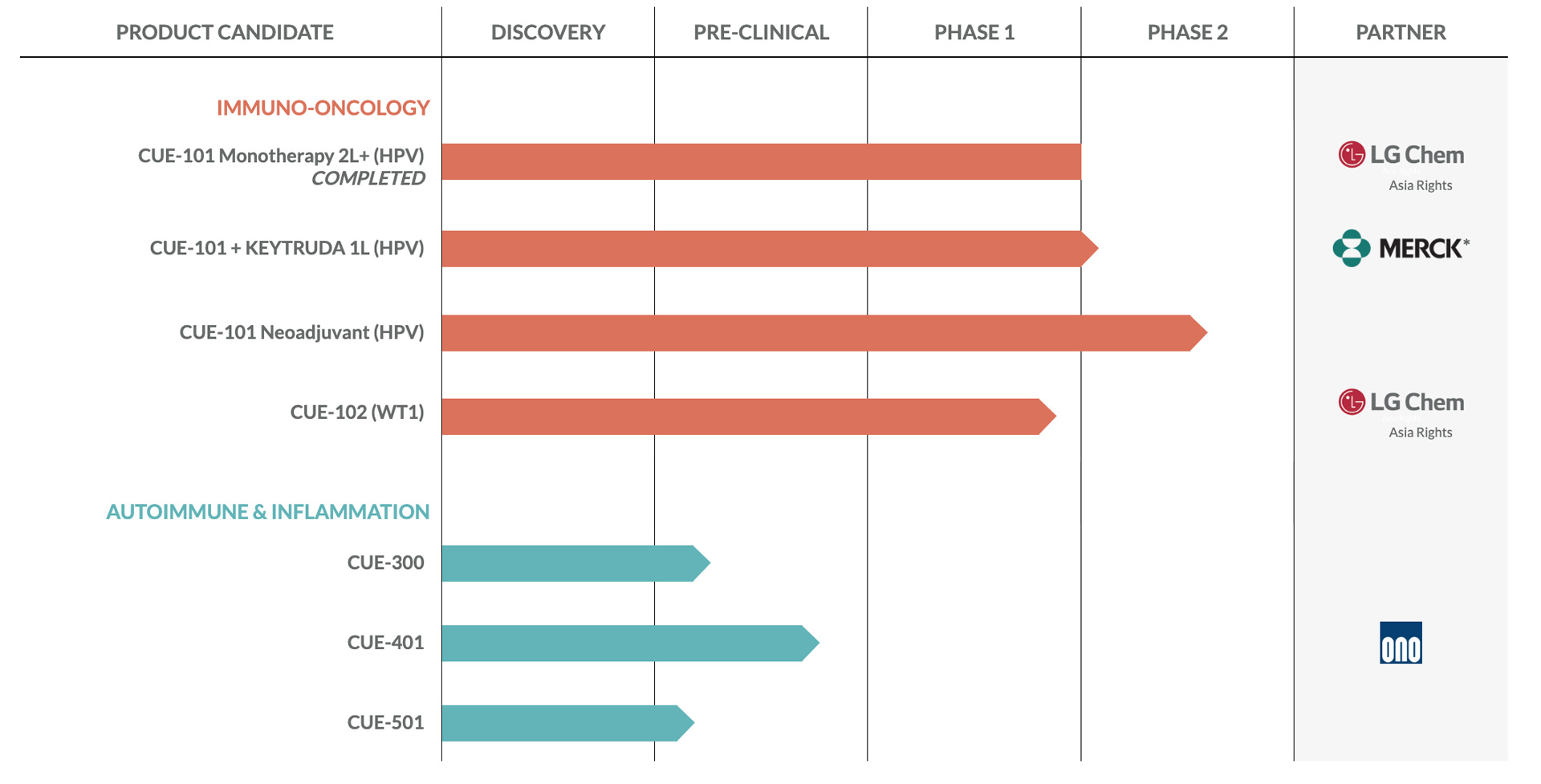
26
キュー101です
CUE-101は当社の最も進んだ臨床段階の資産であり、ヒト白血球抗原HLA-A02に適合する患者を対象とした、ヒトパピローマウイルス陽性(HPV+)、頭頸部扁平上皮がん(HNSCC)の治療薬として臨床的に研究されています。私たちの最初の第1相臨床試験では、CUE-101をR/M、HPV+ HNSCCの単剤療法として、またKEYTRUDAとの併用療法として検討しています。私たちは、2L以上の患者を対象とした単剤療法と、1L R/M、HPV+ HNSCC患者を対象とした現在の標準治療(SoC)との併用療法の両方として、再発性転移性またはR/M、HPV+ HNSCCの治療で、CUE-101のファストトラック指定を受けました。また、ネオアジュバントとアジュバントの設定で、医師が後援する臨床試験も進行中および計画中です。この一連の試験により、CUE-101を幅広い市場機会を持つ複数の患者集団で調査することができます。
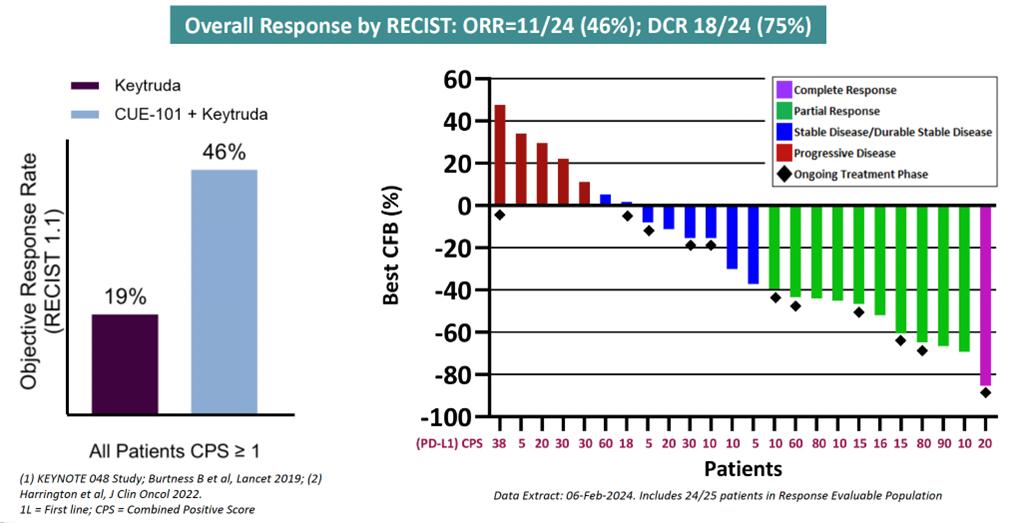
2L+ R/M HNSCCを対象としたCUE-101単剤療法試験とKEYTRUDAを併用した1L試験のCUE-101試験の両方が登録を完了し、臨床活動の測定基準が実証されています。最も注目すべきは、2023年の年次報告書で詳しく説明されているように、現在のSoCであるKEYTRUDAと組み合わせて進行中のCUE-101の第1b相試験では、1件の完全奏効が確認され、10人が部分奏効を確認しました。また、第1b相試験で投与された24人の患者について、全奏効率(ORR)が得られた7人の患者について、全奏効率(ORR)が得られました。このORRは、KEYNOTE 048の調査で報告されたように、KEYTRUDAだけで観察された過去のORRである19%の2倍以上を表しています。重要なのは、これらの反応には、KEYTRUDAに反応する可能性が低いことが知られている患者集団である、PD-L1の発現が低い(合計陽性スコアが20未満)複数の患者が含まれていることです。
KEYTRUDAと併用して4mg/kgのCUE-101を投与された患者におけるベースラインと反応からの最良の変化です
私たちは、CUE-101の第1相用量漸増および増量単剤療法と併用試験の両方で治療を受けた患者を引き続き追跡し、2024年6月に開催される米国臨床腫瘍学会の会議でさらなる最新情報と実質的な分析を提供する予定です。
2024年1月、2L+単剤療法と1Lの併用療法の両方での登録試験への潜在的な道筋を明らかにするために、タイプBの会議でFDAと面会しました。提案されているCUE-101の第2相試験の概要を以下に示します。で
27
提案されている試験で、治療を受けていない最前線のR/M HPV+HNSCC患者は、3つの治療群のいずれかにランダム化されます。CUE-101を2回投与し、200mgのペムブロリズマブまたは200mgのペムブロリズマブ単独を投与し、いずれの場合も、3週間ごとに投与します。全奏効率(ORR)が主要評価項目となり、副次評価項目は無増悪生存(PFS)と全生存(OS)になります。ORRの中間分析は、この第2相試験で最初の患者に投与してから約14か月後に行われ、ORRの一次分析は、この第2相試験で最初の患者が投与されてから約22〜24か月後に行われると予想されています。
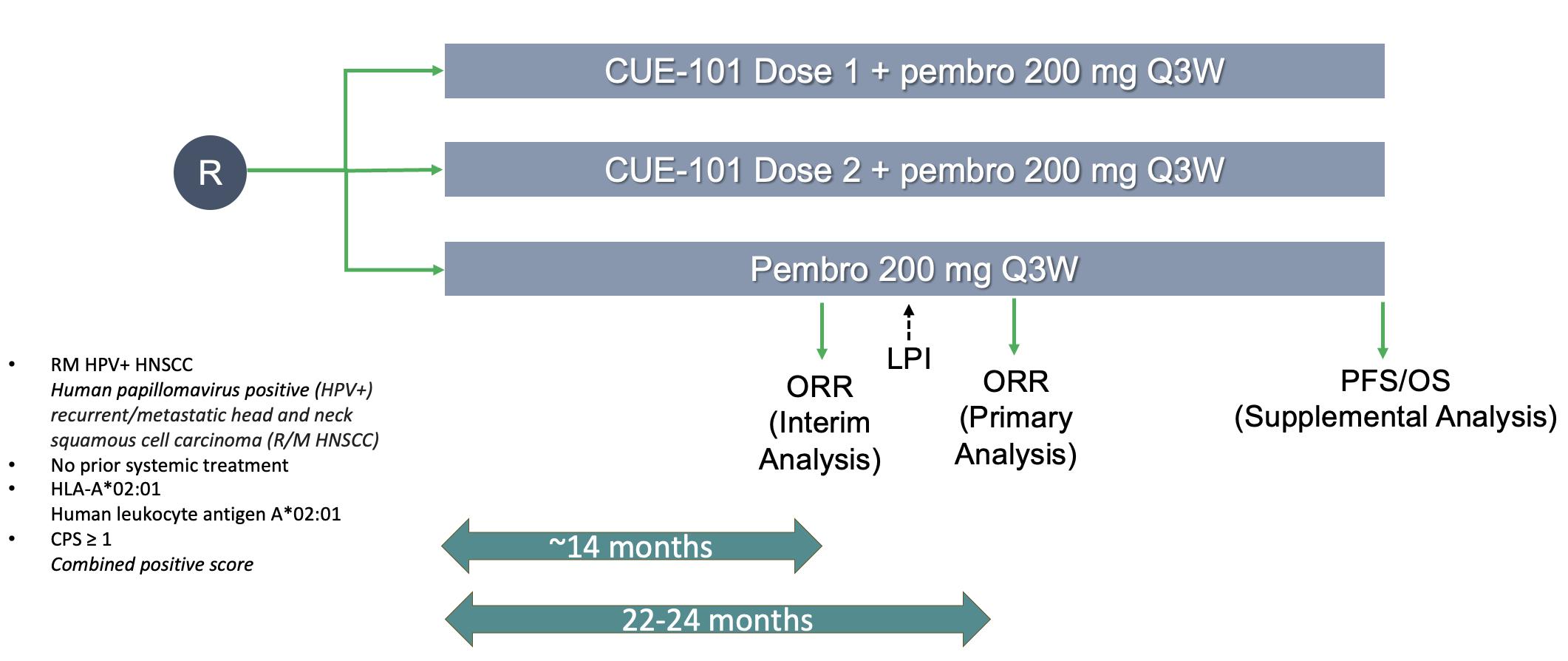
この第2相試験デザインと得られたデータにより、治療効果の明確な推定、第3相で検査する用量の確認が可能になり、潜在的な登録試験の全体的な成功確率が高まり、CUE-100シリーズのリスクのさらなる軽減にもつながると考えています。現在、この第2相試験の実施に必要なリソースと資金の要件を評価しています。
キュー-102です
CUE-100シリーズの2番目のHLA-A02医薬品候補であるCUE-102は、固形腫瘍(結腸直腸、卵巣、膵臓、肺など)と血液悪性腫瘍(急性骨髄性白血病など)の両方を含む20種類以上の癌で過剰発現することが知られている胎児抗原であるウィルムス腫瘍1タンパク質、またはWT1を標的としています。、多発性骨髄腫と骨髄異形成症候群)。私たちは、セカンドラインのR/M WT1+結腸直腸がん、胃がん、卵巣がん、膵臓がんを対象に、CUE-102の第1相単剤療法臨床試験を実施しています。CUE-101と同様に、CUE-102は、現在の標準治療との組み合わせとして、第一選択のR/Mがん、局所的に進行したR/M治療など、複数の患者集団で調査できます。
当社の前臨床データセットと一致して、現在進行中のCUE-102単剤療法試験では、治療を受けた患者でWT1+特異的T細胞の選択的かつ強力な増殖が観察されています。これらのWT1腫瘍特異的T細胞の増殖は、抗腫瘍免疫力を高め、腫瘍の縮小を促進することが期待されています。下のグラフは、第1相CUE-102単剤療法臨床試験の用量漸増部分で治療を受けた患者で観察された腫瘍負荷の減少を示しています。左のグラフに示されているように、CPIを含む3つの治療ラインで進行した胃がん患者は、36週目に3つの標的病変の合計が34%減少しました。青い線が緑の-30%のハッシュラインと交差しています。この胃がん患者は、データ締め切り日の時点で治療を続けています。右のグラフは、緑の -30% のハッシュラインと交差する青い線で示されているように、2 mg/kgの用量漸増コホートの卵巣がん患者で観察された腫瘍量の減少を示しています。これらの患者は両方とも、その後、新しい病変の出現により進行性疾患を経験しました。また、データ締め切り日の時点で治療を継続し、6か月以上持続的に安定した疾患を示した膵がん患者を含む、膵臓がん患者の病勢制御も観察されました。
CUE-102で治療された患者の標的病変の軽減
28
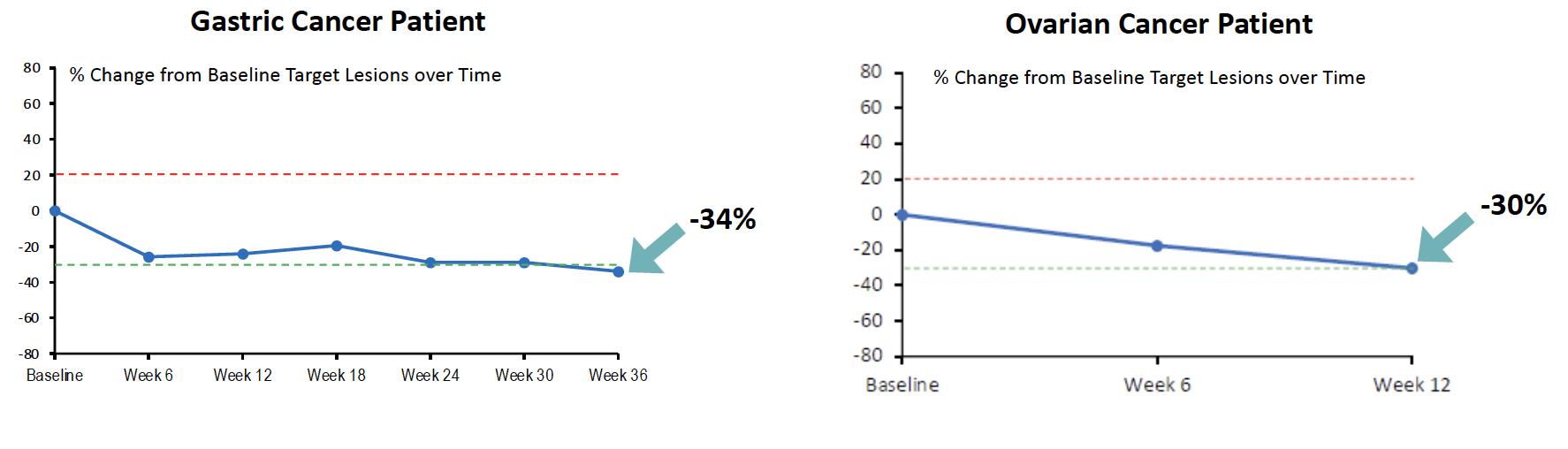
試験の第1相用量漸増部分で4つの適応症すべてにわたって臨床活性の有望な兆候が観察されたことを踏まえ、複数のWT1陽性がんタイプを対象に単剤療法試験の第1相拡大部分を実施しています。2024年6月に開催される米国臨床腫瘍学会の会議で、この進行中の試験のさらなる最新情報と実質的な分析を提供したいと考えています。
CUE-100シリーズに加えて、Immuno-Statプラットフォームのモジュール性と汎用性を活用して、CUE-400やCUE-500など、腫瘍学以外の生物学的シリーズを開発しました。これらは、自己免疫疾患を治療するための個別の治療アプローチに対応するために、合理的なタンパク質工学によって特別に設計されています。CUE-400シリーズは、慢性自己免疫疾患の制御性T細胞(Treg)を選択的に誘導および増殖するように設計された、新しいクラスの二重特異性分子です。CUE-500シリーズは、メモリーT細胞に選択的にB細胞を枯渇させるように指示できる二重特異性イムノスタットを開発するための新しいアプローチです。これは、CAR T療法によるB細胞のアブレーションによって実証され、現在、自己免疫疾患や炎症性疾患の治療の重要な軸として認識されています。CUE-401とCUE-500シリーズの評価から得られた前臨床データは、自己免疫疾患の治療におけるこれらの新しいアプローチの望ましい機構的効果の証拠を示していると考えています。
キュー-401
CUE-401は、IL-2とTregを選択的に誘導するためのトランスフォーミング成長因子ベータ、またはTGFベータという2つの重要なシグナルを持つ二重特異性分子です。CUE-401の構造はCUE-100シリーズで使用されているものと似ていて、同じIL-2バリアントが組み込まれています。TGFのベータバリアントは、安全プロファイルを改善し、製造性を向上させ、効果的なTregの誘導と拡張を実現するためにIL-2信号と機械的に連携するように設計されました。ナイーブCD4+T細胞にIL-2とTGFのベータシグナルを同時送達すると、Tregsのマスター遺伝子転写因子であるFox P3が誘導されます。下のパネルは、ヒト末梢血単核細胞におけるTreg誘導を示しており、Tregを誘導するためにIL-2とTGFのベータシグナルの両方が必要であることを例示しています。以下に示すように、IL-2とTGF betaだけでは、かなりの数の新しいTregを生成することはできません。対照的に、IL-2とTGFベータの両方を持つCUE-401は、前臨床研究で、必要な信号の両方を送信することで、Fox P3+ Tregの強力な集団を生成する能力を実証しました。
CUE-401は前臨床試験で複数のシグナルを利用してTregを誘導しました
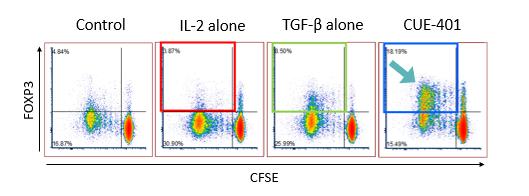
29
私たちは研究室で、またセントルイス大学のリチャード・ディパオロ博士と協力して、CUE-401がTregを拡大して誘発できるかもしれないという前提を支持して、前臨床データを生成しました。得られたTregは機能的に抑制され、安定した表現型を維持します。CUE-401治療により、自己免疫性胃炎のマウスモデルにおける自己反応性T細胞の増殖が抑制されました。CUE-401の治療の可能性は、自己免疫性胃炎のT細胞移植モデルでも観察されています。このモデルでは、CUE-401による治療により、自己反応性T細胞が長期間抑制され、治療を受けたマウスの胃における疾患の病理学的証拠が大幅に減少しました。下の図に示すように、前臨床動物モデルでは、CUE-401による短期治療により、自己免疫性胃炎や組織破壊から長期的に保護されました。組織病理(左側)とまとめられた胃炎スコア(右側)は、CUE-401で治療した動物の組織破壊から有意に保護されていることを示しました。
CUE-401による短期治療は、胃炎や組織破壊から長期的に大幅に保護されました
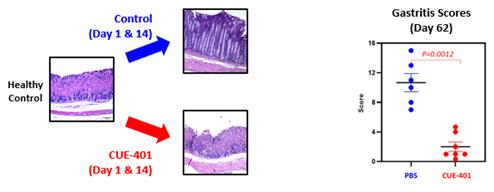
CUE-401は、小野製薬との戦略的協力のもとに開発されています。小野は、臨床に向けた主要な臨床候補を特定するために、現在進行中の前臨床作業のすべてを支援しています。
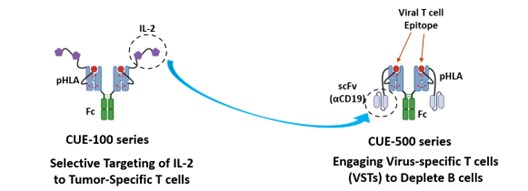
CUE-500シリーズ
CUE-500シリーズは、自己反応性または自己反応性B細胞によって引き起こされる自己免疫疾患に焦点を当てています。CUE-500シリーズのImmuno-stat生物製剤は、防御的な抗ウイルスT細胞レパートリー(ウイルス特異的T細胞、またはVST)を選択的に利用し、B細胞を標的にして枯渇させるように設計されています。すべてのT細胞の全身的な関与と活性化を避けながら、「キラー」T細胞を選択的にリダイレクトし、T細胞を介したB細胞の枯渇を本質的に達成する生物学的製剤を導入する私たちのアプローチは、CD19-CAR-T細胞療法のアプローチで例示されているものと類似していると考えています。私たちは、自己免疫疾患のこの重要なメカニズムに生物学的製剤で取り組むことは、細胞療法に基づく戦略よりも大きな利点があると信じています。CUE-500シリーズの主力候補であるCUE-501は、自己免疫疾患や炎症性疾患に対処するために、選択的メモリーT細胞にB細胞を枯渇させるように指示するように設計された二重特異性株です。CUE-500シリーズは、CUE-100シリーズで達成されたリスク軽減に基づいて構築されており、同じ改良型IL-2を活用しています。これは、CUE-100シリーズのイムノスタット分子がそれぞれリスクを軽減し、その後の医薬品候補をさらに加速させるという私たちの前提をさらに裏付けています。下の図は、CUE-500シリーズの設計と作用メカニズムを示しています。
CUE-500シリーズ T細胞を介したB細胞枯渇のためのリスクのない、検証済みのフレームワークを活用しています
30
運用計画
私たちの技術は、腫瘍学では臨床開発段階、自己免疫疾患では前臨床開発段階にあります。私たちのプラットフォームは、複数の医学的適応症に対応する有望な医薬品候補の多様なパイプラインを構築する可能性があると信じています。私たちは、研究、試験、最適化、パイロット研究の実施、初期段階の臨床開発の実施、そして必要に応じて、より広範囲で後期段階の臨床開発のための提携に注力し、広範な特許保護と知的財産開発を追求することで、イムノスタット薬候補の商品化の価値と可能性を最大化するつもりです。
私たちは開発段階の企業なので、これまでの事業活動の大部分は、資源強化のための戦略的に重要な提携を促進するための事業開発だけでなく、さらなる研究開発と事業開発に専念してきました。
私たちの企業開発戦略の基本的な部分は、主要な製薬またはバイオテクノロジー組織と戦略的パートナーシップを確立することです。これにより、腫瘍学と自己免疫疾患の分野における当社の技術プラットフォームの可能性をより十分に活用し、CUE-100シリーズのパイプラインを加速および拡大することができます。たとえば、以下の「LG化学との協力契約」および「小野との協力およびオプション契約」という見出しに記載されている協力などです。
重要な会計上の見積もりと重要な判断
当社の経営陣による当社の財政状態と経営成績の議論と分析は、米国で一般に認められている会計原則、または米国会計基準に従って作成された財務諸表に基づいています。財務諸表を作成するには、財務諸表の日付における報告された資産と負債の金額、偶発資産と負債の開示、および報告期間中の報告された収益と費用に影響する見積もりと仮定を行う必要があります。私たちは、以下に説明するものを含め、これらの見積もりや判断を継続的に評価しています。私たちは、過去の経験、既知の傾向や出来事、契約上のマイルストーン、および状況下では合理的であると私たちが考えるその他のさまざまな要因に基づいて見積もりをしています。これらの結果は、他の情報源からはすぐにはわからない資産と負債の帳簿価額を判断するための基礎となります。実際の結果は、仮定や条件が異なると、これらの見積もりと異なる場合があります。
当社の重要な会計方針は、フォーム10-Qのこの四半期報告書の他の場所に記載されている要約連結財務諸表の注記2に詳しく記載されていますが、2023年次報告書の項目7の経営陣による財政状態と経営成績の議論と分析に記載されている会計方針に含まれる見積もり、仮定、判断は、当社の財務諸表に最も大きな影響を与えると考えています。そのため、これらの見積もり、前提条件、判断は、当社の財務諸表に最も大きな影響を与えると考えています。重要な会計方針と見積もり。2024年3月31日に終了した3か月間、当社の重要な会計方針と見積もりに重大な変更はありませんでした。
最近の会計上の宣言と採用された基準
最近の会計上の発表についての議論は、フォーム10-Qのこの四半期報告書の要約連結財務諸表の注記2に含まれています。
31
研究開発活動に関連する重要な契約と合意
アインシュタイン使用許諾契約
2015年1月14日、私たちはアルバート・アインシュタイン医科大学(アインシュタイン)と、T細胞の活性、精度、免疫調節薬製品を制御する生物製剤のエンジニアリングのためのコアテクノロジープラットフォームに関する特定の特許権または特許について、2017年7月31日に修正および改訂され、2018年10月30日に修正されたアインシュタインライセンス契約(アインシュタインライセンス)を締結しました。共刺激シグナル伝達分子(リガンド)とT細胞標的ペプチドの発見を可能にする候補と2つのサポート技術。
私たちは、特許を使用するすべての製品、プロセス、サービス(これに関連してアインシュタインから受け取った特定の技術を含む)をサブライセンス、輸入、製造、製造、製造、使用、提供、販売の申し出を行う権利を持つ、世界規模の独占ライセンスを保持しています。これをライセンス製品と呼びます。アインシュタインライセンスでは、次のことが義務付けられています。
2024年3月31日現在、私たちはアインシュタインライセンスに基づく義務を遵守していました。
アインシュタインライセンスは、特定のライセンス製品に関して支払期日となる可能性のあるアインシュタインへのロイヤルティ支払いの最後の義務の満了時に失効します。ただし、その条項に基づいて早期に終了されない限り。アインシュタインライセンスには、当社が契約に基づく義務を履行しなかった場合に発効する特定の終了条項が含まれています。
私たちは、会計基準体系化(ASC、730、研究開発)に従って、アインシュタインライセンスに関連して発生した費用を計上します。2024年3月31日と2023年3月31日に終了した3か月間、このライセンスに関連してアインシュタインに支払うべき手数料として、それぞれ25,000ドルと44,000ドルの手数料が発生しました。そのような費用は、もしあれば、当社の要約連結営業報告書の研究開発費と包括損失に含まれています。
アインシュタイン・ライセンスに従い、2017年12月27日の普通株式の新規株式公開の完了に関連して、アインシュタインに671,572株の普通株式を発行しました。
LG化学とのコラボレーション契約
2018年11月6日より、腫瘍学の分野に焦点を当てた免疫統計の開発に関連して、LG化学株式会社(LG Chem Ltd.)とコラボレーション、ライセンス、オプション契約、またはLG化学コラボレーション契約を締結しました。
32
LG Chemコラボレーション契約に従い、LG化学に、オーストラリア、日本、韓国、シンガポール、マレーシア、ベトナム、タイ、フィリピン、インドネシア、中国(マカオと香港を含む)、および当社が収集した2つの追加のがん抗原または医薬品候補に対してT細胞を標的とするイムノスタットを開発、製造、商品化するための独占ライセンスをLG化学に付与しました。LGケミカルテリトリーとして。私たちは、LG化学協業契約に含まれるすべての資産を、米国およびLG化学地域以外の世界市場で開発および商品化する権利を保有しています。LG化学共同契約に基づき、LG化学地域の主要な対立遺伝子を含むと予想される最大3つの対立遺伝子について、選択した免疫安定剤を設計します。これにより、世界市場の集団の患者を対象とする範囲が広がり、市場へのリーチが拡大します。一方、LG化学は、選択された医薬品候補の開発と商品化のための化学、製造および管理(CMC)プロセスを確立します。さらに、LG Chemは、腫瘍学のターゲット用に1つの追加免疫スタットを選択することも、世界規模での独占的な開発および商品化ライセンスのために追加のイムノスタットを選択することもできます。2019年12月18日、私たちとLG化学はグローバルライセンスおよびコラボレーション契約を締結しました。この契約は2020年11月5日に修正されました。修正されたこのような契約を、グローバルライセンスおよびコラボレーション契約と呼びます。グローバルライセンスおよびコラボレーション契約は、オプション期間の長さや当事者の表明、保証、契約などの特定の条項を除き、LG化学による追加イムノスタットのオプションに関するLG化学コラボレーション契約の規定に優先します。2021年4月30日、グローバルライセンスおよびコラボレーション契約に基づくLG化学のオプションは失効しました。
LG化学コラボレーション契約の条件に基づき、LG化学は当社に500万ドルの返金不可、信用不可の前払いを支払い、500万ドルの普通株式を1株あたり購入しました。これは、LG化学コラボレーション契約の発効日の直前の30取引日間にわたって、1株あたりの出来高加重平均終値に対する20%のプレミアムに相当します。また、研究、開発、規制、商業上の特定のマイルストーンが達成されれば、合計で最大4億ドルの追加支払いを受ける資格があります。2019年5月16日、LG化学共同契約に基づき、当社の主力医薬品候補であるCUE-101のINDがFDAに承認されたことで、250万ドルのマイルストーン支払いが行われました。2020年12月7日、LG化学共同契約に基づく前臨床候補者の選定により、125万ドルのマイルストーン報酬が支払われました。2021年11月23日、医薬品候補の選定により300万ドルのマイルストーン報酬が支払われました。さらに、LG化学協業契約では、LG化学がLG化学地域での市販医薬品候補または共同製品の純売上高に対して、製品ごとおよび国ごとに段階的な一桁のロイヤルティを当社に支払うことも規定しています。ただし、ある国の特許権の満了日、その国での規制上の独占権の満了日、または共同開発製品の最初の商業的販売から10年後のいずれか遅い日までそのような国では、LG Chemに定められた特定のロイヤルティのステップダウン条項が適用されますコラボレーション契約。
LG Chemのコラボレーション契約に従い、両当事者はコラボレーション製品に関連する研究費を分担し、LG化学は特定の医薬品候補にCMCプロセス開発を提供し、場合によってはコラボレーション製品の臨床および商業供給を含む追加の下流製造能力を提供します。CMCプロセス開発を行う見返りに、LG化学はLG化学地域以外のすべての国で販売されたコラボレーション製品の販売に対して、一桁台前半のパーセンテージのロイヤリティ支払いを受ける資格があります。2024年3月31日と2023年3月31日に終了した3か月間、LG化学のコラボレーション契約に関連して、それぞれ34,000ドルと36,000ドルの収益を確認しました。2024年3月31日現在、契約締結以来、この契約に関連するコラボレーション収益は1,990万ドルを記録しています。LG化学協力契約の研究段階の大部分は、2022年3月31日に実質的に完了しました。
LG化学のコラボレーション契約には、さまざまな表明、保証、契約、補償、その他の慣習的な規定が含まれています。LG化学は、LG化学協業契約に定められた通知期間の後いつでも、便宜上、またはプログラムごと、製品ごと、または国ごと、または全体的に、または当社の管理権の変更を理由に、LG化学協業契約を終了することができます。いずれの当事者も、重大な違反が未解決の場合は、LG化学協業契約の全部、またはプログラムごと、製品ごと、または国ごとに解約することができます。また、LG化学協業契約は、(i) 相手方が破産、倒産、清算された場合、または (ii) 相手方が管理する特定の特許への異議申し立てを含む特定の活動については、いずれかの当事者によって解約可能です。早期に終了しない限り、LG化学協業契約は、該当するロイヤリティ期間の満了時に、製品ごと、また国ごとに失効します。
現在までに、LG化学はCUE-102研究プログラムの焦点であるWT1というがん抗原をもう1つ選択しました。私たちは現在、この契約に従ってLG化学と2つのコラボレーション製品を開発しています。
33
小野とのコラボレーションとオプション契約
2023年2月22日、私たちはCUE-401をさらに開発し、CUE-401を臨床に向けて前進させるのに役立つ専用のリソースと能力を提供するために、小野製薬株式会社(Ono)と戦略的コラボレーション契約、つまり小野製薬株式会社(Ono Collaboration and Option Agreement Agreement)を締結しました。小野コラボレーション&オプション契約の条件に基づき、小野は私たちに前払い金を支払い、指定されたオプション期間を通じてCUE-401に関連するすべての研究活動に全額資金を提供することに同意しました。このオプション期間中、私たちはCUE-401の研究開発を担当します。OnoがCUE-401のライセンスオプションを行使すると、オプション行使による支払いが行われ、合計で最大2億2000万ドルの開発および商業マイルストーンの支払いと、販売に対する段階的なロイヤリティの対象となります。そのような行使により、小野はCUE-401を開発および商品化する全世界の権利を受け取り、私たちは米国での共同開発および共同商品化の権利の 50% を保持します。共同開発と共同商品化のオプションを選択するという私たちの決定は、小野がCUE-401のライセンスを取得するオプションを行使してから30日以内に行うことができます。オプション行使と将来のマイルストーン支払いのために小野が私たちに支払う金額は、共同開発および共同商品化オプションを行使するという私たちの決定によって異なります。
小野コラボレーション&オプション契約の条件に基づき、24か月または研究期間という指定されたオプション期間を通じて、CUE-401に関連する研究活動を行います。この研究期間中、私たちは、CUE-401を潜在的なINDおよび規制当局の承認に向けて前進させることを目的とした、科学的調査、非臨床、前臨床、および臨床薬の研究開発活動(総称して研究開発)の実施を担当します。小野は私たちが実施する研究開発活動の資金提供を担当しています。小野コラボレーション&オプション契約によると、当社が実施する研究開発活動の対価として、小野は(i)2023年3月に300万ドルの一回限りの、返金不可、クレジット不可の前払いを行いました。(ii)研究を実施するために発生したすべての費用((a)第三者契約者からのパススルー費用や(b)上限のある正社員の給与など、研究を行うために発生したすべての費用を私たちに払い戻します。研究期間の最初の18か月で210万ドル。その後、当社と小野は、フルタイムの従業員の給与の上限を280万ドルに引き上げることに合意しました。Onoのコラボレーション&オプション契約の期間は、研究期間の満了まで延長され、24か月を超えることはできません。私たちは、最初に策定した研究開発計画に基づいて、研究期間の最初の18か月以内に研究開発活動を完了できると予測しています。
300万ドルの前払い金とパススルー費用に関連する資金調達は別として、2024年3月31日現在、変動する対価を取引価格に含めるべきではないと考えています。このような評価では、変動対価の見積もりが取引価格に含まれるようにするための制約の適用が考慮されました。ただし、次の報告期間で収益が逆転することはないと確信できる場合に限ります。各報告期間やその他の状況の変化に応じて、取引価格に含まれる推定変動対価とすべての制約金額を含め、取引価格を再評価します。2024年3月31日と2023年3月31日に終了した3か月間で、小野のコラボレーションおよびオプション契約に関連して、それぞれ170万ドルと20万ドルの収益を計上しました。2024年3月31日付けの貸借対照表には、180万ドルの短期研究開発負債を記録しました。2023年12月31日現在、連結貸借対照表には210万ドルの短期研究開発負債を記録しています。
業務結果
コラボレーション収益
私たちはまだ製品販売から商業収入を得ていません。現在までに、メルクシャープアンドドーム株式会社(2022年12月に終了)、LG化学、小野とのコラボレーション契約により収益を上げてきました。コラボレーション収益は、コラボレーション契約に関連する作業の進捗状況に応じて、期間ごとに異なる場合があります。
34
営業経費
営業費用は通常、一般管理費と研究開発費という2つのカテゴリーに分類されるため、一般的に認識しています。当社の営業費用には、資産や設備の減価償却および株式ベースの報酬に関連する現金以外の部分も含まれ、これらは必要に応じて一般管理費と研究開発費に配分されます。
一般管理費には、役員、法務、財務、人事、情報技術、管理職の給与と関連費のほか、専門家費用、保険費用、その他の一般的な企業経費が含まれます。公開会社としての運営に関連して、特定の規制および法的手続きの遵守を必要とする追加費用が発生するため、一般管理費は今後増加すると予想しています。法務、会計、保険、従業員報酬、その他の費用など、当社の事業を支援する活動が増えると予想しています。
研究開発費は、主に報酬費用、コンサルタント、外部のサービスプロバイダーや組織(大学の研究機関を含む)に支払われる手数料、施設費、および当社の医薬品候補に関する開発および臨床試験費用で構成されています。研究開発費は、発生時に運営費を請求します。現在進行中および計画中の臨床試験を含め、CUE-101とCUE-102の臨床開発を進め、当社の技術と研究に基づいて潜在的な将来の医薬品候補を開発するにつれて、研究開発費は将来増加すると予想しています。また、インフレ率の上昇、サプライチェーンの混乱、労働力不足も、研究開発費の増加の一因となる可能性があると考えています。
利息収入
私たちは、マネーマーケットファンドに投資された現金から利息収入を得ます。
2024年および2023年3月31日に終了した3か月間
ここに記載されているように、2024年3月31日および2023年3月31日に終了した3か月間の当社の要約連結営業報告書と包括損失を以下に示します。
|
|
3 か月が終了 |
|
|||||
|
|
3 月 31 日 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
|
|
(千単位) |
|
|||||
コラボレーション収益 |
|
$ |
1,717 |
|
|
$ |
187 |
|
営業経費: |
|
|
|
|
|
|
||
一般と管理 |
|
|
4,186 |
|
|
|
4,176 |
|
研究開発 |
|
|
10,199 |
|
|
|
9,391 |
|
営業費用の合計 |
|
|
14,385 |
|
|
|
13,567 |
|
事業による損失 |
|
|
(12,668) |
) |
|
|
(13,380) |
) |
その他の収入 (費用): |
|
|
|
|
|
|
||
利息収入 |
|
|
562 |
|
|
|
641 |
|
支払利息 |
|
|
(241) |
) |
|
|
(370) |
) |
その他の収益(費用)の合計、純額 |
|
|
321 |
|
|
|
271 |
|
純損失 |
|
$ |
(12,347) |
) |
|
$ |
(13,109 |
) |
コラボレーション収益
コラボレーション収益は、2023年3月31日に終了した3か月間の20万ドルから、2024年3月31日に終了した3か月間で150万ドル増加して170万ドルになりました。この増加は、2023年2月に締結された小野コラボレーション&オプション契約から得た収益によるものです。
一般管理費
2024年3月31日および2023年3月31日に終了した3か月間の一般管理費はそれぞれ420万ドルでした。
35
研究開発費用
研究開発費は、2023年3月31日に終了した3か月間の940万ドルから、2024年3月31日に終了した3か月間で80万ドル増加して1,020万ドルになりました。この増加は主に、臨床費が90万ドル増加したことによるもので、外部製造費の10万ドルの減少によって相殺されました。
利息収入
2024年3月31日と2023年3月31日に終了した3か月間の利息収入はそれぞれ60万ドルでした。
支払利息
支払利息は、2023年3月31日に終了した3か月間の40万ドルから、2024年3月31日に終了した3か月間の20万ドルに20万ドル減少しました。この減少は、修正されたローンおよび担保契約、またはファースト・シチズンズ・バンク・アンド・トラスト・カンパニーまたはファースト・シチズンズ・バンク(旧シリコンバレー銀行、SVB)とのローン契約に基づく元本借入残高の減少によるものです。
流動性と資本資源
私たちは、主に株式の私募および公募、メルクシャープアンドドーム株式会社、LG化学、小野からそれぞれのコラボレーション契約に基づいて受け取った現金、およびローン契約に基づく借入を通じて、必要な運転資金を調達してきました。2024年3月31日時点で、継続的な事業活動の資金として利用できる現金および現金同等物は合計4,100万ドルでした。当社の財政状態と経営成績に関する追加情報は、フォーム10-Qのこの四半期報告書に含まれる財務諸表に記載されています。
特定の目的に実際に費やす金額は、研究開発活動やプログラム、臨床試験、規制当局の承認、市況、事業戦略や技術開発計画の変更や改訂など、さまざまな要因によって大きく異なる可能性があります。
2023年5月9日、当社は2023年5月26日に発効が宣言されたフォームS-3(ファイル番号333-271786)に登録届出書を提出しました。これにより、最大3億ドルの当社の普通株式、優先株式、負債証券、ワラント、新株予約権、および/または1つ以上のオファリングにおけるユニットを随時売却登録できます。
2021年10月、私たちは時々、市場での株式公開プログラムを通じて、ジェフリーズLLC(ジェフリーズ)を代理人として、当社の普通株式を総収入最大8,000万ドルで売却する公開市場売却契約、または2021年10月のATM契約を締結しました。2021年10月のATM契約は、(a)2021年10月のATM契約に基づく当社の普通株式8,000万ドルの売却、または(b)当社またはジェフリーズによる2021年10月のATM契約の終了のいずれか早い時期に終了します。2024年3月31日に終了した3か月間に、2021年10月のATM契約に基づいて1,428,200株の普通株式を売却しました。売上高は340万ドルで、支払った手数料を差し引いた金額は取引費用を除きます。2023年3月31日に終了した3か月間、2021年10月のATM契約に基づく販売はありませんでした。2024年3月31日現在、当社は2021年10月のATM契約に基づいて合計9,028,573株の普通株式を、開始以来の取引費用を除いた金額で4,040万ドルで売却しました。これは支払われた手数料を差し引いた金額で、取引費用を除きます。
2022年2月15日、私たちはローン契約を締結し、それに基づいて1,000万ドルを借りました。ローン契約は2023年4月に修正されました。ローン契約に基づくタームローン、またはタームローンには、(A)プライムレート(ウォールストリートジャーナルのマネーレートセクションに掲載されている)に2.25%と(B)5.50%を加えた額のいずれか大きい方に等しい年率変動金利で利息がかかります。毎月1暦日に毎月の利息を支払う必要があり、2023年6月30日から、タームローンの返済を開始しました。(i)元本30回の連続分割と、追加タームローンが前払いされていない場合は毎月の未収利息の支払い、(ii)追加タームローンが前払いされている場合は24か月でタームローンの返済を開始しました。タームローンに基づくすべての未払いの元本、未払利息、未払利息、およびタームローンに関するその他すべての未払債務は、2025年12月1日に全額支払う必要があります。
ローン契約では、ファシリティがファースト・シチズンズ・バンクの別のファシリティで借り換えられている場合を除き、前払い保険料を条件として、タームローンの全部または全部を自発的に前払いすることができます。このような前払いプレミアムは、ローン契約を締結した日の1周年以降、ローン契約を締結した日の2周年以前に前払いした場合、タームローンの元本の2.00%、ローン契約を締結した日の2周年以降に前払いの場合はタームローンの元本の1.00%になります。タームローンの前払いまたは全額返済時に、1回限りの最終支払いが必要です
36
返済される積立タームローンの当初の元本の 5.00% に相当する支払い手数料。ローン契約では、貸主の口座に、すべての現金のうち少ない方、つまり20,000,000ドルのいずれか少ない方の金額に等しい金額を、制限なしかつ担保なしで維持することも義務付けられています。
2023年3月10日、シリコンバレー銀行(SVB)は閉鎖され、連邦預金保険会社(FDIC)が銀行の受取人に任命されました。FDICは後継ブリッジバンクを設立し、SVBのすべての預金は、米国財務省、連邦準備制度、およびFDICによって承認されたシステミックリスクの例外規定に基づいてブリッジバンクに送金されました。2023年3月27日、ファースト・シチズンズ・バンクはSVBの預金とその他の負債をすべて引き受け、SVBの融資とその他の資産の実質的なすべてをFDICから取得しました。ファースト・シチズンズ・バンクは、SVBと締結していたのと同じ既存の条件と契約に基づいて、引き続きタームローンを保有しています。当社の現金および現金同等物の大部分は、SVBアセット・マネジメントが顧問を務める米国銀行の保管口座にあります。
2022年11月14日、私たちは認定投資家と証券購入契約を締結しました。それに従い、2022年11月16日に、そのような投資家に合計7,656,966株の普通株式を発行し、私募で売却しました。また、特定の投資家には、普通株式の代わりに、合計1,531,440株の普通株式を購入するための事前積立ワラントまたはプレファンドワラントを発行し、いずれの場合も、付随するワラント、またはワラント、合計で最大9,188,406株の普通株式(または事前積立ワラント)を追加購入できますその代わりに)1株あたり3.265ドルの価格と付随するワラント(または事前積立ワラントと付随するワラント1株あたり3.2649ドル)、またはPIPEファイナンス。新株予約権の行使価格は1株あたり3.93ドル、その代わりに事前積立ワラントで行使された場合は、事前積立ワラント1株あたり3.9299ドルです。新株予約権は、発行後いつでも行使可能で、締切5周年に終了します。事前積立型ワラントは、発行後いつでも行使可能で、有効期限はありません。PIPEファイナンスからの総収入は3,000万ドルで、プレースメントエージェント手数料と募集費用260万ドルを差し引いたものです。パイパー・サンドラー・アンド・カンパニーがリード・プレースメント・エージェントを務め、パブリック・ベンチャーズLLCがPIPEファイナンスの共同プレースメント・エージェントを務めました。
資金調達のために追加の株式を発行すると、既存の株主の所有率は減少します。新規投資家は、当社の普通株式の既存の保有者よりも上位の権利、優先権、または特権を要求する可能性があります。私たちが債務証券を発行する場合、資産の担保権を与える必要があるかもしれませんし、多額の債務返済義務を負う可能性があり、貸し手は将来の破産または清算の可能性がある場合に(株主と比較して)上級職に就く可能性があります。さらに、企業コラボレーションやライセンス契約により、非経常費用やその他の費用を負担したり、知的財産や研究開発活動に関連する特定の権利を放棄したり、短期および長期の支出を増やしたり、既存の株主を希薄化させる証券の発行、資産に対する先取特権を必要とし、毎月の費用負担が増える債務の発行、または経営と事業の中断が必要になる場合があります。
キャッシュフロー
現在の計画と予測される費用に基づいて、2024年3月31日現在の既存の現金および現金同等物により、2025年の第1四半期まで事業資金を調達できると考えています。ただし、将来の事業資金を調達するためには追加の資本を調達する必要があり、継続企業として存続します。私たちは、株式の提供、コラボレーション、その他の戦略的提携を組み合わせて、将来の現金需要を賄うことを期待しています。米国の資本市場のボラティリティと一般的な経済状況は、必要な資金を調達する上で重大な障害となる可能性があり、その結果、許容できる条件で必要な資金を確保できない場合があります。これにより、私たちが継続企業として存続できるかどうかについて大きな疑問が生じます。
次の表は、2024年3月31日および2023年3月31日に終了した3か月間の現金、現金同等物、および制限付現金の変動をまとめたものです。
|
|
3 か月が終了 |
|
|||||
|
|
3 月 31 日 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
|
|
(千単位) |
|
|||||
提供した純現金(使用量): |
|
|
|
|
|
|
||
営業活動 |
|
$ |
(9,784 |
) |
|
$ |
(10,833さん) |
) |
投資活動 |
|
|
(55) |
) |
|
|
15,002 |
|
資金調達活動 |
|
|
2,354 |
|
|
|
388 |
|
現金、現金同等物および制限付現金の純変動額 |
|
$ |
(7,485) |
) |
|
$ |
4,557 |
|
37
営業活動
2024年3月31日に終了した3か月間の営業活動に使用された純現金は合計980万ドルでしたが、2023年3月31日に終了した3か月間の純現金は1,080万ドルでした。100万ドルの変動は、主に純損失が80万ドルの減少によるものです。
投資活動
2024年3月31日に終了した3か月間の投資活動に使用された純現金は合計10万ドルでしたが、2023年3月31日に終了した3か月間の投資活動によって提供された純現金は1,500万ドルでした。1,510万ドルの変動は、主に2023年3月31日に終了した3か月間の有価証券の償還によるものです。
資金調達活動
財務活動によって提供された純現金は、2023年3月31日に終了した3か月間で合計240万ドルでしたが、2023年3月31日に終了した3か月間は40万ドルでした。200万ドルの変更は、当社のATMサービスに基づく売上高340万ドルによるもので、2024年3月31日に終了した3か月間の合計100万ドルのタームローンの支払いと、2023年3月31日に終了した3か月間のストックオプションの行使による40万ドルの収益によって相殺されました。
資金要件
当社の継続的な活動に関連して、特にImmuno-Statプラットフォームの研究開発を継続し、継続的に継続し、新しい臨床試験を開始し、医薬品候補の市販承認を求めるにつれて、経費は増加すると予想しています。さらに、公開会社としての運営に関連して追加費用が発生することが予想されます。私たちの経費も、次の場合に増えます。
2022年の第1四半期に、私たちはCUE-100シリーズのCUE-101およびCUE-102のオンコロジープログラムに戦略的重点を置きました。私たちは、進行中の臨床試験から得られたデータは、特に登録を通じて、これらのプログラムのさらなる臨床開発の能力を強化するための戦略的パートナーシップを確立するという私たちの目標の確固たる基盤を提供すると信じています。私たちは、腫瘍学と自己免疫疾患の分野における当社の技術プラットフォームの可能性をより十分に活用し、CUE-103、Neo-STATおよびRDI-STATプログラム、CUE-300およびCUE-400シリーズのさらなる開発を含むCUE-100シリーズのパイプラインを加速および拡大するために、パートナーシップやコラボレーション、または代替の資金調達構造を通じて、第三者の支援を積極的に求めています。2022年には、優先順位の高い企業目標と戦略をサポートするために、オフィスとラボの設置面積を減らし、研究開発機能を再構築するための積極的な措置も講じました。これらのステップにより、これまでに主要なプログラムに割り当てられたコスト削減が実現しました。
38
会計基準の更新、またはASU、2014-15、財務諸表の提示—継続的な懸案事項(サブトピック205-40)、またはASC 205-40に基づく要約連結財務諸表の注記の注記1で説明しました。私たちは、財務諸表が発行された日から1年以内に期限が来たときに、状況や出来事が将来の金融債務を履行する能力について実質的な疑念を引き起こすかどうかを評価する責任があります。ASC 205-40の下では、この評価では当初、財務諸表が発行された時点で完全に実施されていない計画による潜在的な緩和効果を考慮に入れていません。私たちは現在、2024年3月31日現在の既存の現金および現金同等物により、2025年の第1四半期までの事業資金を調達できると考えているため、このフォーム10-Qの四半期報告書に含まれる財務諸表の発行日から12か月未満のこのキャッシュランウェイは、累積赤字、損失履歴、および将来の予想損失とともに、ASC 205-40を満たすと判断しました私たちの発行日から1年以内に継続企業として存続できるかどうかについて実質的な疑問を投げかけるための基準このForm 10-Qの四半期報告書には財務諸表が含まれています。このリスクを軽減する計画は整っています。主に、株式公開、コラボレーション、その他の戦略的提携を組み合わせて追加資本を調達することですが、追加資金の利用可能性とレベル、および現金支出の削減によっては、これらの緩和努力が成功する保証はありません。
今後も事業資金を調達し続けるためには、追加の資本を調達するか、追加の負債を負う必要があります。私たちが追加資金を調達できるかどうかは、財務、経済、市場の状況によって異なりますが、その多くは私たちの手に負えないため、必要なときや、私たちにとって有利な条件で資金を調達できない場合があります。必要なときに追加の資金を調達できない場合、製品開発や将来の商品化の取り組みを延期、削減、中止するか、そうでなければ自分で開発して販売したい医薬品候補を開発および販売する権利を付与する必要があります。これは当社の事業見通しに悪影響を及ぼす可能性があり、事業を継続できなくなる可能性があります。医薬品候補の研究、開発、商品化に関連する多くのリスクと不確実性のため、必要な運転資金の正確な金額を見積もることはできません。当社が計画している将来の資本要件に影響を与え、追加の運転資金の必要性を加速させる可能性のある要因には、次のものがあります。
当社の医薬品候補の開発に関して、これらの変数やその他の変数の結果が変化すると、その医薬品候補の開発に関連する費用と時期が大幅に変わる可能性があります。さらに、当社の事業計画は将来変更される可能性があり、そのような事業計画に関連する運営上のニーズや資本要件を満たすために追加の資金が必要になる場合があります。
それまでは、もしあれば、かなりの製品収益を生み出すことができるので、パブリックエクイティまたはプライベートエクイティの提供、デットファイナンス、コラボレーション、戦略的パートナーシップ、またはマーケティングを組み合わせて、現金需要を賄うことを期待しています。
39
第三者との配布またはライセンス契約、および組織や財団からの助成金。普通株式またはその他の株式連動証券の株式を売却して追加の資金を調達する場合、現在の株主の所有持分は希薄化されます。たとえその時点で追加の資本がすぐに必要でなくても、条件が良いときはいつでも、公的または私的資本市場へのアクセスを模索することがあります。第三者とのコラボレーション、戦略的提携、マーケティング、流通、ライセンス契約を通じて追加の資金を調達した場合、当社の技術、将来の収益源、または医薬品候補に対する貴重な権利を放棄するか、私たちが受け入れられない条件でライセンスを付与しなければならない場合があります。デットファイナンスを通じて追加の資金を調達する場合、将来の貸し手に資産の担保権を与える必要があり、債務返済費用が高額になる可能性があり、貸し手は将来の破産または清算に関連して優遇措置を受ける可能性があります。
必要なときに追加の資本を調達できない場合、技術開発の縮小または事業の大幅な縮小または縮小を求められることがあります。権利や資産を売却または処分せざるを得ない可能性があります。商業的に合理的な条件で十分な資金を調達できないと、当社の事業、経営成績、および財政状態に重大な悪影響を及ぼす可能性があります。これには、資金不足により当社の事業が失敗し、解散し、投資家への利益がほとんどまたはまったくない状態で清算される可能性も含まれます。
主なコミットメント
2024年3月31日に終了した3か月間、2023年年次報告書の項目7の財務状況と経営成績に関する経営陣の議論と分析に記載されているように、2023年12月31日現在の契約上の義務とコミットメントに重大な変更はありませんでした。
40
アイテム 3.市場リスクに関する定量的および質的開示
小規模な報告会社なので、この項目3で要求される情報を提供する必要はありません。
アイテム 4.統制と手続き
開示管理と手続き
私たちは、1934年の証券取引法または取引法の規則13a-15(e)および15d-15(e)で定義されているように、開示管理と手続きを維持する責任があります。開示管理と手続きは、取引法に基づいて提出または提出する報告書で当社が開示する必要のある情報が、SECの規則とフォームで指定された期間内に記録、処理、要約、および報告されることを保証するために設計された統制およびその他の手続きです。開示管理と手続きには、取引法に基づいて提出または提出する報告書で当社が開示する必要のある情報を蓄積し、必要に応じて当社の最高経営責任者や最高財務責任者を含む経営陣に確実に伝達し、必要な開示に関する迅速な決定を可能にするために設計された管理と手続きが含まれますが、これらに限定されません。
取引法の規則13a-15で義務付けられている開示管理と手続きに関する経営陣の評価(最高経営責任者および最高財務責任者の参加を得て)に基づいて、当社の最高経営責任者および最高財務責任者は、当社の開示管理および手続きは、このレポートの対象期間の終了である2024年3月31日時点で有効になったと結論付けました。
統制の有効性に関する固有の制限
当社の最高経営責任者や最高財務責任者を含む当社の経営陣は、当社の開示管理や財務報告に関する内部統制が、すべてのエラーや詐欺を防止または検出することを期待していません。制御システムは、どんなにうまく設計および運用されても、制御システムの目的が達成されるという絶対的な保証ではなく、合理的な保証しか提供できません。制御システムの設計は、資源の制約があるという事実を反映しなければならず、統制の利点はコストと相対的に考慮されなければなりません。さらに、すべての統制システムには固有の制限があるため、統制を評価しても、エラーや詐欺による虚偽表示が発生しないこと、または統制上の問題や詐欺の事例がすべて検出されたことを絶対的に保証することはできません。これらの固有の制限には、意思決定の判断に誤りがある場合や、単純なエラーやミスが原因で故障が発生する可能性があるという現実が含まれます。統制は、一部の人物の個別の行為、2人以上の共謀、または経営陣による統制の無効化によっても回避できます。あらゆる統制システムの設計は、将来起こる可能性に関する特定の仮定に一部基づいており、どのような設計であっても、将来起こり得るあらゆる状況下で定められた目標を達成できるという保証はありません。将来の期間における統制の有効性の評価の予測にはリスクが伴います。時間が経つにつれて、状況の変化やポリシーや手続きの遵守度の低下により、統制が不十分になる可能性があります。
財務報告に関する内部統制の変更
2024年3月31日に終了した3か月間、財務報告に対する当社の内部統制に重大な影響を及ぼした、または財務報告に対する内部統制に重大な影響を与える可能性がかなり高い変更はありませんでした。
41
第二部その他の情報
アイテム 1.法的手続き
私たちは現在、重要な法的手続きの当事者ではありません。
アイテム 1A.リスク要因
私たちは急速に変化する環境の中で事業を展開しており、ビジネス、財政状態、または将来の業績に重大な影響を与える可能性のある多くのリスクを伴います。その中には、私たちの制御が及ばないものもあります。これらのリスクのいずれかが発生すると、当社の事業、財務状況、経営成績、および/または成長見通しが損なわれたり、実際の結果が、このレポートに記載された将来の見通しに関する記述や随時作成する将来の見通しに関する記述に含まれるものと大きく異なる可能性があります。当社と当社の事業を評価する際には、このForm 10-Qの四半期報告書やSECに提出するその他の文書に含まれる情報と、以前に「パートI、項目1A」で開示されたリスク要因を慎重に検討してください。2023年の年次報告書の「リスク要因」。
アイテム 2.持分証券の未登録売却および収益の使用
[なし]。
アイテム 3.シニア証券のデフォルト
[なし]。
アイテム 4.鉱山の安全に関する開示
該当しません。
アイテム 5.その他の情報
(c) 取締役および役員の取引契約
私たちの取締役や役員はいません
42
アイテム 6.展示品
|
|
参考により組み込み |
||||
示す 番号 |
展示品の説明 |
提出 これで |
フォーム |
示す |
出願日 |
登録/ファイル番号 |
|
|
|
|
|
|
|
10.1# |
2024年1月13日付けのアルバート・アインシュタイン医科大学との修正および改訂されたライセンス契約の第2修正 |
|
10-K |
10.38 |
3/28/2024 |
001-38327 |
31.1 |
1934年の証券取引法の規則13a-14 (a) または規則15d-14 (a) に基づく証明 |
X |
|
|
|
|
31.2 |
1934年の証券取引法の規則13a-14 (a) または規則15d-14 (a) に基づく証明 |
X |
|
|
|
|
32.1 |
2002年のサーベンス・オクスリー法の第906条に従って採択された、米国法第18条第1350条に基づく認証 |
X |
|
|
|
|
101.インチ |
インライン拡張ビジネスレポーティング言語(XBRL)インスタンスドキュメント — インスタンスドキュメントは、XBRLタグがインラインXBRLドキュメントに埋め込まれているため、インタラクティブデータファイルには表示されません。 |
X |
|
|
|
|
101.SCH |
インライン XBRL タクソノミー拡張スキーマドキュメント |
X |
|
|
|
|
101.CAL |
インライン XBRL タクソノミー拡張計算リンクベースドキュメント |
X |
|
|
|
|
101.DEF |
インライン XBRL タクソノミー拡張定義リンクベースドキュメント |
X |
|
|
|
|
101.LAB |
インライン XBRL タクソノミー拡張ラベルリンクベースドキュメント |
X |
|
|
|
|
101.PRE |
インライン XBRL タクソノミー拡張プレゼンテーションリンクベースドキュメント |
X |
|
|
|
|
104 |
2024年3月31日に終了した四半期の当社の四半期報告書のフォーム10-Qの表紙は、インラインXBRLでフォーマットされています。 |
X |
|
|
|
|
# この展示品の一部は、規則S-Kの項目601 (b) (10) (iv) に従って省略されています。
43
署名
1934年の証券取引法の要件に従い、登録者は署名者に代わってこの報告書に正式に署名させ、正式に権限を与えられました。
|
|
キュー・バイオファーマ株式会社 |
||
|
|
|
|
|
|
|
|
|
|
日付:2024年5月9日 |
|
作成者: |
|
/s/ ダニエル・R・パッセリ |
|
|
|
|
|
|
|
|
|
ダニエル・R・パッセリ 最高経営責任者 (最高執行役員) |
|
|
|
|
|
日付:2024年5月9日 |
|
作成者: |
|
/s/ ケリー・アン・ミラー |
|
|
|
|
|
|
|
|
|
ケリー・アン・ミラー 最高財務責任者 (最高財務会計責任者) |
44