カタログ表
私たちの神経科学臨床プロジェクトは
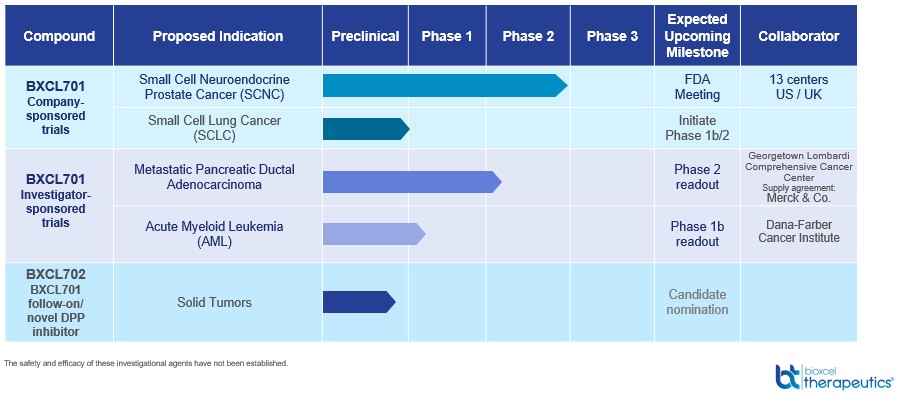
以下は,本四半期報告(Form 10−Q)までの日,我々の主要神経科学臨床開発プロジェクトの状況概要である
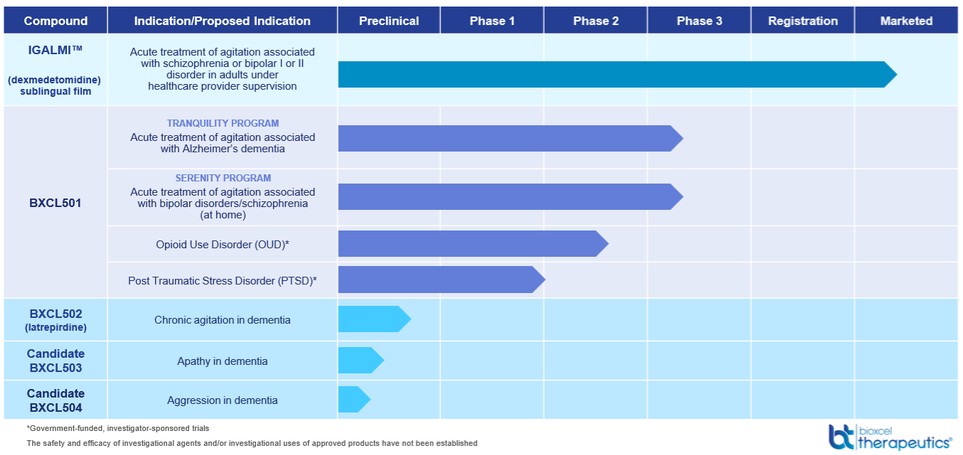
BXCL 501開発
FDAがIGALMIと承認した他の適応ではTMBXCL 501は、Dexの研究、特許、および口腔溶解膜剤であり、Dexは、興奮などのストレス関連行動の症状に対する選択的α-2受容体アゴニストである。BXCL 501は我々の最先端の神経科学臨床プログラムであり,看護機関や家庭環境において双極性感情障害や統合失調症に関連する騒動を家庭急性治療し,アルツハイマー病による可能性のある認知症患者の急性治療(非毎日)を行うための評価を受けている。
BXCL 501は、舌下または口腔投与経路を有する選択的アドレナリン作動性薬剤として、投与が容易であり、数日または数週間を要する可能性のある薬剤と比較して、双極性感情障害、統合失調症、およびアルツハイマー病患者の研究を含む複数の臨床試験において、比較的速い効果を示すように設計されている。これらの研究の結果,BXCL 501は過鎮静を生じることなく不安を減少させる可能性があると考えられる。BXCL 501は抗精神病薬と大きく異なり,後者は現在,過剰鎮静や追加の錐体運動効果などの有害な副作用がしばしば生じるにもかかわらず,第一線の看護標準治療として使用されていると考えられる。神経精神疾患と神経退行性疾患の中で患者の焦慮を管理することは医師と介護者にとって巨大な挑戦である。著者らはBXCL 501がこれらの挑戦を解決する潜在力があると信じ、同時に患者に有効な治療方案を提供する。
BXCL 501がそれぞれの適応に承認されれば,統合失調症,双極性感情障害,アルツハイマー病などの疾患による激越の急性治療の看護基準となる可能性も考えられる。
また,BXCL 501の差別化設計とその潜在的な作用機序を考慮すると,BXCL 501はオピオイド戒断や創傷後ストレス障害(PTSD)を含むいくつかの興奮を症状あるいは潜在疾患とするいくつかの疾患や状況を治療する可能性があると考えられ,これらは第三者による臨床試験で評価されている。
39