
米国
証券取引委員会
ワシントンDC 20549
フォーム
(マークワン)
1934年の証券取引法のセクション13または15 (d) に基づく四半期報告書 |
四半期終了時
1934年の証券取引法第13条または第15条 (d) に基づく移行報告書 |
__________から____________への移行期間について
コミッションファイル番号:
(憲章に明記されている登録者の正確な名前)
(州またはその他の管轄区域) 法人または組織) |
(IRS) 雇用主 識別番号) |
(主要執行機関の住所) |
(郵便番号) |
(
(登録者の電話番号、市外局番を含む)
該当なし
(前回の報告以降に変更された場合、以前の名前、以前の住所、および以前の会計年度)
同法第12条 (b) に従って登録された証券:
各クラスのタイトル |
|
取引 シンボル (複数可) |
|
登録された各取引所の名前 |
|
|
登録者が (1) 1934年の証券取引法第13条または第15条 (d) 条により提出が義務付けられているすべての報告書を過去12か月間(または登録者がそのような報告を提出する必要があったほど短い期間)に提出したかどうか、および(2)過去90日間にそのような申告要件の対象であったかどうかをチェックマークで示してください。
登録者が、過去12か月間(または登録者がそのようなファイルの提出を求められたより短い期間)に、規則S-Tの規則405(本章の§232.405)に従って提出が義務付けられているすべてのインタラクティブデータファイルを電子的に提出したかどうかをチェックマークで示してください。
登録者が大規模な加速申告者、加速申告者、非加速申告者、小規模な報告会社、または新興成長企業のいずれであるかをチェックマークで示してください。取引法規則12b-2の「大規模加速申告者」、「加速申告者」、「小規模報告会社」、および「新興成長企業」の定義を参照してください。
大型加速フィルター |
|
☐ |
|
アクセラレーテッド・ファイラー |
|
☐ |
|
☒ |
|
小規模な報告会社 |
|
||
|
|
|
|
新興成長企業 |
|
新興成長企業の場合は、登録者が取引法第13条 (a) に従って規定された新規または改訂された財務会計基準を遵守するために延長された移行期間を使用しないことを選択したかどうかをチェックマークで示してください。
登録者がシェル会社(取引法規則12b-2で定義されている)かどうかをチェックマークで示してください。はい ☐ いいえ
2024年4月29日現在、登録者は
目次
|
|
ページ |
第一部。 |
財務情報 |
4 |
アイテム 1. |
財務諸表 (未監査) |
4 |
|
連結貸借対照表 |
4 |
|
連結損益計算書と包括損失 |
5 |
|
連結株主資本計算書 |
6 |
|
連結キャッシュフロー計算書 |
7 |
|
未監査の連結財務諸表に関する注記 |
8 |
アイテム 2. |
経営陣による財政状態と経営成績に関する議論と分析 |
16 |
アイテム 3. |
市場リスクに関する定量的・質的開示 |
27 |
アイテム 4. |
統制と手続き |
27 |
第二部 |
その他の情報 |
28 |
アイテム 1. |
法的手続き |
28 |
アイテム 1A. |
リスク要因 |
28 |
アイテム 2. |
株式の未登録売却、収益の使用、および株式の発行者による購入 |
66 |
アイテム 3. |
シニア証券のデフォルト |
66 |
アイテム 4. |
鉱山の安全に関する開示 |
66 |
アイテム 5. |
その他の情報 |
66 |
アイテム 6. |
展示品 |
67 |
署名 |
68 |
|
2
将来の見通しに関する記述
このフォーム10-Qの四半期報告書には、改正された1933年の証券法(「証券法」)のセクション27Aおよび改正された1934年の証券取引法(「取引法」)のセクション21Eに含まれる将来の見通しに関する記述のセーフハーバー条項内の将来の見通しに関する記述が含まれています。このフォーム10-Qの四半期報告書に含まれる現在および歴史的事実の記述以外のすべての記述。これには、STK-001のドラベ症候群の根本的な原因を治療し、指定された投与量レベルまたはまったくで発作を軽減したり、行動や認知の改善を示したりする能力に関する記述、臨床試験の時期と予想される進展、当社の将来の経営成績および財政状態、事業戦略、将来の製品、計画などが含まれますが、これらに限定されません前臨床研究、臨床または野外試験、規制承認、研究開発費用、成功の時期と可能性、および将来の事業に関する経営陣の計画と目標は、将来の見通しに関する記述である可能性があります。場合によっては、将来の見通しに関する記述を「かもしれない」、「するだろう」、「するだろう」、「期待」、「計画」、「予想」、「予想する」、「できる」、「意図する」、「目標」、「プロジェクト」、「熟考する」、「信じる」、「見積もる」、「予測」、「可能性」、「続行」などの用語や、これらの用語やその他の類似の表現の否定的表現で区別できますが、すべての将来の見通しに関する記述にこれらの言葉が含まれているわけではありません。
将来の見通しに関する記述は、当社の経営陣の信念と仮定、および現在入手可能な情報に基づいています。このような記述には、多くの既知および未知のリスク、不確実性、仮定の影響があり、実際の結果は、パートIの項目2で特定されたものを含むがこれらに限定されないさまざまな要因により、将来の見通しに関する記述で表明または暗示されているものと大きく異なる場合があります。「経営陣による財政状態と経営成績の議論と分析」とパートII。項目1A「リスク要因」これらのリスクと不確実性には以下が含まれますが、これらに限定されません。
このForm 10-Qの四半期報告書とここで参照している文書をよくお読みになり、実際の将来の業績は予想とは大きく異なる可能性があることを理解しておいてください。私たちはすべての将来の見通しに関する記述をこれらの注意事項の対象とします。適用法で義務付けられている場合を除き、新しい情報、将来の出来事、状況の変化などの結果として、ここに含まれる将来の見通しに関する記述を公に更新または改訂する予定はありません。
3
パートI—財務情報
アイテム 1.財務諸表。
ストーク・セラピューティクス社とその子会社
連結貸借対照表
(千単位、1株あたりの金額を除く)
(未監査)
|
|
|
|
|
|
|
||
|
|
3 月 31 日 |
|
|
12月31日 |
|
||
|
|
2024 |
|
|
2023 |
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金および現金同等物 |
|
$ |
|
|
$ |
|
||
市場性のある証券 |
|
|
— |
|
|
|
|
|
前払い経費 |
|
|
|
|
|
|
||
その他の流動資産 |
|
|
|
|
|
|
||
繰延融資費用 |
|
|
|
|
|
— |
|
|
売掛金 |
|
|
|
|
|
|
||
流動資産合計 |
|
$ |
|
|
$ |
|
||
制限付き現金 |
|
|
|
|
|
|
||
オペレーティングリースの使用権資産 |
|
|
|
|
|
|
||
資産および設備、純額 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
負債と株主資本 |
|
|
|
|
|
|
||
現在の負債: |
|
|
|
|
|
|
||
買掛金 |
|
$ |
|
|
$ |
|
||
未払負債およびその他の流動負債 |
|
|
|
|
|
|
||
繰延収益-現在の部分 |
|
|
|
|
|
|
||
流動負債合計 |
|
$ |
|
|
$ |
|
||
繰延収益-現在の分を差し引いたもの |
|
|
|
|
|
|
||
その他の長期負債 |
|
|
|
|
|
|
||
長期負債合計 |
|
|
|
|
|
|
||
負債総額 |
|
$ |
|
|
$ |
|
||
コミットメントと不測の事態(注6) |
|
|
|
|
|
|
||
株主資本 |
|
|
|
|
|
|
||
普通株式、額面価格 $ |
|
|
|
|
|
|
||
追加払込資本 |
|
|
|
|
|
|
||
その他の包括損失の累計 |
|
|
— |
|
|
|
( |
) |
累積赤字 |
|
|
( |
) |
|
|
( |
) |
株主資本の総額 |
|
$ |
|
|
$ |
|
||
負債総額と株主資本 |
|
$ |
|
|
$ |
|
||
添付の注記は、これらの未監査の連結財務諸表の不可欠な部分です。
4
ストーク・セラピューティクス社とその子会社
連結損益計算書と包括損失
(千単位、1株あたりの金額を除く)
(未監査)
|
|
3月31日に終了した3か月間 |
|
|
|||||
|
|
2024 |
|
|
2023 |
|
|
||
収入 |
|
$ |
|
|
$ |
|
|
||
営業経費: |
|
|
|
|
|
|
|
||
研究開発 |
|
|
|
|
|
|
|
||
一般と管理 |
|
|
|
|
|
|
|
||
営業費用の合計 |
|
|
|
|
|
|
|
||
事業による損失 |
|
|
( |
) |
|
|
( |
) |
|
その他の収入 (費用): |
|
|
|
|
|
|
|
||
利息収入(費用)、純額 |
|
|
|
|
|
|
|
||
その他の収益(費用)、純額 |
|
|
( |
) |
|
|
|
|
|
その他の収入 (費用) の合計 |
|
|
|
|
|
|
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
1株当たり純損失(基本および希薄化後) |
|
$ |
( |
) |
|
$ |
( |
) |
|
加重平均発行済普通株式、ベーシック |
|
|
|
|
|
|
|
||
総合損失: |
|
|
|
|
|
|
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
その他の総合利益(損失): |
|
|
|
|
|
|
|
||
有価証券の含み損益 (損失) |
|
|
|
|
|
|
|
||
その他の総合利益の合計 |
|
$ |
|
|
$ |
|
|
||
包括的損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
添付の注記は、これらの未監査の連結財務諸表の不可欠な部分です。
5
ストーク・セラピューティクス社とその子会社
連結株主資本計算書
(千単位、1株あたりの金額を除く)
(未監査)
|
|
普通株式 |
|
|
[追加] |
|
|
その他の包括利益(損失)の累計 |
|
|
累積 |
|
|
株主総数 |
|
|||||||||
|
|
株式 |
|
|
金額 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
2022年12月31日現在の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
有価証券の含み益について |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
株式ベースの報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
ストックオプションの行使による普通株式の発行 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
従業員株式購入計画に関連する普通株式の発行 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
コントロッド・エクイティ・オファリング販売契約の一環として売却された株式 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
2023年3月31日現在の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
2023年12月31日現在の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
有価証券の含み益について |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
株式ベースの報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
ストックオプションの行使による普通株式の発行 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
従業員株式購入計画に関連する普通株式の発行 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
コントロッド・エクイティ・オファリング販売契約の一環として売却された株式 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
2024年3月31日現在の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
|
||||
添付の注記は、これらの未監査の連結財務諸表の不可欠な部分です。
6
ストーク・セラピューティクス社とその子会社
連結キャッシュフロー計算書
(千単位)
(未監査)
|
|
3月31日に終了した3か月間 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
営業活動によるキャッシュフロー: |
|
|
|
|
|
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
純損失を営業活動に使用された純現金と調整するための調整: |
|
|
|
|
|
|
||
減価償却 |
|
|
|
|
|
|
||
市場性のある有価証券の償却と増加 |
|
|
( |
) |
|
|
|
|
株式ベースの報酬 |
|
|
|
|
|
|
||
使用権資産の帳簿価額の減少 |
|
|
|
|
|
|
||
資産と負債の変動: |
|
|
|
|
|
|
||
前払費用およびその他の流動資産 |
|
|
( |
) |
|
|
( |
) |
買掛金、未払負債、リース負債 |
|
|
( |
) |
|
|
|
|
繰延収益 |
|
|
( |
) |
|
|
( |
) |
営業活動に使用された純現金 |
|
|
( |
) |
|
|
( |
) |
投資活動によるキャッシュフロー: |
|
|
|
|
|
|
||
資産および設備の購入 |
|
|
( |
) |
|
|
( |
) |
有価証券の売却 |
|
|
|
|
|
|
||
投資活動によって提供される純現金 |
|
|
|
|
|
|
||
財務活動によるキャッシュフロー: |
|
|
|
|
|
|
||
従業員株式購入プランからの収入 |
|
|
|
|
|
|
||
ストックオプションの行使による普通株式の発行による収入 |
|
|
|
|
|
|
||
コントロール・エクイティ・オファリング販売契約からの収入 |
|
|
|
|
|
|
||
財務活動による純現金 |
|
|
|
|
|
|
||
現金、現金同等物および制限付現金の純増額(減少) |
|
|
( |
) |
|
|
|
|
現金、現金同等物および制限付現金—期初 |
|
|
|
|
|
|
||
現金、現金同等物および制限付現金—期末 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
非現金投資および財務活動の補足開示: |
|
|
|
|
|
|
||
未払費用と買掛金に含まれる資産と設備 |
|
$ |
|
|
$ |
|
||
繰延提供費用はまだ支払われていません |
|
$ |
|
|
$ |
— |
|
|
添付の注記は、これらの未監査の連結財務諸表の不可欠な部分です。
7
ストーク・セラピューティクス社とその子会社
連結財務諸表への注記—(未監査)
1。ビジネスの性質
組織
ストーク・セラピューティクス株式会社(以下「当社」)は2014年6月に設立され、州の法律に基づいて設立されました
シェルフ登録
2022年5月、当社はフォームS-3のユニバーサル棚登録声明(「登録届出書」)をSECに提出しました。登録届出書は2022年5月31日にSECによって発効が宣言され、2つの目論見書が含まれています。1つは基本目論見書で、会社による最大募集価格の総額であるドルまでの募集、発行、売却を対象としています
不確実性
当社は、バイオテクノロジー業界の初期段階の企業に共通するリスクと不確実性の影響を受けています。これには、競合他社による新しい技術革新の開発、主要人材への依存、専有技術の保護、政府規制の遵守、事業資金を調達するための追加資本の確保などが含まれますが、これらに限定されません。現在開発中の製品候補には、広範な前臨床試験や臨床試験、商品化前の規制当局の承認など、大幅な研究開発努力が必要です。これらの取り組みには、多額の追加資本、十分な人員とインフラストラクチャ、および広範なコンプライアンス報告機能が必要です。会社の製品開発努力が成功したとしても、いつ会社が製品販売から大きな収益を得るかは定かではありません。
流動性
当社は、営業損失とマイナスのキャッシュフローが当面の間続くと予想しています。これらの未監査の連結財務諸表の発行日現在、当社は、これらの未監査連結財務諸表の発行日から少なくとも12か月間は、現金、現金同等物、および有価証券が営業費用と資本支出の要件を満たすのに十分であると予想しています。
2。重要な会計方針と最近の会計上の声明の概要です
プレゼンテーションと統合の基礎
添付の未監査連結財務諸表は、米国の一般に認められた会計原則(「GAAP」)に従って作成されており、当社とその完全子会社の勘定が含まれています。これらの注記で該当するガイダンスについて言及しているのは、財務会計基準審議会(「FASB」)の会計基準体系化(「ASC」)および会計基準更新(「ASU」)に記載されているGAAPを指すものです。当社とその連結子会社との間の会社間取引はすべて廃止されました。
8
未監査の中間財務情報
添付の中間未監査連結財務諸表および関連する開示は未監査であり、中間財務情報に関するGAAPおよびForm 10-Qおよび規則S-Xの第10条の指示に従って作成されています。したがって、これらには、GAAPが完全な財務諸表に必要なすべての情報や脚注が含まれているわけではなく、2024年3月25日にSECに提出された2023年12月31日に終了した年度現在の当社の連結財務諸表および関連メモと併せて読む必要があります。2024年3月31日現在、および2024年3月31日および2023年3月31日に終了した3か月間の当社の財務情報は未監査ですが、経営陣の見解では、これらの中間期間の結果の提示日および期間における財政状態、経営成績、およびキャッシュフローの公正な表示に必要と考えられる、通常の定期的な調整のみで構成されるすべての調整が含まれています。2023年12月31日現在の貸借対照表情報は、監査済み連結財務諸表から導き出されました。任意の中間期間における当社の業績は、必ずしも他の中間期間または会計年度全体で予想される業績を示すものではありません。
見積もりの使用
GAAPに準拠した連結財務諸表を作成するには、経営陣は、報告された資産、負債、資本、収益、費用、および偶発資産と負債の開示に影響する見積もりと仮定を行う必要があります。見積もりは、状況、事実、経験の変化に照らして定期的に見直されます。実際の結果はそれらの見積もりとは異なる可能性があります。
現金、現金同等物および制限付現金
当社は、購入日に当初の満期が3か月以内の流動性の高い投資はすべて現金同等物と見なしています。会社は現金を当座預金口座、スイープ口座、マネーマーケット口座に入金します。
2024年3月31日時点で、制限付現金は、会社の企業施設のリースに関連して保証金として発行された信用状を担保とするマネーマーケット口座で構成されていました。
連結キャッシュフロー計算書における現金および現金同等物、および制限付現金は、次のもので構成されています(千単位)。
|
|
3月31日の時点で、 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
現金および現金同等物 |
|
$ |
|
|
$ |
|
||
制限付現金-長期 |
|
|
|
|
|
|
||
現金、現金同等物および制限付現金の合計 |
|
$ |
|
|
$ |
|
||
新興成長企業と小規模報告会社のステータス
当社は、2012年のジャンプスタート・アワ・ビジネス・スタートアップ法(JOBS法)で定義されているように、新興成長企業です。雇用法の下では、新興成長企業は、JOBS法の制定後に発行された新しい会計基準または改訂された会計基準の採用を、それらの基準が民間企業に適用されるまで延期することができます。
当社は、公開企業と非公開企業で発効日が異なる新規または改訂された会計基準を遵守するために、この延長された移行期間を、(i) 新興成長企業ではなくなった日、または (ii) JOBS法に規定されている延長された移行期間を肯定的かつ取消不能の形でオプトアウトする日のいずれか早い方まで使用することを選択しました。その結果、会社の連結財務諸表は、公開会社の発効日時点で、新規または改訂された会計上の声明に従う企業と比較できない場合があります。
当社は、(i) 第1会計年度の最終日、(a) 当社のIPO完了から5周年の次の日、(b) 当社の年間総収入が12億3500万ドル以上の場合、または (c) 当社が保有する当社の普通株式の市場価値を意味する大規模な加速申告者とみなされる場合、いずれか早い時期まで、新興成長企業であり続けます。非関連会社による、その前の6月30日の時点で、および(ii)会社が10億ドルを超える非系列を発行した日の時点で、7億ドルを超えています。過去3年間の転換社債証券。当社は、IPO完了5周年に続く会計年度の最終日である2024年12月31日をもって、新興成長企業ではなくなると予想しています。
また、当社は「小規模な報告会社」でもあります。つまり、IPOの場合、非関連会社が保有する株式の市場価値に、そのような募集の結果として当社に提示された総収入の総額を加えた金額は、直近の会計年度における7億ドル未満、年間収益は1億ドル未満です。当社は、(i)非関連会社が保有する株式の市場価値が2億5,000万ドル未満であるか、(ii)直近の会計年度における年間収益が1億ドル未満で、保有する株式の市場価値がある限り、小規模な報告会社であり続けることができます
9
非アフィリエイトは7億ドル未満です。新興成長企業ではなくなった時点で会社が小規模な報告会社だった場合、小規模な報告会社が利用できる特定の開示要件の免除を引き続き頼りにする可能性があります。具体的には、小規模な報告会社として、Form 10-Kの年次報告書には、監査済み財務諸表の直近2会計年度のみを提示することを選択できます。新興成長企業と同様に、小規模な報告会社は役員報酬に関する開示義務を軽減しています。
3。公正価値の測定
次の表は、定期的に公正価値で測定される当社の金融資産に関する情報を示し、そのような公正価値を決定するために使用される公正価値階層のレベル(千単位)を示しています。
|
|
2024年3月31日現在の公正価値の測定値 |
|
|||||||||||||
|
|
レベル 1 |
|
|
レベル 2 |
|
|
レベル 3 |
|
|
合計 |
|
||||
現金同等物: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
マネー・マーケット・ファンド |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
合計 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
市場性のある証券: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
米国政府債務証券 |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
— |
|
合計 |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
— |
|
|
|
2023年12月31日現在の公正価値の測定値 |
|
|||||||||||||
|
|
レベル 1 |
|
|
レベル 2 |
|
|
レベル 3 |
|
|
合計 |
|
||||
現金同等物: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
マネー・マーケット・ファンド |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
合計 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
市場性のある証券: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
米国政府債務証券 |
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
||
合計 |
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
||
会社の現金同等物および有価証券は、公正価値階層に従って決定された公正価値で保有されます。これらの負債は短期的であるため、会社の買掛金および未払費用の帳簿価額は公正価値に近いものです。
公正価値階層でレベル1に分類される当社の公正価値資産には、マネーマーケットファンドが含まれます。マネーマーケットファンドは上場投資信託であり、2024年3月31日および2023年12月31日現在、連結貸借対照表に現金同等物として表示されています。
当社は、有価証券を定期的に公正価値で測定し、それらの商品を公正価値階層のレベル2に分類します。有価証券は、レベル2のインプットを使用するモデルまたはその他の評価方法論を使用して評価されます。これらのモデルは主に、時間価値、イールドカーブ、ボラティリティファクター、デフォルトレート、基礎となる金融商品の現在の市場価格や契約価格、その他の経済的指標など、さまざまな仮定を考慮した業界標準モデルです。これらの仮定は実質的にすべて市場で観察可能であり、観察可能なデータから導き出されたり、市場で取引が実行される観察可能なレベルによって裏付けられたりします。
あった
4。市場性のある証券
会社は持っていた
次の表は、2023年12月31日現在の当社の有価証券(千単位)をまとめたものです。
10
|
|
2023年12月31日 |
|
|||||||||||||
|
|
償却コスト |
|
|
未実現利益 |
|
|
含み損失 |
|
|
公正価値 |
|
||||
市場性のある証券: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
米国政府債務証券 |
|
$ |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
|
||
合計 |
|
$ |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
|
||
2023年12月31日現在、当社の有価証券の加重平均満期は約
会社がやった
5。未払負債およびその他の流動負債
未払負債およびその他の流動負債は以下のとおりです(千単位)。
|
|
3 月 31 日 |
|
|
12月31日 |
|
||
|
|
2024 |
|
|
2023 |
|
||
未払従業員報酬費用 |
|
$ |
|
|
$ |
|
||
未払いの専門経費 |
|
|
|
|
|
|
||
未払の研究開発コスト |
|
|
|
|
|
|
||
オペレーティング・リース負債の現在の部分 |
|
|
|
|
|
|
||
その他の流動負債 |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
6。コミットメントと不測の事態
オペレーティングリース
契約がリースかどうかは、開始時に会社が判断します。会社がリース対象とするのは、リース資産を一定期間管理しつつ、資産の経済的利益を実質的にすべて得る権利がある場合です。オペレーティングリースの使用権資産とオペレーティングリース負債は、リース開始日のリース期間における将来の最低リース支払額の現在価値に基づいて認識されます。リース料の現在価値を決定するために使用される割引率は、リース開始時に入手可能な情報に基づく会社の段階的な借入金利です。これは、当社にはリースに含まれる金利を決定するための情報がなかったためです。オペレーティングリースのリース費用は、リース料総額(初期の直接費用とリースインセンティブを含む)に基づいて、合理的に保証されたリース期間にわたって定額法で計上されます。この費用は、連結損益計算書の営業費用と包括損失に含まれています。会社のリース契約には、主にメンテナンス関連の費用などの変動支払いも含まれています。これらは発生時に費用計上され、使用権資産とリース負債の測定には含まれません。
2018年8月、当社はおおよそのリース契約を締結しました
2021年9月、当社は、当初の契約期間を延長する契約を締結しました
2023年12月、当社は、期間を延長する契約を締結しました
2018年12月、当社はリース契約を締結しました
11
2021年6月、当社は契約を修正し、当初の契約期間を延長しました
2024年3月31日現在のキャンセル不可のリース契約に基づく将来の最低リース支払い額は次のとおりです(千単位)。
2024 |
|
$ |
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
リース料総額 |
|
|
|
|
帰属(帰属)利息が少ない |
|
|
( |
) |
リース負債の現在価値 |
|
$ |
|
2024年3月31日現在のリース残高は次のとおりです(千単位)。
使用権資産の運用 |
|
$ |
|
|
オペレーティングリース負債の現在の部分 |
|
$ |
|
|
オペレーティングリース負債の非流動部分 |
|
|
|
|
オペレーティングリース負債総額 |
|
$ |
|
2024年3月31日現在の当社のオペレーティングリースの加重平均残存リース期間と加重平均割引率は次のとおりです。
加重平均残存リース期間 (年数) |
|
|
|
|
加重平均割引率 |
|
|
% |
オペレーティングリースで発生したリース費用は $
ライセンス契約と研究契約
2016年4月、当社はサウサンプトン大学と独占的なワールドワイドライセンス契約(「サウサンプトン契約」)を締結しました。これにより、当社は当社のTANGO技術に関連する基礎技術の権利を取得しました。サウサンプトン契約に基づき、当社はタンゴに関連する特定のライセンス特許および出願に基づいて、世界規模の独占ライセンスを取得しています。サウサンプトン契約に基づき、会社は特定のマイルストーンの達成を条件として、追加の支払いや、将来の製品販売に対するロイヤリティを支払う義務を負う場合があります。これらのロイヤルティ義務は、(i)対象製品を対象とするライセンス特許の最後の有効な請求期間の満了日、または(ii)ある国における対象製品の規制上の独占権の満了日の遅くまで有効です。さらに、会社がサウサンプトン契約に基づいて権利をサブライセンスする場合、会社はサブライセンス収入の一桁台半ばの割合をサウサンプトン大学に支払う必要があります。2024年3月31日現在、会社はドルを支払っていました
7。アカディアファーマシューティカルズ社とのライセンスおよびコラボレーション契約。
2022年1月、当社はアカディアファーマシューティカルズ株式会社(「アカディア」)と、重度かつまれな中枢神経系の遺伝性神経発達疾患の治療のための新しいRNAベースの医薬品の発見、開発、商品化に関するライセンスおよびコラボレーション契約を締結しました。この契約は、SYNGAP1、MECP2(レット症候群)、および相互に関心のある非公開の神経発達目標に焦点を当てています。各ターゲットに関連して、当社はアカディアと協力して、ライセンス製品としてさらなる開発と商品化のための潜在的な治療法を特定します。SYNGAP1に関して、当社はアカディアと、そのようなターゲット向けのライセンス製品をグローバルで共同開発および共同商品化することに合意しました。これに関連して、当社はアカディアワールドワイドに、そのようなライセンス製品の共同独占ライセンス(ストークと)を付与しました。MECP2と神経発達ターゲットに関して、当社は世界中のアカディアに、そのようなターゲットのライセンス製品を開発および商品化するための独占ライセンスを付与しました。
12
契約条件に従い、会社は$の前払い金を受け取りました
アカディア契約会計
アカディア契約の開始時に、当社は、SYNGAP1、MECP2、および非公開の神経発達目標のそれぞれについて、前臨床研究活動からなる3つの履行義務を特定しました。3つのターゲットのそれぞれについて前臨床研究活動を行うためにアカディアに付与された独占的または共同独占的なライセンスと、それぞれの共同研究委員会への参加は、約束されたサービスとして特定されました。ただし、アカディアに付与されたライセンスと研究活動は区別できないと判断されたため、3つのターゲットのそれぞれを合わせた履行義務とみなされます。アカディアとの取り決めの文脈では、各共同研究委員会への参加は量的にも質的にも重要ではないと判断されました。
当社は、研究サービスが提供されるにつれて、3つのターゲットそれぞれの前臨床研究活動の取引価格を長期的に認識しています。アカディアへの支配権の移転はこの期間に行われ、経営陣の判断では、履行義務の履行に向けた進捗状況を最もよく表しています。3つの研究活動のそれぞれを満たすためにこれまでに発生した費用を、それぞれの義務を果たすための各研究活動の推定合計予測費用に関連づけて測定するインプットメソッドが使われています。研究業績義務を果たすための見積費用および/または取引価格の修正による累積的な影響は、変更が特定され、金額を合理的に見積もることができる期間に記録されます。
規制当局の承認など、会社の管理下にないマイルストーンの支払いは、それらの承認を受けるまで達成される見込みはありません。その他のマイルストーンについては、この評価を行う上で特定のマイルストーンを達成するために克服しなければならない科学的、臨床的、規制的、商業的、およびその他のリスクなどの要素を評価しました。会社またはアカディアの管理外のマイルストーンは、そのようなマイルストーンが達成されるまで認識されません。他のマイルストーンについては、これらのマイルストーンが達成されるかどうか不確実なため、これまでのところ、マイルストーンの支払いは取引価格に含まれていません。当社は、各報告期間の終わりに、制約の対象となるすべてのマイルストーンの達成確率を再評価し、必要に応じて、3つの目標に関する各研究活動の全体的な取引価格の見積もりを調整します。このような調整は、累積的なキャッチアップベースで記録されます。
2024年3月31日現在、会社の資産は
8。株式インセンティブプラン
2019年6月、当社の取締役会および株主は、2019年株式インセンティブ制度(「2019年計画」)を承認しました。これは2019年6月17日に発効し、当社の2014年の株式インセンティブ制度(「2014年計画」)に取って代わりました。2019年プランの発効日に追加された、2014年プランに基づいて将来の発行のために留保された普通株式に加えて、当社は最初に留保しました
2023年4月、当社の取締役会はストーク・セラピューティクス社の2023年誘因計画(「2023年計画」)を採択しました。ナスダックの株式市場の規則で認められているように、会社の株主は2023年計画を承認する必要はありませんでした。2023年計画では、最大で次のことが可能になります
2024年3月31日現在、
13
2024年3月31日に終了した3か月間に、当社は購入オプションを付与しました
株式報酬制度
2024年3月31日現在、ドルがありました
添付の連結営業報告書に研究開発費および一般管理費として計上されている株式ベースの報酬費用と包括損失は次のとおりです(千単位)。
|
|
3月31日に終了した3か月間 |
|
|
|||||
|
|
2024 |
|
|
2023 |
|
|
||
研究開発 |
|
$ |
|
|
$ |
|
|
||
一般と管理 |
|
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
|
||
2019年従業員株式購入プラン
2019年6月、当社は2019年従業員株式購入制度(「ESPP」)を採用し、2019年6月18日に発効しました。会社は当初予約しました
9。1株当たりの純損失
次の表は、当社の基本および希薄化後の1株当たり純損失(1株当たりおよび1株当たりの金額を除く千単位)の計算をまとめたものです。
|
|
3月31日に終了した3か月間 |
|
|
|||||
|
|
2024 |
|
|
2023 |
|
|
||
分子: |
|
|
|
|
|
|
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
分母: |
|
|
|
|
|
|
|
||
加重平均普通株式数、 |
|
|
|
|
|
|
|
||
1株当たり純損失(基本および希薄化後) |
|
$ |
( |
) |
|
$ |
( |
) |
|
14
普通ストックオプション、RSU、PSU、ESPPの購入権を含む当社の潜在的な希薄化有価証券は、希薄化防止効果が生じるため、希薄化後の1株当たり純損失の計算から除外されています。したがって、基本および希薄化後の1株当たり純損失の計算に使用される、当社の発行済普通株式の加重平均株式数は同じです。
当社は、期末の発行額に基づいて提示された以下の潜在的な普通株式を、示された期間の希薄化後の1株当たり純損失の計算から除外しました。それらを含めると、希薄化防止効果が生じるためです。
|
|
3 月 31 日 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
普通株式を購入するための未払いのオプション |
|
|
|
|
|
|
||
制限付株式単位 |
|
|
|
|
|
|
||
合計 |
|
|
|
|
|
|
||
10。所得税
会社がやった
会社がやった
11。その後のイベント
2024年4月、当社は引受公募を終了しました。この公募では、会社が発行および売却しました
15
アイテム 2.経営陣による財政状態と経営成績に関する議論と分析
当社の財政状態と連結経営成績に関する以下の説明と分析を、この四半期報告書の他の部分に記載されている「リスク要因」というタイトルのセクション、中間連結財務諸表および関連事項とともにお読みください。当社の事業および関連する資金調達の計画や戦略に関する情報を含め、この議論と分析に含まれている、またはこの四半期報告書の他の部分に記載されている情報には、リスクと不確実性を伴う将来の見通しに関する記述が含まれています。実際の結果が当社の将来の見通しに関する記述と大きく異なる原因となる可能性のある重要な要因を理解するために、「将来の見通しに関する記述に関する特記事項」と「リスク要因」というタイトルのセクションをよくお読みください。
[概要]
私たちは、RNAベースの医薬品でタンパク質の発現をアップレギュレートすることにより、重篤な疾患の根本的な原因に取り組むことに専念している臨床段階の企業です。当社独自のTANGO(核遺伝子生産量のターゲットを絞った増強)アプローチを使用して、タンパク質レベルを選択的に回復させるアンチセンスオリゴヌクレオチド(「ASO」)を開発しています。
私たちの最初の化合物、STK-001は、重症で進行性の遺伝性てんかんであるドラベ症候群の治療薬として臨床試験中です。ドラベ症候群は、生後1年以内に始まる頻繁で長期にわたる難治性の発作を特徴としています。この疾患は、発達遅延とそれに伴う認知障害のため、発達性脳症とてんかん性脳症に分類されます。ドラベ症候群は、正常なタンパク質レベルの約50%が失われると病気につながるハプロ不全によって引き起こされる多くの病気の1つです。米国のMONARCHと英国のADMIRALを対象としたSTK-001の2件の第1/2a非盲検試験の2件の研究終了データを発表しました。また、ドラベ症候群の小児および青年を対象に、STK-001のオープンラベル拡張(「OLE」)試験を2件実施しています。米国ではスワローテール、英国ではロングウィングです。米国のMONARCH研究または英国のADMIRAL研究に参加し、研究登録基準を満たした患者は、それぞれSWALLOWTAILまたはLONGWINGでの治療を継続する資格がありました。どちらもSTK-001の反復投与の長期的な安全性と耐容性を評価することを目的としています。
また、最も一般的な遺伝性視神経障害である常染色体優性視神経萎縮症(「ADOA」)という、第二のハプロアンプリノーシス疾患の治療も進めています。STK-002は、ADOA治療の主要な臨床候補です。STK-002は、ADOA患者の視力喪失を止めたり遅らせたりすることを目的として、OPA1遺伝子の非変異(野生型)コピーを利用してOPA1タンパク質の発現を回復させることにより、OPA1タンパク質の発現をアップレギュレートするように設計されています。英国では、ADOAの診断が確定していて、OPA1遺伝子に遺伝子変異があるという証拠がある6歳から55歳の小児および成人を対象に、第1相非盲検試験(OSPREY)を進める許可を受けています。OSPREYの研究は2024年に始まると予想しています。
2022年5月、私たちはフォームS-3のユニバーサル棚登録声明(「登録届出書」)をSECに提出しました。登録届出書は2022年5月31日にSECによって発効が宣言され、2つの目論見書が含まれています。1つは基本目論見書で、当社の普通株式、優先株式、負債証券、普通株式、優先株または負債証券を購入するためのワラント、普通株式、優先株または負債証券を購入するための新株予約権、および/または一部のユニットからなる単位を当社が募集し、発行し、売却することを対象としていますこれらすべての証券、および募集に関する売買契約の目論見書、支配株式募集販売契約(「売買契約」)に基づいて発行および売却される可能性のある、最大募集価格の総額1億5,000万ドルまでの普通株式を当社が発行および売却します。基本目論見書に従って提供される有価証券の具体的な条件は、基本目論見書の補足目論見書に明記されます。売買契約目論見書に基づいて提供、発行、売却される可能性のある1億5000万ドルの普通株式は、基本目論見書に基づいて当社が提供、発行、売却する可能性のある4億ドルの有価証券に含まれています。2024年3月31日現在、当社は売買契約に基づいて約650万株の普通株式を発行しており、純収入は5,340万ドルです。このアット・ザ・マーケット・プログラムは、その条件に従い、いつでも終了することができます。2024年4月2日、当社は普通株式の引受公募を完了し、1株あたり13.50ドルの公募価格で5,555,557株の普通株式を発行・売却しました。また、0.0001ドルの行使価格を条件として、1株あたり13.499ドルの公募価格で3,703,730株の普通株式を購入するための事前積立ワラントを発行しました。売却された普通株式と新株予約権は、引受割引と手数料を差し引いた後の純収入は1億2,030万ドルでした。
2024年3月31日と2023年12月31日の時点で、現金、現金同等物、有価証券がそれぞれ1億7,860万ドルと2億140万ドルでした。
創業以来、営業損失が発生してきましたが、その大部分は研究開発活動によるものです。2024年3月31日および2023年3月31日に終了した3か月間の当社の純損失は、それぞれ2,640万ドルと2,250万ドルでした。2024年3月31日現在、当社の累積赤字は4億2,820万ドルでした。
私たちの現金の主な用途は、主に研究開発費で構成される営業費を賄うことです。程度は低いものの、一般管理費です。営業費用の資金調達に使用される現金は、未払いの買掛金および未払費用の変動に反映されるように、これらの費用を支払うタイミングの影響を受けます。当面の間、純損失は引き続き発生すると予想しており、研究開発費、一般管理費、資本支出は引き続き増加すると予想しています。特に、製品候補の開発を続け、規制当局の承認を求め、承認された製品を商品化し始めるにつれて、費用と損失は増加すると予想しています。
16
製品を扱うだけでなく、追加の人材を雇ったり、商業インフラを開発したり、外部のコンサルタント、弁護士、会計士に手数料を支払ったりすると、ナスダックの上場規則やSEC要件の遵守を維持するためのサービスに関連する費用、保険や投資家向け広報活動費用など、上場企業であることに関連するコストが増加します。当社の純損失は、臨床試験の時期やその他の研究開発活動への支出に応じて、四半期ごと、また年ごとに大きく変動する可能性があります。
現在の事業計画に基づくと、2024年3月31日現在の既存の現金および現金同等物と、2024年4月の公募による1億2,030万ドルの純収入により、少なくとも2025年末までは営業費用と資本支出の要件を満たすことができると考えています。現在までに、販売が承認された製品はなく、製品の売上も発生していません。開発が成功裏に完了し、1つまたは複数の製品候補の規制当局の承認を得ない限り、製品販売から収益を生み出すことは期待できません。これには数年かかると予想しています。製品候補のいずれかについて規制当局の承認を得た場合、製品の販売、マーケティング、製造、流通に関連する多額の商品化費用が発生すると予想されます。その結果、その時までは、もしあれば、かなりの製品収益を生み出すことができるので、株式募集、債務融資、またはコラボレーション、ライセンス、その他の同様の取り決めを含むその他の資本源を通じて、必要な資金を調達することを期待しています。ただし、有利な条件で必要な場合、またはまったく必要な場合は、追加の資金調達やその他の取り決めを行うことができない場合があります。必要なときに資金を調達しないと、当社の財政状態や事業計画や戦略を追求する能力に悪影響を及ぼす可能性があります。資金を調達できない場合は、コストを削減するために、計画された活動を延期、削減、または中止する必要があります。
プログラムの更新
ドラベ症候群プログラム — STK-001
2024年3月、STK-001の第1/2a相非盲検試験の試験終了データを発表しました。これらの研究から集められたデータは、STK-001は一般的に良好な耐容性を示しました。患者の30%(81年24時間)が、治験薬に関連する治療に伴う有害事象を経験し、最も一般的なのはCSFタンパク質の上昇と処置による嘔吐でした。22%(18/81)の患者が治療時に誘発される重篤な有害事象が発生し、以前に報告された症例を除いて、すべて治験薬とは無関係と評価されました。予期せぬ重篤な副作用の疑いを経験した1人の患者のうち。
これらの研究のいくつかの副次的評価項目の1つは、毎日の発作日記で測定し、4週間にわたって計算したけいれん発作頻度の変化率(ベースラインから治療後12週間まで、およびベースラインから研究終了までの間)の比較でした。70mgのSTK-001を複数回投与された患者のデータでは、以下に示すように、標準治療に加えてけいれん発作が最も大幅に減少したことが示されました。
時間の経過に伴うけいれん発作頻度の減少の中央値

次の表に示すように、70mgを1、2、3回投与した患者は、最後の投与から3か月後と6か月後にけいれん発作の頻度が大幅に減少しました。
17
70mg用量のSTK-001で治療された患者のけいれん発作頻度の減少
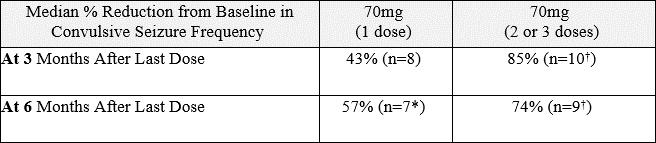
*50%を超える発作日記が欠落していたため、1人の患者の発作データは5〜6か月目から除外されました
バックグラウンド抗発作薬の変更後の2人の患者(最後の投与の3mより前の患者1人、最後の投与の6m前の1人の患者)の発作データは除外されました
第1/2a相試験で少なくとも30mgのSTK-001の累積投与を受け、その後、2つのOLEのいずれかで4か月ごとに30mgまたは45mgの用量のSTK-001による治療を続けた患者からの追加データでは、以下に示すように、治療期間を通じてけいれん発作の頻度が持続的に減少することが示されました。
OLE研究におけるけいれん発作頻度の持続的な減少
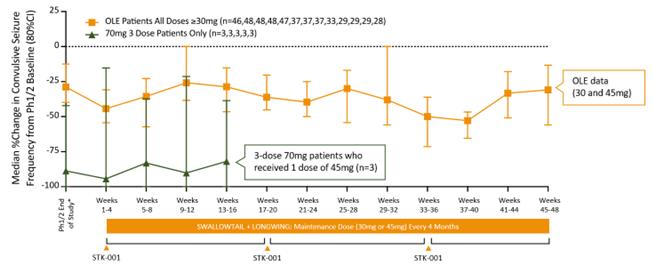
これらの患者の反復測定分析の混合効果モデルのデータでも、Vineland-III(Vineland適応行動尺度、第3版)の複数のサブドメインを含む、認知と行動の複数の測定値において、OLEがベースラインから12か月にわたって臨床的に有意義な改善を示しました。
LONGWINGOLE試験の患者は、現在、4か月ごとに45mgのSTK-001を慢性的に投与されており、2024年3月、米国食品医薬品局が、米国のOLE試験SWALLOWTAILの慢性投与量を4か月ごとに45mgに増やすことを許可すると発表しました。
規制当局と会って、初回70mgのSTK-001投与とそれに続く45mgのSTK-001の継続投与を含む登録試験デザインについて話し合う予定で、2024年の後半に最新情報を提供する予定です。
金融業務の概要
収益
現在、販売が承認されている製品はなく、開始から2024年3月まで、製品販売による収益も得られていません。現在の製品を開発し、規制当局の承認を得て、商品化することができれば
18
将来の製品候補のみ、または第三者と協力して、これらの製品候補の販売から収益を生み出す可能性があります。
2022年1月、私たちはアカディアファーマシューティカルズ社(「アカディア」)と、重度かつまれな中枢神経系の遺伝性神経発達疾患の治療のための新しいRNAベースの医薬品の発見、開発、商品化に関するライセンスおよびコラボレーション契約を締結しました。この契約は、SYNGAP1、MECP2(レット症候群)、および相互に関心のある非公開の神経発達目標に焦点を当てています。各ターゲットに関連して、アカディアと協力して、ライセンス製品としてさらなる開発と商品化のための潜在的な治療法を特定します。SYNGAP1に関しては、アカディアとそのようなターゲット向けのライセンス製品をグローバルで共同開発および共同商品化することに合意しました。これに関連して、アカディアワールドワイドに、そのようなライセンス製品の共同独占ライセンス(私たちと)を付与しました。MECP2と神経発達ターゲットに関しては、世界中のアカディアに、そのようなターゲットのライセンス製品を開発および商品化するための独占ライセンスを付与しました。
契約条件に従い、アカディアから6,000万ドルの前払い金を受け取りました。アカディアは、MECP2と神経発達ターゲットの潜在的なライセンス製品を特定するための研究に資金を提供することに同意しました。また、SYNGAP1の潜在的なライセンス製品を特定するための研究にもアカディアと同等に資金を提供します。各マイルストーンが少なくとも1回達成されたと仮定すると、3つの目標のプログラム全体で特定の開発、規制、最初の商業販売、および販売のマイルストーンイベントを達成したことに基づいて、最大9億750万ドルのマイルストーン支払いを受け取る資格があります。MECP2と神経発達ターゲットのライセンス製品に関しても、アカディアによる世界中のライセンス製品の将来の純売上高に対して、一桁半ばから10桁半ばまでの割合で段階的にロイヤリティを受け取る資格があります。契約に基づいて支払われるロイヤリティは、標準のロイヤリティ減額の対象となります。私たちが共同開発および共同商品化しているSYNGAP1ライセンス製品については、開発および商品化費の50%を負担し、グローバルな商品化による利益の50%を受け取ります。SYNGAP1ターゲット表示に関する共同開発および共同商品化のオプトアウトオプションが当社の裁量で提供されています。このようなオプトアウトは、開発と商品化のマイルストーンを短縮しますが、純売上高のマイルストーンに起因するロイヤルティが段階的に増加することになります。
フォーム10-Qのこの四半期報告書の他の部分に含まれる未監査の連結財務諸表の注記については、注記7—アカディア・ファーマシューティカルズ社とのライセンスおよびコラボレーション契約を参照してください。
営業経費
研究開発
研究開発費は、主に創薬研究と前臨床プログラムの開発にかかる費用で構成されます。これには以下が含まれます。
私たちは、製品候補の特定と開発に向けて、人材とインフラのリソースを複数の研究開発プログラムに活用しています。私たちの直接的な研究開発費は、プログラムが私たちの臨床候補になった時点からプログラムごとに追跡され、主に当社の前臨床活動に関連してコンサルタント、中央研究所、請負業者に支払われる費用などの外部費用で構成されています。私たちは、従業員費用、当社の技術または施設経費に関連する費用(減価償却費やその他の間接費を含む)を特定のプログラムに割り当てていません。これらの費用は現在、複数の製品開発プログラムに分散されており、個別に分類されていないためです。私たちは社内のリソースを使って開発活動を管理しており、従業員は複数の開発プログラムに取り組んでいるので、プログラムごとに彼らの費用を追跡していません。
19
以下の表は、開発プログラムで発生した研究開発費(千単位)をまとめたものです。
|
|
3月31日に終了した3か月間 |
|
|
|||||
|
|
2024 |
|
|
2023 |
|
|
||
STK-001です |
|
$ |
8,534 |
|
|
$ |
6,077 |
|
|
STK-002 |
|
|
1,706 |
|
|
|
2,137 |
|
|
シンガップ1 |
|
|
284 |
|
|
|
75 |
|
|
MECP2 |
|
|
243 |
|
|
|
131 |
|
|
プログラムに特化していない、割り当てられていない研究と |
|
|
11,601 |
|
|
|
11,211 |
|
|
研究開発費の合計 |
|
$ |
22,368 |
|
|
$ |
19,631 |
|
|
私たちは、発生した期間のすべての研究開発費を負担します。特定の開発活動の費用は、ベンダーや第三者のサービスプロバイダーから提供された情報やデータを使用して、特定のタスクの完了までの進捗状況を評価して計上されます。
計画している創薬作業、前臨床および臨床開発活動、および将来計画されている臨床試験に関連して、費用が大幅に増加すると予想しています。現時点では、他の製品候補の前臨床および臨床開発を完了するための費用を合理的に見積もることはできません。私たちのプログラムは開発の後期段階に進み、臨床試験を実施するにつれて、製造への投資を含む、製品候補の開発に関連する研究開発活動への投資を続けているため、研究開発費は当面大幅に増加すると予想しています。規制当局の承認を得るために必要な臨床研究を実施するプロセスには費用と時間がかかり、製品候補の開発が成功するかどうかは非常に不確実です。その結果、研究開発プロジェクトの期間と完了費用、または製品候補の商品化と販売からいつ、どの程度収益を上げるかを決定することができません。
製品開発には多くのリスクと不確実性があるため、現在または将来の前臨床試験と臨床試験の期間と完了費用、あるいは製品候補の商品化と販売から収益を生み出すかどうか、いつ、どの程度収益を上げるかを確実に判断することはできません。製品候補の規制当局の承認を得ることは決してできないかもしれません。前臨床試験や臨床試験、製品候補の開発の期間、費用、時期は、次のようなさまざまな要因によって決まります。
これらの要因のいずれかによって結果が変化した場合、現在および将来の前臨床および臨床製品候補の開発に関連するコストと時期に大きな変化が生じる可能性があります。たとえば、FDAやその他の規制当局が、臨床開発の完了に必要となると現在予想している試験を超える臨床試験の実施を当社に要求した場合、または前臨床試験または臨床試験の実施または登録が大幅に遅れた場合、前臨床および臨床開発の完了に多額の追加財源と時間を費やす必要が生じる可能性があります。製品候補の開発を続けるにつれて、研究開発費は当面増加すると予想しています。
20
一般管理費
一般管理費は、主に人件費、知的財産の維持と出願に関連する費用、法務、人事、情報技術、監査および会計サービスを含む外部の専門サービスの費用、施設およびその他の費用で構成されています。人件費は、給与、福利厚生、株式ベースの報酬費用で構成されています。継続的な研究開発活動、製造活動、公開企業としての運営コストの増加、および製品候補の商品化の可能性を支えるために、一般管理費は今後数年間で増加すると予想しています。これらの増加には、人員の追加雇用、商業インフラの開発、外部コンサルタント、弁護士、会計士への手数料、およびナスダック上場規則と証券取引委員会(「SEC」)の要件の遵守維持に関連するサービスに関連する費用、保険および投資家向け広報活動費用など、上場企業であることに関連する費用の増加が含まれると予想されます。
その他の収入 (費用)
当社のその他の収益(費用)には、(i)営業資金、マネーマーケットファンド、投資口座、および有価証券投資の現金準備金から得られる利息収入、および(ii)その他の収益(費用)(純額)が含まれます。
2024年および2023年3月31日に終了した3か月間の経営成績
次の表は、当社の経営成績を示しています。
|
|
3月31日に終了した3か月間 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
|
|
(千単位) |
|
|||||
要約された連結営業明細書: |
|
|
|
|
|
|
||
収入 |
|
$ |
4,216 |
|
|
$ |
5,152 |
|
営業経費: |
|
|
|
|
|
|
||
研究開発 |
|
|
22,368 |
|
|
|
19,631 |
|
一般と管理 |
|
|
10,220 |
|
|
|
10,211です |
|
営業費用の合計 |
|
|
32,588です |
|
|
|
29,842 |
|
事業による損失 |
|
|
(28,372 |
) |
|
$ |
(24,690) |
) |
その他の収入 (費用): |
|
|
|
|
|
|
||
利息収入(費用)、純額 |
|
|
2,426 |
|
|
|
2,103です |
|
その他の収益(費用)、純額 |
|
|
(428) |
) |
|
|
42 |
|
その他の収入 (費用) の合計 |
|
|
1,998 |
|
|
|
2,145 |
|
純損失 |
|
$ |
(26,374) |
) |
|
$ |
(22,545) |
) |
21
収入
2024年3月31日に終了した3か月間の収益は、2023年3月31日に終了した3か月間の520万ドルに対し、420万ドルで、90万ドル減少しました。収益は、アカディアファーマシューティカルズ社とのコラボレーションおよびライセンス契約の契約上の義務を果たすことから生み出されます。
研究開発費用
2024年3月31日に終了した3か月間の研究開発費は2,240万ドルでしたが、2023年3月31日に終了した3か月間の研究開発費は1,960万ドルで、280万ドル増加しました。以下の表は、当社の研究開発費(千単位)をまとめたものです。
|
|
3月31日に終了した3か月間 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
STK-001です |
|
$ |
8,534 |
|
|
$ |
6,077 |
|
STK-002 |
|
|
1,706 |
|
|
|
2,137 |
|
シンガップ1 |
|
|
284 |
|
|
|
75 |
|
MECP2 |
|
|
243 |
|
|
|
131 |
|
人件費関連費用 |
|
|
7,956 |
|
|
|
8,015 |
|
第三者サービス |
|
|
168 |
|
|
|
531 |
|
科学コンサルティング |
|
|
240 |
|
|
|
158 |
|
施設やその他の研究開発費 |
|
|
3,237 |
|
|
|
2,507 |
|
研究開発費の合計 |
|
$ |
22,368 |
|
|
$ |
19,631 |
|
研究開発費の増加は主に、STK-001プログラムに関連する費用の250万ドルの増加、SYNGAP1、MECP2に関連する外部第三者費用の30万ドルの増加、施設およびその他の研究開発費の70万ドルの増加が、STK-002に関連する費用の40万ドルの減少によって相殺されたことに起因しています。プログラムは、サードパーティのサービスと科学コンサルティングの費用で構成されており、$の割引になります30万ドル、非プロジェクト固有のコンサルティングと第三者サービス、そして10万ドルの人件費の削減。
一般管理費
2023年3月31日に終了した3か月間の一般管理費は1,020万ドルでしたが、2023年3月31日に終了した3か月間は1,020万ドルでした。
その他の収入 (費用)
その他の収益(費用)は、2023年3月31日に終了した3か月間のその他の収益(費用)は190万ドルでしたが、2023年3月31日に終了した3か月間は210万ドルでした。
流動性と資本資源
創業から2024年3月31日まで、当社の事業は、転換社債および転換優先株式の売却、新規株式公開、その後の募集、売買契約による収入、およびアカディアからの前払いによる5億4,390万ドルの純収入によって賄われてきました。2024年3月31日現在、当社には1億7,860万ドルの現金および現金同等物がありました。当面の必要額を超える現金は、主に流動性と資本保全の観点から、当社の投資方針に従って投資されます。2024年4月2日、当社は普通株式の引受公募を完了し、1株あたり13.50ドルの公募価格で5,555,557株の普通株式を発行・売却しました。また、0.0001ドルの行使価格を条件として、1株あたり13.499ドルの公募価格で3,703,730株の普通株式を購入するための事前積立ワラントを発行しました。売却された普通株式と新株予約権は、引受割引と手数料を差し引いた後の純収入は1億2,030万ドルでした。
2014年6月の創業以来、私たちは損失を被っており、2024年3月31日現在、累積赤字は4億2,820万ドルでした。私たちの現金の主な用途は、主に研究開発費からなる営業費を賄うことです。
22
範囲が小さく、一般管理費がかかります。営業費用の資金調達に使用される現金は、未払いの買掛金および未払費用の変動に反映されるように、これらの費用を支払うタイミングの影響を受けます。
現在の事業計画に基づくと、2024年3月31日現在の既存の現金および現金同等物と、2024年4月の公募による1億2,030万ドルの純収入により、少なくとも2025年末までは営業費用と資本支出の要件を満たすことができると考えています。この見積もりは、間違っていると判明する可能性のある仮定に基づいており、現在の予想よりも早く利用可能な資本リソースを活用できました。現在の製品候補を臨床開発に進めたり、他の潜在的な製品候補を開発、買収、またはライセンス供与したり、当面の事業資金を調達したりするために、引き続き追加の資金を必要とします。私たちは引き続き、株式公開、デットファイナンス、またはその他の資本源(コラボレーション、ライセンス、その他の同様の取り決めを含む)を通じて資金を募ります。ただし、有利な条件で必要な場合、またはまったく必要な場合は、追加の資金調達やその他の取り決めを行うことができない場合があります。インフレ、金利の変化、世界の銀行システムの不安定性、米国および世界の信用市場と金融市場の混乱とボラティリティなど、グローバルなマクロ経済状況が悪化する可能性により、当社の追加資金調達能力は悪影響を受ける可能性があります。公開株式または非公開株式の募集を通じて追加の資本を調達した場合、既存の株主の所有権は希薄化され、これらの証券の条件には、株主の権利に悪影響を及ぼす清算またはその他の優遇措置が含まれる場合があります。デットファイナンスを通じて追加資本を調達する場合、追加債務の発生、資本支出、配当の申告など、特定の行動を取る能力を制限または制限する契約の対象となる場合があります。必要なときに資金を調達しないと、当社の財政状態や事業計画や戦略を追求する能力に悪影響を及ぼす可能性があります。資金を調達できない場合は、コストを削減するために、計画された活動を延期、削減、または中止する必要があります。
医薬品の研究、開発、商品化には数多くのリスクと不確実性があるため、必要な運転資金の正確な金額を見積もることはできません。私たちの将来の資金調達要件は、以下を含むがこれらに限定されない多くの要因に左右されます。
さらに、当社の事業計画は変更される可能性があり、臨床試験やその他の研究開発活動の運営上のニーズや資本要件を満たすために追加の資金が必要になる場合があります。現在、信用枠や献身的な資金源はありません。製品候補の開発と商品化には数多くのリスクと不確実性があるため、現在および今後予定されている製品開発プログラムに関連する資本支出と営業支出の増加額を見積もることはできません。
23
キャッシュフロー
次の表は、当社のキャッシュフローをまとめたものです。
|
|
3月31日に終了した3か月間 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
|
|
(千単位) |
|
|||||
提供した純現金(使用量): |
|
|
|
|
|
|
||
営業活動 |
|
$ |
(24,566%) |
) |
|
$ |
(21,356) |
) |
投資活動 |
|
|
9,988 |
|
|
|
53,085 |
|
資金調達活動 |
|
|
1,717 |
|
|
|
45,054 |
|
現金、現金同等物および制限付現金の純増額(減少) |
|
$ |
(12,861) |
) |
|
$ |
76,783 |
|
営業活動
2024年3月31日に終了した3か月間、営業活動に使用された現金は2,460万ドルでした。これは主に、純損失2,640万ドル、純営業資産および負債の470万ドルの純変動によるもので、株式ベースの報酬、減価償却、有価証券の償却および増額のための非現金費用650万ドル、および使用権資産の帳簿価額の減少により相殺されました。
2023年3月31日に終了した3か月間で、営業活動に使用された現金は2,140万ドルでした。これは主に、2,250万ドルの純損失、当社の純営業資産および負債の590万ドルの純変化によるもので、株式ベースの報酬、減価償却、有価証券の償却および増額のための700万ドルの非現金費用、および使用権資産の帳簿価額の減少により相殺されました。
投資活動
2024年3月31日および2023年3月31日に終了した3か月間の当社の投資活動は、有価証券の売却による収益が、不動産や設備の購入によって一部相殺されました。
金融活動
2024年3月31日に終了した3か月間の当社の資金調達活動は、支配株式募集販売契約からの純収入130万ドル、ストックオプションの行使による20万ドル、従業員株式購入制度(「ESPP」)からの収益20万ドルでした。
2023年3月31日に終了した3か月間の当社の資金調達活動は、コントロール・エクイティ・オファリング販売契約からの純収入4,470万ドル、ストックオプションの行使による20万ドル、ESPPからの20万ドルの収益でした。
契約上の義務と約束
次の表は、2024年3月31日現在の契約上の義務と、そのような義務が将来の会計期間における当社の流動性とキャッシュフローに及ぼすと予想される影響をまとめたものです。
|
|
会計期間別の支払い期限 |
|
|||||||||||||||||
|
|
合計 |
|
|
未満 |
|
|
1から3 |
|
|
4から5まで |
|
|
以上 |
|
|||||
|
|
(千単位) |
|
|||||||||||||||||
オペレーティングリース義務 |
|
$ |
7,184 |
|
|
$ |
1,959 |
|
|
$ |
5,225 |
|
|
$ |
— |
|
|
$ |
— |
|
合計 |
|
$ |
7,184 |
|
|
$ |
1,959 |
|
|
$ |
5,225 |
|
|
$ |
— |
|
|
$ |
— |
|
2018年8月に、約23,000平方フィートのスペースを3年間リースする契約を締結しました。リース条件は、年間90万ドルから始まるトリプルネットリースで、その後、年間基本賃料が3%増加し、営業費用、不動産税、光熱費、清掃費が加算されます。リースの開始日は2018年12月10日でした。
2021年9月、23,000平方フィートのリースの初期期間を2024年12月31日までの3年間延長する契約を締結しました。さらに、この契約では、2022年4月1日から2024年12月31日に終了する15,000平方フィートの賃貸可能スペースを追加でリースすることを規定しています。最初の毎月のリース料は、23,000平方フィートのスペースで約10万ドル、15,000平方フィートのスペースで約10万ドルで、いずれの場合も年間家賃の値上げの対象となります。
24
2023年12月、私たちは38,000平方フィートのリース期間を2025年1月1日から2026年12月31日までの2年間、延長する契約を締結しました。2023年12月、私たちは使用権資産とオペレーティングリース負債を410万ドルと認識しました。
2018年12月、2,485平方フィートのスペースを3年間リースする契約を締結しました。リースには、さらに2年間の更新オプションが1つ含まれています。リース条件は年間20万ドルからで、年間基本賃料が 2.5% 上がり、営業費用、不動産税、光熱費、清掃費が加算されます。2019年5月にこのスペースを占有しました。
2021年6月、2,485平方フィートのリースの初期期間を2025年4月30日までの3年間に延長するという契約を修正しました。さらに、この改正により、2021年7月6日から2025年4月30日に終了する2,357平方フィートの賃貸可能スペースを追加でリースすることが規定されました。修正されたリースでは、基本年間家賃を3%引き上げて、リース期間をさらに2年間延長することができます。
コミットメント
私たちのコミットメントは、主にサウサンプトン大学との契約に基づく義務で構成されています。2024年3月31日現在、マイルストーンを達成したり、将来の製品販売を行うタイミングや可能性を見積もることができませんでした。当社の契約に関する追加情報については、フォーム10-Qのこの四半期報告書の他の部分に含まれる注記6 —連結財務諸表の注記のコミットメントと不測の事態を参照してください。
さらに、前臨床試験を目的とした特定の製品候補の製造と加工について、第三者の委託製造業者と契約を締結しています。また、臨床試験の委託研究機関や、運用目的の他のサービスや製品について他のベンダーと、通常の業務過程で他の契約を締結しており、今後も締結する予定です。これらの契約は通常、すでに発生した費用を除き、解約またはキャンセルを規定しています。
貸借対照表外の取り決め
提示された期間中、SECの規則で定義されているオフバランスシート契約はありませんでしたし、現在もしていません。
重要な会計方針と重要な判断と見積もり
当社の経営陣による当社の財政状態と経営成績の議論と分析は、一般に認められた会計原則(「GAAP」)に従って作成された連結財務諸表に基づいています。これらの連結財務諸表を作成するには、連結財務諸表の日付における報告された資産と負債の金額、偶発資産と負債の開示、および報告期間中に発生した報告費用に影響する見積もりと仮定を行う必要があります。私たちの見積もりは、私たちの歴史的経験と、その状況下では妥当であると私たちが考えるその他のさまざまな要因に基づいており、その結果は、他の情報源からはすぐにはわからない資産や負債の帳簿価額を判断するための基礎となります。実際の結果は、仮定や条件が異なると、これらの見積もりと異なる場合があります。以下に説明する会計方針は、当社の過去および将来の業績を理解する上で重要であると考えています。これらの方針は、経営陣の判断と見積もりを含むより重要な分野に関連しているからです。
2024年3月25日にSECに提出されたフォーム10-Kの年次報告書に含まれている「経営陣による財政状態と運営に関する議論と分析」というタイトルのセクションで開示されている重要な会計方針と見積もりと比較して、当社の重要な会計方針と見積もりに大きな変化はありませんでした。
新興成長企業と小規模報告会社のステータス
私たちは、2012年の起業促進法(「JOBS法」)で定義されている「新興成長企業」です。雇用法の下では、新興成長企業は、JOBS法の制定後に発行された新しい会計基準または改訂された会計基準の採用を、それらの基準が民間企業に適用されるまで延期することができます。
この延長された移行期間は、公開企業と非公開企業で発効日が異なる新規または改訂された会計基準に準拠するために利用することを選択しました。(i) 新興成長企業ではなくなった日付、または (ii) JOBS法に規定されている延長された移行期間を肯定的かつ取消不能にオプトアウトする日のいずれか早い方までです。
その結果、当社の連結財務諸表は、公開会社の発効日時点で、新規または改訂された会計上の声明に従う企業と比較できない場合があります。
私たちは、(i)最初の会計年度の最終日(a)新規株式公開(「IPO」)の完了5周年の後、(b)年間総収入が少なくとも12億3500万ドルに達する最初の会計年度の最終日、または(c)私たちが大規模な加速申告者とみなされる場合、つまり当社の普通株式の市場価値の早い時期まで、新興成長企業であり続けます非関連会社が保有しているのは、その前の6月30日の時点で、および(ii)10億ドル以上を発行した日の時点で、7億ドルを超えています
25
過去3年間の非転換社債証券。私たちは、IPO完了から5周年に続く会計年度の最終日である2024年12月31日をもって、新興成長企業ではなくなると予想しています。
また、私たちは「小規模な報告会社」でもあります。つまり、直近の会計年度では、非関連会社が保有する当社の株式の時価は7億ドル未満で、年間収益は1億ドル未満でした。(i)非関連会社が保有する株式の市場価値が2億5,000万ドル未満であるか、(ii)直近の会計年度における年間収益が1億ドル未満で、非関連会社が保有する株式の市場価値が7億ドル未満である限り、私たちは小規模な報告会社であり続けることができます。新興成長企業ではなくなった時点で私たちが小規模な報告会社だった場合、小規模な報告会社が利用できる特定の開示要件の免除を引き続き頼りにする可能性があります。具体的には、小規模な報告会社として、Form 10-Kの年次報告書には、監査済み財務諸表の直近2会計年度のみを表示することを選択できます。新興成長企業と同様に、小規模な報告会社は役員報酬に関する開示義務を軽減しています。
最近発行された会計上の宣言
2023年11月、財務会計基準審議会(「FASB」)は、会計基準更新(「ASU」)2023-07「セグメント報告(トピック280):報告対象セグメント開示の改善」(「ASU 2023-07」)を発表しました。これにより、公開機関の報告対象セグメントに関する開示が拡大され、報告対象セグメントの費用、中間セグメントの損益に関するより詳細な情報が求められます。公的機関の最高執行責任者が、セグメントの業績評価とリソースの配分において、報告されたセグメントの損益情報をどのように使用するか。この基準は、2023年12月15日以降に開始する年次報告期間と、2024年12月15日以降に開始する年度内の中間期間に有効で、早期採用が認められています。当社は現在、採用が連結財務諸表に与える影響を評価しています。
2023年12月、FASBはASU 2023-09「所得税(トピック740):所得税開示の改善」(「ASU 2023-09」)を発表しました。ASU 2023-09では、企業が実効税率調整において特定のカテゴリーを開示することを義務付けています。また、量的基準を満たす項目を調整するための追加情報と、州と連邦の所得税の費用と支払った税金の特定の開示に関する特定の開示も義務付けています。ASC 2023-09は、2024年12月15日以降に開始する会計年度に有効です。当社は、ASU 2023-09の採用が連結財務諸表に重大な影響を与えるとは考えておらず、2025年1月1日からこの基準を採用する予定です。
26
アイテム 3.市場リスクに関する定量的・質的開示
金利リスク
私たちは通常、主に金利感応度を含む市場リスクにさらされています。2024年3月31日と2023年12月31日の時点で、当社の現金、現金同等物、有価証券はそれぞれ1億7,860万ドルと2億140万ドルです。私たちが市場リスクにさらされる主なリスクは、米国の金利の一般的な水準の変化の影響を受ける、金利感応度です。当社の現金および現金同等物は短期的に満期を迎えるため、金利が直ちに 10% 上昇しても、投資の実現価値に大きな影響はないと考えています。したがって、私たちは、現金および現金同等物に関して、重大な市場リスクにさらされているとは考えていません。
インフレリスク
インフレは通常、臨床試験の費用を増加させることで私たちに影響を与えます。2024年3月31日および2023年3月31日に終了した期間中、インフレが当社の事業、財政状態、または経営成績に重大な影響を及ぼしたとは考えていません。
アイテム 4.統制と手順。
開示管理と手続きの有効性に関する結論
最高財務責任者や最高経営責任者を含む経営陣の監督と参加を得て、2024年3月31日現在の開示管理と手続き(1934年の証券取引法(「取引法」)の規則13a-15(e)および15d-15(e)で定義されている)の設計と運用の有効性を評価しました。「開示管理と手続き」という用語は、取引法の規則13a-15(e)および15d-15(e)で定義されているように、企業が取引法に基づいて提出または提出する報告書で開示する必要のある情報が、SECの規則とフォームで指定された期間内に記録、処理、要約、および報告されることを保証するように設計された会社の管理およびその他の手続きを意味します。開示管理と手続きには、会社が取引法に基づいて提出または提出する報告書で開示する必要のある情報が蓄積され、必要に応じて最高執行責任者や最高財務責任者を含む会社の経営陣に確実に伝達され、必要な開示に関する迅速な決定を可能にするために設計された管理と手続きが含まれますが、これらに限定されません。経営陣は、どのような統制や手続きも、それがどれほどうまく設計され運用されても、その目的を達成するための合理的な保証しか提供できないことを認識しており、経営陣は、可能な統制と手順の費用対効果の関係を評価する際に必ずその判断を下します。(最高経営責任者と最高財務責任者の参加を得て)当社の経営陣の評価に基づいて、このレポートの対象期間の終了時点で、当社の最高経営責任者と最高財務責任者は、当社の開示管理と手続きは合理的な保証レベルで有効であったと結論付けました。
財務報告に関する内部統制の変更
このレポートの対象期間中、財務報告に対する当社の内部統制(取引法の規則13a-15(f)および15d-15(f)で定義されているとおり)に、財務報告に対する当社の内部統制に重大な影響を及ぼした、または重大な影響を与える可能性が合理的に高い変更はありませんでした。
統制の有効性に関する固有の制限
財務報告に対する内部統制では、すべてのエラーや詐欺を防止または検出できない場合があります。どんな統制や手順も、どんなにうまく設計され運用されても、望ましい統制目的を達成することを合理的に保証することしかできず、経営陣は、可能な統制と手順の費用対効果の関係を評価する際に必ずその判断を下します。
27
パート II — その他の情報
アイテム 1.法的手続き。
時々、私たちは通常の事業過程で生じる法的手続きに関与することがあります。私たちは現在、経営陣の意見では、当社の事業に重大な悪影響を及ぼすと思われる法的手続きの当事者ではありません。結果がどうであれ、訴訟は、弁護および和解費用、経営資源の流用、悪評や評判の低下などの要因により、当社に悪影響を及ぼす可能性があります。
アイテム 1A.リスク要因。
リスク要因の要約
当社の普通株式への投資にはさまざまなリスクが伴います。将来の投資家は、当社の普通株式に投資する前に、「リスク要因」というタイトルのセクションで説明されている事項を慎重に検討することをお勧めします。これらのリスクには、以下が含まれますが、これらに限定されません。
28
製品開発と規制当局の承認に関連するリスク
私たちは開発活動の初期段階にあります。STK-001、STK-002、および将来の製品候補を開発、規制当局の承認を取得、商品化できない場合、またはそうすることが大幅に遅れた場合、当社の事業は重大な打撃を受けることになります。
私たちは、ドラベ症候群の治療のためのTANGOと現在の主力製品候補であるSTK-001の開発に、すべての努力と財源を費やしてきました。2019年後半に、STK-001の治験中の新薬申請(「IND」)をFDAに提出しました。2020年8月、MONARCH第1/2a相試験の単回漸増投与の部分で、最初の患者さんに10mgの用量レベルでSTK-001を投与しました。
さらに、2020年11月に、常染色体優性視神経萎縮症(「ADOA」)を治療するための前臨床開発の次のターゲットとしてOPA1を指名したことを発表しました。2021年11月、私たちはADOA治療の主力製品候補としてSTK-002を指名したことを発表しました。その開発には多大な努力と財源を投資するつもりです。2023年初頭に英国医薬品ヘルスケア製品規制庁(「MHRA」)にSTK-002の臨床試験承認(「CTA」)申請書を提出し、MHRAは2023年4月にそのようなCTAを承認しましたが、患者の登録と投与はまだ開始されていません。製品収益を生み出す私たちの能力は、たとえあったとしても、何年にもわたって実現するとは予想していませんが、TANGOと製品候補の開発が成功し、最終的に商品化されるかどうかに大きく依存しますが、決して実現しないかもしれません。私たちは現在、どの製品の販売からも収益を上げておらず、市場性のある製品を開発したり商品化したりすることはできないかもしれません。
当社のプログラムと製品候補はそれぞれ、製品販売から収益を得る前に、前臨床および臨床開発、複数の法域での規制当局の承認、前臨床、臨床、および商業製造の供給調達、能力と専門知識、商業組織の構築、多額の投資、および多額のマーケティング活動を必要とします。STK-001、STK-002、および当社の将来の製品候補は、製品候補を商品化する前に、FDA、または欧州医薬品庁(「EMA」)やMHRAなどの他の特定の外国の規制機関から販売許可を受ける必要があります。
STK-001、STK-002、および当社の将来の製品候補の成功は、次のような複数の要因に左右されます。
29
これらの要素の1つまたは複数をタイムリーに、またはまったく成功させなければ、製品候補の商品化が大幅に遅れたり、成功しなかったりして、事業に重大な損害を与える可能性があります。製品候補の規制当局の承認を受けなければ、事業を継続できない可能性があります。
初期の前臨床研究または臨床試験の成功は、ドラベ症候群プログラムやADOAプログラムを含む、その後の前臨床試験や臨床試験で得られた結果を示すものではありません。
STK-001は現在、人体臨床試験で評価中ですが、将来、予想外または陰性の結果が出る可能性があります。商品販売の規制当局の承認を求める前に、当社の製品候補が安全で効果的で、ベネフィット・リスク・プロファイルが良好で、対象となる適応症に使用できることを十分かつ十分に管理された臨床試験を通じて実証する必要があります。マウスモデルにはすべての前臨床研究に関連する固有の制限があるため、前臨床動物モデルで製品候補について観察された肯定的な結果は、ヒトを対象とした将来の臨床試験を予測できない可能性があります。特に、ドラベ症候群のマウスモデルは、人間の病気よりも重症度が高く、症状が出た後の観察期間が短くなります。試験デザインや初期段階の試験の結果は、必ずしも将来の臨床試験のデザインや結果を予測するわけではなく、最初に肯定的な結果が得られたとしても、後期臨床試験では確認されない場合があります。たとえば、最近、STK-001の第1/2a相オープンラベル試験の最終研究データで、ベースラインと比較してけいれん発作頻度の中央値が減少したことが示されましたが、これらの結果は、米国(MONARCH)と英国(ADMIRAL)におけるSTK-001の第1/2a相非盲検試験のデータをまとめたものであり、追加の試験でこれらの結果が確認されない場合があります。また、当社の製品候補は、最初の臨床試験を無事に進めたとしても、臨床開発の後の段階で望ましい安全性と有効性を示さない可能性があり、進行中の試験の暫定暫定データ読み出しでは、そのような試験が完了すると結果が変わる場合があります。発作軽減に対する有効性を実証できたとしても、ドラベ症候群患者を対象とした臨床試験では、STK-001の疾患改善効果を実証できない場合があります。同様に、ADOAプログラムやその他の将来のプログラムでは、STK-002の有効性を実証できない可能性があります。さらに、これまでの臨床試験には、必然的に比較的少数の参加者が参加してきました。したがって、これまでの試験結果に基づいて導き出した結論は、参加者や特性の異なる患者から成る大規模なコホートでは再現できない可能性があります。さらに、当社の臨床試験でSTK-001、STK-002、または将来の製品候補の安全性と有効性が許容できることが実証されたとしても、FDAまたは外国の規制当局との交渉を通じて取得した表示には、副次的評価項目に関するデータが含まれず、同じまたは類似の適応症で承認された他の製品に対する競争上の優位性が得られない場合があります。
30
バイオテクノロジー業界の多くの企業は、開発の初期段階で良い結果を達成した後、後期段階の臨床試験で大きな失敗に見舞われました。また、臨床試験を進める製品候補の不合格率も高いです。さらに、特定の安全性や有効性のパラメータを評価するために使用する方法論、前提条件、用途が異なれば、統計結果も異なる場合があります。製品候補の臨床試験から収集されたデータが有望だとしても、これらのデータはFDAまたは外国の規制当局による承認を裏付けるには不十分かもしれません。前臨床データと臨床データはさまざまな方法で解釈できます。したがって、FDAまたは外国の規制当局は、これらのデータを当社やパートナーとは異なる方法で解釈する可能性があり、規制当局の承認が遅れたり、制限されたり、妨げられたりする可能性があります。私たちの研究データが、ドラベ症候群のSTK-001やADOAのSTK-002など、当社の製品候補の安全性や有効性を一貫してまたは十分に示していない場合、承認要件を満たすためにそのような製品候補の規制当局の承認が大幅に遅れたり、これらの要件を満たせない場合は、承認が保留されたり取り消されたりする可能性があります。製品開発期間中の規制方針の変更など、さまざまな要因の結果として、規制上の遅延や拒否が発生する可能性があります。同じような挫折に直面しないかどうかは定かではありません。
当社が開発するSTK-001、STK-002、またはその他の製品候補の臨床試験で、FDAまたは外国の規制当局が満足する安全性と有効性が実証されなかったり、好ましい結果が得られなかったりした場合、そのような製品候補の開発と商品化の完了に追加費用が発生したり、完了が遅れたり、最終的には完了できなかったりする可能性があります。
STK-001やSTK-002を含む製品候補の販売について規制当局から市販承認を得る前に、前臨床開発を完了し、製品候補の安全性と有効性をヒトで実証するための広範な臨床試験を実施する必要があります。臨床検査は費用がかかり、設計や実施が難しく、完了するまでに何年もかかることがあり、結果も不確実です。1つまたは複数の臨床試験の失敗は、試験のどの段階でも起こり得ます。
臨床試験は、FDA、外国の規制当局、または当社によって臨床試験の全部または一部が臨床保留になる場合があります。これには、規制要件または臨床プロトコルに従って臨床試験を実施しなかった場合など、臨床試験の実施における欠陥、臨床試験の実施または試験実施場所の欠陥、有効性を実証するために必要な試験デザインの欠陥、臨床中に発生する死亡者またはその他の副作用などが含まれますが、これらに限定されません。可能性のある、あるいは起こり得る医学的問題による裁判臨床試験の治療とは関係がない、製品候補が現在の治療法よりも効果的ではないように思われる、製品候補の品質または安定性が許容基準を下回る、または動物実験のデータが、提案された臨床試験で予想される曝露(用量、投与経路、期間)を裏付けるのに十分でない場合があります。たとえば、2020年3月、私たちは、ヒト以外の霊長類における有害な後肢麻痺の観察に基づいて、追加の前臨床試験が行われるまで、MONARCH試験で20mgを超えるSTK-001の投与量を部分的に臨床的に保留したことをFDAが発表しました。部分的な臨床的ホールドは、70mgを超える単回および複数回投与のMONARCH試験と、45mgを超える慢性用量のSWALLOWTAILオープンラベル延長試験では引き続き有効です。現在、MONARCH試験の研究終了データを発表しましたが、部分的な臨床ホールドが解除されない場合、STK-001に関連する他の研究を無事終了する当社の能力、および当社の事業、経営成績、および財政状態に悪影響が及ぶ可能性があります。
さらに、私たち、FDA、外国の規制当局、またはIRBまたは同様の外国の審査委員会または委員会は、健康なボランティアの被験者またはそのような試験に参加している患者が容認できない健康上のリスクにさらされていると私たちまたは彼らが信じる場合など、さまざまな理由で、製品候補の臨床試験の開始をいつでも延期、中断、または制限することができます。他の理由の中でも、前臨床試験での製品候補または関連製品の副作用、または臨床試験の健康なボランティアの被験者または患者への有害な副作用が、このような決定につながる可能性があります。たとえば、2022年11月に、非盲検延長試験の慢性投与量を米国ではスワローテイルで30mg、英国ではロングウィングで45mgに制限する決定を発表しました。当時の私たちの決定は、規制当局とのやり取りと、非ヒト霊長類(「NHP」)を対象とした研究から得られた暫定的な慢性毒性学データのレビューに基づいていました。この研究では、薬の総量が1回以上になりました。1年の期間は、臨床試験の参加者に与えられると予想していた期間よりも大幅に長かったです。
必要な前臨床試験と臨床試験を完了したとしても、製品候補を商品化するための規制当局の承認をいつ、または取得するかどうかを予測することはできず、承認が私たちが求めるよりも狭い適応症のものである可能性があります。
商品化する前に、STK-001、STK-002、およびその他の将来の製品候補は、米国のNDAおよびEMAおよび米国外の同様の規制当局による同様のマーケティング申請に従って、FDAの承認を受ける必要があります。米国でも海外でも、マーケティング承認を取得するプロセスは費用がかかり、承認を得たとしても何年もかかり、関係する製品候補の種類、複雑さ、新規性など、さまざまな要因によって大きく異なります。製品候補のマーケティング承認を得られないと、製品候補の商品化ができなくなります。STK-001、STK-002、またはその他の将来の製品候補の販売について、どの管轄区域の規制当局からも承認を受けていません。当社には、マーケティング承認を得るために必要な申請書の提出とサポートの経験がありません。また、規制当局がそのような申請書を提出することを許可した場合、希望どおりに迅速かつ効率的に提出できない可能性があります。市販の承認を得るには、候補製品の安全性と有効性を確認するために、各治療適応症について広範な前臨床および臨床データと補足情報を規制当局に提出する必要があります。販売承認を得るには、製品の製造プロセスに関する情報を規制当局に提出し、規制当局による製造施設の検査も必要です。私たちの製品候補は効果がないかもしれませんし、唯一の効果があるかもしれません
31
中程度の効果があるか、望ましくない、または意図しない副作用、毒性、またはその他の特徴があり、市販承認の取得が妨げられたり、商業的使用が妨げられたり制限されたりする可能性があります。規制当局は承認プロセスにおいてかなりの裁量権を持っており、申請の受理や提出を拒否したり、データが承認には不十分であり、追加の前臨床研究、臨床研究、その他の研究が必要であると判断したりする場合があります。さらに、前臨床試験と臨床試験から得られたデータの解釈が異なると、製品候補のマーケティング承認が遅れたり、制限されたり、妨げられたりする可能性があります。
STK-001、STK-002、その他の将来の製品候補の承認は、次のようなさまざまな理由で遅れたり拒否されたりする可能性があります。
製品候補が臨床試験で安全性と有効性のエンドポイントを満たしていても、規制当局が審査プロセスを適時に完了しなかったり、規制当局の承認を得られない場合があります。FDA諮問委員会やその他の規制当局が不承認や承認の制限を推奨した場合、さらに遅延が発生する可能性があります。さらに、将来の法律や行政措置による追加の政府規制、または製品開発、臨床試験、連邦政府による一時的な閉鎖の可能性、審査プロセスの期間中の規制当局の方針の変更により、遅延や却下が発生する可能性があります。
規制当局はまた、要求されたよりも限定的な適応症の製品候補を承認する場合もあれば、狭い適応症、警告、またはリスク評価および軽減戦略(「REMS」)という形で重大な制限を課す場合もあります。これらの規制当局は、使用条件に関して予防措置や禁忌を要求したり、費用のかかる市販後の臨床試験の実施を条件として承認を与えたりする場合があります。さらに、規制当局は、製品候補の商品化を成功させるために必要または望ましい表示上の主張を承認しない場合があります。前述のシナリオはいずれも、候補製品の商業的見通しに重大な悪影響を及ぼし、当社の事業、財務状況、経営成績、および見通しに悪影響を及ぼす可能性があります。現在、病院の人員不足や世界的なマクロ経済状況の結果として、臨床試験に大きな遅延や中断は発生していませんが、このような不足や状況が、臨床試験の登録、投薬、規制当局の承認スケジュールに直接的または間接的に影響する可能性があることを考慮しています。
私たちが治療しようとしている特定の疾患は有病率が低く、これらの病気の患者を特定するのが難しい場合があります。そのため、STK-001、STK-002、または将来の製品候補が承認された場合、試験への登録が遅れたり、商業収益の伸びが遅れたりする可能性があります。
遺伝的に定義された病気は一般的に、特に私たちの製品候補が対象としている病気は、発生率も有病率も低いです。ドラベ症候群の世界的な発生率は出生約16,000人に1人、ADOAの発生率は出生3万人に1人であると推定しています。これにより、十分な数の適格な患者を当社の治験にタイムリーに募集して登録することが妨げられたり、製品候補の商業的可能性が制限されたりする可能性があります。患者の登録は、次のような他の要因の影響を受ける可能性があります。
32
計画している臨床試験に十分な数のこれらの疾患患者を登録できない場合、大幅な遅延が発生し、1つまたは複数の臨床試験を完全に開始できなくなったり、中止されたりする可能性があります。臨床試験への登録が遅れると、製品候補の開発コストが増加し、会社の価値が低下し、追加の資金調達ができなくなる可能性があります。
さらに、ドラベ症候群またはADOAの患者数と、当社の製品候補による治療の恩恵を受ける可能性のあるこの疾患患者の数の予測は、当社が委託した市場調査調査から導き出された推定に基づいており、製品候補の市場規模を正確に特定できない場合があります。STK-001、STK-002、および将来の製品候補で対処可能な市場機会の合計は、最終的には、製品候補の最終表示、製品候補が対象適応症で販売が承認されるかどうか、医学界での受け入れと患者へのアクセス、医薬品の価格設定と償還などによって決まります。世界中の患者数が予想よりも少なくなったり、他の方法では患者さんが当社の製品候補による治療を受けられなくなったり、新しい患者の特定や入手がますます困難になったりする可能性があります。これらはすべて、当社の業績と事業に悪影響を及ぼします。
さらに、ドラベ症候群とADOAの影響を受ける可能性のある患者の数が限られていることを考えると、開発および製造コストを回収し、追加の研究に資金を提供し、収益を上げるためには、STK-001、STK-002、および将来の製品候補の患者1人あたりの治療費を高くする必要があります。また、製品候補のマーケティング時に患者サポートプログラムに資金を提供する必要があるかもしれません。そうすると、製品の収益に悪影響を及ぼします。開発努力や販売、マーケティング、製造費用に見合うだけの十分な治療薬の販売量を維持または獲得できない場合があります。
TANGOを使用して製品候補のパイプラインを拡大し、市場性のある製品を開発する取り組みが成功しない可能性があります。
私たちの財源と経営資源は限られているので、特定の適応症について特定した研究プログラムと製品候補に焦点を当てています。私たちのビジネスは、私たちが研究している、または前臨床開発で持っている限られた数の社内製品候補の開発と商品化が成功するかどうかにかかっています。パイプラインの構築を続けることに成功したとしても、特定した潜在的な製品候補の開発には、製品販売から収益を上げる前に、追加の臨床開発、臨床、前臨床、製造活動の管理、複数の管轄区域での規制当局の承認、製造供給能力の獲得、商業組織の構築、および多大なマーケティング活動への多額の投資が必要になります。さらに、そのような製品候補は、有害な副作用、効能の限界、または市販の承認を得て市場で受け入れられる製品である可能性が低いことを示すその他の特性の結果など、臨床開発に適さない可能性があります。私たちの技術的アプローチに基づいた製品候補の開発と商品化を成功させてTANGOを検証できなければ、将来の期間に製品収益を得ることができず、当社の事業、見通し、財政状態、経営成績に悪影響を及ぼす可能性があります。
2021年11月、ADOA治療の主力製品候補としてSTK-002をノミネートしたことを発表しました。ただし、私たちは主にドラベ症候群の主力製品候補であるSTK-001に焦点を当てているため、他の製品候補や、後で商業的可能性が高くなる他の適応症での機会の追求を見送ったり、延期したりする可能性があります。私たちの資源配分の決定により、実行可能な商品や収益性の高い市場機会を活用できなくなる可能性があります。現在および将来の研究開発プログラム、および特定の適応症に対応する製品候補への支出は、商業的に実行可能な製品を生み出さない可能性があります。新製品候補の発見と開発のための生物学的標的の理解と評価では、その後の前臨床および臨床開発で直面する課題を特定できない場合があります。特定の製品候補の商業的可能性やターゲット市場を正確に評価していない場合、単独の開発権と商品化権を保持する方が有利だった場合に、コラボレーション、ライセンス、またはその他のロイヤルティ契約を通じて、その製品候補に貴重な権利を放棄することがあります。
当社が販売承認を得た製品候補はすべて、市販後の広範な規制要件の対象となり、市販後の制限や市場からの撤退の対象となる可能性があります。また、規制要件に従わなかったり、製品候補に予期しない問題が発生したりした場合、それらのいずれかが承認された場合に、罰則の対象となることがあります。
当社の製品候補と、その開発および潜在的な商品化に関連する活動(試験、製造、記録管理、表示、保管、承認、広告、プロモーション、販売、流通を含む)は、FDAおよびその他の米国および国際規制当局による包括的な規制の対象となります。これらの要件には、安全性の提出と
33
市販後のその他の情報とレポート、登録と掲載の要件、現在の適正製造基準(「cGMP」)を含む製造に関する要件、品質管理、品質保証、およびそれに対応する記録と文書の保守(FDAやその他の規制当局による定期検査を含む)、およびプロバイダーへのサンプルの配布と記録管理に関する要件。
FDAは、承認された製品の安全性や有効性を監視するために、費用のかかる市販後の研究や臨床試験やサーベイランスの要件を課すこともあります。FDAは、承認された適応症を対象に、承認された表示の規定に従ってのみ販売されるように、医薬品と生物製剤の承認後のマーケティングと販売促進を厳しく規制しています。FDAは、製品の使用に関する製造業者のコミュニケーションに厳しい制限を課しています。FDAが承認した表示と矛盾する方法やFDAの規制に準拠していない方法で製品候補を宣伝した場合、執行措置の対象となる可能性があります。さらに、当社の製品候補は、既存の製品よりも安全性が向上している可能性があると考えていますが、直接調査を行わない限り、承認された場合、製品の比較表示を行うことはできません。
処方薬の販売促進に関連する連邦食品医薬品化粧品法に違反すると、連邦および州の医療詐欺および乱用に関する法律、ならびに州の消費者保護法および国際法域における同様の法律の違反を申し立てる調査につながる可能性があります。
さらに、当社の製品候補、メーカー、製造プロセスに関するこれまで知られていなかった有害事象やその他の問題が後で発見された場合、または規制要件に従わなかった場合、次のようなさまざまな結果が生じる可能性があります。
安全性モニタリングやファーマコビジランスに関する欧州の要件、および小児向けの製品開発に関する要件を遵守しなかった場合も、多額の罰金が科せられる可能性があります。同様に、個人情報の保護に関する欧州の要件に従わないと、重大な罰則や制裁措置が科せられる可能性があります。
国際的な法域で規制当局の承認を得られないと、米国外での製品候補の販売ができなくなります。
STK-001、STK-002、および将来の製品候補を市場に投入して販売するには、個別に販売承認を取得し、多種多様な規制要件を遵守する必要があります。承認手続きは国によって異なり、追加のテストが必要になる場合があります。承認を得るのに必要な時間は、FDAの承認を得るのに必要な時間とは大きく異なる場合があります。米国外の規制当局の承認プロセスには、通常、FDAの承認取得に関連するすべてのリスクが含まれます。さらに、米国以外の多くの国では、規制当局がその国での製品の販売を承認する前に、製品の償還承認を確保する必要があります。外国の規制当局の承認を得られなかったり、外国の規制要件に従わなかったりすると、大幅な遅延、困難、費用が発生し、特定の国での製品候補の導入が遅れたり、妨げられたりする可能性があります。「Brexit」と呼ばれる英国の欧州連合(「EU」)からの離脱は、2020年12月31日に完全に発効しました。Brexitは、特に英国とEUにおいて、引き続き政治的および経済的不確実性を生み出しています。Brexit以前は、英国の規制の枠組みのかなりの部分がEUの指令や規制から派生していました。英国のEU離脱後、英国は一定の修正を加えたEUの規制制度を独立した英国の法律として維持しました。したがって、英国の規制制度は現在のところEUの規制と似ていますが、英国では医薬品医療機器法という新しい法律が制定されました。この法律の下で、英国は、研究、開発、商品化を含め、医薬品に関するEUの立法制度とは異なる可能性のある変更された規制を採用する可能性があり、将来の変更に関する協議文書を発行しています。Brexitは追加の規制費用につながる可能性があり、英国またはEUでの製品候補の承認に関する規制制度に重大な影響を与える可能性があります。
34
国際市場における規制要件を遵守せず、該当するマーケティング承認を受けなければ、ターゲット市場は縮小され、製品候補の市場ポテンシャルを最大限に引き出す能力が損なわれ、事業に悪影響を及ぼします。たとえあったとしても、すぐに外国の規制当局の承認を得られないかもしれません。他の国の規制当局による製品候補の承認を得られないと、その製品候補の商業的見通しが大幅に低下し、当社の事業見通しが低下する可能性があります。
STK-001、STK-002、または私たちの将来の製品候補は、望ましくない、予期せぬ副作用を引き起こしたり、一般に安全でないと認識されたりする可能性があります。これにより、臨床試験や規制当局の承認への進出が遅れたり妨げられたり、商業的可能性が制限されたり、重大な悪影響が生じたりする可能性があります。
他のアンチセンスオリゴヌクレオチド(「ASO」)は規制当局の承認を受けていますが、ハプロ不全の根底にある遺伝的原因を標的にしてタンパク質発現をアップレギュレートしようとする私たちの方法は、疾患治療への新しいアプローチを提示します。つまり、STK-001、STK-002、または当社の将来の製品候補やアンチセンスオリゴヌクレオチドクラスの薬剤の安全性プロファイルに関連する不確実性があるということです。
当社の製品候補によって引き起こされる副作用に加えて、髄腔内または硝子体内投与プロセスまたは関連手順も有害な副作用を引き起こす可能性があります。このような有害事象が発生した場合、当社の臨床試験は中断または中止される可能性があります。何らかの有害事象が管理プロセスまたは関連手続きによって引き起こされたことを証明できない場合、FDA、欧州委員会、EMA、英国MHRAまたはその他の規制当局は、対象となる適応症の一部またはすべてについて、製品候補のさらなる開発を中止するか、承認を拒否するよう当社に命じることができます。将来発生する重篤な有害事象はすべて製品に関連していないことが証明できたとしても、そのような発生は患者様のリクルートや登録された患者の治験終了に影響する可能性があります。さらに、製品候補の将来の臨床試験を開始、延期、中断、または終了しないことを選択した、または義務付けられた場合、そのような製品候補の商業的見通しが損なわれ、これらの製品候補のいずれかから製品収益を生み出す当社の能力が遅れたり、廃止されたりする可能性があります。これらの出来事はいずれも、他の製品候補を開発する当社の能力を損なう可能性があり、当社の事業、財政状態、経営成績、および見通しに重大な悪影響を及ぼす可能性があります。最後に、バイオジェンが製造するスピンラザは、髄腔内送達を利用したASO療法です。スピンラザが望ましくない副作用を引き起こしたり、潜在的なクラス効果のために安全でないことが判明した場合、STK-001やその他の将来の製品候補の需要に悪影響を及ぼす可能性があります。髄腔内送達を利用した臨床開発を行っている他のASOも、STK-001やその他の将来の製品候補に対する臨床的、規制的、または商業的認識に悪影響を及ぼす可能性のあるデータを生成する可能性があります。
さらに、当社の製品候補のいずれかが販売承認を受けた場合、FDAは、製品の利点がリスクを上回るようにREMSの採用を私たちに要求することができます。これには、たとえば、患者に配布する製品のリスクを概説する投薬ガイドや医療従事者へのコミュニケーション計画、または製品を安全に使用するためのその他の要素が含まれます。さらに、私たちや他の人が後で私たちの製品候補によって引き起こされた望ましくない副作用を特定した場合、次のようないくつかの重大な悪影響が生じる可能性があります。
これらの出来事はいずれも、当社の事業、財政状態、経営成績、および見通しに重大な損害を与える可能性があります。
FDAによる希少小児疾患指定は、製品のNDAが承認時に優先審査券の対象となることを保証するものではなく、開発や規制審査プロセスの迅速化につながったり、STK-001、STK-002、または当社の将来の製品候補が市販承認を受ける可能性を高めたりするものではありません。
希少小児疾患優先審査券プログラムでは、希少小児疾患の治療に関する適格なNDAが承認されると、申請の申請者は希少小児疾患優先審査券を受け取る資格があります。このバウチャーは、今後の生物製剤ライセンス申請またはNDAの優先審査を受けるために使用できます。STK-001の事業戦略の一環として、2022年10月に希少小児疾患指定を受けました。また、将来の他の製品候補について、希少小児疾患の指定を求めることもあります。2024年9月30日より前に製品候補が指定された場合、2026年9月30日より前に承認されればバウチャーを受け取る資格があります。ただし、STK-001、STK-002、または当社の将来の製品候補が、STK-001以外に指定されるか、その日付までに承認されるか、まったく期待できません。また、プログラムがさらに延長されることもありませんので、優先審査券を取得できない可能性があります。さらに、希少小児疾患の治療薬を指定しても、その時点でNDAが希少小児疾患優先審査券の適格基準を満たすとは限りません
35
申請は承認されました。最後に、希少小児疾患指定を受けたからといって、製品の開発や規制当局による審査が迅速になったり、市販承認を受ける可能性が高まったりするわけではありません。
FDAによるファストトラック指定は、STK-001、STK-002、または当社の将来の製品候補のいずれかに付与されたとしても、または迅速承認経路を使用しても、開発や規制当局の審査や承認プロセスを迅速化することはできず、当社の製品候補が市販承認を受ける可能性を高めることもありません。
医薬品が重篤または生命を脅かす状態の治療を目的としており、その薬がその疾患に対する満たされていない医療ニーズに応える可能性がある場合、医薬品スポンサーはFDAにファストトラック指定を申請することができます。この指定を許可するかどうかは、FDAが幅広い裁量権を持っています。特定の製品候補がこの指定の対象であると私たちが考えたとしても、FDAがそれを認めることを保証することはできません。製品候補のいずれかでファストトラック指定を受けたとしても、従来のFDA手続きと比較して、開発プロセス、レビュー、承認が迅速にならない場合があります。FDAは、その指定が当社の臨床開発プログラムのデータによって裏付けられなくなったと判断した場合、ファストトラック指定を取り消すことがあります。ファストトラック指定を受けた医薬品の多くは、承認を得ることができませんでした。
また、製品候補の早期承認を求めることもあります。FDAの迅速承認プログラムでは、臨床的利益を予測する可能性がかなり高い代理エンドポイントや、不可逆的な罹患率や死亡率への影響を予測する可能性がかなり高い不可逆的な罹患率や死亡率よりも早く測定できる臨床エンドポイントに基づいて、既存の治療法よりも患者に有意義な治療効果をもたらす重篤または生命にかかわる病気の治療薬を承認する場合があります。または症状の重症度、希少性、または有病率を考慮に入れたその他の臨床的利益代替治療の利用可能性または欠如。早期承認を求めている当社の製品候補のいずれかと同じ適応症の別の製品を完全に承認すると、製品候補の迅速な承認がより困難になる可能性があります。早期承認を受けた医薬品については、不可逆的な罹患率や死亡率、またはその他の臨床的利益に対する予想される影響を説明するために、市販後の確認試験が必要です。これらの確認試験は十分な注意を払って完了する必要があり、一般的にFDAは承認前に試験の設計および/または開始を要求する場合があります。食品医薬品オムニバス改革法(「FDORA」)が最近制定されました。これには、迅速な承認経路に関する規定が含まれていました。FDORAによると、FDAは承認前または承認後の一定期間内に承認後の研究を開始することを要求する権限を与えられています。FDORAはまた、マイルストーンを含む承認後の必要な研究の条件を指定するようFDAに要求し、スポンサーは必要な承認後の研究の進捗レポートとFDAが要求する条件を提出する必要があります。FDORAにより、FDAは、承認後に必要な調査をデューデリジェンスを実施しなかった場合(FDAが指定した必須条件を満たさなかったり、適時に報告を提出しなかった場合など)に執行措置を講じることができます。早期承認により承認された製品候補の販促資料はすべて、FDAによる事前の審査の対象となります。さらに、FDAは、たとえば次のような場合、迅速承認経路で承認された製品候補または適応症の承認を取り下げることができます。
FDAによる画期的治療薬の指定は、STK-001、STK-002、または将来の製品候補に付与されたとしても、開発や規制当局の審査や承認プロセスの迅速化にはつながりません。また、製品候補が市販承認を受ける可能性も高まりません。
STK-001、STK-002、または将来の製品候補の1つ以上のブレークスルーセラピー指定を求めるかもしれません。画期的な治療法とは、重篤または生命を脅かす病気や状態を治療するために、単独で、または1つ以上の他の薬と組み合わせて治療することを目的とした薬剤と定義されます。予備的な臨床的証拠から、臨床開発の初期段階で観察された実質的な治療効果など、臨床的に重要な1つ以上のエンドポイントで、既存の治療法よりも大幅に改善される可能性があることが示されています。画期的な治療法として指定された医薬品については、FDAと試験のスポンサーとの間の相互作用とコミュニケーションは、効果のない対照レジメンに入れられる患者の数を最小限に抑えながら、臨床開発のための最も効率的な道筋を特定するのに役立ちます。FDAによって画期的な治療法として指定された医薬品も、NDAの提出時に臨床データで裏付けられていれば、優先審査の対象となります。
画期的な治療法としての指定は、FDAの裁量に委ねられています。したがって、当社の製品候補の1つが画期的な治療法としての指定基準を満たしていると私たちが信じたとしても、FDAはこれに同意せず、代わりにそのような指定を行わないことを決定することがあります。いずれにせよ、ある医薬品のブレークスルーセラピー指定を受けたとしても、従来のFDA手続きで承認が検討されている医薬品と比較して、開発プロセス、レビュー、承認が迅速になるわけではなく、FDAによる最終的な承認も保証されません。さらに、1つまたは複数の製品候補が画期的な治療法の資格を得たとしても、FDAは後でその製品候補がもはや資格の条件を満たしていないと判断したり、FDAの審査または承認の期間を短縮しないことを決定したりする場合があります。
36
制定される法律や将来の法律により、製品候補のマーケティング承認を得て商品化するのが難しくなり、費用がかかり、設定する価格に影響する可能性があります。
既存の規制ポリシーが変更されたり、製品候補の規制当局の承認が妨げられたり、制限されたり、遅延したりする可能性のある追加の政府規制が制定される可能性があります。米国または海外で、将来の法律や行政措置によって生じる可能性のある政府規制の可能性、性質、範囲を予測することはできません。既存の要件の変更や新しい要件やポリシーの採用に遅いか適応できない場合、または規制コンプライアンスを維持できない場合、取得したマーケティング承認を取得できないか、失う可能性があり、収益性を達成または維持できない可能性があります。
さらに、米国では、医療費を抑えるための立法上の取り組みが数多く行われており、現在も行われています。製薬業界は特にこれらの取り組みの焦点となっており、主要な立法措置の影響を大きく受けています。以前、2010年3月に、2010年の医療と教育の和解法(総称して「ACA」)によって改正された患者保護および手ごろな価格の医療法(総称して「ACA」)が制定されました。これは、健康保険へのアクセスの拡大、医療費の増加の抑制または抑制、詐欺や虐待に対する救済策の強化、医療および健康保険業界への新たな透明性要件の追加、医療業界への新たな税金と手数料の賦課を目的としています。追加の医療政策改革を課してください。
医療改革の取り組みは最近、2022年8月にインフレ削減法(「IRA」)が制定されたことで最高潮に達しました。これにより、とりわけ、米国保健社会福祉省(「HHS」)は、メディケア&メディケイドサービスセンター(「CMS」)がメディケアパートに基づいて払い戻す、法的に指定された数の医薬品と生物製剤の販売価格について、毎年直接交渉することができます。BとパートD。少なくとも7年間(単一供給源の生物製剤では11年)承認されている、高支出の単一供給源医薬品のみが選択対象となります。CMSで交渉します。交渉価格は選択年の2年後に有効になります。メディケアのパートD製品の交渉は2024年に行われ、交渉価格は2026年に発効します。メディケアのパートB製品の交渉は2026年に始まり、交渉価格は2028年に発効します。2023年8月、HHSは交渉のために選択した10種類のメディケアパートD薬と生物製剤を発表しました。HHSは、2024年9月1日までに交渉された最大公正価格を発表します。この価格の上限は、法定上限価格を超えてはならず、2026年1月1日に発効します。希少疾患または疾患に対してのみ希少疾病用医薬品に指定されている医薬品または生物製品は、IRAの価格交渉要件から除外されますが、複数の希少疾患または状態の指定を受けた場合、または指定された単一の希少疾患または状態に含まれない適応症が承認された場合は、CMSが評価するまでにそのような追加指定または失格承認が取り消されない限り、その除外が失われます。交渉のための選択薬。交渉された価格は、卸売業者や直接購入者にとって平均価格から大幅に割引されます。法律では、メディケアのパートDとパートBの医薬品で、価格がインフレ率を上回る割合で上昇した場合もリベートが課されています。さらに、この法律は、2025年からメディケアパートDの「ドーナツホール」を排除します。これは、新しく設立されたメーカー割引プログラムを通じて受益者の最大自己負担費用を大幅に引き下げることで、メーカーがパートD登録者のブランド医薬品の処方費用の10%を自己負担限度額未満に助成し、自己負担限度額に達した場合は20%を補助することです。IRAはまた、ACAマーケットプレイスで健康保険を購入する個人への補助金の強化を2025年計画年度まで延長します。IRAは、HHS長官が最初の数年間は、規制ではなくガイダンスを通じてこれらの規定の多くを実施することを許可しています。IRAに従わない製造業者は、民事罰金を含むさまざまな罰則の対象となる可能性があります。これらの規定は法的な問題の対象となる可能性があります。たとえば、支出の多い単一供給源医薬品や生物製剤の販売価格の交渉に関する条項は、製薬会社が提起した複数の訴訟で異議を申し立てられています。したがって、IRAがどのように実施されるかは不明ですが、製薬業界に大きな影響を与える可能性があります。
さらに、他の法改正が提案され、採択されました。これらの変更には、2013年に施行された会計年度あたり最大2%のプロバイダーへのメディケア支払いの削減が含まれ、2031年まで有効です。ただし、議会で追加の措置が取られない限り、2020年5月1日から2022年3月31日まで、さまざまなCOVID-19救済法に基づいて実施された一時的な停止は例外です。2013年1月、2012年の米国納税者救済法が成立しました。これにより、とりわけ、複数の医療提供者へのメディケアの支払いが減り、政府が医療提供者への過払いを回収するための時効期間が3年から5年に延長されました。これらの新しい法律により、メディケアやその他の医療費がさらに削減される可能性があり、承認されれば、当社の医薬品を購入する顧客、ひいては当社の財務運営に重大な悪影響を及ぼす可能性があります。さらに、2018年5月30日に、2017年のトリケット・ウェンドラー、フランク・モンジェロ、ジョーダン・マクリン、マシュー・ベリーナの裁判権法が成立しました。この法律は、とりわけ、第1相臨床試験が完了し、FDAの承認に向けて調査中の特定の治験中の特定の治験中の新薬に、特定の患者がアクセスするための連邦的枠組みを定めています。特定の状況下では、対象となる患者は、臨床試験に登録したり、FDAの拡張アクセスプログラムに基づくFDAの承認を得たりしなくても治療を受けることができます。ただし、現在の連邦裁判権法では、製造業者は治験薬を提供する義務はありません。私たちは、製品候補のためのアクセスプログラムを拡大するか、特定の患者さんごとに、または思いやりのある使用プログラムの下で、薬の使用を許可する他の国の同等の規則を利用するかを選択できます。
さらに、医療費の削減を目指す米国連邦および州レベルでは、他にも多くの取り組みが行われています。たとえば、2020年12月、CMSはメーカー価格を大幅に抑える最終規則を発表しました
37
メディケイド医薬品リベートプログラムに基づく変更の報告。これには、元の医薬品の値上げに関連するライン延長の代替リベート計算や、特定の価値に基づく購入契約に関連するベストプライスの報告が含まれます。さらに、2024年1月1日に施行された2021年の米国救済計画法に基づき、製造業者が医薬品単位に対して州のメディケイドプログラムに支払うメディケイド医薬品リベートプログラムのリベートに関する法定上限が廃止されました。この上限を撤廃すると、製薬会社は製品の販売から受け取るよりも多くのリベートを支払う必要が生じる場合があります。さらに、インフラ投資および雇用法により、2023年1月1日から、メディケアパートBに基づいて少なくとも18か月間個別に支払われ、単回投与の容器またはパッケージ(返金可能な単回投与容器または使い捨てパッケージ薬として知られています)で販売されている特定の単一供給医薬品の製造業者に、調剤された薬剤のうち、未使用または廃棄された場合は未使用または廃棄された場合は毎年払い戻しを行うという要件が追加されました。一部が、法令または規制で定められている適用パーセンテージを超えています。製造業者は定期的な監査の対象となり、返金可能な単回投与容器または1回限りの包装薬の払い戻しを怠った製造業者は民事罰の対象となります。すでに採用され、将来採用される可能性のある医療改革は、医薬品の補償範囲と償還水準がさらに引き下げられ、米国政府のリベートプログラムで支払われるリベートが増加し、医薬品価格にさらなる下落圧力がかかる可能性があります。
ACA、IRA、および今後採用される可能性のあるその他の医療改革措置により、補償基準がより厳しくなり、承認された製品について受け取る価格にさらなる下押し圧力がかかると予想しています。メディケアやその他の政府プログラムからの償還額が減ると、個人支払者からの支払いも同様に減る可能性があります。コスト抑制措置やその他の医療改革の実施により、収益を生み出し、収益を上げたり、製品候補を商品化したりできなくなる可能性があります。
米国の州レベルでは、価格制約、特定の製品へのアクセス制限、値上げの報告、高額医薬品の導入など、医薬品や生物製剤の価格を管理するための法律を制定し、規制を実施する議会が増えています。
承認後の要件を拡大し、医薬品の販売や販売促進活動を制限するための立法上および規制上の提案がなされています。追加の法改正が制定されるのか、FDAの規制、ガイダンス、解釈が変更されるのか、そのような変更が製品候補の販売承認にどのような影響を与えるのか(もしあれば)はわかりません。さらに、米国議会によるFDAの承認プロセスの精査が厳しくなると、市販承認が大幅に遅れたり、妨げられたりする可能性があります。また、より厳しい製品表示や市販後のテスト、その他の要件の対象となる可能性があります。
希少疾病用医薬品指定の取得に失敗したり、将来の製品候補のために他社が取得した指定を譲渡したりする可能性があります。また、そのような指定を取得したとしても、STK-001、STK-002、または将来の製品候補について、市場独占権の可能性を含め、希少疾病用医薬品指定に関連するメリットを維持できない場合があります。
STK-001の事業戦略の一環として、2019年に米国で、2022年にEUでもドラベ症候群の治療薬として希少疾病用医薬品指定を受けました。STK-002の事業戦略の一環として、2022年に米国で常染色体優性視神経萎縮症(ADOA)の治療薬としてオーファンドラッグの指定を受けました。他の国でも、製品候補にこのような指定を求めることがあります。ただし、オーファンドラッグ指定は、将来のオーファンドラッグのマーケティング独占性を保証するものではなく、将来の製品候補でそのような指定を確実に取得できる保証もありません。
米国やヨーロッパを含む一部の法域の規制当局は、比較的少数の患者集団の治療を目的とした医薬品を希少疾病用医薬品として指定する場合があります。希少疾病用医薬品法に基づき、FDAは希少疾患または状態(米国内の患者数が20万人未満と定義される)の治療を目的とする医薬品を希少疾病用医薬品に指定することがあります。米国では、希少疾病用医薬品指定により、対象となる臨床研究費用の税額控除や処方薬使用料の免除などの金銭的優遇措置が当事者に与えられます。同様に、EUでは、欧州委員会は希少疾病用医薬品指定申請に関するEMAの希少疾病用医薬品委員会からの意見を受けた後、希少疾病用医薬品の指定を許可します。EUでは、希少疾病用医薬品指定は、生命を脅かすまたは慢性的に衰弱させる状態の診断、予防、または治療を目的とした医薬品の開発を促進することを目的としています。その場合、EUでは10,000人に5人以下で、満足のいく診断、予防、治療方法が承認されていない(または、製品が影響を受ける人々に大きな利益をもたらす可能性がある)。EUでは、希少疾病用医薬品指定により、当事者は手数料の減額や手数料免除などの金銭的インセンティブを受けることができます。
一般に、希少疾病用医薬品指定のある医薬品が、その指定のある適応症について最初の市販承認を受けた場合、その医薬品には一定期間の販売独占権が与えられます。これにより、限られた状況を除き、EMAまたはFDAは、同じ医薬品と適応症に対する別の販売申請をその期間に承認できなくなります。競合他社が、当社の製品候補と同じ有効成分を構成し、同じ適応症を治療する製品について、当社より先に希少疾病用医薬品の独占権を取得できた場合、当社の医薬品が承認された医薬品よりも臨床的に優れていることを示すことができない限り、該当する規制当局による医薬品の承認を長期間取得できない可能性があります。適用期間は、米国では7年、EUでは10年です。医薬品が希少疾病用医薬品指定の基準を満たさなくなった場合、または医薬品が十分に収益を上げて市場独占権が正当化されなくなった場合は、EUの独占期間を6年に短縮できます。
38
希少疾病用医薬品が承認された後でも、対象集団のかなりの部分でより安全であること、より効果的であること、または患者ケアに大きく貢献することが示されているという点で、後者の薬の方が臨床的に優れているとFDAが結論付けた場合、FDAは同じ状態に対する同じ医薬品の後の申請を承認することもできます。さらに、指定されたオーファンドラッグは、オーファンドラッグがオーファン指定を受けた適応範囲よりも広い用途で承認された場合、オーファンドラッグの独占権を受けないことがあります。さらに、指定申請に重大な欠陥があるとFDAが後で判断した場合、または希少疾患や状態の患者のニーズを満たすのに十分な量の製品を製造できない場合、米国でのオーファンドラッグの独占販売権が失われる可能性があります。希少疾病用医薬品指定は、医薬品の開発時間や規制審査時間を短縮するものでも、規制審査や承認プロセスにおいて医薬品が有利になることもありません。
希少疾病用医薬品法に含まれるオーファンドラッグの独占権は、最近、報道機関、一部の議員、医学界の一部から精査されています。さらに、FDAによる希少疾病用医薬品法の解釈は法廷で異議を申し立てられておらず、今後の裁判所の判決もこの傾向が続く可能性があります。FDAによって承認された希少疾病用医薬品に付与された独占権が将来変更されないという保証や、承認された場合、そのような変更が当社の製品にどのように影響するかについての保証はありません。
FDAとMHRAが新製品を審査し承認する能力は、予算や資金水準、政府の閉鎖、主要人材の雇用と維持、法定、規制、政策の変更など、さまざまな要因によって妨げられる可能性があります。
FDAとMHRAが新製品を審査し承認する能力は、予算や資金水準、政府の閉鎖、主要人材の雇用と維持の能力、法定、規制、政策の変更など、さまざまな要因の影響を受ける可能性があります。さらに、研究開発活動に資金を提供する他の政府機関への政府の資金提供は、本質的に流動的で予測不可能な政治的プロセスの対象となります。
FDA、MHRA、その他の政府機関がその機能を適切に管理できるかどうかは、さまざまな要因の中でも特に、政府の資金水準と主要な指導者の任命に応える能力に大きく依存します。重要な役職の補充や交代が遅れると、FDA、MHRA、その他の機関の職務遂行能力に大きな影響を与え、医療や製薬業界に大きな影響を与える可能性があります。
2016年12月、21世紀治療法が成立しました。これは、医療イノベーションを促進し、医薬品や機器の開発と審査に関連する職種を直接雇用する権限をFDAに与えることを目的としています。これまで、FDAは、主要な指導者候補者(科学者を含む)に、民間企業が提供するものと比較して競争力のある報酬パッケージを提供できないことがよくありました。21世紀治療法は、既存の報酬体系で提供される狭い範囲を拡大することで、政府機関の雇用プロセスを合理化し、FDAが指導的人材をめぐって競争できるようにすることを目的としています。
FDA、MHRA、その他の政府機関での混乱により、必要な政府機関による新薬の審査または承認に必要な時間が遅くなり、当社の業績や事業に悪影響を及ぼす可能性があります。
当社の事業および将来の顧客、プロバイダー、第三者支払者との関係は、適用される反キックバック、詐欺、乱用、およびその他の医療法規制の対象となり、刑事制裁、民事罰則、契約上の損害、評判の低下、利益および将来の収益の減少などの罰則の対象となる可能性があります。
当社がマーケティング承認を得た製品候補の推薦と処方では、医療提供者と第三者支払者が主要な役割を果たします。プロバイダー、第三者の支払者、顧客との将来の取り決めにより、広く適用される詐欺や乱用、その他の医療法や規制の対象となり、マーケティング承認を得た製品候補のマーケティング、販売、流通におけるビジネス上または財務上の取り決めや関係を制限する可能性があります。
適用される米国連邦および州の医療法および規制に基づく制限には、以下が含まれます。
39
州法や地方法の中には、製薬会社が製薬業界の自主的なコンプライアンスガイドラインや連邦政府によって公布された関連するコンプライアンスガイダンスを遵守することを義務付けているものもあり、製薬会社は支払いやその他の価値移転に関する情報を医師や他の医療提供者に報告することを義務付けている場合があります。他の州法では、製薬会社は法定基準額を超えるマーケティング支出や値上げの報告、値上げの理由についての情報、または高価な医薬品の市場への導入を報告することが義務付けられています。状況によっては、州法や外国の法律が健康情報のプライバシーとセキュリティを規定していますが、その多くは大きく異なり、HIPAAに取って代わられないことが多いため、コンプライアンスの取り組みが複雑になります。
第三者とのビジネス上の取り決めが適用される医療法や規制を確実に遵守するための努力には、多額の費用がかかります。政府当局が、当社の事業慣行が、適用される詐欺や虐待に関する現在または将来の法令、規制、判例法、その他の医療法や規制に準拠していない可能性があると結論付ける可能性があります。当社の事業がこれらの法律または当社に適用される可能性のあるその他の政府規制に違反していることが判明した場合、重大な民事、刑事、行政処罰、損害賠償、罰金、懲役、メディケアやメディケイドなどの政府資金による医療プログラムからの製品候補の除外、没収、契約上の損害、評判の低下、利益と将来の収益の減少、および削減の対象となる可能性があります事業の再編または事業再編。医師やその他の医療提供者、または当社が取引を行う予定の事業体のいずれかが適用法を遵守していないことが判明した場合、政府資金による医療プログラムからの除外を含む、刑事、民事、または行政上の制裁の対象となる可能性があります。
商業化と製造に関連するリスク
STK-001やSTK-002を含む当社の製品候補の商業的成功は、医療提供者、患者、患者支援団体、第三者支払者、および一般医学界による市場での受け入れの度合いにかかっています。
遺伝子治療に関する倫理的、社会的、法的な懸念により、通常、当社の製品候補を制限または禁止する規制が増える可能性があります。FDA、MHRA、EMA、その他の国際的な規制当局から必要な承認を受けたとしても、当社の製品候補が商業的に成功するかどうかは、タンパク質の発現全般を高めるように設計された医薬品、特に当社の製品候補が医学的に必要で、費用対効果が高く安全であると認められるかどうかに一部かかっています。さらに、感染やその他の合併症のリスクを伴う硝子体内注射、腰椎穿刺、髄腔内投与の受け入れなど、STK-001、STK-002、および将来の製品候補の販売を確立して拡大しようとする上で、課題に直面する可能性があります。私たちが商品化する製品は、医療提供者、患者、患者支援団体、第三者支払者、および一般医学界に受け入れられない可能性があります。これらの製品が適切なレベルの承認を得られないと、大きな製品収益が得られず、利益を上げられない可能性があります。遺伝子医薬品、特にSTK-001、STK-002、および当社の将来の製品候補が商業販売が承認された場合、市場での受け入れ度は次のようないくつかの要因に左右されます。
40
潜在的な製品が前臨床試験や臨床試験で良好な有効性と安全性を示したとしても、その製品が市場に受け入れられるかどうかは発売後まで完全にはわかりません。
新たに承認された製品の価格、保険の適用範囲、および償還状況は不明です。製品候補に対する適切な補償や償還が得られない場合、承認された場合、それらの製品を販売する能力が制限され、製品収益を生み出す能力が低下する可能性があります。
ドラベ症候群やADOAを含む私たちのターゲット適応症は、患者数が少ない適応症です。より少ない患者集団の治療を目的とした製品候補が商業的に成り立つためには、数量不足を考慮して、そのような製品候補の償還額を相対的に高くする必要があります。したがって、潜在的な市場規模が小さいことを考慮して、承認された製品候補については、補償と償還戦略を実施する必要があります。将来の製品候補に対する第三者支払者からの補償範囲や適切な償還を確立または維持できない場合、それらの製品候補の採用と売上収益に悪影響が及び、ひいては承認された場合、それらの製品候補のマーケティングまたは販売能力に悪影響を及ぼす可能性があります。
ほとんどの患者がこれらの治療を受けるためには、第三者支払者による補償と償還が不可欠になると予想しています。したがって、STK-001、STK-002、および当社の将来の製品候補の売上高は、製品候補の費用が健康維持、マネージドケア、薬局給付、および同様の医療管理組織によって支払われるか、政府当局、民間の健康保険会社、その他の第三者支払者によって払い戻されるかによって、国内外で大きく異なります。補償が提供されている場合でも、承認された償還額は、十分な投資収益率を実現するのに十分な価格を設定または維持するのに十分ではない場合があります。
新たに承認された製品の保険適用範囲と払い戻しに関しては、大きな不確実性があります。米国では、新製品の政府当局による新製品の償還に関する主な決定は通常、CMSが行います。これは、新製品がメディケアの対象となるかどうか、またどの程度まで払い戻されるかを決定するためです。個人支払者はCMSをかなりの程度フォローする傾向があります。ただし、ある支払者が医薬品の補償を提供することを決定したからといって、他の支払人もその医薬品の補償を提供することを保証するものではありません。さらに、支払者が医薬品の補償を提供することを決定したからといって、適切な償還率が承認されるわけではありません。ヨーロッパの償還機関はCMSよりも保守的かもしれません。たとえば、多くの抗がん剤は、米国では償還が承認されていますが、特定のヨーロッパ諸国では償還が承認されていません。
米国以外では、国際事業は一般的に政府の広範な価格統制やその他の市場規制の対象となっており、ヨーロッパ、カナダ、その他の国々でコスト抑制の取り組みがますます重要になっているため、製品候補などの治療薬の価格設定と使用に圧力がかかっていると私たちは考えています。多くの国、特にEU諸国では、医療製品の価格は、国民健康制度の一環としてさまざまな価格管理メカニズムの対象となっています。これらの国では、政府当局との価格交渉は、製品の販売承認を受けてからかなりの時間がかかることがあります。一部の国では、償還または価格設定の承認を得るために、製品候補の費用対効果を他の利用可能な治療法と比較する臨床試験の実施が必要になる場合があります。一般的に、このようなシステムの製品の価格は、米国よりも大幅に低いです。他の国では、企業は自社で製品の価格を設定できますが、企業の利益は監視および管理できます。海外での価格統制の強化やその他の価格規制の変更により、候補商品に請求できる金額が制限される場合があります。したがって、米国以外の市場では、製品候補への償還が米国に比べて少なく、商業的に合理的な収益と利益を生み出すには不十分な場合があります。
さらに、米国内外の政府および第三者の支払者による医療費の上限または削減への取り組みが高まっているため、そのような組織は、承認された新製品の補償範囲と償還レベルの両方を制限し、その結果、当社の製品候補をカバーしたり、適切な支払いを提供できなくなったりする可能性があります。マネージドヘルスケアへの傾向、健康維持組織などの特定の第三者支払者の影響力の増大、その他の法改正により、製品候補の販売に関連して価格圧力が発生することが予想されます。下向きの圧力
41
医療費全般、特に処方薬や外科的処置、その他の治療は、非常に高額になっています。その結果、ヘルスケア市場への新製品の参入に対する障壁がますます高まっています。最近、第三者支払者が、治療がFDA承認の製品ラベルに表示されている患者への治療費の払い戻しを拒否するケースがありました。製品候補の商品化のためにFDAの承認を得たとしても、当社の製品候補による治療が適応となるすべての患者さんへの償還を確保できることを保証することはできません。
CMSや個人支払者に加えて、米国医師会などの専門機関は、ケアの基準を決定することで、新製品の償還に関する決定に影響を与えることができます。さらに、多くの個人支払者は、既存の代替品には限られた利益しかもたらさないと見なされる特定の製品の利用を制限し、したがって償還を試みるガイドラインを提供するソフトウェアを販売する商業ベンダーと契約しています。そのような組織は、当社の製品候補の払い戻しや利用を制限するガイドラインを設定することがあります。当社または当社の協力者が規制当局の承認を受けた1つ以上の製品候補で有利な補償および償還ステータスが達成されたとしても、将来的にはそれほど不利な補償方針と償還率が実施される可能性があります。
計画した前臨床試験、将来の臨床試験、または製品候補の製造を委託している第三者が契約上の要求どおりに機能しなかったり、規制や法的要件を満たさなかったり、予定された期限を逃したりすると、当社の開発プログラムが遅れ、事業、財政状態、経営成績、見通しに悪影響が及ぶ可能性があります。
私たちは、遺伝子検査については第三者に頼り、製品候補の発見、製造、前臨床研究、臨床試験に関連する主要な活動の設計、実施、監督、監視は第三者のCRO、CMO、コンサルタントなどに依頼しています。既存および将来のプログラムに関連する将来の活動でも同じことを行うつもりです。私たちは第三者に頼っており、必要な試験、発見、製造、前臨床研究、または臨床試験のすべてを独立して実施することができないため、発見、製造、前臨床研究、臨床試験のタイミング、品質、その他の側面を自分で実施する場合よりも管理しにくくなっています。これらの調査員、CRO、CMO、コンサルタントは当社の従業員ではないため、彼らが私たちのプログラムに費やす時間とリソースは限られています。これらの第三者は、他の事業体(競合他社を含む)と契約関係を結んでいる場合があり、そのために当社のプログラムから時間とリソースを引き出す可能性があります。私たちが契約している第三者は、私たちの発見、製造、前臨床研究、または臨床試験を熱心に、慎重に、またはタイムリーに行わない可能性があり、その結果、試験、発見、製造、前臨床研究、または臨床試験の全部または一部が遅れたり、成功しなかったりする可能性があります。さらに、これらの第三者は、人員不足、サプライチェーン、インフレ圧力などのマクロ経済状況の影響を受け、予想されるスケジュールを達成する能力が制限されたり、コストが高くなったりする可能性があります。たとえば、前臨床研究に利用できるNHPが不足していることを認識しており、それが現在の事業に影響を与えるとは考えていませんが、新製品開発プログラムを開始すると、開発時間が長くなったり、必要な研究を完了するのが困難になったりする可能性があります。
受け入れ可能な第三者と商業的に合理的な条件で契約できない場合、またはまったく契約できない場合、またはこれらの第三者が契約上の義務を果たさなかったり、前臨床試験や臨床試験の実施に関する法的および規制上の要件を満たさなかったり、予想される期限に間に合わなかったりすると、当社の臨床開発プログラムが遅れたり、悪影響を受ける可能性があります。いずれにしても、私たちの前臨床試験と臨床試験のそれぞれが、試験の一般的な治験計画とプロトコル、および規制要件に従って実施されるようにする責任があります。私たちが管理していない第三者に依存しているからといって、これらの責任や要件が軽減されるわけではありません。このような事態は、当社の事業、財政状態、経営成績、および見通しに悪影響を及ぼす可能性があります。
私たちは急速な技術変化の環境で激しい競争に直面しており、競合他社が私たちの前に規制当局の承認を得たり、当社よりも高度で効果的な治療法を開発したりする可能性があります。これにより、当社の事業、財政状態、およびSTK-001、STK-002、および将来の製品候補のマーケティングまたは商品化を成功させる能力が損なわれる可能性があります。
遺伝子医学やアンチセンスオリゴヌクレオチド分野を含むバイオテクノロジーや製薬業界は、技術の急速な変化、競争、知的財産の重視が特徴です。私たちは、さまざまな適応症のRNAベースの治療法の開発に注力している企業がいくつかあり、遺伝子を改変してタンパク質発現を調節する他の方法に取り組んでいる企業もいくつか知っています。また、大規模で専門的な製薬会社、バイオテクノロジー企業、学術研究機関、政府機関、公的および民間の研究機関との競争に直面することも予想されます。
UCBのフィンテプラなどの5-HTアゴニスト、ジャズファーマシューティカルズのエピディオレックスなどのカンナビジオール、クロバザムやスチリペントールなどのGABA受容体アゴニスト、トピラメートの作用機序の1つであるグルタミン酸遮断薬など、てんかんの治療法は数多くあります。さらに、てんかんの治療薬として数多くの化合物が臨床開発中です。臨床開発パイプラインには、カンナビノイド、5-HT放出刺激薬、コレステロール24-ヒドロキシラーゼ阻害薬、カリウムチャネルオープナー、およびさまざまな企業のナトリウムチャネルアゴニストが含まれていると思います。これらの小分子薬との競争に加えて、私たちが開発する可能性のある製品は、遺伝子治療、遺伝子編集、tRNA療法、改変mRNA療法、その他のASOアプローチなど、他の種類の治療法との競争に直面する可能性があります。たとえば、ある会社(エンコーデッド・セラピューティクス)は
42
ドラベ症候群の根本的な遺伝的原因に対処できる遺伝子調節療法の臨床開発計画です。
潜在的な競合他社の多くは、単独で、または戦略的パートナーとともに、大規模な研究開発、臨床、マーケティング、製造組織など、私たちよりもはるかに多くの財務、技術、その他のリソースを持っています。バイオテクノロジーや製薬業界の合併や買収により、より多くのリソースが少数の競合他社に集中する可能性があります。競合他社が、私たちが開発する可能性のあるどの製品候補よりも安全で効果的で、副作用が少ない、または重篤な副作用が少ない、便利で安価な製品を開発して商品化すれば、私たちの商業的機会は減少または排除される可能性があります。また、競合他社は、自社製品のFDAやその他の規制当局の承認を、私たちが承認を得るよりも早く取得する可能性があります。その結果、私たちが市場に参入する前に、競合他社が市場で確固たる地位を確立する可能性があります。さらに、競合他社が開発した新しい技術や高度な技術により、現在または将来の製品候補が不経済になったり時代遅れになったりする可能性があり、競合他社に対する製品候補のマーケティングが成功しない可能性があります。
収益を上げて収益性を維持するには、大きな市場ポテンシャルを持つ製品候補を開発し、最終的には商品化する必要があります。そのためには、さまざまなやりがいのある活動で成功する必要があります。これらの活動には、とりわけ、前臨床試験の完了、製品候補の臨床試験の開始と完了、これらの製品候補のマーケティング承認の取得、承認され市販後の要件を満たす製品の製造、マーケティング、販売が含まれます。私たちはこれらの活動の一部またはすべてで成功することは決してないかもしれませんし、たとえ成功したとしても、収益性を達成するのに十分な、または十分な量の収益を生み出すことは決してないかもしれません。収益性を達成したとしても、四半期または年間ベースで収益性を維持または向上させることができない可能性があります。収益を上げることができず、収益性を維持できなければ、会社の価値が低下し、資金調達、研究開発活動の維持、事業の拡大、または事業の継続が損なわれる可能性があります。当社の価値が下落すると、投資の全部または一部が失われる可能性もあります。
医薬品の製造は複雑で、当社の第三者メーカーは製造時に困難に直面する可能性があります。第三者メーカーのいずれかがこのような問題に直面した場合、STK-001、STK-002、または将来の臨床試験用製品候補の供給能力、市販承認を得る能力、または承認された場合、患者への製品候補の供給が遅れたり停止されたりする可能性があります。
私たちは、前臨床または臨床開発を担当するあらゆる製品候補の原材料や原薬を製造するために、限られた数のサプライヤーと製造関係を確立しています。そのようなプロセスがサプライヤーによって所有されていないか、パブリックドメインではない場合、各サプライヤーはそのような部品を製造するためのライセンスが必要になる場合があります。販売承認の一環として、製造業者とそのプロセスは、商品化前にFDAの認定を受ける必要があります。承認されたベンダーからの供給が中断された場合、商業供給が著しく中断される可能性があります。代替ベンダーはNDA補足による認定を受ける必要があり、さらに遅れる可能性があります。臨床試験材料の製造や商業生産で新しいサプライヤーに頼る場合、FDAまたは米国外の他の規制機関も追加の調査を要求することがあります。ベンダーの切り替えには多額の費用がかかり、希望する臨床および商業のスケジュールが遅れる可能性があります。
医薬品の製造プロセスは複雑で規制が厳しく、複数のリスクにさらされています。医薬品の製造は、汚染、機器の故障、機器の不適切な設置または操作、ベンダーまたはオペレーターのミス、生産量の不一致、製品特性のばらつき、製造プロセスの拡大の難しさにより、製品損失の影響を非常に受けやすくなります。通常の製造プロセスからのわずかな逸脱でも、生産量の低下、製品の欠陥、その他の供給の中断につながる可能性があります。製造業者の施設で微生物、ウイルス、その他の汚染が発見された場合、汚染の調査と是正のためにそのような施設を長期間閉鎖する必要がある場合があります。これにより、臨床試験が遅れ、当社の事業に悪影響が及ぶ可能性があります。さらに、当社の製造業者がcGMPを管理するものを含むFDAの法律および規制に準拠していないとFDAが判断した場合、FDAは、欠陥が是正されるか、NDAの製造業者を準拠している製造業者に置き換えるまで、NDAの承認を拒否することがあります。
さらに、臨床試験や商業規模の大規模製造には、コスト超過、プロセスのスケールアップに関する潜在的な問題、プロセスの再現性、安定性の問題、適正製造基準の遵守、ロットの一貫性、原材料のタイムリーな入手可能性などのリスクがあります。私たちまたは私たちの協力者が製品候補のいずれかについて規制当局の承認を得たとしても、メーカーが承認された製品をFDAや他の規制当局に受け入れられる仕様で製造できるという保証はありません。また、製品の発売予定の要件や将来の潜在的な需要を満たすのに十分な量で生産できるという保証はありません。メーカーが臨床試験や商品化のために十分な量を生産できない場合、研究や商品化の努力が損なわれ、当社の事業、財政状態、経営成績、見通しに悪影響を及ぼします。
限られた数のメーカーへの依存、医薬品製造の複雑さ、製造プロセスのスケールアップの難しさにより、臨床試験、規制当局への提出、製品候補の必要な承認または商品化が遅れ、コストが高くなり、製品候補の商品化が成功しなくなる可能性があります。さらに、サプライヤーが必要とする商業用量の材料を適時かつ商業的に納品できなかった場合
43
手ごろな価格で、実質的に同等のコストでタイムリーに生産できる代替サプライヤーを1社以上確保できず、臨床試験が遅れたり、潜在的な収益が失われたりする可能性があります。
販売およびマーケティング能力を確立できない場合、またはSTK-001、STK-002、および将来の製品候補のマーケティングと販売に関する契約を第三者と締結できない場合、収益を上げることができない可能性があります。
現在、STK-001、STK-002、および将来の製品候補の販売、マーケティング、流通を行う組織はありません。そのような組織の設立と維持にかかる費用は、そうすることの費用対効果を上回る可能性があります。承認される可能性のある製品を販売するには、販売、マーケティング、管理、その他の非技術的能力を構築するか、これらのサービスを実施するために第三者と契約を結ぶ必要があります。現在の特定のプログラムおよび将来のプログラムに関しては、販売とマーケティングをアライアンスパートナーに完全に頼る場合があります。さらに、いずれかの製品候補を販売するための承認を得ることができれば販売組織を設立する予定ですが、STK-001、STK-002、その他の将来の製品候補を開発および商品化するために、第三者と戦略的提携を結ぶ可能性があります。これには、米国外の市場や、当社の資源が及ばないその他の大規模市場も含まれます。これにより、これらの製品の販売から生み出される収益が減少します。
将来の戦略的提携パートナーは、製品候補の商品化に十分なリソースを投入しなかったり、当社の制御が及ばない要因により商品化に失敗したりする可能性があります。医療従事者や米国を含む地域で、当社のマーケティング・営業部門ではカバーされない製品候補品の販売を可能にする効果的な提携を確立できない場合、または将来の戦略的提携パートナー候補が製品候補の商品化に成功しなかった場合、製品販売から収益を生み出す当社の能力に悪影響を及ぼします。
独立であれ第三者であれ、十分な販売、マーケティング、流通能力を確立できない場合、十分な製品収益を生み出すことができず、利益を上げられない可能性があります。私たちは、現在、広範囲で十分な資金のあるマーケティングおよび販売業務を行っている多くの企業と競合することになります。マーケティングや販売の機能を果たす社内チームや第三者のサポートがなければ、私たちはこれらのより確立された企業とうまく競争できないかもしれません。
限られたリソースを特定の製品候補または適応症を追求するために費やし、より収益性が高く、または成功する可能性が高い製品候補または適応症を活用できない場合があります。
私たちの財源と経営資源は限られているので、特定の適応症について特定した研究プログラムと製品候補に焦点を当てています。その結果、他の製品候補や、後で商業的可能性が高くなる他の適応症での機会の追求を見送ったり、延期したりすることがあります。私たちの資源配分の決定により、実行可能な商用製品や収益性の高い市場機会をタイムリーに活用できなくなる可能性があります。現在および将来の研究開発プログラム、および特定の適応症に対応する製品候補への支出は、商業的に実行可能な製品を生み出さない可能性があります。特定の製品候補の商業的可能性やターゲット市場を正確に評価していない場合、コラボレーション、ライセンス、またはその他のロイヤルティ契約を通じて、その製品候補に対する貴重な権利を放棄することがあります。これは、そのような製品候補の唯一の開発および商品化権を当社が保持する方が有利だった場合です。
私たちはアカディアファーマシューティカルズと協力関係を結んでおり、将来的には、製品候補の発見、開発、商品化のために他の第三者との協力関係を築くことを検討する可能性があります。私たちの協力者が私たちのコラボレーション契約に基づく開発努力を中止した場合、またはそれらの契約のいずれかが終了した場合、これらのコラボレーションは商用製品につながらず、これらの契約に基づいてマイルストーンの支払いや将来のロイヤリティを受け取ることができなくなる可能性があります。
私たちはアカディアファーマシューティカルズと協力して、中枢神経系の重度でまれな遺伝性神経発達疾患の治療に役立つ可能性のある特定の新しいRNAベースの医薬品を発見または開発しました。このコラボレーションには、SYNGAP1症候群、レット症候群(MECP2)、および相互に関心のある未公開の神経発達ターゲットが含まれます。このようなコラボレーションは、当社の製品パイプラインのかなりの部分を占める可能性があります。将来の収益のかなりの部分を、これらの契約または将来締結する可能性のある他の同様の契約から得ることができます。研究開発コラボレーションからの収益は、コラボレーションの継続、研究開発サービスの支払いとそれに伴う製品候補のライセンス取得オプション、および当社の研究から開発された将来の製品から得られるマイルストーン、偶発的な支払い、ロイヤルティ(ある場合)の達成によって決まります。
製品候補が関与するコラボレーションは、現在、そして今後も私たちに次のリスクをもたらします。
44
上記の結果、現在および将来のコラボレーション契約では、製品候補の開発や商品化が最も効率的な方法で行われないか、まったく得られない可能性があります。私たちの協力者が企業結合に関与した場合、製品開発または商品化プログラムの継続的な追求と重点が遅れたり、減少したり、中止されたりする可能性があります。現在または将来のコラボレーション契約に従って製品候補の開発または商品化が成功しなかった場合、当社の事業、財務状況、経営成績、および見通しに重大な悪影響を及ぼす可能性があります。
さらに、既存または将来の協力者のいずれかがコラボレーション契約を終了する場合、前臨床試験または臨床試験への資金提供、マーケティングおよび流通費の引き受け、知的財産権の擁護など、これらの製品候補を独自に開発せざるを得ない場合があります。場合によっては、製品候補を完全に放棄する必要があります。いずれも当社の事業計画に変更をもたらし、当社の事業、財政状態、業績に重大な悪影響を及ぼす可能性があります事業と展望について。
将来の特定の製品候補の開発を継続したり、特定の適応症をめぐって市場での商品化や競争に成功したりするための戦略的協力者を見つけることができない場合があります。
将来的には、既存および新製品の候補の開発と潜在的な商品化のために、非営利団体、大学、製薬会社、バイオテクノロジー企業と協力することを決定するかもしれません。適切な協力者を探す上で、私たちは大きな競争に直面しています。コラボレーションについて最終的な合意に達するかどうかは、とりわけ、コラボレーターのリソースと専門知識の評価、提案されたコラボレーションの契約条件、および提案されたコラボレーターによるさまざまな要因の評価によって決まります。これらの要因には、臨床試験のデザインや結果、米国外のFDAまたは同様の規制当局による承認の可能性、対象製品候補の潜在的な市場、そのような製品候補を製造して患者に届ける際のコストと複雑さ、競合薬の可能性、当社の技術所有権に関する不確実性の存在(そのような所有権に異議申し立てがあった場合に存在する可能性のある)などがあります。課題と業界と市場の状況一般的に。また、共同研究者は、代替の製品候補や類似の適応症について共同で取り組むことができる技術を検討したり、そのようなコラボレーションが当社との製品候補よりも魅力的かどうかを検討したりすることもあります。私たちが確立する可能性のある追加のコラボレーションやその他の取り決めの条件は、私たちにとって有利ではないかもしれません。コラボレーションは複雑で、交渉や文書化には時間がかかります。さらに、最近、大手製薬会社間でかなりの数の企業結合が行われ、その結果、将来の潜在的な協力者の数が減少しています。
タイムリーに、許容できる条件で、コラボレーションの交渉ができない場合や、まったく交渉できない場合があります。それができない場合は、協力しようとしている製品候補の開発を縮小したり、開発プログラムやその他の開発プログラムを削減または延期したり、潜在的な商品化を遅らせたり、販売やマーケティング活動の範囲を縮小したり、支出を増やして自費で開発または商品化活動を行わなければならない場合があります。開発活動や商業化活動の資金を調達するために支出を増やすことを選択した場合、追加の資本を得る必要があるかもしれませんが、それは許容できる条件では利用できない場合や、まったく利用できない場合があります。十分な資金がないと、製品候補をさらに開発したり、市場に投入して製品収益を上げることができない可能性があります。
45
潜在的なコラボレーションの取り決めが成功するかどうかは、協力者の努力と活動に大きく依存します。コラボレーターは通常、これらのコラボレーションに適用する取り組みとリソースを決定するにあたり、かなりの裁量権を持っています。臨床開発と商品化の問題に関するコラボレーション契約の当事者間の意見の不一致は、開発プロセスや該当する製品候補の商品化が遅れる可能性があり、場合によっては、そのようなコラボレーション契約が終了する可能性があります。どちらの当事者にも最終的な意思決定権がない場合、これらの意見の不一致は解決が難しい場合があります。製薬会社、バイオテクノロジー企業、その他の第三者とのコラボレーションは、多くの場合、相手方によって終了されたり、期限切れが許可されたりします。このような終了または期限切れは、当社の財務に悪影響を及ぼし、当社の事業上の評判を損なう可能性があります。
私たちの財政状態に関連するリスク
当社には営業損失の歴史があり、収益性を達成または維持できない可能性があります。当面の間、引き続き損失が発生すると予想しています。計画した研究開発活動を実施するための追加資金が得られない場合、製品開発プログラムや商業開発の取り組みを延期、削減、または中止せざるを得ない可能性があります。
私たちは初期段階のバイオテクノロジー企業で、投資判断の基準となる経営履歴は限られています。バイオテクノロジーの製品開発は非常に投機的な事業であり、かなりのリスクが伴います。これまでの私たちの事業は、主に会社の組織と人員配置、事業計画、資金調達、製品および技術の権利の取得と開発、製造、製品候補の研究開発活動の実施に限定されていました。私たちは製品販売から収益を上げたことはありません。私たちはどの製品候補についても規制当局の承認を得ておらず、これまでのところ優先株と普通株式の売却による収益で事業資金を調達してきました。
創業以来、毎年純損失を被っています。2024年3月31日と2023年3月31日に終了した3か月間で、それぞれ2,640万ドルと2,250万ドルの純損失が発生しました。2024年3月31日現在、当社の累積赤字は4億2,820万ドルでした。当社の営業損失のほとんどすべては、研究開発プログラムに関連して発生した費用と、事業に関連する一般管理費によるものです。研究開発、臨床試験、規制遵守活動、製造活動を継続し、製品候補が承認された場合は販売およびマーケティング活動を行い、予想される一般管理費と合わせて、当面の間、多額の費用と営業損失が発生すると予想されるため、今後数年間、また当面の間、多額の費用と営業損失が発生すると予想されます。当社の以前の損失は、将来予想される損失と相まって、株主資本と運転資本に悪影響を及ぼしており、今後も悪影響を及ぼし続けるでしょう。
STK-001、STK-002、または将来の製品候補の潜在的な販売から利益を得るには、追加の資金を調達する必要があると予想しています。この追加融資は、受け入れ可能な条件では利用できない場合もあれば、まったく利用できない場合もあります。必要なときにこの必要な資本を得られないと、製品開発やその他の業務を延期、制限、または中止せざるを得なくなる可能性があります。
STK-001、STK-002、その他の将来の製品候補(もしあれば)の計画的および将来の前臨床および臨床開発を完了し、潜在的にこれらの製品候補を商品化するには、多額の将来資本が必要になります。現在の事業計画に基づくと、2024年3月31日現在の現金、現金同等物、有価証券は1億7,860万ドルで、2024年4月の公募による1億2,030万ドルの収益により、少なくとも2025年末までは営業費用と資本支出の要件を満たすことができると考えています。製品候補の前臨床研究と臨床試験に関連して、支出額が増加すると予想しています。さらに、製品候補のいずれかについてマーケティング承認を得た場合、商業上市、製品販売、医療事務、マーケティング、製造、流通に関連して多額の費用が発生することが予想されます。さらに、公開会社としての運営に関連して追加費用が発生することが予想されます。したがって、継続的な事業に関連して、多額の追加資金を調達する必要があります。必要なときに、または魅力的な条件で資金を調達できない場合、特定のライセンス活動、研究開発プログラム、またはその他の事業を延期、削減、または廃止せざるを得ません。
必要なときに追加の資本が利用できない場合があり、実際の現金要件が予想よりも多い場合があります。私たちの業界や市場全般への投資が限られている時期に追加の資本が必要な場合、たとえまったく有利な条件で資金を調達できない可能性があります。有利な条件で資金を調達できない場合、開発または商業化活動の中止または削減、資産の一部または全部の売却、または別の事業体との合併が必要になる場合があります。その結果、投資の全部または一部が失われる可能性があります。
私たちの将来の資本要件は、次のような多くの要因に左右されます。
46
私たちの製品候補は、承認されても商業的に成功しない可能性があります。私たちの商業収益は、もしあれば、もしあれば、何年もの間商業的に利用できないと予想される製品候補の販売から得られます。したがって、事業目標を達成するためには引き続き追加の資金調達に頼る必要がありますが、許容できる条件では利用できない場合もあれば、まったく利用できない場合もあります。
当社の営業履歴が限られているため、これまでの事業の成功を評価したり、将来の存続可能性を評価したりするのが難しい場合があります。
私たちは2014年6月に設立された臨床段階のバイオテクノロジー企業です。これまでの私たちの事業は、会社の組織と人員配置、事業計画、資金調達、技術の取得、潜在的な製品候補の特定、研究の実施、製品候補の前臨床および臨床開発、製造、ライセンス契約の確立に限定されていました。製品候補の臨床試験を完了したり、マーケティング承認を取得したり、商業規模の製品を製造したり、商品化を成功させるために必要な販売およびマーケティング活動を実施したりする能力をまだ実証していません。したがって、私たちの将来の成功や存続可能性についてあなたがする予測は、私たちの事業の歴史が長い場合ほど正確ではない可能性があります。
さらに、新規事業として、予期せぬ出費、困難、合併症、遅延、その他の既知および未知の要因に遭遇する可能性があります。ライセンスと研究に焦点を当てた会社から、臨床開発と商業活動をサポートできる会社に移行する必要があります。このような移行では成功しないかもしれません。
純営業損失の繰越を利用する当社の能力には制限がある場合があります。
私たちは歴史の中で大きな損失を被りました。すぐに利益を上げることは期待していませんし、収益を上げることは決してないかもしれません。2023年12月31日現在、連邦および州の純営業損失(NOL)は、それぞれ約1億8,950万ドルと1億9,940万ドルで、2022年12月31日現在、連邦および州の純営業損失はそれぞれ約2億1,090万ドルと2億1,280万ドルです。2018年以前のNOLは、2034年からさまざまな日に期限切れになります。一般的に、2018年以降に生成されたNOLには有効期限がありません。NOLを生み出し続ける限り、未使用のNOLは、そのNOLの期限が切れるまで将来の課税所得を相殺するために繰り越されます。改正された1986年の内国歳入法(「IRC」)の第382条および第383条、または同法に基づき、企業が「所有権の変更」(通常、3年間にわたる株式所有権の(価値による)50%を超える変化として定義される「所有権の変更」を受けた場合、その法人が変更前のNOLやその他の変更前の税属性(研究税額控除など)を使用して、変更後の収入を相殺できる場合があります。限られています。同社は最近、IRC 382の調査を実施し、過去数年間の所有権の変化を特定しました。既存の第382条の制限に基づき、既存の連邦NOLの90万ドルは、制限上の制限により使用できなくなります。その後の株式所有権の移転により、将来、さらに所有権が変更される可能性があります。その結果、変更前のNOLを使用して米国連邦の課税所得を相殺する能力には制限があり、その結果、将来の納税義務が増える可能性があります。さらに、州レベルでは、NOLの使用が停止されたり制限されたりする期間があり、これにより、未払いの州税が加速したり、恒久的に増加したりする可能性があります。
米国の連邦所得税改革やその他の税法の変更は、私たちに悪影響を及ぼす可能性があります。
2017年12月、一般に減税・雇用法(「TCJA」)と呼ばれる米国連邦税法が成立し、同法が大幅に改正されました。TCJAには、とりわけ、米国連邦税率の変更や、事業利益の控除可能性に大幅な追加制限を課し、資本支出の経費支出を可能にし、「全世界」の課税制度から部分的な「地域」制度への移行を実施し、多くの事業控除やクレジットを修正または廃止しています。2022年から、TCJAは研究開発費を直ちに控除するオプションも廃止し、納税者に5年間の国内支出と15年間の海外支出を償却するよう義務付けました。
TCJAが当社の事業に与える影響を引き続き調査しています。TCJAは、米国連邦所得税法の広範囲にわたる複雑な改正であり、さまざまなカテゴリーの納税者や業界にさまざまな、場合によっては相殺される影響があり、その後の規則制定と多くの分野での解釈が必要になります。TCJAが経済全体、事業を展開する業界、当社およびパートナーの事業に対するTCJAの長期的な影響は、新法の施行のこの初期段階では確実に予測できません。TCJAが当社の業績、財務に悪影響を及ぼさないという保証はありません
47
状態、および将来の事業運営。TCJAの推定影響は、税理士と相談した結果、経営陣の現在の知識と仮定に基づいています。
米国での評価引当金のため、TCJAの継続的な税効果によって将来の実効税率が大幅に変わることはないと予想されます。
当社の知的財産に関連するリスク
私たちの成功は、知的財産を取得、維持、保護する能力に一部依存しています。私たちの所有権と技術を保護することは困難で費用がかかり、それらの保護を確保できない場合があります。
私たちの商業的成功は、TANGO、STK-001、STK-002、およびTANGOによって特定された追加の遺伝子ターゲット、それぞれの成分、製剤、併用療法、それらの製造方法および治療方法を含む、当社独自の技術と製品候補の特許、商標、企業秘密、その他の知的財産権の取得と維持、ならびに第三者の異議申し立てから当社の特許やその他の知的財産権を首尾よく守ることに大きく依存します。許可されていない第三者による当社の製品候補品の製造、使用、販売、販売の申し出、輸入、またはその他の商業化を阻止できるかどうかは、これらの活動を対象とする有効かつ法的強制力のある特許または企業秘密に基づく権利を当社がどの程度持っているかにかかっています。私たちが開発する製品や技術の特許保護を確保して維持できない場合、または確保されている特許保護の範囲が十分に広くない場合、競合他社は当社と同様または同一の製品や技術を開発して商品化する可能性があり、私たちが開発する可能性のある製品候補を商品化する当社の能力に悪影響を及ぼす可能性があります。特許取得プロセスは費用と時間がかかり、必要または望ましいすべての特許出願を妥当な費用または適時に提出して手続きできない場合があります。さらに、関連するすべての市場で特許保護を追求したり取得したりするわけではありません。また、特許保護を受けるには手遅れになる前に、研究開発成果の特許性のある側面を特定できない可能性もあります。さらに、状況によっては、当社が特許出願の準備、出願、審査を管理したり、特許を維持したりする権利を持たない場合があります。これには、当社が第三者にライセンス供与またはライセンス供与し、当社のライセンサーまたはライセンシーに依存している技術が含まれます。出願中および将来の特許出願では、特許が発行されない場合があります。当社が現在または将来ライセンスしている、または所有している特許出願が特許として発行される場合でも、意味のある保護を提供したり、競合他社や他の第三者が当社と競争するのを防いだり、その他の方法で私たちに競争上の優位性を提供したりするような形で出願することはできません。当社が保有している、またはライセンス中の特許はすべて、第三者によって異議申し立て、狭められたり、回避されたり、無効にされたりする可能性があります。そのため、当社のプラットフォームの進歩や製品候補のいずれかが保護されるのか、それとも有効かつ執行可能な特許によって保護され続けるのかはわかりません。さらに、当社の既存の特許および当社が取得する将来の特許は、他の人が当社の技術を使用したり、競合する製品や技術を開発したりすることを妨げるほど広範ではない可能性があります。
私たちは第三者からライセンスされた知的財産に依存しており、私たちのライセンサーは必ずしも私たちの最善の利益のために行動するとは限りません。知的財産ライセンスに基づく義務を遵守しなかった場合、ライセンスが終了した場合、またはこれらのライセンスに関する紛争が発生した場合、当社の事業にとって重要な重要な権利を失う可能性があります。
私たちは、他者からライセンスされた特許、ノウハウ、独自の技術に依存しています。このような特許、ノウハウ、専有技術に対する当社のライセンスは、関連するすべての使用分野や、将来当社の製品を開発または商品化したいと考えているすべての地域における独占権を提供するわけではありません。特許、ノウハウ、専有技術を他社からライセンスする契約は複雑で、そのような契約の特定の条項は複数の解釈の対象となる場合があります。
たとえば、私たちはサウサンプトン大学とのライセンス契約の当事者であり、それに従ってTANGOプラットフォーム、STK-001、STK-002、および将来の製品候補の主要な特許と特許出願をライセンスしています。契約に関する詳細は、「ビジネス—ライセンス契約と研究契約」を参照してください。この契約は、さまざまな勤勉さ、マイルストーンの支払い、ロイヤリティ、保険、その他の義務を私たちに課します。これらの義務に従わない場合、ライセンサーはライセンスを終了する権利を持つ可能性があります。その場合、TANGOプラットフォーム、STK-001、STK-002、または契約に基づいてライセンスされた知的財産の対象となるその他の技術または製品候補を開発または販売することができなくなります。さらに、研究を進めたり、開発する可能性のある製品候補の商品化を可能にしたりするために、既存のライセンサーなどから追加のライセンスを取得する必要がある場合があります。妥当な費用で、あるいは妥当な条件でも、追加のライセンスを取得できない可能性があります。いずれの場合も、当社の技術、候補製品、またはそれらの製造方法を再設計したり、代替技術を開発またはライセンスしたりするために、かなりの時間とリソースを費やす必要がありますが、これらはすべて技術的または商業的に実現できない場合があります。それができない場合、影響を受ける技術や製品候補を開発または商品化できない可能性があります。
当社または既存の、または将来のライセンサーが、ライセンスされた知的財産を適切に保護できない場合、製品候補を商品化する当社の能力が損なわれる可能性があります。私たちは、ライセンスされた特許と特許出願の維持、出願、訴訟を完全に管理することはできず、ライセンスされる可能性のある将来の知的財産に対する管理が限られている可能性があります。たとえば、既存または将来のライセンサーによる維持や訴追などの活動が、適用法や規制に従って行われているか、今後実施されるのか、あるいは有効で法的強制力のある特許やその他の知的財産権がもたらされるのかは定かではありません。既存または将来のライセンサーによる侵害訴訟や防御活動は、私たちが自分たちで行った場合ほど活発でなかったり、私たちの最善の利益に従って行われなかったりする可能性があります。
48
さらに、当社の既存または将来のライセンス特許および特許出願に含まれる発明は、米国政府の資金またはその他の非政府資金を使用して行われる場合があります。私たちは、既存または将来のライセンサーに、そのような資金提供から生じる適用義務(適時報告、ライセンスされた特許や特許出願に関連する義務など)を確実に遵守するよう頼っています。既存または将来のライセンサーが義務を果たさないと、権利が失われたり、関連する特許が執行不能になったりする可能性があります。たとえば、政府はそのようなライセンスされていない特許に対して特定の権利を持つことができます。これには、政府に発明の使用を許可したり、非営利目的で政府に代わって発明を使用させたりすることを許可する非独占的なライセンスが含まれます。その後、米国政府がこれらの権利を行使することを決定した場合、その際に当社を請負業者として雇う必要はありません。これらの権利により、政府がマーチイン権を行使したり、そのようなライセンス特許の対象となる技術の使用を第三者に許可したりすることもできます。政府はまた、私たちまたは私たちのライセンサーが政府資金による技術の実用化に失敗したために行動が必要であると判断した場合、健康または安全のニーズを軽減するため、連邦規制の要件を満たすため、または米国の産業に優先権を与えるために行動が必要であると判断した場合、政府はマーチイン権を行使することができます。さらに、そのような認可を受けた政府出資の発明に対する当社の権利は、そのような発明を具現化した製品を米国で製造するための特定の要件の対象となる場合があります。上記のいずれも、当社の事業、財政状態、経営成績、および見通しに重大な損害を与える可能性があります。
さらに、生じる可能性のある契約解釈の不一致を解決することで、関連する特許、ノウハウ、専有技術に対する当社の権利の範囲を狭めたり、関連する契約に基づく当社の金銭的またはその他の義務であると考えるものを増やしたりする可能性があります。ライセンス契約の対象となる知的財産に関して、当社と既存または将来のライセンサーとの間で発生する可能性のある紛争には、以下に関する紛争が含まれる可能性があります。
当社がライセンスした知的財産をめぐる紛争により、現在のライセンス契約を許容できる条件で維持する当社の能力が妨げられたり、損なわれたりすると、影響を受ける技術または製品候補の開発と商品化が成功しない可能性があります。その結果、当社の知的財産ライセンスの終了または紛争により、TANGOプラットフォーム、STK-001、またはSTK-002を開発および商品化する当社の能力が失われたり、その他の重要な権利を失ったりする可能性があり、そのいずれかが当社の事業、財政状態、経営成績、および見通しに重大な悪影響を及ぼす可能性があります。
さらに、特定の第三者研究パートナーとの契約では、私たちの関係の中で開発された改善は、当社または第三者の研究パートナーのみが所有することも、当社と第三者が共同で所有することもできると規定しています。当社の新薬候補を商品化したり、当社の競争上の優位性を維持したりするために、研究パートナーまたは当社が協力している他の第三者のみが所有するこのような改良品の権利が必要であると当社が判断した場合、その改良を利用し、医薬品候補の開発、製造、または販売を継続するために、そのような第三者からライセンスを取得する必要がある場合があります。そのようなライセンスを独占的に、商業的に合理的な条件で取得できない場合や、まったく取得できない場合があります。これにより、医薬品候補の商品化が妨げられたり、競合他社などが当社のビジネスにとって重要な技術にアクセスできるようになったりする可能性があります。また、そのような知的財産を第三者に対して行使するために、私たちの知的財産の共同所有者の協力が必要な場合がありますが、そのような協力は私たちに提供されないかもしれません。
当社が所有およびライセンスしている特許と特許出願は、当社のTANGOプラットフォーム、STK-001およびSTK-002製品候補、および将来の製品候補を十分に保護しないか、または競争上の優位性をもたらさない可能性があります。
私たちは、STK-001と関連組成物、病気の治療におけるSTK-001の作用機序と使用に関する複数の米国特許と外国特許のほか、STK-001と関連組成物、および疾患治療におけるSTK-001の作用機序と使用に関する複数の出願中の米国、PCT国際、および外国特許を出願しています。また、STK-001の作用機序、疾患治療のためのメカニズムの使用、および関連する組成物を対象とする複数の米国および外国の特許をライセンスしています。STK-002に関しては、STK-002の作用機序、STK-002に関連する組成物、およびそれらの組成物の経済的に重要ないくつかの国での使用について、特許保護を申請し、現在特許保護を求めています。私たちは、STK-002と関連する組成を対象とした、発行済みの米国特許と発行済みの外国特許を所有しています。また、STK-002および関連組成、作用機序、疾患治療におけるSTK-002の用途を対象とした、PCT国際出願および多数の出願中の米国および外国特許出願も所有しています。さらに、ライセンスで発行された米国および外国の特許(上記)は、STK-002の作用メカニズムを対象としています。私たちが現在所有している、またはライセンス中の発行済み特許のいずれも、STK-001、STK-002、その他のプログラムを適切に保護するかどうか、あるいはそれらに異議申し立て、狭められ、回避され、無効になり、執行不能になることはないと確信できません。また、出願中の特許出願のいずれかが次のように発行されるかどうかも定かではありません
49
特許、もしそうなら、そのような特許がSTK-001、STK-002、その他のプログラムをカバーまたは適切に保護すること、またはそのような特許に異議申立て、絞り込み、回避、無効化、執行不能と見なされないこと。
TANGOプラットフォームの基盤となる技術に向けられたクレームに加えて、当社が所有またはライセンスしている特許と特許出願には、製品候補に含まれる医薬品有効成分(「API」)に含まれる物質の組成、および特定の治療にAPIを使用するための使用方法に関するクレームが含まれています。処方薬の医薬品有効成分に関する物質組成特許は、使用されている原薬の特定の使用方法に関係なく保護を提供します。使用方法の特許は、競合他社や他の第三者が、特許取得済みの方法の範囲外の適応症に対して同一の製品を開発または販売することを妨げるものではありません。さらに、使用方法の特許に関しては、競合他社や他の第三者が、当社が特許を取得する可能性のある適応症や用途について、自社の製品を積極的に宣伝していなくても、医療提供者は患者にこれらの製品を適応外で使用するよう勧めたり、患者自身が使用したりすることがあります。適応外使用は使用方法特許の侵害または侵害の一因となる可能性がありますが、このような慣行は一般的であり、この種の侵害を防止したり訴追したりすることは困難です。
バイオテクノロジーと製薬分野の特許の強みは、複雑な法的・科学的な問題を伴い、不確かな場合があります。当社が所有またはライセンスしている特許出願では、米国または他の外国での当社の製品候補またはその使用を対象とするクレームを含む特許が発行されない場合があります。たとえば、当社の特許出願が保留中である間に、米国特許商標庁(「USPTO」)への先行技術の第三者事前発行申請の対象になったり、外国の法域での干渉または派生手続き、または同等の手続きに巻き込まれたりすることがあります。特許が問題なく発行されたとしても、第三者は、異議申し立て、取り消し、再審査、付与後、および当事者間の審査手続などを通じて、その発明者、有効性、執行可能性、または範囲に異議を申し立てることができます。そのような提出、手続き、または訴訟における不利な判決は、特許権の喪失、独占権の喪失、または特許請求の絞り込み、無効化、または法的強制力の喪失につながる可能性があります。これにより、他者が類似または同一の技術や製品を使用または商品化することを阻止したり、当社の技術や製品候補の特許保護期間を制限したりする可能性があります。さらに、たとえ異議が唱えられなくても、私たちの特許や特許出願は、私たちの知的財産を十分に保護しなかったり、他の人が私たちの主張に基づいて設計することを妨げたりする可能性があります。さらに、当社が所有およびライセンスしている特許と特許出願の一部は、第三者と共同所有されている場合があります。そのような特許または特許出願におけるそのような第三者の共同所有者の利益に対する独占的ライセンスを取得できない場合、そのような共同所有者は競合他社を含む他の第三者に権利をライセンスすることができ、競合他社は競合する製品や技術を販売する可能性があります。さらに、そのような特許を第三者に対して行使するために、そのような特許の共同所有者の協力が必要な場合がありますが、そのような協力は私たちに提供されない場合があります。製品候補に関して当社が保有する特許出願によって提供される保護の幅または強度が脅かされると、企業は当社と協力して製品候補を開発することを思いとどまらせ、当社の製品化能力を脅かす可能性があります。さらに、新製品候補の開発、テスト、規制審査が遅れた場合、特許保護下で製品候補を販売できる期間が短縮されます。
米国およびその他の国での特許出願は、出願後しばらくの間機密扱いとなるため、当社の製品候補に関連する特許出願を過去に、または将来最初に提出する予定であるかどうかは定かではありません。さらに、米国での特許出願の中には、特許が発行されるまで秘密にされるものがあります。その結果、特許請求の有効性や法的強制力に影響を与える可能性のある、私たちが知らない先行技術が存在する可能性があり、優先権紛争の対象となる可能性があります。特定の特許の期間の一部または全部、または特定の特許出願の期間全体を否認するよう求められる場合があります。特許請求の有効性や法的強制力に影響を与える可能性のある、私たちが知らない先行技術があるかもしれません。また、当社が認識していても、請求の有効性や法的強制力には影響しないと考えられる先行技術があり、それが最終的に請求の有効性や法的強制力に影響を与えることが判明する場合もあります。異議を申し立てられた場合、裁判所、特許庁、その他の政府機関によって当社の特許が有効または執行可能であると宣言されること、または有効かつ執行可能であることが判明したとしても、競合他社の技術または製品が当社の特許を侵害していると裁判所によって認定されるという保証はありません。私たちは、私たちの活動に関連すると考える競合他社の特許または特許出願を分析し、製品候補に関しては自由に活動できると考えることがありますが、競合他社は、私たちの取り組みを妨げたり、製品候補や私たちの活動がそのような主張を侵害したりする可能性のある、無関係であると考える特許を含む発行済みの請求を行うことがあります。競合他社が、当社と同様の製品や技術を対象に、特許を出願している可能性があり、将来出願する可能性もあります。これらの特許出願は、当社が所有またはライセンスしている特許出願または特許よりも優先される場合があり、そのような技術を対象とする発行済み特許の権利を取得する必要がある場合があります。また、他社が、当社の特許やその他の知的財産権を侵害しない、当社の製品候補と同じ効果を持つ製品を独自に開発したり、製品候補を対象として当社が発行した特許の主張を中心に設計したりする可能性もあります。
同様に、現在所有およびライセンスされている特許、および特許として発行された場合、当社の独自の技術と製品候補を対象とする特許出願は、特許期間の調整や延長の可能性を考慮せずに、2035年から2045年に失効すると予想されます。最初にライセンスされた特許は、最初の製品が米国または外国の法域での販売承認を得る前または直後に失効する可能性があります。さらに、USPTOまたは関連する外国の特許庁が、現在または将来、当社が所有またはライセンス中の出願中の特許出願を許可するとは保証できません。現在の特許の有効期限が切れると、他の人をこれらの発明の実践から除外する権利を失う可能性があります。これらの特許の有効期限が切れると、当社の事業、財務状況、経営成績、見通しに同様の重大な悪影響が及ぶ可能性があります。
50
法的手段では保護が限定的であり、当社の権利を適切に保護できなかったり、競争上の優位性を獲得または維持したりできない可能性があるため、当社の所有権が将来どの程度保護されるかは不明です。例えば:
上記のいずれも、当社の事業、財務状況、経営成績、および見通しに重大な悪影響を及ぼす可能性があります。
インライセンスを通じて主要技術の権利を取得するという私たちの戦略は成功しないかもしれません。
私たちは、TANGOによって規制が強化される可能性のある特定の遺伝子ターゲットに関連するものを含め、主要技術の権利をライセンスすることで、製品候補パイプラインの拡大を目指しています。私たちのビジネスの将来の成長は、追加の製品候補や技術の権利をインライセンスまたはその他の方法で取得できるかどうかに一部依存します。私たちは過去にサウサンプトン大学からの技術のライセンス供与に成功していますが、製品候補や技術について、許容できる条件で、またはまったく第三者から権利をインライセンスまたは取得できることを保証することはできません。
たとえば、特定の第三者研究パートナーとの契約では、私たちの関係の過程で生じた改善は、当社または第三者の研究パートナーのみが所有することも、当社と第三者が共同で所有することもできると規定しています。当社の新薬候補を商品化するため、または当社の競争上の優位性を維持するために、研究パートナーまたは私たちが協力している他の第三者のみが所有するそのような改良品の独占権が必要であると当社が判断した場合、その改良を使用して当社の開発、製造、またはマーケティングを継続するために、そのような第三者から独占ライセンスを取得する必要がある場合があります
51
医薬品候補者。そのようなライセンスを独占的に、商業的に合理的な条件で取得できない場合や、まったく取得できない場合があります。これにより、医薬品候補の商品化が妨げられたり、競合他社などが当社のビジネスにとって重要な技術にアクセスする機会が与えられたりする可能性があります。また、そのような知的財産を第三者に対して行使するために、私たちの知的財産の共同所有者の協力が必要な場合がありますが、そのような協力は私たちに提供されないかもしれません。
さらに、これらの技術のライセンス供与と買収は非常に競争の激しい分野であり、多くの確立された企業も、魅力的と思われる製品候補や技術をライセンスまたは買収するための戦略を追求しています。これらの確立された企業は、その規模、現金資源、および優れた臨床開発および商品化能力により、私たちよりも競争上の優位性を持っている可能性があります。さらに、私たちを競争相手と見なしている企業は、私たちに権利をライセンスすることを望まないかもしれません。さらに、私たちの重点分野内で適切な製品候補や技術を特定できない場合があります。適切な製品候補または技術に関する権利をうまく取得できない場合、当社の事業と見込み客は重大かつ悪影響を受ける可能性があります。
企業秘密の守秘を守ることができなければ、私たちのビジネスや競争上の地位が損なわれます。
特許保護に加えて、特に特許保護が適切または入手可能ではないと思われる場合は、ノウハウや企業秘密保護、従業員、コンサルタント、第三者との秘密保持契約や発明譲渡契約に基づいて、機密情報や専有情報を保護しています。
当社の従業員、コンサルタント、外部の科学協力者、委託研究者、その他のアドバイザーに、当社との雇用またはコンサルティング関係の開始時に秘密保持契約の締結を要求することが私たちの方針です。これらの契約は、特定の状況を除き、当事者が当社との関係の過程で個人または団体に開発または知らされた当社の事業または財務に関するすべての機密情報を秘密に保ち、第三者に開示しないことを規定しています。従業員の場合、契約では、個人が考案した発明、現在または計画されている事業や研究開発に関連する発明、または通常の勤務時間中に、当社の敷地内で、または当社の機器や専有情報を使用して作成されたすべての発明は、当社の独占的財産であると規定されています。コンサルタントやその他の第三者の場合、契約では、提供されるサービスに関連して考案されたすべての発明は当社の独占的財産であると規定されています。ただし、当社の企業秘密や独自の技術とプロセスにアクセスした、またはアクセスした可能性のある各当事者とそのような契約を締結したことを保証することはできません。また、企業秘密を保護するための方針を採用し、期待されることやベストプラクティスに関するアドバイスを提供する研修を実施しています。このような努力にもかかわらず、これらの当事者のいずれかが契約に違反し、当社の企業秘密を含む当社の専有情報を開示する可能性があり、そのような違反に対する適切な救済策を得ることができない場合があります。
契約上の措置に加えて、物理的および技術的なセキュリティ対策など、その他の適切な予防措置を通じて、専有情報の機密性を保護するよう努めています。しかし、企業秘密やノウハウを保護するのは難しい場合があります。これらの措置は、例えば、アクセスを許可された従業員または第三者による企業秘密の不正流用の場合、当社の機密情報を適切に保護しない可能性があります。当社のセキュリティ対策では、従業員やコンサルタントが当社の企業秘密を悪用して競合他社に提供することを防ぐことはできません。また、この種の不正行為に対して私たちが講じるいかなる手段も、当社の利益を完全に保護するための適切な救済策を提供できない場合があります。ある当事者が企業秘密を違法に開示または不正流用したという申し立てを執行することは、困難で費用がかかり、時間がかかり、結果は予測できません。さらに、企業秘密が他者によって独自に開発され、法的手段が取れなくなる可能性があります。営業秘密など、当社の機密情報または専有情報が開示または不正流用された場合、またはそれらの情報のいずれかが競合他社によって独自に開発された場合、当社の競争力が損なわれる可能性があります。
さらに、米国外の裁判所は、企業秘密を保護しようとはしない場合があります。第三者が私たちの企業秘密を使用することを阻止するために法廷に行くことを選択した場合、多額の費用が発生する可能性があります。たとえ私たちが成功したとしても、この種の訴訟は私たちの時間やその他のリソースを消費する可能性があります。私たちは専有情報と企業秘密を保護するための措置を講じていますが、第三者が独自に実質的に同等の専有情報や技術を開発したり、当社の企業秘密にアクセスしたり、当社の技術を開示したりすることがあります。その結果、企業秘密を有意義に保護できない可能性があります。上記のいずれも、当社の事業、財務状況、経営成績、および見通しに重大な悪影響を及ぼす可能性があります。
知的財産権の侵害に関する第三者からの申し立ては、当社の製品発見や開発努力を妨げたり、遅らせたり、その他の方法で妨げたりする可能性があります。
当社の商業的成功は、第三者の知的財産権や所有権を侵害、不正流用、またはその他の方法で侵害することなく、製品候補を開発、製造、マーケティング、販売し、独自の技術を使用できることに一部依存しています。バイオテクノロジーや製薬業界では、特許やその他の知的財産権に関する訴訟がかなり多く、特許に異議を申し立てるための行政手続き(干渉、派生、当事者間審査、付与後の審査、USPTOでの再審査手続き、または外国の法域における異議申立手続き、その他の同等の手続きを含む)があります。当社の製品候補および/または専有技術が知的財産権を侵害、不正使用、またはその他の方法で侵害しているとして、特許権またはその他の知的財産権を持つ第三者による訴訟にさらされたり、その脅威にさらされたりする可能性があります。私たちが製品候補を開発している分野には、Ionis Pharmaceuticalsなどの第三者が所有する米国および外国で発行された特許や出願中の特許が数多く存在します。バイオテクノロジーとして
52
製薬業界が拡大し、より多くの特許が発行されているため、当社の製品候補が他者の特許権を侵害する申し立てを引き起こすリスクが高まります。さらに、私たちを含む業界関係者にとって、どの特許がさまざまな種類の医薬品、製品、またはその使用方法や製造方法を対象としているかが必ずしも明確ではありません。したがって、私たちの分野では多数の特許が発行され、特許出願が提出されているため、第三者が当社の製品候補、技術、または方法に関する特許権を持っていると主張する可能性があります。
第三者から、当社が知的財産権を侵害、不正流用、またはその他の方法で侵害していると主張した場合、次のような多くの問題に直面する可能性があります。
競合他社の中には、はるかに多くのリソースを持っているため、複雑な特許訴訟の費用を私たちよりも効果的に支えられるものもあります。さらに、訴訟の開始と継続に起因する不確実性は、事業継続に必要な資金を調達する当社の能力に重大な悪影響を及ぼしたり、当社の事業、財務状況、経営成績、および見通しに重大な悪影響を及ぼす可能性があります。
第三者は、当社が許可なく独自の技術を使用していると主張することがあります。これには、当社に対して特許侵害訴訟を起こして当社に対して特許を行使することも含まれます。この点で、法律によって米国で発行された特許には有効性が推定されますが、「明確で説得力のある」証拠、つまり証明基準が強化された場合にのみ反論できます。
当社の製品候補の使用または製造に関連する材料、製剤、製造方法、または処理方法に関するクレームとして、当社が現在認識していない第三者の特許が存在する可能性があります。特許出願は発行までに何年もかかることがあるため、現在出願中の特許出願があり、後で当社の製品候補が侵害する可能性のある特許が発行される可能性があります。さらに、第三者が将来特許を取得し、当社の技術の使用がそれらの特許を侵害していると主張する可能性があります。
当社の製品候補の製造プロセス、製造プロセス中に使用または形成された材料、または最終製品自体を対象として、管轄裁判所によって第三者特許が保有されている場合、それらの特許の所有者は、当社が該当する特許に基づいてライセンスを取得しない限り、またはそれらの特許の有効期限が切れるか、それらの特許が最終的に無効または執行不能と判断されるまで、当社の製品候補の商品化を妨げる可能性があります。可能。同様に、当社の製剤、製造プロセス、使用方法(併用療法や患者選択方法を含む)の一部を対象として、管轄裁判所が第三者特許を保有している場合、その特許の保有者は、当社がライセンスを取得するか、そのような特許の有効期限が切れるか、最終的に無効または執行不能と判断されるまで、製品候補の開発と商品化を妨げる可能性があります。いずれの場合も、ライセンスは商業的に合理的な条件で入手できない場合や、まったく利用できない場合があります。特に、そのような特許が当社の主要な競合企業によって所有または管理されている場合はそうです。商業的に合理的な条件で第三者特許に必要なライセンスを取得できない場合、またはまったく取得できない場合、製品候補の商品化能力が損なわれたり遅れたりして、当社の事業に重大な損害を与える可能性があります。ライセンスを取得したとしても、それは非独占的である可能性があり、それによって競合他社は私たちにライセンスされているのと同じ技術にアクセスできます。さらに、当社の特許や特許出願による保護の幅広さや強さが脅かされると、企業は現在または将来の製品候補のライセンス、開発、または商品化のために私たちと協力することを思いとどまらせる可能性があります。
当社に対して請求を行う当事者は、差止命令またはその他の衡平法に基づく救済を求め、求めることができます。これにより、当社が製品候補をさらに開発および商品化する能力が事実上妨げられる可能性があります。これらの請求の弁護は、そのメリットにかかわらず、多額の訴訟費用がかかり、従業員の時間とリソースを当社の事業から大幅に転用することになります。当社に対する侵害の申し立てが成功した場合、故意の侵害に対する3倍の損害賠償や弁護士費用を含む多額の損害賠償の支払い、第三者からの1つ以上のライセンスの取得、ロイヤルティの支払い、または侵害製品の再設計が必要になる場合があります。これは不可能であるか、多額の時間と費用がかかる場合があります。この種のライセンスが利用できるかどうか、あるいは商業的に合理的な条件で利用できるかどうかは予測できません。さらに、訴訟がない場合でも、私たちは
53
研究を進めるため、または製品候補の商品化を可能にするために、第三者からライセンスを取得する必要がある場合がありますが、これらのライセンスのいずれも妥当な費用で、またはもしあれば、妥当な条件で取得できない場合があります。その場合、製品候補をこれ以上開発して商品化することができず、事業に重大な損害を与える可能性があります。
私たちは、自社またはライセンサーの特許を保護または執行するための訴訟に巻き込まれることがありますが、費用がかかり、時間がかかり、成功せず、そのような特許が執行不能または無効であることが判明する可能性があります。
競合他社は、当社の特許またはライセンサーの特許を侵害する可能性があります。侵害や不正使用に対抗するために、侵害請求を行う必要がある場合がありますが、これには費用と時間がかかります。さらに、侵害訴訟では、裁判所は、当社の特許の1つまたは複数が無効または法的強制力がないと判断したり、当社の特許が問題の技術を対象としていないという理由で、相手方による問題となっている技術の使用を停止することを拒否することがあります。
米国の特許訴訟では、無効および/または執行不能を主張する被告の反訴が一般的であり、第三者が特許の無効または執行不能を主張できる根拠は数多くあります。訴訟の範囲外であっても、第三者が米国または海外の行政機関に同様の請求を提起することもあります。これらの種類のメカニズムには、再審査、付与後の審査、当事者間審査、干渉手続き、導出手続き、および外国の法域における同等の手続き(異議申し立て手続きなど)が含まれます。このような手続きの結果、当社の特許が取り消されたり修正されたりして、当社の製品候補が対象ではなくなる可能性があります。無効と執行不能の法的主張を受けた後の特定の特許の結果は予測できません。たとえば、有効性の問題に関しては、私たち、当社の特許弁護士、および特許審査官が審査中に気づかなかった、無効となる先行技術がないかどうかは定かではありません。被告人が無効および/または執行不能の法的主張で勝訴した場合、またはそれ以外の方法で当社の権利を適切に保護できない場合、製品候補の特許保護の少なくとも一部、場合によっては全部を失うことになります。この種の請求の弁護は、そのメリットにかかわらず、多額の訴訟費用がかかり、従業員のリソースを当社の事業から大幅に転用することになります。
逆に、外国の法域における再審査、付与後の審査、当事者間審査、干渉手続き、導出手続き、および同等の手続き(異議申立手続など)においてUSPTOに特許請求の審査を依頼することで、第三者の米国特許における請求の特許性に異議を申し立てることもできますし、特許異議申立手続において第三者の特許に異議を申し立てることもできます欧州特許庁(「EPO」)または他の外国の特許庁。たとえ成功しても、これらの異議申し立て手続きには多額の費用がかかり、私たちの時間やその他のリソースを消費する可能性があります。USPTO、EPO、またはその他の特許庁で好ましい結果が得られなかった場合、当社の製品候補または専有技術によって特許が侵害されている可能性があるとして、第三者から訴訟を受ける可能性があります。
さらに、知的財産訴訟に関連して大量の証拠開示が必要なため、この種の訴訟中の開示により、一部の機密情報が侵害されるリスクがあります。さらに、聴聞会、動議、その他の暫定手続きや進展の結果が公表されることもあります。証券アナリストや投資家がこれらの結果を否定的に認識した場合、その認識は当社の普通株式の価格に重大な悪影響を及ぼす可能性があります。上記のいずれも、当社の事業財政状態、経営成績、および見通しに重大な悪影響を及ぼす可能性があります。
私たちの外国の知的財産権は限られており、世界中で私たちの知的財産権を保護できない場合があります。
私たちは、米国外では限られた知的財産権しか持っていません。世界中のすべての国で製品候補に関する特許の出願、出願、弁護には法外な費用がかかり、米国以外の一部の国における当社の知的財産権は米国ほど広範囲ではない場合があります。さらに、一部の外国の法律は、米国の連邦法や州法ほど知的財産権を保護していません。そのため、第三者が米国以外のすべての国で私たちの発明を実践したり、私たちの発明を使用して作られた製品を米国や他の法域で販売または輸入したりすることを防ぐことができない場合があります。競合他社は、当社が特許保護を受けていない法域で自社の製品を開発するために当社の技術を使用する可能性があります。さらに、特許保護は受けているが執行が米国ほど強力ではない地域に、その他の方法で侵害している製品を輸出する可能性があります。これらの製品は、当社が発行済みの特許を持たない法域では当社の製品候補と競合する可能性があり、当社の特許請求やその他の知的財産権が競合を妨げるほど有効または十分ではない場合があります。
多くの企業が、外国の法域における知的財産権の保護と擁護において重大な問題に直面しています。特定の国、特に特定の発展途上国の法制度は、特許、企業秘密、その他の知的財産保護、特にバイオ医薬品に関連する保護の執行を優先していません。そのため、一般的に当社の所有権を侵害して、特許を侵害したり、競合製品を第三者に対して販売したりすることを阻止することが困難になる可能性があります。外国の法域で当社の特許権の範囲または有効性に異議を申し立てるために第三者が訴訟を起こすと、多額の費用がかかり、私たちの努力と注意が事業の他の側面からそらされる可能性があります。外国の法域で当社の特許権を行使する手続きは、多額の費用がかかり、私たちの努力と注意を事業の他の側面からそらす可能性があります。また、当社の特許が無効になったり、狭義に解釈されたりするリスクにさらされたり、特許出願が発行されなかったり、第三者が当社に対して請求をしたりする可能性があります。私たちが提起する訴訟では勝訴できない場合があり、損害賠償やその他の救済措置があったとしても、商業的に意味がない場合があります。したがって、世界中で知的財産権を行使しようとする私たちの努力は、私たちが開発またはライセンスする知的財産から大きな商業的利益を得るには不十分かもしれません。
54
米国および海外における地政学的措置は、当社または現在または将来のライセンサーの特許出願の審査または維持、ならびに発行された特許または現在または将来のライセンサーの特許の維持、執行、または防御に関する不確実性とコストを増大させる可能性があります。たとえば、ロシアのウクライナ侵攻に関連する米国および外国政府の措置により、ロシアでの特許出願、出願、維持が制限されたり、妨げられたりする可能性があります。政府の措置により、ロシアで発行された特許の維持が妨げられる可能性もあります。これらの措置により、当社の特許または特許出願が放棄または失効し、ロシアにおける特許権の一部または全部が失われる可能性があります。さらに、2022年3月にロシア政府によって法令が採択されました。これにより、ロシアの企業や個人は、市民権または国籍を持っている、登録されている、または米国やその他の国で、ロシアが非友好的と見なした国で、または主に主要な事業所や営利活動を行っている特許権者が所有する発明を、同意や補償なしに利用することができます。その結果、第三者がロシアで私たちの発明を実践したり、私たちの発明を使用して作られた製品をロシア内外で販売または輸入したりすることを防ぐことはできません。同様に、イスラエルで進行中の紛争により、規制が遅れたり、知的財産の確保や当社製品の商品化ができなくなったりする可能性があります。したがって、当社の競争力が損なわれ、当社の事業、財政状態、経営成績、および見通しに悪影響が及ぶ可能性があります。
オープンソースソフトウェアを使用すると、製品候補を商品化する能力が制限される可能性があります。
私たちがオープンソースソフトウェアを使用していると、製品候補を商品化する能力が制限される可能性があります。私たちのテクノロジーは、オープンソースライセンスの下で第三者の作者から使用が許可されたモジュールを含むオープンソースソフトウェアを利用しています。特に、TANGOに搭載されているソフトウェアの中には、研究やその他の非営利目的での使用を許可するライセンス契約の下で提供されているものがあります。その結果、将来、市販の製品に関連してプラットフォームを使用しようとすると、そのソフトウェアを別のライセンス条件でライセンスする必要があるかもしれませんが、商業的に合理的な条件では不可能かもしれません。商用目的での使用を許可する条件でソフトウェアコンポーネントのライセンスを取得できない場合、それらのソフトウェアコンポーネントの交換を求められることがあります。その結果、遅延、追加費用、規制当局の承認が増える可能性があります。
オープンソースのライセンサーは通常、侵害の申し立てやソフトウェアコードの品質に関する保証やその他の契約上の保護を提供しないため、オープンソースソフトウェアの使用と配布は、サードパーティの商用ソフトウェアの使用と配布よりも大きなリスクを伴う可能性があります。一部のオープンソースライセンスには、使用するオープンソースソフトウェアの種類に基づいて作成する改変や派生品のソースコードを提供するという要件が含まれています。独自のソフトウェアを特定の方法でオープンソースソフトウェアと組み合わせると、特定のオープンソースライセンスの下で、独自のソフトウェアのソースコードを一般に公開することが義務付けられる可能性があります。これにより、競合他社がより少ない開発労力と時間で同様の製品を作成できるようになり、最終的には製品の売上が失われる可能性があります。私たちはオープンソースソフトウェアの使用状況を監視していますが、多くのオープンソースライセンスの条件は米国の裁判所で解釈されておらず、それらのライセンスが、製品候補の商品化に予期しない条件や制限を課すような方法で解釈されるリスクがあります。製品候補の提供を継続したり、製品候補を再設計したり、リエンジニアリングを適時に行えない場合に製品候補の販売を中止したりするために、第三者からライセンスを求める必要がある場合があります。これらのいずれかが当社の事業、財政状態、経営成績、および見通しに重大かつ悪影響を及ぼす可能性があります。
第三者は、当社の従業員やコンサルタントが機密情報を不当に使用または開示したり、企業秘密を不正に流用したと主張することがあります。
バイオテクノロジーや製薬業界でよくあることですが、私たちは競合他社や潜在的な競合他社を含め、大学や他のバイオ医薬品会社や製薬会社で以前に雇用されていた個人を雇用しています。現在、当社に対する不正流用または不適切な開示の申し立ては保留になっていません。また、当社の従業員やコンサルタントが業務において他者の専有情報やノウハウを使用しないように努めていますが、当社または当社の従業員、コンサルタント、または独立請負業者が、元雇用主またはその他の第三者の企業秘密やその他の機密情報を含む知的財産を不注意または方法で使用または開示したという申し立ての対象となる場合があります。。その後、これらの主張から身を守るために訴訟を起こす必要があるかもしれません。金銭的損害賠償に加えてこの種の請求を弁護しなかった場合、貴重な知的財産権や人員を失う可能性があります。この種の請求に対する防御に成功したとしても、知的財産請求に関連する訴訟やその他の法的手続きにより、多額の費用がかかり、技術および管理担当者が通常の責任から注意をそらす可能性があります。さらに、公聴会、動議、その他の暫定手続きや進展の結果が公表される可能性があり、証券アナリストや投資家がこれらの結果を否定的に認識した場合、その認識は当社の普通株式の価格に重大な悪影響を及ぼす可能性があります。この種の訴訟や手続きは、当社の営業損失を大幅に増加させ、開発活動に利用できるリソースを減らす可能性があります。また、この種の訴訟や手続きを適切に実施するための十分な財源やその他のリソースがない可能性があります。たとえば、競合他社の中には、財源が大幅に多いため、この種の訴訟や手続きの費用を私たちよりも効果的に支えられるものもあります。いずれにせよ、知的財産訴訟やその他の知的財産関連手続きの開始と継続から生じる不確実性は、市場での競争力に悪影響を及ぼす可能性があります。
買収やインライセンスでは、開発パイプラインの製品コンポーネントやプロセスに必要な権利を取得または維持できない場合があります。
当社の事業の成長は、第三者の所有権を取得、ライセンス供与、または使用する能力に一部依存する可能性があります。たとえば、当社の製品候補は、効果的かつ効率的に機能するために特定の製剤を必要とする場合や、当社の化合物と既存の医薬品化合物を含む製品候補を開発する場合や、FDAまたは同等の外国から要求される場合があります。
55
規制当局がコンパニオン診断テストまたは製品候補のテストを提供する場合、第三者が保有する知的財産を使用する権利を取得する必要がある場合があります。さらに、私たちが第三者と共同所有する可能性のある特許に関しては、そのような共同所有者にそのような特許の利害に関するライセンスが必要になる場合があります。事業運営に必要または重要であると判断した構成、使用方法、プロセス、またはその他の第三者の知的財産権を、第三者から取得したり、ライセンスしたりできない場合があります。さらに、これらのライセンスのいずれも、妥当な費用で、またはもしあったとしても、妥当な条件で取得できない場合があります。その場合、第三者の知的財産権の対象となる構成や方法の使用をやめる必要があるかもしれませんし、それらの知的財産権を侵害しない代替アプローチの開発を模索する必要があるかもしれません。たとえそのような代替案を開発できたとしても、それは実現不可能かもしれません。ライセンスを取得できたとしても、それは非独占的である可能性があります。つまり、競合他社も私たちにライセンスされているのと同じ技術にアクセスできる可能性があります。その場合、代替技術の開発やライセンス供与に多大な時間とリソースを費やす必要があるかもしれません。
さらに、学術機関との書面による契約に基づき、前臨床の研究開発を加速するために学術機関と協力することもあります。場合によっては、これらの機関は、協力によって生じた技術に関する機関の権利のいずれかに対するライセンスを交渉するオプションを私たちに提供します。そのような選択肢があっても、指定された期間内に、または私たちが受け入れられる条件の下で、機関からのライセンスを交渉できない場合があります。それができない場合、その機関は知的財産権を他者に提供する可能性があり、私たちのプログラムを実施する能力を妨げる可能性があります。
第三者の知的財産権のライセンスと取得は競争の激しい分野であり、私たちよりも実績のある企業やより多くのリソースを持っている企業が、製品候補を商品化するために必要または魅力的と思われる第三者の知的財産権をライセンスまたは取得する戦略を追求している場合もあります。より確立された企業は、その規模、現金資源、および優れた臨床開発および商品化能力により、私たちよりも競争上の優位性を持っている可能性があります。さらに、私たちを競争相手と見なしている企業は、私たちに権利を譲渡したり、ライセンスしたりすることを望まないかもしれません。この種の交渉を無事に完了し、最終的に開発または販売を検討している可能性のある追加の製品候補に関する知的財産の権利を取得できるという保証はありません。必要な第三者の知的財産に対する権利を正常に取得できない場合、または当社が持っている既存の知的財産権を維持できない場合、特定のプログラムの開発を中止せざるを得なくなり、事業の財政状態、経営成績、見通しが損なわれる可能性があります。
当社の特許保護の取得と維持は、政府特許機関が課すさまざまな手続き、書類提出、手数料の支払い、その他の要件の順守にかかっています。これらの要件に従わなかった場合、当社の特許保護が縮小または廃止される可能性があります。
発行された特許の定期的な維持費は、特許の存続期間中、いくつかの段階でUSPTOと外国の特許機関に支払われる予定です。USPTOやさまざまな外国の特許機関も、特許出願プロセス中や特許の発行後に、手続き上、書類上、手数料の支払いなど、多くの規定を遵守するよう求めています。不注意による失効は、多くの場合、延滞料の支払いまたは適用規則に従った他の手段によって是正できますが、違反すると特許または特許出願が放棄または失効し、関連する法域における特許権の一部または全部が失効することがあります。特許または特許出願の放棄または失効につながる可能性のある違反事象には、所定の期限内での公的措置への対応の不履行、手数料の未払い、正式な書類の適切な合法化と提出の失敗などが含まれますが、これらに限定されません。コンプライアンス違反が発生した場合、競合他社が市場に参入する可能性があり、それが当社の事業財政状態、経営成績、および見通しに重大な悪影響を及ぼす可能性があります。
米国および米国以外の法域における特許法の変更は、一般的に特許の価値を低下させ、製品候補を保護する当社の能力を損なう可能性があります。
他のバイオ医薬品企業と同様に、私たちの成功は知的財産、特に特許に大きく依存しています。バイオ医薬品業界で特許を取得して行使するには、技術と法的な複雑さの両方が伴うため、費用と時間がかかり、本質的に不確実です。
過去または将来の特許改革法により、当社の特許出願の審査および発行された特許の執行または防御をめぐる不確実性とコストが増大する可能性があります。たとえば、2013年3月、リーヒー・スミスアメリカ発明法(「アメリカ発明法」)に基づき、米国は「先発明」から「最初に出願する」特許制度に移行しました。「先出」制度の下では、特許性に関する他の要件が満たされていれば、通常、最初に特許を出願した発明者は、他の発明者が以前に発明を行ったかどうかにかかわらず、その発明に関する特許を受けることができます。アメリカ発明法には、特許出願の処理方法に影響する規定、先行技術を再定義する条項、新しい付与後の審査制度の確立など、米国特許法に対するその他の重要な変更が数多く含まれています。USPTOは米国発明法に関連する新しい規制や手続きを公布し続けており、「先申請」条項を含む特許法の実質的な変更の多くが2013年3月に発効したため、これらの変更の影響は現時点では不明です。さらに、裁判所はこれらの規定の多くをまだ扱っておらず、この出願書に記載されている特定の特許に関する法律と新しい規制の適用可能性はまだ決定されておらず、検討する必要があります。しかし、アメリカ発明法とその施行により、特許出願の審査や発行された特許の執行または抗弁をめぐる不確実性とコストが増大する可能性があります。
56
さらに、最近の米国最高裁判所の判決により、特定の状況で利用できる特許保護の範囲が狭まり、特定の状況における特許所有者の権利が弱まりました。将来の特許取得能力に関する不確実性が高まることに加えて、このような事象の組み合わせにより、いったん取得した特許の価値に関しても不確実性が生じています。米国議会、連邦裁判所、USPTOの決定によっては、特許を管理する法律や規制が予期せぬ形で変更され、新しい特許を取得したり、既存の特許や将来取得する可能性のある特許を行使したりする能力が損なわれる可能性があります。たとえば、分子病理学会対ミリアド・ジェネティクス社の訴訟では、米国最高裁判所は、DNA分子に関する特定の請求には特許性がないとの判決を下しました。この決定に基づいて当社が所有またはライセンスしている特許が無効になるとは考えていませんが、裁判所、米国議会、またはUSPTOによる将来の決定が当社の特許の価値にどのように影響するかを予測することはできません。他の法域の特許法における同様の不利な変更も、当社の事業、財政状態、経営成績、および見通しに重大な悪影響を及ぼす可能性があります。
さらに、2023年6月1日から、欧州での出願は、特許が付与された時点で、単一特許になり、統一特許裁判所(「UPC」)の管轄下となる単一特許になることができます。これはヨーロッパの特許実務における大きな変化です。UPCは新しい裁判所制度なので、裁判所には前例がなく、訴訟の不確実性が高まります。
特許条件は、製品候補に対する当社の競争力を十分な期間維持するには不十分かもしれません。
特許の寿命は限られています。米国では、すべての維持費が適時に支払われれば、特許の自然失効は通常、最も早い米国の非仮出願日から20年です。さまざまな延長が可能ですが、特許の存続期間とそれがもたらす保護には制限があります。私たちの製品候補を対象とする特許が取得されたとしても、特許の有効期限が切れると、ジェネリック医薬品を含む競合製品との競争にさらされる可能性があります。新製品候補の開発、テスト、規制審査に必要な時間を考えると、製品候補を保護する特許は、当社またはパートナーがそれらの候補を商品化する前または直後に失効する可能性があります。その結果、当社が所有しライセンスしている特許ポートフォリオでは、当社と類似または同一の製品の商品化から他者を除外するだけの十分な権利が得られない場合があります。
開発する可能性のある製品候補の特許期間延長を取得しない場合、当社の事業は重大な損害を受ける可能性があります。
当社が開発する可能性のある製品候補のFDAマーケティング承認のタイミング、期間、詳細によっては、1984年の医薬品価格競争および特許期間回復法(「ハッチ・ワックスマン改正」)に基づき、当社の米国特許の1つまたは複数が限定的な特許期間の延長の対象となる場合があります。ハッチ・ワックスマン改正では、FDAの規制審査プロセス中に失われた特許期間の補償として、最長5年間の特許延長期間が認められています。特許期間の延長は、製品の承認日から合計14年を超えて特許の残存期間を延長することはできません。延長できるのは製品ごとに1つの特許のみで、承認された医薬品、使用方法、または製造方法に関する請求のみを延長できます。ただし、特許期間の延長を求めた場合でも、試験段階または規制審査プロセス中にデューデリジェンスを行わなかった、適用期限内に申請しなかった場合、関連する特許の有効期限前に申請しなかった場合、またはその他の適用要件を満たさなかったなどの理由で、特許期間の延長が認められない場合があります。さらに、適用される期間または与えられる特許保護の範囲は、私たちが要求するよりも短い可能性があります。当社が特許期間の延長を得ることができない場合、またはそのような延長の期間が当社の要求よりも短い場合、競合他社は当社の特許満了後に競合製品の承認を得る可能性があり、当社の事業、財政状態、経営成績、および見通しは重大な損害を受ける可能性があります。
私たちはさまざまなプライバシーおよびデータセキュリティ法の対象となっており、それらを遵守しないと事業に損害を与える可能性があります。
私たちは、前臨床研究に関連して、機密のビジネス情報や患者の健康情報など、機密情報を大量に保持しており、そのような情報のプライバシーとセキュリティを管理する法律や規制の対象となっています。米国には、連邦および州の健康情報プライバシー法、連邦および州のセキュリティ違反通知法、連邦および州の消費者保護法など、個人情報の収集、使用、開示、保護を規定する連邦および州のプライバシーおよびデータセキュリティ法が数多くあります。これらの法律はそれぞれ解釈が異なり、常に進化しています。2018年5月、新しいプライバシー制度である一般データ保護規則(「GDPR」)が欧州経済領域(「EEA」)と英国で施行されました。GDPRは、ヨーロッパおよび英国の人々の個人データの収集、使用、開示、移転、またはその他の処理を規定しています。GDPRは、英国のEU離脱後にいくつかの改正が行われたものの、英国の法律の一部であり続けています(「英国のGDPR」)。ただし、将来的には相違が生じ、全体的なデータ保護コンプライアンスコストが増加する可能性があります。とりわけ、GDPRと英国のGDPRは、個人データのセキュリティと管轄国のデータ処理当局へのデータ処理義務の通知に関する新しい要件を課し、個人データを処理できる法的根拠を変更し、個人データの定義を拡大し、インフォームドコンセントの慣行の変更、および臨床試験被験者と研究者へのより詳細な通知を要求しています。さらに、GDPRと英国のGDPRにより、欧州経済領域(EEA)および英国にある臨床試験施設から、欧州委員会または英国が「適切な」データ保護法があるとは認めていない米国およびその他の管轄区域への個人データの転送に対する監視が強化され、違反や違反に対して多額の罰金が科せられます(最大2,000万ユーロまたは当社の連結年間世界総収益の 4% のいずれか大きい方)。GDPRと英国のGDPRはまた、データ主体と消費者団体に、監督当局に苦情を申し立てたり、司法上の救済を求めたり、GDPRまたは英国のGDPRの違反に起因する損害賠償を求めたりするための私的行動権を付与しています。
最近では、SECは企業にデータセキュリティ違反に関する開示またはその他の通知を義務付ける規制を制定しました。たとえば、SECは最近、サイバーセキュリティリスク管理および開示規則を採用しました。この規則では、サイバーセキュリティインシデントとサイバーセキュリティリスク管理、戦略、ガバナンスに関する情報の開示が義務付けられています。これらおよびその他の適用されるプライバシーおよびデータセキュリティに関する法律や規制の遵守は厳格で時間がかかります
57
プロセス、そして新しいデータ保護規則の遵守を保証する追加のメカニズムの導入を求められる場合があります。そのような法律や規制に従わなかった場合、当社の事業、財政状態、経営成績に悪影響を及ぼす可能性のある多額の罰金や罰則が科せられる可能性があります。これらおよびその他の適用されるプライバシーおよびデータセキュリティに関する法律や規制の遵守は、厳格で時間のかかるプロセスであり、新しいデータ保護規則の遵守を保証する追加のメカニズムの導入が必要になる場合があります。そのような法律や規制に従わなかった場合、当社の事業、財政状態、経営成績に悪影響を及ぼす可能性のある多額の罰金や罰則が科せられる可能性があります。
従業員問題、成長管理、および当社の事業に関連するその他のリスクに関連するリスク
私たちは開発と規制の能力を拡大することを期待しており、その結果、成長の管理が困難になり、事業が混乱する可能性があります。
特に製品候補の開発と臨床試験の実施能力の向上の分野で、従業員数と事業範囲が大幅に拡大すると予想しています。予想される将来の成長を管理するには、管理、運用、財務システムの導入と改善を続け、施設を拡張し、有能な人材をさらに採用して訓練し続ける必要があります。私たちの財源は限られており、このような成長が見込まれる企業を管理する上での経営陣の経験も限られているため、事業の拡大を効果的に管理したり、資格のある人材を追加で採用・訓練したりできない場合があります。事業の拡大は多額の費用につながり、経営資源や事業開発資源を流用する可能性があります。成長を管理できないと、事業計画の実施が遅れたり、事業が中断されたりする可能性があります。
成功するには、高度なスキルを持つ従業員を引き付けて維持する必要があります。
成功するためには、有能な臨床、科学、技術、管理職の人材を採用し、維持し、管理し、やる気を起こさせる必要があり、経験豊富な人材をめぐる激しい競争に直面しています。特に管理職レベルで有能な人材を引き付けて維持することに成功しなければ、事業計画の実行能力に悪影響を及ぼし、業績に悪影響を及ぼし、STK-001、STK-002、および将来の製品候補の商品化を成功させる能力を高める可能性があります。特に、私たちの将来の成功は、最高経営責任者のエドワード・M・ケイを含む上級管理職や、上級科学者や上級管理職チームの他のメンバーの貢献に大きく依存していると考えています。私たちと随意雇用契約を結んでいるこれらの個人のうちの1人以上がサービスを失うと、当社の製品パイプラインの成功、計画されている臨床試験の完了、または承認されれば製品候補の商品化が遅れたり、妨げられたりする可能性があります。バイオテクノロジー分野の有能な人材をめぐる競争は激しく、その結果、事業の発展に必要な有能な人材を引き続き引き付けて維持したり、適切な代替人材を採用したりできない場合があります。
有能な人材を求めて競争している他のバイオテクノロジー企業の多くは、私たちよりも財源やその他のリソースが豊富で、リスクプロファイルが異なり、業界で長い歴史を持っています。彼らはまた、より多様な機会とキャリアアップのより良い機会を提供するかもしれません。これらの特徴の中には、質の高い候補者にとって、私たちが提供しているものよりも魅力的なものもあります。質の高い人材を引き付けて維持し続けることができなければ、製品候補や事業を発見して開発できる速度と成功率は制限されます。
将来の買収や戦略的提携は、当社の事業を混乱させ、財政状態や経営成績に害を及ぼす可能性があります。
他の事業や医薬品を買収したり、戦略的提携を結んだり、既存の事業を補完または強化すると考えている第三者と合弁事業を設立したりすることがあります。有望な市場や技術を持つ事業を買収しても、既存の事業や企業文化とうまく統合できなければ、買収のメリットを実感できない可能性があります。戦略的提携または買収による新薬の開発、製造、販売において、期待される利益の実現や事業の強化が遅れたり、妨げられたりする多くの困難に遭遇する可能性があります。このような買収後、取引を正当化するために期待される相乗効果が得られることを保証することはできません。買収に関連して私たちが直面するリスクには、次のものがあります。
58
これらのリスクや、過去または将来の買収や戦略的提携に関連して遭遇するその他の問題に対処できなかった場合、これらの取引から期待される利益を実現できず、予期せぬ責任を負い、事業全体に損害を与える可能性があります。また、将来の買収により、負債、偶発負債、償却費用、または営業費用の増加が発生するリスクもあり、いずれも当社の財政状態や経営成績に悪影響を及ぼす可能性があります。
環境、健康、安全に関する法律や規制を遵守しないと、罰金や罰則の対象になったり、事業に悪影響を及ぼす可能性のある費用が発生したりする可能性があります。
私たちは、実験手順や有害物質や廃棄物の取り扱い、使用、保管、処理、廃棄に適用されるものを含め、環境、健康、安全に関する多くの法律や規制の対象となります。私たちの事業には、化学物質や生物学的物質を含む、危険で引火しやすい物質の使用が含まれます。私たちの事業では、有害廃棄物が発生する可能性もあります。通常、これらの材料や廃棄物の処分については、第三者と契約を結ぶ予定です。これらの材料による汚染や怪我のリスクを排除することはできません。当社による有害物質の使用に起因する汚染または傷害が発生した場合、その結果生じた損害に対して当社が責任を負う可能性があり、いかなる責任も当社の責任範囲を超える可能性があります。また、そのような法律や規制に従わなかった場合、民事または刑事上の罰金や罰則に関連して多額の費用が発生する可能性もあります。
私たちは、危険物の使用による従業員の傷害により発生する可能性のある費用と費用をカバーするために労働者災害補償保険に加入していますが、この保険は潜在的な責任に対して十分な補償を提供しない場合があります。
さらに、現在または将来の環境、健康、安全に関する法律や規制を遵守するために、多額の費用が発生する可能性があります。これらの現在または将来の法律や規制は、私たちの研究、開発、または生産活動を損なう可能性があります。これらの法律や規制を遵守しなかった場合、多額の罰金、罰則、その他の制裁措置が科せられる可能性もあります。
不利な世界経済状況は、当社の事業、財政状態、株価、経営成績に悪影響を及ぼす可能性があります。
当社の経営成績は、世界経済および世界の金融市場の一般的な状況によって悪影響を受ける可能性があります。たとえば、2008年の世界的な金融危機は、資本市場と信用市場に極端なボラティリティと混乱をもたらしました。同様に、世界経済は変動する金利とインフレ、そして景気後退やさらなる景気後退の可能性の影響を受けています。さらに、噂や実際の流動性に関する出来事など、金融機関に影響を及ぼす不利な展開は、過去にも将来も市場全体の流動性問題を引き起こす可能性があります。たとえば、2023年3月10日、当社の銀行パートナーの1つであるシリコンバレー銀行(「SVB」)は、カリフォルニア州金融保護イノベーション局により閉鎖され、連邦預金保険公社(「FDIC」)が受取人として指定されました。SVBに直接預ける現金はごくわずかで、その日以降、FDICはSVBの預金者は全員全額出資すると述べていますが、将来銀行が閉鎖された場合に連邦政府がすべての預金者を保証するという保証はありません。また、銀行システムの不安定さが続くと、当社の事業と財政状態に悪影響を及ぼす可能性があります。同様に、資本市場と信用市場は、イスラエルとウクライナで進行中の紛争、より広範な中東、ヨーロッパ、または世界的な紛争の可能性、それに対応して課せられる世界的な制裁、エネルギー危機、潜在的な景気後退によって悪影響を受ける可能性があります。景気が低迷したり衰退したりすると、サプライヤーに負担がかかり、供給が途絶したり、お客様が当社のサービスの支払いを遅らせたりする可能性もあります。現在の株式市場やクレジット市場が悪化すると、必要なデットファイナンスやエクイティファイナンスがより困難になり、費用がかかり、希薄化が進む可能性があります。必要な資金を適時かつ有利な条件で確保できなかった場合、当社の成長戦略、財務実績、株価に重大な悪影響を及ぼし、臨床開発計画を延期または中止せざるを得なくなる可能性があります。さらに、現在のサービスプロバイダー、メーカー、その他のパートナーの1つまたは複数が、このような困難な経済状況を乗り切ることができず、スケジュールと予算内で事業目標を達成する能力に直接影響する可能性があります。また、病院やその他の医療施設は、労使関係の有無にかかわらず、人員不足に直面しています。これにより、登録、施設訪問、評価、または研究開発活動にとって重要なその他の活動が遅れる可能性があります。上記のいずれも当社の事業に害を及ぼす可能性があり、現在の経済情勢と金融市場の状況が当社の事業に悪影響を与える可能性があるすべての方法を予測することはできません。さらに、株式市場のボラティリティと一般的な景気後退により、株価が下落する可能性があります。
私たちまたは私たちが頼りにしている第三者は自然災害によって悪影響を受ける可能性があり、私たちの事業継続計画と災害復旧計画では深刻な災害から私たちを適切に保護できない可能性があります。
自然災害は、当社の事業に深刻な混乱をもたらし、当社の事業、経営成績、財政状態、および見通しに重大な悪影響を及ぼす可能性があります。自然災害、火災、ハリケーン、停電、その他の出来事により、本社の全部または大部分を使用できなくなったり、サプライヤーの製造施設などの重要なインフラストラクチャが損傷したり、その他の理由で業務が中断されたりした場合、かなりの期間事業を継続することが困難になるか、場合によっては不可能になる可能性があります。
59
私たちが実施している災害復旧計画と事業継続計画は、重大な災害などが発生した場合には不十分であることが判明する可能性があります。当社の災害復旧計画と事業継続計画は限定的であるため、多額の費用が発生する可能性があり、事業に重大な悪影響を及ぼす可能性があります。
社内のコンピューターや情報システム、またはCRO、CMO、その他の請負業者やコンサルタントが使用しているシステムでは、障害が発生したり、セキュリティ違反が発生したりして、開発プログラムが重大な混乱を招く可能性があります。
適切なセキュリティ対策を講じていても、社内のコンピューターや情報システム、および現在および将来のCRO、CMO、その他の請負業者やコンサルタントのコンピューターや情報システムは、コンピューターウイルス、不正アクセス、自然災害、テロ、戦争、通信、電気障害による被害を受けやすくなる可能性があります。このような重大なシステム障害や事故は経験しておらず、セキュリティ違反もこれまで認識していませんが、そのような事態が発生して当社の事業が中断された場合、企業秘密やその他の専有情報の紛失、またはその他の同様の中断により、開発プログラムや事業運営に重大な混乱が生じる可能性があります。たとえば、完了した、または将来の前臨床試験や臨床試験のデータが失われると、規制当局の承認作業が大幅に遅れ、データを回復または再現するためのコストが大幅に増加する可能性があります。中断やセキュリティ違反により、当社のデータやアプリケーションが失われたり損傷したり、機密情報や専有情報が不適切な開示になったりした場合、当社は責任を負い、競争力が損なわれ、製品候補のさらなる開発と商品化が大幅に遅れる可能性があります。
当社の技術システムが故障または違反した場合、当社が責任を負ったり、事業運営が中断されたりする可能性があります。
私たちの事業運営は、ますますテクノロジーシステムとデータに依存するようになっています。特に、COVID-19のパンデミックにより、リモートで働く従業員の普及率を高めるなど、ビジネス慣行を変更しました。その結果、私たちは事業運営をテクノロジーシステムにますます依存するようになり、ビジネスを効果的に管理する能力は、サービスとしてのソフトウェア(SaaS)、サービスとしてのプラットフォーム(PaaS)、サービスとしてのプラットフォーム(PaaS)、サービスとしてのインフラストラクチャ(IaaS)などのクラウドテクノロジーの使用を含む、テクノロジーシステムとデータのセキュリティ、信頼性、および妥当性にかかっています。私たちが利用しているクラウド技術を含む当社の技術システムの故障、侵入、破損、破壊、破壊、侵害、および/または当社のデータや情報への不正アクセスは、当社が責任を負ったり、事業運営に悪影響を及ぼしたりする可能性があります。私たちが利用しているクラウド技術を含む私たちの技術システムは、ますます多様で複雑になり、故障、悪意のある侵入、ランダム攻撃に対して潜在的に脆弱になっています。同様に、当社が利用するクラウド技術を含む当社の技術システムへのアクセスを許可された個人によるデータプライバシーまたはセキュリティ侵害は、当社、当社の患者、その他のビジネスパートナーの知的財産、企業秘密、個人情報を含む機密データが、権限のない人物や一般に公開されるリスクがあります。
サイバー攻撃やその他のサイバーセキュリティインシデントは、その頻度、巧妙さ、激しさが増しており、検出がますます困難になっています。多くの場合、国家、組織犯罪グループ、「ハクティビスト」、悪意のある従業員や請負業者など、やる気があり、リソースが豊富で、熟練した、粘り強いアクターによって実行されます。サイバー攻撃には、有害なマルウェアやキーロガーの展開、ランサムウェア、サービス拒否攻撃、悪意のあるWebサイト、ソーシャルエンジニアリングなど、テクノロジーシステムやデータの機密性、完全性、可用性に影響を及ぼす手段が含まれます。サイバー攻撃にはサプライチェーン攻撃も含まれる可能性があり、これにより、当社の製品や委託製造用に製造された製品の製造が遅れる可能性があります。私たちの主要なビジネスパートナーも同様のリスクに直面しており、システムのセキュリティ侵害は当社のセキュリティ体制に悪影響を及ぼす可能性があります。サイバー攻撃には、敵対的な外国政府による不正行為、産業スパイ、振り込め詐欺、その他の形態のサイバー詐欺、有害なマルウェアの展開、サービス拒否、ソーシャルエンジニアリング詐欺、またはデータの機密性、完全性、可用性を脅かすその他の手段が含まれます。サイバー攻撃が成功すると、業務の中断、財務情報を含む機密のビジネス情報の不正流用、企業秘密、財務損失、企業戦略計画の開示など、当社に深刻な悪影響をもたらす可能性があります。現在まで、データや情報システムに重大な侵害は発生していません。しかし、私たちは情報システムを保護するためにリソースを費やしていますが、サイバー攻撃は脅威であることを認識しており、私たちの取り組みが、私たちにビジネス、法的、財政的、または評判上の損害をもたらしたり、当社の経営成績や財政状態に重大な悪影響を及ぼしたりする情報セキュリティ違反を防ぐという保証はありません。
さらに、CRO、CMO、その他の請負業者、コンサルタント、法律事務所、会計事務所など、私たちが頼りにしているさまざまな第三者のコンピューターシステムは、コンピューターウイルス、不正アクセス、データ侵害、フィッシング攻撃、サイバー犯罪者、自然災害(ハリケーンや地震を含む)、テロ、戦争、通信、電気障害による被害を受ける可能性があります。私たちは、効果的なセキュリティ対策を実施し、そのような障害、欠陥、または違反を特定して修正するために、サードパーティのプロバイダーに頼っています。
さらに、クラウドテクノロジーやリモートワークの取り決めの使用が増えると、これらおよびその他の運用上のリスクが高まる可能性があります。クラウドテクノロジーサービスプロバイダーがシステムを適切に保護し、サイバー攻撃を防止しないと、業務が中断され、機密情報や専有情報の不正流用、破損、損失が発生する可能性があります。適切なセキュリティ対策が講じられているにもかかわらず、社内のコンピューターや情報システム、および現在および将来のCRO、CMO、その他の請負業者やコンサルタントのコンピューターや情報システムは、コンピューターウイルス、不正アクセス、自然災害による被害を受けやすくなる可能性があります。
60
テロ、戦争、通信、電気障害。このような重大なシステム障害や事故は経験しておらず、セキュリティ違反もこれまで認識していませんが、そのような事態が発生して当社の事業が中断された場合、企業秘密やその他の専有情報の紛失、またはその他の同様の中断により、開発プログラムや事業運営に重大な混乱が生じる可能性があります。たとえば、完了した、または将来の前臨床試験や臨床試験のデータが失われると、規制当局の承認作業が大幅に遅れ、データを回復または再現するためのコストが大幅に増加する可能性があります。中断やセキュリティ違反により、当社のデータやアプリケーションが失われたり損傷したり、機密情報や専有情報が不適切な開示になったりした場合、当社は責任を負い、競争力が損なわれ、製品候補のさらなる開発と商品化が大幅に遅れる可能性があります。事業継続計画を含め、システムとインフラストラクチャの構築と改善を続けていますが、当社の事業や運営に悪影響を及ぼしたり、重要または機密情報を失ったりして、財務、法律、ビジネス、業務上、業務上、評判に損害を与えたり、競争上の優位性を失ったりする可能性のあるシステムの故障や侵害を防ぐという保証はありません。さらに、当社の賠償責任保険は、セキュリティ侵害、サイバー攻撃、その他の関連する違反に関連する請求に対する補償には、種類や金額が十分ではない場合があります。
当社の従業員、主任研究員、CRO、CMO、コンサルタントは、規制基準や要件の違反、インサイダー取引など、不正行為やその他の不適切な活動に従事する可能性があります。
私たちは、従業員、主任研究員、コンサルタント、および商業パートナーによる詐欺やその他の不正行為のリスクにさらされています。これらの関係者による不正行為には、意図的にFDAや米国以外の規制当局の規制を遵守しなかったり、FDAや米国以外の規制当局に正確な情報を提供したり、米国および海外の医療詐欺や虐待に関する法律や規制を遵守したり、財務情報やデータを正確に報告したり、不正行為を当社に開示したりすることが含まれます。特に、ヘルスケア業界における販売、マーケティング、および事業上の取り決めは、詐欺、不正行為、キックバック、自己取引、その他の虐待行為を防止することを目的とした広範な法律や規制の対象となります。これらの法律や規制は、価格設定、割引、マーケティングとプロモーション、販売手数料、顧客インセンティブプログラム、その他のビジネス上の取り決めを幅広く制限または禁止する場合があります。このような不正行為には、臨床研究の過程で得られた情報の不適切な使用も含まれる可能性があり、規制上の制裁措置が取られ、当社の評判に重大な損害を与える可能性があります。私たちはすべての従業員に適用される行動規範を採用していますが、従業員の不正行為を特定して阻止することが常に可能であるとは限りません。このような行為を検出して防止するために講じた予防措置は、未知または管理されていないリスクや損失を管理したり、これらの法律や規制に従わなかったことに起因する政府の調査やその他の行動や訴訟から私たちを保護したりするのに効果的ではない場合があります。そのような措置が当社に対して行われ、当社が自社の防衛や権利の主張に成功しなかった場合、それらの措置は、多額の罰金やその他の制裁措置など、当社の事業に重大な影響を与える可能性があります。
当社の事業には製造物責任に関する重大なリスクが伴い、十分な保険に加入できるかどうかは、当社の事業、財務状況、経営成績、および見通しに重大な悪影響を及ぼす可能性があります。
STK-001、STK-002、および将来の製品候補の臨床試験における試験に関連して、製造物責任にさらされるという固有のリスクに直面します。また、製品候補のいずれかを商品化すると、さらに大きなリスクに直面することになります。製品候補が傷害を引き起こしたという申し立てから身を守ることができない場合、多額の責任を負う可能性があります。メリットや最終的な結果にかかわらず、賠償請求は次のような結果になる可能性があります。
現在、当社の開発段階に適していると思われる製造物賠償責任保険に加入していますが、臨床開発またはSTK-001、STK-002、または将来の製品候補の販売の前に、より高いレベルを取得する必要があるかもしれません。私たちが加入している、または取得する可能性のある保険は、潜在的な負債に対して十分な補償を提供しない場合があります。さらに、臨床試験と製造物責任保険はますます高価になっています。その結果、当社の事業、財政状態、経営成績、および見通しに重大な悪影響を及ぼす可能性のある製造物責任請求によって生じる損失から当社を保護するために、妥当な費用で十分な保険に加入できない場合があります。
61
当社の普通株式の所有権に関連するリスク
当社の株式の市場価格は変動しやすく、投資の全部または一部を失う可能性があります。
当社の普通株式の取引価格は非常に変動しやすく、さまざまな要因に応じて大きく変動する可能性があり、その中には制御できないものもあります。当社の普通株式の市場価格は、このセクションやこのレポートの他の部分に記載されているその他のリスクや、以下を含む多くの要因の影響を受ける可能性があります。
62
さらに、株式市場全般、特に医薬品、バイオ医薬品、バイオテクノロジー株の市場では、一般的な経済状況の結果を含め、発行体の業績とは無関係または不釣り合いなことが多く、価格や出来高が極端に変動しています。これらの幅広い市場および業界の要因は、実際の業績に関係なく、当社の普通株式の市場価格に深刻な打撃を与える可能性があります。上記のリスクのいずれか、またはこの「リスク要因」のセクションに記載されているものを含む、その他の幅広いリスクのいずれかが実現すると、当社の普通株式の市場価格に劇的かつ悪影響を及ぼす可能性があります。
当社の主要株主は当社の株式のかなりの割合を所有しており、株主の承認を条件とする事項を大幅に管理することができます。
2024年3月31日現在、スコルピオストラストと提携している事業体は、当社の普通株式のすべての発行済み株式の議決権の31.06%を有益所有しています。その結果、これらの事業体は、取締役の選出、組織文書の修正、合併、当社資産の全部または実質的全部の合併、統合、売却、その他の重要な企業取引など、株主の承認を必要とする企業行動の結果に大きな影響を及ぼします。そのような団体の利益は、あなたの利益と同じではないかもしれませんし、矛盾することさえあります。たとえば、これらの事業体は、当社の支配権の変更が他の株主に利益をもたらす場合でも、当社の支配権の変更を遅らせたり妨げたりする可能性があります。これにより、株主は当社または当社の資産の売却の一環として普通株式のプレミアムを受け取る機会を奪われ、当社の普通株式の実勢市場価格に影響を与える可能性があります。
さらに、スコルピオス・トラストは、以前は当社の普通株式の議決権の過半数を支配していたアップル・ツリー・パートナーズから株式を受け取りました。取締役会会長のセス・L・ハリソンは、アップル・ツリー・パートナーズのマネージング・パートナーを務めています。
証券アナリストや業界アナリストが当社の事業に関する調査やレポートを発表しない場合、または当社の株式に関して否定的または誤解を招くような意見を述べると、当社の株価と取引量が下落する可能性があります。
当社の普通株式の取引市場は、業界アナリストや証券アナリストが当社や当社の事業について発表する調査やレポートの影響を受けます。私たちは、アナリスト、または彼らのレポートに含まれる内容や意見を一切管理できません。私たちを担当するアナリストの誰かが、当社、私たちのビジネスモデル、知的財産、または株式パフォーマンスについて否定的または誤解を招くような意見を出した場合、または私たちの前臨床研究、臨床試験、および経営成績がアナリストの期待に応えられなかった場合、当社の株価は下落する可能性があります。そのようなアナリストの1人以上が当社の取材をやめたり、定期的にレポートを公開しなかったりすると、金融市場での可視性が失われ、ひいては株価や取引量が減少する可能性があります。
私たちは「新興成長企業」であり、「小規模な報告会社」であり、新興成長企業または小規模報告企業に適用される報告要件の緩和により、当社の普通株式が投資家にとって魅力的でなくなるかどうかは定かではありません。
私たちは、2012年のJumpstart Our Business Startups法(「JOBS法」)で定義されている「新興成長企業」です。当社が新興成長企業であり続ける限り、新興成長企業ではない他の公開企業に適用されるさまざまな報告要件の免除を利用できます。これには、(i) 改正された2002年のサーベンス・オクスリー法(「サーベンス・オクスリー法」)の第404条の監査人認証要件を遵守する必要がないこと、(ii)経営者に関する開示義務の軽減などが含まれます。定期報告書と委任勧誘状における報酬、および(iii)保有要件の免除役員報酬に関する拘束力のない諮問株主の投票、および以前に承認されていないゴールデンパラシュート支払いに対する株主の承認。
私たちは、(i) 年間総売上高が12億3500万ドル以上の会計年度の最終日、または (b) 当社が大規模な加速申告者とみなされる会計年度の最終日、つまり非関連会社が保有する当社の普通株式の時価が、前の6月30日の時点で7億ドルを超える日付まで、新興成長企業であり続けます。これについて、過去3年間と(iii)2024年12月31日に、10億ドルを超える非転換社債を発行しました。IPO完了から5周年に続く会計年度の最終日である2024年12月31日をもって、新興成長企業ではなくなると予想しています。
雇用法の下では、新興成長企業は、新しい会計基準や改訂された会計基準の採用を、それらの基準が民間企業に適用されるまで延期することもできます。この延長された移行期間のメリットを活用することを選択しました。したがって、当社の連結財務諸表は、そのような新規または改訂された会計基準に準拠している企業の連結財務諸表と比較できない場合があります。当社の連結財務諸表に適用され、公開企業と非公開企業で発効日が異なる、新規または改訂された会計基準が発行された場合、当社が「新興成長企業」ではなくなるまで、または証券法のセクション7(a)(2)(B)で規定されている免除から肯定的かつ取り返しのつかない形でオプトアウトする日まで、新興成長企業以外の成長企業で採用が必要な日付を開示します。最近発行された会計基準を採用する日付。
また、私たちは「小規模な報告会社」でもあります。つまり、直近の会計年度では、非関連会社が保有する株式の市場価値は7億ドル未満で、年間収益は1億ドル未満でした。(i)非関連会社が保有する当社の株式の市場価値が2億5,000万ドル未満であるか、(ii)直近の会計年度における年間収益が1億ドル未満で、保有する株式の市場価値がある限り、私たちは小規模な報告会社であり続けることができます
63
非アフィリエイトによる場合は、7億ドル未満です。新興成長企業ではなくなった時点で私たちが小規模な報告会社だった場合、小規模な報告会社が利用できる特定の開示要件の免除を引き続き頼りにする可能性があります。具体的には、小規模な報告会社として、Form 10-Kの年次報告書には、監査済み財務諸表の直近2会計年度のみを表示することを選択できます。新興成長企業と同様に、小規模な報告会社は役員報酬に関する開示義務を軽減しています。これらの免除に頼っている可能性があるため、投資家が当社の普通株の魅力を低下させるかどうかは予測できません。その結果、一部の投資家が当社の普通株の魅力が薄れていると感じる場合、当社の普通株式の取引市場はあまり活発ではなく、当社の株価はより変動しやすくなる可能性があります。
当社の憲章文書およびデラウェア州法に基づく買収禁止条項により、株主にとって有益な当社の買収がより困難になり、株主による現在の経営陣の交代または解任の試みが妨げられる可能性があります。
当社の改訂された法人設立証明書および改訂された付則には、当社の支配権の変更を遅らせたり妨げたりする可能性のある条項が含まれています。これらの規定により、株主が現在の取締役会のメンバーによって指名されていない取締役を選出したり、経営陣の変更を含むその他の企業行動を取ることが困難になる可能性もあります。これらの規定:
当社の改訂された設立証明書にある独占法廷規定により、株主が当社または当社の取締役、役員、その他の従業員との紛争に有利であると判断した司法裁判所に請求を提出することが制限される可能性があり、そのような請求に関する訴訟を思いとどまらせる可能性があります。
当社の改訂された法人設立証明書は、法律で認められる最大限の範囲で、デラウェア州チャンスリー裁判所が、当社に代わって提起されたデリバティブ訴訟または手続き、受託者責任違反を主張する訴訟、デラウェア州一般会社法(「DGCL」)に従って生じる当社に対する請求を主張する訴訟の唯一の法廷であると規定しています。法人設立証明書、または改訂された細則、または内務原則に準拠する当社に対する請求を主張するあらゆる訴訟。この独占的なフォーラム規定は、取引法によって生じた義務または責任を執行するために提起された訴訟には適用されません。ただし、証券法第22条では、証券法またはその下の規則や規制によって生じる義務または責任を執行するために提起されたすべての訴訟について、連邦裁判所と州裁判所が同時管轄権を持つため、独占裁判規定に列挙されているカテゴリの1つ以上に該当し、証券法に基づく請求を主張する訴訟にも適用できます。証券法に基づく請求に関して裁判所がそのような規定を施行するかどうかは不確実であり、当社の株主が連邦証券法およびそれに基づく規則や規制の遵守を放棄したとは見なされません。
この法廷選択条項により、株主が当社または当社の取締役、役員、その他の従業員との紛争に有利と判断した司法裁判所に請求を提出することが制限され、そのような請求に関する訴訟を思いとどまらせる可能性があります。また、裁判所が、当社の改訂された設立証明書に含まれる法廷条項の選択が訴訟に適用されない、または執行不能であると判断した場合、他の法域でのそのような訴訟の解決に関連して追加費用が発生する可能性があり、その結果、当社の事業、経営成績、および財政状態に悪影響を及ぼす可能性があります。
さらに、DGCLの第203条は、当社の支配権の変更を思いとどまらせたり、遅らせたり、妨げたりする可能性があります。第203条は、当社と当社の普通株式の15%以上の保有者との間の合併、企業結合、その他の取引に一定の制限を課しています。
証券法の第22条では、証券法またはその下の規則や規制によって生じる義務または責任を執行するために提起されたすべての請求について、連邦裁判所と州裁判所が同時管轄権を有しています。2020年4月、私たちは、法律で認められる最大限の範囲で、米国の連邦地方裁判所が唯一の法廷となるように、改訂された細則を改正し、改訂しました
64
証券法(そのような規定、「連邦フォーラム規定」)に基づいて生じた訴因を主張する苦情を解決するためのものです。連邦フォーラム条項を採用するという私たちの決定は、デラウェア州最高裁判所が、そのような条項はデラウェア州法の下では表面上有効であると判断した結果です。連邦裁判所または州裁判所がデラウェア州最高裁判所の判決に従うという保証や、特定のケースで連邦フォーラム条項を施行すべきであると決定するという保証はありませんが、連邦フォーラム規定の適用は、証券法によって生じる義務または責任を執行するために株主が提起した訴訟は連邦裁判所に提起されなければならず、州裁判所に提起することはできないということです。
取引法第27条は、取引法またはその下の規則や規制によって生じる義務または責任を執行するために提起されたすべての請求について、連邦政府の専属管轄権を設けています。さらに、独占フォーラム規定も連邦フォーラム規定も、取引法によって生じる義務または責任を執行するために提起された訴訟には適用されません。したがって、証券取引法またはその下の規則や規制によって定められた義務または責任を執行するための株主による訴訟は、連邦裁判所に提起されなければなりません。
当社の株主は、連邦証券法およびそれに基づいて公布された規制の遵守を放棄したとはみなされません。
当社の証券のいずれかの持分を購入または取得または保有する個人または団体は、連邦フォーラム規定を含む当社の独占的なフォーラム規定に通知し、同意したものとみなされます。これらの規定により、株主が当社または当社の取締役、役員、またはその他の従業員との紛争について、選択した司法裁判所に請求を行うことができなくなる場合があります。これにより、当社および当社の取締役、役員、その他の従業員に対する訴訟が妨げられる可能性があります。
上場企業として運営されている結果、コストが増加し、経営陣は新しいコンプライアンスイニシアチブとコーポレートガバナンスの実践にかなりの時間を費やす必要があります。
上場企業として、特に新興成長企業でなくなった後は、非公開企業としては発生しなかった多額の法務、会計、その他の費用が発生します。サーベンス・オクスリー法、ドッド・フランク・ウォールストリート改革および消費者保護法、ナスダック・グローバル・セレクト・マーケット(「ナスダック」)の上場要件、およびその他の適用される証券規則や規制は、効果的な情報開示、財務管理、コーポレート・ガバナンス慣行の確立と維持など、上場企業にさまざまな要件を課しています。当社の経営陣やその他のスタッフは、これらのコンプライアンスへの取り組みにかなりの時間を費やす必要があります。さらに、これらの規則や規制により、法的および財務上のコンプライアンスコストが大幅に増加し、一部の活動により時間と費用がかかると予想されます。これらの要件に対応するために発生する可能性のある追加費用の金額や時期を予測または見積もることはできません。これらの要件の影響により、取締役会、取締役会、委員会、または執行役員を務める資格のある人材を引き付けて維持することがより困難になる可能性もあります。さらに、これらの規則や規制は、多くの場合、具体性に欠けるため、さまざまな解釈の対象となります。その結果、規制機関や統治機関によって新しいガイダンスが提供されるにつれて、実際の適用が時間の経過とともに変化する可能性があります。その結果、コンプライアンス問題に関する不確実性が継続し、開示とガバナンス慣行の継続的な改訂によりコストが高くなる可能性があります。
将来、財務報告に対する適切かつ効果的な内部統制を維持できなければ、正確でタイムリーな財務諸表を作成する当社の能力が損なわれ、当社の業績、投資家の当社に対する見解、ひいては当社の普通株式の価値が損なわれる可能性があります。
以前は、サーベンス・オクスリー法のセクション404(a)を独自に遵守する必要はありませんでした。サーベンス・オクスリー法のセクション404(a)では、SECに提出する第2次年次報告書から始めて、財務報告に対する内部統制の有効性を経営陣が毎年評価することを義務付けています。2023年12月31日に終了した年度現在の財務諸表を作成する過程で、これらの基準を満たす必要がありました。また、当社の経営陣は、その年度およびそれ以降の毎年、財務報告に対する内部統制の有効性について報告する必要があります。さらに、当社が「新興成長企業」ではなくなったら、サーベンス・オクスリー法の第404(b)条に従い、独立登録公認会計士事務所に、財務報告に対する内部統制の有効性を年次ベースで証明することが義務付けられます。当社の経営陣が財務報告に関する内部統制を評価するために満たさなければならない基準を規定する規則は複雑で、重要な文書化、テスト、および可能な限りの是正が必要です。
所定の期間内にセクション404(b)の遵守を達成するために、財務報告に関する内部統制を文書化して評価するプロセスに取り掛かります。これには費用がかかり、困難でもあります。この点で、私たちは引き続き内部リソースを投入し、場合によっては外部コンサルタントを雇用し、財務報告に対する内部統制の妥当性を評価および文書化するための詳細な作業計画を採用し、必要に応じて統制プロセスを改善するための措置を継続し、統制が文書化されたとおりに機能していることをテストを通じて検証し、財務報告に対する内部統制の継続的な報告と改善プロセスを実施する必要があります。私たちの努力にもかかわらず、財務報告に対する当社の内部統制は第404条で義務付けられているように有効であると規定の期間内に、またはまったく結論付けることができないリスクがあります。重大な弱点を1つ以上特定すると、連結財務諸表の信頼性に対する信頼が失われ、金融市場に不利な反応が生じる可能性があります。また、これらの要件を引き続き満たすことができなければ、ナスダックに上場し続けることができなくなる可能性があります。
65
私たちが成長するにつれて、追加の人員を雇用する予定であり、効果的な内部統制を維持するための方針や手順を実施、文書化、修正するために外部の一時的なリソースを利用する可能性があります。しかし、内部統制の欠陥や弱点を特定することは可能です。当社の内部統制に重大な弱点または欠陥が存在し、発見または是正されない場合、当社の連結財務諸表には重大な虚偽表示が含まれている可能性があり、将来発見された場合、将来の報告義務を果たせなくなり、普通株式の価格が下落する可能性があります。
近い将来、資本ストックに対して現金配当を支払う予定はないため、もしあれば、資本増価が唯一の利益源となります。
私たちは、資本金に対して現金配当を申告したり支払ったりしたことはありません。私たちは現在、事業の成長と発展の資金を調達するために、将来の収益があればそれをすべて留保するつもりです。その結果、当面の間、当社の普通株式の資本増価は、もしあれば、あなたの唯一の利益源となります。
私たちは証券訴訟の対象となる可能性があり、費用がかかり、経営陣の注意がそらされる可能性があります。
当社の普通株式の市場価格は変動する可能性があり、これまで、株式の市場価格の変動を経験した企業は証券集団訴訟の対象となっていました。将来、私たちはこの種の訴訟の対象になる可能性があります。当社に対する証券訴訟は、多額の費用が発生し、経営陣の注意を他のビジネス上の懸念からそらす可能性があり、当社の事業に深刻な損害を与える可能性があります。
アイテム 2.株式の未登録売却、収益の使用および発行者による株式の購入。
[なし]。
アイテム 3.シニア証券のデフォルト.
[なし]。
アイテム 4.鉱山の安全に関する開示。
該当なし。
アイテム 5.その他の情報
2024年3月31日に終了した3か月間、規則16a-1(f)で定義されているように、当社の取締役または役員の誰も、次のことを私たちに知らせませんでした
[名前] |
|
タイトル |
|
アクション |
|
日付 |
|
ルール 10b5-1* |
|
ノンルール 10b5-1** |
|
売却予定の株式総数 |
|
|
有効期限 (1) |
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
||||
* 規則10b5-1 (c) 法の肯定的抗弁を満たすことを目的としています。
** 規則10b5-1 (c) 法の肯定的抗弁を満たすことを意図したものではありません。
(1) 脚注に示されている場合を除き、各取引契約では、(a) すべての購入または販売の完了、または (b) 表に記載されている日付のいずれか早い方までの取引が許可または許可されます。
上の表で採択された新しいルール10b5-1プランには、ルール10b5-1プランが締結された時点で、ルール10b5-1プランの対象となる会社または証券に関する重要な非公開情報を所有していなかったというTzianabos氏からのプラン管理ブローカーへの表明が含まれています。当社のインサイダー取引方針に基づくルール10b5-1計画の採択に関連して、同様の表明がなされました。これらの表明は上記の採択日の時点で行われ、その日の時点でのみ発言されています。これらの表明を行うにあたり、取締役および役員が知らなかった重要な非公開情報、または上記の取締役および役員によって取得された、または代理日以降に取得された重要な非公開情報に関しては、保証はありません。
上記の期間中に採択されたルール10b5-1プランに基づく取引は、実行されると、適用される証券法、規則、規制に従って、SECに提出するフォーム4および/またはフォーム144を通じて公開されます。法律で義務付けられている場合を除き、当社は、Tzianabos氏または当社の他の役員または取締役が採用する可能性のある現在または将来の規則10b5-1プランに基づく変更、終了、またはその他の活動を更新または報告する義務を負いません。
66
アイテム 6.展示品。
フォーム10-Qのこの四半期報告書の一部として提出または提供された展示品は、以下の展示物索引に記載されています。
示す 番号 |
|
説明 |
|
フォーム |
|
ファイル番号 |
|
示す 出願日 |
|
示す いいえ。 |
|
ファイル付き/家具付き これで |
31.1 |
|
2002年のサーベンス・オクスリー法第302条に従って採択された、1934年の証券取引法に基づく規則13a-14 (a) および15d-14 (a) に基づく最高経営責任者の認定 |
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
31.2 |
|
2002年のサーベンス・オクスリー法第302条に従って採択された、1934年の証券取引法に基づく規則13a-14 (a) および15d-14 (a) に基づく最高財務責任者の認定 |
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
32.1* |
|
2002年のサーベンス・オクスリー法第906条に基づいて採択された、米国法第18条第1350条に基づく最高経営責任者の認定 |
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
32.2* |
|
2002年のサーベンス・オクスリー法第906条に基づいて採択された、米国法第18条第1350条に基づく最高財務責任者の認定 |
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
101.インチ |
|
インライン XBRL インスタンスドキュメント (インスタンスドキュメントは XBRL タグがインライン XBRL ドキュメントに埋め込まれているため、インタラクティブデータファイルには表示されません)。 |
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
101.SCH |
|
リンクベース文書が埋め込まれたインラインXBRLタクソノミー拡張スキーマ |
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
104 |
|
インライン送付状インタラクティブデータファイル(インラインXBRLとしてフォーマットされ、別紙101に含まれています)。 |
|
|
|
|
|
|
|
|
|
X |
* この証明書は、証券取引法の第18条の目的のために提出されたものではなく、その条項の責任の対象とはみなされません。また、証券取引法の証券法に基づく出願に参照によって組み込まれていると見なされることもありません。
登録者は、規則S-Kの項目601(a)(5)に従ってスケジュールと展示を省略しました。登録者は、要求に応じて、省略されたスケジュールと展示品のコピーをSECに補足的に提出することに同意します。
67
署名
1934年の証券取引法の要件に従い、登録者は署名者に代わってこの報告書に正式に署名させ、正式に権限を与えられました。
|
|
ストーク・セラピューティクス株式会社 |
|
|
|
|
|
日付:2024年5月6日 |
|
作成者: |
/s/ エドワード・M・ケイ、医学博士 |
|
|
|
エドワード・M・ケイ、医学博士 |
|
|
|
最高経営責任者 (最高執行役員) |
|
|
|
|
日付:2024年5月6日 |
|
作成者: |
/s/ スティーブン・J・チューリパノです |
|
|
|
スティーブン・J・チューリパノです |
|
|
|
最高財務責任者 (最高財務責任者と主任会計責任者) 役員) |
68