
2024年第1四半期の決算およびコーポレートアップデート 2024年5月6日別紙99.2
このスライドプレゼンテーションには将来の見通しに関する記述が含まれています 2 このプレゼンテーションには、改正された1995年の民間証券訴訟改革法の意味における将来の見通しに関する記述が含まれています。これには、BionTechの予想収益と、BIONTechのCOVID-19ワクチンの販売に関連する純利益/(損失)に関する記述が含まれますが、これらに限定されません。BIONTechが管理する地域での完全または条件付きの販売承認の下での使用が承認されている場合はCOMIRNATYと呼ばれ、BionTechの期待収益と純利益/(損失)に関する記述が含まれますが、これらに限定されません。OnTechのコラボレーションパートナー、特に派生した数値についてはBioNTechのパートナーから提供された暫定的な見積もりから、BioNTechのCOVID-19ワクチン、および承認された場合はBioNTechの治験薬の市場での受け入れ率と程度、注文環境の変更や新しい変異や亜系統に対応するためにワクチンを適応させるための規制上の推奨事項など、COVID-19ワクチン需要の予想される変化に関する期待、BioNTechの研究開発の開始、時期、進捗状況、結果、および費用から BioNTechの現在および将来の前臨床研究を含むプログラムと臨床試験(研究または試験および関連する準備作業の開始、登録、終了のタイミング、結果の入手可能性、規制当局の承認と販売承認の申請の時期と結果、追加で登録される可能性のある試験の目標時期と数、およびバイオテックが開始する可能性のある試験の登録可能性に関する記述を含む)、規制当局との話し合い、知的財産に関するバイオエヌテックの期待 BionTechの買収の影響InstaDeep Ltd. とそのコラボレーションおよびライセンス契約、持続可能なワクチンの製造および供給ソリューションの開発、性質、実現可能性、およびBioNTechの収益、研究開発費、販売費、一般管理費、営業活動のための資本支出の見積もり場合によっては、将来の見通しに関する記述は、「意志」、「かもしれない」、「すべき」、「期待」、「意図」、「計画」、「目的」、「期待」、「予測」、「可能性」、「継続」などの用語で識別できますが、これらの用語やその他の同等の用語の否定的表現もありますが、将来の見通しに関する記述がすべてではありませんこれらの単語が含まれています。このプレゼンテーションの将来の見通しに関する記述は、将来の出来事に対するBionTechの現在の期待と信念に基づいており、約束でも保証でもありません。これらの将来の見通しに関する記述には、既知および未知のリスク、不確実性、その他の要因が含まれ、その多くはBioNTechの管理が及ばず、実際の結果がこれらの将来の見通しに関する記述で表明または暗示されるものと大きく異なる可能性があるため、これらの将来の見通しに関する記述に過度に依存しないでください。これらのリスクと不確実性には、予想される臨床エンドポイントを満たす能力、臨床試験の開始日および/または完了日、規制当局の提出日、規制当局の承認日および/または発売日など、研究開発に内在する不確実性、ならびにこのリリースに記載されているデータを含む前臨床および臨床データ(このリリースに記載されているデータを含む)に関連するリスクや、好ましくない新しい前臨床、臨床、または安全性データの可能性を含むリスクが含まれますが、これらに限定されません。既存の前臨床、臨床、または安全性データ、継続的なピアレビュー、規制レビュー、市場解釈の対象となる臨床データの性質、政府当局、民間の健康保険会社、その他の第三者支払者とのCOVID-19ワクチンに関するバイオエヌテックの価格設定と補償範囲の交渉、COVID-19ワクチンの初回または追加投与に対する将来の商業的需要と医療ニーズ、他のCOVID-19ワクチンとの競争、または異なる作用機序を持つものを含む、BioNTechの他の製品候補に関連するものと異なる製造と特に、有効性、コスト、保管と流通の利便性、承認された用途の範囲、副作用プロファイル、免疫反応の持続性、製品候補に対する規制当局の承認の取得時期と維持能力、新たなウイルスの亜種によって引き起こされるCOVID-19を予防するBioNTechのCOVID-19ワクチンの能力、BioNTechおよびその取引相手の管理と調達能力に基づく流通上の制約必要なエネルギー資源。研究機会を特定し、発見するBioNTechの能力治験薬の開発、バイオエヌテックの開発候補と治験薬に関する研究開発活動を継続するBioNTechの第三者協力者の能力と意欲、COVID-19がBionTechの開発プログラム、サプライチェーン、協力者、財務実績に与える影響、BioNTech、BionTechが開発または製造した製品や製品候補の使用から生じるとされる予期せぬ安全上の問題と潜在的な請求とその協力者の商品化とマーケティング能力BioNTechのCOVID-19ワクチン、および承認された場合はその製品候補、BioNTechの開発と拡大を管理する能力、米国およびその他の国における規制の進展、BionTechが生産能力を効果的に拡大して製品と製品候補を製造する能力、グローバルな金融システムと市場に関連するリスク、および現時点でBioNTechに知られていないその他の要因。2024年3月31日に終了した期間のBioNTechのForm 6-Kレポートと、その後BionTechがSECに提出した提出書類の「リスク要因」という見出しに記載されているリスクと不確実性を確認してください。これらの書類は、SECのWebサイト(www.sec.gov)で入手できます。これらの将来の見通しに関する記述は、本書の日付の時点でのみ述べられています。法律で義務付けられている場合を除き、BionTechは、新しい情報や将来の進展などが発生した場合に、このプレゼンテーションに含まれる将来の見通しに関する記述を更新または改訂する意図や責任を一切負いません。

決算イェンス・ホルスタイン、最高財務責任者3 戦略的展望ライアン・リチャードソン、最高戦略責任者 4 パイプラインの最新情報 Ozlem Türeci、共同創設者兼最高医療責任者 2 2024年第1四半期のハイライト共同創設者兼最高経営責任者Ugur Sahin1

1 2024年第1四半期のハイライト創設者兼最高経営責任者のウグル・サヒン

2024 2024年第1四半期の戦略的優先事項と成果 5 1.Duality Biologicsと提携; 2 ロシュグループのメンバーであるジェネンテックと提携 3.ファイザーと提携しました。HER2 = ヒト上皮成長因子受容体2; ADC = 抗体薬物複合体、HR = ホルモン受容体; AACR = 米国がん研究会:mRNA = メッセンジャーリボ核酸、PDAC = 膵管腺がん、NSCLC = 非小細胞肺がん、TROP2 = 栄養膜細胞表面抗原2。PDACの自家遺伝子セブメラン(BNT122)2とNSCLCのBNT116の臨床データをAACRで発表しました。7月からアンネマリー・ハネカンプを最高商務責任者に任命しました。HR+/HER2-低乳がんにおける当社のHER2 ADC BNT323/DB-13031を評価する第3相臨床試験で最初の患者が投与され、当社のファストトラック指定を受けました白金製剤抵抗性上皮性卵巣がん、卵管がん、または原発性腹膜がんの治療のためのTROP2-ADC BNT325/DB-13051 2024/2025シーズンに向けた多様体適応型COVID-19ワクチンの進歩3 臨床オンコロジーでの実施オンコロジーにおける商業的準備状況 COVID-19 リーダーシップ:最初のグローバル製品発売を促進するために、グローバルコマーシャルグループでのさらなる専門知識を任命、米国でのコマーシャルオペレーションの構築を開始した米国ゼネラルマネージャーを任命
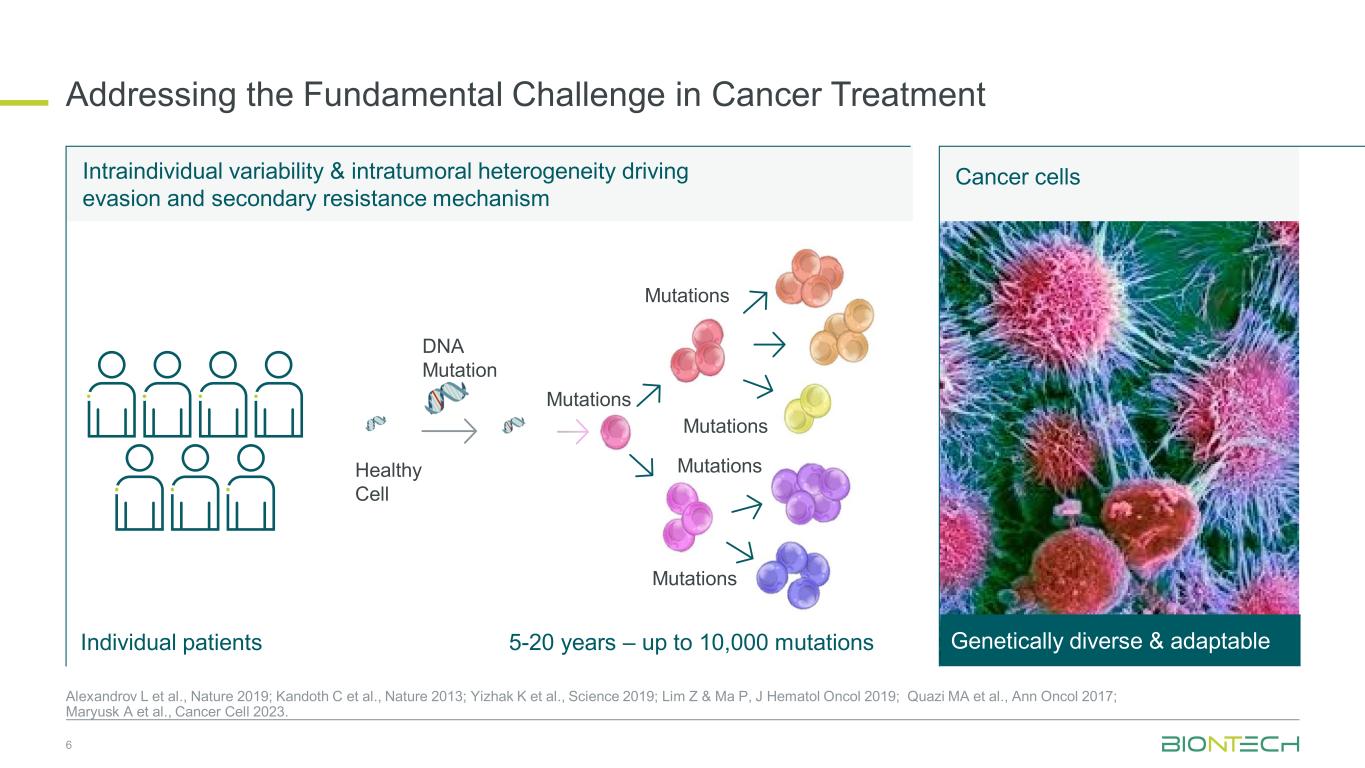
回避と二次抵抗を促進する個人内変動と腫瘍内の不均一性による回避と二次抵抗性メカニズムがん治療における根本的な課題への対処がん細胞遺伝的に多様で適応可能がん細胞 5〜20年 — 最大10,000の突然変異 DNA突然変異 DNA突然変異健康な細胞突然変異、突然変異個々の患者 6 Alexandrov L ら、Nature 2019; Kandoth Cら、Nature 2013; Yizhak K et al。.、サイエンス2019; Lim Z&Ma P、J Hematol Oncol 2019; Quazi MAら、Ann Oncol 2017; Maryusk Aら、Cancer Cell 2023です。

相乗的な作用機序を持つ化合物クラスを網羅する当社のオンコロジーアプローチ7戦略ポートフォリオ•免疫調節剤•標的療法•幅広い固形腫瘍と治療段階にわたる個別化および市販のmRNAワクチンプログラムクラス初またはクラス最高の可能性を秘めた独自の治療法の組み合わせによるプログラム目標がんの継続性への取り組みがん患者に新しい治療法をもたらし、新しい治療パラダイムを確立する新しい選択肢を開くプラットフォームとセラピー
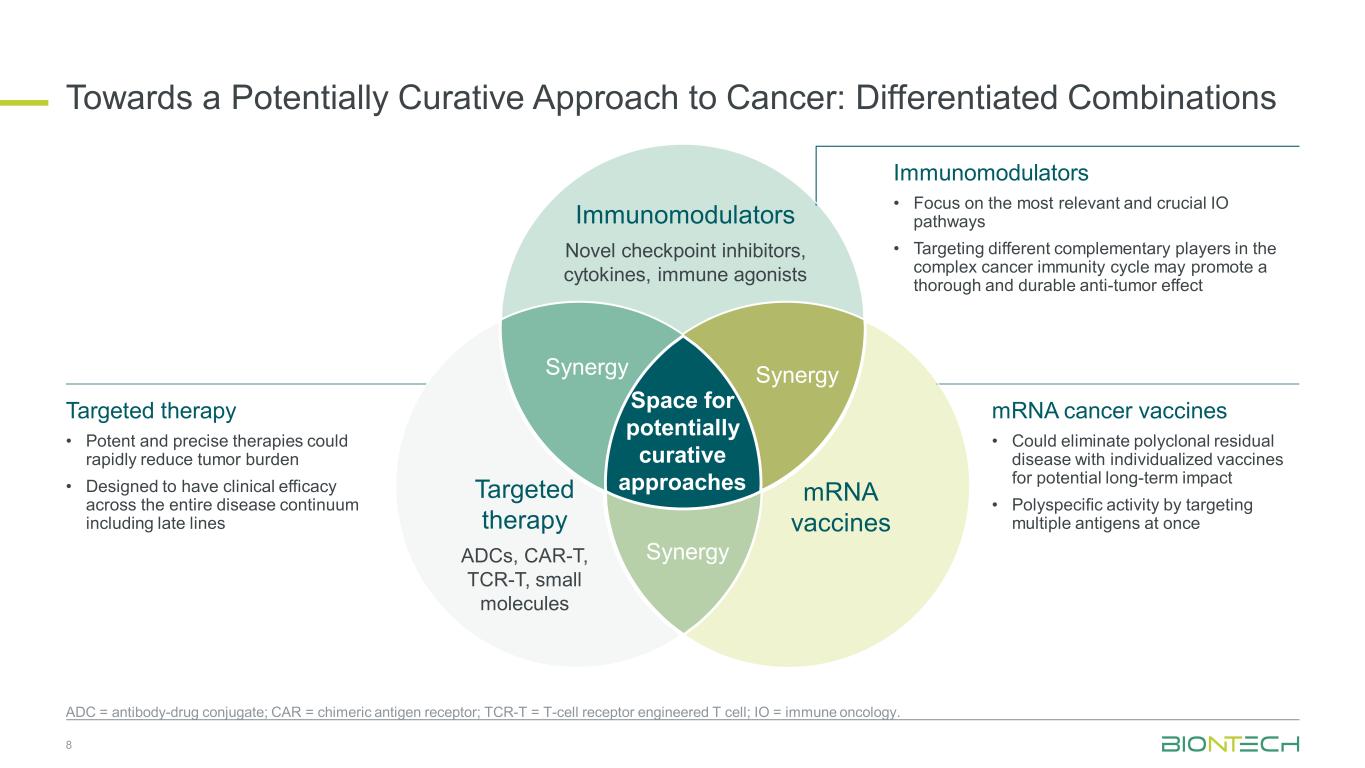
がんに対する治癒の可能性のあるアプローチに向けて:治癒の可能性があるアプローチのための差別化された組み合わせのスペース免疫調節剤新規チェックポイント阻害薬、サイトカイン、免疫アゴニスト、mRNAワクチン標的療法 ADC、CAR-T、TCR-T、小分子 SynergySynergy Synergy 8 ADC = 抗体薬物複合体、CAR = キメラ抗原受容体、TCR-T = T細胞受容体で操作されたT細胞。IO = 免疫腫瘍学。免疫調節薬 • 最も関連性が高く重要なIO経路に焦点を当てる • 複雑ながんの免疫サイクルにおけるさまざまな補完的プレーヤーを標的にすることで、徹底的で持続的な抗腫瘍効果を促進できる可能性がある • mRNAがんワクチンは長期的な影響の可能性を考慮して、個別のワクチンでポリクローナル残存疾患を排除できる • 複数の抗原を一度に標的とすることによる多特異的活性 • 強力で正確な治療法は腫瘍の負担を迅速に軽減できる • 臨床的有効性を持つように設計されているレイトラインを含む一連の病気全体にわたって
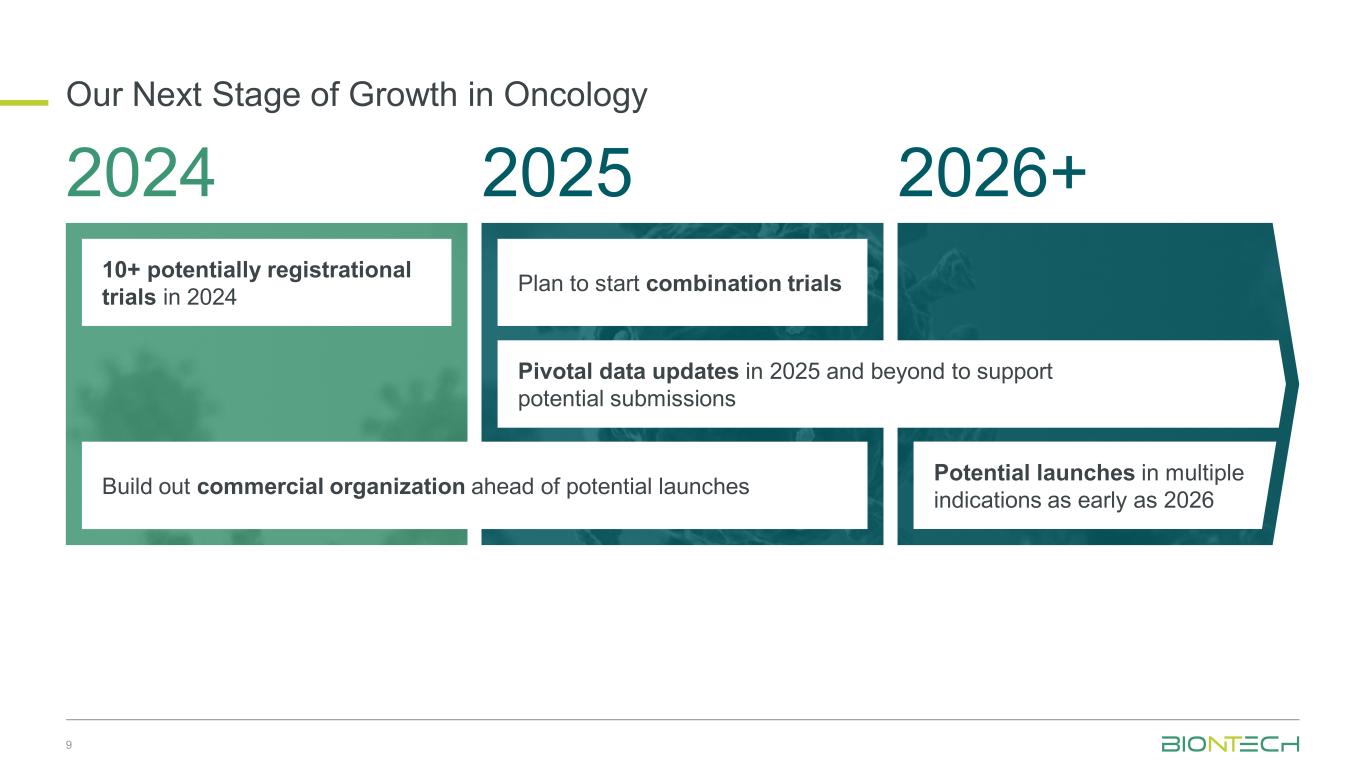
オンコロジーの次の成長段階 9月 2024年 2025年 2026+ 2024年までに10件以上の登録可能な治験、発売予定に先駆けて商業組織の構築コンビネーショントライアルの開始を計画するコンビネーショントライアルの開始を計画する申請候補をサポートするための重要なデータの更新2025年以降のピボットデータの更新早ければ2026年には複数の適応症で発売予定

2 パイプラインの最新情報共同創設者兼最高医療責任者、オズレム・テュレシさん
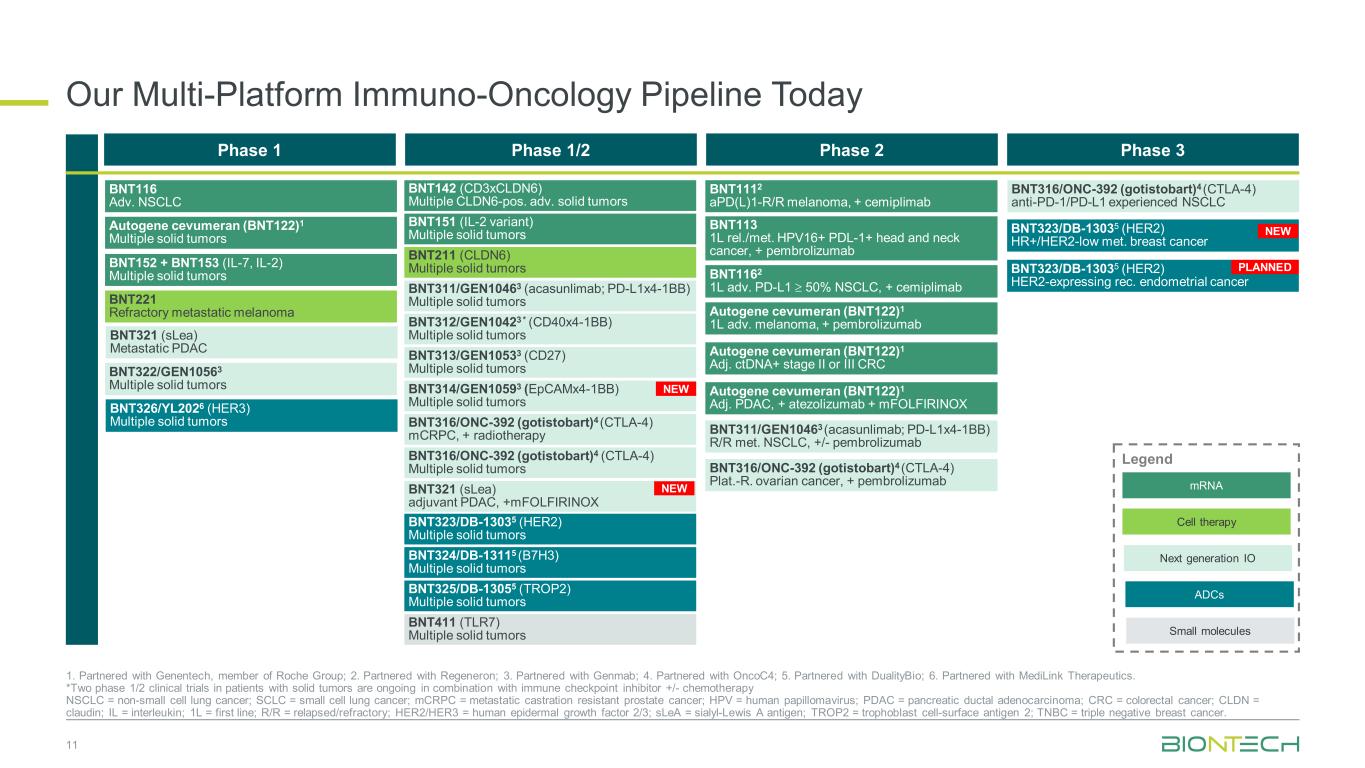
今日のマルチプラットフォームの免疫腫瘍学パイプライン 11 1.ロシュグループのメンバーであるジェネンテックと提携しています。2.リジェネロンと提携。3.ゲンマブと提携しています。4.OnCoCと提携しています。45.DualityBioと提携しています。6.メディリンク・セラピューティクスと提携しています。*固形腫瘍の患者を対象に、免疫チェックポイント阻害薬+/-化学療法と併用して、NSCLC = 非小細胞肺がん、SCLC = 小細胞肺がん、mCRPC = 転移性去勢抵抗性前立腺がん、HPV = ヒトパピローマウイルス、PDAC = 膵管腺がん、CRC = 結腸直腸がん、CLC = 結腸直腸がん、CLCと併用して、2つの第1/2相臨床試験が進行中です。DN = クローディン; IL = インターロイキン; 1L = ファーストライン; R/R = 再発/難治性; HER2/HER3 = ヒト上皮成長因子 2/3; SleA = シアリルルイスA抗原; TROP2 = 栄養膜細胞表面抗原 2; TNBC = トリプル陰性の乳がん。フェーズ 1 フェーズ 1/2 フェーズ 2 フェーズ 3 BNT211 (CLDN6) 多発性固形腫瘍 BNT311/GEN10463 (アカサンリマブ; PD-L1x4-1BB) 多発性固形腫瘍 BNT312/GEN10423* (CD40x4-1BB) 多発性固形腫瘍 BNT313/GEN10533 (CD27) 多発性固形腫瘍 BNT316/ONC-392 (gos) ストバート)4(CTLA-4)複数の固形腫瘍 BNT151(IL-2バリアント)複数の固形腫瘍 BNT142(CD3xCLDN6)複数のCLDN6-POS。進行性固形腫瘍 BNT325/DB-13055(TROP2)複数の固形腫瘍 BNT316/ONC-392(ゴシストバート)4(CTLA-4)抗PD-1/PD-L1を経験したNSCLC BNT323/DB-13035 (HER2) 複数の固形腫瘍 BNT324/DB-13115 (B7H3) 複数の固形腫瘍 BNT323/DB-13035 (HER2) HR+/HER2-低感度乳がん BNT116進NSCLC BNT152 + BNT153 (IL-7、IL-2) 多発性固形腫瘍 BNT221 難治性転移性黒色腫 BNT321 (SleA) 転移性PDAC BNT322/GEN10563多重固形物腫瘍自己遺伝子セブメラン(BNT122)1 多発性固形腫瘍 BNT314/GEN10593(EPCAMx4-1BB)複数の固形腫瘍 mRNA 次世代IO細胞療法レジェンド小分子 ADC BNT326/YL2026(HER3)複数の固形腫瘍 BNT311/GEN10463(アカサンリマブ、PD-L1x4-1BB)R/Rメット。NSCLC、+/-ペムブロリズマブ BNT1112 パッド (L) 1-R/R メラノーマ、+ セミプリマブ BNT113 1L レル。/メット。HPV16+ PDL-1+ 頭頸部がん、+ ペムブロリズマブオートジェーンセブメラン(BNT122)1 1L 進行性黒色腫、+ ペムブロリズマブオートジーンセブメラン(BNT122)1 Adj. ctDNA+ ステージIIまたはIII CRC BNT1162 1L adv。PD-L1 ≥ 50% NSCLC、+ セミプリマブオートジーンセブメラン(BNT122)1 Adj. PDAC、+ アテゾリズマブ + MFOLフィリノックス BNT316/ONC-392(ゴシストバート)4(CTLA-4)プラット。-R. 卵巣がん、+ ペムブロリズマブ BNT316/ONC-392(ゴシストバート)4(CTLA-4)mCRPC、+ 放射線療法 BNT411(TLR7)多発性固形腫瘍 BNT321(SleA)補助PDAC、+Mフォルフィリノックス BNT323/DB-13035(HER2)HER2発現反応。子宮内膜がん計画中 NEW NEW
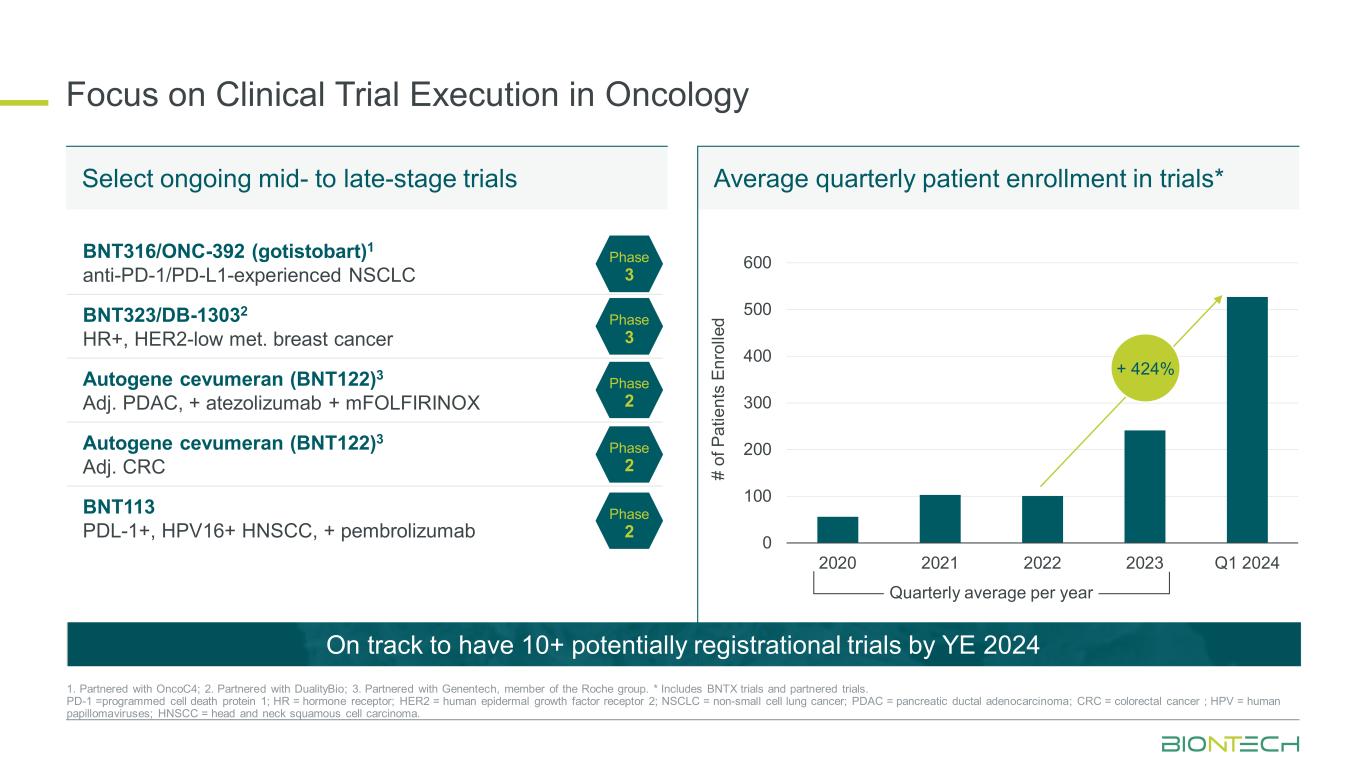
オンコロジーにおける臨床試験の実施に焦点を当てる 0 100 200 300 400 500 2020 2021 2022 2023 Q1 2024 + 424% BNT316/ONC-392(ゴシストバート)1 抗PD-1/PD-L1経験者 NSCLC BNT323/DB-13032 HR+、HER2-低血性乳がん自己遺伝子セブメラン(BNT122)3 PDAC調整、+ アテゾリズマブ+ mfolfirinox Autogene cevumeran(BNT122)3 Adj. CRC BNT113 PDL-1+、HPV16+ HNSCC、+ ペムブロリズマブフェーズ 3 フェーズ 3 フェーズ 3 フェーズ 2 フェーズ 2 フェーズ 2 フェーズ 2 フェーズ 2 1.OnCoCと提携しています; 42.DualityBioと提携しています。3.ロシュグループのメンバーであるジェネンテックと提携しています。* BNTX試験と提携試験を含みます。PD-1 =プログラムされた細胞死タンパク質1、HR = ホルモン受容体、HER2 = ヒト上皮成長因子受容体2、NSCLC = 非小細胞肺がん、PDAC = 膵管腺がん、CRC = 結腸直腸がん、HPV = ヒトパピローマウイルス、HNSCC = 頭頸部扁平上皮がん。現在進行中の中期から後期段階の試験を選択します四半期ごとの平均治験登録者数* 2024年までに10件以上の潜在的に登録可能な試験が行われる見込みです
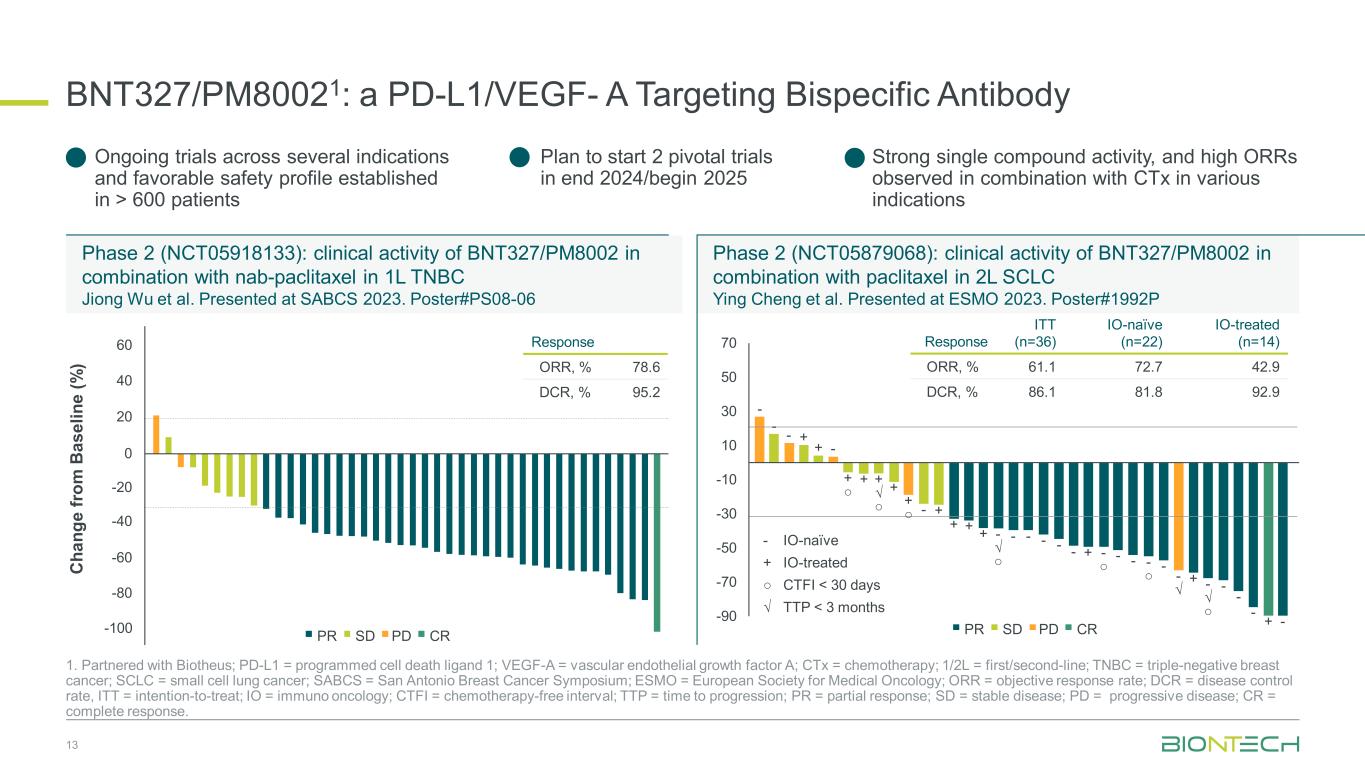
BNT327/PM80021:PD-L1/VEGF-A ターゲティング二重特異性抗体 13 1.ビオテウスと提携。PD-L1 = プログラム細胞死リガンド1、VEGF-A = 血管内皮成長因子A、CTx = 化学療法、1/2L = ファーストライン/セカンドライン、TNBC = トリプルネガティブ乳がん、SCLC = 小細胞肺がん、SABCS = サンアントニオ乳がんシンポジウム、ESMO = 欧州臨床腫瘍学会、ORR = 客観的奏効率; DCR = 疾患コントロール率、ITT = 治療意向、IO = 免疫腫瘍学、CTFI = 化学療法を行わない間隔、TTP = 進行までの時間、PR = 部分奏効、SD = 病勢の安定性、PD = 進行性疾患、CR = 完全応答。フェーズ2(NCT05918133):1Lのナブパ?$#@$タキセルと併用したBNT327/PM8002の臨床活性 TNBC Jiong Wuら。SABCS 2023で発表されました。ポスター #PS08 -06フェーズ2(NCT05879068):2L SCLCにおけるパクリタキセルと組み合わせたBNT327/PM8002の臨床活性 Ying ChengらESMO 2023で発表されました。ポスター #1992P C ha ng e fr om B as el in e (%) -100 60 40 0 -20 -40 -80 20 -60 CRPDSDPR Response ORR、% 78.6 DCR、% 95.2---+-+-+-+-+-+----------------------------IOナイーブ+IO治療済み ○ CTFI 600患者 2024年末に2つの重要な試験を開始する予定です/2025年初頭に2つの重要な試験を開始する予定です。強力な単一化合物の活性が強く、CTxと組み合わせるとさまざまな適応症で高いORRが観察されました CRPDSDPR -90 -70 -50 -30 -10 10 30 50 70
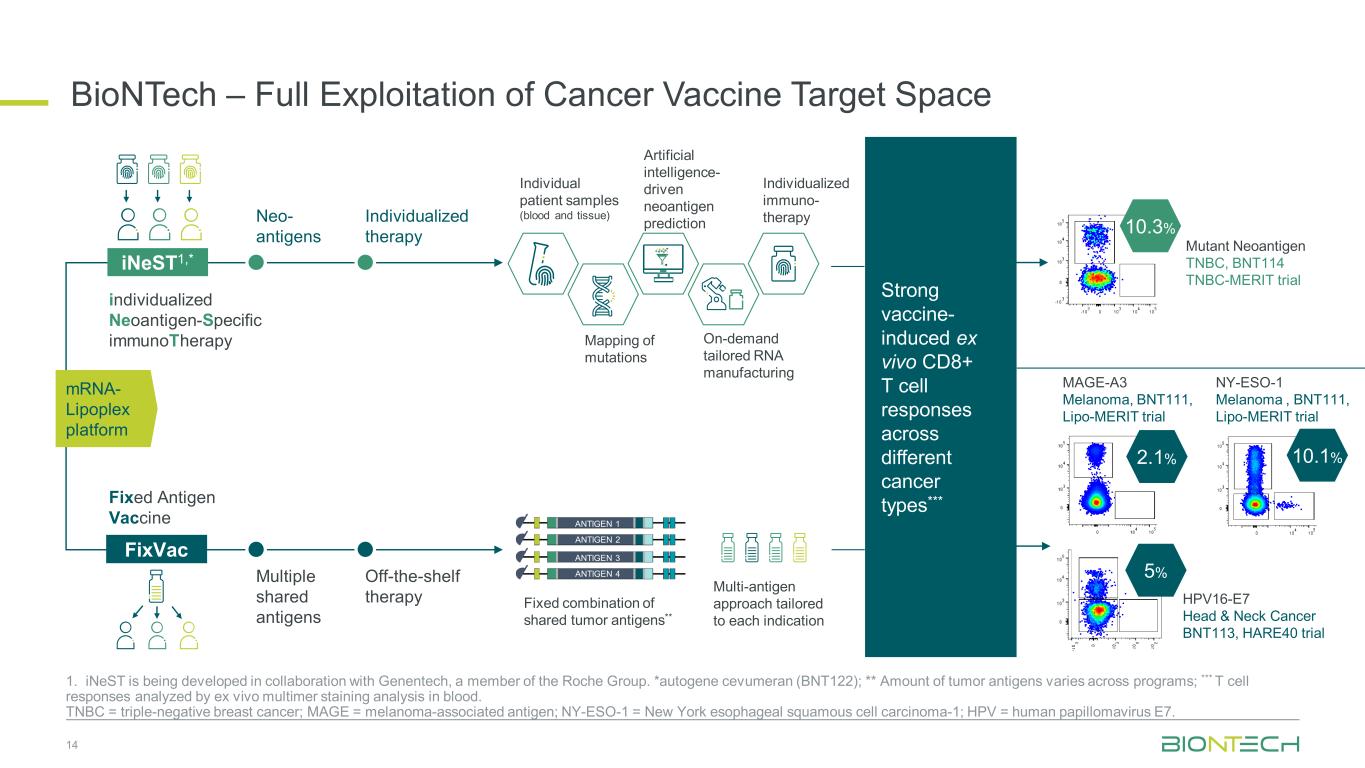
BioNTech — がんワクチンのターゲットスペースを最大限に活用 14 1. iNestは、ロシュグループのメンバーであるジェネンテックと共同で開発されています。*自己遺伝子セブメラン(BNT122); ** 腫瘍抗原の量はプログラムによって異なります。*** 血液中のEx vivoマルチマー染色分析によるT細胞反応の分析。TNBC = トリプルネガティブ乳がん、MAGE = メラノーマ関連抗原、NY-ESO-1 = ニューヨーク食道扁平上皮がん-1、HPV = ヒトパピローマウイルスE7。個々の患者サンプル(血液と組織)人工知能主導の新抗原予測オンデマンドのテーラードRNA製造個別化された免疫療法突然変異のマッピング共有腫瘍抗原の固定組み合わせ** 各適応症に合わせたマルチ抗原アプローチネオ抗原個別化治療複数の共有抗原市販療法 iNest1、* FixVac個別化ネオ抗原特異免疫療法固定抗原ワクチン抗原1抗原ワクチン抗原2抗原 3 抗原 4 さまざまな分野にわたるワクチン誘発性の生体外CD8+T細胞反応が強いがんの種類*** 10.3% 10.1% HPV16-E7 頭頸部がん BNT113、HARE40試験変異ネオ抗原 TNBC、BNT114 TNBC-MERIT試験 5% MAGE-A3メラノーマ、BNT111、リポメリット試験 2.1% NY-ESO-1 メラノーマ、BNT111、リポメリット試験 mRNA-リポプレックスプラットフォーム
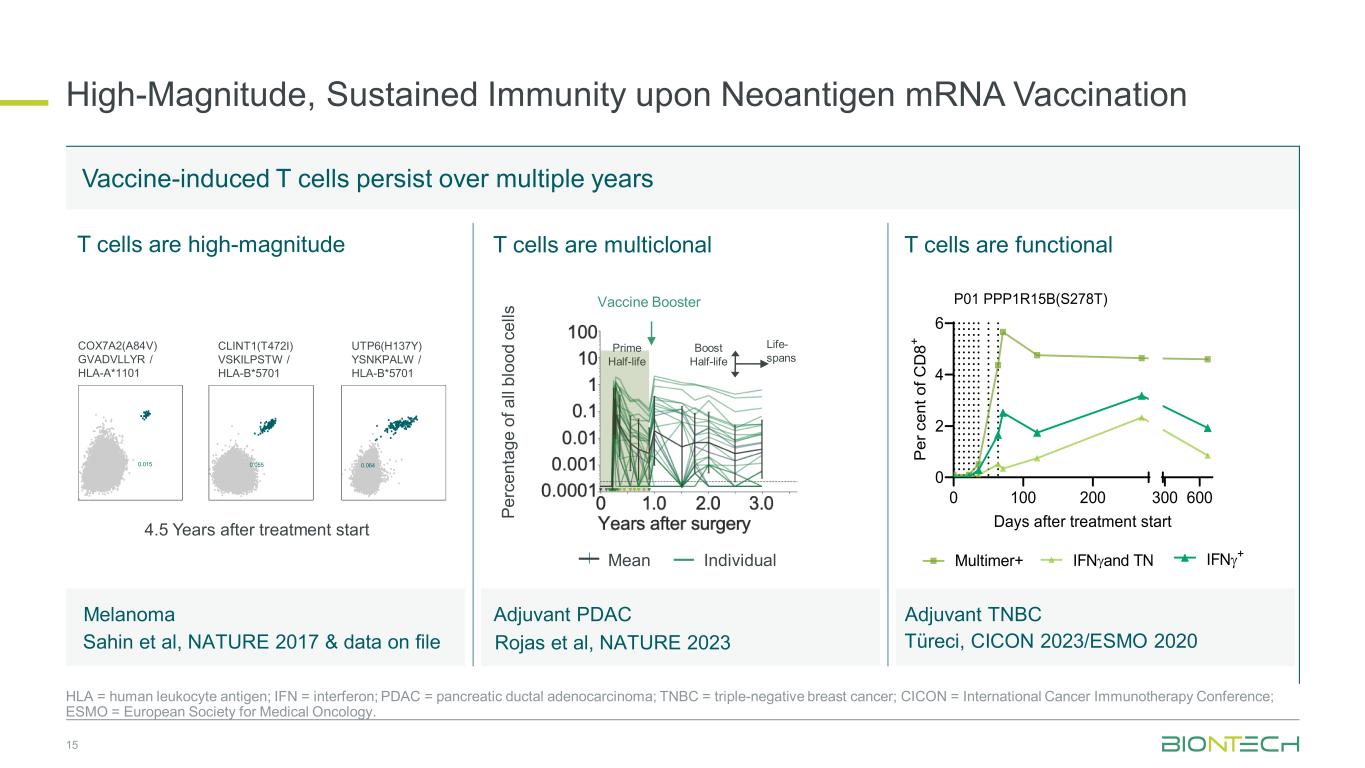
ネオ抗原mRNAワクチン接種による高マグニチュードで持続的な免疫 15 HLA = ヒト白血球抗原、IFN = インターフェロン、PDAC = 膵管腺がん、TNBC = トリプルネガティブ乳がん、CICON = 国際がん免疫療法会議、ESMO = 欧州臨床腫瘍学会。アジュバントTNBCワクチン誘発T細胞は数年間持続します T細胞は高マグニチュードCOX7A2(A84V)GVADVLLYR/HLA-A*1101 CLINT1(T472I)VSKILPSTW/HLA-B*5701 UTP6(H137Y)YSNKPALW/HLA-B*5701 0.015 0.015 0.015 55 0.064 4.5 治療開始後平均個々のT細胞はマルチクローナルT細胞です 0 100 200 0 2 4 6 300 治療開始後600日後に機能しています P er c en t o f C D 8+ P01 PPP1R15B(S278T)メラノーマサヒンら、NATURE 2017およびファイルアジュバントPDACロハスら、ネイチャー2023マルチマー+ IFNNに関するデータ γとTN IFNγ+ プライムハーフライフブーストハーフライフライフスパンワクチンブースター Pe Arc en ta geo f f a ll Bl Oo de ce Alls Turecci、CICON 2023/ESMO 2020
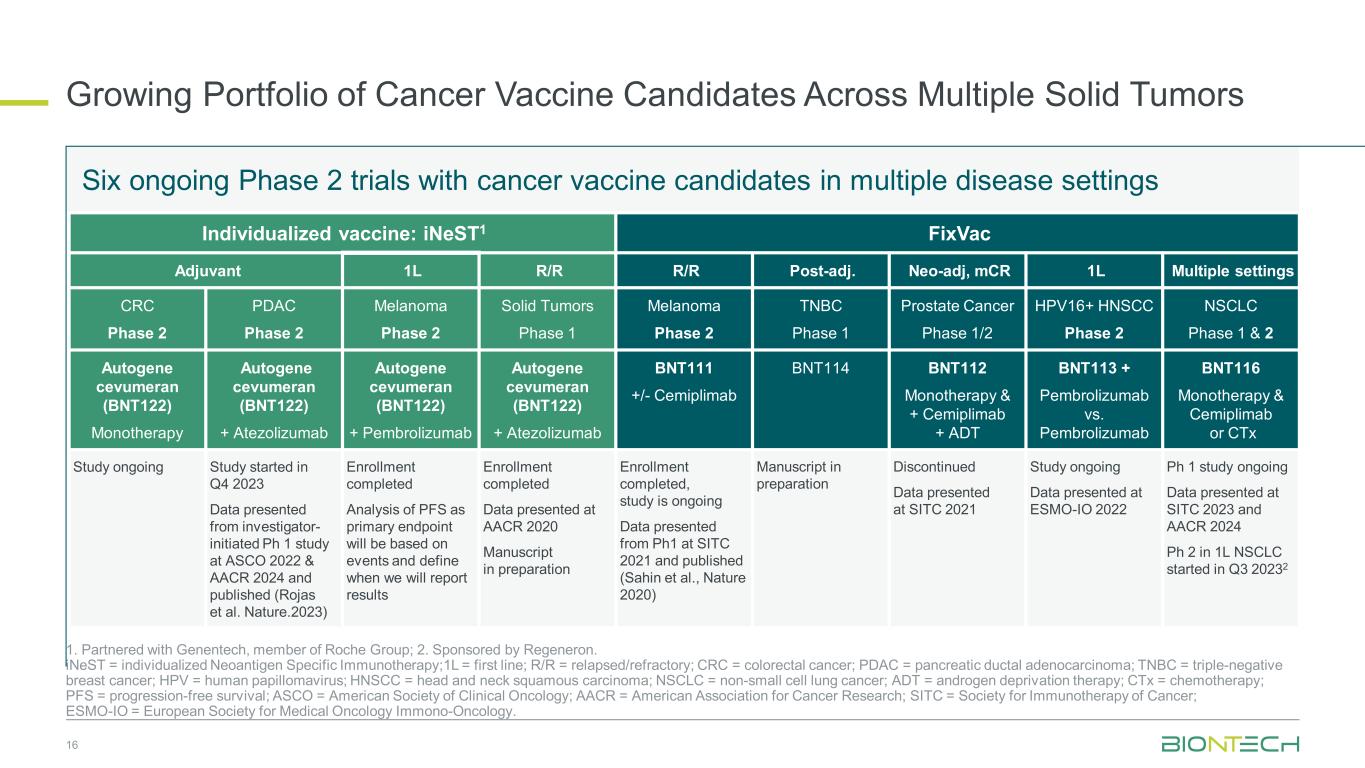
複数の固形腫瘍にわたるがんワクチン候補のポートフォリオの拡大 16 1.ロシュグループのメンバーであるジェネンテックと提携しています。2.リジェネロン主催。iNEST = 個別化ネオ抗原特異的免疫療法、1L = ファーストライン、R/R = 再発/難治性、CRC = 結腸直腸がん、PDAC = 膵管腺がん、TNBC = トリプルネガティブ乳がん、HPV = ヒトパピローマウイルス、HNSCC = 頭頸部扁平上皮がん、NSCLC = 非小細胞肺がん、ADT = アンドロゲン遮断療法、CTx = 化学療法、PFS = 無増悪生存、ASCO = 米国臨床腫瘍学会、AACR = 米国がん研究協会、SITC = がん免疫療法学会、ESMO-IO= 欧州臨床腫瘍学会免疫腫瘍学。複数の疾患環境におけるがんワクチン候補を対象とした6つの進行中の第2相試験個別化ワクチン:iNest1 FixVac アジュバント 1L R/R R/R 事後調整後。neo-adj、mcr 1L 複数設定 CRC フェーズ 2 PDAC フェーズ 2 メラノーマフェーズ 2 固形腫瘍フェーズ 1 メラノーマフェーズ 2 TNBC フェーズ 1 前立腺がんフェーズ 1/2 HPV16+ HNSCC フェーズ 2 NSCLC フェーズ 1 & 2 オートジーンセブメラン (BNT122) 単剤療法オートジーンセブメラン (BNT122) + アテゾリズマブオートジーンセブメラン(BNT122)+ ペムブロリズマブオートジェーンセブメラン(BNT122)+ アテゾリズマブ BNT111 +/-セミプリマブ BNT114 BNT112 モノセラピー & + セミプリマブ + ADT BNT113 + ペムブロリズマブ vs ペムブロリズマブ BNT116 単剤療法 & C エミプリマブまたはCTxの研究が進行中です。2023年第4四半期に開始されたデータは研究者がASCO 2022とAACR 2024で博士課程1号の研究を開始し、出版されました(ロハスらNature.2023) 登録完了主要評価項目としてのPFSの分析はイベントに基づいて行い、結果をいつ報告するかを定義します。登録完了、AACR 2020で発表された原稿は準備中です。登録完了、研究は進行中、SITC 2021のPh1から発表され公開されたデータ (Sahin et al.、Nature 2020) 準備中の原稿準備中SITC 2021で発表された研究継続データ-IO 2022 Ph.1の研究が進行中です。SITC 2023とAACR 2024 Ph 2で発表されたデータは、1LのNSCLCは2023年第3四半期に開始されました

第2相ランダム化試験で調査したオートジーン・セブメラン(BNT122)1と補助大腸がんにおける注意深い経過観察 17 1.ロシュグループのメンバーであるジェネンテックと提携しました。2.コタニら。ネイチャー2023、ナカムラら。エスモ 2023; 3.アンドレ・Tら。J Clin Inc. 2015 CT = コンピューター断層撮影、CRC = 大腸がん、SoC = 標準治療、qxw = X週ごと、ctDNA = 循環腫瘍DNA、(m) DFS = (中央値) 無病生存期間、OS = 全生存、RFS = 無再燃生存、TTR = 反応までの時間、TTF = 治療失敗までの時間。自家遺伝子セブメラン(BNT122)15回投与:6×q1w、2×q2w、7×q6w 12~24週間の観察観察観察による注意深い経過観察補助SoC化学療法。選択基準II期(高リスク)またはIII期のCRCスクリーニング:CTDNAの状態(術後)1回(術後)のスクリーニング 2回(ワクチン製造のためのネオ抗原の選択)3 最終適格性(ctDNA陽性)n=164 R 1:1 バイオマーカー:ctDNAの状態に関係なくBNT122(n=15)iNEST製造 ≤20ネオエピトープ探索的:BNT122スクリーニング3で再発した疾患(n≤20)主要エンドポイントステータス • 最初の患者投与(ランダム化コホート):2021年12月 • トラックプライマリーに関する研究:無病生存効果:RFS、TTR、TTF、OSのctDNA状態の変化フェーズ2、マルチサイト、オープンラベル、ランダム化比較試験(NCT04486378)大腸がん患者における歴史的有効性2、3 MDF(ctDNA+患者を対象としたMDF):6か月 5年間のDFS率:ステージII(ハイリスク)〜 80%、ステージIII 〜 66% 5年OS率:ステージII(ハイリスク)〜 88% '、ステージIII 〜 76%

オートジーン・セブメラン(BNT122)1が第2相ランダム化試験で調査されました。それとPDACの切除後のSoCとの比較 18 1です。ロシュグループのメンバーであるジェネンテックと提携しています。2.コンロイT. ら。ジャマ株式会社 2022年。SoC = 標準治療、PDAC = 膵管腺がん、(m)DFS =(中央値)無病生存期間、(m)OS =(中央値)全生存期間、FPD = 初回患者投与主要評価項目プライマリ:DFS二次:DFS率、OS、OS率、安全状況 • 募集中 • FPD 2023年10月の選択基準スクリーニングパートAで5歳以上の新生児と判定 BNT122スクリーニングパートBのカスタム製造のための血液および腫瘍サンプルからのエピトープ IN/EX基準に基づいて患者の適格性を確認します n=260 R 1:1 治療段階と投与スケジュール研究中、患者を監視しますPDACの再発、新しいがんの発生、または許容できない毒性のいずれか早い方まで、予定された間隔で。手術後6〜12週間後のランダム化 Autogene cevumeran(BNT122)+ アテゾリズマブ + MFOLFIRINOX IMCODE003:フェーズ2、オープンラベル、多施設、ランダム化試験(NCT05968326)• 切除マージン • リンパ節転移層別化因子 mフォルフィリノックス単剤療法の歴史的有効性2 MDFS = 21.4 月、5年DFS = 26.1%のMO = 53.5か月、5年OS = 43.2% • PDACを切除した患者 • PDACの全身的な抗がん治療を受けたことがない •手術後に疾患の証拠がない
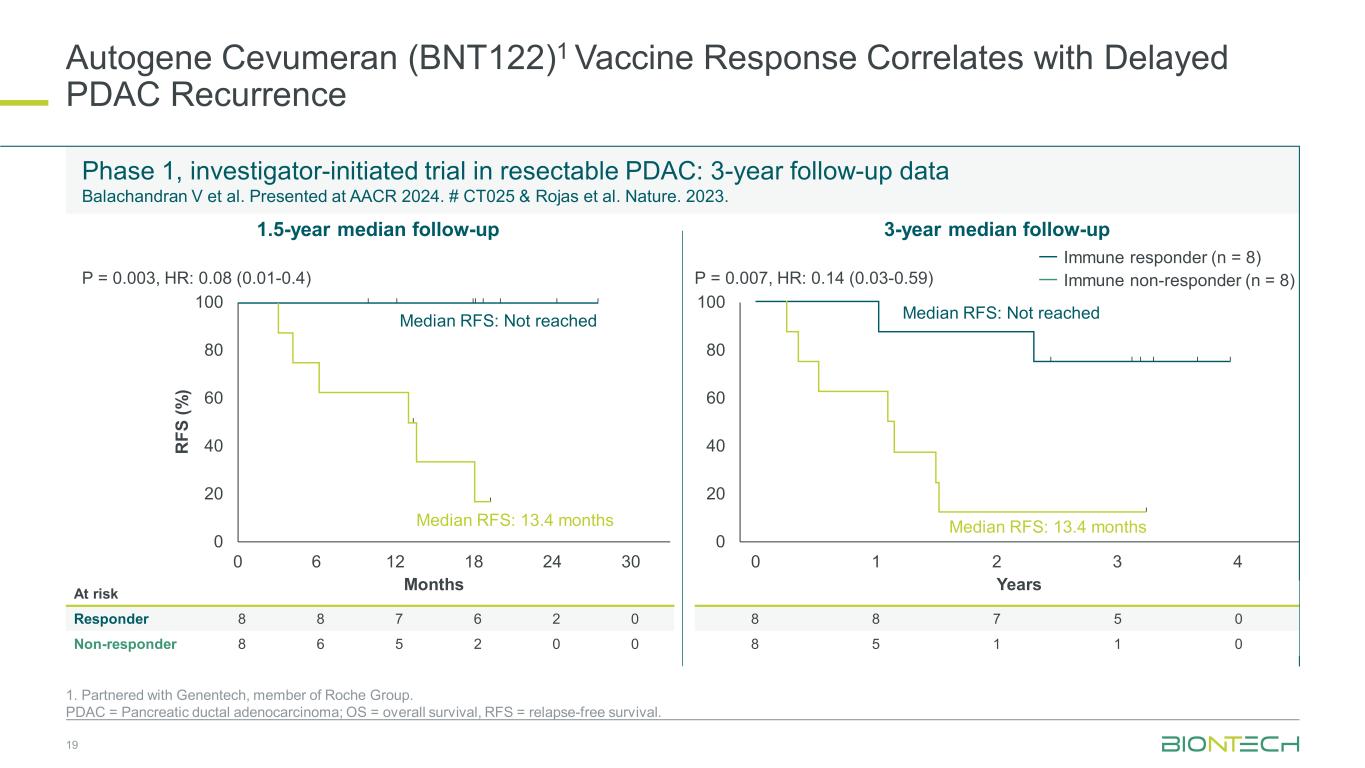
オートジーン・セブメラン(BNT122)1ワクチンの反応はPDAC再発の遅延と相関しています 1.ロシュ・グループのメンバーであるジェネンテックと提携しました。PDAC = 膵管腺がん、OS = 全生存、RFS = 無再燃生存。切除可能なPDACでの医師主導の第1相試験:3年間のフォローアップデータ:Balachandran V et al.AACR 2024で発表されました。#CT025とロハスら。自然。2023。19リスクレスポンダー 8 8 7 6 2 0 ノンレスポンダー 8 6 5 2 0 0 8 8 7 5 8 5 5 1 1 0 1.5年フォローアップ中央値 3 年間のフォローアップ中央値 0 20 40 60 60 100 R FS (%) 月 0 20 40 60 80 100 年 RFS 中央値:RFSの中央値に達していません:13.4か月免疫応答者(n = 8)免疫非応答者(n = 8)免疫非応答者(n = 8)) 0 6 12 18 24 30 0 1 2 3 4 RFS の中央値に達していません:RFSの中央値に達していません:13.4か月 P = 0.003、時間:0.08(0.01-0.4)P = 0.007、時間:0.14(0.03-0.59)
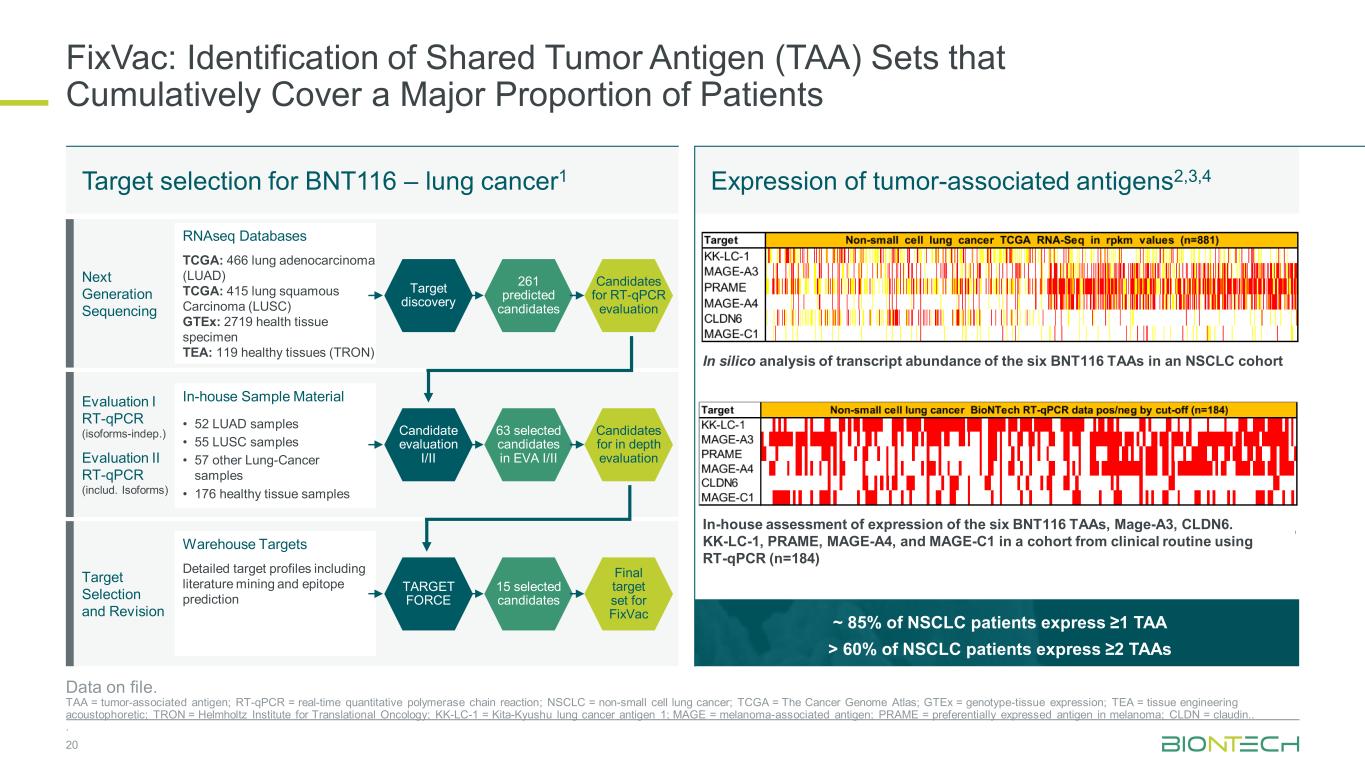
NSCLC患者の約85%が1TAA以上を発現しているNSCLC患者の60%> 2TAA以上を発現します FixVac:患者の大部分を累積的にカバーする共有腫瘍抗原(TAA)セットの同定 20件のデータが登録されています。TAA = 腫瘍関連抗原、RT-qPCR = リアルタイム定量的ポリメラーゼ連鎖反応、NSCLC = 非小細胞肺がん、TCGA = がんゲノムアトラス、GTeX = 遺伝子型-組織発現、TEA = 組織工学音響発現、TRON = ヘルムホルツトランスレーショナルオンコロジー研究所、KK-LC-1 = 北九州肺がん抗原 1; MAGE = メラノーマ関連抗原; PRAME = メラノーマで優先的に発現する抗原、CLDN = クローディン..BNT116のターゲット選択 — 肺がん1 腫瘍関連抗原の発現 2,3,4 次世代シーケンシング評価 I RT-qPCR(アイソフォームインデップ)評価II RT-qPCR(含む。アイソフォーム)ターゲットの選択と改訂 RNAseqデータベース TCGA:466個の肺腺がん(LUAD)TCGA:415個の肺扁平上皮がん(LUSC)GTeX:2719個の健康組織検体 TEA:119個の健康組織(TRON)社内サンプル材料 • 52個のLUADサンプル •55個のLUSCサンプル •57個のその他の肺がんサンプル •176個の健康組織サンプル倉庫ターゲットを含む詳細なターゲットプロファイル文献マイニングとエピトープ予測ターゲット発見候補評価I/II TARGET FORCE RT-qPCR評価のための候補詳細な評価のための候補FixVacの最終ターゲットセット261件の予測候補者 EVA I/IIで63件の候補が選ばれました。15件の候補NSCLCコホートにおける6つのBNT116 TAAの転写産物の存在量のインシリコ分析6つのBNT116 TaA、Magen-A3、CLDN6の発現に関する社内評価。RT-qPCR(n=184)を用いた臨床ルーチンのコホートにおけるKK-LC-1、PRAME、MAGE-A4、MAGE-C1

N = 130N = 130 BNT116:単剤療法および併用療法としての非小細胞肺がんにおける幅広い評価 21 1.リジェネロンが後援しています。NSCLC = 非小細胞肺がん、FIH= ヒトで初めて、PD-L1 = プログラム細胞死リガンド1、TPS = 腫瘍割合スコア、RECIST = 固形腫瘍における反応評価基準、ECOG PS = 東部協同組合腫瘍学グループのパフォーマンスステータス、DLT = 用量制限毒性、ORR = 全体的な奏効率、DOR = 奏効期間、DCR = 疾病コントロール率、DDC = 疾患コントロール期間、PFS = 無増悪生存、OS = 全生存、TEAE = 治療上の緊急有害事象、SAE = 重篤な有害事象、CRT =化学放射線療法。主要エンドポイント:サイクル1でのDLTの発生、安全性副次評価項目:ORR、DoR、DCR、DDC、PFS、OS、治療終了後最大24か月間の3か月ごとのフォローアップ主要エンドポイント:ORR副次評価項目:OS、PFS、DOR、TEAE、SAES Luca-Merit-1:安全性、忍容性、および予備的有効性を評価するFIH、オープンラベル第I相試験 BNT116単独およびNSCLCの併用(NCT05142189)EmpowerVax-Lung1:パーキンソン病を伴う進行性NSCLC患者の第一選択治療におけるセミプリマブとBNT116の併用とセミプリマブ単剤療法の第2相試験-L1 ≥ 50% (NCT05557591) 選択基準コホート1—4: 切除不能 (ステージIII) または転移性 (ステージIV) NSCLC コホート5: 切除不能 (ステージIII) CRT後のNSCLC コホート6: 切除可能 (診断時のステージIIまたはIII) NSCLCコホート1、4、5:ECOG PS 0-2 Co-2 ホート2、3、6:ECOG PS ≤1主な選択基準 • 進行した未治療のNSCLC(IIIB、IIICまたはIV期の扁平上皮性または非扁平上皮性NSCLC、外科的切除または根治的化学放射線療法の対象外)• PD-L1の発現TPS ≥50% • RECIST 1.1によりX線で測定可能な病変が少なくとも1つあること • ECOG-PS ≤1 BNT116 +セミプリマブ(n=20)(虚弱患者)オプション:サイクル3以降のセミプリマブ BNT116単剤療法(n=30)Deme D. et al.セクション。2023年。BNT116 + セミプリマブ(n=20)(PD-L1 ≥ 50%、PD-1またはPD-L1阻害剤による進行性疾患、第一選択/調整として)。Tx) BNT116 + ドセタキセル (n=20) オーブン BBなど。アクア。2024年。BNT116 + セミプリマブ(n=20)(同時CRT後)BNT116 + セミプリマブ+カルボプラチン+ パクリタキセル(ネオアジュセラピー)> 手術 > BNT116+ セミプリマブ(補助療法)(n=20)1 2 3 4 5 6 R 1:1 アーム A:セミプリマブアーム B:BNT116 +セミプリマブ最長24ヶ月または病気が進行するまで
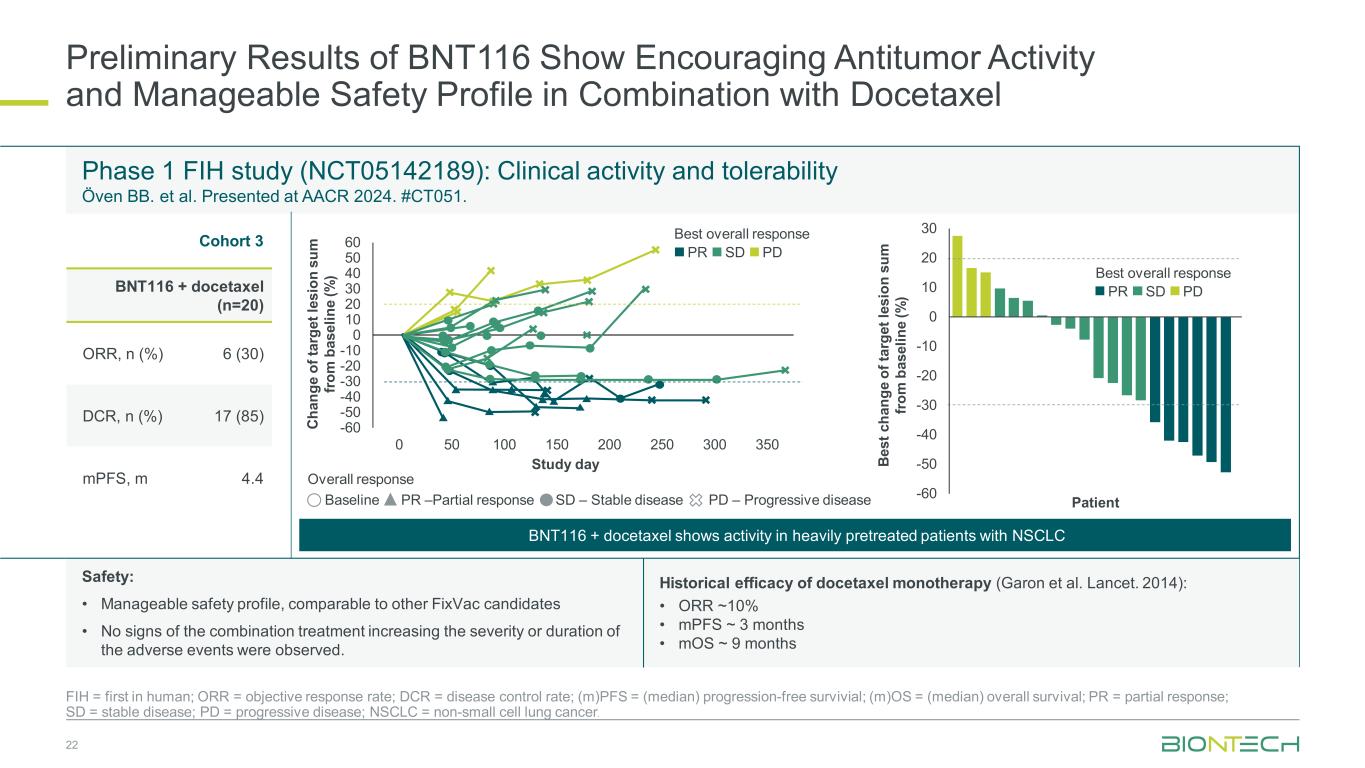
BNT116の暫定結果は、ドセタキセルとの併用で有望な抗腫瘍活性と管理可能な安全性プロファイルを示しています 22 FIH = ヒトで初、ORR = 客観的奏効率、DCR = 疾患コントロール率、(m)PFS =(中央値)無増悪生存期間、(m)OS =(中央値)全生存期間、PR = 部分奏効、SD = 病勢安定、PD = 進行性疾患、NSCLC = 非小細胞肺炎小細胞肺がん。第1相FIH試験(NCT05142189):臨床活性と耐容性 Oven BB. らAACR 2024で発表されました。#CT051。コホート3 BNT116+ ドセタキセル (n=20) ORR, n (%) 6 (30) DCR, n (%) 17 (85) MPFS、m 4.4 Ch、もしその年齢が、私の場合、m b as el in e (%) -60 -50 -40 -30 -20 -30 -20 -30 -50 20 40 40 50 500 200 200 200 250 350 研究日の総合反応最高総合奏効 PR SD PD Be st c ha ng e of ta rg et le si on s um for m b as el in e (%) -60 -50 -40 -30 -20 -10 0 10 20 30 最高の総合反応 PR SD PD BNT116 + ドセタキセルは、NSCLCベースラインでかなり前治療された患者に活性を示します PR —部分奏効SD —安定した病状PD —進行性疾患患者ドセタキセル単剤療法の歴史的効能(Garon et al.ランセット。2014):• ORR ~ 10% • MPFS ~ 3 か月 • MoS ~ 9 か月安全性:• 他のFixVac候補に匹敵する、管理しやすい安全性プロファイル • 併用療法によって有害事象の重症度や期間が延びる兆候は見られませんでした。

ASCO2024のバイオテック23 1.ゲンマブと提携しています。2.ビオテウスと提携。3.メディリンクと提携しています。4.ロシュグループのメンバーであるジェネンテックと提携しました。関連プログラム適応試験 BNT311/GEN1046 (アカサンリマブ) 1 2L 非小細胞肺がんフェーズ 2 BNT327/PM80022 子宮頸がんおよび白金抵抗性卵巣がんフェーズ 1/2 BNT327/PM80022 非小細胞肺がんフェーズ 1/2 BNT326/YL2023 非小細胞肺がんおよび乳がんフェーズ 1 自家遺伝子セブメラン (BNT122) 4 大腸がんの疫学研究 BNT211胚細胞腫瘍の実世界のデータポートフォリオ全体で、さらなる発展の方向性について情報に基づいた意思決定を行うためのデータ

3 決算最高財務責任者イェンス・ホルスタイン
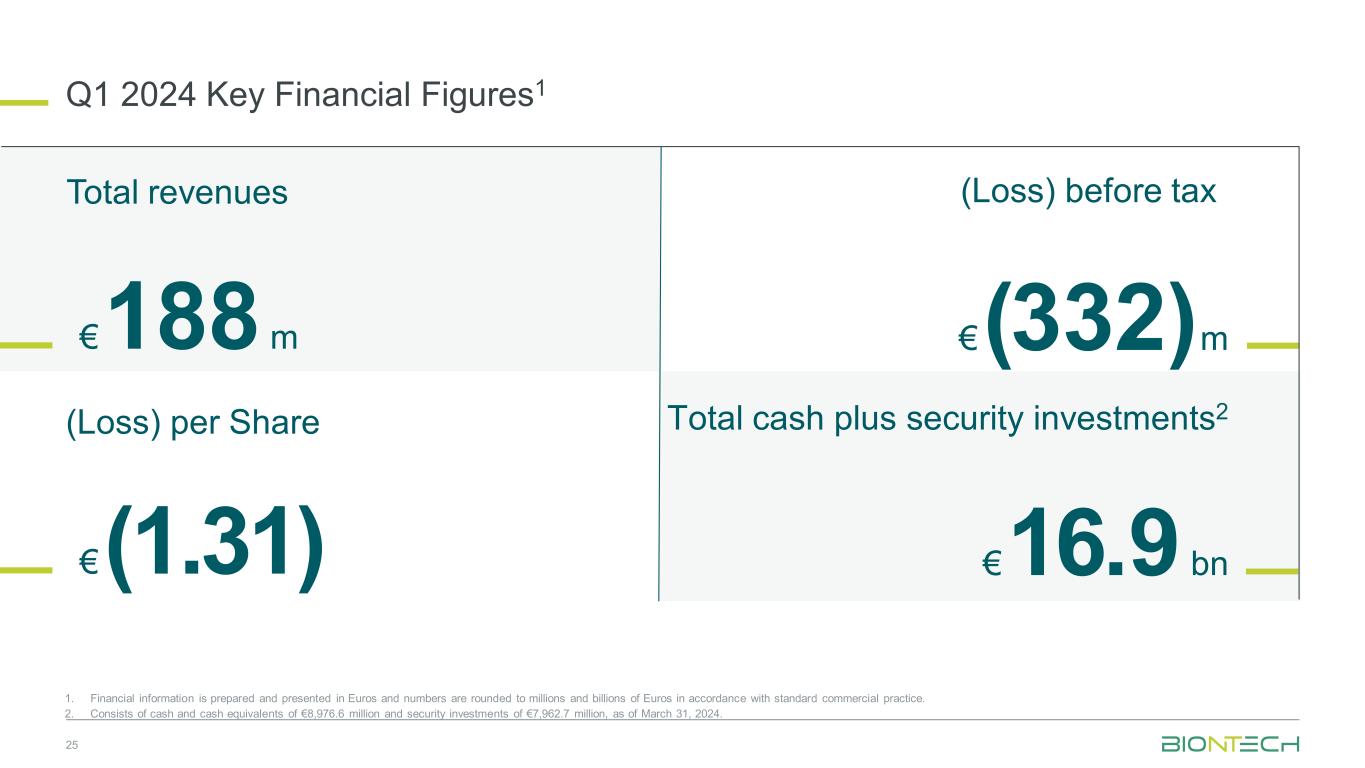
2024年第1四半期の主要な財務数値1 25 1.財務情報はユーロで作成、表示され、標準的な商慣行に従って数値が数百万ユーロから数十億ユーロに四捨五入されます。2.2024年3月31日現在、8,9億7,660万ユーロの現金および現金同等物と79億6,270万ユーロの証券投資で構成されています。税引前の(損失)(131ユーロ)(332)m1.88億ユーロ1株あたりの総収益(損失)169億ユーロ現金と証券投資の合計2

2024年第1四半期の財務結果 26 1.数字は四捨五入されているため、表示されている数字は合計と正確に一致しない場合があり、表のコンテキストで調整されている可能性があります。連結損益計算書の表示が要約されました。2.BioNTechの利益シェアは、2024年5月6日に提出された2024年3月31日に終了した3か月間のBioNTechのForm 6-Kレポートで詳しく説明されているように、ファイザーとバイオエヌテックの間で共有された暫定データに基づいて推定されます。コラボレーションパートナーの総利益の推定シェアに変化があった場合は、将来的に認識されます。総収益は、BioNTechのForm 6-K 3に関するレポートで詳しく説明されているように、COVID-19ワクチンの収益とその他の収益で構成されています。前年度の数値の調整は、内部報告の変更を外部報告にも反映するための一般管理費からその他の運営費まで、特定の法的訴訟に関連する外部法的助言の費用に関するものです。(百万ユーロ、1株あたりのデータを除く)1 2024 2023収益2 187.6 1,277.0 売上原価(59.1)(96.0)研究開発費(507.5)(334.0)販売およびマーケティング費用(15.6)(12.2)一般管理費(117.0)(111.8)その他の営業利益から費用を差し引いた3 4.4(68.6)営業利益/(損失)) (507.2) 654.4 金融収入から費用を差し引いたもの 175.4 53.3 税引前利益/ (損失) (331.8) 707.7 所得税 16.7 (205.5) 当期の利益/ (損失) (315.1) 502.2 1株当たりの収益/ (損失) 1株当たりの期間の基本利益/ (損失) (1.31)) 2.07 1株当たり期間の希薄化後利益/ (損失) (1.31) 2.05 3月31日に終了した3か月間 3月31日に終了した3か月

収益ガイダンスの考慮事項:売上高の感度は、主に次の要因に左右されます • Comirnatyの大幅な売上が見込まれる市場におけるワクチン接種率と価格水準 • 在庫の減少 • InstaDeep、JPTペプチドテクノロジー、IMFSなどのサービス事業に関連する予想収益、およびドイツのパンデミック対策協定2024会計年度ガイダンスが繰り返されました1 27 1.現在および/または将来の法的紛争または関連活動の影響を含みますが、これらに限定されない、まだ知られていない、または定量化できない外部リスクを除きます。2.数値には、開示されている範囲での追加のライセンス契約、コラボレーション、または潜在的なM&A取引から特定された影響が含まれており、将来の進展により更新される可能性があります。3.法的訴訟に関連する外部の法的助言に関連する予想費用は、販管費には反映されませんが、2024会計年度のその他の営業費用には反映されません。ガイダンスには、現在または将来の法的紛争や判決や和解などの関連活動の結果から生じる可能性のある支払いは含まれておらず、その影響を受ける可能性があります。4.当社は、2024会計年度にプラスの純利益額を報告する予定はなく、Comirnatyの2024年のグローバル収益の大部分は下半期に記録されると予想しています。IMFS = BioNTechの革新的な製造サービス 2024年度のガイダンス 2024年度の収益総収益は25億ユーロから3億ユーロから3億ユーロ2024年度の費用、営業利益と設備投資4 研究開発費2 24億ユーロ—26億ユーロ販管費3 7億ユーロから8億ユーロ営業活動のための資本支出 4億ユーロから5億ユーロ

4 戦略的展望最高戦略責任者ライアン・リチャードソン

COVID-19ワクチン市場のダイナミクスと展望1 1.ファイザーと提携しています。2.規制当局の承認が必要です。WHO = 世界保健機関、ICMRA = 国際医薬品規制当局連合、EMA = 欧州医薬品庁、VRBPAC = ワクチンおよび関連する生物製剤諮問委員会、ACIP = 予防接種慣行に関する諮問委員会、FDA = 食品医薬品局。JN.1株についてWHO/ICMRAおよびEMA株の推奨を受け取りました 2024年5月の承認後すぐに発売と出荷予定 2024年8月の新規変異株のモニタリング計画:2024年の80以上の地域での夏の終わりの発売季節適応型ワクチン2 プレフィルドシリンジ用量の供給の大幅な増加ワクチン開発可能性FDAの承認可能 2024年7月下旬〜2024年4月 2024年6月に予想されるVRBPAC株の選択、ACIP勧告29の規制当局への提出が予定されていますバリアント適応型ワクチン開発の潜在的な迅速化スケジュール
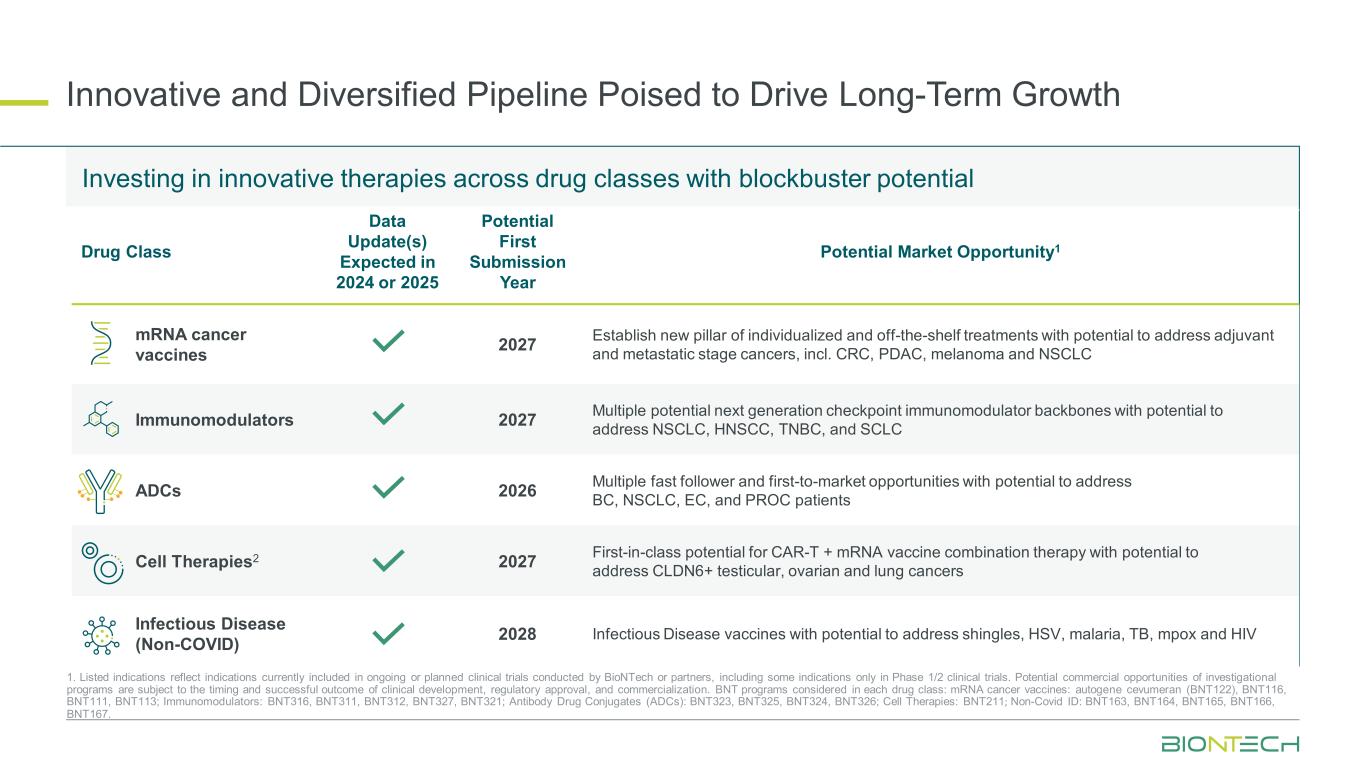
長期的な成長を促進する革新的で多様なパイプライン 1.記載されている適応症は、BioNTechまたはパートナーが実施している進行中または計画中の臨床試験に現在含まれている適応症を反映しています。その中には、第1/2相臨床試験のみの適応も含まれています。治験プログラムの潜在的な商業的機会は、臨床開発、規制当局の承認、および商品化のタイミングと成功結果に左右されます。各薬剤クラスで検討されるBNTプログラム:mRNAがんワクチン:自家遺伝子セブメラン(BNT122)、BNT116、BNT111、BNT113; 免疫調節剤:BNT316、BNT311、BNT312、BNT327、BNT321; 抗体薬物複合体(ADC):BNT323、BNT325、BNT325、BNT321 324、BNT326; 細胞療法:BNT211; 非コビッドID:BNT163、BNT164、BNT165、BNT166、BNT167。大ヒットの可能性を秘めた医薬品クラス全体の革新的な治療法への投資 2024年または2025年に予定されている医薬品クラスデータ更新の可能性のある最初の提出年潜在的な市場機会1 mRNAがんワクチン 2027年 CRC、PDAC、メラノーマ、NSCLC免疫調節剤など、補助がんおよび転移期のがんに対処する可能性のある、個別化された市販治療の新しい柱を確立します 2027 NSCLC、HNSCC、TNBC、およびSCLC ADCに対処する可能性のある、複数の潜在的な次世代チェックポイント免疫調節バックボーン 2026 複数のファストフォロワーとBC、NSCLC、EC、およびPROCの患者に対処する可能性のある、市場初の機会細胞療法2 2027 CLDN6+精巣癌、卵巣癌、肺癌に対処する可能性を秘めたCAR-T+mRNAワクチン併用療法のクラス初の可能性、感染症(非COVID)2028年帯状疱疹、HSV、マラリア、結核、mpoxに対処する可能性のある感染症ワクチン HIV
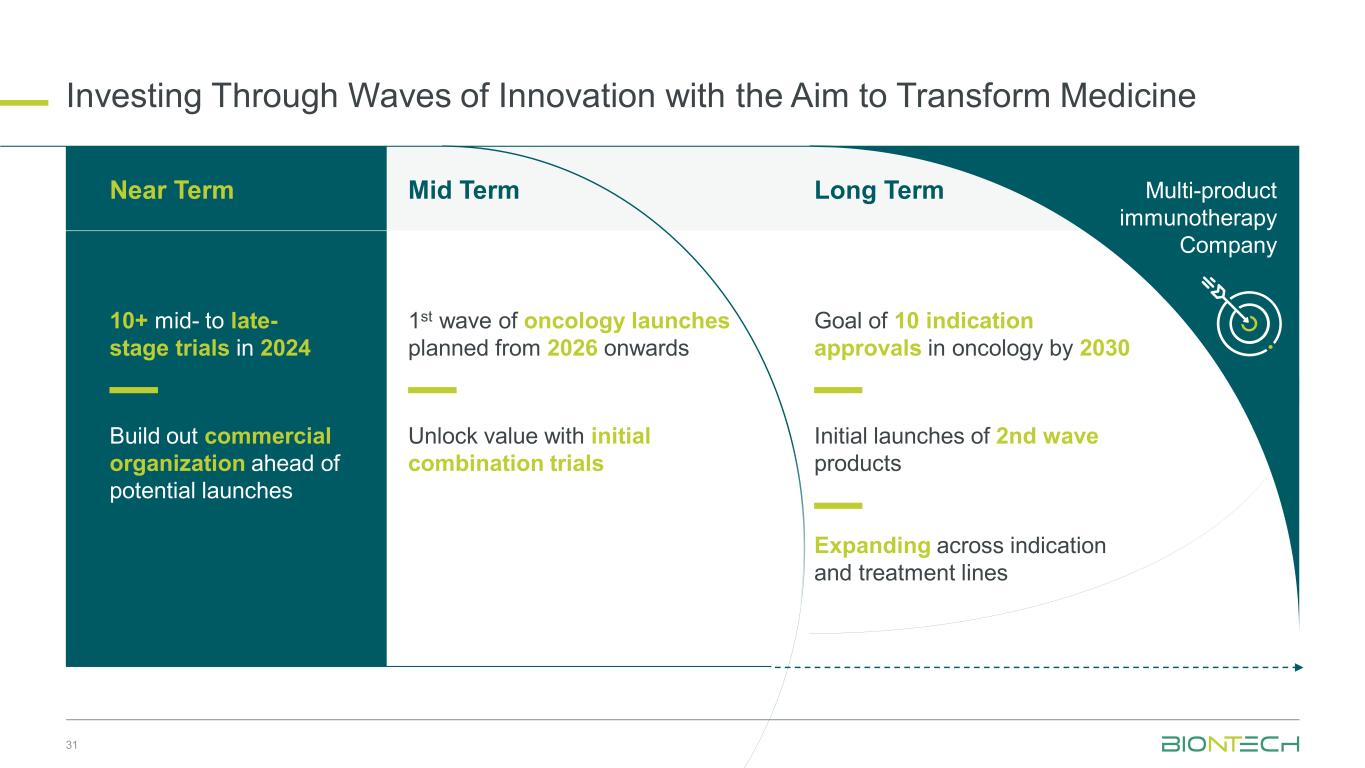
医療の変革を目的としたイノベーションの波を通じた投資 31 2026年以降に予定されているオンコロジーの中期第1波の立ち上げ初期併用試験で価値を引き出す適応症と治療ライン全体での価値の拡大長期目標 2030年までに腫瘍学における適応症承認を10件にする長期目標第2波製品の初回発売マルチプロダクト免疫療法会社 2024年に10件以上の中期から後期段階の試験:短期発売予定に先立って商業組織を構築する

日付を保存してください 2024年5月17日年次総会イノベーションシリーズ:デジタルとAI 2024年10月1日イノベーションシリーズ 2024年11月14日

ありがとう

付録

パイプラインの推進:2024年のデータマイルストーンを選択してください 35 1.ゲンマブと提携しています。2.OnCoc4と提携しています。3.DualityBioと提携しています。4.ビオテウスと提携。5.ファイザーと提携しました。NSCLC = 非小細胞肺がん、R/R = 再発/屈折症。プログラム適応症ターゲットマイルストーンオンコロジー BNT311/GEN1046(アカサンリマブ)1 R/Rを満たしました。NSCLC、+/-ペムブロリズマブフェーズ2データ BNT312/GEN10421 複数の固形腫瘍 Ph1/2拡張コホートデータ BNT316/ONC-392(ゴシストバート)2 複数の固形腫瘍 Ph1/2拡張コホートデータ BNT323/DB-13033 複数の固形腫瘍 Ph1/2拡張コホートデータ BNT325/DB-13053複数の固形腫瘍 Ph1/2拡張コホートデータ BNT325/DB-13053複数の固形腫瘍 Ph1/2拡張コホートデータ BNT325/DB-13053 複数の固形腫瘍 Ph1/2データ 327/PM80024 多発性固形腫瘍フェーズ2データ感染症 BNT162B25 COVID-19、オミクロン XBB.1.5 一価ワクチン、フェーズ 2/3 データ BNT1675 帯状疱疹第1相試験の最新情報