
2024年5月 ZYNLONTA R/R MZL フェーズ 2 IIT 初期データ別紙 99.2

2 将来の見通しに関する記述このプレゼンテーションとそれに付随する口頭発表は、ADC Therapeutics SA(「ADC Therapeutics」、「私たち」または「当社」)が情報提供のみを目的として作成したもので、他の目的では作成していません。このプレゼンテーションに含まれる内容は、発表者、ADC Therapeutics、またはADC Therapeuticsの役員、取締役、従業員、代理人、または顧問による推奨、約束、または表明ではなく、またそのように解釈されるべきでもありません。このプレゼンテーションは、すべてを網羅しているわけでも、必要な情報をすべて含んでいるわけでもありません。このプレゼンテーションとそれに付随する口頭発表で提供される情報は、本書の日付の時点でのみ記載されています。このプレゼンテーションには、1995年の民間証券訴訟改革法のセーフハーバー条項の意味における将来の見通しに関する記述が含まれています。場合によっては、将来の見通しに関する記述を「かもしれない」、「仮定する」、「するだろう」、「期待する」、「期待する」、「意図する」、「計画」、「予想する」、「信じる」、「見積もる」、「予測する」、「潜在的な」、「思われる」、「求める」、「未来」、「続く」、「現れる」、「現れる」、「現れる」などの用語で区別できる場合があります。これらの用語または類似の表現のうち。ただし、すべての将来の見通しに関する記述にこれらの識別語が含まれているわけではありません。将来の見通しに関する記述には、実際の結果が記載されているものと大きく異なる原因となる特定のリスクと不確実性の影響を受けます。このような違いを引き起こす可能性のある要因には、マイアミ大学の治験責任医師主導のr/r MZL試験の将来の時期と結果、規制当局の承認またはNCCN大要への掲載の可否、MZL市場機会の見積もり、当社の最新の企業戦略の成功、2025年第4四半期初頭に予想されるキャッシュランウェイ、新しい商業的ゴー・トゥ・トゥー・トゥ・トーの有効性などがありますが、これらに限定されません。市場戦略、新技術との競争、米国でのZYNLONTA® の収益を伸ばす会社の能力州; スウェーデンのOrphan Biovitrum AB(Sobi®)が欧州経済領域でZYNLONTA® の商品化を成功させた能力、市場での受け入れ、十分な償還範囲、およびそこから得られる将来の収益。Overland ADCT BioPharmaが提出した中国のZynLONTA® のBLAの承認と、田辺三菱製薬を含む戦略的パートナーからの将来の収益株式会社様、外国の法域におけるZYNLONTA® の規制当局の承認を得る能力、およびそれらによる将来の収益と当社への支払いの時期と金額パートナーシップ、LOTIS 5と7、ADCT 601と602、FLとMZLでのIITを含む当社またはそのパートナーの研究開発プロジェクトまたは臨床試験、および標的、リンカー、ペイロードが異なる特定の固形腫瘍の早期研究の時期と結果、当社の製品または製品候補に関する規制当局の提出のタイミングと結果、FDAまたは外国の規制当局による措置、予測収入、経費、事業開発または研究協力取引を締結する会社の能力、会社の負債(ヘルスケア・ロイヤルティ・マネジメント、ブルー・オウルおよびオークツリーの施設を含む)、そのような債務によって会社の活動に課せられる制限、さまざまな契約の条件を遵守してそのような債務を返済する能力、およびそのような債務の返済に必要な多額の現金、および研究、開発、臨床、および商業活動のための財源およびその他の資源を獲得する会社の能力。実際の結果が将来の見通しに関する記述で予想されるものと大きく異なる原因となる可能性のあるこれらおよびその他の要因に関する追加情報は、フォーム10-Kおよびフォーム10-Qの当社の年次報告書の「リスク要因」セクションと、当社のその他の定期および最新報告および米国証券取引委員会への提出書類に含まれています。これらの記述には、既知および未知のリスク、不確実性、および実際の結果、業績、業績、または見通しが、そのような将来の見通しに関する記述で表明または暗示される将来の結果、業績、成果、または見通しと大きく異なる原因となる可能性のあるその他の要因が含まれています。当社は、この文書に含まれる将来の見通しに関する記述に過度に依存しないように投資家に警告しています。将来の見通しに関する記述は、経営陣の信念と仮定、および経営陣が現在入手可能な情報に基づいています。このような将来成果が達成されるという保証はありません。このプレゼンテーションに含まれるこのような将来の見通しに関する記述は、このプレゼンテーションの日付の時点でのみ述べられています。当社は、適用法で義務付けられている場合を除き、当社の期待の変化、またはそのような記述の基礎となる出来事、条件、状況の変化を反映するために、このプレゼンテーションに含まれるこれらの将来の見通しに関する記述を更新する義務または約束を明示的に否認します。そのような将来の見通しに関する記述の正確性について、(明示または黙示を問わず)いかなる表明または保証も行われません。このプレゼンテーションに含まれる特定の情報は、第三者の情報源や社内の見積もりや調査から得られた研究、出版物、調査、その他のデータに関連する、またはそれらに基づいています。このプレゼンテーションの日付の時点で、これらの第三者の情報源は信頼できると考えていますが、第三者の情報源から入手した情報の妥当性、公平性、正確性、完全性について独自に検証しておらず、またその妥当性、公平性、正確性、完全性についても表明していません。さらに、このプレゼンテーションに含まれるすべての市場データには、いくつかの仮定と制限が含まれており、そのような仮定の正確性や信頼性については保証できません。最後に、私たち自身の内部調査は信頼できると思いますが、そのような調査は独立した情報源によって検証されていません。

3 推定3~4,000人の2L+ MZL患者が米国で薬物治療を受けています1。患者が持続的な奏効を達成したにもかかわらず、満たされていない医療ニーズは高いままです

4 MZL市場とZYNLONTAの概要調査ソース:1.クラリベイトDRG(2022)、グローバルデータ(2017)、Cerner Enviza CancerImpact(2023); 2. NCCNガイドライン; 3.マグノリア:ph2、r/r MZLのシングルアーム、AUGMENT:ph3、r/r InHLのR2対Rのランダム化、ガドリン:r/r inHLのベンダ対ベンダ+ロビンのランダム化、ACE-LY-003:ph2、アカラブルットのPh1b/2研究の第3部(r/r MZLコホート)NHLB細胞ではニニブの単独または併用。4.アルデルッチオら、J・クリン・オンコル(2018)、アルデルッチオら、アム・J・ヘマトール(2019)。MZLの治療と市場の概要毎年推定3〜4万人のMZL患者1が全身抗がんレジメンで治療されています NCCNが推奨する薬剤には、BTKIに加えてすべての系統にわたる抗CD20ベースのレジメンが含まれ、2+2のCR率は2L以上のFDA承認薬とNCCN優先薬では中程度です(つまり、

5 3L以上の現在のMZL治療環境:治療ライン。ソース:1.クラリベイトDRG(2022)、グローバルデータ(2017)、サーナーエンビザキャンサーインパクト(2023); 2.NCCNガイドライン。LOT /疫学1 治療パラダイム2 抗CD20ベースのレジメン BTKI抗CD20ベースのレジメン T細胞媒介療法(AXI-CEL)抗CD20ベースのレジメン BTKIの年間治療患者数 0.8 — 1.3 K 2L 年間治療患者数 2.2 — 3.2 K 1L 年間治療患者数 5.5 — 6.5Kの重点分野
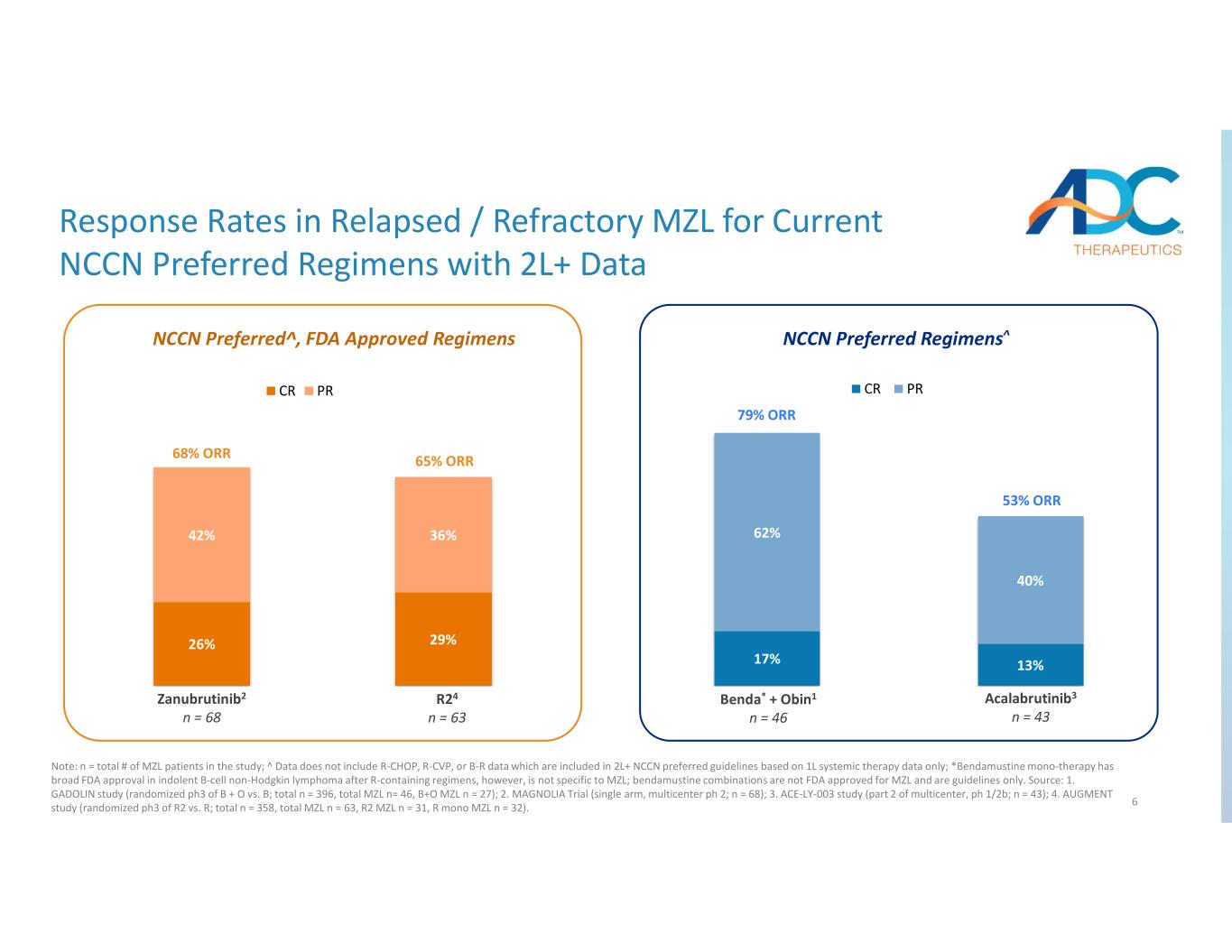
6 17% 13% 62% 40% ベンダ+ オビン1* n=46 アカラブルチニブ4 n=43 CR PR 26% 29% 42% 36% ザヌブルチニブ2 n=68 R25 n=63 CR PR NCCN優先^、FDA承認レジメン NCCN優先レジメン^ 68% ORR 65% または 79% ORR 53% ORR Zan u r tinib2 n 68 24 n 63 Be * + Obin1 n 46 アカラブルチニブ3 n 43 現在のNCCN推奨レジメンにおける再発/難治性MZLの奏効率データノート:n = 研究に参加したMZL患者の総数; ^ データには、2L+ NCCに含まれるR-CHOP、R-CVP、またはB-Rデータは含まれていません 1L全身療法データのみに基づく推奨ガイドライン。*ベンダムスチン単剤療法は、Rを含むレジメン後の潜行性B細胞非ホジキンリンパ腫に対して広くFDAの承認を得ていますが、MZLに限ったものではありません。ベンダムスチンの併用はMZLに対してFDAの承認を受けておらず、ガイドラインにすぎません。ソース:1.ガドリン研究(B+O対Bのランダム化pH3、合計n = 396、合計MZL n= 46、B+O MZL n = 27); 2.マグノリアトライアル(シングルアーム、マルチセンター ph 2; n = 68); 3.ACE-LY-003研究(マルチセンターのパート2、ph 1/2b、n = 43); 4.オーグメント研究(R2対Rのランダム化ph3、合計n = 358、合計MZL n = 63、R2 MZL n = 31、RモノMZL n = 32)。

7 R/R MZLにおけるロンカストキシマブの安全性と有効性を評価するフェーズ2、非盲検試験出典:1.UTX-TGR-205研究(2つのシングルアームコホート、合計n = 710、合計MZL n = 69)。臨床デザイン R/R MZL 以前に1系統以上の全身療法で治療したロンカストキシマブ 150μg/kg (1日目、+/-3) CT/MRIまたはFDG-PET/CT ロンカストキシマブ 75μg/kg (1日目+/-3 q 21日目) CT/MRIまたはFDG-PET/CT 骨髄CT/MRIまたはFDG-PET/CT(スクリーニングサイクル)でのPETアビディティに基づくPETアビディティに基づくCT 3~6 30日間の研究終了 /画像検査によるCRのない画像検査による骨髄CRによるフォローアップ確認研究の概要帰無仮説はH0: P≤P0で、対立仮説はHa: P≧P1です研究開始時に単剤を使用した再燃したMZLは、ウンブラリシブで報告されました。治療を受けた69人の患者で16%です1 この推定に基づいて、帰無仮説では、CR率(P)を16%(P0)と仮定しました。CR率が15%増加し、CR率が31%以上になると予想していました。したがって、対立仮説では、提案された治療法のCR率は 31%(P1)以前の全身治療(clinicaltrials.gov ID:NCT05296070)後のr/r MZL患者50人を対象とした多施設研究(clinicaltrials.gov ID:NCT05296070)2サイトが現在登録中で、5サイトに拡大 20人の患者後の無益性分析研究の根拠
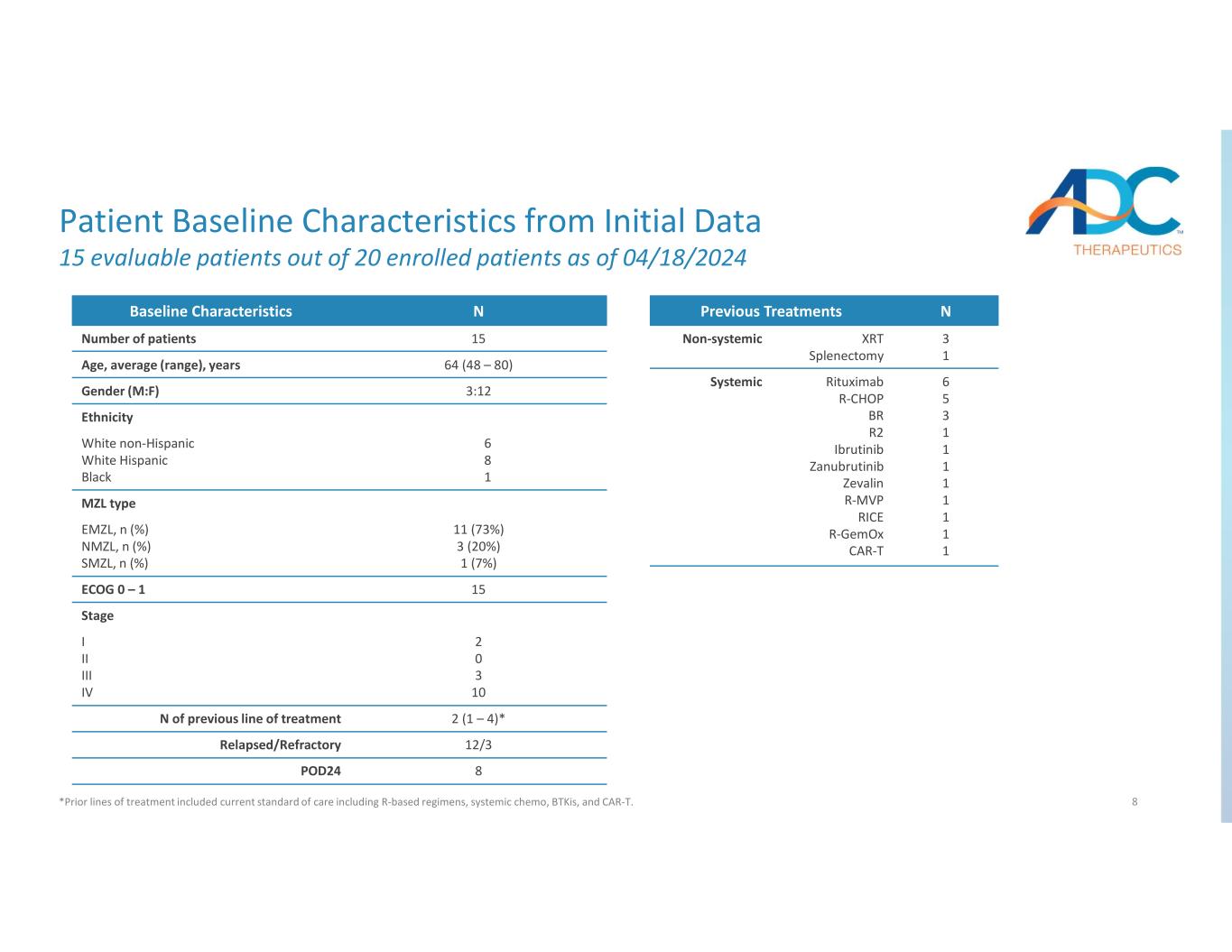
初期データから得た8人の患者ベースラインの特徴 2024年4月18日現在の登録患者20人のうち評価可能な患者15人 *以前の治療ラインには、Rベースのレジメン、全身化学療法、BTKI、CAR-Tなどの現在の標準治療が含まれていました。ベースラインの特徴 15患者数 64 (48 — 80) 年齢、平均 (範囲)、歳 3:12 性別 (M: F) 民族 6 8 1 白人非ヒスパニック系白人ヒスパニック系黒人 MZL タイプ 11 (73%) 3 (20%) 1 (7%) EMZL、n (%) SMZL、n (%) SMZL、n (%) 15ECOG 0 — 1 ステージ 2 0 3 10 I II III IV 2(1 — 4)*前の治療ラインのN 12/3再発/難治性 8POD24 n以前の治療 3 1 XRT 脾摘出術非全身性 6 5 3 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 リツキシマブ R-CHOP BR R2 イブルチニブザヌブルチニブゼバリン R-MVP ライスR-ジェモックス CAR-システミック
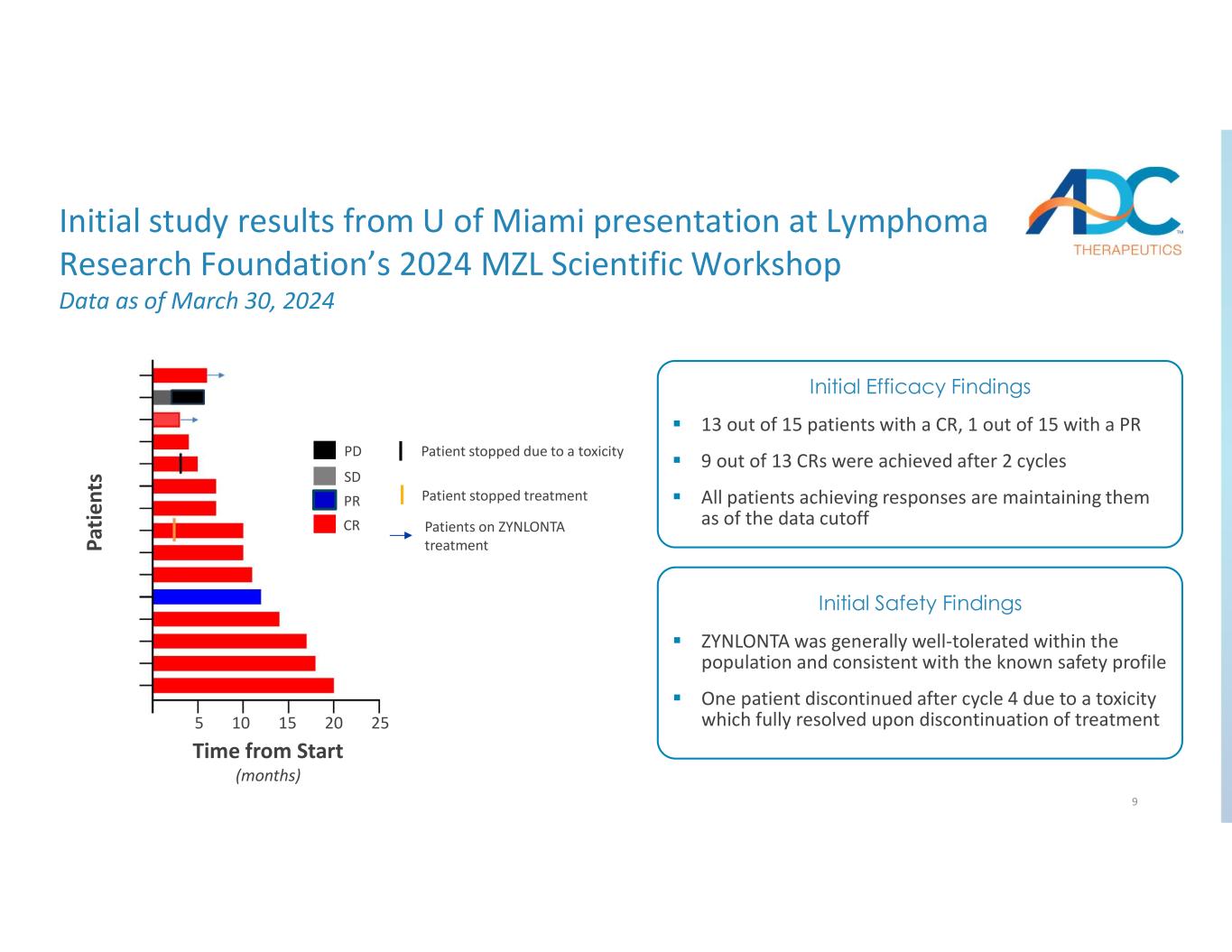
9 PR CR PD SD ZYNLONTA治療中の患者 ZYNLONTA治療中の患者は毒性のために中止されました CR患者15人中13人、PR患者15人中1人、PR13人中9人が2サイクル後に奏効を達成しました。奏効を達成したすべての患者は、データカットオフの時点で反応を維持しています。初期有効性所見によると、ZYNLONTAは集団内で一般的に耐容性が高く、既知の安全性プロファイルと一致していました。サイクル4は毒性によるもので、治療を中止すると完全に解消しました。最初の安全性評価はリンパ腫研究財団の2024 MZL科学ワークショップでのマイアミ大学のプレゼンテーションの研究結果 2024年3月30日現在のデータ Pa timent s 開始からの時間(か月)5 10 15 20 25です
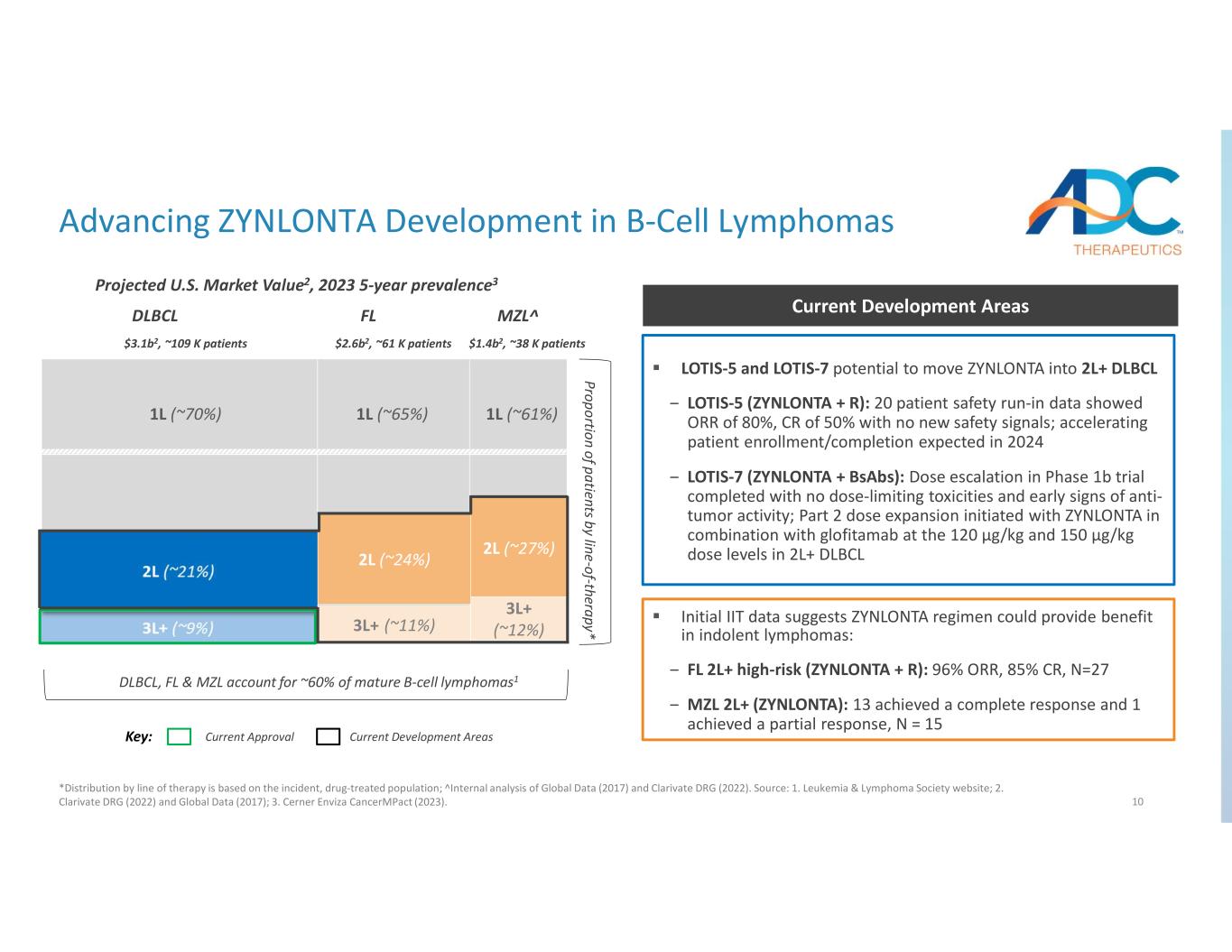
10 治療分野別の患者の割合* DLBCL、FL、MZLが成熟B細胞リンパ腫の約60%を占めています1 1L(〜70%)1L(〜65%)1L(〜61%)MZL^FLDLBCL キー:現在の承認現在の承認現在の開発分野B細胞リンパ腫のZYNLONTA開発を進めています *治療ライン別の分布はインシデント、薬物に基づいています治療対象集団; グローバルデータ(2017年)とクラリベイトDRG(2022年)の内部分析。ソース:1.白血病・リンパ腫学会のウェブサイト; 2.クラリベイトDRG(2022)とグローバルデータ(2017); 3.Cerner Enviza CancerImpact (2023)。2L (~ 24%) 2L (~ 27%) 3L+ (~ 12%) 3L+ (~ 12%) 米国の市場価値2、2023年の5年間の有病率3 LOTIS-5とLOTIS-7は、ZYNLONTAを2L+ DLBCLに移行させる可能性 ‒ LOTIS-5 (ZYNLONTA + R):20人の患者安全に関する慣らしデータでは、ORRが80%、CRが50%であることが示されました。2024年には患者の登録/完了が加速する見込み ‒ LOTIS-7(ZYNLONTA+bsAbs):用量制限毒性作用がなく、抗腫瘍活性の初期兆候もなく完了した第1b相試験の用量増加。パート2では、ZYNLONTAで用量拡大が開始されました2L+DLBCLでの用量レベル120µg/kgおよび150µg/kgのグロフィタマブとの併用。初期のIITデータによると、ZYNLONTAレジメンは潜行性リンパ腫に有益である可能性があります。‒ FL 2L+ 高リスク(ZYNLONTA+ R):96% ORR、85% CR、N=27 ‒ MZL 2L+(ZYNLONTA):13人が完全奏効を達成し、1人が部分奏効を達成しました。N = 15 $3.1b2、約109K人の患者 $26b2、約61,000人の患者 $1.4b2、約38,000人の患者
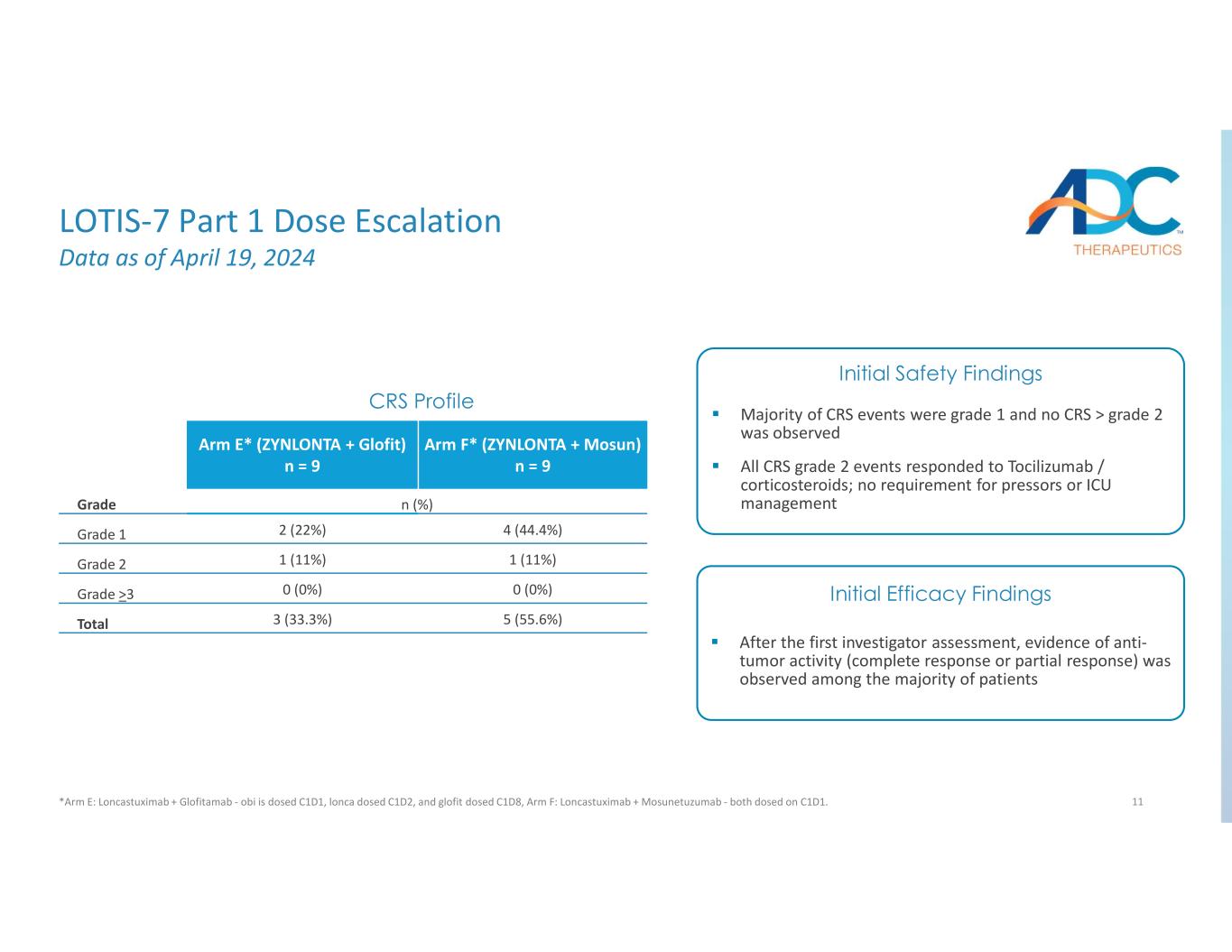
11 Arm F* (ZYNLONTA + Mosun) n = 9 Arm E* (ZYNLONTA + Glofit) n = 9 n (%) グレード 4 (44.4%) 2 (22%) グレード 1 1 (11%) グレード 2 0 (0%) 0 (0%) グレード >3 5 (55.6%) 3 (33.3%) 初回治験責任医師による評価後のCRSプロファイルの総数、証拠大多数の患者で抗腫瘍活性(完全奏効または部分奏効)が観察されました。CRSイベントの大部分はグレード1で、CRSは認められませんでしたが、グレード2を超えるCRSイベントはすべてトシリズマブ/コルチコステロイドに反応しました。プレッサーやICU管理は必要ありません。初期安全性所見初期有効性調査結果 LOTIS-7 Part 1 2024年4月19日現在の用量漸増データ *アームE:ロンカストキシマブ+グロフィタマブ-obiはC1D1、loncaはC1D2、グロフィットはC1D8、アームF:ロンカストキシマブ+モスネツズマブ-どちらもC1D1で投与されています。
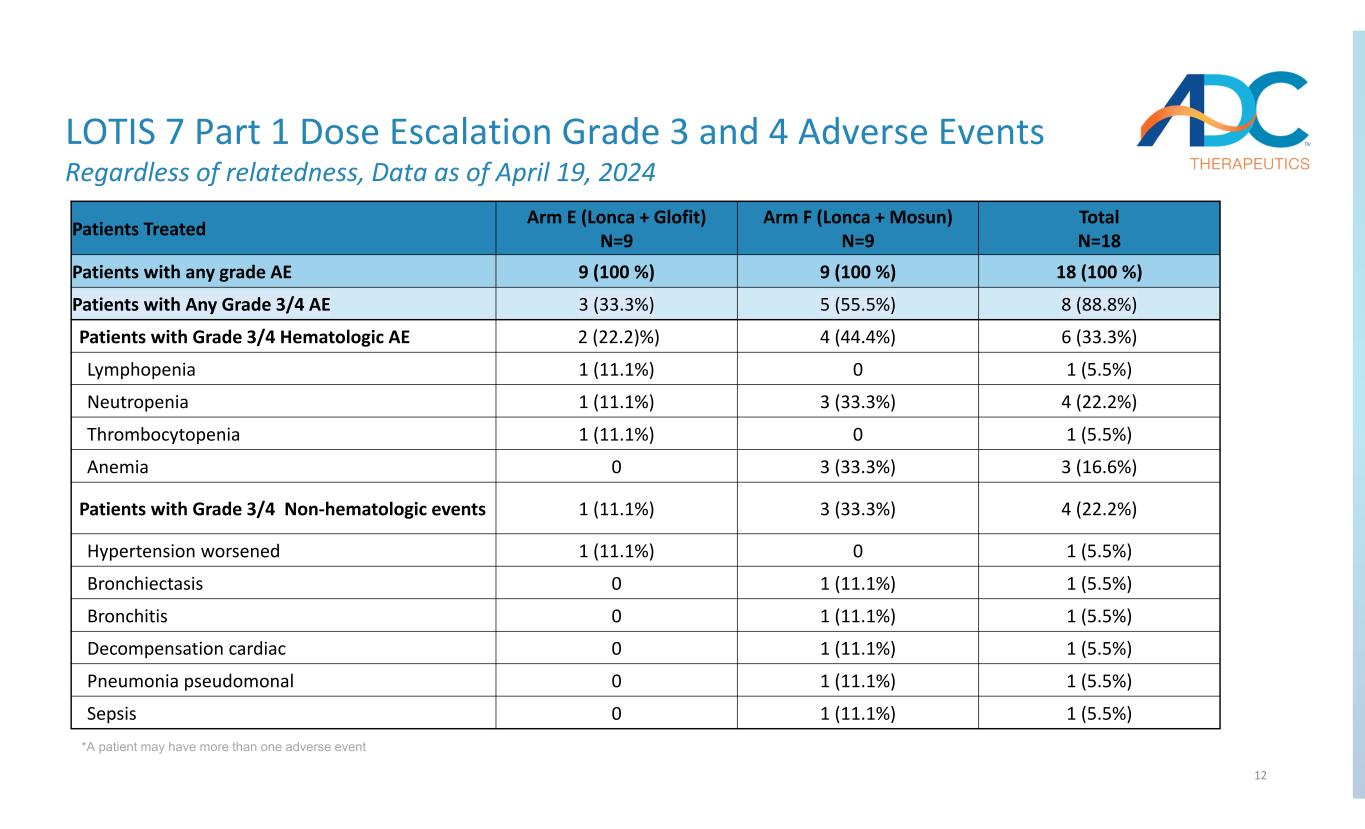
12 LOTIS 7パート1の用量漸増グレード3および4の有害事象関連性に関係なく、2024年4月19日現在のデータ *1人の患者が複数の有害事象を起こす可能性があります。合計N=18アームF(ロンカ+モスン)N=9アームE(ロンカ+グロフィット)N=9人の治療を受けた患者 18(100%)9(100 %)9(100 %)任意のグレードAE 8の患者(88.8%)5(55.5%)3(33.3%)任意のグレード3/4のAE 6の患者(33.3%)4(44.4%)2(22.2)%)グレード3/4の血液学的AE 1(5.5%)01(11.1%)リンパ球減少症4(22.2%)3(33.3%)1(11.1%)好中球減少症1(5.5%)01(11.1%)血小板減少症 3 (16.6%) 3 (33.3%) 0 貧血 (22.2%) 3(33.3%) 1 (11.1%) グレード3/4の非血液学的イベントの患者 1 (5.5%) 01 (11.1%) 高血圧の悪化 1 (5.5%) 1 (11.1%) 0気管支拡張症1 (5.5%) 1 (11.1%) 0気管支炎1 (5.5%) 1 (5.5%) 1 (11.1%) 1 (11.1%) 0代償性心臓 1 (5.5%) 1 (11.1%) 偽肺炎(15.5%)(11.1%)敗血症
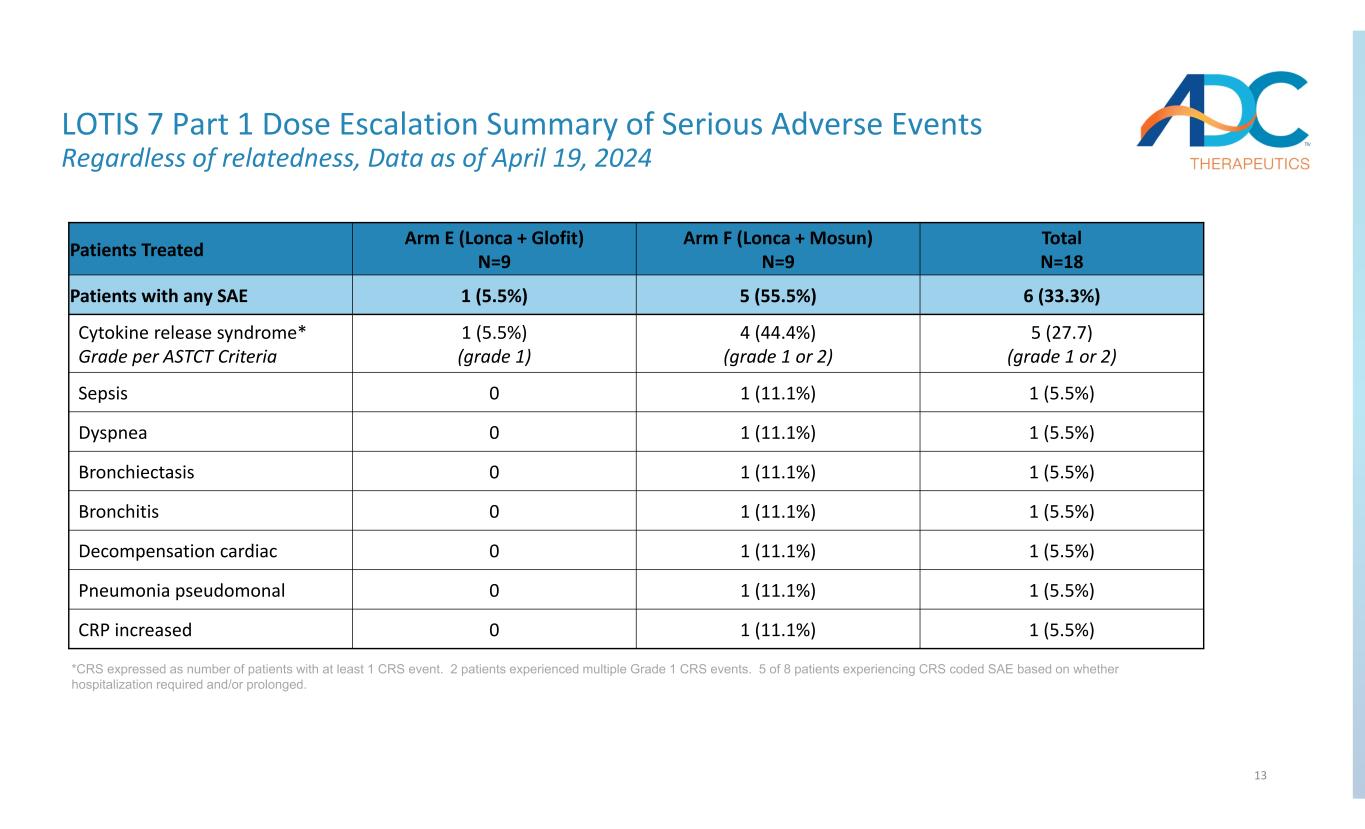
13 LOTIS 7 パート1 重篤な有害事象の用量漸増要約関連性は関係ありません、2024年4月19日現在のデータ *CRSは、少なくとも1つのCRSイベントが発生した患者の数で表されます。2人の患者が複数のグレード1のCRSイベントを経験しました。8人の患者のうち5人は、入院が必要か長期かに基づいて、CRSコード化されたSAEを経験しました。合計N=18 アームF(ロンカ+モスン)N=9 アームE(ロンカ+グロフィット)N=9 治療を受けた患者6(33.3%)5(55.5%)1(5.5%)任意のSAE 5患者(27.7)(グレード1または2)4(44.4%)(グレード1または2)1(5.5%)(グレード1)(グレード1)サイトカイン放出症候群* ASTCT基準によるグレード1 (5.5%) 1 (11.1%) 0敗血症 1 (5.5%) 1 (11.1%) 0呼吸困難 1 (5.5%) 1 (11.1%) 0 気管支拡張症 (5.5%) 1 (11.1%) 0 気管支炎 (15.5%) 1 (11.1%) 0代償性心臓 (5.5%) 1 (11.1%) 0偽肺炎 1 (5.5%) 1 (11.1%) CRPが増加しました