sgmo-202402050001001233偽00010012332024-02-052024-02-05 米国
証券取引委員会
ワシントンD.C. 20549
フォーム 8-K
現在のレポート
第13条または第15条 (d) に基づく
1934年の証券取引法の
報告日 (最初に報告されたイベントの日付): 2024年2月5日
サンガモセラピューティクス株式会社
(憲章に明記されている登録者の正確な名前)
| | | | | | | | | | | | | | |
| | | | |
| デラウェア州 | | 000-30171 | | 68-0359556 |
(州またはその他の管轄区域)
法人化) | | (委員会
ファイル番号) | | (IRS) 雇用主
ID番号) |
501キャナル・ブールバード、 リッチモンド、 カリフォルニア94084
(主要行政機関の住所) (郵便番号)
(510) 970-6000
(登録者の電話番号、市外局番を含む)
該当なし
(前回の報告以降に変更された場合、以前の名前または以前の住所)
フォーム8-Kの提出が、次のいずれかの条項に基づく登録者の提出義務を同時に満たすことを目的としている場合は、下の適切なボックスにチェックを入れてください。
| | | | | |
| ☐ | 証券法(17 CFR 230.425)に基づく規則425に基づく書面による通信 |
| | | | | |
| ☐ | 取引法(17 CFR 240.14a-12)に基づく規則14a-12に基づく資料の勧誘 |
| | | | | |
| ☐ | 取引法(17 CFR 240.14d-2 (b))に基づく規則14d-2 (b) に基づく開始前の連絡 |
| | | | | |
| ☐ | 取引法(17 CFR 240.13e-4 (c))に基づく規則13e-4 (c) に基づく開始前の連絡 |
同法第12条 (b) に従って登録された証券:
| | | | | | | | | | | | | | |
| | | | |
| 各クラスのタイトル | | トレーディングシンボル | | 登録された各取引所の名前 |
| 普通株式、1株あたり額面0.01ドル | | SGMO | | ナスダック・グローバル・セレクト・マーケット |
登録者が1933年の証券法の規則405(この章の§230.405)で定義されている新興成長企業であるか、1934年の証券取引法の規則12b-2(この章の§240.12b-2)で定義されている新興成長企業であるかをチェックマークで示してください。
新興成長企業☐
新興成長企業の場合は、登録者が取引法第13条 (a) に従って規定された新規または改訂された財務会計基準を遵守するために延長された移行期間を使用しないことを選択したかどうかをチェックマークで示してください。☐
項目 8.01 その他のイベント
2024年2月5日、サンガモセラピューティクス株式会社(「サンガモ」または「当社」)は、2月7日に開催される第20回世界シンポジウムでの発表に先立ち、ファブリー病の治療のための完全所有の遺伝子治療製品候補であるイサラルガジェンシパルボベック(ST-920)を評価した第1/2 STAAR試験の予備臨床データの更新を発表しました。2024です。データの概要は以下の通りです。この発表には、2023年9月19日のデータ締め切り日時点で、イサラルガゲン(シバパルボベック)で治療された24人の患者に関するデータが含まれていました。データ締め切り日以降、STAAR第1/2相試験ではさらに4人の患者が投与され、この最新レポートの日付の時点で合計28人の患者が投与されました。
STAAR第1/2相試験のスクリーニングと登録が完了し、残りの登録患者への投与は2024年の前半に予定されています。登録までの道筋について、米国食品医薬品局(FDA)や他の保健当局と生産的な議論が続いています。当社は、共同パートナーシップまたは試験資金が確保されるまで、潜在的な登録試験の計画への追加投資を延期しています。
2024年2月7日の第20回年次世界シンポジウムでの発表に先立ち、2024年2月5日に発表されたIsaralgagene Civaparvovecの第1/2相STAAR試験の最新の予備臨床データの要約です
•STAAR試験は、18歳以上のファブリー病患者を対象としたIsaralgagene ciparvovecの単回注入の安全性と耐容性を評価するために設計された、進行中の第1/2相多施設、非盲検、用量範囲指定の臨床試験です。患者に単回投与で静脈内注入し、52週間経過観察します。この研究で治療を受けた患者を治療後最大5年間監視するために、別の長期フォローアップ研究が進行中です。研究デザインでは、各用量コホートに少なくとも2人の患者を投与することになっており、各コホートで拡大する可能性があります。安定酵素補充療法(「ERT」)を受けている患者は、患者と治験責任医師の裁量により、治療後に管理および監視された方法でERTを中止することができます。
•用量の漸増段階には、古典的なファブリー病の男性が含まれていました。2022年後半に開始されるその後の研究拡大フェーズでは、女性だけでなく、より重度のファブリー関連の心臓病または腎疾患の患者も治療します。この研究の主要評価項目は、治療によって生じる有害事象(「AE」)の発生率です。その他の安全性評価には、日常的な血液学、化学、肝臓検査、バイタルサインモニタリング、心電図、心エコー図、アルファフェトプロテインの連続検査、肝臓の腫瘤形成の可能性を監視するための肝臓の磁気共鳴画像(「MRI」)などがあります。副次的評価項目には、アルファガラクトシダーゼA(「α‑GAL A」)活性、血漿中のグロボトリアオシルセラミド(「Gb3」)とリソ-GB3レベルの1年間の研究期間における特定の時点でのベースラインからの変化、ERT注入の頻度、心臓MRIとRAで測定された腎機能と心機能(左心室腫瘤)の変化が含まれます AV2/6ベクトルクリアランス。主要な探索的エンドポイントには、生活の質、ファブリー症状、神経障害性疼痛スコア、AAV6キャプシドとα-GAL Aに対する免疫反応などがあります。
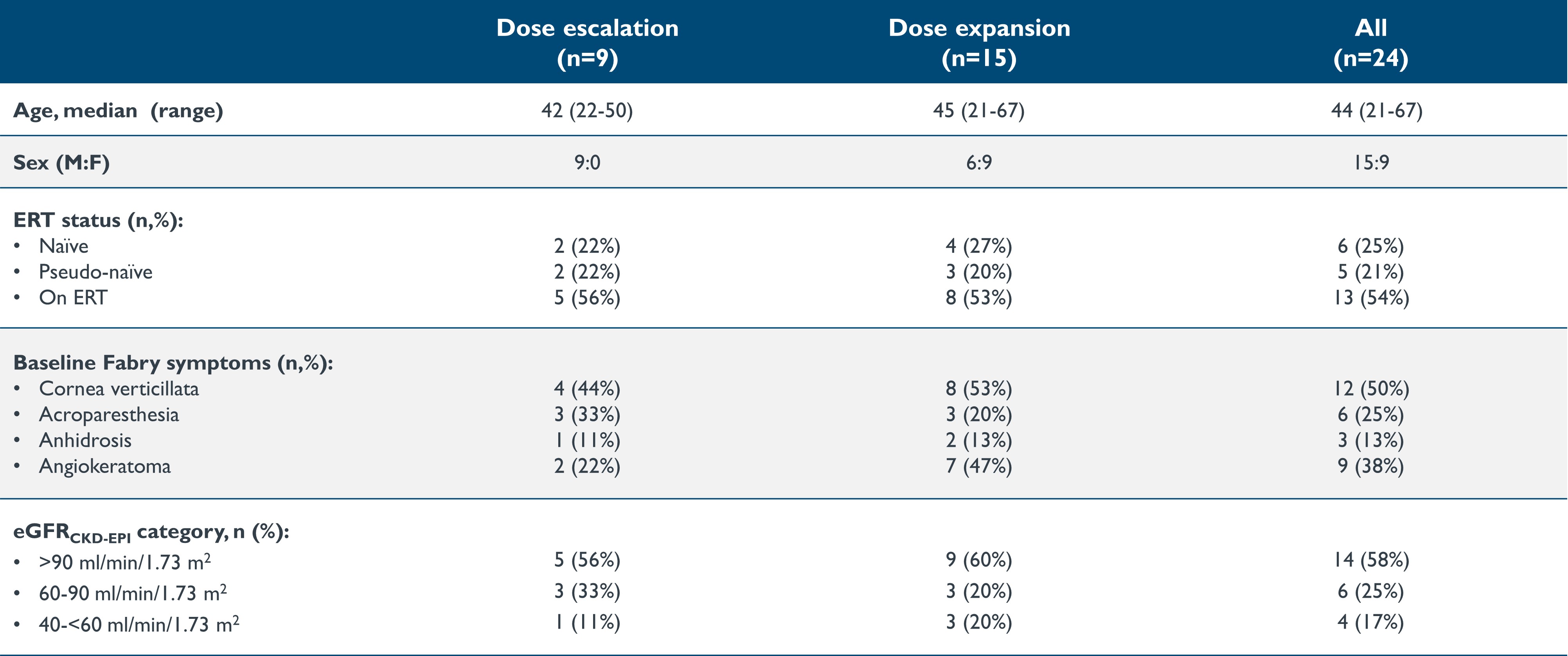
•2023年9月19日のデータ締め切り日現在、21歳から67歳までの24人の患者がイサラルガゲンシバルボベックで治療されました。9人は用量漸増期、15人は研究の拡大段階でした。この24人の患者のベースライン特性を以下の表1に示します。用量漸増段階では、2人の患者がコホート1に0.26x1013 vg/kgの用量で投与され、2人の患者がコホート2に0.53x1013 vg/kgの用量で投与され、3人の患者がコホート3に1.58x1013 vg/kgの用量で投与され、2人の患者がコホート4に2.63xxの用量で投与されました 1013グラム/キログラム。拡大期には、15人の患者に2.63x1013 vg/kgの用量の投与を行いました。2023年9月19日のデータ締め切り日時点で、最初に治療を受けた患者は投与後少なくとも36.2か月間追跡され、最後に治療を受けた患者は投与後0.9週間追跡されていました。
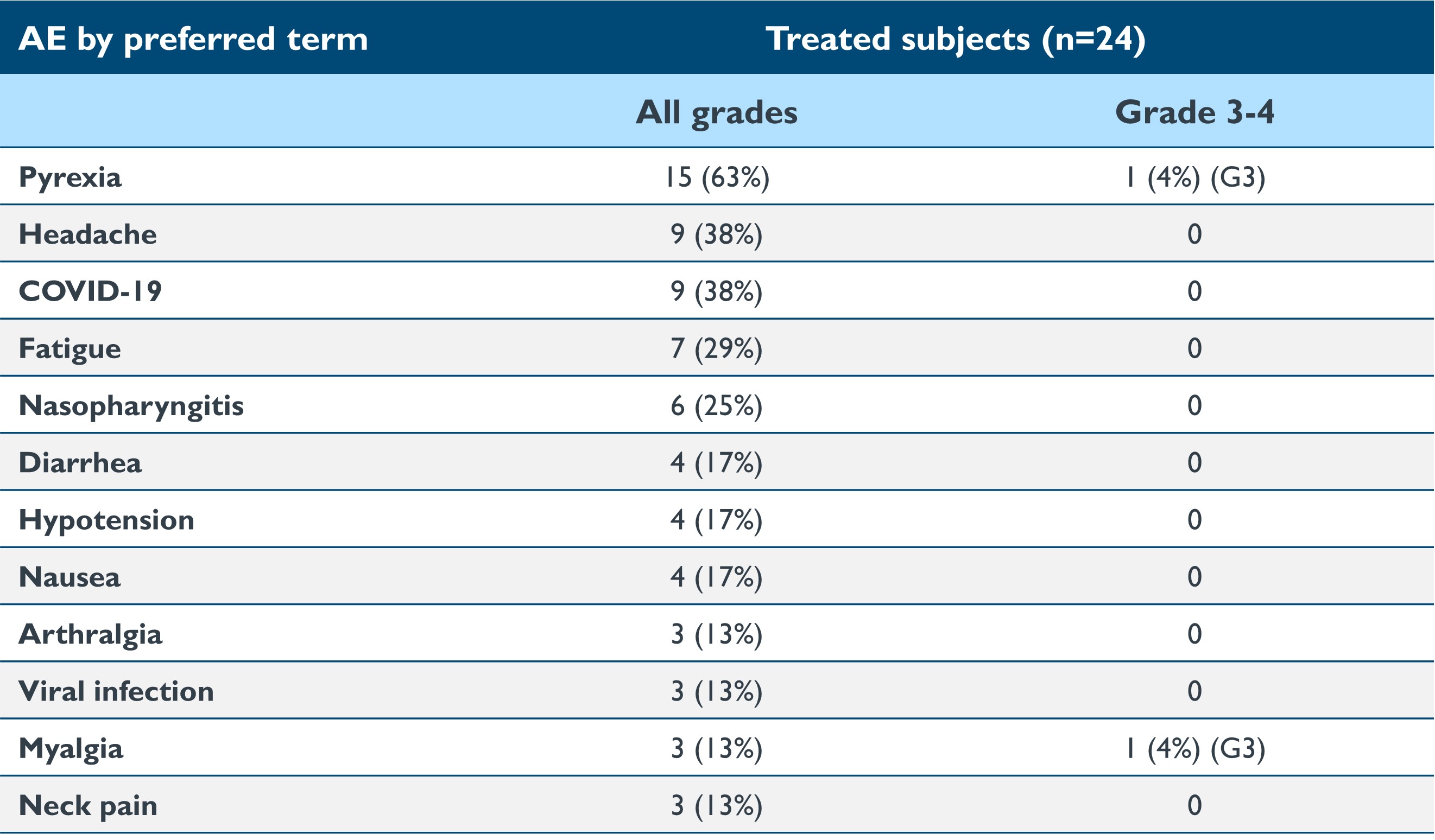
•2023年9月19日のデータ締め切り日現在、isaralgagene civaparvovecは、治療を受けた24人の患者のすべての用量コホートで概ね忍容性が良好で、AEの大多数は軽度(グレード1)または中等度(グレード2)に分類されていました。1人の患者がグレード3の発熱有害事象を経験しました。3人の患者が注入後の高血圧を経験しました:グレード2、ステロイド投与(n=2)、グレード1、生理食塩水ボーラス投与(n=1)。肝機能検査の上昇にはステロイドは必要ありません。予防的なコルチコステロイドやその他の免疫調節剤は投与されていませんでした。2023年9月19日の締め切り日時点で報告された治療関連のAEの概要を以下の表2に示します。治療関連の重篤な有害事象(「SAE」)が4人の患者で報告されました:左腕の痛み(0.53×1013 vg/kg)、敗血症(1.58×1013 vg/kg)、エンセソパシー、脳卒中/虚血性脳卒中(2.63×1013 vg/kg)。どのAEも研究の中止につながりませんでした。
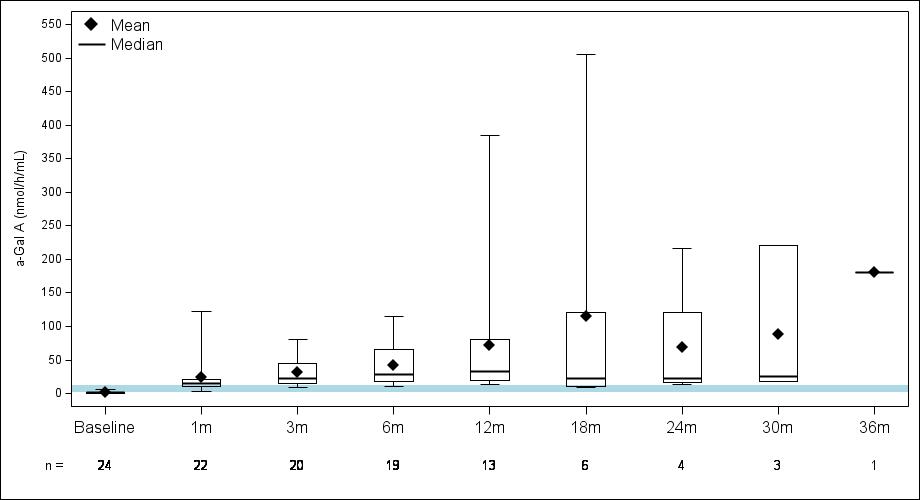
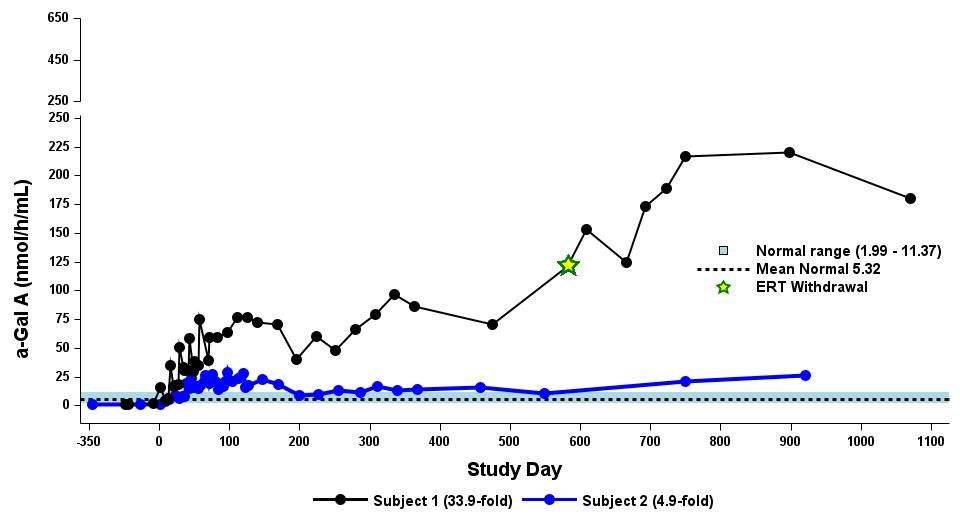
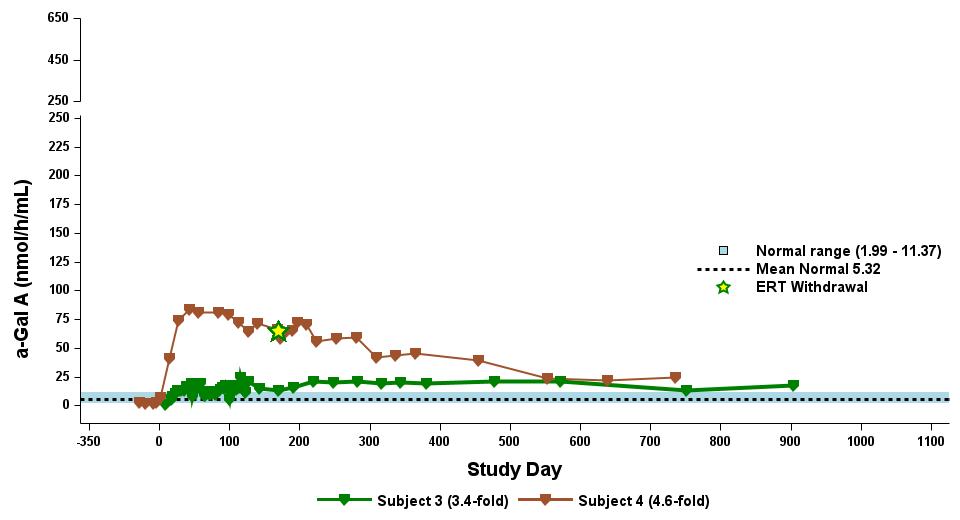
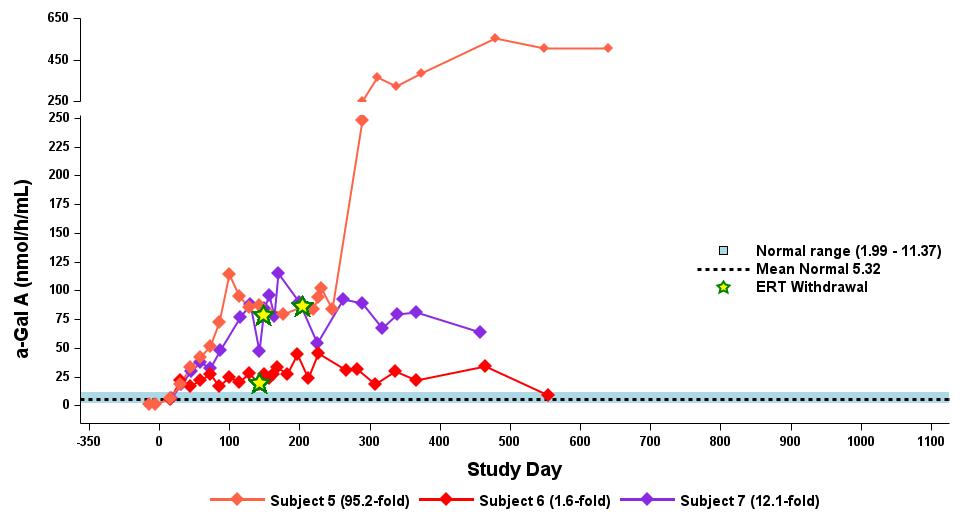
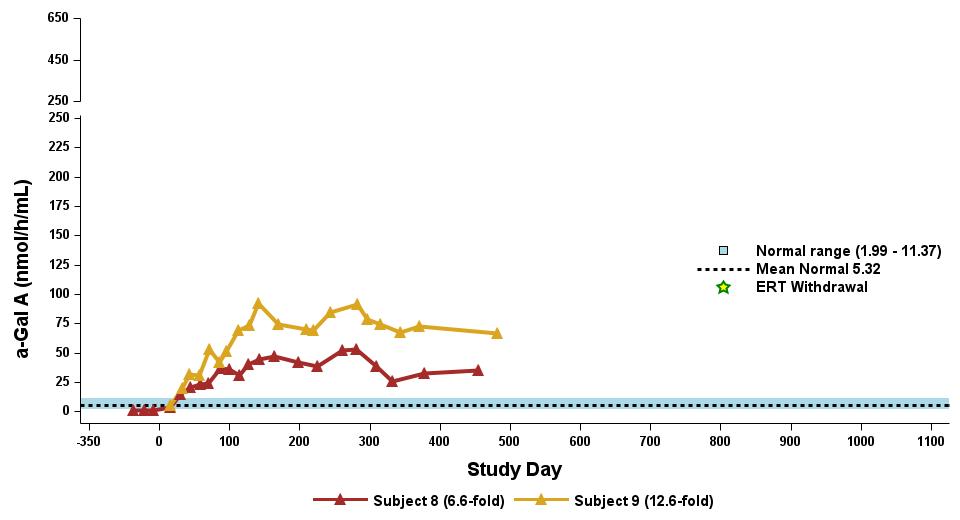
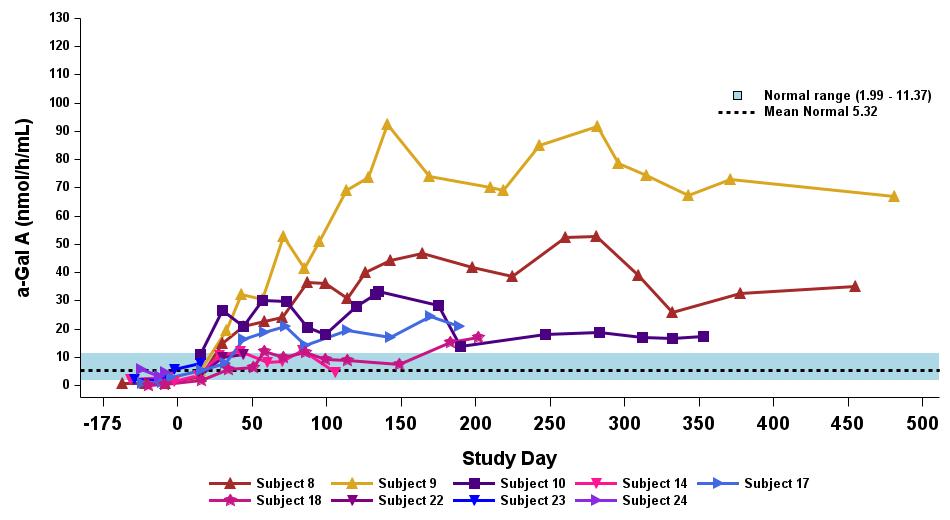
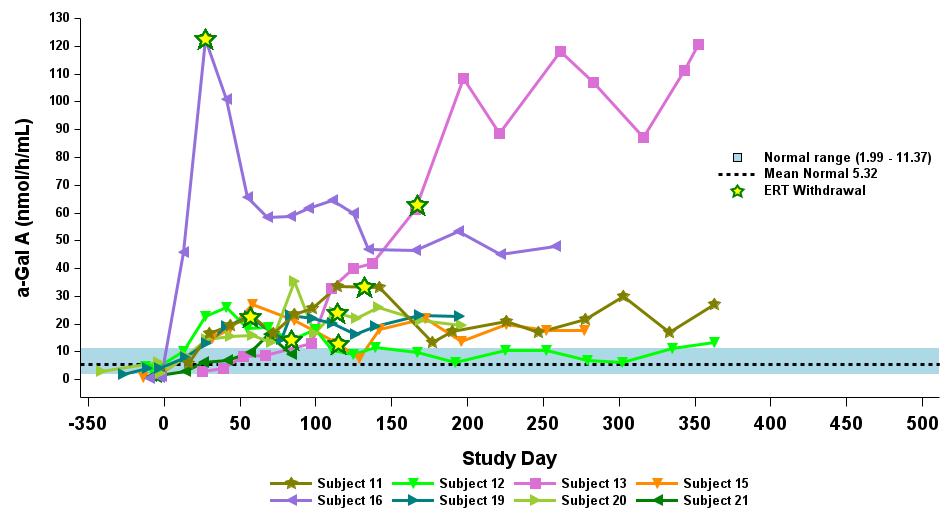
•用量の漸増期と拡大期の24人の患者全員を対象とした、2023年9月19日のデータカットオフ時点の血漿α-GalA活性の結果を表3に示し、以下にさらに詳しく説明します。用量漸増期に治療を受けた9人の患者について、表4に示すように、締め切り日の時点で最長の治療を受けた患者について、9人の患者全員でα-GAL A活性の発現の持続的な上昇が3年近く観察されました。これらの患者さんでは、ST-920を投与してから4〜8週間後にα-GAL A活性の急激な増加が観察されました。ERTに関する研究を開始した5人の患者全員でERTの中止が完了し、ERT離脱後もα-GAL A活性の持続的かつ上昇したレベルが示されました。2024年2月5日現在、これらの患者は誰もERTの再開を必要としていません。用量漸増期のナイーブ患者と疑似ナイーブ患者の場合、最高用量コホートであるコホート4の患者の方が有意に高かった
低用量コホートの患者と比較したα-GAL A活性レベル。2023年9月19日のデータ締め切り日の時点で、これらすべての患者でα-GAL A活性レベルの上昇が持続しました。
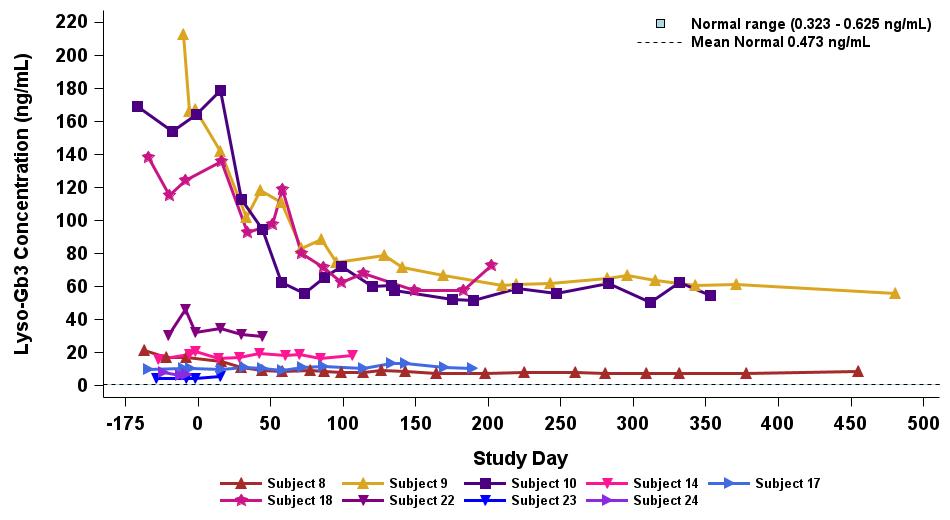
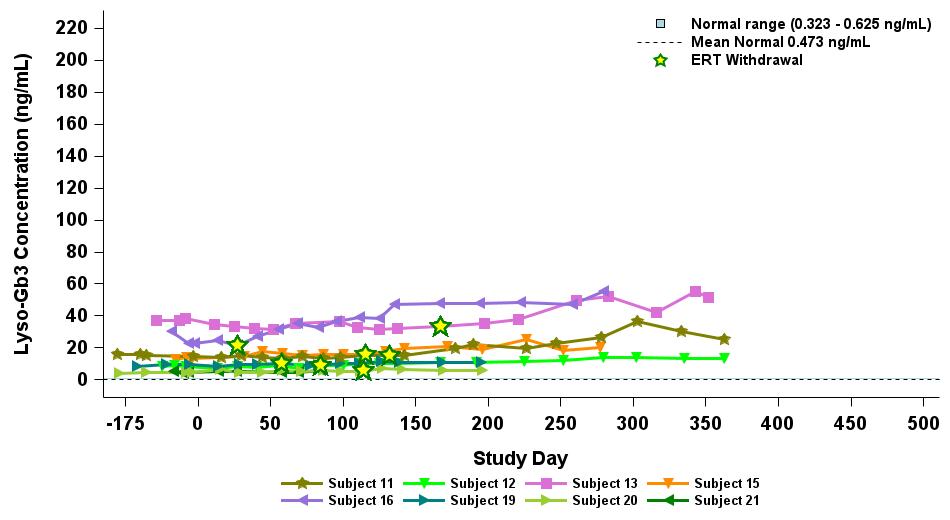
•2023年9月19日のデータ締め切り日現在、最高の用量レベル(2.63 x 1013 vg/kg)を受けたERTナイーブまたは疑似ナイーブ患者は、表5に示すように、最大500日間持続的な超生理学的なα-GAL A活性を示しました。α-GAL A活性の持続的な発現上昇は、Lyso-GB3レベルの低下および/または長期安定化を伴いました。ベースラインで最も高いレベルを示した患者では、血漿Lyso-GB3の減少が最も大きかったです。
•ERTで研究を開始し、その後ERTから中止された12人の患者全員が、表6に示すように、2023年9月19日の締め切り日時点でERTに参加していませんでした。ERTの中止のタイミングは治験責任医師の裁量に委ねられ、イサラルガゲンシパルボベックの投与後8週間以内に行われるようになりました。ERT治療を受けた12人の患者のうち、11人の患者は最大19か月間、超生理学的レベルのα-GAL A活性を示し続け、1人は生理学的レベルを維持しました。拡張用量コホートからの8人のERT治療を受けた患者の禁断症状は、注入後4週目から19週目まで異なりました。重要なのは、血漿Lyso-GB3レベルは、ERTの中止後も最大1年間安定していたことです。
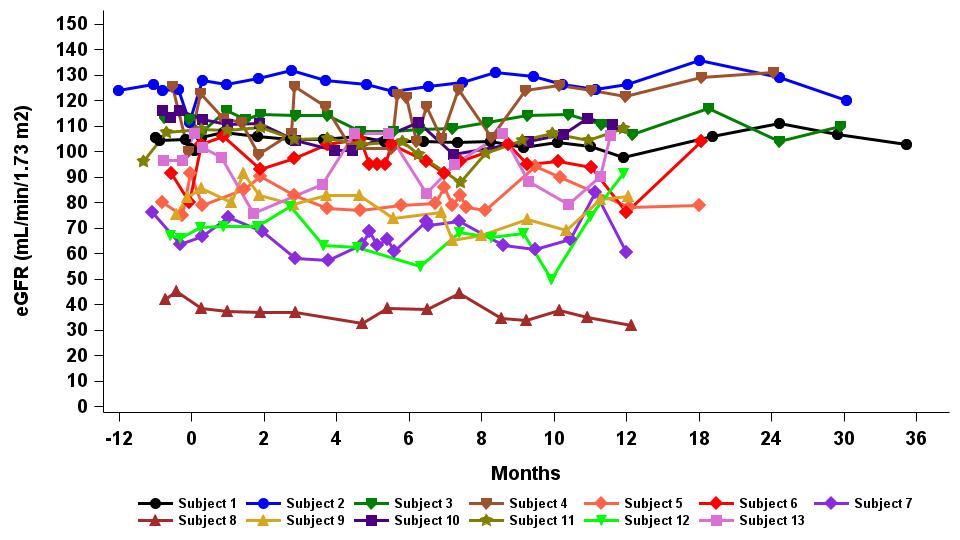
•2023年9月19日のデータ締め切り日時点で12か月以上のフォローアップに達した13人の患者全員が、表7に示すように、推定糸球体濾過率(「eGFR」)で測定すると、副次的評価項目としての腎機能の安定性が維持されました。レベルは患者全体で12か月にわたって維持され、eGFRの年間平均勾配は-0.915 mL/min/1.73m2/年(95%CI:-4.1、2.3)でした。
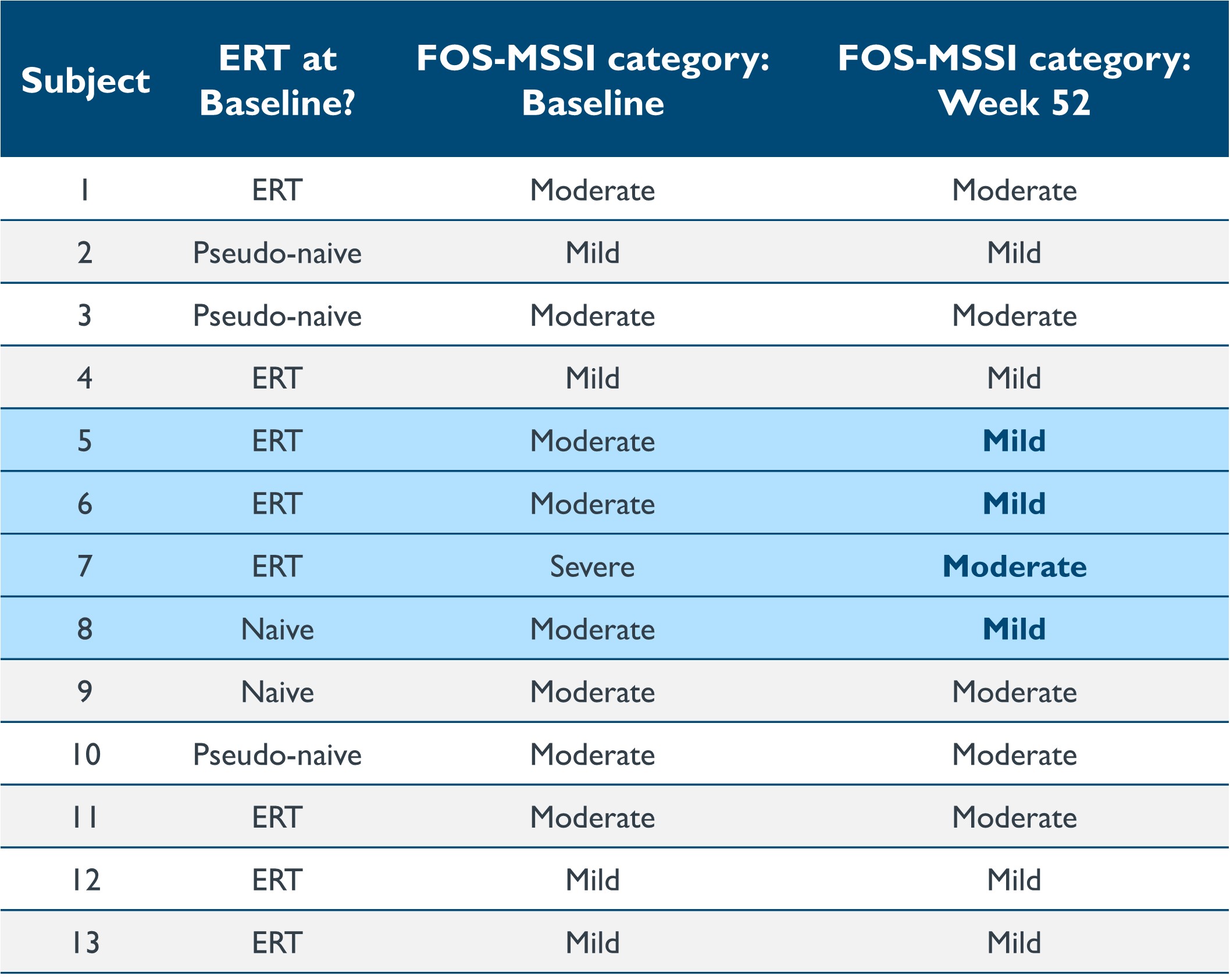
•13人の患者を対象とした12か月のフォローアップでは、病気の重症度、生活の質(「QoL」)、消化管(「GI」)の症状の改善が示されました。2023年9月19日のデータ締め切り日現在、ファブリーアウトカムサーベイでマインツ重症度スコア指数(「FOS-MSSI」)を調整したところ、4つのMSSIセクションのそれぞれで統計的に有意な改善が見られ、69%の患者が12か月目のベースラインから合計MSSIスコアを改善しました。年齢調整スコアの12か月目のベースラインからの平均変化は-3.96(95%CI:[-7.4.-0.5]、p=0.0269)でした。重要なのは、表8に示すように、治療を受けていない患者1人を含む4人の患者が、ベースラインと比較して52週目にFOS-MSSI疾患カテゴリー全体を改善した(たとえば、ベースラインカテゴリーと比較して、ファブリー病の「中等度」から「軽度」のカテゴリーに改善した)ことです。これらの患者のうち3人はベースライン時にERTを受けていて、現在承認されている標準治療よりもイサラガゲンシパルボベックの潜在的な臨床的利点が実証されています。その後中止された8人のERT治療患者のうち、75%がスコアを-3.5から-14ポイント改善し、38%の患者が疾患カテゴリー全体を改善しました。短縮形-36(「SF-36」)のQoLスコアが統計的に有意に改善したことが報告されました。52週目の一般健康スコアと身体成分スコアの平均変化はそれぞれ10.5(p=0.0158)と4.395(p=0.0140)でした。文脈上、どのSF-36スコアでも3ポイントから5ポイントの変化は、臨床的に最小限で重要な違いです。消化器症状評価尺度(「GSRS」)も有意な改善を示し、12か月目のベースラインからの平均変化は-0.26(95%CI:[-0.5、-0.0]、p=0.0226)でした。
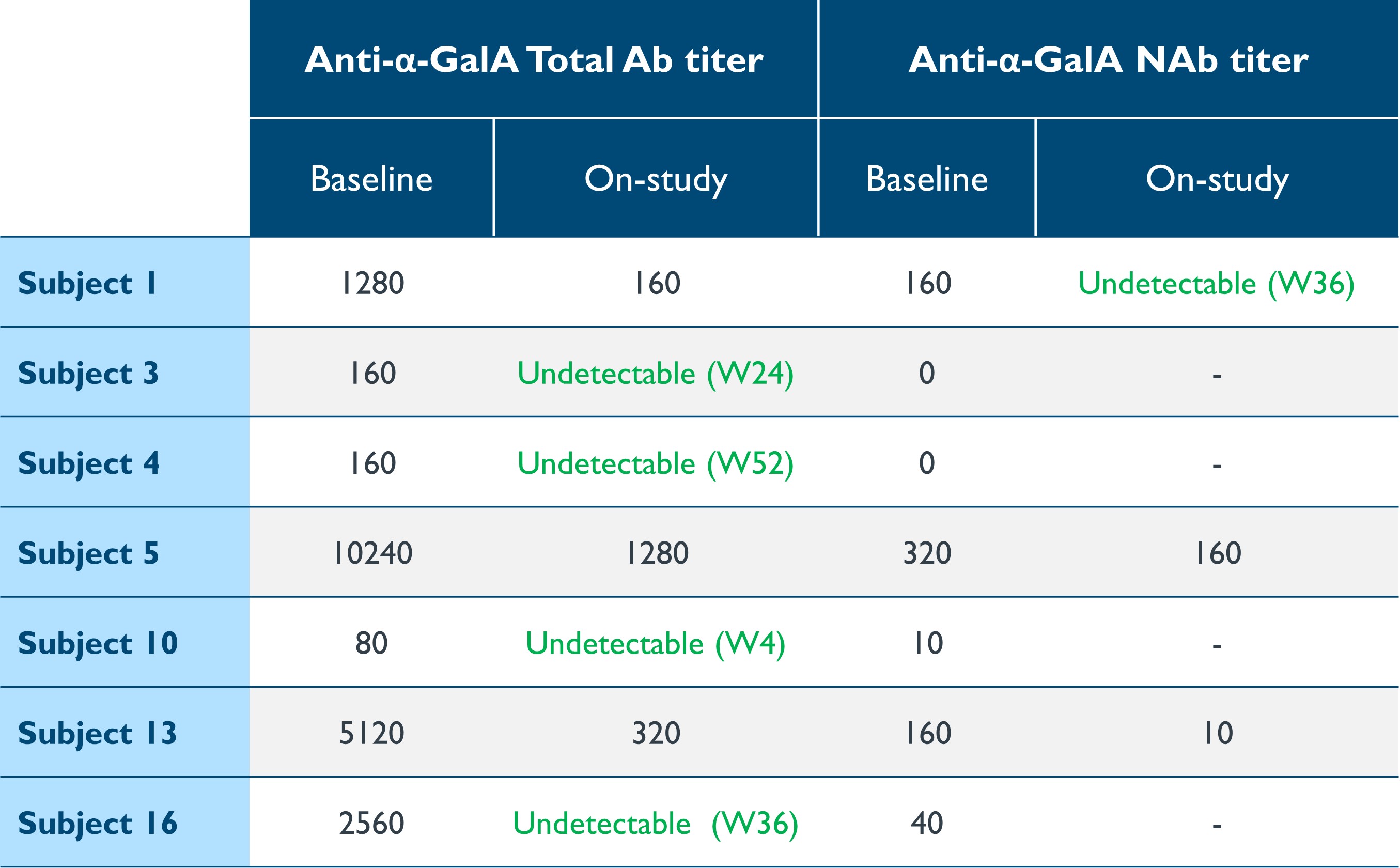
•免疫原性に関連する進行性の臓器障害は、ERTの問題のままです。7人の患者が、ベースライン時にERTに関連するα-GAL Aに対する総抗体(「Ab」)または中和抗体(「NaB」)の力価を測定できました。表9に示すように、投与後、AbまたはNaBの総力価は7人の患者すべてで著しく減少し、5人、つまり患者の71%で検出できなくなりました。治療は血清反応陰性の患者に抗α-GAL A抗体を誘発しませんでした。
表1: ベースラインの特徴:用量漸増段階と用量拡大段階
データ締め切り日:2023年9月19日
eGFR、推定糸球体濾過量(mL/min/1.73m2)、ERT、酵素補充療法
表2:2人以上の患者における治療で出現したAEの概要
データ締め切り日:2023年9月19日
治療中に出現したSAEは、左腕の痛み(0.53×1013 vg/kg)、敗血症(1.58×1013 vg/kg)、エンセソパシー、脳卒中/虚血性脳卒中(2.63×1013 vg/kg)の4人の被験者で報告されました。
表3:α-GAL A活性の発現
データ締め切り日:2023年9月19日
患者14人は148日目に研究をやめました。
表4:用量漸増期に治療を受けた9人の患者に対するナイーブ/疑似ナイーブ患者のα-GAL A活性に対する用量依存的影響
拡張フェーズ用に2.63×1013 vg/kgが選択されました
用量レベル 1:0.26×1013 グラム/キログラム (n=2)
用量レベル 2:0.53×1013 グラム/キログラム (n=2)
用量レベル 3:1.58×1013 グラム/キログラム (n=3)
用量レベル4:2.63×1013グラム/キログラム(n=2)
データ締め切り日:2023年9月19日
α-GAL Aの活性を3時間の反応時間で測定しました。正常範囲は健康な男性と女性で決定されます。データポイント > 365日目は長期フォローアップ調査のものです。
α-GAL A、アルファ-ガラクトシダーゼA、vg/kg、総体重1キログラムあたりのベクターゲノム(ddPCRによる評価)、ERT、ベースライン時にERT処理したERT、N、ERTナイーブ、P-N、疑似ナイーブ、スクリーニング前6か月以上はERTなし
表5:最高用量レベル2.63×1013 vg/kg(n=9)を受けたERTナイーブ/疑似ナイーブ患者におけるST-920駆動血漿α-GalA活性とLyso-GB3の減少
プラズマのα-GalA活性
プラズマ Lyso-Gb3
データ締め切り日:2023年9月19日
α-GAL Aの活性を3時間の反応時間で測定しました。正常範囲は健康な男性と女性で決定されます。長期フォローアップデータ:データポイント > 調査日365日。
α-GAL A、アルファ-ガラクトシダーゼA、ERT、酵素補充療法、リソ-GB3、グロボトリアオシルスフィンゴシン、vg/kg、総体重1キログラムあたりのベクターゲノム(ddPCRによる評価)
表6:最高用量レベル2.63×1013 vg/kg(n=8)を受けたERT治療を受けた患者の血漿α-GalAとリソ-GB3
プラズマのα-GalA活性
プラズマ Lyso-Gb3
データ締め切り日:2023年9月19日
α-GAL Aの活性を3時間の反応時間で測定しました。正常範囲は健康な男性と女性で決定されます。
α-GAL A、アルファ-ガラクトシダーゼA、ERT、酵素補充療法、リソ-GB3、グロボトリアオシルスフィンゴシン、vg/kg、総体重1キログラムあたりのベクターゲノム(ddPCRによる評価)、W、週
表7:フォローアップ期間が12m以上の患者における腎機能の安定性の維持
データ締め切り日:2023年9月19日
eGFR、2009 CKD-EPIクレアチニン式による推定糸球体濾過率(mL/min/1.73m2)、95%CI、95%信頼区間の限界
表8:病気の重症度、生活の質、消化管症状の比較
データ締め切り日:2023年9月19日
フォローアップが1200万以上(n=13)のST-920治療を受けた患者の分析。「12か月目」は52週目の学習時期です。p値はすべて未調整の名目p値です。
ERT、酵素補充療法、FOS-MSSI、マインツ重症度スコア指数のファブリーアウトカムサーベイの適応、SF-36、ショートフォーム-36(SF-36スコアで3ポイントから5ポイントの変化があれば、臨床的に最も重要な差は最小限です)
表9:α-GAL Aに対する抗体の削減または排除
データ締め切り日:2023年9月19日
α-GAL A、アルファ-ガラクトシダーゼA、Ab、抗体、NaB、中和抗体; W、週、(-) は、総Ab力価が0のときにNaB検査が行われていないことを示します
将来の見通しに関する記述
このフォーム8-Kの最新レポートには、サンガモの現在の期待に関する将来の見通しに関する記述が含まれています。これらの将来の見通しに関する記述には、イザラルガゲンシパルボベックの安全性と有効性、治療的および商業的可能性、現在進行中および潜在的な将来の臨床試験を実施し、当社の臨床試験から得られた臨床試験からの臨床データを提示するための予想計画とスケジュール、第1/2相STAAR試験における投薬終了に関する期待、イサラルガゲンシパルボベックの予想される進歩などが含まれますが、これらに限定されません。潜在的なパートナーを探すというサンガモの計画や進めるための追加資金調達など、開発の後期段階へIsaralgagene civaparvovecの将来の潜在的な第3相試験とその時期、および歴史的事実ではないその他の声明。これらの記述は将来の業績を保証するものではなく、予測が難しい特定のリスクや不確実性の影響を受けます。実際の結果が異なる原因となる可能性のある要因には、isaralgagene civaparvovecの潜在的な第3相試験を適時に、またはまったく開始するために必要な資金を確保する能力など、製品候補の完全な開発、規制当局の承認の取得、および商品化のための資本リソースの不足に関連するリスクと不確実性、事業計画を実行し、継続するために多額の追加資金が必要であることが含まれますが、これらに限定されませんマクロ経済的要因または財務上の課題の影響、継続企業として営業していますには、進行中の海外紛争、現在または将来の銀行破綻状況、インフレ、金利上昇の結果として、サンガモおよび当社の協力者のグローバルなビジネス環境、医療システム、事業および運営(臨床試験の運営を含む)、研究開発プロセス(臨床試験の運営と結果、臨床データの提示を含む)、臨床試験の遅延、一時停止、保留が臨床試験のタイムラインと商品化に与える影響を含みます製品候補の;臨床試験結果の時期が不確実で予測不可能な性質。これには、第1/2相STAAR試験の最新の予備臨床データで観察された治療効果が患者さんに持続せず、研究の最終臨床試験データではisaralgagene civaparvovecの安全性と有効性が検証されず、ERTから撤退した患者はERTから除外されるというリスクが含まれます。これは、製品候補の予測不可能な規制承認プロセスです。複数の規制当局にまたがっています。初期の臨床試験の結果に依存しています。これは、製品候補の第3相試験の結果を含め、必ずしも将来の臨床試験の結果を予測するものではありません。これには、サンガモが使用する技術が不要になる技術開発の可能性、協力者への依存と追加の協力を確保できない可能性、期待される将来の財務実績を達成する能力、およびサンガモが米国証券取引委員会に提出した書類に記載されているその他のリスクと不確実性が含まれます。終了した年度の年次報告書(Form 10-K)2022年12月31日。2023年9月30日に終了した四半期のサンガモのフォーム10-Qの四半期報告書によって補足されました。このフォーム8-Kの最新レポートに含まれる情報は、2024年2月5日現在のものです。Sangamoは、適用法で義務付けられている場合を除き、フォーム8-Kのこの最新レポートに含まれる将来の見通しに関する記述を更新する義務を負いません。
署名
1934年の証券取引法の要件に従い、登録者は、登録者に代わってこの報告書に署名させ、正式に権限を与えられた署名者に正式に署名させました。
| | | | | | | | | | | | | | | | | | | | |
| | | | | | |
| | | | サンガモセラピューティクス株式会社 |
| | | |
| 日付:2024年2月6日 | | | | 作成者: | | /s/ スコット・B・ウィロビー |
| | | | 名前: | | スコット・B・ウィロビー |
| | | | タイトル: | | 上級副社長、法務顧問、コーポレートセクレタリー |