
進歩患者、投資家からの電話、2024年4月29日、別紙99.1

2 将来の見通しに関する記述このプレゼンテーションには、これらのスライドの印刷版または電子コピー、発表者による講演、プレゼンテーションおよび質疑応答セッション中に伝えられた情報、およびプレゼンテーション時またはプレゼンテーションに関連して配布された文書または資料が含まれており、改正された1995年の民間証券訴訟改革法を含む適用証券法の意味における将来の見通しに関する記述が含まれています。これらの記述は、「かもしれない」、「するかもしれない」、「できる」、「できる」、「すべき」、「期待」、「計画」、「予測」、「予測」、「予測」、「プロジェクト」、「可能性」、「継続」、「目標」、またはX4の期待、戦略、事業、計画に関係するその他の同様の用語や表現で識別できます。または意図。将来の見通しに関する記述には、12歳以上のWHIM症候群患者への使用が米国で承認されているXOLREMDIの発売計画、入手可能性および商品化の開始時期に関するX4の期待に関する暗示的または明示的な記述が含まれますが、これらに限定されません。この適応症におけるXOLREMDIの商業的発売に関するX4の計画(PantherX Rareを通じた米国での商業的発売計画を含む)、X4の XOLREMDIの商業的発売の準備が整っているという信念。[A] の治療におけるXOLREMDIの潜在的な利点またはB]; WHIM症候群の潜在的な患者数とXOLREMDIの潜在的な市場、市販医薬品の製造が完了するまでの予想時期、および当社の事業の使命と目標。このプレゼンテーションの将来の見通しに関する記述はすべて、経営陣の現在の期待と信念に基づいています。これらの将来の見通しに関する記述は、将来の業績を約束するものでも保証するものでもなく、さまざまなリスクや不確実性の影響を受けます。その多くは、X4が制御できないため、実際の結果がこれらの将来の見通しに関する記述で想定されているものと大きく異なる可能性があります。これには、XOLREMDIに関するX4の米国での立ち上げおよび商品化の取り組みが成功せず、X4が生成できない可能性があるというリスクが含まれます。収益は、私たちが期待するレベル、期待したタイミング、または当社を支えるのに必要なレベルまたはタイミングで目標; WHIM症候群の患者数、追加の治療法の選択肢に対する満たされていないニーズ、およびXOLREMDIの潜在的な市場は、予想よりも大幅に少ない可能性があります。XOLREMDIは、期待する臨床的利益、臨床使用、または市場での受け入れを達成できない場合や、商品化の取り組みの成功に影響を与える償還関連またはその他の市場関連の問題に遭遇する可能性があります。XOLREMDIの有害事象はどの段階でも発生する可能性があります商業化に悪影響を及ぼします。効果的な販売を確立し維持するX4の能力、マーケティング組織または承認された製品の適切な第三者代替品、組織としてのX4は医薬品の販売、マーケティング、流通の経験がない、X4の他の製品候補、X4がXOLREMDIのさらなる機会と適応症を模索している可能性、X4が進行中のXOLREMDIの臨床試験から得られる臨床データの入手可能性、内容、タイミング、臨床試験のデザインと臨床試験および潜在的な治療法への登録潜在的な人のための現在のデザインを含むメリット特定の慢性好中球減少症におけるXOLREMDIを評価する第3相臨床試験で、2024年前半に開始が予定されています。患者の有病率、市場機会、X4の資本使用と財務状況を含むその他の財務結果。実際の出来事や結果は、規制当局の承認の取得と維持のリスク(規制当局の承認の取得と維持のリスク)、前臨床試験や臨床試験および臨床開発の開始と完了、臨床開発の開始と完了、臨床開発に内在する不確実性、試験や研究が遅れるリスクなど、多くの要因により、このプレゼンテーションに含まれる将来の見通しに関する記述で表明または暗示されているものと大きく異なる場合があります満足のいく結果が得られない。そのリスクは前臨床試験またはそれ以前の臨床試験の結果は、後の臨床試験の結果を予測できません。臨床試験の初期または中間結果が、試験の最終結果または将来の試験の結果を予測できないリスク、当社の製品および製品候補の試験または使用から生じる潜在的な安全上の悪影響、患者の有病率、市場、または機会の推定が不正確になるリスク、一般的なマクロ経済の影響とX4の事業における地政学的状況、X4に関連するリスク追加資本を調達する能力、X4が継続企業として存続できるかどうかについての実質的な疑念に関連するリスク、予想されるまたは既存の競争の変化、規制環境の変化、承認されればX4がマボリキサフォールの販売を成功させる能力に関連するリスク、予期せぬ訴訟やその他の紛争、協力者との連携の必要性により、当社の開発および商品化の取り組みが妨げられたり遅れたり、コストが増加したりする可能性があります。主要な協力者のいずれかが失敗した場合、悪影響を受け、コストが増加する可能性があります義務を果たしたり、協力を終了したりします。継続中および計画中の活動に必要な内部および外部費用、およびそれに伴う費用と現金の使用への影響が予想よりも高くなる可能性があり、その結果、予想よりも早く現金を使用したり、計画の一部、あるいはその両方を変更または縮小したりする可能性があります。また、X4のフォーム10-Kの年次報告書の「リスク要因」というタイトルのセクションに記載されているものを含む、その他のリスクと不確実性 2024年3月21日の証券取引委員会(SEC)、およびX4が提出するその他の書類では時々、SECと一緒に。X4は、法律で義務付けられている場合を除き、新しい出来事や状況を反映するためにこのプレゼンテーションに含まれる情報を更新する義務を負いません。このプレゼンテーションに含まれる特定の情報は、第三者の情報源から得られた研究、出版物、調査、その他のデータ、およびX4独自の内部推定と調査に関連するか、またはそれらに基づいています。X4は、このプレゼンテーションの日付の時点で、これらの第三者の情報源は信頼できると考えていますが、第三者の情報源から入手した情報の妥当性、公平性、正確性、または完全性について独自に検証しておらず、またその妥当性、公平性、正確性、または完全性についても表明していません。最後に、X4は自社の内部調査は信頼できると考えていますが、そのような調査は独立した情報源によって検証または検証されていません。X4は、さまざまな商標、商号、サービスマークの所有者です。このプレゼンテーションに記載されているその他の特定の商標、商号、サービスマークは第三者の所有物です。あくまで便宜上、このプレゼンテーションの商標と商号は® とTMの記号を付けずに言及していますが、このような言及は、それぞれの所有者が適用法の最大限の範囲で権利を主張しないことを示すものではありません。

ようこそと概要 Paula Ragan, PhD, 社長兼最高経営責任者ラベルのハイライトと裏付けとなる臨床データ Christophe Arbet-Engels医学博士、医学博士、商業立ち上げ戦略および実行最高医療責任者マーク・バルドリー、最高商務責任者結論と質疑応答
4 X4:希少免疫疾患を持つ人々に革新をもたらす 2014 X4 希少疾患を持つ人々のためのCXCR4を標的とした治療法を推進するために設立されました 2022 X4は、WHIM症候群におけるマボリキサフォーの極めて重要なグローバル第3相試験の好成績を発表しました 2023年 FDAはWHIM症候群のマボリキサフォーのNDAを受け入れ、優先審査を承認 2024年 FDAはXOLREMDITMを承認しました(マボリキサフォール)、WHIM症候群 CXCR4 = CXCケモカイン受容体4、WHIM = いぼ、低ガンマグロブリン血症、感染症、骨髄性障害の患者に適応される最初で唯一の治療法

今、FDAが承認しました!(ゾル・ルム・ディー)

6 生涯にわたる影響2 慢性の先天性疾患一般的に小児期に発症し、診断年齢の中央値は5.5歳で、一般人口と比較して平均余命が短くなる3,4 敗血症、不可逆的な臓器損傷、再発性肺炎、特定の癌によるWHIM症候群は、原発性免疫不全と慢性好中球減少症を組み合わせたものです。1 超まれな人口5 少なくとも1,000人と推定されています米国は、2019年、2020年のX4市場調査に基づいています。異種症状2最も一般的な特徴は次のとおりです。小児(65%)と成人(35%)の患者を含むWHIM症候群患者66人の国際コホートに基づくと、WHIMの頭字語で4つの症状(いぼ、低ガンマグロブリン血症、感染症、骨髄カテキシス)をすべて示す患者は4人に1人未満です。好中球減少症(98%)再発性感染症(92%)低ガンマグロブリン血症(65%)参考文献:1。デールDC、ファーキンF、ボリヤードAA、他、ブラッド。2020; 136 (26): 2994-3003. 2.Geier CB、Ellison M、Cruz R、他、J Clin Immunol。2022; 42 (8): 1748-1765; 3.ドッタL、ノタランジェロL、モラットD、他J アレルギークリニックイムノール。2019; 7 (5): 1568-1577; 4.ボーサン・コーエン・S、フェネトー・O、プルヴィエ・E、他オーファネット・ジョン・レア・ディーズ2012; 7:71; 5.ファイル上のデータ。X4ファーマシューティカルズ株式会社、2024年。いぼ (40%)
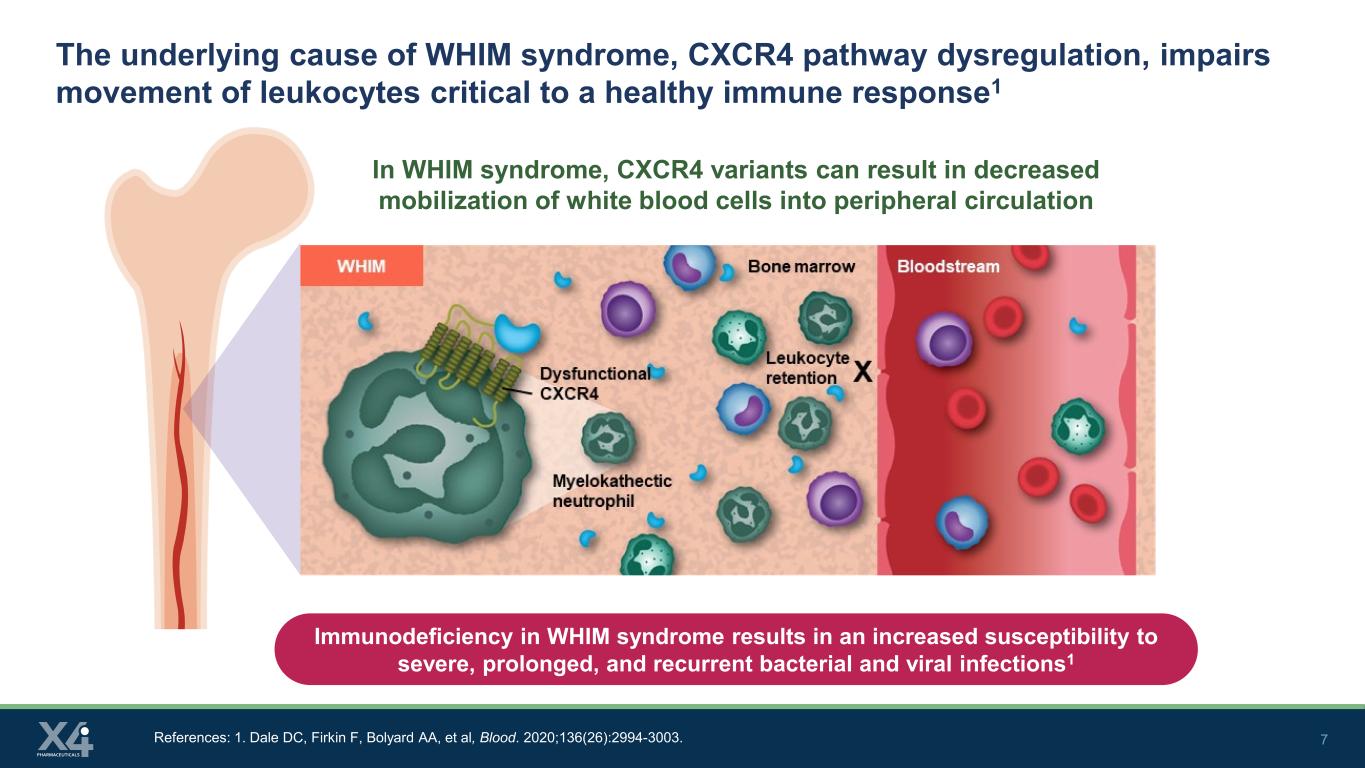
7 WHIM症候群の根本的な原因であるCXCR4経路の調節不全は、健康な免疫反応に不可欠な白血球の動きを損なう1 リンパ球 WHIM症候群では、CXCR4変異体が白血球の末梢循環への動員を低下させる可能性があります。参考文献:1.デールDC、ファーキンF、ボリヤードAA、他、ブラッド。2020; 136 (26): 2994-3003。WHIM症候群の免疫不全は、重篤で長期にわたる再発性の細菌感染症やウイルス感染に対する感受性を高めます1
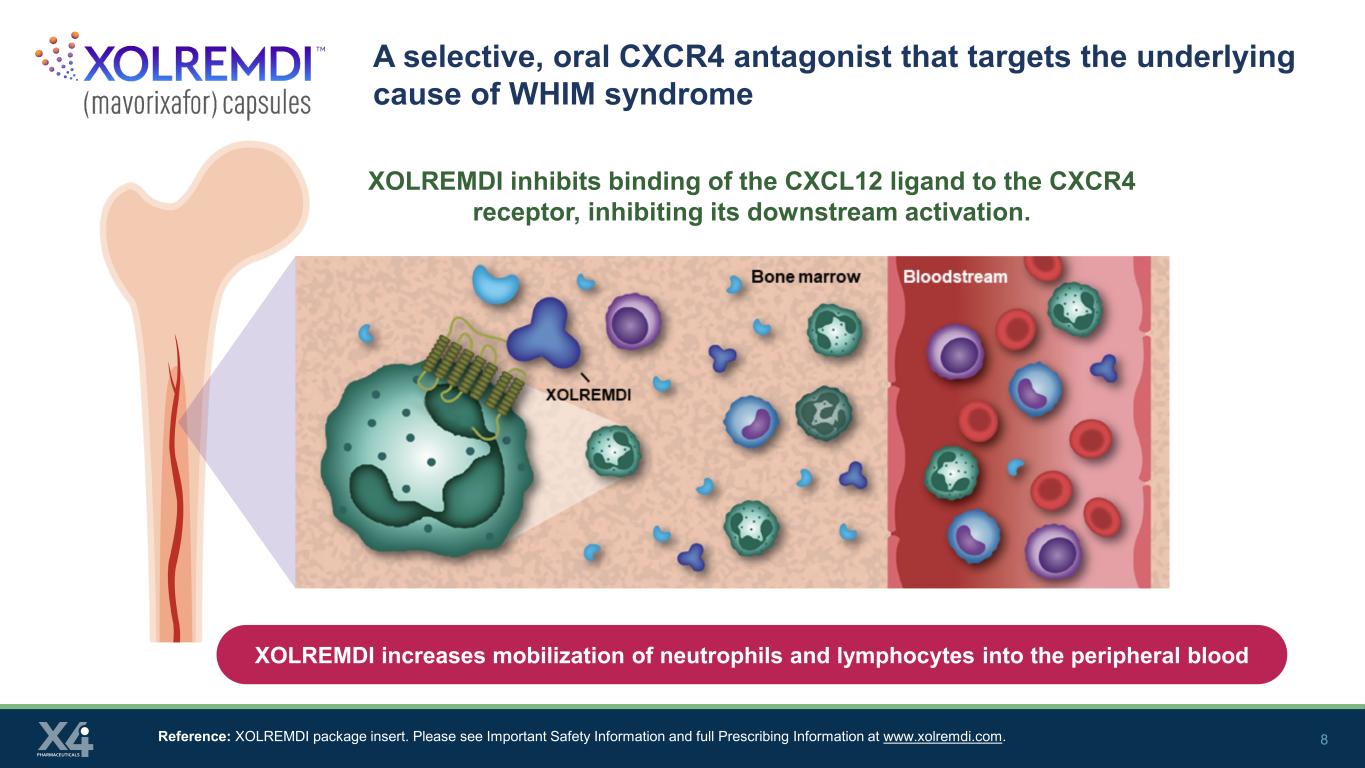
8 WHIM症候群の根本的な原因を標的とする選択的経口CXCR4アンタゴニスト参考文献:XOLREMDI添付文書。www.xolremdi.comの「重要な安全情報」と「処方情報」の全文をご覧ください。XOLREMDIは、CXCL12リガンドのCXCR4受容体への結合を阻害し、その下流の活性化を阻害します。XOLREMDIは好中球とリンパ球の末梢血への動員を高めます

ラベルのハイライトと裏付けとなる臨床データクリストフ・アルベット・エンゲルス、医学博士、最高医療責任者

10これまで、WHIM症候群は根本的な原因に対処しない治療法で管理されてきました。参考文献:1.デールDC、ファーキンF、ボリヤードAA、他、ブラッド。2020; 136 (26): 2994-3003; 2.Geier CB、Ellison M、Cruz R、他、J Clin Immunol。2022; 42 (8): 1748-1765; 3.キスC、コノリーD、コネリーK他、抗生物質、2022年1月11日 (1): 62; 4.X4 2024年3月の研究、74人の医療従事者(44人の免疫学者および30人のHEM/ONC)。G-CSF:顆粒球コロニー刺激因子、IVIg:静脈内免疫グロブリン。抗生物質と抗ウイルス薬 • WHIM症候群に特化したものではない • WHIM症候群の患者を対象とした安全性と有効性を評価する適切で十分に管理された試験はない1,2 • G-CSFとiVigは負担の大きい投与に関連する • 抗菌薬耐性(AMR)の発症リスクと有害事象の累積リスクに関連する抗生物質の長期使用3 • 調査対象の医療従事者の73%(n=74)が懸念しています WHIM症候群患者の抗生物質耐性について4 g-csfiviGの対症療法

11 XOLREMDITM(マボリキサフォー)米国ラベルハイライト適応症ステートメント XOLREMDIは、循環する成熟好中球とリンパ球の数を増やすために、WHIM症候群(いぼ、低ガンマグロブリン血症、感染症、骨髄性動態)の12歳以上の患者さんに使用することが承認されています。禁忌:クリアランスのためにCYP2D6に大きく依存している薬物との併用。箱入り警告なし投与と管理体重が50kgを超える患者:400mgを1日1回経口投与体重が50kg以下の患者:300mgを1日1回経口投与剤形と強度カプセル:100 mgマボリキサフォー製品ラベルの副作用の概要についてはスライド15を参照してください。www.xolremdi.comの「重要な安全情報」と「処方情報」の全文をご覧ください。

12 4WHIMは、WHIM症候群のこれまでで最大の第3相臨床試験でした XOLREMDIは、WHIM症候群の患者31人を対象に実施されたグローバルな無作為化二重盲検プラセボ対照第3相試験で研究されました。主要評価項目 • 13、26、39、52週でANC閾値である500細胞/μLを超える平均時間で測定される、絶対好中球数(ANC)の改善副次評価項目 13、26、39、52週でALC閾値である1000細胞/μLを超える平均時間で測定された絶対リンパ球数(ALC)• 複合エンドポイント:の分析総感染スコア(発生率、重症度)といぼ変化スコアのベースライン訪問XOLREMDI(N= 14)>50 kg:400 mg QD ≤50 kg:200 mg QD プラセボ(N = 17)主要評価項目のうち、非盲検拡張(OLE)研究対象集団で評価済みの主要評価項目〜 90% • 成人および青年(12~)
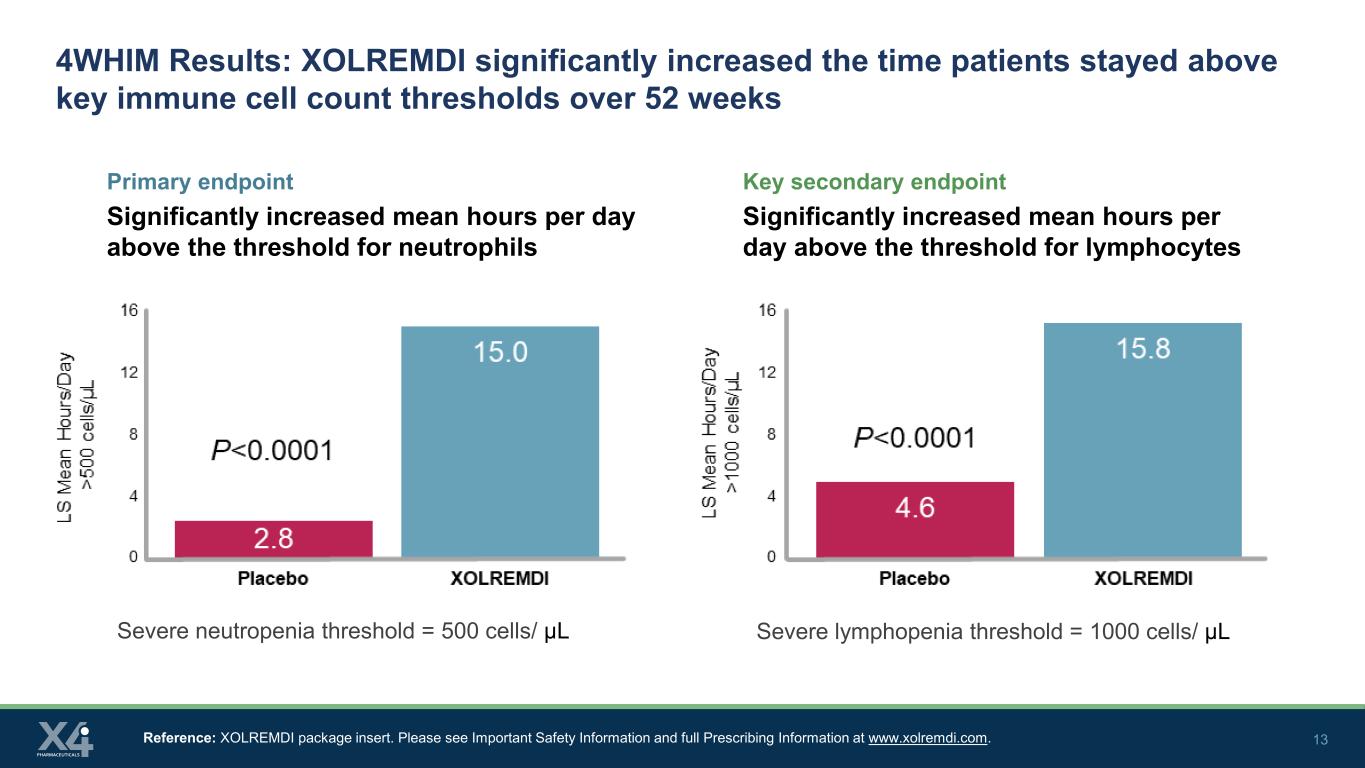
13 4WHIM結果:XOLREMDIは、52週間にわたって患者が主要な免疫細胞数の閾値を超えて滞在する時間を大幅に増加させました。主要エンドポイントは、好中球の閾値を上回る1日あたりの平均時間が大幅に増加しました。主要副評価項目は、リンパ球の閾値を上回る1日あたりの平均時間が大幅に増加しました。参考文献:XOLREMDI添付文書。www.xolremdi.comの重要な安全情報と詳細な処方情報を参照してください。重度の好中球減少症の閾値 = 500 細胞/μL 重度のリンパ球減少症の閾値 = 1000 細胞/μL
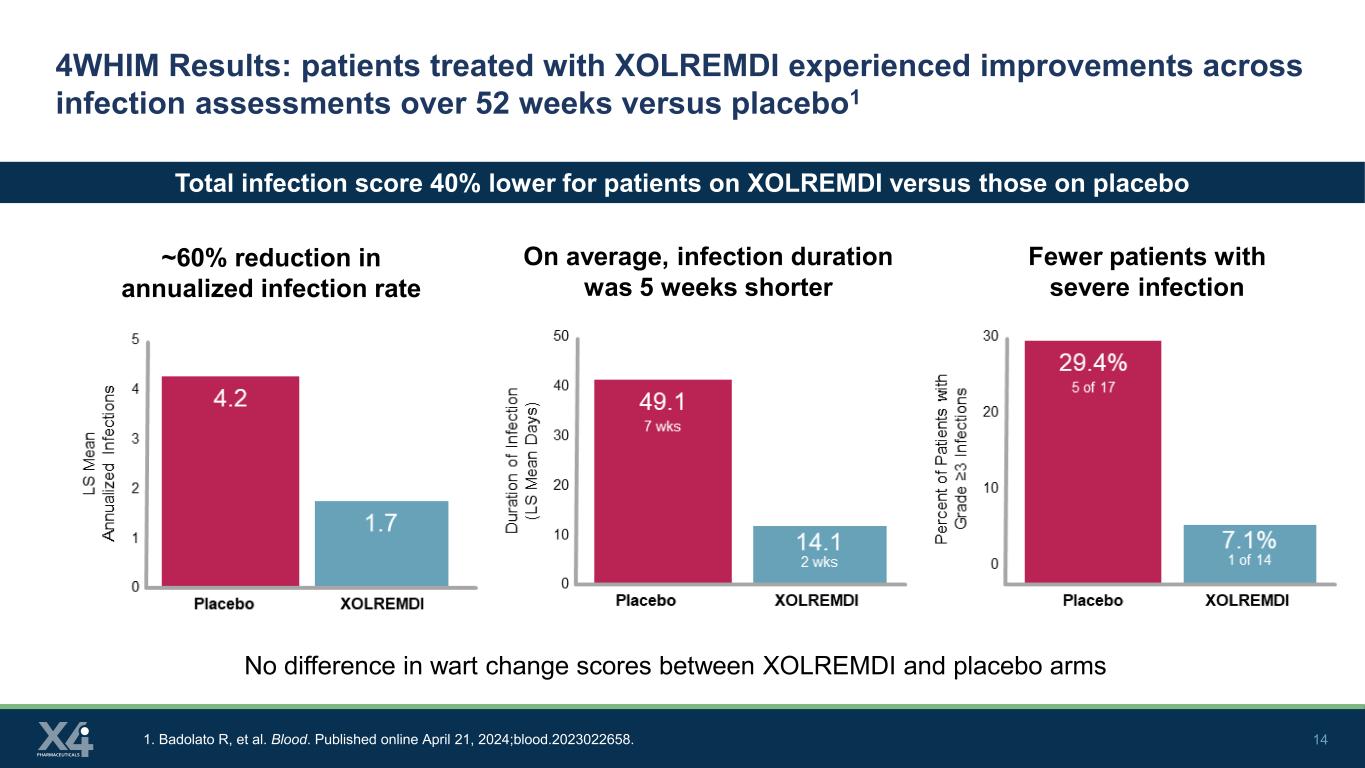
14 4WHIM結果:XOLREMDIで治療された患者は、プラセボ1と比較して52週間にわたって感染評価全体で改善が見られました。年間感染率が60%低下しました1。バドラート R、他血液。2024年4月21日にオンラインで公開されました。血まみれです。2023022658。重篤な感染症の患者の減少平均感染期間は5週間短かった XOLREMDIを投与した患者の総感染スコアはプラセボ群と比較して40%低かった XOLREMDI群とプラセボ群でいぼ変化スコアに差はない
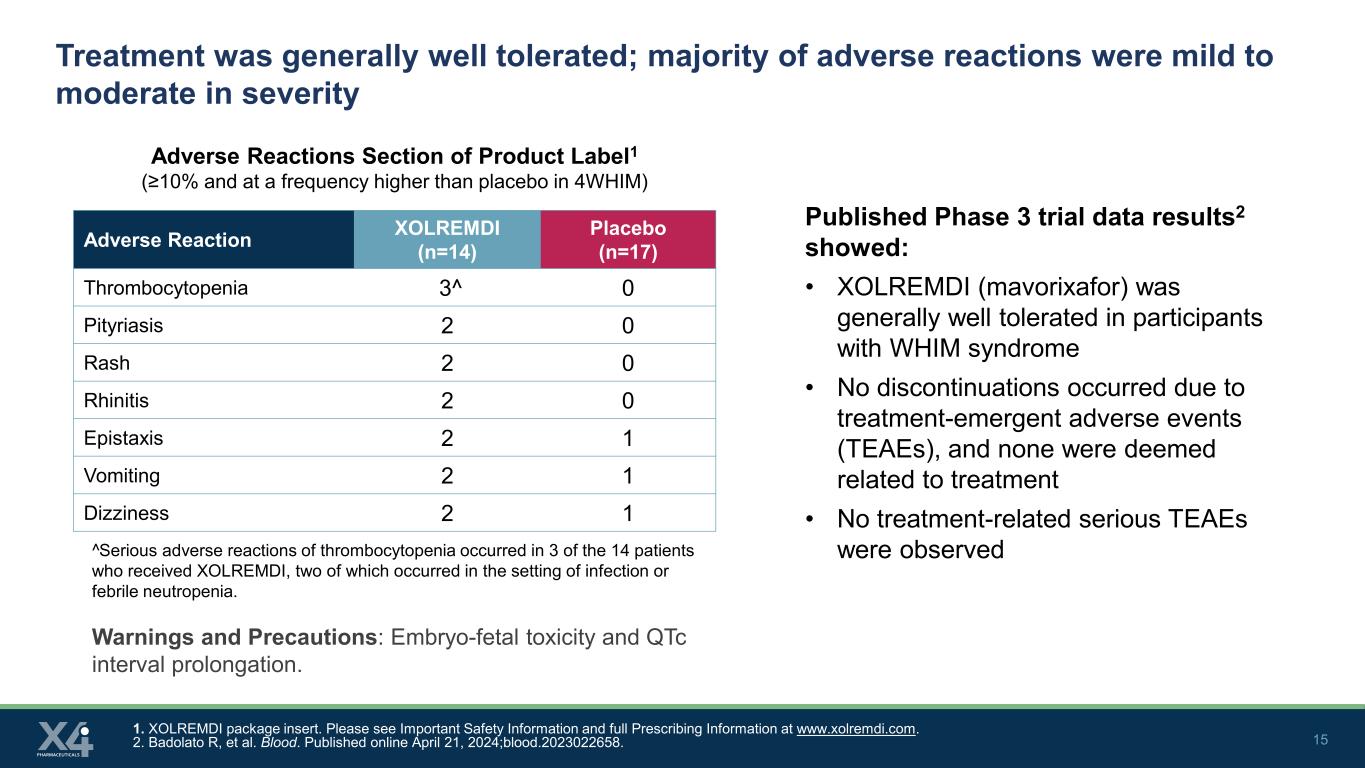
15 治療は一般的に耐容性が高かったです。副作用の大部分は軽度から中等度でした。製品ラベル1の副作用セクション(10%以上、4WHIMではプラセボよりも頻度が高かった)1。XOLREMDIパッケージインサート。www.xolremdi.comで重要な安全情報と完全な処方情報を参照してください。2.バドラート R、他。血液。2024年4月21日にオンラインで公開されました。血まみれです。2023022658。副作用 XOLREMDI(n=14)プラセボ(n=17)血小板減少症 3^ 0 乾癬 2 0 鼻炎 2 0 鼻炎 2 1 嘔吐 2 1 めまい 2 1 公開された第3相試験データ2は次のことを示しました:• XOLREMDI(マボリキサフォー)は、WHIM症候群の参加者では一般的に耐容性が高かった • いいえ治療に伴う有害事象(TEAE)が原因で中止が発生し、治療に関連するとみなされるものはありませんでした • 治療に関連した重篤なTEAEは観察されませんでした^XOLREMDIを投与された14人の患者のうち3人に血小板減少症の重篤な副作用が発生しました。これは、感染症または熱性好中球減少症の状態で発生しました。警告と注意事項:胎児毒性とQTc間隔の延長。

商業的立ち上げ戦略と実行、最高商務責任者、マーク・バルドリー

17 商業戦略の概要:対象を絞った教育、関与、アクセス WHIM症候群についての教育主要な医学会議に参加する対象となる主要な血液専門医と免疫学者を対象とする主要な血液専門医と免疫専門医を対象とするMOAと臨床プロファイルを伝え、適切な患者への採用と取り込みを促進するアクセス障壁を軽減する一連の患者サポートサービスを提供し、患者の診断を支援患者診断支援XOLREMDIをWHIM症候群の標準治療として確立するアジャイルコマーシャルを活用して幅広いアクセスを獲得するX4の最初の製品発売を実行するチーム

18 革新的な希少疾患治療薬を発売するための適切なフィールドチームミッション主導型の患者中心:歴史的に十分なサービスを受けていない人々に新しい治療法をもたらすチームの専門知識 • 希少疾患分野/血液学と免疫学 • 希少疾患の診断の支援 • 患者ジャーニーの理解 • 治療法の新規市場への立ち上げ • 医師、思想的指導者、患者支援団体との地域関係 • 有名な希少疾患および超希少疾患組織から募集されたフィールドチーム Collector 250年以上にわたる実証済みの成功商業用ローンチで
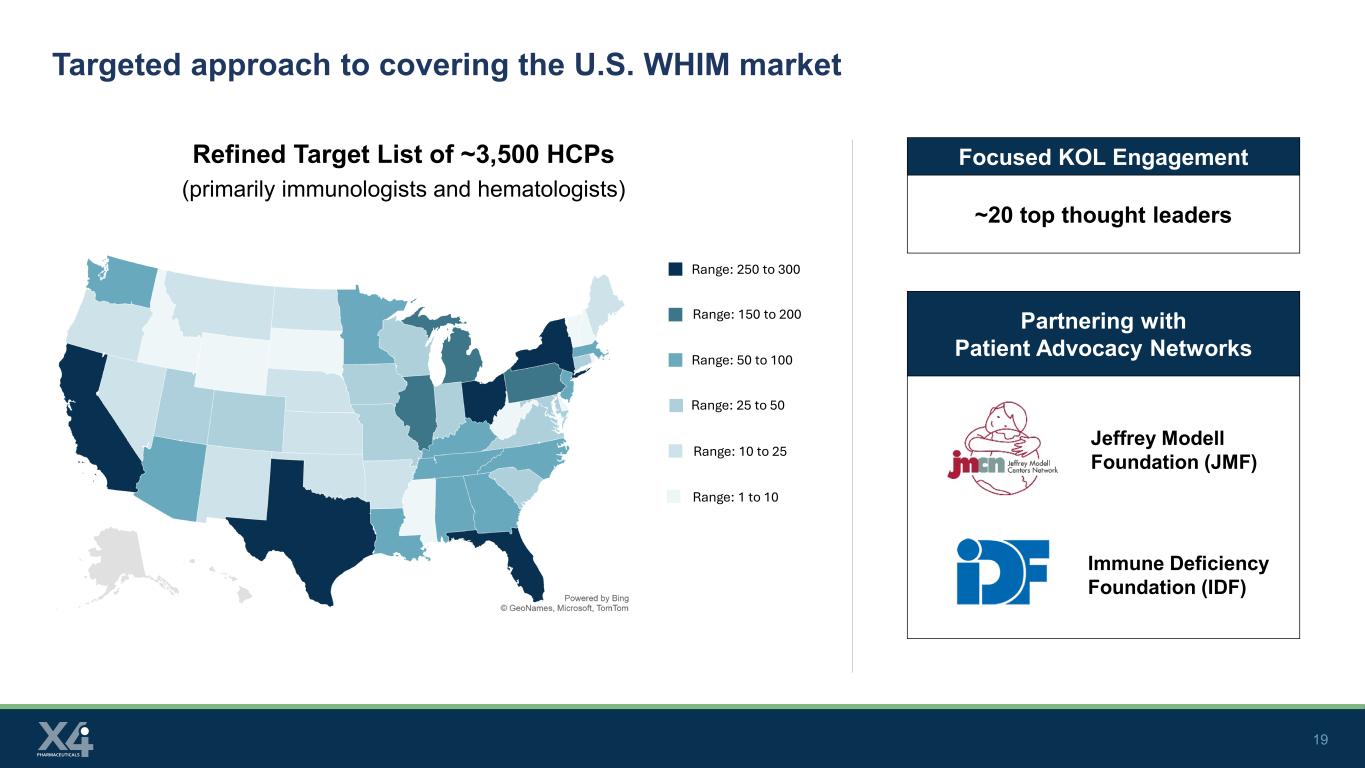
19 患者支援ネットワークとの提携米国のWHIM市場をカバーするための的を絞ったアプローチ約3,500人のHCP(主に免疫専門医と血液専門医)の絞り込み目標リストジェフリーモデル財団(JMF)免疫不全財団(IDF)範囲:250〜300範囲:150〜200範囲:50〜100範囲:25〜50範囲:10から25範囲:1から10に焦点を当てたKOLエンゲージメント〜20人のトップソートリーダー

20人の医療従事者が負担が大きく、ニーズが満たされていない重篤な状態であるWHIM症候群の標的療法を模索しています。• 感染の減少 • 対象を絞った治療の性質 • HCPの経口製剤WHIM症候群は長期にわたる合併症の可能性がある重篤な免疫疾患であると考えています 92% HCP 調査ではWHIM症候群に対する的を絞った効果的な治療法に対する未だ満たされていないニーズが高いと考えています 89%が不満 WHIM症候群の症状を治療するための現在の選択肢で 76% ノーブランドと表示されていますXOLREMDIのプロフィールでは、すべての主要専門分野の医療従事者の間で処方への関心が高く、平均10点満点中9点の評価を受けました。ソース:2024年2月(29人の医療従事者)と2024年3月(医療従事者74人)のX4医薬品のHCP市場調査と試験

21の財政援助プログラム • 財政援助には、適格患者向けのクイックスタート、自己負担支援、ブリッジプログラム、患者支援プログラムなどがあり、患者サポート、専門薬局の処理、臨床薬剤師によるXOLREMDIの処方箋の記入などが利用できます。• 治療に関する質問に答えます。• 潜在的な副作用についての情報を提供する • 治療薬の投与量や調整を確認する x4ConnectTMは、対象となる患者が保険の適用範囲、事前承認要件、および財政支援プログラムをナビゲートできるよう支援します。サポートへのアクセス X4Connect ケアコーディネーター • 補償範囲を調査し、事前の承認、上訴、財政援助オプションへの対応を支援します X4 ナースエデュケーター • XOLREMDIとWHIM症候群に関する教育と利用可能なリソースを患者とその介護者に提供する X4Connect専門薬剤師 • XOLREMDIの処方について患者に助言する

22 XOLREMDIは、ターゲットを絞ったイノベーションで満たされていない高いニーズに応える年間価格*価値を反映しています • 50kgを超える患者 = 1日あたり400mg = 496,400ドル • 50kg以下の患者 = 1日あたり300mg = 372,300ドル高負荷の疾患に対処し、患者の免疫機能の関連する側面を強化する可能性実証された有効性と安全性のプロファイル超まれな患者集団を対象とした画期的な治療法はシンドローム革新的なソリューションの提供に尽力しています X4を通じて受けられる献身的なサポートと教育ConnectとPantherXは、対象となるすべての患者にはまれです。コラボレーション、対象を絞った教育、早期診断のサポートを通じて、WHIM症候群コミュニティの団結を支援しています XOLREMDIは、WHIM症候群の根底にある原因であるCXCR4の調節不全を対象としています。* 卸売購入費用(WAC)。完全なコンプライアンスを前提としています

23 XOLREMDI(マボリキサフォー)が患者診断を支援するという期待に応え、XOLREMDIをWHIM症候群の標準治療として確立し、幅広いアクセスを獲得しています

[デザイン:新しい仕切りをスライドさせてください] 結論 Paula Ragan、博士社長兼最高経営責任者
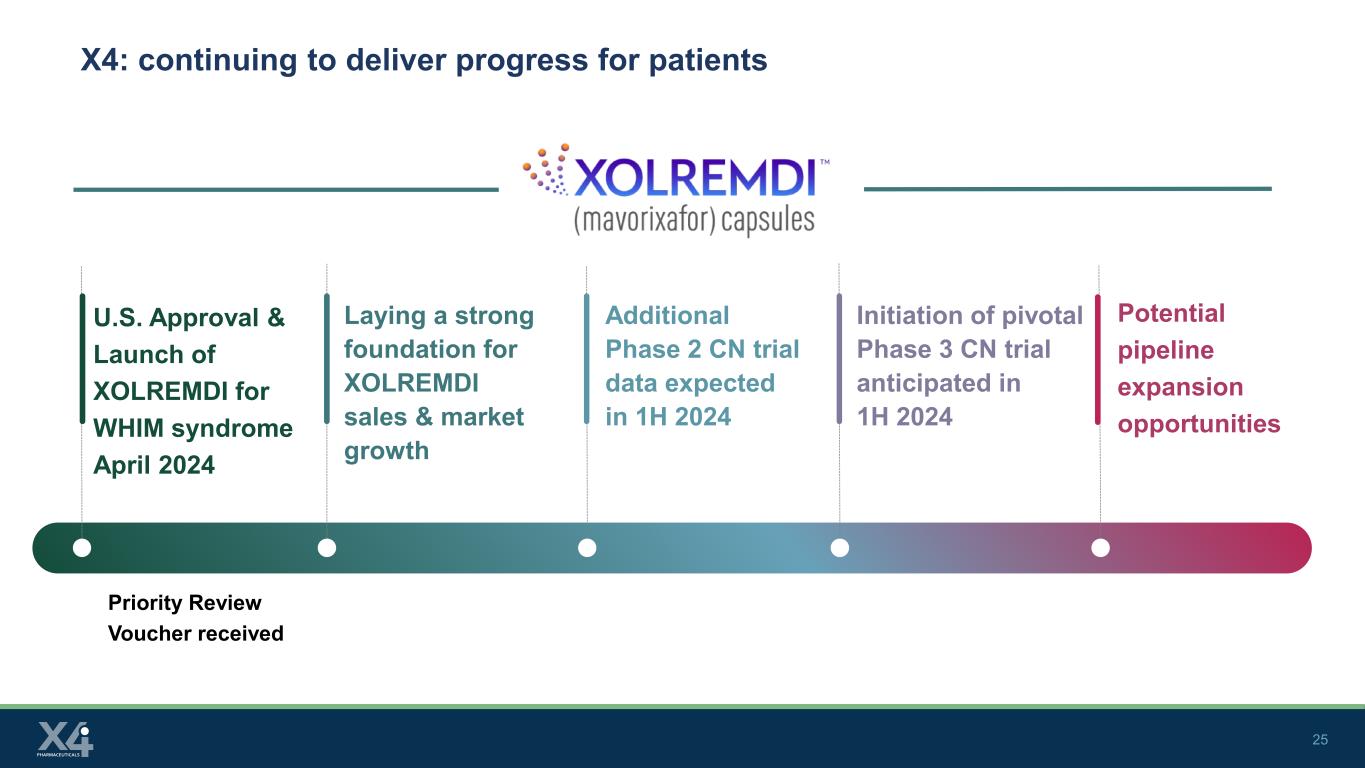
25 X4:患者さんに進歩を提供し続ける優先レビューバウチャーが米国の承認を受け、2024年4月にWHIM症候群に対するXOLREMDIを発売 XOLREMDIの販売と市場成長の強固な基盤を築きました 2024年上半期に予定されている重要な第II相CN試験の開始2024年上半期に予定されている重要な第3相CN試験の開始潜在的なパイプライン拡大機会

コートニー、WHIM症候群での生活