nkgn — 202312312023会計年度--12-310001845459誤り026000P 1 Yhttp://nkgenbiotech.com/20231231#ChangeInFairValueOfConvertibleDebtP 3 Y00018454592023-01-012023-12-310001845459アメリカ-アメリカ公認会計基準:普通株式メンバー2023-01-012023-12-310001845459アメリカ公認会計基準:保証メンバー2023-01-012023-12-3100018454592024-04-16Xbrli:共有00018454592023-06-30ISO 4217:ドル00018454592023-12-3100018454592022-12-310001845459米国-公認会計基準:関連側メンバー2023-12-310001845459米国-公認会計基準:関連側メンバー2022-12-31ISO 4217:ドルXbrli:共有00018454592022-01-012022-12-310001845459米国-公認会計基準:関連側メンバー2023-01-012023-12-310001845459米国-公認会計基準:関連側メンバー2022-01-012022-12-310001845459SRT:シーン先に報告されたメンバ2021-12-310001845459SRT:シーン先に報告されたメンバアメリカ-アメリカ公認会計基準:普通株式メンバー2021-12-310001845459SRT:シーン先に報告されたメンバUS-GAAP:AdditionalPaidInCapitalMembers2021-12-310001845459SRT:シーン先に報告されたメンバnkgn: SubscriptionReceivableMember2021-12-310001845459アメリカ-公認会計基準:受取在庫保持者メンバーSRT:シーン先に報告されたメンバ2021-12-310001845459アメリカ-公認会計基準:前払いメンバーを保留SRT:シーン先に報告されたメンバ2021-12-310001845459SRT:メンバの再調整2021-12-310001845459SRT:メンバの再調整アメリカ-アメリカ公認会計基準:普通株式メンバー2021-12-310001845459SRT:メンバの再調整US-GAAP:AdditionalPaidInCapitalMembers2021-12-310001845459SRT:メンバの再調整nkgn: SubscriptionReceivableMember2021-12-310001845459アメリカ-公認会計基準:受取在庫保持者メンバーSRT:メンバの再調整2021-12-310001845459アメリカ-公認会計基準:前払いメンバーを保留SRT:メンバの再調整2021-12-3100018454592021-12-310001845459アメリカ-アメリカ公認会計基準:普通株式メンバー2021-12-310001845459US-GAAP:AdditionalPaidInCapitalMembers2021-12-310001845459nkgn: SubscriptionReceivableMember2021-12-310001845459アメリカ-公認会計基準:受取在庫保持者メンバー2021-12-310001845459アメリカ-公認会計基準:前払いメンバーを保留2021-12-310001845459US-GAAP:AdditionalPaidInCapitalMembers2022-01-012022-12-310001845459アメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-12-310001845459アメリカ-公認会計基準:前払いメンバーを保留2022-01-012022-12-310001845459アメリカ-アメリカ公認会計基準:普通株式メンバー2022-12-310001845459US-GAAP:AdditionalPaidInCapitalMembers2022-12-310001845459nkgn: SubscriptionReceivableMember2022-12-310001845459アメリカ-公認会計基準:受取在庫保持者メンバー2022-12-310001845459アメリカ-公認会計基準:前払いメンバーを保留2022-12-310001845459US-GAAP:AdditionalPaidInCapitalMembers2023-01-012023-12-310001845459アメリカ-アメリカ公認会計基準:普通株式メンバー2023-01-012023-12-310001845459nkgn: SubscriptionReceivableMember2023-01-012023-12-310001845459アメリカ-公認会計基準:受取在庫保持者メンバー2023-01-012023-12-310001845459アメリカ-公認会計基準:前払いメンバーを保留2023-01-012023-12-310001845459アメリカ-アメリカ公認会計基準:普通株式メンバー2023-12-310001845459US-GAAP:AdditionalPaidInCapitalMembers2023-12-310001845459nkgn: SubscriptionReceivableMember2023-12-310001845459アメリカ-公認会計基準:受取在庫保持者メンバー2023-12-310001845459アメリカ-公認会計基準:前払いメンバーを保留2023-12-310001845459nkgn: ConvertiblePromissoryNotesAndConvertiblePromissoryNotes メンバー2023-01-012023-12-310001845459nkgn: ConvertiblePromissoryNotesAndConvertiblePromissoryNotes メンバー2022-01-012022-12-310001845459nkgn: シニアコンバーチブル約束手形証券ワラント付き会員2023-01-012023-12-310001845459nkgn: シニアコンバーチブル約束手形証券ワラント付き会員2022-01-012022-12-3100018454592023-09-29Xbrli:純nkgn: セグメント0001845459SRT:最大メンバ数2023-12-310001845459SRT:最大メンバ数2022-12-310001845459US-GAAP:コンピュータソフトウェア無形資産メンバ2023-12-31nkgn: 在庫0001845459nkgn: PrivateWarrants メンバー2023-01-012023-12-310001845459nkgn: ワーキングキャピタルワラントメンバー2023-01-012023-12-310001845459nkgn: PublicWarrants メンバー2023-01-012023-12-310001845459nkgn: PIPEWarrantsMember2023-01-012023-12-310001845459nkgn: 従業員ストックオプション後交換比率メンバー2023-01-012023-12-310001845459nkgn: SPAWarrants メンバー2023-01-012023-12-310001845459アメリカ公認会計基準:転換可能債務証券メンバー2023-01-012023-12-310001845459nkgn: 延期創業者株式メンバー2023-01-012023-12-310001845459nkgn: 従業員ストックオプション後交換比率メンバー2022-01-012022-12-3100018454592023-09-282023-09-2800018454592023-09-292023-09-290001845459nkgn: レガシー NKGenMember2023-09-290001845459nkgn: 普通株式 ( 転換社債を含む ) 株式メンバー2023-09-292023-09-290001845459nkgn: レガシー NKGenMember2023-09-292023-09-290001845459nkgn: EquityInstrumentsMember2023-09-292023-09-290001845459nkgn: 責任楽器メンバー2023-09-292023-09-290001845459nkgn: Graf 買収パートナー IVLLC メンバーnkgn: PublicSharesNetOfRedemptions メンバー2023-09-280001845459nkgn: Graf 買収パートナー IVLLC メンバーnkgn: プライベートプレイスメント投資家株式メンバー2023-09-280001845459nkgn: Graf 買収パートナー IVLLC メンバーnkgn: Graf 創設者メンバー2023-09-280001845459nkgn: Graf 買収パートナー IVLLC メンバーnkgn: 普通株主会員2023-09-280001845459nkgn: レガシー NKGen メンバー2023-09-292023-09-290001845459nkgn: Graf 買収パートナー IVLLC メンバー2023-09-292023-09-290001845459nkgn: Graf 買収パートナー IVLLC メンバーnkgn: ベンダーメンバー2023-09-292023-09-290001845459アメリカ公認会計基準:現金会員nkgn: Graf 買収パートナー IVLLC メンバーnkgn: ベンダーメンバー2023-09-292023-09-290001845459nkgn: Graf 買収パートナー IVLLC メンバーアメリカ-アメリカ公認会計基準:普通株式メンバーnkgn: ベンダーメンバー2023-09-292023-09-290001845459nkgn: ベンダーメンバー2023-09-292023-09-2900018454592023-10-012023-12-310001845459nkgn: SubscriptionReceivableMember2023-10-012023-12-310001845459アメリカ-アメリカ公認会計基準:普通株式メンバー2023-10-012023-12-310001845459US-GAAP:AdditionalPaidInCapitalMembers2023-10-012023-12-3100018454592023-09-292023-12-3100018454592023-09-280001845459SRT:シーン予測メンバ2024-09-290001845459SRT:シーン予測メンバ2024-09-292024-09-290001845459SRT:シーン予測メンバnkgn: ボーナスシェアメンバー2024-09-292024-09-290001845459nkgn: Forward 購入契約メンバー2023-12-262023-12-260001845459nkgn: Forward 購入契約メンバー2023-12-26Utr:D0001845459nkgn: Forward 購入契約メンバー2023-12-250001845459nkgn: Forward 購入契約メンバー2023-12-3100018454592023-12-262023-12-260001845459nkgn: FPA 投資家メンバー2023-01-012023-12-310001845459nkgn: Graf 買収パートナー IVLLC メンバーnkgn: PublicWarrants メンバー2021-05-2000018454592021-05-200001845459nkgn: PublicWarrants メンバー2021-05-200001845459nkgn: PublicWarrants メンバー2021-05-202021-05-200001845459nkgn: PublicWarrants メンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2021-05-200001845459nkgn: Graf 買収パートナー IVLLC メンバーnkgn: PrivateWarrants メンバー2021-05-200001845459nkgn: SPAWarrants メンバー2023-12-310001845459US-GAAP:LineOfCreditMemberアメリカ公認会計基準:転換可能債務メンバー2023-09-280001845459nkgn: ワーキングキャピタルワラントメンバー2023-09-290001845459nkgn: PIPEWarrantsMember2023-09-290001845459nkgn: PIPEWarrantsMember2023-09-292023-09-290001845459nkgn: FirstTrancheMembernkgn: PIPEWarrantsMember2023-09-290001845459nkgn: SecondTrancheMembernkgn: PIPEWarrantsMember2023-09-290001845459nkgn: ThirdTrancheMembernkgn: PIPEWarrantsMember2023-09-290001845459SRT:最小メンバ数nkgn: PIPEWarrantsMember2023-09-290001845459nkgn: A2019 コンバーチブルノートメンバー2019-11-012019-12-310001845459nkgn: A2019 関連パーティーコンバーチブルノートメンバー2019-11-012019-12-310001845459nkgn: A2019 コンバーチブルノートメンバーアメリカ公認会計基準:転換可能債務メンバー2019-12-310001845459アメリカ公認会計基準:転換可能債務メンバーnkgn: A2019 関連パーティーコンバーチブルノートメンバー2019-12-310001845459nkgn: A2023 コンバーチブルノートメンバー2023-03-012023-09-300001845459nkgn: A2023 関連パーティーコンバーチブルノートメンバー2023-03-012023-09-300001845459アメリカ公認会計基準:転換可能債務メンバーnkgn: A2023 コンバーチブルメモメンバー2023-09-300001845459nkgn: A2023 関連パーティーコンバーチブルノートメンバーアメリカ公認会計基準:転換可能債務メンバー2023-09-300001845459nkgn: A2023 関連パーティーコンバーチブルノートメンバー2023-01-012023-12-310001845459nkgn: A2023 コンバーチブルノートメンバー2023-01-012023-12-310001845459nkgn: レガシー NKGenCommonStockMember2023-09-292023-09-290001845459nkgn: シニアコンバーチブルノートメンバーアメリカ公認会計基準:転換可能債務メンバー2023-09-282023-09-280001845459nkgn: シニアコンバーチブルノートメンバーアメリカ公認会計基準:転換可能債務メンバー2023-09-280001845459nkgn: シニアコンバーチブルノートメンバーアメリカ公認会計基準:転換可能債務メンバー2023-09-292023-09-290001845459nkgn: シニアコンバーチブルノートメンバーアメリカ公認会計基準:転換可能債務メンバー2023-10-012023-12-310001845459nkgn: シニアコンバーチブルノートメンバーアメリカ公認会計基準:転換可能債務メンバー2023-01-012023-12-310001845459アメリカ-GAAP:高齢者の注意事項メンバーUS-GAAP:変換可能ノードPayableMember2022-12-310001845459アメリカ-GAAP:高齢者の注意事項メンバーUS-GAAP:変換可能ノードPayableMember2023-01-012023-12-310001845459アメリカ-GAAP:高齢者の注意事項メンバーUS-GAAP:変換可能ノードPayableMember2023-12-310001845459nkgn: 商業銀行信用ファシリティ会員US-GAAP:LineOfCreditMemberアメリカ公認会計基準:RevolvingCreditFacilityMembers2023-06-300001845459nkgn: 商業銀行信用ファシリティ会員US-GAAP:LineOfCreditMemberアメリカ公認会計基準:RevolvingCreditFacilityMembers2023-06-012023-06-300001845459nkgn: 商業銀行信用ファシリティ会員US-GAAP:LineOfCreditMemberアメリカ公認会計基準:RevolvingCreditFacilityMembersUS-GAAP:SecuredOvernightFinancingRateSofrOvernightIndexSwapRateRateメンバー2023-06-012023-06-300001845459SRT:シーン予測メンバnkgn: 商業銀行信用ファシリティ会員US-GAAP:LineOfCreditMemberアメリカ公認会計基準:RevolvingCreditFacilityMembers2024-06-300001845459nkgn: 商業銀行信用ファシリティ会員US-GAAP:LineOfCreditMemberアメリカ公認会計基準:RevolvingCreditFacilityMembers2023-12-310001845459nkgn: 商業銀行信用ファシリティ会員US-GAAP:LineOfCreditMemberアメリカ公認会計基準:RevolvingCreditFacilityMembers2023-01-012023-12-310001845459nkgn: 商業銀行信用ファシリティ会員US-GAAP:LineOfCreditMemberアメリカ公認会計基準:RevolvingCreditFacilityMembers2022-01-012022-12-310001845459アメリカ公認会計基準:転換可能債務メンバーnkgn: 関連パーティーローンメンバー2022-12-012022-12-310001845459アメリカ-アメリカ公認会計基準:普通株式メンバーnkgn: 関連パーティーローンメンバー2023-01-012023-03-3100018454592023-01-012023-05-010001845459nkgn: 関連パーティーローンメンバーアメリカ-GAAP:LoansPayableメンバー2023-04-300001845459米国-公認会計基準:関連側メンバー2023-10-012023-12-310001845459米国-公認会計基準:関連側メンバー2022-10-012022-12-310001845459米国-公認会計基準:関連側メンバーアメリカ-GAAP:LoansPayableメンバー2023-12-310001845459米国-公認会計基準:関連側メンバーアメリカ-GAAP:LoansPayableメンバー2022-12-3100018454592023-09-012023-09-300001845459米国-公認会計基準:関連側メンバーアメリカ-GAAP:LoansPayableメンバーnkgn: 関連パーティーローンメンバー2023-09-302023-09-300001845459米国-公認会計基準:関連側メンバーアメリカ-GAAP:LoansPayableメンバーnkgn: 関連パーティーローンメンバー2023-09-300001845459nkgn: PaycheckProtection プログラムローン会員アメリカ-GAAP:LoansPayableメンバー2020-05-012020-05-310001845459nkgn: PaycheckProtection プログラムローンメンバーアメリカ-GAAP:LoansPayableメンバー2020-05-310001845459nkgn: PaycheckProtection プログラムローンメンバーアメリカ-GAAP:LoansPayableメンバー2022-01-012022-12-310001845459nkgn: 修正および復元スポンサーサポートロックアップ契約メンバー米国-公認会計基準:関連側メンバーnkgn: Graf 買収パートナー IVLLC メンバー2023-04-140001845459nkgn: 修正および復元スポンサーサポートロックアップ契約メンバー米国-公認会計基準:関連側メンバーnkgn: Graf 買収パートナー IVLLC メンバー2023-04-142023-04-1400018454592023-04-142023-04-140001845459nkgn: 修正および復元スポンサーサポートロックアップ契約メンバー米国-公認会計基準:関連側メンバーnkgn: Graf 買収パートナー IVLLC メンバーnkgn: 延期創業者株式メンバー2023-04-142023-04-140001845459nkgn: 修正および復元スポンサーサポートロックアップ契約メンバー米国-公認会計基準:関連側メンバーnkgn: Graf 買収パートナー IVLLC メンバーnkgn: TrancheOneMembernkgn: 延期創業者株式メンバー2023-04-142023-04-140001845459nkgn: 修正および復元スポンサーサポートロックアップ契約メンバー米国-公認会計基準:関連側メンバーnkgn: Graf 買収パートナー IVLLC メンバーnkgn: 延期創業者株式メンバーnkgn: トランシェツーメンバー2023-04-142023-04-140001845459米国-公認会計基準:関連側メンバーnkgn: アドバイザリー · リサーチサービスメンバー2023-01-012023-12-310001845459米国-公認会計基準:関連側メンバーnkgn: アドバイザリー · リサーチサービスメンバー2022-01-012022-12-310001845459米国-公認会計基準:関連側メンバーnkgn: アドバイザリー · リサーチサービスメンバー2022-12-310001845459米国-公認会計基準:関連側メンバーnkgn: アドバイザリー · リサーチサービスメンバー2023-12-310001845459nkgn: 実験室用品の購入メンバー米国-公認会計基準:関連側メンバー2023-01-012023-12-310001845459nkgn: 実験室用品の購入メンバー米国-公認会計基準:関連側メンバー2022-01-012022-12-310001845459nkgn: 実験室用品の購入メンバー米国-公認会計基準:関連側メンバー2023-12-310001845459nkgn: 実験室用品の購入メンバー米国-公認会計基準:関連側メンバー2022-12-310001845459nkgn: PrivateWarrants メンバー2023-12-310001845459nkgn: PrivateWarrants メンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001845459nkgn: PrivateWarrants メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001845459nkgn: PrivateWarrants メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2023-12-310001845459nkgn: ワーキングキャピタルワラントメンバー2023-12-310001845459nkgn: ワーキングキャピタルワラントメンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001845459アメリカ-公認会計基準:公正価値入力レベル2メンバーnkgn: ワーキングキャピタルワラントメンバー2023-12-310001845459nkgn: ワーキングキャピタルワラントメンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2023-12-310001845459nkgn: Forward 買入れデリバティブ負債メンバー2023-12-310001845459アメリカ-公認会計基準:公正価値入力レベル1メンバーnkgn: Forward 買入れデリバティブ負債メンバー2023-12-310001845459アメリカ-公認会計基準:公正価値入力レベル2メンバーnkgn: Forward 買入れデリバティブ負債メンバー2023-12-310001845459アメリカ-公認会計基準:公正価値投入レベル3メンバーnkgn: Forward 買入れデリバティブ負債メンバー2023-12-310001845459nkgn: PIPEWarrantsMember2023-12-310001845459アメリカ-公認会計基準:公正価値入力レベル1メンバーnkgn: PIPEWarrantsMember2023-12-310001845459アメリカ-公認会計基準:公正価値入力レベル2メンバーnkgn: PIPEWarrantsMember2023-12-310001845459nkgn: PIPEWarrantsMemberアメリカ-公認会計基準:公正価値投入レベル3メンバー2023-12-310001845459アメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001845459アメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001845459アメリカ-公認会計基準:公正価値投入レベル3メンバー2023-12-310001845459nkgn: シニアコンバーチブルノートメンバー2023-12-310001845459nkgn: A2019 コンバーチブルノートメンバー米国-公認会計基準:非関連側メンバー2021-12-310001845459nkgn: A2019 コンバーチブルノートメンバー米国-公認会計基準:関連側メンバー2021-12-310001845459米国-公認会計基準:非関連側メンバーnkgn: A2023 コンバーチブルノートメンバー2021-12-310001845459米国-公認会計基準:関連側メンバーnkgn: A2023 コンバーチブルノートメンバー2021-12-310001845459nkgn: A2019 コンバーチブルノートメンバー米国-公認会計基準:非関連側メンバー2022-01-012022-12-310001845459nkgn: A2019 コンバーチブルノートメンバー米国-公認会計基準:関連側メンバー2022-01-012022-12-310001845459米国-公認会計基準:非関連側メンバーnkgn: A2023 コンバーチブルノートメンバー2022-01-012022-12-310001845459米国-公認会計基準:関連側メンバーnkgn: A2023 コンバーチブルノートメンバー2022-01-012022-12-310001845459nkgn: A2019 コンバーチブルノートメンバー米国-公認会計基準:非関連側メンバー2022-12-310001845459nkgn: A2019 コンバーチブルノートメンバー米国-公認会計基準:関連側メンバー2022-12-310001845459米国-公認会計基準:非関連側メンバーnkgn: A2023 コンバーチブルノートメンバー2022-12-310001845459米国-公認会計基準:関連側メンバーnkgn: A2023 コンバーチブルノートメンバー2022-12-310001845459nkgn: A2019 コンバーチブルノートメンバー米国-公認会計基準:非関連側メンバー2023-01-012023-12-310001845459nkgn: A2019 コンバーチブルノートメンバー米国-公認会計基準:関連側メンバー2023-01-012023-12-310001845459米国-公認会計基準:非関連側メンバーnkgn: A2023 コンバーチブルノートメンバー2023-01-012023-12-310001845459米国-公認会計基準:関連側メンバーnkgn: A2023 コンバーチブルノートメンバー2023-01-012023-12-310001845459nkgn: A2019 コンバーチブルノートメンバー米国-公認会計基準:非関連側メンバー2023-12-310001845459nkgn: A2019 コンバーチブルノートメンバー米国-公認会計基準:関連側メンバー2023-12-310001845459米国-公認会計基準:非関連側メンバーnkgn: A2023 コンバーチブルノートメンバー2023-12-310001845459米国-公認会計基準:関連側メンバーnkgn: A2023 コンバーチブルノートメンバー2023-12-310001845459nkgn: MeasurementInputProbabilityOfConversion メンバーnkgn: レガシーコンバーチブルノートメンバー2022-12-310001845459nkgn: MeasurementInputProbablyOfNoConversionMembernkgn: レガシーコンバーチブルノートメンバー2022-12-310001845459US-GAAP:入力期待タームメンバーの測定nkgn: レガシーコンバーチブルノートメンバー2022-12-310001845459米国-公認会計基準:投入割引率を測るメンバーnkgn: レガシーコンバーチブルノートメンバー2022-12-310001845459米国-公認会計基準:入力信用拡散メンバーを測定nkgn: シニアコンバーチブルノートメンバー2023-09-290001845459nkgn: シニアコンバーチブルノートメンバーアメリカ公認会計原則:投入価格を測るメンバー2023-09-290001845459アメリカ-GAAP:公正価値は再帰的メンバーを測定する2023-12-310001845459米国-公認会計基準:入力信用拡散メンバーを測定nkgn: シニアコンバーチブルノートメンバー2023-12-310001845459nkgn: シニアコンバーチブルノートメンバーアメリカ公認会計原則:投入価格を測るメンバー2023-12-310001845459nkgn: PrivateWarrants メンバー2023-09-290001845459nkgn: ワーキングキャピタルワラントメンバー2023-09-290001845459US-GAAP:PrivatePlacementMembers2022-12-310001845459nkgn: ワーキングキャピタルワラントメンバー2022-12-310001845459nkgn: PrivateWarrantAndWorkingCapital メンバー2022-12-310001845459US-GAAP:PrivatePlacementMembers2023-01-012023-12-310001845459nkgn: ワーキングキャピタルワラントメンバー2023-01-012023-12-310001845459nkgn: PrivateWarrantAndWorkingCapital メンバー2023-01-012023-12-310001845459US-GAAP:PrivatePlacementMembers2023-12-310001845459nkgn: ワーキングキャピタルワラントメンバー2023-12-310001845459nkgn: PrivateWarrantAndWorkingCapital メンバー2023-12-310001845459アメリカ-公認会計基準:投入予想分配支払いメンバーを測定する2022-12-310001845459アメリカ公認会計原則:投入価格を測るメンバー2023-09-290001845459アメリカ-公認会計基準:投入予想分配支払いメンバーを測定する2023-09-290001845459アメリカ公認会計原則:投入価格を測るメンバー2023-12-310001845459アメリカ-公認会計基準:投入予想分配支払いメンバーを測定する2023-12-310001845459nkgn: PIPEWarrantsMember2022-12-310001845459nkgn: PIPEWarrantsMember2023-01-012023-09-300001845459nkgn: PIPEWarrantsMember2023-09-300001845459nkgn: PIPEWarrantsMember2023-09-290001845459米国-公認会計基準:入力信用拡散メンバーを測定nkgn: PIPEWarrantsMember2022-12-310001845459nkgn: PIPEWarrantsMemberアメリカ公認会計原則:投入価格を測るメンバー2022-12-310001845459nkgn: Forward 買入れデリバティブ負債メンバー2022-12-310001845459nkgn: Forward 買入れデリバティブ負債メンバー2023-01-012023-12-310001845459nkgn: Forward 買入れデリバティブ負債メンバー2023-12-310001845459アメリカ-公認会計基準:投入予想分割率を評価するメンバーnkgn: Forward 買入れデリバティブ負債メンバー2023-09-290001845459nkgn: Forward 買入れデリバティブ負債メンバーアメリカ公認会計原則:投入価格を測るメンバー2023-09-290001845459アメリカ-公認会計基準:投入予想分割率を評価するメンバーnkgn: Forward 買入れデリバティブ負債メンバー2023-12-260001845459nkgn: Forward 買入れデリバティブ負債メンバーアメリカ公認会計原則:投入価格を測るメンバー2023-12-260001845459アメリカ-公認会計基準:投入予想分割率を評価するメンバーnkgn: Forward 買入れデリバティブ負債メンバー2023-12-310001845459nkgn: Forward 買入れデリバティブ負債メンバーアメリカ公認会計原則:投入価格を測るメンバー2023-12-310001845459nkgn: シニアコンバーチブルノートメンバーUS-GAAP:EstimateOfFairValueFairValueDisclosureMember2023-09-290001845459nkgn: SPAWarrants メンバーUS-GAAP:EstimateOfFairValueFairValueDisclosureMember2023-09-290001845459nkgn: シニアコンバーチブルノートメンバーUS-GAAP:EstimateOfFairValueFairValueDisclosureMember2023-12-310001845459nkgn: SPAWarrants メンバーUS-GAAP:EstimateOfFairValueFairValueDisclosureMember2023-12-310001845459アメリカ公認会計基準:従業員ストックメンバー2023-01-012023-12-310001845459米国-GAAP:株式補償計画のメンバーnkgn: A2023 プランメンバー2023-01-012023-12-310001845459米国-公認会計基準:従業員株式オプションメンバーnkgn: A2019 プランメンバー2023-01-012023-12-31nkgn: インストール0001845459米国-公認会計基準:従業員株式オプションメンバーnkgn: A2019 プランメンバーSRT:最小メンバ数nkgn: 取締役会メンバーメンバー2023-01-012023-12-310001845459米国-公認会計基準:従業員株式オプションメンバーnkgn: A2019 プランメンバーSRT:最大メンバ数nkgn: 取締役会メンバーメンバー2023-01-012023-12-310001845459米国-公認会計基準:従業員株式オプションメンバー2023-01-012023-12-310001845459米国-公認会計基準:従業員株式オプションメンバー2023-12-310001845459米国-公認会計基準:研究·開発費メンバー2023-01-012023-12-310001845459米国-公認会計基準:研究·開発費メンバー2022-01-012022-12-310001845459アメリカ-公認会計基準:一般と行政費用メンバー2023-01-012023-12-310001845459アメリカ-公認会計基準:一般と行政費用メンバー2022-01-012022-12-310001845459アメリカ-公認会計基準:本土メンバー2023-12-310001845459アメリカ-公認会計基準:本土メンバー2022-12-310001845459アメリカ-GAAP:BuildingMembers2023-12-310001845459アメリカ-GAAP:BuildingMembers2022-12-310001845459アメリカ-GAAP:家具と固定機器のメンバー2023-12-310001845459アメリカ-GAAP:家具と固定機器のメンバー2022-12-310001845459米国-GAAP:デバイス構成員2023-12-310001845459米国-GAAP:デバイス構成員2022-12-310001845459アメリカ-公認会計基準:リース改善メンバー2023-12-310001845459アメリカ-公認会計基準:リース改善メンバー2022-12-310001845459アメリカ-GAAP:OfficeEquipmentMembers2023-12-310001845459アメリカ-GAAP:OfficeEquipmentMembers2022-12-310001845459アメリカ-GAAP:車両メンバー2023-12-310001845459アメリカ-GAAP:車両メンバー2022-12-310001845459US-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2023-01-012023-12-310001845459US-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2022-01-012022-12-3100018454592018-02-2800018454592021-10-3100018454592023-11-0900018454592021-01-012021-03-310001845459国:アメリカnkgn: NKMAX メンバー2023-12-310001845459nkgn: NKMAX メンバーアメリカ-公認会計基準:欧州連合メンバー2023-12-310001845459nkgn: NKMAX メンバー2023-12-31nkgn: 国0001845459nkgn: CountryBMembernkgn: NKMAX メンバー2023-12-310001845459nkgn: CountryDMembernkgn: NKMAX メンバー2023-12-310001845459nkgn: 国メンバーnkgn: NKMAX メンバー2023-12-310001845459nkgn: NKMAX メンバーnkgn: CountryCMember2023-12-310001845459アメリカ-公認会計基準:州と地方法律法規のメンバー2023-12-310001845459nkgn: カリフォルニア研究開発メンバー2023-12-310001845459アメリカ公認会計基準:副次的事件メンバー2024-01-022024-01-020001845459アメリカ公認会計基準:副次的事件メンバー2024-02-022024-02-020001845459アメリカ公認会計基準:副次的事件メンバー2024-01-112024-01-110001845459アメリカ公認会計基準:副次的事件メンバー2024-01-192024-01-190001845459アメリカ公認会計基準:副次的事件メンバー2024-01-190001845459nkgn: Forward 購入契約メンバーアメリカ公認会計基準:副次的事件メンバー2024-01-190001845459アメリカ公認会計基準:副次的事件メンバー2024-02-212024-02-210001845459nkgn: Forward 購入契約メンバーアメリカ公認会計基準:副次的事件メンバー2024-02-210001845459nkgn: FirstTrancheMemberアメリカ公認会計基準:副次的事件メンバー2024-02-092024-02-090001845459nkgn: SecondTrancheMemberアメリカ公認会計基準:副次的事件メンバー2024-02-092024-02-090001845459アメリカ公認会計基準:副次的事件メンバー2024-02-090001845459アメリカ公認会計基準:副次的事件メンバーUS-GAAP:BridgeLoanMembers2024-02-070001845459アメリカ公認会計基準:副次的事件メンバーSRT:最小メンバ数US-GAAP:BridgeLoanMembers2024-02-072024-02-070001845459アメリカ公認会計基準:副次的事件メンバーSRT:最小メンバ数US-GAAP:BridgeLoanMembers2024-04-012024-04-300001845459アメリカ公認会計基準:保証メンバーアメリカ公認会計基準:副次的事件メンバーUS-GAAP:BridgeLoanMembers2024-02-072024-02-070001845459SRT:シーン予測メンバUS-GAAP:BridgeLoanMembers2024-02-070001845459アメリカ公認会計基準:副次的事件メンバーUS-GAAP:BridgeLoanMembers2024-02-200001845459アメリカ公認会計基準:副次的事件メンバーSRT:最小メンバ数US-GAAP:BridgeLoanMembers2024-02-202024-02-200001845459アメリカ公認会計基準:保証メンバーアメリカ公認会計基準:副次的事件メンバーUS-GAAP:BridgeLoanMembers2024-02-200001845459SRT:シーン予測メンバUS-GAAP:BridgeLoanMembers2024-02-200001845459アメリカ公認会計基準:副次的事件メンバーUS-GAAP:BridgeLoanMembers2024-02-270001845459アメリカ公認会計基準:副次的事件メンバーSRT:最小メンバ数US-GAAP:BridgeLoanMembers2024-02-272024-02-270001845459アメリカ公認会計基準:副次的事件メンバーUS-GAAP:BridgeLoanMembers2024-02-272024-02-270001845459アメリカ公認会計基準:保証メンバーアメリカ公認会計基準:副次的事件メンバーUS-GAAP:BridgeLoanMembers2024-02-272024-02-270001845459SRT:シーン予測メンバUS-GAAP:BridgeLoanMembers2024-02-270001845459アメリカ公認会計基準:副次的事件メンバーnkgn: ブリッジローン契約期限 60 日または資金調達イベントメンバーUS-GAAP:BridgeLoanMembers2024-03-070001845459アメリカ公認会計基準:副次的事件メンバーSRT:最小メンバ数nkgn: ブリッジローン契約期限 60 日または資金調達イベントメンバーUS-GAAP:BridgeLoanMembers2024-03-072024-03-070001845459アメリカ公認会計基準:副次的事件メンバーnkgn: ブリッジローン契約期限 60 日または資金調達イベントメンバーUS-GAAP:BridgeLoanMembers2024-03-072024-03-070001845459アメリカ公認会計基準:保証メンバーアメリカ公認会計基準:副次的事件メンバーnkgn: ブリッジローン契約期限 60 日または資金調達イベントメンバーUS-GAAP:BridgeLoanMembers2024-03-072024-03-070001845459SRT:シーン予測メンバnkgn: ブリッジローン契約期限 60 日または資金調達イベントメンバーUS-GAAP:BridgeLoanMembers2024-03-070001845459nkgn: ブリッジローン契約満期 3 月 222024 メンバーアメリカ公認会計基準:副次的事件メンバー2024-03-07nkgn: 契約0001845459nkgn: ブリッジローン契約満期 3 月 222024 メンバーアメリカ公認会計基準:副次的事件メンバーUS-GAAP:BridgeLoanMembers2024-03-070001845459アメリカ公認会計基準:副次的事件メンバーアメリカ公認会計基準:転換可能債務メンバー2024-03-210001845459アメリカ公認会計基準:副次的事件メンバーアメリカ公認会計基準:転換可能債務メンバー2024-03-212024-03-210001845459SRT:シーン予測メンバアメリカ公認会計基準:転換可能債務メンバー2024-03-210001845459アメリカ公認会計基準:副次的事件メンバーアメリカ公認会計基準:転換可能債務メンバー2024-03-260001845459アメリカ公認会計基準:副次的事件メンバーアメリカ公認会計基準:転換可能債務メンバー2024-03-262024-03-260001845459アメリカ公認会計基準:副次的事件メンバーnkgn: OtherLenderMemberアメリカ公認会計基準:転換可能債務メンバー2024-04-010001845459アメリカ公認会計基準:副次的事件メンバーnkgn: OtherLenderMember米国-GAAP:ビジネス紙のメンバー2024-04-012024-04-010001845459アメリカ公認会計基準:副次的事件メンバーnkgn: FPA 投資家メンバーアメリカ公認会計基準:転換可能債務メンバー2024-04-010001845459アメリカ公認会計基準:副次的事件メンバーnkgn: FPA 投資家メンバー米国-GAAP:ビジネス紙のメンバー2024-04-012024-04-010001845459アメリカ公認会計基準:副次的事件メンバーアメリカ公認会計基準:転換可能債務メンバー2024-04-010001845459アメリカ公認会計基準:副次的事件メンバーアメリカ公認会計基準:転換可能債務メンバー2024-04-05nkgn: トランチ0001845459アメリカ公認会計基準:副次的事件メンバーアメリカ公認会計基準:転換可能債務メンバーnkgn: FirstTrancheMember2024-04-050001845459アメリカ公認会計基準:副次的事件メンバーアメリカ公認会計基準:転換可能債務メンバーnkgn: SecondTrancheMember2024-04-050001845459アメリカ公認会計基準:副次的事件メンバーアメリカ公認会計基準:転換可能債務メンバー2024-04-052024-04-050001845459アメリカ公認会計基準:副次的事件メンバー2024-02-122024-02-120001845459nkgn: Forward 購入契約メンバーアメリカ公認会計基準:副次的事件メンバー2024-04-152024-04-150001845459アメリカ公認会計基準:副次的事件メンバーnkgn: Forward 買取契約株式売却対象メンバー2024-04-152024-04-150001845459nkgn: PrivatePlacementAgreementsMemberアメリカ公認会計基準:副次的事件メンバー2024-04-152024-04-15 アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表10-K
| | | | | |
| x | 1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
現在の財政年度:2023年12月31日
あるいは…。
| | | | | |
o | 1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
移行期間から。
手数料書類番号001-40427
| | |
| 株式会社 NKGen バイオテクノロジー |
(登録者の正確な氏名はその定款に記載) |
| | | | | | | | |
デラウェア州 | | 86-2191918 |
(国やその他の管轄区域 会社や組織のこと | | (税務署の雇用主 識別コード) |
3001 ダイムラー通り
サンタ · アナ, カルシウム.カルシウム, 92705
(主な行政事務室住所)(郵便番号)
(949)396-6830
(登録者の電話番号、市外局番を含む)
適用されない
( 前回報告以降に変更された場合、旧氏名、旧住所、旧会計年度の記載 )
同法第12条(B)により登録された証券:
| | | | | | | | |
| クラスごとのタイトル | 取引コード | 主要な米国市場の名称 |
| 普通株、1株当たり0.0001ドル | NKGN | ナスダック世界市場 |
| 株式承認証では,1株当たり完全株式承認証は1株11.50ドルの行使価格で普通株を行使することができる | NKGNW | ナスダック資本市場 |
同法第 12 条 ( g ) に基づき登録された有価証券 : なし。
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください。はい、そうですo 違います。x.
登録者がこの法第13節または第15節(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示す。はい、そうですo 違います。x.
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示すはい、そうですx番号:o
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示すはい、そうですx番号:o
登録者が大規模な加速申請者、加速申請者、非加速申請者、小規模報告会社、または新興成長企業であるかどうかをチェックマークで示してください。取引法第 12b—2 条の「大規模加速申請者」、「加速申請者」、「小規模報告会社」、および「新興成長会社」の定義を参照してください。
| | | | | | | | | | | |
| 大型加速ファイルサーバ | o | 加速ファイルマネージャ | o |
非加速ファイルマネージャ | x | 規模の小さい報告会社 | x |
新興成長型会社 | x | | |
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守するo
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われるo
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用するo
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示すo
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、そうですo番号:x.
2024 年 4 月 16 日現在。 22,805,643発行済普通株式の額面 1 株当たり 0.0001 ドル
引用で編入された書類
本報告書の第 3 部は、 2023 年 12 月 31 日後 120 日以内に証券取引委員会に提出される予定の当社の最終委任状からの情報を参照して組み込んでいます。
紹介性説明
合併する
2019 年 9 月 29 日 ( 日 )締め切り」), NKGen バイオテクノロジー, 株式会社.( 旧 Graf Acquisition Corp. IV )グラフ」 ( デラウェア · コーポレーション ) 。NKGen の“または”会社」 ) は、 2023 年 4 月 14 日付の合併契約および合併計画 ( 以下、「合併契約」 ) の条件に従って、以前に発表した合併取引を完了しました。合併協定Austria Merger Sub, Inc. 、デラウェア州法人であり、グラフの元完全子会社である ( 「合併子」 ) と NKGen オペレーティングバイオテクノロジー株式会社( 旧 NKGen Biotech , Inc. ) 、デラウェア · コーポレーション ( Delaware Corporation )レガシー · NKGen」 ) 、この合併契約により、 Merger Sub が Legacy NKGen と合併し、 Merger Sub の別個の法人存在が終了し、 Legacy NKGen がクロージング時に当社の完全子会社となる ( 以下に定義 ) ( 以下、「合併するそして、合併協定とともに行われる他の取引業務合併“)”合併の完了に伴い,Graf社はその名称をGraf Acquisition Corp.IVからNKGen Biotech,Inc.,Legacy NKGenに名称をNKGen Biotech,Inc.からNKGen Operating Biotech,Inc.に変更した。業務統合の終了を本稿では“と呼ぶ終業する.”
企業合併について、GRAFはS-4表(アーカイブ番号:333-271929)の登録声明(改訂された登録声明“)米国証券取引委員会(the U.S.Securities and Exchange Commission,略称”アメリカ証券取引委員会“)”2023年8月14日、米国証券取引委員会は登録声明の発効を発表し、2023年8月14日、Grafは最終委託書/募集説明書を提出し、それぞれ2023年9月21日と2023年9月22日の最終委託書/募集説明書補編第1号と補編第2号の改訂と補充(改訂と補充を経て、最終依頼書/目論見書”).
ASa(I)(I)取引終了直前に発行されたすべてのレガシーNKGen普通株式であって、取引完了直前にレガシーNKGen普通株に変換された発行された変換可能手形を含み、交換比率0.408(“為替レート合計15,595,260株の私たちの普通株で、1株当たり0.0001ドルの価値があります(我々のC普通 株 “または”NKGen普通株)および(2)従来のNKGen普通株を購入する各オプションは、既得性でも非既得性でも、我々普通株を購入するオプションに仮定され、変換される(仮定された選択肢)を仮定すると、各仮説株式購入は、元のNKGen株購入に適用される同じ条項および条件によって規定され、交換比率および合併協定に記載されている他の条項に基づいて生成される使用価格および普通株を購入可能な株式の数を受ける必要がある。
文意のほかに指摘がある“私たちは,” “アメリカです。,” “我々の“と”会社我々とその合併後の子会社を指し,“Graf”はGraf Acquisition Corp.IVの取引終了時または直前である.本文書に記載されているすべての“NKGen取締役会“企業合併が発効した後の会社取締役会のことです。
2023年9月25日に開催されたGraf株主特別会議と業務合併では,Graf普通株3,386,528株を保有する株主は1株当たり約10.4415ドルの償還価格でその株を現金で償還する権利を行使し,償還総額は約3,540万ドルであった。取引完了後,会社はGraf信託口座からの約170万ドルと,株式承認契約や証券購入プロトコル(定義は後述)に関する取引約2020万ドルを含む約2190万ドルの毛収入を得た。また、私募配給契約(定義は後述)によると、約3,290万ドルの資金が信託口座に入金されており、当社は業務合併終了に関する資金を受け取っていません。付記4で述べたように、信託資金は、当社、投資家、または両者の組み合わせに発行することができる私募する連結財務諸表にあります。
終値時には,Grafはその譲渡エージェントにGrafの公共部門をそれらの構成要素証券に分離するように指示し,結果は…終値後、Grafの公的機関は単独の証券として取引することができなくなり、ニューヨーク証券取引所から退市する。終値後の第二営業日に、私たちの普通株は21,888,976株の発行と流通株があります。
上記の統合プロトコルの記述は要約のみであり、その全文は統合プロトコルの全文によって制限され、合併プロトコルのコピーは添付ファイル2.1として添付され、参照によって本明細書に組み込まれる。
本年度報告で用いた10-K表中の大文字用語は,ここでは別途定義されておらず,最終依頼書/目論見書にこれらの用語を付与する意味を持つべきである.
本報告では,それぞれの所有者の財産である他の実体に属する商標について言及した。私たちは、任意の他の会社との関係を暗示するために、または他の会社が裏書きしたり、私たちを賛助したりすることを示唆するために、他の会社の商号や商標を使用または展示することを意図していない。
定義された用語のいくつかは
“業務.業務 組み合わせ” 手段.手段 ♪the the the 取引記録 想定中の から ♪the the the 業務.業務 組み合わせ 合意する。
“終業する「事業の閉鎖」の意味 コンビネーション
“締め切り「閉店の日付」を意味します。
“憲章” 手段.手段 ♪the the the 改訂されました そして 改めて述べる 証書 のです。 法団に成立する のです。 NKGen 、 保存済み 使用 The Secretary of State of the State of デラウェア州開ける5月.20 、 2021 年と改正 5月.2023 年 9 月 20 日と 29 日 2023.
““取引所法案”“とはアメリカです1934 年証券取引所法 ( 改正 ) 。
“転送 購入 協議” 手段.手段 それら 一定の 転送 購入 協議 日取り 9月 2023 年 9 月 26 日、 2023 年 9 月 29 日、グラフと特定の間で 2024 年 1 月 19 日、 2024 年 1 月 11 日、 2024 年 1 月 2 日、 2023 年 12 月 26 日に改正された。
“会計原則を公認する「米国の一般に認められた会計原則」
“グラフ「 Graf Acquisition Corp. IV 、デラウェア州法人 ( 閉鎖後、 NKGen Biotech, Inc. となった ) を意味します。
“グラフ IPO「グラフの新規株式公開は、 2021 年 5 月 25 日に 17,161,500 ユニットを 1 ユニット 10 ドルで売却し、完了した。
“レガシー NKGen の” 手段.手段NKGen の オペレーティングバイオテクノロジー株式会社A デラウェア州事業統合により、直接の完全子会社となった法人 NKGen の バイオテクノロジー株式会社文脈に別段の必要がない限り連結子会社です
“合併協定」という合意と計画が 合併, 2023 年 4 月 14 日現在、 Graf 、 Merger Sub 、 Legacy による NKGen 。
“ナスダック“ナスダック株式市場有限責任会社のこと。
“NKGen の” 手段.手段 ♪the the the デラウェア州 会社 その中で この前 至れり尽くせり 完結 のです。 ♪the the the 業務.業務 この合併はグラフ買収と呼ばれた。 カナリア. 四、
“NKGen取締役会「 NKGen の取締役会」を意味します。
“NKGen の 付例“または”付例」と改訂し、改訂した。細則 採用される NKGen の 閉店直後。
“NKGen の ごく普通である 在庫品” あるいは…。 “我々の ごく普通である 在庫品” 手段.手段 1つは 発表されました そして 卓越した 共有 のです。 普通株式、パー 価値がある$0.0001 1 人あたり シェア, のです。 NKGen 。
“NKGen の オプション」という選択肢を獲得する NKGen普通株.
“NKMAX「 NKMAX Co. 」の意味Ltd. 、大韓民国の法律に基づいて設立された NKGen の最大の株主です
“喉頭管捜査令状「ワラント引受契約に基づき、当該ワラント引受者が購入したワラントの総計 10,209,994 枚を意味し、それぞれのワラント引受契約に基づき、一定の状況下で現金または現金なしの行使が可能である。
“私 株式承認証” 手段.手段 ♪the the the 4,721,533 株式承認証 購入した から ♪the the the スポンサー?スポンサー 一斉送信する 使用 グラフ IPO 、 どれも のです。 どっち はい。 練習可能である 適用することができます 現金 はい。 1つは トレーニングをする 値段 のです。 $11.50 あるいは…。 現金を持たない トレーニングをする はい 場合によっては適用することができます1 つのシェア NKGen普通株.
“公衆株式承認証” グラフの IPO で売却されたグラフのユニットの構成要素として含まれる 3,43 2,286 枚のワラントを意味します。 行使可能で 行使価格は 11.50 ドルで 適用することができます1 つのシェア NKGen普通株その条件に従って
“アメリカ証券取引委員会“アメリカ証券取引委員会のことです。
“証券 購入 協議” 手段.手段 ♪the the the 証券 購入 協議 はい。 関係.関係 至れり尽くせり ♪the the the シニア転換社債および シニア転換社債に関連して発行された 1,000,000 枚のワラントは、それぞれ、 NKGen 普通株式 1 株に対して、行使価格 $11.50 で行使されました。 9 月 15 日付グラフと NKMAX による 2023.
“上級生 オープンカー 備考” 手段.手段 ♪the the the $10,000,000 骨材 元金 金額 のです。 5.0% / 8.0% 有価証券買取契約に基づき、 NKMAX に対して非公開発行を行う 2027 年期転換シニア社債。
“スポンサー?スポンサー「 Graf Acquisition Partners IV LLC 、デラウェア州の有限責任会社」を意味します。
“捜査命令引受契約「 2023 年 9 月 26 日および 2023 年 9 月 27 日付のグラフとワラント投資家の間で締結された特定のワラント引受契約を意味します。 へ、その条件に従い、証券投資家は ありますか共同で購読 適用することができます合計 10,20 9,994 株の普通株式をプライベート · プレイスメントで購入することに合意しました はい1 ワラントにつき $1.0 0 の購入価格となり、合計購入価格は $10,209,994.
“株式承認証「私的」の意味 令状ザ · パブリック 株式承認証そして労作資本令状を取る
“労作 資本 注意事項” 手段.手段 ♪the the the オープンカー 約束手形 注意事項 発表されました から グラフ 至れり尽くせり ♪the the the スポンサー?スポンサー 使用 a 元本額は 2023 年 5 月 15 日に 150 万ドルまでです。
“運営資金引受証「クローズ時に運転資本ノートに基づく当時の残高の転換により発行された 523,140 ワラントを意味し、各ワラントは、 NKGen 普通株式 1 株に対して 11.50 ドルの行使価格で現金で行使可能、またはその条件に従って現金なしの行使が可能である。
株式会社 NKGen バイオテクノロジー
表格10-K
2023年12月31日
索引.索引
| | | | | | | | |
| | ページ |
第1部 | | |
第1項。 | 業務.業務 | 3 |
第1 A項。 | リスク要因 | 35 |
項目1 B。 | 未解決従業員意見 | 80 |
プロジェクト1 C。 | ネットワーク·セキュリティ | 81 |
第二項です。 | 属性 | 81 |
第三項です。 | 法律訴訟 | 81 |
第四項です。 | 炭鉱安全情報開示 | 81 |
| | |
第II部 | | |
五番目です。 | 登録者普通株市場、関連株主事項及び発行者による株式証券の購入 | 82 |
第六項です。 | [保留されている] | 82 |
第七項。 | 経営陣の財務状況と経営成果の検討と分析 | 83 |
第七A項. | 市場リスクの定量的·定性的開示について | 104 |
第八項です。 | 財務諸表と補足データ | 105 |
第九項です。 | 会計·財務開示面の変更と会計士との相違 | 143 |
第9 A項. | 制御とプログラム | 144 |
プロジェクト9 B. | その他の情報 | 144 |
プロジェクト9 C. | 検査妨害の外国司法管轄権を開示する | 144 |
| | |
第三部 | | |
第10項。 | 役員·幹部と会社の管理 | 145 |
第十一項。 | 役員報酬 | 145 |
プロジェクト12 | 特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 | 145 |
十三項。 | 特定の関係や関連取引、取締役の独立性 | 145 |
14項です。 | プリンシパル会計士の手数料とサービス | 145 |
| | |
第IV部 | | |
第十五項。 | 展示物 · 財務諸表 | 146 |
第十六項。 | 表格10-Kの概要 | 150 |
| | |
サイン | | 151 |
第1部
前向き陳述に関する特別説明
このフォーム 10—K の年次報告書には、証券法第 27A 条および 1934 年証券取引法第 21E 条 ( 改正 ) の意味における「将来の見通しに関する記述」が含まれている可能性があります。当社の将来の見通しに関する記述には、当社またはその経営陣の将来に関する期待、希望、信念、意図または戦略に関する記述が含まれますが、これらに限定されません。これには、当社の事業の計画および戦略、将来の財務実績、費用水準および流動性源に関する当社の期待が含まれます。また、将来の事象や状況の予測、予測、その他の特徴に言及する記述 ( 基礎となる仮定を含む ) は、将来の見通しに関する記述です。「予想する」、「信じる」、「継続する」、「見積もることができる」、「期待する」、「意図する」、「可能性のある」、「計画する
このフォーム 10—K の年次報告書およびここに組み込まれる文書に含まれる将来の見通しに関する記述は、当社が現在入手可能な情報を考慮して、将来の発展および当社に対する潜在的な影響に関する当社の現在の期待および信念に基づいています。当社に影響を及ぼす将来的な展開が、当社が予想したものであることを保証するものではありません。これらの将来の見通しに関する記述には、多くのリスク、不確実性 ( その多くは予測が困難であり、当社の制御を超えている ) 、または実際の結果または業績がこれらの将来の見通しに関する記述によって表現または暗示されるものと大きく異なる可能性のあるその他の仮定が含まれます。
多くの既知と未知のリスクと不確定性のため、会社の実際の結果や業績はこれらの前向き陳述の中で明示的または暗示的な内容とは大きく異なる可能性がある。実際の結果につながる可能性のあるいくつかの要因は
•将来の資金調達のための会社の能力
•当社の業務および経費、その他の流動性ニーズに対応する能力、および継続事業として継続する能力に対処する能力。
•事業統合による期待される利益を認識する能力
•ナスダック · グローバル · マーケットにおける NKGen 普通株式の上場及びナスダック · キャピタル · マーケットにおけるそのワラントを維持する能力並びにこれらの有価証券の潜在的な流動性及び取引。
•♪the the the リスク それは ♪the the the 完結 のです。 ♪the the the 業務.業務 組み合わせ 破壊 現在のところ 平面図 そして オペレーションは 会社
•企業合併に関連するコストおよび第三者への費用および/または支払い;
•法律や法規の変更を適用する
•会社は企業合併後に私たちの高級管理者、肝心な従業員或いは取締役を維持或いは募集することに成功して、あるいは変動する必要があります
•会社が開発に成功し、関連規制機関の許可を得た任意の候補製品を商業化することができるかどうか
•臨床試験と規制が申請データを承認する時間と結果に対する会社の予想
•同社の業務、運営、財務業績は、以下の通りです
o会社の経営損失の歴史と、将来予想される重大な費用と持続的な損失への期待
o会社が業務戦略を遂行する能力
o会社がブランドと名声を維持する能力を発展させ
•他の会社と協力する能力は
•企業の候補製品の潜在市場規模
•知的財産権の保護および他人の権利を侵害しない能力の獲得と維持に対する当社の期待
•当社に対して提起される可能性のある任意の法的訴訟の結果
•当社の業界、グローバル経済、またはグローバル·サプライチェーンの不利な条件は、金融·信用市場の変動、国際貿易関係、流行病、政治的動揺、自然災害、戦争(例えば、ロシアとウクライナ間の戦争、イスラエルとガザ地区の武力衝突、イスラエルのハマスに対する宣戦)、テロを含む。
これらの展望的陳述は、本年度報告10-K表までの既存の情報および現在の予想、予測および仮定に基づいており、多くのリスクおよび不確定要因に関連している。したがって、本年度報告書のForm 10−Kおよび本明細書で参照される任意の文書中の前向き陳述は、任意の後続の日付における会社の観点を代表するものとみなされてはならず、会社は、適用される証券法が要求されない限り、それらの作成日後のイベントまたは状況を反映するために、それらの日付後のイベントまたは状況を反映するために、任意の後続の日付の観点を代表するものとみなされてはならない。
あなたはこのForm 10-K年間報告書とここに含まれている文書を完全に読み、私たちの未来の実際の結果が私たちが予想していたものと大きく異なる可能性があることを理解しなければなりません。私たちはこのような警告声明を通じて私たちのすべての展望的声明を限定する。
また、“私たちが信じている”という声明と類似した声明は、関連テーマに対する私たちの信念と意見を反映している。これらの陳述は、本年度報告10-K表までの日に我々に提供された情報に基づいており、これらの情報は、このような陳述の合理的な基礎を構成していると考えられるが、このような情報は、入手可能なすべての関連情報について詳細な調査または検討が行われていることを示すものとして解釈されてはならない。このような陳述は本質的に不確実であり、投資家たちにこのような陳述に過度に依存しないように想起させる。
プロジェクト1.ビジネス
私たちの使命とビジョンは
我々の使命は,安全で有効な細胞療法を開発することにより,患者の免疫系の力を利用して,神経変性疾患や腫瘍疾患領域の患者予後を改善することである。私たちのビジョンは自動車自然キラー分野の世界的なリーダーになることだNK“)細胞療法。
概要
我々はバイオテクノロジー会社であり,活性化NK細胞の神経変性疾患と腫瘍性疾患に基づく細胞療法を開発している。NK細胞はヒト先天性免疫反応系の一部であり、異常または罹患した細胞を選択的に識別および破壊することができる。私たちの候補製品はSuperNKの独自製造と冷凍保存プロセスに基づいていますTM (“SNKNKMAXによる体外実験結果から,細胞毒性,サイトカイン産生,受容体発現の活性化などのパラメータから,初期NK細胞個体群に比べて活性が増強した細胞が示された。SNK細胞は解凍と再建後に高レベルの細胞毒性を維持し、受容体の発現を活性化しながら、大量生産と凍結保存ができる。SNK細胞はアルツハイマー病(アルツハイマー病)などの神経変性疾患を有する患者に転化益をもたらす可能性があると信じている広告.広告“パーキンソン病”と“PD)“と、腫瘍学的疾患。
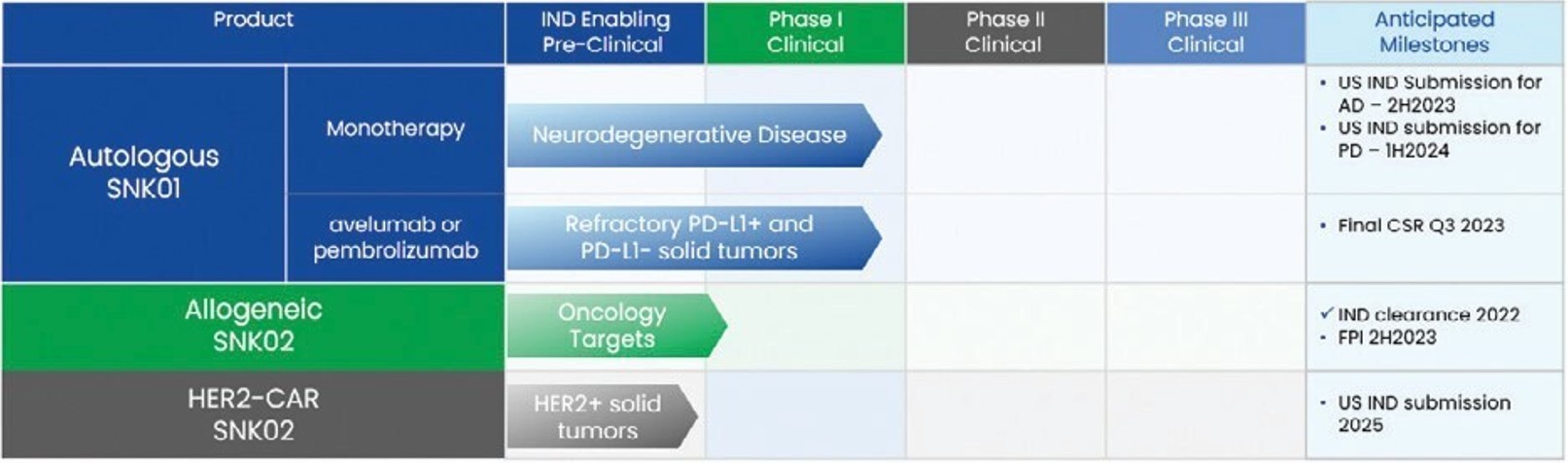
神経変性疾患におけるSNK 01(自己細胞治療候補薬物)の潜在力に対する初歩的な知見は、3人のAD患者と2人のPD患者からの同情使用データから来た。同情的使用とは、臨床試験以外に、許可された医薬製品によって満足に治療できない研究または未承認医療製品(薬物、生物学的または医療機器)を使用することを意味する。SNK 01を使用してこれら5人の患者を治療することは、認知、発声、および運動障害のようないくつかの典型的なADおよびPDに関連する臨床症状の著しい改善に関連する。これらの思いやりのある用例研究の結果は、SNK 01がAD或いはPDを治療する安全或いは有効と考えられることを保証或いは保証することができず、SNK 01は広範な臨床テストと監督管理の承認を必要とするが、これらの結果はNKGenが神経変性疾患を治療する潜在的な治療法としてSNK 01の正式な臨床開発を開始することを招く。そのため、著者らはメキシコでAD患者におけるSNK 01の安全性と耐性を評価するためのI期試験(MX 04)を行っており、この患者は2023年10月に試験的新薬を獲得した(MX 04)工業)FDAが米国でI/IIa期試験を行い,2023年12月にカナダ衛生部の同一試験のCTAの承認を得て,2023年12月に米国でこの試験の最初の患者を開始した。
腫瘍学的には,SNK 01は単一療法,併用検査点阻害剤,標的療法としてI期試験で一定の抗腫瘍活性,腫瘍縮小と固形腫瘍疾患の安定を示した。SNK 01を用いた単一治療群では,厳密な予備治療を受けた難治性患者9名中6名が一定期間腫瘍の進行を阻止した。最高用量レベル(すなわち4×10)で9I期試験中の細胞)は,腫瘍が減少する傾向にあったが,固形腫瘍の反応評価基準を満たしていなかった。SNK 01と免疫チェックポイント阻害剤の連合治療群では、一部の患者は部分的に緩和或いは病状の安定を維持できる状態に達した。この第一段階試験は統計学的意義検定を支援するために設計されたものではない。
2023年に開始されたSNK 01(米国ADのI/IIa期試験)およびSNK 02(固形腫瘍)研究の臨床読み取りは、後続の共同試験の基礎となると予想される。2024年以降、資金が許可されれば、PDの第一段階試験を行い、他の神経変性疾患に拡張した状況を評価し、戦略協力を通じて腫瘍学の発展を加速し、引き続き私たちの製造技術に投資するためにINDをFDAに提出する予定である。
NK細胞は先天性免疫系の構成部分であり、循環リンパ細胞或いはリンパ細胞の約5%~15%を占める。NK細胞は、細胞損傷または感染に関連するマーカーを発現する様々なタイプの細胞を広く認識および破壊する能力を有する。NK細胞破壊の標的細胞は、癌細胞、損傷ニューロン、および感染細胞を含むが、これらに限定されない。数百件のNK細胞の臨床試験が開始されているにもかかわらず,これまでFDAによるNK細胞の治療は承認されていない。臨床結果を改善するための重要な障害の1つは潜在的NK細胞療法の準備様式に関与しており,われわれの特許過程はNK細胞を産生する可能性があり,神経変性疾患や腫瘍疾患の治療に変性的な作用を生じる可能性が考えられる。
私たちの解決策は
著者らはすでにSNK細胞のために1種の革新的な製造技術を開発し、今までNK細胞の治療潜在力を制限してきたいくつかの要素を解決した。
•拡張性それは.健常ドナーや癌患者からNK細胞を産生する能力が示されており,患者が治療を受けられない可能性のある製造障害を最小限にしている。
•活動するそれは.NKMAXによる体外実験結果によると,細胞毒性,サイトカイン産生,受容体発現の活性化などのパラメータから,SNK細胞は初期NK細胞集団に比べてSNK細胞が用量あたりより高いNK細胞活性を提供する能力を示した。
•超低温保存それは.我々はすでにNK細胞の凍結保存を促進する技術を開発し,その大部分の細胞活性を保持している。この能力により,候補製品を生成することができ,これらの製品は既製の治療法として随時提供できると信じている。
•スケーラビリティそれは.我々は,高い細胞活性と活力を保ちながら数十万用量のSNK細胞を生成するためにこの技術の開発に投資している。私たちが非常に流行している病気を解決しようとする時、この能力は必須的だ。私たちは25,000平方メートルのホテルを所有して運営している。英フィナンシャル·タイムズ紙カリフォルニア州サンアナにある医薬品製造工場の約半分に良好な製造仕様が搭載されている(“GMP)“ナチュラルキラー細胞の産生。
著者らはすでに臨床試験でSNK 01を用いて約64名の腫瘍患者と13名のAD患者を治療し、化学療法、セツキシマブ、アヴェルモノクロナル抗体、ペブロリモノクロナル抗体、AFM 24を含む単一療法としても他の薬剤との併用も行った。2023年12月31日までに、これらの患者が新鮮なSNK 01を注入した回数は530回を超えた。すべての研究において,1患者あたりの投与量中央値は6回の輸液であり,最低1回,最大38回であった。他の5名の患者は同情した上でADやPDの治療を受けた。SNK 01に関与すると考えられる重大な有害事象の報告はなく,SNK 01の免疫関連AE分類2によるものもない。これらの要素は神経変性疾患の治療を求める自信を持たせ、著者らは動物モデルではなく、SNK 01の直接ヒト患者における治療潜在力を評価している。
NKGenによる2023年9月30日以降の臨床試験では,SNK 01は凍結保存されたSNK 01を使用している。すべての同種異体研究には凍結保存したSNK 02を用いた。
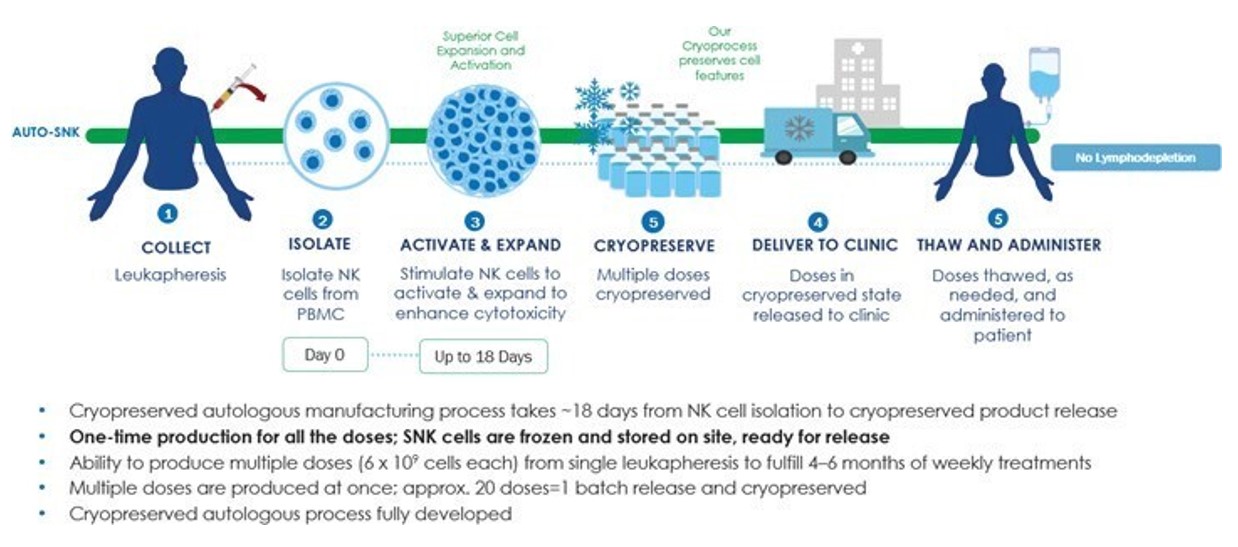
自己SNKと異体SNKの比較
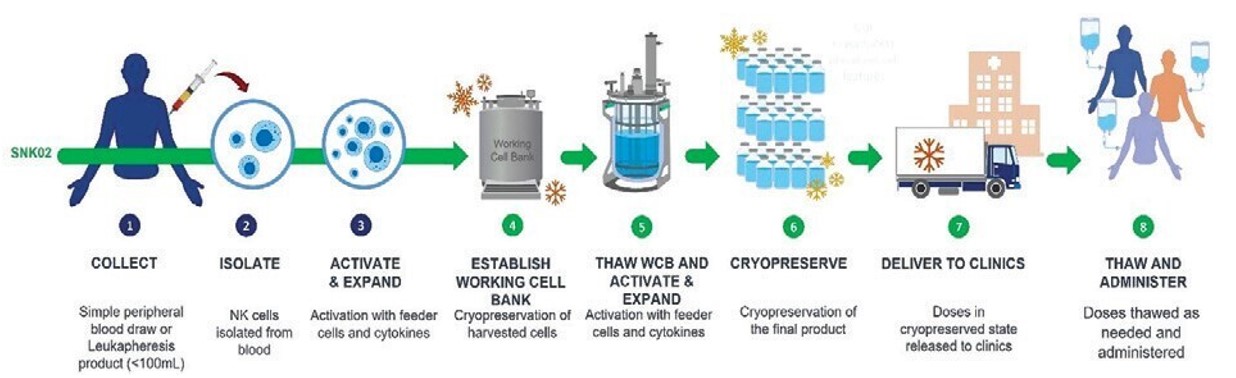
我々の新しい製造技術は、自己(SNK 01)または同種異体(SNK 02)細胞治療のためのSNK細胞の生産を可能にする。自己SNK 01は単一患者自身のNK細胞を用いて製造され、産生された製品は同一の患者に再注入される。患者のNK細胞は精製と培養により18日間拡大し、収穫した細胞は洗浄、包装され、冷凍製品として-130°Cに貯蔵された。ドナーからのNK細胞が精製され、作業細胞バンクを構築するために使用された(“WCB“)”WCBSはNK細胞を長期培養と複数回継代することによってさらに処理し、それによって多用量の同種異体細胞治療製品の生産を可能にした。生産したSNK 02は−130 Cで凍結保存され,任意の患者に使用可能である。
SNK 01
アルツハイマー病やパーキンソン病などの神経変性疾患の潜在的な治療のためのSNK 01を開発しており、5人の患者の同情使用例のデータに基づいている。報告されたこれらの症例の観察結果によると,非対照症例からの研究の限られたデータに警告があるにもかかわらず,SNK 01はこのような神経変性疾患治療を変化させる潜在力があると信じられている。重篤なアルツハイマー病を有する患者はこれ以上歩くことや話すことや食事をすることができず,治療後にこれらの能力を部分的に回復した。ADの評価には通常簡易精神状態検査(“色とりどりの手紙“)得点。早期疾患患者のMMSEスコアは、一般に20~25の間である。患者に中等度の症状が出現し、明らかな障害を示す場合、MMSEスコアは通常13~20である。AD患者はNKGen同情治療を受けた上で重篤な認知症を示し、記録されている治療前MMSEスコアは12であったが、SNK 01 6剤服用後、MMSEスコアは23に改善した。
著者らはすでにFDAとINDを確立し、I/II期臨床試験を開始し、ADにおけるSNK 01の潜在力を評価した(研究は2023年12月に始まった)。この試験を準備するために,SNK 01の用量逓増I期安全性と耐性試験を行い,本年度報告日までにメキシコ11名のAD患者(MX 04)に使用され,病院研究倫理委員会とメキシコ規制機関の承認を得た。この試験の一部として,認知機能テストを行い,AD疾患の重症度に対するSNK 01の影響の評価を支援する探索的バイオマーカーデータを収集している。これまでに得られたデータは,SNK 01を静脈内投与した患者の耐性が良好であり,認知機能の安定あるいは改善を招くことを示している。患者は臨床認知症評価表の総和、アルツハイマー病評価尺度-認知サブスケールとMMSEを用いて評価を行い、いずれもAD臨床試験で広く使用され、臨床検証されている一般的な認知測定である。データにより、SNK 01用量は脳脊髄液中のアミロイド、tauと神経炎症バイオマーカーのレベルの安定或いは低下と関係があり、これらのバイオマーカーは疾病の病理変化を示唆する
著者らとNKMAXは新鮮なSNK 01に対していくつかの試験を行い、これらの試験は腫瘍疾患におけるSNK細胞の耐性と治療潜在力を証明したと信じている。これらの試験は,(1)単一療法として,SNK 01の高度進行期癌患者の治療により評価を受けた患者9名中6名の患者の病態が少なくとも9週間安定している,(2)検査点阻害剤と結合し,SNK 01の添加が難治性肺癌患者の総生存率を改善し無進展生存率を増加させた,(3)NKMAXはメルクKGaA社と協力し,NKMAXはI/IIA段階試験を行い,SNK 01と治療性抗体セツキシマブの組み合わせを検討し,この抗体の市場名はErbituxである,の3つに分類されている®末期上皮増殖因子受容体変異の非小細胞肺癌では,チロシンキナーゼ阻害剤には無効であった。この協力試験の初歩的な結果は年に一度のアメリカ臨床腫瘍学会で公表されたASCO“)2023年6月の会議では,SNK 01併用セツキシマブ治療を受けた6名中3名が部分的緩解を得た。ASCO会議を分析したところ,SNK 01治療を受けた他のすべての患者の病態は安定していた。
SNK 02
腫瘍疾患においてSNK 01によって産生された概念検証データに基づいて、既存製品の使用に対する選好、および自己NK細胞と比較して、同種NK細胞の使用がより良い抗腫瘍反応を有する可能性があることを示す証拠に基づいて、我々は、我々の腫瘍疾患開発計画を自己製品SNK 01から凍結保存された同種製品SNK 02に移行させている。したがって,SNK 02はヒト臨床試験においてより大きな潜在力を有している可能性が考えられる。著者らの製造専門知識のため、著者らは数十万剤の低温保存のSNK 02を生産し、患者の随時獲得に供することができ、現在必要に応じて新鮮なNK細胞製品を生産する時間と資源集約型プロセスを改善することができると予想している。2022年10月14日、我々はFDAからSNK 02同種異体NK細胞による固形腫瘍治療のIND承認を得た。われわれはすでにSNK 01臨床試験の第1段階で難治性固形腫瘍の投与を開始している。我々の同種異遺伝子NK細胞治療製品候補はリンパ枯渇を必要とすることなく、臨床試験を受ける。これは抗腫瘍反応に優れている可能性が考えられる。
背景
我々は2017年に米国で設立され,NKMAXのホールディングス子会社であり,NKMAXは韓国有数のバイオテクノロジー会社であり,NK細胞治療および診断分析,抗体,タンパク質の開発と製造に特化している。NKMAXは2015年にコスダックで発売された。その後間もなく,NKMAXは独自のNK細胞療法の開発を開始し,日本の診療所との協力により日本に子会社を設立した。この協力により,NKMAXはヒト患者における自己NK細胞治療の早期データを得た。これらのデータはNKMAX臨床戦略発展の基礎であり、2019年に韓国の大手病院と共に非小細胞肺癌患者における最初の臨床試験を開始するための基礎を提供し、この試験は自己NK細胞療法SNK 01と免疫検査点阻害剤pembrolizumabを使用した。著者らの成立の目的は腫瘍と神経変性疾患(例えばADとPD)の中で更にSNK 01を開発することである。
SNK 01が開発された後,NKMAXは既製の凍結保存された同種異体NK細胞療法SNK 02を開発し,その腫瘍学的臨床計画を拡大した。NKMAXは韓国でその第1段階SNK 02試験を開始し,2023年10月に韓国規制機関MFDAの承認を得たINDを計画している。著者らはすでに2023年8月にアメリカでSNK 02臨床試験の第一段階用量を開始した。
会社間ライセンスの条項によれば、NKMAX制御されたすべてのデータ(非臨床的、臨床的、および任意の他のデータ)を使用するライセンスを有しており、これらのデータは、許可領域内でNK細胞医薬製品、プロセス、サービスまたは療法を開発、製造、製造、使用または商業化するために合理的に有用である。したがって,韓国におけるNKMAXの臨床開発はSNK細胞の潜在的用途に洞察を提供し続けることが予想され,これらのデータを使用する権利がある。“”というタイトルの部分を参照ビジネス-ライセンス契約-NKMAXライセンス“もっと細かいことを知っている。
我々の目標は神経変性疾患と腫瘍疾患を有する患者に変革性のNK細胞療法をもたらし、それによって著者らのチームの広範なNK細胞専門知識の潜在力を実現することである。私たちの差別化戦略は、私たちが高度に統合されたプラットフォームを利用してNK細胞療法を開発し、製造できると信じている。神経変性疾患に対する著者らの拡張と私たちの固形腫瘍腫瘍戦略は私たちの独特なNK細胞療法の柱である。私たちの戦略の主なハイライトは含まれているが、これらに限定されない
•ADにおけるSNK 01の臨床研究進展これまで,SNK 01が末期AD患者で得られた結果は,患者に変革性の治療メリットをもたらす可能性が示唆されてきた。2023年10月20日、我々はADでSNK 01に対するFDAのIND承認を得た。2023年12月21日、私たちはカナダ衛生部からADへのSNK 01の臨床試験応用に対する同じ提案書を受け取った。2023年12月28日、私たちは米国の最初の参加者にSNK 01-AD 01臨床試験の薬を服用した。2024年以降は,(I)SNK 01の臨床開発を進め,米国とカナダでADを募集するI/IIa期試験を継続し,(Ii)難治性固形腫瘍に対するSNK 02のI期試験を継続する予定である。
•パーキンソン病におけるSNK 01の臨床研究の進展同情に基づいてSNK 01治療を受けた患者の初歩的な結果は,SNK 01耐性が良好であり,パーキンソン病の疾患改良剤となる可能性が示唆された。2024年第1四半期に、著者らはPDで一期試験を行うためにFDAにINDを提出し、資金が許可されれば、私たちは引き続き他の神経変性疾患への拡張を評価し、戦略協力を通じて腫瘍学の発展を加速する。
•多様な腫瘍治療の骨幹としてSNK 02を開発したSNK 02によって生成されたデータによれば、SNK 01と類似した特徴を示し、我々のSNK 02同種製品候補は、我々の自己SNK 01製品に拡張可能な既製代替製品の機会を提供すると考えられる。著者らは2022年10月にSNK 02の固形腫瘍に対するFDAのIND承認を得て、2023年8月にSNK 02の臨床試験の第一段階を開始した。キメラ抗原受容体も開発しています“自動車)、SNK 02の誘導体は、いくつかの高発固形腫瘍に対するものである。
•協力を通じて腫瘍学の発展を加速する我々は,免疫チェックポイント阻害剤や治療用抗体などの癌療法をリードする抗腫瘍潜在力を顕著に増強するために,SNK細胞療法の潜在的機会を決定した。我々は,SNK 01とAvelumabの組み合わせを評価するために,メルクKGaA(AresTradingにより)と協力関係を構築し,将来的には他のバイオテクノロジー会社と類似したパートナー関係を構築することが予想される。
•製造技術に投資し続けています我々のSNK製造技術は、他のNK細胞製造方法のいくつかの重要な制限を解決する能力があることを証明した。単一ドナーから収集した材料を用いて,数十万種類の潜在用量のNK細胞療法を生産する能力があると信じている。これはNK細胞放出療法の治療潜在力に重要であると考えられる。私たちは私たちのプロセスの工業化を最適化し続け、これは私たちの臨床開発活動がもたらす市場機会に対応するために必要であろう。最後に、私たちは私たちのプロセスの自動化を最適化して開発することに投資する予定だ。私たちは25,000平方メートルのホテルを所有して運営している。英フィナンシャル·タイムズ紙カリフォルニア州サンアナにある製薬工場では、その約半分がナチュラルキラー細胞を生産するためのGMPを装備している。
パイプ.パイプ
ナチュラルキラー細胞療法の発展への挑戦
文献と臨床経験はすでにNK細胞の治療応用に理論基礎を提供したが、NK細胞の臨床潜在力を制限する挑戦も存在するが、これらに限定されない。
•制限を拡張するそれは.既存の製造技術はまだ最適化されておらず、すべての患者或いはドナーからNK細胞を強力に生産することができず、このような予測不可能な拡張能力はしばしば治療製品を開発する主要な障害である。
•拡張期間中は活動度が低かった細胞培養時間を延長し、細胞数を増加させることを目的とし、初期NK細胞集団と比較して細胞活性の喪失を招き、老化を引き起こす可能性がある。
•冷凍保存して活性を失う凍結保存したNK細胞の標的比(E:T)は10:1であり,新たに調製したNK細胞と比較して殺傷活性が約50%低下することが報告されている。
•商業的に規模を拡大することは難しいNK細胞の半減期は比較的に短いため、治療は通常複数回の用量を必要とするが、既存の製造技術はこれを行うことは困難である。
今まで、これらの制限はよく他のNK細胞治療会社が真の既製の同種異体薬物を適時に生産する能力を制限し、これらの製品は臨床需要を満たすために数十万剤を必要とするかもしれない
NKGenは、これらの因子がNK細胞患者の治療をもたらし、これらの患者は、NKMAXによるインビトロ実験によるNK細胞活性が低い(初期NK細胞集団と比較して)、1用量当たり送達可能なNK細胞数が少ないため、NK細胞治療のすべての潜在力を証明することができなかったと考えている。低活性(NK細胞の開始集団と比較して)および低細胞数の組み合わせは、一般に、他の免疫細胞からのサイトカイン支持を競合するため、NK細胞療法を生存させるために、患者にリンパ枯渇を受けることを要求する。NKGenは,リンパ枯渇は疾患に対する免疫反応を刺激するための療法には逆効果であるとしている。リンパ枯渇はまた、患者の再投与能力を制限することもよくあり、特に凍結保存ではなく、新鮮に準備しなければならないNK細胞候補製品については、必要に応じて準備して使用する。
私たちの解決策であるSNK細胞は
我々の目標は,NK細胞療法を開発し,NK細胞療法の臨床的および商業的成功を推進するために重要であると考えられるパラメータの最適化に専念することで,他の人が述べた限界を解決することである。これらの最適化パラメータは、これらに限定されるものではない
•ユニット拡張能力を向上させました
•NK細胞の開始集団と比較して高活性細胞を産生する
•冷凍保存技術を改善し、冷凍前後のNK細胞活性損失を最小にした
•商業規模でGMPプロセスを用いて細胞を生産する能力。
NK細胞は通常、循環リンパ球の約5%~15%を占める。これらの血液試料からNK細胞を分離し,特異的なプロセスを用いてそれらを増幅し,“SNK細胞”と呼ばれるものを産生した。SNK細胞はその後、リンパ濾過によるプレコンディショニングを必要とすることなく、患者に送達される。
図1.SNK 01分離、増幅と細胞療法を用いて患者を治療する自己過程の概要を示す。
私たちの自己NK細胞産物候補をSNK 01と呼び、私たちの異体NK細胞産物候補をSNK 02と呼ぶ。
私たちの製造技術は
NK細胞を単離および増幅するプロセスは、IL-2、IL-15およびIL-21などのサイトカインの使用に関連し、これらのサイトカインは、通常組み合わせて使用される。場合によっては、他の細胞は、フィーダー細胞と呼ばれ、その活性化および増殖を促進するためにNK細胞にシグナル刺激を提供するために使用される。これらの過程の細胞増幅効率の差は大きく,約2週間の5倍から同一時間帯の千倍以上と報告されている。
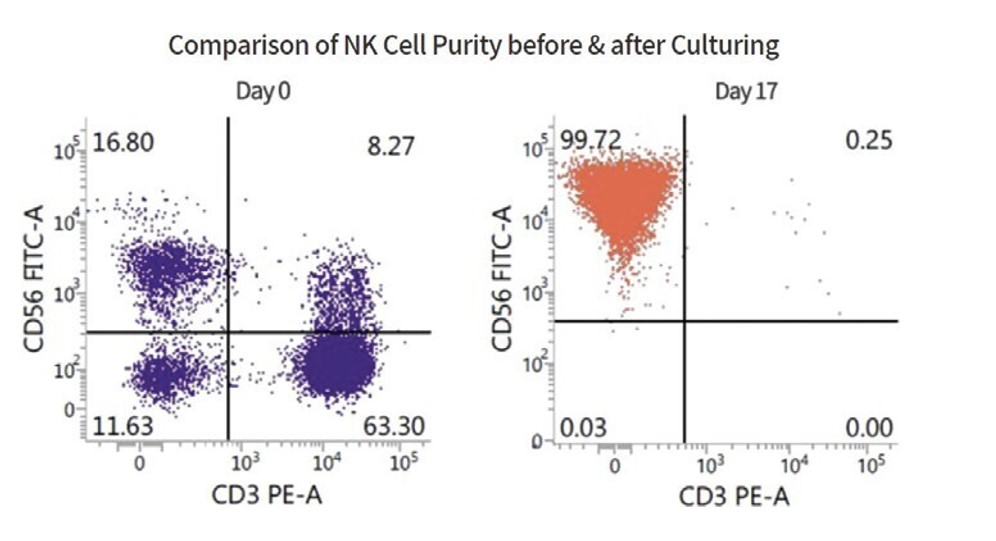
サイトカイン刺激と飼育細胞培養を組み合わせると,通常17~18日で数千倍に増幅する特許プログラムが開発されている。このプロセスは、一般に、99%を超えるNK細胞を産生するNK細胞マーカーCD 56の高レベル発現および細胞マーカーCD 3の低発現によって測定される。
図2.NKGenの製造過程で高度に濃縮されたNK細胞群が産生された。
拡張性
著者らの過程は異なる患者間で高度な再現性を有し、これは自己治療に重要である。
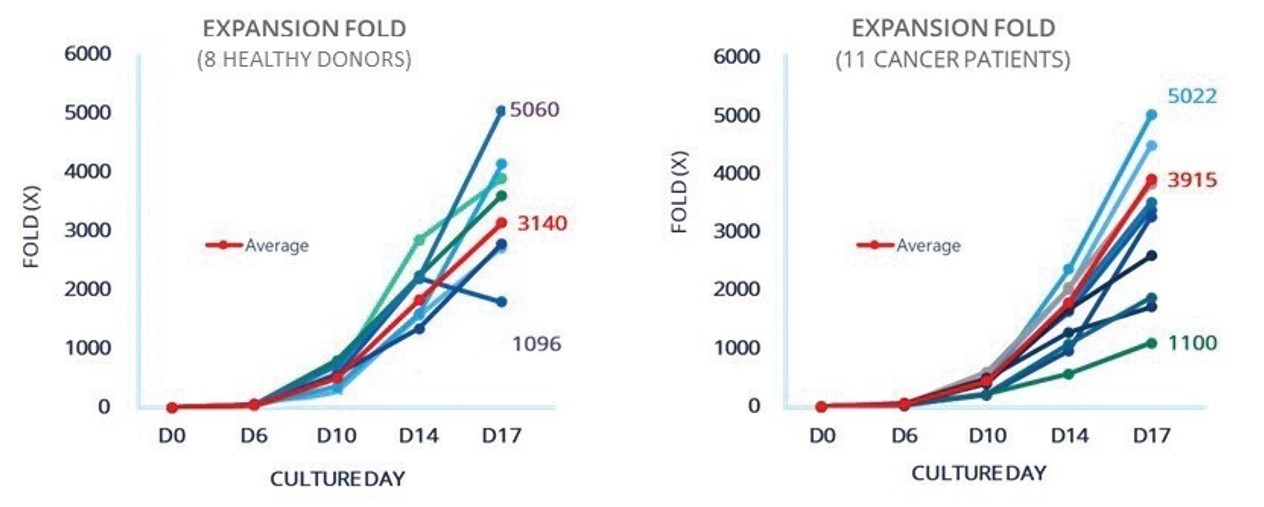
理想的には、治療を推奨されている各患者が、故障または遅延のために、彼らの疾患進行のリスクを増加させるのではなく、NK細胞治療をタイムリーに受けることを目標とする。健常ドナーや癌患者から大量のSNK 01細胞を産生する能力があることが証明されており,後者はこれらの人々に対する自己細胞療法の開発に重要である。これは癌患者の自己NK細胞増幅の伝統的な方法とは対照的であり、伝統的な方法の中で、NKMAXによる体外実験により、以前の癌治療はNK細胞の開始集団ではなく、NK細胞の増幅能力と活性に負の影響を与えた。
図3.NKMAX社が行った体外実験では,NKGenの製造過程は健康ドナーと大量の前処理された癌患者で重複可能であることが示されている。
活動する
我々が設計した製造過程はNK細胞を産生するためであり,ドナーから得られた初期および増幅されたNK細胞の活性よりもNK細胞の活性が高かった。重要なことは,原始ドナーのNK細胞の活性にかかわらず,我々の製造過程はSNK 01細胞を産生し,原始ドナーのNK細胞の活性にかかわらず,SNK 01細胞はドナー間で類似した効力を有することである。NKMAXによるインビトロ実験では、3人のドナーの初期NK細胞から増幅されたSNK 01細胞のNK細胞活性は、ドナーに一致する初期および未増幅NK細胞のNK細胞活性と比較して増加した。これは細胞毒性の増加,サイトカインインターフェロン−γと腫瘍壊死因子−αの発現,およびNK細胞受容体の活性化発現を示すものであり,以下のようになる。
増幅したNK細胞とK 562標的細胞を短期インキュベートした後に放出されたサイトカインの特性を理解するため、増幅したNK細胞を標的細胞及びその培養上清培養し、プロテオミクス分析キットを用いて36種類の異なるヒトサイトカインとケモカイン濃度を測定した。K 562細胞はNK細胞のインターフェロン-γと腫瘍壊死因子-αの産生を刺激する。また,NK細胞がサイトカインを分泌する能力を知るために,K 562刺激後にNK細胞が産生する腫瘍壊死因子−αとインターフェロン−γの数を細胞内染色法を用いて分析した。K 562刺激後,増幅したNK細胞中の腫瘍壊死因子−αとインターフェロン−γの発現レベルはそれぞれ68.5倍と8.2倍(それぞれ7.54%±0.10%と55.30%±1.10%)増加し,未増幅のNK細胞(それぞれ0.11%±0.01%と6.75%±0.60%)と比較して,増幅後のNK細胞は腫瘍壊死因子−αとインターフェロン−γを発現するレベルはそれぞれ68.5倍と8.2倍増加した。模擬増幅したNK細胞をK 562細胞で刺激したところ,腫瘍壊死因子−αとインターフェロン−γの発現レベルはそれぞれ2.9倍と1.6倍(それぞれ7.5 4±0.10%と55.30±1.10%)増加したが,刺激されていない増幅NK細胞(それぞれ2.6 0±0.10%と33.80±0.5%)は未増幅NK細胞と比較してそれぞれ2.9倍と3.8 0±0.50%増加した。
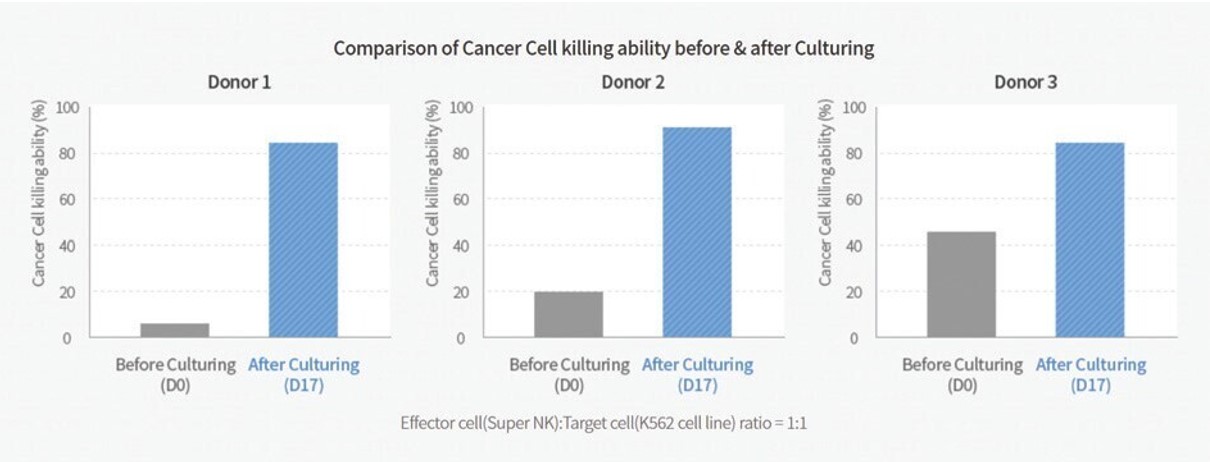
増幅したNK細胞のK 562標的細胞に対する殺傷作用を検討するため、SNK 01培養前後の腫瘍細胞の殺傷能力を比較した。SNK 01の細胞毒性は,同一ドナー試料からNK細胞を増幅する前より数倍(すなわち2.0から10.9倍)増加した。図4を参照すると、ドナー1の細胞毒性は8.4%未満から約91.8%に低下し、ドナー2の細胞毒性は約21.60%から約90.1%に低下し、ドナー3の細胞毒性は約44.70%から約91.0%に低下する。NK細胞毒性試験において、癌細胞殺傷能のパーセンテージは、NK細胞によって殺された標的(癌)細胞の割合を表す。例えば、次の図4のアッセイが90%の細胞毒性を示す場合、これは、標的(癌)細胞の約90%がNK細胞によって殺され、残りの10%が依然として生きていることを意味する。より高い割合は、NK細胞がより強い細胞傷害活性を有し、より有効な反応を有することを示している。
図4.NKMAXによるインビトロ実験では,SNK 01細胞の活性がそれらのNK細胞よりも高かった。
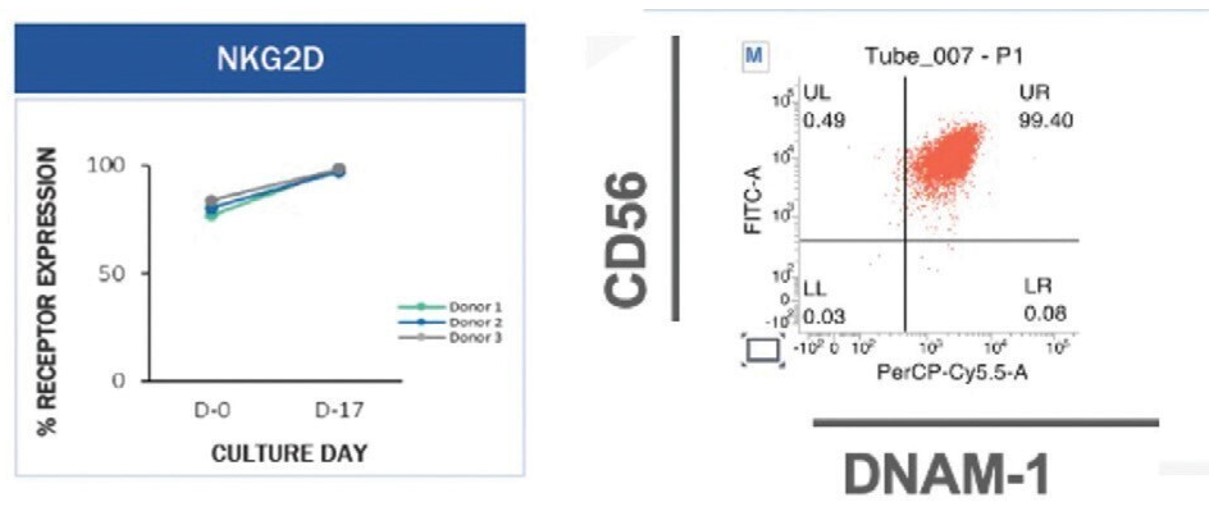
増幅後のNK細胞をCD 16,NKp 30,NKp 46,NKp 44,NKG 2 Dの5種類のNK細胞活性化受容体の抗体を用いて免疫組織化学染色し,フローサイトメーターで解析した。増幅後のNK細胞CD 16(発現97.21±1.76%)、NKp 30(発現97.32±3.58%)、NKp 44(発現62.15±14.88%)、NKp 46(発現93.98±6.59%)、NKG 2 D(発現99.88±0.10%)はそれぞれ1.2倍、5.8倍(発現97.32±3.58%)、135.1倍(発現62.15±14.88%)と1.1倍(発現99.88±0.10%)増加した。NKp 30は16.81±13.06%,NKp 44は0.46±0.38%,NKp 46は40.32±23.07%,NKG 2 Dは91.29±8.18%)であった。より詳細な情報については、以下の図7および図8を参照されたい。
これらの体外実験の結果,3つのドナーのp値が0.05以下で有意に増加した。しかし、より多くのドナーの統計的分析は行われなかった。したがって,各ドナーや中央値ドナーの結果がより大きな集団で統計学的に有意であることは保証されない。
超低温保存
SNK細胞の活性を保存するだけでなく,その活性レベルを向上させることができる凍結保存方法を開発した。未修飾SNK細胞とトランスジェニックCAR NK細胞は解凍後の細胞に対する殺傷活性はほぼ不変であることが証明された。原NK細胞に比べてSNK細胞の活性が高く,凍結保存期間中に観察された活性がやや低下したことに加え,他の方法で産生された新鮮に調製されたNK細胞よりも活性な既製NK細胞候補品を多く生産できると考えられる。
図5.NKMAXによるインビトロ実験では,我々の凍結保存方法はSNK候補産物の活性増加(NK細胞の開始集団と比較して)を保存した。
垢がつく
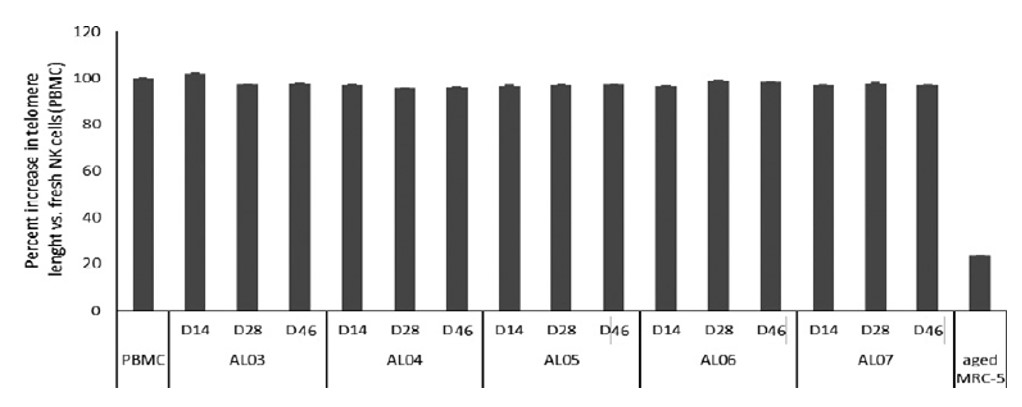
私たちは私たちの製造プロセスが高度なスケーラビリティを持っていると信じている。NK細胞の初期集団と比較して産生された細胞活性はほとんど損失せず,長期的な細胞培養後も老化の兆候がないという証拠もない。この潜在的なスケーラビリティは、同社が単一ドナーから数十万用量の同種異体SNK細胞を産生することを可能にするであろう。これらの細胞を凍結保存する能力に合わせて,患者に既製の細胞治療解決策を提供する能力があると信じている。しかし、私たちはまだ、損傷せず、経済的に効率的で、2年後に変質しないように、長期貯蔵、大量生産のために、私たちの候補製品を生産するための検証された方法を開発していない。カリフォルニア州サンアナに25,000平方フィートの医薬品製造工場を所有し運営していますその約半分はナチュラルキラー細胞GMPを生産する設備を備えています
図6.複数のドナーのSNK 02細胞増幅のテロメア長をみると,老化の兆候はなかった。
SNK 01の分子特性
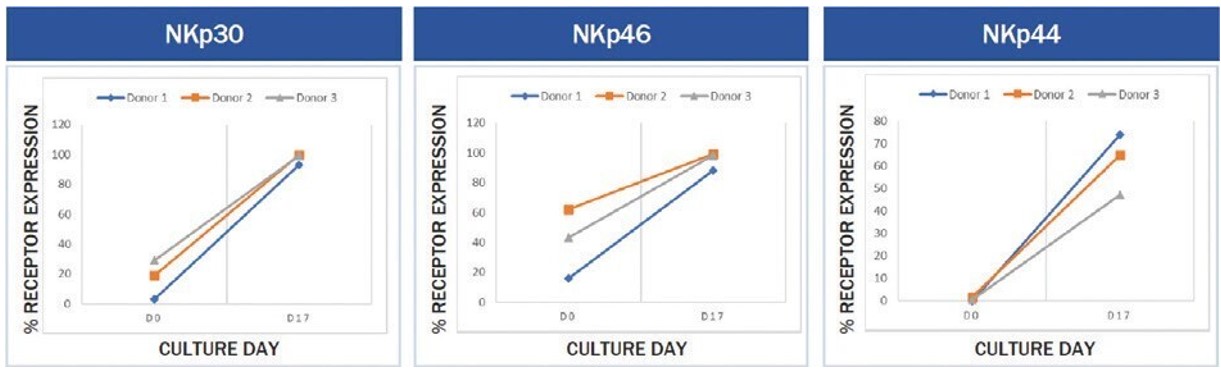
天然細胞毒性受容体のセットのレベル(“NCRS)は、SNK 01の製造過程において通常増加するNKp 30、NKp 46およびNKp 44を含む。これらの受容体は腫瘍細胞を識別し除去する鍵であることが証明された。例えば、NKp 30の1つのリガンドはB 7-H 6であり、よく見られる腫瘍抗原である。NKp 30はB 7-H 6と結合した後にサイトカインを分泌し、例えば腫瘍壊死因子-αとインターフェロン-γ、細胞溶解パーフォリンと顆粒酵素である。NKp 30の発現も胃腸間質腫瘍の全体生存改善と予後改善に関与していることが証明されている。安静NK細胞は通常低レベルでNKp 30とNKp 46を発現するが、NKp 44は活性化NK細胞にしか見られない。初期(初代)NK細胞と増幅されたSNK細胞間の細胞表面受容体の発現も数倍の増加を示した。図7および図8において、ドナー1、2および3において、細胞受容体NKp 30は、それぞれ約0%~95%、約20%~100%、および約30%~100%である。ドナー1、2および3では、細胞受容体NKp 46は、それぞれ約10%~80%、約40%~100%、および約60%~100%である。ドナー1、2および3において、細胞受容体NKp 44は、それぞれ約0%~45%、約0%~65%、および約0%~75%である。ドナー1、2および3では、細胞受容体NKG 2 Dは、それぞれ約70%~100%、約75%~100%、および約75%~100%である。SNK 01での高レベル発現およびNKp 30,NKp 44とNKp 46レベルの上昇はSNK 01の活性化状態を確認した。
図7.NKMAX社が行った体外実験では,SNK 01の製造過程でドナーにおけるNCRの発現増加が観察された。
SNK 01細胞は通常もNKG 2 DとdNaM-1を高発現し、NKG 2 Dは免疫反応の主要な調節因子であり、dNaM-1はNK細胞を介した腫瘍細胞などの損傷細胞溶解に必要な受容体である。
図8.SNK 01細胞はNKG 2 DとdNaM-1を高発現している。SNK 01は神経変性疾患の治療に用いられる
我々は,ADやPDを含む神経変性疾患の治療に用いられるSNK 01,自己NK細胞療法を開発している。SNK 01のケーススタディの結果,同情に加えてSNK 01を使用すると,これらの疾患の末期患者のいくつかの症状が逆転することが示されている。これらの結果は,神経変性疾患に対する多くの他の治療法の報告とは対照的であり,これらの方法では,認知などのパラメータの有意な改善は認められない。SNK 01はこれらの衰弱した疾患の治療法を変更する可能性があると信じており,これらの早期シグナルを探索するための臨床試験を開始している。
産業と競争
生物技術業界、特に細胞治療領域は、その特徴は技術の迅速な進歩と変化、競争の激しさと知的財産権に対する高度な重視である。私たちの方法、戦略、技術、知識、経験は私たちに競争優位を提供してくれると信じていますが、私たちは現在開発中の候補製品の面で激しい競争に直面しており、将来開発や商業化を求める可能性のある他の候補製品の競争に直面しています。競争の源は世界各地の主要な製薬、専門製薬と既存或いは新興のバイオテクノロジー会社、学術研究機関と政府機関及び公共と個人研究機関を含む。私たちの多くの競争相手は、単独でも彼らとのパートナーでも、研究開発、製造、臨床前テスト、臨床試験を行い、監督管理許可とマーケティング許可を得た製品の面で、すべて私たちより多くの財務資源と専門知識を持っている。したがって、彼らは彼らの候補製品をより速い速度で開発して商業化することができるかもしれない。バイオテクノロジー業界の合併と買収は、より大きな資源を数の少ない競争相手に集中させる可能性がある。規模が小さい企業や初期段階にある企業も、単独でも、大型·成熟企業との連携でも重要な競争相手であることが証明される可能性がある。
われわれは現在Acpodia,Artiva,Celulality,世紀治療会社,Cytovia治療会社,Fate治療会社,Nkarta,免疫生物会社からの競争に直面しており,いずれも臨床段階の同種異体遺伝子治療計画がある。また,他の競争相手,例えばAffimed,InNatural Pharma,トンボ治療会社やGT Biophmaは,細胞結合分子を介して患者自身のNK細胞を腫瘍部位に誘導してNK生物学を利用することを求めている。これまで,NK細胞療法に対するFDAの承認を得た他のNK細胞会社は何も知られていない。しかし,類似した細胞免疫療法候補製品や免疫療法の代替品を開発したライバルを含め,かなりの市場シェアを得ている新たなライバルが出現する可能性もある。
これらの競争相手はまた、合格した科学と管理者を募集と維持し、臨床試験場所と臨床試験の患者登録を確立する方面で私たちと競争し、そして私たちの計画と相補的或いは必要な技術を獲得する上で私たちと競争している。したがって、私たちの競争相手は私たちよりも早く、または成功的に製品を発見、開発、許可、または商業化することができるかもしれない。
当社の競合他社が、当社が開発する製品よりも安全で効果的、副作用の少ない、または重度の低い、便利で、または安価な製品を開発し、商業化した場合、当社の商業機会は減少または排除される可能性があります。また、競合他社が当社製品の承認を取得するよりも早く FDA などの規制当局の承認を取得する可能性があります。その結果、当社の市場に参入する前に競合他社が強力な市場ポジションを確立する可能性があります。当社のすべてのプログラムの成功に影響を与える主要な競争要因には、その有効性、安全性、利便性、価格、償還の程度が含まれます。
許可協定
当社は、通常の業務においてライセンス契約を締結しています。NKMAX 社の NK 細胞プログラムの研究開発に必要な特定の技術をライセンスしています。当社の治療薬候補は幅広い適用可能性を有するため、当社が追求する予定のない他の目的や特定の領域のための開発のために、当社の技術を第三者にライセンス供与する可能性がありますが、現時点では計画はありません。
NKMAX のライセンス
2020 年 2 月 12 日、当社は NKMAX ( 以下「 NKMAX 」 ) と特定のライセンス契約を締結しました。許可証原本)に基づいて、2021年10月14日、2023年4月10日、2023年8月1日にNKMAXと締結された特定の改訂許可協定に基づいて修正および再記述を行った(会社間許可証“)”会社間許可によると、NKMAXは、(I)研究、開発、製造、製造、NK細胞医薬製品、方法、サービスまたは療法、または上記の任意の内容と任意の他の活性成分、製品またはサービスとの組み合わせで、NKMAXの任意の使用分野の特定の特許および独自技術に基づいて、複数のレベルで再許可を行う権利がある独占的、印税付き許可を付与する権利がある(“許可を得た製品“)すべての国(アジア諸国·地域は含まれていない)”許可を得た地域)および(Ii)は、許可地域における私たちの権利を支援するために、許可地域以外で許可製品を研究、開発、製造、および製造するためにのみ。
会社間許可によると、NKMAX独占、印税免除、全額支払い、取り消すことができない永久許可は、非常に限られた例外のみであり、その特定の特許および独自技術の下で複数のレベルで再許可を行い、アジアでの研究、開発、製造、製造、使用および商業化のためにすべての分野で使用する権利がある。また,NKMAXには,非独占,印税免除,全額支払いの許可を付与し,そのある特許やノウハウの下で,すべての使用分野の許可製品を再許可して製造する権利があり,許可製品のアジアでの開発,製造,製造,商業化の目的のみでアジア以外で許可製品を製造する権利がある。私たちは、アジアで許可製品を製造および製造し、許可区域内ですべての使用分野のために許可製品を開発、製造、または製造し、それを商業化するために、これらのライセンス項目の非専門権および任意の共同発明または共同特許における私たちの権益を保持する。
会社間許可によって私たちに付与された権利の部分対価格として、私たちは以前原始許可の条項に基づいて100万ドルの費用を前払いしました。私たちはまた、私たちまたは私たちの任意の付属会社が、以下の司法管轄区(および金額)で初めて許可製品の規制承認を受けたために一次マイルストーン支払いを承認する必要があります:アメリカ(500万ドル)、EU(400万ドル)、他の4カ国(各100万ドル)。今まで、私たちは何のマイルストーンの支払いも支払わなかった。私たち、私たちの連合会社、あるいは私たちの分割ライセンシーのライセンス製品の純売上高に一桁の中央値印税を支払う義務がありますが、慣例的に減少しなければなりません。当社の特許使用料義務は、会社間許可に基づいて当社に付与された特許が当該販売国/地域において当該ライセンス製品の最後の有効期限が満了すると主張するまで、個々のライセンス製品及び国/地域を基に継続する。私たちはまた、低い2桁の数百分から中央値の1桁のパーセンテージまで、再許可収入の1パーセントを支払う必要がある。
指定された事前通知期間内に任意の理由で一方的に会社間ライセンスを終了することができます。指定された救済期間と事前通知期間後に会社間ライセンスに必要なお金を支払うことができない場合、NKMAXは会社間ライセンスを終了する可能性があります。いずれか一方が他方の資金が相殺されない場合、または他方が会社間許可証に深刻に違反した場合には、会社間許可証を終了することができる。事前に終了しなければ、会社間ライセンスは、双方が書面で同意しない限り、特許使用料を支払う義務が満了したときに自動的に満期になります。会社間ライセンスが満期になりましたが、事前に終了しない場合、NKMAXが付与したライセンスとNKMAXが付与されたライセンスは、印税免除、全額支払い、撤回不可、永久に継続して存在します。しかし、NKMAXの倒産やNKMAX未治癒の重大な違反で会社間許可を終了した場合、NKMAXの許可は終了し、私たちの手に戻ります。私たちが自発的に会社間許可を終了した場合、私たちはNKMAXの要求に応じて、許可地域のすべての規制機関に許可製品登録を支援するすべての既存データを提供することに同意し、NKMAXはこのようなデータを第三者に提供する制限されない権利を持つことになる。
2023年4月,従来のライセンスを改正し,当初癌治療に限られていたライセンス製品の範囲を任意の使用分野に拡大した。
製造業
私たちの細胞治療候補プロセスは自己および同種製品を生成することを目的としている。
自己プロセス(SNK 01)
我々の製造プロセスは、免疫障害が知られている癌患者からの細胞を含み、製造問題のリスクを低下させる品質の一致した活性化細胞を産生することを目的としており、これらの問題は患者が望む治療製品を奪う可能性がある。我々の目標は、8~12ヶ月の二週間注入のために、NK細胞活性に影響を与えることなく、使い捨てプロセスによって凍結保存用量のNK細胞を製造することである。
SNK 01の製造プロセスは、SNK 01の由来材料が、患者の末梢血または白血球分離から単離された初代NK細胞であることを要約することができる。次いで、これらの原始NK細胞を最大18日間活性化および増幅するために、我々の特許方法を使用して、2つのタイプのフィーダー細胞およびサイトカインを含む。その結果,独自の冷凍保存方法を実施することで冷凍保存製品を実現した。
SNK 01 の安定した臨床供給のために、独自の GMP 製造能力を確立しました。この戦略的動きにより、臨床製品の供給が容易になり、製造の中断に伴うリスクを軽減するとともに、最終的には商業目的で SNK 01 のより費用対効果の高い供給が可能になります。2019 年には、カリフォルニア州サンタアナにある本社に 25,000 平方フィートの臨床 GMP 施設を建設し、その約半分が NK 細胞の GMP 生産に適しています。GMP ハードウェアと堅牢な品質マネジメントシステムの実装 ( 「QMS)は、製造装置、実験室施設、倉庫、および専用の冷蔵貯蔵ゾーンを含む同年に完成した。全面的な資格鑑定過程を経て、何度もの試験運行を含み、著者らは2020年にそのアメリカ腫瘍学臨床試験のために生産運営を行った。われわれの臨床GMP施設では毎年約12,000剤の凍結保存薬物製品が生産され,われわれの臨床試験の期待需要を十分に満たしていると信じている。
同種異体プロセス(SNK 02)
私たちはすでに私たちの同種異体既製NK細胞治療製品SNK 02の製造プロセスを開発し、私たちの自己製品SNK 01の製造プロセスを基礎とした。我々の主な注目点は,SNK 02のスケーラビリティ,再現性,コスト効果,および凍結保存後に一致した活性を維持することである。これらの目標を達成するために、我々の製造プロセスは、以下の重要な要素を含むが、これらに限定されない
•健康なドナーの末梢血から細胞を取得し、異なる遺伝子寄付の資格基準を満たすことを確保する
•NKGenが老化や不全を招くことなく、1つのドナーから数十万剤を産生できるように技術を活性化し、拡張する
•バルクSNK 02製品を効率的に冷凍し、その長期安定性を確保する低温保存技術
•凍結NK細胞製品の解凍技術は、ユーザーが友好的で、異なる臨床環境に適応できる。
これらの技術は一貫した細胞回復、活力、活性を提供することを目的としている。私たちの全体的な製造案を次の図に示す。
図9.SNK 02同種異体分離、増幅と細胞療法による患者治療過程の概要を示す。
SNK 02の生産は、信頼性および高品質の供給材料が得られることを確実にするために、健康ドナーの末梢血から純粋な初代NK細胞を単離することから始まる。NK細胞は独自のプロセスを通じて活性化および拡張の過程を経験する。最初の14日間の拡張期後に細胞が収穫され凍結保存された結果,NKGenを含むWCBのバイアルが数百個産生された。製品をさらに活性化および拡張するために、WCBから1本解凍し、追加の活性化および拡張を行います。そして得られた細胞を収穫し冷凍保存し,凍結保存した最終製品を得る。既製品の投与を容易にするため,凍結保存された最終製品は指定された臨床場所に搬送される。臨床現場では,この製品は解凍と組換えされ,患者に服用する準備ができている。
NKMAXは、SNK 02を製造するために必要なGMP製造能力を有し、臨床および商業用途のためのSNK 02製品の一貫性および信頼性のある供給源を保証するために、我々のプロセスを使用して韓国にある工場でSNK 02を生産すると信じている。NKMAXは新たな製造設備,実験室インフラ,低温貯蔵分野に大量の資金を投入しており,これらは厳しい品質管理システムで管理されている。臨床試験管理における豊富な経験及びSNK 01とSNK 02の生産記録により、NKMAXは有利な地位にあると考えられ、NKGenの固形腫瘍の第一段階研究にコスト効果のある高品質製品を提供することができ、この研究はすでにFDAのIND承認を得た。NKMAXのGMP施設では毎年約12,000剤が生産され,期待される臨床試験需要を満たすために十分な供給が提供されていると予想される。
企業情報
私たちは最初にGraf Acquisition Corp.IVと呼ばれました。2023年9月29日、Graf株主が2023年9月25日に開催された特別会議で承認された後、Legacy NKGen、Graf、Merge Subは合併協議での提案取引を完了しました。取引の終了に伴い,我々の名称をGraf Acquisition Corp.IVからNKGen Biotech,Inc.に変更した
私たちの主な実行事務室はカリフォルニア州サンアナダイムラー街3001号にあります。郵便番号:92705、電話番号は(949)396-6830です。私たちの会社のサイトアドレスは:https://nkgenBiotech.comです。当社のサイトに掲載されているまたは当社のサイトを通して取得できる資料は、本10-Kフォーム年次報告の一部ではありませんが、本10-Kフォーム年次報告に掲載されている当社のサイトのアドレスは非公式テキスト参照のみです。
新興成長型会社の地位
私たちは2012年の“私たちの企業創業法案”(“JumpStart Our Business Startups Act”)で定義されているように、“新興成長型会社”です“雇用法案”“)”新興成長型会社として、役員報酬に関するいくつかの要求に制約されず、役員報酬について拘束力のない諮問投票を行う要求と、ドッド·フランク法案の一部である2010年の“投資家保護と証券改革法案”の要求に適合する総裁と最高経営責任者の総報酬と全従業員の年間総報酬の中央値の比に関する情報を提供することを含む。
雇用法第102条(B)(1)条免除新興成長型企業は、民間企業(すなわち、証券法の施行が宣言されていない登録声明又は取引法に基づいて登録されていない証券種別)まで、新たな又は改正された財務会計基準を遵守することが求められる。JOBS法案では,会社は延長からの移行期間を選択し,非新興成長型会社に適用される要求を遵守することができると規定しているが,いずれの選択脱退も撤回できない。私たちは、移行期間を延長することを選択しないことを選択した。これは、基準が発表または改正された場合、その基準が上場企業または民間企業に異なる適用日があれば、私たちは新興成長型企業として、民間会社が新たな基準または改正基準を採用する際に新たなまたは改正された基準を採用することができることを意味する。これはNKGen Biotechの財務諸表を別の上場会社の財務諸表と比較する可能性があり,後者は新興成長型会社でも新興成長型会社でもなく,使用する会計基準の潜在的な違いにより,延長された過渡期を使用しないことを選択することは困難または不可能である。
(1)(A)Graf初公募株式(IPO)終了5周年後の財政年度の最終日まで、(B)私たちの年間総収入は少なくとも12.35億ドル、または(C)前期第2四半期終了時点で非関連会社が保有する普通株の時価が7億ドルを超えることを意味する大型加速申告会社とみなされるまで、新興成長型会社である。(2)私たちは前3年の間に10億ドルを超える転換不可能債務証券を発行した日。本稿で言及する“新興成長型会社”とは、“証券法”が指す“新興成長型会社”を指し、“雇用法案”によって改正されている。
流動性
私たちは現在、私たちの運営と私たちの支出、その他の流動資金需要を満たすための十分な資金がありません。すぐに資本を増加させる必要があり、私たちの独立公認会計士と経営陣は、私たちが継続的に経営している企業として経営を続ける能力に大きな疑いを示しています。
2023年12月31日と2022年12月31日まで、私たちの現金と現金等価物はそれぞれ約10万ドルと10万ドル未満で、運営資本の赤字はそれぞれ約3750万ドルと1440万ドルだった。私たちは業務合併に関連した多くの取引費用を発生させた。約1,430万ドルの取引費用と繰延引受業者費用は業務統合が完了した後に決済される。しかし、私たちは取引が終わった後に計算されなければならない多くの取引費用を持ち続けている。2023年12月31日現在、業務合併と継続業務運営からの取引費用を含む約1340万ドルの売掛金と売掛金が発生しました。業務合併後、私たちはまだ大量の未払い取引支出及びその他の計上及び未払い運営支出があります。また、上場企業に移行し、上場企業として運営する際に追加料金が発生することが予想されます。
2023年12月31日現在、私たちの未返済債務は約199万ドルで、その中には、私たちと東西銀行の循環信用限度額、関連先との融資、および高度変換可能な手形が含まれています。また、私たちと東西銀行の循環信用限度額は私たちのすべての資産によって保証され、2023年12月31日までに銀行で少なくとも1,500万ドルの現金残高を維持することを要求し、その後、循環信用限度額の下に未返済残高がある限り、最低現金残高を維持しなければならない。2023年12月31日から、東西銀行は契約に基づいてこの現金残高要求を免除しており、2024年4月5日に発効した改正案によると、東西銀行はこの最低現金残高要求を契約に置き換え、東西銀行を会社唯一の現金預金商業銀行とし、満期日を2024年9月18日に延長することに同意した。私たちは、何らかの支払いの遅延を求め続け、より多くの融資が得られるまで現金を保存するために、支出を減らす可能性のある他の方法を探るつもりだ。このような努力は金額的にも時間的にも成功的ではないかもしれないし、私たちの持続的な資本需要を満たすのに十分ではないかもしれない。私たちは追加資金調達を積極的に求め続けている。追加流動資金源が不足している場合、私たちは運営と流動資金需要を満たすのに十分な既存の現金資源を持っていない。しかし、私たちは、私たちがそのような追加流動資金をタイムリーに獲得したり、追加資金の調達に成功したり、必要な資金が許容可能な条項で提供されるか、または既存の株主に大きな希薄な影響を与えないという保証はありません。また、これらの潜在的な流動資金源が、満期債務を履行し、継続的に経営を継続する企業として、私たちの運営を支援するのに十分なキャッシュフローを提供してくれるかどうかを決定することはできません。もし私たちが追加的な流動性源を得ることができないと判断した場合、あるいは満期時に私たちの義務を履行することを許可しない場合、私たちは再構成計画や清算を実施するために、米国破産法に基づいて自発的に救済を申請する必要があるかもしれない。また、私たちの持続経営企業としての持続的な経営能力への大きな疑いは、投資家や他の融資源が商業的に合理的な条項で資金を提供したくない可能性があります(あれば)。十分な資金がなければ、業務活動の一部または全部を延期、縮小、または廃止しなければなりません。これは、私たちの業務の将来性と私たちの運営を継続する能力に悪影響を与えます。
さらに、私たちは私たちの資産を清算しなければならない可能性があり、これらの資産の私たちの財務諸表上の価値を得ることができ、および/または米国破産法第7章または第11章に基づいて保護を求めることができる。これは私たちの運営を停止させ、私たちの普通株へのあなたの投資の全部または一部の損失を招くかもしれない。これは私たちの運営を停止させ、私たちの普通株へのあなたの投資を完全に損失させるかもしれない。参照してください“リスク要因-私たちの業務や業界に関連するリスク-私たちは現在、私たちの運営と費用と対応金にサービスするのに十分な資金がありません。追加の資本が必要です。私たちの独立公認会計士と経営陣は、追加資本なしで経営を続ける能力に大きな疑いを示しましたもっと詳細を知っています。
知的財産権
私たちは、私たちの候補製品をカバーするための特許を求め、維持することを含む、私たちの業務に重要であると考えられるノウハウを保護するために努力しています。直接であっても、NKMAXとの連携でも、私たちの業務発展に重要な技術です。私たちはまた、私たちの業務において特許保護から保護されていないか、または特許保護に適していないと考えられる態様、およびノウハウ、商標、持続的な技術革新および許可内の機会を商業秘密に依存して、その独自の地位を発展させ、維持する。私たちは私たちのNK細胞治療計画に依存する特許の組み合わせを許可した。我々はまだ求めていないが,将来的には米国や他の選定された国/地域に特許出願を提出することにより,我々の候補製品や他のノウハウおよびその用途のための適切な特許保護が求められる可能性がある。
特許
我々は、内部開発であっても、著者らの協力者や他の第三者から許可を得ても、特許権を求め、維持し、擁護することを含む、当社の業務に重要なビジネス的意義を有するノウハウ、発明、および改善を保護し、強化するために努力している。私たちの政策は、米国および米国以外の司法管轄区域で、私たちのノウハウ、発明、改善、および候補製品に関するライセンスを取得し、特許出願を提出することを含む、私たちの独自の地位を保護することを求めることであり、これらの技術、発明、改善、および候補製品は、私たちの業務の発展と実施に非常に重要である。私たちはまた、私たちの特許技術および製品候補に関連する商業秘密および技術的ノウハウ、持続的な革新および許可内の機会に依存して、細胞治療分野における私たちの特許地位を強化し、維持することができる。データ独占性、市場独占性、特許期間の延長に依存することも計画されています(利用可能であれば 適切に、指定された孤児薬によって提供される規制保護を求めて依存することができる。私たちのビジネス成功は、私たちの技術、発明、および改善のために特許および他の固有保護を取得し、維持する能力があるかどうか、私たちの商業秘密を秘密にすること、第三者が所有する知的財産権を使用する私たちのライセンスを維持すること、私たちの特許を含む私たちの固有の権利を擁護し実行すること、および効果的かつ実行可能な特許および第三者の他の独自の権利を侵害することなく運営される可能性がある。
我々は、製造方法、使用方法、および組成物のための請求項を含み、関連する製造プロセスおよびプロトコルを含む、我々の細胞工学技術プラットフォームおよび関連候補製品の開発に関連する技術的ノウハウおよび商業秘密を有する大量の特許および特許出願許可を有する。
2023年12月31日現在、私たちが所有している特許の組み合わせには、米国で許可されている約3つの特許、米国で保留されている約3つの許可非一時特許出願、米国以外の管轄区域で発行されている約1つの許可特許、および米国以外の管轄区域で係わっている約15件の許可特許出願(5つのPCT出願を含む)が含まれている。私たちのポートフォリオでは、米国以外のライセンス特許や特許出願は、ブラジル、カナダ、チリ、エジプト、ヨーロッパ、メキシコ、南アフリカ、ウクライナなどの国/地域で保有されています。私たちが米国で発行した特許および出願されている特許は実用特許または特許出願であり、これらはすべて私たちの候補製品SNK 01および/またはSNK 02に関連している。ライセンスを取得した米国特許および米国特許出願は、特許期間の調整または延長を含む特許条項の変化に応じて、2033年5月~2040年11月(または2033年5月~2043年11月)と予想される。NKGenの非米国特許および特許出願(非一時的およびPCTを含む)もまた、我々の候補製品SNK 01および/またはSNK 02に関連するユーティリティ特許または特許出願である。非米国特許および特許出願予定日は、2039年1月から2043年11月までの間であり、特許条項の変化に依存する 特許期間の調整、延長、または保護証明書の追加に限定されない。
私たちは私たちの候補製品と関連する製造プロセスを開発して商業化するつもりだ。可能であれば、私たちは単独で、または私たちの許可者と協力して、成分、使用方法、プロセス、用量、および処方を含む特許保護を求めることができる。私たちはまた、製造と薬物開発過程と技術、そして私たちの技術プラットフォームに特許保護を求めることができます。市場排他性を拡大するために使用可能な場合、現在または予想される開発技術プラットフォーム、技術コア要素、および/または候補製品に関連することができるかもしれない追加の知的財産権を得ることができる。
個別特許の展示期間が異なり、特許出願の提出日、特許発行日及び特許を取得した国の特許の法的期限に依存する。一般に、米国で出願された特許は、最初の非仮出願日から20年以内に有効である。米国では,特許期間は特許期間を調整することで延長することができる(“PTA)は、特許の審査および承認時の米国特許商標局の行政遅延による特許権者の補償、または以前に提出された特許によって特許が最終的に放棄された場合、短縮することができる。また、FDAが承認した薬物をカバーする米国特許の特許期間を延長する資格がある場合もあり、臨床試験やFDA規制審査期間により実際に失われた一部の特許期間を再獲得する資格がある可能性がある。この延長は特許期間延長と呼ばれる(“PTE“)”回復期間は5年を超えることはできず、回復期間を含む総特許期間はFDA承認後14年を超えてはならないが、米国FDAを含む適用当局が、このような延長を承認すべきかどうか、そのような延長が承認された場合の長さの評価に同意する保証はない。さらに、NKGenは、その許可された特許を延期する権利を求める権利がない可能性があり、またはそのような許可が終了した場合、NKGenは延期する資格のある特許を得る権利がない可能性がある。ヨーロッパおよび他のいくつかの外国司法管轄区域にも同様の規定があり、承認された薬物をカバーする特許の期限を延長する。米国以外の特許の期限は適用される現地法の規定によって異なるが,通常は最も早い非仮出願日から20年である。特許によって提供される実際の保護は、製品によって異なり、国によって異なり、特許のタイプ、そのカバー範囲、規制に関連する延長の利用可能性、特定の国の法的救済措置の利用可能性、および特許の有効性および実行可能性を含む多くの要因に依存する。
場合によっては、私たちまたは私たちの許可者は、特許出願を臨時特許出願として米国特許商標局に直接提出することができる。仮特許出願は、米国でより低コストの初特許出願を提供するためのものである。該当する非仮特許出願は、仮出願の優先権を要求するために、仮出願日の後12ヶ月以内に提出されなければならない。対応する非仮出願における請求項は,より早い仮出願日(S)の利益を有していなくてもよく,最終的に発行された特許の特許期間は,遅い非仮出願日から計算される。このシステムは,我々または我々のライセンス者が優先権日を早期に獲得し,優先権年度に特許出願(S)に材料を添加し,特許期間の開始を延期し,起訴費用を延期することを可能にする。もし私たちまたは私たちの許可者たちがその申請を起訴しないと決定したら、このような遅延は有用かもしれない。私たちは適切な時期に私たちの臨時特許出願に関連する非臨時特許出願を提出することができるが、このような非臨時特許出願が競争優位性を提供する特許の発行につながるかどうかは予測できない。
適用されれば,我々又は我々の許可者は,より早く提出された仮出願の優先日利益を有する米国非仮出願及びPCT出願を提出することができる。PCT制度は、特許出願の最初の優先日から12ヶ月以内に単一出願を提出し、すべてのPCT加盟国を指定することを可能にし、これらの国または地域の特許出願後にPCTによって提出された国際特許出願をこれらの国または地域で出願することができる。PCT検索機関は特許性検索を実行し,拘束力のない特許性意見を発表する。PCT出願は特許として発行されていないが、出願人が国/地域段階出願を介して任意の加盟国で保護を求めることを可能にする。最初の優先日から2年半の間に終了したとき 特許出願は,単独の特許出願は次のいずれかの場合に行うことができる PCTメンバー 場合によっては、欧州特許機関などの地域特許機関を介して出願される場合がある。PCTシステムは費用を遅延させ、国/地域特許出願の成功機会の限られた評価を可能にし、出願が出願の最初の2年半以内に放棄された場合に大量の節約を実現した。
場合によっては、私たちが許可した技術の特許訴訟は私たちの許可者だけによって統制されるかもしれない。もし私たちの許可者がその許可された独自知的財産権の特許または他の保護を獲得し、維持できなかった場合、私たちは知的財産権の権利またはこれらの権利に関連する排他性を失う可能性があり、私たちの競争相手は知的財産権を使用して競合製品をマーケティングすることができる。しかも、私たちの許可者は私たちの最大の利益に合ったクレームを求めたり得たりしないかもしれない。私たちが私たち自身を代表して提出するかもしれない特許出願について、私たちは具体的な状況に基づいて特許請求戦略を決定するつもりだ。私たちはいつも弁護士の提案、特定の国の特許法、そして私たちのビジネスモデルと需要を考慮するつもりだ。私たちは、私たちの独自技術プラットフォームおよび任意の製品の有用なアプリケーションを保護し、これらのアプリケーションおよび製品が戦略的価値を有することを前提として、既存技術プラットフォームおよび製品のための新しいアプリケーションおよび/または用途を発見するために特許を申請することができる。私たちは、既存の特許庁規則の場合に、私たちのプロセスおよび組成の最大カバー範囲および価値を達成することを支援するために、特許出願の数およびタイプ、ならびに係属中および発表された特許権利要件を継続的に再評価する。また、特許訴訟中には、私たちの知的財産権および業務ニーズを満たすためにクレームが修正される可能性がある。
特許保護を得る能力およびそのような保護の程度は、例えば、従来技術の範囲、発明の新規性および非顕著性、ならびに特許法の特許資格、書面説明および許可または支持要件を満たす能力を含む多くの要因に依存することを認識している。さらに、特許出願において要求されるカバー範囲は、特許発行前に大幅に縮小することができ、特許発行後であっても、特許の範囲を再解釈またはさらに変更することができる。したがって、私たちまたは私たちの許可者は、最終的に彼らの任意の候補製品または彼らの技術プラットフォームのために十分な特許保護を得るか、または維持することができないかもしれない。NKGenによって付与された特許出願が任意の特定の司法管轄区域で特許として発行されるかどうか、または発行された特許の任意の権利主張が競合相手に対して十分な独自保護を提供するかどうかを予測することはできない。NKGenが保有または許可している任意の特許は、第三者の疑問、回避、または無効にされる可能性がある。
私たちのような会社の特許地位は通常不確実であり、複雑な法律と事実の問題に関連している。細胞治療分野特許で許容される特許請求の範囲については,米国では一致した政策は出現していない。海外特許状況 アメリカもそうです 確かではありません。米国および他の国の特許法またはその解釈の変化は、私たちまたは私たちのライセンシーが彼らの発明を保護し、彼らの知的財産権を実行する能力を弱める可能性があり、より広く言えば、私たちの知的財産権の価値に影響を与える可能性がある。特に、我々は、我々の知的財産権を侵害する製品を製造、使用、販売、提供、または輸入する第三者の能力を阻止し、その技術、発明、および改善をカバーする特許主張の取得および実行における当社または我々の許可者の成功にある程度依存するであろう。許可された知的財産権および会社のすべての知的財産権について、NKGenは、私たちまたは私たちの許可者の任意の係属中の特許出願または私たちまたは私たちの許可者が将来提出する任意の特許出願が特許を付与されることを保証することはできず、私たちの任意のライセンスにおける既存の特許または将来私たちまたは私たちの許可者に付与される可能性のある任意の特許が、私たちの製品、その用途、およびこれらの製品を製造する方法において商業的用途を有するかどうかを決定することはできない。また、私たちの許可内に発行された特許であっても、製品商業化において私たちの技術を実践する権利は保証されません。バイオテクノロジーにおける特許および他の知的財産権分野は、多くのリスクと不確実性を有し、第三者が特許候補製品を商業化し、我々のノウハウを実践することを阻止する特許を有している可能性がある発展している分野である。いかなる第三者特許の発行が、私たちの開発や商業戦略、あるいは私たちの製品やプロセスを変更し、ライセンスを取得したり、いくつかの活動を停止したりすることを要求するかどうかはまだ確定されていません。私たちは、任意のライセンス契約に違反したり、将来の製品を開発または商業化するために必要な独自の権利の許可を得ることができず、将来の製品に実質的な悪影響を及ぼす可能性があります。もし第三者が米国で準備して提出した特許出願も権利の技術を要求する場合、私たちまたは私たちの許可者は、発明の優先権を決定するために、米国特許商標局の干渉または派生プログラムに参加しなければならない可能性がある。私たちが許可した発行された特許と将来発行される可能性のある特許は挑戦、無効、または回避される可能性があり、これは競争相手のマーケティング関連製品を阻止する能力を制限したり、制限したりする可能性があります 私たちは私たちの候補製品に特許保護を提供するかもしれない。さらに、発行された任意の特許によって付与された権利は、同様の技術を有する競争相手に対する保護または競合優位性を提供してくれない可能性がある。しかも、私たちの競争相手は似たような技術を独立して開発するかもしれない。このような理由で、私たちは私たちの候補製品を競争するかもしれない。さらに、潜在的製品の開発、テスト、および規制審査には長い時間がかかるため、任意の特定の候補製品が商業化される前に、任意の関連特許は、商業化後非常に短い期間にわたって失効または有効に維持される可能性があり、それにより、その特許の任意の利点を弱める可能性がある。私たちのビジネス成功はまた第三者の独占権を侵害しないことにある程度依存するだろう。特許紛争は時々他の商業紛争と絡み合っている。
場合によっては、私たちはまた商業秘密に依存して私たちの技術を保護することができる。しかし、商業秘密は保護することが難しい。私たちは、私たちのビジネス秘密およびノウハウを含む私たちの固有情報を保護することを求めており、一部は、私たちの機密情報にアクセスできる人と秘密協定を締結することによって、私たちの従業員、請負業者、コンサルタント、協力者、およびコンサルタントを含む。これらの合意は、一般に、我々との関係過程で開発または開示されたすべての機密情報を秘密にしなければならず、特定の場合でなければ、第三者に開示してはならないと規定している。私たちの従業員の場合、協定は一般的に、法的に許可された範囲内で、私たちのために従事している仕事、私たちの財産、または私たちの業務に関連するすべての発明、および雇用中に構想または完成した発明は、私たちの固有の財産でなければならないと規定している。適切な場合、私たちが私たちのコンサルタントと合意した合意は、一般に同様の発明条項譲渡も含まれている。さらに、私たちは、通常、業務パートナーと、私たちの機密情報を受け取った他の第三者に機密協定に署名することを要求します。私たちはまた、私たちのノウハウとプログラムの完全性とセキュリティ、私たちの住宅地の実体セキュリティ、そして私たちの情報技術システムの実体と電子セキュリティを維持するために努力しています。私たちはこのような個人、組織、そしてシステムに自信があるにもかかわらず、合意や安全措置は違反される可能性があり、いかなる違反を救済するための十分な救済措置もないかもしれない。しかも、私たちのビジネス秘密は競争相手に知られたり独立したりするかもしれない。私たちの従業員、請負業者、コンサルタント、協力者、およびコンサルタントが、私たちのために働いているときに他人が所有している知的財産権を使用する場合、関連するまたはそれによって生じるノウハウおよび発明の権利に関する紛争が生じる可能性がある。当社のノウハウ、発明、改善、および候補製品に関するこのリスクとより包括的なリスクについては、本募集説明書の題を参照してくださいリスク要因-私たちの知的財産権に関するリスク.”
商標
私たちの登録商標の組み合わせは、約17個の登録商標および未決商標出願を含み、約6つの米国における係属中商標出願、約3つのカナダにおける外国係属商標出願、および米国、ヨーロッパ、カナダ、スイスの国での商標登録を含む。
政府の監督管理
私たちはFDAと他の連邦、州、そして地方規制機関によって広く規制されている。“連邦食品医薬品化粧品法”(The“FD&C法案”)およびFDAの実施条例は、臨床試験、製造、品質管理、安全性、有効性、承認/承認、ラベル、貯蔵、記録保存、報告、流通、輸入、輸出、販売、広告および普及を含む、当社の製品および候補製品の試験、開発要件を規定しています。以下の議論の重点は米国の規制であるにもかかわらず、これが現在の主な注目点であるため、私たちは将来的に私たちの製品を承認/承認し、他の国/地域で私たちの製品を販売することを求めるかもしれない。
一般的に、私たちの他の国での活動は、重要な違いがあるかもしれないにもかかわらず、米国と類似した性質と範囲の規制を受けるだろう。世界的な規制環境は引き続き発展すると予想され、これはコスト、承認に要する時間に影響を与え、最終的には既存の承認または将来の製品承認を維持する能力に影響を与える可能性がある。FDAとアメリカ国内外の他の規制機関の法規は私たちの業務に広範なコンプライアンスと監督義務を課している。これらの機関は私たちの設計と製造実践、ラベル、記録保存、およびメーカーが要求した不良経験報告とその他の情報を審査して、上場製品の潜在的な問題を確定する。私たちは 影響を受けるでしょう 人間が使用する完成品薬品や医療機器の設計、製造、包装および修理に使用される方法および施設および制御を管理する適用された製造および品質システム法規に適合しているかどうかを定期的に検査する。また、FDAと米国国内外の他の規制機関(連邦貿易委員会、衛生·公衆サービス部監察長事務室、米国司法省、各州総検察長を含むがこれらに限定されない)は、我々の製品の普及と広告を監督している。いかなる不利な規制行動も、その規模に応じて、当社の製品を効果的にマーケティング·販売する能力を制限し、将来の発売前に承認を得る能力を制限したり、重大な修正を招いたりする可能性がある 私たちの業務実践と運営サービスのために。
薬品開発と承認
アメリカでは、生物製品は“連邦食品、薬品と化粧品法”、“公衆衛生サービス法”及びその他の連邦、州、地方と外国法規の規制を受けている。FDAが生物製品が米国で発売される前に要求されることができるプログラムは、一般に以下を含むが、これらに限定されない
•FDAの良好な実験室実践の要求に基づいて、臨床前実験室テストと動物研究を完成する(“プロス”);
•臨床試験が開始される前に有効でなければならないINDをFDAに提出する
•試験が開始される前に、各臨床場所のIRBまたは倫理委員会の承認
•FDAの法規(一般にGCP法規と呼ばれる)と人体研究対象及びその健康情報を保護する任意の追加要求に基づいて、十分かつ制御された人体臨床試験を行い、提案された候補生物製品の安全性、純度と効力を決定し、その期待目的を達成する
•バイオ製品ライセンス申請をFDAに提出する準備ができています(“BLA)“全ての重要な臨床試験を終えた後
•適用されれば、FDA諮問委員会の審査が満足的に完了する
•FDAはBLAを受信してから60日以内に再審申請を提出することを決定した
•GMPの適合性を評価し、生物製品の持続的な安全性、純度および効力を維持するのに十分な施設、方法、および制御を確保するために、GMPの適合性を評価するために、生産推奨製品の1つまたは複数の製造施設の承認前検査を良好に完了させ、適用されれば、GCPの適合性を評価するためにFDAの現在の良好な組織実践要件に適合するかどうかを評価すること;
•FDAは、BLAを支持するデータを生成する非臨床試験場所および臨床試験場所を監査することができる
•FDAは、米国で使用される特定の適応の製品の商業マーケティングを可能にするためにBLAを審査および承認する。
人体で任意の候補生物製品をテストする前に、候補製品は臨床前テスト段階に入る。臨床前試験は、非臨床研究とも呼ばれ、製品の化学、毒性と調合に対する実験室評価、及び候補製品の潜在的安全性と活性を評価する動物研究を含む。臨床前試験の進行はGLPを含む連邦法規と要求に適合しなければならない。
米国で最初の候補製品の臨床試験が開始される前に、INDをFDAに提出しなければならない。INDはFDAがヒトの研究を許可する新薬の要請である。INDが提出した文書の中心的な焦点は臨床試験の全体的な研究計画と案(S)である。INDはまた、製品の毒性学、薬物動態学、薬理学および薬効学的特徴を評価する動物およびインビトロ研究の結果、化学、製造および制御情報、および使用をサポートするための任意の利用可能なヒトデータまたは文献を含む 製品を研究する。INDはヒト臨床試験が始まる前に発効しなければならない。INDはFDAが30日以内に提案された臨床試験に対して安全懸念または問題を提起しない限り、FDA受信後30日以内に自動的に発効する。この場合,INDは臨床的に放置される可能性があり,INDスポンサーやFDAは臨床試験が開始される前に未解決の問題や問題を解決しなければならない。したがって,INDの提出はFDA認可による臨床試験の開始につながる可能性があり,そうでない可能性もある。
米国で臨床試験を開始する前にFDAにINDを提出するほか、いくつかの組換え或いは核酸分子の合成に関連する人体臨床試験はNIH“組換えDNA分子に関する研究ガイドライン”(The“ガイドライン”)に規定されているIBCsの監督を受けているアメリカ国立衛生研究院のガイドライン“)”具体的には,NIHのガイドラインによると,ヒト遺伝子転移試験の監督にはIBCによる評価と評価があり,IBCは地方機関委員会であり,組換えや合成核酸分子を用いた研究の審査·監督を担当している。IBCは、研究の安全性を評価し、公衆の健康または環境に対する任意の潜在的リスクを決定し、このような審査は、臨床試験開始前のいくつかの遅延をもたらす可能性がある。NIHガイドラインは強制的ではないが,関連研究がNIH組換えや合成核酸分子研究助成を受けた機関で行われているか,あるいはその助成によって行われていない限り,多くの会社や他のNIHガイドラインに拘束されていない機関は自発的にこれらのガイドラインに従っている。
臨床試験は、GCPに従って合格した研究者の監督の下でヒト被験者に研究製品を服用することを含み、すべての研究被験者に任意の臨床試験への参加についてインフォームドコンセントを提供することを含む。臨床試験は,研究目標を詳細に説明し,安全性をモニタリングするためのパラメータと評価する有効性基準のシナリオで行った。製品開発中に行われる各後続の臨床試験および後続の任意のレジメン修正は、既存のINDに個別に提出されなければならない。また,臨床試験を推奨する各地点の独立IRBは,その地点で臨床試験を開始する前に任意の臨床試験の計画とそのインフォームドコンセントを審査·承認しなければならず,完成まで研究を監視しなければならない。規制当局、IRB、またはスポンサーは、対象が受け入れられない健康リスクに直面していることを発見すること、または試験がその目標を達成する可能性が低いことを含む、様々な理由で臨床試験を随時一時停止することができる。いくつかの研究は、データ安全監視委員会と呼ばれる臨床試験スポンサーによって組織された独立した合格専門家グループの監視をさらに含み、委員会は、研究のいくつかのデータへのアクセスに基づいて、研究が指定されたチェックポイントで行うことができるかどうかを許可し、被験者に受け入れられない安全リスクまたは他の理由があると判定された場合、治療効果を示さない場合、臨床試験を停止する可能性がある。行っている臨床試験や臨床試験結果を公的登録機関に報告することも求められている。
BLAを承認するために、ヒト臨床試験は通常3つの連続段階に分けて行われ、これらの段階は重複または合併する可能性がある:
•第1段階−研究製品は、最初に健康なヒト対象または標的疾患または状態を有する患者に導入される。これらの試験は、人体内での製品の安全性、用量耐性、吸収、新陳代謝と排泄、および用量増加に関連する副作用をテストし、可能な場合に有効性の早期証拠を得ることを目的としている。
•第二段階-初期治療効果、最適用量および用量計画を評価し、可能な不良副作用および安全リスクを決定するために、特定の疾患または状態の限られた患者集団のための製品を研究する。より大規模で高価な3期臨床試験を開始する前に、情報を得るために複数のII期臨床試験を行うことができる。
•第3段階-患者集団を拡大するための研究製品 投与量をさらに評価し臨床有効性の統計的に有意なエビデンスを提供し安全性をさらに試験します一般的に地理的に分散した複数の臨床試験サイトでこれらの臨床試験は、試験用製品の全体的なリスク / ベネフィット比を確立し、製品承認の適切な基礎を提供することを目的としています。
場合によっては、FDAは、所望の治療適応に関する製品のより多くの情報、特に長期安全フォローアップのために、自発的に製品が承認された後に追加の臨床試験を行うことを要求する可能性がある。これらのいわゆる第4段階実験もBLAを承認する1つの条件となる可能性がある。
臨床試験と同時に、会社は追加の動物研究を完成させ、候補製品の生物学的特性に関する追加情報を開発することができ、GMP要求に基づいて商業量産製品の過程を最終的に決定しなければならない。製造過程は一貫して高品質の候補製品ロットを生産することができなければならず、特に最終製品の特性、強度、品質と純度をテストする方法を開発しなければならない。また,適切な包装を選択·テストし,候補製品が賞味期限内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない。
アメリカ食品医薬品局が提出し審査したBLA
すべての適用された法規要件に基づいてすべての要求されたテストが成功したと仮定すると、製品開発、非臨床研究、および臨床試験の結果は、BLAの一部としてFDAに提出され、その製品を1つまたは複数の適応の市場に使用することの承認を要求する。BLAは,否定や曖昧な結果や積極的な発見,製品の化学,製造,制御,提案されたラベルなどに関する詳細な情報を含む臨床前および臨床試験から得られたすべての関連データを含まなければならない。データは、製品の安全性および有効性を試験することを目的とした会社のスポンサーからの臨床試験から来ることができ、独立した調査者による試験を含む多くの代替源からのものであってもよい。BLAを提出するには、免除または免除が適用されない限り、FDAに相当な申請使用料を支払う必要がある。
出願が提出されてから60日以内に、FDAは、FDAが提出を受け入れる前に実質的に完了したかどうかを決定するために、提出されたBLAを審査する。FDAは、それが不完全であるか、または提出時に適切に審査できないと考えられる任意のBLAの提出を拒否することができ、より多くの情報の提供を要求することができる。この場合,BLAおよび付加情報を再提出しなければならない.BLAが提出を受けると、FDAの目標は、提出日から10ヶ月以内に標準出願を審査すること、または、申請に資格優先審査がある場合、FDAが提出申請を受けてから6ヶ月以内に審査することである。標準審査および優先審査では、FDAは、より多くの情報の提供または明確化を要求し、審査プロセスを延長することもできる。FDAは、製品が安全で、純粋かつ有効であるかどうか、およびその製造、加工、包装、または保持されている施設が、製品の持続的な安全、純度および効力を保証するための基準に適合しているかどうかを決定するためにBLAを審査する。FDAは諮問委員会を招集し,審査申請について臨床的知見を提供することも可能である。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を慎重に考慮するだろう。
BLAを承認する前に、FDAは通常、製品を生産する1つまたは複数の施設を検査する。FDAは、製造プロセスおよび施設がGMPに適合していることを決定し、要求された規格の下で製品が一貫して生産されることを保証するのに十分でない限り、申請を承認しないであろう。ヒト細胞や組織製品でもある候補製品については,メーカーがcGTPSに適合していなければ,FDAもこの申請を承認しない。これらは、ヒト細胞、組織、および細胞および組織に基づく製品またはHCT/Psを製造するための方法および使用のための施設および制御を管理するFDAの法規であり、これらのHCT/Psは、ヒトレシピエント内に移植、移植、注入または転移するためのヒト細胞または組織である。GTP要求の主な目的は,細胞や組織に基づく製品の製造方式の確保であり,感染症の導入,伝播,伝播を防止することを目的としている。FDAの規定はまた、組織機関がFDAに彼らのHCT/Pを登録し、適用した場合にスクリーニングとテストを通じてドナーを評価することを要求する。
さらに、BLAを承認する前に、FDAは、GCPに適合することを確実にするために、通常、1つまたは複数の臨床場所を検査する。FDAが申請、製造プロセス、または製造施設が受け入れられないと判断した場合、それは、提出された文書に不足点を列挙し、追加の試験または情報の提供を要求することが多い。任意の要求された補足情報が提出されたにもかかわらず、FDAは最終的に、その申請が承認された規制基準を満たしていないと決定する可能性がある。
FDAがBLAを評価し、研究製品および/またはその薬物を生産する製造施設を検査した後、FDAは承認状を発行することができる 完全な返信(“CRL“)”承認書は、製品の商業マーケティングを許可し、特定の適応に関する具体的な処方情報を提供する。CRLは、FDAがBLAで発見したすべての欠陥を記述するが、FDAが、申請をサポートするデータが承認をサポートするのに不十分であると判断した場合、FDAは、最初に必要な検査、提出された製品ロットをテストすることなく、および/または提案されたラベルを審査することなくCRLを発行することができる。CRLを発行する際に、FDAは、BLAがより多くの情報を提供することを要求すること、または明確にすることを含む、BLAが承認された条件であるように、申請者がとる可能性のある行動を提案することができる。適用される規制基準を満たしていない場合、FDAは、製品の安全性または有効性を監視するために、追加の試験または情報を要求し、および/または上場後の試験および監視を要求するBLAの承認を延期または拒否することができる。
1つの製品が規制部門の承認を受けた場合、このような承認は特定の適応が付与され、製品が発売される可能性のある指定用途の制限をもたらす可能性がある。例えば、FDAは、製品の利点がそのリスクよりも大きいことを保証するために、REMSを使用してBLAを承認することができ、または他の方法で任意の承認範囲を制限することができる。REMSは、製品に関連する既知または潜在的な深刻なリスクを管理し、そのような薬剤の安全な使用を管理することによって、患者がこれらの薬剤を継続的に得ることを可能にするための実装されたセキュリティ戦略であり、制限された分配方法、患者登録、および他のリスク最小化ツールのような薬物ガイドライン、医師のコミュニケーション計画、または安全使用を確保する要素を含むことができる。FDAはまた,提案されたラベルを変更したり,適切な制御や仕様を作成したりすることを条件に承認することも可能である.承認されると、発売前と上場後の要求に対する遵守が保たれていない場合、あるいは製品が市場に進出した後に問題が発生した場合、FDAは製品承認を撤回する可能性がある。FDAは、製品の商業化後の安全性と有効性をさらに評価し、監視するために、1つまたは複数の第4段階上場後の試験およびモニタリングを要求する可能性があり、これらの発売後の研究結果に基づいて製品のさらなる販売を制限する可能性がある。
開発と審査計画を加速する
FDAは合格した候補製品に一連の迅速な開発と審査計画を提供した。例えば、迅速チャネル計画は、深刻または生命に危険な疾患または状態を治療することを目的とした新製品の審査プロセスを加速または促進し、疾患または状態を解決する満たされていない医療需要の潜在力を示すことを意図している。具体的には、新しい生物製品が、深刻または生命に危険な疾患または状態を治療することを意図し、その疾患または状態を解決する満たされていない医療需要の潜在力を示す場合、迅速なチャネル指定を得る資格がある。高速チャネル指定以下の項目に適用される組合せ 研究中の製品と具体的な適応。新規生物製剤のスポンサーが、製品の臨床開発中のいつでもFDAに生物学的製剤を迅速チャネル製品として指定することを要求することができる、新規生物製剤のスポンサー。Fast Track製品のスポンサーは,製品開発期間中に適用されるFDA審査チームとより頻繁なインタラクションを行う機会があり,BLAを提出すると,候補製品が優先審査を受ける資格がある可能性がある。高速チャネル製品もスクロール審査を行う資格がある可能性があり、この場合、FDAは、完全な出願を提出する前にBLAの審査部分をスクロールして考慮することができ、スポンサーがBLA部分を提出するスケジュールを提供した場合、FDAはBLAの部分を受け入れることに同意し、スケジュールが許容可能であると判断し、スポンサーはBLAの第1の部分を提出する際に任意の必要な使用料を支払うことができる。
重篤または生命に危険な疾患や状況を治療しようとする候補品も,その開発や審査を加速するための画期的な療法指定を受ける資格がある可能性がある。予備臨床証拠が、候補製品が単独または1つまたは複数の他の薬物または生物製品と組み合わせて使用される可能性があることを示す場合、候補製品は、1つまたは複数の臨床重要終点において、既存の治療法よりも実質的な改善を示す可能性があり、例えば、臨床開発早期に観察された実質的な治療効果を示す場合、候補製品は突破的治療称号を得ることができる。この指定には、Fast Track計画のすべての機能と、第1段階で開始されたより密集したFDA相互作用および指導と、高度な管理者の参加を含む候補製品開発および審査を加速する組織約束とが含まれる。
迅速なチャネル指定および/または突破療法指定を有する候補製品を含むFDA承認を提出する任意の医薬またはバイオマーケティング出願は、優先審査および加速承認のようなFDAが開発および審査を加速することを意図している他のタイプの計画の資格に適合する可能性がある。候補製品が満足できる代替療法なしに安全かつ有効な治療を提供する可能性がある場合、または市販されている製品と比較して、治療、診断または疾患予防において有意に改善されている可能性がある場合、候補製品は優先審査する資格がある。FDAは 追加の資源は、審査を促進するために、指定された優先審査の新しい生物製品の申請を評価するために使用される。最初のBLASについて、優先審査指定は、FDAの目標が、60日の申請日後6ヶ月以内にマーケティング申請に行動することであることを意味する(標準審査下の10ヶ月と比較)。
さらに、深刻または生命に危険な疾患または状態の治療における安全性および有効性を研究する候補製品については、臨床利益を合理的に予測することができる代替終点、または不可逆的な発病率または死亡率の前に測定可能な臨床終点、不可逆的な発病率または死亡率または他の臨床的利益を合理的に予測することができる臨床終点に対して有効であることを決定する際に、病状の重症度、希少性または流行度、および代替治療を利用可能または不足することを考慮しながら、承認を加速することができる。承認を加速する条件として、FDAは通常スポンサーに十分かつ良好な制御を行う上場後の臨床試験を要求し、不可逆的な発病率或いは死亡率或いは他の臨床利益に対する期待影響を検証し、記述する。スポンサーが必要な上場後研究やこのような研究が予測の臨床的利益を検証できなかった場合、加速的な承認を得た製品は迅速な脱退プログラムの影響を受ける可能性がある。また、FDAは現在、承認を加速させる条件として宣伝材料を事前承認することを求めており、製品商業発売の時期に悪影響を及ぼす可能性がある。
2017年、FDAは、以下の基準に適合する任意の薬物または生物の有効な開発計画を促進し、審査を加速するための新しいRMAT名を確立した:(I)薬物または生物は、細胞療法、治療用組織工学製品、ヒト細胞および組織製品、またはそのような治療または製品を使用する任意の組み合わせ製品として定義されているが、限られた例外的な状況である;(Ii)薬物または生物は、治療、修正、逆転または治癒または生命に深刻なまたは危険な疾患または状態を治療、修正、または治癒することを目的としている。および(Iii)の初歩的な臨床証拠は、このような薬物または生物学的製剤が、このような疾患または状態が満たされていない医療需要を解決する可能性があることを示している。RMAT指定は、FDAとより頻繁に会議を行い、候補製品の開発計画およびスクロール審査および優先審査の資格を検討することを含む画期的な治療指定のすべての利点を提供する。
RMAT資格が付与された候補製品は、合理的に長期的な臨床的利益を予測する可能性のある代替物または中間終点に基づいて、または試験をより多くの場所に拡張することによって加速承認を得ることを含む、大量の臨床試験地点から得られるデータに依存する資格がある可能性もある。加速的承認を得たRMAT指定製品は、臨床証拠、臨床試験、患者登録または他の真の証拠源(例えば、電子健康記録)を提出することによって、より大きな検証性データセットを収集することによって、または治療を承認する前に、そのような治療を受けたすべての患者を承認後に監視することによって、その承認後の要求を満たすことができる。迅速チャネル指定、画期的な治療指定、優先審査、加速承認、およびRMAT指定は、承認の基準を変更することはありませんが、開発または承認プロセスを加速する可能性があります。1つの候補製品がこれらの計画のうちの1つまたは複数に参加する資格があっても、FDAは、その製品がもはや合格条件を満たしていないことを決定するか、または決定することができる FDAの審査や承認の時間は短縮されないだろう。
孤児薬の指定と排他性
孤児医薬品法によれば、FDAは、米国での患者数が20万人未満であるか、または米国での患者数が20万人を超えることが定義されており、米国での薬剤または生物学的薬剤の開発および提供のコストが、米国での薬剤または生物学的薬剤の販売から回収されることが合理的に予想されていない稀な疾患または疾患の治療のための薬剤または生物学的指定を孤児として指定することができる。BLAを提出する前に,指定孤児薬を申請しなければならない。FDAが孤児薬物指定を承認した後、FDAは、治療薬の模倣薬識別情報およびその潜在的孤児の使用を開示する。指定孤児薬は、規制審査と承認過程でいかなる利点も伝達されず、規制審査と承認過程の持続時間を短縮することもない。
米国では,孤児薬を指定することで一方が臨床試験費用,税収割引,ユーザ費用減免のために贈与資金を提供する機会などの財政的インセンティブを得る権利がある。さらに、孤児薬物指定を有する製品がその後、そのような指定された疾患を有する特定の薬剤または生物学的製剤に対するFDAの最初の承認を得た場合、この製品は、孤児製品の排他性を得る権利があり、これは、FDAが完全なBLAを含む他の出願を承認しない可能性があり、限られた場合を除いて、同じ適応の同じ生物学的製剤が7年以内に販売される可能性があることを意味する。例えば、孤児薬物排他性を有する製品に対する臨床的優位性を示すか、またはFDAは、指定された薬物の疾患または状態を有する患者の需要を満たすために十分な数の孤児薬を得ることができることを証明していないことを発見する。
孤児薬物の排他性は、FDAが同じ疾患または条件のために異なる薬剤または生物学的薬剤を承認することを阻止しないか、または異なる疾患または条件のための同じ薬剤または生物学的薬剤を使用することを阻止しない。もし競争相手がFDAで定義された同じ生物製品の承認を得た場合、または私たちの候補製品が競争相手の製品に含まれると決定された場合、同じ適応または疾患のために、孤立した製品排他性も7年以内に私たちの製品が承認されることを阻止する可能性がある。
指定された孤児薬物が孤児が指定された適応よりも広い用途で承認された場合,孤児薬物の排他性を得ることはできない。さらに、FDAが後に指定要求に重大な欠陥があると判断した場合、または上述したように、第2の出願人が、その製品が孤児排他性を有する承認製品よりも臨床的に優れていることを証明する場合、または製品を承認する製造業者が、まれな疾患または疾患患者の需要を満たすのに十分な数の製品を保証できない場合、米国における孤児薬の独占営業権を失う可能性がある。
承認後に要求する
生物製品はFDAの普遍的かつ持続的な規制を受けており、その中には記録保存、副作用報告、定期報告、製品サンプリングと流通、および製品の広告と販売促進に関連する要求が含まれている。承認後、承認された製品の大多数の変更は、新たな適応または他のラベル宣言を追加するなど、FDAの事前審査および承認を経なければならない。どんな発売された製品についても、継続的な年間計画費用があります。
承認されたバイオ製品の製造·流通に関連するバイオメーカーや他のエンティティは、FDAや特定の州機関にその機関を登録しなければならない FDAとある州機関の定期的な抜き打ち検査を受け、GMP要求や他の法律を遵守することを確保した。そのため、メーカーはGMPコンプライアンスを維持するために、生産と品質管理に時間、お金、労力をかけ続けなければならない。製造プロセスや施設の変更は厳しく規制されており,変更の重要性により,FDAが事前に承認して実施する必要がある可能性がある。FDAの規定はGMPとの偏差を調査·是正し,報告を強制的に要求することも求められている。そのため、メーカーは生産と品質管理の分野で時間、お金、精力をかけ続けて、GMPや他の方面に合った法規遵守性を維持しなければならない。
規制要件や基準が守られていない場合、あるいは製品発売後に問題が発生した場合、FDAは承認を撤回する可能性がある。その後、製品には、予期されない深刻度または頻度の不良事象、または生産プロセス、または規制要件を遵守できなかったことを含む、以前に未知の問題が存在することが発見され、新しいセキュリティ情報を追加するために承認されたラベルの改訂を招く可能性がある;新しい安全リスクを評価するために発売後研究または臨床試験を実施すること、またはREMS計画に従って流通制限または他の制限を実施することが可能である。
他の他の潜在的な結果には
•製品の販売や製造を制限し、市場から製品を完全に撤回したり、製品をリコールしたりする
•罰金、警告状、見出しなしの手紙
•臨床試験を堅持する
•FDAは、承認されるべき出願または承認された出願の追加申請を拒否するか、または製品ライセンスの承認を一時停止または撤回する
•製品の差し押さえ、差し押さえ、あるいは製品の輸出入を許可しないことを拒否した
•法令に同意し、会社の誠実な合意に同意し、連邦医療計画の資格を取り消したり、除外したりする
•宣伝材料とラベルを強制的に修正し、訂正情報を発表する
•セキュリティ警報、親愛なるヘルスケア提供者への手紙、プレスリリース、および製品に関する警告または他のセキュリティ情報を含む他の通信;または
•民事または刑事処罰を禁令または適用する。
FDAは生物製品のマーケティング、ラベル、広告、販売促進を厳格に規制している。1社はFDAが承認したラベルの規定に基づいて、安全性と有効性、純度、効力に関する声明しか提出できない。FDAと他の機関は非ラベル用途の普及を禁止する法律法規を積極的に施行している。これらの要求を守らないことは、否定的な宣伝、警告状、広告の是正、潜在的なリスクを招く可能性がある 民事と刑事処罰。FDAの制裁には、承認保留申請の拒否、承認撤回、臨床封印、警告または無名手紙、製品リコール、製品差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金、政府契約の拒否、強制要求の是正広告、または医師とのコミュニケーション、取り締まり、原状回復、利益の返還または民事または刑事罰が含まれる可能性がある。医師は、合法的に得られた製品のための処方、製品ラベルに記載されていない使用、およびFDA試験および承認とは異なる使用のために処方することができる。このようなラベル外の使用は医学専門科でよく見られる。彼らの独立した医学的判断では、医師たちは、異なる場合、このような非ラベル使用は多くの患者の最適な治療法であると信じているかもしれない。FDAは医者が治療を選択する時の行動を規範化しない。しかし、FDAは製品ラベルの外使用問題に対する製造業者のコミュニケーションを制限した。
生体模倣薬と参考製品の排他性
2010年に法律に署名された“平価医療法案”には、“生物製品価格競争と革新法案”という副題が含まれている(“生物製品価格競争と革新法案”)“BPCIA)は、FDAによって許可された参照生物学的製品と類似したまたは交換可能な生物学的製品のための短い承認経路を作成する。FDAはすでにいくつかの指導文書を発表し,生体模倣薬の審査·承認方法について概説した。
生物類似性は生物製品と参照製品が安全性、純度と効力の面で臨床的に意義のある差がないことが要求され、これは分析研究、動物研究と臨床試験によって証明できる。互換性は、製品が基準製品生物と類似していることを必要とし、この製品は、任意の所与の患者において、参照製品と同じ臨床結果を生成することが期待できることを証明しなければならず、複数回投与された製品の場合、以前の投与後、生物および参照生物は、安全リスクを増加させることなく、または参照生物の独占的使用と比較して治療効果のリスクを低下させることなく、交互にまたは交換することができる。しかし、生物製品がもっと大きく、よくもっと複雑な構造及びこのような製品を製造する技術に関連する複雑性は、FDAがまだ制定している簡略化審査経路の実施に重大な障害を構成した。
BPCIAによると,生物類似製品の申請は,参考製品が初めてFDA許可を得た4年後にFDAに提出されなければならない。また,FDAによる生物類似製品の承認は,参考製品が初めて許可された日から12年後に発効する可能性がある。この12年間の独占期間内に、FDAが競合製品の完全なBLAを承認した場合、出願人自身の臨床前データと、その製品の安全性、純度および有効性を証明するために、十分かつ良好に制御された臨床試験からのデータとを含み、別の会社は、参照製品の競合バージョンを販売する可能性がある。BPCIAはまた、交換可能な製品として承認された生物模倣薬のためのいくつかの排他的期限を設けている。この節では,FDAが“交換可能”と考えている製品が本当に州薬剤法に管轄されている薬局に取って代わられるかどうかは不明である。
生物製品は米国でも小児科市場の排他性を得ることができる。小児科専有権が付与された場合、既存の専有期間と特許条項を6ヶ月増加させる。この6ヶ月の独占経営権は その他の排他的保護または特許期間は,小児科研究を自発的に完成させたうえで,FDAによって発表されたこのような研究の“書面請求”を付与することができる。BPCIAは複雑であり、FDAによって解釈され、実施され続けている。また、政府の提案は12年間の参考製品専門期間を短縮しようとしている。
BPCIAの他の面では,そのいくつかがBPCIAの排他的条項に影響を与える可能性があり,最近の訴訟のテーマでもある.したがって,BPCIAの最終的な影響,実行,影響は重大な不確実性の影響を受ける。
他の医療保険法
製薬会社は、連邦政府およびそれらが業務を展開している州と外国の司法管轄区域当局の追加的な医療監督管理と法執行を受けており、私たちが研究、販売、マーケティング、流通し、マーケティングの許可を得た任意の製品の財務配置や関係を制限する可能性がある。このような法律には、連邦および州のリベート、詐欺および乱用、虚偽声明、データプライバシーおよび安全、価格報告、ならびに医師および他のヘルスケア提供者の透明性に関する法律および法規が含まれているが、これらに限定されない。もし私たちの業務がこのような法律または任意の他の適用可能な政府法規に違反していることが発見された場合、私たちは行政、民事と刑事処罰、損害賠償、罰金、返還、削減または再構成業務、誠実な監督と報告義務、連邦および州医療計画から除外され、監禁されることを含む罰を受ける可能性がある。
他の事項に加えて、連邦反リベート法規は、任意の個人またはエンティティが、購入、レンタル、注文または購入の手配、レンタルまたは購入の手配、レンタルまたは注文として、Medicare、Medicaid、または他の連邦医療計画に従って精算可能な任意の物品またはサービスの見返りとして、故意に、または故意に現金または実物で直接または間接的に、公開または隠蔽的に提供、支払い、請求または任意の報酬を受けることを禁止する。報酬という単語は価値のあるものを含むと広く解釈されている。逆リベート法規は、医薬品メーカーと処方者、購入者、および処方管理人との間の手配に適用されると解釈される。いくつかの法的例外と規制避難所がいくつかの一般的な活動を保護することは起訴されない。
例外および安全港は狭義であり、処方、購入または推奨される報酬を誘導するために告発される可能性があるやり方に関連し、例外または安全港の資格を満たしていない場合は審査される可能性があるが、例外および安全港は狭義であり、保護を提供するために厳格に遵守する必要がある。特定の適用された法定例外や安全港を規制するすべての要求を満たしていないことは、このような行為自体が“反リベート条例”に規定された不法行為であることを意味するわけではない。代わりに、そのすべての事実と状況の累積審査に基づいて、この手配の合法性を逐案的に評価する。
さらに、反リベート法規および連邦HIPAA下の刑事医療詐欺法規下の意図基準は、個人または実体が違反を実施するために、法規または法規違反の特定の意図を実際に理解する必要がなくなるように、ACAによってより厳しい基準に改正される。また,ACAは判例法を編纂し,連邦虚偽申告法の目的により,連邦反リベート法規違反による物品やサービスのクレームを含めて虚偽や詐欺的クレームを構成しているFCA“(以下、議論する)。
他の事項に加えて、FCAは、任意の個人またはエンティティが虚偽支払いまたは承認の提出を意図的に連邦政府に提出するか、または虚偽請求材料を作成、使用するか、または虚偽記録または陳述を作成または使用させて、連邦政府に虚偽または詐欺的クレーム材料を提供することを禁止する。2009年の“詐欺法執行·回収法案”の改正により、クレームには、米国政府に提出された金銭又は財産に対する“任意の請求又は要求”が含まれている。
これらの法律により、製薬と他の医療保険会社は起訴され、罪は顧客に無料で製品を提供し、顧客がその製品のために連邦計画に請求書を発行し、これらの会社のマーケティング活動によって虚偽の声明を提出することを期待することです この製品は未承認の用途に使用されるため、保証範囲内ではない。
HIPAAはまた、計画を故意に実行または実行しようとすることを禁止する新しい連邦刑法を制定し、虚偽または詐欺的な口実、陳述または承諾の方法で任意の医療福祉計画(個人第三者支払者を含む)が所有または制御または保管している任意の金銭または財産を詐欺または取得し、悪巧み、計画または装置によって重大な事実を偽造、隠蔽または隠蔽すること、または医療福祉、プロジェクトまたはサービスの提供または支払いに関連する任意の重大な虚偽、架空、または詐欺的な陳述を故意に行うことを禁止する。また、多くの州で同様の詐欺や法律や法規の乱用があり、医療補助や他の州が計画して精算するプロジェクトやサービスに適用されたり、いくつかの州では支払者にかかわらず適用されている。
さらに、ACAの範囲内の連邦医師は、Medicare、Medicaidまたは児童健康保険計画(いくつかの例外)に従って支払うことができるいくつかの薬品、器具、生物および医療用品製造業者に、医師(医師、歯科医、検眼師、足科医および脊椎マッサージ師を含む)および教育病院およびこれらの医療保健提供者およびそれらの直系親族が所有するいくつかの所有権および投資権益に関するいくつかの支払いまたは他の価値移転に関する情報を毎年報告する。2022年から適用されるメーカーは,前年に医師アシスタント,看護師勤務者,臨床看護師専門家,麻酔科医アシスタント,登録看護師麻酔科医,登録助産師への支払いやその他の価値移転の情報を報告することも要求される。
私たちは 連邦政府や 私たちが業務を展開している州。HIPAA、“衛生情報技術による経済と臨床衛生法”(“HITECH”)およびその実施条例は、保証エンティティまたは保証エンティティに代わって、個人が健康情報を識別することができる特定の医療保健提供者、健康計画、保健情報センターおよびそれらのそれぞれの事業パートナー、ならびに個人が健康情報を識別することができるプライバシー、セキュリティおよび送信に関連する保証下請け業者を作成、受信、維持または送信することを含む保証エンティティに要求する。他の事項に加えて、HITECHは、保護された健康情報を受信または取得するために、カバーエンティティに代わってサービスを提供する商業パートナー、独立請負業者、またはエージェントに、HIPAAのプライバシーおよびセキュリティ基準を直接適用させる。HITECHはまた4つの新しい民事罰金等級を作成し、HIPAAを改訂し、民事と刑事処罰を商業パートナーに直接適用し、州総検察長に新しい権力を与え、連邦裁判所に民事訴訟を提起し、損害賠償または禁止令を要求して連邦HIPAA法を執行し、連邦民事訴訟に関連する弁護士費と費用を求めることができる。また,州法は特定の場合に健康情報のプライバシーやセキュリティを管理しており,その多くの法律は互いに大きく異なり,同様の効果が生じず,コンプライアンス作業を複雑にする可能性がある。
製品を商業的に流通させるためには、州の法律を遵守し、州の薬品メーカーと卸売業者に登録を要求しなければならない。いくつかの州では、これらのメーカーまたはディーラーがその州に営業場所がなくても、製品をその州のメーカーおよびディーラーに輸送することを含む。一部の州はまた、メーカーと流通業者が流通チェーン中で製品の系統を確立することを要求しており、いくつかの州はメーカーと他の州に流通チェーン中の製品の流れを追跡し追跡できる新しい技術を採用することを要求している。いくつかの州はすでに立法を公布し、製薬会社にマーケティングコンプライアンス計画を確立し、州政府に定期報告を提出し、医師および他の医療保健提供者に支払う販売、マーケティング、定価、追跡および報告プレゼント、報酬および他の報酬、臨床試験および他の活動を定期的に公開開示し、および/またはその販売代表を登録し、薬局および他の保健実体が製薬会社に販売およびマーケティングのためのいくつかの医師処方データを提供することを禁止し、いくつかの他の販売およびマーケティング行為を禁止する。私たちのすべての活動は連邦と州消費者保護と不正競争法によって制限されるかもしれない。
私たちの業務が上記の任意の連邦および州医療保健法律または私たちに適用される任意の他の政府法規に違反していることが発見された場合、私たちは、MedicareとMedicaid、禁止、個人通報者が政府の名義で提起した個人訴訟、または政府契約、契約損害、名声損害、行政負担、利益減少および将来の収入減少、ならびに私たちの業務の削減または再編を含む、民事、刑事および/または行政処罰、損害賠償、罰金、返還、監禁、MedicareおよびMedicaid、禁止、個人通報者の政府名義での個人訴訟を含む重大な処罰を受ける可能性があります。いずれも私たちの業務運営能力と運営結果に悪影響を及ぼす可能性があります。
保証と精算を請け負う
任意の製品の販売は、連邦、州と外国政府医療保健計画、商業保険とホスト医療組織、および第三者支払人のこの製品に対する清算レベルなど、第三者支払者のこの製品に対する保証程度にある程度依存する。提供されるべき補償範囲と金額に関する決定は個々の計画に基づいて行われる。第三者支払人の精算は多くの要素に依存する可能性があり、第三者支払人が1種の製品が安全、有効と医学上必要であることを決定すること;特定の患者に適している;コスト効果がある;同業者が審査した医学定期刊行物の支持を得ること;臨床実践ガイドラインに含まれる;及び美容製品でもなく、実験製品でもなく、研究製品でもない。第三者支払者はまた、私たちの治療を清算する前に、いくつかの一連の治療を完了または失敗することを要求することができる。新薬精算に関する主な決定は通常,医療保険と医療補助サービスセンター(“Cententers for Medicare&Medicaid Services”)によって行われる細胞質これはアメリカ衛生·公衆サービス部ですHHS“)”CMSは製品がどの程度連邦医療保険の下でカバーと精算されるかを決定し、個人支払者はしばしばCMSに大きく従う。第三者支払者は、彼らがどの製品と手続きをカバーし、精算レベルを確立するかを決定する。第三者支払者が特定の製品やプログラムをカバーしても、それによる精算支払率が十分高くない可能性がある。これらの第三者決済者は医療製品、薬品、サービスの保証と精算をますます減少させている。また、米国政府、州立法機関、外国政府は価格制御、カバー範囲と補償の制限及び模造薬代替の要求を含むコスト制御計画を継続して実施している。価格制御及びコスト制御措置、並びに既存の制御及び措置を講じている司法管区において、より限定的な政策をとることにより、任意の製品の販売をさらに制限することが可能となる。いかなる製品の第三者精算または第三者支払者が製品を保証しないことを決定することは、医師の使用量や患者の製品に対する需要を減少させ、販売に実質的な悪影響を及ぼす可能性がある。
医療改革
米国では,ACAは2010年3月に公布され,政府と民間保険会社が医療保健に資金を提供する方式を大きく変更し,製薬業に重大な影響を与えた。ACAには、連邦医療計画の登録、補償調整、および詐欺および乱用の法律の改正を含むいくつかの条項が含まれている。例えば、ACA:
•ブランド医薬品メーカーが支払うべき医療補助税還付の最低水準を平均メーカー価格の15.1%から23.1%に引き上げた
•医療補助管理保健機関が支払った薬品の要求に対してリベートを請求する
•メーカーに保険ギャップ割引計画に参加することを要求し、この計画によると、彼らは保険ギャップ中に条件を満たす受益者に適用ブランド薬品交渉価格の70%の販売時点割引を提供することに同意しなければならず、メーカーの外来薬が連邦医療保険Dで部分的にカバーされる条件として同意しなければならない
•指定された連邦政府プロジェクトで“ブランド処方薬”を販売する薬品メーカーまたは輸入業者に差し引かれない年会費を徴収する
•指定された連邦政府プロジェクトで“ブランド処方薬”を販売する薬品メーカーまたは輸入業者に差し引かれない年会費を徴収する
•公共衛生サービス薬品の価格設定計画の下で割引を受ける資格のある実体を拡大する
•新しい患者を中心とした結果研究所を創立し、監督、優先事項を確定し、臨床治療効果の比較研究を行い、そしてこのような研究に資金を提供する。
ACAのいくつかの側面は行政、司法、そして国会の挑戦を受けている。例えば、2019年1月1日からACAが1年の全部または一部の期間に合格健康保険を維持できなかった個人に対する税金ベースの分担責任支払いを廃止する条項を含む税法が公布され、これは一般に“個人強制”と呼ばれる。2018年12月14日テキサス州北区のアメリカ地裁判事は個人強制令は したがって、税法は廃止されたため、税法の残りの条項も無効だ。また、2019年12月18日、米国第5巡回控訴裁判所は、個人強制令が違憲であると判断し、ACAの残りの条項も無効であるか否かを判定するために、事件を地域裁判所に返送する。米国最高裁判所は現在この事件を審査しているが、いつ決定するかはまだわからない。米国最高裁判所はACAの合憲性についてまだ裁決していないにもかかわらず,ACA市場による医療保険の取得を目的とした2021年2月15日から2021年8月15日までの特別保険期間を開始する行政命令を出した。行政命令はまた、特定の政府機関に、医療補助モデルプロジェクトおよび免除計画の再審査、および医療補助またはACAによる医療保険カバー範囲の獲得による不必要な障害をもたらす政策を含む医療補助モデルプロジェクトおよび免除計画の再審査および見直し、医療補助またはACAによる医療保険のカバー範囲を制限する既存の政策およびルールを再検討するように指示する。最高裁の裁決,その他のこのような訴訟,バイデン政府の医療改革措置がACAや我々の業務にどのように影響するかは不明である。
ACAが公布されて以来、アメリカはまた他の立法改正を提案し、採択した。2011年8月2日、“2011年予算制御法”などは、医療保険提供者に支払う医療保険総金額を2%/年度削減し、2013年4月1日に施行することが含まれている。しかし,新冠肺炎の救済立法は2020年5月1日から2021年12月31日までの2%の連邦医療保険自動減額を一時停止した。2013年1月、“2012年米国納税者救済法”が署名され、病院、画像形成センター、がん治療センターを含むいくつかの医療サービス提供者に支払う医療保険をさらに減少させ、医療サービス提供者への多額の支払いを政府が取り戻す訴訟時効を3年から5年に延長した。
最近、政府は製薬会社がその上場製品の価格設定の方式をより厳格に審査し、いくつかの国会調査と提案された連邦立法、および州政府の努力を招き、これらの努力は製品定価の透明性の向上、連邦医療保険制度下の処方薬のコストの低減、定価とメーカー患者計画との関係の審査、政府計画の薬品の精算方法の改革を目指している。これらの措置や、前トランプ政権による他の措置が成功する可能性はまだ定かではなく、特にバイデン新政府を考慮している。州レベルでは、立法機関は、価格または患者の精算制限、割引、特定の製品参入の制限、マーケティングコスト開示および透明性措置を含む、医薬品および生物製品の価格設定を制御するための法規を立法および実施することが増えており、場合によっては、他の国からの輸入および大量購入を奨励することを目的としている。
これらの新しい法律は、私たちが承認された任意の製品のカバー範囲と価格を追加の下振れ圧力に直面させ、私たちの業務を深刻に損なう可能性があると予想しています。医療保険や他の政府が計画している精算のどの減少も、個人支払者の支払いのような減少を招く可能性がある。コスト抑制措置や他の医療改革を実施することは、私たちの収入の創出、利益の実現、または私たちの製品を商業化することを阻止するかもしれません(承認されれば)。さらに、さらなる立法や規制がある可能性があり、私たちの業務、財務状況、運営結果を損なう可能性があります。例えば、政府は新冠肺炎の流行に対応するためにより多くの行動をとる可能性がある。
保証と精算を請け負う
私たちの製品と私たちが規制承認を受ける可能性のある任意の候補製品のカバー範囲と精算状態には大きな不確実性があります。私たちのすべての製品と候補製品の販売は、承認されれば、ある程度依存します これらの製品は第三者支払者でカバーされ,連邦医療保険や医療補助などの政府医療計画,商業健康保険会社や管理医療組織などの個人支払者が含まれる。第三者支払人は彼らがどの薬を保証するか、そして彼らが保険薬に提供する精算金額を決定する。米国では支払者間に保険や補償決定のための統一的な制度はない。また、支払者が製品に保険を提供するか否かを判定する過程は、 価格や販売率を設定する過程とは別に、保険が承認されると、支払人は製品に費用を支払う。第三者支払者は、承認されたリストまたは処方表上の特定の製品に保証範囲を制限することができ、FDAによって承認された特定の適応のすべての製品を含まない可能性がある。
私たちの製品の保証範囲と精算を確保するためには、その製品の医療の必要性と費用効果を証明し、FDAや他の同様の規制の承認を得るために必要な高価な研究を行うために高価な薬物経済学的研究が必要かもしれない。私たちが薬物経済学の研究を行っても、私たちの製品と候補製品は支払人に医学的に必要あるいは費用効果が高いと思われないかもしれない。また、支払者が製品に保険を提供することを決定することは、十分な返済率を承認することを意味するものではない。
また,政府や民間保険会社がより低いレートを実施し,サービスプロバイダと契約料率を下げることで医療コストを抑制しようとしていることに伴い,米国の医療業界はコストを抑制する傾向を経験している。したがって、私たちは私たちの製品を使用する手続きが費用効果のあるレベルで精算されるかどうかを確認することができない。第三者支払者が、これらのコストをプログラムの総コストに含めるために、我々の製品のコストが合理的であると思うかどうかも判断できない。第三者支払者が使用する方法は、実行されたプログラムタイプに応じて金額を設定するものであり、例えば、政府計画や多くの個人管理医療システムが使用するプログラムである。保険を提供しても、承認された精算金額は、利益を達成するのに十分な価格を確立したり維持したりするのに十分ではないかもしれません。また、将来的に第三者決済者が使用する精算方法がどのように変化するかは予測できない。
“平価医療法案”に関連する他の立法変化、規制変化、司法挑戦は依然として可能であり、上記の副題“米国医療改革”で議論されているように。また,連邦と州の2級の立法者,規制機関,第三者支払者は医療コスト抑制の提案を継続する可能性がある。したがって、我々の製品や規制の承認を受けた任意の候補製品が有利な保証·精算状態を獲得しても、将来的にはあまり有利ではない保証政策や精算料率が実施される可能性がある。
医療詐欺と法の乱用
FDAによる医薬品マーケティングの制限に加えて、私たちの業務は連邦政府と私たちが業務を展開している州の医療詐欺と規制乱用と法執行を受けています。これらの法律は以下を含むが、これらに限定されない
•他の事項に加えて、連邦反バックル法規は、購入、レンタル、注文、手配または推薦購入、レンタルまたは注文として、Medicare、Medicaid、または他の連邦によって援助された医療計画に従って全部または部分的に精算することができる任意の医療項目またはサービスの見返りとして、故意に直接または間接的に現金または実物の形態で提供、支払い、請求または報酬を受けることを禁止する。“報酬”という言葉は価値のあるものを含むと広く解釈されている。その他の事項以外に、“平価医療法”は連邦の“反リベート法規”の意図要求を改正し、個人或いは実体がこの法規或いは違反の具体的な意図を実際に理解する必要がなくなり、違反を実施することができる。
•虚偽申告法を含む連邦民事および刑事虚偽申告法は、個人代表政府が民事通報者または準訴訟によって強制的に執行することができ、民事罰金法、個人または実体が虚偽または詐欺的な政府資金支払い申請の提出または提出を意図的に禁止するか、または政府に資金を支払う義務の作成、使用、または作成または使用に重大な意味を有する虚偽記録または報告書を作成、使用するか、または米国連邦政府に資金を支払う義務を故意に隠蔽または故意に不正に回避、減少または隠蔽することができる。
•HIPAAは、個人第三者支払者を含む任意の医療福祉計画を故意かつ故意に実行または実行しようとする計画を禁止する。HIPAAはまた、重大な事実を明らかにし、故意に偽造、隠蔽または隠蔽し、または任意の重大な虚偽、架空または詐欺的な陳述または陳述を行うこと、または医療福祉、プロジェクトまたはサービスの提供または支払いに関連する任意の重大な虚偽、架空または詐欺的陳述または記録項を含むことを知っているか、または任意の虚偽の書面または文書を作成または使用することを禁止する。
•HITECH及びその実施条例の改正を経たHIPAAは、個人が健康情報を識別できるプライバシー、安全と伝送を保護する上で、“保険エンティティ”は、特定の医療保健提供者、健康計画と医療情報交換所、およびそれらのそれぞれの“業務パートナー”及びカバー実体又はそれを代表する個人識別可能な健康情報を作成、受信、維持又は送信するパケット業者を含み、個人が健康情報を識別できるプライバシー、安全及び伝送を保護する義務があると規定している。HITECHはまた,HIPAAによって適用可能な民事と刑事罰を増加させ,州総検事長に新たな権力を与え,連邦裁判所に民事訴訟を提起し,損害賠償やHIPAAの強制執行を要求することができる.
•多くの州にも連邦反リベートや虚偽申告法のような法規や法規があり,連邦医療補助や他の州計画に基づいて精算するプロジェクトやサービス,あるいはいくつかの州では支払者にかかわらず適用される。いくつかの州は今製薬会社にマーケティングや販売促進に関する費用の報告を要求しています 医薬製品 これらの州の個人医療提供者に支払われたプレゼントと支払いを報告する。
•その中のいくつかの州はまた、特定の医療提供者にプレゼント、食事、または他の物品を提供することを含む、いくつかのマーケティング関連活動を禁止している。他の州の法律は薬品販売代表の登録または免許の保有を要求し、またいくつかの州は製薬会社が患者に提供できる共同支払い援助に制限を加えることができる。またいくつかの州では 製薬会社にコンプライアンス計画やマーケティングコードを実施することを要求する。
•“医師支払い陽光法案”は、連邦医療保険、医療補助または児童健康保険計画(いくつかの例外)に基づいて支払うことができる医薬品、設備、バイオ製品および医療用品の製造業者に、直接または間接的な支払いおよび医師(医師、歯科医師、検眼師、足科医および脊椎マッサージ師を含むと定義される)、他の保健専門家(例えば、医師アシスタントおよび看護師従業員)および教育病院および医師およびその直系親族が会社で所有する所有権および投資権益に関する情報をCMSに報告することを要求する開放支払計画の形態で実施される。
このような法律法規を遵守するためには多くの資源が必要だ。これらの法律の範囲は広いため、既存の法定例外状況や安全港の規制範囲は狭く、私たちのいくつかの商業活動は法的挑戦と法執行行動の影響を受ける可能性がある。政府当局が、私たちの業務行為が現在または将来、詐欺および乱用または他の医療保健法律および法規を適用する現行または将来の法規、法規または判例法に適合していないと認定した場合、彼らはこれらの法律に基づいて制裁を実施することができ、これらの制裁は重大である可能性があり、民事罰金、損害賠償、実体または個人を政府医療計画から除外すること、刑事罰金および監禁、これらの法律違反の疑いを解決するために会社の誠実な合意または他の和解協定の制約を受けた場合、追加の報告要求がある可能性がある。私たちがこれらの法律に違反していると判断されなくても、政府のこれらの問題の調査には通常、大量の資源がかかり、否定的な宣伝が必要だ。
“反海外腐敗法”
また、1997年の米国“反海外腐敗法”は、会社およびその中間者が業務を取得または保留したり、公的な身分で働いている人に影響を与えたりする活動を禁止している。他の国の任意の役人、政府職員、政党または政治候補者に支払いを提案し、任意の価値のあるものを支払うことを提案して、業務を取得または保留しようとしているか、またはそのような身分で働いている人に他の方法で影響を与えることを試みている人は、不法である。
NKGenのチーム
2023年12月31日までに、約63人のフルタイム従業員がいます。私たちのほとんどの従業員はカリフォルニア州にいます。
私たちの職員たちは労働組合代表者もなく、集団交渉協定のカバー範囲もない。私たちは何の実質的な停止も経験しておらず、私たちは私たちと従業員との関係が良好で健康で透明だと思う。我々は積極的に管理者と接触し,その作業環境をどのように改善するかに関するフィードバックや意見を収集した。
我々の人的資本目標には、適用された場合に、既存の従業員、コンサルタント、コンサルタントを識別、募集、保留、インセンティブ、統合することが含まれる。私たちの株式と現金インセンティブ計画の主な目的は、株と現金に基づく報酬報酬を付与することで、従業員を引きつけ、維持し、奨励し、これらの人たちを激励して私たちの目標を達成することで、株主価値と私たちの成功を増加させることです。
利用可能な情報
当社は“取引法”の報告と情報要求に制約されているため,年度,四半期と現在の報告,依頼書と情報声明,その他の情報を米国証券取引委員会に提出する義務がある。同社は、米国証券取引委員会に電子的に届出またはこれらの届出ファイルを提供した後、合理的で実行可能な場合には、そのウェブサイト(http://nkgenBiotech.com/Investors/Finance-filings/)上でこれらの届出ファイルをできるだけ早く無料で提供する。会社サイト上の情報は、本2023年年度報告の一部を構成していません。さらに、米国証券取引委員会には、年間、四半期、および現在の8-Kフォーム報告、依頼書および情報声明、および会社が米国証券取引委員会に電子的に提出または提供する他の情報を含むウェブサイトが設けられている。
第1 A項。リスク要因
リスク要因をまとめる
私たちの証券への投資は大きな危険と関連がある。以下は、当社および当社の業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性のある、厳選されたリスクおよび不確実性の概要です。このForm 10-K年次報告書のタイトルを含むすべての情報をよく考慮しなければなりません“リスク要因もっと詳細を知っています。以下の要約では,このようなリスクと不確定要因をより網羅的に議論することにより,その全文を限定したこれらのリスクには以下のようなリスクがある
私たちのビジネスや産業に関するリスクは
•私たちは現在、私たちの運営と費用と対応金にサービスするのに十分な資金がありません。追加の資本が必要です。私たちの独立公認会計士と経営陣は、追加資本なしで経営を続ける能力に大きな疑いを示しています。
•私たちの業務は私たちのNK細胞治療プラットフォームの成功に依存している。
•NK細胞を利用することは腫瘍と神経変性疾患を治療する新しい方法であり、私たちは重大な挑戦を克服して、私たちの候補製品を開発、商業化し、製造しなければならない。
•NK細胞の機能と産生のいくつかの方面は現在まだ不明或いはあまり知られておらず、更なる臨床前試験と臨床試験を通じてしか知ることができないかもしれない。私たちの手続きに対するどんな潜在的な変更も遅延と追加費用をもたらす可能性がある。
•訪問計画を使用して私たちの候補製品を受け入れたいかなる患者に同情する結果は、制御された良好な臨床試験における候補製品の表現を代表するものとみなされてはならず、規制部門の承認を得るために安全性または有効性を決定するために使用されてはならない。
•臨床開発は長くて高価な過程に関連し、結果は不確定であり、各種の著者らがコントロールできない原因により、著者らは重大な遅延に遭遇する可能性がある。
•私たちの業務は私たちの候補製品の臨床成功に高度に依存して、特にSNK 01とSNK 02の臨床成功に依存して、私たちはSNK 01、SNK 02及び/或いは私たちの他の候補製品の開発に成功できないかもしれないし、監督部門の許可を得られないかもしれない。
•私たちが製品候補の規制承認を得ても、私たちの製品は後続の規制義務と審査の制約を受け続けるだろう。
•私たちはこれまで候補製品を商業化したことがありません。もし承認されれば、私たちはどんな製品の商業化に成功するために必要な専門知識、人員、資源が不足しているかもしれません。もし私たちの候補製品が承認されたら、効果的なマーケティングと販売能力を確立できないかもしれないし、第三者や関係者と合意して私たちの製品をマーケティングして販売することができないかもしれないので、製品収入を生み出すことができないかもしれません。
私たちの財務状況に関連するリスク
•私たちの経営の歴史は限られており、設立以来ずっと大きな損失を被っており、予見可能な未来には引き続き重大な損失を被ることが予想される。
•私たちは製品販売から収入を得たことがなく、永遠に達成されたり利益を維持したりしないかもしれない。
•東西岸融資協定と株式および商業融資協定(以下以下参照)は、各融資者に私たちのすべての資産に対する保証権益を提供し、金融契約および他の私たちの行動に対する制限を含み、私たちの運営の柔軟性を制限したり、他の方法で私たちの運営結果に悪影響を及ぼす可能性がある。
•私たちの2023年のNKMAXローン協定、東西岸ローン協定と株式と商業ローン協定の条項は私たちにいくつかの支払い義務を履行することを要求して、私たちを違約させる可能性があります。
政府の規制に関するリスク
•FDAと同様の外国規制機関の規制承認過程は長く、時間がかかり、本質的には予測不可能であり、必要な臨床試験を完了しても、私たちのどの候補製品がいつ、あるいは規制承認を受けるかどうかを予測することはできず、どのような規制承認も私たちが求めているよりも狭い適応を得るためである可能性がある。
•私たちは今も未来もアメリカと特定の外国の輸出入規制、制裁、禁輸、反腐敗法律、反マネーロンダリング法律法規の制約を受けるだろう。このような法律基準を遵守することは国内と国際市場での私たちの競争能力を弱めるかもしれない。私たちは違反によって刑事および/または民事責任と他の深刻な結果に直面する可能性があり、これは私たちの業務を損なうだろう。
製造業に関するリスク
•私たちの製造過程は斬新で複雑で、私たちは生産中に困難、あるいは内部製造上の困難に直面する可能性があり、承認されれば、これは臨床試験または患者に十分な候補製品を提供する能力を延期または阻止することになる。
•私たちの製造施設の調整を遅延させ、規制部門の承認を得ることは、私たちの開発計画を延期し、候補製品の開発と収入を創出する能力を制限するかもしれません。
私たちの知的財産権に関するリスクは
•NKMAXとのライセンスプロトコルが終了すれば、私たちはNK細胞技術プラットフォームの重要なコンポーネントをサポートする権利を失うかもしれません。
•私たちは第三者から追加の知的財産権許可を得る必要があるかもしれませんが、そのような許可は得られないかもしれませんし、商業的に合理的な条項では得られないかもしれません。
•我々は、現在および将来の候補製品および技術の開発および商業化の権利について、他社が私たちに付与するライセンスの条項および条件をある程度制限されている。
私たちの証券所有権に関わるリスクは
•私たちの株価は変動する可能性があり、その経営業績にかかわらず下落する可能性がある。
•私たちは将来ナスダックでの私たちの証券の上場を維持できないかもしれない。
•既存の株主は将来株式を売却することで私たちの株価を下落させるかもしれない。
•当該等持分証及び管路株式承認証は全く行使しない可能性があり、或いは現金なしに行使することができ、吾等も当該等持分証又は管路承認持分証を行使することによりいかなる現金収益を受け取ることもできない。
•私たちは、私たちと長期購入契約を締結した投資家に現金を支払うか、普通株を発行することを要求されるかもしれません。これは、私たちが利用できる現金の数を減少させるか、またはあなたの私たちの所有権をさらに希釈するかもしれません。
•私たちはあなたの承認なしに普通株または他の株式証券を増発するかもしれません。これはあなたの所有権権益を希釈し、私たちの普通株の市場価格を下げる可能性があります
リスク要因
私たちの証券に投資することは高度な危険と関連がある。我々の証券への投資を決定する前に、上記の“前向き陳述特別説明”、本10-K年度報告書の末尾の財務諸表および関連説明、および“経営陣の財務状況および経営結果の議論および分析”の節で議論されたリスクおよび不確定要因を含む、以下に説明するリスクおよび不確実性、ならびに本10-K年度報告に含まれるすべての他の情報をよく考慮しなければならない。以下のいずれかの事件や事態が発生した場合、私たちの業務、見通し、経営業績と財務状況は重大な影響を受ける可能性があり、私たちの普通株の取引価格は下落する可能性があり、あなたの投資はすべてまたは部分的に損失する可能性があります。以下に説明するリスクと不確実性は私たちが直面している唯一の危険と不確実性ではない。私たちは今知らないか、あるいは私たちが現在どうでもいいと思っている他のリスクと不確実性はまた私たちの業務に悪影響を及ぼすかもしれない。
私たちのビジネスや産業に関するリスクは
私たちは現在、私たちの運営と費用と対応金にサービスするのに十分な資金がありません。追加の資本が必要です。私たちの独立公認会計士と経営陣は、追加資本なしで経営を続ける能力に大きな疑いを示しています。
私たちは現在、私たちの運営と私たちの支出、その他の流動資金需要を満たすための十分な資金がありません。すぐに資本を増加させる必要があり、私たちの独立公認会計士と経営陣は、私たちが継続的に経営している企業として経営を続ける能力に大きな疑いを示しています。
2023年12月31日と2022年12月31日まで、私たちの現金と現金等価物はそれぞれ約10万ドルと10万ドル未満で、運営資本の赤字はそれぞれ約3750万ドルと1440万ドルだった。私たちは業務合併に関連した多くの取引費用を発生させた。約1,430万ドルの取引費用と繰延引受業者費用は業務統合が完了した後に決済される。しかし、私たちは取引が終わった後に計算されなければならない多くの取引費用を持ち続けている。2023年12月31日現在、業務合併と継続業務運営からの取引費用を含む約1340万ドルの売掛金と売掛金が発生しました。業務合併後、私たちはまだ大量の未払い取引支出及びその他の計上及び未払い運営支出があります。また、上場企業に移行し、上場企業として運営する際に追加料金が発生することが予想されます。
2023年12月31日現在、私たちの未返済債務は約199万ドルで、その中には、私たちと東西銀行の循環信用限度額、関連先との融資、および高度変換可能な手形が含まれています。また、私たちと東西銀行の循環信用限度額は私たちのすべての資産によって保証され、2023年12月31日までに銀行で少なくとも1,500万ドルの現金残高を維持することを要求し、その後、循環信用限度額の下に未返済残高がある限り、最低現金残高を維持しなければならない。2023年12月31日から、東西銀行は契約に基づいてこの現金残高要求を免除しており、2024年4月5日に発効した改正案によると、東西銀行はこの最低現金残高要求を契約に置き換え、東西銀行を会社唯一の現金預金商業銀行とし、満期日を2024年9月18日に延長することに同意した。私たちは、何らかの支払いの遅延を求め続け、より多くの融資が得られるまで現金を保存するために、支出を減らす可能性のある他の方法を探るつもりだ。このような努力は金額的にも時間的にも成功的ではないかもしれないし、私たちの持続的な資本需要を満たすのに十分ではないかもしれない。私たちは追加資金調達を積極的に求め続けている。追加流動資金源が不足している場合、私たちは運営と流動資金需要を満たすのに十分な既存の現金資源を持っていない。しかし、私たちは、私たちがそのような追加流動資金をタイムリーに獲得したり、追加資金の調達に成功したり、必要な資金が許容可能な条項で提供されるか、または既存の株主に大きな希薄な影響を与えないという保証はありません。また、これらの潜在的な流動資金源が、満期債務を履行し、継続的に経営を継続する企業として、私たちの運営を支援するのに十分なキャッシュフローを提供してくれるかどうかを決定することはできません。もし私たちが追加的な流動性源を得ることができないと判断した場合、あるいは満期時に私たちの義務を履行することを許可しない場合、私たちは再構成計画や清算を実施するために、米国破産法に基づいて自発的に救済を申請する必要があるかもしれない。また、私たちの持続経営企業としての持続的な経営能力への大きな疑いは、投資家や他の融資源が商業的に合理的な条項で資金を提供したくない可能性があります(あれば)。十分な資金がなければ、業務活動の一部または全部を延期、縮小、または廃止しなければなりません。これは、私たちの業務の将来性と私たちの運営を継続する能力に悪影響を与えます。
さらに、私たちは私たちの資産を清算しなければならない可能性があり、これらの資産の私たちの財務諸表上の価値を得ることができ、および/または米国破産法第7章または第11章に基づいて保護を求めることができる。これは私たちの運営を停止させ、私たちの普通株へのあなたの投資の全部または一部の損失を招くかもしれない。これは私たちの運営を停止させ、私たちの普通株へのあなたの投資を完全に損失させるかもしれない
独立公認会計士事務所が2023年12月31日に提出した財務諸表の報告書には、経営を続ける企業として経営を継続する能力に大きな疑いを示しているとの解釈がある。私たちの経営陣はまだ独立して確定しており、私たちは経営を続ける企業として経営を続ける能力に大きな疑問を持っています。私たちはすでに重大な運営赤字が発生しており、予測可能な未来に引き続き損失を被ることが予想されています。私たちが財務諸表を作成する前提は、このような不確実性に起因する可能性のあるいかなる調整も含まれていない持続的な経営企業として継続することである。私たちの財務状況に不確実性があることを考慮して、合理的な期間にわたって継続的に経営し続けることができる企業があるかどうかには大きな疑問がある。
業務合併で得られた金及び当社は本文の“管理層の財務状況及び経営業績に対する討論及び分析”で討論した短期融資手配は、長期購入プロトコル、株式証引受プロトコル及び証券購入プロトコルを含み、吾などの計算及び未払い支出及び経営業務を提供するために必要な現金及び流動資金を支払うのに不十分であるため、吾らは引き続き追加融資を求め、債務及び株式融資、及びその他の融資源、例えば長期購入手配、優先的に本チケット及びその他の資金源を転換することができ、関連側との融資を含む。もし私たちが将来株式や債務を売却することで追加資本を調達すれば、私たちの株主の所有権権益は希釈されるだろう。これらの証券の条項は、清算または他の特典を含むことができ、私たちの既存の普通株主の権利に悪影響を及ぼす可能性がある。もし私たちが協力協定、マーケティング協定、または許可手配を通じてより多くの資金を調達すれば、私たちは私たちの技術、未来の収入流、または候補製品に対する貴重な権利を放棄しなければならないかもしれません。条件は私たちに不利かもしれません。
もし私たちが将来の業務活動を支援するための追加資金を求めている場合、私たちが継続的に経営している企業としての能力にはまだ大きな疑問があり、投資家や他の融資源は商業的に合理的な条項や追加資金を提供したくないかもしれない。また,我々が契約義務を履行する能力が懸念されるため,継続的に経営する企業として経営を継続できない可能性があるとの見方が,潜在的な戦略的機会や我々の業務を経営する能力を求めることを阻害する可能性があると考えられる。いかなる追加的な拠出努力も、私たちの経営陣の日常活動に対する関心を移すかもしれません。これは、私たちの候補製品を開発し、商業化する能力に悪影響を及ぼすかもしれません。また、必要な資金を調達する能力は、インフレ時期や経済減速、ロシアのウクライナ侵攻やイスラエル列国のハマス戦争に関する影響を含む地政学的事件による市場影響など、マクロ経済状況の影響を受ける可能性がある。もし私たちが受け入れ可能な条件下で十分な資金を得て経営を続けることができない場合、私たちは私たちの1つまたは複数の研究または開発計画または任意の候補製品の商業化を大幅に削減、延期、または停止するか、または他の方法で私たちの運営を減少または停止することを要求されるかもしれない。もし私たちが最終的に経営を続けることができなければ、私たちは破産法の保護を求めたり、私たちの資産を清算したりしなければならず、これらの資産の私たちの監査された財務諸表よりも低い価値を得ることができ、私たちの株主は彼らの投資の全部または一部を失う可能性が高い。
私たちの業務は私たちのNK細胞治療プラットフォームの成功に依存している。
私たちの成功は私たちのNK細胞技術プラットフォームを利用して候補製品を生成する能力に依存し、これらの候補製品に対する規制許可を得て、最終的にこれらの候補製品を商業化する。我々の最初の候補NK細胞製品SNK 01を評価するI期とI/II期臨床試験が行われている。私たちの技術プラットフォームから開発されたすべての候補製品は、大量の追加の臨床および非臨床開発、審査、米国食品医薬品局(FDA)の承認を必要とするだろう林業局)または1つまたは複数の法域の他の規制当局は、大量の投資、十分な商業製造能力、および大量のマーケティング努力を得て、それを商業化することに成功する。もし私たちの任意の候補製品が安全または効果の問題、開発遅延または規制の問題、または他の問題に遭遇した場合、これらの問題は、私たちのすべての候補製品が同じコアNK細胞製造技術に基づいているので、私たちの他の候補製品の開発計画に影響を与える可能性がある。
NK細胞を利用することは腫瘍と神経変性疾患を治療する新しい方法であり、私たちは重大な挑戦を克服して、私たちの候補製品を開発、商業化し、製造しなければならない。
FDAはこれまで,いくつかの細胞ベース療法のみを商業化することを承認しており,NKベースの細胞療法の商業用途への認可はなされていない。FDAまたは他の適用規制機関によって課せられたプロセスおよび要求は、上場許可の承認を得るための当社の候補製品の遅延および追加コストをもたらす可能性があります。細胞ベースの療法が比較的新しいので、規制機関は、私たちのNK細胞プラットフォーム候補製品のような候補製品を評価する前例が不足している可能性があるので、私たちのNK細胞プラットフォーム候補製品は新しいと信じています。細胞ベースの治療領域の更なる発展に伴い、規制機関が課す過程と要求は、私たちに不利な影響を与える方法で変化する可能性がある。私たちの候補製品の新規性もまた、IND申請を提出する際にFDAが私たちのIND申請を審査するのに必要な時間を含み、私たちの開発コストを増加させ、NK細胞治療プラットフォームの候補製品の承認と商業化を延期または阻止することを含む規制審査過程を延長することも可能である。
また、腫瘍や神経変性疾患を治療する細胞に基づく新しい治療法の推進は、これらに限定されないが、大きな挑戦をもたらしている
•私たちが行っている臨床試験で十分な数の患者を募集し維持しています
•自然破壊細胞を適切に準備し管理するのに十分な数の医療従事者を訓練します
•著者らの臨床試験で十分な数量の医療と臨床実験室人員を訓練し、臨床サンプルを正確に収集と処理し、彼らが薬物動態学と薬効学を十分に理解し、最適な投与方案を設計できるようにした
•教育医療関係者は著者らのNK細胞の潜在的な副作用概況を理解し、そして臨床計画の進展に伴い、観察された治療副作用を理解した
•私たちのNK細胞を製造するための信頼性、安全かつ効率的な方法を開発する
•NK細胞の製造、冷凍、貯蔵、輸送物流を経済的に効率的に大規模に処理した
•臨床や商業生産に適した原料を探し
•販売およびマーケティング能力を確立し、任意の承認された製品の商業化を支援するために、製造プロセスおよび流通ネットワークを開発する。
私たちはNK細胞を利用して私たちの候補製品を開発、商業化、製造できるように、これらの挑戦を克服できなければならない。
NK細胞の機能と産生のいくつかの方面は現在まだ不明或いはあまり知られておらず、更なる臨床前試験と臨床試験を通じてしか知ることができないかもしれない。私たちの手続きに対するどんな潜在的な変更も遅延と追加費用をもたらす可能性がある。
著者らの現在のNK細胞治療の臨床経験は主に健康ドナーと患者からの細胞に基づく。現在の業界制限は細胞生産を商業レベルまで拡大することが困難であり、ベースライン細胞毒性が低く、冷凍保存後の細胞毒性喪失、重複投与が必要な持続性が低いこと、及び固形腫瘍微小環境透過性が悪いことを含む。われわれはSNK 01とSNK 02のI期臨床試験を行っており,SNK 01の臨床開発を進めており,米国でADのI/IIa期試験を開始している。早期の臨床結果や同情使用結果は将来の臨床試験結果を反映できない可能性があり,試験設計やテストプログラムの他の側面を再評価する必要があるかもしれない。臨床で使用されているNK細胞製造の歴史も限られており,NK細胞生物学的理解も拡大している。もし私たちが現在の製造技術が不十分であることを発見すれば、あるいは材料改善の機会を決定すべきであり、プロセス改善に適応するには大量の時間と費用が必要かもしれない。技術改善にも新しい臨床前研究と臨床方案が必要であり、製品の比較可能性を確立する可能性がある。もし私たちが技術が変わった後に比較性を示すことができなければ、私たちの製造技術と/あるいは臨床試験を更に変える必要がある。例えば,十分な比較可能性を示さない場合には,1つ以上の臨床試験を繰り返す必要があるかもしれない。
上記の過程は、私たちの候補製品のために臨床方案と臨床試験を再設計することを要求し、完成するために大量の追加の時間と資源を必要とするかもしれないし、大量の追加の臨床試験参加者と細胞ドナーの参加を要求し、いずれも候補製品の臨床開発と最終的な商業化を延期する。
訪問計画を使用して私たちの候補製品を受け入れたいかなる患者に同情する結果は、制御された良好な臨床試験における候補製品の表現を代表するものとみなされてはならず、規制部門の承認を得るために安全性または有効性を決定するために使用されてはならない。
私たちの臨床試験登録基準を満たしていない患者に私たちの研究薬を使用することに対する医師の同情的な使用要請を受けた。一般に,これらの重篤な疾患に対して,患者に同情して使用することが求められる医師には他に治療選択はない。個人的な状況に応じて個々の共感的使用要求を評価し,場合によっては,我々の研究製品が病態に影響を及ぼす可能性があると考える理由があれば,現在承認されている治療が終了した後にのみ,我々が支援する臨床試験以外の研究製品候補使用を承認する。
患者個人のTシャツ使用結果は、彼らの経験、証明、テスト結果、および関連画像を含むが、規制申請の提出をサポートするために使用されない可能性があり、候補製品の承認を支持しないかもしれないし、進行中または将来良好に制御されている臨床試験の結果とみなされてはならないかもしれない。私たちがどんな候補製品のために規制承認を求める前に、私たちが承認を求めている適応に対して安全かつ有効であることを、制御された良好な臨床試験で証明しなければならない。私たちの同情使用計画の結果は、安全性や有効性や規制承認を決定するために使用されないかもしれない。
臨床開発は長くて高価な過程に関連し、結果は不確定であり、各種の著者らがコントロールできない原因により、著者らは重大な遅延に遭遇する可能性がある。
臨床試験は高価で時間がかかり、しかも大きな不確定性が存在する。科学的実行可能性、安全性、有効性、絶えず変化する医療標準とその他の変数のため、著者らの1つ或いは複数の臨床試験は臨床試験過程中のいつでも失敗する可能性がある。私たちの1つ以上の臨床試験のどんな失敗も、私たちの候補製品を商業化するために、FDAおよび他の必要な規制承認を得ることを阻止する可能性がある。候補製品の臨床前試験、同情使用または早期臨床試験の結果は、候補製品の後期臨床試験で得られる結果を予測できない可能性がある。FDAまたは他の適用可能な規制機関は、そのような試験に参加する対象が許容できない健康リスクまたは副作用、または他の不利な初期経験または発見を含むが、これらに限定されない、様々な理由で候補製品の臨床試験を随時一時停止または終了することができる。FDAまたは他の適用可能な規制機関は、負の結果または不確定な結果または他の理由で、追加の臨床前研究または臨床試験を要求する可能性があり、私たちが依存する第三者メーカーの原材料、製造プロセス、または施設内の欠陥を承認または発見することができず、臨床開発中に彼らの承認政策または法規または彼らの前の私たちの指導を変更し、私たちの臨床データが承認を得るのに十分ではないようにする。さらに、臨床試験から収集されたデータは、BLAまたは他の適用可能な規制文書の提出をサポートするのに十分ではない可能性がある。私たちが計画したり起動したりする可能性のある任意の臨床試験が計画通りに行われるか、あるいは予定通りに完成することは保証できません。もしあれば。
我々の臨床開発の成功を妨げる可能性があり、適時に完成し、または積極的な結果を得ることができるイベントは、これらに限定されない
•臨床試験を開始するために規制部門の承認を遅延させた
•期待された臨床試験場所や契約研究機関と受け入れ可能な条項について合意することを遅延させる(“CRO)は、その条項が広範な交渉を行うことができ、異なる裁判場所とCROとの間に大きな差がある可能性がある
•十分な患者を迅速に募集し維持することはできません
•十分な数の臨床試験場所を得るか、必要な機関審査委員会を得るのに遅延があります(“IRB)および/または他の特定の場所の審査委員会(S)、各臨床試験場所における承認(S);
•新たに出現したデータに基づいて、一時的または永続的な臨床保留は、私たちまたはFDAまたは他の規制機関によって実施される
•臨床サイトが試験案から外れているか、または試験から離脱した者
•患者の退出或いは患者は病状が進展する前に方案を受けた後に治療を受けることを選択したため、著者らは長期フォローアップデータを得ることができなかった
•臨床試験を行う機関のIRBまたはデータ安全監視委員会(例えば、適用される)による臨床試験の一時停止または終了;
•臨床試験に適用される製造技術の十分な開発、表現或いは制御に遅延が発生したり、著者らの任意の契約メーカーの生産遅延、停止或いは挫折が発生したりする
•候補製品、特に特定の患者のためにカスタマイズされた候補製品が要求された仕様に適合しない場合、追加の法規、現場、および臨床試験参加者の承認が必要となるため、遅延が生じる
•遅延と規制機関は私たちの臨床試験の設計や実施について合意した
•規制要件やガイドラインの変化は、私たちが新しい臨床案を修正したり提出したりする必要があるかもしれないし、そのような要求は私たちが予想しているのとは異なるかもしれない
•臨床発展計画に基づく看護または治療基準の変化は、新しいまたは追加の試験を必要とする可能性がある
•比較器または併用薬剤の利用可能性の潜在的制限を含む、候補製品の数または品質が不足しているか、または私たちの候補製品の臨床前研究または臨床試験を行うために必要な他の材料;
•私たちの候補製品の臨床試験は否定的または不確定な結果をもたらし、これは私たちが追加の臨床試験を要求したり、製品開発計画を放棄したりすることを決定または監督機関に要求する可能性がある
•医療サービスや文化的慣習の違い、あるいは外国の規制制度に関連する追加行政負担のため、外国で登録された患者は臨床案を遵守できなかった
•もし私たちがいくつかの規制要求を満たしていなければ、規制機関は私たちが外国の管轄区域で完成した臨床試験のデータを受け入れることができない
•私たち自身または任意の第三者製造業者、請負業者、またはサプライヤーは、法規要件を遵守し、十分な品質管理を維持することができなかったか、または私たちの候補製品の臨床前研究または臨床試験を行うために十分な製品供給を提供することができなかった
•私たちまたはNKMAXのパートナー(例えば、メルクKGaA)は、義務を履行したり、関係を終了したりすることができなかった
•私たちのパートナーは、不足、生産停止、協力中止、または他のいかなる理由でも、併用薬を提供できなかった。
私たちの業務は私たちの候補製品の臨床成功に高度に依存して、特にSNK 01とSNK 02の臨床成功に依存して、私たちはSNK 01、SNK 02及び/或いは私たちの他の候補製品の開発に成功できないかもしれないし、監督部門の許可を得られないかもしれない。
SNK 01、SNK 02(異体SNK 02およびHER 2-CAR SNK 02を含む)または私たちの未来の任意の候補製品が安全で有効であるか、または商業化が許可されることを保証することはできず、適時または根本的に保証されない。臨床試験、規制承認、現在のGMPについて経験のある従業員がいるにもかかわらず、SNK 01を用いた非小細胞肺癌治療の臨床試験を完了したが、任意の候補製品のBLAをFDAに提出していないか、または外国当局よりも同様の規制承認文書を提出することができ、SNK 01およびSNK 02または私たちの任意の他の候補製品が臨床試験で成功または規制承認を得るかどうかは決定できない。FDAおよび他の同様のグローバル規制機関は、様々な理由で候補製品の承認を延期、制限、または拒否することができる。
このような理由のさらなる詳細については、“を参照されたい臨床開発は長くて高価な過程に関連し、結果は不確定であり、各種の著者らがコントロールできない原因により、著者らは深刻な遅延に遭遇する可能性がある“適用可能な規制承認を遅延したり得ることができないことは、SNK 01、SNK 02、または任意の他の候補製品を商業化に成功させる能力を遅延または損害し、私たちの業務、財務状況、運営結果、および成長の見通しに大きな悪影響を及ぼす可能性があります。
SNK 01は早期臨床試験段階であり,薬物開発固有のリスクの影響を受ける。もしSNK 01あるいはSNK 02が行っている試験が安全信号、治療効果の問題、製造問題、登録問題、開発遅延、監督管理問題或いはその他の問題に遭遇した場合、私たちのSNK 01或いはSNK 02の開発計画は深刻に損傷する可能性があり、これは私たちの業務、財務状況、運営結果と成長の将来性に実質的な不利な影響を与える可能性がある。
また、SNK 01およびSNK 02は私たちの主要な候補製品であるため、私たちの他の候補製品は類似した技術に基づいているため、もし私たちのSNK 01またはSNK 02の臨床試験が上記のいずれかの問題に遭遇した場合、私たちが開発している他の候補製品の開発計画も深刻な影響を受ける可能性があり、これは私たちの業務、財務状況、運営結果、および成長見通しに大きな悪影響を及ぼす可能性がある。
我々はまた、FDAまたは米国以外の同様の規制機関の承認を得ていない1つまたは複数の他の神経変性疾患治療薬と組み合わせて、私たちの候補製品を評価することができる。FDAや米国以外の同様の規制機関がこれらの他の薬剤を承認しない場合、または私たちが開発した任意の候補製品に関連して評価する薬剤を選択した場合、安全性、有効性、製造、または供給の問題が発生した場合、私たちの候補製品の承認を得ることができないか、市場に出すことができないかもしれない。
私たちが製品候補の規制承認を得ても、私たちの製品は後続の規制義務と審査の制約を受け続けるだろう。
私たちは神経変性疾患を治療するために私たちの候補製品を開発するつもりだ。他の既存療法と組み合わせて使用するために開発された任意の候補製品が市販承認または商業化されていても、FDAまたは米国以外の同様の規制機関が、私たちの候補製品使用の併用療法の承認を取り消す可能性があるか、またはこれらの既存療法が安全性、有効性、製造または供給問題に生じる可能性があるリスクに直面するであろう。これは私たち自身の製品が市場から撤退されたり、商業的にあまり成功しないことをもたらすかもしれない。
もし私たちの候補製品が承認されれば、それらは薬物警戒、製造、ラベル、包装、貯蔵、広告、販売促進、サンプリング、記録保存、上場後研究(ある場合)を含む持続的な法規要求を遵守し、米国の連邦と州要求、および類似の規制機関の同等の要求を含む他の上場後情報を提出する。
メーカーおよびメーカーの工場は、品質管理および製造プロセスがGMP法規に適合することを確保することを含む、広範なFDAおよび同様の規制機関の要求を遵守しなければならない。したがって、私たちと私たちの契約製造業者は、GMPに適合しているかどうか、および任意のマーケティング許可申請で行われた約束を遵守するかどうかを評価するために、継続的な審査および検査を受けるであろう。したがって、私たちと私たちと協力している他の人たちは、製造、生産、品質管理を含むすべての規制コンプライアンス分野で時間、お金、エネルギーをかけ続けなければならない。
私たちまたは私たちの協力パートナーが私たちの候補製品のために得た任意の規制承認は、製品上場によって承認された使用条件または承認条件によって制限される可能性があり、または臨床試験を含むコストの高い追加のデータ生成要件を含む可能性がある。いくつかの不良反応や生産問題をFDAおよび類似の規制機関に報告し、候補製品の安全性と有効性を監視するように監視することが求められる。薬品の安全に関連するいかなる新しい立法も、製品開発や商業化の遅延を招き、あるいはコンプライアンスを確保するコストを増加させる可能性がある。
私たちは私たちの製品の広告と販売促進に関する要求を守らなければならない。処方薬に関する販売促進情報は様々な法律や法規によって制限されており,これらの制限は世界各地で異なり,製品が承認されたラベル上の情報と一致しなければならない。したがって、私たちは、例えば、承認されていない適応または用途のための、FDAによって承認されたラベルと一致しない方法で私たちの製品を宣伝しないかもしれない。
もし私たちの候補製品が承認された場合、私たちは新しい申請または補充申請を提出し、許可製品、治療適応、製品ラベル、および製造プロセスをいくつか変更するために事前に承認を得なければならない。これらの変化は、臨床データを含む可能性がある大量のデータパケットを提出する必要があるかもしれない。
規制当局が承認された製品に、意外な重大性または頻度の不良事象のような以前に未知の問題があることを発見した場合、または製品の製造施設に問題がある場合、または監督機関が製品の広告、販売促進、マーケティング、またはラベルに同意しない場合、規制機関は製品または私たちに制限を加える可能性がある。もし私たちが適用された規制要求を遵守できなければ、FDAなどの規制機関は他の措置を取るかもしれない
•警告状や無見出しの手紙を出す
•事件を米司法省に移管する(“アメリカ司法省)民事または刑事罰を適用する
•規制承認を一時停止または撤回する手続きを開始する;
•輸入警報を発表する
•私たちが行っている臨床研究を中断したりIND臨床研究を中断したり
•私たちが提出した保留申請(承認された申請の補充申請を含む)の承認を拒否する
•製品のリコールを開始することを要求しています
•事件を米司法省に提出し、製品の没収や没収、またはその運営に制限を加えた禁止令を得る
政府は法律や法規違反の疑いのあるいかなる調査にも対応するために多くの時間と資源を必要とする可能性があり、否定的な宣伝が生じる可能性がある。現行の法規の要求を守らないいかなる行為も、私たちの製品の商業化と創造能力に重大な悪影響を及ぼす可能性がある。規制制裁を実施したり、規制承認を撤回したりすれば、私たちの価値と経営業績は不利な影響を受けるだろう。
私たちはこれまで候補製品を商業化したことがありません。もし承認されれば、私たちはどんな製品の商業化に成功するために必要な専門知識、人員、資源が不足しているかもしれません。もし私たちの候補製品が承認されたら、効果的なマーケティングと販売能力を確立できないかもしれないし、第三者や関係者と合意して私たちの製品をマーケティングして販売することができないかもしれないので、製品収入を生み出すことができないかもしれません。
私たちは以前バイオ製薬製品のマーケティング、販売、流通についてほとんど経験がなく、現在は限られたビジネスインフラを持っています。私たちが他人に権限を与える可能性のある候補製品を商業的に成功させるために、私たちはこれらの協力者の助けと指導に依存する。私たちが商業化権利とマーケティング承認の候補製品を保持し、承認されれば、私たちの候補製品を商業化するためには、包括的な医療コンプライアンス計画を含むマーケティング、販売、流通能力を強化し続けなければならないし、第三者がこれらのサービスを実行するように手配しなければなりません。これには時間と大量の財務支出が必要であり、どの製品の発表を遅らせることも可能であり、私たちはそれに成功できないかもしれません。商業インフラの建設と管理は重大な危険と関連がある。
私たちまたは私たちの協力者は、医療事務、マーケティング、販売、商業支援者を募集、採用、訓練、管理、維持するために、他の製薬とバイオテクノロジー会社と競争しなければならないだろう。採用、訓練、販売チームを維持するのは高価で時間がかかり、いかなる製品の発表を延期するかもしれない。販売チームを募集し、マーケティング能力を確立する候補製品の商業発表が何らかの理由で延期または発生していない場合、これらの商業化費用を早期または不必要に発生させる。これらの努力は費用が高いかもしれません。もし私たちが私たちの販売とマーケティング担当者を維持したり、再配置できなければ、私たちの投資は損失します。もし私たちが商業インフラを開発できなければ、現在または未来の候補製品を商業化できないかもしれないが、これは私たちが製品収入を作る能力を制限するだろう。販売チームを効率的に構築し、マーケティング·販売インフラを構築することができても、私たちの販売チームとマーケティングチームは、私たちの現在または未来の候補製品を商業化することに成功できないかもしれません。ある程度、私たちは第三者に依存して規制の承認を受けた任意の製品を商業化し、彼らの販売活動の制御は少なくなり、彼らが適用される法律や規制要求を遵守できなければ、私たちは責任を問われる可能性があります。
臨床試験で患者を募集と保留することは高価で時間のかかる過程であり、私たちがコントロールできない様々な要素によって延期され、より困難になり、あるいは不可能になる可能性がある。
新製品候補製品の臨床試験は、製品候補製品が治療しようとしている疾患を有する患者と、他の資格基準に適合する患者とを含む十分な数の患者を登録する必要がある。患者の入院率は臨床試験時間の重要な構成部分であり、それは多くの要素の影響を受け、含まれるが限定されない
•臨床試験に参加する研究場所を識別し同定する能力は
•患者群の大きさと性質;
•臨床試験の設計と資格基準
•被験者の臨床場所への接近度は
•医者の患者の回診のやり方
•臨床サイトの人員流出率
•私たちが調査している適応に関する医療実践パターンやガイドラインを変えて
•競合する臨床試験または承認された治療法は、患者と彼らの医師に魅力的な代替案を提供する
•類似または競合療法において観察された副作用の結果を含む、研究された候補製品の知覚的リスクおよび利点
•様々な理由で患者の同意を得て維持することができます
•被験者が実験終了前に退出したり死亡したりするリスク
•臨床試験を完了していない患者、または治療後にフォローアップした患者;
•患者や臨床試験のために必要な候補製品を生産する能力
•私たちまたは私たちの臨床サイトは、比較器または併用薬剤の利用可能性の潜在的制限を含む、臨床試験を行うために必要な十分な数の成分および用品の任意の失敗または任意の遅延を得ることができなかった。
また,多くの進行中の臨床試験と競合し,予想される臨床試験に参加する患者を募集する必要がある。私たちの臨床試験は、私たちの候補製品と類似した細胞免疫療法の分野にある他の候補製品の臨床試験と競合する可能性もあり、この競争は、私たちの試験に参加することを選択する可能性のある患者の中には、競争相手のうちの1つによる試験に参加することを選択する可能性があるので、使用可能な患者数およびタイプを減少させる可能性がある。合格臨床研究者の数が限られているため、著者らはいくつかの競争相手が使用した同じ臨床試験地点で著者らのいくつかの臨床試験を行う可能性があり、これはこれらの臨床試験地点で臨床試験を行うことができる患者数を減少させる。私たちの臨床試験に十分な数の患者をタイムリーに募集できなければ、私たちの臨床試験の完成が遅れたり、実現できない可能性があり、これは私たちの候補製品のさらなる開発や商業化を阻止します。
私たちの候補製品の臨床開発は私たちが臨床試験の製造と必要な候補製品の供給を提供する能力にかかっている。私たちは臨床試験を行うのに十分な数と品質の候補製品を生産し、提供することを遅延させることができず、患者の募集と治療能力を延期するか、あるいは私たちの現在または未来の候補製品の臨床試験を時間通りに完成させる能力があるかもしれない。
著者らの候補製品の臨床開発はまた臨床試験で使用されるいくつかの他の材料と試薬の十分な供給に依存する。例えば、ある臨床試験方案は対照治療を使用する必要がある。任意の標準的な看護療法が利用できなくなったり,供給が限られたりすれば,われわれの試験遂行能力に悪影響を及ぼす。さらに,他の神経変性疾患との治療法との併用療法として,我々のいくつかの候補製品を開発する可能性があり,これらの治療剤をいくつかの臨床試験レジメンで提供し使用する必要がある。
私たちの臨床試験に十分な数の患者をタイムリーに募集できなければ、私たちの臨床試験の完成が遅れたり、実現できない可能性があり、これは私たちの候補製品のさらなる開発や商業化を阻止します。
私たちの臨床前計画は遅延したり、永遠に臨床試験に入らない可能性があり、これは私たちが適時あるいは根本的に監督管理の承認を得られない、あるいはこれらの計画を商業化する能力に不利な影響を与える。
FDAまたは他の規制機関の承認を得るためには、人体における新たな生物製品の安全性、純度および効力または有効性を証明しなければならない。これらの要求を満たすためには,十分かつ良好な制御の臨床試験が必要である。2022年10月14日、我々はFDAからSNK 02同種異体NK細胞による固形腫瘍治療のIND承認を得た。2023年10月20日、我々はADでSNK 01に対するFDAのIND承認を得た。2023年の残り時間には,(I)SNK 01の臨床開発を進め,米国でADのI/IIa期試験を開始し,(Ii)難治性固形腫瘍に対するSNK 02のI期試験を継続する予定である。他の候補製品の臨床試験を開始する前に、米国で計画されているINDを支援するために、広範な臨床前試験と研究を完成させなければならない。
われわれはわれわれの臨床前試験と研究の適時な完成或いは結果を確定することができず、FDAが著者らが提出した臨床計画を受け入れるかどうか、あるいは著者らの臨床前試験と研究の結果が最終的に著者らの計画の更なる発展を支持するかどうかを予測することもできない。さらに、いくつかの製品開発計画については、他の候補製品を優先するように、遅延、一時停止、終了、または他の候補製品を優先するような第三者との協力を自発的に決定することができる。したがって、私たちは、私たちの予想される時間内に私たちの臨床前計画のためにINDまたは同様の申請を提出しないかもしれませんし、INDまたは同様の申請を提出することは、FDAまたは他の規制機関が臨床試験の開始を可能にすることを引き起こさないかもしれません。
臨床試験を行う前は長く、時間がかかり、高価な過程である。時間長は、プログラムのタイプ、複雑さ、および新規性によって大きく異なることができ、各プログラムは、一般に数年またはそれ以上の時間であってもよい。私たちまたは潜在的な未来のパートナーの臨床前テストおよび研究におけるどんな遅延も、追加の運営費用をもたらす可能性があります。候補製品の臨床前研究の開始および完成速度は、例えば、多くの要因によって遅延する可能性がある
•臨床試験の開始をサポートするのに十分な臨床前または他の体内または体外データを生成することができない
•遅延と規制機関は研究設計について合意した
•FDA(または他の規制機関)は、いくつかの規制要件を満たさずに外国司法管轄区で行われた臨床試験に依存することを許可しない
•FDA(または他の規制機関)は、以前の他の類似製品の安全性および有効性の発見に依存することを許さず、科学文献を発表した。
また,臨床前評価の基準が発展しているため,急速に変化する可能性があり,FDAとIND前提案について合意しても,FDAは提出されたIND提出を受け入れない可能性があり,この場合,臨床試験スケジュールが延期される可能性がある。
臨床前研究と早期臨床試験の結果は未来の結果を予測できないかもしれない。著者らの臨床試験の一時、“背線”と初歩的なデータは最終データと大きく異なる可能性がある。
臨床前研究の結果は臨床試験の結果を予測できない可能性があり,われわれが開始したいかなる早期臨床試験の結果も後期臨床試験の結果を予測できない可能性がある。例えば、腫瘍学細胞治療に応用される臨床前モデルは臨床環境を十分に代表することができないため、臨床活動或いはすべての潜在的なリスクを予測することができず、治療の適切な用量或いは投与方案について十分な指導を提供できない可能性がある。
私たちは時々、私たちの臨床試験の予備または“バックライン”データを開示することができるかもしれない。これらのデータは、当時利用可能なデータの予備分析、結果、および関連する発見および結論に基づいて、患者登録の継続および既存の患者のより多くのデータが利用可能であることを含む、特定の試験の関連データをより全面的に検討した後に変化する可能性がある。私たちはまた、私たちのデータ分析の一部として、すべてのデータを全面的かつ詳細に評価する機会がないか、または受け取る機会がないかもしれないという仮説、推定、計算、および結論を出した。したがって、著者らの臨床試験の任意の背線データ、例えばSNK 01は、同じ臨床試験の将来の結果と異なるかもしれないし、指示的ではないかもしれないし、あるいはより多くのデータを受け取って十分な評価を行うと、異なる結論や考慮要素がこのような背線結果を合格させる可能性がある。バックラインデータはまだ監査と確認手続きを受ける必要があり、これは最終データが私たちが以前に発表した予備データと大きく異なる可能性がある。したがって、最終データが利用可能になるまで、バックラインデータを慎重に見るべきであり、初期データまたは中間データと最終データとの間の負の差は、このようなデータ更新の影響を受ける任意の候補製品の将来性に重大な悪影響を及ぼす可能性がある。
さらに、規制機関を含む他の人は、私たちの仮定、推定、計算、結論または分析を受け入れないか、またはデータの重要性を異なる方法で解釈またはトレードオフする可能性があり、これは、特定の計画の価値、特定の候補製品または製品の承認または商業化、およびわが社の全体的な価値に影響を与える可能性がある。さらに、開示された特定の研究または臨床試験に関する情報は、一般に、大量の情報の要約であり、他の人は、私たちが決定した重大な情報または他の適切な情報に同意しない可能性があり、私たちが開示しないことを決定した任意の情報は、最終的には、特定の製品、候補製品、または私たちの業務に関する将来の決定、結論、観点、活動、または他の態様に重要な意味を有すると考えられるかもしれない。もし私たちが報告したバックラインデータが実際の結果と異なる場合、あるいは規制機関を含む他の人が結論に同意しない場合、私たちが承認を得て私たちの候補製品を商業化する能力が損なわれる可能性がある。
もし私たちの任意の候補製品または任意の競争候補製品が関連する深刻な有害事象を示す場合、私たちはさらなる臨床開発を停止または延期することを要求されるかもしれない。
私たちの候補製品が引き起こす可能性のある副作用は、私たちまたは規制機関の臨床試験の中断、延期、または停止を招く可能性があり、予想よりもラベルが厳しくなるか、またはFDAまたは同様の外国の規制機関の規制承認を延期または拒否する可能性がある。われわれの臨床試験結果は副作用や予期せぬ特徴の重症度と流行度を示す可能性がある。
SNK 01臨床試験の最新データにより、SNK 01の全体的な耐性は良好であることが示唆された。これまで,臨床試験全体で2名の参加者が報告してきた4つの2級イベントがSNK 01に関連している/SNK 01に関与している可能性がある。1人の患者は計3回の事件,すなわち2級身震い,3級身震い,2級輸液反応を経験し,これらの事件はすべて解決された。もう1人の患者は2級間欠性上中腹痛事件を経験し,この事件も軽快した。しかし,SNK 01開発計画が報告されているイベントは少ないため,われわれが臨床試験を継続するにつれて,追加的で予見できないイベントが出現する可能性がある
著者らはAD患者の安全性と耐性を調査したSNK 01の第一段階臨床試験とSNK 01と治療性抗体セツキシマブが結合したI/IIa臨床試験を調査したデータにより、NK細胞による治療は耐性が良好である可能性があるが、未来の患者に副作用が出現しないことを保証できない。もし私たちの候補製品が開発中に受け入れられない副作用が出現し、もはや積極的な利益-リスク特徴を有さなくなった場合、私たち、FDA、または我々の試験を行った機関のIRBsは、私たちの臨床試験を一時停止または終了することができ、またはFDAまたは同様の外国の規制機関は、任意またはすべての目標適応のために、私たちの候補製品を承認することを拒否するように臨床試験を停止することを命令することができる。治療に関連する副作用は、患者が試験を完了する能力を募集したり、組み入れたり、あるいは潜在的な製品責任クレームを引き起こす可能性もある。さらに、治療医療従事者は、これらの副作用を適切に識別または管理していない可能性があり、私たちの候補製品の潜在的な副作用を認識または管理する上での訓練不足は、患者の負傷または死亡を引き起こす可能性がある。副作用の発生は私たちの名声や私たちの製品の名声を損なう可能性もあり、これは私たちの業務や株価に大きな影響を与えるかもしれません。
受け入れ可能な条項で臨床試験に関連する活動を許容可能な条項で維持または確保することができない場合、またはこれらの第三者が契約に従って彼らのサービスを履行していない場合、またはこれらの第三者が彼らが持っている任意の規制情報を直ちに私たちに送信できない場合、候補製品のための規制部門の承認を得ることができない場合や、私たちの開発努力によって生成された任意の候補製品を商業化することができない場合、または予想される締め切りを逃す可能性がある。
私たちは学術機関、CRO、病院、診療所と他の第三者戦略パートナーを含む可能性があり、私たちの現在と未来の候補製品の臨床前研究と臨床試験を監視、支持、実施、監視するために、私たちのコントロール以外の実体に依存する。したがって,我々自身がこれらの実験を行うのに比べて,これらの研究の時間やコストおよび被験者を募集する能力の制御は少ない.許容可能な条項でこれらの第三者と合意することができない場合、またはそのような約束が早期に終了された場合、被験者をタイムリーに募集することができない場合、または他の方法で計画的に臨床試験を行うことができない可能性がある。また、これらの第三者が私たちの臨床試験に十分な時間と資源を投入すること、あるいは私たちの候補製品に関する臨床試験情報を維持することを含む、私たちの契約要件や法規の要求に従って実行されることは保証されない。これらの第三者が予想される期限内に、任意の規制情報をタイムリーに送信できなかった場合、合意を遵守できなかった場合、または規制要求に従って、または彼らと達成された合意に従って行動できなかった場合、または彼らが不適格な方法で、またはその活動またはその取得されたデータの品質または正確性を損なう方法で動作した場合、私たちの候補製品の臨床試験は、追加のコストを生成するか、またはFDAまたは他の規制機関によって拒否される可能性がある。結局、私たちは私たちのすべての臨床試験が適用された方案、法律、法規、科学的基準に従って行われることを保証する責任があり、私たちの第三者への依存は私たちの規制責任を免除しない。
私たちとCROは良い臨床実践を守らなければならない“GCP)、FDAおよび同様の外国規制機関が臨床開発中の製品に対して実行する法規およびガイドライン。監督管理機関は定期的に臨床試験スポンサー、主要な研究者と臨床試験地点を検査することによって、これらのGCPを実行する。もし私たちまたは私たちのいかなるCROも適用されたGCPに従わなかった場合、私たちの臨床試験で生成された臨床データは信頼できないと思われるかもしれません。私たちのマーケティング申請は延期されるかもしれません。あるいはFDAや外国の規制機関は、私たちのマーケティング申請を承認する前に追加の臨床試験を行うことを要求するかもしれません。検査後、FDAまたは同様の外国規制機関は、私たちの任意の臨床試験が不合格または適用されたGCPを遵守できなかったことを決定することができる。
私たちのCROおよび/または臨床試験サイトが詐欺および乱用または虚偽声明法律法規または医療プライバシーおよび安全法律に違反している場合、私たちの業務も影響を受ける可能性があります。
私たちの任意の第三者臨床試験サイトが任意の理由で終了すれば、これらの被験者のケアを別の合格した臨床試験サイトに移すことができない限り、進行中の臨床試験に登録されている被験者の後続情報を失う可能性がある。また,我々のCROおよび/または臨床試験サイトは無期限または独占的に我々と協力する必要はない。CROおよび/または臨床試験サイトとの既存のプロトコルは、場合によっては取引相手によって終了する可能性がある。任意のCROおよび/または臨床試験サイトが我々との合意を終了した場合、関連候補製品の研究および開発が一時停止され、将来の候補製品を研究、開発および許可する能力が損なわれるであろう。私たちは私たちの候補製品を開発するためにより多くの資源を投入する必要があるかもしれないし、新しいCROパートナーおよび/または臨床試験場所を探す必要がありますが、私たちが確立した任意の追加的な配置の条項は私たちに不利かもしれません。CROおよび/または臨床試験サイトまたは他のサービスプロバイダを交換または増加させることは、大量のコストを伴う可能性があり、大量の管理時間および重点を必要とする可能性がある。さらに、新しいCROおよび/または臨床試験場所またはサービスプロバイダが作業を開始すると、自然な過渡期がある。したがって,遅延が生じる可能性があり,期待される臨床開発スケジュールを満たす能力に実質的な影響を与える可能性がある。もし私たちが代替手配を求めることを要求された場合、それによって生じる遅延と潜在的に適切な代替者を見つけることができないことは、私たちの業務に実質的で不利な影響を与える可能性がある。
私たちはNK細胞治療プラットフォームに基づいて候補製品を開発する方法は検証されていないが、私たちは商業価値のある製品を開発できるかどうか、あるいは競争する技術方法が私たちの候補製品の商業価値を制限するかどうか、あるいは私たちのプラットフォームを時代遅れにすることができるかどうか分からない。
私たちの成功は、私たちのNK細胞治療プラットフォームを利用して、規制機関が私たちの候補製品を承認し、それを商業化する能力に依存し、比較的新しい技術を利用する製造能力を含む。著者らのプラットフォームに基づいて、著者らはすでに良好な臨床前研究結果を持っているが、私たちはまだ、臨床試験でいかなる候補製品の有効性と安全性を証明することに成功しないかもしれない、あるいはその後に発売許可を得る可能性がある。私たちは私たちの主要な候補製品SNK 01とSNK 02の第一段階試験を開始した。私たちが臨床研究を適時に完成できることは保証できません。私たちは追加のスケジュール遅延あるいは深刻な不良事件を経験するかもしれません。私たちの候補製品は永遠に商業化されないかもしれません。私たちのすべての候補製品は大量の追加の臨床と非臨床開発、FDAまたは1つ以上の司法管轄区域の他の規制機関の審査と承認、大量の投資と重大なマーケティング努力が成功して商業化する必要がある。私たちの細胞治療方法および新しい方法は他の候補製品の識別に成功しない可能性があり、私たちのプラットフォームに基づく任意の候補製品は有害な副作用を有することが証明される可能性があり、あるいは他の特徴を持つ可能性があり、追加の臨床試験を行う必要があるかもしれない、あるいは候補製品が販売できない、または発売承認を得ることができないかもしれない。
さらに、私たちのすべての候補製品および開発計画は、私たちのNK細胞治療プラットフォームに基づいているので、私たちの1つの計画に関連する不良な発展は、私たちの他の計画の実際または予想される成功可能性および価値に大きな悪影響を及ぼす可能性がある。例えば,我々のSNK 01臨床試験が安全性,有効性や製造問題,開発遅延,規制問題,あるいは他の問題に遭遇した場合,我々が開発している他の候補製品に対する開発計画は深刻な影響を受ける可能性がある
さらに、我々の競争相手は、彼らの臨床前研究または試験の中期または最終データおよび/または結果を時々開示することも可能である。競合他社が発表した不良データまたは発見は、NK細胞療法の有効性または安全性に関連しても、臨床試験に参加する患者を募集する能力を含むが、これらに限定されないが、“カテゴリ効果”の解釈を反論するためにより多くの研究を行う必要がある可能性があり、これには追加の時間、リソース、および資金が必要となるかもしれない。
規制部門の特別な指定を求めて、規制承認を加速させる可能性がありますが、このような指定を得ることができない可能性があり、受け取っても、開発や規制承認過程に不利になる可能性があります。
私たちは再生医学高度療法のような規制機関を通じて提供される様々な加速計画を求めることができるかもしれない(“RMAT)指定、画期的な治療指定、高速チャネル指定、優先審査、または優先医学(素数.素数)“規制機関から来て、私たちが開発した任意の候補品について。もし製品候補が治療、修正、逆転、または深刻な生命を脅かす疾患を治療、修正、または治癒するための再生医学療法であり、臨床的意義を有する終点に関する初歩的な臨床証拠が、候補製品がこのような疾患が満たされていない医療需要を解決する潜在力を有することを示す場合、候補製品はFDAのRMAT称号を得ることができる。FDAは、1つまたは複数の他の薬剤との単独または複数の他の薬剤との併用治療が深刻または生命に危険な疾患または状態を治療することを意図した薬剤として定義され、初歩的な臨床証拠は、1つまたは複数の臨床的に重要な終点において、現在承認されている治療法よりも実質的に改善された効果を示す可能性があり、例えば、臨床開発早期に観察される実質的な治療効果を示す可能性があることを示している。1つの製品が深刻または生命を脅かす疾患の治療に使用され、臨床前または臨床データが、このような疾患が満たされていない医療需要を満たす可能性があることを示す場合、製品スポンサーは、FDAの迅速なチャネル認証を申請することができる。Primeはヨーロッパ薬品管理局(European Medicines Agency)が発起した自発的な計画であるEMA)は、有望な薬物開発者との相互作用および早期対話を強化することによって、患者がそのような薬物をより早期に取得するのを助けるために、開発計画を最適化し、評価を加速させるために、満たされていない医療需要に対する薬物開発の支援を強化する。
これらの指定を求め、獲得することは、私たちの臨床計画の結果および他の考慮事項に依存しており、私たちがいつ、私たちの臨床計画からのデータを持っている可能性があるかどうかは、そのような指定の申請を支援することを支持することはできない。FDAとEMAは適用された場合に広範な裁量権を持ち,これらの指定を付与するかどうかを決定するため,ある特定の候補製品がそのうちの1つまたは複数の指定を得る資格があると考えても,適用される規制機関がそれを付与することを決定することは保証できない.私たちが申請可能な指定を受けたとしても、私たちは適用された従来のFDAやEMAプログラムよりも速い開発過程、審査、または承認を経験しないかもしれない。FDAまたはEMAが、我々の臨床開発計画のデータがもはや承認された指定をサポートしていないと考える場合、それは任意の承認された指定を取り消す可能性がある。
世論や神経変性疾患の治療に対する細胞ベース免疫腫瘍療法の審査は、わが社や候補製品に対する公衆の見方に影響を与えたり、業務を展開する能力を低下させたりする可能性がある。
我々のプラットフォームは、患者自身またはスクリーニングされた健康成人ドナーの末梢血または白血球分離術から純粋な初代NK細胞を分離し、その後拡張することに関連する新しい技術を利用した。未来の製品は遺伝子改変を使用して開発されるかもしれない。われわれの知る限り,これまでFDAが承認していないNK細胞による療法はない。公衆の認知はNK細胞による免疫療法が無効、安全でない、不道徳または非道徳的な説の負の影響を受ける可能性があり、したがって、私たちの方法は公衆または医学界の受け入れを得ることができない可能性がある。細胞ベースの免疫療法に対する公衆の負の反応は、細胞ベースの免疫療法製品(私たちの任意の候補製品を含む)に対する政府のより厳しい規制およびより厳しいラベル要件をもたらす可能性があり、私たちが開発する可能性のある任意の製品の需要を減少させる可能性がある。公衆の悪い態度は私たちが臨床試験を募集する能力に悪影響を及ぼすかもしれない。より厳しい政府法規や負の世論は、私たちの業務や財務状況に悪影響を及ぼす可能性があり、候補製品の開発および商業化を遅延または損害したり、私たちが開発する可能性のある任意の製品の需要を悪化させたりする可能性があります。
私たちは他の候補製品を識別または発見できないかもしれないし、より大きなビジネス機会をもたらすかもしれないし、成功する可能性のある計画または候補製品を利用できないかもしれない。
私たちの業務は候補製品を識別し、開発し、商業化する能力にかかっている。私たちの戦略の重要な要素の1つは私たちのNK細胞治療プラットフォームに基づいて、より多くの候補製品を発見し、開発することである。我々は,我々の内部研究計画を通じてこれを実現し,新たな候補製品を発見するための戦略協力を探索することを求めている.候補製品を決定する研究計画は、最終的に任意の候補製品が決定されたか否かにかかわらず、大量の技術、財政、人的資源を必要とする。さらに、異なる神経変性疾患の標的には、開発速度を遅くしたり、候補製品を生産できなくなったりする可能性があるNK製造プラットフォームを変更する必要があるかもしれません。我々の研究計画は当初、潜在的な候補製品の決定に希望を示す可能性があるが、多くの原因で臨床開発のための候補製品が生成されなかったが、以下の原因を含むが、これらに限定されない
•使用される研究方法または技術プラットフォームは、潜在的な候補製品の決定に成功しない可能性がある
•競争相手は代替製品を開発し、私たちの候補製品を時代遅れや魅力を低下させるかもしれない
•臨床結果に希望がないと判断すれば開発を中止することを選択するかもしれません
•私たちが開発した候補製品はまだ第三者特許または他の独占権によって保護されているかもしれない
•候補製品は、有効ではないか、または適用されない規制基準に適合していないことを示す有害な副作用または他の特徴を有することが証明される可能性がある
•候補製品は患者、医学界、または第三者支払人に受け入れられない可能性がある。
リソースが限られているため、特定の種類の治療法、または特定の種類の神経変性疾患に対する治療法の開発を追求し、資金を提供することを選択しなければならず、特定のプログラムや製品候補、または後でより大きな商業的可能性が証明される適応症に対する機会の追求を放棄または遅らせることがあります。当社の製品候補の潜在的な市場に関する当社の推定は不正確である可能性があります。また、特定の製品候補の商業的可能性を正確に評価しない場合、当社は、戦略的提携、ライセンスその他の取り決めを通じて、当該製品候補に対する貴重な権利を放棄する可能性があります。あるいは、パートナーシップを締結することがより有利であった治療分野の製品候補に社内リソースを割り当てる場合があります。
これらの事件のいずれかが発生した場合、特定の候補製品の開発作業を放棄または延期させるか、または成功する可能性のある候補製品を開発することができない可能性がある。
もし私たちが臨床試験を行う第三者に依存して契約の職責を成功裏に履行し、法規の要求を遵守したり、予想された期限内に完成できなければ、私たちの候補製品の市場承認を得たり、商業化することができないかもしれない。
私たちは独立して臨床試験を行うことができない。私たちはCROのような医療機関、臨床研究者、契約実験室と他の第三者に依存して、私たちの候補製品の臨床試験を行うか、あるいは他の方法で支持する。私たちはこれらの方が私たちの候補製品のために臨床試験を実行し、その活動のいくつかの方面だけを制御することに深刻に依存している。しかし、私たちは私たちのすべての臨床試験が適用された方案、法律と法規の要求、および科学的な基準に従って行われていることを保証する責任があり、私たちのCROと他の第三者への依存は私たちの規制責任を軽減しない。私たちの臨床試験期間中のいかなる法律と法規に違反する行為に対して、私たちは無タイトルの手紙、警告状、あるいは法執行行動の影響を受ける可能性があり、これらの行動は民事処罰を含む可能性があり、最高で刑事起訴に達することができる。
著者らと臨床試験を行うことに依存する第三者は必ず法規と要求を遵守しなければならず、臨床試験結果を行い、モニタリング、記録と報告するGCPを含み、データと結果が科学的に信頼性と正確であることを確保し、そして試験患者が臨床試験に参加する潜在的なリスクを十分に理解し、彼らの権利が保護されることを確保する。これらの規定はFDAと類似の外国監督管理機関によって臨床開発中の任意の薬物に対して実行される。FDAは臨床試験スポンサー,主要研究者,試験地点の定期検査によりGCP要求を実行している。私たちまたはこれらの第三者が適用されたGCPに従わなかった場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられる可能性があり、FDAまたは同様の外国の規制機関は、私たちのマーケティング申請を承認する前に追加の臨床試験を行うことを要求するかもしれません。検査後、FDAは私たちの将来のどの臨床試験もGCPから外れないことを確認することはできません。また,われわれの臨床試験はGMP法規により生産された候補製品を用いて行わなければならない。私たちの失敗やこれらの第三者がこれらの規定を遵守できなかった場合、私たちは臨床試験を繰り返す必要があるかもしれません。これは上場承認過程を遅らせ、法執行行動の影響を受ける可能性があります。私たちはまた、政府が支援しているデータベースClinicalTrials.govに特定の時間範囲でいくつかの行われている臨床試験を登録し、試験計画に関連する情報を含むいくつかの情報を提供することを要求されている。そうしないと罰金、否定的な宣伝、そして民事と刑事制裁につながるかもしれない。
我々の候補製品のための臨床試験を設計する予定であるが,第三者による臨床試験を行う予定である。そのため、著者らの臨床開発の多くの重要な方面は、それらの行為とタイミングを含め、著者らの直接制御下にない。われわれ自身に完全に依存しているスタッフと比較して,第三者による将来の臨床試験への依存も臨床試験により開発されたデータ管理の直接制御の減少を招く。外部の当事者とのコミュニケーションも挑戦的である可能性があり、ミスや協調活動の困難を招く可能性がある。外部当事者は、これに限定されるものではない
•人員配置が困難である
•契約義務を履行しない者
•規制コンプライアンスの問題に直面しています
•患者を臨床試験に参加させたり、候補製品を生産したりする際に中断または遅延に遭遇します
•優先順位が変化したり、財務的苦境に陥ったりする
•他の実体との関係を構築し、その中のいくつかは私たちの競争相手かもしれない。
もし第三者が満足できる方法で私たちの臨床試験を実行していなければ、彼らの私たちに対する義務に違反したり、法規の要求を遵守できなかった場合、私たちはこれらの第三者が収集した臨床データに依存できなくなり、私たちが行った任意の臨床試験の規模を繰り返し、延長または増加させることが要求される可能性があり、これは商業化を著しく延期し、支出を著しく増加させる必要があるかもしれない。
もし私たちがこのような第三者とのいかなる関係も終わらなければ、私たちは商業的に合理的な条項で代替の第三者と合意できないかもしれない。第三者がその契約の責務または義務を成功裏に履行できなかった場合、または予期された最終期限内に完了できなかった場合、交換が必要である場合、または彼らが取得した臨床データの品質または正確性が、我々の臨床規程、規制要件、または他の理由を遵守できなかった場合、その第三者に関連する任意の臨床試験は、延長、延期または終了される可能性があり、私たちは、候補製品の市場承認または商業化に成功することができない可能性がある。したがって、私たちの財務業績と私たちの候補製品のテーマ指示におけるビジネスの見通しが損なわれ、私たちのコストが増加する可能性があり、私たちの収益能力が遅れる可能性があると思います。
もし私たちが商業的に合理的な条件下で製薬やバイオテクノロジー協力を作ることができなければ、あるいは根本的にできなければ、私たちの開発と商業化計画を変えなければならないかもしれない。
私たちの候補製品と開発計画、および私たちの現在と未来の候補製品の潜在的な商業化を推進するためには、第三者との協力、パートナーシップ、または他の合意が必要となり、このような関係に関連する費用を支払うために多くの追加の現金が必要となるかもしれない。これらの関係は、私たちに非日常的な費用や他の費用を発生させ、私たちの最近と長期的な支出を増加させ、私たちの既存の株主を希釈する証券を発行し、私たちの候補製品に対する貴重な権利を放棄したり、私たちの管理と業務を混乱させたりすることを要求するかもしれない。
私たちは適切な戦略パートナーを探す上で激しい競争に直面しており、交渉過程は時間がかかり複雑だ。私たちが新しい協力について最終的に合意するかどうかは、協力者の資源と専門知識の評価、提案された協力の条項と条件、提案された協力者のいくつかの要素の評価に依存するだろう。これらの要因は、臨床試験の設計または結果、私たちの臨床試験の進展状況、FDAまたは米国国外の類似規制機関が承認した可能性、候補製品の潜在的な市場、製造と患者へのこのような候補製品のコストと複雑さ、競争製品の潜在性、技術所有権に対する不確実性を含むことができ、挑戦の是非曲直および一般的な業界および市場条件を考慮せずに私たちの所有権に挑戦する場合、このような不確実性が存在する可能性がある。我々の競争相手の類似した指示に対して,協力者は,連携のために候補製品や技術を代替することや,そのような連携が我々と我々が行った連携よりも我々の候補製品に魅力的であるかどうかを考えることもできる.さらに、将来の候補製品のための戦略的パートナーシップや他の代替手配を確立する努力は成功しないかもしれないが、協力努力の開発段階が早すぎると考えられるかもしれないので、または第三者が安全性および有効性を示すために必要な潜在力を示さないと考える可能性があるからである。私たちが開発した任意の候補製品に関連する任意の新しい協力または戦略的パートナーシップ協定のいかなる遅延も、私たちの候補製品の開発および商業化を延期する可能性があり、これは、私たちの業務の将来性、財務状況、および運営結果を損なうことになります。
もし私たちの候補製品がマーケティングおよび商業化のために承認された場合、私たちは内部または第三者からマーケティング、販売、流通能力を開発または確保していなければ、このような製品を商業化することに成功せず、製品収入を生み出すこともできないかもしれない。
私たちは今何の商業販売もありません。FDAまたは他の規制機関によって承認された任意の候補製品を商業化するために、内部および外部販売、マーケティングおよび流通能力およびインフラを発展させる必要があり、これは高価で時間がかかるか、または第三者とパートナーシップを構築してこれらのサービスを実行するであろう。もし私たちが任意の承認された製品を直接マーケティングすることを決定すれば、私たちは大量の財務と管理資源を投入して、技術的な専門性と流通、管理、コンプライアンスをサポートする能力を持つマーケティングと販売チームを発展させる必要があるだろう。もし私たちが第三者に依存して製品をマーケティングしたり、パートナーと共同で製品を普及させることを決定した場合、私たちは第三者とマーケティングと流通手配を確立し、維持する必要があり、受け入れ可能な条項で、またはそのような計画を達成することが全く保証されない保証はありません。第三者マーケティングまたは流通手配を達成する際に、私たちが受け取った任意の製品収入は、第三者の努力に依存し、これらの第三者が十分な販売および流通能力を確立するか、または任意の承認された製品に対する市場の受け入れに成功することを保証することはできません。もし私たちが将来承認されたどの製品を商業化することに成功できなければ、私たち自身も第三者を通じても、私たちの業務、財務状況、運営結果、成長の見通しは重大な悪影響を受ける可能性がある。
承認されれば、私たちの候補製品の市場機会は限られる可能性があり、もしこれらの市場機会が私たちが予想していたより小さければ、私たちの収入は実質的な悪影響を受ける可能性があり、私たちの業務は影響を受ける可能性がある。
私たちの候補製品はFDAや他の規制機関の市場販売承認を受けていない。現在、SNK 01あるいはSNK 02あるいは私たちの任意の候補製品が人類に安全に使用されているかどうか、あるいはそれらが神経変性疾患の面でいかなる改善を示すかどうかはまだ知られていない。活性が十分であれば、私たちは最初に、1つまたは複数の以前に承認された治療を受けた患者の治療として、私たちが開発した任意の候補製品を承認することを求めるかもしれない。しかし,我々が開発した候補製品が遅い治療のために承認されても,より早い治療のために承認されることは保証されず,いずれの承認を得る前に追加の臨床試験を行わなければならない。
私たちが狙っている神経変性疾患患者の数は予想より少ないかもしれない。さらに、私たちの現在の計画または未来の製品候補の潜在的にアドレス指定可能な患者集団は限られているかもしれない。私たちの製品候補製品の潜在的にアドレス指定可能な患者集団は推定数字だけです。これらの推定は不正確であることが証明される可能性があり,米国や他の地域の潜在患者の推定数は予想を下回る可能性がある。さらに、このような患者は、私たちの候補製品を治療することができないか、または様々な理由(承認されている他の薬剤を含む)のために、患者の識別および治療を得ることがますます困難になる可能性があり、これらの理由のいずれも、私たちの業務、財務状況、運営結果、および成長の見通しに大きな悪影響を及ぼす可能性がある。
私たちの任意の候補製品の商業成功は、その候補製品が医師、患者、第三者支払人、および医学界の他の人によって受け入れられる程度に依存するだろう。
私たちの候補製品は商業的に成功しないかもしれない。米国FDAと他の国際規制機関の必要な承認を得ても、私たちの候補製品の商業成功はある程度、医師、患者と医療保険支払者の細胞療法製品に対する全体的な受容度、特に私たちの候補製品が医療必要性、費用効果と安全性を持っているかどうかに依存する。医師、患者、医療支払者、医療界の他の人は私たちの商業化されたいかなる製品も受け入れないかもしれない。もしこれらの製品が十分な受容度に達していなければ、私たちは著しい製品収入が生じないかもしれないし、利益を上げることができないかもしれない。市場の細胞療法製品、特に私たちの候補製品に対する受容度は、商業販売のために承認されれば、いくつかの要因に依存するが、これらに限定されない
•臨床試験で証明されたこれらの候補製品の有効性と安全性
•代替療法に対する候補製品の潜在的かつ知覚可能な利点;
•代替療法の治療費に対して
•FDAが承認した候補製品の臨床適応
•医師は患者を紹介し新しい治療法を処方します
•ターゲット患者集団が新しい治療法を試みる意欲は
•副作用の性質や流行の程度や重症度
•FDAまたは他の規制機関によって課せられた製品ラベルまたは製品挿入要件は、製品承認ラベルに含まれる任意の制限または警告を含む
•管理は比較的便利で容易である
•製品が市場に投入されるタイミングを競う
•私たちの候補製品に対する否定的な宣伝や競争製品と治療方法の肯定的な宣伝
•第三者支払者のカバー面は十分であり、第三者は訓練センターや人員訓練に制限があり、十分な精算がある
•第三者支払者や政府当局が保険や補償を受けていない場合、対象患者人口が自己負担費用を支払うことを望むかどうか
•FDAによって承認された候補製品ラベルに含まれる制限または警告;
•FDAはリスク評価と緩和戦略の任意の要求を要求している(“REMS”);
•私たちの販売、マーケティング、流通の有効性
•潜在的な製品責任クレーム。
候補製品が臨床前研究と臨床試験において良好な治療効果と安全性を示しても、市場のこの製品に対する受容度はこの製品が発売されてから完全に知ることができる。私たちの候補製品は広範囲な市場で受け入れられないかもしれない。
さらに、FDAや他の規制機関の政策が変わる可能性があり、製品の上場承認を阻止、制限、または延期するための追加の政府法規が公布される可能性がある。
米国や海外の将来の立法や行政行動によって生じる可能性のある政府規制の可能性、性質、程度を予測することはできない。もし私たちが既存の要求の変化に緩やかに適応できない場合、あるいは新しい要求や政策を採用することができない場合、または規制適合性を維持できない場合、私たちは私たちが得る可能性のあるマーケティング承認を失う可能性があり、利益を達成したり維持することができないかもしれない。
私たちおよび/またはNKMAXは、Affimed、ファイザー、およびメルクKGaAといくつかの候補製品について協力合意に達しており、他の候補製品を開発するため、または商業化するために、第三者とより多くの協力を達成する可能性がある。これらの候補製品に対する私たちの見通しは、これらの協力の成功に大きく依存し、私たちはこれらの協力のメリットを意識していないかもしれない。
われわれは,NKGen Biotechは,これまでAresTrading S.A.,ZI.de L‘Ouriettaz()と臨床試験協力と供給プロトコルを締結してきたAresTrading)(メルクKGaAの子会社)、及びファイザー社(ファイザー社)2020年8月にAvelumabを使用したSNK 01の安全性および耐性、およびAffimed GmbHとの評価(確認済み)2020年9月にSNK 01とAFM 24の潜在的な結合を調査した(この研究は2023年6月に中止することに同意された)。2023年7月現在,メルクKGaA(その子会社AresTradingを介して)とファイザーとの連携が終了し,SNK 01とAvelumabの安全性と耐性研究についてメルクKGaAとの協力が行われている。著者らの親会社NKMAXは2021年4月にメルクKGaAと臨床試験協力と供給協定を締結し、SNK 01とセツキシマブの潜在的な組み合わせを研究した。私たちは、これらの協力は、腫瘍疾患を治療するために、私たちの臨床開発計画をさらに構築し、私たちのNK細胞治療プラットフォームを設計し、推進するのに役立つと信じています
私たちは私たちの候補製品について戦略連合を結成したり、合弁企業や協力関係を構築したりするかもしれませんが、これは私たちの既存の業務を補完したり拡大したりすると思います。私たちは常に一連の製薬やバイオテクノロジー会社と協力して議論し、いつでも新しい協力が可能だ。もし私たちが協力、戦略連合、または許可手配を達成すれば、協力が成功する保証はなく、将来のどのパートナーもこのような製品の開発、規制承認、商業化を行うのに十分な資源を投入する保証もなく、このような連合がこのような取引を行う価値のある収入をもたらすことも保証されない。
私たちおよび/またはNKMAXがいずれか一方の重大な違約または他の理由ですべて終了または特定の候補製品と終了した場合、終了した候補製品(S)の研究、開発、および商業化を継続するために、停止費を支払い、追加のコストを負担する必要がある可能性があるので、コストが増加する可能性があります。私たちおよび/またはNKMAXは、これらのパートナーと条項を再交渉したり、私たちに有利な条項で将来の合意を交渉することができないかもしれません。さらに、さらなる開発の全責任を担うことは、私たちの支出を増加させる可能性があり、1つまたは複数の計画の規模および範囲を制限し、追加の資金を求め、および/または1つまたは複数の影響を受ける候補製品の仕事を完全に停止することを選択する必要があることを意味するかもしれない。これはこれらの候補製品から将来の収入を生み出す潜在力が限られている可能性があり、私たちの業務は悪影響を受ける可能性がある。
私たちが第三者と協力するたびに、私たちは以下のリスクに直面するかもしれないが、これらに限定されない
•協力者は彼らがこれらの協力の努力と資源に適用することを決定する上で大きな自由裁量を持っている
•協力者は開発を求めてはならない、あるいは臨床試験結果に基づいて、競争薬物の買収によってその戦略的重点、資金の利用可能性、または他の移転資源、あるいは相互競争の優先順位を創造する外部要素に基づいて、開発計画を継続しないか、または更新することを選択することができる
•協力者は臨床試験を延期し、臨床試験に十分な資金を提供し、臨床試験を停止し、候補製品を放棄し、あるいは新しい臨床試験を繰り返し或いは行うことができる
•協力者は、第三者開発と直接または間接的に当社の製品または候補製品と競合する製品およびプロセスを独立して開発することができ、または第三者開発と直接または間接的に競合することができる
•協力者は、私たちが彼らと協力して作った知的財産権を持っているか、あるいは共同で所有しているかもしれません。この場合、私たちはこのような知的財産権を商業化する権利がないかもしれません
•協力者は、私たちの知的財産権を正しく実行したり、維持したり、守ったりすることができない可能性があり、または何らかの方法で私たちの固有の情報を使用して、実際または脅威的な訴訟をもたらし、それによって、私たちの知的財産権または独自の情報を危険にさらしたり、または潜在的な訴訟または他の知的財産権訴訟に直面させたりする可能性がある
•協力者と私たちの間で紛争が発生し、候補製品の研究、開発または商業化の遅延または終了を招き、あるいは高価な訴訟や仲裁を招き、管理職の注意と資源を分散させる可能性がある
•もし私たちの現在または未来のパートナーが業務統合に参加すれば、このような協力の下で私たちの製品開発または商業化計画が延期、減少、または終了する可能性があることを追求し、強調することができる
•協力協定は私たちが新製品を独立して開発する権利を制限するかもしれない。
もし私たちの協力者と私たちの間に衝突が発生すれば、私たちの協力者は私たちに不利な方法で行動し、私たちが戦略を実施する能力を制限するかもしれない。ファイザーまたはメルクKGaAまたは将来のパートナーは、単独で、または他のパートナーと関連する分野で、これらの協力テーマの製品または潜在的な製品と競争力のある製品を開発することができることが確認された。競合製品は、協力者によって開発されたものであっても、協力者が使用する権利があるものであっても、我々の候補製品の支援を撤回することにつながる可能性がある。私たちの協力者は私たちが競争相手との協力を阻止し、適時に監督管理の承認を得ることができず、私たちとの合意を早期に終了したり、十分な資源を製品の開発と商業化に投入できなかったりするかもしれない。
協力者または戦略パートナーによって開発された競争候補製品、または協力者または戦略パートナーが開発する権利のある候補製品は、私たちの協力者またはパートナーが私たちの候補製品の支援を撤回することをもたらす可能性がある。このような進展のいずれも私たちの製品開発努力を損なう可能性がある。
したがって、私たちが新しいまたは既存の連携協定と戦略的パートナーシップを私たちの既存の業務と組み合わせることに成功しなければ、私たちはそれらの利点を達成できないかもしれません。これは、私たちのスケジュールを延期したり、他の方法で私たちの業務に悪影響を与えるかもしれません。戦略的取引や許可証の後に、このような取引の合理的な収入または特定の純収入を証明することが達成されるかどうかも確認できません。
私たちが候補細胞免疫療法製品を開発または代替する学術機関や他のバイオテクノロジー会社と効果的に競争できなければ、私たちの業務は実質的な悪影響を受けるだろう。
細胞免疫治療新製品の開発と商業化競争は激しい。我々が現在開発している各候補製品については,既存と将来の競争相手からの競争に直面しており,将来的には開発や商業化を求める可能性のある他の候補製品も競争に直面するであろう。例えば,Acpodia,Artiva,Celularity,Century Treateutics,Cytovia Treeutics,Fate Treateutics,Nkarta,免疫生物会社には臨床段階の同種異体遺伝子治療計画がある。また,他の競争相手,例えばAffimed,InNatural Pharma,トンボ治療会社やGT Biophmaは,細胞結合分子を介して患者自身のNK細胞を腫瘍部位に誘導してNK生物学を利用することを求めている。いくつかの学術機関もこれらの領域で臨床前と臨床研究を行っている。類似または代替細胞免疫療法製品を開発したライバルを含む新たなライバルが出現する可能性もあり、かなりの市場シェアを獲得している。これらの競争相手は、そのより大きな規模、資源、または機関経験のために、私たちよりも優れているかもしれないし、私たちよりも安全で、より効果的で、より広く受け入れられ、より費用対効果があり、またはより高い患者の生活の質を提供することができる製品を開発することができるかもしれない。より成熟したバイオテクノロジー会社も、彼らの候補製品をより速い速度で開発し、商業化する可能性があり、これは、私たちの候補製品が完全に開発または商業化される前に時代遅れになったり、競争力に欠けたりする可能性がある。もし私たちが既存および潜在的な競争相手と効果的に競争できなければ、私たちの業務、財務状況、経営業績、成長見通しは重大な悪影響を受ける可能性がある
私たちは私たちの組織の規模を拡大する必要があり、私たちは成長を管理する上で困難に直面するかもしれない。
2023年12月31日までに63人のフルタイム従業員がいます。私たちの管理、運営、臨床、品質、人的資源、法律、製造、サプライチェーン、金融、ビジネス、その他の資源を引き続き拡大して、私たちの運営と臨床試験を管理し、私たちの開発活動を継続し、最終的に私たちの候補製品を商業化する必要があります。私たちの既存の管理と人員、システム、そして施設は未来の成長を支援するのに十分ではないかもしれない。私たちは成長戦略を効果的に実行する必要がありますがそれに限らず
•新しい候補製品を発見し、IND支持研究とFDA提出のためにプロセスと分析方法を制定し、各製品に必要なIND支持研究を完成し、そしてFDAと他の監督管理機関の許可を得て、このような候補製品の臨床試験を開始した
•私たちの供給者や臨床試験を効率的に管理しています
•より多くの従業員を決定し、採用し、維持し、激励し、統合する
•私たちの従業員基盤の拡大に伴い、より多くのオフィスや実験室空間に拡張された
•私たちの運営、財務、管理制御、報告システム、そして手続きを引き続き改善する。
熟練した人材の確保、組織の拡大、将来の成長の効果的な管理ができない場合、事業戦略の実行能力が損なわれ、当社の事業、財務状況、業績および成長見通しに著しい悪影響を及ぼす可能性があります。また、経営陣は、日々の活動から不釣り合いな注意をそらし、これらの成長活動の管理にかなりの時間を費やす必要があり、製品候補の開発能力や承認された場合の商業化能力に悪影響を及ぼす可能性があります。
もし私たちが高級管理、臨床と肝心な科学者を引き付けることができなければ、私たちは私たちの候補製品の開発に成功し、私たちの臨床試験を行い、そして私たちの候補製品を商業化することができないかもしれない。
私たちの成功部分は私たちが引き続き高い素質の管理、臨床と科学者を吸引、維持と激励する能力にかかっている。また、私たちは私たちの上級管理職、特に私たちの最高経営責任者である宋志強博士と、私たちの上級管理チームの他のメンバーに高く依存しています。これらの人のいずれもサービスを失っても、私たちの製品ラインの成功した開発、私たちが計画している臨床試験の開始または完成、あるいは私たちの将来の候補製品の商業化を遅延または阻止する可能性があります。私たちは私たちの高級管理団体と雇用協定を締結しなかった。
私たちの業界に必要な技能と経験を持つ個人の数が限られているため、バイオテクノロジーと製薬分野の合格人材に対する競争は非常に激しい。私たちの臨床開発と製造活動を拡大したり、ビジネス活動を始めたら、もっと多くの人を募集する必要があります。私たちは受け入れ可能な条件で良質な人材を吸引し、維持することができず、甚だしきに至っては人材を誘致と維持することができないかもしれない。もし私たちが業務を経営するために必要な合格者を募集し、維持することができなければ、私たちの業務、財務状況、経営業績、成長の見通しは重大な不利な影響を受けるだろう。さらに、もし私たちが競争相手から人員を雇用すれば、私たちは彼らが不当に要求されたり、彼らが独自または他の機密情報を漏らしたり、彼らの元雇用主が彼らの研究成果を持っているという告発を受けるかもしれない。
当社の従業員、独立請負業者、コンサルタント、ビジネスパートナー、主要な調査者、CRO、サプライヤー、およびサプライヤーは、規制基準および要件を遵守しないことを含む、不適切な行為または他の不適切な活動に従事する可能性があります。
従業員、独立請負業者、コンサルタント、ビジネスパートナー、主要調査者、CRO、サプライヤー、およびサプライヤーが従業員詐欺または他の不正活動を行うリスクに直面しています。これらの当事者の不正行為には、FDAおよび他の同様の外国規制機関の法律に準拠できなかったこと、FDAおよび他の類似外国規制機関に真実、完全かつ正確な情報を提供すること、私たちが制定した製造基準を遵守すること、米国および同様の外国詐欺的不正行為法律を遵守する医療詐欺および乱用法律を遵守すること、または財務情報またはデータを正確に報告すること、または不正活動を開示することを含む、故意、無謀、および/または不注意な行為が含まれる可能性がある。もし私たちの候補製品がFDAの承認を得て、米国でこれらの候補製品の商業化を開始すれば、私たちのこのような法律の下での潜在的リスクは著しく増加し、私たちはこのような法律を遵守することに関連するコストも増加する可能性がある。特に、医療製品やサービスの普及、販売とマーケティング、および医療業界のいくつかの商業配置は、詐欺、リベート、自己取引、その他の乱用行為を防止するための広範な法律と法規の制約を受けている。これらの法律法規は、幅広い価格設定、割引、マーケティングおよび販売促進、構造および手数料(S)、特定の顧客インセンティブ計画、および他のビジネススケジュールを制限または禁止する可能性があります。これらの法的制約を受けた活動はまた、患者を募集して臨床試験を行う過程で得られた情報の不正使用に関するものであり、これは規制制裁を招き、私たちの名声に深刻な損害を与える可能性がある。
私たちは、私たちの業務運営において従業員または第三者が従事している不適切な行為または他の不適切な活動を常に識別し、阻止することができるわけではなく、不正行為を発見し、防止するための予防措置は、未知または未管理のリスクまたは損失を効果的に制御することができないか、またはそのような法律や法規に準拠できないことによる政府の調査または他の行動または訴訟から私たちを保護することができないかもしれない。もし私たちにこのような行動を提起し、私たちが私たちの権利を弁護したり、維持することに成功しなかった場合、これらの行動は、私たちを政府の医療計画から除外し、私たちの名声を深刻に損なうことを含む、巨額の罰金や他の制裁を加えることを含む、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。また,我々の任意の候補製品の米国国外での承認と商業化は,上記の医療保健法や他の外国法の外国等価物の制約を受ける可能性もある。私たちの業務計画が適用される医療保険法に適合することを確保する努力は巨額のコストに及ぶ可能性がある。
私たちの業務の様々な運営および管理に依存している任意の第三者がタイムリーで正確かつ持続的なサービスを提供できなかった場合、または技術システムおよびインフラに緩和できない障害が発生した場合、私たちの業務は悪影響を受ける可能性があります。
私たちは現在、研究、臨床相談と管理を含む第三者顧問と請負業者に具体的な運営と行政サービスを提供することに依存している。これらの第三者のいずれかが正確かつタイムリーなサービスを提供できない場合、私たちの業務運営に悪影響を及ぼす可能性がある。
さらに、これらの第三者サービスプロバイダが一時的または永久的に運営を停止し、財務的苦境や他の業務中断に直面し、彼らの費用を増加させる場合、またはこれらのプロバイダとの関係が悪化した場合、同等のプロバイダが見つかるまで、または内部能力を発展させることができるまで、より高いコストに耐えることができるかもしれない。また、私たちが質の高いパートナーを選択したり、見つけることに成功しなかった場合、費用対効果のある関係を彼らと交渉できなかった場合、あるいはこれらの関係管理に力がなければ、私たちの業務や財務業績に悪影響を及ぼす可能性があります。
また、私たちの運営は、私たちの情報技術、通信システム、インフラの持続的で効率的な動作、およびクラウドベースのプラットフォームに依存しています。これらのシステムおよびインフラのいずれも、地震、破壊、破壊、テロ、洪水、火災、停電、電気通信障害、コンピュータウイルス、またはシステムを意図的に破壊しようとする他の意図的な破壊または中断を受けやすい。自然または故意の災害が発生し、十分な通知がなく、私たちが使用している施設を閉鎖する任意の決定、または特にクラウドベースの仮想サーバ施設に意外な問題が発生した場合、当社のサービスに有害な中断が発生し、当社の業務に悪影響を及ぼす可能性があります。
私たちに対する製品責任訴訟は、私たちが重大な責任を負うことを招き、私たちが開発する可能性のある任意の候補製品の商業化を制限する可能性があります。
私たちは臨床試験で私たちの候補製品をテストすることに関連する固有の製品責任リスクに直面しており、私たちが開発可能な任意の候補製品を商業化すれば、より大きなリスクに直面する可能性がある。もし私たちが自分自身を弁護することに成功できなければ、このような候補製品のいかなる被害にも反対すれば、私たちは重大な責任を招くかもしれない。賠償責任請求は、是非曲直や最終結果にかかわらず、これらに限定されるものではない
•私たちが開発する可能性のある候補製品の需要を減らすことができます
•収入損失
•実験参加者や患者に多額の報酬を与え
•関連訴訟を弁護するための重要な時間と費用
•臨床試験参加者の脱退
•保険料が増加する
•私たちが開発する可能性のある候補品を商業化することはできません
•私たちの名声とメディアの深刻な否定的な関心を害した。
どのような結果も、私たちの業務、財務状況、運営結果、および成長の見通しに実質的な悪影響を及ぼす可能性があります。
私たちの保険証は十分ではないかもしれません。私たちのすべての潜在的な責任をカバーできないかもしれませんし、取り返しのつかないリスクに直面させるかもしれません。
私たちは私たちの業務が直面する可能性のあるすべての種類のリスクに保険をかけない。私たちの製品責任保険カバー範囲には私たちの臨床試験が含まれていますが、このような保険は私たちが発生する可能性のあるすべての責任をカバーするのに十分ではないかもしれません。私たちは製品責任保険のカバー範囲を増やすことを要求されるかもしれません。私たちは臨床試験を始めるたびに、すべての候補製品を商業化することに成功すれば、私たちの保険カバー範囲を増やす必要があると予想しています。保険の獲得性、保証条項と定価は引き続き市場状況の変化に従って変化する。私たちは私たちが決定した保険可能なリスクのために適切な保険範囲を得るために努力している。しかし、私たちは保険可能なリスクを正確に予測したり、定量化することができないかもしれません。適切な保険範囲を得ることができないかもしれません。保険会社は対応できないかもしれません。起こりうる保険事件を引き受けたいからです。いかなる重大な未加入責任も、私たちが多くの費用を支払う必要があるかもしれません。これは、私たちの業務、財務状況、運営結果、および成長に実質的な悪影響を及ぼすでしょう。
しかも、私たちは特定のキーパーソンに依存しているが、私たちはこのような個人にどんなキーパーソン生命保険も提供していない。したがって、もし私たちの最高経営責任者や他の幹部が死亡したり障害があったりすれば、私たちはこのような個人の欠席を助けるために何の補償も受けないだろう。そのような人を失うことは、私たちの業務、財務状況、運営結果、および成長の見通しに実質的な悪影響を及ぼすかもしれない。
私たちの業務は危険材料の使用に関連しており、私たちと私たちの第三者製造業者とサプライヤーは環境法律と法規を守らなければなりません。これは高価かもしれませんし、私たちの業務方式を制限しています。
私たちの研究開発と製造活動、そして私たちの第三者メーカーとサプライヤーの活動は、私たちが持っている危険材料の制御された貯蔵、使用、処分に関するものです。私たちと私たちの製造業者とサプライヤーはこれらの危険材料の使用、製造、貯蔵、運搬と処分に関する法律法規を守らなければならない。場合によっては、これらの危険材料とそれらを使用して発生した様々な廃棄物が私たちのメーカーの施設に貯蔵され、使用と処分を待っている。
私たちは汚染リスクを除去することができません。これは、薬品の供給と在庫、および環境破壊を含む私たちの研究開発作業と業務運営の中断を招き、高価な清掃作業を招き、これらの材料の管理と指定廃棄物の使用、貯蔵、処理、処分の適用法律と法規に基づいて責任を負うことができます。我々の第三者メーカーやサプライヤーがこれらの材料を処理·処分する際に使用するセキュリティプログラムは、全体的にこれらの法律法規に規定されている基準に適合していると信じているが、状況が確かにそうであることは保証されず、これらの材料の意外な汚染や傷害のリスクを除去することもできない。この場合、私たちはそれによって生じるいかなる損害に対しても責任を負うことができ、このような責任は私たちの資源範囲を超える可能性があり、州、連邦、または他の適用機関は、いくつかの材料の使用を制限し、および/または私たちの業務運営を中断するかもしれない。また,環境法律法規は複雑で変化が頻繁であり,時間の経過とともにより厳しくなることが多い。私たちはこのような変化の影響を予測することもできないし、私たちの未来のコンプライアンス状況を決定することもできない。私たちは現在生物や危険廃棄物保険を受けていない。したがって、このような危険材料のいかなる汚染も、私たちの業務、財務状況、運営結果、成長の見通しに重大な悪影響を及ぼす可能性がある。
私たちの財務状況に関連するリスク
私たちの経営の歴史は限られており、設立以来ずっと大きな損失を被っており、予見可能な未来には引き続き重大な損失を被ることが予想される。
著者らは臨床段階の生物技術会社であり、神経変性疾患と腫瘍疾患のために細胞療法を開発し、運営歴史は限られており、これらの歴史に基づいてその業務と将来性を評価することができる。2017年の設立以来、私たちは重大な運営赤字が発生した。2023年12月31日と2022年12月31日までの年度の純損失はそれぞれ8300万ドルと2670万ドルだった。2023年12月31日現在、我々の累計赤字は1.621億ドルです。会いましょう“-私たちの業務や業界に関連するリスク-私たちは現在、私たちの運営と費用と対応金にサービスするのに十分な資金がありません。追加の資本が必要です。私たちの独立公認会計士と経営陣は、追加資本なしで経営を続ける能力に大きな疑いを示しました私たちの現在の財務と業務情報と関連するリスクに関するより多くの詳細な情報。
私たちは予測可能な未来に、私たちが私たちの候補製品を開発し続けるにつれて、運営損失が増加し続けると予想しています。また、以下の場合、私たちの費用は大幅に増加すると予想される
•SNK 01およびSNK 02の臨床発展を継続する
•メルクKGaAと協力した候補製品を含む、より多くの候補製品を臨床試験に押し出す;
•より多くの病気適応のために現在の候補品を開発しています
•より多くの候補品を発見し開発することです
•私たち自身の臨床と商業規模の臨床GMP施設を維持します
•規制当局の許可を求めて様々な管轄区の候補製品で商業販売を行っています
•私たちの知的財産権の組み合わせを維持し、拡大し、保護する
•他の候補製品や技術を買収したり許可したり
•上場企業の運営に関連する追加コストを発生させる
•商業化を支援するために、マーケティング、販売、および流通能力を内部または第三者と発展または確保すること;
•上記活動を支援するために従業員数と関連費用を増加させる。
私たちは、このような努力のコストが私たちが現在予想しているより高い、あるいはこのような努力が収入をもたらさないかもしれないということを発見するかもしれない。また,我々の経験は限られており,同業界会社がよく遭遇する多くのリスクや不確実な要因を克服することに成功していることは証明されていない。もし私たちが達成および/または持続的に利益を得ることができない場合、またはこれらの努力によって私たちが期待している成長を達成できなければ、私たちの業務、財務状況、または運営結果に大きな悪影響を及ぼす可能性がある。私たちが未来に利益を達成しても、私たちはその後の時期に利益を維持できないかもしれない。
私たちは製品販売から収入を得たことがなく、永遠に達成されたり利益を維持したりしないかもしれない。
私たちは臨床段階のバイオテクノロジー会社で、商業販売が許可されている製品もなく、製品販売から何の収入も得ていません。我々は活性化NK細胞に基づく神経変性疾患や腫瘍疾患の細胞療法の開発に焦点を当てており,我々の技術は比較的新しく,検証されていないことが大きい。2017年の設立以来、私たちは大部分の資源を私たちの候補製品の開発、私たちの知的財産権の組み合わせの構築、臨床試験を行い、私たちの内部製造能力を発展させ、業務計画を行い、資金を調達し、これらの業務に一般的かつ行政的な支援を提供してきた。したがって、私たちは私たちの業務を評価する意味のある業務を持っていません。もし私たちがより長い運営歴史や開発成功と商業化医薬製品の歴史を持っていれば、私たちの将来の成功や生存能力の予測はそんなに正確ではないかもしれません。私たちは、急速に発展しているバイオテクノロジー業界の企業がよく遭遇する多くのリスクや不確実な要因を克服する能力があることを証明していない。
私たちは持続的な運営と私たちの2つの主要な候補製品SNK 01とSNK 02に関連する巨額の研究開発とその他の費用を発生し続けている。私たちのすべての候補製品は大量の追加の開発時間と資源が必要で、それから私たちは規制部門の承認を申請したり、製品販売から収入を得ることができます。FDAまたは任意の他の規制機関は、SNK 01、SNK 02、または当社の任意の他の候補製品を承認しておらず、SNK 01、SNK 02、または私たちの他の候補製品がFDAまたは他の規制機関の承認を得ておらず、候補製品のマーケティングおよび販売に成功することができなければ、製品販売から収入を得ることはないと予想される。私たちが製品販売から収入を創出する能力は、以下の点での私たちまたは潜在的な未来のパートナーの成功にかかっています
•私たちの候補製品の臨床開発を完成させ
•陽性臨床試験に成功した候補製品のために求め、監督部門の許可を得た
•商業インフラを構築したり、商業化パートナーと協力したりすることで、候補製品を発売し、商業化する
•政府と第三者支払者が私たちの製品候補者に十分な保険と補償を提供する資格があります
•私たちのすべての候補細胞治療製品のための持続可能、拡張可能、反復可能、および譲渡可能な製造プロセスを確立し、維持し、強化し、
•候補製品に対する臨床開発および市場の需要を支援するために、数量および品質において十分な製品およびサービスを提供することができる第三者との供給および製造関係を確立し、維持することができる
•市場が私たちの候補品を実行可能な治療案として受け入れてくれます
•競争的な技術や市場の発展に対応しています
•必要に応じてより多くの内部システムとインフラを実施する
•私たちが参加する可能性のある任意の協力、許可、または他の手配で有利な条件を交渉し、このような協力で私たちの義務を履行する
•特許、商業秘密、ノウハウ、および商標を含む、私たちの知的財産権の組み合わせを維持、保護、拡大します
•第三者の妨害または侵害クレームを回避し、それを抗弁すること;
•人材を引きつけ、採用し、引き留める。
私たちは承認された候補製品の商業化に関連する費用が高いと予想する。FDAまたは他のグローバル規制機関が臨床試験および/または他の臨床前研究を要求する場合、私たちの費用は、現在予想されている試験および/または臨床前研究の範囲ではなく、現在の予想を超えるまで増加する可能性がある。
たとえ承認された製品の販売から収入を得ることができても、利益を上げることができない可能性があり、四半期や年度の収益性を維持または向上させることができない可能性がある。私たちは実現して利益を維持することができず、会社の価値を下げ、資金を集める能力を弱めることで、私たちの研究開発計画や業務の拡大、あるいは運営継続の努力を制限することができます。
東西岸融資協定と株式および商業融資協定(以下以下参照)は、各融資者に私たちのすべての資産に対する保証権益を提供し、金融契約および他の私たちの行動に対する制限を含み、私たちの運営の柔軟性を制限したり、他の方法で私たちの運営結果に悪影響を及ぼす可能性がある。
2023年6月、私たちは東西銀行と500万ドルの循環信用限度額協定を締結した。この循環信用限度額は、カリフォルニア州サンアナにある自社不動産の信託契約を含むNKGen Legacyのすべての資産の優先保有権を保証している。私たちはこの循環信用限度額を確保するために、銀行で少なくとも30万ドルの現金残高を維持することを要求され、2024年3月31日までに銀行で少なくとも1500万ドルの現金残高を維持することが要求され、その後、循環信用限度額の下に未返済残高がある限り、最低現金残高を維持しなければならない。東西銀行融資協定によると、最低現金残高要求を満たしていないと違約事件を構成し、これは東西銀行が東西融資協議下の債務の返済を加速することを許可し、NKGenが当該などの債務を返済できない場合、NKGenはNKGenの資産に対する担保償還権を喪失し、その所有する不動産を含み、当該不動産は東西銀行を受益者とする信託契約の制約を受ける。2024年4月5日、最低現金残高要件を会社唯一の現金預金商業銀行として東西銀行に変更し、満期日を2024年9月18日に延長する改正案に署名した。東西岸融資協定は、NKGenが融資協定項下の融資(借りたすべての利息と任意の費用とともに)を全額返済することにより、東西岸融資協定及びその下の担保権益を随時終了することを可能にする。本年度報告のForm 10-K部分を参照して、タイトルは“経営陣の財務状況と経営結果の検討と分析−流動資金と資本源−流動資金源−後続融資手配−もっと詳細を知っています
2024年4月に株式と商業融資協定を締結しました“株式と商業融資協定“)NKGen LegacyおよびBDW Investments LLC(”BDW“株式と商業融資協定”では、元金は最大500万ドルまでの多枝定期融資融資と規定されており、これらの定期融資は、カリフォルニア州サンアナにある不動産の信託契約を含むNKGen所有資産の第一優先留置権とNKGen遺産所有資産の第二優先留置権を担保しているが、東西銀行と債権者間の合意が必要である後続事件詳細については、総合財務諸表をご覧ください
私たちの未済債務の条項は、私たちの現在と未来の業務を制限し、将来の業務または資本需要に資金を提供したり、所望の方法で業務戦略を実行する能力に悪影響を及ぼす可能性があります。また、このような条約を遵守することは、私たちのビジネス戦略を成功させ、私たちの成長戦略に投資し、これらの制限されていない会社と競争することを難しくするかもしれない。
吾らが循環信用限度額協定或いは株式及び商業融資協定によって指定された任意の契約或いは支払い要求を遵守できなかった場合、循環信用限度額協定又は株式及び商業融資協議下の違約事件を招く可能性があり、貸金者に追加融資及び信用延期の提供の約束を終了させる権利があり、そして任意及びすべての未返済債務を計上及び未払い利息及び費用と共に即時満期及び支払いを宣言する。さらに、貸手は、基本的に私たちのすべての資産で構成された私たちに彼らに保証権益を付与した担保に対して訴訟を提起する権利があるだろう。もし私たちの未返済債務が加速すれば、私たちは融資のために再融資したり、十分な資産を売却して融資を返済するのに十分な現金や十分な資金を借りることができない可能性があり、これは私たちのキャッシュフロー、業務、経営業績、および財務状況に重大で不利な影響を与えるかもしれない。
私たちの2023年のNKMAXローン協定、東西岸ローン協定と株式と商業ローン協定の条項は私たちにいくつかの支払い義務を履行することを要求して、私たちを違約させる可能性があります。
我々は2023年1月から2023年4月までの間に一連の2023年のNKMAXローン協定に調印し、元金総額は500万ドルである。融資で得られたお金は私たちが運営資金として使用し、私たちの一般業務需要に資金を提供する。貸出年利率は4.6%、満期日は2024年12月31日。2023年6月に、吾らもEast West Bankと500万ドルの循環信用限度額合意を締結し、その金利は(I)一ヶ月の担保付き隔夜融資金利プラス2.9%或いは(Ii)7.5%の両者の中で比較的に高い者を基準とした。2024年4月に、吾らはBDWと最高500万ドルの多枝定期融資を締結し、東西岸ローン協定がまだ完成していない限り、あるいは東西岸ローン協定が再融資された場合、このローンの年間金利は東西岸ローン協定に適用される金利に等しく、あるいは東西岸ローン協定あるいはその任意の再融資手配が未返済のいかなる日でもなく、定期ローンの利息は1ヶ月期SOFRプラス2.85%に等しい。しかし、いずれの場合も、年利率はいつでも7.50%を下回ってはならない。もし私たちが2023年のNKMAXローン協定の下で違約すれば、適用される弁護士費を含めてNKMAXにすべての催促費用を支払わなければなりません。もし私たちが東西岸ローン協定または株式と商業ローン協定に基づいて違約した場合、貸主の選択の下で、すべての債務は直ちに満期になって支払います。非常に限られた例外は除外します。上記のいずれかの合意に基づいて違約事件が発生すると、他の合意(合併合意を含む)下の義務に違反する可能性がある。これらの貸主のいずれかの違約事件に対するいかなる声明も、私たちの業務と将来性に実質的な損害を与え、私たちが業務を展開する方法を制限する可能性がある。
政府の規制に関するリスク
FDAと同様の外国規制機関の規制承認過程は長く、時間がかかり、本質的には予測不可能であり、必要な臨床試験を完了しても、私たちのどの候補製品がいつ、あるいは規制承認を受けるかどうかを予測することはできず、どのような規制承認も私たちが求めているよりも狭い適応を得るためである可能性がある。
生物製品を含む薬品の研究、テスト、製造、ラベル、承認、販売、輸入、輸出、マーケティングと流通はすべてアメリカ国内外のFDAとその他の監督管理機関の広範な監督管理を受けている。FDAのBLA承認を得るまで、私たちは米国でいかなる生物医薬製品も販売することを許可されなかった。我々はこれまでFDAにBLAを提出したこともなく,類似した外国当局に類似した承認文書を提出したこともない.BLAは、各必要な適応の候補製品の安全性および有効性を決定するために、広範な臨床前および臨床データおよび支持情報を含まなければならない。BLAはまた、製品の識別チェーンおよび保管チェーンに関する情報を含む製品の化学、製造および制御に関する重要な情報を含む必要がある。
我々の候補製品はFDAや同様の外国規制機関の規制承認を得ることができない可能性があるが、これらに限定されない
•私たちの臨床試験の設計や実施には同意しません
•私たちの候補製品が安全で有効であること、またはその提案の適応が積極的な利益/リスクプロファイルであることを監督管理機関に証明できなかった
•臨床試験は承認に必要な統計的意義レベルに達しなかった
•GCPと国際調整理事会が規定したガイドラインに従って臨床試験を行っていない
•前臨床研究や臨床試験データの説明には同意しません
•私たちの候補製品の臨床試験から収集されたデータが不足しており、BLAまたは他の提出を支持し、提出したり、規制部門の承認を得たりすることができない
•私たちと臨床および商業用品契約を締結した第三者メーカーまたは私たち自身の製造施設の私たちの製造プロセスまたは施設の承認を得ることができなかった;または
•審査政策或いは法規の変化は、著者らの臨床前と臨床データが承認を得るのに十分ではない。
この長い承認過程と将来の臨床試験結果の予測不可能性は、規制部門の承認を得られず、私たちの候補製品を販売することができなくなり、これは私たちの業務、運営結果、将来性を深刻に損なうことになるかもしれない。FDAまたは同様の外国の規制機関は、承認を支援する追加の臨床前または臨床データを含むより多くの情報を必要とする可能性があり、これは、承認および私たちの商業化計画を延期または阻止するか、または開発計画を放棄することを決定する可能性がある。もし私たちが承認されれば、規制機関は私たちの任意の候補製品の適応が私たちが要求しているものよりも少ないか限られているかもしれない(最も商業的な見通しのある適応を承認できないことを含む)、高価な発売後の臨床研究の表現によって承認されるかもしれない、またはそのラベルが候補製品の商業化に必要または必要なラベル宣言を含まないことを承認するかもしれない。私たちの製品候補製品が臨床試験でその安全性と有効性の終点に達しても、監督部門はその審査プロセスを適時に完成できない可能性があり、あるいは私たちは監督部門の許可を得られない可能性がある。
私たちは私たちの候補製品の新規性が規制部門の承認を得る上でさらなる挑戦をもたらすと予想している。FDAは諮問委員会(The Consulting Committee)と呼ばれる専門家グループを必要とする可能性もある諮問委員会)は、セキュリティおよび有効性データがマーケティング許可をサポートするのに十分であるかどうかを審議する。諮問委員会の意見には拘束力はないが,FDAが諮問委員会の提言を常に遵守しているため,完成した臨床試験に基づいて候補製品のマーケティング認可を得る能力に大きな影響を与える可能性がある。さらに、将来の立法や行政行動における追加的な政府規制、または製品開発、臨床試験、審査過程における規制機関の政策の変化による遅延や拒否に遭遇する可能性がある。したがって、私たちの候補製品の規制承認経路は不確実で複雑で高価で長く、承認されないかもしれない。規制機関はまた、要求されたよりも限られた適応の候補製品を承認することができ、または狭い適応、警告、またはREMSの形態で重大な制限を加えることができる。これらの規制機関は、使用条件に関連する予防または禁忌症を含むラベルを要求することができ、あるいは高価な発売後の臨床試験の表現に基づいて承認される可能性がある。さらに、規制当局は、私たちの候補製品の商業化に必要なまたは望ましいラベル宣言を承認しないかもしれない。監督管理部門は、上場許可を得た後、当該製品の承認を撤回または一時停止したり、その販売に制限を加えたりすることができる。上記のいずれの状況も、私たちの候補製品のビジネス見通しに重大な損害を与え、私たちの業務、財務状況、運営結果、および見通しに重大な悪影響を及ぼす可能性があります。
私たちは今も未来もアメリカと特定の外国の輸出入規制、制裁、禁輸、反腐敗法律、反マネーロンダリング法律法規の制約を受けるだろう。このような法律基準を遵守することは国内と国際市場での私たちの競争能力を弱めるかもしれない。私たちは違反によって刑事および/または民事責任と他の深刻な結果に直面する可能性があり、これは私たちの業務を損なうだろう。
私たちの候補製品は、アメリカの輸出管理法規、アメリカ税関法規、アメリカ財務省外国資産規制事務室によって実施された様々な経済·貿易制裁法規、1977年のアメリカ反海外腐敗法、アメリカ連邦法典第18編201節に含まれるアメリカ国内賄賂法規、アメリカ旅行法、アメリカ愛国者法、そして私たちが活動を展開している国の他の州と国の反賄賂と反マネーロンダリング法律を含む輸出規制と輸入法律法規の制約を受ける。私たちの候補製品の輸出は輸出規制と制裁の法律法規を守らなければならない。場合によっては、いくつかの許可、許可、または報告要件を実行する必要があるかもしれない。さらに、これらの法律は、特定の政府、個人、実体、国、および地域に私たちのいくつかの候補製品を供給することを完全に制限または禁止するかもしれない。私たちの候補製品の変更または適用される輸出または輸入法律法規の変更は、他の司法管轄区域で私たちの候補製品を発売または提供する遅延を招き、他の人が私たちの候補製品を使用することを阻止するか、または場合によっては、特定の国、政府または個人への私たちの候補製品の輸出または輸入を完全に阻止する可能性がある。私たちの輸出または候補製品能力を提供するいかなる制限も、私たちの業務、財務状況、および運営結果に悪影響を及ぼす可能性があります。
反腐敗法の解釈は広く、会社とその従業員、代理人、第三者中間者、合弁パートナー、および協力者の直接的または間接的な許可、約束、提供、または不正な支払いまたは福祉の公共または民間部門の受給者への提供を禁止する。われわれは海外でCROを用いて臨床試験活動を行うことができる。また、我々の候補製品が商業化段階に入ると、および/または必要な許可、許可証、および他の規制承認を得ると、第三者仲介者を招いて、私たちの候補製品や解決策を海外に販売することができるかもしれない。私たちまたは私たちの第三者仲介者は、政府機関または国有または付属実体の役人や従業員と直接的または間接的な相互作用を持っている可能性がある。私たちは、私たちが明確に権限を持っていなくても、または実際にこれらの活動を理解していなくても、これらの第三者仲介機関、私たちの従業員、代表、請負業者、パートナー、および代理人の腐敗または他の不正活動に責任を負わなければならないかもしれない。もし私たちがこのような法律と法規を守らなければ、私たちと私たちのいくつかの従業員は、大量の民事または刑事罰金と処罰、監禁、輸出入特権の喪失、資格取り消し、税金の再評価、契約違反と詐欺訴訟、名声損害、その他の結果に直面するかもしれない。
私たちは反腐敗政策をとっており、“海外腐敗防止法”や世界各地での業務に適用される他の反腐敗法律の遵守を求めています。しかし、私たちは私たちの従業員と第三者仲介機関がこの政策やこのような反腐敗法律を遵守することを保証できない。反腐敗と反マネーロンダリング法を守らなければ、私たちは告発者の苦情、調査、制裁、和解、起訴、他の調査、または他の法執行行動を受けるかもしれない。このような行動を開始したり、政府または他の制裁を実施したり、または可能な民事または刑事訴訟で私たちが勝つことができない場合、私たちの業務、運営結果、および財務状況は実質的な損害を受ける可能性がある。また、どの行動への対応も、経営陣の注意力と資源の重大な移転、巨額の国防·コンプライアンスコスト、その他の専門費用を招く可能性がある。場合によっては、法執行当局は私たちに独立したコンプライアンス監督官を任命させるかもしれませんが、これは追加のコストと行政負担を招く可能性があります。
医療改革計画と他の行政と立法提案は私たちの業務を損なうかもしれない。
米国、メキシコ、日本、EU、または任意の他の管轄区域の将来の立法または行政行動によって生じる可能性のある政府規制の可能性、性質、または程度を予測することはできない。アメリカでは、議会は最近数回の調査を行い、連邦と州立法を提出し、公布し、薬品定価の透明性を高め、定価とメーカー患者計画との関係を審査し、政府の薬品に対する計画精算方法を改革することを目的とした。例えば、2022年8月16日、総裁·バイデンは“2022年インフレ降下法案”に署名した(アイルランド共和軍)が、(I)米国衛生公衆サービス部に指示することを含む法律となるHHS)連邦医療保険カバーのいくつかの高支出、単一由来薬物および生物製品の価格を交渉し、(Ii)連邦医療保険B部分およびD部分に基づいてリベートを徴収して、インフレを超える価格上昇を処罰する。これらの規定は法的挑戦を受ける可能性があるにもかかわらず、2023年度から段階的に施行されるだろう。これらの計画の実施に伴い,HHSは指導意見を発表·更新し続けている。アイルランド共和軍がどのように実施されるかは不明であるが,製薬業に大きな影響を与える可能性がある。また,バイデン政府の2022年10月の行政命令に応えるために,HHSは2023年2月14日に報告を発表し,医療保険と医療補助革新センターが試験する3種類の新しいモデルを概説し,これらのモデルは薬品コストを低減し,可獲得性を促進し,医療の質を向上させる能力に基づいて評価する。これらのモデルが将来の任意の医療改革措置で使用されるかどうかは不明である。もし私たちまたは私たちが接触する可能性のある任意の第三者が既存の要求の変化に緩やかに適応できない場合、または新しい要求や政策を採用することができない場合、または私たちまたはそのような第三者が規制適合性を維持できない場合、私たちの候補製品は得られた可能性のあるいかなる規制承認も失う可能性があり、私たちは利益を達成したり維持することができないかもしれない。さらに、将来の価格制御または医薬品定価に関連する他の価格設定法規の変化または否定的な宣伝は、私たちの医薬製品に受け取ることができる費用を制限する可能性があり、これは、私たちの候補製品が商業的に生存できず、許容可能な条項で追加資本を調達する能力に大きな悪影響を及ぼす可能性がある。
もし第三者支払者が私たちの候補製品に十分な保険と補償を提供できなければ、私たちの経営業績と全体の財務状況に実質的な悪影響を及ぼす可能性があります。
私たちが規制部門の承認を得る可能性のある任意の候補製品のカバー範囲と精算状態には、重大な不確実性がある。いずれの候補製品の販売も,承認されれば,連邦医療保険や医療補助などの政府医療計画や,商業健康保険会社や管理医療組織などの個人支払者を含む第三者支払者が製品コストを支払う程度にある程度依存する.第三者支払人は彼らがどの薬を保証するか、そして彼らが保険薬に提供する精算金額を決定する。米国では支払者間に保険や補償決定のための統一的な制度はない。また、支払者が商品に保険を提供するか否かを判定する過程は、価格又は販売率を設定する過程と分離する可能性があり、保険が承認されると、支払者は製品に料金を支払う。第三者支払者は、承認されたリストまたは処方表上の特定の製品に保証範囲を制限することができ、FDAによって承認された特定の適応のすべての製品を含まない可能性がある。
我々の候補製品が保険や精算を受けることを確保するためには,承認されると,その製品の医療必要性やコスト効果を証明し,FDAや他の同様の規制承認を得るために必要な高価な研究を行う必要があるかもしれない。私たちが薬物経済学の研究を行っても、私たちの候補製品が承認されると、支払人に医学的に必要あるいは費用効果が高いと思われないかもしれない。また、支払者が製品に保険を提供することを決定することは、十分な返済率を承認することを意味するものではない。
また,政府や民間保険会社がより低いレートを実施し,サービスプロバイダと契約料率を下げることで医療コストを抑制しようとしていることに伴い,米国の医療業界はコストを抑制する傾向を経験している。したがって、私たちの候補製品を使用する手続きが承認されると、費用便益に合ったレベルで精算されるかどうかを決定することはできない。実行されたプログラムタイプに基づいて金額を設定する方法を使用する第三者支払者が、これらのコストをプログラムの総コストに組み込むために、候補製品のコストが合理的であると考えるかどうかも決定できない。保険を提供しても、承認された精算金額は、利益を達成するのに十分な価格を確立したり維持したりするのに十分ではないかもしれません。また、将来的に第三者決済者が使用する精算方法がどのように変化するかは予測できない。
マーケティング承認を受けた任意の候補製品に対して、第三者支払者から保険と十分な補償を迅速に得ることができません。これは、私たちの経営業績、製品の商業化に必要な資金を調達する能力、および私たちの全体的な財務状況に実質的な悪影響を及ぼす可能性があります。
1つの管轄区域で私たちの候補製品の上場承認または商業化を獲得し、維持することは、他の管轄区域で私たちの候補製品のマーケティング承認を得ることに成功するという意味ではありません。
承認手続きは司法管轄区域によって異なり、1つの管轄区で行われる臨床試験は他の管轄区の監督機関によって受け入れられない可能性があるため、米国と異なるか、または米国の要求と行政審査期限よりも大きい場合があり、追加の臨床前研究または臨床試験を含む。米国以外の多くの管轄区では、候補製品は先に精算許可を得てから、その管轄区で販売を許可することができる。場合によっては、私たちが私たちの製品のために受け取る価格もまた承認されなければならない。
もし私たちがアメリカ国外で承認された製品を販売すれば、私たちは商業化の過程で追加のリスクに直面すると予想されますが、これらに限定されません
•外国の治療承認に対する様々な規制要求;
•知的財産権の保護を減らすことです
•関税、貿易障壁、規制要求の意外な変化
•インフレ、特に外国経済と市場の政治的不安定を含む経済的疲弊
•外国に住んだり旅行したりする従業員は税収、雇用、移民、労働法を遵守する
•外国為替変動は、営業費用の増加と収入の減少、他の国での業務展開に付随する他の義務を招く可能性がある
•海外清算、定価、保険制度
•労働騒乱がアメリカよりも一般的な国では労働力の不確実性
•海外の原材料の供給や製造能力に影響を与える事件による生産不足;
•地政学的行動による業務中断は、戦争とテロ(例えば、ロシアとウクライナとの間の軍事衝突やイスラエル列国のハマスに対する戦争)、地震、台風、洪水、火災を含む自然災害、その他の公衆衛生危機、疾病、流行病、または流行病を含む。
私たちは以前このような分野で経験がなかった。また、私たちがその中で業務を展開する可能性のある多くの国は、複雑な規制、税金、労働者、その他の法律要件を規定しており、これらの要求を遵守する必要があるだろう。上記のようないかなる困難に遭遇すれば、私たちの業務、財務状況、経営業績と成長見通しに重大な悪影響を及ぼす可能性がある。
我々の業務運営や調査者,医療専門家,コンサルタント,第三者支払者,患者組織と顧客との関係は,適用される詐欺や濫用,その他の医療法律や法規の影響を受け,罰を受ける可能性がある。
これらの法律は、私たちがどのように私たちの候補製品を研究、マーケティング、販売、流通するかを含めて、私たちが業務を展開する業務または財務的手配と関係を制約するかもしれない。これらの法律には、アメリカ連邦反リベート法規、アメリカ連邦民事と刑事虚偽クレームと民事罰金法律、民事虚偽請求法、経済·臨床健康衛生情報技術法案によって改正された1996年連邦健康保険携帯性と責任法案、アメリカ医師支払い陽光法案とその実施条例、州反リベートと虚偽請求法を含む米国州法律法規、製薬会社に製薬業界の自発的コンプライアンスガイドラインとアメリカ連邦政府が公布した関連コンプライアンスガイドラインの遵守を要求する法律が含まれている。または他の方法で医療提供者および他の潜在的な紹介源に支払う可能性のある費用を制限し、医薬品製造業者に価格設定およびマーケティング情報に関連する報告書を提出することを要求する法律、医薬品販売代表の登録を要求する法律、場合によっては健康情報のプライバシーおよび安全を管理する法律、ならびに医療提供者との相互作用およびそれに支払う報告要件を詳細に説明することを含む他の管轄区域の同様の医療法律法規を制限する。
不正行為を識別し、阻止することは常に可能ではなく、私たちがこのような活動を発見し、防止するための予防措置は、未知または未管理のリスクまたは損失を効果的に制御することができないか、またはこれらの法律または法規を遵守できないことによる政府の調査または他の行動または訴訟から私たちを保護することができないかもしれない。我々の内部運営と将来の第三者の業務配置が適用される医療法律や法規に適合することを確保し、巨額のコストにも関わる。私たちの業務が上記の任意の法律または私たちに適用される可能性のある他の任意の政府の法律および法規に違反していることが発見された場合、私たちは、MedicareおよびMedicaidまたは他の国または司法管轄区域の同様の計画、違反、返却、個人監禁、契約損害、名声損害、利益減少、および私たちの業務の削減または再編に関する告発を解決するために、民事、刑事および行政処罰、損害賠償、罰金、MedicareおよびMedicaidまたは他の国または司法管轄区域の同様の計画のような重大な処罰を受ける可能性がある。もし私たちがそれと業務を行うことを期待している任意の医師や他の提供者や実体が適用されない法律を遵守していないことが発見された場合、彼らは政府の援助された医療計画や監禁から除外されることを含む刑事、民事または行政制裁を受ける可能性があり、これは私たちの業務運営能力に影響を及ぼす可能性がある。さらに、このような行動を防御するには費用がかかり、時間がかかる可能性があり、多くの人的資源が必要となる可能性がある。上記のいずれも、私たちの業務、財務状況、経営結果、および成長の見通しを深刻に損なう可能性があります。
私たちは、厳格で変化する法律、法規、規則、契約義務、政策、およびデータプライバシーやセキュリティに関する他の義務の制約を受けています。私たちが実際にまたはそのような義務を履行できなかったことは、規制調査または行動、訴訟、罰金および処罰、業務運営中断、名声損害、収入または利益損失、およびその他の不利な業務結果を招く可能性があると考えられている。
通常の業務プロセスにおいて、我々は、独自および機密の商業データ、商業秘密、知的財産権、臨床試験敏感第三者データ、業務計画、取引および財務情報に関連する試験参加者データ(総称して“敏感データ”と総称する)を含む個人データおよび他の敏感な情報を収集、受信、記憶、処理、生成、使用、送信、開示、提供、保護、処置、送信および共有する(総称して“敏感データ”と呼ぶ)。
私たちのデータ処理活動は、様々な法律、法規、ガイドライン、業界基準、外部および内部プライバシーおよびセキュリティポリシー、契約要件、およびデータプライバシーおよびセキュリティに関連する他の義務のような多くのデータプライバシーおよびセキュリティ義務を負うことができます。
米国では、連邦、州、地方政府は、データ漏洩通知法、個人データプライバシー法、消費者保護法(例えば、連邦貿易委員会法案第5条)、および他の同様の法律(例えば、盗聴法)を含む多くのデータプライバシーおよびセキュリティ法律を公布している。例えば、2018年“カリフォルニア消費者プライバシー法案”(“CCPA」 ) は、消費者、事業者の代表者、および従業員の個人情報に適用され、事業者はプライバシー通知で特定の開示を提供し、特定のプライバシー権を行使するカリフォルニア州居住者の要求を尊重することを要求します。CCPA は、違反ごとに最大 7,500 ドルの民事罰則を規定し、特定のデータ侵害の影響を受けた民間訴訟当事者が重大な法定損害賠償を回復することを可能にします。CCPA は臨床試験の文脈で処理される一部のデータを免除しますが、 CCPA はコンプライアンスコストとカリフォルニア州居住者に関するその他の個人データに関する潜在的な責任を増加させます。さらに、 2020 年のカリフォルニア州プライバシー権法は、個人が個人情報を修正する新たな権利を追加し、法律を実施し執行するための新しい規制機関を設立するなど、 CCPA の要件を拡大しています。バージニア州やコロラド州などの他の州でも包括的なプライバシー法が成立しており、同様の法律が他のいくつかの州や連邦および地方レベルで検討されている。これらの州は、 CCPA のように、臨床試験の文脈で処理されるデータの一部を免除していますが、これらの進展はコンプライアンス努力をさらに複雑にし、当社および当社が依存する第三者の法的リスクとコンプライアンスコストを増加させる可能性があります。
アメリカ以外では、ますます多くの法律、法規、業界標準がデータプライバシーとセキュリティを規範化し、私たちの拡張に従って私たちに適用されるかもしれません。例えば、EUの“一般データ保護条例”(“EU GDPR)と連合王国のGDPRは個人データの処理に厳しい要求をしている。例えば、EU GDPRによれば、会社は、一時的または最終的なデータ処理および他の是正行動の禁止に直面する可能性があり、最大2000万ユーロまたは世界の年収の4%までの罰金、または法的許可によってその利益を表す様々なデータ主体または消費者保護組織によって提起された個人データに関連する個人訴訟を処理することができる。
さらに、データの現地化要求や国境を越えたデータの流れの制限は、個人データを他の管轄地域から米国や他の国に移すことができない可能性がある。例えば、ヨーロッパや他の司法管轄区域では、データの現地化や他の国への個人データの移転を制限する法律が制定されている。他の司法管轄区域はそのデータ現地化と国境を越えたデータ転送法に対して類似の厳格な解釈を行う可能性がある。
データプライバシーやセキュリティ法律に加えて、私たちは将来、業界組織が採用している業界基準や他のこのような義務によって契約上制約される可能性があります。私たちはまた、データプライバシーやセキュリティに関する契約義務の制約を受けており、これらの義務を守る努力は成功しないかもしれません。プライバシーポリシー、マーケティング資料、およびデータプライバシーおよびセキュリティに関する他の声明も発表しています。もしこのような政策、材料、または声明が私たちの接近に欠陥があることが発見された場合、透明性の欠如、詐欺的、不公平または不実であれば、私たちは調査、規制機関の法執行行動、または他の不利な結果を受けるかもしれない。
データプライバシーやセキュリティに関する義務は急速に変化しており,ますます厳しくなり,規制の不確実性をもたらしている。さらに、これらの義務は、法ドメイン間で不一致または衝突する可能性がある異なる適用および解釈される可能性がある。これらの義務を準備して遵守するには、私たちが大量の資源を投入する必要があり、私たちのサービス、情報技術、システム、やり方、および個人データを処理する任意の第三者を代表するサービス、情報技術、システム、およびやり方を変更する必要があるかもしれません。しかも、このような義務は私たちが私たちのビジネスモデルを変えることを要求するかもしれない。
私たちは、私たちのデータプライバシーやセキュリティ義務を守る努力に失敗することがある(または失敗したと考えられる)。また、私たちが努力しているにもかかわらず、私たちが依存している人や第三者がこのような義務を履行できない可能性があり、これは私たちの業務運営に悪影響を及ぼす可能性があります。私たちまたは私たちが依存している第三者が適用されるデータプライバシーおよびセキュリティ義務を解決または遵守できないとみなされていない場合、私たちは、政府の法執行行動(例えば、調査、罰金、監査、検査、および同様の行動)、訴訟(集団訴訟クレームを含む)、追加の報告要件および/または監視、個人データの処理の禁止、個人データの廃棄または使用の命令、およびこれらに限定されない重大な結果に直面する可能性がある。このような事件は、顧客流出、個人データの処理または特定の司法管轄区域での運営ができないこと、私たちの製品を開発すること、またはそれを商業化する能力が限られていること、任意のクレームまたは調査のために時間と資源をかけて弁護すること、否定的な宣伝、または私たちのビジネスモデルまたは運営の重大な変化を含む、私たちの名声、業務または財務状況に重大な悪影響を及ぼす可能性がある。
製造業に関するリスク
私たちの製造過程は斬新で複雑で、私たちは生産中に困難、あるいは内部製造上の困難に直面する可能性があり、承認されれば、これは臨床試験または患者に十分な候補製品を提供する能力を延期または阻止することになる。
私たちの候補製品は工学改造を経た人体細胞であり、これらの候補製品を製造する過程は複雑で、高度に監督管理され、そして多くのリスクに直面している。私たちの候補製品を製造することは、健康なドナーまたは患者から血球を採取し、末梢血単球からNK細胞を分離し、NK細胞を活性化および拡大し、凍結保存、貯蔵し、最終的に出荷することを含む。著者らは一貫して候補細胞療法製品を確実に生産する能力は著者らの成功に重要であり、しかも高級臨床試験或いは商業化に必要なレベルに拡張することに関連するリスクは、コスト超過、材料源の潜在的な問題、品質管理、安定性問題、一致性と原材料の適時獲得性を含む。
我々の生産過程は、ドナーから出発材料を収集すること、そのような材料を製造場所に搬送すること、最終製品を臨床試験受給者に搬送すること、製品を準備することを管理すること、製造問題または異なる製品特性などに関連する物流問題であり、ドナー出発原料の差異、試薬ロット間の差異、製造過程における中断、汚染、設備または試薬故障、設備設置または操作の不適切、サプライヤーまたはオペレータの誤り、細胞成長の不一致、および製品特性の多変性を含むため、製品損失や失敗、または患者の予後に悪影響を及ぼす可能性のある製品変化の影響を受けやすい。
正常製造プロセスとの微小な偏差でも生産量の低下、製品欠陥、その他の供給中断を招く可能性がある。我々の候補製品において、または製品または他の材料を製造する任意の製造施設において微生物、ウイルス、または他の汚染が発見された場合、そのような製造施設は、汚染を調査および修復するために長い間閉鎖される必要がある可能性がある。製造過程中のいかなる故障も一連の製品が使用できなくなる可能性があり、供給に影響を与え、私たちの臨床試験の進捗を遅延させる可能性があり、監督部門の候補製品の承認に影響を与える可能性があり、罰金や処罰を招く可能性があり、あるいは私たちと私たちの候補製品の名声を損なう可能性がある。
私たちの候補製造製品は様々な原因で要求された規格を満たすことができないかもしれません。出発材料の変化性、正常な製造プロセスとの偏差、あるいは特定のプロセスステップの十分な最適化を含む。このような規格に適合しない場合は、供給不足を招くか、または追加の監督、現場、および患者の承認を得て臨床試験を継続することに関連する遅延を招く可能性がある。必要とされる追加の承認が得られない場合、生産が再起動を必要とするため、および/または患者が研究に残り続けることができない可能性があるので、追加の遅延が生じる可能性がある。SNK 01、SNK 02、または私たちの他の候補製品の臨床開発または商業化のいかなる遅延も、私たちの業務、財務状況、運営結果、および成長の将来性に重大な悪影響を及ぼす可能性がある。
開発過程の異なる時点、さらには商業化後に、コストの抑制、規模の実現、加工時間の短縮、製造成功率の向上、その他の理由で、様々な理由で私たちの製造プロセスを変更する可能性があります。私たちの製造プロセスを変更することは、予想される目標を達成できないリスクをもたらし、これらの変更のいずれも、私たちの候補製品の表現が異なり、私たちが行っている臨床試験の結果、あるいは製品が商業化された後の性能に影響を与える可能性がある。臨床開発過程における我々の流れの変更は、早期臨床段階または試験早期段階で使用される候補製品と、臨床後期または試験後期に使用される候補製品との比較性を示すことを要求する可能性がある。細胞治療製品の比較可能性を決定することは困難であり,拡大過程における過程変化を検証する努力を複雑化させる可能性がある。商業化の前または後に我々の製造プロセスの他の変更は、最終製品と早期プロセスを使用した臨床試験で使用される候補製品との比較性を示すことを要求する可能性がある。このような展示は、任意の修正されたプロセスから追加の非臨床的または臨床的データを収集し、その後、このような修正されたプロセスで生産された候補製品の市場承認を得る必要があるかもしれない。これらのデータが安全性または有効性の面で最終的に早期試験または同一の試験の早期試験で見られるデータと比較できない場合、または規制当局が比較可能性が確立されたことに同意しない場合、我々のプロセスをさらなる変更および/または追加の臨床試験を行う必要があるかもしれないが、いずれの場合も、関連候補製品の臨床開発または商業化を著しく遅らせる可能性があり、これは、私たちの業務、財務状況、運営結果、および成長見通しに大きな悪影響を及ぼす。
SNK 01臨床試験のために我々自身の内部製造施設でSNK 01を生産し,将来的にはSNK 02を含む他の候補製品を我々の内部製造施設で生産する予定であるにもかかわらず,候補製品の内部生産に問題が生じる可能性がある。われわれの現在の臨床GMP生産施設は期待される臨床試験の需要を満たすと信じているが,必要な用量やサイクル数が増加すれば,現在の生産プロセスは試験の登録を支援できない可能性があり,生産を拡大するまで遅延を招く可能性がある。私たちの製造施設は日々増加する生産需要を満たすことができると信じていますが、これは依然として従業員と大量の内部資源を増加させる必要があります。私たちの製造施設は規制要求によって遵守されるだろうが、私たちはこのような要求を達成することが難しいかもしれない。採用難やその他の問題により、内部製造施設の適切な人員配置に問題が生じる可能性があります。例えば,将来発生する可能性のある新冠肺炎変異や関連制限などの要因は,候補製品の生産に適切な人員を配置する能力に影響する可能性がある。現在のインフレ圧力は、我々の商業規模製造施設の建設コストにマイナス影響を与えており、引き続きマイナス影響を与える可能性がある。いくつかの材料の調達遅延や長い納期を含むグローバル·サプライチェーンの中断は、当社の商業規模製造施設の完成予定および/またはコストに悪影響を与え続ける可能性があります。私たちはまた従業員を訓練する上で問題に直面する可能性があり、私たちは私たちの候補製品を生産するために必要な複雑な製造過程を効果的に管理し、制御し、必要なすべての法規を遵守しなければならない。私たちはまた、製造過程に重要なサプライチェーン問題を適切に管理することが難しいことを発見するかもしれない。もし私たちが私たちの製造施設を設立、維持し、製造過程を管理し、制御し、法規を遵守することができなければ、私たちの候補製品の臨床開発や商業化は著しく遅延する可能性があり、これは私たちの業務、財務状況、運営結果、成長の見通しに重大な悪影響を及ぼすだろう。
私たちの製造施設の調整を遅延させ、規制部門の承認を得ることは、私たちの開発計画を延期し、候補製品の開発と収入を創出する能力を制限するかもしれません。
内部GMP製造は臨床製品供給を促進し,製造中断のリスクを低減し,より費用対効果のある製造を実現するために重要であると信じている。カリフォルニア州サンアナにGMP工場があり、早期臨床試験に必要な候補製品を提供することができます。
また、我々の生産施設は、GMPに適合し続けることを確実にするために、FDAや他の同様の規制機関の持続的な定期検査を受ける。私たちはこれらの法規或いは他の法規に対する私たちの要求を遵守し、記録することができず、臨床候補製品の供給の重大な遅延を招く可能性があり、あるいは臨床研究の終了或いは保留を招く可能性がある。適用される法規を遵守しないことは、罰金、禁止、民事処罰、私たちの1つ以上の臨床試験の一時停止または棚上げを要求すること、規制機関が私たちの候補薬物の上場を承認できなかったこと、遅延、一時停止または承認の撤回、免許取り消し、候補薬物の没収またはリコール、経営制限および刑事起訴を含む制裁を加える可能性があり、これらはいずれも、私たちの業務、財務状況、運営結果、成長の見通しに重大な悪影響を及ぼす可能性がある。
私たちは次のような問題に直面するかもしれませんが
•アメリカ国外の監督機関の絶えず変化するドナー伝染病テスト、追跡可能性、製造、候補製品の発表とその他の要求に関する規定を遵守する
•規制機関の基準または規範に適合する十分または臨床レベルの材料を一貫かつ許容可能な生産生産量およびコストで得ること
•私たちの生産施設では細菌や真菌やウイルス汚染
•自然災害やサプライチェーン中断による中断;
•合格者、原材料、または重要な請負業者が不足している。
私たちの候補製品が関連する規制機関の承認を得たら、市場需要を満たすために大量の商業供給が必要になるかもしれない。これらの場合、私たちは最初の生産レベルでの生産過程の重要な要素を増加または“拡大”する必要があるかもしれない。もし私たちが内部や第三者と十分な製造能力や経験を発展させることができなかった場合、生産を遅延させたり、経済的または合理的な規模や数量で私たちの候補製品を生産できなかったり、あるいはこのような拡大したコストが経済的に実行できない場合、私たちの開発計画および任意の承認された製品の商業化は重大な悪影響を受け、将来の需要を満たすのに十分な数の私たちの候補製品を生産できない可能性があり、私たちの業務、財務状況、運営結果、成長見通しは大きな悪影響を受ける可能性がある。
私たちの製造過程中の任意の汚染或いは中断、原材料不足、或いは私たちのサプライヤーが必要なコンポーネントを渡すことができなかったことは、私たちの臨床開発或いはマーケティング計画の遅延を招く可能性がある。
細胞療法生産の性質に鑑み,汚染のリスクがある。我々の候補製品において、または製品または他の材料を製造する任意の製造施設において微生物、ウイルスまたは他の汚染物質が発見された場合、そのような製造施設は、汚染を調査および修復するために長い間閉鎖される必要があるかもしれない。どの汚染も私たちが計画通りに候補製品を生産する能力に悪影響を与える可能性があるため、私たちの臨床試験を延期し、私たちの運営結果を損害し、名声を損なう可能性がある。私たちの製造過程で必要ないくつかの原材料は生物源から来ている。これらの原材料は入手が難しく、汚染されたりリコールされたりする可能性がある。原料不足、汚染、リコール、または我々の候補製品の生産における生物由来物質の使用を制限することは、商業生産または臨床材料の生産に悪影響または中断を与える可能性があり、これは、私たちの開発スケジュールおよび私たちの業務、財務状況、運営結果、および将来性に悪影響を及ぼす可能性がある。
私たちの候補製品の最適なドナーおよび製造パラメータはまだ決定されておらず、これは、候補製品の最適化または起こりうる任意の安全または治療効果の問題を解決する能力を阻害する可能性がある。
もし私たちの任意の臨床試験が私たちの任意の候補製品の安全性または有効性に問題があることを示すならば、ドナー選択基準または製造プロセスを修正してこれらの問題を解決する必要があるかもしれない。代替的に、プロセスの効率または候補製品の効果の向上に努力するために、製造プロセスを修正することを選択することができる。しかし、現在、著者らはドナーの特徴と製造技術パラメータがどのように著者らの工学NK細胞製品の体外と動物の治療効果研究における最適な機能潜在力に影響するか、あるいはこの潜在力の差がどのように人類の臨床試験で見られる治療効果に転化するかは、意義のある臨床反応を実現する患者の割合と任意のこのような臨床反応の持続時間を含む。私たちがこれらのパラメータに基づいて私たちの製造プロセスや製品の効力、安全性あるいは有効性を改善する能力は限られており、大量の試験とミスが必要かもしれません。これは私たちに大きなコストをもたらすかもしれません。あるいは私たちの候補製品の臨床開発と最終商業化の重大な遅延を招く可能性があります。
NK細胞、ウイルスベクター、主細胞バンク、および作業細胞バンクを保存するためにサードパーティに依存すると、任意の損傷または損失は交換遅延をもたらし、私たちのトラフィックは影響を受ける可能性があります。
NK細胞,ウイルスベクター,主細胞バンク,作業細胞バンクは第三者生物倉庫の冷凍庫に格納され,我々の生産施設の冷凍庫にも格納される。これらの材料がこれらの施設で破損した場合、これらの冷凍庫または私たちの予備電力システムの損失または故障、ならびに火災、停電、または他の自然災害による損傷を含む場合、私たちはNK細胞、ウイルスベクター、および主および作業細胞バンクの置換を確立する必要があり、これは臨床供給に影響を与え、私たち患者の治療を遅延させるであろう。代替材料を作ることができなければ、大量の追加費用が発生し、治療を遅延させた患者に責任を負う可能性があり、私たちの業務は影響を受ける可能性がある。
私たちはまだ候補製品に一年から二年以上の賞味期限を設定していません。これは商業供給と費用に影響を与えるかもしれません。
私たちはまだ私たちの候補製品を生産するための検証された方法を開発していません。長期貯蔵、大量生産、損傷せず、経済的に効率的で、1~2年以上変質しないようにしています。関連方法の策定が困難であるだけでなく,治療にこの方法を使用するための規制承認を得ることも困難である可能性がある。私たちの候補製品が安全に長期的に保存され、規制機関の満足度を達成できることを十分に証明できなければ、規制部門の許可を得て私たちの製品を市場に出し、さらに商業化する上で大きな遅延に直面する可能性がある。もし私たちが輸送目的のために私たちの候補製品を長期的に保存する検証された方法を開発できなければ、私たちの候補製品の採用を促進し、私たちの生産施設を利用して規模経済を実現する能力は制限されるだろう。私たちがこの方法を成功的に作ることができても、私たちは費用効果と信頼性のある流通と物流ネットワークを発展させる必要があり、私たちはそれができないかもしれない。
また、候補製品が長時間保存できない場合、私たちが生産した材料が期限が切れる前に使用されることを確実にするために、生産ロットを減らす必要があるかもしれない。この場合、私たちの生産過程の規模は私たちの期待した効率をもたらさず、候補製品の1剤当たりのコストは大幅に上昇するだろう。さらに、私たちの候補製品が長期的な安定性を確立していない場合、私たちは、より頻繁な生産運転を行うコスト、または安定性の問題によって生じる可能性のある候補製品の使用に関連する潜在的な紛争または問題のような大量の追加費用を生じる可能性がある。
私たちの知的財産権に関するリスクは
NKMAXとのライセンスプロトコルが終了すれば、私たちはNK細胞技術プラットフォームの重要なコンポーネントをサポートする権利を失うかもしれません。
2020年2月12日,2021年10月,2023年4月,2023年8月1日にNKMAX(会社間許可)と改訂されたライセンス契約を締結した。NKMAXは、会社間許可に基づいて、(I)アジア諸国および地域以外のすべての国および地域(“許可地域”)における任意のNK細胞医薬製品、プロセス、サービスまたは療法、またはこれらの任意の製品と任意の他の活性成分、製品またはサービスとの組み合わせ(“許可製品”)を研究、開発、製造、製造、使用するために、任意の分野のNK細胞治療に関連する特定の特許および技術の独占的(さらにはNKMAXおよびその付属会社)、印税付き再許可の許可を付与してくれた。許可地域での私たちの権利を支持するためにのみ許可地域以外で許可製品を製造して製造します。私たちは、会社間許可に従って私たちに提供されるいくつかの権利およびノウハウに依存して、SNK 01およびSNK 02のようないくつかの候補製品を生産し、開発します。私たちは以前にNKMAXに100万ドルの払い戻しできない前払い費用を支払いました。私たちあるいは私たちのどの付属会社も初めて監督機関から許可製品の承認を受けた後、いくつかの使い捨てマイルストーン費用をNKMAXに支払わなければなりません。司法管轄区域によって100万ドルから500万ドルまで様々です。また、私たち、私たちの付属会社あるいは私たちの許可者は許可製品の純売上高に対して中央値の印税を受け取ることができますが、慣例の減少を守らなければなりません。NKMAXは、重大な違反が治癒されていない、会社間許可に必要なお金を支払うことができなかったり、倒産したりするなど、何らかの事件が発生したときに会社間許可を終了する可能性があります。
NKMAXが会社間許可を終了すれば、私たちの候補製品(SNK 01およびSNK 02を含む)の開発、生産、またはマーケティングは重要または必要な知的財産権の使用を失う可能性があり、これは、これらの候補製品の商業化に成功し、私たちの業務、財務状況、運営結果、および成長の見通しに重大かつ不利な影響を与えることを阻害または阻止する可能性がある。上記のいずれかの状況が発生すると、候補製品の開発と商業化が遅れる可能性があり、さらに私たちの業務、財務状況、運営結果、成長見通しに重大な悪影響を及ぼす可能性がある。
私たちは第三者から追加の知的財産権許可を得る必要があるかもしれませんが、そのような許可は得られないかもしれませんし、商業的に合理的な条項では得られないかもしれません。
私たちの業務の成長は私たちが追加的な独占権を獲得したり許可したりする能力にある程度依存するかもしれない。例えば、私たちの計画は、第三者が保有する他の独占権を使用する必要がある可能性のある候補製品を含むことができる。私たちの候補製品はまた効率的で効率的に働くために特定の処方が必要かもしれない。このような処方は他の人たちが持っている知的財産権によってカバーされるかもしれない。私たちの組成物と既存の医薬組成物を含む製品を開発することができる。このような薬品は他人が持っている知的財産権によってカバーされるかもしれない。FDA、EMA、または他の外国規制機関は、私たちの候補製品に1つ以上のセット診断テストを提供することを要求するかもしれません。このような診断テストまたはテストは他の人たちが持っている知的財産権によってカバーされるかもしれない。私たちは入手できないかもしれませんが、私たちの業務運営に必要または重要な任意の関連第三者知的財産権が必要だと思います。私たちは合理的な費用または合理的な条項でこれらのライセンスのいずれかを得ることができないかもしれないが、もしあれば、これは私たちの業務を損なうだろう。このような第三者知的財産権がカバーする成分や方法の使用を停止する必要がある可能性があり、このような知的財産権を侵害しない代替方法の開発を求める必要がある可能性があり、たとえこのような不可能な代替方法を開発することができても、追加のコストと開発遅延をもたらす可能性がある。たとえ我々がこのような知的財産権の許可を得ることができても,どのような許可も非排他的である可能性があり,これは我々の競争相手が我々に許可してくれた同じ技術へのアクセスを可能にする可能性がある.
我々は、現在および将来の候補製品および技術の開発および商業化の権利について、他社が私たちに付与するライセンスの条項および条件をある程度制限されている。
私たちは第三者と締結された様々な知的財産権ライセンス契約の側であり、将来的により多くのライセンス契約を締結したいと考えています。これらのライセンスプロトコルは、SNK 01およびSNK 02を含む現在および将来の候補製品を生産および開発するために、第三者からいくつかの権利およびノウハウを得ることを可能にする。しかし、これらのライセンスは、すべての関連使用分野および将来的に私たちの技術および製品を開発または商業化するすべての地域でこのような知的財産権および技術を使用することを選択する独占的な権利を提供しない可能性がある。したがって、私たちは競争相手が私たちのすべてのライセンスに含まれる地域で競争製品を開発し、商業化することを阻止できないかもしれない。
また、学術や非営利機関の科学者と協力したり、コンサルティングパートナー関係を構築したりして、私たちが得られない技術や材料を得ることもできます。これらの協力またはコンサルティングパートナーシップを管理する合意には、これらの協力プロセスにおいて機関が作成した任意の発明の権利について許可交渉を行うオプションが含まれている可能性があるが、私たちは、機関と独占的許可について最終合意に達することができない可能性がある。
私たちはまた、他の方法では得られない技術や材料を得るために、商業実体と協力または許可協定を締結した。私たちがこのようなエンティティと達成した合意は、私たちの候補製品の発見、開発、または商業化に技術的許可を提供するかもしれない。場合によっては、このようなライセンスは非排他的である可能性がある。
このようなライセンスおよび他の契約は、そのようなライセンスおよび契約の解釈について、設定者および/または様々な第三者と食い違いを生じる可能性がある。発生する可能性のある任意のこのような相違の解決は、関連技術に対する私たちの権利範囲に影響を与えるか、または関連協定の下での財務または他の義務に影響を与える可能性があり、いずれも、費用対効果を有する方法で私たちの候補製品を開発し、それを商業化する能力を抑制することができ、これは、逆に、私たちの業務、財務状況、運営結果、および成長見通しに実質的な悪影響を及ぼす可能性がある。
私たちの既存の許可協定は、私たちの将来の許可協定は、様々な勤勉、マイルストーン支払い、特許権使用料、保険、賠償、その他の義務を負担することを要求すると予想されています。場合によっては、例えば深刻な条項に違反して、私たちの許可者は私たちの許可協定を終了することができる。これらの許可内で終了された場合、または基礎特許が予期される排他性を提供できなかった場合、競争相手は、規制部門の承認を自由に求め、私たちと同じまたは類似した製品を販売することができる。さらに、我々は、我々の許可者からより多くの許可を得ることを求める可能性があり、このような許可を得る際には、第三者(我々の競争相手を含む可能性がある)が既存の許可の一部の知的財産権の許可を得ることを許可する条項を含む、許可者に有利な方法で我々の既存の許可を修正することに同意することができるかもしれない。
さらに、私たちは、特許の準備、提出、起訴、維持、実行、および弁護、および第三者から許可された技術のための特許出願を制御する権利がないかもしれない。したがって、私たちはこのような特許と特許出願の準備、提出、起訴、維持、強制執行、そして弁護が私たちの最大の利益に合った方法で行われるということを決定することはできない。例えば、私たちが特許訴訟を制御し、許可者から許可を得た技術のための特許および特許出願を維持する権利がない場合、これらの許可者は、端末免責声明を提出することができ、および/または特許または特許出願期間を短縮する可能性のある他の行動をとることができる。もし私たちの許可者がこれらの特許を起訴、維持、強制執行および保護できなかった場合、またはこれらの特許または特許出願の権利を失う場合、私たちが許可した権利は減少またはキャンセルされる可能性があり、私たちはそのような許可権利主体として開発および商業化された任意の製品候補製品の権利が損なわれる可能性がある。さらに、私たちは私たちが彼らから許可を得た特許と特許アプリケーションに関連するすべての費用を私たちの許可者に清算し、起訴、維持、実行、弁護する必要があるかもしれない。さらに、これらの権利が縮小または強制的に実行されない場合、私たちの競争相手を含む第三者は、私たちの製品および技術と競争することができるかもしれない。
さらに、私たちのライセンス者は、第三者コンサルタントまたは協力者または第三者からの資金に依存する可能性があり、したがって、私たちのライセンス者は、私たちが許可を得た特許の唯一および独占所有者ではありません。他の第三者が私たちが許可した特許の所有権を持っている場合、彼らはこれらの特許を私たちの競争相手にライセンスすることができ、私たちの競争相手はそれと競争する製品と技術を販売することができるかもしれない。これは私たちの競争地位と私たちの業務を損なうかもしれない。
特許期間の持続時間は、候補製品における私たちの競争地位を十分に保護するのに十分ではないかもしれませんが、私たちの特許の満了は、私たちをより激しい競争に直面させるかもしれません。
2023年12月31日現在、私たちに割り当てられ、他人と共有して、私たちに与えられるかもしれない特許の組み合わせは、私たちのプラットフォーム、SNK 01、SNK 02およびそれらの特許シリーズに関連する、米国、ブラジル、カナダ、チリ、エジプト、ヨーロッパ、メキシコ、南アフリカおよびウクライナで発行された特許出願を含む。我々の発行済み特許組合せは,未解決の特許出願を含まず,満期日は約2033年6月から2039年1月までの予定である.我々の製品組合せには,発行された特許が含まれており,発行された場合には,未解決の非仮出願(特許協力条約出願を含む)も含まれており,満期日は約2033年5月から2043年11月までと予想される.特許期限調整、特許期限延長または免責声明など様々な事件が満期日に変更される可能性があります。私たちは私たちのSNK 01とSNK 02候補製品に対してもっと多くの特許出願を提出するかもしれない。しかし、私たちは私たちがこれらまたは他の候補製品のために申請したり、追加の特許保護を受けることができるという保証はない。
特許有効期間は、免責宣言の終了、特許期限の調整、補充保護証明書、および特許期限の延長を含む様々な要因によって短縮または延長される可能性がある。特許期限の延長や補充保護証明書は、一時特許変換の完全な1年期限までに提出されるなど、規制過程の影響を受ける可能性があり、特許期間を著しく延長しない可能性がある。私たちの特許保護はまた、政府特許機関によって提出された様々なプログラム、書類提出、費用支払い、および他の要求に従わないことによって減少またはキャンセルされる可能性がある。さらに、私たちまたは私たちのライセンシーが適用される特許期間の延長または調整を申請できなかった場合、私たちまたは私たちのライセンシーが付与した特許権を実行するためにより限られた時間があります。
候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。私たちはアメリカで特許期間の延長を求めることができるかもしれませんが、あれば、私たちが特許権を所有したり、取得したりする他の国/地域で延長を求めることもできます。米国では、1984年の“薬品価格競争と特許期限回復法”は、特許が正常満了後に最大5年間延長することを許可しており、特許は薬品承認日から14年以上強制的に実行できないことが条件であり、これは承認された適応(または延長期間中に承認された任意の他の適応)に限定される。さらに、各承認された製品は1つの特許のみを延長することができ、承認された製品、使用方法、または製造方法のための権利要件のみを延長することができる。しかし、FDAと米国特許商標局を含む適用当局(“USPTO)および他の国/地域の任意の同等の規制機関は、このような延期が利用可能かどうかの評価に同意しない可能性があり、私たちの特許延期の承認を拒否するか、または私たちが要求するよりも限られた延期を承認する可能性があるかもしれない。私たちは私たちに許可された特許を延長する権利がないかもしれないし、そのような許可が終了した場合、私たちは資格延長された特許を得る権利がないかもしれない。もし私たちが特許訴訟と私たちに許可された特許権の維持を担当すれば、私たちは適用される特許所有者に責任を負うかもしれない。もし私たちまたは私たちの許可者が私たちの候補製品および技術に対する特許および特許出願を維持できなかった場合、私たちは競争相手が私たちの候補製品と同じまたは似た製品を販売することを阻止できないかもしれない。また、他の商業化製品は、私たちと類似または同じ製品、および私たちの競争相手は、私たちの臨床および臨床前データを参考にして、私たちの開発および臨床試験への投資を利用し、他の場合よりも早く彼らの製品を発売することができるかもしれません。これは、私たちの候補製品の競争を増加させ、私たちの業務、財務状況、運営結果、成長見通しに実質的かつ不利な影響を与える可能性があります。
もし私たちまたは私たちの許可者が獲得した任意の特許保護が十分でなければ、私たちの競争相手は私たちと似たような製品や技術を開発して商業化することができます。
細胞治療市場の競争は激しく、そして迅速な技術変化の影響を受ける。私たちの成功は、これらの分野で使用される技術や製品の開発と保護において競争的地位を維持する能力と、私たちの候補製品と私たちの技術について米国および他の国で特許保護を獲得し、維持または許可する能力に大きく依存する。私たちは、私たちの候補製品や私たちの業務に重要な技術に関する特許出願をアメリカと海外に提出することで、私たちの独自の地位を保護することができます。もし私たちが私たちの知的財産権を保護できなければ、私たちの競争地位は、第三者が私たちとほぼ同じ製品や技術を製造、使用、または販売することができるかもしれないので、私たちの競争地位は、私たちが生み出した巨額の開発と許可コストを生じることがないかもしれないからだ。これは逆に市場での私たちの競争能力に実質的な悪影響を及ぼすだろう。
バイオテクノロジーや製薬会社の特許地位は通常不確定であり,複雑な法律や事実問題に関連しており,近年多くの訴訟のテーマとなっている。したがって,我々の特許権の発行,範囲,有効性,実行可能性,商業的価値は高い不確実性を持っている.私たちの許可内、処理されるべき、および将来の特許出願は、私たちを保護する技術または候補製品を保護する特許を発行すること、または他社が競争技術および候補製品を商業化することを効果的に阻止することをもたらす可能性がある。
特許訴訟過程は高価で、時間がかかり、複雑であり、私たちは必要または望ましいすべての特許出願を合理的なコストまたはタイムリーに提出、起訴、維持、または許可することができないかもしれない。私たちの研究開発成果の特許可能な側面を特定できないかもしれませんし、特許保護を受けるのが遅いと、私たちの研究や開発成果の特許可能な側面を特定できないかもしれません。
特許出願における特許請求範囲は,特許発行前に大幅に縮小することができ,特許発行後にその範囲を再解釈することができる.私たちが許可したり所有している特許出願が実際に特許の形で発表されても、それらの発表形態は私たちに意味のある保護を提供してくれたり、競争相手や他の第三者が私たちと競争することを阻止したり、他の方法で私たちにどんな競争優位性を提供してくれたりしません。我々の競争相手または他の第三者は、非侵害的に類似または代替製品を開発することによって、私たちの特許を回避することができるかもしれない。
発行後も、私たちのライセンス内特許または将来獲得した特許は挑戦される可能性があり、成功すれば、第三者からライセンスを取得する必要があるかもしれません。これらのライセンスは、商業的に合理的な条項や根本的に得られないか、または基礎技術の使用を停止する可能性があり、これは、私たちの業務に実質的な悪影響を及ぼす可能性があります。
特許の発行は,その発明性,範囲,有効性または実行可能性に対して決定的ではなく,我々または我々のライセンシーの特許は,発行後も米国や海外の裁判所または特許庁で挑戦される可能性がある。第三者の挑戦は、排他性の喪失または私たちまたは私たちの許可者の特許主張が縮小され、無効にされ、または実行できない可能性があり、これは、他の人が類似または商業化または同じ技術および製品を使用することを阻止する能力を制限するか、または私たちの技術および候補製品の特許保護期間を制限する可能性がある。
私たちの特許が有効かつ強制的に実行可能と決定されても、それらは、他社が私たちと類似した製品を販売することを阻止したり、私たちまたは私たちの許可者の特許を中心に設計されたりするのを阻止するために十分に広く解釈されないかもしれない。
私たちは、関連する第三者特許を識別しないか、または第三者特許の関連性、範囲、または失効を誤って解釈する可能性があり、これは、私たちの候補製品を開発、製造、およびマーケティングする能力に重大な悪影響を及ぼす可能性がある。
バイオテクノロジー産業には多くの特許が発行されたり出願されており、私たちは他の人が持っている特許や特許出願が私たちの業務に関連していることを知らないかもしれない。私たちは、関連特許の識別、関連特許請求の範囲分析、または関連特許満期の決定を含むが、関連特許の範囲分析、または関連特許満了の決定を含む、私たちまたは私たちの許可者の任意の特許検索または分析を保証することはできず、私たちは、米国および他の場所が私たちの候補製品の開発および商業化に関連しているか、または必要な各第三者特許および未定出願を識別したことを確実にすることはできない。
例えば、米国および多くの国際司法管轄区の特許出願は、通常、いくつかの優先権文書が提出されてから18ヶ月後に発表され(または場合によっては、それらが特許として発表されるまで)、科学文献内の出版物は、実際の発見よりも遅れていることが多い。したがって、他の会社が私たちの技術または私たちが予想している技術について特許出願を提出したり、開示したりしていないことを確認することはできません。第三者はすでに提出されている可能性があり、将来的には私たちの候補製品または私たちまたは私たちの許可者の技術と同様の特許出願を提出することができる。このような特許出願のいずれかの優先日は、我々の特許出願または特許、または我々許可者の特許出願よりも早い可能性があり、これは、そのような技術に対する特許を取得する権利をさらに要求することができる。場合によっては、第三者がそのような特許出願を提出した場合、誰が私たちの出願または発行された特許の請求項に記載の任意の主題を最初に発明したかを決定するために、そのような第三者によって、または米国特許商標局自体によって干渉手順を開始することができる。
さらに、特許発行後、特許請求の範囲は、依然として法律解釈、特許における書面開示、および特許の起訴履歴に依存する。特許または保留出願の関連性または範囲の解釈は正しくない可能性があり、私たちの候補製品または技術が第三者特許のカバー範囲内にないか、または第三者未定出願が関連範囲のクレームを提出するかどうかを誤って予測する可能性がある。アメリカや他のどこでも関連する特許の満期日の決定は正しくないかもしれません。もし私たちが関連特許を正確に識別したり解釈できなかったら、私たちは侵害請求を受けるかもしれない。私たちは私たちがこのような侵害請求を成功的に解決したり、他の方法で解決できるという保証はない。もし私たちがこのような紛争で失敗すれば、金銭損害賠償の支払いを余儀なくされるほか、私たちの候補製品の商業化は一時的または永久的に禁止される可能性がある。私たちはまた、第三者の知的財産権を侵害しない方法で私たちの候補製品や技術を再設計しようとする試みを迫られるかもしれない。これらの活動のいずれかは、私たちが最終的に勝っても、大量の財務と管理資源を移転する必要があるかもしれません。そうでなければ、私たちは候補製品の開発と商業化に投入することができます。
私たちが提起した侵害、流用、または他の方法で第三者の知的財産権を侵害したり、不正な競争に従事するクレームは高価で時間がかかり、私たちの候補製品の開発や商業化に成功したり、商業化したりすることを阻止または延期する可能性があります。
私たちの成功は、第三者の独占権を侵害することなく、私たちの技術を開発、製造、販売し、私たちの技術を使用する能力にある程度かかっている。私たちまたは私たちの協力者は第三者のクレームの影響を受ける可能性があり、これは私たちに巨額の弁護費用を発生させる可能性があり、成功すれば、私たちまたは私たちの協力者が第三者の知的財産権を侵害していることが発見された場合、これらのクレームは、巨額の損害賠償金の支払いを要求し、および/または候補製品を商業化する能力を制限することができるかもしれない。
いくつかの第三者特許と特許出願は私たちが候補製品を開発している分野と関連があるかもしれない。また,我々の業界の拡張やより多くの特許の発行に伴い,我々の候補製品や技術に関連する特許が第三者に発行される可能性があり,我々は知らない,あるいは現在予想されている運営を継続できるように挑戦する必要がある可能性があり,このリスクが増加している.したがって、私たちの技術および私たちが商業化された任意の未来の製品は、特許権または第三者の他の固有の権利の侵害として告発される可能性があり、これは、費用の高い訴訟を必要とする可能性があり、もし私たちがこのような訴訟に成功しなければ、巨額の損害賠償金を支払うことになり、および/または候補製品を商業化する能力を制限する可能性があります。米国および多くのヨーロッパ諸国/地域を含む多くの国/地域では、発行された特許は有効であると推定される権利があり、私たちの技術または私たちの任意の候補製品を所有する他の人が発行した特許は、これらの特許が満了するまで、またはこれらの特許が満了するまで、または適用司法管轄区域の裁判所で無効または強制実行が宣言されない場合、請求項に記載の発明を実施する許可証または他の権利を取得しない限り、候補製品を商業化する能力を制限する可能性がある。
私たちは以前他のバイオテクノロジーや製薬会社に雇われていた個人を、私たちの競争相手や潜在的な競争相手を含めて雇用する。これらの従業員は、私たちにその前の雇用主に属する機密情報を開示することを禁止されているが、私たちは、これらの従業員または私たちがその前の雇用主の商業秘密または他の固有情報を使用または開示していると告発される可能性がある。
第三者は、私たちが彼らの特許、商業秘密、商標、または他の知的財産権を侵害していると主張する訴訟または他の法的手続きを脅迫または開始することができる。訴訟は私たちが第三者の独占権の範囲、実行可能性、有効性を決定することで自分を弁護したり、私たちの独占権を確立する必要があるかもしれない。私たちが特許や他の知的財産権を侵害するどのような疑惑が望ましいかどうかにかかわらず、そのような告発は時間をかけて、管理層の注意と財政資源を分散させる可能性があり、評価と弁護コストが高い。
このような訴訟の結果は予測することが困難であり、非侵害代替製品を開発する際に、いくつかの条件の治療を停止すること、許可証を取得すること、または私たちの候補製品または技術を修正すること、または巨額の和解費用をもたらす可能性があるかもしれない。訴訟は、侵害行為に対する実質的な損害賠償に関連する可能性があり(裁判所が侵害行為が故意であると認定された場合、損害賠償金および特許権者の弁護士費の3倍の支払いを命じられる可能性がある)、裁判所は私たちの候補製品の販売を禁止することができ、あるいは第三者から許可を得ることを要求することができ、第三者は商業的に合理的な価格またはそれを必要としない。第三者が許可を提供する場合、私たちは大量の印税、前払い費用、またはマイルストーン費用を支払うか、または私たちの候補製品または技術に知的財産権交差許可を付与する必要があるかもしれない。私たちはまた、第三者の知的財産権を侵害しないように、私たちの候補製品または技術を再設計しなければならないかもしれないし、それは不可能かもしれないし、多くのお金の支出と時間が必要かもしれません。その間、私たちの候補製品は製造、使用、または販売できないかもしれません。
私たちは、私たちの知的財産権の不正使用を効果的に監視し、私たちまたは私たちの許可内の知的財産権を侵害から実行することができず、私たちまたは私たちの許可内の知的財産権に関する訴訟や他の訴訟を提起することによって巨額の費用が発生する可能性がある。
私たちの知的財産権を無許可に使用することを規制することは難しくて高価だ。私たちは私たちの知的財産権を不正に使用したり、私たちの知的財産権を実行するために適切なステップを取ることができないかもしれない。私たちの知的財産権を不正に使用することを効果的に監視できないいかなる行為も、競争相手が私たちの候補製品やサービス機能を含む製品を提供することを招き、逆に私たちの製品に対する需要を減少させる可能性がある。
私たちが成功する可能性があり、知的財産権の増加を招く可能性があると判断した場合、私たちは時々侵害者に私たちの知的財産権を行使することを求める可能性もある。もし私たちがどちらかに私たちの特許権を強制的に執行することを選択した場合、その側は私たちの特許の無効および/または強制執行ができないことを反訴することができる。被告は特許取調および控訴委員会に訴訟を起こし,当社または当社のライセンス者の特許に挑戦することができる(“PTAB)は、締約国間審査および贈与後審査を含む。
特許に挑戦する訴訟手続きはまた、例えば、反対手続きおよび無効訴訟を含む国際的に利用可能である。米国の特許訴訟では,無効および/または実行不能およびPTAB挑戦の反訴はありふれていると主張している。有効性を疑問視する理由は、出願可能な特許の主題の欠如、新規性の欠如、明確性の欠如、書面記述の欠如、または実施できないことを含む、いくつかの法定要件のいずれかを満たすことができないと言われているからであるかもしれない。主張を実行できない理由は,特許起訴に関連する者が起訴中に米国特許商標局に関連情報を隠蔽したり,誤った声明をしたりしたためかもしれない.第三者はPTABに類似したクレームを出すことも可能であり,訴訟範囲外でも同様である。法的に無効と実行不可能と断言された後の結果は予測できない。有効性については、例えば、無効な以前の技術がないことは確認できませんが、私たち、私たちの許可者、特許審査員は起訴中にこれを知りません。もし被告が無効および/または強制執行できない法的主張に勝った場合、私たちは私たちの候補製品の少なくとも一部またはすべての特許保護を失うかもしれない。
しかも、私たちがこのような特許の侵害を阻止することに成功しても、このような訴訟と訴訟は高価であり、時間と資源がかかり、管理と科学者の注意をそらすだろう。訴訟は本質的に予測不可能であり,裁判所がこのような特許を無効と判断し,相手の発明の使用を阻止する権利はないというリスクがある.さらに、私たちのいくつかの競争相手は、彼らがより多くの資源を持っているので、私たちよりも複雑な特許訴訟の費用を効果的に受けることができるかもしれない。もう1つのリスクは,これらの特許の有効性が支持されても,裁判所は相手の活動が我々の知的財産権を侵害していないことを理由に,相手を阻止することを拒否することである.
薬品は偽造されやすい。私たちの候補製品が承認されて商業化されれば、第三者は私たちの製品が通過する様々な製造·テスト基準の偽造バージョンよりも低い製品を不正に生産·販売する可能性がある。偽造薬品はしばしば安全ではなく、無効であり、生命を脅かす可能性がある。多くの偽造品は視覚的に正規品と区別しにくい可能性があるため,偽造品の存在は正規品に対する消費者の全体的な自信に影響を与える可能性がある.公衆は製薬製品、特に私たちのいかなる製品も偽製品の誠実さによって自信を失い、私たちの業務、将来性、財務状況と運営結果に重大な悪影響を与える可能性がある。さらに、潜在的な法的紛争および/または規制手続きの影響を受ける可能性があり、これは、私たちの経営陣の関心や資源を分散させる可能性があり、これは私たちの財務状況に大きな悪影響を及ぼす可能性があります。
公聴会、動議、または他の一時的な手続きや事態の発展の結果も公表される可能性があり、証券アナリストや投資家がこれらの結果がマイナスだと思う場合、私たちの普通株の価格に大きな悪影響を及ぼす可能性がある。最後に、いかなる訴訟の開始と継続によって生じるいかなる不確定要素も、運営を継続するために必要な資金を調達する私たちの能力に実質的で不利な影響を及ぼす可能性がある。
私たちと私たちの許可者は、世界各地のすべての管轄区域で私たちの知的財産権を保護することを求めません。私たちが保護を求めている司法管轄区でも、私たちの知的財産権を十分に実行できないかもしれません。
私たちは多くの国際特許と特許出願を許可し、私たちの許可者が私たちが業務を展開しようとしている多くの重要な市場で特許保護を求め続けることを期待している。しかし、世界のすべての国と地域で私たちの候補製品や技術に関連する特許を申請し、起訴し、擁護することは、私たちのすべての認可内の特許権を含めて、目を引くほど高価になるだろう。私たちと私たちの許可者たちは最終的に国ごとに特許保護を求めなければならないが、これは高価で時間のかかる過程であり、結果は不確定である。したがって、私たちまたは私たちの許可者は、特定の国で特許保護を求めないことを選択することができ、私たちはこれらの国で特許保護のメリットを享受しないだろう。
また、米国以外のある国では、知的財産権の保護は米国ほど広くないかもしれない。したがって、我々または我々のライセンス者が特定の外国司法管轄区で発行された特許を求めて取得しても、米国以外のすべての国/地域で独自技術を使用して第三者が独自技術を使用して製造した製品を米国または他の管轄区域内で販売または輸入することを阻止することはできないかもしれない。このような製品は私たちの製品と競争するかもしれませんが、私たちの可能な特許権または私たちの他の知的財産権は、彼らの競争を効果的にまたは阻止するのに十分ではないかもしれません。もしこれらの競争製品が私たちが知的財産権を行使できない司法管轄区域に現れたら、私たちの業務、財務状況、運営結果、成長の見通しは重大で不利な影響を受ける可能性があります。
米国特許法または他の管轄区域特許法の変化は、私たちまたは私たちのライセンシーが特許を得る能力の確実性を低下させ、全体的に特許の価値を低下させ、私たちの現在および任意の未来の候補製品を保護する能力を弱めるかもしれない。
米国最高裁判所と連邦巡回控訴裁判所はすでに米国特許法の解釈方法を変更し続ける可能性がある。例えば、近年、米国最高裁判所は、USPTOが過去20年間に特許を付与する際に使用したいくつかのテストを修正し、これは、私たちまたは私たちのライセンシーが特許を取得できる可能性を低下させ、私たちが取得または許可した任意の特許に挑戦する可能性を増加させる可能性がある。同様に、国際裁判所は、それぞれの管轄範囲内の特許法の解釈方法を変更し続ける可能性がある。これらの変化は、私たちの特許権と私たちまたは私たちのライセンシーがライセンス特許を取得する能力に実質的な悪影響を及ぼす可能性があります。
米国特許法または特許法解釈の変化は、特許出願をめぐる起訴および発行された特許の実行または弁護の不確実性およびコストを増加させる可能性がある。例えば、“ライシー·スミス米国発明法”(Leahy-Smith America発明法)アメリカ発明法)米国特許法のいくつかの重大な改正を含む2011年に公布された。米国の発明法による特許法の多くの実質的な改正が2013年3月に施行された。例えば、2013年3月、米国は“先発明”の特許制度から特許制度に移行し、このような制度の下で、他の特許性要件を満たすと仮定すると、最初に特許出願を提出した発明者は、要求された発明が第三者が最初に発明したものであるか否かにかかわらず、1つの発明の特許を取得する権利がある。米国発明法はまた、特許出願の起訴方法および発行された特許に対する疑問の方法に影響を与えるいくつかの重大な変化を含み、例えば、特許起訴中に第3の方向に米国特許商標局が以前の技術を提出することを可能にし、付与後に、付与後審査、当事者間の審査、および派生手続を含む、発行された特許有効性の新たな付与後行政訴訟を攻撃するために使用されることができる。米国の発明法およびその実施は、私たちまたは私たちの許可者の特許出願をめぐる起訴、および私たちの許可内に発行された特許の実行または保護の不確実性および/またはコストを増加させる可能性があり、これらのすべては、私たちの業務、財務状況、運営結果、および成長の見通しに実質的な悪影響を及ぼす可能性がある。
さらに、米国最高裁判所は近年、いくつかの特許事件に対して裁決を下し、場合によっては入手可能な特許保護範囲を縮小するか、場合によっては特許所有者の権利を弱めるかを決定している。このようなイベントの組み合わせは,我々または我々のライセンシーが将来特許を取得する能力に関する不確実性の増加に加えて,いったん特許を取得した価値に関する不確実性をもたらしている.米国議会、連邦裁判所、および米国特許商標局の行動によれば、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、新しい特許を取得したり、私たちが許可または将来獲得する可能性のある特許を実行する能力を弱める可能性がある。
同様に、他の国または管轄区域特許法律および法規の変化、これらの法律および法規を実行する政府機関の変化、または関連政府当局が特許法律または法規を実行する方法の変化は、私たちまたは私たちのライセンシーが新しい特許を獲得したり、私たちが許可または将来獲得可能な特許を実行する能力を弱める可能性があり、これは逆に、私たちの業務、財務状況、運営結果、および成長の見通しに大きな悪影響を及ぼす可能性がある。例えば、近年ヨーロッパ特許法の複雑さと不確実性も増加している。欧州では、新たな統一特許制度が2023年6月1日に施行され、このような制度が導入される前に付与された特許を含む欧州特許に大きな影響を与える。単一特許制度の下で、特許が付与されると、欧州特許出願は単一特許になる権利があり、これは単一特許裁判所(The Unitative Patent Court)によって管轄されるであろうコンゴ愛国者連合“)”UPCは新しい裁判所制度であるため、裁判所には前例がなく、いかなる決定もなされる可能性もなく、いかなる訴訟の不確実性も増加している。2023年6月1日現在失効しておらず,UPCに訴訟を提起していない既存の欧州特許は,UPCの管轄権から脱退し,UPC国の国家特許として保持することができる。UPC管轄下の特許はUPCによる単一撤回挑戦を受けやすい可能性があり,成功すれば,UPCプロトコルを承認したすべての国で特許を無効にする可能性がある.私たちはどんな潜在的な変化の長期的な影響も確実に予測できない。
私たちは私たちの職員たちと請負業者から知的財産権譲渡を受けたり実行することができないかもしれない。
私たちの政策は、知的財産権の概念や開発に参加する可能性のある私たちの従業員と請負業者が合意に署名し、このような知的財産権を私たちに譲渡することを要求していますが、実際に私たちが自分の知的財産権と見なしているすべての当事者と実行可能な合意を実行することができないかもしれません。さらに、私たちの譲渡協定は自動的に実行されないかもしれないし、違反される可能性があり、私たちは私たちの知的財産権の所有権だと思うことを決定するためにクレームを提出または弁護することができます。私たちはこのようなクレームでは成功しないかもしれません。もし私たちが知的財産権を譲渡する合意を得ることができない場合、またはそのようなクレームを提起したり、弁護したりする場合、金銭的損害賠償の支払いに加えて、貴重な知的財産権を失う可能性がある。このような結果は、我々の業務、財務状況、運営結果、および成長見通しに実質的な悪影響を及ぼす可能性がある。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣や他の従業員の注意を分散させる可能性がある。
もし私たちがビジネス秘密や他の固有情報の漏洩を十分に防ぐことができなければ、私たちの候補技術や製品の価値は大幅に低下する可能性がある。
ビジネスの秘密は保護するのが難しい。私たちは、特に特許保護が適切でないと考えられている場合、またはそのような特許が実行されにくい場合には、商業秘密に依存して、私たちの固有の情報および技術を保護することができるかもしれない。私たちは、従業員、コンサルタント、請負業者、パートナー、科学協力者、および他のコンサルタントと締結された秘密協定にある程度依存して、私たちのビジネス秘密および他の固有の情報を保護します。私たちは、私たちの独自の情報や技術を得ることができるすべての当事者とこのような合意を締結したことを保証することはできず、これらの合意がすでに存在しても回避されない保証はない。これらのプロトコルは、独自の情報または技術の開示を効果的に防止することができない可能性があり、そのような情報または技術の開示を許可せずに適切な修復措置を提供することができない可能性がある。さらに、他の人たちは、私たちの商業秘密および独自の情報を独立して発見することができ、この場合、私たちは、そのような商業秘密または独自の情報を利用して私たちと競争することを阻止する権利がないかもしれない。私たちの独占権の範囲を実行して決定するには、高価で時間のかかる訴訟が必要となる可能性があり、商業秘密保護を獲得または維持できなければ、私たちの業務、財務状況、運営結果、成長の見通しに重大な悪影響を及ぼす可能性がある。
一般リスク因子
私たちの業務は、上昇するインフレ、金利、サプライチェーン制限を含むマクロ経済状況の影響を受けている。
各種のマクロ経済要素は私たちの業務、経営業績と財務状況に不利な影響を与える可能性があり、インフレ、金利と全体の経済状況の変化、及び銀行システムと全世界の金融市場の現在と未来の状況による不確定要素を含む。例えば、インフレは私たちに否定的な影響を与え、私たちの労働コストを増加させることによって(より高い賃金を通じて)、商業支援、建築、製造、臨床供給支出を通じて私たちに否定的な影響を与え続けるかもしれない。“と書かれています製造業に関するリスク以上が我々の商業規模製造施設建設に及ぼすインフレの影響に関するリスクである。現在のインフレ圧力が続くと、私たちの業務に否定的な影響を及ぼすかもしれない。また、金利、信用市場の流動性、資本市場の変動性は、必要に応じて私たちの業務に資金を提供するために、私たちの資金調達能力に影響を与える可能性もあります。銀行システムや金融市場に影響を与える金融状況は、現金を得る能力や、私たちの業務を支援するために必要な信用状や他の資金を得る能力を脅かす可能性があり、これには、短時間で追加の現金や資金源を探す必要があるかもしれません。同様に、これらのマクロ経済要因は、もしあれば、私たちの第三者製造業者、請負業者、またはサプライヤーが費用効果のある方法で私たちの候補製品を生産するために必要な材料の能力に影響を与える可能性がある。
いかなる買収や戦略協力も、私たちの資本要求を増加させ、私たちの株主を希釈し、私たちに債務を発生させたり、負債を負担したり、あるいは他のリスクに直面させたりする可能性がある。
私たちは時々、薬物、知的財産権、技術、または業務の許可または買収を含む様々な買収や戦略的協力を評価するかもしれない。潜在的な買収や戦略的パートナーシップは、多くのリスクをもたらす可能性があるが、これらに限定されない
•業務費と現金需要が増加した
•債務を負担したり、債務や未知の債務を負担したり
•買収された会社の業務、知的財産権、薬品を吸収し、新しい人員の統合に関する困難を含む
•得られた知的財産権の保護を十分に起訴し、維持する
•私たちの経営陣の関心を既存の薬物計画とこのような戦略的パートナーシップ、合併または買収を求めるイニシアチブから移してください
•重要な従業員の保留、キーパーソンの流出、そして私たちがキー業務関係を維持する能力の不確実性
•そのような取引の他方に関連するリスクおよび不確実性は、その当事者およびその既存の候補薬剤または製品の将来性および規制承認を含む;
•私たちは買収された薬品、知的財産権、技術、および/または業務から十分な収入を得ることができず、買収の目標を達成することができず、関連する買収と維持コストを相殺することさえできない。
また、買収や戦略協力を行えば、希釈証券を発行し、債務を負担したり、発生したり、巨額の使い捨て費用を発生させたり、重大な将来の償却費用をもたらす可能性のある無形資産を買収する可能性があります。さらに、私たちは適切な買収や戦略的協力の機会を見つけることができないかもしれませんが、これは私たちの成長を損なうことができたり、私たちの業務発展に重要かもしれない技術や薬を獲得することを制限したりします。
財務会計基準の変更や説明は私たちの経営結果に影響を与える可能性があり、私たちの業務慣行を変えることにつながるかもしれません。
私たちは公認会計基準に基づいて財務諸表を作成する。これらの会計原則は、財務会計基準委員会、米国証券取引委員会、および会計規則や法規を解釈·制定するために設立された様々な機関の解釈を受ける。会計規則の変化は、私たちの報告書の財務結果に大きな影響を与える可能性があり、変化を宣言する前に完了した取引の報告に影響を与える可能性があります。これらの規則の変化や現在のやり方に対する疑問は、本文書に含まれる財務業績、または私たちが業務を展開する方法を含む、我々の財務業績に実質的な悪影響を及ぼす可能性がある。
もし私たちの情報技術システムまたはデータまたは私たちが依存する第三者のシステムまたはデータが破壊された場合、私たちは、規制調査または行動、訴訟、罰金および処罰、私たちの業務運営の中断、名声損害、収入または利益損失、およびその他の不利な結果を含む、このような損害によって生じる不利な結果を経験する可能性がある。
私たちの正常な業務過程で、私たちと私たちが依存する第三者は敏感なデータを処理し、したがって、私たちと私たちが依存する第3の側面は、セキュリティ事件を引き起こす可能性のある恐喝ソフトウェア攻撃を含むが、これらに限定されない様々な変化する脅威に直面している。ネットワーク攻撃、インターネットベースの悪意のある活動、オンラインおよびオフライン詐欺、および他の同様の活動は、私たちの敏感なデータおよび情報技術システム、ならびに私たちが依存する第三者システムの機密性、完全性、および可用性を脅かす。このような脅威は一般的であり、検出がますます困難になっており、従来のコンピュータ“ハッカー”、脅威参加者、“ハッカー活動家”、組織的犯罪脅威参加者、人員(例えば、窃盗または乱用によって)、複雑な民族国家、および民族国家によって支持される参加者を含む様々なソースから来ている。
一部の行為者は現在、地政学的な理由で軍事衝突と防御活動を組み合わせた民族国家行為者を含むサイバー攻撃に従事し、継続することが予想される。戦争と他の重大な衝突の間、私たちと私たちが依存している第三者は、報復的なネットワーク攻撃を含むこれらの攻撃の高いリスクを受けやすく、私たちのシステムと運営、サプライチェーン、および私たちの候補製品を開発し、それを商業化する能力を実質的に乱す可能性がある。
我々と私たちが依存する第3の態様は、社会工学攻撃(ネットワーク釣り攻撃を含む)、悪意コード(例えば、ウイルスおよびワーム)、マルウェア(高度な持続的脅威侵入を含む)、サービス拒否攻撃(例えば、充填証明書)、証拠窃取、人員不正行為またはエラー、恐喝ソフトウェア攻撃、サプライチェーン攻撃、ソフトウェア脆弱性、サーバ障害、ソフトウェアまたはハードウェア障害、データまたは他の情報技術資産損失、広告ソフトウェア、電気通信障害、地震、火災、洪水、および他の同様の脅威を含むが、様々な変化する脅威に直面している。
特に、深刻な恐喝ソフトウェア攻撃はますます一般的になっており、私たちの運営が深刻に中断され、敏感なデータと収入損失、名声損害、資金移転を招く可能性がある。恐喝支払いは恐喝ソフトウェア攻撃の否定的な影響を軽減するかもしれないが、例えば、適用された法律または法規によってそのような支払いが禁止されているため、私たちはそのような支払いを望んでいないか、または支払うことができないかもしれない。
ますます多くの従業員が私たちのオフィスやネットワークの外でネットワーク接続、コンピュータと設備を使用して、家、途中と公共の場所で仕事をすることを含めて、遠隔仕事はますます一般的になり、私たちの情報技術システムとデータのリスクを増加させた。さらに、将来的または過去のビジネス取引(例えば、買収または統合)は、我々のシステムがエンティティのシステムおよび技術に存在する脆弱性を買収または統合する負の影響を受ける可能性があるので、より多くのネットワークセキュリティリスクおよび脆弱性に直面する可能性がある。また,これらの買収や統合されたエンティティを職務調査する際に発見されなかったセキュリティ問題が発見される可能性があり,会社を我々の情報技術環境やセキュリティ計画に統合することは困難である可能性がある.
また、第三者サービスプロバイダへの依存は、サプライチェーン攻撃や他の脅威を含む、当社の業務運営に新たなネットワークセキュリティリスクや脆弱性をもたらす可能性があります。我々は、クラウドベースのインフラ、データセンター施設、暗号化および認証技術、従業員電子メール、および他の機能を含むが、これらに限定されない様々な環境で敏感なデータを処理するために、第三者サービスプロバイダおよび技術に依存して重要なビジネスシステムを実行する。私たちはまた、第三者サービスプロバイダが他の製品、サービス、部品、または他の方法を提供して私たちの業務を運営することに依存します。これらの第三者の情報セキュリティアプローチを監視する能力は限られており、これらの第三者には十分な情報セキュリティ対策がない可能性がある。もし私たちの第三者サービス提供者がセキュリティ事件や他の中断に遭遇したら、私たちは悪い結果に直面するかもしれない。第三者サービス提供者がプライバシーや安全に関する義務を履行できなかった場合、損害賠償を受ける権利があるかもしれませんが、どの賠償も私たちの損害を補うのに十分ではないかもしれません。あるいはそのような賠償を取り戻すことができないかもしれません。また、サプライチェーン攻撃の頻度と深刻さが増加しており、私たちのサプライチェーンにおける第三者のインフラや私たちの第三者パートナーのサプライチェーンが損なわれていないという保証はありません。
任意の以前の識別または同様の脅威は、不正、不正または意外な取得、修正、廃棄、損失、変更、暗号化、開示、または私たちの敏感なデータまたは私たちの情報技術システム、または私たちが依存する第三者の敏感なデータまたはシステムにアクセスする可能性があるセキュリティイベントまたは他の中断をもたらす可能性がある。セキュリティイベントや他の中断は、私たち(および私たちが依存する第三者)が私たちの候補製品を開発し、商業化し、私たちの業務を運営する能力を乱す可能性があります。
私たちは大量の資源を費やしたり、私たちの業務活動(私たちの臨床試験活動を含む)を修正したりして、安全事故を防止しようとするかもしれない。さらに、特定のデータプライバシーおよびセキュリティ義務は、私たちの情報技術システムおよび敏感なデータを保護するために、特定のセキュリティ対策または業界標準または合理的なセキュリティ対策を実施し、維持することを要求する可能性があります。
我々はすでにセキュリティ事件を防ぐためのセキュリティ対策を実施しているが,これらの措置が有効である保証はない.私たちは抜け穴を検出し、救済する措置を取っているが、私たちはすべての脆弱性を検出して修復することができないかもしれない。脆弱性を利用するための脅威と技術は常に変化し、本質的には複雑であることが多いからだ。したがって、このような脆弱性は利用されることができるが、セキュリティイベントが発生した後に検出される可能性がある。このような抜け穴は私たちの業務に実質的な危険をもたらす。さらに、私たちはこのような決定された抜け穴を解決するための救済措置を制定して配置することに遅延があるかもしれない。
適用されるデータプライバシーとセキュリティ義務は、関連利害関係者にセキュリティイベントを通知することを要求する可能性があります。このような開示は費用が高く、そのような要求を開示または遵守しないことは悪い結果をもたらすかもしれない。もし私たち(または私たちが依存する第三者)がセキュリティ事件を経験した場合、またはセキュリティ事件を経験したと考えられる場合、私たちは、政府の法執行行動(例えば、調査、罰金、処罰、監査、および検査)、追加の報告要件および/または監視、敏感なデータ(個人データを含む)の処理の制限、訴訟(カテゴリクレームを含む)、賠償義務、負の宣伝、名声損害、通貨資金移動、私たちの業務中断(データ利用可能性を含む)、財務損失、および他の同様の損害に遭遇する可能性がある。安全事件とそれに伴う結果は、私たちの業務成長と運営能力に否定的な影響を及ぼすかもしれない。
私たちの契約には責任制限が含まれていないかもしれませんが、あっても、私たちの契約における責任制限は、私たちのデータプライバシーとセキュリティ義務に関連する責任、損害、またはクレームから私たちを保護するのに十分である保証はありません。私たちの保険範囲が私たちのプライバシーと安全慣行によって生じる責任から私たちを保護または軽減するのに十分か、または私たちを保護するのに十分かどうかは確認できません。私たちはこのような保険が商業的に合理的な条項や根本的に存在しない、あるいはそのような保険が未来のクレームを支払うと判断することはできません。
セキュリティ事件を経験することに加えて、第三者は、公共ソース、データ仲介人、または他の方法から、私たちの組織に関する競争の敏感な詳細を漏洩し、私たちの競争優位性または市場地位を破壊するために使用される可能性がある私たちに関する敏感な情報を収集、収集、または推定することも可能である。
私たちの証券所有権に関わるリスクは
私たちは証券法の意味での“新興成長型企業”と“比較的小さい報告会社”であり、新興成長型企業が獲得できるいくつかの開示要求免除を利用すれば、私たちの証券の投資家への魅力を低下させる可能性があり、私たちの業績を他の上場企業の業績と比較することを難しくする可能性がある。
証券法第2(A)(19)節の定義によると、我々は“新興成長型会社”であり、“雇用法案”により改正されている。したがって、他の非新興成長型企業に適用される上場企業に適用されるいくつかの免除を利用する資格があり、新興成長型企業である限り、これらに限定されるものではないが、(A)サバンズ·オックス法404条の監査人認証要件を遵守する必要はない、(B)当社の定期報告及び委託書における役員報酬に関する開示義務の削減、及び(C)免除は、役員報酬及び株主承認前に承認されていない任意の金パラシュート支払いについて非拘束性相談投票を行うことを要求する。したがって、私たちの株主は彼らが重要だと思ういくつかの情報を得ることができないかもしれない。我々は、(I)当該事業年度6月30日現在の非関連会社が保有する普通株式時価が7億ドルを超える事業年度の最終日まで新興成長型会社とし、(Ii)当該事業年度の総収入が12.35億ドル(インフレ指数で算出)の前期の最終日に達するか、(Iii)前3年間に10億ドルを超える転換不能債券を発行した日、又は(Iv)2026年12月31日、Graf初公募による普通株売却5周年後の財政年度の最終日である。私たちは投資家が私たちの証券がこれらの免除に依存して、私たちの証券の魅力が低下すると思うかどうか予測できない。
一部の投資家がこれらの免除に依存して私たちの証券の魅力が低下していると感じた場合、私たちの証券の取引価格は他の状況を下回る可能性があり、私たちの証券の取引市場はそれほど活発ではなくなり、私たちの証券の取引価格はさらに変動する可能性がある。
また、雇用法第102条(B)(1)条免除新興成長型企業は、民間企業(すなわち、施行が宣言されていない証券法登録声明又は“取引法”に基づいて登録されていない証券種別)が、新たな又は改正された財務会計基準の遵守を要求されるまで、新たな又は改正された財務会計基準を遵守する。JOBS法案では,会社は延長からの移行期間を選択し,非新興成長型会社に適用される要求を遵守することができると規定しているが,いずれの選択脱退も撤回できない。私たちは、移行期間を延長することを選択しないことを選択した。これは、基準が発表または改正された場合、その基準が上場企業または民間企業に異なる適用日があれば、私たちは新興成長型企業として、民間会社が新たな基準または改正基準を採用する際に新たなまたは改正された基準を採用することができることを意味する。これは、別の上場企業が新興成長型会社でも新興成長型会社でもなく、使用される会計基準の潜在的な違いにより、延長された過渡期間を使用しないことを選択することが困難または不可能であるため、私たちの財務諸表を別の上場企業と比較することができる。
新興成長型企業としては、他の非新興成長型企業の上場企業に適用される様々な報告要件のいくつかの免除を利用することも可能であり、これに限定されるものではないが、サバンズ·オキシリー法案第404条によれば、財務報告書の内部統制の有効性評価を独立公認会計士事務所から得る必要はなく、定期報告書や依頼書における役員報酬に関する開示義務や、役員報酬に対する非拘束性相談投票の要求を免除し、株主承認前に承認されなかった金パラシュート給与の要求を免除することも可能である。私たちは投資家が私たちがこれらの免除に依存して私たちの普通株の魅力が低下することを発見するかどうか予測できない。したがって、一部の投資家が私たちの普通株の吸引力が低下していることを発見すれば、私たちの普通株市場はそれほど活発ではなくなり、私たちの株価はもっと変動するかもしれない。
また,S−K法規第10(F)(1)項で定義された“小さな報告会社”となる資格がある。規模の小さい報告会社は、2年間の監査済み財務諸表のみを提供することを含む、いくつかの減少した開示義務を利用する可能性がある。いずれの財政年度の最終日までにも、(A)非関連会社が保有するNKGen普通株の当年第2四半期末の時価が2.5億ドル以上でなければ、または(B)完成した会計年度内の年収が1億ドル以下であり、当年第2四半期末までに非関連会社が保有する私たちの普通株の時価が7億ドル以上であれば、規模の小さい報告会社となることが予想される。このような削減された開示義務を利用する程度では、これはまた、我々の財務諸表を他の上場企業と比較することを困難にするか、または不可能にする可能性がある。
私たちの株価は変動する可能性があり、その経営業績にかかわらず下落する可能性がある。
当社の普通株式の市場価格は、以下を含むがこれらに限定されない多くの要因に応じて大きく変動し、また、これらの理由その他の理由により変動し続ける可能性があります。
•私たちの収入と経営結果の実際または予想変動
•当社が将来公表する可能性のある財務見通し、これらの見通しの変更、またはこれらの見通しを満たさないこと。
•証券アナリストが当社のカバレッジを開始し維持しなかったこと、当社に従う証券アナリストによる財務見通しまたは格付けの変更、またはこれらの見通しまたは投資家の期待を満たさなかったこと。
•私たちまたは私たちの競争相手は、重大な技術革新、買収、戦略的パートナーシップ、合弁企業、経営業績、または資本約束を発表します
•他のライフサイエンス企業全般、特にバイオテクノロジー産業の業績や株式市場評価の変化
•全体の株式市場の価格と出来高変動は、経済全体の傾向の結果を含む
•当社の普通株式出来高
•当社の普通株式をインデックスから含め、除外または除外すること
•NKGen 取締役会または経営陣の変更
•取締役、高級管理者、関連会社、その他の主要投資家によるNKGen普通株の取引
•私たちを脅したり訴訟を起こしたり
•私たちの業務に適用される法律や法規の変化
•私たちの資本構造の変化例えば将来の債務や株式証券の発行
•私たちの株式の空売り、ヘッジ、および他のデリバティブ取引に関する
•アメリカと私たちが経営している他の市場の全体的な経済状況
•新冠肺炎の大流行(他の変種を含む)を含むが、これらに限定されない大流行病または他の公衆衛生危機
•戦争、テロ事件、またはこれらの事件に対する反応に起因するイベントまたは要因を含む他のイベントまたは要因;
•“リスク要因”の節で述べた他の要因。
株式市場は最近極端な価格と出来高変動を経験した。会社証券の市場価格は、往々にしてその経営業績に関係なく、あるいは比例しない変動を経験している。従来,株主は証券市場価格が変動した後に会社に対して証券集団訴訟を起こすことがあった.私たちに対するいかなる類似訴訟も、巨額の費用を招き、経営陣の注意と資源を移転させ、その業務、財務状況、運営結果を損なう可能性がある。
私たちは将来ナスダックでの私たちの証券の上場を維持できないかもしれない。
私たちの普通株式と公共株式証明書は現在ナスダックに上場しています。しかし、私たちは私たちの証券がナスダックに上場し続けるという保証がない。もし私たちが適用された上場規則の要求を達成できなかったら、そのような失敗は私たちの株を将来的に停止したり退市させたりする可能性がある。退市の場合、吾等が上場規定の遵守を回復するために講じたいかなる行動も、吾等の証券を再上場させ、市場価格を安定させたり、証券の流動性を改善したり、吾等の証券が最低株価要求を割ったり、後日上場規定を遵守しないことを防止することを保証することはできない。これはさらに法律や規制手続き、罰金、その他の処罰、私たちの法的責任、私たちの株主が彼らの株を取引できず、私たちの株価、名声、運営、財務状況、そして私たちの将来の資金調達活動を行う能力に悪影響を及ぼす可能性がある。もしナスダックが私たちの証券を退市して、私たちの証券を別の国の証券取引所に上場することができなければ、私たちの証券は場外取引市場で見積もりを出すことができると予想します。このような状況が発生すれば、私たちは重大な不利な結果に直面するかもしれないが、これらに限定されない
•私たちの証券の市場オファーは限られています
•証券の流動性が減少しています
•同社のニュースやアナリストに対する報道数は限られている
•将来的により多くの証券を発行したり、より多くの融資を得る能力が低下する。
私たちの普通株の活発な取引市場は持続できないかもしれない。
私たちの普通株はナスダック世界市場に上場し、コードはNKGNで、この市場で取引されています。私たちはあなたに活発な普通株取引市場が続くということを保証できない。
したがって、私たちはあなたにどんな取引市場の流動性も保証することができません。あなたは必要な時にあなたの普通株、あるいはあなたの株が入手可能な価格を売ることができますか。
既存の株主は将来株式を売却することで私たちの株価を下落させるかもしれない。
我々の既存株主が公開市場で大量のNKGen普通株を売却または売却する意向を示した場合、NKGen普通株の取引価格が低下する可能性がある。証券法第144条の規定によると、発行された株式オプションに制約され、その株式インセンティブ計画に基づいて発行されたニクソン普通株を予約し、証券法に従ってS-8表で登録し、公開市場で販売する資格があると予想される規則第百四十四条)“は、付属会社の制限に適用されます。これらの追加株式が売却された場合、または公開市場で販売されると考えられた場合、NKGen普通株の取引価格が低下する可能性がある。また、NKMAXは2023年12月13日にアルツハイマー病薬物発見基金会、アルツハイマー病研究·予防基金会、米国ブライアン基金会、韓国AIブロックチェーン集合会社、韓国脳研究所、韓国経済社会研究所、地球光慈善有限会社、シカゴ大学を含む合計250万株のNKGen普通株を8つの慈善組織または実体に無料で寄付した。慈善支援者は、制限が終了するまで、当該寄付された株式の任意の売却または譲渡制限を受け続ける。
発起人や一部の株主は,保有するNKGen普通株株式の譲渡によって制限される可能性があるが,これらの株式はそれぞれのロック期間満了後に販売することができる.転売終了の制限と我々の証券転売の登録声明が使用可能であるため、現在制限されている株の保有者がNKGen普通株を売却または市場に売却する予定とされている場合、NKGen普通株の市場価格が低下する可能性がある。
♪the the the株式承認証 パイプとパイプです株式承認証そうじゃないかもしれない鍛えられた完全かそうかもしれない鍛えられた現金なしでは私たちはそうでないかもしれないトレーニングをするのです株式承認証 パイプやパイプ 令状を取る。
の行使価格の 株式承認証 または PIPE Warrants may NKGen 普通株式の基礎となる株式の現行市場価格よりも高いこと。の行使価格の 株式承認証 または PIPE 株式承認証市場状況の影響を受け 5月.NKGen 普通株式の基礎となる株式の実勢市場価格が行使価格を下回っている場合、有利ではありません。行使に関連する現金収益 株式承認証 または PIPE 株式承認証普通株式の購入は株価によって決まりますザ 価値がある普通株式は変動し、 5月.ワラントの行使価格と一致しません いつでもいいですV.与えられるもう時間です私たちは信じるなら 株式承認証 パイプとパイプです株式承認証あります 『 OUT のです。 ♪the the the お金 > > 意味がある ♪the the the トレーニングをする 値段 はい。 もっと高い 比 ♪the the the 市場 値段 のです。 我々の ごく普通である 株は、 証券保有者が 5月.運動しないことを選び 令状を取るその結果、私たちは 5月.受け取らない どんなものでも行使による収益は 株式承認証 パイプやパイプ 令状を取る。
また、 使用 よろしくお願いします 至れり尽くせり ♪the the the 私 令状 労作 資本 株式承認証 そして ♪the the the パイプ.パイプ 令状それは… はい。 可能なのは それは 私たちは 5月. 注釈 受信する 現金 はい 彼らの 体を鍛える それ以来 ( i ) これらのワラントの基礎となる NKGen 普通株式の登録の遅延、 ( ii ) 特定のワラント保有者が特定のワラントをキャッシュレスで株式に転換することを可能にする NKGen 普通株式 1 株当たりの価格を含む一定の条件. A 現金を持たない トレーニングをする 許す 捜査命令 所持者 至れり尽くせり 転換する ♪the the the 株式承認証 Vt入って入って 株 のです。 我々の 普通株 もしなければ ♪the the the 必要です 適用することができます a 現金 支払います。 代わりに のです。 支払います 現金 はい 体を鍛える ♪the the the 捜査命令 保持者 所定の数式に基づいて株式の数を減らすことができますその結果、キャッシュレス行使により発行される株式数は、現金行使の場合に比べて少なくなり、現金行使による収益に影響を及ぼす可能性があります。
パブリック · ワラントおよび PIPE ワラントは、当該ワラントの行使時に発行可能な NKGen 普通株式を登録した有効な登録書がある場合に限り、現金に対してのみ行使することができます。その時点で有効な登録声明がない場合、証券法に基づく登録免除に従って、そのような令状は「現金なし」で行使することができます。
私たちは、私たちと長期購入契約を締結した投資家に現金を支払うか、普通株を発行することを要求されるかもしれません。これは、私たちが利用できる現金の数を減少させるか、またはあなたの私たちの所有権をさらに希釈するかもしれません。
事業統合のクローズに関連して、グラフは特定の投資家とフォワード購入契約を締結しました ( 「FPA投資家2023年9月22日、2023年9月26日、2023年9月29日に、FPA投資家は、約320万株のNKGen普通株を約3290万ドルで集団購入することに同意し、これらの株は私たちに支払われず、信託口座に入金した(第三者預かり口座)は、長期購入プロトコルの条項と条件に基づいている。信託口座内のすべての資金は、取引が1(1)周年記念日を終了する前に、会社および/またはFPA投資家に発行される。また、各代行口座内の資金が稼いだすべての利息は、それぞれのFPA投資家に発行される。
長期購入プロトコルは、当社がその時点で適用されたリセット価格よりも低い価格で売却、発行、または任意の変換可能またはNKGen普通株と交換可能な普通株または証券(いかなる二次譲渡も含まない)を付与する場合、リセット価格(以下、定義は後述)をより低い販売価格に下げることができると規定している。リセット価格は、満期日決済の計算および早期終了(後述)を選択する際に決済株価として使用され、差額を前払いするために販売の“下限”株価として使用される(定義は後述)。リセット価格が実際により低い価格に低下した場合、それは、逆に、長期購入プロトコルに規定されている私たちに発行される資金の減少をもたらす可能性がある。参照してください“経営陣の財務状況と経営結果の検討と分析−流動資金と資本資源−流動資金源−長期購入プロトコル,FPA引受プロトコルと添付“長期調達プロトコルおよび関連プロトコルがどのように動作するか、および代行アカウント支払いをどのように計算するかに関するより多くの情報。さらに、リセット価格は、FPA投資家の株式の一部または全部の売却、早期終了または保有の決定に影響を与える可能性があり、このような株式の売却は、私たちの普通株の取引量および/または取引価格の変動をもたらす可能性がある。普通株式取引量および/または取引価格のこのような変動は、追加資金を調達する能力に悪影響を及ぼす可能性がある。
信託口座から会社に発行される可能性のある金額は、評価期間内の取引価格(定義は後述)と適用されるリセット価格に基づきます。しかしながら、会社は、信託口座内のすべての資金を受信しない可能性があり、上述したように、株式または現金で決済金額の調整を要求される可能性がある(以下に説明する)。我々の株価が適用されるリセット価格(以下のように定義)より2.00ドル以上高い場合、FPA投資家は、信託口座および公開市場でこのような販売を販売する収益からより多くの集団対価格を獲得し、会社に支払う金額を減算する可能性があるので、株式を購入して推定日に保有する場合(以下のように定義する)ことができるからである。このような販売のいずれも、取引価格の変動性を増加させ、および/または取引価格の低下をもたらす可能性がある。また、FPA投資家が推定日まで株式の一部または全部を保有しており、20取引日の適用出来高加重平均価格が1株当たり2.00ドル未満である場合には、推定日(以下の定義)までに保有している引受株式1株当たり2.00ドルに相当する金額(または決済金額調整)を株式形式でFPA投資家に支払うことを要求される(現金で支払うことを選択しない限り)、大量に希釈し、さらに株価を低下させる可能性がある。もし私たちが株式形式でこの金額を支払うことができなければ、FPA投資家とのいくつかの合意に基づいて、私たちは現金で決済調整金額の欠陥を支払う必要があるかもしれない。いずれにしても、私たちは何の現金収益も受けず、私たちの流動性や財務状況に悪影響を及ぼす可能性があり、これは私たちの業務や運営業績に悪影響を及ぼす可能性があります。このような活動は私たちの普通株の取引価格にも悪影響を及ぼす可能性があり、これは私たちの他の証券保有者の取引頭寸にも悪影響を及ぼす可能性がある。
私たちはあなたの承認なしに普通株または他の株式証券を増発するかもしれません。これはあなたの所有権権益を希釈し、私たちの普通株の市場価格を下げる可能性があります。
2023年12月31日現在、NKGen未償還オプションを有し、合計2,101,760株のNKGen普通株、および発行された承認株式証を購入することができ、最大5,246,033株のNKGen普通株を購入することができる(パイプ承認証や転換高級転換可能債券の発行可能な株式は含まれていない)。NKGenはまた,業務合併完了後に通過した2023年株式インセンティブ計画に基づき,取引終了時までにNKGen普通株をすべて希釈して発行された普通株12.0%に相当するNKGen普通株と,取引日ESPP項で完全希釈された普通株最高3.0%に相当するNKGen普通株を最初に発行する能力がある。
いくつかの場合、株主の承認を必要とすることなく、将来的に未償還債務の買収または償還に関連する株式を含む普通株式または他の同等またはそれ以上の株式を将来的に発行することができる。
我々がNKGen普通株または他の同等または高級株式証券を増発することは以下の影響を与える可能性があるが、これらに限定されない
•私たちの既存株主のわが社での所有権の割合は減少するだろう
•将来配当金の支払いに使用される場合(あれば)減少する可能性があることを含む、1株当たりの利用可能な現金額
•以前発行されたNKGen普通株1株あたりの相対投票権力が弱まる可能性がある
•私たちの普通株の市場価格は下落するかもしれない。
証券や業界アナリストが私たちに関する研究を発表しない場合、私たち、私たちの業務またはその市場に関する不正確または不利な研究を発表したり、彼らが私たちの普通株に対して逆の提案をした場合、私たちの普通株の取引価格や取引量が低下する可能性がある。
私たちの普通株の取引市場は、証券や業界アナリストが発表する可能性のある、私たちの業務、市場、あるいは競争相手に関する研究と報告の影響をある程度受けている。1人以上のアナリストが不利な格付けで研究を開始するか、または普通株の格付けを引き下げ、我々の競争相手に関するより有利な推奨を提供するか、またはその業務に関する不正確または不利な研究報告を発表する場合、普通株の取引価格が低下する可能性がある。また、私たちは現在、証券研究アナリストが彼ら自身の業務の定期的な予測を確立し、発表することを予想している。これらの予測は大きく異なる可能性があり,我々が実際に得た結果を正確に予測できない可能性がある.その実績がこれらの証券研究アナリストの予測と一致しなければ、その株価は下落する可能性がある。アナリストの報道範囲を検討する予定だが、アナリストが報道を開始しなければ、普通株の取引価格や取引量は悪影響を受ける可能性がある。もし私たちのアナリストが私たちの報告を停止したり、私たちに関する報告書を定期的に発表できなかった場合、私たちは金融市場での可視性を失う可能性があり、これは逆に普通株の取引価格や取引量を低下させる可能性がある。
デラウェア州の法律と私たちの憲章と定款の条項は合併、買収要約あるいは代理権競争を困難にし、私たちの普通株の取引価格を下げる可能性があります。
私たちの憲章や規約に含まれる条項は、行動をとることで、私たちの支配権の変更を阻止、延期、または阻止したり、株主が有利だと思う経営陣の変更を阻止したりすることで、NKGen普通株の取引価格を下げる可能性があります。これらの規定は、以下を含むが、これらに限定されない
•すべてのNKGen取締役会のメンバーが選挙で生まれたわけではありません
•取締役会には、取締役数を決定し、空きや新設された役員のポストを埋める権利がある
•株主は、取締役選挙で投票する権利があった当時発行された株式の少なくとも3分の2(2/3)が賛成票を投じた場合にのみ、正当な理由で取締役を罷免する
•NKGen取締役会は、株主権利計画の優先株を実施するために使用することができる“空白小切手”
•NKGen取締役会は、株主の承認なしに私たちが許可したが発行されていない普通株と優先株を発行する権利があります
•私たちの株主は株主特別会議を開く能力がありません
•私たちの株主は、書面同意によって行動する権利がありません。書面同意はすべての株主の行動が私たちの株主会議で取らなければならないからです
•役員と上級職員に対する責任と賠償規定の制限
•NKGen別例の権利を制定、修正、または廃止する取締役会;および
•NKGen取締役会メンバーを指名したり、株主が年次株主総会で行動可能な事項の事前通知要求を提出したりする。
私たちの憲章やNKGen規約のどのような遅延または制御権の変更を阻止する条項は、私たちの株主がそれが持っているNKGen普通株からプレミアムを得る機会を制限する可能性があり、また一部の投資家がNKGen普通株に支払いたい価格に影響を与える可能性がある。
私たちの憲章は、デラウェア州衡平裁判所は、私たちと株主との間の基本的なすべての紛争の独占法廷になると規定しており、これは、私たちの株主が私たちまたは私たちの役員、役員、または従業員との紛争で有利な司法フォーラムを得る能力を制限するかもしれない。
私たちの憲章は、デラウェア州衡平裁判所は、私たちを代表して提起された任意の派生訴訟または訴訟、受託責任違反を主張するいかなる訴訟、改正されたデラウェア州会社法、私たちの憲章またはNKGen附例に基づいて私たちにクレームを提起した訴訟、または私たちの内部事務原則によって管轄されているクレームを提起する任意の訴訟に対する独占フォーラムである。これらの裁判所条項の選択は、株主が司法裁判所において、私たちまたは私たちの役員、上級管理者、または他の従業員と紛争することに有利であると考えるクレームを提出する能力を制限し、このような訴訟を阻止する可能性がある。この規定は、取引法に規定された義務または責任を執行するためのクレームにも適用されず、連邦裁判所が排他的管轄権を有する他のクレームにも適用されない。我々の憲章はさらに,法律によって許容される最大範囲で,米国連邦地域裁判所が証券法に基づいて提起された訴訟理由の任意の苦情を解決するための独占的なフォーラムとなると規定している.しかし、証券法第22条には、連邦裁判所及び州裁判所は、証券法又はその下の規則及び条例に基づいて提起された訴訟に対して同時管轄権を有すると規定されている。排他的裁判所条項が証券法に基づいて請求される裁判所への制限については,裁判所がこの条項を実行するかどうかには不確実性がある。私たちは投資家たちが連邦証券法とその下の規制を放棄してはいけないということに気づいた。また,他社の会社登録証明書の中で類似した場所条項を選択する実行可能性が法的手続きで疑問視されており,裁判所はこれらのタイプの条項が適用されないか実行不可能であると考える可能性がある.デラウェア州裁判所は、このような選択された裁判所条項が事実上有効であることを決定しているが、株主は依然として排他的裁判所条項が指定された場所以外の場所でのクレームを求めることができ、これらの規定がこれらの他の法域の裁判所によって実行されることを保証することはできない。もし裁判所が私たちの憲章に記載されている排他的法廷条項が訴訟で適用されないか、実行できないことを発見した場合、私たちは他の司法管轄区域でこのような訴訟を解決するために追加費用が発生する可能性があり、これはその業務を損なう可能性がある。
予測可能な未来に、私たちは配当金を支払うつもりはない。
私たちは現在、将来のいかなる収益も維持し、その業務の運営と拡張に資金を提供する予定であり、予測可能な未来にはいかなる配当金も発表または支払うことはないと予想している。さらに、吾等又は吾等の任意の付属会社が締結した任意の循環信用手配の条項は、吾等が配当金を支払う能力を制限することができ、吾等又は吾等の任意の付属会社が将来発生する可能性のある任意の追加債務は、同様の制限を含む可能性がある。そのため、株主は、将来の投資収益を実現する唯一の方法として、価格上昇後に普通株を売却することに頼らなければならない。
上場企業として、私たちはより多くのコストと義務を招くだろう。
上場企業として、当社は、特に当社が JOBS 法で定義される「新興成長企業」ではなくなった後、最近では負担する必要がなかった法的、会計、その他の費用を大幅に負担することになります。また、ドッド · フランク · ウォール街改革 · 消費者保護法、その下で公布され、公布される予定の規則、およびサーベンス · オックスリー法を含む、コーポレート · ガバナンスおよび情報開示に関する新規および変更される法律、規制および基準。JOBS 法や SEC や全米証券取引所の規則や規制は、公開企業に不確実性を生み出し、NKGen の取締役会と経営陣がこれらの規則を遵守するために費やさなければならないコストと時間。これらの規則や規制は、法的および財務的なコンプライアンスコストを増加させ、収益を生み出す活動から経営時間と注意を逸脱させると予想しています。
また、上場企業を設立するために必要な会社インフラの必要性は、経営陣の成長戦略の実施への関心を分散させる可能性があり、業務、運営結果、財務状況の改善を阻害する可能性があります。我々は、上場企業としての報告義務を履行するために、当社の財務報告·会計システムの内部統制·手順を変更し続けていきます。しかし、私たちが取った措置は上場企業としての私たちの義務を履行するのに十分ではないかもしれない。
上場企業としての要求は、私たちの資源を緊張させ、経営陣の注意を分散させ、私たちの合格取締役会のメンバーを吸引し、維持する能力に影響を与える可能性がある。
私たちは“取引所法案”、“サバンズ-オキシリー法案”、それに基づいて公布された任意の規則の報告要件、およびナスダックの規則を守らなければならない。これらの規制の要求は、私たちの法律と財務コンプライアンスコストを増加させ、いくつかの活動をより困難にし、時間をかけたり、高価にしたり、私たちのシステムと資源の需要を増加させた。“サバンズ-オキシリー法”(Sarbanes-Oxley Act)は、私たちに効率的な開示制御、手続き、および財務報告の内部統制を維持することを要求する。この基準を達成するために財務報告の開示制御および手順および内部統制を維持し、必要に応じて改善するためには、大量の資源および管理監督が必要であるため、管理職の注意が他の業務に移る可能性がある。このような規制はまた私たちが合格した独立した取締役会のメンバーを引きつけて維持することの難しさを増加させるだろう。また、これらの規制は、私たちが役員や上級管理職の責任保険を獲得することをより困難で高価にしてくれる。私たちは低減された保証範囲を受け入れることを要求されるかもしれません。あるいはより高い費用を負担してこそ保証を受けることができます。上場企業の報告要求を守るコストの増加や、これらの要求を満たすことができない可能性があり、私たちの運営、業務、財務状況、あるいは運営結果に重大な悪影響を及ぼす可能性があります。
もし私たちが財務報告に対する適切かつ効果的な内部統制を確立し、維持することができなければ、上場企業として、私たちが正確かつタイムリーな財務報告を作成する能力が損なわれる可能性があり、投資家は私たちの財務報告に自信を失い、私たちの普通株の取引価格が下落する可能性がある。
サバンズ·オキシリー法第404条によると、財務報告の内部統制に関する経営陣の報告書は、我々の財務報告及び内部統制(会計買収側として)について、新たな成長型会社でなくなった場合には、独立公認会計士事務所の認証も必要となる。管理管理層が財務報告内部統制を評価するために達成しなければならない基準の規則は複雑であり、大量の文書、テスト、可能な救済措置が必要である。歴史的に見ると、私たちは必ずしもこれらのすべての規則を遵守する必要はありません。サバンズ-オキシリー法案を遵守し、取引所法案によって報告会社になる要求と将来の任意の複雑な会計規則を遵守するためには、私たちの伝統的な情報技術システムをアップグレードし、追加の財務と管理制御、報告システムと手続きを実施し、より多くの会計と財務者を雇用する必要があるかもしれません。
もし私たちがこのような要求を遵守するために追加の会計と財務者を雇うことができなければ、私たちはもっと多くの外部顧問を維持する必要があるかもしれない。もし私たちまたは私たちの独立公認会計士事務所が財務報告の内部統制に有効であると結論できなければ、投資家は私たちの財務報告に自信を失うかもしれません。これは私たちの証券価格にマイナスの影響を与えるかもしれません。
法律または法規の変更またはそのような法律または法規の解釈または適用方法の変化、またはいかなる法律または法規にも遵守できないことは、私たちの業務および運営結果に悪影響を及ぼす可能性がある。
私たちは国、地域、そして地方政府によって制定された法律法規に支配されている。特に、私たちは特定のアメリカ証券取引委員会と他の法的要求を遵守することを要求された。適用される法律と規定を遵守して監視することは困難で、時間がかかり、費用がかかるかもしれない。解釈及び適用される適用法律又は法規を遵守しないことは、我々の業務及び運営結果に重大な悪影響を及ぼす可能性がある。また、これらの法律·法規とその解釈や応用は、経済、政治、社会、政府政策の変化を含む時々変化する可能性があり、これらの変化は、私たちの業務や運営結果に重大な悪影響を及ぼす可能性がある。
項目1 B。未解決従業員意見
ない。
プロジェクト1 C。ネットワーク·セキュリティ
業務合併前は、業務のない空白小切手会社であったため、私たち自身の業務は重大なサイバーセキュリティの脅威に直面した業務は何もありませんでした。我々は,内部情報技術(“IT”)に従う予定の流れを含めてプロセスを開発する予定であるそれは…)ITシステムおよび我々が作成、使用、送信、受信、および維持する情報からなるネットワークセキュリティ脅威の重大なリスクを評価、識別および管理することを目的とするセキュリティポリシー。私たちはまた、これらのプロセスと政策を私たちの企業全体のリスク管理システムとプロセスに統合することを求めている。ネットワークセキュリティ脅威(第三者サービスプロバイダを使用することに関連する脅威を含む)からの重大なリスクを評価、識別、管理する流れは、影響を受ける可能性のある関連資産の決定、可能な脅威源および脅威イベントの決定、脅威の潜在的可能性および影響に応じて脅威を評価すること、およびそのようなリスクを管理および/または緩和するための適切または必要な制御措置を決定することを含むであろう。我々は、参加する前にすべての第三者サービス提供者のセキュリティ評価を行い、関連するネットワークセキュリティ基準の遵守を保証するために、継続的な監視を維持する予定である。
ネットワークセキュリティに影響を与えるイベントが発生した場合、管理チームは、取締役会に報告し、そのようなイベントに関連する任意のリスクに対応して低減するために、管理チームイベント応答計画の最新情報を提供する。データセキュリティ保護に大きな投資をしていない初期の会社として、このような事件から身を十分に守ることができないかもしれません。我々はまた,ネットワークイベントを十分に防止したり,ネットワークイベントのいかなる脆弱性を調査したり修復したりするのに十分な資源が不足している.これらのイベントのいずれか、またはそれらの組み合わせは、私たちのビジネスに実質的な悪影響を与え、財務損失をもたらす可能性がある。
項目2.財産
私たちの主なオフィスはカリフォルニア州の聖アンナにありますそこには約25,000平方フィートのオフィス、製造、実験室空間があり、約半分を占めています のです。 NK細胞のGMP産生に適している。私たちはまだカリフォルニア州のオーウェンで事務施設を借りています
私たちの施設は、新しいレンタルを交渉したり、その運営の追加的または代替空間を評価したりすることを求めるかもしれませんが、現在の需要を満たすのに十分だと信じています。
項目3.法的訴訟
時々、私たちは法的手続きの影響を受けるかもしれない。個別または全体が私たちの業務、財務状況、または経営結果に重大な悪影響を及ぼすと考えられる積極的な法的手続きには、現在、参加または承知していません。結果にかかわらず,弁護や和解コスト,管理資源分流などにより,訴訟は我々に悪影響を与える可能性がある。
プロジェクト4.鉱山安全情報開示
適用されません。
第II部
項目5.登録者普通株式市場、関連株主事項、発行者による株式購入
市場情報
私たちの普通株はナスダック世界市場に上場して、コードはNKGNで、私たちのナスダック資本市場での権利証上場コードはNKGNWです。
所持者
2024年4月16日まで、約53名のNKGen普通株保有者と2名の私たちの公共株式証記録保有者は、1人当たり1株11.50ドルの行使価格で1株普通株を行使することができる。株主の実際の数は受益者である株主を含む記録保持者の数を超えているが、その株は仲介人や他の被著名人が街頭名義で保有している。この数の登録所有者は、その株式が他のエンティティが信託形式で保有する可能性のある株主も含まれていない。
配当政策
設立以来、私たちはどんな現金配当金も発表したことがなく、私たちは予測可能な未来にも何の配当も送らないと予想している。代わりに、私たちのすべての収益は、運営資金を提供し、私たちの運営を支援し、私たちの業務の成長と発展に資金を提供することが予想されます。配当金の支払いはNKGen取締役会が適宜決定し、私たちの収益、資本要求、財務状況、見通しに依存する;適用されるテキサス州の法律は、配当金が黒字または現在の純利益からしか支払うことができないことを規定している;およびNKGen取締役会が関連する他の要素を考慮する可能性がある。適用される州法が一般的に適用される制限を除いて、現在、私たちが普通配当金を支払う能力を制限していない。
最近売られている未登録証券
これまで8-K表で開示されていた情報を除いて、2023年12月31日までの財政年度内に、会社は未登録株式証券の販売を何も行っていない。
発行人が株式証券を購入する
2023年12月31日までの四半期または年度内に、普通株または他の株式証券は購入していません。
株式補償計画に基づく発行承認証券。
本プロジェクトに要求される持分補償計画に関する情報は、本年度報告テーブル10−K第12項の情報を参照して格納される。
第六項です[保留されている]
第7項:経営陣の財務状況と経営成果の検討と分析。
以下、当社の財務状況及び経営結果の検討及び分析は、本年度報告書10-K表の他の部分に含まれる連結財務諸表及び関連付記とともに読まなければならない。総合財務情報以外に、以下の討論は展望性陳述を含み、著者らがリスクと不確定要素に関連する計画、推定、信念と期待を反映している。私たちの実際の結果と事件の時間は、このような前向きな陳述で議論されているのとは大きく違うかもしれない。これらの差異を引き起こすかまたは促進する可能性のある要因は、以下の議論の要因と、本年度報告におけるテーブル10−Kに関する他の内容、特に項目1 Aにおけるものを含む。“リスク要因”と“前向き陳述に関する特別な説明”。7項で用いた大文字タームは他に定義されていないが,その意味は8項で述べたタームと同じ意味であるべきである
概要
著者らは臨床段階の生物技術会社であり、独自のSNKプラットフォームを利用して革新的な自己、異体とCAR-NK細胞療法を開発し、それを商業化することに集中している。我々の候補製品は,NKMAXによる体外実験結果に基づいて,細胞毒性,サイトカイン産生,受容体発現の活性化などのパラメータに基づいて,初期NK細胞個体群よりも活性化されたSNK細胞を生産する特許製造と凍結保存プロセスに基づいている。NKGenは、SNK細胞はアルツハイマー病(AD)などの神経変性疾患患者に転化益をもたらす可能性があると考えている広告.広告“パーキンソン病”と“PD“)、そして癌。
我々は最初に2021年1月28日にデラウェア州に登録設立され、名称はGraf Acquisition Corp.IVであり、合併、資本株式交換、資産買収、株式購入、再編、または1つまたは複数の企業または実体との任意の他の同様の業務合併を実現することを目的とした特殊な目的買収会社である
2023年4月14日,Graf,Merge SubとLegacy NKGen間の合併協定と計画を締結した。合併協議項での取引が2023年9月29日に完了した後、Merge Subは当社と合併して当社に合併し、Legacy NKGenはGrafの完全子会社として生き残った。業務合併の完了に合わせて、Grafは“と改名しました株式会社 NKGen バイオテクノロジー“Legacy NKGenを改名”NKGenはバイオテクノロジー会社を運営しています。合併後の会社の普通株と権利証はナスダック株式市場で取引を開始したNKGN“と”NKGNW“それぞれ2023年10月2日に。
総合財務諸表付記では、明記や文脈が別に示唆されているほか、“当社”、“吾等”、“吾等”及び“吾等”は、業務合併完了前のレガシーNKGen及び業務合併完了後の当社を指す
企業合併
業務合併について、いくつかの金融商品が発行された。これには高度変換可能手形、SPA株式承認証、管路株式証明書と長期購入プロトコルが含まれる。また、Grafのいくつかの以前に存在した金融商品は、Grafの残りの公開株式、私募株式証、株式公開承認証、運営資金承認証を含む業務合併の逆資本再編処理によって発行されたとみなされている。さらに、取引コスト、いくつかの方正株式が帰属条件で終了または配給され、私たちのレガシー変換可能チケットが変換され、Grafのすべての資産および負債がNKGenの資産および負債と歴史的コストベースで統合され、レガシーNKGenのすべての普通株式および株式オプションが交換比率に従って当社の普通株に交換され、その他の重大なイベントが発生した。注3を参照してください逆資本再編業務合併の詳細については、総合財務諸表を参照されたい
業務のハイライト
私たちの目標は変革的な自然殺しを(“NK)神経変性疾患および腫瘍疾患を有する患者に細胞治療を提供し、それにより、我々の広範なNK細胞専門知識の可能性を達成する。2022年10月14日に研究中の新薬を受け取りました工業“アメリカ食品医薬品局の承認を得ています”林業局SNK 02固形腫瘍の同種異体NK細胞治療に用いられる。2023年10月20日、我々はADでSNK 01に対するFDAのIND承認を得た。2023年12月21日、私たちはカナダ衛生部からADへのSNK 01の臨床試験応用に対する同じ提案書を受け取った。2023年12月28日、私たちは米国の最初の参加者にSNK 01-AD 01臨床試験の薬を服用した。2024年以降は,(I)SNK 01の臨床開発を進め,AD治療のI/IIa期試験を米国とカナダで継続し,SNK 02による難治性固形腫瘍治療のI期試験を完成させる予定である。著者らはまたPD(FDA承認INDに依存する)で実験を行い、他の神経変性疾患に拡張した状況を評価し、戦略協力を通じて腫瘍学の発展を加速し、引き続き著者らの製造技術に投資する予定である。
NKGenは2023年10月25日に開催された第16回アルツハイマー病年度臨床試験会議でそのI期臨床試験データを公表した。著者らの10週間のI期用量逓増臨床試験において、前の三つの列中の10名のAD患者が分析された。実験では、患者NK細胞の100%が活性化および増幅に成功した。治療に関連する副作用は認められなかった。最後の服薬後1週間(11週目)、30%の患者はAD総合採点で臨床改善を示した(ADCOMSベースラインと比べ、60%の患者のADCOMS採点はベースラインと比べて安定であり、50%-70%の患者の臨床痴呆採点の総和は安定或いは改善した(BOCKS)CDR−Sb)、アルツハイマー病評価量表-認知分量表(Adas-Cog“)および/または小型精神状態検査(”色とりどりの手紙“)得点。1人の患者のスコアはADCOMSの中等度分類から軽度分類への移行を示した。最後の服薬(22週目)12週後、44%~89%の患者のすべての認知スコアは、11週目と比較して安定または改善し、11週目と比較して50%の患者のADCOMSスコアは安定していた。脳脊髄液バイオマーカーデータによると、SNK 01の静脈内投与は血液脳関門を越えているようであり、脳脊髄液pTau 181レベルおよびGFAP測定の神経炎症を低下させ、この影響は22週目に持続したようである。われわれの広範なNK細胞専門知識を利用して,神経変性疾患患者に変性性をもたらすNK細胞療法を目指している。
われわれの業績に影響を与える要素
これまで、私たちの業務は私たちのSNKプラットフォームを利用して業務計画、資金調達、NK細胞療法、臨床研究とその他の研究開発活動を行うことに限られている。私たちは運営から利益を出したことがありません。2023年12月31日と2022年12月31日の年度まで、私たちの純損失はそれぞれ8300万ドルと2670万ドルです。2023年12月31日現在、我々の累計赤字は1.621億ドルです。私たちは少なくとも今後数年以内に、私たちの持続的な活動に関連する巨額の費用と運営損失が引き続き発生すると予想しています:
•私たちの候補製品のために非臨床研究と臨床試験を開始し、完成した
•私たちの候補製品のために追加プロセス開発を製造し実行する契約を締結した
•現在の候補品を超えて私たちのルートを構築するために研究と開発を続けています
•私たちの知的財産権の組み合わせを維持し、拡大し、保護する
•より多くの臨床、品質管理、科学、管理者を招聘する
•私たちの製品開発努力と計画の将来の商業化を支援するために、運営や財務者を増やす
•上場企業の運営に適した運営と管理能力を増加させる。
W私たちが1つ以上の候補製品の開発を成功させ、規制部門の承認を得ない限り、製品販売から何の収入も得られないことは、あれば何年も達成されないだろう。したがって、候補製品を販売することで大量の収入を生み出すことができる前に、株式発行、債務融資、または他の資本源(関連者を含む)、および可能な贈与、協力、許可、または他の同様の手配によって、私たちの現金需要を満たすことが予想されます。しかし、私たちは必要に応じて優遇条件で、または追加資金を調達できないか、またはそのような他の計画を達成することができないかもしれない。私たちは必要な時に資金を調達したり、このような他の計画を達成することができず、私たちの財務状況に負の影響を与え、私たちの製品開発や将来の商業化努力を延期、制限、減少または終了させるか、あるいは候補製品や私たちのプラットフォーム技術を開発し、マーケティングする権利を与えるかもしれません。そうでなければ、私たちはこれらの製品を自分で開発し、マーケティングしたいと思います
私たちは今のところありませんし、私たちの運営、私たちの費用、他の流動性の需要を満たすのに十分な資金もないと予想され、すぐに追加的な資本が必要になります。また、私たちは持続的な経営を続ける企業として私たちが能力があるかどうかを大きく疑っています。私たちは私たちがこのような追加的な支出を許容可能な条件でタイムリーに得ることができるか、または全く保証できないという保証はない。もし私たちが十分な資本をすぐに集めることができなければ、私たちは私たちの業務運営と支払いに必要なお金を支払うのに十分な現金と流動性がなく、私たちの製品開発を延期、制限、削減、または中止することを要求されるかもしれないし、運営を停止したり、破産保護を申請したりすることを余儀なくされる可能性がある。
運営結果の重要な構成要素は
収入.収入
私たちは今のところ販売が許可されている製品は何もありません。今まで何の製品収入も確認されていません。将来、私たちは製品販売、ライセンス支払い、マイルストーン支払い、または協力手配を含むが、これらに限定されない様々なソースから収入を得るかもしれません。もし私たちが臨床的に成功できなければ、あるいは私たちのどの候補製品も規制部門の承認を得ることができなければ、私たちの将来収入を作る能力は制限されるだろう。
2023年12月31日までの年間では、このようなサービスの提供を停止しているため、今後の間に新冠肺炎(以下の定義)テストサービスに関連した収入が発生することも望まない。2022年12月31日までの年間で、コロナウイルス試験サービスを提供することで収入が発生しました(“新冠肺炎”).
コストと支出
収入コスト
従来、収入コストには、新冠肺炎検出サービスの提供に関連する第三者から購入された検出キットおよびサプリメントが含まれていた。2023年12月31日までの1年間、私たちは何の収入コストもなく、今後もこのようなコストは発生しないと予想されます。新冠肺炎検査サービスの提供を中止したからです。
研究と開発費
著者らは主に資源を研究と開発活動に集中し、著者らの候補製品のための臨床前研究、製品開発、監督管理支持と臨床試験を含む。私たちの研究開発費は
•従業員に関する費用は、研究開発職能者の賃金、福祉、税収、出張、および株式ベースの報酬費用を含む
•候補製品のプロセス開発と生産に関する費用;
•臨床前活動と監督操作に関連するコストは、研究材料の取得、開発、製造のコストを含む
•私たちの候補製品の規制届出に関する臨床試験と活動
•設備分配、間接費用、減価償却と実験室設備の償却その他の費用。
私たちは私たちが引き続き私たちのプラットフォームと候補製品を開発することに伴い、将来私たちの直接と間接研究開発費用が増加すると予想しています。
私たちのプラットフォームと候補製品の開発成功は大きな不確実性を持っている。必要な臨床前と臨床研究を行い、監督管理の許可を得る過程は高価で時間がかかる。現在、私たちのすべての候補製品の開発に必要な努力の性質、時間、コストを合理的に見積もることはできず、これらの候補製品の現金純額(あれば)がどのくらいで始まるかを合理的に見積もることはできない。これは,治療法の開発に関連する多くのリスクや不確実性要因が,様々な要因に依存するためであり,これらに限定されない
•臨床試験の範囲、進捗、費用、結果
•プロセス開発と製造の範囲、進捗、費用
•臨床前や他の研究活動や
•規制部門が承認した時間。
研究·開発費用には,我々の候補製品を発見·開発するための研究·開発活動による費用が含まれている。直接研究開発コストには,臨床前と臨床活動を展開する契約研究機関,コンサルタントや他のサプライヤーが締結した協定による外部研究開発費,臨床前および臨床研究に用いられる候補製品の生産に関する費用,実験室用品と許可費がある。間接研究開発コストには、従業員の給料、賃金税、ボーナス、福祉、研究開発に参加する個人の株式ベースの給与費用が含まれる。我々の研究·開発作業で発生したコストは発生時に費用を計上している。
私たちは通常、私たちの研究開発プロジェクトで従業員、コンサルタント、施設、設備、そしていくつかの供給資源を使用します。我々は、候補製品または開発計画に従ってアウトソーシング開発コストを追跡するが、人員コスト、他の内部コスト、またはいくつかの外部コンサルタントコストを特定の候補製品または開発計画に割り当てることはない。このような費用は間接研究開発費用に含まれている。2023年12月31日と2022年12月31日までの年間で,すべての直接研究·開発費用はSNK 01とSNK 02に関係している。
一般と行政
一般および行政費用は、主に管理者、人的資源、財務および他の一般および行政従業員に関連する費用を含み、賃金および株式報酬、専門サービス費用、および施設および間接費用の分配を含む。
上場企業となる一次コストや上場会社としての運営継続コストに関する一般的·行政費用は将来的に増加し,従業員数の拡大や取締役や外部コンサルタントの費用の増加を含むことが予想される。上場企業に適用されるコーポレート·ガバナンス、内部統制、同様の要求を遵守することには巨額のコストが生じると予想される。また、我々の候補製品が任意の潜在的な将来の規制承認または商業化を得る前に、販売、マーケティング、商業化機能の確立に関連するコストが増加することが予想される。
利子支出
2023年12月31日現在、利息支出には、主に当社関連側融資、短期関連側融資、循環信用限度額および高度変換可能手形による利息が含まれている。
利息支出には、2022年12月31日現在、主に当社関連先の融資に関する利息が含まれています。
私たちが公正価値で計算したレガシー転換可能な本チケットに関する利息支出をそのような手形の公正価値変動に計上することを選択した。
変換可能な本チケットと関連先に対応する変換可能なチケットは価値変動を公正に許容する
関連先の変換可能本票および変換可能本票に対応する公正価値変動には,2023年まで,2023年および2022年12月31日までの年度レガシー転換可能手形公印価値変動の損益が含まれており,先に他の支出を計上し,2022年12月31日現在および2021年12月31日まで年度純額を計上している。高度な変換可能なチケットは、公正価値に基づいて入金されないので、本財務諸表のタイトルには含まれない
長期調達契約発行損失
長期購入契約の発行損失は,私募配給契約に関する長期購入デリバティブ負債や紅株の初歩的な確認であり,このような合意は2023年9月に業務合併完了時に発行されるため,2022年における我々の経営業績の構成要素とはならない。当社は紅株についていかなる追加的な代価も徴収することはなく、非日常的な公正価値計量である。長期購入派生負債は日常的な公正価値計量である。そのため、長期購入派生負債の公正価値変動は著者らの未来の経営業績の構成部分になる。
長期住宅購入契約変更損失
2023年12月26日、FPA修正案は、50万ドルの対価格と交換するために、長期購入協定によって得られる可能性のある現金収益に影響を与えるFPA投資家と署名した。FPA改正により,長期購入契約により得られる最大現金収益は,引受売掛金残高に反映され,低減された。受取引受額が減少したのは、(I)改訂されたリセット価格が当社が受け取ることができるFPA株式1株当たりの最高価格(1株当たり10.44ドル)を低下させ、(Ii)200,000株のFPA株式を赤株に再指定し、FPA株式の総数を減少させ、(Iii)改訂された前払い差額が前払い差額を増加させたためである。私たちは紅株や差額販売を販売したり決済したりする対価は何も受けないだろうFPA投資家が第三者にFPA株を売却する収益は、残高がなくなるまでプリペイド不足を減少させるとみなされなければならず、その際、会社はFPA株の売却から収益を得ることができる会社は相応の減価を確認した修正日に長期購入デリバティブ負債を計上するのは、売掛金の引受金のうち、吾などではなくFPA投資家に発行できる部分を表すからである.
長期購入由来負債の公正価値変動
長期購入由来負債の公正価値変動は長期購入由来負債の公正価値変動の確認であり、この等変動は資産負債表日ごとに四半期純損失で確認される。
デリバティブ · ワラント負債の公正価額変動
デリバティブワラント負債の公正価値の変化は、各貸借対照表日において四半期ごとに純損失として認識されているプライベートワラント、運転資本ワラント、 PIPE ワラントの公正価値の変化を認識しています。
取引費用支出
支出された取引費用は、事業統合に関連して発生した Legacy NKGen の取引費用を表し、相対公正価値に基づいて発行された負債分類商品に割り当てられたものです。事業統合は 2023 年 9 月に実施されたため、取引費用は 2022 年度の業績に含まれていません。
その他の収入、純額
その他の利益は、主に 2023 年 12 月期におけるサブリース利益および給与税控除、 2022 年 12 月期におけるサブリース利益で構成されています。
所得税支給
当社は、許容控除、控除、不確実な税務ポジション、繰延税金資産および負債の変化、税法の変更を調整した、制定された税率に基づく米国連邦および州の所得税の対象となります。
所得税の引当金は、主に繰延税金の変動によるもので、評価引当金によって一部相殺されます。
経営成果
2023 年 12 月期と 2022 年 12 月期の比較
2023 年 12 月期および 2022 年 12 月期における業績は、以下の表のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | 変わる |
| 2023 | | 2022 | | $Change | | 変更率 |
| 収入.収入 | $ | — | | | $ | 77 | | | (77) | | | * |
| コストと支出: |
| | | | | |
|
収入コスト | — | | | 18 | | | (18) | | | * |
研究開発 | 15,668 | | | 16,746 | | | (1,078) | | | (6) | % |
一般と行政 | 14,078 | | | 7,659 | | | 6,419 | | | 84 | % |
総費用 | 29,746 | | | 24,423 | | | 5,323 | | | 22 | % |
| 運営損失 | (29,746) | | | (24,346) | | | (5,400) | | | 22 | % |
| その他の収入(支出): |
| | | | | | |
利子支出 | (745) | | | (2,306) | | | 1,561 | | | (68) | % |
関連当事者による転換社債の公正価値の変動 | (1,043) | | | (177) | | | (866) | | | * |
先物買取契約の発行損失 | (24,475) | | | — | | | (24,475) | | | * |
先物買入れ契約の変更による損失 | (442) | | | — | | | (442) | | | * |
先物買入れデリバティブ負債の公正価値の変化 | (9,784) | | | — | | | (9,784) | | | * |
派生株式証負債の公正価値変動 | (13,503) | | | — | | | (13,503) | | | * |
取引コストを支出しました | (3,329) | | | — | | | (3,329) | | | * |
その他の収入、純額 | 120 | | | 82 | | | 38 | | | 46 | % |
所得税引当前純損失 | (82,947) | | | (26,747) | | | (56,200) | | | 210 | % |
所得税支給 | (7) | | | (7) | | | — | | | * |
| 純損失と総合損失 | $ | (82,954) | | | $ | (26,754) | | | $ | (56,200) | | | 210 | % |
*意味がない
収入.収入
2023 年 12 月 31 日を末日とする会計年度には収益は計上されませんでした。売上高は 10 万ドル減2023 年 12 月 31 日を末日とする会計年度は、 2022 年 12 月 31 日を末日とする会計年度と比較しています。この減少は、 2023 年 12 月 31 日を末日とする会計年度における COVID—19 検査収益の縮小によるものです。
収入コスト
2023 年 12 月 31 日を末日とする会計年度に発生した収益費用は発生しなかった。2023 年 12 月 31 日を末日とする会計年度の収益コストは、 2022 年 12 月 31 日を末日とする会計年度と比較して 10 万ドル未満減少しました。これらの減少は、 2023 年 12 月 31 日に終了した年度における NKGen の COVID—19 検査収益の縮小に完全に関連しています。
研究と開発費
以下の表は、 2023 年 12 月期および 2022 年 12 月期の研究開発費の構成要素 ( 千単位 ) をまとめたものです。
| | | | | | | | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | 変わる |
| 2023 |
| 2022 |
| $Change | | 変更率 |
直接研究開発費総額 | $ | 1,485 | |
| $ | 1,394 | |
| $ | 91 | | | 7 | % |
| タイプ別の間接研究開発費: |
|
|
|
|
| | |
人事関係のコスト | 8,395 | |
| 8,912 | |
| (517) | | | (6) | % |
研究開発用品とサービス | 4,426 | |
| 4,891 | |
| (465) | | | (10) | % |
割り当てられた施設、設備、その他の費用 | 1,362 | |
| 1,549 | |
| (187) | | | (12) | % |
間接研究と開発費用総額 | 14,183 | |
| 15,352 | |
| (1,169) | | | (8) | % |
| 研究と開発費用総額 | $ | 15,668 | |
| $ | 16,746 | |
| $ | (1,078) | | | (6) | % |
2023 年 12 月期の研究開発費の総額は、 2022 年 12 月期と比較して 110 万ドル ( 6% ) 減少しました。これは、主に間接研究開発費が 120 万ドル ( 8% ) 減少したことによるものです。
2023 年 12 月期における直接研究開発費の増加は、主に 2023 年第 3 四半期に SNK 02 第 1 相臨床試験を開始したことによるものです。
間接研究開発費総額の減少 この年度までに2023年12月31日は、主に研究開発用品やサービスが50万ドル、または10%減少し、人員関連のコストが50万ドル、または6%減少し、分配された施設、設備、その他の費用が20万ドル、または12%減少したため、2022年12月31日までの年間と比較して、主に研究開発用品およびサービスが50万ドル減少したため、または10%減少した。
研究開発用品やサービスの減少この年度までに2022年12月31日までの年度と比較して、2023年12月31日の主な原因は、2022年12月31日までの年度と比較して、研究開発材料の調達減少により、実験室供給コストが40万ドル、または17%減少し、また、コンサルティングや規制事務コストの低下により、専門費用が10万ドル、または6%減少したためである。
2022年12月31日までの年度と比較して,2023年12月31日までの人事関連コストが減少したのは,主にNKGenが2022年下半期に行ったSNK 01肉腫第1期臨床試験が大幅に完了し,研究開発者の報酬コストが130万ドル,あるいは17%減少したためであるが,2023年第1四半期の株式オプション付与により増加した株式報酬支出90万ドルが部分的に相殺され,株式オプション付与期間は付与時から4年まで様々であった。
分配された施設、設備、その他の費用の削減この年度までに12月31, 2023年は2022年12月31日までの年度と比較して,主に2023年12月31日までの年度のメンテナンス費用が2022年12月31日までの年度に比べて20万ドル,または47%減少したが,公共事業コストが10万ドル未満増加し,その影響を部分的に相殺したためである。
一般と行政費用
2022年12月31日までの年度と比較して、2023年12月31日までの年度一般および行政支出は640万ドル、あるいは84%増加している。この増加は、主に2023年第1四半期に株式オプションを付与することにより320万ドルの株式オプション補償支出が増加し、これらの株式オプション付与の期間が2年から4年まで様々であることと、上場企業に関する法律、コンサルタント、会計コストの増加により210万ドルの専門費用が増加したことによるものである。
利子支出
2022年12月31日までの年度と比較して、2023年12月31日までの年度の利息支出は160万ドル、または68%減少した。減少の主な原因は、関連側の融資利息支出が180万ドル減少したことであるが、循環信用限度額と高度変換可能手形の利息支出の増加によって相殺される。これは,2022年12月31日と比較して,2023年12月31日までの関連側融資残高の未償還元本が減少したためであり,付記7で述べたように,成約時に何らかの関連側融資残高を株式に変換するためである債務2023年12月31日現在及び同年度までの総合財務諸表。
循環信用限度額は2023年6月に設立されたため、循環信用限度額に関連する利息支出は20万ドルであり、2023年12月31日と2022年12月31日までの年度はそれぞれゼロである。
本票を転換して価値変動を公正に許容することができる
2023年12月31日までの年度の交換可能手形の公正価値変動は、旧交換手形による2022年12月31日の公開価値と旧交換手形の成約時の公正価値との比較である(発行により増加した公正価値は含まれていない)。2022年12月31日現在、変換の確率はゼロである。成約時には、レガシー転換手形を契約価格で割引して両替します。当社は2023年12月31日までに,関連先の転換可能本票および変換可能本票の公正価値変動損失に対応する合計100万ドルを確認し,予想両替価格,両替確率および両替前に同期間に発行された当算利息が変動したためである.
長期調達契約発行損失
業務合併は2023年9月29日に完了したため、長期調達契約発行の損失は私たちの2022年の運営業績の構成要素ではありません
2023年12月31日までに年度発行長期購入契約損失は2,450万ドルであり、長期購入デリバティブ負債及び私募配給契約に関連して発行された紅株を初歩的に確認することを含む
長期住宅購入契約変更損失
業務合併は2023年9月29日に完了したため、長期調達契約改訂の損失は私たちの2022年の運営業績の構成要素ではない。2023年12月31日までの年度の長期購入契約改定損失は40万ドル。
2023年12月26日、FPA修正案は、50万ドルの対価格と交換するために、長期購入協定によって得られる可能性のある現金収益に影響を与えるFPA投資家と協定に署名した。FPA修正案に関連する損失は受取引受額の減少であることが確認されたが、一部は長期購入デリバティブ負債の減少と会社が受け取った50万ドルの代償によって相殺された。
長期購入由来負債の公正価値変動
業務合併は2023年9月29日に完成したため、長期購入派生負債の公正価値変化は私たちの2022年の経営業績の構成部分ではない
長期購入デリバティブとは、FPA投資家に発行可能な引受売掛金部分である。長期購入デリバティブ負債の公正価値変動とは、各貸借対照表日に長期購入デリバティブ負債の公正価値の再計量による損益を確認することである。長期購入デリバティブ負債の公正価値の減少は主に当社の2023年12月31日までの年度の株価が初回発行に比べて下落した影響と関係があり、これは受取引受金の下の潜在金額を減少させ、受け取るべき引受金の公正価値はそれに応じて長期購入デリバティブ負債の公平値を減少させた。
デリバティブ · ワラント負債の公正価額変動
業務合併は2023年9月29日に完了したため、派生権証負債の公正価値変化は私たちの2022年の運営業績の構成要素ではない
派生株式証負債の公正価値変動とは、各資産負債表の日に私募株式証、運営資金承認株式証及びパイプ承認持分証の公正価値を再計量することを確認したことによる損益である。2023年12月31日までに、私募株式証及び運営資金株式承認証の公平値はそれぞれ150万ドル及び20万ドル減少した。2023年12月31日までの1年間に、パイプ承認株式証の公正価値は1,510万ドル増加した。私募株式証および運営資金株式承認証の公平値が減少したのは,主に2023年12月31日までの年度内に,我々の株価が初回発行時より下落したためである.管路承認株式証の公正価値の増加は主に管路株式証のいくつかの特徴の影響によるものであり、価格リセットと下行保護現金の実行、及び私たちの株価の初回発行から2023年12月31日までの間の変動を含む。
取引費用支出
業務合併は2023年9月29日に完了したため、取引コスト支出は私たちの2022年の運営業績の構成要素ではありません
2023年12月31日までの年間取引コストは330万ドルで、業務合併に関連して発行された負債分類ツールに相対公正価値で割り当てられた取引コストが含まれている
その他の収入、純額
2022年12月31日までの年度と比較して、2023年12月31日現在の年度では、他の収入純額は10万ドル未満増加し、46%増となっている。増加の要因は,2023年12月31日までに年度確認された10,000,000ドルの新冠肺炎賃金税控除であったが,転貸収入が10,000,000ドル減少したことで部分的に相殺され,NKGenは転貸レンタル者であった。転貸は2023年7月までに終了します。
所得税支給
2022年12月31日までの年度と比較して、2023年12月31日までの年間所得税支出は10万ドル未満増加しており、これは主に繰延税収残高の変化が推定手当部分で相殺されているためである。
流動性と資本資源
資金需要と持続的な経営
設立以来,運営損失と運営キャッシュフローが負となる状況が発生している。私たちはまだ開発の初期段階にあり、予測可能な未来に、私たちは私たちの研究と臨床前研究と臨床試験を続けるにつれて、私たちの第1段階と第1/2段階の臨床試験と予想される第2段階の臨床試験を含み、私たちの現在の候補製品研究のパイプ或いは範囲を拡大し、私たちの候補製品のためにより多くの臨床前研究或いは他の研究或いは臨床試験を開始し、より多くのメーカー或いはサプライヤーを変更或いは増加させ、臨床研究を成功させるための任意の候補製品のために監督とマーケティング許可を求め、他の候補製品と技術を買収し、私たちの知的財産権の組み合わせを維持、保護、拡大することができるかもしれない。技術者を誘致し、維持し、上記のいずれかの遅延や問題に遭遇した。
相当な製品収入を生み出すことができる前に、もしあれば、株式と債務融資または他の資本源(関連先を含む)を組み合わせることで、私たちの現金需要を満たすことが予想される。もし私たちが将来株式や債務を売却することで追加資本を調達すれば、私たちの株主の所有権権益は希釈されるだろう。これらの証券の条項は、清算または他の特典を含むことができ、私たちの既存の普通株主の権利に悪影響を及ぼす可能性がある。もし私たちが協力協定、マーケティング協定、または許可手配を通じてより多くの資金を調達すれば、私たちは私たちの技術、未来の収入流、または候補製品に対する貴重な権利を放棄しなければならないかもしれません。条件は私たちに不利かもしれません。もし私たちが株式や債務融資で十分な資金を調達できない場合、私たちは私たちの製品開発や将来の商業化努力の延期、制限、削減、または破産保護の申請を余儀なくされる可能性があるかもしれない。しかも、私たちは決して利益を上げないかもしれないし、利益を上げても、恒常的な収益力を維持できないかもしれない。
2023年12月31日と2022年12月31日まで、私たちの現金と現金等価物はそれぞれ約10万ドルと10万ドル未満で、運営資本の赤字は約3750万ドルと1440万ドルだった
私たちは業務合併に関連した多くの取引費用を発生させた。2023年12月31日までに、業務合併と継続業務運営からの取引費用を含む約1340万ドルの売掛金と売掛金を累計しました。しかし、業務統合後、私たちはまだ多くの取引費用が計上されていて支払われていない。また、上場企業への転換や上場企業としての運営に関する追加料金が発生することが予想されています。また、2023年12月31日までに、私たちと東西銀行の循環信用限度額、関係者との債務、2023年12月31日以降1年未満の債務を含む199万ドルの未返済債務があります。また、私たちと東西銀行の修正された循環信用限度額は私たちのすべての資産によって保証され、2023年12月31日まで銀行で少なくとも1,500万ドルの現金残高を維持することを要求し、その後、循環信用限度額の下に未返済残高がある限り、最低現金残高を維持しなければならない。2023年12月31日から、東西銀行は契約に基づいてこの現金残高要求を免除しており、2024年4月5日に発効した改正案によると、東西銀行はこの最低現金残高要求を契約に置き換え、東西銀行を会社唯一の現金預金商業銀行とし、満期日を2024年9月18日に延長することに同意した。参照してください“リスク要因-私たちの財務状況に関するリスク-東西岸融資協定と株式および商業融資プロトコル(以下に定義する)は、各融資者に私たちのすべての資産に対する保証権益を提供し、金融契約および他の私たちの行動に対する制限を含み、これらの制限は、私たちの運営柔軟性を制限するか、または他の方法で私たちの運営結果に悪影響を及ぼす可能性があるもっと詳細を知っています。著者らはすでに異なる投資家といくつかの長期買収手配を確立し、業務合併の完備を促進した。しかし,この等長期購入プロトコルによると,当該等取引に関する集資はホスト口座に入金されており,当社は業務合併終了時にその等を受け取っていない。その会社が大量の資金または長期購入協定に関連するいかなる資金を得るかは保証されない。また、場合によっては、当社の財務状況や経営業績に悪影響を及ぼす可能性があるパイプ承認株式証所持者に現金や普通株の増発を支払う必要がある可能性があります。参照してください“リスク要因-私たちの証券所有権に関連するリスク-私たちはいくつかの発行された株式承認証の行使から現金収益を得ることができないかもしれません。場合によっては、現金の支払いや追加の普通株の発行を要求される可能性がありますもっと詳細を知っています
私たちの長期業務は引き続き純損失が予想され、潜在的な債務や株式融資が必要であることを考慮している。しかし、私たちが受け入れられる条件で追加的な資金や他の資金源を提供する保証はないし、根本的に保証されない。もし必要な時に追加の資金が得られなければ、私たちはこれらの資金を受け取るまで、私たちの業務を延期または削減する必要があるかもしれない。もし私たちが十分な資本が不足して私たちの業務を拡大したり、他の方法で私たちのビジネスチャンスを利用することができなければ、私たちの業務、財務状況、そして経営結果は実質的な悪影響を受けるかもしれない。
私たちは今のところありませんし、私たちの運営、私たちの費用、他の流動性の需要を満たすのに十分な資金もないと予想され、すぐに追加的な資本が必要になります。また、私たちは持続的な経営を続ける企業として私たちが能力があるかどうかを大きく疑っています。私たちは私たちがこのような追加的な支出を許容可能な条件でタイムリーに得ることができるか、または全く保証できないという保証はない。もし私たちが十分な資本をすぐに集めることができなければ、私たちは私たちの業務運営と支払いに必要なお金を支払うのに十分な現金と流動性がなく、私たちの製品開発を延期、制限、削減、または中止することを要求されるかもしれないし、運営を停止したり、破産保護を申請したりすることを余儀なくされる可能性がある。
私たちの融資スケジュールの収益は、私たちの計算された費用および未払い費用を支払い、私たちの業務を運営するために必要な現金および流動性を提供するのに十分ではないので、私たちは引き続き、株式の発行、株式リンクおよび/または債務証券、債務融資、長期購入スケジュール、または他の資本源を含む可能性のある潜在的な代替案によって追加資金を調達する機会を探し続ける。しかし、私たちはタイムリーで、受け入れ可能な条項と条件で、または追加融資を根本的に成功的に得ることができないかもしれない。また、継続的に企業としての私たちの能力を疑うことは、投資家や他の融資源があれば、商業的に合理的な条項で資金を提供したくない可能性があります。十分な資金がなければ、関連する運営費用を含むいくつかの業務活動を延期、縮小、またはキャンセルしなければなりません。これは、私たちの業務の将来性と私たちの運営を継続する能力に悪影響を与え、私たちの財務状況と私たちの業務戦略を実施する能力に悪影響を与えます。さらに、私たちは私たちの資産を清算しなければならない可能性があり、私たちの財務諸表上のこれらの資産よりも低い価値を得ることができ、および/または米国破産法第7章または第11章に基づいて保護を求めることができ、これは私たちの運営を停止させ、私たちの投資家がすべてまたは一部の損失を受ける可能性がある。
これらの条件のため,我々が継続的に経営している企業として経営を継続する能力には大きな疑問があると結論したが,総合的に考慮した条件や事件は,現在満期債務を履行できず,財務諸表発表日後1年以内に債務を履行できないことが予想されるからである。添付財務諸表は持続経営を基礎として作成され、正常業務過程における資産の現金化及び負債の返済及び負担を考慮する。財務情報や財務諸表には必要な調整は一切含まれておらず、会社が経営を続けることができなければ。私たちが経営を続ける能力は私たちが追加資金を調達して資金を調達する能力にかかっている。現在の業務計画や現在のマクロ経済状況を考慮した期待と仮定に基づいて運営を継続するために、直ちにより多くの資金を調達する必要があります。私たちは私たちが受け入れ可能な条件でこのような追加的な支出を得ることを保障できないという保証はない。私たちがすぐに十分な資本を得ることができなければ、現在想定されている業務運営に資金を提供するための十分なキャッシュフローや流動性がなく、私たちの業務を大幅に変更し、さらには私たちの業務を停止する必要があるかもしれません。破産手続きや債務不履行、あるいは私たちの資本構造再編が発生した場合、私たちの株主は彼らの投資のすべての損失を受ける可能性がある
流動資金源
これまで、私たちの運営資金は主に優先転換可能な本チケットの発行、関連側融資の発行、循環信用限度額の利用、株式証券の発行と販売、パイプ承認株式証、私募と業務合併による純収益から来ている。2023年12月31日まで、私たちの現金と現金等価物は10万ドル未満で、制限的な現金は30万ドルです。将来的には、関連側との融資を含め、株式と債務融資を組み合わせた方法で現金需要に資金を提供する予定です。
高度変換可能手形
NKMAXと変換可能チケット引受契約を締結し、総収益は1,000万ドルで、終値時四つ-年間、5.0%の現金利息ではなく、半年ごとに8.0%の現金利息を支払う予定です。
レガシー変換可能な手形
2019年11月から12月まで、2019年の変換可能チケットと2019年の関連先変換可能チケットを発行し、2023年3月から9月まで、2023年変換可能チケットと2023年関連側変換可能チケットを発行し、総称してレガシー変換可能チケットと呼びます。
2019年の変換可能チケットと2019年の関連先の変換可能チケットから調達された総収益は、それぞれ1080万ドルと30万ドルです
業務統合の終了は、従来の変換可能チケットの契約割引による変換をトリガします。その条項によると、すべてのレガシー変換可能チケットは変換されました5,579,266株の伝統的なNKGen普通株に変換し、その後、株式交換比率によって終値時に2,278,598株普通株に変換した。
循環信用限度額
2023年6月、私たちは商業銀行と1年間の500万ドルの循環信用限度額協定を締結した。循環信用限度額は、カリフォルニア州サンアナにある私たちが所有する不動産の信託契約を含む、私たちのすべての資産を保証します。しかも、私たちは発行後30万ドルの制限された現金残高を維持しなければならない。通り抜ける2023年12月31日私たちは循環信用限度額から490万ドルを引き出して、引き出しを返済していません
関係者ローン
2019年8月から2023年4月まで、関連側融資をNKMAXと締結しました
2022年12月、当時返済されていなかった関連側の融資総額6610万ドルの元金と利息が転換された6,943,789株普通株式(交換比率適用後)これは2022年12月31日までの年度の出資額として確認されている。
2023年1月から4月までにNKMAXと追加の関連側融資を締結し,総収益は500万ドルであった。これらの追加の関連側融資金利は4.6%で、2024年12月31日に満期になる。関連側の融資に関連する金融または非金融契約はない。新規関連者ローンは株式に転換することはできない。
短期関係者ローン
2023年9月に短期関連者ローンに関する30万ドルの収益を集め、期限は30日、金利は5.12%だった。短期関連側融資は株式に転換できず、その後2023年10月5日に返済される
私募する
私たちは2023年12月31日まで、私募契約の現金収益を受け取っていない。2024年の間、私たちは以下のように私募協定改正から収益を得ました
2024年1月2日、私たちはFPA投資家との長期購入協定を修正し、50万ドルと交換するために前金不足を50万ドル増加させた。他のすべての条項と条件は変わらない
2024年1月11日、私たちはFPA投資家との長期購入協定を修正し、前金ギャップを50万ドル増加し、50万ドルと交換する可変金額を追加した。他のすべての条項と条件は変わらない
2024年1月19日、私たちはFPA投資家との長期購入協定を修正し、前金不足を30万ドルに当時の前金残高の20%を追加して、会社に30万ドルを支払うことと交換した。このプロトコルはまた、リセット価格を改訂し、リセット価格(I)を毎週の業績VWAPによるスクロール調整を行い、上限は1株10.44ドル(“初期価格”)、および(Ii)はVWAP評価基準に対して通常10%の割引があり、FPA投資家に利益を得させる。他のすべての条項と条件は変わらない
2024年2月21日、FPA投資家との長期購入協定を修正し、前金不足を20万ドル増加させ、配当株を20万株増加させ、20万ドルと交換した。他のすべての条項と条件は変わらない
SPA株式証明書
我々は,終値時にSPA承認株式証の報酬は何も受け取っていないが,権利証を行使する際に収益を得ることが可能である.
喉頭管捜査令状
成約前に、私たちはある投資家と株式証明書引受協定を締結し、この協定は2023年9月29日に完成した。株式承認証引受契約によると、株式承認証投資家は全部で10,209,994件の引受権証を購入し、1部当たりの株式承認証の購入価格は1,00ドルであり、総収益は1,020万ドルである
開ける2024年2月9日(I)権利証投資家が保有するすべての引受権証は、現金支払いと交換するために、権利証投資家と私たちの権利証引受協定を修正して、現金支払いと交換する資格がある30万ドル,(Ii)株式有効登録後,過去5日間のVWAPにより,2回目の現金支払いはたかだか30万ドルであった(Iii)株式承認証投資家の“最恵国”地位を付与して、株式承認証の再編を行い、いかなる引受権証がまだ完成していない限り、及び(Iv)株式承認証投資家のいくつかの登録権を付与する。他のすべての条項と条件は変わらない。
運営資金引受証
取引終了時に運営資金株式承認証を発行した場合,吾らは何の収益も受け取っていないが,当該等株式承認証を行使する際に収益を受け取る可能性がある
株式証を公開する
私たちは成約時に公開株式証の収益を受けていませんが、引受権証を行使する際に収益を受け取る可能性があります
個人株式証明書
Graf初公募とともに,GrafはGraf Acquisition Partners IV LLCに4,721,533件の株式承認証を発行した。Graf初公募とともに,GrafはGraf Acquisition Partners IV LLCに4,721,533件の株式承認証を発行した。成約時には、私らは株式承認証を私募して任意の追加収益を受け取ることはできないが、当該等株式証明書を行使する際には何の収益も受け取る可能性がある
転換可能な過橋ローン
開ける2024年2月7日、私たちは40万ドルの関連側過橋融資協定を締結し、満期時に20%割増した。関連側ブリッジローンは(I)発行後60日または(Ii)第三者融資金額が500万ドルを超えた場合に満期となり,両者は早い者を基準とする2024年4月、過渡的ローンの満期日は(I)発行から90日に改正され、(Ii)第3者超過が発生した500万ドル、または(Iii)
いかなる違約事件の発生も。この過渡的な融資協定の取引相手はまた400,000件の引受権証を獲得し、1株2.00ドルの執行価格で400,000株の会社普通株を購入する権利がある。
2024年2月20日、満期時の保険料は20%となる10万ドルの過渡的融資合意に達した過渡的融資は(I)発行後60日後または(Ii)第3者を超える1000万ドルそれは.このブリッジローン契約の取引相手も受け取りました100,000株式購入承認証100,000その会社の普通株の価格は$2.001株当たりの執行価格。
2024年2月27日と2024年3月7日、私たちは1件10万ドル、満期時に20%の過渡的な融資協定を締結した。過渡的融資は(I)発行後60日または(Ii)第三者融資金額が500万ドルを超えた場合に満期になり、両者は比較的早い者を基準とする。過渡的融資協議の単独取引相手ごとに3667株の普通株および375,000株の株式承認証を獲得し、1株1.5ドルの実行価格で会社375,000株の普通株を購入した。
橋を渡りローンを組む
2024年3月7日、私たちは2つのブリッジローン協定を締結し、1件10万ドルで、発行日から15日で満期になり、満期時には7.5%の割増があります。この二つのローンはいずれも転換保証本券が成約したときに返済します。
転換可能なチケット
2024年3月21日、私たちは12%の本チケット契約を締結しました。金額は30万ドルで、期限は1年で、10%の割引で発行されます。貸金人は、発行日から満期日までのいずれかまたはすべての未償還元金と利息を会社普通株の選択権に変換することを保留する。転換保証された本券は、転換可能保証本券が決済されたときに返済されます。この合意と同時に、私たちは融資権証を発行し、融資者が1株2.00ドルの初期使用価格で最大330,000株の普通株を買収し、調整することができる
2024年3月26日、私たちは貸主と12%の本票契約を締結し、貸主もFPAの投資家で、金額は30万ドル、期限は1年で、10%の割引で発行された。貸金人は、発行日から満期日までのいずれかまたはすべての未償還元金と利息を会社普通株の選択権に変換することを保留する。この合意と同時に、私たちは融資権証を発行し、融資者が1株2.00ドルの初期使用価格で最大330,000株の普通株を買収し、調整することができる
開ける2024年4月1日当社は一つの項目を注文しました12%貸手との元票契約20万ドルで1年ですそして、10%割引します。貸金人は、発行日から満期日までのいずれかまたはすべての未償還元金と利息を会社普通株の選択権に変換することを保留する。本協議と同時に,我々は貸方承認株式証を発行し,貸金者に最大22の買収権を持たせた0,000普通株、初期行権価格は$2.001株につき,調整することができる
開ける2024年4月1日当社は一つの項目を注文しました12%FPA投資家でもある貸手との本票契約30万ドルそして、10%割引します。この約束手形は4月1日に満期になります, 2025それは.貸金人は、発行日から満期日までのいずれかまたはすべての未償還元金と利息を会社普通株の選択権に変換することを保留する。本協議と同時に,本行は貸金権証を発行し,貸金先に買収の権利を持たせる330,000普通株、初期行権価格は$2.001株につき,調整することができる.
転換保証本券
2024年4月5日、私たちは1ヶ月の保証付き隔夜融資金利に2.85%の毎月現金借金を支払い、発行日から1ヶ月間支払いを開始し、2026年10月4日に満期となる500万ドルの転換可能な保証付きチケット契約を締結した。転換本チケットは2回に分けて発行され、第1弾は100万ドルで、2024年4月8日に決済され、第2弾は400万ドルで、2024年4月9日に決済される。この転換保証本券は、カリフォルニア州サンアナにある自社不動産の第二留置権を担保としています。転換可能な保証チケットは500万ドルの循環信用限度額に従属する。未償還元金金額は貸金者の選択に応じて随時普通株に変換することができ、転換価格は2.00ドル(株式分割などの通常の減額調整の制約を受ける)本契約と同時に、貸手は1回目の成約時に833,333株の普通株と相当する株を獲得する権利がある250万ドル割る5日間2回目の成約時のVWAP測定および貸手が最も多く獲得する権利を持たせる1,000,000普通株、初期行権価格は$2.001株につき,調整することができる.
キャッシュフロー
以下に我々のキャッシュフローの要約(単位:千):
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| 経営活動のための現金純額 | $ | (21,948) | | | $ | (22,557) | |
| 投資活動のための現金純額 | $ | (48) | | | $ | (163) | |
| 融資活動が提供する現金純額 | $ | 22,155 | | | $ | 22,486 | |
経営活動のための現金純額
2022年12月31日までの年度と比較して,2023年12月31日までの年間で経営活動のための現金純額が60万ドル減少したのは,主にNKGenのSNK 01肉腫第一段階臨床試験が2022年下半期にほぼ完了し,研究·開発支出が減少したためである。
2023年12月31日現在、経営活動で使用されている現金純額は2,190万ドルであり、主にNKGenの純損失8,300万ドルであるが、220万ドルの営業資産と負債変化および5880万ドルの非現金費用によって部分的に相殺され、これらの変化は主に長期購入契約発行による損失2,450万ドル、長期購入派生ツール負債の公正価値変化980万ドル、および派生権証負債の公正価値変化1350万ドルに関連している。
2022年12月31日までの1年間で,経営活動で使用された現金純額は2260万ドルであり,これは主にNKGenの純損失2680万ドルおよび運営資産と負債の変化が10万ドル未満であり,420万ドルの非現金費用(主に230万ドルの関連先非現金利息支出に及ぶ)および120万ドルの減価償却と償却に相殺されたためである。
投資活動のための現金純額
2022年12月31日までの年度と比較して、2023年12月31日までの年間で、投資活動のための現金純額が10万ドル減少したのは、主に購入した財産や設備が減少したためである。
2023年12月31日までの1年間で、投資活動のための純現金は10万ドル未満で、資本化ソフトウェアの購入を含む10万ドル未満だった。
2022年12月31日までの年度の投資活動用現金純額は20万ドルで、資本化ソフトウェアの購入10万ドルと財産や設備購入の10万ドルが含まれている。
融資活動が提供する現金純額
2022年12月31日までの年度と比較して,2023年12月31日までの年間で,融資活動が提供する現金純額が30万ドル減少したのは,主に優先転換可能本票を発行し,循環信用限度額を利用して引受権証を発行したが,取引コストの支払いや関連側融資の減少によって相殺されたためである。
2023年12月31日現在,融資活動が提供する現金純額は2,220万ドルであり,主にSPA承認株式証付き高度変換可能手形の発行による1,000万ドル,管路株式承認証発行による1,020万ドル,関連側融資および短期関連側融資による530万ドル,従来の変換可能手形の発行による620万ドル,循環信用限度額から抽出した500万ドルおよび普通株発行による170万ドル,取引コストの支払いは1,460万ドルで相殺されている。
2022年12月31日までの年度、融資活動が提供する現金純額は2,250万ドルで、その中には主に関連側融資2,300万ドルと普通株式オプションを行使して得られた収益2,300万ドルが含まれており、そのうち100万ドルは賃金保護計画ローンの返済部分によって相殺されている。
契約義務と約束
賃貸借証書
私たちの経営リースは主に会社のオフィスで構成されています。その他の資料については、別注14-を参照のこと引受金とその他の事項本年度報告シート10−K項目8“財務諸表と補足データ”に列挙された連結財務諸表の付記にある
長期債務
私たちは2027年に満期になった長期債務を持っている。その他の資料については,別注6-を参照されたい転換可能な手形そして付記7-債務本年度報告シート10−K項目8“財務諸表と補足データ”に列挙された連結財務諸表の付記にある。
重要な会計政策と試算
私たちの経営陣の財務状況と経営結果の討論と分析は私たちの財務諸表に基づいています。これらの報告書はアメリカで公認されている会計原則やGAAPに基づいて作成されています。これらの財務諸表を作成する際には、管理層は、財務諸表の日付の資産および負債額、または有資産および負債の開示および報告期間内の報告の収入および支出に影響を与えるために、推定および仮定を行う必要がある。私たちはこのような推定と判断を持続的に基づいて評価する。我々は歴史的経験や当時の状況では合理的な様々な他の要因を推定していると考えられるが,これらの要因の結果は資産や負債の帳簿価値を判断する基礎となっており,そのような資産や負債の帳簿価値は他の源から容易に見られるものではない。異なる仮定や条件の下で、私たちの実際の結果はこれらの推定とは異なる可能性がある。
私たちの重要な会計政策は付記2により包括的に説明されていますが重要会計政策の概要私たちの財務諸表については、以下の会計政策が、我々の財務状況や経営結果を全面的に理解し評価するために最も重要であると考えています。
臨床と研究開発費を計算しなければならない
すべての研究と開発コストは発生した期間内に支出される。研究および開発費用は、主に、株式ベースの給与費用、外部サービスプロバイダ、施設コスト、コンサルタントおよび他の専門サービスに支払う費用、許可料、減価償却および研究開発に使用される用品を含む契約機関が提供する臨床開発サービス、賃金および人員関連費用を含む。研究·開発のための貨物またはサービスを受け取る前に支払われる金は、関連貨物またはサービスを受け取る前に資本化される。
財務諸表作成プロセスの一部として、各貸借対照表の日付までの計上費用を見積もる必要がある。このプロセスは、未締結契約および調達注文を審査し、私たちの担当者とコミュニケーションして、私たちに代わって実行されるサービスを決定し、インボイスを受け取っていない場合、または他の方法で実際のコストを通知している場合に、実行されたサービスレベルおよびサービスによって生じる関連コストを推定することを含む。私たちは、私たちが当時知っていた事実と状況に基づいて、各貸借対照表の日付までの課税費用を推定した。私たちは定期的にサービスプロバイダと私たちの推定の正確性を確認し、必要に応じて調整します。著者らが計算すべき臨床試験と研究開発費用の重大な推定は、著者らのサプライヤーが提供する臨床試験と研究開発活動に関連するサービスによるコストを含むが、私たちはまだ領収書を受け取っていない。
我々は,我々を代表して臨床試験や研究開発活動を行うサプライヤーとのオファーと契約に基づいて,我々が受け取ったサービスや費用の見積もりに基づいて,臨床試験や研究開発活動に関連する費用を決定した。これらの合意の財務条項は交渉が必要であり、契約によって異なり、支払いの不均衡を招く可能性がある。場合によっては、私たちのサプライヤーに支払われるお金は、提供されたサービスレベルを超え、臨床試験および研究開発費用の前払いにつながる可能性があります。サービス料を計算する際に、サービスを提供する時間帯と各時間の努力度を見積もります。サービス実行の実際の時間または努力の程度が私たちの見積もりと異なる場合、私たちはそれに応じて計算すべき費用または前払い費用を調整します。将来の臨床試験または研究開発活動のための貨物およびサービスの前金は、支払い時ではなく、活動が行われたときまたは貨物を受信したときに計上される。
実際に発生した金額と実質的に差がないと予想されているにもかかわらず、提供されたサービスの状態および時間の推定が提供されたサービスの実際の状態および時間と異なる場合、これは、任意の特定の時期に報告された金額が高すぎたり、低すぎたりする可能性がある。これまで、このような費用の見積もりと実際に発生した金額との間に実質的な差はありませんでした。
株に基づく報酬
株式ベースの報酬支出には、従業員とコンサルタントに付与された株式オプションが含まれている。これまで,我々が付与した株式オプション奨励は,サービスに基づく付与条件のみを含み,市場や業績条件を達成することなく付与することができた.これらの株式ベースの奨励は、ASC 718-10に規定されている公正価値に基づく方法で計算されている株の報酬それは.株式オプションの公正価値は,付与日にBlack-Scholesオプション定価モデルを用いて推定される.このオプション定価モデルは多くの推定に関連し、対象普通株の1株当たり価値、行権価格、未来変動率の推定、株式オプション奨励の期待期限、無リスク金利と期待年間配当収益率を含む。
我々は、必要なサービス期間(通常はホーム期間)において、階層的ホームスケジュールのオプションを有する費用を直線的に確認する。没収行為は発生時に確認します。
普通株の推定値
私たちの普通株が2023年10月2日までに取引市場を公開していないことを考慮すると、私たちの普通株の終値後の最初の取引日であり、米国公認会計士協会の会計と推定ガイドラインによると、補償として発行された個人持株会社株式証券の推定値我々の取締役会は、その合理的な判断を行使し、多くの客観的かつ主観的な要素を考慮して、私たちの普通株式の公正価値の最適な推定を決定しているが、これらに限定されない
•私たちの普通株の独立第三者評価
•資金源と財務状況
•流動性イベントを実現する可能性とタイミング
•歴史的経営と財務的業績、そして未来の財務業績の見積もり
•会社の評価に匹敵する
•私たちの現状は
•2023年10月2日までの私たちの普通株の相対的な市場性は不足している
•市場成長と出来高、マクロ経済事件のような業界情報
•私たちのビジネスに関する他の客観的で主観的な要素は
•合併取引の隠れた公正な価値。
2023年10月2日までに、我々の取締役会は、収益法と市場法の2つの推定方法を用いて、私たちの普通株の公正価値を決定します。収益法は会社の将来に生じるキャッシュフローの期待に基づいて価値を見積もる。市場法は、標的会社と同類業務の比較可能な上場会社との比較及び合併取引(例えば業務合併)の暗黙的公正価値に基づいて価値を推定する。市場法の下で、テーマ会社と同類の業務の中で上場企業との比較に基づいて、市場性の割引が不足している(“DLOM)は、普通株式の公正価値を得るのに適している。DLOMの目的は,未公開取引の株式が販売可能性に乏しいことを説明することである.2023年12月31日までに年度内に付与される普通株式オプション関連普通株の推定値は、業務合併において合意された普通株式暗黙的公正価値に基づいて市場法に基づいて推定され、それぞれの付与日における普通株式の公正価値は、それぞれの付与日の既存の状況に基づいて、以前の推定値と業務合併の予想終了日との間の線形補間法を用いて決定される。直線計算は著者らの普通株の推定値に最も合理的な基礎を提供し、推定日の間に公正価値の重大な変化を招く可能性のある事件が発生しなかったため、確定された。
これらの推定方法を適用することは、著者らが期待している未来の収入と支出、割引率、補間、推定倍数の決定、比較可能な上場会社の選択及び未来の事件の可能性を含む高度な複雑と主観的な推定、判断と仮定を使用することに関連する。これらすべての推定および仮定の変化は、各推定日における私たちの推定値に影響を与える。これらの変化は私たちの普通株の推定値と私たちの株式ベースの奨励に実質的な影響を及ぼすかもしれない。
2023年10月2日から、私たちの普通株の公正価値は私たちが公開した株価をベースにしています.
企業合併に関連して発行された精選金融商品の会計処理
業務合併では、他のツール以外に、株式公開承認証、私募株式承認証、管路株式承認証、SPA株式承認証、運営資金株式承認証、高級転換可能手形、繰延方正株式と長期購入デリバティブツール(総称して、これを総称して、金融商品を選ぶ“)”選りすぐりの金融商品をめぐる会計決定は、私たちが報告した財務状況や経営結果に大きな影響を与えます
まず次の各ツールを評価することで、厳選された金融商品の会計分類を決定します財務会計基準委員会(“FASB“)会計基準編集(”ASC”) 480, 負債と持分を区別するそしてASCでの各ツールを評価します815, 派生ツールとヘッジ活動. ASC 480によれば、手形が強制的に償還されることができ、現金または他の資産清算株式証または関連株式を支払う責任があり、可変数の株式を発行することによって決済される必要がある場合、負債分類とみなされる。手形がASC 480-10での負債分類に適合しない場合、現金純額決済特徴をトリガする取引が発生する可能性にかかわらず、発行者に現金決済契約の契約が公正な価値で記録された負債であることを要求する可能性があるASC 815~40での要求を評価する。金融商品が米国会計基準815-40に基づいて負債分類を行う必要がない場合、権益分類を完了するために、ツールが私たち自身の普通株式にリンクされているかどうか、およびツールが米国会計基準815-40または他の公認会計基準に基づいて権益に分類されているかどうかも評価する。このすべての評価の後、私たちはこのような道具が負債に分類されるか資本に分類されるのかという結論を出した
また、ASC 815会社は、その宿主ツールからいくつかの特徴を分離し、いくつかの基準を満たす場合には、独立した派生金融商品と見なすことを要求する。我々は,このようなツールがデリバティブであるか,埋め込まれたデリバティブ資格に適合する特徴を含むかを決定するために,我々の金融ツールを評価した.分岐のすべての要求を満たせば,埋め込まれたデリバティブは主契約とは別に測定しなければならない.デリバティブ枝に埋め込まれた周囲の条件の評価は,宿主契約の性質とデリバティブの特徴に依存する.分岐埋め込み派生ツールは公正価値で確認し,公正価値は総合経営報告書および各期間の全面損失で確認される.分岐埋め込みデリバティブは我々の総合貸借対照表において関連する宿主契約とともに分類される.派生ツールの分類は、そのようなツールが負債または資本として記録されるべきかどうかを含み、各報告期間の終了時に再評価される。
ASC 480またはASC 815に従って負債とみなされない変換可能債務ツールには、ASC 470が適用される借金を抱えこのようなツールに対する会計処理は、任意のプレミアムまたは割引を含む。
負債分類ツールは発行時と初回発行後に公正価値会計を行うことを要求し、公正価値の発行日後のすべての変動は総合経営報告書と全面損失に記録されている。株式分類ツールは発行時に公正価値会計のみが要求され,発行日後には何の変化も確認されない
上述の会計指針による当社の精選金融ツールの条項、特徴及び状況に対する応用に基づいて、株式証明書、SPA株式証明書及び繰延方正株式を公開して株式分類ツールとして確定されたが、高級交換可能手形、私募株式承認証、パイプライン株式承認証、運営資金株式承認証、レガシー交換可能株式手形及び長期購入派生ツールは負債分類ツールとして確定された。高度変換可能チケットは、負債分類として決定されるが、それらは、ASC 480またはASC 815の範囲には属さず、ASC 470の範囲に属すると決定される。したがって、高級交換券は、SPA株式承認証と共に発行されるので、このツールの公正価値計量は、以下に説明する相対公正価値分配の目的のためであるので、公正価値に応じて恒常的に計量されないであろう。
金融商品の公正価値
私たちはアメリカ公認会計原則に基づいて構築した枠組みに基づいて、私たちの金融商品の公正価値に対して会計処理を行い、この枠組みは公正価値を定義し、公正価値計量の開示を拡大した。公正価値は、計量日の市場参加者間の秩序ある取引において資産を売却するか、または負債を移転して受信した価格として定義される。公正価値を計量するための推定技術は,観察可能な投入を最大限に利用し,観察不可能な投入を最大限に減少させなければならない。この基準は、レベル3投入に基づく公正価値レベルを記述し、その中で、最初の2段階は観測可能であると考えられ、最後のレベルは観測不可能と考えられ、公正価値を計量するために使用することができる。これらの見積りは主観的である可能性があり,不確実性や重大な判断事項に関連しているため,正確には決定できない.
第1レベル-私たちは、計量日に得られた同じ資産または負債のアクティブ市場でのオファーを得ることができます。
第2のレベル-非アクティブな市場における資産または負債のオファーのような直接的または間接的に観察可能な第1のレベル以外の入力、または実質的に全体の資産または負債の観察可能な市場データによって確認され得る他の入力が観察可能であるか、または観察可能である。
第三段階--観察できない、市場活動支援が非常に少ない、または全くない、資産または負債の公正な価値に大きな影響を与える定価投入。
報告で述べた期間開始時に第1,2,3レベルを行き来する振込を確認する.2023年12月31日と2022年12月31日までの1年間、1級、2級、3級を行き来する移行はなかった。
ASC 820、公正価値計量多くの場合、取引価格は公正価値に等しくなることが指摘されている(例えば、取引日に資産を購入する取引が資産売却市場で行われている場合、この場合であってもよい)。取引価格が初期確認時の公正価値を表すか否かを判定する際には、取引が関連者間の取引であるか否か、強制取引であるか否か、取引価格の課金単位が計量ツールの課金単位を代表しないか否かなど、様々な要因が考慮される
私たちは公正な価値で日常的に資産を計量しない。当社の関連側融資の帳簿価値は、融資に類似した市場金利に近いため、当該融資の短期的な性質のため、発行後3年以上以内に満了しなければならない。私たちの現金、制限現金、売掛金、課税費用、他の流動負債、前払い費用および他の流動資産、資本化ソフトウェア、関連側融資および循環信用限度額の帳簿価値は、主にこのような口座の短期的な性質によって公正価値に近い。
権益類ツールの公正価値は計量日まで同じ証券の取引価格に基づいて決定される。負債-公正価値による経常的基礎計量の分類ツールは、私募株式承認証、運営資金株式承認証、長期購入派生ツール、管路株式承認証及びレガシー転換可能手形を含む。分類負債ツールの公正価値を決定するためには、会計推定および仮定を使用する必要がある。公正な価値に応じて非日常的に計量された負債分類ツールは、高度な変換可能なチケットを含む
これらの見積もりや仮定は性質を判断するものであり,我々が報告した財務状況や運営結果に大きな影響を与える可能性がある。
私募株式証及び運営資金株式証明書の条項は同じである。したがって,これらのツールを評価するための方法と仮定は同じである.私募株式証及び運営資金承認株式証の公正価値は公正価値によってBlack-Scholesモデルを用いて計量した。私募株式証と運営資金承認株式証の推定公正価値は第三級投入センチを使用して決定された。ブラック·スコイルズモデル固有の仮定は、期待株価変動、期待寿命、無リスク金利、配当収益率と関係がある。当社が想定している波動性我々の私募株式承認証及び運営資金株式承認証は、当社が売買した私募株式証及び運営資金株式承認証の暗黙的な変動率、及び私募株式証及び運営資金承認株式証の期待残存寿命に適合する選定同業会社普通株の歴史的変動性に基づく。無リスク金利は付与日の米国財務省ゼロ金利収益率曲線に基づいており、その満期日は私募株式証と運営資金承認株式証の期待残存寿命と類似している。私募株式証及び運営資金株式証の予想年間仮定は残りの契約期間と同じである。配当率は歴史金利に基づいており、私たちは歴史金利がゼロに維持されると予想している。
我々は従来、予測される未来の投資リターンの確率に基づいて現在値を重み付けし、変換特徴を有さない類似債務ツールの公正価値を測定することによって、レガシー変換可能チケットの公正価値を推定するシナリオに基づく分析を用いてレガシー変換可能チケットの帳票価値を決定してきた。類似した債務ツールが存在しない場合、公正価値は、市場金利、信用状態、収益率曲線、および変動性を含む市場参加者が債務ツールの価格設定の際に使用する仮定を使用することによって推定される。取引終了直前の変換前のレガシー変換可能手形の公正価値は,我々の普通株が変換時に発行した株式の公正価値に基づいており,我々の普通株の取引終了時の公正価値,すなわち転換日に基づいている
2023年12月31日現在の管理権証の公正価値はモンテカルロシミュレーション法を用いて推定しました当社の普通株価は、評価日から有効期限日までの期間にわたって幾何学的ブラウン運動に従うと仮定されています。可能なすべてのシナリオの幅は、資本構造の違いを考慮した、比較企業の過去の株式ボラティリティに基づいて、ボラティリティの推定値に捉えられました。各シミュレーションパスについて、測定期間中の毎日の株価に基づいてテスト価格とリセット価格を算出しました。リセット日ごとに、テスト価格と下振れ保護しきい値価格を比較して、下振れ保護条件が満たされているかどうかを評価しました。その後、ワラントの各トランチの価値は、該当する場合にはダウンサイド · プロテクション · 株式およびダウンサイド · プロテクション · キャッシュを考慮して計算されました。ザ この可能性のあるシナリオの範囲にわたる平均値は、リスクフリーレートを使用して割引されて提示され、 PIPE ワラントの公正価値として使用されました。
長期購入派生負債の公正価値は、モンテカルロシミュレーションを用いて推定される。私たちの普通株価格は一連の異なる可能なシナリオの下で毎日時間ステップサイズでシミュレーションされています。すべての可能なシナリオの広さは、比較可能な会社の歴史的株式変動性に基づいており、それらの資本構造の違いを考慮した変動性推定に反映される。シミュレーション価格と長期購入プロトコルの決済調整特徴を比較した.すべてのシミュレーションされた未来の株価シナリオの下で、私たちは長期購入デリバティブ債務手配の価値を計算した。無リスク金利割引を使用した一連の可能なシナリオの平均値は、長期デリバティブ負債の公正価値として使用される。
高度変換可能チケットはSPA株式証明書とともに発行される.各ツールはすべてその公正価値によって入金されるが、その公正価値が総公正価値に占めるパーセンテージを限度とし、この相対公正価値は2023年9月29日の成約価格を基礎とする。SPA引受権証の相対公正価値は、高度変換可能チケットの割引とみなされ、高度変換可能チケットは、高度変換可能チケットの期限内に利息支出に償却される
我々は,二項格子モデルを用いて高度な変換可能チケットの独立公平価値を決定し,このモデルはチケット期限内の株価の分布を生成し,チケットに関する報酬を計算し,格子中の確率重み付き価値を推定日に割引する.公正価値は、市場金利、信用格付け、収益率曲線、および変動性を含む、転換可能な債務ツールのための価格設定の際に市場参加者によって使用される仮定を使用して推定される
近く発表·採択された会計公告
私たちは最近発表された付記2に適用される会計声明について説明した重要会計政策の概要2023年12月31日現在及び同年度までの総合財務諸表。
新興成長型会社の地位
私たちは新しいものになる資格があります生長JumpStart Our Business Startupsのような会社は“雇用法案”)と、Graf初公募が完了してから5年に及ぶ間、新興成長型企業である可能性がある。私たちがまだ新興成長型企業である限り、私たちは、新しい発表や改訂された会計基準の採用を延期すること、個人会社に適用されるまで、私たちの独立公認会計士事務所がサバンズ-オックスリー法案404条に基づいて財務報告を内部統制監査すること、当社の定期報告書および委託書における役員報酬に関する開示義務の削減、および免除が役員報酬および以前に承認されていない金パラシュート報酬について無拘束力の相談投票を行うことを含む、いくつかの免除に依存して様々な上場企業報告要件を遵守することが許可され、依存することができる。したがって、本稿に含まれる情報は、あなたが株を持っている他の上場企業から受け取った情報とは異なる場合があります。
事業合併の完成に伴い、私たちは新興成長型会社である (I)Graf初公募完了5周年後の財政年度の最終日、(Ii)我々の年間総収入が少なくとも12.35億ドルの財政年度の最終日、(Iii)取引法第12 b-2条の規定により、“大型加速申告会社”の財政年度の最終日とみなされ、当該年度第2四半期までの最終営業日であれば、非関連会社が保有する我が普通株の時価は7.00億ドルを超える。あるいは(Iv)私たちは前の3年間に10億ドルを超える転換不可能債務証券を発行した日。
我々は“小さな報告会社”となる資格があるが,この用語は“取引法”第12 b-2条に定義されているため,非関連会社が保有する我々の普通株の時価に提案の総金額を加えているのです。業務合併が会社にもたらした毛収入は7.0億ドル未満で、最近終了した会計年度では、私たちの年収は1.00億ドル未満です。業務合併終了後、(I)非関連会社が保有する我が普通株の時価が2.5億ドル以下である場合、または(Ii)最近終了した会計年度の年収が1.00億ドル未満であり、非関連会社が保有する我が普通株の時価が7.00億ドル未満であれば、規模の小さい報告会社であり続ける可能性がある。もし私たちが小さな報告会社であれば、私たちがもう新興成長型会社ではない場合、私たちはより小さな報告会社が得ることができるいくつかの開示要求の免除に依存し続けるかもしれない。具体的には、小さな報告会社として、我々のForm 10-K年度報告書に最近の2つの会計年度の監査財務諸表のみを公表することを選択する可能性があり、新興成長型企業と同様に、小さな報告会社は役員報酬に関する開示義務を減少させている。
第七A項。市場リスクに関する定量的で定性的な開示。
1934年の証券取引法第12 b-2条の定義によると、我々は比較的小さな報告会社であり、この項に基づいて情報を提供する必要はない。
第八項です。財務諸表と補足データ。
連結財務諸表索引
| | | | | |
| ページ |
独立公認会計士事務所報告(PCAOB ID:42) | 106 |
合併貸借対照表 | 107 |
合併経営報告書と全面赤字 | 108 |
合併株主権益報告書(損失)) | 109 |
統合現金フロー表 | 110 |
連結財務諸表付記 | 111 |
独立公認会計士事務所報告
NKGen Biotech,Inc.株主と取締役会へ
財務諸表のいくつかの見方
NKGen Biotech,Inc.(当社)2023年12月31日までと2022年12月31日までの連結貸借対照表,同年度までの関連運営と全面赤字報告書,株主権益(赤字)とキャッシュフロー,および関連付記(総称して“連結財務諸表”と呼ぶ)を監査した。総合財務諸表は、すべての重要な面で、2023年12月31日と2022年12月31日までの会社の財務状況と、2023年12月31日と2022年までの経営結果と現金流量を公平に反映しており、米国公認会計原則に適合していると考えられる。
会社が経営を続ける企業として経営を続ける能力
財務諸表にはこのような不確実性の結果がもたらす可能性のあるいかなる調整も含まれていない。添付されている総合財務諸表の作成仮説会社は引き続き経営を継続する企業となる。財務諸表付記1で述べたように、当社は経営により経常赤字を被り、運営資金が不足しており、当社の持続経営企業としての継続経営能力には大きな疑問があることを示している。付記1はまた、これらの事項に関する経営陣のイベントや条件の評価、経営陣の計画について説明しています。合併財務諸表には、このような不確実性の結果生じる可能性のある調整は含まれていません。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性に対する意見を表明するためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
/s/ 安永法律事務所
2020年以来、当社の監査役を務めてきました。
カリフォルニア州オーウェン
2024年4月16日
株式会社 NKGEN バイオテクノロジー
合併貸借対照表
(千単位、株式及び額面データを除く)
| | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 |
| 資産 | | | |
| 流動資産: | | | |
現金と現金等価物 | $ | 26 | | | $ | 117 | |
売掛金 | — | | | 29 | |
制限現金 | 250 | | | — | |
前払い費用と他の流動資産 | 1,654 | | | 204 | |
| 流動資産総額 | 1,930 | | | 350 | |
| 財産と設備、純額 | 14,459 | | | 15,521 | |
| 経営的リース使用権資産純額 | — | | | 362 | |
| 大文字ソフトウェア、ネットワーク | 92 | | | 97 | |
| 総資産 | $ | 16,481 | | | $ | 16,330 | |
| 負債と株主権益(赤字) | | | |
| 流動負債: | | | |
買掛金及び未払い費用 ( 関連当事者金額 $を含む )688そして$812023 年 12 月期および 2022 年 12 月期 ) | $ | 13,395 | | | $ | 2,652 | |
転換期望手形、現行 | — | | | 11,392 | |
関連当事者債権の転換期望手形 | — | | | 263 | |
循環信用限度額 | 4,991 | | | — | |
関連当事者ローン | 5,000 | | | — | |
リース負債を経営する | — | | | 379 | |
その他の経常負債 ( 関連当事者金額 $を含む )202そしてゼロ2023 年 12 月期および 2022 年 12 月期 ) | 262 | | | 55 | |
長期購入デリバティブ | 15,804 | | | — | |
| 流動負債総額 | 39,452 | | | 14,741 | |
| 繰延税金負債 | 33 | | | 26 | |
派生株式証負債 | 25,759 | | | — | |
関連当事者によるシニア転換社債 ( 非流動 ) | 9,930 | | | — | |
| 総負債 | 75,174 | | | 14,767 | |
| 引受金及び又は有事項(付記14) | | | |
| 株主権益(赤字): | | | |
普通株、$0.0001額面価値500,000,0002023 年および 2022 年 12 月 31 日時点の認可株式 21,888,976そして13,303,7952023年12月31日と2022年12月31日までの発行済株式 | 2 | | | 1 | |
追加実収資本 | 121,727 | | | 80,738 | |
受取引受金 | (17,792) | | | — | |
株主からの債権 | (500) | | | — | |
赤字を累計する | (162,130) | | | (79,176) | |
| 株主権益合計 | (58,693) | | | 1,563 | |
| 総負債と株主権益(赤字) | $ | 16,481 | | | $ | 16,330 | |
付記はこれらの連結財務諸表の構成要素である。
株式会社 NKGEN バイオテクノロジー
合併経営報告書と全面赤字
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| 収入.収入 | $ | — | | | $ | 77 | |
| コストと支出: | | | |
| 収入コスト | — | | | 18 | |
研究開発 ( 関連当事者金額 $を含む )620そして$4392023 年 12 月期と 2022 年 12 月期 ) | 15,668 | | | 16,746 | |
| 一般と行政 | 14,078 | | | 7,659 | |
| 総費用 | 29,746 | | | 24,423 | |
| 運営損失 | (29,746) | | | (24,346) | |
| その他の収入(支出): | | | |
利子費用 ( 関連当事者金額 $を含む )431そして$2,2712023 年 12 月期と 2022 年 12 月期 ) | (745) | | | (2,306) | |
転換社債及び関連当事者による転換社債の公正価値の変動 ( 関連当事者金額 $を含む )12そして$42023 年 12 月 31 日期と 2022 年 12 月 31 日期 ) | (1,043) | | | (177) | |
先物買取契約の発行損失 | (24,475) | | | — | |
先物買入れ契約の変更による損失 | (442) | | | — | |
先物買入れデリバティブ負債の公正価値の変化 | (9,784) | | | — | |
派生株式証負債の公正価値変動 | (13,503) | | | — | |
取引コストを支出しました | (3,329) | | | — | |
その他の収入、純額 | 120 | | | 82 | |
| 所得税未払い準備前純損失 | (82,947) | | | (26,747) | |
| 所得税支給 | (7) | | | (7) | |
| 純損失と総合損失 | $ | (82,954) | | | $ | (26,754) | |
| 加重平均発行済み普通株式、基本普通株式、希釈後普通株 | 15,426,908 | | 6,356,348 |
| 1株当たり基本と希釈して純損失 | $ | (5.38) | | | $ | (4.21) | |
付記はこれらの連結財務諸表の構成要素である。
株式会社 NKGEN バイオテクノロジー
合併株主権益報告書(損失)
(単位:千、共有データを除く)
2023年12月31日と2022年12月31日までの年度
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| レガシー普通株 | | 普通株 | | | | | | | | | | |
| 株 | | 金額 | | 株 | | 金額 | | その他の内容
支払い済み
資本 | | 定期購読する
売掛金 | | 売掛金
送信者
株主.株主 | | 積算
赤字.赤字 | | 合計する
株主の
権益
(赤字) |
| 2021年12月31日現在の残高 | 14,382,093 | | $ | 14 | | | - | | $ | - | | | $ | 14,356 | | | $ | - | | | $ | - | | | $ | (52,422) | | | $ | (38,052) | |
| 資本増強の遡及適用 | (14,382,093) | | (14) | | | 5,873,711 | | 1 | | | 13 | | | - | | | - | | | - | | | - | |
| 2021 年 12 月 31 日現在の調整済み残高 | - | | - | | | 5,873,711 | | 1 | | | 14,369 | | | - | | | - | | | (52,422) | | | (38,052) | |
| 株に基づく報酬 | - | | - | | | - | | - | | | 69 | | | - | | | - | | | - | | | 69 | |
| 普通株予約権の行使 | - | | - | | | 486,295 | | - | | | 161 | | | - | | | - | | | - | | | 161 | |
| 関連当事者借入金の転換による普通株式の発行 ( 注 7 ) | - | | - | | | 6,943,789 | | - | | | 66,139 | | | - | | | - | | | - | | | 66,139 | |
| 純損失 | - | | - | | | - | | - | | | - | | | - | | | - | | | (26,754) | | | (26,754) | |
| 2022年12月31日現在の残高 | - | | - | | | 13,303,795 | | 1 | | | 80,738 | | | - | | | - | | | (79,176) | | | 1,563 | |
| 株に基づく報酬 | - | | - | | | - | | - | | | 4,135 | | | - | | | - | | | - | | | 4,135 | |
| 普通株予約権の行使 | - | | - | | | 12,867 | | - | | | 12 | | | - | | | - | | | - | | | 12 | |
| 逆資本増強取引、純 | - | | - | | | 8,572,314 | | 1 | | | 36,842 | | | (32,915) | | | - | | | - | | | 3,928 | |
| 先物買入れ契約の変更による損失 | - | | - | | | - | | - | | | - | | | 15,123 | | | (500) | | | - | | | 14,623 | |
| 純損失 | - | | - | | | - | | - | | | - | | | - | | | - | | | (82,954) | | | (82,954) | |
| 2023年12月31日現在の残高 | - | | $ | - | | | 21,888,976 | | $ | 2 | | | $ | 121,727 | | | $ | (17,792) | | | $ | (500) | | | $ | (162,130) | | | $ | (58,693) | |
付記はこれらの連結財務諸表の構成要素である。
株式会社 NKGEN バイオテクノロジー
統合現金フロー表
(単位:千)
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| 経営活動 | | | |
| 純損失 | $ | (82,954) | | | $ | (26,754) | |
| 純損失と経営活動で使用される現金純額の調整: | | | |
減価償却および償却 | 1,203 | | | 1,210 | |
株に基づく報酬 | 4,135 | | | 69 | |
非現金レンタル費用 | 362 | | | 440 | |
関連当事者による転換社債及び転換社債の公正価値の変動 | 1,043 | | | 177 | |
非現金利子費用 ( 関連当事者金額 $を含む )431そして$2,2712023 年 12 月 31 日期と 2022 年 12 月 31 日期 ) 。 | 504 | | | 2,271 | |
取引コストを支出しました | 3,329 | | | — | |
先物買取契約の発行損失 | 24,475 | | | — | |
先物買入れ契約の変更による損失 | 442 | | | — | |
先物買入れデリバティブ負債の公正価値の変化 | 9,784 | | | — | |
デリバティブ · ワラント負債の公正価値の変化 | 13,503 | | | — | |
経営性資産と負債変動状況: | | | |
売掛金 | 29 | | | (29) | |
前払い費用と他の流動資産 | (1,403) | | | 57 | |
売掛金と売掛金 | 3,993 | | | 443 | |
リース負債を経営する | (379) | | | (437) | |
その他、純額 | (14) | | | (4) | |
経営活動のための現金純額 | (21,948) | | | (22,557) | |
| 投資活動 | | | |
財産と設備を購入する | — | | | (101) | |
資本化されたソフトウェアの購入 | (48) | | | (62) | |
投資活動のための現金純額 | (48) | | | (163) | |
| 融資活動 | | | |
普通株式オプションを行使して得られる収益 | 12 | | | 161 | |
関連側の融資収益 | 5,300 | | | 23,000 | |
関係者の融資を償還する | (300) | | | — | |
転換社債及び関連当事者に対する転換社債の発行による収益 | 6,215 | | | — | |
回転信用枠の引出による収益 | 4,991 | | | — | |
普通株式を発行して得た金 | 1,668 | | | — | |
証券付きシニア転換社債の関連当事者発行による収益 | 10,000 | | | — | |
PIPE ワラントの発行による収益 | 10,210 | | | — | |
回転信用枠による債務発行費用の支払 | (100) | | | — | |
給料保護ローンの返済 | — | | | (675) | |
繰延引受料を支払う | (1,250) | | | — | |
取引費用の支払い | (14,591) | | | — | |
融資活動が提供する現金純額 | 22,155 | | | 22,486 | |
| 現金、現金等価物、および制限的現金純増加(減少) | 159 | | | (234) | |
| 期初時点の現金、現金同等物及び制限現金 | 117 | | | 351 | |
| 期末における現金、現金同等物及び制限現金 | $ | 276 | | | $ | 117 | |
| 現金と現金等価物 | 26 | | | 117 | |
制限現金 | 250 | | | — | |
| 現金総額、現金等価物、制限された現金 | $ | 276 | | | $ | 117 | |
| キャッシュフロー情報を補充する | | | |
| 利子支出に支払われた現金 | $ | 241 | | | $ | 35 | |
| 非現金投資·融資活動の追加開示 | | | |
普通株式に転換した関係者貸付金及び利子 | $ | — | | | $ | 66,139 | |
| 購買債権の発行 | $ | 32,915 | | | $ | — | |
| レガシー転換社債の転換 ( 未払利息を含む ) | $ | 18,913 | | | $ | — | |
| 買掛金に含まれる未払いの取引コストと未払いの費用 | $ | 5,802 | | | $ | — | |
| デリバティブ · ワラント負債の引き受け | $ | 2,046 | | | $ | — | |
| 先物買入れ契約の変更に伴う株主債権 | $ | 500 | | | $ | — | |
| 売掛金及び売掛金に含まれる財産及び設備 | $ | 73 | | | $ | 8 | |
| 買掛金および未払い費用に含まれる資本化ソフトウェア費用 | $ | 15 | | | $ | — | |
付記はこれらの連結財務諸表の構成要素である。
株式会社 NKGEN バイオテクノロジー
連結財務諸表付記
1.会社情報
株式会社 NKGen バイオテクノロジー(“会社“または”NKGen の」 ) は、カリフォルニア州サンタアナに本社を置くデラウェア州の企業で、独自の SNK ( Super—Natural—Killer ) プラットフォームを利用した革新的な自己細胞、同種細胞、および CAR—NK ナチュラルキラー細胞療法の開発と商業化に焦点を当てた臨床段階のバイオテクノロジー企業です。当社は NKMAX Co. が過半数を所有 · 管理しています。株式会社 ( 「NKMAX「大韓民国の法律に基づいて設立された会社です。
当社は、もともと 2021 年 1 月 28 日にデラウェア州で Graf Acquisition Corp. IV ( 「 Graf Acquisition Corp. IV 」 ) という名前で設立されました。グラフ」 ) 、合併、資本証券取引所、資産取得、株式購入、再編、または 1 つ以上の事業または法人との類似の事業結合を行う目的で、特別目的の買収会社として。
2023 年 4 月 14 日、当社は Graf , Austria Merger Sub , Inc. との間で合併契約及び合併計画を締結しました。デラウェア州法人およびグラフの完全子会社 ( “合併子NKGen Biotech, Inc. について(“合併協定”). 2023 年 9 月 29 日に合併契約に基づく取引が完了すると ( 以下「業務合併」), Merger Sub と合併し、 NKGen Biotech, Inc. に。(“レガシー · NKGen」) と Legacy NKGen は、 Graf の完全子会社として合併を生き残りました (「合併する”).事業統合の完了に関連して ( 「終業する」と改称された。株式会社 NKGen バイオテクノロジー“Legacy NKGenを改名”NKGenはバイオテクノロジー会社を運営しています。合併後の会社の普通株と権利証はナスダック株式市場で取引を開始したNKGN“と”NKGNW“それぞれ2023年10月2日に。
連結財務諸表の注記を通じて、特に明記されていない限り、または文脈によって示唆されない限り、「会社「事業統合完了前のレガシー NKGen 、事業統合完了後の当社」をいう。
流動性
財務会計基準委員会 ( Financial Accounting Standards Board )FASB“)会計基準編纂(”ASC」 ) トピック 205 — 40 、 財務諸表のプレゼンテーション —Going Concern経営陣は、連結財務諸表の発行日から 1 年以内に債務が満期となる場合に、事業体が継続する能力及び債務を履行する能力について実質的な疑念を集計して生じる関連する条件及び事象があるかどうかを評価することを要求する。ガイダンスに基づき、当社はまず、事業体が継続する能力について実質的な疑念を生じる状況や事象があるかどうかを評価しなければならない ( ステップ 1 ) 。当社が実質的な疑念があると判断した場合、経営陣はその疑念を軽減するかどうかを検討する必要があります ( ステップ 2 ) 。
当社の経営歴史は限られており、設立以来重大な経営赤字が発生しており、当社の業務や市場の収入と収入の潜在力は実証されていない。当社の総合財務諸表は、持続経営企業に適した公認会計原則を用いて作成されており、この原則は正常業務過程で資産の現金化と負債の清算を考慮している。自分から2023年12月31日同社の累積損失は$162.1百万以下の現金及び現金等価物10万ドルそれは.これまで、同社の運営資金は主に優先転換可能な本チケットの発行、関連側融資の発行、循環信用限度額の利用、株式証券の発行と販売、管路承認株式証、私募と業務合併による純収益から来ている。同社は今後数年で巨額の運営損失が予想され、追加の短期融資を得て、その研究·開発活動を継続し、臨床試験を開始·完成させ、規制部門の承認を得た候補製品を発売し、商業化する必要がある。経営陣はすでにキャッシュフロー予測を用意しており,会社の予想に基づく運営損失と負キャッシュフローを示しており,会社が継続的に経営を継続できる企業としての能力があるかどうかには大きな疑問がある12か月これらの連結財務諸表が発行された日から発効します。
当社は引き続き関連側、私募株式又はその他の源から追加の債務又は持分融資を得ることにより、その運営損失及び資本融資需要に資金を提供する計画である。会社が十分な追加資金を得られない場合、会社は支出の削減を余儀なくされる可能性があり、サプライヤーとの支払い期限を延長し、可能な限り資産を清算し、計画の項目を一時停止または削減し、あるいは運営の停止や破産保護の申請を余儀なくされる可能性がある。これらの行動のいずれも、会社の業務、経営結果、将来の見通しに実質的な損害を与える可能性がある。あるかもしれない違います。このような融資が利用可能であることを保証するか、または会社が受け入れ可能な条項で提供されるだろう。これらの連結財務諸表の作成には、このような不確実性の結果によって生じる可能性のあるいかなる調整も含まれていない。
2.重要会計政策の概要
陳述の基礎
添付財務諸表は、米国証券取引委員会(“米国証券取引委員会”)の規則及び規定及び米国公認会計原則(“米国公認会計原則”)に基づいて作成される。当社は計上すべき会計方法でその会計記録を保存し、米国公認会計原則と一致する。
業務合併
NKMAXは業務合併前にLegacy NKGenの多数投票権を持ち,業務合併後も当社の多数投票権を保有している。したがって,制御権に変化がないため,業務統合はLegacy NKGenに関する共同制御取引および会社の逆資本再編に計上される.したがって、会計目的については、当社の財務諸表はLegacy NKGen財務諸表の継続であり、業務合併はLegacy NKGen発行株とGrafの純資産と交換し、資本再編を伴うとみなされている。GRAFの純資産は決済時に履歴コストで確認されており,営業権や他の無形資産は記録されていない.業務合併前の業務は旧NKGenの業務として示されており,旧NKGenの累積損失は閉鎖後に繰り越されている
業務合併完了後、Legacy NKGenの全持分を交換比率で(“為替レート“)”また,Legacy NKGenのすべての株式購入権は両替比率で同じ条項および帰属条件で自社株式のオプションを行使できるように変換された。2023年9月29日まで、成約の日、為替レートは約0.408.
業務合併前のすべての期間はすでに外貨比率を用いて遡及調整を行い、逆資本再編を反映した。業務合併の逆資本再編処理については,業務統合が完了した場合,Grafのすべての発行済み証券と未償還証券は当社の発行とみなされる.
合併原則
添付されている総合財務諸表には、当社及びその完全子会社の勘定が含まれている。すべての重大な会社間残高と取引は合併で販売された。
予算の使用
アメリカ公認会計原則に基づいて連結財務諸表を作成する時、管理層は推定と仮定を行い、ある資産と負債の報告金額、合併財務諸表の日付のある開示、及び報告期間内の収入及び支出報告金額に影響する必要がある。会社の連結財務諸表の中で最も重要な推定は、臨床および研究開発費用を計算すべきであるが、レガシー変換可能なチケット、関連する側に対応する高度な変換可能な本チケット、長期購入派生負債、派生株式証負債、普通株式および株式奨励を含むが、これらに限定されない。このような推定や仮定は,過去の経験,現在の事件に対する認識,およびその際に合理的とされている様々な他の要因に基づいており,その結果,資産や負債の額面を判断する基礎を構成し,他のソースからは知覚しにくい支出を記録している.実際の結果はこのような推定とは大きく異なるかもしれない。
細分化市場
運営部門は、個々の財務情報を取得し、首席運営決定者が定期的に審査することができるエンティティの構成要素として定義されている(“CODM“)個別部門にどのように資源を割り当てるかを決定し、業績を評価する上で。会社のCEOは会社の最高経営責任者です。CODMは経営決定を行い、資源を分配し、財務業績を評価するために、企業全体に基づいて提供された財務情報を審査する。そこで同社は1つは報告可能な部分。また、同社のすべての収入は米国から来ており、そのすべての長期資産を米国内に保持している。
現金と現金等価物
当社はすべての原始期限を3か月貸借対照表で報告されている現金と現金等価物の帳簿価値はコスト値であり,このコストはその公正価値とほぼ同じである注釈このような口座の損失を経験しました経営陣は会社が違います。流動性の高い投資信用リスクにさらされます
制限現金
制限付き現金は、リボルビング · クレジット · ラインにより契約上制限されている資金で構成されます。 2023年6月.回転信用枠の条件に従い、当社は以下を維持することが求められました。 $15.0百万貸し手との現金残高では 2024年3月31日リボルビング · クレジット · ラインに基づく貸し手に対する元本等の返済が借入金の追加担保として行われるまでその後、 2024 年 4 月には、当社が貸し手を主要な銀行関係として利用することに合意し、最低現金預金要件を免除しました。As Of 2023年12月31日, $0.3百万連結貸借対照表に計上されています 違います。制限現金残高は 2022 年 12 月 31 日時点で計上されました。当社は、連結キャッシュ · フロー計算書に記載されている期初 · 期末合計の調整に際し、現金、現金同等物及び制限付き現金による銀行預金を含めています。 2023年12月31日そして2022.
リスクが集中する
当社が信用リスクを集中させる可能性のある金融商品は、現金および現金同等物で構成されます。当社は、当面の運用に必要な現金を短期マネーマーケット · ファンド、国債、および / または短期コマーシャル · ペーパーに投資することにより、信用エクスポージャーを最小限に抑えます。現在までに、当社は 注釈この信用リスクに関連する損失を経験しており、このエクスポージャーは重要ではないと考え続けています。現金預金は連邦預金保険公社 ( Federal Deposit Insurance Corporation ) によって保険される。FDIC」 ( Up to ) $250,000.当社は、 FDIC の保険限度額を超える現金預金を保有することがあります。
終了した各年について 2023年12月31日そして2022, 違います。顧客はオーバーを占める 10%総売上高と当社は 違います。貿易売掛金の残高終了した各年について 2023年12月31日そして2022会社が所有していますゼロより少ないのです$0.1百万それぞれ他の売掛金にあります。
財産と設備、純額
物件や設備はコストに応じて入金され、その推定耐用年数で減価償却されます。賃貸改善は、推定耐用年数または賃貸期間の短い時間に直線法で減価償却を行います。修理·維持コストは発生時に費用を計上します。資産が廃棄または販売されている場合は、資産や減価償却は該当金額から差し引かれ、どの収益や損失も添付された総合経営報告書と全面赤字で確認されます(場合によって)。
大文字ソフトウェア、ネットワーク
内部使用ソフトウェアに関する支出は資本化されています。これらの支出はその受益期間内に償却され、通常は3年制期間中は,直線手法を用いる.
取引コスト
同社は繰延取引コストを資本化し、これらのコストは主に増加した法律費用、会計費用、その他の予想される融資取引に直接起因することができるコストを含む。繰延取引コストは関連融資取引が発生した時に再分類される。この年度までのすべての繰延取引コスト2023年12月31日業務統合終了時に再分類する違います。繰延取引コストは2022年12月31日.
単一のツールに特定されない取引コストは、相対的に公正な価値に割り当てられる。持分分類ツールに割り当てられた取引コストは追加実収資本に計上される。経常公正価値計測を用いた負債分類ツールに割り当てられた取引コストは,総合経営報告書における取引コスト、費用、全面損失。
繰延債務発行コスト
短期融資を提供する各方面に循環信用限度額を支給することによる費用は、繰延債務発行費用に反映される。これらのコストは一般に実金利法または他の近似実利子法の方法を用いており、融資ツールの有効期限内に償却して利息支出とする。自分から2023年12月31日より少ないのです$0.1百万繰延債務では、発行コストは総合貸借対照表における前払い費用や他の流動資産に計上される違います。繰延債務発行コスト記録は2022年12月31日まで。
混合器
財務会計基準委員会 ( Financial Accounting Standards Board )FASB“)会計基準編集(”ASC”) 480, 負債と持分を区別するその混合ツールのタイムアウトを評価している.無条件債務を体現する金融商品、または条件付き債務を体現する流通株以外の金融商品は、発行者が発行数可変の株式によって決済可能な金融商品でなければならないか、開始時に債務の通貨価値が完全にまたは主に以下のいずれかに基づいている場合、負債(または場合によっては資産)に分類されるべきである:(A)初期に既知の固定通貨金額、(B)発行者持分の公正価値以外の変化、または(C)発行者持分の公正価値変化に反比例する変化。このような基準に適合する混合ツールは、いかなる埋め込み誘導ツールについてもさらに評価されず、各貸借対照表の日に公正な価値で負債を計上する。
派生ツール
FASB ASC 815派生ツールとヘッジ活動会社は、ある特徴をその宿主ツールから分離し、ある基準を満たす場合に独立した派生金融ツールとして計算することを要求する。当社はデリバティブを使用して金利、市場または外貨リスクをヘッジしません。同社はその金融商品を評価し、これらのツールがデリバティブであるかどうか、あるいは埋め込まれたデリバティブ資格に適合する特徴を含むかどうかを決定する。分岐のすべての要求を満たせば,埋め込まれたデリバティブは主契約とは別に測定しなければならない.デリバティブ枝に埋め込まれた周囲の条件の評価は,宿主契約の性質とデリバティブの特徴に依存する.分岐埋め込み派生ツールは公正価値で確認し,公正価値は総合経営報告書および各期間の全面損失で確認される.分岐埋め込みデリバティブは当社の総合貸借対照表において関連する主契約とともに分類される。派生ツールの分類は、そのようなツールが負債または資本として記録されるべきかどうかを含み、各報告期間の終了時に再評価される。
債務
ASC 480またはASC 815による負債とみなされない転換可能債務ツールには、当社はASC 470を適用する債務このようなツールに対する会計処理は、任意のプレミアムまたは割引を含む。同社のプレミアム転換可能チケットはASC 470で入金されます。課税対象利息は当社が優先的に本券の帳簿金額に換算できるものに計上します。
引受と株主の売掛金
当社は発効日に株式発行状況を記録します。発行時に資金がない場合、会社は引受金または株主受取金を資産として貸借対照表に記録する。貸借対照表の日までにASC 505の規定要求を満たす引受売掛金または株主売掛金が受信されていない場合、権益また、引受または株主売掛金は、貸借対照表上で株主権益(損失)の対売口座に再分類される。
株主売掛金とは株主が受け取るべき金額のことです。株主が貸借対照表の日までに売掛金に資金を提供していない場合、会社は貸借対照表で売掛金を株主権益(赤字)の対売口座に再分類する。
長期資産減価準備
イベントまたは環境変化が資産または資産グループの帳簿価値が回収できない可能性があることを示すたびに、当社は、その長期資産の減価を検討する。回収可能能力は、資産または資産グループの帳簿金額と、その資産が予想されている推定未割引将来のキャッシュフローとを比較することによって測定される。1つの資産または資産グループの帳簿金額がその推定された将来のキャッシュフローを超える場合、減値費用は、資産または資産グループの帳簿価値が資産または資産グループの公正価値を超える金額で確認される注釈この年度までのいかなる減価損失も確認した2023年12月31日そして2022.
価値オプションを公正に承諾する
個々のツールに基づいて、当社は、分岐の代わりに、ASC 825要件の基準に適合するいくつかの金融商品のための公正な価値オプションを選択することができる金融商品それは.当社は、そのレガシー変換可能なチケットのために、ASC 825の要求基準に適合する公正価値オプションを選択しました金融商品それは.レガシー変換可能本チケットに関する利息支出は,そのようなチケットの公正価値変動に計上される.
金融商品の公正価値
当社はASC 820-10に従い、公正価値計量と開示このガイドラインは、公正価値を定義し、公正価値を計量するための指導を提供し、いくつかの開示を要求する。この指針は、株式支払いに関する計量には適用されない。この指針は、市場法(市場価格と比較可能)、収益法(将来の収入またはキャッシュフローの現在値)およびコスト法(資産サービス能力またはリセットコストを置き換えるコスト)のような推定技術を議論する。この指針は、公正価値階層構造を構築し、公正価値を計量するための評価技術の入力を3つの広いレベルに分割する。
当社の金融商品には、現金および現金等価物、前払い費用およびその他の流動資産、資本化ソフトウェア、売掛金、計算費用、2019年から2022年までに投資家に発行される転換可能本票(“2019年変換可能手形”)、関連先に対応する変換可能元票(“関連側変換可能手形”と2019年変換可能手形と合わせて“変換可能手形”)、関連側の債務(“関連側融資”)およびその他の流動負債が含まれています。他の流動負債とは、一般に、これらのツールの短期的な性質のため、それぞれの価値を代表すると考えられる。
当社は、成立時とその後の各報告日に公正価値で入金することを選択し、規定の基準を満たした2019年の交換可能手形と関連する株式交換手形を選択した。経営報告書と全面赤字の純額を総合します。転換可能な手形に関する利息支出は、転換可能な手形の公正価値変動に計上されています。この等の見積もりは主観的な見積もりである可能性があり、不確定要素や重大な判断事項に関連しているため、正確に特定することはできません。当社の関連側の融資の帳簿価値は公正価値に近く、このようなローンの公表金利は同種のローンの市場金利と一致しており、かつそのようなローンは短期的な性質であるからです。
ASC 820、公正価値計量多くの場合、取引価格は公正価値に等しくなることが指摘されている(例えば、取引日に資産を購入する取引が資産売却市場で発生する場合、そのような場合がある)。取引価格が初期確認時の公正価値を表すか否かを決定する際には、取引が関連者間の取引であるか否か、強制取引であるか否か、取引価格の課金単位が計量ツールの課金単位を代表しないか否かなど、様々な要因が考慮される。当社は公正な価値に応じて恒常的に資産を計量しません付記9を参照してください金融商品の公正価値当社の公正価値計量をさらに検討する.当社の関連側融資の帳簿価値は公正価値に近いが、この金利は融資のような市場金利に近いため、当該等の融資の短期的な性質により、当該等の融資は1年送信者2023年12月31日.
従業員福祉計画
2019年1月1日から、会社は国税法第401(K)節の資格を満たし、その合資格の従業員を代表する固定払込計画を採用し、維持している。*業務合併を完了した後、会社は2023年株式インセンティブ計画(“2023年計画”)を通過し、NKGenはこの日に2019年計画に基づいて追加奨励を与えないことを決定した。従業員の支払いは自発的で、個人に基づいて決定され、連邦税務法規で許可された最高額に限定される2023年12月31日そして2022その会社はできました注釈この二つの計画のいずれかに貢献する。
収入確認
歴史的に見ると、会社は2019年のコロナウイルス病に関する収入を確認した(新冠肺炎“テストサービス。年末までの第1四半期に2023年12月31日会社は新冠肺炎検査サービスの提供を停止した。
当社はASC 606により収入を確認します取引先と契約した収入顧客とのすべての契約に適用されるが、レンタル、保険、協力手配、金融商品などの他の標準範囲内の契約は除外される。ASC 606によれば、収入の確認方法は、製品またはサービスの制御権が顧客に移転することが記載されており、会社が製品またはサービスから取得する権利がある対価格金額を反映している。このようにする過程で、会社は、(I)顧客との契約を決定し、(Ii)契約における履行義務を決定し、(Iii)取引価格を決定する。(Iv)取引価格を履行義務に割り当て、(V)顧客が製品またはサービス制御権を取得したときに収入を確認する。*当社は、収入確認基準を適用する際に、契約条項およびすべての関連事実および状況を考慮する。当社は、類似した特徴および類似した状況を有する契約に対して、任意の実際の便宜を含む収入確認基準を一貫して採用する。
取引価格は、会社が製品やサービスの制御権を顧客に譲渡する交換で得られる対価格金額である。取引価格を決定する際には、会社は、重要な融資成分、任意の可変要因の影響、非現金対価格、顧客に支払うべき対価格が存在するかどうかを考慮する。重要な融資成分が存在する場合、取引価格は金銭の時間的価値に応じて調整される。可変性要因が存在する場合、会社は予想される対価格を推定し、製品やサービスが顧客に移転したため、その金額を確認収入の基礎としなければならない。
一つの契約に複数の履行義務がある場合、会社は取引価格をそれぞれ異なる履行義務に分配し、金額は会社が獲得する権利のある対価格を反映する 各項目ごとに異なる履行義務を履行する交換条件とする。項目ごとに異なる履行義務については、収入が会社が当該履行義務に適用される製品又はサービスに対する制御権を移転する際(又はその旨とする)に確認する。
当社が義務を履行する前にまず対価格を受けた場合、当社は当該対価格を(又は)当社が当該義務を履行するまで契約責任に分類する。
確認された資産の予想償却期間が1年以下である場合、または資産の金額が実質的でない場合、会社は契約が発生した場合、契約を取得して履行する増額コストを資本に計上する。そうでなければ、このようなコストが契約の増分であり、基礎契約の収入確認に比例する費用で償却された場合、その等のコストは契約資産に資本化される。
協力協定
当社はASC 808の範囲に属する研究協定を締結している協力手配パートナーからの精算は、合併経営報告書と全面赤字で研究開発費の減少額と記載されています。同様に、パートナー不足の金額は、合併経営報告書と全面赤字で研究開発費として確認されています。
研究と開発費
すべての研究および開発費用は、発生した期間内に支出される。研究および開発費用は、主に、株式ベースの補償費用、外部サービスプロバイダ、施設コスト、コンサルタントおよび他の専門サービスに支払う費用、許可料、減価償却および研究開発に使用される用品を含む契約組織が臨床開発に提供するサービス、人員賃金および関連費用を含む。研究開発のための商品またはサービスを受け取る前に支払われた金は、関連商品またはサービスを受け取るまで資本化される。契約に規定されたサービス期間内に行われる研究はコストを計算し、必要であれば調整されると予想される。実際に発生した作業量と費用の継続的な検討に基づいている。
賃貸借証書
当社はASC第842条に基づいてそのリースに対して会計処理を行う賃貸借証書経営性賃貸使用権資産とは、会社がリース期間内に対象資産に対する使用権を意味し、経営性賃貸負債は会社が賃貸に対して生じる賃貸支払いの義務である。経営性賃貸は貸借対照表のROU資産、当期経営性賃貸負債、非流動経営性賃貸負債に含まれる。経営性賃貸ROU資産とリース負債は、最初に会社がリース資産に適用した逓増借款金利計算の将来の最低賃貸期間の現在値に基づいて確認される。隠れた金利が容易に決定されない限り。レンタルROU資産を経営するには、レンタル開始時または前に支払う任意のレンタル支払いも含まれており、受信されたレンタルインセンティブは含まれていません。-会社はレンタル期間をレンタルのキャンセル不可期限として決定し、会社が選択権を行使すると合理的に決定したときにレンタルを延長または終了するオプションを含むことができます。レンタル期間は12か月当社のレンタルには残額保証は含まれていません。*最低賃貸支払いのレンタル料金は直線原則でレンタル期間内の賃貸料支出と確認されています。可変レンタル支払いにはレンタル運営費用が含まれています。
株に基づく報酬
株式ベースの報酬支出には、従業員とコンサルタントに付与された株式オプションが含まれている。当社はASC 718-10に規定されている公正価値法で株式奨励を計算した株の報酬それは.株式オプションの公正価値は,付与日にBlack-Scholesオプション定価モデルを用いて推定される.このオプション定価モデルは多くの推定に関連し、対象普通株の1株当たり価値、行権価格、未来変動率の推定、株式オプション奨励の期待期限、無リスク金利と期待年間配当収益率を含む。
株式オプション関連普通株の公正価値は、2023年10月2日までに関連普通株が公開市場されていないため、従来から会社取締役会によって決定されてきた。会社の取締役会は会社の普通株の公正価値を確定する時、多くの客観と主観要素を考慮して、その中に当時の第三者の会社の普通株に対する推定値、比較可能な会社の推定値、公平な取引中に外部投資家に会社の普通株を売却する、会社の経営と財務表現、市場性の不足、全体と特定業界の経済見通し、及び合併取引時の暗黙的な公正価値などの要素を含む。
当社は、必要なサービス期間(通常は帰属期間)において、階層的帰属スケジュールのオプションを有する費用を直線原則で確認する。没収行為は発生時に確認します。
所得税
当社は、財務諸表に含まれている事件の予想される将来の税務結果について繰延税金資産と負債を確認することを要求する貸借対照法に基づいて所得税を計算する。この方法によれば、繰延税金資産と負債は、財務諸表と資産と負債の税ベースとの差額に基づいて決定され、予想される差額の年間の現行税率を採用する。税率変化による繰延税金資産と負債への影響は、制定日を含む期間の収入で確認される。
当社は、繰延税項純資産の範囲が、当社がこれらの資産がより顕在化する可能性があると考えている程度であることを確認した。この決定の際、管理層は、既存の課税の一時的な違いの将来逆転、将来予想される課税収入、税務計画戦略、最近の経営業績を含むすべての利用可能なプラスおよび負の証拠を考慮する。*経営陣が将来、その記録純額を超える繰延税項資産を実現できると判断した場合、管理層は繰延税金資産の推定値を調整し、所得税の支出を減らすことになる。
当社は、2段階の流れ記録に基づいて不確定な税務頭寸、すなわち(1)管理層は、その技術的優位性に基づいて、税務頭寸を維持する可能性が高いかどうかを決定する。(2)確認のハードルに達する可能性の高い税務頭寸については、管理層は、最終的に関連税務機関と和解した後に実現可能な最大税収割引額が50%を超えることを確認する。当社は所得税支出において、税収割引に関する利息と罰金を確認している。どの課税利息や罰金にも関連税務責任が計上されている違います。税負担、利息、罰金は、不確定な税務状況による連結財務諸表で確認されました。
普通株の基本純損失と償却純損失
普通株1株あたりの基本純損失の算出方法は,今年度の純損失を当該年度に発行された普通株の加重平均で割ったものである。1株当たりの純損失の計算方法は,当期に発行された普通株と潜在的希薄化証券の加重平均を純損失で割ったものであり,これらの株が希薄化されていれば在庫株やIF変換法で計算する。1株当たりの普通株の純損失は1株当たりの普通株の純損失とほぼ同じであり、潜在的な希薄化株式を計上することは1株当たりの普通株損失と全面赤字の計算に不利になるからである。
その会社は所有している1つは発行された株と発行された株の種類。そのため、1株当たりの基本純損失と希釈後の1株当たり純損失は複数種類の株間に分配されない。終値前のすべての期間の基本と償却1株当たりの純損失はすでに為替レートによってさかのぼって調整され、逆資本の再編に影響を与える
この年度までの1株当たり純損失を計算する際には潜在的な減価償却株式は含まれていない2023年12月31日以下の内容を含む
| | | | | |
| 個人株式証明書 | 4,721,533 |
| 運営資金引受証 | 523,140 |
| 株式証を公開する | 3,432,286 |
| 喉頭管捜査令状 | 10,209,994 |
| 株式オプション | 2,078,986 |
| SPA株式証明書 | 1,000,000 |
| 高度転換手形の株 | 1,000,000 |
繰延正株(1) | 1,173,631 |
| 合計する | 24,139,570 |
(1)付記8で述べたように、関係者取引なお、繰延正株には投票権がなく、配当に関与しておらず、当社の同意を得ていない場合は譲渡することができません。そのため、繰延正株は法的には発行済み株式とみなされ、総合株主権益表(損失)上の既発行株式総数に計上されているが、会計目的については、基本および償却1株当たりの純損失を含む既発行株式とはみなされていない。
2022年12月31日までの年度1株当たり純損失を計算する際には、潜在的な反薄株は含まれていない185,231(交換レートを実施した後)、およびレガシー変換可能チケットに関連する株式。当社は、転換後に発行可能な株式数を決定できないため、2022年12月31日までの年間レガシー変換可能チケットに係る株式数を定量化することができません。
新興成長型会社
当社は証券法第2節(A)節で定義された“新興成長型会社”であり,2012年のJumpStart Our Business Startups Actにより改正された“雇用法案”)と、他の非新興成長型企業の上場企業に適用される様々な報告要件のいくつかの免除を利用することができ、これに限定されるものではないが、サバンズ-オキシック法第404条の監査人認証要件の遵守を要求されないこと、定期報告および依頼書における役員報酬に関する開示義務を低減すること、および役員報酬に対する非拘束性諮問投票の要求を免除すること、および株主承認前に承認されなかった任意の金パラシュート支払いを免除することを含む
また、雇用法第102条(B)(1)第1条は、民間企業まで新た又は改正された財務会計基準を遵守する新興成長型企業の要件を免除する(すなわち、証券法登録声明の発効を宣言していないもの、または取引法に基づいて登録されていない証券)は、新たな財務会計基準または改正財務会計基準の遵守を要求されている。雇用法案の規定は、会社は延長された移行期間から撤退することを選択し、非新興成長型企業に適用される要求を遵守することができるが、任意の選択脱退の選択は撤回できない。会社は、このような延長された移行期間から撤退することを選択しており、これは、基準が発行または改正されたときに、上場企業または民間企業に対して異なる出願日を有し、会社が新興成長型企業として、 これにより、当社の総合財務諸表を、新興成長型会社でも新興成長型会社でもない別の上場企業と比較し、後者は使用する会計基準の潜在的な違いにより、延長された過渡期を使用しないことを選択する可能性がある
最近採用された会計公告
2016年6月、財務会計基準委員会(“FASB”)FASB“)発表された会計基準更新(”ASU“2016-13号”金融商品信用損失の計量それは.ASU 2016−13およびその後に発表された一連の関連ASUは、トピック326に組み込まれている。主題326は、売掛金を含む特定の金融資産を測定する際に、予想される信用損失を推定することを要求する新しい要件を規定する。新たなガイドラインは2022年12月15日以降の会計年度に施行される。同社は2023年1月1日からの会計年度に新たなガイドラインを採用している。ASC 326を採用することは、会社の財務諸表に実質的な影響を与えない
2020年8月にFASBはASU 2020-06を発表しました債務-帯転換および他の選択された債務(主題470-20)および派生ツールおよびヘッジエンティティ自己資本における契約(主題815-40):エンティティ自己資本における変換可能な手形および契約の会計現在の会計原則に要求されている主要な分離モードを廃止することにより、変換可能ツールの会計処理を簡略化し、株式契約がデリバティブ範囲の例外を取得する資格があるために必要ないくつかの決済条件を廃止する。ASU 2020-06は、2023年12月15日以降の会計年度(これらの会計年度内の移行期間を含む)に有効であり、事前採用を許可する。当社は2023年12月31日まで財政年度に新指針を採択します。ASU 2020-06の採択は当社の財務諸表に大きな影響はありません。
最近発表された未採用の会計公告
はい2023年12月FASBはASU番号2023-09を発表しました所得税開示の改善(主題740)それは.ASUは,報告エンティティの有効税率入金に関する分類情報と,支払われた所得税に関する補足情報を提供することを要求している。ASUは2024年12月15日以降の年次期間に前向きである。また、未印刷または印刷可能な年次財務諸表の早期採用も許可されている。採択されると、このASUは、必要な追加開示を私たちの連結財務諸表に含めることになります。 同社は現在、この基準がその財務諸表や関連開示に及ぼす影響を評価している。
3.逆資本再編
注1で述べたように、会社情報業務合併は2023年9月29日に終了しました。業務合併について:
•Legacy NKGenのすべてのレガシー変換可能チケットは、取引終了直前にその条項によってLegacy NKGen普通株に変換され、合計5,579,266株、これらの株はその後ログアウトされ、2,278,598株式交換比率を実施した会社普通株
•すべての伝統的なNKGen38,185,814発行済みと流通株は解約されて転換された15,595,262交換比率を実施した会社普通株式(従来のNKGen変換可能手形を含む株式を含む);
•すべての伝統的なNKGen5,146,354発行済みのストックオプションは取り消され 2,101,760当社の未払いのストックオプション
•当社の改訂 · 改訂された設立証明書及び改訂 · 改訂された定款が採択されました。
•当社は、従業員株式購入計画を採用しました。
•同社は採用した。 2023株式インセンティブプランです
閉鎖に関連して発生したその他の関連事象は以下のとおりです。
•注釈 4 に記載されている私募契約の履行 私募する;
•注釈 5 に記載されているように、公的および私的令状の仮定。株式承認証;
•注釈 5 に記載されているワラント引受契約の履行。 株式承認証;
•注 6 に記載されている Legacy NKGen のレガシー転換社債の転換について、 転換可能な手形;
•注 6 に記載されている有価証券購入契約の履行 転換可能な手形および
•注釈 8 に記載されている修正されたスポンサー支援およびロックアップ契約の履行。 関係者取引.
付記9を参照してください金融商品の公正価値上記の契約に関連して発行された金融商品に関する当社の計測のため。
レガシー NKGen が発生 $7.5百万レガシー NKGen の資本調達取引と判断された事業統合に関連する取引費用。オブザ $7.5百万取引コストでは、 $4.2百万そして$3.3百万株式分類商品と負債分類商品に相対的な公正価値に基づいてそれぞれ割り当てられました
以下の表は、事業統合の要素と当社の連結財務諸表を照合しており、上記の脚注 ( 株式金額を除く千単位 ) と併せて読む必要があります。
| | | | | |
| 株 |
グラフ公開株式 ( 償還差し引く ) | 93,962 |
プライベート · プレイスメント投資家の株式 | 3,683,010 |
グラフ創設者株式 | 2,516,744 |
| 事業合併直前のトータルグラフ株式発行済状況 | 6,293,716 |
レガシー NKGen 転換社債の転換 ( 為替レート適用後 ) | 2,278,598 |
レガシー NKGen ロールオーバー株式 ( 為替比率適用後 ) | 13,316,662 |
| トータルレガシー NKGen 株式 | 15,595,260 |
| 事業統合直後の当社普通株式発行済総額 | 21,888,976 |
| | | | | |
| (単位:千) | 資本再編 |
| 成約収益 | |
普通株式を発行して得た金 | $ | 1,667 | |
PIPE ワラントの発行による収益 | 10,210 | |
ワラント付きシニア転換社債の発行による収益 | 10,000 | |
| 決算支出 | |
Less : グラフ繰延引受手数料の支払い | (1,250) | |
Less : 決算時の Graf 取引コストの支払い (1) | (7,456) | |
Less : クローズ時のレガシー NKGen 取引コストの支払い | (3,510) | |
| 事業統合による当期純現金利益 | $ | 9,661 | |
Less : クローズ前のレガシー NKGen 取引コストの支払い | (2,089) | |
| 事業合併による純現金利益 | $ | 7,572 | |
| ノンキャッシュ活動 | |
レガシー NKGen 転換社債の転換 | 18,913 | |
減 : グラフから引き受けた営業負債 | (860) | |
Less: 未払いの取引コスト — Graf から想定 (1) | (5,400) | |
より少ない: 未払いの取引コスト — レガシー NKGen | (1,938) | |
| 負債分類商品 | |
減 : PIPE ワラントの公正価値 | (10,210) | |
マイナス : 先物買入れデリバティブ負債の公正価値 | (20,201) | |
減 : シニア転換社債の公正価値(2) | (9,707) | |
差し引く:私募権証の公正価値 | (1,841) | |
以下 : 運転資本ワラントの公正価値 | (204) | |
| 事業統合による自己資本への影響 | $ | (23,876) | |
(1)グラフの取引コストは $を含む。4.0特定のベンダーに関連する 100 万ドルの未払い金は現金と普通株式で支払われます2.0それぞれ 100 万ドルクローズ時に、現金支払い $1.3このベンダーに 100 万ドル支払われました残り $2.7100 万ドルの金額はグラフから引き受けた未払いの取引コストの構成要素として認識されました0.7100 万ドルは現金決済義務で残りは2.0100 万株は、 ASC 480 の下で負債として計上された固定金銭額に対して可変数の株式を発行する義務を表します。 負債と持分を区別する「 ASC480 」ASC 480 の下では、株式発行義務は、金銭額が固定されているため、利益に計上された変動とともに適正価額で測定されません。
(2)割り当て公正価値を表す。
連結株主資本 ( 赤字 ) 計算書に記載されているとおり ( 千単位 ) :
| | | | | |
| 事業統合による自己資本への影響 | $ | (23,876) | |
先物買取契約の発行損失 | 24,475 | |
取引コストを支出しました | 3,329 | |
株主総赤字に対する事業統合の総影響 (1) | $ | 3,928 | |
購買債権の発行 | 32,915 | |
発行済み普通株式額面 | (1) | |
| 事業統合が追加資本に及ぼす影響 | $ | 36,842 | |
(1)連結株主資本 ( 赤字 ) 計算書に別途記載されている、事業統合による純損失への影響を除く。
4.私募する
初期認知
背景
閉鎖前に、当社は個人契約を結んだ ( 「個人投資契約投資家 ( 「投資家」 )FPA投資家購入契約 ( 購入契約 ) 」長期購入協定」 ) 、サブスクリプション契約、サイドレター、およびエスクロー契約。プライベート · プレイスメント契約は 2023 年 9 月 29 日に締結されました。プライベート · プレイスメント契約に基づき、 FPA 投資家は 3,168,121普通株式(“普通株式”)FPA 株“)$32.9百万 ( > >前払い額”). プライベート · プレイスメント契約に基づき、 FPA 投資家は追加で 767,990普通株です
前払い額はエスクロー口座に入金されました。プライベート · プレイスメント契約の条件は、以下のとおりです 1つはFPA 投資家の選出により、いかなる数の FPA 株式についても早期終了および決済を条件として、クロージング後 1 年間 ( 「測算期エスクロー口座の資金は、当社の普通株式のボリューム加重平均価格を含む要因の組み合わせに基づいて、 FPA 投資家、当社、または両者の組み合わせに解放されることがあります ( 「VWAP( 計測期間中の特定評価期間 )リセット価格」 ) 、測定期間中に FPA 投資家が売却した株式数、および希薄防止条項の適用。プライベート · プレイスメント契約は、測定期間の終了時に終了します。
エスクローにあるすべての資金は、当社、 FPA 投資家、またはその両方の組み合わせに、またはその前に解放されます。 1年閉店記念日です。エスクローから解放できる最大値と最小値は、前払い額と ゼロFPA 投資家と当社の両方に対して、それぞれ。さらに、エスクロー口座の資金から得られたすべての利子は、 FPA 投資家に解放されます。
度量衡期間内に、会社の株価が$に近づいたり超えたりすれば10.441株当たり、会社に放出される信託資金の可能性及び金額が増加し、FPA投資家に放出される信託資金の可能性及び金額が減少する。逆に度量衡期間中に会社の株価が$を割ると10.441株当たり、会社に放出される信託資金の可能性及び金額が減少し、FPA投資家に放出される信託資金の可能性及び金額が増加する。和解結果の他の駆動要因には,算定期間内にFPA投資家が第三者に売却する株式数が含まれており,これにより,株式売却はFPA投資家に放出される一部の信託資金を減少させ,最高で$に達する可能性がある2.001株当たりの売却、逆希釈条項の適用、売却と決済のタイミング、その他の要因。また、前金不足は#ドルです0.1100万ドルは私募配給契約に基づいている“繰り上げ返済不足“)”私募配給契約の条項及び条件に基づいて、第三者にFPA株式を売却するには、引受金(以下、さらに説明する)の前にまず差額を前払いする必要がある。
FPAの株以外にもFPAの投資家は514,889普通株、増量対価格はありません(“赤い株“)”紅株は信託手配の制約を受けない
会計計算
すべてのFPA株と紅株は会社の流通株であり、信託方式で保有せず、制限されずに譲渡することができ、会社の他の株と同じ投票権、配当、清算参加権を持つことができる。そのため、当該等の株式は権益別に分類され、連結財務諸表に他の普通株とともに記載されている。
信託契約では,FPA投資家の利益のために信託された資金は,私募合意の条項によって当社に解放されるまで信託形式で保有されるが,当社の債権者は当社が倒産した場合には信託資金を使用できないことが規定されている。そのため、同社は最初の前金金額#ドルを計算した32.9保有する資金は株主の売掛金を代表するため、100万ドルを売掛金とする。
私募配給契約の特徴は、基礎名義金額、支払い準備、純決済を含むため、ASC 815に規定された派生商品基準を満たしている。したがって,デリバティブ負債の確認は,代行資金のうちFPA投資家に解放可能な資金部分の推定計量に基づいており,これは決済時までに存在する状況に基づいている。引受金列報の前払額と派生負債の純残高として、総合的に考慮すると、会社が信託口座から受信することが予想される信託資金の推定額を代表する。私募契約に関連する派生負債の公正価値のその後の変動は四半期収益で確認される
終値時に$を除いて32.9引受金百万ドル,長期購入契約発行損失計#ドル24.5派生負債を含む100万ドルを記録しました#ドル20.2百万ドルと赤い株の公正価値$4.3百万ドルです。長期購入派生負債は、私募配給契約の満了またはその他の場合には、流動負債とみなされる1年あるいはその前に1年閉幕周年記念日。
2023年12月改正案
2023年12月26日、当社はFPA投資家と彼らを改訂する長期購入協定を締結した(“FPA修正案“)総収益は$0.5百万ドルです。2023年12月31日までの年度内に、他の私募配給契約は改訂されていない。“FPA修正案”の規定:(一)200,000FPA株は赤株に再指定されます。(Ii)リセット価格の定義が変更されました(“修正後のリセット価格“、(3)プリペイドギャップの定義を改訂しました(”修正した早期返済不足);および(4)代理口座内の資金は、FPA投資家が所有する別の口座に移行する。当社は2024年1月までFPA投資家から改訂に関する資金を受け取っていません
改訂リセット価格の条項規定(I)FPA改訂実行日から発効するスクロール上限は,毎週の業績VWAPをもとに,当社が算定期間内の株価上昇,および(Ii)一般割引の恩恵を受けないようにしている10FPA投資家に利益を与えるVWAP測定の%である
FPA投資家がFPA株を第三者に売却する収益は、前金不足が残高がなくなるまでプリペイド不足を減少させたとみなされなければならない(“販売不足)は、このとき株を売却して得られた金は、引受売掛金の減少と見なすことができ、当社に現金収益をもたらす可能性がある。すべてのFPA株が前金不足を完全に補うことなく販売されている場合、会社は、残りのプリペイドギャップ残高に相当する現金金額を支払うことを選択しなければならない90尾引きVWAPの%20取引日
修正された前払い差額の条項は#ドルに規定されている0.5FPA投資家が以前存在していた早期返済不足を100万ドル増加させました0.1百万ドルです
FPA修正案を実行する際に、会社は長期購入契約改訂の損失を確認し、以下に述べる(千単位)
| | | | | |
| 改訂中の損失 |
| 受取引受金の減少 | $ | 15,123 |
| 長期購入デリバティブ負債の削減 | (14,181) |
| 株主売掛金 | (500) |
| 長期住宅購入契約変更損失 | $ | 442 |
これは1ドルです0.4FPA改正案に関連して確認された百万ドルの損失とは、会社が長期購入契約によって受け取る可能性のある現金収益の減少であるが、長期購入デリバティブ負債と株主売掛金の減少分によって相殺されるFPA改正案の結果として,会社が長期購入契約によって得られる最高現金収益(引受受取残高に反映)が低下している。受取引受金の減少$15.1百万その理由は、(I)改訂されたリセット価格が、会社が入手可能なFPA株1株当たりの最高価格を低下させたからである(最初、$10.441株);.(Ii)再指定200,000FPA株を紅株に変更し、FPA株の総数量を減少させ、および(Iii)早期返済不足を改訂し、早期返済不足金額を増加させた。当社は紅株や販売差額を売却または決済することで何の代価も徴収しません。詳細は以下の通りです。売掛金の減少を除いて,会社は公正価値の減少を確認した先物買入れデリバティブ負債の $14.2百万.
FPA 株式の売却について
非公開配分契約の条件に従い、非公開配分契約に関連する当社普通株式の売却は、すべての FPA 株式が売却されるまで、ボーナス株式の売却として扱われない場合があります。
FPA 改正後、 FPA 投資家は売却しました。 139,793当社の普通株式を第三者に売却し、 FPA 株式の不足売却として扱った。したがって、サブスクリプション債権残高の影響は受けませんでした。2023 年 12 月期は、その他の FPA 株式の売却は行われませんでした。
価値変動を公平に承諾する
この注釈 4 に記載されているように、先物買入れデリバティブ負債は、当社ではなく FPA 投資家に解放される可能性のある減額引受債権の一部を表します。G再測定に起因する損失や損失は 先物買入れデリバティブ負債の公正価値の変化は四半期ごとに決算に計上されます注釈 9 を参照。 金融商品の公正価値更なる議論のために。
5.株式承認証
2023 年 12 月 31 日現在、下記のすべての令状は未執行のままです。
株式証を公開する
株式会社グランプリの公開買付けについて ( 略 )初公募株”), 3,432,286投資家の皆さまは、「投資家の皆さまは、公共の命令 > >).公的令状は、 th を権利する。E登録所持者は購入しなければなりません1つは会社普通株で価格を行使する$11.50授権によって行使可能となる30日数企業合併が完了した後,期限が切れる5年自自業務合併を完了するか、または償還時により早く完了する。もし会社の株価が$以上であれば、会社は適宜公募株式証の償還を一任することができる18.001株当たりの収益と他の特定の条件を満たす。公募株式証は、会社自身の株式にリンクする条項および他の持分分類基準に適合するか否かによって持分に分類される
個人株式証明書
GrafがIPOを行うとともに,Grafが発行した4,721,533Graf Acquisition Partners IV LLC(“個人株式証明書“)”私募株式証の条項は公共株式証明書と同様に行使価格は$である11.50各株式権証明書は、いくつかの譲渡と販売の制限を受けなければならず、しかも初期購入者或いはその譲渡者が所有を許可されている限り、選択的に償還することはできない。また、私募株式証は現金なしで行使することができる。私募株式証が初期購入者又はその許可譲渡者以外の一方が保有している場合、当該等私募株式証は自社で償還することができ、当該等所有者が公開株式証と同じ基準で行使することができる。条項は会社自身の株にリンクしないため、私募株式証は負債に分類される。付記8で述べたように、関係者の取引、私募株式証は関連側金融商品である。プライベートエクイティ証は、最後の連結貸借対照表の日付から1年を超えるため、非流動負債に分類される。
SPA株式証明書
なお、注釈 6 に記載のシニア転換社債の発行に伴い、 転換可能な手形, 1,000,000NKMAX にワラントが発行されました11.50命令書 ( 」 )SPA株式証明書”). SPA ワラントの条件は、パブリックワラントの条件と同一であり、当社の株価が $200 以上の場合、当社の単独の裁量により償還されます。18.001 株当たりその他の一定の条件を満たしていますSPA ワラントは、当社自有株式にインデックス化された条件およびその他の株式分類基準の満足 ( 当社の株価が $等しい場合、当社の支配下での償還を含む ) により株式に分類されます。18.001 株あたり注釈 8 に記載されているように。 関係者の取引、SPA ワラントは、関連当事者の金融商品です。
運営資金引受証
閉鎖に先立ち、グラフは運転資本ローンファシリティの引き下げを実行しました。閉店時に、 $0.8運転資本貸付ファシリティの残高 100 万ドルは 523,140命令 ( 」 )ワーキングキャピタル Warrants »).運転資本ワラントの条件は、行使価格が $のプライベートワラントの条件と同じです。11.50令状でね運転資本ワラントは、当社自有株式にインデックス化されていない条件により分類される負債です。注釈 8 に記載されているように、 関係者の取引、運転資本ワラントは関連当事者の金融商品です。運転資本ワラントは、期間の終了が最新の連結貸借対照表日から 1 年を超えるため、非流動負債に分類されます。
喉頭管捜査令状
市を受け取る前に、当社は株式証明書引受契約を締結した(“株式引受契約“ある投資家と()権証投資家“)は、2023年9月29日に閉鎖された。株式承認証引受契約に基づいて,株式承認証投資家は合算して購入した10,209,994株式証明書を承認し,購入価格は$とする1.00命令書 ( 」 )喉頭管捜査令状“)総収益は$10.2百万ドルです。水道権証は、以下の期間に現金で行使することができる(または場合によっては“現金なし”で行使する場合がある)5年制終値の日からの期間。管理権証の3分の1は最初にドルで行使できる10.00各株式証明書によると、3分の1のパイプ承認株式証は最初にドルで行使できる12.501部の株式承認証と3分の1の管路承認持分証の最初に行使可能な価格は$である15.00令状によると。株の初期行使価格は一年おきに調整されます180会社普通株取引価格の下落や、株式分割、株式配当などの逆希釈調整により、終値から数日以内に調整される。また、パイプ株式証は下行保護条項を含み、この条項によると、権利証投資家は無現金方式であるパイプ株式証を交換することを要求することができ、関連参考価格が#ドル以下の範囲内で無現金交換を要求することができる1.501株当たり、現金で支払い、$と計算します1.501株及び当時の行使価格に適用される引受権証株式数を乗じて、株式承認証投資家に支払わなければならない。条項は会社自身の株式とその現金決済条項にリンクしていないため、管理権証は負債に分類される。
パイプ承認株式証は、それらの期限が最新の総合貸借対照表の日付から1年を超えるため、非流動負債に分類される。
6.転換可能な手形
レガシー変換可能な手形
2019 年 11 月から 12 月にかけて、当社は投資家に転換社債を発行しました ( 「2019 年債券」と関係者 ( 「2019 年関連当事者転換社債”). 2023 年 3 月から 9 月にかけて、当社は投資家に発行された転換社債を追加発行しました。2023年変換可能チケット」と関係当事者 ( 「2023 関連当事者転換社債」と総称される。レガシー変換可能な手形”.
2019 年有価証券および 2019 年関連当事者有価証券からの調達総額は $でした。10.8百万ドルとドル0.3それぞれ 100 万ドルでそれぞれが利子を持ち 1.7満期は 2023 年 12 月 31 日である。2023 年有価証券および 2023 年関連当事者有価証券からの調達総額は $でした。6.1百万ドルとドル0.1それぞれ 100 万ドルでそれぞれが利子を持ち 4.6年率% と満期日があった 3年それぞれの発行日からですレガシー転換社債の条件は、事業統合のクロージングを含む適格な資金調達取引の発生時に普通株式への転換を規定しています。
これらの条件に従い、クロージングの直前に、すべてのレガシー転換社債が転換されました。 Vt入って入って5,579,266レガシー NKGen 普通株式の株式は 2,278,598当社の普通株式は、為替レートに基づく決算時です。
高度変換可能手形
当社は、本取引に先立ち、転換社債の引受契約 ( 「有価証券購入協議」と NKMAX の総収益を $10.0百万一つ持っています四つ-年だ期間と金利は 5.0%現金で半年ごと支払われるか 8.0%支払いは種類 ( “高度変換可能手形」 ( 2023 年 9 月 29 日に閉鎖された。 利息は、クローズ時に発生し始め、半年ごとに延滞して支払われ、現物で支払われる利息 ( 該当する場合 ) は、各利息支払日に未払いの元本を増やします。当社は、現在、定期的な現金支払いの代わりに現物利子を支払う予定です。シニア · コンバーチブルノート NKMAX のオプションで、いつでも、全部または一部で転換可能です。換算価格は $10.00普通株式 1 株当たり ( 株式分割等の場合には希薄化防止調整を行う場合 ) 。シニア転換社債には、 NKMAX が行使できるプットオプションがあります。 2.5年.年シニア転換社債の発行後。以下ではない 6か月プットオプションの行使後、当社はシニア転換社債の元本及び未払利息の全額を返済する必要があります。プットオプションが未行使のままである場合、未払いの元本および未払利息は 2027 年 9 月 29 日に支払われます。また、注釈 5 に記載されているように、 株式承認証証券買取契約書とともに、 スパ · ワラント NKMAX に対して発行されたため、注 9 に記載の相対公正価値配分及び割引が適用され、 金融商品の公正価値. シニア転換社債には、金融的または非金融的契約はありません。2023 年 12 月 31 日を末日とする会計年度は、 $0.2シニア転換社債に関連する利子費用と割引償却額 100 万ドルです注釈 8 に記載されているように、 関係者の取引、シニア転換社債は、関連当事者の金融商品です。
以下の表は、シニア転換社債の調整状況 ( 千単位 ) です。
| | | | | |
| シニアコンバーチブル
備考 |
| 2022年12月31日現在の残高 | $ | — |
| 発行する. | 9,707 |
| 割引して償却する | 17 |
| 支払実物利子 | 206 |
| 2023年12月31日現在の残高 | $ | 9,930 |
7.債務
循環信用限度額
2023年6月、当社はドルを締結しました5.0商業銀行と締結された百万循環信用限度額協定(それぞれ2023年9月19日、2024年1月30日、2024年4月5日に改訂)1年制期限と金利は、(I)1ヶ月保証隔夜融資金利に高いものを基準とします2.9%または(Ii)7.5%です。発行料:$0.1100万ドルはこの循環信用限度額と関連がある。循環信用限度額でのすべての未返済残高は2024年6月20日に満期になり、支払いされる。2024年4月、協定を修正し、循環信用限度額の満期日を2024年9月18日に延長した。循環信用限度額は、カリフォルニア州サンアナにある自社不動産の信託契約を含む会社のすべての資産を担保にしている。その会社は貸手に少なくとも$の預金を預けるように要求された15.0一定期間、未返済の債務残高があれば、100万ドルの債務を得ることができる。2023年12月31日現在、会社は私たちの債務契約を守っています。2024年4月、貸手はその後、会社が融資者をその主要な銀行関係とすることに同意したと引き換えに、最低現金預金要求を免除した。また、同社は#ドルの制限された現金残高を維持する必要がある0.3発行後の100万ドル。2023年12月31日現在、循環信用限度額の金利は8.2%.
2023年12月31日現在、同社は$を抽出した4.9循環信用限度額に100万ドル増加し、引き出しを返済しなかった。利子支出$0.2循環信用限度額は2023年12月31日までの年間で100万ドルの現金支払いが発生した違います。2022 年 12 月 31 日を末日とする会計年度にリボルビング · クレジット · ラインの利子費用が発生しました。
関係者ローン
当社は、 2019 年 8 月から 2023 年 4 月にかけて、 NKMAX との関連当事者ローン ( 以下「関連当事者ローン」 ) を締結しました。
2022 年 12 月時点で、当時の残高総額である関連当事者ローンの元本と利息は $66.1100 万ドルが 6,943,7892022 年 12 月 31 日を末日とする会計年度の出資として認識された普通株式 ( 為替比率適用後 ) 。
2023 年 1 月から 4 月にかけて、当社は NK MAX との追加関連当事者ローンを締結し、総売上高は $5.0百万だこれらの追加的な関連当事者ローンの金利は 4.62024 年 12 月 31 日に満期します。関連当事者ローンに関連する財政的または非財政的契約はありません。追加の関連当事者ローンは、株式に転換できません。
関連当事者ローンに関連して発生した利子費用は $でした。0.2百万ドルとドル2.32023 年 12 月 31 日と 2022 年 12 月 31 日を末日とする会計年度はそれぞれ 100 万ドルです連結貸借対照表におけるその他の経常負債に計上される関連当事者利子支払額は $でした。0.2百万ドルとゼロそれぞれ2023年12月31日と2022年12月31日まで。
短期関係者ローン
はい2023年9月, NKGen raised $0.3百万関連当事者による融資に関連した収益に 30— 日間の期限と金利 5.1% (“短期関係者ローン”).この関係者借入金は株式転換ではなく、 2023 年 10 月 5 日に現金で返済されました。関連当事者の利子費用は以下の $0.1百万この年度までに2023年12月31日そして、そしてゼロこの年度までに2022年12月31日.
賃金保障計画ローン
2020 年 5 月、当社は借入金を受け取った。1.1Paycheck Protection Program (PPP) の略称。CARES 法の一環として設立された PPP は、適格な給与費、家賃、光熱費、住宅ローンやその他の債務の利子をカバーするために、中小企業に融資を提供しています。ローンの金利は 1.0%.ローンは 2022 年 5 月に返済された。当社は $の利子費用を計上した。0.12022 年 12 月 31 日を末日とする会計年度の連結営業計算書および包括損失において、 PPP ローンに関連する利子費用は 100 万ドルとなりました。いいえ給与保護プログラムローンに関連する金額は 2023年12月31日.
8.関係者取引
方正株
合併契約の履行と同時に、グラフと NKGen は修正されたスポンサーサポートおよびロックアップ契約を締結しました。スポンサーサポート · ロックアップ契約の修正 · 更新”).修正および再記載されたスポンサーサポートおよびロックアップ契約に関連して、 4,290,375グラフの株式は、以前グラフのスポンサーとインサイダーが保有していたものです。方正株”): (i) 1,773,631株式は没収された。 1,173,631株価は制限付き株価となる ( 株価は制限付き株価となる ) 。繰延創業者株式( 3 ) 残り ( 3 ) 1,343,113株式は最大取引制限の対象となります 2年.発行済株式であり続けました
繰延創業者株式は議決権を持たず、配当に参加せず、譲渡できません。授与期間中は 5年Closing ( 閉店 )帰属期間」 ) 、普通株式の支配権の変更に伴う取引価格または 1 株当たり価格の対価が以下である場合 $14.00いつでもいいです20取引日数 A 30連続した取引日の期間では 873,631繰延創業者株式は直ちに付与されます。 $20.00いつでもいいです20取引日数 A 30連続した取引日の期間、そして追加の 300,000延期創業者株式は直ちに譲渡されます。当社が売却される場合、当該売却の完了の直前に、契約書に定義されている計算される買収者売却価格は、支配権の変更時に付与される繰延創業者株式の数を考慮に入れます。譲渡期間の満了に伴い、未譲渡の創業者株式は対価なしで没収され取り消されます。
繰延創業者株式を含むすべての創業者株式は、支配権の変更を含め、主に当社自有株式にインデックスされた条件により株式に分類されます。
関連当事者の金融商品
当社の関連当事者金融商品には、 ( i ) 本注釈 8 に記載の繰延創業者株式を含む創業者株式、 ( ii ) 本注釈 5 に記載の SPA ワラント、 株式承認証注 5 に記載されている運転資本令状、 株式承認証, ( iv ) 注記 6 に記載のシニア転換社債 転換可能な手形, ( v ) 注釈 6 に記載されているレガシー転換社債を選択し、 転換可能な手形( vi ) 注釈 7 に掲げる関連当事者貸付金 債務注記 7 に掲げる短期関連当事者貸付金 債務注 5 に記載されている私的令状。 株式承認証.
アドバイザリー · 研究サービス
当社は、 Paul Song が最高経営責任者に就任する前に、専門的な臨床プログラムアドバイザリーサービスを提供していました。 2022年12月. 違います。当社に対して提供されたサービスまたは発生したサービス 2023年12月31日それは.この年度までに2022年12月31日, $0.4百万これらのアドバイザリーサービスに関連する研究開発費を計上しましたAs Of 2022年12月31日支払額以下の金額 $0.1百万関連当事者からのアドバイザリー · リサーチサービスに関する残高は連結貸借対照表の買掛金と未払い費用に計上されましたAs Of 2023年12月31日, 違います。関連当事者からのアドバイザリー · リサーチサービスに関する未払いの残高
実験用品の購入
この年度までに2023年12月31日そして2022年12月31日当社は研究開発費を計上しました。 $0.6百万そして$0.1百万NKMAX からの実験用品の購入に関連していますAs of 2023年12月31日そして2022年12月31日, $0.6百万より少ないのです$0.1百万NKMAX からの実験用品の購入に関する残高は、連結貸借対照表の買掛金と未払い費用に計上されています。
9.金融商品の公正価値
当社は、適正価値を定義し、適正価値測定に関する開示を拡大する米国 GAAP が確立した枠組みに基づいて、金融商品の適正価値を計上しています。公正価値は、測定日に市場参加者間の秩序ある取引において、資産を売却するために受け取るか、負債を移転するために支払われる価格と定義されます。公正価値を測定する評価手法は、観測可能なインプットの使用を最大化し、観測できないインプットの使用を最小限に抑える。この基準は、公正価値を測定するために使用できる 3 つのレベルのインプットに基づく公正価値の階層を記述しています。
当社の経営陣は、金融商品の適正価値を推定するために、以下の方法と仮定を用いた。
Level 1-会社が計量日に取得する能力のある同じ資産または負債のアクティブ市場でのオファー。
第2のレベル--第1のレベル以外の直接的または間接的に観察可能な入力、例えば、市場における同様の資産または負債のオファーをアクティブにしない、または実質的に全体の資産または負債の観察可能または観察可能な市場データによって確認される他の入力。
第3レベル-定価入力は観察できず、市場活動の支持が少ないか、またはないことは、資産または負債の公正な価値に大きな意味を持つ。
このようなツールは短期的な性質であるため、当社の金融資産および金融負債の額面は、それぞれの公正価値を代表するとみなされている。
公正な価値に応じて日常的に計量された負債は2023年12月31日以下は(単位:千):
| | | | | | | | | | | | | | | | | | | | | | | |
| 報告日の公正価値計量使用 |
| 締め切りの残高
十二月三十一日
2023 | | レベル1 | | レベル2 | | レベル3 |
| 個人株式証明書 | $ | 378 | | | $ | — | | | $ | — | | | $ | 378 | |
| 運営資金引受証 | 42 | | | — | | | — | | | 42 | |
| 長期購入デリバティブ | 15,804 | | | — | | | — | | | 15,804 | |
| 喉頭管捜査令状 | 25,339 | | | — | | | — | | | 25,339 | |
| 合計する | $ | 41,563 | | | $ | — | | | $ | — | | | $ | 41,563 | |
経常的な基礎の上で公正な価値で計量する項目のほかに、当社には非日常的な上で公正な価値で計量された負債があります。これらの負債は公正な価値で恒常的に計量されていないため、上の表には含まれていない。2023年12月31日現在、非日常的に公正な価値に基づいて計量された負債には、高度な変換可能な手形が含まれている。高級交換可能手形の推定値は$8.52023 年 12 月 31 日現在 100 万人シニア転換社債は、 ASC 470 の範囲内であると決定されました。 債務.したがって、本商品の適正価額測定は、 SPA ワラントとともにシニア転換社債が発行されたため、下記の相対適正価額配分を目的としたものであるため、定期的な適正価額測定は行われません。
レガシー変換可能な手形
以下の表は、レガシー転換社債の調整を示しています ( 単位 : 千 ) :
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2019
オープンカー
備考 | | 2019 年関連
会合
オープンカー
備考 | | 2023
オープンカー
備考 | | 2023 年関連
会合
オープンカー
備考 | | 合計する |
| 2021年12月31日現在の残高 | $ | 11,219 | | | $ | 259 | | | $ | — | | | $ | — | | | $ | 11,478 | |
| 価値変動を公平に承諾する | 173 | | | 4 | | | — | | | — | | | 177 | |
| 2022年12月31日現在の残高 | 11,392 | | | 263 | | | — | | | — | | | 11,655 | |
| 発行する. | — | | | — | | | 6,090 | | | 125 | | | 6,215 | |
| 価値変動を公平に承諾する | 1,083 | | | 13 | | | (52) | | | (1) | | | 1,043 | |
| 変換と決済 | (12,475) | | | (276) | | | (6,038) | | | (124) | | | (18,913) | |
| 2023年12月31日現在の残高 | $ | — | | | $ | — | | | $ | — | | | $ | — | | | $ | — | |
当社は、従来、レガシー転換社債の帳簿価額を決定し、転換機能を持たない類似債券の適正価値を測定することにより、将来の投資収益予想の確率加重現在価値に基づいてレガシー転換社債の適正価値を推定するシナリオベースの分析を行ってきました。類似の債券商品が存在しない場合、市場参加者が債券商品の価格設定に使用する仮定 ( 市場金利、信用状況、イールドカーブ、ボラティリティなど ) を使用して公正価値を推定しました。
レガシー転換社債の適正価額の決定にあたっては、以下の観測できない仮定を使用しています。 2022年12月31日:
| | | | | |
| 変換確率 | — | |
| 転換なし満期まで保有する確率 | — | |
| 潜在的な変換トリガー日までの残期 ( 年 ) | 0 |
割引利回り (1) | 20.0 | % |
(1)比較債券分析および S & P Global Inc. を用いて推定した。多項式論理回帰を用いた格付け尺度です
決算時の転換直前のレガシー転換社債の適正価額は、 2,278,598当社の株式の総額は、その転換時に発行された普通株式の合計 $18.91 株当たり 100 万ドルの価値で8.30換算日であるクローズ時の当社普通株式の適正価額に基づく。
高度変換可能手形
本シニア転換社債は、 2023 年 9 月 29 日の決算時に認識されました。さらに、注釈 6 で述べたように、 転換可能な手形また,高度な変換可能チケットは公正価値に応じて恒常的に計測されない.そのため,高度な変換可能チケットの入金は提案されていない
当社では,二分木モデルを用いて高度な変換可能チケットの独立公正価値を決定し,株価のチケット期限内の分布を生成し,チケットに関する収益を計算し,メッシュ中の確率重み付き価値を推定日に割引する.公正価値は、市場金利、信用格付け、収益率曲線、および変動性を含む、転換可能な債務ツールのための価格設定の際に市場参加者によって使用される仮定を使用して推定される。
高度な変換可能チケットの成約時の公正価値を決定する際には,以下の観察不可能な仮定を用いた
| | | | | |
信用利回りが悪い(1) | 12.1 | % |
| 株式変動性 | 45.0 | % |
(1)比較可能債券分析を用いて、Sグローバル会社のS信用格付け基準に基づいて、複数の論理回帰を用いて推定を行う
2023年12月31日現在、会社は高度変換可能手形の公正価値を$と決定しました8.5百万ドルです
高度な変換可能チケットの2023年12月31日の公正価値を決定する際に、以下の観察できない仮定が使用された
| | | | | |
信用利回りが悪い(1) | 12.7 | % |
| 株式変動性 | 45.0 | % |
(1)比較可能債券分析を用いて、Sグローバル会社のS信用格付け基準に基づいて、複数の論理回帰を用いて推定を行う
個人持分証及び運営資金引受持分証
私募株式証と運営資金株式承認証は2023年9月29日に成約した時に認められた。終値までの公正価値は$1.8百万ドルとドル0.2それぞれ100万ドルです2023年12月31日まで、公正価値はドルです0.4百万ドル以下0.1それぞれ百万ドルです。
表に私募株式証と運営資金株式承認証の入金状況(千計)を示す
| | | | | | | | | | | | | | | | | |
| 私
株式承認証 | | 労作
資本
株式承認証 | | 合計する |
| 2022年12月31日現在の残高 | $ | — | | | $ | — | | | $ | — | |
| 企業合併に関する確認 | 1,841 | | | 204 | | | 2,045 | |
| 価値変動を公平に承諾する | (1,464) | | | (162) | | | (1,626) | |
| 2023年12月31日現在の残高 | $ | 377 | | | $ | 42 | | | $ | 419 | |
私募株式証及び運営資金株式証明書の条項は同じである。したがって,これらのツールを評価するための方法と仮定は同じである.
私募株式証と運営資金承認株式証の公正価値はブラック-スコルスモデルを用いて計量した。私募株式証と運営資金承認株式証の推定公正価値は第三級投入センチを使用して決定された。ブラック·スコイルズモデル固有の仮定は、期待株価変動、期待寿命、無リスク金利、配当収益率と関係がある。当社は、当社が売買する私募株式承認証と運営資金株式承認証の暗黙的な変動率、及び私募株式証と運営資金承認株式証の期待残存寿命に応じた同業会社普通株の選定の歴史的変動率に基づいて、その私募株式承認証と運営資金承認株式証の変動率を推定する。無リスク金利は付与日の米国財務省ゼロ金利収益率曲線に基づいており、その満期日は私募株式証と運営資金承認株式証の期待残存寿命と類似している。私募株式証及び運営資金株式証の予想年間仮定は残りの契約期間と同じである。配当率は歴史金利に基づいており、会社は歴史金利を維持すると予想していますゼロ.
私募株式証と運営資金株式承認証の成約時の公正価値を決定する際には,以下のような観察できない仮定を用いた
私募権証と運営資金権証の2023年12月31日までの公正価値を決定する際には、以下のような観察できない仮定を用いた
喉頭管捜査令状
管権証は2023年9月29日の終値時に認められた。2023年12月31日までの公正価値は25.3百万ドルです。
次の表にパイプ株式証の入金状況(千計)を示す
| | | | | |
| パイプ.パイプ
株式承認証 |
| 2022年12月31日現在の残高 | $ | — |
| 発行する. | 10,210 |
| 価値変動を公平に承諾する | 15,129 |
| 2023年12月31日現在の残高 | $ | 25,339 |
パイプ承認株式証の公正価値はそれぞれの取引価格#ドルで計量される10.2100万ドルを使って10,209,994パイプは株式証を承認し,買い入れ価格は$とする1.00すべての令状は事件が終わった時に
2023年12月31日現在,管権証の公正価値は$である25.3百万ドルです。管路承認株式証の公正価値は第三級投入を用いて推定し,モンテカルロシミュレーションを用いて推定した。同社の普通株価格は推定値日から満期日までの間幾何ブラウン運動に従っていると仮定する。すべての可能なシナリオの広さは、比較可能な会社の歴史的株式変動性に基づいており、それらの資本構造の違いを考慮した変動性推定に反映される。シミュレーションパスごとに,テスト価格とリセット価格は測定期間中の1日株価から算出した.リセット日ごとに、テスト価格と下り保護閾値価格とを比較することにより、下り保護条件が満たされているか否かを評価する。そして、承認株式証ごとの価値を計算し、任意の下り保護株式と下り保護現金(適用すれば)を計上する。この一連の可能な場合、無リスク金利割引を使用した平均値は、管権証の公正価値として使用される。PIPE株式承認証の公平値変動は、主に株式承認証引受プロトコルの一部の機能によるものであり、価格リセットおよび下り保護の実行を含み、これは当社の株価下落や株価変動の増加に伴い価値を増加させる。
配管権証の2023年12月31日の公正価値を決定する際には、以下のような観察できない仮定を用いた
| | | | | |
| 信用利回りが悪い | 12.7 | % |
| 株式変動性 | 100.0 | % |
長期購入デリバティブ
長期購入デリバティブ負債は2023年9月29日決算時に確認された。2023年12月31日までの公正価値は15.8百万ドルです。
次の表に長期購入デリバティブ負債の入金状況(単位:千):
| | | | | |
| 転送
購入
導関数
負債.負債 |
| 成約時の長期購入デリバティブ負債 | $ | 20,201 | |
| 長期調達契約修正損失に関する公正価値変動 | (14,181) | |
| 先物買入れデリバティブ負債の公正価値の変化 | 9,784 | |
| 2023年12月31日現在の残高 | $ | 15,804 | |
長期購入派生負債の公正価値は、モンテカルロシミュレーションを用いて推定される。同社の普通株価格は様々な可能な状況で毎日時間ステップサイズでシミュレーションされている。すべての可能なシナリオの広さは、比較可能な会社の歴史的株式変動性に基づいており、それらの資本構造の違いを考慮した変動性推定に反映される。シミュレーション価格と長期購入プロトコルの決済調整特徴を比較した.各シミュレーションの未来の株価シナリオの下で、会社は長期購入デリバティブ負債手配の価値を計算した。この一連の可能な場合、無リスク金利割引を使用する平均値は、長期購入デリバティブ負債の公正価値として使用される
決済時の長期購入デリバティブ負債の公正価値を決定する際には、以下の観察できない仮定を用いた
2023年12月26日改正直後の長期購入デリバティブ負債の公正価値を決定する際には、以下のような観察できない仮定を用いた
2023 年 12 月 31 日時点の先物買入れデリバティブ負債の公正価値の決定にあたっては、以下の観測できない仮定を用いた。
相対的公正価値
シニア転換社債は、 SPA ワラントとともに発行されました。各商品は、有価証券購入契約の取引価格 $に基づく公正価値総額に対する公正価値の割合に基づく相対的公正価値に限られ、公正価値で計上されました。10.02023 年 9 月 29 日に閉店した。SPA ワラントの相対的公正価値は、シニア転換社債に対する割引として扱われ、シニア転換社債の期間中に利子費用として償却されます。
シニア転換社債及び SPA ワラントの初期認識時の単独公正価値は $でした。12.9百万ドルとドル0.4それぞれ 100 万人ですシニア転換社債と SPA ワラントの単独公正価値は $でした。8.5百万ドルとドル0.12023 年 12 月 31 日現在 100 万人シニア転換社債及び SPA ワラントの当初の認識時及び 2023 年 12 月 31 日時点の相対的公正価値は、 $でした。9.7百万ドルとドル0.3それぞれ100万ドルです
10.株主権益
逆資本再編
注2で述べたように、重要会計政策の概要なお、本連結財務諸表におけるストックオプションデータを含む過去の株式データは、 2023 年 9 月 29 日に発生した逆資本増強を反映して為替レートにより遡及的に調整されています。
普通株
2023年12月31日まで、当社は許可しました500,000,000普通株、額面$0.0001一株ずつです。2023年12月31日までに21,888,976普通株式が発行され発行済でした 478,111,024普通株式は将来の発行のために予約されていました
優先株
2023年12月31日まで、当社は許可しました10,000,000優先株、額面$0.0001それは.2023年12月31日までにゼロ優先株は発行されたか発行された。
従業員株購入計画
当社は、事業統合の完了に伴い、従業員株式購入計画 ( 「ESPP”). ESPP に基づいて発行することができる当社の普通株式の最大数は、 3.0当社の完全希薄化普通株式の% ( 決算終了直後に決定 ) 。この株式の最大数は、自動的に毎年増加します。当社の従業員および指定された関連会社の従業員は、 ESPP に参加することができます。ESPP 株式の買取価格は 85募集初日または該当する購入日における当社の普通株式の公正市場価値の低い方の% 。2023 年 12 月 31 日現在、 ESPP に関する取引は行われていません。
2023年計画
事業統合の完了に伴い、当社は 2023 年株式インセンティブプラン ( 「 2023 年株式インセンティブプラン」 ) を採用しました。2023年計画“)”2023年計画によると、発行可能な普通株の最高数は12.0会社が完全に希釈した普通株の割合は、取引終了後に確定した。このような最大株式数は年次自動増資によって制限されている。2023年計画によると、従業員および非従業員に制限株式とサービスまたは業績条件付き株式オプションを付与することができる
2023年計画が発効した日から、会社は2019年計画に基づいて追加的な奨励を与えてはならない。2023年12月31日現在、2023年計画では何の賞も授与されていない。
2019年計画
会社2019年計画(“2019年計画”)は2019年10月23日から施行されます。2019年には、会社員、取締役、コンサルタントに奨励的株式オプション、不合格株式オプション、株式付加価値権、制限株式単位奨励、業績株奨励を付与する計画です。2023年12月31日現在、会社は株式オプションのみを発行している。
2019年の計画によると付与された株式オプションは10年与えられた日から通常は4年制期間中に帰属が発生する割合は25最初の終了時に%で、その後は36等額の毎月分割払い、または取締役会メンバーに付与された奨励については、月ごとに支払います三つあるいは…4年それは.一般的に既得オプションが存在しなければ3か月サービス終了後に。
各従業員および非従業員株式オプション付与の公正価値は、付与された日にBlack-Scholesオプション定価モデルを用いて推定される。会社の経営歴史が限られており、しかも会社に特定された歴史と隠れた変動率データが不足しているため、当社は1組の上場した類似会社の歴史変動率に基づいて予想変動率を推定する。履歴変動性データは、計算された株式の報酬に基づく期待期限の等価期間内の選定会社株の1日終値を用いて計算される。歴史的な行権の歴史が不足しているため、当社従業員の株式オプションの期待期限は“簡略化”奨励方法で決定された。無リスク金利は、奨励付与時に発効した米国債収益率曲線を参考にして決定され、期間は奨励の予想期限にほぼ等しい。期待配当収益率はゼロ当社は配当を支払ったことがなく、当面も配当を支払う見込みはありません。
2023 年 12 月 31 日を末日とする年度における当社のストックオプション活動の概要は以下の通りです。
| | | | | | | | | | | |
| 株式オプション
卓越した | | 重みをつける
平均値
行権価格 |
| 2022年12月31日現在の未返済債務 | 185,231 | | $ | 1.37 | |
| 授与する | 2,173,693 | | 6.67 | |
| 没収される | (267,072) | | 6.56 | |
| 演習 | (12,866) | | 0.88 | |
| 2023年12月31日現在の未返済債務 | 2,078,986 | | $ | 6.25 | |
ブラック · ショールズ · オプション価格モデルにおいて、ストック · オプション付与の公正価値を決定するために使用された加重平均仮定。 2023年12月31日具体的には以下のとおりである
| | | | | |
| 普通株式の公正価値 | $ | 9.18 | |
| 無リスク金利 | 3.5% |
| 予想変動率 | 111.0% |
| 予想期限(年単位) | 6.1 |
| 期待配当収益率 | 0.0% |
ストックオプションの発行済、付与、付与および行使予定 2023年12月31日具体的には以下のとおりである
| | | | | | | | | | | | | | | | | | | | | | | |
| 量
在庫品
オプション | | 重みをつける
平均値
残り
契約書
寿命(年) | | 重み付けの-
平均値
トレーニングをする
値段 | | 合計する
骨材
固有の
(In)値
数千人) |
| 2022年12月31日現在の未返済債務 | 185,231 | | 6.98 | | $ | 1.37 | | | $ | 980 | |
| 2023年12月31日現在の未返済債務 | 2,078,986 | | 8.86 | | $ | 6.25 | | | $ | 317 | |
| 帰属しており、2023年12月31日に帰属する予定です | 2,078,986 | | 8.86 | | $ | 6.25 | | | $ | 317 | |
| 2023 年 12 月 31 日現在行使可能 | 302,760 | | 7.46 | | $ | 3.79 | | | $ | 317 | |
本質価値は、当該測定日における 1 株当たり適正価額を下回る行使価格を有するオプションについて、原生となるオプションの行使価格と普通株式の推定適正価額の差額として算出されます。当期に行使されたストックオプションの本質的価値の合計 2023年12月31日かつては…$0.1百万.期末に付与されたストックオプションの適正価額 2023年12月31日かつては…$1.2百万.
自分から2023年12月31日付与された未払いストックオプションに関連する未認識株式報酬の総額は $14.1百万当社は、残りの加重平均期間にわたって認識する予定です。 3.0年.年.
2019 年度の連結業績計算書および連結損失に計上された株式報酬費用は、以下の通り ( 単位 : 千円 ) です。
| | | | | | | | | | | |
| 締切り年数
十二月三十一日 |
| 2023 | | 2022 |
| 研究開発 | $ | 898 | | | $ | 45 | |
| 一般と行政 | 3,237 | | | 24 | |
| 株式に基づく報酬総支出 | $ | 4,135 | | | $ | 69 | |
11.財産と設備、純額
財産と設備の純額には、以下の項目が含まれる(千計)
| | | | | | | | | | | | | | | | | |
| 使用寿命 | | 十二月三十一日
2023 | | 十二月三十一日
2022 |
| 土地 | — | | $ | 5,025 | | | $ | 5,025 | |
| 建物.建物 | 40年.年 | | 8,325 | | | 8,325 | |
| 家具と固定装置 | 7年.年 | | 749 | | | 677 | |
| 実験室装置 | 5年.年 | | 4,004 | | | 4,003 | |
| 賃借権改善 | 推定耐用年数未満または
関連リース期間 | | 52 | | | 52 | |
| 事務設備 | 5年.年 | | 17 | | | 17 | |
| 車両 | 5年.年 | | 112 | | | 112 | |
| | | 18,284 | | | 18,211 | |
| 減算:減価償却累計 | | | (3,825) | | | (2,690) | |
| | | $ | 14,459 | | | $ | 15,521 | |
資産設備に関する減価償却費は $1.1百万そして$1.2百万ここ数年で2023年12月31日そして2022それぞれ,である違います。財産設備の処分による損益は、終了した年ごとに計上されています。 2023年12月31日そして2022.
12.その他貸借対照表情報
前払い料金および他の流動資産には、以下のものが含まれている(千計)
| | | | | | | | | | | |
| 十二月三十一日
2023 | | 十二月三十一日
2022 |
| 前払い費用 | $ | 1,565 | | | $ | 133 | |
| その他売掛金 | 26 | | | 67 | |
| 回転信用発行手数料ライン | 47 | | | — | |
| 他にも | 16 | | | 4 | |
| 前払い費用と他の流動資産 | $ | 1,654 | | | $ | 204 | |
買掛金および未払い費用は以下のとおりです ( 千単位 ) 。
| | | | | | | | | | | |
| 十二月三十一日
2023 | | 十二月三十一日
2022 |
| 売掛金 | $ | 11,040 | | | $ | 975 | |
| 負債を計算すべきである | 1,360 | | | 1,359 | |
| 従業員補償 | 911 | | | 291 | |
| 他にも | 84 | | | 27 | |
| 売掛金と売掛金 | $ | 13,395 | | | $ | 2,652 | |
13.協力協定
2020 年 9 月 17 日、当社は Affimed GmbH ( 「 Affimed GmbH 」 ) と戦略的提携を締結しました。確認済みAFM24 は Affimed が開発した表皮成長因子受容体の NK 細胞殺害を指示するように設計された四価生物学的薬剤である。EGFR.EGFR」と腫瘍を表現する。協業契約に基づき、当社と Affimed は複合製品の開発コストを均等に分担します。Affimed との戦略的コラボレーションに関連する研究は、 2023 年 6 月に合意により中止されました。
研究開発費の削減額 ( 期末 ) 2023年12月31日そして2022はい$0.2百万そして$0.4百万それぞれ,である.
14.引受金とその他の事項
賃貸借証書
はい2018年2月当社は、アーバイン州パスツール 10 番地にあるオフィススペースについて、賃借期間約 1 年間のオペレーティングリース契約を締結しました。 5年. 2018 年 2 月に家賃支払いを開始。契約は 2023 年 2 月 5 日に終了した。入り 2021年10月当社は、以下のオフィススペースの運営リース契約を締結しました。 19700フェアチャイルドのリース期間は約 2年.1 人の任期を延長するオプションがあります 二つ-年だ当時は合理的に行使が保証されていなかったためリース期間には含まれていなかった家賃支払開始 2021年12月.リースの満了は 2023年12月31日.
当社は、 2023 年 11 月 9 日、カリフォルニア州アーバインにあるオフィススペースについて、約 3 年間のリース期間で新たなオペレーティングリース契約を締結しました。 3年家賃支払いは 2024年1月1日 (“オフィスリース”).リース開始日は 2024 年 1 月 1 日です。
新オフィスリースにおける将来の最低賃貸料支払額は以下の通りです ( 千単位 ) 。
| | | | | |
| 最低賃貸
支払い |
| 2024 | $ | 235 | |
| 2025 | 242 | |
| 2026 | 249 | |
| オペレーティングリース負債総額 | $ | 726 | |
許可協定
当社は、 NKMAX と 2021 年 10 月、 2023 年 4 月、 2023 年 8 月に改正された独占ライセンス契約 ( 以下、「会社間ライセンス」 ) を締結し、当社は特定の知的財産を取得しています。当社は、各ライセンス契約に基づき、知的財産の独占的ライセンスの対価として、前払い料金を支払いました。 $1.0百万( 「ライセンス技術」 ) 。
ライセンスがあるように 違います。当社は、当期連結業績計算書において、前払い料金を研究開発費として計上しました。 2020年12月31日.さらに、当社は、以下の法域 ( および金額 ) におけるライセンス技術について、当社またはその関連会社による規制当局の承認の最初の受領に対して、 1 回限りのマイルストーン支払いを支払う必要があります。$5.0百万( EU ) ( EU ) ( EU ) ($4.0百万)、そして、四つ他の国 ($1.0百万それぞれの ) 。当社は、当社、その関連会社またはそのサブライセンシーによるライセンス技術の純販売に対して、慣習的な減額を条件として、 1 桁の中程度のロイヤルティを支払う義務があります。当社はまた、サブライセンス収益の低い 2 桁の割合から中程度の 1 桁の割合までの割合を支払う必要があります。As of 2023年12月31日会社が所有しています注釈マイルストーンペイメントを支払い 違います。ライセンス技術の販売が行われた。
訴訟を起こす
当社は、通常の業務の過程で生じる法的手続およびクレームの対象となります。
当社は、財務状態、業績またはキャッシュフローに重大な悪影響を及ぼす可能性のある、現在係争中の法的問題または請求の対象ではありません。
通常の業務において、当社は、様々な表明や保証を含み、一般的な補償を規定する契約や契約を締結しています。これらの契約に基づく当社のエクスポージャーは、将来的に当社に対して行われる可能性があるが、まだ行われていないクレームを含むため、不明です。当社は、将来的に支出が生じる可能性があり、かつ、合理的に見積もることができる場合には、これらの事項に対する負債が発生します。 違います。累計金額は 2023年12月31日そして2022年12月31日.
15.所得税
当社は、米国およびさまざまな州の管轄区域で課税されます。当社は、外国で課税されません。 年度までの所得税支給2023年12月31日そして2022具体的には以下のとおりである(千単位)
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| 現在: | | | |
| 連邦制 | $ | — | | | $ | — | |
| 状態.状態 | — | | | — | |
| 延期: | | | |
| 連邦制 | 7 | | | 7 | |
| 状態.状態 | — | | | — | |
| 所得税支給 | $ | 7 | | | $ | 7 | |
連邦法定所得税率で計算された所得税と報告された所得税引当金の調整は以下のとおりです ( 千単位 ) 。
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
法定連邦税率による税制優遇措置 | $ | (17,419) | | | $ | (5,618) | |
州税、連邦税制優遇措置を除く。 | (1,946) | | | (1,694) | |
| 利子支出 | 47 | | | 477 | |
評価免税額を引き上げる | 9,189 | | | 7,908 | |
| 永久品 | 12 | | | 37 | |
| 株の報酬 | 359 | | | (4) | |
| 未実現損失 FV 紙幣 | 219 | | | — | |
| 一般事業税額控除 | (1,278) | | | (1,098) | |
| 先物買取契約の発行損失 | 5,140 | | | — | |
| 募集債権の修正損失 | 93 | | | — | |
| デリバティブ評価の損失 | 4,890 | | | — | |
他にも | 701 | | | (1) | |
| 所得税支給 | $ | 7 | | | $ | 7 | |
重要な構成要素 会社の繰延所得税は以下の通りです。 千人):
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| 繰延税金資産: | | | |
純営業損失 | $ | 22,843 | | | $ | 17,890 | |
税額控除キャリーフォワード、ネット | 4,523 | | | 3,285 | |
費用を計算する | 395 | | | 347 | |
第 174 条 R & E の資本化 | 4,939 | | | 2,847 | |
| 無形資産 | 707 | | | — | |
リース責任 | — | | | 106 | |
株に基づく報酬 | 699 | | | 20 | |
繰延税金資産総額 | 34,106 | | | 24,495 | |
| 繰延税金負債: | | | |
経営的リース使用権資産 | — | | | (101) | |
財産と設備 | (406) | | | (595) | |
繰延税金負債総額 | (406) | | | (696) | |
| 繰延税項目純資産 | 33,700 | | | 23,799 | |
減算:推定免税額 | (33,733) | | | (23,825) | |
| 繰延税金純負債 | $ | (33) | | | $ | (26) | |
繰延税金資産の実現は、将来の収益に依存しており、その時期や金額は不確実です。収益履歴がないため、繰延税金資産は、将来の課税所得の源泉となる繰延税金負債の逆転を差し引いた評価引当金によって相殺されています。評価手当は約増加した $9.9百万そして$7.9百万ここ数年で2023年12月31日そして2022それぞれ,である.
当社は、連邦および州の所得税目的での純営業損失繰越を約 $76.3百万そして$96.7百万それぞれ,2023年12月31日. 2017 年税法及び雇用法に基づき、 $76.3百万2017 年 12 月 31 日以降に発生した連邦純営業損失は無期限に繰越されますカリフォルニア州の純営業損失繰越は、以前に利用されない限り 2037 年に失効します。
自分から2023年12月31日また、連邦政府およびカリフォルニア州の研究開発税額控除は約 $3.2百万そして$2.3百万それぞれ。連邦の研究開発クレジットのキャリーフォワードは 2038 年に失効し始めます。カリフォルニア州の研究開発クレジットのキャリーフォワードは無期限に利用できます。
連邦およびカリフォルニア州の税法は、内国歳入法第 382 条および第 383 条で定義されているように、会社の所有者が変更された場合の純営業損失繰越金の利用に重大な制限を課しています。当社は、所有権の変更による税務属性の制限を決定するための正式な調査を完了しておらず、所有権の変更による営業損失繰越、信用繰越その他の税務属性の利用に制限がある可能性があります。
法人代替最低税 (CAMT) を組み込んだ 2022 年インフレ削減法 (IRA) は、 2022 年 8 月 16 日に署名されました。変更は、以降に始まる課税年度に有効になります。 2022年12月31日.新しい税法では、企業は連邦所得税の目的のために 2 つの別々の計算を計算し、新しい最低税または通常の納税義務の大きい方を支払う必要があります。IRA は、当社に重大な影響を及ぼすとは考えられません。
不確定税収割引
違います。不確定税務状況に関する負債は財務諸表に記録される以下の表は、当期における未認識の税金優遇措置に関する活動の概要です。 十二月三十一日(単位:千):
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| 期初残高 | $ | 403 | | $ | 269 |
| 本年度の税務ポジションの追加 | 129 | | 131 |
| 前年度比の税務ポジションの減額 | 19 | | 3 |
| 期末残高 | $ | 551 | | $ | 403 |
不確実な税制優遇措置の逆転は、当社が繰延税金資産に対する評価引当金を維持し続ける限り、実効税率には影響しません。当社は、未認識の税制優遇措置について、今後も大きな変更は見込まれません。 12か月.
所得税申告は、米国とカリフォルニア州で提出されます。当社は現在、内国歳入庁およびカリフォルニア州による監査を受けていません。2019 年以降は、連邦所得税の目的のために、 2018 年以降は、当社が対象となるカリフォルニア州所得税のために、引き続き審査対象となります。純営業損失の繰越により、当社が納税申告を行う国内課税管轄区域による所得税審査は事実上全年継続しています。
当社の慣行は、所得税に関する利息および罰則を所得税費用に計上することです。終了した年々 2023年12月31日そして2022その会社は所有している注釈所得税に関連する利息または罰則は、当社の連結営業計算書および包括損失に計上されました。
16.後続事件
フォワード購入契約の修正
開ける2024 年 1 月 2 日当社は、 FPA 投資家との前払い契約を修正し、前払い不足額を増加させました。 $0.5百万引き換えに $0.5百万会社への支払いですその他の利用規約は変更なし。
開ける2024年1月11日当社は、 FPA 投資家との前払い契約を修正し、前払い不足額を増加させました。 $0.5百万引き換えに $0.5百万会社への支払いですその他の利用規約は変更なし。
開ける2024年1月19日当社は、 FPA 投資家との前払い契約を修正し、前払い不足額を増加させました。 $0.3100万人以上20%現行の前払い不足残高の引き換えに $0.3百万会社への支払い。本契約はまた、リセット価格を修正し、リセット価格 ( i ) は、毎週の後続 VWAP に基づいてローリングベースで調整されるようにします。 $10.441 株当たり ( 「当初価格」 ) 、および ( ii ) 一般的な割引。 10%FPA 投資家に利益をもたらす VWAP 測定に。 その他の利用規約は変更なし。
開ける2024年2月21日当社は、 FPA 投資家との前払い契約を修正し、前払い不足額を増加させました。 $0.2万万ボーナスシェアを増やして 200,000引き換えに $0.2百万会社への支払いですその他の利用規約は変更なし。
PIPE Warrants 修正
開ける2024年2月9日なお、当社は、 ( i ) 当社が保有するすべての引受権が、当社が当社が保有する引受権契約の株式転換規定を即座に加速する資格を有するものとし、当社が当社が引受権者との引受権契約を改正しました。 $0.3100 万ドル ( ii ) 2 度目の現金支払い最大0.3追跡に基づいて 100 万人 5株式の有効登録後の VWAP 日、 (iii) 引受権が未払いのままである限り、令状再編に関して、令状投資家に「最恵国」の地位を付与すること、および (iv) 特定の登録権を令状投資家に付与すること。その他の利用規約は変更なし。
転換可能な過橋ローン
開ける2024年2月7日当社は関係者ブリッジローン契約を締結しました。 $0.4百万1つを使う20%満期時のプレミアムです関連当事者ブリッジローンの満期は、 ( i ) のいずれか早いもの 60日数発行または ( ii ) 第三者との資金調達イベントにおいて $5.0百万. 2024 年 4 月には、ブリッジローンの満期を ( i ) のいずれか早いものに変更しました。 90( ii ) 第三者との資金調達イベントが発行から数日後 $5.0100 万ドルまたはデフォルトの発生ですこのブリッジローン契約の相手方には、 400,000株式購入承認証400,000会社の普通株式は、それぞれストライク価格で $2.00一株ずつです。
2024 年 2 月 20 日、当社は $のブリッジローン契約を締結しました。0.1100万ドルを持っています20満期時に支払われる% プレミアム。 ブリッジローンの満期は、 ( i ) のいずれか早いもの。 60日数発行または ( ii ) 第三者との資金調達イベントにおいて $10.0百万それは.このブリッジローン契約の取引相手も受け取りました100,000株式購入承認証100,000その会社の普通株の価格は$2.001株当たりの執行価格。
開ける2024年2月27日当社はブリッジローン契約を締結しました。 $0.1百万1つを使う20%満期時のプレミアムですブリッジローンの満期は、 ( i ) のいずれか早いもの。 60日数発行または ( ii ) 第三者との資金調達イベントにおいて $5.0百万.このブリッジローン契約の相手方には、 3,667普通株式の株式だけでなく 375,000株式購入承認証375,000その会社の普通株の価格は$1.501株当たりの執行価格。
開ける2024年3月7日当社はブリッジローン契約を締結しました。 $0.1百万1つを使う20%満期時のプレミアムですブリッジローンの満期は、 ( i ) のいずれか早いもの。 60日数発行または ( ii ) 第三者との資金調達イベントにおいて $5.0百万.このブリッジローン契約の相手方には、 3,667普通株式の株式だけでなく 375,000株式購入承認証375,000会社の普通株式をストライク価格で発行する。
橋を渡りローンを組む
開ける2024年3月7日当社は参入した。 二つブリッジローン契約の $0.1百万成長したそれぞれが 2024年3月22日1つを使う7.5%満期時に支払われるプレミアム両橋渡しローンは 2024 年 4 月 10 日に全額返済された。
転換可能なチケット
開ける2024年3月21日当社は一つの項目を注文しました12%約束手形協定 $0.3100万ドルを持っています1年用語.用語そして、10%割引です貸し手は、発行日から満期日まで、残高および未払いの元本および利息の一部または全部を当社普通株式に転換するオプションを保持していました。約束手形はその後全額支払われた。 2024年4月8日.本契約に伴い、当社は、貸し手に対し、以下の金額までの取得権を与える貸し手令状を発行しました。 330,000普通株、初期行権価格は$2.001株につき,調整することができる
開ける2024年3月26日当社は一つの項目を注文しました12%FPA投資家でもある貸手との本票契約$0.3100万ドルを持っています1年用語.用語そして、10%割引です貸し手は、発行日から満期日まで、残高および未払いの元本および利息の一部または全部を当社普通株式に転換するオプションを保持します。本契約に伴い、当社は、貸し手に対し、以下の金額までの取得権を有する貸し手証券を発行しました。 330,000普通株、初期行権価格は$2.001株につき,調整することができる
開ける2024年4月1日当社は一つの項目を注文しました12%約束手形協定 $0.2100万ドルを持っています1年用語.用語そして、10%割引です貸し手は、発行日から満期日まで、残高および未払いの元本および利息の一部または全部を当社普通株式に転換するオプションを保持します。本契約に伴い、当社は、貸し手に対し、以下の金額までの取得権を有する貸し手証券を発行しました。 220,000普通株、初期行権価格は$2.001株につき,調整することができる
開ける2024年4月1日当社は一つの項目を注文しました12%FPA投資家でもある貸手との本票契約$0.3100万ドルを持っています1年用語.用語そして、10%割引です貸し手は、発行日から満期日まで、残高および未払いの元本および利息の一部または全部を当社普通株式に転換するオプションを保持します。本契約に伴い、当社は、貸し手に対し、以下の金額までの取得権を有する貸し手証券を発行しました。 330,000普通株、初期行権価格は$2.001株につき,調整することができる.
転換保証本券
2024 年 4 月 5 日、当社は $の転換担保証券契約を締結しました。5.0100 万ドル 1 か月保証付きオーバーナイトファイナンスレートプラス金利で 2.85支払いは、 2026 年 10 月 4 日に満期となる発行から 1 ヶ月で開始され、月額で現金で支払われる。転換社債は、 二つトランシェは最初のものは $でした1.02024 年 4 月 8 日に閉鎖され、 2 番目のトランシェは $4.02024 年 4 月 9 日に閉鎖された 100 万人。転換担保付き約束手形は、カリフォルニア州サンタアナにある当社所有の不動産に対する第二の留置権によって担保されています。転換担保付き約束手形は、 $に従属します。5.0100 万ドルの回転信用枠です未払いの元本額は、貸し手のオプションにより満期までいつでも普通株式に転換可能です。2.00換算価格 ( 株式分割等の慣習的な希薄化防止調整の対象となります ) 。この契約と同時に、貸し手は受け取る権利があります 833,333最初のクローズ時に普通株式と以下の株式を $2.5百万割る5日間2回目の成約時のVWAP測定および貸手が最も多く獲得する権利を持たせる1,000,000普通株、初期行権価格は$2.001株につき,調整することができる.
株式オプション付与
2024年2月12日取締役会が許可3,233,028株式オプション。
FPA 株式の売却について
これらの財務諸表の発表日までに合計1,768,121FPAの株が売られています1,000,000FPA株は初発行後も発行されておらず,最高で追加的に増加することができる1,167,990FPA株は私募配給契約に基づいて発行することができる。
項目9.会計·財務開示面の変更と会計士との相違
ない。
第9条。制御とプログラムです
情報開示制御と手続きの評価。
我々は、取引法に基づいて提出または提出された報告書で開示を要求する情報を確保するために、1934年の証券取引法(改正)または“取引法”の下で規則13 a-15(E)および15 d-15(E)で定義された“開示制御および手順”を維持し、(1)米国証券取引委員会規則および表に指定された期間内に記録、処理、まとめ、報告すること、(2)必要な開示に関する決定をタイムリーに行うために、我々の経営陣に蓄積して伝達することを目的としている。経営陣は、どのような制御やプログラムが、どんなに設計や操作が良くても、その目標を実現するために合理的な保証を提供するしかないことを認識しており、管理部門は、可能な制御とプログラムのコスト-利益関係を評価する際にその判断を運用しなければならない
我々の経営陣は、最高経営責任者と財務責任者の参加の下、2023年12月31日までの開示統制と手続きの有効性を評価した。評価によると、我々の最高経営責任者およびCEOは、その日までに、私たちの開示制御および手続きが有効であり、合理的な保証レベルで動作すると結論した
財務報告書の内部統制の変化。
本10-K表年次報告がカバーされている間、取引所法案規則13 a-15(D)および15 d-15(D)によって要求される評価に関連して、財務報告の内部統制には何の変化もなく、これは私たちの財務報告の内部統制に大きな影響を与え、あるいは合理的な可能性が私たちの財務報告の内部統制に大きな影響を与える
財務報告の内部統制に関する経営陣の報告
私たちの経営陣は財務報告書の十分な内部統制を確立して維持する責任がある。“取引法”第13 a-15(F)及び15 d-15(F)条によると、財務報告の内部統制は、会社の主要幹部及び主要財務官が設計又はその監督の下で、米国公認会計基準に基づいて財務報告の信頼性及び外部目的の財務諸表を作成するために合理的な保証を提供するために、会社の取締役会、管理層及びその他の人員によって実施されるプログラムとして定義される。
本年度報告Form 10−Kで開示されているように,我々は2023年9月29日に業務統合を完了した。NKGenは業務合併前に特別目的の買収会社であった。したがって、上場企業の財務報告後の合併内部統制の設計はすでに行われており、私たちの経営陣や他の人員が多くの時間と資源を投入する必要があるだろう。したがって、不合理な資源を配備しなければ、経営陣は2023年12月31日までの財務報告内部統制を評価することができない。したがって、当社には、経営陣が米国証券取引委員会“S-Kコンプライアンスと開示説明”215.02節の財務報告の内部統制に関する報告を含まない。
プロジェクト9 B。その他の情報
ない。
プロジェクト9 Cです。外国司法管轄権の開示防止検査について
適用されません。
第三部
プロジェクト10.取締役、上級管理者、および企業管理
本プロジェクトに要求される情報は、2024年株主総会の最終依頼書に記載されています依頼書)を含み、参照によって本明細書に組み込まれる。
プロジェクト11.役員報酬
プロジェクトに必要な情報は、参照によって本明細書に組み込まれる依頼書に記載されるであろう。
プロジェクト12.特定の実益所有者および経営陣および株主の保証所有権に関する事項
プロジェクトに必要な情報は、参照によって本明細書に組み込まれる依頼書に記載されるであろう。
第13項:特定の関係及び関連取引、並びに取締役独立性
プロジェクトに必要な情報は、参照によって本明細書に組み込まれる依頼書に記載されるであろう。
第 14 話に登場プリンシパル会計士の手数料とサービス
プロジェクトに必要な情報は、参照によって本明細書に組み込まれる依頼書に記載されるであろう。
第4部
第 15 話。展示物と財務諸表。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 引用で編入する |
| | | | |
| 証拠品番号: | | 説明する | | スケジュール/
表 | | 書類番号. | | 展示品 | | 提出日 |
| 2.1+ | | Graf Acquisition Corp. IV 、 Austria Merger Sub , Inc. による 2023 年 4 月 14 日付の合併契約及び合併計画NKGen Biotech , Inc. と | | 8-K | | 001-40427 | | 2.1 | | 2023年4月17日 |
| 3.1 | | NKGen Biotech , Inc. の改訂 · 改定の設立証 | | 8-K | | 001-40427 | | 3.1 | | 2023年10月5日 |
| 3.2 | | NKGen Biotech , Inc. の定款の改正および再定款 | | 8-K | | 001-40427 | | 3.2 | | 2023年10月5日 |
| 4.1 | | 2024 年 3 月 21 日付の FirstFire に対する普通株式買取証書発行。 | | 8-K | | 001-40427 | | 4.1 | | 2024年3月27日 |
| 4.2 | | 2024 年 3 月 26 日付でメテオラに発行された普通株式買取証書。 | | 8-K | | 001-40427 | | 4.2 | | 2024年3月27日 |
| 4.3 | | 2024 年 4 月 1 日付の AJB に対する普通株式買取証書発行。 | | 8-K | | 001-40427 | | 4.1 | | 2024年4月5日 |
| 4.3 | | 2024 年 4 月 1 日付でサンディアに対して発行された普通株式買取証書。 | | 8-K | | 001-40427 | | 4.2 | | 2024年4月5日 |
| 4.4 | | NKGen Biotech, Inc. が発行する普通株式買取令状について2024 年 4 月 5 日付の BDW Investments LLC に有利です。 | | 8-K | | 001-40427 | | 4.1 | | 2024年4月11日 |
| 10.1.1 | | Graf Acquisition Corp. IV 、 NKGen Biotech , Inc. との間で 2023 年 9 月 22 日付の先方購入契約および Meteora Capital Partners , LP およびその関連会社の一部。 | | 8-K | | 001-40427 | | 10.1 | | 2023年9月22日 |
| 10.1.2 | | Graf Acquisition Corp. IV と Meteora Capital Partners , LP およびその関連会社との間で、 2023 年 9 月 22 日付のサブスクリプション契約。 | | 8-K | | 001-40427 | | 10.2 | | 2023年9月22日 |
| 10.1.3 | | Graf Acquisition Corp. IV と Meteora Capital Partners , LP およびその一部の関連会社との間で、 2023 年 9 月 19 日付の書簡契約。 | | 8-K | | 001-40427 | | 10.1.3 | | 2023年10月5日 |
| 10.2 | | Graf Acquisition Corp. IV と Sandia Investment Management LP およびその関連会社との間で、 2023 年 9 月 26 日付のフォワード · バイア契約。 | | 8-K | | 001-40427 | | 10.3 | | 2023年9月29日 |
| 10.3.1 | | Graf Acquisition Corp. IV と Polar Multi—Strategy Master Fund による 2023 年 9 月 29 日付のフォワード · バイア契約。 | | 8-K | | 001-40427 | | 10.4 | | 2023年9月29日 |
| 10.3.2 | | FPA資金金額引受協定は,2023年9月29日にGraf Acquisition Corp.IVとPolar多戦略総基金が署名した。 | | 8-K | | 001-40427 | | 10.5 | | 2023年9月29日 |
| 10.4.1 | | 株式承認証引受協定は,期日は2023年9月19日であり,Graf Acquisition Corp.IVと気象会社実体が署名した。 | | 8-K | | 001-40427 | | 10.1 | | 2023年9月19日 |
| 10.4.2 | | 改訂と再署名された引受権証引受協定は,2023年9月26日にGraf Acquisition Corp.IVと気象実体との間で署名された。 | | 8-K | | 001-40427 | | 10.2 | | 2023年9月29日 |
| 10.4.3 | | 追加株式証明書引受契約フォーマット | | 8-K | | 001-40427 | | 10.1 | | 2023年9月29日 |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 10.5 | | Graf Acquisition Corp.IVとNKMAX Co.,Ltd.が署名した証券購入協定は,2023年9月15日であった。 | | 8-K | | 001-40427 | | 10.1 | | 2023年9月18日 |
| 10.6# | | 改訂と再署名された登録権協定は,2023年9月29日,NKGen Biotech,Inc.,Graf Acquisition Partners IV LLCのメンバーおよびNKGen Operating Biotech,Inc.のある前株主間の合意である。 | | 8-K | | 001-40427 | | 10.6 | | 2023年10月5日 |
| 10.7.1 | | 保全者支援とロックプロトコルは,2023年4月14日に,Graf Acquisition Corp.IV,NKGen Biotech,Inc.,Graf Acquisition Partners IV LLCと当事者とされるGraf Acquisition Corp.IVのある高度管理者と取締役によって署名された。 | | 8-K | | 001-40427 | | 10.1 | | 2023年4月17日 |
| 10.7.2 | | 初めて改訂·再署名された保証人支援·ロック協定は,2023年9月21日に,Graf Acquisition Corp.IV,NKGen Biotech,Inc.,Graf Acquisition Partners IV LLCと,当事者に指定されたGraf Acquisition Corp.IVのある上級管理者と取締役が署名した。 | | 8-K | | 001-40427 | | 10.1 | | 2023年9月22日 |
| 10.7.3 | | 3回目の改訂と再署名は,2023年9月29日の保全者支援とロック協定に署名し,Graf Acquisition Corp.IV,NKGen Biotech,Inc.,Graf Acquisition Partners IV LLCと合意当事者とされたGraf Acquisition Corp.IVのある上級管理者と役員が署名した。 | | 8-K | | 001-40427 | | 10.7.3 | | 2023年10月5日 |
| 10.7.4 | | 2回目の改訂と再署名された保証人支援·ロック協定は,2023年9月28日に,Graf Acquisition Corp.IV,NKGen Biotech,Inc.,Graf Acquisition Partners IV LLCと,各当事者に指定されたGraf Acquisition Corp.IVのある上級管理者と取締役が署名した。 | | 8-K | | 001-40427 | | 10.7.4 | | 2023年10月5日 |
| 10.8 | | グラフ · アクイジション · コーポレーション IV と NKGen Biotech , Inc. の株主との間で、 2023 年 4 月 14 日付の NKGen 支援契約。当事者としての名前です | | S-4 | | 001-40427 | | 10.4 | | 2023年5月15日 |
| 10.9 | | NKGen Biotech , Inc. の特定の株主によるロックアップ契約の様式Graf Acquisition Corp. IV 。 | | S-4 | | 001-40427 | | 10.6 | | 2023年5月15日 |
| 10.10# | | NKGen Biotech , Inc. 発行の約束手形リサ · J · リング、 2023 年 9 月 5 日付。 | | 8-K | | 001-40427 | | 10.10 | | 2023年10月5日 |
| 10.11.1* | | NKGen と NKMAX による 2023 年 4 月 10 日付のライセンス契約の修正および再確認。 | | S-4/A | | 333-271929 | | 10.15.1 | | 2023年8月4日 |
| 10.11.2* | | NKGen と NKMAX による 2023 年 8 月 1 日付の修正および再定用ライセンス契約の修正。 | | S-4/A | | 333-271929 | | 10.15.2 | | 2023年8月4日 |
| 10.12.1* | | 株式会社 NKGen バイオテクノロジー2019 年度株式インセンティブプラン。 | | S-4/A | | 333-271929 | | 10.13 | | 2023年6月26日 |
| 10.12.2* | | NKGen Biotech , Inc. の新株予約権契約の形式2019 年度株式インセンティブプラン。 | | S-4/A | | 333-271929 | | 10.14.1 | | 2023年6月26日 |
| 10.12.3* | | NKGen Biotech , Inc. における新株予約権付与通知の様式2019 年度株式インセンティブプラン。 | | S-4/A | | 333-271929 | | 10.14.2 | | 2023年6月26日 |
| 10.13.1#+ | | NKGen Biotech , Inc. との間で、 2023 年 6 月 20 日付の事業貸付契約 ( 改正及び補足 )ヨルダン川西岸地区です | | S-4/A | | 333-271929 | | 10.16 | | 2023年8月4日 |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 10.13.2# | | NKGen Biotech , Inc. による 2023 年 9 月 19 日付の事業貸付契約の改正ヨルダン川西岸地区です | | 8-K | | 001-40427 | | 10.13.2 | | 2023年10月5日 |
| 10.14 | | NKGen と NKMAX の間で 2023 年 1 月 6 日付の融資契約。 | | S-4/A | | 333-271929 | | 10.17.1 | | 2023年8月4日 |
| 10.15 | | NKGen と NKMAX の間で 2023 年 1 月 18 日付の融資契約。 | | S-4/A | | 333-271929 | | 10.17.2 | | 2023年8月4日 |
| 10.16 | | NKGen と NKMAX の間で 2023 年 2 月 3 日付の融資契約。 | | S-4/A | | 333-271929 | | 10.17.3 | | 2023年8月4日 |
| 10.17 | | NKGen と NKMAX の間で 2023 年 2 月 28 日付の融資契約。 | | S-4/A | | 333-271929 | | 10.17.4 | | 2023年8月4日 |
| 10.18 | | NKGen と NKMAX による 2023 年 3 月 20 日付の貸付契約。 | | S-4/A | | 333-271929 | | 10.17.5 | | 2023年8月4日 |
| 10.19.1* | | Sangwoo Park と NKGen による 2020 年 1 月 1 日付のオファーレター。 | | S-4/A | | 333-271929 | | 10.19.1 | | 2023年8月4日 |
| 10.19.2* | | Sangwoo Park と NKGen Biotech , Inc. による 2022 年 12 月 28 日付の修正および再記載のオファーレター。 | | S-4/A | | 333-271929 | | 10.19.2 | | 2023年8月4日 |
| 10.20*# | | 2022 年 12 月 26 日付の Paul Y によるオファーレター。ソングと NKGen Biotech , Inc. | | S-4/A | | 333-271929 | | 10.18 | | 2023年8月4日 |
| 10.21*# | | Yong Man Kim と NKMAX Co. Ltd. による 2019 年 12 月 15 日付のオファーレター | | S-4/A | | 333-271929 | | 10.21 | | 2023年8月4日 |
| 10.22*# | | 2021 年 10 月 15 日付のピエール · ガニオンと NKGen Biotech , Inc. によるオファーレター | | S-4/A | | 333-271929 | | 10.20 | | 2023年8月4日 |
| 10.23*# | | 2023 年 9 月 29 日付のオファーレター、ジェームズ A による。グラフと NKGen Biotech , Inc. | | 8-K | | 001-40427 | | 10.23 | | 2023年10月5日 |
| 10.24.1* | | 株式会社 NKGen バイオテクノロジー2023 年株式インセンティブプラン。 | | 8-K | | 001-40427 | | 10.24.1 | | 2023年10月5日 |
| 10.24.2* | | 2023 年エクイティ · インセンティブ · プランに基づくストック · オプション付与通知書及びストック · オプション契約書。 | | 8-K | | 001-40427 | | 10.24.2 | | 2023年10月5日 |
| 10.24.3* | | 2023 年株式インセンティブ計画に基づく制限付き株式付与通知書及び制限付き株式契約書。 | | 8-K | | 001-40427 | | 10.24.3 | | 2023年10月5日 |
| 10.25* | | 株式会社 NKGen バイオテクノロジー2023 年従業員株式買入れ計画。 | | 8-K | | 001-40427 | | 10.25 | | 2023年10月5日 |
| 10.26* | | NKGen Biotech , Inc. との間の補償契約の様式取締役や執行役員です | | 8-K | | 001-40427 | | 10.26 | | 2023年10月5日 |
| 10.27 | | NKGen と Meteora Capital Partners , LP およびその一部の関連会社との間の 2023 年 12 月 26 日付のフォワード購入契約の修正。 | | 8-K | | 001-40427 | | 10.1 | | 2023年12月27日 |
| 10.28 | | NKGen と Meteora Capital Partners , LP およびその一部の関連会社との間の 2024 年 1 月 2 日付のフォワード購入契約の第 2 次修正。 | | 8-K | | 001-40427 | | 10.1 | | 2024年1月8日 |
| 10.29 | | NKGen と Meteora Capital Partners , LP およびその一部の関連会社との間の 2024 年 1 月 11 日付のフォワード購入契約の第 3 次修正。 | | 8-K | | 001-40427 | | 10.1 | | 2024年1月11日 |
| 10.30 | | NKGen とサンディア · インベストメント · マネジメント LP との間で、 2024 年 1 月 19 日付の先方買取契約の修正。 | | 8-K | | 001-40427 | | 10.1 | | 2024年1月22日 |
| 10.31 | | 当社とメテオラとの間で 2024 年 2 月 9 日に締結されたタームシート。 | | 8-K | | 001-40427 | | 10.1 | | 2024年2月12日 |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 10.32 | | NKGen と Meteora Capital Partners , LP およびその一部の関連会社との間の 2024 年 2 月 21 日付のフォワード購入契約の第 4 次修正。 | | 8-K | | 001-40427 | | 10.1 | | 2024年2月22日 |
| 10.33 | | 2024 年 3 月 21 日付ファーストファイアに発行された約束手形。 | | 8-K | | 001-40427 | | 10.1 | | 2024年3月27日 |
10.34+ | | 2024 年 3 月 21 日付の FirstFire と当社との間で締結された有価証券購入契約。 | | 8-K | | 001-40427 | | 10.2 | | 2024年3月27日 |
| 10.35 | | 2024 年 3 月 26 日付のメテオラに発行された約束手形。 | | 8-K | | 001-40427 | | 10.3 | | 2024年3月27日 |
10.36+ | | 2024 年 3 月 26 日付のメテオラと当社との間の有価証券購入契約。 | | 8-K | | 001-40427 | | 10.4 | | 2024年3月27日 |
| 10.37 | | 2024 年 4 月 1 日付 AJB に対して発行された約束手形。 | | 8-K | | 001-40427 | | 10.1 | | 2024年4月5日 |
10.38+ | | AJB と当社との間で締結された 2024 年 4 月 1 日付の有価証券購入契約書。 | | 8-K | | 001-40427 | | 10.2 | | 2024年4月5日 |
| 10.39 | | 2024 年 4 月 1 日付のサンディアに発行された約束手形。 | | 8-K | | 001-40427 | | 10.3 | | 2024年4月5日 |
10.40+ | | サンディアと当社との間で締結された 2024 年 4 月付の有価証券購入契約。 | | 8-K | | 001-40427 | | 10.4 | | 2024年4月5日 |
| 10.41 | | NKGen Biotech , Inc. による株式及び事業貸付契約 ( 2024 年 4 月 5 日付 )NKGen オペレーティングバイオテクノロジー株式会社BDW Investments LLC 。 | | 8-K | | 001-40427 | | 10.1 | | 2024年4月11日 |
10.42+ | | NKGen Biotech , Inc. が発行する担保付き転換社債NKGen Operating Biotech , Inc. 2024 年 4 月 5 日付の BDW Investments LLC に有利です。 | | 8-K | | 001-40427 | | 10.2 | | 2024年4月11日 |
| 10.43 | | NKGen Biotech , Inc. による登録権契約 ( 2024 年 4 月 5 日付 )BDW Investments LLC について | | 8-K | | 001-40427 | | 10.3 | | 2024年4月11日 |
| 10.44 | | NKGen Operating Biotech , Inc. による 2024 年 4 月 5 日付の貸付契約の第 3 次修正。ヨルダン川西岸地区 | | 8-K | | 001-40427 | | 10.4 | | 2024年4月11日 |
14.1** | | 株式会社 NKGen バイオテクノロジー企業行動規範と倫理規範 | | | | | | | | |
19.1** | | 株式会社 NKGen バイオテクノロジーインサイダー取引ポリシー | | | | | | | | |
21.1** | | NKGen Biotech , Inc. の子会社一覧 | | | | | | | | |
24.1** | | 委任状 ( 本書の署名ページに記載 ) 。 | | | | | | | | |
31.1** | | 2002年サバンズ·オキシリー法第302条に基づく証券取引法第13 a−14(A)及び15(D)−14(A)条による主要行政官の認証 | | | | | | | | |
31.2** | | 2002年サバンズ·オキシリー法第302条に基づく証券取引法第13 a−14(A)及び15(D)−14(A)条による首席財務官の認証 | | | | | | | | |
32.1^ | | 2002年にサバンズ·オクスリ法案第906条で可決された“米国法典”第18編1350条による最高経営責任者と最高財務責任者の認証 | | | | | | | | |
| 101.INS | | 連結されたXBRLインスタンス文書−インスタンス文書は、そのXBRLタグがイントラネットXBRL文書に埋め込まれているので、相互作用データファイルには表示されない。 | | |
| 101.書院 | | インラインXBRL分類拡張アーキテクチャ文書. | | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 101.カール | | インラインXBRL分類拡張はリンクベース文書を計算する. | | |
| 101.def | | XBRLソート拡張を連結してLinkbase文書を定義する. | | |
| 101.介護会 | | XBRL分類拡張ラベルLinkbase文書を連結する. | | |
| 101.Pre | | インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント | | |
| 104 | | 表紙インタラクションデータファイル(イントラネットXBRL文書に埋め込まれている). | | |
| | | | | | | | | | |
+S-K法規第601(A)(5)項によれば、本プロトコルの付表および証拠物は省略されている。任意の漏れたスケジュールおよび/または展示品のコピーは、要求に応じて米国証券取引委員会に提供される
#この添付資料の一部は、規制 S—K 項目 601 ( b ) ( 10 ) ( iv ) に従って省略されています。なぜなら、それらは重要ではなく、登録者がプライベートまたは機密として扱う情報の種類であるからです。登録者は、要求に応じて、 SEC に添付書類の編集されていないコピー、またはそのセクションを補足的に提供することに同意します。
*契約または補償計画または手配を管理することを指す。
^本件は、証券取引法第 18 条の目的のために「提出された」ものとみなされず、証券法または証券取引法に基づくいかなる提出書類 ( フォーム 10—K のこの年次報告書の日付の前後に作成されたかどうかにかかわらず ) に参照によって組み込まれるとみなされない。
**関数のアーカイブ
項目16.表格10-Kの概要
ない。
サイン
取引法第13条又は15(D)条の規定によれば,登録者は,本報告が正式に許可された署名者によって代表されて署名されるように促す。
| | | | | | | | |
| 株式会社 NKGen バイオテクノロジー |
| | |
日時 : 2024 年 4 月 16 日 | 差出人: | ポール · Y 。ソング |
| | ポール Y 。曲 |
| | 最高経営責任者 (首席行政主任) |
授権依頼書
以下に署名されている各人は、ポール · ソングおよびジェームズ · グラフおよびそれらのそれぞれ、彼または彼女の真実かつ合法的な代理人および代理人を構成し、任命し、彼または彼女および彼または彼女の氏名、場所および代理人を、いかなる能力においても、この報告書のすべての修正に署名し、同じものを提出することを、これらの提示によりすべての人に知ること。証券取引委員会に対し、当該弁護士及び代理人に対し、当該敷地内及び敷地内において行うために必要かつ必要なすべての行為及び事を行うための完全な権限及び権限を付与すること。ここに、前述の代理人または代理人またはその代理人が合法的に行うことまたは行うことを承認し確認します。
本報告書は、改正された1934年の証券取引法の要求に基づき、以下の登録者によって登録者として指定日に署名された。
| | | | | | | | | | | | | | |
サイン | | タイトル | | 日取り |
| | | | |
/ s / ポール Y.曲 | | 取締役CEO兼最高経営責任者 | | 2024年4月16日 |
ポール Y 。曲 | | (首席行政官) | | |
| | | | |
/ s / ジェームズ · グラフ | | 臨時首席財務官 | | 2024年4月16日 |
ジェームズ · グラフ | | (首席財務会計官) | | |
| | | | |
/ s / サンウパーク | | | | |
サンウ公園 | | 役員.取締役 | | 2024年4月16日 |
| | | | |
/ s / マイケル · クローデン | | | | |
マイケル · クロウデン | | 役員.取締役 | | 2024年4月16日 |
| | | | |
/ s / Kathleen Scott | | | | |
キャサリーン · スコット | | 役員.取締役 | | 2024年4月16日 |
| | | | |
| | | | |