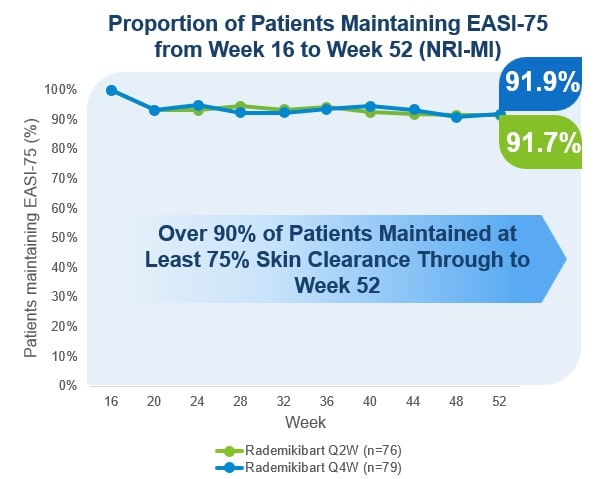
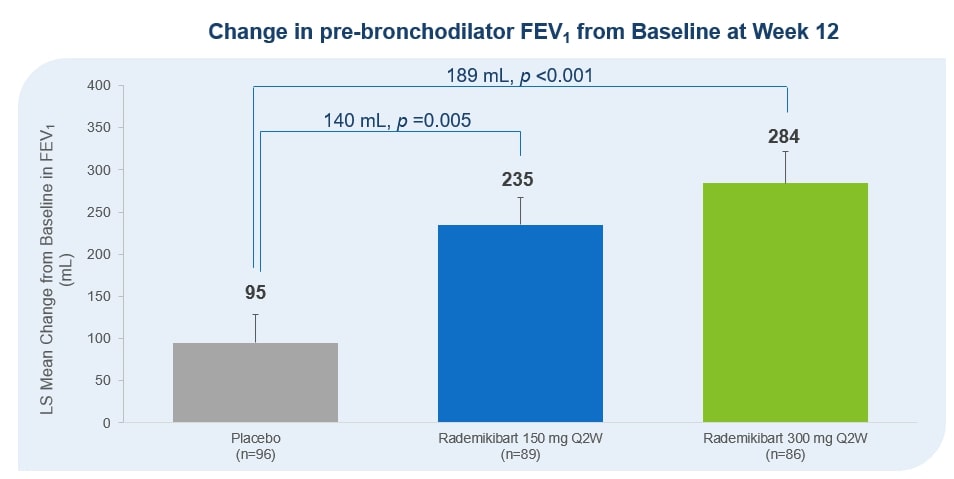
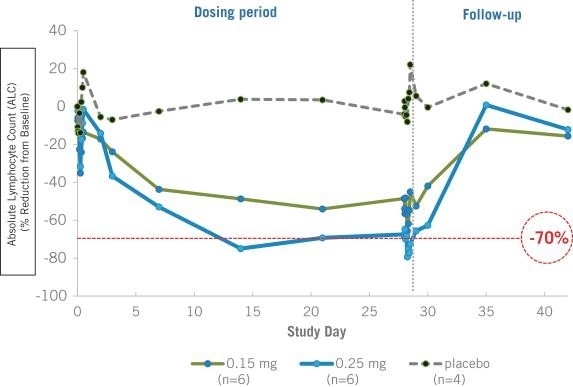
cntb — 202312310001835268会計年度誤り2023二つ00018352682023-01-012023-12-310001835268Dei:ビジネス連絡先のメンバー2023-01-012023-12-3100018352682023-12-31Xbrli:共有00018352682021-01-012021-12-31ISO 4217:ドル00018352682022-01-012022-12-31ISO 4217:ドルXbrli:共有00018352682021-12-3100018352682022-12-310001835268IFRS-Full:IssuedCapitalMembers2020-12-310001835268IFRS-Full:SharePremiumMembers2020-12-310001835268IFRS-Full:財務シェアメンバー2020-12-310001835268IFRS-FULL:共有ベースの予約支払いメンバー2020-12-310001835268IFRS-FULL:他の保留メンバー2020-12-310001835268IFRS-FULL:他の総合収入を累積メンバー2020-12-3100018352682020-12-310001835268IFRS-FULL:他の総合収入を累積メンバー2021-01-012021-12-310001835268IFRS-FULL:他の保留メンバー2021-01-012021-12-310001835268IFRS-Full:IssuedCapitalMembers2021-01-012021-12-310001835268IFRS-Full:SharePremiumMembers2021-01-012021-12-310001835268IFRS-Full:財務シェアメンバー2021-01-012021-12-310001835268IFRS-FULL:共有ベースの予約支払いメンバー2021-01-012021-12-310001835268IFRS-Full:IssuedCapitalMembers2021-12-310001835268IFRS-Full:SharePremiumMembers2021-12-310001835268IFRS-Full:財務シェアメンバー2021-12-310001835268IFRS-FULL:共有ベースの予約支払いメンバー2021-12-310001835268IFRS-FULL:他の保留メンバー2021-12-310001835268IFRS-FULL:他の総合収入を累積メンバー2021-12-310001835268IFRS-FULL:他の総合収入を累積メンバー2022-01-012022-12-310001835268IFRS-FULL:他の保留メンバー2022-01-012022-12-310001835268IFRS-Full:IssuedCapitalMembers2022-01-012022-12-310001835268IFRS-Full:SharePremiumMembers2022-01-012022-12-310001835268IFRS-Full:財務シェアメンバー2022-01-012022-12-310001835268IFRS-FULL:共有ベースの予約支払いメンバー2022-01-012022-12-310001835268IFRS-Full:IssuedCapitalMembers2022-12-310001835268IFRS-Full:SharePremiumMembers2022-12-310001835268IFRS-Full:財務シェアメンバー2022-12-310001835268IFRS-FULL:共有ベースの予約支払いメンバー2022-12-310001835268IFRS-FULL:他の保留メンバー2022-12-310001835268IFRS-FULL:他の総合収入を累積メンバー2022-12-310001835268IFRS-FULL:他の総合収入を累積メンバー2023-01-012023-12-310001835268IFRS-FULL:他の保留メンバー2023-01-012023-12-310001835268IFRS-Full:IssuedCapitalMembers2023-01-012023-12-310001835268IFRS-Full:SharePremiumMembers2023-01-012023-12-310001835268IFRS-Full:財務シェアメンバー2023-01-012023-12-310001835268IFRS-FULL:共有ベースの予約支払いメンバー2023-01-012023-12-310001835268IFRS-Full:IssuedCapitalMembers2023-12-310001835268IFRS-Full:SharePremiumMembers2023-12-310001835268IFRS-Full:財務シェアメンバー2023-12-310001835268IFRS-FULL:共有ベースの予約支払いメンバー2023-12-310001835268IFRS-FULL:他の保留メンバー2023-12-310001835268IFRS-FULL:他の総合収入を累積メンバー2023-12-310001835268IFRS-FULL:一般共有メンバ2023-01-012023-12-310001835268IFRS-FULL:一般共有メンバ2023-12-310001835268cntb: ConnectBiopharmaHongKongLimitedConnectHK メンバー2023-01-012023-12-31Xbrli:純0001835268cntb: ConnectBiopharmLLCConnectUS メンバー2023-01-012023-12-310001835268cntb: コネクトバイオファーマオーストラリア PTYLTD コネクト AUMember2023-01-012023-12-310001835268cntb: 蘇州コネクトバイオファーマ株式会社コネクト SZMember2023-01-012023-12-310001835268cntb: コネクトバイオファーマ上海株式会社コネクト SH メンバー2023-01-012023-12-310001835268cntb: コネクトバイオファーマ北京株式会社コネクト BJ メンバー2023-01-012023-12-310001835268cntb: ConnectBiopharmaShenzhenCo.LtdConnectSHZ メンバー2023-01-012023-12-3100018352682021-03-012021-03-310001835268IFRS-FULL:ボトムレンジメンバーcntb: ラボ機器メンバ2023-01-012023-12-310001835268IFRS-Full:TopOfRangeMembercntb: ラボ機器メンバ2023-01-012023-12-310001835268IFRS-Full:レンタル改善メンバーIFRS-FULL:ボトムレンジメンバー2023-01-012023-12-310001835268IFRS-Full:TopOfRangeMemberIFRS-Full:レンタル改善メンバー2023-01-012023-12-310001835268IFRS-FULL:ボトムレンジメンバーIFRS-Full:FixturesAndFittingsMember2023-01-012023-12-310001835268IFRS-Full:TopOfRangeMemberIFRS-Full:FixturesAndFittingsMember2023-01-012023-12-310001835268IFRS-Full:CurrencyRiskMember2022-12-310001835268IFRS-Full:CurrencyRiskMember2023-12-310001835268IFRS-Full:1年遅れないメンバーIFRS-Full:CreditRiskMember2022-12-310001835268IFRS-Full:CreditRiskMemberIFRS-Full:1年遅れ、2年遅れないメンバー2022-12-310001835268IFRS-Full:2年遅れと5年遅れのメンバーIFRS-Full:CreditRiskMember2022-12-310001835268IFRS-Full:CreditRiskMemberIFRS-Full:5年遅れのメンバー2022-12-310001835268IFRS-Full:CreditRiskMember2022-12-310001835268IFRS-Full:1年遅れないメンバーIFRS-Full:CreditRiskMember2023-12-310001835268IFRS-Full:CreditRiskMemberIFRS-Full:1年遅れ、2年遅れないメンバー2023-12-310001835268IFRS-Full:2年遅れと5年遅れのメンバーIFRS-Full:CreditRiskMember2023-12-310001835268IFRS-Full:CreditRiskMemberIFRS-Full:5年遅れのメンバー2023-12-310001835268IFRS-Full:CreditRiskMember2023-12-310001835268IFRS-Full:RecurringFairValueMeasurementMemberIFRS-FULL:第1レベル公平価値レベルメンバ2022-12-310001835268IFRS-Full:Level 2 O fFairValueHierarchyMembersIFRS-Full:RecurringFairValueMeasurementMember2022-12-310001835268IFRS-Full:Level 3 of FairValueHierarchyMembersIFRS-Full:RecurringFairValueMeasurementMember2022-12-310001835268IFRS-Full:RecurringFairValueMeasurementMember2022-12-310001835268IFRS-Full:RecurringFairValueMeasurementMemberIFRS-FULL:第1レベル公平価値レベルメンバ2023-12-310001835268IFRS-Full:Level 2 O fFairValueHierarchyMembersIFRS-Full:RecurringFairValueMeasurementMember2023-12-310001835268IFRS-Full:Level 3 of FairValueHierarchyMembersIFRS-Full:RecurringFairValueMeasurementMember2023-12-310001835268IFRS-Full:RecurringFairValueMeasurementMember2023-12-310001835268cntb: ライセンス契約メンバーcntb: シムセレ製薬株式会社会員2023-11-21ISO 4217:人民元0001835268cntb: LicenseAgreementMembercntb: シムセレ製薬株式会社会員2023-12-310001835268cntb: ライセンス契約メンバーcntb: ライセンス契約支払いメンバーcntb: シムセレ製薬株式会社会員2024-03-310001835268cntb: LicenseAgreementMembercntb: シムセレ製薬株式会社会員2023-11-212023-11-210001835268cntb: LicenseAgreementMembercntb: シムセレ製薬株式会社会員2023-01-012023-12-310001835268cntb: 研究開発費メンバー2021-01-012021-12-310001835268cntb: 研究開発費メンバー2022-01-012022-12-310001835268cntb: 研究開発費メンバー2023-01-012023-12-310001835268cntb: 管理費メンバー2021-01-012021-12-310001835268cntb: 管理費メンバー2022-01-012022-12-310001835268cntb: 管理費メンバー2023-01-012023-12-3100018352682021-05-012021-05-310001835268国:香港2018-04-012018-04-010001835268国:香港IFRS-FULL:ボトムレンジメンバー2018-04-012018-04-01ISO 4217:香港ドル0001835268国:香港2022-01-012022-12-310001835268国:香港2023-01-012023-12-310001835268国:香港2021-01-012021-12-310001835268cntb: ConnectBiopharmaHongKongLimitedConnectHK メンバー国:アメリカ2021-01-012021-12-310001835268cntb: ConnectBiopharmaHongKongLimitedConnectHK メンバー国:アメリカ2022-01-012022-12-310001835268cntb: ConnectBiopharmaHongKongLimitedConnectHK メンバー国:アメリカ2023-01-012023-12-310001835268cntb: ConnectBiopharmLLCConnectUS メンバーSTPR:CA2022-01-012022-12-310001835268cntb: ConnectBiopharmLLCConnectUS メンバーSTPR:CA2021-01-012021-12-310001835268cntb: ConnectBiopharmLLCConnectUS メンバーSTPR:CA2023-01-012023-12-310001835268cntb: ConnectBiopharmLLCConnectUS メンバー2021-01-012021-12-310001835268cntb: ConnectBiopharmLLCConnectUS メンバー2022-01-012022-12-310001835268cntb: ConnectBiopharmLLCConnectUS メンバー2023-01-012023-12-310001835268国/地域:オーストラリアcntb: コネクトバイオファーマオーストラリア PTYLTD コネクト AUMember2023-01-012023-12-31ISO 4217:豪ドル0001835268国/地域:オーストラリアcntb: コネクトバイオファーマオーストラリア PTYLTD コネクト AUMember2022-01-012022-12-310001835268国/地域:オーストラリアcntb: コネクトバイオファーマオーストラリア PTYLTD コネクト AUMember2021-01-012021-12-310001835268国:CN2021-01-012021-12-310001835268国:CN2023-01-012023-12-310001835268国:CN2022-01-012022-12-310001835268国:CN2021-01-012022-10-310001835268国:CN2022-11-012023-12-3100018352682021-03-122021-03-120001835268IFRS-Full:Gross CarryingAmount Membercntb: ラボ機器メンバ2020-12-310001835268IFRS-Full:レンタル改善メンバーIFRS-Full:Gross CarryingAmount Member2020-12-310001835268IFRS-Full:Gross CarryingAmount MemberIFRS-Full:FixturesAndFittingsMember2020-12-310001835268IFRS−FULL:施工進捗メンバーIFRS-Full:Gross CarryingAmount Member2020-12-310001835268IFRS-Full:Gross CarryingAmount Member2020-12-310001835268IFRS-FULL:累積切り下げと償却メンバーcntb: ラボ機器メンバ2020-12-310001835268IFRS-Full:レンタル改善メンバーIFRS-FULL:累積切り下げと償却メンバー2020-12-310001835268IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:FixturesAndFittingsMember2020-12-310001835268IFRS−FULL:施工進捗メンバーIFRS-FULL:累積切り下げと償却メンバー2020-12-310001835268IFRS-FULL:累積切り下げと償却メンバー2020-12-310001835268cntb: ラボ機器メンバ2020-12-310001835268IFRS-Full:レンタル改善メンバー2020-12-310001835268IFRS-Full:FixturesAndFittingsMember2020-12-310001835268IFRS−FULL:施工進捗メンバー2020-12-310001835268cntb: ラボ機器メンバ2021-01-012021-12-310001835268IFRS-Full:レンタル改善メンバー2021-01-012021-12-310001835268IFRS-Full:FixturesAndFittingsMember2021-01-012021-12-310001835268IFRS−FULL:施工進捗メンバー2021-01-012021-12-310001835268cntb: ラボ機器メンバ2021-12-310001835268IFRS-Full:レンタル改善メンバー2021-12-310001835268IFRS-Full:FixturesAndFittingsMember2021-12-310001835268IFRS−FULL:施工進捗メンバー2021-12-310001835268IFRS-Full:Gross CarryingAmount Membercntb: ラボ機器メンバ2021-12-310001835268IFRS-Full:レンタル改善メンバーIFRS-Full:Gross CarryingAmount Member2021-12-310001835268IFRS-Full:Gross CarryingAmount MemberIFRS-Full:FixturesAndFittingsMember2021-12-310001835268IFRS−FULL:施工進捗メンバーIFRS-Full:Gross CarryingAmount Member2021-12-310001835268IFRS-Full:Gross CarryingAmount Member2021-12-310001835268IFRS-FULL:累積切り下げと償却メンバーcntb: ラボ機器メンバ2021-12-310001835268IFRS-Full:レンタル改善メンバーIFRS-FULL:累積切り下げと償却メンバー2021-12-310001835268IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:FixturesAndFittingsMember2021-12-310001835268IFRS−FULL:施工進捗メンバーIFRS-FULL:累積切り下げと償却メンバー2021-12-310001835268IFRS-FULL:累積切り下げと償却メンバー2021-12-310001835268cntb: ラボ機器メンバ2022-01-012022-12-310001835268IFRS-Full:レンタル改善メンバー2022-01-012022-12-310001835268IFRS-Full:FixturesAndFittingsMember2022-01-012022-12-310001835268IFRS−FULL:施工進捗メンバー2022-01-012022-12-310001835268cntb: ラボ機器メンバ2022-12-310001835268IFRS-Full:レンタル改善メンバー2022-12-310001835268IFRS-Full:FixturesAndFittingsMember2022-12-310001835268IFRS−FULL:施工進捗メンバー2022-12-310001835268IFRS-Full:Gross CarryingAmount Membercntb: ラボ機器メンバ2022-12-310001835268IFRS-Full:レンタル改善メンバーIFRS-Full:Gross CarryingAmount Member2022-12-310001835268IFRS-Full:Gross CarryingAmount MemberIFRS-Full:FixturesAndFittingsMember2022-12-310001835268IFRS−FULL:施工進捗メンバーIFRS-Full:Gross CarryingAmount Member2022-12-310001835268IFRS-Full:Gross CarryingAmount Member2022-12-310001835268IFRS-FULL:累積切り下げと償却メンバーcntb: ラボ機器メンバ2022-12-310001835268IFRS-Full:レンタル改善メンバーIFRS-FULL:累積切り下げと償却メンバー2022-12-310001835268IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:FixturesAndFittingsMember2022-12-310001835268IFRS−FULL:施工進捗メンバーIFRS-FULL:累積切り下げと償却メンバー2022-12-310001835268IFRS-FULL:累積切り下げと償却メンバー2022-12-310001835268cntb: ラボ機器メンバ2023-01-012023-12-310001835268IFRS-Full:レンタル改善メンバー2023-01-012023-12-310001835268IFRS-Full:FixturesAndFittingsMember2023-01-012023-12-310001835268IFRS−FULL:施工進捗メンバー2023-01-012023-12-310001835268cntb: ラボ機器メンバ2023-12-310001835268IFRS-Full:レンタル改善メンバー2023-12-310001835268IFRS-Full:FixturesAndFittingsMember2023-12-310001835268IFRS−FULL:施工進捗メンバー2023-12-310001835268IFRS-Full:Gross CarryingAmount Membercntb: ラボ機器メンバ2023-12-310001835268IFRS-Full:レンタル改善メンバーIFRS-Full:Gross CarryingAmount Member2023-12-310001835268IFRS-Full:Gross CarryingAmount MemberIFRS-Full:FixturesAndFittingsMember2023-12-310001835268IFRS−FULL:施工進捗メンバーIFRS-Full:Gross CarryingAmount Member2023-12-310001835268IFRS-Full:Gross CarryingAmount Member2023-12-310001835268IFRS-FULL:累積切り下げと償却メンバーcntb: ラボ機器メンバ2023-12-310001835268IFRS-Full:レンタル改善メンバーIFRS-FULL:累積切り下げと償却メンバー2023-12-310001835268IFRS-FULL:累積切り下げと償却メンバーIFRS-Full:FixturesAndFittingsMember2023-12-310001835268IFRS−FULL:施工進捗メンバーIFRS-FULL:累積切り下げと償却メンバー2023-12-310001835268IFRS-FULL:累積切り下げと償却メンバー2023-12-310001835268cntb: LandUseRightsMember2020-12-310001835268cntb: OfficeRentMember2020-12-310001835268cntb: LandUseRightsMember2021-01-012021-12-310001835268cntb: OfficeRentMember2021-01-012021-12-310001835268cntb: LandUseRightsMember2021-12-310001835268cntb: OfficeRentMember2021-12-310001835268cntb: LandUseRightsMember2022-01-012022-12-310001835268cntb: OfficeRentMember2022-01-012022-12-310001835268cntb: LandUseRightsMember2022-12-310001835268cntb: OfficeRentMember2022-12-310001835268cntb: LandUseRightsMember2023-01-012023-12-310001835268cntb: OfficeRentMember2023-01-012023-12-310001835268cntb: LandUseRightsMember2023-12-310001835268cntb: OfficeRentMember2023-12-310001835268cntb: LandUseRightsMember2023-09-012023-09-300001835268cntb: OtherReceivables メンバーcntb: 金融資産適正価額その他総合所得メンバー2022-12-310001835268IFRS-FULL:財務資産償却コストメンバーcntb: OtherReceivables メンバー2022-12-310001835268IFRS-FULL:財務資産価値公正価値収益または損失カテゴリメンバーcntb: OtherReceivables メンバー2022-12-310001835268cntb: OtherReceivables メンバー2022-12-310001835268IFRS-Full:財務資産価値公正価値他の総合収入カテゴリを通じてメンバーcntb: 金融資産適正価額その他総合所得メンバー2022-12-310001835268IFRS-Full:財務資産価値公正価値他の総合収入カテゴリを通じてメンバーIFRS-FULL:財務資産償却コストメンバー2022-12-310001835268IFRS-Full:財務資産価値公正価値他の総合収入カテゴリを通じてメンバーIFRS-FULL:財務資産価値公正価値収益または損失カテゴリメンバー2022-12-310001835268IFRS-Full:財務資産価値公正価値他の総合収入カテゴリを通じてメンバー2022-12-310001835268cntb: CashAndCashEquivalentMembercntb: 金融資産適正価額その他総合所得メンバー2022-12-310001835268IFRS-FULL:財務資産償却コストメンバーcntb: CashAndCashEquivalentMember2022-12-310001835268IFRS-FULL:財務資産価値公正価値収益または損失カテゴリメンバーcntb: CashAndCashEquivalentMember2022-12-310001835268cntb: CashAndCashEquivalentMember2022-12-310001835268cntb: 金融資産適正価額その他総合所得メンバー2022-12-310001835268IFRS-FULL:財務資産償却コストメンバー2022-12-310001835268IFRS-FULL:財務資産価値公正価値収益または損失カテゴリメンバー2022-12-310001835268cntb: OtherReceivables メンバーcntb: 金融資産適正価額その他総合所得メンバー2023-12-310001835268IFRS-FULL:財務資産償却コストメンバーcntb: OtherReceivables メンバー2023-12-310001835268IFRS-FULL:財務資産価値公正価値収益または損失カテゴリメンバーcntb: OtherReceivables メンバー2023-12-310001835268cntb: OtherReceivables メンバー2023-12-310001835268IFRS-Full:財務資産価値公正価値他の総合収入カテゴリを通じてメンバーcntb: 金融資産適正価額その他総合所得メンバー2023-12-310001835268IFRS-Full:財務資産価値公正価値他の総合収入カテゴリを通じてメンバーIFRS-FULL:財務資産償却コストメンバー2023-12-310001835268IFRS-Full:財務資産価値公正価値他の総合収入カテゴリを通じてメンバーIFRS-FULL:財務資産価値公正価値収益または損失カテゴリメンバー2023-12-310001835268IFRS-Full:財務資産価値公正価値他の総合収入カテゴリを通じてメンバー2023-12-310001835268cntb: CashAndCashEquivalentMembercntb: 金融資産適正価額その他総合所得メンバー2023-12-310001835268IFRS-FULL:財務資産償却コストメンバーcntb: CashAndCashEquivalentMember2023-12-310001835268IFRS-FULL:財務資産価値公正価値収益または損失カテゴリメンバーcntb: CashAndCashEquivalentMember2023-12-310001835268cntb: CashAndCashEquivalentMember2023-12-310001835268cntb: 金融資産適正価額その他総合所得メンバー2023-12-310001835268IFRS-FULL:財務資産償却コストメンバー2023-12-310001835268IFRS-FULL:財務資産価値公正価値収益または損失カテゴリメンバー2023-12-310001835268IFRS-Full:財務負債償却コストメンバーcntb: OtherPayables メンバー2022-12-310001835268IFRS-Full:財務負債償却コストメンバーcntb: TradePayables メンバー2022-12-310001835268IFRS-Full:財務負債償却コストメンバーIFRS-Full:レンタル担当メンバー2022-12-310001835268IFRS-Full:財務負債償却コストメンバー2022-12-310001835268IFRS-Full:財務負債償却コストメンバーcntb: OtherPayables メンバー2023-12-310001835268IFRS-Full:財務負債償却コストメンバーcntb: TradePayables メンバー2023-12-310001835268IFRS-Full:財務負債償却コストメンバーIFRS-Full:レンタル担当メンバー2023-12-310001835268IFRS-Full:財務負債償却コストメンバー2023-12-310001835268cntb: U. S.TreasuryBills メンバー2023-12-310001835268cntb: U. S.TreasuryBills メンバー2022-12-310001835268cntb: ListedBondsMember2023-12-310001835268cntb: ListedBondsMember2022-12-310001835268cntb: 政府機関債券メンバー2023-12-310001835268cntb: 政府機関債券メンバー2022-12-310001835268cntb: 未上場債務証券メンバー2023-12-310001835268cntb: 未上場債務証券メンバー2022-12-310001835268IFRS-Full:Level 3 of FairValueHierarchyMembers2021-12-310001835268IFRS-Full:Level 3 of FairValueHierarchyMembers2022-12-310001835268IFRS-Full:Level 3 of FairValueHierarchyMembers2022-01-012022-12-310001835268IFRS-Full:Level 3 of FairValueHierarchyMembers2023-01-012023-12-310001835268IFRS-Full:Level 3 of FairValueHierarchyMembers2023-12-310001835268IFRS-FULL:第1レベル公平価値レベルメンバ2023-12-310001835268IFRS-FULL:第1レベル公平価値レベルメンバ2021-12-310001835268IFRS-FULL:第1レベル公平価値レベルメンバ2022-12-310001835268IFRS-FULL:第1レベル公平価値レベルメンバ2022-01-012022-12-310001835268IFRS-FULL:第1レベル公平価値レベルメンバ2023-01-012023-12-310001835268国:アメリカ2022-12-310001835268国:アメリカ2023-12-310001835268国:CN2022-12-310001835268国:CN2023-12-310001835268国/地域:オーストラリア2022-12-310001835268国/地域:オーストラリア2023-12-3100018352682021-03-120001835268IFRS-FULL:一般共有メンバ2021-03-120001835268IFRS-FULL:一般共有メンバ2020-12-310001835268cntb: IssuedCapitalAndShare プレミアムメンバー2020-12-310001835268IFRS-FULL:一般共有メンバ2021-01-012021-12-310001835268cntb: IssuedCapitalAndShare プレミアムメンバー2021-01-012021-12-310001835268IFRS-FULL:一般共有メンバ2021-12-310001835268cntb: IssuedCapitalAndShare プレミアムメンバー2021-12-310001835268IFRS-FULL:一般共有メンバ2022-01-012022-12-310001835268cntb: IssuedCapitalAndShare プレミアムメンバー2022-01-012022-12-310001835268IFRS-FULL:一般共有メンバ2022-12-310001835268cntb: IssuedCapitalAndShare プレミアムメンバー2022-12-310001835268cntb: IssuedCapitalAndShare プレミアムメンバー2023-01-012023-12-310001835268cntb: IssuedCapitalAndShare プレミアムメンバー2023-12-3100018352682022-03-310001835268IFRS-FULL:一般共有メンバ2022-03-310001835268IFRS-FULL:一般共有メンバ2021-03-012021-03-310001835268IFRS-FULL:一般共有メンバ2022-05-012022-05-3100018352682022-11-0100018352682023-05-0100018352682023-11-010001835268cntb: SeriesB ファイナンシングメンバーIFRS-FULL:一般共有メンバcntb: CoFoundersMember2018-12-20cntb: 投票0001835268cntb: A2021 株式インセンティブプランメンバー2023-12-310001835268cntb: 従業員シェア購入プランメンバー2023-01-012023-12-310001835268cntb: A2021 株式インセンティブプランメンバー2022-01-012022-12-310001835268cntb: A2021 株式インセンティブプランメンバー2023-01-012023-12-310001835268cntb: A2019 ストックインセンティブプランメンバー2021-01-012021-12-310001835268cntb: A2021 株式インセンティブプラン会員2021-01-012021-12-310001835268cntb: A2021 従業員シェア購入プランメンバー2023-12-310001835268cntb: A2021 従業員シェア購入プランメンバー2023-01-012023-12-310001835268cntb: A2021 従業員シェア購入プランメンバー2022-05-012022-05-01cntb: 購入期間0001835268cntb: A2021 従業員シェア購入プランメンバー2022-01-012022-12-310001835268cntb: その他買掛金および未払い現在のメンバー2023-12-310001835268cntb: 株式インセンティブプランメンバー2021-01-012021-12-310001835268cntb: 株式インセンティブプランメンバー2022-01-012022-12-310001835268cntb: 株式インセンティブプランメンバー2023-01-012023-12-310001835268cntb: 株式インセンティブプランメンバーIFRS-FULL:ボトムレンジメンバー2021-01-012021-12-310001835268IFRS-Full:TopOfRangeMembercntb: 株式インセンティブプランメンバー2021-01-012021-12-310001835268cntb: 株式インセンティブプランメンバーIFRS-FULL:ボトムレンジメンバー2022-01-012022-12-310001835268IFRS-Full:TopOfRangeMembercntb: 株式インセンティブプランメンバー2022-01-012022-12-310001835268cntb: 株式インセンティブプランメンバーIFRS-FULL:ボトムレンジメンバー2023-01-012023-12-310001835268IFRS-Full:TopOfRangeMembercntb: 株式インセンティブプランメンバー2023-01-012023-12-310001835268cntb: 従業員シェア購入プランメンバーIFRS-FULL:ボトムレンジメンバー2022-01-012022-12-310001835268IFRS-Full:TopOfRangeMembercntb: 従業員シェア購入プランメンバー2022-01-012022-12-310001835268cntb: 従業員シェア購入プランメンバーIFRS-FULL:ボトムレンジメンバー2023-01-012023-12-310001835268IFRS-Full:TopOfRangeMembercntb: 従業員シェア購入プランメンバー2023-01-012023-12-310001835268cntb: 従業員シェア購入プランメンバー2022-01-012022-12-310001835268cntb: 株式インセンティブプランメンバー2021-12-310001835268cntb: 株式インセンティブプランメンバー2022-12-310001835268cntb: 株式インセンティブプランメンバー2023-12-310001835268cntb: 従業員シェア購入プランメンバー2022-12-310001835268cntb: 従業員シェア購入プランメンバー2023-12-310001835268IFRS-FULL:ボトムレンジメンバー2023-01-012023-12-310001835268IFRS-Full:TopOfRangeMember2023-01-012023-12-310001835268cntb: SeriesB ファイナンシングメンバーIFRS-FULL:一般共有メンバcntb: CoFoundersMember2018-12-310001835268IFRS-FULL:一般共有メンバcntb: CoFoundersMember2021-03-310001835268IFRS-FULL:一般共有メンバcntb: CoFoundersMember2021-12-310001835268cntb: CoFoundersMembercntb: シリーズ CPreferredSharesMember2021-03-310001835268cntb: CoFoundersMember2023-01-012023-12-310001835268cntb: 株式購入契約メンバーcntb: シリーズ CPreferredSharesMember2020-12-010001835268cntb: 株式購入契約メンバーcntb: シリーズ CPreferredSharesMember2020-11-302020-12-010001835268cntb: 株式購入契約メンバー2021-01-012021-12-310001835268IFRS-Full:ファーストオプション共有メンバーcntb: 金融商品 PreferredRightsMember2021-03-012021-03-310001835268cntb: シリーズ前 APreferredSharesMember2023-12-310001835268cntb: シリーズ APreferredSharesMember2023-12-310001835268cntb: SeriesBPreferredSharesMember2023-12-310001835268cntb: シリーズ CPreferredSharesMember2023-12-310001835268cntb: 金融商品 PreferredRightsMember2023-12-310001835268IFRS-Full:ファーストオプション共有メンバーcntb: 金融商品 PreferredRightsMember2023-12-310001835268IFRS-Full:ファーストオプション共有メンバーcntb: 金融商品 PreferredRightsMember2021-03-180001835268cntb: 金融商品 PreferredRightsMember2020-12-310001835268cntb: 金融商品 PreferredRightsMember2021-01-012021-12-310001835268cntb: 金融商品 PreferredRightsMember2021-12-310001835268IFRS-Full:ファーストオプション共有メンバーcntb: 金融商品 PreferredRightsMember2021-03-192021-03-190001835268cntb: 金融商品 PreferredRightsMember2020-12-310001835268IFRS-Full:レンタル担当メンバー2020-12-310001835268cntb: 金融商品 PreferredRightsMember2021-01-012021-12-310001835268IFRS-Full:レンタル担当メンバー2021-01-012021-12-310001835268cntb: 金融商品 PreferredRightsMember2021-12-310001835268IFRS-Full:レンタル担当メンバー2021-12-310001835268cntb: 金融商品 PreferredRightsMember2022-01-012022-12-310001835268IFRS-Full:レンタル担当メンバー2022-01-012022-12-310001835268cntb: 金融商品 PreferredRightsMember2022-12-310001835268IFRS-Full:レンタル担当メンバー2022-12-310001835268cntb: 金融商品 PreferredRightsMember2023-01-012023-12-310001835268IFRS-Full:レンタル担当メンバー2023-01-012023-12-310001835268cntb: 金融商品 PreferredRightsMember2023-12-310001835268IFRS-Full:レンタル担当メンバー2023-12-3100018352682022-05-012022-05-310001835268IFRS-FULL:重大な一般共有取引メンバー2024-01-012024-04-010001835268IFRS-Full:ParentMember2022-12-310001835268IFRS-Full:ParentMember2023-12-310001835268IFRS-Full:ParentMember2021-01-012021-12-310001835268IFRS-Full:ParentMember2022-01-012022-12-310001835268IFRS-Full:ParentMember2023-01-012023-12-310001835268IFRS-Full:ParentMember2020-12-310001835268IFRS-Full:ParentMember2021-12-31cntb: セグメント アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表20-F
| | | | | |
| o | 1934年証券取引法第12(B)又は(G)条に基づく登録声明 |
あるいは…。
| | | | | |
| x | 1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで十二月三十一日, 2023
あるいは…
| | | | | |
| o | 1934 年証券取引所法第 13 条または第 15 条 ( d ) に基づく移行報告書 |
あるいは…
| | | | | |
| o | 1934 年証券取引所法第 13 条または第 15 条 ( d ) に基づくシェルカンパニー報告書 |
このシェルカンパニーレポートを必要とするイベントの日付 : 該当しません。
手数料書類番号001-40212
コネクト · バイオファーマホールディングス
(登録者の正確な氏名はその定款に記載)
適用されない
(登録者氏名英文訳)
ケイマン諸島
(登録成立または組織の司法管轄権)
12265 エル · カミノ · レアル, 350軒の部屋
サンディエゴ, カルシウム.カルシウム92130, アメリカです
(主にオフィスアドレスを実行)
Dr. Zheng Wei
12265 エル · カミノ · レアル, 350軒の部屋
サンディエゴ, カルシウム.カルシウム92130, アメリカです
電話:+1 (858)727-1040
ファックス:+1 (858) 614-7007
(会社の連絡先名、電話、電子メールおよび/またはファックス番号および住所)
法第 12 条 ( b ) に従って登録された、または登録される有価証券
| | | | | | | | | | | | | | |
| クラスごとのタイトル | | 取引コード | | 登録された各取引所の名称 |
アメリカ預託株式は、それぞれ 1 株の普通株式を表す。 額面価値 1 株当たり $0.000174 | | CNTB | | ナスダック世界市場 |
法第 12 条 ( g ) に従って登録された、または登録される有価証券
ありません
(クラス名)
同法第15(D)条により報告義務のある証券が規定されている
ありません
(クラス名)
年度報告までの期間終了時の発行者毎の資本または普通株の流通株数を説明した
55,102,954普通株式、額面 1 株当たり 0.0 00174 ドル
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください。はい、そうですo 違います。x
本報告が年次報告又は移行報告である場合は、登録者が1934年“証券取引法”第13又は15(D)節に基づいて報告を提出する必要がないか否かを勾印で示してください。はい、そうですo 違います。x
注-上記チェックボックスを選択することは、これらの条項の下で、1934年の証券取引法第13条または15(D)条に基づいて報告書の提出を要求する任意の登録者の義務を解除しない。
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示すはい、そうですx違いますo
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示すはい、そうですx違いますo
登録者が大型加速ファイルサーバ,加速ファイルサーバ,非加速ファイルサーバであるか新興成長型会社であるかをチェックマークで示す.取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“新興成長型会社”の定義を参照されたい
| | | | | | | | | | | | | | |
| 大型加速ファイルサーバ | o | | ファイルマネージャを加速する | o |
| | | | |
| 非加速ファイルマネージャ | x | | 新興成長型会社 | x |
米国 GAAP に準拠して財務諸表を作成する新興成長企業の場合は、登録者が新規または改訂された財務会計基準に準拠するために延長移行期間を使用しないことを選択したかどうかをチェックマークで示します。†取引法第 13 条 ( a ) に基づき提供されます。 o
† 新たな又は改訂された財務会計基準とは、財務会計基準委員会が2012年4月5日以降に発表したその会計基準編纂の任意の更新を意味する
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われるo
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用するo
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示すo
登録者が本文書に含まれる財務諸表を作成する際にどのような会計基盤を使用しているかをチェックマークで示す
| | | | | | | | | | | | | | |
アメリカは会計原則を公認しているo | | 国際財務報告基準発行済みの | | 他にもo |
| | 国際会計によって 標準委員会x | | |
前の質問に答えたときに“その他”をチェックした場合は、登録者がどの財務諸表項目に従うかをチェックしてください。プロジェクト17oプロジェクト18o
これが年次報告書である場合は、登録者が空殻会社であるか否かをチェックマークで示してください(取引法第12 b-2条で定義されているように)。はい、そうですo違いますx
| | | | | |
| カタログ表 | |
この年報について | 1 |
財務資料の列報 | 1 |
為替レート | 1 |
前向きな陳述に関する警告的声明 | 2 |
第1部 | 4 |
ITEM 1 。取締役、上級管理職および顧問の身元。 | 4 |
ITEM 2 。オファーの統計と予想されるタイムテーブル。 | 4 |
ITEM 3 。キー情報。 | 4 |
A. [保留されている] | 4 |
B.資本化と負債 | 4 |
C.報酬を提案し使用する理由 | 4 |
D.リスク要因 | 4 |
第四項会社に関する資料 | 86 |
A.会社の歴史と発展 | 86 |
B.業務概要 | 88 |
C.組織構造 | 135 |
D.財産、工場、設備 | 135 |
^ a b c d e f g h i 。未解決のスタッフのコメント。 | 136 |
第 5 話。運営と財務のレビューと見通し。 | 136 |
A.経営実績 | 136 |
B.流動資金と資本資源 | 145 |
C.研究、開発、特許およびライセンス、等。 | 148 |
D.トレンド情報 | 148 |
E.キー会計推定数 | 148 |
第 6 話。取締役、上級管理職および従業員。 | 149 |
A.役員と上級管理職 | 149 |
B.補償 | 151 |
C.取締役会の慣例 | 158 |
D.従業員 | 162 |
E.株式所有権 | 163 |
第 7 話。主要株主および関連当事者の取引。 | 163 |
A.主要株主 | 163 |
B.関連者取引 | 165 |
C.専門家と弁護士の利益 | 168 |
項目8.財務情報。 | 168 |
A.連結レポートおよびその他の財務情報 | 169 |
B.重大な変化 | 169 |
第九条。要約と看板。 | 170 |
A.特典と発売詳細 | 170 |
B.配送計画 | 170 |
C.市場 | 170 |
D.売却株主 | 170 |
E.希釈 | 170 |
F.発券人の料金 | 170 |
第10項補足資料 | 170 |
| | | | | |
A.株 | 170 |
B.組織覚書と規約 | 170 |
C.材料契約 | 177 |
D.外国為替規制 | 178 |
E.課税 | 179 |
F.配当金と支払代理人 | 186 |
G.専門家の発言 | 186 |
H.展示された書類 | 186 |
一、付属情報 | 186 |
J.証券保有者に提出された年次報告 | 186 |
第11項.市場リスクに関する定量的かつ定性的開示 | 186 |
第12項株式証券以外の他の証券の説明 | 187 |
第II部 | 189 |
13番目の項目は配当金、延滞配当金、そして配当金を滞納する。 | 189 |
項目14.保持者を保証する権利および収益の使用を実質的に修正する。 | 189 |
プロジェクト15.制御とプログラム | 189 |
プロジェクト16 A。監査委員会の財務専門家。 | 190 |
プロジェクト16 B。道徳的基準。 | 190 |
プロジェクト16 Cです。チーフ会計士費用とサービスです。 | 190 |
プロジェクト16 Dです。監査委員会の上場基準に対する免除。 | 191 |
プロジェクト16 E。発行者と関連購入者が持分証券を購入する。 | 191 |
プロジェクト16 Fです。登録者の認証会計士を変更します。 | 191 |
プロジェクト16 Gです。会社が管理する。 | 191 |
16 H項です。炭鉱の安全情報開示。 | 192 |
^ a b c d e f 。検査を妨げる外国の管轄区域に関する開示。 | 192 |
プロジェクト16 Jです。インサイダー取引政策 | 195 |
プロジェクト16 Kです。ネットワーク·セキュリティ | 195 |
第三部 | 194 |
プロジェクト17.財務諸表 | 194 |
プロジェクト18.財務諸表 | 194 |
プロジェクト19.証拠品。 | 195 |
連結財務諸表索引 | F-1 |
この年報について
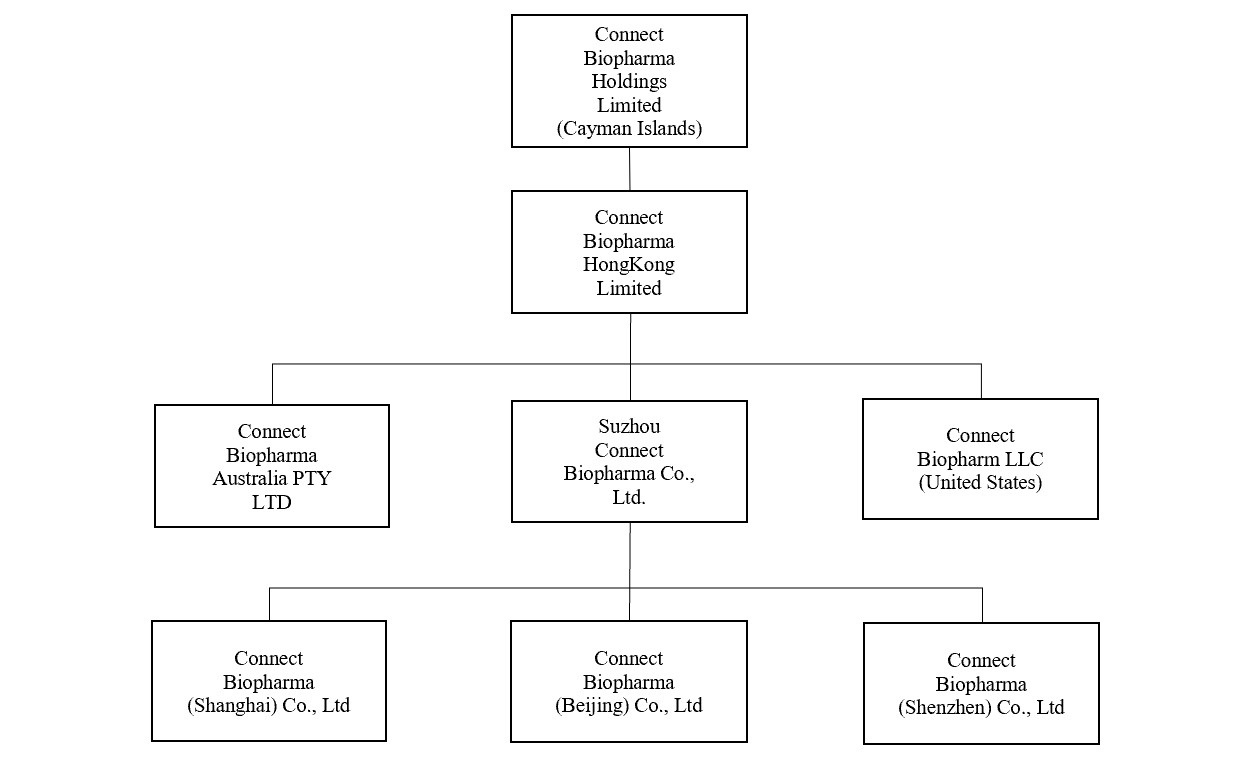
文意が別に指す或いは別の指示がある以外、すべて“私たち”或いは“私たち”或いは“会社”に言及すると、すべて康乃徳生物控股有限会社及びその直接或いは間接全資付属会社を指し、コン乃徳生物香港有限会社、連系生物医薬有限会社、康乃徳生物オーストラリア有限会社、蘇州康乃徳生物有限会社、康乃徳生物(上海)有限会社、康乃徳生物(北京)有限会社及び康乃徳生物(深セン)有限会社を含む。
財務資料の列報
本年度報告書に含まれる総合財務諸表は、国際会計基準委員会(IASB)が発表した国際財務報告基準(IFRS)に基づいて作成された。私たちの連結財務諸表はすべてアメリカ公認会計基準に従って作成されたものではありません。私たちのデモ通貨はドルです。別の説明がない限り、本年度報告書のすべての通貨金額はドルで価格される。本年度報告で言及された“ドル”、“ドル”、“ドル”はいずれもドルを指し、言及されたすべての“人民元”と“人民元”は人民元を指す。列報通貨の変化は付記2で議論されている通貨の変化を示します私たちの総合財務諸表は本年度報告書の他の部分に含まれている。私たちは本年度報告書のいくつかの数値を四捨五入した。したがって、いくつかのテーブルで合計として表示される数字は、前の数字の算術集約ではない可能性がある
商標、サービスマーク、商号
便宜上、本年度報告で言及されている商標、サービスマーク、ロゴ、著作権、および商号には、および記号は含まれていない。このような参照は、私たちが適用法律に従って、これらの商標、サービスマーク、ロゴ、著作権、および商号に対する私たちまたは適用許可者の権利を最大限に主張しないか、または適用所有者が、これらの商標、サービスマーク、ロゴ、著作権、および商号に対する権利を主張しないことを示すものではない。本年度報告書には,他の人の他の商標,サービスマーク,ロゴ,著作権,商号が含まれており,これらはそれぞれの所有者の財産である.我々の知る限り,本年度報告に登場するすべての商標,サービスマーク,ロゴ,著作権,商号は,それぞれの所有者の財産である.私たちは、私たちが他の会社との関係、または他の会社の私たちの支援または賛助を示唆するために、他の会社の商標、サービスマーク、ロゴ、著作権または商号を使用または展示するつもりはありません。
前向きな陳述に関する警告的声明
本年度報告書には、“1995年個人証券訴訟改革法”が指す“前向き陳述”が含まれている。本年度報告に含まれる歴史的事実に関する陳述を除いて、本年度報告に含まれるすべての陳述は、私たちの将来の経営結果と財務状況、業務戦略、予想製品、製品承認、研究開発コスト、将来の収入、成功のタイミングと可能性、未来経営の計画と目標、予想製品の将来結果と見通し、管理計画と目標に関する陳述を含み、すべて前向きな陳述である。これらの表現は既知と未知のリスク、不確定性とその他の重要な要素に関連し、私たちの実際の結果、業績或いは成果は展望性表現中の明示的或いは暗示的な任意の未来の結果、業績或いは成果と大きく異なることを招く可能性がある。
場合によっては、“予想”、“信じ”、“考慮”、“継続”、“可能”、“推定”、“予想”、“意図”、“可能”、“計画”、“潜在”、“予測”、“計画”、“すべき”、“目標”、“将”または“将”またはこれらの用語の否定または他の同様の表現によって、前向きな陳述を識別することができる。すべての展望的声明書がこのような単語を含んでいるわけではないにもかかわらず。本年度報告書に含まれる展望的陳述は、以下の態様に関する陳述を含むが、これらに限定されない
•私たちの臨床試験は候補製品の安全性と有効性、その他の積極的な結果を証明することができます
•私たちが行っているのと未来の臨床前研究と臨床試験の時間、進展、重点と結果、およびこれらの研究と試験のデータの報告と解釈
•私たちの中期、トップライン、そして初歩的な結果は変化するかもしれない
•私たちは、重点的に注目されている地理的地域と販売戦略を含む、協力して臨床試験を行ったり、私たちの候補製品を商業化する計画(承認されれば)と協力しています
•私たちの製品の市場機会と競争構造は
•競争療法の成功や可能性があります
•臨床試験では患者の募集を遅らせることができませんでした
•私たちの候補製品の有益な特性、安全性、有効性、治療効果
•開始と完了時間、私たちの薬物発見と研究計画の進展状況
•様々な病気の候補製品に対する規制と承認の時間や可能性
•私たちの候補製品に対する規制承認を得て維持することができる
•私たちが求める可能性のある他の適応も含めて私たちの候補製品をさらに開発する計画について
•米国、中国人民Republic of China、または中国、ヨーロッパおよび他の司法管轄区域の既存の法律、法規、規制動態は、任意の可能な退市、私たちの証券取引の禁止、または米国で取引される証券価値に対する不利な影響を含む
•利用可能な場合に既存の特許条項を延長することを含む、私たちの知的財産権および独自技術の計画および能力を取得し、維持し、保護し、実行する
•私たちは引き続き第三者に依存して私たちの候補製品に対して追加の臨床試験を行い、臨床前研究と臨床試験のために私たちの候補製品を生産した
•私たちの計画、および私たちが任意の協力、許可または他の手配を達成する能力、および任意の協力、許可または他の手配について交渉する能力、これらの協力、許可または他の手配は、私たちの候補製品を開発、製造、または商業化するために必要または必要である可能性がある
•より多くの人を雇用し、これらの人々を引き付けて維持する能力が必要だ
•私たちは私たちの高度な管理チームを拡大することを含む業務の発展と拡大に関する計画
•費用、将来の収入、資本需要、追加融資需要の推定
•私たちの財務業績は
•私たちの既存の現金と現金等価物は、私たちの将来の運営費用と資本支出需要の期間を支払うのに十分であると予想される
•既存の資源の使用が期待されています
•雇用法案によると、新興成長型企業として適用される開示要求が減少し、米国預託証明書の投資家への魅力を低下させる可能性がある
•地政学的事件やロシアとウクライナ間の戦争に関連するリスクは、生産性に負の影響を与え、私たちが行っているおよび未来の臨床試験、臨床前研究と研究開発活動を緩和または延期する可能性がある。
これらの展望的な陳述は主に、私たちの現在の私たちの業務、私たちが経営している業界、および私たちの業務、財務状況、経営結果、および見通しの財務傾向の期待と予測に基づいており、これらの展望的な陳述は未来の業績や発展の保証ではない。これらの前向き陳述は,本年度報告の日までの状況のみを代表しており,“プロジェクト3.重要な情報であるリスク要因”という節と本年度報告の他の部分で述べた一連のリスク,不確実性,仮説の影響を受ける可能性がある。展望性陳述は、リスクおよび不確実性の影響を固有に受けているので、いくつかのリスクおよび不確実性は予測または定量化できないので、未来のイベントの予測として、これらの前向き陳述に依存してはならない。著者らの展望性陳述に反映された事件と状況は実現できない或いは発生できない可能性があり、実際の結果は展望性陳述中の予測結果と大きく異なる可能性がある。法律の適用に別の要求がない限り、私たちは、本年度報告書を発表した後、任意の新しい情報、未来のイベント、または他の理由でも、本明細書に含まれる任意の前向きな陳述を公開または修正するつもりはありません。
また、“私たちが信じている”という声明と類似した声明は、関連テーマに対する私たちの信念と意見を反映している。これらの陳述は,本年度報告日までに我々が把握した情報に基づいており,これらの情報がこのような陳述の合理的な基礎を構成していると考えられるが,これらの情報は限られているか不完全である可能性があり,我々の陳述は,入手可能なすべての関連情報について詳細な調査や検討が行われていることを示していると解釈されてはならない.このような陳述は本質的に不確実であり、あなたにこのような陳述に過度に依存しないように想起させる。
第1部
項目1.役員、上級管理者、コンサルタントの身分
適用されません
項目2.見積統計データと予想スケジュール
適用されません
プロジェクト3.重要な情報
会社の概要
私たちはケイマン諸島持株会社で、私たちは中国の子会社を通じて一部の業務を展開していますが、私たちは中国運営会社ではありません。本年度報告日までの我々の組織構造の詳細については、次の図を参照されたい。
A.[保留されている]
B.資本化と負債化。
適用されません
C.収益を提供して使用する理由。
適用されません
D.リスク要因です
リスク要因の概要
私たちのアメリカ預託証明書への投資は、私たちの限られた経営歴史、財務状況、資本要求に関するリスク、私たちの候補製品の発見、開発と規制承認に関するリスク、私たちの第三者への依存に関するリスク、私たちの製品の商業化に関連するリスクを含む多くのリスクの影響を受けるだろう
これらのリスクには、候補者に関するリスク、私たちの業務運営や業界に関連するリスク、知的財産権に関するリスク、私たちのアメリカ預託証書の所有権に関連するリスク、中国人民Republic of Chinaでのビジネスに関するリスク、および一般的なリスクが含まれる。投資家は米国預託証明書に投資する前に、本年報のすべての情報をよく考慮すべきである。以下のリストでは,これらのリスクの一部(ただしすべてではない)をまとめた.これらのリスクや他のリスクをより全面的に説明するために、“リスク要因”と題する節の情報を読んでください。
私たちの限られた経営歴史、財務状況、資本要求に関するリスク
•私たちの経営の歴史は限られており、設立以来ずっと重大な運営損失を受けており、予測可能な未来に重大な損失が予想されている。私たちはどんな収入も利益を達成しないかもしれないし、あるいは、もし私たちが利益を達成すれば、私たちは持続できないかもしれない。
•私たちは私たちの目標を達成するために多くの追加資金を必要とするだろうし、必要な時に受け入れ可能な条件で必要な資金を獲得したり、これらの資金を得ることができなければ、私たちの製品開発計画、商業化努力、または他の運営を延期、制限、減少または終了させることができるかもしれない。私たちの既存の資本は規制部門の承認を通じて候補製品に資金を提供するのに十分ではなく、私たちはそれらの開発と商業化を達成するために追加の資本を調達する必要があるだろう。
我々の候補製品の発見,開発,規制承認に関するリスク
•臨床薬物開発は長くて高価な過程に関連し、結果は不確定である。私たちは、私たちの候補製品の開発と商業化を完成または最終的に達成できない過程で予測できないコストや遅延が生じるかもしれない。
•私たちの候補製品は著者らの臨床試験中の患者登録人数に依存し、遅延或いは患者の臨床試験への参加が困難な場合がある。
•私たちの候補製品は深刻な有害事象や副作用に関連している可能性があり、あるいはその臨床開発を遅延または停止し、その規制承認を遅延または阻止し、その商業潜在力を制限し、あるいは重大な負の結果を招く可能性のある他の特性を持っている可能性がある。
•我々はすでに国際地点で我々の候補製品の臨床試験を継続することが可能であり,適用された規制機関は外国地点での試験データを受け入れない可能性がある。
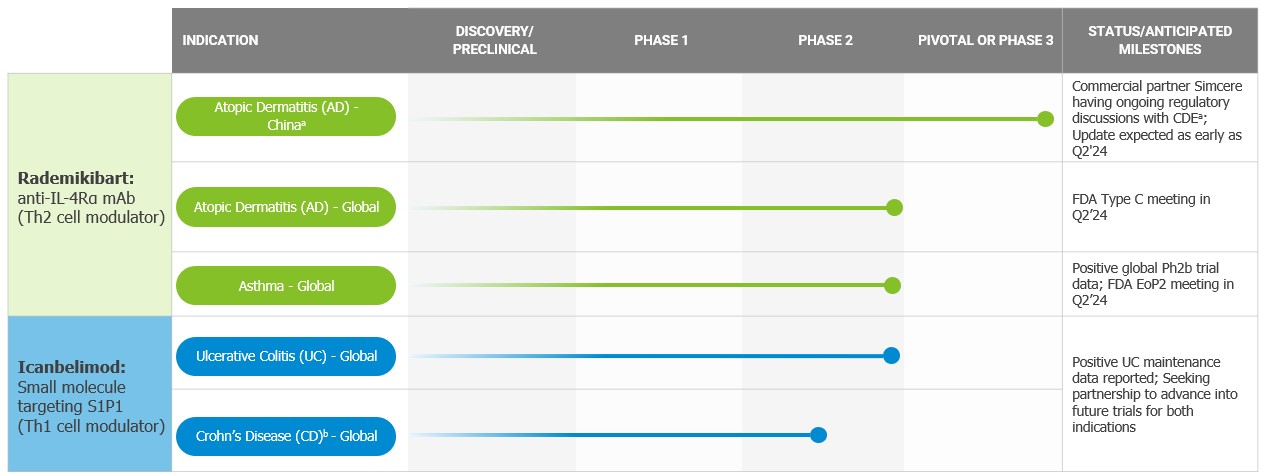
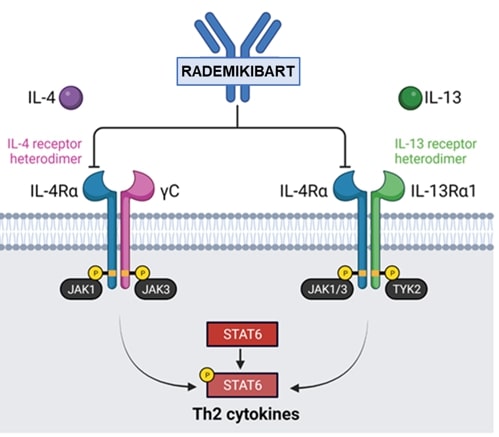
•我々は2つの候補製品のみであり,rademikibart(従来のCBP−201)とicanbelimod(従来のCBP−307)のみが臨床開発中である。もし私たちが候補製品の開発に成功しなかったり、開発過程で重大な遅延に遭遇したら、私たちの業務は実質的な損害を受けるだろう。
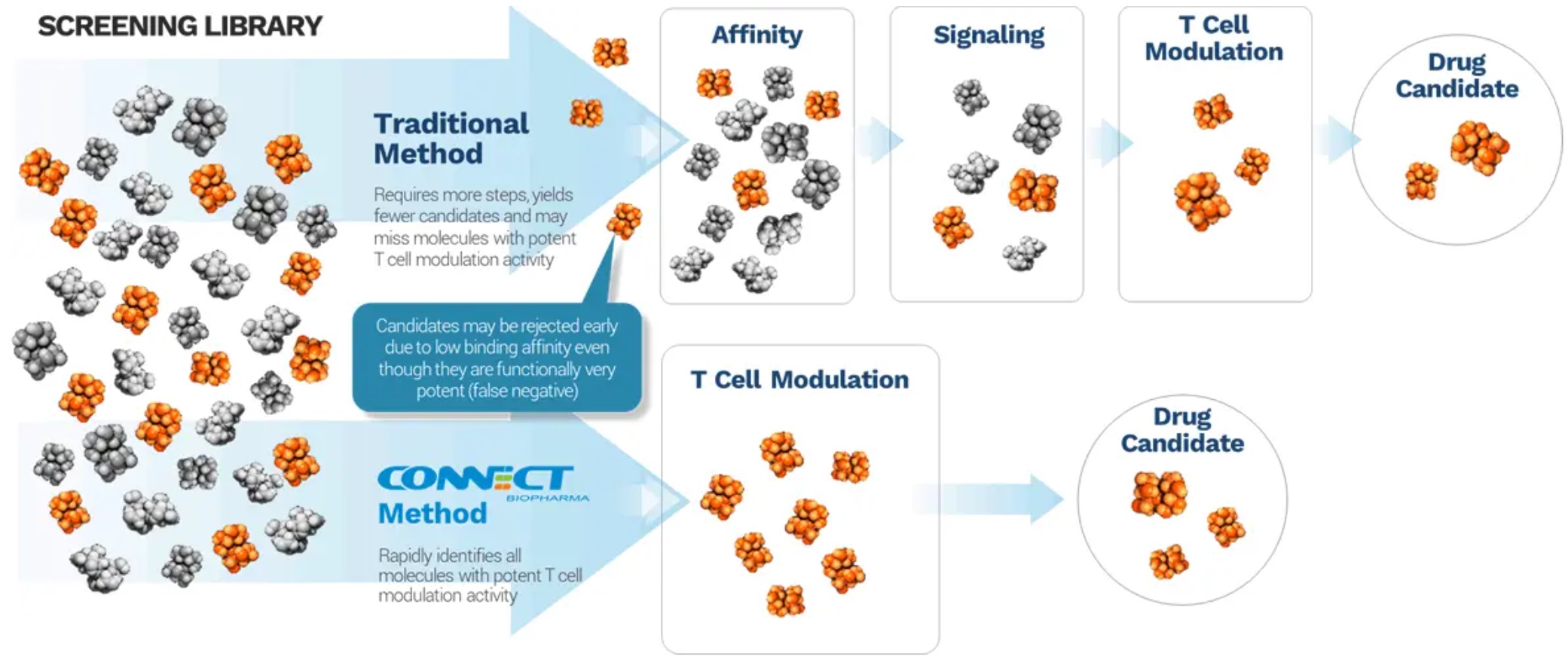
•強力なT細胞変調活性に基づいて候補製品を発見·開発する方法は検証されておらず,ビジネス価値のある製品を開発できるかどうか,あるいは競争的な技術的方法が候補製品の商業的価値を制限したり,我々の方法を時代遅れにしたりすることができるかどうかは分からない。
•私たちは新薬申請またはNDA、または生物製品許可証申請またはBLAを提出したことがなく、私たちの任意の候補製品に提出できないかもしれない。
•FDA、中華人民共和国国家医療製品管理局或いはNMPA、ヨーロッパ薬品管理局或いはEMA、欧州委員会及び類似外国機関の監督管理審査過程は長く、時間がかかり、本質的に予測できず、もし私たちが最終的に私たちの候補製品のために監督管理の許可を得ることができなければ、私たちの業務は深刻な損害を受ける。
•私たちは承認されたバイオ製品候補製品が予想以上に早く競争に直面する可能性があることを求めるつもりだ。
•EU薬品立法の提案改正はEU医薬製品(孤児医薬製品を含む)に適用される監督管理枠組みに不確定性がある可能性がある。
私たちの第三者への依存に関するリスクは
•著者らは依存し、そして引き続き第三者に依存し、独立した臨床研究者と契約研究組織を含めて、著者らの臨床前研究と臨床試験のいくつかの方面を行う予定である。
•我々は第三者と契約を結び,臨床前研究と行われている臨床試験のために候補製品を製造し,より多くの臨床試験を行い,最終的に商業化する予定である。
私たちの候補製品の商業化に関するリスクは
•私たちの候補製品の商業成功は医師、患者、医療保険支払人と医学界の他の人がこれらの候補製品に対する市場受け入れの程度に依存する。
•私たちの候補製品の商業化に成功し、承認されれば、政府当局と健康保険会社が構築した保険範囲、十分な補償レベル、優遇された価格設定政策にある程度依存する。
私たちの業務運営や業界に関連するリスク
•私たちは経営陣や他の臨床·科学者のサービスに依存しており、これらの人を引き留めたり、より多くの管理や臨床·科学者を募集することができなければ、私たちの業務は影響を受けるだろう。
知的財産権に関するリスク
•私たちの成功は私たちの知的財産権とノウハウを獲得し、維持し、保護し、実行する能力にかかっている。
アメリカの預託証券の所有権に関連するリスクは
•私たちのアメリカ預託証明書の取引価格は大きく変動する可能性があり、アメリカ預託証明書の購入者は大きな損失を受ける可能性があります。
•外国の個人発行者として、米国内発行者に適用されるいくつかの米国証券法開示要求に制約されず、株主が公開して得られる情報を制限する可能性がある。
•私たち米国預託証明書の保有者が所有する権利は株主より少なく、信託機関を通じて彼らの権利を行使しなければならない。
•私たちは未来の財務報告の内部統制における私たちの重大な弱点を発見し、経験し、引き続き発見し、経験することができる。
中国でのビジネスに関するリスク
•中国政府の政治·経済政策の変化は、私たちの業務、財務状況、経営結果に重大な悪影響を及ぼす可能性があり、私たちの成長と拡張戦略を維持できない可能性がある。
•中国政府は法律法規に基づいて私たちの業務に関与したり、影響を与えたりする可能性があり、これは私たちの業務に重大な変化をもたらし、私たちのアメリカ預託証明書の価値に重大な悪影響を及ぼす可能性がある
•2022年12月まで、上場企業会計監督委員会(PCAOB)は従来、私たちの独立した公認会計士事務所が私たちの財務諸表のために行った監査を検査することができなかったが、PCAOBは過去に私たちの監査人を検査することができず、私たちの投資家がこの検査から得たメリットを奪ってしまった。将来PCAOBが再び私たちの独立した公認会計士事務所の仕事を検査または徹底的に調査できない場合、投資家はPCAOB検査のメリットを奪われるだろう。
•もしPCAOBが再び中国にある監査役を全面的に検査あるいは調査できなければ、私たちのアメリカ預託証明書と株は将来HFCAAによる取引が禁止される可能性があるため、ナスダック世界市場は私たちの証券を退市することを決定するかもしれない。もしこのような状況が発生した場合、私たちのアメリカ預託証明書や株式がアメリカ以外の取引所に上場できるかどうか、あるいは私たちの株式市場がアメリカ国外で発展するかどうかを決定することはできません。私たちのアメリカ預託証明書は取得されたり、取引が禁止されたり、それらが削除されたり、取引が禁止されたりする脅威は、私たちのアメリカ預託証明書の価値に実質的な悪影響を与える可能性があります。
•中国の新しい“データ安全法”、“ネットワークセキュリティ審査方法”、“個人情報保護法”、多層保護計画に関する法規やガイドライン、その他の将来の法律法規を遵守することは巨額の支出を生む可能性があり、私たちの業務に重大な影響を与える可能性がある
•私たちの現在の業務運営を管理する中国の法律法規は時々曖昧であるため、これらのリスクは私たちの子会社の運営に大きな負の変化をもたらす可能性があり、私たちのアメリカ預託証券価値が大幅に下落したり、私たちが投資家に私たちの証券を提供したり継続したりする能力が完全に阻害され、投資家の証券価値が一文の価値もなくなる可能性がある。
•中国の法規によると、私たちの証券の将来のアメリカ市場でのどの発行も、中国証券監督管理委員会(CSRC)の承認と届出を得る必要があるかもしれない
•中国のいくつかの規制は私たちが買収を通じて成長を達成することをもっと難しくするかもしれない。もし私たちが中国の反独占法律と法規を遵守できなければ、政府の調査や法執行行動、訴訟、あるいは私たちに対するクレームを招き、私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性がある。
•私たちはますます激化する政治的緊張とアメリカと中国の間のいかなる潜在的な衝突の悪影響を受けるかもしれない
•最近アメリカに上場している中国企業をめぐる訴訟、監督審査、負の宣伝は、私たちがより厳しい監督管理審査を受け、私たちのアメリカ預託証明書の取引価格にマイナスの影響を与える可能性がある。
•私たちの業務は、中国政府当局が付与した税収優遇や財政優遇と適宜政策から利益を得ている。このような奨励または政策の満了、キャンセル、または減少は私たちの運営結果に悪影響を及ぼすだろう。
•私たちは特定の業界の法律法規の制限を受ける可能性があり、私たちの科学データを中国以外に移すことはできません。
•米国証券取引委員会が提起した行政訴訟では、我々の独立公認会計士事務所を含む中国の会計士事務所に追加の救済措置を適用することができ、それにより、私たちの総合財務諸表が米国証券取引委員会の要求に適合しないと判断される可能性がある。
一般リスク
•私たちは新冠肺炎を含む健康流行病によるリスクに直面している。
•私たちはインフレ圧力、自然災害、環境、健康、安全に関する法律法規を遵守できなかったリスクに直面している
“外国会社の責任追及法案”
改正された“外国会社責任法”またはHFCAAによると、米国証券取引委員会が、我々が提出した監査報告が2年連続でPCAOB検査を受けていない公認会計士事務所から発行されたと判断した場合、米国証券取引委員会は、米国国家証券取引所または場外取引市場での私たちの株式または米国預託証券の取引を禁止する。このような取引禁止により、ナスダック世界市場は私たちの証券を退市することを決定するかもしれない。2021年12月16日、PCAOBは、中国大陸部および香港に本部を置く完全登録会計士事務所を検査または調査できない米国証券取引委員会に報告書を発行し、我々の監査役を含む。2021年12月31日までの会計年度Form 20−F年度報告書を提出した後,2022年5月,米国証券取引委員会は我々をHFCAA下の委員会が指定した発行元とした。2022年12月15日、PCAOBは2021年12月16日の裁決を撤回し、完全に登録されていない会計士事務所を検査または調査できない司法管轄区域リストから削除する報告書を発表した。したがって,PCAOBが任意の新たな裁決を発表するまで,HFCAA下の委員会で確認された発行者としては決定されないことが予想される。PCAOBが今後、中国大陸部と香港の会計士事務所を全面的に検査·調査する完全な権限を持たなくなったと判断した場合、上記のいずれかの司法管轄区に本部を置く会計士事務所を使用して、米国証券取引委員会に提出された財務諸表に対して監査報告を発行し続け、委員会が指定した発行者として再決定する。私たちが将来証監会が指定した発行元に指定されない保証はありません。もし私たちが2年連続で証監会が指定した発行者に指定されたら、私たちはHFCAA下の取引禁止令の制約を受けますので、ナスダック世界市場は私たちの証券を退市することを決定するかもしれません。3.D項を参照されたい。“リスク要因-中国でのビジネスに関連するリスク-PCAOBが中国にある監査役を全面的に検査または調査できない場合、私たちのアメリカ預託証明書および株は将来、HFCAAによる取引が禁止される可能性があるため、ナスダック世界市場は私たちの証券を退市することを決定するかもしれない。もしこのような状況が発生した場合、私たちのアメリカ預託証明書や株式がアメリカ以外の取引所に上場できるかどうか、あるいは私たちの株式の市場がアメリカ国外で発展するかどうかを決定することはできません。私たちのアメリカ預託証明書は市を退市したり、取引を禁止したり、それらが取得されたり、取引が禁止されたりする脅威は、私たちのアメリカ預託証明書の価値に実質的な悪影響を与える可能性があります“
私たちの業務を経営することと外国投資家に私たちの証券を売ることは中国当局の許可、許可、許可証と許可が必要です
私たちは中国の子会社を通じて一部の業務を展開しています。私たちの中国子会社は中国で業務を展開するために必要なすべての許可証と承認を得ており、これまでどのような許可証や承認の申請も拒否されていない。我々の中国子会社が中国で業務を展開するために必要な材料許可、承認、許可証、許可の詳細については、項目4.Bを参照されたい。業務概要-中国国内の材料許可、承認、許可証、許可。もし吾等が中国証監会、中国商監会又はその他の中国監督管理機関による任意の証券発行又は経営に必要な許可又は承認をタイムリー又は根本的に得ることができなかった場合、又はそのような許可又は承認を放棄したり、そのような許可又は承認を必要としない結論を無意識に得たり、又は適用された法律、法規又は解釈が変化した場合、将来このような許可又は承認を得る義務があり、吾等は罰金及び処罰を科される可能性があり、中国での業務活動を一時停止又は制限し、私たちの営業許可を取り消し、ウェブサイトを閉鎖し、任意の証券発行による収益の中華人民共和国への貢献を遅延又は制限することができる。または、私たちの業務、財務状況、運営結果、名声、および見通しに実質的な悪影響を及ぼす可能性のある他の制裁。また、中国証監会、中国民航総局、その他の中国監督管理機関
私たちが未来のどんな発行も賢明に止めるように要求するためにまた行動するかもしれない。したがって、もしあなたが私たちが時々提供する任意の証券の決済および受け渡しの前に市場取引や他の活動に従事すれば、あなたは決済および受け渡しが起こらない可能性がある危険を冒すだろう。3.D項を参照されたい。“リスク要因--中国でのビジネスに関するリスク--中国の新しい”データセキュリティ法“、”ネットワークセキュリティ審査方法“、”個人情報保護法“、多層的な保護計画に関する法規やガイドライン、および任意の他の将来の法律や法規を遵守することは、巨額の費用が発生し、私たちの業務に大きな影響を与える可能性がある”。“リスク要因--中国での業務経営に関連するリスク--私たちの現在の業務運営を管理する法律法規は、曖昧で不確実な場合がありますので、これらのリスクは、私たちの子会社の運営に大きな負の変化をもたらす可能性があり、私たちのアメリカ預託証明書の価値が大幅に下落したり、投資家に私たちの証券を提供したり継続したりする能力が完全に阻害され、投資家の証券価値が一文の価値もなくなる可能性があります”そして“リスク要因--中国でのビジネスに関するリスク--中国の法規によると、将来アメリカ市場で私たちの証券を発行するには、中国証監会の承認を得る必要があるかもしれない”
新興成長型企業と外国の非上場企業としての意味
新興成長型会社
私たちは“2012年創業始動法案”や“雇用法案”で定義されている“新興成長型会社”です。したがって、他の非新興成長型会社の上場実体に適した各種報告要求の特定免除を利用することができる。これらの免除には
•2002年サバンズ-オキシリー法404節の監査人認証要件の遵守が要求されていない
•PCAOBが通過する可能性のある強制監査会社のローテーションに関する任意の要求、または監査および財務諸表に関する追加情報を提供する監査師報告書の補足(すなわち、監査人の議論および分析)を遵守することは要求されていない
•“報酬発言権”、“頻度発言権”、および“黄金パラシュート発言権”のような役員報酬問題を株主諮問投票に提出する必要はない
•役員報酬と業績との相関、および最高経営責任者報酬と従業員報酬中央値との比較など、役員報酬に関する項目を開示する必要はない。
したがって、私たちはいくつかの投資家が私たちのアメリカ預託証明書の魅力が低下していると思うかどうか分からない。その結果、私たちのアメリカ預託証券取引市場はそれほど活発ではなく、私たちのアメリカ預託証明書の価格はもっと変動する可能性があるかもしれない。
(I)私たちの年間総収入が12.35億ドルを超える最初の会計年度の最後の日まで、新興成長型会社であり、(Ii)私たちの初公募(IPO)完了5周年後の会計年度の最終日、(Iii)取引法第12 b-2条の規定により、私たちが“大型加速申告会社”になった日は、最近完成した第2四半期の最終営業日までに、非関連会社が保有する私たちの普通株の時価が7億ドルを超えると発生する。あるいは(Iv)私たちが任意の3年間に10億ドルを超える転換不可能な債務証券を発行した日。
外国の個人発行業者
取引法によると、私たちは外国の個人発行者の地位を持つ非アメリカの会社です。新興成長型企業になる資格がなくなった後であっても、私たちが“取引法”に規定されている外国の個人発行者資格に適合している限り、米国国内の上場企業に適用される具体的な条項には拘束されない
•取引法では、取引法に基づいて登録された証券募集依頼書、同意または許可の章について規範化されている
•取引法では、内部者にその株式所有権及び取引活動の公開報告書の提出を要求する条項と、短期的に行われた取引から利益を得た内部者の責任と、
•取引法に規定されている規則は、特定の重大な事件が発生した場合に、監査されていない財務及び他の特定の情報を含むForm 10−Q四半期報告、又はForm 8−Kの現在の報告を米国証券取引委員会に提出することを要求する。
また,取引法に基づいて証券を登録している米国国内会社のようにタイムリーに米国証券取引委員会に年報や総合財務諸表を提出する必要はなく,重大な情報の選択的開示を制限するFD法規を遵守する必要もない。
外国の個人発行者や新興成長型会社も、より厳しい役員報酬開示規則の制約を受けない。したがって、新興成長型企業の資格に適合しなくなっても、外国人個人発行者であっても、新興成長型会社でも外国人個人発行者でもない会社に要求されるより厳しい報酬開示を免除し続ける。
リスク要因
投資家は、我々の米国預託証明書への任意の投資に投資または維持するか否かを決定する前に、本年度報告における他の部分および“経営および財務回顧および展望”における総合財務諸表および関連付記を含む、以下に述べるリスクおよび不確実性、ならびに本年度報告における他の情報を慎重に考慮すべきである。このようなリスクが発生した場合、私たちの業務、財務状況、運営結果、あるいは見通しは重大な悪影響を受ける可能性がありますので、私たちのアメリカ預託証明書の市場価格は低下し、一部または全部の価値が損失する可能性があります。以下に説明するリスクと不確実性は私たちが直面している唯一の危険と不確実性ではない。私たちは今知らないか、あるいは私たちが現在どうでもいいと思っている他のリスクと不確実性はまた私たちの業務に悪影響を及ぼすかもしれない。
私たちの限られた経営歴史、財務状況、資本要求に関するリスク
私たちの経営の歴史は限られており、設立以来ずっと重大な運営損失を受けており、予測可能な未来に重大な損失が予想されている。私たちはどんな収入も利益を達成しないかもしれないし、あるいは、もし私たちが利益を達成すれば、私たちは持続できないかもしれない。
バイオ製薬製品開発は投機性の強い仕事であり、大きなリスクに関連している。著者らは臨床段階の生物製薬会社であり、運営歴史は限られており、投資家はこれに基づいて著者らの業務と将来性を評価することができる。私たちは2012年に運営を開始し、これまで、私たちは主に私たちの会社、業務計画、資金調達、研究開発活動の展開、私たちの知的財産権の組み合わせの構築、潜在的な候補製品の発見及び臨床前研究と臨床試験に集中してきた。候補製品を発見し開発する方法は実証されておらず、ビジネス価値のある製品を開発できるかどうかもわかりません。われわれの臨床開発ではrademikibartとicanbelimodのみである。このような活動の資本要件を満たすことを含む、任意の候補製品の開発を継続したり、それをさらなる臨床試験に進めることができる保証はない。規制部門の承認を得たり、ビジネス規模の製品を製造したり、第三者代表がそうしてくれたり、成功した製品の商業化に必要な販売やマーケティング活動を行う能力があることは証明されていません。したがって、もし私たちがバイオ製薬製品の開発と商業化に成功した歴史があれば、私たちの将来の成功や生存能力のいかなる予測もそれほど正確ではないかもしれない。
設立以来、私たちは深刻な運営損失が発生した。もし私たちの候補製品が成功的な開発と承認を受けなければ、私たちは決して何の収入も生じないかもしれない。2023年、2023年、2022年12月31日までの年間純損失はそれぞれ5,950万ドルと1.181億ドルだった。2023年12月31日現在、私たちは累計5.393億ドルの赤字を計上しています。我々のほとんどの損失は,我々の研究や開発計画に関する費用と我々の運営に関する一般的かつ行政コストによるものである.私たちの候補製品は大量の追加的な開発時間と資源を必要とし、その後、規制の承認を申請したり、製品販売から収入を得ることができます。私たちは予測可能な未来に損失を被ることが予想され、私たちは計画中の臨床前研究と臨床試験を行い、私たちの研究と開発活動を継続し、私たちの生産能力を高め、私たちの候補製品のための規制承認を求め、より多くの人員を募集し、私たちの知的財産権を獲得し、保護し、私たちの候補製品ルートを商業化または拡大するために追加のコストを発生させるため、これらの損失は大幅に増加することが予想される。
利益を実現し、維持するためには、大量の収入を生む製品を開発し、最終的に商業化しなければならない。これは、私たちの候補製品の臨床前研究と臨床試験を完成させ、これらの候補製品の規制承認を得ること、および私たちが規制承認を得る可能性のある任意の製品を含む、一連の挑戦的な活動で成功することを要求するだろう。私たちはただこのような活動の大多数の初期段階にいるだけだ。私たちはこのような活動で決して成功しないかもしれないし、たとえ私たちが成功しても、利益を達成するのに十分な収入が生まれないかもしれない。また私たちはまだ能力を示していません
会社が新たかつ急速に発展する分野でよく遭遇する多くのリスクと不確実性、特にバイオ製薬業界での克服に成功した。バイオ製薬製品開発に関連する多くのリスクや不確実性のため、費用を増加させる時間や金額、あるいはいつ、または利益を達成できるかどうかを正確に予測することはできない。たとえ私たちが利益を達成したとしても、私たちは収益性を維持したり向上させることができないかもしれない。もし私たちが達成して利益を維持できなければ、私たちのアメリカ預託証明書の価値は低くなるかもしれません。私たちは資金を調達し、業務を拡大し、研究開発努力を維持し、私たちの候補製品を多様化し、更には私たちの業務を継続する能力が損なわれる可能性があり、私たちのアメリカ預託証明書の一部或いは全部の価値は損失する可能性があります。
私たちは私たちの目標を達成するために多くの追加資金を必要とするだろうし、必要な時に受け入れ可能な条件で必要な資金を獲得したり、これらの資金を得ることができなければ、私たちの製品開発計画、商業化努力、または他の運営を延期、制限、減少または終了させることができるかもしれない。 私たちの既存の資本は規制部門の承認を通じて候補製品に資金を提供するのに十分ではなく、私たちはそれらの開発と商業化を達成するために追加の資本を調達する必要があるだろう。
バイオ製薬候補製品の開発は資本集約型である。私たちの設立以来、私たちは私たちの運営を支援するために大量の現金を使用しており、今後数年間私たちの持続的な活動に関連する費用が増加することが予想され、特に私たちは計画中のレドミクバートとicanbelimodの臨床試験を行い、他の任意の候補製品の研究と開発を継続し、規制機関に現在の候補製品と私たちが開発する可能性のある任意の未来の候補製品を承認することを求めている。特に、私たちは、私たちの主要候補製品rademikibartの次の段階の臨床開発を支援するために、より多くの経験やインフラを提供するために、潜在的なグローバル·地域パートナーを積極的に探しています。私たちがタイムリーに基づいて、または許容可能な条件下で任意の必要なパートナーシップを保証することは保証されない。さらに、各パートナーシップの条項と条件によって、私たちがコントロールできない外部要因は、このようなパートナーシップの下でマイルストーン支払いまたは特許使用料を受け取ることに影響を与える可能性があります。例えば、2023年11月21日、両社の完全子会社Connect HKおよびConnect SZ、すなわちConnect許可者は、Simcere製薬有限会社またはSimcereライセンス側と独占ライセンスおよび協力協定、またはSimcereプロトコルを締結して、大中国のRdemikibartを開発して商業化する。より多くの情報については、10.C項を参照されたい。“材料契約”。しかし、適用される法律の変化、政府行動、または私たちがコントロールできない他の類似した状況のような外部要素は、Simcere許可者がSimcereプロトコルに従って私たちの将来の支払い遅延または中断を招く可能性がある。また,我々の中国rademikibart実験が実験プロトコルに規定されている対応する主要な終点に達しなかった場合,Simcere許可者はSimcereプロトコルを終了する権利がある.
また、私たちの候補製品が開発と商業化の過程で進展するにつれて、私たちの許可者と他の第三者に印税やその他のお金を支払う必要があるかもしれません。さらに、私たちが将来的に獲得を求めている場合、または許可範囲内でより多くの候補製品または権利を獲得する場合、私たちは大量の前払い、マイルストーン支払い、許可支払い、印税支払い、および/または他のタイプの支払いを支払う必要があるかもしれない。もし私たちの候補製品が規制部門の承認を得たら、製品製造、マーケティング、販売、流通に関連した巨額の商業化費用が発生することも予想される。いかなる臨床試験或いは臨床前研究の結果はすべて高度に不確定であるため、著者らは著者らの候補製品の開発と商業化に成功するために必要な実際の数量を合理的に見積もることができない。また、上場企業の運営に関する巨額のコストが発生しており、上場企業としての運営に関する巨額のコストが発生し続ける見通しである。したがって、私たちは私たちの持続的な業務と関連した多くの追加資金を得る必要があるだろう。もし私たちが必要な時や魅力的な条件下で資金を調達したり、代替融資源を見つけることができない場合、私たちは私たちの研究開発計画や将来の商業化努力を延期、減少または廃止することを余儀なくされます。私たちは、私たちが将来達成する可能性のある任意の許可や協力協定に関する努力を含めて、私たちの努力をより少ない候補製品に集中させて、私たちの資源を保護する必要があるかもしれません。
私たちの現在知られていない多くの要素のため、私たちの運営計画と私たちの現金資源に対する他の需要は変化する可能性があり、私たちは計画よりも早く追加資金を求める必要があるかもしれません。潜在的な協力、ライセンス、その他の同様の手配を含む、公共または私募株式または債務融資または他の資本源を通じて。また、有利な市場条件や戦略的考慮により、現在または将来の運営計画のために十分な資金があると考えても、追加の資本を求めることができる。
いかなる追加的な融資努力も、私たちの経営陣の彼らの日常活動に対する関心を移す可能性があり、これは私たちが現在と未来の候補製品を開発し、商業化する能力に悪影響を及ぼすかもしれない。追加的な資金は受け入れ可能な条項では得られないかもしれないし、全く得られないかもしれない。新型肺炎の大流行とその蔓延を緩和するための行動、金利と経済インフレの実際または予想変化、露烏戦争の影響により、世界の信用と金融市場は流動性と信用供給の深刻な減少、消費者自信の低下、経済成長の低下を含む極端な変動と破壊を経験した
失業率の上昇、そして経済的安定性の不確実性。株式市場や信用市場が悪化すれば、任意の必要な債務や株式融資をより困難にし、コストをより高くしたり、希釈度を高くしたりする可能性がある。
私たちの未来の資金調達需要は多くの要素に依存するだろう
•私たちは、将来行われる候補製品の臨床試験および臨床前研究のタイプ、数量、範囲、進展、拡張、結果、コスト、および時間を行うか、または選択することができる
•私たちの候補製品の使用に関する安全問題
•より多くの情報を得ると、私たちの候補製品の効果に関する不利な発見があります
•我々の候補製品の製造コストと時間は、商業製造を含む(任意の候補製品が承認された場合)
•私たちの候補製品に対する規制審査のコスト、時間、結果
•当社の特許および他の知的財産権および独自の権利を取得、維持、強制および保護し、第三者知的財産権および独自権利に関連する紛争を解決するためのコスト;
•財務報告の内部統制を強化することを含む上場企業としての義務を履行するために、運営システムの強化と増任者の強化に努めている
•私たちの臨床活動の増加に伴い、より多くの人員やコンサルタントの雇用に関するコストが増加している
•私たちはライセンス者と他の第三者に特許使用料または他のお金の時間と金額を支払わなければならない
•任意の候補製品が承認された場合、販売およびマーケティング能力のコストおよび時間を確立または確保する
•私たちは第三者支払者から十分な市場受容度、カバー率、および十分な補償を得ることができ、任意の承認された製品のために十分な市場シェアと収入を得ることができる
•協力、許可、および他の同様のスケジュールの条項および時間を確立して維持すること;
•私たちが許可または取得可能な任意の候補製品、製品、または技術に関連するコスト。
臨床試験と臨床前研究を行うことは時間がかかり、高価と不確定な過程であり、数年の時間をかけて完成する必要があり、しかも著者らは永遠に監督部門の許可を得て製品販売を実現するために必要なデータ或いは結果を生成できないかもしれない。しかも、私たちの候補製品が承認されれば、商業的成功を得られないかもしれない。私たちの商業収入は、もしあれば、何年も商業用途がないと予想される製品を販売します。もしなければ。
したがって、私たちは追加的な資金調達に依存して私たちの業務目標を達成し続ける必要があるだろう。私たちは受け入れ可能な条項で十分な追加融資を受けることができないかもしれないし、根本的にできないかもしれない。もし私たちが必要な時や魅力的な条件下で資金を調達できない場合、私たちは私たちの製品開発を延期、制限、減少または終了させたり、将来の商業化努力を強要したり、第三者に候補製品を開発およびマーケティングする権利を与えたりします。そうでなければ、私たち自身を開発し、マーケティングすることができます。この場合、私たちの業務の発展と支援、市場挑戦に対応する能力が大きく制限される可能性があり、これは私たちの業務、財務状況、運営結果に大きな悪影響を及ぼす可能性があります。
また、現金や現金等価物の大部分を米国の主要金融機関や国際金融機関の口座に保持しており、その中には一部の機関の預金が保険限度額を超えている。市場状況はこのような機関の生存能力に影響を及ぼすかもしれない。例えば、2023年の間、シリコンバレー銀行(SVB)はカリフォルニア州金融保護·革新部(FDIC)によって閉鎖され、FDICは、新たに設立された移行銀行(Silicon Valley Bank,N.A.)、またはSVBから移行したすべての資産を担うSVB NAを監督する係に任命される。ノースカロライナ州ローリー市のFirst−Citizens Bank&Trust Companyは後にSVBのすべての預金と融資を購入し,SVBの預金者はFirst Citizensの預金者となった。私たちはFirst Citizensだけで少量の預金を持っていて、私たちの預金の大部分をFirst Citizensから他の金融機関に移したので、私たちは現在First Citizensや他の金融機関で私たちの預金を取得することに問題がないと予想している。しかし、現金や現金等価物を維持している任意の金融機関が倒産したり、合意した金融機関が倒産したりすれば、未保険資金をタイムリーにまたは根本的に得ることができる保証はありません。このような資金を得ることができない場合や遅延されたどんな状況も、私たちの業務と財務状況に悪影響を及ぼす可能性がある。
追加資本の調達は、私たちの株主(私たちのアメリカ預託証明書保持者を含む)に大量の希釈をもたらし、私たちの運営を制限したり、私たちの技術または候補製品の権利を放棄することを要求するかもしれません。
これまで、相当な収入を生み出すことができれば、潜在的な協力、ライセンス、その他の同様の手配を含む株式発行、債務融資、または他の融資源を通じて、私たちの業務および運営需要に資金を提供する予定です。私たちが株式または転換可能な債務証券を売却することで追加資本を調達する場合、投資家の所有権権益は大幅に希釈される可能性があり、これらの証券の条項は清算または他の特典を含む可能性があり、投資家が私たちのアメリカ預託証券所有者としての権利に悪影響を及ぼす可能性がある。私たちは現在、Leerink Partners LLC(SVB Securities LLC)とCantor Fitzgerald&Coとの販売合意に基づいて、時々“市場”で発行·販売される300,000,000ドルに達する米国預託証明書を含む有効な米国預託証明書を持っている。この販売協定によると、私たちの米国預託証明書は米国預託証明書を減記または販売されていないが、このような融資が達成されれば、私たちの証券保有者に大きな希釈をもたらす可能性がある。
債務融資および優先株融資に関与する可能性のある協定は、追加債務を招く、資本支出を行う、または配当を宣言するなど、私たちが具体的な行動をとる能力を制限または制限する契約を含む。
もし私たちが将来の協力、許可、その他の同様の手配を通じて資金を調達すれば、私たちは私たちの将来の収入源、研究計画、または候補製品に対する貴重な権利を放棄しなければならないかもしれないし、私たちに不利である可能性があり、および/または私たちのアメリカ預託証明書の価値を低下させる可能性がある条項で許可を付与しなければならないかもしれない。このような第三者配置のため、私たちはまた、臨床試験の速度と範囲のような、私たちの製品または候補製品の開発の制御を失う可能性がある。もし私たちが必要な時に株式や債務融資で資金を調達できない場合、私たちは私たちの製品開発や将来の商業化努力を延期、制限、減少または終了することを要求されるか、あるいは私たちがより開発とマーケティングを望んでいた製品または候補製品を開発し、マーケティングする権利を与える。
我々の候補製品の発見,開発,規制承認に関するリスク
臨床薬物開発は長くて高価な過程に関連し、結果は不確定である。私たちは、私たちの候補製品の開発と商業化を完成または最終的に達成できない過程で予測できないコストや遅延が生じるかもしれない。
我々は臨床薬物開発活動を展開しようとしているすべての司法管轄区域はこれらの活動を深くかつ詳細に監督した。私たちはアメリカと中国を含む主要市場に私たちの活動を集中させるつもりだ。私たちは現在、アメリカ、中国、EU、あるいはEU、オーストラリア、ニュージーランドを含む臨床試験を行っており、各司法管轄区域の多くかつ異なる規制要求を守らなければならない。FDA、アメリカ国家薬品監督管理局、欧州委員会あるいは他の類似の外国監督機関が私たちの候補製品の販売を許可する前に、私たちは私たちの候補製品の有効性と安全性を証明するために、臨床前開発と広範な臨床試験を完成しなければならない。臨床テストは高価で時間がかかり、不確実性も存在する。1つまたは複数の臨床試験の失敗はこの過程の任意の段階で発生する可能性があり、臨床前研究および早期臨床試験の結果は後の臨床試験の成功を予測できない可能性がある。そのほか、臨床前と臨床データはよく異なる解釈と分析の影響を受けやすく、多くの会社は彼らの候補製品が臨床前研究と臨床試験で満足できると考えているが、しかし依然としてその薬物の発売許可を得られなかった。
私たちはどんな臨床試験も計画通りに起動したり、計画通りに完成することを保証することはできない。例えば,中国政府のガイドラインに基づき,我々は2023年にレドミキバートに関する2つの新しい研究を開始し,薬物登録申請をさらに支援することを決定した。INDまたは同様の出願の提出がFDA、NMPA、EU加盟国、または他の規制機関に(適用される場合)臨床試験の即時開始を可能にするかどうかも確認できません。また,これらの試験期間中であっても,規制当局のこのような臨床試験の一時停止や終了を招く可能性があるという問題がある。1つまたは複数の臨床試験の失敗は試験の任意の段階で起こる可能性があり、私たちの将来の臨床試験は成功しないかもしれない。成功またはタイムリーな臨床試験の開始または完了を妨げる可能性のあるイベントは、
•臨床試験の開始または継続を支援するために、十分な臨床前、毒理学または他の体内または体外データを生成することはできない
•遅延と監督当局は臨床試験の研究設計或いは実施について合意した
•試験開始の規制許可または許可を得ることができなかったか、または規制当局が研究範囲または設計について適用した条件を遵守できなかった
•遅延と予想される契約研究組織またはCROと臨床試験地点は受け入れ可能な条項について合意し、その条項は広範な交渉を行うことができ、異なるCROと臨床試験地点の間に有意差が存在する可能性がある
•適切な臨床研究者の確定、採用、訓練に遅延が発生した
•各臨床試験場所における必要な倫理委員会または機関審査委員会またはIRBの承認を得ることを遅延させるか、またはIRBが私たちの臨床試験を終了または一時停止するか
•臨床試験のために十分に安定した数の私たちの候補製品を生産、試験、発表、検証、または輸入/輸出を遅延させるか、または上記のいずれの操作も行うことができない
•臨床試験に必要な候補製品或いは他の材料の供給或いは品質が不足或いは不十分であり、或いは臨床試験に適した製造技術を十分に開発、確定或いは制御する方面で遅延が発生した
•規制当局は、INDまたは修正案または同等の外国申請または修正案を審査した後、新たな安全発見によって臨床試験参加者に不合理なリスクを構成すること、または私たちの臨床試験操作または研究場所の検査結果が陰性であることを含む、様々な理由で一時的、部分的、全部または永久的な臨床一時停止を実施する
•競争相手による関連技術試験の進展はFDA、NMPA、EMA或いは外国監督機関のこの技術の患者に対する広範なリスクに対する懸念を引き起こし、或いはFDA、NMPA或いは外国監督機関は研究方案或いは計画が明らかに不足していることを発見し、その声明の目標を実現できなかった
•適切な患者を遅延または募集、スクリーニングおよび募集できなかったこと、および患者が臨床試験から退出したか、または治療後のフォローアップに戻らなかったことによる遅延または失敗;
•患者団体や調査者と協力することは困難です
•CRO、他の第三者、または臨床試験プログラムを遵守できませんでした
•FDA、NMPA、EMAまたは任意の他の類似した外国監督機関の良好な臨床実践要求またはGCPまたは他の国に適用される規制ガイドラインに従って臨床試験を行うことができなかった
•候補製品に関連する有害事象の発生は、その潜在的な利益を超えると考えられるか、または他社が行う同一種類の薬剤の試験において不良事象を発生させると考えられる
•臨床試験案を修正し
•臨床サイトが試験案から外れているか、または試験から離脱した者
•新しい臨床プログラムの規制要件およびガイドラインの変更を修正または提出する必要がある
•臨床開発計画に基づく看護基準の変化は、新しいまたは追加の試験を必要とするかもしれない
•結果データを長時間観察または分析する必要がある臨床終点を選択すること
•私たちの候補製品の臨床試験コストは予想以上に高く
•私たちの候補製品の臨床試験は否定的または不確定な結果をもたらし、これは、私たちが追加の臨床試験を要求したり、そのような候補製品の開発を放棄したりすることを決定または監督機関に要求する可能性がある
•製造プロセスを、契約製造組織またはCMOによって運営されるより大規模な施設に移し、私たちのCMOまたは私たちは、これらの製造プロセスを任意の必要な変更を遅延させるか、または行うことができない
•第三者は私たちに対するそれの契約義務を履行したくないか、または履行できない。
臨床試験はFDA,NMPA,その他の類似した外国規制機関の要求,法規やガイドラインに従って行わなければならず,これらの要求,法規やガイドラインは意外かつ重大な変化が生じる可能性があり,これらの政府機関や臨床試験を行う医療機関の倫理委員会やIRBsの監督を受ける。臨床試験が、我々、データ安全監視委員会またはFDA、NMPA、または任意の他の同様の外国規制機関によって一時停止または終了された場合、またはそのような試験を行った機関のIRBsが、その臨床研究者およびその審査を受けた場所の参加を一時停止または終了した場合、候補製品を開発する際に遅延または失敗に遭遇する可能性がある。関係当局はいくつかの要素のために臨床試験を一時停止または中止することができ、それに従わなかったことを含む
これらの問題は、臨床試験の安全性要件または私たちの臨床規程;FDA、米国国家薬品監督管理局または他の同様の外国の監督管理機関の臨床試験操作または試験場所の検査による臨床一時停止、予見できない安全問題または副作用、候補製品の使用のメリットを証明できなかった、政府法規または行政措置の変化、または臨床試験を継続するのに十分な資金が不足している要素を含む。
また,海外では候補製品の臨床試験が行われており,われわれが行っている臨床試験のように追加のリスクをもたらし,われわれの臨床試験の完成を遅らせる可能性がある。これらのリスクには、外国に登録された研究参加者が医療サービス、言語または文化的慣習の違いによって臨床案を遵守できなかったこと、外国の規制制度に関連する追加行政負担の管理、戦争を含むこのような外国に関連する政治的および経済的リスクが含まれる。例えば,ウクライナで我々が行っているicanbelimodやrademikibart試験を含むCROを米国以外で臨床試験を行っている。ロシアとウクライナの戦争は、私たちがウクライナと周辺地域で裁判を続ける能力に影響を与え、以前これらの国に位置していた場所から裁判データを得ることを阻止した。これはまた、私たちの臨床試験および/または臨床結果分析の完了を延期し、これは私たちの業務に実質的な損害を与える可能性がある。
また,われわれの臨床試験の首席研究員は時々私たちの科学コンサルタントやコンサルタントを務め,このようなサービスに関する報酬を得る可能性がある。場合によっては、私たちはFDA、NMPA、または任意の他の同様の外国規制機関にいくつかの関係を報告することを要求されるかもしれない。FDA、NMPAなどの外国の監督管理機関は結論を出す可能性があり、私たちと主要な研究者との間の財務関係は利益の衝突をもたらし、あるいは他の方法でこの研究の解釈に影響を与えた。そのため、FDA、アメリカ国家薬品監督管理局或いは類似の外国監督機関は適用された臨床試験地点で発生したデータの完全性を疑問視する可能性があり、臨床試験自体の効用が脅かされる可能性がある。これはFDA、NMPAなどの外国規制機関が私たちの上場申請の承認を遅延または拒否することを招き、最終的に私たちの候補製品が上場承認を拒否される可能性がある。
私たちの候補製品の任意の臨床試験の遅延または失敗は私たちのコストを増加させ、私たちの候補製品の開発と承認過程を遅くし、私たちの製品販売を開始し、製品収入を創造する能力を遅延または危険にさらす可能性がある。さらに、臨床試験の開始または完了遅延をもたらす多くの要因は、最終的には、私たちの候補製品が規制部門の承認を得ることを拒否される可能性もある。したがって、私たちの臨床試験で発生したいかなる遅延や失敗も、私たちが独占的に候補製品を商業化する権利を持つ可能性がある任意の時間帯を短縮することができ、私たちの競争相手は私たちの前に製品を市場に出すかもしれません。私たちの候補製品の商業的可能性は著しく低下するかもしれません。このようなどんな状況でも、私たちの業務、財政状況、そして見通しに大きな被害を及ぼす可能性がある。
また,FDAや他の規制機関の臨床試験に関する政策が変わる可能性があり,追加の政府法規が公布される可能性がある。例えば,EUの臨床試験に関する規制構造が最近変化している。EU臨床試験条例,あるいはCTRと呼ばれ,2014年4月に採択され,EU臨床試験指令が廃止され,2022年1月31日に施行された。EU臨床試験指令は、臨床試験を行う各加盟国において、国家衛生当局と独立した倫理委員会に単独の臨床試験申請(CTA)を提出することを要求しているが、CTRは集中的な手続きを導入し、多センター試験の申請を提出することのみを要求している。CTRは、スポンサーが各会員国の主管当局と道徳委員会に文書を提出することを可能にし、各会員国が決定を下すことを可能にする。CTAの評価手続きも統一されており、すべての関連加盟国による共同評価を含み、道徳基準を含む各加盟国が個別にその領土に関する具体的な要求を評価する。各会員国の決定は集中されたEUポータルサイトを通じてスポンサーに伝達される。CTAが承認されると,臨床研究開発は継続可能である。CTRは3年間の過渡期が予想される。進行中の臨床試験と新たな臨床試験がCTRによってどの程度制御されるかはそれぞれ異なる。2022年1月31日までにEU臨床試験指令に基づいて申請を提出した臨床試験、または(Ii)が2022年1月31日から2023年1月31日までの間、かつスポンサーがEU臨床試験指令に適用される臨床試験を選択し、2025年1月31日までこの指令の管轄を受ける。この日以降,すべての臨床試験(行われている臨床試験を含む)はCTR条項に拘束される。我々と我々の第三者サービスプロバイダ(例えばCRO)がCTR要求を遵守することは、我々の開発計画に影響を与える可能性がある。
私たちの候補製品は臨床試験における患者登録人数に依存する。もし著者らが臨床試験で患者を募集する時に遅延或いは困難に遭遇すれば、著者らの研究開発仕事及び業務、財務状況と運営結果は実質的な不利な影響を受ける可能性がある。
臨床試験の成功と適時な完成には十分な数の候補患者を募集する必要がある。われわれが行ったこれらの試験や他の試験は,患者登録時間が予想よりも長く,患者の退出や有害事象を含む様々な原因で遅延する可能性がある。このような種類の開発は私たちが実験を延期したり、さらなる開発を中断させることを招くかもしれない。
私たちの臨床試験は、私たちの候補製品と同じ治療分野での他の臨床試験と競争し、この競争は、私たちの試験に参加することを選択する可能性のある患者の中には、私たちの競争相手のうちの1つによる試験に参加することを選択するかもしれないので、利用可能な患者の数およびタイプを減少させる。合格した臨床研究者と臨床試験地点の数が限られているため、著者らはいくつかの競争相手が使用している同じ臨床試験地点で著者らのいくつかの臨床試験を行い、これらの臨床試験地点で臨床試験を行うことができる患者数を減少させることが予想される。また,臨床研究に利用可能な患者プールは限られている可能性がある。我々の臨床研究の資格基準は、我々が測定可能な特定の特徴を有することを患者に要求するか、あるいは彼らの疾患が十分に深刻でないか、あまり深刻ではないことを保証するため、利用可能な研究参加者をさらに制限する。
患者の入選は他の要因にも依存しています
•患者群の大きさと性質;
•調査中の病気の重症度は
•試験の資格基準
•患者と臨床場所の距離
•臨床プログラムの設計
•患者の同意を得て維持する能力
•適切な能力と経験を持つ臨床試験研究者を募集する能力
•臨床試験に参加した患者は、私たちの製品候補薬または試験が完了する前に試験から退出するリスク;
•競争的臨床試験の有用性
•臨床試験で調査されている適応の新薬または調査中の候補薬の供給状況;
•研究中の薬物と他の既存の治療法との間の潜在的なリスクと優位性に対する臨床医師と患者の見方。
これらの要素は、私たちが十分な患者を募集して、適時かつ費用効果的に私たちの臨床試験を完成させることを困難にするかもしれない、あるいは1つ以上の臨床試験を完全に放棄する必要があるかもしれない。例えば,ウクライナで我々が行っているicanbelimodやrademikibart試験を含め,米国以外でCROを招いて臨床試験を行い,2022年にウクライナの患者登録が戦争で中断された。私たちの候補製品のすべての臨床試験の完了を遅延または終了することは私たちのコストを増加させ、私たちの候補製品の開発と承認過程を遅くし、私たちの製品販売と収入を創造する能力を遅延または危険にさらす可能性がある。さらに、臨床試験の開始または完了遅延をもたらすいくつかの要因は、最終的には、私たちの候補製品が規制部門の承認を拒否される可能性もある。
私たちの候補製品は深刻な有害事象や副作用に関連している可能性があり、あるいはその臨床開発を遅延または停止し、その規制承認を遅延または阻止し、その商業潜在力を制限し、あるいは重大な負の結果を招く可能性のある他の特性を持っている可能性がある。
私たちの候補製品によって引き起こされる有害事象や他の副作用は、私たちまたは規制機関の臨床試験の中断、延期、または停止を招く可能性があり、より厳しいラベル、またはFDA、NMPAまたは他の同様の外国規制機関のこのような候補製品に対する規制承認が延期または拒否される可能性がある。われわれの臨床試験結果は副作用や予期せぬ特徴の重症度と流行度を示す可能性がある。候補製品の臨床試験では治療に関連する有害事象が観察された。
臨床試験を行っている間、患者は彼らの研究医に疾病、傷害、不快感を含む彼らの健康変化を報告した。一般に、研究されている候補製品がこれらの状況をもたらしているかどうかを決定することは不可能だ。私たちがより大きく、より長く、より広い臨床試験で私たちの候補製品を試験するとき、またはこれらの候補製品の使用がより広くなるにつれて(規制部門の許可を得た場合)、患者は、以前の試験で観察された疾患、傷害、不快感、および他の有害事象、および以前の試験で発生しなかったか、または検出されなかったことを報告する。多くの場合,研究製品が大規模臨床試験で試験を行った後,あるいは承認後に患者にビジネス規模の製品を提供した後にのみ,副作用を検出することができる場合がある。われわれのicanbelimod第1段階試験の単回用量レジメンでは,2.5 mg icanbelimod治療を受けた健常成人で一過性停止に関連する徐脈が出現し,治療に関連する重篤な有害事象と考えられた。被験者は高流量酸素治療を受け,完全に回復した。
どんな深刻な有害事象が発生した場合、私たちが開発または商業化した任意の候補製品または製品の臨床試験または商業流通は一時停止または終了する可能性があり、私たちの業務は深刻な損害を受ける可能性がある。治療に関連する副作用はまた、患者の募集と患者の試験完了或いは潜在的責任クレームを招く能力に影響を与える可能性がある。規制当局は、私たちに、任意のまたはすべての目標適応の任意の候補製品または製品の販売を停止することを要求することを、さらなる開発を停止し、承認を拒否するか、または要求することができる。もし私たちが任意の臨床試験または商業化努力を延期、一時停止または終了することを要求された場合、1つまたは複数の候補製品または製品の商業的見通しが損なわれる可能性があり、これらの製品または私たちが開発した他の候補製品から製品収入を創出する能力が延期またはキャンセルされる可能性がある。さらに、もし私たちの1つまたは複数の候補製品が発売承認され、私たちまたは他の人が後にこのような製品によって引き起こされる不良副作用または有害事象を発見した場合、多くの潜在的な重大な負の結果をもたらす可能性があるが、これらに限定されない
•規制部門は、このような製品の承認を一時停止、制限、または撤回することができ、またはその製造または流通を禁止する禁止を求めることができる
•規制当局は、“ボックス”警告、または安全警報、親愛なるヘルスケア提供者レター、プレスリリース、または警告または製品に関する他のセキュリティ情報を含む他の通信を含むラベルに警告を追加することを要求することができる
•私たちは製品の投与方法を変更したり、追加の臨床試験を行ったり、承認した後の研究を要求されるかもしれない
•リスク評価および緩和戦略、またはREMSを作成する必要があるかもしれませんが、そのような副作用のリスクを概説し、患者に配布する薬物ガイドラインが含まれている場合があります
•私たちは罰金、禁止、または行政または刑事罰を受けるかもしれない
•私たちは起訴され、患者への傷害に責任を負うかもしれない
•私たちの名声は損なわれるかもしれない。
これらの事件のいずれも、特定の候補製品に対する市場の受容度を達成または維持することを阻止することができ、承認されれば、私たちの業務を深刻に損なう可能性がある。
我々はすでに国際地点で我々の候補製品の臨床試験を継続することが可能であり,適用された規制機関は外国地点での試験データを受け入れない可能性がある。
我々はすでに我々の候補製品のために米国以外で臨床試験を行い,将来的にも選択して行うことが可能である。FDAや同様の外国規制機関が米国や他の管轄地域以外で行われている臨床試験を受ける研究データは,特定の条件によって制限される可能性があり,まったく受け入れられない可能性もある。外国の臨床試験からのデータが米国での上場承認の唯一の根拠となることを意図している場合、FDAは通常、(I)データがアメリカの人口とアメリカの医療実践に適用されない限り、外国のデータのみに基づいて申請を承認しない。(Ii)試験は公認能力を有する臨床研究者によって行われ、GCP規定に適合する。および(Iii)データは、FDAによる現場検査を必要とすることなく、有効であると考えることができ、またはFDAがこのような検査を行う必要があると考えた場合、FDAは、現場検査または他の適切な手段によってデータを検証することができる。また,海外の研究データが承認の唯一の根拠としようとしていなくても,その研究がINDに基づいて行われていなければ,FDAはそのデータを上場承認申請の支援として受け入れず,本研究がGCP要求に基づいて行われない限り,FDAは必要と考えた場合に現場検査によりその研究からのデータを検証できる必要がある。多くの外国の規制機関も似たような要求を持っている。また、このような外国裁判は、裁判を行う外国司法管轄区域に適用される現地法によって管轄される。FDA、NMPA、または任意の他の類似した外国規制機関が、米国または適用司法管轄区域以外で行われた試験データを受け入れることは保証されない。FDA、NMPA、または他の類似した外国の規制機関がこれらのデータを受け入れない場合
候補製品の臨床試験を見ると、追加の試験が必要になる可能性があり、これは高価で時間がかかり、候補製品の開発を延期または永久的に停止する可能性がある。
著者らが時々公表或いは公表した臨床試験の一時、“第一線”或いは初歩的なデータは更に多くの患者データの獲得に従って変化する可能性があり、そして監査と検証手続きの影響を受け、これは最終データの重大な変化を招く可能性がある。
私たちは時々私たちの臨床前研究と臨床試験の主要或いは初歩的なデータを公開する可能性があり、これらのデータは当時利用可能なデータの初歩的な分析に基づいて、結果及び関連する発見と結論は特定の研究或いは試験の関連データをより全面的に審査した後に変化する可能性がある。私たちはまた、私たちのデータ分析の一部として、すべてのデータを全面的かつ詳細に評価する機会がないか、または受け取る機会がないかもしれないという仮説、推定、計算、および結論を出した。また,逐一分析からではないデータを比較する際には,どのような結論も慎重に得るべきである。したがって、より多くのデータが受信され、十分に評価されると、私たちの報告の主要または予備結果は、同じ研究の将来の結果とは異なる可能性があり、または異なる結論または考慮要因が、これらの結果を合格させる可能性がある。トップラインや予備データはまだ監査と確認手続きを受ける必要があり、これは最終データが以前に公表された予備データと大きく異なる可能性がある。したがって、最終データが利用可能になる前に、トップラインまたは予備データは慎重に見られなければならない。
私たちはまた時々私たちの臨床前研究と臨床試験の中期データを開示することができる。私たちが完成する可能性のある臨床試験の中期データは、患者登録の継続とより多くの患者データの獲得に伴い、あるいは私たちの臨床試験の患者が彼らの疾患の他の治療を継続するにつれて、1つまたは複数の臨床結果が実質的に変化する可能性があるというリスクを受ける可能性がある。初期または中期データと最終データとの間の不利な違いは、私たちのビジネスの将来性を深刻に損なう可能性があります。 私たちまたは私たちの競争相手が中間データを開示することはまた私たちのアメリカ預託証明書の価格変動を招く可能性がある。
さらに、規制機関を含む他の人は、私たちの仮定、推定、計算、結論または分析を受け入れないか、またはデータの重要性を異なる方法で解釈またはトレードオフする可能性があり、これは、特定の計画の価値、特定の候補製品または製品、ならびに私たちの米国預託証明書の承認または商業化に影響を与える可能性がある。さらに、私たちが開示する特定の研究または臨床試験に関する情報を選択することは、一般に広範な情報に基づいており、投資家または他の人は、私たちが決定した重大または他の適切な情報が私たちの開示に含まれることに同意しない可能性がある。もし私たちが報告した中期、営業または予備データが実際の結果と異なる場合、または規制機関を含む他の人が結論に同意しない場合、私たちが承認を得て私たちの候補製品を商業化する能力は損なわれる可能性があり、これは私たちの業務、経営業績、将来性、または財務状況を損なう可能性がある。
承認を加速するルートを使用することで、FDA、NMPAなどの外国規制機関の承認を得ることを試みるかもしれません。もし私たちがそのような承認を得ることができなければ、私たちは予想以上の追加臨床試験を要求される可能性があり、これは必要な上場承認を得る費用を増加させ、必要な上場承認を遅らせる可能性がある。FDA、NMPA、または同様の外国規制機関の加速承認を得ても、我々の検証的試験が臨床的利益を確認していない場合、または厳格な上場後の要求を遵守していない場合、FDA、NMPAまたは同様の外国規制機関は承認撤回の加速を求める可能性がある。
私たちは未来に私たちの1つ以上の候補製品の承認を加速させることを求めるかもしれない。例えば、米国の加速承認計画の下で、FDAは、候補製品が臨床的利益を合理的に予測する可能性のある代替終点または中間臨床終点に影響を与えることを決定した後、既存の治療法よりも意義のある深刻または生命に危険な疾患の治療を目的とした候補製品の承認を加速することができる。FDAは臨床利益は特定の疾病の背景下で臨床意義のある積極的な治療効果であり、例えば不可逆的な発病率或いは死亡率であると考えている。承認を加速するために、代替終点は1つの標識であり、例えば実験室測定、放射画像、バイタルサイン或いは他の臨床利益を予測できると考えられる指標であるが、それ自体は臨床利益の測定基準ではない。中間臨床終点は不可逆的発病率或いは死亡率への影響の前に測定できる臨床終点であり、それは不可逆的な発病率或いは死亡率或いは他の臨床利益に対する影響を合理的に予測する可能性がある。加速承認経路は既存療法に対する新薬の優位性は直接の治療優位ではないかもしれないが、患者と公衆衛生の観点から見ると臨床上重要な改善状況である。承認された場合、承認を加速することは、一般に、薬剤の臨床的利益を検証および説明するために、勤勉な方法で検証的研究を行うことにスポンサーが同意するかどうかに依存する。このような検証的研究が薬剤の臨床的利益を確認できなかった場合、またはスポンサーがこのような研究をタイムリーに行わなかった場合、FDAは
その薬に対する承認は迅速に撤回された。また、2022年12月、総裁·バイデンは2023年度まで米国政府に資金を提供する総合支出法案に署名した。この総合法案には、以前加速された承認を受けた無効薬物の潜在的リスクを軽減するために、FDAに新たな法定権力を与えることを含む2022年の食品·薬物総合改革法案が含まれている。これらの規定により、FDAは、承認を加速させる製品を求めるスポンサーに、承認前に検証的試験を行うことを要求することができる
我々の任意の候補製品については、FDAの加速承認や他の規制機関の同様の加速または条件付き承認を求める前に、適用規制機関からのフィードバックを求め、任意の形態の加速または条件付き承認を求める能力を他の方法で評価する予定である。フィードバックや他の要因を評価した後、セキュリティプロトコルやBLAを求めたり、承認を加速したり、他の形態の加速開発、審査、承認を求めたりすることを決定することは保証されません。また、私たちが候補製品のために加速承認申請を提出することを決定した場合、そのような提出または申請が受け入れられること、または開発加速、審査または承認がタイムリーに承認されるか、または全く保証されない保証はない。FDA、NMPA、または他の同様の外国規制機関も、私たちの申請を考慮したり、任意のタイプの申請を承認する前にさらなる検討を要求することができます。
そのほか、過去数年間、中国は臨床試験の許可、一部の薬物と医療機器の評価と承認及び臨床試験過程の簡略化と加速の面で監督管理措置を採用した。
もし私たちの候補製品が加速承認または任意の他の形態の加速開発、審査または承認を得られなかった場合、候補製品の商業化の時間がより長くなり(あれば)、候補製品の開発コストを増加させ、市場での競争地位を損なう可能性がある。我々の製品が加速的に承認されても、FDA、NMPA、または他の同様の外国規制機関は、私たちの検証的試験の結果に基づいて承認を撤回することができる。
臨床開発では2つの候補製品rademikibartとicanbelimodしかありませんもし私たちが候補製品の開発に成功しなかったり、開発過程で重大な遅延に遭遇したら、私たちの業務は実質的な損害を受けるだろう。
臨床開発では2つの候補製品rademikibartとicanbelimodしかありませんいずれの他の候補製品も臨床開発前にINDを有効にする研究が必要である。著者らはほとんどの努力と財力を投入して著者らの現在の候補製品を開発し、潜在的な候補製品を確定し、そして臨床前研究と臨床試験を行った。したがって,会社として,臨床試験や規制インタラクションに参加する上でのインフラや経験は限られており,我々が行っているあるいは計画中の臨床試験が時間どおりに起動または完了しているかどうかは決定できず,できれば,我々が計画している開発計画がFDA,NMPAなどの他の類似した外国の規制機関によって受け入れられているかどうか,あるいは承認されれば,これらの候補製品が商業化に成功するかどうかは不明である。特に、私たちは、私たちの主要候補製品rademikibartの次の段階の臨床開発を支援するために、より多くの経験やインフラを提供するために、潜在的なグローバル·地域パートナーを積極的に探しています。私たちがタイムリーに基づいて、または許容可能な条件下で理想的なパートナーシップを確保することは保証されない。また、私たちはすべての支払いマイルストーンに到達する保証もなく、いかなる販売も保証されず、任意の所望のパートナー関係の下で印税支払いを受ける権利を持つことができる。例えば、Simcereプロトコルによって支払われたすべてのマイルストーンと特許使用料が私たちに提供される保証はない。
私たちのいくつかの開発と臨床計画はまだ初期段階にあるため、私たちの候補製品の成功は以下のいくつかの要素に依存する
•適時と成功に臨床試験への参加を登録し、臨床試験と臨床前研究を完成し、そして有利な結果を得て、例えば、ウクライナ-ロシア戦争が著者らの臨床試験スケジュールに与える影響、患者登録と試験データ収集への影響を含む
•FDAあるいはアメリカ国家薬品監督管理局などの外国の監督管理機関がINDS下の臨床試験を提出し、著者らの臨床前候補製品の臨床試験と私たちの未来の臨床試験の提案設計を行うことを許可した
•適用可能な規制機関を満足させるために、私たちの候補製品の安全性、純度、効力、および/または有効性を証明する
•FDAのNDAまたはBLAS、またはNMPAまたは同様の外国規制機関の同様の規制文書を含む関連規制機関の上場承認を受け、そのような承認を維持する
•私たちの第三者製造業者と商業製造能力を手配したり確立したりします
•販売、マーケティング、流通能力を確立し、承認を得た後、単独でまたは他人と協力して私たちの製品の商業販売を開始します
•特許、商業秘密、および他の知的財産権を確立、維持、実行、保護し、私たちの候補製品に独自の保護または規制排他性を提供する
•製品が承認された後(あれば)許容可能な安全性、耐性、および有効性を維持すること
•患者、医療界、そして第三者支払者が承認し、私たちの製品を受け入れる場合、受け入れ可能なコストで私たちの候補製品を製造し、
•私たちの製品や技術を開発することができる人員組織を維持して発展させる。
私たちの事業の成功は、私たちが将来業務のために融資し、どんな収入を創出する能力も含めて、主に私たちの候補製品の成功開発、規制承認、商業化にかかっていますが、これは決して起こらないかもしれません。私たちは臨床試験あるいはその後発売許可を得た時にすべての候補製品の安全性或いは有効性を証明することに成功できないかもしれない。もし私たちが私たちの候補製品を開発できない場合、あるいは規制部門の承認を得ることができない場合、あるいは承認されれば、私たちの候補製品を商業化することに成功できない可能性があり、私たちは私たちの業務を継続するのに十分な収入を生み出すことができないかもしれない。
強力なT細胞変調活性に基づいて候補製品を発見·開発する方法は検証されておらず,ビジネス価値のある製品を開発できるかどうか,あるいは競争的な技術的方法が候補製品の商業的価値を制限したり,我々の方法を時代遅れにしたりすることができるかどうかは分からない。
我々の業務の成功は,主に強力なT細胞調節活性を有する分子を迅速に認識する製品の識別,開発,商業化に基づく能力に依存しており,新規かつ検証されていない方法である。我々の薬物スクリーニング方法は,多様なアレルギー性や自己免疫疾患に対する候補製品を識別·開発できるようにすることを目的としている。
私たちはレドミキバートとイカンベリーモットの臨床前、第一段階および/または第二段階の結果がさらなる臨床開発を支持すると信じているが、私たちはまだ、上場承認を得るのに十分な方法で私たちの任意の候補製品の安全性と有効性を証明することに成功しないかもしれない。私たちは臨床開発で他の候補製品を持っていない。
強力なT細胞変調活性を有すると考えられる分子に対する方法は、他の候補製品の識別に成功しない可能性があり、我々の技術に基づく任意の候補製品は、有害な副作用を有することが証明される可能性があるか、または他の特徴を有する可能性があり、追加の臨床試験が必要であるか、または候補製品が販売できないか、または上場承認を得ることができない可能性がある。さらに、我々のrademikibartまたはicanbelimod計画に関する不利な発展は、私たちの薬物スクリーニング方法に基づく将来の候補製品の実際または予想成功可能性および価値に大きな悪影響を及ぼす可能性がある。
しかも、バイオテクノロジーと生物製薬産業の特徴は技術が急速に進歩していることだ。私たちの未来の成功はある程度私たちがT細胞調節活動方法を通じて競争地位を維持できるかどうかに依存する。もし私たちが技術変革の最前線に立つことができなければ、このような技術と方法を利用して候補製品を創造し、開発することができなければ、効果的に競争することができないかもしれない。我々の競争相手は、従来技術の方法を改善することによって、または新しいまたは異なる方法(例えば、私たちの異なる標的方法を使用する)を開発することによって、私たちの方法を時代遅れにしたり、候補製品の商業的価値を制限したりすることによって、強力なT細胞変調活性を有する分子を標的にすることによって得られると考えられる利点を潜在的に除去することができるかもしれない。対照的に、私たちと類似したT細胞調製方法を使用しようとする他の会社の不利な発展は、私たちの候補製品の実際または期待価値と潜在力に悪影響を及ぼす可能性がある。
上記のいずれかの事件が発生した場合、私たちは1つ以上のプロジェクトの開発を放棄することを余儀なくされる可能性があり、これは私たちの業務に実質的な悪影響を与え、運営を停止させる可能性があります。
私たちは秘密協定やBLAを提出したことがなく、私たちのどんな候補製品にも提出できないかもしれない。
私たちは、私たちの現在または未来の任意の候補製品を市場に出すために、FDA、NMPA、または同様の外国規制機関の承認を成功させる必要がある。成功した秘密保持協定またはBLAを提出することは複雑で高価な時間の過程だ。会社として、規制書類の準備、提出、起訴の経験は限られていて、まだありません
秘密保護協定またはBLAまたは他の同様の外国規制文書が、任意の候補製品のために以前に提出された。今後数年以内に複数の候補製品のための複数の臨床試験を同時に行う予定であり,限られた資源で管理する困難な過程である可能性があり,経営陣の注意を分散させる可能性がある。さらに、規制提出を支援し、任意の候補製品が承認されることを支援するために、必要な臨床試験を成功的かつ効率的に実行·完了することができない可能性がある。私たちは私たちの競争相手よりも多くの時間とより多くのコストを必要とするかもしれないし、私たちが開発した候補製品の規制承認を得ることに成功しないかもしれない。私たちの計画した臨床試験を開始または完了または遅延することは、NDAまたはBLASの提出を阻止または遅延し、私たちの候補製品を商業化することができるかもしれない。
FDA、NMPA、および外国機関のような規制承認過程は長く、時間がかかり、予測できないが、もし私たちが最終的に私たちの候補製品のために規制承認を得ることができなければ、私たちの業務は実質的な損害を受けるだろう。
FDA、NMPA、および類似外国当局の承認を得るのに要する時間は予測できないが、通常は臨床試験開始後数年後に必要であり、監督機関のかなり大きな裁量権を含む多くの要素に依存する。さらに、承認政策、法規、または承認を得るために必要な臨床データのタイプおよび数量は、候補製品の臨床開発過程において変化する可能性があり、異なる司法管轄区域間で意外かつ有意な差が生じる可能性がある。私たちはまだアメリカ、中国、あるいは他の任意の司法管轄区でいかなる候補製品の監督管理許可を得ていません。そして私たちは将来開発を求める可能性のあるいかなる候補製品も決して規制の承認を得ないかもしれません。FDAのNDAやBLAの規制承認または同様の外国規制機関が提出したような外国規制文書を取得する前に、私たちまたは未来のパートナーは、米国または任意の他の管轄地域で私たちの任意の候補製品を販売することを許可しません。
米国、中国、または他の場所で候補製品を商業化する承認を得る前に、私たちまたは私たちの協力者は、厳格に制御された臨床試験から大量の証拠を得なければならず、FDA、NMPAまたは他の同様の外国の規制機関(状況に応じて)を満足させなければならない。これらの候補製品は、その予期される用途に対して安全で有効であるか、または米国の生物製品にとって安全で純粋で有効であることを証明しなければならない。非臨床研究と臨床試験の結果は異なる方法で解釈できる。私たちの候補製品の非臨床的または臨床的データが有望だと信じていても、これらのデータはFDA、NMPA、または他の同様の外国規制機関の承認を支持するのに十分ではないかもしれない。FDA、米国国家薬品監督管理局、または他の同様の外国規制機関も、承認前または後に、私たちの候補製品に対して追加の臨床前研究または臨床試験を行うことを要求するかもしれないし、または私たちの臨床開発計画の内容に反対する可能性がある。
FDA、NMPA、または他の同様の外国規制機関は、私たちの候補製品の承認を延期、制限、または拒否することができ、または追加の非臨床または臨床テストを要求するか、または以下の理由を含む多くの他の理由で計画を放棄することができる
•FDA、米国国家薬品監督管理局、または同様の外国の監督機関は、私たちの臨床試験の設計または実施に同意しないかもしれない
•FDA、米国食品薬品監督管理局、または同様の外国の監督管理機関に、候補製品がその提案の適応に対して安全かつ有効であることを証明することができないかもしれない
•私たちの臨床試験結果はFDA、NMPAなどの外国の監督管理機関が許可した統計的意義レベルに符合しないかもしれない
•臨床試験参加者または私たちの候補製品と類似した薬物または生物学的製剤を使用する個人が遭遇する深刻かつ予期しない薬物または生物学的関連副作用;
•候補製品の臨床的および他の利益がその安全リスクよりも大きいことは証明できないかもしれない
•FDA、アメリカ国家薬品監督管理局或いは類似の外国の監督管理機関は臨床前研究或いは臨床試験データの解釈に同意しないかもしれない
•我々の候補製品の臨床試験から収集されたデータは、BLAまたはNDAまたは他の同様の外国提出の提出を受け入れないか、または米国、中国または他の場所の規制承認を得るのに十分でない可能性がある
•FDA、米国国家食品薬品監督管理局、または同様の外国の監督管理機関は、私たちの候補製品の調合、ラベル、および/または規格に食い違いがあるかもしれない
•私たちの臨床サイト、研究者、あるいは臨床試験の他の参加者は試験案から外れ、法規の要求に従って試験を行うことができなかったり、試験を脱退したりする可能性がある
•FDA、NMPA、または同様の外国の規制機関は、私たちと臨床および商業用品契約を締結する第三者メーカーの製造プロセスまたは施設を承認できない可能性があります
•FDA、NMPA或いは類似の外国監督管理機関の承認政策或いは法規は重大な変化が発生する可能性があり、著者らの臨床データは承認を得るのに十分ではない。
大量に開発されている薬物のうち,一部のみがFDA,NMPAなどの外国規制承認手続きに成功し,商業化されている。長い承認過程と将来の臨床試験結果の予測不可能性は、私たちの候補製品を販売するために規制部門の承認を得ることができなくなり、これは私たちの業務、財務状況、運営結果、および将来性を深刻に損なうかもしれない。
最終的に臨床試験を完了し、我々の候補製品のNDA、BLAまたは他の同様の外国から提出された承認を得ても、FDA、NMPAまたは他の同様の外国の規制機関は、高価な追加の臨床試験(第4期臨床試験を含む)の発現および/またはREMSの実施によって承認される可能性があり、これは、承認後の薬剤の安全な使用を確保するために必要である可能性がある。FDA、NMPA、または同様の外国の規制機関もまた、適応または患者数が私たちが最初に要求したものよりも限られた候補製品を承認する可能性がある。どのような遅延が適用されるか、または適用されない規制承認は、その候補製品の商業化を延期または阻止し、私たちの業務および将来性に大きな悪影響を及ぼすだろう。
資金不足や世界的な健康問題によりFDA、NMPA、類似の外国規制機関および他の政府機関の中断は、重要な指導部および他の人員の採用、保留または配置の能力を阻害する可能性があり、あるいは新しいまたは修正された製品のタイムリーまたは根本的な開発、承認、商業化を阻止することは、私たちの業務にマイナスの影響を与える可能性がある。
FDA、国家食品薬品監督管理局、類似の外国監督機関と他の政府機関が新製品を審査·承認する能力は、政府予算と資金レベル、法定、監督と政策の変化、監督機関のキーパーソンの雇用と保留、ユーザー費用の支払いを受ける能力、その他の監督管理機関の通常の機能を履行する能力に影響を与える可能性のある事件を含む様々な要素の影響を受ける可能性がある。例えば、FDAとNMPAの平均審査時間は近年変動している。また,他の研究開発活動を援助する政府機関への政府の援助は政治過程の影響を受けており,この過程は本質的に不安定で予測不可能である。FDA、NMPA、および他の機関の中断は、新薬および生物製品または承認された医薬品および生物製品の修正が必要な政府機関によって審査および/または承認されるのに要する時間を遅らせる可能性もあり、これは私たちの業務に悪影響を及ぼす。例えば、ここ数年間、米国政府は何度か閉鎖されており、FDAのような規制機関のいくつかは、キー従業員を休暇にし、キー活動を停止しなければならない。
また、新冠肺炎の流行に対応するため、アメリカ食品薬品監督管理局は国内外の異なる場所の製造施設の大部分の検査を延期した。FDAはすでに実行可能な状況でアメリカ国内と国外の製造施設に対する標準検査操作を回復したが、ウイルスのいかなる巻き返し或いは新しい変種の出現は検査或いは行政上の遅延を招く可能性がある。政府が長期的に停止している場合、または世界的な健康問題がfda、nmpaまたは他の同様の外国規制機関が定期的な検査、審査または他の規制活動を阻止する場合、fda、nmpaまたは他の同様の外国規制機関が私たちが提出した規制文書を適時に審査して処理する能力に深刻な影響を与える可能性があり、これは私たちの業務に大きな悪影響を及ぼす可能性がある
私たちは承認されたバイオ製品候補製品が予想以上に早く競争に直面する可能性があることを求めるつもりだ。
“平価医療法案”は、“2009年生物製品価格競争と革新法案”という副題、またはBPCIAを含み、FDA許可の参照生物製品と類似しているか、または交換可能な生物製品のための短い承認経路を作成する。BPCIAによると、高度類似または“生物類似”製品の申請は、参考製品が初めてFDA承認を得た日から4年後にFDAに提出されることができる。また,FDAの生物類似製品の承認は,参考製品が初めて承認された日から12年後に発効する可能性がある。この12年間の独占期間内に、FDAが競合製品の完全なBLAを承認した場合、スポンサー自身の臨床前データおよび十分かつ良好に制御された臨床試験からのデータを含み、その製品の安全性、純度および有効性を証明するために、別の会社は依然としてこの参照製品の競合バージョンを販売する可能性がある。
BLAによりバイオ製品として承認されたいずれの我々の候補製品も12年の専門期間を得る資格があるべきであると考えられる。しかしながら、国会の行動や他の理由により、この排他性は短縮される可能性があり、またはFDAは、我々の製品候補製品を競合製品の参考製品とみなさないことは、予想よりも早く競争機会を創出する可能性がある。BPCIAの他の面では,そのいくつかがBPCIAの排他的条項に影響を与える可能性があり,最近の訴訟のテーマでもある.さらに、承認されると、生物類似体が私たちのいずれかの参考製品をどの程度置換するかは、非生物製品の伝統的な模倣薬代替に類似しており、これが多くの市場および規制要因に依存するかどうかは不明である。
EUの薬品立法の提案改正はEUの医薬製品に適用される監督管理枠組みに不確定性が存在する可能性があり、孤児医薬製品を含む.
2023年4月26日、欧州委員会は現行のEU薬品立法を改正する提案、すなわちEU薬法審査を発表した。 EU薬法審査は2つの提案からなり、1つの新しい指令と1つの新しい法規、あるいはEU薬法提案と呼ばれ、孤児薬品に関する立法を含む関係者用薬品に関する立法を廃止し、代替する。 EU薬法審査はEU革新医薬製品の監督管理データ保護或いはRDPに重大な影響を与える可能性がある。 現在の形で可決されれば,EU製薬法提案は現在のデータ排他性ベースラインを低下させる。 このRDPの減少は後発薬と生物模倣薬のより早くEU市場に進出する可能性がある。 また、EU薬品法の審査はEU孤児薬品の指定と激励措置に重大な影響を与える可能性がある。提案された改正は欧州議会と欧州理事会の合意と採択が待たれるため,EU医薬法提案は採択前に重大な改正が行われる可能性があり,2026年初めまではないと予想される。しかし、長期的には、これらの改正は製薬業と私たちの業務に大きな影響を与える可能性がある
私たちの第三者への依存に関するリスクは
著者らは依存し、そして引き続き第三者に依存し、独立した臨床研究者とCROを含めて、著者らの臨床前研究と臨床試験のいくつかの方面を行う予定である。これらの第三者がその契約義務を成功的に履行し、適用された法規要件を遵守し、または予想される期限までに完了できなければ、規制部門の私たちの候補製品の承認を得られないか、商業化される可能性があり、私たちの業務は深刻な損害を受ける可能性がある。
著者らはずっと独立した臨床研究者と第三者CROを含む第三者に依存し、引き続き第三者に依存することを計画し、著者らの臨床前研究と臨床試験のある方面を行い、そして著者らが行っている臨床前と臨床計画のモニタリングと管理データを提供している。私たちはこれらの方に依存して、私たちの臨床前研究と臨床試験を実行し、彼らの活動のいくつかの側面だけを制御します。しかし、私たちは私たちのすべての研究と実験が適用された議定書、法律、法規、そして科学的基準に従って行われ、私たちのこのような第三者への依存が私たちの規制責任を免除しないことを確実にする責任がある。私たちと私たちの第三者請負業者は、私たちのCROを含めて、GCP要件を遵守しなければなりません。これらの要件は、FDA、NMPA、および同様の外国規制機関が臨床開発において私たちの候補製品に対して実行する法規およびガイドラインである。規制当局は,試験スポンサー,主要調査者,試験地点を定期的に検査することでこれらのGCPを実行している。もし私たちまたはこれらの第三者(私たちのCROを含む)が適用されたGCPを遵守できなかった場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられる可能性があり、FDA、NMPAまたは同様の外国の規制機関は、私たちの上場申請を承認する前に追加の臨床試験を行うことを要求するかもしれない。私たちは投資家に保証することができません。特定の監督管理機関が検査を行った後、この監督管理機関は私たちのいかなる臨床試験がGCP規定に符合することを確定します。また,われわれの臨床試験は現行の良好な製造規範やcGMP法規により生産された製品を用いて行わなければならない。私たちがこれらの規定を遵守しないことは、私たちが臨床試験を繰り返す必要があるかもしれないが、これは規制部門の承認過程を遅らせるだろう。さらに、これらの第三者のいずれかが連邦、州または外国の詐欺および乱用または虚偽クレーム法律法規または医療プライバシーおよび安全法律に違反した場合、私たちの業務は悪影響を受ける可能性がある。
また、これらの研究者とCROは私たちの従業員ではなく、契約を除いて、私たちの候補製品や臨床試験に投入される資源の数を時間を含めて制御することはできません。これらの第三者はまた、私たちの競争相手を含む他の商業実体と関係があるかもしれません。彼らはまた、これらの実体のための臨床試験や他の製品開発活動を行っているかもしれません。これは、彼らが私たちを代表する表現に影響を与えるかもしれません。独立した調査者またはCROが私たちの候補製品の開発に十分な資源を投入できなかった場合、または彼らが契約の義務または義務を成功裏に履行しなかった場合、または予想される期限内に完了しなかった場合、もし彼らが必要であれば
もし彼らが得た臨床データの品質或いは正確性が私たちの臨床規程、法規の要求或いはその他の原因を遵守できなかったために置換或いは破損或いは不正確であれば、私たちの臨床試験は無効になる可能性があり、延長、延期、或いは終了する可能性があり、私たちは監督部門の私たちの候補製品の承認或いは商業化に成功することができないかもしれない。したがって、私たちの運営結果と候補製品のビジネス見通しは損なわれ、私たちのコストは増加する可能性があり、私たちの収入を作る能力は延期されたり、完全に排除されたりする可能性がある。
未治癒の材料漏れが発生した場合、私たちの臨床サイトとCROは私たちとの合意を終了する権利がある。また,我々の臨床サイトやCROのいくつかは,我々の臨床試験に参加した被験者の安全が債権者の利益のために一般的に譲渡されていれば,あるいは清算された場合には,それぞれの我々との合意を終了する権利がある
また、米国の輸出規制法と経済制裁は、米国の制裁対象国、政府、個人に特定の製品やサービスを提供することを禁止している。他国の軍事衝突により、米国がすでにまたは実施可能な制裁は、このような制裁がカバーされる地域内でCROが臨床試験地点で活動し続ける能力に影響を与える可能性がある。例えば、ロシアとウクライナの間の軍事衝突により、米国とその欧州同盟国は、ロシアおよびウクライナドネツクとルガンスク地域の特定の業界部門や政党に制裁を実施し、いくつかの製品や業界への輸出規制を強化した。これらおよび任意の追加の制裁および輸出規制、ならびにロシアまたは他の管轄区域政府の任意の経済対策は、このような制裁がカバーされる地域内で臨床試験場所で活動し続ける能力に悪影響を及ぼすか、または直接的または間接的に私たちのサプライチェーンを混乱させる可能性がある。もし私たちまたは私たちの第三者請負業者が、私たちのCROを含めて、輸出入法規およびそのような経済制裁を遵守できなかった場合、罰金および/または特定の輸出特権の剥奪を含む罰を受ける可能性がある。
これらの第三者との当社の関係が終了した場合、当社は代替サイトまたは CRO との取り決めを締結できないか、または商業的に合理的な条件で契約できない場合があります。サイトや CRO の切り替えや追加には追加コストがかかり、管理時間と集中力が必要です。また、新しいサイトや CRO が作業を開始する際には自然な移行期間があります。その結果、遅延が発生し、望ましい臨床開発タイムラインを満たす能力に大きな影響を与える可能性があります。さらに、臨床サイトや CRO は、より高いワークロードを吸収したり、ニーズをサポートするための追加の能力を引き受けたりする能力がない場合があります。当社は、 CRO および CRO を通じた臨床サイトとの関係を慎重に管理していますが、今後同様の課題や遅延が発生しないこと、またはこれらの遅延や課題が当社の事業、財務状況および見通しに重大な悪影響を及ぼさないことを保証するものではありません。
我々は第三者と契約を結び,臨床前研究と行われている臨床試験のために候補製品を製造し,より多くの臨床試験を行い,最終的に商業化する予定である。このような第三者への依存は、許容可能なコストで十分な数の候補製品または薬物またはそのような数を得ることができないリスクを増加させ、これは、私たちの開発または商業化努力を延期、阻止、または損害する可能性がある。
私たちは開発と商業化のために私たちの候補製品を生産するためのインフラや内部能力を持っていない。私たちは依存して、私たちは引き続き第三者メーカーに依存して私たちの候補製品を生産して、臨床前研究と臨床試験に使用する予定です。私たちは長期的な供給協定を持っていない。しかも、私たちの候補製品の原材料は場合によっては単一源の供給者から来ます。もし私たちの任意の候補製品または任意の未来の候補製品が任意の理由(製造、供給または貯蔵問題、または他の理由にかかわらず)によって意外に供給を失った場合、私たちは、未解決または行われている臨床試験の遅延、中断、一時停止または終了、または再起動または反復が要求される可能性がある。例えば、グローバル·サプライチェーンの中断が、私たちの候補製品を開発するために十分な供給を得る能力に与える影響の程度は、地域軍事衝突とテロ、国と地域との貿易関係のような、私たちがコントロールできない多くの要素に依存する可能性がある。
私たちは引き続き第三者メーカーに依存して市場の承認を得た任意の候補製品に商業的な供給を提供したい。私たちは中国国内と海外の複数のサプライヤーを絶えず評価して、私たちが持続的な候補製品が世界の研究と試用に提供されることを確実にしています。しかし、私たちは第三者製造業者と必要な合意を維持または確立することができないかもしれないし、受け入れ可能な条項でそうすることができないかもしれない。たとえそうであっても
私たちは第三者製造業者と合意することができるが、第三者製造業者に依存することは追加的なリスクをもたらす
•第三者が私たちの計画に従って私たちの候補製品を作ることができなかった場合、あるいは私たちの第三者請負業者が私たちの候補製品よりも他の製品の供給よりも優先している場合、または私たちと彼らとの間の合意条項に従って満足できるように履行されていない場合を含む
•仕入先が生産または納品を減少または終了するか、または価格を向上させるか、または再交渉条項を提供する
•私たちの第三者請負業者は、私たちにとって費用が高いか不便なときに合意または合意を終了または更新しない
•第三者請負業者は私たちと彼らとの合意に違反します
•第三者請負業者は適用された規制要件を遵守できなかった
•第三者請負業者は、私たちの仕様および/または法規要件に基づいて、私たちの候補製品を製造することができませんでした
•臨床用品のラベルエラーは、供給された用量エラーを引き起こす可能性があり、または研究薬またはプラセボが正しく識別されていない
•臨床用品は時間通りに臨床現場に送ることができず、臨床試験の中断を招き、或いは薬品供給が適時に商業サプライヤーに配布されず、販売損失を引き起こした
•私たちのビジネス秘密とノウハウを含む私たちの固有情報を盗用する。
私たちは生産過程のすべての側面を完全にコントロールすることはできず、私たちの契約製造パートナーに依存してcGMP(および類似の外国)法規を遵守して、活性医薬物質と完成品を生産する。第三者メーカーは、cGMP法規や米国以外の類似した法規要件を遵守できない場合や、我々の規格に適合した材料の生産に成功できない可能性があります。もし私たちの契約メーカーがFDA、NMPA、または他の同様の外国規制機関の厳格な規制要件を遵守できなければ、彼らは私たちの候補製品製造の承認を確保および/または維持することができないだろう。しかも、私たちの契約製造業者が十分な品質管理、品質保証、合格者の能力を維持することを制御することはできません。FDA、NMPA、または同様の外国規制機関が、私たちの候補製品を生産するためにこれらの施設を承認しない場合、または将来的にそのような承認を撤回すれば、代替製造施設を探す必要があるかもしれません。これは、私たちの候補製品を開発、獲得、またはマーケティングする能力に深刻な影響を与えます(承認されれば)。もし私たちまたは私たちの第三者製造業者が適用された法規を遵守できなかった場合、罰金、禁止、民事処罰、遅延、一時停止または許可の撤回、許可証の取り消し、候補製品または薬物の差し押さえまたはリコール、運営制限、および刑事起訴を含む制裁を加える可能性があり、いずれも候補製品や薬物の供給に重大な悪影響を与え、私たちの業務および運営結果を損なう可能性があります。
私たちは現在、将来的に他人が私たちの候補製品や薬物を生産することへの依存が、私たちの将来の利益率と、私たちが適時かつ競争力のある上場で承認された候補製品の商業化能力に悪影響を及ぼす可能性があると予想している。
私たちの第三者への依存は、競争相手や他の第三者がこれらの秘密を発見したり、私たちの商業秘密が流用または開示されたりする可能性を増加させる、私たちのビジネス秘密を共有することを要求します。
私たちは現在、他の第三者に依存して私たちの候補製品を製造し、開発、品質テスト、および他のサービスを実行しているため、ビジネス秘密を含む当社のノウハウや機密情報を彼らと共有しなければならない場合があります。私たちは、独自の情報の研究または開示を開始する前に、当社のコンサルタント、従業員、およびコンサルタントと秘密協定、コンサルティング契約、または他の同様の合意を締結することによって、私たちのノウハウを保護することを求めています。これらの合意は、第三者が私たちの機密情報を使用または開示する権利を制限することを目的としているが、このような合意は違反される可能性があり、私たちはすべての適用されるすべての当事者とそのような合意に到達できないかもしれない。第三者と協力する際に契約条項が採用されているにもかかわらず、商業秘密および他の機密情報を共有する必要は、そのような商業秘密が我々の競争相手または他の第三者に知られ、他の人の技術に意図的にまたは意図的に組み込まれているか、またはこれらの合意に違反する方法で開示または使用されるリスクを増加させる。私たちの独自の地位部分が私たちのノウハウおよび商業秘密に基づいていることを考慮して、私たちは私たちのビジネス秘密を保護しようと努力しているにもかかわらず、競争相手または他の第三者が私たちの独自技術と機密情報または他の許可されていない使用または開示を発見することは私たちの利益を損なうだろう
これは私たちの業務、財務状況、経営結果、そして見通しに重大な悪影響を及ぼすかもしれない。
私たちは合意し、協力、許可、他の類似した手配を求める予定ですが、成功しないかもしれませんが、このような関係のメリットを意識していないかもしれません。
私たちが候補製品を開発または商業化する能力に資金コストや他の影響を与える理由、またはいくつかまたはすべての司法管轄区域の製造制限のために、私たちの候補製品の開発または商業化についての協力、合弁、許可、および他の同様の手配を求め続けている。例えば,2023年11月21日,Connectライセンス側はSimcereライセンス側と独占ライセンスと連携協定を締結し,大中国でrademikibartを開発·商業化した。また、私たちは、私たちの主要候補製品rademikibartの次の段階の臨床開発を支援するために、より多くの経験やインフラを提供するために、潜在的なグローバル·地域パートナーを積極的に探しています
私たちの候補製品のために他の協力の努力は成功しないかもしれません。私たちの研究開発ルートが不足している可能性があるので、私たちの候補製品は協力努力の開発段階が早すぎると思われるかもしれません。あるいは第三者は私たちの候補製品が安全性と有効性や重大なビジネス機会を示す必要な潜在力を持っていると思わないかもしれません。また、適切な戦略的パートナーを探す上で激しい競争に直面しており、交渉過程は時間がかかり複雑かもしれない。最近,大手製薬とバイオ医薬会社の間に大量の業務合併が出現し,将来の潜在的パートナー数の減少を招き,合併後の会社の戦略が変化する可能性がある
上記のような要素のため、私たちはタイムリーにまたは許容可能な条件下で協力を交渉することができないかもしれない。もし私たちがそれができない場合、私たちは候補製品の開発を減らし、私たちの1つ以上の他の開発計画を減らしたり、その候補製品の潜在的な商業化を延期したり、任意の計画の販売やマーケティング活動の範囲を縮小したり、私たちの支出を増加させ、自費で開発、製造、または商業化活動を行う必要があるかもしれない。
また、未来の協力協定は、潜在的な協力者と他の合意を締結することを制限することができます。私たちは戦略的取引や許可証の後、私たちが経済的利益を得て、このような取引が合理的であることを証明することを確信できない。
私たちがこのような協力を成功させたとしても、私たちが合意した条項は私たちに不利になるかもしれないが、例えば、候補製品の開発や承認が延期され、候補製品の安全性が疑問視されたり、承認された候補製品の販売が満足できない場合、私たちはこのような協力を維持できないかもしれない。例えば、rademikibartの開発または承認に関するいかなる遅延、または私たちが制御できない候補製品の任意の満足できない販売は、Simcereプロトコルに従って私たちの利益を達成する能力の遅延または中断をもたらす可能性がある。
しかも、どんな潜在的な未来の協力も私たちの戦略的パートナーによって中止されるかもしれないし、私たちはこのような合意の下で私たちの権利を十分に保護できないかもしれない。また、承認されれば、戦略的パートナーは、私たちの候補製品の開発と商業化に関する決定を制御するために、交渉によっていくつかの権利を得ることができ、これらの活動は、私たちと同じ方法で行われない可能性がある。もし私たちが将来協力を終了したり、私たちの候補製品に関する協力を遅延させたりすれば、候補製品の開発と商業化を延期し、それらの競争力を低下させる可能性があり、それらが市場に進出すれば、私たちの業務、財務状況、運営結果に大きな悪影響を及ぼす可能性がある。例えば、Connectライセンス者やSimcereライセンス側の制御以外の要因により、rademikibartが直ちに開発、承認、商業化されることは保証されませんが、大中国地域の将来のrademikibartの開発、承認、マーケティング、または販売の任意の遅延は、Simcereプロトコルの下での遅延実現の利点をもたらす可能性があります。
私たちが統制している無形資産(印鑑や印鑑を含む)の受託者や権限使用者が彼らの責任を履行できなかった場合、またはこれらの資産を流用または乱用した場合、私たちの業務および運営は実質的な悪影響を受ける可能性がある。
中国の法律によると、会社取引の法律文書は、署名実体の印鑑又は印鑑を用いて署名されたか、又は法定代表者によって署名され、当該法定代表者の指定は国家市場監督管理総局(SAMR)の関連地方支局に登録及び届出されている。私たちは一般に、指定された法定代表者が書類に署名するのではなく、印鑑や印鑑を押すことで法律文書に署名する。私たちの子会社の印鑑は通常関連実体が持っていて、書類が現地で署名できるようにします。通常は印鑑を使って契約を実行していますが
わが子会社の登録法定代表者は、当該等の実体を代表して印鑑を押す必要がなく、当該等の契約に別段の規定がない限り、契約を締結する権利がある。
印鑑の物理的安全を維持するために、私たちは通常、印鑑を安全な位置に保存して、私たちの法律、行政、あるいは財務部門の指定された重要な従業員だけが入ることができます。私たちが指定した法的代表は一般的に印鑑に触れることができない。私たちは、私たちの子会社の指定法定代表者を含めて、私たちのキースタッフを監視する手続きを持っていますが、これらの手続きは、すべての乱用や不注意を防ぐのに十分ではないかもしれません。私たちの主要な従業員や指定された法律代表は、例えば、私たちの利益に反する契約で私たちの子会社を拘束する可能性があります。他方が私たちの印鑑や私たちの法律代表の署名の表面的権威に誠実に依存している場合、私たちはこれらの契約を履行する義務があるからです。任意の指定された法定代表者が関連実体に対する統制権を取得するために印鑑の支配権を取得する場合、新たな法定代表者を指定するための株主又は取締役会決議が必要であり、法的行動をとり、印鑑の返還を要求し、関係当局に新たな印鑑を申請するか、又は他の方法で当該法定代表者の不正行為について法的救済を求める。指定された法定代表者が任意の理由で私たちの印鑑や印鑑または他の統制無形資産を獲得し、乱用または流用した場合、私たちの正常な業務運営は妨害される可能性があります。私たちは会社や法的行動を取らなければならないかもしれませんが、これは問題を解決するために多くの時間と資源を関連しているかもしれませんが、経営陣の私たちの運営への関心を分散させ、私たちの業務や運営は実質的で不利な影響を受ける可能性があります。
私たちの候補製品の商業化に関するリスクは
私たちの候補製品が規制部門の承認を得ても、それらは持続的な監督審査と重大な上場後の監督要求と監督を受けるだろう。
私たちが入手可能な任意の候補製品の規制承認は、候補製品の安全性および有効性を監視するために、規制機関および監督機関に報告書を提出することを要求し、特定の年齢層の使用制限、警告、予防措置または禁忌症に関連する重大な制限を含む可能性があり、承認後の研究またはリスク管理要件を重く含む可能性がある。例えば、FDAは、私たちの候補製品を承認するためにREMSを必要とすることができ、これは、制限された分配方法、患者登録、および他のリスク最小化ツールのような薬物ガイドライン、医師トレーニングおよびコミュニケーション計画、または安全な使用を保証する他の要素を必要とする可能性がある。さらに、FDA、米国食品薬品監督管理局または他の類似の外国監督管理機関が私たちの候補製品を承認した場合、私たちの候補製品の製造技術、ラベル、包装、流通、不良事件報告、貯蔵、広告、サンプリング、販売促進、輸入、輸出、記録保存は広範かつ持続的な監督管理要求を受けるだろう。これらの要求には,安全性や他の上場後の情報や報告,登録の提出,および我々が承認後に行った任意の臨床試験においてcGMP(類似した外国要求)やGCPを継続的に遵守することが含まれる。また、医薬品メーカーおよびその施設は、cGMPまたは同様の法規および基準の遵守を確保するために、FDA、NMPA、および他の同様の外国規制機関の持続的な審査および定期的な抜き打ち検査を受けている。私たちまたは規制機関が、予想されていない深刻度または頻度の不良事象、または製品の製造施設に問題があるような以前に未知の問題があることを発見した場合、規制機関は、製品のリコールを要求するか、または市場から製品を撤回するか、または生産を一時停止することを含む、製品、製造施設、または私たちに制限を加えることができる。したがって、私たちと私たちと協力している他の人たちは、製造、生産、品質管理を含むすべての規制コンプライアンス分野で時間、お金、エネルギーをかけ続けなければならない。
さらに、FDA、NMPA、および他の類似した外国規制要件を遵守しなければ、私たちは行政または司法制裁を受ける可能性がある
•製品申請または承認申請を遅延させるか、または承認された補充品の審査を遅延させるか;
•製品の流通方式を変更し、追加の臨床試験を行い、製品のラベルを変更したり、追加の発売後の研究やモニタリングを要求したりすることが求められている
•私たちの臨床試験を行う能力の制限は、進行中または計画中の試験の全部または一部の臨床保留を含む
•製品、製造業者、または製造プロセスの制限;
•警告状や見出しのない手紙
•民事、行政、刑事罰
•禁令
•規制承認の一時停止または撤回;
•輸入製品の差し押さえ、差し押さえ、または禁止;
•自発的または強制的な製品のリコールと宣伝要求
•生産を停止しています
•費用の高い新しい製造要件を含む運営に制限を加える。
上記のいずれかの事件や処罰が発生すると、候補製品を商業化し、収入を創出する能力を抑制する可能性があり、対応するために多くの時間と資源が必要となり、負の宣伝が生じる可能性がある。
FDA、NMPA、および他の同様の外国規制機関の政策は変わる可能性があり、私たちの候補製品に対する規制承認を阻止、制限、または延期するための追加の政府法規が公布されるかもしれない。もし私たちが既存の要求の変化に適応できない場合、あるいは新しい要求や政策を採用することができない場合、あるいは規制適合性を維持できない場合、私たちは私たちが得る可能性のあるマーケティング承認を失う可能性があり、私たちは利益を達成したり維持することができないかもしれない。
FDAと他の規制機関は非ラベル使用の普及を禁止する法律法規を積極的に実行している。もし私たちが発見されたり、不正に非ラベル用途を普及させたりすると、私たちは重大な責任を負うかもしれない。
もし私たちの候補製品が承認され、私たちがこれらの製品のラベル外用途を不正に普及させたことが発見されれば、私たちは重大な責任を負うかもしれない。FDAや他の規制機関は、承認されれば、処方製品(例えば、私たちの候補製品)に対する販売促進主張を厳格に規制することができる。特に、製品は、製品が承認されたラベルに反映されるように、FDAまたは他の規制機関によって承認されていない使用に使用されてはならない。もし私たちが候補製品のマーケティング承認を得たら、医者は承認されたラベルと一致しない方法で患者に処方するかもしれない。もし私たちがこのようなラベル外の使用を普及させることを発見されたら、私たちは重大な責任を負うかもしれない。米連邦政府は、ラベル外使用の不当な普及の疑いがある会社に巨額の民事と刑事罰金を科し、いくつかの会社がラベル外販売促進に従事することを禁止している。政府はまた、企業に同意法令に署名したり、永久禁止を実施したりすることを要求し、これらの禁止令に基づいて、特定の販売促進行為が変更または制限される。もし私たちが私たちの候補製品の普及を成功的に管理できなければ、承認されれば、私たちは重大な責任を負う可能性があり、これは私たちの業務や財務状況に実質的な悪影響を及ぼすだろう。
私たちの候補製品の商業成功は医師、患者、医療保険支払人と医学界の他の人がこれらの候補製品に対する市場受け入れの程度に依存する。
私たちの候補製品は商業的に成功しないかもしれない。たとえ私たちのすべての候補製品が監督部門の許可を得ても、それらは医者、患者、医療保険支払人あるいは医学界の他の人の市場認可を得ることができないかもしれない。私たちの現在または未来の任意の候補製品の商業成功は、承認された適応を得るために、医師および患者の最終製品の広範な採用および使用に大きく依存するであろう。もし私たちの製品が商業販売に許可されたら、市場の受け入れ度は多くの要素に依存します
•他のより成熟した製品と比較して、臨床治療効果と安全性を示した
•私たちの候補製品が承認された適応
•私たちの目標患者数の制限と、任意の規制機関によって承認されたラベルに含まれる他の制限または警告
•病気の流行度や重症度や副作用は
•管理の利便性と簡便性
•衛生保健提供者及びその患者が新薬又は生物製剤を関連適応として受ける場合;
•私たちの製品の精算、定価、費用効果、そして私たちの製品の代替療法や療法に関する治療コスト
•私たちは十分な第三者保険を獲得して維持し、政府医療計画(連邦医療保険と医療補助、個人健康保険会社、他の第三者支払者を含む)から十分な補償を受けることができる
•第三者支払者および政府当局が保険および適切な補償を受けていない場合、患者は自己負担費用の全部または一部を支払いたい
•私たちの製品の使用に対する制限や、いかなる悪影響の普遍性と深刻さ
•私たちの医師教育プログラムは成功しました
•私たちの製品と薬品が発売されるタイミングを競う
•潜在的な製品責任クレーム
•私たちの候補製品が治療しようとしている疾患適応に対して、代替的な有効な治療法があるかどうか、およびこれらの治療法の相対的なリスク、収益、およびコスト
•私たちまたは私たちの潜在的な未来のパートナーの流通、販売、およびマーケティング戦略の有効性
•この製品に関する不良宣伝。
任意の候補製品が承認されたが,医師,患者,医療支払者,医療界の他の人の受け入れ程度に達していなければ,その製品から十分な収入を得ることができず,利益を達成したり維持することができない可能性がある。私たちの教育医療界や医療支払者が私たちの製品のメリットを知る努力には大量の資源が必要かもしれませんし、決して成功しないかもしれません。
私たちの候補製品の商業化に成功し、承認されれば、政府当局と健康保険会社が構築した保険範囲、十分な補償レベル、優遇された価格設定政策にある程度依存する。もし私たちの製品が保証範囲を獲得したり維持したりして十分な精算を得ることができなければ、これらの製品をマーケティングする能力を制限し、収入を創出する能力を低下させるかもしれません。
承認されれば,政府医療計画(例えば米国のMedicareやMedicaid),個人健康保険会社や他の第三者支払者が提供する保険範囲や精算が十分であり,多くの患者が候補品などの処方薬を獲得し負担できるために重要である。第三者支払者のカバー範囲や新承認製品の精算に関する不確実性が大きい。第三者支払者の私たちの製品に対するカバー範囲と受け入れ可能な精算レベルを実現することができるかどうかは、私たちの製品を商業化することに成功する能力に影響を与えます。第三者支払者が特定の製品の保険を獲得したとしても,それによる精算支払率が十分でない可能性があり,あるいは保険政策は受け入れられないほど受け入れられないほど高い自己負担を要求する可能性がある。私たちはアメリカ、中国、EU、あるいは他の地方の保険と精算が私たちが開発する可能性のある任意の製品に適用されることを保証することができません。将来的にはいかなる可能な精算も減少またはキャンセルする可能性があります。
米国では,連邦医療保険や医療補助計画のような政府支払者は,新薬のカバーや精算範囲を決定する上で重要な役割を果たしている。連邦医療保険や医療補助計画は,個人支払者や他の政府支払者がどのように薬品保険や精算政策を策定するかのモデルとして利用されるようになってきている。しかし、米国の第三者支払者では、製品のカバーや精算に統一された政策はない。そのため、製品の保証範囲と精算範囲は支払人によって異なる。そのため、保証プロセスは各支払人にそれぞれ私たちの製品を使用する科学と臨床支持を提供する必要があるかもしれないが、保証範囲が一貫的に応用あるいは最初に得られることを保証することはできない。第三者支払者は私たちの製品を代替製品と見なし、価格の低い製品にのみ保険を提供するかもしれません。
また、精算に関する規則や条例は常に変化しており、場合によっては短時間で通知されており、これらの規則や条例が変わる可能性があると考えられる。獲得とメンテナンスの精算状態は時間がかかり、コストも高く、確定していない。これらの支払人は特定の製品の精算金額をいつでも拒否または撤回することができる。精算が得られない場合や限られた精算レベルだけでは、私たちの製品を商業化することに成功できないかもしれませんし、私たちが開発する可能性のある製品から満足できる財務リターンを得ることができないかもしれません。第三者決済者が私たちの製品の保証範囲と精算についてどのように決定するか予測するのは難しいです。アメリカの医療業界と他の地域の主な傾向の一つはコストコントロールだ。第三者支払者は,特定の薬物のカバー範囲や精算金額を制限することでコストを抑制しようとしている。私たちが商業化したどんな薬も保険と精算を受けることができることを確実にすることはできません。もし精算できるなら、清算レベルはいくらですか。不十分な保険と精算は、私たちが発売許可を得た任意の薬物の需要や価格に影響を及ぼす可能性がある。保険や十分な精算が得られない場合、あるいは限られたレベルに限られていれば、私たちが開発した現在および将来の候補製品を商業化することに成功できない可能性があり、運営実績や全体の財務状況に悪影響を及ぼす可能性があります。
第三者支払い者は、薬品およびサービスのために支払う価格にますます挑戦し、薬局福祉マネージャーを通じて割引またはリベートを要求する。私たちの製品が治療効果や安全性を高めることに成功したとしても、既存の薬物の価格は私たちの製品に対する料金を制限するかもしれません。だから、市場価格、要求されるかもしれない割引を含めて、低すぎるかもしれません
製品開発への私たちの投資の適切な見返りを実現する。追加の外国価格規制や定価規制の他の変化は私たちの製品に対する料金を制限するかもしれません。そのため、米国以外の市場では、米国に比べてわが製品の精算が減少する可能性があり、商業的に合理的な収入や利益を生み出すには不十分である可能性がある。
中国では、中国国家医療保障総局或いは省級或いは地方医療保障当局は他の政府当局と薬品を中華人民共和国の基本医療保険、労災保険と生育保険の国家薬品目録、国家精算薬品目録或いは国家医療保険計画の省級或いは地方医療保険目録から削除するかどうか、及び薬品の分類レベルを審査し、両者は計画参加者が当該などの薬品を購入する精算可能な金額に影響を与える。私たちのすべての候補製品が商業販売のために初歩的に承認された後にNRDLに含まれる保証はありません。歴史的に見ると、NRDLに組み入れられた薬品は通常後発薬と基本薬物であり、著者らの候補製品と類似した革新薬物はコスト制限のため、NRDLに組み込む面で更に多くの制限を受けた。2019年以降、我々と類似した革新薬はNHSAとNRDLを組み入れて定価交渉を行い、大幅に値下げされる可能性がある。もし私たちが私たちの製品の商業販売を開始することに成功したが、私たちの製品をNRDLに組み込むことができなかったら、私たちの商業販売収入は患者の自己負担に高度に依存し、これは私たちの製品の競争力を低下させるかもしれない。
また、米国、中国、その他の司法管轄区の政府と第三者支払人が医療コストを制限あるいは低減することは、支払人が新承認製品の保証範囲と精算レベルを制限する可能性があるため、彼らは私たちの製品に十分な支払いを提供できない可能性がある。医療全体のコスト上昇,管理型ヘルスケアの傾向,ヘルスケア組織の影響力の増加,追加の立法や法規の変化により,いずれの候補製品の販売も定価圧力に直面することが予想される。全体的には,医療コスト,特に処方薬の下り圧力が非常に大きくなっている。そのため、新製品の参入にはますます高い壁が設けられている。
アメリカと中国以外では、国際業務は通常広範な政府価格制御と他の市場監督管理を受けており、ヨーロッパと他の国のコスト制御措置の日々の重視はすでに私たちの製品の定価と使用に圧力を与え続けると信じている。多くの国では、国家衛生システムの一部として、医療製品の価格は異なる価格制御メカニズムの制約を受けている。他の国は会社が自ら医療製品を価格設定することを許可しているが、会社の利益を監督してコントロールしている。
私たちは競争に直面しています。もし私たちの競争相手が技術や製品候補を開発することが私たちより速い、あるいは彼らの技術がより効果的であれば、私たちが製品を開発し、商業化する能力は不利な影響を受ける可能性があります。
生物技術と製薬業界の特徴は技術が迅速に進歩し、競争が激しく、特許と新製品及び候補製品を非常に重視していることである。私たちの競争相手は、私たちの候補製品と競争する製品または候補製品を開発、開発しているか、または開発しているかもしれません。我々が開発と商業化に成功した任意の候補製品は,既存の療法や将来出現する可能性のある新しい療法と競争するであろう。相当な数の製品が現在開発中であり、将来的に商業的に使用される可能性があり、候補製品の開発を試みる可能性のある条件を治療するために使用される可能性があると信じている。特に,免疫学と炎症領域の競争は非常に激しい。私たちの競争相手はより規模が大きく、資金が豊富な製薬、生物製薬、バイオテクノロジー、治療会社を含む。また,大学や他の研究機関と競合する可能性もあり,これらの大学や他の研究機関は我々の目標指標で活躍し,我々と直接競争する可能性がある.また、これらの組織と競合して管理者、科学者、臨床開発者を募集しており、これは私たちの専門レベルや業務計画を実行する能力に悪影響を及ぼす可能性があります。著者らはまた臨床試験場所を確立し、患者を募集して臨床試験を行い、新製品の候補製品の確定、許可と知的財産権の確立と独自の保護の面で競争に直面する。規模が小さいか早い段階にある会社も重要な競争相手になる可能性があり、特に大手や成熟会社との協力で手配する。
既存製品と開発中の製品からの競争に直面することが予想され、各候補製品は、本年度報告の他の“業務競争”と題する部分に記載される。
私たちはアメリカ、中国、その他のところに競争相手がいて、大型多国籍製薬会社、専門製薬会社、バイオテクノロジー会社を含みます。私たちの多くの競争相手は私たちよりも多くの財務、技術、製造、マーケティング、販売、資源または経験を持っています。もし私たちが任意の候補製品の承認を得ることに成功すれば、私たちは私たちの製品の安全性と有効性、私たちの製品の管理の容易さ、これらの製品が規制承認された時間と範囲、製造、マーケティング、販売能力の可用性とコスト、価格、精算範囲、特許地位を含む多くの異なる要素に基づく競争に直面するだろう。私たちと競争する製品は、私たちが開発する可能性のある任意の製品よりも効率的で、安全で、より便利で、より安価で、またはより効率的なマーケティングおよび販売を含む、より良い治療代替案を提供することができます。我々が候補製品を開発·商業化する費用を回収する前に、競争力のある製品は、私たちが開発したいかなる製品も時代遅れまたは競争力を持たないかもしれない。もし私たちが効果的に競争できなければ、私たちが開発する可能性のある製品を販売することから収入を得る機会は不利な影響を受けるかもしれない。
もし私たちの製品の市場機会が私たちが思っているより小さいなら、私たちの収入は不利な影響を受けるかもしれません。私たちの業務は影響を受けるかもしれません。
私たちが私たちの製品候補を通じてすべての状況を解決することに努力している正確な発病率と流行率はまだ不明である。これらの疾患を有する人の数と、私たちの候補製品治療から利益を得る可能性があるこれらの疾患患者のサブセットの予測は、私たちの信念と推定に基づいている。これらの推定は様々な源から来ており、科学文献、診療所調査、患者基金会或いは市場研究を含み、正しくないことが証明されている可能性がある。また、新しい試験はこれらの疾病の推定発病率或いは流行率を変える可能性がある。
私たちのすべての候補製品の総潜在市場は、最終的には、他の事項を除いて、販売が許可された各候補製品の最終ラベルに含まれる診断基準、代替療法の利用可能性、およびこれらの代替療法に対する私たちの候補製品の安全性、利便性、コストおよび有効性、医学界と患者の受容度、薬品定価と精算に依存する。米国、中国、その他の主要市場および他の地方の患者数は予想を下回る可能性があり、患者は私たちの製品治療を受け入れられないかもしれない、あるいは新しい患者はますます識別しにくくなったり、接触したりする可能性があり、これらすべては私たちの運営結果と業務に不利な影響を与える。
私たちは現在マーケティングや販売組織がなく、会社としても製品を商業化した経験がなく、これらの能力を開発するために大量の資源を投入しなければならないかもしれません。マーケティングや販売能力を確立できない場合や、第三者と合意して私たちの製品をマーケティングして販売することができなければ、製品収入を生み出すことができないかもしれません。
私たちは内部販売、マーケティング、流通能力もなく、製品を商業化していない。もし私たちの任意の候補製品が最終的に規制部門の承認を得たら、主要市場でこのような各製品を商業化するために、技術的な専門性と流通能力を支援するマーケティング·販売組織を構築しなければならない。これは高価で時間がかかる、あるいは直接販売チームや流通システムを構築する第三者と協力して、私たち自身の販売チームや流通システムを強化し、あるいは私たち自身の販売チームや流通システムの代わりになるだろう。ある会社として、私たちは以前生物製薬製品のマーケティング、販売と流通の面で経験がなく、販売組織の構築と管理は重大なリスクに関連しており、私たちは合格者を雇用、維持と激励し、十分な販売手がかりを生成し、販売とマーケティング人員に十分な訓練を提供し、異なる地理的な位置に分散した販売とマーケティングチームを有効に管理する能力を含む。私たちの内部販売、マーケティング、流通能力の発展のいかなる失敗や遅延も、これらの製品の商業化に悪影響を及ぼすだろう。私たちは、受け入れ可能な財務条項で協力することができないか、またはコンサルタントまたは外部サービスプロバイダを招いて、私たちの販売、マーケティング、および流通機能を支援することができないかもしれません。また、私たちが第三者に依存してこれらの機能を実現すれば、私たちの製品の収入と収益力(あれば)は、私たちが開発したどの製品のマーケティング、販売、流通よりも低くなる可能性があります。私たちはこのような第三者に対して支配権がほとんどないかもしれません。彼らのいずれも必要な資源と注意力を投入して、私たちの製品を効果的に販売し、マーケティングすることができないかもしれません。もし私たちが私たちの製品を商業化することに成功できなければ、私たち自身でも、1つ以上の第三者との手配によっても、私たちは未来にどんな製品収入も発生できないかもしれないので、私たちは重大な追加損失を招くだろう。
私たちの将来の成長は海外市場における私たちの運営能力にある程度依存するかもしれませんが、そこでは追加の規制負担や他のリスクや不確実性の影響を受けることになります。
私たちの将来の成長は私たちの候補製品を海外市場で開発し商業化する能力にある程度依存するかもしれない。海外市場適用規制機関の規制承認を得るまで、私たちは私たちの候補製品のマーケティングや普及は許可されておらず、私たちはいかなる候補製品の規制承認も得られないかもしれない。多くの他の国や地域で単独の規制承認を得るためには、安全性と有効性、および私たちの候補製品を管理する臨床試験、商業販売、定価、流通など、多くの異なる規制要件を遵守しなければならない。
もし私たちが規制機関の候補製品の承認を得て、最終的に私たちの製品を海外市場で商業化すれば、私たちは追加のリスクと不確実性に直面します
•私たちの国際販売、マーケティング、流通努力との協力や許可手配を達成するための第三者との努力は、私たちの費用を増加させたり、候補製品の獲得や開発に対する経営陣の注意をそらしたりする可能性があります
•国外の薬品審査に対する監督管理要求は異なる
•知的財産権その他の所有権の保護の低下
•私たちのビジネスの潜在的に関連する追加の第三者特許権が存在するかどうか
•関税、貿易障壁、規制要求の意外な変化
•適用される中華人民共和国以外の税制構造の影響と潜在的に悪影響
•特定の国や地域の政治文化気候や経済条件の変化
•インフレ、特に外国経済と市場の政治的不安定を含む経済的疲弊
•居住または旅行する従業員の税務、雇用、移民および労働法の遵守;
•外国為替変動は、営業費用の増加と収入の減少、他の国での業務展開に付随する他の義務を招く可能性がある
•海外清算、定価、保険制度
•地方司法管轄区域で契約条項を効果的に実行することの困難さ
•労働騒乱が一般的に存在する国では労働力の不確実性
•当社の従業員および契約した第三者が、米国財務省外国資産管理局の規則および規制、 1977 年の米国海外腐敗行為防止法 ( 改正 ) 、およびその他の適用される規則および規制を遵守しなかったこと。
•並行輸入の可能性とは、現地販売者が高いまたは高い現地価格に直面して、現地で商品を購入する際に発生する場合ではなく、国際市場からより低い価格で商品を輸入することを選択することである
•海外の原材料供給や製造能力に影響を与える事件による生産不足
•政府の価格統制やその他の市場のダイナミクスによって価格が低下する国からの競合製品の違法輸入
•戦争やテロなどの地政学的行動、地震、台風、洪水や火災などの自然災害、公衆衛生上の流行による事業の中断。
私たちの業務運営や業界に関連するリスク
私たちの経営業績は大幅に変動する可能性があり、これは私たちの将来の経営業績を予測しにくくし、私たちの経営業績が予想を下回ったり、私たちが提供する可能性のあるいかなる指導を招く可能性があります。
当社の業績は大きく変動する可能性があるため、将来の業績を予測することは困難です。これらの変動は、以下を含むがこれらに限定されない様々な要因により発生する可能性があります。
•私たちの候補製品に関する研究、開発、規制承認、商業化活動の時間、コスト、投資レベルは時々変化する可能性がある
•私たちの候補製品についての保険·精算政策(承認されれば)、将来私たちの製品と競争する可能性のある薬
•私たちの候補製品を製造するコストは、生産数量と第三者製造業者と合意した条項によって変化するかもしれません
•私たちはライセンス者や他の第三者に使用料または他の支払いの時間と金額を支払わなければなりません。これらのライセンシーと他の第三者から子会社の統制権変更によって支払われるべき金額を含む候補製品の許可を得ました
•他の候補品や技術の獲得、開発、商業化のための支出が生じる可能性があります
•承認された製品の需要レベルには、大きな差がある可能性がある
•未来の会計宣言や私たちの会計政策の変化;
•我々の候補製品または競合製品の臨床前研究または臨床試験のタイミングおよび成功または失敗、またはわが業界の競争構造における任意の他の変化は、私たちの競争相手またはパートナー間の統合を含む。
これらの要素の累積影響は私たちの経営業績に大きな変動と予測不可能を招く可能性がある。したがって、異なる時期に私たちの経営業績を比較することは意味がないかもしれない。投資家たちは私たちの過去の業績を私たちの未来表現の指標として依存してはいけない。
このような変化性および予測不可能性はまた、業界や金融アナリスト、または投資家の任意の時期に対する期待を満たすことができない可能性がある。もし私たちの収入や経営業績がアナリストや投資家の予想よりも低い場合、または私たちが市場に提供するいかなる予測よりも低い場合、または私たちが市場に提供する予測がアナリストや投資家の予想よりも低い場合、私たちのアメリカ預託証明書の価格は大幅に低下する可能性がある。私たちが提供する可能性のある以前に公開された収入や収益指針に達していても、このような米国預託株式価格の下落が起こる可能性がある。
私たちは経営陣や他の臨床·科学者のサービスに依存しており、これらの人を引き留めたり、より多くの管理や臨床·科学者を募集することができなければ、私たちの業務は影響を受けるだろう。
著者らの成功はある程度著者らが引き続き高素質の管理者及び臨床と科学者の能力を吸引、維持と激励することにかかっている。私たちは私たちの上級管理職、特にCEO、総裁、会長、そして私たちのベテラン科学者と上級管理チームの他のメンバーに高く依存しています。これらの人の誰もがサービスを失っても、私たちの製品パイプラインの成功開発、私たちの計画中の臨床試験の開始または完成、あるいは私たちの候補製品の商業化を遅延または阻止する可能性があります。私たちはすでに私たちの上級管理チームの各メンバーと雇用協定や招聘書に署名していますが、これらの合意は自由に終了することができますので、彼らのサービスを予定通りに維持することができないかもしれません。現在、CEOや会長総裁以外には、役員や従業員の生命に“キーパーソン”生命保険をかけることはありません。保険不足は、私たちがこのような個人のサービス損失を補うために十分な賠償を受けられない可能性があるということを意味する。
私たちの臨床開発と商業化努力に成功するために、私たちの管理、運営、財務、その他の資源を拡大し、効果的に管理する必要があるだろう。私たちはアメリカ、中国、その他の国の他の生命科学技術会社、大学と研究機関と合格した管理と科学人材を争っている。製薬、生物科学技術とその他の業界の合格人材に対する激しい競争のため、著者らは未来に著者らの独特な会社文化を維持することに成功し、引き続き合格の管理と科学と臨床人材を誘致或いは維持することができないかもしれない。近年、私たちの業界の管理職の流出率は高い。私たちが必要な人員を誘致、統合、維持、激励することができなければ、私たちの業務目標を達成することは、私たちの発展目標の実現、追加資本を調達する能力、そして私たちが業務戦略を実施する能力を深刻に阻害する制限に直面する可能性があります。
私たちは、私たちの高度な管理チームの拡大や施設の建設など、私たちの成長を管理し、私たちの業務の拡大に成功することで困難に直面するかもしれません。
2023年12月31日までに81人のフルタイム従業員がいます。私たちは私たちの高度管理チームの拡大を含めて、合格人材の誘致と維持に挑戦した。私たちは引き続き求人を希望していますが、適時に優遇条件で私たちのニーズに合った応募者を誘致し、維持することは困難に直面する可能性があります。
私たちは将来的に私たちの候補製品の臨床開発と潜在的な商業化を含む私たちの成長を支援するために、アメリカと中国での施設を拡大するかもしれない。しかし、吾らはすでに中国で土地使用権を取得した土地に研究開発実験室、製造施設、行政事務室を建設する計画を中止しており、これは吾らが中国政府当局から付与された適宜政策から将来の機会や利益を得ることを制限し、さらに吾などの財務状況や経営業績に負の影響を与える可能性がある
私たちが引き続き私たちの候補製品の潜在的な商業化を開発し、追求することに伴い、私たちは引き続き私たちの財務、開発、監督、マーケティング、販売能力を拡大し、あるいは第三者と契約を締結し、これらの能力を提供してくれる必要がある。私たちの業務の拡大に伴い、様々な戦略パートナー、サプライヤー、他の第三者とのより多くの関係を管理する必要があると予想されます。私たちの将来の財務業績と、私たちの候補製品を開発し、商業化し、効果的に競争する能力は、将来の任意の成長を効果的に管理する能力にある程度依存するだろう。
我々は臨床的に複数の候補製品を有し,様々な目標適応を考慮しているため,より利益や成功可能性の高い製品候補や適応を利用することはできない限られた資源をかけて特定の候補製品を追求する可能性がある。
財源と管理資源が限られているため、特定の製品候補、適応症、開発プログラムに注力しています。また、今後数年間にわたって複数の製品候補の臨床試験を並行して実施する予定であり、どの製品候補に焦点を当てるかの決定がより困難になる可能性があります。その結果、より大きな商業的可能性のある他の製品候補との機会の追求を放棄または遅らせることがあります。資源配分の決定は、実行可能な商用製品や収益性の高い市場機会を活用できない可能性があります。特定の適応症のための現在および将来の研究開発プログラムおよび製品候補への支出は、商業的に実行可能な製品をもたらさない可能性があります。当社が特定の製品候補の商業的可能性またはターゲット市場を正確に評価しない場合、当社は、当該製品候補の単独の開発および商業化権を保持することがより有利であった場合、将来のコラボレーション、ライセンスおよびその他の類似の取り決めを通じて、当該製品候補に関する貴重な権利を放棄することがあります。
さらに、追加的な許可内や開発段階の資産や計画を買収することが求められる可能性があり、これは私たちに追加的なリスクをもたらすだろう。将来性のある候補製品を確定、選別、獲得するには大量の技術、財政と人的資源の専門知識が必要である。このような努力は、可能な特定の候補製品を実際に獲得することを招くことはなく、何のメリットも生じることなく、私たちの管理職の時間と資源支出の分流をもたらす可能性がある。例えば、最終的に製品の承認につながる計画を決定できなければ、最終的に投資収益を提供できない製品を評価、買収、開発するために大量の資本や他の資源がかかる可能性がある。
私たちはすでに私たちの候補製品に多くの臨床試験費用を支払い続けるかもしれない。
私たちはすでに私たちの候補製品に多くの臨床試験費用を支払い続けるかもしれない。私たちの第三者費用の大部分はrademikibartとicanbelimodの開発と関連がある。2022年および2023年12月31日までの年度までに,吾らはそれぞれレドミキバートに関する臨床試験関連支出5,410万ドルおよび3,660万ドル,およびそれぞれicanbelimodに関する臨床試験関連支出2,630万ドルおよび360万ドルに相当した。臨床開発後期にある候補製品は通常,臨床開発早期段階の候補品よりも開発コストが高いのは,主に後期臨床試験の規模と持続時間が増加しているためである。臨床試験(特に第3段階臨床試験に入ると)を継続し,任意の候補製品を生産または生産していれば,コストが増加すると予想される。
臨床開発自体の予測不可能性のため、著者らは著者らの製品候補製品の現在或いは未来の臨床試験の時間、コスト或いは成功確率を決定することができない。臨床試験の結果,規制の発展,および候補製品ごとのビジネス潜在力の評価に基づいて,どのような適応を採用するか,どの程度の資金が必要かを決定し,各適応を継続的に指導することが予想される。私たちは将来的に私たちの候補製品の臨床開発のために追加の資金を集める必要があるかもしれません。もし私たちの候補製品が商業化できれば。特に、私たちは、私たちの主要候補製品rademikibartの次の段階の臨床開発を支援するために、より多くの経験やインフラを提供するために、潜在的なグローバル·地域パートナーを積極的に探しています。私たちがタイムリーに基づいて、または許容可能な条件下でこのようなパートナーシップを構築することは保証されない さらに、すべてのパートナーシップの条項と条件に支配されており、私たちがコントロールできない外部要因は、このようなパートナーシップの下で支払いを達成し、資金調達目標を達成する能力に影響を与える可能性がある。例えば2023年11月21日に接続許可者はSimcereに入ります
シムセルライセンス保有者と合意し、中国大区でラドミキバートを開発し商業化した。しかしながら、適用される法律の変更、製品開発または承認の遅延、私たちが制御できない他の要因、またはいくつかの中国のrademikibart実験がそれぞれの主要な終点に到達できなかったことは、Simcereプロトコル下での将来の支払いを達成する遅延または中断をもたらす可能性がある。
我々の候補製品の臨床開発コストは高度に不確定であり、以下の要素によって大きく異なる可能性がある
•患者1人当たりの試験コストは
•承認に必要な試験回数
•実験に含まれる場所の数
•どの国で実験を行っていますか
•条件に適合する患者を登録するのに要する時間長;
•実験に参加した患者数
•患者の中退率や中途停止率
•規制当局が要求する潜在的な追加的な安全監視;
•患者が試験とフォローアップの持続時間に参加した
•私たちの候補製品を作るコストとタイミング
•私たちの候補製品の開発段階
•私たちの候補製品の有効性と安全性。
我々の候補製品開発に関するこれらの変数のいずれも,その開発に関するコストや時間の大きな変化を招く可能性がある.私たちが努力し、発生し、発生するコストにもかかわらず、私たちは規制部門の任意の候補製品の承認を得ることができないかもしれません。これは私たちの業務、経営業績、将来性、または財務状況を深刻に損なう可能性があります。
私たちは、米国の“海外腐敗防止法”や“海外腐敗防止法”や、中国と私たちが業務を経営している他の国の反腐敗·反賄賂法律、および米国と外国の輸出規制、貿易制裁、輸入法律法規のような責任に直面する可能性がある。これらの法律要件を遵守することは、私たちの海外市場での競争能力を制限する可能性があり、私たちがこれらの法律に違反したと判断するいかなる行為も、私たちの業務または私たちの名声に実質的な悪影響を及ぼす可能性がある。
私たちの業務は“海外腐敗防止法”および中国と私たちが業務を展開している他の国の反賄賂や反腐敗法律、法規または規則のような制約を受けています。“海外腐敗防止法”およびその他の法律は、一般に、業務または他の利益を獲得または保留することを目的として、私たち、私たちの官僚、私たちの従業員、および仲介機関が非米国政府当局者に不正なお金を直接または間接的に提供、許可または支払いすることを禁止している。私たちは第三者を招いてアメリカ以外で臨床試験を行い、商業化段階に入った後に私たちの製品を海外に販売し、および/または必要な許可、許可証、特許登録、その他の規制承認を得ることができる。私たちはすでに政府機関や政府付属病院、大学、その他の組織の役人や従業員と直接または間接的な相互作用を行っている。
私たちの業務の拡大に伴い、“海外腐敗防止法”や他の反賄賂法の私たちの業務への適用性が増加します。もし私たちが反賄賂コンプライアンスの手続きおよび制御措置を監督して私たちを従業員や代理の無謀なまたは犯罪から守ることができない場合、または私たちまたは私たちの従業員、代理、請負業者、または他の協力者が適用される反賄賂法律を遵守できない場合、私たちの名声は損なわれる可能性があり、私たちは刑事または民事処罰、他の制裁および/または巨額の費用を招く可能性があり、これは私たちの財務状況、運営結果、キャッシュフロー、および将来性を含む私たちの業務に実質的な悪影響を及ぼすかもしれない。
また、私たちの製品が承認されれば、米国と外国の輸出規制、貿易制裁、輸入法律法規の制約を受ける可能性がある。私たちの製品の輸出入に対する政府の規制、あるいは私たちの製品のために必要な輸出入許可を得ることができなかったり(適用されれば)、私たちの将来の販売を損なう可能性があり、私たちの将来の収入に悪影響を及ぼす可能性があります。私たちの製品輸出に関する適用法規の要求を遵守することは、私たちの製品を国際市場に導入することを延期したり、場合によっては、私たちの製品のいくつかの国/地域への輸出を完全に阻止するかもしれません。また、米国の輸出規制法と経済制裁は、米国の制裁対象国、政府、個人に特定の製品やサービスを輸送することを禁止している。もし私たちが適用された輸出入条例とこのような経済制裁を守らなければ、罰金および/または特定の輸出を拒否することを含む罰を受けるかもしれない
特権です。私たちの製品の輸出や販売能力のいかなる制限も、承認されれば、私たちの業務に悪影響を及ぼす可能性があります。
私たちは様々な外国、連邦、州医療保健法律法規の制約を受けて、これらの法律法規を守らなければ、私たちの運営結果と財務状況を損なう可能性があります。
私たちの業務運営と調査者、医療専門家、コンサルタント、第三者支払者と顧客との現在と将来の手配は、私たちが広く適用される外国、連邦、州詐欺と乱用、その他の医療法律と法規に直面させます。これらの法律は、私たちがマーケティング、販売、流通をどのように研究、マーケティング、販売、流通するかを含む、私たちが業務を展開する業務または財務配置と関係を制約するかもしれません。これらの法律には
•米国の“反リベート条例”は、他の事項に加えて、個人または実体が直接または間接的に、現金または実物で直接または間接的に請求、提供、受取、または任意の報酬(任意のリベート、賄賂またはリベートを含む)を提供することを禁止し、個人の推薦または購入、レンタルまたは注文、または任意の商品、施設、物品またはサービスの購入、レンタルまたは注文を手配または推薦して、連邦医療保険および医療補助などの連邦医療計画に基づいて全部または部分的な支払いを行うことを禁止する。この法規は、他の事項を除いて、薬品メーカーと処方者、薬局、購入者、処方管理人との間の手配に適用されると解釈されている。個人または実体は、連邦反リベート条例またはこの条例に違反する具体的な意図を実際に知る必要がなく、違法行為を実施することができる
•米国の虚偽申告法は、民事虚偽申告法および民事罰金法を含み、他の事項に加えて、個人または実体が故意に連邦政府に虚偽または詐欺的な支払いまたは承認クレームを提出または提出することを禁止し、虚偽または詐欺的クレームに関連する虚偽記録または声明を故意に作成、使用または使用し、またはそれを知っているか、または連邦政府に金銭を支払う義務を回避、減少または隠蔽するために虚偽陳述を行うことを引き起こすことを禁止する。また、米国政府は、民事虚偽請求法案については、連邦反リベート法規違反による物品やサービスを含むクレームが虚偽または詐欺的クレームを構成していると断言できる。責任は医療保健業界において潜在的な重大な意義を持っている。法規規定はすべての虚偽或いは詐欺的な違反クレーム或いは声明に対して3倍の損害賠償と重大な強制処罰を規定しているからである
•“経済·臨床健康情報技術法案”(HITECH)及びそのそれぞれの実施条例により改正された米国1996年“健康保険携帯及び責任法案”(HIPAA)は、任意の医療福祉計画を詐欺の計画を故意に実行または実行しようとしているか、または医療福祉、プロジェクトまたはサービスの提供または支払いに関連する重大な事実を故意に偽造、隠蔽または隠蔽または隠蔽するなどの行為に対して、刑事および民事責任を適用する。連邦反リベート法規と同様に、個人または実体は、この法規または法規違反の具体的な意図を実際に理解する必要がなく、違反を実施することができる
•米国の“医師支払い陽光法案”は、ある薬品、機器、生物製品および医療用品のメーカーが毎年医療保険および医療補助サービスセンター(CMS)に医師(医師、歯医者、検眼師、足科医師および脊椎マッサージ師を含むと定義されている)、ある非医師従事者(医師アシスタント、看護師従事者、臨床看護師、登録看護師麻酔科医)への支払いおよび他の“価値移転”に関する情報を報告することを要求しており、これらのメーカーはMedicare、Medicaidまたは児童健康保険計画(いくつかの例外を除く)に基づいて支払う。麻酔科医アシスタントと勤務看護師助産師)と教育病院、これらの医師とその直系親族が持つ所有権と投資権益;そして
•同様の州および外国の法律、例えば、州反リベートおよび虚偽クレーム法律は、研究、流通、販売およびマーケティング、および非政府第三者支払者(個人保険会社を含む)による精算または患者自身による支払いに関する医療項目またはサービスに関するクレームを含むが、これらに限定されないが、州法律は、製薬会社に製薬業界の自発的コンプライアンスガイドラインおよび連邦政府によって発行された関連するコンプライアンスガイドラインを遵守することを要求するか、または他の方法で医療保健提供者および他の潜在的な転換源への支払いを制限することを含むが、これらに限定されない。医薬品製造業者に、価格設定およびマーケティング情報に関連する報告書の提出を要求するか、または医師、他の医療提供者および実体に提供されるプレゼントおよび他の報酬および価値項目を追跡することを要求する州法律および法規、ならびに医薬品販売代表の登録を要求する州および地方法律。
これらの法律の範囲が広く、既存の限られた法定例外状況と安全港の規制によって、私たちのいくつかの商業活動は1つ以上のこのような法律の挑戦を受けるかもしれない。
私たちが第三者の業務配置と適用される医療法律や法規に適合するように努力することは、多くのコストに関連することを確実にします。これらの法律に違反して私たちにとった行動は、たとえ私たちが弁護に成功しても、巨額の法的費用を招き、私たちの経営陣の業務運営への注意をそらす可能性があります。持続的に変化するコンプライアンス環境、および異なるコンプライアンスおよび/または報告要件を有する複数の司法管轄区域の必要性に適合するために、強力かつ拡張可能なシステムを確立し、維持することは、医療会社が1つまたは複数の要件と衝突する可能性を増加させる
もし私たちの運営がこれらの法律または任意の他の私たちに適用される可能性のあるすべての政府法規に違反していることが発見された場合、私たちは重大な民事、刑事と行政処罰、損害賠償、罰金、返還、監禁、MedicareおよびMedicaidなどの政府援助に参加する医療計画から除外され、追加の報告要求および監督に直面する可能性があり、もし私たちが会社の誠実な合意または同様の合意の制約を受けて、これらの法律違反に関する告発を解決し、私たちの業務を削減または再構築することができる
実際または予想されるように、適用されるデータ保護、プライバシーおよびセキュリティ法律、法規、基準、およびその他の要求を遵守できないことは、私たちの業務、運営結果、および財務状況に悪影響を及ぼす可能性があります。
プライバシーとデータ保護の立法と規制構造は世界各地の司法管轄区域で発展し続けており、プライバシーやデータ保護問題にますます注目されており、これは私たちの業務に影響を与える可能性がある。これらの要求を遵守することは困難で、時間がかかり、高価である可能性があり、私たちの業務慣行を変更し、追加のコンプライアンスメカニズムを確立する必要があるかもしれない。個人または他の敏感な情報に関する法律、法規、および契約およびその他の義務を遵守しないことは、罰金、公開非難、処罰の処理、影響を受けた個人の損害クレーム、私たちの名声被害、および名誉損失を含む、私たちに対する法執行行動を引き起こす可能性がある。新しい法律と既存の法律は私たちのやり方と一致しない方法で解釈·適用される可能性があり、私たちが変化していくデータ保護ルールを守る努力は失敗するかもしれない。
米国では、 HITECH によって改正された HIPAA およびその実施規則、または総称して HIPAA は、とりわけ、個人を特定できる健康情報のプライバシー、セキュリティ、送信および違反報告に関する特定の基準を課しています。患者の健康情報を取得する研究機関を含むほとんどの医療提供者は、 HIPAA の下で公布されたプライバシーおよびセキュリティ規制の対象となります。当社は現在、 HIPAA の対象事業体またはビジネスパートナーとして活動しており、したがって HIPAA の下で直接規制されていないとは考えていませんが、誰でも HIPAA の刑事規定に基づいて直接または助長または共謀の原則の下で起訴される可能性があります。結果として、事実や状況によっては、 HIPAA が適用する医療提供者または研究機関から、個人を特定できる健康情報の開示に関する HIPAA の要件を満たしていない個人を特定できる健康情報を故意に受け取った場合、当社は重大な刑事罰に直面する可能性があります。
一部の州では、同様のプライバシーやセキュリティ法律法規を採択し、健康に関する個人情報や他の個人情報のプライバシー、処理、保護を管理している。これらの法律と法規は、異なる裁判所や他の政府当局によって解釈され、私たちおよび未来の顧客と戦略パートナーに潜在的な複雑なコンプライアンス問題をもたらすだろう。例えば、2018年カリフォルニア消費者プライバシー法、またはCCPAは、2020年1月1日に施行される。CCPAはカリフォルニアの消費者にプライバシー権を創出し,特定の個人情報を扱うエンティティのプライバシーとセキュリティ義務を増加させている.また、データ漏洩に個人訴権を提供し、データ漏洩訴訟の可能性と関連リスクを増加させ、法定損害賠償枠組みを作成した。また、カリフォルニアプライバシー権法案、またはCPRAは、一般に2023年1月1日に施行され、消費者の個人情報に関する権利を拡大し、実施や法執行を監督するための新たな州機関を作成することを含むCCPAの大きな改正が行われている。2023年7月にCPRAを実施する前に、追加のコンプライアンス投資と潜在的なビジネスフローの変化が必要になる可能性があります。例えば、バージニア州、コネチカット州、ユタ州、ワシントン州、コロラド州では類似した法律が可決され、他の州や連邦政府も同様の法律を提出しており、これは米国がより厳しいプライバシー立法に傾いている傾向を反映している。このような法律の公布は相互衝突の要求があり、コンプライアンスを挑戦的にする可能性がある。もし私たちがHIPAA、CCPA、CPRA、または他のアメリカ国内のプライバシーおよびデータ保護法律の制約または影響を受けた場合、これらの法律の要求を遵守できなかったために負ういかなる責任も、私たちの財務状況に悪影響を及ぼす可能性があります。
私たちのヨーロッパとイギリスやイギリスでの業務はまたデータ保護当局によってより厳格に審査されたり注目されたりするかもしれない。例えば,EU一般データ保護条例(EU GDPR)は個人データの処理に厳しい要求をしている。英国はEU GDPRを英国GDPR(総称してGDPRと呼ぶ)として施行し,2018年の英国データ保護法と肩を並べている。GDPRはEUやイギリスで行われている臨床試験に対する義務を増加させ,例えば個人データの定義を拡大し,コードデータを含めてインフォームドコンセントに具体的な要求を加え,臨床試験対象や研究者に詳細な通知を提供している。GDPRは管制官に追加的な義務を課しています
その中には,問責や透明性に関する要求,任意の新製品やサービスを開発する際に資料保護を考慮する義務,個人資料保護権利を遵守する義務,および,(I)資料保障監督当局に個人資料が侵害されたことを報告する義務が含まれており,関連する個人資料が漏洩されて資料当事者の権利や自由にリスクを与える可能性が相当する限り,(Ii)個人資料が漏洩することがその権利や自由に高いリスクを与える可能性が高い場合には,関連する個人資料が漏洩した後の不適切な遅延(72時間遅れなく)を資料保障規制当局に報告してはならない。EU GDPRの要求を守らないことは、20,000,000ユーロまでの罰金や要求を満たしていない会社の前会計年度の世界年商の4%を招き、高い者を基準に、その他の行政処罰を招く可能性がある。また,GDPRはデータ当事者と消費者協会が監督当局に苦情を申し立て,司法救済を求め,GDPR違反による損害賠償の私的訴権を獲得することを与えている
他の要件では、EU GDPRは、データ転送機構が確立されていない限り、またはEU GDPR下の克減に依存することができる限り、GDPRによって拘束された個人データを欧州経済地域(EEA)から欧州委員会に“十分な”データ保護レベルを提供できないと考えている第三国への国際転送を禁止する。2020年7月、欧州連合裁判所(CJEU)は、国際移転のために使用されるEU-米国プライバシー盾の枠組みが無効である組織がどのように個人データをEEAから米国に合法的に移転するかを制限し、会社に移転プライバシー影響評価(TIA)を要求することを含む、標準契約条項(EU SCC)の使用にさらに制限を加えた。欧州委員会は2021年6月4日にCJEUの決定と欧州データ保護委員会からの提案を説明するために改訂されたEU SCCSを発表した。2023年7月10日、欧州委員会は、米国がEU-米国データプライバシー枠組み(DPF)自己認証のエンティティへの個人データの十分性または十分性決定を送信することを承認する最終実施決定を採択した。EUのSCCに依存して米国に移転するエンティティも、米国の国家安全保障措置および修復措置に関するTIAの等価性を支持するために、十分な決定における分析に依存することができる
英国GDPRも、個人データをイギリスからイギリス政府に移すのが不適切とされている管轄区域に類似した制限を加えている。イギリス情報事務室は、(I)イギリス以外への移行の国際データ転送プロトコルと呼ばれる自身の形態のEU SCCと、(Ii)イギリスの範囲内で動作するためにこのような条項の関連条項を修正する新しいEU SCCSの“イギリス付録”と、(Iii)自身のバージョンのTIA(各エンティティはEUまたはイギリス式のTIAを採用することを選択することができるが)とを公表している。また,2023年9月21日,イギリス科学,革新,技術大臣は英米データブリッジ(すなわちイギリスの十分性決定に相当)を構築し,英米データブリッジ(イギリス充足性法規)を実施するためのイギリス法規を採択した。現在,個人データはイギリスによるDPFの拡張によりイギリスから英米データブリッジを介してDPFによるイギリス拡張自己認証組織に転送されることができる。
英国GDPRは、1,750万GBまでの罰金や違反会社の前会計年度の世界年商総額の4%を含むEU GDPRや同様の処罰規定とは異なる義務を課しており、金額の高い者を基準としている
2022年1月31日、EU“臨床試験条例”の応用が開始された。この新規定は臨床試験によるデータの使用に義務を課し,EU患者に臨床試験に関する情報を得る機会を与えている
私たちが他の国や司法管轄区域に拡張し続けるにつれて、私たちは追加の法律と法規の制約を受けるかもしれません。これらの法律と法規は私たちが業務を展開する方法に影響を与えるかもしれません。
中国の監督管理機関はすでにデータ保護に関する複数の立法と監督管理提案を実施し、考慮している。例えば、2017年6月に施行された“中華人民共和国ネットワークセキュリティ法”は、インターネットまたは他の情報ネットワークを介してサービスを提供するすべての中国組織を含む可能性がある中国初の国家レベルデータ保護をネットワーク事業者に創出した。また、いくつかの特定の業界の法律と法規は中国国内の個人データの収集と移転に影響を及ぼす。例えば、2019年5月28日、中華人民共和国国務院は“人類遺伝資源管理条例”を公布し、2019年7月1日から施行した。この規則によると、ヒト遺伝資源或いはHGRに関連する国際協力プロジェクトはMOSTの許可を得なければならないが、中国で発売された薬物と器械の臨床試験国際協力を支持することを目的としており、これらの協力はHGR材料を国外に移転しない。中国はこのような例外のための届出手続きを構築した。中国全国人民代表大会常務委員会が2020年10月に公表した“中華人民共和国生物安全法”はさらにこのHGR監督管理制度を確認し、2021年4月に施行された。この届出手続きを遵守するためには,双方の当事者が裁判開始前に使用する高GRのタイプ,数,用途に関する情報を提出しなければならない.HGRサンプルまたは関連データの国境間転送については、それぞれ異なる形態の審査および事前承認を受ける必要がある。HGRサンプルの輸出或いは国境を越えた譲渡は、MOSTの許可を得て、輸出証明書を取得しなければならない。以下のサービスを提供します
HGR関連データを非中華人民共和国締約国に提供するか、または非中華人民共和国締約国がHGR関連データを使用することを可能にするには、MOSTに記録を提出し、対応する情報のコピーを提出する必要がある。このような規定または許可された用途が公衆衛生、国家安全、または中華人民共和国の公共利益に影響を与える可能性がある場合、追加の安全審査が行われる。2023年5月、衛生部は“中華人民共和国人類遺伝資源管理条例実施細則”を発表し、非中華人民共和国締約国の定義、国際協力の範囲、HGR情報とHGR材料及び安全審査基準について一定の解明を行った。2023年3月、第14期全国人民代表大会は国務院の再編を発表し、HGRの審査権限はMOSTから国家衛生委員会、即ちNHCに移行する可能性がある。この取り組みは,改正された“ヒト遺伝資源管理条例”と一致しており,2024年3月に改正され,2024年5月に施行される。これらの改正に基づいて、NHCはHGRの審査と承認手続きを担当するだろう。これらの法律の解釈と適用は私たちのやり方と一致しない可能性があり、不正収益の返還、HGRサンプルと関連データの没収、行政罰金、一時(1-5年)またはさらなるHGRプロジェクトにおける会社と責任者の資格を永久に取り消し、さらには刑事責任を負う可能性がある。また、国際協力関係者は、国際協力による特許を共同で所有することが求められており、これは、我々の製品に関連するこのような協力による特許を独占的に所有する能力に悪影響を及ぼす可能性がある。
中国のデータ保護とネットワークセキュリティ法のさらなる情報については、項目3.dを参照されたい。リスク要因−中国でのビジネスに関するリスク−中国の新しいデータセキュリティ法,ネットワークセキュリティ審査方法,個人情報保護法,多段保護計画に関する法規やガイドライン,その他の任意の将来の法律や法規を遵守することは,巨額の費用が発生し,我々の業務に大きな影響を与える可能性がある
適用される法律、法規、基準、私たちの契約義務、および他の法的義務を遵守するために努力しているにもかかわらず、これらの要求は、異なる司法管轄区域で不一致な方法で修正、解釈、適用される可能性があり、お互いまたは私たちが遵守しなければならない他の法的義務と衝突する可能性がある。私たちまたは私たちの従業員、代表、請負業者、コンサルタント、協力者、または他の第三者は、そのような要求を遵守できなかったか、またはプライバシーおよびセキュリティ問題を十分に解決できなかったと考えられ、根拠がなくても、私たちの追加コストおよび責任を招き、私たちの名声を損なうことができ、私たちの業務および運営結果に悪影響を及ぼす可能性があります。
最近公布された立法、将来の立法、医療改革措置は、候補製品の市場承認を獲得し、それを商業化する難しさとコストを増加させ、設定可能な価格に影響を与える可能性がある。
米国、中国、一部の外国司法管轄地域では、医療システムは、コスト制御措置を含む複数の立法·規制改革を継続しており、これらの措置は、新薬の保証範囲や精算範囲を減少または制限し、上場承認された任意の候補製品を収益的に販売する能力に影響を与える可能性がある。特に,米国連邦や州レベルでは,医療コストの低減と医療の質の向上を図る取り組みが継続されている。
例えば,2010年3月,米国では“保健·教育協調法”により改正された“患者保護と平価医療法”が公布され,総称して“平価医療法”と呼ばれている。ACAの中で私たちの潜在的な製品候補に重要な意味を持つ条項の中で、ACA:任意の指定ブランドの処方薬や生物製剤の実体に控除できない年間費用を生産または輸入すること、メーカーの医療補助リベート責任を連邦医療補助管理に参加する医療機関に割り当てられた個人の保険薬品に拡大すること、医療補助計画の資格基準を拡大すること、340 B薬品割引定価計画によって割引を得る資格がある実体を拡大すること、医療薬品補助リベート計画に基づいてメーカーが支払わなければならない法定最低リベートを高めること;患者を中心とした新たな結果研究所を構築し、監督、優先事項を確定し、臨床効果比較研究を行い、このような研究に資金を提供すること;そして、CMSに医療保険と医療補助革新センターを設立し、革新的な支払いとサービス交付モデルをテストし、医療保険と医療補助支出を低減する。
ACAのいくつかの側面は公布以来、行政、司法、そして国会の挑戦を受けてきた。2021年6月17日、米国最高裁はいくつかの州がACAに対して提出した最新の司法挑戦を却下したが、ACAの合憲性を具体的に裁くことはなかった
さらに、ACAが公布されて以来、他の立法改正も提案され、採択された。2011年8月2日、2011年予算統制法が法律に署名され、それ以外にも、2013年から提供者に支払われる医療保険が減少し、その後の立法改正により有効となったが、2020年5月1日から2022年3月31日まで2022年前の6ヶ月間一時停止された
国会が追加行動を取らない限り、2032年12月31日までの財政年度。2013年1月2日、2012年の“米国納税者救済法”が法律に署名し、病院を含むいくつかの医療サービス提供者に支払う医療保険を減らし、政府が提供者に追加金を取り戻す訴訟時効を3年から5年に延長した。2021年3月11日,総裁·バイデンは2021年米国救援計画法案に署名し,2024年1月1日から法定医療補助薬品還付上限を廃止した。これまで,還付の上限は薬品メーカーの平均価格の100%であった。
また、処方薬のコストが上昇していることを受けて、米国政府は薬品定価のやり方の審査を強化した。このような審査は,最近の数回の国会調査を招き,製品定価の透明性の向上,価格設定とメーカー患者計画との関係の審査,政府計画の製品精算方法の改革を目的とした連邦や州立法を提案·採択した。2022年8月、“2022年インフレ削減法案”(IRA)が署名され法律となった。他の事項を除いて、アイルランド共和軍は薬品と生物製品メーカーに対して連邦医療保険B部分とD部分精算製品にインフレリベートを徴収し、これらの製品の価格上昇速度がインフレより速い場合は2023年から、連邦医療保険D部分福祉を改正し、2025年から福祉年度自己支出上限を2,000ドルとし、製薬業者に新たな割引義務を課し、2026年から連邦医療保険·医療補助サービスセンターと価格交渉を行った後、連邦医療保険B部分とD部分がカバーする固定数量の薬品と生物製品のための“最高公平価格”を確立するあるいは…不妊系CMS。CMSはまた、2023年6月30日に、2023年から2024年の間に行われる第1回価格交渉の要求を詳細に説明し、2026年に発効する“最高公平価格”条項の製品に適用する指導意見を発表し、2023年8月29日に、薬品価格交渉計画が現在法的課題に直面しているにもかかわらず、価格交渉を受ける10種類の薬物の初期リストを公表し、あるメーカーが段階的に製品割引に参加する資格があることを決定する段階の方法を概説する“個人退職法案”を実施する措置を講じている。そして2023年12月14日に48種類の連邦医療保険B部分製品を含むリストを発表し、これらの製品の共同保険料率はアイルランド共和軍2024年1月1日から2024年3月31日までのインフレリベート条項に基づいて調整された。アイルランド共和軍は衛生·公衆サービス部長官が最初の数年に規制ではなく指導によってその多くの規定を実施することを許可した。このような理由と他の理由で、アイルランド共和軍がどのように実施されるのかは不明だ。似たようなものや他の薬品の価格設定提案は未来の立法に現れるかもしれない
州レベルでは、立法機関は、価格(価格変化、マーケティングコスト、研究コストなどを含む)の開示を要求する透明性措置を含む、薬品および生物製品の価格設定問題を解決するための法規を立法し、実施することが増えている。場合によっては、国家法律法規は、他の国からの輸入と大口調達を奨励することを目的としている。最近,FDAは2024年1月5日にフロリダ州の輸入計画を承認し,同州の薬剤師や卸がカナダから何らかの薬物の輸入を許可した さらに、過去数年間に公布されたいくつかの州法律は、関連法規によって決定された一定レベルを超える価格上昇を州機関および/または商業購入者に開示することを要求する。その中のいくつかの法律は政府職員たちがまだ明確にしていない曖昧な要求を含む。法律とその実施の不明確性を考慮して、私たちの未来の通報行動は関連連邦と州法律法規の処罰条項によって制限されるかもしれない。また,地域医療当局や個別病院では,どの薬品やサプライヤーが処方薬や他の医療計画に含まれるかを決定するために入札プログラムが使用されるようになってきている。第三者支払者による支払金額の価格制御またはその他の制限は、当社の業務、運営結果、財務状況、見通しを損なう可能性があります。
また、2018年5月30日、2017年のTrickett Wendler、Frank Mongiello、Jordan McLinn、Matthew Bellina Right to Trial Act、またはRight to Trial Actと呼ばれ、法律に署名されました。他の事項以外に、この法律は生命を脅かす疾病或いは状況を有する患者に連邦フレームワークを提供し、彼らが第一段階の臨床試験を完成したいくつかの研究新薬製品を得ることができるようにした。場合によっては、条件に適合する患者は、臨床試験に参加することなく、FDA拡大参入計画に従ってFDAの承認を得ることなく治療を求めることができる。“試用権法案”によると、薬品メーカーはその薬品を条件に合った患者に提供する義務がない。
将来的にとりうる医療改革措置は,連邦医療保険や他の医療資金のさらなる減少,より厳しいカバー基準,新たな支払い方法,および任意の承認された製品に対してより大きな下方圧力を受ける可能性があると予想される。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。コスト抑制措置や他の医療改革を実施することは、承認されれば、収入を創出し、利益を達成することができ、あるいは候補製品を商業化することができるかもしれない。
EUでは、承認されれば、同様の開発が候補品を利益にして商業化する能力に影響を与える可能性がある。2021年12月13日,第2011/24/EU号指令の改正第2021/2282号衛生技術評価条例(HTA)が可決された。HTA規制は2022年1月に施行されますが、開始されるだけです
2025年1月から申請され、その間に実行に関する準備と手順が取られる。適用されると、それは関連製品に従って段階的に施行されるだろう。HTA規制は、新医薬製品を含む衛生技術の評価におけるEU加盟国の協力を促進し、これらの分野の共同臨床評価にEUレベルの協力基盤を提供することを目的としている。EU加盟国がEUの範囲内で汎用的なHTAツール、方法、およびプログラムを使用することを可能にし、4つの主要な分野で協力することを可能にする最高値患者への潜在的な影響は,科学相談に連携し,開発者はHTA当局にアドバイスを求め,新興の衛生技術や有望な技術を早期発見し,他の分野での自発的な協力を継続することができる。個別EU加盟国は、衛生技術の非臨床(例えば、経済、社会、倫理)の評価を引き続き担当し、定価と精算について決定する。
我々のいくつかの投資は米国外国投資委員会(CFIUS)の審査を受ける可能性があり、これは取引完了を延期または阻止する可能性がある。
CFIUSは外国人が米国会社への支配権を獲得した投資と、キー技術、キーインフラあるいは敏感な個人データ取引に従事するアメリカ企業のいくつかの非持株投資に対して管轄権を持っている。キーテクノロジー取引に関連する米国企業のいくつかの取引は強制的な届出要求を守らなければならない。したがって,我々の業務の米国部分が外国投資家の投資を受け入れることを決定した場合,あるいは米国業務の全部または一部を投資または買収することにした場合,このような投資はCFIUSの管轄を受ける可能性がある。これまで我々の投資はCFIUSの審査を受けていなかったが,進行中や将来の投資の詳細により,取引完了前にCFIUSの承認を得る義務がある可能性があり,署名から完了までの期間が遅れる可能性がある.CFIUSの申請が強制的ではない(あるいは他の方式で提案されている)と判断すれば,CFIUSが取引がその管轄を受けていると判断すれば,自分の審査を開始するリスクがある.ある投資が重大な国家安全懸念を引き起こした場合、米国外国投資委員会は緩和条件を適用したり、総裁に取引を阻止することを提案する権利がある。
私たちに製品責任訴訟を提起すれば、私たちは重大な責任を負い、私たちの製品の商業化を制限することを要求されるかもしれません。
私たちの候補製品の臨床試験のため、私たちは固有の製品責任リスクに直面して、私たちの候補製品を商業化すれば、私たちはもっと大きなリスクに直面します。例えば、私たちの候補製品が製品テスト、製造、マーケティング、または販売中にダメージを与えたり、不適切なことが発見されたと言われた場合、私たちは起訴されるかもしれない。このような製品責任クレームは、製造欠陥、設計欠陥、候補製品固有の危険について警告、不注意、厳格な責任、または保証違反の告発を含む可能性がある。臨床試験参加者、患者、または他の使用、管理、または将来承認される可能性のある製品を販売する人は、私たちにクレームをつけるかもしれない。州消費者保護法によると、クレームも主張することができる。
もし私たちが製品責任クレームで自分を弁護することに成功できなければ、私たちは重大な責任を招いたり、私たちの製品の商業化を制限または停止することを要求されるかもしれません。成功的な防御であっても、多くの財政的で管理的な資源が必要だ。事件がどうであっても最終的な結果がどうであろうと、賠償責任は次のようになるかもしれない
•私たちの製品への需要が減少しました
•私たちの名声とメディアの深刻な否定的な関心を損なう
•臨床試験参加者は吸引したり脱退したりすることは困難である
•関連訴訟の弁護費用
•経営陣の時間と資源を移転する
•実験参加者、患者、または他のクレーム者に巨額の金銭的補償を提供する
•製品のリコール、撤回またはラベル付け、マーケティング、または販売促進制限;
•深刻な財務的負の影響
•候補品を商業化することはできません
•私たちのアメリカ預託株式の価格は下がりました。
私たちの臨床試験の拡大に伴い、あるいは候補製品を商業化し始めたら、私たちの保険カバー範囲を増やす必要があるかもしれません。保険範囲はますます高くなっています。潜在的な製品責任クレームを防止するために、許容可能なコストで十分な製品責任保険を得ることができず、これは私たちの候補製品の商業化を阻止または阻害する可能性がある。私たちはこのような保険を受けていますが、私たちに対するいかなるクレームも裁判所の判決や和解につながる可能性があります
これは私たちの保険範囲を超えています。私たちの保険証書も様々な排除があります。私たちは製品責任クレームの影響を受けるかもしれませんが、私たちは保険範囲を持っていません。私たちは私たちの保険範囲の制限を超えたり、私たちの保険カバー範囲内でない裁判所の裁決または和解合意で達成された任意の金額を支払う必要があるかもしれません。私たちはこれらの金額を支払うために十分な資本を持っていないか、または得ることができません。
私たちの情報技術システム、または私たちのCRO、製造業者、他の請負業者、サプライヤー、コンサルタント、または協力者のシステムは、システム障害、セキュリティホール、またはネットワークセキュリティ上の欠陥を受ける可能性があり、これは、私たちの製品開発計画を深刻に中断させ、私たちの業務に関連する敏感な情報を危険にさらし、または契約および法的義務を引き起こす可能性があります。
我々は,業務を展開するために必要なデジタル形式の情報を収集·維持し,コンピュータシステム,ハードウェア,ソフトウェア技術インフラ,我々の業務に重要で運営に役立つ内部および外部運営のオンラインサイトやネットワーク(総称して“ITシステム”と呼ぶ)にますます依存している.我々はいくつかのITシステムを有して管理しているが、クラウドコンピュータサービスを含むが、これらに限定されない一連のITシステムおよび関連製品およびサービスの提供にも依存している。私たちの通常の業務プロセスでは、私たちは、私たちのいくつかの第三者プロバイダと、機密情報、知的財産権、独自業務情報、臨床試験データ、保護された健康情報および個人情報を含む、当社の顧客、従業員、業務パートナー、および他のタイプの情報に関する大量の情報を収集、維持、記憶、処理、送信し、総称して“秘密情報”と呼ぶ。機密情報の機密性と完全性を維持するために、安全な方法でそうしなければなりません. 特に、当社のITシステムまたは機密情報の利用可能性、完全性またはセキュリティへのいかなる悪影響も、法的クレームまたは訴訟(例えば、集団訴訟)、規制調査および法執行行動、罰金および処罰、および負の名声影響をもたらす可能性があり、これらのいずれも、私たちの業務、運営実績、および財務状況に重大な悪影響を及ぼす可能性があります。
セキュリティ対策が実施されているにもかかわらず、我々のポリシー、制御、またはプログラムを含む、我々のネットワークセキュリティリスク管理計画およびプロセスは保証されず、我々のITシステムおよび機密情報を完全に実施、遵守、または効率的に保護する。特に、私たちは多くの変化するネットワークセキュリティリスクに直面しており、これらのリスクは、私たちのITシステムと機密の機密性、完全性、可用性を脅かす 情報です。当社のITシステムおよび現在および将来のCROおよび他の請負業者、コンサルタント、サプライヤー、および協力者のITシステムは、ネットワークセキュリティイベント、攻撃、障害、データ漏洩、コンピュータウイルス、誤った構成、または当社のITシステムに統合された商業ソフトウェアの他の利用ホールの中断または被害、ならびにマルウェア(例えば、恐喝ソフトウェア)、ネットワークセキュリティ脅威、コンピュータハッカー、社会工学/ネットワーク釣り、詐欺、サービス攻撃の劣化の影響を受けやすい可能性があります 悪意のあるコード、人為的エラーまたは汚職、窃盗または乱用、分散拒否サービス攻撃、複雑な民族国家および民族国家が支持する行為者、不正アクセス、自然災害、テロ、戦争、火災、電気通信、および電気故障。このようなITシステムは,会社のファイアウォール,サーバ,インターネット接続を含み,系統的な障害のリスクに直面しており,我々の運営を混乱させる可能性がある
ネットワーク攻撃、ネットワークセキュリティホール、コンピュータウイルス、マルウェア、および他のイベントを含むネットワークセキュリティイベントは、機密情報の流用、紛失、または他の不正な漏洩を引き起こす可能性がある。人工知能を使用することによって、恐喝ソフトウェア、ネットワーク釣り、構造化クエリ言語注入、および分散拒否サービス攻撃を含むネットワーク攻撃に使用されていることを含む、ますます複雑な方法。例えば、2021年5月に、私たちの従業員の電子メールアカウントがインターネット釣り攻撃を受けた。脅威行為者は支払い要求を送信することに成功し、その要求は最終的に処理される。私たちは私たちのネットワークセキュリティ保険提供者から一部の損失を取り戻したにもかかわらず、この事件はいくつかの財務的損失を招き、私たちは私たちのプロバイダから完全に取り戻すことができない。近年,世界各地からの未遂攻撃や侵入の数,強度,複雑性の増加にともない,データセキュリティが破壊されたり中断されたりするリスクが一般的に増加している
また、ハイブリッド作業環境が続く結果、インターネットやクラウド技術への依存により、サイバーセキュリティリスクが高まる可能性があります。リモートで作業する従業員の数を考えると、当社は事業運営を IT システムに依存しており、そのような依存はサイバー犯罪者が脆弱性を悪用するさらなる機会を生み出す可能性があります。 サイバー犯罪者が使用する技術は頻繁に変化し、起動するまで認識されない可能性があり、外部サービスプロバイダー、組織犯罪関連会社、ハッカー活動家、テロリスト組織、敵対的な外国政府や機関などの外部グループを含む多種多様な情報源から発生する可能性があります。そのため、サイバーセキュリティ侵害が長期間にわたって検出されない可能性があります。特定された場合でも、攻撃者が制御を回避し、検出を回避し、法医学的証拠を削除または難読化するために設計されたツールやテクニックをますます使用しているため、インシデントや侵害を適切に調査または是正できない可能性があります。
私たちと私たちのいくつかの第三者は時々サイバー攻撃とサイバーセキュリティ事件を受けている。このようなイベントが再び発生し、私たちの運営を中断させるか、または許可されていない使用、開示、またはアクセスをもたらす場合
秘密情報については、私たちの開発計画と私たちの業務運営が実質的に破壊される可能性があります。私たちのビジネス秘密の損失や他の同様の破壊によっても、私たちは契約義務に違反し、強制的な是正行動を受けます。そうでなければ、私たちは守秘情報のプライバシーと安全を保護する法律、法規、契約に基づいて責任を負い、重大な法律と財務リスクおよび名声の損害を招く可能性があります
私たちはこのような第三者と契約保護協定を締結しているにもかかわらず、ネットワークセキュリティホールに関する通知や後続行動は、私たちのブランドや名声に影響を与える可能性があり、法的費用を含む巨額のコストを発生させ、顧客の信頼と信頼を損ない、新しい市場への私たちの拡張を損ない、救済費用を発生させたり、既存の顧客を失ったりする可能性がある。私たちはまた、第三者に依存して私たちの候補製品を製造しており、彼らのITシステムに関連する類似のイベントも私たちの業務に実質的な悪影響を及ぼす可能性があります。任意の中断またはセキュリティホールにより、私たちのデータやアプリケーションが失われたり、破損したり、機密または独自の情報が適切に開示または使用されない場合、私たちは責任を招く可能性があり、私たちの候補製品のさらなる開発および商業化は延期される可能性があり、プライバシーおよびセキュリティ法律に違反するいかなる行為によっても巨額の罰金、処罰、または責任に直面する可能性があります。上記のいずれも、我々の業務、財務状況、経営結果、または将来性に重大な悪影響を及ぼす可能性がある。
また,我々のITシステムを上記のようなリスクから保護しようとするコストとネットワーク攻撃への対応コストは膨大である.さらに、私たちおよび/または私たち第三者のセキュリティ対策、および秘密情報の不正伝播は、財務的または医療的アイデンティティが盗まれるリスクに直面させるか、または私たちまたは他の第三者をこの情報を紛失または乱用するリスクに直面させ、調査、規制法執行行動、重大な罰金および処罰、業務損失、訴訟または他の私たちの業務、将来性、名声、運営結果、および財務状況に重大な悪影響を及ぼす可能性のある行動をもたらす可能性があります。さらに、私たちが秘密情報の処理、使用、送信、および開示に関する政策および他の公表された声明または適用法に従わなかった場合、または私たちの声明またはやり方が詐欺的または非現実的な陳述を持っていることが発見された場合、私たちは規制行動、罰金、および他の責任に直面する可能性がある
私たちのネットワーク保険カバー範囲は、罰金と罰金を含むネットワークセキュリティ事件によって発生したすべてのクレーム、責任、費用をカバーするのに十分ではないかもしれません。また、ネットワークセキュリティ事故保険が商業的に合理的な条項で提供され続けるか、どの保険会社が将来のいかなるクレームにも保険を提供することを拒否しないとは確信できない。このようなイベントの最終的な解決策を予測することは困難である可能性があり、それによって引き起こされる可能性のある潜在的損失の額または範囲を推定することも困難である。ネットワークセキュリティ事件の解決や潜在的な損失をコントロールすることができなければ、私たちの業務運営能力および私たちの運営結果や財務状況に実質的な影響を与える可能性があります。
我々のネットワークセキュリティ対策,戦略,ガバナンスの詳細については,項目16.Kを参照されたい.サイバーセキュリティ--サイバーセキュリティリスク管理、戦略、ガバナンス
私たちの従業員と独立請負業者は、首席調査者、CRO、コンサルタント、サプライヤーを含み、規制基準と要求を遵守しないことを含む、不当な行為またはその他の不当な活動に従事する可能性がある。
私たちは、首席調査者、CRO、コンサルタント、サプライヤーを含む、私たちの従業員と独立請負業者に直面しています。不適切な行為や他の不適切な活動に従事する可能性があります。これらの当事者の不正行為は、(1)FDA、NMPAまたは他の同様の規制要件の法律および法規に違反し、これらの当局に真実、完全かつ正確な情報を報告することを要求する法律、(2)cGMP要件を含む製造基準、(3)米国および海外の連邦および州データ、プライバシー、セキュリティ、詐欺および乱用、および他の医療保健法律法規、または(4)財務情報またはデータを実際に、完全かつ正確に報告することを要求する法律を含む、意図的、無謀、および/または不注意な行為、または許可されていない活動を開示することを含む可能性がある。これらの法律の制約を受けた活動はまた、不適切な使用或いは歪曲臨床試験過程で得られた情報を含み、著者らの臨床前研究或いは臨床試験において虚偽のデータを作成し、或いは薬物製品を不法に流用し、これは規制制裁を招き、著者らの名声に深刻な損害を与える可能性がある。従業員や他の第三者の不正行為を常に識別し、阻止することができるわけではなく、このような活動を発見し、防止するための予防措置は、未知または管理不可能なリスクや損失を効果的に制御することができないか、またはそのような法律や法規を遵守できないことによる政府調査または他の行動または訴訟から私たちを保護することができない可能性がある。
さらに、私たちは、一人や一人の政府が、起こらなくても、このような詐欺や他の不適切な行為を告発する可能性があるというリスクに直面している。もし私たちにこのような訴訟を起こして、私たちが自分の権利を弁護したり、維持することに成功しなかったら、これらの行動は私たちの業務や財務業績に大きな影響を与えるかもしれません
重大な民事、刑事および行政処罰、損害賠償、罰金、引き渡し、連邦医療保険、医療補助および他の医療保健計画から除外される可能性があり、個人監禁、契約損害、名声損害、利益および将来の収益の減少、追加の報告要件および監督(これらの法律違反に関する告発を解決するために会社の誠実な合意または同様の合意の制約を受けている場合)、および私たちの業務を削減することは、いずれも私たちの業務運営能力および私たちの運営結果に悪影響を及ぼす可能性があります。
私たちは戦略的取引に従事するかもしれません。これは私たちの流動性に影響を与え、私たちの費用を増加させ、私たちの経営陣に大きな妨害を与えるかもしれません。
我々は、企業の買収、資産の購入、および知的財産権、製品または技術の対外許可または内部許可のような戦略的取引を時々考慮するかもしれない。また、私たちは政府当局と手配しているかもしれません。これらの手配は私たちが成功できない義務や責任を持っていて、私たちに重大な不利な結果をもたらすかもしれません。将来のいかなる取引も、私たちの短期的かつ長期的な支出を増加させ、私たちの株式証券(私たちの米国預託証明書を含む)の潜在的な希釈発行、または債務、または負債、償却費用、または買収が行われている研究開発費を発生させる可能性があり、これらのいずれも、私たちの財務状況、流動性、および運営結果に影響を及ぼす可能性がある。
私たちが将来考慮する可能性のある他の潜在的な取引は、剥離、戦略パートナー関係、合弁企業、再編、資産剥離、業務合併と投資を含む様々な商業手配を含む。将来の買収はまた私たちが追加的な融資を受ける必要があるかもしれないし、これらの融資は優遇条項で提供されないかもしれないし、全くないかもしれない。このような取引は決して成功しないかもしれないし、多くの時間と経営陣の注意が必要かもしれない。さらに、私たちが将来買収する可能性のある任意の業務の統合は、私たちの既存の業務を混乱させる可能性があり、複雑で、リスクとコストの高い努力かもしれません。私たちはそのすべてのメリットを実現することができないかもしれません。したがって、上記の性質のいかなる取引も行うか、成功することは保証されませんが、私たちが達成したどのような取引も、私たちの業務、運営結果、財務状況、および見通しに大きな悪影響を及ぼす可能性があります。
知的財産権に関するリスク
私たちの成功は私たちの知的財産権とノウハウを獲得し、維持し、保護し、実行する能力にかかっている。
私たちの成功は、特許、商業秘密、および他の知的財産権を取得して維持する能力、および現在および将来の任意の候補製品、ノウハウおよびその用途に独自の保護を提供する能力、および他人の知的財産権および独自の権利を侵害、流用、または他の方法で侵害することなく運営する能力にある程度依存する。もし私たちが私たちの知的財産権と固有の権利を保護できない場合、または私たちの知的財産権と独自の権利が私たちの現在または未来の任意の製品候補製品を満たすのに十分でない場合、私たちの競争地位は損なわれる可能性がある。私たちは一般に、私たちの候補製品、ノウハウ、およびその用途に関する特許出願を米国、中国、海外に提出することによって、私たちの独自の地位を保護することを求めています。これらの特許は、私たちの業務に非常に重要です。私たちはまた、第三者から関連するかもしれない発表された特許、係属中の特許出願、および他の知的財産権を買収することによって、私たちの独自の地位を保護しようと努力している。私たちはまた、ビジネス秘密、技術ノウハウ、持続的な技術革新によって、私たちの独自と知的財産権の地位を発展させ、維持しています。
係属中の特許出願は、そのような出願が特許を発行するまで、かつ、発行された特許要件がそのような技術をカバーする範囲に限定されない限り、そのような出願に必要な技術を実施する第三者に対して強制的に実行することはできない。現在または未来の特許出願または現在および将来のライセンス者の特許出願が、米国特許商標局または米国特許商標局、米国特許商標局、米国特許商標によって保証されることは保証されないさらに、発行された特許が、競合他社または同様の技術を有する他の第三者に対して十分な保護を提供するか、または侵害、設計、または失効されないことは保証されない。発行された特許が後になっても、すべてまたは一部が無効または強制執行できないと認定される可能性があり、または第3の方向の各特許庁または裁判所が提起した訴訟において修正または撤回される可能性がある。限られた保護だけを提供するかもしれないし、私たちの権利を十分に保護できないかもしれないし、私たちがどんな競争優位性を獲得したり維持したりすることを可能にするかもしれない。また、中国特許法によれば、いかなる組織及び個人が外国で中国で完成した発明又は実用新案のために特許を出願するためにも、国家知的財産権局に報告して秘密審査を行わなければならない。
そうでなければ、後に中国で申請すれば、特許権は付与されないだろう。これらの不確実性および/または制限は、私たちの財務状況および運営結果に大きな悪影響を及ぼす可能性があります。これらの不確実性および/または制限は、私たちの現在および未来の候補製品の知的財産権を適切に保護するかもしれません。
特許出願プロセスは、多くのリスクと不確実性の影響を受け、私たちまたは私たちの潜在的な未来のパートナーが特許を獲得、維持、擁護、実施することによって、現在および任意の未来の候補製品を保護することに成功することを保証することはできない。これらのリスクと不確実性には
•USPTO、CNIPA、および各種外国政府特許機関は、特許プロセス中にいくつかのプログラム、文書、費用支払いおよびその他の義務を遵守することを要求し、これらの義務を遵守しないことは、特許または特許出願が放棄または失効され、関連する司法管轄区域の一部または全部で特許権を喪失する可能性がある
•特許出願は特許付与を招いてはならない
•特許は、疑問、無効宣言、修正、撤回、回避、実行不可能が発見されるか、または他の方法ではいかなる競争優位性も提供されない可能性がある
•私たちの競争相手、その多くの人は私たちよりもはるかに多くの資源を持っていて、その中の多くの人は競争技術に重大な投資を行って、彼らは特許を求めているか、あるいはすでに特許を得ているかもしれません。これらの特許は、私たちが現在および未来の候補製品を製造、使用、販売する能力を制限、妨害、または阻止します
•世界的な健康問題に関連する公共政策として、アメリカ政府と国際政府機関は大きな圧力に直面する可能性があり、アメリカ国内と国外の成功が証明された疾病治療方法に対する特許保護範囲を制限することが求められている
•米国以外の国の特許法は米国の特許法よりも特許権者に有利である可能性があり,これにより外国競争者に競争相手の製品を創造,開発,マーケティングさせることができる。
特許訴訟過程も高価で時間がかかり、私たちと私たちの許可者は、合理的なコストで、または商業的利点を持つ可能性のあるすべての司法管轄区域を保護するために、必要または望ましいすべての特許出願を提出し、起訴することができないかもしれない。我々と我々の許可側も,特許保護を得るのが遅くなるまで,我々の研究開発成果の特許可能性を識別できない可能性がある.私たちおよび私たちの現在および未来の許可者もまた、規制承認中に意図せずに、特許出願起訴中に取られた立場と一致しない声明を規制機関に行う可能性があり、これは、このような特許が縮小され、無効にされ、または実行できない可能性がある。さらに、場合によっては、私たちは、特許出願の準備、提出および起訴を制御する権利がないか、または第三者または第三者から取得された技術を許可するための特許を維持する権利がないかもしれない。私たちはまた、ライセンスの特許権を実行または擁護するために、私たちのライセンシー、ライセンシー、または他の協力者の協力が必要である可能性があり、このような協力は提供されないかもしれない。したがって、これらの特許及び出願は、私たちの業務の最良の利益に適合した方法で起訴、維持、強制執行、弁護されてはならない。私たちは、私たちのライセンシーの特許起訴および維持活動が適用された法律および法規を遵守しているか、またはそのような特許またはそのような出願が発行される可能性のある任意の特許の有効性および実行可能性に影響を及ぼす可能性があることを確認することができない。もし彼らがそうしなければ、これは私たちが許可している任意の知的財産権を適用する権利を失う可能性がありますので、私たちが製品や候補製品を開発して商業化する能力は不利な影響を受ける可能性があり、競争相手が競合製品を製造、使用、販売することを阻止できないかもしれません。
さらに、私たちは、私たちの従業員、外部科学協力者、CRO、第三者メーカー、コンサルタント、コンサルタント、および他の第三者などと、私たちの研究開発成果を得る権利のある特許に関する当事者と秘密保持および秘密協定を締結したにもかかわらず、いずれもこのような合意に違反し、特許出願を提出する前にそのような成果を開示し、特許保護を求める能力を危険にさらす可能性がある。上記のいずれも、我々の競争地位、業務、財務状況、経営結果、および見通しに重大な悪影響を及ぼす可能性がある。
もし私たちがいかなる許可、協力、または他の合意の下での義務を履行できなかった場合、あるいは私たちと私たちの協力者は当事者との業務関係が中断されるかもしれません。私たちは損害賠償金の支払いを要求され、現在および未来の候補製品の開発と保護に必要な知的財産権を失う可能性があります。
私たちは未来に知的財産権を許可するかもしれない。何らかの理由で、任意の許可プロトコルが終了した場合、または私たちが他の方法で許可に関連する権利を失った場合、これは私たちのビジネスに悪影響を及ぼす可能性があります。私たちが締結または締結可能な任意の協力協定または許可協定、または適用される可能性のある様々な開発、商業化、資金、職務調査、再認可、保険、特許起訴および強制執行またはその他の義務
アメリカ、そしてマイルストーン、特許使用料、年間維持、その他の支払い義務。もし私たちが何らかの実質的な義務に違反したり、許可されていない方法で知的財産権を使用したり、もし私たちの努力にもかかわらず、協力者が私たちがこのような合意下の義務に実質的に違反していると結論した場合、私たちは損害賠償金の支払いを要求される可能性があり、許可者は許可を終了する権利がある可能性があり、これは、許可技術がカバーされた製品を開発、製造、製造し、それを商業化することができない、あるいは新たなまたは回復した許可をあまり有利ではない条項で交渉しなければならない、あるいは競争相手や他の第三者が許可技術を得ることができるようにしなければならない。さらに、将来の任意のライセンスプロトコルに関連する知的財産権の元のライセンス者ではない第三者からの従属ライセンスが含まれている場合、私たちは、その主要ライセンスプロトコルに従って知的財産権を適用する権利を取得する主なライセンス契約の下での義務を履行することに依存しなければならず、私たちは、その権利の元のライセンス者とは何の関係もないかもしれない。この許可側が上流許可プロトコルでの義務を履行できなかった場合、元の第三者許可者が元の許可を終了する権利がある可能性があり、これは我々の再許可を終了する可能性がある。もしこのような状況が発生した場合、私たちは関連する権利の所有者から私たち自身の直接許可を得ることができない限り、私たちはこれ以上知的財産権を適用する権利を持たないだろうし、私たちは合理的な条項や全くそうしないことができないかもしれないし、このような許可は非排他的である可能性があり、競争相手や他の第三者が私たちに許可された同じ技術にアクセスできるようにすることができる。このような事件は、関連する知的財産権を含む任意の候補製品を現在および将来的に開発し、商業化し続ける能力に影響を及ぼす可能性がある。
私たちは、第三者からより多くのライセンスを取得して、私たちの研究を進めたり、現在および任意の未来の候補製品の商業化を可能にする必要があるかもしれません。私たちは、第三者特許または他の知的財産権または独自の権利が存在しない保証を提供することはできません。このようなライセンスがなければ、私たちの現在および未来の候補製品に対して強制的に実行されるかもしれません。私たちはもしあれば、商業的に合理的な条項でこのような許可証のいずれかを得ることができないかもしれない。たとえ我々が許可を得ることができても,我々の競争相手や他の第三者が我々に許可されている同じ技術にアクセスできるように非排他的である可能性がある.この場合、私たちは代替技術を開発または許可するために多くの時間と資源を必要とするかもしれない。もし私たちがそれができなければ、私たちは影響を受けた候補製品を開発したり商業化することができないかもしれません。これは私たちの業務に実質的な損害を与えるかもしれません。このような知的財産権を持つ第三者は、私たちの販売禁止を求めることができますし、私たちの販売に関しては、印税および/または他の形態の賠償を支払う義務があります。
知的財産権許可は私たちの業務に非常に重要であり、複雑な法律、商業、科学的な問題に関連している。ライセンス契約によると、私たちとライセンシーとの間で知的財産権紛争が発生する可能性があります
•ライセンス契約に従って付与された権利範囲および解釈に関連する他の問題;
•私たちの技術とプロセスが侵害されているかどうか、流用または他の方法で許可協定に拘束されていない許可側の知的財産権を侵害しているかどうか、および侵害の程度
•私たちは特許と他の知的財産権または独自の権利を第三者の権利に再許可する;
•私たちの現在と未来の候補製品の開発と商業化に関する使用許可技術の職務義務と、どのような活動がこれらの職務義務を満たしているか
•私たちがライセンスを譲渡または譲渡する権利;および
•特許、発明、ノウハウおよび他の知的財産権、ならびに許可者、私たちおよび私たちのパートナーによって行われた活動によって生成された独自の権利の所有権。
このような協定は複雑かもしれないし、このような協定のいくつかの規定は様々な解釈の影響を受けるかもしれない。可能性のある契約解釈の相違の解決は、関連する知的財産権または技術に対する私たちの権利の範囲を縮小するか、または関連協定の下での私たちの財務または他の義務を増加させることができるかもしれません。また、我々が許可している知的財産権をめぐる紛争が許容可能な条項で現在の許可手配の能力を維持していることを阻害したり、損害を与えたりすれば、影響を受けた候補製品の開発に成功し、商業化することができない可能性がある。さらに、私たちのいくつかの合意は、私たちがいくつかの取引を完了する能力を制限または延期するかもしれないし、これらの取引の価値に影響を与えるかもしれないし、または私たちが特定の活動を行う能力を制限するかもしれない。上記のいずれも、我々の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす。
もし私たちが獲得した任意の特許保護の範囲が十分に広くない場合、あるいは私たちがいかなる特許保護を失った場合、競争相手および他の第三者が私たちと似ているか、または同じ候補製品を商業化する能力が悪影響を受けることを阻止する。
バイオテクノロジーと製薬会社の特許地位は通常高度に不確定であり、複雑な法律と事実問題に関連しており、近年多くの訴訟のテーマとなってきた。しかも、外国の法律はアメリカの法律のように私たちの権利を保護しないかもしれない。例えば,欧州特許法のヒト治療法に対する特許性制限は米国法よりも多い。科学文献中の発見発表は往々にして実際の発見より遅れており,米国や他の管轄区の特許出願は通常出願18カ月後に発表され,時にはまったく発表されないこともある.したがって、私たちは、私たちが所有または許可している特許または出願中の特許出願において最初に要求された発明であるか、またはそのような発明のための最初の特許保護であるかを正確に知ることができない。したがって,我々の特許権の発行,範囲,有効性,実行可能性,商業的価値は高い不確実性を持っている.私たちの将来の特許出願は、特許の発行、私たちの技術または製品の全部または一部を保護すること、または他の人が競争相手の技術および製品を商業化することを効果的に阻止することを招くことができないかもしれない。米国や他の国の特許法や特許法解釈の変化は,我々の特許の価値を低下させたり,我々の特許保護の範囲を縮小したりする可能性がある。
同様に、中国でも知的財産権の法律が発展しており、中国は知的財産権の保護の改善に努めている。例えば、“中華人民共和国特許法”は2020年10月17日に改正され、2021年6月1日から施行される。その中で、新薬の発売承認にかかる時間を補償するために、特許行政部門はすでに中国国内で上場許可を得た新薬の発明特許に対して、特許権の有効期限補償を与えることが規定されている。補償期間は5年を超えてはならず,有効特許権の総期限は新薬承認発売後14年を超えてはならない。したがって、私たちの中国特許の条項は延長する資格があり、私たちの製品の特許保護を延長することができ、第三者が所有する特許の条項も延長される可能性があり、これは逆に権利侵害リスクに直面することなく候補製品を商業化する能力に影響を与える可能性がある。もし私たちが商業化を長く延期することを要求されれば、技術進歩は発展するかもしれないし、新しい競争製品が発売される可能性があり、これは私たちの製品を競争力を失うかもしれない。中国の知的財産権法の他の変化が私たちの知的財産権保護にマイナスの影響を与えないことも保証できない。
特許出願で要求されるカバー範囲は特許発行前に大幅に縮小することができ,特許発行後にその範囲を再解釈することができる.特許審査中に、私たちまたは私たちの許可者は、既存技術を克服するために係属中の特許請求の範囲を縮小することを要求される可能性があり、このプロセスは、特許保護の範囲を制限する可能性がある。私たちが所有または許可している特許出願が特許の形態で発表されても、それらの発表形態は、競争相手や他の第三者が私たちと競争することを阻止したり、他の方法で私たちにどんな競争優位性を提供してくれたりすることを提供してくれない。私たちが現在または将来所有または許可している任意の未来の特許は、第三者の挑戦または回避を受ける可能性があり、または第三者の挑戦のために縮小、修正、失効、または撤回される可能性がある。したがって、私たちは私たちが現在または任意の未来の候補製品が効果的で強制的に実行可能な特許によって保護されているか、または引き続き保護されているかどうか分からない。私たちの競争相手または他の第三者は、類似または代替技術または製品を非侵害的に開発することによって、私たちの将来の特許または私たちの現在および未来のライセンシーの特許を回避することができ、これは、私たちの業務、財務状況、運営結果、および見通しに重大な悪影響を及ぼす可能性がある。
特許の発行は、その発明性、範囲、有効性、または実行可能性に対して決定的ではなく、私たちが所有し、許可している特許は、米国、中国または他の地方の裁判所または特許庁で挑戦される可能性がある。私たちが所有しているまたは許可されている、将来所有可能な、または許可中の特許の発明権および所有権は、第三者の挑戦を受ける可能性がある。このような挑戦は、このような特許の独占的権利を失うことをもたらす可能性があり、これは、他人が同様の技術および製品を使用または商業化することを阻止または商業化する能力を制限するか、またはこれらの第三者から商業的に合理的な条項で獲得することが独占的権利を保証することができることを要求する可能性がある。もし私たちが発明権や所有権にこのような挑戦をした場合、裁判所が私たちの勝訴を裁定する保証もなく、保証することもできません。もし私たちが許可を求めることを選択した場合、私たちは受け入れ可能な条項でこのような許可を得ることができますか、または全くできません。さらに、私たちは、第3の方向の米国特許商標局が提出した既存技術の制約を受け、私たちの特許または特許出願に要求される発明の優先権に疑問を提起する可能性があり(提出は特許発行前に提出される可能性がある)、または反対、派生、再審査、撤回、当事者間の審査、付与後の審査、妨害、または他のプログラムを含む発行前および発行後の手続きに巻き込まれ、私たちの特許権またはそれから特許権許可を得た他の人の特許権に挑戦することができる。例えば、私たちの候補製品のうちの1つをカバーする特許を強制的に執行するために、当事者または他の協力者が第三者に対して法的訴訟を提起することができる場合、被告は、私たちの候補製品をカバーする特許が無効または強制的に実行できないことを反訴することができる。このような書類、手続き中の不利な裁決は
または訴訟は、私たちの特許権の全部または一部を縮小または無効にすることができ、第三者が私たちに支払うことなく、または第三者の特許権を侵害することなく、製造、製造、または商業化された製品を製造、または商業化することを可能にする可能性がある。
いかなる特許権の喪失、排他性の喪失、または特許主張の全部または部分的な縮小、無効または実行不能は、私たちに支払うことなく、他人が私たちに支払うことなく、または同様の技術および製品を使用または商業化する能力を制限し、私たちの現在または任意の未来の候補製品の特許保護期間を制限したり、私たちの候補製品を製造、製造、商業化することができなくなり、これは私たちの業務に実質的かつ不利な影響を与える可能性がある。知的財産権に関する訴訟は巨額のコストを招く可能性もあり、最終的な結果が私たちに有利であっても、私たちの科学者や経営陣が多くの時間を費やす必要がある。さらに、私たちの特許および特許出願または私たちの現在および未来の許可者の特許および特許出願によって提供される保護の広さまたは強度が脅かされている場合、結果にかかわらず、会社が現在または任意の未来の候補製品を許可、開発、商業化することを阻止することができる。上記のいずれも、当社の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
私たちの現在または未来の候補製品の特許保護と特許起訴は第三者にかかっているかもしれない。
私たちは将来的に第三者に特許出願を提出し、起訴し、特許を維持し、いくつかの現在および将来の許可協定の下で許可された知的財産権を保護し、実行するかもしれない。このような配置の下で、私たちはいくつかの特許または特許出願および他の知的財産権のこれらの活動を十分に制御していないかもしれない。私たちは、第三者のこのような活動が適用された法律および法規に準拠しているか、または効果的かつ強制的に実行可能な特許または他の知的財産権をもたらすだろうと判断できない。さらに、現在および将来のライセンシーまたは被許可者は、起訴、保守、強制執行または保護のいずれの特許権においても、私たちと完全に協力または同意しない可能性があり、これは、このような特許権を損なう可能性がある。したがって、私たちはこのような特許と特許出願の準備、提出、起訴、維持、強制執行、弁護が私たちの業務の最適な利益に合致しているかどうかを決定することができない。
私たちは将来的にライセンス契約を締結する可能性があり、ライセンシーまたは被許可者は、ライセンス特許の実施を制御する権利があるか、またはこれらの特許が無効であると主張する任意のクレームを抗弁する権利があり、たとえ私たちがこのような強制執行または抗弁を許可されても、私たちのライセンシーまたはライセンシーの協力が必要となる可能性がある。私たちは、私たちの許可者や許可者が十分な資源を割り当てているかどうか、またはそのような特許の実行またはこのような主張の弁護を優先して、許可特許における私たちの利益を保護することを優先することはできません。たとえ私たちがこれらの法的行動の一方でなくても、不利な結果は、私たちが業務を運営する必要があるかもしれない知的財産権を許可し続けることを阻止し、あるいは特許または他の知的財産権の範囲を無効にしたり、制限されたりする可能性があるので、私たちの業務を損なう可能性がある。私たちの現在または未来の任意のライセンシー、ライセンシー、または協力者が、私たちの現在または任意の未来の候補製品をカバーする特許保護を適切に起訴し、維持できない場合、私たちがこれらの候補製品を開発および商業化する能力は悪影響を受ける可能性があり、競争相手または他の第三者が競合製品を製造、使用、販売することを阻止することができないかもしれない。
さらに、私たちが第三者から取得または許可した特許出願または特許の起訴、保守、実行、および弁護を制御する権利があっても、私たちがそのような活動を制御する前の以前のすべての人、ライセンシー、および/または彼らの弁護士の不利な影響または損害を受ける可能性がある。
ライセンシーは、基礎技術を非商業学術および研究用途に使用する権利、その技術に関連する研究の一般的な科学的発見を発表する権利、およびその技術に関連する情報を従来の科学および学術的に開示する権利を含む、彼らが私たちに許可してくれた技術を許可する権利を保持することができる。これらのライセンシーが技術の使用をこれらの用途に制限しているかどうかを監視することは困難であり,悪用すると,ライセンス技術の権利を強制的に執行するための大量の費用が生じる可能性がある。
取得または許可された技術を利用する能力が制限されている場合、または重要な許可内技術の権利を失った場合、私たちは私たちの製品を開発、許可、マーケティング、販売することに成功できないかもしれません。これは新製品の発売を阻止または延期する可能性があります。私たちの業務戦略はライセンスと買収の技術を商業製品に開発することに成功しています。したがって、これらの技術を利用する能力に対するいかなる制限も、私たちの候補製品を開発、許可、またはマーケティング、販売する能力を損なう可能性があります。上記のいずれも、当社の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
私たちが現在と未来の候補製品のための特許期間の延長に成功しなければ、私たちの業務は損害を受ける可能性があり、有効な特許連絡実行が不足していることや、国家特許管理局が承認していない特許期限の延長とデータ、および製品候補製品の市場排他性は、私たちの製品の中国での早期模造薬と競争するリスクを増加させる可能性がある。
特許の寿命は限られている。例えば、米国では、特許の自然失効は、通常、特許要求優先出願の最初の非臨時出願が提出されてから20年後である。様々な延期があるかもしれない;しかし、特許の有効期限とその提供される保護は限られている。私たちは、適用特許庁の二重特許拒絶を克服するために、特許期間の一部を放棄することを要求される可能性があり、それによって、私たちの専門期間を短縮することができる。もし私たちが現在または未来の候補製品に特許保護がなければ、私たちはそのような製品の模造バージョンからの競争を含む競争に直面するかもしれない。新製品候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。したがって、私たちはアメリカと海外で特許期間の延長を求めることを望んでいる。
FDAが現在および将来の候補製品の上場承認の時間、期限、および詳細に基づいて、私たちの1つまたは複数の米国特許は、1984年の“薬品価格競争および特許期限回復法”(Hatch-Waxman修正案と略称する)に従って限られた特許期間を回復する資格がある可能性がある。Hatch−Waxman修正案は、薬物開発およびFDA規制審査中に失われた特許期間の補償として、特許が正常満了後に最大5年間延長することを可能にし、これは、承認された適応(または延長期間内に承認された任意の追加適応)に限定される。この延期は、承認された製品、その製品の承認された用途、または製品の製造方法をカバーする特許に限定される。特許期間の延長は,製品承認の日から計14年の期限を超えてはならず,その承認に係る薬品,その使用方法又はその製造方法に関する権利要件のみを延長することができる。私たちの現在および将来の候補製品に適用される規制承認を得た後、いくつかの外国の国/地域で特許期間を延長する可能性もある。しかし、適用当局は、米国のFDAおよびUSPTO、および他の国または地域の任意の同等の規制機関を含み、このような延期が利用可能かどうかの評価に同意しない可能性があり、私たちの特許延期の承認を拒否するか、または私たちが要求したよりも限られた延期を承認する可能性がある。適用の最終期限内に出願を提出できなかったこと,関連特許が満了する前に出願を提出できなかったことや適用の要求を満たしていなかったことなどにより延期が得られなかった可能性がある。しかも、特許保護の適用期間や範囲は私たちが要求しているものよりも短いかもしれない。
もし私たちまたは私たちの許可者が私たちまたは彼らの既存特許の期限を延長できない場合、あるいはより長い満期日の新しい特許を得ることができない場合(場合によっては)、私たちの競争相手および他の第三者は、私たちの臨床および臨床前データを参考にして、私たちの開発および臨床試験への投資を利用して、私たちの特許が満期になった後に競争製品の承認を得て、他の場合よりも早く彼らの製品を発売することができるかもしれない。
Hatch−Waxman修正案はまた、後続の出願人と特許所有者または被許可者との間の訴訟が懸案されている間、FDAは、一般に30ヶ月間、いくつかの後続出願の承認を一時停止する特許関連プログラムを提供する。最後に、ハッジ-ワックスマン修正案は法的排他性を規定し、いくつかの後続のマーケティング申請の提出または承認を阻止することができる。例えば、連邦法では、新しい化学物質の承認を受けた最初の申請者は、米国内で5年間の非特許データ排他期があり、申請者が修正された承認を得るために新しい臨床研究を要求された場合、以前に承認された活性成分のいくつかの革新を保護するために3年間の排他性があると規定されている。同様に、米国の“孤児薬物法案”は、いくつかのまれな疾患を治療する薬剤に7年間の市場排他性を提供し、FDAは候補製品を孤児薬として指定し、指定された孤児疾患または疾患のために許可されている。これらの条項は革新を促進することを目的としており、FDAが革新製品の発売を許可してからしばらくの間、競争相手の製品の市場進出を阻止することができる。
しかしながら、中国では、特許関連やデータ独占性(規制データ保護と呼ばれる)を規定する法律や法規がそれほど成熟していないため、歴史的には、コストの低い後発薬がより早く市場に参入する可能性がある。中国の規制機関は2021年に特許紛争早期解決メカニズムの規定を発表し、これは米国の特許連動制度に匹敵する可能性がある。2021年に発効した“中華人民共和国特許法改正案”は、米国連邦法下の特許期限延長に相当する最長5年間の特許期限補償を導入した。“中華人民共和国特許法実施細則”と2024年1月から施行される“特許審査ガイドライン”は,特許期限賠償の実施を規定している。このような規制は比較的新しいので、実際の実行には不確実性がある。さらに条例改正案は
“薬品管理法”は2022年5月に施行され、公開意見を求めて2022年6月9日まで、任意の新しい化学実体を含む薬品の未開示試験データとその他のデータの6年間データ独占性を規定した;中国はまだ決定されておらず、いかなる法規を通じてデータ独占性を実施している。これらの要素は私たちの中国での模倣薬競争に対する保護をアメリカでの私たちの保護より弱い。上記のいずれも、当社の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
私たちの特許保護の獲得と維持は、政府特許機関によって提出された様々なプログラム、書類提出、費用支払い、および他の要求を遵守することに依存し、これらの要求に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある。
発行された特許の定期維持費は、特許有効期間内にいくつかの段階に分けて米国特許商標局、CNIPA、および他の外国特許機関に支払われなければならない。さらに、USPTO、CNIPA、および様々な外国国または国際特許機関は、特許出願中に、いくつかのプログラム、文書、費用支払い、およびその他の同様の規定を遵守することを要求する。多くの場合、適用規則に従って滞納金を支払うか、または他の方法で不注意を是正することによって失効を是正することができるが、場合によっては、規定を遵守しないことは、特許または特許出願が放棄または失効され、関連法ドメインの特許権の一部または全部の喪失をもたらす可能性がある。特許権の放棄または失効を招く可能性のある不正事件には、国際特許出願に基づく国および地域段階の特許出願がタイムリーに提出されなかったこと、所定の期間内に公式行動に応答できなかったこと、費用が支払われていなかったこと、および所定の期間内に正式な文書が適切に合法化および提出されなかったことが含まれるが、これらに限定されない。もし私たちまたは私たちの許可者が特許および特許出願を保持できなかった場合、現在または将来所有しているか、許可されているかにかかわらず、私たちの現在または未来の任意の候補製品および技術をカバーしていれば、私たちの競争相手は市場に参入することができるかもしれません。これは、私たちの業務、財務状況、運営結果、および見通しに悪影響を及ぼすでしょう。
第三者が、特許または他の知的財産権および独自の権利を無効にしようとするクレームまたは訴訟を侵害、流用、または他の方法で侵害すると主張することは、現在または将来の候補製品の開発および商業化を延期または阻止する可能性がある。
私たちのビジネス成功は、第三者の知的財産権と独占権を侵害、流用、または他の方法で侵害することなく、私たちの候補製品を開発、製造、マーケティング、販売する能力にある程度依存する。アメリカ国内外で、大量の製薬と生物技術業界の特許とその他の知的財産権に関連する訴訟があり、特許侵害訴訟と妨害、派生、各方面間の審査と付与後の審査手続き、アメリカ特許商標局、及び外国司法管轄区における反対意見と類似手続きを含む。知的財産権に関する訴訟や他の手続きはしばしば非常に複雑で、非常に高価で時間がかかる可能性があり、コア業務に対する私たちの管理職の注意を分散させ、不利な結果を招く可能性があり、これは、第三者が現在および未来の候補製品との競争を阻止する能力を制限する可能性がある。
1つまたは複数の第三者は、関連する特許主張の一部または全部が無効または実行できない、または非侵害的な裁決をもたらす可能性がある現在または未来の特許に挑戦する可能性がある。例えば、第三者が私たちの製品の模造コピーのために短い新薬申請またはANDAを提出し、私たちまたは私たちによって行われた研究に完全にまたは部分的に依存している場合、第三者は、(1)FDAの出版物“治療同等性評価を有する承認された医薬製品”(一般に“オレンジブック”と呼ばれる)には、適用された承認された製品候補に対するNDAに関する特許情報が記載されていないこと、(2)Orange Bookに記載されている特許が期限切れであることを証明するように要求されるであろう。(3)に掲げる特許は満了していないが,ある特定の日に失効し,特許の満了後に承認を申請するものである,(4)に掲げる特許は無効であるか,又は第三者模倣薬の製造,使用,販売によって侵害されないものである。新薬が適用されない承認製品候補製品のオレンジブックに記載されている特許又はこのような特許が無効であることを第四項証明と呼ぶ。第3の方向FDAが第4項の認証を提出した場合、第三者のANDAがFDAによって届出を受けた場合、第4項の認証の通知も我々に送信しなければならない。そして、私たちは通知で決定された特許を守るために訴訟を提起するかもしれない。通知を受けてから45日以内に特許侵害訴訟を提起し、30ヶ月または特許満了日までFDAが第三者のANDAを承認することを自動的に阻止し、訴訟が和解に達したか、または裁判所が侵害訴訟において第三者に有利な裁決を下す。もし私たちが要求された45日間以内に特許侵害訴訟を提起しなかった場合、第三者のANDAはFDAによって承認された30ヶ月の猶予の制約を受けないだろう。主張を実行できない理由には,特許起訴に関連する者が起訴中に米国特許商標局に関連情報を隠蔽したり,誤った陳述をしたりした疑いがある.私たちの既存または未来の特許に対するいかなる挑戦も、一部または全部の特許を無効にする可能性があり、そうでなければ、これらの特許はオレンジブックに私たちの製品のうちの1つを列挙する資格があるかもしれない。もし第三者がすべての特許に挑戦することに成功すれば、オレンジブックに私たちの特許をリストする資格があるかもしれません
私たちの製品の模造コピーについては、ANDA申請を提出してから30ヶ月以内にFDAの承認を得る権利がありません。
私たちは第三者特許が存在しないという保証はありません。これは私たちの現在と未来の候補製品に強制的に施行されるかもしれません。我々が将来候補製品を開発しているか、または可能性のある分野には、第三者が所有する米国、中国、その他の外国から発行された特許や未解決の特許出願が多く存在する。バイオテクノロジーや製薬業界の拡張や特許の発行に伴い、上場企業としてより高い知名度と市場露出率を獲得することにより、私たちの候補製品や他の商業活動が第三者特許や他の独自の権利を侵害するクレームを受けるリスクが増加する可能性がある。
第三者は私たちが彼らの特許を侵害したり、彼らの独自技術を不正に使用したと主張するかもしれない。現在および将来の候補製品の使用または製造に関連する第三者特許または特許出願が存在する可能性があり、これらの特許または特許出願は、材料、処方、製造方法、または治療方法を必要とする。特許出願は、発行されるまでに数年かかる可能性があり、提出後18ヶ月以上秘密にされている可能性があり、未決定の特許声明は、発行前に修正することができるので、現在および将来の候補製品が発行された特許を侵害する可能性がある現在の未解決の特許出願を含む、現在未解決の特許出願が存在する可能性がある。さらに、第三者は将来的に特許を取得し、私たちの技術を使ってこれらの特許を侵害したと主張するかもしれない。
このようなクレームに法的根拠がないと考えても、裁判所が侵害、有効性、実行可能性、あるいは優先権の問題で私たちに有利になる保証はない。連邦裁判所で米国特許の有効性に挑戦することに成功するためには,有効性推定を克服する必要がある。この負担が重いため,このような米国特許主張の無効について明確で納得できる証拠を提出することが求められているため,管轄権のある裁判所がこのような米国特許の主張の無効を宣言する保証はない.管轄権のある裁判所が、任意の第三者特許が有効かつ強制的に実行可能であり、私たちの現在および将来の候補製品の任意の製造プロセス、その製造プロセスで形成された任意の分子、その製造プロセスで生成された任意の最終製品、または共同療法を含む私たちの処方またはその使用方法をカバーする場合、任意のそのような特許の保持者は、適用特許によって許可されなければ、またはその特許が満了するまで、我々が適用可能な候補製品を開発および商業化する能力を阻止することができるかもしれない。そのようなライセンスは、大量の支払いおよび他の義務を含む可能性があり、または商業的に合理的な条項では得られないかもしれない、または全く得られない可能性がある。我々がこのような許可を得ることができても,我々の競争相手や他の第三者が我々に許可してくれた同じ技術にアクセスできるように非排他的条項で付与することができる.さらに、私たちは、商標、著作権または商業秘密など、他人の知的財産権(例えば、商標、著作権または商業秘密)を侵害、流用、または侵害する疑いを受ける可能性があり、もし、私たちの従業員、コンサルタント、または請負業者が、私たちのために働いているときに、他人が所有する知的財産権または独自の情報を使用する場合、関連するまたはそれによって生じるノウハウおよび発明の権利について議論される可能性がある。
我々にクレームをつけた当事者は、禁止または他の公平な救済を受ける可能性があり、これは、私たちの現在と未来の候補製品のさらなる開発と商業化を効果的に阻止することができるかもしれない。これらのクレームの弁護は、その是非にかかわらず、巨額の訴訟費用がかかり、当社の業務における従業員資源を大量に移転することになる。私たちの侵害または他の知的財産権請求が成功した場合、私たちはまた、故意に侵害された3倍の損害賠償および弁護士費、第三者から1つ以上のライセンスを取得すること、印税を支払うこと、または影響を受けた製品を再設計することを含む大量の損害賠償を支払わなければならない可能性があり、または多くの時間とお金の支出が必要である可能性がある。私たちはそのようなライセンスがあるかどうか、あるいは商業的に合理的な条項で提供されるかどうかを予測できない。また、訴訟がない場合であっても、我々の研究を進めたり、現在及び将来の候補製品の商業化を可能にするために第三者からライセンスを取得する必要がある可能性があり、常にそうしている。私たちはもしあれば、合理的な費用または合理的な条項でこのような許可証のいずれかを得ることができないかもしれない。したがって、私たちは影響を受けた候補製品をさらに開発して商業化することができない可能性があり、これは私たちの業務を深刻に損なう可能性がある。我々が第三者の機密情報や商業秘密を盗用したと主張することは,我々の業務に類似した負の影響を与える可能性がある.さらに、知的財産権訴訟は大量の開示を必要とするため、このような訴訟の間、私たちのいくつかの機密情報は開示によって漏洩される可能性がある。聴聞、動議、または他の一時的手続き、または事態発展の結果を公開することもできる。証券アナリストや投資家がこれらの結果がマイナスだと考える場合、私たちのアメリカ預託証明書や普通株の価格に悪影響を及ぼす可能性がある。上記のいずれも、我々の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす。
関連する第三者特許を識別できないか、または第三者特許の関連性、範囲、または満了時間を誤って解釈することができない可能性があり、これは、私たちが製品を開発およびマーケティングする能力に悪影響を及ぼす可能性がある。
私たちは、関連特許の識別、特許請求の範囲、または関連特許の満了日を含めて、私たちのいかなる特許検索または分析も保証することはできず、私たちは、米国、中国、および他の場所が私たちの候補製品の商業化に関連しているか、または必要なすべての第三者特許および未定出願を識別したことを保証することもできない。
特許請求の範囲は、法律の解釈、特許における書面開示、および特許の起訴履歴に依存する。特許または保留出願の関連性または範囲の解釈は正しくない可能性があり、これは私たちの製品を販売する能力に悪影響を及ぼす可能性がある。私たちの製品が第三者特許のカバー範囲内にないか、または第三者の保留出願が関連範囲のクレームを出すかどうかを誤って予測する可能性がある。私たちはアメリカ、中国、あるいは他の私たちが関連する任意の特許の満期日の決定は正しくないかもしれないと考えています。もし私たちが関連特許を識別して正確に解釈できなければ、私たちが私たちの製品を開発してマーケティングする能力は負の影響を受けるかもしれません。
私たちは第三者から知的財産権を取得する必要があるかもしれませんが、このような許可は得られないかもしれませんし、商業的に合理的な条項では得られないかもしれません。
我々の開発計画は,他の側が持つ知的財産権を使用する必要がある可能性があるため,我々の業務の成長は,このような第三者知的財産権を取得,許可,使用する能力にある程度依存する可能性がある.私たちは、私たちが現在および未来の候補製品に必要であると考えている任意の成分、使用方法、プロセス、または他の第三者知的財産権を第三者から得ることができないかもしれません。第三者知的財産権の許可·買収は競争分野であり、一部のより成熟した企業も魅力的と考えられる第三者知的財産権許可または買収戦略を求めている。これらの老舗会社は私たちより競争優位を持っているかもしれません。それらの規模、現金資源及びより強い臨床開発と商業化能力のためです。しかも、私たちを競争相手と思っている会社は私たちに権利を譲渡したり許可したりしたくないかもしれない。私たちはまた私たちの投資が適切な見返りを得るための条項の許可や第三者知的財産権を得ることができないかもしれない。必要な第三者知的財産権の取得に成功したり、既存の知的財産権を維持したりすることができない場合、適用可能なプログラムの開発および/または非侵害、流用、または他の方法でそのような知的財産権を侵害する代替方法の開発を放棄しなければならない可能性がある。これは追加的なコストと開発遅延をもたらすかもしれないが、このような代替品を開発することは不可能かもしれない。上記のいずれの場合も、私たちの1つまたは複数の候補製品の開発または商業化を阻止し、これらの候補製品の修正を強要したり、私たちの業務運営のいくつかの態様を停止させたりすることができ、私たちの業務、財務状況、運営結果、および見通しが影響を受ける可能性がある。
私たちは、高価で、時間がかかり、成功していないかもしれない、私たちまたは私たちのライセンシーの特許または他の知的財産権を保護または強制的に執行する訴訟に巻き込まれるかもしれない。
競争相手は、私たちまたは私たちのライセンシーの特許または他の知的財産権を侵害、流用、または他の方法で侵害する可能性がある。権利侵害や不正使用に対抗するために、私たちまたは私たちの許可者は、高価で時間がかかるかもしれない法的請求を要求されるかもしれない。さらに、このような訴訟では、裁判所は、主張された特許が無効であるか、または強制的に実行できないと判断することができ、または、主張された特許または他の知的財産権が関連する第三者技術をカバーしていないことを理由に、他方の関連する技術の使用を阻止することを拒否することができる。任意の訴訟または弁護手続における不利な結果は、1つまたは複数の主張された特許が無効または狭義に解釈されるリスクに直面する可能性があり、関連特許出願を発行できないリスクに直面させる可能性がある。第三者へのクレームは、私たちの特許が無効または強制的に実行できないと主張するような第三者からの反クレームを引き起こす可能性もある。米国、中国、その他の地方の特許訴訟では、被告が主張する特許の有効性、実行可能性、または範囲を疑問視する反訴はありふれている。有効性を疑問視する理由は、新規性の欠如、明らかな、実施できない、または法定テーマの欠如を含む、いくつかの法定要求のいずれかを満たすことができなかったと言われている可能性がある。主張を実行できない理由は,特許訴訟に関連する者が起訴期間中にUSPTO,CNIPAあるいは任意の他の適用された特許庁に関連する重要な情報を隠蔽したり,重大な誤解を持つ声明をしたりしたからであろう。第三者はまた、一方的な再審、当事者間の再審または付与後の再審、または米国国外での反対または同様の手続、訴訟と同時に、さらには訴訟の範囲外で行われるような、付与後の手続において米国特許商標局に同様の有効性要件を提出することもできる。法的に無効と実行不可能と断言された後の結果は予測できない。私たちは私たちと特許審査員が起訴中に知らなかった無効な以前の技術がないということを確認できない。特許を出願する
もし私たちが将来私たちが許可する特許および特許出願があれば、私たちは第三者の挑戦から任意の許可された特許を保護する権利に参加する権利がないかもしれない。もし被告が無効または強制不可能な法的主張に勝った場合、私たちは少なくとも部分的、さらにはすべて、私たちの現在または未来の候補製品の任意の未来の特許保護を失うだろう。このような特許保護の喪失は私たちの業務を損なうかもしれない。
私たちは、私たちの知的財産権を侵害する他の行為を単独で、または許可者と一緒に発見または防止することができないかもしれません。特に法律では、米国がこれらの権利を十分に保護している国に及ばないかもしれません。私たちの知的財産権を強制的に執行する訴訟や他の手続きは失敗する可能性があり、成功しても巨額のコストを招き、私たちの経営陣や他の従業員の注意を分散させる可能性があります。侵害行為が成立したと認定しても,裁判所はさらなる侵害活動に禁止令を付与せず,金銭賠償のみを決定する可能性があり,十分な救済措置ではない可能性もある。さらに、知的財産権訴訟は大量の開示を必要とするため、このような訴訟の間、私たちのいくつかの機密情報は開示によって漏洩される可能性がある。聴聞、動議、または他の一時的手続き、または事態発展の結果を公開することもできる。証券アナリストや投資家がこれらの結果がマイナスだと考える場合、私たちのアメリカ預託証明書や普通株の価格に悪影響を及ぼす可能性がある。上記のいずれも、当社の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
派生、干渉、または他のプログラムは、私たちの現在または将来の候補製品に関連する発明の優先度を決定するために必要である可能性があり、不利な結果は、関連技術の使用を停止すること、または勝利者から権利許可を得ることを試みることを要求する可能性がある。
派生、干渉、または第三者によって引き起こされるか、または我々によって提起されるか、または米国特許商標局によって発表されたプログラムまたは外国特許庁の同様のプログラムは、現在または将来の特許または特許出願または私たちの現在および将来のライセンス者の発明に関する優先度を決定するために必要である可能性がある。不利な結果は、私たちが関連技術の使用を停止することを要求するか、または勝利者から許可を得ようとすることを要求するかもしれない。もし勝利者が商業的に合理的な条項で私たちに許可証を提供しなければ、私たちの業務は損害を受けるかもしれない。私たちのこのような訴訟に対する弁護は失敗する可能性があり、成功しても巨額のコストを招き、私たちの経営陣や他の従業員の注意を分散させる可能性がある。さらに、このようなプログラムに関連する不確実性は、私たちの臨床試験を継続するために資金を調達し、私たちの研究計画を継続し、第三者から必要な技術的許可を得ること、またはパートナー関係を開発または製造する能力に重大な悪影響を及ぼす可能性があり、これらのパートナーシップは、現在および任意の将来の候補製品を市場に出すのを助ける。
訴訟の費用と不確実性のため、私たちは第三者に対して私たちの知的財産権を強制的に実行できないかもしれない。
訴訟の費用と不確実性のため、第三者が私たちの所有しているまたは権限内の特許または他の知的財産権を侵害、流用、または他の方法で侵害しても、その第三者に対してクレームまたは訴訟を提起して実行するリスク調整コストが高すぎるか、または私たちの株主の最適な利益に合致しない可能性があると結論するかもしれない。この場合、私たちは、状況を簡単に監視するか、または他の非訴訟の行動または解決策を開始または求めることで、より慎重なやり方を決定するかもしれない。
特許改革立法は、私たちの現在および未来の特許出願または私たちの現在および未来の許可者を起訴する特許出願をめぐり、私たちの現在および未来に発表された特許または私たちの現在および将来の許可側の特許を実行または保護する不確実性およびコストを増加させる可能性がある。
生物製薬業界で特許を獲得と実施することは技術上の複雑性と法律上の複雑性にも関連するため、コストが高く、時間がかかり、しかも内在的な不確定性を持っている。アメリカと他の国の最近の特許改革立法はこのような不確実性とコストを増加させるかもしれない。
2011年9月16日、“ライシー·スミス米国発明法”または“ライシー·スミス法案”が法律に署名された。“ライシー·スミス法案”は米国特許法を多くの重大な改正を行った。これらの条項には,USPTOでの起訴や特許出願に挑戦する方法に影響を与える条項が含まれており,特許訴訟に影響を与える可能性もある。米国特許商標局は、“ライシー·スミス法案”の管理を管理するために、新たな条例やプログラムを制定し、継続している。
ライシー·スミス法案は、特許可能な他の要求が満たされていると仮定して、最初に特許出願を提出した発明者が、他の発明者がより早く発明を提出したか否かにかかわらず、その発明の特許を取得する権利を有する“先行出願”制度を確立している。これは発明から特許出願までの時間を理解し、勤勉に特許出願を提出することを要求しますが、状況は私たちが迅速に阻止するかもしれません
私たちの発明について特許出願を提出します。したがって、Leahy-Smith法案とその実施は、私たちの発明が特許保護を得ることを難しくし、私たちの特許出願をめぐる起訴と、私たちが発表した特許の実行または保護の不確実性とコストを増加させる可能性があり、これらのすべては、私たちの業務、運営結果、および財務状況を損なう可能性がある。同様に、中国も“先備案”の制度をとっている。
Leahy—Smith 法はまた、特許出願が起訴される方法に影響を与え、特許訴訟に影響を与える可能性のある重要な変更の数を含んでいます。これらには、特許権者が特許侵害訴訟を提起できる場所を制限すること、特許訴訟中に第三者が先行技術を USPTO に提出することを許可すること、授与後の審査、当事者間審査および派生手続によって USPTO における特許の有効性を攻撃するための追加手続の提供が含まれます。そのような提出または手続における不利な決定は、当社の特許権の範囲または執行可能性を縮小したり、当社の特許権の全部または一部を無効にし、当社の競争力に悪影響を及ぼす可能性があります。
USPTO訴訟における証拠基準は、米国連邦裁判所が特許請求の無効を宣言するために必要な証拠基準よりも低いため、第三者は、USPTO手続きにおいて、USPTOが権利要求を無効とするのに十分な証拠を提供する可能性があり、同じ証拠が最初に地域裁判所訴訟で提出された場合には、権利請求を無効にするのに十分ではない。したがって,第三者は米国特許商標局の手続きを用いて我々の特許主張の無効を宣言しようとする可能性があり,第三者が地域裁判所訴訟で最初に被告として疑問を提起すれば,我々の特許主張は無効ではない.したがって、“ライシー·スミス法案”およびその実施は、私たちの将来の特許出願または私たちの現在および未来のライセンシーの特許出願をめぐる起訴、および私たちが将来発行する特許または私たちの現在および未来のライセンシーの特許の実行または保護の不確実性およびコストを増加させる可能性があり、これらは、すべて私たちの業務、財務状況、運営結果、および見通しに大きな悪影響を及ぼす可能性がある。
米国特許法、中国特許法、または他の国·地域特許法の変化は、特許の全体的な価値を低下させ、現在および将来の候補製品を保護する能力を弱める可能性がある。
生物製薬産業で特許を取得して実施することは高度な技術と法律の複雑さに関連している。したがって、生物製薬特許を取得して実行することは高価で、時間と固有の不確実性だ。米国、中国および他の国の特許法または特許法解釈の変化は、我々の知的財産権の価値を低下させる可能性があり、特許出願をめぐる起訴および発表された特許の実行または弁護の不確実性およびコストを増加させる可能性がある。私たちは、私たちの将来の特許または第三者特許で許容または実行される可能性のある特許請求の範囲の広さを予測することができない。また,定期的に提出されている中国,米国,その他の国の特許法を改正する提案もあり,採択されれば,我々のノウハウを実行する能力に影響を与える可能性がある。
中国では知的財産権法律が発展しており、中国の知的財産権保護の改善に努めている。例えば、“中華人民共和国特許法”は2020年10月17日に改正され、2021年6月1日から施行される。その中で、新薬の発売承認にかかる時間を補償するために、特許行政部門はすでに中国国内で上場許可を得た新薬の発明特許に対して、特許権の有効期限補償を与えることが規定されている。補償期間は5年を超えてはならず,有効特許権の総期限は新薬承認発売後14年を超えてはならない。したがって、私たちの中国特許の条項は延長する資格があり、私たちの製品の特許保護を延長することができ、第三者が所有する特許の条項も延長される可能性があり、これは逆に権利侵害リスクに直面することなく候補製品を商業化する能力に影響を与える可能性がある。もし私たちが商業化を長く延期することを要求されれば、技術進歩は発展するかもしれないし、新しい競争製品が発売される可能性があり、これは私たちの製品を競争力を失うかもしれない。中国の知的財産権法の他の変化が私たちの知的財産権保護にマイナスの影響を与えないことも保証できない。
進化し続ける特許法の司法解釈はまた私たちの業務に悪影響を及ぼす可能性がある。米国最高裁判所と米国連邦巡回控訴裁判所は近年、多くの前例意見を発表し、場合によっては入手可能な特許保護範囲を縮小したり、場合によっては特許所有者の権利を弱めたりしている。我々の将来の特許取得能力に関する不確実性の増加に加えて,このようなイベントの結合は,いったん特許を取得する価値に関する不確実性をもたらしている.米国議会、米国連邦裁判所、米国特許商標局または外国司法管轄区類似機関の将来の行動によれば、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、それにより、新しい特許を取得したり、私たちが許可または将来所有または許可する可能性のある特許を強制的に執行または保護する能力を弱める可能性がある。同様に、他の国または管轄区域の特許法および法規の変化、またはそれらを実行する政府機関の変化、または関連政府当局が特許法律または法規を実行する方法の変化は、私たちが新しい特許を取得したり、私たちの現在および未来の特許を実行する能力を弱める可能性がある。
ヨーロッパ統一特許裁判所は特にヨーロッパの競争相手に対して私たちの特許権を保護し実行する能力に不確実性をもたらすかもしれません。2012年、欧州特許パッケージまたはEU特許パッケージ法規が採択され、欧州特許に関連する訴訟に単一の汎欧州統一特許と新しい欧州統一特許裁判所(UPC)を提供することを目標とした。EU特許一括計画は2023年から実施される。UPCによれば、すべての欧州特許は、欧州特許パッケージを承認する前に発表された特許を含み、デフォルトでは自動的にUPCの管轄に分類される。UPCは私たちの競争相手に新しいフォーラムを提供し、私たちの欧州特許を集中的に撤回し、競争相手が汎ヨーロッパ禁止を獲得する可能性を可能にするだろう。UPCが認める特許権の範囲と提供される特許救済措置の力を知るのに数年かかるだろう。EU特許セットによると、私たちは裁判所が存在する7年前に私たちの特許をUPCから離脱することを選択する権利があるだろうが、そうすることは私たちが新しい統一裁判所の利点を達成することを阻止するかもしれない
私たちは中国を含めて世界各地で私たちの知的財産権を保護できないかもしれない。
世界のすべての関連司法管轄区域で私たちの現在と未来の候補製品のための申請、起訴、特許保護の費用は目を引くほど高いかもしれないし、私たちのアメリカ以外のいくつかの国の知的財産権はアメリカの知的財産権が広くないかもしれない。ある司法管轄区域、特に発展途上国では、特許性に対する要求はそれぞれ異なる。例えば,中国はより特許性の高い要求を有しており,特に主張されている薬物の医療用途の詳細な説明が求められている。また、中国を含むいくつかの国の法律は知的財産権の保護の程度は米国の連邦や州法律に及ばない。したがって、私たちは、米国以外のすべての国/地域で第三者が私たちの発明を実施したり、米国または他の管轄区域で私たちの発明を使用して製造された製品を販売または輸入することを阻止することができないかもしれない。競争相手は私たちが特許保護を受けていない司法管轄区域で私たちの技術を使用して自分の製品を開発することができ、また、他の侵害製品を私たちが特許保護を持っているが法執行力がアメリカに及ばない地域に輸出することもできる。これらの製品は私たちの現在または未来の候補製品と競争するかもしれませんが、私たちの特許、私たちの現在および未来のライセンシーの特許、または他の知的財産権は彼らの競争を効果的にまたは阻止するのに十分ではないかもしれません。また,一部の国には強制許可法があり,これらの法律により特許権者は第三者に許可を強制的に付与される可能性がある。多くの国はまた、政府機関や政府請負業者に対する特許の実行可能性を制限している。これらの国では,特許権者の救済措置は限られている可能性があり,このような特許の価値を大幅に低下させる可能性がある。
多くの会社は外国の管轄区域の知的財産権の保護と保護に重大な問題に直面している。多くの国の法制度は、特許および他の知的財産権保護の実施を支持しておらず、これは、私たちの知的財産権の侵害、流用、または他の方法での私たちの知的財産権の侵害を阻止したり、競争製品を販売したりすることを困難にする可能性がある。中国関連法律の有効性、実行可能性と保護範囲が変化しているため、中国知的財産権関連法律の歴史的実施と実行はあまり強い先例価値を持っていない。したがって、中国の知的財産権や秘密保持法制度は米国や他の国のように保護を提供しない可能性がある。外国の司法管轄区域で知的財産権または独自技術を許可されていない行為を規制することは困難で高価であり、私たちまたは私たちの現在または未来の許可者に発行された特許を強制的に実行または擁護するために訴訟に訴えるか、または私たちまたは他の人の固有の権利の実行可能性、範囲、有効性を決定する必要があるかもしれない。外国の管轄区域で私たちの特許権を強制的に執行するこのような訴訟や訴訟は、巨額のコストを招き、私たちの努力と注意を私たちの業務の他の側面から移転させる可能性があり、私たちの特許または私たちの現在と未来のライセンシーの特許が無効または狭義に解釈されるリスクに直面する可能性があり、私たちの特許出願または私たちの現在と未来のライセンシーの特許出願は発行できない可能性があり、第三者が私たちにクレームを請求する可能性がある。また、中国の裁判所を含む外国司法管区裁判所は知的財産権訴訟を処理する上での経験や能力がそれぞれ異なり、結果は予測できない。私たちは私たちが起こしたどんな訴訟でも勝てないかもしれないし、判決された損害賠償や他の救済措置(もしあれば)は商業的な意味がないかもしれない。このような訴訟や訴訟で不利な判断を下すことは、私たちの知的財産権を深刻に損なう可能性があり、私たちの業務、将来性、名声を損なう可能性があります。
さらに、一部の国の法律が許可されている場合には、他の当事者が、場合によっては私たちの登録商標と類似した商標を登録する可能性があり、消費者の混同を引き起こす可能性がある。私たちは他の当事者が私たちと似たような商標を使用することを防ぐことができないかもしれないし、私たちの消費者は私たちの治療センターを類似の商標を使用している他の人と混同するかもしれない。この場合、私たちの商標の名誉と価値、そして私たちのブランドやイメージに対する大衆の認知は不利な影響を受ける可能性があります。私たちのブランドとイメージに対する負の印象は私たちの販売に実質的な悪影響を与える可能性があり、それによって私たちの業務、財務状況、運営結果、将来性に悪影響を及ぼすかもしれません。したがって、私たちが世界各地で私たちの知的財産権を実行する努力は十分ではないかもしれない
上記のいずれの状況も、私たちの業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
さらに、各国の地政学的行動は、私たちの特許出願または任意の既存または将来の許可者を提訴または維持することをめぐる特許出願を増加させ、私たちが発行した特許または任意の既存または将来の許可者の特許を維持、実行または保護する不確実性およびコストを増加させる可能性がある。例えば、ウクライナでのロシアの衝突に関連する米国と外国政府の行動は、ロシアでの特許出願の提出、起訴、維持を制限または阻止する可能性がある。政府の行動はまたロシアで発行された特許を維持することを阻止するかもしれない。これらの行動は、ロシアにおける特許権の一部または全部の喪失を招く可能性がある私たちの特許または特許出願を放棄または失効させる可能性がある。このような事件が発生すれば、私たちの業務に実質的な悪影響を及ぼす可能性がある。
特許の作成者や発明者に対する報酬の義務的な基準は相当なものになるかもしれない。
中国の法律によると、私たちは雇用されている間に私たちの業務のために作られた特許の発明者または作成者に報酬を支払わなければならない。発明者やクリエーターが我々との間でトラブルが発生した場合,関連法律法規に規定されている強制報酬基準が適用される可能性がある。私たちの政策は、発明者が私たちの業務に貢献した特許の報酬として所定の一度支払いまたは利益割合を奨励するためのいかなる規則も含まれておらず、私たちと発明者との間でトラブルが発生する可能性がある場合には、関連する法律および法規に規定されている強制的な報酬基準が適用される可能性がある。このような強制的な賃金基準は相当なものである可能性があり、私たちの業務、財務状況、運営結果、および見通しに重大な悪影響を及ぼす可能性がある。
もし私たちが私たちの商業秘密の機密性を保護できなければ、私たちの商業と競争の地位は損なわれるだろう。
私たちはまた、私たちの競争的地位を維持するために、非特許技術的ノウハウ、技術、および他の固有の情報を含む、私たちのビジネス秘密を保護することに依存しています。第三者との秘密協定の締結や、従業員、コンサルタント、CROおよびコンサルタントとの秘密情報および発明協定の締結を含む、当社の商業秘密および非特許ノウハウを保護するための措置を講じているにもかかわらず、私たちは、私たちの商業秘密または独自の情報に可能または接触したすべての当事者とこのような合意を締結し、そのようなすべての合意が正式に実行されていることを保証することはできません。これらのすべての当事者は、私たちのビジネス秘密を含めて合意に違反し、私たちの固有の情報を開示または使用する可能性があり、このような違反について十分な救済措置を得ることができないかもしれません。ビジネス秘密や他の機密情報の不正な使用や漏洩を監視することは困難であり,我々がビジネス秘密や機密情報を保護するための手順が有効であるかどうかも分からない.強制執行側が商業秘密を不正に開示したり流用したりする主張は困難であり、高価で時間がかかり、結果は予測できない。しかも、米国国内外のいくつかの裁判所は商業秘密をあまり望んでいないか、または保護したくない。また、私たちは私たちのビルの実体安全と、私たちの情報科学技術システムの実体と電子安全を維持して、私たちの資料と商業秘密の完全性とセキュリティを維持することに力を入れています。私たちはこのような安全措置に自信があるが、それらは破壊されるかもしれない。
さらに、第三者は、私たちの商業秘密または独自の情報を合法的に取得することができ、またはこの情報または同様の情報を独立して開発または他の方法で取得することができ、私たちは、彼らがこの技術または情報を使用して私たちと競合することを阻止する権利がない。もしこのような事件が発生した場合、あるいは私たちが私たちのビジネス秘密の保護を失った場合、これらの情報の価値は大幅に低下し、私たちの競争的地位は損なわれるかもしれない。もし私たちが他の方法で私たちのノウハウと他の機密情報を秘密にすることができなければ、私たちの商業秘密情報を保護する能力が脅かされるかもしれない。上記のいずれも、当社の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
私たちは、私たちの従業員、コンサルタント、または独立請負業者が、その前の雇用主または他の第三者の機密情報を誤って使用または開示したと非難されるかもしれない。
私たちが雇った人たちは以前他のバイオテクノロジーや製薬会社に雇われていた。私たちの従業員、コンサルタント、および独立請負業者が、私たちのために働くときに他人の知的財産権、独自の情報、ノウハウ、または商業秘密を使用しないことを確実にするために努力しているにもかかわらず、私たちまたは私たちの従業員、コンサルタント、または独立請負業者は、以前の雇用主または他の第三者のいわゆる商業秘密または他の機密情報を不注意または他の方法で使用または漏洩することによってクレームを受ける可能性がある。私たちはまた、前雇用主または他の第三者が私たちの特許または他の知的財産権所有権の権利を持っているというクレームを受ける可能性がある。訴訟を起こす
このような主張を正当化する必要があるかもしれないが、成功を保証することはできない。私たちがこれらのクレームを弁護できなかった場合、金銭的損害賠償の支払いに加えて、そのような知的財産権が第三者からの商業秘密または他の固有情報を含むか、または派生する場合、価値のある知的財産権の独占的所有権または使用権のような貴重な知的財産権を失う可能性がある。たとえ私たちが成功しても、訴訟は巨額のコストを招き、私たちの経営陣や他の従業員の注意を分散させる可能性がある。さらに、このような訴訟またはその脅威は、私たちの名声、戦略連合を形成したり、協力者に私たちの権利を譲渡したり、科学コンサルタントと接触したり、従業員やコンサルタントを雇う能力に悪影響を及ぼす可能性があり、すべては私たちの業務、運営結果、および財務状況に悪影響を及ぼすだろう。
また、私たちの政策は、知的財産権開発に参加する可能性のある従業員と請負業者の代表が私たちにこのような知的財産権を譲渡する協定に署名することを要求しているにもかかわらず、私たちが実際に自分たちの知的財産権を開発しているすべての側とこのような合意を実行することができないかもしれない。このような合意は自動的に実行されないかもしれないし、違反される可能性があり、第三者にクレームを請求させられたり、私たちが私たちの知的財産権の所有権とみなされていることを決定するために、私たちが提起したクレームを正当化することができます。上記のいずれも、我々の業務、財務状況、経営結果及び見通しに実質的な悪影響を及ぼす可能性がある。
もし私たちの商標と商号が十分に保護されていなければ、私たちは興味のある市場で知名度を作ることができないかもしれません。私たちの業務は悪影響を受けるかもしれません。
私たちは登録または未登録の商標または商号を使用して、私たち自身と私たちの製品をブランドしてマーケティングするつもりです。私たちは新しい商標を設計または作成して登録を申請することができますが、私たちの商標申請はアメリカ、中国、または他の任意の関連司法管轄区で承認されないかもしれません。第三者は、私たちの商標出願または商標をキャンセルしようとしたり、他の方法で商標の使用に挑戦しようとしたりすることができる。もし私たちの商標が成功的に挑戦されれば、私たちは私たちの薬を再命名することを余儀なくされるかもしれません。これはブランド認知度の喪失を招き、広告と新しいブランドをマーケティングするために資源を投入する必要があるかもしれません。競争相手や他の当事者は、私たちと同様の商号や商標を採用して、ブランド表示を確立する能力を阻害し、市場の混乱を招く可能性があります。しかも、彼らは私たちの商標を侵害するかもしれないし、私たちは私たちの商標を実行するのに十分な資源がないかもしれない。もし私たちが私たちの商標を強制的に執行し、商標侵害クレームを主張しようとするならば、裁判所は私たちが主張する商標が無効または強制執行できない、または私たちが商標侵害を主張する側が関連商標に対してより高い権利を持っていると判断するかもしれない。この場合、私たちは最終的にこのような商標の使用を中止することを余儀なくされるかもしれない。
私たちは私たちの商標と商品名を流通業者のような第三者に許可するかもしれない。これらのライセンス契約は、私たちの商標や商号をどのように使用するかに指針を提供する可能性がありますが、ライセンシーは、これらの合意に違反したり、私たちの商標およびビジネス番号を乱用したりすることで、私たちの権利を危険にさらしたり、私たちの商標や商号に関連する商標の名誉を弱める可能性があります。
長期的には、私たちの商標や商号に基づいて名称を確立することができなければ、効果的に競争できない可能性があり、私たちの業務は悪影響を受ける可能性があります。
私たちがすでにまたは将来達成する可能性のあるいかなる協力計画も成功しない可能性があり、これは私たちが製品を開発し、それを商業化する能力に悪影響を及ぼすかもしれない。
私たちの協力計画の成功は私たちの協力者とパートナーの努力と活動に大きく依存するだろう。
協力とパートナーシップは多くのリスクに直面しています
•協力者は彼らが協力の努力と資源に適用することを決定する上で大きな自由裁量を持っている
•パートナーは、我々の製品の開発および商業化を行わない可能性があり、試験または試験結果に応じて、競争製品の買収によって戦略的重点、資金利用可能性、または他の外部要因(例えば、資源の移転または競争的優先事項を創造する業務統合)を変更して、開発または商業化計画を継続または更新しないことを選択する可能性がある
•協力者は、第三者開発と直接または間接的に我々の製品または候補製品と競合する製品を独立して開発するか、または第三者開発と直接または間接的に競合することができる
•1つまたは複数の製品に対してマーケティング、製造、および流通の権利を有する協力者は、これらの活動を行うのに十分な資源を投入しないか、またはこれらの活動を満足に行うことができない可能性がある
•私たちは私たちの協力者に独占的な権利を与えることができ、これは私たちが他人と協力することを阻止するだろう
•協力者は、私たちの知的財産権を正確に維持、保護、強制、保護することができないかもしれない、または何らかの方法で私たちの知的財産権または独自の情報を使用して、実際または脅威の訴訟を引き起こし、それによって私たちの知的財産権または固有の情報を危険にさらしたり、潜在的な責任を負わせたりすることができる
•協力者は、第三者の知的財産権または独自の権利を侵害、流用、または他の方法で侵害する可能性があり、これは、私たちを訴訟および潜在的な責任に直面させる可能性がある
•現在または将来の製品候補の研究、開発または商業化の遅延または終了を引き起こす、または経営陣の注意とリソースを逸脱させる高価な訴訟または仲裁につながる当社と提携者の間に紛争が生じる可能性があります。
•協力は終了することができ、終了すれば、適用可能な現在または将来の製品をさらに開発するために追加の資金が必要になるか、または商業化される可能性がある
•協力者は、私たちが協力して生成した製品候補製品の知的財産権を持っているか、または共同で所有している可能性があり、この場合、私たちはその知的財産権を開発または商業化する独占的な権利を持っていない
•協力者の販売およびマーケティング活動または他の操作は、適用される法律に適合していない可能性があり、これは、私たちの民事または刑事訴訟につながる可能性があります。
上記のいずれも、我々の業務、財務状況、経営結果及び見通しに実質的な悪影響を及ぼす可能性がある。
知的財産権はすべての潜在的な脅威を解決できるとは限らない。
私たちの知的財産権が提供する未来の保護の程度は不確定であり、知的財産権には限界があるため、私たちの業務を十分に保護できないか、あるいは競争優位性を維持することができるかもしれない。例えば:
•他の会社は、私たちの候補製品と同様の製品を製造することができ、または私たちが現在または将来所有または許可している特許請求の範囲がカバーされていない同様の技術を使用することができるかもしれない
•私たちまたは私たちのライセンシーまたは協力者は、私たちが現在または将来所有または許可している発表特許または係属特許出願がカバーする最初の発明をした最初の人ではないかもしれない
•私たちまたは私たちのライセンシーまたは協力者は、私たちまたは彼らのいくつかの発明に関する特許出願を最初に提出した人ではないかもしれない
•他の会社は、私たちが持っているまたは許可された知的財産権を侵害することなく、類似または代替技術を開発したり、私たちのいかなる技術を複製したりすることができる
•以前の開示が存在する可能性があり、私たちまたは私たちの許可者またはパートナーの特許を無効にするかもしれない
•私たちが権利を持っている発行された特許は、私たちにいかなる競争優位性を提供することができないかもしれないし、または私たちの競争相手または他の第三者による法的挑戦を含む無効または実行不可能と認定される可能性がある
•私たちの競争相手や他の第三者は、特許権のない国や安全港法律を研究·開発している国で研究·開発活動を行い、これらの活動から得られた情報を利用して競争力のある製品を開発し、私たちの主要な商業市場で販売することができる
•私たちは他の特許を申請できる独自技術を開発しないかもしれない
•私たちまたは私たちの許可者またはパートナーの特許または特許出願の所有権、有効性、または実行可能性は、第三者から疑問視される可能性がある
•他の人の特許または未定または将来の出願は、発行されれば、私たちの業務を損なう可能性がある;および
•商業秘密またはノウハウを保護するために、私たちは特許を出願しないことを選択することができ、第三者はその後、そのような知的財産権をカバーする特許を提出する可能性がある。
これらの事件が発生すると、それらは私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。
アメリカの預託証券の所有権に関連するリスクは
私たちのアメリカ預託証明書の取引価格は大きく変動する可能性があり、私たちのアメリカ預託証明書の購入者は大きな損失を受ける可能性があります。
私たちのアメリカ預託証明書の取引価格はずっと変動し続ける可能性があります。一般的な株式市場、特にバイオ製薬会社の株式市場は極端な変動を経験しており、この変動は往々にしてある会社の経営業績とは無関係である。このような変動により、私たちのアメリカ預託証明書の一部または全部の価値が損失する可能性がある。私たちのアメリカ預託証明書の市場価格は本“リスク要素”の部分と多くの他の要素の影響を受ける可能性があります
•アメリカと中華人民共和国の間の政治的緊張関係
•私たちは進行中と計画中の臨床試験で被験者の能力を募集しています
•私たちの臨床試験と臨床前研究の結果(および結果の解釈)、および私たちの競争相手または私たちの市場分野の他社の試験結果(および結果の解釈)
•私たちの候補製品の規制承認、またはそれの使用に対する特定のラベル適応または患者集団の制限、または規制審査中の変化または遅延;
•アメリカ、中国、その他の国の規制動向
•医療支払い制度の構造の変化、特に現在の米国の医療制度の改革を考慮する
•私たちが他の候補製品を取得、許可、または開発する努力の成功または失敗
•私たちや競争相手が開発した革新や新製品
•私たちまたは私たちの競争相手は、重大な買収、戦略的パートナーシップ、合弁企業、または資本約束を発表します
•製造、供給、または流通遅延または不足;
•私たちは、任意の製造業者、サプライヤー、許可者、未来のパートナー、または他の戦略的パートナーシップとの任意の変化
•予想される製品販売と収益性を達成する
•私たちの財務業績や私たちと似ていると思われる会社の財務業績の違い
•バイオ製薬業界の市場状況と証券アナリスト報告または提案の発表;
•当社のアメリカ預託証明書の取引量
•追加資金を得ることができません
•内部の人や株主が私たちの証券を売っています
•一般的な経済、産業、そして市場状況の他の事件や要素の多くは私たちがコントロールできない
•キーパーソンの増減
•新冠肺炎の大流行の持続と未来の影響とその伝播を緩和するための行動
•変化する世界的な政治環境と軍事行動と経済·金融市場への影響
•知的財産権、製品責任、または私たちに対する他の訴訟。
また,過去にバイオ製薬会社株の市場価格が変動した後,株主はこれらの会社に対して集団訴訟を起こしていた。私たちにこのような訴訟を提起すれば、私たちに巨額の費用が発生し、経営陣の注意と資源を移転させる可能性があり、これは私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
不安定な市場と経済状況は、私たちの業務、財務状況、経営結果、および私たちのアメリカ預託証明書の価格に深刻な悪影響を及ぼす可能性があります。
世界の信用と金融市場は時々極端な変動と破壊を経験し、流動性と信用供給の深刻な減少、消費者自信の低下、経済成長の低下、失業率の上昇及び経済安定の不確定性を含む。将来の信用と金融市場の悪化と経済状況に対する自信が起こらない保証はない。私たちのビジネス戦略や業績は、このような経済低迷、不安定なビジネス環境、または持続不可能で不安定な市場状況のいずれかの悪影響を受ける可能性があります。金融市場と世界経済もまた不利な影響を受ける可能性がある
ロシア-ウクライナ戦争やテロや他の地政学的事件の影響を含む現在または予想される軍事衝突の影響を受ける。米国や他の国がウクライナ紛争を含むこのような紛争に対応するために実施している制裁は、金融市場や世界経済に悪影響を及ぼす可能性もあり、影響を受けた国や他の国のいかなる経済対策も市場や経済の不安定を悪化させる可能性がある。現在の株式と信用市場が悪化すれば、任意の必要な債務や株式融資をより困難にし、コストがより高く、希釈程度をより高くする可能性がある。適切かつ有利な条件で必要な融資を得ることができなければ、私たちの業務、財務状況、運営結果、および私たちのアメリカ預託証明書の価格に大きな悪影響を及ぼす可能性があります。
もし私たちがナスダックの持続的な上場要求を満たすことができなければ、私たちのアメリカ預託証明書がカードを取られるかもしれません。
私たちのアメリカ預託証明書はナスダック世界市場に発売されています。私たちの上場を維持するために、私たちは1株当たり最低終値1.00ドル、最低資本額、および各種の会社管理要求を含む最低財務とその他の要求を満たさなければならない。
私たちは現在ナスダック世界市場の持続的な上場要求を守っているにもかかわらず、私たちは過去にナスダックからいくつかの上場要求を遵守していないと通知を受けたことがあり、私たちは投資家に保証することはできません。私たちは未来にこれらの要求を守り続けることができます。もし私たちのアメリカ預託証明書がナスダック世界市場から撤退し、他の市場や取引所でオファーまたは上場する資格がない場合、私たちのアメリカ預託証券は場外取引市場または非上場証券のために設立された電子掲示板(例えば、粉票または場外取引掲示板)でしか取引できません。この場合、我々の米国預託証明書を処分したり、正確な米国預託証明書のオファーを得ることがより困難になる可能性があり、証券アナリストやニュースメディアによる私たちの報道も減少する可能性があり、これにより、私たちの米国預託証明書の価格がさらに低下する可能性がある。しかも、私たちが大型取引所に上場しなければ、私たちは追加的な資本を調達することが難しいかもしれない。
また、1940年に“投資会社法”や“投資会社法”によると投資会社とみなされ、私たちがカードを外される可能性があります。私たちは“投資会社”でもなく、“投資会社法”に基づいて“投資会社”に登録するつもりもない。一般に、ある会社が、自分が主に証券投資、再投資または取引業務に従事しているか、または合併せずにその総資産(米国政府証券および現金プロジェクトを含まない)の価値の40%を超える価値を有する投資証券を所有または保有しようとしている場合、その会社は、例外、免除または避難港が適用されない限り、“投資会社”である。私たちは自分が主に証券投資、再投資あるいは取引業務に従事していることや計画を主にしていることを示していない。逆に,われわれは歴史的に主に炎症性疾患療法の開発に従事してきたが,現在も同様である。私たちは私たちが投資会社とみなされないように事業を継続するつもりだ。しかし、“投資会社法”によると、私たちの地位はいくつかの要素に依存するかもしれない。もし私たちが“投資会社法”の制約を受けたら、“投資会社法”に違反するいかなる行為も、潜在的な重大な規制処罰を含む実質的な不利な結果に直面する可能性がある。しかも、外国の個人発行者として、私たちは投資会社法に基づいて登録する資格がない。そのため、米国証券取引委員会の免除を受けたり、投資会社の定義に属さないように投資を処分したりしなければならず、いずれも当社に大きな悪影響を及ぼす可能性がある。最後に、“投資会社法”によると、投資会社とみなされることも、米国上場企業としての報告義務を履行できない可能性があり、これは、私たちのアメリカ預託証明書と普通株の流動性と価値に重大な悪影響を与え、米国市場で投資家に証券を提供する能力と、ナスダック世界市場に上場し続ける能力に影響を与える可能性がある
私たちのアメリカ預託証明書は活発で流動性の強い取引市場を維持できないかもしれない
私たちは私たちのアメリカ預託証明書のために活発な取引市場を維持できるという保証はない。活発な市場の不足は、投資家が私たちのアメリカ預託証明書の売却を望んでいるとき、または投資家が合理的と思う価格で私たちのアメリカ預託証明書を売却する能力を弱める可能性がある。不活発な市場は、株を売却することで資金を調達する能力を弱める可能性もあり、株式を犠牲にして他の業務や技術を買収する能力を弱める可能性があり、逆に私たちの業務に大きな悪影響を及ぼす可能性がある。
我々の役員、取締役、主要株主は、彼らが共同行動を選択すれば、株主に承認されたすべての事項を制御または顕著に影響することができるだろう。しかも、私たちの現在のいくつかの役員は私たちの主要株主によって任命されている
我々の行政者,役員および5%を超える株主は合計で約76.9%の発行済み普通株を所有している(米国預託証明書に代表される36,530,101株の普通株を含み、発行された購入株式を行使しないと仮定する)。しかも、私たちの現在のいくつかの役員は私たちの主要株主によって任命されている。したがって、これらの人または彼らが私たちの取締役会で任命した人は、彼らが一緒に行動すれば、コントロールすることができるか、または
私たちの取締役会または株主承認に提出されたすべての事項には、私たちの経営陣の任命、取締役の選挙および罷免、任意の重大な取引の承認、および私たちの経営陣および業務事務が、大きな影響を与えています。このような所有権の集中は、制御権の変更を遅延、遅延、または阻止する可能性があり、我々の合併、合併、買収または他の業務合併に関連することを阻害するか、または潜在的な買収者が要約買収を提案することを阻止するか、または他の方法で我々の業務に対する支配権を獲得しようと試みる可能性があり、たとえそのような取引が他の株主に利益をもたらすであろう。
私たちは現在、私たちの証券に配当金を支払うつもりはありませんので、私たちがアメリカ預託証明書で投資リターンを実現する能力は、私たちのアメリカ預託証明書価格の上昇にかかっています(あれば)。
私たちは私たちの証券のどんな現金配当金も発表したり支払ったりしたことがない。私たちは現在、事業の発展、運営、拡張のために未来の収益を保留し、予測可能な未来に現金配当金を発表または支払うことはないと予想している。しかも、未来のどんな債務協定の条項も私たちが配当金を支払うことを阻止するかもしれない。
ケイマン諸島の法律の要求によると、私たちの取締役会は配当金を分配するかどうかを決定する権利が完全にある。また、私たちの株主は一般決議で配当を発表することができますが、いかなる配当も私たちの取締役が提案した金額を超えてはいけません。ケイマン諸島法律によると、ケイマン諸島会社は利益またはその株式割増口座から配当金を支払うことができるが、いずれの場合も、正常な業務過程で満期になった債務を返済できない場合には、配当金を支払うことができない。私たちの取締役会が配当金を発表して支払うことを決定しても、将来の配当の時間、金額、形式(あれば)は、私たちの将来の経営業績とキャッシュフロー、私たちの資本需要と黒字、私たちが子会社から得た割り当て金額(あれば)、私たちの財務状況、契約制限、取締役会が関連していると思う他の要素に依存します。したがって、私たちのアメリカ預託証明書への任意の投資リターンは、私たちのアメリカ預託証明書の将来のいかなる価格上昇にもかかっている。私たちのアメリカ預託証明書が値上がりする保証はありません。私たちのアメリカ預託証明書の購入価格が変わらないことさえ保証できません。私たちのアメリカ預託証明書への投資の一部または全部は損失する可能性があります。
私たちの既存の株主が公開市場で私たちのアメリカ預託証明書や普通株を大量に販売することは私たちのアメリカ預託証明書の価格を下落させる可能性があります
公開市場で私たちのアメリカ預託証明書や普通株を大量に販売したり、これらの売却が発生する可能性があると考えたり、私たちのアメリカ預託証明書の市場価格を著しく低下させる可能性があります 十分な資本を集める能力を弱化させています
私たちは36,530,101株の米国預託証明書に代表される普通株であり、行使されていないオプションが行使されていないと仮定し、これらのオプションは、それらが私たちの関連会社によって保有または購入されない限り、公開市場で自由に取引することができる。当社が保有する米国預託証券は公開市場で販売する資格があり、証券法第144条の規定により出来高が制限されています
当社の約1,860万株の発行済み普通株を保有しているか、あるいは当社の発行済み普通株総数の約33.7%を占める保有者は、証券法に基づいてその株式を登録する権利がある。証券法によると、これらの株式(連属会社の株式を含む)を登録することで、これらの株式を自由に取引できるようになり、証券法の制限を受けない。これらの株主のどの証券売却も、われわれの米国預託証券の取引価格に重大な悪影響を及ぼす可能性がある
私たちは新興成長型会社であり、新興成長型会社に適用される開示要求の低下は、私たちの米国預託証明書の投資家に対する魅力を低下させる可能性がある。
“雇用法案”の定義によると、我々は新興成長型企業であり、IPO完了5周年後の会計年度最終日までは、新興成長型企業であった可能性がある。しかし、この5年間の期間が終わる前に特定の事件が発生した場合、もし私たちが“大型加速申告会社”になれば、私たちの年間総収入は12.35億ドルを超え、あるいは任意の3年間に10億ドルを超える転換不可能債券を発行した場合、私たちはこの5年が終わるまで新興成長型会社ではなくなるだろう。私たちがまだ新興成長型企業である限り、私たちは他の非新興成長型企業に適用されるいくつかの上場企業の開示要求の免除に依存することが許可され、依存するつもりだ。これらの免除には
•当社の財務報告の内部統制を評価する際には、監査人の認証要求を遵守することは要求されていない
•上場企業会計監督委員会が通過する可能性のある強制ローテーション監査会社に関する任意の要求、または監査および財務諸表に関する追加情報を提供する監査師報告書の補足を遵守することが要求されていない;
•役員報酬に関する開示と他の義務を減らす。
この年間報告書で、私たちは減少した報告書の負担を利用した。これらの免除に依存することは、私たちのアメリカ預託証明書の魅力を低下させる可能性があり、したがって、私たちのアメリカ預託証明書の取引市場はそれほど活発ではない可能性があり、私たちのアメリカ預託証明書の取引価格は低下または不安定になる可能性がある。
外国の個人発行者として、米国内発行者に適用されるいくつかの米国証券法開示要求に制約されず、株主が公開して得られる情報を制限する可能性がある。
外国の個人発行者として、私たちは取引所法案のすべての定期的な開示と現在の報告要求を守る必要がないので、私たちがアメリカ国内発行者であるよりも、私たちに関する公開情報が少ないかもしれません。例えば、私たちは現在、6ヶ月ごとに財務情報を報告していますが、現在は四半期ごとに財務情報を報告する計画はありませんが、米国内の発行者はそうすることを要求されます。また,我々は米国委託書規則の制約を受けず,我々の年間株主総会に関する開示はケイマン諸島の要求に管轄される.さらに、我々の上級管理者、取締役、および主要株主は、申告を免れることができ(すなわち、取引時に表3、4または5を提出しない)、取引法第16節の“短期”利益回収条項およびその規則の制約を受けない。したがって、私たちの株主は、例えば、私たちの役員、取締役、および主要株主がいつ私たちの普通株式またはアメリカ預託証明書を購入または売却するかを知らないかもしれません。
外国の個人発行者として、私たちは会社の管理事務の面でいくつかのナスダック会社の管理上場基準とは大きく異なる母国のやり方を採用することを許可された。これらのやり方は、当社が上場基準を完全に遵守している場合に比べて、株主への保護が少ない可能性があります。
外国の個人発行者として、私たちはナスダック上場規則のいくつかの条項を利用することを許可され、これらの条項は私たちがいくつかの統治事項でケイマン諸島の法律に従うことを可能にする。ケイマン諸島の会社管理規則は会社管理上場標準と大きく異なる可能性がある。一般的な受託責任と注意責任以外に、ケイマン諸島の法律は具体的な会社管理標準を規定する会社管理制度がないからである。ケイマン諸島の法律は私たちの取締役会が大多数の独立役員で構成されることを強制していません。ケイマン諸島の法律も賠償委員会の設置や指名委員会や指名手続きに具体的な要求をしていない。もし私たちが将来自国のやり方に従うことを選択すれば、私たちの株主が獲得した保護は、アメリカ国内発行者に適用されるコーポレートガバナンス上場基準を下回る可能性がある。
我々が改訂·再記述した組織定款の大綱·細則によると、投資家は株主総会や投票において、いくつかの米国会社の株主が所有する同じ権利を持っていない。
私たちのホールディングスはケイマン諸島の法律に基づいて設立されました。当社は改正及び再記述された組織定款大綱及び定款細則により、任意の株主総会で業務を処理するために必要な定足数は1名又は複数名の身身又は被委員会代表が出席する株主であり、彼らが保有する株式の合計は当社のすべての発行済み株式及び有投票株式の3分の1以上の投票権を有すると規定されている。また、吾等の改訂及び再記載された組織定款の大綱及び細則は、任意の株主総会の任意の採決は、当該会議の議長又は任意の1人又は複数の株主が(挙手採決結果が発表される前又は挙手結果を発表する際に)投票方式で採決されなければならないと規定しており、これらの株主は、会議に出席する代表を自ら又は委任する普通株式総数の10%以上の投票権を共有している。私たちのマイノリティ法定人数規定はナスダック上場企業に適用される要求を満たしているにもかかわらず、いくつかのアメリカ会社の定足数要求はこれらよりも厳しい。また、一部の米国企業の株主投票は、デラウェア州法律に基づいて設立された会社のように、書面で行わなければならず、手を挙げて行うことはできない。そのため、私たちは組織定款の大綱と定款の細則を修正し、再記述したため、投資家はいくつかのアメリカ会社の株主が享受する株主総会や投票に関する手続き的保護を享受することができない。
私たちは未来に外国の個人発行者の地位を失うかもしれないし、これは多くの追加的な費用と支出を招くかもしれない。
上述したように、私たちは外国の個人発行者なので、私たちは取引法のすべての定期的な開示と現在の報告要件を遵守する必要はありません。外国の個人発行者の地位の決定は毎年発行者が最近完成した第2四半期の最後の営業日に行われる。例えば、普通株式の50%以上が米国住民によって直接または間接的に保有されている場合、私たちは私たちの外国個人発行者の地位を維持するために必要な追加の要求を満たすことができない場合、私たちは外国の個人発行者の地位を失うだろう。もし私たちがこの日に外国の個人発行者の身分を失ったら、私たちは外国の個人発行者が利用できる表よりも詳細で広いアメリカ国内発行者表の定期報告書と登録声明をアメリカ証券取引委員会に提出することを要求されるだろう。また、アメリカ連邦委託書の要求を強制的に遵守しなければなりません。私たちの上級管理者、役員、主要株主は、取引所法案第16条の短期利益開示と回収条項の制約を受けます。また、私たちはナスダック上場規則の下で特定の会社のガバナンス要求に依存する能力を失うだろう。米国で上場している非外国人個人発行者として、米国証券取引所での上場を維持するために、多くの追加の法律、会計、その他の費用が発生します。これらの費用は、私たちが外国人個人発行者としては起こらないことと、会計、報告、その他の費用です。
通貨レートの変動は、私たちの運営結果や私たちのアメリカ預託証明書への任意の投資の価値に重大な悪影響を及ぼす可能性がある。
人民元の米ドルやその他の通貨に対する価値は変動し、政治や経済条件の変化などの要素の影響を受ける可能性がある。2005年7月21日、中国政府は10年に及ぶ人民元とドルをリンクさせる政策を変更し、次の3年間で人民元の対ドル高は20%以上上昇した。2008年7月から2010年6月にかけて、人民元の切り上げが停止し、人民元対米ドルレートは狭い区間内に維持された。2010年6月、中国人民銀行中国銀行は、中国政府が為替レートの弾力性を高め、その後人民元の対ドルレートを中国人民銀行が設定した狭い区間で緩やかに切り上げることを許可すると発表した。しかし、最近、2015年8月11日、12日、13日に、中国人民銀行は人民元対米ドルレートをそれぞれ前日より1.9%、1.6%、1.1%下げ、大幅に値下がりした。2016年10月1日、人民元はドル、ユーロ、円、ポンドとともにIMFの特別引出権(SDR)通貨バスケットに加入した。2016年第4四半期には、人民元が大幅に値下がりし、ドルが高騰し、中国は持続的な資本流出を経験した。外国為替市場の発展、金利自由化と人民元国際化の進展に伴い、中国政府は将来的にさらなる為替制度改革を発表する可能性がある。今後人民元の対ドルレートが大幅に上昇したり大幅に切り下げられたりしない保証はない。将来の市場力、中国と米国政府の政策法規が人民元の対ドルレートにどのように影響するかを予測することは難しい。
人民元の大幅な上昇は私たちのアメリカ預託証明書のいかなる投資にも実質的な悪影響を及ぼす可能性がある。例えば、私たちの業務がドルを人民元に両替する必要がある程度では、人民元の対ドル高は私たちが両替から得た人民元金額に悪影響を与える。逆に、普通株式やアメリカ預託証明書の配当金や他の商業目的のために私たちの人民元をドルに両替することを決定すれば、ドルの人民元の上昇は私たちが利用できるドルの金額にマイナスの影響を与えるだろう。また、ドルに対する人民元の切り上げや切り下げは、私たちの業務や経営業績にかかわらず、ドル建ての財務業績に影響を与えます。
中国のヘッジ選択は非常に限られており、為替レート変動のリスクを減らすための開放性がある。今まで、私たちは為替両替リスクを下げるために、何のヘッジ取引も行っていません。将来的にヘッジ取引を行うことになるかもしれませんが、これらのヘッジの可用性と有効性は制限される可能性があり、私たちは私たちのリスクを十分にヘッジできず、ヘッジすることさえできないかもしれません。また、私たちの通貨為替損失は中国の外国為替法規によって拡大される可能性があり、これらの法規は人民元を非中国通貨に両替する能力を制限している。
私たちのアメリカ預託証明書の保有者は私たちの株主よりも少ない権利を持っており、彼らの権利は信託機関を通じて行使されなければならない。
私たちのアメリカ預託証明書保持者は私たちの登録株主と同じ権利を持っていません。私たちのアメリカ預託証明書の所有者として、投資家は私たちの株主総会に出席したり、そのような総会で投票する直接的な権利はありません。所有者として
我々の米国預託証明書では,投資家は預金協定の規定に基づいて信託機関に投票指示を出すことで,我々の米国預託証明書に代表される関連普通株による投票権を間接的に行使することしかできない.任意の投資家の投票指示を受けた後、信託銀行は可能な限り投資家の指示に従って、私たちのアメリカ預託証明書関連普通株に投票します。我々が投資家に指示を要求する場合,投資家の投票指示を受けた後,信託機関はこれらの指示に基づいて対象普通株への投票を試みる.もし私たちが委託者に投資家の指示を求めるように指示しなければ、委託者は依然として投資家の指示に従って投票することができるが、そうしなければならないわけではない。投資家は、投資家が株主総会記録日前に当該株式を撤回し、当該株式の登録所有者とならない限り、関連する普通株について任意の投票権を直接行使することができない。株主総会が開催されると、投資家は、我々の米国預託証券関連株式を撤回し、当該株式の登録所有者となるために十分な総会事前通知を受けない可能性があり、それにより、投資家が株主総会に出席することを許可し、株主総会で審議及び採決された任意の特定事項又は決議について直接投票する。また、吾等の改訂及び再記述された組織定款の大綱及び細則によると、どの株主が任意の株主総会に出席して任意の株主総会に投票する権利があるかを特定するために、吾等の取締役は吾等の株主登録簿及び/又は事前に会議に関する記録日を決定することができ、吾等の株主名簿を閉鎖したり、その記録日を設定することは、投資家が記録日前に吾等の米国預託証券関連普通株を撤回し、当該等の株式の登録所有者となることを阻止することができ、投資家は株主総会に出席したり、直接投票することができなくなる可能性がある。投資家に指示を求めると、信託機関は投資家にこれから行われる投票を通知し、私たちの投票材料を投資家に渡すように手配します。私たちは株主総会が開催される前に預金管理通知を十分に出すことに同意した。しかし、投資家は、投資家が私たちの米国預託証明書に代表される対象株式に投票するように信託機関に指示できることを確実にするために、投票材料をタイムリーに受け取ることを投資家に保証することはできない。また,保管人およびその代理人は,採決指示やその採決指示を実行できなかった方式に対して無責任である.これは、投資家が私たちのアメリカ預託証券関連株の投票方法を示すためにいかなる権利も行使できない可能性があり、もし私たちのアメリカ預託証券関連株が要求通りに投票していない場合、投資家は法的救済を得ることができない可能性があることを意味する。また、米国預託株式保有者として、投資家は株主総会を開催することができない。
限られた状況でなければ、投資家が株主総会で投票しなければ、私たちのアメリカ預託証券受託係は私たちに適宜の依頼書を与えて、私たちのアメリカ預託証明書関連普通株を投票させます。これは投資家の利益に悪影響を及ぼす可能性があります。
米国預託証明書の預託協定によると、投資家が投票していない場合、信託銀行は投資家が信託機関に全権委託を指示したと考え、株主総会で米国預託証明書に関連する普通株を投票しましょう
•私たちは委託者に通知して、私たちは全権委任を望んでいません
•会議の採決事項に大きな反対意見があることを保存者に通知した
•会議の採決事項は株主に重大な悪影響を及ぼす
•大会の投票は挙手で行われ、適用される上場規則や当社の組織規約細則が投票方式で投票されることが規定されていない限り行われる。
この全権委託書の効果は,上記の場合を除き,投資家が我々の米国預託証券関連普通株の投票を阻止することができないことである.これは株主たちが私たちの経営陣に影響を与えるのをもっと難しくするかもしれない。私たちの普通株式の保有者はこの全権委託によって制限されない。
そのような配信が不正または非現実的である場合、または任意の投資家にそのような配信を提供するために必要な政府の承認を得ることができない場合、投資家は、私たちの米国預託証明書の配信またはそのような配信に関する任意の価値を得ることができない。
私たちは現在配当金を支払う計画はありませんが、私たちのアメリカ預託証明書の受託者は、私たちのアメリカ預託証明書に関連する普通株または他の預金証券から受け取った現金配当金または他の分配を投資家に支払うことに同意しました。その費用と支出、ならびに任意の適用された税金および政府料金を差し引くことに同意しました。投資家は私たちのアメリカ預託証明書に代表される普通株式数に比例した分配を得るだろう。しかし,保管者がどの米国預託証明書保持者に流通を提供するかが不正または非現実的であると認定された場合,その保管者は責任を負わない。例えば、米国預託証券所有者が発行した証券を証券法に基づいて登録する必要があるが、適用される登録免除の下でこのように適切に登録または配布されていない場合、その証券保有者への流通は不正となる。保管人はまた、特定の財産を分配することは合理的な範囲では不可能であることを確認することができる。これらの場合、保管者は、このような財産を割り当てないことを決定することができる。このような分配によって得られた米国預託証券、普通株式、権利、または他の証券の発行を米国証券法に基づいて登録する義務はありません。私たちは
米国預託証明書保持者に米国預託証明書、普通株式、権利、または他のものを配布することを可能にする他の行動をとる義務もない。これは、普通株を投資家に提供することが不法または非現実的であれば、投資家は普通株式または普通株に対する任意の価値の分配を得ることができない可能性があることを意味する。このような制限は私たちのアメリカ預託証明書の価値を大幅に低下させるかもしれない。
投資家が将来の任意の株式発行に参加する権利は制限される可能性があり、これにより、私たちが持っている米国預託証明書の保有量が希釈される可能性がある。
私たちは時々私たちの証券を購入する権利を含めて私たちの株主に権利を割り当てるかもしれない。しかし、私たちは、証券法に従って権利および権利に関連する証券を登録するか、または登録要件を免除することができない限り、米国の投資家に権利を提供することはできない。また、預金協定によれば、権利および任意の関連証券が証券法に基づいて登録されているか、または米国預託株式保有者に権利を分配して証券法による登録を免れない限り、預金銀行は投資家に権利を提供しない。私たちはこのような権利や証券について登録声明を提出する義務がないし、その登録声明を発効させるために努力する義務はない。しかも、私たちは証券法に基づいて登録免除を確立することができないかもしれない。保管人が権利を割り当てない場合、保管者プロトコルに従って、それは可能な場合にこれらの権利を販売することができ、またはこれらの権利の失効を許可することができる。そのため、投資家は私たちの株式発行に参加できない可能性があり、私たちのアメリカ預託証明書での持株が希釈されるかもしれない。
私たちは受動的外国投資会社に分類されるかもしれませんが、これは私たちのアメリカ預託証明書や普通株のアメリカ保有者に不利なアメリカ連邦所得税の結果をもたらすかもしれません。
いずれの課税年度においても、特定の前向きルールが適用された後、(I)この年度の私たちの総収入の75%以上が“受動的収入”(1986年に改正された米国国内税法の関連条項によって定義される)(収入試験)、または(Ii)年間の私たちの資産価値の50%以上(通常は四半期平均値に基づいて決定される)が受動的収入を生成するための資産(資産テスト)の生成または保有によるものであることを条件に、受動的外国投資会社またはPFICに分類される。私たちの資産価値によると、営業権、そして私たちの収入と資産の構成を含めて、2023年12月31日までの納税年度内に米国連邦所得税のPFICであるとは思いません。しかし,PFICルールの適用はいくつかの点で不確実性があり,どの課税年度でもPFICにはならないことを投資家に保証することはできない。米国の保有者が任意の課税年度に我々の米国預託証明書または普通株を保有しているとみなされる場合、米国連邦所得税の不利な結果は、“税務-米国連邦所得税考慮事項”によって定義されるように、米国所有者に適用される可能性がある。
投資家たちは私たちのアメリカ預託証明書の譲渡によって制限されるかもしれない。
私どものアメリカ預託証明書は信託銀行の帳簿に譲渡することができます。しかし,保管人は,職務遂行に関与していると考えられる場合には,その譲渡帳簿を随時あるいは随時閉鎖することができる。さらに、私たちの帳簿または委託者の帳簿が閉鎖されたとき、または法律または任意の政府または政府機関の任意の要求、または預金協定の任意の規定または任意の他の理由によって、いつでもそうすることが望ましいと考えられる場合、受託者は、米国預託証明書の交付、譲渡または登録を拒否することができる。
投資家が米国預託証明書保持者として預託機関に債権を追徴する権利は預金協定条項によって制限される。
預金協定によれば、預金協定又は預金協定又は予定されている取引、又は吾等を有する米国預託証明書によって引き起こされ、又はホスト銀行に関連する訴訟又は法律手続きは、ニューヨークの州又は連邦裁判所でしか提起されないが、任意の投資家は、吾等の米国預託証明書の所持者として、投資家が当該等の法的手続に対して提起する可能性のある反対を撤回することができず、いかなる訴訟又は法律手続における当該等の裁判所の排他的司法管轄権を撤回することができない。保管人は、預金協定に記載されている条項による仲裁の提出を適宜要求し、預金協定によって生じる関係によって生じる任意の論争または分岐を最終的に解決することができる。これらの仲裁条項はこのような論争や分岐を管轄し、いかなる場合も投資家が証券法や“取引法”に基づいて州または連邦裁判所にクレームを出すことを阻止しない
米国預託株式保有者は、預金協定に基づくクレームを陪審裁判する権利がない可能性があり、このような訴訟において原告(S)に不利な結果を招く可能性がある。
吾等の普通株を代表する米国預託証券を管理する預託協定は、信託銀行が申索を仲裁に提出することを要求する権利がある場合、ニューヨーク市の連邦又は州裁判所は、預託協定によるクレームを審理及び裁決する排他的司法管轄権を有し、法律で許容される最大範囲内で、米国預託株式保有者は、二級取引における米国預託証明書の購入者を含み、彼らが吾等又は信託会社に対して提起する可能性のある任意の又は吾等の普通株、吾等の米国預託証明書又は預金協定に関連するクレームに起因し、米国連邦証券法に基づいて提出された任意のクレームの陪審裁判の権利を放棄する。
もし私たち又は保管人が放棄に基づく陪審裁判要求に反対する場合、裁判所は適用された州及び連邦法律に基づいて、事件の事実及び状況に基づいて、放棄が強制的に執行できるか否かを決定する。私たちの知る限り、契約紛争前の陪審員による連邦証券法に基づくクレームの裁判免除の実行可能性は、米国最高裁判所の最終裁決を得ていない。契約中の論争前の陪審裁判免除条項を執行するか否かを決定する際、裁判所は通常、一方の当事者が知っているかどうか、賢明かつ自発的に陪審裁判を受ける権利を放棄したかどうかを考慮する。契約規定の争議前の陪審員免審条項は一般的に実行可能であり、保証金協定を管轄するニューヨーク州法律を含むと考えられる。私たちは預金協定と私たちのアメリカ預託証明書がこのような状況だと思う。投資家は私たちのアメリカ預託証明書に投資する前に、陪審員免除条項について法律顧問に相談することを提案します。
投資家又は米国預託証明書の任意の他の所有者又は実益所有者が預金契約又は我々の米国預託証明書の下で生じる事項について、連邦証券法に基づいて提起されたクレームを含む場合、吾等又は受託保管者に申索を提出し、投資家又は当該等の他の所有者又は実益所有者が当該等の申索について陪審裁判を行う権利がない可能性があり、これは、吾等及び/又は受託保管者に対する訴訟を制限及び阻止することができる。預金協定に基づいて私たちおよび/または信託銀行に訴訟を提起した場合、適用される初審裁判所の裁判官または裁判官によってしか審理されない場合、これは、異なる民事手続きに従って行われ、任意のこのような訴訟において原告(S)に不利になる可能性のある結果を含む陪審裁判とは異なる結果をもたらす可能性がある。
しかし、もしこの陪審裁判免除条項が執行されない場合、法廷訴訟が継続される限り、それは陪審裁判の預金協定の条項に従って行われる。預金協定又は米国預託証明書の任意の条件、規定又は規定は、米国預託証明書のいかなる所有者又は実益所有者を構成しないか、又は我々又は信託機関が米国連邦証券法及びその公布された規則及び法規の任意の実質的な規定を遵守することを放棄する。
投資家は投資家の利益を保護する上で困難に直面する可能性があり、アメリカの裁判所を通じて投資家の権利を保護する能力は限られている可能性があります。私たちはケイマン諸島の法律登録によって成立したからです。
私たちの持ち株会社はケイマン諸島の法律登録に基づいて設立された免除会社です。当社の会社事務は、当社が改訂及び再記述した組織定款大綱及び細則、ケイマン諸島会社法(改正)及びケイマン諸島普通法によって管轄されています。ケイマン諸島法律によると、株主が私たちの役員に対して行動する権利と私たち取締役の私たちに対する受託責任はケイマン諸島普通法によって大きく管轄されています。ケイマン諸島の一般法の一部は,ケイマン諸島の比較的限られた司法判例およびイングランドの一般法に由来しており,イングランド裁判所の裁決はケイマン諸島の裁判所に説得力があるが,拘束力はない。ケイマン諸島法律によると、我々株主の権利や役員の受託責任は、米国のある司法管轄区の法規や司法前例のように明確に確立されていない。特に、ケイマン諸島の証券法システムはアメリカほど発達していない。ケイマン諸島と比較して、米国のいくつかの州、例えばデラウェア州は、より完全な会社法機関と司法解釈を持っている。また、ケイマン諸島会社は米連邦裁判所で株主派生訴訟を起こす資格がないかもしれない。
ケイマン諸島免除会社の株主、例えば、ケイマン諸島法律によれば、一般的な権利は、会社の記録(組織定款大綱や定款細則、これらの会社が採択した任意の特別決議、およびこれらの会社の担保および担保登録)を調べたり、これらの会社の株主リストの写しを取得したりする権利はない。ケイマン諸島の法律によると、私たちの現役員の名前は会社登録所で行われた査証によって得ることができます。私たちの改訂·再記載された会社規約によると、私たちの取締役は、私たちの会社の記録が私たちの株主が閲覧できるかどうかを決定する権利があり、どのような条件で調べることができますが、これらの記録を株主に提供する義務はありません。これは、株主の動議に必要な任意の事実を決定するために、または委託書と競合する場合に他の株主に依頼書を求めるために、投資家が必要な情報を得ることを困難にする可能性がある。
以上のような理由により、我々の公衆株主は、経営陣又は取締役会メンバーの行動に直面した場合、米国に登録設立された会社である公衆株主よりも自己の利益を保護することが困難である可能性がある。
私たちは未来に財務報告書の内部統制について経験したり、より多くの重大な弱点を経験し続けるかもしれない。もし私たちが私たちの重大な弱点の救済措置に効果がなければ、あるいは私たちが未来により多くの重大な弱点に遭遇した場合、あるいは私たちが他の方法で財務報告書を適切かつ有効な内部統制を維持することができなければ、私たちが正確かつタイムリーな総合財務諸表を作成する能力が損なわれる可能性があり、投資家は私たちの財務報告書に自信を失う可能性があり、私たちのアメリカ預託証明書の取引価格が低下する可能性がある。
サバンズ·オキシリー法第404条によると、我々の経営陣は、2022年12月31日までの財政年度から、財務報告書の内部統制に対する我々の有効性を毎年報告しなければならない。“新興成長型企業”の地位を失い、申告加速のハードルに達した場合、独立公認会計士事務所は、財務報告に対する内部統制の有効性を証明することを求めることになる。管理管理層が財務報告内部統制を評価するために達成しなければならない基準の規則は複雑であり、大量の文書、テスト、可能な救済措置が必要である。“取引法”における報告会社としての要求に適合するためには、我々の情報技術システムを絶えずアップグレードし、より多くの財務·管理制御、報告システムおよびプログラムを実施し、より多くの会計·財務者を招聘する必要がある。もし私たちまたは私たちの監査人が財務報告の内部統制に有効であると判断できなければ、投資家は私たちの財務報告に自信を失って、私たちのアメリカ預託証明書の取引価格が低下する可能性がある。
私たちの総合財務諸表の監査について、2021年12月31日および12月31日までの年度について、私たちと私たちの独立公認会計士事務所は、財務諸表の決済過程の内部統制に2つの大きな欠陥があることを発見しました。重大な欠陥は財務報告内部統制の欠陥または欠陥の組み合わせであり、私たちの年度または中期連結財務諸表の重大なミス報告は合理的な可能性があり、適時に防止または発見できないようにする。現在発見された重大な弱点は(I)私たちは十分かつ適任な財務報告と会計人員が不足しており、国際財務報告基準とアメリカ証券取引委員会が提出した報告要求に対して適切な理解があり、複雑な国際財務基準技術会計問題を処理し、国際財務報告基準とアメリカ証券取引委員会の報告に基づいて総合財務諸表と関連開示の作成と審査を要求している;(Ii)正式かつ有効な財務決算政策と手続き、特に期末費用削減と課税項目に関連する政策と手続きが不足している。
2022年12月31日までの1年間に、これらの大きな弱点を補い、財務報告の流れと制御を策定·実施することで、財務報告の内部統制を強化する措置を講じている。具体的には、財務·運営部門間の費用対帳を含む期末財務決済政策とプログラムを実施し、より多くの会計·財務者を募集するための人員配備計画を実行し、複雑な会計問題を処理し、財務諸表を効率的に作成するために、適切な知識と専門知識を有するより多くの合格資源を招聘し、財務報告·会計人員のための定期的かつ持続的なIFRS会計·財務報告訓練計画を展開した。2023年12月31日までの年間では、追加行動はとられていない。
私たちは未来に私たちの財務報告書の内部統制にもっと大きな欠陥やどんな重大な欠陥も発生しないということを投資家に保証することはできない。財務報告を有効に維持できなかったいかなる内部統制も、財務状況、運営結果、またはキャッシュフローを正確に報告する能力を深刻に抑制する可能性がある。もし私たちが財務報告の内部統制に有効であるという結論を得ることができない場合、あるいは私たちの独立公認会計士事務所が第404条の審査を開始すると、私たちの財務報告の内部統制に新たな重大な弱点や重大な欠陥があると認定され、投資家は私たちの財務報告の正確性と完全性に自信を失う可能性があり、私たちのアメリカ預託証明書の市場価格が下落する可能性があり、私たちはナスダック、米国証券取引委員会、または他の規制機関の制裁または調査を受ける可能性がある。財務報告の内部統制のいかなる重大な欠陥を補うことができなかったり、上場企業に必要な他の効果的な制御システムを実施または維持できなかったりすることは、将来的に資本市場に参入する機会を制限する可能性もある。
私たちが改訂して再記述した組織定款の大綱と定款には反買収条項が含まれており、第三者が私たちを買収することを阻止する可能性があり、これは私たちのアメリカ預託証明書に代表される普通株を含む私たちの株主が彼らの株式を割増売却することを制限するかもしれない。
私たちが改訂して再記述した組織定款大綱と定款細則には、他人が私たちに対する支配権を獲得したり、私たちが支配権変更取引に参加する能力を制限する条項が含まれています。これらの規定は、第三者が要約買収や同様の取引で我々の支配権を獲得することを求め、現在の市場価格よりも高い割増で株主がその株式を売却する機会を奪うことを阻止する可能性がある。例えば、私たちの取締役会は、私たちの株主がさらなる行動を取らない場合、1つまたは複数の一連の優先株を発行し、彼らの指定、権力、優先権、特権、相対参加、選択的または特殊な権利、および資格、制限または制限を決定する権利があり、配当権、転換権、投票権、償還条項、および清算優先権を含み、これらのすべての権利のいずれかまたは全部は、米国預託株式であっても他の形態でも、私たちの普通株に関連する権利よりも大きい可能性がある。優先株は速やかに発行される可能性があり、その条項は、私たちの支配権の変更を延期または阻止したり、経営陣の更迭を困難にしたりすることを目的としている。もし私たちの取締役会が優先株を発行することを決定すれば、私たちのアメリカ預託証明書の価格は下落する可能性があり、私たちの普通株とアメリカ預託証明書保持者の投票権や他の権利は重大で不利な影響を受ける可能性がある。
私たちは証券集団訴訟の影響を受けるかもしれない。
従来、証券集団訴訟は、ある会社の証券市場価格が下落した後に提起されることが多かった。このリスクは、バイオテクノロジーや製薬会社が近年大幅な株価変動を経験しているため、特に私たちと関連している。私たちがこのような訴訟に直面すれば、巨額のコストを招き、経営陣の注意と資源を移転させる可能性があり、これは私たちの業務を損なう可能性があります。
証券や業界アナリストが我々の業務に関する研究報告書を発表し続けたり、不正確または不利な研究報告を発表しなければ、我々の米国預託証明書の市場価格および取引量は低下する可能性がある。
私たちアメリカの預託証券の取引市場は株式研究アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存しています。私たちはこのようなアナリストを統制することができない。もし研究アナリストが十分な研究カバー範囲を維持していない場合、あるいは1人以上のアナリストが私たちを追跡したアナリストが私たちのアメリカ預託証明書の格付けを引き下げたり、私たちの業務の不正確または不利な研究報告を発表した場合、私たちのアメリカ預託証明書の市場価格は低下する可能性がある。もし一人以上のアナリストが私たちの報告書を停止したり、私たちに関する報告書を定期的に発表できなかったりすれば、私たちは金融市場での可視性を失う可能性があり、これは逆に私たちのアメリカ預託証明書の市場価格や取引量を大幅に低下させる可能性がある。
ソーシャルメディアプラットフォームの使用はますます多くなり、新たなリスクと挑戦をもたらしている。
ソーシャルメディアは私たちと私たちの製品が治療を目的としている病気を交流するためにますます使用されている。バイオ製薬業界のソーシャルメディア実践は発展し続けており、このような使用に関連する法規は常に明確ではなく、私たちの業務に適用される法規に適合しない不確実性とリスクをもたらしている。例えば、患者は、ソーシャルメディアチャネルを使用して、製品の有効性をレビューしたり、いわゆる有害事象を報告したりすることができる。このような開示が発生した場合、適用される有害事象報告義務を監督して遵守できないリスクがあり、あるいはソーシャルメディアによる政治的および市場的圧力の下で自分または公衆の合法的な利益を守ることができない可能性があり、これは私たちの製品に対する私たちの発言が制限されているからである。いずれのSNSにおいても、敏感な情報または否定的または不正確な投稿またはコメントを不適切に開示するリスクがある。さらに、私たちの製品に関する不適切または根拠のない声明はソーシャルメディア上に伝わるかもしれない。もしこのような事件が発生したり、私たちが適用された法規を遵守できなかった場合、私たちは責任を負い、あまりにも厳格な規制行動に直面したり、私たちと私たちの業務に他の損害を与えたり、私たちの製品の名声を損なうことを含むかもしれません。
中国でのビジネスに関するリスク
中国政府の政治·経済政策の変化は、私たちの業務、財務状況、経営結果に重大な悪影響を及ぼす可能性があり、私たちの成長と拡張戦略を維持できない可能性がある。
私たちの財務状況と経営業績は中国経済、政治、法律発展の影響を大きく受けており、私たちは中国で大量の業務を持っている。中国経済は多くの面で大多数の先進国の経済と異なり、政府参加の程度、発展レベル、成長速度、
外国為替制御と資源配置。1978年に改革開放政策が施行される前、中国は主に計画経済だった。近年、中国政府は中国の経済体制と政府構造を改革してきた。例えば、過去30年間、中国政府は経済改革と中国経済発展に市場力を利用することを強調する措置を実施した。このような改革は著しい経済成長と社会的展望をもたらす。
中国経済は過去30年間で著しい成長を経験しているが、地理的にも経済の各部門間でも成長は不均衡である。中国政府は経済成長を奨励し、資源配置を誘導する様々な措置を実施した。その中のいくつかの措置は中国経済全体に有利かもしれないが、私たちにマイナスの影響を与える可能性もある。例えば、私たちの財務状況や経営結果は、資本投資に対する政府の規制や現在私たちに適用されている税収規制の変化の悪影響を受ける可能性があります。また、中国政府は過去に、経済成長の速度を管理するための利上げを含むいくつかの措置を実施した。これらの措置は中国の経済活動を減少させる可能性があり、私たちの業務や経営業績に悪影響を及ぼす可能性がある。2021年7月、中国政府は中国に本部を置く会社の中国海外融資に新たな指導を提供し、可変利益実体(VIE)と呼ばれる手配を含む。2021年12月、中国証監会は意見募集稿を発表し、VIEを含む中国企業が外国為替取引所への上場を申請してから3営業日以内に中国証監会に届出することを要求した。2023年2月17日、中国証監会は“国内企業の海外証券発行上場管理試行方法”及びいくつかのセット規則を公布し、総称して新届出規則と呼ばれている。新しい届出規則に基づいて、そして中国証監会の記者の質問に答えた明確化と結合して、VIE構造を採用した中国会社は中国国外で発行と上場を行うことができるが、同時に、新しい届出規則はVIE構造の中国会社の上場に対する審査要求を強調した。これらの事態を受けて、米国証券取引委員会は、米国証券取引委員会に証券登録を求める中国会社に対して、より厳しい開示要求を実施している。私たちはVIEアーキテクチャを持っていませんが、私たちの中国での業務のため、将来的には中国、アメリカあるいは他の規則や法規が融資や他の活動に制限を加えたり、中国企業に開示を強化することを要求したりすることで、私たちの業務や運営業績に悪影響を及ぼす可能性があります。中国や国際投資の観点から見れば、中国のビジネス環境が悪化すれば、中国政府は中国と米国での私たちの運営や業務に介入する可能性があり、私たちの米国預託証明書の市場価格は悪影響を受ける可能性がある。
中国政府は法律法規に基づいて私たちの業務に関与したり、影響を与えたりする可能性があり、これは私たちの業務に重大な変化をもたらし、私たちのアメリカ預託証明書の価値に重大な悪影響を及ぼす可能性がある。
中国政府は私たちの業務行為を重大に監督し、法律と法規に基づいて、政府が適切だと思う場合に私たちの運営に介入したり、影響を与えたりして、さらなる規制、政治、社会目標を実現する可能性がある。近年、中国政府が発表した新政策は、教育やインターネット業界などのいくつかの業界に大きな影響を与えており、将来的に私たちの業界や私たちに関する法規や政策を発表する可能性を排除することはできません。これらの法規や政策は、私たちの業務、財務状況、経営業績に悪影響を及ぼす可能性がある中国政府当局の許可を求めている可能性があります。
2022年12月まで、PCAOBは、私たちの独立公認会計士事務所が財務諸表のために行った監査作業を検査することができなかったが、PCAOBは過去に監査役を検査することができず、このような検査から投資家が得たメリットを奪ってしまった。もし将来PCAOBが再び私たちの独立した公認会計士事務所の仕事を検査または徹底的に調査できなければ、投資家はPCAOB検査のメリットを奪われるだろう
我々の監査人は、本年度報告の他の部分に含まれる監査報告を発行する独立公認会計士事務所であり、米国上場企業の監査役およびPCAOBに登録された事務所として、米国の法律に制約されており、これらの法律に基づいて、PCAOBは、適用される専門基準に適合しているか否かを評価する定期検査を行う。我々の監査人は中国に位置しているため,PCAOBは従来中国当局の許可を得ずに検査を行うことができなかったため,PCAOBは将来的に我々の監査師を全面的に検査あるいは調査できないリスクがある。
過去に中国国内でPCAOB検査を行うことができなかったため、中国国外でPCAOB検査を受けた監査人よりも、我々の独立公認会計士事務所の監査プログラムや品質制御プログラムの有効性を評価することが困難になった2022年12月15日、PCAOBは2021年12月16日の裁決を撤回し、大陸部中国と香港を完全登録会計士事務所を検査または調査できない司法管轄区域リストから削除する報告書を発表したもし未来には
PCAOBは中国大陸部と香港の会計士事務所を検査または調査する権利が完全にあるわけではなく、これらの管轄区の一つに本部を置く会計士事務所を用いて、私たちがアメリカ証券取引委員会に提出した財務諸表について監査報告を発表し、私たちとADSの投資家はこのようなPCAOB検査のメリットを再び奪われ、これは私たちのADSの投資家と私たちのADSの潜在的な投資家が私たちの監査手続きと報告の財務情報と私たちの財務諸表の品質に自信を失う可能性がある。
もしPCAOBが再び中国にある監査役を全面的に検査あるいは調査できなければ、HFCAAによると、私たちのアメリカ預託証明書と株は将来アメリカでの取引が禁止される可能性があるため、ナスダック世界市場は私たちの証券を退市することを決定するかもしれない。もしこのような状況が発生した場合、私たちのアメリカ預託証明書や株式がアメリカ以外の取引所に上場できるかどうか、あるいは私たちの株式市場がアメリカ国外で発展するかどうかを決定することはできません。私たちのアメリカ預託証明書は取得されたり、取引が禁止されたり、それらが削除されたり、取引が禁止されたりする脅威は、私たちのアメリカ預託証明書の価値に実質的な悪影響を与える可能性があります。
本年度報告書に掲げる監査報告を発行する独立公認会計士事務所は、米国上場企業の監査役とPCAOBに登録された事務所として、米国の法律に基づいてPCAOBの定期検査を受け、米国の法律や専門基準に適合しているか否かを評価する。HFCAAによると、米国証券取引委員会が、我々が提出した監査報告が2年連続でPCAOB検査を受けていない公認会計士事務所から発行されたと判断した場合、米国証券取引委員会は、米国の全国的な証券取引所または場外取引市場での私たちの株式または米国預託証券の取引を禁止する。このような取引禁止により、ナスダック世界市場は私たちの証券を退市することを決定するかもしれない。
2021年12月16日、PCAOBは、中国大陸部および香港に本部を置く完全登録会計士事務所を検査または調査できない米国証券取引委員会に報告書を発行し、我々の監査役を含む。2021年12月31日までの会計年度Form 20−F年度報告書を提出した後,2022年5月,米国証券取引委員会は我々をHFCAA下の委員会が指定した発行元とした。2022年12月15日、PCAOBは2021年12月16日の裁決を撤回し、完全に登録されていない会計士事務所を検査または調査できない司法管轄区域リストから削除する報告書を発表した。したがって,PCAOBが任意の新たな裁決を発表するまで,HFCAA下の委員会で確認された発行者としては決定されないことが予想される。
PCAOBが今後、中国大陸部と香港の会計士事務所を全面的に検査·調査する完全な権限を持たなくなったと判断した場合、上記のいずれかの司法管轄区に本部を置く会計士事務所を使用して、米国証券取引委員会に提出された財務諸表に対して監査報告を発行し続け、委員会が指定した発行者として再決定する。私たちが将来証監会が指定した発行者に指定されない保証はありません。もし私たちが2年連続で証監会が指定した発行者に指定されたら、私たちはHFCAA下の取引禁止令の制約を受けますので、ナスダック世界市場は私たちの証券を退市することを決定するかもしれません
このような状況が発生した場合、私たちのアメリカ預託証明書や株式をアメリカ以外の取引所に上場できるかどうか、あるいは私たちの株の市場がアメリカ以外で発展するかどうかは定かではありません。
米国での取引を禁止することは、投資家が私たちのアメリカ預託証明書を売却または購入する能力を大幅に弱化させ、退市に関連するリスクと不確定性は私たちのアメリカ預託証明書の価格に負の影響を与えるだろう。さらに、そのような禁止は、私たちが受け入れられる条項で資金を調達する能力に深刻な影響を与え、これは私たちの業務、財務状況、および見通しに実質的な悪影響を及ぼすだろう。
中国の新しい“データ安全法”、“ネットワークセキュリティ審査方法”、“個人情報保護法”、多層保護計画に関する法規やガイドライン、その他の将来の法律法規を遵守することは巨額の支出を生む可能性があり、私たちの業務に重大な影響を与える可能性がある。
中国はすでに規則を実施または実施しており、データ保護に関する追加的な提案を考慮している。中華人民共和国の新しい“データ安全法”は2021年9月に施行された。データセキュリティ法は、データを保護するためには、データ処理活動は“データ分類と階層保護システム”に基づいて行わなければならず、中国国内の実体が許可されていない中国政府当局が事前に承認した場合、中国に格納されているデータを外国の法執行機関または司法機関に移転することを禁止すると規定されている。
また、中国の“ネットワークセキュリティ法”は、そのネットワークとそのネットワーク上に格納されたデータのセキュリティを確保するために、いくつかの組織、技術、行政措置、および他の必要な措置をとることを要求している。具体的には、“ネットワークセキュリティ法”では、中華人民共和国は多段保護案、すなわちMLPを採用することが規定されている
ネットワーク事業者にセキュリティ保護義務を履行し、ネットワークが干渉、中断、または不正アクセスされないようにし、ネットワークデータの漏洩、盗難、または改ざんを防止することを要求する
2022年、中国網信弁或いはCACはいくつかの中国インターネット会社が米国証券取引所で初めて公募株(IPO)を提訴した。その理由は、国家安全リスクと不当な中国データ主体の個人情報の収集と使用の疑いがあるからである。2020年4月、中国政府は“ネットワークセキュリティ審査方法”または“2020年ネットワークセキュリティ審査方法”を公布し、2020年6月1日から施行した。2021年7月、中国民航総局などの関係部門は2020年の“ネットワーク安全審査方法”改正案草案を発表し、公衆の意見を求めた。2021年12月28日、中国政府は改訂された“ネットワークセキュリティ審査方法”、すなわち“2022年ネットワークセキュリティ審査方法”を公布し、2022年2月15日から施行され、“2020年ネットワークセキュリティ審査方法”に代わる
“2022年ネットワーク安全審査方法”によると、(I)ネットワーク製品とサービスを購入するキー情報インフラ事業者とデータ処理活動を行うインターネットプラットフォーム事業者は、このような活動が国家安全に影響を与える可能性があれば、“2022年ネットワーク安全審査方法”に従ってネットワーク安全審査を行うべきである;(Ii)100万ユーザー以上の個人情報を持ち、外国証券取引所に上場するインターネットプラットフォーム経営者を求め、ネットワーク安全審査弁公室に届出してネットワーク安全審査を行うべきである。“2022年ネットワークセキュリティ審査方法”は、関連要求がすでに中国海外証券取引所で初公募株を完成した会社の後続発行に適用されるかどうかはまだ不明である。当年報の日付まで、吾らはいかなる中国政府機関からも吾らにCIIOやインターネットプラットフォームの運営業者になる資格があることを通知していないが、吾らも百万人を超えるユーザの個人情報を持つ資料処理業者ではない。また、我々はCACや他の中国政府当局が開始したいかなるネットワークセキュリティ関連調査にも参加しておらず、中国政府当局からいかなるネットワークセキュリティ関連警告や制裁も受けておらず、関連当局からネットワークセキュリティ審査の提出を要求されたいかなる通知も受けていない。したがって、中国の現行法律法規に対する私たちの理解に基づいて、私たちは米国証券取引所に上場し続けたり、その上で私たちの証券を発行したりすることで、このようなネットワークセキュリティ審査を受けることは不可能だと思います。 しかしながら、CACは、国家セキュリティに影響を与える可能性があるまたは影響する可能性があると考えられるデータ処理活動に対してネットワークセキュリティ審査を開始する権利がある。したがって,我々がCACの当然のネットワークセキュリティ審査を受ける可能性を排除することはできず,米国で上場する可能性が増加するかどうかは定かではない.私たちがこのようなネットワークセキュリティ審査を受けた場合、私たちは業務の一時停止を命じられたり、審査が完了する前に新製品候補製品や業務パートナーの開発などを中断することができます。もし私たちがネットワーク安全審査を通過しなければ、罰金、休業、ウェブサイト閉鎖、関連営業許可証と許可証の取り消しなどの処罰に直面する可能性があり、いずれも私たちの業務と経営業績に実質的な悪影響を及ぼす可能性があります。
2021年11月14日、中国民航総局は“ネットワークデータ安全管理条例草案”を発表し、意見募集稿の締め切りは2021年12月13日である。管理条例草案によると、外国の上場データ処理業者は年間データ安全評価を行い、評価報告を市のネットワーク空間管理部門に提出しなければならない。
2022年7月7日、中国民航総局は“対外データ伝送安全評価方法”を公布し、2022年9月1日から施行した。“セキュリティ評価方法”によると、データ処理者は、任意のデータを中国国外に転送する前に、(I)重要なデータ、(Ii)個人情報がCIIOおよび100万人を超える個人情報を処理するデータ処理者によって中国国外に転送されること、(Iii)前年1月1日以来、中国国外で10万人の個人情報または1万人の敏感な個人情報を提供している中国国外のデータ処理者、または(Iv)反腐敗委員会が要求する他の状況を主管部門に申請しなければならない。
2024年3月22日、CACは“国境を越えたデータ移転の促進と規範化に関する規定”を公布し、安全評価を申請する条件範囲を縮小した。“国境を越えたデータ移転の促進と規範化の規定”によると,任意のデータ処理者が個人情報を輸出し,個人情報を海外に移転する前にセキュリティ評価を申請すべきである,(1)個人情報と重要データはキー情報インフラ事業者以外の任意のデータ処理者が海外に提供する,(2)重要データはキー情報インフラ事業者以外の任意のデータ処理者が提供するか,あるいはその年1月1日から海外で合計100万人以上の個人情報(敏感個人情報を含まない)や合計1万人以上の敏感個人情報を提供する,のいずれかに該当する。個人情報が100,000人を超えると,合計1,000,000人未満となる
その年の1月1日から、キー情報インフラ事業者以外のいかなるデータ処理者が海外で個人(敏感な個人情報を含まない)或いは個人敏感情報の総量が1万人以下であることを提供する場合、海外の受信者と個人情報移転標準契約を締結し、或いは法に基づいて個人情報保護認証を通過しなければならない。それにもかかわらず、データ処理者がデータを海外に転送する場合、以下の条件のうちの1つに該当するものは、国境を越えた移動安全評価の申請を免除し、海外に個人情報を提供する標準契約を締結するか、または個人情報によってセキュリティ証明を保護することができる:(一)国境を越えたショッピング、国境を越えた配送、国境を越えた送金、国境を越えた支払い、国境を越えた支払い、航空券およびホテルの予約、ビザ処理、および審査サービスのような当事者のための契約を締結または履行するための個人情報を提供する必要がある。(2)法に基づいて制定された労働規則と集団契約に従って,海外で従業員の個人情報を提供して国境を越えた人的資源管理を行う必要がある,(3)緊急時に海外に個人情報を提供する必要があり,自然人の生命,健康,財産の安全を保護する必要がある,(4)キー情報インフラ事業者以外のデータ処理者は,その年1月1日までに累計10万人以下の個人情報(敏感な個人情報を含まない)を海外に提供する。本年度報告日まで、2024年1月1日以降、1,000,000人を超える個人情報や10,000人を超える敏感な個人情報は、中国国外では処理されていません。また、本年度報告日まで、私たちはまだ中国政府機関から通知を受けていません。私たちはCIIOの資格を満たしています情報セキュリティ技術·重要データ識別ガイド意見募集稿だけで,まだ正式に採択されていない.
また、全人代は個人情報保護法を発表し、2021年11月1日から施行された。個人資料保護法は個人資料を処理する資料の私隠と保護規定に一連の適用を提供し、資料保護コンプライアンス責任を中国国内の組織と個人が個人資料を処理すること、及び中国国外で中国国内の人々の個人資料を処理することを含むまで拡大した(例えばこのような処理の目的は中国国内の人々に製品とサービスを提供し、或いはその行為を分析及び評価することである)。個人情報保護法はまた、キー情報インフラ事業者と個人情報処理実体が処理する個人情報が中国サイバー空間規制機関が設定した数のハードルに達した場合には、中国で生成あるいは収集した個人情報を保存し、中国サイバー空間規制機関による当該などの個人情報の輸出に対する安全評価を行わなければならないと規定している。最後に、個人情報保護法は、深刻な違反行為に対して5000万元または前年の年収5%に達する巨額の罰金を科し、主管部門に関連活動の一時停止や関連営業許可証または営業許可証の取り消しを命じられる可能性があると規定している。私たちは保存しないし、中国患者の個人身分健康情報も保存するつもりはありません。しかし、私たちは臨床試験のための未識別の健康データを現地法規に従って収集し、維持している。
中国国家情報安全標準化技術委員会は2022年6月24日に“ネットワークセキュリティ標準実践ガイドライン--個人情報越境処理セキュリティ認証規範”を発表し、2022年12月16日にこのようなガイドラインの2.0版、あるいは総称してセキュリティ認証規範と呼ばれることを発表した。セキュリティ認証規範は,個人情報の国境を越えた転送のための個人情報のセキュリティ認証に関する指導である.しかし,安全認証規範は推奨された指導原則のみであり,強制的ではない.
2023年2月22日、CACは“個人情報越境移転標準契約方法”、略称“標準契約方法”を発表し、“条例”が規定する個人情報越境移転標準契約条項を正式に発表した個人情報保護法それは.“標準契約方法”は2023年6月1日に発効し、6ヶ月の猶予期間を提供した。個人情報越境移転標準契約の適用範囲、締結条件、詳細な届出要求を規定しており、これらの契約は個人情報保護コンプライアンス機構の一部となっている。“フォーマット契約方法”に違反した場合は,“個人情報保護法”などの法律法規に従って処罰する。個人情報保護法では,改正,警告などの処罰措置が規定されており,違反行為の深刻さに応じて適用される。2024年3月22日、CACは“個人情報出力標準契約届出指針(第2版)”を発表し、同日発表された“国境を越えたデータ移転の促進と規範化に関する規定”と一致した。“個人情報出力標準契約届出案内(第二版)”は、個人情報越境移転標準契約の適用範囲、締結条件、詳細な届出要求をさらに明確にした。2023年12月、民航局と革新科学技術署が共同で制定した“粤港澳大湾区(大陸部、香港)個人情報の国境を越えた流動契約実施指針”
粤港澳大湾区(以下“大湾区”と呼ぶ)の個人情報処理者と受信者は、“実施指針”の要求に基づいて、標準契約を締結する方式で、大湾区内で大陸部と香港間の個人情報の国境を越えた流動を行うことができるが、関係当局或いは地区の通知或いは公開を経て重要なデータとして公表された個人情報は除外する。
これらの法律、規則、条例の解釈、適用、執行は時々変化し、その範囲は新しい立法、既存の立法の修正または実行の変化によって変化していく可能性がある。このような法律、規則、法規を遵守することは、私たちの運営コストを著しく増加させ、私たちが現在運営しているか、あるいは将来運営可能な司法管轄区で運営することを阻止することを要求し、運営に大きな変化を要求する可能性がある。プライバシー、データ保護、情報セキュリティに関する適用法律、規則、法規、その他の義務を遵守しようと努力していますが、私たちの運営は私たちに課せられたすべての要求を満たすことができないかもしれません。私たちの側のいかなる不遵守、または個人情報や他のデータの不正アクセス、使用または発表を招くいかなる安全妥協、または失敗や妥協が発生したと考えたり主張するいかなる行為も、私たちの名声を損なう可能性があり、新しいパートナー、サプライヤー、または他の当事者が私たちと契約を締結することを阻止するか、または政府当局の調査、罰金、一時停止または他の処罰、ならびに個人クレームまたは訴訟を引き起こす可能性があり、いずれも私たちの業務、財務状況、および運営結果に大きな悪影響を及ぼす可能性がある。私たちの業務が法的挑戦を受けなくても、プライバシー問題に対する見方は、有効であるか否かにかかわらず、私たちの名声を損なう可能性があり、私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性がある。また、このような法律、規則及び法規による法的不確実性、及び最近の中国政府の行動は、米国市場での公開又は私募株式又は債務融資を含む、資金調達又は有利な条件で融資を行う能力に重大な悪影響を及ぼす可能性がある。
私たちの中国子会社は中国で業務を展開するために必要なすべての許可証と承認を得ており、これまでどのような許可証や承認の申請も拒否されていない。もし私たちが中国証監会、CACまたは他の中国監督管理機関が私たちの証券の任意の発行または継続してアメリカ証券取引所に上場したり、私たちの業務のために必要な許可または承認を得ることができなかったり、そのような許可または承認の放棄をタイムリーまたは根本的に得ることができなかったり、このような許可または承認を必要としない結論を誤って出したり、適用された法律、法規や解釈が変化し、将来このような許可または承認を得ることを強要した場合、罰金と処罰を受け、中国での業務活動を一時停止または制限し、営業許可を取り消し、サイトを閉鎖することができる。中国への任意の発売によって得られた金額の貢献を遅延または制限したり、私たちの業務、財務状況、経営業績、名声および将来性に重大な悪影響を及ぼす可能性のある他の制裁を制限したりする
私たちの現在の業務運営を管理する中国の法律法規は時々曖昧であるため、これらのリスクは私たちの子会社の運営に大きな負の変化をもたらす可能性があり、私たちのアメリカ預託証券価値が大幅に下落したり、私たちが投資家に私たちの証券を提供したり継続したりする能力が完全に阻害され、投資家の証券価値が一文の価値もなくなる可能性がある。
私たちの中国での業務は中国の法律、規則、法規によって管轄されている。私たちの中国子会社は中国での外国投資に適用される法律、規則、法規の制約を受けている。中華人民共和国の法律制度は成文法規に基づく民法制度である.一般法制度と異なり,従来の裁判所判決は参考になるが,その先例価値は限られている。
中国政府はすでに一連の監督管理行動と声明を開始し、中国での商業運営を規範化し、証券市場の不法活動に打撃を与え、可変利益実体構造或いはVIE構造を使用した中国海外上場企業に対する監督管理を強化し、新しい措置を講じてネットワーク安全審査の範囲を拡大し、反独占法執行力を拡大する。これらの声明および規制行動は比較的新しいので、立法または行政法規制定機関はどのくらいの時間内に対応するであろうか、既存または新しい法律または法規または詳細な実施および解釈が修正または公布されるであろう(あれば)、これらの修正または新しい法律および法規は、私たちの日常業務運営、外国投資の受け入れ、米国または他の外国為替上場の能力に潜在的な影響を与えることは非常に不確定である。私たちはVIEアーキテクチャを持っていませんが、私たちの中国での業務のため、将来的にはいかなる中国、アメリカまたは他の規則や法規が融資や他の活動に制限を加えたり、中国企業に開示を強化することを要求したりすることで、私たちの業務と運営結果および私たちのアメリカ預託証明書の市場価格に悪影響を及ぼす可能性があります。
最近公布された法律、規則、法規は中国の経済活動のすべての方面をカバーするのに十分ではないかもしれないし、あるいは中国の監督管理機関の重大な解釈を受ける可能性がある。特に,これらの法律,規制,条例は比較的新しく,公表された決定数は限られており,拘束力がないからである
法律、規則と条例は往々にしてこれらの決定をどのように実行するかについて規制機関にある程度の裁量権を与えるため、これらの法律、規則と条例の解釈と実行は不確実性に関連し、一致せず予測できない可能性がある。また、中国の法制度部分は政府政策と内部規則に基づいており、その中のいくつかは適時に公表されていないか、あるいは全く公表されておらず、追跡力を持っている可能性がある。したがって、私たちは違反が発生してから、私たちがこのような政策と規則に違反していることを認識しなければならないかもしれない。
中国または当社で業務を経営する任意の司法管区の任意の行政及び裁判所訴訟は長引く可能性があり、追加の重大なコスト及び資源及び管理層の注意が移される可能性がある。中国の行政と裁判所当局は事実と状況に基づいて法定と契約条項を解釈·実施する上で決定的な適宜決定権を行使する権利があるため、行政と裁判所訴訟の結果および私たちが享受する法的保護レベルを評価することはより難しいかもしれない。これらの要因は、私たちが締結した契約を実行する能力を阻害し、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性があります。
過去数年間、中国監督管理機関は中国政府により多くの監督管理を提供するための監督行動を発表し、中国で大量のユーザーを持つ営利性教育部門と技術プラットフォームを含む中国経済部門の監督を強化した。生物科学技術業界は中国で厳格な監督管理を受けており、これまでこのような行動や規制が私たちのような会社に適用されている形跡はないが、中国政府は将来、中国のビジネス環境と金融市場に重大な影響を与える監督管理行動をとるかもしれない。それらは私たち、私たちの業務を経営する能力、私たちの流動資金、そして私たちが資本を得るルートに関連しているからである。
中国の法規によると、将来私たちの証券のアメリカ市場でのどの発行も中国証監会の許可を得て中国証監会に届出する必要があるかもしれない
中国政府はすでに、中国国外で行われた発行および/または外国投資中国の発行者により多くの監督と制御を加える行動をとる意向を示している。例えば、中央弁公庁、国務院弁公庁は共同で“法に基づいて不法証券活動に厳しく打撃することに関する意見”を通達し、2021年7月6日に社会に公表した。意見は、不法証券活動の管理を強化し、大陸部会社の海外上場に対する監督管理を強化することを強調した。関連する監督管理制度の建設を推進し、海外上場企業のリスクと事件、ネットワークセキュリティとデータプライバシー保護要求などの類似事項に対応するなど、有効な措置が取られる。これから公布される意見と任意の関連する実施細則は、私たちを未来にコンプライアンス要求の制約を受けるかもしれない
2023年2月17日、中国証監会は“国内企業の海外証券発行上場管理試行方法”及びいくつかのセット規則を公布し、総称して新届出規則と呼ばれている。新しい届出規則によると、国内会社に次のような状況の一つがある場合は、海外で証券を上場したり発行したりしてはならない:(一)法律、法規と関連規定により上場融資を禁止する;(二)中華人民共和国国務院の関係主管部門の審査を経て、海外上場は国家の安全を脅かす或いは危害を与える;(三)当該国内会社或いはその持株株主、実際の支配者はこの三年間、汚職、賄賂、横領、財産流用などの刑事犯罪行為、又は社会主義市場経済秩序を破壊することがある。(四)当該国内会社は、犯罪又は重大な違法違反の疑いで司法機関の調査を受けており、まだ明確な結論が得られていない、又は(五)当該国内会社の持株株主又は持株株主又は実際に支配者が制御する株主が保有する持分に重大な所有権紛争がある。国内会社が海外で上場して発行する前に上記の状況の一つがある場合は、海外上場発行を一時停止または終了し、適時に中国証監会と国務院の関係主管部門に報告しなければならない
また、新しい届出規則によると、海外上場の発行者は、以下の届出または報告義務を負う:(I)発行者は証券を発行する(株式インセンティブの実施、株式配当金の分配、株式分割などの目的で発行された証券は含まれていない)。域外の同一証券取引所,又は当該発行者が海外で上場した後に転換可能な債券,交換可能な債券,優先株を発行する場合は,発行完了日から3(3)営業日以内に中国証監会に届出しなければならない,(2)発行者が発行して上場した後,海外証券取引所での第2上場又は第1上場を求める
海外で発行して上場する場合は、海外発行発行申請書類を提出した日から3(3)営業日以内に中国証監会に届出しなければならない;(3)発行者が海外で発行した後、許可範囲内で分期発行した場合は、初発行完了後3営業日以内に中国証監会に届出し、発行予定証券の総額を説明しなければならない。その他の発行事項が完了した後、中国証監会に発行合併報告を提出しなければならない;(四)海外上場の発行者は、その制御権の変更、海外監督機関或いは関係主管部門の調査、上場身分或いは上場業界の変更、自発的或いは強制的な上場停止などの重大事項が発生し、公告しなければならない日から3(3)の営業日以内に中国証監会に詳細を報告しなければならない。(5)海外上場発行者の主要な業務、経営活動に重大な変化が発生し、届出要求範囲に属さない場合は、変化が発生した日から3営業日以内に、中国証監会に中国国内の法律事務所が発行した特別テーマ報告と法律意見書を提出し、関連状況を説明しなければならない
新届出規則は比較的に新しいため、本年度報告日まで、新届出規則の解釈と実施には重大な不確定性が存在する。中国証監会の公式ウェブサイトが発表した新しい届出規則の発表に関する質疑応答によると、中国証監会の関係者は、新届出規則の公布前にすでに中国国外で公開発行と上場を完了した中国国内の会社は、現有の発行者或いは現有の発行者と見なすべきである。現有の発行者は直ちに中国証監会に届出する必要はないが、未来に直接或いは間接方式を通じて中国海外市場で発行或いは上場証券(新届出規則について言えば、それは株式株式、預託証明書、株式株式に変換可能な会社債券、及び中国国内会社が直接或いは間接的に中国国外で発行と上場する他の持分証券と定義される)が将来的に直接或いは間接方式を通じて中国証監会に届出することが要求される
既存の発行者として、我々の“市場での”発売計画に基づいて将来的に私たちの米国預託証明書を販売することを含む、新しい届出規則の未来証券発行に対する要求を遵守します。私たちは投資家に保証することはできません。私たちはこのような申請をタイムリーに完了したり、新しい申請規則に従って私たちに加えられる他の要求を遵守することができます。新届出規則下の届出要求或いは任意の他の要求を遵守できなかったことは、関連する中国国内会社に対する修正令、警告、罰金人民元1,000,000元から人民元10,000,000元までの不等、及び持株株主と他の担当者への罰金、吾などの経営制限、証券取引所からの退市、外国投資家への証券発行の一時停止、その他は吾などの運営及び吾などの投資家の利益に重大な悪影響を与える可能性があり、吾などの普通株及び米国預託証明価格の大幅な切り下げを招く行動を招く可能性がある。
さらに、新しい届出規則によって適用される要求は、私たちの未来の証券発行を延期または阻止し、受け入れ可能な条項で融資を受ける能力を損なうか、または全くできないかもしれない。
また、2023年2月24日、中国証監会、財政部などの主管部門は、2009年10月20日に発表された“海外証券発行上場守秘とファイル管理の強化に関する規定”に代わって、2023年3月31日に施行された“国内企業の海外証券発行上場守秘とファイル管理の強化に関する規定”を発表した。“秘密とファイル規定”によると、国内会社は海外(直接或いは間接)で証券発行と上場を行い、中華人民共和国の関連法律法規を厳格に遵守し、守秘とファイル管理の法律意識を強化し、健全な守秘とファイル管理制度を構築すべきであり、これらに限定されない:(一)国内会社或いはその海外上場実体は、証券会社、証券サービス機関、海外監督機関及びその他の部門と個人が国家秘密或いは政府の仕事の秘密に関連するある書類と資料を他の当事者に提供或いは公開することを含む。政府主管部門の許可を得て、主管機密行政部門に記録しなければならない。(2)規制情報を共有する中国国内の会社及び証券会社又は証券サービス提供者は、中国国外証券監督管理機関又は関係主管部門と協力し、又は検査及び調査のために任意の文書及び材料を提供する前に、事前に中国証監会又は政府主管部門の承認を得なければならない。“秘密とアーカイブ規定”は最近公布されたため、その解釈と実行にはまだ大きな不確実性が存在する。この規定の実施は、米国証券法および上場要求を遵守する能力を阻害したり、証券弁護士、潜在的引受業者、または他の投資家の定例的な職務調査を阻害したり、要求された情報の提供を阻止または延期したり、重大な合意または開示を提出したりすることを阻害する可能性がある。このようなリスクの結果は著しく制限されるかもしれません
私たちのアメリカ資本市場への参入を完全に阻害し、私たちの証券、特に私たちのアメリカ預託証明書の価値が大幅に低下したり、一文の価値もなくなったりする可能性があります。
もし私たちが中国証監会または他の中国監督管理機関の任意の必要な許可または承認を迅速に得ることができなかった場合、または中国証監会または他の中国監督管理機関への任意の必要な許可または承認を完了できなかった場合、またはそのような許可または承認を直ちにまたは根本的に放棄することができなかった場合、私たちは罰金と処罰を受け、中国での業務活動を一時停止または制限し、私たちの営業許可証を取り消し、サイトを閉鎖し、遅延または制限することができる または私たちの業務、財務状況、経営業績、名声、見通しに重大な悪影響を及ぼす可能性のある他の制裁。また、中国証監会、CAC、あるいは他の中国監督管理機関も行動する可能性があり、いかなる発行も停止することを要求したり、提案したりする可能性がある。したがって、投資家が予想され、未来に時々提供される可能性のある証券決済および受け渡しの前に市場取引または他の活動に従事すれば、投資家がそうすることは、決済および受け渡しが起こらない可能性があるリスクを冒すことになる。
また、中国の現在の規制環境を踏まえると、私たちは依然として中国のルールや法規の解釈と実行の不確実性を受けており、これらのルールや法規は事前通知が少ない場合に迅速に変化する可能性があり、中国当局の将来のいかなる行動もある。いかなる米国取引所での上場(遡及を含む)を維持するために、中国政府の許可を得る必要があるかどうかは不明であり、このような許可を求めても、拒否されたり撤回されたりするかどうかは定かではない。中国証監会や他の中国監督管理機関は将来、中国国外で行われている発行や外国投資中国発行者により多くの監督と制御を加えることで、投資家に証券を提供する能力を著しく制限したり、完全に阻害したりし、私たちの証券価値が大幅に縮小したり、一文の価値もなくなったりする可能性がある。
中国のいくつかの規制は私たちが買収を通じて成長を達成することをもっと難しくするかもしれない。もし私たちが中国の反独占法律と法規を遵守できなければ、政府の調査や法執行行動、訴訟、あるいは私たちに対するクレームを招き、私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性がある。
2006年8月8日、商務部、国資委、国家税務総局、国家工商総局、中国証監会と国家外貨管理局などの6つの中国監督管理機関は共同で“外国投資家の国内企業M&A条例”を採択し、2006年9月8日から施行し、2009年6月22日に改正を行った。この等の条項は、中国国内会社又は個人がコントロールし、中国国外で中国国内会社又は資産を買収して海外で上場するために設立されたオフショア特別目的担体が中国国外証券取引所に上場及び取引する前に、中国証監会の許可を得なければならないことを規定することを目的としている。2006年9月21日、中国証監会はその公式ウェブサイトで特殊な目的機関が海外で上場する審査方法を公表した。しかし,M&Aルールをオフショア特殊目的担体に適用する範囲と適用性には,大きな不確実性が存在する.
これらの規定はまた追加の手続きと要求を確立し、非中国投資家の中国でのM&A活動をより時間と複雑にすることが予想される。例えば、M&A規則の要求は、非中国投資家が中国国内企業の制御権を制御して取引を変更し、(1)重要な業界に関連し、(2)国家経済安全に影響があるか、影響を与える可能性のある要素に関連する場合、あるいは(3)このような取引が有名な商標や中国の老舗を持つ中国国内企業の制御権を変化させる場合は、事前に商務部に通知しなければならない。中国企業又は住民が中国国外で設立又はコントロールしている会社が中国国内の関連会社を買収する場合は、商務部の許可を得なければならない。1つの市場主体が別の市場主体を制御し、あるいは別の市場主体に決定的な影響を与えるM&A或いは契約手配を許可する場合も、2008年8月に国務院が発表し、2024年1月に改訂された“経営者集中事前通知敷居規定”の規定の敷居をトリガした場合には、事前に国務院反独占機関に通知しなければならない。また、商務部が2011年9月から施行した“安全審査規則”では、非中国投資家が行う“国防と安全”の懸念を引き起こすM&A、および非中国投資家がM&Aを通じて国内企業の“国家安全”に対する懸念の実際のコントロール権を獲得する可能性のあるM&Aは、商務部の厳格な審査を受け、委託代理や契約制御による取引の手配を含む安全審査を迂回しようとする活動を禁止すべきである。私たちは私たちの業界で運営している他の会社を買収することで私たちの業務を拡大することができる。新しい規則の要求を守って、このような取引を完成するのは時間がかかるかもしれません。そして必要な承認は何でもあります
商務部の承認を含むプロセスは、私たちがこのような取引を完了する能力を延期または抑制することができ、これは、業務を拡大したり、市場シェアを維持する能力に影響を与える可能性があります。また、中国政府当局は法定条文の解釈及び実施にある程度の適宜決定権を持っているため、吾等は投資家に保証することができず、中国の関連政府当局が逆の立場をとる場合、吾等は中国の法律、法規又は政策に基づいて当該等の承認を得る必要がなく、又は当該等の審査を通過する必要がなく、又は必要なときに当該等の承認を取得するか、又は当該等の審査を通過することができるか否かを予測することもできない。取得または遅延取得に必要な政府の承認や審査ができなかった場合、吾らは違法行為の停止、違法収入の没収、以上の年間売上高の1%から10%または人民元500,000元以下の罰金を含む中国の関係監督当局からの制裁を受ける(具体的な罰金金額は違法行為の性質、行為の継続の程度と時間などによって確定されるべきである)。
M&A規則の適用状況はまだ不明だが、吾らの中国の現行の法律や法規に対する理解によると、Connect SZは二零一二年五月に中国国内会社に登録され、二零一二年八月二十三日にM&A規則によって中外合弁会社になったため、M&A規則は吾などには適用されないため、吾らは将来アメリカ市場で証券を発売する際に中国証監会の承認を必要としないと信じている。しかし、中国証監会はまだ米国市場の後続発行証券がM&A規則に制約されているかどうかについて明確な規則や解釈を発表していない。関連する中国政府機関が、中国証監会を含めて、私たちと同じ結論を出すことは保証されない。もし中国証監会や他の中国監督管理機関が私たちの後続発行が中国証監会の承認を得る必要があると認定した場合、あるいは中国証監会や他の中国政府機関がいかなる解釈や実施規則を公布した場合、私たちの後続発行が中国証監会や他の政府の承認を得なければならないことを要求する場合、私たちは直ちにこのような承認を得ることができないか、あるいはこのような承認を得ることができない可能性があり、もし私たちが何の許可も受けずに私たちの証券発行を継続すれば、私たちは中国証監会や他の中国監督機関の不利な行動や制裁に直面する可能性がある。いずれにしても、当該等の監督管理機関は、吾等の中国における業務に罰金及び懲罰、吾等の中国における経営特権、遅延又は制限を加え、将来の発売で得られた金を中国に送金するか、又は吾等の業務、財務状況、経営業績、名声及び見通しに重大な悪影響を及ぼす可能性のある他の行動をとる可能性がある。
政府の通貨両替の制御は、私たちが資金を中国に送金し、私たちの資本や未来の収入を有効に利用する能力を制限し、私たちのアメリカ預託証明書への任意の投資の価値に影響を与える可能性がある。
持ち株会社として、私たちは子会社の現金配当金、分配、その他の移転に依存して配当金を支払う。2023年12月31日まで、私たちの子会社にはこのような配当金や他の分配はありません。しかも、私たちの子会社は私たちやアメリカの投資家にどんな配当金や分配も支給したことがない。
私たちの収入の大部分は人民元建てであることが予想され、外貨不足は配当金や他の支払い能力を制限したり、外貨建ての債務を返済したりする可能性があります(あれば)。中国の現行外貨法規によると、ある手続きの要求に符合すれば、経常項目の支払いは、利益分配、利息支払いと貿易関連取引の支出を含み、事前に中国国家外国為替管理局の許可を得る必要はなく、外貨で支払うことができる。人民元を外貨に両替して中国に送金して資本支出を支払い、例えば外貨建てのローンを返済する場合、関係政府当局の許可を得なければならない。中国政府は経常口座取引の外貨使用に適宜制限を加えることができ、将来このような状況が発生すれば、私たちの株主に外貨配当金を支払うことができない可能性がある。
中国政府は人民元を非中国通貨に両替することと、場合によっては通貨を中国に送金することを規制している。私たちは中国での業務に資金を提供し、私たちの将来のいくつかの収入は人民元建てになると予想しています。人民元を非中国通貨に両替して中国に送金して資本支出(例えば非中国通貨建ての融資を返済する)を支払うには、中国の関係政府当局の承認を得たり、登録したりする必要がある。そのため、私たちは外管局の許可を得て、私たちの中国子会社が運営している現金を使って人民元以外の通貨でそれぞれ中国国外実体の債務を返済したり、人民元以外の通貨で中国国外の他の資本支出を支払うことができます。
2016年の人民元の疲弊による中国資本の流出を受けて、中国政府はより厳格な外貨政策を実施し、中国海外直接投資を含む重大な対外資本流動の審査を強化した。外管局は資本口座に属する国境を越えた取引を監督するため、より多くの制限措置と厳格な審査手続きを発表した。このような保険証書の監督管理を受けたいかなる株主が中国国外で適用される直接投資申告或いは審査要求に適時或いは完全に適合できなかった場合、中国の関係当局の処罰を受ける可能性がある。中華人民共和国政府は適宜進入をさらに制限することができる
未来には非中国通貨で経常口座取引が行われる。もし外国為替規制システムが私たちの非中国通貨の需要を満たすのに十分な非中国通貨を得ることを阻止すれば、私たちのアメリカ預金証明書所持者を含めて私たちの株主に非中国通貨の配当金を支払うことができないかもしれません。
中国の海外持ち株会社の中国実体への融資や直接投資の監督管理は、私たちの中国子会社への融資や追加出資を制限または阻止する可能性がある。
中国の法律や法規によると、私たちは融資や出資を通じて私たちの中国子会社に資金を提供することができ、これらの子会社は中国の法律に基づいて“外商投資企業”とみなされている。しかし、私たちが中国子会社に貸してその活動を援助するローンは法定限度額を超えてはいけません。中国外管局の現地対応機関に登録しなければなりません。私たちの中国子会社への出資は中国政府主管部門に必要な登録をしなければなりません
外管局は“改革のさらなる深化による国境を越えた貿易投資の円滑化促進に関する通知”、すなわち“改革の一層の深化による国境を越えた貿易投資の円滑化促進に関する通知”を発表し、2023年12月4日から施行される。2023年第28号通知によると、非金融企業外債項の資本金、外貨収入及び決済で取得した人民元資金は、実際の自己使用の原則に従って使用すべきであり、法律で禁止されている支出に使用してはならない。別の規定以外に、証券投資とその他の投資信託投資に使用してはならないが、リスクレベルが二級を超えない投資信託商品と構造的預金は除外し、非関連企業への融資に使用してはならないが、業務範囲と特殊地区が明確に許可しているものは除外する。2023年に発行された第28号通達は、私たちが持っている任意の非中国通貨を私たちの中国付属会社に移転する能力を大幅に制限する可能性があり、これは私たちの流動資金と私たちが中国業務に資金を提供し、業務を開拓する能力に悪影響を及ぼす可能性がある。2019年10月23日、外匯局は“国境を越えた貿易投資の利便化をさらに促進することに関する通知”、すなわち2019年第28号通知を発表し、非投資性非中国資本企業が海外決済で獲得した資本金を利用して、真の投資プロジェクトで中国国内で株式投資を行うことを許可し、有効な非中国資本投資制限及びその他の適用法律に適合している。2020年4月10日、外匯局は“外国為替管理の最適化による渉外業務の発展支援に関する通知”を発表し、外国企業が海外資本金領収書を使用することを許可し、事前に銀行に逐筆取引の真実性証明材料を提供する必要がなく、このような海外資本金領収書の使用が真実であり、そしてある適用される行政法規に符合することを前提とした。しかし、2019年の第28号通知が公布されて以来、実際の解釈と実行には依然として大きな不確実性が存在している。
中国の中国への融資と中国での直接投資規定の各種要求にかんがみて 付属会社としては、吾らは投資家に保証することができず、吾らは吾等の中国付属会社に対する将来の融資や将来の出資について必要な政府登録を速やかに完了したり、必要な政府承認を取得したりすることができる。そのため、必要に応じて中国子会社にタイムリーな財務支援を提供する能力があるかどうかには、不確実性がある。もし吾らがそのような登録を完了できなかったり、そのような承認を得られなかったりすれば、吾らが非中華人民共和国通貨や資本化を使用したり、他の方法で吾などの中国業務に資金を提供する能力が負の影響を受ける可能性があり、これは吾等の流動資金や我々が業務に資金を提供し、業務を拡張する能力に重大な悪影響を与える可能性がある。
中国従業員株式インセンティブ計画の登録要求に関する法規を遵守できなかった場合、私たちの株式インセンティブ計画参加者または私たちは罰金やその他の法律または行政処罰を受ける可能性があります。
2012年2月、外匯局は2007年に公布された古い規定に代わって、“国内個人の海外上場企業株激励計画への参加に関する問題に関する通知”を発表した。このような規則によると、中国公民及び非中国公民が連続して中国に1年以上居住し、中国国外に上場している公衆会社のいかなる株式激励計画に参加している場合には、中国合格代理人(当該会社が中国国外で上場している可能性のある中国付属会社)を介して外国為替局に登録し、他の手続きを完了しなければならない。また、非中国委託機関を保留し、株式オプションの行使または売却や株式の売買及び権益に関する事項を処理しなければならない。当社及び当社の幹部及びその他の従業員は、もし中国公民或いは非中国公民であれば、中国に連続して1年以上居住し、すでにオプションを付与し、すべてこのなどの規定によって制限されている。安全登録を完了できなかった場合は、実体に最高300,000元の罰金、個人には最高50,000元の罰金を科す可能性があり、私たちの中国子会社に追加資本を注入する能力と、私たちの中国子会社が私たちに配当金を分配する能力を制限する可能性があります。私たちはまた規制面の不確実性に直面しており、これは中国の法律に基づいて取締役、幹部、従業員のための追加インセンティブ計画を実施する能力を制限する可能性がある。第6項を参照。役員、上級管理職、そして従業員の報酬
また、SATは従業員の株式オプションと制限株に関する通知をいくつか発表した。同等の通達によると、吾らが中国で働いている従業員は、購入権を行使したり、制限的な株式を付与したりする場合、中国個人所得税を支払う必要がある。我々の中国子会社は、従業員の株式購入または制限的な株式購入に関する書類を関連税務機関に提出し、株式購入権を行使する従業員のために個人所得税を源泉徴収する義務がある。もし私たちの従業員が納めていない場合、あるいは私たちが関連する法律法規に従って彼らの所得税を源泉徴収していなければ、私たちは税務機関あるいは他の中国政府機関の処罰に直面するかもしれません。第6項を参照。役員、上級管理職、そして従業員の報酬
中国住民のオフショア投資活動に関する中国の法規は、私たちの中国子会社がその登録資本を変更したり、私たちに利益を分配する能力を変更したり、他の方法で私たちまたは私たちの中国住民の実益に中国の法律下の責任と処罰を負わせることを制限する可能性がある。
2014年7月、外匯局は“域内住民のオフショア投融資と特殊目的担体往復投資外貨管理に関する問題に関する通知”、すなわち第37号通知を発表した。第37号通達は、中国住民(中国個人と中国法人実体及び外国為替管理において中国住民とみなされている非中国個人を含む)に、その直接又は間接的なオフショア投資活動について外国為替局又はその現地支店に登録することを要求する。第37号通達はまた、オフショア特別目的担体の基本情報が変化し、例えば中国個人株主、名称及び経営期限の変化、又はオフショア特別目的担体に関する重大な変化、例えば出資の増減、株式譲渡又は交換、合併又は分立の場合、外国為替局登録を修正する必要があることを要求している。第37号通達は、吾等が中国住民の株主又は実益所有者であり、吾等の将来行われるいかなる海外買収にも適用可能である。外匯局が2015年2月13日に発表し、2019年12月30日に改訂した“直接投資外貨管理政策の一層の簡略化と改善に関する通知”によると、2015年6月1日から、地方銀行は第37号通知に基づいて外国為替初期登録と変更登録を含む海外直接投資外貨登録の審査と手続きを行う。
もし私たちの株主や実益所有者が中国住民や実体であるが、現地外管局支店または合資格地元銀行で登録を完了できなかった場合、私たちの中国付属会社は私たちに任意の減資、株式譲渡または清算で得られた利益と収益の分配を禁止される可能性があり、私たちが中国付属会社に追加資本を提供する能力は制限される可能性がある。また、上記外管局登録を遵守しないことは、中国の法律に基づいて適用される外貨制限の責任を逃れることにつながる可能性がある。
私たちは私たちの証券で直接または間接的な権益を持っているすべての中国住民や実体の身分を知らされないかもしれませんし、私たちの株主や実益所有者に安全登録要求を守るように強要することもできません。私たちは投資家に、私たちのすべての中国住民または実体に属する株主または実益所有者が遵守し、将来的に外管局の規定の任意の適用登録または承認を行ったり、更新したりすることを保証することはできない。
当該等の株主又は実益所有者が外管局の規定を遵守できないか、又は吾等がわが中国付属会社の外国為替登録を改訂できなかった場合、吾等又は規則に適合しない株主又は実益所有者に罰金又は法律制裁を受けさせ、中国以外又は国境を越えた投資活動を制限し、私たちの中国付属会社が私たちに配当金を支払う能力を割り当てたり、又は私たちの所有権構造に影響を与えることを制限する可能性がある。したがって、私たちの業務運営と私たちが投資家に任意の将来の利益を分配する能力は実質的で不利な影響を受ける可能性がある。
“中国企業所得税法”によると、私たちは中国住民企業とみなされる可能性があるため、私たちの世界的な収入は中国所得税を納める必要があるかもしれない。
中国企業所得税法及びその実施規則によると、中国国外司法管轄区の法律に基づいて設立され、かつ“実際の管理機関”が中国国内にある企業は、税務目的について中国税務住民企業と見なすことができ、その全世界収入の25%税率で中国企業所得税を納めることができる。“事実上の管理機関”とは、企業の生産経営、人員、会計及び資産に対して実質的、全面的な管理及び制御を行う管理機関をいう。国家税務総局は2009年4月22日に“事実上の管理機関に基づいて中国が支配するオフショア登録企業を中国税務住民企業と決定することに関する通知”、すなわち第82号通告を発表し、最近の改正は2017年12月29日である。第82号通達は、中国が支配するオフショア登録企業の“事実上の管理機関”が中国にあるかどうかを決定する具体的な基準を規定している。第82号通達は、中国企業や個人がコントロールするオフショア企業ではなく、中国企業が制御するオフショア企業にのみ適用されるが、第82号通達に規定されている確定基準は、SATが“事実上の管理機関”テストをどのように行うかの一般的な立場を反映している可能性がある
これらの企業が中国企業によってコントロールされているかどうかにかかわらず、オフショア企業の税務住民の地位を確定するのに適している。もし私たちが中国住民企業とみなされれば、私たちは世界収入の25%の税率で中国企業所得税を納めます。この場合、私たちのキャッシュフローは、私たちの世界的な収入が企業所得税法に基づいて課税されることで大幅に減少する可能性がある。中国税務について言えば、私たちの中国以外のどの実体も中国住民企業ではないと信じています。しかし、企業の税務住民身分は中国の税務機関の決定に依存し、“事実上の管理機関”という言葉に関する解釈には依然として不確定性がある
私たちが私たちの非中国投資家に支払った配当金(もし私たちが配当金を支払ったことがあれば)と私たちの非中国投資家が私たちのアメリカ預託証明書を売却した収益は中国税を支払う必要があるかもしれません。
国務院が公布した“企業所得税法”及びその実施条例によると、投資家に支払われる配当金は非住民企業であり、中国に設立或いは営業場所がない、或いは中国国内に設立或いは営業場所がないが、配当金は当該設立或いは営業地点と有効な関係がないものであり、10%の中華人民共和国源泉徴収税が適用されるが、この等の配当金は中国国内から来ている。このような投資家がアメリカの預託証明書或いは普通株を譲渡して取得した任意の収益は中国国内からの収入とみなされ、このような収益も現行の税率10%で中国税項を納付しなければならない。もし吾等が中国住民企業とみなされた場合、吾等の普通株又は米国預託証明書が支払った配当金、及び吾等の普通株又は米国預託証明書を譲渡して現金化した任意の収益は、中国国内からの収入とみなされるため、中国税項目を納付しなければならない。また、吾等が中国住民企業とみなされていれば、中国住民ではない個人投資家に支払われた配当金及び当該等の投資家が米国預託証明書又は普通株を譲渡して得られた任意の収益は、20%の税率で中国税を納付することができる(配当については、源から配当金を徴収することができる)。どの中国の納税義務も適用された税金条約によって減少することができる。しかし、もし私たちまたは私たちが中国国外に設立した任意の付属会社が中国住民企業とみなされている場合、私たちのアメリカ預託証明書所持者が中国と他の国や地域との間で締結された所得税条約や協定のメリットを享受できるかどうかは不明である。もし私たちの非中国投資家に支払われた配当金やそのような投資家に私たちのアメリカ預託証明書を譲渡する収益は中国国内からの収入とみなされるため、中国税を支払う必要があり、私たちのアメリカ預託証明書の価値は大幅に低下する可能性がある。
私たちおよび私たちの株主は、中国住民企業の株式を間接的に譲渡したり、中国で設立された非中国会社の他の資産に起因したり、非中国会社が中国で所有している不動産の面で不確実性に直面している。
2015年2月3日、国家統計局は“非中国住民企業の間接譲渡資産企業所得税問題に関する公告”または“公告7”を発表し、2017年12月29日に改訂を行った。本公告7によると、非中国住民企業の“間接譲渡”資産は、非中国住民企業の非公開取引株式を含み、このような手配は合理的な商業目的がなく、中国企業の所得税の納付から逃れるために確立された場合、再定性することができ、中国課税資産を直接譲渡すると見なすことができる。そのため、当該等の間接譲渡からの収益は中国企業所得税を払わなければならない可能性がある。公告7によると、“中国課税資産”には、中国国内機関に帰属する資産、中国国内に位置する不動産及び中国住民企業の株式投資が含まれており、中国住民企業の直接所有者が当該等の資産を譲渡して得られた収益は中国企業所得税を納付しなければならない。取引手配に“合理的な商業目的”があるかどうかを確定する際に考慮すべき要素は、オフショア企業の株式に関する主要な価値が中国の課税資産に由来しているかどうか、オフショア企業の資産が主に中国での直接或いは間接投資から構成されているかどうか、あるいはその収入が主に中国から来ているかどうか、オフショア企業及びその直接或いは間接的に中国の課税資産を持っている子会社が真の商業性質を持っているかどうか、これはその実際の機能とリスクから証明されることができるかどうか;商業モデルと組織構造の存在期限;直接譲渡中国課税資産による取引の復元可能性;そしてこのような間接譲渡と適用される税金条約や似たような配置の税金状況。間接的にオフショア移転した中国機関の資産については、それによって生じた収益は移転された中国機関や営業地点の企業所得税申告に計上されるため、25%の税率で中国企業所得税を納めることになる。関連譲渡が中国国内に位置する不動産や中国住民企業への株式投資に関連し、当該譲渡は非住民企業の中国での設立や営業場所とは無関係であれば、税務条約や同様の手配を適用して得られる税収優遇の下で、10%の中国企業所得税を適用し、譲渡金を支払う義務がある方に源泉徴収義務がある。公告7これらの株式が公共証券取引所の取引により得られた場合は、投資者が公共証券取引所を介して株式を売却する取引には適用されない。2017年10月17日、国家税務総局は“源から非住民企業所得税の源泉徴収に関する国家税務総局の公告”または“国家税務総局第37号通知”を発表し、自
2017年12月1日、最近の改正は2018年6月15日です。非住民企業に徴収される所得税の代理徴収手続きを簡略化することを含む通知37号。
私たちは、オフショア再編、私たちのオフショア子会社の株式の売却、投資のような、中国または他の課税資産の過去および将来の取引に関する報告およびその他の影響の不確実性に直面している。もし私たちがこのような取引の譲渡者であれば、私たちは申告義務を履行し、独立した推定値を得る必要があるか、または納税する必要があるかもしれません。もし私たちが公告7およびSAT通告37に規定されているこのような取引の譲受人であれば、控除義務を負う必要があるかもしれません。もし中国住民企業でない投資家が私たちの証券を譲渡すれば、私たちの中国子会社は公告7とSAT通達37に基づいて届出に協力することを要求されるかもしれません。したがって、私たちは、公告7およびSAT通告37を遵守するために貴重な資源を費やすことを要求されるか、または課税資産を購入する関連譲渡者にこれらの出版物を遵守することを要求するか、またはこれらの出版物に基づいて私たちに課税すべきではないと判断することができ、これは私たちの財務状況および運営結果に大きな悪影響を及ぼす可能性がある。
私たちと私たちの株主たちは私たちが可能な再構成や再構成に関する不確実性に直面している
私たちは従来、子会社や知的財産権や他の資産に対して様々な再編と再編を行ってきた。我々は現在、知的財産権および他の資産の許可または譲渡に関連する可能性があるなど、さらなる再編または再構成を行う可能性があるが、任意のさらなる再編または再編はまだ実施される必要があり、十分な計画が必要であり、複雑性に関連し、任意のそのような組換えまたは再構成が予期される目標を効果的に達成することを保証することはできず、私たちの業務、運営結果、財務状況、および将来性に重大な悪影響を及ぼす可能性のある意外な税収または他の結果をもたらす可能性がある
私たちはますます激化する政治的緊張とアメリカと中国の間のいかなる潜在的な衝突の悪影響を受けるかもしれない。
米国と中国の間で日増しに激化する政治的緊張といかなる潜在的な衝突も、2つの主要経済体間の貿易、投資、技術交流、その他の経済活動のレベルを減少させる可能性があり、これは世界経済状況と世界金融市場の安定に重大な悪影響を及ぼす。これらの要素のいずれも、私たちの業務、見通し、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。また、近年、米国政府内では中国企業の米国資本市場への参入を制限または制限する可能性が考えられていると報じられている。このような審議が現実になれば、それによる立法は米国に上場する中国発行者の株式表現に重大かつ不利な影響を与える可能性がある。この提案された立法が採択されるかどうかはまだ分からない。
私たちの大部分の薬物発見と臨床業務は中国とアメリカで行われており、私たちはアメリカ商務省の輸出管理条例を含む中国、アメリカあるいは他の輸出入規制に関する法律と法規を守らなければならない。現在,このような法律法規は,米国原産の薬物発見ツールを中国の子会社に提供する能力を制限していない。しかし、私たちはアメリカの輸出入規制法律法規の将来の変化の影響を受けるかもしれない。このような法規の変化により、私たちのアメリカ原産の薬物発見ツールを中国大陸に移すことができず、第三者からアメリカ原産のソフトウェアとコンポーネントを得ることができない、あるいは他の方法でアメリカの技術を得ることができなければ、私たちの業務、運営結果、財務状況は実質的で不利な影響を受けるだろう。
中国と米国がそれぞれ徴収した関税は両国間の貿易に悪影響を与えている。関税は私たちの臨床用品の価格を高め、私たちの業務、運営結果と財務状況にマイナス影響を与えるかもしれません。
最近アメリカに上場している中国企業をめぐる訴訟、監督審査、負の宣伝は、私たちがより厳しい監督管理審査を受け、私たちのアメリカ預託証明書の取引価格にマイナスの影響を与える可能性がある。
米国に上場する中国企業をめぐる訴訟、規制審査、マイナス宣伝はこのような会社の株価にマイナス影響を与えていると考えられる。中国で大量の業務を持っているアメリカ上場会社はずっと投資家、株式研究機構と監督機関--例えばアメリカ証券取引委員会と上場会社の会計基準委員会--厳格な審査の対象である。その中の一部の会社は株主訴訟の対象となったり、会計違反や誤り、有効な財務会計内部統制の欠如、コーポレートガバナンス政策などの告発に対して内部または外部調査を行っている。私たちの似たような審査は、価値が不足していても、分流を招く可能性があります
これらのリスクには、管理資源と精力、デマや訴訟を防ぐ潜在的なコスト、米国預託株式取引価格の低下と変動、および取締役や高級管理者の保険料の増加が含まれており、我々の業務、運営結果、財務状況に実質的な悪影響を及ぼす可能性がある。
“中華人民共和国労働法”、“労働契約法”及びその他の労働関連法規の中国での実施は、我々の労働コストを増加させ、労働力の柔軟性を制限する可能性がある。もし私たちが中国の労働に関する法律を守らなければ、私たちは処罰を受けるかもしれない。
“中華人民共和国労働契約法”によると、使用者は、使用者のために10年間連続勤務する労働者と無固定期限労働契約を締結することが義務付けられている。また、従業員が2回連続して締結された固定期限労働契約の更新を要求または同意した場合、生じる契約は固定期限なしでなければならないが、いくつかの例外がある。“中華人民共和国労働契約法”の規定により労働契約を解除又は更新しない場合は,使用者は労働者に経済補償金を支払わなければならないが,特別な規定があるものを除く。したがって、私たちが従業員を解雇する能力は非常に制限されている。また、中国政府は従業員の権利をさらに保護するために、様々な労働に関する規定を公布した。これらの法律によると、12カ月以上連続勤務している従業員は、5日から15日の年次休暇を享受する権利があり、その日の給料の3倍の未休年休暇日数の補償を受けることができるが、例外的な場合は除く。もし私たちが私たちの雇用や労働慣行を変えることを決定すれば、“中華人民共和国労働契約法”とその実施細則は、コスト効果があると考えられる方法でこれらの変更を実施する能力を制限することも可能である。しかも、これらの新しい規定の解釈と実施はまだ変化しているため、私たちの雇用慣行はいつでも新しい規定に適合しているとみなされないかもしれない。私たちが労使紛争や調査で厳しい処罰を受けたり、重大な責任を負ったりすれば、私たちの業務や財務状況は悪影響を受ける可能性があります。
中国で経営している会社は、社会保険、住宅積立金、その他の福祉志向の支払義務を含む政府が支援する各種従業員福祉計画に参加し、ボーナスや手当を含むその従業員の給料に相当する特定の割合の金額をこれらの計画に納付しなければならないが、現地政府が時々規定している最高額を超えてはならない。地域によって経済発展レベルが異なることから、中国の地方政府は従業員福祉計画の維持要求を一貫して実行していない。私たちは中国の関連法規を厳格に遵守して、私たちの従業員と私たちを代表する従業員のために社会保険と住宅積立金支払いを支払うことができないかもしれません。なぜなら、現地の法規が異なり、中国地方当局の執行や解釈が一致していないことと、私たちの従業員の住宅積立金制度に対する受け入れ度が異なるからです。もし私たちが適用された中国の法律と法規に従って支払わなければ、私たちは罰金と処罰を受けるかもしれない。私たちはこのような計画の支払いと滞納金と罰金を支払うことを要求されるかもしれない。もし私たちがどんな報酬が低すぎる従業員の福祉で処罰、滞納金あるいは罰金を受けたら、私たちの財務状況と経営業績は不利な影響を受けるかもしれません。
吾等賃貸物件の一部の賃貸権益は中国関連法律の規定に従って関連中国政府当局に登録されていない。レンタル権益を登録できなかったことは私たちを潜在的な罰金に直面させるかもしれない。
私たちはまだ関連政府部門に私たちのレンタル協定の中の一つを登録していない。関連する中国の法律や法規によると、吾らは関係政府当局に署名した賃貸契約の登録及びアーカイブを要求される可能性がある。未登録当社の賃貸物件の賃貸契約は、当該等の賃貸契約の有効性に影響を与えませんが、所定の時間内に登録を完了できなかった場合、住宅主管部門は、所定の期間内に賃貸契約を登録するよう命じ、未登録の賃貸契約所に対して人民元1,000元から10,000元までの罰金を科すことができます。
私たちの業務は、中国政府当局が付与した税収優遇や財政優遇と適宜政策から利益を得ている。このような奨励または政策の満了、キャンセル、または減少は私たちの運営結果に悪影響を及ぼすだろう。
中国政府当局はすでに私たちの中国付属会社に税務優遇または財政優遇を付与し、中国業務の発展を奨励する努力の一部として、私たちが先に中国政府当局と締結した国有建設用地使用権を付与する契約または土地使用協定、投資協定または投資協定を含む。私たちは私たちが土地使用権を獲得した施設を建設する計画を中止した
2023年4月に、江蘇太倉ハイテク産業開発区管理委員会はConnect SZと合意を締結し、江蘇太倉ハイテク産業開発区管理委員会は元の購入価格に従ってConnect SZに土地使用権を買い戻すことができ、そして土地使用協定と投資協定の関連規定を中止することができる。土地使用権抹消登録は2023年4月に完了し、当社は2023年9月に買収価格を受け取った。
2021年、私たちは土地使用権の購入に関連する建設中資産を核販売し、2022年、私たちは土地使用権を購入した土地に研究開発実験室、製造施設、行政事務室を建設する建設プロジェクトを中止した。しかし、もし私たちが将来本当にもっと多くの施設を開発しようと努力すれば、私たちは私たちが以前計画していたよりも高いコストと支出を生むかもしれない。私たちは中国政府当局が付与した適宜保険証書の将来の機会と利益を得る上で困難に直面する可能性があり、これは逆に私たちの財務状況や経営業績にマイナスの影響を与えるだろう。
税金優遇や政府財政奨励の時間、金額、基準は現地政府当局が自ら決定し、私たちが実際にどんな財政奨励を受けるまで、確定的に予測することはできない。私たちは政府当局にこのような決定を下すことに影響を与えることができない。政府主管部門は法律法規に基づいて税金優遇や奨励を減少または廃止することを決定することができる。さらに、いくつかの政府の税金優遇または財政奨励は、プロジェクトまたはマイルストーンに基づいて与えられ、適用される投資または財政奨励協定の遵守、その中の特定のプロジェクトまたはマイルストーンの完成を含むいくつかの条件の満足に依存する。私たちは私たちがすべての関連条件を満たすことを保証することはできません。もし私たちが満足できなければ、私たちは関連する税金優遇やインセンティブを奪われるかもしれません。私たちは投資家たちに、私たちが現在享受している政府の税金優遇やインセンティブが継続または未来に利用可能になるということを保証することはできない。私たちに与えられた税金優遇や財政的または他のインセンティブを廃止または減少させるいかなる措置も、私たちの経営業績に悪影響を及ぼすだろう。
中国の製薬業界は厳しい規制を受けており、これらの法規は変化する可能性があり、これは私たちの薬品の承認と商業化に影響を与える可能性がある。
我々の研究開発業務や施設の大部分は中国にあり,臨床,商業,規制面の優位性を与えていると考えられる。中国の製薬業は全面的な政府監督管理を受けており、新薬の審査、登録、製造、包装、許可とマーケティングを含む。中国における我々の現在及び計画における業務活動に適用される法規要件の検討については、項目4.業務概要−政府法規及び製品承認−中華人民共和国法規“を参照されたい。近年,中国の製薬業に関する規制の枠組みが大きく変化しており,引き続き重大な変化が予想される。このような変更や改訂は、当社の業務のコンプライアンスコストを増加させたり、中国での候補製品の開発成功や商業化の遅延や阻止を招いたりする可能性があり、中国での候補製品の開発や製造から現在得られているメリットを減少させる可能性があります。中国当局は製薬業界の法律を実行する上でますます警戒されており、私たちまたはパートナーが適用される法律や法規を遵守できなかったり、必要な許可や許可を取得して維持できなかったりすることで、中国での業務活動の一時停止または終了を招く可能性がある。私たちの戦略と方法は中国政府の規制政策と一致していると信じているが、私たちの戦略と方法がこのように一致することを保証することはできない。
私たちは特定の業界の法律法規の制限を受ける可能性があり、私たちの科学データを中国以外に移すことはできません。
2019年5月28日、国務院は“人類遺伝資源管理条例”を公布し、2019年7月1日から施行した。本規則によると、非中華人民共和国締約国に人類遺伝資源材料或いは人類遺伝資源材料と人類遺伝資源情報或いは人類遺伝資源情報を提供し、異なる形式の審査と事前承認を受ける必要がある。HGR材料はヒトゲノム、遺伝子及びその産物を含む器官、組織或いは細胞などの遺伝物質であり、HGR情報はHGR材料を用いることによって産生された遺伝情報或いはデータである。関連薬物や医療機器の中国での販売許可を得るためだけであり,輸出されていない場合には,臨床機関で中国のHGR材料とHGR情報を用いた国際臨床試験協力を承認する必要はない。しかし、使用しようとするHGR材料とHGR情報のタイプ、数量と用途は臨床試験前に科学技術部或いはMOSTに報告すべきである。そうでなければ、中華人民共和国のHGR材料とHGR情報を利用して科学研究の国際協力を展開するには、規定の条件を満たし、協力双方が共同で申請を提出し、最高人民法院の許可を得なければならない。また、中国国外でHGR材料を交付、郵送或いは携帯する場合は、エネルギー省の許可を得て、輸出証明書を取得しなければならない。HGRの提供
非中華人民共和国締約国に情報を提供するか、または非中華人民共和国締約国がHGR情報を使用することを許可するには、MOSTに記録を提出し、対応する情報コピーを提出する必要がある。このような規定または許可された用途が公衆衛生、国家安全、または中華人民共和国の公共利益に影響を与える可能性がある場合、追加の安全審査が行われる。2024年3月に“ヒト遺伝資源管理条例”が改正され,2024年5月から施行され,この条例によりHGRの承認権がMOSTからNHCに移行する。その後、NHCはHGRの審査と承認手続きを行う。
もし私たちが必要な承認をタイムリーに得られなかったり、必要な届出手続きを完了したりすることができなければ、候補製品の研究と開発が阻害される可能性があり、これは私たちの業務、運営結果、財務状況、見通しに重大で不利な影響を与える可能性がある。もし中国の関係政府部門が私たちの材料、データあるいは情報の伝送が関連規定に違反していると判断した場合、私たちは警告、改正、違法所得および不法収集と保存されたHGR材料とHGR情報を含む当該政府部門の具体的な行政処罰を受け、100万元以上1000万元以下の罰金(違法所得100万元以上、違法所得の5倍以上10倍以下の罰金)、一時(1-5年)または永久除名を科す可能性がある。機構と責任者は人類遺伝資源プロジェクトの責任をさらに追及してはならず、甚だしきに至っては刑事責任を追及してはならない。
米国当局が米国証券の法律や法規に違反して私たち、私たちの役員、役員、または今年度の報告で指名された専門家を提訴する能力は限られている可能性がある。そのため、投資家はアメリカ国内の会社投資家と同じ保護を受けることができないかもしれない。
アメリカ証券取引委員会、アメリカ司法省、その他のアメリカ当局は、私たちのような非アメリカ会社や私たちの中国での役員や役人などの非アメリカ人に訴訟を起こし、訴訟を実行する際に大きな困難に直面することが多い。司法管轄権制限、礼譲問題、様々な他の要因により、米国証券取引委員会、米司法省、その他の米国当局が中国などの新興市場で不良行為(詐欺行為を含む)を追及する能力が制限される可能性がある。中国における我々の業務及び資産については、米国当局が、我々又は我々の役員、役員又は他の門番が詐欺又はその他の不正行為に関与している場合には、我々又は我々の役員、役員又は他の門番に対する調査又は訴訟に必要な情報を得るためには、重大な法律及びその他の障害がある。また、中国地方当局が米国当局や非中国投資家の法的訴訟に協力する能力が制限される可能性がある。したがって、もし私たち、私たちの役員、役員、または他の門番が証券法違反、詐欺、または他の財務不正行為を犯した場合、アメリカ当局は私たち、私たちの役員、役員、または他の門番を効果的に調査したり、行動したり、強制的に実行することができないかもしれません。そのため、投資家は米国の各当局が米国国内会社の投資家に提供する同等の保護を享受できない可能性がある。
投資家は、米国または他の非中国法律に基づいて中国で法律手続きを履行し、非中国判決を執行したり、私たち、私たちの役員、幹部、あるいは今年度の報告書に列挙された専門家に対するオリジナル訴訟を提起したりする際に、困難に直面する可能性がある。したがって、投資家たちはこのような法律の保護を効果的に享受できないかもしれない。
我々の中国における業務及び資産については、米国連邦証券法又は適用される州証券法に規定されている事項を含む、我々、我々の役員及び上級管理者に法的手続き文書を送達することができない可能性がある。投資家が中国国外の米国裁判所や他の裁判所で私たち、私たちの役員や上級管理職、または本年度報告で指名された専門家に不利な判決を受けても、投資家は中国で私たちまたは彼らに対する判決を実行できないかもしれない。中国には米国または大多数の他の西側諸国裁判所の判決を相互に認めて実行する条約はない。したがって、中国で上記のいずれかの司法管区裁判所の判決を認めて実行することは困難または不可能である可能性がある。また、投資家は、米国や他の非中国法律に基づいて、中国で私たち、私たちの役員や上級管理者、または本年度報告で指名された専門家に対してオリジナル訴訟を提起することができないかもしれません。そのため、米国で一般的な株主クレームには、証券法に基づく集団訴訟や詐欺クレームが含まれており、中国では法律や実際の状況で訴訟を起こすことは困難または不可能である。
例えば、中国では、中国ではない実体に関する株主調査や訴訟やその他の方面に必要な資料を取得することには重大な法律やその他の障害がある。中国地方当局は、他の国や地域の証券監督管理機関と規制協力メカニズムを構築し、国境を越えた監督管理を実施することができるが、相互かつ実務的な協力メカニズムが不足している場合には、このような米国証券監督管理機関との規制協力は有効ではない。2020年3月に施行された“中華人民共和国証券法”第百七十七条によると、海外証券監督機関
中華人民共和国が中華人民共和国国内で直接調査あるいは証拠取得活動を行うことを許可する。そのため、中国証券監督管理機関と関係部門の同意を得ず、いかなる組織と個人も中国国外の各方面に証券業務活動に関する文書と資料を提供してはならない。“中国証券法”第177条の詳細な解釈や実施規則はまだないが、中国国外の証券監督管理機関は中国国内で直接調査や証拠取得活動を行うことができず、投資家の利益を保護する上で投資家が直面する困難をさらに増加させる可能性がある。そのため、投資家は米国の法律法規が提供する米国公衆投資家を保護するための保護を効果的に享受できない可能性がある。
米国証券取引委員会が提起した行政訴訟では、我々の独立公認会計士事務所を含む中国の会計士事務所に追加の救済措置を適用することができ、それにより、私たちの総合財務諸表が米国証券取引委員会の要求に適合しないと判断される可能性がある。
2012年12月、米国証券取引委員会は、米国証券取引委員会が調査している他の一部の中国会社に関する監査作業の下稿やその他の文書を提供できず、米国証券法に違反したことを告発する行政訴訟を、我々の独立公認会計士事務所を含む中国証券取引委員会に対して提起した。2015年2月、これら4つの中国に本社を置く会計士事務所は、米国証券取引委員会を非難し、罰金を支払うことにそれぞれ同意し、紛争を解決し、米国証券取引委員会以前の勤務能力と米国上場企業に対する監査能力が一時停止されることを回避した。和解合意は、両弁護士が詳細な手続きに従い、中国証監会を通じて米国証券取引委員会にこのような事務所の監査文書を提供することを求めている。これらの会社がこれらの手続きに従わない場合、あるいは米国証券取引委員会と中国証監会との間の手続きが失敗した場合、米国証券取引委員会は停職などの処罰を科すことができ、行政訴訟を再開することもできる。私たちの独立公認会計士事務所が停職などの追加的な法的挑戦や処罰を受けた場合、アメリカ証券取引委員会が合併財務諸表の提出を要求する能力に影響を受ける可能性があります。もし私たちがアメリカ証券取引委員会の要求に従って速やかに連結財務諸表を提出していないと認定すれば、最終的に私たちがナスダックから退市したり、アメリカ証券取引委員会から登録を取り消したり、あるいは両方を持っている可能性があり、これは私たちのアメリカ預託証明書の米国での取引を大幅に減少または効果的に終了させるだろう。
中国に本社を置く会計士事務所が最終結果により米国証券取引委員会や米国上場会社会計基準委員会の追加的な法的挑戦を受けた場合、中国で主要業務を有する米国上場企業は、中国での業務について核数師を保留することが困難または不可能であることが発見される可能性があり、財務諸表が取得される可能性を含む取引所法の要求に適合しないと判断される可能性がある。また、将来的にこれらの監査会社に対するこのような訴訟に関する負のニュースは、投資家が中国などの中国に本社を置く米国上場企業に不確実性をもたらす可能性があり、私たちのアメリカ預託証明書の市場価格は悪影響を受ける可能性がある。
私たちの独立公認会計士事務所が拒否された場合、一時的であっても、米国証券取引委員会の前に勤務する能力があり、また、他の公認会計士事務所を見つけて私たちの合併財務諸表を監査して意見を出すことができず、私たちの合併財務諸表は取引法の要件を満たしていないと判断される可能性がある。このような決定は、最終的に、私たちの米国預託証明書がナスダックから退市するか、または米国証券取引委員会から登録をキャンセルするか、または両方を合併することをもたらす可能性があり、これは、米国における私たちの米国預託証明書の取引を大幅に減少または効果的に終了させることになる。
一般リスク
私たちは潜在的な健康流行病による危険を受けやすい。
新冠肺炎の大流行或いはその他の流行病の影響、及び政府、私たち自身と第三者が新冠肺炎或いはその他の流行病の伝播を減少させるために取った行動と政策は、すでに未来に引き続き生産力に負の影響を与える可能性があり、未来の臨床試験、臨床前研究及び研究開発活動を緩和或いは延期し、そして更に私たちのサプライチェーンの中断を招く可能性があり、そして私たちの業務発展戦略を実行する能力を弱める可能性がある。例えば,我々が中国CD患者で行ったicanbelimod第二段階臨床試験は,新冠肺炎疫病による募集挑戦により早期に中止された。政府当局がウイルスやウイルス変種や他の流行病の伝播に対応するために新たな制限措置を回復または適用すれば、現在現場で働いている従業員は私たちの施設にアクセスできなくなる可能性があり、私たちの運営は制限されたり減少したりする可能性がある。
未来のいかなる流行疾病も中断を引き起こす可能性があり、著者らの業務、臨床前研究と臨床試験に深刻な影響を与える
•私たちが計画している臨床試験を開始するために地元の規制機関から許可を得るのを遅延させます
•著者らの臨床試験では患者を募集し、維持することに遅延或いは追加の困難が発生した
•患者は登録後に任意の健康状態に感染したり、隔離されたために著者らの臨床試験から退出するリスクがある可能性があり、これは不良事件或いはフォローアップを失った患者の数を増加させ、それによって臨床試験の結果に不利な影響を与える可能性がある
•臨床サイトの起動または拡張の遅延または困難は、臨床サイト調査員および臨床サイトスタッフを募集する困難を含む
•臨床試験を行うために必要な用品および材料の遅延を受信する臨床サイトは、臨床試験材料輸送に影響を及ぼす可能性のある世界的な輸送中断を含む
•流行病への対応の一部として法規制の変化 これは予期せぬコストを招くか、このような臨床試験を完全に停止させることを要求するかもしれません
•医療資源を臨床試験の進行から移し,われわれの臨床試験場所である病院や臨床試験を支援してくれた病院スタッフを他の場所に移すことを含む
•連邦または州政府、雇用主および他の人が強要または提案した旅行制限、または臨床試験被験者のアクセスおよび研究プログラムの中断により、臨床試験データの完全性に影響を与える重要な臨床試験活動の中断、例えば臨床試験場所の監視;
•従業員資源が限られているか、または政府または請負業者が休暇を余儀なくされているため、監督機関、道徳委員会、および他の機関と請負業者との必要な相互作用に遅延が生じている
•食品薬品監督管理局、国家食品薬品監督管理局または他の監督管理機関の運営中断または遅延は、審査および承認スケジュールに悪影響を及ぼす可能性がある
•規制当局はその管轄外の影響を受けた地域の臨床試験データの受け入れを拒否した。
私たちの業務や世界経済におけるこれらや他の中断は、私たちの業務、運営業績、財務状況に悪影響を及ぼす可能性があります。
われわれの臨床試験は流行病の影響を受けており,将来も影響を受ける可能性がある。例えば、私たちのいくつかの臨床試験サイトは、臨床試験における新しい患者登録の緩慢さ、サイトモニタへのアクセス拒否、およびいくつかの操作において影響を受けた。同様に,主な調査者や現場スタッフの能力が悪影響を受ける可能性があり,医療提供者として流行病への接触が増加する可能性があるからである。著者らと著者らのCROはすでに未来に著者らの試験操作を調整し、患者のモニタリングと安全を確保し、大流行期間中の試験完全性のリスクを最小限に下げるために努力する可能性があり、これは著者らの臨床試験を延期し、臨床試験を完成するコストを増加させ、そして著者らの臨床試験データの完全性、信頼性或いは壮健性に負の影響を与える可能性がある。
さらに、流行病または感染症に関連する隔離、避難所、および同様の政府命令、またはそのようなコマンド、閉鎖または他の業務運営制限が発生する可能性があるとの見方は、私たちが依存する第三者製造施設の人員または材料の利用可能性またはコストに悪影響を及ぼす可能性があり、これは、私たちの候補製品のサプライチェーンを乱す可能性がある。もし私たちのサプライヤーとサービスプロバイダが私たちが彼らと達成した合意下の義務を履行できない場合、あるいは彼らが流行病のために商品とサービスの提供を遅延させたり、私たちの候補製品の臨床供給需要を満たし続けたり、他の方法で私たちの候補製品開発を推進する能力が損なわれる可能性があります。
インフレ圧力、持続的に高い企業の価格とサプライヤーが使用する原材料或いは他の投入の不確定な可用性、あるいは物流と関連コストの不安定は、著者らの運営、臨床前研究と臨床試験に負の影響を与える可能性がある
仕入先が使用する原材料又はその他の投入品の価格上昇は、インフレ及び金利上昇、又は物流及び関連コストの増加を含み、我々の運営コストの上昇を招き続ける可能性がある。また、サプライヤーのキー材料コストのいかなる増加または減少も、私たちの臨床前研究と臨床試験のコスト増加を招き、私たちの候補製品の安全性と有効性結果を達成する能力を阻害する可能性がある。さらに、このような材料に対する世界的に増加している需要および不確実な供給は、私たちまたは私たちのサプライヤーがそのような材料をタイムリーに取得する能力を乱す可能性があり、および/またはコスト増加をもたらす可能性がある。地政学的リスク、需給変動、金利変動、為替変動、 他の経済や
政治的要素はすでに原材料と他の投入の価格設定圧力をもたらし続ける可能性がある。このようなインフレ圧力は逆に私たちの運営と業務に否定的な影響を及ぼすかもしれない。
私たちまたは私たちが依存している第三者は、地震、火災、または他の自然災害の悪影響を受ける可能性があり、私たちの業務の連続性や災害復旧計画は、深刻な災害から私たちを十分に保護できないかもしれません。
私たちの工場はカリフォルニア州のサンディエゴと中国蘇州の太倉にあります。この二つの地域は地震を経験しました。もし地震、火災、他の自然災害、テロ、そして私たちがコントロールできない似たような事故が私たちのすべてまたは大部分の施設を使用することを阻止すれば、私たちは難しいかもしれないし、場合によっては長い間私たちの業務を継続することはできない。災害復旧や事業継続計画がなく、特に地震保険が不足している場合には、当社の内部または第三者サービスプロバイダの災害復旧や業務連続性計画の欠落や性質に巨額の費用が発生する可能性があり、当社の業務に大きな悪影響を及ぼす可能性があります。さらに、私たちのサプライチェーンのいくつかの当事者は単一の場所で運営される可能性があり、自然災害や他の突発的、予見不可能、深刻な不良事件におけるそれらの脆弱性を増加させる。このような事件がわれわれのサプライチェーンに影響を及ぼすと,われわれの臨床試験を行う能力,われわれの開発計画,業務に実質的な悪影響を及ぼす可能性がある
もし私たちが環境、健康、安全の法律法規を守らなければ、私たちは罰金や罰金を科されたり、コストを発生したりする可能性があり、これは私たちの業務の成功に実質的な悪影響を及ぼすかもしれない
私たちは多くの環境、健康と安全法律と法規の制約を受けて、それらの研究室の手続きと危険材料と廃棄物の処理、使用、貯蔵、処理と処理を管理する法律と法規を含む。私たちのすべての業務は化学品と生物材料を含む危険かつ可燃性材料の使用と生産に関するものだ。私たちは一般的に第三者と契約を結び、このような材料と廃棄物を処理する。私たちはこのような材料が汚染や傷害をもたらす危険を除去することができない。もし私たちが私たちと施設を共有している第三者が危険材料を使用して汚染や損傷をもたらした場合、私たちはそれによるいかなる損害に責任を負うかもしれません。どんな責任も私たちの資源範囲を超えている可能性があります。私たちはまた民事や刑事罰金と処罰に関連した巨額の費用を発生させるかもしれない。
私たちは従業員たちが危険な材料を使用して怪我をしてコストと費用を発生させるかもしれない。私たちは私たちが危険材料を貯蔵したり処分したりすることで、私たちが提起した環境責任や有毒侵害請求に保険を提供することはできません
また、現在または未来の環境、健康、安全法律法規を遵守するためには、巨額のコストが生じる可能性がある。このような現行または未来の法律法規は私たちの研究と開発を損なうかもしれない。このような法律法規を遵守しないことはまた巨額の罰金、処罰、または他の制裁につながる可能性がある
第四項会社に関する資料
A.会社の歴史と発展
一般情報
当社は二零一五年十一月にケイマン諸島免除会社株式会社に登録され、当社の事務は当社の組織定款大綱及び定款細則(時々改訂)、ケイマン諸島会社法(改正)及びケイマン諸島一般法規管を受けています。私たちの法定名称は康乃徳生物控股有限会社で、私たちの商業名は康乃徳生物です。これまで、私たちの業務は2012年5月に中国蘇州に登録設立された蘇州康乃徳生物有限公司またはConnect SZによって行われました。私たちのケイマン諸島の登録事務所はMaples企業サービス有限会社のオフィスにあり、住所はケイマン諸島KY 1-1104大ケイマンUgland House郵便ポスト309号です。私たちの主な行政事務室はアメリカにあり、住所:12265 El Camino Real、Suite 350、San Diego、California 92130。私たちはEl Camino Real 12265 El Camino Real,Suite 350,San Diego,California 92130を私たちの代理人として指定し、アメリカが私たちに提起したいかなる訴訟でも訴訟手続きを送達することができる。私たちの中国での研究開発と管理機構は江蘇省太倉市北京西路6号東研究開発ビル3階科学技術園に位置し、郵便番号:中国215400。私たちのサイトの住所はwww.Connectbiopharm.comです。本年度報告に本サイトで取得可能な情報が含まれているか、または取得可能な情報は、本年度報告の一部を構成しない。私たちはこの年間報告書に私たちのウェブサイトのアドレスを含めて、ただ非アクティブなテキストとして参考にしている。米国証券取引委員会には、米国証券取引委員会に電子的に提出された報告書、依頼書、情報声明、その他の発行者に関する情報が含まれており、URLはwww.sec.govである。
私たちは持株会社であり、私たちは、株主またはアメリカ預託証明所有者に配当金や他の現金分配に必要な資金を支払うか、または私たちが発生する可能性のある任意の債務を返済することを含む、子会社が支払う配当金および他の配当金分配に依存して、私たちの現金および融資需要を満たすことができます。もし私たちのどの子会社も将来自分の名義で債務を発生させれば、そのような債務を管理する道具は私たちに配当金を支払う能力を制限するかもしれない。今まで、私たちの子会社はそのような配当金や他の分配を持っていなかった。しかも、私たちの子会社は私たちやアメリカの投資家にどんな配当金や分配も支給したことがない。将来、中国海外融資活動から調達した現金収益は、出資や株主ローン(場合によっては)を通じて私たちの子会社に移転することができます。
社内現金移転のやり方は書面分析と承認の支持を得た。具体的には、これらの政策は、各子会社の運営および純運営資本需要を支援するために、四半期、場合によっては毎月流動現金需要を評価することによって支援される。評価には、私たちが承認したサプライヤーとの契約、商品およびサービス、ならびにこれから来る支払いの推定、および他の内部現金需要の検討が含まれています。分析の後は書面審査と経営陣メンバーが承認した内部現金移転だ。どの振込も外国為替機関に登録する必要がある場合、振込手続きが完了する前に、このような振込を登録するために追加の書類と手続きを行う必要があります。
中国の法律及び法規によると、当社の中国付属会社は配当金、ローン又は立て替えの形でその一部の純資産を当社に移転してはならない。2023年12月31日現在、当社の中国子会社が実収資本と法定準備金を含む制限された純資産は人民元8,530万元(3,180万ドル人民元を米ドルに換算し、人民元7.0827元から1ドルに換算すると、中国外国為替システムの2023年12月31日の為替レートに相当)および人民元2,21.5,000元(人民元6.9646から1ドル換算で人民元3,180万ドル、中国外国為替システムの2022年12月31日の為替レートに相当)である。2022年
2023年12月31日までの3年間の主要資本支出と資産剥離の説明、及び現在行われている資本支出及び資産剥離については、項目5を参照されたい。“経営と財務の回顧と展望”
会社設立
•二零一二年五月、Connect SZは中国の法律に従って有限責任会社に登録された。その際、Connect SZはカリフォルニア州の法律によって組織された単一メンバー有限責任会社Connect Biopamm LLCまたはConnect USの100%持分を持っていた。Connect USは2012年1月に運営を開始した。
•2014年7月、康乃徳生物オーストラリア有限公司が設立され、オーストラリアの法律に基づいて設立された有限責任会社である。
•2015年10月、康乃徳生物(上海)有限公司が設立され、中国の法律に基づいて設立された有限責任会社である。
•2015年11月、康乃徳生物控股有限公司はケイマン諸島免除有限責任会社として設立され、2015年12月、香港相互接続は香港法律に基づいて有限責任会社として設立された。康乃徳生物控股有限公司及びConnect HKは以下に述べるConnect SZ大株主の持株会社を完成するために設立された。
•康乃徳生物(北京)有限公司、又は北京を接続し、2019年7月に設立され、以下に述べる再編及び再編後に設立された有限責任会社は、中国の法律に基づいて設立される。
•2021年11月、康乃徳生物(深セン)有限公司が設立され、中国の法律に基づいて設立された有限責任会社である。
組換えと組換え
•2016年1月、当社とその付属会社は再編を行い、これにより、康乃徳生物控股有限公司は、Connect SZが保有する株式と引き換えに、それぞれ自社グループ創設者である魏博士及び潘博士に普通株を発行した。普通株を発行するため、魏博士及び潘博士は当社及びConnect HKの100%持分を保有し、当社及びその付属会社に対する共同制御権を保持している。
•魏博士と潘博士に当社の株式を発行した後、Connect SZの残りの30%の株式は1人の既存投資家が持っている。このような権利は非制御的権益と呼ばれる。
•2018年10月,我々は再編を行い,これにより,子会社Connect USとConnect AU(当時Connect SZが保有していた)の流通株をConnect HKに100%譲渡した
譲渡後,Connect USとConnect AUはConnect HKの完全子会社となる.著者らも2018年10月に深港通非持株権益を持つ非持株株主に康乃徳生物有限会社の普通株を発行し、このような非持株権益と交換する;康乃徳生物持株有限会社もそれぞれ深港通優先株主にAシリーズを発行する前に転換可能な優先株を発行し、1株当たり額面0.0001ドル、あるいはAシリーズ転換優先株、1株当たり額面0.0001ドル、あるいはAシリーズ優先株は、彼などが深港通の同じ持分を持つ代償とする。取引完了後,Connect SZの株主は当社の株主となり,Connect SZはConnect HKの完全子会社となる.上記の2018年のイベントを再構成と呼ぶ.
•Connect SZは引き続きConnect SH、Connect BJ、Connect SEの100%持分を保有しています。
上記の再編および再編に続き、康乃徳生物控股有限公司は当社とそのすべての付属会社の最終親会社となった。2021年3月23日、私たちは初公募株(IPO)を完成し、総現金対価格は2.199億ドルで、その後1540万ドルの引受割引と手数料を獲得した。
B.業務の概要
我々は世界的な臨床段階の生物製薬会社であり,T細胞駆動の炎症性疾患を治療する療法を開発している。私たちの目標は、T細胞生物学の他の方面に対する小分子と抗体のための豊富な内部設計の完全なパイプラインを構築することである。著者らの核心的な専門はT細胞の機能細胞分析を用いて免疫標的に対する有効な候補製品をスクリーニングと発見することである
私たちの2つの最先端の臨床段階計画は、検証された目標に対する高度に差別化された候補製品を含む。著者らの主要な候補製品rademikibartはIL-4受容体α或いはIL-4 Rαに対する抗体であり、アトピー性皮膚炎或いはADと喘息などの炎症性疾患を治療する有効な標的である。推計によると、2022年の世界AD市場は約85億ドルで、2028年までに232億ドルに増加すると予想され、複合年間成長率やCAGRは18.2%である。2022年の世界喘息市場価値は約88億ドルと推定され、2028年までに120億ドルを超え、複合年間成長率は6.0%と予測されている。臨床前研究と臨床試験の所見から,rademikibartは先に承認されたIL−4 ra抗体と区別される可能性がある。著者らは最近中国で中から重度AD患者に対する肝心な試験を完成し、試験の第一段階で主要と肝心な副次的終点を満たし、その後試験の第二段階で部分的に一致した治療効果の結果を示した。著者らは最近、レドミキバートによる2型炎症性喘息の治療を評価する全世界2 b期試験を完成し、この試験において、主要かつ重要な副次的終点を満たした。我々は,中から重度のADあるいは中から重度の喘息を有する成人患者において世界第3段階計画を開始することを評価している。また,炎症性腸疾患の治療に用いられるスフィンゴシン1−リン酸受容体1またはS 1 P 1というT細胞受容体の調節剤としてicanbelimodを開発している。具体的には,外部許可パートナーが求められていることを背景に,潰瘍性大腸炎やUCのためのicanbelimodを開発している。
我々の免疫調節剤候補製品は、生物関連機能細胞分析に基づいて、高スループットの生化学分析ではなく、一次薬物スクリーニングを行う我々の薬物発現方法に由来する。著者らは著者らの候補製品が観察した臨床と臨床前結果のため、このような生理関連方法がより有効な方法で高度差別化解決方案を産生する潜在力を支持した。我々の方法は知られていない薬物形態であり,小分子や抗体製品候補の識別に用いられている。
我々は,ADや喘息などの炎症性疾患の治療に用いられる抗IL−4 Rα抗体の研究であるレドミックバートを開発している。IL-4 Rαを抑制することは2種類の炎症性サイトカインの作用を遮断することができる:IL-4或いはIL-4とIL-13或いはIL-13。健康ボランティアで行われた無作為、プラセボ対照の1 a期試験では、単剤レドミクバートの耐性が良好であり、血清炎症バイオマーカーの阻害を招いた。著者らが2022年に成年AD患者で完成した無作為二重盲検プラセボ対照全世界の2 b期試験と2023年に成年AD患者で完成した無作為二重盲検プラセボ対照中国の肝心な試験において、著者らは主要と肝心な副次的終点が皮膚明瞭度、疾病の重症度と掻痒の面ですべて明らかに改善し、レドミックバートは全体的に耐性が良好であることを観察した。対面試験は行われておらず,試験設計,場所,被験者の特徴や他の要因の違いにより,関連しない臨床試験からのデータは信頼できる比較ができないにもかかわらず,現在の看護基準と比較して,レドミキバートは,(1)中国のキー試験の第2段階では,成人AD患者では,患者の長期臨床反応が他の生物製剤から報告された第三者臨床反応データよりも持続し,1年間の皮膚除去の維持や疾患重症度の低下を含む患者の割合を含む3つの潜在的な利点を有していると考えられる。(2)著者らが中~重度成人喘息患者に対して行った全世界Ph 2 b試験において、報告された他の生物製剤のある第三者臨床反応データと比較して、著者らは肺機能の改善とより速い緩和の面でより積極的な治療効果の結果を見た。(3)の方が便利
著者らの最近の中国肝心な試験と私たちの全世界の2 b期試験データは、中重度ADと喘息を有する成人と青少年患者に対して、私たちのQ 4 W用量(4週間当たり300ミリグラム用量)の陽性結果がQ 2 W用量(毎週300 mg用量)より低いことを示し、これは私たちが提案した投与方案を証明した。
Icanbelimodは研究中の経口小分子調節剤S 1 P 1であり、T細胞がリンパ節外から外周に動員される調節器である。S 1 P 1の抑制は循環中のこれらのT細胞レベルの低下を招き,自己免疫に関連する炎症を減少させる。S 1 P 1は、多発性硬化症の治療のために3つの薬剤が承認された検証された治療標的であり、ノ華社によってGilenyaで販売されているFingolimod、ノファ社によってMayzentで販売されているsiponimod、および百時美施貴宝によって販売されているZeposaで販売されているオザニモドである。第三者臨床試験からの証拠は、S 1 P 1調節剤の潜在力は、UCなどの高度な需要を満たしていない高度な流行を有する疾患を含む多発性硬化症をはるかに超えることを示しており、Zeposaは2021年にFDAおよびEMAによって中等度~重度の活動を有するUCを有する成人の治療のために許可されている。2021年の統一通信の世界市場規模は約59億ドルと推定され、2028年には110億ドルを超え、複合年間成長率は9.3%と予想されている。われわれの前臨床研究や臨床試験で観察された効力,特異性,薬物動態により,icanbelimodはこれらの疾患を潜在的に治療するために良い位置にあると信じている。われわれはすでにUCで世界第二段階試験を完了し,2022年誘導期のトップライン結果と2023年保守期の長期結果を報告した。その結果,icanbelimodは誘導期内に疾患の重症度の測定基準を著しく改善し,維持期に観察された改善臨床緩解を維持し,全体的な耐性は良好であった。同社はUCとCDの将来試験でicanbelimodの許可を得て,UCとCD患者の潜在力を満たすことを積極的に求めている。
私たちのパイプは
コナイダー生物はすべての候補製品の世界的な開発と商業化の権利を持っている
a我々は大中国のパートナーで将来の開発と守秘協定の提出を担当し,現在中国国家医療製品管理局(CDE)薬品評価センターと規制検討を行っており,AD患者のためにレドミックバートの守秘協定を提出する予定である。私たちは早くて2024年第2四半期にこのような次の措置に関する最新の状況を受け取ると予想している
b新冠肺炎に関する登録挑戦のため,CD第2段階試用は早期に終了した。
私たちの戦略
我々の目標は,炎症性疾患患者のための治療薬を開発し,商業化する世界的なバイオ製薬会社となることである。この目標を達成するための戦略は以下のとおりである
•炎症性疾患に対する候補製品を発見·開発し,これらの疾患は重大な未満足医療ニーズを有している私たちは 免疫システムを調節する候補製品を設計と開発し、特にT細胞に注目している。我々の免疫システムの標的治療における内部専門知識と独特な知見を利用することにより、我々の目標は検証された標的に対する高度な差別化、同類の最適な候補製品である可能性があり、そして新しい標的に対する潜在的な一流分子を識別することである。我々は引き続き炎症性疾患に対する候補製品の発見と開発に専念し,これらの疾患は重大な満たされていない医療需要を有し,世界の数百万人の患者に影響を及ぼす。
•可能な場合には、私たちの3つの最先端の候補製品を引き続き開発しますRademikibartとicanbelimodはそれぞれ可能だと信じています AD、IBDおよび喘息などの炎症性疾患を有する患者に顕著な治療利益を提供する。これらの候補品を可能な限り現在検討されている適応の臨床試験に進め,臨床試験を通過する予定である。また,我々の候補製品の開発を他の適応に拡張する予定である.
•それらのマーケティング、製造、臨床インフラを利用するために、ビジネス段階会社とのパートナー関係を求めている。AD或いは喘息などの大型疾病の適応に対して、大量の資金と資源が必要であり、登録レベルの臨床研究を完成して監督部門の許可を得て、そしてそれを市場に押し上げることに成功した。我々はすでに中国大区のラドミキバートとシムセルの許可側とビジネスパートナー関係を構築しており、グローバルパートナーと地域パートナーを選定するビジネスインフラと実力を利用することができる高価値なパートナー関係を求める予定である。
•私たちの早期計画を推進し、私たちのルートを拡大し強化するために研究開発に投資し続ける私たちは続けます 著者らの免疫学方面の専門知識を応用して標的を選択し、分析方法を設計し、臨床前薬物発見計画を実行し、著者らの候補製品導管を拡大する
•アメリカと中国における私たちの核心的な優位性を利用して、私たちの世界での業務を拡大します私たちは今 アメリカ、中国、オーストラリア、ヨーロッパ、香港で業務をしています。世界的には,我々と臨床研究組織,膨大な患者集団,現地インフラとの関係を利用して,競争優位性を提供してくれると考えられる。また,米国と中国の薬物開発における我々の専門知識や関係を利用する予定である
炎症性疾患におけるT細胞の調節失調
T細胞はリンパ球,あるいは白血球と呼ばれ,病原体やアレルゲンなどの外来物質に対する免疫反応の制御·形成を担当する。T細胞調節失調はよく自己免疫と炎症に関連する多種の疾病の発生を招く。これらの疾患には,喘息などの呼吸器疾患,ADなどの皮膚疾患,IBDなどの胃腸疾患や多発性硬化症などの神経変性疾患がある。T細胞生物学の詳細に対する理解の過去20年間の発展に伴い、多くのこれらの疾病に対する標的薬物はすでに開発され、これらの薬物は直接T細胞生物学を調節する。
Tヘルパー細胞と呼ばれるT細胞サブクラスは、身体攻撃の性質に基づいて適切な免疫反応を決定するのを助ける。T補助細胞自身は2大亜類に属し、2種類の免疫反応、即ちTh 1とTh 2免疫反応を引き起こす。
広義には,Th 1免疫反応は本質的に炎症性である。身体が細胞内の病原体に反応する必要がある場合,Th 1反応をトリガする。このTh 1反応の失調は,多発性硬化症,乾癬,IBDなどの自己免疫疾患などの病態にも関与している。この場合,身体はあたかも脅威であるかのように自分の一部に反応し,それによって生じる炎症はTh 1反応の一部である。Th 1シグナルを妨害する治療方法は、グルココルチコイド、腫瘍壊死因子αの阻害剤、ならびにインターロイキン12およびインターロイキン23の阻害剤、またはIL−12/IL−23を含む。これらの治療法は、関節リウマチ、乾癬、IBDなどの様々な疾患の治療に承認されている。
Th 2免疫反応は体が細胞外病原体を攻撃し、アレルギー反応を駆動するのを助ける。Th 2失調による疾患には,喘息,アルツハイマー病,アレルギーがある。これまでに承認されたIL−4 Ra抗体は,IL−4およびIL−13を阻害することによりTh 2サイトカインの活性を阻害し,ADおよび喘息の治療に承認されている。
先に承認されたTh 1とTh 2免疫反応の調節剤は,標的T細胞治療に関連する広範な治療潜在力と巨大な商業市場を説明した。しかし,臨床検証に対する次世代療法の開発やTh 1やTh 2免疫反応を調節する新たな標的の開発には様々な機会があると考えられる。
私たちの方法は
著者らの差別化方法は著者らの免疫システム、特にT細胞生物学に対する深い理解、及びT細胞を用いて複雑な機能分析を開発する能力に基づいて、専門的に候補製品を確定することを目的としている。伝統的な薬物発見方法と異なり、伝統的な薬物発見方法は通常生化学特性に基づく高スループットスクリーニングから始まり、著者らはこれらの機能分析を直接用いて私たちの分子をスクリーニングする。我々の方法は,関連分子をより迅速に認識し,従来のスクリーニング分析では進められない可能性のある魅力的な分子の除去を避けることができると信じている。
我々は,炎症性疾患に関連するT細胞調節標的に対する候補製品を我々の方法を用いて開発し,これらの疾患は満足されていない多くの需要を有している。私たちの目標はこのような目標を満たすために一流または一流の候補製品を生産することだ。
図1.我々の薬物スクリーニング方法
私たちの候補製品
抗IL−4 Rα抗体レディミバート
我々は、ADや喘息などの炎症性アレルギー性疾患の治療のための抗IL-4 Rα抗体を開発している。IL-4 Rαを抑制することは2種類の炎症性サイトカイン:IL-4とIL-13の作用を遮断することができる。以前に承認されたIL-4 Rαに対する抗体は、これらの疾患の患者に対して有意な治療的利益があることが証明されている。この抗体は7年間しか発売されていないにもかかわらず,これまでに承認されたIL−4 Ra抗体メーカーの推計によると,この抗体の売上高は2023年に107億ユーロを超え,2022年より34%増加し,2024年には130億ユーロを超え,複合年間成長率は2030年まで2桁低いと予想されている。
アトピー性皮膚炎疾患の概要
アトピー性皮膚炎 ( AD ) は、湿疹とも呼ばれ、皮膚バリアの破壊と免疫調節の異常を特徴とする、最も一般的に診断される慢性炎症性皮膚疾患の 1 つです。慢性炎症性皮膚病変は、疾患に関連する主な症状である持続性かゆみ、局所的な痛みや睡眠障害を引き起こす。全米湿疹協会によると、米国では 2610 万人が AD を持っています。このうち、 660 万人の成人が中等度から重度の疾患を抱えている。世界的に AD の有病率は増加しており、 2018 年現在、生涯有病率は最大 20% と推定されています。中華人民共和国では、 1 ~ 7 歳の小児における臨床診断 AD の有病率は 2016 年時点で約 13% と推定されている。AD の有病率は高所得国では安定しているが、先進工業国では 1970 年代以降歴史的に 2 ~ 3 倍に増加している。AD の世界市場は、 2022 年に約 85 億ドルに達し、 2028 年には 232 億ドルに成長すると予想されています。
コルチコステロイドおよびカルシニューリン阻害剤などの局所抗炎症薬は、通常、皮膚の健康を管理し、軽度から中等度のAD患者の皮膚炎症を軽減するために使用される。局所治療を行ったにもかかわらず,突然発作した患者は,コルチコステロイドの経口投与やシクロスポリンAの経口投与などの全身薬を処方され,疾患の重篤なバイタルサインや症状を迅速に緩和する可能性がある。これらは突発的事象の一時的治療として有効であるが,使用時間の延長は多くの潜在的な副作用や有害事象に関連している。全身ステロイドは,強い松のように症状が軽快するが,ステロイドに関連する多くの副作用や,突然の治療中止時に重篤な疾患発作を発症する傾向があるため,安定した緩解誘導は推奨されていない。シクロスポリンも一般に1年から2年以上の使用は推奨されておらず,腎毒性,多毛症,嘔気,リンパ腫に関与しているためである。2014年のアデルフィ米国AD疾患特定計画のデータによると,中重度AD成人の58%を超える医師がこれらの治療法が十分にコントロールできないと考えている疾患を有している。
伝統的なAD治療の欠点を解決するため、人々はAD発病機序に関連する特定の生物学的標的を探索し、その中の1つの肝心な焦点はIL-4或いはIL-4とIL-13、或いはIL-13である。IL−4の産生は末梢血液や組織中の免疫グロブリンE(IgE)や好酸球レベルの増加をもたらす。IL-13はTh 2関連サイトカインであり、B細胞と単球に影響し、それによって炎症と免疫反応を調節することができる。両サイトカインともIL−4 Rαを介して作用し,IL−4 RはT細胞,B細胞,マクロファージなどの細胞表面に発現し,アレルゲンに対する炎症性免疫反応の活性化に関与している。IL−4 RαはIL−13受容体やIL−13 raとヘテロ二量体を形成することができるため,IL−4やIL−13に結合して活性化することができる。IL−4とIL−13は余分な活性を有し,いずれも体内アレルギー性炎症の主要な駆動因子である。IL−4 Rαの活性化はサイトカインの産生,マクロファージの活性化,B細胞の免疫グロブリンE産生,気道上皮細胞の粘液産生および真皮の炎症とリモデリングをもたらす。
喘息生物製剤の世界市場機会は急速に増加しており,2022年の総市場規模は約88億ドルであり,2028年には120億ドルに増加し,年複合成長率は6.0%と予想される。
これまでに承認されたIL−4 Ra抗体は印象的な結果が得られたにもかかわらず,この抗体を用いて治療した患者では,かなりの数の患者が有意な活動性未制御疾患を有していた。例えば,第三者臨床反応データは,60%までの患者が十分な疾患コントロールを実現していないことを示している。また,この抗体治療に反応する患者であっても,十分な制御を実現するのに12週間から16週間を要する可能性がある。最後に、この抗体は成人や青少年の2週間に1回の用量で使用されることが承認されない。
私たちの解決策rademikibartは
レディミバートはIL-4 Rαに対する研究中のヒト由来モノクロナル抗体である。レドミックバートはIL−4 Rαの阻害剤としてIL−4とIL−13の炎症シグナルを遮断する。レドミキバートはIL-4 Rαの1つの領域に結合し、この領域はIL-4 Rαと高い結合親和性と効力を有し、臨床反応の改善を招く可能性があると信じている。著者らの臨床開発計画はレドミキバートの臨床反応程度と比較的に少ない頻繁な投与における潜在力に集中している。
図2:rademikibartはIL-4とIL-13のシグナル伝達を遮断することを目的とした抗IL-1 ra抗体である。
完成した臨床試験
我々は,長期代替用量計画の有効性,安全性,薬物動態学,薬効学(Radikibart WW001)の長期代替用量計画の有効性,安全性,薬物動態学,薬効学(Rademikibart WW001)を米国,中国,オーストラリア,ニュージーランドの59試験点で行ったレドミキバートの成人患者における2 b期の全世界試験を完了した。すべての主要と重要な副次的終点は満足され,レドミックバートは全体的に良好な耐性が観察された
WW001試験の鍵となる組み入れ基準は,局所コルチコステロイドとカルモジュリン阻害剤で制御が不十分な中から重度AD成人患者まで,AD持続時間が少なくとも1年,EASIスコアが少なくとも16点,IGAスコアが少なくとも3点,少なくとも10%のBSAが関与していることである。この実験では,レドミックバートとプラセボ対照の3つのキューに関連して226名の患者を募集した。第1群は負荷量600 mgのレドミバートを受け,その後2週間ごとに150 mg(Q 2 W)であった。第2群は負荷量600 mg,次いで300 mg,q 2 wを受けた。第3のrademikibartキューは負荷量600 mgを1回受け,4週間ごとに300 mg(Q 4 W)を受けた。すべての患者は計16週間服用し、その後8週間の安全フォローアップ期間を行った。主要な終点は、ベースラインから16週目までのEASIのパーセンテージ変化である。重要なサブ終点は、IGA 0、1、EASI-75、EASI-90に達した患者の割合、およびベースラインから16週目までのPNRsの変化を含む。
WW001実験の結果は、主な補助端末とキー補助端末を詳細に説明した
•レドミキバートは主要かつ重要な副次的終点を満たすことに成功し、プラセボと比較して、皮膚除去、疾病の深刻性と掻痒の面で著しい改善を示し、そしてレドミキバート300 mgと150 mgの間に潜在的な用量反応が存在することを表明した。
•レドミキバートの耐性は通常非常に良く、類似の治療発生率-緊急不良事件(TEAE)、深刻な不良事件(SAE)と深刻な不良事件(TEAE)は研究能動群とプラセボ群の間の薬物中止を招く。レドミックバート治療を受けた患者では,注射部位反応(1.8%)と結膜炎(3.5%)の発生率が低いことが報告されている
•WW001試験は新冠肺炎の大流行期間に発生し,従来の第三者IL−4 Rα抗体3期試験と比較して募集した患者群のAD疾患の重症度は有意に低く,患者停止率が高かった。これらの要因は,われわれの試験では,第三者試験よりもプラセボ応答率が高く,積極群応答率が低く,ベースライン疾患の重症度が高く,患者中断回数が少ないことを招いていると考えられる。そこで,これらの因子がレドミキバートの治療効果結果に及ぼす影響を評価するために,実験から事後分析を行った。これらの分析は、ベースライン疾患の重症度の増加に伴い、レドミキバートのすべての用量での治療効果の結果はある程度改善し、プラセボ反応は低下傾向を呈し、著者らがQ 2 WとQ 4 Wの300 mgレドミクバートを服用する計画をさらに開発することを支持した。
また,中から重度ADまでの2 b期rademikibartグローバル試験の後期データ解析では,rademikibartによるADの全4つの身体領域:頭部と頸部,体幹,上肢,下肢のAD症状やバイタルサインの急速かつ持続的な改善を報告し,プラセボに比べて2週間早く2週間と4週間用量レジメンを使用し,16週間まで検討を継続した。事後分析の結果,我々の最初の研究の観察が拡大した.
具体的には,16週の治療でEASIはすべての4つの身体領域で亜分が改善した。また,300ミリグラムQ 2 WとQ 4 Wの間の改善は同様である.2週目には,レドミバート300 mg Q 4 W治療を受けた患者のEASIは−26.3%(頭/頸部),−26.4%(体幹),−21.6%(上肢)と−23.2%(下肢)低下したが,プラセボ服用患者EASIは−9.5%−−15.7%低下した。16週にEASIはさらに-69.2%(頭頚部)、-72.1%(体幹)、-64.2%(上肢)と-68.5%(下肢)に低下したが、プラセボ群は-21.2%~-49.1%(P)であった
著者らはまた2023年下半期にCN 002を完成し、これは中国に対する重要な試験であり、330名の中重度AD成人患者におけるレドミバートの応用を評価するためのものである。実験の第1段階は16週間であり,主要かつ重要な副次的端末を詳細に説明した結果は以下のとおりである
•プラセボと比較して,レドミキバート負荷量600 mgを服用し,その後2週間ごとに300ミリクレデミキバートを服用し,主要かつ重要な副次的終点に達することに成功し,皮膚郭清,疾患の重症度と掻痒の著明な改善を示した。主要終点はIGA 0,1であり,16週目のベースラインと比較して少なくとも2段階低下し,重要な二次終点はベースラインから16週目までEASI−50,EASI−75,EASI−90に達した患者の割合を含む。
•レディミキバートの耐性は一般的に良好であり,TEAE,SAEとTEAEの発生率は類似しており,研究能動群とプラセボ群の間の薬物中止を招いた。レドミキバート治療を受けた患者では,注射部位反応の報告発生率は6.5%,結膜炎の発生率は4.7%と低かった
•レドミキバート負荷量600 mgを服用し,その後2週間ごとに300ミリクレデミキバートを服用すると,症状は急速に軽快し,1週目は掻痒が軽減し,4週目はすべての研究終点が有意に改善し,16週まで持続した。具体的には,ベースラインEASI中央値は29.3であった。54.8%の患者が深刻と考えられ、ベースライン免疫グロブリンスコアは4であった。16週間でレドミキバート治療を受けた患者の免疫グロブリンスコアは0-1(皮膚透明またはほぼ透明)に達し、2点免疫グロブリン低下の割合はプラセボを服用している患者(29.0%対5.9%)よりも高く、研究の主な終点に達した(図3参照)。58.6%のrademikibart患者は75%の皮膚明瞭度(EASI-75)を実現したが、プラセボ群のこの割合は22.6%であった(図4参照)。
図3.16週目の主端点
図4.16週目のEASI-75端末
36週間の第2段階試験は、225人のEASI-50応答者をランダムに選択することを含み、彼らは、4週間当たり300 mg用量を服用するか、または2週間毎に300 mg用量を服用する。試験の第2段階保守部分の主な結果は以下の通りである
•Rademikibartを用いた52週維持データはQ 2 W,Q 4 W用量レジメンとも陽性であった。
•患者の87%はQ 4 W用量でIGA 0/1反応を維持し、76%の患者はQ 2 W用量でIGA 0/1反応を維持した(図5参照)。
•90%を超える患者は、Q 4 WおよびQ 2 W用量でEASI-75反応を維持した(図6参照)。
•レドミキバート治療16週間後に16週目の治療効果を改善した結果:
◦16週間後に免疫グロブリン0/1の患者は約30%増加した
◦16週間後に患者の約16%がEASI-75に達した
•ラミキバートは全体的な耐性が良好であり,52週間の長期治療後に新たな安全シグナルはなかった
図5.IGA 0/1の長期保守
図6.EASI-75の長期保守
同社は2023年にSimcereライセンス所持者とビジネスパートナー関係を構築した。協力条項によると、Simcere許可所持者は大中華区中国地区のレドミキバートのすべての監督文書を担当し、中国国家薬監局CDEに機密協定を提出し、レドミキバート治療中の重度ADの承認を求めることを含む。
我々はまた,2023年下半期に2 b期試験,すなわちrademikibart WW002を完了し,2型炎症を伴う重度喘息患者へのrademikibartの応用を評価した。
この2 b期試験は世界的、多中心、ランダム、二重盲検、プラセボ対照研究であり、アメリカ、ポーランド、ハンガリー、中国と韓国の79地点で行い、322名の患者を1:1:1でランダムにレドミキバート150ミリグラムQ 2 W(負荷量600 mg)、レドミキバート300 mg Q 2 W(負荷用量600 mg)とプラセボ(プラセボ)に分けた。レミジバートは皮下注射(SC)とした。研究は24週間の治療期と8週間のフォローアップ期間に分けられた。研究の主な終点は,12週目の力呼気量とベースラインの変化である。副次的な終点は,他の時間点肺機能とベースラインの変化,喘息増悪,患者報告結果(ACQ−6,症状日記),薬効学的マーカー(呼気一酸化窒素(FeNO),好酸球,好酸球陽イオン蛋白(ECP),オステオカルシン,胸腺と活性化調節ケモカイン(TARC))および救急薬の使用である。この実験の主な結果は
•この実験はその主要な終点、すなわち前気管支拡張剤の1秒力呼気量(FEV)とベースラインの絶対変化を達成した1)は、12週目に、レドミキバート150ミリグラム群の肺機能がプラセボ変化群より140 ml(p=0.005)および189 ml(P)と有意に改善したことを示した
•150 mgと300ミリグラムを併用したプラセボと比較して,有意な改善は1週目に開始した(p
•喘息コントロールの著明な改善も認められ,患者報告の結果である。24週間の間、プラセボ調整後の喘息制御アンケート(ACQ-6)スコアとベースラインとの絶対変化は-0.33(P)であった
•この研究では進行に統計学的有意差は認められなかったにもかかわらず,レドミクバートの治療は強力な数字結果を示し,悪化の減少と初回増悪の延長に有用であった
•150 mgおよび300 mgのQ 2 Wレドミックバートの治療耐性は良好であった
図7.12週目の主端点(FEV 1)の結果
図8.FEV 1の経時的変化は1週目から緩和し始めたことを示している
計画中の臨床試験
中重度AD成人患者に対する全世界2 b期試験と中重度喘息患者に対する全世界2 b期試験の成功結果に基づいて、著者らは2024年上半期に監督管理機関と面会し、喘息とADプロジェクトにおける潜在的な第三段階試験の計画を検討する予定である
•世界第3段階喘息試験の進路を決定するために、FDAおよびEMAとの第2段階会議を終了する。
•早期試験の積極的な結果を考慮して,C型会議はFDAと会議を行い,世界AD第3段階試験の規制経路を決定した。
神経スフィンゴシン1−リン酸受容体1調節剤Icanbelimod
Icanbelimodは我々が開発しているUCやCDの神経スフィンゴシン1−リン酸受容体1(S 1 P 1)を治療するための研究における選択的調節剤である。S 1 P 1活性の調節は、T細胞遊走を抑制し、炎症を軽減することができることが証明されており、Fingolimod、siponimodおよびOzAnimodなどのS 1 P 1調節剤が多発性硬化症の治療に使用されている。Icanbelimodの体外効力,選択性,薬物動態が観察されており,他のS 1 P 1調節剤よりも優れていることが示唆されたと考えられる。他のS 1 P 1調節剤が蓄積した臨床的証拠と,T細胞の循環を阻止して炎症の胃腸実質組織に移行する可能性を減少させる分類機序に基づいて,icanbelimodはUCやCDでは満たされていない需要を解決する可能性があると信じている。健常ボランティアで行われた第1段階試験は完了しており,この試験ではicanbelimodは全体的に耐性が良好であった。Icanbelimod投与により循環リンパ球が減少し,治療完了後1週間以内に回復した。UCでは全世界第2段階試験を行っており,icanbelimodは疾患の重症度の測定基準を有意に改善し,全体的な耐性が良好である研究誘導段階のトップクラスの結果を報告している。同社はUCとCDの将来試験でicanbelimodの許可を得て,UCとCD患者の潜在力を満たすことを積極的に求めている。
潰瘍性大腸炎疾患の概要
炎症性腸疾患(IBD)は消化管組織の慢性炎症に関与する疾患を記述する用語であり,クローン病(CD)と潰瘍性大腸炎(UC)の2つの場合に分けられる。この二つの状況は違う方法で腸管に影響を及ぼすだろう。クローン病は口腔から肛門までの消化管の任意の部分の全層腸壁炎症を引き起こし,UCは大腸(結腸と直腸)の内層炎症に関与する。潰瘍性大腸炎の症状は下痢、直腸出血、腸管緊急症、便失禁、腹痛、疲労と意外体重減少を含む可能性があり、具体的には病状の重症度と部位に依存する。この疾患は症状に関連しており,これらの症状は腹痛,血性下痢,直腸出血,緊迫感,便失禁,疲労を含む疾患の程度と重症度に依存する。UCは緩解と再発周期を経験する疾患である。
2015年に米国では約1.3%の成人,すなわち約300万人がUCやCDと診断されたと推定されている。2017年、世界で約680万人がIBDの影響を受け、多くのIBD患者がUCを患っている。2021年、統一通信の世界市場は約59億ドルと推定され、2028年の複合年間成長率は9.3%に達し、110億ドルを超えると予想される。
メサラミンは通常、軽度~中等度の活動期UCおよびCDの第一線の治療および緩和の維持に使用され、コルチコステロイドの経口投与による疾患発作の治療を補助することができる。中和重度疾患またはメサラミンおよび経口コルチコステロイド薬に無効な患者には、抗腫瘍壊死因子α、抗インテグリンA 4?7、抗IL-12/23またはJAKの小分子阻害剤を含む静脈ステロイドまたは生物学的製剤を使用することができる。
既存療法の限界
IBDは多種の治療方案が選択できるが、現有の治療法に関連する耐性、臨床反応と緩和不足、作用速度と投与負担のため、まだ大量の満足されていない医療需要がある。ステロイドの長期接触静注は副作用に関連しており,臨床的メリットを超える可能性がある。抗腫瘍壊死因子α試薬は感染または悪性腫瘍のリスクに関連しているが、承認された特定のJAK阻害剤のタグは、重篤な感染、死亡、悪性腫瘍および血栓形成を含むリスクに対する“ブラックボックス”警告を含む。既存療法に関する安全問題に加えて,UCやCDの臨床管理は不十分であり,2013年の研究では,半数未満の患者のみが長期緩和を実現していることが報告されている。そのほか、いくつかの高級療法の効果開始遅延は3ケ月に達し、最大限の臨床緩和は1年に及ぶ治療が必要であるかもしれない。いくつかの治療法は複雑な投与レジメンにも関連し、生物製剤は定期的に皮下注射或いは静脈注射が必要である。したがって,治療中から重度活動性IBDまでの新規経口薬は,増強するリスク−利益分布とより便利な投与があり,医学的需要は満たされていない。
炎症におけるS 1 P 1の役割
S 1 P 1は臨床検証された抗炎症薬であり、3種類の発売薬がそれを対象としている:Fingolimod、ノ華社はGilenyaで販売され、siponimod、ノファ社はMayzentで販売され、オザニモドは百時美施貴宝によって販売され、Zeposaで販売されている。この3つの薬は多発性硬化症の治療に承認された。2019年、Fingolimodの売上高は32億ドル。
5種類の1−リン酸スフィンゴシン受容体:S 1 P 1−S 1 P 5。特にS 1 P 1は,自己免疫疾患の潜在的炎症に関連するリンパ球に発現する。重要なのは、S 1 P 1受容体の調節は胸腺と末梢リンパ組織中の循環リンパ細胞の選択性と可逆性隔離を招くことである。この隔離はリンパ球の輸送を変えることで実現される。これらの変化は逆に多発性硬化症の中枢神経系やIBDの胃腸を含む自己反応性リンパ球の炎症部位への移行を阻止している。このような潜在破壊性リンパ細胞遊走の減少はS 1 P 1シグナルに関与する理想的な結果である。
他の神経スフィンゴシン1−リン酸受容体は炎症に関与しない生理作用を有する。例えば,選択性の悪いS 1 P 1調節剤,例えばFingolimodを用いて,S 1 P 3の抑制はマウスモデルの線維化に関与している。S 1 P 2とS 1 P 3も筋線維芽細胞に発現し、それらの調節は血管収縮と血圧上昇を招く。S 1 P 4とS 1 P 5の臨床相関性は現在まだ不明である。高選択性に乏しいFingolimodは著明なAEsに関与しており,心疾患歴のある患者では禁忌である。
私たちはこのような選択性の欠如の問題を、より的確な薬物発見方法で克服できると信じている。また,S 1 P 1のリンパ球輸送に対する調節は,UCのような需要が満たされていない高流行疾患を含む他の自己免疫疾患に有用である可能性が考えられる。S 1 P 1に対して高度な特異性を有するS 1 P 1調節剤は心血管効果の減少を招く可能性があり、これらの効果は選択性の低い調節剤が広範な人の中で使用する潜在力を制限する。先の第2世代S 1 P 1調節剤オザニモッドとetrasimodの臨床試験はIBDの有効性を確認したが,IBD適応のいずれにも承認されていない。高選択性S 1 P 1調節剤をさらに最適化する薬物動態や薬効学は、特にUCにおいて自己免疫疾患を治療する最適な薬剤となる可能性がある。
私たちの解決策icanbelimodは
Icanbelimodは1種の経口投与の次世代S 1 P 1小分子調節剤であり、T細胞を殺すことなく、或いは特定のサイトカインを標的とすることなく炎症を減少させることを目的としている。設計により,icanbelimodはS 1 P 1に対して高い選択性を有するが,S 1 P 2とS 1 P 3受容体サブタイプに対して有意な活性がなく,循環Tリンパ球に対して最適化作用を及ぼす可能性があり,有意な抗炎症活性をもたらす可能性が考えられる。臨床前研究において、icanbelimodは非常に強い薬物動態学と薬効学を示し、効果が速く、Tリンパ細胞の回復が速い。Icanbelimodは半減期が短く,絶対リンパ球の減少を1ミクロンLあたり約400~750細胞に迅速に誘導することができ,リンパ球数はベースラインよりも>60%~70%減少し,承認されたS 1 P 1調節剤が達成した目標と比較して有利である。また,その薬物動態学的特性はイカベモートの1日1回の経口投与を可能にした。Icanbelimodは親薬物ではなく,体内変換を必要としない。これらの特徴は,UCが現在承認しているエージェントが満たしていない治療効果,安全性,利便性の需要を解決することが可能であると信じている。
図9.icanbelimodのメカニズム
私たちは、望ましい生物学的性質 ( この場合、小分子が T 細胞表面のネイティブ部位から S 1 P 1 を内部化させる能力 ) の機能スクリーニングを実行することで、 icanbelimod を発見しました。この内部化のために、 T 細胞はリンパ節を離れて循環に入ることができない。この目的の結果に発見を集中させることにより、 S 1 P 1 に強く結合するが内部化を引き起こさない化合物の偽陽性結果や、組換え S 1 P 1 に強く結合しない化合物の偽陰性結果を回避しながら、非常に強力な S 1 P 1 調節因子であるイカンベリモドを同定することができました。
イカンベリモドは S 1 P 1 の非常に強力で選択的な変調剤であり、前臨床試験では S 1 P 1 に対して S 1 P 3 の 8 万倍以上の選択性が示されている。さらに、前臨床試験では、ヒスタミン受容体 H 1 に対する 57% の阻害効果を除き、体内で重要な生理学的機能を有する他の G タンパク質共役受容体およびイオンチャネルに対して、 10 μ M のイカンベリモドは広範な受容体パネルスクリーニングにおいて有意な相互作用を示さなかった。前臨床試験では、イカンベリモドはプロファイリングされた 7 つの主要なシトクロム P 450 代謝酵素のうち 2 つのみによって有意に阻害された。
| | | | | | | | | | | | | | | | | |
| 名前.名前 | ヨーロッパ共同体50(海) |
| S 1 P 1 | S1P2 | S 1 P 3 | S1P4 | S 1 P 5 |
| | | | | |
| ICANBELIMOD | 0.09(1) | >10,000(2) | 7,900(2) | 19(2) | 3.97(2) |
| | | | | |
| | | | | |
オズニーモッド (CC-1122273) | 2.99 | >10,000 | >10,000 | >10,000 | 29.32 |
| | | | | |
| | | | | |
エトラシモッド(2) (APD 334) | 6.10 | >10,000 | >10,000 | 147 | 24.4 |
| | | | | |
(i)Camp Assay
(Ii)バーファンステイン測定法
図10.Icanbelimodは、インビトロでS 1 P 1を効率的かつ選択的に調節する。上の表で提供されている情報は説明目的のみであり,逐一比較するわけではない.研究あるいは試験設計と被験者の特徴の間に差があり、異なる研究のデータを比較する際には慎重に行動すべきである。
完成した臨床試験
我々はすでにオーストラリアの44人の健康成人においてicanbelimodの第1段階試験を完了しており、その中には7日間の単回増量用量レジメンと28日の複数回増量用量レジメンを含み、もう1つの試験は中国の30名の健康成人で行われている。♪the the the
オーストラリア試験における単回用量レジメンは、0.1 mg、0.25 mg、0.5 mg、2.5 mg、およびプラセボ列を含む。オーストラリア試験における多用量レジメンは、0.15 mg、0.25 mg、およびプラセボ列を含む。中国の試験では、単回用量レジメンおよび多用量レジメンは、0.1 mg、0.2 mg、およびプラセボキューを含み、多用量レジメンは、0.3 mgキューをさらに含む。1日1回0.25 mgまでのicanbelimodを1日1回服用するのは通常耐性が良好である。すべてのレジメンで観察された最もよく見られる副作用は白血球減少と頭痛を含む。AEsは軽度または中等度が多い。肺機能、一連の眼科検査、血圧或いは肝酵素レベルの面で臨床上の顕著な変化はなかった。他のS 1 P 1調節剤臨床試験の所見と一致し,いずれのレジメンでも早期に用量依存性の心拍数低下が認められた。1名の健常成人が単量2.5 mgのicanbelimod治療を受けた後、一過性心停止に関連する徐脈が出現し、治療に関連する重篤な有害事象と考えられた。健常成人は高流量酸素治療を受け,完全に回復した。
リンパ組織中のリンパ細胞の隔離は末梢循環中のリンパ細胞数の減少を招き、これは採血を通じて測定することができ、それによって臨床前と臨床研究に強力な機械的薬効バイオマーカーを提供した。われわれの試験は統計学的有意差に達しなかったにもかかわらず,6名の健常成人では,0.25 mgのicanbelimodは投与14日目に循環リンパ球数を75%減少させ,1日投与期間の残りの時間はこのリンパ球阻害レベルを維持した。投与終了後,リンパ球レベルは1週間でベースラインレベルに回復した。
図11.イカンベモトは、健康なボランティアの循環リンパ球レベルの低下をもたらす。
健常成人で行った第1段階臨床試験のデータでは,28日後にオザニモド1ミリグラムを服用した患者は平均65%減少したが,第1段階試験ではアイトラシモド2ミリグラムを服用した患者では,7日目から21日目までの安定状態で平均69%減少した。われわれの試験とこれらの独立した臨床試験では循環リンパ球減少の比較は意義があると考えられ,これらの試験はすべて健常ボランティアで行われているため,21日または28日の多用量レジメンを用いている。健常者のリンパ球絶対数(ALC)は白血球総数に占めるリンパ球の割合の正常範囲と同じである。われわれの試験と同様に,オザニモドの1期臨床試験とetrasimodの1期臨床試験は健常ボランティアの血液学的正常が求められている。したがって,これらの被験者の循環リンパ球ベースラインレベルは類似していると考えられる。既知かつ検証された薬理作用パターンによると,S 1 P 1調節剤は循環リンパ球数を減少させることから,これらの健常被験者の試験における循環リンパ球の減少は,研究された研究薬の影響によるものと考えられ,われわれの試験ではicanbelimodを含む。
また,投与完了後のリンパ球レベルの回復は,報告されている他のS 1 P 1調節剤よりも速い回復が認められた。これらの結果は,健常被験者で観察されたicanbelimodの短い半減期が約25時間であったためである。これはFingolimodとは逆にFingolimodの半減期は6~9日,リンパ球回復期間は30~60日である。イカンベリ治療を受けた患者が被害を受ける可能性のある時間の長さを最大限に短縮できるため,リンパ球レベルを迅速に回復する能力が重要であると信じている
免疫力、これは患者感染のリスクを低下させる可能性がある。Fingolimod治療を受けた患者は,服薬終了後2カ月に及ぶ感染のリスクがある可能性がある。
| | | | | | | | |
| | |
| 薬品名 | T 1≒2時間(日) | リンパ球回復時間 |
| | |
| | |
| Fingolimod(0.5 mg,qd) | ~216時間(6-9日) | 30-60d |
| | |
| | |
| MT−1303(0.4 mg,qd) | 451 H(19 D) | >48d |
| | |
| | |
オザニモッド(1 mg,qd)
(CC 1122373) | ~264h
(11d) | >7d
(この時間以降は報告していません) |
| | |
| | |
| エトレシモッド(2 mg,qd) | 35 h(1.5 d) | |
| | |
| | |
| Icanbelimod(0.25 mg,qd) | 25 H(1 D) | |
図12.icanbelimodは他のS 1 P 1調節剤と比較して半減期が短く,リンパ球回復時間が短いことに関連している。上の表で提供されている情報は説明目的のみであり,逐一比較するわけではない.研究あるいは試験設計と被験者の特徴の間に差があり、異なる研究のデータを比較する際には慎重に行動すべきである。
2022年上半期には、中重度UCを有する成人患者145人においても、イカビリーモートの二重盲検、プラセボ対照の世界第2段階試験を完了した。この試験の主な終点は,修正されたMayoスコアによって測定された0.2 mg icanbelimod群とプラセボ群の12週目の臨床反応であった。われわれが2022年上半期に報告した主なデータでは,12週間後に調整したMayoスコアにより,icanbelimodの疾患重症度は数字的に低下したが,反応は統計学的には有意ではなかった。しかし、icanbelimodは臨床緩和を経験した患者数の面で統計学的意義が得られ、その定義は直腸出血採点=0、大便頻度採点1、内視鏡採点1である
2023年上半期には,この第2段階試験12週誘導期以降の36週の治療期の結果も発表した。メンテナンス結果によると:
•誘導期12週目に臨床緩解に達した80%の患者では,Icanbelimodは48週以内に持続的な臨床緩解を示した。
•Icanbelimodは継続耐性が良好であり,観察された誘導期安全データと一致した
第二段階の実験結果から,icanbelimodは全体的に耐性が良好であり,安全性はわれわれの早期のicanbelimod第一段階研究と一致していることが分かった。すべてのレジメンで観察された最もよく見られる副作用は白血球減少と頭痛を含む。AEsは軽度または中等度が多い。肺機能、一連の眼科検査、血圧或いは肝酵素レベルの面で臨床上の顕著な変化はなかった。他のS 1 P 1調節剤臨床試験の所見と一致し,いずれのレジメンでも早期に用量依存性の心拍数低下が認められた。
計画中の臨床試験
S 1 P 1調節剤はすでに多発性硬化症,乾癬,IBDを含む多くのTh 1関連免疫疾患において臨床効果を示している。我々は世界的なビジネスパートナーを積極的に探し,icanbelimodをUCとCDの治療の世界第3段階に進めている。最初の開発資源をIBDに集中させることを選択し,既存製品に比べてicanbelimodが最も高い潜在力を持って優れた臨床反応と安全性を示していると考えられる。IBDの臨床活動を観察すると,他の免疫疾患におけるicanbelimodの潜在力を検討することが考えられる。
商業化する
私たちの候補製品の開発段階を考慮すると、私たちはまだ商業インフラや流通能力に投資していません。私たちは2023年にシムセル許可側と中国大区のラドミキバートとビジネスパートナー関係を構築し、製薬会社や他の会社とより多くのパートナー関係を構築し、必要な商業·流通インフラを構築して、私たちの候補製品を世界的および/または地域的に商業化する予定です。
競争
生物技術と製薬業界の特徴は技術進歩が迅速で、競争が激しく、知的財産権を強調することである。著者らは主要と専門製薬、生物製薬、治療と生物技術会社、学術研究機構、政府機関及び公共と個人研究機関を含む多くの異なる源からの潜在的な競争に直面している。私たちが開発と商業化に成功したどの候補製品も、現在の治療法と将来出現する可能性のある新しい療法と競争するだろう。もし私たちの競争相手が私たちが開発する可能性のあるいかなる製品よりも安全で、より効果的で、便利で、あるいは副作用が少なく、またはより深刻でない製品を開発·商業化すれば、私たちのビジネス機会は減少または消失する可能性がある。私たちの競争相手はまた私たちよりも早くFDA、NMPA、または他の規制機関からその製品の承認を得ることができるかもしれない。私たちのすべての候補製品の成功に影響を与える重要な競争要素は、効果、安全状況、利便性、コスト、市場参入と支払人の精算、これらの製品に対する販売促進活動レベル及び知的財産権保護を含むと信じている。
私たちのすべての候補製品について、私たちは既存製品と開発中の製品からの競争に直面することが予想されます。以下に説明するものに加えて、承認された場合、候補製品と競合する他の早期臨床計画がある可能性がある。私たちの多くの競争相手は私たちよりも多くの財務、技術、製造、マーケティング、販売、資源または経験を持っています。製薬業界のより多くの合併と買収は、私たちの競争相手により多くの資源を集中させるかもしれない。技術の商業適用性の進展や、これらの分野でより多くの投資可能な資本があるため、競争はさらに激化する可能性がある。著者らの成功はある程度私たちが薬物の組み合わせを確立し、積極的に管理する能力に基づいて、これらの薬物の組み合わせは満足されていない医療需要を満たし、患者の治療において価値を創造することができる。
承認されれば,rademikibartは主にセノフィやRegeneronで販売されているDupixentモノクロナルおよび3 Sbio Inc.の子会社である日光国健製薬が現在開発しているもう1つのIL−4 Rα抗体といくつかの標的適応で競合することが予想される。
重症ADの治療のための使用が承認されると、rademikibartはまた、JAK阻害剤、礼来社で販売されているオルメット、AbbVieで販売されているRINVOQのupadacitinib、ファイザー販売CIBINQOの阿波シチニブ、および市販の抗IL−13中和モノクロナル抗Adbry/Adtrlazaのような他の承認された全身投与製品と直接競合する。臨床開発において、rademikibartが競合することができる他の系統的製品は、lebrikizumab(抗IL-13中和モノマブ;Eli LillyおよびAlmirall S.A.,risankizumab(抗IL-23 mAb;AbbVie)、amlitlimab(抗OX 40 mAb;サイノフェナンシー)、GBR 830(抗OX 40 mAb;Glenmark製薬会社)、KHK 4083(抗OX 40 mAb;Kyowa Kirin/Amgen)、etraasimod(S 1 P 1、S 1 P 4およびS 1 P 5;Arena)、およびPTC-走化調節剤(CCC-4、または受容体4;Remutica-4;Remutica/Rums)を含む。AK 120(抗IL-4αモノクロナル;Akesobio)、MG-K 10(抗IL-4αモノクロナル抗体;Mabgeek)、GR 1802(抗IL-4αモノクロナル抗体、江西志祥製薬)、SHR-1819(抗IL-4αモノクロナル抗体、江蘇恒瑞製薬)、611(抗IL-4αモノクロナル、上海陽光国健製薬)、QX 005 N(抗IL-4αモノクロナル治療会社)
重症喘息の治療のための使用が許可された場合、レドミキバートは、DUPILUMAを含むいくつかの承認された抗体と直接競合し、遺伝子技術/ロースおよびノワール社によってXolairとして販売されたomalizumab、抗IgEモノマブ、アスリコンによってFasenraとして販売されたBenralizumab、抗IL-5モノクロナル抗体、グラクソ史克社によってNucalaとして販売されたMepolizumab、抗IL-5モノクロナル抗体、およびTeva製薬社によるCinqair、抗IL-5モノクロナル抗体、およびAmgen AZenizumabによって販売されたTespireをさらに販売する。喘息の治療では,rademikibartはRPT 193からの競争にも直面する。
UCの治療が承認された場合、icanbelimodは、Janssen PharmPharmticalsによって販売されているインフリキシマブRemicade、抗TfFa中和モノクロナル抗体、AbbVie販売HUMIRAのAdalimumabを含むいくつかのシステム管理抗体および経口免疫療法と競合することが予想される
中和モノクロナル抗体は,ヤンソン製薬社がSimponiのGolimumab,抗腫瘍壊死因子中和モノクロナル抗体,武田製薬会社がEntyvioのvedolizumab,抗A 4?7インテグロン,およびヤンセン製薬社によりStelaraのUstekinumab,抗IL−12/23モノクロナル抗体を販売している。また、icanbelimodは、経口可逆JAK 1およびJAK 3阻害剤であり、現在UCの治療に使用されており、UCの治療に使用されているオザニモド(S 1 P 1、S 1 P 4およびS 1P 5調節剤;百時美施貴宝)であるXeljanzの名称で販売されているTofactinibと競合することも予想される。
臨床開発では、icanbelimodは、UCの治療を競合することができる他の候補製品として、risankizumab(抗IL-23 mAb;AbbVie)、guselkumab(抗IL-23 mAb;Janssen PharmPharmticals)、brazikumab(抗IL-23 mAb;アスリコン)mirikizumab(抗IL-23 mAb;Eli Lilly)、filgog inib(可逆JAK 1阻害剤;Gilead Sciences)、upadacitinib(JAK 1阻害剤;AbbVie)、S 1 rasimod(S 1 R、S 1 Xena;VS 1 R)と競合することができる。
特許、商業秘密、商標、著作権を含む知的財産権は、私たちの業務に非常に重要だ。私たちのビジネス成功は、現在と未来の候補製品および新しい発見、製品開発技術、ノウハウのために独自の知的財産権保護を獲得し、維持する能力にある程度依存しています。一般に、我々の候補製品および関連技術を保護するためには、関連特許権を第三者に付与することによって、または世界各地(米国、中国、ヨーロッパ、および他の主要市場を含む)に特許協力条約(PCT)出願および国家段階特許出願を提出することによって特許保護を求めることができ、いずれの場合も、我々の技術、発明、および改善に関連するテーマに関連しており、これらのテーマは、私たちの業務の発展および実施に非常に重要である。商標、著作権および商業秘密法律、および従業員開示および発明譲渡協定に加えて、技術的ノウハウ、秘密保持方法およびプロセス、および持続的な技術革新によって、私たちの独自の地位を発展させ、維持します。私たちのビジネスの成功はまた、他人の所有権を侵害、流用、または他の方法で他人の所有権を侵害することなく運営する能力、および他人の侵害、流用、または他の方法で私たちの所有権を侵害することを防止する能力にある程度依存する
2023年12月31日現在、発行された70件以上の米国または外国特許を所有または独占的に許可し、米国、中国、イギリス、フランス、ドイツ、スイス、オランダ、スウェーデン、スペイン、ベルギー、イタリア、ロシア、カナダ、オーストラリア、日本、韓国、マレーシア、香港を含む70件以上の未解決特許出願を複数の管轄区域で所有している。
これらの特許および特許出願は、
•Rademikibart事項の構成については、発行された米国特許、発行された外国特許(中国および日本を含む)、および異なる管轄区における係属特許出願を有する特許家族があり、発行された特許および特許出願が発行された場合、利用可能な特許期間の調整または延長を含まず、2036年から2037年の間に満了する予定である。我々のrademikibart計画に関連して発行された中国特許を有する他の2つの特許シリーズがあり、米国を含む異なる司法管轄区における係属中の特許出願が含まれており、米国では、特許出願が承認された場合、2039年から2041年の間に満了する予定であるが、利用可能な特許期間の調整または延長は含まれていない
•Icanbelimodの構成については、発行された米国および外国特許、中国、日本およびヨーロッパにおける特許、および異なる司法管轄区における係属特許出願を含む特許家族を有しており、これらの管轄区において、発行された特許および係属中の特許出願は、利用可能な特許期間調整または延長を含まずに2033年から2034年の間に満了する予定である。我々は中国でも合成方法と結晶形態に関する2つの発行済み特許を有しており,これらの発行された特許は2034年から2035年までに満了する予定である。さらに、我々は、発行された米国特許、発行された外国特許(中国を含む)、および異なる司法管轄区における処理すべき特許出願を有しており、icanbelimodの他の塩および塩結晶形態に関連しており、発行された特許および特許出願が発行された場合、2037年から2038年の間に満了する予定であるが、利用可能な特許期限の調整または延長は含まれていない
個別特許の期限は特許を取得した国の法的期限に依存する。私たちが出願したほとんどの国では,米国を含め,特許期間は非臨時特許出願が提出された最初の日から20年である。米国では,特許期限は特許期限調整を行う資格がある可能性があり,これは,米国特許商標局が特許起訴中に発生した遅延の補償として特許期限を増加させることになる.また、FDAによって承認された薬物をカバーする特許については、1984年の“薬品価格競争および特許期限回復法”または“ハッジ·ワックスマン法案”は、特許期間を特許満了後最大5年間延長することを許可している。特許期間の延長の長さは、薬物が規制審査を受ける期間の長さと関係があるが、特許期間の延長は、特許の残存期間を製品承認日から合計14年間延長することはできない
ハッジ·ワックスマン法によると、各承認された薬剤は1つの特許のみであり、承認された薬剤、使用方法、または製造方法に関する特許要件のみが延長される。欧州や他の外国司法管区にも同様の規定があり、承認された薬物をカバーする特許の期限を延長する。将来、私たちの製品が他の司法管轄区でFDAの承認または適用の承認を受けた場合、私たちは米国および他の管轄区域でこれらの製品のために特許期間を延長することが予想されるが、米国FDAを含む適用当局がこのような延長および延長期間を承認すべきかどうかの評価に同意する保証はない。試験段階や規制審査過程で職務調査を行うことができなかったこと、適用された最終期限内に出願を提出できなかったこと、関連特許が満了する前に出願を提出できなかったこと、適用された要求を満たすことができなかったことなどにより、延期が得られなかった可能性もある
私たちの特許地位は一般的に不確実であり、複雑な法律と事実の問題を扱っている。関連する特許法及びその解釈は,米国国内でも海外でも不確実である。米国および他の管轄区域特許法またはその解釈の変化は、私たちの技術または候補製品を保護する能力を弱める可能性があり、そのような知的財産権の価値に影響を与える可能性がある。特に、私たちは、第三者が私たちの知的財産権を侵害する製品を製造、使用、販売、提供または輸入侵害、流用または他の方法で侵害することを阻止する能力は、私たちの技術、候補製品、発明、および改善をカバーする特許主張を成功的に獲得し、実行できるかどうかにかかっている。私たちは、私たちの任意の未解決特許出願または将来提出または許可される可能性のある任意の特許出願について特許を付与することを保証することはできず、将来私たちまたは私たちの許可者に付与される可能性のある任意の特許が、私たちの製品、使用方法、またはこれらの製品の製造を保護する上で商業的に有用であることを保証することはできない。また,発行された特許は,製品商業化において我々の技術を実践する権利を保証していない.発行された特許は、場合によっては、潜在的な競争相手が発行された特許によって主張される発明を実践することを阻止することのみを可能にする
また、製薬やバイオテクノロジー分野の特許や他の知的財産権は、多くのリスクや不確実な要素に関連して進化している。例えば、第三者は、私たちの候補製品および任意の未来の候補製品を商業化し、私たちの独自技術を実践することを阻止する阻止特許を有することができ、発行された任意の特許は、挑戦、無効、または回避される可能性があり、これは、競争相手のマーケティング関連製品を阻止する能力を制限するか、または候補製品および任意の未来の候補製品の特許保護期間を制限する可能性がある。さらに、公開された特許によって付与された任意の権利の範囲は、競合他社または同様の技術を有する他の当事者のための保護または競争優位性を提供してくれない可能性がある。さらに、我々の競争相手または他の当事者は、発行された特許のいずれの権利の範囲内でも付与されていない同様の技術を独立して開発することができる。このような理由で、私たちは私たちの候補製品と未来の任意の候補製品の面で競争に直面するかもしれない。さらに、潜在的製品の開発、テスト、および規制審査に要する時間が長いため、任意の特定の候補製品が商業化できる前に、候補製品に対する任意の特許保護は、商業化後非常に短い期間で満了または有効に維持される可能性があり、それにより、特許提供の商業的利点が減少する
私たちはまた、ビジネス秘密法の保護に依存し、当社の業務において特許保護から保護されているか、または特許保護に適していないと考えられる側面を保護し、独自の情報の機密性の保護と維持を求めています。例えば、私たちのビジネス秘密は、プロジェクトに固有のいくつかの合成、処方、患者選択戦略、および私たちの研究のいくつかの態様を含む。私たちの政策は、私たちの従業員、コンサルタント、外部科学協力者、賛助された研究者、および他のコンサルタントに、私たちとの雇用またはコンサルティング関係を開始する際に秘密保護協定に署名し、従業員とコンサルタントに発明譲渡協定を締結することを要求することです。これらの協定は、個人と我々との関係中に開発または開示されたすべての機密情報は、特定の場合を除いて第三者に開示されてはならないことを規定することを意図している。適用される場合には、合意は、個人が発明者として貢献したすべての発明を私たちに譲渡し、それにより私たちの財産となることも規定されている。しかし、このような合意および私たちの政策が、そのような情報を無許可に使用または開示する場合に、私たちの商業秘密に意味のある保護または十分な救済措置を提供することは保証されない。私たちはまた、実際に私たちを自分の知的財産権として発想したり開発したり、私たちの機密情報へのアクセスを得たすべての当事者とこのような合意に達することができないかもしれません。知的財産権の譲渡は自動的に実行されないかもしれないし、合意に違反する可能性があり、第三者にクレームをつけさせられたり、私たちが私たちの知的財産権の所有権だと思うことを決定するために、私たちが提起したクレームを弁護したりすることができます。また、第三者が私たちのノウハウを盗用することを防止するために、物理的および技術的セキュリティ対策のような他の適切な予防措置を講じている。また、米国、中国、その他の複数の司法管轄区域で“生物製薬”と“コン乃徳生物”を結ぶ商標保護を求めている。
2012年6月、私たちはアリーナと独占ライセンス契約またはアリーナ協定を締結した。その後改訂されたアリーナ協定に基づき、アリーナは、当社等に世界的独占(アリーナを除くが、内部研究用途を除く)、印税を徴収し、再許可可能(特定の条件に制限されている)のライセンスを付与し、H 3 RアンタゴニストおよびこのようなH 3 Rアンタゴニストの製造および使用に関連するいくつかの特許およびノウハウ下の製品を識別、研究、開発、製造、製造、使用、販売および輸入する
競技場協定によると、吾らは事前に競技場に60日間の書面通知を出した後、無断で競技場合意を終了する権利がある。2024年3月現在、通知日後60日以内に有効となるアリーナプロトコルの無断終了通知をアリーナに送信しました。終了後,吾らはアリーナへの譲渡·交付(I)吾らがアリーナ合意によって許可されたか,あるいは吾らがアリーナ合意の有効期間内およびその後1年以内に開発した特許製品に関するノウハウおよび特許の権利,所有権および権益,および(Ii)特許製品に関する規制届出,出願および承認を責任を負う。
中国国内の材料許可、承認、許可証、許可証
私たちは中国の子会社を通じて一部の業務を展開しています。私たちの候補製品rademikibartとicanbelimodのIND承認および私たちの各中国子会社の営業許可証は私たちの中国子会社が中国で業務を展開するために必要な実質的な許可、承認、許可証、許可です。さらに、大中国地域でRdemikibartを開発·商業化する権利をSimcereライセンス受け入れ先にアウトソーシングしています。したがって,ライドミキバートの大中国での商業化については,国家食品薬品監督管理局に秘密保持協定を提出する必要はない。
政府規制と製品審査
アメリカの法規
私たちはアメリカで業務をしているバイオ製薬会社として広く規制されている。その中、FDA、アメリカ衛生·公衆サービス部監察長事務室、医療保険と医療補助サービスセンター(CMS)及び州と地方司法管轄区の類似規制機関は著者らが開発している薬物と生物製品の臨床開発、製造、マーケティングと流通に参与する会社に対して大量の激務の要求を提出した。これらの機関と他の連邦、州と地方実体は私たちの候補製品の研究開発、テスト、製造、品質管理、安全、有効性、ラベル、包装、貯蔵、記録保存、承認、広告と販売促進、流通、承認後の監督と報告、サンプリングと輸出入などの方面に対して監督を行う。
アメリカの薬品や生物製品の規制は
アメリカでは、FDAは連邦食品、薬物と化粧品法案(FDCA)及びその実施条例に基づいて薬品を監督し、FDCAと公衆衛生サービス法(PHSA)及びその実施条例に基づいて生物製品を監督する。規制の承認を得て、その後、適切な連邦、州、地方、外国の法規と条例を遵守する過程には、多くの時間と財政資源が必要だ。製品開発過程,承認過程又は承認後のいずれかの場合,出願人が適用される米国の要求を遵守できない場合には,行政又は司法制裁を受ける可能性がある。FDAの制裁には、承認保留申請の拒否、承認撤回、臨床一時停止、警告または他の実行書、製品のリコールまたは市場からの撤回、製品の差し押さえ、生産または流通禁止の完全または部分的な一時停止、罰金、政府契約の拒否、元の回復、返還または民事または刑事罰が含まれる可能性がある。どんな機関や司法法執行行動も私たちに実質的な悪影響を及ぼすかもしれない
薬品或いは生物製品はアメリカで発売される前にFDAの許可を得る必要があり、しかもそれらは他の連邦、州と地方法規の制約を受けている。FDAが候補製品が米国で発売される前に必要とされるプログラムは、一般に以下のような態様を含む
•広範な臨床前実験室テストと臨床前動物研究を完成し、その中のいくつかは良好な実験室実践或いはGLP、法規とその他の適用要求に従って行わなければならない
•ヒト臨床研究が開始される前に発効しなければならない研究用新薬出願またはINDをFDAに提出する
•各臨床研究が開始される前に、各臨床サイトの独立したIRBまたは倫理委員会の承認;
•良好な臨床実践またはGCPの要求に基づいて十分かつ良好に制御された人体臨床研究を行い、安全性と有効性を決定し、あるいは生物製品について、各提案された適応について候補製品の安全性、純度と効力を決定する
•すべての重要な臨床研究が完了した後、新薬申請またはNDAまたは生物製品許可証申請またはBLAをFDAに提出する準備ができ、これらの研究は分析研究および非臨床試験および臨床試験結果からの薬物安全性、純度および有効性の実質的な証拠を含む
•適切かつ適用された場合、FDA諮問委員会の審査は満足的に完了する
•FDAは、NDAまたはBLAを受信した60日以内に再審申請を提出することを決定した
•現在の良好な製造規範(CGMP)のコンプライアンスを評価し、NDAまたはBLAをサポートするデータを生成する非臨床研究および臨床試験会場の検査を完了し、GCPに適合することを保証するために、FDAの生産推奨製品の1つまたは複数の製造施設の検査を満足的に完了させることができる
•FDAは、米国で任意の商業マーケティングまたはこの薬剤を販売する前に、NDAまたはBLAの審査および承認を行う。
INDはFDAが研究用新薬や生物製品の使用をヒトに許可する要求である。初期IND提出の中心的な焦点は一般研究計画と臨床試験の案である。INDによって提出された文書は、製品の毒性学、薬物動態学、薬理学および薬効学的特徴、化学、製造および対照またはCMC、情報、および研究製品の使用を支援するために、製品の毒性学、薬物動態学、薬理学および薬効学的特徴を評価する動物およびインビトロ研究の結果をさらに含む。INDはヒト臨床試験が始まる前に発効しなければならない。INDはFDAが30日以内に提案された臨床試験に対して安全懸念または問題を提起しない限り、FDA受信後30日以内に自動的に発効する。この場合,INDは臨床的に放置される可能性があり,INDスポンサーやFDAは臨床試験が開始される前に未解決の問題や問題を解決しなければならない。したがって,INDの提出はFDA認可による臨床試験の開始につながる可能性があり,そうでない可能性もある。
臨床試験は、GCPに従って合格した研究者の監督の下でヒト被験者に研究製品を服用することを含み、すべての研究対象に任意の臨床研究に参加するためのインフォームドコンセントを提供することを含む。臨床試験は,研究目標,用量プログラム,被験者選択と排除基準,安全性をモニタリングするためのパラメータ,評価すべき有効性基準を詳細に説明するレジメンで行った。製品開発中に行われる各後続の臨床試験および後続の任意のレジメン修正は、既存のINDに個別に提出されなければならない。INDは活発であるが、前回の進展報告以来行われた臨床試験と非臨床研究結果の進展報告をまとめ、他の情報以外に、少なくとも毎年1回の書面IND安全報告をFDAに提出しなければならず、その中でFDAと調査者に書面IND安全報告を提出しなければならず、深刻かつ意外な疑わしい不良事件を理解し、他の研究結果は同じ或いは類似の薬物に暴露することは人類に対して重大なリスクがあることを表明し、動物或いは体外試験結果は人類に対して重大なリスクがあることを表明し、及び方案或いは研究者のマニュアルに列挙された深刻な疑わしい不良反応の発生率と比較して、任意の臨床重要な疑わしい副作用の発生率は増加する。
また,臨床試験を推奨する各地点の独立IRBは,その地点で臨床試験を開始する前に任意の臨床試験の計画とそのインフォームドコンセントを審査·承認しなければならず,完成まで研究を監視しなければならない。FDAのような規制機関は、一部または全ての臨床休止を実施することができ、またはIRBまたはスポンサーは、対象が受け入れられない健康リスクに直面していることを発見すること、または試験がその宣言の目標を達成することができないことを発見することを含む、様々な理由に基づいて随時臨床試験を一時停止することができる。いくつかの研究はまた、臨床研究スポンサーによって組織された独立した合格専門家グループの監視を含み、このグループは、研究のいくつかのデータへのアクセスに基づいて、研究が指定されたチェックポイントで行うことができるかどうかを許可するデータ安全監視委員会と呼ばれ、被験者に受け入れられない安全リスクまたは他の理由があると判定された場合、治療効果を示さない場合、臨床試験を停止する可能性がある。現在行われている臨床前研究,臨床試験,臨床研究結果を公的登録機関に報告することに関する要求もある。
薬物の臨床研究は一般的に3段階に分けられる。これらの段階は通常順序で行われるが、それらは重複したり統合されたりする可能性がある。
•研究製品は、最初に健康なヒト被験者または標的疾患または状態を有する患者に導入される。これらの研究は人体内における製品の安全性、用量耐性、吸収、代謝、分布と排泄、及び用量増加に関連する副作用をテストし、可能な場合に有効性の早期証拠を得ることを目的としている。
•段階2.初期治療効果、最適用量および用量計画を評価し、可能な不良副作用および安全リスクを決定するために、特定の疾患または状態のための製品の限られた患者集団を研究する。より大規模かつより高価な3期臨床試験を開始する前に、複数の2期臨床試験を行って情報を得ることができる。
•第三段階:製品を拡大した患者群に研究し、用量を更に評価し、臨床治療効果の統計的顕著な証拠を提供し、更に安全性をテストし、通常複数の地理的に分散した臨床試験地点で行われる。これらの臨床試験は研究製品の全体的なリスク/収益比を確定し、製品ラベルに十分な基礎を提供することを目的としている。
場合によっては、FDAは、スポンサーの同意を得て承認された後に追加の臨床研究を行うことを条件に、候補製品のNDAまたはBLAを承認する可能性がある。他の場合、スポンサーは、承認された後に自発的に追加の臨床研究を行うことができ、その薬剤に関するより多くの情報を得ることができる。このような承認後の研究は通常4期臨床研究と呼ばれる。
スポンサーは選択可能であるが,必要ではなく,IND下で海外臨床研究を行っている。ある国外の臨床研究がIND下で行われる時、放棄しない限り、すべてのIND要求を満たさなければならない。もし国外の臨床研究がINDの下で行われない場合、スポンサーはこの研究がFDAのいくつかの法規要求に符合することを確実にしなければならず、この研究をINDを支持する或いはアメリカで上場許可を申請する研究として使用しなければならない。具体的には,このような研究はGCPに従って行わなければならず,FDAが現場検査を行う必要があると考えた場合,FDAは現場検査により研究データを検証できる必要がある。マーケティング申請が外国の臨床データのみに基づいていれば、研究がIND下で行われるか否かにかかわらず、FDAは研究をGCP要求に従って行うことが要求され、データはアメリカ人口とアメリカの医療実践に適用される。海外の研究は公認能力を有する臨床調査者が行う必要があり,FDAがこのような検査を行う必要があると考えた場合,FDAは現場検査や他の適切な手段でデータを検証できる必要がある。
臨床試験と同時に、会社は追加の動物研究を完成させ、候補製品の生物学的特性に関する追加情報を開発することができ、cGMP要求に基づいて商業量産製品の過程を最終的に決定しなければならない。製造過程は高品質の候補製品ロットを持続的に生産できる必要があり、特に最終製品の特性、強度、品質と純度をテストする方法を開発しなければならない、あるいは生物製品に対しては、安全、純度、効力の試験方法を開発しなければならない。また,適切な包装を選択·テストし,候補製品が賞味期限内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない。
セキュリティプロトコルとBLAレビューの流れ
すべての適用された法規要件に基づいてすべての要求されたテストが成功したと仮定し、製品開発の結果、非臨床研究および臨床試験を含み、NDAまたはBLAの一部としてFDAに提出され、その製品を1つまたは複数の適応の市場に使用することの承認を要求する。NDAやBLAは,否定や曖昧な結果や積極的な発見,製品のCMCや推奨タグに関する詳細な情報など,関連する臨床前研究や臨床試験から得られたすべての関連データを含まなければならない。データは、製品の安全性および有効性を試験するための会社によって支援された臨床研究から来ることができ、研究者によって開始および賛助された研究を含む多くの代替源から来てもよい。セキュリティプロトコルまたはBLAを提出するには、免除または免除が適用されない限り、FDAに大量のアプリケーション使用料を支払う必要がある。
さらに、小児科研究公平法またはPREAによれば、NDAまたはBLAまたはNDAまたはBLAのサプリメントは、すべての関連する小児科サブセットにおいて主張される適応候補生物製品の安全性および有効性を評価し、その安全に有効であると考えられる各小児科サブセットの用量および投与をサポートするためのデータを含まなければならない。FDAは、新しい活性成分、新適応、新剤形、新投与レジメンまたは新投与経路を含む薬物または生物製品をマーケティング申請に提出することを計画しているスポンサーは、第2段階会議終了後60日以内に、またはスポンサーとFDAとの間で合意した場合に、初歩的な小児科研究計画を提出しなければならない。規制が別途要求されない限り、PREAは、孤児の称号が付与された医薬または生物学的製品のいかなる適応にも適用されない。
出願が提出されてから60日以内に、FDAは、出願が実質的に完了したかどうかを決定するために、提出されたBLAまたはNDAを審査し、その後、FDAはその提出を受け入れる。FDAは、それが不完全であるか、または提出時に適切に審査できないと考えられる任意のNDAまたはBLAの提出を拒否することができ、より多くの情報の提供を要求する可能性がある。この場合,秘密保持プロトコルやBLAおよび付加情報を再提出しなければならない.NDAやBLAが受け入れられると
届出については,FDAは届出日後10カ月以内に基準申請を審査すること,あるいは,申請に資格優先審査があれば,FDAが届出申請を受けてから6カ月以内に審査することを目標としている。標準審査および優先審査では、FDAは、出願の主な修正として指定された新しい情報に応答するために、審査プロセスを3ヶ月延長することもできる。FDAがセキュリティプロトコルを検討する目的の1つは、製品がその予期される用途に対して安全かつ有効であるかどうかを決定すること、およびその製造が製品の特性、強度、品質、および純度を確保し維持するのに十分であるかどうかを決定することである。FDAは、製品が安全で、純粋かつ有効であるかどうか、およびその製造、加工、包装、または保持されている施設が、製品の持続的な安全、純度および効力を保証するための基準に適合しているかどうかを決定するためにBLAを審査する。NDAやBLAを審査する際には,FDAは諮問委員会を招集し,審査申請について臨床見解を提供することができる。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を慎重に考慮するだろう。
NDAまたはBLAを承認する前に、FDAは、通常、製品を製造する1つまたは複数の施設を検査する。FDAは、製造プロセスおよび施設がcGMP要件に適合していることを決定し、要求された仕様の下で製品が一貫して生産されることを保証するのに十分でない限り、申請を承認しないであろう。さらに、NDAまたはBLAを承認する前に、FDAは、通常、GCPに適合することを確実にするために、1つまたは複数の臨床場所を検査する。
FDAがNDAまたはBLAを評価し、研究製品および/またはその薬剤を生産する製造施設を任意の必要な検査を行った後、FDAは、承認状または完全な返信、またはCRLを発行する可能性がある。承認書は、製品の商業マーケティングを許可し、特定の適応に関する具体的な処方情報を提供する。CRLは,FDAがNDAまたはBLAで発見したすべての欠陥を記述する.決定された欠陥は微小である可能性があり、例えば、ラベル変更が必要であるか、または重大であり、例えば、追加の臨床試験が必要である。また,CRLは,申請者がとる提案行動を含むことができる.CRLが発行された場合,申請者はNDAまたはBLAを再提出し,手紙で決定されたすべての欠陥を解決し,申請を撤回するか,公聴会の開催を要求することができる.このようなデータや情報を提出しても,FDAはBLAやNDAが承認基準を満たしていないと決定する可能性がある.
1つの製品が規制部門の承認を受けた場合、このような承認は特定の適応が付与され、製品が発売される可能性のある指定用途の制限をもたらす可能性がある。例えば、FDAは、製品の利点がそのリスクよりも大きいことを確実にするために、リスク評価および緩和戦略(REMS)を有するNDAまたはBLAを承認する可能性がある。REMSは、製品に関連する既知または潜在的に深刻なリスクを管理し、そのような薬剤の安全な使用を管理することによって、患者がこれらの薬剤を継続的に得ることを可能にするための安全戦略であり、制限された分配方法、患者登録、および他のリスク最小化ツールのような薬物ガイドライン、医師のコミュニケーション計画、または安全使用を保証する要素を含むことができる。FDAはまた,提案されたラベルを変更したり,適切な制御や仕様を作成したりすることを条件に承認することも可能である.FDAはまた、商業化後の製品の安全性および有効性をさらに評価および監視するために、1つまたは複数の第4段階上場後の研究または監視計画を行うことを要求することができ、これらの上場後の研究の結果に基づいて製品のさらなる販売を制限する可能性がある。
開発と審査計画を加速する
FDAは合格した候補製品に一連の迅速な開発と審査計画を提供した。例えば、高速チャネル計画は、特定の基準に適合する候補製品の審査プロセスを加速または促進することを意図している。具体的には、候補製品が深刻または生命に危険な疾患または状態を治療することを意図し、その疾患または状態が満たされていない医療需要を満たす潜在力を示す場合、迅速なチャネル指定を得る資格がある。高速チャネルは,候補製品と研究中の特定の適応に適した組合せを指定する.高速チャネル候補製品のスポンサーは,製品開発期間中に審査チームとより頻繁なインタラクションを行う機会があり,機密協定やBLAが提出されると,申請は優先審査を受ける資格がある可能性がある.高速チャネル候補製品もスクロール審査を行う資格がある可能性があり、この場合、FDAは、完全な出願を提出する前に、NDAまたはBLAの審査部分をスクロール考慮することができ、スポンサーがNDAまたはBLA部分を提出するスケジュールを提供した場合、FDAはNDAまたはBLAの部分を受け入れることに同意し、スケジュールは許容可能であると判断し、スポンサーはNDAまたはBLAの第1の部分を提出する際に任意の必要な使用料を支払うことができる。
重篤または生命に危険な疾患や状況を治療しようとする候補品も,その開発や審査を加速するための画期的な療法指定を受ける資格がある可能性がある。予備臨床証拠が、候補製品が単独で、または1つまたは複数の他の薬物または生物学的製品と組み合わせて使用されることを示す場合、候補製品は、1つまたは複数の臨床的重要終点において、例えば、臨床開発早期に観察される実質的な治療効果を示す可能性がある場合、候補製品は、画期的な治療指定を得ることができる。この指定には、高速チャネル計画のすべての機能と、より密なFDA相互作用およびガイダンスが含まれています
最初に第1段階から、組織は高級管理者の参加を含む候補製品の開発と審査を加速させることを約束した。
迅速なチャネル指定および/または画期的な治療指定を有する候補製品を含むFDA承認を提出する任意の医薬またはバイオマーケティング出願は、優先審査のようなFDAの審査および承認プロセスを加速することを意図した他のタイプの計画の資格に適合する可能性がある。候補製品が重篤な疾患または状態の治療、診断または予防に著しい改善を提供する可能性がある場合、BLAまたはNDAは優先的に審査する資格がある。新しい分子実体NDAおよび元のBLASについて、優先審査指定は、FDAの目標が、提出日から6ヶ月以内に上場申請に行動することであることを意味する(標準審査では10カ月)。
さらに、適用される臨床試験の設計によれば、深刻または生命に危険な疾患または状況の治療において安全性および有効性研究を行う候補製品は、候補製品が臨床利益を合理的に予測する可能性のある代替終点を決定するか、または不可逆的な発病率または死亡率よりも早く測定可能な臨床終点、不可逆的な発病率または死亡率または他の臨床的利益を合理的に予測する可能性のある代替終点を決定する上で有効である場合に、病状の重症性、希少性または盛行度、および代替療法の利用可能性または不足を考慮しながら、加速承認を得る可能性がある。承認を加速する条件として、FDAは、通常、不可逆的な発症率または死亡率または他の臨床的利益に対する予想される影響を検証および説明するために、スポンサーに十分かつ制御された検証的臨床研究を要求し、これらの研究が承認時に行われていることを要求する可能性がある。スポンサーが必要な検証的研究やこのような研究が予測の臨床的利益を検証できなかった場合、加速された承認を得た製品は迅速な脱退プログラムの影響を受ける可能性がある。また、FDAは現在、承認を加速させる条件として宣伝材料を事前承認することを求めており、製品商業発売の時期に悪影響を及ぼす可能性がある。
迅速チャネル指定、画期的な治療指定、優先審査、および承認の加速は、承認の基準を変更することはありませんが、開発または承認プロセスを加速させる可能性があります。1つの製品がこれらの計画のうちの1つまたは複数に適合していても、FDAは、製品がもはや資格条件に適合していないことを後で決定することができ、またはFDAの審査または承認を決定する期間が短縮されないことができる。私たちは私たちの候補製品のためのいくつかの機会を適切に探索するかもしれない。
孤児薬名
孤児医薬品法によれば、FDAは、米国では20万人未満に影響を与えるか、または米国では20万人を超える影響を与える稀な疾患または疾患を治療するための薬剤または生物に孤児の称号を付与することができるが、米国では、そのような疾患または疾患を治療する薬剤または生物薬剤を米国で開発および提供するコストが、米国での薬剤または生物学的薬剤の販売から回収されることを合理的に予想することができない。NDAやBLAを提出する前に,指定孤児薬を申請しなければならない。FDAが孤児薬物指定を承認した後、FDAは、治療薬の模倣薬識別情報およびその潜在的孤児の使用を開示する。孤児薬物の指定は、規制審査または承認過程においていかなる利点も伝達されず、規制審査または承認過程の持続時間を短縮することもない。
孤児医薬品の指定を受けた製品が、その後、そのような指定を受けた疾患または状態に対して最初の FDA 承認を受けた場合、その製品は孤児医薬品独占権を有します。つまり、限られた状況を除き、 FDA は、同じ疾患または状態に対して同じ医薬品または生物学的医薬品を販売するための完全な NDA または BLA を含む他の申請を 7 年間承認することはできません。例えば、孤児医薬品独占製品に対する臨床的優位性の示し、または FDA が孤児医薬品独占保有者が、その医薬品または生物学的医薬品が指定された疾患または状態の患者のニーズを満たすのに十分な量の孤児医薬品の入手可能性を保証できることを示していないと判断した場合。孤児医薬品の排他性は、 FDA が同じ疾患や状態に対して異なる医薬品や生物学的医薬品を承認することを妨げるものではありません。孤児医薬品指定のその他の利点としては、一部の研究に対する税額控除や、 NDA または BLA 申請の利用料の免除がある。
指定された孤児薬物が孤児が指定された適応よりも広い用途で承認された場合,孤児薬物の排他性を得ることはできない。さらに、FDAが指定された要求に重大な欠陥があると後に判断した場合、または製造業者がこのような稀な疾患または疾患患者の需要を満たすのに十分な数の製品を保証できない場合、米国での独占営業権を失う可能性がある。
承認後に要求する
FDAによって製造または流通が許可された任意の製品は、記録保存、有害事象報告、定期報告、製品サンプリングおよび流通、ならびに製品広告および販売促進に関連する要件を含むFDAによって普遍的かつ持続的に規制される。承認後、承認された製品の大多数の変更は、新たな適応または他のラベル宣言を追加するなど、FDAの事前審査および承認を経なければならない。継続的なユーザ料金要求もあり,この要求に基づいて,FDAは承認されたNDAまたはBLAで決定された製品ごとの年間計画費用を評価する.医薬品および生物製造業者およびその下請け業者は、FDAおよびいくつかの州機関に彼らの機関を登録し、BLAまたはNDA保持者および任意の第三者製造業者へのいくつかの手続きおよび文書要件を含むcGMPに適合することを確実にするために、FDAおよびいくつかの州機関の定期的な抜き打ち検査を受けなければならない。製造プロセスの変更は厳しく規制されており,変更の重要性により,FDAが事前に承認して実施する必要がある可能性がある。FDAの規定はまた、cGMPから外れた状況を調査·是正し、私たちと私たちが使用を決定する可能性のある任意の第三者メーカーに報告することを要求している。そのため、メーカーは、cGMPの遵守やその他の規制遵守を維持するために、生産や品質管理の分野で時間、お金、精力をかけ続けなければならない。
規制要件や基準が守られていない場合、あるいは製品発売後に問題が発生した場合、FDAは承認を撤回する可能性がある。その後、製品には、予期されない深刻度または頻度の不良事象、または生産プロセス、または規制要件を遵守できなかったことを含む、以前に未知の問題が存在することが発見され、新しいセキュリティ情報を追加するために承認されたラベルの改訂を招く可能性がある;新しい安全リスクを評価するために発売後研究または臨床研究を実施すること、またはREMS計画に従って流通制限または他の制限を実施することが可能である。他の他の潜在的な結果には
•製品の販売または製造を制限し、市場から製品を完全に撤退させるか、または製品をリコールすること
•承認後の臨床研究には罰金、警告状、放置を科す
•FDAは、承認されるべき出願の承認または承認された出願の追加を拒否するか、または既存の製品の承認を一時停止または撤回する
•製品が差し押さえられたり、差し押さえられたり、米国食品薬品監督管理局は製品の輸出入を許可することを拒否した
•法令に同意し、会社の誠実な合意に同意し、連邦医療計画の資格を取り消したり、除外したりする
•宣伝材料とラベルを強制的に修正し、訂正情報を発表する
•セキュリティ警報、親愛なるヘルスケア提供者への手紙、プレスリリース、および製品に関する警告または他のセキュリティ情報を含む他の通信;または
•民事または刑事処罰を禁令または適用する。
FDAは薬品と生物製品のマーケティング、ラベル、広告と販売促進を密接に監督している。1社はFDAが承認したラベルの規定に基づいて、安全性と有効性、純度、効力に関する声明しか提出できない。FDAと他の機関は非ラベル用途の普及を禁止する法律法規を積極的に施行している。これらの要求を守らないことは、否定的な宣伝、警告状、改正広告、および潜在的な民事と刑事罰を招く可能性がある。医師は、製品ラベルに記載されていない使用のための合法的に入手された製品の処方、および我々が試験およびFDAによって承認された用途とは異なる使用を行うかもしれない。このようなラベル外の使用は医学専門科でよく見られる。医師は,異なる場合,このような非ラベル使用が多くの患者の最適な治療法であると考えるかもしれない。FDAは医者が治療を選択する時の行動を規範化しない。しかし、FDAは製品ラベルの外使用問題に対する製造業者のコミュニケーションを制限した。
薬品マーケティング排他性
FDCAによって許可された市場排他性条項は、いくつかのマーケティング申請の提出または承認を延期する可能性がある。例えば、FDCAは、新しい化学エンティティ秘密協定の承認を得た最初の出願人に、5年間の米国内の非特許データ排他期間を提供する。FDAが以前に同じ活性部分を含む任意の他の新薬、すなわち分子またはイオンを承認していない場合、薬物は、薬物がエステル、塩または他の非共有結合誘導体であることをもたらす分子またはイオン、水素結合または配位結合を有する塩、または医薬物質の作用を担う錯体、キレートまたはケージ化合物などの他の非共有結合誘導体を含まない新しい化学物質である。排他的期間内に、FDAは、他方から提出された簡略化された新薬出願またはANDAを承認または受け入れないか、または505(B)(2)条または505(B)(2)条に従って提出されたNDAを承認しない可能性がある
出願人が合法的な権利を有していないか、または承認に必要なすべてのデータを有していない場合、その薬剤が元の革新薬と同じ適応であるか、別の適応のためのものであるかにかかわらず、会社は同じ活性部分に従って別の薬剤を会社に申請することができる。しかしながら、出願がイノベーターNDA所有者がFDAに記載された特許のうちの1つを含む特許が無効または未侵害証明である場合、4年後に出願することができる。
FDAが、出願人が行っているまたは後援する新しい臨床研究(バイオアベイラビリティ研究を除く)が、既存の薬剤の新しい適応、用量または強度のような出願の承認に重要であると考えている場合、FDCAは、NDAまたは既存のNDAに3年間の非特許排他性、または既存のNDAの補完を提供することができる。この3年間の排他性は、新しい臨床研究に基づいて承認された承認条件のみをカバーし、FDAがANDAまたは505(B)(2)NDAを承認することは禁止されておらず、元の適応または使用条件の有効成分を含む薬剤に使用される。5年と3年の排他性は完全な秘密協定の提出や承認を延期したり承認したりしないだろう。しかしながら、完全なセキュリティプロトコルを提出する出願人は、安全かつ有効であることを証明するために、任意の臨床前研究および十分かつ良好に制御された臨床試験を参照するために必要な権利を行うか、または得ることを要求されるであろう。
小児科専門権は米国で利用可能な別のタイプのマーケティング専門権である。小児科排他性規定は,スポンサーがFDAの書面請求に応じて児童に臨床試験を行う場合,別の既存特許期間または規制排他期間内に追加6カ月の排他性を付加することを規定している。“書面申請”の発表はスポンサーに述べた臨床試験を要求していない
生体模倣薬と参考製品の排他性
2009年の“生物製品価格競争と革新法”(BPCIA)は、高度に類似している、またはFDAによって承認された参考生物製品と交換された生物製品のための短い承認の道を開いた。FDAはすでにいくつかの指導文書を発表し,生体模倣薬の審査·承認方法について概説した。生物類似性は生物製品と参照製品が安全性、純度と効力の面で臨床的に意義のある差異が存在しないことであり、通常分析研究、動物研究と臨床研究によって示される。互換性は、製品が基準製品生物と類似していることを必要とし、この製品は、任意の所与の患者において、参照製品と同じ臨床結果を生成することが期待できることを証明しなければならず、複数回投与された製品の場合、以前の投与後、生物および参照生物は、安全リスクを増加させることなく、または参照生物の独占的使用と比較して治療効果のリスクを低下させることなく、交互にまたは交換することができる。FDAによって承認された参照生物製品と類似しているか、または交換可能であることが証明された製品は、FDAが以前に承認された参照製品の安全性および有効性の決定に部分的に依存する可能性があり、これは、承認された製品を市場に投入するのに要するコストおよび時間を減少させる可能性がある。
BPCIAによると,生物類似製品の申請は,参考製品が初めてFDA許可を得た4年後にFDAに提出されなければならない。また,FDAによる生物類似製品の承認は,参考製品が初めて許可された日から12年後に発効する可能性がある。この12年間の独占期間内に、FDAが競合製品の完全なBLAを承認した場合、出願人自身の臨床前データと、その製品の安全性、純度および有効性を証明するために、十分かつ良好に制御された臨床試験からのデータとを含み、別の会社は、参照製品の競合バージョンを販売する可能性がある。BPCIAはまた、交換可能な製品として承認された生物模倣薬のためにいくつかの専用期間を設けた。この節では,FDAが“交換可能”と考えている製品が本当に州薬剤法に管轄されている薬局に取って代わられるかどうかは不明である。
以上のように,生物製品は米国でも小児科市場の排他性を得ることができ,BLAスポンサーが自発的に小児科研究を完了すれば,FDAがこのような研究を行う“書面請求”に公平に対応している
アメリカ医療保険法
薬品と医療機器メーカーは連邦政府およびそれらが業務を展開する州と外国司法管轄区当局の追加医療法規と法執行の制約を受けている。このような法律には、連邦および州の反リベート、詐欺および乱用、虚偽声明、価格報告および透明性法律、および米国以外の司法管轄区の同様の外国法律が含まれているが、以下の議論に限定されない法律が含まれているが、これらに限定されない。
他の事項に加えて、連邦反バックル法規は、個人およびエンティティが任意の商品またはサービスを誘導または奨励するために、個人およびエンティティを直接または間接的に、公開または隠蔽的に現金または実物の形態で要求、提供、支払い、受け入れ、または提供することを禁止し、個人の推薦または購入、注文または推薦の任意の商品またはサービスを誘導または奨励し、これらの商品またはサービスは、連邦医療保健計画に従って全部または部分的に支払うことができる。個人や実体は,連邦の“反リベート法令”やその法令違反の具体的な意図を実際に知る必要がなく,違法行為を実施することができる.連邦反リベート法違反の有罪判決は刑事罰金および/または監禁を招き、連邦医療計画への参加を強制的に排除することを要求する可能性がある。もし政府が1つの実体が連邦反リベート法規によって禁止された行為を犯したと判断すれば、連邦医療計画から除外することもできる。
個人または実体が知らずに連邦政府に虚偽、架空または詐欺的な支払いまたは承認請求を提出または提出することを禁止する民事虚偽請求法案を含む連邦民事罰金および虚偽クレーム法律、虚偽または詐欺的なクレームまたは連邦政府への金銭または財産の支払いまたは移転の義務を故意に行い、使用または使用または虚偽陳述または記録材料の使用または使用を引き起こすこと、または連邦政府への金銭または財産の支払いまたは移転の義務を故意に隠蔽または故意に回避または不当に減少させることを含む、連邦民事罰金および虚偽クレーム法律。FCAによると、メーカーが政府支払人に直接クレームを提出していなくても、虚偽や詐欺的なクレームを“原因”とされていれば、責任を問われる可能性がある。FCAはまた、“密告者”としての個人代表が連邦政府を代表して訴訟を起こし、FCA違反を告発し、任意のお金を共有して取り戻すことを許可している。また,政府は,FCAについては,連邦反リベート法規違反による物品やサービスを含むクレームが虚偽または詐欺的クレームを構成していると断言できる。FCAの責任は医療保健業界において潜在的に大きな意義を持っており、この法規は、違反の虚偽或いは詐欺的なクレーム或いは声明に対して、3倍の損害賠償金と重大な強制的処罰を支払わなければならないと規定しているからである。FCA違反に対する処罰には、政府の実際の損害賠償の3倍に達し、個々の単独の虚偽クレームまたは陳述に対する強制的な民事処罰が含まれる可能性がある。他の処罰は連邦医療計画から除外される可能性があることを含む。また,FCAは民事法規であるにもかかわらず,FCA違反には様々な連邦刑法が関与している可能性がある。FCAに類似した米国連邦刑事虚偽請求法案もあり、連邦政府に虚偽、架空または詐欺的クレームを提出または提出した人に刑事責任を課す。
連邦民事罰金法は、以下の活動に従事するエンティティに巨額の民事罰金を科すことを許可する:(1)意図的に、要求通りに提供されていないサービスクレームの提出、または任意の方法で虚偽または詐欺を提出すること、(2)連邦医療計画から除外された個人またはエンティティと契約を締結して、連邦医療保険または連邦医療計画によって精算可能な項目またはサービスを提供すること、(3)連邦反減税法規に違反すること、または(4)既知の追加金を報告および返還すること。
HITECHおよびそのそれぞれの実施条例改正されたHIPAAは、任意の医療福祉計画(個人支払人を含む)を詐欺するために計画を故意に実行または実行しようとしているか、知っていることを知って医療福祉計画を故意に流用または窃取し、医療違反行為に対する刑事調査を故意に阻害したり、重大な事実を偽造、隠蔽または隠蔽または隠蔽したり、医療福祉、プロジェクトまたはサービスの交付または支払いに関連する任意の重大な虚偽陳述を行う行為に対して、刑事および民事責任を適用する。連邦反リベート法規と同様に、個人または実体は、この法規やこの法規に違反する具体的な意図を実際に知る必要がなく、違反を実施することができる。
“医師支払い陽光法案”は、連邦医療保険、医療補助または児童健康保険計画に基づいて支払うことができる薬品、器具、生物製品および医療用品のいくつかのメーカーに対して、医師(現在、医師、歯科医師、検眼師、足科医師および脊椎マッサージ師を含むと定義されている)、特定の非医師提供者(医師アシスタントおよび勤務看護師を含む)、教育病院およびこれらの医師およびその直系親族が所有する所有権および投資権益に提供されるいくつかの支払いおよび“価値移転”を含む年次報告要件を規定している。
また、類似した国や外国の法律法規の範囲は上記の規定の範囲よりも広い可能性があり、支払者にかかわらず適用可能である。いくつかの州の法律は、製薬会社が製薬業界の自発的なコンプライアンスガイドラインと関連する連邦政府コンプライアンスガイドラインを遵守することを要求する;医薬品メーカーは医師および他の医療保健提供者への支払いおよび他の価値移転に関する情報を報告することを要求し、その中の多くの情報は互いに重大な差があり、それによってコンプライアンス仕事をさらに複雑化させる;マーケティング行為を制限するか、または値上げ通知を含むマーケティング支出と価格設定情報の開示を要求する。
このような任意の法律または任意の他の適用可能な政府法規に違反することは、重大な行政、民事および刑事罰、損害賠償、罰金、追加の報告義務および監督を含むが、これらの法律を遵守しない、削減または再構成運営、政府医療計画から除外され、監禁された疑惑を解決するために、会社の誠実な合意または他の合意の制約を受ける場合を含むが、処罰を招く可能性がある。
“中華人民共和国条例”
私たちは私たちの業務のあらゆる面に影響を与える様々な中国の法律、規則、法規に支配されている。この部分は、私たちの業務と運営に大きな影響を及ぼす可能性のある主な関連法律、法規、規則、および政策を概説しています。
会社設立·外商投資管理条例
中国国内の法人実体の設立、経営及び管理はすべて“中華人民共和国会社法”或いは“中華人民共和国会社法”によって管轄され、この法律は全国人民代表大会常務委員会によって1993年12月に公布され、それぞれ1999年12月、2004年8月、2005年10月、2013年12月及び2018年10月に更に改正された。最近では2023年12月に改正され、2024年7月に施行される。“中華人民共和国会社法”によると、会社は一般的に有限責任会社と株式会社の2種類に分類される。“中華人民共和国会社法”は非中国資本有限責任会社にも適用される
2002年2月に国務院が発表し、2002年4月から施行した“外商投資指導意見”、及び商務部と国家発展改革委員会は2021年12月に改正され、2022年1月から施行された“外商投資参入特別管理方法”(ネガティブリスト)である。ネガティブリストは、非中国投資参入に対する持株比率と管理要求、中国投資の受け入れを禁止する業界などの制限措置を統一的にリストした。ネガティブリストは12の業界をカバーし、ネガティブリストに属さない分野は、中国と非中国への投資を同一視する原則に従って管理する。
“中華人民共和国外商投資法”は2019年3月に全国人民代表大会によって公布され、2020年1月から施行される。外商投資法の施行後、“中華人民共和国外商独資企業法”、“中華人民共和国中外合弁経営企業法”と“中華人民共和国中外合作経営企業法”は同時に廃止された。非中国自然人、企業またはその他の組織(総称して“非中国投資家”と呼ぶ)の中国国内での直接または間接投資活動は、外商投資法を遵守し、適用しなければならない。これらの活動には、(1)非中国投資家が中国国内で単独または他の投資家と共同で非中国投資企業を設立すること、(2)非中国投資家が中国企業の株式、株式、不動産株式またはその他の類似権益を買収すること、(3)非中国投資家単独または他の投資家と共同で中国国内に新プロジェクトを投資すること、(4)法律、行政法規、国務院が規定する他の投資形態がある。
2019 年 12 月、国務院は「中華人民共和国外国投資法実施条例」を公布し、 2020 年 1 月に施行した。「中華人民共和国外国投資法実施条例」が施行されたとき、「中華人民共和国中外合弁企業法実施条例」、「中外合弁企業期間に関する暫定条例」、中華人民共和国外商完全投資企業法施行規則及び中華人民共和国外商完全投資企業法施行規則中華人民共和国の外国協力合弁企業法が同時に廃止された。
2019年12月、商務部と国家市場監督管理総局は“外商投資情報報告方法”を発表し、2020年1月から施行した。“外商投資情報申告方法”の施行後、“外商投資企業設立と変更届出管理暫定方法”は同時に廃止された。2020年1月1日から、非中国投資家が直接或いは間接的に中国国内で投資活動を展開する場合、非中国投資家或いは非中国投資企業は“外商投資情報報告方法”に従って関係ビジネス主管部門に投資情報を報告しなければならない。
ネットワークセキュリティ対策
2020年4月、中国政府は“2020年ネットワークセキュリティ審査方法”を公布し、2020年6月1日から施行した。2021年12月28日、中華人民共和国政府は“2022年ネットワークセキュリティ審査方法”を公布し、その中で
2022年2月15日から施行され、“2020ネットワークセキュリティ審査方法”に代わる。“2022年ネットワーク安全審査方法”によると、(I)ネットワーク製品とサービスを購入する肝心な情報インフラ経営者とデータ処理活動を行うインターネットプラットフォーム経営者は、もしこのような活動が国家安全に影響を与える可能性があれば、“2022年ネットワークセキュリティ審査方法”に従ってネットワークセキュリティ審査を行うべきである;(Ii)100万ユーザー以上の個人情報を持ち、中国海外証券取引所に上場するインターネットプラットフォーム経営者を求め、ネットワーク安全審査弁公室に届出してネットワーク安全審査を行うべきである。国務院が2021年7月30日に公布し、2021年9月1日から施行された“肝心な情報インフラ安全条例”によると、重要な情報インフラは公共電気通信と情報サービス、エネルギー、交通、水利、金融、公共サービス、電子政務と国防、科学技術と工業などの重要な業界と領域の重要なネットワーク施設と情報システム、及びその他の重要なネットワーク施設と情報システムであり、一旦破壊、機能喪失或いはデータ漏洩が発生すると、国家安全、国家経済と公共利益を深刻に損害する可能性がある。“2020年ネットワーク安全審査方法”と比べ、“2022年ネットワーク安全審査方法”は以下の主な変化がある:(一)データ処理に従事するインターネットプラットフォーム経営者も監督管理範囲に入れる;(2)国家ネットワーク安全審査メカニズムを共同で構築するために、中国証監会を監督管理機関の一つに入れる;(3)インターネットプラットフォーム経営者はユーザーの個人情報を100万以上持ち、そして海外証券取引所に上場することを求め、ネットワーク安全審査弁公室に記録してネットワーク安全審査を行うべきである。(四)核心データ、重要データ或いは大量の個人情報が盗まれ、漏洩、廃棄、破損、不正使用或いは不法に非中国側に転送されるリスク、重要な情報インフラ、核心データ、重大なデータ或いは大量の個人情報が非中国政府に影響され、コントロール或いは悪用されるリスク、及び会社上場後の任意のネットワークセキュリティリスクはネットワークセキュリティ審査過程において集団的に考慮されるべきである;(5)“2022年ネットワークセキュリティ審査措置”がカバーするキー情報インフラ事業者とインターネットプラットフォーム事業者は“2022年ネットワークセキュリティ審査措置”の要求に基づいて措置を講じ、ネットワークセキュリティリスクを防止し、緩和すべきである。2021年11月14日、CACは、(I)データ処理者、すなわち、そのデータ処理活動の目的と方法を自主的に決定し、個人情報100万人以上の個人情報を処理する個人と組織が、中国国外で上場する前にネットワークセキュリティ審査を申請すべきである管理条例草案を発表した。(Ii)非中国上場データ処理者は年間データセキュリティ評価を行い、評価報告を市ネットワーク空間管理部門に提出すべきである。(三)データ処理者が百万人以上の重要なデータと個人情報に係るものを合併、再構成、分割する場合、データ受信者は市レベル主管部門に報告しなければならない。“行政管理条例”草案はパブリックコメントのみを発表し、条項草案と予想通過または発効日が変化する可能性があるため、その解釈と実施には依然として大きな不確実性が存在する。現段階では、行政法規案がわが社の運営に与える影響を予測することはできませんので、ルール制定過程のどのような発展にも注目して評価していきます。
現在、“2022年ネットワーク安全審査方法”と“管理条例”の草案は私たちの業務と運営に重大な影響を与えていない。私たちは維持しないため、未来も中国患者の個人が識別できる健康情報を維持するつもりはなく、私たちの業務活動が国家安全に影響を与えると解釈される可能性があると信じていない。本年報の日付では、吾らはまだ関連する中国政府当局から通知を得ておらず、吾らは“キー情報インフラ運営業者”や“100万人を超える個人資料を処理する資料処理業者”と認定されたりしている。私たちはまた、私たちがネットワークセキュリティ審査や年間データセキュリティ評価を提出しなければならないという要求があることを知らず、私たちはこの点での質問、通知、警告、そして制裁を受けていない。したがって、中国の現行法律法規に対する私たちの理解に基づいて、私たちは米国証券取引所に上場し続けたり、その上で私たちの証券を発行したりすることで、このようなネットワークセキュリティ審査を受けることは不可能だと思います。しかし、中国政府当局は法定条文の解釈と実施に重大な情動権を持っているため、関連する中国のネットワークセキュリティ法律と法規の解釈と実行にはまだ重大な不確定性が存在し、中国がネットワークセキュリティ法律と法規の執行を強化することが予想され、もし中国の監督管理当局が私たちと反対の立場をとる場合、私たちなどが将来中華人民共和国のネットワークセキュリティ法律及び法規に従って100万人を超える個人情報を処理する重要な情報インフラ事業者或いはデータプロセッサとみなされないことを保証することはできない、あるいは行政法規草案をさらに改訂したり、ネットワーク安全審査或いはその他のコンプライアンス要求に符合するため、他の法律或いは法規を公布しないことは保証されない。このような状況で、私たちはこのような強化された規制要件を解決する上で挑戦に直面するかもしれない
薬品開発·承認·登録管理条例
薬品監督制度
“中華人民共和国薬品管理法”或いは“薬品管理法”は全国人民代表大会常務委員会によって1984年9月に公布された。薬品管理法の最近の2回の改正は、それぞれ2015年4月と2019年8月に公布された改正案である。“薬品管理法実施条例”は2002年8月に国務院によって公布され、最後の改正は2019年3月である。“薬品管理法”と“薬品管理法実施条例”は共同で中国薬品管理の法律枠組みを確立し、新薬の研究、開発と製造を含む。薬品管理法は薬品の開発、生産、経営、応用と監督管理に従事する単位と個人に適用される。それは医療機関の薬品メーカー、薬品貿易会社と薬品製剤の管理、及び薬品の開発、研究、製造、流通、包装、定価と広告にフレームワークを提供した。同時に、“薬品管理法実施条例”は薬品管理法の実施細則を規定した。
2017年、薬品監督体制は新たな重大な改革時期に入った。国務院弁公庁、中国共産党中国弁公庁は共同で“審査評価審査制度改革の深化による薬品医療機器の革新奨励に関する意見”あるいは“革新意見”を印刷·配布した。加速したプロジェクト、届出制度、優先審査機序、革新意見に基づいて非中国臨床データを受け入れ、最近の他の改革は薬品メーカーがまず中国で発売許可を求め、高度優先的な治療領域の薬物、例えば腫瘍学或いは稀な疾病を開発することを奨励する。
革新意見が提出した監督管理改革を実施するため、全人代常務委員会、国家医薬品監督管理局或いは2018年に新しく設立された政府機関国家薬品監督管理局及びその他の主管部門は現在薬品と業界の法律、法規と規則の改訂を担当している。
2019年8月、全人代常務委員会は新たな“薬品管理法”、すなわち“2019年改正案”を公布し、2019年12月から施行した。2019年改正案には、中国政府が2015年から実施した多くの重大な改革措置が含まれており、上場許可所有者制度、薬品条件審査、薬品トレーサビリティ制度、及び良好な製造規範と良好な供給規範に基づいて関連認証を廃止することが含まれている。
2022年5月、国家薬品監督管理局は薬品管理法実施条例改正案草案を公表し、薬品管理法の実施細則を更に完備することを目的とした。草案は、ある承認された薬物の未開示試験データと他のデータに対して6年間のデータ独占性、稀な疾患を治療する薬物の最大7年間の市場独占性、およびある条件下での小児科薬物の最大12ケ月の市場独占性を提供することを提案した。この条例草案はまだ決定されていない。
監督部門
中華人民共和国の医薬品は、 NMPA によって全国規模で監視 · 監督されている。地方の省医薬品行政当局は、それぞれの行政区域内の医薬品の監督管理を担当しています。NMPA は SAMR の下で新たに設立された。NMPA の前身である国家薬品監督管理局は、 2018 年に国務院が実施した制度改革の一環として、後に中国食品薬品監督管理局に再編された国家食品薬品監督管理局 ( SFDA ) 、または後に SAMR に置き換えられた CFDA に置き換えられました。
国家衛生·公衆サービス部の主な職責は:
•中国国内の薬品、医療機器と設備、化粧品の管理を監視し、監督する
•医薬品 · 医療機器 · 化粧品産業の監督管理に関する行政規則 · 政策の策定
•新薬、模造薬、輸入薬品と漢方薬に対して審査、登録と審査を行う
•医薬品、医療機器の製造、流通、輸出入許可証の承認と発行
•医薬品の生産·販売に従事する企業の設立を許可する
•薬品、医療機器、化粧品の安全性の検査と評価を行う
•薬品、医療機器、化粧品に関する重大な事故を処理する。
2013年、衛生部と国家人口·計画出産委員会は中華人民共和国国家衛生·計画出産委員会に編入された。2018年3月、第13期全国人民代表大会第1回会議は国務院機構改革提案を承認し、この提案に基づいて、衛計委と他のいくつかの政府機関が国家衛生委員会に合併し、NHCと略称する。国家衛生委員会の職責は他の以外に、国家薬品政策、国家基本薬物制度と国家基本薬物目録を協調的に制定し、そして国家基本薬物の調達、分配と使用管理規則を起草することを含む。
中国食品薬品監督管理局が2017年3月に発表し、2017年5月に発効した“ある薬品行政審査項目の下での審査手続きの調整に関する決定”によると、IND審査は薬品評価センターが中国薬品監督管理局を代表して発表すべきである。
薬品臨床試験と登録管理規定
薬品登録管理方法
2007年7月、国家食品薬品監督管理局は改訂版の“薬品登録管理方法”を公表し、2007年10月から施行した。登録方法は、(1)薬品登録申請の定義と薬品監督管理の監督管理の職責、(2)新薬、模倣薬、輸入薬品および補充申請の登録申請、および再登録の申請を含む薬品登録の一般的な要求、(3)臨床試験、(4)新薬、模倣薬および輸入薬品の申請と承認、(5)薬品の補充申請と再登録、(6)検査、(7)登録基準と仕様、(8)期限、(9)再審査、を含む。(十)責任その他付則。
“登録方法”によると、薬品登録申請は国内新薬申請、国内模造薬申請と輸入薬品申請の3種類の異なるタイプに分けられる。薬物の作用機序によって、薬物を3つの種類に分け、即ち薬物は化学薬物、生物製品、漢方薬か天然薬物かである。国内新薬出願、又は国内NDAとは、中国で発売されていない薬物の登録出願をいう。また、発売薬品の剤形を変更し、投与経路を変更し、新しい適応を増加する薬品登録は、新薬申請手続きに従って申告しなければならない。登録方法によると、1種類の薬物はいかなる国でも発売されていない新薬であり、このような薬物は国家薬品監督管理局の特別審査或いは迅速な審査を受ける資格がある。
2020年1月、国家薬品監督管理局は改訂後の“薬品登録管理方法”、あるいは改訂後の“登録方法”を発表し、2020年7月から施行され、“登録方法”の代わりになった。改訂後の“登録方法”は“薬品管理法”が確立した肝心な監督管理理念に対して詳細な手続き性と実質的な要求を行い、そして過去数年間に取ったいくつかの改革行動を確認し、これらに限定されない:(I)MAH制度を全面的に実施し、臨床試験の開始を黙示する;(Ii)薬品、補助剤と包装材料に対して関連審査を実施する;(Iii)4種類の薬品登録を加速するプログラム、即ち先駆的治療薬物、条件付き審査プログラム、優先審査手続きと特別審査手続きを導入する。国家薬品監督管理局は2020年6月29日に薬品分類実施細則と相応の申請材料の要求を公布した。
2016年3月、中国食品薬品監督管理局は“化学薬物登録種別改革方案”を発表し、その中で“登録方法”下の薬品申請の再分類を概説した。“化学薬物登録分類改革方案”によると、第一種類の薬品はまだ世界のどこにも発売されていない革新型新薬である。世界でどこでも販売されていない改良新薬は第二種の薬である。模倣薬、すなわち
元の薬品と同等の品質と治療効果があり、そしてすでに中国国外で発売されているが、まだ中国で発売されていないものは、第三種類の薬品に分類できる。発起人の薬品と同等の品質と治療効果があり、すでに中国で発売された模倣薬は第四種類の薬品に属する。第5種類の薬物とはすでに中国国外で発売されているが、中国ではまだ承認されていない薬物である。第1類薬品と第5類薬品はそれぞれ“登録方法”が規定する“国内新薬申請”と“輸入薬品申請プログラム”を通じて登録することができる。国家薬品監督管理局はこの分類を確認し,2020年6月29日に発表された“化学薬品登録種別と登録提出書類の公表に関する通知”では,カテゴリごとの製品とカテゴリごとの製品登録に必要な証明書類に対してより詳細な要求を提供している
国家薬品監督管理局は2009年1月に“新薬登録特別審査管理規定”を公布し、(1)植物、動物、鉱物などから抽出した薬品の有効成分及びその製剤は中国国内で発売されたことがなく、しかも原料薬及びその製剤が新たに発見された;(2)化学原料薬及びその製剤、生物製品は境内外での発売が許可されていない。(3)新薬はエイズ、悪性腫瘍、孤児などの疾病に対して明らかな臨床治療優勢がある;(4)新薬治療は現在まだ有効な治療方法がない。
“新薬登録特別審査”は,製品候補品種が第(1)項又は第(2)項に属するものであり,出願人は臨床試験申請段階で特別審査を提出することができる。“規定”は,第(3),(4)項の製品候補に属するものは,届出生産前に特別審査申請を提出してはならないと規定している。
臨床試験と登録承認を加速する
“革新意見”は薬品、医療機器と設備審査制度改革の枠組みを確立した。“革新意見”は薬品登録審査標準を高め、革新薬と薬物臨床試験の審査の過程を加速した。
中国食品薬品監督管理局は2015年11月に“薬品登録審査の若干の政策に関する通知”を発表し、更に臨床試験の審査プロセスを簡略化と加速する措置と政策を明確にした
•現在段階的に申請および承認されているプログラムの代わりに、新薬臨床試験のすべての段階を全面的に承認することを可能にする使い捨て包括承認プログラム
•以下に申請された薬品の迅速な登録または臨床試験承認経路:(1)HIV、癌、重篤な伝染病と孤児疾患などの革新的な新薬の登録、(2)小児科薬の登録、(3)老年薬物と老年流行疾患を治療する薬物の登録、(4)国家重大科学技術プロジェクトまたは国家重点研究開発計画に登録された薬物の登録、(5)先進技術、革新的な治療方法または明らかな臨床効果を有する臨床緊急薬物の登録;(6)中国国内で生産された非中国革新薬物の登録、(7)米国又はEUで承認された新薬臨床試験の同時出願、又は米国又はEU薬品審査主管部門に上場を申請し、米国又はEU薬品審査部門を通じて現場検査を通過し、中国国内の同一生産ラインで生産された薬品の同時薬品登録出願、(8)3年以内に臨床緊急及び特許満了を必要とする薬品の臨床試験出願、1年以内に臨床緊急及び特許満了を必要とする薬品の認可出願。
国家薬品監督管理局は2018年7月に“薬品臨床試験評価審査手続きの調整に関する通知”を発表し、通知によると、申請者はIND申請受理と費用支払い後60(60)営業日以内に、申請者がCDEのいかなる否定的或いは質疑意見を受けていない場合、提出された臨床試験方案に従って当該薬物の臨床試験を行うことができる。このような承認手続きは2019年の修正案にさらに書き込まれた。
外国のデータの免除と受け入れを試行する
国家薬品監督管理局は2018年7月に“外国薬物臨床試験データの受け入れに関する技術指導原則”を発表し、“革新意見”の実施細則の一つとして、中国国外の臨床データは可能であると規定している
中国国内で薬品登録申請を提出する.この申請の形式は,中国の臨床試験,移行試験,直接の国内新開発薬に基づく免除とすることができる。“外国薬物臨床試験データの受け入れに関する技術指導原則”に基づいて、発起人は非中華人民共和国臨床試験データを使用して中国での薬品登録を支持することができるが、発起人は非中国臨床試験データの真実性、完全性、正確性と追跡可能性を確保しなければならず、しかもこれらのデータは必ず国際人用薬品登録技術要求協調会議(ICH)“良好な臨床試験実践”中の関連要求に符合しなければならない。発起人は非中国臨床試験データを用いて中国で薬品登録を申請する際に、また“登録方法”の他の関連条項を守らなければならない。
アメリカ国家薬品監督管理局は現在正式に許可し、その前身機関は過去にケースベースで中国国外で許可された薬物が中国で条件的に承認されることを許可し、中国で事前承認の臨床試験を行う必要がない。具体的には、国家薬品監督管理局と国家薬品監督管理局は2018年10月に“海外臨床で必要な新薬審査プログラム”を発表し、過去10年以内にアメリカ、EU或いは日本で許可された孤児疾患の予防或いは治療を許可した薬物、或いは中国で有効な治療方法がない深刻な生命に危害を及ぼす疾患、或いは中国で承認されていない薬物が明らかな臨床優勢を持つ薬物を予防或いは治療する。申請者はリスク緩和計画の構築を要求され、薬物発売後に中国で試験を完成することが要求される可能性がある。CDEはすでに上記の基準を満たす合格薬物リストを作成した。
臨床試験の流れと良好な臨床実践
“登録方法”によると、臨床試験は第一、第二、第三と第四段階を含む。第一段階は人体で行われた初歩的な臨床薬理と安全性評価研究を指す。第二段階は候補製品の患者特定適応下の治療効果と安全性に対して初歩的な評価を行い、第三段階の臨床試験の設計に証拠と支持を提供し、そして管理用量方案を確定することである。第三段階は臨床試験を行い、目標適応を有する患者に対する治療効果と安全性を確定し、薬物の全体的な利益-リスク関係を評価し、そして最終的に薬品登録申請の審査に十分な証拠を提供することである。第四段階は新薬の発売後の研究であり、この薬物の広範な使用時の治療効果と副作用を評価し、この薬物が普通の人群或いは特定の集団で使用する時の全体的な利益-リスク関係を評価し、そして投与量を調整する。
臨床試験の品質を高めるため、国家薬品監督管理局は2003年8月に“薬品良好臨床試験規範”を公布し、そして2020年4月に国家薬品監督管理局と国家薬品監督管理局によって公布され、2020年7月に発効した。改訂されたGCP規則によれば、臨床試験とは、調査された薬物の機能、副作用および/または吸収、分布、代謝および排泄を証明または明らかにするために、ヒト被験者(患者または健康ボランティア)上で薬物のシステム調査を行うことを指す。臨床試験の目的はこの薬物の治療効果と安全性を確定することである。改訂されたGCP規則は中国の臨床試験の設計と進行について全面的かつ実質的な要求を提供した。特に,改訂後のGCPルールは対象者の保護を強化し,臨床試験で収集した生物試料の制御を強化した。
改訂されたGCP規則は、(1)臨床試験センターの専門認証、臨床試験の専門知識、訓練経験と能力を有し、最新の履歴書と関連資格文書の提供を要求すべきであること、(2)試験案、研究者マニュアル、申請者が提供する試験薬に関する情報を熟知すること、(3)改訂されたGCP規則と臨床試験に関する法律法規を熟知し、遵守すること、(4)研究者が署名した作業分配授権表のコピーを保存すること、を必要とする臨床試験に参加する研究者とセンターの資格と要求を規定する。(五)申請者組織の監督検査及び薬品監督管理部門の検査を受ける;(六)調査者及び臨床試験センターが他の個人又は機関が臨床試験に関連する職責及び機能を担うことを許可する者は、その資格を確保し、完全な手順を確立し、職責及び機能の十分な履行を確保し、信頼できるデータを生成しなければならない。
CDEとのコミュニケーション
“薬物臨床試験審査審査承認手続きの調整に関する通知”によると、新薬臨床試験申請が承認されたのは、I、II期臨床試験終了後、III期臨床試験前に、申請者はCDEにコミュニケーション会議申請を提出し、III期臨床試験方案設計を含む肝心な技術問題を討論すべきである。六十以内
IND出願が受け入れられて費用が支払われた数日後,出願人がCDEの否定的または質疑的意見を受けていない場合,出願人は提出された臨床試験案に従って薬物の臨床試験を行うことができる。
国家薬品監督管理局は2018年9月に“薬品研究開発と技術評価コミュニケーション管理方法”を公布し、2020年12月にそれを改訂と交換し、改訂後の規定により、化学薬物研究開発期間と登録申請などの面で、申請者はCDEとのコミュニケーション会議を提案することができる。コミュニケーション会議は三つのタイプに分けることができる。第一種類の会議を開催することは薬物臨床試験中の肝心な安全問題、及び突破的な治療薬物の研究と開発中の肝心な技術問題、或いはその他のいくつかの規定の情況を解決するためである。第二類会議は、薬物の重要な研究及び開発期間中に開催され、主にIND出願前の会議、第二段階試験完了及び第三段階試験開始前の会議、新薬発売申請を提出する前の会議、及びリスク評価及び制御会議を含む。第3のクラス会議とは、第1のクラスまたは第2のクラスに属さない会議を意味する。
薬物臨床試験登録
“登録方法”によると、IND申請の承認を得た後、臨床試験を行う前に、申請者は国家食品薬品監督管理局にレジストリを提出しなければならず、その中には、臨床試験方案、先頭機関の主要な研究員名、参加機関と研究者の名称、倫理委員会の批准書とインフォームドコンセントサンプルを含み、コピーを試験機関所在地の省級主管部門に送付しなければならない。中国薬品監督管理局は2013年9月に“薬品臨床試験情報プラットフォーム公告”を発表し、公告によると、上述した中国薬品監督管理局に届出した登録を除いて、すべて中国薬品監督管理局の許可を得て中国で行われた臨床試験はすべて臨床試験登録を完成し、そして薬物臨床試験情報プラットフォームを通じて試験情報を発表すべきである。出願人は、臨床試験の承認を得てから1ヶ月以内に試験事前登録を完了して、試験の唯一の登録番号を取得し、第1の被験者が試験に参加することを登録する前に、後続情報の一部の登録を完了しなければならない。IND出願の承認後1年以内にまだ登録が完了していない場合は,出願人は説明を提出しなければならない;初めての提出が3年以内に完了していない場合は,IND出願の承認は自動的に失効する。
新薬申請
“登録方法”によると、薬品登録出願は、国内非特許薬品出願、国内模造薬出願及び輸入薬品出願を含む。薬品は化学薬物、生物製品と漢方薬或いは天然薬物に分けられる。一期、二期と三期の臨床試験が完了した後、申請者は国家食品薬品監督管理局に国内NDAの承認を申請することができる。そして、国家食品薬品監督管理局は疾病管理センターが提供した総合評価意見に基づいて申請を許可するかどうかを決定した。この2段階に分けたプログラムは、改訂された“新登録カテゴリ製品登録方法”に基づいて引き続き実施される。改訂後の“登録方法”によると、申請者は(一)関連する薬物、薬理と毒理研究、臨床薬物試験とその他の薬品の発売登録を支持する研究を完成した後、(二)薬品の品質標準を確定し、(三)商業規模の生産過程の検証を完成し、(四)薬品登録検査の準備をして、薬品監督管理局に薬品上場許可申請を提出しなければならない。CDEは関連要求に応じて,薬学,医療などの専門家を組織して受理した薬品の発売許可申請を審査する。
MAHシステムの実験計画
“革新意見”はMAH制度に試験方案を提供した。
全国人民代表大会常務委員会の許可を経て、国務院弁公庁は2016年5月に“薬品マーケティング許可所持者メカニズム試験方案”を発行し、MAH制度の中国10省における試験方案について詳しく説明した。MAH制度の下で、試験地区の中国国内の薬品研究開発機構と個人は薬品登録所持者になる資格があり、薬品メーカーになる必要はない。販売許可保持者は契約メーカーを招いて生産することができるが,契約メーカーは許可を得て試験地域内に位置しなければならない。MAH制度に適合する薬品には、(1)新薬(第1~第4の化学薬、および第5の化学薬、生物製品、標的製剤、徐放製剤、制御放出製剤を含むがこれらに限定されない)が含まれる
上記MAH制度試験計画実施後に承認された後発薬,(2)“化学薬品種別登録改革方案”によりIII類あるいはIV類薬物として承認された後発薬,(3)元薬品と同等性評価を通過した承認された後発薬,(4)試験地域にもともと位置していた薬品メーカーは許可証を持っていたが,企業合併やその他の理由で試験地域に転出した承認された薬品であった。
中国食品薬品監督管理局は2017年8月に“薬品上場許可所持者制度試験の推進に関する事項に関する通知”を発表した。それはMAHの法律責任を明確にし、彼は薬物の全製造と営業チェーンと全ライフサイクルを管理し、そして臨床前薬物研究、臨床試験、製造、マーケティング、流通と薬物副作用モニタリングに対して法律責任を負う。“薬品発売許可所持者制度試験の関連事項の推進に関する通知”によると、衛生部は毎年年末後20営業日以内に中国食品薬品監督管理局に薬品生産、マーケティング、処方、技術、薬物警戒、品質管理措置などの状況報告を報告すべきである。
“薬品上場許可所持者メカニズム試験方案”によると、この試験方案は当初3年間であり、2018年11月に満期になる予定である。2018年10月、全人代常務委員会は“許可国務院が一部の地方で薬品上場許可所持者メカニズムの試験方案を展開することに関する決定”を公表し、MAH制度の期限を2019年11月4日まで延長した。
2019年12月1日から施行される“2019年改正案”によると、MAH制度は全国的に適用され、薬品MAHの法定代表者と主要責任者は薬品品質に対して全面的に責任を負う。また、“2019年改正案”の規定によると、外国MAHは中国でMAHの責任を履行し、外国MAHと連帯責任を負うために1人のローカルエージェントを委任しなければならない。このような地方エージェントに関する詳細な実施条例が制定されている。
国際多センター臨床試験
中国食品薬品監督管理局は2015年1月に公布し、2015年3月に発効した“国際多中心臨床試験ガイドライン”或いは“多中心臨床試験ガイドライン”は多区域臨床試験(MRCT)の中国での実施に指導を提供した。多センター臨床試験ガイドラインによると、国際多センター臨床試験申請者は同じ臨床試験方案を使用して、異なるセンターで同時に臨床試験を行うことができる。申請者が中国国内で国際多センター臨床試験を実施しようとしているのは、“薬品管理法”、“薬品管理法実施条例”、“登録方法”などの関連法律法規を遵守し、GCP規則を実行し、ICH-GCPなどの国際共通原則を参照し、国際多センター臨床試験参加国の法律法規を遵守すべきである。申請者が国際多中心臨床試験データを利用して中国で薬品登録を許可しようとしているのは、少なくとも中国を含む2つの国家に関連し、そして“多中心臨床試験ガイドライン”、“登録方法”などの関連法律法規の臨床試験に対する要求に符合すべきである。
2020年4月,NMPAとNHCは改訂されたGCP規則を公布し,2020年7月から発効した。改訂されたGCPルールは、MRCTを開始する前に、(I)出願人は、すべての臨床試験に参加するセンターが試験案に適合することを保証すべきであり、(Ii)出願人は、同じ臨床試験および実験室データ統一評価基準および同じ症例報告表ガイドラインを遵守すべきである、(Iii)各センターは、同じ症例報告表を使用して、試験中に得られた各人体被験者のデータを記録すべきである、MRCTを開始するための要求をまとめている。(4)臨床試験を開始する前に,各センター研究者の役割を明確にするための書面が必要である,(5)出願人は各センター研究者間のコミュニケーションを確保すべきである。
国際多センター臨床試験からのデータはアメリカ国家薬品監督管理局の新薬応用に応用できる。申請者は国際多中心臨床試験データを用いて中国新薬申請を支持する時、“国際協調会議-汎用技術文書”の内容とフォーマットの要求に従って、完全な全世界臨床試験報告、統計分析報告とデータベース、及び関連支持データを提出すべきである;同時に同時にグループ化研究成果の総括と比較分析を行うべきである。著者らのパートナーが行った国際多センター臨床試験で得られた臨床試験データを利用して、著者らは不必要な重複臨床試験を避けることができ、更に国内のNDA過程を加速することができる。
中国食品薬品監督管理局は2017年10月に“輸入薬品登録管理事項の調整に関する決定”を発表し、その中には以下のポイントが含まれている
•1つの薬物の国際多中心臨床試験またはIMCTが中国で行われれば、この薬物の第1段階臨床試験は同時に行うことができる。予防性生物製品を除いて、このIMCT薬物は中国以外の国では第二期または第三期の臨床試験に許可または入る必要がない
•IMCTが中国で行われていれば、IMCTが完了した後に直接薬品発売許可申請を提出することができる。登録申請は“登録管理方法”及び関連法律法規を遵守しなければならない
•輸入革新化学薬物と治療性生物製品の臨床試験と販売申請は、非中国薬品生産企業の所在地国家或いは地区の販売許可を必要としない
•“輸入薬品登録管理事項の調整に関する決定”発表前に受理された薬品申請は、関連要求に適合する場合、IMCTで発生したデータに基づいて輸入薬品の臨床試験を免除することを要求し、輸入を許可することができる。
人類遺伝資源の検定
科学技術部と衛生部は1998年6月に“人類遺伝資源暫定管理方法”を公布し、中華人民共和国の人類遺伝資源を保護と公平に利用することを目的とした。科学技術部は2015年8月に“人類遺伝資源サンプリング、採集、取引、出力或いは中国審査行政許可事項サービスガイドライン”を発表し、非中国投資スポンサーによる人類遺伝資源のサンプリング、採集、研究活動は国際協力範囲に属し、中国側協力機構はネットワークシステムを通じて中国人類遺伝資源管理弁公室に許可すべきである。科学技術部は2017年10月に更に“人類遺伝資源の行政審査の最適化に関する通知”を公布し、2017年12月から施行し、中国薬品の発売サンプリングと人類遺伝資源の採集の審査を簡略化した。
国務院が2019年5月に公表し、2019年7月から施行した“中華人民共和国人類遺伝資源管理条例”はさらに、人類遺伝資源材料を輸出していない臨床機関は中国人類遺伝資源を利用して国際臨床試験協力を展開し、中国の関連薬品と医療器械の発売許可を得る必要があり、許可する必要がない。しかし,使用しようとするヒト遺伝資源の種類,数,用途は臨床試験前にMOSTを提出すべきである。しかも、国際協力の当事者たちは国際協力によって作られた特許を共同で持っていなければならない。実際,MOSTは非中華人民共和国側が中国で行った臨床試験が製品登録目的で共通していることを強制的に要求していないが,探索的試験にこの要求を加えていることは確かである。2024年3月、“中華人民共和国人類遺伝資源管理条例”が改正され、2024年5月から発効し、HGR監督管理機関はMOSTからNHCに移転する。その後、NHCはHGRの審査と承認手続きを行う。
上記条例で規定されている規制枠組みは“中華人民共和国生物安全法”の確認を得ており、同法は2020年10月に全国人民代表大会常務委員会によって公布され、2021年4月から施行される。
2022年3月、衛生部は“中華人民共和国人類遺伝資源管理条例実施細則”草案を発表し、非中華人民共和国締約国の定義、国際協力の範囲、HGR情報とHGR材料及び安全審査基準について一定の解明を行った。本草案はまだ公表されていない
2023年3月、第14期全国人民代表大会は国務院の改組を発表した。再構成の結果としては,HGR承認機関が最も多かったが,実際にHGR審査や承認を行った部門はNHCに移行した
2023年5月、科学技術部は最終的に“中華人民共和国人類遺伝資源管理条例実施細則”を確定し、2023年7月1日から施行した。 本実施細則は、現行規定の承認と届出要求を確認するとともに、非中華人民共和国当事者が中国で行った臨床試験についていくつかの明らかにした
•非中国側当事者の定義を明らかにし、外国会社と個人および外国会社と個人が実際にコントロールする中国実体を含み、実際の制御は50%以上の持分を保有するか、あるいは契約手配などを通じて行うことができる
•HGR材料はヒトゲノムと遺伝子を含む遺伝物質であり、例えば器官、組織と細胞などである。
•HGR情報とは、ヒト遺伝子およびゲノムに関するデータ、およびHGR材料を用いて生成された他の情報および材料であるが、臨床データ、画像データ、タンパク質データ、および代謝データは含まれていない。
•承認された国際協力プロジェクトにおけるパートナー以外の非中国側にHGR情報を提供する前に,MOSTに申請を提出する必要がある。また,非中華人民共和国締約国に提供するHGR情報が(I)重要遺伝子系のHGR情報,(Ii)特定地域のHGR情報,または(Iii)500人を超えるエクソン群配列決定やゲノム配列決定情報である場合には,安全審査が必要である。
薬品生産経営管理条例
薬品生産
“薬品管理法”と“薬品管理法実施条例”の規定によると、薬品生産企業は中華人民共和国の関係省級薬品監督管理部門が発行した“薬品生産許可証”を取得しなければならない。このような許可証の発行は,製造施設の検査と,衛生条件,品質保証システム,管理構造,設備が要求基準に適合しているかどうかを決定するための検査を経なければならない。2004年8月に公布され、2017年11月と2020年1月に改正され、2020年7月から施行された“薬品管理法実施条例”と“薬品生産監督管理方法”によると、薬品生産許可証の有効期限は5年であり、関係部門の再審を経て、有効期限が満6ヶ月前に少なくとも継続しなければならない。薬品生産許可証に記載されている企業名、法定代表者、登録住所とタイプは、工商行政管理部門が発行した“営業許可証”に記載されている企業名、法定代表者、登録住所とタイプと一致しなければならない。MAHが内部生産ではなく契約生産機関を通じて生産された薬品については、MAHは国家薬品監督管理局の省級対応部門に薬品生産許可証を申請し、この機関の検査とその他の監督監督を受けなければならない。
2023年10月、国家環境保護局は“MAH代行活動監督管理の強化に関する第132号通知”を発表し、代行組織を通じてその製品を生産する必要があるMAHに対してより具体的な要求を提出した。
“薬品良好生産規範”は1988年3月に公布され、1992年12月、1999年6月と2011年1月に改訂された。“薬物良好製造規範”は1セットの詳細な薬物製造標準指針を含み、機関と従業員資格、生産場所と施設、設備、衛生条件、生産管理、品質管理、製品操作、原料管理、販売記録の保存、顧客苦情と不良事件報告の管理を含む。
薬品配送
薬品管理法及びその実施条例と2007年1月に国家食品薬品監督管理局が公表し、2007年5月から施行した“薬品流通監督管理方法”によると、薬品企業はその生産、流通、使用、調達、販売、輸送、貯蔵の薬品の品質に対して責任を負うべきである。
2004年2月に公表され、2017年11月に中国食品薬品監督管理局によって改訂された“薬品経営許可証管理方法”によると、“薬品経営許可証”の有効期限は5年である。“薬品経営許可証”の保有者は、許可証の有効期限が満了する6ヶ月前に延期を申請しなければならない。薬品卸売販売会社を設立するには、省級薬品行政主管部門の許可を得る必要がある。承認後、主管部門は薬品卸売流通会社に薬品流通許可証を発行する。小売薬局を設立するには、現地の県級以上の薬品行政主管部門の許可を得なければならない。承認された後、当局は小売薬局に薬品流通許可証を発行する
2023年9月27日、国家薬品監督管理局は“薬品経営使用品質監督管理方法”を公表し、2024年1月1日から施行し、“薬品流通監督管理方法”と“薬品経営許可証管理方法”の代わりになった。 今回の新しい規則は従来の“中国薬品卸売業者、小売業者管理条例”が薬品卸売業者、小売業者に対して省或いは地方が発行した“薬品経営許可証”に対する一般的な要求を引き続き適用し、“2019年改正案”を徹底し、薬品卸売業者、小売業者に対して品質管理システム、人員配備、倉庫施設、製品貯蔵、届出、エンドユーザーへの販売行為などの面でより具体的、更新的な要求を提出した。これらの要求を満たすことで,薬品卸売業者や小売業者がその経営活動の薬品流通許可証を取得·維持できるようになる。
その他中華人民共和国政府規則
“知的財産権条例”
国際条約では、中華人民共和国は“貿易に関する知的財産権協定”、“工業財産権保護パリ条約”、“商標国際登録マドリード協定”、“特許協力条約”を締結している(含まれるがこれらに限定されない)。
特許
1984年3月に全人代常務委員会が公布し、1992年9月、2000年8月、2008年12月と2020年10月に改正され、2021年6月に施行された“中華人民共和国特許法”、及び2001年6月に国務院が公布し、2002年12月、2010年1月と2023年12月に改正された“中華人民共和国特許法実施細則”に基づいて、中華人民共和国の特許は3種類に分けられる:発明特許、実用新案特許と外観設計特許。発明特許の保護期間は20年,実用新案特許と意匠特許の保護期間は10年であり,出願日から計算される。個人又は単位が特許権者の許可を得ず,勝手に特許を使用し又は他の特許侵害活動を行った場合は,特許権者に賠償し,関係行政から罰金を科し,犯罪を構成する者は,法に基づいて刑事責任を追及しなければならない。“中華人民共和国特許法”によると,いかなる組織及び個人が中国国外で中国国内に設立された発明又は実用新案特許を出願した場合でも,国家知的財産権局に秘密審査を報告しなければならない。
2020年10月に改正された“中華人民共和国特許法”は,米国特許連動制度に匹敵する特許紛争早期解決メカニズムを創設した。国家知的財産権局と中国国家知的財産権局が共同で発表した実施細則と最高人民法院が発表した司法解釈はさらにこのメカニズムを定義し、両者とも2021年7月から発効した。このメカニズムによると、遺伝子薬物申請者は薬物を申請する際に、国家薬品監督管理局が構築した特許情報登録プラットフォーム上でその模倣薬と関連特許について4種類の公告を行わなければならず、例えば、模倣薬がこのプラットフォームに登録された任意の特許を侵害する可能性があるかどうか。特許権利者は、国家薬品監督管理局が模造薬申請を受理した日から45日以内に、主管裁判所に司法訴訟を提起するか、あるいは国家薬品監督管理局に行政訴訟を提起して、模倣薬がその特許範囲に属するかどうかを決定することができる。アメリカ国家薬品監督管理局は9ケ月の待機期間を提供し、行動或いはプログラムに関する適切な通知を受けた後、後発薬申請を許可しないが、国家薬品監督管理局はこの待ち期間内にこれらの模倣薬申請に対する技術審査を停止しない。
商業秘密
1993年9月に全人代常務委員会が公布し、2017年11月と2019年4月にそれぞれ改正された“中華人民共和国反不正競争法”によると、商業秘密とは、公衆に知られておらず、効用があり、その合法的な所有者または所有者のために商業利益または利益を創造し、その合法的な所有者または所有者によって秘密にされている技術と商業情報を指す。“中華人民共和国反不正競争法”によると、経営者は、(1)窃盗、賄賂、詐欺、脅迫、電子侵入などの不正な手段で合法的な所有者または所有者から商業秘密を取得すること、(2)前項(1)項で不正に取得した商業秘密の漏洩、使用、または他人の使用を許可すること、(3)契約契約または合法的な所有者または所有者の秘密の要求に違反し、他人の商業秘密の使用を漏洩、使用または許可することによって、他人の商業秘密を侵害することを禁止する。(四)他人を指図、誘導、協力して守秘義務に違反し、又は権利者の商業秘密秘密に対する要求に違反し、権利者の商業秘密を漏洩、使用又は許可する者。第三者は上記の違法行為を知っているか,知っているはずであるが,取得,使用,開示する
他にも、3人目は他人のビジネス秘密を盗用したと考えることができる。商業秘密が侵害された当事者は行政改正を申請することができ、監督部門は違法行為を制止し、侵害者に罰金を科すことができる。
商標
1982年8月に全国人民代表大会常務委員会が公布し、それぞれ1993年2月、2001年10月、2013年8月と2019年4月に改正された“中華人民共和国商標法”によると、登録商標の有効期限は10年であり、登録日から計算される。引き続き使用する場合は,登録者は商標満了前12ヶ月以内に更新手続きをしなければならない。登録者がそうしなければ、6ヶ月の猶予を与えることができる。1回の継続登録の有効期間は10年であり,商標が前回の有効期間が満了した日から計算される。期限が満了して継続しない場合は,登録商標を抹消する.工商行政管理機関は法律に基づいて登録商標専用権を侵害する行為を調査する権利がある。刑事犯罪の疑いがある場合は,直ちに司法機関に移送して法に基づいて決定しなければならない.
ドメイン名
2017年8月、工信部は“インターネットドメイン名管理方法”を発表し、2019年6月、中国相互接続ネットワーク情報センターは“国家トップクラスドメイン名登録実施細則”を公表し、ドメイン名の保護を行った。工業·情報化部は中華人民共和国のインターネットドメインの管理を担当する主要な監督管理機関である。ドメイン登録は関連規定により設立されたドメイン名サービス機関によって処理され,登録に成功した後,出願人はドメイン名保持者となる.
“製品責任条例”
厳格な新薬審査手続きのほか、中国は消費者の権利を保護し、中国の医療製品のコントロールを強化するための法律を公布した。中国の現行法律によると、中国国内に欠陥製品のあるメーカーや販売業者は、当該などの製品による損失や損害に責任を負う可能性がある。1986年4月に公布され、2009年8月に改正された“中華人民共和国民法通則”、2017年3月に公布され、2017年10月に施行された“中華人民共和国民法通則”及び2020年5月に公布された“中華人民共和国民法典”、“中華人民共和国民法”に基づいている。
1993年2月、“中華人民共和国製品品質法”を公布し、“中華人民共和国民法”に対する補充として、エンドユーザーと消費者の合法的権益を保護し、製品品質に対する監督管理を強化することを目的とした。製品品質法が前回改正されたのは2018年12月。改正された製品品質法により、欠陥製品を生産するメーカーは民事又は刑事責任に直面し、営業許可証を取り消される可能性がある。
“中華人民共和国消費者権益保護法”は1993年10月に公布され、2013年10月に改正され、商品やサービスを購入または使用する際の消費者の権益を保護する。同法によれば,すべての経営者が商品の生産又は販売及び/又は顧客にサービスを提供する際には,本法を遵守しなければならない。最新の改正案によると、すべての経営者は顧客のプライバシーを保護し、業務運営中に得られた任意の消費者情報を厳格に秘密にすべきである。さらに、極端な場合、医薬品製造業者および経営者は、その商品またはサービスが顧客または他の第三者を死亡または負傷させた場合、刑事責任を負う可能性がある。
侵害行為に関するいくつかの規定
全国人民代表大会(全人代)が2020年5月に公布した“中華人民共和国民法典”によると、第三人の過ちにより、輸送又は倉庫を提供する当事者が、欠陥製品により他人に損害を与えた場合、製品の生産者及び販売者は当該第三人にそれぞれの損失を補償する権利がある。欠陥製品の投入流通後に発見された,生産者あるいは販売者は直ちに警告を発し,製品をリコールするなどの救済措置を講じなければならない。生産者や販売者は
適時に救済措置を取らなかったか、あるいは救済措置を取らなかった場合、損害をもたらした場合は、侵害責任を負わなければならない。製品の生産または販売に既知の欠陥が存在し、死亡または深刻な不良健康問題をもたらした場合、被侵害者は懲罰的賠償、および補償性損害賠償を要求する権利がある。
“環境保全条例”
全人代常務委員会が1989年12月に公布し、2014年4月に改正され、2015年1月に施行された“中華人民共和国環境保護法”によると、任意の部門はその経営過程或いはその他の活動中に汚染物質を排出或いは排出し、このような活動で発生した排ガス、廃水、廃棄スラグ、粉塵、悪臭ガス、放射性物質、騒音振動、電磁放射線及びその他の危害を制御及び適切に処理するために、有効な環境保護保障措置とプログラムを実施しなければならない。環境保護法の規定によると,中華人民共和国の他の関連法律法規を除いて,環境保護部とその地方関係部門はこれらの環境保全事項の管理と監督を担当している。
環境保護法の規定によると,建設プロジェクトの環境影響報告書は,建設プロジェクトが発生する可能性のある汚染とその環境への影響を評価し,防除措置を規定しなければならず,報告書は環境保全行政主管部門の承認を報告すべきである。建設プロジェクトの汚染防止施設は主体と一緒に設計、建設、操業しなければならない。
2002年10月に公布され,2018年12月に改正された“中華人民共和国環境影響評価法”に基づき,中華人民共和国政府は建設プロジェクトの環境影響に基づいて,建設プロジェクトの環境影響評価を分類管理している。建設事業者は環境影響報告書あるいは環境影響報告書を作成し,あるいは“環境影響登録表”に記入すべきである。
2013年10月に公布され、2014年1月から施行された“都市排水·下水処理条例”、2015年1月公布、2015年3月施行、2022年12月に改正された“都市下水排出管網許可管理方法”によると、都市排水施設がカバーする排水単位は、政府の規定に基づいて都市排水施設に汚水を排出しなければならない。排水単位は都市排水施設に下水を排出する必要がある場合は,本法の規定に従って排水許可証を申請しなければならない。排水許可証を取得していない排水単位は都市排水施設に下水を排出してはならない。
“消防条例”
中華人民共和国消防法または消防法は1998年4月に成立し,前回改正されたのは2021年4月であった。“消防法”は,建築工事の消防設計と施工は,中華人民共和国の消防技術基準に適合しなければならないと規定している。建設部門、建設部門、建設部門は法に基づいて建設プロジェクトの消防設計と施工品質に対して責任を負わなければならない。開発プロジェクトは国家消防技術標準の要求に従って消防安全設計を行う場合、開発プロジェクト消防安全設計検収制度を実行すべきである。2020年4月に公布、2023年8月に最近改訂された“建築工事消防設計検収管理暫定規定”の規定は、特定の建築面積と用途標準と制限に符合する特殊な建築項目に対して、消防安全設計検収制度を実行する。その他の建設プロジェクトは届出と抜き取り検査制度を実行する.
公安部が2015年8月に発表した“公安消防部門の改革サービス経済社会発展の深化8つの措置”によると、30万元以下、建築面積300平方メートル以下(あるいは省人民政府住宅と都市建設部門が規定する限度額以下)の建設プロジェクト消防設計と竣工検収消防届出を要求しない
外国為替と配当分配条例
外国為替管理
1996年1月に国務院が公布し、1997年1月と2008年8月に改正された“中華人民共和国外貨管理条例”と“外国為替決済管理条例”によると、
中国人民銀行中国銀行が1996年6月に公布した販売と支払い規定によると、利益の分配または配当の支払いを許可する取締役会決議を提出した後、中国国内の指定外国為替銀行から分配利益と配当金の支払いに必要な外貨を購入することができる。
外匯局の“直接投資外国為替政策の更なる改善と調整に関する通知”とその付録によると、外匯局により2015年5月、2018年10月と2019年12月に改訂され、(1)直接投資プロジェクト下の外国為替口座の開設と支払いは外匯局の許可を得なくなった;(2)非中国資本企業は中国国内で合法的な収入で再投資を行い、外匯局の許可を得なくなった;(3)非中国資本企業が必要とする検資確認手続きを簡略化した。(4)直接投資項目の下での購入と対外支払いは外国為替局の承認を必要としなくなる;(5)直接投資項目の下での国内外貨移転は外国為替局の承認を必要としなくなる;(6)非中国資本企業の外貨資金転換管理が完備されている。その後、外匯局は2015年2月に“直接投資外国為替管理政策の更なる簡略化に関する通知”を発表し、2019年12月に更に改訂し、銀行が外匯局の代わりに外商直接投資項目下の外貨登録審査を行うことができることを規定し、外為局及びその支店は銀行を通じて外商直接投資項目下の外貨登録審査を間接的に監督管理することができる。
2013年5月に外為局が発表し、2018年10月と2019年12月に改訂された“海外投資家の対外直接投資外貨管理規定”は、外商直接投資外貨管理を規範化し、明確にした。
2015年3月に発表され、2019年12月に改訂された第19号通知と2016年6月に発表された第16号通知によると、非中国投資企業の決済は適宜決済政策が適用される。しかし、決済は非中国投資企業の経営範囲内の自営業務に限られ、真実性の原則に従っている
配当金分配
外匯局は2017年1月に“真実性とコンプライアンス検査の強化と外国為替管理業務のさらなる推進に関する通知”を発表し、その中で国内機関が海外機関に利益を送金するいくつかの資本規制措置を規定し、(1)真実取引の原則の下で、銀行は以下の場合、取締役会の利益分配に関する決議、納税申告記録原本、監査された財務諸表を照合しなければならない 中国機関のために5万ドル以上の利益の送金業務を行う;(2)中国国内機関は利益を送金する前に、収入を数年前の損失に計上すべきだ。また、中国は資金源と使用手配を詳細に説明し、対外投資登録手続きを完了する際に取締役会決議、契約、その他の証明を提供しなければならない。私たちの中国子会社がオフショア実体に配当金を支払う能力の制限は、主に:(I)中国子会社は、中国会計基準と法規によって決定された関連法定条件と手続き(あり)を満たした後にのみ、その累積した税引後利益から配当金を支払うことができる;(Ii)各中国子会社は、その登録資本の50%に達するまで、毎年少なくともその税引き後利益の10%を準備基金として支出しなければならない。(Iii)中国付属会社は外国為替規制に関する手続き規定を完成しなければ、非中国通貨で配当金を支払うことができる;及び(Iv)中国付属会社は配当送金時に10%以下の税率で源泉徴収税を支払わなければならない。このような制限は私たちが投資家に利益を分配する能力に実質的な悪影響を及ぼすかもしれない。
中国住民のオフショア投資外貨登録
国家外匯局は2014年7月に“国家外貨管理局第37号通知”を発表した。中国外管局第37号通達は、中国住民(中国機関と個人を含む)が中国国外で直接或いは間接投資して中国住民が直接或いは間接的に制御する特殊な目的ツール(SPV)についてオフショア投資と融資を行い、中国国内企業の合法的な所有資産或いは権益又はその合法的に所有するオフショア資産又は権益を外管局現地支店に登録することを要求する。もし特殊目的機関の基本情報が変化した場合、例えば中国住民個人株主、特殊目的会社の名称或いは経営期限が変化し、あるいは特殊目的機関が重大な変化が発生した場合、例えば中国住民個人が特殊目的機関への出資を増加或いは減少させ、或いは特殊目的機関の任意の株式譲渡或いは交換、合併、分立など、当該中国住民も外匯局に修正登録しなければならない。
2015年2月に公表され、2015年6月に発効し、2019年12月にさらに改訂された“直接投資外貨管理政策の一層の簡略化と完備に関する通知”は、中国住民が海外で海外直接投資のために設立またはコントロールするオフショア実体は、外国為替局ではなく適格銀行に登録できることを規定している。外匯局及びその支店は銀行の直接投資外貨登録に対して間接監督管理を実施する。
外管局第37号通達に記載されている登録手続きを遵守できない場合、在岸会社の外国為替活動は制限される可能性があり、中国国外の親会社或いは連合経営会社に配当金及びその他の分配、中国海外機関からの資金流入及び決済を支払い、関連する中国会社或いは中国住民が中国外貨管理条例の処罰を受ける可能性がある。
“労働条例”
労働法と労働契約法
1994年7月に全国人民代表大会常務委員会が公表し、それぞれ2009年8月と2018年12月に改正された“中華人民共和国労働法”、2007年6月に公布され、2012年12月に改正され、2013年7月に施行された“中華人民共和国労働契約法”、及び2008年9月に国務院が公布した“中華人民共和国労働契約法実施条例”に基づいて、書面労働契約を実行し、労使双方の労働関係を構築しなければならない。しかも、賃金は現地の最低賃金基準を下回ってはいけない。使用者は労働安全衛生制度を確立し、中華人民共和国の規則制度と標準を厳格に遵守し、従業員に対して労働安全衛生教育を行い、中華人民共和国の規定に従って従業員に労働安全衛生条件と必要な防護用品を提供し、職業病危害作業に従事する従業員に対して定期的に健康検査を行わなければならない。
社会保険と住宅積立金
2010年10月に全人代常務委員会が公表し、2011年7月に施行され、2018年12月にさらに改正された“中華人民共和国社会保険法”によると、1999年1月に国務院が公表し、2019年3月に改正された“社会保障基金徴収暫定条例”、及び1999年4月に国務院が公表し、2002年3月と2019年3月に改正された“住宅積立金管理条例”に基づいて、使用者が従業員を代表して基本養老保険、失業保険、基本医療保険など多くの社会保障基金の納付を要求した。労災保険、生育保険、住宅積立金。資金を供給できなかったいかなる雇用主も罰金を科され、規定された期限内に差額を補うように命じられる可能性がある。
税金と源泉徴収税条例
企業所得税と源泉徴収税
全人代が2007年3月に公布し、2017年2月と2018年12月に改正された“企業所得税法”、及び2007年12月に国務院が公布し、2019年4月に改正された“中華人民共和国企業所得税法実施条例”に基づいて、少数の例外状況を除いて、中国国内企業と非中国投資企業の所得税税率はすべて25%である。企業は“住民企業”と“非住民企業”に分かれている。中国国内に設立された企業のほか、中国国外に設立された“実際の管理機関”が中国国内にある企業は“住民企業”とされ、その全世界の収入には統一された25%の企業所得税税率が適用される。非住民企業とは非中国の法律に基づいて設立された実体であり、その“事実上の管理機関”は中国国内にはないが、中国に機関や営業場所が設置されているか、あるいは中国には機関や営業場所が設置されていないが、収入源は中国国内にある。10%の所得税率は一般的に非中国住民企業投資家に宣派された配当金に適用され、このような配当金は中国国内に設立或いは営業場所がない、あるいはそのような設立或いは営業地点が設置されているが、関連収入は当該等の設立或いは営業地点と有効な関連がなく、ただこのような配当金は中国国内から来た。
2017年1月から施行された“先進技術サービス業企業所得税政策の全国的な実施推進に関する通知”または“通知”によると、“通知”に“先進技術サービス業企業”と認定された企業は、15%の税率で企業所得税を徴収する。
2006年8月に公布され発効した“大陸部と香港特別行政区の所得に対する二重課税と脱税防止に関する手配”或いは“二重租税回避手配”及びその他の適用される中国法律に基づいて、もし中国主管税務機関が香港住民企業がすでにこの二重租税回避手配とその他の適用法律の関連条件と要求に符合したと認定すれば、香港住民企業が中国住民企業から獲得した配当金の10%源泉徴収税は5%に下げることができる。しかし、国家税務総局が2009年2月に公布した“税務条約配当規定の執行に関する若干の問題に関する通知”によると、中国の関連税務機関が適宜認定すれば、会社は主に税収によって駆動される構造や手配によって低下した所得税税率から利益を得ており、この中国税務機関は優遇税収待遇を調整することができる。国家税務総局が2018年2月に公布し,2018年4月に発効した税収条約における“実益所有者”に関する若干の問題に関する公告によると,申請者の経営活動が実質的な経営活動を構成していない場合,その“実益所有者”の地位の否定認定を招き,申請者は上記の二重租税回避手配による5%の減税所得税率を享受できない可能性がある。
付加価値税
1994年1月に施行され、2008年11月、2016年2月、2017年11月にさらに改正された“中華人民共和国付加価値税暫定条例”とその実施細則、および1994年1月に施行され、2008年12月と2011年10月に改正された実施細則によると、別途規定があるほか、納税者が貨物、労務または有形個人財産レンタルサービスまたは輸入貨物を販売する場合には、17%の税率が適用される。納税者が輸送サービス、郵便サービス、基礎電気通信サービス、建築サービスまたは不動産賃貸サービスを販売し、不動産を売却し、土地使用権を譲渡する場合には、11%の税率が適用され、販売サービスまたは無形資産の場合は、6%の税率が適用される。
2018年4月に採択された“財政部と国家税務総局の付加価値税税率の調整に関する通知”によると、2018年5月から、納税者が付加価値税を目的として課税販売活動または輸入貨物に従事している場合は、17%と11%の税率が16%と10%に調整されていた。
2019年4月から施行された“増値税改革の深化に関する政策に関する公告”によると、増値税一般納税者が販売または輸入貨物に適用する16%の増値税税率は13%、10%の増値税税率は9%に低下する。
2018年6月に改訂された“営業税流動企業付加価値税徴収方法(試行)”によると、中国国内企業は専門技術サービス、技術移転、ソフトウェアサービスなどの国境を越えた課税活動を提供し、かつ中国国外でのみ消費される場合、上記の国境を越えた課税活動は付加価値税を免除する。
間接譲渡税
2015年2月3日、SATは第7号公報を発表し、2017年10月17日と2017年12月29日に改正した。公告7によると、非中国住民企業は資産(中国住民企業の株式を含む)に対する“間接譲渡”を再同定することができ、これを中国課税資産の直接譲渡と見なすことができ、当該等の手配に合理的なビジネス目的がなく、かつ中国企業所得税の納付を回避するために確立されていることを前提としている。そのため、当該等の間接譲渡からの収益は中国企業所得税を払わなければならない可能性がある。取引手配に“合理的な商業目的”があるかどうかを決定する時、考慮すべき要素はオフショア企業の株式の主要な価値が直接或いは間接的に中国課税資産に由来するかどうかを含む;オフショア企業の資産が主に中国での直接或いは間接投資から構成されているかどうか、或いはその収入が主に中国から来ているかどうか;及びオフショア企業及びその直接或いは間接的に中国課税資産を持っている付属会社が真の商業性質を持っているかどうかは、その実際の機能とリスク開放から証明することができる。公告7によると、納税者が税の納付を代行していない場合は、譲渡人は法定期限内に自ら税務機関に納付税を申告しなければならない。ちょっと遅いです
適用税金の支払いは譲渡先に違約利息を負担させます。公告7投資家が公共証券取引所を介して株式を売却する取引には適用されず、これらの株式は公共証券取引所で取得される。
2017年10月17日、SATはSAT第37号通知を発表し、この通知を修正し、2018年6月15日にSATがある税収規範ファイルの修正に関する公告を発表した。国家税務総局第37号通知はさらに、非住民企業の事前提出税金の計算、申告と納付義務に関する実施細則を述べた。それにもかかわらず、公告7の解釈および適用には不確実性が残っている。税務機関は、公告7が我々のオフショア取引または株式の売却に適用されるか、または非住民企業(譲渡先)に関連するオフショア子会社のオフショア取引または売却を決定する可能性がある。
ヨーロッパ法規
私たちの候補製品は、安全監視、詐欺防止、法律の乱用、企業コンプライアンス計画の実施、医療保健専門家への支払いまたは他の価値移転を含む、例えば適用される上場後の要件を含む可能性がある米国以外の司法管轄区域(特にEU)によって実施される同様の法律法規によって制限されるであろう。
私たちの製品がFDAの承認を得ているかどうかにかかわらず、私たちはこれらの国で臨床試験を開始したり、販売したりするために、外国の比較可能な規制機関の承認を得なければならない。一つの規制機関の承認は他の管轄区域の規制機関も承認することを確実にすることはできない。承認プロセスは国によって異なり、FDA要件以外の追加テストに関連する可能性があり、FDA承認よりも長いまたは短い場合がある。臨床試験、製品許可、定価、普及と精算を管理する要求は国によって異なる。
非臨床研究と臨床試験
アメリカと類似して、EUの非臨床と臨床研究の各段階は重要な監督管理によって制御されている。
非臨床研究を行うのは,新たな化学や生物物質の健康や環境安全性を証明するためである。非臨床(薬物毒性)研究は、EU指令2004/10/ECに規定されている良好な実験室やり方またはGLPの原則を遵守しなければならない(いくつかの特定の医薬製品に別の理由がない限り、例えば放射性ラベル目的のための放射性薬物前駆体)。特に、体外と体内の非臨床研究は必ずGLP原則に従って計画、実行、モニタリング、記録、報告とアーカイブを行い、GLP原則は組織過程の品質体系と非臨床研究の条件として一連の規則と標準を定義した。このようなプロス基準は経済協力と開発組織の要求を反映する
EUでは,医療製品の臨床試験は,EUとEU加盟国の法規や国際コーディネーター用薬品技術要求理事会(ICH)のGCPに関するガイドラインおよび“ヘルシンキ宣言”からの適用法規要求と倫理原則に従って行わなければならない。欧州委員会からの追加GCPガイドラインは、特にトレーサビリティを重視し、高級治療薬物製品(ATMP)の臨床試験に適している。臨床試験の発起人がEU内で成立していない場合、それはEU実体をその法定代表者として指定しなければならない。スポンサーは臨床試験保険証書を購入しなければならず、大多数のEU加盟国では、スポンサーは臨床試験で負傷したいかなる研究対象にも“非のない”賠償を提供する責任がある
EUの臨床試験に関連する規制構造は最近変化した。臨床試験条例((EU)第536/2014号)、あるいはCTRは、2022年1月31日に施行され、臨床試験指令(2001/20/EC)、あるいはCTDの代わりに廃止された。指示とは異なり、CTRはすべてのEU加盟国に直接適用され、加盟国がそれをさらに国家法律として実施する必要はない。CTRは臨床試験情報システムを通じてEU全体の臨床試験の評価と監督過程を著しく調整し、このシステムは集中したEU門戸とデータベースを含む
CTDは臨床試験を行う各加盟国で主管する国家衛生当局と独立した倫理委員会に単独の臨床試験申請を提出することを要求し、FDAとIRBのように、CTRは集中的な手続きを導入し、ただ多中心試験の申請を提出することを要求する。CTRは、スポンサーが各会員国の主管当局と道徳委員会に文書を提出することを可能にし、各会員国が決定を下すことを可能にする。CTAは含めなければなりません
他の事項以外に、試験案のコピーと被調査薬品の生産と品質情報を含む調査薬品ファイル。CTAの評価手続きも統一されており、すべての関連加盟国による共同評価を含み、道徳基準を含む各加盟国が個別にその領土に関する具体的な要求を評価する。各会員国の決定は集中されたEUポータルサイトを通じてスポンサーに伝達される。CTAが承認されると,臨床試験開発は継続可能である。臨床試験の発起人がEU内で成立していない場合、それはEU内の実体をその法定代表者として指定しなければならない。スポンサーは臨床試験保険証書を購入しなければならず、大多数のEU加盟国では、スポンサーは臨床試験で負傷したいかなる研究対象にも“非のない”賠償を提供する責任がある
CTRは3年間の過渡期が予想される。進行中の臨床試験と新たな臨床試験がCTRによってどの程度制御されるかはそれぞれ異なる。(I)2022年1月31日までにCTDに基づいて申請を提出した臨床試験、または(Ii)2022年1月31日から2023年1月31日までの間、スポンサーがCTD申請を選択した臨床試験は、2025年1月31日までこの指示によって管轄されている。この日以降,すべての臨床試験(行われている臨床試験を含む)はCTR条項に拘束される。
CTAに提出された試験案または他の情報のいずれかの重大な修正は、関係主管当局および道徳委員会に通知するか、またはその承認を得なければならない。臨床試験で使用される薬品はGMPで生産されなければならない。他の国と連合の範囲の規制要件も適用される可能性がある。
医薬製品の開発過程において、欧州医薬品管理局とEU加盟国の主管当局は、開発計画について対話や指導を行う機会を提供することができる。EMAレベルでは、これは通常、CHMPによって提供される科学的提案の形態で行われる。すべての科学的提案手続きは費用を発生させるだろう。EMAの提言は,通常,品質(化学,製造と制御試験),非臨床試験と臨床試験,薬物警戒計画やリスク管理計画などの問題に基づいて提供される。関連製品の将来の任意のマーケティング許可申請またはMAAについては、法的拘束力がないことをお勧めします。
マーケティング許可
連合で私たちの未来の候補製品を販売するために、私たちは個別的な規制承認を受けなければならない。より具体的には、EUでは、候補医薬製品はマーケティング許可(MA)を得た後にのみ商業化することができる。EU規制制度によると、規制機関の候補製品の承認を得るためには、MAAを提出しなければならない。このようにする過程は,他を除いて医薬製品の性質に依存する。2つのタイプのMAがあります
•集中MA“は、EMA人用医薬品候補委員会(CHMP)の意見に基づいて欧州委員会によって集中プログラムによって発行され、EU全体で有効である。集中手順は、特定のタイプの候補製品に対して強制的であり、例えば、(I)バイオテクノロジー過程で誘導される医薬製品、(Ii)指定された孤児医薬製品、(Iii)抗精神病薬(例えば、遺伝子治療、体細胞治療および組織工学製品)、および(Iv)HIV/エイズ、癌、神経変性疾患、糖尿病、自己免疫およびウイルス疾患のような特定の疾患を治療するための新しい活性物質を含む医薬製品である。集中手順は、重大な治療、科学または技術革新を代表する他の製品、またはその許可が公衆の健康に有利になるか、または強制的な適応以外に指定されるための新しい活性物質を含む他の製品の場合には任意である
•“国家MA”はEU加盟国の主管当局によって発行され、それぞれの領土のみをカバーし、集中プログラムの強制範囲に属さない製品候補が使用可能である。1つの製品がEU加盟国で販売されることが許可されている場合、その国MAは、相互認識手順によって別の加盟国で承認を得ることができる。この製品が申請時にどの加盟国でも国MAを取得していない場合、分散手続きによって各加盟国で同時に承認を得ることができる。分権手続きに基づいて、MAを求める各加盟国の主管当局に同じ書類を提出し、申請者はそのうちの1つを参考加盟国として選択する。
上記の手順により、MAを付与する前に、EMA又はEU加盟国主管当局は、製品の品質、安全性及び有効性に関する科学的基準に基づいて、製品のリスク−利益バランスを評価する。
素数案
2016年7月、EMAは優先薬品計画を発表した。PrimeはEMAを強化するための自発的な計画です 満たされていない医療ニーズに対する薬物の開発。その基礎は、有望な薬剤を開発している会社との相互作用と早期対話を増加させ、彼らの製品開発計画を最適化し、より早期に患者に接触するのを助けるために、彼らの評価を加速させることである。Primeの製品開発者から恩恵を受けました
加速評価を行う資格が指定されることが予想されるが、これは保証されていない。良質な指定の利点は、MA申請を提出する前にCHMPから調査委員を任命すること、重要な開発マイルストーンで早期対話および科学的提案を行うこと、および申請プロセスがより早い時期に候補製品の資格鑑定を加速的に検討することが可能であることを含む。
EU医薬品立法を修正する提案にはPrime計画を支持する修正案が含まれている。2026年までに新しい条項が採択されないと予想される。
適応経路
EMAには患者が早期かつ漸進的に薬物を獲得することを可能にする適応経路計画がある。♪the the the 適応性経路概念は薬物承認方法であり、患者が高度に満足されていない医療需要下で薬物を獲得する機会を改善することを目的としている。この目標を達成するためには、重篤な疾患を有する小人口を決定し、そこでは薬物の利益-リスクバランスが有利である可能性があり、適切な場合には実世界のデータをより多く利用して臨床試験データを支援する方法が想定され、開発された早期に衛生技術評価機関を参加させて、支払いを提案し、最終的に国家医療システムによってカバーされる薬剤の機会を増加させる。適応経路概念は主に医療需要の高い地域の治療に適用され,これらの地域では伝統的な経路でデータを収集することは困難であり,大型臨床試験は薬物から利益を得ることが不可能な患者を不必要に暴露する。この接近は既存のEUの法的枠組み内ですでに準備された規制手続きに基づいている。これらは、科学的提案、同情的使用、条件付き承認機序(生命に危害を及ぼす疾患を治療するための薬物)、現実生活データを収集し、各薬物のためのリスク管理計画を策定することを可能にする患者登録および他の薬物警戒ツールを含む。
適応的経路計画は,報酬やリスクを評価する基準を変更することはなく,MAを獲得するために必要な報酬−リスクバランスを証明する要求を変えることもない
データとマーケティングの排他性.
EUでは、マーケティングを許可された新製品候補製品や参考製品は通常8個得られます 長年のデータ独占権と追加2年間の市場独占経営権。データ特定期間模倣薬または生物類似薬を防止する出願人は、EUで模倣薬または生物類似薬を申請する際に、参照製品がEUで初めて許可を得た日から8年以内に、参照製品プロファイルに含まれる臨床前および臨床試験データに依存する。市場排他期は、参考製品がEUで最初の許可を得た10年後まで、成功した模倣薬または生物類似申請者がその製品をEUで商業化することを禁止している。新たな治療適応が承認された場合,10年の市場専門期間をさらに1年延長することができ(最大11年),条件は,(I)既存療法と比較して新たな申請が重大な臨床的利益を表し,(Ii)新たな適応は最初のMA後の最初の8年以内に付与されることである。
生体模倣薬、すなわち参考医薬製品と類似しているが、模倣薬の定義に適合しない生物医薬製品については、例えば、原材料または製造技術の違いによる特殊な制度がある。 このような製品については,適切な臨床前または臨床試験の結果を提供しなければならず,EMAのガイドラインは異なるタイプの生物製品に提供される補足データのタイプを詳細に説明している。遺伝子や細胞療法医薬製品のような複雑な生物製品に対しては,このようなガイドラインがないため,これらの製品の生体模倣薬がEUで承認される可能性は低い。しかし、EMAの指導意見は、将来的には当時得られた科学的知識と規制経験に基づいてこれらの提案を考慮することを示している.
孤児の生薬
EUにおいて、医薬製品のスポンサーが、(1)生命または慢性衰弱に危害を及ぼす疾患の診断、予防または治療を目的としている場合、(2)申請したとき、そのような疾患のEUにおける影響が10,000人のうちの5%以下であること、または(B)孤児の身分から得られた利益がない場合、EUでは十分な見返りが生じず、必要な投資が合理的であることを証明することができ、(3)満足できる診断方法がなく、そうでなければ、製品を“孤児医薬製品”に指定することができる。EUが許可している問題のある疾患を予防または治療するか、または、そのような方法が存在すれば、薬物はその疾患の影響を受けている人に大きな利益を与えるであろう。
EUでは、孤児製品に指定された申請はMAAを提出する前のいつでも提出することができる。EU孤児の指定は一方が費用の削減や費用の免除、礼賓援助、獲得などの権利を得る権利があります
集中化したプログラム。MAを承認した後,孤児医薬製品が適応を承認する10年間の市場排他性を有することは,その間,主管当局が別のMAAを受け入れたり,MAを承認したり,同一適応の類似医薬製品MAを10年間延長する申請を受けることができないことを意味する。合意した小児科調査計画(PIP)にも適合する孤児薬品については,市場排出期間を2年間延長した。いかなる補充保護証明書も孤児の症状に関する小児科研究によって延期してはならない。孤児指定は、規制審査および承認過程においていかなる利点も伝達されず、規制審査および承認過程の継続時間を短縮することもない。
しかし,5年目の終了時にその製品が孤児の薬物獲得先の基準を満たしていないこと,すなわちこの疾患の流行率が敷居を超えていること,あるいはその製品の利益が十分に高いと判定され,市場独占性を維持することが合理的であることを証明するのに不十分であれば,この孤児市場の専門期間を6年に短縮することができる。さらに、(I)第2の出願人が、その製品が類似しているが、より安全で、より効果的であるか、または臨床的により良いことを証明することができる場合、(Ii)出願人が2回目の孤児医薬品の申請に同意するか、または(Iii)出願人が十分な孤児薬を供給できない場合、いつでも同じ適応について同様の孤児薬品にMAを付与することができる。ある会社は自発的に一つの製品を孤児登録簿から削除することができる。
小児科調査計画
EEAにおいて、新しい医薬製品候補のMAAは、EMAの小児科委員会またはPDCOが(1)特定の製品免除、(2)カテゴリ免除、または(3)PIPに含まれる1つまたは複数の措置を遅延させない限り、EMAによって承認されたすべての小児科人口サブクラスをカバーするPIPに含まれるすべての措置を含む小児科集団において行われた研究結果を含まなければならない。PIPは,MAが求められている薬物の小児科適応を支援するために,データ発生時間とアドバイスの措置を規定している。PDCOは、成人における製品の有効性および安全性を証明するのに十分なデータがあるまで、PIPの一部または全ての措置の実施を延期する義務を許可することができる。さらに、小児臨床試験データを必要としないか、または提供するのに適していない場合、PDCOは、子供に無効または安全でない可能性があるので、これらのデータを提供する義務を免除することができ、この製品は、治療のために使用される疾患または状態が成人集団でのみ発生することが予想される場合、または小児科患者の既存の治療に対して有意な治療利益がない場合。すべてのEU加盟国でMAを取得し、研究結果を製品情報に含めると、否定的な場合であっても、6ヶ月間の補充保護証明書の延期(承認時に有効であれば)、または孤児医薬製品については、孤児市場固有権を2年間延長する資格がある。
上述のEU規則はヨーロッパ経済区、すなわちEEAに一般的に適用され、27のEU加盟国にノルウェー、リヒテンシュタイン、アイスランドを加えて構成されている
EU及び加盟国が臨床試験の進行、生産承認、医薬製品のM&A及びそのような製品のマーケティングに適用される法律を遵守せず、M&Aを付与する前及び後、医薬製品の製造、法定医療保険、賄賂及び反腐敗、又は他の適用される法規の要求は、行政、民事又は刑事罰を招く可能性がある。これらの処罰は、臨床試験の遅延または許可を拒否すること、またはMAの承認、製品の撤回およびリコール、製品の差し押さえ、一時停止、MAの撤回または変更、生産の完全または部分的な一時停止、流通、製造または臨床試験、経営制限、禁止、免許停止、罰金、および刑事罰を含むことができる。
EU薬品立法審査
2023年4月26日、欧州委員会は現行のEU薬品立法を改正する提案、すなわちEU薬法審査を発表した。改正は2つの提案からなり、1つの新しい指令と1つの新法規或いはEU薬法提案は、孤児医薬製品と児童用医薬製品に関する立法を含む関係者用医薬製品に関する立法を廃止し、代替する。EU薬法審査はEU革新医薬製品の監督管理データ保護或いはRDPに重大な影響を与える可能性がある。
現在の形で可決されれば,EU製薬法提案は現在のデータ排他性ベースラインを低下させる。 このRDPの減少は後発薬と生物模倣薬のより早くEU市場に進出する可能性がある。 また、EU薬法審査は、EUとEUの孤児医療製品の指定とインセンティブに大きな影響を与える可能性がある 小児科医療製品について。提案された改正は欧州議会と欧州理事会の合意と採択が待たれるため,EU医薬法提案は採択前に重大な改正が行われる可能性があり,2026年初めまではないと予想される
アメリカの医療保険と精算
いかなる薬品の販売はある程度第三者支払者のこのような製品に対する保証程度に依存し、例えば連邦、州と外国政府医療保健計画、商業保険とホスト医療組織、及び第三者支払人のこのような製品の精算レベルに依存する。提供されるべき補償範囲と金額に関する決定は個々の計画に基づいて行われる。1つの第三者支払人はある特定の製品を保証することを決定し、他の支払人もその製品に保証を提供することを確保することはできない。したがって、支払人の保証プロセスは、製造業者がそれぞれ各支払人に製品使用の科学的および臨床的支援を提供することを要求する可能性があり、これは時間のかかるプロセスである可能性があり、保証と適切な補償が一致して適用されるか、または最初に補償を得ることが保証されないかもしれない。そのほか、セット診断テストは単独で保証と精算を受ける必要があり、しかもそのセットの薬品或いは生物製品の保証と精算を含まない。医薬品や生物製品に適用される保険獲得や精算に適した類似課題は随伴診断にも適用される。
第三者支払者も薬品やサービスの精算を減らすようになってきている。米国政府と州立法機関は価格制御、保険と精算に対する制限及び模造薬代替の要求を含むコスト制御計画を引き続き実施している。第三者支払者は薬品の安全性と有効性を疑問視するほか、徴収された価格に挑戦し、医療の必要性と薬品の費用効果を審査することにますます挑戦している。価格制御及びコスト制御措置、並びに既存の制御及び措置を講じている司法管区において、より限定的な政策をとることにより、任意の製品の販売をさらに制限することが可能となる。いかなる製品の第三者精算または第三者支払者が製品を保証しないと決定したかを減らすことは、医師の使用や患者のその製品に対する需要を減少させる可能性がある。
国際市場では,精算や医療保険支払い制度は国によって異なり,多くの国で特定製品や治療法に価格上限が設定されている。例えば、EUは、その加盟国に様々な選択を提供し、その国の健康保険制度が補償を提供する医療製品の範囲を制限し、人が使用する医療製品の価格を制御する。加盟国は医薬製品の具体的な価格を承認することができ、医薬製品を市場に投入する会社の収益力に対して直接或いは間接的に制御制度をとることもできる。薬品は外国の低価格製品からの競争に直面する可能性があり、これらの製品は薬品に対して価格規制を実施し、輸入した外国製品と競争する可能性もある。また,1つの製品が医学的に合理的であることは保証されず,特定の適応が必要であり,第三者支払者がコスト効果があると考えている製品は保証されず,保険があっても適切な精算レベルが決定される保証はなく,第三者支払人の精算政策がメーカーが製品を販売する能力に悪影響を与えない保証はない。
EUは定価と清算をする
他の国もまた違う価格設定と精算プログラムを持っている。EUでは,各国政府はその定価と精算規則や国家医療システムの制御により薬品の価格に影響を与え,これらのシステムは消費者にこれらの製品の大部分のコストを支払っている。いくつかの法域はプラスリストとネガティブリスト制度を実行し、この制度の下で、製品は補償価格を合意した後にのみ効果的に販売することができる。精算または定価の承認を得るために、いくつかの国は、特定の候補製品のコスト効果を現在利用可能な治療法と比較するために、臨床試験の完了を要求する可能性がある。他の会員国たちは会社が自分の薬品価格を固定することを許可するかもしれないが、会社の利益を監視する。医療コストの下振れ圧力が大きくなる。そのため、新製品の参入にはますます高い壁が設けられている。また、一部の国では、低価格市場からの国境を越えた輸入が一国国内の定価に商業圧力をかけている。
2021年12月,(EU)2021/2282)“HTA条例”または“HTA条例”が採択された。HTA法規は2022年1月に施行されたが,2025年1月12日から腫瘍学や高度治療薬療法,2028年1月13日に孤児薬,2030年1月13日に他の薬剤にのみ適用された。それは特に国家当局の自発的なネットワークに基づく現行制度に取って代わり、新しい枠組みは連合臨床評価、連合科学協議、新たに出現した保健技術の確定及び国家当局の自発的な協力をカバーしている。HTA規制は、EUの衛生技術評価に透明かつ包容的な枠組みを提供することを目的としており、EU加盟国が新しい技術の有効性および価値を決定し、医療保険会社または衛生システムの定価および精算を決定するのを助ける。
アメリカの医療改革
米国や一部の外国司法管轄区では、医療システムはすでに複数の立法と規制改革を行っている。2010年3月、ACAは法律に署名し、米国政府と民間保険会社が医療に資金を提供する方法を大きく変えた。例えば、ACAはブランド薬品メーカーが支払うべき医療補助リベートの最低レベルを15.1%から23.1%に向上させる;医療補助管理保健組織が支払うべき薬品に対してリベートを要求する;特定の連邦政府がいくつかの“ブランド処方薬”を販売する予定の製薬業者または輸入業者に控除できない年会費を徴収する;新しい方法を実施し、吸入、注入、点滴、移植または注射の外来薬物メーカーに対して医療補助薬品リベート計画下でのリベートを計算する;医療補助計画の資格基準を拡大した。新しい患者を中心とした結果研究所を創立し、監督、優先事項を確定し、臨床治療効果の比較研究を行い、そしてこのような研究に資金を提供した;そしてCMSに医療保険と医療補助革新センターを設立し、革新的な支払いとサービス交付モードをテストし、医療保険と医療補助支出を下げ、処方薬支出を含む可能性がある。
ACAのいくつかの側面は公布以来、司法と国会の挑戦を受けてきた
2022年6月17日、米国最高裁はいくつかの州がACAに対して提出した最新の司法挑戦を却下したが、ACAの合憲性を具体的に裁くことはなかった。国会が公布したりバイデン政府が実施した他の医療改革措置(あれば)が我々の業務にどのように影響するかは不明である。
ACAが公布されて以来、提供者に支払われる医療保険の全面的な削減を含む他の立法改正も提案され、2013年に施行され、国会の追加行動なしに2032年まで有効となるが、新冠肺炎の大流行により一時停止された2020年5月1日から2022年3月31日まで除外される。また,政府は最近,メーカーが販売する製品に価格を設定する方式をより厳しく審査し,国会で数回の調査を行い,製品定価の透明性の向上,審査定価とメーカー患者計画との関係,政府計画の薬品精算方法を改革するための立法を提案·公布した。さらに、米国各州も、価格または患者の精算制限、割引、特定製品への参入および変更の制限、マーケティングコスト開示および透明性措置、場合によっては他の国からの薬品と大口購入コストの輸入を奨励するメカニズム、および研究コストなど、薬品の価格設定問題を解決するための法規をますます積極的に実行している。また、第三者支払人と政府当局は薬品支出の定価システムと公表割引と値札にますます興味を持っている。
2022年8月、総裁·バイデンは“インフレ低減法案”(IRAと略称する)に署名し、薬品定価改革と連邦医療保険D部分福祉設計の変化を含む連邦医療保険計画を実質的に改革した。その他の改革では,アイルランド共和軍は連邦医療保険BとD部分で精算された製品の薬品や生物製品メーカーにインフレリベートを徴収し,これらの製品の価格増加速度が2023年より速いインフレを前提とし,連邦医療保険D部分福祉を改正し,2025年から福祉年度自己支出上限を2,000ドルとし,製薬メーカーに新たな割引義務を課し,2026年から連邦医療保険·医療補助サービスセンターと価格交渉を行った後,連邦医療保険B部とD部分がカバーする固定数の薬品や生物製品のための“最高公平価格”を確立した。アイルランド共和軍は衛生·公衆サービス部長官が最初の数年に規制ではなく指導によってその多くの規定を実施することを許可した。2023年8月29日、衛生·公衆サービス部は、薬品価格交渉計画が現在法律の挑戦を受けているにもかかわらず、価格交渉を受ける上位10種類の薬物のリストを公表した。このような理由と他の理由で、アイルランド共和軍がどのように実施されるのかは不明だ。
今後講じられる可能性のある医療改革措置は,より厳しいカバー基準をもたらす可能性があり,承認された任意の製品の価格に追加的な下振れ圧力を与える可能性が予想される。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。
データプライバシーとセキュリティ法
多くの州、連邦、および外国の法律は、健康に関する情報および他の個人情報の収集、伝播、使用、アクセス、秘密、およびセキュリティを規定しており、現在または将来、私たちの業務または私たちのパートナーの業務に適用される可能性があります。アメリカでは、州データ漏洩通知法、州健康情報プライバシー法、連邦と州消費者保護法律法規を含む多くの法律と法規が、健康に関連する個人情報と他の個人情報の収集、使用、開示と保護を管理している。さらにいくつかの外国法は
健康関連データを含む個人データのプライバシーとセキュリティを管理しますプライバシーおよびセキュリティに関する法律、規制、およびその他の義務は絶えず進化しており、互いに矛盾し、コンプライアンス努力を複雑にする可能性があり、重大な民事および / または刑事罰およびデータ処理の制限につながる調査、手続、または行動につながる可能性があります。
C.組織構造です。
次の図に本年度報告日までの会社構成を示す
2022 年 12 月 31 日及び 2023 年 12 月 31 日現在における各子会社の主たる事業内容及び持分比率は以下のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | | | 12月31日まで |
| 名前.名前 | | 主な活動 | | 司法管轄権があります
法団に成立する | | 2022 | | 2023 |
| コネクトバイオファーマ香港株式会社 | | 投資持株 | | 香港.香港 | | 100 | % | | 100 | % |
| コネクトバイオファーマ LLC | | 薬剤 R & D | | アメリカです。 | | 100 | % | | 100 | % |
| コネクトバイオファーマオーストラリア PTY LTD | | 医薬品 R & D | | オーストラリア | | 100 | % | | 100 | % |
| 蘇州コネクトバイオファーマ Co. 、リミテッド | | 医薬品 R & D | | 中華人民共和国 | | 100 | % | | 100 | % |
| 康乃徳生物(上海)有限会社 | | 医薬品 R & D | | 中華人民共和国 | | 100 | % | | 100 | % |
| 康乃徳生物(北京)有限会社 | | 医薬品 R & D | | 中華人民共和国 | | 100 | % | | 100 | % |
| 康乃徳生物(深セン)有限会社 | | 医薬品 R & D | | 中華人民共和国 | | 100 | % | | 100 | % |
同社の設立目的は康乃徳生物香港有限公司を買収することだ。康乃徳生物香港有限会社の唯一の持分所有者として、当社は康乃徳生物香港有限会社の業務を経営し、その戦略決定と日常運営を制御している。私たちは6社の完全子会社を持っている。
D.不動産、工場、設備。
江蘇太倉に研究開発と行政施設があり、人民Republic of Chinaがあります。私たちはそこで約25,476平方フィートのオフィスと実験室空間を借りました。賃貸契約は2026年4月30日に満期になりました。カリフォルニア州サンディエゴに行政と行政事務室があります。そこで約3,600平方フィートのオフィススペースを借りました。賃貸契約は2025年4月に満期になります。私たちの施設は私たちの現在の需要を満たすのに十分で、必要な時に適切な追加空間を提供すると信じている。
2021年5月、私たちは土地使用協定を締結した。この協定に基づき、著者らは太倉ハイテク産業開発区に位置する約70,400平方メートルの国有土地の使用権を獲得し、使用権は50年間である。私たちは土地使用権を得て研究開発実験室を建設しました
施設とオフィスです。このような施設の建設計画を終了し,2022年12月31日までの年度総合純損失報告書から470万ドルの関連建設コストを減値純損失から解約した。2022年12月31日現在、私たちは土地使用権に合計約2230万元(350万ドル)を支払い、使用権資産として私たちの合併貸借対照表に記録しています
上記土地使用協定については、吾らは江蘇太倉HIDC(太倉地方政府当局)と投資協定を締結している。この協定によると、江蘇太倉HIDCは、土地使用協定が以前に想定されていた施設開発に関連した具体的な財務支援および報酬を提供することに同意した。2022年12月31日まで、我々は本協定に基づいて、私たちの蘇州インター研究開発業務に約5.255億元(約7540万ドル)の現金を提供し、私たちの太倉施設の研究開発と管理費用を支払うために使用した。
2023年4月に、江蘇太倉HIDCはConnect SZと合意を締結し、江蘇太倉HIDCは原価に従ってConnect SZに土地使用権を買い戻すことができ、そして土地使用協定と投資協定の関連条文を中止することができる。土地使用権抹消登録は2023年4月に完了し、当社は2023年9月に買収価格を受け取った。
^ a b c d e f g h i 。未解決のスタッフのコメント。
適用されません。
第 5 話。運営と財務のレビューと見通し。
すべての場合、あなたは以下の議論と分析と、私たちの監査された財務諸表と、本年度報告書に含まれる他の場所に含まれる付記を読まなければなりません。私たちが監査した財務諸表は、国際会計基準委員会が発表した国際財務報告基準に基づいて作成された。以下の議論は、リスク、不確実性、および仮定に関する前向きな陳述を含む。多くの要素の影響により、著者らの実際の結果はこれらの展望性陳述中の予想結果と大きく異なる可能性があり、これらの要素は“第3項、重要な情報-D.リスク要素”と本年度報告の他の部分に記述された要素を含むが、これらに限定されない。
私たちの連結財務諸表はドルまたはドルで表されている。当社は2023年1月1日からその列報通貨を人民元からドルに変更することを決定した。数字は2021年1月1日から再列報され、列報通貨が人民元からドルに変更された変化を反映している。
当社株主が2021年3月12日に承認した後、普通株1.74株ごとに1株普通株(“株式合併”)に合併する(付記20)。
A.経営実績
概要
我々は世界的な臨床段階の生物製薬会社であり,T細胞駆動の炎症性疾患を治療する療法を開発している。著者らの核心的な専門はT細胞の機能細胞分析を用いて免疫標的に対する有効な候補製品をスクリーニングと発見することである。私たちの2つの最先端の臨床段階計画は、検証された目標に対する高度に差別化された候補製品を含む。著者らの主要な候補製品rademikibartはIL-4 Rαに対する抗体であり、ADや喘息などの炎症性疾患を治療する有効な標的である。推計によると、2022年の世界AD市場は約85億ドルで、2028年までに232億ドルに増加すると予想され、複合年間成長率やCAGRは18.2%である。2022年の世界喘息市場価値は約88億ドルと推定され、2028年までに120億ドルを超え、複合年間成長率は6.0%と予測されている。著者らは最近中国で中から重度AD患者に対する肝心な試験を完成し、試験の第一段階で主要と肝心な副次的終点を満たし、その後試験の第二段階で部分的に強力な治療効果を示した。著者らは最近、レドミキバートによる2型炎症性喘息の治療を評価する全世界2 b期試験を完成し、この試験において、主要かつ重要な副次的終点を満たした。我々は,中から重度のADあるいは中から重度の喘息を有する成人患者において世界第3段階計画を開始することを評価している。また,炎症性腸疾患の治療に用いられるスフィンゴシン1−リン酸受容体1またはS 1 P 1というT細胞受容体の調節剤としてicanbelimodを開発している。具体的には,外部許可パートナーが求められていることを背景に,潰瘍性大腸炎やUCのためのicanbelimodを開発している。
設立以来、著者らは免疫システムに対する深い理解に基づいて差別化薬物発見方法を開発し、そして臨床前研究と臨床試験を行い、そして著者らが複数の特許家族から構成された知的財産権を保護することに取り組んできた。また、一連の候補製品を開発するために、業務計画や資金調達に資源を活用している。私たちは主に株式と優先株融資を通じて私たちの運営に資金を提供する。2021年3月23日、私たちは初公募株(IPO)を完成し、総現金対価格は2.199億ドルで、その後1540万ドルの引受割引と手数料を獲得した。2023年12月31日現在、私たちは1.06億ドルの現金と現金等価物、1260万ドルの短期投資を持っている。
研究集約型で革新に専念する実体として、私たちは設立以来赤字を続けており、運営キャッシュフローは負である。2022年、2022年、2023年12月31日までの年間純損失はそれぞれ1.181億ドルと5950万ドルだった。2023年12月31日現在、私たちは累計5億397億ドルの赤字を計上しています。私たちは予測可能な未来に、私たちが進行·計画中の臨床前研究と臨床試験に伴い、私たちの研究と開発活動を継続し、規制機関が私たちの候補製品の承認を求め、より多くの人員を募集し、私たちの知的財産権を獲得し、保護し、私たちの候補製品ルートを拡大し、巨額の費用と運営損失を招き続けると予想される。
私たちの候補製品がさらに臨床開発段階に入るにつれて、私たちは協力を選択する可能性のある第三者からマイルストーン支払いと他の支払いを受けるかもしれません。また、私たちの候補製品が規制部門の承認を得られれば、製品商業化から収入を得ることも可能です。しかし、これらの収入や収入源があっても、損失とマイナス運営キャッシュフローを継続する可能性があり、追加拠出、許可、または協力収益なしに後期計画に資金を提供できない可能性がある。私たちは、私たちの既存の現金と現金等価物、および上記の短期投資は、少なくとも今後12ヶ月の予想される日常運営需要を満たすのに十分であると信じている
私たちの業務に影響を与える重要な要素と傾向
私たちの業務の将来の成功は私たちの研究開発計画の継続にかかっており、最初は第二段階と第三段階の臨床試験でレドミックバートとイカンベリーモットを普及させ、その後、アメリカ、中国、ヨーロッパ、オーストラリア、その他の司法管轄区域の規制承認を求めた。私たちは現在、私たちのすべての候補製品またはすべての計画適応の後期臨床試験を達成するための十分な資本資源がない。
私たちの運営結果の重要な構成要素は
収入.収入
独占ライセンスと連携協定に調印しており,会社がIPとノウハウの譲渡をほぼ完了すると,ライセンス収入が確認される予定である。私たちは現在、規制部門の承認を得て将来的に私たちの候補製品を商業化しない限り、製品収入を生成しない承認された製品は何もありません。
運営費
研究と開発費
研究開発費用は主に第三者臨床試験コスト、薬物製造コストと著者らの候補製品と発見仕事の他の臨床前研究と関係があり、そして給料と関連費用及びシェアに基づく給与コストと関連している。
研究·開発費用には,(1)臨床研究を行うCRO,研究者,臨床試験場所に支払われる費用,(2)臨床試験に使用される薬物物質や医薬製品の製造コスト,(3)我々の技術臨床前試験に関連する費用,が主に含まれている。(4)臨床試験設計及びデータ分析に関するコンサルタントサービス、(5)研究·開発活動に従事する者の賃金及びその他の関連費用、(6)原材料及び用品、製品試験、減価償却及び施設関連費用を含む候補製品の開発費用、(7)その他の研究及び開発費用。研究·開発費用が我々の研究·開発サービスに関連しており、他の将来の用途がない場合には、研究·開発費用は発生した費用に計上される。
私たちの第三者費用の大部分はrademikibartとicanbelimodの開発と関連がある。2022年および2023年12月31日までの年度までに,吾らはそれぞれレドミキバートに関する臨床試験関連支出5,410万ドルおよび3,660万ドル,およびそれぞれicanbelimodに関する臨床試験関連支出2,630万ドルおよび360万ドルに相当した。私たちは私たちの人員と施設関連資源を私たちのすべての研究開発活動に配置した。私たちは引き続き私たちの候補製品を開発し、そして私たちの臨床前計画のために発見と研究活動を展開することに伴い、著者らは私たちの研究開発支出を大幅に増加した。臨床開発後期にある候補製品は通常,臨床開発早期段階の候補品よりも開発コストが高いのは,主に後期臨床試験の規模と持続時間が増加しているためである。我々が継続的に行い,新たな臨床前研究と臨床試験を計画·実施し,我々の候補製品を生産することに伴い,我々の研究開発コストは増加し続けると予想される。
臨床前と臨床開発自体の予測不可能性のため、著者らは著者らの候補製品の現在或いは未来の臨床前研究と臨床試験の開始時間、持続時間或いは完成コストを確定できない。臨床前と臨床開発スケジュール、成功の確率と開発コストは期待と大きく異なる可能性がある。我々は,進行中と将来の臨床前研究と臨床試験の結果,規制発展,および各候補製品のビジネス潜在力の継続的な評価に基づいて,どの候補製品を開発し,各候補製品にどれだけの資金を提供するかを決定していく予定である。私たちが規制部門の承認を得たと仮定すると、私たちは将来的により多くの資金を集めて、私たちの製品を商業化する必要があるかもしれない。
著者らの臨床開発コストは高度に不確定であり、以下の要素によって大きく異なる可能性がある
•患者1人当たりの試験コストは
•承認に必要な試験回数
•実験に含まれる場所の数
•どの国で実験を行っていますか
•条件に適合する患者を登録するのに要する時間長;
•実験に参加した患者数
•患者の中退率や中途停止率
•規制当局が要求する潜在的な追加的な安全監視;
•患者が試験とフォローアップの持続時間に参加した
•私たちの候補製品を作るコストとタイミング
•私たちの候補製品の開発段階
•私たちの候補製品の有効性と安全性。
私たちの候補製品または私たちが開発する可能性のある任意の他の将来の候補製品の開発に関連する任意の変数は、その開発に関連するコストおよび時間の大きな変化をもたらす可能性がある。例えば、FDA、アメリカ国家薬品監督管理局あるいは他の監督機関が私たちに臨床前研究と臨床試験を要求する場合、私たちが現在予想している臨床開発を完成するために必要な研究と臨床試験ではなく、あるいは任意の臨床試験の登録に重大な遅延がある場合、私たちは大量の追加の財政資源と時間をかけて私たちの臨床開発計画を完成する必要があるかもしれない。私たちのどんな候補製品も規制部門の承認を得ることができないかもしれない。
行政費
行政費用には、主に、一般会社機能(財務、法律、情報技術、業務発展、投資家関係および人的資源を含む)に関連する従業員の賃金および関連費用、株式ベースの給与コスト、保険費用、第三者監査および会計費用、弁護士費、これらの機能に使用される施設および設備に関連する賃貸料および減価償却費用、専門サービス料およびその他の会社の一般関連費用が含まれる。
将来的には当社の上場企業インフラを支援するための管理費が増加し、任意の候補製品がマーケティング承認を得られれば、商業化活動も支援することが予想されます。また、監査、法律、規制、税務関連サービス、ナスダック上場や米国証券取引委員会の要求に関連する費用、取締役や高級職員保険料、上場会社の運営に関連する投資家関係コストなど、専門費用に関する支出が増加することも予想される。
減価損失純額
減価損失とは、資産価値の低下や資産購入プロジェクトの終了により資産の将来の経済的価値に損失が生じたと判断された場合に、資産(建設中資産を含む)のログアウトをいう
その他の収入
他の収入には私たちが受け取った政府補助金が含まれている。政府からの贈与はその公正な価値で確認されており、合理的な保証があれば、私たちは贈与を受け、すべての付加条件を遵守します。費用が発生する前に受け取った政府の贈与は、関連費用が確認されるまで延期される。我々の資産コストを補償する贈与金は,最初に繰延収入として列報され,関連資産の耐用年数内に直線ベースで総合損益表で収入として確認された。
その他(損失)/収益-純額
その他の損益には、外貨取引の決済による為替損益、公正価値に基づいて損益を計上する投資収益、現金等価物の利息収入、短期投資の異なる期限、浮利した投資信託商品への投資収益が含まれる。投資信託商品の短期投資の公正価値はその期待リターンを使用した割引キャッシュフローに基づいている。これらの金融資産の公正価値変動は他の収入(損失)/収益純額に計上される。
財政収入
財務収入は主に短期·長期投資、銀行、定期預金で稼いだ利息収入からなる。
融資コスト
融資コストには、主にリース負債優先権を有する金融商品の発行コストが含まれる。
優先購入権金融商品の公正価値損失
市場取引を活性化していない優先権を有する金融商品の公正価値は、推定技術を使用して決定される。我々はまず資本価値を決定し,次にオプション定価逆求解方法(OPM)または混合方法を用いて資本構造の各要素に資本価値を割り当て,この方法はOPMと確率重み付け予測リターン方法(PWERM)の概念を採用し,この2つの方法を1つの枠組みに統合した.公正価値差は、総合損失表内に優先権を有する金融商品の公正価値損失を計上する。
所得税費用
所得税支出は、我々が業務を運営している以下の主要税収管区の所得税税率に基づいて確認されている。当社はケイマン諸島に登録設立され、香港、中国(中国)、オーストラリアおよびアメリカに付属会社が設置され、ケイマン諸島からの所得税の納付が免除されている。私たちのアメリカ実体は香港実体のサービス提供者なので、そのコストプラス収入はアメリカで納税しなければなりません。2022年まで、2022年及び2023年12月31日まで年度は課税オーバー額を推定していないため、香港、中国或いはオーストラリアでは税金支出がない。
経営成果
2022年12月31日までと2023年12月31日までの年次比較
以下の表は、我々の指摘した時期における業務成果の主な構成要素をまとめたものである
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2022 | | 2023 | | 変わる |
| | | | | |
| 研究開発費 | $ | (96,630) | | | $ | (51,913) | | | $ | 44,717 | |
| 行政費 | (20,806) | | | (14,515) | | | 6,291 | |
| 減価損失純額 | (4,698) | | | — | | | 4,698 | |
| その他の収入 | 929 | | | 1,580 | | | 651 | |
その他収益-純額 | 1,889 | | | 2,774 | | | 885 | |
| 営業損失 | (119,316) | | | (62,074) | | | 57,242 | |
| 財政収入 | 1,544 | | | 2,714 | | | 1,170 | |
| 融資コスト | (21) | | | (23) | | | (2) | |
| 財務(コスト)/収入-純額 | 1,523 | | | 2,691 | | | 1,168 | |
| 所得税前純損失 | (117,793) | | | (59,383) | | | 58,410 | |
| 所得税費用 | (298) | | | (120) | | | 178 | |
| 今年度の純損失 | $ | (118,091) | | | $ | (59,503) | | | $ | 58,588 | |
研究と開発費
研究·開発費は4470万ドル減少し,2022年12月31日までの年度の9660万ドルから2023年12月31日までの年度の5190万ドルに低下し,これは主に第三者臨床試験コストおよび関連する薬物·薬品製造コストが4100万ドル減少したためである。2022年12月31日までの1年間に,レドミキバートやicanbelimodのための医薬物質や医薬品製造活動,UC用のicanbelimodの世界第2段階試験,CrowNP適応用レドミキバートの世界第2段階試験,アトピー性皮膚炎に関連する掻痒の治療のためのヒスタミン受容体拮抗薬の第1段階試験の3つの追加試験があり,これらの試験は2023年までに終了した。また、研究開発者の減少により、2023年12月31日までの年間で、私たちの人員コストは380万ドル減少しました。
行政費
管理費は2022年12月31日までの年度の2080万ドルから2023年12月31日までの年度の1450万ドルに減少し、630万ドル減少した。行政費用が減少した主な理由は、相談費用、求人費用、法律費用、保険費用を含む専門サービス費用が360万ドル減少したことと、従業員数のわずかな減少と株式ベースの給与費用の減少により、賃金と関連報酬と福祉費が230万ドル減少したことである。
その他の収入
その他の収入は70万ドル増加し、2022年12月31日現在の90万ドルから2023年12月31日までの160万ドルに増加した。この成長は主に中国地方政府が提供した70万ドルの補助金とオーストラリア政府が研究開発活動に提供した90万ドルのインセンティブと関係がある
その他収益-純額
その他の収益である純額は、2022年12月31日現在の190万ドルから2023年12月31日現在の280万ドルに増加し、90万ドル増加した。増加の要因は、公正価値で損益記録された投資の投資収入が230万ドル増加したが、110万ドル減少したことである
純外国為替収益。2023年の間、ドルの対人民元レートは2022年よりやや上昇し、2023年の外貨収益が小さくなった。
財政収入
財務収入は120万ドル増加し、2022年12月31日現在の150万ドルから2023年12月31日現在の270万ドルに増加した。増加の要因は,(I)銀行と定期預金利息が50万ドル増加したことと,(Ii)他の総合収益/(赤字)により公正価値記録された投資投資収入が70万ドル増加したことである。
融資コスト
2022年12月31日と2023年12月31日までの毎年、財務コストは変わらず、それぞれ20万ドルとなっている。
所得税費用
所得税支出は20万ドル減少し、2022年12月31日までの年間30万ドルから2023年12月31日までの年間10万ドルに低下した。減少は主にConnect USの2022年12月31日までの年度の活動が減少したためであり,所得税についてはConnect USはConnect HKのサービスプロバイダであるため,そのコスト加算収入は米国で連邦と州所得税目的で課税される。
2021年12月31日までと2022年12月31日までの年度比較
以下の表は、我々の指摘した時期における業務成果の主な構成要素をまとめたものである
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2021 | | 2022 | | 変わる |
| | | | | |
| 研究開発費 | $ | (80,496) | | | $ | (96,630) | | | $ | (16,134) | |
| 行政費 | (19,014) | | | (20,806) | | | (1,792) | |
| 減価損失純額 | — | | | (4,698) | | | (4,698) | |
| その他の収入 | 2,950 | | | 929 | | | (2,021) | |
| その他(損失)/収益-純額 | (1,547) | | | 1,889 | | | 3,436 | |
| 営業損失 | (98,107) | | | (119,316) | | | (21,209) | |
| 財政収入 | 97 | | | 1,544 | | | 1,447 | |
| 融資コスト | (7) | | | (21) | | | (14) | |
| 財務収入--純額 | 90 | | | 1,523 | | | 1,433 | |
| 優先権金融商品の公正価値損失 | (103,983) | | | — | | | 103,983 | |
| 所得税前純損失 | (202,000) | | | (117,793) | | | 84,207 | |
| 所得税費用 | (266) | | | (298) | | | (32) | |
| 今年度の純損失 | $ | (202,266) | | | $ | (118,091) | | | $ | 84,175 | |
研究と開発費
研究開発費は1,610万ドル増加し,2021年12月31日までの年度の8,050万ドルから2022年12月31日までの年度の9,660万ドルに増加したが,これは主にわれわれの主要候補製品を遅い臨床試験段階に進めるために必要な第三者臨床試験コストが1,560万ドル増加したためである。具体的には,2022年に米国,中国,オーストラリア,ニュージーランドでレドミキバートの世界2 b期臨床試験を完了し,中国で中重度ADを有する成人AD患者に対するレドミキバートの独立したキー臨床試験を開始し,臨床試験と製造費用を著しく増加させた。また,レドミキバートによる喘息と慢性副鼻腔炎鼻ポリープ(CRSwNP)適応の世界第2段階臨床試験,icanbelimodのUCとCrohn病(CD)適応の全世界第2段階試験のための追加的な薬品供給と臨床費用が発生した。
行政費
管理費は180万ドル増加し、2021年12月31日現在の1,900万ドルから2022年12月31日現在の2,080万ドルに増加した。管理費の増加は、主に(I)賃金·関連費用の150万ドルの増加、株式ベースの報酬支出、業務運営の増加を支援するために必要な資源を含む従業員の増加、(Ii)事務·ソフトウェア費用の20万ドルの増加、および(Iii)減価償却·償却費用の30万ドルの増加によるものである。
減価損失純額
2022年の減価損失純額は470万ドルであり、2021年に購入した土地に研究開発実験室、製造施設、行政事務室の建設プロジェクト終了に関する建設中資産のログアウトが原因である。2023年4月に、江蘇太倉HIDCはConnect SZと合意を締結し、江蘇太倉HIDCは原価に従ってConnect SZに土地使用権を買い戻すことができ、そして土地使用協定と投資協定の関連条文を中止することができる。土地使用権抹消登録は2023年4月に完了し、当社は2023年9月に買収価格を受け取った
その他の収入
その他の収入は210万ドル減少し、2021年12月31日までの年度の300万ドルから2022年12月31日までの90万ドルに低下した。この減額は主に二零二一年に中国政府から当社初の公募上場のために提供された1,700,000ドルの一次支出を受けたことに関係している。
その他(損失)/収益-純額
その他(赤字)/収益-純額は、340万ドル増加し、2021年12月31日現在の年度その他損失150万ドルから2022年12月31日までの純収益190万ドルに増加した。この増加は、主に(I)2022年の為替レートの有利な変動200万ドルと(Ii)公正価値に基づいて損益に計上された投資収益が20万ドル増加したことと、(Iii)2021年の間、ネット釣り事件により当社が110万ドルの損失を出したことにより、当社は当社のサプライヤーではなく、この金を釣り人が設立した口座に振り込んだためである。今回のネット釣り事件に関連する会社データの紛失や第三者情報の紛失や漏洩は発見されていない。2022年の間、ドルの対人民元レートが強くなり、2022年の外貨収益が高くなった。
財政収入
財務収入は2021年12月31日までの年度の10万ドルから2022年12月31日までの年度の150万ドルに増加し、140万ドル増加した。増加の要因は,(I)銀行と定期預金利息が10万ドル増加したことと,(Ii)他の総合収益/(赤字)により公正価値で記録された投資投資収入が140万ドル増加したことである。
融資コスト
資金調達費用の同比変化は微々たるものだ。
優先購入権金融商品の公正価値損失
優先権を持つ金融商品の公正価値損失は1.04億ドル減少し、2021年12月31日までの年度の1.04億ドルから2022年12月31日までの年度のゼロドルに減少した。当社のすべての優先権を持つ金融商品は2021年に当社初公募により普通株に変換されました
所得税費用
所得税支出は30万ドル増加し、2021年12月31日までの年間30万ドルから2022年12月31日までの年間30万ドルに増加した。この増加は主に2022年12月31日までの年間Connect USの研究開発活動の増加に関係しており,所得税についてはConnect HKのサービスプロバイダであるため,そのコスト加算収入は米国では連邦と州所得税目的で課税されている。
重要な会計政策と試算
私たちの総合財務諸表は国際会計基準委員会が発表した国際財務報告基準に基づいて作成された。我々の総合財務諸表は歴史コスト慣例に基づいて作成され、公正価値に基づいて損益を計上した金融資産、公正価値に基づいて他の全面収益を計上した金融資産及び優先的な権利を持つ金融商品の再評価によって改訂された
当社は2023年1月1日からその列報通貨を人民元からドルに変更することを決定した。数字は2021年1月1日から再列報され、列報通貨が人民元からドルに変更された変化を反映している。列報通貨のこのような変化は、国際会計基準(“国際会計基準”)8に基づいて適用される会計政策の変化をたどることを構成している会計政策、会計見積もり変更、ミスそして、“国際会計基準21号”の要求に基づいて、これらの連結財務諸表に影響を受けている為替レート変動の影響.
財務諸表の作成には会計見積もり数を用いる必要があるが、定義により、見積もり数は実際の結果と一致しない可能性がある。
経営陣は会計政策を適用する時にも判断しなければならない。
推定と判断は絶えず評価されている。それらは、将来財務的影響を及ぼす可能性のあるイベントの予想を含む歴史的経験および他の要因に基づいており、この場合には合理的であると考えられる。これらの見積もりは実際の結果と一致しないかもしれない。
(a)研究開発費
私たちは研究と開発活動にコストと費用を発生させた。研究費は費用が発生している間は費用として損益に計上する。開発コストが新たに開発されたサービスまたは製品に直接起因することができ、以下のすべての場合を証明できる場合、開発コストを資産として確認する
•開発プロジェクトを完成させ、使用または販売できるようにする技術的実行可能性
•開発プロジェクトを完成させたり製品を使用したりする意向
•製品を使用したり販売する能力
•開発プロジェクトがどのような方法で将来の経済効果をもたらすのか
•開発プロジェクトを完成させ、製品を使用または販売するのに十分な技術、財政、および他の資源がある
•資産の開発過程における支出は確実に計量することができる。
研究開発費には,(1)我々が開発している技術や臨床試験の前試験に関する費用,例えば臨床研究を行う臨床試験関連研究者や臨床試験場所に支払われる費用,(2)臨床試験設計やデータ分析に関するコンサルタントサービス,(3)研究·開発活動に従事する者の給与やその他の関連費用,(4)原材料や用品,製品試験,減価償却,施設関連費用を含む候補製品開発費用,および(5)その他の研究開発費がある。研究·開発費用が我々の研究·開発サービスに関連しており、他の将来の用途がない場合には、研究·開発費用は発生した費用に計上される。
(b)取引先と契約した収入
当社は研究開発、製造、商業化活動と取引相手とその候補製品の開発と商業化について協力と許可手配を達成することができる。これらの構成は、(I)ライセンスおよび(Ii)研究および開発活動のような複数の構成要素を含むことができる。これらの手配に基づいて支払われるお金には、払戻不可能および払戻可能な金額、重大な規制、開発および商業マイルストーンを達成する際の支払い、特定の合意された金額で製品を販売すること、および製品販売の特許権使用料が含まれる場合があります。
このような合意の下での義務を履行する際に確認すべき適切な収入額を決定する場合、当社は、(1)顧客との契約を決定するステップ(S)、(2)区別できるか否かを含む契約中の履行義務を決定するステップ、(3)取引価格の計量を実行する
可変対価格の制限,(Iv)取引価格を契約履行義務に割り当てること,(V)会社が契約履行義務を履行する際に収入を確認することが含まれる.
(c)株式に基づく報酬費用の確認
適切な人材を誘致し、維持するために、従業員、役員、コンサルタントに株式ベースの報酬インセンティブを提供します。我々は,帰属期間内に支出される二項オプション定価モデルを用いてオプション付与の総公正価値を決定する.このような費用金額を得るためには、付与日株価、予想変動率、予想先行権倍数、オプション期限、無リスク金利、配当収益率などの仮定を重大に推定する必要がある。また,ブラック·スコアーズオプション定価モデルを用いて従業員株式購入計画(ESPP)の公正価値,すなわち付与日までの報酬費用計算を決定した。私たちが発展し、製品開発の重要な段階に入るにつれて、従業員、取締役、コンサルタントに株ベースのインセンティブを提供し続け、将来的に支出額が増加する可能性があると予想されています。
主な仮定は以下のとおりである
| | | | | | | | | | | | | | | | | | | | | | | |
| 株式激励計画 | | ESPP |
| 十二月三十一日までの年度 | | 十二月三十一日までの年度 |
| 2022 | | 2023 | | 2022 | | 2023 |
| 年内加重平均行使価格 | $3.44 | | $1.12 | | (i) | | (Ii) |
| 付与日株価 | $0.75~$4.91 | | $0.77~$1.29 | | $0.86~$1.86 | | $1.05 |
| 無リスク金利 | 1.9%~3.4% | | 3.6%~4.4% | | 1.5%~4.8% | | 4.1%~5.1% |
| 予想変動率 | 61.4%~62.0% | | 59.3%~60.10% | | 51.1%~60.2% | | 46.96%~52.32% |
| オプション寿命 | 10年間 | | 10年間 | | 0.5 ~ 2.0 年 | | 0.5 ~ 2.0 年 |
| 予想される早期運動複数 | 2.2~2.8 | | 2.2~2.8 | | 適用されない | | 適用されない |
| 配当率 | ありません | | ありません | | ありません | | ありません |
| 罰金率 | 3.0%-10.8% | | *8.3%-12.3% | | 3.0% | | 3.0%-5.0% |
| 年内に付与されるオプションの加重平均公正価値 | $1.98 | | $0.64 | | $0.71 | | $0.40 |
*- 2023 年 12 月 31 日を末日とする会計年度の没収率は、役員の 8.3% から 12.3% 、その他すべての従業員の 9.5% から 1 1.7% の範囲でした。
(i)- 2022 年 12 月期における ESPP 発行株式の割引価格は、 0.74 米ドルでした。
(Ii)- 2023 年 12 月期における ESPP 発行株式の割引価格は、 0.73 米ドルと 0.89 米ドルでした。
主要な仮定の説明 :
•付与日株価 —助成日の終値に基づいています。
•無リスク金利-リスクフリー金利は、当社のリスクフリー金利の米国国債利回りに基づいており、これに対応します。 予想される期間
•期待ボラティリティ —予想ボラティリティの代理として、同等の企業の平均ボラティリティを採用しました。 基礎となるシェア各同等の企業のボラティリティは、ストックオプションの残りの満期期間に見合った期間における過去の日々の株価に基づいています。
•オプション寿命— オプションの契約条件に従って、オプション寿命を採用しました。
•予想される早期運動マルチ —従業員の助成金受給者と上級管理職の予想早期行使倍数を見積もった 学術研究を参照してそれぞれ助成金を得ます
•配当収益率-当社は、普通株式に対する現金配当を支払った実績はなく、当社は当期における配当を期待していません。 予見可能な未来
•没収率 —私たちは履歴に基づいて従業員受贈者が脱退する確率を推定した。
近く発表·採択された会計公告
2023年1月1日までに初めて適用される基準に関する情報は、2023年12月31日までの連結財務諸表を参照してください。
B.流動性と資本資源
概要
私たちは臨床開発段階の会社で、何の収入も生じておらず、流動性リスクを含む様々な財務リスクに直面している。設立以来、私たちの運営は大きな損失と負のキャッシュフローを見せてきた。2023年12月31日現在、私たちの累計損失は5.393億ドルで、予測可能な未来に引き続き大きな損失が出ると予想されています。2023年12月31日現在、私たちは1.06億ドルの現金と現金等価物、1260万ドルの短期投資を持っています。我々の主要な資金源は従来、普通株式保有者と優先株主からの持続的な現金貢献であり、2021年3月23日に完成した初公開株式(IPO)を含み、引受割引と手数料の前に、総現金対価格は2.199億ドルであった。私たちは現在、Leerink Partners LLC(SVB Securities LLC)とCantor Fitzgerald&Coとの販売合意に基づいて、時々“市場”で発行·販売される300,000,000ドルまでの米国預託証明書を含む有効な米国預託証明書を持っている。この販売合意によると、私たちの米国預託証明書または米国預託証明書の販売はまだ減値が発生していないが、このような融資が達成されれば、私たちの証券保有者に大きな希釈をもたらす可能性がある。
私たちの現在の運営計画と予想支出によると、私たちの既存の現金、現金等価物、および短期投資は、2023年12月31日までの財務諸表の発表日から少なくとも今後12ヶ月の予想運営現金支出を満たし、持続的な経営企業の要求を満たすのに十分であると信じている。長期的には、私たちの候補製品の後期臨床試験を十分に支援するために、より多くの拠出、許可、または協力収益を求め続けます。
私たちは主に株式融資を通じて私たちの運営に資金を提供する。これらの融資所は最初に康乃徳生物控股有限公司の銀行口座に入金され、私たちの子会社の運営に資金を提供するために使われた。現金及び現金等価物、公正価値に基づいて損益を計上する金融資産及び公正価値で他の全面収益を計上する金融資産の信用リスクは限られており、取引相手はケイマン諸島、米国、中国及び豪州に位置する信用の良い商業機関であるからである
また、銀行機関の預金口座残高が各国のこのような口座に対する保険限度額を超えている場合には、信用リスクが存在する可能性がある。
また、私たちは中国政府の発展奨励と補助金を得た。2023年と2022年12月31日までの年間で、それぞれ約70万ドルと90万ドルを受け取りました
次の表は、私たちの持ち株会社から私たちの運営子会社に移った現金をまとめています
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2021 | | 2022 | | 2023 |
(単位:千) | | | | | |
| 康乃徳生物控股有限公司のキャッシュフロー: | | | | | |
| コネクトバイオファーマ香港株式会社 | $ | 105,483 | | | $ | 96,800 | | | $ | 40,000 | |
| 運営子会社に移転した現金総額 | $ | 105,483 | | | $ | 96,800 | | | $ | 40,000 | |
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2021 | | 2022 | | 2023 |
(単位:千) | | | | | |
| 康乃徳生物香港有限会社まで: | | | | | |
| コネクトバイオファーマ LLC | $ | 48,510 | | | $ | 62,000 | | | $ | 33,000 | |
| 蘇州コネクトバイオファーマ Co. 、リミテッド | 55,871 | | | 25,000 | | | 6,000 | |
| コネクトバイオファーマオーストラリア PTY LTD | — | | | 6,800 | | | 1,000 | |
| 運営子会社に移転した現金総額 | $ | 104,381 | | | $ | 93,800 | | | $ | 40,000 | |
蘇州康乃徳生物有限公司が他の中国付属会社に提供した資金金額は取るに足らない。当社はいかなる中国実体も中国以外のいかなる実体にも割り当て、配当、あるいはいかなる他の移転を行うことはできない。
2021年,2022年,2023年12月31日までの年間現金流量
次の表は、示す期間のキャッシュフローをまとめたものである
| | | | | | | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| | 2021 | | 2022 | | 2023 | | |
(単位:千) | | | | | | | |
| キャッシュフローデータ: | | | | | | | |
| 経営活動のための現金純額 | $ | (84,324) | | | $ | (101,520) | | | $ | (47,930) | | | |
純現金(投資活動用)/投資活動で発生 | (5,207) | | | (86,243) | | | 75,155 | | | |
融資活動のための現金純額 | 202,220 | | | (85) | | | (246) | | | |
| 現金と現金等価物の純増加/(減少) | $ | 112,689 | | | $ | (187,848) | | | $ | 26,979 | | | |
経営活動
2023年12月31日までの年間で,経営活動で使用されている現金純額は4790万ドルであり,主な原因は税前純損失5940万ドルであるが,200万ドルの何らかの調整や我々の運営資産と負債の運営資本の変化950万ドルに相殺されている。これらの調整には主に330万ドルの株式ベースの給与支出と100万ドルの減価償却と償却費用が含まれているが、40万ドルの純為替差額と200万ドルの利息収入によって相殺されている。運営資産と負債の正の運転資金の変化は、主にSimcereライセンス発行収入契約の契約負債が1,330万ドル増加し、他の売掛金および前払いが100万ドル減少したためである。これは、CROへのrademikibartおよびicanbelimodの臨床試験前払いの支払いと、付加価値税の徴収による他の非流動資産の10万ドルの減少により、これらの残高は将来の付加価値税の支払いを相殺することができるが、繰延された政府贈与が20万ドル減少し、未払いの時間手配により貿易支払いが430万ドル減少することによって相殺されるためである。他の支払金と未払い金が50万ドル増加したのは、未払い金の支払い時間スケジュールが原因である。
2022年12月31日までの年間で,経営活動で使用されている現金純額は1.015億ドルであり,主な原因は税前純損失1.178億ドルであるが,980万ドルの何らかの調整と我々の運営資産と負債の運営資本の変化650万ドルに相殺されている。これらの調整には主に690万ドルの株式給与支出、470万ドルの建設工事解約時に確認された減価純損失、100万ドルの減価償却と償却費用が含まれているが、150万ドルの純為替差額と140万ドルの利息収入によって相殺されている。運営資産および負債の正の運営資金変動は,主に売掛金の支払いスケジュールにより貿易売掛金が80万ドル減少したことと,他の売掛金や前払金が410万ドル減少したことによるものであり,CROへのrademikibartやicanbelimodの臨床試験前払金の支払いと,付加価値税(すなわち付加価値税)残高の徴収による将来の付加価値税売掛金の相殺による他の非流動資産270万ドルの減少と,その他の売掛金や売掛金項目の50万ドルの増加によるものである。
2021年12月31日までの年間で,経営活動で使用されている現金純額は8430万ドルであり,税前純損失2.02億ドルが主な原因であるが,1.141億ドルの何らかの調整と運営資本によって相殺されている
私たちの営業資産と負債の変化は360万ドルです。この等調整は主に優先権利金融商品の公正価値変動1.04百万ドル、株式ベースの給与支出9.0百万ドル、純為替差額0.5百万ドル及び減価償却及び償却支出0.6百万ドルを含む。営業資産と負債の正の運営資本の変化は、主に未払いの時間スケジュールにより貿易売掛金が900万ドル増加したが、他の売掛金の増加と230万ドルの前金によって相殺されたが、これは、CROへのrademikibartとicanbelimodの臨床試験前金の支払いと、付加価値税(VAT)残高の増加により、他の非流動資産が140万ドル増加したため、将来の付加価値税支払いを相殺することができること、および未払い支払いの時間スケジュールにより、他の支払いおよび売掛金が170万ドル減少するためである。
投資活動
2023年12月31日現在,投資活動による現金純額は7520万ドルであり,主に公正価値で他の総合収益に計上された金融資産の満期日1.036億ドル,他の総合収入により公正価値で計上された金融資産の購入3100万ドル,公正価値で10万ドル未満の金融資産を計上した販売純額,および売却物件,工場および設備の購入290万ドルに関連している。
2022年12月31日現在、投資活動のための現金純額は8,620万ドルであり、主に他の全面収入によって公正価値で記録された金融資産の満期日2,770万ドル、他の全面収入によって公正価値で記録された金融資産の購入1.096億ドル、公正価値で記録された金融資産の販売純額が10万ドル未満、物件、工場、設備440万ドルの購入に関連している。
2021年12月31日現在、投資活動のための現金純額は520万ドルで、主に金融資産を売却して得られた2010万ドルに関係しているが、購入された金融資産1800万ドル、購入物件、工場および設備380万ドルおよび賃貸支払い340万ドルが相殺されている。
融資活動
融資活動に用いられた現金純額は、2023年、2023年および2022年12月31日までにそれぞれ20万ドルおよび10万ドルであり、主に賃貸負債の支払いから来ている。
2021年12月31日現在、融資活動による現金純額は2.022億ドルで、主に普通株を売却して得られた金総額2.20億ドルに由来しているが、在庫株の買い戻しによる60万ドル、上場支出に関する支払い1710万ドルおよびリース負債10万ドルの支払いにより一部相殺されている。
材料現金需要
以下に述べるように、2023年12月31日とその後の中期まで、私たちの重大な現金需要は主に私たちの資本支出と経営賃貸義務を含む。私たちは私たちの既存の現金、現金等価物、短期投資残高を使って、私たちの既存と未来の重要な現金需要に資金を提供するつもりです。私たちは私たちの業務成長を支援するために資本支出を含む現金約束を続けるつもりだ
2023年12月31日まで、私たちは実質的な約束をしなかった。
契約義務の開示
私たちの契約債務は、総合貸借対照表における分類に基づいて財務負債として表示される。賃貸負債は賃貸契約中の契約条項によって分類される。2021年、カリフォルニア州サンディエゴで3年間のオフィスビル賃貸契約を締結し、約3,600平方フィート、賃貸契約は2022年3月に開始された。2023年に、私たちは江蘇省太倉市人民Republic of Chinaにある研究、開発と管理施設の3年間の賃貸契約を更新し、賃貸借契約は2026年4月30日に期限が切れ、約25,476平方フィートの事務と実験室空間であり、残りのレンタル期間のレンタル義務は約50万ドルである。2023年12月31日現在、私たちがSimcere協定に基づいて受け取った前払い費用の契約責任は1330万ドルです。
持株会社構造
私たちは持ち株会社で、主に私たちの各子会社を通じて業務を展開しています。したがって、私たちが配当金を支払う能力は私たちの子会社が私たちに支払う配当金にかかっている。もし私たちの既存の子会社やわが社の任意の新しく設立された子会社が未来に彼ら自身を代表して債務を発生させれば、彼らの債務を管理する道具は彼らが私たちに配当金を支払う能力を制限するかもしれない。また、私たちの中国子会社は、中国の会計基準と法規に基づいて決定された留保収益(あればある)から配当金を支払うことしかできません。中国の法律によると、私たちの各中国付属会社とその付属会社は毎年、その備蓄金がその登録資本の50%に達するまで、特定の法定備蓄金の資金として、毎年少なくとも10%の税引後利益(あり)を確保しなければならない。また、私たちのすべての中国付属会社は適宜或いはその組織定款に基づいて、中国会計基準に基づいてその税引き後利益の一部を従業員福祉とボーナス基金、自由可黒字基金と企業拡張基金に分配することができる。このような準備基金と職員福祉とボーナス基金は現金配当金として分配できない。外商独資会社は配当金を中国に送金するには、外匯局が指定した銀行の審査を経なければならない。私たちの中国付属会社は配当金を派遣していません。累積利益が発生し、法定備蓄金の要求に合うまで、配当金を派遣することはできません。2023年12月31日現在、中国の会計基準と法規に基づいて決定された制限金額(実収資本を含む)は人民元8,530万元。
C.研究開発、特許、ライセンスなど。
“プロジェクト4.会社情報--B.業務概要”と“プロジェクト5.経営と財務回顧及び展望--A.経営業績”を参照
D.トレンド情報
“プロジェクト5.経営と財務回顧と展望--A.経営成果”を参照
E.肝心な会計見積もり
適用されない
安全港
「将来の見通しに関する警告声明」を参照してください。
第 6 話。取締役、上級管理職および従業員。
A.役員と上級管理職です。
行政員および役員
以下の表は、本年次報告書の作成日現在の執行役員および取締役の年齢を含む情報を示しています。
| | | | | | | | | | | | | | |
| 名前.名前 | | 年ごろ | | ポスト |
| 行政員 | | | | |
Zheng Wei 博士 (3) | | 60 | | 取締役CEO兼最高経営責任者 |
| Wubin Pan 博士。 | | 60 | | 代表取締役会長 · 代表取締役会長 |
| スティーヴン · チャン | | 52 | | 首席財務官 |
| |
| |
|
| 非執行役員 | | | | |
クレントス G 。Xanthopoulos, Ph. D. (2) | | 66 | | 独立役員を筆頭にする |
ジェームズ·ハング(1)(2) | | 58 | | 役員.取締役 |
陳さん、博士(3) | | 42 | | 役員.取締役 |
劉珍(1)(3) | | 55 | | 役員.取締役 |
カレン·J·ウィルソン(1)(2) | | 60 | | 役員.取締役 |
(1)監査委員会委員
(2)報酬委員会委員
(3)指名とコーポレートガバナンス委員会のメンバー
私たちの幹部と取締役会の現在の業務住所はアメリカカリフォルニア州サンディエゴ康乃徳生物控股有限会社で、住所は12265 El Camino Real、Suite 350、郵便番号:92130です。
以下は私たちの行政者と役員の簡単な伝記です
行政員
鄭偉、博士。魏博士は同社の共同創業者で、2012年の会社設立以来、私たちの最高経営責任者と取締役会のメンバーを務めてきた。これまで、魏博士は2007年12月から2011年3月までアリーナPharmPharmticals,Inc.で免疫学取締役主管を務め、同社の免疫学発見プロジェクトを担当していた。これまで、魏博士は1998年4月から2007年9月までの間にChemoCentryx社の科学者とプロジェクトの責任者を務めていた。これまで、魏博士は1992年9月から1995年11月までGlycomed,Inc.(Ligand製薬会社に買収された)で科学者を務めていた。魏博士はGlycomed,Inc.に加入する前にスタンフォード大学医学院で免疫学研究を行っていた。魏博士はカリフォルニア大学デイビス校で生物化学と分子生物学博士号を取得し、南中国師範大学で生物学学士号を取得した。魏博士の私たちの業務に対する深い理解と彼の豊富な発展、商業と行政管理経験に基づいて、彼は私たちの取締役会のメンバーを務める資格があると信じています
Wubin Pan 博士。潘博士は同社の共同創業者の一人で、2012年5月以来私たちの総裁と取締役会の議長を務めてきた。これまで,潘博士は2006年6月から2011年10月までの間にベンチャー企業が支援する契約研究機関Crown Bioscience Inc.を共同で創設し指導してきた。この間、中華人民共和国最高経営責任者総裁や執行副総裁など、会社で複数の行政指導職を務めていた。これに先立ち、潘博士は2000年11月から2006年5月まで清華源興生物製薬有限会社で総裁副社長を務めた。これまでパン博士は1996年10月から2000年10月までTerraGen Discovery Inc.(立方製薬会社に買収された)で研究科学者を務めていた。潘博士はスセックス大学で生化学博士号を取得し、カリフォルニア大学バークレー校でポストドクター訓練を完了した。彼は清華大学で工商管理修士号、中山大学で薬理学修士と動物学学士号を取得した。私たちは信じています
潘博士の私たちの業務に対する広範な理解と生物製薬会社における彼の高度な管理と取締役会の経験に基づいて、潘博士は私たちの取締役会の議長を務める資格があります
スティーブン·チェンですMr.Chanは2021年11月以来私たちの首席財務官を務めてきた。Mr.Chanはこれまで、2019年4月から2021年11月まで世界の材料メーカーデルユタカ工業有限責任会社の首席財務官を務めてきた。これまでMr.Chanは2017年4月から2019年4月までArcus Biosciences,Inc.財務および企業総監副総裁,2014年11月から2017年3月までMr.ChanはMyoKardia,Inc.財務および企業総監副総裁,2010年6月から2014年11月までSolta Medical,Inc.企業財務副総監を務めていた。Mr.Chanはカリフォルニア大学バークレー校ハースビジネススクールの工商管理学士号を有し、現在カリフォルニア州公認会計士(非在職状態)である
非執行役員
K.K.DXanthopoulos博士は2020年12月から取締役会のメンバーを務め、2022年1月以来独立取締役CEOを務めています。Xanthopoulos博士は現在Shoreline Biosciences Inc.の会長兼最高経営責任者であり、革新バイオテクノロジー会社の設立と投資に集中しているStork Capital生命科学会社の会長である。2015年から2021年まで、Xanthopoulos博士は上場医療技術会社IRRAS ABの最高経営責任者を務めた。2015年から2020年までの間、彼はCerus DMCCの実行一般パートナーだった。これまで、2007年にRegulus治療会社設立時から総裁兼最高経営責任者を務め、2015年6月まで務めてきた。それまで、彼は企業パートナーベンチャー会社の取締役の取締役社長だった。2000年から2006年まで、Xanthopoulos博士はAnadys PharmPharmticals,Inc.の共同創業者とCEOであり、同社のCEOを務めていた。Anadys製薬会社が2011年に羅氏に買収されるまで、Xanthopoulos博士は同社のメンバーだった。彼はオーロラ生物科学会社(Vertex PharmPharmticals,Inc.に買収)の総裁副社長である。1997年から2000年までですXanthopoulos博士はSent Labsの初代最高経営責任者兼社長を共同創立し、細胞治療会社Shoreline BiosciencesとIRRAS ABの取締役会メンバーを務めた。1995年から1997年にかけて,Xanthopoulos博士は国家ヒトゲノム研究所の課長としてヒトゲノム計画に参加した。これまでスウェーデンのストックホルムカロリンスカ研究所の助教授で、ニューヨークのロックフェラー大学でポストドクター研究奨学金を修了していた。海岸生物科学会社やIRRAS AB社で取締役を務めているほか、Xanthopoulos博士はゾサノ製薬会社やセント実験室の取締役会メンバーでもある。Xanthopoulos博士は優れた成績でギリシャのセサロニキアリストテレス大学の生物学学士号を取得し、2つの修士号を取得した。スウェーデンストックホルム大学微生物学と分子生物学博士号。Xanthopoulos博士は45件以上の同業者評議出版物といくつかの特許を持っている。著者らは、Xanthopoulos博士が大型生物技術会社の高級管理経験、及び彼の生命科学業界における広範な業界知識と指導経験を管理と発展させ、彼に著者らの取締役会のメンバーを務める資格があると信じている
陳さん、博士。陳博士は2020年12月以来私たちの取締役会のメンバーを務めてきた。陳博士は現在、啓明低侵襲創業投資管理(上海)有限公司のパートナーと責任者であり、2016年2月以来ずっと医療投資に集中している。陳博士もそれぞれ2021年3月、2020年12月及び2020年8月にAntengene Corporation Limited、北海康成製薬及びシオン製薬有限会社の取締役会メンバーに就任し、2020年2月から2021年6月までの間にAbBisko Cayman Limitedの取締役を務めた。2014年10月から2016年1月まで、陳博士はジョンソンの高級科学者であり、主に癌医学研究に従事している。これまで、陳医師は江蘇恒瑞医薬の組長であり、そこで彼は癌免疫治療に特化していた。陳博士はハーバード医学院で免疫学博士後訓練を完成し、ケスジー大学で細胞生物学博士号を取得し、復旦大学で生物科学学士号を取得した。陳博士は生物製薬会社に投資した経験と免疫学と薬物研究開発における専門知識のため、私たちの取締役会のメンバーを務める資格があると信じている。
ジェームズ·HuangですMr.Huangは2024年2月12日から私たちの取締役会メンバーを務めています。Mr.HuangはPanacea Ventureの創始管理パートナーであり、生命科学に集中した投資会社であり、世界の革新と転換の早期と成長期の医療保健と生命科学会社に投資することに集中している。Panaceaに加入する前、Mr.Huangは凱鵬華盈中国の管理パートナーであり、生命科学投資に専念するベンチャー投資会社Vivo Venturesの管理パートナーでもあった。彼はAnesiva社の社長でもあり、痛み管理治療に専念するバイオ製薬会社である。彼のキャリアの初期には、トゥラリック社(安進に買収された)、グラクソ·スミスクライン社、百時美施貴宝社、ALZA社(ジョンソンに買収された)で業務開発、販売、マーケティング、研究開発の高級職を務めていた。また、Mr.Huangは2013年4月から2023年4月までカルシ製薬会社の取締役会メンバーを務め、2018年12月から2023年4月までWindtree治療会社の取締役会メンバーを務め、2020年7月から2023年9月までALaunos治療会社の取締役会メンバーを務めた。現在、Mr.Huangは多くの会社で取締役会のメンバーを務めており、Kindstarユニバーサル遺伝子科学技術有限会社(9960.HK)を含む。彼はスタンフォード大学商学院の工商管理修士号とワシントン大学の化学工学学士号を取得した
カリフォルニア州、バークレー。Mr.Huangは,ヘルスケアや生命科学会社での投資経験とバイオ製薬業界での専門知識のため,我々の取締役会メンバーを務める資格があると考えられる。
劉珍。Ms.Liuは2021年8月から私たちの取締役会のメンバーを務めてきた。Ms.Liuはレーガン社の首席法務官であり、これは世界的な多製品バイオテクノロジー会社であり、2023年12月にファイザーに買収され、2014年以来ファイザーに勤めている。これまで、Ms.LiuはHalozyme治療会社総法律顧問総裁副主任、デュレット社首席法務官兼会社秘書を務めていた。彼女のキャリアの初期、Ms.LiuはPillsbury、Madison&Sutro LLP(現在はPillsbury Winthrop Shaw Pittman LLP)とVenture Law Groupの弁護士であり、そこで彼女は技術移転、許可、特許、および著作権、商標訴訟に相談を提供した。Ms.Liuはミシガン大学細胞と分子生物学学士号、スタンフォード大学生物学修士号、コロンビア大学法学博士号を持っている。私たちはMs.Liuが私たちの取締役会のメンバーになる資格があると信じています。彼女は法律専門知識と生物製薬会社での高度な管理経験を持っているからです。
カレン·J·ウィルソンですウィルソンさんは2020年12月以来、私たちの取締役会のメンバーを務めてきた。ウィルソンさんは現在もElicio Treateutics,Inc.(Angion Biomedica)とLava Treateutics B.V.の取締役会メンバー。2020年8月から2022年8月までの間、ウィルソンさんはVaxart社の取締役会メンバーも務めている。ウィルソンさんはJazz PharmPharmticals Plc財務副総裁兼首席会計官総裁を務めた後、2020年9月までJazz PharmPharmticals plc財務部門の上級副総裁を務めてきた。2011年2月にJazz製薬会社に入社する前、ウィルソンさんは2009年から2011年1月までPDL BioPharma,Inc.で財務副総裁と首席会計官を務めた。ウィルソン·クリスラーコンサルティングの首席財務官、Virrologic社の首席財務官、Novare Surgical Systems社の首席財務官兼運営副主任総裁、徳勤会計士事務所の顧問、監査役も務めた。ウィルソンさんは公認会計士で、カリフォルニア大学バークレー校の商業学士号を取得した。私たちはウィルソンさんが財務と会計の専門知識と製薬業界での高級管理経験のため、私たちの取締役会のメンバーを務める資格があると信じている
家族関係
私たちのどんな役員や役員の間にも家族関係はありません。
主要株主、顧客、サプライヤーとの手配
以下の“7.B.関連側プロトコル-株主プロトコル”の項の下で株主合意に基づいて作成した董事委員会の任以外に、主要な株主、顧客、サプライヤー或いはその他の人といかなる手配或いは了解を締結することがなく、それによって任意の人は取締役或いは高級管理者として選択される。
B.補償する
2023年12月31日の会計年度までに、私たちまたは他の方法でサービスを提供してくれる役員や役員が獲得した報酬総額は約390万ドルです。法律の規定によると、私たちの中国子会社は従業員の給料の特定の割合で年金、医療保険、失業保険、その他の法定福祉及び住宅積立金を納めなければならない。2023年12月31日までの財政年度には、私たちに雇用されたり、他の方法でサービスを提供してくれた役員や役員に年金、退職、または同様の福祉を提供する予約または課税総額は10万ドルです。上記の総補償額には,李展文博士に支払われた補償が含まれており,2023年8月6日まで我々の首席医療官を務め,雇用終了まで幹部であった。李博士は彼の辞任に関する現金補償を何も受けていません。
2023年、私たちの幹部は会社と個人の業績目標を達成するために年間現金ボーナスを得る機会があります。どの士官にも2023年の年間目標ボーナスがあり、ボーナスはその年間基本給の割合で表されている。2023年ボーナス計画下の報酬は、通常、私たちの臨床開発計画および個人貢献に関連する全社的な目標に基づいており、当社の報酬委員会によって決定されます。これらの年間ボーナスについて支払われる金額は、上段に示す総補償金額に含まれています。
我々の取締役会は、2022年1月1日に発効し、2024年1月に更新される計画である非従業員役員報酬計画を採択した。役員報酬計画は全面的な報酬案を提供し、合格かつ経験豊富な人を取締役に引き付け、維持することができ、取締役の利益と株主の利益を一致させることを目的としている。同時にわが社の従業員や私たちの重要な投資家の取締役でもありますが彼らが私たちの取締役会でのサービスで報酬を得ることはありません。私たちは清算し、取締役会会議に出席した非従業員取締役による実際の自己負担費用と支出を引き続き精算します。
役員報酬計画によると、非従業員取締役は私たちの取締役会と取締役がいる各委員会に勤めており、現金事前招聘金を得ることができる。私たちの首席独立役員と私たちの取締役会の各委員会の議長はこのようなサービスのためにより高い採用権を得るだろう。現金前払い金は四半期ごとに延滞しています。どの部分のカレンダー四半期のサービスに対しても、毎年の現金予約金は比例して計算されます。また、この計画によれば、各非従業員取締役は、付与日の1周年又は会社支配権変更時(2021年株式インセンティブ計画の定義に基づいて)に年間付与されたオプションを取得する。役員報酬計画によると、2024年から、私たちの非従業員取締役の年会費と株式奨励は以下の通りである
| | | | | | | | | | | | | | |
| 役柄 | | 年度ノルマ | | 年間オプション賞 |
| 非従業員取締役 | | $40,000 | | 26,450 |
| 独立役員を筆頭にする | | $17,500 | | 7,090株 |
| 監査委員会議長 | | $15,000 | | — |
| 監査委員会委員 | | $7,500 | | — |
| 報酬委員会議長 | | $10,000 | | — |
| 報酬委員会委員 | | $7,500 | | — |
| 委員会の議長を指名する | | $10,000 | | — |
| 委員会のメンバーを指名する | | $7,500 | | — |
2023年12月31日まで、私たちの株式激励計画に基づいて、私たちの役員と取締役の購入2,720,002株のオプションは返済されていません。加重平均行権価格は1株当たり5.99ドルです。また、2024年までに、私たちの執行者と取締役に追加オプションを付与して、1,034,440株の普通株を購入することを承認しました。総加重平均行権価格は1株当たり1.18ドルです。私たちの株式インセンティブ計画下のオプションは付与日から十年以内に満期になりません
行政者との雇用協定
私たちは私たちのすべての執行官たちと雇用協定を締結した。このような合意に基づいて、私たちの一部の執行官たちは規定された時間帯に招聘された。私たちはいつでも職員たちの特定の行動を実行することで雇用を中止することができる。
各幹部は、雇用に関連する義務を履行する際または適用される法律の要求に基づいて、雇用契約の終了または終了後に厳格に秘密にすることに同意しており、私たちのいかなる機密情報や商業秘密、私たちの業務パートナーの任意の機密情報または商業秘密、または私たちが受信した任意の第三者の機密または独自情報を使用しない限り、私たちはこれに対して守秘義務を負っている。執行者はまた、実行者が私たちに雇用されている間に、彼らの概念、開発、または実践に還元されたすべての発明、設計および商業秘密を秘密に開示し、これらの発明、設計および商業秘密のすべての権利、所有権および権益を私たちに譲渡し、これらの発明、設計および商業秘密の特許、著作権および他の法的権利の取得および実行に協力することに同意する。
潘武斌と雇用協定を締結する
2021年1月1日から、康乃徳生物香港有限会社及びその連合会社は潘武斌博士と雇用協定を締結し、康乃徳生物香港有限会社及び当社の主席兼総裁として招聘された条項を明らかにした。協定によると,潘博士は495,000ドルの年間基本給(2022年1月1日から発効,512,000ドル)を得る権利があり,この額は減らすことはできないが,年次審査が必要である
私たちの取締役会またはその指定者たちが自分で決定する。潘博士の雇用協定では、年間業績ボーナスを得る資格がある可能性があり、目標額はその年度基本給の50%に相当すると規定されている。
その雇用合意によると、潘博士の雇用関係を不当な理由で中止したり、潘博士が正当な理由で雇用関係を終了したり(両者ともその雇用合意で定義されている)、会社を受益者とするクレームをタイムリーに履行·撤回しないことが条件である。(1)彼が全額稼いだが支払われていない基本給、および終了日までの未使用の有給休暇は、当時の有効比率で計算し、先に支払うべき任意の年間ボーナス(以前に支払われていない範囲を限度)、彼が獲得する権利のある任意の補償計画または実務項目の下のすべての他の金額を追加する。(2)その当時の基本給12カ月分に相当する金額を支払い、終了日後60日に一度に支払う、(3)終了日が発生したカレンダー年度に比例して算出された目標年間ボーナスに相当する金を支払い、終了日60日後に一度に支払う、(4)その者及びその合格扶養者の健康保険料を支払い、(A)終了日後18ヶ月が満了するまで、又は(B)当該者が新規雇用健康保険を受ける資格がある日まで、両者のうち比較的早い者を基準とする。このような終了が、当社の支配権変更前2(2)ヶ月から終了後12(12)ヶ月までの間(又は2019年株式インセンティブ計画に従って付与された持分奨励に関する会社取引)(又は2019年株式インセンティブ計画に基づいて付与された持分奨励に関する会社取引)(又は2019年株式インセンティブ計画に基づいて付与された持分奨励に関する会社取引)である場合は、上記提供された解散費給付を除いて、潘博士のすべての持分奨励は、終了日または制御権変更日が遅いことに基づいて帰属を加速するであろう(任意の持分報酬がより有利な帰属条件によって制限されている場合、このようなより有利な条項は適用されなければならない)。
もし吾らが正当な理由で潘博士の雇用を中止すれば、彼は十分な理由なく雇用を中止したり、死亡や永久障害時には、その全額を受け取ってまだ支払われていない基本賃金だけを受け取る権利があり、終了日までの課税および未使用の有給休暇(当時の比率で計算)、以前の例年に対応した任意の年間ボーナス(以前に支払われていないものを限度)、彼が受け取る権利のある任意の補償計画や実務項目の下のすべての他の金額を受け取る権利がある。
彼の雇用契約によると、潘博士は1年間の終了後の非聴聞契約と永久的な非けなす契約を守らなければならないほか、雇用期間中に適用される競業禁止契約と、当社の標準的な独自情報や発明譲渡契約に基づいて負う義務がある。
鄭偉と雇用協定を結ぶ
2021年1月1日から、Connect Biopamm LLCとその連合会社は鄭偉博士と雇用契約を締結し、彼のConnect Biopharm LLCとわが社の最高経営責任者としての雇用条項を明らかにした。協定によると、魏博士は495,000ドル(539,000ドル、2022年1月1日から発効)の年間基本給を得る権利があり、この額は減少してはならないが、我々の取締役会またはその指定者が自ら決定して年次審査を行う必要がある。魏博士の雇用協定では、年間業績ボーナスを獲得する資格がある可能性があり、目標金額はその年度基本給の50%に相当すると規定されている。
彼の雇用協定によると、魏博士との雇用関係を不当な理由で中止したり、魏博士が正当な理由で雇用関係を終了したり(両者とも雇用合意で定義されている)、会社を受益者とするクレームを速やかに履行·撤回しないことが条件である。(1)彼が全額稼いだが支払われていない基本給と、解雇の日までの応算と未使用の有給休暇は、当時の比率で計算すると、先に支払うべき例年のボーナス(以前に支払われていない範囲を限度)である。彼が獲得する権利のある任意の補償計画または実務項目の下のすべての他の金額を追加する。(2)その当時の基本給に相当する12カ月分の金は、終了日後60日に一度に支払う。(3)終了日が例年に比例して割り当てられた目標年間ボーナスに相当する金は、終了日後60日に一度に支払う。(4)(A)終了日後18ヶ月が満了するまでコブラ保険料を支払う,(B)“コブラ法案”により継続保険の資格が満了するか、または(C)新たな仕事に関する健康保険を取得する資格がある日、両者の中で最初の1つである。このような終了が当社の支配権変更の前の2(2)ヶ月から終了後12(12)ヶ月の間(または2019年の株式インセンティブ計画に従って付与された持分奨励については、会社取引(以下定義する))で発生した場合、上述した規定の解散料を除いて、魏博士のすべての持分奨励は、終了日または支配権変更日(または2019年の株式インセンティブ計画に従って付与される持分奨励に関する)に基づいて加速的に付与される。会社取引)(しかし、任意の持分報酬がより有利な帰属条件によって制限されている場合、そのより有利な規定が適用される)。
もし吾らが正当な理由で魏博士の雇用を中止すれば、彼は十分な理由なく雇用を中止したり、死亡や永久障害時には、その全額を受け取っても支払われていない基本賃金、終了日までの未使用の有給休暇、以前の例年に対応していたいかなる年間ボーナス(以前に支払われていなかった部分)も、彼が受け取る権利のある他の補償計画ややり方でのすべての他の金額を受け取る権利がある。
彼の雇用契約によると、魏博士は1年間の終了後の非聴聞契約と永久的な非けなす契約を遵守し、また、雇用期間中に適用される競業禁止契約と、当社の標準的な独自情報や発明譲渡協定に基づいて負う義務を守らなければならない。
スティーブン·チャンとの招聘状
Connect生物製薬有限責任会社はSteven Chanと招聘状を締結し、日付は2021年10月11日であり、Connect生物製薬有限責任会社とその付属会社の首席財務官を務める採用条項を示した。招聘状によると、Mr.Chanは(I)410,000ドルの年間基本給、(Ii)その年度基本給の40%に相当する年間情状花紅、(Iii)310,000株のコン乃徳生物控股有限公司の普通株の選択権を購入する権利、(Iv)75,000ドルの使い捨てチェックイン花紅(仕事を開始した日から2年間以内に自発的に雇用関係を終了すれば、全数または部分的に返済できる)、および(V)最大50,000ドルの引っ越し支出を返済する権利がある。
招聘状付録によると,Mr.Chanの雇用関係を理由なく終了したり,幹部が推定終了によりその雇用関係を終了したり(両者とも適用された招聘状で定義されている),以下の支払いと福祉を得る権利があり,(1)(A)その当時の現在の基本給の9カ月プラス(B)その適用年度目標年度ボーナスの75%に相当する:(1)(A)その当時の現在基本給の9カ月プラス(B)その適用年度目標年次ボーナスの75%に相当することが条件である。解除契約が発効した日から五日以内に一度に支払う。そして(2)契約終了日から彼と彼の合格した養育者に9ヶ月にわたるコブラ保険料を支払う。このような終了が当社の支配権変更の2ヶ月前から終了12ヶ月までの期間(定義が適用される要項参照)で発生した場合、上記の規定の解散料を除いて、役員のすべての未償還持分報酬は、終了日または制御権変更日が遅いことに基づいて付与を加速させる(ただし、任意の持分奨励がより有利な帰属条件の制約を受けている場合は、このようなより有利な条項が適用されなければならない)。
Mr.Chanは私たちと標準的な従業員秘密情報と発明譲渡協定、すなわちCIIAを締結し、彼が私たちに雇われ始めたことに関連している。
法的責任及び弁済事項の制限
ケイマン諸島の法律は、ケイマン諸島裁判所がこのような規定が公共政策に違反していると考えない限り、例えば民事詐欺や犯罪結果について賠償を提供するなど、会社の組織定款大綱や定款細則が高級管理者や役員に対して賠償を行う程度を制限していない。当社の組織規約では、当社は、取締役又は取締役が当社の業務又は事務による処理(任意の判断ミスを含む)、又はその職責、権力、権限又は適宜決定権を執行又は履行する際に招く又は受ける一切の行動、訴訟、費用、損失、損害又は責任について賠償を行うべきであるが、その不誠実、故意に違約又は詐欺以外の理由を除き、上記一般性を損なわない原則の下で、取締役又はその上級職員がケイマン諸島又は他の地方のいずれの裁判所においても当社又はその事務に関連する任意の民事訴訟について抗弁(成功するか否かにかかわらず)による損失又は責任。この行為基準は一般的にデラウェア州会社が許可するデラウェア州会社の行為基準と同じだ。
また、私たちは私たちのすべての役員と幹部と賠償協定を締結した。これらの合意によると、私たちは、彼らが取締役またはわが社の幹部であることによって発生した特定の法的責任と費用を賠償することに同意します。
証券法による責任の賠償は、吾等の役員、上級管理者、または上記条項に基づいて吾等を統制する者を許可する可能性があることから、米国証券取引委員会は、このような賠償は証券法が表明した公共政策に違反しているため、強制的に執行することはできないとしている。
2021年株式インセンティブ計画
私たちの取締役会と株主は、2021年株式インセンティブ計画、すなわち2021年計画を承認し、従業員、取締役、コンサルタントに追加的なインセンティブを提供し、私たちの業務を促進しています。
次の各段落は2021年計画の主な条項を説明する。
発行可能株それは.2021年計画に基づくすべての奨励により発行可能な普通株の最高総数は(1)6,000,000株普通株であり、(2)2021年計画発効日(I)に加えて2019年計画に従って発行することができ、または(Ii)2019年計画に基づいてその後その条項に基づいて2021年計画に従って発行可能な未償還奨励金のいずれかの普通株を提供することができる。2022年1月1日に開始される財政年度開始2021年度期間において、最初に発行可能な普通株式数は、各事業年度の初日に増加し、増加した金額は、(I)前期最終日に発行および発行された普通株式総数の少なくとも5.0%に相当するか、または(Ii)我々取締役会が決定する可能性のあるより少ない数の普通株式に相当する。我々の取締役会は、2021年計画下で2023年1月1日と2024年1月1日から始まる財政年度の増資幅を、それぞれ2022年12月31日と2023年12月31日に決定した流通株の2.5%と5.0%とすることを決定した。いずれの場合も、2021年計画に基づいて奨励的株式オプション(米国国税法422節の意味に適合)を行使した後、発行可能な株は60,000,000株を超えてはならない。
2021年までの計画発効日まで、2019年計画ではこれ以上の贈与は提供されません。しかし、2019年には、この計画に基づいて付与された未決定の賞の条項や条件の管理を継続する予定です。
賞のタイプ。2021年計画は、2021年計画に従って付与されたオプション、株式付加権、制限株式、制限株式単位、配当等価権、または株式または現金ベースの他の報酬を計画管理人に付与することを可能にする。
計画管理それは.私たちの取締役会や取締役会が指定した委員会は2021計画を管理するだろう。委員会または取締役会の全メンバーは(状況に応じて)決定する権利がある:(1)任意の財政年度に奨励を付与するかどうかを決定する;(2)株式オプション付与通知および奨励協定に規定された公平な市場価値および行使価格を決定する。(Iii)“2021年計画”の下で使用される認可プロトコルフォーマットを承認し、授標協定の条項を改訂する;(Iv)“2021年計画”に従って付与された任意の未決定授標の条項を改訂するが、条件は、授授者の書面の同意を得ず、承認者が授標を完了していない権利に悪影響を及ぼす修正を行ってはならないことである。(V)“2021年計画”および授賞条項を解釈し、説明する。また、我々の取締役会は、2021年計画下の報酬を付与し、2021年計画下の権限をこれらの役員に委譲することを許可することができる。私たちの報酬委員会は2021計画を全面的に管理すると予想していますが、非従業員役員への報酬は除外し、これは引き続き取締役会が管理していきます。
授標協定それは.2021年計画に基づいて付与される報酬は、各報酬の条項、条件、制限を規定する報酬プロトコルによって証明され、その中には、報酬の期限、被贈与者が雇用されたり、サービスが終了した場合に適用される条項、および私たちが一方的または二国間で修正、修正、一時停止、キャンセル、または撤回する権限が含まれている可能性がある。
資格それは.当社とその関連実体の従業員、役員、コンサルタントに賞を授与することができます。しかし、私たちは、私たちの従業員と私たちの親会社と子会社の従業員にのみ、インセンティブ株式オプション資格に適合するためのオプションを付与することができます。
帰属付表それは.一般に、計画管理者は、関連する付与プロトコルで指定される付与スケジュールを決定する。
裁決的行使それは.計画管理者は、必要に応じて各報酬の行使価格または購入価格を決定することになり、これは報酬プロトコルで説明される。オプションが付与された時点で計画管理人が確定した時間前に行使しなければ,オプションの付与済み部分は満了する.ただし,最長行使可能期間は付与日から10年とした。
譲渡制限.計画管理人に別段の規定がない限り,受領者は遺言又は相続法及び分配法以外のいずれの方法でもボーナスを譲渡してはならない。
“2021年計画”の終了と改訂それは.早期に終了しない限り、2021年計画の期限は、我々の取締役会が2021年計画を初めて採択した日から10年となる。私たちの取締役会または報酬委員会は計画を修正または終了する権利がありますが、適用される法律の要求に適合するために株主の承認を受けなければなりません。しかし,受給者の同意を得ない限り,このような行動は以前に付与されたいかなる裁決にも実質的な悪影響を与えてはならない.
2019年株式インセンティブ計画
私たちの株主と取締役会は、2019年11月に2019年株式インセンティブ計画、すなわち2019年計画を採択し、従業員、取締役、コンサルタントに追加のインセンティブを提供し、私たちの業務を促進します。本年報日までに、2019年計画下のすべての奨励により発行可能な普通株の最高総数は2,570,864株普通株である。
以下の各段落は2019年計画の主な条項を記述している。
賞の種類それは.2019年計画では、オプション、株式付加価値権、制限株式、制限株式単位、配当等価権、または計画管理人が2019年の計画に従って付与された任意の他のタイプの奨励を決定することを許可する予定です。
計画管理それは.私たちの取締役会または取締役会が指定した委員会は、1人以上の取締役会メンバーで構成され、2019年計画を管理する責任があります。委員会または取締役会全体は、(1)いずれかの財政年度内にボーナスとその総数を付与するか否かを決定する権利がある。(2)株式オプション付与通知および奨励協定に規定されている公平な市場価値および行使価格を決定する権利がある。(Iii)“2019年計画”で使用される授権協定フォーマットを承認し、授権協定の条項を改訂する;(Iv)“2019年計画”によって付与された任意の未解決の授権書の条項を改訂するが、被授権者の書面の同意を得ず、係属中の授権書の権利に悪影響を及ぼす修正を行ってはならないことを条件とする。(V)“2019年計画”および授権書の条項を解釈し、解釈することは、任意の授標通知または授標合意、および(Vi)“2019年計画”、任意の授標合意または授賞通知に規定される他の権力を行使することである。また、我々の取締役会は、1人以上の取締役に2019年計画下の報酬を付与し、2019年計画下の権限をこれらの役員に委譲することを許可することができます。
授標協定それは.2019年計画に基づいて付与される報酬は、奨励協定によって証明され、この協定には、各報酬の条項、条件、制限が規定されており、その中には、報酬の期限、被贈与者の雇用またはサービス終了時に適用される条項、および私たちが一方的または二国間で修正、修正、一時停止、キャンセル、または撤回する権限が含まれている可能性がある。
資格それは.当社とその関連実体の従業員、役員、コンサルタントに賞を授与することができます。しかし、私たちは、私たちの従業員と私たちの親会社と子会社の従業員にのみ、インセンティブ株式オプション資格に適合するためのオプションを付与することができます。
帰属付表それは.一般に、計画管理者は、関連付与プロトコルに規定されたホームスケジュールを決定する。
裁決的行使それは.計画管理者は、適用状況に基づいて、報酬プロトコルに規定されている各報酬の使用価格または購入価格を決定する。オプションが付与された時点で計画管理人が確定した時間前に行使しなければ,オプションの付与済み部分は満了する.ただし,最長行使可能期間は付与日から10年とした。
譲渡制限それは.計画管理人に別段の規定がない限り,受領者は遺言又は相続法及び分配法以外のいずれの方法でもボーナスを譲渡してはならない。
2019年計画の終了と改訂それは.事前に終了しない限り、2019年計画の期限は10年で、私たちの取締役会の日から計算します 役員は2019年の計画を初歩的に採択した。私たちの取締役会はこの計画を修正または終了する権利がありますが、適用法に適合するために株主の承認を受けなければなりません。しかし,受給者の同意を得ない限り,このような行動は以前に付与されたいかなる裁決にも実質的な悪影響を与えてはならない.
従業員持株実体. 中国の株式奨励に関する監督管理と実際の管理問題のため、著者らは一つの手段としてConnect Unionを設立した 2019年計画に基づいて私たちの中国にいる従業員への普通株式の発行と交付を促進する。これに関連して,Connect Unionに2,570,864株の普通株を発行し,2019年に保有する予定である.Connect Unionは我々がエージェント構造として発行した普通株を持ち,従業員,取締役,コンサルタントがオプション行使時に獲得したわが社の普通株はConnect Unionが保有するわが社の普通株からなる.2021年9月、Connect Unionは2,570,864株の普通株を渡し、世代名人構造に従って発行した普通株の保有を停止しました。
2021年従業員株購入計画
我々の取締役会と我々の株主は、2021年従業員株式購入計画、または2021年従業員持株計画を承認しており、具体的な条項を以下のように概説する。
2021年にESPPは2つの異なる構成要素から構成され、より大きな柔軟性を提供し、2021年にESPPに従って米国および非米国人従業員に株式購入の選択権を付与する。具体的には、2021年ESPP認可(1)法典第423節に基づいて米国連邦税収割引を受ける資格を有する米国人従業員にオプションを付与する(“第423節構成要素”)、および(2)法典第423節に基づいて納税資格を満たしていないオプションを付与して、米国外で米国連邦税制優遇待遇から利益を受けていない従業員の参加を促進し、非米国法および他の考慮事項を遵守するための柔軟性を提供する(“非423節構成要素”)。現地の法律および慣行が許可されている場合、非423条項コンポーネントは、一般に423条項コンポーネントと同様の条項および条件に従って実行および管理されると予想される。
奨励に使える株それは.2021年のESPPによると、最初は計60万株の普通株を保留して発行した。はい また、2021年にESPPで発行可能な株式数は、2022年から2031年(2031年を含む)までの各カレンダー年度の1月1日に毎年増加し、増加した金額は、(A)前日のカレンダー年度最終日に発行された普通株式の1%と(B)我々の取締役会が決定した少ない数に相当し、第423条成分に基づいて発行された普通株は12,000,000株を超えてはならないことが前提となる。我々の取締役会は、2021年計画下で2023年1月1日と2024年1月1日から始まる財政年度の増資幅を、2022年12月31日と2023年12月31日に決定した流通株の0.0%と0.0%とすることを決定した。私たちの取締役会または取締役会委員会は、2021年のESPPの条項を管理し、説明し、参加者の資格を決定する権利があります。報酬委員会は2021年のESPPの初期管理人だ。
資格それは.私たちのすべての従業員は2021年のESPPに参加する資格がある。しかし従業員には権利が与えられないかもしれません 従業員が付与直後に(直接または帰属によって)私たちのすべてのカテゴリ株の総投票権または総価値の5%以上を所有している場合、2021年のESPPに従って株を購入する。
権利を授与するそれは.株式は発売期間中に2021年にESPPにより発売される。2021年ESPPによると、発売期限の長さは 計画管理者によって決定され、最長27ヶ月に達する。従業員給与控除は、発売期間中の購入日ごとに株を購入するために使用される。各発売期間の購入日は発売期間の最終取引日となります。2021年のESPPでの製品期限は、計画管理者が決定した時点で開始されます。計画管理人は今後のサービス期間の条項を適宜修正することができる。賃金控除による2021年のESPPへの参加が禁止されている非米国司法管区では、計画管理人は、条件に適合した従業員が、賃金控除の代わりに、2021年にESPP管理人が受け入れられる形で、参加者の2021年ESPPアカウントに支払いを行うことによって参加することを選択することができる。
2021年にESPPは、参加者が給与減額によって普通株を購入することを可能にし、減額幅は最高でその合格報酬の特定のパーセンテージに達することができる。計画管理者は、参加者が任意の提供中に購入可能な最大株式数を決定する。また、どの従業員も、当該等の購入権を行使していないいかなる例年(当社の普通株が要件期間の初日の1株当たり公平市価で計算)においても、25,000ドルを超える比率で第423条に規定する成分に基づいて株式を購入する権利を累積してはならない。
各発売期間の最初の取引日には、各参加者が私たちの普通株式を購入する選択権を自動的に獲得する。この株式購入は、適用要件期間終了時に満了し、その際に要件期間内に累積された賃金減額分を行使する。逆に指定されていない場合、株式の買い取り価格は#年最初の取引日の普通株式公開時価の85%となる
発行期間または購入日。参加者は、適用される発売期限終了前の指定期間内の任意の時間に任意の時間に参加を自発的に終了し、2021年のESPPへの参加を終了し、普通株の購入に使用されていない給与を減額することができる。参加者は雇われを終了すると,参加は自動的に終了する.
参加者は、遺言または相続法および分配法を通過しない限り、2021年にESPPによって付与された権利を譲渡することができず、2021年のESPP下のオプションは、通常、参加者によってのみ行使されることができる。
いくつかの取引それは.もし私たちの普通株に影響を与える特定の非互恵取引や事件が発生したら、計画管理者はそうします 2021年のESPPと未解決の権利を公平に調整する。制御権変更を含む特定の異常または非日常的なイベントまたは取引が発生した場合、計画管理人は、(1)未弁済権利を他の権利または財産で置換するか、または未弁済権利を終了して現金と交換すること、(2)相続人または存続会社またはその親会社または子会社(例えば、)が未弁済権利を接収または代替するか、(3)未弁済権利に拘束された株式の数およびタイプの調整、を規定することができる。(4)参加者の累積賃金減額を用いて次の予定購入日前の新規購入日に株式を購入し、進行中の発売期間のいずれかの権利を終了するか、または(5)すべての未償還権利を終了する。
図は改訂されるそれは.計画管理者は2021年のESPPを随時修正、一時停止、または終了することができる。しかし株主の承認は 取得された任意の修正案は、2021年のESPPの下で販売可能な株式総数を増加させたり、株式タイプを変更したり、2021年のESPPに参加する資格がある従業員の会社または会社カテゴリを変更したりする。
ビジネス行為と道徳的基準
私たちの取締役会は私たちのすべての従業員、幹部、そして役員に適用されるビジネス行動と道徳基準を採択した。“行動基準”は、www.Connectbiopharm.comのウェブサイトの“コーポレート·ガバナンス”の一部で閲覧できます。私たちの取締役会は“行動基準”を監督する責任があり、従業員、役員、取締役の“行動基準”に対するいかなる免除も承認する必要があります。私たちは“行動基準”の任意の修正またはその要求に対するいかなる免除も私たちのウェブサイトで開示されると予想している。当社のサイトアドレスへの引用は、当社のサイトに掲載されているか、または本サイトを介して提供される情報への引用とはなりませんので、本年度報告の一部と見なすべきではありません。
C.取締役会が実践する
取締役会構成
当社の修正および再記載された覚書および定款、または定款に基づき、当社の取締役会は少なくとも 3 人のメンバーで構成されなければなりません。当社の取締役は、取締役会の決議、または株主の通常決議によって選出されることがあります。通常決議は、株主総会に出席して投票する権利を有する株主の単純多数による承認、または株主総会に投票する権利を有する株主の全会一致の書面による同意を必要とします。また、修正および修正された覚書および定款では、当社の取締役は、理由の有無にかかわらず、出席した株主の議決権の少なくとも過半数の所有者の賛成票、代理人による投票、または関連する定時株主総会における郵送による投票により解任されることが定められています。取締役の死亡または辞任に起因する取締役会の欠員は、現役取締役の過半数の投票によって補充されることがあります。欠員を埋めるために選出または任命された取締役は、取締役会によって選出され、交代された取締役の現任期 ( もしあれば ) の残りの任期で選出される。
現在は 7 人の取締役がいます。以下の表は、取締役の氏名および初任年度のとおりです。
| | | | | | | | | | | | | | | | | |
| 名前.名前 | | 現在の位置 | | 任命年 |
| Wubin Pan 博士。 | | 議長.議長 | | 2015 | (1) |
| K.K.D | | 独立役員を筆頭にする | | 2020 | |
| 陳さん、博士。 | | 役員.取締役 | | 2020 | |
ジェームズ · ファン | | 役員.取締役 | | 2024 | |
| ジャン · 劉 | | 役員.取締役 | | 2021 | |
| 鄭偉、博士。 | | 役員.取締役 | | 2015 | (1) |
| カレン · J · ウィルソン | | 役員.取締役 | | 2020 | |
(1)2012 年から Connect SZ の取締役を務め、 2015 年の組織再編後も引き続き取締役を務めています。第 4 項を参照。「会社に関する情報」。詳細はこちら
Wubin Pan 博士、会長として取締役会を率いています会長は、取締役会が当社に効果的なガバナンスを提供することを保証する主な責任を負います。その際、会長は取締役会および株主総会の議長を務めています。議長は、取締役会の運営を主導し、取締役間の効果的なコミュニケーションを促進します。取締役会およびその委員会の組織、構成、実効性を含むガバナンスに関する事項を監督する責任があります。議長は、会議、スケジュール、議題、コミュニケーション、文書化などの取締役会の管理活動を監督します。
クレントス G 。Xanthopoulos 、 Ph. D 、独立取締役を務めています。独立取締役は、独立取締役に対してリーダーシップを発揮し、独立取締役を代表して連絡を取り、取締役会の実効性を確保し、当社の質の高いガバナンスと取締役会の効果的な機能を維持します。
役員は自主独立している
外国の個人発行者として、ナスダックの上場要求と規則によると、私たちの取締役会には独立取締役が必要ありませんが、私たちの監査委員会を除いて、ナスダックの上場要求は段階的スケジュールの指定を許可しています
当社の取締役会はすでに、アメリカ証券取引委員会の関連規則とナスダックの上場基準に基づいて、潘博士と鄭偉博士を除いて、当社のすべての取締役が“独立取締役”の資格を満たすことを決定した。このような決定を下す際に、我々の取締役会は、各非従業員取締役と我々との関係、および取締役会が取締役独立性の決定に関連すると考えている他のすべての事実および状況を考慮して、取締役およびその関連実体実益が所有する普通株式数を含む
リスク監督における取締役会の役割
私たちの取締役会の主な機能の一つは私たちのリスク管理過程を知ることだ。リスク監督機能を果たす際には、私たちの取締役会は、これらの戦略が私たちや私たちの証券保有者のために長期的な価値を創出できない可能性を低減するために、経営陣が適切な業務戦略を策定し、実行することを監督する責任があり、あるいはこれらの戦略は、管理層に過度なリスクを負担する可能性を奨励する。私たちの取締役会は、マクロ経済リスクを含む、私たちの財務、運営、戦略リスクに関する情報を定期的に審査します。私たちの首席独立取締役も私たちの監査委員会と給与委員会のメンバーであり、彼は私たちの会長や経営陣、および適用された場合には私たちの外部専門家と連絡を取り合い、リスク管理に関するリーダーを提供します。我々の取締役会には常設のリスク管理委員会はなく、私たちのリスク管理を直接監督していますが、我々の取締役会には様々な常設委員会があり、それぞれの規制分野固有のリスクを扱っています。特に、我々の取締役会は戦略的リスクの監視と評価を担当しており、私たちの監査委員会は、リスク評価と管理を行う過程を管理するためのガイドラインや政策を含む、私たちの主要な財務リスクの開放と、これらの開口を監視·制御するための私たちの経営陣のステップを考慮して議論する責任があります。私たちの監査委員会はまた法律と法規の要求事項の遵守状況を監視する。私たちの指名とコーポレートガバナンス委員会は、不正または不正な責任創造行為を成功的に防止したかどうかを含む、わが社のガバナンス実践の有効性を監督します。私たちの報酬委員会は私たちの任意の報酬政策を評価して監視しています
そして、このような計画は過度な冒険を奨励する可能性がある。各委員会はいくつかのリスクを評価し、このようなリスクの管理を監督する責任があるが、私たちの取締役会全体は定期的に委員会の報告を通じてこのようなリスクを理解している
会社管理実践
ケイマン諸島の登録免除を受けて設立された有限責任会社として、ケイマン諸島の法律に基づいて、様々な会社の管理要求を遵守しなければならない。また、ナスダックに上場する海外私募発行者として、私たちはナスダック社の上場基準に支配されている。しかし、ナスダックの上場基準は、一部の例外的な状況を除いて、外国の個人発行者がナスダックの規則ではなく、自国の会社管理実践に従うことを許可することを規定している。ケイマン諸島のいくつかのコーポレートガバナンスのやり方はコーポレートガバナンスの上場基準と大きく異なるかもしれない。例えば、ケイマン諸島の会社法または我々が改訂および再記述した組織定款の大綱および細則は、(I)大部分の取締役が独立取締役であることを要求しない、(Ii)我々の報酬委員会は独立取締役のみを含むか、または(Iii)我々の独立取締役は、独立取締役のみが出席する会議を定期的に開催する。以下に述べる以外に,ケイマン諸島法律に基づいてナスダックの企業管理上場基準を可能な限り遵守する予定である。しかし、私たちは未来に母国の接近に従うためにこのような接近を変えることを選択するかもしれない
私たちは外国の個人発行者であるにもかかわらず、監査委員会の構成および職責に関する“取引所法案”の第10 A-3条の規定を遵守しなければならない。規則10 A-3は、監査委員会は、私たちの監査員の指名、報酬、および選択に直接責任があり、その義務を履行し、苦情を処理し、コンサルタントを選択することを制御しなければならないと規定している。規則10 A-3によれば、外国の民間発行者が所在する国の法律がそのような事項のいずれかが会社の取締役会または株主の承認を必要とすることを要求する場合、監査委員会のそのような事項における責任または権力は諮問的である可能性がある
また、ナスダック規則は、上場企業に任意の株式保有者会議の定足数が、同社の普通株に議決権を持つ株式流通株の少なくとも33.3%であることを明らかにすることを求めている。我々の上場後に改正及び再記載された組織定款大綱及び定款細則の規定、及びケイマン諸島の法律で許可されている場合、株主総会に必要な定足数は、1名以上の投票権を含み、自ら又は委員会の代表又は(例えば、株主が会社のような)正式に許可された代表によって出席する株主を含み、当該等の株式の合計は、当社のすべての発行及び有権投票株式に付随する全投票権の3分の1以上である。
また、ナスダック規則は、上場会社の独立取締役が独立取締役のみが出席する会議を定期的に開催しなければならないことを求めている。私たちはこのナスダック規則を守るのではなく、ケイマン諸島母国での私たちの接近に従うつもりだ
また、“ナスダック”は、上場企業は完全に独立役員からなる指名委員会を設立しなければならないと規定している。私たちはこの“ナスダック”規則を守るのではなく、“取締役会構成”で述べたように、ケイマン諸島母国での私たちのやり方に従うつもりだ。
わが社の取締役会各委員会
私たちの取締役会には以下の常設委員会があります:監査委員会、報酬委員会、そして指名、そして会社管理委員会です。私たちのすべての委員会の構成と運営は“ケイマン諸島会社法”、“取引所法案”、“ナスダック”、“アメリカ証券取引委員会”の規則と規定を遵守している
取締役会監査委員会
監査委員会はウィルソンさん、Ms.LiuとMr.Huangから構成され、取締役会が私たちの会計と財務報告の流れ及び私たちの総合財務諸表の監査を監督することに協力します。ウィルソンさんは委員会の議長を務めています。監査委員会は完全に財務知識に通じた取締役会メンバーで構成されており、ウィルソンさんは適用される米国証券取引委員会規則で定義された“監査委員会財務専門家”とされ、適用されたナスダック規則によって定義された必要な財務経験を持っている。我々の取締役会は、監査委員会のすべてのメンバーが取引所法案規則10 A-3に規定されている“独立性”の要件に適合していることを決定した。監査委員会はナスダック規則に適合した定款によって管轄されている
監査委員会の役割には、以下のことが含まれる
•独立監査役の任命を株主総会に推薦する
•監査報告書の作成または発表、または他の監査サービスの実行のために、任意の会計士事務所を採用、補償、保留、監督する
•独立監査師を招聘して監査サービスおよび非監査サービスを提供する前に、当該監査師が提供する監査サービスおよび非監査サービスを予め承認しておく
•独立監査役の資格、業績、独立性を評価し、少なくとも毎年取締役会全員に結論を提出する
•私たちの総合財務諸表および財務報告手続きを実行し、幹事、取締役会、および独立監査人と検討した
•関連者取引ポリシーに基づいて、任意の関連者取引を承認または承認する(関連者取引ポリシーの定義を参照)
監査委員会は、1名以上の監査委員会のメンバーが必要と思う回数で会議を行うが、いずれにしても、毎年少なくとも4回の会議を行う。監査委員会は少なくとも年に一度は私たちの独立会計士と会議を開き、私たちの執行担当者はここにいない
取締役会報酬委員会
報酬委員会はXanthopoulos博士、Mr.Huangとウィルソンから構成され、取締役会に協力して役員報酬を決定した。Xanthopoulos博士は委員会の議長を務めている。米国証券取引委員会とナスダックの規定によると、給与委員会のメンバーの独立性基準は、私たちから標準取締役会メンバーの費用以外の任意の報酬を徴収することを含むより高い。外国の個人発行者はこのより高い基準を達成する必要はないが、私たちのすべての給与委員会のメンバーはこのより高い基準を満たしている
報酬委員会の役割には、
•役員報酬に関する政策を決定、検討、提出した
•これらの政策に基づいて各幹部の業績を評価し、取締役会に報告する
•可変報酬構成部分の可能な結果および実行幹事の報酬にどのように影響を与える可能性があるかを分析する
•給与政策に基づいて各役員報酬の任意の持分長期インセンティブ部分を推薦し、私たちの役員報酬と福祉政策を全面的に検討する
•私たちが法律上取らなければならない追跡政策の遵守状況を審査、提案、採用、管理、そして監視する
•私たちの給与政策と接近によって発生した危険を検討して評価する
取締役会指名及び企業管理委員会
Ms.Liu、魏博士と陳博士から構成された指名と会社管理委員会は私たちの取締役会が確立した標準に基づいて、私たちの取締役会のメンバーと幹部になる資格のある個人を探し、そして私たちの会社の管理原則を制定します。Ms.Liuは指名と会社統治委員会の議長を務めた
指名とコーポレートガバナンス委員会の役割には:
•取締役会のメンバーの選考基準と任命手続きを作成する
•私たちの取締役会の規模と構成を審査して評価し、少なくとも毎年取締役会の構成概要を提案します
•当社の取締役会とその委員会の指名者を推薦します
•取締役会の個別メンバー及び行政人員の運営状況を評価し、評価結果を取締役会に報告する
•取締役会を管理する規則を制定し、取締役会に推薦し、取締役会規則の十分性を審査·再評価し、任意の提案された変化を取締役会に提案する
役員の職責
ケイマン諸島法律によると、私たちの役員は、忠誠の義務、誠実な行動の義務、そして彼らが私たちの最大の利益に合致すると思う善意に基づいて行動する義務を含む当社の会社に対して受託責任を持っています。私たちの役員もまた適切な目的だけで彼らの権力を行使しなければなりません。私たちの役員も私たちの会社に責任があり、テクニックと慎重な方法で行動します。従来,役員が職責を遂行する際に示すスキルレベルは,それが持つ知識や経験に対する合理的な期待よりも高い必要はないと考えられてきた.しかし、イギリスと英連邦裁判所は必要な技能と配慮の面で客観的な基準に向かって進んでおり、ケイマン諸島もこれらの規定に従う可能性が高い。私たちへの注意義務を履行する際には、私たちの取締役は、私たちが時々改正して再記載した会社定款を遵守し、その定款に基づいて株式所有者に付与された種類の権利を確保しなければならない。いくつかの限られた例外の場合、私たち取締役の義務が違反された場合、株主は私たちの名義で損害賠償を請求する権利がある可能性がある。私たちの取締役会は私たちの商業事務所を管理、指導、監督するために必要なすべての権力を持っている。当社の取締役会の職権には、以下のようなものがある
•株主周年総会と臨時株主総会を開催し、株主に仕事を報告する
•配当と分配を宣言する
•士官を任命し,士官の任期を決定した
•当社の借金権力を行使し、当社の財産を抵当に入れる
•わが社の株式の譲渡を許可し、その株式をわが社の株式登録簿に登録することを含む。
役員および上級者の任期
私たちの役員は取締役会の決議または私たちの株主の一般的な決議によって任命することができる。私たちの役員は任期の制限を受けず、株主が決議を採択して彼らの職を罷免する前に勤めています。董事(その中に含まれる)は、破産又は債権者とのいかなる債務返済手配又は債務立て直し協議を達成するか、(Ii)身が故又は精神不健全であることが発見された場合、(Iii)書面で当社にその職を辞任することを通知するか、又は(Iv)特別の許可を得ずに当社取締役会を3回連続して欠席することを決定し、当社取締役が当社の組織定款大綱及び組織定款細則に基づいて任意の他の条文によりその職を罷免することを決定した場合、取締役はもはや取締役ではない。私たちの官僚たちは私たちの取締役会によって選出され、取締役会が適宜決定する。私たちは私たちの執行官たちと雇用協定を締結した。
D.従業員。
2021年12月31日,2022年12月31日,2023年12月31日までに,それぞれ108名,100名,81名の常勤従業員を有している。
次の表は、従業員が履行している主要業務機能別に、過去3年末の私たちの従業員の大まかな数を示しています
| | | | | | | | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2021 | | 2022 | | 2023 |
| 研究開発 | | 69 | | 60 | | 49 |
| 一般と行政 | | 39 | | 40 | | 32 |
| 合計する | | 108 | | 100 | | 81 |
以下の表には、過去3年間の年末の従業員数を地理的に示しています
| | | | | | | | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2021 | | 2022 | | 2023 |
| 中国と香港 | | 82 | | 68 | | 62 |
| アメリカです | | 25 | | 32 | | 19 |
| 他にも | | 1 | | - | | - |
| 合計する | | 108 | | 100 | | 81 |
私たちの職員たちは集団交渉協定の下で働いている人は一人もいない。私たちは労働に関する休業やストライキを経験したことがなく、私たちと従業員との関係が満足できると信じている。
E.所有権を共有する。
取締役と上級管理者の株式所有権に関する資料は、項目7.Aを参照されたい。“大株主および関連側取引--大株主”。私たちの株式インセンティブ計画に関する情報は、項目6.Bを参照されたい。役員、上級管理職、そして従業員の報酬インセンティブ計画
F.開示登録者が誤って判決された賠償の行動を取り戻す。
ない。
第 7 話。主要株主および関連当事者の取引。
A.大株主です。
次の表は、2024年3月1日現在の私たちの普通株式の実益所有権に関する情報を示しています
•私たちが知っている実益は、私たちが発行した普通株式の5%以上のすべての人または各グループの関係者を持っている
•私たちの取締役会のすべての会員たちと私たちのすべての執行役員たち
各エンティティ、個人、取締役会メンバー、または役員実益が所有する普通株式数は、米国証券取引委員会の規則に基づいて決定され、これらの情報は、実益所有権が任意の他の目的のために使用されるとは限らない。これらの規則によれば、利益所有権は、個人が投票権または投資権を単独または共有する任意の株式と、個人が2024年3月1日から60日以内に任意のオプションまたは他の権利を行使することによって取得する権利を有する任意の株式とを含む。別の説明のほか,コミュニティ財産法を適用した規約の下で,表に記載されている者は,所有するすべての普通株に対して独占投票権と投資権を持つ.
実益が持つ普通株の割合は,2023年12月31日までに発行された55,102,954株の普通株の換算に基づいて計算される。1人の人は2024年3月1日から60日以内に買収する権利があり、そのような権利を持つ人の所有権パーセンテージを計算する際に発行された普通株式とみなすが、他の人の所有権パーセンテージを計算する場合は発行済み普通株とはみなさないが、すべての取締役会メンバーおよび行政人員の1つのグループとしての所有権パーセンテージについては発行済み普通株とはみなさない。以下に別途説明しない限り、各実益所有者のアドレスは、C/oコン乃徳生物控股有限公司であり、アドレスは12265 El Camino Real,Suite 350,San Diego,CA 92130,United Statesである。
| | | | | | | | | | | | | | |
| 実益所有者の氏名又は名称及び住所 | | 量
実益株
オーナー * * | | パーセント
実益株
持っている |
| 5%以上の株主: | | | | |
Panacea Opportunity Fund I , L. P. の関連団体。(1) | | 12,000,000 | | 21.8% |
バイオフォーチュン株式会社 (2) | | 6,197,398 | | 11.2% |
上海敏慧企業経営コンサルティングパートナーシップ ( 有限合弁会社 ) (3) | | 5,306,149 | | 9.6% |
Qiming Venture Partners の関連団体 (4) | | 4,840,898 | | 8.8% |
アドバンテックキャピタル II コネクトパートナーシップ L. P. (5) | | 4,762,185 | | 8.6% |
リリー · アジア · ベンチャーズ ( 以下「 LAV 」 ) の関連会社 (6) | | 3,336,907 | | 6.1% |
| | | | |
| | | | |
| 管理職と役員: | | | | |
Zheng Wei 博士 (7) | | 6,487,545 | | 11.8% |
Wubin Pan 博士。 (2) (8) | | 6,728,292 | | 12.2% |
スティーヴン · チャン (9) | | 225,036 | | * |
| 陳さん、博士。 | | — | | * |
ジェームズ · ファン | | — | | * |
劉珍(10) | | 70,858 | | * |
カレン·J·ウィルソン(11) | | 141,758 | | * |
K.K.D (12) | | 138,848 | | * |
役員全員と執行幹事(八(8)人) | | 13,792,337 | | 25.0% |
| | | | |
*実益保有株式が発行済み普通株式総数の1%未満であること。
**アメリカ預託証明書に代表される普通株が含まれています
(1)2024年2月23日に提出された付表13 Dで述べたように,Panacea Venture Healthcare Fund II,L.P.は12,000,000株の普通株を持っていることを示している。HuangはPanacea Innovation Limitedの唯一の所有者であり、Panacea Venture Healthcare Fund II GP Company,Ltd.はPanacea Venture Healthcare Fund IIの一般パートナーであり、L.P.取締役会のJames HuangはPanacea Innovation Limitedの唯一の所有者であり、Panacea Venture Healthcare Fund II GP Company,Ltd.はPanacea VentHealthare Fund IIの一般的なパートナーである。したがって、Huang、Panacea Innovation LimitedおよびPana VentalHecure FundはCompanyである。株式会社は、本稿で直接報告した普通株の実益所有権を共有すると見なすことができるが、それぞれこの実益所有権を放棄する。Panaceaエンティティの登録アドレスは、ケイマン諸島ケイマン諸島大ケイマンKY 1-1104 Ugland House C/o Maples企業サービス株式会社である。
(2)2024年2月13日に提出された明細書G/Aによると、英領バージン諸島法律に基づいて設立された株式会社BioFortune Inc.によると、6,158,016株の普通株を保有しており、その中には(I)潘武斌博士、我々の総裁兼取締役会議長が保有する530,894株と、(Ii)潘博士の配偶者が保有する39,382株の普通株が含まれている。潘博士はBioFortune Inc.の唯一の株主であり、このような株式に対して投票権と投資権を持っているとみなされる可能性がある。潘博士は当該等の株式の実益所有権を放棄したが、いかなる金銭的利益に関わる者も除外した。BioFortune Inc.の登録住所は英領バージン諸島トルトラ路町ウェハン礁二期海岸ビル郵便ポスト2221号です
(3)上海民匯企業管理コンサルティング組合(有限組合)が保有する5,306,149株の普通株から構成され、この有限組合は中国法律に基づいて設立された有限組合企業である。蘇州祥唐創業投資有限公司は、中国の法律に基づいて設立された有限責任会社であり、その最終株主は顧振振さんおよび顧建平さんであり、上海民匯管理諮詢組合(有限責任組合)の一般パートナーである。上海民匯企業管理コンサルティング組合(有限組合)の登録住所は中国上海自由貿易試験区ヤオ花路251号初の1階である。蘇州祥唐創業投資有限公司、顧振起さん、顧建平さんの営業住所は中国江蘇省太倉市上海東路168號祥堂大廈9階
(4)(I)ケイマン諸島免除を獲得した有限組合会社啓明取締役社長基金が保有している96,285株の普通株;(Ii)ケイマン諸島で免除された有限組合企業啓明創業組合有限会社が保有している3,102,470株の普通株;(Iii)ケイマン諸島で免除された有限組合企業啓明七期戦略投資家基金が保有している14,993株の普通株;及び(Iv)ケイマン諸島で免除された有限組合啓明創業共同有限会社が保有する1,627,150株の普通株を代表する。啓明創投パートナーV,L.P.の普通パートナーは啓明GP V,L.P.であり,その普通パートナーは啓明企業GP V,Ltd.であり,ケイマン諸島免除を獲得した会社である。啓明社GP V株式会社も
啓明取締役社長基金V,L.P.の一般パートナー.啓明取締役社長基金V,L.P.および啓明創投パートナーV,L.P.の当社株式に対する投票権および投資権は、啓明創業投資有限公司が行使し、コンバースさん、ゲーリーRieschelさんおよびNisa Leungさんによって所有されている。啓明創投パートナーVII,L.P.と啓明VII戦略投資家ファンドL.P.の一般パートナーは,啓明GP VII,LLC,ケイマン諸島有限責任会社である。甲斐明創業パートナーVII,L.P.および啓明VII戦略投資ファンド,L.P.自社株に対する投票権および投資権は,啓明GP VII,LLCが行使し,啓明GP VII,LLCの実益所有者は,ベル氏,Gary RieschelおよびNisa Leungさんである。メル氏さん,Gary RieschelさんおよびNisa Leungさんはこの株式を所有することは一切ないが,金銭的利益に関わる者は除外する.啓明実体の登録先はM&C企業サービス有限会社,郵便ポスト309 GT,ケイマン諸島ジョージ城南堂街Ugland House 309 GTである
(5)研華Capital II Connect Partnership L.P.が保有する4,762,185株の普通株を含み、研華はケイマン諸島免除を獲得した有限組合企業、あるいは研華である。研華資本二期投資パートナー有限公司はケイマン諸島の法律登録に基づいて設立された免除会社であり、研華の一般パートナーであり、研華が保有する特定の株式を実益と見なす可能性がある。研華資本二期投資パートナー有限会社は研華資本二期有限会社の実益が所有と制御し、研華資本二期有限会社は最終的に彭継昌によって制御される。Mr.Chanは研華保有株式の実益所有権を放棄したが,その中のいかなる金銭的利益も除外した。研華実体の登録アドレスはケイマン諸島大ケイマンKY 1-9005ジョージ町Elgin Avenue 190号である。
(6)(I)LAV Biosciences Fund V,L.P.が保有する1,824,605株の普通株,(Ii)LAV Star Limitedが保有する300,000株の普通株,(Iii)LAV Opportunities Limitedが保有する300,000株の普通株,および(Iv)蘭有限公司が保有する912,302株の普通株を含む。LAV実体の住所は香港中環雪工場街2号聖ジョージビル606-7室礼来アジアベンチャー会社です。
(7)2024 年 2 月 13 日に提出されたスケジュール 13 G / A に記載されているように、 Wei 博士は、 ( i ) 5,92 8,164 株の普通株式、および ( ii ) 2024 年 3 月 1 日時点で行使可能であるか、またはその日から 60 日以内に行使可能になるオプションの基礎となる普通株式 559,381 株を含む。
(8)これには、 (i) 2024 年 3 月 1 日時点で行使可能な潘博士が保有するストックオプションの基礎となる普通株式 530,894 株、および (ii) 潘博士の配偶者が保有する普通株式 39,382 株が含まれます。
(9)2024 年 3 月 1 日以降 60 日以内に行使可能なオプション原価 217,536 株を含みます。
(10)2024 年 3 月 1 日以降 60 日以内に行使される Liu 氏が保有するオプションの原価となる普通株式 70,858 株を表します。
(11)2024 年 3 月 1 日以降 60 日以内に行使されるウィルソン氏が保有するオプションの原価となる普通株式 131,758 株を含む。
(12)2024 年 3 月 1 日以降 60 日以内に行使される Xanthopoulos 博士が保有するオプションの基礎となる普通株式 138,848 株を表します。
私たちの取締役の一部は次の表に示すように、私たちの主要株主と関連があります
| | | | | | | | |
| 役員.取締役 | | 大株主 |
| | |
| 陳さん、博士。 | | 創造的な関連実体を明らかにする |
| ジェームズ · ファン | | Panacea Opportunity Fund I , L. P. の関連団体。 |
Wubin Pan 博士。 | | BioFortune Inc. |
2024年3月31日現在、米国証券取引委員会の公開届出文書によると、上記の場合を除いて、我々の5%以上の普通株または普通株を代表する米国預託証券を保有する大株主はいない。2024年3月31日現在、登録されている一般株主4人の住所は米国にある。ドイツ銀行アメリカ信託会社は我々米国預託証明書の預託機関として36,530,101株の普通株を保有している。
私たちの知る限り、上記で開示された場合を除いて、私たちは、別の会社、任意の外国政府、または任意の他の自然人または法人、または他の個別または共同所有または制御によって直接的または間接的に制御するわけではない。私たちが知っている限り、何の手配や操作もないことは、私たちがその後の日付で制御権の変更を経験することをもたらすかもしれない。私たちの主要株主は私たちの他のどの株主とも違う投票権を持っていない。
B.関係者取引記録。
以下は、2021年1月1日以来、任意の取締役会メンバーまたは役員、および5%を超える普通株を保有する保有者と達成した重大関連者との取引について説明する。
優先株配向増発
以下は過去3年間に我々が発行した証券の概要である.以下に述べる証券発行履歴は、当社初公募前に実施された1.74株普通株のうち1株合併には適用されない。
普通株
2020年4月14日,BioFortune Inc.と鄭偉博士にそれぞれ245,798株の普通株を発行した。
2018年12月から2020年12月まで、著名人であるConnect Unionに4,473,305株の普通株を発行し、奨励発行を実施したり、2019年の計画に基づいて当社の従業員、取締役、コンサルタントに普通株を発行したりしました。2021年9月、Connect Unionはこのような普通株式をすべて渡し、世代有名人構造として発行された普通株式の保有を停止しました
初公募完了時に、吾らは株主合意に記載された反償却条文に基づいてC系列優先株保有者に(I)12,937,500株普通株(発売中に購入した米国預託証券代表)、(Ii)121,080株普通株を発売直後に我々の創設者に発行し、(Iii)株主合意に記載された逆償却条文に基づいてC系列優先株保有者に46,232株を発行した。
優先株
シリーズPre-A優先株融資それは.再編については、2018年10月30日、既存の株主に発行して販売します Connect SZ合計31,090株Pre-Aシリーズ優先株(2018年12月に3,109,000株Pre-Aシリーズ優先株に分割)を売却し、Connect SZで保有している同じ株式を対価として交換する。Connect SZで保有している株式は最初に合計500万ドルで購入されました。
Aシリーズ優先株融資それは.再編については、2018年10月30日、既存株主に発行して売却しました SZ合計84,712株のAシリーズ優先株(2018年12月に8,471,200株Aシリーズ優先株に分割)を対価とし、Connect SZで所有している同じ株式と交換した。Connect SZが保有している株式は最初に2000万ドルの総対価格で購入されました。
Bシリーズ優先株融資それは.2018年12月20日に私募方式で投資家に合計10,127,579株を発行·販売しました Bシリーズ優先株は、引受価格は1株5.4307ドル、総代価は5,500万ドル。
Cシリーズ優先株融資2020年8月21日に私たちは私募方式で投資家に16,605,196を発行·販売しました Cシリーズ優先株は、引受価格は1株6.3233ドル、総代価は1.05億ドル。2020年12月1日、我々は1株6.3233ドルの引受価格で方向性増発の投資家に合計4,744,341株のCシリーズ優先株を発行し、売却し、総対価格は3,000万ドルであった。
下記表に上記融資取引において5%を超える普通株を保有する保有者が購入した普通株と優先株の総数を示す。次の表に示すように、1株当たり優先株は初公募を完了した後に普通株に変換される。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| 参加者 | | 普通だよ
株 | | Aシリーズ
優先して優先する
株 | | Bシリーズ
優先して優先する
株 | | Cシリーズ
優先株 |
| 株主 5% 以上 ( 1 ) | | | | | | | | |
| Qiming Venture の関連会社 | | | | | | | | |
| パートナー ( 2 ) | | — | | 4,235,600 | | 1,012,758 | | 3,162,895 |
| アドバンテックキャピタル II コネクト | | | | | | | | |
| パートナーシップ L. P. | | — | | — | | 8,286,202 | | — |
| RA Capitalに関連する実体 | | | | | | | | |
| 経営 (3) | | — | | — | | — | | 6,325,789 |
| 上海敏慧企業 | | | | | | | | |
| 経営コンサルティング | | | | | | | | |
| パートナーシップ ( 有限合弁会社 ) | | 9,232,700 | | — | | — | | — |
| リリー · アジア関連会社 | | | | | | | | |
| ベンチャー事業 | | | | | | | | 5,806,218 |
(1)これらの株主およびその持分に関する詳細は、本年次報告書の「主要株主」のキャプションの下に記載されています。
(2)Qiming Managing Directors Fund V , L. P. が取得した株式を代表する。Qiming Venture Partners V 、 L. P. 、Qiming VII Strategic Investors Fund , L. P. および Qiming Venture Partners VII , L. P.
(3)RA Capital Healthcare Fund,L.P.,RA Capital Nexus Fund,L.P.とBlackwell Partners LLCを代表して買収した株式−Aシリーズ。
(4)LAV生物科学基金V、L.P.,LAV Star Limited、LAV Opportunities Limited、蘭有限会社を代表して買収した。
株主合意
私は2020年12月1日に吾等及び一部の株主(上記で述べた5%以上の普通株を保有する各株主を含む)と2回目の改訂及び再署名された株主合意を締結したに等しい。改正された株主合意は、吾等にいくつかの肯定的な義務を課し、所有者特定の権利を付与し、それが保有する証券の登録権、優先購入権、共同販売及びドラッグ権、並びにいくつかの情報及び査察権を含む。株主合意によると、融資条件に達したため、初公募が完了した直後に我々の創設者に121,080株の普通株を発行した。我々の創設者に普通株を発行するため、株主合意の反希釈条項に基づいてCシリーズ優先株保有者に46,232株普通株を追加発行した。
Ms.LiuとMr.Huangを除いて、株主合意により、当社の現職取締役一人ひとりが当社の取締役会メンバーに任命された。魏博士、潘博士、ウィルソンさん、Xanthopoulos博士は私たちの創始者に彼らの代表として私たちの取締役会に任命されました。啓明によって指定された陳博士は私たちの取締役会のメンバーに選ばれ、私たちAシリーズの優先株の代表として選ばれた。
以下に述べる登録権利に加えて、株主合意項における株主権利は、当接吾等の初公募が完了する前に終了し、先に本合意により吾等の取締役会に選ばれたメンバーは、辞任、免職、又はその後継者が吾等の普通株式保有者によって正式に選択されるまで取締役を継続する。私たちの取締役会の構成は“管理-取締役会構成”の節でより詳細に説明されている
私たちの役員や役員との手配
私たちの執行者や役員との合意
私たちは私たちのすべての執行官たちと雇用協定を締結した
2021年3月、私たちは鄭偉博士に20,765株の普通株を買い戻し、代償は人民元250万元(40万ドル)で、株式奨励に関連する従業員の源泉徴収税を支払うために使用した。買い戻しの後、この種の株は解約された
2022年5月、BioFortune,Inc.は唯一の株主である潘武斌博士とともに、60,540株の普通株を無料で引き渡した。返金された株式は解約されます。株式の引き渡しについては、当社は将来の代価や補償についていかなる合意や承諾も締結していません。
賠償協定
私たちは私たちのすべての役員と幹部と賠償協定を締結した。“管理-責任と賠償事項の制限”を参照
Artemis Catalystとの相談スケジュール
私たちは以前、管理コンサルティング会社Artemis Catalyst Ltdとコンサルティング契約を締結しました。同社は私たちの元首席商務官Selwyn Ho、MB BSが完全所有しています。2021年1月に何博士がフルタイム採用を開始した時、コンサルタント協定は終了しました。2021年12月31日までの1年間に、諮問協定に基づいて支払われるべき総金額は30万ドルである。
契約研究組織サービス
日常業務過程において、吾らはすでに多くの付属会社と取引を行い、杭州信諾株式会社、前置実験室(蘇州)有限会社、杭州泰格医薬コンサルティング有限会社、北京医薬発展(蘇州)有限会社及び上海泰格医薬コンサルティング有限会社を含み、後者は2020年11月までに弊社の取締役株主であり、2021年2月までにConnect SZ取締役会の葉小平である。2020年12月31日までの1年間、何の取引もなかった。
2019年株式インセンティブ計画
“管理-2019年株式インセンティブ計画”を参照
関連者取引政策
我々の取締役会は、関係者取引の審査及び承認又は承認のための政策及び手続を規定する書面による関連者取引政策を採択した。本保険証書は,吾らの関係者との間で吾らや関係者に大きな影響を与える任意の取引や提案による任意の取引をカバーしており,関係者が関連者に商品やサービスを購入したり,関係者や実体に商品やサービスを購入したりすることは含まれていないが,関係者はそのような取引やサービスに重大な権益,負債,債務保証および吾などの雇用関係者を持っている.このような取引を承認する際に、我々の監査委員会の任務は、取引の条項が公平な取引の条項に相当するか否か、および取引における関係者の権益の程度を含むすべての関連する事実および状況を考慮することである
C.専門家と弁護士の利益。
適用されません。
項目8.財務情報。
A.連結報告書と他の財務情報
第18項を参照。本年度報告の一部として提出された監査された総合財務諸表の“財務諸表”
訴訟を起こす
吾らは当社の正常な業務過程で発生した様々な請求や法的手続きに時々参加しているが、これらの既存の請求や法律手続きが当社の業務、総合財務状況や経営業績に大きな影響を与えるとは信じていない。私たちは現在、私たちが知っている任意の懸案または脅威のような手続きを含む実質的な法的手続きの当事者ではない。
配当政策
会社が設立されて以来、私たちは普通株についていかなる配当金を支払ったり発表したこともなく、私たちは予測可能な未来にも私たちの普通株に配当金を支払わないと予想している。私たちはすべての利用可能な資金と任意の未来の収益を保留するつもりで、もしあれば、私たちの業務の発展と拡張に資金を提供します。したがって、普通株式または米国預託証明書が増加した場合にのみ、私たちの普通株または米国預託証明書の投資家は予測可能な未来に利益を得ることができる。
私たち普通株の任意の配当金は普通株式登録所有者である口座開設銀行に支払い、その後、口座開設銀行は預金契約の条項に基づいてアメリカ預託証明書所持者にその金額を支払います。法律·法規が適用可能な範囲内で、私たち米国預託証明書の所持者は、私たちの普通株式保有者と同程度の任意の配当金を取得し、預金協定に基づいて支払われるべき費用と支出を差し引く。
任意の未来配当金の決定は私たちの取締役会によって適宜決定され、ケイマン諸島の法律によって制限されるだろう。また、私たちの株主は一般決議で配当を発表することができますが、いかなる配当も私たちの取締役会が提案した金額を超えてはいけません。ケイマン諸島法律によると、ケイマン諸島会社は利益またはその株式割増口座から配当金を支払うことができるが、いずれの場合も、会社が正常な業務過程で満期になった債務を返済できない場合は、配当金を支払うことができない。当社の取締役会が配当金を発表して派遣することを決定しても、将来配当金を派遣する時間、金額及び形式は当時の状況に応じて決定され、当社の経営業績、財務状況、現在及び予想される資本需要、業務見通し、契約制限及び取締役会が関連すると考えられる他の要素を含み、そして任意の未来融資ツール及び当社が時々改訂した組織定款の大綱及び定款細則に記載されている制限によって制限される。私たちは配当のためのいかなる利益や株式プレミアムも私たちの業務に再投資できないと発表した。
また、私たちは持ち株会社で、自分の業務運営は何も行わない。したがって、私たちは子会社の現金配当金、分配、そして他の移転に依存して配当金を支払う
2023年12月31日までの年間、私たちは何の配当金も発表したり支払ったりしなかった。
B.重大な変化
今年度報告書の財務諸表に盛り込まれた日から、大きな変化は生じていない。
第九条。要約と看板。
A.割引と発売詳細
当社の ADS は、 2021 年 3 月 19 日にナスダックグローバルマーケットで取引を開始しました。それ以前は、 ADS の公的市場は存在しませんでした。
B.配送計画
適用されません
C.市場
当社の ADS は Nasdaq Global Market に「 CNTB 」というシンボルで上場しています。
D.売却株主
適用されません。
E.薄めにする
適用されません
F.発行人の費用
適用されません。
第10項補足資料
A.株本
適用されません
B.定款の大綱と定款の細則を組織する.
当社は、有限責任で設立されたケイマン諸島免除会社であり、当社の業務は、当社の定款および定款、ケイマン諸島会社法 ( 以下、会社法と呼ぶ ) 、およびケイマン諸島のコモン · ローによって管理されます。
当社の株主は、上場完了直前の第 4 回修正定款を完全に置き換えて発効した修正定款を採択しました。以下は、当社普通株式の重要な条件に関する修正定款及び定款並びに会社法の一部の重要な規定の概要です。
弊社の目的。 修正された定款および定款に基づき、当社の目的は 制限されず、私たちはケイマン諸島の法律で禁止されていないいかなるものも実施する十分な権力と権力を持っている。
普通株です私たちの普通株は登録形式で発行され、私たちのメンバー(株主)登録簿に登録された時に発行されます。 私たちは無記名に株を発行しないかもしれない。私たちの非ケイマン諸島の住民株主は彼らの株式を自由に保有して投票することができる。普通株ごとに所有者に当社の株主総会で議決されたすべての事項について一票を投じる権利があります。
配当金私たちの普通株式の保有者は私たちの取締役会が発表する可能性のある配当金を得る権利がある。さらに私たちの 株主は普通決議案で配当を発表することができるが、配当は取締役が提案した額を超えてはならない。我々は組織規約の大綱と定款細則の規定を改正し,再記述した,我々の
取締役は、任意の配当金を提案または発表する前に、合法的に割り当て可能な資金の中から、適切であると考えられる資金を1つまたは複数の準備金として引き出すことができ、その備蓄金は、取締役の絶対的な適宜決定権の下で、配当金を平均化するか、またはそのような資金を適切に運用することができる他の任意の目的に対処するために使用することができる。ケイマン諸島の法律によると、当社は利益や私たちの株式割増口座から配当金を支払うことができますが、いずれの場合も、当社が正常な業務過程で満期になった債務を返済できない場合は、配当金を支払うことができません。
投票権普通株ごとに当社の株主総会で議決されたすべての事項について一票を投じる権利があります。いつでも投票する 株主総会は,要求(挙手結果が発表される前または後)に投票で投票されない限り挙手で行われる.株主総会議長または任意の1人または複数の株主は、投票方式での投票を要求することができ、これらの株主は、会議に出席する普通株式総数の10%以上の投票権を共有または受委代表する。
株主が会議で採択した一般決議は会議で投票された普通株式の単純多数票の賛成票を必要とし、特別決議は会議で投票された普通株式に添付された投票数の3分の2以上の賛成票を必要とする。名称の変更や改訂及び再記述された組織定款の大綱及び定款細則などの重要事項を変更する場合、特別な決議案が必要となる。他の事項を除いて、わが社は私たちの株主の普通株式を分割または合併することができます。
株主総会ケイマン諸島の免除会社として、会社法に基づいて株主に要求する義務はありません 年度株主総会。吾等は改訂及び重述された組織定款大綱及び定款細則を規定し、吾等は毎年株主総会を当社の株主周年大会として開催することができ、この場合、吾らは総会開催の通告で当該会議を示し、株主総会は当社取締役が決定した時間及び場所で開催される。
株主総会は私たちの取締役会長が開催することもできますし、私たちの大多数の取締役が(取締役会決議に基づいて)開催することもできます。当社は年次株主総会(ある場合)及び任意の他の株主総会を開催し、少なくとも10日前に通知を出さなければならない。任意の株主総会に必要な定足数は、自社のすべての発行済み株式に添付されているすべての投票権の3分の1以上を保有し、その株主総会で投票する権利を有する1人以上の親身または代表が出席する株主を含む。
“会社法”は,株主が株主総会の開催を要求する限られた権利のみを与え,株主に株主総会に何の提案も与えるいかなる権利も与えない。しかし、このような権利は会社の定款で規定されることができる。吾等の改訂及び再記述された組織定款大綱及び定款細則は、株主が自社発行及び発行済み株式の3分の1以上の投票権を有し、株主総会で投票する権利を有する株式を保有することを要求する場合、当社取締役会は特別株主総会を開催し、総会で収用された決議案を採決する。しかし、吾等の改訂及び再記述された組織定款の大綱及び細則は、当社株主にいかなる権利を与えず、当該等の株主で開催されない株主総会又は特別株主総会にいかなる提案を行うこともない。
普通株譲渡次の制限の規定の下で,当社のいかなる株主もその全部又は任意の普通株を譲渡することができる 通常または一般的な形態または取締役会によって承認された任意の他の形態の譲渡文書。
当社の取締役会は、その絶対的な情動権を行使することができ、未納持分または当社の保有権を有する普通株の譲渡を拒否することができます。取締役会は普通株式の譲渡を拒否することもできます
•譲渡書は私の行に提出し、それに関連する普通株式証明書とわが社の取締役会が合理的に要求する可能性のある他の証拠を添付して、譲渡者が譲渡を行う権利があることを証明します
•譲渡文書は1種類の普通株式にのみ適用される
•必要があれば、譲渡文書には適切な印紙が押されている
•連名所有者に譲渡された、普通株が譲渡した連名所有者の数は四人を超えない
•これについてナスダック世界市場で予想される最高額の費用や吾ら取締役が時々要求する低い金額の費用を吾等に支払う。
もし私たちの役員が譲渡の登録を拒否した場合、彼らは譲渡文書を提出した日から3ヶ月以内に、譲渡者と譲受人にそれぞれ拒否通知を出さなければならない。
ナスダック世界市場の要求に従った任意の通知に従った後、譲渡登録は当社の取締役会が時々決定した時間と期限内に登録を一時停止·閉鎖することができるが、いかなる例年においても、譲渡登録は30日を超えてはならない。
清算するわが社の清算時に,われわれの株主に分配できる資産が十分であれば 清算開始時に全株式を返済し、黒字は株主が清算開始時に保有する株式の額面に比例して分配されるが、支払金の株式から自社の未納引受金またはその他の金を差し引かなければならない。もし私たちが分配できる資産がすべての株式を返済するのに十分でなければ、これらの資産は私たちの株主が彼らの保有株式の額面に比例して損失を負担するように分配されるだろう。
株式を催促して株式を没収する私たちの取締役会は時々株主に未払いの金を支払うかもしれません 彼らの株式は、指定された支払時間及び場所が少なくとも14日前に当該等の株主に送達される通知を行う。償還されたがまだ支払われていない株は没収されるだろう。
株式を買い戻し、買い戻し、引き渡しする私たちは私たちの選択に基づいて株を発行したり、償還したりすることができる 当該等株式保有者の選択権は、その条項及び方式は当社取締役会が決定する。当社は、当社の取締役会又は当社株主の一般決議案で承認された条項及び方式で、当社の任意の株式を買い戻すこともできます。会社法によれば、任意の株式の償還又は買い戻しは、自社の利益又は償還又は買い戻し目的のために発行された新株所得金から支払うことができ、又は資本(株式割増帳及び資本償還備蓄を含む)から支払うことができ、当社が支払後直ちに通常業務過程で満了した債務を償還することができることを前提とする。さらに、“会社法”によれば、このような株式は、(A)完全に納付されない限り、(A)完全に納付されない限り、(B)償還または買い戻しの場合、流通株がないことになるか、または(C)わが社が清算を開始した場合である。また、当社は未納株式の任意の株式を無料で引き渡すことができます。
持分変動いつでも、私たちの株式が異なるカテゴリまたはシリーズの株式に分類された場合、権利は任意のカテゴリに付属します 当該カテゴリ又は系列株式の発行条項が別途規定されていない限り、当社が清算しているか否かにかかわらず、当該カテゴリ又は系列株式所有者の3分の2の発行済み株式所有者の書面による同意、又は当該カテゴリ又は系列株式所有者が別の会議で可決した特別決議案の承認を受けて、当該株式又は系列株式(当社が清算しているか否かにかかわらず)を変更することができる。優先権または他の権利を有する任意のカテゴリ株式所有者に付与される権利は、増設、配布、またはより多くの等級の株式の発行によって変更されるとみなされてはならないが、そのカテゴリ株式がその時点で付随する任意の権利または制限によって制限されなければならない平価通行証この既存カテゴリ株式または当社が任意のカテゴリ株式を償還または購入したときまたは後に。株式所有者の権利は、優先権または他の権利を有する株式の設立または発行によって重大な悪影響を及ぼすものとみなされるべきではなく、増強または重み付け投票権を有する株式を設立することを含むが、これらに限定されない。
新株を増発する当社の改訂及び再記述された組織定款の大綱及び細則は当社の取締役会の発表を許可します 既存のライセンスが発行されていない株式の範囲内で、私たちの取締役会が時々普通株式を増発することを決定します。
私たちはまた、組織規約の大綱と定款の細則を修正し、再記述し、また、私たちの取締役会が時々1つ以上の優先株シリーズを設立することを許可し、任意のシリーズの優先株についてこのシリーズの条項と権利を決定することを含む
•このシリーズの名前;
•このシリーズの株の数
•配当権、配当率、転換権、投票権
•優先権の償還と清算の権利と条項。
私たちの取締役会は、私たちの株主が行動する必要がなく、許可されているが発行されていない範囲で優先株を発行することができる。これらの株を発行することは普通株式保有者の投票権を希釈するかもしれない。
本と記録の検査ケイマン諸島法律によると、私たちの普通株式の所有者はコピーを検査または取得する一般的な権利を持っていない 改訂及び重述された組織定款大綱及び定款細則、当社株主が可決した特別決議案、当社の住宅ローン及び押記登録簿及び現取締役リストを除き、当社の株主リスト又は当社の会社記録を除く。しかし、私たちは株主に年間監査された総合財務諸表を提供するつもりだ。“どこでより多くの情報を見つけることができるか”を参照してください
反買収条項私たちが修正して再記述した組織定款の大綱と定款のいくつかの条項は阻害される可能性がある 株主が有利と考えられる会社または経営陣の統制権変更を延期または阻止することは、以下の条項を含む
•私たちの取締役会が1つまたは複数のシリーズの優先株を発行することを許可し、これらの優先株の価格、権利、優先、特権、および制限を指定し、私たちの株主がさらなる投票や行動を必要とすることなく、
•株主要求と株主総会を開催する能力を制限する。
しかしながら、ケイマン諸島の法律に基づき、当社の取締役は、当社の修正および再記載された覚書および定款の下で付与された権利および権限を、適切な目的のためにのみ行使することができ、また、当社の最善の利益になると誠実に信じるもののためにのみ行使することができます。
会社を免除する当社は、会社法に基づく免除有限責任会社です。会社法では 普通居住会社と免除会社ですケイマン諸島に登録されているが、主にケイマン諸島外で事業を行っている企業は、免除会社として登録を申請することができます。免除会社の要件は、以下の点を除き、通常会社と本質的に同じです。
•会社登録処長に株主周年申告書を提出する必要はない
•必要な多数票に関する法定規定は満たされている
•検査のためにメンバー登録簿を開く必要はありません
•年次株主総会を開催する必要はない
•無額面の株を発行することができます
•未来の税金を徴収しない約束を得ることができる(このような約束は通常、最初に20年を与える)
•他の法域で登録を継続し、ケイマン諸島で登録を取り消すことができる
•存続期間の限られた会社として登録することができる
•独立したポートフォリオ会社に登録することができる。
“有限責任”とは、各株主の責任が、株主が会社の株式に対して未払いの金額に限定されていることを意味する(詐欺、代理関係の構築または不正または不正目的に関連している場合、または裁判所が会社のベールを剥がす可能性がある他の場合を除く)。
当社の会計年度は 12 月 31 日を末日とする暦年です。
会社法の違い
ケイマン諸島の会社法は、大部分が古いイングランドの会社法から派生しているが、最近のイングランドの法令に従っておらず、したがってケイマン諸島の会社法と現行のイングランドの会社法との間には大きな違いがある。また、会社法は、米国法人とその株主に適用される法律とは異なります。以下は、当社に適用される会社法の規定と、米国で法人化された会社およびその株主に適用される法律との間の重要な相違点の概要です。
合併及び類似手配それは.会社法は、ケイマン諸島会社間およびケイマン諸島会社と非ケイマン諸島会社との間の合併と合併を許可する。この目的のために,(I)“統合”
2つ以上の構成会社が合併し、その業務、財産及び債務をそのうちの1つの会社に帰属し、既存の会社とすること;及び(Ii)“合併”とは、2つ以上の構成会社を1つの総合会社に合併し、当該等の会社の業務、財産及び法的責任を当該総合会社に帰属させることをいう。このような合併又は合併を行うためには、各構成会社の取締役は、合併又は合併の書面計画を承認しなければならず、その後、(A)各構成会社の株主の特別決議及び(B)当該構成会社の組織定款細則に規定されている他の認可(ある場合)を通過しなければならない。合併又は合併の書面計画は、合併又は存続会社の支払能力に関する声明、各構成会社の資産及び負債リスト、及び各構成会社のメンバー及び債権者に合併又は合併証明書の写しを発行する約束とともにケイマン諸島会社登録所に提出しなければならず、合併又は合併の通知はケイマン諸島公報に公表される。このような法的手続きに従って行われた合併や合併は裁判所の承認を必要としない
ケイマン諸島の親会社とその1つ以上のケイマン諸島子会社との間の合併がケイマン諸島子会社の株主の決議権限を必要としない場合、メンバーが別の同意がない限り、合併計画のコピーはケイマン諸島子会社の各メンバーに配布される。このように、1社が保有する発行済み株式の合計が当該子会社の株主総会投票権の少なくとも90%(90%)を占めていれば、同社はその子会社の“親会社”である。
ケイマン諸島の裁判所がこの要求を放棄しない限り、構成会社が固定的または変動的な保証権益を持つすべての所有者の同意を得なければならない。
限られた場合を除き、ケイマン諸島構成会社の株主は、合併または合併に対して異なる意見を持つ場合、合併または合併に反対するときにその株式の公平な価値を支払う権利がある(双方が合意に達していなければ、ケイマン諸島裁判所によって決定される)、異なる意見を持つ株主は、会社法に記載されている手続きを厳格に遵守しなければならない。異なる政見を持つ者の権利の行使は、異なる政見者の株主の行使を阻止するか、または彼女が株式を保有することによって権利を有する可能性のある任意の他の権利を阻止するが、合併または合併が無効または不法であることを理由に済助を求める権利は除外される。
合併及び合併に関する法定条文のほか、“会社法”にも法定条文が記載されており、計画の方式で会社の再編及び合併を促進するが、関連手配は(A)価値75%の株主又は種別株主(所属状況に応じて決まる)又は(B)価値75%に相当する債権者又はそれを手配する各種類の債権者(所属状況に応じて決定される)の多数の承認を得る必要があり、それぞれの場合、当該等の債権者は自ら又は受委代表がこの目的のために開催される会議又は会議に出席して採決を行わなければならない。会議の開催とその後の計画はケイマン諸島大裁判所の承認を受けなければならない。異なる意見を持つ株主は、取引を承認すべきではないという意見を裁判所に表明する権利があるが、裁判所が以下のことを裁定すれば、裁判所は関連手配を承認することが予想される
•必要な多数票に関する法定規定は満たされている
•株主は関係会議で公平な代表を得て、法定多数の人が誠実に行動し、少数の人から脅迫されず、その種類の利益に逆行する利益を促進した
•この計画は、そのカテゴリの一人がその利益について行動する聡明で誠実な人によって合理的に承認することができる
•会社法の他の条項によると、このような配置はもっと適切な制裁方法ではない
“会社法”には強制買収の法定権力も含まれており、買収要約時に異なる意見を持つ少数株主を“排除”するのに役立つ可能性がある。買収要約が4ヶ月以内に提出され、影響を受けた株式の90.0%の所有者に受け入れられた場合、要約者は、当該4ヶ月の期限満了後2ヶ月以内に、残りの株式の所有者に当該等の株式を要約条項に従って要約者に譲渡することを要求することができる。ケイマン諸島大裁判所に異議を唱えることができるが、詐欺、悪意、または談合の証拠がない限り、このような承認の申し出を受けて成功する可能性は低い。
したがって、手配案による手配および再編が承認され、承認された場合、または買収要約を提出して受け入れた場合、異なる意見を持つ株主には評価権と同等の権利がなく、そうでなければ、デラウェア州会社の異なる意見を持つ株主は通常、このような権利を得ることができ、現金支払い司法によって決定された株式価値を受け入れる権利がある
株主訴訟それは.原則として、私たちは通常、私たちを会社としての不当行為を起訴する適切な原告であり、一般的には、小株主はデリバティブ訴訟を起こしてはならない。しかしイギリス当局によると
ケイマン諸島裁判所は説得力を持つ可能性が高いので、ケイマン諸島裁判所は、非持株株主が会社の名義で集団訴訟または派生訴訟を開始することを可能にするために、一般法の原則(すなわちフォスがハボット事件中の規則とその例外を訴えている場合)に従うことが予想され、以下の場合に訴訟に疑問を提起する
•その法案はそうではないにもかかわらず越権行為まだ獲得されていない単純な多数票の許可を得た場合にのみ、正式に発効することができる
•会社を統制している人たちは少数の人たちに詐欺をしている
役員及び行政者の賠償及び責任制限それは.ケイマン諸島の法律は、ケイマン諸島裁判所がこのような規定が公共政策に違反していると考えない限り、例えば民事詐欺や犯罪結果について賠償を提供するなど、会社の組織定款大綱や定款細則が高級管理者や役員に対して賠償を行う程度を制限していない。当社は、改正及び重述された組織定款の大綱及び定款細則の規定により、当社は取締役又は高級社員が当社の業務又は事務の処理(任意の判断ミスを含む)又はその職責、権力、権限又は適宜決定権を執行又は履行することにより招く又は被ったすべての行動、法的手続、費用、費用、損失、損害又は法的責任について賠償するが、当該等の者の不誠実、故意の失責又は詐欺を除くため、前記条文の一般性を損なわない原則を含む。取締役又はその上級職員がケイマン諸島又は他の地方のいずれの裁判所においても当社又はその事務に関連する任意の民事訴訟について抗弁(成功するか否かにかかわらず)による損失又は責任。この行為基準は一般的にデラウェア州会社が許可するデラウェア州会社の行為基準と同じだ
また、私たちは、私たちの役員や特定幹部と賠償協定を締結し、これらの人たちに、組織規約の大綱や定款細則に規定されている追加賠償を改訂して再説明しました
証券法による責任の賠償は、吾等の役員、上級管理者、または上記条項に基づいて吾等を統制する者を許可する可能性があることから、米国証券取引委員会は、このような賠償は証券法が表明した公共政策に違反しているため、強制的に執行することはできないとしている
役員の受託責任それは.デラウェア州会社法によると、デラウェア州会社の取締役は会社とその株主に対して受託責任がある。この義務には2つの構成要件がある:注意義務と忠実義務。注意義務は、取締役に誠実信用の原則に基づいて行動することを求めており、慎重さは通常の慎重な人の類似した場合の慎重度と同じである。この義務によれば、取締役は自分に知らせ、重大な取引に関連するすべての合理的に利用可能な重要な情報を株主に開示しなければならない。忠実な義務は重役に彼や彼女が最も会社の利益に合っていると合理的に判断するように要求します。彼や彼女は彼らの会社の地位を利用して私利や利益を図ることができない。この義務は,取締役の自己取引を禁止し,取締役,役員あるいは持株株主が所有する一般株主が共有していないいかなる権益よりも会社とその株主の最適な利益を優先することを要求している。一般に,役員の行為は,知っているうえで善意に基づいて行動が会社の最良の利益に合致すると誠実に信じていると推定される.しかし,この推定は,いずれかの受託責任に違反した証拠によって覆される可能性がある.取締役が取引についてこのような証拠を提出すれば、取締役は取引が手続き的に公平であり、取引が会社にとって公平であることを証明しなければならない
ケイマン諸島法律によると,ケイマン諸島会社の取締役は同社の受託者であるため,同社に対しては,会社の最良の利益に基づいて誠実に行動する義務,その役員の地位によって利益を得ない義務(会社が許されない限り),自分を会社の利益や第三者への義務と衝突させない義務,そのような権力を行使する目的で権力を行使する義務があるとみなされている。ケイマン諸島の会社の役員はその会社に対して慎重に行動する義務があります。従来,役員が職責を遂行する際に示すスキルレベルは,その知識や経験に対する合理的な期待よりも高い必要はないと考えられてきた.しかし、イギリスと英連邦裁判所は必要な技能と配慮の面で客観的な基準に向かって進んでおり、ケイマン諸島もこれらの規定に従う可能性が高い
株主が書面決議で提起した訴訟それは.デラウェア州一般会社法によると、会社はその会社の登録証明書を修正することで、株主が書面で同意して行動する権利をなくすことができる。ケイマン諸島法律と私たちの改正と再記載の会社定款は、私たちの株主が通過することができます
会議を開催することなく、株主総会で議決する権利があるはずの各株主またはその代表によって署名された一致書面決議
株主提案それは.デラウェア州一般会社法によると、株主は年次株主総会で任意の提案を提出する権利があり、この提案が管理文書中の通知条項に適合することを前提としている。取締役会または管理文書中で特別会議の開催を許可している他の誰でも特別会議を開催することができるが、株主は特別会議を開催してはならない
“会社法”は,株主が株主総会の開催を要求する限られた権利のみを与え,株主に株主総会に何の提案も与えるいかなる権利も与えない。しかし、このような権利は会社の定款で規定されることができる。当社は改訂及び再記述された組織定款細則により、合算して自社発行及び発行済み株式の3分の1以上の全投票権を有する株主が株主特別総会の開催を申請することを許可し、この場合、当社取締役会は特別株主総会を開催し、総会で収用された決議案を採決する責任がある。株主総会の開催を要求する権利以外に、当社は改訂及び再記述された組織定款細則を経て、株主に株主周年総会又は特別総会に提案する他のいかなる権利も与えられていない。免除されたケイマン諸島会社として、私たちは法的制約を受けずに株主総会を開催することができます
投票を累積するデラウェア州会社法によると、会社の会社登録証明書が明確に規定されていない限り、取締役選挙に対する累積投票は許可されていません。累積投票制は、小株主が単一の取締役に株主が投票する権利のあるすべての票を投じることを可能にするため、取締役会における小株主の代表性を潜在的に促進し、選挙取締役における株主の投票権を増加させる。ケイマン諸島の法律によると、累積投票に関する禁止はないが、私たちが改正して再記載した組織規約は累積投票を規定していない。したがって、私たちの株主がこの問題で得られる保護や権利はデラウェア州会社の株主より少ないわけではない
役員の免職それは.デラウェア州会社法によると、分類取締役会を設立した会社の取締役は、投票権のある多数の流通株が承認された場合にのみ除名されることができ、会社登録証明書が別途規定されていない限り除外されることができる。我々が改訂·重述した定款によると、取締役は理由の有無にかかわらず、株主の一般決議により免職することができる。また、董事は、(I)破産又は債権者と任意の債務返済手配又は債務立て直し合意を達成すること、(Ii)精神不健全又は死亡が発見されたこと、(Iii)会社に書面でその職を辞任することを通知すること、(Iv)特別な許可を得ずに当社取締役会を3回連続して欠席し、取締役会がその職を罷免すること、又は(V)改正及び再記述された組織定款大綱及び定款細則の任意の他の規定により免職される
興味のある株主との取引。デラウェア州一般会社法には、デラウェア州会社に適用される企業合併法規が含まれており、この法規によると、会社がその会社の登録証明書を改訂することで当該法規の管轄を受けないことを明確に選択しない限り、その人が利益株主になった日から3年以内に、同社が当該“利益株主”と各種の商業合併を行うことを禁止する。興味のある株主とは、通常、過去3年以内に目標会社の15%以上の議決権を発行した株式を所有または所有する個人または団体を指す。これは,潜在的な買収者が目標に対して2段階の買収カプセルを提示する能力を制限し,この場合,すべての株主が平等に扱われることはない.その他の事項を除いて、当該株主が利害関係のある株主となる日までに、取締役会は、当該者が利害関係のある株主となる企業合併又は取引を承認した場合は、当該定款は適用されない。これは、デラウェア州会社の任意の潜在的な買収者がターゲット会社の取締役会と任意の買収取引の条項を交渉することを奨励する
ケイマン諸島の法律には似たような規制がない。したがって、私たちはデラウェア州商業合併規制によって提供される保護タイプを利用することができない。しかし、ケイマン諸島の法律は会社とその大株主との間の取引を規範化していないにもかかわらず、このような取引は、少数の株主に対して詐欺を構成する場合ではなく、会社の最良の利益に合った場合に誠実に行わなければならないと規定している
再編成する会社は次のような理由でケイマン諸島大裁判所に要請し、再編官の任命を要求することができる
(A)現在、またはその債務を償還することができなくなる可能性がある
(B)“会社法”、外国法律、または双方の同意による再編の方法で、その債権者(またはそのカテゴリ)に妥協または手配を提案するつもりである。
その他の事項を除いて、大裁判所は、このような請願書を聞いた後に命令を下し、裁判所命令の権限を有し、裁判所命令を履行する機能を有する再編官を任命することができる。(I)委任再編上級者の提出を要求した後であるが,委任再編上級者の命令が下されるまでのいかなる時間,および(Ii)再編上級者を委任する命令が下された場合は,その命令が解除されない限り,会社に対していかなる訴訟,訴訟やその他の法律手続き(刑事法律手続を除く)を行ってはならず,会社を清算する決議を通過してはならず,会社に対して清算請求を提出してはならないが,裁判所の許可を得た場合は例外である。しかし、再編官の任命や再編官の任命を求める要望書が提出されているにもかかわらず、会社の全または一部の資産を担保している債権者は、裁判所の許可を必要とせず、任命された再編官にも関与しない担保を強制的に実行する権利がある。
棚卸しをするそれは.デラウェア州会社法によると、取締役会が解散の提案を承認しない限り、解散は会社の総投票権100%を持つ株主の承認を得なければならない。取締役会が解散してこそ、会社流通株の簡単な多数の承認を得ることができる。デラウェア州の法律は、デラウェア州の会社がその会社登録証明書に取締役会が開始した解散に関する絶対多数の投票要求を含むことを許可している
ケイマン諸島法律によると、会社はケイマン諸島裁判所の命令またはそのメンバーの特別決議によって清算することができ、会社が満期時に債務を返済できない場合は、そのメンバーの一般決議で清算することができる。裁判所は裁判所がそうすることが公正で公正だと思うことを含む、いくつかの特定の状況で清算を命令する権利がある
株式権利の変更それは.“デラウェア州一般会社法”によると、会社登録証明書に別段の規定がない限り、会社は当該カテゴリ流通株の多数の承認を得て、当該カテゴリ株式の権利を変更することができる。ケイマン諸島法律及び吾等の改正及び重述された組織定款細則によれば、吾等の株式が複数の株式に分類され、吾等は、当該種別の既発行株式の3分の2の保有者の書面同意の下、又は当該種別株式保有者の株主総会で可決された特別決議案の承認の下、任意の種別株式に付随する権利を変更することができる
管治文書の改訂それは.デラウェア州一般会社法によると、会社の管理書類は、会社の登録証明書が別に規定されていない限り、投票する権利のある流通株の多数の承認の下で修正することができる。“会社法”および我々が改訂·再記述した組織定款大綱と定款細則によると、我々の組織定款大綱と定款細則は、我々の株主が特別決議で改訂するしかない
非香港住民または外国株主の権利それは.当社の改訂及び再記述された組織定款大綱及び定款細則は、非住民又は外国株主が当社の株式投票権を保有又は行使する権利には何の制限もありません。また、我々が改訂·再記述した組織定款大綱及び定款細則には、株主所有権が開示されなければならない所有権敷居に関する規定はない。
C.材料契約
2023年11月21日、私たちの2つの完全子会社である康乃徳生物香港有限公司と蘇州康乃徳生物有限公司は、許可側Connect HKと独占許可と協力協定を締結し、Simcere製薬有限会社またはSimcere製薬集団有限公司の子会社と独占許可と協力協定を締結し、大中国地区でレドミキバートを開発と商業化した。
協定に基づき,許可側はレドミキバートが行っている中国治療アトピー性皮膚炎(AD)の臨床試験の完了を担当し,中国にAD治療の新薬申請を提出する。許可側はすでに大中華区(中国大陸部、香港、マカオ、台湾を含む)ですべての人間の適応を開発、製造、商業化する独占的な権利を付与されており、許可側は他のすべての市場に保持されている。許可側はレドミキバートの中国でのAD治療の新薬申請を担当し,大中国地域で行われ,レドミキバートのすべての追加ヒト適応のすべての将来の臨床研究の費用を担当する。
協定条項によると、許可側は1.5億元(約2,100万ドル、中国外国為替取引システムに規定されている2023年10月31日人民元対1ドル=7.3166元)の前金を取得し、そのうち1億元から560万元(約13.3ドル)の付加価値税を引く
2023年12月31日現在、5,000万元(中国外国為替システムに規定されている2023年12月31日人民元対1ドル=7.0827元で計算)を受け取り、残りの5,000万元から付加価値税280万元を引いた(2024年3月28日中国外国為替システムに規定されている人民元7.0950元から1ドルのレートで計算すると、約670万ドル)、2024年3月31日までに8.75億元(10月31日現在の人民元7.3166元から1ドルの為替レートで約1.2億ドル)を受け取った。2023年)は,ある開発とビジネスマイルストーンを実現する際に,特許使用料を除いて,最高純売上高の2桁数百分に達することができる
D.外国為替規制。
1996年1月に国務院が公布し、1997年1月と2008年8月に改正された“中華人民共和国外貨管理条例”と1996年6月に中国人民銀行が公布した“外貨決済、販売と支払い管理条例”に基づいて、利益と配当金の支払いに必要な外貨を分配し、利益の分配或いは配当金の支払いを許可する取締役会決議によって中国国内の指定外国為替銀行に購入することができる。
外匯局の“直接投資外国為替政策の更なる改善と調整に関する通知”とその付録によると、外匯局により2015年5月、2018年10月と2019年12月に改訂され、(1)直接投資プロジェクト下の外国為替口座の開設と支払いは外国為替局の許可を得なくなる;(2)非中国資本企業は中国国内で合法的な収入で再投資を行い、外匯局の許可を得なくなる;(4)非中国資本企業が必要とする検資確認手続きを簡略化する。(4)直接投資項目の下での為替購入と対外支払いは外国為替局の承認を必要としなくなる;(5)中国国内直接投資項目の下での外貨移転は外国為替局の承認を必要としなくなる;(6)外商投資企業の外貨資金転換管理が完備されている。その後、外匯局は2015年2月に“直接投資外国為替管理政策の更なる簡略化に関する通知”を発表し、2019年12月に更に改訂し、銀行が外匯局の代わりに外商直接投資項目下の外貨登録審査を行うことができることを規定し、外為局及びその支店は銀行を通じて外商直接投資項目下の外貨登録審査を間接的に監督管理することができる。
2013年5月に外為局が発表し、2018年10月と2019年12月に改訂された“海外投資家の対外直接投資外貨管理規定”は、外商直接投資外貨管理を規範化し、明確にした。
2015年3月に発表され、2019年12月に改訂された第19号通知と2016年6月に発表された第16号通知によると、外商投資企業の決済は適宜決済政策が適用される。しかし、決済は非中国投資企業の経営範囲内の自営業務に限られ、真実性の原則に従っている
当社の総合貸借対照表に記載されている年度内に、当社は当社の中国実体から現金を転出していないため、外国為替規制に関する問題はありません。
配当金分配
外匯局は2017年1月に“真実性と適合性検査の強化と外貨管理業務の更なる推進に関する通知”を発表し、国内機関がオフショア機関に利益を送金することに対していくつかの資本規制措置を規定し、(1)真実取引の原則の下で、銀行は取締役会の利益分配決議、納税申告記録原本と監査された財務諸表を照合すべきである;(2)国内機関は利益を送金する前に数年前の損失に対して収入計算を行うべきである。また、中国国内機関は対外投資登録手続きを行う際に、資金源と使用手配を詳細に説明し、取締役会決議、契約などの証明を提供しなければならない。我々の中国子会社がオフショア実体に配当金を支払う能力の制限は、主に:(I)中国子会社は、中国会計基準と法規によって決定された関連法定条件と手続き(ある場合)を満たした後にのみ、その累積した税引後利益から配当金を支払うことができる;(Ii)各中国子会社は、その登録資本の50%に達するまで、毎年少なくともその税引き後利益の10%を準備基金として支出しなければならない。(Iii)中国付属会社は外国為替規制に関する手続き規定を完成しなければ、非中国通貨で配当金を支払うことができる;及び(Iv)中国付属会社は10%以下の税率で税金を前納しなければならない
配当金が送金された時。このような制限は私たちが投資家に利益を分配する能力に実質的な悪影響を及ぼすかもしれない。
当社の設立以来、当社は中国実体からの配当金は何も派遣していません。
中国住民のオフショア投資外貨登録
国家外匯局は2014年7月に“国家外貨管理局第37号通知”を発表した。中国外管局第37号通達は、中国住民(中国機関と個人を含む)が中国国外で直接或いは間接投資して中国住民が直接或いは間接的に管理する特殊な目的ツール(SPV)についてオフショア投資と融資を行い、中国国内企業の合法的な所有資産又は権益又は中国国外で合法的に所有している資産又は権益を外管局現地支店に登録することを要求する。もし特殊目的機関の基本情報が変化した場合、例えば中国住民個人株主、特殊目的会社の名称或いは経営期限が変化し、あるいは特殊目的機関が重大な変化が発生した場合、例えば中国住民個人が特殊目的機関への出資を増加或いは減少させ、或いは特殊目的機関の任意の株式譲渡或いは交換、合併、分立など、当該中国住民も外匯局に修正登録しなければならない。
2015年2月に公表され、2015年6月に発効し、2019年12月にさらに改訂された“直接投資外貨管理政策の一層の簡略化と完備に関する通知”は、中国住民が中国国外で海外直接投資のために設立またはコントロールする実体は、外国為替局ではなく適格銀行に登録できることを規定している。外匯局及びその支店は銀行の直接投資外貨登録に対して間接監督管理を実施する。
外管局第37号通達に記載されている登録手続きを遵守できなかった場合、中国企業の外国為替活動が制限される可能性があり、中国国外の親会社あるいは共同経営会社に配当金及びその他の割り当て、中国海外機関からの資金流入及び決済を支払い、中国会社又は中国住民に中国外国為替管理条例の処罰を受ける可能性がある。
私たちが設立して以来、私たちのどの中国実体もいかなる特殊な目的機関でも直接または間接的なオフショア投資を行っていない。
資本支出
人民元を非中国通貨に両替して中国に送金して資本支出を支払い、例えば非中国通貨建ての融資を返済するには、中国の関係政府当局の許可を得たり、登録したりする必要がある。したがって、私たちの中国子会社は外管局の許可を得たり、特定の登録手続きを完了しなければ、その運営によって発生した現金を使用して人民元以外の通貨でそれぞれ中国国外実体の債務を返済したり、人民元以外の通貨で中国国外の他の資本支出を支払うことができる。
E.税収
ケイマン諸島、中国及び米国連邦所得税と買収、所有及び処分に関する以下の米国預託証明書又は普通株に関する議論は、本年報の日付までに発効した法律及びその関連解釈に基づいており、これらのすべての法律或いは解釈は変更或いは異なる解釈がある可能性があり、追跡力を持っている可能性がある。この要約は、米国州および地方税法またはケイマン諸島、中国および米国以外の司法管轄区域税法による税務結果のような、私たちの米国預託証明書または普通株に投資することに関連するすべての可能な税務結果に関するものではない。あなたはあなた自身の税務コンサルタントに問い合わせて、あなたの特定の場合の税金結果と、任意の州、地方、外国、または他の税務管轄区域の法律によって生じる可能性のあるいかなる税金結果を理解しなければなりません。
ケイマン諸島の税金
ケイマン諸島には現在、利益、収入、収益または付加価値に基づいて個人や会社に課税されておらず、相続税や相続税の性質の税収もない。ケイマン諸島政府が徴収する他の税金は私たちにとって実質的ではないかもしれないが、ケイマン諸島で署名されたか、または署名後にケイマン諸島の管轄内に持ち込まれた文書に適用される印紙税は除外されるかもしれない。ケイマン諸島は
私の会社やわが社に支払うのに適用されるいかなる二重税金条約にも参加しません。ケイマン諸島には外国為替規制や通貨制限がない
当社の普通株或いはアメリカ預託証明書の配当及び資本の支払いについては、ケイマン諸島で税金を支払う必要がなく、当社の普通株或いはアメリカ預託証明書を持ついかなる所有者に配当金或いは資本を支払う場合も、いかなる金を源泉徴収する必要がなく、当社の普通株或いはアメリカ預託証明書を売却して得られた収益もケイマン諸島の所得税或いは会社税を支払う必要がありません
中華人民共和国の税収
企業所得税と源泉徴収税
“中国企業所得税法”及びその実施細則によると、中国企業所得税については、中国国外に“実際の管理機関”を設立した企業は住民企業を納税するとみなされ、その全世界の収入は一般的に統一された25%税率で企業所得税を納付する。“中華人民共和国企業所得税法実施細則”は、事実上の管理機関を、企業の業務、生産、人員、会計及び財産に対して全面的、実質的な制御及び全面的な管理を行う機関と定義する。2009年4月、国家税務総局はオフショア登録設立された中国持株企業の“事実上の管理機関”が中国国内にあるかどうかを決定する具体的な基準を規定する第82号通告を発表した。本通達は、中国企業または中国企業グループによって制御されるオフショア企業にのみ適用され、中国個人または非中国企業によって制御されるオフショア企業には適用されないが、この通知で提出された基準は、“事実上の管理機関”テキストをどのように適用してすべての非中国企業の税務住民の地位を決定するかに関する国家税務総局の一般的な立場を反映している可能性がある。第82号通達によると、中国企業又は中国企業グループによって制御される非中国登録企業は、以下のすべての条件を満たす場合、(I)日常経営管理の主要な場所は中国にある;(Ii)企業の財務及び人的資源事項に関する決定は中国に位置する組織又は人員が行うか又は承認する場合、当該企業は中国の“事実上の管理機関”により中国税務住民とみなされる。(Iii)企業の主要資産、会計帳簿および記録、会社印鑑、および取締役会および株主決議は、中国に位置または保存されている;および(Iv)投票権を有する取締役会メンバーまたは上級管理者の少なくとも50%は、中国に常住している
吾らは、中国税務については、吾らは中国住民企業とみなされるべきではなく、(I)吾らは中国国外で登録設立され、かつ中国企業や中国企業グループに支配されていないため、および(Ii)吾などは上記のすべての条件を満たしていないと考えている。しかし、企業の税務住民身分は中国の税務機関の決定に依存し、“事実上の管理機関”という言葉に関する解釈には依然として不確定性がある。中国の税務機関が最終的に違う見方をしないという保証はない
もし中国税務機関が企業所得税について吾などを中国住民企業と認定した場合、吾らの全世界の収入は25%の企業所得税を徴収することができる;吾などの普通株あるいはアメリカ預託証明書に対応する非住民企業所有者の配当は中国国内からの収入と見なすことができるので、10%の源泉徴収税(あるいは非住民個人所有者については20%)を支払う必要があり、適用される所得税条約が別途規定されていない限り。また、非住民企業株主(我々の米国預託株式保有者を含む)が我々の普通株式または米国預託証明書を売却する際に実現される資本収益は、中国国内からの収入とみなされる可能性があるので、適用される所得税条約が別途規定されていない限り、10%の所得税(非住民個人株主または米国預託株式保有者の場合は20%)を納付しなければならない。もし当社が中国住民企業とみなされていれば、当社の非中国株主がその税務居住国と中国との間のいかなる税務協定の利益を享受できるかどうかは不明である。“リスク要因-中国でビジネスをすることに関連するリスク-中国企業所得税法によると、私たちは中国住民企業とみなされる可能性があるため、私たちの世界的な収入は中国所得税を納める必要があるかもしれない”
吾等が中国住民企業とみなされない限り、吾等の普通株又は米国預託証明書の非中国住民保有者は、吾等が発行した配当金又は売却又は他の方法で吾等の普通株又は米国預託証明書を処分して取得した収益について中国所得税を支払う必要がない。しかし、公告7によれば、非住民企業が課税資産(特に中国住民企業の持分)を譲渡することにより、非中国持株会社の持分を処分することにより間接的に“間接移転”を行う場合、譲渡先である非住民企業又は当該等の課税資産を直接所有する譲受人又は中国実体は、このような間接移転を関係税務機関に報告することができる。“実質は形式よりも重い”という原則によると、中国の持ち株会社でなければ合理的な商業目的が不足し、かつ減税、租税回避、あるいは中国税金の繰延のために設立されていれば、中国税務機関は同社の存在を考慮しなくてもよい。したがって,このような間接遷移から得られる報酬はPRCを支払う必要がある可能性がある
企業所得税は、譲渡者又は他の譲渡費用を支払う義務がある者には適用される税金を源泉徴収することが義務付けられており、現在中国住民企業株式譲渡の税率は10%である。私たちと私たちの非中国住民投資家は公告7に基づいて申告書を提出し、課税されることを要求されるリスクに直面する可能性があり、私たちは貴重な資源を使って公告7を遵守することを要求されるかもしれません。あるいはこれらの法規に基づいて課税されるべきではないと判断します。
付加価値税
1994年1月に施行され、2008年11月、2016年2月、2017年11月にさらに改正された“中華人民共和国付加価値税暫定条例”とその実施細則、および1994年1月に施行され、2008年12月と2011年10月に改正された実施細則によると、別途規定があるほか、納税者が貨物、労務または有形個人財産レンタルサービスまたは輸入貨物を販売する場合には、17%の税率が適用される。納税者が輸送サービス、郵便サービス、基礎電気通信サービス、建築サービスまたは不動産賃貸サービスを販売し、不動産を売却し、土地使用権を譲渡する場合には、11%の税率が適用され、販売サービスまたは無形資産の場合は、6%の税率が適用される。
2018年4月に採択された“財政部と国家税務総局の付加価値税税率の調整に関する通知”によると、2018年5月から、納税者が付加価値税を目的として課税販売活動または輸入貨物に従事している場合は、17%と11%の税率が16%と10%に調整されていた。
2019年4月から施行された“増値税改革の深化に関する政策に関する公告”によると、増値税一般納税者が販売または輸入貨物に適用する16%の増値税税率は13%、10%の増値税税率は9%に低下する。
2018年6月に改訂された“営業税流動企業付加価値税徴収方法(試行)”によると、中国国内企業は専門技術サービス、技術移転、ソフトウェアサービスなどの国境を越えた課税活動を提供し、かつ中国国外でのみ消費される場合、上記の国境を越えた課税活動は付加価値税を免除する。
間接譲渡税
2015年2月3日、SATは第7号公報を発表し、2017年10月17日と2017年12月29日に改正した。公告7によると、非中国住民企業は資産(中国住民企業の株式を含む)に対する“間接譲渡”を再同定することができ、これを中国課税資産の直接譲渡と見なすことができ、当該等の手配に合理的なビジネス目的がなく、かつ中国企業所得税の納付を回避するために確立されていることを前提としている。そのため、当該等の間接譲渡からの収益は中国企業所得税を払わなければならない可能性がある。取引手配に“合理的な商業目的”があるかどうかを決定する時、考慮すべき要素はオフショア企業の株式の主要な価値が直接或いは間接的に中国課税資産に由来するかどうかを含む;オフショア企業の資産が主に中国での直接或いは間接投資から構成されているかどうか、或いはその収入が主に中国から来ているかどうか;及びオフショア企業及びその直接或いは間接的に中国課税資産を持っている付属会社が真の商業性質を持っているかどうかは、その実際の機能とリスク開放から証明することができる。公告7によると、納税者が税の納付を代行していない場合は、譲渡人は法定期限内に自ら税務機関に納付税を申告しなければならない。超過納付適用税金は譲渡先に違約利息を負担させます。公告7投資家が公共証券取引所を介して株式を売却する取引には適用されず、これらの株式は公共証券取引所で取得される。2017年10月17日、SATはSAT第37号通知を発表し、この通知を修正し、SATは2018年6月15日にSATがある税収規範ファイルの修正に関する公告を発表した。国家税務総局第37号通知はさらに、非住民企業の事前提出税金の計算、申告と納付義務に関する実施細則を述べた。それにもかかわらず、公告7の解釈および適用には不確実性が残っている。税務機関は、公告7が我々のオフショア取引または株式の売却に適用されるか、または非住民企業(譲渡先)に関連するオフショア子会社のオフショア取引または売却を決定する可能性がある。
アメリカ連邦所得税の考慮要素
以下の議論は、米国連邦所得税の米国預託証明書または普通株投資の米国保有者(定義は以下参照)に対するいくつかの重大な影響を説明する。本要約は、米国預託証明書または普通株を資本資産(一般に投資のために保有する財産を指す)を保有し、ドルをその資産とする投資家にのみ適用される
機能通貨です。本議論は,1986年に改正された“米国国税法”,または本年度報告の日から施行された“国税法”と,本年度報告の日までに発効または場合によっては提案された米国財務省条例と,その日またはその日までに行われた司法·行政解釈に基づいている。上述したすべての主管部門は変化する可能性があり、これらの変化は追跡力を持つ可能性があり、以下に述べる税収結果に影響を与える可能性がある。以下の要約では、純投資収入の連邦医療保険拠出税または代替最低税に関連する結果のような、特定の米国所有者の特定の状況に関連する可能性のある米国連邦税結果については議論しない
以下の議論は、特定の投資家に対する税金の結果も、特別な税金の場合に適用される個人のすべての税金結果についても記載されていない
•銀行
•ある金融機関は
•保険会社
•規制された投資会社
•不動産投資信託基金
•仲買商
•アメリカの華僑
•時価ベースの税務会計方法を使用する貿易業者を選択する
•免税実体;
•クロスボーダー、ヘッジ、転換または統合取引の一部として米国預託株式または普通株を保有する者;
•実際または建設的に私たちの株式の10%以上を所有している人は、総投票権または価値で計算します
•任意の従業員の株式オプションの行使または他の方法で補償として米国預託証明書または普通株を取得する人;または
•共同企業または他の伝達実体を介して米国預託証明書または普通株を保有する者
本議論において、“米国保有者”とは、米国預託証明書または普通株の実益所有者、すなわち米国連邦所得税について、
•アメリカ市民や住民の個人です
•米国内または米国、その任意の州またはコロンビア特区の法律に従って設立または組織された会社(または米国連邦所得税の目的のために会社として課税される他のエンティティ)
•その収入は、その出所にかかわらず、米国連邦所得税の遺産を納めなければならない
•信託(A)は、米国内裁判所の監督を受け、米国国内税法第7701条(A)(30)に記載されている1人以上の米国人の統制を受け、または(B)適用される米国財務省法規に基づいて、有効な選択を有し、米国人とみなされる。
米国連邦所得税の目的から、組合企業の実体とみなされたり、米国預託証明書または普通株を保有するように手配されたりする場合、パートナーの納税待遇は一般的に組合企業の地位と活動に依存する。米国持株者が米国預託証明書または普通株を保有する共同企業のパートナーであれば、その税務顧問に相談しなければならない
以下の議論では,預金プロトコルに記載されている陳述が事実であると仮定し,預金プロトコルおよび任意の関連プロトコルの義務がその条項に従って遵守されると仮定する.このような仮定によれば、米国預託証明書を持っている場合、米国連邦所得税については、一般に、そのような米国預託証明書に代表される関連普通株の所持者とみなされるべきである
米財務省は、米国預託株式保有者と標的普通株発行者との間の所有権チェーン上の中間者が、標的普通株の実益所有権と一致しない行動をとっている可能性を懸念している。そのため、米国預託証券保有者の海外税収控除の信頼性又はある非会社米国保有者が受け取った配当金が低減された税率を得ることができるか否かは、米国預託株式保有者と会社との間の所有権チェーンにおける中間者の行動の影響を受ける可能性がある
米国預託証明書又は普通株の配当金及びその他分配の課税
以下で議論するPFICルールの制約の下で、我々は、米国預託証明書または普通株が閣下に作成した任意の割り当てられた総金額(差し押さえのいかなる金額によっても減少しない)について、一般に、預託機関が受信した日に外国配当収入としてあなたの毛収入に計上し、米国預託証明書、またはあなたの普通株であれば、現在または累積されている収益および利益(米国連邦所得税原則に基づいて決定される)から支払われる範囲内に限定される。このような種類の配当金は、会社が他のアメリカ会社から受け取った配当金を差し引く資格がないだろう。割り当てられた金額が私たちの現在および累積された収益および利益(米国連邦所得税原則に基づいて決定された)を超えた場合、超過した金額は、まずADSまたは普通株式における免税納税申告書とみなされ、その後、超過金額がADSまたは普通株における納税ベースを超えた場合、資本利益とみなされる。しかし、私たちは現在持っていないし、アメリカ連邦所得税の原則に基づいて私たちの収入と利益を計算するつもりもない。したがって、米国所有者は、任意の分配が通常配当金として報告されることを予想すべきであり、たとえその分配がそうでなくても、免税資本リターンとみなされるか、または上記の規則に従って資本収益とみなされる
一部の非会社米国所有者については、個人米国所有者を含む場合、配当金は“合格配当金収入”に適用されるより低い資本利益率で課税することができ、前提は、(1)米国預託証明書または普通株(場合によっては)米国の成熟した証券市場で随時取引することができること、または米国と締結された適格所得税条約のメリットを享受する資格があること、(2)配当金を支払う納税年度または前納税年度には、PFICでもなく、あなた(以下に述べる)ともみなされないことである。(三)米国預託証明書又は普通株は、除利日前60日から121日以内に60日を超える保有期間を有する。前項(1)項については、普通株式又は米国預託証券がナスダックに上場すれば、我々の米国預託証券の現在の状況のように、米国の成熟した証券市場で容易に売買できるとみなされるのが一般的である。もし私たちが中国の税務目的で“住民企業”(“税務-中華人民共和国税務”参照)とみなされれば、私たちはアメリカと中国の間の所得税条約やこの条約のメリットを享受する資格があるかもしれない。あなたはあなたの税務コンサルタントに問い合わせて、合格配当収入に適用されるより低い資本利益税が、私たちのアメリカ預託証明書または普通株について支払う任意の配当金に適用されるかどうかを理解しなければなりません
米国所有者が当該米国所有者に適用される税率に従って支払う(または支払われたとみなされる)任意の非米国源泉徴収税(任意の中華人民共和国源泉徴収税(“税収−中華人民共和国税収”参照)を含む)は、外国税控除(またはそのような相殺の代わり)を得る資格があるが、適用制限の制限を受けている。どんな配当金も外国の税収控除制限の外国源収入を構成するだろう。配当金が適格配当収入として課税される場合(上述したように)、外国税収相殺限度額を計算する際に計上される配当金金額は、一般に配当総額に限定され、合格配当収入に適用される減税税率を乗じ、配当金に通常適用される最高税率で割る。控除を受ける資格がある外国の税収限度額は特定の収入種別で個別に計算される。そのため、著者らはアメリカ預託証明書或いは普通株に割り当てられた任意の配当金について通常“受動カテゴリ収入”を構成する。源泉徴収として選択されていない外国所得税が外国税控除を申請している米国の保有者は、米国連邦所得税目的でこのような源泉徴収の減額を申請することができるが、当該保有者がすべての控除可能な外国所得税として選択することができる年度内に減額を申請することしかできない 最近発表された米国財務省法規は、米国国税局の現在の指導によれば、納税者は、発表前の納税年度終了をさらに指導する納税年度のこのような制限を考慮することなく、外国司法管轄区域で徴収される税収の性質に基づいて、どのような外国税収相殺の利用可能性を制限するかを制限するかもしれない。
外国の税収控除の決定に関連する規則は複雑であり、米国の保有者は、その特定の場合に適用される所得税条約の影響を含むどの程度の控除が得られるかを決定するために、その税務顧問に諮問すべきである
米国預託証明書または普通株を処分する課税
以下に議論する米国上場企業規則によれば、米国預託証明書または普通株を売却またはその他の方法で処分する場合、米国保有者は一般に米国連邦所得税について資本収益または損失を確認し、その金額は米国預託株式または普通株の現金化金額と米国保有者の当該米国預託証明書と普通株における納税基礎との差額に等しい。米国の保有者が処置時に保有する米国預託証明書または普通株の保有期間が1年を超える場合、任意のこのような収益または損失は、長期資本収益または損失とみなされる。アメリカ個人の長期資本収益は一般的に税率を下げてアメリカ連邦所得税を納めます。資本損失の控除には制限がある
外国の税収控除制限について、あなたが一般的に確認した任意のこのような損益は、アメリカ源の収入または損失とみなされるだろう。しかし、中国税務の目的であれば、私たちは“住民企業”とみなされ、本条約のメリットを享受する資格があるかもしれない。この場合、米国預託証明書または普通株を売却する任意の収益が中国税を徴収された場合、本条約の利益を享受する資格のある米国所有者は、その収益を外国税収控除の中国由来収入と見なすことを選択することができる。最近発表された米国財務省法規は、米国国税局の現在の指導によると、納税者は通常、発表前の納税年度終了をさらに指導する納税年度のこのような制限を考慮することなく、外国司法管轄区域で徴収される税収の性質に基づいて任意のこのような相殺の獲得性を制限する可能性がある。米国の保有者は、どのような適用可能な所得税条約の影響を含む、彼らの特定の場合に収益または損失をどのように正確に処理するかを知る税務コンサルタントに相談しなければならない
受動的対外投資会社
非米国会社はどの課税年度においても米国連邦所得税のPFICとなり、ある検査規則を適用した後、以下のいずれかの場合である
•この課税年度の総収入のうち、少なくとも75%が受動所得(利子審査)、または
•その資産総生産の少なくとも50%(一般に年間資産四半期価値の平均値に基づく)は、現金(資産テスト)を含む受動的収入を生成するために、または受動的収入を生成するために保有される資産に起因することができる
そのため、株式の25%以上(価値で計算)を持つ他の会社の資産を直接または間接的に所有し、割合で持っている収入シェアを稼ぐと考えられる。
私たちの資産価値によると、営業権、そして私たちの収入と資産の構成を含めて、2023年12月31日までの納税年度内に米国連邦所得税のPFICであるとは思いません。しかし,PFICルールの適用はいくつかの点で不確実性があり,どの課税年度でもPFICにはならないことを投資家に保証することはできない
もしあなたがアメリカ預託証明書や普通株を持っている任意の課税年度内に、私などが個人私募株式投資会社であれば、閣下が私などの普通株やアメリカ預託証明書を持ってからのすべての年度内に、私などは私募株式投資会社とみなされ続け、私などが私募株式投資会社のためにならない限り、閣下は普通株式またはアメリカ預託証明書について“売却として”の選択をします。上記のように選択が適時に下され、閣下は吾らのプライベート株投資会社としての前の課税年度の最終日に、閣下が持っている米国預託証明書や普通株を公平な市価で売却するとみなされ、このように売却されるいかなる収益も以下の2項で述べた結果の影響を受ける。また,PFICルールでは,普通株と米国預託証明書の新規保有期間が開始とみなされる。推定売却選択後、あなたの普通株式または米国預託証明書は、私たちがその後個人私募株式投資会社にならない限り、個人私募株式投資会社の株式とはみなされません
PFICに対するとみなされる各課税年度については、以下に説明する“時価計算”の選択がなされない限り、米国預託証明書または普通株式から確認された任意の収益に関する特別税規則は、以下に説明した“時価計算”の選択を行わない限り、あなたが受け取った任意の“超過配分”および売却またはその他の処理(前に議論した売却および質権を含む)から確認される特別税ルールを遵守します。1つの課税年度に受領された割り当ては、前の3つの課税年度または米国預託証明書または普通株式期間の短い期間に受信した平均年次割り当ての125%を超えた場合、超過割り当てとみなされる。このような特別な税金ルールによると
•超過割り当てまたは収益は、アメリカの預託証明書または普通株式を持っている間に比例して割り当てられます
•本課税年度に割り当てられた額と、我々がPFICである第1の課税年度までの保有期間内のいずれの課税年度も、一般収入とみなされる
•1年ごとに分配される金額は1年ごとに個人や会社に有効な最高税率に適用され、一般的に税金の少ない支払いに適用される利息費用は1年ごとに占める税金に徴収される
さらに、私たちが配当金を支払う納税年度または前の納税年度にPFICである場合、非会社米国所有者は、私たちから受信した任意の配当金の減税税率を享受する資格がない(上記“-米国預託証明書または普通株の配当金および他の分配の課税”で述べたように)
処分年度又は“超過分配”年度までに課税年度に分配された税項課税税金は、当該年度のいかなる純営業損失から相殺することができず、米国預託証明書又は普通株を売却又は処分して現金化した収益(ただし、非損失)は、当該米国預託証明書又は普通株を資本資産として保有していても資本と見なすことはできない
もし私がいかなる課税年度において閣下にとってPFICとみなされ、吾等の任意の付属会社もPFICであり、あるいは吾等がPFICに属する他の実体に直接又は間接的に株式投資を行う場合、閣下は吾等が直接又は間接的に所有する当該等の低レベルのPFICの株式を所有しているとみなされる可能性があり、これらの株式の割合は、閣下が所有する米国預託証明書及び普通株価値とすべての米国預託証明書及び普通株価値との割合であり、閣下はあなたが所有している当該等の低レベルのPFICの株式を前述の各段落で述べた不利な税務結果を負担する必要があるかもしれない。あなたはあなたの税務コンサルタントに問い合わせて、PFIC規則が私たちのどの子会社に適用されるかを理解しなければなりません
PFICに“販売可能株”(定義は後述)を持つ米国の保有者は、上述した超過分配および収益確認に関するPFICルールを脱退するために、このような株を時価で選択することができる。米国預託証明書または普通株に対して有効な時価選択を行う場合、あなたは、あなたの納税年度終了時に、米国預託証明書または普通株の公平な時価値が、このような米国預託証明書または普通株の調整に基づく公平な時価超過に相当する金額を、PFICである私たちの毎年の収入に計上することになります。課税年度終了時には、米国預託証明書または普通株の調整基準がその公平な市場価値を超える部分が差し引かれることが認められる。しかしながら、あなたが以前に納税した年度の収入に含まれる米国預託証明書または普通株の任意の時価純収益の範囲内でのみ、控除が許可されます。時価計算の選択によると、あなたの収入に含まれる金額、および米国預託証明書または普通株の収益を実際に売却またはその他の方法で処理することは、普通収入とみなされる。一般損失処理は、米国預託証明書または普通株の任意の時価損失の控除可能部分、および米国預託証明書または普通株を実際に売却またはその他の方法で処理することによって現金化された任意の損失にも適用され、当該等の損失の金額が当該米国預託証明書または普通株が以前に計上した市価計算による純収益を超えない限り。アメリカの預託証明書または普通株式における基準は、このような任意の収入または損失金額を反映するように調整されます。もしあなたが市価で価格を計算することを選択した場合、私たちが行った任意の分配は、一般に、上記の“-米国預託証明書または普通株の配当金および他の分配の課税”の節で議論された税収規則を遵守するが、適格配当金収入に適用されるより低い税率(上記で説明した)は適用されないだろう
時価ベースの選挙は“販売可能株”にしか適用されず、極小の各カレンダー四半期内に少なくとも15日間(“定期取引”)の合格取引所または適用される米国財務省条例によって定義された他の市場の数。ナスダックは合格した取引所です。私たちのアメリカ預託証明書は現在ナスダックで看板取引をしています。したがって、もしあなたがアメリカ預託証明書の所有者であり、アメリカ預託証明書を定期的に取引すれば、もし私たちがアメリカ預託証明書になれば、時価建ての選択ができるかもしれません。私たちは私たちが持っているいかなるより低いレベルのPFICの株式に対しても時価での選挙を行わないかもしれないので、これらの投資はPFIC規則の制約を受け続ける可能性があり、米国連邦所得税の目的でこれらの投資はPFICの株式とみなされる。あなたはあなたの税務コンサルタントに問い合わせて、時価ベースの選挙の利用可能性と入手可能性、およびこのような選挙が任意の低レベルPFICの利益に与える影響を理解しなければならない
代替的に、非米国会社が個人投資会社である場合、同社の株式保有者は、“適格選挙基金”(“QEF選挙”)を選択することによって、会社の現在の収入におけるシェアを収入に含めることができ、超過分配および収益確認に関するPFICルールに従って課税されることを回避することができる。しかし、私たちが毎年あなたにいくつかの税務情報を提供することに同意した場合にのみ、あなたは私たちのアメリカ預託証明書または普通株について適格な選挙基金選択を行うことができます。私たちが任意の課税年度のPFICであると判断すれば、QEF選挙に必要な情報を提供し、私たちが制御する低レベルのPFICごとにこの低いレベルのPFICに関するこのような情報を提供することを促すつもりです
米国PFICの保有者は通常、米国国税局に年次報告書の提出を要求されている。もし私たちがPFICになるなら、あなたの税務コンサルタントに問い合わせて、あなたの任意の報告要求に適用される可能性があることを理解しなければなりません
あなたは税務コンサルタントに問い合わせて、アメリカの預託証明書や普通株への投資にPFICルールが適用されるかどうかを知る必要があります
情報報告とバックアップ減納
米国預託証明書または普通株に関連する任意の配当金支払い、ならびに米国預託証明書または普通株を売却、交換、償還、または他の方法で処理して得られた任意の配当金は、米国国税局に情報を報告し、米国に抑留される可能性がある。しかしながら、バックアップバックルは、正しい納税者識別子を提供し、任意の他の必要な証明を行う米国の所有者、または他の方法でバックアップ源泉徴収を免除する人には適用されない。その免除身分を決定することを要求された米国の保有者は、通常、米国国税局表W−9上でそのような証明を提供しなければならない。アメリカの保有者はアメリカの情報報告と予備源泉徴収ルールの適用について彼らの税務顧問に相談しなければならない
予備源泉徴収は付加税ではありません。予備源泉徴収としての源泉徴収金額は、あなたのアメリカ連邦所得税債務に計上される可能性があり、適切な返金申請を米国国税局にタイムリーに提出し、任意の必要な情報を提供することによって、予備源泉徴収規則に従って源泉徴収された任意の超過額の返金を得ることができます
追加報告要求
個人(および特定のエンティティ)であるいくつかの米国所有者は、私たちの米国預託証明書または普通株の権益に関する情報を報告することを要求されるが、いくつかの例外は除外される(いくつかの金融機関口座に保有されている米国預託証明書および普通株の例外を含む)。米国の所有者は、これらの規則が私たちのアメリカ預託証明書または普通株の所有権と処置に与える影響(あれば)について彼らの税務顧問に相談しなければならない。
F.配当と有料代理店です
適用されません
G.専門家の発言
適用されません
H.展示されている書類
私たちは、改正された1934年の証券取引法または“取引法”の定期報告およびその他の情報要求を遵守しなければならない。取引法によると、私たちはアメリカ証券取引委員会に報告書と他の情報を提出しなければならない。具体的には、独立公認会計士事務所が監査する財務諸表が掲載されている20-F表を毎年提出しなければならない。各財政年度終了後120日、すなわち毎年12月31日より遅くない。米国証券取引委員会はまた、そのEDGARシステムを用いて米国証券取引委員会に電子届出を行った登録者の報告、依頼書および情報声明、およびその他の情報を含むウェブサイトwww.sec.govを保持している。外国個人発行者としては、取引所法第16条に記載されている報告書及び短期運転利益回収条項の制約を受けず、高級管理者、取締役及び主要株主も、取引所法第16条に記載されている報告及び短期運転利益回収条項の制約を受けない。
我々はまた、米国証券取引委員会または電子的に米国証券取引委員会に提出された文書を電子的に提出した後、これらの報告書の任意の修正、およびいくつかの他の米国証券取引委員会文書を含む、私たちのウェブサイト上で、私たちの年報およびForm 6-K報告書のテキストをできるだけ早く無料で提供する。私たちのサイトの住所はWwwn.Connectbiopharm.com.cnそれは.本サイトへの参照は、非アクティブなテキスト参照のみであり、その中に含まれているか、または関連する情報は、本年度報告には含まれない。
I.子会社情報
適用されません。
J.証券保有者への年次報告。
適用されません。
第11項.市場リスクに関する定量的かつ定性的開示
市場リスクとは金融商品の公正価値或いは未来のキャッシュフローが市場価格の変化によって変化するリスクである。主に私たちに影響を及ぼす市場リスクタイプは外国為替リスクだ。
金利リスク
私たちの金利リスクは主に投資信託商品への短期投資から来ています。これらの投資は公正な価値で損益および現金と現金等価物によって計量されます。変動金利で利下げされた債券は私たちをキャッシュフロー金利リスクに直面させ、固定金利で利下げされた債券は公正な価値金利リスクに直面させる。私たちはこの報告書で述べられている間、私たちに重大な金利リスクがないと思う。
為替リスク
上述したように、私たちの業務は国際化されており、外貨リスクに直面する可能性があり、主にドルです。為替リスクは、将来の商業取引および非関連グループの実体機能通貨での通貨建ての確認された資産および負債から来る。総合財務諸表および関連脚注開示当社が報告期末に直面する可能性のある外貨リスクの詳細を参照してください。
人民元を機能通貨とする子会社については、大部分の外国為替取引はドル建てである。2023年12月31日、2023年12月31日、2022年12月31日までの年度内に、他のすべての変数が不変のままで、ドル対人民元が5%上昇/切り下げられれば、それまでの年度の純損失はそれぞれ80万ドル減少/増加し、50万ドル減少/増加する。私たちは潜在的なリスクを最小限に抑えるために、ドルの人民元に対する為替変動を監視する予定だ。
信用リスク
信用リスクは主に現金と現金等価物、公正価値によって損益を計算する金融資産及びその他の売掛金から来ている。信用リスクに対する最大の開口は貸借対照表の各金融資産の帳簿価値で表される。
取引相手は主に中国に位置する国有或いは信用の良い商業機関及びオーストラリアとアメリカに位置する他の信用の良い金融機関であるため、公正な価値によって損益を計算する現金及び現金等価物及び金融資産の信用リスクは限られている。また、銀行機関預金口座の残高が各国のこのような口座に対する保険限度額を超えている場合には、信用リスクが存在する可能性がある。
その他の売掛金については、管理層は過去の決済記録及び過去の経験に基づいて定期的及び個別に売掛金の回収可能性を評価し、債務者の売掛金返済能力に影響するマクロ経済要素に基づいて展望性資料を調整する。
我々は、償却コストで計量された金融資産に期待信用損失モデルを適用する。その他の売掛金の減価は12ケ月の予想信用損失或いは生涯予想信用損失の計量に従って、初期確認以来信用リスクが大幅に増加するかどうかに依存する。信用リスクが著しく増加しているかどうかを評価するために,利用可能で合理的かつ支持的な前向き情報を考慮することにより,報告日までの資産違約リスクと初期確認日までの違約リスクを比較した。
債務者との協力歴史,他の売掛金の良好な催促歴史および前向き要因から,これらの未返済売掛金固有の信用リスクは重大ではないと考えられる。
流動性リスク
私たちの目標は、満期になる債務および将来の運営および資本需要を満たすために、十分な現金、現金等価物、短期投資、および長期投資を維持することだ。
インフレリスク
私たちはインフレが私たちの業務、財務状況、または経営結果に実質的な影響を及ぼすとは思わない。もし私たちの費用が深刻なインフレ圧力を受けたら、私たちは価格上昇によってこれらのより高いコストを完全に相殺することができないかもしれない。私たちはそれができないかできないかは私たちの業務、財務状況、そして経営業績を損なうかもしれない。
第12項株式証券以外の他の証券の説明
A.債務証券
適用されません
B.権利証と権利
適用されません
C.他の証券です
適用されません
D.アメリカ預託株です
Deutsche Bank Trust Company Americas は、預託者として ADS を登録し、引き渡します。各 ADS は、預託者のカストディアンとしてドイツ銀行香港支店に預託された普通株式 1 株の所有権を表します。各 ADS は、預託者が保有する可能性のあるその他の有価証券、現金またはその他の財産の所有権も表します。ADS が管理される預託者の法人信託事務所は、 1 Columbus Circle, New York, NY 10019, USA にあります。寄託者の主要執行事務所は、 1 Columbus Circle , New York , NY 10019 , USA にあります。
直接登録システムは,信託会社が管理するシステムであり,このシステムによれば,受託者は証明書のない米国預託証明書の所有権を登録することができ,所有権は,米国預託株式を所有する権利を有する所有者に発行された定期声明によって証明されなければならない.
当社は、 ADS 保有者を当社の株主として扱わないため、 ADS 保有者としてお客様は株主権を有しません。ケイマン諸島の法律は株主権を支配する。預託者は、 ADS の基礎となる普通株式の保有者です。ADS の保有者として、あなたは ADS の保有権を持つことになります。当社、預託者、 ADS 保有者としてのお客様、および ADS の受益者との間の預託契約は、 ADS 保有者の権利および預託者の権利義務を定めるものです。預金契約および ADS は、ニューヨーク州の法律が支配します。
費用と支出
ADS 保有者として、投資家は預託銀行に以下の手数料および特定の税金および政府手数料 ( お客様の ADS に表される預託証券に対して支払うべき適用される手数料、費用、税金およびその他の政府手数料に加えて ) を支払う必要があります。
| | | | | | | | |
| サービス.サービス | | 費用.費用 |
•米国預託証明書を発行された者又は株式配当金又はその他の無料分配株式、配当分配、株式分割又はその他の分配(現金に変換されたものを除く)に基づいて米国預託株式分配を行う者 | | アメリカの預託株式1枚につき最高0.05ドルが得られます |
•預金契約を終了する場合を含む米国預託証明書の廃止 | | 米国預託株式1件につき最高0.05ドルを廃止 |
•現金配当の分配 | | 保有しているアメリカ預託株式は最高0.05ドルが得られます |
•現金を分配する権利(現金配当金を除く)および/または権利、証券および他の享受すべき権利を売却して得られる現金収益 | | 保有しているアメリカ預託株式は最高0.05ドルが得られます |
•権利の行使に基づく ADS の配布。 | | 保有しているアメリカ預託株式は最高0.05ドルが得られます |
•米国預託証明書ではない証券の流通または追加の米国預託証明書の購入の権利 | | 保有しているアメリカ預託株式は最高0.05ドルが得られます |
•信託サービス | | 口座開設銀行で設立された適用記録日(S)が保有する米国預託株式あたり最高0.05ドル |
米国預託証明書の発行とログアウト費用は,株への入金や抽出目的で米国預託証明書を渡した投資家またはその代理の仲介機関に直接受け取る。保管人は、投資家に分配する費用を受け取り、分配された金額からこれらの費用を差し引くか、または分配可能な財産の一部を売却して費用を支払う。保管人は、現金分配から控除されるか、または投資家に直接課金するか、または投資家を代表する参加者の帳簿課金システム口座に課金することによって、ホストサービスの年会費を徴収することができる。保管人は一般的にこれらのサービスの料金を支払うまで、吸引料金のサービスを拒否することができます。
第II部
13番目の項目は配当金、延滞配当金、そして配当金を滞納する。
ない
項目14.保持者を保証する権利および収益の使用を実質的に修正する。
2021年3月18日、米国証券取引委員会は、当社が初公募時に提出した改訂されたF-1表(書類第333-253631号(“登録説明書”)が発効すると発表した。“登録声明”によると、吾らは引受業者が追加米国預託証明書を購入する選択権に基づいて、最大1,687,500件の米国預託証明書を含む12,937,500件の米国預託証明書の要約及び販売を登録した。Jefferies LLC、SVB Leerink LLC、Piper Sandler&Co.と中金社香港証券有限公司が今回発行された引受業者代表を務めている。
2021年3月23日、私たちは1株17.00ドルで12,937,500件のアメリカ預託証明書を発行し、販売した。販売株の総発行価格は約2.199億ドル。2021年3月23日のIPO完了後、引受割引、手数料、発行費用1710万ドルを差し引いて、2.028億ドルの純収益を得た。当社は、(I)当社の任意の上級者又は取締役又はその連絡先、(Ii)当社の任意の種類の持分証券を10%以上有する任意の者、又は(Iii)当社の任意の連属会社に当該等の支出を直接又は間接的に支払うことはない。
登録声明に基づいて登録されたすべての証券を売却した後、発売は終了します。2023年12月31日現在,我々のIPO募集資金のうち約1.06億ドルが使用されている.2023年12月31日現在,我々のIPO募集資金のうち約7300万ドルが候補製品の臨床開発を支援するために用いられている
以下は,我々のIPO募集資金純額の現在期待されている用途の概要である
•約1億2千万ドルで候補製品の臨床開発に資金を提供しています
•研究や臨床前開発計画を支援するための約2000万ドルです
•残りの部分は、現在および将来の他の研究および開発活動を支援するために使用され、資本プロジェクトを含む可能性がある運営資本および他の一般会社用途に使用される。
プロジェクト15.制御とプログラム
(a)制御と手続きを開示する
取引所法案第13 a-15条の要求によると、経営陣は、我々の最高経営責任者及び最高財務官を含めて、本報告で述べた期間終了までの開示制御及び手続の有効性を評価している。開示制御および手続きとは、取引法に従って提出または提出された報告書において開示を要求することを保証するための情報が、米国証券取引委員会規則および表に指定された期間内に記録、処理、集約および報告されることを保証するための制御および他のプログラムを意味する。開示制御及び手続は、取引法に基づいて提出又は提出された報告書において開示を要求する情報が蓄積され、管理層に伝達されることを保証するために、制御及び手続に限定されるものではないが、我々の主要幹部及び主要財務官、又は同様の機能を適宜履行する者を含めて、必要な開示についてタイムリーに決定することを目的としている。このような評価に基づき、我々の経営陣は、我々の最高経営責任者及びCEOを含め、2023年12月31日までに、我々の開示統制及び手続が有効であると結論した。
(b)財務報告書の内部統制に関する経営陣の報告書
我々の経営陣は、取引法第13 a-15(F)及び15 d-15(F)条の規定に基づいて、財務報告に対する有効な内部統制の確立及び維持を担当している
財務報告の内部統制は、財務報告の信頼性を合理的に保証することを目的としたプログラムであり、公認された会計原則に基づいて外部目的の財務諸表を作成する。その固有の限界により、財務報告の内部統制は重大な誤報を防止あるいは発見できない可能性がある。また,将来期間のいずれの有効性評価の予測も影響を受ける
条件の変化により、制御が不十分になる可能性があり、あるいは政策やプログラムに対する遵守度が悪化する可能性があるリスクを低減する
我々の経営陣は、テレデビル委員会後援組織委員会(COSO)が発表した“内部統制-総合枠組み(2013)”で確立された基準に基づき、2023年12月31日までの財務報告内部統制の有効性を評価した。この評価に基づき、我々の経営陣は、経営責任者と最高財務責任者の参加の下、2023年12月31日現在、財務報告の内部統制に有効であると結論した
(c)独立公認会計士事務所に報告します。
本年度報告書には、“雇用法案”によると、新興成長型会社であるため、会社公認会計士事務所の認証報告は含まれていません。
(d)財務報告書の内部統制の変化。
本20-F表年次報告書に記載されている間、財務報告の内部統制に大きな影響を与えていないか、または合理的に当社の財務報告の内部統制に大きな影響を与える可能性のある変化はありません。
プロジェクト16 A。監査委員会の財務専門家。
監査委員会はウィルソンさん、Mr.HuangとMr.Liuから構成され、取締役会が私たちの会計と財務報告の流れ及び私たちの総合財務諸表の監査を監督することに協力します。ウィルソンさんは委員会の議長を務めています。監査委員会は完全に財務知識に通じた取締役会メンバーで構成されており、ウィルソンさんは適用される米国証券取引委員会規則で定義された“監査委員会財務専門家”とされ、適用されたナスダック規則によって定義された必要な財務経験を持っている。我々の取締役会は、監査委員会のすべてのメンバーが取引所法案規則10 A-3に規定されている“独立性”の要件に適合していることを決定した。監査委員会はナスダック規則に適合した定款によって管轄されている。
プロジェクト16 B。道徳的基準。
私たちの取締役会は、私たちすべての従業員、役員、および役員に適用されるビジネス行動と道徳基準(“行動基準”)を採択しました。“行動基準”は、www.Connectbiopharm.comのウェブサイトの“コーポレート·ガバナンス”の一部で閲覧できます。私たちの取締役会は“行動基準”を監督する責任があり、従業員、役員、取締役の“行動基準”に対するいかなる免除も承認する必要があります。私たちは“行動基準”の任意の修正またはその要求に対するいかなる免除も私たちのウェブサイトで開示されると予想している。当社のサイトアドレスへの引用は、当社のサイトに掲載されているか、または本サイトを介して提供される情報への引用とはなりませんので、本年度報告の一部と見なすべきではありません
プロジェクト16 Cです。チーフ会計士費用とサービスです。
以下の指定カテゴリは,我々の主要な非常勤原子力数師普華永道中天会計士事務所が指定期間中に提供するいくつかの専門サービスに関する費用総額を示す.
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2023 |
(単位:千) | | | |
料金を審査するi | $ | 798 | | | $ | 902 | |
他のすべての費用II | — | | | — | |
| 合計する | $ | 798 | | | $ | 902 | |
(i)“監査費用”とは、各会計年度内に、我々の主要監査人が我々の総合財務諸表を監査するために提供する専門サービスと、法定及び規制書類又は業務に関連する中間審査サービスによって徴収される総費用をいう
(Ii)“他のすべての費用”とは、私たちの主な監査人が提供する製品およびサービスの各会計年度の総費用を意味するが、監査費用、監査に関連する費用、および税金項目の下で報告されるサービスは除外される。
監査委員会があらかじめ承認した政策と手続き
我々の監査委員会は手続きを通過し、委員会が普華永道中天法律事務所が提供するすべての監査および非監査サービスを審査·承認する方法を規定している。前置承認手順は以下のとおりである
•独立会計士が吾等に提供する任意の監査又は非監査サービスは、(I)監査委員会によって予め承認されなければならない。または(Ii)委員会によって指定された1人以上の委員会のメンバーが事前に承認され、監査委員会によって承認されなければならない。
プロジェクト16 Dです。監査委員会の上場基準に対する免除。
適用されません
プロジェクト16 E。発行者と関連購入者が持分証券を購入する。
次の表は、取引法第10 b-18(A)(3)条で定義された“関連購入者”が2023年度に購入した株式の要約である。すべてのADSは公開市場で購入された。当社は2023年度に株式証券を買い戻していません。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 購入したアメリカ預託証明書の総数 | | | アメリカ預託株式につき平均価格(ドル)を支払う | | | 公開発表計画の一部として購入した米国預託証明書の総数 | | | | この計画によってはまだ購入していないアメリカの預託証明書の約ドルの価値(ドル)があるかもしれません | | |
2023年12月 | | 269,627 | | | | $ | 0.91 | | | | 269,627 | | | | $ | — | | |
プロジェクト16 Fです。登録者の認証会計士を変更します。
適用されません。
プロジェクト16 Gです。会社が管理する。
ケイマン諸島の登録免除を受けて設立された有限責任会社として、ケイマン諸島の法律に基づいて、様々な会社の管理要求を遵守しなければならない。また、ナスダックに上場する海外私募発行者として、私たちはナスダック社の上場基準に支配されている。しかし、ナスダックの上場基準は、一部の例外的な状況を除いて、外国の個人発行者がナスダックの規則ではなく、自国の会社管理実践に従うことを許可することを規定している。ケイマン諸島のいくつかのコーポレートガバナンスのやり方はコーポレートガバナンスの上場基準と大きく異なるかもしれない。例えば、ケイマン諸島の会社法又は我々が改訂及び再記述した定款大綱及び細則は、(I)大部分の取締役が独立取締役であることを要求せず、(Ii)我々の報酬委員会は独立取締役のみを含むか、又は(Iii)我々の独立取締役は定期的に独立取締役のみが出席する会議を開催する。以下に述べる以外に、我々は現在、ケイマン諸島の法律の下で可能な限りナスダックの企業管理上場基準を遵守している。しかし、私たちは未来に母国の接近に従うためにこのような接近を変えることを選択するかもしれない。
私たちは外国の個人発行者であるにもかかわらず、監査委員会の構成および職責に関する“取引所法案”の第10 A-3条の規定を遵守しなければならない。規則10 A-3は、監査委員会は、私たちの監査員の指名、報酬、および選択に直接責任があり、その義務を履行し、苦情を処理し、コンサルタントを選択することを制御しなければならないと規定している。規則10 A-3によれば、外国の民間発行者が所在する国の法律がそのような事項のいずれかが会社の取締役会または株主の承認を必要とすることを要求する場合、監査委員会のそのような事項における責任または権力は諮問的である可能性がある。
また、ナスダック規則は、上場企業に任意の株式保有者会議の定足数が、同社の普通株に議決権を持つ株式流通株の少なくとも33.3%であることを明らかにすることを求めている。我々の上場後に改正及び再記載された組織定款大綱及び定款細則の規定、及びケイマン諸島の法律で許可されている場合、株主総会に必要な定足数は、1名以上の投票権を含み、自ら又は委員会の代表又は(例えば、株主が会社のような)正式に許可された代表によって出席する株主を含み、当該等の株式の合計は、当社のすべての発行及び有権投票株式に付随する全投票権の3分の1以上である。
また、ナスダック規則は、上場会社の独立取締役が独立取締役のみが出席する会議を定期的に開催しなければならないことを求めている。私たちはこのナスダック規則を守るのではなく、ケイマン諸島母国での私たちの接近に従うつもりだ。
また、“ナスダック”は、上場企業は完全に独立役員からなる指名委員会を設立しなければならないと規定している。私たちはプロジェクト6と題する部分で述べたように、私たちのケイマン諸島母国の接近に従うつもりだ。このナスダック規則を遵守するのではなく、“役員、上級管理者、従業員-取締役会慣行”である。
また、ナスダック規則は、各発行者が発行者のいる会計年度終了後1年以内に年次株主総会を開催しなければならないことを要求している。我々は年次株主総会において我々の自国のやり方に従い,2023年12月31日までの年度内に年次株主総会を開催しない予定である。しかし、株主の承認が必要な重大な問題があれば、将来的に年次株主総会を開催することができます。
16 H項です。炭鉱の安全情報開示。
適用されません
^ a b c d e f 。検査を妨げる外国の管轄区域に関する開示。
適用されません。
プロジェクト16 Jです。インサイダー取引政策。
適用されません。
プロジェクト16 Kです。ネットワークセキュリティです。
サイバーセキュリティリスク管理、戦略、ガバナンス
我々は,我々のキーシステムと情報の機密性,完全性,可用性を保護するためのネットワークセキュリティリスク管理計画を策定し実施した
我々は,国家標準·技術研究所のネットワークセキュリティフレームワーク(NIST CSF)に基づいて我々の計画を設計·評価した。これは、特定の技術基準、規範、または要求を満たすことを意味するわけではありませんが、ガイドラインとしてNIST CSFを使用して、私たちの業務に関連するネットワークセキュリティリスクの識別、評価、管理を支援しています。
我々のネットワークセキュリティリスク管理計画は、私たちの全体企業リスク管理計画に統合され、企業リスク管理計画全体に適用される汎用的な方法、報告ルート、管理プロセスを共有し、他の法律、コンプライアンス、戦略、運営、金融リスク分野に適用される。
我々のネットワークセキュリティリスク管理計画の重要な要素は、以下に限定されるものではない
•ネットワークセキュリティイベント応答計画は、ネットワークセキュリティイベントに対応するプログラムを含む。
•Microsoft 365サービスは、電子メール、データストレージ、ワンポイント登録(SSO)のための識別プロバイダ(IdP)、遠隔ユーザやデバイス管理などの他の技術制御に利用される。
•Microsoft 365は、セキュリティおよび業界標準を満たして構成されています。私たちはITチームのための自動リスク管理機構と警報通知を有効にした。
•私たちのセキュリティ状況の基準として、私たちのマイクロソフトセキュリティ採点を定期的に監視し、私たちの改善作業を指導します。
•リスク評価は、年間外部評価と脆弱性スキャンを含む、当社の重要なシステム、情報、製品、サービス、およびより広範な企業IT環境が直面する重大なネットワークセキュリティリスクを識別することを目的としています
•セキュリティチームは,(1)我々のネットワークセキュリティリスク評価プロセス,(2)我々のセキュリティ制御,および(3)サイバーセキュリティイベントに対する我々の反応を主に管理する
•安全意識訓練の第三者リーダーKnowBe 4が管理する2つの模擬釣り電子メール活動を含む安全意識訓練コースを定期的に開催している
•災害時の業務継続手順を含む災害復旧計画。この計画には,バックアッププログラム,すべての現代SaaSサービスのフェイルオーバ機能,およびデータ回復プロトコルがある.
•第三者リスク管理(TPRM)プロセスは、リスク識別、参加前の職務調査とリスク評価、およびリスクレベルに基づいて第三者を分類するために、私たちの運営の鍵となる程度の評価とそれぞれのリスク概況に基づいて、サービスプロバイダ、サプライヤー、サプライヤーによるリスクを防止する
私たちは、私たちの運営、業務戦略、運営結果、または財務状況を含む、既知のネットワークセキュリティ脅威(これまでの任意のネットワークセキュリティイベントを含む)から、私たちに重大な影響を与えるか、または合理的に私たちに重大な影響を与える可能性があるリスクを決定していません。2023年、私たちはどんな重大なITセキュリティ事件も経験しなかった。私たちはネットワークセキュリティの脅威からのリスクに直面しており、これらの脅威が現実になれば、私たちの運営、業務戦略、運営結果、あるいは財務状況を含む大きな影響を与える可能性が高い。リスク要因-当社の情報技術システム、または当社のCRO、製造業者、他の請負業者またはコンサルタントまたは協力者のシステムに障害が発生したり、システム障害、セキュリティホール、またはネットワークセキュリティ上の欠陥を受けたりする可能性があり、これは、私たちの製品開発計画を深刻に中断させ、私たちの業務に関連する敏感な情報を危険にさらしたり、契約および法的義務をトリガしたりする可能性があります
サイバーセキュリティ·ガバナンス
本委員会はネットワークセキュリティリスクはそのリスク監督機能の一部であると考え、監査委員会にネットワークセキュリティとその他の情報技術リスクの監督を依頼した。監査委員会は経営陣が私たちのネットワークセキュリティリスク管理計画の実施を監督している
監査委員会は定期的に私たちのネットワークセキュリティリスクに関する管理職の報告を受け、私たちのITチームは定期的に監査委員会に直接報告します。また、管理層は、必要に応じて、任意の重大なネットワークセキュリティイベントおよび任意の影響の小さいイベントの最新状況を監査委員会に通報する
監査委員会は、ネットワークセキュリティに関する活動を含む取締役会全員にその活動を報告した。取締役会の全メンバーはまた、我々のネットワークリスク管理計画に関する経営陣のブリーフィングを聴取した 取締役会メンバーは、上場企業に影響を与えるテーマに関する取締役会の継続教育の一部であるネットワークセキュリティテーマに関する内部スタッフの紹介を聴取した。
最高財務責任者 ( CFO ) と最高コンプライアンス責任者 ( CCO ) を含む経営陣は、サイバーセキュリティの脅威による重大なリスクを評価し、管理する責任を負っています。当社の CFO は、 CCO と緊密に連携し、サイバーセキュリティリスクの評価、モニタリング、管理の責任を負い、業界に関連するリスクに関する豊富な経験と知識を有しています。経営陣の監督の下、 IT チームはサイバーセキュリティリスク管理プログラム全体の主な責任を負い、社内のサイバーセキュリティ担当者を監督しています。
私たちの管理チームは、内部セキュリティ担当者のプレゼンテーション、政府、公共またはプライベートソース(私たちが招聘した外部コンサルタントを含む)から得られた脅威情報および他の情報、およびIT環境に配備されたセキュリティツールによって生成された警報および報告を含む様々な手段によって、ネットワークセキュリティリスクおよびイベントを予防、検出、緩和および修復する作業を監視する。
第三部
プロジェクト17.財務諸表
当社は、第 18 号に定める財務諸表及び関連情報の提供を選択しました。
プロジェクト18.財務諸表
財務諸表は本年度報告書の一部として提出され、F-1ページから始まる。
プロジェクト19.証拠品。
登録ステートメントまたは年次報告書の一部として提出されたすべての展示物をリストアップします。
| | | | | | | | | | | | | | | | | | | | |
| | 引用で法団として成立する |
| | | | | | |
| 証拠品番号: | 説明する | 表 | 書類番号. | 証拠品番号: | 提出日 | 提出済み/
家具を完備する |
| 1.1 | Connect Biopharma Holdings Limited の第 5 回修正 · 修正覚書および定款 | 20-F | 001-40212 | 1.1 | 3/31/2022 | |
| | | | | | |
| 2.1 | 普通株式証明書サンプル | F-1/A | 333-253631 | 4.1 | 3/12/2021 | |
| | | | | | |
| 2.2 | コネクト · バイオファーマ · ホールディングス · リミテッド、預託者、およびこれに基づいて発行された米国預託株式の保有者および実質所有者との間の預託契約 | S-8 | 333-254524 | 4.3 | 3/19/2021 | |
| | | | | | |
| 2.3 | 米国預託証券 ( 別紙 2.2 に含まれる ) | S-8 | 333-254524 | 4.3 | 3/19/2021 | |
| | | | | | |
| 2.4 | Connect Biopharma Holdings Limited 、その子会社及び一部の株主との間で締結された 2020 年 12 月 1 日付の第 2 次修正株主契約書 | F-1 | 333-253631 | 4.4 | 2/26/2021 | |
| | | | | | |
| 2.5 | 証券説明書 | 20-F | 001-40212 | 2.5 | 3/31/2022 | |
| | | | | | |
4.1† | 合意の形式を達成する | F-1/A | 333-253631 | 10.2 | 3/17/2021 | |
| | | | | | |
| 4.2† | コネクトバイオファーマホールディングス 2019 年株式インセンティブプラン | F-1 | 333-253631 | 10.1 | 2/26/2021 | |
| | | | | | |
| 4.3† | 2021 年度インセンティブ · アワード · プラン及びこれに基づく新株予約権付与通知書及び新株予約権契約書の様式 | F-1/A | 333-253631 | 10.3 | 3/12/2021 | |
| | | | | | |
| 4.4† | 2021年従業員株購入計画 | F-1/A | 333-253631 | 10.4 | 3/12/2021 | |
| | | | | | |
| 4.5† | 非従業員役員報酬計画 | | | | | * |
| | | | | | |
| 4.6† | Connect Biopharm LLC と Zheng Wei , Ph. D. の間の雇用契約 ( 2021 年 1 月 1 日付 ) 。 | F-1 | 333-253631 | 10.11 | 2/26/2021 | |
| 4.7† | Connect Biopharma Hong Kong Limited と Wubin Pan , Ph. D. との間の雇用契約 ( 2021 年 1 月 1 日付 ) | F-1 | 333-253631 | 10.12 | 2/26/2021 | |
| 4.8† | 2021 年 10 月 13 日付の Connect Biopharm LLC と Steven Chan 間の雇用書簡 | 20-F | 001-40212 | 4.10 | 3/31/2022 | |
| 4.9 | 蘇州コネクトバイオファーマ株式会社との 2023 年 5 月 1 日付のリース更新契約の英語訳Ltd. と Taicang 科学技術ベンチャーパーク有限公司、リミテッド | 6-K | 001-40212 | 99.1 | 6/23/2023 | |
| | | | | | |
| 4.10 | Connect Biopharm LLC と Paseo Del Mar LLC との間で 2021 年 12 月 22 日付のリース契約 | 20-F | 001-40212 | 4.13 | 3/31/2022 | |
| | | | | | |
| 4.11 | Connect Biopharma Hong Kong Limited 、 Suzhou Connect Biopharma Co. との間の 2023 年 11 月 21 日付のライセンスおよび協力契約の英語翻訳株式会社シムセール製薬株式会社 | 6-K | 001-40212 | 99.1 | 11/21/2023 | |
| | | | | | |
| 8.1 | 付属会社名簿 | | | | | * |
| | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| 12.1 | 2002年の“サバンズ-オキシリー法案”第302節に基づいて発行された最高経営責任者証明書。 | | | | | * |
| | | | | | |
| 12.2 | 2002年のサバンズ-オキシリー法第302節に基づいて発行された首席財務官証明書。 | | | | | * |
| | | | | | |
| 13.1 | 2002年にサバンズ·オクスリ法案第906条に基づいて発行された最高経営責任者証明書。 | | | | | ** |
| | | | | | |
| 13.2 | 2002年のサバンズ·オキシリー法第906条に基づいて発行された首席財務官証明書。 | | | | | ** |
| | | | | | |
| 15.1 | PricewaterhouseCoopers Zhong Tian LLP 、独立した登録公認会計事務所の同意。 | | | | | * |
| | | | | | |
| 97 | コネクトバイオファーマホールディングス株式会社クローバックポリシー | | | | | * |
| | | | | | |
| | | | | | |
| 101.INS | XBRLインスタンスドキュメントを連結する. | | | | | * |
| | | | | | |
| 101.書院 | インラインXBRL分類拡張アーキテクチャ文書. | | | | | * |
| | | | | | |
| 101.カール | インラインXBRL分類拡張はリンクベース文書を計算する. | | | | | * |
| | | | | | |
| 101.def | インラインXBRLソートはLinkbase文書を定義する. | | | | | * |
| | | | | | |
| 101.介護会 | XBRL分類拡張ラベルLinkbase文書を連結する. | | | | | * |
| | | | | | |
| 101.Pre | インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント | | | | | * |
| | | | | | |
| 104 | 表紙インタラクションデータファイル(イントラネットXBRL文書に埋め込む) | | | | | |
*本局に提出します
**手紙で提供する
†契約または補償計画または手配を管理することを指す
本年次報告書の資料として提出される契約の中には、当事者が相互に行った表明および保証が含まれます。これらの表明および保証は、かかる契約の他の当事者の利益のためにのみ行われ、かかる契約の他の当事者に開示され、かかる契約に反映されない特定の情報によって修飾される可能性があります。さらに、これらの表明および保証は、実際の事実の記述ではなく、そこに含まれる記述が不正確であることが判明した場合に当事者間でリスクを配分する方法として意図される場合があります。したがって、そのような表明や保証は、事実の実際の状態の特徴付けとして信頼することはできません。また、かかる表明および保証の主題に関する情報は、かかる契約の日付以降に変更されている可能性があります。
サイン
登録者は、それが20-F表を提出するすべての要求に適合し、本年度報告書に署名するために以下の署名者を正式に手配し、許可したことを証明する
| | | | | |
| コネクト · バイオファーマホールディングス |
| |
日時 : 2024 年 4 月 16 日 | / s / スティーヴン · チャン |
| スティーブン · チャン最高財務責任者 |
バイオファーマホールディングス株式会社コネクト
連結財務諸表索引
| | | | | |
| ページ |
| 連結財務諸表監査済み | |
独立公認会計士事務所レポート(PCAOB ID)1424) | F-2 |
2021 年、 2022 年、 2023 年 12 月期連結損益計算書 | F-3 |
2021年,2022年,2023年12月31日までの年度総合全面損失表 | F-4 |
2022 年 1 月 1 日、 2022 年 12 月 31 日、 2023 年現在の連結貸借対照表 | F-5 |
2021 年、 2022 年、 2023 年 12 月期連結株主 ( 赤字 ) / 自己資本の変動計算書 | F-6 |
2021年,2022年,2023年12月31日終了年度までの統合キャッシュフロー表 | F-8 |
連結財務諸表付記 | F-9 |
独立公認会計士事務所報告
コネクトバイオファーマホールディングス株式会社の取締役会および株主へ
財務諸表のいくつかの見方
当社は、 Connect Biopharma Holdings Limited およびその子会社の連結貸借対照表を監査しました。( 以下「当社」といいます ) 2023 年 12 月 31 日および 2022 年 12 月 31 日時点の連結損益計算書、連結損益計算書関連注記を含む ( 総称して「連結財務諸表」といいます ) 。当社は、連結財務諸表は、国際会計基準審議会が発行する IFRS 会計基準に従い、 2023 年 12 月 31 日及び 2022 年現在の当社の財務状況並びに 2023 年 12 月 31 日を末日とする 3 年間の各事業の結果及びキャッシュフローを、すべての重要な点において公正に示していると考えています。
会計原則の変化
当社は、連結財務諸表注記 2 のとおり、 2023 年の財務諸表の提示通貨を人民元から米ドルに変更し、 2022 年 1 月 1 日の貸借対照表を含めることとなりました。
意見の基礎
これらの連結財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の総合財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従ってこれらの連結財務諸表を監査した。これらの基準は、連結財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性に対する意見を表明するためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、連結財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれる。これらの手続きは、連結財務諸表中の金額および開示に関する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、合併財務諸表の全体列報の評価も含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
/s/ 普華永道中天法律事務所
北京、ペ中華民国ソウ共和国
2024年4月16日
2020年以来、当社の監査役を務めてきました。
バイオファーマホールディングス株式会社コネクト
合併損失表
(In千米ドル ( 1 株あたりのデータを除く )
| | | | | | | | | | | | | | | | | | | | | | | |
| | | 十二月三十一日までの年度 |
| 備考 | | 2021 | | 2022 | | 2023 |
| | | 再発表i | | 再発表i | | |
| 研究開発費 | 6 | | $ | (80,496) | | | $ | (96,630) | | | $ | (51,913) | |
| 行政費 | 6 | | (19,014) | | | (20,806) | | | (14,515) | |
| 減価損失純額 | 13 | | — | | | (4,698) | | | — | |
| その他の収入 | 8 | | 2,950 | | | 929 | | | 1,580 | |
| その他(損失)/収益-純額 | 9 | | (1,547) | | | 1,889 | | | 2,774 | |
| 営業損失 | | | (98,107) | | | (119,316) | | | (62,074) | |
| 財政収入 | 10 | | 97 | | | 1,544 | | | 2,714 | |
| 融資コスト | 10 | | (7) | | | (21) | | | (23) | |
| 財務収入--純額 | 10 | | 90 | | | 1,523 | | | 2,691 | |
| 優先権金融商品の公正価値損失 | 25 | | (103,983) | | | — | | | — | |
| 所得税前純損失 | | | (202,000) | | | (117,793) | | | (59,383) | |
| 所得税費用 | 11 | | (266) | | | (298) | | | (120) | |
| 純損失 | | | $ | (202,266) | | | $ | (118,091) | | | $ | (59,503) | |
| 純損失は | | | | | | | |
| 当社のオーナー | | | $ | (202,266) | | | $ | (118,091) | | | $ | (59,503) | |
| | | | | | | |
| | | | | | | |
| 1株当たり純損失 | | | | | | | |
| 基本的希釈の | 12 | | $ | (3.88) | | | $ | (2.15) | | | $ | (1.08) | |
添付注記は、連結財務諸表の不可欠な部分です。
( 一 ) 当社グループは、本連結財務諸表の注記 2 に記載されているとおり、 2023 年 1 月 1 日付で提示通貨を人民元から米ドルに変更することを選択しました。2021 年 12 月期および 2022 年 12 月期連結損失計算書は、当社グループの報告通貨の変更を反映して再報告しています。
バイオファーマホールディングス株式会社コネクト
合併全面損失表
(In USD 数千 )
| | | | | | | | | | | | | | | | | | | | | | | |
| | | 十二月三十一日までの年度 |
| 備考 | | 2021 | | 2022 | | 2023 |
| | | 再発表i | | 再発表i | | |
| 純損失 | | | $ | (202,266) | | | $ | (118,091) | | | $ | (59,503) | |
| その他総合(赤字)/収入 | | | | | | | |
| 損益に再分類できる項目 | | | | | | | |
| 渉外業務翻訳のコミュニケーションの違い | 2.6 | | 940 | | | (3,235) | | | (604) | |
| その他総合利益を通じた債券の適正価額変動について | 3.3, 18(a) | | — | | | (365) | | | 354 | |
| | | | | | | |
| | | | | | | |
| その他当期総合 ( 損失 ) / 利益 ( 税抜 ) | | | 940 | | | (3,600) | | | (250) | |
| 本年度の総合損失総額 | | | $ | (201,326) | | | $ | (121,691) | | | $ | (59,753) | |
| 以下の理由による包括的な損失総額: | | | | | | | |
| 当社のオーナー | | | $ | (201,326) | | | $ | (121,691) | | | $ | (59,753) | |
添付注記は、連結財務諸表の不可欠な部分です。
( 一 ) 当社グループは、本連結財務諸表の注記 2 に記載されているとおり、 2023 年 1 月 1 日付で提示通貨を人民元から米ドルに変更することを選択しました。2021 年 12 月期および 2022 年 12 月期連結損益計算書は、当社グループの記載通貨の変更を反映して再記載しています。
バイオファーマホールディングス株式会社コネクト
合併貸借対照表
(In USD 数千 )
| | | | | | | | | | | | | | | | | | | | | | | | | |
| | | 1月1日から | | 12月31日まで | | |
| 備考 | | 2022 | | 2022 | | 2023 | | |
| | | 再発表i | | 再発表i | | | | |
| | | | | | | | | |
| 資産 | | | | | | | | | |
| 非流動資産 | | | | | | | | | |
| 財産·工場·設備 | 13 | | $ | 9,307 | | | $ | 4,976 | | | $ | 4,274 | | | |
| 使用権資産 | 15(a) | | 3,580 | | | 3,494 | | | 453 | | | |
| 無形資産 | | | 88 | | | 72 | | | 62 | | | |
| 投資: | | | | | | | | | |
| 他の総合収益で公正な価値で計算される金融資産 | 18(a) | | — | | | 9,440 | | | — | | | |
| 他の非流動資産 | 14 | | 2,950 | | | 252 | | | 132 | | | |
| 非流動資産総額 | | | 15,925 | | | 18,234 | | | 4,921 | | | |
| 流動資産 | | | | | | | | | |
| その他売掛金と前金 | 17 | | 7,412 | | | 3,362 | | | 2,318 | | | |
| 投資: | | | | | | | | | |
| 他の総合収益で公正な価値で計算される金融資産 | 18(a) | | — | | | 73,407 | | | 12,646 | | | |
| 現金と現金等価物 | 18(b), 19 | | 267,716 | | | 79,010 | | | 106,007 | | | |
| 流動資産総額 | | | 275,128 | | | 155,779 | | | 120,971 | | | |
| 総資産 | | | $ | 291,053 | | | $ | 174,013 | | | $ | 125,892 | | | |
| 負債.負債 | | | | | | | | | |
| 非流動負債 | | | | | | | | | |
| 賃貸負債 | 15(b) | | $ | 26 | | | $ | 245 | | | $ | 180 | | | |
| 収入を繰り越す | | | 784 | | | 652 | | | 405 | | | |
| 非流動負債総額 | | | 810 | | | 897 | | | 585 | | | |
| 流動負債 | | | | | | | | | |
| 貿易応払い | | | 12,735 | | | 11,937 | | | 7,660 | | | |
| その他の支払及び課税項目 | 24 | | 5,151 | | | 3,501 | | | 2,999 | | | |
| 契約責任 | 5 | | — | | | — | | | 13,320 | | | |
| 賃貸負債 | 15(b) | | 99 | | | 186 | | | 285 | | | |
| 流動負債総額 | | | 17,985 | | | 15,624 | | | 24,264 | | | |
| 総負債 | | | 18,795 | | | 16,521 | | | 24,849 | | | |
| 純資産 | | | 272,258 | | | 157,492 | | | 101,043 | | | |
| 株主権益 | | | | | | | | | |
| 株本 | 20 | | 10 | | | 10 | | | 10 | | | |
| 株式割増 | 20 | | 628,643 | | | 628,661 | | | 628,707 | | | |
| 国庫株 | 21 | | (180) | | | (180) | | | (180) | | | |
| 株式報酬準備金 | 22(a) | | 9,566 | | | 16,473 | | | 19,731 | | | |
| その他の備蓄 | 22(b) | | (4,028) | | | (7,628) | | | (7,878) | | | |
| 損失を累計する | | | (361,753) | | | (479,844) | | | (539,347) | | | |
| 株主権益総額 | | | 272,258 | | | 157,492 | | | 101,043 | | | |
| 総負債と株主権益 | | | $ | 291,053 | | | $ | 174,013 | | | $ | 125,892 | | | |
添付注記は、連結財務諸表の不可欠な部分です。
( 一 ) 当社グループは、本連結財務諸表の注記 2 に記載されているとおり、 2023 年 1 月 1 日付で提示通貨を人民元から米ドルに変更することを選択しました。2022 年 1 月 1 日および 2022 年 12 月 31 日時点の連結貸借対照表は、当社グループの提示通貨の変更を反映して再提示しています。
バイオファーマホールディングス株式会社コネクト
連結株主変動計算書 ( 赤字 ) / 自己資本
(In USD 数千 )
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 備考 | | 共有
資本 | | 共有
割増価格 | | 財務局
株 | | 株式を基礎とする
補償する
埋蔵量 | | 他にも
埋蔵量 | | 積算
損 | | 合計する
株主の
( 赤字 ) / 株式 | | | | | | | | | | |
| | | 再発表i | | 再発表i | | 再発表i | | 再発表i | | 再発表i | | 再発表i | | 再発表i | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | | | | | | |
| 2021年1月1日の残高 | | | $ | 3 | | | $ | 6,012 | | | $ | — | | | $ | 972 | | | $ | (4,582) | | | $ | (159,487) | | | $ | (157,082) | | | | | | | | | | | |
| 総合損失 | | | | | | | | | | | | | | | | | | | | | | | | | |
| 純損失 | | | — | | | — | | | — | | | — | | | — | | | (202,266) | | | (202,266) | | | | | | | | | | | |
| 為替差違 | | | — | | | — | | | — | | | — | | | 940 | | | — | | | 940 | | | | | | | | | | | |
| | | | — | | | — | | | — | | | — | | | 940 | | | (202,266) | | | (201,326) | | | | | | | | | | | |
| 所有者との取引 | | | | | | | | | | | | | | | | | | | | | | | | | |
| 普通株発行は発行コストを差し引く | 20, 23 | | 2 | | | 200,630 | | | — | | | — | | | — | | | — | | | 200,632 | | | | | | | | | | | |
| 優先株から普通株式への転換について | 20 | | 5 | | | 421,456 | | | — | | | — | | | — | | | — | | | 421,461 | | | | | | | | | | | |
| 普通株買い戻し | 20 | | — | | | — | | | (180) | | | — | | | (386) | | | — | | | (566) | | | | | | | | | | | |
| 共同創業者への株式の発行 | 23 | | — | | | 218 | | | — | | | (218) | | | — | | | — | | | — | | | | | | | | | | | |
| 株式オプションの行使 | 20 | | — | | | 327 | | | — | | | (174) | | | — | | | — | | | 153 | | | | | | | | | | | |
| 株式ベースの報酬 | 23 | | — | | | — | | | — | | | 8,986 | | | — | | | — | | | 8,986 | | | | | | | | | | | |
| | | | 7 | | | 622,631 | | | (180) | | | 8,594 | | | (386) | | | — | | | 630,666 | | | | | | | | | | | |
| 2021年12月31日の残高 | | | 10 | | | 628,643 | | | (180) | | | 9,566 | | | (4,028) | | | (361,753) | | | 272,258 | | | | | | | | | | | |
| 総合損失 | | | | | | | | | | | | | | | | | | | | | | | | | |
| 純損失 | | | — | | | — | | | — | | | — | | | — | | | (118,091) | | | (118,091) | | | | | | | | | | | |
| その他総合利益による債券の適正価額変動による未実現損失 | | | — | | | — | | | — | | | — | | | (365) | | | — | | | (365) | | | | | | | | | | | |
| 為替差違 | | | — | | | — | | | — | | | — | | | (3,235) | | | — | | | (3,235) | | | | | | | | | | | |
| | | | — | | | — | | | — | | | — | | | (3,600) | | | (118,091) | | | (121,691) | | | | | | | | | | | |
| 所有者との取引 | | | | | | | | | | | | | | | | | | | | | | | | | |
| 普通株発行は発行コストを差し引く | 20 | | — | | | 18 | | | — | | | — | | | — | | | — | | | 18 | | | | | | | | | | | |
| 株式の譲渡 · 取消 | 21 | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | | | | | | | | | |
| 株式ベースの報酬 | 23 | | | | — | | | — | | | 6,907 | | | — | | | — | | | 6,907 | | | | | | | | | | | |
| | | | — | | | 18 | | | — | | | 6,907 | | | — | | | — | | | 6,925 | | | | | | | | | | | |
| 2022年12月31日の残高 | | | $ | 10 | | | $ | 628,661 | | | $ | (180) | | | $ | 16,473 | | | $ | (7,628) | | | $ | (479,844) | | | $ | 157,492 | | | | | | | | | | | |
添付注記は、連結財務諸表の不可欠な部分です。
( 一 ) 当社グループは、本連結財務諸表の注記 2 に記載されているとおり、 2023 年 1 月 1 日付で提示通貨を人民元から米ドルに変更することを選択しました。2021 年 12 月期および 2022 年 12 月期連結株主 ( 赤字 ) / 自己資本の変動については、当社グループの記載通貨の変更を反映して再記載しています。
バイオファーマホールディングス株式会社コネクト
連結株主変動計算書 ( 赤字 ) / 自己資本
(In USD 数千 )
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 備考 | | 株本 | | 株式割増 | | 国庫株 | | 株式を基礎とする
補償する
埋蔵量 | | その他の保護区 | | 積算
損 | | 株主総数
( 赤字 ) / 株式 |
| | | 再発表i | | 再発表i | | 再発表i | | 再発表i | | 再発表i | | 再発表i | | 再発表i |
| | | | | | | | | | | | | | | |
| 2023年1月1日の残高 | | | $ | 10 | | | $ | 628,661 | | | $ | (180) | | | $ | 16,473 | | | $ | (7,628) | | | $ | (479,844) | | | $ | 157,492 | |
| 総合損失 | | | | | | | | | | | | | | | |
| 純損失 | | | — | | | — | | | — | | | — | | | — | | | (59,503) | | | (59,503) | |
| その他総合利益による債券の適正価額変動による未実現利益 | 18(a) | | — | | | — | | | — | | | — | | | 354 | | | — | | | 354 | |
| 為替差違 | | | — | | | — | | | — | | | — | | | (604) | | | — | | | (604) | |
| | | — | | | — | | | — | | | — | | | (250) | | | (59,503) | | | (59,753) | |
| 所有者との取引 | | | | | | | | | | | | | | | |
| 普通株発行は発行コストを差し引く | 20 | | — | | | 44 | | | — | | | — | | | — | | | — | | | 44 | |
| 株式オプションの行使 | 20 | | — | | | 2 | | | — | | | (1) | | | — | | | — | | | 1 | |
| 株式ベースの報酬 | 23 | | — | | | — | | | — | | | 3,259 | | | — | | | — | | | 3,259 | |
| | | — | | | 46 | | | — | | | 3,258 | | | — | | | — | | | 3,304 | |
| 2023年12月31日の残高 | | | $ | 10 | | | $ | 628,707 | | | $ | (180) | | | $ | 19,731 | | | $ | (7,878) | | | $ | (539,347) | | | $ | 101,043 | |
添付注記は、連結財務諸表の不可欠な部分です。
( 一 ) 当社グループは、本連結財務諸表の注記 2 に記載されているとおり、 2023 年 1 月 1 日付で提示通貨を人民元から米ドルに変更することを選択しました。2021 年 12 月期および 2022 年 12 月期連結株主 ( 赤字 ) / 自己資本の変動については、当社グループの記載通貨の変更を反映して再記載しています。
バイオファーマホールディングス株式会社コネクト
統合現金フロー表
(In USD 数千 )
| | | | | | | | | | | | | | | | | | | | | | | |
| 備考 | | 十二月三十一日までの年度 |
| | | 2021 | | 2022 | | 2023 |
| | | 再発表i | | 再発表i | | |
| | | | | | | |
| 経営活動のキャッシュフロー | | | | | | | |
| 運営に使われている現金 | 26(a) | | $ | (84,324) | | | $ | (101,520) | | | $ | (47,930) | |
| 経営活動のための現金純額 | | | (84,324) | | | (101,520) | | | (47,930) | |
| 投資活動によるキャッシュフロー | | | | | | | |
| 家屋·工場·設備を購入する | | | (3,834) | | | (4,405) | | | (294) | |
| 損益により公正な価値で金融資産を購入する | 18(b) | | (17,959) | | | (6,456) | | | (1,573) | |
| 他の総合収益で公正な価値で金融資産を購入する | 18(a) | | — | | | (109,608) | | | (31,028) | |
| 固定資産、無形資産及びその他の長期資産の処分による収益 | | | — | | | — | | | 2,943 | |
| 公正価値に応じて金融資産を損益処分することで得られる収益 | | | 20,076 | | | 6,478 | | | 1,578 | |
| その他総合利益による金融資産の適正価額満期による収益 | 18(a) | | — | | | 27,748 | | | 103,613 | |
| 投資運用手数料の支払 | | | — | | | — | | | (84) | |
| 使用権資産の支払 | 15(a) | | (3,442) | | | — | | | — | |
| 無形資産を購入する | | | (48) | | | — | | | — | |
| 純現金(投資活動用)/投資活動で発生 | | | (5,207) | | | (86,243) | | | 75,155 | |
| 融資活動によるキャッシュフロー | | | | | | | |
| オプション行使で得られた収益 | 23 | | 34 | | | 119 | | | — | |
| 普通株式を発行して得た金 | 20 | | 219,985 | | | 18 | | | 44 | |
| 賃借債務を支払う | 15(b) | | (126) | | | (222) | | | (290) | |
| 普通株買い戻しの支払い | 20 | | (566) | | | — | | | — | |
| 上場費用に関する支払い | 20 | | (17,107) | | | — | | | — | |
| 融資活動による現金純額 | | | 202,220 | | | (85) | | | (246) | |
| 現金と現金等価物の純増加/(減少) | | | 112,689 | | | (187,848) | | | 26,979 | |
| 年初現金および現金等価物 | | | 154,803 | | | 267,716 | | | 79,010 | |
| 現金および現金等価物に及ぼす為替レート変動の影響 | | | 224 | | | (858) | | | 18 | |
| 年末現金および現金等価物 | | | $ | 267,716 | | | $ | 79,010 | | | $ | 106,007 | |
添付注記は、連結財務諸表の不可欠な部分です。
( 一 ) 当社グループは、本連結財務諸表の注記 2 に記載されているとおり、 2023 年 1 月 1 日付で提示通貨を人民元から米ドルに変更することを選択しました。2021 年 12 月期および 2022 年 12 月期連結キャッシュ · フロー計算書は、当社グループの提示通貨の変更を反映して再提示しています。
バイオファーマホールディングス株式会社コネクト
連結財務諸表付記
1. 概要 · 組織再編 · プレゼンテーションの根拠
1.1一般的な情報
Connect Biopharma Holdings Limited ( 以下「当社」 ) は 2015 年 11 月 23 日はいケイマン諸島免除有限責任会社として当社の登記事務所の住所は P. O. Box 613 , Harbour Centre , George Town , Grand Cayman KY1 — 110 7 , Cayman Islands 。当社は 2021 年 3 月に新規株式公開 ( 「 IPO 」 ) を完了し、それ以来、当社の米国預託株式 ( 「 ADS 」 ) はナスダック · グローバル · マーケット ( 「ナスダック」 ) に上場しています。当社の各 ADS は 1つは普通株式、面額米ドル ( 「 USD 」 ) 0.000174一株ずつです。
当社およびその子会社 ( 総称して「当社グループ」 ) は、重篤な自己免疫疾患および炎症症の治療のための次世代免疫調節剤の発見と開発に焦点を当てた臨床段階の企業です。当グループは、 T 細胞調節の生物学に関するノウハウを活かし、炎症の重要な経路を標的とする低分子と抗体からなる医薬品候補のポートフォリオを構築しています。当社グループは現在、米国、中華人民共和国 ( 「 PRC 」 ) 、ヨーロッパ、およびその他の法域で、製品候補の臨床試験を実施しています。
2023 年 12 月 31 日現在、当社は以下の主要子会社に直接または間接の持分を有しています。
| | | | | | | | | | | | | | | | | | | | |
| 会社名 | | 主な活動 | | 設立の場所と日付 | | 持分帰属
グループへ |
| 直接開催 : | | | | | | |
| Connect Biopharma Hong Kong Limited ( 「 Connect HK 」 ) | | 投資持株 | | 香港.香港/2015 年 12 月 1 日 | | 100 | % |
| 間接保有 : | | | | | | |
| Connect Biopharm LLC ( 「 Connect US 」 ) | | 医薬品 R & D | | San Diego, アメリカ合衆国/2012 年 1 月 24 日 | | 100 | % |
| Connect Biopharma Australia PTY LTD ( 「 Connect AU 」 ) | | 医薬品 R & D | | プラハラン, オーストラリア/2014 年 7 月 18 日 | | 100 | % |
| 蘇州コネクトバイオファーマ Co. 、株式会社 ( 「コネクト SZ 」 ) | | 医薬品 R & D | | 中国蘇州/2012 年 5 月 2 日 | | 100 | % |
| 接続バイオファーマ ( 上海 ) Co. 、Ltd ( 「 Connect SH 」 ) | | 医薬品 R & D | | 上海, 中華人民共和国/2015 年 10 月 23 日 | | 100 | % |
| コネクトバイオファーマ ( 北京 ) Co. 、Ltd ( 「 Connect BJ 」 ) | | 医薬品 R & D | | 中国北京/2019 年 7 月 9 日 | | 100 | % |
| 接続 Biopharma ( シンセン ) Co. 、Ltd ( 「 Connect SHZ 」 ) | | 医薬品 R & D | | 中国深セン/2021 年 11 月 15 日 | | 100 | % |
2. 重要な会計方針の概要
これらの財務諸表を作成するために採用された主な会計政策は以下のとおりである。他の説明がない限り、このような政策は提出されたすべての年に適用されてきた。
2.1基礎の準備
当社グループの連結財務諸表は、国際会計基準審議会 ( 以下「 IASB 」 ) が発行する国際財務報告基準 ( 以下「 IFRS 会計基準」 ) に従って作成されています。ザ · グループ
2018 年 1 月 1 日に IASB が発行した IFRS 会計基準を採択し、移行しました。財務諸表は、損益を通じた公正価値の金融資産、その他の包括的利益を通じた公正価値の金融資産、優先権を有する金融商品の再評価により修正された歴史的原価慣習に基づいて作成されています。
当社グループは、 2023 年 1 月 1 日から始まる年次報告期間において、以下の基準および改正を初めて採用しました。
| | | | | | | | |
基準 | 主な要件 | 年間有効
当日かそれ以降から |
国際財務報告基準第17号 | 保険契約 | 2023年1月1日 |
“国際会計基準1”と“国際財務報告基準実務説明2”の修正 | 会計政策の開示 | 2023年1月1日 |
“国際会計基準”改正案第8号 | 会計見積もりの定義 | 2023年1月1日 |
“国際会計基準”改正案第12号 | 単一取引に起因する資産及び負債に関する繰延税 | 2023年1月1日 |
“国際会計基準”改正案第12号 | 国際税制改革の柱 2 モデルルール | 2023年1月1日 |
| | |
| | |
| | |
上記の基準及び修正は、前期に計上された金額に影響を及ぼさず、当期又は将来に著しい影響を及ぼす見込みはありません。
2021 年、 2022 年、 2023 年 12 月 31 日を末日とする連結財務諸表は、 2024 年 4 月 16 日に当社の取締役会 ( 以下「取締役会」といいます ) によって発行が承認されました。
流動性
創業以来、当社グループは累積米ドルの損失を計上しています。 539.3百万だ2023 年 12 月 31 日を末日とする会計年度の営業損失は米ドルでした。 62.1百万ドルと純営業現金がドルに流出します47.9百万ドルです。歴史的に見ると、資金の主な源は持分所有者の現金寄付だ。2023年12月31日までの累計入金は約ドルです440.1百万ドルが含まれています219.9初公募株に関する普通株で得られた百万ドルを発行する。2023年12月31日までのグループ純資産はドル101.0百万ドルは主に現金、現金等価物と他の総合収益ドルによる公正な価値による短期投資を含みます118.7百万ドルです。この点を考慮して、本グループは、少なくとも当該財務諸表の発行日から今後12ヶ月以内に、当グループは、その債務および運営資金需要に対応するために十分な利用可能な財務資源を有すると信じている。したがって,本グループは持続経営をもとに総合財務資料を作成することが適切であると考えられる。
2.2 列報貨幣の変動
当社は2023年1月1日からその列報通貨を人民元からドルに変更することを決定した。この変動は,本グループが評価したためであり,この変動は本グループの財務業績をより明確に理解し,同業者業績との比較性を向上させるのに役立つであろう。数字は2021年1月1日から再列報され、列報通貨が人民元からドルに変更された変化を反映している。列報通貨のこの変化は資産、負債、あるいは株式の推定値に影響を与えない
このような列報通貨の変化は、国際会計基準第8号にさかのぼって適用される会計政策の変化を構成している会計政策、会計見積もり変更、ミスこれらの連結財務諸表には、“国際会計基準”第21号に規定された要求適用手続が反映されることにより、為替レート変動の影響.
そこで、本グループが2018年1月1日以降に報告した財務情報は、以下に概説するプログラムを用いて再翻訳されました
•連結財務状況表は資産負債表の日の為替レートで換算された
•合併損失表、合併全面損失表、合併キャッシュフロー表はそれぞれの期間の平均レートに換算した
•歴史株式取引は取引当日の為替レートで換算され、その後歴史的価値に基づいて計算される
•列報通貨に換算した為替差額は、他の全面収益で確認された
•使用されたすべての外国為替レートは、そのグループの基本的な財務記録から抜粋された
2018年1月1日までに財務記録をコピーすることは不可能であるため、当社は2018年1月1日から列報通貨の変化を前向きに適用している。本グループは2018年1月1日までに機能通貨がドルの実体による純損失ではなく、各年度の相関平均レートでドルに換算した。純資産再換算による差額は他の全面収益で確認されています。
当社グループは、連結財務諸表に記載されている前期間の比較情報に加え、 IAS 1 に従い、記載通貨の変更により、 2022 年 1 月 1 日時点の連結貸借対照表を追加的に提示します。 財務諸表の発表。
2.3グループがまだ採用していない新しいおよび修正された基準および解釈
連結財務諸表において、発行済みでまだ効力を生じていない以下の新改訂 IFRS は適用していません。
| | | | | | | | |
基準 | 主な要件 | 年間有効
当日かそれ以降から |
“国際会計基準”改正案第1号 | 負債は流動負債または非流動負債に分類される | 2024年1月1日 |
“国際会計基準”改正案第1号 | チェーノの非流動負債 | 2024年1月1日 |
“国際財務報告基準”改正案第16号 | 販売レンタル中のレンタル責任 | 2024年1月1日 |
国際会計基準第7号及び国際財務報告準則第7号の修正 | 仕入先の財務手配 | 2024年1月1日 |
“国際会計基準”第21条改正案 | 互換性を欠く | 2025年1月1日 |
国際財務報告準則第10号及び国際会計基準第28号の修正 | 投資家とその共同経営企業又は合弁企業との間の資産売却又は出資 | 未定である |
| | |
| | |
| | |
これらの基準、更新、解釈が強制的になった場合、専門家グループはこれらの基準、更新、そして解釈を期待している。このような基準は、本グループの最初の適用期間および将来の報告期間の総合財務諸表によって開示される資料または報告された金額に大きな影響を与えないことが予想される。
2.4統合の原則
付属会社
子会社は本グループが支配権を持つすべてのエンティティである.本グループがあるエンティティに参加することによって可変リターンを得る権利がある場合、本グループはそのエンティティを制御し、そのエンティティ活動を指導する権力によってこのリターンに影響を与える能力がある。子会社は支配権が当グループに移管された日から全面的に合併する。それらは統制権が停止した日から合併を解除する。
グループ内部取引,グループ会社間取引の残高と未実現収益が打ち切られた.取引が資産減価の証拠を提供しない限り、実現されていない損失もログアウトされる。必要があれば、付属会社が届出した金額は、当グループの会計政策に適合するように調整されています。
2.5外貨換算
(a)本位貨幣と列報貨幣
当グループの総合財務諸表はドルで列報しています
本グループの各実体の財務諸表に掲載されている項目は、いずれも当該実体経営が置かれている主要な経済環境の通貨(“機能通貨”)で計量されている。会社の本位貨幣はドルです子会社は以下のビットコインを持っている
| | | | | |
| 機能通貨 |
| |
香港とアメリカを結ぶ | ドル |
SZ接続、SH接続、BJ接続、SHZ接続 | 人民元 |
AUを接続する | オーストラリアドル |
| |
| |
| |
(b)取引記録と残高
外貨取引使用取引日の為替レートは本位貨幣に換算されます。このような取引所による為替損益の決済や、年末為替レート換算で外貨建ての通貨資産や負債による為替損益は、一般に損益で確認される。
本グループには借入金がないため,すべての為替損益を他(損失)/損益純額で純額で総合損益表に列記した。
外貨公正価値で計量された非貨幣性項目は、公正価値が確定した日の為替レートによって換算される。公正価値台帳の資産と負債の換算差額を公正価値損益の一部として報告する。例えば、非金銭的資産および負債(例えば、損益によって公正価値で保有されている持分)の換算差異は、損益において他の(損失)/収益の一部として確認され、非金銭的資産(例えば、他の包括収益によって公正価値に分類された株式)の換算差異は、他の包括収益で確認される。
(c)グループ会社
機能通貨は、列報通貨とは異なる外国業務(1つの業務のない通貨は悪性インフレ経済に属する)の結果と財務状況を列報通貨に換算すると以下のようになる
•列報された各貸借対照表の資産および負債は、その貸借対照表の日付の終値で換算される
•各損失表と総合収益/(損失)表の収入と費用は平均レートで換算される(この平均値が取引日の現行為替レート累積影響の合理的な近似値でない限り、この場合、収入と費用は取引日の為替レートに換算される)
•これにより生じたすべての通貨換算差額は他の全面損益で確認される。
合併時には、外国実体のいずれかの純投資に換算することによる為替差額が他の全面収益で確認されている。海外業務を売却したり、純投資の一部を構成する任意の借金を返済したりする場合、関連為替差額は売却損益の一部として損益に再分類される。
2.6財産、工場、および設備
財産·工場·設備は歴史的コストから減価償却を引いて申告する.歴史的費用は購入プロジェクトに直接起因することができる支出を含む。
その後のコストは、プロジェクトに関連する将来の経済的利益が当グループに流れる可能性があり、プロジェクトのコストが確実に計量できる場合にのみ、資産の帳簿金額に計上されるか、または場合によっては単独資産として確認される。単独資産入金の任意の構成要素である帳票価値は、交換時にキャンセル確認される。他のすべてのメンテナンスと保守が報告期間中に発生した損益は利益または損失を計上する。
本グループの建設中資産は建設中および設置予定のビルおよび設備であり、コストから累積減価損失(あればある)を差し引いたものである。費用には建造と調達費用が含まれる。建設中の資産は完成して使用しようとする前に、減価償却準備をしない。資産が使用可能になると、適切な資産カテゴリに移行する。
減価償却は直線法を用いて計算され、推定された耐用年数内に残存価値を差し引くコストを分配したり、賃貸改善の場合には、短い賃貸期限を割り当てたりすると、以下のようになる
| | | | | | | | |
| 資産 | | 使用寿命 |
| 実験室装置 | | 5-10年.年 |
| 賃借権改善 | | レンタル期間が短いあるいは…5年.年 |
| 事務設備と家具 | | 3-5年.年 |
資産の残存価値と耐用年数は、各報告期間終了時に適切に審査·調整される。
資産の帳簿金額がその推定された回収可能金額より大きい場合、資産の帳簿金額は直ちにその回収可能金額に減額される(付記2.7)。
処分損益は,収益と帳簿金額を比較することで決定され,損失表中の他の収益/(損失)純額で確認される。
2.7非金融資産の減価準備
営業権以外の非金融資産や使用年数が不定な無形資産は、事件や状況変化が帳簿額面が回収できない可能性があることを示すたびに、減値テストを行う。減価損失は,資産の帳簿金額がその回収可能金額を超えていることを確認した。回収可能金額は,資産の公正価値から処分コストと使用価値を差し引いた高い者である。評価減額については、資産は、現金流入を独立して識別可能な最低レベルでグループ化されており、現金流入は、他の資産または資産グループ(現金生成単位)からの現金流入とは大きく独立している。減価が発生した営業権以外の非金融資産は、減値を打ち消す可能性があるかどうかを決定するために、各報告期間終了時に審査を行う。
2.8投資およびその他の金融資産
(a)分類する
本グループはその金融資産を以下の計測カテゴリに分類する
•その後、公正価値(他の包括収益(“保監所”)または損益によって計量される資産、および
•これらは余剰費用で計算されるだろう。
分類は、実体が金融資産を管理する業務モデルとキャッシュフローの契約条項に依存する。
公正価値に応じて計量された資産については,損益は損益または保監所に計上される。取引のために保有していない株式ツール投資に対して、本グループは初歩的な確認時に撤回できない選択を行い、公平な価値で保監所(“FVOCI”)を通じて株式投資を計上する。
そして、債務投資を管理する業務モデルが変化した場合にのみ、そのグループは債務投資を再分類する。
(b)再認識と再認識
通常の方法で金融資産を売買することは、取引日に確認され、すなわち、当グループが資産の購入または売却を承諾した日である。金融資産からキャッシュフローを受け取る権利が満了または譲渡され、当グループが実質的にすべての所有権を移転したリスクおよびリターンがある場合、金融資産は再確認されない。
(c)測定測定
初歩的な確認時に、本グループはその公正価値に基づいて金融資産を計量し、非公正価値計損益(“FVTPL”)に属する金融資産であれば、当該金融資産を買収することに直接帰属できる取引コストで計量する。FVTPL台帳に記載されている金融資産の取引コストは損益で計上されている。デリバティブを含む金融資産は、そのキャッシュフローが元本および利息の支払いにのみ使用されるかどうかを決定する際に全体的に考慮される。
(i)債務道具
債務ツールの後続計測は、本グループが資産を管理する業務モデルと資産のキャッシュフローの特徴に依存する。本グループはその債務ツールを3つの計測カテゴリに分類している
•余剰コスト:契約キャッシュフローを収集するために持っている資産であり、その中でこれらのキャッシュフローは元金と利息の支払いのみを代表し、分担コストによって計量する。これらの金融資産の利子収入は有効金利法を用いて金融収入に計上されている。キャンセル確認によるいずれの損益も直接損益で確認し,他の損益では為替損益とともに列記する。減価損失は損失表に単独の項目として示す.
•FVOCI:契約キャッシュフローの収集と金融資産の売却のための資産であり,そのうちの資産のキャッシュフローは元金と利息の支払いのみを表し,FVOCIで計測される.損益で確認された減値損益,利息収入および為替損益を除いて,帳簿金額の変動は保監所に計上されている。金融資産が再確認されていない場合には、先に保監所で確認された累積収益または損失が権益から損益に再分類され、他の収益/(損失)で確認される。これらの金融資産の利子収入は有効金利法を用いて金融収入に計上されている。為替損益は他の損益に列報し,減価費用は損益表に単独で計上した。
•FVTPL:償却コストやFVOCI基準を満たしていない資産はFVTPLで計測される.その後FVTPLで計測した債務投資の損益を損益で確認し,発生期間中の他の損益に純額を列記した。
(Ii)持分道具
本グループはその後、公正価値に基づいてすべての株式投資を計量する。もし本グループの管理層がすでに保監所の株式投資の公正価値損益を報告することを選択した場合、この投資を終了して確認した後、公正価値損益を損益に再分類しなかった。本グループが金銭を受け取る権利を確立した場合、当該等投資からの配当は引き続き損益で他の収入として確認される。
FVTPL金融資産公正価値の変動は損益表の他の収益/(損失)で確認された。FVOCIで計測された持分投資の減価損失(と減値損失のフラッシング)は,公正価値の他の変化とは別に報告されていない。
いくつありますか違います。報告期間内の株式投資。
(d)減損する
本グループは展望性方式でその分担コスト及びFVOCI値による債務ツールに関連する期待信用損失を評価した。採用されている減価方法は信用リスクが大幅に増加しているかどうかに依存するが,詳細は付記3.1(B)を参照されたい。
2.9現金と現金同等物
現金流動量表のリストによると、現金及び現金等価物は、手元現金、金融機関で随時保有する預金、最初の満期日が3ヶ月以下の他の短期高流動性投資を含み、随時既知額の現金に変換することができ、価値変動の軽微なリスクの影響を受ける。
2.10株式ベースの報酬
本グループは株式決済の株式報酬計画を実行し、この計画に基づき、当グループは従業員、取締役及びコンサルタントから提供されるサービスを受ける。コンサルタントが本グループに提供する仕事は従業員と同様に本グループが指導し,コンサルタントが提供するサービスは本グループの従業員が提供するサービスと同等である.
株式インセンティブ計画により付与されたオプションの公正価値は、従業員福祉支出として確認され、それに応じて配当金が増加する。支出の総金額を付与されたオプションの公正価値を参照して決定される:
•実体の株価のような市場表現状況を含む
•任意のサービスおよび非市場業績帰属条件の影響(例えば、収益性、販売増加目標、および特定の期間内にそのエンティティの従業員)を排除すること;
•任意の非帰属条件の影響(例えば、従業員に特定の期間内に株式を保存または保有することが要求される)を含む。
総費用は、帰属期間内に確認され、ホーム期間は、すべての指定されたホーム条件を満たす期間である。各期間が終了すると、本グループは、非市場帰属およびサービス条件に基づいて、予期される帰属オプション数の推定値を修正する。本グループは元の推定(あれば)の損益への影響を確認し、権益に対して相応の調整を行う。
2.11お客様との契約の収入
(a)収入確認
本グループは研究開発、製造及び商業化活動について取引相手と協力と許可手配を締結し、その候補製品を開発し、商業化することができる。これらの構成は、(I)ライセンスおよび(Ii)研究および開発活動のような複数の構成要素を含むことができる。これらの手配に基づいて支払われるお金には、払戻不可能な金額、重大な規制、開発および商業マイルストーンを達成する際の支払い、特定の合意金額で製品を販売すること、および製品販売の特許使用料が含まれる場合があります。
当グループは国際財務報告基準第15号を適用している取引先と契約した収入その範囲内の収入取引まで。国際財務報告基準第15号によると、当グループは、顧客又は所有者が約束された商品又はサービスに対する制御権を取得したときに収入を確認する。専門家グループが記録した収入額は、その予想がこのような貨物やサービスと交換されることを反映している。本グループは以下の5つのステップを採用して、この金額を決定する:(I)顧客と締結した契約(S)、(Ii)契約内の契約履行責任を決定する;(Iii)可変代価の制限を含む取引価格の計量を決定する;(Iv)取引価格を契約履行責任に分配する;(V)本グループが各履行責任を履行する時に収入を確認する
グループが顧客に譲渡された貨物またはサービスと交換するために獲得する権利のある対価格を受け取る可能性が高い場合、グループは、これら5つのステップを契約に適用する。契約が契約開始時にIFRS 15の範囲に属すると決定されると、本グループは、どの履行義務を履行しなければならないか、およびこれらの履行義務のうちどれが異なるかを決定するために契約を審査する。本グループは,個々の履行義務またはその履行義務を履行する際にその履行義務に割り当てられた取引価格金額が収入であることを確認している.
(b)契約資産
契約資産は、顧客に譲渡された貨物またはサービスを対価格する権利である。本グループが顧客が対価または満期支払いを支払う前に商品またはサービスを顧客に譲渡する場合、各報告期間内に、契約資産は条件付き利益コストで確認され、減値が評価される。
(c)契約責任
本グループが関連商品またはサービスを譲渡する前に顧客の支払いを受信した場合、すなわち契約責任を確認する。本グループが契約項下の履行義務を完了した場合、契約負債は収入であることを確認する。
2.12研究開発費
このグループは研究や開発活動にコストと努力を生み出している。研究費は費用が発生している間は費用と記入します。研究開発費には,(1)本グループが開発している技術の臨床前試験や臨床試験に関する費用,例えば臨床研究を行う契約研究機関(“CRO”)調査員や臨床試験地点に支払われる費用,(2)臨床試験設計やデータ分析に関するコンサルタントサービス,(3)研究·開発活動に従事する者の給与やその他の関連費用,(4)契約製造機関(“CMO”)生産候補製品の製造費用,原材料,供給品,薬物物質,薬品費用,および(5)その他の研究開発費が含まれる。
本グループは,それを代表して当該等のサービスを行うサプライヤーと締結した契約に基づき,提供されたサービスに基づいて臨床前研究,臨床研究,製造費用を試算する。専門家グループは,内部管理者や外部サービス提供者とサービスの進捗や完了段階およびこれらのサービスに支払う契約費用について検討し,これらの費用を推定した.サービス表現の実時間や作業レベルが元の予想と異なる場合,本グループは対応する項目を調整する.関連サービスのために前払いされた金は、総合貸借対照表にサービスを提供するまで前払いと記載されている。
開発コストが新たに開発されたサービスまたは製品に直接起因し、以下のすべての基準を満たすか、または存在する場合、開発コストは資産として確認される
•開発プロジェクトを完成させ、使用または販売できるようにする技術的実行可能性
•開発プロジェクトを完成させたり製品を使用したりする意向
•製品を使用したり販売する能力
•開発プロジェクトがどのような方法で集団に可能な未来の経済的利益をもたらすのか
•開発プロジェクトを完成させ、製品を使用または販売するのに十分な技術、財政、および他の資源がある
•資産の開発過程における支出は確実に計量することができる。
研究·開発費は,上記のすべての基準に達していないため,列報のすべての期間の発生費用に計上されている。
2.13利息収入
FVTPL金融資産の利子収入は当該等資産の投資収益又は損失に計上される(付記9参照)。利息収入は金融資産の帳簿総額に実金利を適用することで計算されるが、その後信用減値が発生した金融資産は除外される。信用減額金融資産については、実際の金利は金融資産の帳簿純資産(損失計上後を差し引く)に適用される。
2.14政府支出
適切な保証があれば贈与を受け、本グループがすべての規定の条件を遵守することが予想される場合、政府からの贈与はその公正価値で確認される。コストの前に受け取った政府補助金
発生した費用は関連費用が確認されるまで延期されるだろう。本グループの資産コストを補償する贈与金は、最初に繰延収入として列報され、関連資産の耐用年数内に直線法で総合損益表で収入として確認された。
3. 金融商品とリスク管理
3.1財務的リスク要因
本グループの活動は、市場リスク(金利リスクと為替リスクを含む)、信用リスク、流動性リスクの様々な金融リスクに直面させる。グループ全体のリスク管理計画は金融市場の予測不可能性に重点を置き、グループの財務業績への潜在的な悪影響を最小限に抑えることを求めている。リスク管理は当グループの上級管理職が担当しています。
(a)市場リスク
(i)金利リスク
本グループの金利リスクは、主に投資信託商品への投資、他の全面収益により公正価値で計量された投資、損益によって公正価値に応じて計量された投資(付記18)と現金(付記19)に由来する。変動金利値の金利で自グループをキャッシュフロー金利リスクに直面させ、固定金利値での金利は自グループを公正価値金利リスクに直面させる。当グループは現在、当グループに金利変動リスクを負わせる債務や他の借款手配を持っていない
(Ii)為替リスク
グループ経営は国際化し、外貨リスクに直面しており、主に人民元の対ドルレートである。為替リスクは、将来の商業取引および非関連グループの実体機能通貨での通貨建ての確認された資産および負債から来る本グループの報告期間末における外貨リスクの開放は以下の通りである
| | | | | | | | | | | |
| 12月31日まで |
(単位:千) | 2022 | | 2023 |
| | | |
| 現金と現金等価物 | $ | 472 | | | $ | 806 | |
損益で確認された純為替(損失)/収益総額は:
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2021 | | 2022 | | 2023 |
| | | | | |
| 純為替(損失)/その他(損失)に含まれる収益/収益-純額 | $ | (516) | | | $ | 1,469 | | | $ | 367 | |
人民元機能通貨を持つ子会社については、ほとんどの外国為替取引はドル建てである。2021年、2021年、2022年、2023年12月31日までの年度は、ドルが強ければ/弱くなる5他のすべての変数が不変のままである場合,当時終了した年度の純損失はドルとなる0.5百万ドル高/低0.4百万ドル以下/もっと高いとドル0.7それぞれ低い/高い百万である.
(b)信用リスク
信用リスクは主に現金と現金等価物、公正価値によって損益に計上された金融資産、公正価値によって他の全面収益に計上された金融資産及びその他の売掛金から来る。信用リスクに対する最大の開口は貸借対照表の各金融資産の帳簿価値で表される。
現金及び現金等価物、公正価値に基づいて損益を計上する金融資産及び公正価値で他の全面収益を計上する金融資産の信用リスクは限られており、取引相手はケイマン諸島、米国、中国及び豪州に位置する信用の良い商業機関であるからである。また、銀行機関の預金口座には、各国のこのような口座に対する保険限度額を超える信用リスクが存在する可能性がある。
その他の売掛金については、管理層は過去の決済記録及び過去の経験に基づいて定期的及び個別に売掛金の回収可能性を評価し、債務者の売掛金返済能力に影響するマクロ経済要素に基づいて展望性資料を調整する。
本グループは予想信用損失モデルを償却コストで計量した金融資産に適用した。その他の売掛金の減価は12ケ月の予想信用損失或いは生涯予想信用損失の計量に従って、初期確認以来信用リスクが大幅に増加するかどうかに依存する。信用リスクが大幅に増加するかどうかを評価するため、本グループは現有、合理及び支持性の展望性資料を考慮することを通じて、報告日までの資産違約リスクと初期確認日までの違約リスクを比較した。
(c)流動性リスク
本グループの目標は、満期直前の債務および運営·資本要求に対応するために十分な現金を維持することです。
以下の表は、各年末期日から契約満期日までの残り期間に基づいて、本グループの財務負債を関連満期日別にグループ分けして分析する。表に開示されている金額は契約未割引現金流量です。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2022年12月31日まで |
| (単位:千) | 少ないです
1年 | | 中間にある
1和
2年 | | 中間にある
2と
5年間 | | 更に
比
5年間 | | 合計する |
| | | | | | | | | |
| 貿易応払い | $ | 11,937 | | | $ | — | | | $ | — | | | $ | — | | | $ | 11,937 | |
| その他の支払い | 1,353 | | | — | | | — | | | — | | | 1,353 | |
| 賃貸負債 | 225 | | | 203 | | | 34 | | | | | 462 | |
| 合計する | $ | 13,515 | | | $ | 203 | | | $ | 34 | | | $ | — | | | $ | 13,752 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2023年12月31日まで |
(単位:千) | 少ないです
1年 | | 中間にある
1和
2年 | | 中間にある
2と
5年間 | | 更に
比
5年間 | | 合計する |
| | | | | | | | | |
| 貿易応払い | $ | 7,660 | | | $ | — | | | $ | — | | | $ | — | | | $ | 7,660 | |
| その他の支払い | 1,083 | | | — | | | — | | | — | | | 1,083 | |
| | | | | | | | | |
| 賃貸負債 | 301 | | | 160 | | | 25 | | | | | 486 | |
| 合計する | $ | 9,044 | | | $ | 160 | | | $ | 25 | | | $ | — | | | $ | 9,229 | |
3.2キャピタルマネージメント
当社グループの資本運用上の目的は、株主へのリターン及びその他のステークホルダーへの利益を提供するために、当社グループの継続能力を確保し、資本コストを削減するための最適な資本構造を維持することです。
当社グループは、資本構造や資本市場全体を定期的に見直し、資本をモニタリングしています。当社グループは、十分な資源を維持するために、当社グループが満足できる条件で追加的な資金調達または債務を求めることができます。
2022 年 12 月 31 日、 2023 年 12 月 31 日現在、当社グループは 違います。未払い債務
3.3公正価値の推定
以下の表は、 2023 年 12 月 31 日時点の当社グループの金融商品を適正価額で計上し、適正価額の測定に使用される評価手法へのインプットのレベル別に分析しています。このような評価インプットは、公正価値の階層内で以下の 3 つのレベルに分類されます。
(i)同じ資産または負債のアクティブ市場におけるクォート価格 ( 調整なし ) ( レベル 1 ) 。
(Ii)資産または負債に対して直接 ( 価格として ) または間接 ( 価格から派生したもの ) で観察可能な、レベル 1 に含まれる見積価格以外のインプット ( レベル 2 ) 。
(Iii)観測可能な市場データに基づいていない資産または負債の入力 ( 観測できない入力 ) ( レベル 3 ) 。
| | | | | | | | | | | | | | | | | | | | | | | |
| 2022年12月31日まで |
*(単位:千) | レベル1 | | レベル2 | | レベル3 | | 合計する |
| | | | | | | |
| 資産 | | | | | | | |
| 現金等価物 | $ | 18,368 | | | $ | — | | | $ | — | | | $ | 18,368 | |
| 他の総合収益で公正な価値で計算される金融資産 | 40,668 | | | 42,179 | | | — | | | 82,847 | |
| 総資産 | $ | 59,036 | | | $ | 42,179 | | | — | | | $ | 101,215 | |
| | | | | | | | | | | | | | | | | | | | | | | |
| 2023年12月31日まで |
*(単位:千) | レベル1 | | レベル2 | | レベル3 | | 合計する |
| | | | | | | |
| 資産 | | | | | | | |
| 現金等価物 | $ | 78,317 | | | $ | — | | | $ | — | | | $ | 78,317 | |
| 他の総合収益で公正な価値で計算される金融資産 | 1,750 | | | 10,896 | | | — | | | 12,646 | |
| 総資産 | $ | 80,067 | | | $ | 10,896 | | | $ | — | | | $ | 90,963 | |
この間,レベル1,2,レベル3の間には何の遷移もなかった.
レベル1の金融商品
第1レベルの金融商品の公正価値が確認されたことは、市場で計量日に取得可能な同じ資産または負債の見積によってサポートされる
第2級の金融商品
第2レベルの金融商品の公正価値は、観察可能な市場データを最大限に利用し、特定のエンティティの測定基準に可能な限り依存する推定技術によって決定されることが確認された。これらの金融商品については、公正な価値投入として必要なすべての重大な投入が観察される。
第3級金融商品
1つまたは複数の重大な投入が観察可能な市場データに基づいていない場合、そのツールは、第3のレベルに計上される。本グループの資産および負債内の第3のツールには、公正な価値に応じて損益を通して計量された投資信託商品の短期投資と、優先権を有する金融商品とが含まれる。
金融商品の価値を評価するための具体的な推定方法は、
•類似ツールの市場見積もりまたは取引業者の見積もり
•取引日に増加した購入価格と満期日額面との比較、およびその後の類似取引との価格比較
•観察可能と観察不可能な入力の組み合わせは、期待収益率、無リスク収益率、予想変動率、市場の割引率(DLOM)、債券条項と条件、現在の業績データなどを含む。
公正価値に応じて損益を計上する金融資産と、公正価値に応じて他の全面収益を計上する金融資産はそれぞれ1、2と3級に分類される(付記18参照)。
4. 重要な会計見積もりと判断
財務諸表の作成には会計見積もり数を用いる必要があるが、定義により、見積もり数は実際の結果と一致しない可能性がある。経営陣は本グループの会計政策を適用する際にも判断しなければならない。推定と判断は絶えず評価されている。それらは、本グループに財務的影響を与える可能性のある未来のイベントの予想、および当時の場合には合理的であると考えられる歴史的経験および他の要因に基づいている。
(a)研究開発費
研究費は費用が発生している間は費用と記入します。本グループは,本グループを代表してこれなどのサービスを行う研究機関,CROおよびCMOと締結した契約に基づき,提供されたサービスから臨床前研究,臨床研究および製造費用を見積もる。専門家グループは,内部管理者や外部サービス提供者とサービスの進捗や完了段階,およびこれらのサービスに支払われる契約費用についての検討や確認に基づいて,これらの費用を見積もる.関連サービスのために前払いされた金は、総合貸借対照表にサービスを提供するまで前払いと記載されている
研究·開発費用は、列報のすべての期間に発生した費用に計上されており、これらの支出は開発プロジェクトを完成させる技術的可能性に達していないため、使用または販売が可能であり、将来的には他の用途はない
(b)収入確認
本グループは研究開発、製造及び商業化活動について取引相手と協力と許可手配を締結し、その候補製品を開発し、商業化することができる。これらの構成は、(I)ライセンスおよび(Ii)研究および開発活動のような複数の構成要素を含むことができる。これらの手配に基づいて支払われるお金には、払戻不可能な金額、重大な規制、開発および商業マイルストーンを達成する際の支払い、特定の合意金額で製品を販売すること、および製品販売の特許使用料が含まれる場合があります。
“国際財務報告基準”第15号の適用は、重大な判断と推定を行う必要があり、(1)履行義務の決定、(2)可変対価格推定を含む取引価格の決定、(3)推定販売価格の決定、可変対価格を1つ以上の履行義務に割り当てることを含む、すべての履行義務ではない、および(4)適用割合履行を含む収入確認の時間およびパターン、サービスに関する承諾進展の測定基準として、供給に関する承諾適用時点確認を含む
重大な判断が必要である:(1)合意内のどの約束が契約範囲内で異なるかを決定する。例えば、ライセンスが他の約束とバンドルされている場合、吾らは、バンドルされた約束が統合されるべきか単独の義務を履行すべきかを評価するために使用され、(Ii)可変対価格の制約および可変対価格の推定方法を含む取引価格を推定する方法は、どの方法が当グループが獲得する権利があると予想される対価格金額を予測するかに依存する。トリガイベントが発生する前に、規制部門の承認を受けた支払いに依存するような、私たちまたは許可者の制御範囲内ではないマイルストーン支払いは、実現されない可能性が高いと考えられる。各報告期間の終了時に、各マイルストーンの実現確率と任意の関連制限を再評価し、必要に応じて全体の取引価格の推定を調整する。1つの手配に必要な努力の程度を決定し、1つの手配の下で義務履行の期限を達成することを期待する際には、重大な管理判断を行う必要がある。
(c)株式に基づく報酬費用の確認
株式決済の株式ベースの報酬オプションは従業員とコンサルタントに付与される。本グループは従業員の株式購入及び従業員の株購入計画に対してそれぞれ二項オプション定価モデル及びBlack-Scholesオプション定価モデルを採用し、オプション付与の総公正価値を決定し、そして帰属期間に列支する。経営陣は対象株式の公正価値、無リスク金利、予想変動率、配当収益率などの仮定を重大に推定しなければならない。
管理職が株式給与の公正価値を決定する際に採用されている主な仮定および見積もりの詳細については、付記23を参照されたい。
5. 収入確認
2023年11月21日(“発効日”)に、本グループはその2社の完全子会社付属会社Connect HK及びConnect SZ(“許可側”と略称する)とSimcere製薬グループ有限会社(以下“Simcere Pharmtics Group Ltd.”或いは“Simcere”)と独占許可及び協力協定(“ライセンス契約”)を締結し、コン乃徳生物の大区中国におけるrademikibartを開発することを発表した
許可側は、大中華区(中国大陸部、香港、マカオ、台湾を含む)におけるすべての適応の独占的な開発、製造、商業化の権利を付与されており、ライセンサー側は他のすべての市場に保持されている権利を有している。ライセンス契約により,ライセンス側はレドミキバートが領土内で行っているすべてのアトピー性皮膚炎(“AD”)の臨床試験と関連分析を完了し,ライセンサー側はレドミキバートの中国でのAD治療の新薬申請を担当し,大中国地域で行われ,レドミキバートのすべての他の疾患適応のすべての将来の臨床研究の費用を担当する
ライセンス契約には、前払い許可料、研究および開発コストの精算、および協力目標およびマイルストーンの実現状況に基づくもの、または対価格支払いが含まれる。ライセンス契約の条項によると,許可者は受け取ることになる1502000万元(約ドル)21(百万)前金で最高8752000万元(約ドル)123いくつかの開発とビジネスマイルストーンを実現した後、印税を除いて、最高純売上高の2桁の数百ポイントに達する。また,ライセンス契約の条項に基づいて,ライセンス側は獲得する302000万元(約ドル)4行っているAD臨床試験の開発活動の費用補償。2023年12月31日までに1001000万元、付加価値税は減税します5.62000万元(約ドル)13.3(百万)の前金が受け取りましたが、残りは501000万元、付加価値税は減税します2.82000万元(約ドル)6.72024年第1四半期に受け取りました)
Simcereライセンス契約
専門家グループの結論は、許可協定は国際財務報告基準第15号の範囲に属するということだ。
国際財務報告基準第15号によると、専門家グループは、ライセンス契約において被許可者に約束された貨物又はサービスが単独であるか合併の履行義務であるかを評価する。本グループは、貨物またはサービスが異なることを前提として、契約によって約束された貨物またはサービスから、契約下の重大な履行義務として決定されるか、または実質的に同じであり、同じ移行パターンを有する一連の異なる貨物またはサービス(すなわち、一連の各異なる貨物またはサービスが時間の経過とともに満たされ、同じ方法を使用して進行を測定する)と決定される。本グループは、ライセンスプロトコルにおける以下の商品またはサービスが単独の重大な履行義務を表すことを決定しました
1.知的財産権(“IP”)許可を付与する
2.進行中の実験を継続して完成させるために開発サービスを履行する
契約条項
ライセンス契約の期限は,販売による使用料を支払う期限と同じであり,約12許可された化合物が商業化されて数年後に。この期間の後、ライセンスは全額支払いとみなされ、Simcereは領土上でライセンス内の権利を利用し続けることができる。
成約価格
発効日に、当グループは取引価格を設定します1802000万元(約ドル)25(I)を含む1,000,000,000ドル)1502000万元(約ドル)21(1,000,000)許可者へのライセンスの前払い;および(Ii)302000万元(約ドル)4いくつかの臨床試験報告書を交付する際の費用は精算される
本グループはこの手配の下での将来の発展と監督管理マイルストーンの支払いを考慮して、このような可変対価格に加入するだけで、未来期間の累計収入が大幅に逆転する可能性があり、発効日および2023年12月31日までは制限されており、このようなマイルストーンは本グループの制御範囲内ではないからである
引受製品の年間売上高が指定水準に達し、販売が発生した場合は、販売に基づくマイルストーン支払い及び印税を支払わなければならない。知的財産権許可が手配中の主な承諾と決定された場合、販売に基づくマイルストーン支払いおよび特許権使用料は、関連履行義務が履行されたか、または販売が発生したときに遅く確認される
出来高払いの分配
取引価格は,一般に,異なる履行責任の相対独立販売価格(“SSP”)ごとに確認された履行責任を割り当てる.しかし、本グループは、いくつかの規制および発展マイルストーン支払いのみをいくつかの特定の履行義務(S)に分配し、当該等支払いの条項は、具体的には、当グループがそれぞれの履行義務を履行する努力に関連しており、この等分配は、当該等履行義務の履行と引き換えに、本グループが獲得する権利があることを反映するために、各履行義務に取引価格を割り当てる目標に適合しなければならない。
識別する
本グループでは,評価財やサービス制御権がいつカード所有者に移行するかを判断し,履行責任が一定時間またはある時点で履行されているかどうかを決定し,収入を確認するために進捗を測定する適切な方法を利用する.一定期間の収入を確認する際には,本グループは報告期間ごとの進捗指標を評価し,必要に応じて業績と関連収入確認の進捗を調整する。
当グループでは以下の取引価格を確認する予定です1802000万元(約ドル)25(百万ドル)、ある時点または上記各義務履行の期待履行期間内である違います。収入は2023年12月31日までの年度内に確認された。本グループは,当社がSimcereへの知的財産権およびノウハウの実質的な譲渡を完了した後,本ライセンス契約の収入の確認を開始することを期待している.
契約資産
2023年12月31日までに違います。貸し切り契約に基づいて資産契約を結ぶ。
契約責任
2023年12月31日現在、当グループは受け取った前払い費用に対して契約責任があります1001000万元、付加価値税は減税します5.62000万元(約ドル)13.3(億ドル)。
6. 性質別に列挙した費用
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2021 | | 2022 | | 2023 |
| | | | | |
| 臨床試験関連費用 | $ | 66,005 | | | $ | 81,586 | | | $ | 40,616 | |
| 給付費 ( 注 7 ) | 18,669 | | | 21,573 | | | 15,438 | |
専門サービス料i | 10,787 | | | 10,314 | | | 7,545 | |
| 研究開発資材 · 消耗品 | 2,131 | | | 1,178 | | | 527 | |
| 減価償却および償却 | 634 | | | 1,031 | | | 988 | |
| 事務費 | 567 | | | 745 | | | 716 | |
| 他の人は | 717 | | | 1,009 | | | 598 | |
| | $ | 99,510 | | | $ | 117,436 | | | $ | 66,428 | |
( 一 ) 当社グループは、 CBP — 174 を第三者のライセンサーから独占的にライセンス供与しています。このようなライセンスは全世界でロイヤルティ付きです。2023 年 12 月 31 日現在、 CBP—174 はまだ商業化されておらず、当社は払い戻し不可、信用不可のライセンス維持料のみを支払っており、これは第三者ライセンサーに毎年支払われ、研究開発費用の中にコンサルタント料として計上されます。
本ライセンス契約に基づき、当社グループは、第三者のライセンサーに 60 日前までに書面による通知を提出することにより、理由なくライセンス契約を終了する権利を有します。当社グループは、 2024 年 3 月現在、第三者ライセンサーに対して、理由なくライセンス契約契約を解除する通知を送付しており、当該通知の日から 60 日後に効力を生じます。このような終了から重大な義務は生じない。
7. 従業員福祉支出
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2021 | | 2022 | | 2023 |
| | | | | |
| 株式報酬費 ( 注 23 ) | $ | 8,986 | | | $ | 6,907 | | | $ | 3,259 | |
| 給料と給料とボーナス | 8,451 | | | 12,593 | | | 10,409 | |
| 福祉費 | 1,022 | | | 1,823 | | | 1,559 | |
| 住宅基金 | 210 | | | 250 | | | 211 | |
| | $ | 18,669 | | | $ | 21,573 | | | $ | 15,438 | |
連結損益計算書では、以下の項目に福利厚生費用を計上しています。
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2021 | | 2022 | | 2023 |
| | | | | |
| 研究開発費 | $ | 10,598 | | | $ | 12,015 | | | $ | 8,177 | |
| 行政費 | 8,071 | | | 9,558 | | | 7,261 | |
| | $ | 18,669 | | | $ | 21,573 | | | $ | 15,438 | |
8. その他の収入
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2021 | | 2022 | | 2023 |
| | | | | |
政府支出i | $ | 2,950 | | | $ | 929 | | | $ | 1,580 | |
( 一 ) 政府助成金は、主に、中国で発生した特定のマイルストーンや運営費に基づく中華人民共和国政府からの現金インセンティブと、オーストラリアで臨床研究開発活動を行うためのオーストラリア政府からの税制インセンティブに関連しています。2021 年には、グループが USD の 1 回限りの賞を受賞しました。 1.7 IPO 上場の成功に 100 万ドルを支払いその他の補助金も 1.0 中国地方政府と米ドルから 100 万ドル 0.3 オーストラリア政府から研究開発活動へのインセンティブとして 100 万ドル2022 年、グループは米ドルの補助金を受けました。 0.9中国地方政府から 100 万ドルです2023 年、グループは米ドルの補助金を受けました。 0.7中国地方政府と米ドルから 100 万ドル 0.9 オーストラリア政府から研究開発活動へのインセンティブとして 100 万ドル
9. その他 ( 損失 ) / 純利益
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2021 | | 2022 | | 2023 |
| | | | | |
| 為替換算純損益 | $ | (516) | | | $ | 1,469 | | | $ | 367 | |
損益を通じた適正価額による投資による投資収益i | — | | | 248 | | | 2,503 | |
| ウェルスマネジメント商品からの投資収益 | 68 | | | 22 | | | 5 | |
その他(損失)/収益II | (1,099) | | | 150 | | | (101) | |
| | $ | (1,547) | | | $ | 1,889 | | | $ | 2,774 | |
(i)損益を通じた適正価額での投資による投資利益は、現金同等物に含まれる短期投資による投資利益である ( 注釈 3.3 、 18 ( b ) 参照 ) 。
(Ii)グループは米ドルの損失を被りました 1.12021 年 5 月に発生したフィッシング事件により、当社グループが当社グループのベンダーの 1 つではなく、フィッシャーが設定した口座に送金した。企業データの紛失や第三者情報の紛失や侵害は発見されていません。2022 年 12 月期に保険金請求を行い、米ドルを回収しました。 0.2サイバー保険会社から 100 万ドルです
10. ファイナンス純利益
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2021 | | 2022 | | 2023 |
| | | | | |
| 財政収入 | | | | | |
| 銀行預金、定期預金、その他の利子 | $ | 97 | | | $ | 192 | | | $ | 684 | |
| その他総合利益を通じた適正価額投資による利子収入 | — | | | 1,352 | | | 2,030 | |
| 97 | | | 1,544 | | | 2,714 | |
| 融資コスト | | | | | |
| リース負債の利子 | (7) | | | (21) | | | (23) | |
| (7) | | | (21) | | | (23) | |
| 財務収入--純額 | $ | 90 | | | $ | 1,523 | | | $ | 2,691 | |
11. 所得税
所得税費用は、当社グループが事業を展開する以下の主要税務管轄区域の所得税率に基づいて認識しています。
(a)ケイマン諸島
当社は、ケイマン諸島会社法に基づく免除有限責任会社としてケイマン諸島で設立されており、したがってケイマン諸島の所得税は免除されています。
(b)香港.香港
香港の所得税率は 16.52018 年 4 月 1 日の二段法所得税制度の施行時点での税率は 8.25最初の HK $の評価可能な利益の% 2百万ドルと16.5超過の評価可能な利益の% 。 違います。香港の利益税は、あるように提供された。 違います。2021 年、 2022 年、または 2023 年 12 月 31 日を末日とする会計年度における香港利益税の対象となる推定評価利益。
(c)アメリカです
Connect US は米国で組織されており、米国の所得税目的では無視される単一会員有限責任会社です。米国税務の観点から、 2021 年、 2022 年、 2023 年 12 月 31 日を末日とする年度は、 Connect HK は米国連邦法人所得税の税率で課税されます。 21カリフォルニア州の州所得税は、 8.84Connect US に配分可能な収入の範囲の% 。2021 年、 2022 年、 2023 年 12 月 31 日を末日とする年度の所得税引当金は米ドルです。 0.3百万ドル0.3百万ドルと0.1それぞれ100万ドルです
(d)オーストラリア
Connect AU はオーストラリアで法人化。オーストラリアに登録された企業は、関連するオーストラリア税法に従って調整されたそれぞれの法定財務諸表に報告された課税所得に対してオーストラリアの利益税の対象となります。オーストラリアの税率は 30%. Connect AU has 違います。したがって,列報のすべての期間の課税所得額違います。所得税の規定が設けられました
(e)中華人民共和国
中華人民共和国法人所得税の引当金は、法定所得税率に基づいて計算されます。 252021 年、 2022 年、 2023 年 12 月 31 日を末日とする年度の各中華人民共和国の法人の評価所得に対する割合は、関連する中華人民共和国の法人所得税規則に基づき、
違います。中華人民共和国の法人所得税引当金は、当社グループが以前と同様に、 2021 年、 2022 年、 2023 年 12 月 31 日を末日とする年度の引当金です。 違います。その年の課税利益は終了しました
当社グループの実際の課税額と、中華人民共和国の法定所得税率 25% に基づいて算出した金額の調整は以下の通りです。
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2021 | | 2022 | | 2023 |
| | | | | |
| 中華人民共和国における事業損失 | $ | (35,420) | | | $ | (41,445) | | | $ | (27,321) | |
| 海外法人による損失 | (166,580) | | | (76,348) | | | (32,062) | |
| 所得税前損失 | (202,000) | | | (117,793) | | | (59,383) | |
| 中華人民共和国の企業所得税率 25% での税金費用 | (50,714) | | | (28,538) | | | (14,846) | |
| 所得税控除不可の費用 | 2,124 | | | 2,563 | | | 354 | |
研究開発費のスーパー控除i | (5,521) | | | (6,171) | | | (5,945) | |
| 繰延所得税資産が認識されていない税金損失及び控除可能一時差額 | 17,738 | | | 24,747 | | | 22,827 | |
| 中華人民共和国以外の法域における所得税の効果 | 36,639 | | | 7,697 | | | (2,270) | |
| 所得税費用 | $ | 266 | | | $ | 298 | | | $ | 120 | |
(i)中華人民共和国国家税務局が公布した政策によると、当社の一部子会社は研究開発費に対する税制優遇措置を受けることができます。2021 年 1 月から 2022 年 10 月まで、 2022 年 11 月から 2023 年 12 月まで、中華人民共和国の各機関は以下の税制優遇措置を計算した。 175%和200税額控除可能な研究開発費のそれぞれ% です。
2023 年 12 月 31 日に終了した会計年度の当社グループの所得税費用は 0.1100 万ドルは、主に Connect US の所得税費用によるものです。 Connect US は、 Connect HK のサービスプロバイダーとして所得税目的で扱われ、コストプラスベースでサービス料収入を得ています。
そのグループは確かにやりました注釈累積税金損失と控除可能一時差額について繰延所得税資産を計上します 208.1百万ドル316.4百万ドルと366.82021 年 12 月 31 日現在、 2022 年 12 月 31 日現在、 2023 年 12 月 31 日現在、将来の課税所得に対して繰り越すことができます。2023 年 12 月 31 日現在の Connect US の研究開発税額控除の残高は米ドルです。 5.9将来の納税義務に対して繰り越すことができます
2021 年、 2022 年、 2023 年 12 月 31 日現在、当グループは 注釈不確実な税務ポジションがあります
12. 1株当たり純損失
2021 年 3 月 12 日の株主総会の承認により、 1.74普通株式を 1 株に連結 ( 「連結株式」 ) しました ( 注 20 ) 。
基本 1 株当たり純損失は、当社所有者に帰属する純損失を、発行済普通株式の加重平均数で割って算出しています。 当社の普通株式発行の影響を反映した 1 株当たり純損失および希薄化純損失は以下のとおりです。
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位は千、1株当たりのデータは除く) | 2021 | | 2022 | | 2023 |
| 会社の所有者は純損失を占めなければならない | $ | (202,266) | | | $ | (118,091) | | | $ | (59,503) | |
| 発行済み普通株式加重平均 | 52,177 | | 55,044 | | 55,067 |
| 1 株当たり純損失および希薄化損失 ( 米ドル ) | $ | (3.88) | | | $ | (2.15) | | | $ | (1.08) | |
オプション、優先株式および従業員株式購入計画株式は、報告期間を通じて潜在的に希薄化すると考えられます。しかしながら、当社グループは 2021 年、 2022 年、 2023 年 12 月期に損失を計上しているため、希薄化株式は普通株式に転換した場合の 1 株当たり純損失に対して希薄化防止効果を有します。したがって、 1 株当たり希薄化純損失は、 1 株当たり基本純損失に相当します。
13. 不動産·工場および設備
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
(単位:千) | 実験室
装備 | | 賃借権
改良 | | オフィス
装置は、
家具.家具
その他 | | 資産項目の下 建設i | | 合計する |
| | | | | | | | | |
| 2021年1月1日まで | | | | | | | | | |
| コスト | $ | 869 | | | $ | 224 | | | $ | 90 | | | $ | 292 | | | $ | 1,475 | |
| 減価償却累計 | (224) | | | (124) | | | (64) | | | — | | | (412) | |
| 帳簿純価値 | $ | 645 | | | $ | 100 | | | $ | 26 | | | $ | 292 | | | $ | 1,063 | |
| 2021年12月31日までの年度 | | | | | | | | | |
| 期初帳簿純価値 | $ | 645 | | | $ | 100 | | | $ | 26 | | | $ | 292 | | | $ | 1,063 | |
| 為替差益 | 82 | | | 9 | | | 3 | | | 5 | | | 99 | |
| 足し算 | 4,636 | | | 122 | | | 133 | | | 3,779 | | | 8,670 | |
| 振替 | — | | | 378 | | | — | | | (378) | | | — | |
| 処置する | (34) | | | — | | | (5) | | | — | | | (39) | |
| 減価償却 | (304) | | | (126) | | | (56) | | | — | | | (486) | |
| | | | | | | | | |
| 期末帳簿純価値 | $ | 5,025 | | | $ | 483 | | | $ | 101 | | | $ | 3,698 | | | $ | 9,307 | |
| 2021年12月31日まで | | | | | | | | | |
| コスト | $ | 5,553 | | | $ | 733 | | | $ | 221 | | | $ | 3,698 | | | $ | 10,205 | |
| 減価償却累計 | (528) | | | (250) | | | (120) | | | — | | | (898) | |
| 帳簿純価値 | $ | 5,025 | | | $ | 483 | | | $ | 101 | | | $ | 3,698 | | | $ | 9,307 | |
| | | | | | | | | |
| 2022年12月31日までの年度 | | | | | | | | | |
| 期初帳簿純価値 | $ | 5,025 | | | $ | 483 | | | $ | 101 | | | $ | 3,698 | | | $ | 9,307 | |
| 為替差益 | (414) | | | (36) | | | 1 | | | (412) | | | (861) | |
| 足し算 | 312 | | | 65 | | | 119 | | | 1,455 | | | 1,951 | |
| 振替 | 43 | | | — | | | — | | | (43) | | | — | |
| | | | | | | | | |
| 減価償却 | (494) | | | (151) | | | (78) | | | — | | | (723) | |
減価損失i | — | | | — | | | — | | | (4,698) | | | (4,698) | |
| 期末帳簿純価値 | $ | 4,472 | | | 361 | | | $ | 143 | | | $ | — | | | $ | 4,976 | |
| 2022年12月31日まで | | | | | | | | | |
| コスト | $ | 5,494 | | | $ | 762 | | | $ | 341 | | | $ | — | | | $ | 6,597 | |
| 減価償却累計 | (1,022) | | | (401) | | | (198) | | | — | | | (1,621) | |
| 帳簿純価値 | $ | 4,472 | | | $ | 361 | | | $ | 143 | | | $ | — | | | $ | 4,976 | |
| | | | | | | | | | |
| 2023年12月31日までの年度 | | | | | | | | | |
| 期初帳簿純価値 | $ | 4,472 | | | $ | 361 | | | $ | 143 | | | $ | — | | | $ | 4,976 | |
| 為替差益 | (73) | | | (3) | | | — | | | — | | | (76) | |
| 足し算 | 83 | | | — | | | — | | | — | | | 83 | |
| | | | | | | | | |
| 処置する | (1) | | | — | | | (1) | | | — | | | (2) | |
| 減価償却 | (494) | | | (131) | | | (82) | | | — | | | (707) | |
| | | | | | | | | |
| 期末帳簿純価値 | $ | 3,987 | | | $ | 227 | | | $ | 60 | | | $ | — | | | $ | 4,274 | |
| 2023年12月31日まで | | | | | | | | | |
| コスト | $ | 5,503 | | | $ | 759 | | | $ | 340 | | | $ | — | | | $ | 6,602 | |
| 減価償却累計 | (1,516) | | | (532) | | | (280) | | | — | | | (2,328) | |
| 帳簿純価値 | $ | 3,987 | | | $ | 227 | | | $ | 60 | | | $ | — | | | $ | 4,274 | |
(i) 当社グループは、太倉ハイテク工業開発区における研究開発実験室、製造施設、オフィス施設の建設計画を終了し、建設中の純減損損失を USD に計上しました。 4.72022年12月31日までの1年間で
14. 他の非流動資産
| | | | | | | | | | | |
| 12月31日まで |
(単位:千) | 2022 | | 2023 |
| | | |
| 付加価値税控除額 | $ | 159 | | | $ | 108 | |
| 非流動資産の購入前払い | 59 | | | — | |
| 他の人は | 34 | | | 24 | |
| $ | 252 | | | $ | 132 | |
15. 使用権資産 · リース
連結貸借対照表に計上される金額は以下のとおりです。
(a)使用権資産
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
(単位:千) | 土地使用権i | | オフィス賃料 | | 合計する | | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | | | | | | |
| 2021 年 1 月 1 日現在の純帳簿額 | $ | — | | | $ | 142 | | | $ | 142 | | | | | | | | | | | | | | | | | | | | | |
| 足し算 | 3,442 | | | 80 | | | 3,522 | | | | | | | | | | | | | | | | | | | | | |
| 減価償却 | (46) | | | (95) | | | (141) | | | | | | | | | | | | | | | | | | | | | |
| 為替差益 | 53 | | | 4 | | | 57 | | | | | | | | | | | | | | | | | | | | | |
| 2021 年 12 月 31 日現在の純帳簿額 | 3,449 | | | 131 | | | 3,580 | | | | | | | | | | | | | | | | | | | | | |
| 足し算 | — | | | 514 | | | 514 | | | | | | | | | | | | | | | | | | | | | |
| 減価償却 | (66) | | | (233) | | | (299) | | | | | | | | | | | | | | | | | | | | | |
| 為替差益 | (290) | | | (11) | | | (301) | | | | | | | | | | | | | | | | | | | | | |
| 2022 年 12 月 31 日現在の純帳簿額 | 3,093 | | | 401 | | | 3,494 | | | | | | | | | | | | | | | | | | | | | |
| 足し算 | — | | | 305 | | | 305 | | | | | | | | | | | | | | | | | | | | | |
| 減価償却 | (22) | | | (250) | | | (272) | | | | | | | | | | | | | | | | | | | | | |
政府買戻し | (3,108) | | | — | | | (3,108) | | | | | | | | | | | | | | | | | | | | | |
| 為替差益 | 37 | | | (3) | | | 34 | | | | | | | | | | | | | | | | | | | | | |
| 2023 年 12 月 31 日現在の純帳簿額 | $ | — | | | $ | 453 | | | $ | 453 | | | | | | | | | | | | | | | | | | | | | |
| 2023年12月31日まで | | | | | | | | | | | | | | | | | | | | | | | | | |
| コスト | — | | | 1,193 | | | 1,193 | | | | | | | | | | | | | | | | | | | | | |
| 減価償却累計 | — | | | (740) | | | (740) | | | | | | | | | | | | | | | | | | | | | |
| 帳簿純価値 | $ | — | | | $ | 453 | | | $ | 453 | | | | | | | | | | | | | | | | | | | | | |
(I)二零二一年十二月三十一日現在、新規土地使用権は、土地使用権証明書の取得中国江蘇太倉土地使用長期権益の取得と関係がある。その会社は全部でドルを支払った3.42021年に土地使用権は1億8千万元の資金を調達する。本グループは2022年12月31日までにこの土地に施設を建設する建設プロジェクトを終了した。
2023年4月に、江蘇太倉HIDCはConnect SZと合意を締結し、江蘇太倉HIDCは原価に従ってConnect SZに土地使用権を買い戻すことができ、そして土地使用協定と投資協定の関連条文を中止することができる。土地使用権抹消登録は2023年4月に完了し,会社は買い戻し代金ドルを受け取った3.12023年9月は1億2千万ドル。
(b)賃貸負債
著者らは中国江蘇太倉で研究開発と行政施設をレンタルし、2026年4月30日に満期になり、カリフォルニア州サンディエゴで行政と行政事務室をレンタルし、2025年4月に満期になった次の表はこれらのレンタルに関する情報を提供します
| | | | | | | | | | | |
| 12月31日まで |
(単位:千) | 2022 | | 2023 |
| | | |
| 当面ではない | $ | 245 | | | $ | 180 | |
| 現在のところ | 186 | | | 285 | |
| $ | 431 | | | $ | 465 | |
資産減価償却費用の使用権を除いて、連結損益表で確認された金額は以下の通りです
| | | | | | | | | | | | | | | | | |
| 12月31日までの年度 |
(単位:千) | 2021 | | 2022 | | 2023 |
| | | | | |
| 利子支出 | $ | 7 | | | $ | 21 | | | $ | 23 | |
| 短期レンタルに関する費用(行政費や研究開発費を含む) | 2 | | | — | | | — | |
| 低価値資産のリースに関する費用は、上記では短期賃貸(行政費用や研究開発費に含まれる)とはされていない | 9 | | | — | | | — | |
| $ | 18 | | | $ | 21 | | | $ | 23 | |
2021年,2021年,2022年,2023年12月31日までのリース現金流出総額はドルである0.1百万ドル0.2百万ドルと0.3それぞれ100万ドルです
16. カテゴリー別の金融商品
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| 金融資産 | | 金融資産
FVOCIで | | 金融資産
償却コストで計算する | | 金融資産
FVTPLで | | 金融資産総額 |
| | | | | | | | |
| 2022年12月31日まで | | | | | | | | |
(単位:千) | | | | | | | | |
| その他売掛金 | | $ | — | | | $ | 283 | | | $ | — | | | $ | 283 | |
| 他の総合収益で公正な価値で計算される金融資産 | | 82,847 | | | — | | | — | | | 82,847 | |
| 現金と現金等価物 | | — | | | 60,642 | | | 18,368 | | | 79,010 | |
| | $ | 82,847 | | | $ | 60,925 | | | $ | 18,368 | | | $ | 162,140 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| 金融資産 | | 金融資産
FVOCIで | | 金融資産
償却コストで計算する | | 金融資産
FVTPLで | | 金融資産総額 |
| | | | | | | | |
| 2023年12月31日まで | | | | | | | | |
(単位:千) | | | | | | | | |
| その他売掛金 | | $ | — | | | $ | 229 | | | $ | — | | | $ | 229 | |
| 他の総合収益で公正な価値で計算される金融資産 | | 12,646 | | | — | | | — | | | 12,646 | |
| 現金と現金等価物 | | — | | | 27,690 | | | 78,317 | | | 106,007 | |
| | $ | 12,646 | | | $ | 27,919 | | | $ | 78,317 | | | $ | 118,882 | |
| | | | | | | | |
| 金融負債 | | 金融
負債のある
原価を償却する |
| | |
| 2022年12月31日まで | | |
(単位:千) | | |
| その他の支払い | | $ | 1,353 | |
| 貿易応払い | | 11,937 | |
| 賃貸負債 | | 431 | |
| | $ | 13,721 | |
| | | | | | | | |
| 金融負債 | | 金融
負債のある
原価を償却する |
| | |
| 2023年12月31日まで | | |
(単位:千) | | |
| | |
| その他の支払い | | $ | 1,083 | |
| 貿易応払い | | 7,660 | |
| 賃貸負債 | | 465 | |
| | $ | 9,208 | |
17. その他の売掛金 · 前払い
| | | | | | | | | | | |
| 12月31日まで |
(単位:千) | 2022 | | 2023 |
| | | |
| 臨床試験 · 医薬品製造サービスの前払い | $ | 2,710 | | | $ | 1,732 | |
| 前払い費用 | 369 | | | 357 | |
| 預金.預金 | 51 | | | 51 | |
| 他の人は | 232 | | | 178 | |
| $ | 3,362 | | | $ | 2,318 | |
18. 公正な価値で計算される金融資産
(a)他の包括収益で公正な価値で計算された金融資産
FVOCI の金融資産は、契約上のキャッシュフローが元本と利息のみであり、グループのビジネスモデルの目的は、契約上のキャッシュフローの回収と金融資産の売却によって達成される債務証券への投資で構成されています。 FVOCI の金融資産は、以下の投資から構成されます。
| | | | | | | | | | | |
| 十二月三十一日 |
(単位:千) | 2022 | | 2023 |
| | | |
| 非流動資産 | | | |
| アメリカ国庫券 | $ | 1,686 | | | $ | — | |
| 上場債券 | 7,754 | | | — | |
| 9,440 | | | — | |
| 流動資産 | | | |
| アメリカ国庫券 | 38,983 | | | 1,750 | |
| 官庁債 | 1,201 | | | 3,953 | |
| 上場債券 | 7,571 | | | — | |
非上場債券i | 25,652 | | | 6,943 | |
| $ | 73,407 | | | $ | 12,646 | |
| | | |
(i)非上場債務証券は、金融機関のコマーシャルペーパーへの投資です。
負債投資の処分に際しては、 FVOCI 準備金内の関連残高は損益内のその他 ( 損失 ) / 利益に再分類されます。FVOCI で記録された債務投資の満期合計米ドル 92.92023 年 12 月 31 日を末日とする会計年度の 100 万ドル。
| | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| | 2022 | | 2023 |
| | | |
(単位:千) | | | |
| 負債投資に係る損益に計上される利息収入 | $ | 1,352 | | | $ | 2,030 | |
| 負債投資に係るその他の総合利益に計上した損益 | $ | (365) | | | $ | 354 | |
FVOCI の金融資産は、短期および長期の投資としてレベル 1 および 2 の商品として反映されています。2023 年 12 月 31 日現在、当社グループは米ドル 12.6 FVOCI 短期投資の 100 万ドルです 以下の金額表は、 FVOCI におけるデット投資の短期 · 長期投資のレベル 1 及びレベル 2 商品の変更を示しています。
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2022 | | 2023 |
| | | |
| 他の総合収益で公正な価値で計算される金融資産 | | | |
| 期初残高 | $ | — | | | $ | 82,847 | |
| 足し算 | 109,608 | | | 31,028 | |
| 決済 ( クーポン利息含む ) | (27,748) | | | (103,613) | |
| 応算利息 | 482 | | | 327 | |
| 割引付加 | 870 | | | 1,703 | |
その他総合利益に対する公正価額変動i | (365) | | | 354 | |
| 為替差益 | | | — | |
| 期末残高 | $ | 82,847 | | | $ | 12,646 | |
( I ) 。 報告期末残高に起因するその他の総合利益に計上された未実現損益を含みます。
公正価値の決定に用いられる方法及び仮定に関する情報は、注 3 に記載されています。FVOCI における金融資産の減損は、予想損失および信用リスクの変化に基づいて計測され、決定時に損益に計上されます。2023 年 12 月 31 日現在、 FVOCI における負債投資に減損は計上されていません。FVOCI のすべての金融資産は米ドル建てです。
(b)損益を通じた公正価額における金融資産
FVTPL の金融資産は、ウェルスマネジメント商品への投資とマネーマーケットファンドへの投資で構成されています。
ウェルスマネジメント商品への投資は、短期投資としてレベル 3 の商品として反映されます。 ウェルスマネジメント商品短期投資のレベル 3 商品の推移は以下のとおりです。
| | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | | 2022 | | 2023 |
| | | | |
| 公正価値に基づいて損益する金融資産 | | | | |
| 期初残高 | | $ | — | | | $ | — | |
| 足し算 | | 6,456 | | | 1,573 | |
| 集まって落ち合う | | (6,478) | | | (1,578) | |
| 損益に計上される公正価額益 ( 注 9 ) | | 22 | | | 5 | |
| 期末残高 | | $ | — | | | $ | — | |
| | | | |
ウェルスマネジメント商品の公正価値は、期待リターンを用いた割引キャッシュフローに基づいています。これらのウェルスマネジメント商品のリターンは保証されておらず、契約上のキャッシュフローは元本と利息の支払いだけではありません。これらの金融資産の公正価値の変化は、連結損益計算書において、その他 ( 損失 ) / 利益 ( 純 ) に計上されます。
マネーマーケットファンドへの投資は、現金同等物としてレベル 1 の商品として反映されます。2023 年 12 月 31 日現在、当社グループは米ドル 78.3現金同等物に含まれる貨幣市場投資額です 2023 年 12 月期における現金同等物に含まれるマネーマーケットファンドのレベル 1 商品の推移は、以下のとおりです。
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2022 | | 2023 |
| | | |
| 公正価値に基づいて損益する金融資産 | | | |
| 期初残高 | $ | — | | | $ | 18,368 | |
| 足し算 | 97,526 | | | 103,613 | |
| 決済 ( クーポン利息を含む。手数料を除く ) | (79,406) | | | (46,167) | |
| 損益計上投資所得 | 248 | | | 2,503 | |
| | | |
| 期末残高 | $ | 18,368 | | | $ | 78,317 | |
現金、その他の債権、貿易買掛金およびその他の買掛金を含む当社グループのその他の金融資産および負債の帳簿額は、適正価額に近いものです。
19. 現金と現金等価物
| | | | | | | | | | | |
| 12月31日まで |
(単位:千) | 2022 | | 2023 |
| | | |
| 銀行の現金 | | | |
| - 米ドル預金 | $ | 50,739 | | | $ | 10,767 | |
| - 人民元の預金 | 9,169 | | | 15,614 | |
| - オーストラリア · ドル預金 | 734 | | | 1,309 | |
現金等価物i | 18,368 | | | 78,317 | |
| | $ | 79,010 | | | $ | 106,007 | |
(i)マネーマーケットファンドへの投資や、元の満期が 90 日以下で、価値変動のリスクが著しい短期投資は、流動性が高いため、現金同等物に分類されます。したがって、これらの現金同等物は適正価額で計上され、適正価額の変動は損益に反映されます ( 注記 18 ( b ) 参照 ) 。
米ドル建ての現金等価物は、米国の銀行に保有されています。
中華人民共和国に所在する銀行に預ける現金は、日々の銀行預金金利に基づく変動金利で利子を得ることができます。一方、中華人民共和国の外の銀行に預ける預金は、最大年率利回りを得るスイープ口座に置かれます。 4.2%.
人民元建ての銀行現金は、中華人民共和国の銀行に預けられます。これらの人民元建て残高の外貨への換算及び中国国外への送金は、中華人民共和国政府が公布した為替管理規則の対象となります。
20. 株本
2021 年 3 月 12 日の株主総会の承認により、 1.74通常株式の額面額は米ドル 0.0001当社の承認株式資本金 ( 発行済株式および未発行株式を含む ) の各株式を、額面価値米ドルの 1 株に統合しました。 0.000174それぞれ。このため、当社の承認資本金を米ドルから変更しました。 50,000USD へ 76,560. 2023 年 12 月 31 日現在の当社の承認株式資本金は米ドルです。 76,560.
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 普通株式数 | | 共有
資本 | | 共有 割増価格 | | 合計する |
(単位:千、共有データを除く) | | | | | | | | |
| 2021年1月1日まで | | 19,653,791 | | $ | 3 | | | $ | 6,012 | | | $ | 6,015 | |
普通株の発行i | | 12,937,500 | | 2 | | | 200,630 | | | 200,632 | |
優先株式から普通株式への転換 ( 注 25 ) | | 24,791,804 | | 5 | | | 421,456 | | | 421,461 | |
普通株買い戻しII | | (20,765) | | — | | | — | | | — | |
共同創業者への株式発行三、三、 | | 121,080 | | — | | | 218 | | | 218 | |
| 株式オプションの行使 | | — | | — | | | 327 | | | 327 | |
2021年12月31日まで | | 57,483,410 | | 10 | | | 628,643 | | | 628,653 | |
普通株の発行v | | 25,468 | | — | | | 18 | | | 18 | |
株式の譲渡 · 取消四 | | (60,540) | | — | | | — | | | — | |
2022年12月31日まで | | 57,448,338 | | 10 | | | 628,661 | | | 628,671 | |
普通株の発行v | | 60,207 | | — | | | 44 | | | 44 | |
| 株式オプションの行使 | | — | | | — | | | 2 | | | 2 | |
2023年12月31日まで | | 57,508,545 | | $ | 10 | | | $ | 628,707 | | | $ | 628,717 | |
(i)2021年3月12,937,500アメリカ預託証明書12,937,500普通株式 ( 引受人による追加 ADS の購入オプションの全額行使を含む ) は、当社による
ナスダックに上場し、受け取った収益は米ドルでした 219.9百万だ米ドルの発行コストが発生 19.3この申し出に関連して 100 万ドルです
(Ii)2021 年 3 月、共同創業者の要請により、当社は 20,765米ドルの対価として彼から普通株式を 0.4株式報酬に関連する源泉徴収税の支払いに 100 万ドルを支払いましたその株式は取り消されました
(Iii)シリーズ C 資金調達の完了時に有効な当社の株主契約 ( 注釈 23 参照 ) に従い、当社の各創業者は、特定の状況下で共同創業者が議決権の過半数を支配することを確実にするために、 2 つ以上の議決権を有していました。
(Iv)2022 年 5 月、関係者が降伏。 60,540普通株は対価なしです売却された株式は取り消された。当社は、株式譲渡に関連して、将来の対価や補償に関するいかなる契約や約束も締結していません。
(v)2022 年 11 月 1 日、 25,468株式は2021年のESPP計画に基づいて発行された。2023年5月1日と2023年11月1日30,312そして29,895それぞれ2021年ESPP計画に基づいて発行された株です。
21. 国庫株
国庫株はこれまでConnect Unionが保有しており、2019年と2020年に2019年の株式インセンティブ計画に基づいて株を発行することを目的としています。Connect Unionが保有する当社の普通株は2021年9月にすべて当社に返送されました。2021年、2021年、2022年、2023年12月31日まで、2,407,091, 2,407,091そして2,405,591それぞれ国庫株である。
22. 埋蔵量
(a)株式報酬準備金
株式報酬備蓄とは、財務諸表に付記されている2.10に記載の株式決済株式支払いに用いられる会計政策に基づいて確認された従業員に付与された購入持分の不行使の公正価値である。
(b)その他の備蓄
その他の備蓄とは、主に株式購入権を行使する際に株式給与備蓄から移行する備蓄と、2.5(C)に記載の外貨換算備蓄を付記することである。
(c)法定備蓄金
“中華人民共和国条例”と現在本グループに組み入れられている“中国会社定款”によると、年度利益分配の前に、中国に登録した会社は必ず残さなければならない10中国の関連会計基準に基づいて定められたいずれかの前年度赤字後の年度純利益の%を法定黒字積立金に計上する。このような備蓄の残高が50%のエンティティ登録資本は、任意の追加支出がオプションです。報告されている間、これらのエンティティは累積損失状態にあるため、利益をバックログに分配していない。
中国の法律及び法規によると、当社の中国付属会社はいくつかの純資産を配当、ローン又は立て替えの形で当社に譲渡してはならない。当社の中国子会社の有限純資産は,実収資本と法定積立金を含めてドルである33.22022年12月31日までの百万ドルとドル14.22023年12月31日現在で100万円。
23. 株式ベースの報酬
2019年株式インセンティブ計画
本グループは2019年11月1日に2019年株式インセンティブ計画(“2019年計画”)を採択し、取締役会の承認を得て、この計画により、当グループは従業員、取締役及びコンサルタントにオプション、制限株式又は制限株式単位等の各種奨励を付与し、その提供するサービスを表彰することができる
この計画によると、授権者は取締役会が決めた価格で普通株を引受する権利がある。サービス条件を満たす場合にのみ,付与されたオプションを付与することができる.この計画により付与されたオプションは以下の点で有効である10授与と帰属の日からサービス期間内の年数は,通常4年; 25付与オプションの割合は付与日の最初の周年日に帰属し,残りのオプションは来月の等額分割払いに帰属する36何ヶ月になりますか。一部のオプションは、サービス期間全体にわたって月額または年単位で分割され、または全てのサービスが提供された場合には、付与された日に直ちに付与される。
いくつかの引受人の授出日は、彼らが株式購入の条件に適合するようにサービスを提供し始めた日に発生した後、管理層は授出日の各報告期間の公正価値を推定し、サービス開始日から授出日までの支出を確認する。授出日が確定した後、支出は実際の授出日株式購入株式の変動期間の公正価値に基づいていることを確認した。
もし引受人が終了日から3ヶ月以内(またはいくつかの株式購入所有者が最初の公募開始日から3ヶ月以内に)既得株購入権を行使しない場合、何らかの理由で本グループを離れない引受人は既存の株式を購入する権利を失う。
2021年株式インセンティブ計画
当グループは2021年株式インセンティブ計画(“2021年計画”)により、初公募発効日から発効します。2021計画に従って付与される報酬は、株式オプション、株式付加価値権(SARS)、制限株式単位(RSU)、制限株式報酬(RSA)、または配当等価権(DER)とすることができる。2021計画によれば、すべての奨励が発行可能な普通株式総数の上限は(1)である6,000,000普通株式には、(2)2021年計画発効日(I)2019年計画に基づいて発行可能または(Ii)2019年計画によると、その後その条項に従って2021計画に従って発行可能な未償還奨励金のいずれかを加えることができる。2021年1月1日から始まる財政年度から2021年度にかけて、最初に発行可能な普通株式数は、各財政年度の初日に増加し、増加した金額は(I)に相当する5.0前会計年度の最終日に発行され、発行された普通株式総数の割合を占める;あるいは(Ii)当社取締役会が決定したより少ない数量の普通株である可能性がある。我々の取締役会は、2021年計画下で2023年1月1日と2024年1月1日から始まる財政年度の増加額を2.5%和5.0それぞれ2022年12月31日および2023年12月31日に決定された発行済み株式のパーセンテージ。どんな状況でも超えません60,000,0002021年計画によると、株式は奨励的株式オプション(米国国税法第422条の意味に適合)を行使した後に発行することができる。
この計画によると、授権者は取締役会が決めた価格で普通株を引受する権利がある。サービス条件を満たす場合にのみ,付与されたオプションを付与することができる.この計画により付与されたオプションは以下の点で有効である10授与と帰属の日からサービス期間内の年数は,通常4年; 25付与オプションの割合は付与日の最初の周年日に帰属し,残りのオプションは来月の等額分割払いに帰属する36何ヶ月になりますか
何らかの理由で本グループを離れた引受人ではなく,終了日から3カ月以内に既得オプションを行使しなければ,既存オプションの権利を失う.
当社は2021年12月31日までに合算して授与します2,403,660以下を含むオプション897,6602019年計画と1,506,0002021年計画のオプション。2022年、2022年及び2023年12月31日まで、当社は授与します2,986,547そして2,324,087それぞれ2021年計画中のオプションです。
2023年12月31日まで、グループは予約しました5,278,6582021年計画に基づいて付与可能な株式。
2021年従業員株購入計画
本グループは2021年従業員株購入計画(“2021年従業員持株計画”)を採択し、2022年5月に実施を開始した。合計する600,000普通株式は最初に2021年のESPP計画に基づいて予約発行された。2022年1月1日から2031年1月1日までの例年の初日には、2021年ESPP計画により発行可能な株式数は、以下の両者のうち小さい者に等しい株式数を増加させるべきである1.0前の年の最後の日本グループのすでに発行された普通株式総数のパーセンテージあるいは本グループの取締役会が決定した比較的少ない株式数を占める。私たちの取締役会は、2021年1月1日、2023年、2024年1月1日からの会計年度に2021年にESPP発行の利用可能株式数を増やすことを承認していません
2021年ESPPによると、2022年5月1日から、この計画の第423条構成要素に、条件を満たす従業員に普通株を購入する権利が付与され、これは超えられない賃金減額によって資金を提供することができる重要な条項が含まれている要約が提供されている15従業員一人当たりの報酬の%です。2021年ESPPは一般的に規定されています24ヶ月提供期限、その中には四つ6か月購入期間です各購入期間の終了時に、適格な従業員は以下で普通株式を購入することができます。 85募集期間の開始時の適正時価または購入期間の終了時の適正時価のいずれか低い方の% 。最初のオファリング期間は 2022 年 5 月 1 日に始まり、 6 ヶ月ごとに次のオファリング期間が続きます。2022 年 12 月期における従業員の購入額 25,468加重平均割引価格で株式を0.74株式報酬費用は米ドルを計上しました 392021 年 ESPP に関して千。2023 年 12 月期における従業員の購入額 60,207加重平均割引価格で株式を0.73株式報酬費用は米ドルを計上しました 142021 年 ESPP に関して千。
2019 年及び 2021 年計画 ( 株式連結後 ) におけるオプション活動については、 2021 年、 2022 年及び 2023 年 12 月期は以下のとおりです。
| | | | | | | | | | | |
| オプション数 | | 加重平均
行権価格ごとに
シェアオプション |
| 2021 年 1 月 1 日現在残高のオプション | 1,665,883 | | |
| 授与する | 2,403,660 | | $ | 13.76 | |
| 鍛えられた | (163,773) | | $ | 0.96 | |
没収されるi | (157,381) | | $ | 14.76 | |
| 2021 年 12 月 31 日現在のオプション残高 | 3,748,389 | | |
| 授与する | 2,986,547 | | $ | 3.44 | |
| | | |
没収されるi | (1,631,309) | | $ | 9.61 | |
| 2022年12月31日までの未返済オプション | 5,103,627 | | |
| 授与する | 2,324,087 | | $ | 1.12 | |
| 鍛えられた | (1,500) | | $ | 0.75 | |
没収されるi | (878,593) | | $ | 5.31 | |
| 2023年12月31日までの未返済オプション | 6,547,621 | | |
| 2023年12月31日までに行使可能なオプション | 3,019,701 | | |
2021 年、 2022 年、 2023 年 12 月 31 日時点のオプション残高の加重平均残存契約期間は 9.2, 8.7そして8.2それぞれ数年です
(i)雇用終了時にオプションが没収された。
2021 ESPP に基づく株式インセンティブプランおよび株式の公正価値
当社は、上場完了に先立ち、自己資本価値をハイブリッド法により推定し、配分モデルを採用し、基礎となる普通株式の公正価値を決定しました。IPO 完了後、新株予約権の公正価値は、付与日における当社普通株式の公正市場価値に基づいて推定されます。
当社グループは、付与日時点におけるオプションの適正価額を、原普通株式の適正価額に基づき、二項オプション価格モデルを用いて決定しています。これとは別に、当グループは、 Black—Scholes オプション価格モデルを用いて、助成日時点での ESPP 補償費用計算の公正価値を決定しました。2023 年 12 月 31 日現在、金額
従業員の給料から徴収された合計 USD 14経常負債内のその他の買掛金および未払い金に計上されます。 期間および ESPP 報酬に付与されるオプションの主な仮定は以下のとおりです。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 株式激励計画 | | ESPP |
| 十二月三十一日までの年度 | | 十二月三十一日までの年度 |
| 2021 | | 2022 | | 2023 | | 2022 | | 2023 |
| 年内加重平均行使価格 | $13.80 | | $3.44 | | $1.12 | | (i) | | (Ii) |
| 付与日株価 | $4.30~$23.30 | | $0.75~$4.91 | | $0.77~$1.29 | | $0.86~$1.86 | | $1.05 |
| 無リスク金利 | 1.2%~1.7% | | 1.9%~3.4% | | 3.6%~4.4% | | 1.5%~4.8% | | 4.1%~5.1% |
| 予想変動率 | 60.5%~62.2% | | 61.4%~62.0% | | 59.3%~60.1% | | 51.1%~60.2% | | 47.0%~52.3% |
| オプション寿命 | 10年.年 | | 10年.年 | | 10年.年 | | 0.5~2.0年.年 | | 0.5~2.0年.年 |
| 予想される早期運動複数 | 2.2 | | 2.2~2.8 | | 2.2~2.8 | | 適用されない | | 適用されない |
| 配当率 | ありません | | ありません | | ありません | | ありません | | ありません |
| 罰金率 | 3.0%-9.6% | | 3.0%-10.8% | | *8.3%-12.3% | | 3.0% | | 3.0%-5.0% |
| 年間付与された加重平均公正価値 | $10.60 | | $1.98 | | $0.64 | | $0.71 | | $0.40 |
*2023 年 12 月 31 日を末日とする会計年度の役員の没収率は 8.3%から12.3% その他の従業員は 9.5%から11.7%.
(i)2022 年 12 月 31 日を末日とする会計年度の発行済株式の割引 ESPP 価格は $0.74.
(Ii)2023 年 12 月 31 日を末日とする会計年度の発行済株式の割引 ESPP 価格は $0.73そして$0.89.
当社グループは、原株の予想ボラティリティの代理として、同等の企業の平均ボラティリティを採用しています。各同等の企業のボラティリティは、ストックオプションの残りの満期期間に見合った期間における過去の日次株価に基づいています。
共同創業者に対する株式報酬
当社は、当社と株主との間で締結された株主総約に基づき、 702,2782021 年 3 月の IPO 完了までの特定の R & D マイルストーンの達成に対して、共同創業者に普通株式を付与する。IPO 中の株式統合の一環として、これらの株式は 403,606普通株です。
また、上場後、株主合意に基づき、一定の研究開発マイルストーンの達成に伴い、 210,6822021 年 12 月 31 日を末日とする会計年度の共同創業者に普通株式を株式連結後、これらの株式は 121,080普通株です。
2021 年 3 月には、当社グループの希薄化防止義務に基づき、シリーズ C 優先株式の追加発行を行いました。 80,457シリーズ C 優先株。株式統合後、これらは 46,232優先株式これらの優先株式は、 IPO 完了時に 1 対 1 ベースで普通株式に転換されました。
当社グループは、ハイブリッド法を用いて自己資本価値を決定し、配分モデルを採用し、本株式ベースの支払いの公正価値を米ドルで決定しました。 0.9株式連結前の 1 株当たり ( USD 1.57株式連結後 ) 付与日に付与します。主な仮定には、リスクフリー金利が含まれる。 2.5%、予想変動率60.0配当利回りはゼロであり、経営陣の最善の見積もりに基づいている。
シリーズ C 優先株主への株式報酬
追加とともに 3,162,8942020 年 12 月に最終シリーズ C 優先株主に米ドルの現金対価として発行されたシリーズ C 優先株式 20.0当社グループは、発行日における追加シリーズ C 優先株式の適正価額と受け取った現金対価の差額を、約 100 万米ドルの株式報酬として認識しています。 3.12021年12月31日までの1年間で
株式報酬費用分類
連結損益計算書に含める株式報酬費用は、 2021 年、 2022 年、 2023 年度の各年度の次のとおりです。
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2021 | | 2022 | | 2023 |
| | | | | |
| 研究開発費 ( 注 7 ) | $ | 4,120 | | | $ | 3,073 | | | $ | 1,437 | |
| 管理費 ( 注 6 ( ii ) 、注 7 ) | 4,866 | | | 3,834 | | | 1,822 | |
| | $ | 8,986 | | | $ | 6,907 | | | $ | 3,259 | |
IPO の完了に伴い、発行済および発行済の追加シリーズ C 優先株式はすべて普通株式に転換されました。 1つは—for—one ベース(see^ a b c d e f g h 『官報』 25 頁。
24. その他の買掛金と未払い金
| | | | | | | | | | | |
| 12月31日まで |
(単位:千) | 2022 | | 2023 |
| | | |
| 建設買掛金 | $ | 201 | | | $ | 4 | |
| 給与 · 福祉 · ボーナス支払金 | 2,148 | | | 1,916 | |
| 累積プロフェッショナルサービス料 | 816 | | | 645 | |
| 他の人は | 336 | | | 434 | |
| | $ | 3,501 | | | $ | 2,999 | |
25. 優先権付き金融商品
当社グループは、以下のような優先株式の発行による一連の資金調達を完了しました。
| | | | | | | | | | | | | | | | | | | | |
| 購読年月 | | 円形 | | 量
優先株 | | 定期購読する
考慮する |
(単位:千) | | | | | | |
| 2016 年 03 月 3 日 | | シリーズ Pre—A | | 3,109 | | $ | 5,000 | |
| 2017 年 1 月 3 日 | | Aシリーズ | | 8,471 | | 20,000 | |
| 2018年12月20日 | | Bシリーズ | | 10,128 | | 55,000 | |
2020 年 8 月 21 日 / 2020 年 12 月 1 日 | | Cシリーズ | | 21,350 | | 135,000 | |
| | | | 43,058 | | $ | 215,000 | |
株式連結後、上記の優先株式数を以下に変更しました。 24,745,572さらに、 46,232注釈 23 に記載されている優先株式について、当社の発行済優先株式および発行済優先株式は 24,791,8042021 年 3 月 19 日以前。
2021 年 12 月期における優先権を有する金融商品の変動は以下のとおりです。
| | | | | |
| 公正価値 |
(単位:千) | |
| 2021年1月1日まで | $ | 317,473 | |
| 損益で確認された公正価値変動 | 103,983 | |
| その他総合利益に計上される外国為替換算による公正価額変動 | — | |
| IPO にて普通株式に転換 | (421,456) | |
| 2021年12月31日まで | $ | — | |
グループは IPO 価格 ( USD ) を使用しました。 17) は、 2021 年 3 月 19 日に優先権を有する金融商品の公正価値を決定するためです。2021 年 3 月の IPO 完了に伴い、これらの優先株式は以下のとおり普通株式に転換されました。 1つは-1を基本とする。
26. キャッシュフロー情報
(a)業務用現金
| | | | | | | | | | | | | | | | | | | | | | | |
| | | 十二月三十一日までの年度 |
(単位:千) | 備考 | | 2021 | | 2022 | | 2023 |
| | | | | | | |
| 所得税前純損失 | | | $ | (202,000) | | | $ | (117,793) | | | $ | (59,383) | |
| 以下の項目を調整する | | | | | | | |
| リース負債の利子 | 10 | | 7 | | | 21 | | | 23 | |
| ウェルスマネジメント商品への投資による投資収益 | 18(b) | | (68) | | | (22) | | | (5) | |
| その他総合利益を通じた適正価額投資による利子収入 | 18(a) | | — | | | (1,352) | | | (2,030) | |
| 無形資産の償却 | | | 7 | | | 9 | | | 9 | |
| 財産·工場·設備の減価償却 | 13 | | 486 | | | 723 | | | 707 | |
| 使用権資産の減価償却 | 15 | | 141 | | | 299 | | | 272 | |
| 減価損失純額 | 13 | | — | | | 4,698 | | | — | |
| 株式ベースの給与費用 | 23 | | 8,986 | | | 6,907 | | | 3,259 | |
| 純為替 | 9 | | 516 | | | (1,469) | | | (367) | |
優先権を有する金融商品の公正価値変動 | 25 | | 103,983 | | | — | | | — | |
土地使用権の処分による損失 | | | — | | | — | | | 100 | |
| 財産·工場·設備の損失を処分する | | | 39 | | | — | | | — | |
| 運営資金の変動 | | | | | | | |
| その他売掛金と前金 | | | (2,306) | | | 4,050 | | | 1,044 | |
| 他の非流動資産 | | | (1,358) | | | 2,698 | | | 120 | |
| その他の支払及び課税項目 | | | (1,723) | | | 487 | | | (475) | |
繰延の政府支出 | | | — | | | — | | | (247) | |
契約責任 | 5 | | — | | | — | | | 13,320 | |
| 貿易応払い | | | 8,966 | | | (776) | | | (4,277) | |
| 運営に使われている現金純額 | | | $ | (84,324) | | | $ | (101,520) | | | $ | (47,930) | |
キャッシュフロー情報の追加:
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2021 | | 2022 | | 2023 |
| | | | | |
| 受け取った利息 | $ | 97 | | | $ | 419 | | | $ | 3,204 | |
| 納めた所得税 | — | | | 462 | | | 120 | |
(b)非現金投資 · 資金調達活動
| | | | | | | | | | | | | | | | | | | | | | | |
| | | 十二月三十一日までの年度 |
(単位:千) | 備考 | | 2021 | | 2022 | | 2023 |
| | | | | | | |
| 建設買掛金 | | | $ | 2,631 | | | $ | 201 | | | $ | 4 | |
| 優先権を有する金融商品の公正価値変動 | 25 | | 103,983 | | | — | | | — | |
| | | | $ | 106,614 | | | $ | 201 | | | $ | 4 | |
(c)資金調達活動に起因する負債の調整
| | | | | | | | | | | |
| 金融
楽器は
優先権 | | リース責任 |
(単位:千) | | | |
| 2021年1月1日 | $ | 317,477 | | | $ | 140 | |
| キャッシュフロー | — | | | (126) | |
| 新規賃貸借契約 | | | 104 | |
| 利子支出 | — | | | 7 | |
| 外国通貨換算の違い | (4) | | | — | |
| 価値変動を公平に承諾する | 103,983 | | | — | |
| 普通株式への転換 | (421,456) | | | — | |
| 2021年12月31日 | — | | | 125 | |
| キャッシュフロー | | | (222) | |
| 新規賃貸借契約 | — | | | 507 | |
| 利子支出 | — | | | 21 | |
| | | |
| | | |
| 普通株式への転換 | | | — | |
| 2022年12月31日 | — | | | 431 | |
| キャッシュフロー | — | | | (290) | |
| 新規賃貸借契約 | — | | | 301 | |
| 利子支出 | — | | | 23 | |
| 2023年12月31日 | $ | — | | | $ | 465 | |
27. 支払いを引き受ける
資本約束
2022 年 12 月 31 日を末日とする会計年度において、当社グループは、太仓ハイテク工業開発区における研究開発実験室、製造施設、オフィス施設の建設計画を終了し、建設中の減損損失を USD で計上しました。 4.7100 万人 ( 注 12 参照 ) 。2022 年 12 月 31 日現在、 2023 年 12 月 31 日現在。 違います。資本約束。
28. 関係者取引
当事者は、一方の当事者が、直接的または間接的に、他方の当事者に対して支配または重要な影響力を行使する能力を有する場合、関連していると考えられる。当事者は、共通の管理の対象となる場合も関連していると考えられる。また、当社グループの主要経営陣およびその近親者も関連当事者とみなされます。
| | | | | | | | |
| 関係者名 | | 関係の性質 |
| 杭州 Simo 株式会社 | | 当社の元取締役が支配する法人 |
| Frontage Laboratories ( 蘇州 ) 有限公司 | | 当社の元取締役が支配する法人 |
| 上海タイガーメッドコンサルティング有限公司 | | 当社の元取締役が支配する法人 |
| 杭州 Tigermed コンサルティング有限公司 | | 当社の元取締役が支配する法人 |
| 北京医療開発 ( 蘇州 ) 有限公司 | | 当社の元取締役が支配する法人 |
2021 年 2 月 2 日に葉暁平元取締役が辞任したため、 2022 年 12 月 31 日と 2023 年 12 月 31 日を末日とする年度は、上記会社は関連当事者とはみなされなくなりました。
なお、本財務情報に記載されているその他の関連当事者との取引及び残高に加え、 2021 年、 2022 年、 2023 年 12 月期および 2022 年、 2023 年 12 月期における重要な関連当事者との取引及び残高の概要を以下に示します。
(a)当社の子会社への持分については、注釈 1.1 に記載しています。
(b)関連当事者との重要な取引
この集団は違います。2021 年、 2022 年または 2023 年 12 月 31 日を末日とする年度の関連当事者との取引
(c) 関連当事者とのバランス
この集団は違います。2022 年 12 月 31 日または 2023 年 12 月 31 日時点の関連当事者との残高
( d ) 主要管理職の報酬
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2021 | | 2022 | | 2023 |
(単位:千) | | | | | |
| 給料と給料とボーナス | $ | 2,872 | | | $ | 2,621 | | | $ | 2,262 | |
| 株式ベースの給与費用 | 4,486 | | | 2,627 | | | 1,410 | |
| 福祉 · 住宅基金等 | 49 | | | 70 | | | 57 | |
| $ | 7,407 | | | $ | 5,318 | | | $ | 3,729 | |
グループ累計米ドル 0.5百万ドルとドル0.6 2022 年 12 月 31 日現在、 2023 年 12 月 31 日現在、その他の支払金およびこれらの年に獲得した年間ボーナスの未払い金にそれぞれ 100 万ドル。
( e ) 主要経営陣からの株式取得
2021 年 3 月、当社グループが 20,765共同創業者の一人からの普通株式 ( 注 20 参照 ) 。
( f ) 主要管理職からの株式譲渡
2022 年 5 月、関係者が降伏。 60,540普通株で使う違います。考慮だ売却された株式は取り消された。当社グループは、株式譲渡に関連して、将来の対価や補償に関するいかなる契約や約束も締結していません ( 注 20 参照 ) 。
29. その期間の後に起こった事件を報告する
なお、本財務諸表に記載されている事項のほか、報告期間以降に発生した以下の事項を記載しています。
2024年1月から4月1日まで、グループは1,419,667従業員および取締役にサービスに基づく帰属条件と加重平均行使価格がドルである普通株式オプションを提供する1.18.
Simcereとのライセンス契約により,本グループは以下の前払い費用の残りを受け取る501000万元、付加価値税は減税します2.82000万元(約ドル)6.72024年第1四半期)(注5参照)。
30. 制限された純資産と親会社のみの簡明財務情報
当社が配当金を支払う能力は主に当社がその子会社から資金配分を受けることにかかっています。関連する中国の法律及び法規は、当社が中国の付属会社が中国の会計基準及び法規に基づいて定めた留保収益(あればある)から配当金を支払うことを許可するだけである。
中国の法律法規によると、法定積立金は計算すべきであり、しかも特定の目的にしか使用できず、現金配当金として分配してはならない。これらの中華人民共和国の法律法規は毎年支出を要求しているため10配当金を派遣する前に,税引き後の純利益の%を法定黒字基金に充てなければならない50当社グループの中国付属会社は当実体登録資本の6%を保有しているため、純資産の一部を当社に譲渡する能力が制限されています。
当社は、米国証券取引委員会S-X法規第4-08(E)(3)節“財務諸表一般付記”に基づいて、その連結子会社の制限純資産(“制限純資産”)をテストし、親会社に2022年、2022年、2023年12月31日まで、および2021年、2021年、2022年、2023年12月31日までの簡明な財務情報を報告することを求めていると結論した。
また、当社の中国子会社の中国以外の親会社への現金移転は中国政府の通貨両替規制を受けている。外貨供給不足は、中国付属会社および総合共同経営実体が十分な外貨を自社に配当金やその他の金を支払うか、あるいは他の方法でその外貨債務を履行することを制限する可能性がある。
(a)簡明貸借対照表
| | | | | | | | | | | |
| 12月31日まで |
(単位:千) | 2022 | | 2023 |
| | | |
| 資産 | | | |
| 非流動資産 | | | |
| 付属会社の権益 | $ | 287,878 | | | $ | 330,947 | |
| 他の総合収益で公正な価値で計算される金融資産 | 9,440 | | | — | |
| 非流動資産総額 | 297,318 | | | 330,947 | |
| 流動資産 | | | |
| 現金と現金等価物 | 47,972 | | | 79,597 | |
| 他の総合収益で公正な価値で計算される金融資産 | 73,407 | | | 12,646 | |
| その他売掛金 | 12,951 | | | 12,997 | |
| その他流動資産 | 369 | | | 356 | |
| 流動資産総額 | 134,699 | | | 105,596 | |
| 総資産 | $ | 432,017 | | | $ | 436,543 | |
| 負債.負債 | | | |
| 非流動負債 | | | |
| 収入を繰り越す | $ | — | | | $ | 250 | |
| 非流動負債総額 | — | | | 250 | |
| 流動負債 | | | |
| 貿易応払い | — | | | — | |
| その他の支払及び課税項目 | 7,330 | | | 8,453 | |
| 流動負債総額 | 7,330 | | | 8,453 | |
| 総負債 | 7,330 | | | 8,703 | |
| 純資産 | 424,687 | | | 427,840 | |
| 株主権益 | | | |
| 株本 | 10 | | | 10 | |
| 株式割増 | 628,661 | | | 628,707 | |
| 国庫株 | (180) | | | (180) | |
| 株式報酬準備金 | 16,473 | | | 19,731 | |
| その他の備蓄 | (4,271) | | | (3,917) | |
| 損失を累計する | (216,006) | | | (216,511) | |
| 株主権益総額 | $ | 424,687 | | | $ | 427,840 | |
(b)減損計算書
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2021 | | 2022 | | 2023 |
| | | | | |
| 行政費 | $ | (6,790) | | | $ | (6,035) | | | $ | (5,112) | |
| その他の利益 — ネット | — | | | 248 | | | 2,503 | |
| 営業損失 | (6,790) | | | (5,787) | | | (2,609) | |
| 財務(コスト)/収入-純額 | — | | | 1,352 | | | 2,104 | |
| 優先権金融商品の公正価値損失 | (103,983) | | | — | | | — | |
| 所得税前純損失 | (110,773) | | | (4,435) | | | (505) | |
| 所得税費用 | — | | | — | | | — | |
| 今年度の純損失 | $ | (110,773) | | | $ | (4,435) | | | $ | (505) | |
(c)簡明現金フロー表
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
(単位:千) | 2021 | | 2022 | | 2023 |
| | | | | |
| 経営活動のための現金純額 | $ | (4,352) | | | $ | (3,437) | | | $ | (876) | |
| 純現金(投資活動用)/投資活動から | (104,000) | | | (178,432) | | | 32,501 | |
| 融資活動による現金純額 | 202,346 | | | 119 | | | — | |
| 現金と現金等価物の純増加/(減少) | 93,994 | | | (181,750) | | | 31,625 | |
| 年初現金および現金等価物 | 135,728 | | | 229,722 | | | 47,972 | |
| 現金および現金等価物に及ぼす為替レート変動の影響 | — | | | — | | | — | |
| 年末現金および現金等価物 | $ | 229,722 | | | $ | 47,972 | | | $ | 79,597 | |
31. その他の潜在的材料会計政策の概要
本付記は、これらの連結財務諸表を列記する際に採用される他の可能な重大な会計政策を示しているが、これらの政策は、上記の他の付記では開示されていない。他の説明がない限り、このような政策は提出されたすべての年に適用されてきた
31.1個別の財務諸表
子会社への投資はコストから減値を引いて入金する。費用は投資の直接帰属費用を含む。子会社の業績は当社が受取配当金に基づいて会計処理を行います。
付属会社への投資が当該等投資の配当を受けた場合には、当該配当が当該付属会社の配当発表期間における全面収益総額を超えたり、当該等の独立財務諸表に投資された帳簿金額が被投資会社の純資産の総合財務諸表における帳簿金額を超えた場合には、当該等投資の減値テストを行う必要がある。
31.2エクイティ
普通株は株式に分類される。新株またはオプションの発行に直接起因する増額コストは、利益から税項を差し引いた純額として権益に表示される。
任意のグループ会社が当社の権益ツールを購入する場合、例えば、株式買い戻しまたは株式ベースの支払い計画のため、支払われた対価は、任意の直接占有すべき増分コスト(所得税純額を差し引く)を含み、株式が抹消または再発行されるまで、株式としてグループ所有者が占有すべき権益から在庫株として差し引かれる。もしこのような普通株がその後再発行された場合、いかなる直接増加取引コスト及び関連所得税の影響を占めた後に受信したいかなる代価を差し引いても、本グループの所有者が権益を占めるべきであることを計上する。
これまでConnect Unionが保有していた株式を在庫株として開示し,Connect Unionが成立した目的は株式インセンティブ計画のために株式を保有することである.
31.3当期および繰延所得税
当期所得税支出又は相殺とは、各司法管轄区に適用される所得税税率に基づいて、一時的な差異と未使用税項損失に起因する繰延税項資産と負債変動調整の当期課税所得額である。
今期及び繰延税項は損益で確認されているが、他の全面収益又は権益の中で直接確認された項目に関係する者は除外される。この場合,税金もそれぞれ他の全面収益で確認または直接権益で確認される.
(a)当期所得税
現在の所得税費用は、当社及びその子会社が経営し、課税所得国が報告期間末に公布又は実質公布した税法に基づいて計算される。経営陣は税務法規の適用について説明しなければならない場合について定期的に申告表内の立場を評価し、税務機関が不確定な税務処理を受ける可能性があるかどうかを考慮する。本グループは最も可能な金額あるいは期待価値に基づいてその税金残高を計量し、どの方法が不確実性の解決をよりよく予測できるかに依存する。
実体が法に基づいて強制的に執行可能な相殺権利を有し、純額で決済するか、または同時に資産と決済負債を現金化しようとする場合、当期税金資産と税金負債は相殺される。
(b)所得税を繰延する
繰延所得税はバランスシート法を採用し,財務諸表における資産と負債の計税基準とその帳簿金額との間に生じる一時的な差を全額計上する。しかしながら、繰延税金負債が営業権の初期確認に生じた場合には、確認されない。繰延所得税は、業務合併以外の取引における資産または負債の初期確認に起因し、その資産または負債は、取引時に会計にも影響を与えず、課税損益にも影響を与えず、等しい課税と差し引くことができる仮差額が生じない場合には、繰延所得税には計上されない。繰延所得税は報告期間末に公布された或いは実質的に公布された税率(及び法律)に基づいて決定され、関連する繰延所得税資産の現金化或いは繰延所得税負債を清算する際に適用されることが予想される。
繰延税金資産は、将来課税額がこれらの一時的な差異や損失の利用に利用できる可能性がある場合にのみ確認されます。
繰延税金負債や資産は海外業務投資の帳簿金額や課税基準との一時的な差については確認されないが,本グループは一時的な差異の振り戻し時間を抑えることができるが,このような違いは予見可能な将来には振り戻されない可能性が高い。
法に基づいて強制的に執行可能な当期税項資産と負債を相殺する権利が存在し、かつ繰延税項残高が同一の税務機関に関係している場合、繰延税項資産と負債は相殺される。
投資免税額と類似の税収割引
グループ内の会社は、条件を満たす資産への投資または条件に適合した支出に関連する特別減税(例えば、研究開発税優遇または他の投資免税額)を申請する権利がある可能性がある。当グループは税額控除等の免税額、すなわち当該等の免税額を計上することで、所得税及び当期税務支出を減少させることができる。未使用の税額控除は繰延税項資産として確認されており、将来の課税利益が未使用の税額相殺に利用できる可能性が高いことが前提となっている。
31.4従業員福祉
(a)短期債務
賃金及び賃金の負債は、非貨幣福祉及び累積病気休暇を含み、従業員が関連サービスを提供する期間終了後12ヶ月以内にすべて弁済する予定であり、報告期間が終了した従業員サービスについて確認し、負債を返済する際に支払う予定金額に応じて計量する。負債は貸借対照表に他の売掛金及び売掛金項目における当期従業員福祉債務として示されている。
(b)固定払込計画
固定納付計画については、米国国税法第401(K)条に規定されている納付計画を含め、当グループは強制的、契約性又は自発的な方法で公共管理の養老保険計画に入金を支払う。一度入金して支払うと、当グループにはこれ以上の支払い義務はありません。これらの貢献は
満期時に従業員福祉支出として確認された。前払い入金は、現金返金や将来の支払いが減少した場合に資産として確認されます。
本グループが中国で登録設立した付属会社は、その従業員の賃金のある割合で月ごとに中国関係政府機関組織の固定出資退職福祉計画に入金する。政府当局はこのなどの計画に基づいてすべての現有と未来の退職従業員に支払わなければならない退職福祉責任を負担することを承諾したが、本グループはすでに提供した以外に、他の退職後の福祉責任はない。これらの計画に対する支払いは発生時に費用を計上する。この計画の資産は政府当局が保有·管理し,本グループの資産と分離している。
(c)住宅積立金と医療保険
当グループの中国従業員は各種政府が監督する住宅積立金と医療保険に参加する権利がある。本グループは従業員の給料のあるパーセントに基づいて月ごとにこれらの基金に支払いますが、ある上限に制限されなければなりません。当グループの当該等基金に対する負債は毎期対応の供出に限られ、満期時に従業員福祉支出として確認されている。
31.5資産とレンタルの使用権
使用権資産には土地使用権とオフィスビル賃貸が含まれている
中国国内のすべての土地は中国大陸部政府が所有している.中華人民共和国政府は一定期間内に土地使用権を譲渡することができる.土地使用権の購入価格は、中国政府に支払われた賃貸前金を代表し、貸借対照表に使用権資産として入金される。使用権資産は残りの賃貸期間内に償却する。二零二一年、当グループは中国政府から蘇州太倉、中国に位置する土地使用権を購入した。その後、2023年に、本グループはその建築プロジェクトを終了し、土地使用権を中国政府に返却した。
当グループレンタルオフィスでは、レンタル契約の固定期限は通常約2至れり尽くせり4何年もです。契約書はレンタルと非レンタルコンテンツを同時に含むことができます。本グループは、リース及び非リース組成物の相対独立価格に基づいて契約中の対価格をリース及び非リース組成物に分配する。しかし、本グループがテナントである不動産賃貸については、本グループは賃貸と非賃貸構成要素を分離するのではなく、単一賃貸構成要素として計算することを選択している。
レンタル条項は個人ベースで協議されています。賃貸者が保有する賃貸資産上の担保権益を除いて、賃貸契約はいかなる契約も押し付けない。賃貸資産は借入担保として使用してはならない。
レンタルによって発生した資産と負債は最初に現在値で計量される。レンタル負債には、以下のレンタル支払いの正味現在価値が含まれています
•固定支払い(実質固定支払いを含む)から任意の受取賃貸報酬を減算すること
•指数またはレートに基づく可変レンタル支払いは、最初に開始日までの指数またはレートを使用する
•本グループは、剰余価値保証に基づいて支払うべき金額を保証する
•購入オプションの使用価格(本グループがこのオプションを行使することを合理的に決定するように);および
•賃貸借終了の罰金を支払う(たとえばレンタル期間はグループがその選択権を行使することを反映する).
合理的に決定された延期に応じて支払いを選択するレンタル金も負債の計量に含まれる。
レンタル支払いはレンタルに隠された金利を使用して割引します。この金利を簡単に決定することができない場合(本グループ賃貸は一般的にこのように)、テナントの漸増借入金利、すなわち個別テナントが類似した経済環境下で、使用権資産価値に応じた資産を使用するために支払う借入金金利を類似条項、担保及び条件で借り入れる。
レンタル支払いは元本と融資コストの間で分担します。融資コストは、期間毎の負債残高に対して一定の定期金利を発生させるために、リース期間内の損益に計上される。
使用権資産はコストで計量され、コストは以下のようになる
•賃貸負債の初期計量金額
•開始日または前に支払われた任意のレンタル支払いから受信された任意のレンタル報酬を減算すること;
•どんな初期直接コストでも
•修復コスト。
使用権資産は一般に資産使用年数やリース期間の短い時間で直線減価償却される。本グループが購入選択権を行使することを合理的に決定すれば,使用権資産は対象資産の耐用年数内で減価償却される.
短期賃貸およびすべての低価値資産賃貸に関連する支払いは、直線法で損益費用とみなされる。短期賃貸とは、レンタル期間が12ヶ月以下の賃貸契約のことで、購入選択権がありません。
31.6細分化市場情報
部門の決定は,首席運営意思決定者(“CODM”)に提出された内部報告に基づく。本グループのCEOは本グループの共同創設者である.本グループはその業務を異なる部門に分類するのではなく,CODMは本グループの全体的な業務運営および管理を1つは分部、これは集団の内部組織や報告制度と一致する。本グループには何の収入もなく、基本的にすべての非流動資産は登録地以外の中国国内に位置している。
1株当たり純損失31.7
(a)1株当たりほぼ純損失
1株当たりの基本損失の計算方法は:
•本グループの所有者は損失を占めなければならず、普通株以外のいかなる株式サービスコストも含まない
•この財政年度内に発行された普通株の加重平均(在庫株を除く)
(b)薄めて1株当たり純損失
1株当たり損失調整を希釈して、1株当たりの基本損失の数字を決定するために使用され、以下の要素を考慮する
•希釈性潜在普通株に関する利子及びその他の融資コストの所得税後影響、及び
•すべての希釈性潜在普通株を変換した後,発行された余分な普通株の加重平均を仮定する.