カタログ表
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表:
(マーク1)
| | 1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度まで
| | 1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
_の過渡期:
手数料書類番号:
| MONOPAR治療会社です。 | ||
| (登録者の正確な氏名はその定款に記載) |
| | | |
| (登録設立又は組織の国又はその他の管轄区域) | (税務署雇用主身分証明書番号) | |
| | | |
| (主にオフィスアドレスを実行) | (郵便番号) |
(
(登録者の電話番号、市外局番を含む)
同法第12条(B)に基づいて登録された証券:
| クラスごとのタイトル | 取引 記号 | 各取引所名 それに登録されている | ||
| | | “ウォールストリートジャーナル” (ナスダック資本市場) |
同法第12条(G)に基づいて登録された証券:
ありません
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください。はい、そうしません
登録者がこの法第13節または第15節(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示す。はい、もう成功しました
再選択マークは、登録者(1)が過去12ヶ月以内に(または登録者がそのような報告を提出することを要求するより短い時間以内に)1934年の証券取引法第13条または第15条(D)が提出を要求したすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合してきたことを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出および掲示を要求されたより短い時間)に、S−Tルール405(本章232.405節)に従って提出を要求した各対話データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
| 大型加速ファイルサーバ | ☐ | ファイルマネージャを加速する | ☐ | ||
| | ☒ | 規模の小さい報告会社 | | ||
| 新興成長型会社 | |
新興成長型企業であれば、登録者が、取引法第13(A)節に提供された任意の新しいまたは改正された財務会計基準を遵守するために、延長された移行期間を使用しないことを選択するか否かを再選択マークで示す
登録者が報告書を提出したかどうかを再選マークで示し、その経営陣が“サバンズ·オクスリ法案”(“米国法典”第15編7262(B)節)第404(B)条に基づいて、その監査報告書を作成または発表する公認会計士事務所の財務報告内部統制の有効性を評価した
証券が同法第12条(B)に基づいて登録されている場合は,登録者が届出中の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示す
これらのエラーのより真ん中に登録者の任意の幹部が関連回復中に§240.10 D−1(B)に従って受信されたインセンティブベースの報酬に基づいて回復分析を行う必要があるかどうかを再選択マークで示す。☐
登録者が空殻会社であるか否かをチェックマークで示す(同法第12 b-2条で定義される)。はい、そうです
非関連会社が保有する投票権と無投票権のある普通株の総時価を説明し,その算出方法は,前回の普通株売却価格,あるいは登録者が最近完了した第2財政四半期の最終営業日までのこのような普通株の平均入札と要件を参照する。2023年6月30日現在,登録者の非関連会社が保有する投票権と無投票権普通株の総時価は$である
2024年3月8日まで、私たちの普通株当たりの流通株数は以下の通りです
| クラス: | 流通株数 | |
| 普通株は一株当たり0.001ドルの価値があります | |
参照によって組み込まれたファイルは以下のとおりである:なし。
MONOPAR治療会社です。
カタログ
| ページ |
|||||
| 第1部 |
|||||
| 第1項。 |
業務.業務 |
7 |
|||
| 第1 A項。 |
リスク要因 |
23 |
|||
| プロジェクト1 C。 | ネットワーク·セキュリティ | 23 | |||
| 第二項です。 |
属性 |
58 |
|||
| 第三項です。 |
法律訴訟 |
58 |
|||
| 第II部 |
|||||
| 五番目です。 |
登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
59 |
|||
| 第七項。 |
経営陣の財務状況と経営成果の検討と分析 |
59 |
|||
| 第八項です。 |
財務諸表と補足データ |
69 |
|||
| 第九項です。 |
会計と財務情報開示の変更と相違 |
69 |
|||
| 第9条。 |
制御とプログラム |
70 |
|||
| プロジェクト9 B。 |
その他の情報 |
70 |
|||
| 第三部 |
|||||
| 第10項。 |
役員·幹部と会社の管理 |
71 |
|||
| 第十一項。 |
役員報酬 |
74 |
|||
| 第十二項。 |
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
80 |
|||
| 十三項。 |
特定の関係や関連取引と取締役の独立性 |
83 |
|||
| 14項です。 |
チーフ会計士費用とサービス |
84 |
|||
| 第IV部 |
|||||
| 第十五項。 |
展示品と財務諸表の付表 |
85 |
|||
前向きに陳述する
このForm 10−K年次報告書には、“1933年証券法”(改正)第27 A節と“1934年証券取引法”改正第21 E節で示された“前向き陳述”が含まれている。本年度報告10-K表では,歴史的事実に関する陳述を除いて,他のすべての陳述は前向き陳述である.“希望”、“信じる”、“予想”、“計画”、“求める”、“推定”、“プロジェクト”、“予想”、“予定”、“可能”、“可能”、“すべき”、“会する”、“会する”、“継続する”、および同様の表現は、前向き陳述を識別することを目的としている。以下の不確定性と要素などは未来の業績に影響する可能性があり、実際の結果は展望性陳述中の表現或いは暗示的な事項とは大きく異なる
| ● |
今後12ヶ月以内に十分な資金を調達して、進行癌のためのMNPR-101の放射性薬物の持続的な臨床開発を支援することができ、進行中の1 b期用量漸増研究の積極的なデータの支援が得られれば、Camsiruicinの臨床開発およびMNPR-202および関連化合物の臨床前開発を継続し、将来的に臨床試験を完了することによって、任意の将来の製品候補計画を支援するための追加資金を調達する能力と、現在および未来の製品候補計画が承認手続きおよび(適用されれば)商業化される能力をサポートする能力がある; |
| ● | 私たちは、2024年8月26日までの10取引日(おそらく最大20取引日)の株式の終値が少なくとも1.00ドルであることを要求するナスダック上場基準を再遵守することができ、入札不足を補うために逆株式分割を実施する必要があれば、私たちの株価への不確定な影響、またはより多くの時間が必要であれば、ナスダックに追加時間を請求する能力を得ることができる |
| ● | 受け入れ可能な条件で資金を調達する能力は |
|
|
● |
私たちは受け入れ可能な財務条件の下で適切な1つ以上の製薬パートナーを見つけて、私たちの発展努力を推進することができる |
| ● |
臨床前研究、臨床試験、監督提出、および製造と品質費用を含む、私たちまたは私たちの開発パートナーの研究開発活動に関連するリスクと不確実性 |
| ● |
新たな放射性薬物療法やイメージング剤の開発に関連する既知および未知のリスク |
| ● |
私たちの臨床試験と規制審査承認の上場の推定時間枠は不確定である |
| ● |
私たちは現在または未来の候補薬の賞味期限が限られている可能性があることによる履行と後方勤務の挑戦に対応できるかどうか |
| ● |
私たちは合理的な価格で十分な放射性同位体供給を得ることができます。私たちは現在使用しているか、あるいは私たちの候補薬に入れているかもしれません。この供給はロシア-ウクライナ、イスラエル-ハマス間の戦争、および他の不確定な経済と市場の影響を受ける可能性があるからです |
| ● |
私たちが発売許可を得た任意の製品の定価、有効性、安全性の面での市場受容率と競争力、および私たちはより大きな製薬会社と比較して競争力を持ってこのような製品をマーケティングする能力がある |
前向きな陳述(続)
| ● |
商業化、営業化、製品化の難点と全体戦略 |
| ● |
新たな発見と特許出願を含む知的財産権の地位と戦略の不確実性 |
| ● |
私たちは経験と合格のあるキーパーソンを誘致し、維持し、あるいは外部経験、専門知識及び科学、医学と商業化知識の能力を探し、利用して、製品開発と新製品の商業化を完成させる |
| ● |
私たちが推定した必要な費用レベル、資本要求、および許容可能な条件で必要な追加融資を得るための固有のリスク |
| ● |
政府の医療や薬品の制御を強化し、直接価格制御を招いて価格低下を推進し、治療や画像化製品の販売コスト要件や構造に影響を与える政府法規、および最近他の業界に影響を与える政府立法を含む政府の法律法規の影響は、間接的に商品やサービスを得るコストと私たちの資本コストを増加させる可能性がある |
| ● |
新冠肺炎または別の大流行のいかなる復興も、臨床計画を推進し、追加資金を調達する能力に不確定な影響を与える可能性がある |
|
| ● |
国内と世界のインフレの累積影響、金融市場の変動および/または景気後退の可能性は、私たちが商品やサービスを得るコストを増加させたり、私たちがより受け入れられない条件を作ったり、融資を受けることができないようにしたりする |
| ● |
ロシア-ウクライナ戦争またはイスラエル-ハマス戦争が私たちの臨床材料製造費用とスケジュール、ならびに一般経済、貿易、金融市場状況に与える不確定な影響; |
| ● |
我々の財務予測と運営スケジュールや新たな競争力のある製品や技術の開発には不確実性がある。 |
私たちはこれらの展望的陳述で決定されたリスク評価が適切だと考えているにもかかわらず、このようなリスクが現実になる保証はない。警告的陳述は、本年度報告においてForm 10−Kの形態で開示され、前向き陳述に関連する“第1 A項--リスク要因”というタイトルの陳述を含むが、これらに限定されない。私たちまたは私たちを代表する人たちに起因するすべての後続の書面と口頭前向き声明は、警告声明によって明確に完全に制限されている。本年度報告書のForm 10-Kまたは他の形態で行われた任意の陳述を更新する義務はないが、法的に別の要求がない限り、いかなる前向きな陳述にも限定されない。
本年度報告(Form 10-K)の任意の前向き表現は、既知と未知のリスク、不確定性および他の要素に関連して、未来の事件または私たちの未来の財務表現に対する私たちの現在の見方を反映しており、私たちの実際の結果、業績または業績は、これらの前向き表現が明示的または暗示している任意の未来の結果、業績または達成とは大きく異なる可能性がある。推定,予測,予測,市場研究や類似方法に基づく情報自体が不確実な要因の影響を受け,実際のイベントや状況はその情報で予測されたイベントや状況と大きく異なる可能性がある.
リスク要因をまとめる
我々の業務は、本年度報告10-K表の他の部分の“第1 A項--リスク要因”で強調されたリスクおよび不確定要因を含む多くのリスクおよび不確定要因の影響を受ける。他にもこれらのリスクには
| ● |
私たちは臨床段階のバイオ製薬会社で、財務赤字の歴史があります。予測可能な未来には引き続き大きな損失を被ることが予想され、現金の自給自足や収益力を永遠に実現または維持できない可能性があり、これは私たちの普通株の時価低下を招く可能性がある。 |
| ● |
これまでに調達された資金は,計画の第1段階臨床試験以外に進行癌のMNPR−101の臨床開発を支援するには不十分であり,進行中の1 b期用量漸増研究の積極的なデータの支持が得られれば,Camsiruicinの臨床開発とMNPR−202と関連化合物の臨床前開発を継続する。私たちが今後12ヶ月以内に私たちの普通株や他の融資努力によって十分な資金を集めることができない場合、または私たちの候補製品の許可を超えたり、臨床的または商業的パートナー関係を達成するような戦略的合意や協力を達成できない場合、私たちは1つまたは複数の計画を優先的に考慮および/または終了しなければならないかもしれない。私たちは私たちが満足できる条件でこのような融資を受けたり、適切な開発パートナーを見つけることができるという保証がない |
| ● |
我々のValidive臨床試験は2023年3月末に終了し、私たちの株価を下落させた。私たちの株の終値は30以上の取引日連続で1.00ドルを割って、2023年8月28日、私たちはナスダックの上場基準を満たしていないとナスダックの通知を受けて、180日間コンプライアンスを回復してくれました。2024年2月27日、我々はナスダックから180日間の追加コンプライアンス期間を与える通知を受けた。2024年8月26日までにコンプライアンスを回復したり、延長締め切りの控訴を受けることができなければ、退市や株式逆分割が必要となり、株価や融資能力に深刻な悪影響を与える可能性があり、これは私たちの業務を延期、再編、あるいは他の方法で再検討する可能性がある。入札不足を補うために逆株式分割を行う必要がある場合、私たちの株価への影響は不確定であり、不利かもしれない。 |
| ● |
私たちは持っていないし、承認された製品は決して発売されないかもしれない。私たちの業務は米国や国際政府機関から得られたマーケティング承認に強く依存しており、私たちが候補製品の製造·販売の承認を得なければ、私たちの業務は深刻な損害を受けることになります。 |
| ● |
私たちの臨床試験は十分な確実な結果を出さないかもしれません。監督機関に私たちの製品のマーケティングと販売戦略を承認させて、これは私たちの財務状況に不利な影響を与えます。 |
| ● |
患者を臨床試験に参加させる際に遅延や困難に遭遇した場合、必要な規制承認を受けることは延期または阻止され、計画スケジュールを深刻に延期し、財務状況に悪影響を及ぼす可能性がある。 |
| ● |
もし私たちまたは私たちの許可者、開発協力者、またはサプライヤーが十分な数量または定義された品質仕様で私たちの製品を製造できない場合、あるいは製造施設の監督管理の承認を得ることができない場合、私たちは私たちの製品の需要を開発および/または満たすことができず、上場時間と潜在収入を損失する可能性があります。 |
|
|
|
|
|
| ●
|
私たちは合格した第三者に基づいて、私たちの活性薬物成分の製造、私たちの薬物製品の製造、非臨床研究と臨床試験を行った。これらの第三者が彼らの契約義務を成功裏に履行できず、予期された期限または性能目標を達成できない場合、私たちの臨床試験の開始や進行が延期され、現在の候補製品や未来の製品に対する規制部門の承認を得ることができないか、または商業化される可能性があり、私たちの財務状況は悪影響を受けるだろう。 |
|
| ● |
放射性薬物技術は癌イメージングと治療の比較的新しい方法であり、これは放射性同位体の利用可能性、放射性薬物の安全性に対する潜在的な誤解、およびその新規性による市場受容度が低いなど、重大で潜在的な予測不可能な挑戦をもたらす可能性がある。私たちが私たちの放射性薬物計画に集中するにつれて、これらの挑戦に対する見方は資金調達の難しさを増加させる可能性がある
|
リスク要因の概要(継続)
| ● |
露烏戦争、それに伴うロシアとロシアの実体への制裁、ロシアはEUや他の同盟国への天然ガス輸送を減少させ、燃料コストを増加させ、重要な供給の獲得を減少させ、輸送遅延を招く可能性がある。また、イスラエルとハマスの戦争はより多くの不確実性を創出した。より広範な経済、貿易、金融市場の結果は現在まだ確定されておらず、これは私たちの臨床材料の供給コストを増加させ、私たちの臨床材料の生産を延期し、放射性同位体の獲得可能性を制限し、他の商品やサービスのコストを増加させるか、あるいは追加資金の調達をより困難またはより高価にする可能性があり、これらのいずれも私たちの臨床プロジェクトや財務状況に悪影響を及ぼす可能性がある。 |
|
|
|
||
| ● |
市場変数、例えば製品コスト、労働力価格と燃料、運賃とエネルギーコストのインフレ、および地政学的事件は、私たちの運営と管理費用を大幅に増加させる可能性がある。 |
|
|
|
||
| ● |
銀行の安定性への懸念による市場変動や、インフレによる経済的課題など、不安定な市場や経済状況は、資金調達能力に深刻な悪影響を及ぼす可能性があり、運営を延期、再編、または停止させる可能性がある。 |
|
|
|
||
| ● |
薬品価格を低下させる経済的及び政治的圧力の影響は研究に基づく新薬品の経済生存能力に対する主要な脅威であり、薬品価格のいかなる大幅な低下も我々の研究製品の財務的魅力と追加資本調達の将来性に実質的な悪影響を与える可能性がある。 |
|
|
|
||
| ● |
我々の目標医療適応では,他の放射性製薬,バイオテクノロジー,製薬会社,研究に基づく学術医療機関からの激しい競争に直面しており,効率的な競争ができなければ,我々の経営業績は悪影響を受ける。私たちの業界の多くの競争相手は、より強力な組織能力、より高い利用可能な資本資源、およびターゲット市場で確立されたマーケティングと販売資源と経験を持っている。競争と技術的変化は私たちの候補製品を時代遅れにしたり、競争力を欠いたりするかもしれない。 |
| ● |
サードパーティライセンスの終了は、私たちの製品の開発およびマーケティングに必要な重要な化合物または技術の権利に悪影響を及ぼすでしょう。 |
| ● |
もし私たちと私たちの第三者許可者が私たちそれぞれの知的財産権を獲得して保護することができなければ、私たちの競争相手はそれと競争する薬物を開発して販売する可能性があり、これは私たちの財務状況に悪影響を及ぼすだろう。 |
| ● |
私たちが重要な管理リーダーシップ、および/または私たちの科学者の専門知識や経験を失った場合、将来のニーズを満たすために合格した従業員や他の高い素質と経験の豊富な人員を募集できなければ、重大なプロジェクトの遅延や運営や報酬コストの増加のリスクに直面し、私たちの業務は深刻な妨害を受けることになります。 |
| ● |
新冠肺炎或いは任意の他の疫病の未来或いは長期影響は依然として不確定であり、その範囲と影響は著者らの業務、財務状況、経営業績、株価と追加資金を調達する能力に重大なマイナス影響を与える可能性がある。 |
第1部
プロジェクト1.ビジネス
以下の議論は、2023年12月31日までの財務諸表および本年度報告書の他の場所にForm 10-K形式で含まれるこのような財務諸表の付記に関連して読まなければなりません。
概要
私たちは臨床段階の生物製薬会社で、癌患者のための革新的な治療法の開発に専念している。我々は,内部開発や臨床前後期と臨床開発段階で治療薬の許可と調達を得ることで候補薬物パイプラインを構築している。著者らは著者らの科学と臨床経験を利用してリスクを低減し、著者らの候補薬物の臨床開発を加速することを助ける。
我々は現在,1)MNPR−101−Zr,臨床段階UPAR標的放射線診断イメージング剤,2)MNPR−101−RIT,進行癌治療の臨床前末期放射線治療薬,3)Camsiiruicin(MNPR−201,GPX−150の一般名,5−imino−13−デオキシアドリアマイシン),1 b期臨床段階の新規アドリアマイシン類似体,抗癌活性を維持しながら心臓への毒性作用を最小限に抑えるように設計された新規アドリアマイシン類似体,および4)早期Camsiruicin類似体,MNPR−202,各種癌用に開発されている
私たちの製品ライン

私たちの候補製品
放射性製薬用MNPR−101
我々のMNPR-101放射線薬計画は、尿キナーゼ型プラスミノーゲン活性化剤受容体(“uPAR”)を発現する進行癌のために我々によって開発された。この特許の一流の放射線薬計画は、大多数の三陰性乳癌、結腸直腸癌、膵臓癌を含むuPARを発現する腫瘍を識別し、選択的に死滅させることを目的としている。この計画は,放射性同位体ペイロードを腫瘍に正確に輸送する手段として,MNPR−101を用いて,我々独自のuPARに対するヒト化モノクロナル抗体である。我々はすでにMNPR-101放射性薬物計画に有望な臨床前データを示した。uPARを発現する三陰性乳癌、結腸直腸腫瘍、膵臓腫瘍の臨床前ヒト腫瘍移植マウスモデルの陽電子放出断層撮影(“PET”)画像データは、イメージング放射性同位体ジルコニウム-89(“MNPR-101-Zr”)に結合したMNPR-101の選択性と持続性の摂取を示している。また,臨床前にMNPR−101を用いて治療用放射性同位体(“MNPR−101−RIT”)に結合した三陰性乳癌と膵癌マウスモデル研究は良好な抗腫瘍活性を示した。全体的に、臨床前イメージングおよび治療効果の研究結果は、MNPR-101が正確な標的放射性薬剤として、複数の癌適応のイメージングおよび治療において潜在的な使用を有することを示している。著者らはオーストラリアで進行癌患者のMNPR−101−Zrの最初の第1段階用量学的臨床試験を積極的に目指している。
MNPR-101はuPARを選択的に結合するために設計されている.UPARは乳癌、膵臓癌、結腸直腸癌を含む多くのタイプの腫瘍に高度に発現しているが、多くの正常細胞には発現していない。97%の乳癌、89%の膀胱癌、87%の膵臓癌、85%の結腸直腸癌患者において、腫瘍および/または腫瘍関連細胞がuPARを発現していると推定されている。また、いくつかの進行癌患者の第1段階PETイメージング研究では、uPARは腫瘍でしか検出されず、正常組織では検出されず、放射性薬物を含む癌治療の潜在的に魅力的な標的となっていることが明らかになった。
2024年2月、オーストラリアでヒト研究倫理委員会(HREC)の承認を得て、進行癌患者に対するMNPR-101-Zrの第1段階線量学的試験を開始した。全身PET/CT(陽電子放出断層撮影-コンピュータ断層撮影)イメージングを用いて腫瘍摂取、正常臓器の生物分布、安全性を評価する。この研究はメルボルン体感革新センター(MTIC)で行われ,MBBS(Hons),MD,FRACP,FICIS,FAAHMSのRodney Hicks教授が指導し,世界で最も鋭敏な臨床全身PET/CTスキャナの一つであるシーメンスBioggraph Vision Quadraを用いてMNPR−101−Zrの癌患者における標的能力をイメージングする。約12人の患者を募集する予定の第1段階臨床試験において、腫瘍の摂取、生物学的分布、および安全性が鼓舞的に見える場合、我々は、Ac-225(Ac-225またはAc)のような放射性標識同位体を使用した治療バージョンのMNPR-101のヒトにおける治療効果を評価する予定である。
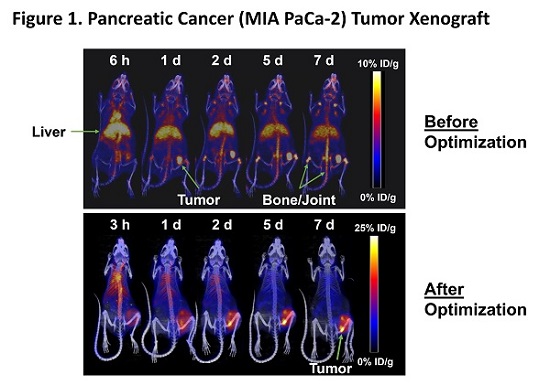
臨床前研究進展概要
2024年2月、我々はMNPR-101放射性薬物イメージングおよび治療剤の良好な臨床前データを発表し、uPARを発現する腫瘍における高度な選択性と持続的な摂取、およびヒト腫瘍異種移植マウスモデルにおける強力な抗腫瘍作用を示した。放射線薬物治療において、正常組織に対する腫瘍の投与量を最大限に増加させることは重要である。以下の図1にMNPR−101−Zr最適化前後の様子を示す。MNPR-101-Zrはジルコニウム標識型のMNPR-101であり、uPARを発現する末期固形腫瘍の治療のための新しい放射性薬物イメージング剤が開発されている。Monoparの内部放射性薬物開発チームは、MNPR-101-Zrの摂取を著しく増加させるとともに、健康組織の摂取を最小限にすることができる。この臨床前PET配列成像時系列に示すように。高度な特異性と持続的な腫瘍摂取は最適化した後下のパネルです。
 |
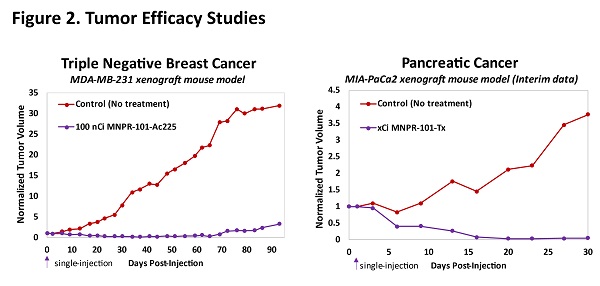
今までの臨床前データにより、治療用放射性同位体に結合したMNPR-101は納得でき、持続的な抗腫瘍利益を有することが示された。以下の図2は、MNPR-101に結合した2つの異なる治療用放射性同位体を使用した三陰性乳癌(左)および膵臓癌(右)ヒト腫瘍異種移植マウスモデルにおける臨床的前治療効果データを示し、これらの放射性同位体のうちの1つはAc-225として開示されている。両研究の結果とも,放射性薬物の単回投与後,腫瘍はほぼ完全に消失した。これらの研究はMNPR−101に基づく放射性薬物が癌患者に非常に意義のある臨床的利益を提供する潜在力を証明した。
 |
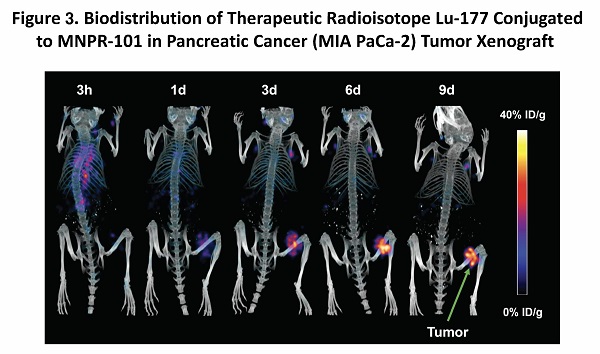
MNPR-101に結合した治療用放射性同位体の生物分布を可視化するために、プルトニウム-177(“Lu-177”)が使用された。図3は、Lu-101に結合した治療用放射性同位体を用いた連続SPECTイメージング時系列(“単一光子放出コンピュータ断層撮影”)の結果を示している。MNPR-101-Luの腫瘍におけるMNPR-101-Luの高特異性と持続的な摂取は、正常組織に対して明らかであり、MNPR-101に結合した治療的放射性同位体を一回投与した後に腫瘍がほぼ完全に除去された現象の説明に役立つ。
カシルビシン(5−イミノ−13−デオキシアドリアマイシン;前MNPR−201,GPX−150)
Camsiiruicinはアドリアマイシンの新型類似体であり、アドリアマイシンによる心臓毒性副作用を減少させ、同時に有効な抗癌活性を維持することを目的としている。前のカシルシン2期臨床試験の投与量は265 mg/mに達しました2末期(例えば、切除不能または転移性)軟組織肉腫(“AST”)患者において各周期を完成させる。これらの患者の平均期待寿命は12−15カ月であった。この以前の研究では、52.6%の腫瘍進展を評価可能な患者は、用量に比例し、より高い累積用量(>1000 mg/m)で持続的に観察された臨床的利益(部分的緩和または安定)を示した2)である。この研究では,カシルビシン耐性が良好であり,AST患者において累積用量制限を受けずにカルバシルビシンを潜在的に使用する能力を強調した。40年以上の間アドリアマイシンはASTの標準治療薬であったが、アドリアマイシンの生涯累積用量の上限は450 mg/mであった2これは不可逆的な心臓毒性を引き起こすリスクが存在するためである。したがって,患者がアドリアマイシンに反応しても,生涯累積投与量に達すると治療は停止する。
アドリアマイシンと異なり,CamsiiruicinはトポイソメラーゼII−αに対して選択的である。アドリアマイシンは、軟組織肉腫、乳癌、胃癌、卵巣癌および膀胱癌、白血病およびリンパ腫を含む成人および小児実体および血液(血液)癌の治療に使用される。臨床研究により、高累積用量のアドリアマイシンは抗癌にメリットがあるが、アドリアマイシンの臨床治療効果は以前から患者の不可逆的な、潜在的に生命を脅かす心臓毒性のリスクの制限を受けている。例えば、1990年代に完成したいくつかの臨床研究によると、アドリアマイシン(60 mg/m)の併用は2転移性乳癌患者ではパクリタキセルの総有効率は94%であったが,18%の患者がうっ血性心不全に進展した。アドリアマイシンを4−6クールに減少させることでうっ血性心不全の発生率を低下させるが,応答率も45%−55%に低下した。用量反応を観察する臨床研究では,肉腫患者は高用量(75 mg/m)を服用している2アドリアマイシンの有効率は37%であったが,小用量(45 mg/m)の有効率は18%であった2アルギニングループです。アドリアマイシンの累積投与量制限下で、ASTS患者の平均無進展生存期間は約6ケ月であり、平均総生存期間は12-15ケ月であった。アドリアマイシンの代替品を開発するための重大な満たされていない機会があり、より高い用量とより長い時間で抗腫瘍活性を向上させることができる。
Camsiiruicinはアドリアマイシンの抗癌活性を保持するために設計されたものであり、同時に心臓に対する毒性作用を最小限に低下させる。アドリアマイシンと類似して,Camsiiruicinの抗腫瘍作用は,DNA鎖断裂後に安定したトポイソメラーゼII複合体とDNA挿入による腫瘍細胞アポトーシス(細胞死)により実現されている。トポイソメラーゼII−αサブタイプの抑制は抗癌効果に必要であるが、トポイソメラーゼII−βサブタイプの抑制は、現在臨床で使用されているすべてのアントラサイクリン系薬剤の心臓毒性を少なくとも部分的に媒介することが証明されている。トポイソメラーゼII−αやトポイソメラーゼII−βを抑制する上で,Camsiiruicinはアスペルギナーゼよりも高い選択性を示した。この選択性は,これまで臨床前や臨床研究で観察されてきたカシール星の最小の心臓毒性を部分的に説明している可能性がある。これらの特性は,累積投与量に潜在的な制限を加えることなく,単一療法としてのカシルシンの開発や他の抗癌剤との併用に強力な理由を提供し,広範な癌型でカシル星を追求する巨大な市場機会を提供していると考えられる。
カシル·ビシン臨床資料
カシール星の2つの臨床研究が完了し、1つは現在進行中である。
2013年10月、アイオワ大学が行った第1段階用量アップグレード研究は、14~265 mg/mの8種類の異なる用量のうちの1つを受けた24人の患者の登録を完了した2それは.これらの患者の中には、アントラサイクリン系薬剤(アドリアマイシンまたは関連分子)の治療を以前に受けた4人の患者を含む不可逆的な心臓毒性の証拠は認められなかった。この第1段階の研究では,55.0%の患者が4名の患者のうち3名を含む55.0%の患者の病態が安定しており,結合組織と平滑筋から起源する軟部組織肉腫であり,最もよく見られるのは子宮,胃,小腸である。患者は増殖因子支持(G−CSF)を投与せず,制限毒性は好中球減少であった。
2015年1月、多中心開放ラベル単一アーム第二段階臨床試験がアドリアマイシン欠乏AST患者で開始された。この二期臨床試験は22名の患者を募集し,2016年8月に完成した。カシルビシンは265 mg/mの速度で静脈注射した23週間ごとに最大16剤,すべての患者で成長因子が支持されており,この耐性の良好な用量とスケジュールで抗癌活性があることが明確に示唆されている。大多数(52.6%)の腫瘍進展を評価できる患者は臨床的利益(病状の安定或いは部分的緩和)を示し、これは用量に比例し、比較的に高い累積用量(>1000 mg/m)で持続的に観察された2)である。6ケ月の無進展生存率は38%であり、最近の3つの研究中のアドリアマイシンの6ケ月無進展生存率より高く、後者はアドリアマイシンの6ケ月無進展生存率はそれぞれ23%、25%と33%であることを示した。この研究では,カシールビシンの耐性が良好であり,AST患者におけるカシオ星の潜在能力を使用しており,累積用量に制限はないことを強調した。Tシャツ使用の場合,1名の患者は20周期のカルバシルシン(累積投与量5300 mg/m)を受けた2)である。1例の患者は発熱性好中球減少症と深刻な白血球減少症が出現した以外、4級毒副作用の報告がなく、貧血以外に3級副作用がなかった。カシルシン治療を受けた4名の患者では,一過性の左室駆出率(“LVEF”)の低下を認めた。カシルシン治療を受けた患者では,LVEFのこれらの低下は重篤な有害事象ではなく,一時的であり,その後4名の被験者全員が正常レベルに回復した。この研究の一部の被験者は20周期にわたるカシルシン治療を受けたにもかかわらず、心機能への影響は臨床的意義がなく、どの被験者も不可逆的な心不全があるという証拠もない。
以前の臨床結果に基づいて、2021年9月、著者らはアメリカで開放ラベルの1 b期用量増加試験、即ちCamsiruicinプラス成長因子支持(pegfilgratim/G-CSF)を開始し、AST患者の第一線の治療とした。その目的は,累積用量を制限せずにカシルビシンを投与し,患者の治療に対する反応を維持することで潜在的に治療効果を向上させることである。これらの患者は手術或いは放射線治療に適しておらず、主に転移性疾患患者から構成されている。アドリアマイシンはこれらの患者の現在の第一線の治療標準である。この1 b期の設計はカシルビシンの最大耐容量を決定するためであったが,アドリアマイシンが繰り返し証明した歴史的用量依存性抗腫瘍反応を考慮すると,用量の増加に伴い,これらの患者の奏効率測定が追跡されている。私たちは現在5回目の投与量レベルの患者を募集している。第5用量レベルは以前の任意の臨床試験で達成された最高用量(650 mg/m)の2倍以上である2265 mg/mと2).
MNPR−202及びその類似体
2021年6月、シンガポール国立大学(世界トップ大学の一つに選ばれてきた)のシンガポール癌科学研究所(“CSIシンガポール”)と協力協定を締結し、MNPR-202および関連類似体の多様な癌における活性を評価する。MNPR−202は、カシルビシンと同じ潜在的な非心臓毒性骨格を保持するように設計されているが、他の位置では、カシルシンおよびアドリアマイシン耐性のいくつかの癌において機能することができるように改造されている。2020年12月、我々は、MNPR−202および関連類似体をカバーする米国特許(US 10,450,340)の発行を発表した。CSIシンガポールはすでに臨床前癌モデルでMNPR-202をテストし、結果は人を奮い立たせた。
ライセンス、ソフトウェア開発、連携プロトコル
Xoma有限会社
我々のMNPR−101抗体を人間化するために,XOMA(US)LLCヒューマン技術とノウハウの非独占的許可を得た。ヒト化は、ヒト免疫系がこの抗体を外来抗体として認識する能力を最大限に減少させるために、抗体をヒト配列で置換したマウス配列の大部分の非重要部分を含む。したがって、MNPR-101は、XOMA技術を使用して95%のヒト配列に設計される。XOMA Ltd.との非独占許可条項によると、私たちは臨床、監督と販売マイルストーンによって費用を支払うだけで、もし私たちがすべてのマイルストーンを実現すれば、1492.5万ドルに達するかもしれない。協定は販売特許使用料の支払いを要求しない。私たちがどんなマイルストーンに到達するか保証できない。2024年3月8日現在、私たちは何のマイルストーンにも達しておらず、本ライセンス契約に基づいてXOMA株式会社に何の資金も支払うことを要求されていません。最初の記念碑的支払いは,第2段階臨床試験で初めてヒト患者に服薬したときに支払われた。
Onxeo S.A.
2016年6月、フランスの上場企業Onxeo S.A.とValidive(塩酸クロニジン膜;塩酸クロニジンMBT)の独占選択権を与え、Lauriad接着剤技術に基づくクロニジン接着シートを付与する協定を締結した。この協定には、臨床、規制、開発、販売マイルストーン、増加していく純売上高特許使用料が含まれている。2017年9月,OnxeoからValidive許可を得るオプションを行使し,価格は100万ドルであった.2023年3月27日,我々のデータ安全監視委員会が,あらかじめ定義された閾値,すなわちValidiveとプラセボが重篤な口腔粘膜炎の予防に15%の絶対差があることを決定したため,Validiveステージ2 b/3音声試験を中止した。私たちは許可や特許使用料義務は生じておらず、許可は2024年1月に終了した。
知的財産権の組み合わせと排他性
我々の戦略の重要な部分の1つは,我々の候補製品の独自性を保護し,他社が類似した競争エージェントを開発することを防ぐために特許保護を得ることである.私たちの特許の組み合わせにはアメリカと他の国で発行された特許と係属中の特許出願が含まれています。私たちの慣行は世界の主要市場で特許保護を求めることだ。
MNPR-101
我々のMNPR-101抗体(huATN-658)およびそのエピトープの特許の組み合わせは、米国で発行された2つの物質成分およびその使用方法特許と、EU、日本および他のアジア諸国を含む複数の外国司法管轄区域の対応する(付与され出願されている)特許および特許出願とを含む。これらの特許は私たちの所有です。MNPR-101物質組成をカバーする特許は2025年に満了し、MNPR-101エピトープをカバーする特許は2027年に満了する。新しい生物製品として、“生物製品価格競争と革新法案”(BPCI Act)によると、米国で12年の独占経営権を獲得する資格があり、多くの他の国や地域で異なる期限の類似独占経営権を受けることになる。MNPR−101(“uPRIT”)特許の放射線免疫治療デリバティブが付与されれば,2041年に満期となる。
特許有効期間の決定は,出願の提出日および特許法公布の他の要因に依存する。米国を含むほとんどの国/地域では,特許期間は通常,適用国/地域の非臨時特許出願の最初の要求提出日(優先日)から20年であり,将来提出可能な任意の潜在的特許期間の調整または入手可能ないかなる規制延期も考慮されていない。私たちのいくつかの特許は現在期限が切れそうで、私たちは適切な状況でこれらの特許の期限を延長したり、特許を無効にすることを求めているかもしれません。“リスク要因-私たちの知的財産権に関するリスク”を見てください。
放射性製薬用MNPR−101
北極星会社と協力して、著者らは2020年6月15日にアメリカ特許商標局に臨時特許出願を提出し、“尿キナーゼ型プラスミノーゲン活性化剤受容体(UPAR)の精確な放射免疫治療標的治療深刻な新冠肺炎病”と題する。一時的な出願日の優先権を要求する完全な国際出願(国際出願番号PCT/US 2021/037416)は、2021年6月15日に特許協力条約に基づいて提出された。この応用は,uPARに結合した抗体に付着した細胞毒性放射性同位体の新たな成分と用途をカバーし,重篤な新冠肺炎や他の気道疾患の治療に用いられるuPRITsとも呼ばれる正確な標的放射線療法を作成した。
2021年5月、私たちおよび北極星は、“Ac-225および製造方法を含む生物標的放射性医薬組成物”と題する臨時特許出願を米国特許商標局に提出した。放射性薬物療法は,タンパク質/抗体に結合した放射性同位体を用いて細胞を標的·殺傷する有望な癌や他の疾患を治療する方法である。さらなる評価によって検証されれば、Ac−225に基づく放射性薬物の治療効果および安全性を改善し、その製造効率を向上させる可能性があり、そのすべての潜在力は現在Ac−225の価格および希少性によって制限されている。
また2021年5月に、私たちと北極星は、“ウロキナーゼ型プラスミノーゲン活性化剤受容体標的放射薬物”と題され、我々の特許抗体MNPR-101が同位体結合剤PCTAを介してAc-225に結合した放射線治療薬を含む一時物質成分特許出願を提出した。この放射免疫反応は98%の放射化学純度と高い安定性を示し,多くの癌,重篤な新冠肺炎,その他のuPAR異常発現を特徴とする疾患を高選択的かつ有効に治療する方法となる可能性がある。
カシルーピー星
CamsiRubicin(GPX-150)は製造技術特許によって保護されている。私たちは、アドリアマイシン、ダウノマイシン、エピアドリアマイシンおよび伊達ビシンなどの心臓毒性の“13-オン”アントラサイクリンを新規で特許出願可能な心臓毒性の小さい“5-イミノ-13-デオキシ”類似体に変換するのに有効な化学合成技術の特許を有している。このような合成中間体のための新しい化学成分も特許されている。また,癌治療のためのCamsiruicinとパクリタキセルの組み合わせ,およびこれら2つの薬剤の使用方法をカバーする特許を有している。私たちのCamsiRubicin特許の組み合わせは、発行された8つの米国特許(うち2つが満期になっている)と、出願中の米国特許の8つを含む。私たちは29の外国司法管轄区に米国、EU、日本、その他のアジア諸国を含むいくつかの対応する特許と出願を持っている。合成アブラナ素中間体の技術特許は2024年に満期になり、アブラナ素及びその類似物とタキサンとの併用をカバーする特許は2026年に満期になる。この特許は2038年に満了する新しい、より効果的かもしれないCamsiruicin類似体をカバーする。私たちは適切な状況で特許期間を延長したり、特許を無効にすることを求めることができる。中間体とCamsiiruicinを製造するための方法の特許保護を得ており,後発薬競争を防止するためにHatch−Waxman独占経営権(新しい化学物質に適した)を5年間獲得する予定である。私たちはまたアメリカとEUが軟組織肉腫を治療する孤児薬の地位を獲得した。
MNPR-202
2020年12月、我々は、物質組成物(2-ピロリピン)を含む米国特許(US 10,450,340)を、新しいリコピン類似体ファミリーに発行することを発表した。この特許は,同社のCamsiiruicin知的財産組合を拡大し,特許期間の延長を含まず2038年に満了する予定である。この特許は、私たちのCamsiruicin製品の組み合わせを拡大し、Camsiruicinの潜在的に有利な非心臓毒性化学主幹とアドリアマイシンの強力な広域抗腫瘍活性を保持するための導管を作成した。また,臨床前証拠は,この新しい2−ピロリドン類似体ファミリーが抗アドリアマイシンの腫瘍細胞において活性を発揮する可能性があり,カルバシルシンが使用可能なタイプではなく癌タイプに使用できる可能性があることを示している。
製造業
我々は現在、MNPR−101放射性薬物計画、カシルビシン、またはMNPR−202を製造または試験するための製造施設を所有または運営しておらず、予測可能な将来に独自の製造事業を発展させる計画もない。私たちは現在、第三者契約メーカーに依存して、私たちの臨床前と臨床研究所に必要なすべての原材料、活性薬物成分(“原料薬”)と完成薬を提供している。我々は,我々の第1段階放射線治療計画における進行癌患者の治療のための臨床ロットのMNPR−101−Zrを生産している。また,我々が行っている1 b段階用量漸増カルバシルビシン臨床試験に用いられているカルバシルビシンの臨床ロット医薬製品の生産を完了した。
腫瘍学市場競争
製薬業界、特に腫瘍治療業界全体で、競争が激しい。私たちは製薬とバイオテクノロジー会社からの競争に直面しており、その中の多くの会社は私たちよりも規模が大きく、資金が十分である。我々は学術や政府実験室から新たな腫瘍療法を開発し,それを商業化する努力の中でも競争に直面している。我々が開発している療法は,商業化に成功すれば,市場に既存の療法や現在開発されている新しい療法や将来発見·開発可能な新しい療法と競争せざるを得ない。私たちの候補製品はまた、放射線治療の改善のような代替治療方式と競争しなければならず、これも絶えず革新と改善が必要である。より多くの情報は、“リスク要因-私たちの業務運営や業界に関連するリスク”と題する節で見つけることができます
MNPR−101放射性薬物プロジェクトコンテスト
治療用放射性同位体に結合したMNPR−101−ZrおよびMNPR−101を含むMNPR−101放射性薬物計画は、腫瘍学市場競争に関する本節の第1段落に記載されたすべての競合要因の影響を受けやすい。現在の進行癌患者の看護基準に加えて,我々の最も直接的な競争相手は,癌治療のための標的放射性薬物を開発している会社であると考えられる。いくつかの会社が癌治療の放射性薬物を開発しているが、これらに限定されないが、バイエル株式会社、百時美施貴宝社、礼来社、ノワ製薬会社、Actdium製薬会社、ジョンソン、トリックス製薬有限会社、ランセウスホールディングス、遺伝子テイク社、末期癌に対する標的放射性薬剤を開発しているいくつかの早期会社がある。UPARを標的とした放射性薬物については,デンマークバイオテクノロジー社CuraSightは現在,MNPR−101と比較してuPARに結合する異なるエピトープを有する抗体非ベースのuPAR放射線診断と放射線治療ペアを開発している。
カシル·ビシン大会
私たちのCamsiRubicin計画が承認されれば、アドリアマイシンの代わりにASTの第一線の治療薬になると信じている。また,CamsiRubicinは他の癌適応において市販のアントラサイクリン系薬剤のいくつかと競合すると考えられる。これらは、主にアドリアマイシンの誘導体、またはリポソームアドリアマイシン(例えば、ドシシ、ジョンソン販売)のようなアドリアマイシンの再製剤である。これらすべてに心臓毒性の問題がある。承認された製品のほかに、アドリアマイシンの新処方や派生商品を主に開発中の候補製品もある。
MNPR-202コンテスト
我々のMNPR−202計画は開発の初期段階であるため,腫瘍学市場競争に関する本節の第1段落に示したすべての競争要因の影響を最も受けやすい。
政府規制と製品審査
アメリカ連邦、州と地方の各レベル及びオーストラリアなどの他の国の政府当局は私たちが開発している製品の研究、開発、テスト、製造、品質管理、承認、ラベル、包装、貯蔵、記録、販売促進、広告、流通、承認後のモニタリングと報告、マーケティングと輸出入などの方面に対して広範な監督管理を行った。私たちが開発した候補薬品はアメリカ食品と薬物管理局(FDA)と治療商品管理局(TGA)の許可を得なければ、それぞれアメリカとオーストラリアで合法的に発売することができる。“リスク要素--臨床開発と監督管理審査に関連するリスク”を見た。
オーストラリアの規制枠組み
治療商品管理局は1989年の“治療商品法”と“治療商品条例”を通じて、オーストラリアの薬品と医療機器の治療効果、品質、安全性、タイムリーな獲得性を担当している。TGAの使命は“オーストラリアが提供した治療商品の安全性、品質と有効性を確保し、比較可能な国と同じ基準に達し、合理的な時間内に治療商品を発売前に評価する”ことである。TGAは臨床試験の2つの方法、すなわち臨床試験通知(CTN)と臨床試験承認(CTA)計画を管理している。これらの措置は“未承認の”治療物品を合法的に供給することができ、人体実験目的にのみ使用できる経路を提供した。どの経路(CTNまたはCTA)を選択するかは,まずオーストラリアの臨床試験スポンサー,次いでその案を承認する人間研究倫理委員会(“HREC”)に依存する。
薬物や生物製品の臨床試験は通常開発された“段階”を経ており,通常は段階1(ヒト薬理学),段階2(治療探索),段階3(治療確証)に従う。第4段階は発売後のモニタリング或いは治療不確実性の解決に応用できる。臨床開発経路は段階的にそれほど硬直化せず,シームレス適応性試験設計と他の段階を越えた研究が存在する。CTNとCTA計画によると,試験中の治療薬の使用は良好な臨床実践ガイドライン,国家声明,監督試験を担当するHREC承認案に適合しなければならない。試験スポンサーはまた、任意の他の英連邦および/または州と地域の臨床試験と治療用品の供給に関する法規の要求を守らなければならない。
**オーストラリアで治療用商品を提供することを希望する会社または組織は、TGAに市場許可を申請しなければなりません。TGAは申請を評価し,市場許可を得ると,治療商品はオーストラリア治療商品登録(ARTG)に登録される。TGAは3つの主要経路を用いて処方薬:標準経路,優先審査経路,一時承認経路を評価する.法規によると、TGAは255営業日以内に標準経路薬物の評価を完了しなければならない。優先的に経路を検討する目標時間フレームワークは150営業日であり、重要で救命された処方薬をより迅速に評価することを可能にする。将来性の高い新しい処方薬の発起人(初歩的な臨床データのみ)は臨時承認経路を通じて迅速な登録を求めることができる。すべての経路は薬物が良好な製造規範(GMP)によって製造されたという証拠が必要である。GMPは治療製品の質の高さを確保する原則と手順を説明した。TGAはGMP規格に適合することを確保するためにオーストラリア(および一部の海外)メーカーを検査した。
| ● |
提出前:申請を提出する前に、潜在的なスポンサーは、提案された製品が評価された上場薬物経路の予備資格要件に適合することを確実にしなければならない。出願人は、評価された新しい発売薬の出願を提出する前に、無料のオプションの提出前会議を手配することができる |
|
|
|
||
| ● |
出願提出:TGAビジネスサービスによる作成および提出申請; |
|
|
|
||
| ● |
初歩的評価:TGAは申請を初歩的に評価し、それが評価する行政要求と基本技術資格要件に適合するかどうかを決定する |
| ● |
評価および情報要求:申請が初歩的な評価によって評価費を支払うと、申請は評価段階に入る。この段階では,TGAは申請を評価し,情報要求に対する任意の回答を審査し,調査結果を記録する.TGAは、補充薬物諮問委員会(ACCM)のような国際専門家諮問委員会のアドバイスを求めることを決定することができる |
| ● |
決定:治療商品法(1989)第26 AE条に基づいて薬物をARTGに入れるか否かを決定する際には、意思決定者(厚労省秘書の代表)は、アーカイブ、評価報告、情報請求に対する回答、専門家諮問委員会の提案を含む申請に関するすべての文書を審査する |
|
|
|
||
| ● |
最終決定:スポンサーは、法案26 B(1)節に従って正式な特許証明書を提供する必要があるか、または薬剤がARTGに列挙される前にそうする必要のない通知を提供する必要がある |
|
|
|
||
| ● |
発売後要求(あれば):いつでも1種類の薬物を選択して発売後コンプライアンス審査を行うことができる。TGAはスポンサーが自己認証した監督管理要求に照らして評価された上場薬品の適合性を検査する。 |
彼らは、治療商品は通常ARTGに入力して、オーストラリアで販売する必要があると言いました。しかし、患者はオーストラリアでの使用が許可されていない製品を様々な方法で得ることができる
| ● |
国家特別参入計画(“SAS”)は衛生従事者がケースに基づいて個別患者に未承認の治療商品を獲得することを許可した |
| ● |
医療専門家はTGAに特定の未承認商品となるライセンス申告者を申請し,特定の医療条件を有する特定患者にサービスを提供することができる。場合によっては、医師の申請は、人間研究倫理委員会の承認や専門学院の承認を得る必要がある |
| ● |
関連するリスクレベルに基づいて、非臨床試験のスポンサーは、TGA委員会に正式な通知または試験中の未承認商品の使用を申請することができる |
| ● |
個人輸入計画によると、個人は合法的にいくつかの未承認の治療用品を輸入して個人に使用することができ、3ヶ月間、TGAの許可を必要としない。S 4およびS 8薬剤は、オーストラリアの登録医の処方を必要とする |
| ● |
ARTGに含まれる代替薬物の供給が需要に追いつかなければ、部長(あるいは代表)はARTGに含まれていない代替薬物の輸入と供給を許可することができる。場合によっては、薬剤師が薬剤を得ることができない場合には、異なる強度や形態の製品を含む処方医の承認なしに薬剤を代替することが可能となる。 |
アメリカの医薬製品開発の流れ
米国では,FDAは連邦食品,薬物,化粧品法案(“FDCA”)とその実施条例に基づいて薬品を規制している。薬品はまた他の連邦、州、そして地方の法律法規によって制限されている。規制の承認を得て、その後、適切な連邦、州、地方、外国の法規と条例を遵守する過程には、多くの時間と財政資源が必要だ。製品開発プロセス、承認プロセス、または承認後の任意の時間に適用される米国の要求を遵守できなかった場合、出願人は行政または司法の強制執行を受ける可能性がある。FDAの実行は、未解決の申請の承認の拒否、承認の撤回、臨床棚上げ、警告状、製品のリコール、製品の差し押さえ、生産または流通禁止の完全または部分的な一時停止、罰金、政府契約の拒否、原状回復、返還、返還、または民事または刑事罰をもたらす可能性がある。どんな機関や司法法執行行動も私たちに実質的な悪影響を及ぼすかもしれない。非バイオ医薬品が米国で発売される前にFDAが必要とするプログラムは、通常、以下のいくつかの態様を含む
| ● |
“良好な実験室規範”(“GLP”)と他の適用法規に基づいて臨床前実験室テスト、動物研究と調合研究を完成した |
|
|
|
||
| ● |
ヒト臨床研究が開始される前に発効しなければならない研究用新薬出願(“IND”)をFDAに提出する |
|
|
|
||
| ● |
FDAの現在の良好な臨床実践(“GCP”)に基づいて十分かつ良好に制御された人体臨床研究を行い、提案薬物の安全性、有効性と期待用途の最適投与量を決定した |
|
|
|
||
| ● |
新規医薬品の新薬申請(NDA)または生物製品許可証申請(BLA)をFDAに提出すること; |
| ● |
FDAの現在の良好な製造仕様基準(“cGMP”)に適合するかどうかを評価して、施設、方法、および薬品の特性、強度、品質、および純度を維持するのに十分な制御を保証するために、医薬品を製造するための1つまたは複数の製造施設の検査を良好に完了させる |
|
|
|
||
| ● |
NDAまたはBLAを支持するデータを生成する臨床前および臨床研究現場に対するFDAの監査 |
|
|
|
||
| ● |
食品医薬品局による秘密保持協定の審査と承認 |
|
|
|
||
| ● |
FDA上場後の要求を満たしているかどうか(あれば)。 |
承認を求める長い過程と、適用される法規や条例を遵守する必要があり続けるには大量の資源が必要であり、承認自体は不確実である。
人体に潜在的な治療価値を有する任意の化合物をテストする前に、候補薬物は臨床前試験段階に入る。臨床前試験は製品の化学、毒性と調合に対する実験室評価、及び候補薬物の潜在的安全性と活性を評価する体外と動物研究を含む。これらの早期の原則証明研究は健全な科学プログラムと包括的な文書を用いて行われている。動物における単回と反復用量の毒理学と毒動態学研究はGLPを含む連邦法規と要求に適合しなければならない。スポンサーは,臨床前試験の結果を,生産情報,分析データ,任意の利用可能な臨床データや文献,提案された臨床案とともにFDAに提出し,INDの一部としなければならない。INDはFDAが懸念を持ってスポンサーに通知しない限り、FDAが受信した30日後に自動的に有効になる。この場合,INDスポンサーやFDAは臨床研究が開始される前に未解決の問題を解決しなければならない。30日間の審査期間内に解決策が達成できない場合、FDAはINDを臨床的に保留するか、スポンサーが申請を撤回するか。FDAはまた、臨床研究の前または期間のいつでも、安全考慮または規定に適合していない理由で、候補薬物の臨床保留を実施することができる。したがって,INDの提出がFDAが臨床研究の開始を許可するかどうか,あるいは開始すると,このような臨床研究を一時停止または終了させるという問題は生じない。
新薬開発期間中、スポンサーはいつかFDAと会う機会がある。これらの要件は、INDを提出する前、第2段階の終了時、およびNDAまたはBLAを提出する前にある可能性がある。他の時間に会議を開催することを要求することができます。これらの会議は,スポンサーにこれまで収集してきたデータに関する情報を共有する機会を提供し,スポンサーのFDAへの具体的な問題提起,FDAへの提案,スポンサーとFDAのための次の段階の開発について合意することができる。スポンサーは通常、第2段階会議が終了した時間を利用して彼らの第2段階臨床結果を検討し、新薬承認を支持すると考えられる重要な第3段階臨床(登録)試験(S)の計画を提出する。スポンサーは特殊方案評価(SPA)を申請することができ、その目的はFDAと第三段階の臨床試験方案の設計と分析について合意することであり、これらの設計と分析は治療効果声明の主要な基礎を構成する。
FDAのSPAプロセスに関する業界ガイドラインによると,事前条件に適合したスポンサーはSPAに対して具体的な要求を行うことができ,提案臨床試験の設計と規模に関する情報を提供することができる。FDAの目標は、提案された実験が十分であるかどうかを評価するために、要求が提出されてから45日以内に評価することであり、評価は、議論および要求により多くの情報を提供することをもたらす可能性がある。提案された裁判が開始される前にSPA要求を提出しなければならず,裁判が開始される前にすべての未解決問題を解決しなければならない.書面で合意されれば、それは記録され、IND記録の一部になるだろう。この協定はFDAに対して拘束力があり、試験開始後、スポンサーまたはFDAは、スポンサーとFDAが書面合意に達しない限り、またはFDAが試験開始後に薬物の安全性または有効性を決定するために重要な重大な科学的問題を発見したことを決定することができない。
臨床研究は合格調査者の監督の下で候補薬物を健康ボランティア或いは患者に服用することに関連しており、これらの調査者は通常臨床研究スポンサーに雇用されたりコントロールされていない医師である。臨床研究は,臨床研究の目標,投与手順,被験者の選択·排除基準,結果がどのように分析·提示されるか,および被験者の安全性を監視するためのパラメータを詳細に説明した場合に行われる。すべてのプログラムはINDの一部としてFDAに提出されなければならない。臨床研究は良好な臨床実践(“GCP”)ガイドラインに従って行わなければならない。さらに、各臨床研究は、臨床研究を行う各機関に設けられているか、またはサービスする独立した機関審査委員会(“IRB”)によって審査および承認されなければならない。審査委員会は,研究参加者の福祉や権利の保障を担当し,臨床研究に参加する個人のリスクが最小限に減少しているかどうか,期待利益に対して合理的であるかどうかなどの項目を考慮している。IRBはまた、各臨床研究対象またはその法律代表に提供されなければならないインフォームドコンセントを承認し、完成まで臨床研究を監視しなければならない。
ヒト臨床研究は通常3つの連続した段階で行われ、これらの段階は重複または合併する可能性がある:
| ● |
第一段階:まず薬物を健康な人体に導入し、その安全性、用量耐性、吸収、代謝、分布と排泄をテストする。 |
|
|
|
||
| ● |
段階2.限られた患者集団において薬物製品を評価して、可能な副作用および安全リスクを決定し、特定の標的疾患に対するこの製品の治療効果を初歩的に評価し、用量耐性、最適用量および投与計画を決定し、特定の特徴を有する患者集団を決定し、これらの患者集団において、薬物製品がより有効である可能性がある。 |
|
|
|
||
| ● |
第三段階:地理分散の臨床研究地点で臨床研究を行い、拡大した患者群中の投与量、臨床治療効果と安全性を更に評価する。これらの臨床研究は製品の全体的なリスク/収益比を確定し、製品ラベルに十分な基礎を提供することを目的としている。これらの研究はよく制御されなければならず、一般に比較のための対照アームを含む。FDAはNDAまたはBLA承認を得るために1~2つの3期研究を必要とし、これは疾患の重症度および他の利用可能な治療方案に依存する。 |
|
|
|
||
| ● |
承認後の研究或いは4期の臨床研究は最初の上場承認後に行うことができる。これらの研究は,治療適応が予想される患者の治療から追加的な経験を得るために用いられている。 |
|
|
|
||
| ● |
臨床研究結果を詳細に説明する進展報告は少なくとも毎年FDAに提出しなければならず、書面IND安全報告はFDAと調査者に提出しなければならず、深刻かつ意外な有害事象或いは実験室動物試験で発見された任意のヒト被験者に重大なリスクがある場合を発見する。第1段階、第2段階、および第3段階の臨床研究は、もしあれば、任意の指定された時間内に成功しないかもしれない。FDAまたはスポンサーまたはそのデータ安全監視委員会は、研究対象または患者が受け入れられない健康リスクに直面していることを発見することを含む、随時様々な理由で臨床研究を一時停止することができる。同様に,ある臨床研究が委員会の要求に沿って行われていない場合や,その薬剤製品が患者の意外な深刻な傷害に関与している場合,委員会はその施設で行われている臨床研究の承認を一時停止または終了することができる。 |
臨床研究と同時に、会社は通常追加の動物研究を完成し、薬物製品の化学と物理特性に関する追加情報を開発し、cGMP要求に基づいて商業大量生産製品のプロセスを最終的に決定しなければならない。製造過程は一貫して高品質の候補薬品ロットを生産できる必要があり,他にも最終薬品の特性,強度,品質,純度を試験するための方法を開発しなければならない。また,適切な包装を選択·テストし,候補薬品が賞味期限内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない。
アメリカの審査と承認の流れ
製品開発,臨床前研究と臨床研究の結果,および製造過程の記述,薬品化学の分析テスト,提案されたラベルとその他の関連情報は,NDAやBLAの一部としてFDAに提出され,この製品の発売承認を要請した。セキュリティプロトコルまたはBLAを提出するには、大量の使用料を支払う必要があり、いくつかの限られた場合、そのような費用の免除を得ることができる。
さらに、“小児科研究公平法”(“PREA”)によると、NDA、BLAまたはその付録は、すべての関連する小児科亜群で主張される薬剤の適応の安全性および有効性を評価し、安全かつ有効な各小児科亜群に対する投与および投与をサポートするためのデータを含まなければならない。FDAはデータの提出を延期することを許可するか、またはすべてまたは部分的な免除を与えることができる。規制が別途要求されない限り、PREAは孤児の称号が付与されたいかなる適応の薬にも適用されない。
FDAは、提出されたすべてのNDAおよびBLAを受け入れる前にそれを検討し、NDAまたはBLAの届出を受け入れるのではなく、より多くの情報の提供を要求する可能性がある。提出された申請が受け入れられると、FDAはNDAまたはBLAの深い審査を開始する。FDAが“処方薬使用料法案”(PDUFA)に基づいて達成した目標と政策によると、FDAは標準NDAまたはBLAの予備審査を完了し、申請者に応答し、NDAまたはBLAを優先して6ヶ月間、FDAが10ヶ月の時間を持っている。FDAは、そのPDUFA規格および優先NDAまたはBLAの目標日を常に満たすわけではない。FDAが要求を出した場合、またはNDAまたはBLAスポンサーがPDUFA目標日の前の最後の3ヶ月以内に提出材料に提供された情報に関する補足情報を提供または明確にした場合、審査プロセスおよびPDUFA目標日を3ヶ月延長することができる。
NDAまたはBLA提出が届出のために受け入れられた後、FDAは、提案された製品がその予期される用途に対して安全に有効であるかどうかを決定し、製品の特性、強度、品質、および純度を保証および維持するために、cGMPに従って生産されるかどうかを決定するためにNDAまたはBLA出願を審査する。FDAは、新しい薬物または医薬製品の申請を諮問委員会に提出することができ、一般に、申請を承認すべきかどうか、およびどのような条件下で申請を承認すべきかを審査、評価および提案するための臨床医および他の専門家を含むグループである。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を慎重に考慮するだろう。薬品の審査過程において、FDAはまた、薬品の安全な使用を確保するために、リスク評価と緩和戦略(“REMS”)が必要かどうかを決定する。FDAがREMSが必要であると結論した場合,NDAまたはBLAのスポンサーは提案したREMSを提出しなければならず,必要であればFDAはREMSのないNDAやBLAを承認しないであろう。
NDAまたはBLAが承認される前に、FDAはこの製品を生産する施設を検査する。FDAは、製造プロセスおよび施設がcGMP要件に適合していることを決定し、要求された仕様の下で製品が一貫して生産されることを保証するのに十分でない限り、この製品を承認しないであろう。さらに、NDAまたはBLAを承認する前に、FDAは、GCPおよびcGMPに適合することを確実にするために、1つまたは複数の臨床場所および製薬製品の生産場所を検査するのが一般的である。FDAが申請、製造プロセス、または製造施設が受け入れられないと判断した場合、それは、提出された文書に不足点を列挙し、追加の試験または情報の提供を要求することが多い。さらに、FDAは製品ラベルの審査と承認を要求するだろう。
NDAおよびBLAの審査および承認プロセスは長く困難であり、適用される規制基準に適合していない場合、または追加の臨床データまたは他のデータおよび情報が必要とされる可能性がある場合、FDAはNDAまたはBLAの承認を拒否する可能性がある。このようなデータや情報を提出しても,FDAはNDAやBLAが承認基準を満たしていないことを最終的に決定する可能性がある.臨床研究から得られたデータは常に決定的ではなく,FDAのデータ解釈はスポンサーの同じデータに対する解釈とは異なる可能性がある。FDAがNDAまたはBLAを承認しないと決定した場合、FDAは完全な返信を発行する。完全な応答は、一般に、FDAによって決定されたNDAまたはBLA内のすべての特定の欠陥を記述する。識別された欠陥は軽微である可能性があり、例えば、タグ変更が必要であり、重大である可能性もあり、例えば、追加の臨床研究が必要である。さらに、完全な返信状は、出願人がとり得る、申請を承認条件に置くための提案行動を含むことができる。完全な返信が発行された場合、出願人は、手紙で決定されたすべての不足点を解決するために、または出願を撤回するために、秘密保持プロトコルまたはBLAを再提出することができる。
1つの製品が規制部門の承認を得た場合、この承認は、特定の疾患および用量に明らかに限定される可能性があり、または使用の適応が制限される可能性があり、これは、製品の商業的価値を制限する可能性がある。さらに、FDAは、いくつかの禁忌症、警告、または予防措置を製品ラベルに含めることを要求する可能性がある。さらに、FDAは、医薬品の安全性および有効性をさらに評価するための臨床研究を含む第4段階試験を要求する可能性があり、商業化された承認製品の安全性を監視するための試験および監視計画を要求する可能性がある。
その他の国際法規
アメリカとオーストラリアの法規のほかに、各種の外国法規が私たちの未来の候補製品を管理する臨床研究と商業販売と流通があります。製品がFDAやHRECの承認を得ているか否かにかかわらず,製品は外国の比較規制機関の承認を得なければならず,これらの国で臨床研究やマーケティングを開始することができる。承認過程は国によって異なり,FDAやHREC承認に要する時間よりも長いか短い可能性がある。臨床研究、製品許可、定価と精算を指導する要求は国によって異なる。さらに、一部の国/地域の一部の規制機関は、以前に行われた臨床前および/または臨床研究を、それぞれの国/地域の承認基準に基づいて繰り返すことを要求する可能性があり、これは、承認すべき特定の市場の承認コストを延期および/または大幅に増加させる可能性がある。
EUの監督管理制度の下で、薬品のマーケティング申請は通常集中的な手続きに従ってヨーロッパ薬品管理局に提出される。集中化手続きはすべてのEU加盟国に有効な単一マーケティング許可を付与することを規定している。EMAには孤児薬物の名前もあり、適用すれば、より迅速な審査、より低い費用、より多くの機会を提供して薬物開発中にアドバイスを得ることができる。EUのマーケティング認可は集中しているが、臨床研究(申請、審査、要求)のシステムは各国で処理されている。ある国での臨床研究の承認は、他のどの国でも承認される保証はない。カナダの製薬業はカナダ保健省によって規制されている。新薬提出(“NDS”)は米国のNDAに相当し,カナダで販売されている薬品の承認を得るために提出しなければならない。マーケティング規則と清算は国家と省の法律によって制限されている。日本では,新薬の製造·販売の承認申請は厚生労働省の承認を得なければならない。非臨床と臨床研究は日本の法律の要求に適合しなければならない。日本国外で行われている臨床研究の結果は,日本患者で行われている少なくとも1つの移行臨床研究と補完しなければならない。
ヨーロッパ、カナダ、日本、オーストラリアとアメリカの法規のほか、様々な外国法規が未来の候補製品の臨床研究、商業流通と精算を管理しており、私たちは規制機関がMNPR-101放射性薬物計画、カシルビシン、あるいは任意の未来の国際候補製品を承認することを求めている時、これらの法規の制約を受ける可能性がある。
環境法を守る
私たちは自分の実験室や製造施設を持っていないので、環境法律を遵守するいかなる年間コストも見積もることができません。
従業員
私たちの業務は現在5人の個人が管理しており(私たちの執行主席と代理首席医療官を含む)、うち2人は博士号、2人は医学博士号、2人はMBA学位、1人は医療経済と政策修士号、1人はスタンフォード大学修士号、もう1人は元公認会計士だ。彼らはBioMarin製薬会社、Raptor製薬会社、瑪瑙製薬会社など、業界をリードする会社で働いていた。2024年3月8日現在、私たちは10人の従業員がいます;そのうち9人はフルタイム社員です。私たちは、MNPR-101計画とCamsiRubicin開発、業務発展、会社戦略を支援するために、臨床運営、規制事務、その他の部門でより多くの従業員を募集し、私たちの臨床研究、監督管理提出と製造を管理する予定だ。また、著者らの内部専門知識を補充するために、著者らは医療と科学顧問、メーカー、実験室と契約研究組織と契約を締結し、これらの組織は臨床開発、臨床前開発、製造、品質保証と監督管理事務を含む薬物開発の各方面に専門的に従事している。
企業情報
私たちは2014年12月に設立され、デラウェア州の有限責任会社で、名称はMonopar Treateutics、LLCです。2015年12月、私たちはデラウェア州C社と改名した。私たちの主な執行事務所はイリノイ州ウィルメッテのSkokie Blvd 1000号、Suite 350、Wilmette、60091にあります。私たちの電話番号は(847)388-0349です。私たちの会社のサイトは:Www.monopartx.comそれは.当サイトに含まれている、または当社のウェブサイトを介してアクセス可能ないかなる情報も、本Form 10-K年次報告書に引用的に組み込まれることはありません。
商標公告
本年度報告Form 10−Kにおけるすべての商標,サービスマーク,商号は,それぞれの所有者の財産である。本稿で使用する商標の名称および名称(適用する場合)は省略する。
利用可能な情報
私たちの会社のサイトは:Www.monopartx.comそれは.これらのサイトへの言及は,サイトに掲載されている情報への引用ではなく,本10-Kフォーム年次報告の一部と見なすべきではない.
私たちは、私たちのウェブサイト上で上記の情報を公開することによって、Form 8-K第5.05項のビジネス行為および道徳基準条項の改正または放棄に関する任意の開示要件を満たす予定です。
第1 A項。リスク要因
リスク要因
私たちの普通株に投資することは高い危険と関連がある。潜在投資家は,我々の普通株への投資を決定する前に,以下のようなリスクに関する情報と,本年度報告でForm 10−K形式で出現する他の情報を詳細に考慮すべきである。以下のリスクの発生は、私たちの業務、財務状況、経営結果、および将来の見通しに重大な悪影響を及ぼす可能性があり、潜在的投資家はすべてまたは一部の投資を損失する可能性があります。以下および本Form 10−K年次報告で検討したリスク要因は詳細ではなく,本Form 10−K年次報告では識別されていない他の重大なリスクが存在する可能性があるが,このようなリスクが発生すると,我々の業務,見通し,財務状況,運営結果に大きな悪影響を及ぼす可能性がある。
私たちの財務状況と資本要求に関連するリスク
私たちの運営歴史は限られており、重大な運営損失が予想され、永遠に利益を上げないリスクが高い。
私たちは2014年12月に運営を開始し、約9年の運営歴史があります。したがって、私たちの業績を評価するために使用できる歴史的財務や運営情報は限られている。我々の将来性は,会社がその早期臨床運営段階でよく遭遇する不確実性,リスク,費用,困難を考慮しなければならない。私たちの業界の多くの会社は、大多数の会社でなければ、私たちの発展段階で利益を達成したことがなく、商業販売から収入を生み出し、利益を達成する製品の開発に成功する前に、主要製品資産を買収、合併、販売したり倒産したりした。
2014年12月の設立から2023年12月31日まで、約6,020万ドルの損失が発生しており、1,350万ドルの非現金を含む研究開発が行われており、2017年のCamsiRubicinの買収に関連している。今後数年以内に、現在と未来に許可または購入された候補製品の臨床開発は引き続き巨額の運営損失を出し、予測可能な未来に損失を続けることを予想している。我々の戦略計画を実行するために,我々の研究開発とG&A費用が増加することを予想している.したがって、私たちは今後12ヶ月以内により多くの資金を集め、私たちの将来の運営に資金を提供することを期待している。市場販売計画、債務融資、戦略協力、贈与資金など、株式発行の組み合わせで必要な資金を得ることを求める。これまで、私たちは、私たちの普通株の純収益、市場販売計画による私たちの普通株の純収益、私たちの優先株と普通株の私募、Camsiiruicinおよび関連資産の買収に関する資金純収入を初めて公開することで、私たちの運営に資金を提供してきました。
未来の損失の額と私たちがいつ利益を上げるかは不確実だ。私たちは商業販売から収入を生む製品もなく、近い将来に製品の商業販売から収入を生むことを望んでいない。私たちが収入を創出し、利益を達成する能力は、候補製品の開発の成功、FDAと国際規制機関の必要な規制承認の獲得、第三者との製造/品質、販売、マーケティングと流通手配の確立、第三者支払者の十分な清算、そして十分な資金を集めて私たちの活動に資金を提供することに依存するだろう。もし私たちがこれらの業務の一部または全部で成功しなければ、私たちの業務、財務状況、および経営結果は実質的で不利な影響を受けることが予想される。
私たちは、私たちの臨床計画を推進し、私たちの臨床前活動を支援するために、大量の追加資金を集めたり、1つ以上の適切な製薬パートナーを見つける必要があるだろう。
商業的に実行可能なために、私たちは、規制部門の承認、製造、導入、マーケティング、および流通の一部または全部のMNPR-101-Zr、MNPR-101 RIT、Camsiruicin、11およびMNPR-202、および私たちが開発する可能性のある任意の他の候補製品を成功裏に研究、開発、テストしなければならない。これらの開発マイルストーンを実現するために必要な推定に必要な資本および時間枠組みは、本年度報告で述べたように、私たちが時々述べているように、内在的リスクの影響を受ける可能性があり、これらのリスクは制御できない。MNPR−101−Zr,MNPR−101 RIT,Camsiiruicin,MNPR−202の臨床開発には多くの資金が必要となる。これまで,我々の普通株売却収益は,計画中のMNPR−101−Zrの第一段階線量学試験,MNPR−101−RITの持続開発,および行われている開放ラベルCamsiruicin 1 b期臨床試験を完成させるのに十分である可能性があるが,MNPR−101の進行癌用放射性薬物の追加臨床開発,および1 b期を超えるCamsiRubicin臨床開発を支援するには不十分であろうと信じている。MNPR−101放射性薬物とカシルシン臨床プロジェクトを完成させるためには,数千万ドルの追加資金を調達する必要がある。したがって、今後12ヶ月以内に大量の追加資金を調達したり、適切な製薬パートナーを見つけたり、臨床試験、承認プロセス、商業化(適用されれば)を完成させることによって、現在および未来の候補製品を支援する必要があります。もし資金を集めることができれば、私たちに不利な条項で行われるかもしれません。もし十分な資金を集めたり、適切な製薬パートナーを見つけることができなければ、私たちは現在または未来の候補製品の臨床開発を停止または延期しなければならないかもしれません。
ロシア-ウクライナ戦争および/またはイスラエル-ハマス戦争は、燃料コストと輸送に持続的な世界的影響を与える可能性があり、経済、貿易、金融市場の状況により広い影響を与える可能性があり、これは、私たちの臨床材料製造の供給輸送を延期し、製造費用の増加を招く可能性があり、私たちの臨床計画が遅延し、私たちに与える 資金調達活動と財務状況。
ロシア-ウクライナ戦争とイスラエル-ハマス戦争は動揺した状況であり、それぞれの地域の金融サービスと銀行業の不安定を招いた。米国や他の国のロシアやロシア実体に対する制裁は、イスラエルとハマス戦争後の既存のインフレ状況やサプライチェーンの挑戦に加え、燃料コストや輸送に影響を与えており、様々な供給のコスト上昇や遅延を招いている。これらのコスト増加と遅延は私たちの臨床材料製造に影響を与える可能性があり、これは私たちの財務状況に悪影響を及ぼす可能性がある。また、現段階では、戦争やそれに伴う不安定が欧州、米国、あるいは世界経済、貿易、金融市場状況により広範な悪影響を及ぼすかどうかを予測することはできず、様々な方法で私たちの業務や財務状況に悪影響を及ぼす可能性がある。特に、金融市場の不安定さや変動は、調達に必要な融資をより困難にする可能性がある。
もし私たちが運営赤字を受け続け、運営に必要な資金が得られなければ、私たちの開発計画を進めたり、臨床試験を完成したり、製品を市場に出したり、減少や完全な運営停止を余儀なくされる可能性があります。しかも、私たちが獲得したいかなる資本も、私たち、私たちの投資家、または両方に不利な条項で得られるかもしれない。
現在,少なくとも2025年6月30日まで運営されている十分な現金があると考えられるが,新薬を開発し,1つ以上の疾患適応に対する臨床試験や規制審査過程には大量のコストが関与している。我々は、様々な仮定に基づいて最近の現金需要を予測したが、そのような仮定の一部または全部は、不正確および/または不完全である可能性があり、大きく逆である可能性がある。私たちの実際の現金需要はこれらの予測と大きくずれているかもしれません。市場状況の変化や他の要素は私たちの現金需要を増加させるかもしれません。あるいは私たちが現在予測している短期的に必要な現金金額を集めることができないかもしれません。私たちが未来に追加資本を調達する必要がある追加資本の額は、以下の要素を含むが、これらに限定されない多くの要素によって異なるだろう
| ● |
必要な資金よりも少ない資金を得ています |
|
| ● |
私たちの活性医薬成分、放射性同位体、および候補製品の製造と輸送のコストは予想以上に高い |
|
| ● |
臨床前の試験コストは予想以上だった |
|
| ● | Ac−225またはZr−89のような放射性同位体のコストおよび入手性、または我々の新製品候補に組み込まれ得る任意の他の医療同位体; |
|
| ● |
私たちの臨床試験の数、規模、持続時間、および/または複雑さの増加 |
|
| ● |
我々のMNPR−101放射性薬物計画、Camsiiruicin、およびMNPR−202または他の候補製品の開発における進展は、計画遅延による追加コストを含むが、これらに限定されない他の候補製品の開発における進展は予想よりも遅い |
|
| ● |
規制承認を得ようとすることに関連するコストは、追加の規制要件またはそれ以上の臨床試験要件による追加コストを含むが、これらに限定されない |
|
| ● |
人員、コンサルティング、または他の費用は、人員または業界専門家コンサルタントを増加させるか、または許可証の発行/より多くの資産の購入のために努力するなど、予想よりも高い |
|
| ● |
私たちの知的財産権の組み合わせを保護したり、他の方法で私たちの知的財産戦略を実施するコストは予想以上です。 |
私たちがより多くの資金を調達しようとする時、私たちが十分な量や全く得られない追加資金を得ることができるという保証はない。私たちは、私たちの運営および/または財務パフォーマンス、私たちおよびバイオ製薬業界に対する投資家の自信、銀行や他の金融機関から得られた信用、現在のプロジェクトの状況、および私たちが必要な規制承認を得る見通しを含む、追加資本を調達できないかもしれない。最近のインフレ、銀行不安定、その他の要因の影響を受けた全体的な経済·金融市場状況は、より多くの資金を調達する能力にも悪影響を及ぼす可能性がある。潜在的投資家の資本投資は、より高いリターンおよび/またはより低いリスクを有すると考えられる他の機会に移っている可能性があり、それにより、私たちが利用可能な資本(あれば)を減少させる。
さらに、追加的な融資を受けることができない可能性があり、たとえあっても、私たちまたは当時の既存投資家が受け入れられる条項では得られない可能性がある。私たちは、公開または私募株式発行による資金調達を求め、市場販売計画、債務融資、企業協力または許可手配、合併、買収、知的財産権の売却、または他の融資ツールまたは手配を含む。もし私たちが株式証券や他の証券を発行することで追加資本を調達すれば、私たちの当時の既存投資家は希釈されるだろう。もし私たちが債務融資や銀行ローンを通じて資金を調達すれば、私たちは制限的な条約の制約を受ける可能性があり、私たちの資産は債務の担保として担保されるかもしれないが、当時私たちの既存の投資家の利益は債務保有者や銀行に属するだろう。また、私たちが債務やローンの担保として資産を使用して利用する能力は制限されたり没収されたりする可能性があります。私たちが協力や許可手配によって追加資金を調達する範囲では、私たちは、私たちの技術または製品候補に重要な権利(知的財産権を含むが、限定されない)を放棄すること、または私たちに不利な条項に許可を与えることを要求されるかもしれない。もし私たちが受け入れ可能な条件で必要な資金を調達できない場合、私たちは可能な選択を含む支出を削減しなければならないだろう:業務の削減、機会の放棄、許可証の発行または資産の売却、臨床開発または他の進展を損なう程度までコストを下げる、または運営を完全に停止する。
市場変数、例えば製品コスト、労働力価格と燃料、運賃とエネルギーコストのインフレ、および地政学的事件は、私たちの運営と管理費用を大幅に増加させる可能性がある。
新冠肺炎の流行、ロシア-ウクライナ戦争、イスラエル-ハマス戦争、その他の地政学的要因の後、経済状況は緊張し、インフレとサプライチェーン挑戦は世界企業に影響を与えている。このような状況は燃料コストと輸送に影響を与え、様々な供給のコスト上昇と遅延を招く。これらのコスト増加と遅延は私たちの臨床材料製造に影響を与える可能性があり、これは私たちの財務状況に悪影響を及ぼす可能性がある。また、インフレ状況に対する反応は、金利が大幅に上昇するなど、経済や市場状況への影響を予測することは困難である。米国や世界経済、貿易、金融市場の状況が挑戦や変動を受け続けている場合、あるいはこれらの状況に対する私たちの反応を効果的に管理していなければ、私たちの運営や財務状況は様々な方法で悪影響を受ける可能性がある。
不安定な市場や経済状況は、資金調達能力に深刻な悪影響を及ぼす可能性があり、運営を延期、再編、または停止させる可能性がある。
世界と国内の信用と金融市場は時々極度の混乱が現れ、流動性と信用供給の深刻な減少、消費者自信の低下、経済成長の低下、失業率の上昇、及び経済安定性の不確定性を含む。最近、新冠肺炎、露烏戦争、イスラエル-ハマス戦争は波動性と不確実性を作り、最近銀行業の不安定は波動性と不確定性を増加させた。私たちの融資戦略は、このような経済低迷、不安定なビジネス環境、持続不可能で不安定な市場状況のいずれかの悪影響を受けるだろう。株や信用市場が悪化すれば、債務や株式融資を完成させにくくなり、コストが高く、希薄化の程度が高くなる可能性がある。有利な条件で任意の必要な融資をタイムリーに得ることができなければ、私たちの業務戦略や財務業績に大きな悪影響を与え、私たちの運営を停止または延期することを要求することができます。
著者らの運営と財務業績は新冠肺炎の再発或いは未来のいかなる大流行の不利な影響を受ける可能性があり、これは著者らが臨床試験候補製品を生産する能力、著者らが臨床試験を蓄積と行う能力に負の影響を与える可能性があり、そして監督機関の反応を遅らせる可能性がある。このような影響はすべて私たちの財務状況にマイナス影響を与え、臨床開発計画の延期を要求するかもしれない
もし新冠肺炎が再発あるいは未来にいかなる流行病が出現すれば、私たちは中断を経験する可能性があり、それによって著者らの業務、臨床前研究と臨床試験に深刻な影響を与える
| ● |
FDA、オーストラリアTGA、その他の外国監督機関の許可を得て、私たちが計画した臨床試験を開始することを遅延させた |
| ● |
私たちの臨床試験では患者の遅延や困難を募集し監視しています |
| ● |
臨床サイト起動の遅延または困難は、臨床サイト調査員と臨床サイトスタッフを募集する上での困難を含む |
| ● |
試験薬品の輸送遅延は、ワクチン輸送が現有の薬品輸送通路を占有し、コストを増加させたためである |
| ● |
医療資源を臨床試験の進行から移し,われわれの臨床試験場所である病院や臨床試験を支援してくれた病院スタッフを他の場所に移すことを含む |
| ● |
われわれの臨床試験に参加した参加者は、臨床試験中に疾患に感染するリスクがあり、観察された有害事象の数を増加させることを含む臨床試験の結果に影響を与える可能性がある |
| ● |
連邦または州政府、雇用主と他の人が押し付けたりアドバイスしたりする旅行制限、あるいは臨床試験被験者の訪問と研究プログラムの中断により、被験者のデータと臨床研究終点の完全性に影響を与える可能性があり、臨床試験現場のデータモニタリングのような重要な臨床試験活動の中断を招く可能性がある |
| ● |
FDA、アメリカ食品薬品監督管理局、アメリカ食品薬品監督管理局とその他の外国監督管理機関の運営中断或いは遅延は、審査スケジュールに影響を与える可能性がある |
| ● |
人員や供給不足、生産の減速、世界的な出荷遅延または運休、および交付システムの中断、または遅延のため、私たちの契約製造組織から私たちの候補製品の供給を受け取ることができます |
| ● |
私たちの従業員あるいは彼らの家族が病気になったり、従業員が大勢との接触を避けることを望んでいるため、私たちの従業員資源は制限され、そうでなければ、臨床前研究と臨床試験に集中する。 |
| ● |
FDA、アメリカ食品薬品監督管理局、アメリカ食品薬品監督管理局とその他の外国監督機関は影響を受けた地域の臨床試験データの受け入れを拒否した |
| ● |
長期遠隔作業スケジュールの影響、例えば、増加したネットワークセキュリティリスク。 |
新冠肺炎の長期影響或いは任意の未来の大流行が著者らの業務(著者らの臨床前研究と臨床試験、運営結果と財務状況を含む)に対する更なる影響の程度は未来の発展に依存し、これらの発展は依然として高度に不確定であり、自信に満ちて予測することもできない。
臨床開発と規制承認に関するリスク
放射性薬物は、癌イメージングおよび治療に比較的斬新な方法を提供しており、これはそれに重大で潜在的な予測不可能な挑戦をもたらす可能性がある。
私たちの将来の成功は、放射性薬物用途のためのMNPR-101と、放射性同位体を腫瘍に標的化することによって癌を画像化、識別または治療することを目的とした独自に開発、許可または買収する可能性のある未来の放射性医薬製剤(S)の開発にかかっている。放射線は癌治療法として数十年存在しているが、全体的には、システムを用いて標的放射性薬物を送達する腫瘍学的治療は比較的新しい。放射性同位体を輸送するシステムを利用した治療法は世界的に承認され、限られた数の放射性同位体療法に基づく製品の臨床試験しか行われていない。現在承認されていないAC−225を用いた療法は,MNPR−101とともに探索されている。AC−225の世界的な供給は現在も限られており、商業規模に必要な数を提供するために十分に拡大できない可能性がある。そのため,同社の候補製品が製品発見や鑑定,臨床前研究と臨床試験,承認を得た後に商業化を行う過程で遭遇する可能性のある開発挑戦を正確に予測することは困難である。さらに、放射性薬物治療は末期放射線毒性を含む長期的な影響を与える可能性があり、同社の現在または未来の任意の放射性薬物候補製品は現在予測できない。私たちの候補製品開発の時間とコストを予測することは難しいです。これらの要素のいずれも、会社が私たちが開始する可能性のある臨床前および臨床試験を完成させることを阻止するか、または任意の候補製品の商業化をタイムリーまたは利益的に開発することを阻止するかもしれません。また、同社の現在と将来の放射性製薬プロジェクトの成功は、以下の要素を含むいくつかの要素に依存する
| ● |
放射性同位体のような臨床用品や商業用品を調達するために、商業化が承認されれば、私たちの主要な候補製品を生産するための材料のために調達する |
|
|
|
||
| ● |
十分な数の候補製品を生産するために製造能力を調達または確立すること |
|
|
|
||
| ● |
同位体半減期が限られていることを考慮して、私たちの候補製品に信頼できるサプライチェーンを確保します |
|
|
|
||
| ● |
我々の候補治療薬を使用する前に、造影剤を用いて腫瘍摂取を可視化することは、副作用のリスクを増加させる可能性がある |
| ● |
患者が私たちの候補製品を管理できる限られた数の施設を使用するのを便利にする |
|
|
|
||
| ● | 副作用を十分にコントロールできない可能性があり、または治療効果に悪影響を及ぼす可能性がある薬剤を使用して、候補薬剤の副作用を管理する |
|
|
|
||
| ● |
任意の規制承認を得た後、販売とマーケティング能力を確立し、同社の最新の放射性薬物イメージングと治療薬に対する市場の受け入れを得る。 |
承認を求める長い過程と適用法律法規の遵守には大量の資源が必要であり、承認自体は不確定である。もし私たちの任意の候補放射性薬物計画製品が承認されれば、それらの商業成功は競争製品、放射性同位体に対する公衆の見方、および医師、患者、医療支払人、医学界の他の人の市場受け入れの程度に依存するだろう。
我々の候補製品の臨床試験または他の放射性薬物または類似薬の開発の臨床試験における有害事象およびそれによって生じる負の宣伝、および将来発生する可能性のある任意の他の放射性薬品分野の有害事象は、我々の候補製品に対する需要の減少を招く可能性がある。また,我々の候補薬物が承認されれば,将来の成功は医師,患者,第三者支払人,医学界の他のメンバーの受け入れを獲得し,維持するかどうかに依存し,それらは競合製品や治療法の有効かつコスト効果のある代替品であると考えられる。
しかし、MNPR-101-ZrおよびMNPR-101治療剤の放射性特性、および私たちの将来の候補放射性薬物は、一旦生産されると、私たちの候補薬剤は限られた安定性を有するため、履行および物流の面で困難に直面する可能性がある。もし、私たちまたは私たちの製造業者が、私たちのMNPR-101放射性薬物計画組成または任意の将来の候補薬剤に固有の時間制限による挑戦に対応できない場合、私たちの業務、財務状況、運営結果、および将来の見通しに悪影響を及ぼす。
私たちは私たちの他の放射性薬物候補薬もまた時間制限の安定性を持っていることを願う。したがって,MNPR−101放射性薬物計画を含む候補薬剤は,必要に応じて生産され,ほぼ直ちに出荷されなければならない。私たちのMNPR-101放射性薬物計画を含む候補薬剤は、出荷前に数日間“貯蔵”して貯蔵することができないので、私たちまたは任意の第三者メーカーは、私たちの候補薬剤を生産することができなければなりません。どんな形の遅延も、些細に見えても、すぐに患者に候補薬剤を提供する能力に大きな影響を与える可能性があります。患者に候補薬物を提供する上でのいかなる重大な遅延も私たちの名声を損なう可能性があり、私たちの臨床試験方案から逸脱する可能性があり、これは逆に私たちのMNPR-101放射性薬物計画の臨床前および臨床開発を適時に推進する能力、あるいは私たちの現在と未来の他の候補放射性薬物の能力に影響を与える可能性があり、甚だしきに至っては影響がない。我々は現在製造施設がないため,我々が行っている研究に関するMNPR−101放射性薬物計画の生産に第三者メーカーに依存している。私たちはこの製造業者たちが放射性薬物プロジェクトに対する私たちの需要をタイムリーに満たすことができるかどうかを確認することができない。
さらに,生産されると,我々のMNPR−101放射性薬物計画および臨床的に将来の放射性薬物候補薬は,適用可能な臨床試験場所に迅速かつ安全に輸送されなければならない。業務規模の拡大に伴い,より大規模な臨床試験を募集し,潜在的な商業化に備え,輸送能力を拡大する必要がある。労使紛争、政府制限、停止、流行病、脱線、破損または損失事件、悪天候条件、および他の私たちがコントロールできないイベントは輸送を中断または遅延する可能性があり、これは、MNPR-101放射性薬物計画または現在または未来に同様の賞味期限制限を有する任意の候補薬剤を損害させる可能性がある。
もし私たちまたは私たちの製造業者が、私たちのMNPR-101放射性薬物計画または私たちの現在または未来の任意の候補薬に固有の時間制限によってもたらされる挑戦に対応できない場合、これは私たちの業務、財務状況、運営結果、および見通しに悪影響を及ぼすだろう。
市場でのこれらの挑戦とリスクに対する見方は、臨床前と臨床仕事の重点を私たちの放射性製薬計画に重点を置いているので、私たちの株価と私たちの資金調達に成功する能力に悪影響を及ぼすかもしれない。
私たちは持っていないし、承認された製品は決して発売されないかもしれない。私たちのビジネスは複数のアメリカを獲得しオーストラリア籍そして、国際政府機関は、私たちの候補製品の製造と販売を許可されなければ、深刻な被害を受けることになります。
任意の癌または任意の他の疾患適応の治療法を商業化するためには,この適応に対するこのような治療の規制承認を得なければならない。監督管理要求を満たすことは高価な過程であり、長年の時間を要し、人類の使用薬物の研究開発、テスト、製造、品質管理、ラベルと普及などの要求を遵守することに関連する。必要な規制承認を得るためには,我々の製品が特定の適応に対して安全かつ有効であることを証明する臨床試験を完了しなければならない。私たちの製品が安全で有効であることが証明される保証はありません。私たちの臨床試験は、私たちの候補製品が必要な安全性と有効性を持っていることを証明しますか、あるいは私たちが開発したどの治療法も、このような安全性と有効性が証明されても、規制部門の承認を得ることに成功しません。
著者らが臨床試験で遭遇したいかなる遅延或いは困難はFDA或いは国際監督管理機関の監督管理許可を延期或いは排除する可能性がある。規制承認のいかなる遅延や妨害も、私たちの製品の商業化を延期したり排除したりするだろう。我々が臨床試験で遭遇する可能性のある遅延や困難の例は含まれているがこれらに限定されない。以下の内容:
| ● |
臨床試験は十分な確実な結果が生じない可能性があり、監督管理機関に著者らの製品の使用を許可させる。 |
|
| ● |
私たちの製品は現在の治療法よりもっと効果的ではないかもしれないし、根本的に有効ではないかもしれない。 |
|
| ● |
私たちの製品に副作用があることが発見されるかもしれません。これは、私たちの製品が遅延したり、規制部門の承認を得られなかったり、私たちの目標患者の有効規模を減少させたり、他の方法で私たちを重大なビジネスと法的リスクに直面させたりする可能性があります。 |
|
| ● |
治療が安全で有効であるかどうかを決定するには、予想よりも長い時間を要する可能性がある。 |
|
| ● |
われわれの臨床試験に参加した患者は,われわれの製品を用いた治療,一時停止のためにも,他にもわれわれの治療効果が含まれていない可能性があるため(われわれのコントロール範囲内でも外でも)重篤な副作用,さらには死亡する可能性がある。 |
| ● |
私たちの臨床試験では、試験統計計画を満たし、統計学的意義を得るのに十分な数の患者を募集することができないかもしれないし、あるいは予想よりも長い時間を登録する必要があるかもしれない。 |
|
| ● |
著者らの臨床試験に登録された患者は、特定の適応または患者群の規制承認に必要な安全性または有効性特徴を得ていない可能性がある。 |
|
| ● |
私たちは臨床試験を達成するのに十分な量の製品を生産できないかもしれない。 |
|
| ● |
われわれが臨床試験で成功しても,必要な政府の承認が得られないか,あるいは承認されても維持できない可能性がある。 |
|
| ● |
商業化が承認されれば、許可された使用は、商業成功に必要な制限よりも多くなる可能性があり、または承認の条件は、さらなる臨床試験または他の活動を完了することである可能性があり、これはコストの大幅な増加を招き、実施または達成できない可能性がある。 |
|
| ● |
承認されれば、私たちの製品に問題やデータが発生した場合、私たちの製品に問題があることを示したり、法律や法規が変化した場合、承認が撤回されたり制限されたりする可能性があります。 |
私たちが臨床試験の特定の段階で得たいかなる成功も、FDAや他の規制機関の最終承認を含むが、FDAや他の規制機関の最終承認を含むが、その後のどの段階でも成功する保証はない。
将来の立法または行政行動は、追加の政府規制、またはFDAまたは他の規制機関の製品開発、臨床試験、または規制審査中の政策の変化を生じるため、規制承認中に遅延または拒否に遭遇する可能性がある。適用される規制要件を遵守しないことは、刑事起訴、民事処罰、製品のリコールまたは差し押さえ、いくつかの活動の完全または部分的な一時停止または禁止、および私たちの候補製品または私たちのための他の規制行動をもたらす可能性がある。会社としては、製品規制の承認を得ることに成功した経験がないため、規制承認の獲得に関連するリスクを測定または管理できない可能性がある。
米国以外では、我々の製品をマーケティングする能力は、オーストラリアのHRECを含む適切な非米国規制機関の承認を得ることに依存する。非米国規制機関の承認には、通常、上述したFDA承認に関連するすべてのリスクと、地政学的不確実性と、海外で事業を展開する米国製薬会社が直面している追加の不確実性と潜在的偏見とが含まれる。場合によっては、政府の価格設定制限ややり方は、限られた収益性を実現することを非常に困難にする可能性がある。
FDと議論した臨床試験を終えてもAまたはTGA、そこでISは本書類を提出する際に保証しないAやTGAは私たちの新薬申請を受けます“NDA”)または生物製品ライセンス申請(“BLA”)は、議論に基づく試験である。
FDAおよびTGA委員会の将来の任意の決定は、私たちが現在行っているまたは任意の未来の計画における実験によって生成されたデータに大きく依存するだろう。しかし、FDAおよびTGAを含む他の規制機関は、複数の適応の多様な薬物を審査するためのすべての経験を学ぶであろう。彼らは、これらの広範かつ多様な経験知識を適用し、私たちの製品と完璧に一致していなくても、FDAまたはTGAが追加の臨床試験を要求すれば、私たちのコストを増加させ、私たちの潜在的な商業化の道を延期し、私たちの財務状況に実質的な影響を与える可能性がある。
ある会社として、著者らは臨床試験を完成したことがなく、監督管理申告を完成する上での経験は限られており、監督管理申告のいかなる遅延も著者らの財務状況に重大な影響を与える可能性がある。
私たちのチームメンバーは以前の会社で大量の臨床試験を行い、アメリカと国際で革新的な薬物製品を発売し、マーケティングしたが、会社としてはまだ候補製品の臨床試験を完了しておらず、市場の承認を得たり、商業規模の候補製品を生産したり、製品の商業化に成功するために必要な販売やマーケティング活動を展開していることも証明されていない。したがって、会社として、私たちの将来の成功や生存能力を評価したり確実に予測したりする歴史的な基礎はありません。
また,我々のチームは従来の規制届出会社で経験を持っているが,会社としてFDA,TGAやEMAなどの機関の規制届出における経験は限られている。私たちの候補製品に対する規制届出のいかなる遅延も、適用規制機関のこのような届出の審査に関連するいかなる不利な発展、または不利とされる事態の発展は、FDAが“届出拒否”の手紙を出したり、より多くの情報を提供することを要求したりして、私たちの財務状況に重大な影響を与える可能性がある。
私たちまたは任意の未来のパートナーは、アメリカとヨーロッパでの私たちの候補製品の孤児薬物独占経営権を獲得し、維持することができないかもしれない。
Camsiruicinは,軟組織肉腫の治療のための米国とEUでの孤児薬の指定を承認している。私たちは、私たちの候補パイプライン製品、他の適応、または将来の候補製品のための追加の孤児薬物指定または規制インセンティブを求めるかもしれません。私たちがそのような称号を得ることができるという保証はない。
私たちが候補製品の孤児薬物名を得ても、私たちはその薬の孤児薬物排他性を維持できないかもしれない。例えば,ある地域では,適応の流行率が指定維持に必要な患者数制限を超えるまで増加すると,孤児薬指定が廃止される可能性がある。一般に、孤児の薬物名を有する薬物がその後、そのような名称を有する適応の最初の発売許可を得た場合、薬物は、一定期間内に市場排他期を得る権利があり、これにより、EMAまたはFDAは、同じ適応の同一製品の別の発売申請をその期間内に承認することができない。FDAまたはEMAが、指定された要求に重大な欠陥があると判断した場合、または製造業者が、まれな疾患または疾患を有する患者の要求を満たすのに十分な量の製品を有することを保証できない場合、孤児薬の排他性を失う可能性がある。さらに、孤児薬が承認された後であっても、FDAが、我々の製品よりも臨床的に安全で、より効果的で、または患者ケアに大きな貢献をしていると結論すれば、FDAはその後、同じ状況に対して異なる薬剤を承認することができる。
FDAは“孤児薬品法”とその法規や政策を再評価する可能性があり,EMAもその政策や法規を再評価する可能性がある。FDAやEMAが将来,いつ,あるいはどのように彼らの孤立した薬物法規や政策を変更するかどうかも分からず,いかなる変化も我々の業務にどのように影響する可能性があるかは不明である。FDAおよび/またはEMAがその孤児の薬物法規および政策に変化する可能性があることによって、私たちの業務は悪影響を受ける可能性がある。
もし私たちの候補製品開発過程で深刻な不良または副作用が発見されれば、私たちはそのような候補製品の開発または商業化を放棄または制限する可能性がある。
私たちの候補製品が不良副作用または予期しない特徴に関連している場合、私たちはそれらの開発を放棄する必要があるかもしれないし、その開発をいくつかの用途またはサブグループに制限する必要があり、これらの用途またはサブグループにおいて、不良副作用または他の特徴は、リスク-収益の観点からそれほど一般的ではなく、それほど深刻ではない、またはより容易に受け入れられるではない。
私たちが私たちの候補製品のうちの1つと行われた任意の臨床試験を一時停止または終了させることを選択または強制された場合、候補製品の商業的将来性が損なわれ、候補製品から収入を創出する能力は延期またはキャンセルされるであろう。このようなどんな状況でも、私たちの業務、財政状況、そして見通しに大きな被害を及ぼす可能性がある。
もし私たちが臨床試験の被験者登録中に遅延や困難に遭遇した場合、必要な規制承認を受けることは延期または阻止される可能性があり、これは私たちの財務状況に大きな影響を与える可能性がある。
著者らの候補製品に参加する患者を識別、スクリーニングと募集する臨床試験は著者らの成功に重要であり、著者らは必要或いは必要な特徴を持つ十分な数の患者を識別、募集、募集と提供することができず、適時に著者らの臨床試験を完成することができる。著者らの臨床試験の時間は、著者らが患者の参加を募集する能力と、その後これらの患者に薬物を注射し、必要な後続段階を完成させる能力に依存する
さらに、増加または予見できない規制、法律および後方勤務要件に関連する登録遅延、およびいくつかの臨床試験地点で現在行われているか、または任意の将来の地政学的リスクに関連する問題に遭遇する可能性がある。これらの遅延は,規制機関の審査と個別臨床試験地点との契約検討による可能性がある。著者らの現在の臨床試験で募集及び/或いは患者への投与量のいかなる遅延はコスト増加、著者らの候補製品の推進遅延、著者らの候補製品の有効性テストの遅延或いは臨床試験の完全な終了を招く可能性がある。
我々の競争相手が我々の候補製品と同じ適応を持つ製品を用いて行っている臨床試験を行い,本来われわれの臨床試験に参加する資格のある患者が競争相手の臨床試験に参加すれば,患者登録が影響を受ける可能性がある。患者登録は、他の要因の影響を受ける可能性もある
| ● |
アメリカ、オーストラリア、あるいは他の外国の監督機関の臨床試験の開始に対する承認を延期する |
|
| ● |
任意の臨床研究機関と協調して臨床試験を登録·管理する |
|
| ● |
個別の場所の協力者と調査員を調整して招聘します |
|
| ● |
患者集団の規模と患者を識別するプログラムの有効性 |
|
| ● |
臨床試験プログラムの設計 |
|
| ● |
資格と排除基準 |
|
| ● |
研究されている候補製品の知覚的治療リスクと利益 |
|
| ● |
市場で得られる競争療法や他の競合製品の臨床試験; |
|
| ● |
1年で始まったり裁判が行われたりする時間 |
|
| ● |
病気の重症度や予後が調査されています |
|
| ● |
被験者の同意を得て維持する能力は |
|
| ● |
患者を迅速に募集し治療することができます |
|
| ● |
登録された被験者が試験終了前に退出するリスク; |
|
| ● |
潜在患者に臨床試験場所の近似性と可用性を提供する |
|
| ● |
治療中および治療後に被験者の能力を十分に監視すること |
|
| ● | 私たちの現在または未来の候補薬の賞味期限が限られていることによる後方課題 |
|
| ● |
医師の患者への転職方法と |
|
| ● |
新冠肺炎の潜在的な長期影響、そのいかなる灰色再発或いは任意の未来の大流行。 |
十分な数の患者を募集して臨床試験を行うことはできません。これは深刻な遅延を招き、1つ以上の臨床試験を完全に放棄することを要求するかもしれません。これらの臨床試験の登録遅延は私たちの候補製品の開発コストを増加させる可能性があり、これは私たちの財務状況に大きな影響を与える可能性がある。
もし私たちまたは私たちの許可者、開発協力者、またはサプライヤーが十分な数量または定義された品質仕様で私たちの製品を製造できない場合、あるいは製造施設の監督管理の承認を得ることができない場合、私たちは私たちの製品の需要を開発および/または満たすことができず、上場時間と潜在収入を損失する可能性があります。
私たちの臨床試験を完成させ、私たちの候補製品を商業化するためには、私たちの候補製品を十分に供給できる施設を獲得したり開発したりする必要があります。我々は第三者を利用してMNPR−101放射線治療レジメンとカシルーシンを生産する。我々には現在臨床使用されているMNPR−101−Zrとカシールビシンの製造スケジュールがあり,臨床使用されているMNPR−101−RITやMNPR−202の製造プロトコルは得られていない。
将来的には、様々な理由で、臨床試験のためにも、将来のある日に商業流通のためにも、私たちの供給源に依存して私たちの候補製品を生産することができないかもしれません。私たちは他の第三者製造業者または代替第三者製造業者を決定することができないかもしれないし、私たちが確定したどの第三者製造業者とも受け入れ可能な条項を協議することができないかもしれない。私たちはこれらのメーカー工場に入る競争に直面するかもしれません。もしメーカーが他の顧客に私たちよりも高い優先権を与えたら、私たちは生産遅延の影響を受けるかもしれません。追加的または代替的な第三者製造業者を決定することができても、その製造業者の確立および維持関係に関連する遅延およびコストは、私たちに実質的な悪影響を及ぼす可能性がある。
Camsiiruicin、MNPR-101-Zr、MNPR-101 RIT、MNPR-202、または任意の他の候補製品の商業的生産を開始する前に、製造施設およびプロセスの規制承認を得なければならない。臨床と商業目的のための薬物製造は現在の良好な製造規範の要求に符合しなければならず、通常は“cGMP”と呼ばれる。CGMPは品質管理とファイルポリシーとプログラムの管理を要求する.CGMPと非米国法規の要求を遵守するためには,製品が適用される規格や他の要求に適合することを確保するために,生産,記録保存,品質管理に時間,お金,労力をかける必要がある。私たちまたは私たちの契約製造工場はまたFDAまたはTGAが承認される前に承認される前に検査しなければなりません。承認前検査を通過できなければ、FDA、TGA、あるいは他の国際規制機関によるわが製品の承認を大幅に延期または阻止する可能性が高い。もし私たちがこれらの要求を遵守できなかった場合、私たちは可能な規制行動を受け、製品の販売が許可された司法管轄区域に制限され、上場時間と潜在収入を損失する可能性がある。
製品責任保険が製品責任クレームを処理するのに十分であるかどうか、またはそのようなクレームに対する保険が負担できるかどうか、または将来許容可能な条件で提供されるかどうかは不明である。
臨床研究は臨床試験方案に基づいて人類ボランティアに新薬をテストすることを含む。このようなテストは患者が不良副作用、新薬の使用不適切或いは不正ボランティア行為などの原因による人身傷害或いは死亡のリスクに関連する。クレームは、患者、臨床試験ボランティア、消費者、医師、病院、会社、機関、研究者、または他の使用、販売または購入した人、およびいくつかの州で我々の薬品に基づく模倣薬に対して提起される可能性のある製品責任を含む政府機関からのものである可能性がある。さらに、製品責任および関連リスクは、特に、私たちと開発、マーケティング、または流通協力を達成している当事者が任意の製品を商業化またはマーケティングする際に、時間の経過とともに増加する可能性がある。私たちの臨床試験に関連する製品責任保険を受けていますが、このような保険の保険金額や範囲が何かのクレームが発生した場合に適切かつ十分である保証はありません。そうしようとしたときに追加の保険を受けることができる保証はありませんし、私たちの保険会社がこのような保険証書を受け取るいかなる試みにも異議を唱えたり拒否したりしない保証はありません。その価値や最終結果にかかわらず、製品責任クレームは次のような結果になる可能性がある
| ● |
臨床試験ボランティアの脱退 |
|
| ● |
承認されて私たちの製品への需要が減少した |
|
| ● |
私たちの名声やメディアへの大きな否定的な関心と |
|
| ● |
潜在的な巨額の訴訟費用は、我々が敗訴または和解した場合、原告が得た任意の損害賠償を含むが、これらに限定されない。 |
もし私たちが現在と潜在的な将来の候補薬の市場機会が私たちが思っているより小さいならば、私たちの製品収入を生む能力は悪影響を受け、私たちの業務は影響を受けるかもしれない。
彼は、uPARを発現し、MNPR-101-ZrとMNPR-101-RIT標準に符合する末期癌患者および末期軟組織肉腫(AST)患者に対する理解は、推定と政府或いは学術機関の各種の科学出版物に基づいていると述べた。これらの推定または報告は、不正確であることが証明される可能性があり、新しい研究は、MNPR-101-Zr、MNPR-101-RIT、およびカルシル星に適合または準拠する可能性が低い推定発症率または罹患率を証明または提案する可能性がある。また、多くの異なる要素により、合格或いは言うことを聞く患者はますます識別と接触が困難になり、例えば放射性製薬領域の日々の競争が激しくなる可能性がある。さらに、私たちの推定またはアドレス指定可能な集団が間違っている場合、またはアドレス指定可能な集団内の患者サブ集団が、私たちのMNPR-101放射性薬物計画またはカシル星から利益を得ることができない場合、私たちのMNPR-101放射性薬物計画およびカシル星の標的集団はさらに減少する可能性がある。
私たちの第三者への依存に関するリスクは
企業、非営利組織、学術協力者は、私たちの製品の成功を延期、阻止、または破壊するための行動(有効な行動の不足を含む)を取る可能性がある。
候補製品の開発、臨床試験、製造、商業化における私たちの運営と財務戦略は、当社、非営利組織、学術機関、許可側、ライセンサー側、および他の当事者との協力に大きく依存しています。私たちがそのような協力を成功的に設立することを保証することはできない。現在と未来の協力は協力者が自ら決定して終了することができる。どんな協力者の活動も私たちの直接統制の範囲内ではなく、私たちの能力の範囲内にないかもしれない。いかなる協力者がその義務を履行し、私たちを満足させることが保証されないか、あるいは私たちがこのような協力からいかなる収入、利益、または利益を得ることができるか、またはいかなる協力者が私たちと競争しないという保証はない。何の協力も行わなければ、提案した製品の開発や商業化を行うためにより多くの資金が必要となる可能性があり、これらの製品を効率的に開発·商業化することができない可能性がある。さらに、開発と商業化協力の不足は、提案製品を特定の市場に押し上げること、および/または提案製品のこれらの市場での販売を減少させることに大きな遅延をもたらす可能性がある。さらに、現在と未来の協力者たちは意図的にまたは意図的に私たちの利益を損なう方法で行動するかもしれない。
第三者ライセンスの終了は、重要な化合物または技術を使用する私たちの権利に悪影響を及ぼすかもしれない。
我々は,XOMAとの非独占的許可プロトコルによって得られたMNPR-101のいくつかの権利に依存する.許可側として,XOMAは許可を終了する権利があり,許可プロトコルでの義務に違反し,XOMAからこのような違反に関する書面通知を受けた後,設定された時間内にそのような違反行為は一切救済しない.ライセンスプロトコルの終了は、そのうちの1つが市場に参入すれば、MNPR-101-ZrまたはMNPR-101 RITの開発および/または販売を停止させる可能性がある。
私たちが依存する協力者および他の当事者によって提供されるデータは、独立して確認されておらず、不正確、誤導性、または不完全であることが証明される可能性がある。
私たちは第三者サプライヤー、科学者、協力者に依存して、私たちのプロジェクト、臨床試験、業務に関連する重要なデータとその他の情報を提供してくれます。私たちはこのようなすべてのデータを独立して確認したり監査したりしない(その重要な部分を含むことができる)。したがって、これらのデータは、不正確、誤って、または不完全である可能性がある。
場合によっては、私たちは、あるサプライヤーに依存して特定の製造材料またはサービスを提供する必要があるかもしれませんが、プロバイダの任意のサービス中断または終了は、私たちの製品の商業化を遅延または中断する可能性があります。
私たちは第三者供給者たちに化合物を製造するために必要な材料を提供することに依存する。その中のいくつかの材料は時々供給者からしか得られないかもしれない。このような単一ソース供給者の任意のサービス中断または終了は、代替供給源が見つかるまで、生産遅延または中断を引き起こす可能性がある。私たちは私たちが代替的な供給源を見つけることに成功したり、これらの潜在的なサプライヤーと受け入れ可能な条件を交渉することに成功することを保証できない。
私たちは限られた数の契約製造工場に依存している。 もし応募して入隊する必要があれば新しい契約メーカー、これはMNPR-101放射性薬物計画と私たちのカシルシン計画を延期し、私たちの臨床試験のコストを増加させるかもしれません。
我々が契約したカムシビシン活性医薬成分製造工場および我々が契約した原材料製造工場はアジアとヨーロッパ諸国に位置しており,両国のいずれも,ロシア-ウクライナ戦争やイスラエル-ハマス戦争など,徴収された関税とその統制以外の地政学的要因の影響を受ける可能性があり,カシルービシン活性医薬成分や原材料の供給に影響を与える可能性がある。もし私たちが新しい契約メーカーを募集する必要があれば、これは私たちのカシルシン臨床計画を延期し、私たちの1 b期と将来のカシルシン臨床試験のコストを増加させるかもしれない。
我々が契約したMNPR−101−Zr製造工場および我々の原材料サプライヤーは現在米国に位置しているが,ロシア−ウクライナ戦争やイスラエル−ハマス戦争は放射性同位体の調達や臨床場所MNPR−101−Zrのタイムリーな供給に悪影響を及ぼす可能性がある。新たな契約メーカーを募集する必要があれば、MNPR−101−Zr臨床計画を延期し、現在行われているまたは将来の臨床試験のコストを増加させる可能性がある。
私たちは第三者に依存して私たちの非臨床研究と臨床試験を行う。これらの第三者がその契約義務の履行に成功しなかった場合、または予想される最終期限までに完了することができない場合、私たちの現在の候補製品または任意の未来の製品に対する規制部門の承認または商業化をタイムリーに効果的にまたは根本的に得ることができない場合、私たちの財務状況は不利な影響を受けるだろう。
私たちは独立して非臨床研究と臨床試験を行う能力がない。著者らは医療機関、臨床研究者、契約実験室、パートナーとその他の第三者、例えば契約研究機構或いは臨床研究機関に依存して、著者らの製品候補に対して非臨床研究と臨床試験を行う。我々と契約して我々の非臨床研究と臨床試験を実行する第三者は,これらの研究と試験を行い,その後データを収集·分析する上で重要な役割を果たしている。しかし、これらの第三者は私たちの従業員ではなく、契約責任と義務に加えて、彼らが私たちの計画に投入する資源の数やスケジュールを制御する能力が限られている。
著者らは第三者に依存して著者らの非臨床研究と臨床試験を行うが、著者らは著者らのすべての非臨床研究と臨床試験がその研究計画と方案に従って行われることを保証する責任がある。そのほか、FDA、TGA、EMAとその他の外国の監督管理機関は著者らに臨床試験結果を行う、モニタリング、記録と報告する法規と標準を遵守することを要求し、いくつかの通常良好な臨床実践(GCP)と呼ばれる法規と標準を含み、データと結果が科学的に信頼性と正確であることを確保し、そして試験対象が臨床試験に参与する潜在リスクを十分に理解することを確保する。
また,非臨床研究と臨床試験の実行およびその後に生じるデータの編集と分析には各当事者間の協調が必要である。このような機能を効果的かつ効率的に履行するために、このような当事者たちはお互いに意思疎通と調整をしなければならない。さらに、これらの第三者は他の商業実体と関係がある可能性もあり、その中のいくつかは私たちと競争する可能性がある。場合によっては、これらの第三者は、私たちとの合意を短時間で終了することができる。我々の臨床試験を行う第三者がその契約義務または義務を履行していない場合、作業中断、予想される締め切り前に仕事を完了していない、私たちとの合意を終了していない、または交換する必要がある場合、または彼らが得た臨床データの質または正確性が、私たちの臨床試験規程やGCPを遵守できないことによって影響を受ける場合があり、あるいは任意の他の理由で、代替第三者と新たな計画を達成する必要がある可能性があり、これは困難、高価または不可能である可能性があり、私たちの臨床試験は延長、延期、または終了する可能性があり、または重複する必要があるかもしれない。上記のいずれかの状況が発生した場合、私たちは、このような試験で試験された候補製品に対する規制部門の承認をタイムリーかつ効率的に得ることができないか、または商業化することができない可能性があり、したがって、私たちの財務状況は悪影響を受けるであろう。
私たちの候補製品の商業化に関するリスクは
会社として、私たちは製品を商業化した経験がない。もし私たちが商業専門知識を得ることができなければ、規制機関が製品を承認した後、私たちの製品発表と収入は延期される可能性がある。
会社として、私たちは規制部門の承認を得たこともなく、どんな製品も商業化したことがない。したがって、私たちはまだどんな販売、マーケティング、または流通能力も確立し始めていない。有効な販売、マーケティング、流通能力を確立したり契約したりすることができない場合、または第三者と合意して、優遇条項または任意の合理的な条項で私たちの候補製品を商業化することができなければ、私たちの候補製品が発売されると、製品収入を効果的に生み出すことができないかもしれません。もし私たちが薬物承認後に商業専門知識や能力を得ることができなければ、私たちの製品発表および後続収入は延期され、および/またはその商業的潜在力を発揮できないかもしれない。
私たちの製品開発はまだ初期段階にあります。私たちはまだどんなマーケティング努力も行っていませんし、未来に予想される市場テストと分析が私たちのマーケティング戦略を検証することを保証することもできません。私たちは製品を修正する必要があるかもしれないし、私たちはこのような製品を開発したり販売したりすることに成功しないかもしれない。
企業としては、候補製品の開発や臨床試験が完了していないため、いかなる製品のマーケティングや商業化からの収入も開始されていない。これらの候補製品の承認を得るには、多くの追加的な研究と開発と高価な臨床試験が必要になるだろう。私たちが私たちの候補製品の開発を成功的に達成したり、それらを市場に押し上げることに成功する保証はありません。私たちは研究開発、規制承認、候補製品の知的財産権、または他の要素に関連する問題と遅延に直面する可能性がある。私たちの開発計画が成功することは保証されず、私たちの候補製品が臨床試験中または後に安全かつ有効であることが証明される保証はなく、どの候補製品も必要な規制承認を得ることができる保証はない、あるいは必要な規制承認を得ても、私たちの特許出願が特許を得る保証はなく、私たちが獲得したいかなる知的財産権保護も十分であるか、あるいは私たちの協力手配は許可や他の手配によって私たちの知的財産権の価値を低下させないだろう。また,我々が販売する可能性のあるどの製品も顧客(医師,支払人,患者,すべての3者にかかわらず)に歓迎される保証はなく,第三者支払者が十分に精算し,競合製品がより良く表現されないこと,および/またはマーケティングがより成功しないことを保証することはできない.また、将来のどの市場テストや分析も私たちのマーケティング戦略を検証する保証はありません。私たちはより多くの研究を通じて製品ラベルを修正して、それらを市場に成功させて、その商業潜在力を発揮することができるようにする必要があるかもしれない。
販売、マーケティング、流通機能を実行するために、許可者またはパートナーと関係を築くことができない場合、または効果的なマーケティング、販売、および流通能力を作成することができなければ、私たちの製品のマーケティングに成功することはできません。
私たちのビジネス戦略は、マーケティングおよび医薬製品の販売において経験のある大企業に候補製品をライセンスすること、またはそれと協力することを含むことができる。私たちがどんな第三者とマーケティング、販売、流通関係を構築することに成功するか保証することはできません。このような関係を構築すれば、私たちは成功します。あるいは私たちが開発する可能性のあるどの製品も市場に認められることに成功します。私たちが第三者とどんなマーケティング、販売、あるいは流通手配を達成すれば、私たちの単位当たりに販売される製品の収入は私たちの直接マーケティング、販売、流通の状況よりも低いと予想され、私たちが得たいかなる収入もこれらの第三者の努力にかかっている。
もし私たちがこのような第三者マーケティングと販売関係を構築できない場合、あるいはそうしないことを選択すれば、内部マーケティングと販売能力を確立しなければならないだろう。我々は腫瘍薬物製品をマーケティングあるいは販売した経験がなく、現在マーケティング、販売或いは流通インフラもなく、腫瘍関連製品のためにこのようなインフラを開発或いは管理した経験もない。すべての製品を直接販売するためには、技術的な専門性があり、流通能力をサポートできるマーケティング、販売、流通力を構築しなければならない。生物製薬業界は技術熟練のマーケティング、販売と流通人員に対する競争は非常に激しく、これらの人員を誘致と維持することは著者らのコストを著しく増加させる可能性がある。私たちが内部マーケティング、販売、流通能力を確立できる保証はありませんし、これらの能力が私たちの需要を満たすのに十分である保証はありません。
私たちの候補製品の商業成功は医師、支払人、患者のこれらの製品に対する受け入れの程度に依存するだろう。
私たちが開発する可能性のあるどの候補製品も、医師、支払人、患者の市場受け入れを得ることができないかもしれない。私たちが開発する可能性のある製品に対する市場の受け入れと需要は、多くの要素に依存するだろうが、これらに限定されない
| ● |
本症適応治療の有効性と安全性の比較は,代替療法と比較して優れている |
|
| ● |
副作用の発生率が低く、罹患率が低く、重症度が高い |
|
| ● |
代替療法と比較した潜在的な利点は |
|
| ● |
費用対効果 |
|
| ● |
便利で使いやすく、安定性が良く、賞味期限が長く、ディーラー、医者と患者に適している |
|
| ● |
十分な第三者保険および/または精算 |
|
| ● |
強力な販売、マーケティング、流通支援能力 |
|
| ● |
私たちは受け入れ可能で納得できる安全性と有効性の証拠を提供する能力がある。 |
もし私たちが開発したすべての候補製品が監督部門の承認を得たが、医師、支払人、患者の十分な市場受容度に達していなければ、私たちが発生する可能性のある製品の収入が不足し、少ない、あるいは製品収入がなく、製品開発コスト投資から適切なリターンを得ることができず、十分な製品販売量で利益を得ることができず、持続可能な収益力を得ることができるかもしれない。
私どもの製品は第三者支払人に精算を受けたり十分に精算されたりしないかもしれません。
私たちが開発する可能性のある任意の製品の商業化の成功は、私たちの製品および関連治療のコストが政府当局、個人医療保険会社、および他の第三者支払者(例えば、健康維持組織)によって受け入れ可能なレベルで精算されるかどうかに大きく依存する。第三者支払者、保険計画のタイプ、その他の類似や異なる要素によって、精算料率が異なる可能性があります。もし私たちの製品が十分な精算を達成していなければ、私たちの製品の医師処方の数量は私たちの製品を利益を出すのに十分ではなく、私たちの投資から合理的なリターンを得るのに十分な利益を得るのに十分ではないかもしれません。将来の次世代製品への投資と新技術プラットフォームへの投資に資金を提供するためにキャッシュフローを提供します。
比較有効性研究により、競争相手製品のメリットが私たちの候補製品の販売に悪影響を及ぼす可能性があることが分かった。もし第三者支払者が私たちの製品が他の利用可能な療法と比較して費用効果があると思わない場合、彼らは彼らの計画に基づいて私たちの製品を福祉としてカバーしないかもしれません。あるいは、もし彼らがそう思うなら、支払いレベルは利益に基づいて私たちの製品を販売し、わが社が競争力を維持し、発展させるのに十分ではないかもしれません。
製品開発の製品投資への適切なリターンを実現するために、十分な価格レベルを維持することができるように、十分な第三者精算が得られない可能性がある。また,米国では,個人支払者も政府機関も,比較有効性研究が重要視されている。他の薬物や療法が私たちの製品よりも有効であることが発見された場合、支払人は、私たちの製品の代わりに、または低いレートで私たちの製品を清算するために、このような療法を受けることができます。
薬品価格を低下させる経済的及び政治的圧力の影響は研究に基づく新薬品の経済生存能力に対する主要な脅威であり、薬品価格のいかなる大幅な低下も我々の将来性に実質的かつ不利な影響を与える可能性がある。
米国では,管理式医療や政府価格制御への重視が増加しており,薬品定価の圧力が増加していくことが予想される。保証政策と第三者精算料率は随時変化する可能性がある。規制部門の承認を得た1つまたは複数の製品が有利な引受·精算状態を獲得しても、将来的にはあまり有利ではない引受政策や精算料率が実施される可能性がある。
このような分野のどんな発展も私たちの見通しに実質的な悪影響を及ぼすかもしれない。医療産業に関連する政治的、立法的、または規制的変化を予測することはできないが、政府および/または個人または第三者の保証·精算に影響を与える変化、またはそのような立法または規制の変化が私たちの業務にどのような影響を与えるかを含むが、これらに限定されない。しかし、政府の価格管理が薬品研究に非常に高い価格を提供しなければ、それは私たちの業界と私たちの将来性に非常に厳しい挑戦をもたらしたり、研究生産性の面で突破する必要があり、それは保証できません。
もし私たちの候補製品がFDAによって承認されれば、私たちは様々な連邦と州詐欺と法律乱用の制約を受けるだろう;これらの法律は私たちが提案した販売、マーケティング、教育計画などに影響を及ぼすかもしれない。詐欺や法乱用の広さや詳細が増加することが予想され、これは私たちの運営コストを増加させ、このような強化法を遵守することを確保する計画の複雑さを増加させる可能性がある。
もし私たちの候補製品がFDAの承認を得て、アメリカでこれらの製品を商業化し始めたら、私たちの運営は私たちの顧客、ディーラー、または他の業務パートナーを通じて、私たちの運営コストを増加させる可能性のある反リベート法規および虚偽のクレーム法規を含むが、これらに限定されない様々な連邦および州詐欺および乱用の法律によって制限されるかもしれない。このような法律は私たちが提案した販売、マーケティング、そして教育計画などに影響を及ぼすかもしれない。また、私たちは連邦政府と私たちが業務を展開している州のデータプライバシーと安全法規の制約を受けるかもしれない。
もし私たちの業務が私たちに適用される任意の連邦および州詐欺および乱用法律または任意の他の政府法規に違反していることが発見された場合、私たちは刑事訴訟と巨額の民事罰金を受ける可能性があり、これは私たちの業務運営能力と私たちの運営結果に悪影響を及ぼすだろう。
もし私たちの業務が任意の連邦および州の詐欺および乱用法律に違反していることが発見された場合、リベート法規および虚偽請求法規または私たちに適用される任意の他の政府法規を含むが、これらに限定されないが、私たちは、刑事および重大な民事罰金、損害賠償、罰金、監禁、政府医療計画から除外され、私たちの業務を削減または再構築することを含む罰を受ける可能性があり、いずれも私たちの業務運営能力および私たちの運営結果に悪影響を及ぼす可能性がある。もし私たちの任意の候補製品が最終的に海外で販売された場合、私たちは同様の外国の法律法規の制約を受けることができ、その中には、例えば、安全監視、詐欺防止、法律の乱用、企業コンプライアンス計画の実施、医療保健専門家への支払いまたは価値移転を含む適用された上場後の要求が含まれている可能性がある。
D一部の処方薬計画と他の政府計画がカバーしているわが製品の交渉価格は本来入手可能な価格よりも低くなります。
政府が処方薬を支払う費用の一部は、発売承認された製品に対する需要を増加させる可能性がありますが、D部分処方薬計画と他の政府計画がカバーする製品のいかなる交渉価格も、私たちが入手可能な価格を下回ることになります。連邦価格設定の影響を受ける製品の数量とタイプは時間の経過とともに大幅に増加すると予想される。政府の資金援助の一部を要求する政府や医療機関は、政府の直接医療計画と同じ高度な優遇価格で薬品を得ることが許可されるかもしれない。
私たちの知的財産権に関するリスクは
もし私たちと私たちの第三者許可者が私たちそれぞれの知的財産権を獲得して保護することができなければ、私たちの競争相手は私たちの(そして私たちの許可側を利用するかもしれない)’)開発競争薬の開発努力。
私たちのビジネス成功は、私たちのために開発可能な任意の製品および他の技術の特許保護にある程度依存し、私たちが獲得した任意の特許を第三者の挑戦から保護することに成功するだろう。TacticGem,LLC(“TacticGem”)からCamsiruicin(前身はGPX−150)特許の組合せを譲渡·譲渡する作業が完了した。我々はすでに米国と世界各地で我々MNPR−101計画に対するuPAR抗体の特許を出願し,取得している。米国や世界各地でUPAR上の特定のアミノ酸配列の特許も取得しており,MNPR−101抗体がこの配列に結合している。私たちは現在、MNPR-101をさらに保護するために、世界の他の国でこの特許を起訴している。我々はまた,我々の協力者北極星と共同でMNPR−101−ZrおよびMNPR−101−RIT結合体の特許を出願した。特許過程は多くの危険と不確実性に直面しており、私たちが特許を取得して保護することに成功する保証はない。“ビジネス-知的財産権の組み合わせと排他性”を参照されたい。これらのリスクと不確定要素は含まれているが、これらに限定されない
| ● |
発行または許可される可能性のある特許は、挑戦、無効、または回避される可能性があり、または他の理由ではいかなる競争優位性も提供できない可能性がある。 |
|
| ● |
私たちの許可者は、私たちが競争を排除する能力を低減または阻止するために、私たちの既存または未来の許可協定を終了または違反する可能性があり、このような許可協定を終了することは、私たちを特許侵害のリスクに直面させ、私たちはこれ以上これらの特許の許可を持っていないかもしれない。 |
|
| ● |
私たちの競争相手の多くは、私たちよりもはるかに多くの資源を持っていて、競争技術に大きな投資を行っています。彼らは特許を求めたり、獲得したかもしれません。これらの特許は、アメリカや国際市場で私たちの潜在的な製品を製造、使用、販売する能力を制限、妨害、または除去します。 |
|
| ● |
世界的な健康問題に関わる公共政策問題として,米国政府や他の国際政府機関は大きな圧力に直面する可能性があり,成功した癌治療法の国内と国際特許保護範囲を制限することが求められている。 |
|
| ● |
米国裁判所が支持する特許法と比較して,米国以外の国の特許法はそれほど厳しくない可能性があるため,非米国の競争相手はこれらの法律を利用して競合製品を創造,開発,マーケティングすることができる。一部の国では、医薬品特許、特許出願および他の知的財産権法規の法律適合性は非常に弱く、場合によっては政府援助の下で能動的に回避される場合もある。 |
さらに、米国特許商標局(USPTO)および他の管轄地域の特許庁は、特許出願に例示された特定の革新のみをカバーするために、製薬および/またはバイオテクノロジー関連発明に関連する特許出願を制限または大幅に縮小することを要求し、競合挑戦に対する保護範囲を制限することが多い。したがって、私たちまたは私たちのライセンシーが特許を得ることができても、特許の範囲は予想よりもはるかに狭いかもしれない。
もし私たちが私たちの特許の失効や満了を許可すれば、私たちは保護されず、競争優位性も失うだろう。もしこのような状況が発生すれば、私たちの製品の価値は大きく縮むかもしれない。私たちの特許は様々な時間に満了し、複数の国の法的制約を受けている。私たちのいくつかの特許は現在期限が切れそうで、私たちは適切な状況でこのような特許の期限を延長することを求めたり、それらを無効にすることを可能にするかもしれない。“ビジネス-知的財産権の組み合わせと排他性”を参照されたい。
特許に加えて、私たちは商業秘密と独自技術に依存している。従業員、コンサルタント、協力者と秘密や発明協定を締結することでこれらの情報を保護する措置をとっていますが、これらの合意が完全に実行可能で違反されない保証はありません。これらの合意が完全に実行または違反されなければ、開示された有害な影響から身を守ることができ、違反の救済措置は私たちを十分に補償してくれます。これらの合意はその期待された目標を達成するか、または私たちのビジネス秘密は他の方法で競争相手に知られたり、独立して発見されないという保証はありません。強制執行側が商業秘密を不正に開示したり流用したりする主張は困難であり、高価で時間がかかり、結果は予測できない。しかも、米国国内外のいくつかの裁判所は商業秘密をあまり望んでいないか、または保護したくない。もし私たちのどんなビジネス秘密も競争相手によって合法的に取得または独立して開発されたなら、私たちは彼らがその技術や情報を使用して私たちと競争することを阻止する権利がないだろう。もし私たちのどんなビジネス秘密が競争相手に漏れたり、競争相手によって自主開発されたりすれば、私たちの競争地位は損なわれ、商業秘密の価値は大幅に縮小する可能性がある。
私たちが私たちの候補製品のために獲得して保持している特許保護は、私たちに実質的な競争優位性を提供するのに十分ではないかもしれない。
私たちは私たちが許可したり所有している知的財産権が存在するにもかかわらず、競争を受けるかもしれない。私たちの知的財産権主張が、私たちの所有または許可された特許をめぐる第三者の設計を阻止し、競争製品を開発し、商業化するのに十分であることは保証できません。私たちの知的財産権を避ける競争製品の存在は私たちの経営業績や財務状況に重大な悪影響を及ぼす可能性があります。さらに、第三者が私たちの製品または将来の製品の商業化リスクが許容可能なリスクよりも高いと考えている場合、私たちの知的財産権における制限または知覚の制限は、第三者が私たちと協力したり、協力したり、または他の方法で取引する興味を制限する可能性がある。もし競争相手が私たちが現在または未来に持っている任意の使用方法やレシピ特許を中心に設計することに成功すれば、私たちの業務と競争優位性は不利な影響を受ける可能性が高い。
特許条項は候補製品に対する私たちの競争地位を十分に長く保護するのに十分ではないかもしれない。このような状況が発生すれば、私たちの競争地位、業務、財務状況、運営結果、見通しは実質的な損害を受けるだろう。
特許の寿命は限られている。米国では、すべての維持費が適時に支払われる場合、特許の自然失効時間は、通常、米国で最初の非臨時出願日から20年である。様々な延期があるかもしれないが、特許の有効期限とその提供される保護は限られている。私たちの候補製品をカバーする特許を取得しても、候補製品の特許有効期限が満了すると、模倣薬を含む競争薬からの競争に直面する可能性がある。新製品候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。したがって、私たちが持っている特許と許可された特許の組み合わせは、他の会社が私たちと似ているか同じ候補製品を商業化することを排除するために十分な権利を提供してくれないかもしれない。
FDAが私たちの候補製品の上場承認の時間、持続時間、条件に基づいて、私たちの1つ以上の米国特許は、1984年の“薬品価格競争と特許期限回復法”(“ハッジ-ワックスマン修正案”と略称する)とEUの同様の立法によって限られた特許期間延長を受ける資格がある可能性がある。Hatch-Waxman修正案は、製品開発およびFDA規制審査中に失われた有効特許期間の補償として、承認された製品をカバーする特許を最大5年間延長することを可能にする。しかしながら、試験段階または監督審査中に職務調査を行うことができず、適用の最終期限内に出願を提出できなかった場合、関連特許の満了前に出願を提出できなかった場合、または適用の要求を満たすことができなかった場合、延期されない可能性がある。しかも、延期の長さは私たちが要求したものより短いかもしれない。各承認された製品は1つの特許しか延長できず,展示期間は承認された日から総特許期間を14年以上延長することはできず,承認された薬物,その使用方法または製造方法に関する権利要件のみを延長することができる。もし私たちが特許期間の延長を得ることができない場合、あるいはこのような延長の期限が私たちが要求したものよりも短い場合、適用される候補製品に対して特許権を行使することができる期限が短縮され、競争相手は市場競争製品の承認をより早く得ることができるかもしれない。したがって、私たちは適用された製品からの収入が減少するかもしれない。また、このような状況が発生すれば、私たちの競争相手は私たちの臨床と臨床前データを参考にして、私たちの開発と試験への投資を利用して、他の場合よりも早く彼らの製品を発売し、私たちの競争地位、業務、財務状況、運営結果、将来性は実質的に損なわれるだろう。
知的財産権紛争は、このような紛争を解決するために時間とお金をかけ、私たちの知的財産権を制限する可能性があるかもしれない。
生物製薬業界の特徴は特許とその他の知的財産権をめぐる広範な訴訟であり、会社は知的財産権訴訟とUSPTOライセンス後訴訟を利用して競争優位を獲得している。私たちは、発明の優先権および特許可能性を決定するために、私たちの競争相手の特許および係属中の出願に起因する侵害請求または訴訟、または米国特許商標局が発表した追加の妨害手続を受ける可能性がある。知的財産権訴訟の弁護と起訴、米国特許商標局の訴訟および関連する法律と行政訴訟はいずれも高価で時間のかかる訴訟であり、その結果はまだ確定していない。訴訟は、私たちが発表した特許を強制的に実行し、私たちの商業秘密およびノウハウを保護したり、他人の独占権の実行可能性、範囲、有効性を決定するために必要かもしれない。私たちが当事者になる可能性のある訴訟やUSPTO許可後および介入手続きにおける不利な裁決は、第三者からライセンスを取得するか、または特定の市場で私たちの製品を販売することを制限または阻止することを要求する重大な責任を負わせるかもしれません。特定の特許や知的財産権紛争が許可や同様の手配によって解決されても、私たちが支払う巨額の固定支払いや持続的な使用料を含む可能性が高い可能性があります。しかも、必要なライセンスは満足できる条項で提供されていないかもしれないし、全くそうではないかもしれない。私たちが価値のあるクレームや抗弁を持っていても、訴訟費用は、これらのクレームや抗弁を追跡するのを阻止し、および/または、これらのクレームや抗弁を追及するために大量の財力と人的資源を必要とする可能性がある。さらに、私たちの現在と未来の特許には形式的な欠陥がある可能性があり、これは私たちが予想されたクレームを弁護できない可能性がある。上記の要因や他の要因による知的財産権紛争は、我々の業務に実質的な損害を与える可能性がある。
私たちは世界各地で私たちの知的財産権を強制的に施行できないかもしれない。
一部の国の法律は知的財産権の保護の程度はアメリカの法律に及ばない。ある外国の司法管轄区では、会社は知的財産権の保護と保護に深刻な問題に直面している。一部の国の法制度、特に発展途上国の法制度は、特許及び他の知的財産権保護の実行、特に生命科学に関連する特許及び知的財産権保護を支持していない。これは私たちが私たちの特許を侵害したり、私たちの他の知的財産権を流用することを防ぐことを難しくするかもしれない。例えば、多くの外国国には強制許可法があり、これらの法律によると、特許権者は第三者に許可を付与しなければならない。また、多くの国は、政府機関や政府請負業者を含む第三者に対する特許の実行可能性を制限している。このような国では、特許は限られた利点を提供するかもしれないし、利益さえないかもしれない。
外国司法管区で私たちの特許権の訴訟を強制的に執行することは、成否にかかわらず、巨額のコストを招く可能性があり、私たちの努力と関心を私たちの業務の他の側面に移します。また、私たちが予想している重要な市場で私たちの知的財産権を保護するつもりですが、私たちが現在または任意の未来の候補製品をマーケティングすることを望む可能性があるすべての司法管轄区域で同様の努力を開始または維持することができることを確実にすることはできません。したがって、このような国で知的財産権を保護するための私たちの努力は十分ではないかもしれない。また、米国や外国の法律や裁判所の法的裁決の変化は、私たちの製品や技術のために十分な知的財産権保護を獲得し、実行する能力に影響を与える可能性があります。
米国や他の管轄区特許法の変化は、特許の全体的な価値を低下させ、私たちの候補製品を保護する能力を弱める可能性がある。
他の生物製薬会社と同様に、私たちの成功は知的財産権、特に特許に大きく依存している。生物製薬業界で特許を獲得し、実施することは技術と法律の勤勉さと複雑性にも関連する。したがって、生物製薬特許を取得して実行することは高価で、時間と固有の不確実性だ。また、米国は最近、広範囲な特許改革立法を公布し、実施している。近年、米国最高裁判所はいくつかの特許事件に対して裁決を下し、場合によっては利用可能な特許保護範囲を縮小するか、場合によっては特許所有者の権利を弱めるかを決定している。我々の将来の特許取得能力に関する不確実性の増加に加えて,このようなイベントの結合は,いったん特許を取得する価値に関する不確実性をもたらしている.米国議会、連邦裁判所、USPTOおよび世界各地の他の管轄区域の将来の行動によると、特許を管理する法律と法規は予測不可能な方法で変化する可能性があり、それによって、私たちが新しい特許を獲得したり、私たちの既存特許と将来獲得可能な特許を実施する能力を弱める可能性がある。
私たちの特許保護の獲得と維持は、政府特許機関によって提出された様々なプログラム、書類提出、費用支払い、および他の要求を遵守することに依存し、これらの要求に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある。
米国特許商標局および各種外国政府特許機関は、特許過程において、いくつかのプログラム、文書、費用支払い、およびその他の規定を遵守することを要求する。場合によっては、私たちがコントロールできない問題により規定を遵守しないことにより、特許または特許出願が放棄または失効され、関連する司法管轄区域の特許権の一部または全部が失われる可能性がある。この場合、競争相手は他の場合よりも早く市場に参入するかもしれない。
もし私たちがいかなる許可、協力、または他の知的財産権関連協定の下での義務を履行できなかった場合、私たちは損害賠償金の支払いを要求され、現在または未来の技術または候補薬剤を保護するために必要な知的財産権を開発、商業化、保護することができないか、または再許可を付与するいくつかの権利を失う可能性がある。
任意の許可、協力、または知的財産権に関連する他の合意、および私たちが将来達成する任意の許可、協力、または知的財産権に関連する他の合意は、様々な開発、商業化、資金、マイルストーン、印税、勤勉、再許可、保険、特許起訴、および法執行、または他の義務を私たちに強要するかもしれない。もし私たちがこれらの義務に違反したり、許可された知的財産権を無許可で使用したりすれば、私たちは損害賠償金の支払いを要求される可能性があり、許可者は許可を終了する権利があるかもしれない。私たちが最善を尽くしたにもかかわらず、私たちの将来のどの許可側も、私たちがライセンス協定に深刻に違反しているため、ライセンス契約を終了し、これらのライセンスプロトコルがカバーする製品や技術を開発し、商業化する能力を失う可能性があると結論する可能性があります。私たちが締結したいかなる許可協定も複雑である可能性があり、このような協定のいくつかの条項は様々な解釈の影響を受ける可能性がある。起こりうる任意の契約解釈の相違の解決は、関連する知的財産権または技術に対する私たちの権利と考えられる範囲を縮小するか、または関連する合意の下での私たちの財務または他の義務を増加させる可能性があり、いずれも、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。
私たちは将来的に許可者からの許可を求めるかもしれないが、私たちは合理的なコストや合理的な条項でそのような許可を得ることができないかもしれない。さらに、将来のいずれかの許可者がそのような許可プロトコルを終了した場合、そのような許可終了は、許可技術によってカバーされた製品を開発、製造、販売することができないか、または競合他社が許可技術を得ることができるようにすることができる可能性がある。これらの事件のいずれも、私たちの競争地位、業務、財務状況、運営結果、および利益を達成する能力に実質的な悪影響を及ぼす可能性がある。
さらに、私たちは第三者から許可された特許と特許出願の準備、提出、起訴、維持、実行、および弁護を制御する権利がないかもしれない。したがって、私たちはこのような特許と特許出願の準備、提出、起訴、維持、強制執行、弁護が私たちの業務の最適な利益に合致しているかどうかを決定することができない。もし私たちの将来の許可者が私たちが許可を得る可能性のある特許を起訴、維持、強制執行、保護できなかった場合、または許可された特許または特許出願の権利を失った場合、私たちの許可権は減少またはキャンセルされる可能性がある。この場合、任意の製品または候補薬剤を開発および商業化する権利は、そのような許可権利の標的である重大な悪影響を受ける可能性がある。場合によっては、私たちが許可された特許権は、彼らの特許訴訟と維持費用をライセンシーに精算することに依存します。
さらに、私たちのライセンス者は、許可されていない知的財産権を所有または制御する可能性があり、したがって、私たちは、その是非にかかわらず、侵害、流用、または他の方法でライセンシーの知的財産権を侵害するクレームを受ける可能性があり、そのようなクレームが成功すれば、生じる任意の損害賠償または将来の印税義務は、開発および商業化に成功した製品で使用される技術および知的財産権に依存するであろう(もしあれば)。したがって、製品を開発して商業化することに成功しても、これらの義務のため、利益を達成したり維持したりすることができない可能性がある。
第三者は、知的財産権の侵害、流用、または他の方法での侵害を告発する法律訴訟を提起する可能性があり、その結果は不確実であり、私たちの業務の成功に重大な悪影響を及ぼす可能性があります。
私たちのビジネスの成功は、私たちまたは私たちの任意の未来のパートナーが私たちの現在または任意の未来の候補薬剤を開発、製造、マーケティング、販売する能力、および第三者の独自および知的財産権を侵害、流用、または他の方法で侵害することなく、私たちの独自技術を使用する能力にある程度依存する。バイオテクノロジーと製薬業界の特徴は特許と他の知的財産権に関する訴訟が広くて複雑だということだ。
私たちまたは私たちの任意の未来のライセンシーまたは戦略パートナーは、派生、再審、当事者審査、認可後審査または米国特許商標局の介入訴訟、および反対訴訟のような米国以外の司法管轄区域の同様の訴訟を含む、私たちの現在または任意の潜在的な将来の候補薬物および技術に関連する知的財産権の対抗訴訟または訴訟の脅威に関与または受ける可能性がある。もし私たちまたは私たちのライセンシーまたは戦略パートナーが私たちまたは彼らが直面している任意の妨害訴訟または他の優先権または有効性紛争で失敗した場合(任意の特許異議を含む)、私たちは1つ以上の特許を失うことによって貴重な知的財産権を失うかもしれない、または私たちの特許主張は縮小され、無効にされ、または実行できない可能性がある。場合によっては、私たちは、このような対抗性訴訟または訴訟に関連する任意の費用を補償する必要があるかもしれません。第三者はまた、既存の特許または将来付与される可能性のある特許および他の知的財産権に基づいて、その是非曲直にかかわらず、私たち、私たちのライセンシー、または私たちの戦略パートナーに侵害、流用、または他のクレームを提起することができる。第三者は、特許権または他の知的財産権を強制的に執行するか、または他の方法で主張するために、私たち、私たちのライセンシー、または私たちの戦略パートナーと訴訟または他の対抗性訴訟を行うことを選択するかもしれない。このような主張に法的根拠がないと考えても、管轄権のある裁判所は、これらの第三者特許および他の知的財産権が有効で、強制的に実行可能で侵害されていると判断する可能性があり、これは、私たちが開発した技術を利用して、または私たちが現在または未来に侵害されている候補薬物を商業化する能力に実質的な悪影響を及ぼす可能性がある。連邦裁判所でこのような米国特許の有効性に挑戦することに成功するためには,明確で納得できる無効証拠を提示することで有効性推定を克服する必要がある.私たちが明確で納得できると思う証拠を提出しても、管轄権を持つ裁判所は、このようないかなる米国特許の権利要求も無効だと宣言することは保証されない。
さらに、私たちは私たちがこのような対抗性訴訟や訴訟を成功的に解決したり、他の方法で解決できるという保証はない。もし私たちが受け入れられる条項で未来のクレームを成功的に解決できなければ、私たちは費用が高く、予測できない、時間のかかる訴訟を行うことを要求されるかもしれませんし、私たちの候補薬物のマーケティングにおいて重大な遅延に遭遇する可能性があります。もし私たちまたは私たちの任意のライセンシーまたは戦略パートナーが第三者特許または他の知的財産権の侵害、流用または侵害が発見された場合、もし私たちが故意の侵害が発見された場合、私たちは3倍の損害賠償金と弁護士費を含む損害賠償金の支払いを要求されるかもしれない。さらに、私たちまたは私たちの任意のライセンシーまたは戦略パートナーは、第三者の許可を求めるか、または要求されることを選択することができ、これらの許可は、商業的に合理的な条項では得られない可能性がある。商業的に合理的な条項で許可を得ることができても、これらの権利は非排他的である可能性があり、これは私たちの競争相手が私たちに許可してくれる同じ技術または知的財産権を獲得する可能性があり、私たちは大量の許可と印税の支払いを要求されるかもしれない。私たちはまた、裁判所の命令によって、私たちが開発した技術を使用、開発、製造、商業化したり、権利侵害の候補とされたりする薬物の使用を中止することを余儀なくされる可能性がある。私たちは現在または未来の技術や製品を再設計することを余儀なくされるかもしれない。上記のいずれも、私たちが収入を創出したり、利益を達成する能力に実質的な悪影響を及ぼす可能性があり、私たちが私たちの運営を維持するのに十分な収入を生むことを阻止することができる。
さらに、私たちまたは私たちのライセンシーまたは戦略パートナーは、私たちの特許または他の知的財産権を保護または強制するために、クレームを出したり、訴訟を提起したりする必要があることを発見するかもしれません。もし私たちまたは私たちのライセンシーまたは戦略パートナーが第三者に対して法的訴訟を提起して、私たちの候補薬物または私たちが開発した技術のうちの1つをカバーする特許を強制的に執行する場合、被告はその特許を無効または強制執行できないと反訴することができる。米国の特許訴訟では,被告が無効または実行不可能と主張する反訴が一般的である。有効性を疑問視する理由は、例えば、特許が条件を満たしていないと主張される主題、新規性の欠如、不確実性、書面記述の欠如、実施できない、予期されている、または明らかないくつかの法定要件のいずれも満たされていないと言われているからである可能性がある。主張を実行できない理由は,特許訴訟に関連する者が米国特許商標局に関連情報を隠蔽したり,起訴中に誤った陳述をしたりすることである可能性がある.このような無効で強制できない主張の結果は予測できない。有効性の問題に関しては、例えば、私たちまたは私たちのライセンシーまたは戦略的パートナーおよび特許審査員が起訴中に知らない無効な以前の技術がないことを決定することはできない。もし被告が無効または実行不可能な法的主張で勝った場合、私たちは少なくとも一部、さらにはすべて、私たちの1つまたは複数の候補薬物の特許保護を失うかもしれない。私たちが所有し許可されている特許請求の範囲の縮小または損失は、他人が類似または同じ技術および製品を使用することを阻止し、またはそれを商業化する能力を制限する可能性がある。このようなすべての事件は、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。特許や他の知的財産権も、合法的な侵害、流用、または私たちの特許または他の知的財産権に違反することなく、競争相手または第三者がこれらの候補薬物および技術を中心に設計されている場合、私たちの候補薬物および技術を保護しないだろう。
私たちが私たちの特許や他の知的財産権に関連する訴訟や他の訴訟手続きを弁護したり、訴訟を提起するコストは巨大かもしれません。たとえ私たちに有利な問題を解決しても、どんな訴訟や他の訴訟手続きも私たちの経営陣の注意を分散させ、私たちの人員の正常な責任を分散させます。このような訴訟または訴訟は、私たちの運営損失を大幅に増加させ、開発活動または任意の将来の販売、マーケティング、または流通活動に使用することができるリソースを減少させる可能性がある。私たちはそのような訴訟や訴訟手続きを適切に行うのに十分な財政的または他の資源がないかもしれない。私たちのいくつかの競争相手は、彼らがより多くの資源を持っているので、複雑な特許訴訟のコストをより効果的に維持することができるかもしれない。特許訴訟または他の訴訟の開始と継続による不確実性は、私たちの研究開発努力を延期し、私たちが運営を継続する能力を大きく制限する可能性がある。さらに、いくつかのこのようなプログラムは、大量の情報を開示する必要があるため、開示によって我々のいくつかの機密情報が漏洩する可能性がある。さらに、公聴会、動議、または他の一時的な手続きまたは事態の発展の結果が公開される可能性があり、証券アナリストまたは投資家がこれらの結果が否定的であると考える場合、そのような発表は、私たちの普通株価格に大きな悪影響を及ぼす可能性がある。
第三者の知的財産権は、現在または将来の技術または候補薬物を商業化する能力に悪影響を及ぼす可能性があり、私たちは、商業的に合理的な条項では得られないか、または全く得られない可能性がある、または第三者からライセンスを取得するために、現在または将来の技術または候補薬剤を開発またはマーケティングする必要があるかもしれない。
多くの会社が特許を出願しており,免疫療法を広くカバーする特許を発行しているか,あるいは我々が求めている目標と同じまたは類似した標的に対する小分子をカバーしている。第三者に発行された特許または他の第三者知的財産権が、私たちの現在または未来の技術、候補薬物またはその要素、または私たちの開発計画に関連する私たちの製造または使用をカバーすれば、私たちの競争地位は大きな影響を受ける可能性がある。この場合、関連する第三者知的財産権を無効または無効にするか、または知的財産権所有者とライセンス合意(商業的に合理的な条項がある場合)に訴訟を起こすことに成功しない限り、現在または将来の技術または候補薬剤を開発または商業化することができないかもしれない。私たちは第三者が保有している発行された特許を知らないかもしれないが、もし発見された場合、有効かつ実行可能であれば、私たちの現在または未来の技術または候補薬物によって侵害されるかもしれない。私たちが知らない未解決の特許出願は、私たちの現在または未来の技術または候補薬物によって侵害される可能性がある発行された特許をもたらすかもしれない。このような侵害クレームが成功裏に提起された場合、私たちは、巨額の損害賠償金の支払いを要求されるか、または現在または未来の技術または候補薬剤を放棄することを余儀なくされるか、または任意の特許所有者に許可を求めることができる。許可証が商業的に合理的な条項で提供されることを保証することはできない。
第三者知的財産権保有者は、権利侵害、流用、または他の告発による知的財産権侵害のクレームを積極的に提起することもできる。私たちは私たちがこのようなクレームを成功的に解決したり、他の方法で解決できるという保証はない。もし私たちが受け入れられる条項で未来のクレームを成功的に解決できなければ、私たちは費用が高く、予測不可能で時間のかかる訴訟を行い、阻止されたり、重大な遅延を経験したりして、私たちの候補薬を販売することを要求されるかもしれない。もし私たちがこのような紛争で失敗した場合、損害賠償金の支払いを余儀なくされることに加えて、私たちは、現在または未来の任意の技術または候補薬物を商業化することを一時的または永久的に禁止される可能性があり、これらの技術または候補薬物は、第三者の知的財産権を侵害、流用、または他の方法で侵害されると考えられる。可能であれば、私たちはまた、第三者の知的財産権を侵害、流用、または侵害しないように、現在または未来の技術または候補薬剤の再設計を余儀なくされる可能性がある。これらのいずれかは、私たちが最終的に勝っても、本来私たちの業務に投入できる大量の財務·管理資源を移転する必要があるかもしれませんが、これは私たちの財務状況や運営結果に実質的な悪影響を及ぼす可能性があります。
私たちの業務運営や業界に関連するリスク
私たちの運営の歴史は限られている。
これまで、著者らはすでに候補薬品を獲得し、候補製品の権利を許可し、著者らの薬品開発の肝心なサービス或いは技術について協力合意に達し、そして臨床試験を行ったが、まだいかなる政府の許可を得ておらず、まだいかなる製品を市場に投入しておらず、まだいかなる薬品を大量生産或いは販売していない。会社として、私たちは交渉、戦略関係の構築と維持、臨床試験と監督管理の審査過程を管理する上での経験は限られており、これらはすべて私たちが成功するために必要なものである。私たちはこれらの重要な分野で経験が不足しており、これは潜在的な投資家が私たちの能力を評価することを難しくし、私たちが戦略を成功させることができないリスクを増加させる。
しかも、もし私たちの業務が急速に増加すれば、私たちの運営、管理、法律、そして財務資源は緊張するだろう。私たちの発展には、私たちの管理チームと私たちの運営、管理、法律、財務システムと統制が絶えず改善され、拡大される必要があるだろう。
通常の業務プロセスでは、我々の経営陣が、我々の業務の特許、化合物および技術の潜在的な買収および/またはライセンスを補完または拡大できると考えていることを評価し、評価する予定である。もし私たちが魅力的だと思う買収が候補になるかもしれないと決定すれば、これらの特許、化合物、または技術を融資または利益で利用するために合意を成功させるか、または許可する保証はない。また、このような買収や許可は、管理時間や資源を他の活動から移行させ、現在の業務発展を促進する可能性がある。
もし私たちが重要な管理指導者および/または科学者を失ったら、もし私たちが合格した従業員、マネージャー、役員、役人、または他の重要な人員を募集できなければ、私たちは計画遅延と報酬コストが増加する状況に遭遇する可能性が高く、私たちの業務は実質的な妨害を受けるだろう。
私たちの将来の成功は、私たちの管理、指導者、科学者の主要メンバーの持続的なサービスに強く依存しており、彼らはいつでも私たちとの雇用関係を終了し、私たちと競争することができるかもしれない。私たちのいかなる重要な管理、指導者、または科学者、特に取締役会(“取締役会”と略称する)のクリストファー·M·スタール執行主席と社長兼最高経営責任者のチャンドラー·D·ロビンソンは、私たちの業務を深刻に混乱させ、候補製品の成功した製品の開発と商業化を深刻に遅延または阻害する可能性がある。私たちはロビンソン博士と期限がないが、自由に雇うことができる雇用契約を持っているということは、この幹部がいつでも彼の雇用関係を終わらせる能力があることを意味している。私たちはスタール博士と相談合意があります。もしスタル博士や私たちが30日前に私たちに通知すれば、その合意は終了することができます。
私たちの未来の成功はまた、私たちが組織のすべての分野のために高技能者を探し、採用し、維持する能力にかかっているだろう。生物製薬業界の科学技術人材に対する競争は非常に激しく、著者らは合格人材の発見、採用と維持に失敗する可能性がある。私たちは引き続き高い能力者を探し、採用し、維持することを要求しており、これは私たちの報酬コストを大幅に増加させるかもしれない。
私たちは上場企業としての運営にコストが発生し、私たちの経営陣は投資家関係を処理し、公衆に情報とコミュニケーションを提供し、関連するコンプライアンス措置と会社管理実践を処理する必要があります。
上場企業として、特に2024年以降に新興成長型企業ではなくなった後、多くの法律、会計、その他の費用が発生し、これらの費用は民間会社としては発生していません。サバンズ-オクスリ法案、ドッド-フランクウォール街改革と消費者保護法案、ナスダック資本市場の上場要求、その他の適用される証券規則と法規は上場企業に対して様々な要求を提出し、有効な開示、財務制御、会社管理のやり方を確立と維持することを含む。私たちの経営陣と他の人たちはこのようなコンプライアンス計画に多くの時間を投じた。しかも、このような規則と規制は私たちの法律と財務コンプライアンスコストを増加させ、いくつかの活動をより時間的で高価にする。例えば、これらのルールや規定は、取締役や上級管理職責任保険を獲得することを難しくし、合格した取締役会のメンバーを引き付け、維持することを難しくする可能性があると予想されています。しかし,これらの規則や条例は異なる解釈を受けることが多く,特殊性に欠ける場合が多いため,規制機関や理事機関が新たな指導意見を提供するにつれて,これらの規則や条例の実践への適用は時間とともに変化する可能性がある。これは遵守事項に関する持続的な不確実性と、開示と統治慣行を絶えず修正するために必要なより高いコストをもたらす可能性がある。
コンプライアンス研修や定期的な教育を行っているにもかかわらず、私たちの従業員やコンサルタントは、規制基準や要求を守らないことを含む不正行為や他の不適切な活動に従事する可能性があり、これは、私たちの開発計画の遅延や終了を招き、私たちの業務に悪影響を及ぼす可能性があります。
私たちは定期的に従業員のコンプライアンス訓練を行っていますが、これまで不正行為や不適切な活動は発見されていませんが、従業員やコンサルタント詐欺や他の不正行為のリスクに直面しています。私たちの従業員またはコンサルタントの不適切な行為は、FDAの規定を故意に遵守しないこと、FDAに正確な情報を提供すること、生産基準を遵守すること、連邦および州医療詐欺および法律法規を遵守すること、財務情報またはデータを正確に報告すること、または許可されていない活動を私たちに開示することを含むかもしれない。特に、医療業界の販売、マーケティング、商業配置は、詐欺、リベート、自己取引、その他の乱用を防止するための広範な法律法規によって制約されている。これらの法律法規は、広範な価格設定、割引、マーケティングおよび販売促進、販売手数料、顧客インセンティブ計画、および他のビジネス計画を制限または禁止する可能性があります。従業員とコンサルタントの不当な行為はまた臨床試験過程で得られた情報の不適切な使用に関連する可能性があり、これは規制制裁と私たちの名声に深刻な損害を与える可能性がある。このような不正行為を常に識別し、阻止できるわけではなく、私たちがそのような活動を発見し、防止するための予防措置は、未知または未管理のリスクまたは損失を効果的に制御することができないか、またはそのような法律や法規に準拠していないことによる政府の調査または他の行動または訴訟から私たちを保護することができないかもしれない。もし私たちにこのような行動を取って、私たちが自分の権利を弁護したり、維持することに成功しなかったら、これらの行動は巨額の罰金や他の制裁を加えることを含めて、私たちの業務に大きな影響を与えるかもしれない。このような行動は、私たちの1つまたは複数の開発計画を延期または終了することを含む、私たちの業務に悪影響を及ぼすかもしれない。
私たちは新興成長型企業であり、新興成長型企業に適用される開示要求を低減することが、私たちの普通株の投資家に対する魅力を低下させるかどうかを決定することはできません。
私たちは新興成長型会社です。2012年のJumpStart Our Business Startups Act(“JOBS法案”)によると、新興成長型企業は、これらの基準が民間会社に適用されるまで、新たな会計基準の採用や改訂を延期することができる。私たちはこの条項を撤回できないように選択していますので、非新興成長型企業の上場企業に新たな会計基準の採用や改訂が要求された場合には、これらの基準を遵守します。
私たちが新興成長型会社である限り、他の上場企業の様々な報告要求に適用されるいくつかの他の免除を利用したいが、これらに限定されないが、私たちの定期報告や依頼書における役員報酬に関する開示義務を減らし、役員報酬について拘束力のない顧問株主投票を行う要求を免除し、以前承認されていなかった金パラシュート支払いを免除する。財務報告に対する我々の内部統制を評価する際には、監査人認証の要件を免除し、上場企業会計監督委員会が採用することができる強制監査会社の交替又は監査及び財務諸表(監査人議論及び分析)に関する追加情報を提供する監査人報告に関する任意の要件を免除する。もし私たちがこれらの免除を利用すれば、私たちが株主に提供する情報は他の上場企業の情報とは異なるだろう。私たちは投資家が私たちがこのような免除に依存して私たちの普通株の吸引力が低下することを発見するかどうか予測できない。もし投資家が私たちの新興成長型会社としての地位で私たちの普通株の吸引力が低下していることを発見すれば、私たちの普通株の流動性は減少する可能性があり、私たちの株価はもっと変動するかもしれない。
(1)本年度の最終日まで、(A)私たちの初公募(IPO)完了5周年後、(B)私たちの年間総収入が少なくとも12.35億ドル、または(C)前年6月30日現在、非関連会社が保有する普通株の時価が7億ドルを超え、(2)前3年間に10億ドルを超える転換不可能債務証券を発行したことを意味する、新興成長型会社である。2024年12月31日になると予想されています。新興成長型企業の資格に適合しなくなった後も、“小さな報告会社”および“非加速申告会社”である可能性があり、そのような会社が入手可能ないくつかの減少した開示義務および/または免除に依存しています。
競争と技術的変化は私たちの候補製品競争力を低下させたり時代遅れにするかもしれない。
生物製薬産業は迅速な技術変化の影響を受けている。私たちは大手製薬と化学会社、専門バイオ製薬会社、大学、その他の研究機関を含む多くの潜在的な競争相手を持っている。これらの会社、会社、その他の機関は、私たちの候補製品よりも効果的な製品を開発したり、私たちの候補製品の競争力を低下させたり、時代遅れにするかもしれません。その中の多くの会社、会社、その他の機関は私たちよりも多くの財務資源を持っており、生物製薬業界内の不利な市場条件をよりよく受け、対応することができるかもしれないが、長い製品開発と候補製品の監督審査過程を含むが、これらに限定されない。
私たちは他のバイオテクノロジーや製薬会社からの激しい競争に直面しています。もし私たちが効果的に競争できなければ、私たちの経営業績は影響を受けます。
生物技術と製薬業界の特徴は技術進歩が迅速で、競争が激しく、そして独自製品を高度に重視していることである。小分子や生物製剤,まれな疾患の臨床開発における専門知識,強力な知的財産権の組み合わせが顕著な競争優位性を有していると信じているが,現在,アドリアマイシン類似体/代替品やUPARを目標とした会社からの薬物開発計画の競争に直面している。競争はより大きな製薬会社、生物技術会社と学術界を含む複数の源から来る可能性がある。したがって、私たちの競争相手は私たちよりも多くの資源を持っているかもしれません。治療承認を得て、広範な市場受け入れを得る上で、私たちよりも成功しています。我々が最終的に商業化する可能性のある任意の製品については,任意の既存の療法や現在開発されている療法と競合するだけでなく,将来起こりうる新しい療法と競争せざるを得ないであろう。
私たちは戦略的取引に従事するかもしれません。これは私たちの流動性に影響を与え、私たちの費用を増加させ、私たちの経営陣に大きな妨害を与えるかもしれません。
時々、私たちは、買収会社、資産購入、ならびに製品、候補製品または技術の外部許可または内部許可のような戦略的取引を考慮することができる。私たちが考慮する可能性のある他の潜在的な取引には、剥離、戦略パートナー関係、合弁企業、再編、資産剥離、業務合併と投資を含む様々な異なる商業計画が含まれる。このような取引は、私たちに非日常的または他の費用を発生させることを要求し、私たちの短期的および長期的な支出を増加させる可能性があり、重大な統合挑戦をもたらしたり、私たちの管理や業務を妨害したりする可能性があり、これは私たちの運営や財務業績に悪影響を及ぼす可能性がある。例えば、これらの取引は、多くの業務および財務リスクをもたらす可能性がある
| ● |
未知の技術、製品候補、医療条件および適応、製品製造挑戦および不確実性、および他の潜在的に高リスクな未知要素に曝露する; |
|
| ● |
私たちの業務を中断し、買収した製品、候補製品、または技術を開発するために、私たちの経営陣の時間と注意を移す |
|
| ● |
買収を支払うために発生する大量の債務または持分証券の希釈発行; |
|
| ● |
買収と統合コストは予想以上だった |
|
| ● |
資産、営業権、または減価費用の減記; |
|
| ● |
償却費が増える |
|
| ● |
買収された企業の業務および人員を私たちの業務および人員と合併する困難およびコスト |
|
| ● |
経営陣および所有権の変化により、買収された任意の企業の主要なサプライヤーまたは顧客との関係が減少した |
|
| ● |
変更された状況に応じて買収された業務の重要な従業員や現在の業務の重要な従業員を維持することはできません。 |
したがって、上記の性質の任意の取引を行うか、または成功することは保証されないが、私たちが確実に達成した任意の取引は、前述または他のリスクの影響を受ける可能性があり、私たちの業務、経営業績、財務状況、および見通しに重大な悪影響を及ぼす可能性がある。
私たちの業務と運営は、コンピュータシステムの故障、ネットワーク攻撃、またはネットワークセキュリティ欠陥の影響を受けやすく、これは私たちの支出を増加させ、私たちの管理層とキーパーソンの業務運営に対する注意を移し、私たちの運営結果に悪影響を与える可能性があります。
セキュリティ対策が取られているにもかかわらず、私たちの内部コンピュータシステムおよび私たちが依存する第三者のコンピュータシステムは、コンピュータウイルス、マルウェア、自然災害、テロ、戦争、電気通信および電気障害、インターネット上のネットワーク攻撃またはネットワーク侵入、電子メール添付ファイル、私たちの組織内部の人、または私たちの組織内部システムにアクセスできる人によって破壊されやすい。世界各地からの未遂攻撃と侵入の数、強度と複雑性の増加に伴い、セキュリティホールや破壊のリスクは普遍的に増加し、特にコンピュータハッカー、外国政府とネットワークテロリストを含むネットワーク攻撃或いはネットワーク侵入を介している。このような事件が発生して私たちの運営が中断されると、私たちの製品開発計画が実質的に中断される可能性があります。例えば、完了したか、または計画されている臨床試験における臨床試験データの損失は、我々の規制承認作業を遅延させる可能性があり、データを回復または複製するコストを著しく増加させる。任意の中断またはセキュリティホールが私たちのデータやアプリケーションを紛失したり、破損したり、機密または独自の情報を適切に開示しない場合、私たちは重大な法的クレームと責任を招き、私たちの名声を損なう可能性があり、私たちの候補製品のさらなる開発が延期される可能性があります。私たちは、システムの破損を修復し、より多くの人員と保護技術を導入することで、ネットワークセキュリティ保護コストを増加させ、監督管理の罰金を支払い、法的クレームと規制行動を解決することを含む多くの資源を費やしてネットワークセキュリティホールに対応することを余儀なくされる可能性があり、これらはすべて私たちの支出を増加させ、私たちの管理層とキーパーソンの私たちの業務運営に対する注意を移し、私たちの運営結果に悪影響を与える。
健康およびデータ保護の法律法規を遵守しないことは、政府の法執行行動(民事または刑事罰を含む可能性がある)、個人訴訟または負の宣伝を招き、私たちの経営業績および業務に負の影響を与える可能性がある。
私たちおよび私たちの現在および未来の任意の協力者は、連邦、州、および外国のデータ保護法律および法規(すなわち、プライバシーおよびデータセキュリティに関する法律および法規)によって制約される可能性がある。米国では、健康関連情報および他の個人情報の収集、使用、開示および保護を管理する連邦健康情報プライバシー法(例えば、健康情報技術促進経済および臨床健康法案(HITECH)によって改正された“健康保険携帯性と責任法案”(HIPAA))、州データ漏洩通知法、州健康情報プライバシー法、連邦および州消費者保護法(例えば、連邦貿易委員会法第5条)は、私たちまたは私たちの協力者の運営に適用される可能性がある。さらに、HIPAA(HITECH改訂)や他のプライバシーおよびデータセキュリティ法のプライバシーおよびセキュリティ要件によって制限される第三者(臨床試験データを取得する研究機関を含む)から健康情報を取得することができる。事実および状況によると、もし私たちがHIPAAによってカバーされているエンティティによって維持されている個別に識別可能な健康情報を故意に取得、または許可されていない方法で取得、使用、または開示する場合、私たちは刑事罰を受ける可能性がある。
国際データ保護法には、一般データ保護条例(GDPR)と呼ばれる2016/679号法規が含まれており、米国以外で得られた健康に関する情報や他の個人情報にも適用可能です。GDPRは2018年5月25日に施行されました。GDPRはEUに新たなデータ保護要求を導入し、違反会社に2000万ユーロまたは世界年収4%の罰金を科す可能性がある。この条例は、個人情報の収集、使用、記憶、および開示に多くの新しい要求を提出し、その個人情報をデータ当事者と共有し、どのように使用しなければならないかに関するより厳しい要求、規制機関および影響を受けた個人に個人データ違反行為を通報する義務、広範な新しい内部プライバシー管理義務、および個人がその個人情報において拡大しなければならない権利(例えば、そのデータをアクセス、訂正、削除する権利)を尊重する義務を含む。さらに、GDPRは、国境を越えたデータ転送の制限を含む。GDPRは,GDPRに拘束された個人データの処理における我々の責任と責任を増加させ,個別国で実施されるメカニズムを含めてGDPRの遵守を確保するための追加的なメカニズムを構築する必要があるかもしれない。
オーストラリアでは、彼らは市民の個人情報を保護するための強力なデータ保護法規を制定した。これらの法律は1988年の連邦プライバシー法と2022年のプライバシー法改正案を含む。これらの法律はまた、特に、データ滞在要件、個人健康記録の処理の要件、およびその個人データの収集および使用におけるオーストラリア市民の具体的な権利を詳細に示すデータ主体の権利に関するデータ保護措置に関する。
さらに、カリフォルニアは“カリフォルニア消費者プライバシー法”(CCPA)を公布し、カリフォルニアの消費者のために新しいプライバシー権(法律で定義されているような)を創造し、消費者または家庭の個人データを処理するエンティティにより多くのプライバシーと安全義務を課した。CCPAは、カバーする会社が、そのような会社がデータを収集、使用、および共有する方法に関する新しい開示を消費者に提供し、これらの消費者に、特定の販売からの撤退または個人情報の移転を選択する新しい方法を提供し、消費者に追加の訴訟理由を提供することを要求する。CCPAは2020年1月1日に発効し、一部の修正案は2023年に発効する。他の州も似たような法律を採択した。CCPAや他州プライバシー法は我々の業務活動に影響を与える可能性があり,個人データや保護された健康情報に関する変化する規制環境における我々の業務の脆弱性を説明している。
米国と国際データ保護法律法規を遵守することは、私たちがデータを収集、使用、開示する能力を制限し、または場合によってはいくつかの司法管轄区域で運営する能力に影響を与える契約でより重い義務を負うことを要求するかもしれない。米国および国際データ保護の法律および法規を遵守しないことは、政府の法執行行動(民事または刑事罰を含む可能性がある)、個人訴訟または負の宣伝を招き、私たちの経営業績および業務に負の影響を与える可能性がある。
もし私たちの契約研究機関が“CRO”)または当社のITベンダーが、セキュリティまたはデータプライバシーの漏洩、または他の不正または不適切なアクセス、個人データの使用または破壊に遭遇した場合、コスト、重大な責任、当社ブランドへの損害、およびビジネス中断に直面する可能性があります。
私たちの薬物研究開発では、私たちまたは私たちのCROは、名前、郵送住所、電子メールアドレス、電話番号、臨床試験情報などの様々な個人データを収集して使用することができるかもしれない。我々は、我々が開発した技術および候補薬物に関連する臨床試験中に患者データを共有および損失することを防止するための広範な措置を講じているが、セキュリティホールまたは不正アクセスを防止または減少させ、私たちの臨床データまたは患者個人データを使用または開示することができない行為は、州法(例えば、州通知法)、連邦法(HIPAA、HITECH改正)、およびGDPRなどの国際法によって規定された重大な責任をもたらす可能性がある。セキュリティホールや不適切なアクセスを防止または軽減することができず、私たちの臨床データまたは患者個人データを使用または開示する行為は、私たちの名声に重大な悪影響を与える可能性があり、私たちの新しい研究を行う能力に影響を与え、私たちの業務を妨害する可能性がある。私たちはまた、第三者ITベンダーに依存して、または他の方法で私たちおよびユーザのいくつかのデータを処理することができ、そのようなITベンダーがセキュリティホールを防止または軽減できない場合、またはそのような情報に不適切なアクセスまたは開示を行うことができない場合、私たちに同様の不利な結果をもたらす可能性がある。このようなセキュリティやデータプライバシー漏洩の影響を防止または軽減できなければ、訴訟や政府調査に直面する可能性があり、業務の潜在的な中断を招く可能性があります。
もし私たちが環境、健康、そして人間の安全を保護する法律を守らなければ、私たちの業務は不利な影響を受けるかもしれない。
私たちの研究開発と候補薬物と将来の商業製造は危険材料と各種化学品の使用に関連する可能性がある。著者らは現在メンテナンス研究実験室がないが、著者らは第三者研究機関とメーカーを招いて臨床前研究、臨床試験と製造を行っている。これらの第三者実験室とメーカーは、これらの危険材料を使用、製造、貯蔵、運搬、処分する際には、連邦、州、現地の法律と法規を遵守しなければならない。これらの材料の所在州や米国労働部職業安全·健康管理局に関するガイドラインを遵守するためには,第三者がその施設でこれらの材料を保管,処理,処分するプログラムに依存しなければならない。これらの材料を処理·処分するセキュリティプログラムは適用法規の基準に適合していると考えられるが,これらの材料による意外な汚染や傷害のリスクは解消できない。もし事故が発生したら、私たちの開発が深刻な遅延を招くかもしれない。私たちはまた多くの環境、健康、そして職場の安全法律法規によって制限されている。私たちは私たちのコストと支出を支払うために労災賠償保険を維持していますが、従業員の負傷によって損失を受ける可能性がありますが、この保険は潜在的な責任に対処するのに十分ではないかもしれません。未来には私たちが運営する他の連邦、州、そして地方法律に影響を及ぼすことができるかもしれない。私たちはこれらの法律や法規を守るために巨額のコストを招くかもしれません。もし私たちがこれらの法律や法規に違反したら、私たちは巨額の罰金や処罰を受けるかもしれません。
私たちは役員と上級管理職の責任を制限し、それを賠償しました。
私たちの役員と上級管理者は私たちに責任があり、私たちの事務を処理する際には誠実で良好な商業判断と誠実さを持たなければなりませんが、私たちの二回目の改正と再改訂された会社登録証明書(“会社登録証明書”)と私たちのすべての非従業員と高級職員が署名した賠償協定は、私たちの非従業員取締役と高級職員はデラウェア州の法律で許容される最大の賠償を受けることになります。したがって、当社の登録証明書や賠償協定にこれらの条項がないのと比較して、我々の株主の非従業員取締役や上級管理職に対する株主の権利は減少する可能性があり、株主が受託責任に違反して損害賠償を求める能力が減少または制限される可能性がある。以下の場合、デラウェア州法律は、私たちの非従業員取締役および高級職員に対する賠償を許可する:(A)非従業員取締役または高級職員は、誠実さに基づいて行動し、その行為は、私たちの最良の利益に適合または違反しない、(B)任意の刑事訴訟または法的手続きについて、非従業員取締役または高級職員がこの行為が不法であると信じる合理的な理由がない場合。
会社の登録証明書及び補償協定によると、すべての非従業員取締役及び職員は、彼又は彼女が非従業員取締役又は職員であったために法律手続きになった側であれば、任意及びすべての責任について当社に補償するが、本行は、以下の状況について非従業員取締役又は職員に補償してはならない:(A)その者がMonoparに対して法的責任があるか、又はMonoparに有利な強制救済を受けなければならない訴訟によって引き起こされたいかなる責任を判決されたか、(B)故意に不正行為又は違法、詐欺又は深刻な不注意を知りながら違法又は不行為であることを含む、(C)不法配布;(D)非従業員取締役または高級職員がこれによって個人的利益またはデラウェア州法律に従って他の方法で禁止または許可されていない任意の取引を受けること、または(E)吾等とそのような非従業員取締役または高級職員との間の任意の紛争または法的手続きについて、取締役会の利害関係のない多数のメンバーまたは利害関係のない株主の多数の承認を受けない限り、補償を受けること。私たちは、非従業員取締役又は上級職員が賠償を求める弁護士費及び支出の支払い又は精算を要求され、非従業員取締役又は高級職員が協定に署名し、管轄権のある裁判所が最終的に当該人が賠償を受ける権利がないと判断した場合には、支払う又は返還すべき金額を償還する。
今後の立法、行政、民間部門の行動は、製品の商業化の難しさとコストを増加させ、このような製品の価格に悪影響を及ぼす可能性がある。
アメリカでは、医療コストを抑えるための多くの立法措置が続いているだろう。例えば、2010年3月、“平価医療法案”(“ACA”)が公布され、政府や民間保険会社が医療に融資する方式を大きく変え、米国の製薬業に大きな影響を与えた。
公布以来、ACAのいくつかの側面は多くの司法、行政、行政、立法方面の挑戦を受けており、私たちは今後もACAに対してより多くの挑戦と修正案を提出することが予想される。これらの事態のいずれかが薬品定価に下り圧力を継続していれば,特に連邦医療保険計画の下で,あるいは規制負担や運営コストを増加させることは,我々の業務に悪影響を及ぼす可能性がある。ACAのさらなる変化が私たちの業務にどのような影響を与えるか予測できない。
また、政府の価格報告や支払い法規は複雑で、これらの義務に基づいて任意の将来の価格を計算し、報告するための方法を評価していくことが求められています。私たちの計算方法は本質的に主観的であり、異なる政府機関の審査と挑戦を受ける可能性があり、これは私たちの解釈に同意しないかもしれない。もし政府が私たちの報告書の計算に同意しなければ、私たちは以前に報告されたデータを再陳述し、追加の財務と法的責任に直面する可能性があるかもしれない。
また、GDPに占める医療コストの割合が上昇しており、大多数の政府ヘルスケア計画(連邦医療保険や医療補助、州や地方医療保健計画、特に退職福祉)の背後には巨大で増加している繰延負債があり、依然として経済的挑戦であり、米国全体の経済健康を脅かしている。医療コストをより良くコントロールし、大幅に低減しなければならないと考えられる各方面にとって、ライフサイクル早期にある高コスト医療製品や療法は魅力的な目標である。薬品価格と医療改革は長年立法者によって議論され、行動されてきた。将来的に医療改革に関連する立法や行政または民間部門の行動は、薬品開発のリスクとコストに報いるのに十分な価格で収入を創出し、資金を調達し、私たちの製品をマーケティングする能力を低下させ、私たちの業務に実質的な悪影響を与える可能性がある。
連邦や州医療改革が私たちの将来の業務や財務業績に悪影響を与えないことは保証されず、将来の連邦や州が医療改革や第三者支払者に関連する立法、司法または行政改革が製薬業、特に私たちの業務全体にどのように影響するかを予測することもできない。
任意の候補薬剤を商業化することができても、これらの候補薬剤は、不利な価格設定法規や第三者保険および精算政策の制約を受ける可能性があり、これは私たちの業務を損なうことになる。
私たちがどの製品を商業化することに成功するかどうかは、政府当局、個人医療保険会社、健康維持組織などの第三者支払者がこれらの製品と関連治療に保険と十分な補償を提供する程度にある程度依存する。処方薬を服用して疾患を治療する患者は、通常、その処方薬に関連する費用の全部または一部を精算するために第三者支払者に依存する。政府医療計画(例えばMedicareやMedicaid)および民間医療保険会社のカバー範囲と十分な補償は、新製品の受容度に重要である。患者は私たちの未来の製品を使用することはあまりできません。もしあれば、保険を提供しなければ、かなりの費用を支払うのに十分です。
統制費用はアメリカの医療産業と他の地域の優先順位だ。そこで,政府当局や他の第三者支払者は,特定の薬物のカバー範囲や精算金額を制限することでコストを抑制しようとしている。ますます多くの第三者支払人は製薬会社に価格に基づいて所定の割引を提供し、医療製品の定価に挑戦することを要求している。第三者支払人はまた、上場承認に必要なデータ以外の追加の臨床証拠を得ることを要求することができ、会社に高価な薬物経済学研究を行い、その製品の医療必要性と費用効果を証明することを要求することができる。商業第三者支払者は,その精算率を設定する際には通常連邦医療保険カバー政策や支払い制限に依存するが,連邦医療保険確定以外にも独自の方法や承認プロセスがある。そのため、アメリカの薬品の保証範囲と精算範囲は支払人によって異なる。商業化されたどの製品にもカバー範囲と十分な精算があることを確実にすることはできません。精算があれば、精算レベルが十分かどうかを保証することはできません。保証範囲と精算は、私たちが発売許可を得た任意の候補薬物の需要や価格に影響を与える可能性がある。保険や精算が得られない場合、あるいは限られたレベルに限られていれば、上場承認された任意の候補薬を商業化することに成功しない可能性がある。
そのほか、新薬と治療性生物製剤の監督管理審査、定価と精算を管理する法規は国によって異なる。一部の国は薬物或いは治療性生物製剤の販売価格が承認されてから発売されることを要求している。多くの国で、定価審査期間は発売が承認された後から始まる。一部の外国市場では、処方薬の定価は初歩的な承認を得た後も、政府の持続的なコントロールを受けている。したがって、特定の国で製品の規制承認を受ける可能性がありますが、その後、価格規制の制約を受け、これらの規制は私たちの製品の商業発表を延期し、長い間延期される可能性があり、その製品の国/地域での販売から生じる収入にマイナスの影響を与えることができます。不利な価格設定制限は、私たちの候補薬が規制部門の承認を得ても、1つ以上の候補薬への投資を回収する能力を阻害するかもしれない。
政治的分裂した政府行動や政府以外の政治行動がFDAに影響を与える可能性がある’Sがアメリカの新医薬製品と私たちの業務を適時かつ効率的に審査する上での役割は不利な影響を受ける可能性がある。
近年、米国政府が運営する予算や政府資金問題をめぐり、重大な政治的衝突が存在している。政府の閉鎖や政府の閉鎖の脅威は繰り返し発生する事件だ。従来,これらの活動はFDAを差し迫った人間の生命の脅威に対応するために必要な活動や繰越使用料による助成活動に制限されていた。今後政府の閉鎖やその他の活動はFDA(特に薬物評価·研究センター)が利用可能な財政資源を制限し、新製品の薬物開発提出、審査·承認、その他の必要な規制行動の処理を延期する。そのような遅延は私たちの業務と財政状況に悪影響を及ぼすだろう。
FDAとの効果的な協力 候補薬物の承認は要求の高いプロセスであり、承認される時間と費用の増加につながる可能性がある。
わが社は薬品審査管理において内部専門知識と経験を持っています。合格した顧問と薬物研究機関も私たちの薬品審査プロセスに協力することができる;しかし、薬品審査プロセスに固有の討論と相互作用、未来の発展或いは新しい改善は遅延、費用増加と新しい科学/医学要求を招き、これは不利な財務結果を招き、会社の株の価格に影響を与える可能性がある。
未来の税金改正措置は私たちの財政状況に否定的な影響を及ぼすかもしれない。
税改正措置は予測不可能であり、米議会や行政指導部の変化に伴って変化する可能性がある。例えば、2017年12月22日、2017年に減税と雇用法案が調印されて法律となり、改正された1986年の国内収入法典(以下、“法典”)が大幅に改正された。将来どのような税制改革措置が実施される可能性があるか、これらの措置が私たちの財務状況や業務にどの程度影響を与えるかを予測することは難しい。
外貨為替レートは私たちの連結財務諸表に悪影響を及ぼす可能性があります。
ドル以外の通貨での売却と購入はドルに対する外貨の変動に直面させ、私たちの総合財務諸表に悪影響を及ぼす可能性があります。ドルが強くなると、将来的にドルで他の国に販売される薬品の有効価格が増加し、これは価格を下げたり、現地通貨価格を上げることなく販売に悪影響を与える必要があるかもしれません。ドルの弱さは私たちが海外で購入した材料、製品、サービスのコストに悪影響を及ぼす可能性がある。報告目的では、我々の非米国業務の販売や費用もドルに換算され、ドルの切り上げや切り下げは不利な外貨換算や取引影響を招く可能性がある。また、私たちのいくつかの業務は将来的に業務本位貨幣以外の通貨で顧客に領収書を発行する可能性があり、領収書を発行する貨幣の本位貨幣に対する変動も不利な外貨換算や取引影響を招く可能性がある。私たちが海外で保有し経営している子会社の投資も為替リスクに直面している。
来年の運営費用と資本支出は私たちの管理に基づいていると予想しています’Sは将来起こりうるイベントを推定した.新しい条件の実際の金額とコストは私たちの経営陣が見積もっているのとは大きく違うかもしれません。
薬品と抗癌薬の開発リスクは極めて高く、予測できない。私たちはいくつかの仮定に基づいて次の年の運営費用と資本支出を推定した。仮定の任意の変化は、実際の結果が予想費用および支出と大きく異なる可能性があり、実際の費用または支出と予測費用または支出との大きな差をもたらす可能性がある。しかも、このようなすべての要素は予見できない未来の事件の影響を受ける。資本支出と運営費用の見積もりは連邦証券法の意味での展望的な陳述を代表する。潜在投資家に注意すると、このような展望性陳述は未来の業績の保証ではなく、リスクと不確定要素に関連する。各種の要素により、本年度報告10-K表の“リスク要素”の節に列挙されたリスク要素を含むため、実際のイベント或いは結果は前向き陳述で議論されたものと大きく異なる可能性がある。
私たちが時々行う可能性のある財政的で業務的な予測は固有の危険の影響を受けるかもしれない。
私たちがここで提供しているか、または私たちの経営陣が時々提供する可能性のある予測(戦略的および実質的な財務資源の調達に成功したが、臨床試験のコストと時間、臨床と規制スケジュール、生産と供給事項、商業発表日、および他の財務または運営事項を含む)は、私たちの特定および一般的な業務、規制、経済、市場と財務状況、および他の事項の仮定を含む、私たちの経営陣が下した多くの仮定を反映しており、これらの多くは私たちがコントロールできない。したがって,予測を作成する際に行われる仮説や予測自体が不正確であることが証明される可能性がある.実際の結果と予測結果の間には差がある可能性があり,実際の結果は予測結果と大きく異なる可能性がある.本年報の10-Kテーブルに予測を加えることは,我々の管理層がそのような予測を未来イベントの保証予測と考えたり考えたりするべきではないため,このような予測に依存すべきではない.“前向きな陳述に関する警告声明”を参照してください
私たちの現在と未来の潜在的な国際業務は、米国以外での業務展開に関連するビジネス、政治、運営、金融リスクに直面する可能性がある。
私たちの業務は国際業務の展開に関連するリスクの影響を受けています。私たちのいくつかのサプライヤー、臨床研究組織、臨床試験場所はアメリカ以外に位置しています。また、私たちまたは任意の未来のパートナーが任意の製品の開発に成功した場合、私たちはEU、イギリス、アメリカ以外の他の司法管轄区でこれらの製品を販売することが予想されます。承認されれば、私たちまたはパートナーは販売代表を招聘し、アメリカ以外の場所で医師や患者協会の外聯活動を行う可能性があります。国際的な業務展開には多くのリスクが含まれていますが、これらに限定されません
| ● |
プライバシー法規、税法、輸出入制限、就業法、規制要件および他の政府の許可、許可、許可などの複数の相互衝突と変化する法律法規、これらの法規は、異なる司法管轄区域の審査と実行程度によって異なることができる |
|
| ● |
私たちは様々な国で私たちの製品を使用する規制の承認を得ることができませんでした |
|
| ● |
他の国家主管部門は国外の臨床試験データに対する拒否或いは鑑定; |
|
| ● |
私たちの製品および候補薬が必要かもしれない他の可能性のある第三者特許および他の知的財産権の開発と商業化; |
|
| ● |
私たちの特許および他の知的財産権を取得、維持、実行、保護する上での複雑さと困難 |
|
| ● |
小規模組織は人員の配置と外国業務の管理に困難を抱えている |
|
| ● |
複数の支払人精算制度、政府支払人または患者自己支払いシステムの管理に関連する複雑さ |
|
| ● |
アメリカに本社を置く会社として、国際市場に進出する能力は限られている |
|
| ● |
金融リスク、例えば、長い支払い周期、売掛金の回収が困難であること、地元および地域的金融危機が私たちの製品の需要と支払いに与える影響、外貨為替レートの変動の影響を受ける |
|
| ● |
戦争、テロ、政治的動乱、疾病の発生、ボイコット、貿易およびその他の商業制限の削減、関税の実施を含む自然災害、政治的、経済的不安定 |
|
| ● |
いくつかの費用は、他の費用以外に、旅費、翻訳と保険料を含む |
|
| ● |
反腐敗コンプライアンスと記録保存に関連する監督管理とコンプライアンスリスクは、アメリカ“反海外腐敗法”、その会計条項或いは反賄賂条項或いはその他の国/地域の反腐敗或いは反賄賂法律条項の範囲に属する可能性がある。 |
これらの要因のいずれも、私たちが行っている国際臨床業務およびサプライチェーン、および将来の任意の国際拡張および業務を損なう可能性があり、それによって、私たちの業務、財務状況、運営の将来性、および結果を損なう可能性がある。
私たちの業務はアメリカと外国の反腐敗と反マネーロンダリング法律の制約を受けており、これらの法律を守らないと私たちに刑事または民事責任を負わせ、私たちの業務を損なう可能性があります。
米国が1977年に改正した“反海外腐敗法”(以下、“海外腐敗防止法”と略す)、“米国法典”第18編201節に含まれる米国国内賄賂法規、米国旅行法、米国愛国者法、および私たちが活動を行っている国の他の州や国の反賄賂と反マネーロンダリング法を遵守しなければならない。反腐敗法の解釈は広く、会社とその従業員、代理人、第三者中間者、合弁パートナー、および協力者の直接的または間接的な許可、約束、提供、または不正な支払いまたは福祉の公共または民間部門の受給者への提供を禁止する。私たちは政府機関や政府付属病院、大学、他の組織の役人や従業員と交流している。また、第三者仲介機関を招いて海外で私たちの臨床研究活動を普及させたり、必要な許可、免許、その他の規制承認を得たりする可能性があります。私たちは、私たちが明確に権限を持っていなくても、または実際にこれらの活動を理解していなくても、これらの第三者仲介機関、私たちの従業員、代表、請負業者、パートナー、および代理人の腐敗または他の不正活動に責任を負わなければならないかもしれない。
私たちには商業行為と道徳基準があり、“海外腐敗防止法”や世界各地での業務に適用される他の反腐敗法律の遵守が求められている。しかし、私たちの従業員と第三者仲介機関がこの規則またはこのような反腐敗法律を遵守するということを保証することはできません。反腐敗および反マネーロンダリング法を遵守しないことは、私たちを告発者の苦情、調査、制裁、和解、起訴、他の法執行行動、利益の返還、巨額の罰金、損害賠償、他の民事と刑事罰または禁止、特定の人との契約の一時停止または禁止、輸出特権の喪失、名声損害、不利なメディア報道、およびその他の付随的な結果に直面する可能性がある。任意の召喚状、調査または他の法執行行動が発行されたり、政府または他の制裁が実施されたり、または可能な民事または刑事訴訟で勝つことができない場合、私たちの業務、運営結果、および財務状況は実質的な損害を受ける可能性がある。また、どの行動への対応も、経営陣の注意力と資源の重大な移転、巨額の国防·コンプライアンスコスト、その他の専門費用を招く可能性がある。場合によっては、法執行当局は私たちに独立したコンプライアンス監督官を任命させるかもしれませんが、これは追加のコストと行政負担を招く可能性があります。
私たちの普通株に関するリスクは
既存および新しい投資家は、2016年の株式インセンティブ計画およびこの計画の任意の改正に基づいて、私たちの普通株および未来オプション活動を将来的に売却または発行することで希釈されるだろう。
時間が経つにつれて、私たちの非従業員役員、従業員、および私たちのいくつかの顧問はすでに株式を獲得し、および/またはオプションを付与するだろう。改正·再改訂されたMonopar Treateutics Inc.2016株式インセンティブ計画によると、我々の普通株は、株式オプションまたは制限株式単位として合計5,100,000株を発行することができ、我々の普通株を購入する株式オプション(株式オプション1,553,867株を行使可能)が付与され、2024年3月8日現在、非従業員および従業員に付与された410,136株制限株式単位とともに流通している。帰属制限された株式単位および/またはそのようなオプションを行使した後にそのような持分を発行し、新しい持分奨励を付与することは、私たちの既存および私たちの新しい投資家の株式を希釈する。2024年3月8日現在、株式オプション189,346件が行使されている。
私たちの既存の投資家と私たちの新しい投資家も、私たちがいくつかの取引に関連する株式証券を発行することによって深刻な希釈を受けるだろう。これらの取引は、将来の資金調達努力、知的財産権許可、買収、または商業化計画の中で将来的に株式を発行することを含むが、これらに限定されない。
私たちの普通株式保有者は私たちの運営や重大な取引の決定を統制できないだろう。
私たちの業務と事務は私たちの取締役会または取締役会の指導の下で管理されています。私たちの株主は連邦または州法律で株主投票が必要と規定されている場合にのみ投票する権利がある。株主承認は、私たちの多数以上の流通株を保有する株主の同意と承認を得る必要がある。株式には累積投票権がないため、当社の発行済み株式の大部分を持つ保有者はすべての取締役会メンバーを選挙することができる。TacticGem,LLC(“TacticGem”)は7166,667株普通株(41.06%)を有している。有限責任会社協定は,TacticGemがそのメンバがTacticGemに占める割合で投票用紙(取締役選挙の投票を含む)をそのメンバに渡すことを要求している(TacticGemは57.367の株式,Gemは42.633の株式を持つ).そのため、私たちの初期投資家TATY Pharmaは私たちの約24.51%の実益権益を持っていて、Gemの約17.50%の実益所有権を持っていて、この2つの実体は私たちの大部分の株をコントロールして、すべての取締役会のメンバーの選挙と私たちの事務の制御に重大な影響を与えるだろう。また、私たちのCEOと取締役、そして私たちの他の取締役の一人は、テディ製薬と関連があります。
我々のValidive 2 b/3期臨床計画の中期分析ではできない決定が得られ,我々の株価が低下した。もし私たちの株価がナスダック延長の回復コンプライアンスの最終期限までに上昇しなかった場合、あるいはより多くの時間を要求する控訴を獲得しなければ、 私たちの業務は不利な影響を受けるかもしれない。
2023年3月末の否決決定により、我々のValidive臨床試験は終了し、私たちの株価は下落した。私たちの株の終値は30以上の取引日連続で1.00ドル以下に下落しました。2023年8月28日、私たちはナスダックの上場基準を満たしていないとナスダックの通知を受けて、180日間コンプライアンスを回復してくれました。2024年2月27日、2番目の180日目の期限を取得し、2024年8月26日までにコンプライアンスを再獲得した。しかし、私たちが必ずコンプライアンスを再獲得する保証はありません。もし入札不足を補うために逆株式分割を実施する必要があれば、私たちの株価への影響は不確定で、不利かもしれません。もし私たちがコンプライアンスを再獲得しなければ、私たちは退市に直面します。これは私たちの融資能力に深刻な不利な結果をもたらすかもしれません。これは、私たちの運営を延期、再編、または他の方法で再検討することにつながるかもしれません。
私たちはナスダック資本市場の他の持続的な上場要求を満たすことができず、私たちの普通株が銘柄を取られる可能性があります。
ナスダック資本市場の他の持続的な上場要求を満たすことができなければ、例えば企業統治要求に限定されない場合、ナスダック株式市場(“ナスダック”)は、我々の普通株を撤退させる措置をとる可能性がある。このような退市や退市発表は私たちの普通株の価格にマイナス影響を与え、私たちの普通株を売却または購入する能力を弱めるだろう。退市事件が発生した場合、私たちはナスダックの上場要求を遵守するために行動しますが、私たちが取ったどのような行動も、私たちの普通株の再上場を許可し、市場価格を安定させたり、私たちの普通株の流動性を高めたり、私たちの普通株がナスダックの最低購入価格要求を割ったり、将来ナスダックの上場要求に合わないことを防止することを保証することはできません。
私たちの経営業績にかかわらず、私たち普通株の株価は変動するかもしれませんし、下がる可能性もあります。
バイオテクノロジーや製薬会社証券の市場価格は従来から大きく変動しており,市場はしばしば重大な価格や出来高変動を経験しており,特定の会社の経営業績とは無関係のようである。我々の普通株は2019年12月19日からナスダック資本市場で取引されており、2024年3月8日現在、我々の普通株価格は最低0.274ドルから最高点48.00ドルまでの大幅な変動を経験している。ニュース配信に対応するためにも、不確定な理由でも、私たちの株価は時々顕著なディスク変動と出来高変化を経験している。我々の上場流通株の規模は比較的に小さく、取引量は相対的に低く、不一致であり、これは変動性を悪化させた。
多くの要素のため、私たちの普通株の市場価格は高度な変動を維持し、大幅に変動する可能性があります
| ● |
私たちの臨床試験の進展と成功の公告について、私たちは私たちの候補製品のための規制承認を得て、それを商業化する能力を含み、FDAまたはTGAから受け取った任意の規制承認を遅延させること、または承認された場合に私たちの候補製品を発売する追加の研究またはデータの要求を含む |
| ● |
製薬とバイオテクノロジー部門や経済全体の市場状況は不安定だ |
| ● |
株式市場全体の価格と出来高が変動する |
| ● |
私たちの候補製品が承認された場合、予想された商業成功を得ることができなかった |
| ● |
放射性同位体の供給を中断したり、放射性同位体を製造するために必要な原材料の供給を中断し、臨床場所への放射性薬物のタイムリーな供給を妨害する可能性がある任意の事件を宣言した |
| ● |
私たちまたは私たちの直接競争相手は臨床成功、NDA承認、または新製品の発売を発表します |
| ● |
他人の製品開発成果や知的財産権の進捗状況を公告する |
| ● |
私たちの潜在的または承認された製品の安全性および/または有効性に対する訴訟または大衆の懸念; |
| ● |
我々の四半期や年度の経営業績の実際の変動、および将来このような変動が発生する可能性があることに対する投資家の懸念は、内部問題があることを示している |
| ● |
私たちの経営業績は証券アナリストの見積もりや他のアナリストのコメントとずれています |
| ● |
キーパーソンの増減 |
| ● |
医薬品の価格設定を制御するための措置と、第三者保険と補償政策を含む医療改革立法 |
| ● |
現在または未来の戦略的協力に関する公告または宣伝; |
| ● |
財経、科学メディア、オンライン投資家コミュニティによる私たちの会社、私たちの株価、または私たちの潜在的な未来の市場価値の討論; |
| ● |
新冠肺炎の変動状況に対する市場の反応、または将来の任意の流行病、またはロシア-ウクライナ戦争またはイスラエル-ハマス戦争に対する反応。 |
私たちは証券集団訴訟に巻き込まれるかもしれません。これは経営陣の注意をそらすかもしれません’Sは私たちの業務に注意して損害を与えました。
株式市場は時々重大な価格と出来高の変動を経験し、生物技術と製薬会社の普通株の市場価格に影響を与えた。私たちが初めて株式を公開して以来、私たちの株価はこのような変動を経験した。このような広範囲な市場変動は私たちの株の市場価格の上昇や下落を招くかもしれない。従来、証券集団訴訟は、ある会社の証券市場価格が下落した後に提起されることが多かった。このリスクは,バイオテクノロジーやバイオ製薬会社が近年大幅な株価変動を経験しているため,特に我々と関連している。私たちは未来にこのような種類の訴訟に巻き込まれるかもしれない。訴訟費用は往々にして高く、経営陣の注意力や資源を分散させており、私たちの業務に悪影響を及ぼす可能性がある。
私たちの大量の流通株は市場で販売されるかもしれない。もし私たちの普通株が大量に売却されたら、私たちの普通株の価格は下がるかもしれない。
もし私たちの普通株が大量に売却されれば、特に私たちの非従業員取締役、役員、大株主の売却、あるいは私たちの普通株が大量に売却できる株があれば、市場は売却すると考えて、私たちの普通株の価格は下がるかもしれません。2024年3月8日まで、私たちは17,454,925株の普通株流通株を持っている。我々普通株のかなりの部分の流通株は現在、非従業員取締役、役員、その他の関連会社が保有しており、改正された1933年証券法(証券法)第144条に規定する出来高制限を受けている。
ある条件の下で、私たちの最大株主は私たちに彼らの株式に関する登録声明を提出することを要求する権利があり、あるいは彼らの株を私たち自身または私たちの株主のために提出する可能性のある登録声明に含める権利がある。私たちはまた私たちが発行し、私たちの従業員株式激励計画に基づいて発行される可能性のある普通株を登録した。これらの株は発行後に公開市場で自由に販売することができるが、場合によっては売却禁止や、関連会社の数量制限など、既存の内部やり方を遵守しなければならない。公開市場で大量の普通株を売却したり、大量の普通株の保有者が彼らの株を売却しようとしていると市場が考えているため、我々の普通株の市場価格は低下する可能性がある。
純営業損失の繰越や他の税務属性を使用する能力が制限される可能性があります。
この規則第382条によると、会社が“所有権変更”(価値で計算すると、その株式の3年間の変動が50%を超えることを指す)を経験した場合、会社は変動前の純営業損失の繰越及びその他の変動前税務項目属性(例えば税務相殺を研究する)を用いて変動後の収入を相殺する能力が限られる可能性がある。今後3年間の追加拠出努力は、近い将来に“所有権変更”制限を引き起こす可能性があると考えられる。したがって、もし私たちが課税純収入を稼ぐと、変動前の純営業損失繰越を使ってアメリカ連邦課税収入を相殺する能力が制限され、これらの制限を受けなければ、将来の納税義務が増加する可能性があります。
証券や業界アナリストが我々の業務に関する研究報告を発表しない場合、あるいは不正確または不利な研究報告を発表しなければ、私たちの株価や取引量は低下する可能性がある。
私たちの普通株の取引市場は、証券や業界アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存するだろう。私たちの1人以上のアナリストを追跡して私たちの株式格付けを引き下げたり、私たちの業務に関する不正確または不利な研究報告を発表したりすれば、私たちの株価は下落するかもしれない。これらのアナリストのうちの1人以上がわが社への報道を停止したり、私たちに関する報告書を定期的に発表できなかったりすれば、私たちの株に対する需要が減少する可能性があり、これは私たちの株価や取引量を低下させる可能性がある。
私たちは予測可能な未来に配当金を支払うつもりはありません。したがって、あなたが投資リターンを達成する能力は私たちの普通株価格の上昇にかかっています。
私たちは私たちの配当金についてどんな現金配当金も発表したり、支払ったりしたことがなく、予測可能な未来にも私たちはどんな現金配当金も支払うつもりはない。将来配当金を派遣するかどうかは、当社の取締役会が適宜決定する。したがって、投資家は、将来の収益を実現する唯一の方法として、価格上昇後に普通株を売ることに依存しなければならない。これは決して起こらないかもしれないからである。
私たちが私たちの会社を売却することで私たちの投資家に流動性を提供する保証はない。
私たちのような製薬会社の買収は珍しくありませんが、当社がどんな形の合併、合併または売却、あるいは任意の合併、合併または売却が発生するかは保証されませんが、完成しても、私たちの投資家に流動性や利益を提供することはできません。あなたは私たちの投資家に流動資金や利益を提供して、私たちの会社に投資するために業務を売却することを期待してはいけません。
デラウェア州の法律と私たちの改正と再記述された定款の条項は合併、買収要約あるいは代理競争を困難にする可能性があり、それによって私たちの普通株の潜在取引価格を下げる可能性がある。
我々の定款書類やデラウェア州法律によると、反買収条項は買収を困難にし、現在の経営陣や取締役会の試みを制限または罷免し、株価に悪影響を及ぼす可能性がある。
私たちの改正および再記述された定款の条項は、株主がその株によってプレミアムな取引を得る可能性があること、または私たちの株主がその最適な利益に適合すると考える可能性のある取引を含む、私たちの支配権または経営陣の実際または潜在的な変化に関連する取引を遅延または阻止する可能性がある。したがって、このような規定は私たちの株価に悪影響を及ぼすかもしれない。他の事項を除いて、私たちが改訂し、再説明した付例は以下のとおりである
| ● |
取締役会のすべての空きは取締役会でしか埋められず、株主が埋めることはできないと規定している |
|
| ● |
任意の役員選挙で投票する権利のある多数の普通株式保有者が、もしそうすべきなら、すべての選挙に参加する取締役を選挙することを許可する |
|
| ● |
株主の特別会議は私たちの取締役会だけで開催されることが規定されている。 |
また,我々はデラウェア州に登録設立されているため,デラウェア州会社法第203条の規定により,デラウェア州会社が株主が“利害関係のある”株主になった日から3年以内に任意の“利害関係のある”株主と広範な業務統合を行うことを一般的に禁止している。
プロジェクト1 C。ネットワーク·セキュリティ
多くの会社のように、私たちは重大で持続的なネットワークセキュリティリスクに直面しています。しかし、私たちの組織は規模が小さく、資源が限られており、これらのリスクを悪化させる可能性があります。しかし、私たちは、これらのリスクの管理と監視を維持し、標準的な操作手順(SOP)と訓練を実施して、これらのリスクの評価、識別、監視、対応を支援することに取り組んでいます。実施されているプログラムには、ソフトウェアおよびデータベースに暴露された内部リスト、データベースサプライヤーのリスク分析、サプライヤーのバックアップ審査、セキュリティ、プライバシー対策が含まれています。さらに、私たちはSOPと訓練の基礎になる内部ネットワークセキュリティ政策を起草している。我々の内部サーバにはファイアウォールが含まれており,毎日何回かマルウェアをスキャンし,必要に応じて回復するためにデータをクラウドにバックアップする.従業員は釣り電子メールを避ける訓練を受け、私たちの内部制御システムは詐欺的な領収書を支払うリスクを低減することを目的としている。当社の10-K表の日まで、これまでの事件による、あるいは私たちの業務戦略、運営結果、財務状況に重大な悪影響を及ぼす可能性が高いと考えられるネットワークセキュリティ脅威を経験したことはありませんが、将来重大な事件を経験しない保証はありません。このような事件は、成功するか否かにかかわらず、機密手術や患者記録を含む重要な情報の取得を損なう可能性があり、高い費用をかけて救済措置を実施する可能性があります。私たちのネットワークセキュリティリスクに関するより多くの情報は、“リスク要因”を参照してください。
私たちの目標は、私たちの規模と財務力のような会社の業界ベストプラクティスを私たちのサイバーセキュリティ計画に組み込むことです。我々のネットワークセキュリティ戦略は、重大なネットワークセキュリティリスクを評価、識別、管理するための効果的かつ効率的な制御、技術、トレーニング計画の実施に集中している。我々の取締役会は、ネットワークセキュリティリスクを最終的に監視し、私たちの最高財務官が率いるネットワークセキュリティ委員会を設立した。*資源の限られた小組織として、特定のネットワークセキュリティ組織や特定のネットワークセキュリティの専門知識を持つ従業員はいない。私たちの最高財務官が私たちのネットワークセキュリティ委員会の責任者に選ばれたのは、財務およびオペレーティングシステムおよび第三者プロバイダの監督においてより広範な管理経験があるからである。当社の管理チームと取締役会は、通常、毎年少なくとも1回、またはより頻繁に必要または提案として決定される当社のネットワークセキュリティ計画を定期的に検討しています。
項目2.財産
私たちは現在、イリノイ州ウィルマット村Skokie Blvd 1000号にある行政本部を当社のオフィスとして月ごとに借りていますが、今後12ヶ月以内に長期賃貸契約を締結するかもしれません
項目3.法的訴訟
私たちは今まで持っていなかったし、今までどんな不利な実質的な法的手続きにも参加したことがない。
第II部
項目5.登録者普通株式市場、関連株主事項、発行者による株式証券の購入
市場情報
私たちの普通株はナスダック資本市場に看板を掲げて上場しています。コードはMNPRです。
所持者
2024年3月8日現在、我々の発行済み普通株は17,454,925株であり、登録されている株主30名と約3,200人の受益株主が保有している。
配当をする
私たちは私たちのいかなる株にも現金配当金を支払ったことがありません。今私たちは私たちの未来の収益を保留するつもりです。もしあれば、私たちの業務の発展と成長に資金を提供します。予測可能な未来に、私たちは私たちの普通株の保有者に現金配当金を支払うつもりはない。
登録権
私たちは、TacticGemの指示の下で、TacticGemまたはそのメンバーGem PharmPharmticals、LLCが私たちの任意の普通株を転売することを含むS-3表または他の適切な形式の登録声明を提出することを要求するTacticGem、LLC(“TacticGem”)と合意された合意を受けた。本稿の日付まで,TacticGemは,将来的に要求されない保証はないにもかかわらず,このような転売登録声明の提出を要求していない.
最近販売されている未登録証券。
本報告で述べた期間には、証券法に基づいて登録された証券発行はない。
第7項:経営陣の財務状況と経営成果の検討と分析。
本年度報告書の末尾にForm 10-K形式で提供されている当社の財務状況および経営結果の検討および分析、および当社の財務諸表および関連付記を読まなければなりません。本議論および分析に含まれるまたは本Form 10-K年次報告の他の部分に記載されている情報は、リスクおよび不確実性に関する前向きな陳述を含む、我々の業務および関連融資活動の計画および戦略に関する情報を含む。本年度報告表の10-K第1 A項の“リスク要因”の節を読むべきであり、議論は、以下の議論および分析における前向きな陳述に記載されているまたは示唆された結果とは大きく異なる重要な要素をもたらす可能性がある。
概要
私たちは臨床段階の生物製薬会社で、癌患者のための革新的な治療法の開発に専念している。我々は,臨床前後期あるいは臨床開発段階にある治療薬の許可と買収により薬物開発パイプラインを構築している。著者らは私たちの科学と臨床経験を利用して、私たちの候補薬物製品のリスクを下げ、その臨床開発を加速するのを助ける。
財務状況
2023年12月31日まで、私たちの現金、現金等価物、投資は730万ドルです。以下と本年度報告の他の部分でさらに議論されるように,少なくとも2025年6月30日までに,我々の既存の資金は,(1)MNPR−101−Zr放射性薬物計画の最初のヒト臨床試験を行い終了するのに十分である,(2)我々が行っているオープンタグCamsiRubicin 1 b期臨床試験を継続する,(3)MNPR−202の研究を継続するのに十分であると予想される。私たちは私たちの臨床と臨床前計画をさらに進めるために追加の資金が必要になり、今後12ヶ月以内により多くの資金を集め、将来の運営に資金を提供することを予想しています。
過去3年間、我々の主な資金源は、ジョーンズ取引機関サービス有限責任会社(“ジョーンズ取引”)と締結された資本オンデマンド販売協定により、市場販売計画に基づいて我々の普通株の株を売却することである。2023年12月31日までの1年間に、1株平均毛価格1.21ドルで1,793,441株の普通株を売却し、費用、手数料と支出98,230ドルを差し引いた純収益は2,072,503ドルであった
2024年1月1日から3月8日まで、1株平均毛価格1.29ドルで2545,305株の普通株を売却し、81,932ドルの手数料と手数料を差し引くと、純収益は3,194,310ドルであった
放射性薬物用MNPR−101,開発更新
著者らの独自の、斬新なMNPR-101放射薬物計画は随一のウロキナーゼ型プラスミノーゲン活性化剤受容体(“uPAR”)であり、末期腫瘍に対する放射薬物である。同社の放射性薬物開発チームはすでに独自の一流ヒト化モノクロナル抗体MNPR-101をイメージングと治療性放射性同位体と組み合わせており、MNPR-101はその独自の一流のヒト化モノクロナル抗体であり、uPARに対して高い選択性を有し、高精度なイメージングと治療用放射性薬剤を開発し、健康組織を保持しながらuPARを発現する腫瘍をイメージングと根絶する可能性がある。同社は2024年2月、希望に満ちた臨床前データとオーストラリアの規制許可を発表し、進行癌患者の腫瘍イメージングのための初のMNPR-101-Zrヒト第1段階臨床試験を開始した。Monoparはこの段階のより多くの患者に積極的に登録を開放している
カシル·ビシン臨床最新の進展
末期軟組織肉腫(“ASTS”)患者のカシルビシン1 b期開放マーカー、投与量増加臨床試験は現在進行中であり、そして第5用量レベル列(650 mg/m)に登録した2)は、これまでの任意の臨床試験で評価された最高用量(265 mg/m)のほぼ2.5倍である2).
MNPR−202および関連するシミュレーション更新
MNPR−202はカルシル星の類似体であり,アドリアマイシンとカシルシン耐性癌の潜在的治療を目的としており,現在我々の協力者であるシンガポール国立大学シンガポール癌科学研究所が臨床前モデルでテストを行っている。
Validive開発を中止する
2023年3月27日,Validiveに基づいてわれわれの中期臨床試験データ解析においてあらかじめ指定された奏効率閾値に達していないことを発表し,研究を終了し,Validiveの開発を中止し,その後Onxeo,SAとの許可を終了した。
私たちの戦略
我々の管理チームは,世界的な規制による治療や医療技術の開発を承認·商業化する上で豊富な経験を持っている。全体的に、彼らが共同創立した会社はすでにアメリカとEUで4つの薬物承認と3つの診断医学画像装置の許可を得て、管理層が開発した資産の売却に成功し、この資産はその後積極的な3期臨床試験を行い、2つの腫瘍学に焦点を当てた診断画像化業務を全世界の1000強会社に売却し、臨床と商業開発を完成し、最終的に8億ドルを超える現金で商業生物製薬会社を売却した。また、このチームはFDAとEMAが提出した複数の規制文書を支持し、米国とEUで多くの薬物を発売した。臨床前、臨床、監督管理と商業開発プロセスと障害を理解することは薬物開発成功の重要な要素であり、著者らの管理チームがこれらのすべての領域で展示した専門知識は著者らの製品ラインの中で候補製品を推進する成功可能性を増加させた。我々の戦略目標は癌患者の重要な満足されていない医療需要を満たすために、将来性のある腫瘍学候補製品を獲得、開発、商業化することである。この目標を達成するための戦略の5つの重要な要素は
| ● |
治療と診断イメージング剤として放射性薬物用MNPR−101の開発を継続した。放射性標識MNPR−101で得られた有望な臨床結果に基づき,オーストラリア進行癌患者におけるMNPR−101−Zrの第一段階用量臨床試験が許可されている。 |
|
| ● |
アドリアマイシンが有効な適応を示すことを求めてカシルシンの臨床開発を進めている。ASTが最初の適応となり、カシオが現在の第一線の治療薬アドリアマイシンと正面から渡り合うことが予想される。この適応の中で、単腕2期研究において、カシルシンは以前腫瘍の進展を評価できる52.6%の患者に臨床的利益(疾病の安定或いは部分的緩和)を示した。臨床的利益は用量に比例し、比較的に高い累積用量(>1000 mg/m)で持続的に観察された2)である。この第2段階の研究では、カシルビシンの耐性は非常に良く、累積用量によって制限されることなく、カルシルビシンを潜在的に投与する能力を強調した(アドリアマイシンは心臓毒性により450 mg/mに制限されている2(累積用量)。著者らが現在行っている1 b期の臨床試験は引き続き次期のASTS臨床試験のために新しい、もっと高い推奨投与量を確立した。 |
|
| ● |
MNPR-202および関連類似体は、様々なタイプの癌のために開発されている。2-ピロリドン化合物(MNPR-202)および関連類似体は、アブラナ素の非心臓毒性骨格を保持するように設計された独自物質の組成物を代表するが、抗腫瘍活性および機序において新たな特徴を示し、これらの類似体をアブラナ素およびアドリアマイシンと区別し、アブラナ素およびアドリアマイシン耐性癌を潜在的に解決する。 |
|
| ● |
我々は,追加の候補製品,特に既存の科学や臨床データを利用して臨床開発の次のリスクを低減することを支援する製品を獲得または獲得することで,我々の薬物開発パイプラインを拡大していく予定である。 |
|
| ● |
私たちのチームの資産買収、薬物開発、商業化の分野での専門知識と以前の経験を利用して、私たちのリードするバイオ製薬会社としての地位を確立しました。私たちの高度管理チームは、バイオ製薬の内部許可と買収、承認と商業化による候補製品の開発に関する経験を持っています。全体的に、私たちのチームはBioMarin Pharmtics(ナスダック株コード:BMRN)、Sensant Corp(シーメンスに買収された)、American BioOptics(オリンパスが買収した資産)、Raptor PharmPharmticals(Horizon Treeuticsに8億ドルで売却)、Tack Pharma、LLC(以下TATY Pharma)(鉛資産四硫黄モリブデンコリンを売却し、最終的に2018年6月にAlexionに7.64億ドルで買収された;Alexionはその後アスリーカンに買収された)を共同で創設した。 |
新しい成長型会社になる意義
私たちは2012年にJumpStart Our Business Startups Act(“JOBS Act”)で定義された“新興成長型会社”の資格を満たしています。新興成長型会社は所定の減少した報告負担を利用することができ,そうでなければこれらの負担は通常上場企業に適用される。これらの規定は含まれているが、これらに限定されない
| ● |
必要な監査されていない中期財務諸表を除いて、3年ではなく、2年間の監査済み財務諸表のみを入れ、それに応じて“経営陣の財務状況と業務成果の討論と分析”の開示を減少させる |
| ● |
2002年のサバンズ-オクスリ法案(“サバンズ-オクスリー法案”)によると、財務報告に対する私たちの内部統制を評価する際に、監査人の証明要件を免除する |
| ● |
上場企業会計監督委員会(“PCAOB”)が採択した要求強制ローテーション監査会社の任意の新しい要求を遵守することを免除する |
| ● |
行政職員の報酬の開示を減らすこと |
| ● |
役員報酬や黄金パラシュート手配について拘束力のない相談投票を求める要求を免除する。 |
私たちは私たちがこれ以上新興成長型会社ではないまで、このような条項を利用する予定だ。我々は、(1)当社初公募完了5周年後の最終日、すなわち2024年12月まで、(B)我々の年間総収入が少なくとも12.35億ドルであるか、または(C)前年6月30日現在、非関連会社が保有する我々普通株の時価が7億ドルを超えることを意味する新興成長型会社である。そして(2)前3年の間に10億ドルを超える転換不能債券を発行した日。2024年末には新興成長型会社になる資格がないと予想される。
我々は、本年度報告Form 10-Kにおけるいくつかの減少した開示義務を利用することを選択し、将来の届出文書において他の減少した報告要求を利用することを選択することが可能である。したがって、私たちが株主に提供する情報は、他の公開報告会社から得られる情報よりも少なく、および/またはより詳細になる可能性があります。
また、取引法12 b-2条で定義されている“より小さい報告会社”でもあり、他の報告会社が要求する広範な説明開示を避けるなど、より小さい報告会社のいくつかの削減開示要求を利用することを選択している。特に役員報酬記述の面では、私たちの小さな報告会社としての地位は、2024年末に新興成長型企業の地位を失う影響を受けないため、資格があれば、これらの規模の小さい開示要求を利用し続ける可能性がある。また、新興成長地位を失うことは、私たちの“非加速申告会社”の地位に影響を与えない。それはまた財務報告の内部統制に関する監査人認証要求の免除を提供する。
収入.収入
私たちは新興成長型会社です。私たちは承認された薬もなく、何の収入も生まれなかった。これまで、私たちは候補薬物製品の獲得または許可に着手し、私たちの候補薬物製品のテストと臨床開発について協力合意に達し、私たちの候補薬物製品の臨床開発を支援するためにインフラを提供した。私たちが私たちの候補薬物製品のテストと開発を完了し、上場許可を得たり、私たちの販売、協力マーケティング計画を達成したり、私たちの候補薬物製品の一つを他方に許可するまで、運営から商業収入を得ることはないと予想されます。“流動性と資本資源”を見てください
近く発表·採択された会計公告
2023年12月31日までの年度内に、最近発表された2つの会計声明が、本年度報告Form 10−Kの他の部分の連結財務諸表の付記2により詳細に記載されている。
重要な会計政策と試算の使用
我々の主な会計政策は、本年度報告10-K表の他の場所の総合財務諸表付記2により詳細に記載されているが、以下の会計政策は、我々が総合財務諸表を作成する際に使用する判断や推定に重要であると考えられる。
臨床試験すべき項目
著者らは契約研究組織、サービスプロバイダと臨床試験場所と締結した協定に基づいて、単一の研究の全ライフサイクル内に完成した仕事のパーセンテージに基づいて推定し、第三者による臨床試験活動のために費用と支出を計算しなければならない。我々は,内部臨床者や外部サービスプロバイダとの試験やサービスの進展や完了段階,およびそのようなサービスに支払う取り決め費用の検討に基づいて計算すべき金額を推定する。試験に参加する臨床試験地点を構築する費用は直ちに研究開発費として支出される。患者がスクリーニング/試験に入ると、患者のスクリーニングと登録に関連する臨床試験地点の費用が積算される。
株に基づく報酬
我々は公正価値法を用いて従業員、非従業員取締役および顧問との株式報酬スケジュールを計算し、これは株式オプションおよび制限株式単位(“RSU”)付与を含むすべての株式報酬付与に関連するコストの報酬支出を確認することを要求する。公正価値法は,オプション定価モデルを用いて付与日の株式支払い奨励の公正価値を推定することを要求し,RSUであれば付与日の終値を推定する.
我々従業員、非従業員取締役、コンサルタントに付与された株式報酬コストは、株式オプション付与日のブラック·スコアーズオプション定価モデルから計算されたベースツールの公正価値から計算され、RSU付与日の終値を用いて、必要なサービス期間(すなわち帰属期間)内に直線ベースで料金として確認される。適切な公正価値モデルおよび関連仮定を決定するには、我々の将来の株価変動および予想保有期間を推定する方法を選択することを含む判断が必要である。2023年に付与されたオプションについて、予想変動率は、2019年12月18日の初公募株から2022年12月31日までの3年間の実際の歴史変動率に基づいて推定される。2023年12月31日と2022年12月31日までの年度内に付与される株式オプションの期待期限は、簡略化方法を用いて推定される。没収はこれまでの実際の没収のみが含まれており、会社は没収の歴史が限られているために発生した没収を計算した。私たちは配当金を支払っていないし、将来の帰属中に現金配当金を支払うことも期待していないので、私たちが使用する予想配当収益率はゼロだ。無リスク金利は、満期日と奨励予想期限が一致する米国債金利をもとにしている。
経営成果
2023年12月31日までの年度と2022年12月31日までの年度比較
次の表は、2023年12月31日現在と2022年12月31日現在の年間運営結果をまとめています
| 十二月三十一日までの年度 |
||||||||||||
| (単位:千) |
2023 |
2022 |
分散.分散 |
|||||||||
| 研究開発費 |
$ | 5,600 | $ | 7,592 | $ | (1,992 | ) | |||||
| 一般と行政費用 |
3,231 | 2,945 | 286 | |||||||||
| 総運営費 |
8,831 | 10,537 | (1,706 | ) | ||||||||
| 営業損失 |
(8,831 | ) | (10,537 | ) | 1,706 | |||||||
| 利子収入 |
429 | 21 | 408 | |||||||||
| 純損失 |
$ | (8,402 | ) | $ | (10,516 | ) | $ | 2,114 | ||||
研究と開発(“研究開発”)費用
この年度までの研究開発費2023年12月31日560万ドルですが終了年度は7592,000ドルです2022年12月31日それは.この数字が1,992,000ドル減少したのは,主に(1)この計画が2023年3月に終了したため,Validive臨床試験と製造コストが1,375,000ドル減少した,(2)カルバマゼピン臨床試験と製造コストが904,000ドル減少した,(3)研究開発賃金が126,000ドル減少したが,(1)MNPR−101放射線治療活動に関する408,000ドルの増加と(2)他の研究開発費の純増加5,000ドル分で相殺されたためである。
一般と行政("G&A“)料金
年度までのG&A費用2023年12月31日3,231,000ドル、終了年度は2 945,000ドル2022年12月31日それは.これは、G&A人員の賃金、ボーナス、福祉、年間(非現金)配当金の株式報酬が220,000ドル増加したことと、他のG&A費用が66,000ドル純増加したことによる286,000ドルの増加を意味する。
利子収入
当年度までの利子収入2023年12月31日年末までの年間に比べて408,000ドル増加しました2022年12月31日それは.この成長です国庫券と貨幣市場口座による利息がより高い金利を生み出したからですはい2023.
流動性と資本資源
流動資金源
私たちが運営を開始して以来、私たちはすでに赤字と累積マイナス現金流が発生しており、2023年12月31日までの累計赤字は約6020万ドルです。予測可能な未来には、引き続き損失を被ることが予想されます。我々の戦略計画を実行するために,我々の研究開発とG&A費用が増加することを予想している.したがって、私たちは今後12ヶ月以内により多くの資金を集め、私たちの将来の運営に資金を提供することを期待している。市場販売計画、債務融資、戦略協力、贈与資金など、株式発行の組み合わせで必要な資金を得ることを求める。これまで、私たちは、私たちの普通株の純収益、市場販売計画による私たちの普通株の純収益、私たちの優先株と普通株の私募、Camsiiruicinの買収に関する資金純収入を初めて公開することで、私たちの運営に資金を提供してきました。2024年3月8日までの現在の利用可能資金は、少なくとも2025年6月30日まで計画されている運営に資金を提供すると予想されている。
私たちは現金等価物を二つの通貨市場口座とアメリカ国庫券に投資する。
キャッシュフロー
次の表は,2023年12月31日と2022年12月31日までの年度のキャッシュフロー情報を提供している.
| 十二月三十一日までの年度 |
||||||||||||
| (単位:千) |
2023 |
2022 |
分散.分散 |
|||||||||
| 経営活動のための現金純額 |
$ | (7,858 | ) | $ | (7,228 | ) | $ | (630 | ) | |||
| 提供した現金純額(使用する)投資活動 |
4,928 | (4,919 | ) | 9,847 | ||||||||
| 提供した現金純額FIジャンプ活動 |
2,027 | 33 | 1,994 | |||||||||
| 為替レートの影響 |
(17 | ) | (4 | ) | (13 | ) | ||||||
| 現金と現金等価物の純減少 |
$ | (920 | ) | $ | (12,118 | ) | $ | 11,198 | ||||
2023年12月31日まで及び2022年12月31日まで年度, 私たちの現金の純流出はそれぞれ920,000ドルと12,118,000ドルで、前年同期より11,198,000ドル減少した。.の間に 2022年、金利上昇により、私たちの遊休現金への投資を開始し、投資活動で使用される現金が大幅に増加しました.の間に2023,*投資活動を通じて純現金を提供しました。私たちの投資は 2022年の期限が切れて経営活動や融資活動に使用されるより高い純現金を提供するのは、市場販売計画に基づいて私たちの普通株を売却することで調達される資金が多いからです至れり尽くせり2022.
経営活動に使われている現金流量
2023年12月31日までの年間で,経営活動に用いられるキャッシュフローは,2022年12月31日までの年度とほぼ横ばいである。
投資活動のためのキャッシュフロー
投資活動は今年度末までに提供されるキャッシュフローが増加する2023年12月31日年末までの年間投資活動用現金と比較した2022年12月31日合計9,847,000ドルですこれは,米国国庫券への投資が2022年12月に始まり,満期債券が2023年通年で再投資または運営資本として利用されることに関係している
融資活動が提供するキャッシュフロー
財務活動は同年度までの現金流量が増加した2023年12月31日年末までの年度と比べると2022年12月31日1,994,000ドルの主な理由は、市場販売計画を通じて私たちの普通株を売却してより多くの純収益を得たからです。
将来の資金需要
今まで、私たちは製品販売から何の収入も得ていません。私たちはいつまたは製品販売からどんな収入を得るか分からない。規制部門の承認を得て、現在または将来の任意の候補薬物製品を商業化するか、候補薬物製品の許可または販売を他方に提供しない限り、製品販売または特許権使用料からいかなる収入も得られないと予想される。同時に、私たちが行っている開発活動に関連する費用は増加すると予想され、特に私たちが研究、開発、未来の臨床前研究と臨床試験を継続し、規制機関が私たちの現在と未来の候補薬物製品に対する承認を求める。もし私たちの現在または未来の任意の候補薬物が規制部門の承認を得たら、商業化要求と私たちの持続的な薬物製品開発業務を満たすために多くの追加資金が必要になるだろう。
会社として、私たちはまだ市場を通じていかなる治療製品の開発も承認していない。予想される未来には、費用は引き続き大幅に増加し、運営損失も増加していくと予想される。私たちの費用は大幅に増加すると予想されています
| ● |
癌をイメージングおよび治療するために、MNPR-101-ZrおよびMNPR-101-RITの臨床および臨床前活動を継続する; |
|
| ● |
カシル星の臨床開発を推進し |
|
| ● |
様々な癌適応のためのMNPR−202(および関連類似体)の臨床前活動を継続し、後で臨床開発に入る可能性がある |
| ● |
より多くの候補パイプライン医薬製品を取得および/または許可し、これらの候補医薬製品の将来の臨床前および/または臨床開発に取り組む; |
| ● |
現在と未来に登録臨床試験を成功させた任意の候補薬物のために監督部門の承認を求める |
|
| ● |
販売、マーケティング、流通インフラのサービスを確立または購入し、私たちが市場の承認を得た任意の製品を商業化する |
|
| ● |
製造/品質能力を開発または契約するか、または私たちの臨床需要を支援し、市場の承認を得た任意の製品のために市場を発売し、供給するのに十分な能力を提供するのに十分な信頼性、高品質のサプライチェーンを確立すること |
|
| ● |
私たちの候補薬物開発および計画における商業化努力を支援するために、必要な運営、財務および管理情報システムおよび能力、および他の専門家の人員を増加または契約する。 |
私たちは2024年3月8日までの利用可能な資金が少なくとも以下のように私たちの債務に資金を提供すると予想している2025年6月30日。私たちは間違っていることが証明される可能性があるという仮定に基づいてこの推定をして、私たちは現在予想されているよりも早く私たちが利用できる資本資源を使用することができる。私たちの候補薬物製品の開発や商業化に関連する多くのリスクと不確実性、および第三者と協力して候補薬物製品の開発と商業化に関与しているため、現在および予想されている候補薬物製品開発計画に関連する資本支出の増加と運営支出の増加に要する金額と時間を高い信頼性で正確に見積もることができない。
私たちの将来の資本需要は多くの要素に依存します
| ● | MNPR−101放射線治療計画の臨床開発と調節相互作用の進展と承認; | |
| ● |
カシル星の臨床開発と制御相互作用と承認の進展 |
|
| ● |
FDA、TGA、および他の国際規制機関によって承認されたコスト、時間、および結果を求め、獲得し、維持する |
|
| ● |
MNPR−202(および関連類似体)の臨床前および潜在的臨床研究の進展; |
|
| ● |
私たちが許可、買収、発明、または他の方法で追求する可能性のある他の候補薬の数量および特徴 |
|
| ● |
未来の候補薬物の研究、臨床前開発と臨床試験の範囲、進度、時間、コストと結果及び監督管理要求; |
| ● |
製造/品質要件、信頼性の高いサプライチェーンの確立、販売、マーケティングおよび流通能力契約の確立または締結に関連するコスト; |
|
| ● |
私たちは、任意の特許または他の知的財産権の許可、提出、弁護、実行に関連する任意の支払いの金額および時間を含む、私たちの知的財産権の組み合わせの範囲を維持、拡大、擁護することができる |
|
| ● |
私たちは、追加の管理、行政、科学、医療、販売とマーケティング、製造/品質、および他の専門家または外部の専門知識を雇用または契約する能力が必要です |
| ● |
競合製品や新療法が市場に参入する効果とタイミングは、市場浸透を制限したり、候補薬物製品の発売を阻止したり、私たちの製品の組み合わせのビジネス潜在力を低下させたりする可能性がある |
|
| ● |
私たちは追加的に必要な内部管理、業務、記録保存、および他のシステムおよびインフラを実施する必要がある |
|
| ● |
私たちの既存の協力および許可スケジュールの経済的および他の条項、時間と成功、ならびに私たちが将来加入する可能性のある任意の協力、許可、または他の手配は、これらの手配に基づいて他人に任意の許可、マイルストーン、または特許使用料を受け取るか、または他人に支払う時間を含む。 |
2024年下半期以降の支出は増加すると予想される
| ● |
我々のMNPR−101放射線咽頭癌計画の開発は,様々な進行癌のイメージングと治療を目的としている | |
| ● |
データが1 b段階を超える開発をサポートしていれば、私たちのCamsiruicin計画を開発します |
|
| ● |
潜在的なライセンス内の新製品候補製品を開発する | |
| ● | 放射性製薬のためのMNPR-101、Camsiiruicin、およびMNPR-202(および関連する類似体)を含む、我々の候補製品計画の進展を支援するために必要な活動範囲の拡大を支援するための従業員報酬および相談料 |
MNPR−101−Zrステージ1用量学的臨床試験の登録を開始するために努力している。腫瘍の摂取、生物分布、および安全性がこの段階の用量学的試験において鼓舞的に見える場合、我々は、Ac-225などの同位体に結合した治療用放射性標識バージョンMNPR-101のヒトにおける治療的放射性標識バージョンの治療的効果を評価し続けるかもしれないが、これは、追加の資金を必要とするか、または適切な薬物パートナーを探すことを必要とするであろう。このようなどんな事件も発生するという保証はない。私たちは私たちのチャンネルを拡大するために候補薬を評価し続けるつもりだ。高品質の化合物の識別と確保には通常時間と関連費用が必要であるが、より多くの候補薬物を獲得し、臨床開発に入ると、私たちの支出は2024年以降に大幅に加速する可能性がある。この場合、私たちの管理チームを拡大し、より高い契約製造コスト、契約研究組織費用、他の臨床開発コスト、保険コストを支払うことが要求される可能性があり、これらのコストは現在予測されていない。臨床試験、承認手続き、商業化(適用されれば)を通じて、私たちの現在と未来の候補製品を支援するための追加の長期資金が必要です。
私たちが十分な製品収入を生み出して私たちの現金需要を満たすことができるまで、私たちは主に株式発行の組み合わせを通じて、市場販売計画、債務融資、戦略協力、贈与資金を含む将来の現金需要を満たす予定です。もし私たちが株式または転換可能な債務証券を売却することで追加資本を調達すれば、私たちの既存株主の所有権権益は希釈され、これらの証券の条項は清算または他の既存株主の権利に悪影響を及ぼす特典を含む可能性がある。債務融資が可能であれば、追加債務を招く、資本支出を行う、または配当を宣言するなど、私たちが具体的な行動をとる能力を制限または制限する契約を含むいくつかの合意が含まれる可能性がある。もし私たちが他の当事者とのマーケティングおよび流通手配または他の協力、戦略連盟、または許可手配によって追加資金を調達する場合、私たちは、私たちの技術、将来の収入源、研究プロジェクトまたは候補薬物に対する貴重な権利を共有または放棄しなければならないかもしれない、または私たちに不利になる可能性のある条項でライセンスを付与することは、私たちの将来のリターンを減少させ、私たちの将来の運営柔軟性に影響を与えるかもしれない。もし私たちが必要な時に株式や債務融資を通じてより多くの資金を調達できない場合、私たちは私たちが行っている製品開発や商業化努力を延期、制限、減少、または中止する必要があるかもしれません。あるいは、私たちが開発とマーケティングをより望んでいた候補薬剤の権利を他人に与える必要があります。
契約義務と約束
ライセンス、ソフトウェア開発、連携プロトコル
Xoma有限会社
XOMA株式会社とMNPR-101開発で使用されたヒューマン技術について合意した非独占ライセンス契約によると、XOMA株式会社に臨床、監督、販売マイルストーンを支払う義務があり、MNPR-101のすべてのマイルストーンを実現すれば、1492.5万ドルに達する可能性がある。協定は販売特許使用料の支払いを要求しない。私たちがどんなマイルストーンも達成するという保証はない。2024年3月8日現在、私たちは何のマイルストーンにも達しておらず、本ライセンス契約に基づいてXOMA株式会社に何の資金も支払うことを要求されていません。最初の記念碑的支払いは,第2段階臨床試験で初めてヒト患者に服薬したときに支払われた。
Onxeo S.A.
2016年6月、私たちはフランスの上場会社Onxeo S.A.とValidive(塩酸クロニジンフィルム;塩酸クロニジンMBT)の独占選択権を獲得し、Lauriad接着剤技術に基づくクロニジン接着シートを許可する協定を締結した。2017年9月,OnxeoからValidive許可を得るオプションを行使し,価格は100万ドルであった.2023年3月,我々のデータ安全監視委員会が,あらかじめ定義された閾値,すなわちValidiveとプラセボが重篤な口腔粘膜炎の予防に15%の絶対差があることを決定したため,Validiveステージ2 b/3音声試験を中止した。私たちは許可や特許使用料義務は生じておらず、許可は2024年1月に終了した。
サービス提供者
正常な業務過程において、著者らはサービス提供者と契約を締結し、研究開発仕事の実行に協力し、薬品製造、技術開発、臨床と臨床前開発、及び財務戦略、監査、税務と法律支持を含むG&Aを含む。私たちはいつでもこのような合意の下での仕事を止めることを選択することができる。私たちはまた、プリペイドおよび/または長期現金約束を必要とする可能性がある共同研究開発、契約研究、製造、およびサプライヤー合意に到達することができる。
オフィスビルレンタル
私たちは現在イリノイ州ウィルマット村にあるSkokie Blvd 1000号の行政本部のために月ごとにオフィススペースを借りています。毎月のレンタル料は4,238ドルです。
法律や事項がある
私たちは今まで持っていなかったし、今までどんな不利な実質的な法的手続きにも参加したことがない。
賠償する
正常な業務過程において、私たちは様々な陳述と保証が含まれており、一般賠償を規定する契約と協定を締結する。これらの合意の下での私たちのリスクの開放は未知であり、それは未来に私たちに提起されるかもしれないクレームに関連しているが、まだ提起されていない。今まで、私たちは何のクレームも支払わなかったし、私たちの賠償義務に関連したいかなる訴訟も弁護されなかった。しかし、このような賠償義務のため、私たちは未来に費用を記録するかもしれない。
私たちの第二次改正と再改訂された会社登録証明書、改訂と再制定された定款、および各高級職員と非従業員取締役との賠償協定に基づいて、私たちの高級職員と非従業員取締役が私たちの要求に応じてこのような身分でサービスする時、私たちはある事件や事故について私たちの高級職員と非従業員取締役に賠償を提供する義務があります。今まで、誰もクレームを出していない。項目1 Aを参照すると,“リスク要因である取締役や上級管理職の責任を制限して賠償した”とある
項目8.財務諸表と補足データ
本プロジェクトが提出を要求した資料は,本年度報告表格10−KのF−1からF−22ページに掲載されている。
項目9.会計·財務開示面の変更と会計士との相違
ない。
第9条。制御とプログラム
我々の最高経営責任者および最高財務責任者は、添付ファイル31.1、31.2、および32.1に示された証明を提供します。これらの証明書は、これらの証明書によってカバーされる事項をより完全に理解するために、本項目9 Aに記載された情報に関連して読まれるべきである。
(A)財務報告の内部統制に関する経営陣の年次報告
我々の経営陣は、1934年の証券取引法(以下、“取引法”という。)第13 a 15(F)条の規定に基づいて、財務報告に対する十分な内部統制の確立·維持を担当している。我々の財務報告に対する内部統制は、米国公認会計原則に基づいて財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的とした過程である。このプロセスは、(I)私たちの資産の取引および処置を合理的かつ詳細に正確かつ公平に反映する記録の保存に関連する政策および手順、(Ii)私たちの経営陣および非従業員役員の許可の下でのみ収入および支出を行うことができる、(Iii)当社の財務諸表に重大な影響を与える可能性のある不正な買収、使用または処置を防止またはタイムリーに発見するための合理的な保証、および(Iv)GAAPに基づいて財務諸表を作成するために必要な取引が記録されることを保証するための合理的な保証を提供する。その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。さらに、将来の財務報告の内部統制をどのように評価するかの予測は、条件の変化によって内部制御が不十分になる可能性があり、または政策またはプログラムを遵守する程度が悪化する可能性があるリスクに直面する可能性がある。
私たちの経営陣は、2023年12月31日までの財務報告書の内部統制に対する我々の有効性を評価した。経営陣は、テレデビル内部統制である総合枠組み委員会後援組織委員会(2013年)が提案した基準に基づいてこの評価を行った。経営陣の評価には、私たちの財務報告の内部統制設計の評価と、私たちの財務報告の内部統制の運営有効性のテストが含まれています。経営陣の評価によると、経営陣は、2023年12月31日現在、財務報告の内部統制に有効であると結論している。
(B)開示制御およびプログラム
我々は、取引法第13 a 15(E)及び15 d 15(E)条の規定に基づいて、最高経営者及び最高財務官を含む経営陣の監督及び参加の下で、2023年12月31日現在の開示統制及び手続の有効性を評価した。この評価に基づいて、我々の最高経営責任者および最高財務官は、その日までに、我々の開示制御および手続きが有効であると結論した。
(C)財務報告の内部統制の変化
本年度報告にForm 10−K形式で含まれる連結財務諸表やその他の財務情報は,すべての重要な点で我々の財務状況,経営結果,および上記期間までの全面的な損失とキャッシュフローを公平に反映していると結論した。
2023年12月31日までの四半期内に、財務報告の内部統制に大きな影響を与えたり、合理的に財務報告の内部統制に大きな影響を与える可能性のある変化はありません。
プロジェクト9B.その他の情報
第三部
プロジェクト10.役員、役員、および企業管理
役員.取締役
2024年3月28日現在、私たちの取締役の名前、地位、年齢は以下の通りです
| 名前.名前 |
年ごろ |
ポスト |
董事自 |
| クリストファー·M·スタール博士 |
71 |
取締役執行議長、計画管理委員会のメンバー |
2014年12月 |
| チャンドラー·D·ロビンソン医学修士MBA修士 |
40 |
取締役最高経営責任者 |
2014年12月 |
| レイモンド·W·アンダーソンMBA |
82 |
取締役、監査委員会議長、報酬委員会議長、コーポレートガバナンス及び指名委員会メンバー、計画管理委員会メンバー |
2017年4月 |
| マイケル·J·ブラウン理学修士 |
67 |
取締役、監査委員会委員、報酬委員会委員、会社管理·指名委員会委員、計画管理委員会委員 |
2014年12月 |
| アーサー·J·クラウスナーMBA |
63 |
取締役、コーポレートガバナンス及び指名委員会議長、監査委員会メンバー、報酬委員会メンバー |
2017年8月 |
| 金·R·土本 |
61 |
役員首席財務官 |
2023年3月 |
役員たちの背景
私たち各取締役の過去5年間(場合によっては、数年前)の主な職業は以下の通りである
クリストファー·M·スタール博士執行議長兼取締役会のメンバーです
スタール博士は私たちの共同創業者で、2014年12月にMonopar Treateutics LLCが設立されて以来、私たちと私たちの前身のMonopar Treateutics、LLCの執行議長と取締役会のメンバーを務めてきた。2006年設立から2014年12月まで、Starr博士はRaptor PharmPharmticals(“Raptor”)(ナスダック株式コード:RPTP)の共同創業者と最高経営責任者であり、2016年10月までRaptorがHorizon Pharma plcに売却されるまでRaptorの取締役を続けている。Raptorの主な業務はまれな疾患治療の開発と商業化である。スタール博士は1997年にバイオマリン製薬会社(ナスダックコード:BMRN)の共同創業者でもあり、それまで2006年まで会社で研究開発副総裁を務めていた。BioMarinは完全に統合された多国籍生物製薬会社だ。スタール博士はシラキュース大学で学士号を取得し、ニューヨークのシラキュース州立大学健康科学センターで生化学と分子生物学博士号を取得した。スタール博士は現在も個人持株のGlycomine Inc.とカナダの上場スタートアップバイオテクノロジー会社Thigenation Treateutics Corp.の取締役会に勤めている。
スタール博士の取締役会経歴は、公共生物製薬会社の助成と経営を含め、25年以上の行政経験を持っている。私たちはスタール博士の経験が彼が私たちの取締役会の執行議長を務める資格があると信じている。
チャンドラー·D·ロビンソンMD MBA修士-CEO兼取締役会のメンバーです
ロビンソン博士は私たちの共同創業者で、2014年12月にMonopar Treateutics、LLCが設立されて以来、私たちと私たちの前身のMonopar Treateutics LLCのCEOと取締役会のメンバーを務めてきた。ロビンソン博士は2010年以降、テディ製薬のマネージャーであり、同社のマネージャーを続けている。2014年4月にホールディングスになるまで、ロビンソン博士は同社の共同創業者と最高経営責任者であり、同社の最高経営責任者を務めてきた。テーク製薬会社は臨床前と臨床段階のバイオ製薬化合物を獲得し開発した。2003年から2006年まで、ロビンソン博士は西北大学で現在開発されているウィルソン病を治療する候補薬物について研究を行い、この薬物は2010年にTATY Pharmaに買収され、2014年に販売された。彼の以前の職歴の中で、Robinson博士は2008年に腫瘍学生物製薬会社Onyx PharmPharmticalsのNexavarマーケティング部で働き、2008年から2009年までカリフォルニア州サンホセの医療診療所で連合席マネージャーを務め、2004年から現在まで非営利研究に集中した学部生組織の創始者と総裁を務め、現在この組織は20年目に入り、2006年から2007年までベルストン投資銀行の数量化内部ヘッジファンドスタイルチームのメンバーとした。彼は以前は生物製薬会社Wilson Treeutics(Alexion PharmPharmticals Inc.に買収され、現在はアスリコンの一部)の共同創業者と取締役会メンバーであり、現在は西北大学生命過程化学研究所の取締役会メンバーである。Robinson博士は優秀な成績で西北大学を卒業し、ロンドン経済学院国際衛生政策と衛生経済学修士号を取得し、フルブライト奨学金を取得し、ケンブリッジ大学の工商管理修士号を取得し、ビル·ゲイツ信託基金会が提供したゲイツ奨学金を取得し、スタンフォード大学の医学博士号を取得した。
ロビンソン博士は豊富な指導と管理経験、そして彼の医学と商業学位、彼の創業と戦略の目、そしてMonopar候補製品と運営に対する理解を得て、彼は私たちの取締役会のメンバーになるべきだと結論した。
マイケル·J·ブラウン理学修士取締役会のメンバーは
ブラウンさんは、2014年12月の設立以来、我々の前身であるMonopar Treateutics、LLCの取締役会メンバーとなっています。1994年以降、ブラウンさんは、金融機関、小売業者、サービスプロバイダ、個人消費者に支払い·取引処理および流通ソリューションを提供するEuronet Worldwide Inc.(ナスダック·コード:EEFT)の会長兼CEOを務めてきました。ブラウンは2014年12月からEuronetの総裁を務めてきた。ブラウンはEuronetの前身会社の取締役会にも勤めていた。彼は分子と細胞生物学の修士号を持っている。
ブラウンさんは、戦略的計画、業務の発展、および融資戦略を含むリーダーシップと管理経験を豊富にし、取締役会のメンバーになるべきだと結論付けました。
レイモンド·W·アンダーソンMBA MS取締役会のメンバーは
アンダーソンさんは2017年4月以来私たちの取締役会のメンバーでした。2006年設立から2016年まで買収され、アンダーソンはバイオ製薬会社Raptorの取締役会メンバー、監査委員会議長、報酬委員会メンバーを務めてきた。アンダーソンは2003年7月から皮膚病処方薬調合会社陶氏薬業で働き始め,2010年6月に退職した。彼は最近2009年1月から2010年6月まで陶氏化学取締役社長を務め、これまで陶氏化学首席財務官と財務·行政事務を担当してきた副総裁を務めてきた。アンダーソン·さんは、2003年に陶氏化学に加入する前に、民間超音波外科システム会社Transgerical,Inc.の首席財務官である。この前に、アンダーソンさんは、1998年6月から2002年1月までバイオ製薬会社BioMarinの最高経営責任者および最高財務責任者を務めました。アンダーソンさんは、ハーバード大学のビジネス管理修士号、ジョージワシントン大学の行政管理修士号、米国軍事大学の工学学士号を所有しています。
アンダーソンさんは、バイオ製薬産業の財務担当者としての背景と経験、ならびに彼は米国証券取引委員会とナスダック規則の下で“監査委員会財務の専門家”としての資格を持っており、彼は我々の取締役会のメンバーになるべきだと結論付けました。
アーサー·J·クラウスナーMBA取締役会のメンバーは
クラウスナーさんは2017年8月以来、我々の取締役会のメンバーだった。2009年以降、バイオ製薬業界のコンサルタントを務め、現在は腫瘍薬物開発会社コンカルロ治療会社のCEOを務めている。2018年から2022年にかけて、クラウスナーさんは腎症薬開発会社の金髪治療会社のCEOと取締役を務めている。2012年9月から宝石製薬有限責任公司のCEOを務め、2017年まで宝石の薬物開発資産を買収してきた。Gemでの職務のほか、クラウスナーは2012年から2015年まで眼科治療会社Jade Treateutics Inc.のCEOを務めた。これまで、Klausnerさんは生命科学ベンチャー企業Domain AssociatesとPappas Ventures(現在はPappas Capital)で合計18年間働いてきました。Klausnerさんは現在、ニューヨーク大学革新リスク基金とニューヨーク大学ランゲルニ健康会社のベンチャーキャピタル審査委員会に勤めています。彼はスタンフォード大学ビジネススクールで工商管理修士号を取得し、プリンストン大学で生物学学士号を取得した。
バイオ製薬業界でのKlausnerさんの広範なリーダーシップと管理経験は、当社の取締役会のメンバーになるべきだという結論に至りました。
Kim R.Tsuhimoto首席財務官兼取締役会メンバー
Tsuhimotoさんは2015年6月から私たちの最高財務官を務めており、2023年3月以来取締役会のメンバーとなっています。2006年5月から2012年9月まで、土本さんは生物製薬会社のRaptorで9年を超える首席財務官を務め、2012年9月から2015年2月まで、Raptorは国際金融、税務と国庫の総裁副主管を担当し、2015年2月から5月まで、Raptorは財務計画と分析及び内部制御を担当する副総裁を務めた。Raptorに加入する前に、Tsuhimotoさんは生物製薬会社BioMarinとその前身であるGlyko,Inc.で8年間働いており、そこで彼女は総裁副財務担当、総裁副財務総監、財務総監を務めた。Tsuhimotoさんはサンフランシスコ州立大学の工商管理学士号を取得した。彼女は役に立たないカリフォルニア州公認会計士免許を持っている。土本幸男は現在、カナダのスタートアップ生物科学技術会社Thigenation Treateutics Corp.の取締役会に勤めている。
土本さんは生物製薬業界で25年以上の経験を含み、彼女の豊富な財務管理、会社管理と財務戦略経験を含み、彼女は私たちの取締役会のメンバーを担当すべきだと結論した。
行政員
私たちの現職幹部、彼らの2024年3月28日までの年齢と職位を次の表に示す。次の表に実行幹事1名(ロビンソン博士と土本さんを除く)の履歴資料を示す。ロビンソン博士と土本さんのプロフィールは上記の取締役の一節に載っています。
| 名前.名前 |
年ごろ |
ポスト |
| チャンドラー·D·ロビンソン医学修士MBA修士 |
40 |
取締役最高経営責任者 |
| 金·R·土本 |
61 |
取締役首席財務官、秘書、財務主管 |
| アンドリュー·J·シタディン |
52 |
首席運営官 |
| Patrice Rioux医学博士 |
73 |
首席医療官代理 |
アンドリュー·J·シタディン–首席運営官
Cittadineさんは2021年6月以来、私たちの最高経営責任者を務めています。Cittadineさんは、概念から商業化に至るまでの概念を確立し、フォーチュン·グローバル1000社に買収されたヘルスケア企業への認識、作成、確立に成功した経験豊富な医療幹部と連続創業者である。キタディンは2020年から2021年までコンサルティング会社Alatri Groupの担当者を務め,他の生命科学会社とともにMonoparにコンサルティングサービスを提供している。2011年から2020年までの間に、Cittadineさんは、ベンチャー投資によってサポートされる腫瘍学の手術および診断用の先進的なイメージングシステムの開発者および製造業者である診断用光電子会社のCEOを務めています。これまで米国生物光学社の共同創業者兼最高経営責任者であり、先進的な胃腸癌腫瘍診断テスト·スクリーニングシステムを開発した会社であり、オリンパス医療会社に買収されていた。これまで、CittadineさんはSonarMed Inc.の臨時CEOであり、SonarMed Inc.は天使とベンチャー投資によって支援された重症看護会社であり、新生児呼吸監視システムを開発し、SonarMedは美敦力によって買収され、Sensant Corp.マーケティングの共同創業者であり副社長であり、Sensant Corp.は天使によって支援された腫瘍学イメージング初発会社であり、3 D超音波画像システムを開発し、Sensant Corp.はシーメンス医療会社によって買収された。Cittadineさんは、スタンフォード大学の学士号、理科の学士号、理科の修士号、およびノースウエスト大学のケロッグ管理アカデミーのMBA号を取得しています。
Patrice Rioux医学博士–首席医療官代理
Rioux博士は2016年12月以来、私たちの首席医療官代理を務めてきた。彼は取締役会社の共同創業者と最高経営責任者であり、Rioux博士は2004年6月から現在まで彼のコンサルティング会社PRX Consulting LLCを通じて開発、医療/監督と臨床コンサルティングサービスを提供している。Rioux博士はフランスパリ第六大学医学院で医学教育を受け、フランスパリ第七大学で数理統計博士号を取得し、パリ第六大学で薬理学(薬物動態学と臨床薬理学)の学位を取得した。
ビジネス行為と道徳的基準
私たちは、私たちの最高経営責任者、最高財務責任者、最高会計官、または財務総監、または同様の機能を実行する人に適用されるビジネス行動および道徳的基準を採択しました。それはまた私たちのすべての職員たちと非職員たちの役員にも適用される。私たちのビジネス行動と道徳基準は、私たちのウェブサイトwww.monopartx.comで見つけられ、要求に応じて誰にでも無料で提供されます。
監査委員会
我々の監査委員会は、Andersonさん、Klausnerさん、Brownさんで構成され、監査委員会に適用されるナスダック規則と取引所法案の下の規則10 A-3で定義される米国証券取引委員会によって定義された独立したメンバーである。アンダーソンさんは監査委員会の議長を務め、ナスダックとアメリカ証券取引委員会の定義された“監査委員会財務の専門家”です。
項目11.役員および役員報酬
役員報酬集計表
次の表は、最高経営責任者と前会計年度の報酬が10万ドルを超える役員2人を含む、私たちが任命した役員が2023年12月31日と2022年12月31日までの年間で稼いだ報酬情報を提供します。
| 氏名と職位 |
財政年度 |
給料(元) |
ボーナス(ドル) |
株式奨励(元)(1)(2) |
オプション賞($)(1)(2) |
非持分インセンティブ計画(ドル)(3) |
他のすべての補償 |
合計(ドル) |
| チャンドラー·D·ロビンソン医学博士 |
2023 |
580,000 |
- |
534,078 |
534,077 |
130,500 |
- |
1,778,655 |
| 取締役CEO兼最高経営責任者 |
2022 |
550,000 |
- |
446,662 |
446,662 |
158,125 |
- |
1,601,448 |
| 金·R·土本 |
2023 |
300,000 |
- |
247,219 |
247,221 |
54,000 |
- |
848,441 |
| 首席財務官、秘書、財務担当者、役員 |
2022 |
285,000 |
- |
172,290 |
172,289 |
65,550 |
- |
695,128 |
| アンドリュー·シタディン |
2023 |
360,000 |
- |
247,219 |
247,221 |
56,700 |
- |
911,141 |
| 首席運営官 |
2022 |
325,000 |
- |
182,000 |
179,920 |
65,406 |
- |
752,326 |
(1)これらの列中の金額代表は,適用年度内に指定役員にそれぞれ付与された制限的株式単位と株式オプションの付与日公正価値の合計を,FASB ASCトピック718により算出する.株式奨励欄に反映される制限株式単位の公正価値は、付与された日の終値に基づいている。オプション報酬の欄の株式オプションの公正価値は、付与された日にBlack-Scholesオプション定価モデルを使用して推定される。推定仮定の検討については,本年度報告Form 10−Kに含まれる総合財務諸表付記5を参照されたい。
(2)Robinson博士、Tsuhimotoさん、Cittadineさん氏は2023年1月1日から株式オプションを授与され、それぞれ221,839株、102,688株、102,688株のうちの普通株を3.16ドルの相場で購入した。詳しくは以下の節“財政年度末傑出株式賞”の節を参照されたい。ストックオプション補償費用に対するブラック·スコアーズの推定モデルによると、ロビンソン、土本、シタディンの株式オプション価値はそれぞれ534,077ドル、247,221ドル、247,221ドルであった。株式オプションは2023年6月30日に6/48が付与され、その後毎月1/48が付与される。
2023年にはロビンソン博士、土本氏、およびCittadineさんによりそれぞれ169,012,78,234および78,234の制限株式単位が与えられ、これらの単位は2023年6月30日に6/48が付与され、その後四半期ごとに3/48が付与された。贈られた日の終値によると、ロビンソン博士、土本さん、およびCittadineさんの制限株式単位の価額は、それぞれ534,078ドル、247,219ドル、247,219ドルでした。
2022年にはRobinson博士、Tsuhimoto夫人、Cittadineさんが株式オプションを授与され、それぞれ最大211,018株、81,395株、85,000株のうちの普通株式を購入し、1株当たり2.80ドルを行使し、詳しくは“財政年度末傑出株式賞”の一節を参照されたい。ストックオプション補償費用に対するブラック·スコアーズの推定モデルによると、ロビンソン、土本、シタディンの株式オプション価値はそれぞれ446,662ドル、172,289ドル、179,920ドルであった。株式オプションは2022年6月30日に6/48が付与され、その後毎月1/48が付与される。
2022年には、ロビンソン博士、土本さん、およびCittadineさんによってそれぞれ159、522、61、532および65,000の制限株式単位が取得され、2022年6月30日には6/48が授与され、その後、四半期ごとに3/48が付与されます。与えられた日の終値によると、ロビンソン博士、土本さん、およびCittadineさんの制限株式単位の価額は、それぞれ446,662ドル、172,290ドル、182,000ドルでした。
(3)非持分インセンティブ計画は、2023年および2022年と比較して、予め設定された2023年と2022年の企業目標を部分的に達成することに基づく支払いをそれぞれ代表する。
最高経営責任者報酬
2016年12月、私たちはロビンソン博士と雇用契約を締結し、彼に私たちの最高経営責任者を務めさせた。私たちは2016年1月1日からロビンソン博士に報酬を支払い始めたが、私たちは2016年12月まで正式な雇用協定を締結しなかった。ロビンソン博士の雇用協定は無期限(無期限雇用)だ。その協定は2017年11月1日に修正され、再説明された。
彼の2017年の雇用協定によると、ロビンソン博士は指定された基本給を獲得し、正常なビジネス慣行に応じて随時調整し、私たちが自ら決定することができる。また、ロビンソン博士は、年間非持分インセンティブ計画業績ボーナスを取得する資格があり、最高でその基本給の50%に達することができ、これは経営陣の提案を実現するための予め設定された書面目標に基づいており、私たちの報酬委員会と執行議長の審査を経て取締役会の承認を得ている。2023年2月、取締役会はロビンソン博士158,125ドルのボーナスを付与し、予め設定された2022年非株式インセンティブ計画目標を部分的に達成するために、ロビンソン博士58万ドルの新しい基本給を承認した。2024年2月、取締役会はロビンソン博士に130,500ドルのボーナスを付与し、予め設定された2023年の非持分インセンティブ計画目標の一部実現に用いた。
最高財務官報酬
2017年11月1日、私たちは土本さんと雇用契約を締結し、彼女に私たちの首席財務官を担当させた。Tsuhimotoさんの雇用協定は無期限だ(無期限雇用)。この協定は2018年3月1日に修正された。彼女の雇用協定によると、土本さんは特定の基本給を得て、正常なビジネス慣行に応じて時々調整し、私たちが自分で決めることができる。そのほか、土本さんは年間非持分激励計画の業績ボーナスを獲得する資格があり、最高で基本給の40%に達することができ、ボーナスの基礎は管理層の提案、給与委員会と執行主席の審査を経て取締役会の許可を受けた予め設定された書面目標を実現することである。2023年2月、取締役会は土本さんに65,550ドルのボーナスを支給し、あらかじめ設定された2022年の非持分インセンティブ計画目標を部分的に実現するために、土本さんの30万ドルの新しい基本給を承認した。2024年2月、取締役会は土本さんに54000ドルのボーナスを授与し、あらかじめ設定された2023年の非持分インセンティブ計画目標の一部実現に用いた。
最高経営責任者報酬
2021年6月1日、私たちはCittadineさんと私たちの最高経営責任者を務める雇用契約を締結しました。Cittadineさんの雇用契約は無期限の(無期限雇用)。彼の雇用契約によると、Cittadineさんは、通常のビジネス慣行に応じて時々調整され、当社自身で決定する可能性がある特定の基本給を取得しています。また、Cittadineさんは、年間非持分インセンティブ·プログラムの業績ボーナスを取得する資格があり、その基本給の最高35%を、経営陣の勧告に基づいて審査·執行委員会および取締役会の承認を経て予め設定された書面で決定したものである。取締役会は、2023年2月に、予め設定された2022年の非持分インセンティブ·プログラムの目標を一部達成するためのCittadineさん65,406ドルのボーナスを付与し、Cittadineさんの新しい基本給を360,000ドルで承認します。取締役会は、2024年2月に、予め設定された2023年非持分インセンティブ·プログラム目標の一部達成に向けたCittadineさん56,700ドルのボーナスを付与します。
2023年12月31日の未償還持分賞
次の表は、2023年12月31日までに任命された役員が保有する未償還株式オプション奨励を示しています。
| 名前.名前 |
行使可能な未行使オプションの証券数(#) |
未行使オプションの証券数(#)行使不可 |
オプション取引権価格(ドル) |
オプション期限 |
まだ帰属していない株式または株式単位数(#) |
まだ帰属していない株式又は株式単位の時価($)(8) |
||
| チャンドラー·D·ロビンソン医学博士 |
55,460 |
(1) |
166,379 |
(1) |
$ 3.16 |
2033年2月1日 |
||
| 取締役CEO兼最高経営責任者 |
105,509 |
(2) |
105,509 |
(2) |
$ 2.80 |
2032年2月2日 |
||
| 52,500 |
(3) |
17,500 |
(3) |
$ 6.81 |
2031年1月26日 |
|||
| 70,000 |
(4) |
- |
(4) |
$ 14.35 |
2030年2月11日 |
|||
| 145,500 |
(5) |
- |
(5) |
$ 6.00 |
2028年8月27日 |
|||
| 84,000 |
(6) |
- |
(6) |
$ 0.001 |
2027年2月19日 |
|||
| 84,000 |
(7) |
- |
(7) |
$ 0.001 |
2026年4月3日 |
|||
| 229,009 |
77,909 |
|||||||
| キム·R·土本アメリカ |
25,672 |
(1) |
77,016 |
(1) |
$ 3.16 |
2033年2月1日 |
||
| 首席財務官·秘書兼財務主管 |
40,698 |
(2) |
40,697 |
(2) |
$ 2.80 |
2032年2月2日 |
||
| 20,570 |
(3) |
6,857 |
(3) |
$ 6.81 |
2031年1月26日 |
|||
| 20,455 |
(4) |
- |
(4) |
$ 14.35 |
2030年2月11日 |
|||
| 41,100 |
(5) |
- |
(5) |
$ 6.00 |
2028年8月27日 |
|||
| 23,520 |
(6) |
- |
(6) |
$ 0.001 |
2027年2月19日 |
|||
| 21,000 |
(7) |
- |
(7) |
$ 0.001 |
2026年4月3日 |
|||
| 95,556 |
32,508 |
|||||||
| アンドリュー·J·シタディン |
25,672 |
(1) |
77,016 |
(1) |
$ 3.16 |
2033年2月1日 |
||
| 最高経営責任者: |
42,500 |
(2) |
42,500 |
(2) |
$ 2.80 |
2032年2月2日 |
||
| 18,750 |
(9) |
11,250 |
(9) |
$ 5.89 |
2031年6月30日 |
|||
| 45,208 |
(10) |
24,792 |
(10) |
$ 5.76 |
2031年6月1日 |
|||
| 91,175 |
31,018 |
| (1) |
ロビンソン博士、suhimoto夫人、およびCittadineさんは、2023年2月1日に配当金を付与され、2023年1月1日に帰属を開始し、帰属開始日6ヶ月(2023年6月30日)に6/48を付与され、その後毎月1/48帰属する。 |
| (2) |
ロビンソン博士、suhimoto夫人、およびCittadineさんは、2022年2月2日に配当金を付与され、2022年1月1日に帰属を開始し、帰属開始日6ヶ月(2022年6月30日)に帰属する6/48を付与し、その後毎月1/48に帰属する。 |
| (3) |
ロビンソン博士と土本さんは2021年1月26日に株式オプション奨励を付与され、2021年1月1日に帰属を開始し、帰属開始日6カ月周年日(2021年6月30日)に6/48が付与され、その後毎月1/48に帰属する。 |
| (4) |
ロビンソン博士と土本さんは2020年2月11日に株式オプション奨励を授与され、2020年1月1日に授与され、帰属開始日6カ月周年(2020年6月30日)に6/48が授与され、その後毎月1/48が授与される。 |
| (5) |
ロビンソン博士と土本さんは2018年8月28日に株式オプション奨励が付与され、2018年10月1日に帰属を開始し、帰属開始日6ヶ月周年(2019年3月31日)に6/51に帰属し、その後毎月1/51に帰属する。 |
| (6) |
ロビンソン博士と土本さんは2017年2月20日に株式オプション奨励が付与され、授与日6カ月周年記念日(2017年8月20日)に6/48、その後毎月1/48が授与された。 |
| (7) |
ロビンソン博士と土本さんは2016年4月4日に株式オプション奨励、授与日(2016年4月4日)に50%、授与日6カ月周年日(2016年10月4日)に25%、授与日1周年日(2017年4月3日)に25%を授与された。 |
| (8) |
表に示されている帰属していないRSUの価値は、2023年12月31日の我々の普通株の終値0.3402ドルを用いて計算される。
2023年にはロビンソン博士、土本氏、およびCittadineさんによりそれぞれ169,012,78,234および78,234の制限株式単位が与えられ、これらの単位は2023年6月30日に6/48が付与され、その後四半期ごとに3/48が付与された。
2022年には、ロビンソン博士、土本さん、およびCittadineさんによってそれぞれ159、522、61、532および65,000の制限株式単位が取得され、2022年6月30日には6/48が授与され、その後、四半期ごとに3/48が付与されます。
2021年、ロビンソン博士と土本さんはそれぞれ63,060と19,536個の制限株式単位を獲得し、2021年6月30日に6/48を授与し、その後四半期ごとに3/48を授与した。
2020年、ロビンソン博士と土本さんは26,895株と4,923株の制限株を獲得し、それぞれ2021年1月1日、2022年1月1日、2023年1月1日と2024年1月1日に25%を授与した |
| (9) |
Cittadineさんは2021年6月30日に株式オプション奨励金を付与し、雇用開始6ヶ月周年(2021年11月30日)に6/48を付与し、その後毎月1/48を付与する。 |
| (10) |
Cittadineさんは2021年6月1日に株券オプションを付与し、その授与日の6ヶ月間(2021年11月30日)に6/48を授与し、その後毎月1/48を授与する。 |
終了または制御権変更時の潜在的支払い
ロビンソン博士、土本さん、およびCittadineさんのすべての雇用契約は、署名と発効のクレーム解除後に、ロビンソン博士、土本さん、およびCittadineさんが私たちとの雇用関係を終了する場合には、彼らは解散料を得る権利があります。もし私たちが“理由”なしに彼らの雇用を終了した場合、またはRobinson博士またはTsuhimotoさんが“十分な理由”で辞任した場合、それぞれの場合、“統制権変更”がなければ、Robinson博士は(1)基本給が12ヶ月連続で、(2)任意の既得持分奨励金が12ヶ月継続して行使され、(3)終了後12ヶ月または幹部が雇用主の計画に従って保険を受ける資格がある日まで保険継続保険を支払うか補償する。土本さんは、(1)3ヶ月連続の基本給、(2)任意の既得持分奨励金は12ヶ月継続可能である、(3)土本さんがフルタイムである場合は、契約終了後12ヶ月、または雇用主によって保険を受ける資格がある日の早い者まで保険継続保険を支払うか補償する。Cittadineさんは、(1)3ヶ月連続の基本給を得ることになり、(2)任意の既得持分奨励金を6ヶ月間継続して行使することができ、また、(3)メガネ蛇の支払いまたは補償を受けて、契約終了後6ヶ月以内に保険を受ける資格があるか、または役員が雇用主計画に基づいて保険を受ける資格を有することになる。
ロビンソン博士の雇用が支配権変更後12ヶ月以内に理由なくまたは十分な理由で終了された場合、(1)それぞれの基本給の1.5倍に相当する金額に当年の目標年間ボーナスを一度に支払う権利があり、(2)コブラが保険を継続し、終了後18ヶ月または幹部が雇用主計画保険を受ける資格がある日までの18ヶ月を支払う権利と、(3)未払いの持分報酬のすべてを加速する権利がある。ロビンソン博士が死亡や永久障害で解雇された場合、私たちは3ヶ月の基本給の更新とコブラの支払いや精算を提供する義務があります。
土本さんの雇用が支配権変更後12カ月以内に理由なくあるいは十分な理由で終了した場合、(1)基本給の0.25倍に相当する総払いを獲得する権利があり、発生当時の目標年間ボーナスの終了に加え、(2)土本さんがフルタイムであれば、終了後3カ月の早い1カ月または幹部が雇用主計画に基づいて保険を受ける資格がある日まで、すべての未払い株式奨励を全面的に加速させる権利がある。土本さんが死亡や永久障害で解雇された場合、私たちは3ヶ月の基本給の更新とコブラの支払いや精算を提供する義務があります。
もしCittadineさんの雇用が支配権変更後12ヶ月以内に理由なくまたは十分な理由で終了した場合には、(1)基本給の0.75倍に相当し、終了後6ヶ月以内に雇用主計画保険を取得する資格がある者まで、および(3)すべての未償還持分報酬の全額帰属を加速させる権利がある、(2)キングコブラ継続保険の支払いまたは補償金の発生日に相当する早期の雇用主報酬を一度に支払う権利がある。Cittadineさんが死亡や永久障害により解雇された場合、基本賃金の更新とコブラの支払いまたは精算の提供を3ヶ月間義務付けます。
Robinson博士、Tsuhimotoさん、Cittadineさんは、任意の雇用の終了時に、未払いの基本給と未払いの年間ボーナスを得る権利があります。
Robinson博士、suhimotoさん、およびCittadineさんと締結された雇用契約では、当社の支配権変更に関連するいかなる金額も、改正された1986年の国内税法第499条に基づいて消費税が納付される必要がある場合は、その均等金は、その課税を伴わない最大の支払額に減額されることになりますが、この減少は、規則499条に基づく減税および消費税の支払がないよりも、役員が税額に基づいて増額されることになることを前提としています。
年金福祉
私たちは固定収益年金計画を持っていない。当社が指定した行政官は、2023年12月31日までの年間、当社が後援する退職金または固定利益退職計画の下での特別福祉に参加または他の方法で受給していません。
401(K)計画
私たちは私たちの職員たちのために固定支払従業員の退職計画を維持する。この計画の目的は、401(K)計画の納付と、このような入金から稼いだ収入が401(K)計画から抽出または分配される前に、参加者に課税されないように、“規則”第401(K)節に規定する合格納税計画の資格を満たすことである。
401(K)計画は、各参加者が最高で税引前報酬の100%に貢献でき、最高で法定上限、すなわち2023年の22,500ドルに達することを規定している。50歳になった参加者も“追う”貢献ができ、2023年には法定限度額より7500ドル多くなる可能性があります。従業員が会社で積極的に働いた4カ月後、401(K)計画に参加する資格がある。
401(K)計画によると、各従業員は彼または彼女の繰延賃金支払いを完全に得ることができる。従業員の支払いはその計画の受託者によって保有され、投資される。401(K)計画はまた、既定の限度額およびホームスケジュールの制限の下で、適宜の利益共有支払いおよび適宜の対支払いを行うことを可能にする。
非限定延期補償
2023年12月31日までの年間で、私たちの指定幹部は、私たちが後援する任意の固定納付または他の計画に貢献したり、いかなる金額を稼いだりしていません。このような計画または計画は、税務資格を満たしていない上で補償を延期することを規定しています。
ヘッジ政策
私たちのインサイダー取引政策は私たちの株の空売りを禁止し、私たちの高級管理者と非従業員取締役の短期取引を禁止します。私たちの従業員(高級職員を含む)または非従業員取締役が金融商品(前払い可変契約、株式交換、基金リングおよび外国為替基金を含む)を購入する能力があるかどうか、または他の方法で取引を行い、彼らの保有する証券の時価のいかなる低下をヘッジまたは相殺または相殺することを目的としているかについては、私たちは他の方法や政策を取っていない。
2023年12月31日までの年間役員報酬
次の表に2023年12月31日までの年間非従業員役員の給与を示す。
| 稼いだ費用や |
株式大賞 |
オプション大賞 |
他のすべての補償 |
合計する |
|||||
| 名前.名前 |
現金払い(ドル) |
($) (1) |
($) (2) |
($) |
($) |
||||
| クリストファー·M·スタール博士です |
80,000 |
32,020 |
32,021 |
120,000 |
264,041 |
||||
| マイケル·J·ブラウン |
62,000 |
32,020 |
32,021 |
0 |
126,041 |
||||
| レイモンド·W·アンダーソン |
72,500 |
32,020 |
32,021 |
0 |
136,541 |
||||
| アーサー·J·クラウスナー |
64,500 |
32,020 |
32,021 |
0 |
128,541 |
(1)財務報告:本欄の金額代表2023年12月31日までの年度内に非従業員取締役に付与された株式奨励の総付与日公価値は、FASB ASCテーマ718に基づいて算出される。制限株式単位の公正価値は付与日の終値に基づいている。推定仮定の検討については,本年度報告における他箇所のForm 10−K総合財務諸表付記5を参照されたい。
(2)財務報告:本欄の金額代表2023年12月31日までの年度内に非従業員取締役のオプション奨励を付与する付与日公価値合計は、FASB ASCテーマ718により算出される。株式オプションの公正価値はブラック·スコアーズオプション定価モデルによって付与された日に推定される。推定仮定の検討については,本年度報告における他箇所のForm 10−K総合財務諸表付記5を参照されたい。
(3)2022年1月1日から、スタール博士は、臨床開発、規制戦略、製造分野の専門知識に基づいて、毎月10,000ドルで相談サービスを提供する諮問協定に署名した。その協定はどちらか一方が終わらない限り、年に1回更新される。
2023年12月31日現在、私たちの非従業員取締役は以下の数の株式オプションを持っており、これらのオプションは完全に付与されています
| 名前.名前 |
株式奨励を受けた株式の総数 |
株式オプションに拘束された株式総数 |
| クリストファー·M·スタール博士です |
- |
233,247 |
| マイケル·J·ブラウン |
- |
86,271 |
| レイモンド·W·アンダーソン |
- |
86,271 |
| アーサー·J·クラウスナー |
- |
86,271 |
2023年12月31日現在、帰属していない限定的な株式単位はない。
次の表は2023年の非従業員取締役の非持分費用スケジュールを反映している。長期株式報酬はブラック·スコアーズ推定モデルおよび同業者グループ会社の審査を利用して毎年決定されている。
| 2023 |
|
| ポスト: |
年会費(元)* |
| 取締役会のメンバー |
|
| 独立役員基本費 |
40,000 |
| 取締役会執行議長の追加費用 |
40,000 |
| 委員会 |
|
| 委員会費用は基本的な取締役会の会員費用以外の費用だ。 |
|
| 監査委員会 |
|
| 監査委員会議長 |
15,000 |
| 監査委員会委員 |
10,000 |
| 報酬委員会 |
|
| 報酬委員会議長 |
12,500 |
| 報酬委員会委員 |
7,000 |
| 企業管理·指名委員会(CG&N) |
|
| CG&N委員会議長 |
7,500 |
| CG&N委員会メンバー |
5,000 |
*季節ごとに借金を支払います。
プロジェクト12.特定の実益所有者の保証所有権及び管理職及び株主に関する事項
次の表と関連説明は、2024年3月8日までの私たちの普通株の利益所有権情報を提供します。普通株は私たちの唯一の流通株カテゴリです
| ● |
私たちの非従業員の誰もが |
| ● |
私たちのすべての任命された執行官は |
| ● |
私たちの現在の非従業員役員と行政職員は全体として |
| ● |
私たちが知っているすべての人たちの実益は私たちの普通株の5%以上を持っている。 |
受益所有権は、証券に対する投票権または投資権を含む、米国証券取引委員会の規則に基づいて決定される。オプションの行使によれば、個人またはグループが2024年3月8日から60日以内に買収する可能性のある普通株式は、その個人またはグループの所有権パーセンテージを計算する際に未償還とみなされるが、表に示されている任意の他の人の所有権パーセンテージを計算する際には、未償還普通株式とはみなされない。利益所有権パーセンテージは、2024年3月8日までに発行された普通株に基づく17,454,925株である。
本表の脚注に示す以外に、吾らは、本表に記載された株主が当該等株主が吾等に提供する資料に基づいて、その実益が所有するすべての普通株式に対して独占投票権及び投資権を有すると信じている。
| 実益所有者の氏名又は名称及び住所*別の説明がない限り、住所はイリノイ州ウィルマット市スコキ通り1000番地、Suite 350、IL 60091 |
実益所有普通株 |
クラス保持率 |
| TacticGem,LLC(1) |
7,166,667 |
41.1% |
| TATY Pharma LLC(1) |
4,277,940 |
24.5% |
| GEM製薬株式会社(1)941 Lake Forest Cir.,バーミンガム,AL 35244 |
3,055,394 |
17.5% |
| ダイアン·ヘンドリックス(1) |
3,524,144 |
20.2% |
| 取締役CEOチャンドラー·D·ロビンソン(2) |
787,702 |
4.4% |
| クリストファー·M·スタール執行議長(3) |
308,510 |
1.7% |
| マイケル·J·ブラウン、取締役(4) |
322,134 |
1.8% |
| レイモンド·W·アンダーソン取締役(5) |
113,134 |
* |
| アーサー·クラウス、取締役(6) |
117,134 |
* |
| 取締役首席財務官土本金男(7) |
255,236 |
1.4% |
| 最高経営責任者Andrew J.Cittadine(8) | 208,499 | 1.2% |
| グループの執行役員として(8人)(9人) |
6,488,751 |
34.1% |
| (1) |
TATY PharmaはTacticGemに対して4,111,273株の我々の普通株の投票権と投資権を持ち,GemはTacticGemが持つ3,055,394株に対する我々の普通株の投票権と投資権を持っており,TacticGem有限責任会社の合意により,我々の普通株のすべての投票権はTacticGemとGemのTacticGemにおける百分率権益の割合でTATY PharmaとGemに伝達されるからである.最初の保有期間終了後,我々が“取引法”の報告要求を遵守して少なくとも12カ月のすべての必要な報告を提出した後,TacticGemのどのメンバもその割合を超えない普通株を割り当てることができる.TATY Pharmaは166,667株を自分の名義で持っている。ロビンソン博士はTATY Pharma社のマネージャーである;したがって、彼はTacticGem社が持っている私たちの普通株の4,111,273株とTACY Pharma社が持っている普通株に対して投票権と処分権を持っていると思われるかもしれない。GEMはPharma Investments LLCによって制御されるが,Pharma Investments LLCはDiane M.Hendricksによって制御される。ヘンドリックスが制御するDMH Business LLCは、私たちの初公募株で468,750株を購入した。ヘンドリックスがコントロールする金額には、Gemの所有権とDMH Business LLCの所有権が含まれる。 |
| (2) |
2024年3月8日後60日以内に帰属または帰属する638,873件の普通株式オプションを含む。 |
| (3) |
233,247個の普通株式オプションを含み、これらのオプションは、2024年3月8日後60日以内に帰属または帰属する。 |
| (4) |
86,271個の普通株式オプションを含み、これらのオプションは、2024年3月8日後60日以内に帰属または帰属する。 |
| (5) |
86,271個の普通株式オプションを含み、これらのオプションは、2024年3月8日後60日以内に帰属または帰属する。 |
| (6) |
86,271個の普通株式オプションを含み、これらのオプションは、2024年3月8日後60日以内に帰属または帰属する。 |
| (7) |
210,640個の普通株式オプションを含み、これらのオプションは、2024年3月8日後60日以内に帰属または帰属する。 |
| (8) |
156,729個の普通株式オプションを含み、これらのオプションは、2024年3月8日後60日以内に帰属または帰属する。 |
| (9) |
TATY Pharma実益が持つ4,277,940株を含む。上文脚注(1)を参照されたい。 |
*1%未満
株式補償計画に基づいて発行された証券
次の表は、既存株式補償計画に基づいて発行可能な普通株式に関する2023年12月31日までの情報を提供する。
| 計画種別 |
未償還オプション,株式承認証及び権利を行使する際に発行される証券数 |
未償還オプション、権証および権利の加重平均行権価格 |
株式補償計画の下で将来発行可能な証券の数 |
| 証券保有者が承認した持分補償計画(1) |
2,109,001 |
$4.01 |
1,956,038 |
(1)Monopar Treateutics Inc.2016株式インセンティブ計画。
私たちのすべての持分補償計画は私たちの証券所有者の承認を受けた。
第十三項特定関係及び関連取引及び取締役独立性
関係者と取引する
2023年1月以降、私たちは共同創業者、非従業員取締役、役員、私たちの5%以上の議決権証券の保有者、私たちの非従業員取締役の関連側または直系親族、私たちの議決権証券の5%以上の役員と保有者、および私たちの共同創業者と報告すべき取引を行ったことがありません。
登録権
私たちは、TacticGemの指示の下で、TacticGemまたはそのメンバーGem PharmPharmticals、LLCが私たちの任意の普通株を転売することを含むS-3表または他の適切な形式の登録声明を提出することを要求するTacticGem、LLC(“TacticGem”)と合意された合意を受けた。本稿の日付まで,TacticGemは,将来的に要求されない保証はないにもかかわらず,このような転売登録声明の提出を要求していない.
関係者取引の手続き
“関係者”には、任意の非従業員、取締役の被著名人または会社幹部、任意のカテゴリに投票権を有する証券の実益所有者が5%を超える人、およびそのような非従業員取締役の直系親族、取締役の被著名人、役員または5%以上の実益所有者である者(用語“直系家族”は、任意の子供、継子、親、継親、配偶者、兄弟姉妹、義母、義父、婿、息子嫁を含むべきである。義弟又は兄嫁及び上記のいずれかの非従業員取締役と共同で住んでいる任意の者(テナント又は従業員を除く)、取締役の被引名者、幹部又は5%を超える実益所有者)。
私たちの取締役会は私たちの監査委員会の定款を通過し、監査委員会の審査と関連者の取引を許可した。監査委員会は、米国証券取引委員会条例S-K 404項に基づく当社と任意の関連者との間の任意の取引を継続的に審査および承認または承認せず、ナスダックを監督し、関連者の取引を判断するための政策および手続を監査委員会に要求する。私たちの監査委員会は、取引の商業的理由と適切な開示が行われたかどうかについて、私たちの経営陣と議論するだろう。
役員は自主独立している
私たちの取締役会に独立取締役がいることは重要であり、彼らは個人の利益の影響を受けることなく決定することができると信じています。上記の考えに基づき、各取締役またはその任意の家族のメンバーと吾ら、吾らの上級経営陣および独立公認会計士事務所との間で確定したすべての関連取引または関係を審査した後、著者らの取締役会は、ナスダックが上場基準を適用する独立取締役のことを確定した:スタール博士、Brownさん、Andersonさん、Klausnerさん。この決定を下したとき、吾ら取締役会は、取締役と吾などと重大あるいは他の喪失資格との関係がないことを発見した。スタール博士について、取締役会はコンサルティングサービスの報酬を受けたとしており、このことは本年度報告書10-K表の他の場所で開示されており、ナスダックの独立のハードルを超えていない。
我々の監査委員会は、Andersonさん、Klausnerさん、Brownさんで構成され、監査委員会に適用されるナスダック規則と取引所法案の下の規則10 A-3で定義される米国証券取引委員会によって定義された独立したメンバーである。アンダーソンは監査委員会の議長を務め、ナスダックと米国証券取引委員会が定義した金融専門家である。
我々のCG&N委員会は、独立メンバーのクラウスナーさん、ブラウンさん、アンダーソンさんから構成されています。クラウスナーさんは、CG&N委員会の議長です。
我々の報酬委員会は、アンダーソン·さん、ブラウン·さん、クラウスナーさんで構成されており、彼らはナスダックが報酬委員会のメンバーに適用する規則で定義された独立したメンバーです。アンダーソンは報酬委員会の議長を務めている。
私たちの計画管理委員会は、スタール博士、ブラウンさん、アンダーソンさんによって構成され、彼らは独立したメンバーです。
私たちのどの取締役も他の人との間には他の合意や了解がありません。これにより彼らは取締役に選ばれました。
プロジェクト14.主な会計費用とサービス
BPM LLPが提供するすべての監査、監査関連、税務、その他のサービスは、監査委員会によって審査され、業績が事前に承認され、監督される。監査を許可し、非監査サービスは、アンダーソン·さん監査委員会議長または監査委員会のメンバーであるクラウス·さん(例えば、アンダーソン·さん)が代表する監査委員会によって事前に承認することができます。事前承認決定は議長/代表が速やかに監査委員会に報告するが、次に予定された監査委員会会議に遅れることはない。
独立公認会計士事務所の費用
以下は、我々の独立公認会計士事務所BPM LLPが、2023年12月31日及び2022年12月31日までの年度において、公認会計原則に基づいて記録した監査及びその他のサービスの総費用の概要である。
| 12月31日までの年度 |
|||
| BPM LLPが提供するサービス説明 |
2023 |
2022 |
|
| 監査費用:*これらのサービスは、当社の財務諸表の審査または監査に関連しています* |
$ 310,500 |
$ 279,000 |
|
| 監査関連費用:これらのサービスは、財務諸表の監査または審査の業績に合理的に関連するまたは派生した保証およびサービスに関する。 |
$ 15,000 |
$ 32,477 |
|
| 税務契約料:このようなサービスは私たちの連邦、州、外国納税申告書と他の申告書類の準備に関するものです。 |
- |
- |
|
| 税務コンサルティングとコンサルティングサービス:これらのサービスは主に税金戦略と私たちの連邦、州、地方、外国の税金を最大限に減らすことに関連している。 |
- |
- |
|
| 他のすべての費用 |
- |
- |
|
*前年度の年末財務諸表監査および今年度の四半期審査に関連する監査費用が含まれます。
第4部
項目15.物証、財務諸表付表
1.財務ファクトシート
財務諸表索引
| ページ | |||
| 独立公認会計士事務所レポート(PCAOB ID:) | F-2 | ||
| 2023年12月31日と2022年12月31日までの連結貸借対照表 | F-3 | ||
| 2023年12月31日と2022年12月31日までの総合経営報告書と全面赤字 | F-4 | ||
| 2023年12月31日までと2022年12月31日まで年度株主権益総合レポート | F-5 | ||
| 2023年12月31日と2022年12月31日までの統合現金フロー表 | F-6 | ||
| 連結財務諸表付記 | F-7からF-22まで |
2.財務諸表の添付表
他の財務諸表明細書は、それらが必要ではないので、またはこれらの情報が他の方法で連結財務諸表または付記に表示されるので、含まれていない。
(B)展示品
本年度報告10−K表の一部として,以下の証拠物を提出した。
| 展示品 | 文書 | 引用によって結合しています | ||
| 3.1 | 2回目の改訂と再署名された会社登録証明書 | 2018年3月26日に提出されたForm 10-K | ||
| 3.2 | 付例を改訂および再制定する | 2022年5月12日提出の10-Qフォーム | ||
| 4.1 | 登録証券説明 | ここでは添付ファイル4.1としてアーカイブします | ||
| 10.1* | XOMA株式会社と締結したライセンス契約です。 | 2018年3月26日に提出されたForm 10-K | ||
| 10.2* | 投稿プロトコル(351)-TacticGemとの登録権を含む | 2018年3月26日に提出されたForm 10-K | ||
| 10.3 | 改訂された2016年度株式インセンティブ計画 | 2022年4月29日に提出されたフォームDEF 14 A | ||
| 10.4 | インセンティブ株式オプション協定のフォーマット | 2022年3月24日提出のForm 10-K | ||
| 10.5 | 非限定株式オプション協定のフォーマット | 2022年3月24日提出のForm 10-K | ||
| 10.6 | 制限株式単位授権書のフォーマット | 2022年3月24日提出のForm 10-K | ||
| 10.7 | チャンドラー·D·ロビンソン雇用協定−2017年11月1日施行 | 2018年3月26日に提出されたForm 10-K | ||
| 10.8 | 2017年11月1日発効の金·R·土本茂の雇用協定 | 2018年3月26日に提出されたForm 10-K | ||
| 10.9 | 2018年3月1日に発効した岩本金雇用協定改正案1 | 2018年3月26日に提出されたForm 10-K | ||
| 10.10 | PRXコンサルティング(Patrice Rioux)のコンサルティング契約-2023年1月1日発効 | 添付ファイル10.1としてアーカイブします | ||
| 10.11 | “クリストファー·M·スタール諮問協定”が2022年1月1日に発効 | 2022年3月24日提出のForm 10-K | ||
| 10.12 | 必要に応じて資本に対応するTM*ジョーンズ取引機関サービス有限責任者との販売契約 | 2022年4月20日提出のForm 8-K | ||
| 21.1 | Monopar Treateutics Inc.2023年12月31日現在の子会社 | 添付ファイル21.1として提出します | ||
| 23.1 | 独立公認会計士事務所の同意 | 添付ファイル23.1としてアーカイブします | ||
| 24.1 | 授権書(本文書の署名ページに含まれる) | |||
| 31.1 | チャンドラー·D·ロビンソンの認証 | 添付ファイル31.1として提出します | ||
| 31.2 | Kim R.Tsuhimotoの認証 | ここに添付ファイル31.2としてアーカイブします | ||
| 32.1 | チャンドラー·D·ロビンソン最高経営責任者キム·R·土本の認証 | 添付ファイル32.1として提出します | ||
| 97 | 補償補償政策 | 添付ファイルとして97アーカイブを保存します |
| 101.INS | イントラネットXBRL分類拡張アーキテクチャ | |||
| 101.書院 | イントラネットXBRL分類拡張アーキテクチャ | |||
| 101.カール | イントラネットXBRL分類拡張計算リンクライブラリ | |||
| 101.def | インラインXBRL分類拡張Linkbaseの定義 | |||
| 101.介護会 | XBRL分類拡張ラベルLinkbaseを連結する | |||
| 101.Pre | インラインXBRL分類拡張プレゼンテーションLinkbase | |||
| 104 | 表紙相互データファイル(添付ファイル101に含まれるイントラネットXBRLのフォーマット) |
(*)と表示された展示品では,機密情報は省略され,単独で米国証券取引委員会に届出されている.2018年1月8日の命令により、漏れた情報の秘匿処理が承認されました。
サイン
1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、次の署名者が代表して本報告書に署名することを正式に許可した。
| MONOPAR治療会社は | |||
| 日付:2024年3月28日 | 差出人: | /S/金·R·土本健二 | |
| 名前:土本金 | |||
| 役職:首席財務官 | |||
| (首席財務官) | |||
以下の署名した各個人は、Chandler D.Robinsonおよびその代理弁護士Kim R.Tsuhimotoを構成し、指定し、本Form 10 K年次報告を任意およびすべての身分で修正し、証拠品および他の関連文書と共に米国証券取引委員会に提出し、ここで上述したすべての実際の受権者またはその代替代理人が本表10 Kによって任意の修正を行うことができることを承認し、確認することができる。
1934年の証券取引法の要求によると、本報告は、次の日に登録者として次の日に署名された
| サイン | タイトル | 日取り | ||
| /S/チャンドラー·D·ロビンソン | 2024年3月28日 | |||
| チャンドラー·D·ロビンソン | CEOと役員(最高経営責任者) | |||
| /S/金·R·土本健二 | 2024年3月28日 | |||
| 金·R·土本 | 首席財務官及び取締役(首席財務官及び首席会計官) | |||
| /S/クリストファー·M·スタール | 2024年3月28日 | |||
| クリストファー·スタール | 取締役会執行議長兼取締役 | |||
| /S/レイモンド·W·アンダーソン | 2024年3月28日 | |||
| レイモンド·W·アンダーソン | 役員.取締役 | |||
| /S/マイケル·J·ブラウン | 2024年3月28日 | |||
| マイケル·ブラウン | 役員.取締役 | |||
| /S/アーサー·J·クラウスナ | 2024年3月28日 | |||
| アーサー·クラウスナー | 役員.取締役 |
財務諸表索引
| ページ | |||
| 独立公認会計士事務所報告 | F-2 | ||
| 2023年12月31日と2022年12月31日までの連結貸借対照表 | F-3 | ||
| 2023年12月31日と2022年12月31日までの総合経営報告書と全面赤字 | F-4 | ||
| 2023年12月31日までと2022年12月31日まで年度株主権益総合レポート | F-5 | ||
| 2023年12月31日と2022年12月31日までの統合現金フロー表 | F-6 | ||
| 連結財務諸表付記 | F-7からF-22まで |
独立公認会計士事務所報告
Monopar治療会社の株主と取締役会に。
財務諸表のいくつかの見方
Monopar Treateutics Inc.とその子会社の2023年12月31日と2022年12月31日までの連結貸借対照表、および2023年12月31日までの2年度の関連総合経営報告書と全面赤字、株主権益と現金流量、および関連付記(総称して“財務諸表”と呼ぶ)を監査した。これらの財務諸表は,Monopar治療会社の2023年12月31日と2022年12月31日までの財務状況と,2023年12月31日までの2年間の年間の経営結果とキャッシュフローをすべて公平に反映しており,米国公認の会計原則に適合していると考えられる。
意見の基礎
このような財務諸表は実体管理層が責任を負う。私たちの責任は私たちの監査に基づいてこのような財務諸表に意見を述べることだ。私たちはアメリカ上場会社会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちはMonopar Treateutics Inc.から独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。Monopar治療会社は必要なく、私たちがその財務報告書の内部統制を監査する必要もない。私たちの監査の一部として、私たちは財務報告の内部統制を理解することが求められているが、実体的な財務報告の内部統制の有効性について意見を述べるためではない。したがって、私たちはそのような意見を表現しない。
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
/s/
2015年以来、私たちはMonopar治療会社のS監査役を務めてきた。
2024年3月27日
Monopar治療会社です
総合貸借対照表
| 2023年12月31日 | 2022年12月31日 | |||||||
| 資産 | ||||||||
| 流動資産: | ||||||||
| 現金と現金等価物 | $ | $ | ||||||
| 投資する | ||||||||
| その他流動資産 | ||||||||
| 流動資産総額 | ||||||||
| 経営的リース使用権資産 | ||||||||
| 総資産 | $ | $ | ||||||
| 負債と株主権益 | ||||||||
| 流動負債: | ||||||||
| 売掛金、売掛金、その他流動負債 | $ | $ | ||||||
| 流動負債総額 | ||||||||
| 非流動経営賃貸負債 | ||||||||
| 総負債 | ||||||||
| 引受金とその他の事項(注9) | ||||||||
| 株主権益: | ||||||||
| 普通株、額面$一株一株株式を許可してそして2023年12月31日と2022年12月31日までの発行済株式 | ||||||||
| 追加実収資本 | ||||||||
| 累積的その他総合 国際電気通信連合E(損失) | ( | ) | ||||||
| 赤字を累計する | ( | ) | ( | ) | ||||
| 株主権益総額 | ||||||||
| 総負債と株主権益 | $ | $ | ||||||
付記はこれらの連結財務諸表の構成要素である。
Monopar治療会社です
合併企業経営報告書と全面赤字
| 12月31日までの年度 | ||||||||
| 2023 | 2022 | |||||||
| 運営費用: | ||||||||
| 研究開発 | $ | $ | ||||||
| 一般と行政 | ||||||||
| 総運営費 | ||||||||
| 運営損失 | ( | ) | ( | ) | ||||
| 利子収入 | ||||||||
| 純損失 | ( | ) | ( | ) | ||||
| その他の全面収益(損失): | ||||||||
| 外貨換算N損失 | ( | ) | ( | ) | ||||
| 投資の未実現収益 | ( | ) | ||||||
| 総合損失 | $ | ( | ) | $ | ( | ) | ||
| 1株当たり純損失: | ||||||||
| 基本的希釈の | $ | ( | ) | $ | ( | ) | ||
| 加重平均流通株: | ||||||||
| 基本的希釈の | ||||||||
付記はこれらの連結財務諸表の構成要素である。
Monopar治療会社です
株主権益合併報告書
2023年12月31日までおよび2022年12月31日までの年度
| 積算 | ||||||||||||||||||||||||
| その他の内容 | 他にも | 合計する | ||||||||||||||||||||||
| 普通株 | もう払いました- | 全面的に | 積算 | 株主の | ||||||||||||||||||||
| 株 | 金額 | “資本論”で | 収入(損) | 赤字.赤字 | 権益 | |||||||||||||||||||
| 2022年1月1日の残高 | $ | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||||
| 必要資本項目の下で普通株発行TMJones Trading Institution Services LLCとの販売プロトコルは,手数料,手数料,支出を差し引いた純額は$である | ||||||||||||||||||||||||
| 既得制限株式単位に基づいて非従業員取締役に普通株を発行する | ( | ) | ||||||||||||||||||||||
| 既得制限株式単位に基づいて従業員に普通株を発行し,税後純額 | ( | ) | ( | ) | ||||||||||||||||||||
| 株式オプション行使時に普通株を発行する | ||||||||||||||||||||||||
| 株ベースの報酬(非現金) | — | |||||||||||||||||||||||
| 純損失 | — | ( | ) | ( | ) | |||||||||||||||||||
| その他総合収益 | — | |||||||||||||||||||||||
| 2022年12月31日の残高 | ( | ) | ||||||||||||||||||||||
| Jones Trading Institution Services LLCと達成したオンデマンド資本販売協定により普通株を発行し、手数料、手数料、費用を差し引いた純額は#ドルである | ||||||||||||||||||||||||
| 既得制限株式単位に基づいて非従業員取締役に普通株を発行する | ( | ) | ||||||||||||||||||||||
| 既得制限株式単位に基づいて従業員に普通株を発行し,税後純額 | ( | ) | ( | ) | ||||||||||||||||||||
| 株式オプション行使時に普通株を発行する | ||||||||||||||||||||||||
| 株ベースの報酬(非現金) | — | |||||||||||||||||||||||
| 純損失 | — | ( | ) | ( | ) | |||||||||||||||||||
| その他の総合情報E損失 | — | ( | ) | ( | ) | |||||||||||||||||||
| 2023年12月31日の残高 | $ | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||||
付記はこれらの連結財務諸表の不可分の一部である
Monopar治療会社です
統合現金フロー表
| 12月31日までの年度 | ||||||||
| 2023 | 2022 | |||||||
| 経営活動のキャッシュフロー: | ||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| 純損失と経営活動で使用される現金純額の調整: | ||||||||
| 株ベースの報酬(非現金) | ||||||||
| 経営性資産と負債変動、純額 | ||||||||
| その他流動資産 | ( | ) | ||||||
| 売掛金、売掛金、その他流動負債 | ( | ) | ||||||
| 経営的リース使用権資産と負債純額 | ( | ) | ||||||
| 経営活動のための現金純額 | ( | ) | ( | ) | ||||
| 投資活動によるキャッシュフロー: | ||||||||
| 短期投資を購入する | ( | ) | ( | ) | ||||
| 短期投資満期日 | ||||||||
| 提供された現金純額bY(用)投資活動 | ( | ) | ||||||
| 資金調達活動のキャッシュフロー: | ||||||||
| 必要に応じて資本項目に計上して普通株を売却する現金収益TM販売協定 | ||||||||
| 既得制限株式単位株式純決済に関する税金 | ( | ) | ( | ) | ||||
| 株式オプション行使時に株を発行して得られた現金収益 | ||||||||
| 融資活動が提供する現金純額 | ||||||||
| 為替レートの影響 | ( | ) | ( | ) | ||||
| 現金と現金等価物の純減少 | ( | ) | ( | ) | ||||
| 期初現金及び現金等価物 | ||||||||
| 期末現金および現金等価物 | $ | $ | ||||||
| 非現金投資·融資活動の追加開示 | ||||||||
| 融資費を計上する | $ | $ | ||||||
付記はこれらの連結財務諸表の構成要素である。
注意事項1-ビジネスの性質および流動資金
業務的性質
Monopar治療会社(“Monopar”あるいは“会社”)は臨床段階の生物製薬会社であり、癌患者のための革新的な治療方法の開発に専念している。Monoparは現在いくつかの化合物が開発されている1)MNPR-101−ジルコニウム、臨床段階のuPAR標的放射線診断イメージング剤;2)MNPR-101−RIT、進行癌の臨床前末期放射線治療;3)Camsiruicin(MNPRの一般名-201,GPX-150; 5-アミノ-13-デオキシアドリアマイシン)、a相1b臨床段階のアドリアマイシンの新しい類似体は、抗癌活性を維持するように設計されており、同時に心臓への毒性影響を最小限に低下させる4)初期のカシルシン類似体、MNPR-202,様々な癌を治療しています2023年3月27日同社はValidive段階を停止しました2b/3音声実験はそのデータセキュリティ監視委員会の決定に基づく注釈所定の薬効閾値に達しています
流動性
同社は累計約#ドルの赤字を出している
リスクと不確実性
同社のValidive臨床試験は#年末に終了した2023年3月会社の株価が下落した。同社株の終値は以下に下がった$1.00それだけではない30取引日を連続して2023年8月28日当社はナスダックの上場基準を満たしていないことを説明して、ナスダックから通知を受けました180数日後にコンプライアンスを再獲得します。開ける2024年2月27日その会社は1つを獲得した二番目 180-コンプライアンスを回復する日数;しかしあるかもしれない違います。会社がナスダックが延長した時間制限と要求内にコンプライアンスを再獲得することを保証します。もし会社がそうしたら注釈コンプライアンスを再獲得すれば会社は退市とそれに直面します5月.会社の資金調達能力に深刻な悪影響を与えています5月.Monoparの延期、再編成、あるいは他の方法でその運営を再検討することを招く。入札価格の不足を補うために逆株式分割を行う必要がある場合には、会社の株価への影響は不確定であり、不利である可能性がある。
会社が注目している市場変数違います。製品コストの上昇,資本コストの上昇,人件費や燃料,運賃やエネルギーコストの上昇などの制御要因,および地政学的事件は,会社の運営や管理費用の大幅な増加を招く可能性がある。
ロシア戦争、そしてロシアとロシアの実体または同盟国への制裁は、燃料コストと5月.出荷遅延になります。しかも、イスラエルとハマスの間の戦争はまたもっと多くの不確実性をもたらした。現在、これらの事件がより広範な経済、貿易、金融市場に与える影響はまだ確定していない5月.臨床材料の供給コストを増加させ5月.臨床材料の生産を延期し5月.他の商品およびサービスのコストを増加させるか、または追加融資を調達する難しさまたはコストを増加させることは、いずれも、会社の臨床および開発計画および会社の財務状況に悪影響を及ぼす可能性がある。
ヨーロッパのコロナウイルスの長期的な影響についてはまだ不確実性があります19潜在的な復活でもあります同社はCOVIDを推定できません19’sまたは将来の大流行疾患の財務的影響または持続時間、治療選択および現在または将来のCOVIDに応じた新しい症例の潜在的急増-19変種または将来の大流行またはその会社の現在の臨床試験および開発計画に対する潜在的な影響、COVIDを含む-19’sあるいは将来の大流行が世界の候補薬物の製造、輸送、臨床場所、規制機関の患者募集に与える影響
注意事項2-重要な会計政策
陳述の基礎
これらの総合財務諸表は、Monopar Treateutics Inc.,その完全所有のフランス子会社Monopar Treateutics,SARLおよびその完全所有のオーストラリア子会社Monopar Treateutics Australia Pty Ltdの財務業績を含み、GAAPが財務報告で要求するすべての開示を含む米国公認会計原則(“GAAP”)に従って作成されている。すべての会社間口座は除去された。これらの総合財務諸表を作成するために採用されている主要会計政策は以下のとおりであり、列報のすべての期間にわたってこれらの政策を踏襲してきた。同社は主に研究活動に従事し、候補製品を開発し、これらの活動を支援·拡大するために資金を集めてきた。
添付されている総合財務諸表は、会社の現在までを公平に反映するために必要なすべての正常な経常的な調整を含む2023年12月31日そして2022、当社の年度までの総合経営実績及び総合損失及び当社総合キャッシュフロー2023年12月31日そして2022.
機能通貨
当社の合併機能通貨はドルです。会社のオーストラリア子会社とフランス子会社はそれぞれその機能通貨としてオーストラリアドルとヨーロッパユーロを使用している。四半期末ごとに、外国子会社ごとの貸借対照表は四半期末の為替レートからドルに換算され、それらの経営報告書と全面損失およびキャッシュフロー表はその期間の平均レートに基づいてドルに換算される。
総合損失
総合損失とは純損失に他の収入や損失を加えることです注釈当社の総合株主権益表に反映されている債務証券投資損益及び未実現損益が総合経営報告書及び全面損失に反映されている外貨換算損益等。
予算の使用
公認会計原則に従って財務諸表を作成することは、連結財務諸表および付記に報告された資産および負債額、または有資産および負債の開示および報告の費用額に影響を与えるために、管理層に推定および仮定を要求する。実際の結果はこれらの推定とは異なる可能性がある
継続経営評価
会社は会計基準を実行して編集する205-40(“ASC205-40”), ある実体に関する不確実性を開示する’Sが経営を続ける能力財務会計基準委員会(“FASB”)はこの報告書を発表し、報告会社がその財務諸表に持続的な経営不確実性を開示しなければならない時間と方法について指導を提供しなければならないと判断した。ASC205-40経営陣には実体の持続経営企業としての能力の中期評価と年次評価が求められる1つは実体財務諸表が印刷された日の年(又は1つは適用される場合には、財務諸表は印刷された日の1年後に提供されることができる)。また、“実体経営を継続する能力に大きな疑いがある”場合には、会社は何らかの開示を提供しなければならない。はい2024年3月同社は少なくとも以下のように現金需要を分析した2025年6月30日会社の現在の現金によると会社は違います。経営を続ける企業として存続する能力に深刻な疑いが生じている。
現金等価物
その会社はすべての購入期限を三つ購入日から6ヶ月以下の時間で現金等価物とする。現在の現金等価物2023年12月31日と…2022以下の部分からなる二つ通貨市場口座とアメリカ国庫券です
投資する
同社は債務証券(米国政府または機関)へのすべての投資を考慮しており、これらの証券の満期日は三つ数ヶ月後1つは販売可能な証券の年。これらの投資は公正価値で入金され、未実現収益と損失は会社総合貸借対照表の累計その他の全面収益(赤字)に反映される。売却投資の実現済み収益と損失(あれば)は、総合経営報告書と総合損失の中で純額として決定される。当社が選択した投資は米国政府によって発行されているため、その固有の信用リスクレベルは低く、その公正な価値のいかなる変化も主に金利と市場流動性の変化によるものである。現在までの投資2022年12月31日満期日を超えるアメリカの国庫券で構成されています三つ数ヶ月前1つは一年です。
前払い費用
前金は,貨物を利用したりサービスを受ける前の貨物やサービスの支出であり,収益を実現する際に運営費用を計上する.前払い費用5月.開発協力者への支払いを含め、協力者が各報告期間終了時に計算した実費を超える。前金には保険料、会費、購読料、ソフトウェア料金#ドルも含まれています
賃貸借証書
ASCに基づいてレンタルプロトコルを評価して、レンタルするか、レンタルを含むかを決定する842, 賃貸借証書それは.使用権賃貸資産及びリース負債は開始日レンタル期間内に将来最低賃貸支払いの現在値を確認します。当社の総合貸借対照表上の使用権賃貸資産には、支払い済みのリース金が含まれており、レンタル奨励は含まれていません。当社の信用品質と類似資産の借入金利を考慮すると、増量借金は将来の支払いの現在値を決定するために使用される。リース費用は会社合併経営報告書と全面赤字に一般費用と行政費用を計上する。
信用リスクが集中する
会社を集中的な信用リスクに直面させる可能性のある金融商品には、現金と現金等価物が含まれる。会社は現金と現金等価物を二つ信用の良い金融機関。自分から2023年12月31日残高は1つは金融機関が$を超えた
金融商品の公正価値
現金および現金等価物、投資、売掛金、売掛金、その他の流動負債からなる金融商品については、その満期日が相対的に短いため、帳簿金額は公正価値の合理的な見積もりである。
会社はASCを採用した820, 価値の計量と開示を公正にして改正された後、金融資産と金融負債の公正価値の計量に関する。この基準によれば、公正価値は、計量日市場参加者間の秩序ある取引において資産を売却するか、または負債を移転させるために課金される価格(すなわち、“脱退価格”)として定義される。
この基準は,公正価値を計量する際に使用する投入のための階層構造を構築し,利用可能なときに最も観察可能な投入を使用することを要求することで,観察可能な投入を最大限に利用し,観察できない投入を最大限に削減する。観察可能な投入は、独立したソースから得られた市場データが資産または負債定価である場合に市場参加者が使用するという仮定を反映している。観察不可能な投入は、報告エンティティがこの場合に得られる最適な情報に基づいて策定された資産または負債の定価を反映する。公正価値階層構造は以下の部分からなる三つレベル:3
水平1ツール推定値は、同じ資産に関する活発な外国為替市場取引のリアルタイム見積から得られる。
水平2ツールの推定値は、比較可能なツールの既製価格源から得られる。
水平3金融商品の推定値は観察可能な市場価値なしに得られ、公正価値を決定するために高いレベルの判断が必要である。
資産または負債がどの種類の資産または負債に属するかを決定するには、重大な判断が必要である。会社はすべての報告期間でその階層開示状況を評価するだろう。いくつありますか違います。レベル間の移行1, 2あるいは…3年度までの公正価値階層2023年12月31日そして、そして2022それは.以下の表は、公正価値で会社総合貸借対照表に公正価値で経常的に記載されている資産と負債を示している違います。値はレベルに記録されている2またはレベル3はい2023年12月31日そして、そして2022.
公正な価値に応じて恒常的に計量された資産と負債
| 2023年12月31日 | レベル1 | 合計する | ||||||
| 資産: | ||||||||
| 現金等価物(1) | $ | $ | ||||||
| 合計する | $ | $ | ||||||
| 2022年12月31日 | レベル1 | 合計する | ||||||
| 資産: | ||||||||
| 現金等価物(1) | $ | $ | ||||||
| 投資する(2) | ||||||||
| 合計する | $ | $ | ||||||
(1)現金等価物、現在まで2023年12月31日と…2022以下の方面における会社の投資の公正価値を代表する二つ購入日に満期になった通貨市場口座とアメリカ国庫券三つ数ヶ月以下の時間です
(2)投資とは、会社が米国国庫券に投資する公正価値であり、これらの国庫券は購入日から満期となる三つ数ヶ月前1つは一年です。
1株当たり純損失
同年度までの1株当たり純損失2023年12月31日そして、そして2022純損失は期間内に発行された普通株の加重平均株式数を除く。同年度までの1株当たり純損失2023年12月31日そして、そして2022純損失を加重平均株式数で割るa)加重平均発行済み普通株式(
研究と開発費
研究と開発(“R&D”)コストは発生時に費用を計上する。研究開発費の主要な構成部分は会社の研究開発者に支払う給料と福祉、研究開発を行うG&A人員の給与支出、コンサルタントと会社を代表してある研究開発活動を行う実体に支払う費用、及び報告期間内に研究開発活動のための材料と用品を含む
臨床試験すべき項目
同社は以下の者による臨床試験活動の費用を計上し,支出しなければならない第三に双方は契約研究組織、サービスプロバイダと臨床試験地点と達成した合意に基づいて、単一研究の全ライフサイクル内に完成した仕事のパーセンテージを推定した。同社は,内部臨床者や外部サービスプロバイダとの試験やサービスの進展や完了段階,およびそのようなサービスに支払う取り決め費用の検討に基づいて計算すべき金額を推定している。試験に参加する臨床試験地点を構築する費用は直ちに研究開発費として支出される。患者がスクリーニング/試験に入ると、患者のスクリーニングと登録に関連する臨床試験地点の費用が積算される。
協力協定
会社とそのパートナーは協力協定の積極的な参加者であり、すべての当事者は重大なリスクとリターンに直面し、具体的には活動の技術と商業の成功度に依存する。提携協議で他の当事者に支払われた契約金および当社が特定の取引の主な参加者とされた場合に発生するコストは,毛数で研究開発費で確認した。印税と許可証支払いは稼いだものとして記録されている。
次の年度まで2023年12月31日そして、そして2022, 違います。一里塚に達しました違います。特許使用料は稼いでいるので、会社は確かに注釈ライセンスまたは特許使用料の支払いまたは支出。
許可協定
同社は様々な合意ライセンスがその製品や技術計画開発に使用されている技術を持っている。ライセンスには成功的なマイルストーン義務と未来の販売の特許権使用料が含まれている。次の年度まで2023年12月31日そして、そして2022, 違います。一里塚に達しました違います。特許使用料は稼いでいるので、会社は確かに注釈任意の許可または特許使用料は、任意の許可協定に従って支払うか、または計算されなければならない/支出される。
特許費用
当社は,総合経営報告書および全面赤字のうち,一般および行政支出の一部として,発行済み特許および特許出願に関するコストを支出し,法律,更新および出願費用に関するコストを含む。
所得税
当社は貸借対照法を用いて繰延所得税を会計処理し、その財務諸表で確認されたが財務諸表で確認された事件の予想される将来の税務結果について繰延所得税資産と負債を確認することを要求する注釈その課税所得額に反映された。ある税務負債を計算し、一時的な差と繰越によって生じるいくつかの繰延所得税資産の回収可能性を決定する際には、推定と判断が必要である。繰延所得税資産及び負債は、現行公布された税率計量を採用し、この税率は、当該等の税収資産及び負債の年間の有効課税所得額の実現又は決済に適用される。
当社はその繰延所得税資産が回収可能な所得税から現金化されたり、将来の課税所得額から回収される可能性を定期的に評価しています。当社ではどんな額でも注釈“もっと可能性がありますそうじゃない“これを実現するために、当社は繰延所得税資産を削減するために推定値を計上する準備をしている。もし会社が繰延税の純資産の全部または一部を確定したら注釈将来的に現金化が可能であれば、推定免税額の調整はこのような予想期間の収益に計上される。同様に、当社がその後、以前に非現金化不可能と判定された繰延所得税資産が現在現金化可能であると判定された場合、対応する推定支出が逆転され、その決定期間中の収益を調整することになる。
“国内収入コード”の章382そして383(“各節382そして383”)所有権変更後、純営業損失(“NOL”)の繰越と研究開発ポイントの使用を制限する。これまで会社は注釈1節主宰した382あるいは…383しかし、会社は今後数年間引き続き大量の株式を調達するため、会社は各部分を予定している382そして383会社が将来的にNOLと研究開発ポイントの使用を制限する。
ASC740, 所得税純営業損失、一時的差額、信用繰越を要求する税収利益が資産として記録されており、経営陣がこの実現可能性比を評価すればよいそうじゃないよ“将来の税金優遇の実現は、会社が繰越期間内に十分な課税収入を発生させる能力に依存する。当社はすでに繰延税金資産の現金化に関連するプラスと負の証拠を審査し、繰延税金資産と考えている注釈“もっと可能性がありますそうじゃない“実現が待たれる。そのため,会社は以下の日に全額推定手当を記入した2023年12月31日そして、そして2022それは.アメリカ連邦研究開発税は2016至れり尽くせり2019今後の期間中の賃金税の削減に用いられ、他の流動資産として入金される(年内に受け取る予定12月)は、会社の総合貸借対照表に載っています。当社はその撤回を支持する十分な証拠があるまで推定手当を維持するつもりです。同社は定期的にその税務状況を審査している。税収優遇を認めるためには,関連する税収状況がさらに可能でなければならないそうじゃない“検査を受ける時に支持します。確認された金額は通常最大の収益ですそうじゃない“決済待ちの時に現金になります。当社の政策は、所得税に関する利息と罰金を所得税支出として確認することです。ここ数年で2023年12月31日そして、そして2022その会社はできました注釈確認されていない税金優遇に関連した利息または処罰がありますか。
同社はアメリカ連邦、イリノイ州、カリフォルニア州の所得税を支払う必要がある。しかも、その会社はフランスとオーストラリアの現地税法の制約を受けている。各司法管区内の税収法規は関連税収法律法規の解釈に準じており、適用するには重大な判断が必要である。Monoparは最初の年に設立された有限責任会社です2014年12月そして統合して2015年12月16日同社は納税年度にアメリカ連邦,州,地方税務機関の税務検査を受けている2015通り抜ける2022.その会社はやった注釈現在の不確定な税収状況は大きく変化すると予想される2023年12月31日それは.同社は今年度までのアメリカ連邦と州納税申告書を提出する予定です2023年12月31日すべての管轄区域で提出締め切りを延長する前に。
株に基づく報酬
当社と従業員、非従業員取締役、コンサルタントとの間の株式報酬スケジュールは、公正価値法で計算され、これは、株式オプションおよび制限株式単位(“RSU”)の付与を含むすべての株式奨励に関連するコストの報酬支出を確認することを要求する。公正価値法は,付与日にオプション定価モデルを用いて株式に基づく支払奨励の公正価値を推定することを要求し,RSUであれば付与日の終値を推定する.
従業員,非従業員取締役およびコンサルタントに付与された株式ベースの報酬支出は,株式オプション付与当日のブラック·スコアーズオプション定価モデルから計算された関連ツールの公正価値に基づいて計算され,RSUに付与された当日の終値を用いて計算され,必要なサービス期間(すなわち帰属期間)内で直線原則で料金として確認される。適切な公正価値モデルと関連仮定を決定するには、未来の株価変動と予想条項を推定することを含む判断が必要である。付与株オプション2022,予想変動率は当社の過去による二つ-初公募から1年2019年12月18日通り抜ける2021年12月31日付与株オプション2023,予想変動率は当社の過去による三つ-初公募から1年2019年12月18日通り抜ける2022年12月31日没収にはこれまで知られていた没収のみが含まれており、当社は没収の歴史が限られていることによる没収を計算したためです。これまでに付与されたオプションの期待期限は簡略化手法を用いて推定されている.その会社は所有している注釈配当金を払ってやった注釈将来の帰属中に現金配当金が支払われ、それに応じて期待配当収益率がゼロになることが予想される。無リスク金利は、満期日と奨励予想期限が一致する米国債金利をもとにしている。
最近の会計公告
はい2023年10月FASBが発表した会計基準更新(“ASU”)2023-06, 開示を改善し、修正案を作成し、米国証券取引委員会の開示更新と簡略化イニシアティブに応答する。*米国証券取引委員会(米国証券取引委員会)は、ユーザが米国証券取引委員会の既存の開示に制約されるエンティティとそれらをより容易にすることができるように、様々な編纂テーマの開示および提示要件を明確にまたは改善することが予想されるいくつかの開示要件を組み込んでいる注釈従来はこれらの要求に制約され,編集中の要求を米国証券取引委員会の規定と一致させていた.各改正案の発効日は、米国証券取引委員会が当該関連開示をS規則から削除した日とするXあるいはS-K条例が施行され、事前採用が禁止される。他のすべてのエンティティに対して、修正案が発効します二つ数年後アリゾナ州立大学によると2023-06,会社に備考が増えた8-1株当たりの損失
注意事項3-投資
自分から2023年12月31日その会社は所有している二つ通貨市場口座と売却可能投資、契約期間は90日数または以下現金等価物に分類される日数は以下のとおりである
| 2023年12月31日まで | 原価基礎 | 未実現収益 | 公正価値を合計する | |||||||||
| アメリカ国庫券 | $ | $ | $ | |||||||||
| 貨幣市場口座 | ||||||||||||
| 合計する | $ | $ | $ | |||||||||
自分から2023年12月31日-いくつありますか
| 2022年12月31日まで | 原価基礎 | 未実現収益 | 公正価値を合計する | |||||||||
| アメリカ国庫券 | $ | $ | $ | |||||||||
| 貨幣市場口座 | ||||||||||||
| 合計する | $ | $ | $ | |||||||||
自分から2022年12月31日-いくつありますか
備考をご参照ください2会社が公正な価値計量に関するもっと多くの討論をする。
注意事項4-株の本
普通株式保有者は次の配当を受ける権利がある5月.合法的に使用可能な資金から取締役会によって発表される。今までのところ違います。配当金は既に発表された.会社解散·清算時には、普通株式保有者は、会社債権者に支払った後に残った会社純資産の中で比例して計算されたシェアを得る権利がある。普通株保有者には権利がある1つは1株当たりの取締役が取締役会メンバーに指名されたことと1つは株主に提出された他のすべての事項に対する1株当たり投票権。
当社の改訂及び再記載された会社登録証明書は当社の発行を許可します
普通株販売
開ける2022年4月20日当社はJones Tradingと新たな資本オンデマンド販売協定に調印し、この合意に基づき、Monopar5月.Monoparの普通株式は、時々、または販売エージェントまたは依頼者としてJones Tradingに提供され、販売される。開ける2022年4月20日同社は米国証券取引委員会に、協定に基づいてその普通株を時々提供し、売却することに関連した目論見書補充書類を提出し、総金額は最高$に達する
自分から2023年12月31日その会社はすでに完成しました
注意事項5-株インセンティブ計画
はい2016年4月当時会社の発行済み株の多数を占めていた会社の取締役会と株主はMonopar治療会社を承認しました2016改訂された株式インセンティブ計画(“計画”)は,会社に最高総額を付与することを許可する
年末までに年度を終える2023年12月31日会社計画管理委員会(非高級従業員及び顧問に関する)及び取締役会の承認を受けた会社報酬委員会(高級管理者及び非従業員取締役について)は、高級管理者、非高級従業員、非従業員取締役及びコンサルタントに購入のための総株式オプションを付与する
本計画によると、オプションを行使する際に発行される株式の1株当たりの権益は計画管理人が決定しなければならないが、1株当たりの権益は
この計画下の株式オプション活動は以下のとおりである
| 未完成オプション | ||||||||
| オプション制約を受けた株式数 | 加重平均行権値 | |||||||
| 2022年1月1日の残高 | $ | |||||||
| 授与する | ||||||||
| 没収される | ( | ) | ||||||
| 鍛えられた | ( | ) | ||||||
| 2022年12月31日の残高 | ||||||||
| 授与する(1) | ||||||||
| 没収される(2) | ( | ) | ||||||
| 鍛えられた | ||||||||
| 2023年12月31日の残高 | ||||||||
| 帰属していない未帰属オプションが付与される見通しだ(3) | ||||||||
(1)
(2)没収されたオプションは、従業員の離職に関連する未取得株および既得、期限切れ株を表す。
(3)没収には、没収の歴史が限られているため、当社は通常、没収発生時に計算されるため、これまで知られている没収のみが含まれると予想される。
現在までの未完了オプションの概要2023年12月31日以下のようになる
| 行権価格 | オプション制約を受けた未償還株式数 | 加重平均残契約期間(年) | 完全帰属および行使可能オプションの制限を受けた株式数 | 加重平均残契約期間(年) | ||||||||||||
| $0.001 - $5.00 | ||||||||||||||||
| $5.01 - $10.00 | ||||||||||||||||
| $10.01 - $15.00 | ||||||||||||||||
| $15.01 - $20.00 | ||||||||||||||||
この計画下の限定的な株式単位活動は以下のとおりである
| 限定株単位 | 加重平均付与日単位公正価値 | |||||||
| 2021年12月31日現在の未帰属残高 | $ | |||||||
| 授与する | ||||||||
| 既得 | ( | ) | ||||||
| 没収される | ( | ) | ||||||
| 2022年12月31日の未帰属残高 | ||||||||
| 授与する | ||||||||
| 既得 | ( | ) | ||||||
| 没収される | ||||||||
| 2023年12月31日の未帰属残高 | ||||||||
この計画に基づいて付与された株式オプションと公正価値は以下のとおりである
| 十二月三十一日までの年度 | ||||||||
| 2023 | 2022 | |||||||
| 付与された株式オプション | ||||||||
| 帰属株式の公正価値 | $ | $ | ||||||
はい2023年12月31日未償還既得株式オプションの総内在価値は$である
次の年度まで2023年12月31日そして、そして2022、会社は$を確認しました
注意事項6-関係者取引
自分から2023年12月31日,TACY Pharma,LLC(“TYY Pharma”),会社の初期投資家,実益を持つ
ありませんこの項で述べた関連側の報酬には、市場で計算された報酬、市場に基づく株式報酬および福祉、業績に基づくインセンティブボーナスに加えて、非従業員取締役には、市場で計算された取締役料金と、市場で計算された株式ベースの報酬が含まれる。当社は以下の個人を関連先としている:当社の取締役会メンバー2人もTATY Pharmaの管理メンバーである2023年12月31日それは.チャンドラー·D·ロビンソンは,会社連合創業者,最高経営責任者,普通株株主,TATY製薬会社の管理メンバー,前身有限責任会社の前マネージャー,CDR製薬会社のマネージャーおよびMonopar as a C社の取締役会メンバーである。マイケル·ブラウンはTATY Pharmaの管理メンバーです2019年2月1日使用違います。投票権)は,有限責任会社のMonoparの前管理メンバーとして,C社のMonoparの普通株主と取締役会メンバーとする.
注意事項7-所得税
ASC740, 所得税純営業損失、一時的差額、信用繰越を要求する税収利益が資産として記録されており、経営陣がこの実現可能性比を評価すればよいそうじゃないよ“将来の税金優遇の実現は、会社が繰越期間内に十分な課税収入を発生させる能力に依存する。当社はすでに繰延税金資産の現金化に関連するプラスと負の証拠を審査し、繰延税金資産と考えている注釈“もっと可能性がありますそうじゃない“実現が待たれる。推定手当は約#ドル増加した
年収所得税支給2023年12月31日そして、そして2022以下の内容を含む
| 12月31日まで | ||||||||
| 2023 | 2022 | |||||||
| 現在: | ||||||||
| 連邦制 | $ | $ | ||||||
| 状態.状態 | ||||||||
| 外国.外国 | ||||||||
| 総電流: | ||||||||
| 延期: | ||||||||
| 連邦制 | ||||||||
| 状態.状態 | ||||||||
| 外国.外国 | ||||||||
| 延期集計: | ||||||||
| 準備総額* | $ | $ | ||||||
*所得税準備金の総額は#ドル
有効税率と米国連邦税率との差額は以下のとおりである(単位:%):
| 12月31日まで | ||||||||
| 2023 | 2022 | |||||||
| 連邦所得税 | ||||||||
| 州所得税、連邦福祉の減少 | ||||||||
| 税金控除 | ||||||||
| 恒久的差異 | ( | ) | ( | ) | ||||
| 評価免除額を変更する | ( | ) | ( | ) | ||||
| 他にも | ( | ) | ||||||
| 有効税率割引 | ( | ) | ( | ) | ||||
繰延税金資産と負債には以下の内容が含まれる
| 12月31日まで | ||||||||
| 2023 | 2022 | |||||||
| 繰延税金資産: | ||||||||
| 純営業損失が繰り越す | $ | $ | ||||||
| 税金の繰り越しを免除する | ||||||||
| 株に基づく報酬 | ||||||||
| 無形資産基礎差異 | ||||||||
| 負債と準備金を計算すべきである | ||||||||
| 資本化研究と開発 | ||||||||
| 繰延税項目総資産 | ||||||||
| 推定免税額 | ( | ) | ( | ) | ||||
| 繰延税項目純資産 | $ | $ | ||||||
自分から2023年12月31日、会社が繰り越した連邦純営業損失総額は約$
自分から2023年12月31日その会社の連邦と州の税金は$として免除されています
“アメリカ税改正法案”1986会社の持分が変化する場合には、純営業繰越と研究開発ポイントの使用を制限する。会社の所有権が変更された場合、繰越や研究開発ポイントの使用が制限される可能性があります。その会社は所有している注釈これまで,純営業損失や研究開発信用利用研究が行われてきた。
当社はASCにより不確定税務頭寸を会計処理している740-10, “所得税における不確実性会計“ASC740-10申告表に出現する任意の不確定税務状況を確認、計量、列報、および開示するために、全面的なモードを規定する。会社の政策は所得税に関する罰金と利息支出を所得税支出に計上することである。
未確認税収割引の期初と期末金額の入金は以下の通り
| 2023 | 2022 | |||||||
| 不確定な税金優遇を始める | $ | $ | ||||||
| 本年度は増加する | ||||||||
| 前年--増加(減少) | ( | ) | ||||||
| 不確定な税金割引を終了する | $ | $ | ||||||
不確定税収残高に含まれています2023年12月31日はい$です
同社はアメリカ連邦、カリフォルニア州、イリノイ州の納税申告書を提出した。同社はカリフォルニア州の最低フランチャイズ税を払わなければなりません。すべての納税申告書は連邦と州税務当局の審査のために開放されます三つそして四ついかなる純営業損失の繰越または研究開発信用使用の日から計算した年度。また、ある外国での業務のため、当社は当該等の国の現地税法の管轄を受けなければならない。それにもかかわらず現在まで2023年12月31日これらの国の支出は些細なことで違います。材料税の当社への影響2023連結財務諸表。
開ける2017年12月22日“減税と雇用法案”2017(以下、“TCJA”と呼ぶ)が制定された。開ける2022年1月1日TCJAの条項が発効し,発生年度の研究開発コストを資本化し,納税者にこれらのコストを償却することを要求している5人年和15国内費用と海外費用はそれぞれ5年です。同社はTCJAの影響を評価し,第#節の税収目的のための研究と開発支出の処理に従うことで準備を行っている174.
注意事項8--1株当たりの損失
普通株の基本純損失と希釈後の1株当たり純損失は以下のように計算される
| 十二月三十一日までの年度 | ||||||||
| (単位:千、1株当たり純損失を除く) | 2023 | 2022 | ||||||
| 分子: | ||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| 分母: | ||||||||
| *加重平均発行済み普通株式、基本普通株式、および希釈普通株式 | ||||||||
| 普通株1株当たりの基本と償却純損失 | $ | ( | ) | $ | ( | ) | ||
| 1株当たり純損失を計上しない逆希釈潜在普通株等価物 | ||||||||
| 普通株購入株式オプション | ||||||||
| 未帰属限定株式単位 | ||||||||
注意事項9-約束およびまたは事項
許可、開発、協力協定
Xoma有限会社
MNPR開発で使用されているヒューマン技術についてXOMA株式会社との非独占ライセンス契約に基づいて−101,同社はXOMA株式会社に臨床、監督、販売マイルストーンを支払う義務があり、最高で$に達する
Onxeo S.A.
はい2016年6月同社はまた、フランスの上場会社Onxeo S.A.とMonoparに独占的選択権(全世界独占ベース)Validive(塩酸クロニジンフィルム;塩酸クロニジンMBT)を付与し、Lauriad接着剤技術に基づくクロニジン接着シートを付与する協定を結んだ。はい2017年9月MonoparはOnxeoからValidiveライセンスを取得する選択権を行使しており,価格は$である
賃貸借契約を経営する
その会社は現在その行政本部のために事務場所を借りています。住所は1000Skokie Blvdイリノイ州ウィルマット村にあり、価格は$
自分から2023年12月31日ASCに準拠842, 賃貸借証書Vtの..二つリースは、営業賃貸使用権(“ROU”)資産とリース負債として記録され、売掛金、売掛金及びその他の流動負債、並びに会社総合貸借対照表上の非流動経営賃貸負債に計上される。初期ROU資産および関連負債は、最低賃貸支払いの現在値に等しい。レンタルに隠れている金利が少なく確定しやすいため、当社は当社の信用品質と類似資産の借入金利を考慮して、逓増借入金金利を採用しています。ROU資産および関連リース負債を計算するための賃貸条項注釈延期オプションは含まれていますが、レンタル契約を終了するオプションが含まれています。経営リースのリースコストは予想リース期間内に直線的に確認し、会社の総合経営報告書と全面赤字に一般と行政費用を計上する。年間ROU資産の償却を開始する2022年4月1日そして2022年6月1日上には二つそれぞれレンタルを経営しています違います。純資産または賃貸負債は2021レンタル義務が少ないため1つは一年です。
レンタル料金の構成は以下のとおりである
| 十二月三十一日までの年度 | ||||||||
| 2023 | 2022 | |||||||
| 総賃貸コスト | $ | $ | ||||||
賃貸負債満期日2023年12月31日具体的には以下のとおりである
| 運営中です | ||||
| 財政年度 | 賃貸借証書 | |||
| 2024年12月31日 | $ | |||
| 賃貸支払総額 | ||||
| 差し引く:推定利息 | ( | ) | ||
| 2023年12月31日現在の賃貸総負債 | $ | |||
残りのレンタル債務は#年に支払います2024.
以下の表に、本報告に記載されている期間の純資産収益率および関連賃貸負債を計算するための加重平均残存賃貸期間と割引率を示す
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| レンタル期間: | ||||||||
| リース経営(年) | ||||||||
| 割引率: | ||||||||
| レンタルを経営する | % | % | ||||||
補足貸借対照表情報:
| 12月31日まで | ||||||||
| 2023 | 2022 | |||||||
| ROU資産-非流動 | $ | |||||||
| 総ROU資産 | $ | |||||||
| 賃貸負債を経営しています | $ | |||||||
| 賃貸負債を経営しています--非流動 | ||||||||
| リース負債総額を経営する | $ | |||||||
法律や事項がある
会社(The Company)5月.通常の業務過程で時々クレームと評価の影響を受ける違います。今まで、クレーム要求が提起された
賠償する
通常の業務過程において、会社は、各種陳述及び保証を含む契約及び協定を締結し、一般賠償を規定する。同社のこれらの合意の下でのリスクは不明であり,以下のクレームに関連しているからである5月.将来的に会社に告発されますがこれは注釈しかし作られましたこれまで会社は注釈いかなるクレームも支払われず、その賠償義務に関するいかなる行動も弁護されなかった。しかしその会社は5月.このような賠償義務に対する未来のクレームのため、未来の費用は記録されるだろう
ITSによると二番目改訂と重述された会社登録証明書、改訂と再記述された会社定款及び各高級職員と非従業員取締役との賠償協定に基づいて、当社は高級職員及び非従業員取締役が当社の要求に応じてこのような身分でサービスする期間中に、その高級職員及び非従業員取締役に対して賠償義務があるが、一定の制限を受けなければならない。あったことがある違います。今までの賠償請求。
注意事項10-後続の活動
自自一月一日至れり尽くせり2024年3月8日会社とJones Tradingの市場合意により、会社は売却した