
ユナイテッド 州
証券 と交換手数料
ワシントン、 ワシントンD.C. 20549さん
フォーム
| に基づく年次報告書 1934年の証券取引法のセクション13または15(D) |
にとって
終了した会計年度
| 移行 1934年の証券取引法のセクション13または15(D)に基づく報告 |
にとって __________から_________への移行期間
手数料
ファイル番号
(正確です 登録者の名前(憲章に明記されています)
(州またはその他の管轄区域) 法人または組織) |
(IRS) 雇用主 識別番号) |
| (住所 (主要な執行機関の) | (郵便番号 コード) |
登録者の
電話番号:
証券 法のセクション12 (b) に従って登録されました:
| タイトル 各クラスの | 取引 シンボル (s) | 名前 登録された取引所の | ||
| ザ・リクシ・
|
証券 法のセクション12(g)に従って登録されました:なし
示してください
証券法第405条で定義されているように、登録者が有名な経験豊富な発行者である場合は、チェックマークを付けてください。はい ☐
示してください
登録者が法の第13条または第15(d)条に従って報告を提出する必要がない場合は、チェックマークを付けてください。はい ☐
示してください
登録者(1)が、証券取引所のセクション13または15(d)で提出する必要のあるすべての報告を提出したかどうかをチェックマークしてください
過去12か月間の1934年の法律(または登録者がそのような報告を提出する必要があったほど短い期間)、および(2)
過去90日間、このような提出要件の対象となっています。はい ☐
示してください
登録者が、規則に従って提出する必要のあるすべてのインタラクティブデータファイルを電子的に提出したかどうかをチェックマークしてください
過去12か月間(または登録者がそのようなファイルを提出する必要があったほど短い期間)の規則S-Tの405です
示してください チェックマークを付けて、登録者が大規模なアクセラレーテッド・ファイラー、アクセラレーテッド・ファイラー、非アクセラレーテッド・ファイラー、または小規模なレポーティング・ファイラーのいずれであるかをチェックマークしてください 会社。「大規模アクセラレーテッドファイラー」、「アクセラレーテッドファイラー」、「小規模報告会社」の定義を参照してください 証券取引法の規則12b-2で。(1つチェックしてください):
| 大きいです アクセラレーテッドファイラー | ☐ | 加速しました ファイラー | ☐ | |
| ☒ | 小さい 報告会社 | |||
| 新興国 成長会社 |
もし
新興成長企業です。登録者がコンプライアンスのために延長された移行期間を使用しないことを選択した場合は、チェックマークで示してください
証券取引法のセクション13(a)に従って提供された、新規または改訂された財務会計基準と一緒に。
示してください
登録者が管理者の有効性評価に関する報告と証明を提出したかどうか、チェックマークを付けてください
登録者によるサーベンス・オクスリー法(15 U.S.C. 7262(b))のセクション404(b)に基づく財務報告に対する内部統制について
監査報告書を作成または発行した公認会計事務所。
もし
証券は法のセクション12(b)に従って登録されています。登録者の財務諸表かどうかをチェックマークで示してください
提出書類には、以前に発行された財務諸表の誤りの訂正が反映されています。
示してください それらの誤りの訂正が、インセンティブベースの報酬の回収分析を必要とする言い直しのものであるかどうか、チェックマークを付けてください §240.10D-1 (b) に基づく関連する回復期間中に、登録者の執行役員のいずれかが受領した。☐
示してください
登録者がシェル会社(証券取引法の規則12b-2で定義されている)であるかどうかをチェックマークしてください。はい ☐ いいえ
その
登録者の株式はどの取引所にも上場されておらず、
として 2024年3月28日の、ありました 発行済みで発行済みの会社の普通株式です。
テロミール 製薬株式会社
年次 フォーム10-Kのレポート
にとって 2023年12月31日に終了した会計年度
| テーブル 目次の | ||
| 将来の見通しに関する記述に関する注意事項 | 3 | |
| パート I | 5 | |
| アイテム 1。 | 事業内容の説明 | 5 |
| アイテム 1A。 | リスク要因 | 17 |
| アイテム 1B。 | 未解決のスタッフコメント | 42 |
| アイテム 1C。 | サイバーセキュリティ | 42 |
| アイテム 2。 | 物件の説明 | 42 |
| アイテム 3。 | 法的手続き | 42 |
| アイテム 4。 | 鉱山の安全に関する開示 | 42 |
| パート 2 | 43 | |
| アイテム 5。 | 普通株式市場および関連する株主問題 | 43 |
| アイテム 6。 | 選択した財務データ | 43 |
| アイテム 7。 | 経営陣による財政状態と経営成績に関する議論と分析 | 44 |
| アイテム 7A。 | 市場リスクに関する定量的・質的開示 | 50 |
| アイテム 8。 | 財務諸表 | 50 |
| アイテム 9。 | 会計と財務情報開示に関する会計士の変化と意見の相違 | 50 |
| アイテム 9A。 | 統制と手続き | 50 |
| アイテム 9B。 | その他の情報 | 51 |
| アイテム 9C。 | 検査を妨げる外国の管轄区域に関する開示 | 51 |
| パート 3 | 52 | |
| アイテム 10。 | 取締役、執行役員およびコーポレートガバナンス | 52 |
| アイテム 11。 | 役員報酬 | 58 |
| アイテム 12 | 特定の受益者の担保所有権、経営者および関連する株主に関する事項 | 65 |
| アイテム 13。 |
特定の関係および関連取引、および取締役の独立性 |
66 |
| アイテム 14。 | 主任会計士の費用とサービス | 68 |
| パート IV | 69 | |
| アイテム 15。 | 展示品、財務諸表スケジュール | 69 |
| 署名 | 70 | |
でない限り 本レポートでは「TELO」、つまり「会社」への言及は、別の方法で示しましたが、文脈上、 「私たち」、「私たち」、「私たち」、または同様の用語は、フロリダ州の企業であるテロミールファーマシューティカルズ社を指します。
| 2 |
注意深い 将来の見通しに関する記述に関するメモ
これ Form 10-Kの年次報告書には、将来の見通しに関する記述が含まれています(のセクション27Aで定義されているとおり) 改正された1933年の証券法、および改正された1934年の証券取引法(「取引法」)のセクション21Eは 現在の期待と将来の出来事に対する見解を反映してください。場合によっては、将来の見通しに関する記述を用語で識別できます たとえば、「かもしれない」、「する」、「すべき」、「期待」、「計画」、「予想する」などです。 「できた」、「意図する」、「ターゲット」、「プロジェクト」、「熟考する」、「信じる」、 「見積もり」、「予測」、「可能性」、「継続」、またはこれらの用語やその他の用語の否定語 似たような表現。特に、当社が事業を展開している市場に関する声明(当社の調査、成長に関する期待を含む) 私たちのさまざまな市場、そして私たちの期待、信念、計画、戦略、目標、見通し、前提条件、または将来の出来事や業績について この年次報告書の「リスク要因」、「経営陣による財務の議論と分析」という見出しに含まれています 「経営状況と業績」と「事業」は将来の見通しに関する記述です。
私たち これらの将来の見通しに関する記述は、現在の期待、仮定、見積もり、予測に基づいています。私たちはこれらを信じていますが 期待、仮定、見積もり、予測は合理的です。このような将来の見通しに関する記述は単なる予測であり、以下が含まれます 既知および未知のリスクと不確実性。その多くは私たちの制御が及ばないものです。これらおよびその他の重要な要素(説明したものを含む) この年次報告書の「リスク要因」、「経営陣の議論と財政状態の分析」という見出しで および「経営成績」と「業績」により、当社の実際の業績、業績、または業績が大きく異なる可能性があります これらの将来の見通しに関する記述によって明示または暗示される、または当社の株式に影響を与える可能性のある将来の結果、業績、または成果から 価格。実際の結果や出来事が将来の見通しで示されたものと大きく異なる原因となる可能性のある重要な要因 ステートメントには次のものが含まれますが、これらに限定されません。
| ● | 私たちの 当社の製品候補の規制当局の承認を得て維持する能力。 | |
| ● | 私たちの FDAの承認が得られれば、製品候補の商品化と販売を成功させる能力。 | |
| ● | 私たちの 第三者のサプライヤー、メーカー、その他のサービスプロバイダーと契約する能力、およびそれらのサプライヤーが適切に業務を遂行する能力。 | |
| ● | の 当社の製品候補の潜在的な市場規模、機会、成長可能性(FDAの承認があれば)。 |
| ● | 私たちの 当社の事業および開発活動のための追加資金を調達する能力。 | |
| ● | の 経費、資本要件、追加融資の必要性に関する見積もりの正確さ。 | |
| ● | の 当社の前臨床試験と臨床試験、および研究開発プログラムの開始、タイミング、進捗状況と結果 | |
| ● | の 規制当局への申請が予定されているタイミング。 | |
| ● | 私たちの 将来の経費、資本要件、追加資金の必要性 | |
| ● | 私たちの 主要な専門家の継続的なサービスを維持し、資格のある専門家をさらに発見、雇用、維持する能力。 | |
| ● | 私たちの 製品候補を臨床試験に進め、無事に完了する能力。 | |
| ● | 私たちの 適切な患者を私たちの臨床試験に募集して登録する能力。 | |
| ● | の 科学、臨床、規制、およびその他の製品開発に関するさまざまな目標が達成されるタイミングまたは可能性 | |
| ● | の 製品候補の価格設定と払い戻し(FDAの承認を受けた場合) |
| 3 |
| ● | の 当社の製品候補が市場で受け入れられる割合と度合い(FDAの承認を得た場合) | |
| ● | の 当社のビジネス、製品候補、テクノロジーに関するビジネスモデルと戦略計画の実施。 | |
| ● | の 当社の製品候補と技術を対象とする知的財産権について確立し、維持できる保護範囲 | |
| ● | 開発 競合他社や業界に関するものです。 | |
| ● | の 新型コロナウイルスの大流行や世界的に発生するその他のパンデミックを含む、主要な公衆衛生上の懸念の進展、および このような出来事が当社の事業運営と資金調達要件に及ぼす将来の影響。そして | |
| ● | その他の この年次報告書の「リスク要因」やその他の項目に記載されているリスクと要因。 |
与えられた この年次報告書に記載されているリスクと不確実性については、そのような将来の見通しに関する記述に過度に依存しないように注意してください。 この年次報告書に含まれる将来の見通しに関する記述は、将来の業績や当社の実際の経営成績を保証するものではありません。 財政状態、流動性、および当社が事業を展開する業界の発展は、将来の見通しとは大きく異なる可能性があります この年次報告書に含まれる声明。さらに、たとえ私たちの経営成績、財政状態と流動性、そして出来事が起こったとしても 私たちが事業を展開している業界では、この年次報告書に含まれる将来の見通しに関する記述と一致していますが、そうではないかもしれません 将来の業績や進展を予測できる。
任意です この年次報告書に記載されている将来の見通しに関する記述は、その記述の日付の時点でのみ述べられています。連邦政府によって義務付けられている場合を除きます 証券法、私たちは、以下のいずれかを更新または改正する義務、または更新または改訂を公表する義務を負いません この年次報告書の日付以降の、新しい情報、将来の出来事、またはその他の結果であるかどうかにかかわらず、将来の見通しに関する記述。
| 4 |
一部 私は
アイテム 1。ビジネスの説明
[概要]
私たち は、開発と商品化に焦点を当てた前臨床段階の製薬会社です テロミール-1、小説 小分子は経口剤として機能するように開発中です その場で ヒト幹細胞の治療法。に その場幹細胞療法は、体の天然資源を使って損傷した組織を再生し、細胞を新しい機能的なものに置き換えます 細胞。
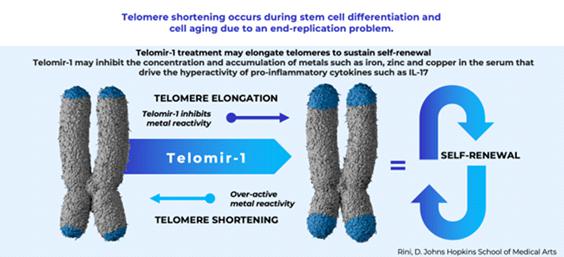
具体的には、 多能性幹細胞は、自己複製してさまざまな細胞タイプを生み出す能力を持つ幹細胞の一種です 体の組織の。将来の臨床試験で実証され、米国食品医薬品局(FDA)によって承認されれば、 また、TELOMIR-1はテロメアを伸ばして刺激することで幹細胞を保護し、幹細胞の自己再生を維持できると考えています。 テロメアは染色体の末端にある反復DNA配列で、染色体がほつれたり絡まったりするのを防ぎます。毎回 細胞は分裂し、テロメアは少し短くなり、やがてテロメアは短くなり、細胞は分裂できなくなります。 その結果、細胞が死んでしまいます。事実上、テロメアはプラスチックの先端のようにキャップを形成して染色体の末端を保護します 靴ひもについているので、細胞分裂中に染色体を適切に交換することができます。
ベースです これまでの前臨床研究で、最終的にFDAの承認が得られれば、TELOMIR-1は金属として役立つ可能性があると考えています 鉄、亜鉛、銅などの必須金属の酵素阻害剤。これらの必須金属は、加齢に伴う多くの炎症に関与しています 変形性関節症やヘモクロマトーシス(体が鉄分を過剰に吸収し、臓器に損傷を与える可能性がある状態)などの状態 と組織)、そして化学療法後の健康問題でも。前臨床研究に基づいて、TELOMIR-1には 加齢に伴う炎症に伴う鉄、亜鉛、銅などの金属の過負荷を減らすことで、その場で幹細胞を保護する可能性 インターロイキン-17(またはIL-17)などの炎症誘発性サイトカインの調節による状態や特定のがん。
私たちの 目標は、加齢に伴う潜在的な治療的介入として、米国でテロミール-1の臨床開発を進めることです 炎症状態。私たちの当初の開発計画は、その後のヘモクロマトーシスの潜在的な治療法としてテロミール-1を研究することでした 化学療法後の回復適応症によって。ヘモクロマトーシスの前臨床マウスモデルを定義して登録することができないためです 研究者のサイトでは、2024年3月に、変形性関節症をテロミール-1の主な適応症にすることに研究の焦点を移しました。私たちの研究 現在の計画では、2番目の適応症としてヘモクロマトーシスを含め、その後に化学療法後の回復が続きます。研究が進むにつれて、私たちは 必要と思われる場合や状況に応じて、さまざまな適応症を調べたり、適応症の焦点を移したりします。
テロミール-1 は、Telomor-1の治験薬申請(IND)の提出を目的として、現在前臨床試験中です。 FDAへ。承認されれば、人体臨床試験への移行が許可されます。特に、私たちはTELOMIR-1の可能性を研究しています 細胞の金属の全身的な不均衡を引き起こすIL-17によって誘発される炎症経路を遮断して予防します。私たちの調査によると TELOMIR-1は、用量依存的に金属イオンに選択的に結合し、酵素の反応性を遅くすることで、この結果を達成する可能性があります。 人間の染色体のテロメアの保護と伸長を行います。臨床試験で実証され、FDAによって承認され、同等のものであれば 外国の規制当局は、TELOMIR-1は非毒性の経口酵素阻害剤としての可能性を秘めており、過活動を抑制する可能性があると考えています 過剰な金属反応性によって引き起こされる酵素。
に 日付、私たちはTELOMIR-1に関するいくつかの前臨床試験を完了しました。これらの研究のいくつかは、それを実証するために設計されました TELOMIR-1は変異原性がなく、生物学的および金属結合能に優れています(図1)。使用します 「インシリコモデリング」は、人工知能主導の計算モデルを導入して化合物の治療薬を予測します 可能性、生物活性、毒性、私たちはテロミル-1の作用機序に可能性があるという証拠を探し続けています DNAの保護テロメアキャップを長くすることで、変形性関節症などの加齢に伴う症状を逆転させます。
| 5 |

グラフィック 1。テロミール1分子
私たち 私たちのために調査を行う第三者と協力しています。その1つが、ライフサイエンスによって設立されたInSilicoTrialsです。 サイバーセキュリティとデジタルイノベーションの専門家。インシリコデジタルシミュレーションを活用しています。このようなコラボレーションを通じて、私たちは専門化しています 人工知能とシミュレーションを活用して医薬品開発を強化しています。インシリコ技術を使用して、データを分析して予測します 潜在的な化合物の安全性と有効性。これは、効率的で費用対効果の高い研究開発の進歩だと私たちは信じています 後の臨床試験の適用範囲を最小限に抑える可能性があります。
に 幹細胞のその場治療法
ステム 細胞は自分自身を更新する可能性があります。幼少期から成人期にかけて、体内でさまざまな細胞型に発達する可能性があります。 多能性幹細胞には、成人の体のすべての細胞に分化する能力があります。多能性幹細胞は未分化なので、 それらには、特殊な機能を果たすための組織特有の特徴はありません。再生能力を考えると そして成人の体にある限られた量の幹細胞、 その場で 幹細胞の治療と保護は重要なことかもしれません 病気の治療のための治療メカニズム。
その 下のグラフは、TELOMIR-1刺激とそれに続く幹細胞の自己再生に続発するテロメアの伸長を示しています。前述のように、テロメア 自然な老化の過程で短くなります。最初の研究に基づいて、テロミール1は加齢に伴う遅延または逆転作用があると考えています テロメアの伸長による状態。
| 6 |
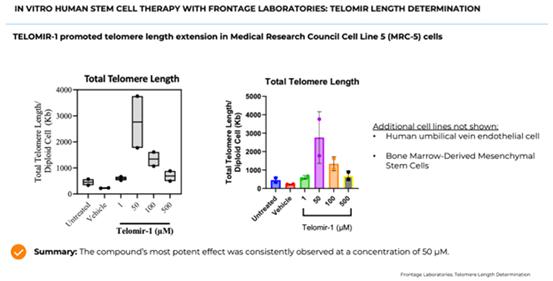
インビトロ フロンテージラボラトリーズによるヒト幹細胞療法:テロミールの長さ測定
を通して Frontage Laboratoriesとの調査研究では、ヒト細胞株中の体外ヒト幹細胞を調査しています。具体的には、私たちは フロンテージ・ラボラトリーズと協力して、次のことを行いました:
セル 行選択。テロメアとエイジングの研究への適性を強調した文献に基づいて、フロンテージは3つ買収しました 各幹細胞株用のバイアル:初代ヒト臍帯静脈内皮細胞、非不死化ヒト線維芽細胞、およびヒトBM由来 間葉系幹細胞株。次に、細胞を評価して、テロメアの長さと細胞再生能力を判断します。 以下に説明するように、増殖と細胞死の評価を行います。
テロメア 長さの決定。市販のqPCRキットを使用して、細胞の絶対テロメア長を治療および評価します。 細胞はさまざまな濃度のテロミール-1で処理され、その後、異なる時間間隔で採取され、その後 テロメアの長さ分析を受けます。
結果 フロンテージ・ラボラトリーズとの研究の詳細を下のグラフに示します。グラフは、50mMのTELOMIR-1の細長いテロメアを示しています 未処理細胞や車載細胞と比較してください。
| 7 |
私たちの 戦略
私たちの 目標は、TELOMIR-1を開発し、米国の規制当局の承認を得て、伸長を目的とした新しい治療選択肢として商品化することです 加齢に伴う炎症状態の治療のためのテロメア。最初の臨床の焦点は変形性関節症で、その後にヘモクロマトーシスが続きます。 その後、TELOMIR-1の開発を化学療法後の回復療法に拡大する予定です。私たちの戦略の重要な要素 この目標を達成するためには以下が含まれます:
| ● | 前進 TELOMIR-1は変形性関節症の臨床開発と承認を経ています。 変形性関節症 は障害の最も一般的な原因です。変形性関節症の治療法はありません。痛みは 投薬、治療、外科的処置によって軽減されます。私たちは、TELOMIR-1がそうかもしれないと信じています 変形性関節症の治療の機会です。
| |
| ● | 前進 TELOMIR-1はヘモクロマトーシスの臨床開発と承認を経ています。 当社の製品候補であるTELOMIR-1は前臨床段階にあります 研究。ヘモクロマトーシスの既存の治療選択肢には大きな制限があり、承認されれば、TELOMIR-1は 患者さんにとって治療上の大きな進歩です。 | |
| ● | 探検してください 化学療法後の回復におけるテロミール-1の可能性。 私たちは、TELOMIR-1がそうかもしれないと信じています 化学療法後の患者さんにとって、治療上の大きな進歩です。私たちの製品候補は、 TELOMIR-1は化学療法後の回復の可能性を秘めているかもしれません。 | |
| ● | TELOMIR-1の前臨床開発を続けています 細胞の老化に関連するさまざまな炎症性疾患にわたって。 テロメアキャップの再成長の影響を考えると 加齢に伴うさまざまな炎症性疾患について、私たちはテロミール1を信じているように、テロミール-1のより広い可能性を探るつもりです さまざまな代謝性疾患や老人関連疾患に関連する、いくつかの炎症性疾患に潜在する可能性があります。 | |
| ● | 探検します TELOMIR-1の価値を最大化するための戦略的コラボレーション。 私たちは、最大化するために、機会を見越してコラボレーションを検討する予定です テロミール-1の価値。私たちは、私たちのプログラムに対する重要な経済的および商業的権利を保持するつもりです。 |
変形性関節症 バックグラウンド
によると CDCによると、変形性関節症は関節炎の最も一般的な形態です。それを変性関節疾患または「摩耗」と呼ぶ人もいます 関節炎。手、腰、膝に最も頻繁に発生します。変形性関節症では、関節内の軟骨が壊れ始めます 下がると、下にある骨が変化し始めます。これらの変化は通常、ゆっくりと進行し、時間の経過とともに悪化します。変形性関節症の原因となる可能性があります 痛み、こわばり、腫れ。場合によっては、機能低下や障害の原因にもなります。主な影響を受ける関節には、手、膝、 ヒップ、ネック。変形性関節症のほとんどの患者は、軟部組織の損傷が進行するにつれて、関節に痛みとこわばりを感じることがよくあります。 通常の生活活動に参加する能力を制限します。IL-17は調節することで変形性関節症の進行を促進します 軟骨細胞のオートファジー、老化、軟骨基質の分解。
そこに は変形性関節症の治療法ではないので、医師は通常、変形性関節症の症状をさまざまな治療法で治療します。これには次のようなものがあります。 身体活動、筋力強化運動を伴う理学療法、減量、薬(市販の鎮痛剤を含む) 松葉杖や杖などの補助器具や手術(他の治療法が効果的でない場合は、通常は関節置換術)。
ヘモクロマトーシス 背景
によると CDCによると、ヘモクロマトーシスとは、皮膚、心臓、肝臓、膵臓、下垂体に鉄分が過剰に蓄積される疾患です。 とジョイント。この鉄分の過剰摂取は体に有害です。時間が経つにつれて、高濃度の鉄分は組織や臓器、鉛に損傷を与える可能性があります 肝障害、肝臓がん、心臓病、関節炎、糖尿病などの症状に。高鉄に関連するその他の条件 レベルには、炎症状態、慢性腎臓病、自己免疫疾患が含まれます。ヘモクロマトーシスは生涯続く病気です 薬理学的選択肢の乏しい長期にわたる重篤な影響を避けるための定期的な治療。ヘモクロマトーシスの最もよく使われる治療法は 静脈切開術、患者の血液の一部を取り除く手術です。静脈切開術は比較的安価で、広く受け入れられ、忍容性も良好です。 しかし、定期的に医療従事者の診察と採血が必要で、すべての患者に適しているとは限りません。
| 8 |
化学療法後 リカバリの背景
化学療法後 抗腫瘍治療の副作用からの回復は、がん治療の成功にとってしばしば重要です。化学療法治療中に がんに対して非常に効果的ですが、化学療法薬はがんと健康ながんの両方を破壊するため、多くの副作用を伴うこともあります 細胞。化学療法を受けている患者のための潜在的な補完療法として、TELOMIR-1の使用を検討する予定です 炎症誘発性サイトカインを抑制し、血中鉄濃度を低下させるため、1日2回の経口療法という形で、より多くの効果が得られる可能性があります 効果的な遵守と成果の向上。
前臨床 INDを可能にする研究
に 日付、下の表のように、実証を目的としたTELOMIR-1に関するいくつかのIND有効化研究を完了しました そのテロミール-1は無毒です。フロンテージ・ラボラトリーズとの調査研究も、新陳代謝とマキシマムの確立に役立ちました テロミール-1の許容用量(またはMTD)。
| タイプ 研究の | 種 (に ビトロ 研究) |
目的 | 結果 | |||
| 代謝産物 身分証明書 | CD-1 マウス、SD-ラット、ビーグル犬、カニクイザル、人間
|
に 種を超えたTELOMIR-1の代謝経路を調べます | テロミール-1 CYP酵素による代謝はほとんど/まったく示されませんでした。 | |||
| テロミール-1 肝臓S9を使った反応フェノタイピング | マウス、 ラット、サル、人間の肝臓 | 身分証明書 肝臓のS9画分を使ったTELOMIR-1の代謝に関与する酵素の | その 化合物はシトクロムP450酵素の基質ではないようです。ほとんど/まったくありませんでした 犬S9のテロミル-1の代謝、犬にアルデヒドオキシダーゼがないという事実と一致しています アクティビティ。
| |||
| シトクロム P450 (CYP) 反応のフェノタイピング | 人間 | に TELOMIR-1が薬物間相互作用の被害者になる可能性を評価してください
|
テロミール-1 マウス、ラット、サル、イヌ、そしてヒトの肝細胞で広範囲に代謝されました。 | |||
| シトクロム P450 (キプロス) 阻害 | 人間 | に テロミール1が加害者として薬物間相互作用を引き起こす可能性を評価してください
|
テロミール-1 (最大100 µM)は、試験したCYP酵素のいずれも阻害しませんでした。 | |||
| プラズマ タンパク質結合 | CD-1 マウス、SDラット、ビーグル犬、カニクイザル、人間
|
に 血漿中のテロミル-1の不結合分を知っています | ない たんぱく質結合が高い | |||
| 最大値 ラットを対象とした許容用量と7日間の反復投与毒性/トキシコキネティクスの研究 | スプレイグ ドーリー・ラッツさん | に TELOMIR-1の毒性動態と毒性を評価して特徴づけ、推定するには テロミール-1のMTD:
|
ザ・ 1日50、200、750 mg/kg/kgの用量レベルでテロミール-1を7日間繰り返し投与した後のMTDが測定されました 750 ミリグラム/キロ/日以上であること | |||
| 最大値 犬における耐用量と7日間の反復投与毒性/トキシコキネティクスの研究 | ビーグル 犬 | に TELOMIR-1の毒性動態と毒性を評価して特徴づけ、推定するには テロミールのMTD-
|
そこに 7.5までの治療関連の臨床観察、体重、臨床病理、解剖学的総病理所見はありませんでした ミリグラム/キロ/日。 | |||
| セーフティスクリーン 44 TM | N/A | に 酵素アッセイと放射性リガンド結合アッセイで、TELOMIR-1の活性を評価します | いいえ 重要な結果が注目されました |
私たち 犬とラットの変形性関節症研究を含む、TELOMIR-1の前臨床概念実証研究を計画しています。
すべて この年次報告書に記載されている前臨床研究は、フロンテージ・ラボラトリーズを含む第三者の支援を受けて実施されました ペンシルベニア州エクストンとイタリアのトリエステにあるInSilico Trials Technologies社の、それぞれを利用しています 人工知能主導のコンピューターインシリコ試験モデル。
| 9 |
私たちの 臨床開発計画
フォローしています 毒物学研究と前臨床概念実証研究を終えたら、前臨床開発プログラムに提出する予定です FDA、INDで、変形性関節症の治療薬としてTELOMIR-1の研究に焦点を当てています。ヘモクロマトーシスのための2番目のINDを検討します FDAのガイダンス付き。
私たちの 変形性関節症の治療薬としてTELOMIR-1を調査する最初のIND申請は、現在第1四半期に予定されています 2025年の。安全性、耐容性を評価するための第I相二重盲検無作為化プラセボ対照試験の実施がFDAに許可されれば、 40〜60人の健康な男性と女性の成人被験者におけるTELOMIR-1の薬物動態は、IND提出の約30日後に開始されます。
私たちの 2回目のIND申請は、ヘモクロマトーシスの治療薬としてのTELOMIR-1の研究に焦点を当てる可能性が高く、提出する予定です FDAの指導のもと。さらに、追加のガイダンスがあれば、化学療法後の回復を将来の候補として考えるかもしれません FDAから。
私たちの 臨床開発計画は、私たちのIND申請がFDAに承認されるかどうかにかかっています。必要に応じて、そしてとの話し合いのもと FDA、特定の申請および関連する臨床試験のスケジュールを定期的に調整することがあります。プロセスに注意することが重要です 臨床試験の実施が不確実で、私たちの臨床開発活動が計画どおりに進むという保証はありません 上記のタイムライン。
製造 の臨床開発活動用製品
国歌 インドに拠点を置く大手受託開発・製造組織であるBiosciencesは、大規模な合成装置を開発してきました。 私たちのためのプロトコルであり、私たちの前臨床および臨床開発活動に必要な量のTELOMIR-1を供給する予定です。私たちは 現在、TELOMIR-1を臨床試験用の固形経口剤形に製剤することについて、フロンテージ・ラボラトリーズと話し合っています。ダボス Pharmは、インドのAnthemと米国のTelomirの間の米国の仲介業者です。
市場 機会
テロミール-1、 承認されれば、最初は変形性関節症の市場で競争し、次にヘモクロマトーシスが続くと予想されます。TELOMIR-1は、承認されれば、 化学療法後の回復市場で二次的に競争する可能性。
ポテンシャル 変形性関節症の市場
として CDCによると、2022年には、米国では約3,250万人の成人、つまり人口の平均10%が変形性関節症を患っています。 患者数は2040年までに7,840万人に増加する見込みです。米国の人口が高齢化するにつれて、変形性関節症の負担が増えると予想されます 増加し、入院関連費用の5%〜6%を占めます。ほとんどの患者は、さまざまな薬理学を使用して症状を管理します そして、感じた痛みの重症度に応じた非薬理学的ツール。重症例とみなされる患者の約25%に対して(すなわち 痛みのスコアが10点満点中7点以上の場合、通常はコルチコステロイド、ヒアルロン酸から始めて、さまざまな医薬品の選択肢があります。 と処方強度の非ステロイド性抗炎症薬(またはNSAID)。市場 変形性関節症の治療薬は、患者1人あたり年間600〜800ドル、または年間費用配分で約195億ドルから260億ドルの価値があります NSAIDからステロイドまで、複数の医薬品にわたります。私たちは、TELOMIR-1が変形性関節症の新しい第一選択治療薬になることを目指しています。 そして、推定医療費市場で重要なシェアを競います。
| 10 |
ポテンシャル ヘモクロマトーシスの市場
患者 の変異したコピーが2つ付いています HFE 遺伝子(C282YとH63D)は、患者と並んでヘモクロマトーシスを発症するリスクが最も高くなります ヘモクロマトーシスの家族歴があります。その結果、米国では約1,300万人の患者がヘモクロマトーシスの変異を持っていますが 症状があるのはほんの一部で、すべての症状のある患者がヘモクロマトーシスを発症するわけではありません。平均して、約75万人の米国人の患者 鉄過剰症の症状を1つ以上表現します。ヘモクロマトーシスには2種類あり、患者構成は次のとおりです:150,000原発性ヘモクロマトーシス、 と65,000件の続発性ヘモクロマトーシスの確定診断が米国で確認されています。今日、15万人以上の患者が求めていると推定されています 2018年以降の治療で、ほとんどが静脈切開術、つまり血液を採取して鉄分を正常に戻す手術を受けています。
ポテンシャル 化学療法後の市場
患者 がんの種類に関係なく化学療法を受けることはリスクがあります。とはいえ、65歳以上の高齢患者はリスクが高くなります 消化器系の問題、睡眠と記憶の問題、疲労、体の痛みなど、化学療法後の副作用の発症について。その他のリスク要因 代謝状態の有無、化学療法薬の投与量、血球数、およびBMIを含みます。US CDCの健康データの推定値 米国では毎年65万人の患者が化学療法を受けており、45%が重篤な副作用を経験し、40%が中等度の副作用を経験しています 副作用。したがって、約158,000人の患者が、化学療法(抗腫瘍および免疫抑制)の副作用と診断されました 薬。現在、Neulastaは副作用の管理に役立つ「万能」療法として化学療法を受けている患者に投与されています。 Neulastaは通常、化学療法後に回復のために患者に投与されます。
競争
私たち 製薬会社、バイオテクノロジー企業、学術研究機関との競争の対象となっています。私たちのほぼすべて 競合他社は私たちよりもはるかに多くのリソースと経験を持っています。
テロミール-1 最初のターゲット適応症である変形性関節症と、潜在的な2番目のターゲット適応症であるヘモクロマトーシスで競合に直面します その後、化学療法後の回復が続きます。
に 変形性関節症、TELOMIR-1は、NSAID、コルチコステロイドなど、さまざまな薬理学的化合物との治療法として競合します。 ヒアルロン酸、オピオイド、幹細胞注射、血小板注射、栄養補助食品。現在のところ治療法は知られていないので、 変形性関節症の最前線の治療は疼痛管理ですが、一部の治療法は変形性関節症を逆転させることを目的としています。 は、私たちがTELOMIR-1の対象としているものです。
に ヘモクロマトーシスは、前述のように、現在の標準治療は静脈切開術で、通常、1回の地域訪問で80ドルから300ドルの費用がかかります 医療施設または血液銀行で無料で提供されています。過去の治療データに基づくと、静脈切開術はヘモクロマトーシスの95%以上に役立ちます この適応症に対してFDAが承認した治療法はないので、患者さんへ。静脈切開術を使用する患者は、次のことを考えると、引き続き採血術を受け入れます 臨床オプションがなく、利用しやすく、治療費が低い。ただし、このオプションは血友病患者には利用できません およびその他の血液疾患。患者の約5%は、ExjadeやJadenuなどの鉄キレート剤(および関連するジェネリック)で治療されています。 これらのオプションはより高価です。Exjadeは1日あたり532ドル、Jadenuは1日あたり517ドルです。最後の治療法の選択肢、デ?$#@$シロックス /IQVIAのクレームとスクリプトのデータによると、デフェロキサミンはわずか7,000人の患者(2018-2022年)に使用されました。治療のための将来の臨床オプション ヘモクロマトーシスは存在しますが、限定的です。たとえば、2つの分子は前臨床用、2つは第1フェーズ、1はフェーズ2、1はフェーズ3です 臨床試験。
| 11 |
に 化学療法後の回復ですが、現在の標準治療では、患者を減らすために設計された少量の化合物を処方します 副作用による不快感。処方薬の例としては、フィルグラスチム、ペグフィルグラスチム、サルグラモスティムなどがあります。これらの薬 皮下注射で健康な白血球と顆粒球の成長を刺激します。しかし、価格が高く、費用がかかる可能性があります 1回の注射あたり約4,000ドルから6,400ドルです。チロシンキナーゼ阻害薬のJakafiは、真性多血症に使用され、 移植片対宿主病。ジャカフィの価格は1本あたり16,200ドルで、卸売購入費用(WAC)の単価は270ドルです。したがって、 費用を考えると、リスクの高い患者のうち、スクリプトが渡されるのは一部のみです。これらは通常65歳以上の患者で、 免疫系が弱く、白血球数が少ない。このクラスの薬を使用する患者は、減らすために使用します 使用により発熱や痛みを感じたとしても、治療後の感染リスクがあります。競合他社の開発パイプライン 資産は堅調ですが、鉄欠乏症や血栓抑制などの特定の副作用を対象としています。
知識人 財産
私たち 知識人のMIRALOGX, LLC(「MIRALOGX」)から、人体への応用におけるテロミール-1の使用に関する米国特許権のライセンス供与を行っています 不動産開発と持株会社。ミラログスは8月に特許協力条約(PCT)、PCT/US2023/073106の出願を提出しました 29、2023年。申請は米国を指定し、米国の国内段階に入ります。申請書(承認され、支払いが必要な場合) 特許維持費のうち、米国では少なくとも2043年8月29日までの保護を提供します。TELOMIR-1の特許権 米国外は現在の特許権には含まれていません。
私たちの MIRALOGXからのライセンスは、2023年8月11日付けの当社間の修正および改訂された独占ライセンス契約に記載されています とMIRALOGXは、それに基づいて上記の特許権に基づく独占的な永久権とライセンスを取得しました。 人体用、前臨床試験、あらゆる種類の活動のために、米国で「ライセンス製品」を製造、使用、販売しています 規制当局の承認を得るか、人間が使用するための商品化を促進するために実施されました(「最初のMIRALOGXライセンス契約」)。 2023年11月10日、私たちとMIRALOGXは、以下に従い、修正および改訂されたライセンス契約の修正第1号を締結しました。 ライセンスに関連する使用分野は、動物の治療やその他の医療または健康用途を含むように修正されました。 人間に加えて、規制当局の承認取得を促進するために実施された関連する前臨床試験と活動 人間に加えて獣医の治療や用途の商品化(「MIRALOGX」の初期ライセンスとともに) 契約、「MIRALOGXライセンス契約」)。「ライセンス製品」は契約書では医薬品として定義されています 有効剤として2,4,6-トリス(3,4-ジヒドロ-2H-ピロール-2-イル)ピリジンまたは薬学的に許容される塩、エステル、または溶媒和物を含む そのうち。また、私たちには、ライセンスされた特許権に基づいて対応するサブライセンスを付与する権利もあります。MIRALOGXライセンス契約には以下が含まれます 当社または当社のサブライセンシーによるライセンス製品の純売上高に対する8%のロイヤリティ(四半期ごとに支払う)をMIRALOGXに支払うことと ロイヤリティを含まないマイルストーン収益について。ライセンス契約には、前払い、履行金、マイルストーン支払いはありません。さらに、 これまでのところ、契約に基づく支払いは行われていません。
政府 規制
その FDAおよび州および地方の管轄区域の同等の規制当局は、企業に実質的で負担の大きい要件を課しています 医薬品の臨床開発、製造、マーケティング、流通に関わっています。これらの機関やその他の連邦、州、 地域団体は、とりわけ、研究開発、試験、製造、品質管理、安全性、有効性を規制します。 ラベル付け、保管、記録管理、承認、広告と宣伝、流通、承認後の監視と報告、サンプリング そして私たちの創薬候補品の輸出入。
米国。 政府規制
に 米国では、FDAは連邦食品医薬品化粧品法(FDCA)とその施行規則に基づいて医薬品を規制しています。 規制当局の承認を得るプロセスと、それに続く適切な連邦、州、地方、および外国の法令の遵守 と規制にはかなりの時間と財源が必要です。適用される米国の要件に従わなかった 製品開発プロセス中、承認プロセス中、または承認後いつでも、申請者はさまざまな管理を受けることができます またはFDAによる保留中の新薬申請(NDA)の承認拒否、承認の撤回、強制などの司法上の制裁 臨床保留、警告書の発行、製品のリコール、製品の差し押さえ、生産または流通の全部または一部の停止、 差止命令、罰金、政府との契約の拒否、賠償、没収、または民事上または刑事上の罰則。
| 12 |
ザ・ 医薬品が米国で販売される前にFDAが要求する手続きには、通常、次のものが含まれます。
| ● | 完了 FDAの優良検査基準に準拠した前臨床検査試験、動物試験、製剤研究の (「GLP」) 規制; | |
| ● | 提出 IND申請をFDAに提出します。この申請は、人体臨床試験が開始される前に発効する必要があります。 | |
| ● | 承認 独立した機関審査委員会(「IRB」)が、各試験の開始前に各臨床現場で実施します。 | |
| ● | パフォーマンス 優良臨床基準(「GCP」)の要件に従った、適切で十分に管理された人体臨床試験の 各適応症について提案されている医薬品の安全性と有効性を確認すること。 | |
| ● | デモンストレーション 原薬と完成品がcGMPの条件下で製造され、アイデンティティ、強度に関して適用されるすべての基準を満たしていること、 品質と純度; | |
| ● | 提出 機密保持契約(NDA)のFDAへ。 | |
| ● | 満足です FDA諮問委員会審査の完了(該当する場合) |
| ● | 満足です コンプライアンスを評価するために、製品が生産されている1つまたは複数の製造施設に対するFDA検査の完了 cGMPの要件に従い、施設、方法、管理が医薬品の同一性を維持するのに適切であることを確認するために、 強度、品質、純度。 | |
| ● | FDA 商業マーケティングの前に、NDAのレビューと承認(FDA諮問委員会の意見の検討を含む) または米国での医薬品の販売。そして | |
| ● | コンプライアンス リスク評価および軽減戦略(「REMS」)を実施するための潜在的な要件を含む、承認後のあらゆる要件と一緒に または承認後の調査を行います。 |
前臨床 研究
変更前 医薬品または生物学的製剤候補をヒトで試験する場合、製品候補は厳格な前臨床試験を受ける必要があります。前臨床 開発段階には通常、医薬品の化学、製剤、安定性の実験室での評価と、評価のための研究が含まれます 動物への毒性、有害事象(「AE」)の可能性を評価し、場合によっては、その根拠を確立するため 治療上の使用。前臨床試験の実施は、GLP規制を含む連邦の規制と要件の対象となります 安全性/毒物学の研究。INDのスポンサーは、製造情報とともに前臨床試験の結果を提出しなければなりません。 分析データ、入手可能な臨床データまたは文献、および提案された臨床プロトコルを、INDの一部としてFDAに提出します。
アン INDは、研究用製品を出荷して人間に投与するためのFDAからの許可を求めるもので、許可されなければなりません 人体臨床試験が始まる前にFDAが手続きを進めることです。生殖に関する動物実験など、長期にわたる前臨床試験 AEと発がん性は、INDが提出された後も続く可能性があります。INDは、受領後30日で自動的に有効になります FDA。ただし、その前にFDAが提案されている1つ以上の臨床試験に関連して懸念や疑問を提起し、試験を実施する場合を除きます 臨床保留中です。このような場合、INDのスポンサーとFDAは、臨床試験を開始する前に未解決の懸念事項を解決しなければなりません。 その結果、INDを提出しても、FDAは臨床試験の開始を許可しない可能性があります。
| 13 |
臨床 トライアル
その 開発の臨床段階には、健康なボランティアまたは以下の患者に治験薬を投与することが含まれます 資格のある研究者、一般的には治験依頼者に雇用されていない、または治験依頼者の管理下にない医師を、以下に従って監督します GCP。これには、すべての研究患者があらゆる臨床への参加についてインフォームドコンセントを提供するという要件が含まれます 試用版。臨床試験は、とりわけ臨床試験の目的、投与手順を詳述したプロトコルの下で実施されます。 被験者の選択と除外基準、および被験者の安全性を監視し、有効性を評価するために使用するパラメーター。各プロトコルは、 およびその後の議定書の修正は、INDの一部としてFDAに提出する必要があります。さらに、各臨床試験は 個人へのリスクを確認するために、臨床試験が実施される各機関のIRBによる審査と承認を受けます 臨床試験への参加は最小限に抑えられ、期待される利益と比較して合理的です。IRBも承認しています 各臨床試験被験者またはその法定代理人に提出し、臨床を監視する必要があるインフォームドコンセントフォーム 完了するまで試用版です。進行中の臨床試験と完了した臨床試験結果の報告には要件もあります 公共のレジストリに。ほとんどの臨床試験に関する情報は、www.clinicaltrials.govで公開するために特定の期間内に提出する必要があります ウェブサイト。製品、患者数、調査段階、治験実施場所、治験責任医師およびその他の事項に関する情報 の臨床試験は、臨床試験の登録の一環として公開されます。スポンサーには結果を開示する義務もあります 完了後の臨床試験のこれらの試験の結果の開示は、場合によっては最大2年遅れることがあります トライアルの終了日以降。競合他社は、この公開情報を利用して、進捗状況に関する知識を得るかもしれません 開発プログラムの。
人間 臨床試験は通常、3つの連続した段階で行われ、重複したり組み合わされたりすることがあります。
| ● | フェーズ i 臨床試験は通常、最初に曝露された少数の健康なボランティアまたは病気に罹患した患者を対象としています 製品候補の単回投与、次に複数回投与。これらの臨床試験の主な目的は、代謝を評価することです。 薬理作用、副作用の耐容性と薬の安全性。 |
| ● | フェーズ II臨床試験では、病気に罹患した患者を対象に、望ましい効果を得るために必要な用量を決定するための研究が含まれます。で 同時に、安全性、およびさらなる薬物動態学的および薬力学的情報、起こりうる副作用と安全性が収集されます リスクが特定され、有効性の予備評価が行われます。 | |
| ● | フェーズ III臨床試験は通常、複数の施設で多数の患者を対象としており、必要なデータを提供するように設計されています 本来の用途における製品の有効性、使用中の安全性を実証し、全体的な利益/リスクを確定する 製品の関係と、製品承認の適切な根拠を提供してください。これらの試験にはプラセボとの比較が含まれる場合があります および/または他のコンパレータ処理。多くの場合、マーケティング中の製品の実際の使用を模倣して、治療期間が延長されます。 |
承認後 第IV相臨床試験と呼ばれることもある試験は、最初の市販承認後に実施される場合があります。これらの試験は 意図した治療適応症における患者の治療から、特に長期にわたる安全フォローのために、さらなる経験を積んでください アップ。場合によっては、FDAは、NDAまたは生物製剤の承認条件として、第IV相臨床試験の実施を義務付けることがあります。 ライセンス申請(「BLA」)。
進捗状況 臨床試験の結果を詳述した報告書は、少なくとも年に1回、重要な場合はもっと頻繁にFDAに提出する必要があります 有害事象(「SAE」)が発生します。FDAまたはスポンサーはいつでも臨床試験を中断または終了することができ、FDAは 研究対象の患者が容認できない健康状態にさらされているという発見など、さまざまな理由で他の制裁を課します リスク。同様に、IRBは、その機関での臨床試験が承認されていない場合、治験の承認を拒否、一時停止、または終了することができます IRBの要件に従って投与されている場合、または薬が患者に予期せぬ重大な危害をもたらした場合。
同時に 臨床試験では、企業は通常、追加の前臨床試験を完了し、それに関する追加情報も開発する必要があります 医薬品または生物学的製剤の物理的特性、および商業用製品の製造プロセスの最終決定 cGMP要件に準拠した数量。製造工程では、高品質のバッチを一貫して生産できなければなりません 製品候補について、そしてとりわけ、スポンサーはアイデンティティ、強み、品質、効力をテストする方法を開発しなければなりません。 そして最終的な生物学的製剤の純度。さらに、適切なパッケージを選択してテストし、安定性試験を行う必要があります 生物製剤候補がその有効期間にわたって容認できないほど劣化しないことを証明するために実施されました。
| 14 |
マーケティング 承認
仮定します 必要な臨床試験が無事に完了したこと、前臨床試験と臨床試験の結果、詳細とともに 製品の化学的性質、製造、管理、表示提案などに関する情報が提出されます 1つまたは複数の適応症を対象とした製品の販売承認を求めるNDAの一環として、FDAに。ほとんどの場合、の提出 NDAには多額の申請ユーザー料金がかかります。
その 審査プロセスは通常、NDAがFDAに提出された日から12か月かかります。FDAは予備審査を行います すべてのNDAは、提出後最初の60日以内に、提出前に実質的な審査を行うのに十分な完成度があるかどうかを判断します それらの「申請」を受け入れます。FDAは、NDAを提出する代わりに追加情報を要求することがあります。このイベントでは、 申請書は追加情報を添えて再提出する必要があり、追加の申請ユーザー料金がかかる場合があります。再送信されました また、申請はFDAが提出を承認する前に審査の対象となります。提出書類の提出が承認されると、FDAが手続きを開始します 詳細な実質的なレビュー。FDAはNDAを審査して、とりわけ、その薬が安全で効果的かどうか、また 製造、加工、包装、または保管されている施設は、製品の継続を保証するために設計された基準を満たしています 安全性、品質、純度。処方薬使用料法(PDUFA)で施行されている現在のガイドラインでは、FDAには目標があります 新しい分子の標準NDAの予備審査が完了してから10か月以内に提出書類を審査し、それに基づいて行動すること エンティティ。
その FDAは、薬の利点がリスクを上回ることを保証するために、REMS計画の提出を要求する場合もあります。REMSプランには以下が含まれる可能性があります 投薬ガイド、医師とのコミュニケーション計画、評価計画、および/または安全な使用を保証するための要素(制限付き配布など) 方法、患者登録、またはその他のリスク最小化ツール。
その FDAは新薬の申請を諮問委員会に付託することがあります。諮問委員会は、以下を含む独立した専門家の集まりです 臨床医やその他の科学専門家が、申請書を審査し、評価し、推奨を行います 承認されました、そしてどのような条件で。FDAは諮問委員会の勧告に拘束されませんが、そのような勧告を検討します 決断するときは慎重に。
変更前 NDAを承認すると、FDAは通常、製品が製造されている1つまたは複数の施設を検査します。FDAは承認しません 製造プロセスと施設がcGMP要件に準拠していて適切であると判断されない限り、申請書です 必要な仕様の範囲内で製品を一貫して生産するために。さらに、NDAを承認する前に、FDAは検査を行うことがあります GCP要件への準拠を保証するための1つ以上の臨床試験施設。
後 NDAとすべての関連情報(諮問委員会の勧告(ある場合)、および関連する検査報告書を評価します 製造施設や臨床試験施設では、FDAが承認書を発行したり、場合によっては完全な回答書を発行したりすることがあります。 完全な回答書には、通常、最終承認を得るために満たさなければならない特定の条件の記述が含まれています NDAであり、FDAが申請を再検討するために、追加の臨床試験または前臨床試験が必要になる場合があります。でも この追加情報を提出すると、最終的にFDAは申請が規制基準を満たしていないと判断する可能性があります 承認用です。これらの条件がFDAが満足できるほど満たされている場合、FDAは通常、承認書を発行します。 承認書は、特定の適応症に関する特定の処方情報を記載した医薬品の商業販売を許可します。
承認後 要件
薬 FDAの承認に従って製造または販売されるのは、以下を含むFDAによる広範囲かつ継続的な規制の対象となります。 その他、記録管理に関する要件、定期報告、製品のサンプリングと流通、広告とプロモーションに関する要件 と、製品に関する不利な経験の報告。承認後、新しい表示の追加など、承認された製品へのほとんどの変更 またはその他の表示に関する主張は、FDAの事前の審査と承認の対象となります。また、いずれの場合も、継続的な年間ユーザー料金要件があります 市販されている製品およびそのような製品が製造されている施設、および補足申請の新規申請料 臨床データと一緒に。
| 15 |
従業員 と人的資本資源
として 2024年3月15日現在、私たちには正社員1人、最高財務責任者、パートタイム従業員が8人いて、そのうち1人はパートタイムでした 従業員は研究開発に従事しています。当社の従業員はいずれも労働組合に代表されておらず、団体によってカバーされていません 交渉契約。私たちは、従業員との関係は満足のいくものだと考えています。さらに、私たちは請負業者のサービスを利用しています そして、私たちの組織のニーズをサポートしてくれる非常勤の外部コンサルタント。私たちは、できる限りチームを構築し続けることを期待しています 開発計画を効果的に実行してください。
リーガル 議事録
そこに 取締役、役員、またはそのような取締役や役員の仲間が不利な当事者となるような重要な訴訟ではありません 当社または当社の子会社に、または当社または当社の子会社に不利な重大な利害関係がある。監督はいないか 執行役員とは、破産申請をした、または破産した企業の取締役または執行役員です 過去10年間にそれに対して請願書が提出されました。現在の取締役や執行役員は刑事犯罪で有罪判決を受けたことはありません または過去10年間に係争中の刑事訴訟の対象となっています。現在の取締役や執行役員は対象になっていません 彼の関与を恒久的または一時的に禁止、禁止、一時停止、またはその他の方法で制限する裁判所の命令、判決、または判決について 過去10年間のあらゆる種類のビジネス、証券、銀行業務。現在の取締役や役員は見つかりませんでした 過去10年間に連邦または州の証券または商品法に違反した裁判所。時々、私たちの名前が付けられることがあります で、通常の業務過程で生じる請求。
私たち 私たちは、知的財産権を守るために多大な財源と経営資源を費やすことを期待しています 私たちの権利が侵害されたと私たちが信じるなら、未来。また、財務および管理に多額の費用を費やすと予想しています 当社の製品やサービスが第三者の知的財産権を侵害しているという申し立てを防ぐためのリソース。
コーポレーション 情報
私たち TELOMIR-1の開発と商業化を追求する目的で、2021年8月にフロリダ州の企業として組織されました 米国では人体への応用です。私たちはもともと「メタロセラピーズ株式会社」という名前で設立され、変わりました。 2022年10月に「テロミールファーマシューティカルズ株式会社」に社名を変更しました。
私たちの 本社は、メリーランド州ボルチモアのノースウルフストリート855番地、スイート601にあります。21205です。私たちの電話番号は (737) 289-0835です。
私たちの ウェブサイトのアドレスはwww.telomirpharma.comです。当社のウェブサイトに含まれている、または当社のウェブサイトからアクセスできる情報は、そうではないとみなされます この年次報告書に組み込まれるか、この年次報告書の一部になるか。私たちのウェブサイトに含まれる情報を考慮すべきではありません この年次報告書の一部になります。
| 16 |
アイテム 1A。リスク要因
リスク 要因
投資しています 私たちの普通株式は非常に投機的であり、高いリスクを伴います。 リスクを慎重に検討する必要があります そして、不確実性については後述します。この年次報告書の「経営陣の議論と財務分析」というタイトルのセクション 経営状況と業績」と、この年次報告書の他の部分に含まれる当社の財務諸表と関連メモ。その 私たちが直面しているのは、以下に説明するリスクと不確実性だけではありません。私たちが気付いていないその他のリスクや不確実性、または 現在重要ではないと考えていることも、私たちに影響を与える重要な要素になる可能性があります。次のリスクのいずれかが発生した場合、私たちの ビジネス、経営成績、見通しは重大な損なわれる可能性があります。その場合、当社の普通株の価格が下落する可能性があり、 投資の一部または全部を失う可能性があります。
重要 実際の結果や出来事が大きく異なる原因となる要因ですが、これらに限定されません。
| ● | 私たちの このオファリングからの純収入の使用。 | |
| ● | 私たちの 当社の製品候補の規制当局の承認を得て維持する能力。 | |
| ● | 私たちの FDAの承認が得られれば、製品候補の商品化と販売を成功させる能力。 | |
| ● | 私たちの 第三者のサプライヤー、メーカー、その他のサービスプロバイダーと契約する能力、およびそれらのサプライヤーが適切に業務を遂行する能力。 | |
| ● | の 当社の製品候補の潜在的な市場規模、機会、成長可能性(FDAの承認があれば)。 |
| ● | 私たちの 当社の事業および開発活動のための追加資金を調達する能力。 | |
| ● | の 経費、資本要件、追加融資の必要性に関する見積もりの正確さ。 | |
| ● | の 当社の前臨床試験と臨床試験、および研究開発プログラムの開始、タイミング、進捗状況と結果 | |
| ● | の 規制当局への申請が予定されているタイミング。 | |
| ● | の 当社の臨床試験のデータが入手可能になる時期。 | |
| ● | 私たちの 将来の費用、必要な資本、追加の資金調達の必要性、純収益が見込まれる期間 このオファーから、既存の現金および現金同等物と合わせて、当社の営業費用と資本を賄うのに十分です 支出要件; | |
| ● | 私たちの 主要な専門家の継続的なサービスを維持し、資格のある専門家をさらに発見、雇用、維持する能力。 | |
| ● | 私たちの 製品候補を臨床試験に進め、無事に完了する能力。 | |
| ● | 私たちの 適切な患者を私たちの臨床試験に募集して登録する能力。 | |
| ● | の 科学、臨床、規制、およびその他の製品開発に関するさまざまな目標が達成されるタイミングまたは可能性 | |
| ● | の 製品候補の価格設定と払い戻し(FDAの承認を受けた場合) |
| 17 |
| ● | の 当社の製品候補が市場で受け入れられる割合と度合い(FDAの承認を得た場合) | |
| ● | の 当社のビジネス、製品候補、テクノロジーに関するビジネスモデルと戦略計画の実施。 | |
| ● | の 当社の製品候補と技術を対象とする知的財産権について確立し、維持できる保護範囲 | |
| ● | 開発 競合他社や業界に関するものです。 | |
| ● | の 新型コロナウイルスの大流行や世界的に発生するその他のパンデミックを含む、主要な公衆衛生上の懸念の進展、および それとCOVID-19が当社の臨床試験、事業運営、資金調達要件に及ぼす将来の影響。そして | |
| ● | その他の この目論見書の「リスク要因」やその他の場所に記載されているリスクと要因。 |
リスク 私たちの知的財産に関連します
私たち 私たちにライセンスされている、またはライセンスされる予定のTELOMIR-1の権利によります。私たちはTELOMIR-1やその他の知的財産権を所有していません それに対する私たちの権利を失うと、私たちの製品を販売できなくなる可能性があります。
以内 現在および将来の治療パイプライン、TELOMIR-1は別の会社からライセンスされています。現在、私たちは知識人を所有していません このライセンスの基礎となる特許出願を含む財産権。TELOMIR-1を使用する私たちの権利は交渉の対象となります 本ライセンスの条項の、継続、遵守。したがって、非仮特許出願は私たちが書いたものではありません または私たちの弁護士、そして私たちは起草と起訴を制御できませんでした。特許権者と私たちのライセンサーは与えていないかもしれません これらの特許や出願の起草と審査には、私たちが所有していた場合と同じ注意を払っています 特許を出願し、起草を管理していました。ライセンスされた特許、出願、または特許の起草については確信が持てません ライセンサーによる訴追は、適用法規制に従って行われた、またはこれから行われた、または今後有効になる見込みです そして強制力のある特許やその他の知的財産権。この特許の起草、出願に対する統制の欠如と 申請や、ロイヤリティの支払いの違反、守秘義務違反などは、結果として生じる可能性があることのほんの一部にすぎません で、会社がライセンスを失い、事業を継続できなくなった。
重要な TELOMIR-1を行うには、追加の研究開発活動、前臨床試験、および/または臨床試験が必要です ライセンスや商品化のための実行可能な製品を手に入れるチャンスです。私たちのビジネスは現在、開発の成功に完全に依存しています。 規制当局の承認、および当社製品候補のライセンスまたは商品化。これらは決して実現しない可能性があります。
執行 当社のライセンス特許の出願や、これらの特許の無効を主張する請求の抗弁は、多くの場合、支配下にあります。 ライセンサーの協力。当社がライセンスしている知的財産の所有者および不利な立場にある知的財産の所有者に対して訴訟が提起される可能性があります このような法的措置の結果は、そのような企業や機関がライセンスを継続できなくなる可能性があるため、当社の事業に害を及ぼす可能性があります 事業運営に必要な知的財産。さらに、そのようなライセンサーは、そのような訴訟を次のような方法で解決することができます 利益は得られますが、テロミル-1を開発して商品化するための自由な運営能力に悪影響を及ぼします。
私たち 当社の製品候補や市場における当社独自の技術を十分に保護できない可能性があります。
私たちの 成功は、特許を取得し、企業秘密を保護し、所有権を侵害することなく事業を運営できるかどうかに一部かかっています 他人の権利。特許、企業秘密保護(ノウハウなど)、商標、ライセンス、機密保持の組み合わせに頼る場合があります 製品候補の知的財産を保護するための契約。製薬分野における特許の強みは 複雑で法的、科学的な質問で、不確かなこともあります。必要に応じて、私たちは自分たちの特定の側面について特許保護を求めます 製品と技術。しかし、天然に存在する化合物の特許保護は、取得、防御、 強制します。世界中の特許の出願、出願、弁護には法外な費用がかかるため、私たちの方針は 大きな商業的機会がある法域で商業的可能性を秘めた特許技術。しかし、特許保護 私たちが開発している製品や技術の一部では利用できない場合があります。保護に多大な時間とお金を費やす必要がある場合は、 当社の特許を弁護または行使したり、他者が保有する特許を中心に設計したり、ライセンス供与したりします。高額な費用がかかる可能性のある、特許、その他 他者が保有する所有権、当社の事業、経営成績、財政状態が損なわれる可能性があります。追加開発はできないかもしれません 特許性のある専有製品。
| 18 |
その 医薬品の特許ポジションは複雑で不確実です。私たちは特許を模索してきましたし、今後も特許を求めることを期待していますが 当社の候補製品、その使用方法、製造方法、それらの一部またはすべてに対する保護は、有効ではない場合があります 特許保護。当社の製品のいずれかが承認され、当社が特許を発行していない適応症向けに販売されている場合は、 当社の特許を利用して、競合他社が当社の市販製品のノーブランド版を非特許品向けに商品化することを防ぐことができます 表示が著しく損なわれたり、表示されなくなったりする可能性があります。
出版物 当社の製品候補に関連する情報のうち、当社または他の企業が、これらに関連する特許の取得または行使を妨げている可能性があります 製品と製品候補。さらに、他の人が独自に類似の製品を開発したり、当社の製品を複製したり、デザインしたりする場合があります。 私たちの特許権について。さらに、当社が発行した特許のいずれかが異議を申し立てられたり、無効または執行不能と宣言されたりする場合があります。失敗したら 私たちの知的財産を適切に保護するために、競争のためにジェネリック製品を作ろうとする企業との競争に直面する可能性があります 私たちの製品候補と一緒に。また、当社の製品とほぼ同じ製品を開発している企業との競争に直面する可能性もあります。 私たちのどの特許にもカバーされていない候補者。
たくさんの 企業は、外国の法域における知的財産権の保護、擁護、行使において重大な問題に直面しています。 特定の国、特に特定の発展途上国の法制度は、特許などの執行を支持していません 知的財産権、特に医薬品に関連するものは、侵害を阻止することを困難にする可能性があります 当社の特許について、または一般的に当社の所有権を侵害する競合製品のマーケティング。私たちの特許を行使するための手続き 外国の法域での権利は、多額の費用をもたらし、私たちの努力と注意が事業の他の側面からそらされる可能性があります。
現在、 私たちは、最初の製品を商業的に開発するために使用される知的財産や技術の権利を所有していません 候補者、テロミール-1。MIRALOGXは、によって設立された信託が所有する独立した知的財産開発会社です 会社の創設者はTELOMIR-1の特許権を保有しています。現在出願中の非仮特許で構成されています アプリケーション。非仮特許出願の発行を待つ間、私たちはMIRALOGXから独占的なライセンスを受けます 人間用および人間以外の用途向けに、米国でTELOMIR-1を開発し、商品化してください。ライセンスの期間はずっと続きます 最後に失効するライセンス特許の有効期限が切れる日、またはそれより遅い場合は、最後の戦略の有効期限が切れる日 ライセンス製品を対象とするパートナーシップ/サブライセンス契約。ライセンスされた特許権は2043年まで延長される予定です。 医薬品の規制審査の時期によっては、追加の特許条件を含め、追加の特許条件が付与される可能性があると予想しています。 製品。ライセンス契約では、前払い、実行料、マイルストーン支払いは必要ありません。さらに、支払いはありません 契約に基づいて現在までに作成されました。また、引き換えに純売上高または収益に対して 8% のロイヤリティを支払う必要があります 特許権の独占的かつ世界的なライセンス。また、そのライセンスに基づく当社の特許権を行使するために、自社の名前で訴訟を起こす場合があります 同意します。契約に基づく権利を行使できない場合、または当社の不正使用を検出できない場合 知的財産。TELOMIR-1の商業開発に使用されたライセンス権の恩恵を失う可能性があります。MIRALOGXが制御します テロミール-1の特許出願の審査です。
もし 第三者は、私たちの知的財産、製品、プロセス、または私たちが使用するその他のものが彼らの知的財産を侵害していると主張しています 不動産、当社の営業利益は悪影響を受ける可能性があります。
そこに は、米国内の特許権やその他の知的財産権に関する、米国内外のかなりの量の訴訟です 製薬業界。時々、特許、商標、著作権を侵害しているという申し立てが通知されることがあります。 または第三者が所有するその他の知的財産権、そして他の企業ができないような保証はできません。 将来、私たち、私たちの商業パートナー、または私たちがライセンスしている第三者の専有技術に対して、そのような侵害請求を提起してください。 特許権やその他の知的財産権を侵害していることが判明した場合、または以下に基づくライセンスの取得または更新に失敗した場合 第三者からの特許またはその他の知的財産権、または私たちが技術のライセンスを受けていた第三者が見つかった場合 他の第三者の特許権やその他の知的財産権を侵害すると、次のような損害賠償を求められることがあります。 発見または評価された損害額の最大3倍の損害賠償。侵害が故意であることが判明した場合は、特定の製品の製造を一時停止します 可能であれば、製品を再設計またはリブランドしてください。そうしないと、特定の新しい製品市場に参入できなくなる可能性があります。そのような主張は また、経営陣の注意と資源を守り、そらすために、費用と時間がかかることもあります。私たちの競争力 その結果、苦しむ可能性があります。さらに、有効な秘密保持契約または譲渡契約の締結を拒否または締結しなかった場合 どんな理由であれ、私たちが発明や知的財産を所有していない可能性があり、私たちの製品が十分に保護されていない可能性があります。したがって、私たちはできません 当社の製品候補またはその商品化が、第三者の知的財産権を侵害せず、今後も侵害しないことを保証します 財産。
| 19 |
私たち テロミール-1を人体に応用して米国で開発する権利のライセンスが付与されていますが、私たちは付与されていません 外国の法域におけるTELOMIR-1を対象とする特許の権利のライセンス。
私たち 米国でテロミール-1を開発する権利のライセンスが付与されていますが、米国以外の国では付与されていません。 MIRALOGXは米国外のすべての権利を保持しており、そのような権利を他の当事者にライセンスする場合があります。したがって、MIRALOGXは潜在的に 米国外のそのような管轄区域向けに競合製品を開発することができました。
リスク 当社の事業と財務状況に関連します
私たち 収益のない開発の初期段階の会社です。
として 前臨床医薬品の開発に焦点を当てた、非常に初期の開発段階の企業を、私たちは生み出しました 収益はなく、2023年12月31日と2022年12月31日現在、それぞれ1410万ドルと100万ドルの累積赤字があります。 私たちの開発プログラムを進めるために必要な十分な資金が事業やそれから生み出されるという保証はありません 資金は、負債やエクイティファイナンス、その他の潜在的な資金源など、外部資金源から入手できます。追加資本の不足 事業からキャッシュフローを生み出せない、または外部から資金を調達できないため、私たちは大幅に次のことを余儀なくされます 事業を縮小または停止すると、事業に重大な悪影響を及ぼします。さらに、保証はありません そのような必要な資金は、もしあれば、魅力的な条件で入手可能であること、または希薄化効果があまりないこと 既存の株主について。このような理由から、私たちが継続企業として存続できるかどうかについてはかなりの疑問があり、 継続企業としての当社の能力に関する説明文は、当社の独立会計報告書に記載されています 2023年12月31日に終了した会計年度の監査済み財務諸表に記載されています。
私たち 収益の増加を通じて、将来も継続企業であり続ける能力に影響を与える状況を克服するよう努めています 暫定的なキャッシュフロー不足は、追加のエクイティファイナンスとデットファイナンスを通じて対処されています。を通じて、追加の資金を調達することを期待しています 近い将来、私たちの事業運営を支援するための公的または私的資金調達、戦略的関係、またはその他の取り決め。ただし、 十分な金額の追加資本を求める契約を第三者から受けていない場合があります。そのような資金調達があるかどうかは定かではありません 許容できる条件で利用可能になるか、まったく利用できなくなります。必要なときに資金を調達しないと、事業を継続する能力が制限される可能性があります。 追加資金を獲得できるかどうかによって、継続企業として存続できるかどうかが決まります。追加資金を確保できなかった 適時かつ有利な条件で行うと、当社の財務実績、経営成績に重大な悪影響を及ぼします。 株価を設定し、事業の縮小または停止、資産の売却、破産による債権者からの保護を求めるよう要求します 手続き、またはその他。さらに、追加のエクイティファイナンスは、当社の普通株式保有者にとっては希薄化要因となる可能性があります。また、デットファイナンスも 可能であれば、追加の資金を調達するために、制限条項や戦略的関係を結ぶこともあり、必要な場合もあります 私たちが貴重な権利を放棄するということです。
なぜなら 当社の営業履歴は限られているため、当社の事業を正確に評価できない場合があります。
私たち これまでのところ業務は限られていました。したがって、投資のメリットを評価するための営業履歴は限られています 私たちの会社。私たちの株主は、新しい会社が通常直面する困難と高い失敗率を知っておくべきです そのような企業の。成功の可能性は、問題、費用、困難、合併症、そして 私たちが引き受ける予定の業務に関連して遅延が発生しました。これらの潜在的な問題には以下が含まれますが、これらに限定されません に、事業運営に十分なキャッシュフローを生み出す能力に関する予期せぬ問題、および追加費用と 現在の見積もりを超える可能性のある費用。当面の間、引き続き大きな損失が発生すると予想しています。私たちは認識しています 私たちの事業計画が効果を発揮しなければ、事業を継続することはできないということです。歴史はありません これに基づいて、私たちが成功する可能性についての仮定の基礎となるものですが、私たちが何らかの事業を生み出すかどうかは疑わしいです 収益を上げたり、収益性の高い事業を達成したりします。これらのリスクへの対処に失敗すると、私たちのビジネスは失敗する可能性が高くなります。
| 20 |
私たち 事業を継続するためには、追加の資金を調達する必要があります。
なぜなら 私たちは収益を上げておらず、現在は赤字で営業しています。私たちは資金調達の継続的な利用に完全に依存しています 事業を継続するために。私たちが事業を継続するのに十分な資金があるという保証はありません 将来利用できるようになります。
私たち 継続的な事業運営で持続可能なレベルを達成するために、事業計画のさらなる発展を完了するには、追加の資金が必要になります 収入から資金を調達することができます。私たちは、事業と初期の臨床開発に資金を提供するための十分なリソースが利用できることを期待しています 2024年の第4四半期半ばのプログラム。事業計画を完全に実施するには、さらなる資金が必要になります 成長計画の可能性を広げ、達成します。追加の資金調達が可能になるという保証や、可能であれば条件付きで利用できるという保証はありません それは私たちには受け入れられます。
私たちの 将来の資金調達に失敗したり、財務上のニーズを満たすレベルの収益を生み出せなかったりすると、事業を継続できなくなる可能性があります 継続企業として、そして私たちの事業の失敗として。
私たちの 業績は変動する可能性があり、顧客基盤を拡大し、持続可能な収益を確立する能力に悪影響を及ぼす可能性があります そして全体的に成功しています。
私たちの 経営成績は、さまざまな要因によって変動する可能性があり、その中には当社の制御が及ばないものもありますが、これらに限定されません に:
| ● | 将軍 私たちがサービスを販売し、事業を行っている地域や業界の経済状況、立法政策 私たちはサービスを販売し、事業を行っています。 | |
| ● | の お客様の予算上の制約。 | |
| ● | 成功 私たちの戦略的成長イニシアチブの。 | |
| ● | 費用 新規事業または買収事業の立ち上げまたは統合、当社、サプライヤーによる新製品の導入時期に関連する と競合他社、製品とサービスの組み合わせ、在庫状況、利用状況、価格。 | |
| ● | の 私たちの収入、人員、資産の混合(州別、国別)、金利または税率の変動、 | |
| ● | 変更します 会計規則の適用と適用、当社に適用される規則の変更、および訴訟事項。 |
として これらの要因の結果、私たちは事業が成功せず、廃業する可能性があります。
私たち 私はまだ利益を上げておらず、もしあったとしても、近い将来に利益を上げることはないでしょう。
私たち 私はまだ収益や利益を上げておらず、もしあったとしても、近い将来には生み出さないでしょう。できるかどうかは定かではありません 収益を上げるのに十分な収益を実現しています。さらに、競合他社の多くは、業界での存在感が大幅に高く、 収益の流れはあるが、まだ収益を上げていない。将来も継続企業として存続できるかどうかは、育てることにかかっています プラスの成果を上げるために、取引の資金調達、収益の増加、営業費用を収益水準以下に抑えることによる資本 キャッシュフロー、どれも保証できません。
| 21 |
確か の執行役員は、フルタイムで雇用されることはありません。
博士 当社の最高経営責任者で取締役会会長のクリストファー・チャップマンは、当社にフルタイムで雇用されることはありません 基礎。当社との雇用契約書に規定されているように、彼は必要に応じてパートタイムで働くことが期待されています。 彼は当社でフルタイムで働かないため、すぐに解決策を提供できない場合があります 私たちが事業を行う過程で発生し、ひいては事業に悪影響を及ぼす問題や懸念に対処します。さらに、 彼は自分の仕事時間の一部を他のビジネス活動に費やし、責任を負っている可能性があるため、利益相反の対象になる可能性があります 他の団体に。チャップマン博士は当社と適用法と方針に対する自分の義務と説明責任を認識していますが 企業機会や利益相反に関しては、そのような利益相反には、どれだけの時間を割くべきかの決定が含まれる場合があります 私たちの業務や、どのようなビジネスチャンスを私たちに提示すべきかについて。
確か の取締役および役員は、他社との立場を理由に、実際のまたは潜在的な利益相反を抱えている可能性があります。
博士 当社の最高経営責任者で取締役会会長のクリストファー・チャップマンは、引き続き取締役、社長を務めます。 そしてMyMDファーマシューティカルズ株式会社(「MyMD」)の最高医療責任者。チャップマン博士はMyMDの正社員ではありませんが、 彼らが他の会社での仕事に費やす時間が、その時間の長さに悪影響を与える可能性があります 彼らは私たちの会社の仕事に費やすことができます。これらの人物は、MyMDまたは以下を含む他の関連会社の株式を所有または取得することもあります。 普通株とそのような普通株を購入するためのオプション。MyMDでのそれぞれのポジション(該当する場合)、および任意の株式の所有権 またはMyMDまたは他の会社の株式報酬(該当する場合)は、利益相反を引き起こしたり、利益相反のように見えたりする可能性があります 個人は、MyMDに決定が私たちに与える影響とは異なる可能性のある決定に直面しています。
対立 私たちとMIRALOGXの間で興味深いものが生まれるかもしれません。
ミラログス TELOMIR-1の権利について非仮特許を出願しています。MIRALOGXは独立した知的財産開発会社です ベイ・ショア・トラストが所有しています。ベイ・ショア・トラストは、創設者のジョニー・R・ウィリアムズ・シニアとブライアン・マクナルティが設立した取消不能の信託です は受託者です。ベイショア・トラストは当社の筆頭株主でもあります。さらに、当社の元法務顧問兼取締役であるクリストスも ニコロウディスは、必要に応じて、彼の法律事務所であるクリストス・ニコルディスPLLCの法律事務所を通じて、MIRALOGXのコンサルティング業務を行っています。 基礎。私たちはMIRALOGXから、人間用および人間以外の用途向けにTELOMIR-1を米国で開発および商品化するための独占ライセンスを取得しています。 MIRALOGXの持分はベイ・ショア・トラストが 100% 所有しており、ウィリアムズ氏もニコルディス氏も役員ではありませんが またはMIRALOGXの取締役で、ウィリアムズ氏はベイ・ショア・トラストが保有する当社の株式に対する議決権または処分権を持っていません。 ベイショア・トラスト、ウィリアムズ氏、またはニコルディス氏との関係により、次のような対立が生じたり、対立が発生したりする可能性があります MIRALOGXにとっても、その決定が私たちにもたらす影響とは異なる可能性のある決定に直面したときの関心です。さらに、 私たちがMIRALOGXと締結しているライセンス契約に照らして、MIRALOGXと私たちの間で私たちの過去に関連して紛争が生じた場合 またはMIRALOGXとの将来の関係、または知的財産問題に関して、これらの潜在的な利益相反が発生する可能性があります そのような紛争を好意的に解決することは私たちにとってより困難です。
リスク 私たちのビジネスと業界に関連して
私たちの 将来の成功は、TELOMIR-1の成功と将来の製品候補の成功に大きく依存します。その開発にはかなりの時間がかかります 資本資源と長年の臨床開発努力。
私たち 現在、医薬品は市場に出ておらず、私たちの医薬品開発プロジェクトはすべて前臨床開発段階にあります。私たちの ビジネスは、前臨床および臨床開発、FDA規制当局の承認、および商品化の成功にほぼ完全に依存しています 当社の製品候補の、主にTELOMIR-1です。当社の株主は、以下を含む多額の追加投資について知っておく必要があります。 許可される前に、前臨床および臨床開発、およびFDA規制への提出と承認の取り組みが必要になります もしあれば、臨床研究を行い、製品候補を売り込み、商品化します。私たちが始めるには数年かかるかもしれません 臨床試験、もしあれば。すべての臨床試験は、多数の政府当局による広範囲かつ厳格な審査と規制の対象となります。 承認されれば、製品候補を販売する予定の米国およびその他の管轄区域で。規制を受ける前に 当社の製品候補のいずれかの承認には、前臨床試験と臨床試験を通じて、その製品候補であることを証明する必要があります 特定の用途には安全で効果的です。このプロセスには何年もかかることがあり、市販後の調査やサーベイランスが含まれることもあります。 それには相当な資源の支出が必要になります。米国で承認待ちに開発中の多数の医薬品のうち 米国(および世界の他の地域)では、資金へのFDA規制承認融資を無事に完了できるのはごくわずかです 私たちが計画している研究、開発、臨床プログラムでは、どの製品候補も成功する保証はありません。 開発または商品化。
| 22 |
私たち 製品候補の一部またはすべてを策定またはスケールアップできない場合があります。どの製品候補もその保証はありません 製品の安定性、含有量の均一性に関するFDAの基準を満たす方法で製造または製造される、または製造できる および米国およびその他の市場での製品承認に必要なその他すべての基準。私たちの製品候補はどれも失敗する可能性があります 臨床試験で指定されたエンドポイントを達成するために。
さらに、 製品候補は、臨床試験で指定されたエンドポイントを達成したとしても、承認されない場合があります。FDAは私たちと意見が合わないかもしれません 治験のデザインと臨床試験のデータの当社による解釈、または審査後も承認要件が変更される場合があります そして、私たちの臨床試験のデザインについてコメントしました。FDAは、私たちが要求するよりも少ない適応症や限定的な適応症の薬を承認する場合もあります または、費用のかかる承認後の臨床試験(つまり、第IV相試験)の実施を条件として承認を与える場合があります。さらに、 FDAは、当社製品の商品化を成功させるために必要または望ましいと当社が考える表示表示の主張を承認しない場合があります 候補者。
もし 私たちは、予想されるスケジュール内にパイプラインを拡張し、製品候補の規制当局の承認を得ることができません。 私たちのビジネス戦略を効果的に実行することができず、収益を大幅に増やす能力は限られています。 当社の長期的な事業、経営成績、財政状態、および見通しに重大な悪影響を及ぼす可能性があります。
私たち は、現在および将来の製品候補に依存しています。その中には、規制当局の承認を受けていないか、商品化が成功しないものもあります。
私たちの 私たちの計画を進める能力は、私たちが臨床的に開発し、規制当局の承認を得て、最終的に商品化する能力にかかっています。 私たちの製品候補です。製品候補をうまく商品化できるかどうかは、とりわけ私たちの能力にかかっています。 に:
| ● | 完了しました 研究を進めることができるような前臨床研究やその他の非臨床研究や臨床試験 | |
| ● | 受け取ります FDAからのIND承認と規制当局の承認。 | |
| ● | 農産物、 FDAを含む規制当局によって十分に検査および承認された製造施設で、検証済みのプロセスを通じて 商品化を成功させるための製品候補を大量に用意しています。 | |
| ● | 取得します 政府の医療プログラムや保険会社などの支払者からの償還を受け、商業的に魅力的なレベルを達成しています 価格設定の; | |
| ● | 安全です 医師、医療保険者、患者、医学界からの製品候補の受け入れ。 | |
| ● | 作成する 当社の製品候補を取り巻く積極的な宣伝。 | |
| ● | 管理します 臨床試験と商業化により費用と経費が増加するにつれて、私たちの支出も増えます。そして | |
| ● | 取得します そして、製品候補に十分な知的財産権を行使してください。 |
| 23 |
私たちの 上記の要因のいずれかに関する故障または遅延は、当社の事業、経営成績に重大な悪影響を及ぼす可能性があります と財政状態。
結果 の前臨床研究とそれ以前の臨床試験は、必ずしも将来の結果を予測する指標ではありません。
任意です 製品候補の将来の前臨床試験や将来の臨床試験で得られた肯定的な結果は、必ずしもそうとは限りません フェーズ I、フェーズ II、フェーズ III の臨床試験の結果を予測できます。さらに、導き出された結果の解釈は 臨床データから、または前臨床データに基づく結論から、不正確であることが判明する可能性があります。頻繁に、製薬とバイオテクノロジー 前臨床試験と初期段階で肯定的な結果が得られた後、企業は臨床試験で大きな挫折を経験しました 臨床試験を行っていますが、同様の失敗に直面しないかどうかは定かではありません。これらの失敗は、前臨床という事実が原因である可能性があります と臨床データはさまざまな解釈や分析の影響を受けやすいです。さらに、特定の製品候補は満足のいく性能を発揮する可能性があります 前臨床研究や臨床試験に使われていますが、それでもFDAの承認や適切な承認を得ることができません 他の国の規制当局。製品候補の臨床試験で肯定的な結果が得られなかった場合は、 開発スケジュール、規制当局の承認、商品化の見通し、ひいては当社の事業と財務 見込み客は、重大な悪影響を受けます。
私たち マーケティングの経験は限られており、現時点では営業部隊の設立や流通、および償還の予定はありません 機能があり、将来承認された場合、製品候補をうまく商品化できない可能性があります。
私たちの 収益を生み出すことができるかどうかは、最終的には、承認された製品を販売し、適切な第三者からの償還を確保できるかどうかにかかっています。 現在、製品のマーケティングと販売の経験は限られています。現在、販売が承認されている製品はありません 米国またはその他の国。
その 製品候補の商業的成功は、当面の間は起こらず、他にも多くの要因に左右されます 医師が当社の製品を患者に処方する意欲、支払者の意思と能力を含む、当社の統制 薬の支払い、達成された価格水準、私たちの薬に対する患者の反応、そして私たちのマーケティングパートナーの能力 売り上げを伸ばします。人材、システム、取り決め、能力を確立または維持できるという保証はありません TELOMIR-1または将来FDAによって承認された製品候補の商品化を成功させるために必要です。確立に失敗したら または、成功したマーケティング、販売、および償還能力を維持するか、第三者とのマーケティング契約をうまく締結できない 当事者にとっては、当社の製品収益が損なわれる可能性があります。
私たち 将来、組織の規模と複雑さをさらに拡大する必要があり、管理が困難になる可能性があります 私たちの成長と成長戦略の実行。
私たちの 現在実施されている経営陣や人員、システム、施設は、当社の事業計画や将来の成長をサポートするには不十分かもしれません。 その結果、組織の特定の分野をさらに拡大する必要があるかもしれません。
私たちの 事業運営、成長、さまざまなプロジェクトを効果的に管理するには、次のことが必要です。
| ● | 続けます 当社の運営、財務、管理、規制のコンプライアンス管理および報告システムと手順を改善するため。 | |
| ● | 引き付ける そして、十分な数の有能な従業員を維持してください。 | |
| ● | 管理します 私たちの臨床試験は効果的に。 |
| ● | 管理します 委託研究機関との外部製造業務を効果的かつ費用対効果の高い方法で行っています。 | |
| ● | 管理します 請負業者やその他の第三者との契約上の義務を果たしながら、効果的に開発努力をしています。そして |
| 24 |
に さらに、パートタイムの外部コンサルタントや請負業者のサービスを利用して、タスクを含むいくつかのタスクを代行する場合があります。 コンプライアンスプログラム、臨床試験管理、規制業務、製剤開発、その他の医薬品開発機能に関連しています。 私たちの成長戦略では、今後、これらのタスクやその他のタスクを実行するために、コンサルタントや請負業者の利用を拡大することが必要になるかもしれません。もし 新しい従業員を雇用し、コンサルタントや請負業者の利用を拡大しても、組織を効果的に拡大することはできません。 計画した研究、開発、製造を効果的に実行するために必要なタスクを正常に実行できない場合があります。 と商品化活動、したがって私たちの研究、開発、商品化の目標を達成できない可能性があります。
私たち 多くの場合、私たちよりも優れたリソースと経験を持つ企業からの激しい競争に直面することが予想されます。
その 医薬品や医薬品の開発と商品化は非常に競争が激しいです。私たちはさまざまな多国籍製薬会社と競争しています 企業やバイオテクノロジー専門企業、大学やその他の研究機関によって開発されている製品やプロセス 機関。競合他社の多くは、競合する可能性のある医薬品やプロセスを開発した、開発中、または開発する予定です 私たちの医薬品候補です。競合製品には、医薬品規制当局によってすでに承認され、医療機関で承認されている製品が含まれます コミュニティと市場に参入する可能性のある新製品。一部の医薬品開発プログラム/関心分野、その他の治療について オプションまたは製品は現在入手可能で開発中であり、将来市販される可能性があります。私たちの製品のいずれかなら 候補者は、私たちが現在研究している疾患や症状に当てはまると承認されています。さまざまな医薬品や治療薬と競合する可能性があります 開発中の治療法、将来開発される治療法、または現在市販されている治療法。
設立 企業は、その規模と経験、財源、および制度的ネットワークにより、私たちよりも競争上の優位性を持っている可能性があります。 競合他社の多くは、私たちよりもはるかに多くの財務、技術、人的資源を持っている可能性があります。これらの要因により、私たちの 競合他社は、承認された医薬品のマーケティングにおいて優位に立つ可能性があり、その前に医薬品候補の規制当局の承認を得る可能性があります 私たちはできます。そのため、医薬品候補を開発または商品化する能力が制限される可能性があります。競合他社も医薬品を開発したり 私たちのものよりも安全で、効果的で、広く使われていて、安価な薬。これらの利点は、当社に重大な影響を与える可能性があります 製品候補をうまく開発し、承認されれば商品化する能力。さらに、これらの競合他社の中には 買収したり、自社や第三者と協力関係を築いて、迅速に利益を得る能力を高めたりします 市場シェア。
ビジネス 中断すると、製品候補の開発が遅れ、製品の販売が中断される可能性があります。
私たちの 研究開発活動は、外部の請負業者やメーカーを通じて行われます。受託製造の喪失 火災、盗難、その他の原因による施設、保管在庫、実験施設、または原材料の紛失により、 製品開発活動を継続し、事業を遂行する能力に悪影響を及ぼします。パートナーへの供給の失敗 商用製品を使用すると、パートナーが製品供給の責任を引き継ぐ権利など、悪影響が生じる可能性があります。 現在、このような事業中断を補償する保険はありません。私たちの委託製造業者とサプライヤー それを別々の事業で提供してください。しかし、そのような補償は、私たちへの損害を全額補償するには不十分であることが判明するかもしれません それらの施設への重大な物的損失または死傷者損失に起因する事業。
私たち 流動性のニーズが非常に高まっており、追加の資金が必要になる場合があります。
私たちの 事業は創業以来かなりの金額の現金を消費してきました。2023年12月31日に終了した年度について、純営業を報告しました 390万ドルのキャッシュアウトフローと390万ドルの財務活動からの純キャッシュインフロー。2022年12月31日に終了した年度については、 営業純キャッシュアウトフローは50万ドル、投資活動からの純キャッシュインフローは50万ドルと報告されています。
リサーチ 開発費、一般管理費、運営に使用される現金は引き続き大幅に増加し、増加する可能性があります 新しい研究開発イニシアチブや継続的な製品商品化の取り組みに関連して、実質的には将来的にそうです。 事業資金を調達したり、規制当局の承認を得るために臨床試験を継続したりするために、追加の資金を調達する必要があるかもしれません マーケティングへの応用、および当社製品の商品化への資金提供。
| 25 |
その 将来の資金調達要件の金額と時期は、以下を含むがこれらに限定されない多くの要因によって決まります。
| ● | FDAの承認のタイミング(ある場合)、および国際市場での製品候補の承認のタイミング(もしあれば)。 | |
| ● | 当社製品の販売による収入、または助成金やその他の資金源からの収入の時期と金額。 | |
| ● | 臨床試験やその他の製品開発プログラムの進捗率と費用。 | |
| ● | 販売、マーケティング、流通機能の確立またはアウトソーシングの費用 | |
| ● | 拡張された社内製造施設、および製品候補の外部委託された商業製造供給契約の費用と完成時期。 | |
| ● | 当社の製品候補に関連する特許請求やその他の知的財産権の申請、訴訟、弁護、執行にかかる費用。 | |
| ● | 競合する技術開発や市場開発の影響。 | |
| ● | 人員、施設、設備の要件。そして | |
| ● | 当社が締結する可能性のある追加のコラボレーション、ライセンス、共同プロモーション、またはその他の取り決めの条件とタイミング。 |
一方 私たちは、既存の現金残高、事業による将来のキャッシュフローなど、いくつかの資金源から将来の資本要件を賄うことを期待しています および株式公開による収益については、これらの資金源のいずれかが有利な条件で利用可能であることを保証することはできません。 またはまったく。さらに、上記のすべての資金源から資金を調達できたとしても、調達した金額が私たちの将来を賄うのに十分ではない可能性があります 資本要件。
運営しています 結果は将来の期間で大きく変わる可能性があります。
私たちの 経費と経営成績は過去に変動しており、当社の収益、経費、業績も変動する可能性があります 将来的にはずっと。当社の財務結果は予測不可能であり、特に以下の理由により変動する可能性があります。
| ● | コマーシャル 当社製品の販売。 | |
| ● | 私たちの 製品開発目標とマイルストーンの達成。 | |
| ● | 臨床的 トライアルの登録と費用。 | |
| ● | 研究 と開発費。そして | |
| ● | の 受託製造および委託研究費の支払いのタイミングと性質。 |
A 当社のコストの大部分は、研究開発に多額の費用がかかることもあり、年間ベースで事前に決められています。したがって、 収益のわずかな減少は、四半期の業績に不釣り合いに影響する可能性があります。これらの要因により、当社の業績は 今後1四半期またはそれ以上の四半期で、証券アナリストや株主の期待に応えられなくなる可能性があり、それが当社の株式に影響する可能性があります 価格は下がるでしょう。
私たち 当社の主要人員と、従業員を引き付けて維持する能力にかかっています。
私たちの 将来の成長と成功は、従業員の採用、維持、管理、モチベーションを高める私たちの能力にかかっています。雇用や維持ができない 経験豊富な管理職は、当社の事業計画を実行する能力に悪影響を及ぼし、業績を損なう可能性があります。期限 私たちのビジネスの専門的な科学的および経営的な性質に合わせて、資格のある科学者を引き付けて維持する能力に大きく依存しています。 技術者、管理職員。製薬分野の有能な人材をめぐる競争は激しいです。この強烈なせいで 競争では、事業の発展に必要な有能な人材を引き付けて維持し続けることができない場合があります または適切な代替要員を募集します。
| 26 |
私たちの 専有情報、またはお客様、サプライヤー、ビジネスパートナーの情報が失われたり、セキュリティ違反が発生したりする可能性があります。
に 通常の業務では、貴重で商業的に機密性の高い知識人を含む機密データを収集して保存します。 財産、臨床試験データ、当社独自のビジネス情報、お客様、サプライヤー、ビジネスパートナーの情報、そして個人情報 お客様、治験被験者、従業員、患者の、ネットワーク上、および第三者との識別可能な情報 クラウドサービスプロバイダー。この情報を安全に処理、保守、送信することは、私たちの事業にとって非常に重要です。にもかかわらず 当社のセキュリティ対策、情報技術とインフラストラクチャ、および第三者のセキュリティ対策は、次のような攻撃に対して脆弱になる可能性があります。 ハッカー、または従業員のミス、不正行為、またはその他の混乱による侵害。どんな侵害でも、私たちのネットワークと情報が危険にさらされる可能性があります そこに保存されていると、アクセスされたり、公開されたり、紛失したり、盗まれたりする可能性があります。そのようなアクセス、開示、またはその他の情報損失が発生する可能性があります 法的請求や手続き、個人情報のプライバシーを保護する法律に基づく責任、規制上の罰則、妨害では 私たちの事業は、私たちの評判を傷つけ、私たちの製品や臨床試験を実施する能力に対する信頼を失わせます。 当社のビジネスと評判に悪影響を及ぼし、TELOMIR-1やその他の製品の規制当局の承認取得が遅れる可能性があります 候補者。
失敗 サイバーセキュリティ攻撃やその他のデータセキュリティインシデントを含む当社の情報技術システムは、重大な混乱を招く可能性があります 私たちの事業の運営。
私たちの ビジネスは、以下を含む、重要で複雑で相互に依存する情報技術(「IT」)システムにますます依存しています。 インターネットベースのシステム。その一部はサードパーティによって管理またはホストされており、ビジネスプロセスだけでなく、社内外にもサポートされています コミュニケーション。私たちのITシステムの規模と複雑さは、ITシステムの故障や悪意のある侵入に対して潜在的に脆弱です。 とコンピューターウイルス。その結果、事業を効果的に運営する能力が損なわれる可能性があります。
私たち 当社の計画的な成長に対応するために、ITシステムを継続的に評価し、必要に応じて強化しています。これには、当社のサポートも含まれます 計画された製造作業。当社のITシステムの強化を実施することには、固有のコストとリスクが伴います。 重要なビジネス情報や財務情報へのアクセスの遅延や誤り、多額の資本支出など、 追加の管理時間と運営費、強化されたシステムの実装と運用に十分なスキルを持つ人材の維持 システム、管理時間への要求、拡張システムへの移行が遅れたり困難になったりすることによるコスト、どれでも可能です 当社の事業と経営成績を損ないます。さらに、ITシステムの強化を実施しても、生産性が向上しない可能性があります 実装コストを上回るレベルへの改善、あるいはまったくありません。さらに、当社のシステムおよび第三者のシステム プロバイダーや協力者は、機密データを権限のない人に公開する可能性のあるデータセキュリティ違反に対して潜在的に脆弱です または一般に。このようなデータセキュリティ違反は、機密情報、企業秘密、その他の知的財産の損失につながる可能性があります 財産、個人情報(個人を特定できる情報や個人を特定できる情報を含む)が一般に公開される可能性があります 当社の従業員、治験患者、顧客、ビジネスパートナー、その他の健康情報)が潜在的なアイデンティティにつながる可能性があります 盗難、または評判を傷つける可能性があります。データセキュリティ違反は、臨床試験データの損失や完全性の低下につながる可能性もあります そのデータの。さらに、当社の従業員や請負業者によるソーシャルメディアの使用が増えると、不注意による開示につながる可能性があります 機密情報、企業秘密、その他の知的財産を含むがこれらに限定されない、機密データまたは個人情報の 財産。
任意です このような混乱やセキュリティ違反、および当社、当社の従業員、または請負業者による、RAPADYと矛盾する可能性のあるあらゆる行動 米国内および当社が事業を行うその他の地域で適用されるデータプライバシーおよびセキュリティに関する法律および規制の変化、 米国の州、米国連邦政府、または外国政府による執行措置、以下に基づく責任または制裁につながる可能性があります 特定の種類の機密情報を保護するHIPAAなどの医療法を含むデータプライバシー法、規制上の罰則、 その他の法的手続き(私的訴訟、多額の是正費用の発生、業務の中断などが含まれますが、これらに限定されません) 私たちの開発プログラム、事業運営とコラボレーション、経営努力の転用、そして私たちの評判へのダメージ、それは 私たちのビジネスと運営に害を及ぼす可能性があります。テクノロジーが急速に変化し、サイバーセキュリティがますます高度化しているためです 脅威、そのようなリスクを防ぎ、対応し、最小限に抑えるための私たちの対策はうまくいかないかもしれません。
| 27 |
セキュリティー 侵害、データの損失、その他の混乱により、当社の事業に関連する機密情報が危険にさらされ、アクセスできなくなる可能性があります 重要な情報であったり、責任にさらされたりすると、当社の事業や評判に悪影響を及ぼす可能性があります。
に 通常の業務では、私たち、ベンダー、およびサードパーティのクラウドサービスプロバイダーが機密データを収集して保存することがあります。 法的に保護された患者の健康情報、クレジットカード情報、従業員に関する個人を特定できる情報を含みます と患者、知的財産、および専有ビジネス情報。私たちは、アプリケーションとデータを利用して管理および保守しています クラウドベースとオンサイトシステム。これらのアプリケーションとデータには、研究を含むビジネスに不可欠なさまざまな情報が含まれています と開発情報、商業情報、ビジネスと財務情報。
ザル この重要な情報の安全な処理、保管、保守、送信は、当社の事業と事業戦略にとって不可欠です。 そして、私たちはそのような情報の保護に多大なリソースを費やしています。機密情報を不正から保護するための対策を講じていますが アクセスや開示により、私たちの情報技術とインフラストラクチャは、ハッカーによる攻撃、ウイルス、侵害に対して脆弱になる可能性があります。 従業員の過失、不正行為、その他の混乱による中断、またはプライバシーとセキュリティに関する義務違反による中断。任意です このようなウイルス、侵害、中断により、当社のネットワークが危険にさらされ、そこに保存されている情報に権限のない者がアクセスする可能性があります。 公開されたり、紛失したり、盗まれたりしました。予防し、必要に応じて検出して対応するための対策を講じています セキュリティインシデント、プライバシー侵害、セキュリティ義務など。しかし、将来、そのようなアクセス、開示、またはその他の損失が発生した場合 の情報が、法的請求や手続き、個人情報のプライバシーを保護する法律に基づく責任につながる可能性があります。 米国のHIPAAや欧州連合の一般データ保護規則(GDPR)、政府の執行措置など と規制上の罰則。不正アクセス、紛失、または流布は、処理能力を含む当社の業務に支障をきたす可能性もあります サンプル、検査結果の提供、安全性データの共有と監視、支払者または患者への請求、カスタマーサポートサービスの提供、調査の実施 と開発活動、会社の財務情報の処理と準備、私たちのさまざまな一般管理面の管理 事業であり、当社の評判を傷つける可能性があり、そのいずれかが当社の事業、財政状態、経営成績に悪影響を及ぼす可能性があります。
リスク 製品候補の開発と規制当局の承認に関連します
臨床 製品候補の試験は、費用がかかり、時間がかかり、不確実で、変更、遅延、または終了の影響を受けやすいです。結果 の臨床試験は異なる解釈の余地があります。
臨床 試験は高価で時間がかかり、設計と実施が困難です。規制当局は結果を分析または解釈することがあります 私たちとは違います。臨床試験の結果が良好であっても、当社の多くの製品候補の臨床試験は は数年間継続する予定で、完了するまでにかなり長い時間がかかる場合があります。さらに、私たち、FDA、またはその他の規制 州や地方自治体を含む当局、または機関審査委員会(IRB)は、その機関での裁判に関しては、 当社の臨床試験をいつでも中断、延期、または終了することができ、追加の臨床試験を実施することを要求したり、特定のことを要求したりすることができます 臨床試験を当初の計画よりも長期間継続するには、実施するように開発計画を変更する必要があります ある製品候補の臨床試験を順番を変えて、例えば同じものを2回試験するのではなく、段階的に行うなど 並行して製品候補です。停止、遅延、または終了には、次のようなさまざまな理由が考えられます。
| ● | 欠く 臨床試験中のあらゆる製品候補の有効性について | |
| ● | 発見 試験参加者が経験した重篤または予期しない毒性作用や副作用、あるいは薬物相互作用などの他の安全上の問題については、 他の併用薬のレベルに重大な変化を引き起こすものを含みます。 | |
| ● | もっとゆっくり 被験者の募集率と臨床試験への登録率が予想を上回っています。 | |
| ● | 難易度 臨床試験を開始したが、治療による有害な副作用のためにいつでも中止する可能性のある被験者を維持するために、 効能が不十分、臨床試験の過程での疲労、またはその他の理由で。 | |
| ● | 遅延 または、規制や製造が原因で、臨床試験に使用するのに十分な量の材料を製造できない、または入手できない 制約; |
| ● | 不十分さ 製造プロセスまたは製品配合の変更または変更。 |
| 28 |
| ● | 遅延 「臨床保留」や中断が必要な遅延を含む、試験を開始するための規制当局の承認を得る際に または、試験の開始前または後に、FDAなどの規制機関による試験の終了。 | |
| ● | 変更します 研究の範囲、性質、または時期に課せられる要件の変更を含む、適用される規制方針および規制。 | |
| ● | 遅延 または将来の臨床試験施設との臨床試験契約またはプロトコルにおける許容条件について合意に達しなかった。 | |
| ● | 不確実性 適切な投与量について。 | |
| ● | 遅らせます または、規制仕様に準拠した臨床試験用の製品の供給の失敗。 | |
| ● | 不利です 進行中の前臨床研究と臨床試験の結果。 | |
| ● | 失敗 すべての契約要件を遵守する当社の委託研究機関、CRO、またはその他の第三者請負業者、または タイムリーに、または許容できる方法でサービスを実行すること。 |
| ● | 失敗 私たち、私たちの従業員、CRO、またはその従業員が、適用されるすべてのFDAまたはその他の規制要件を遵守して 臨床試験の実施または取り扱い、保管、セキュリティ、記録管理。 | |
| ● | スケジューリング 参加している臨床医や臨床機関との衝突。 |
| ● | 失敗 適切な臨床試験プロトコルを設計すること。 | |
| ● | 不十分です 規制当局の承認を裏付けるデータ。 | |
| ● | できない または医療研究者が私たちの臨床プロトコルに従うことを嫌がる、または | |
| ● | 難易度 治療中または治療後に患者と連絡を取り合うため、データが不完全になる可能性があります。 |
任意です 上記のうち、当社の事業、経営成績、および財政状態に重大な悪影響を及ぼす可能性があります。
任意です 既存の規制を順守しないと、当社の評判や業績が損なわれる可能性があります。
私たち 製品候補が進行中の各市場では、米国連邦政府および州政府による広範な規制の対象となっています 承認プロセスを経て。
私たち また、FDAの優良検査基準、優良臨床基準、および現在の製品を含むすべての規制要件を遵守する必要があります 製造基準要件(「cGMP」)のファーマコビジランス要件、広告、プロモーションの制限、報告 と記録管理の要件。当社またはサプライヤーが、FDAの事前承認または事後承認を含む適用規制を遵守しなかった場合 cGMPの要件があれば、FDAは私たちを制裁する可能性があります。医薬品がFDAの承認を受けたとしても、規制当局は重大な制限を課すことがあります 製品の指示された用途やマーケティングについて、または潜在的に費用のかかる市販後の試験に継続的な要件を課すこと。テロミール-1、 また、将来米国で承認される可能性のある当社の製品候補はすべて、継続的な規制要件の対象となります 製造、ラベリング、包装、保管、流通、輸入、輸出、広告、プロモーション、サンプリング、記録管理、提出用 米国における連邦および州の要件を含む、安全性やその他の市販後の情報。さらに、メーカーと 製造業者の施設は、品質管理や製造の確保など、FDAの広範な要件に準拠する必要があります 手順はGMPに準拠しています。そのため、私たちと委託製造元(将来委託製造業者が任命される場合) GMPの遵守状況を評価するために、継続的な見直しと定期検査の対象となります。したがって、私たちと私たちが一緒に働く他の人たち 製造、生産、品質管理など、規制コンプライアンスのすべての分野に時間、お金、労力を費やし続けなければなりません と品質保証。また、特定の副作用や生産上の問題がある場合は、FDAに報告する必要があります。 当社製品の広告やプロモーションに関する要件を遵守するため。処方箋に関するプロモーションコミュニケーション 医薬品は、さまざまな法的および規制上の制限の対象となり、製品の情報と一致している必要があります 承認済みラベル。
| 29 |
もし 規制機関が、予期せぬ重大度や頻度の有害事象など、製品に関するこれまで知られていなかった問題を発見し、 または製品の製造施設に問題がある、または製品のプロモーション、マーケティング、またはラベル付けに同意しない、 その製品または当社に、製品を市場から撤退させることを含め、制限を課す可能性があります。私たちが従わなかったら 該当する規制要件があれば、規制当局または執行機関は次のことを行うことができます。
| ● | 問題 無題または警告状。 | |
| ● | 求める 私たちの活動を楽しむこと。 | |
| ● | 課します 民事または刑事の罰則。 | |
| ● | 中断します 規制当局の承認。 | |
| ● | 一時停止します 現在進行中の臨床試験のいずれか | |
| ● | 拒否します 保留中の申請を承認したり、当社が提出した承認申請書を補足したりすること。 | |
| ● | 課します コーポレート・インテグリティ契約の締結を要求したり、委託製造業者を閉鎖したりするなど、当社の事業に対する制限があります 施設(あれば)。または | |
| ● | つかむ または製品を留保するか、製品のリコールを要求してください。 |
に さらに、法律違反の疑いについて政府が調査を行うと、対応に多大な時間とリソースを費やす必要が生じる可能性があります そして否定的な評判を生む可能性があります。現行の規制要件に従わないと、重大な悪影響が及ぶ可能性があります 製品候補を商品化し、収益を生み出す私たちの能力。規制上の制裁措置が適用されるか、規制当局の承認が下りたら が撤回された場合、当社の事業価値と経営成績に悪影響が及ぶ可能性があります。
任意です これらの法律違反を理由に当社に対して訴訟を起こすと、たとえ私たちが弁護に成功したとしても、多額の法的費用が発生する可能性があります。 経営陣の注意を事業運営からそらし、私たちの評判を傷つけます。私たちはかなりのリソースを費やしています コンプライアンスへの取り組みやそのような費用は予測不可能で、業績に悪影響を及ぼす可能性があります。法律、規制、基準の変更 また、不確実性、経費の増加、保険費用の増加を招く可能性があります。その結果、合理的に必要なものをすべて投資するつもりです 進化する基準に準拠するためのリソース、そしてこの投資は管理費と管理費の増加につながる可能性があります 経営者の時間と注意を、収益を生み出す活動からコンプライアンス活動に転用すること。
ザル FDAとの規制当局の承認プロセスは時間がかかり、本質的に予測がつかないものです。
私たち 新薬の承認を受けるまで、医薬品候補を米国またはその他の国で医薬品として販売することは許可されていません 規制当局から承認を受けるまで、FDAまたは外国からの医薬品申請(「NDA」) そのような国の。医薬品候補の承認を得るためにNDAをFDAに提出する前に、前臨床試験を完了しておく必要があります 研究や臨床試験を行い、当社の製品がアイデンティティ、強度、品質、純度に関して適用されるすべての基準を満たしていることを実証しています 有効期限まで。臨床プログラムを無事に完了し、NDAの承認を得るのは複雑で時間がかかります。 高価で不確実な手続きのため、FDA(または他の国の医薬品規制機関)は、製品の承認を遅延、制限、または拒否することがあります 候補者にはさまざまな理由があります。理由としては、
| ● | です 私たちの製品候補が、FDAが満足するほど患者を治療する上で安全で効果的であることを実証できない。 | |
| ● | 結果 FDAが要求する統計的または臨床的有意性のレベルを満たしていない可能性のある臨床試験の。 |
| 30 |
| ● | 意見の相違 臨床試験の数、デザイン、規模、実施、または実施に関してFDAに問い合わせてください。 | |
| ● | 要件 追加の臨床試験を実施するためにFDAによって。 | |
| ● | 不承認 FDAによる、製品候補の特定の配合、表示、または仕様について。 | |
| ● | 調査結果 FDAによると、前臨床研究と臨床試験のデータが不十分だということです。 | |
| ● | 調査結果 FDAによると、当社の原薬または完成品は、アイデンティティ、強度、品質、純度に関して適用されるすべての基準を満たしていないとのことです。 | |
| ● | の FDAは、前臨床試験と臨床試験のデータの解釈に反対するかもしれません。そして | |
| ● | の FDAは承認方針を変更したり、新しい規制を採用したりすることがあります。 |
任意です これらの要因の多くは、私たちの手に負えないものであり、開発時間やコストを増加させたり、入手能力を危険にさらしたりする可能性があります 当社の医薬品候補の規制当局の承認。
そこに 臨床試験を進めている医薬品候補の失敗率が高いです。
一般的に、 臨床試験を進める医薬品候補の失敗率は高いです。私たちは臨床で重大な挫折を経験するかもしれません 製薬業界やバイオテクノロジー業界の他の多くの企業の経験と同様の試験を、受けた後も 以前の試験で有望な結果が出ました。さらに、たとえ私たちが臨床試験の結果が肯定的だったとしても、FDAは私たちに同意しないかもしれません データの解釈。製品候補やその他の問題に関する臨床試験の結果、陰性の結果が出た場合 潜在的な化学物質、製造・管理上の問題、またはその他の障害に関連して、当社の製品候補が承認されませんでした。 事業を継続するのに十分な収益を生み出せなかったり、資金を調達できなかったり、現在の事業を遂行する能力が得られない場合があります 事業計画が著しく損なわれる可能性があり、業界や投資界における当社の評判が著しく損なわれる可能性があります そして、私たちの普通株の価格は大幅に下がる可能性があります。さらに、私たちが適切に設計、開始、完成することができません 臨床試験は、臨床試験のタイミングと結果、および新薬候補の承認を求める能力に悪影響を及ぼす可能性があります。
もし 連邦または州の「詐欺と虐待」に関する法律に違反していることが判明した場合、罰金の支払いを求められたり、停職処分を受けたりすることがあります 私たちの事業、財政状態、業績に悪影響を及ぼす可能性のある連邦または州の医療プログラムへの参加から オペレーションの。
に 米国では、反キックバックを含む、さまざまな連邦および州の医療の「詐欺と虐待」法の対象となっています 影響を与える可能性のある連邦および州の医療プログラムにおける詐欺や虐待を減らすことを目的とした法律、虚偽請求法、その他の法律 特に、米国での製品の商品化が成功したことを受けています。1987年のメディケアおよびメディケイド患者保護法では、 または連邦反キックバック法により、処方薬メーカー(またはその製造者)を含むすべての人にとって違法とされています に代わって)、ビジネスの紹介を誘発することを目的とした報酬を故意かつ意図的に募集、受け取り、提供、または支払うこと、 連邦医療プログラムに基づいて支払いができる特定の薬の購入、注文、処方を含みます。 メディケアやメディケイドなど。連邦法の下では、セーフハーバーと呼ばれる一部の取り決めは、連邦政府の反キックバックに違反しないと見なされています 法令。私たちは、該当するすべての要件に従って事業上の取り決めを構築するよう努めていますが、多くの場合難しいです 特定の状況で法律がどのように適用されるかを正確に決定するため。したがって、私たちの慣行に異議が唱えられる可能性があります 連邦反キックバック法および連邦虚偽請求法に基づいています。詐欺や虐待に関する法律違反は刑事に処せられる可能性があります および/または罰金、および/またはメディケアなどの連邦および州の医療プログラムからの除外または停止を含む民事制裁 メディケイドと米国政府との契約の禁止。さらに、個人には行動を起こす能力があります 連邦虚偽請求法およびいくつかの州の虚偽請求法に基づき、政府を代表して。
| 31 |
たくさんの 州は連邦反キックバック法と同様の法律を採用しており、その一部は医療への患者の紹介に適用されます 政府の支払者だけでなく、あらゆる資金源から払い戻されるサービス。これらの州に準拠するために何が必要かが曖昧です 要件、および適用される州法の要件に従わなかった場合、罰則の対象となる可能性があります。
どちらでもない 政府も裁判所も、詐欺や虐待に関する法律を当社の事業に適用するための明確なガイダンスを提供しています。法執行機関 当局はこれらの法律の施行にますます注力しており、私たちの慣行の一部がこれらの法律の下で異議を申し立てられる可能性があります 法律。私たちはこれらの法律に準拠するように事業上の取り決めを構築したと考えていますが、政府がそうする可能性はあります これらの法律の違反を主張したり、違反したとして私たちに有罪判決を下したりしてください。これらの法律のいずれかに違反していることが判明した場合、義務付けられる可能性があります 罰金を支払うと、連邦または州の医療プログラムへの参加、および当社の事業、業績への参加が一時停止または除外される可能性があります の事業と財政状態は悪影響を受ける可能性があります。
真剣に 有害事象やその他の安全上のリスクにより、開発を中止し、製品候補の承認を除外、延期、または制限しなければならない場合があります。 承認されたラベルの範囲や市場での承認を制限したり、すでに承認されている製品のリコールやマーケティング承認の喪失を引き起こしたりする 市販されています。
もし 商業販売の承認前または承認後に、重篤または予期しない副作用を引き起こす、または関連する製品候補のいずれか 誤用、乱用、流用などの他の安全上のリスクがあると、次のような重大な悪影響が生じる可能性があります。
| ● | 規制 当局は臨床試験を中断、延期、中止することがあります。 |
| ● | 規制 当局は、当社の製品候補の規制当局の承認を拒否することがあります。 | |
| ● | 規制 当局は、警告、禁忌、表示の制限など、特定の表示に関する声明を要求する場合があります で、リスク評価および軽減戦略(「REMS」)という形で、配布に使用したり、配布に制限を課したりします 承認または事後承認との関係。 | |
| ● | 規制 当局は承認を取り下げたり、より面倒な表示表示を要求したり、より制限の厳しいREMSを課したり、私たちに要求したりすることができます 承認された製品をリコールすること。 | |
| ● | 私たち 製品の投与方法を変更したり、追加の臨床試験を実施したりする必要があるかもしれません。 | |
| ● | 私たちの 協力パートナーとの関係が損なわれる可能性があります。 | |
| ● | 私たち 患者に生じた危害について訴えられ、責任を問われる可能性があります。または | |
| ● | 私たちの 評判が損なわれる可能性があります。開発中の製品候補の評判リスクは、開発中の製品よりも高くなっています 小児科の適応症について。 |
私たち 臨床試験が参加者に容認できないリスクをもたらすと当社が判断した場合、いつでも治験を自発的に中断または終了することができます または、予備データから、当社の製品候補が規制当局の承認を受ける可能性が低い、または成功する可能性は低いと判明した場合 商品化されています。製品の商業販売の承認を受けた後、私たちは自発的にその製品を撤回またはリコールすることがあります 市場の使用または人がそれにさらされると、健康に悪影響を及ぼしたり、死亡したりする可能性があると私たちが判断した場合。 現在まで、承認された製品を市場から削除するための撤回、リコール、またはその他の措置は、自発的であれ義務的であれ、講じていません。 さらに、規制機関、IRB、またはデータ安全監視委員会はいつでも、一時的または恒久的な中止を勧めることができます 私たちの臨床試験について、または治験責任医師が治験に賛成していると思われる場合は、治験への派遣をやめるよう依頼してください 適用される規制要件に従って実施されていない、または参加者に容認できない安全上のリスクをもたらすということ。 規制機関、IRB、またはデータ安全性監視委員会から、臨床試験を一時的に中止するように依頼されたことはありませんが または恒久的に、当社の製品候補の臨床試験を中断または中止せざるを得ない場合、商業的見通し なぜなら、その製品が損なわれ、その製品から製品収益を生み出す当社の能力が遅れたり、なくなったりする可能性があるからです。さらに、 これらのいずれの場合も、警告や禁忌などの表示が出る可能性があります。さらに、そのようなイベントやラベル付けは 当社または当社のパートナーが、影響を受ける製品の市場での受け入れを達成または維持することを妨げ、大幅に増加させる可能性があります 製品候補の商品化にかかる費用と、これらの製品の商品化による収益創出の妨げになります 私たちまたはコラボレーションパートナーのいずれかによって。
| 32 |
リスク 第三者への依存に関連して
私たち 当社の製品候補の臨床試験を実施するにあたり、第三者に頼り、今後も頼り続けることを期待しています。もしこれらの第三者がいるなら 契約上の義務をうまく遂行できなかったり、規制要件を遵守しなかったり、予定された期限に間に合わなかったりすると、私たちはそうではないかもしれません 製品候補のマーケティング承認を得たり、商品化したりすることができ、当社の事業に大きな打撃を与える可能性があります。
私たち 臨床試験、前臨床研究、非臨床試験の実施を第三者に委託しています。具体的には、、、 医療機関、臨床研究者、委託研究機関(CRO)、およびコンサルタントに引き続き頼るつもりです いずれの場合も、当社の研究プロトコルと適用される規制要件に従って、非臨床研究と臨床試験を実施します。 これらのCRO、治験責任者、その他の第三者は、これらの研究や試験の実施とタイミングにおいて重要な役割を果たします。 その後のデータの収集と分析。ただし、CROや調査員などとの関係を慎重に管理することを期待しています 第三者、私たちが将来問題や遅延に遭遇しないこと、またはこれらの遅延や課題に遭遇しないという保証はありません 当社の事業、財政状態、見通しに重大な悪影響はありません。さらに、私たちは契約を結んでいますし、今後もそうするつもりです 第三者請負業者の活動を管理していますが、その実際の業績に対する影響は限定的です。それでも、私たちは 当社の各臨床試験が該当するプロトコルと法律、規制に従って実施されるようにする責任があります と科学的な基準と要件、そしてCROや他の第三者に頼っているからといって、私たちの規制が緩和されるわけではありません 責任。さらに、私たちとCROは、該当する場合は規制であるGLPとGCPの要件を遵守する必要があります および非臨床研究と臨床の実施に関連してFDAおよび同等の外国の規制当局によって施行されているガイドライン それぞれ。規制当局は、治験依頼者、主任研究者、および トライアルサイト。当社、または当社のCROまたは治験実施施設が、該当するGLP、GCP、またはその他の要件を満たしていない場合、収集された非臨床は 私たちの臨床試験で生成されたデータまたは臨床データは、FDAまたは同等の外国の規制当局では信頼できないと見なされることがあります もしあれば、マーケティング申請を承認する前に、追加の非臨床研究または臨床試験の実施を要求することがあります。さらに、 私たちの臨床試験は、cGMP規制に従って製造された材料を使用して実施する必要があります。これらの規制に従わなかった 臨床試験を繰り返す必要があり、規制当局の承認プロセスが遅れてしまいます。
そこに 私たちのCRO、治験責任者、その他の第三者がそのような試験に十分な時間とリソースを投じることができなくなるリスクです 契約上の要求に応じて勉強したり、実行したりします。これらの第三者のいずれかが予定期限に間に合わない場合は、当社の臨床プロトコルに従ってください または規制要件を満たしている、または標準以下の方法で実施された場合、当社の臨床試験は延長、延期、または中止される可能性があります。 さらに、私たちが契約している第三者の多くは、私たちを含む他の営利団体と関係がある場合もあります 当社の競争力を損なう可能性のある臨床試験やその他の開発活動を行っている可能性のある競合他社。 さらに、私たちの臨床試験の主任研究者は、その時から、私たちの科学顧問またはコンサルタントとしての役割を果たすことが期待されています 時々、そのようなサービスに関連して現金または株式報酬を受け取るかもしれません。もしこれらの関係とそれに関連する報酬があれば その結果、利益相反が認識された、または実際に利益相反になった場合、または金融関係が解釈に影響を与えた可能性があるとFDAが結論付けました 研究について、該当する臨床試験サイトで生成されたデータの完全性や、臨床試験の有用性に疑問が生じる可能性があります 試験自体が危険にさらされる可能性があり、その結果、私たちが提出する機密保持契約がFDAによって遅延または却下される可能性があります。そのような遅延や拒否は TELOMIR-1や将来の製品候補の規制当局の承認や商品化を妨げる可能性があります。
私たちの CROには、未解決の重大な違反が発生した場合やその他の特定の状況下で、当社との契約を終了する権利があります。 これらの第三者との関係のいずれかが終了した場合、代替の第三者と取り決めを結ぶことができなくなる可能性があります 商業的に合理的な条件で、適時に、またはまったくパーティーを。CRO、調査員、その他の第三者の切り替えまたは追加 追加コストがかかり、経営陣の時間と集中力が必要です。さらに、次のような自然な移行期間があります 新しいCROが仕事を始めます。その結果、遅延が発生し、希望する臨床開発スケジュールを満たす能力に重大な影響を与える可能性があります。 私たちはCRO、調査員、その他の第三者との関係を慎重に管理するよう努めていますが、保証はありません 将来、課題や遅延に遭遇することはない、またはこれらの遅延や課題が重大な悪影響を及ぼさないこと 私たちの事業、財政状態、見通しについて。
| 33 |
私たち 現在、臨床開発のためにTELOMIR-1の製造を第三者に依頼していますが、今後も第三者に依存する見込みです 当面の間。このように第三者に依存していると、当社製品の供給品が製造されないリスクが高まります 仕様によると、または許容できるコストで十分な量のTELOMIR-1またはそのような数量が手に入らない場合、 私たちの開発や潜在的な商品化の取り組みを遅延、阻止、または損なう可能性があります。
私たち 製造施設を所有または運営しておらず、独自の臨床または商業規模の製造能力を開発する予定もありません。 TELOMIR-1と関連する原材料の製造は第三者に頼っていますが、今後も第三者に頼ると予想しています 臨床開発用、またTELOMIR-1が市販承認を受けた場合は商業製造用です。供給するリスクがあります の前臨床または臨床試験に使用する当社の製品が、当社の仕様に従って製造されない可能性があります。 私たちの試験データを役に立たなくしたり、私たちが知的財産を持っていない斬新な化合物の作成につながったりします 保護。メーカーとの契約条件に基づくと、このようなエラーが発生した場合、メーカーに訴える手段がない可能性があります。
さらに、 第三者メーカーがTELOMIR-1を製造するために使用する施設は、FDAおよび同等の外国の規制によって承認されなければなりません 私たちがFDAにNDAを提出した後、またはそれに匹敵する書類を外国人に提出した後に実施される検査に基づく権限 規制当局。私たちはサードパーティメーカーの製造プロセスを管理しておらず、完全に依存しています 製品の製造に関するcGMP要件の順守。これらの第三者メーカーが材料をうまく製造できない場合 それは私たちの仕様と、FDAまたはそれに匹敵する外国の規制当局の厳しい規制要件に準拠しています。 製造施設の規制当局の承認を確保および/または維持することができなくなります。
に さらに、サードパーティメーカーが適切な品質管理、品質保証を維持する能力を制御することはできません 資格のある人員。FDAまたは同等の外国の規制当局がこれらの製造施設を承認しない場合 TELOMIR-1について、または将来そのような承認が取り消された場合は、代替の製造施設を探す必要があるかもしれません。 承認された場合、TELOMIR-1の開発、規制当局の承認取得、または販売能力に大きな影響を与えます。私たちの失敗、または失敗 のサードパーティメーカーが、適用される規制を遵守しようとすると、次のような制裁措置が科せられることもあります。 TELOMIR-1の臨床保留、罰金、差止命令、民事罰則、遅延、承認の一時停止または撤回、差し押さえまたはリコール またはその他の将来の製品、営業制限、刑事訴訟。いずれも供給に著しい悪影響を及ぼす可能性があります 当社の製品と財政状態について。
私たちの または第三者が当社の製造要件を商業的に合理的な条件で、適時に実行しなかったり、 cGMPやその他の規制要件に準拠していると、次のようなさまざまな形で当社の事業に悪影響を及ぼす可能性があります。
| ● | です TELOMIR-1または将来の製品候補の臨床試験を開始または完了できない タイムリーに。 |
| ● | 遅らせます TELOMIR-1の規制申請書を提出したり、販売承認を受けたりする際に 将来の製品候補ならどれでも。 |
| ● | 主観します サードパーティの製造施設または当社の将来の潜在的な製造施設は 規制当局による追加検査。 |
| ● | 要件 TELOMIR-1や将来の製品候補の開発を中止するか、バッチをリコールすること。 と |
| ● | に TELOMIR-1または将来の製品候補の販売と商品化が承認された場合、 TELOMIR-1または将来の製品候補に対する商業的需要を満たすことができません。 |
| 34 |
に さらに、第三者メーカーと長期的な契約や供給契約を結んでいません。確立できないかもしれません 第三者メーカーとの長期供給契約、または許容できる条件での供給契約。これにより、失敗するリスクが高まります 許容できるコストで十分な量のTELOMIR-1またはそのような量をタイムリーに入手してください。契約を結ぶことができても サードパーティメーカーの場合、サードパーティメーカーに依存すると、次のような追加のリスクが伴います。
| ● | 失敗 規制要件を遵守し、品質を維持するサードパーティメーカーの 保証; |
| ● | 違反 第三者による製造契約の |
| ● | 失敗 当社の仕様に従って製品候補を製造します。 |
| ● | 失敗 製造に必要な適切な原材料やその他の材料を入手すること。 |
| ● | 失敗 当社のスケジュールに従って製品を製造すること、またはまったく製造すること。 |
| ● | 失敗 必要に応じて、製造能力を首尾よく拡大してください。 |
| ● | 流用 潜在的な企業秘密やノウハウを含む当社の専有情報。そして |
| ● | 終了 または、費用がかかったり不便になったりしたときに、第三者による契約の更新をしないこと 私たちのために。 |
任意です 既存または将来の製造業者の業績不備は、臨床開発やマーケティングの承認を遅らせたり、危険にさらしたりする可能性があります TELOMIR-1または将来の製品候補の商品化を開始または継続する当社の能力、および関連する是正措置 実装には費用や時間がかかるかもしれません。現在、冗長電源やセカンドソースの取り決めは整っていません 当社の製品候補品の製造に使用されるすべての必要な原材料について。既存または将来のサードパーティメーカーの場合 合意されたとおりに機能しない場合、そのようなメーカーの交換が必要になり、タイムリーに交換できない場合や まったく。必要な原材料のサプライヤーを追加しなければ、商業的立ち上げの商業的ニーズを満たすことができない可能性もあります 将来の製品候補ならどれでも。
に さらに、TELOMIR-1および将来の製品候補の製造において、現在および将来的に予想される他の企業への依存 当社の将来の利益率と、適時にマーケティングの承認を受けた製品を商品化する能力に悪影響を及ぼす可能性があります と競争基盤。
私たちの 既存のコラボレーションの取り決めや、将来締結する可能性のあるものが成功しない可能性があり、悪影響を及ぼす可能性があります 製品候補を開発して商品化する当社の能力。
私たち 製薬会社やバイオテクノロジー企業との既存のコラボレーション契約があり、今後も追加のコラボレーションの取り決めを模索する見込みです 製品候補の製造、テスト、開発、または商品化のため。私たちは、製品候補に関しては、 比較して自社の商品化権を保持することのメリットに応じて、選択的に新しい取り決めを締結します 各製品候補について、大手製薬会社またはバイオテクノロジー企業と選択的なコラボレーション契約を結ぶこと、 米国でも海外でも。私たちが協力契約を締結することを決定する限り、私たちは大きな競争に直面するでしょう 適切な協力者を探していて、私たちが確立する可能性のある協力やその他の取り決めの条件が好ましくない場合があります 私たちに。
任意です 現在締結されているコラボレーションまたは将来のコラボレーションでは、そのようなコラボレーションの目標をタイムリーに達成できない場合があります またはまったく。私たちのコラボレーションの取り決めは、協力者の努力と活動に大きく依存します。協力者 通常、これらのコラボレーションに適用する取り組みとリソースを決定する際には、かなりの裁量権を持っています。 開発、知的財産、規制、またはに関する協力協定の当事者間の意見の不一致 商品化の問題により、該当する製品候補の開発プロセスや商品化が遅れる可能性があります そして、場合によっては、コラボレーション契約の終了。これらの意見の相違は、どちらもなければ、解決するのが難しいかもしれません 当事者には最終意思決定の権限があります。このような終了または有効期限が切れると、当社のビジネスの評判が損なわれ、悪影響を及ぼす可能性があります 私たちに財政的に影響します。
| 35 |
私たち 候補製品の製造に必要な材料や部品については、限られた数のサプライヤーに依存しています。これらの紛失 サプライヤーが、またはサプライヤーが適時に当社に供給しなかった場合、現在および将来の生産能力に遅れが生じ、悪影響を及ぼす可能性があります 私たちのビジネス。
私たち 候補製品の製造に必要な材料や部品は、限られた数のサプライヤーに依存しています。その結果、 将来、十分な量の重要な材料や部品を入手できなくなる可能性があります。私たちによる遅延または中断 サプライヤーは、当社の事業、経営成績、財政状態に害を及ぼす可能性もあります。さらに、設立に必要なリードタイム 新しいサプライヤーとの関係は長くなる可能性があり、新しいサプライヤーに切り替える必要がある場合、需要を満たすのに遅れが生じる可能性があります サプライヤー。新しいサプライヤーの資格を得るための時間と労力と、場合によっては規制当局の承認を得るための時間と労力が、さらに増える可能性があります コスト、資源の転用、または製造利回りの低下。いずれも当社の業績に悪影響を及ぼします。私たちの依存 単一ソースのサプライヤーは、次のような多くのリスクにさらされています。サプライヤーは、生産や配送を停止または削減する可能性があります。 価格を上げたり、条件を再交渉したりすると、サプライヤーが破産したり取引が中止されたり、適切な代替品が見つからなかったりすることがあります。 納得のいく条件で、適時に、あるいはまったく供給者からの連絡があり、供給問題による遅延は、当社の評判を傷つけ、不満を募らせることがあります。 顧客に、将来のニーズを競合他社に頼らせます。
リスク 当社の普通株式の所有権に関する
なぜなら 当社への投資の投機的な性質上、投資の全額を失う可能性があります。
アン 当社の証券への投資には高いリスクが伴うため、投機的な投資と見なすべきです。私たちはとても 限られた営業履歴で、製品候補の開発の前臨床段階にあり、収益を上げたことはありません。 配当を支払っておらず、当面または近い将来に配当を支払う可能性は低いです。私たちができる可能性は 目標を達成し、事業を運営するには、問題、費用、困難、合併症、遅延を考慮して検討する必要があります 初期段階のバイオテクノロジー企業の設立に関連して頻繁に遭遇します。私たちの証券への投資 その結果、そのような投資全体が失われる可能性があります。経験のある株主と潜在的な株主のみ リスクの高い投資で、投資の全額を失う余裕がある人は、私たちの証券への投資を検討すべきです。
確か 当社の創立株主に加えて、既存の役員や取締役は、当社に対する大きな関心を握っているため、特定の人々に影響を与える可能性があります 株主投票を必要とする行動。
私たちの 創設株主には、創設者のジョニー・R・ウィリアムズ・シニアとMIRALOGXの家族の利益のための2つの信託が含まれます。 発行済み普通株式および発行済み普通株式の30%以上を共同所有しています。ブライアン・マクナルティはそのような信託の受託者を務めています。私たちの 役員や取締役も当社の普通株式を所有しています。したがって、これらの団体や個人が結果に影響を与える可能性があります 取締役の選任や重要な企業取引の承認など、株主の承認が必要な事項です。
セールス 公開市場における当社の普通株式のかなりの数、またはそのような売却が行われる可能性があるという認識は、落ち込む可能性があります 私たちの普通株式の市場価格。
セールス 公開市場における当社の普通株式のかなりの数、または結果としてそのような売却が発生する可能性があるという認識 私たちがユニバーサルシェルフ登録届出書を利用している、またはそうでなければ当社の普通株式の市場価格を押し下げて減損するおそれがあります 追加の株式の売却を通じて資本を調達する当社の能力。特に、当社の普通株式の多数 当社の創立株主が保有していましたが、公的な再販のために登録されており、公開市場で売却される可能性があり、落ち込んでいます 私たちの株価。さらに、一般的に、当社の普通株式の将来の売却による影響や、それに対する市場の認識を予測することはできません 普通株式の市場価格で売れるはずの有価証券のかなりの数の売却が許可されています。
| 36 |
ザル 上場企業であることの要件は、私たちの資源に負担をかけ、経営陣の注意をそらし、誘致能力に影響を与える可能性があります そして、経営幹部と資格のある取締役会メンバーを維持してください。
として 報告発行体である場合は、その発行体が所在する法域の該当する証券法の報告要件の対象となります。 は、報告発行体です。ナスダックの上場要件、およびその他の適用される証券規則と規制。これらへのコンプライアンス 規則や規制があると、法的および財務上のコンプライアンスコストが増加し、一部の活動がより困難で時間のかかるものになります。 コストがかかり、システムとリソースへの需要が高まっています。適用される証券法では、とりわけ特定の書類を提出する必要があります 事業と経営成績に関する年次および四半期報告書。さらに、適用される証券法では 私たちは、とりわけ、効果的な開示管理と手続き、および財務報告に関する内部統制を維持します。
に 開示管理と手続き、および財務報告に関する内部統制を維持し、必要に応じて改善するために この基準、多大なリソースと管理監督が必要です。具体的には、取引がますます複雑になっているため、 主に財務報告に関する開示管理と手続き、および内部統制を改善することが期待されています 正式な方針の継続的な策定と実施、プロセスと文書化手順の改善を通じて、 追加の財源の継続的な調達。その結果、経営陣の注意が他の事業からそらされる可能性があります 当社の事業や経営成績に悪影響を及ぼす可能性のある懸案事項。これらの要件を満たすために、より多くの従業員を雇用する必要があるかもしれません 将来、または外部のコンサルタントを雇うと、コストと経費が増加します。
に さらに、コーポレートガバナンスと公開情報に関する法律、規制、基準の変化により、不確実性が生じています 上場企業、法的および財務上のコンプライアンスコストが増加し、一部の活動により時間がかかるようになっています。これらの法律、規制 および標準は、多くの場合、具体性に欠けるため、さまざまな解釈の対象となります。その結果、その適用は 実際には、規制機関や統治機関によって新しいガイダンスが提供されるにつれて、時間の経過とともに進化する可能性があります。これにより、不確実性が続く可能性があります 開示とガバナンス慣行の継続的な改訂によって生じるコンプライアンス問題と高額な費用について。私たちはするつもりです 進化する法律、規制、基準に準拠するために引き続きリソースを投資してください。この投資により、一般消費が増える可能性があります と管理費、そして経営者の時間と注意を収益を生み出す活動からコンプライアンスに転用する アクティビティ。新しい法律、規制、基準を遵守するための私たちの取り組みが、規制や行政によって意図された活動と異なる場合 団体は、その適用と慣行に関する曖昧さにより、規制当局が当社に対して法的手続きを開始する可能性があります。 これは、当社の事業と財務結果に悪影響を及ぼす可能性があります。
として これらの規則や規制の対象となる公開会社では、取締役や役員の責任を取る方が費用がかかる場合があります 保険。また、補償範囲の縮小を受ける必要がある場合や、補償を受けるために大幅に高い費用が発生する場合があります。これらの要因は また、特に監査役を務める資格のある取締役会のメンバーを引き付けて維持することをより困難にします 委員会と報酬委員会、および資格のある執行役員。
として 公開会社に求められる書類に情報を開示した結果、私たちの事業と財務状況はさらに悪化します 目に見えるので、脅迫されたり、競合他社やその他の第三者による訴訟が実際に起こったりする可能性があります。そのような主張が成功すれば、 当社の事業と経営成績が損なわれる可能性があります。申し立てが訴訟に至らなかったり、有利に解決されたとしても、 これらのクレーム、およびそれらを解決するために必要な時間とリソースは、当社の経営資源を流用し、事業に悪影響を及ぼす可能性があります と経営結果。
| 37 |
私たち は「新興成長企業」であり、特定の限定された報告と開示のみに従うという当社の決定は 新興成長企業に適用される要件により、当社の普通株式は投資家にとって魅力が薄れる可能性があります。
私たち 証券法のセクション2(a)で定義されている「新興成長企業」です。私たちが新興国であり続ける限り 成長企業であれば、他の上場企業に適用されるさまざまな報告要件の免除を利用するかもしれません それらは新興成長企業ではありません。これには、当社の独立登録公会計士の取得が義務付けられていないことが含まれますが、これらに限定されません 企業監査:サーベンス・オクスリー法第404条に基づく財務報告に関する内部統制、開示義務の軽減 定期報告書の役員報酬と拘束力のない諮問投票の要件の免除について 以前に承認されていないゴールデンパラシュート支払いの役員報酬と株主の承認。私たちは新興成長者かもしれません 会社は、新規株式公開の完了後、会計年度末日の5周年記念日まで、ただし、当社の 年間売上高が12億3500万米ドルを超える場合、普通株式の市場価値であれば、状況はより早く変化します 非関連会社が保有する株式は、毎年6月30日時点で7億米ドル以上であるか、または10億米ドルを超える非転換株を発行しています その期間が終了する前の3年間にわたる借金。
投資家 これらの免除に頼ることを選択した場合、私たちの株の魅力が薄れる可能性があります。その結果、一部の投資家が株式の魅力が薄れたと感じたら 将来の情報開示を減らすためにどのような選択肢があっても、私たちの株式の取引市場はそれほど活発ではなく、私たちの株価はより変動しやすくなる可能性があります。
にとって 私たちが「新興成長企業」である限り、私たちの独立登録公認会計士事務所は次のことを要求されません 第404条に基づく財務報告に対する当社の内部統制の有効性を証明します。私たちは「新進気鋭の企業」かもしれません 「成長企業」は、新規株式公開が発効した後の会計年度末日の5周年記念日まで 2024年2月9日に。内部統制の有効性を独自に評価することで、経営陣が抱えている問題を発見できる可能性があります 評価はそうではないかもしれません。内部統制の重大な弱点が発見されないと、財務諸表の修正につながる可能性があり、 修復費用を私たちが負担します。
もし 財務報告に関する内部統制の重大な弱点や、要件を遵守できない場合は特定します 第404条を適時に提出するか、財務報告に対する当社の内部統制が有効であることを主張するか、または当社が独立登録した場合 公認会計士事務所が、財務報告に対する当社の内部統制の有効性について意見を述べることができないのは 必須、投資家は当社の財務報告の正確性と完全性、および当社の有価証券の市場価格に対する信頼を失う可能性があります マイナスの影響を受ける可能性があり、当社の証券が上場されている証券取引所による調査の対象となる可能性があります。 SEC、またはその他の規制当局。追加の財務および管理リソースが必要になる可能性があります。
私たち は「小規模な報告会社」であり、新興成長企業としての資格がなくなったとしても、対象となる可能性があります 報告要件を緩和しました。
さらに、 私たちは、規則S-Kの項目10(f)(1)で定義されている「小規模な報告会社」です。小規模な報道会社は取るかもしれません 特に、2年間の監査済み財務諸表のみを提供することを含む、特定の開示義務を軽減することの利点。 (i) 株式の市場価値のいずれかである限り、会計年度の最終日までは小規模な報告会社であり続けます。 非関連会社が保有する普通株式のうち、その前の6月30日の時点で2億5000万ドル以上ではない番目の; または(ii)私たちの年次 このような完了した会計年度の収益は1億ドル以上ではありませんでした。このような開示量の減少を利用する範囲で 義務。また、当社の財務諸表を他の公開企業と比較することが困難または不可能になることもあります。
もし ナスダック上場規則の遵守を怠ると、当社の株式がナスダックから上場廃止になり、取引が制限される可能性があります 私たちの株式を売り込み、将来の負債やエクイティファイナンスの獲得を会社にとってより困難にします。
私たちの 普通株はナスダック・キャピタル・マーケットに「TELO」のシンボルで上場されています。しかし、私たちがそうするという保証はありません ナスダックの継続上場要件への準拠を引き続き維持することができます。そうしなければ、私たちの証券は 上場廃止になり、ナスダックでの取引を停止します。その結果、株式の数量が少ないため、有価証券の売却がより困難になる可能性があります または新株予約権が売買されたり、取引が遅れたり、セキュリティアナリストの私たちの対応範囲が狭まったりする可能性があります。 さらに、当社の証券が上場廃止になった場合、ブローカー・ディーラーは特定の規制要件に直面することになり、それが期待を裏切る可能性があります それらは証券の取引に影響を与え、証券の流動性をさらに制限します。これらの要因により、低くなる可能性があります 有価証券の買値と売値における価格とより大きなスプレッド。このようなナスダックからの上場廃止と、継続的またはさらなる下落 また、有価証券の株価は、株式または負債を通じて必要な追加資本を調達する当社の能力を大きく損なう可能性があります 資金調達を行っており、資金調達やその他の目的で株式を発行することによる株主の所有権の希薄化を大幅に拡大する可能性があります 取引。
| 38 |
もし 私たちの株式はナスダックから上場廃止になる予定でしたが、SECの「ペニーストック」規則の対象となる可能性があります。
上場廃止 ナスダックから、当社の証券がSECの「ペニーストック」規則の対象となる可能性があります。SECは一般的に ペニー株を、市場価格が1株あたり5.00ドル未満、または行使価格が5.00ドル未満の株式と定義しています 1株あたりで、特定の免除の対象となるナスダックなどの国内証券取引所には上場されていません。したがって、株式なら 当社の普通株式のうち、ナスダックから上場廃止になった場合、当社の証券はSECの「ペニー」の対象となる可能性があります 株式」ルール。これらの規則では、とりわけ、当社の証券の購入または売却を行うすべてのブローカーが提供することが義務付けられています その顧客に:(i)リスク開示文書、(ii)市場相場の開示(もしあれば)、(iii)報酬の開示 取引に参加したブローカーとその営業担当者の、および(iv)当社証券の市場価値を示す毎月の口座明細書 お客様のアカウントで保持されます。ブローカーは、ビッド&オファーの見積もりと報酬情報を提供する必要があります 取引を行う前に。この情報は、お客様の確認書に記載する必要があります。一般的に、ブローカーは少ないです これらの追加の配送要件により、ペニー株の取引に喜んで影響を与えます。これらの要件により、さらに難しくなる可能性があります 株主が当社の普通株式を購入または売却できるように。この情報は私たちではなくブローカーが準備するので、私たちはしません そのような情報が正確、完全、または最新であることを保証できます。
いくつか フロリダ州法の規定、当社の修正および改訂された定款、および修正および改訂された付則には、買収禁止措置が含まれる場合があります 買収が株主にとって有益であっても、他者による当社の買収を思いとどまらせる可能性のある影響、および 株主が現在の経営陣を置き換えたり解任したりするのを防ぎましょう。
私たちの フロリダ州の企業としての地位と、フロリダ州事業会社法の買収防止規定(私たちが時々言及することもあります) FBCAのように、たとえ支配権の変更が株主にとって有益であっても、支配権の変更を思いとどまらせたり、遅らせたり、妨げたりする可能性があります。
その 支配権取得法、FBCAのセクション607.0902では、通常、個人が議決権のある株式を取得する場合には次のように規定されています の発行済み株式および発行済み株式すべての議決権の20%を超える会社のうち、取得した株式には何もありません 議決権は、個別に投票する権利がある各クラスまたはシリーズの過半数の議決権者によってそのような権利が回復されない限り、 支配株式を取得する人、または会社の取締役でもある当社の役員または従業員が保有する株式を除きます。 遺産相続法または遺産相続法に従って取得された株式など、特定の株式の取得はこれらの規則から免除されます FBCAの当事者である場合は、FBCAに従って行われた合併または株式交換による、贈答品または遺言上の譲渡に 合意、または買収が以前に当社の取締役会で承認されている場合は、当社の株式の取得に従って 買収。支配権の取得法は通常、フロリダ州を意味するあらゆる「発行公社」に適用されます 次のような企業があります:
| ● | 一つ 100人以上の株主。 |
| ● | その フロリダ州の主な事業所、その主な事務所、または重要な資産。そして |
| ● | どちらか (i)株主の10%以上がフロリダに居住しています。(ii)株式の10%以上がフロリダ州の居住者が所有しています。 または (iii) 1000人の株主がフロリダに住んでいます。 |
その アフィリエイト取引(またはいわゆる「企業結合」)に関する法律、FBCAのセクション607.0901では、次のことを行うことが規定されています 特定の合併、統合、資産の売却、株式の発行、再分類、資本増強、その他の関連会社には関与していません 「利害関係のある株主」との、その株主になった日から3年間の取引 関心のある株主です。ただし、次の場合を除きます。
| ● | 先に そのような株主が利害関係のある株主になるまで、当社の取締役会は関連取引のいずれかを承認しました または株主が利害関係のある株主になることになった取引、または |
| ● | アポン 株主が利害関係株主になり、利害関係者が所有するに至った取引の成立 取引開始時に発行されている議決権のある株式の少なくとも 85%。または |
| ● | で またはそのような株主が利害関係のある株主になった時点で、関連取引は当社の取締役会によって承認されます 取締役で、年次または特別株主総会で承認され、書面による同意ではなく、賛成票によって承認されます 利害関係のある株主が所有していない発行済み議決権株式の少なくとも3分の2です。 |
| 39 |
アン 「利害関係株主」とは、一般的に当社の発行済株式の15%以上の受益者である人を指します 議決権のある株式。
ザ・ 上記の議決権行使要件は、以下を含む1つ以上の条件が満たされている場合、特定の提携取引には適用されません。 ただし、これらに限定されません。関連取引が利害関係のない取締役の過半数によって承認された場合、私たち 提携取引日の前の3年間のどの時点でも、登録株主数が300人を超えていません 発表済み。利害関係のある株主が、少なくとも当社の発行済み議決権株式の80%以上の受益者であった場合 提携取引が発表された日の3年前、または各クラスの保有者に対価が支払われる場合 または関連取引における議決権株式のシリーズは、形式と金額に関する法令の特定の要件を満たしています。 他のこと。
両方 支配権の取得法および関連取引法は、特定の人を思いとどまらせたり妨げたりする効果があるかもしれません 私たちが関与する支配権の変更または買収取引。
に さらに、当社の修正および改訂された定款および修正および改訂された定款には、それをさらに充実させる可能性のある条項が含まれています 第三者が当社を買収したり、買収費用を増やしたりすることは困難です。たとえそうすることが当社の株主に利益をもたらすとしても、 そうでなければ株主が株式の割増を受ける可能性のある取引。これらの規定には以下が含まれます:
| ● | 何もありません 私たちの修正および改訂された定款では、権限のある株主の承認なしに将来の発行を行うことはできません 当社の普通株式の未発行株式。 |
| ● | 前進 株主が取締役選挙の候補者を指名したり、年次総会に書類を提出したりするには、通知手続きが適用されます の株主; |
| ● | a 特別株主総会は、取締役会の議長、最高経営責任者、社長のみが招集できます (最高経営責任者がいない場合)、取締役会の過半数、または全議決権の10%以上の保有者 特別株主総会で検討が予定されているあらゆる問題にキャストされる権利があります。 |
| ● | いいえ 当社の修正および改訂された定款または修正および改訂された付則の規定は、累積投票を規定しています。 少数株主が取締役候補者を選出する能力を制限します。 |
| ● | 取締役 削除できるのは、正当な理由がある場合のみです。 |
| ● | 私たちの 修正および改訂された定款により、指定されていない優先株が承認されます。その条件は定められている場合があり、 当社の資本金の保有者の承認なしに発行できる株式。そして |
| ● | 特定の 私たちに対する訴訟はフロリダでのみ提起できます。 |
これら 規定により、当社の支配権の変更を伴う取引が妨げられたり、遅れたり、妨げられたりする可能性があります。これらの規定はまた 代理コンテストを思いとどまらせ、あなたや他の株主があなたが選んだ取締役を選出することをより困難にし、私たちに働きかけてください あなたが望むもの以外の企業行動をとること。「資本金の説明」を参照してください。
| 40 |
私たちの 改正および改訂された付則では、実質的にフロリダ州内にある州裁判所を専属管轄裁判所として指定しています。 私たちと株主、および連邦地方裁判所との間のすべての紛争(証券法請求の専属裁判所)、 株主が私たちとの紛争について有利な司法裁判所を得る能力を制限する可能性があります。
私たちの 修正および改訂された細則では、代替フォーラムの選択について書面で同意しない限り、唯一かつ独占的な規定が規定されています (i) 当社に代わって提起されたデリバティブ訴訟または手続き、(ii) 受託者責任違反の申し立てを主張するあらゆる訴訟のフォーラム 現在または以前の取締役、役員、その他の従業員が、当社または当社の株主に支払う義務がある、(iii)以下に従って生じるあらゆる行為 FBCAの任意の規定、当社の修正および改訂された定款、または修正および改訂された細則、または(iv)その他 内務原則が適用される請求を主張する訴訟は、フロリダ州内の州裁判所とします (または、フロリダ州内の州裁判所が管轄権を持たない場合は、中部地区連邦地方裁判所 フロリダ州); ただし、独占フォーラム規定は、によって生じた責任または義務を執行するために提起された訴訟には適用されません 取引法、または連邦裁判所が専属管轄権を有するあらゆる請求に対して。改正および改訂された細則には、 つまり、代替裁判所の選択について書面で同意しない限り、米国連邦地方裁判所が専属管轄となります 証券法に基づいて生じるあらゆる請求の解決のためのフォーラム。証券法では、連邦裁判所と州裁判所が同時に管轄しています 証券法によって生じる義務または責任を執行するために提起されたすべての訴訟を管轄し、当社の株主は権利を放棄することはできません 連邦証券法およびそれに基づく規則と規制の遵守。したがって、かどうかについては不確実性があります 裁判所は、証券法に基づいて生じる請求に関連して書かれたようなフォーラム選択条項を施行します。
によって 当社の株主になると、当社の修正および改訂された条項に通知し、同意したものとみなされます フォーラムの選択に関する細則。改正および改訂された細則のフォーラム条項の選択により、株主の権利が制限される場合があります 当社との紛争について、有利な司法裁判所を得ることができる。さらに、フォーラム選択条項の強制力も 他の会社の規制文書が法的手続きで異議を申し立てられていますが、何かに関連してそれが起こる可能性があります 当社に対して提起された該当する訴訟では、裁判所は、修正および改訂された付則に含まれる法廷条項の選択肢を認める可能性があります そのような行為には適用されないか、法的強制力がないということです。もしそうなら、他の方法でそのような訴訟を解決することに関連して追加費用が発生する可能性があります 当社の事業、経営成績、および財政状態に害を及ぼす可能性のある管轄区域。
証券 または業界アナリストは、当社に関するレポートを定期的に公開しない場合があります。これにより、当社の有価証券の価格や取引量が下落する可能性があります。
その 当社の証券の取引市場は、業界アナリストや証券アナリストが発表する可能性のある調査やレポートの影響を受ける可能性があります。 私たちのビジネス、市場、または競合他社。私たちはこれらのアナリストをコントロールすることはできず、そのようなアナリストがいることを保証することはできません 私たちをカバーするか、有利な補償を提供します。私たちの事業を担当する可能性のあるアナリストのうち、推奨を変更した人がいたら 私たちの有価証券が不利だったり、競合他社に対してより有利な相対的推奨を提供したりすると、私たちの有価証券の価格は おそらく辞退します。私たちの事業を担当する可能性のあるアナリストが取材をやめたり、定期的にレポートを公開しなかったりした場合、私たちは 金融市場での可視性が失われ、ひいては証券の価格や取引量が下落する可能性があります。
私たち は将来、当社の株式をさらに募集する可能性があります。その場合、比例持分が希薄化される可能性があります。
私たち 将来、現在のプロジェクトの資金調達や、その後のプロジェクトの資金調達のために、株式公開を行う必要があるでしょう 引き受けることにしました。追加資金と引き換えに当社の普通株式が発行された場合、1株あたりの価格は以下より低くなる可能性があります 現在の株主が支払ったものです。私たちは、資金を調達するために、引き続き普通株式の株式売却に頼ると予想しています 事業運営。普通株式または普通株式に転換可能な証券を追加発行する場合、あなたのパーセンテージは 私たちへの関心が薄れる可能性があります。
私たち 将来、優先株を発行する可能性があります。これにより、他の会社が私たちを買収することが困難になるか、そうでなければその可能性があります 当社の普通株式の保有者に悪影響を及ぼし、当社の普通株式の価格を押し下げる可能性があります。
私たちの 設立証明書は、私たちが1つ以上の優先株を発行することを許可します。私たちの取締役会が権限を持ちます 優先株の優先権、制限および相対的権利を決定し、優先株を構成する株式の数を確定します 任意のシリーズとそのシリーズの指定。株主によるそれ以上の投票や行動は必要ありません。私たちの優先株が発行される可能性があります 議決権、清算、配当、その他の権利は、当社の普通株式の権利よりも優れています。優先株の発行の可能性 当社の支配権の変更を遅らせたり妨げたりする可能性があり、市場価格よりも割高な価格で当社の普通株式への入札を大幅に思いとどまらせる可能性があります 市場価格、および当社の普通株式保有者の議決権およびその他の権利に悪影響を及ぼします。
| 41 |
私たち 資本金に対する現金配当や分配金の申告や支払いをしたことはありません。現金配当を支払う予定はありません 近い将来、当社の普通株式について。
私たち 資本金の現金配当や分配金の申告や支払いをしたことはありません。私たちは現在、将来の収益を維持するつもりです。 もしあれば、事業を支援し、事業拡大の資金を調達するため、普通株式に現金配当を支払う予定はありません 近い将来。
その 将来の配当金の申告、支払い、金額は、取締役会の裁量で行われ、決定は以下によって異なります。 とりわけ、当社の経営成績、キャッシュフローと財務状況、営業要件と資本要件、その他 取締役会が関連すると考える要因。将来の配当が支払われるという保証はありません。また、もし配当金が 支払済みですが、そのような配当の金額に関する保証はありません。
アイテム 1B。未解決のスタッフのコメント。
[なし]。
アイテム 1C。サイバーセキュリティー。
私たち サイバーセキュリティの脅威に関連する重大なリスクを評価、特定、管理することの重要性を認識しています。このような用語は 規則S-Kの項目106(a)で定義されています。これらのリスクには、とりわけ、業務上のリスク、知的財産の盗難、詐欺などがあります。 強要、従業員への危害、データプライバシーまたはセキュリティ法の違反。
識別します サイバーセキュリティリスクの評価は、当社の全体的なリスク管理システムとプロセスに統合されています。に関連するサイバーセキュリティリスク 私たちのビジネス、技術業務、プライバシー、コンプライアンスの問題は、次のような多面的なアプローチによって特定され、対処されます 第三者評価、内部IT監査、ITセキュリティ、ガバナンス、リスク、コンプライアンスレビュー。サイバーセキュリティの防御、検知、対応のため インシデント、私たちは、とりわけ、システムとアプリケーションのプライバシーとサイバーセキュリティを積極的にレビューし、監査を実施します。 データ、従業員トレーニングの実施、データ保護と情報セキュリティに関連する新しい法律や規制の監視と実施を行います 適切な変更。
私たちの リスク管理プログラムでは第三者のリスクも評価し、第三者によるリスクを特定して軽減するために第三者リスク管理を行っています 当社が第三者のサービスプロバイダーを利用することに関連するベンダー、サプライヤー、その他のビジネスパートナーなどの第三者。サイバーセキュリティー リスクは、該当する第三者サービスプロバイダーおよび潜在的な第三者の選定と監督を決定する際に評価されます 従業員、ビジネス、または顧客のデータを処理および/または処理する際のリスク。
アイテム 2。物件の説明。
私たちの 管理会計事務所はフロリダ州タンパにあります。現在、別のMIRAファーマシューティカルズ社とスペースを共有しています 有効期限が迫っているリース契約で、約2,279平方フィートのオフィススペースをリースしている医薬品開発会社 2025年3月31日に。タンパのオフィスと費用を他の2社と共有しています。当社の本社とエグゼクティブオフィス メリーランド州ボルチモアにあります。約150平方フィートのボルチモアの店舗は、期限が切れる予定のリース契約を結んでいます 2024年4月30日に。満了時にこのリースを更新することはせず、代わりに本社に関連するすべての活動を移管します 前に参照したフロリダ州タンパの共有スペースに。
アイテム 3。法的手続き。
なし
アイテム 4。鉱山の安全に関する開示。
ない 該当します。
| 42 |
一部 II
アイテム 5。登録者の普通株式、関連する株主問題、発行者による株式購入の市場。
市場 情報
私たちの 普通株はナスダック・キャピタル・マーケットに「TELO」のシンボルで上場されており、2024年2月9日に取引が開始されました。
ホルダー 普通株の
として 2024年3月28日現在、当社の普通株式の登録保有者は約70名でした。普通株式には現金配当は支払われていません 現在まで。私たちは現在、さらなる事業発展のために収益を維持するつもりであり、当面は現金配当を支払う予定はありません 未来。
未登録 持分証券の売却と収益の使用
なし
発行者 株式証券の購入
なし
アイテム 6。[予約済み]
| 43 |
アイテム 7。
経営陣の の議論と分析
金融 運用の状態と結果
その 以下の議論と分析は、私たちの経営陣が評価と理解に関連すると考える情報を提供します 当社の経営成績と財務状況。当社の経営成績に関する以下の説明と分析をお読みください と財務状況、当社の財務諸表、関連メモ、および本年度の他の部分に含まれるその他の情報 報告してください。
に 過去の財務情報に加えて、このディスカッションには、現在の予想に基づく将来の見通しに関する記述が含まれています それにはリスクと不確実性が伴います。当社の実際の結果は、次のような将来の見通しに関する記述とは大きく異なる可能性があります 「リスク要因」や「将来の見通しに関する記述に関する注意事項」に記載されているものを含む、さまざまな要因 この年次報告書の他の部分に含まれています。さらに、当社の過去の結果は、必ずしも次のような結果を示すものではありません 将来のどの時期にも予想されます。
[概要]
私たち は、新しい小分子であるテロミル-1の開発と商品化に焦点を当てた前臨床段階の製薬会社です ヒト幹細胞の経口その場治療薬として機能するように開発されています。私たちの最初の焦点は、以下の治療です 治療薬としてテロミル-1の経口投与により、IL-17などの炎症誘発性サイトカインの産生を抑制します その場での幹細胞。私たちの目標は、加齢に伴う治療のためのTELOMIR-1の米国での臨床開発を進めることです 変形性関節症やヘモクロマトーシスなどの炎症性疾患、および化学療法後の回復期。当初の目標は 適応症は、変形性関節症、ヘモクロマトーシス、化学療法後の回復です。
私たち 2023年12月31日、2022年12月31日に終了した年度の純損失はそれぞれ1,310万ドルと85万ドルでした。
逆 株式分割
効果的 2023年12月11日、第2次修正および再表示の提出をもって、発行済普通株式の株式逆分割を完了しました フロリダ州務長官の定款です。その逆に関連して端数株式は発行されていませんし、発行される予定もありません 株式分割、および株式併合によって生じた端数株式はすべて、最も近い整数に切り上げられましたし、今後も切り上げられます。 当社の発行済み新株予約権の行使時に発行可能な株式、および当該新株予約権の行使価格は、以下を反映するように調整されています 株式の逆分割。特に断りのない限り、この年次報告書の株式および1株あたりの情報には、リバースストックが反映されています 分割。
コンポーネント 当社の経営成績の
研究 と開発費
リサーチ および開発費は、当社の製品候補の研究開発を行うためにかかる費用を表しています。私たちはすべての研究を認めています および発生する開発費。研究開発費は主に次のもので構成されています。
| ● | 契約しました 研究と製造; | |
| ● | コンサルティング アレンジメント、そして | |
| ● | その他の 会社の研究開発活動を進めるために発生する費用。 |
私たちの これまで、営業費用は、前臨床研究開発活動への初期投資に関連する費用でした。 TELOMIR-1を臨床試験に進め、臨床試験を進めるにつれて、研究開発費は将来増加すると予想しています。 規制当局の承認を求めるには、臨床試験、規制サポート、契約の費用に多額の投資が必要になります 製造。さらに、追加の製品候補や技術を取得したり、ライセンス供与したりする機会を評価します。 ライセンス料やマイルストーンの支払い、臨床開発の追加により、研究開発費が高くなる可能性があります 費用。
| 44 |
その 規制当局の承認を得るために必要な臨床試験を実施するプロセスには、費用と時間がかかります。私たちはタイムリーに成功することは決してないかもしれません 製品候補の開発と規制当局の承認の達成。私たちの製品候補が成功する確率は 臨床データ、競争、製造能力、商業的存続可能性など、さまざまな要因の影響を受けます。その結果、私たちは 開発プロジェクトの期間と完了費用、またはいつ、どの程度収益を上げるかを決定できません 製品候補の商品化と販売から。
将軍 と管理費
将軍 および管理費には、管理機能のほか、法務費、コンサルティング料、施設費として支払われる費用が含まれます それ以外の場合、研究開発費には含まれていません。訴訟費用には、一般的な企業法務費用とライセンス費用が含まれます。期待しています 上場企業になった結果、規則や規制の遵守に関連する費用を含む、追加費用が発生する SECとナスダック、追加保険、投資家向け広報、その他の管理費と専門サービス。
結果 2023年12月31日および2022年に終了した年度の事業期間
| 12月31日に終了した年度 | ||||||||
| 2023 | 2022 | |||||||
| 収入 | $ | - | $ | - | ||||
| 運用コスト: | ||||||||
| 一般管理費 | 600,192 | 20,941 | ||||||
| 関連当事者の旅費 | 1,767,550% | - | ||||||
| 研究開発費用 | 1,574,306 | 833,206 | ||||||
| 総運用コスト | 3,942,048 | 854,147 | ||||||
| 支払利息 | (1,643,049 | ) | - | |||||
| 債務の消滅による損失 | (7,486,767 | ) | - | |||||
| 普通株主に帰属する純損失 | $ | (13,071,864 | ) | $ | (854,147) | ) | ||
将軍 と管理費。 その年の間に、60万ドルと202万ドルの一般管理費が発生しました それぞれ2023年12月31日と2022年12月31日に終了しました。一般管理費は、コンサルティング料、事務費、家賃費で構成されていました。
関連しています パーティーの旅費。 2023年12月31日に終了した年度に、関係者の旅費として177万ドルが発生しました。ありました 2022年12月31日に終了した同時期には、そのような費用は発生しませんでした。関係者の旅費は、共有リースと共同使用で構成されていました 共通の制御下にあるエンティティを持つ飛行機の。関係者の旅費の増加は、CROとベンダーのサイト訪問によるものです。 それと、IPO関連の取り組み。当社は、2024年3月以降、および規約に従って飛行機の使用には参加しません 契約の内容は、契約に基づくそれ以上の義務にはなりません。
| 45 |
研究 と開発費。 終了した数年間に157万ドル、80万ドルの研究開発費が発生しました それぞれ2023年12月31日と2022年12月31日。2022年と比較して2023年の研究開発費が増加したのは、 2023年の前臨床プログラムの拡大。
メジャー 2023年の研究開発費の構成要素は次のとおりです。
| 研究開発カテゴリー | 経費 | |||
| 毒物学 | $ | 60万人 | ||
| 前臨床研究 | $ | 50万人 | ||
| 研究開発コンサルタント | $ | 40万人 | ||
興味 費用。 2023年12月31日に終了した年度に、160万ドルの支払利息が発生しました。その間はそのような費用はありませんでした 2022年12月31日に終了した同時期です。2023年の支払利息は、信用枠に関連する債務発行費用で構成されていました 資金調達。
損失 債務の消滅について。 転換契約に従い、以下の関連当事者の負債が普通株式に転換されました (2023年12月11日に行われた1対2.05の株式併合を実施した後)、2023年11月30日:ベイ・ショア・ライン のクレジット — 注記4、当社の普通株式674,637株への140万ドルの残高、およびMIRALOGXの残高170万ドルを参照してください。 当社の普通株式837,841株に。ベイショア・ライン・オブ・クレジットとMIRALOGXの残高の転換により、損失が発生しました 2023年12月31日に終了した年度の負債転換額は7,486,767ドルです。
流動性 と資本資源
情報源 流動性の
以来 2021年8月に設立された当社は、主に大手企業との無担保信用枠を通じて事業資金を調達してきました 株主および関連会社、および100万ドルの当社の普通株式の私募により 2023年第1四半期は1株あたり3.73ドルでした(2023年12月11日に行われた1対2.05の株式併合を実施した後)。 私たちは、既存の現金、潜在的な新しい負債源、そして、必要な臨床開発プログラムと運転資金の資金を調達するつもりです。 エクイティ・ファイナンス(2024年2月に行われた新規株式公開による収益を含む)。
オン 2023年6月15日、私たちは創設者のジョニーによって設立された信託であるベイ・ショア・トラストと約束手形およびローン契約を締結しました R・ウィリアムズ・シニア、そして彼の家族の何人かが受益者になっています。この約束手形とローン契約に基づき( 「ベイ・ショア・ノート」)、私たちはベイ・ショア・トラストからいつでも総額500万ドルまで借りる権利があります ベイショアノートの発行2周年、またはそれ以前の場合は、新規株式公開(「IPO」)の完了時。 ベイ・ショア・ノートに基づいて資金を借りる当社の権利は、その資産、事業に重大な不利な変化がないことを条件としています。 または見込み客。ベイシェアノートは、未収利息とともに、発行2周年に支払期日となり、支払われます。 ただし、違約金なしでいつでも前払いできる場合に限ります。ベイ・ショア・ノートには、以下と等しい金利で利息が発生します 手形が未払いの最初の1年間は年率7%、単純利息、その後は年率10%。ザル ベイ・ショア・ノートはセキュリティで保護されていません。2023年11月30日現在、ベイショアノートの未払い額は140万ドルでした。合計 発行済金額は、2023年11月30日に1株あたり2.05ドルの転換レートで674,637株の普通株式に転換されました (2023年12月11日に行われた1対2.05の株式併合を実施した後)。転換契約に基づく。として 2024年2月9日に、契約は終了しました。
以来 2023年1月1日、ベイショア・トラストとスターウッド・トラストが所有する知的財産開発・持株会社であるMIRALOGXは、 創設者が設立した別の信託で、運営資金を調達するためにベイショア・トラストに代わって当社に資金を前払いしています アクティビティ。2023年11月30日現在の前払い金と未払い額の合計は170万ドルでした。これらの前払金は837,841ドルに転換されました 2023年11月30日の1株あたり2.05ドルの転換率での当社の普通株式(1対2.05のリバースを適用した後) 転換契約に基づいて2023年12月11日)に行われた株式分割。
| 46 |
私たち 創業以来、事業から多額の損失とマイナスのキャッシュフローを被っており、それまでにさらに損失が発生すると予想されています 大きな収益と利益を生み出すことができるような時です。営業活動によるマイナスキャッシュフローは約390万ドルでした 2023年12月31日に終了した年度で、2023年12月31日現在の累積赤字は約1,410万ドルです。12月の時点で 2023年31日当社の現金および現金同等物は約001万ドルでした。
私たち 現在、当社の新規株式公開による630万ドルの純収入を考慮すると、当社の現金および現金同等物が予想されます 2024年2月13日に終了したオファリングは、当社の運営、開発計画、および途中の資本支出の資金を調達するのに十分です 2024年の第4四半期まで。そのため、当社が継続企業として存続できるかどうかについては大きな疑問があります。
私たち 20023年12月31日現在、キャンセルできない重要な契約上の義務はありませんでした。
現金 フロー
ザ・ 次の表は、提示された期間の当社のキャッシュフローに関する情報を示しています。
| 2023年12月31日に終了した年度 | 年度終了 2022年12月31日 | |||||||
| 提供した純現金(使用量): | ||||||||
| 営業活動 | $ | (3,859,796 | ) | $ | (468,661 | ) | ||
| 資金調達活動 | 3,859,608 | 470,080 | ||||||
| 現金の純増減額 | $ | (188) | ) | $ | 1,419 | |||
ネット 営業活動に使われた現金
ザル 営業活動に使用された現金は、主に当社の純損失と、買掛金および未払負債の構成要素の変化によるものです。
にとって 2023年12月31日に終了した年度の営業活動では、主に1,310万ドル、つまり0.10ドルの純損失により、390万ドルの現金が使用されました 買掛金、未払費用、前払い費用の100万件の変更を、160万ドルの債務発行費用の償却と7.5ドルで相殺しました 負債の普通株式への転換による100万ドルの損失。買掛金は、研究開発買掛金、家賃で構成されていました と法的費用。
にとって 2022年12月31日に終了した年度では、主に85万ドルの純損失により、営業活動で47万ドルの現金が使用されましたが、 38万ドルの買掛金の変更。買掛金は、研究開発買掛金と家賃費用で構成されていました。
ネット 財務活動によって提供される現金
12月31日に終了した年度については、 2023年、関連当事者からの170万ドルの純借入金、150万ドルの資金調達活動により、390万ドルの現金が提供されました で、関連当事者の与信枠に基づく純借入額。普通株式の売却による100万ドル、繰延株式30万ドルで相殺されました 関連当事者への提供費用と505万ドルの返済。
にとって 2022年12月31日に終了した年度に、財務活動により47万ドルの現金が提供されました。これは、関連事業に支払うべき金額が46万ドルだったためです 当事者、606万ドルの新株予約債権の回収、505万ドルの繰延募集費用で相殺されました。
に 日付、私たちは製品販売による収益を上げていません。そうでない限り、製品の販売から収益が得られるとは考えていません 私たちは、プログラムの前臨床および臨床開発を無事に完了し、規制当局の承認を受け、商品化しました。そして それがいつ起こるか、あるいは起こるかどうかはわかりません。継続的な活動に関連して、経費が大幅に増加すると予想しています。 特に、前臨床活動や研究を進め、臨床試験を開始するときは特にそうです。また、規制を受ければ どんなプログラムでも承認されると、製品の販売、マーケティング、流通に関連する多額の費用がかかると予想されます そのような販売、マーケティング、流通は、潜在的な協力者の責任ではないということです。さらに、の完成により 2024年2月の新規株式公開では、公開企業としての運営に関連する追加費用が発生すると予想しています。その 営業支出のタイミングと金額は、上記の要因によって大きく異なります。
| 47 |
私たちの 資金調達要件、事業支出の時期と金額は、以下を含むがこれらに限定されない多くの要因によって決まります。
| ● | の TELOMIR-1プログラムやその他の開発プログラムの開発の進捗率 | |
| ● | の 現在および将来のその他のプログラムの前臨床試験と臨床試験の範囲、進捗状況、結果、費用 | |
| ● | の 当社が開発する、またはライセンスで供与する可能性のあるプログラムと技術の数と特徴 | |
| ● | の 当社のいずれについても、製造、マーケティング、販売、流通を含む、将来の商品化活動の費用と時期 マーケティングの承認を受けたプログラム | |
| ● | の 米国およびその他の法域で承認された製品について、規制当局の承認を得るために必要な費用(あれば)、 承認が得られた法域の規制当局が要求する可能性のある市販後調査の費用 | |
| ● | の 特許出願の準備、出願、手続き、知的財産権の維持と行使にかかる費用と時期 そして知的財産関連のあらゆる主張を弁護する | |
| ● | の 既存のライセンス契約の継続と、新しいコラボレーションとライセンス契約への参入 | |
| ● | の 事業運営を維持するために発生する費用 | |
| ● | の 臨床、品質管理、製造、その他の科学スタッフを追加雇用する費用 | |
| ● | の 運用、財務、管理情報システムと人員を追加するコスト | |
| ● | の 上場企業になることに関連する費用 | |
| ● | の マーケティングの承認を受けたプログラムの商業販売から受け取った収益(ある場合) | |
| ● | の 競合する技術開発や市場開発の影響と | |
| ● | の ライセンスやコラボレーションの締結を含め、事業、製品、技術を買収または投資する範囲 プログラムの手配。 |
識別します 潜在的なプログラム、製品候補、前臨床研究や臨床試験の実施は時間がかかり、費用がかかり、不確実です 完了するまでに何年もかかるプロセスで、マーケティングの承認を得るのに必要なデータや結果が得られない場合があります。 製品の販売を達成します。さらに、私たちのプログラムは、承認されても商業的に成功しない可能性があります。私たちの商業収入があれば、 何年もの間市販されないと予想される製品の売上から導き出されます(もしあれば)。したがって、必要になります 事業目標を達成するために多額の追加資金を調達するため。
| 48 |
最近 発行および採択された会計宣言
A 当社の財政状態と業績に影響を与える可能性のある、最近発行され採択された会計上の声明の説明 事業内容は、この年次報告書の最後に記載されている財務諸表の注記1に開示されています。
オフバランス シートアレンジメント
中に 提示された期間には、「一般承認」で定義されているオフバランスシート契約はありませんでしたし、現在もありません 会計原則(GAAP)とSEC規則。
まとめ 重要な会計方針の
研究 と開発費
研究 開発費は発生した期間に支出され、契約などの第三者に支払われる費用も含まれます 会社に代わって研究開発活動を行う研究機関やコンサルタント。特許関連の費用、 登録費用、書類作成費用、および申請に関連するその他の弁護士費用を含め、次の期間に支出されます それは彼らが被っています。
使用 見積もりの
その 米国で一般に認められている会計原則に従って財務諸表を作成するには、 会社の経営陣は、報告された資産と負債の金額に影響する見積もりと仮定を行い、 財務諸表の日付における偶発資産と負債、および財務諸表作成中の報告された費用額の開示 報告期間。実際の結果はそのような見積もりとは異なる場合があり、そのような違いは重大なものになる可能性があります。
株式ベースです 補償
その FASB ASC 718の規定に基づき、会社は株式ベースの報酬を計上しています。」報酬-株式報酬」、 これには、従業員、取締役、コンサルタントに対して行われるすべての株式ベースの報奨の報酬費用の測定と認識が必要です 付与日の推定公正価値に基づいています。当社は、付与日における株式ベースの報奨の公正価値を、以下を使用して見積もります ブラック・ショールズモデル。賞金のうち、最終的に権利が確定すると予想される部分の価値は、費用を上回る費用として認識されます 定額制による必要なサービス期間。当社は、株式ベースの報奨金の没収を考慮に入れることを次のように選択しました それらは起こります。
新興国 成長企業選挙
私たち 証券法のセクション2(a)で定義されている「新興成長企業」であり、その利点を活用することを選択しました 新規または改訂された財務会計基準への移行期間が延長されることのメリット。私たちはこれからも活用していくことを期待しています 移行期間の延長によるメリットについてですが、そのような新しいまたは改訂された会計基準を早期に採用することを決定するかもしれません そのような基準で許可されている範囲です。この延長された移行期間は、新規または改訂された会計処理に準拠するために利用する予定です 公開企業と非公開企業で発効日が異なる基準は、私たち(i)が廃止された日付のいずれか早い方までです 新興成長企業、または(ii)JOBS法に規定されている延長された移行期間を肯定的かつ取り返しのつかない形でオプトアウトします。 これにより、当社の財務結果を他の公開会社の財務結果と比較することが困難または不可能になる場合があります 新興成長企業ではないか、長期移行を利用しないことを選択した新興成長企業です 使用される会計基準の潜在的な違いによる期間免除。
| 49 |
に さらに、私たちは、JOBS法で規定されているその他の免除や軽減された報告要件に頼るつもりです。特定の条件に従う JOBS法と適用法の遵守に定められています。新興成長企業として、そのような免除に頼っている場合は 特に必須ではありません。(a) 当社の財務に関する内部統制システムに関する監査人の証明報告書を提出する必要があります 2002年のサーベンス・オクスリー法のセクション404(b)に基づく報告。(b)必要と思われる報酬の開示をすべて提供してください 2010年のドッド・フランク・ウォールストリート改革および消費者保護法に基づく非新興成長公開企業のうち。(c)以下を遵守してください 監査法人の強制ローテーションまたは補足に関して、公開会社会計監視委員会が採用する可能性のあるすべての要件 監査と財務諸表に関する追加情報を提供する監査報告書へ(監査人の議論と分析) と (d) 役員報酬と業績の相関関係など、特定の役員報酬関連の項目を開示してください そして最高経営責任者の報酬と従業員の報酬の中央値の比較。
私たち (a) 2027年12月31日、(b) 会計年度の最終日のいずれか早い方まで、JOBS法に基づく新興成長企業であり続けます 当社の年間総売上高が少なくとも10億7,000万ドルだった年、(c)当社が「大型加速株」と見なされた日 SECの規則に基づく「申告者」、または(d)10億ドルを超える非転換債務証券を発行した日 過去3年間。
アイテム 7A。市場リスクに関する量的および質的開示。
小さい 報告会社はこの項目に必要な情報を提供する必要はありません。
アイテム 8。財務諸表と補足データ。
私たちの 連結財務諸表とその注記、および当社の独立登録公認会計士事務所であるCherry Bekaertの報告書 (PCAOB ID:42)は、このレポートのF-1ページからF-11ページに記載されています。
アイテム 9。会計と財務情報開示に関する会計士の変化と意見の相違。
[なし]。
アイテム 9A。統制と手順。
評価 開示管理と手続きの
私たち 開示管理と手続きを維持してください。このような用語は、取引法の規則13a-15(e)と15d-15(e)で定義されています。の下に 監督し、最高経営責任者や最高財務責任者を含む経営陣の参加を得て、評価を行いました 取引所の規則13a-15および15d-15に基づく当社の開示管理と手続きの設計と運用の有効性 行為。その評価に基づいて、当社の最高経営責任者兼最高財務責任者は、当社の開示管理と手続きについて結論付けました 2023会計年度末の時点では有効ではありませんでした。
| 50 |
財務報告の内部統制に関する経営陣の年次報告書
これ 年次報告書には、財務報告に対する内部統制に関する経営陣の評価報告書や証明書は含まれていません 証券取引所の規則によって定められた移行期間による、会社の登録公認会計士事務所の報告書 新規上場企業の手数料。
変更 財務報告の内部統制
そこに 2023年12月31日に終了した年度中に発生した、財務報告に関する当社の内部統制における実質的な変更はありませんでした 財務報告に関する当社の内部統制に影響を受ける、または重大な影響を与える可能性がかなり高い。
アイテム 9B。その他の情報。
[なし]。
アイテム 9C。検査を禁止する外国の管轄区域に関する開示
ない 該当します。
| 51 |
一部 III
アイテム 10。取締役、執行役員、コーポレートガバナンス。
私たちの 本報告書の日付現在の取締役および執行役員とその年齢は以下の通りです:
| 名前 | 年齢 | ポジション | ||
| クリストファー チャップマン・ジュニア、MD | 71 | チーフ 執行役員兼会長 | ||
| ネイゼン フエンテス、公認会計士 | 41 | チーフ 財務責任者、会計、秘書 | ||
| クリストス ニコロウディス弁護士 | 34 | 将軍 カウンセルとディレクター | ||
| マイケル ドイツ、公認会計士 | 40 | ディレクター | ||
| ブラッド クルーニッヒ | 44 | ディレクター | ||
| クレイグ イーグル、メリーランド州 | 56 | ディレクター | ||
| タルヒア タック | 45 | ディレクター | ||
| ヒュー マッコール三世 | 63 | ディレクター | ||
| 博士 マイケル・ロイゼン | 77 | キー 年齢逆転に関するアドバイザー |
ザ・ 以下は、現在の各執行役員と取締役の簡単な経歴です。
エグゼクティブ 役員と取締役
クリストファー チャップマン・ジュニア、MD 2022年11月付けで当社の最高経営責任者兼会長に任命されました。チャップマン博士 また、上場企業であるMyMD Pharmaceuticals, Inc.(ナスダック:MYMD)の社長、最高医療責任者、取締役も務めています。 臨床段階の医薬品開発会社(「MyMD」)。チャップマン博士は以前、社長兼最高医療責任者を務めていました 2020年11月1日付けでMyMDファーマシューティカルズ(フロリダ)株式会社(「MyMDフロリダ」)の役員。私のMDフロリダは MYMDの合併による前身です。MyMD Floridaに入社する前、そして1999年以来、チャップマン博士は最高経営責任者も務めています。 製薬会社や製薬会社をサポートするコンサルティング組織、チャップマンファーマシューティカルコンサルティング社の役員 製品の安全性、ファーマコビジランスなどの問題に取り組んでいる北米、ヨーロッパ、日本、インド、アフリカのバイオテクノロジー企業、 医療機器、臨床試験、規制問題。チャップマン博士は、医療事務、医薬品安全および医療のディレクターを務めました 1995年から2003年まで、クインタイルズ(現在はIQVIAとして知られています)のライティング部門。チャップマン博士は取締役も務めました 2007年から2016年までのロッククリークファーマシューティカルズ株式会社(旧スターサイエンティフィック社)の取締役(取締役を含む) 2007年から2014年までは監査委員会、2007年から2014年までは報酬委員会委員長、執行委員長 2007年から2014年までの調査委員会。チャップマン博士は経験豊富な経営幹部であり、グローバルな医療専門家であり、幅広い経験を持っています 成人と小児の両方を対象とした進行中の臨床試験のモニタリングと監督を行っています。チャップマン博士も 募集のために設立されたIRSセクション501(c)(3)の非営利団体であるチャップマン製薬健康財団の創設者 公的資金と、エイズ、糖尿病、高血圧、ループス、鎌状赤血球貧血、マラリアなどの医療ニーズを支援します 結核、2006年に組織されました。チャップマン博士は、非営利ファイナンシャル・スチュワードシップのエグゼクティブ・サーティフィケートを取得しました 2020年のハーバード・ケネディスクール。チャップマン博士は1987年にワシントンDCのジョージタウン大学で医学博士号を取得し、 内科のインターンシップ、麻酔科の研修医、心臓血管と産科のフェローシップを修了しました。 ジョージタウンの麻酔科。また、公務員としてMIRAファーマシューティカルズ株式会社(ナスダック:MIRA)の会長も務めました。 取引のある前臨床医薬品開発会社。私たちは、チャップマン博士が当社の取締役の1人を務める資格があると信じています 製薬およびバイオテクノロジー業界での経営経験と、医療の専門知識。チャップマン博士の 最近の出版物には2つのポスター発表があります。1)英国免疫学会、英国リバプール、2022年12月5日から8日 薬理学です とMYMD-1の臨床プロファイル® (イソミオサミン)は、交配効果のある経口選択的次世代TNF-α阻害剤です 血液脳関門 と2)毒物学会、テネシー州ナッシュビル、2023年3月19〜22日、 自然に生まれる小説 治療薬 とTNF-αの経口選択的阻害剤、 私のMD-1® (イソミオサミン)、 はるかに コラーゲン抗体誘発性関節炎のマウスモデルにおける炎症と病気の重症度を軽減しました。さらに、チャップマン博士 Drug Researchに原稿を出版しました。「二重盲検、プラセボ対照、無作為化、単回投与、漸増投与、複数回投与 健康な成人を対象とした経口用イソミオサミンカプセルの安全性、耐容性、および薬物動態を評価するための第1相試験 主題」(ブラガー、J.、チャップマン、C.、ダン、L.、カプリン、A.(2023)。二重盲検、プラセボ対照、無作為化、単盲検査 経口投与イソミオサミンの安全性、耐容性、および薬物動態を評価するための段階的および複数回投与の第1相試験 健康な成人を対象としたカプセル。 薬物研究、 73(2)、95—104。https://doi.org/10.1055/a-1962-6834)。フロンテージ・ラボラトリーズのダニエル・R・ベイカー博士が、「テロミール1はテロメアを誘発します」というタイトルのポスターを発表しました。 シンガポールで開催された健康長寿センター(CHL)カンファレンス2024で、「ヒト原発性細胞株の拡張」が発表されました。 クリス・チャップマン、MD、ジェナ・ブラガー、Ph.D.、ニコラス・ノビレッティ、 博士号。 スティーブン・ガチェル博士
| 52 |
ネイゼン フエンテス、公認会計士、 2023年9月21日に最高財務責任者、会計、秘書として当社に入社しました。提供する前に フエンテス氏は、当社の最高財務責任者、財務責任者、秘書として、中堅企業のプライベートエクイティ支援企業で働いてきました スペシャリティヘルスケア業界(2023年5月から9月までエマージェンス・ヘルス・ホールディングスに最高財務責任者を務めたことも含む) 2023; 2022年7月から2023年5月までダイバージェント・デンタル・グループの最高財務責任者を務め、ファミリー・ファーストの最高財務責任者を務めました 2019年から2022年7月までは在宅医療、2017年から2019年までは皮膚科医療パートナーズの最高財務責任者兼パートナーを務めました。彼 また、2013年から2017年までGlytecのコントローラーを務め、2012年から2013年までプライスウォーターハウスクーパースで経験豊富なアソシエイトを務めました。 プライスウォーターハウスクーパースでの経験を積む前は、住宅建設会社でさまざまな管理職を歴任しました。フエンテス氏は経験があります 投資家向け広報活動、人的資源を管理しながら、レバレッジの高い環境での買収と有機的成長の取り組みを主導します。 財務、会計、収益サイクル機能。フエンテス氏はフロリダ大学でマーケティングの理学士号を取得しています そして彼はフェアフィールド大学で会計学の理学修士号を取得しました。フエンテス氏は公認会計士です。
クリストス ニコロウディスさん 2023年8月11日に取締役および法務顧問として当社に入社しました。彼は当初、以下の人に任命されました 当社と筆頭株主であるベイ・ショア・トラストとの間の、指定代表者としての役割を果たすという契約 ベイショア・トラストの取締役会に参加しています。また、MIRAファーマシューティカルズ社の取締役会のメンバーも務めました。 (ナスダック:MIRA) 上場企業です。Nicholoudis氏は、自身の事務所である法律事務所で実務経験のある弁護士です クリストス・ニコルディスPLLCは、2022年2月以来、契約、仕事、個人を含む幅広い法的問題を扱っています。 傷害、不動産、遺言信託、不動産、刑法。その前に、2019年7月から2022年の2月まで、ミスターさん ニコロウディスは、フロリダ州に12年の公選弁護人として雇われました番目の 司法巡回裁判所と2012年7月から 2020年2月、ニコルディス氏はコルテス・ロードハウス合同会社のレストランフランチャイズを所有・運営していました。ニコロウディス氏は2012年です コーネル大学ホテル管理学部を卒業し、ホスピタリティの学士号を取得し、2017年に同大学を卒業しました。 ステットソン・カレッジ・オブ・ローで法務博士号を取得しました。彼はニューヨーク、フロリダ、テキサス、ワシントンDCの弁護士資格を取得しています。 私たちは、Nicholoudis氏が法務経験と訓練、そして、彼の法務経験と訓練に基づいて、当社の取締役の1人を務める資格があると考えています 多様な経営経験。
マイケル ドイツ、公認会計士 2023年11月に取締役として入社しました。また、インヒビターの取締役会のメンバーも務めています セラピューティクス株式会社(OTC: INTI)。ジャーマン氏は、会計と財務を専門とするホーリーウェル・パートナーズのマネージング・パートナーを務めてきました。 2019年5月からコンサルティング会社で、複数のプライベートエクイティに裏打ちされた企業に最高財務責任者やその他のサービスを提供してきました エネルギー、SaaS、製造業界で。ホーリーウェル・パートナーズでの職務に就く前は、米国のPwCで取締役を務めていました。 2007年1月から2019年8月まで英国で、2003年7月から2015年6月まで米国空軍のキャプテンを務めました。彼はグローバルを率いてきました 小売、消費財、エネルギー、公益事業と鉱業、運輸業の業界における公的および私的クライアントの関与 ロジスティクス。ジャーマン氏は、クライアント・エクイティとデット・オファリング、上場を含む企業結合、企業結合において豊富な経験があります と報告要件、初期評価と継続的なのれん減損分析、株式ベースの報酬、リストラクチャリング、グローバル 税金、利害関係者の管理、特に年次および四半期ごとの取締役会と経営陣のプレゼンテーションの経験があります 要件、手数料交渉、技術的な会計と財務の議論、詐欺とコンプライアンス違反の調査。ドイツマンさん は、迅速なプロジェクトの動員と緊急問題のための熟練した人材の配備、設計、実施を専門としています 小規模から大規模の保証要件とアドバイザリープロジェクト。ジャーマン氏のその他の経験には、PwCを率いたことが含まれます データ収集の方法とツール、クライアントの獲得、および新しいSOX準拠の統制計画の実装を含むシステム実装 複数のシステムにまたがって、共同ソースの内部監査プロジェクトを主導し、PwCのリーン効率化イニシアチブの推進に費やした時間。 ジャーマン氏は、複雑なヨーロッパとEMEA地域をサポートするSEC PCAOB品質グループのPwCナショナルオフィスのメンバーでした。 会計と監査の相談。彼はサウスフロリダ大学で会計学の学士号を、サウスフロリダ大学で会計学の修士号を取得しています タンパ大学、オックスフォード大学で経営学修士号を取得しています。
| 53 |
ブラッド クルーニッヒ 2022年11月に取締役として当社に入社しました。また、MIRAファーマシューティカルズ株式会社(ナスダック:MIRA)の取締役会のメンバーを公務員として務めたこともあります。 取引会社。2000年以来、クルーニッヒ氏の主な職業は 世界をリードするファッションモデルの一人として活躍してきました。クルーニッヒ氏はラルフ・ローレン、ザ・ギャップ、トミー・ヒルフィガー、シャネルの顔でした。 フェンディ、ピーターミラー、その他多くのトップブランド。models.comは2004年から2006年にかけて彼を世界で #1 の男性モデルにランク付けし、ヴォーグ誌もランク付けしました。 彼を史上の #3 男性モデルにランク付けしました。クローニッヒ氏はまた、多くの民間企業や初期段階でビジネスおよび戦略のコンサルタントを務めています。 企業。コンサルティング事業の一環として、経営陣の構築と関係の管理について企業に助言しています。 投資家と。Kroenig氏は経験豊富な投資家であり経営幹部であり、経営幹部レベルとのコラボレーションにおいて豊富な経験があります。 とクロスファンクショナルチーム、ビジネス状況の分析、実践的な投資家戦略の開発と実施。クルーニッヒさん NCAAディビジョンIサッカー奨学金でフロリダ国際大学に通いました。私たちは、Kroenig氏のビジネス経験を信じています モデル業界で経営幹部として活躍したことで、彼は当社の取締役の1人を務める資格があります。
クレイグ イーグル、メリーランド州 2022年11月に取締役として当社に入社しました。また、2021年4月16日からMyMDのディレクターも務めています。博士 イーグルは現在、2021年からガーダントヘルス社の最高医療責任者を務めています。以前、イーグル博士は腫瘍学担当副社長でした ジェネンテックで、ジェネンテックのオンコロジーポートフォリオ全体の医療プログラムを監督していました。現在の役職に就く前は、イーグル博士 2009年から2019年までファイザーでいくつかの役職を歴任しました。その中には、英国とカナダでオンコロジー事業の責任者を務めたものも含め、 ニューヨークを拠点とするオンコロジー・ストラテジック・アライアンス・アンド・パートナーシップのグローバル・リーダー、オンコロジー・セラピューティック・エリア・グローバルの責任者を務めています 米国のオンコロジー医療事業を含む、メディカル・アンド・アウトカムズ・グループ。イーグル博士はファイザーでの複数の役職を通じて、大きな業績を上げました 事業を成長させ、複数の戦略的買収や事業売却に携わっていました。さらに、ファイザーにいる間、イーグル博士は監督しました 広範なオンコロジー臨床試験プログラム、ファイザーのオンコロジーポートフォリオ全体にわたる複数の規制当局および支払者の承認、健康 国立がん研究所(NCI)などの主要なグローバル研究機関とのアウトカム評価と科学的協力、そして 欧州がん研究治療機構(EORTC)で、以下を含むいくつかの化合物の世界的な開発を主導しました セレコキシブ、アロマシン、イリノテカン、ダルテパリン、オザゴマイシン。イーグル博士は現在、取締役会のメンバーおよび議長を務めています 非公開のライフサイエンス企業であるPierian Biosciencesの科学政策委員会の。イーグル博士は医学部に通っていました オーストラリアのシドニーにあるニューサウスウェールズ大学に通い、ロイヤル・ノースショア病院で一般内科医の研修を受けました シドニー。彼はシドニーのロイヤル・プリンス・アルフレッド病院で血液腫瘍学と検査血液学の研修を修了し、学位を取得しました 王立オーストラリア医科大学(FRACP)とオーストラリア王立病理学会(FRCPA)のフェローシップ。彼の後 トレーニング中、イーグル博士はロイヤルプリンスオブウェールズ病院で血小板を抑制する新しいモノクローナル抗体を開発するための基礎研究を行いました 製薬業界に移る前に。イーグル博士が当社の取締役を務める資格には、彼の長年の経験と 国際製薬業界で成功を収めた経歴、ビジネスの成長、戦略などの分野での上級管理職の経験 アライアンス、合併、買収取引、ヘルスケアの上場企業と非公開企業の両方の取締役会のメンバーとしての彼の経験 とライフサイエンス業界、そして彼の豊富な腫瘍学の経験(科学研究、規制の指導や参加を含む) 治療分野の化合物の価格設定と償還交渉。
タルヒア タック 2022年11月に取締役として当社に入社しました。彼女は2021年11月1日からMIRAのディレクターも務めています。 彼女は10年以上高等教育分野で働いてきました。直近ではアシスタントディレクターを務めました。 2024年のジョージタウン法科大学院への入学。2019年から2023年まで、タックさんはジョージタウン大学ロースクールのプロジェクトディレクターでした 地域安全イノベーションセンター(旧イノベーティブ・ポリシング・プログラム)では、新しいアプローチを探っています 警察における長年の問題。タックさんは、2016年から2019年までジョージタウン大学で入試担当アソシエイトディレクターを務めました。 そこで彼女は学部への出願を評価し、いくつかの入学委員会の議長を務めました。2016年以前は、タックさん Starのコミュニケーションおよび投資家向け広報担当副社長として、投資関係およびコミュニケーションの分野で働いていました Scientific, Inc.(OTC:STSC)では、株主、金融界とのコミュニケーションの調整を担当していました。 とメディア。彼女はまた、ロープス&グレイ・ニュー・オルタナティブ・プログラムに参加したので、法律業界での経験もあります メリーランド州モンゴメリー郡州検事局のフェローとして、その後企業で働きました ワシントンDCのRopes & Gray LLPの部署。ロースクールに通う前は、タックさんはMSNBC、NBCでジャーナリストでした。 ニュース、ABCニュース、CBS系列のWINK-TVで、ハーバード大学のハーバード大学で入学担当官として働いていました。彼女 また、2000年7月から2001年4月まで、ゴールドマン・サックスの投資管理部門の財務アナリストを務めました。私たち タックさんは公共政策と投資関係の経験を持っているので、当社の取締役の1人を務める資格があると思います。 彼女はハーバード大学で学士号を取得しました。 優等生です、ハーバード大学ロースクールで法務博士号を取得しました。私たち タックさんは公共政策と投資関係の経験を持っているので、私たちの社員になる資格があると思います 取締役。
| 54 |
ヒュー マッコール三世 2022年11月に取締役として当社に入社しました。マッコール氏は、2010年からファンド・オブ・ファンドであるコルウィック・キャピタルLLCの共同マネージング・メンバーとして、またマネージング・メンバーを務めています。 2006年から家族投資事務所であるマッコール・ブラザーズ・ロックウッド合同会社のメンバー。2015年6月以来、彼はでシニアアドバイザーを務めています ブラウン・ブラザーズ・ハリマン・キャピタル・パートナーズでは、調達、投資評価、取引実行、投資後のサービスを支援しています。 ポートフォリオ企業への付加価値監視。Collwick Capital LLCを共同設立する前、マッコール氏はヘッジファンド業界で14年間過ごしました。 ラウンド・テーブル・インベストメント・マネジメントとマッコール・ブラザーズ・ロックウッドLLCのプライベート・インベストメント・ポートフォリオ・マネージャーを務めていましたが、 M&Mパートナーズ合同会社の最高執行責任者で、マッコール・パートナーズ合同会社の最高経営責任者でした。マッコール氏は奉仕してきました 2019年からヘリテージ・ブランズ社、2021年からフォロ・ホールディングス社、2022年からウェストロック・コーヒー・カンパニーの取締役を務めています。マッコール氏は学士号を取得しました 1982年にノースカロライナ大学チャペルヒル校で経営学を学び、バージニア大学で経営学修士号を取得しました 1987年のダーデン・スクール・オブ・ビジネス。私たちは、McColl氏の投資管理と経営経験が彼にふさわしいと信じています 私たちの取締役会のメンバーを務めてください。私たちは、McColl氏の投資管理と経営経験が適格だと考えています 彼は私たちの取締役会のメンバーになる予定です。
キー 年齢逆転に関するアドバイザー
博士 マイケル・ロイゼン 2023年11月30日から当社の顧問を務めています。2007年以来、ロイゼン博士はチーフを務めています クリーブランド・クリニックのウェルネス・オフィサー(2019年2月から名誉最高健康責任者を務めたほか、ウェルネス・インスティテュートも務めています) 2007年6月から議長を務めています。また、クリーブランド・クリニック・ラーナー医科大学の医学教授でもあります。ロイゼン博士が開発しました 「RealAge」のコンセプトで、ニューヨークタイムズのベストセラーでナンバーワンの5本を執筆または共同執筆しています。彼は165件以上のピアレビューを受けています 出版物と100の医学章、14の米国特許、彼はいくつかの会社を設立し、FDA諮問委員会に参加しています 16年間、FDA諮問委員会の議長を務めました。彼は1967年にウィリアムズ大学で化学と経済学の学士号を取得しました。 そして彼はカリフォルニア大学サンフランシスコ校医学部に通い、ハーバード大学のベス・イスラエルで研修を行いました。 デコネスメディカルセンター。彼はカリフォルニア大学サンフランシスコ校の教員として9年間過ごし、学部の議長を務めました。 シカゴ大学で16年間麻酔、救命救急および疼痛管理を学び、シカゴ大学の学部長を務めました ニューヨーク州立大学アップステート校の医学および生物医科学担当副学長。
理事会 構成
私たちの 事業と業務は、現在7人のメンバーで構成されている取締役会の指示の下で管理されています。番号 取締役の数は、修正および改訂された定款の条件に従い、取締役会によって決定されます。 細則当社の取締役会は引き続き7人のメンバーで構成され、取締役は1年の任期で選出されます。
ファミリー リレーションシップ
そこに 当社の取締役や執行役員の間には家族関係はありません。
ディレクター 独立
私たちの 取締役会は、各取締役の独立性の見直しを行いました。各取締役から提供された情報に基づいて 彼または彼女の経歴、雇用、所属、当社の取締役会は、マイケル・ジャーマン、タヒア・タック、クレイグ博士を決定しました イーグルとヒュー・マッコール3世は、独立した判断を行使して実行することを妨げるような関係はありません ナスダック上場規則に基づく取締役および独立取締役の責任。
に これらの決定を下す際に、当社の取締役会は、各非従業員取締役の現在および以前の関係を検討しました 当社および取締役会が独立性の判断に関連するとみなしたその他すべての事実と状況を考慮して この年次報告書の「特定の関係および関連当事者取引」というタイトルのセクションに記載されている取引。
| 55 |
委員会 取締役会の
私たちの 取締役会は、監査委員会、報酬委員会、指名・コーポレートガバナンス委員会を設置しています。ザ・ これらの委員会の機能は以下のとおりです。メンバーは、辞任するまで、または辞任するまで、これらの委員会に参加します 取締役会によって決定されます。当社の取締役会は、必要または適切と判断した他の委員会を設置することがあります 時々。
監査 委員会
その 監査委員会は、2024年2月9日の新規株式公開の発効時に設立され、マイケル・ジャーマンで構成されています。 ヒュー・マッコール3世、ブラッドリー・クルーニッヒ、マイケル・ジャーマンが監査委員会の委員長を務めています。各メンバーは要件を満たしています ナスダックの上場基準およびSECの規則および規制(証券取引法に基づく規則10A-3(b)(1)を含む)に基づく独立性については。 監査委員会の各メンバーは、ナスダックの上場基準の金融リテラシー要件を満たしています。さらに、私たちの取締役会は の取締役が、ジャーマン氏が規則S-Kの項目407(d)の意味における監査委員会の財務専門家であると判断しました 証券法の下で。
ザ・ 監査委員会の主な目的は、当社の企業会計と財務報告プロセスを監督することです。私たちの監査委員会は とりわけ、次のことに責任を負ってください。
| ● | 選択する 当社の財務諸表を監査する独立登録公認会計士事務所としての役割を果たす資格のある会社 | |
| ● | 手伝います 独立登録公認会計士事務所の独立性と業績を確保するため。 | |
| ● | 話し合う 独立登録公認会計士事務所による監査の範囲と結果、およびレビュー、経営陣と 独立登録公認会計士事務所、当社の中間および期末の経営成績 | |
| ● | 開発中 疑わしい会計や監査事項について、従業員が匿名で懸念事項を提出するための手続き | |
| ● | レビューしています リスク評価とリスク管理に関する当社の方針。 | |
| ● | レビューしています 関連当事者取引; | |
| ● | レビューしています そして、必要に応じて、独立登録市民が行うすべての監査およびすべての許容される非監査サービスを事前に承認します 会計事務所、そして | |
| ● | アシストします 当社の取締役会は、内部監査機能のパフォーマンスを監視しています。 |
私たちの 監査委員会は、SECの適用規則と上場基準を満たす書面による憲章に基づいて運営されています ナスダックの。そのコピーは、当社のウェブサイト(www.telomirpharma.com)で入手できるようになります。
報酬 委員会
その 報酬委員会は2024年2月9日の新規株式公開の効力発生時に設立され、タリヤから構成されています。 タック、マイケル・ジャーマン、クレイグ・イーグル。タリア・タックが報酬委員会の委員長を務めています。委員会の各メンバー ナスダックとSECの規則と規制の上場基準に基づく独立性の要件を満たしています。私たちの報酬の各メンバー 取引法に基づいて公布された規則16b-3または規則16b-3に従って定義されているように、委員会は非従業員取締役でもあります。到着時に これらの決定時に、当社の取締役会は、報酬委員会のメンバーがいるかどうかの決定に関連するすべての要素を検討しました そのメンバーが持ち運びに関して経営陣から独立するうえで重要な、私たちと関係がありました 報酬委員会メンバーとしてのそのようなメンバーの義務について。
| 56 |
ザ・ 報酬委員会の主な目的は、役員の報酬と福利厚生に関する方針を検討し、推奨することです と従業員。私たちの報酬委員会は、とりわけ次のことを担当しています。
| ● | レビュー中、 報酬と報酬の取り決めに関する承認、決定、または取締役会への勧告 当社の執行役員の。 | |
| ● | 管理します 私たちの株式報酬制度。 | |
| ● | レビューしています そして、インセンティブ報酬と株式報酬プランを承認するか、取締役会に勧告します。 と | |
| ● | 確立します そして、従業員の報酬と福利厚生に関する一般的な方針を見直しています。 |
私たちの 報酬委員会は、SECと上場企業の適用規則を満たす書面による憲章に基づいて運営されます ナスダックの基準。そのコピーは当社のウェブサイトで入手可能です。
推薦します とコーポレートガバナンス委員会
ザ・ 2024年2月9日の新規株式公開の発効時に、指名およびコーポレートガバナンス委員会が設立されました。 タヒア・タック、ブラッドリー・クルーニッヒ、クレイグで構成され、タヒア・タックがノミネートとコーポレートガバナンスの議長を務めています 委員会。委員会の各メンバーは、ナスダックとSECの規則の上場基準に基づく独立性の要件を満たしています。 規制。
私たちの 指名委員会とコーポレートガバナンス委員会は、とりわけ次のことを担当します。
| ● | 識別します、 取締役会への選挙候補者の評価、選出、または取締役会への推薦を行います とその委員会; | |
| ● | 開発中 そして、取締役会とその委員会の年次評価を監督しています。 | |
| ● | 検討しています そして、取締役会とその委員会の構成について取締役会に勧告をしています。 | |
| ● | 監督します 私たちのコーポレートガバナンス慣行。そして | |
| ● | 作ります コーポレートガバナンスガイドラインに関する取締役会への提言。 |
私たちの 指名およびコーポレートガバナンス委員会は、該当する上場基準を満たす書面による憲章に基づいて運営されます ナスダック、そのコピーは当社のウェブサイトで入手できるようになります。
報酬 委員会インターロックとインサイダー参加
何もありません の報酬委員会のメンバーが、当社の現在または以前の執行役員または従業員です。私たちの幹部は誰もいません 役員は、当社の報酬を担当する執行役員が1人以上いる事業体の報酬委員会のメンバーです 委員会。
| 57 |
リスク 監督
一つ 取締役会の主な機能の1つは、リスク管理プロセスの情報に基づいた監視です。私たちの取締役会が管理します この監督は、取締役会全体、および取締役会のさまざまな常任委員会を通じて直接機能します それぞれの監視領域に内在するリスクに対処します。特に、私たちの取締役会は監視する責任があります そして、サイバーセキュリティとデータ保護に関連するリスクを含む戦略的リスクの評価を行い、当社の監査委員会は 私たちの主要な財務リスクを考慮する責任と、経営陣がそれらを監視および管理するために取った措置を検討する責任です リスク評価と管理を行うプロセスを規定するガイドラインやポリシーを含む公開情報。私たちの監査委員会 財務諸表に重大な影響を与える可能性のある法律、規制、コンプライアンス事項を検討します。私たちの推薦 そして、コーポレートガバナンス委員会は、当社のコーポレートガバナンス慣行の有効性を、それらが成功しているかどうかも含めて監視します 違法または不適切な責任創出行為の防止に役立ちます。当社の報酬委員会が、当社の報酬のいずれかを評価し、監視します ポリシーやプログラムは、過度のリスクテイクを助長する可能性があります。一方、各委員会は特定の評価を担当しています リスクとそのようなリスクの管理を監督するために、委員会の報告を通じて取締役会全体に定期的に通知されます そのようなリスクについて。
ボード 多様性
私たちの 指名委員会とコーポレートガバナンス委員会が、毎年、取締役会で審査する責任があります。 取締役会全体および個々のメンバーに必要な、適切な特性、スキル、経験。とはいえ 私たちの取締役会には、取締役候補者の評価に関する正式なダイバーシティポリシーが書かれていません。 取締役候補者の評価では、指名およびコーポレートガバナンス委員会が、以下を含むがこれらに限定されない要素を検討します。 性格、誠実さ、判断、潜在的な利益相反、その他の約束、多様性に関する問題、そして多様性に関しては 性別、人種、民族、経験、専門分野、その他の個人の資質や属性などの要素 取締役会に代表される視点や経験の多様性に貢献します。
その 指名およびコーポレートガバナンス委員会は、取締役会の多様性に関するナスダックの新しい規則(「ナスダック」)を確実に遵守します。 多様性ルール」)、ナスダック多様性ルールで義務付けられている日付またはそれ以前。ナスダックの多様性ルールでは、以下の条件を満たす必要があります 当社の普通株式はナスダック・キャピタル・マーケットに上場しており、私たちは小規模な報告会社です。 少なくとも2人の取締役が取締役を務めています。そのうちの少なくとも1人は女性で、2人目は女性です 2026年12月31日までに、女性、過小評価されている少数派、またはLGBTQ+であること。ただし、取締役会が5人以下の取締役で構成されている場合は除きます。
コード ビジネス行動と倫理の
私たちの 取締役会は、すべての取締役、役員(社長を含む)に適用されるビジネス行動と倫理の規範を採用しています 執行役員、最高財務責任者、最高会計責任者)、および該当するすべてのグローバル従業員 ナスダック・キャピタル・マーケットの連邦証券法とコーポレートガバナンス規則。私たちのビジネス行動規範と倫理規定は 私たちのウェブサイトで利用可能です。ビジネス行動規範と倫理規範の改正、またはその要件の放棄は、必要に応じて 当社のウェブサイトで公開されます。
コーポレート ガバナンスガイドライン
私たちの 取締役会はコーポレートガバナンス・ガイドラインを採用しました。そのコピーは当社のウェブサイトで入手できるようになります。
ディレクター 報酬
私たち 2023年12月31日に終了した年度中、どの取締役にも現金または株式報酬を提供しませんでした。彼らの立場では 取締役、そして私たちはまだ取締役の報酬プログラムを採用していません。
アイテム 11。役員報酬。
これ セクションでは、以下の人を対象とした役員報酬プログラムの重要な構成要素について説明します。(i) 役を務めるすべての人 2023年の当社の主要執行役員と、(ii)報酬を受けた他の執行役員の中で最も報酬の高い役員 2023年の間に少なくとも10万ドルを持っていて、2023年12月31日に執行役員を務めていた人。私たちはこれらの人々を私たちの「名前付き」と呼んでいます 執行役員」とその役職は次のとおりです。
| ● | クリストファー チャップマン・ジュニア、MD、最高経営責任者兼会長。そして | |
| ● | ネイゼン フエンテス、最高財務責任者、会計、秘書。 |
| 58 |
まとめ 報酬表
その 次の表は、2022および2021会計年度中に当社が指名された執行役員に支払った報酬を示しています。示されているとおり 以下では、2021年または2022年の間に、当社の指名された執行役員に支払われた報酬はありませんでした。報酬の説明については 2022年以降の指名された執行役員向けのプログラムについては、以下の「—役員報酬制度」を参照してください。
| 氏名と主たる役職 | 年 | 給与 | ボーナス | ストックアワード | オプションアワード | その他すべての報酬 | 合計 ($) | ||||||||||||||||||||
| クリストファー・チャップマン・ジュニア、MD | 2023 | $ | - | - | - | - | - | $ | - | ||||||||||||||||||
| 最高経営責任者兼会長 | 2022 | $ | - | - | - | - | - | $ | - | ||||||||||||||||||
| ネイセン・フエンテス (1) | 2023 | $ | 18,192 | - | - | - | - | $ | 18,192 | ||||||||||||||||||
| 最高財務責任者、会計、秘書 | 2022 | $ | - | - | - | - | - | $ | - | ||||||||||||||||||
| (1) | さん フエンテスは、2023年9月21日付けで最高財務責任者、会計、秘書に任命されました。 |
エグゼクティブ 報酬の取り決め
下に は、指名された執行役員に関連する現在の役員報酬プログラムの要素をより詳細にまとめたものです。
雇用 契約
クリストファー チャップマン・ジュニア、MD
私たち チャップマン博士と雇用契約を締結しました。これは、以下の通り、この新規株式公開の終了日から発効します。 チャップマン博士は当社の最高経営責任者および取締役会の議長を務めます。彼の雇用契約に基づき、 チャップマン博士は、当社の業務に関して、必要に応じてパートタイムで働くことに同意します。チャップマン博士の雇用 契約では、彼の雇用は随意に行われ、チャップマン博士または私たちのどちらかがいつでも解雇できると規定されています。 原因。この契約に基づき、チャップマン博士には、最初の基本給の終了時から年間275,000ドルの初期基本給が支給されます。 2024年2月13日に行われた公募です。チャップマン博士の雇用が当社によって終了された場合 「原因」、または「正当な理由」でチャップマン博士によって解雇された場合、チャップマン博士は退職金を受け取る権利があります 3か月間の給与継続という形で(チャップマン博士が慣習的な将軍の執行と派遣を条件とします) 会社に有利なリリース)。契約書の「原因」には、不正直、不正流用、故意の違法行為が含まれると定義されています。 契約違反、およびその他の慣習的な問題。「正当な理由」とは、博士の重大な不利な変化を含むと定義されています。 チャップマンの報酬または義務と責任レベル。雇用契約には慣習的な守秘義務も含まれています とチャップマン博士が従う発明譲渡契約。2023年から、健康保険と401kの代わりに 福利厚生については、チャップマン博士の生命保険料を四半期あたり最大2,215ドルまで支払うことに同意しました。
ネイゼン フエンテス、公認会計士
私たち 2023年12月11日に、フエンテス氏と修正および改訂された雇用契約を締結し、元の雇用契約を修正して書き直しました。 2023年9月21日に発効した雇用契約。これに基づき、フエンテス氏は当社の最高財務責任者、会計係を務めています。 と秘書。雇用契約に基づき、フエンテス氏は仕事の全時間と労力を事業に費やすことに同意しました 会社の。フエンテス氏の雇用契約では、彼の雇用は随意に行われ、解雇できると規定されています。 正当な理由により、フエンテス氏または当社のどちらかによっていつでも。この契約に基づき、フエンテス氏には165,000ドルの初期基本給が支給されます その給料で年収があった場合、最初の1年間に遡及的に250,000ドルに調整され、有効になったときのみ 2024年2月9日に行われた当社の新規株式公開の。フエンテス氏の給与に対する追加のボーナスと調整 当社の取締役会が独自の裁量で決定することができます。彼の雇用が「理由」なしに当社によって解雇された場合 または、「正当な理由」でフエンテス氏によって解雇された場合、フエンテス氏は次のような形で退職金を受け取る権利があります。 3か月間の給与継続(フエンテス氏が慣習的な一般発表を行い、賛成の意を示すことを条件とします) 会社の)。契約書の「原因」には、不正直、不正流用、故意の違法行為、違反が含まれると定義されています 契約やその他の慣習事項について。「正当な理由」とは、フエンテス氏の「重大な不利な変更」を含むと定義されています 報酬または義務と責任レベル。雇用契約には、慣習的な守秘義務と発明の譲渡も含まれています フエンテス氏が従う契約。
| 59 |
ベース 給与
その 雇用されている執行役員の基本給は、上記に要約されているように、それぞれの雇用契約に明記されています。
賞与
私たち 2022年または2023年の間、指名されたどの執行役員にも賞与を支払っていませんでした。執行役員との雇用契約 取締役会の裁量により、執行役員に賞与が支給される場合があることを規定してください。
エクイティ 報酬
を通して この年次報告書の日付、当社の役員、取締役、従業員のいずれも株式報酬を受け取っていません。
退職 計画
私たち 現在、従業員の退職金制度は実施していません。
優れた 会計年度末の株式報酬
そこに 2023年12月31日現在、ストックオプションは付与されておらず、発行済みです。
2023 オムニバスインセンティブプラン
私たちの 取締役会は、テロミアファーマシューティカルズ社2023オムニバスインセンティブプランを採用し、株主も承認しました( 「2023オムニバスプラン」)は、2024年2月9日の新規株式公開の完了時に発効しました。2023年は オムニバスプランは、内国歳入法422条の意味の範囲内で、インセンティブストックオプションの付与を許可します 当社の従業員、親会社および子会社の従業員、および法定外のストックオプションの付与、制限付き 株式、制限付株式ユニット、株式評価権、パフォーマンスユニット、および当社の従業員、取締役、コンサルタントへのパフォーマンスシェア と、将来の子会社の従業員とコンサルタント。以下は、特定の利用規約の概要です 2023年のオムニバスプランの。この要約は、別紙として添付されている2023年のオムニバスプランを参考にして完全に認定されています この年次報告書の一部となる登録届出書。
管理
その 2023 オムニバスプランは、取締役会、報酬委員会、その他の委員会や小委員会によって管理されています。 権限が委任された1人以上の当社の役員(総称して「管理者」)。管理者は 2023年のオムニバスプランと2023年のオムニバスプランに関して締結されたアワード契約を解釈する権限、作成、変更する権限 そして、2023年のオムニバス計画に関する規則や規制を廃止します。2023年のオムニバス計画に変更を加えたり、不一致があれば修正したりします オムニバスプランまたはアワードを対象とするアワード契約、および2023年のオムニバスプランを管理するために必要なその他の措置を講じること。
| 60 |
適格性
その 管理者は、2023年オムニバスプランの参加者として次のいずれかを指定できます。役員、従業員、または個人 当社または当社の関連会社の役員または従業員、および当社または当社の関連会社のコンサルタント、および 取締役(当社の非従業員取締役を含む)
タイプ アワードの
その 2023オムニバスプランでは、管理者がストックオプション、株式評価権(「SAR」)、パフォーマンスシェアを付与することができます。 パフォーマンスユニット、普通株式、制限付株式、制限付株式ユニット(「RSU」)、現金インセンティブ報酬、配当 同等のユニット、または2023年のオムニバスプランで許可されているその他の種類の特典。管理者はあらゆる種類の賞を授与することができます 選択したすべての参加者。ただし、インセンティブストックオプションの付与を受けることができるのは、当社の従業員または子会社の従業員だけです 内国歳入法第422条の意味の範囲内です。賞は、単独で授与することも、それに加えて、または(件名)と組み合わせて授与することもできます 他のアワード(または当社の別のプランで付与されたその他のアワード)の代わりとして、以下に説明する価格改定禁止事項が適用されます 会社または任意の関連会社(買収した事業体のプランを含む)。
株式 2023年のオムニバスインセンティブプランに基づいて予約されています
その 2023年のオムニバス計画では、当社の普通株式650万株を2023年のオムニバス計画に基づいて発行用に留保します。 インセンティブストックオプションの行使により発行されることがあります。2023年のオムニバスで発行可能な株式数 計画には、新規株式公開が完了した後の各会計年度の初日の年間増額も含まれます 2024年2月9日は、直前の最終日現在の当社の普通株式の全クラスの発行済み株式の1.0%に相当します 会計年度または取締役会が決定するその他の金額。
ザ・ 2023年のオムニバスプランに基づいて発行のために留保されている株式数は、報奨の付与日に最大で減額されます そのような報奨が付与される株式の数(ある場合)。ただし、現金のみで決済できる特典は 賞が授与された時点で、2023年オムニバスプランの株式準備金を使い果たしてください。(a) 特典の有効期限が切れたり、キャンセルされたり、終了したりした場合 株式を発行しない場合、または現金で決済された場合、(b)管理者は、報奨に基づいて付与された株式は発行されないと判断しました 発行条件が満たされないため、(c)株式は報奨により没収され、(d)株式は発行されますので、発行可能です あらゆる報奨で、株式の発行時に当社の留保権に従って再取得します。(e)株式が入札または源泉徴収される オプションの行使価格の支払い、または発行済みの株式評価権または (f) 株式の純決済の結果として 連邦、州、または地方税の源泉徴収義務を満たすために入札または源泉徴収され、それらの株式は準備金に戻されます そして、2023年のオムニバスプランの新しい特典に再び使用できます。ただし、(d) 項に従って株式が準備金に戻されました。 前の文の (e) または (f) は、インセンティブストックオプションでは発行できません。
[オプション]
その 管理者はストックオプションを付与し、各ストックオプションのすべての条件(株式数を含む)を決定することができます 付与されたオプション、ストックオプションがインセンティブストックオプションか非適格ストックオプションか、および付与日 ストックオプション。ただし、普通株式の1株あたりの行使価格は、普通株式の公正市場価値を下回ることはできません 付与日の株式と有効期限は、付与日から10年以内にしてください。ストックオプションは行使可能です とが権利確定時に権利が確定し、管理者が決定した制限や条件が適用されます。これには次の点も含まれます。 そのようなストックオプションの行使価格の支払い方法に。
株式 感謝の権利
その 管理者は、参加者が一定額の現金または公正な市場で普通株式を受け取る権利を表すSARを付与することができます 価値。一定期間における普通株式の公正市場価値の上昇と同じです。2023年のオムニバス プランでは、管理者が各SARのすべての契約条件を決定することが規定されています。これには、とりわけ、(a) SARは、ストックオプションとは独立して付与されるか、ストックオプションに関連します。(b)付与価格は、以下であってはなりません 付与日に決定された当社の普通株式の公正市場価値、(c)期間は、付与日から10年以内でなければなりません の付与、および(d)特別行政区が現金、普通株式、またはその2つの組み合わせで決済するかどうか。
| 61 |
パフォーマンス とストックアワード
その 管理者は、普通株式、制限付株式、RSU、パフォーマンス株式、またはパフォーマンスユニットの株式に報奨を与えることができます。制限されています 株式とは、没収のリスクまたは譲渡制限の対象となる普通株式で、達成時に失効する可能性があります または業績目標の一部達成(後述)、またはサービス期間の終了時。RSUは参加者に付与します 普通株式1株の公正市場価値と等しい現金または普通株式を受け取る権利、 業績目標が達成された範囲で、またはサービス期間が終了したときです。パフォーマンスシェアは参加者に 業績目標が達成された範囲で普通株式を受け取る権利。パフォーマンスユニットは参加者に権利を与えます 指定されたドル価値を持つ、またはその価値が等しいユニットに関連して評価された現金または普通株式を受け取ること 業績目標が達成された範囲で、普通株式の1株以上の公正市場価値に。
ザ・ 管理者は、(a)業績目標を達成する必要があるかどうかを含め、アワードのすべての条件を決定します アワードに基づいて提供される特典の一部を利用する参加者、(b)権利確定期間または履行期間の長さ、および 異なる場合は、給付金の支払いが行われる日付、(c) 業績単位に関して、価値を測定するかどうか 指定されたドル価値または1株以上の普通株式の公正市場価値に対する各単位の、および(d)関連して パフォーマンス・シェア、パフォーマンス・ユニット、RSUに、アワードが現金で決済されるのか、普通株式(制限付株を含む)で決済されるのか 株)、またはその2つの組み合わせで。
現金 インセンティブアワード
その 管理者は現金によるインセンティブ賞を授与することができます。インセンティブアワードとは、1回以上の業績に応じて現金での支払いを受ける権利です 目標は達成されました。現金インセンティブアワードのすべての条件は管理者が決定します。これには以下が含まれますが、これらに限定されません。 業績目標(後述)、業績期間、支払予定額、支払時期。一方、2023年には オムニバスプランでは、2023年のオムニバスプランに基づいて現金インセンティブアワードを付与できます。また、外部で現金インセンティブアワードを作成することもできます 2023年のオムニバスプランの。
パフォーマンス 目標
にとって 2023年オムニバス計画の目的、管理者は、あらゆる業績に適用できる客観的または主観的な業績目標を設定できます 賞。このような業績目標には、当社に関する以下の措置の1つ以上が含まれますが、これらに限定されません または1つまたは複数の当社の子会社、関連会社、またはその他の事業部門:純売上高、売上原価、総収入、収益、 営業利益、税引前利益、利息および税引前利益、利息、税金、減価償却前利益 利息、税金、減価償却費、償却費および例外項目を控除する前の収益、継続事業からの収益、純利益、収益 1株当たり、希薄化後の1株当たり利益、株主総利益、普通株式の公正市場価値、キャッシュフロー、提供された純現金 営業活動別、営業活動によって提供された純現金から投資活動に使用された純現金を差し引いたもの、負債と負債の比率 プラス株式、株主資本利益率、投資資本利益率、平均総使用資本利益率、純資本利益率 雇用済み、資産収益率、利息および税引前純資産収益率、営業運転資本、平均売掛金 (毎月末の売掛金の平均をとって計算); 平均在庫(平均をとって計算) 毎月末の在庫について)、経済的付加価値、後継者育成計画、製造資産収益率、製造マージン、 と顧客満足度。パフォーマンス目標は、参加者の個々のパフォーマンスに関連する場合もあります。管理者は予約します 業績目標を調整する権利、または業績目標を測定または評価する方法を変更する権利。
| 62 |
配当 同等の単位
その 管理者は配当相当額を付与することができます。配当相当単位は、参加者に支払いを受ける権利を与えます。 現金または普通株式。普通株式に対して当社が支払う現金配当またはその他の分配金と同額。 配当等価単位報奨の条件はすべて当社が決定します。ただし、配当等価単位は付与されない場合があります ストックオプションまたはSARとの関係、および別のアワードに関連して付与された配当等価単位の報奨は、以下を提供できません 該当する場合、当該特典が確定または獲得される日までにお支払いください。
その他 株式ベースのアワード
その 管理者は、参加者が受け取る他の報酬の代わりとして、参加者に無制限株式の株式を付与することができます 報酬の取り消しと引き換えに、現金報酬の代わりに、取締役報酬の支払いなどを受ける権利があります またはボーナスとして。
譲渡可能性
アワード は、遺言または血統と分配に関する法律を除き、どの金融機関にも譲渡できません。 管理者は、参加者が (a) アワードを行使する受益者またはアワードに基づく支払いを受ける受益者を書面で指定することを許可します 参加者の死亡後、(b)aに発生した国内関係命令の要求に応じて、元配偶者に特典を譲渡します 離婚、または (c) 対価を受け取らずに特典を譲渡すること。
調整
もし (a) 私たちは、普通株式が変更または交換される合併またはその他の取引に関与しています。(b) 細分化したり、 普通株式を合算するか、普通株式、その他の証券、またはその他の資産(以外)の株式で支払われる配当金を申告してください 株主権利契約に基づいて発行された株式購入権);(c)公正配当の10%を超える現金配当を行います 普通株式の市場価値、または現金または普通株式の買戻しによるその他の配当または分配 当社の取締役会が特別株か特別株か、資本増強または再編に関連していると判断した株式。 または(d)管理者の判断により、希釈または拡大を防ぐために調整が必要なその他の事象が発生しました 2023年のオムニバスプランで提供される予定の特典については、管理者は公平と判断する方法で、 (1)2023年オムニバスプランの対象となる株式の数と種類の一部または全部を調整し、イベント後に対象とされる可能性のある株式の数と種類を調整します の報奨金、(2)発行済報奨の対象となる普通株式の数と種類、(3)付与、購入、または行使価格 あらゆる賞について、そして (4) 賞の業績目標について。いずれの場合も、管理者は現金を提供するかもしれません 条件に従い、賞の全部または一部のキャンセルと引き換えに、未払いの特典の保有者に支払いを行います 2023年のオムニバスプランの。
その 管理者は、合併、統合、資産または株式の取得、または再編に関連して、発行を承認することができます または、普通株式の数に影響を与えずに、適切と判断した条件に基づく報奨の引き受けです 2023年のオムニバスプランで予約済みまたは利用可能です。
変更します コントロールの
アポン 支配権の変更(2023年のオムニバス計画で定義されているとおり)、後継者または存続法人は、未払いの一部または全部を引き継ぐことに同意する場合があります 参加者の同意なしに、同様の利用規約で賞を授与したり、同じ種類の特典と交換したりすること、件名 次の要件に:
| ● | それぞれ 想定される特典は、そのような支配権の変更後すぐに、番号とクラスに適用されるように適切に調整する必要があります アワードが行使されていれば、そのような支配権の変更が完了した時点で参加者に発行可能だったはずの有価証券の そのような支配権の変更の直前に権利が確定した、または獲得された、およびその他契約条件の適切な調整が行われた 賞が授与されるかもしれません。 | |
| ● | もし 支配権の変更後に報奨の対象となった証券は、国内の証券取引所に上場も取引もされていません。 それから(a)各参加者には、そのような有価証券の発行の代わりに、現金を受け取ることを選択するオプションを提供する必要があります そうでなければ発行されたはずの有価証券の公正価値に等しい金額、(b)反映のために減額することはできません 市場性の欠如、少数派、または同様の対価の公正価値を決定するための割引 証券。 | |
| ● | もし 参加者が理由なく解雇されたり、死亡や障害により解雇されたり、参加者が仕事を辞めたり 2年以内の正当な理由(参加者と当社または関連会社との間のアワードまたはその他の契約で定義されているとおり) 支配権の変更後、その終了時に、その日に有効な参加者のすべてのアワードは 解約は全額確定するか、全額獲得したものとみなされます。 |
| 63 |
もし 購入者、承継人、または存続企業が特典を引き継いだり、代替特典を発行したりしない場合、変更の直前に 管理者が別段の決定をしない限り:
| ● | それぞれ その後、参加者が保有していたストックオプションまたはSARは直ちに完全に権利が確定し、すべてのストックオプションとSARは取り消されます 支配日の変更時に、株式の支配価格変更の超過分と同額の現金支払いと引き換えに 普通株は、報奨に基づく当該株式の購入価格または付与価格を上回っています。 | |
| ● | 未確定 制限付株式とRSU(業績報酬ではない)は全額権利が確定します。 | |
| ● | すべて パフォーマンスシェア、パフォーマンスユニット、およびパフォーマンス期間が終了した現金インセンティブアワードは、以下に基づいて支払われます 実際の実績、および公演期間が満了していないすべての賞は、現金と引き換えにキャンセルされます そのような報奨の下で支払われるはずだった金額と同額の支払いで、目標業績目標の達成を前提として評価されます 支配権の変更の時期を、業績期間中に経過した月数に基づいて比例配分されます。 | |
| ● | すべて 権利が確定していない配当等価ユニットは(そのようなユニットと同時に付与されるアワードと同じ範囲で)権利が確定し、支払われます。 | |
| ● | すべて その他の権利が確定していない特典は権利が確定し、支払われる金額はすべて現金で支払われます。 |
期間 プランの
でない限り 2023年のオムニバスプランは、取締役会によって早期に終了し、その後はそれ以上の賞は授与されません 10番目 (10)番目の) 発効日の記念日。
解約 とプランの修正
私たちの 取締役会または管理者は、2023年オムニバス計画をいつでも修正、変更、停止、中止、または終了することができます。件名 次の制限があります:
| ● | 私たちの 2023年オムニバス計画の修正が事前の措置で必要であると判断した場合、取締役会は承認しなければなりません 当社の取締役会、適用会社法、またはその他の適用法の | |
| ● | 株主 2023年のオムニバスプランの修正はすべて承認する必要があります。これには、留保株式数を大幅に増やすための修正が含まれる場合があります 2023年のオムニバスプランで、取引法、コード、上場第16条で承認が必要であると判断した場合は その後に株式が取引される主要な証券取引所または市場の要件、またはその他の適用法。そして | |
| ● | 株主 参加者の特典限度による保護を弱めるような2023年オムニバスプランの改正案はすべて承認しなければなりません または価格改定やバックデートの禁止事項。 |
| 64 |
改正、 アワードの変更、キャンセル、廃棄
件名 2023年のオムニバスプランの要件に合わせて、管理者は特典を変更または修正したり、制限や条件を放棄したりすることができます 任意のアワードまたはアワードの行使に適用される、または任意のアワードに適用される利用規約を修正、変更、またはキャンセルする場合 いずれの場合も、管理者と参加者、または賞に関心を持つ可能性のある他の人の相互の合意により、 そのような措置によって2023年のオムニバスプランに基づいて発行可能な普通株式の数が増えない限り。
私たち 調整に従って許可されるそのような行為(a)について、参加者(または他の利害関係者)の同意を得る必要はありません 2023年オムニバスプランの規定。(b)適用法または掲載内容を遵守するために必要であると当社が判断した範囲で その後、当社の普通株式が取引される主要な証券取引所または市場の要件。(c)当社が訴訟と見なす範囲で 当社にとって何らかの裁定の会計上または税務上の優遇措置を維持するために必要です。または(d)そのような措置があると当社が判断した範囲で 賞の価値に重大かつ悪影響を及ぼさず、そのような行為が影響を受ける参加者の最善の利益になることもありません または、その賞に興味があると思われる他の人。
その 管理者は、参加者にアワードを没収させ、アワードに起因する利益を放棄するよう参加者に要求することができます。 参加者が、管理者がその裁量で判断したとおり、終了の原因となる何らかの行動をとった場合、または 重要な企業ポリシー、アワード契約、または参加者と当社または当社の関連会社との間のその他の契約の違反 競業避止、勧誘禁止、守秘義務、企業秘密、知的財産、中傷の禁止、または同様の義務について。
任意です 2023年のオムニバスプランに基づいて付与された報酬、および報奨に基づいて発行された普通株式または現金で支払われたすべての株式には、以下の内容が適用されます 当社の報酬回収ポリシー(後述)に基づく回収、または任意の回収 または同様の要件、法律、規制、または上場基準によって当社に適用される、または現金で規定されている場合があります または私たちが付与した株式報酬。
報酬 回復ポリシー
オン 2023年10月2日、当社の取締役会は、回復を規定する方針(通称「クローバック」ポリシー)を採択しました 会計上の再表示を作成する必要がある場合に、誤って特定の役員にインセンティブ報酬が授与された 連邦証券法に基づく財務報告要件を当社が著しく遵守していないためです。この方針は設計されています 改正された1934年の証券取引法のセクション10D、関連規則、ナスダックの上場基準に準拠すること 株式市場または将来当社の株式が上場されるその他の証券取引所。この方針は、私たちの理事会によって管理されています 取締役、または取締役会で指定された場合は報酬委員会。理事会が下した決定はすべて最終的なものとする そして、影響を受けるすべての個人を拘束します。
その このポリシーの対象となる個人(「対象役員」)とは、以下のように特定された、現在または以前の従業員です。 私たちの社長、最高財務責任者、最高会計責任者(またはそのような会計責任者がいない場合は、コントローラー)、 主要な事業部門、部門、または機能(営業、管理、財務など)を担当する副社長、その他 重要な政策決定機能を果たす役員、またはその他の人物(子会社の執行役員を含む)、 関連会社)は、私たちのために同様の重要な政策立案機能を果たしています。
その ポリシーは、開始後に個人が受け取った「インセンティブベースの報酬」(ポリシーで定義されているとおり)の回収を対象としています 対象役員としての役割を果たし、そのインセンティブ報酬の業績期間中いつでも対象役員を務めたことがある。 会計上の訂正書を作成する必要がある場合、ポリシーにより、誤りがあった場合は、合理的に速やかに回復することが義務付けられています 対象役員が受け取ったインセンティブベースの報酬(取締役会または報酬委員会が決定)を授与しました このような会計上の再表示の作成が義務付けられる日の直前に完了した3つの会計年度中に。
その 前述の当社の報酬回収ポリシーの説明は、完全であることを意図したものではなく、完全に条件によって認められています およびそのようなポリシーの条件。そのコピーは本レポートの別紙として提出され、参照用にここに組み込まれています。
アイテム 12。特定の受益者の担保所有権、経営および関連する株主に関する事項。
その 次の表は、このレポートの日付の時点で、(i)各取締役、(ii)すべての人による当社の有価証券の所有権を示しています。 私たちの知る限り、普通株式の発行済み株式の5%以上の受益者は誰ですか、(iii)各役員 役員、および(iv)すべての取締役および執行役員(グループ)。この表に挙げられている各人には、唯一の投資力があります また、特に明記されていない限り、その人の名前の反対側に記載されている普通株式に関する唯一の議決権です。
| 受益者の名前 | 受益所有権の金額と性質 | 2024年3月31日現在のクラスの割合 | ||||||
| 取締役および執行役員 | ||||||||
| クリストファー・チャップマン・ジュニア、MD | 975,610 | 3.03 | % | |||||
| ネイセン・フエンテス | 101,134 | * | ||||||
| クリストス・ニコロウディス弁護士 | - | - | ||||||
| ブラッド・クルーニッヒ | 48,781 | * | ||||||
| マイケル・ジャーマン、公認会計士 | - | - | ||||||
| クレイグ・イーグル | 487,805 | 1.51 | % | |||||
| タリアタックさん | 48,781 | * | ||||||
| ヒュー・マッコール三世 | 48,781 | * | ||||||
| 現在のすべての取締役および役員(グループ)(8人) | 1,710,892 | 5.31 | % | |||||
| 5% 株主 | ||||||||
| ブライアン・マクナルティ(1) | 11,187,151 | 34.74 | % | |||||
| フランシス・E・オドネル・ジュニア博士(2) | 2,119,220 | 6.58 | % | |||||
| *受益所有権が 1% 未満であることを表します | ||||||||
| (1) | 含みます (i)ベイショア・トラストが保有する6,821,076株、(ii)セレステ・J・ウィリアムズ生涯QTIPトラストが保有する1,902,659株、(iii) マクナルティ氏が直接保有している24,391株、および(iv)ベイショア・トラストが保有するワラントに従って発行可能な2,439,025株 それはすぐに行使可能です。ベイ・ショア・トラストとセレステ・J・ウィリアムズ生涯QTIPトラストの両方の管財人として、マクナルティさん 各信託が保有する株式に対して唯一の議決権と処分権を持ち、その結果、受益所有権を持っているとみなされます 各信託が保有する有価証券の(証券取引法のセクション13(d)に基づいて決定されます)。創設者のジョニー・R・ウィリアムズ・シニアさん そして、ベイ・ショア・トラストの設立者は、ベイ・ショア・トラストが保有する株式に対する議決権や処分権を持っていません。 |
| (2) | 成り立っています (i) フランシス・E・オドネル・ジュニア博士が直接保有している585,366株と (ii) レイチェル・ジーン・ウィリアムズが保有する1,533,854株 2021 取り返しのつかない信頼。レイチェル・ジーン・ウィリアムズ 2021 Irrevocable Trustの管財人として、フランシス・E・オドネル・ジュニア博士には 信託が保有する株式に対する議決権および処分権、そしてその結果、受益所有権を有するとみなされます(決定したとおり 信託が保有する有価証券の取引法のセクション13(d)に基づきます。 |
| 65 |
アイテム 13。特定の関係と関連する取引、および取締役の独立性。
その 以下は、当社が関わってきた過去3年以内の取引で、取引金額が超過した取引についての説明です またはが120,000ドルを超え、当社の執行役員、取締役、または当社の議決権有価証券の5%を超える保有者のいずれか、または その近親者が、直接的または間接的に物質的利害関係を持っていた、または持つ予定です。私たちは、得られた条件または対価を信じています 下記の取引に関連して、該当する場合、当社が支払った金額または受領した金額は、利用可能な条件または金額と同等でした それは、必要に応じて、関係のない第三者との独立取引で支払いまたは受領されます。
ライン ベイ・ショア・トラストの信用状と約束手形
オン 2023年6月15日、私たちは創設者のジョニーによって設立された信託であるベイ・ショア・トラストと約束手形およびローン契約を締結しました R・ウィリアムズ・シニア、そして彼の家族の何人かが受益者となっています(「ベイ・ショア・トラスト」)。この約束の下で 手形と貸付契約(「ベイ・ショア・ノート」)では、私たちはザ・ベイから総額500万ドルまで借りる権利があります ショア・トラストは、ベイ・ショア・ノートの発行2周年まで、またはそれ以前の場合は、発行完了時ならいつでも 新規株式公開。ベイ・ショア・ノートに基づいて資金を借りる当社の権利は、重大な不利な変化がないことを条件としています 私たちの資産、事業、または見込み客。ベイシェアノートは、未収利息とともに、2周年記念日に支払期日となり、支払われます 紙幣の発行について。ただし、違約金なしでいつでも前払いできます。ベイ・ショア・ノートは次の場所で利息が発生します 手形が未払いの最初の1年間は年率7%、単利は年率10%、単純利息、 その後。ベイ・ショア・ノートは無担保です。2023年11月30日現在、ベイショアノートの未払い金額の合計は1.4ドルでした 百万。発行済総額は、2023年11月30日に換算レートで674,637株の普通株式に転換されました 転換に基づく1株あたり2.05ドル(2023年12月11日に行われた1対2.05の株式併合を実施した後) 契約の結果、2023年12月31日に終了した年度に330万ドルの損失が発生し、2023年12月31日現在の残高が残っています 10万ドルです。2024年2月9日の新規株式公開の発効をもって、契約は終了します。
に ベイ・ショア・トラストが提供する融資枠を検討し、ベイ・ショア・トラストに普通株式購入ワラントを発行しました 2023年6月15日、ベイショア・トラストは、行使価格3.73ドルで最大2,439,025株の普通株式を購入する権利を与えられました 1株当たり(2023年12月11日に行われた1対2.05の株式併合を実施した後)、ワラントの有効期限は5時です 付与日から数年後。発行時に、ワラントは「会計」の分析に基づく株式として分類される基準を満たしていました スタンダード・コード化(480)ASC 480、」負債と資本の区別」と公正価値で測定されます。 その結果、ブラック・ショールズの評価手法を用いたワラント発行時の初期公正価値は約595万ドルになりました。
取引 ミラログ合同会社と
以来 2023年1月1日、MIRALOGXと創業者が設立した独立した信託であるスターウッド・トラストが、ベイショアに代わって資金を調達しました 営業活動の資金を調達するために、当社に信頼を寄せてください。2023年11月30日現在の前払い金と未払い額の合計は1.7ドルでした 百万。これらの前払金は、2023年11月30日に837,841株あたり2.05ドルの転換レートで当社の普通株式837,841株に転換されました 転換契約に基づく株式(2023年12月11日に行われた1対2.05の株式併合を実施した後) その結果、2023年12月31日に終了した年度には410万ドルの損失が発生し、2023年12月31日現在の残高は0.3ドルになりました。 百万。
| 66 |
オン 2023年7月31日、私たちはMIRALOGXと知的財産の開発である初期MIRALOGXライセンス契約を締結しました。 私たちの創設者でTELOMIR-1の発明者であるジョニー・R・ウィリアムズ・シニアによって設立された持株会社。「ビジネス — 知識人」を参照してください プロパティ」。MIRALOGXはベイ・ショア・トラストが完全所有しており、ウィリアムズ氏にはベイ・ショア・トラストに対する議決権や処分権はありません ベイ・ショア・トラストが保有する当社の株式で、ウィリアムズ氏はベイ・ショア・トラストの役員でも取締役でもありません。11月10日に、 2023年、私たちは最初のMIRALOGXライセンス契約の修正を締結し、それに従って人間以外のライセンスも取得しました 「ライセンス製品」の用途。
私たち また、2023年4月1日付けのMIRALOGXおよびMIRA Pharmaceuticals, Inc.との共有リース費用に関する契約の当事者でもあります。 MIRALOGXとの航空機リース契約に基づき、MIRALOGXが支払うべき運用使用費の比例配分を支払うことに合意しました とSupera Aviation I LLC(「Supera Aviation」)は、毎月のリース航空機の使用状況に基づいています。金額は支払えません リースされた航空機を使用する場合を除き、またその範囲で航空機の使用を中止する場合を除き、本契約に基づいて当社が提供します そして、いつでもこの契約を解除してください。Supera Aviationは、ウィリアムズ氏が設立したスターウッド・トラストが所有する会社です。 2023年12月31日に終了した年度に、当社は航空機リース契約に基づいて177万ドルの費用を負担しました。
レビュー および関連当事者取引の承認
私たちの 取締役会は、関連当事者取引の審査と承認に関する方針を書面で採択しました。私たちの監査委員会憲章 監査委員会が関連当事者間の取引を検討し、承認または不承認を行うことを規定しています 当社および関係者で、関係者の総額が120,000ドルを超える、または超える見込みがあり、その関係者がいる場合 直接的または間接的に重要な利害関係を持っている、または持つ予定です。当社と関係者との間の取引に関する当社の方針は 関連人物とは、取締役、執行役員、取締役候補者、または当社の普通株式の5%を超える受益者として定義されていること 株式、いずれの場合も、直近の年の初めからの株式、およびその近親者のいずれか。
確か 前述の開示のうちは、当社の関連当事者契約の特定の条項の要約であり、全体として適格です そのような契約のすべての条項を参照してください。これらの説明は適用される契約の要約に過ぎないので、 それらには、必ずしもあなたが役に立つと思うすべての情報が含まれているわけではありません。特定の契約書のコピーが提出されました この年次報告書が含まれている登録届出書の別紙として、次の年次報告書のウェブサイトで電子的に入手できます。 SECで www.sec.gov。
として コーポレートガバナンスの方針の問題ですが、私たちは「プロモーター」に役員への融資や融資保証を提供していませんし、今後も提供しません その用語はSECと州の証券当局では一般的に理解されているからです。
すべて 当社と当社の役員、取締役、または 5% の株主、およびそれぞれの関連会社との間の将来の取引は、条件どおりになります 関連のない第三者から得られるよりも不利で、当社の独立取締役の過半数の承認を受ける予定です 取引に関心がなく、当社の費用負担で当社の弁護士または独立した弁護士に相談できた人。
| 67 |
アイテム 14。主任会計士の費用とサービス。
監査 手数料。Cherry Bekaert LLPが当社の年次財務諸表の監査のために提供された専門サービスに対して請求した合計手数料は、 フォーム10-Q(該当する場合)に含まれる各期間の財務情報、およびその他の必要な書類の確認 2023年12月31日および2022年12月31日に終了した年度のSECとの合計は、それぞれ30億4,000万ドルと502万ドルでした。
ザ・ 上記の金額には、暫定手続きと監査手数料、および監査委員会会議への出席が含まれます。
監査関連 手数料。Cherry Bekaert LLPが2023年12月31日および2022年に終了した年度の監査関連費用として請求した手数料の合計は それぞれ0億3600万ドルと00万ドルです。手数料は、レビューと更新手続きからなるサービスの対価として提供されました 登録届出書やその他のSEC提出書類に関連付けられています。
税金 手数料。12月に終了した年度に税務コンプライアンスのために提供された専門サービスに対してCherry Bekaert LLPが請求した合計料金 31年、2023年、2022年は、それぞれ0億900万ドルと0百万ドルでした。料金は、以下を含むサービスの対価として提供されました 納税申告書の作成と関連する税務アドバイスについて。
すべて その他の手数料。なし
その 取締役会の監査委員会は事前承認の方針と手続きを定めており、監査委員会はそれに従って行われます 2023年にCherry Bekaert LLPが提供する前述の監査および非監査サービスを承認しました。監査委員会の 当社の独立監査人を雇用する責任、すべての監査および許可された非監査サービスには、監査委員会による事前承認が必要です。 監査委員会全体が、提案されたサービスとこれらのサービスの料金見積もりを承認します。監査委員会委員長が指名されました 監査委員会が、その年に発生した監査関連サービスのうち、監査委員会によって事前承認されなかったものを承認します。 監査以外のサービスは、監査委員会全体の承認が必要です。監査委員会委員長が承認したサービスが伝えられています 次回の定例会議では監査委員会全体に送られ、監査委員会は毎会計年度のサービスと手数料を検討します そのような会議。これらの手続きに従い、監査委員会はCherry Bekaert LLPが提供する前述のサービスを承認しました。
| 68 |
一部 IV
アイテム 15。別紙、財務諸表スケジュール。
その この項目で求められる情報は、このフォーム10-Kの別紙索引を参照してここに組み込まれています。
索引 展示品へ
| 展示 いいえ。 | 展示 説明 | |
| 1.1^ | 引受契約の形式 | |
| 3.1^ | テロミール・ファーマシューティカルズ社の第2次修正および改訂された定款 | |
| 3.2^ | テロミアファーマシューティカルズ社の細則の修正および改訂版 | |
| 4.1^ | 代理人令状の形式 | |
| 4.2^ | 2023年6月15日付けの、テロミール・ファーマシューティカルズ社とベイ・ショア・トラスト間の普通株式購入ワラント | |
| 4.3^ | 2023年1月から2023年3月までの当社と特定の投資家による、および間の、普通株式購入ワラントの形式 | |
| 4.4** | 有価証券の説明 | |
| 10.1+^ | 2023年オムニバスインセンティブプラン | |
| 10.2+^ | 2023年オムニバスインセンティブプランに基づくストックオプション報奨の形式 | |
| 10.3^ | 補償契約の形式 | |
| 10.4^ | 2023年8月11日付けの、テロミールファーマシューティカルズ社とMIRALOGX LLCとの間の修正および改訂されたライセンス契約 | |
| 10.5^ | 2023年11月10日付けの、テロミールファーマシューティカルズ社とMIRALOGX LLCとの間の修正および改訂されたライセンス契約の修正第1号 | |
| 10.6+^ | 2023年12月11日付けの、テロミール・ファーマシューティカルズ社と公認会計士のネイテン・フエンテスとの間の修正および改訂された雇用契約。 | |
| 10.7+^ | テロミール・ファーマシューティカルズ社とクリストファー・チャップマン・ジュニア医学博士との間の、新規株式公開の終了日から発効する雇用契約 | |
| 10.8^ | 2023年6月15日付けの、テロミール・ファーマシューティカルズ社とベイ・ショア・トラストとの間の約束手形とローン契約 | |
| 10.9^ | 2023年4月1日付けの、テロミールファーマシューティカルズ株式会社、MIRALOGX LLC、およびMIRAファーマシューティカルズ株式会社との間の、共有リース費用に関する契約 | |
| 10.10^ | 2023年11月30日付けの、テロミールファーマシューティカルズ社とMIRALOGX LLCとの間の債務転換契約 | |
| 10.11^ | 2023年11月30日付けの、テロミール・ファーマシューティカルズ社とベイショア・トラストとの間の債務転換契約。 | |
| 14.1^ | ビジネス行動規範と倫理規範 | |
| 21.1^ | 登録者の子会社のリスト | |
| 31.1** | 2002年のサーベンス・オクスリー法第302条に従って採択された米国法第18条第1350条に基づく最高執行役員の認定* | |
| 31.2** | 2002年のサーベンス・オクスリー法第302条に従って採択された米国法第18条第1350条に基づく最高財務責任者の認定* | |
| 32.1** | 2002年のサーベンス・オクスリー法第906条に従って採択された、米国合衆国法第18条第1350条に基づく最高執行役員の認定です。 | |
| 32.2** | 2002年のサーベンス・オクスリー法第906条に基づいて採択された、米国法第18条第1350条に基づく最高財務責任者の認定 | |
| 97.1** | 誤って授与された報酬の回収に関する方針 | |
| 99.1^ | 監査委員会憲章 | |
| 99.2^ | 指名およびコーポレートガバナンス委員会憲章 | |
| 99.3^ | 報酬委員会憲章 | |
| 99.4^ | コーポレートガバナンス・ガイドライン | |
| 99.5^ | インサイダー取引ポリシー | |
| 99.6^ | 関係者の取引方針と手続き |
| * | 修正により提出される予定です。 |
| ** | ここに備え付けられています |
| ^ | 以前に提出しました。 |
| + | 管理契約または補償計画または取り決めを示します。 |
| 69 |
テロミール 医薬品株式会社
索引 財務諸表へ
| 独立登録公認会計士事務所の報告書(PCAOB ID 00) |
F-1 |
| 2023年12月31日および2022年12月31日現在の貸借対照表 | F-2 |
| 2023年12月31日および2022年に終了した年度の営業報告書 | F-3 |
| 株主声明 2023年12月31日および2022年に終了した年度の株式(赤字) | F-4 |
| 2023年12月31日および2022年に終了した年度のキャッシュフロー計算書 | F-5です |
| 財務諸表に関する注記 | F-6です |
報告してください 独立登録公認会計士事務所の
に 取締役会と株主
テロミール 製薬株式会社
タンパ、 フロリダ州
意見 財務諸表について
私たち 2023年12月31日現在のテロミールファーマシューティカルズ株式会社(以下「当社」)の添付貸借対照表を監査しました。 2022年、および関連する2年間の各年度の営業報告書、株主資本(赤字)、およびキャッシュフロー 2023年12月31日に終了した期間および関連メモ(総称して「財務諸表」と呼びます)。私たちの意見では、 財務諸表は、2023年12月31日現在の会社の財政状態を、すべての重要な点で公正に示しています。 2022年、そして2年間の各年の経営成績とキャッシュフロー 2023年12月31日に終了した期間は、アメリカ合衆国で一般に認められている会計原則に準拠しています。
行く 懸念
その 添付の財務諸表は、当社が継続企業として存続できることを前提として作成されています。で説明したように 財務諸表の注記2では、当社は創業以来、経常的な純損失と繰り返しマイナスの営業キャッシュフローを被っています また、手元に十分な現金がないか、既存の取り決めでは利用可能な流動性がない可能性があり、予測される流動性ニーズを満たすことはできません 次の12か月間。これらの要因は、とりわけ、当社が継続企業として存続できるかどうかについて大きな疑問を投げかけています。 これらの事項に関する経営陣の計画は、注記2にも記載されています。財務諸表には調整は含まれていません それはこの不確実性の結果から生じるかもしれません。
基礎 意見について
これら 財務諸表は会社の経営陣の責任です。私たちの責任は、これらの財務について意見を述べることです 当社の監査に基づく声明。私たちは、公開企業会計監視委員会(ユナイテッド)に登録された公認会計事務所です。 州)(「PCAOB」)であり、米国連邦証券に従って会社に対して独立していることが義務付けられています 法律と証券取引委員会とPCAOBの適用される規則と規制。
私たち PCAOBの基準に従って監査を実施しました。これらの基準では、以下を実現するための監査を計画して実施する必要があります 財務諸表に、誤りによるものか詐欺によるものかを問わず、重大な虚偽表示がないかどうかを合理的に保証します。会社 財務報告に関する内部統制の監査を行う必要はなく、また監査を行うよう依頼したこともありません。監査の一環として、 財務報告に関する内部統制について理解する必要がありますが、意見を述べるためではありません 財務報告に対する会社の内部統制の有効性について。したがって、私たちはそのような意見を表明しません。
私たちの 監査には、誤りが原因であるかどうかにかかわらず、財務諸表の重大な虚偽表示のリスクを評価するための手続きの実施が含まれていました または詐欺、そしてそれらのリスクに対応する手続きを実行すること。このような手続きには、次のような証拠をテストベースで調べることが含まれていました 財務諸表の金額と開示。私たちの監査には、使用されている会計原則と重要性の評価も含まれていました 経営陣による見積もり、および財務諸表の全体的な表示の評価。私たちの監査は 私たちの意見の合理的な根拠を提供してください。
/s/
私たち 2023年から会社の監査人を務めています。
3月 29、2024年
| F-1 |
テロミール 製薬株式会社
貸借対照表
12月です 2023年31日と2022年12月31日です
| 12月31日 | 12月31日 | |||||||
| 2023 | 2022 | |||||||
| 資産 | ||||||||
| 流動資産: | ||||||||
| 現金 | $ | $ | ||||||
| 繰延オファリング費用 | ||||||||
| 前払い経費 | - | |||||||
| 関連当事者からの期限 | - | |||||||
| その他の流動資産合計 | ||||||||
| 繰延融資費用 | - | |||||||
| 総資産 | $ | $ | ||||||
| 負債と株主資本(赤字) | ||||||||
| 現在の負債: | ||||||||
| 買掛金と未払負債の取引 | $ | $ | ||||||
| 関係者のため | ||||||||
| 関連当事者の信用枠 | - | |||||||
| 流動負債合計 | ||||||||
| 負債総額 | ||||||||
| 株主資本 (赤字) | ||||||||
| 優先株式、 額面価格、 承認された株式と 発行済みまたは未処理です。 | - | - | ||||||
| 普通株式、 額面価格; 承認済み株式、 そして それぞれ2023年12月31日と2022年12月31日に発行済み株式と発行済み株式。 | - | - | ||||||
| 追加払込資本 | ||||||||
| 累積赤字 | ( | ) | ( | ) | ||||
| 株主資本の総額(赤字) | ( | ) | ||||||
| 負債総額と株主赤字 | $ | $ | ||||||
その 財務諸表に付随する注記は、これらの財務諸表の不可欠な部分です。
| F-2 |
テロミール 製薬株式会社
運用明細書
何年も 2023年12月31日および2022年12月31日に終了しました
| 12月31日に終了した年度 | ||||||||
| 2023 | 2022 | |||||||
| 収入 | $ | - | $ | - | ||||
| 運用コスト: | ||||||||
| 一般管理費 | ||||||||
| 関連当事者の旅費 | - | |||||||
| 研究開発費用 | ||||||||
| 総運用コスト | ||||||||
| 支払利息 | ( | ) | - | |||||
| 債務の消滅による損失 | ( | ) | - | |||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| 1株当たりの基本損失 | $ | ) | $ | ) | ||||
| 希薄化後の1株当たり損失 | $ | ) | $ | ) | ||||
| 基本加重平均発行済普通株式数 | ||||||||
希薄化後の加重平均発行済普通株式 | ||||||||
その 財務諸表に付随する注記は、これらの財務諸表の不可欠な部分です。
| F-3 |
テロミール 製薬株式会社
株主資本計算書(赤字)
何年も 2023年12月31日および2022年12月31日に終了しました
| 普通株式 | 追加支払い済み | 株式購読 | 累積 | 株主総数 | ||||||||||||||||||||
| 株式 | 金額 | 資本 | 売掛金 | 赤字 | 赤字 | |||||||||||||||||||
| 残高、2022年1月1日 | - | $ | $ | ( | ) | $ | ( | ) | $ | ( | ) | |||||||||||||
| 新株予約売掛金の回収 | - | - | - | - | ||||||||||||||||||||
| 純損失 | - | - | - | - | ( | ) | ( | ) | ||||||||||||||||
| 残高、2022年12月31日 | $ | - | $ | $ | - | $ | ( | ) | $ | ( | ) | |||||||||||||
| 普通株式 | 追加支払い済み | 株式購読 | 累積 | 株主総数 | ||||||||||||||||||||
| 株式 | 金額 | 資本 | 売掛金 | 赤字 | 赤字 | |||||||||||||||||||
| 残高、2023年1月1日 | $ | - | $ | $ | - | $ | ( | ) | $ | ( | ) | |||||||||||||
| 普通株式の発行、純額 | - | - | - | |||||||||||||||||||||
| 普通株式への負債転換 | - | - | - | |||||||||||||||||||||
| 株式併合により端数株式に追加された株式 | - | - | - | - | - | |||||||||||||||||||
| ワラントの発行 | - | - | - | - | ||||||||||||||||||||
| 純損失 | - | - | - | - | ( | ) | ( | ) | ||||||||||||||||
| 残高、2023年12月31日 | $ | - | $ | $ | - | $ | ( | ) | $ | |||||||||||||||
その 財務諸表に付随する注記は、これらの財務諸表の不可欠な部分です。
| F-4 |
テロミール 製薬株式会社
キャッシュフロー計算書
何年も 2023年12月31日および2022年12月31日に終了しました
12月31日に終了した年度 | ||||||||
| 2023 | 2022 | |||||||
| 営業活動によるキャッシュフロー | ||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| 純損失を事業からの純現金と調整するための調整 | ||||||||
| 債務の消滅による損失 | - | |||||||
| 債務発行費用の償却 | - | |||||||
| 営業資産および負債の変動: | ||||||||
| 買掛金と未払費用 | ||||||||
| 前払い経費 | ( | ) | - | |||||
| 営業活動に使用された純キャッシュフロー | $ | ( | ) | $ | ( | ) | ||
| 財務活動: | ||||||||
| 繰延募集費用の支払い | ( | ) | ( | ) | ||||
| 関係者への借り入れ | ( | ) | ||||||
| 関連当事者からの借り入れ | - | |||||||
| 関連当事者の信用枠に基づく借入金 | - | |||||||
| 新株予約売掛金の回収 | - | |||||||
| 普通株式の売却による収入 | - | |||||||
| 財務活動によってもたらされる純キャッシュフロー | ||||||||
| 現金での純振替 | ( | ) | ||||||
| 現金、年の初め | - | |||||||
| 現金、年末に | $ | $ | ||||||
| 利息として支払われた現金 | - | - | ||||||
| 非現金金融活動の補足スケジュール: | ||||||||
| 関連当事者の信用枠でのワラントの発行 | $ | $ | - | |||||
| 未払いの提供費用 | - | |||||||
| 普通株式への負債転換 | - | |||||||
| アフィリエイトへの進出 | - | |||||||
その 財務諸表に付随する注記は、これらの財務諸表の不可欠な部分です。
| F-5です |
テロミール 製薬株式会社
補足 キャッシュフロー情報
現金以外 営業、資金調達、投資活動:
その
会社は合計の公正価値を記録しました
ザル
会社は$を計上しました
その
会社は、転換契約に基づき、以下の関連当事者負債の金額を転換しました
ザル
会社は$を記録しました
| F-6です |
テロミール 製薬株式会社
メモ 要約財務諸表へ
12月です 2023年31日と2022年12月31日です
メモ 1。 事業内容と重要な会計方針の概要
[概要]
テロミール ファーマシューティカルズ株式会社(「テロミール」または「当社」、以前はメタロ・セラピーズ社として知られていました)は、 2021年8月、フロリダを拠点とする初期前臨床段階のバイオ医薬品会社で、製品候補のテロミル-1を開発中です。 経口薬として機能するように開発中の新しい小分子 その場で ヒト幹細胞の治療法。に基づく 会社の前臨床研究、およびFDAおよび同等の外国の規制当局によって承認されれば、テロミールファーマシューティカルズ社は信じています そのTELOMIR-1は、亜鉛や銅などの必須金属の金属酵素阻害剤として効果的に機能する可能性があります。これらの必須金属 多くの酵素反応の生成と機能、および主要な細胞経路の調節において重要な役割を果たしています。特に、 亜鉛は、インターロイキン-17やIL-17などの多くの加齢に伴う役割を果たす炎症誘発性サイトカインの機能に不可欠です 変形性関節症やヘモクロマトーシスなどの炎症性疾患、および化学療法後の健康問題。
として など、TELOMIR-1は、加齢に伴う炎症状態に対する治療的介入を提供する可能性について研究中です このような変形性関節症やヘモクロマトーシス、そして誘発されたIL-17を中断して予防することによる化学療法後の回復に 細胞内金属の全身的な不均衡を引き起こす炎症経路。
実質的 事業は2022年後半に開始され、同社の新薬治験申請は米国食品局に提出される予定です。 と2025年第1四半期に変性関節症の治療薬局(「FDA」)。非仮特許出願は出願中です 新しい分子実体としてのTELOMIR-1とその治療用途については。この特許については注記3を参照してください。
その 会社の会計および報告方針は、アメリカ合衆国で一般に認められている会計原則に準拠しています (「ギャップ」)。経営陣の意見では、すべての調整は財務諸表の公正な表示に必要と考えられます 提示された期間が含まれています。2023年12月31日に終了した年度の経営成績は必ずしも指標ではありません 将来の期間に予想される結果について。
として ここで使われているのは、1株あたりの額面金額のない当社の普通株式を「普通株式」と呼び、当社の 1株あたりの額面価格のない優先株は、「優先株」と呼ばれます。
収入 税金
その 会社はC社です。繰延税金資産と負債は、差異に起因する将来の税務上の影響として計上されます 既存の資産および負債の財務諸表帳帳簿価額とそれぞれの課税基準との間で。繰延税金資産 将来の控除額となる一時的な差異や、損失の繰越が認められます。評価 繰延税金資産については、もしあれば、それが繰延税金資産の一部である可能性が高い場合は、引当金が計上されます 実現されません。
研究 と開発費
リサーチ 開発費は発生した期間に支出され、契約などの第三者に支払われる費用も含まれます 会社に代わって研究開発活動を行う研究機関やコンサルタント。
使用 見積もりの
その 米国で一般に認められている会計原則に従って財務諸表を作成するには、 会社の経営陣は、報告された資産と負債の金額に影響する見積もりと仮定を行い、 財務諸表の日付における偶発資産と負債、および財務諸表作成中の報告された費用額の開示 報告期間。実際の結果はそのような見積もりとは異なる場合があり、そのような違いは重大なものになる可能性があります。
| F-7です |
現金
その 会社は、経営陣が信用の質が高いと考える金融機関との現金残高を管理しています。会社の 現金口座は、連邦政府の保険限度額を超えることがあります。会社はそのような口座で損失を被ったことはなく、それを信じています は、その現金口座からの重大な信用リスクにさらされていません。
フェア 金融商品の価値
その 会社は、公正価値を定義するGAAPに従って金融商品の公正価値を測定し、以下の枠組みを確立します 公正価値を測定し、公正価値の測定に関する開示を拡大します。
ギャップ 公正価値とは、資産として受け取る、または元本の負債を譲渡するために支払われる交換価格(出口価格)と定義しています または、測定日の市場参加者間の秩序ある取引において、資産または負債にとって最も有利な市場。 GAAPはまた、公正価値の階層を確立しています。これにより、企業は観察可能なインプットを最大限に活用し、使用量を最小限に抑える必要があります。 公正価値を測定する際の観察不可能なインプットです。当社は、繰延募集費用の帳簿価を概算と考えています この商品の短期的な性質による公正価値。GAAPには、公正価値の測定に使用できる3つのレベルのインプットが記載されています。
レベル 1 — 同一の資産または負債の活発な市場における相場価格。
レベル 2 — 活発な市場における類似資産や負債の相場価格や、目に見えるインプットの相場価格。
レベル 3 — 観察できないインプット(たとえば、仮定に基づくキャッシュフローモデリングの入力)。
メモ 2。 流動性と資本資源
として
2023年12月31日現在、会社の現金は約$でした
歴史的に、 同社は主にTELOMIR-1の開発に従事してきました。これらの活動中に、会社は大きな損失を被りました。ザ・ FDAの承認に必要な継続的な事業と将来の臨床試験に資金を提供する会社の能力は、会社次第です 短期的に多額の追加外部資金を獲得する能力。創業以来、当社は事業資金を調達してきました 関連当事者による資金調達(注記4を参照)および新規株式公開(注記8を参照)を通じて。その他の資金源としては 会社が求めています。しかし、次の場合、資金調達が商業的に合理的な条件で達成されるという保証はありません。 まったく。
として この年次報告書の提出日以降、会社は引き続き損失を被り、現金および現金同等物が不足します 財務諸表が発行された日から少なくとも12か月間は、その業務をサポートするために準備されています。これらの条件 財務日から12か月間継続企業として継続できる会社の能力について、かなりの疑問を投げかけています 明細書が発行されます。
メモ 3。 使用許諾契約、関係者
その 会社はMIRALOGX, LLC(「MIRALOGX」)から、人体への使用におけるテロミール-1の使用に関する米国特許権をライセンスしています。 会社の創設者で唯一の人物であるジョニー・R・ウィリアムズ・シニアによって設立された知的財産開発および持株会社 テロミール-1の発明者。
オン
2023年8月11日(「発効日」)、当社とMIRALOGXは、修正および改訂された独占ライセンスを締結しました
この契約では、当社が独占的かつ永続的な権利を有し、上記の特許権に基づくライセンスを保有しています。
人体への使用、前臨床研究、およびあらゆる活動のために、米国で「ライセンス製品」を製造、使用、販売しています
規制当局の承認の取得または人間用の商品化(「MIRALOGX ライセンス」)を促進するために実施されたようなもの
契約」)。2023年11月10日、私たちとMIRALOGXは、修正および改訂されたライセンスの修正第1号を締結しました
契約に基づき、ライセンスに関連する使用分野が治療やその他を含むように修正されました
人間に加えて動物の医療や健康への応用、および関連する前臨床研究や活動を促進するために実施された活動
動物用医薬品、人体用治療および治療用途に加えて、規制当局の承認を得て商品化する
(「最初のMIRALOGXライセンス契約」、「MIRALOGXライセンス契約」と一緒に)。「ライセンス取得済み
契約書では、「製品」は、2,4,6-トリス(3,4-ジヒドロ-2H-ピロール-2-イル)を有効成分として含む医薬品として定義されています
ピリジンまたはその薬学的に許容される塩、エステル、または溶媒和物。また、私たちには対応するサブライセンスを付与する権利もあります
ライセンス特許権の下で。MIRALOGXライセンス契約は、MIRALOGXへの支払いを規定しています
その MIRALOGXからのライセンス期間は、最後に失効するライセンス特許の有効期限が切れる日まで、またはそれより遅い場合は、 ライセンス製品を対象とする最後の戦略的パートナーシップ/サブライセンス契約の満了日。特許権 2043年まで延長される予定で、その時期によっては追加の特許期間を含め、追加の特許期間が与えられる可能性があります 医薬品の規制審査のために撮影されました。
その 契約では、テロミールが特許権を行使するために自社の名前で訴訟を起こすことも規定されています。MIRALOGXは、の起訴を管理します テロミール-1の特許出願です。Telomirは、特許審査活動についてMIRALOGXから常に通知を受ける必要があり、選択することができます 特許保護の対象国を特定しました。Telomirは、特許審査と維持費をMIRALOGXに払い戻すことになっています。
| F-8です |
メモ 4。 関連当事者取引
期限
関係者から- 2023年12月31日に終了した年度中、当社は普通株主に運転資金の前払金を提供しました
コントロール。これらの前払金は需要に応じて支払われ、利息は発生しません。2023年12月31日現在に関連当事者から支払われるべき金額は
$
期限
関係者へ- 2023年12月31日と2022年12月31日に終了した年度に、当社は運転資本の前払い金を受け取りました
共通の管理下にある企業から。これらの前払金は需要に応じて支払われ、利息は発生しません。12月31日に終了した年度中に、
2023、ドルの金額の前払い
ベイ ショア・トラスト・ライン・オブ・クレジット
オン
2023年6月15日、当社は、当社が設立した信託であるベイ・ショア・トラストと約束手形および貸付契約を締結しました
創設者、ジョニー・R・ウィリアムズ・シニア、そして彼の家族のさまざまなメンバーが受益者です。この約束手形とローンの下で
契約(「ベイ・ショア・ノート」)により、会社は総額$まで借りる権利があります
に
当社がベイショア・トラストに普通株式購入を発行したベイ・ショア・トラストが提供する融資枠の検討
2023年6月15日の保証により、ベイ・ショア・トラストは最大購入権を得ました
中に
2023年12月31日に終了した年度に、当社はドルを受け取りました
ライセンス 契約-注3を参照してください。
関連しています
パーティーの旅費- 2023年4月1日、当社は共有リース費用に関する契約(「共有契約」)を締結しました。
関連当事者であるミラログス合同会社と。共有契約に基づき、会社は以下に従って毎月の拠出または支払いを行うことに同意します
共有機を家賃の支払いに利用しています。2023年12月31日および2022年12月31日に終了した年度中に、当社が負担しました
$
関連しています パーティーレンタル契約- 変数リースについては注5を参照してください
メモ 5。 リース
ザ・
会社の本社はメリーランド州ボルチモアにあり、オフィススペースのリースも含まれています。このリースは11月に始まりました
2022年で、2023年4月に修正されました。このスペースは約
その
会社は、ASC 842「リース」に規定されている資産と負債の使用権を開示しないことを選択しました。リースの金額が
変数 リース費用
変数 リース費用には、主に光熱費、固定資産税、および貸手から転嫁されるその他の運営費が含まれます。可変リース 航空機に関連する費用には、パイロットの費用、ジェット燃料、一般的な飛行費用などの使用費が含まれます。
| F-9です |
はじまり
2023年8月1日、当社の経理および管理スタッフは、フロリダ州タンパの関係者とオフィススペースを共有し始めました。
2023年12月31日現在、家主からの改訂されたリース契約が出るまで、正式な合意はありません。そのため、同社は
リースが締結されるまで、タンパのリースの費用を分割することに同意しました。2023年12月31日に終了した年度の中で、この変動の最小コストは
フロリダ州タンパのスペースに関連する合計$$
ザ・ リース費用の構成要素は次のとおりです。
| 12月31日に終了した年度 | ||||||||
| 2023 | 2022 | |||||||
| リース費用 | ||||||||
| オペレーティングリース費用 | ||||||||
| オペレーティングリース | $ | $ | - | |||||
| 変動リース費用 | - | |||||||
| リース費用合計 | $ | $ | - | |||||
メモ 6。 株主資本
資本 株式
の 会社には発行する権限があります 資本金の株式、 普通株式と 未指定優先株の株式。一連の優先株の場合、その権利と特権は取締役会によって決定されます 株式は指定されています。
逆 株式分割
効果的 2023年12月11日、当社は発行済普通株式の株式併合を完了しました フロリダ州務長官の定款の第2改正および改訂版。端数株式は発行されていませんし、発行される予定もありません 株式併合に関連して、株式併合によって生じた端数株式はすべて四捨五入され、今後も四捨五入されます 最も近い整数まで。発行済みの新株予約権の行使時に発行可能な株式、およびそのような新株予約権の行使価格、 株式併合を反映するように調整されています。特に明記されていない限り、この年次報告書の株式および1株当たりの情報 株式併合を反映しています。
プライベート プレースメントワラント
中に
2023年12月31日に終了した年度に、当社は2023年の私募投資家に普通株式を購入する権利を保証する普通株式を発行しました
まで
ベイ ショア・トラストのワラント
に
当社がベイショア・トラストに普通株式の購入を発行したベイ・ショア・トラストが提供する与信枠の対価
2023年6月15日の保証により、ベイ・ショア・トラストは最大購入権を得ました
その
新株予約権の公正価値は、ブラック・ショールズ評価モデルと仮定に基づくレベル3のインプットを使用して、付与日に見積もられました
予想ボラティリティ、予想配当、予想期間、およびリスクフリー金利。その結果、ドルになりました
| 予想価格変動率 | % | |||
| リスクフリー金利 | % | |||
| 基礎となる普通株式の公正市場価値 | $ | |||
| 加重平均期待寿命(年数) | ||||
| 配当利回り | - |
| F-10 |
メモ 7 — 所得税
ザ・ 12月31日現在の当社の純繰延税金資産の重要な構成要素は次のとおりです。
| 12月31日 | ||||||||
| 2023 | 2022 | |||||||
| 繰延税金資産 | ||||||||
| 純営業損失の繰越し | $ | $ | ||||||
| 第174条適格研究費 | ||||||||
| その他 | - | |||||||
| 繰延税金資産、総額 | ||||||||
| 控除:評価手当 | ( | ) | ( | ) | ||||
| 繰延税金資産、純額 | - | - | ||||||
| 繰延税金負債 | ||||||||
| 繰延税金資産の純合計 | $ | - | $ | - | ||||
はじめに
2022年には、内国歳入法第174条に従い、適格研究費は税務上の目的で資産計上され、償却されます
5年間にわたって。したがって、所得税の観点から、2023年12月31日および2022年12月31日現在、当社は
合計で約$の繰延税金資産を記録しました
ザ・ 所得税引当金の構成要素は次のとおりです。
| 2023 | 2022 | |||||||
| 繰延税金: | ||||||||
| 繰延給付 | $ | ( | ) | $ | ( | ) | ||
| 評価手当の変更 | ||||||||
| 繰延総額 | - | - | ||||||
| 所得税引当金の総額 | $ | - | $ | - | ||||
ASC
トピック740では、入手可能な証拠の重みに基づいて、繰延税額を評価額控除額で減額する必要があります
繰延税金資産の一部または全部が実現しない可能性が高い(50%を超える可能性)。評価
繰延税金資産を、実現されそうな金額まで減額するには、引当金が十分でなければなりません。会社
決定したとおり、純営業損失の繰越によって生じた繰延税金資産に対して、全額評価引当金を計上しています
これまでの会社の過去の損失を考えると、そのような金額は認識できないかもしれません。2023年12月31日現在、当社は
連邦政府の累積純営業損失の繰越額は約$です
メモ 8 — 後続イベント
初期 公募増資
オン
2024年2月13日、当社は、以下からなる新規株式公開を終了しました $の価格の株式 1株あたり約
$
その 株式は、当初、修正されたフォームS-1の会社の登録届出書(ファイル番号333-275534)に従って売買されました。 2023年11月14日に証券取引委員会(「SEC」)に提出された(「登録届出書」) そして、改正された1933年の証券法の規則424(b)(4)に従って委員会に提出された最終四半期報告書。登録 この声明は、2024年2月8日に委員会によって発効が宣言されました。普通株はナスダック・キャピタル・マーケットで取引を開始しました 2023年2月9日に「TELO」のシンボルを付けてください。IPOのクロージングは2024年2月13日に行われました。
| F-11 |
署名
に 取引法のセクション13または15(d)に従い、登録者は、登録者に代わってこのレポートに正式に署名させました 署名なし、そこで正式に承認されました。
| テロミール 医薬品株式会社 | ||
| 日付: 2024年3月28日 | 作成者: | /S/ クリス・チャップマン |
| 名前: | クリス チャップマン | |
| タイトル: | チーフ 執行役員 | |
| (校長 執行役員) |
| 作成者: | /S/ ネイセン・フエンテス | |
| 名前: | ネイゼン フエンテス | |
| タイトル: | チーフ 財務責任者 | |
| (校長 財務責任者) |
に 取引法に従い、この報告書は登録者に代わって以下の担当者によって署名されています と記載された日付に。
| 個人 | キャパシティ | 日付 | ||
| /s/ クリストファー・チャップマン | チーフ 執行役員兼会長 | 3月 28、2024年 | ||
| クリストファー チャップマン | (校長 執行役員) | |||
| /s/ ネイセン・フエンテス、公認会計士 | チーフ 財務責任者 | 3月 28、2024年 | ||
| ネイゼン フエンテス、公認会計士 | (校長 財務責任者および最高会計責任者) | |||
| /s/ クレイグ・イーグル博士 | ディレクター | 3月 28、2024年 | ||
| 博士 クレイグ・イーグル | ||||
| /s/ クリストス・ニコロウディス、Esq。 | 将軍 カウンセルとディレクター | 3月 28、2024年 | ||
| クリストス ニコロウディス弁護士 | ||||
| /s/ マイケル・ジャーマン、公認会計士 | ディレクター | 3月 28、2024年 | ||
| マイケル ドイツ、公認会計士 | ||||
| /s/ ブラッド・クルーニッヒ | ディレクター | 3月 28、2024年 | ||
| ブラッド クルーニッヒ | ||||
| /s/ タリアタックさん | ディレクター | 3月 28、2024年 | ||
| タルヒア タック | ||||
| /s/ ヒュー・マッコール三世 | ディレクター | 3月 28、2024年 | ||
| ヒュー マッコール三世 |
| 70 |