アメリカ アメリカ
証券取引委員会
ワシントンD.C.,20549
表
(タグ 一)
| 1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
締め切りの財政年度について
| 1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
に対して,過渡期は_から
手数料ファイル番号
(登録者の正確な名称は、その定款に規定されている名称と同じ)
(州や他の管轄区域 会社や組織) |
(I.R.S.雇用主 標識 番号) |
| (主に実行オフィスアドレス ) | (Zip コード) |
(登録者の電話番号、市外局番を含む)
同法第12条(B)に基づいて登録された証券:
| クラスごとのタイトル | 取引 個の記号 | 登録された各取引所の名称 | ||
同法第12条(G)に基づいて登録された証券:
ありません
(クラスタイトル )
登録者が証券法規則405で定義されている有名な経験豊富な発行者であれば、再選択マークで
を示してください。はい。☐
登録者が取引法13節または15(D)節に基づいて報告を提出する必要がない場合は,再選択マークで
を示してください。はい
再選択マークは、登録者が、(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求された短い期間内)に、1934年の証券取引法第13または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)
が過去90日以内にそのような提出要件に適合しているかどうかを示す
登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)にS-T規則
405条に従って提出された各相互作用データファイルを電子的に提出したかどうかをチェックマークで示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな申告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
| 大型 加速ファイルサーバ☐ | ファイルサーバが加速されました☐ |
| 小さな報告会社
| |
| 新興成長型会社 |
もしbrが新興成長型会社である場合、登録者が延長された移行期間を使用しないことを選択したかどうかを再選択マークで示して、取引法第13(A)節に従って提供された任意の新しいまたは改正された財務会計基準を遵守してください
登録者が報告書を提出したか否かを再選択マークで示し、その経営陣が“サバンズ-オキシリー法案”(“米国法典”第15編7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する
証券が当該法第12(B)条に基づいて登録されている場合は、届出書類に含まれる登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かをチェックマークで示してください
これらのエラーのより真ん中に再記述があるかどうかをチェックマークで示すことは、登録者の任意の幹部が関連する回復中に受信したインセンティブベースの報酬を§240.10 D−1(B)に従って回復分析する必要があるかどうかを示す
登録者が空殻会社であるかどうかをチェックマークで表す(“取引法”第12 b-2条で定義されている)。
はい
No
国の非関連会社が保有する投票権と無投票権のある普通株の総時価は,登録者が最近完成した第2財期の最終営業日の普通株の最終売却価格またはそのような普通株の平均入札と要件から算出される。
2023年6月30日現在,登録者の非関連会社が保有する登録者普通株の総時価は$である
破産に関連した登録者にのみ適用される
議事録(Br)の5年前:
裁判所が確認した計画に基づいて証券分配を行った後、登録者が1934年の“証券取引法”第12、13又は15(D)節に提出されたすべての書類及び報告を再選択マークで示した
2024年3月28日までに普通株式の株式を発行しました。
参照により組み込まれた文書
ありません
索引.索引
ページ 違います。 | ||
| 前向きに陳述する | 3 | |
| 第1部 | 3 | |
| 第 項1. | 公事です。 | 3 |
| 1 a項目. | リスク要因です | 35 |
| 項目 1 B. | 未解決の従業員のコメント。 | 67 |
| プロジェクト 1 C. | ネットワークセキュリティです。 | 67 |
| 第 項2. | 財産です。 | 68 |
| 第 項3. | 法律訴訟。 | 68 |
| 第 項. | 炭鉱の安全情報開示。 | 68 |
| 第II部 | 69 | |
| 第 項5. | 登録者普通株、関連株主事項及び発行者が株式証券を購入する市場。 | 69 |
| 第 項6. | [保留されている]. | 69 |
| 第 項7. | 経営陣の財務状況と経営結果の検討と分析。 | 69 |
| 第 7 A項。 | 市場リスクに関する定量的で定性的な開示。 | 77 |
| 第 項8. | 財務諸表と補足データ。 | 77 |
| 第 項9. | 会計や財務開示における会計士との変更と食い違い。 | 77 |
| 第 9 A項。 | 制御とプログラムです | 77 |
| 第 9 B項。 | 他の情報。 | 79 |
| 第 9 C項. | 検査を妨害する外国司法管轄区域を開示する。 | 79 |
| 第三部 | 80 | |
| 第 項10. | 役員、幹部、会社が管理する。 | 80 |
| 第 項11. | 役員報酬。 | 85 |
| 第 項12. | いくつかの実益所有者の保証所有権及び管理層及び関連株主事項。 | 88 |
| 第 項13. | 特定の関係と関連取引、そして役員の独立性。 | 90 |
| 第 項14. | チーフ会計士料金とサービス料です。 | 91 |
| 第4部 | 92 | |
| 第 項15. | 展示品と財務諸表明細書。 | 92 |
| 第 項16. | 表格10-K要約。 | 95 |
| サイン | 96 | |
| 2 |
第 部分I
前向き陳述
本年度報告書は連邦証券法で定義された展望的な陳述を含む。本年度報告に含まれる前向き 陳述に記述されているイベントは発生しない可能性がある。一般に、これらの陳述は、業務計画または戦略、私たちの計画または戦略の予想収益または他の結果、我々が行う買収の予想収益または予想収益、または予想収入、収益、または私たちの経営業績に関する他の態様の予測に関するものである。“可能”、“将”、“予想”、“信じ”、“予想”、“計画”、“計画”、“予定”、“推定”、“継続”などの語およびその対義語および類似表現は、前向き表現を識別することを目的としている。私たちはあなたに、これらの陳述は未来の業績や事件の保証ではなく、 は多くの不確実性、リスク、および他の影響を受けることを想起させ、その多くは私たちがコントロールできないものであり、これらは陳述の正確性 および陳述に基づいた予測に影響を与える可能性がある。我々の業績に影響を与える可能性のある要因には、本年度報告第1 A項で議論されたリスク·不確定要因(“リスク要因”)が含まれているが、これらに限定されない。
これらの不確実性、リスク、および他の影響のいずれか1つまたは複数は、私たちの運営結果および私たちが行った前向きな陳述に最終的に正確に重大な影響を与えることが証明される可能性がある。私たちの実際の結果、業績、業績は、これらの展望的陳述で明示的または暗示的な状況とは大きく異なるかもしれない。私たちは、新しい情報、未来のイベント、または他の状況に基づいて、いかなる前向き 宣言を公開または修正する義務はありません。
知的財産権
本年度報告書には連邦に登録されている商標への引用が含まれているバイオレメディエーション療法そしてトンボ.トンボデザイン、 BRTX-100, 熱乾法そしてBRTXそれは.♪the the theトンボ.トンボLOGOはアメリカ著作権局にも登録されています。本年度報告書には,他の組織財産に属する商標,商号,サービスマークへの引用も含まれている。便宜上、本年度報告で言及された商標および商号は未使用、SMまたは記号が出現し、著作権保護された コンテンツは記号を使用していないが、これらの記号は、我々または第三者が所有する知的財産権の有効性または実行可能性 を反映していない。
| 第 項1. | 商売人. |
(a) 業務を広げる
本10−K表年次報告または年次報告で用いられる は,言及した“会社”,“我々”,“我々”,“br}または”我々“とはBioRestorative Treatures,Inc.を指す。
私たちは1997年6月13日にネバダ州に登録して設立した。2011年8月15日に幹細胞保険会社から改名しました“BioRestorative Treatures,Inc.”まで私たちは2015年1月1日からデラウェア州に再登録した。2022年12月31日からネバダ州に再登録します。
| 3 |
我々は細胞と組織プログラムを用いて治療製品や医療療法を開発し,主に成人幹細胞に関与している
私たちは現在私たちを追求しています椎間板·脊椎計画私たちの最初の研究治療製品はBRTX-100 2022年3月、アメリカ特許が私たちの椎間板·脊椎計画それは.米国食品医薬品局(FDA)にIND申請を提出し、許可を得て第2段階の臨床試験を開始し、調査を開始したBRTX-100Brで退行性腰椎間板疾患による慢性下腰痛を治療した。私たちはFDAの許可を得て、このような臨床試験を始めた
著者らはすでに独占的な許可を得て、技術を成人幹細胞の研究に応用して腰椎間板ヘルニアと膨張を含む腰椎間板と脊柱疾患を治療することができる。この技術は高度な幹細胞注射プログラムであり、腰部の痛み、臀部と足の痛み、そして足と足のしびれと痛みを緩和することができる
私たちも開発していますThermoStem計画それは.この臨床前計画は、2型糖尿病および肥満および高血圧、他の代謝障害および心臓欠陥の細胞ベース治療に褐色脂肪(脂肪)を使用することに関するThermoStem計画アメリカと他の管轄区域で発表された。
また,生物製剤をベースとした化粧品事業の発展を求めている。この業務によると、化粧品や生毛製品を製造·販売し、化粧品や美容用途に利用する。
材料 2023年のイベント
2023年4月に、吾らは仲量連行機関サービス有限責任会社や代理店と資本オンデマンド販売契約や販売契約を締結し、この合意により、吾らは時々代理店を介して、総発行価格が6,109,000ドルまでの普通株式を代理店または代理店に発売することができる。今まで、私たちは販売協定に従って約622,000ドルの株を売却した。
2023年4月、第2段階臨床研究の安全摩耗部分の登録が完了したことを発表しましたBRTX-100.
2023年5月、私たちはニューヨーク州最大の医療提供者と個人雇用主Northwell Healthと臨床試験協定を締結したことを発表しました。この協定によると、Northwell Healthは私たちの第2段階の臨床研究に参加しますBRTX-100.
2023年5月、自己ドナー由来の骨髄間葉系幹細胞を組織銀行として扱うことができるニューヨーク州衛生局発行許可証を取得したことを発表した。
2023年6月に最終テーマを発表しましたBRTX-100第二段階臨床試験安全待ち行列はすでに投与された。
2023年6月、私たちは、私たちの第2段階の臨床試験を監督する独立データ安全監視委員会は、方案のバージョンに基づいて研究を継続することを提案し、何の変更もしないことを発表した。
| 4 |
2023年6月私たちとのThermoStem計画私たちに送ってくれました。
2023年6月私たちとのThermoStem計画私たちに送ってくれた.
2023年7月私たちとのThermoStem計画私たちに送ってくれました。
2023年7月、685,033株の普通株を登録直接公開発行方式で売却した。我々は今回の発行から約2,100,000ドルの総収益を得た.
2023年9月、私たちはバイオ化粧品サプライヤーと供給協定を締結した。供給プロトコルに基づき,我々のcGMP ISO−7認証クリーンルームを用いて,化粧品や美容用途のための組織生物製剤を製造した。2023年12月、私たちは供給協定を終了した。
2023年12月にはThermoStem計画私たちに送ってくれた.
材料 2024年の事件
2024年2月、私たちは株式承認証の行使によって2,000,000株の普通株を発行した。発行に関連して、私たちは2,513,686株の普通株の引受権証を発行し、1,351,580株の普通株 を追加発行することが義務付けられていますが、これらの追加株式はすべて支払われていますが、株式承認証所有者の1人の最大実益所有権制限のため発行されていません。 私たちは株式承認証の行使から約8,100,000ドルの毛収入を得た。
(b) 業務.業務
一般情報
我々は細胞と組織方案を用いて治療製品を開発し、主に成人幹細胞に関連している。以下に述べるように、私たちの2つのコア計画は椎間板/脊柱疾患と代謝障害の治療に関連している
| ● | 光ディスク/脊柱 プログラム(BrtxDisc)私たちの有力細胞治療候補者はBRTX-100患者の骨髄から収集した自己(または個人自身)培養された間葉系幹細胞またはMSCsから製造された製品である。この製品を疼痛の腰椎椎間板疾患の非手術治療,あるいは外科手術の無料治療として用いる予定であるBRTX-100生産プロセスは,患者の骨髄を収集し,骨髄中の幹細胞を分離·培養し,細胞を凍結保存することを含む特許技術を利用している。外来手術ではBRTX-100患者が損傷した椎間板に医師brを注入した。この治療は疼痛が非手術プログラムで緩和されていない患者、および手術の将来性に直面する可能性のある患者に適している。FDAから許可を得て、以下の技術を用いて第2段階の臨床試験を開始することができますBRTX-100退行性腰椎間板疾患による慢性下腰痛を治療する。我々は,PRC ClinicとCROプロトコルを署名し,臨床試験場プロトコルを実行し,患者登録,患者プログラムの開始,製造設備の購入,臨床生産能力を含む我々の実験室 を拡大することにより,このような臨床試験を開始した。2022年3月私たちとの椎間板·脊椎計画 が発表されました。私たちはこの特許の独占的許可権を付与された。以下の“Disc/Spine Program”を参照されたい。 |
| 5 |
| ● | 代謝計画(ThermoStem)それは.肥満や代謝障害に対する細胞ベースの治療レジメンを開発し,褐色脂肪(FAT)由来幹細胞(BADSC)を用いて褐色脂肪組織(BAT)を生成している。これを私たちのと呼んでいますThermoStem計画BATは自然に産生され、人類の新陳代謝動態バランスを調節する褐色脂肪貯蔵庫をシミュレーションすることを目的としている。最初の臨床前研究により、動物体内の褐色脂肪含有量の増加は追加のカロリー燃焼およびグルコースと脂肪レベルの低下の原因である可能性が示唆された。褐色脂肪レベルの高い人の肥満や糖尿病のリスクが低下する可能性があることが分かった。特許に関連する特許ThermoStem計画アメリカと他の管轄区域で発表された。以下の“代謝性ブラウン脂肪(脂肪)計画”を参照してください。 |
我々はまた、細胞および/または他の治療製品または材料を脊柱および椎間板(ならびに身体の他の部分)に送達することを目的とした研究用湾曲針装置を許可した。私たちはその設備が商業化される前にFDAの承認や許可を得る必要があると予想する。第2段階の臨床試験でこの装置を使うつもりはありませんBRTX-100. 次の“ルーパー装置”を参照してください。
当該製品の特許及び特許出願椎間板·脊椎計画Vtの..ThermoStem計画エルボ装置は次の“技術;研究と開発”の項目に列挙されている
我々も生物製剤に基づく化粧品業務の発展を求めている。この業務によると、化粧品や生毛製品を製造·販売し、化粧品や美容用途に利用する。
概要
すべての人の体内に幹細胞がありますこれらの細胞はヒト発育の早期段階からヒトの生命の末期まで存在している。私たちの人生では、私たちの体は絶えず幹細胞を産生し、これらの幹細胞は再生し、分化した細胞を産生し、皮膚、血液、筋肉、神経のような身体の様々な側面を構成する。これらの幹細胞は一般に成人(非胚)幹細胞と呼ばれる。これらの細胞は、失われた細胞または損傷した細胞または組織の代わりに、または他の方法で疾患を治療することを目的とした医学的治療目的に重要である。
再生細胞療法は、罹患、損傷或いは機能障害の細胞を健康、機能正常な細胞で置換し、或いは損傷或いは罹患した組織を修復することに依存する。末梢血や臍帯血,骨髄,脂肪組織に発見された細胞を含む広範な細胞は細胞治療に用いることができる。65年間,医師たちは骨髄由来の成人幹細胞を用いて様々な血液癌を治療してきた(最初の成功した骨髄移植手術は1956年に行われた)。最近,医師たちは幹細胞を用いて様々な他の疾患を治療し始めている。細胞や組織製品および再生治療プログラムを開発する予定であり,主に成人幹細胞に関与しており,患者が細胞による治療を受けられるようにしている。
| 6 |
われわれは最初に治療領域に集中していたが,これらの領域は患者へのリスクが低く,回復が比較的容易であり, は十分な臨床データから結果を証明することができ,患者や医師はこのプログラムに満足するであろう。私たちは識別しやすい患者集団がこのような手続きから利益を得ると信じている。また,最も一般的な外科手術レジメンに比べてこれらの手術のコストは大きく低下し,長期的には数年持続可能な保存的治療費よりも有利になると考えられる。
そこで,我々は最初の開発努力を細胞による治療製品や臨床開発計画に集中しており,これらの製品や臨床開発計画は治療案が低侵襲な特定医学分野に適用されている。これらの領域には椎間板や脊柱の治療や代謝に関連する疾患がある。規制部門の承認後、私たちの製品と手続きのための第三者精算を求めます。しかし、私たちが成功しなければ、患者は自腹を切って私たちの製品と手続きを全額支払う必要があるかもしれません。いかなる政府や他の第三者支払者も精算できないことは、私たちの見通しに悪影響を与えます。
著者らは細胞と組織方案を用いた研究治療製品と医学治療に関する研究と開発を展開し、主に成人幹細胞に関連している。以下の“椎間板/脊柱計画”、“新陳代謝脂肪(脂肪)計画”、および“弯針装置”を参照されたい。これらの計画の結果として,我々は7つの米国特許,13件の外国特許,1つの米国特許出願,4つの我々の研究に関連する外国特許出願を持っているThermoStem計画です私たちはまた4つのアメリカ特許出願の許可証を取得しました光ディスク/脊柱br計画、私たちとの椎間板·脊柱計画はアメリカ特許のライセンスを取得しました
著者らはすでに研究実験室施設を設立し、現在良好な製造規範或いはcGMP能力を備え、臨床レベルの製品 を生産することができ、著者らは細胞に基づく治療、製品と方案、幹細胞関連の知的財産権 或いはIP、及び翻訳研究応用の更なる開発を求めている。以下の“実験室”を参照されたい。
今まで、私たち はまだ相当な収入を生み出していない。2021年11月、私たちは23,000,000ドルの証券公開を完了しました。 2023年、私たちは証券公開を通じて約2,680,000ドルの追加毛収入を集めました。2024年2月には、私たちはまた権利証の行使によって約8,100,000ドルの毛収入を受けた。このような総資金は私たちの第2段階の臨床試験を完成させ調査に使用するのに十分ですBRTX-100退行性腰椎椎間板疾患による慢性腰背部痛の治療において、brは本節でさらに紹介し、著者らの臨床前研究と開発を継続するThermoStem計画そして、私たちの現在の運営資金の需要を満たす;しかし、私たちの業務計画の実施は以下に述べるように、以下に期待される第3段階の臨床試験を含む、私たちの研究および開発事業を支援するための追加の資金を受ける必要があるだろうBRTX-100私たちのbrに関する期待的な臨床試験ですThermoStem計画他の方法で私たちの運営を支援してくれます私たちは投資銀行家やバイオテクノロジー基金、戦略パートナー、他の金融機関を通じて資金を調達することを求めるつもりだ。私たちが予想していた第3段階の臨床試験を完成させるためには多くの追加資金が必要になりますBRTX-100です。本節で紹介した他の計画を実施し,一般運営に資金を提供するために多くの追加資金が必要となる.私たちが予想しているこのような用途に必要かもしれない資金の額が正しいか、あるいは予想される時間範囲で私たちの目標を達成できるという保証はありません。しかも、私たちが商業的に合理的な条項や他の方法で必要な資金調達を受けることができるという保証はない。もし私たちが十分な資金を得ることができなければ、私たちは私たちが提案したbr業務を大幅に削減または停止することを要求されるかもしれない。
| 7 |
光ディスク/脊柱(Br)計画
一般情報
私たちが現在実施している計画では椎間板·脊椎計画私たちの最初の候補はBRTX-100. 独占許可を得ました(“参照”独占許可成人幹細胞を用いて椎間板と脊柱疾患を治療する技術を可能にした。この技術は高度な幹細胞培養と椎間板或いはIVDへの注射過程であり、下腰痛、臀部と足の痛み及び足と足のしびれと痛みを緩和することができる。
腰背部痛は全世界で最もよく見られる、最も障害に至る、最も高価な筋肉骨格疾患である。全世界生命科学コンサルティング会社利邦組合会社の2016年の市場報告 によると、2.5億人のアメリカ成人の中で、2500万人近くが慢性下腰痛を患っており、その中の約1200万人は腰椎間板変性と診断され、治療を受け、約560万人の は椎間板ヘルニア或いは負傷による痛みを患っている。毎年500,000から100万例の侵襲的外科手術があり,これらの下背部疾患に関連する痛みの緩和を試みていると考えられ,このような手術の費用は約400億ドルである。臨床研究では,痛みの源として最も一般的なのはIVDへの被害であることが示されている。力としては,個々の荷重でも微小侵襲を繰り返しても,IVD固有のこれらの荷重に抵抗する能力を超えた場合に発生する。年齢、肥満、喫煙、生活様式とある遺伝要素はIVD損傷を招く可能性がある。現在,背部痛を治療する手術方法は極めて侵襲的であり(通常脊柱の生物力学に不利な変化を与え,さらに後退させやすい),成功率は受け入れられないほど低い(2回目の手術の確率は10%から20%)。また,現在の手術法は非常に高価であり,脊柱融合術の費用は約110,000ドル,椎間板摘出術の費用は約20,000から50,000ドル,椎間板置換術の費用は約80,000から150,000ドルである。保存的治療でも高価かもしれないが,経口薬の年間費用は1,000ドルから2,000ドル,注射治療は年間約8,000ドル,理学療法は年間約20,000ドルである。BRTX−100を用いた1回の治療のコストは,数年持続可能な保存的治療よりも有利であり,最も一般的な外科手術よりも安くなると予想される。
良性と考えられていたが,腰背部痛の自然歴は通常進行性障害をきたす慢性反復発作の痛みである。これはIVD受傷後の癒合能力が悪い直接的な結果と考えられる。IVDは体内最大の無血管構造(少ないかないか)であり,細胞密度は低い。したがって,受傷後癒合する固有の能力 は悪い。本研究の臨床的意義BRTX-100患者自身が培養した高濃度骨髄間葉系幹細胞を病理部位に輸送し、癒合を促進し、痛みを緩和する。
| 8 |
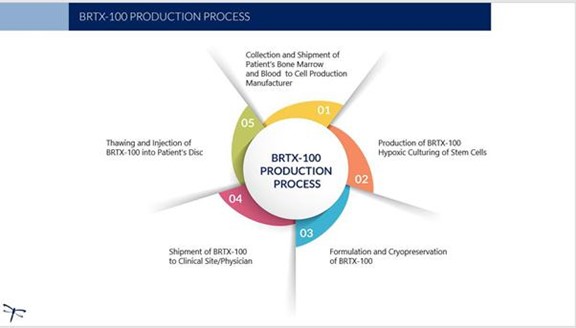
私たちは間葉系幹細胞候補を開発しましたBRTX-100自己(あるいは人自身の)ヒト骨髄から抽出し、独自の方法で培養と調製し、痛みの腰椎椎間板移植に特化した。候補製品 の開発部分は以下のものを用いた“独占許可“以下に述べる 在“BRTX-100“と”生産と交付,” BRTX-100培養過程により開発された低酸素(低酸素)幹細胞製品である。損傷椎間板の無血管環境における骨髄間葉系幹細胞の生存率を向上させるためにBRTX-100低酸素条件下で拡張するように設計されている。この過程の目的は損傷した椎間板内に細胞を注入した後、大量の細胞数の増加を招き、生存能力と治療潜在力が増強することである。
2017年2月,IND申請によりFDAから認可を受け,第2段階臨床試験を開始し,使用を調査したBRTX-100著者らの鉛細胞療法候補は、退行性腰椎間板疾患による慢性下腰痛の治療に用いられる。著者らはすでにPRC ClinicとCRO協定を署名し、臨床試験場協定を実行し、患者登録、患者プログラムの開始、製造設備の購入と臨床生産能力を含むために著者らの実験室を拡張し、それによって著者らの第二段階の臨床試験を開始した。われわれが臨床試験開始時間についてFDAに提出した定期報告によると,既存のINDは依然として有効であると信じている。
では開発を除いてBRTX-100この技術を戦略的第三者に再許可することも可能であり,FDAによる腰椎椎間板適応の承認や,腰椎や脊柱に関連する疾患に関する細胞ベース開発計画に関する第三者の使用を支援することも可能である。
私たちは細胞製品の生産(含む)を行うためのクリーンルーム施設を含む実験室を設立しましたBRTX-100)“br}は、我々の臨床試験、第三者細胞製品、または一般的な研究目的のために使用される。この実験室を利用して私たちの未来の製品のパイプラインを開発し、幹細胞に関連する知的財産権を拡大することもできます。以下の“実験室”および“技術、研究、開発”を参照されたい。
2022年3月米国の特許はBRTX-100もう発表されました。私たちはこの特許の独占許可権 を取得した。参照してください“独占許可“下だ。
BRTX-100
私たちの主な候補製品 BRTX-1001種の自己低酸素(低酸素)培養間葉系幹細胞製品であり、患者自身の骨髄から来て、特許生物材料担体(血小板溶解物)を用いて調製し、効力、活性と生存率を高める。我々はすでに冷凍保存した無菌細胞製品候補製品を設計し,瓶に入れて痛みの腰椎椎間板に注射することができる。候補製品は標準的な20号3.5インチ導入針と25号br}6インチ針を使用して交付され、この針は交付時に光ディスクセンターまで延びると予想される。監督部門の承認後、私たちは医師に承認された注射手続きに関する訓練を提供する予定です。候補製品の配送には30分の手続きがかかると予想される。
| 9 |
骨髄間葉系幹細胞はBRTX-100他の人が開発している他のMSCsと似ている;しかし、損傷椎間板の無血管環境における我々の骨髄由来MSCsの生存能力を増強するために、BRTX-100低酸素条件下で拡張するように設計され,持続時間は約3週間であった。この過程の目的は,約4000万個の細胞計数集団 を受傷した脊椎ディスクに局所注入した後,より高い生存能力と治療潜在力を有することである。出版物と科学文献により、常酸素(常酸素)条件下で培養したMSCsと比べ、低酸素環境下で事前適応したMSCsはもっと強い骨格筋再生特性を示し、そして循環と血管形成への影響を改善した。
2018年8月転換医学雑誌我々の研究結果を発表し,長期低酸素培養ヒト骨髄間葉系幹細胞の利点を評価した。
2021年9月、我々は低酸素培養骨髄間葉系幹細胞の治療効果を評価するために、米国国立衛生研究院小型企業技術移転(STTR)の第1段階支出256,000ドルを獲得した(BRTX-100)をポリエチレングリコールペプチドヒドロゲルで被覆した後。この仕事はセントルイスワシントン大学と協力して行われた。
2022年6月以来、著者らはすでに16地点と臨床試験協定を締結し、慢性腰椎間板疾患に対する第二段階の臨床試験を展開した。
生産と交付
私たちの候補製品の生産はBRTX-100まず,医師は局所麻酔下に患者から骨髄を採取する。brは患者から末梢血液も採取する。そして,医師は患者の骨髄と血液サンプルを我々の実験室(または契約実験室)に送って培養·調製する。低酸素培養過程は、内部椎間板環境における生存の可能性を向上させるのに適した細胞集団を選択することを目的としている。細胞培養過程と製品調製には約3週間が必要であり,また製品発表基準を満たすためには2週間の品質管理試験が必要と予想される。そして治療的に凍結保存された幹細胞をBRTX-100Br)無菌小瓶を医師室に戻し、そこでは手術前に制御された解凍を行う。このプログラムと我々のサービスの価格構造 は未定であり,その価格構造 がそのプログラムやサービスの販売可能性に影響を与える保証はない.以下にこの過程を説明する

| 10 |
独占ライセンス
我々がRegenerative Sciences、LLCまたはRegenerativeと締結した2012年4月に発効した許可協定または再生許可協定によると、他の事項を除いて、我々はRegenerativeから世界範囲(アジアとアルゼンチンを含まない)の独占的、特許権使用料の許可を得て、特定の細胞培養方法を使用または再許可し、椎間板と脊柱の開発計画 に関連し、椎間板ヘルニアや疼痛および無血管地帯の治療を含む。許可された研究技術は先進的な幹細胞培養と注射プログラムであり、下腰痛、臀部と足部の痛み、足部と足部の麻痺と痛みを緩和することができる。再生許可プロトコルによれば、我々はまた、特定の細胞および/または細胞製品を椎間板および/または脊柱(および身体の他の部分)に管理するために、特定の研究エルボ装置を使用または再許可するために、再生性から世界的に独占的なbr印税許可を得る。生細胞を含む物質の人体内の特定の位置への輸送を容易にし,近傍構造への潜在的被害を最小限にするために,この研究装置の設計を改善する必要がある。
再生性ライセンスプロトコルの主体である 特許はRegenexx,LLCに譲渡されており,この有限責任会社から 再生性はRegenerativeの付属会社であることが提案されている.
動物研究
我々の候補製品の有効性と安全性はBRTX-100すでに変性したウサギ椎間板モデルでテストを行った。この研究では,80頭のウサギが手術を受け,椎間板に穿孔を行った。術後4週間、各ウサギは対照剤、生体材料担体或いはBRTX-100光ディスクに注入する。その生物分布と薬効を研究するためにBRTX-100 はそれぞれ56日目と120日目にウサギの評価を行った。
動物研究の主な安全性の発見は以下の通りである
| ● | 証拠や投与に関連する深刻な毒性が観察されていませんBRTX-100どの時点でも。両群および2つの時点の臨床病理はいずれも予想される正常な歴史範囲内であり、テスト条件下であった。br}は、両群が2つの終点で撮影した放射画像 を振り返った後、異常は認められなかった(骨折または腰椎椎間板疾患の明らかな兆候を含む)。注射を受けた動物の全身組織や椎間板には明らかな毒性や不良発現はなかったBRTX-100. |
| 11 |
| ● | ヒト細胞は検出されなかった(BRTX-100)56日目の一時時点で観測された。これは が提案した行動機構と一致するBRTX-100分泌成長と免疫調節因子の傍分泌作用により作用する。 |
動物研究の主な効果は以下の通りである
| ● | BRTX-100120日目に対照群と比較して統計学的に有意なDHI(椎間板高増加)を示した。 | |
| ● | BRTX-100有効な組織学的スコアにより,120日目に椎間板組織学は対照群と比較して統計学的に有意な改善を示したBRTX-100120日目には,椎間板の細胞密度や基質は対照群と比較して有意に改善した。 |
臨床試験
FDAに提出したIND申請によると,第2段階臨床試験を開始し,br使用を調査することが許可されているBRTX-100われわれはすでにわれわれの第二段階臨床試験を開始し,PRC臨床とCRO協定を締結し,16地点と臨床試験br協定を実行し,患者を募集し,患者プログラムを開始し,製造設備を購入し,臨床生産能力を含むわれわれの実験室を拡大した。
以下にFDA認可の第二段階臨床試験を紹介する
2期展望性、二重盲検、プラセボ対照、無作為研究
| ● | 将軍 |
| ● | 99例の患者、ランダムに2:1、BRTX-100制御のために4000万個の細胞/用量 | |
| ● | 10-20の臨床試験サイト(15個の臨床試験サイトを利用する予定) | |
| ● | 主なbrの治療効果の終点は12ヶ月です | |
| ● | 患者の安全性と有効性24ケ月間のフォローアップ | |
| ● | 組み込まれたbr被験者は症状のある椎間板を1つしか持たなければならない | |
| ● | 組み込まれた被験者は、病歴、検査、X線検査、または他の許容可能な方法で確認された単一の腰椎椎間板変性の典型的な疼痛および慢性腰椎椎間板疾患の現在の診断を有しなければならない | |
| ● | 組み入れられたbr被験者は従来の保存的非手術療法を使い果たさなければならない |
| 12 |
| ● | 主な 効能の終点 |
| ● | Responder Endpoint−機能改善と疼痛閾値低下を満たす患者のパーセンテージ | |
| ● | 機能改善 OSwestryアンケート(ODI)より,少なくとも30%増加する機能と定義する | |
| ● | 痛み減少brは,視覚シミュレーションスコア(VAS)を用いて測定した痛みが少なくとも30%減少すると定義する |
| ● | 他の 個または補助端末 |
| ● | 12ヶ月後の臨床反応 | |
| ● | 第2、12、26、52と104週にVAS採点とODIを用いて疼痛のベースラインに対する変化を評価した | |
| ● | ODIによる2,12,26,52,104週目の評価のベースラインにより,機能変化 | |
| ● | ローラン·モリス障害アンケート(RMDQ)により26,52,104週に評価されたベースラインよりの機能変化 | |
| ● | 12週、52週、および104週における機能階層指数(FRI)評価のベースライン機能変化 | |
| ● | 第2、12、26、52および104週目にベースライン生活の質評価(SF-12アンケート)から得点変化 |
2021年12月、私たちは専門研究コンサルティング会社d/b/a PRC臨床と主なサービス契約を締結し、これは臨床試験管理に特化した契約研究機関またはCROであり、私たちの第2段階の臨床試験を行うためのものである。
2023年4月、第2段階臨床研究の安全摩耗部分の登録が完了したことを発表しましたBRTX-100.
2023年5月、私たちはニューヨーク州最大の医療提供者と個人雇用主Northwell Healthと臨床試験協定を締結したことを発表しました。この協定によると、Northwell Healthは私たちの第2段階の臨床研究に参加しますBRTX-100.
2023年6月に最終テーマを発表しましたBRTX-100第二段階臨床試験安全待ち行列はすでに投与された。
2023年6月、私たちは、私たちの第2段階の臨床試験を監督する独立データ安全監視委員会は、方案のバージョンに基づいて研究を継続することを提案し、何の変更もしないことを発表した。
FDAの承認過程は長く、高価で不確定である可能性があり、臨床試験(S)が完了するか、または この製品が最終的に承認または承認されることは保証されない。
自分が必要な臨床試験を行う代替案として、私たちの候補製品に関する権利の許可を探るかもしれませんBRTX-100戦略的パートナーですこのような計画は、資金調達の開始と臨床試験の完了に必要な大量の資本を除去または大幅に減少させる可能性があるBRTX-100製品販売収入ではなく、許可に関する収入を提供してくれるだろう。商業的に合理的な条項であるかどうかにかかわらず、どんな許可協定が締結されるかどうかは保証されない。
| 13 |
定義された 実行状況報告
2018年3月、業務発展と戦略コンサルティング会社Defined Healthに依頼しましたBRTX-100 Defined Healthは製薬、バイオテクノロジー、ヘルスケア業界の多くのリーディングカンパニーと25年以上協力しています。
審査の目的は知られている独立した意見を集めることだBRTX-100重要なオピニオンリーダーやKOL(すなわち,背部や脊柱外科が得意な幹細胞治療経験のある整形外科医)では,彼らは適用可能な臨床材料を研究した後,将来の治療潜在力について意見を述べることができるBRTX-100.
“定義された健康報告”で指摘されているように、KOLは幹細胞療法が慢性腰椎間板疾患の治療と他の治療領域において巨大な潜在力を持っていることを示している。KOLは候補製品の価値主張に積極的に反応していますBRTX-100彼らは,これまでに公表された臨床データが将来の臨床研究に反映される可能性が高いと楽観的に考えている。機会があれば KOLは,彼らのセンターが臨床試験を提供すれば参加する可能性があり,適切な条件に適合する患者にbrという研究を推奨することを示している。報告書によるとBRTX-100FDAの承認を得た場合,KOLは条件を満たす慢性腰椎椎間板疾患患者の看護基準に統合されると予想される。
類似のbr療法
ヒト比較療法研究におけるデータBRTX-100すでに痛みの軽減、機能増強を示し、しかも重大な安全問題がなく、反応は持続し、以下に示す

| 14 |
公衆衛生に影響を与える
米国は世界のヒドロコドン(99%)とオキシコドン(83%)の主要消費国であり,1人当たりのこのような薬物の消費量も世界1位(2位のカナダの2倍)である。2020年、アメリカでは9.1万人が服薬過剰で死亡した。
米国では,痛み(頭痛,背部痛,頸部痛を含む)に関する年間医療·生産性損失の総コストは6,000億ドルと見積もられており,これは心臓病に関連する年間コストの2倍であり,癌や糖尿病に関連する年間コストの総和を上回っている。
代謝性ブラウン脂肪計画
2011年6月以来、著者らは褐色脂肪(FAT)由来幹細胞或いはBADSCsを利用して治療を行う研究プラットフォーム技術の臨床前研究に取り組んできた。私たちはこの計画を私たちのと呼んでいますThermoStem計画.
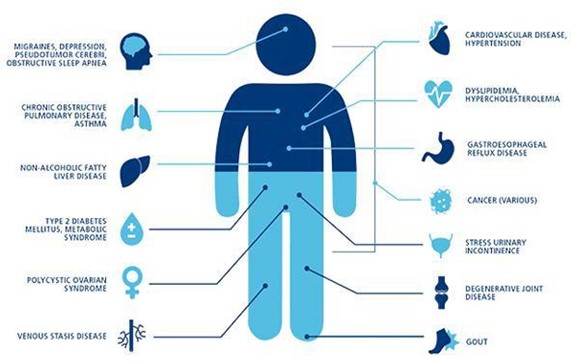
褐色脂肪は人体で発見された特殊な脂肪組織であり、哺乳動物の産熱(震えない体熱を産生する)とエネルギー動態バランスの進化保守機序において重要な役割を果たしているが、哺乳動物のエネルギー動態バランスは長い間冬眠している哺乳動物と人類新生児に存在すると考えられてきた。最近の研究により、褐色脂肪は成人体内に存在し、健康な新陳代謝の維持と調節に関与している可能性があるため、熱調節に関与している可能性が示唆された。臨床前 ThermoStem計画2型糖尿病、肥満、高血圧および他の代謝疾患、ならびに心臓欠陥のような細胞ベース(褐色脂肪組織構造)の使用による代謝疾患の治療に関する。私たちが対象とする可能性のある病気、障害、症状 ThermoStem計画具体的には以下のとおりである
| 15 |
我々はすでに褐色脂肪組織構造を動物に移植することに成功しており,現在我々はbrをヒトに転移させる方法を模索している。現在でもコウモリの体重は健康な成人では非常に低く肥満層ではさらに低くなっていますしたがって、全身の新陳代謝に自然に影響を与えるのに十分でもなく、大多数の集団における活性を増加させることを目的とする薬剤の標的になるのにも十分ではないかもしれない。コウモリの質を増やすことが代謝活動から利益を得る鍵ですThermoStem計画実現を求める。他の天然生物製剤や化学工学分子を決定することもでき,褐色脂肪組織の性能や活性を増強する可能性がある。
肥満、白色脂肪組織の異常蓄積は、多くの代謝異常を招き、全世界の2型糖尿病と心血管疾患上昇の駆動力である。食欲と満腹感の中枢制御を調節することによって代謝動態バランスを変化させる薬物努力は、これらの脳中心を調節する重大な心理と生理安全問題に直接起因するため、市場浸透率は限られている。脂肪組織は人体の最大の器官の一つであり、中枢エネルギーバランスと脂質バランスにおいて重要な役割を果たしている。哺乳動物の体内には白と茶色の脂肪組織がある。白色脂肪組織の機能はエネルギー貯蔵であるが,BATはエネルギー消費を担当している。2020年に発表されるように“国際分子科学誌”BATの誘導、分化、増殖および発熱活性を制御する機序を明らかにする上での最新の進展、およびヒトBAT可視化のためのイメージング技術の応用は、人々を楽観的にBAT活性化/産熱産生に新しい策略を提供し、それによって有効かつ安全な肥満標的治療を引き起こす可能性がある。
我々はBADSCsを用いて肥満や代謝障害に対して細胞ベースの候補製品を開発している。生体工学に移植可能な褐色脂肪組織構造の開発を目指し,人体内に自然に存在する脂肪組織を模倣することを目的としている。コウモリ倉庫に存在するヒト多能性幹細胞個体群を分離し同定しましたこれらの幹細胞を臨床関連数に増幅し,機能的な褐色脂肪細胞に分化させることに成功した。成人幹細胞を用いて,前駆細胞や完全に分化した褐色脂肪細胞,あるいは関連する細胞タイプに分化し,患者の治療に利用できる予定である。我々は,同種異体細胞(すなわち遺伝子は類似しているが異なるドナー由来の幹細胞)を利用した治療計画の開発に取り組んでいる。
| 16 |
これらの分化した細胞を目標位置に送るために体内にあるBADSCsを3次元生体ステントに移植した。br食誘導肥満の臨床前動物モデルは、生体ステントによって支持された分化したBADSCsを移植し、ステントのみを用いた対照群と比較して、体重と血糖値が有意に低下した。私たちは実現するために技術を確認しています体内にある小動物モデルで出産する。私たちのコウモリを使って小動物で概念検証を終えた後、私たちは現在次世代のコウモリを開発しています。次世代製品にはより高純度のBADSCとより多くの機能性褐色脂肪細胞が含まれることが予想され,われわれの第1世代製品と比較して治療効果の向上が期待される。さらに、我々は、宿主循環とBATインプラントとの間の小分子交換のみを可能にするカプセル化技術を用いた治療薬の提供を模索している。マイクロカプセル化は,我々の現在の生体足場と比較して,免疫能を有する宿主が起こりうる任意の免疫反応やインプラント拒絶反応を防止すること,および移植された細胞の宿主組織への侵入を防止することにより安全性を向上させることを含むいくつかの利点を有する可能性が予想される。我々は、2型糖尿病、肥満症、高脂血症、および高血圧の代謝プラットフォーム計画を治療するための細胞送達システムとして使用される、ヒト幹細胞由来の組織工学ブラウン脂肪をカプセル化装置にロードする有望なデータを開発した。この進展はヒトへの褐色脂肪の移植に成功する可能性がある。私たちはまず小動物モデルでテストする次世代BAT構造を評価している。この配送システムが有効である保証はありません体内にある動物や人間にあります我々の同種異体褐色脂肪由来幹細胞プラットフォームは、細胞の肥満および関連代謝障害の治療に治療および商業モデルを提供する可能性がある。
2014年2月に茶色脂肪由来幹細胞集団を同定する研究が発表されました幹細胞br細胞尊敬される幹細胞誌です
2014年3月、世界の製薬会社ファイザーと研究協定を締結した。ファイザーとの研究プロトコル により,我々はヒト褐色脂肪細胞モデルの開発と検証のための共同研究に研究と開発サービスを提供することに雇われている。ファイザーとの研究協定では、合意の2年間の期間内に、250,000ドルの初期支払いと、525,000ドルまでの追加支払いを受けることが規定されています。研究プロトコルは,その中で提供されるサービスが完了すると期限切れ となる.
2015年8月、著者らはペンシルバニア大学と1年間の研究協力協定を締結し、褐色脂肪生物学及び代謝障害における作用を理解した。2018年9月、私たちはペンシルバニア大学と研究目的のために独自の茶色脂肪組織細胞brを使用することができる1年間の研究協力協定を締結した。この二つの合意によると、私たちは私たちに何の金も支払わなかった。
| 17 |
2015年9月ThermoStem計画私たちに送ってくれました。
2017年4月オーストラリアの特許とThermoStem計画私たちに送ってくれました。
2017年12月にはThermoStem計画私たちに送ってくれました。
2019年1月1日ThermoStem計画私たちに送ってくれました。
2019年10月オーストラリアの特許とThermoStem計画私たちに送ってくれました。
2019年10月イスラエルの特許はThermoStem計画私たちに送ってくれました。
2020年3月にはThermoStem計画私たちに送ってくれました。
2020年3月にペンシルバニア大学と協力して出版しました細胞報告尊敬されている同業者のレビュー誌はThermoStem計画.
2020年4月にはThermoStem計画私たちに送ってくれました。このヨーロッパ特許はベルギー、フランス、ドイツ、イタリア、ポーランド、スペイン、スウェーデン、スイス、イギリスで検証された。
2020年5月イスラエルの特許はThermoStem計画私たちに送ってくれました。
2021年1月にはThermoStem計画私たちに送ってくれました。このヨーロッパ特許はフランス、ドイツ、イタリア、スペイン、イギリスで検証された。
2021年3月にはThermoStem計画私たちに送ってくれました。
2021年6月私たちとのThermoStem計画私たちに送ってくれました。
2021年7月私たちのThermoStem計画私たちに送ってくれました。
2021年8月私たちとのThermoStem計画私たちに送ってくれました。
2022年2月私たちとのThermoStem計画私たちに送ってくれました。
2022年3月イスラエルの特許はThermoStem計画私たちに送ってくれました。
2022年12月,我々は米国国立衛生研究院ユニス·ケネディ·シュライバーから授与された小規模企業革新研究(SBIR)の第1段階を獲得し,我々の発展と評価を支援することを発表したThermoStem計画多嚢胞性卵巣症候群(PCOS)を治療した。この仕事は天普大学代謝性疾病研究センター准教授の呉勝博士と協力して完成する。
2023年6月私たちとのThermoStem計画私たちに送ってくれた.
| 18 |
2023年6月私たちとのThermoStem計画私たちに送ってくれた.
2023年7月私たちとのThermoStem計画私たちに送ってくれた. このヨーロッパ特許はフランス、ドイツ、イタリア、スペイン、イギリスで検証された。
2023年12月にはThermoStem計画私たちに送ってくれた.
著者らはすでに著者らの初代褐色脂肪由来幹細胞を用いて、臨床前動物研究の概念検証を完成した。我々は,より多くの臨床前動物研究を行い,投与を最適化し,より多くの適応に対する可能性を探る予定である。このような研究は2024年に開始される予定である。これらの研究が完了した後,成功すればINDをFDAに提出し臨床試験を開始する予定である。FDAの承認過程は長く、高価で不確実である可能性があり、最終的に承認や承認を得ることは保証されない。
我々のこの分野での開発作業の大部分は,我々の実験室施設,学術,研究あるいは医療機関や請負業者のコア施設以外で行われることが予想される。以下の“実験室”を参照されたい。
曲線型針具
“Disc/Spine Program”によると独占許可以上,我々は許可を得て,さらに屈曲針装置,あるいはCNDを開発し,液体や他の物質を搬送または除去するためにbrが位置決め困難な領域に入ることを可能にする屈曲内挿管付き針システムである。研究中のCNDは、幹細胞および/または他の治療製品または材料をヒト椎間板の内部、脊柱領域、または潜在的な身体の他の領域に送達することを意図している。この装置の設計は,予備屈曲した入れ子カニューレを用いることに依存し,椎間板の後部や側部に細胞や材料の沈着を可能にし,脊柱,脊髄,脊髄神経などの周辺構造のため,これらの部位に直接接触することはできない。研究中のCNDの使用は,生細胞を含む物質を人体内の特定の位置に輸送し,近傍構造への被害の可能性を最小限にすることに寄与すると予想される。研究中の設備もより広く応用されている可能性がある。2015年8月、CNDの米国特許は許可者Regenerativeに発行された。 我々が検討しているCNDは商業化前にFDAの承認または許可が必要であると予想される。CNDを第2段階臨床試験に使うつもりはありませんBRTX-100それは.FDAの審査と承認過程は長く、高価で不確実である可能性があり、最終的に承認または承認を得ることは保証されない。
実験室
私たちはすでにニューヨークのメルビルに研究目的のための実験室を設立し、実験室内に細胞ベースの候補製品、例えば細胞ベースの候補製品を生産するためのクリーンルームを設立したBRTX-100臨床試験、第三者細胞製品または一般的な研究目的に使用される。
著者らは著者らの実験室を拡大し、臨床生産臨床と細胞候補治療を研究する能力を持たせた。我々が拡張したcGMP施設には,プロセス開発空間,ISO 7クリーンルーム,最先端設備がある。私たちは私たちの研究開発業務を臨床製造を含むまで拡張しました。これは私たちの第二段階の臨床試験に必要なステップですBRTX-100それは.FDAとヨーロッパ薬品管理局の法規とガイドラインによると、新しい施設は臨床レベルの細胞の生産を支持するためにcGMP製造を提供することを目的としている。2023年5月、私たちは、自己ドナーからの間葉系幹細胞を組織銀行として扱うことができるニューヨーク州衛生局から発行された許可証を取得したことを発表した。
| 19 |
私たちの業務と私たちの候補幹細胞製品を発展させ、監督部門の許可を得ることに伴い、私たちは自分の を治療のための成人幹細胞の主要な供給者として確立し、幹細胞治療に他の市場分野を提供する細胞に拡大することを求めている。細胞治療サービスや細胞製品製造に特化した外部実験室を用いることも可能である。
技術の開発
我々は我々の実験室または第三者実験室を細胞研究活動に用いる予定である。ハニカムに基づく治療技術ライセンスを取得し、私たちの知的財産権の組み合わせを増やすつもりです。私たちは潜在的な幹細胞送達システムや装置の開発を求めるつもりだ。これらの専用の送達システムまたは装置の目標は、細胞を人体の特定の領域に送達し、治療に使用される細胞の速度、数、およびタイプを制御し、これらの領域に十分な幹細胞を充填して、成功した治療結果を得ることである。
我々はまた,治療前と治療後の結果を改善するために,ある幹細胞最適化化合物,すなわち細胞成長と再生を促進するためのメディエーターbrを開発する予定である。
私たちの椎間板·脊椎計画再生許可プロトコルの標的となる技術に関する13件の特許出願が提出されている(“Disc/Spine Program参照−独占許可“(上図)。再生体は,そのエルボ治療送達装置に関する特許をそのいずれかの出願から取得している。この特許は2031年3月に満期になるだろう。さらに2022年3月にはBRTX-100枚発行されました。この特許は2029年12月に満期になるだろう。提出された他の11個の申請のうち、4つの申請がまだ審理中だ。再生許可プロトコル主体である特許はRegenexx,LLCに譲渡されており,同社はRegenerativeの付属会社であることが知られている。
私たちのThermoStem計画私たちは、3つの特許シリーズの中で1つの出願中のアメリカ特許と7つのアメリカ特許 を持っている。そのうち4つの特許は2032年6月に満期になり、3つの特許は2034年4月に満期になる。最初の特許家族について ThermoStem計画5つの外国司法管轄区で特許出願が出願されている(うち4つの出願は外国特許として承認されており、1つの出願は失効している)。これらの特許は2032年6月に満期になるだろう。第2の特許家族について ThermoStem計画4つの外国司法管轄区で特許出願が出願されている(うち4つの出願は外国特許が付与されている)。これらの特許は2034年4月に満期になるだろう。世界で3番目の特許家族についてThermoStem計画 は4つの外国司法管轄区で特許出願を提出している。
我々の特許出願およびRegenexx,LLCの特許出願は現在審理中である(すなわち,我々とRegenexx,LLCは発行された特許を求めている).
| 20 |
2014年3月、著者らは日本製薬会社Rohto Pharmtics Co.,Ltd.,Rohtoと研究開発協定を締結した。Rohtoと締結した研究開発協定によると、著者らは幹細胞に関する研究開発サービスを提供するために招聘された。Rohtoとの合意は合意で規定されたサービスが完了した後に無効になる。
私たちはすでにアメリカ特許商標局で以下の商標の登録を受けています
| ● |  | |
| ● | BRTX-100 | |
| ● | 熱管 | |
| ● | BRTX |
トンボのマークアメリカ著作権局にも登録されています。
私たちは商標の連邦一般法の権利も持っていますバイオレメディエーション療法並びに業務を展開するために登録されていない他の商標及び商品名。
私たちの成功は私たちの独自技術を開発して保護する能力に大きく依存するだろう。私たちは、特許、商業秘密およびノウハウ、著作権および商標法、ならびに秘密協定、許可協定、競業禁止協定、および他の合意の組み合わせに依存して、私たちの独自の権利を確立し、保護するつもりです。私たちの成功はまた、司法が私たちがこのような権利を侵害していると認定した場合、私たちは損害賠償金の支払い、私たちのサービス、製品またはプロセスの変更、許可証の取得、またはいくつかの活動の停止を要求されるかもしれないので、私たちが他人の固有の権利を侵害することを避ける能力があるかどうかにも依存するだろう。
2023年と2022年12月31日までの年間で、私たちの研究開発費はそれぞれ4,034,591ドルと3,513,352ドルです。
科学コンサルタント
我々は,我々の業務に関連する科学事務についてアドバイスと指導を提供することを目的とした科学顧問委員会を設立した。科学諮問委員会はDISC諮問委員会を設立して私たちとの光ディスク/脊柱(Br)計画それは.私たちの科学諮問委員会のメンバーはウェイン·マラスコ博士(議長)、ジェイソン·リペッツ博士、ウェイン·オラン博士、喜び·カヴァグナロ博士、ハヴェンダー·サンドゥ博士、クリストファー·プラスラタラス博士。Disc諮問委員会メンバーはLipetz博士(議長)、Olan博士、Sandhu博士、Plastaras博士。Marasco博士、Lipetz博士、Olan博士、Cavagnaro博士、Sandhu博士、Plastaras博士の主要ポストリストについては、本年度報告第10項(“役員、幹部、会社統治-科学諮問委員会”)を参照されたい。
| 21 |
競争
我々は,多くの製薬,バイオテクノロジー,医療機器会社や他の細胞に基づく医療技術や療法の開発と商業化に関与する民間や公的幹細胞会社と競争する。
再生医学は急速に発展しており,ヒト組織から細胞を分離するための細胞ベース療法や装置の発展に大きく寄与している。大多数の努力は骨髄、脂肪組織、胚胎と胎児組織、臍帯及び末梢血液と骨格筋などの細胞源に関連する。
椎間板や脊柱に関連する再生医学分野で働く会社には,他社を除いてMesoblast,SpinalCyte,DiscGenics とIsto Biologicsがある。肥満や糖尿病に対抗する製品や療法を開発している会社には,ノとノド,サイノフェイ,メルク,礼来,羅氏,ファイザー,Regeneron,Altimmuneがある。最近、FDAによって承認され、複合版のグルカゴン様ポリペプチド-1(GLP-1)受容体アゴニスト医薬製品、例えばWegoyとOzempic(Semagluide)は、肥満の治療に広く使用され、肥満市場の競争を著しく増加させた。
私たちの多くの競争相手と潜在的な競争相手は私たちよりも多くの財務、技術、研究開発、マーケティング、人的資源を持っている。これらの会社がいつあるいはその製品や療法を市場に出すことが可能かどうかを正確に予測することはできません。私たちが求めている製品や療法と競争しています。
生物製品価格競争および革新法案、またはBPCIAは、生物類似性および交換可能な生物製品を承認するための簡略化された方法を制定し、これらの生物製品は、FDAによって生物類似製品の未来の競争者(もしあれば)として使用されることができる。br}FDAは、生物類似製品を承認するためには、参考製品と提案された生物類似製品との間に臨床的に有意な差がないことを発見しなければならない。互換性は、製品が基準製品生物と類似していることを必要とし、製品brは、参照製品と同じ臨床結果を生成することが期待されなければならず、複数回投与された製品については、安全リスクを増加させることなく、または参照生物の独占使用と比較して治療効果が低下するリスクを増加させることなく、以前の投与後に生物および参照生物を交換することができる。BPCIAによれば、生物類似製品の申請は、参照製品が承認されてから4年後にのみFDAに提出されることができ、FDAは、生ブランド製品が生物製品ライセンス申請またはBLAによって承認された後12年以内に承認される可能性がある。
私たちは、もし私たちのすべての候補製品がBLAによって生物製品として承認されれば、12年の専門期間 を得る資格があると信じている。しかしながら、FDAは、生物学的に類似した申請者が、私たちの候補治療薬以外の承認された生物製品を引用することを可能にすることができ、それによって、私たちの排他性を迂回し、予想よりも早く競争機会を創出することができるかもしれない。また、この規制排他期間は、簡略化された経路で規制承認を求める会社ではなく、独自の伝統的なBLAには適用されない。また,適用される州法により,生物類似製品は我々の製品と“交換可能”として承認される可能性があるため,医療専門家が私たちの製品を代替することができる。
| 22 |
私たちはFDA発売前の承認を必要としない治療センターからの幹細胞療法のますます激しい競争に直面する可能性もあります。2022年8月、連邦地方裁判所はアメリカはカリフォルニアの幹細胞治療センター、Inc.Brのある自己脂肪幹細胞治療は“生物製品”ではないため、FDAの承認を必要としないと考えられている。br}FDAはこの決定を控訴しているが、この決定が維持されれば、高価で時間のかかるFDA承認手続きを経ることなく、幹細胞診療所からの競争に直面する可能性がある。
以下に以下の設定の比較を示すBRTX-100中胚葉までの成体幹細胞生物学:
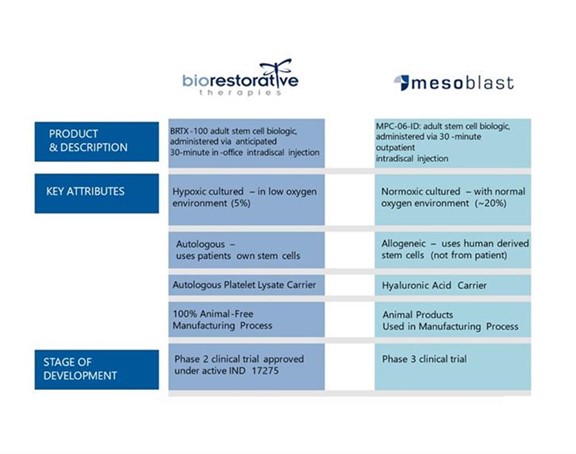
私たちは信じていますBRTX-100Mesoblastの製品と比較して競争優位である理由は以下のとおりである
| ● | 自己細胞の使用は、低または拒絶のリスクがなく、より大きな安全性(ウイルス/遺伝子の導入)および流線形の調節経路をもたらす | |
| ● | 低酸素培養は細胞増殖を促進し、可塑性を増強し、傍分泌効果を増加させ、細胞生存率を高めることができる | |
| ● | 自己血小板溶解物は細胞と相互作用する増殖因子を提供し、それによって細胞生存率を高めることができる | |
| ● | 免疫学と人畜共通感染症(動物伝人)に関する安全リスクはリスクがないほど低い |
| 23 |
顧客
監督部門の許可を得た後、私たちの候補細胞製品は医師、他の医療保健専門家、病院、研究機関、製薬会社、軍に向けてマーケティングを行う。研修を受け脊柱注射に習熟した医師は,椎間板を注射で治療する可能性が最も高い医師であると予想されるBRTX-100規制部門が承認した後。これらの医師には,介入理学療法士(物理内科医),疼痛管理麻酔科医,介入放射線科医,神経外科医が含まれる。
政府規制
アメリカ政府法規
医療産業はアメリカで厳格に規制されている。連邦政府は各部門と機関、州と地方政府および個人第三者認証組織を通じて医療保健業界、関連製品と運営を管理·監視している。FDAと州と地方司法管轄区及び国外の類似監督機関は薬品、生物製品と医療器械を含む医療製品の臨床開発、審査、製造、流通とマーケティングに対して実質的な要求を提出した。これらの機関と他の連邦、州と地方実体監督管理研究開発活動及び医療製品のテスト、製造、品質管理、安全、有効性、ラベル、包装、貯蔵、流通、記録保存、承認、承認後の監視、広告、販売促進、サンプリングと輸出入。以下に我々の業務に関する法律法規の概要 を示す.
幹細胞治療と製品に対するFDAの規制
FDAは公衆衛生サービス法案(PHSA)と連邦食品、薬物と化粧品法案(FDCA)の許可に基づいて、ヒト幹細胞治療と関連製品の製造を監督する。幹細胞はFDAのヒト細胞,組織, と細胞と組織製品法規(HCT/Ps)によって規制することができ,FDAの薬品,生物あるいは医療機器法規の規制を受ける可能性もあり,具体的な内容は以下のとおりである。
ヒト細胞、組織、細胞、組織系産物の規制
PHSA第361節によると,FDAはヒトへのHCT/Psの使用に関する具体的な規定を発表した。“連邦法規法典”(CFR)第21章1271部分あるいは“HCT/P条例”によると、FDAはHCT/Pを生産と加工する機関のために統一的な登録とリスト制度を構築した。条例にはまた、ドナー資格の決定に関する規定が含まれている;生産のすべての段階をカバーする現在の良好な組織慣行は、収穫、加工、製造、貯蔵、ラベル貼り、包装、配布、および伝染病の伝来、伝播、伝播を防止する他の手続きを含む。
Hct/P条例は、Hct/Psを“移植、移植、注入、またはヒトレシピエントに移植、移植、または転移するために使用されるヒト細胞または組織を含むか、または含む物品”として定義する。Hct/P法規は、Hct/Pとしてのみ規制可能な製品タイプを厳格に制限している。考慮されている要素は、操作程度、製品が類似したbr機能に使用されているかどうか、製品が非細胞または非組織成分と結合しているかどうか、および製品の人体代謝機能に対する影響または依存である。これらの場合、細胞、組織及び細胞と組織製品が最小限の処理のみを経て、厳格に相同用途に使用され、非細胞或いは非組織物質と結合しておらず、しかもbrは人体の新陳代謝に依存しない、或いは人体の新陳代謝にいかなる影響を与えない場合、メーカーはFDAに登録し、生産された製品リストを提出し、伝染病制御プログラムを採用し、実施する必要がある。上記の1つまたは複数のbr要因を超える場合、製品は、HCT/Pではなく、医薬品、生物学的製品または医療機器として規制されるであろう。
| 24 |
我々は運営の初期段階にある企業であり,運営から相当な収入を得ていないため,我々が提供する可能性のある一連の製品やサービスが規制状態にある可能性を予測することは困難である.一部の成人自己(自己)幹細胞は私たちの細胞治療製品やサービスに使用されると信じていますThermoStem計画Hct/P法規によりFDAがHct/Psとして管理することができる。しかしながら、FDA はこの立場に同意しないかもしれないし、私たちの幹細胞治療製品またはサービスの一部または全部が適用されるbrの定義および法規免除に適合していないと結論する可能性がある。2020年7月、FDAは“ヒト細胞、組織、細胞、組織製品の規制考慮:最低限の操作とそれに応じた使用”と題する更新された指導文書を発表し、FDAがHCT/P法規をどのように解釈するかについて追加のbr指導を提供し、特に用語“最低限の操作”と“br}”に対応する使用“の定義を提供した。ガイドラインでは、FDAは、2021年5月31日まで、HCT/P規制に適合しない製品に対して法執行裁量権を行使すると表明している。この日から、HCT/P規制に適合しないHCT/P形式で販売されている製品の製造業者は、FDA法執行行動の影響を直ちに受ける。もし私たちがHCT/P法規によって完全に規制されていなければ、私たち はFDCAにおけるFDAの広範な規制権限を遵守するために大量の資源を必要とするだろう。歴史的に見ると、アメリカ連邦裁判所はFDAがFDCA規制によってFDAのHCT/P法規に対する解釈に符合しない幹細胞製品の権力を支持してきた。しかし2022年8月に連邦地方裁判所は米国はカリフォルニア州幹細胞治療センター,Inc.を訴えているFDAは生物製品のある自己脂肪幹細胞治療 が逆にHCT/P定義範囲内であることを主張しているため,FDA承認を必要としないと考えられる。FDAはこの決定を上訴しているが,この決定が維持されれば,HCT/P規制のみで規制されている幹細胞製品のタイプを拡大する可能性がある。
FDAのHCT/P法律および法規条項のみに基づいて規制されている場合、米国の実験室で動作を開始すると、幹細胞を処理して保存するために、以下の要件および他の要求を満たす必要がある
| ● | HCT/Pを食品医薬品局に登録してリストします | |
| ● | ドナーのスクリーニングとドナーテストの要件を含むドナー資格決定 | |
| ● | 現在の良好な組織方法は、具体的には、施設、環境制御、設備、用品、試薬の要求、患者からヘキサクロロエチレン/ポリ塩化ビフェニルの回収、加工、貯蔵、ラベル、文書制御、およびヘキサクロロトリクロロフェノール/ポリ塩化ビフェニルの実験室、貯蔵または他の施設への配布と輸送を含む | |
| ● | ヘキサクロロビフェニル/ポリ塩化ビフェニル及びヘキサクロロビフェニル/ポリ塩化ビフェニルを製造するための設備、供給品及び試薬のトレーサビリティ; | |
| ● | 不良事件報告 | |
| ● | FDA検査; | |
| ● | HCT/Psの保有、リコール、廃棄、および生産停止に関するFDAの任意のコマンドを遵守します。 |
| 25 |
PHSA第(Br)361節のみで規制されている米国に輸入される非生殖性Hct/Psや非末梢血幹/前駆細胞も21 C.F.R.§1271.420の要求を満たさなければならない。第1271.420条輸入記録を要求した輸入業者は、輸入前又は輸入時に食品及び医薬品局に通知し、食品及び医薬品局が受理決定を行うために十分な情報を提供する。また,FDAが受理決定を行う前に,輸入業者はHCT/Pを無傷に保ち,感染症の伝播を防止するために必要な条件を保持しなければならない。
FDAが適用される規制要件を遵守できないと判断した場合、公開警告状、罰金、同意法令、製品保留令、リコールまたは廃棄令、生産停止令、br、刑事起訴を含む様々な法執行行動をとることができる。もしこのような事件のいずれかが発生すれば、私たちに実質的な悪影響を及ぼすかもしれない。
我々の細胞治療活動は米国国外での製品とサービスの開発に限られていることを考慮すると、以下に詳細に説明するように、製品およびサービスはFDAによって規制されないが、外国の管轄区域の適用要求 によって制限される。私たちは適用されるすべての外国政府の要求を遵守するつもりだ。
薬品と生物製品の規制
PHSA第361条に規定されている唯一の規制基準を満たしていないHCT/P製品は、FDCAおよび/またはPHSA第351条および適用されるFDA法規に従って薬物、器具または生物製品として規制される。FDAは米国で販売されている薬品や生物製品に対して広範な規制権力を持っている。FDAは薬品と生物製品の研究、臨床試験、製造、安全性、有効性、ラベル、貯蔵、記録保存、普及、流通と生産に対して監督管理を行う。FDAはまた、場合によっては米国で生産された薬品や生物製品を国際市場に輸出することを規定している。
FDAが米国で発売される前に医薬品または生物製剤を要求するために必要な流れは、一般に以下を含む:
非臨床実験室テスト、動物研究と調合研究を完成し、“良好な実験室規範”、“食品と薬物管理局”或いはその他の適用法規に符合した
FDAが30日以内に異議を唱えない限り、INDを提出し、臨床試験の開始を許可する
Brは、試験参加者の権利、安全および福祉が保護される国際道徳および科学的品質基準を確保し、データの完全性を維持するために、FDA法規および良好な臨床実践またはGCPによって行われる、その予期される用途に使用される薬剤または生物の安全性と有効性を決定するために、十分かつ良好な人体臨床試験を行う
| 26 |
アメリカ食品·薬物管理局規制製品の臨床試験登録といくつかの臨床試験情報;
新薬申請の準備と食品·薬物管理局への提出は、薬物またはBLAであれば生物学的である
適切または適用可能な場合には、食品·医薬品局諮問委員会が製品を審査する
GCP要件に適合する状況を評価するために、生産製品またはそのコンポーネントの製造施設および臨床試験場所の承認前検査を満足的に完了し、GCP要件に適合する状況を評価するために選択された臨床試験場所を評価する
(Br)FDAによって承認された秘密保持プロトコルまたはBLAは、医薬または生物学的薬剤が市販または販売される前に行われなければならない。
秘密保持プロトコル を承認するためには、薬物がその予期される用途に対して安全かつ有効であることを証明する必要があり、薬物の製造、加工、および包装のための方法、施設および制御 は、その特性、強度、品質、および純度を維持するのに十分である。BLAを得るためには、製造者は、提案された製品が安全、純粋かつ有効であり、製品を製造、加工、包装、または保持する施設 が既定の品質管理基準に適合していることを証明しなければならない。
FDAがNDAまたはBLAを承認する目的で、ヒト臨床試験は通常以下の段階で行われる(重複する可能性がある)
Br第1段階:この研究製品は最初に健康なヒト被験者または患者に投与し、安全性、用量耐性、吸収、代謝、分布および排泄テストを行った。これらの実験はまた有効性に関する早期証拠を提供する可能性がある。第一段階の臨床試験において、研究製品の薬物動態学と薬理作用に関する十分な情報を得て、br}設計制御が良好かつ科学的に有効な第二段階の臨床試験を提供する可能性がある。
第二段階:これらの臨床試験は、可能な副作用および安全リスクを決定し、特定の標的疾患に対する研究製品の治療効果を決定し、用量 耐性および用量レベルを決定するために、標的集団中の限られた数のヒト対象者において行われる。スポンサーは、より規模が大きく、コストの高い3期臨床試験を開始する前に情報を得るために、複数の2期臨床試験を行う可能性がある。
第三段階:第三段階臨床試験は、研究製品の一定量の範囲が有効であり、耐性のある安全性を有するように見えることを第二段階の臨床試験が証明した後に行われる。第二段階の臨床試験はまた第三段階の臨床試験の設計に十分な情報を提供しなければならない。第三段階の臨床試験を行うことは臨床治療効果の統計的顕著な証拠を提供し、そして複数の臨床試験地点で拡大した人類被験者群の安全リスクを更にテストするためである。これらの臨床試験は用量、有効性と安全性を更に評価し、研究製品の全体的な利益-リスク概況を確立し、そして製品ラベルとFDA承認に十分な基礎を提供することを目的としている。多くの場合、FDAは薬物或いは生物の治療効果を証明するために、2つの十分かつ良好な3期臨床試験を制御する必要がある。
| 27 |
すべての臨床試験はFDA法規、GCP要求及びそのプロトコルに従って行わなければならず、データが監督管理目的の信頼できるデータと考えられるようにしなければならない。臨床試験結果を詳細に説明する進捗報告は少なくとも毎年FDAに提出しなければならず,重篤な有害事象が発生すればより頻繁である。第1段階、第2段階および第3段階の臨床試験は、任意の指定された時間内に成功することができないか、または全く成功できない可能性がある。これらの政府法規は、かなりの期間にわたって候補製品の承認を延期または阻止し、私たちの業務運営にコストの高い手続きを適用する可能性がある。
製品が承認された後、FDAは、第4段階臨床試験と呼ばれる追加の臨床試験を要求するかもしれない。このような試験は、薬物を継続的に承認する条件として使用される可能性がある。4期臨床試験の結果、候補製品の有効性を確認することができ、重要な安全性情報を提供することができる。また,FDAはスポンサーに上場後の試験を要求し,同機関が決定したセキュリティ問題を具体的に解決する権利がある。
“小児科研究公平法”(PREA)によれば、いくつかのNDAおよびBLAならびにNDAまたはBLAのいくつかのサプリメントは、すべての関連する小児科亜群において主張されるこの薬剤の安全性および有効性を評価し、各安全で有効な小児科亜群に対するこの製品の用量および投与をサポートするためのデータを含まなければならない。FDAは小児科データの提出を延期することを許可するか、またはすべてまたは部分的な免除を与える可能性がある。スポンサーが、新しい活性成分、新適応、新剤形、新投与レジメンまたは新投与経路を含む薬物としてマーケティング申請を提出することを計画している場合、第2段階の会議終了後60日以内にFDAに予備小児科研究計画またはPSPを提出し、そのような会議がない場合には、第3段階または第2/3段階研究を開始する前に可能な限り早く提出する。初期PSPは、研究目標および設計、年齢グループ、関連終点および統計方法、またはそのような詳細な情報を含まない理由、および小児科研究データおよびサポート情報の提供を延期または完全または部分的に免除することを要求する任意の要件を含む発起人計画によって行われる1つまたは複数の小児科研究の大綱を含まなければならない。FDAとスポンサーはPSPについて合意しなければならない。臨床前研究,早期臨床試験および/または他の臨床開発計画から収集したデータに基づいて小児科計画の変更を考慮する必要があれば,スポンサーは合意した初期PSPに対する修正案を随時提出することができる。
適応、ラベル、生産プロセスまたは施設の変更を含む承認申請において確立されたいくつかの条件を変更するには、変更を実施するために、新しいNDAまたはBLA、または新しいNDAまたはBLAサプリメントを提出し、FDAの承認を得る必要がある。br}の新しい適応のNDAまたはBLAサプリメントは、通常、元の出願と同様の臨床データを必要とし、NDAおよびBLAサプリメントを審査する際に使用されるFDA の手順および操作は、NDAおよびBLAサプリメントを審査する際に使用されるのと同じである。
医薬品および生物製品はまた、監視および記録活動、製造要件、適用される規制機関に製品の副作用を報告すること、監督管理機関に最新の安全および治療効果情報を提供すること、製品のサンプリングおよび流通要件、および販売促進および広告要件を遵守することを含む適用された要求に適合しなければならず、その中には、消費者向けの広告基準、患者集団における未承認の薬物ラベルまたはラベル外での使用を制限する薬物が含まれている。業界主催の科学·教育活動の制限とインターネットに関連した広報活動への要求。医師は彼らの独立した専門医学判断に基づいて、合法的な薬品を発行してラベル外使用に使用することができるが、メーカーは通常このようなラベル外使用の薬物を販売或いは普及させることができない。
| 28 |
FDAの現在の適用法の説明によるとBRTX-100候補製品は を生物製品としてPHSAによって規制されている。したがって、私たちはコンプライアンスを確保するために多くの資源を使う必要があります。 は私たちがFDA対を獲得するかどうかを保証することはできませんBRTX-100製品候補。設計、進行、編集とBLA承認の提出に必要な非臨床と臨床研究の過程は時間も高価であり、しかも は予測できない。製品とFDAの要求に応じて、この過程は何年もかかるかもしれない。
さらに、候補製品が規制部門の承認を得ても、承認は、特定の疾患状態、患者数および用量に限定されてもよく、または警告、予防または禁忌症の形態で、または煩雑なリスク管理計画、流通または使用制限、または発売後の試験要件の形態で使用の重大な制限が含まれている可能性がある。また、監督部門の承認を得た後であっても、製品が後に発見された以前の未知の問題は、br}セキュリティラベルを含む、またはリスク評価と緩和策またはREMSを強制的に実施し、発売後の研究または臨床試験を要求し、さらには市場から完全に撤回することを要求する可能性がある。私たちの製品に対する規制機関の承認を遅延させたり、承認されたりすることはできませんが、用途は非常に限られており、私たちの業務を損なうことになります。また、将来のアメリカや外国政府の行動にどのような不利な政府法規が生じる可能性があるのか予測できない。
FDAが適用される規制要件を遵守できないと判断した場合、公開警告状、罰金、禁止、同意法令および民事処罰から、許可の一時停止または遅延、私たちの製品の差し押さえ、私たちの生産の完全または部分的な閉鎖、承認の撤回、刑事起訴まで、様々な法執行行動を実施することができます。もしこれらの イベントのいずれかが発生すれば、私たちに実質的な悪影響を及ぼす可能性がある。
FDA迅速審査計画
FDAは、NDAおよびBLASの検討を様々な方法で加速させることを許可されている。Fast Track計画によると,候補薬物やバイオ製品のスポンサーは,INDを申請すると同時にまたはその後,FDAに特定の適応の製品をFast Track製品として指定することを要求することができる。もし薬物と生物製品が深刻或いは生命に危害を及ぼす疾病を治療することを目的とし、そしてこのような疾病が満たされていない医療需要を満たす潜在力を示すならば、迅速なチャンネル指定を受ける資格がある。高速チャネルは,候補製品と研究中の特定の適応に適した組合せを指定する.
他の利点に加えて、例えば、FDAとより大きな相互作用を行うことができることに加えて、FDAは、申請が完了する前に、ローリングレビューと呼ばれる高速チャネルセキュリティプロトコルまたはBLAの部分の審査を開始することもできる。
| 29 |
迅速チャネル計画を含むマーケティングのためにFDAに提出された任意の製品は、開発および審査を加速するための以下のFDA他のタイプの計画の資格に適合する可能性もある:
突破的治療指定。画期的な治療計画の資格を得るためには、候補製品は深刻なbrまたは生命に危害を及ぼす疾患または状態の治療に使用されなければならず、初歩的な臨床証拠は、このような候補製品が1つまたは複数の臨床的有意な終点において既存の治療法よりも著しく改善されている可能性があることを示さなければならない。FDAは画期的な候補治療製品のスポンサーが効率的な薬物開発計画に関する密集指導を得ることを確保するために努力し、 高級管理者と経験豊富な従業員は積極的、協力と学際的な審査と転動審査への深い参加を確保する。
優先審査。候補製品が重篤な疾患を治療している場合、優先審査を受ける資格があり、承認されれば、市販されている製品と比較して、重篤な疾患の治療、診断または予防の安全性または有効性の重大な改善となる。FDAの目標は、標準審査の10ヶ月ではなく、6ヶ月以内に優先審査申請の審査を完了することだ。
承認速度を高速化した.深刻または生命を脅かす疾患の治療における研究されている薬物または生物学的製品の安全性および有効性 は、既存の治療法よりも意義のある治療効果を提供する薬物または生物学的製品が加速的に承認される可能性がある。承認を加速することは、候補製品が十分かつ制御された良好な臨床試験によって承認され、候補製品が臨床利益を合理的に予測する可能性のある代替終点に影響を与えるか、または生存率または不可逆的な発病率または死亡率または他の臨床利益ではなく、臨床終点への影響に基づいて、病状の重症度、希少性と流行度、および代替治療を利用可能または不足することを決定することを意味する。承認の一つの条件として,FDAは承認を加速させる候補薬物やバイオ製品のスポンサーに十分かつ良好に制御された発売後臨床試験 を要求することができる。また、FDAは現在、宣伝材料として承認を加速する条件を要求している。FDAがアルツハイマー薬(Aducanumab)の加速承認経路の使用に関する議論のため、国会 は加速承認手続きを改訂し、2022年の食品と薬物総合改革法案の一部として、FDAに追加のbr認可を提供し、承認後の研究要求を実行し、これらの要求を満たさない場合に承認を撤回する。
迅速な追跡指定、画期的な治療指定、優先審査、承認の加速は承認基準 を変更することはないが、開発や承認過程を加速する可能性がある。
また,FDAは再生先進療法に指定された製品の審査と承認を加速する権利がある。製品が再生医学高度療法またはRMAT(細胞療法を含む可能性がある)である場合、br}治療、修正、逆転または治癒が深刻または生命に危険な疾患または状態を意図しており、初歩的な臨床証拠は、この薬剤がこのような疾患または状態の満たされていない医療需要を満たす可能性があることを示している場合、この称号を得る資格がある。RMATを指定する利点は、開発および審査、画期的な治療の利点、潜在的な優先審査資格、およびエージェントまたは中間終点に基づく加速承認を加速するためにFDAとの早期相互作用を含む。
| 30 |
医療機器法規
FDAは米国で販売されている医療機器の規制においても広範な権力を持っている。FDAは医療機器の研究、臨床試験、製造、安全、ラベル、貯蔵、記録保存、発売前の審査、普及、流通と生産に対して監督管理を行う。FDAはまた,米国製医療機器の国際市場への輸出を規制している。
FDCAによると,医療機器は医療機器に関するリスクの程度と安全性や有効性の確保に必要な制御度によって,I類,II類またはIII類の3つに分類される。クラスIデバイスは,低リスクデバイスと考えられているため,FDAの一般的な 制御に準拠すればよい程度の規制審査を受けている。一般的な制御は品質体系法規の登録、上場、不良事件報告の要求と適用部分、および一般ブランドの誤りと偽禁止を含む。
クラスIIのデバイスは、510(K)の発売前に通知されるように、一般的な制御およびいくつかの特別な制御によって制約される。クラスIIIデバイス は、通常、生命支援および生命維持デバイスおよびインプラントを含む最も厳しい規制によって検討されている。 それらは、上場前承認申請またはPMAを含む一般的な制御および特別な制御によって制御されている。新しい“br}デバイスは、低リスクデバイスであることが証明されない限り、クラスIIIデバイスとして自動的に管理され、この場合、それらは再検討され、クラスIまたはクラスIIに移される可能性がある。研究デバイスの臨床研究は、FDAの調査デバイスによって免除またはIDE規制によって制限される。非重大リスク機器は、簡略化された要求によって制約され、これらの要件はFDAに提出する必要はないが、機関審査委員会(IRB)の承認を得なければならず、インフォームドコンセント、ラベル、記録保存、報告、および監視に関連する他の要件に適合しなければならない。重大なリスク·デバイスは、IDE申請をFDAに提出し、IDE申請に対するFDAの承認を得る必要があります。
FDAの上場前の承認過程は長く、高価で不確実かもしれない。提出から510(K)の発売前承認を得るまでには、より長い時間がかかる場合があるにもかかわらず、通常3~12ヶ月を要する。PMAの承認は、申請が提出された日から1年から4年以上を要する可能性があり、最終的に承認または承認を得ることは保証されない。FDAの承認と承認を確保するためには、FDAに大量の臨床データおよび支援情報を提出する必要がある可能性がある。さらに、FDAは、FDAによって承認または承認されていない適応または用途のデバイスのマーケティングおよび促進を禁止する 法規を積極的に実行し、 さらに、製品の修正または強化がセキュリティまたは有効性に影響を与える可能性がある場合、または510(K)プロセスによって承認されたまたはPMAプロセスによって承認されたデバイスの予期される用途に大きな影響を与える場合、FDA が新しい510(K)またはPMAを介してさらなる審査を提出する必要がある可能性がある。
我々が開発したプロセス,製品,サービスがFDA法規の医療機器要求に適合すれば,このような法規を遵守する。FDAが私たちの製品が医療機器として規制されていると判断し、私たちが適用された規制要求を遵守できなかった場合、公開警告状、アプリケーション完全性プログラム、罰金、禁止、同意法令および民事処罰から、許可の一時停止または遅延、私たちの製品の差し押さえ、私たちの生産の完全または部分的な閉鎖、承認の撤回、刑事起訴まで様々な法執行行動を実施することができます。もしこのような事件のいずれかが発生すれば、それは私たちに実質的な悪影響を及ぼすかもしれない。
| 31 |
現在の細胞治療製品の良好な生産規範とFDAの他の規制
はHCT/P法規に属さず,薬品,生物製品あるいは機器として規制されている製品は適用されるcGMP 法規に適合しなければならない。これらのcGMPと関連品質標準は工場で加工された製品がFDAの特性、強度、品質、無菌、純度と安全性への適用要求を満たすことを確保することを目的としている。もし私たちのアメリカでの国内業務がFDAの薬品、生物製品、あるいは器械法規の制約を受けたら、私たちは適用されるcGMPと品質法規を遵守するつもりです。
FDAが適用される規制要件を遵守できないと判断した場合、公開警告状、罰金、禁止、同意法令および民事処罰から、許可の一時停止または遅延、私たちの製品の差し押さえ、私たちの生産の完全または部分的な閉鎖、承認の撤回、刑事起訴まで、様々な法執行行動を実施することができます。もしこれらの イベントのいずれかが発生すれば、私たちに実質的な悪影響を及ぼす可能性がある。
海外細胞療法の普及“医療旅行”
我々は,第三者が米国国外に成人幹細胞治療施設を設立することに関連する技術を確立したり,第三者に技術を許可したりする可能性がある。病院や医師と協力し,海外で治療している患者に幹細胞による療法を提供する予定である。“医療旅行”は、医療を得るために国際境界を越えて旅行する方法として定義されている。
連邦貿易委員会または連邦貿易委員会は、連邦貿易委員会法案またはFTCAに基づいて米国の医療、手続き、養生方法の広告を規制する権利がある。連邦貿易委員会は規制権力を持っており、不公平で詐欺的なやり方と虚偽広告を防ぐことができる。具体的には、連邦貿易委員会は広告主と推進者にクレームを確認し、支持するための合理的な基礎を持つことを要求する。連邦貿易委員会には多くの執行権があり、そのうちの1つは、自由貿易法違反とされた任意の利益の返還を発起人に命令する権利があり、さらなる違反普及の禁止を命じることができる。私たちが医療旅行業務で使用する可能性のある広告はFTC規制機関によって規制され、このような規制規定を遵守するつもりです。類似した法律や要求は他の国/地域に存在する可能性が高く,我々は のような要求を遵守する予定である.
連邦臨床実験室条例
連邦臨床実験室改善修正案(CLIA)は医療保険と医療補助サービスセンター(CMS)を許可し、アメリカで行われたすべての実験室テスト(研究を除く)を許可した。医療補助と州運営センター(CMSO)配下の調査·認証チーム内の実験室サービス部がCLIA計画の実施を担当している。
| 32 |
CLIA計画は患者のテスト結果の正確性、信頼性と適時性を確保することによって、高品質な実験室テスト を確立することを目的としている。CLIAによると、実験室はヒトからの標本に対して実験室テストを行う施設であり、疾患の診断、予防、治療または損害または健康評価に情報を提供するためのものである。そのため,幹細胞や他の生体物質を処理する実験室がCLIA計画に組み込まれている。CLIA計画によると、実験室は政府認証を取得し、政府の品質と人員基準を満たし、能力テストを受け、検査を受け、費用を支払わなければならない。もし私たちの業務活動がCLIA認証を必要とする場合、私たちはこのような認証を取得して維持するつもりだ。もし私たち がCLIAに制約されていれば、CLIA標準を守らないと、実験室のCLIA証明書が取り消し、取り消し、あるいは制限される可能性があります。しかも、罰金や刑事罰を科すことができる。上記のいずれかのイベントが発生すると,我々の業務運営 に影響を与える可能性がある.
健康“保険携帯性と責任法案”−患者の健康情報を保護する−
私たちbrは、連邦政府と私たちが業務を展開している州のデータプライバシーと安全法規によって同時に制約される可能性があります。“経済と臨床健康健康情報技術法案”(HITECH)によって改正された1996年の“健康保険携帯性法案”(HIPAA)とそのそれぞれの実施条例は、特定のタイプの個人と組織の個人が健康情報を識別できるプライバシー、安全、送信について具体的な要求を提出しています。また、ある州の法律は、場合によっては健康情報のプライバシーやセキュリティを管理しており、その多くの法律は互いに異なり、HIPAAとは重大な点で異なり、同じ効果が生じず、コンプライアンス作業を複雑化させる可能性がある。さらに、私たちは他の連邦や州のプライバシー法律と法規を遵守する必要があるかもしれません。これらの法律と法規は、それらが私たちに適用される限り、HIV/エイズのような特定の診断に適用される可能性があります。
衛生·公衆サービス部(HHS)は、その民権事務室を通じて違反報告を調査し、行政或いは技術改正が必要かどうか、民事又は刑事制裁を実施すべきか否かを判断する。HIPAAや施行条例を遵守していない会社も民事罰金を受ける可能性があり,あるいは違反を知っている場合には,罰金,監禁,または両方を含めて刑事罰を受ける可能性がある。場合によっては、州総検察長は連邦裁判所に強制執行と適切な制裁を求めることができる。
他に適用されるアメリカの法律
米国連邦と州政府の上述した法規を除いて、以下は私たちの業務能力に直接または間接的に影響を与える可能性のある他の連邦と州法律と法規である
| ● | 国と地方の薬品や生物製品開発の許可、登録、管理 | |
| ● | 国と地方の医療従事者の許可 | |
| ● | 国は企業の医師に関する法律を制定している |
| 33 |
| ● | 米国税関と国境保護局が管理する米国への生体材料の輸入に関する法律と法規br; | |
| ● | FDAが管理している他の法律 | |
| ● | 衛生と公衆サービス部が管理する他の法律法規; | |
| ● | 人体研究と臨床試験を管理する国と地方の法律法規 | |
| ● | 連邦医の自己推薦禁止は、スタッカー法と同じ州法とも呼ばれている | |
| ● | 連邦虚偽申告法はFCAと呼ばれています | |
| ● | 連邦反リベート規制、またはAKS、および任意の類似した州法規と条例 | |
| ● | 連邦と州保険と清算法律; | |
| ● | 医療廃棄物や生物危険物質の処分·処分に関する国と地域の法律 | |
| ● | 職業安全と健康管理局、またはOSHA、法規と要求; | |
| ● | 米国国税局の“中間制裁規則”は、免税組織との“超過利益取引”に対する潜在的な金融制裁を規定している | |
| ● | 医師は日光法案を支払う(私たちの製品が薬品、生物製品、設備または医療用品に分類され、連邦医療保険、医療補助または児童健康保険計画によって精算される場合) | |
| ● | 健康情報のプライバシーに関する州や他の連邦法 | |
| ● | 州および外国の法律と上記の各連邦法律との等価物、例えば、反リベートおよび虚偽請求法は、製薬会社の任意の第三者支払人(商業保険会社を含む)が精算するプロジェクトまたはサービスの州法律に適用可能であり、製薬会社に製薬業界の自発的コンプライアンスガイドラインおよび連邦政府によって公布された関連コンプライアンスガイドラインの州法律を遵守することを要求するか、または医療専門家および他の潜在的な転換源に支払う可能性のあるお金を他の方法で制限する。医薬品製造業者は、医師および他の医療専門家またはマーケティング支出への支払いおよび他の価値移転に関する情報を報告することを要求する州法と、場合によっては健康情報のプライバシーおよび安全を管理する州法 とを要求し、その多くの法律は互いに大きく異なり、同じ効果を生じず、コンプライアンス作業を複雑化させる可能性がある。 |
上記の任意の法律または任意の他の政府の法律および法規に違反すると、民事および刑事罰、損害賠償、罰金、削減または再編業務、連邦および州医療計画から除外され、監禁されることを含む罰を受ける可能性がある。また,ブランド処方薬製品メーカーにとっては,業務活動や業務手配が適用される医療法令に適合することを確保する努力が費用がかかる可能性がある。
外国政府法規
通常、私たちは私たちの治療センターがある各国/地域の政府法規を遵守する必要があり、br製品は流通と販売を行う。これらの法規の複雑さはそれぞれ異なり、米国FDAの法規と同じように厳しく、時にはさらに厳しいかもしれない。最近世界各国で新しい細胞治療法規が起草および/または実施されているため、これらの新しいおよび新興法規の応用およびその後の実施はほとんど例がない。したがって、すべての国の複雑性と厳格性 を常に正確に理解するわけではなく、これは国際監督管理過程により大きな不確実性をもたらす。また、政府法規はほとんど通知なしにbrを変更することができ、私たちの製品(S)の監督管理を向上させる可能性があり、それによって私たちの細胞br加工技術製品により大きな監督管理負担をもたらす可能性がある。私たちは外国の管轄区域で遵守されなければならない適用法律 を徹底的に探索していない。私たちは私たちの業務を1つ以上の外国司法管轄区域に拡張することを許可されないかもしれない。
| 34 |
私たちは、私たちがどの国で幹細胞治療診療所を設立するかについて明確な計画や計画はありません。 私たちはこのような機会があった時に探索するつもりです。
オフィス
私たちの主な実行オフィスはニューヨーク州メルヴェルマルクス通り40号Suite One、郵便番号:(631)760-8100です。私たちのサイトはwww.biorestorative.comです。我々のインターネットサイトおよびそれに含まれるまたは接続された情報は、本年度報告に引用的に組み込むことを意図していない。
従業員
私たちは現在11人の従業員がいて、すべてフルタイム社員です。私たちは私たちの従業員が仲がいいと信じている。
| プロジェクト 1 a. | リスク要因 . |
本節で列挙されたリスク要因は、私たちの実際の結果が、私たちが前向きな陳述で説明した予想とは大きく異なる可能性があるリスク、不確実性、およびイベントの例を提供する。読者は、これらのリスク要因に記載されている任意のイベントの発生が、私たちの業務、運営結果、および財務状況に重大な悪影響を及ぼす可能性があることを認識すべきである。私たちは、新しい情報、未来のbr}イベント、または他の理由でも、いかなる前向きな陳述を公開更新または修正する義務はない。
完全なリスク要因の前に、その後のいくつかのリスク要因のリストがある。関連するリスクの完全な説明については、完全なリスク要因を参照してください。
私たちの業務に関するリスク
| ● | 私たちの運営の歴史は限られています。私たちは設立以来ずっと巨額の損失を受けています。私たちは近いうちに損失を被ることが予想されます。 | |
| ● | 私たちは臨床試験を完成させ、私たちの業務計画を実施するために多額の資金を得る必要があるだろう。 | |
| ● | 私たちの業務戦略を実施するためには合意が必要です。 | |
| ● | 私たちは私たちの幹部と私たちがより多くの合格者を引き付けて維持する能力に依存している。 |
| 35 |
私たちの細胞治療製品開発に関わるリスク
| ● | 私たちの未来の成功は私たちが慢性腰椎間板疾患を治療する主要な候補製品BRTX-100の適時と成功の開発と商業化に大きく依存する;もし私たちがこの候補製品及び任意の他の候補製品の開発過程中に遅延或いは困難に遭遇すれば、私たちの業務の将来性は深刻な損害を受けるだろう。 | |
| ● | われわれの臨床試験に十分な数の患者を募集する際には,遅延や他の困難に遭遇する可能性があり,brを延期したり,必要な規制承認を阻止したりする可能性がある。 | |
| ● | 我々の細胞治療候補製品の開発は不確実性の影響を受けており,自家細胞治療自体が可変であるためである。 | |
| ● | 候補細胞治療製品の臨床開発に使用するメディエーター(細胞培養メディエーターを含む)と試薬のいかなるbr中断も、私たちの臨床試験を行い、将来の監督提出を求める能力に悪影響を及ぼす可能性がある。 | |
| ● | 私たちの臨床試験は私たちの候補製品の安全性と有効性を十分に証明できないかもしれません。これはbr監督部門の承認と商業化を阻害または延期します。 | |
| ● | 必要な臨床試験が完了しても,いつあるいは規制部門の承認を得て候補製品を商業化するかどうかは予測できず,承認範囲は我々が求めている範囲よりも狭い可能性がある。 | |
| ● | 私たちのどの候補製品もアメリカでFDAの承認を得られないかもしれません。たとえ私たちが承認されても、私たちはいかなる外国の司法管轄区域でも許可されたり、私たちの任意の候補製品を商業化したりすることはありません。これは、私たちがbr市場の潜在力を十分に発揮する能力を制限することになります。 | |
| ● | 私たちの は現在、私たちの候補製品を商業規模で量産する製造能力が不足しており、現在予備の 製造供給がありません。これは、将来の製品の任意の需要を満たす能力に悪影響を及ぼす可能性があります。 | |
| ● | 私たちの製品のビジネス潜在力と収益力は未知であり、重大なリスクと不確実性の影響を受けている。 | |
| ● | われわれ は褐色脂肪(脂肪)組織を得ることが困難である可能性がある。 | |
| ● | 我々や幹細胞に基づく新しい療法を開発している他の人が安全問題に遭遇すれば,我々の幹細胞イニシアティブは実質的なbrや悪影響を受ける可能性がある。 | |
| ● | われわれbrは競争や技術変革の影響を受けやすく,医師の不活性の影響も受けやすい。 | |
| ● | われわれ は細胞療法の開発やマーケティングにおける経験が限られており,br}収益業務の構築に成功していない可能性がある。 | |
| ● | 我々の細胞治療ビジネスは、固有の高価で高リスクで、市場に理解または受け入れられない可能性のある新しい技術に基づいており、これは私たちの将来の価値に悪影響を及ぼす可能性がある。 | |
| ● | バイオ製品として承認を求めるbr細胞療法候補製品は予想よりも早く競争に直面する可能性がある。 | |
| ● | 私たちの候補製品を人体に使用することによってリスクにさらされる可能性があり、私たちの保険は出現可能なクレームをカバーするのに十分ではない可能性がある重大な製品責任クレームと訴訟に直面する可能性があります。 | |
| ● | 我々のbr内部コンピュータシステムまたは私たちの臨床研究者、臨床研究組織、または他の請負業者またはコンサルタントが使用することが予想されるコンピュータシステムは、故障またはセキュリティホールに遭遇する可能性があり、これは、私たちの候補製品の開発計画が実質的に中断される可能性がある。 | |
| ● | 私たちは個人や政府保険会社から製品やサービスの精算を得ることができず、私たちの製品やサービスの需要に悪影響を及ぼす可能性があります。 |
| 36 |
私たちの知的財産権に関するリスク
| ● | 私たちは私たちの所有権を保護できないかもしれない。 | |
| ● | 米国特許法の変更 は我々の知的財産権に重大な悪影響を及ぼす可能性がある。 | |
| ● | 特定の国/地域では、特許所有者は、その国の将来の任意の収入に重大かつ有害な影響を及ぼす可能性がある強制許可の付与を要求される可能性がある。 |
政府規制に関するリスク
| ● | もし私たちが候補製品のために規制されて承認されたとしても、私たちの製品は監督されるだろう。 | |
| ● | 私たち は連邦と州医療詐欺と乱用法律、虚偽申告法および健康情報プライバシーと安全法律の制約を直接または間接的に受ける可能性がある。もし私たちがこのような法律を遵守できないか、または完全に遵守できなければ、私たちは巨額の処罰に直面するかもしれない。 | |
| ● | 私たちの細胞治療候補製品は規制部門の承認を得られず、これは私たちの業務と将来性に重大で不利な影響を与える可能性がある。 | |
| ● | もし私たちが規制や公認された基準に基づいて臨床研究を行うことができない場合、私たちはFDAや他の規制機関から私たちの候補製品に対する規制承認を受けることが遅延されるかもしれないし、永遠に受け入れられないかもしれない。 | |
| ● | 医療会社はずっと連邦と州調査の対象であり、私たちは未来に調査されるかもしれない。 | |
| ● | それは、政府、個人健康保険会社、および第三者支払者が、私たちのサービスに関連する治療および製品の保険をどの程度承認するか、または精算を提供するかどうかを決定しない。米国連邦医療保険、医療補助、その他の連邦医療保健計画資金の減少により、このような精算の獲得性はさらに制限される可能性がある。 | |
| ● | EUの競争相手であるbr社や病院はEUのルールを利用して,個人 患者に許可されていない薬品の販売を許可し,マーケティング許可なしに競合製品を販売することが可能である。 |
私たちの普通株に関するリスク
| ● | 私たちは配当金を払いません。 | |
| ● | 当社の普通株未登録株式を保有する株主 は、当社以前の“空殻会社”として第144条に規定する転売制限を受けています | |
| ● | 材料br}私たちは財務報告の内部統制に欠陥があり、私たちの財務結果 を適時に正確に報告できないか、あるいは私たちの合併財務諸表に重大な誤報を招く可能性があります。 | |
| ● | 私たちの普通株は将来的に重大な発行や転売がある可能性があり、これは株主の所有権利益を深刻かつ不利に希釈し、私たちの証券の市場価格に影響を与える可能性がある。 | |
| ● | 反買収条項と私たちが制約される可能性のある法規は、第三者が私たちに対する支配権を獲得することを難しくする可能性があり、 制御権の変更が私たちの証券保有者に有利であっても。 |
| 37 |
私たちのナスダック上場に関するリスク
| ● | 私たちはあなたに保証できません。私たちはナスダックの最低入札価格要求を守り続けることができます。 | |
| ● | 我々普通株の市場価格は機関投資家を含む新投資家を引き付けることができない可能性があり、これらの投資家の投資要求を満たすことができない可能性もある。したがって、私たちの普通株の取引流動性は改善されないかもしれない。 |
私たちの業務に関するリスク
私たちの運営の歴史は限られています。私たちは設立以来ずっと巨額の損失を受けています。私たちは近いうちに損失を被ることが予想されます。
私たち の運営履歴は限られています。設立以来、私たちは純損失を被った。2023年12月31日までの累計赤字は167,056,381ドルです。
私たちは臨床試験を完成させ、私たちの業務計画を実施するために多額の資金を得る必要があるだろう。
私たちの設立以来、私たちは私たちの業務から収入を得るのではなく、私たちの株式証券や債務証券を売却することで私たちの業務に資金を提供しています。本年度報告第1項(“業務”)で述べたように、我々の業務計画の実施には、必要な設備、技術および材料を購入するために十分な株式および/または債務融資を受ける必要があり、私たちの臨床試験および他の研究開発事業に資金を提供し、他の方法で私たちの運営に資金を提供する。臨床試験を達成するために多くの追加資金が必要になりますBRTX-100それは.また、本年度報告第1項(“ビジネス”)に記載されている他の計画を実施するために多くの追加資金が必要になりますThermoStem計画、 一般業務に資金を提供しています私たちが予想しているこのような用途に必要かもしれない資金の額が正しいか、あるいは予想される時間範囲で私たちの目標を達成できるという保証はありません。また、私たちが商業的に合理的な条項や他の方法で必要な融資を受けることができる保証はありません。もし私たちが上記の目的に必要な融資を得ることができなければ、私たちは私たちの開発、マーケティング、販売促進活動を削減しなければならないかもしれません。これは私たちの業務、財務状況、運営結果に重大な悪影響を与え、最終的には運営を停止し、清算を余儀なくされる可能性があります。
私たちの業務戦略は高リスクです。
我々 は,我々の資源と努力を主にセルベースの製品やサービスの開発に集中しており,研究,開発,商業化活動に大量の現金が必要となる.これは私たちの製品とサービスを保証できないので、高リスク戦略です椎間板·脊椎計画そして私たちの熱乾法代謝性ブラウン脂肪研究計画は,商業的に可能であるかどうか(ビジネスリスク)であり,他社が我々の発明と開発に基づくサービスや製品を提供することで市場シェアと利益(法的リスク)を奪うことを防止し,新たな業務分野である再生医学である1社のbrを管理することに成功し,過去とは異なる規模で経営(操作リスク),幹細胞や再生細胞を用いて期待される治療結果(科学的リスク)を達成することができるであろう。あるいは私たちの現金資源 は、私たちが利益を達成するまで、私たちの製品やサービスを開発するのに十分になるだろう(財務リスク)。私たちは経済の中で最もリスクの高い業界の一つ(戦略リスク)に現金を使用する。これは私たちの証券が多くの投資家の投資に適していないようにするかもしれない。
| 38 |
私たちの業務戦略を実施するためには合意が必要です。
再生科学有限責任会社と締結した特定のライセンス契約およびわれわれの第二段階臨床試験の実施に関する合意を除いて,われわれの業務戦略を実施することについては実質的な合意や了承は得られていない。私たちが私たちの業務の発展について必要な合意に到達できるという保証はない。私たちはこのような合意に到達できず、私たちの運営結果や財務状況に大きな悪影響を及ぼすだろう。
私たちは私たちの幹部と私たちがより多くの合格者を引き付けて維持する能力に依存している。
私たちの業績は私たちの最高経営責任者Lance Alstodtの業績に大きくかかっている。私たちは彼に戦略的な業務決定と指導に依存している。私たちはまた、研究開発副総裁のフランシスコ·シルバの表現に依存しています。 アルストートとシルバはそれぞれ私たちと雇用協定を締結しました。私たちは私たち二人の幹部のために何のキーパーソン保険証書も購入していません。私たちは未来に適切な製品とサービスを開発し、競争地位を獲得する方面の成功は、私たちがより多くの合格した管理と科学者を引き付けることができるかどうかに大きく依存すると信じている。このような人員に対する競争は非常に激しく、これらの人々を引き付け、引き留めることができる保証はありません。 アルストートさんおよび/またはシルバさんのサービスを失い、または必要に応じてより多くの人員を引き付け、引き留めることができず、専門知識 を発展させることは、私たちの運営結果や財務状況に大きなマイナス影響を与えます。
新冠肺炎の影響と関連リスクは私たちの運営結果と将来性に重大な影響を与える可能性があります.
2020年3月から,新型コロナウイルス新冠肺炎に関する全世界大流行が世界経済に影響を与え始めている。今回の疫病の規模と広さのため、新冠肺炎のすべての直接と間接的な結果はまだ不明であり、一定期間内にも出現しない可能性がある。新冠肺炎の持続的な影響によるリスクは:
臨床試験 新冠肺炎の大流行は著者らの臨床試験に負の影響を与える可能性が予想される。全世界が新冠肺炎に対抗しようと努力しているため,この方面での臨床仕事も増加しており,臨床試験に必要ないくつかの実験室用品,設備,他の材料を得ることは困難であると考えられる。また,新冠肺炎の伝播が懸念されているため,臨床試験参加者になることをためらう人もいる可能性が予想される。より多くの人がワクチンを接種するにつれて,これらの可能な負の影響が軽減されていると信じているが,ワクチン接種がどのような影響を与えるかは不明である。
| 39 |
不利な立法および/または規制行動。連邦,州,地方政府が新冠肺炎の影響に対応·抑制する行動はわれわれに悪影響を及ぼす可能性がある。例えば、私たちは立法および/または規制行動の影響を受け、臨床試験を行う方法に負の影響を与える可能性がある。
運営中断とより高いネットワークセキュリティリスク。もし私たちの上級管理職の重要なメンバーやかなりの割合の従業員が病気、政府指示、その他の理由で仕事を続けることができなければ、私たちの運営は中断される可能性があります。さらに、遠隔作業スケジュールの増加に伴い、私たちは、より高いネットワークセキュリティ攻撃またはデータセキュリティイベントのリスクに直面し、インターネットおよび電気通信アクセスおよび能力により依存する。
私たちの細胞治療製品開発に関わるリスク
私たちの未来の成功は私たちが慢性腰椎間板疾患を治療する主要な候補製品BRTX-100の適時と成功の開発と商業化に大きく依存する;もし私たちがこの候補製品及び任意の他の候補製品の開発過程中に遅延或いは困難に遭遇すれば、私たちの業務の将来性は深刻な損害を受けるだろう。
私たち は私たちの候補製品の成功的な開発、承認、商業化に依存している。規制部門が私たちの候補製品の承認を求めることができる前に、人体における安全性と有効性を証明するために、広範な臨床試験を行い、完成しなければならない。私たちの主な候補製品はBRTX-100開発の初期段階で最近使い始めたばかりですBRTX-100腰椎椎間板ヘルニア/膨張関連の退行性疾患による慢性下腰痛 を治療した。
臨床試験費用が高く、設計と実施が困難であり、完成まで数年かかるかもしれない。重要なのは、これらまたは任意の他の臨床試験のうちの1つまたは複数の失敗が、試験の任意の段階で発生する可能性があることである。臨床試験期間中または臨床試験の結果において、私たちは多くの予見できない事件に遭遇する可能性があり、これらの事件は、私たちの臨床研究の完成を延期または阻止し、監督管理の承認を得るか、あるいは私たちの候補細胞療法製品を商業化することを含む
| ● | 一時停止、 設計、起動、登録、実施または完了に必要な臨床試験の遅延または変更;私たちの財務状況の不利な変化または臨床開発計画コストの顕著かつ意外な増加;規制承認過程において、現在の開発戦略の変更または不確実性 または追加を変更する必要がある;臨床試験結果 は、安全性および/または有効性の面で否定的であり、不確実であるか、または予想されていないものであり、追加の臨床研究または製品開発の終了を必要とする可能性がある。製品を生産する能力を遅延させるか、または任意の必要な臨床試験に適した形で生産すること | |
| ● | 知的財産権の制限は私たちの候補細胞治療製品を製造、使用、商業化できないようにしています |
| 40 |
| ● | 私たちの候補製品の供給または品質、あるいはこれらの候補製品に対して臨床試験を行うために必要な他の材料の供給または品質は不足または不十分かもしれない;臨床研究の開始を支持するために十分な臨床前、毒理学または他の体内または体外データを生成することができない | |
| ● | 遅延 は予期される臨床研究地点と受け入れ可能な条項について合意し、その条項は広範な交渉 を必要とする可能性があり、異なる臨床研究地点の間に有意差がある可能性がある | |
| ● | 各臨床研究場所で必要な機関審査委員会またはIRBの承認を得ることを遅延させる | |
| ● | 監督管理機関は多種の原因で臨時或いは永久臨床一時停止を実施し、IND申請或いは修正案或いは同等の申請或いは修正案を審査した後;新しい安全発見のため臨床参加者に対して不合理なリスクを構成する;著者らの臨床研究操作或いは研究場所の検査に対して否定結果を得る;競争相手が行った試験br或いは関連技術の承認製品の発売後の開発はFDAのこの技術の患者リスクに対する広範な懸念を引き起こした。またはFDAが研究計画または計画が明らかにその宣言の目標を達成できないことを発見した場合 | |
| ● | 患者団体や調査者と協力することは困難です | |
| ● | 私たちのCRO、他の第三者、または私たちは臨床研究要求を守ることができなかった | |
| ● | FDAの現在の良好な臨床実践またはGCP要求、または他の国/地域に適用される規制ガイドラインを実行できなかった; | |
| ● | Brを遅延させることにより、患者は1つの研究に参加する資格があるか、或いは治療後のフォローアップに戻ることができる | |
| ● | 患者 は研究を脱退した; | |
| ● | 候補製品に関連する有害事象の発生 は、その潜在的な利点を超えていると考えられる | |
| ● | 臨床開発計画に基づいた看護基準を変更するには、新しいまたは追加の試験が必要かもしれない | |
| ● | 製造プロセスを任意の学術協力者から契約製造組織またはCMOまたは私たちによって運営されているより大規模な施設に移し、私たちのCMOまたは私たちはそのような製造プロセスを必要な変更を行うことができないか、または遅延するか、またはそのような製造プロセスを必要に変更することができない | |
| ● | 新冠肺炎の大流行或いはその他の衛生突発事件は著者らの臨床試験の遅延を招いた | |
| ● | 臨床研究のために十分に安定した数の私たちの候補製品を遅延させるか、または上記の任意の操作を実行することができない、brの生産、テスト、発表、検証、または輸入/輸出の十分な数の私たちの候補製品を遅延させる; | |
| ● | FDAは、医療基準が米国とは異なる国の臨床地点で行われる可能性のある試験の臨床データを受け入れない | |
| ● | 臨床試験を完成させるのに十分な資金を集めることができませんでした |
臨床前と臨床開発を成功させることができないいかなるbrは、私たちの追加コストを招くか、あるいは私たちの創造能力を弱める可能性がある。さらに、私たちが私たちの候補製品を製造または配合変更した場合、私たちは私たちの修正された候補製品をより早いバージョンに接続するために追加的な研究を行うことを要求されるかもしれません。臨床研究遅延はまた、私たちの製品が特許保護されている時間を短縮し、私たちの競争相手が私たちよりも先に製品を市場に出す可能性があり、これは候補製品を商業化する能力を弱める可能性があり、私たちの業務と運営結果を損なう可能性がある。
| 41 |
たとえbrが候補製品の臨床開発計画を成功させ、最終的に監督部門の許可を得て1つ以上の製品を販売することができれば、私たちは:
| ● | われわれが求めている適応のように広範でない適応については,brの承認を得た | |
| ● | 発売が承認された後、その製品が出荷されたかどうか | |
| ● | ビジネス用品の製造に問題がある; | |
| ● | 追加の上場後のテスト要求を受ける;および/または | |
| ● | 製品の配布や使用方法に関する制限を受ける。 |
私たちは私たちのBRTX-100製品候補期間は少なくとも5年です。
十分な数の患者を臨床試験に参加させるのに十分な数の患者を募集する際に遅延や他の困難に遭遇する可能性があり,必要な規制承認を遅らせるか阻止する可能性がある。
もし私たちがFDAや他の規制機関が要求する臨床試験に参加するのに十分な数の条件を満たす患者を確定し、募集できなければ、私たち は計画通りにいかなる臨床試験を開始或いは完成できない可能性がある。十分な数の臨床試験サイトを招いてわれわれの試験を行うこともできないかもしれない。
われわれは細胞の療法の新規性,患者群の規模 および試験参加資格基準に基づいているため,われわれの臨床試験への患者の参加を募集する上で挑戦に直面する可能性がある。また,一部の患者は細胞療法に懸念がある可能性があり,開発中の療法に対する見方や試験参加の決定に悪影響を及ぼす可能性がある。また,目標適応内疾患を有する患者が競争的臨床試験に参加する可能性があり,試験登録を完了する能力に悪影響を及ぼす可能性がある。臨床試験における登録挑戦は通常候補製品の開発コストの増加、著しい遅延を招き、甚だしきに至っては臨床試験を放棄する可能性がある。
われわれbrは臨床試験の完成に他の遅延がある可能性があり,これらの試験をまったく達成できない可能性がある。
私たちは最近必要な臨床試験を始めたばかりでFDAの承認を得て候補製品を販売していますBRTX-100それは.著者らは臨床試験の完成と薬物の商業化に豊富な経験が不足しているため、著者らはこのような経験を持つ外部コンサルタント を招いた。臨床試験BRTX-100様々な要因のため、開発中の他の候補製品は、以下のように延期または終了される可能性がある
| ● | 患者は治療に満足していない、副作用或いはその他の原因で臨床試験を完成できなかった | |
| ● | 規制当局は臨床試験を開始することを許可できませんでした | |
| ● | 患者の安全に対する懸念、私たちの臨床研究計画中の研究場所および/または研究者がGCP要求を遵守できなかったこと、現在のcGMP要求を遵守できなかったこと、または私たちの契約メーカーが現在のcGMP要求を遵守できなかったことを含む、様々な原因で一時停止または規制された機関によって臨床研究を終了する | |
| ● | 臨床試験を行うために必要な製品の臨床供給を契約メーカーから得ることができないか、または契約メーカーから臨床試験を受けるために必要な製品の臨床供給を遅延させることができない |
| 42 |
| ● | 治療brは臨床試験期間中に治療効果の乏しい候補として現れた | |
| ● | 顕著なセキュリティ信号を示す候補者を処理する;および/または | |
| ● | 臨床試験を継続したりパートナーを見つけて臨床試験を支援することはできない。 |
私たちの候補製品のいかなる の臨床試験の完了とFDA承認の遅延または失敗は、私たちの開発と商業化コスト、特定の候補製品から収入を得る能力に大きな悪影響を及ぼす可能性がある。
我々の細胞治療候補製品の開発は不確実性の影響を受けており,自家細胞治療自体が可変であるためである。
自家細胞療法を作製する場合,細胞集団の数や組成は患者によって異なる。これらの細胞の数および組成のこのような変化は、臨床試験のための、または(承認された場合)商業販売のための能力のために、経済的に効率的または利益的な方法で自己細胞療法を製造し、許容可能な製品発表仕様を満たすことに悪影響を及ぼす可能性がある。したがって、自己細胞療法製品の開発および規制承認プロセスは、決して達成できない可能性がある。
我々が細胞候補治療製品の臨床開発に使用するメディエーター(細胞培養培地を含む)と試薬のいかなるbr中断も、私たちの臨床試験を行い、将来の監督提出を求める能力に悪影響を及ぼす可能性がある。
臨床試験で使用され、商業生産において必要または使用される可能性のあるいくつかのbr培地(細胞培養媒体を含む)および試薬、ならびに装置、材料およびシステムは、独立した第三者によって提供される予定である。これらの媒体、試薬、設備、材料、およびシステムはいかなる理由でも持続的に供給できず、これらの研究を完成させる能力に重大な悪影響を与え、治療計画製品の商業的生産の実現に悪影響を及ぼす可能性がある。これらの媒体、試薬、装置、材料、およびシステムの他の利用可能なソースが市場に存在する可能性があるにもかかわらず、私たちはそれらのコスト、効果、または知的財産権ベースを評価していないので、このような他の潜在的ソースの適用性または利用可能性を保証することはできない。
研究開発において有望に見える製品 は延期される可能性があり,あるいは臨床開発の後期段階に入らない可能性がある。
セルベースの製品が開発に成功するかどうかは不確実性が高い.臨床前と早期開発で有望に見える候補製品は延期されたり,後期開発段階に入らない可能性がある。候補製品のさらなる開発に関する決定は、限られた不完全なデータを使用しなければならず、これにより、限られたリソースの割り当ておよび特定の候補製品への追加資本支出が予期される結果をもたらすかどうかを確実にさらに正確に予測することは困難である。br}臨床前および臨床データは、異なる方法で解釈することができ、br}臨床試験中の否定または不確定な結果または有害事象は、候補製品の開発を延期、制限、または阻止する可能性がある。我々の臨床研究では、積極的な臨床前データは、将来の被験者においてbr}が持続または出現しない可能性があり、我々の候補製品に関連する進行中または将来の研究で重複または観察されない可能性がある。また、私たちの候補製品も、臨床開発の後期段階で必要な安全性および有効性を示すことができない可能性があるが、予備臨床研究に成功している。また、製品開発期間中の規制政策の変化を含む多くの要因により、監督管理の遅延や拒否に遭遇する可能性がある。
| 43 |
我々のbr臨床試験は,我々の候補製品の安全性と有効性を十分に証明できない可能性があり,規制部門の承認と商業化を阻害または延期する。
私たちの候補製品の臨床試験と私たちの製品の製造とマーケティングはアメリカと他の国/地域の多くの政府機関の広範かつ厳格な審査と規制を受け、私たちはこれらの国/地域で私たちの候補製品をテストし、販売するつもりです。規制部門が私たちの任意の候補製品の商業販売を承認する前に、私たちの候補製品が各目標適応において安全かつ有効であることを、長く、複雑で高価な臨床前試験および臨床試験によって証明しなければならない。特に、私たちのいくつかの候補製品は生物学的薬物製品として規制されているため、私たちはこれらの製品が安全で、純粋で有効であり、その目標適応に使用できることを証明する必要がある。各候補製品は、その目標患者集団およびその予期される用途が十分なリスクと収益を有することを証明しなければならない。製品許可に必要なリスク/収益状況は、これらの要因によって異なり、疼痛の軽減または除去、十分な反応持続時間、疾患進展の遅延、機能の改善および/または障害の減少を含む可能性がある。
また,これらの実験が成功しても,FDAが我々のように結果を解釈する保証はなく,承認のための候補製品を提出する前に,より多くの実験を行う必要があるかもしれない.試験結果がマーケティング申請をサポートするためにFDAを満足させることができない場合、私たちの候補製品が承認される可能性があることを支援するために、追加の実験を行うために多くの資源が必要になるかもしれない。
必要な臨床試験が完了しても,いつあるいは規制部門の承認を得て候補製品を商業化するかどうかは予測できず,承認範囲は我々が求めている範囲よりも狭い可能性がある。
適切な規制機関が候補製品を審査·承認する前に、候補製品を商業化することはできません。私たちの候補製品が臨床試験でその安全性と有効性の終点に達しても、規制機関はその審査プロセスを適時に完成できない可能性があり、あるいは規制部門の承認を得ることができない可能性があります。FDA諮問委員会または他の規制機関が承認を承認しないか、承認に制限または条件を適用することを提案した場合、追加の遅延を招く可能性がある。また、製品開発、臨床試験、審査過程において、将来の立法または行政行動における追加の政府法規や規制機関の政策の変化によって、遅延や拒否に遭遇する可能性がある。規制機関 はまた、要求よりも限られた適応の候補製品を承認することができ、または狭義の適応、禁忌またはリスク評価および緩和策(REMS)の形態で重大な制限を加える可能性がある。これらの規制機関は、使用条件に関する警告や予防措置を要求することができ、あるいは高価な発売後の臨床試験の表現によって承認される可能性がある。また、規制当局はラベル宣言を承認しない可能性があり、私たちの候補製品の商業化に必要なまたは必要な販売促進声明も許可しない可能性がある。上記のいずれの状況も、私たちの候補製品のビジネス見通しに重大な損害を与え、私たちの業務、財務状況、運営結果、および見通しに重大な悪影響を及ぼす可能性があります。
| 44 |
私たちのどの候補製品もアメリカでFDAの承認を得られないかもしれません。たとえ私たちが承認されても、私たちはいかなる外国司法管轄区域でも許可されたり、私たちの任意の候補製品を商業化したりすることはありません。これは、すべての市場潜在力を達成する能力を制限することになります。
最終的に任意の特定の外国司法管轄区で我々の任意の候補製品を販売するためには、各管轄区において、多くの安全性および有効性に関する様々な法規要件を確立し、遵守しなければならない。米国FDAの承認を得ても、他の国や管轄区域規制機関の承認を得ることは確保できない。また、1つの国/地域で行われる臨床前研究および臨床試験は、他の国/地域の規制機関によって受け入れられない可能性があり、1つの国/地域での規制承認は、他のどの国/地域でも規制承認を得ることが保証されない。
承認の流れは国/地域によって異なり、追加の製品テストと検証、および追加の行政審査期限が含まれる可能性があります。外国の監督管理機関の承認を求めることは、私たちに困難とコストをもたらす可能性があり、追加の臨床前研究や臨床試験が必要であり、これは高価で時間がかかる可能性があります。規制要件は国/地域によって異なる可能性があり、これらの国/地域での候補製品の発売が延期または阻止される可能性があります。外国の規制承認プロセスに関連するリスクはFDA承認に関連するリスクと類似している。私たちは国際市場を含めてどの司法管轄区での販売も承認されていません。私たちもこのような承認を得ようとしていません。もし私たちが国際市場の規制要求を遵守できなかった場合、あるいは必要な承認を得て維持できなかった場合、あるいは国際市場の規制承認が延期された場合、私たちの目標市場は減少し、製品のすべての市場潜在力を実現する能力は実現できないかもしれない。
私たちの は現在、私たちの候補製品を商業規模で量産する製造能力が不足しており、現在予備の 製造供給がありません。これは、将来の製品の任意の需要を満たす能力に悪影響を及ぼす可能性があります。
私たちの研究室では臨床生産に必要な細胞処理サービスを提供していますBRTX-1002期ディスク臨床試験に用いました私たちは、第2段階試験の残りの部分に関連するこのようなサービスを提供する十分な実験室能力があると信じているが、私たちは、以下の潜在的なビジネスニーズを満たすために、このような細胞処理サービスを提供するために、私たちの製造能力を大幅に拡張する必要があるBRTX-100そして、私たちの任意の他の候補製品(承認された場合)、および私たちの他の任意の は、規制部門によって承認される可能性のある候補製品です。そのような拡張は追加的な規制承認を必要とするだろう。私たちが私たちの製造能力を向上させても、私たちは需要を満たすのに十分な生産能力が足りないかもしれない。最終的に、もし私たちが私たちの製品を供給して商業需要を満たすことができなければ、加工制限のせいでも、私たちが遭遇した他の中断、遅延あるいは困難であっても、製品の販売及び長期的な商業見通しは深刻な損害を受ける可能性があります。
私たちは第三者メーカーの利用を求める可能性がありますBRTX-100または私たちの他の任意の候補製品;しかし、私たちは第三者製造業者と何の 手配を達成しなかった。もし私たちがこれらの候補製品を生産する施設または私たちのbr設備が深刻に損傷したり、破損したり、または他の中断、遅延、または困難な影響がある場合、私たちの計画と将来の臨床研究、およびこれらの候補製品の商業生産は深刻に 中断および遅延する可能性がある。この容量を第三者で置き換えるのは時間も高価であり、特にどんな新しい施設でも規制要求を遵守する必要があるからである。
| 45 |
最終的に、私たちが商業需要を満たすために候補細胞療法製品を供給できない場合(商業承認を得ると仮定する)、“br}はプロセス制限や他の中断、遅延、あるいは困難のためであっても、私たちの生産コストは大幅に増加する可能性があり、製品の販売およびその長期的な商業見通しは深刻な損害を受ける可能性がある。
私たちの製品のビジネス潜在力と収益力は未知であり、重大なリスクと不確実性の影響を受けている。
細胞療法候補製品の開発に成功し,規制部門の承認を得ても,市場はこれらの製品 を理解あるいは受け入れられない可能性があり,将来の販売のタイミングやレベルに悪影響を及ぼす可能性がある。最終的に、私たちの候補製品(または未来の任意の候補製品)に対する市場の受け入れ度は、多くの要素に依存するだろう
| ● | この製品の臨床有効性、安全性と利便性、特に代替治療において | |
| ● | 私たちの製品(成人細胞に関連する)を、ヒト胚または胎児組織からの幹細胞製品に関連する任意の倫理的および政治的論争と区別することができる | |
| ● | 製品のコスト、政府、第三者支払者の精算政策、そして私たちは十分な第三者保険や精算能力を得ています。 |
たとえ私たちが候補製品の販売に成功したとしても、これらの製品がどの程度利益を上げるかはわかりません。 は細胞治療製品の生産に関連する商品コストが高いです。さらに、製造プロセスまたはプログラムのいくつかの変更は、一般に、実施前にFDAまたは外国規制機関が審査および承認する必要がある。私たちはこのような変更の承認を支持するために、追加の臨床前研究と臨床試験を行う必要があるかもしれない。また、この審査過程はコストが高く、時間がかかる可能性があり、候補製品の商業化を延期または阻止する可能性がある。
われわれ は褐色脂肪(脂肪)組織を得ることが困難である可能性がある。
私たちは褐色脂肪(脂肪)組織を使用して、私たちの臨床前研究のために褐色脂肪由来幹細胞を同定し、特徴づけたThermoStem 計画私たちが潜在的な茶色脂肪組織源と確立された任意の関係を通じて褐色脂肪サンプルを収集し続けることができるかどうかは確認できない。茶色の脂肪組織が得られないことは私たちのThermoStem計画です
| 46 |
我々や幹細胞に基づく新しい療法を開発している他の人が安全問題に遭遇すれば,我々の幹細胞イニシアティブは実質的なbrや悪影響を受ける可能性がある。
幹細胞を治療適応に応用することは非常に早期の発展段階にある。我々が提案する製品および/またはサービスまたは他の製品および/またはサービスに関連する臨床試験中に有害事象が発生した場合、FDAおよび他の規制機関は、臨床試験を停止するか、または追加の研究を要求する可能性がある。このようなイベントの発生は、私たちの開発作業を延期し、コストを増加させ、私たちが提案する製品および/またはサービスの商業化を非現実的または不可能にする可能性がある。
われわれbrは競争や技術変革の影響を受けやすく,医師の不活性の影響も受けやすい。
私たちは私たちの技術と製品の開発において、バイオテクノロジー、医療設備、製薬会社を含む多くの国内外の会社と競争します。多くの既存と潜在的な競争相手は、より多くの財務、技術、研究、および 開発、マーケティング、および人的資源を持っている。私たちの競争相手が、私たちが開発する可能性のある製品および/またはサービスよりも効率的で、より使いやすい、またはより経済的な代替製品および/またはサービスを開発することに成功しないか、または私たちの製品および/またはサービスを時代遅れにし、競争力がないという保証はありません。一般に、私たちは、他社が私たちと類似した機能を開発したり、または私たちよりも先に販売した競争力のある製品および/またはサービスを開発したり、販売したりすることを阻止できないかもしれない。
競争相手 は製品、療法或いは設備の開発、臨床試験を行い、監督許可或いは承認を得て、製造と商業化の面でより多くの経験を持つ可能性がある。競争相手は私たちよりも早くFDAの特許保護、承認または許可を得ることができ、またはより早く商業化を達成する可能性があり、いずれの場合も私たちの業務に実質的な負の影響を与える可能性がある。
骨髄,脂肪組織,臍帯血,潜在的胚など,他由来の細胞ベース療法と競合する。医師は従来,我々のような新技術を採用する速度が遅く,どんな利点があっても,旧技術 は老舗プロバイダの支持を得続けてきたからである。このような不活性を克服するためには、一般に、非常に大きなマーケティング支出または決定された製品性能および/または価格設定利点が必要である。
私たちbrは医師の不活性と疑いも私たちの未来の製品やサービスを通じて市場浸透を得ようとする大きな障害になると予想している。私たちはこのような不活性および疑いを克服するために、長い時間のかかる臨床研究(医学的利益に納得できる証拠を提供するために)を援助する必要があるかもしれない。
私たち は将来的に協力または戦略的同盟を形成したり、または他の許可スケジュールを達成したりするかもしれませんが、私たち はそのような連合または許可スケジュールの利点を達成できないかもしれません。
我々 は、第三者 と戦略的連合を構築したり、合弁企業または協力関係を構築したり、または第三者と追加の許可協定を締結したりする可能性があり、これは、候補製品および将来開発可能な任意の候補製品の開発および商業化を補完または強化することになると考えられる。これらの関係のいずれも、非日常的な費用および他の費用の発生を要求することができ、br}は、私たちの近未来および長期支出を増加させ、既存の株主の株式を希釈する証券を発行したり、私たちの管理や業務を妨害したりすることを要求することができる。また、適切な戦略的パートナーを探す上で激しい競争に直面しており、交渉過程は時間がかかり複雑である。また、私たちの候補製品のための戦略的パートナーシップや他の代替手配を構築する努力は成功しないかもしれません なぜなら、彼らは協力努力の開発段階が早すぎると思われるかもしれないので、第三者は私たちの候補製品が安全性と有効性を証明するために必要な潜在力を持っているとは思わないかもしれません。これまで,このような努力 は成功しなかった.
| 47 |
また、 は、我々の候補製品の連携に関連しており、例えば、第三者研究機関との連携は、以下のリスクを含む可能性がある多くの リスクに直面する
| ● | 協力者(Br)は、彼らが協力の仕事や資源に適用されることを決定する上で大きな裁量権を持っている | |
| ● | パートナー(br}は、我々の候補製品の開発と商業化を行ってはならず、臨床試験結果に基づいて、競争製品の買収によってその戦略的重点を変更し、資金または他の外部要素(例えば、資源の移転や競争重点を創造する業務合併)を獲得して、開発または商業化計画を継続しないか、または継続しないか、または商業化計画を選択することもできる | |
| ● | 協力者 は臨床試験を延期し、臨床試験に資金不足を提供し、臨床試験を停止し、候補製品を放棄し、br}の繰り返し或いは新しい臨床試験を行うことができ、或いは新しい候補製品の調合による臨床試験を要求することができる | |
| ● | 協力者 は、独立して、または第三者開発と直接または間接的に私たちの製品または候補製品と競合する製品 ; | |
| ● | 1つまたは複数の製品に対してマーケティングおよび流通権限を有するbr}協力者は、そのマーケティングおよび流通のために十分なリソースを投入していない可能性がある | |
| ● | 協力者 は、私たちの知的財産権を正確に維持または擁護できない可能性があり、または何らかの方法で私たちの知的財産権または固有の情報 を使用して、実際または脅威の訴訟を引き起こし、それによって、私たちの知的財産権または専有情報を危険にさらしたり、無効にしたり、または潜在的な責任を負わせたりすることができる | |
| ● | 私たちとパートナーとの間で紛争が発生する可能性があり、私たちの候補製品の研究、開発または商業化の遅延または終了、または高価な訴訟や仲裁を招き、管理職の注意と資源を分散させる | |
| ● | 協力は を終了する可能性があり、終了すれば、適用可能な候補製品 をさらに開発または商業化するために追加の資金が必要となる場合がある;および | |
| ● | 協力者 は、私たちがそれと協力することによって生成された製品の知的財産権を持っているか、または共同で所有することが可能であり、この場合、私たち は、このような知的財産権を商業化する独占的権利を持たないであろう。 |
したがって、もし私たちが協力合意と戦略的パートナーシップを達成すれば、私たちの製品や業務が可能かもしれません。もし私たちがこれらの取引を私たちの既存の業務や会社文化と統合することに成功できなければ、私たちはこのような取引の利点を達成できないかもしれません。これは、私たちのスケジュールを延期したり、他の方法で私たちの業務に悪影響を与える可能性があります。戦略的取引や許可証の後に、このような取引の合理的な収入または特定の純収入を証明することが達成されるかどうかも確認できません。私たちの候補製品に関連する新しい協力または戦略的パートナーシップ協定の任意の遅延 は、いくつかの地域における私たちの候補製品の開発および商業化を延期する可能性があり、これは、私たちの業務の将来性、財務状況、および運営結果を損なうことになる。
| 48 |
われわれ は細胞療法の開発やマーケティングでは経験が限られており,利益のあるbr業務の構築には成功しない可能性がある。
私たちのビジネス計画は従来、盛んな細胞治療の分野でスプーンに分けることに集中してきた。著者らは細胞治療製品の開発とマーケティング分野及び関連する監督管理問題とプロセスに関する経験が限られている。著者らは設計と臨床試験を行う経験のあるチームを募集し、FDA顧問を招聘したが、会社として、著者らは臨床試験を行う経験が限られており、監督機関がいかなる候補製品 を承認するまで臨床試験を行うことは経験がない。一部は経験不足のため,計画中の臨床試験が時間どおりに開始または完了するかどうかを決定することはできない。私たちが臨床開発目標を達成したり、細胞治療市場でスプーンを分ける計画を実現することに成功する保証はありません。
我々のbr細胞治療業務は、固有の高価で高リスクで、市場に理解または受け入れられない可能性のある新しい技術に基づいており、これは私たちの将来の価値に悪影響を及ぼす可能性がある。
細胞や組織による療法の臨床開発,商業化,マーケティングは早期段階であり,基本的には研究志向であり, は財務的に投機的である。これまで,細胞療法製品の開発と商業化に成功した会社は少ない。一般に、不良および予期しない副作用、意外な免疫系反応、治療効果の不足、またはその承認または商業使用を阻止または制限する可能性のある他の特性を含む、細胞または組織に基づく製品は、様々なリスクの影響を受けやすい可能性がある。また、BRTX-100細胞に基づく候補細胞であり,患者自身の幹細胞 から骨髄から抽出される。規制当局による候補新製品の承認、例えばBRTX-100新しい製造技術を用いて製造することは、他のより有名或いはより広く研究されている製薬或いは生物製薬製品よりも複雑で、より高価で、時間がかかる可能性があり、これはFDAが経験が不足しているためである。我々の知る限り,FDAは椎間板に関連する幹細胞治療製品を承認していない。経験不足は規制審査過程を延長する可能性があり、追加のbr研究や臨床試験を行う必要があり、これは私たちの開発コストを増加させ、規制の立場や解釈の変化を招き、これらの候補製品の承認と商業化を遅延または阻止したり、重大な承認後の制限や制限を招いたりする。また、細胞や組織療法が使用される可能性のある人数を正確に予測することは困難である。私たちの将来の成功は、細胞と組織療法のための巨大な世界市場を構築することと、私たちの候補製品を通じてこの市場のシェアを占める能力があるかどうかにかかっている。
バイオ製品として承認を求めるbr細胞療法候補製品は予想よりも早く競争に直面する可能性がある。
2009年に“生物製品価格競争と革新法”(BPCIAと略称する)が公布され、FDAによって承認された革新者(原始)生物製品と生物類似性、高度類似性、或いは互換性があることが証明された製品を承認するために、短い監督管理の道を開いた。簡略化された規制経路は、生物類似物と既存の参照製品との類似性に基づいて、それを“交換可能な”生物製剤として指定することを含む、FDAのための生物類似生物製品の審査と承認の法的権威を確立した。BPCIAによると、生物類似製品の申請は、生ブランド製品が生物製品許可証申請(BLA)によって承認されてから12年後にのみFDAの承認を得ることができる。2009年にBPCIAが公布されて以来、FDAは生物類似と交換可能な生物類似過程において豊富な経験を蓄積した。もし私たちの任意の候補製品 がBLA経路で承認されたら、生物類似申請者は私たちの製品の生物類似および/または交換可能なバージョン を承認することを求め、これは私たちの製品の価格をもっと低くする可能性がある。
| 49 |
私たちは、もし私たちのすべての候補製品がBLAによって生物製品として承認されれば、12年の専門期間 を得る資格があると信じている。しかしながら、FDAは、このような排他的な他の参照製品を持たない生物類似申請者を承認する可能性があり、予想よりも早く大きな競争の機会を創出する可能性がある。
私たちはFDA発売前の承認を必要としない治療センターからの幹細胞療法のますます激しい競争に直面する可能性もあります。2022年8月、連邦地方裁判所はアメリカはカリフォルニアの幹細胞治療センター、Inc.Brのある自己脂肪幹細胞治療は“生物製品”ではないため、FDAの承認を必要としないと考えられている。br}FDAはこの決定を控訴しているが、この決定が維持されれば、高価で時間のかかるFDA承認手続きを経ることなく、幹細胞診療所からの競争に直面する可能性がある。
再生医療製品に対するFDAの規制はまだ予測できません。これが私たちの製品の潜在的な承認にどのような影響を与えるかは確定できません
幹細胞製品や技術からの治療法に対するFDAの規制は進化しており,進化し続ける可能性がある。2016年12月、21世紀治療法案または治療法案が米国で法律に署名され、医療革新の獲得を促進する。治療法案は新たなFDA再生医学高度治療またはRMATの称号を確立した。この指定 は、臨床開発中にFDAの支援を強化すること、申請の優先審査 を行うこと、潜在的な代替終点に基づく承認を加速すること、および患者登録データおよび他の形態の実世界証拠を使用して承認された可能性のある検証的研究を含む、候補製品に様々な利点を提供する。我々の任意の候補製品がFDAからRMAT 指定または任意の他のタイプの迅速審査計画指定を得るかどうかは不明である。いずれの場合も、FDA従来の手順に従って承認を考慮した製品と比較して、FDA RMAT指定 または他の迅速な審査計画指定を受けることは、より速い開発プロセス、審査または承認をもたらすことができず、FDAの最終承認を保証することもできない可能性がある。
私たちの候補製品を人体に使用することによってリスクにさらされる可能性があり、私たちの保険は出現可能なクレームをカバーするのに十分ではない可能性がある重大な製品責任クレームと訴訟に直面する可能性があります。
私たちの業務は私たちを細胞治療製品のテスト、加工とマーケティング過程に固有の潜在的な製品責任リスクに直面させます。このような責任クレームの弁護コストは非常に高く、私たちに対する重大な判決を招く可能性があります。著者らは人体臨床試験において、現在と未来の候補製品のテストに関連する固有の製品責任リスクに直面しており、もし私たちの製品が承認されれば、より大きな商業販売リスクに直面する。長い間、候補製品が広く使用されていないため、セキュリティデータは限られている。細胞治療会社はヒト細胞源から候補製品を製造する原材料を獲得したため、製造過程と処理要求は広く、これは品質故障とその後の製品責任クレームのリスクを増加させた。
| 50 |
候補製品brを商業化する前に、私たち は私たちの臨床試験をカバーし、保険範囲を増やすのに十分な保険範囲を維持する必要があるだろう。私たちの臨床試験期間または商業化後のいつでも、このような状況が発生した場合、私たちは十分な保証範囲または根本的にできない製品責任保険を受け入れられないか、または私たちに対するクレームが私たちの保証範囲を大幅に超えた場合、私たちの財務状況は深刻な損害を受ける可能性がある。
私たちが最終的に出現する可能性のあるどの製品責任訴訟で勝訴するかどうかにかかわらず、このような訴訟は私たちの大量の財務と管理資源を消費し、私たちの製品に対する需要を減少させ、私たちの名声を損なう可能性がある。
我々は,エラーや見落とし,役員や上級管理者,労働者補償,その他の保険を我々の業務活動に適していると考えられるレベルに維持することを求めている.しかし、もし私たちがこの保険の範囲を超えたクレームや私たちの保険の範囲を超えたクレームを受け、クレームが成功した場合、私たちは私たち自身の限られた資源からクレームを支払うことを要求されます。これは私たちの財務状況、運営、および業務結果に重大な悪影響を及ぼす可能性があります。さらに、責任やいわゆる責任は、私たちの経営陣の関心や資源を分散させ、私たちの名声を害し、それによって私たちの業務を損なう可能性があります。
我々のbr内部コンピュータシステム、または我々の臨床研究者、臨床研究組織または他のbr}請負業者またはコンサルタントが使用することが予想されるコンピュータシステムは、故障またはセキュリティホールが発生する可能性があり、これにより、私たちの候補製品の開発計画が実質的に破壊される可能性がある。
私たちは情報技術システムに依存して財務記録を保存し、実験室と会社の記録を維持し、従業員と 外部の各方面とコミュニケーションを行い、その他の重要な機能を実行する。これらのコンピュータシステムの任意の重大な劣化または障害は、我々の計算の不正確またはデータ損失をもたらす可能性がある。セキュリティ対策が実施されているにもかかわらず、これらの内部コンピュータシステムおよび我々の臨床研究者、臨床研究組織および他の請負者およびコンサルタントが使用するコンピュータシステムは、コンピュータウイルス、許可されていないアクセス、自然災害、テロ、戦争、および電気通信および電気故障の破壊を受けやすい。犯罪者や外国政府がこれらのコンピュータシステムを攻撃するために使用される可能性のある技術は非常に複雑で、変化が頻繁で、規制の少ない世界の遠隔地から来ているかもしれない。これまで,このようなシステム障害,情報盗難,事故やセキュリティホールは経験していないが,このような事件が発生して我々の運営が中断されると,われわれの臨床開発活動が実質的に中断される可能性がある。例えば、歴史或いは未来の臨床試験における臨床試験データの紛失は監督管理の承認作業の遅延を招く可能性があり、データの回復或いは複製のコストを著しく増加させる。もし、任意の中断、情報の盗難、またはセキュリティホールにより、データまたはアプリケーションの損失または破損、または不適切な機密または独自の情報漏洩が原因である場合、私たちは責任を招く可能性があり、私たちの候補製品の臨床開発および将来の開発は を遅らせる可能性がある。
| 51 |
国際市場での経営と販売はリスクが大きい。
私たちは国内と海外市場で私たちの製品とサービスを普及させるつもりです。国際取引には多くの危険がある。私たちの製品やサービスをアメリカ以外の管轄地域でマーケティングできるようにするためには、これらの国/地域で必要なbr規制の承認または許可を取得し、維持する必要があり、安全、製造プロセス、品質に関する特定の国/地域の法規を遵守しなければならない。これらの規定には、上場の承認または承認の要求が含まれており、FDAの規制計画とは異なる可能性がある。国際業務と販売はまた、政治的不安定、価格規制、貿易制限、関税変化の制限または妨害を受ける可能性がある。また、通貨レートの変動は、製品やサービス提供国の通貨で私たちの製品やサービスの価格を高め、私たちのサービスや製品の需要に悪影響を及ぼす可能性があります。
私たちが製品やサービスをマーケティングしようとしているすべての国/地域で規制の承認や許可を得る保証はありません。外国の規制の承認や許可を得たり維持したりする際に巨額のコストが発生しない保証はありませんし、異なる海外市場で私たちの製品やサービスを商業化することに成功する保証もありません。海外での私たちの製品やサービスの販売の承認または許可の受信を遅延させ、そのような承認または許可を得ることができなかったり、将来的に以前に受け取った承認または許可を失うことは、私たちの運営結果や財務状況に大きなマイナス影響を与える可能性があります。
私たちは個人や政府保険会社から製品やサービスの精算を得ることができず、私たちの製品やサービスの需要に悪影響を及ぼす可能性があります。
私たちの候補製品に対する市場の受け入れと販売は保険と精算政策と医療改革措置にかかっているかもしれません。処方保険に関する決定や、政府当局および第三者支払者(例えば、個人健康保険会社や健康維持組織)が私たちの候補製品のために支払った費用を患者に精算するレベルと、これらのbr支払者が私たちの候補製品のために直接支払うレベル(適用すれば)は、これらのbr製品の商業化に成功するかどうかに影響を与える可能性がある。私たちは私たちのどんな候補製品も精算されることを保証できない。私たちも保険範囲や精算金額が候補製品の需要や価格を下げない保証はありません。
保険や精算が得られない場合や、限られたレベルに限られていれば、製品を商業化することに成功できない可能性があります。2022年8月に可決された“患者保護·平価医療法案”(Patient Protection and Affordable Care Act,PPACAと略称)と、2022年8月に可決された“インフレ低減法案”、およびいくつかの医療費の制限または禁止、または薬品および生物製品の定価を政府の制御下に置くことを含む他の医療改革措置。また、多くの外国、特にEU諸国やEUでは、薬品や生物製品の定価が政府によって規制されている。もし私たちの製品が政府法規によって制限されたり、支払いが禁止されたり、あるいは私たちの製品の価格が政府によってコントロールされている場合、私たちは収入を創出し、利益を達成したり、製品を商業化することができないかもしれません。
| 52 |
また、第三者支払人は新薬と生物製品のカバー範囲と精算レベルを制限することが増えている。彼らはまた、厳格な事前許可要求を実施することができ、および/または承認された製品を医療 適応のために使用することを拒否する任意の範囲を実施することができるが、FDAが発売を許可した製品は除外する。したがって,第三者支払者が新たに承認された薬物や生物製品を患者に使用して費用を返済するかどうか,どれだけ賠償するかには大きな不確実性がある。もし私たちが候補製品のために十分な清算レベルを得ることができなければ、候補製品のマーケティングと販売に成功する能力は損なわれるだろう。
私たちの知的財産権に関するリスク
私たちは私たちの所有権を保護できないかもしれない。
私たちのビジネス成功は私たちの権利を保護する能力に大きくかかっているだろう。例えば、我々または我々の許可者の係属中の出願に基づいて任意の追加の特許が発行されることが保証されないか、または、発行された場合、そのような特許が再審査の対象とならないことが保証されず、競争優位性が提供されず、第三者の挑戦を受けることもなく、他の人の特許が我々の技術を採用した製品およびサービスの商業化を阻止しない保証もない。さらに, は,他の人が類似した製品やサービスを独立して開発したり,我々のいかなる製品やサービスを複製したり,我々が取得した任意の特許を中心に設計されていないことを保証することはできない.
私たちの商業的成功はまた私たちが他人に侵害特許を発行することを避ける能力にかかっているだろう。もし私たちが司法的に任意の第三者特許を侵害していると判定された場合、私たちは損害賠償金の支払い、私たちの製品、サービスまたはプロセスの変更、ライセンス取得、br、またはいくつかの活動の停止を要求される可能性があります。もし私たちが将来私たちのいくつかの製品および/またはサービスのために第三者からいかなる許可を得ることを要求されたら、もし本当にそうすれば、私たちが商業的に有利な条項でそうすることができる保証はありません。米国や外国の特許出願は直ちに公開されないため,我々が積極的に使用している技術 を他の人に付与した特許に驚く可能性がある。私たちは数年前に私たちと椎間板·脊椎計画この技術の修正および/または可能なさらなる開発は、初期FTOのカバー範囲内にない場合がある。私どものお客様にはFTOは行っておりません熱乾法茶色脂肪計画です。
私たちに発行または許可された任意の特許の所有権を強制的に執行または確認するため、または第三者の独占権の範囲と有効性を決定するためには、訴訟を行う必要があるかもしれないが、これは私たちに巨額のコストをもたらし、私たちの精力を移すだろう。もし私たちの競争相手 も私たちの技術的権利を持っていて、アメリカで特許出願を準備して提出すると主張した場合、私たちは、発明の優先度 を決定するために、米国特許商標局、特許庁、または外国特許庁によって発表された介入訴訟手続きに参加しなければならない可能性があり、これは、最終結果が私たちに有利であっても、大量のコストと仕事の分流をもたらす可能性がある。このような訴訟や介入手続きは、結果がどうであっても、高価で時間がかかる可能性がある。
異議、再審手続き、または妨害手続きによって私たちの特許に挑戦することに成功したことは、関連する司法管轄区域の特許権利喪失を招く可能性がある。もし私たちが他の側の特許に対する訴訟が成功せず、私たちが第三者の特許を侵害していると判断した場合、私たちは訴訟を受ける可能性があり、あるいは関連する司法管轄区域で潜在的なbr製品および/またはサービスを商業化することが阻止されるか、またはこれらの特許のライセンスを取得することが要求されるか、または代替br技術を開発または取得する可能性があり、いずれも私たちの業務を損なう可能性がある。さらに、私たちの特許権に対するこのような挑戦が私たちに有利な方法で解決できない場合、私たちは、新たな協力を延期または阻止したり、特定の製品および/またはサービスを商業化することを延期または阻止される可能性があり、これは、私たちの業務および運営結果に悪影響を及ぼす可能性があります。
| 53 |
さらに、知的財産権訴訟に関連する大量の発見により、私たちのいくつかの機密または敏感な情報は、訴訟発生時に開示によって漏洩する可能性がある。また,訴訟過程では,聴聞,動議や他の一時的な手続きや事態の発展の結果が公表される可能性がある.証券アナリストや投資家がこれらの結果がマイナスであると考えると、私たちの普通株の価格に重大な悪影響を及ぼす可能性がある。
特許に加えて、私たちは非特許の商業秘密とノウハウに依存している。私たちが将来計画しているいくつかの細胞関連の治療製品および/またはサービスはこの種類に属する可能性がある。私たちはまた、パートナー、従業員、コンサルタント、サプライヤー、コンサルタントと締結された秘密保護協定にある程度依存して、私たちのビジネス秘密およびノウハウの専門知識を保護します。Brがこれらの合意に違反しないことを保証することもできないし、私たちがいかなる違反行為に対して十分な救済措置を持っていることも保証できないし、私たちの非特許商業秘密とノウハウの専門知識が他の方法で競争相手に知られたり、独立して発見されないことを保証することもできない。
特許保護を取得または維持できなかったこと、商業秘密を保護できなかったこと、第三者が私たちの特許、商業秘密または独自の権利にクレームをつけること、または私たちが訴訟に巻き込まれることを含む私たちの特許、商業秘密または固有の権利に関する紛争に巻き込まれることは、ビジネスの他の側面に対する私たちの努力と注意を分散させ、私たちの運営結果および財務状況に大きな負の影響を与える可能性がある。
私たち はアメリカ以外の国で私たちの知的財産権を保護できないかもしれない。
米国以外の知的財産権法は不確定であり,多くの国/地域で現在審査·改正が行われている。ある国の法律は私たちの特許や他の知的財産権の保護の程度はアメリカの法律に及ばない。第三者 は,異議申立手続きを提起することにより,海外での特許付与に反対しようとすることができる。私たちが外国で提出した任意の特許出願に対する反対訴訟 は、米国で発行されたか、または承認されるべき対応する特許に悪影響を及ぼす可能性がある。私たちは、米国以外の国で発行されている私たちの特許または競争相手の特許の有効性を決定するために、訴訟手続きに必要または有用に参加することができる。これは大量のコストを招く可能性があり、 は私たちの精力と注意を業務の他の側面から移行させ、私たちの運営結果と財務状況に実質的な悪影響を及ぼす可能性がある。
米国特許法の変更 は我々の知的財産権に重大な悪影響を及ぼす可能性がある。
2011年に法律に署名した“ライシー·スミス米国発明法”(Leahy-Smith America Invents Act,略称AIA)は米国の特許法を大きく変えた。法律の意味を決定するのに時間がかかるかもしれないが、それは単に下級裁判所、連邦巡回控訴裁判所、および最高裁判所によって解釈されるからである。これらの決定の効果はまだわからない。1つ目の大きな変化は,友邦保険が米国の特許制度を“先発明”制度から“先出願”制度に変更したことである。現在、最初の出願システム が発効し、別の会社はほぼ同じ時間に同じまたは同様の特許を独立して開発し、 を取得し、私たちの代わりに特許を取得する可能性がある。さらに、第2の大きな変化について、友邦保険は、干渉プログラムを廃止し、以前の出願で指定された発明者が指定された発明者から特許請求の範囲の発明を派生させた全ての場合に、干渉プログラムを提起する期間が満了していない場合に干渉プログラムを置換するための派生プログラムを確立した。現在派生プログラムが発効しており、どの未解決特許出願の発明権も派生理由で挑戦される可能性がある。 の3つ目の主な変化は、友邦保険が許可された異議申立手続を確立し、発効後に提出された特許出願にのみ適用されることである。付与後の反対は,非特許所有者が特許付与後9ヶ月以内に特許庁に訴訟を提起することができ,特許が無効にキャンセルされる可能性がある。友邦保険に加えて、最近の裁判所判決は、特許を取得し、維持する能力にも不確実性をもたらしている。したがって、私たちの任意の特許が付与されると、付与後に反対される可能性があり、これは、新たに付与された任意の特許の有効性の不確実性を増加させるか、または最終的に特許がキャンセルされる可能性があるというリスクがある。
| 54 |
また、最高裁は最近、何が特許出願可能なテーマを構成するのかについてより制限的な立場をとっている。したがって、以前に特許を出願可能な発明をカバーする多くの特許は、現在、非法的標的とみなされ、現在無効とされている発明をカバーするように決定されている。連邦巡回控訴裁判所のこの意見とその後の意見により,特許庁は現在,特許出願中の権利要求により厳しい制限を加え,従来特許を得ることができると考えられていた技術分野での特許付与を拒否している。そのため,我々の製品をカバーする特許が得られないリスクがあり,このような特許が付与されれば,その後これらの特許が無効であることが発見される可能性がある.
特定の国/地域では、特許所有者は、その国の将来の任意の収入に重大かつ有害な影響を及ぼす可能性がある強制許可の付与を要求される可能性がある。
ヨーロッパのいくつかの国/地域を含む多くの国/地域には,強制許可法があり,これらの法律により,特許権者はライセンス を第三者に強制的に付与される可能性がある。また、ほとんどの国では、特許の政府機関や政府請負業者に対する強制執行を制限している。 これらの国では、特許権者は金銭救済に限られている可能性があり、侵害を禁止できない可能性があり、特許の価値を実質的に低下させる可能性がある。直接立法や国際イニシアティブにより,救命製品の強制許可は発展途上国でも一般的になってきている。このような強制許可は私たちの候補製品に拡張することができ、これは私たちの候補製品がもたらす可能性のある任意の未来の収入を含む、私たちの潜在的な収入機会を制限するかもしれない。
政府規制に関するリスク
もし私たちが候補製品のために規制されて承認されたとしても、私たちの製品は監督されるだろう。
私たちが監督部門の承認を得た候補製品は、製造、ラベル、包装、貯蔵、広告、販売促進、記録保存、および安全および他の上場後の情報の提出に関する持続的な規制要求の制約を受ける。私たちの候補製品のために得られた任意の規制された許可は、REMSまたは外国司法管轄区と同等の機関である上場許可条件(Br)に加えられる特定の義務、製品がどのような承認された指示用途に使用できるかの制限または承認条件、またはコストの高い上場後の試験要件を含む可能性があり、 は第4段階の臨床試験、および製品の品質、安全性および有効性を監視する監督を含む。例えば、米国では、承認された新薬出願またはNDAまたはBLAの保持者は、NDAまたはBLAにおける仕様を満たすために、不良事象および製品の任意の障害を監視および報告する義務がある。承認されたセキュリティプロトコルまたはBLAの所有者はまた、承認された製品、製品ラベル、または製造プロセスをいくつかの変更することができるように、新しいまたは追加の出願を提出し、FDAの承認を得なければならない。広告と販売促進材料は“連邦食品、薬品と化粧品法”あるいは“連邦食品、薬品と化粧品法”(FDCA)と実施条例に符合し、FDA監督と発売後の報告義務の制約、その他の適用可能な連邦と州法律を受けなければならない。
| 55 |
さらに、製品製造業者およびその施設は、申請および計画費用を支払い、cGMP要件に適合し、NDA、BLAまたは海外マーケティング申請で行われた約束を遵守することを確実にするために、FDAおよび他の規制機関の持続的な審査および定期検査を受ける必要がある可能性がある。もし私たちまたは規制機関が製品に以前に未知の問題があることを発見した場合、 例えば、意外な深刻性または頻度の不良事象、または製品生産施設の問題、または規制機関が私たちの製品の販売促進、マーケティングまたはラベルに同意しない場合、規制機関は、市場からの製品のリコールまたは撤回またはbr}の生産停止を要求することを含む制限を適用する可能性がある。
もし私たちが承認された後、任意の候補製品に適用される規制要求を遵守できなければ、規制機関はできる
| ● | 私たちが法律に違反していると主張する警告または無タイトルの手紙を出す | |
| ● | 禁令または行政、民事または刑事罰または罰金を求める | |
| ● | Brを一時停止するか、規制承認を撤回するか | |
| ● | 現在行われている臨床試験を一時停止します | |
| ● | 私たちまたは私たちの戦略パートナーが提出した待機BLAまたは同様の海外マーケティング申請(またはその任意の追加)を承認することを拒否する; | |
| ● | 製品の販売や製造を制限する | |
| ● | 製品を差し押さえたり、差し押さえたり、製品を市場から撤回またはリコールすることを要求または要求する他の方法で; | |
| ● | 製品の輸入や輸出を拒否します | |
| ● | その製品の自主的なリコールを要請して発表する;または | |
| ● | Brを拒否することは、政府契約を含めて私たちが供給契約を締結することを許可する。 |
| 56 |
どの政府の法執行行動や違法行為の疑いのある調査にも、対応するために多くの時間と資源 を必要とする可能性があり、否定的な宣伝が生じる可能性がある。上記のいずれの事件や処罰が発生しても、候補製品を商業化する能力を抑制し、私たちの業務、財務状況、運営結果、および将来性に悪影響を及ぼす可能性があります。
私たち は連邦と州医療詐欺と乱用法律、虚偽申告法および健康情報プライバシーと安全法律の制約を直接または間接的に受ける可能性がある。もし私たちがこのような法律を遵守できないか、または完全に遵守できなければ、私たちは巨額の処罰に直面するかもしれない。
米国では、医薬品および生物製品の研究、製造、流通、販売および普及は、FDA、医療保険および医療補助サービスセンター(CMS)、他の部門の衛生·公衆サービス部(HHS)(例えば、監察長事務室)、米国司法省br連邦検事事務室、連邦貿易委員会、および州と地方政府を含む様々な連邦、州、地方当局の規制によって規制されている。私たちの業務は、連邦リベート法(AKS)、連邦民事および刑事虚偽請求法案(FCA)、医師支払いbr陽光法案、および他の国/地域の法規および同様の条項を含む様々な連邦および州詐欺および乱用法律法規を直接または間接的に通過します。また、私たちは連邦政府と私たちが業務を展開している州の患者プライバシー法の制約を受けるかもしれない。
州と連邦規制·執行機関は医療法律法規違反行為を積極的に調査し続け、米国議会は法執行ツールの武器庫を強化し続けている。例えば、2018年の両党予算法は、AKSを含むある連邦医療保健法違反に対する刑事と民事処罰を増加させた。法執行機関 もこれらの法律に基づいて新たな責任理論を求め続けている。政府機関は最近、製薬会社が支援または賛助するプロジェクトに対する監督審査や法執行活動を強化し、費用精算と自己負担支援、独立慈善基金会、その他の患者に福祉を提供するプロジェクトを援助している。このようなプロジェクトに対するいくつかの調査は重大な民事と刑事和解につながった。
これらの法律の広さと、法定例外と利用可能な安全港の狭さのために、私たちのいくつかの商業活動は、1つ以上のそのような法律の挑戦を受けるかもしれない。私たちの業務が上記の任意の法律または私たちに適用される任意の他の政府法規に違反していることが発見された場合、民事および刑事罰、損害賠償、罰金、連邦医療保険や医療補助などの政府医療計画から除外され、監禁br、および私たちの業務を削減または再構築することを含む罰を受ける可能性があり、これらは、私たちの業務運営能力および私たちのbr運営結果に悪影響を及ぼす可能性があります。私たちがこれらの法律に違反していると判断されなくても、政府のこれらの問題の調査には通常、大量の資源がかかり、マイナスの宣伝が必要であり、これは私たちの財務状況を損なう可能性があり、私たちの経営陣の業務運営に対する注意をそらす可能性がある。
| 57 |
また,臨床試験を含めて外国司法管轄区で業務を展開することを決定した場合,1977年の“米国反海外腐敗法”や“海外腐敗防止法”を遵守する必要がある。“海外腐敗防止法”は、その子会社、第三者請負業者、流通業者、コンサルタント、従業員を含む会社を禁止し、業務を獲得または強化する目的で、腐敗方式で外国人官僚に贈賄または外国人官僚への贈賄を行う。法律によると、“外国人役人”は、政府の実体によって運営される衛生システムの従業員を含む。“海外腐敗防止法”では、具体的な記録保存と内部会計制御も確立されている。“海外腐敗防止法”違反は民事処罰や刑事起訴を招く可能性がある。“海外腐敗防止法”を守らないことは私たちの業務に悪影響を及ぼすだろう。
“海外腐敗防止法”に加えて、各国の外国政府の法律法規を遵守する必要があり、これらの国では、私たちが設立する可能性のあるどの治療センターもこれらの国/地域に位置し、製品も流通·販売される。これらの法規の複雑さはそれぞれ異なり,米国FDAの法規と同様に厳しく,場合によってはさらに厳しいかもしれない。最近世界各国で新しい幹細胞および細胞治療法規が起草および/または実施されているため、これらの新しいおよび新興法規の応用およびその後の実施はほとんど例がない。したがって、 は現在、各国/地域の複雑性と厳格性が常に正確に理解されているわけではなく、これは国際規制プロセスにより大きな不確実性をもたらしている。さらに、法律法規の実施、改正、および/または再解釈が私たちの業務に悪影響を与えないことは保証されない。同様に,このようなすべての医療法律や法規の遵守を維持するために資源を持つことができるかどうかは保証されない。このような医療法律および法規を遵守できなかったこと、およびそのようなコンプライアンスまたはそのような医療法律および法規の実行に関連するコストは、私たちの運営に重大な悪影響を及ぼすかもしれないし、私たちの運営を再構成したり、収益運営の能力を弱める必要があるかもしれない。
私たちは現在と未来の従業員、コンサルタントと顧問、そして私たちの未来の主要な調査者、医療機関と商業パートナー は規制基準と要求を守らないことを含む不当な行為或いはその他の不当な活動に従事する可能性がある。
私たちbrは、現在および未来の従業員、コンサルタント、コンサルタント、主要な調査者、医療機関および商業パートナー(契約実験室を含む)およびCROの詐欺または他の不適切な行為のリスクに直面している。これらの当事者の不正行為は、FDA法規または他の司法管轄区域に適用される法規を故意に遵守しないこと、FDAおよび他の規制機関に正確な情報を提供すること、米国および海外の医療詐欺および法律法規の乱用、財務情報またはデータを不正確に報告すること、または不正な活動を開示することを含むことができる。
私たちのbrは現在できないし、将来は私たちの候補製品研究、臨床前と臨床前テストおよび候補製品製造のすべての方面を独立して行わないかもしれない。CRO、医療機関、契約実験室を含む第三者に依存して、私たちが行っている臨床前および臨床プロジェクトのデータを監視し、管理していれば、私たちは引き続き彼らのbr活動が適用された研究案、法律、法規、科学基準に従って行われることを確保する責任を負います。私たちと私たちの第三者サプライヤーは、FDA、EU、および同様の外国当局によって、私たちの臨床開発されたすべての候補製品に対して実行されるすべての法律および法規のセットである現在のcGMP、GCPおよび良好な実験室仕様またはGLP要件を遵守することを要求されるであろう。
| 58 |
また、医療保健業界の販売、マーケティングと業務手配は、詐欺、不当行為、リベート、自己取引とその他の乱用行為を防止するための広範な法律法規の制約を受けている。これらの法律法規は、広範な価格設定、割引、マーケティングおよび販売促進、販売手数料、顧客インセンティブ計画、および他の業務手配を制限または禁止している。このような不正行為はまた、臨床試験中またはFDAまたは他の監督管理機関との相互作用の過程で得られた情報の不適切な使用に関連する可能性があり、これは監督部門の制裁を招き、私たちの名声に深刻な損害を与える可能性がある。
従業員や第三者の不正行為を検出して防止するための予防措置は、未知または未管理のリスクや損失を効果的に制御できない可能性があり、またはこれらの法律や法規を遵守できないことによる政府の調査や他の行動や訴訟から私たちを保護することができないかもしれません。 もし私たちにこのような訴訟を提起し、私たちが自分たちの権利を弁護したり、維持することに成功しなかったら、これらの行動は、巨額の罰金または他の制裁を加えることを含む、私たちの業務、財務状況、運営結果、および見通しに大きな影響を及ぼすかもしれない。
私たちの細胞治療製品候補製品は規制部門の承認を得られず、私たちの業務と将来性に実質的な悪影響を与える可能性がある。
Br日まで、私たちは規制部門の許可を得ていません。どの司法管轄区でも私たちの任意の候補製品を販売します。私たちが私たちの細胞治療製品候補製品の承認を求める場合、私たちは、その安全性と有効性を支持する広範な臨床前および臨床データ、ならびに製造プロセスに関する情報をFDAおよび可能な他の規制機関に提出し、私たちの製造施設または他の契約製造施設に対してbr}検査(使用など)を行うことを要求される。FDAおよび他の規制機関によって承認されたプロセスコストが高く、一般に数年を要し、多くのリスクおよび不確実性の影響を受け、特に我々の電池ベースの候補製品のような複雑および/または新規な候補製品である。規制承認要求、政策、または裁判所の判断の変化は、承認の遅延や申請の拒否を招く可能性があり、我々の競争相手が規制承認を得て市場に参入しやすくするか、または競合他社がFDAの承認を得ることなく市場に参入することを可能にする。最終的に、FDAおよび他の規制機関は、承認中にかなりの自由裁量権を有し、任意の申請を拒否することができ、または追加の臨床前、臨床または他の研究を提出することなく、私たちの候補製品データが承認を得るのに十分ではないと決定することができる。また、臨床前と臨床試験から得られたデータに対する機関の異なる解釈は監督管理部門の候補製品の承認を延期、制限或いは阻止する可能性がある。私たちの候補製品に対する規制機関の承認を得る際に遭遇するどんな困難や失敗も、私たちが製品販売を作る能力に重大な悪影響を及ぼす可能性があり、任意の協力パートナーを検索することをより困難にする可能性があります。同様に、私たちが最終的に得たどんな規制承認も制限されたり、制限されたり、承認された後に約束された制約を受けたりして、承認された製品が商業的に実行できないようにする可能性がある。
| 59 |
もし私たちが法規と公認された基準に基づいて臨床研究を行うことができない場合、私たちはFDAと他の規制機関の私たちの候補製品に対する規制の承認を受けるのを遅延させるかもしれない、あるいは永遠に受け取らないかもしれない。
私たちの候補製品をアメリカと海外で市場承認を得るためには、他の要求に加えて、候補製品が安全であることをFDAおよび他の規制機関に証明し、承認を求める各適応に有効であることを証明するために、十分な と良好な制御の臨床試験を完了しなければならない。もしFDAが試験に参加している患者が行っている臨床試験中に深刻な不良事件が発生するなどの原因により、不合理な重大な疾病或いは傷害リスクに直面することを発見した場合、FDAは著者らの1つ或いは複数の臨床試験を一時停止することができる。もし安全問題が発生したら、私たちは、あるいはFDAや機関審査委員会が、完成する前に影響を受けた試験を停止することを要求するかもしれない。
私たちの臨床試験の完成もまた、以下のことを含む多くの他の原因で遅延または終了する可能性がある
| ● | 第三者臨床研究者は予想スケジュール或いは臨床試験方案に従って臨床試験を行っておらず、FDAとその他の法規要求の良好な臨床実践、或いは他の第三者は適時或いは正確にデータ収集と分析を行っていない | |
| ● | FDAまたは他の規制機関は、臨床試験サイトの検査に対して違反を発見し、1つまたは複数のサイトを一時停止または終了するか、またはマーケティングアプリケーションをサポートするためのデータの一部または全部の使用を禁止する修正措置をとることを要求する |
| ● | FDAまたは1つまたは複数の機関審査委員会は、研究場所の試験を一時停止または終了するか、または他の対象者の登録を禁止する。 |
われわれの臨床試験に重大な遅延が生じた場合,あるいは修正,一時停止,中止,あるいは臨床試験の重複が要求されると,われわれの開発コストが増加する。もし私たちが臨床試験を正確に行うことができなければ、私たちは決して監督部門の許可を得ず、私たちの候補製品 を市場に出すことができないかもしれない。
医療会社はずっと連邦と州調査の対象であり、私たちは未来に調査されるかもしれない。
連邦と州政府機関は民事と刑事法執行を強化した。ヘルスケア会社とその幹部やマネージャーに対する調査はまだ行われている。また,連邦FCAに対する改正案は,医療改革立法を含め,個人当事者を容易にするりっぱな担い手“(または通報者)br社に対する訴訟は、これらの訴訟によれば、告発者は、政府に支払われた任意の金から一定の割合の収入を得る権利がある可能性がある。FCAは、 部分規定は、虚偽のbrまたは詐欺的な連邦政府支払い要求の提出を意図的に提出するか、または虚偽の陳述を行うか、または虚偽記録を使用してクレームを承認させた任意の個人またはエンティティに対して訴訟を提起することができると規定している。政府の立場は,連邦AKS,スターク法や他の医療保健関連法律に違反するクレームは,FDAが施行した法律を含めてFCA違反とみなされる可能性がある。処罰には,虚偽クレームごとに巨額の罰金を科すこと,連邦政府がその個人または実体の行為および/または連邦医療保険や医療補助計画から除外されたことによる損害賠償金額の3倍が含まれる。しかも、ほとんどの州は似たような州密告者と虚偽請求条項を採用している。
私たちは私たちの施設や管理に関するどんな政府調査も知らない。私たちは適用された政府の医療法律や法規を遵守していると信じていますが、将来私たちの業務や役員に対するどんな調査も、私たちの巨額のコストを招き、重大な責任や処罰、そして私たちの名声を損なう可能性があります。
| 60 |
それは、政府、個人健康保険会社、および第三者支払者が、私たちのサービスに関連する治療および製品の保険をどの程度承認するか、または精算を提供するかどうかを決定しない。米国連邦医療保険、医療補助、その他の連邦医療保健計画資金の減少により、このような精算の獲得性はさらに制限される可能性がある。
医療提供者が我々の製品や療法の保険や精算を受けることができなければ,その患者にこのような製品や療法を提供しないことを選択することができるため,我々のサービスを必要としない可能性がある。また,医療業界のコスト抑制圧力の増加に伴い,政府や個人支払者は,医療提供者への精算金額を制限するための戦略をとる可能性がある。
同様に,米国の管理型ヘルスケアとヘルスケアサービスバンドル定価の傾向は,br}医療製品やサービスの購入に著しく影響する可能性があり,より低い価格と我々が開発している治療製品への需要減少を招く可能性がある。
私たち は連邦医療保険などの連邦医療計画から直接あるいは間接的に収入を得ることが可能である。連邦医療計画brは,遡及料率調整を含む保険と精算規則やプログラムの変更の影響を受ける。これらの意外な状況は、このような計画がカバーするサービス範囲または直接的または間接的に私たちの製品およびサービスのために支払われる販売率を大幅に減少させる可能性がある。もしどんな医療改革も、私たちが開発している治療製品ではなく、他の治療法を精算する傾向がある場合、このような改革は私たちのサービスを販売する能力に影響を与える可能性があり、これは私たちの収入に実質的な悪影響を及ぼす可能性がある。
個人や政府支払者が提供する精算制限は、私たちの製品やサービスへの需要を減らしたり、その価格を下げたりする可能性があり、これは私たちの収入に実質的な悪影響を及ぼす可能性があります。将来的には、医療業界や第三者保険や精算に関連する他の法律や法規が公布される可能性があり、これは私たちの製品やサービスの販売収入に悪影響を及ぼす可能性があります。
また、近年、Medicare、Medicaid、他の連邦医療計画の全体的な資金は減少傾向にあります。br}政府計画資金の減少は、政府や個人支払人によって精算された製品やサービスと関係があるため、私たちのサービス需要に悪影響を及ぼす可能性があります。
アメリカの医療改革の意外な結果は私たちの業務に悪影響を及ぼすかもしれない。
政治、経済、規制の影響を受けて、医療産業は根本的な変化を経験している。米国では“PPAA”が2010年にオバマ政権の下で署名されて法律となった。全面的な改革を実施することにより,この法律は他を除いて未加入者が医療保健を獲得する機会を増やし,経済における医療支出の上昇を抑制することを求めている。
| 61 |
また、PACAが公布されて以来、他の立法改正も採択された。これらの変化には、2013年4月に施行された各会計年度に提供者に支払われるMedicare総額が2%減少し、2018年の両党予算法案の成立後、国会が追加的な行動を取らない限り、2030年まで有効になることが含まれている。2013年1月、総裁·オバマ氏は“2012年米国納税者救済法” を法律に署名し、いくつかの提供者への医療保険支払いをさらに減少させ、政府が提供者に多額の支払いを取り戻す訴訟時効を3年から5年に延長した。国会 その後、予算赤字を削減する立法の一部として、薬品や設備の医療保険精算をさらに削減することを考えています。 似たような立法は未来に公布されるかもしれない。薬品,設備,サービスをどのように保険·精算するかを決定する“連邦医療保険条例”や“解釈的決定”も変化する可能性がある。これらの法律,法規,解釈的決定は連邦医療保険や他の医療資金のさらなる減少を招く可能性があり,これは我々の業務に影響を与える可能性がある。
2022年8月、総裁·バイデンは、(I)政府はFDA承認日から9年(小分子薬)または13年(生物製品)を超える部分高コスト連邦医療保険D部分(2026年から)と連邦医療保険B部分(2028年から)に価格を設定または協議することができ、(Ii)メーカーは連邦医療保険D部分とD部分薬品価格がインフレよりも速い場合、2022年から連邦医療保険D部分薬と2023年連邦医療保険B部分薬のリベートを支払い、br}とする“インフレ低減法案”に署名した。そして(Iii)連邦医療保険D部分を再設計し,現在のカバーギャップ条項の代わりに,2025年から連邦医療保険受益者の自己負担上限費用に2,000ドルの上限を設定し,メーカーがコストの10%,最高 2,000ドルの上限を担当し,上限に達すると20%とした。アイルランド共和軍の実施は規制当局が間もなくとる行動によって行われると予想され、行動の結果はまだ確定していない。
ヘルスケアが将来とる可能性のある改革措置は,より厳しいカバー基準と精算削減につながる可能性がある。コスト抑制措置や他の医療改革を実施することは、私たちの収入の創出、利益の実現、あるいは私たちの候補製品 の商業化を阻止する可能性がある。PPACA、IRA、および/または将来発行される追加の立法または法規下の法執行措置が私たちの業務にどのように影響するかを予測することは難しい。PPACA、IRA、および/または将来発行される追加の立法または法規がこのような意外な結果または間接的な影響をもたらす場合、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
EUの競争相手であるbr社または病院は、EUが個別の患者のための許可されていない薬品の販売を許可するルール を利用して、マーケティング許可なしに競合製品を販売することができる可能性がある。
EU薬品規則は個別加盟国がマーケティング許可なしに薬品を供給することを許可し、br}の特殊な需要を満たすことを許可し、もし製品が医療保健専門家の規範 によって制定された真の能動的注文に基づいて提供され、個人がその直接個人責任の下で使用することができる。いくつかの国/地域では、これは、特定の患者または患者のグループを治療するための製品をEU以外の国で生産および輸入するのにも適用可能である。また、高度な治療薬が非通常ベースで調製され、個々の患者の医療処方に従って同じEU加盟国の病院で使用される場合、マーケティング許可は必要とされない。
| 62 |
これらの免除は、マーケティング許可を得ることなく、特にこれらの競合他社が関連EU加盟国に細胞処理施設を持っている場合、臨床試験費用を負担することなく、EUでの販売を可能にすることができる。同様に, のある病院はこれらのルールに基づいて私たちと競争できるかもしれない。
私たちの普通株に関するリスク
私たちは配当金を払いません。
私たち は過去に現金配当を行ったことがなく、現在も予見可能な未来に現金配当を行うつもりはない。私たちは収益(あれば)を保留し、私たちの業務の発展と拡張に資金を提供するつもりです。私たちの将来の配当政策は私たちの取締役会の決定権に依存し、将来の収益(あれば)、私たちの財務状況、資本要求、br}一般業務状況、その他の要素に依存します。したがって、私たちはどんな形の配当金が私たちの普通株の所有者に支払われるか保証できない。
私たちの普通株の活発な取引市場が続くという保証はない。
私たちのbr普通株はナスダックに上場しています。しかし、私たちの普通株の活発な市場が続くという保証はない。また、私たちの普通株には市商が存在しているにもかかわらず、これらの市商が引き続き私たちの証券で市場をしている保証はありません。あるいは私たちがコントロールできない他の要素は、彼らが私たちの証券に市を停止させることを招くことはありません。br証券は、購入と要約の見積もりを維持し、見積もりに従って合理的な数量の取引を行うことができ、様々な証券法や他の規制要求の制約を受けることができます。また,公開取引市場の発展と保守は意思のある買手や売手の存在に依存しており,これらの買手と売手の存在は我々やいかなる市商の制御範囲内にもない.市商は持続的な二国間市場を維持する必要はなく、限られた数の証券の実盤オファーを守るだけで、いつでも自由に実盤オファーを撤回することができる。市商であっても,我々の過去の運営損失や会社規模が小さいなどの要因は,我々の証券が予見可能な将来の発展に活発で流動性の強い市場を持つ保証がないことを意味する.私たちの証券に市場があっても、私たちは証券所有者 がその証券を任意の価格で転売できる保証はありません。
当社の普通株式未登録株式を保有する株主 は、当社は以前は“空殻会社”であったため、第144条の規定により、転売制限を受けなければならない
私たちは、以前は証券法第144条または第144条に規定されていた“幽霊会社”であったため、他の事項を除いて、取引法13条または“br}15(D)条を遵守し続け、取引法に基づいて米国証券取引委員会に必要なすべての定期報告を提出することができない。私たちの未登録証券は、このような要求を満たし続ける限り、規則144に従って販売することができないので、私たちは、提供されるサービスまたは任意の他の目的の代償として、このような要求を継続しない限り、将来的にコンサルタントまたは従業員に販売または発行される任意の未登録証券を、流動資金 がないであろう。したがって、私たちは私たちの運営に資金を提供し、現金ではなく私たちの証券で私たちのコンサルタントや従業員を支払うために融資を受けることがもっと難しいかもしれない。
| 63 |
私たちはすでにアメリカ証券取引委員会報告会社になるためにコストを増加させ続けています。
2002年のサバンズ-オクスリ法案、あるいはサバンズ-オクスリ法案、および米国証券取引委員会が実施した様々な関連規則は、会社管理のやり方の変更を要求し、上場企業の開示要求を普遍的に高めた。報告会社として、私たちの公開開示や他の義務によって、多くの法律、会計、その他の費用が発生しました。現在発効している米国証券取引委員会法規によると、財務報告に対する私たちの内部統制を確立し、評価し、報告する必要があります。報告会社に適用される無数の規制や関連するコンプライアンス問題を遵守するには、私たちの経営陣が多くの時間とエネルギーを投入する必要があると考えています。
材料br}私たちは財務報告の内部統制に欠陥があり、私たちの財務結果 を適時に正確に報告できないか、あるいは私たちの合併財務諸表に重大な誤報を招く可能性があります。
本年報の第9 A項(“制御及びプログラム”)が更に述べたように、著者らは財務報告内部制御の設計と動作に制御欠陥が存在し、重大な弱点を構成していることを発見した。重大な欠陥は財務報告の内部制御の欠陥であり、 あるいは欠陥の組み合わせは、私たちの合併財務諸表の重大なミス報告が合理的な可能性があり、適時に防止或いは発見できないようにする。私たちの実質的な弱点は以下の制御欠陥と関連がある
| ● | 公式的な政策と手続きの遵守が足りない |
| ● | 内部統制に関するリスク評価手続きが不足し、財務報告リスクをタイムリーに発見することができない |
| ● | 文書が形成された正式なプログラムおよび制御プログラムの十分な正式管理テストが不足し、日記帳分録および口座台帳の準備および審査の文書化制御を含む完全かつ正確な財務報告および開示を実現するために、制御措置の持続的な有効性を評価する時間がない。 |
上記の 欠陥が是正されないと、我々の年間 または中期連結財務諸表の1つまたは複数のアカウント残高または開示の誤った陳述を招く可能性があるので、これらの制御 欠陥は重大な弱点を構成していると考えられる。
我々の重大な弱点を解決するために、会計·財務者を増やし、新たな財務会計プロセスを実施した。我々は引き続き措置を講じ,我々の会計システム内で改善と制御を実施し,より多くの合格した会計と財務資源を雇用し,我々の会計と四半期および年度決算プロセスをさらに発展させることで,上記の重大な弱点を補うつもりである。これらのステップが完了し,十分な時間で効率的に動作するまで,これらの制御欠陥を修復することはできず,管理層はテストにより制御が有効に動作していると結論した.私たちの会計と独自システムおよび制御の再設計と実施の改善はコストが高く、時間がかかる可能性があり、修復コストは私たちの未来の運営結果に影響を与える可能性があります。
| 64 |
もし私たちが私たちの重大な弱点を補うことができなかった場合、将来の財務報告の内部統制における重大な弱点を見つけることができない場合、あるいは“サバンズ-オキシリー法案”を含む上場企業からの要求を満たしていない場合、私たちは私たちの財務業績を正確に報告できないかもしれないし、法律や証券取引所法規の要求期間内に財務業績を報告することができないかもしれません。“サバンズ-オキシリー法案”404条の規定を遵守できなければ、米国証券取引委員会や他の規制機関の制裁や調査を受ける可能性もあります。もし未来に他の重大な弱点が存在したり、発見されたりすれば、私たちはこのような重大な弱点を修復することができず、私たちの名声、運営結果、財務状況は影響を受けるかもしれない。
私たちの株価は大幅に変動する可能性があり、変動性が大きく、これは証券保有者が魅力的だと思っている数量、価格、時間を私たちの証券を転売することが困難になる可能性があります。
私たちの普通株の市場価格は大きく変動し、変動が大きい可能性があり、これはbr証券保有者が証券保有者が魅力的だと思っている数量、価格、時間に応じて私たちの証券を転売することを困難にする可能性がある。これらの“私たちの業務に関するリスク”、“私たちの細胞治療製品開発に関するリスク”、“私たちの知的財産権に関するリスク”、“政府規制に関するリスク”、“私たちの普通株に関するリスク”、“私たちのナスダック上場に関するリスク”など、多くの要因が私たちの株価や取引量に影響を与えます
株式市場は総じて、価格と出来高の変動が大きく、私たちの証券の市場価格は引き続きこのような市場変動の影響を受ける可能性があり、これらの変動は私たちの経営業績や見通しとは関係がないかもしれない。市場変動性と変動の激化 は我々証券の市場価格を大幅に下落させる可能性がある。
私たちの普通株は将来的に重大な発行や転売がある可能性があり、これは株主の所有権の利益を深刻かつ不利に希釈し、私たちの証券の市場価格に影響を与える可能性がある。
私たち は現在最大75,000,000株の普通株を発行する権利があり、2024年3月28日までに6,769,919株 が流通株を発行した。また、項目1(“業務-事業発展--2024年期間の重大事件”)で述べたように、1,351,580株の普通株式を追加発行することが義務付けられている。私たちは将来的に私たちの普通株式の追加株式を発行することに制限されません。転換可能、交換可能、または行使可能な普通株式を含む。また、1,398,158株B系列優先株が発行·流通している。場合によっては、このような株は同等の数の普通株に変換されることができる。
私たちが2021年11月に公開発売した証券によると、私たちはすでに株式承認証を発行して、合計2,645,000株の普通株 を購入しました(その中で株式承認証はすでに行使されて、合計1,675,000株の普通株を購入しました)及び引受業者 引受権証を購入して、235,970株の普通株を購入しました。我々は,証券法 により有効なS-3フォーム登録宣言を持ち,その等の株式の発行を登録した.S-3表登録宣言に基づいて発行可能な株式は公開市場で自由に取引でき、関連会社が保有する株式は除く。また、公開発売において、交換可能手形および株式承認証所有者との交換合意に基づいて、合計313,789株普通株およびbr引受権証を発行して、合計1,856,938株普通株(その中で株式承認証を行使して合計1,676,580株普通株を購入した)を発行した。このような所有者に発行された普通株は公開市場で転売する資格があり(関連会社の第144条出来高制限に適用されることに制限されている)、これは市場での販売増加や株価下落を招く可能性がある。私たちはこの等株式承認証を行使した後に発行可能な普通株式の再販売に登録しています。上記株式承認証を行使した後に普通株を発行することは、私たち株主の所有権を希釈します。
| 65 |
また、2024年2月、第1項(“業務-業務発展-2024年重大事件”)で議論された権利証の行使について、合計2,513,686株の普通株を購入するための引受権証を発行しました。この等株式証の基礎となる普通株の売却を登録する登録声明を米証券取引委員会に提出することに同意しました。
我々 はまた,証券法で規定されているS-8表の有効登録声明を持ち,我々の2021年株式インセンティブ計画や2021年計画(うち319,797株発行済み)によって発行可能な普通株総数3,850,000株を登録している.2024年3月28日現在、2021年計画により、3,401,608株を購入した我々の普通株のオプションが発行された。S-8表登録宣言 発行と発行可能な株式は公開市場で自由に取引可能であり,連属会社が保有する株式は除外する.当社は、アルストートおよびシルバさん(その他の関連会社)が保有するオプションを行使し、上述の RSUに帰属する場合に、それらに発行することができる株式のリコールを含むS-8表の2021年計画に関する登録説明書に含まれることができる。このような株式の転売は現在第144条に規定されている数量によって制限される。
また、証券法によると、有効なS-3表の棚登録声明があり、7500万ドルの株式と債務証券が登録されています。 S-3表の要求によると、私たちは現在、S-3表によって任意の12ヶ月の間に、総時価が非関連会社が持っている私たちの普通株の総時価の3分の1を超えない証券 を販売することができる。
相当な数の普通株または交換可能または行使可能な普通株に変換または行使可能な証券 は、将来の発行において我々の既存株主によって直接または二次市場であっても、 は、このような発行または転売が発生する可能性があると考えられているか、または将来的に私たちの普通株または証券 を発行または転売するために使用することができ、交換可能、または行使可能であると考えられる私たちの普通株の株式は、私たちの証券の市場価格と、将来的に魅力的な条項で株式または株式関連証券を発行して資金を調達する能力に重大かつ悪影響を及ぼす可能性があります。
また、私たちの取締役会は、株主のさらなる承認を必要とせずに18,456,842株の優先株を指定·発行する権利を有しており、当社の取締役会によって決定された権利と特典を含んでいます。様々な理由から、我々はまた、一般株よりも優先的な他の株式および株式関連証券を将来的に発行することができるが、これらに限定されないが、運営および成長をサポートし、将来の規制基準を遵守する任意の変化を含むことができる。
| 66 |
反買収条項と私たちが制約される可能性のある法規は、コントロール権の変更が私たちの証券保有者に有利であっても、第三者が私たちの支配権を得ることを難しくするかもしれない。
私たちはネバダ州に登録します。ネバダ州法律および当社の定款や定款における逆買収条項は、第三者が私たちに対する支配権を獲得することを難しくし、株主がその証券からプレミアムを得ることを阻止する可能性があります。私たちの会社登録証明書(Br)は、私たちの取締役会は、株主の承認を必要とすることなく、1つ以上のシリーズの最大20,000,000株の優先株を発行することができ、取締役会が適切と考える条項、特典、権利、特権を発行することができると規定しています。この20,000,000株の認可株式のうち、1,398,158株Bシリーズ優先株が発行·発行された。これらの規定や他の要因 は制御権の変更を阻害または阻止する可能性があり,制御権の変更が我々の他の株主に有利であるとみなされたり,このような が要求される.
私たちのナスダック上場に関するリスク
Brは保証できません。ナスダックの最低入札価格要求を守り続けることができます.
私たちの普通株の市場価格はナスダックの初期上場最低入札価格要求を満たしているにもかかわらず、私たちの普通株の市場価格はこの要求を守り続けるために必要な1株1.00ドルのレベルを維持することは保証されません。マイナスの財務や運営業績のような多くの要素があり、私たちの普通株の市場価格に悪影響を与え、ナスダックの最低入札価格要求を維持する能力を危うくする可能性があります。
我々普通株の市場価格は機関投資家を含む新投資家を引き付けることができない可能性があり、これらの投資家の投資要求を満たすことができない可能性もある。したがって、私たちの普通株の取引流動性は改善されないかもしれない.
我々はナスダックの上場が機関投資家を含むより大きな、より広範な投資家の興味を刺激すると信じているが、 はこの点では保証されない。しかも、私たちの普通株の市場価格がこのような投資家の投資要求を満たすという保証はない。したがって、私たちの普通株の取引流動性は必ずしも改善されるとは限らない。
| プロジェクト 1 B. | 未解決 従業員意見. |
は適用されない.
| プロジェクト 1 C. | ネットワーク·セキュリティ. |
我々 は,敏感な情報の保護,運営の弾力性の維持,利害関係者の利益の保護におけるネットワークセキュリティの重要性を認識している.
| 67 |
我々はネットワークセキュリティ政策を策定しており、組織全体のネットワークセキュリティリスクを識別、評価、緩和、対応し、ネットワークセキュリティ脅威によるリスクを含む重大なリスクを評価、識別、対応するためのプロトコルを実施している。この戦略は、標準的な流量監視ツールを使用して、訓練者が異常活動を識別および報告し、信頼性のあるサービスプロバイダと協力して、安全基準が私たち自身の基準以上であることを保証することを含むだろう。
これらの 措置は,我々のより広範な運営リスク管理の枠組みに統合され,我々の運営における不要なリスク を最大限に削減することを目的としている.ネットワークセキュリティについては,コンサルタントや第三者サービスプロバイダと協力し,我々のシステムにおける潜在的な脅威や脆弱性を識別し緩和するための業界標準 戦略を実施している.また,政策戦略 は,深刻なセキュリティイベントを管理し,組織全体の効率的な協調 を確保するための包括的なネットワークセキュリティ危機対応計画を策定する.
ネットワークセキュリティ脅威は我々の運営に大きな影響を与えず,このようなリスクは我々の業務,戦略,財務状況や運営結果に実質的な影響を与えないと予想される.しかし、ネットワークセキュリティの脅威がますます複雑になっていることを考慮して、私たちの予防的な措置はいつも十分ではないかもしれない。入念に設計された制御措置が制定されているにもかかわらず、私たちはすべてのセキュリティホールを予見できないことを認め、 第三者の人工知能技術の濫用による脆弱性と、適時な予防措置の実施における潜在的な挑戦を含む。Br第1 A項(“リスク要因-我々の内部コンピュータシステム、または私たちの臨床研究者、臨床研究組織または他の請負者またはコンサルタントが使用すると予想されるシステムは、故障やセキュリティホールに遭遇する可能性があり、これにより、私たちの候補製品の開発計画が実質的に破壊される可能性があります。 ”)私たちが直面する可能性のあるサイバーセキュリティ攻撃に関するリスクに関するさらなる洞察。
私たちの最高財務官は、ネットワークセキュリティ計画と私たちのネットワークセキュリティイベント応答プロセス を含む、私たちの情報セキュリティ計画を監視します。取締役会の監査委員会はネットワークセキュリティリスク管理活動を監督し、管理職、取締役会、外部顧問の支持を得ている。我々は潜在的な影響に基づいてリスクを評価し、リスク優先度を決定し、技術制御を実施し、 と第三者サプライヤーの安全実践を監視する。
| 第 項2. | 特性. |
私たちの主な実行オフィスと研究室はニューヨーク州メルヴェルマーカス通り40番地Suite Oneにあります。2024年12月に満期になった賃貸契約によると、私たちは6,800平方フィートの空間を占めています。レンタル契約は現在の年間基本レンタル料は173,060ドルと規定されています。私たちのオフィスは私たちの現在の運営需要を満たすのに適しています。
| 第 項3. | 法的手続き . |
ない。
| 第 項. | 鉱山 安全情報. |
は適用されない.
| 68 |
第 第2部分
| 第 項5 | 登録者普通株,関連株主事項及び発行者が株式証券を購入する市場. |
市場情報
私たちの普通株の取引は現在ナスダック資本市場でBRTXコードで報告されています。
所持者
2024年3月28日現在、352人の私たちの普通株の記録保持者がいる。
配当をする
は適用されない.
最近販売されている未登録証券
ない。
発行者は株式証券を購入する
ない。
| 第 項6. | [保留されている] |
| 第 項7. | 経営陣の財務状況と経営結果の検討と分析. |
以下、BioRestorative Treatures,Inc.2023年12月31日現在、2023年12月31日および2022年12月31日まで、および2022年12月31日現在、2023年および2022年までの総合運営結果および財務状況の検討および分析は、我々の財務諸表および本年度報告書第16項の他の部分に含まれる財務諸表の付記(“Form 10-K要約”)と共に読むべきである。本“経営陣の財務状況と経営結果の議論と分析” 中の“私たち”、“私たち”、“私たち”と類似した用語はBioRestorative Treatures,Inc.を指す本年度報告 は連邦証券法で定義された前向き陳述を含む。本年度報告書に含まれている展望的陳述に記載されている事件は起こらないかもしれない。一般に、これらの陳述は、業務計画または戦略、我々の計画または戦略の予想または予想収益または他の結果、我々が行う可能性のある買収の予想または予想収益、予想収入、収益、または私たちの経営業績に関連する他の態様の予測に関するものである。“可能”、“将”、“br}”、“予想”、“信じる”、“予想”、“プロジェクト”、“計画”、“予定”、“推定”および“継続”およびそれらの対義語および同様の表現は、前向き陳述を識別することを意図している。私たちは、これらの陳述が未来の業績や事件の保証ではなく、多くの不確実性、リスク、および他の影響を受けることを想起させ、その多くは私たちが制御できないことであり、これは陳述の正確性と陳述の根拠となる予測 に影響を与える可能性がある。本年度報告書第1 A項(“リスク要因”)を参照して、この等の陳述に関連するいくつかの不確定要因、リスク及び仮定を検討する。
| 69 |
概要
我々は細胞と組織プログラムを用いて治療製品や医療療法を開発し,主に成人幹細胞に関与している。
私たちは現在私たちを追求しています椎間板·脊椎計画私たちの最初の研究治療製品はBRTX-100 2022年3月、アメリカ特許が私たちの椎間板·脊椎計画それは.FDAの許可を受けて第2段階臨床試験を開始して使用を調査しますBRTX-100退行性腰椎間板疾患による慢性下腰痛の治療に用いられる。著者らはすでにPRC ClinicとCRO協定を署名し、臨床試験場協定を実行し、患者登録、患者プログラムの開始、製造設備の購入と臨床生産能力を含むために著者らの実験室を拡張し、それによってこのような臨床試験を開始した。著者らはすでに独占的な許可を得て、腰椎椎間板ヘルニアと膨張を含む成人幹細胞による腰椎椎間板と脊柱疾患の治療研究に応用することができる。この技術は高度な幹細胞注射プログラムであり、下腰痛、臀部と足部の痛み、及び足部と足部の麻痺と痛みを緩和することができる。
私たちも開発していますThermoStem計画それは.この臨床前計画は、細胞ベースの2型糖尿病および肥満、ならびに高血圧、他の代謝障害および心臓欠陥の治療に褐色脂肪(脂肪)を使用することに関する。米国特許はThermoStem計画2015年9月、2019年1月、2020年3月、2021年3月、2021年7月、2023年6月、2023年12月に発行されたThermoStem計画2017年4月、2019年10月、2021年8月にそれぞれ発行されたThermoStem計画2017年12月、2021年6月、2022年2月、2023年6月に発行されました。イスラエルと私たちのThermoStem計画それぞれ2019年10月、2020年5月、2022年3月に発行されたThermoStem計画それぞれ2020年4月、2021年1月、2023年7月に発表された。
我々は、細胞および/または他の治療製品または材料を脊柱および椎間板または他の潜在的な部位に送達することを意図した針システムである特許文献1に許可されている。私たちはその設備が商業化される前にFDAの承認や許可を得る必要があると予想する。第2段階の臨床試験でこの装置を使うつもりはありませんBRTX-100.
我々は生物製剤に基づく化粧品事業の発展を求めている。この業務によると、化粧品や生毛製品を製造·販売し、化粧品や美容用途に利用する。
私たちの事務所はニューヨーク州メルビルにあり、私たちはそこに実験室施設を設立して、私たちの能力を高めて、可能な細胞ベースの治療、製品と方案、幹細胞に関連する知的財産権、翻訳研究応用をさらに開発しました。
| 70 |
2023年12月31日までの累計赤字は167,056,381ドルです。歴史的に見ると、私たちは少量の収入しか生じていません。私たちの損失は主に私たちの製品やサービスを商業化するための研究開発、マーケティング、販売促進活動による運営費用、上場企業の要求を満たすためのコストです。私たちは少なくとも今後1年以内に、このような活動が巨額の費用を発生させ続けると予想する。
2021年11月、私たちは23,000,000ドルの証券単位委託公開発行を完了し、これにより合計2,300,000株の私たちの普通株と引受権証を発行して、合計2,645,000株の普通株を購入しました。今回発行した純利益:(I)以下の臨床試験を以下のように行うBRTX-100それらに関連する収集と交付プログラム;(Ii)我々の臨床前研究と開発ThermoStem計画;および(Iii)一般会社および運営資金用途。今回の公開について、私たちの普通株はナスダック資本市場に上場しています。
2021年11月、公開発売を完了すると同時に、合計313,789株の普通株、 1,543,158株Aシリーズ優先株と引受権証を発行し、元金総額10,046,897ドルの転換可能本券を交換し、課税利息、br}と引受権証とともに、合計1,856,938株普通株 と株式承認証を購入した。このような債務と引受権証の交換価格は単位証券あたり10.00ドルであり,我々の普通株と引受権証単位の公開発行価格と一致する.新たに発行された権証の発行期間は5年、行使価格は1株10.00ドル。2022年9月、A系優先株の1,543,158株は同量のB系優先株と交換された。2024年3月28日現在、発行済みと発行済みのBシリーズ優先株は計1,398,158株。
2023年4月、私たちはJones Trading Institution Services LLCまたは販売エージェントとオンデマンド資本販売協定を締結し、この協定によると、現在、私たちは時々販売エージェントを通じて私たちの普通株の株を発行し、販売することができ、総発行価格は約6,109,000ドルであり、これは通常言われている“市場で”またはATM計画である。 は2023年12月31日までの年間で、我々はATM計画により販売エージェントとともに132,827株の普通株を売却し,加重平均毛価は1株約4.68ドルであり,約622,000ドルの毛収入を集めた。手数料と関連する法的費用総額は約127,000ドルであり,我々が得た純収益は約495,000ドルである。2023年12月31日まで、ATM計画により、残りの能力 は5,487,000ドルまでの普通株を追加販売することができます。
2023年7月、私たちは登録直接公開で合計685,033株の普通株を売却した。我々は今回の発行から約1,854,000ドルの純収益 を獲得した.
2021年11月の公開発行、ATM計画、登録の直接発売から受け取った純収益は、以下の第2段階の臨床試験を完成させるのに十分ですBRTX-100;しかし、私たちは私たちの計画の第3段階を達成するために多くの追加資金が必要になるだろうBRTX-100臨床試験(何の収入も受けていないと仮定)。本年度報告タイトル第1項(“業務”)で議論されているように,我々の他の計画を実施するためには大量の追加資金が必要であり,我々の代謝を含むThermoStem計画一般業務に資金を提供しています我々が予想しているこのような用途に必要かもしれない資金 が正しいか,あるいは予想される時間範囲で我々の目標 を実現できる保証はない.しかも、私たちが商業的に合理的な条項や他の方法で必要な資金調達を受けることができるという保証はない。
| 71 |
合併の運営結果
2023年12月31日までの年度と2022年12月31日までの年度との比較
以下の表に、2023年12月31日現在と2022年12月31日までの年度総合経営報告書における精選項目 :をそれぞれ示す
| ここ数年で | ||||||||
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 収入,純額 | $ | 145,800 | $ | 119,800 | ||||
| 運営費用: | ||||||||
| 研究開発 | 4,034,591 | 3,513,352 | ||||||
| 一般と行政 | 11,331,983 | 15,580,473 | ||||||
| 総運営費 | 15,366,574 | 19,093,825 | ||||||
| 運営損失 | (15,220,774 | ) | (18,974,025 | ) | ||||
| その他の収入: | ||||||||
| 利子収入 | (552,293 | ) | (11,650 | ) | ||||
| 購買力平価ローンの減免を得る | - | (250,000 | ) | |||||
| 補助金収入 | (83,333 | ) | (110,518 | ) | ||||
| その他の収入 | (169,664 | ) | (107,088 | ) | ||||
| その他収入合計 | (805,290 | ) | (479,256 | ) | ||||
| 純損失 | $ | (14,415,484 | ) | $ | (18,494,769 | ) | ||
収入.収入
2023年12月31日と2022年12月31日までの年間で,それぞれ145,800ドルと119,800ドルの我々のbr分割許可協定に関する印税収入が発生した。
研究開発
研究および開発費用には、以下の費用の現金および非現金報酬が含まれる:(A)研究開発副総裁、(B)科学顧問委員会のメンバー、(C)実験室スタッフ、および私たちの茶色脂肪および腰椎/脊柱計画に関連するコスト。研究開発費 は発生時に費用を計上する。2023年12月31日までの年度では,研究開発費は521,239ドル増加し,15%増の4,034,591ドルであったが,2022年12月31日現在の年度は3,513,352ドルであった。増加の主な原因は、賃金とボーナスの増加による給与の857,294ドルの増加、実験室用品費用の193,298ドルの増加、修理·メンテナンス費用の30,521ドルの増加、ライセンス契約および費用の増加25,155ドルの増加、相談費の112,581ドルの増加であるが、実験室現場費用の53,029ドルの減少と、2022年12月31日までの年間に発生する非日常的な起動および実行費用による中華人民共和国サービス費用の644,245ドルの減少によって相殺される。
| 72 |
我々 は,上記の計画の継続に伴い,我々の研究開発費が増加し続けることを予想している。
通常 と管理
一般および行政費用は、主に、従業員の賃金、ボーナス、賃金税、および株式ベースの報酬(研究開発副社長および研究室従業員の現金または非現金報酬を含まない)、および法律および専門費用、投資家関係および占有関連費用のような会社費用 を含む。2023年12月31日までの年度、一般および行政支出は、2022年12月31日までの年度の15,580,473ドルから4,248,490ドル、または27%から11,331,983ドル減少した。減少の主な原因は、株式給与が4,753,377ドル減少し、特許経営税費が130,850ドル減少し、償却費用が104,630ドル減少し、出張費用が84,122ドル減少し、保険費用が53,858ドル減少し、これらすべてが賃金およびボーナスによる報酬増加775,678ドル、投資家関係費用80,957ドル増加、専門費用増加44,056ドルおよび事務用品費用10,616ドル増加によって相殺されたからである。
私たちは、従業員を拡大し、インフラを発展させ、業務増加を支援する追加コストが生じるにつれて、運営に関連する一般的かつ管理費用が増加すると予想しています。
利息収入
2023年12月31日までの年度の利息収入は、2022年12月31日現在の11,650ドルから552,293ドルに増加し、540,643ドルまたは4641%に増加した。これは,有価証券を持つ投資の利子と配当収入が増加したためである。
PPPローンの減免を受ける
アメリカの小企業管理局の給与保護計画(PPP)の条項によると、私たちの250,000ドルのPPPローンは2022年12月31日までの年間で免除されます。
補助金 収入
2023年12月31日までの1年間の贈与収入は83,333ドルで、国立衛生研究院小企業技術移転(STTR)の第1段階で受け取った資金が含まれており、関連費用と相殺される。2022年12月31日までの年間の贈与収入は110,518ドルで、2021年9月に付与された256,000ドルの国立衛生研究院小規模企業技術移転(STTR)第1段階で寄せられた資金が含まれています。
その他 純収入
2023年12月31日までの年度、その他の収入純額は169,664ドルで、主に従業員の留任税収控除、ある課税費用の決済収益及びすでに実現した投資収益と関係がある。2022年12月31日までの年度の他の収入純額は107,088ドルで、主に何らかの計算すべき費用の決済収益と投資の未実現収益と関係がある。
| 73 |
流動性 と資本資源
流動性
様々な方法で私たちの流動性を測定しています
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 現金、現金等価物、投資 | $ | 11,065,995 | $ | 14,749,408 | ||||
| 運営資金 | $ | 10,327,134 | $ | 14,688,188 | ||||
追加資金の可用性
2023年12月31日までの累計赤字167,056,381ドルに基づいて、持続的な運営損失の予測と、予想される臨床試験を支援するための融資が必要です。この日までに、私たちは私たちの運営を継続するために追加の株式および/または債務融資が必要です。しかし、2023年12月31日現在の手元現金および投資、および以下に議論する権証行使に基づいて2024年2月に受け取った約8,100,000ドルの毛収入によると、経営陣は、本年度報告に含まれる財務諸表の発行日から12ヶ月間の十分な現金を持っていると考えている。
私たちの運営需要には、私たちの臨床試験に資金を提供するのに必要な金額、運営資本 と資本支出が含まれている運営業務の計画コストが含まれています。私たちの将来の資本需要と利用可能な資金の十分性は、私たちの製品およびサービスを商業化する能力、競争する技術および市場開発に成功し、他の会社と協力したり、他の会社や技術を買収したりして、私たちの製品およびサービスの需要を強化または補完することを含む多くの要素に依存するだろう。
私たちは必要な時に十分な追加資本を調達できないかもしれませんし、優遇条件で資金を調達できないかもしれません。将来の融資は、私たちの特定の資産を質的に拘留し、契約を締結することを要求するかもしれません。これは、私たちのいくつかの業務活動または私たちがさらなる負債を生成する能力を制限し、私たちの株主または私たちに不利な他の条項を含むかもしれません。もし私たちが合理的な条項で十分な資金を得ることができなければ、私たちは運営を大幅に削減または停止したり、魅力的でない条項で融資協定を締結することで資金を得ることを要求されるかもしれない。
“市場で” 製品
2023年4月、私たちはJones Trading Institution Services LLCまたは販売エージェントとオンデマンド資本販売協定を締結し、この協定によると、現在、私たちは時々販売エージェントを通じて私たちの普通株の株を発行し、販売することができ、総発行価格は約6,109,000ドルであり、これは通常言われている“市場で”またはATM計画である。 は2023年12月31日までの年間で、我々はATM計画により販売エージェントとともに132,827株の普通株を売却し,加重平均毛価は1株約4.68ドルであり,約622,000ドルの毛収入を集めた。手数料と関連する法的費用総額は約127,000ドルであり,我々が得た純収益は約495,000ドルである。2023年12月31日まで、ATM計画により、残りの能力 は約5,487,000ドルの普通株を追加販売することができます。
| 74 |
直売製品を登録しました
2023年7月、私たちは登録直接公開で合計685,033株の普通株を売却した。我々は今回の発行から約1,831,000ドルの純収益 を獲得した.
許可演習
2024年2月、私たちはまだ行使していない引受権証を行使したことで、約8,100,000ドルの総収益を受けた。より多くの情報はプロジェクト1(“業務 -業務発展-2024年の間の材料活動”)を参照されたい。
キャッシュフロー
2023年12月31日と2022年12月31日までの年間で、私たちの現金源と用途は以下の通りです
| 十二月三十一日までの年度 | ||||||||
| 2023 | 2022 | |||||||
| 経営活動のための現金純額 | $ | (6,430,211 | ) | $ | (5,913,100 | ) | ||
| 投資活動提供の現金純額 | 3,252,043 | (13,399,855 | ) | |||||
| 融資活動が提供する現金純額 | 2,351,343 | - | ||||||
| 現金の純減少 | $ | (826,825 | ) | $ | (19,312,955 | ) | ||
純額 経営活動で使用した現金
2023年12月31日現在の年度、経営活動で使用されている現金純額は6,430,211ドルであり、主な原因は14,415,484ドルの純損失を補うための現金であるが、主に株式報酬に関する非現金支出7,469,947ドルと、我々の運営資産と負債の変化によって提供される現金515,326ドルによって部分的に相殺されている。2022年12月31日現在の年度,経営活動で使用されている現金純額は5,913,100ドルであり,18,494,769ドルの純損失を補うための現金と,購買力平価融資を免除して得られた250,000ドルの非現金収益が主に原因であるが,主に株式報酬に関する非現金支出12,567,525ドルと運営資産と負債の変化による14,144ドルの現金部分で相殺されている。
純額 投資活動から提供される現金
2023年12月31日現在,投資活動が提供する現金純額は2022年12月31日までの年度より16,731,432ドル増加しており,主に最初に16,000,000ドルの現金で2022年に有価証券を購入した投資が原因であり,2023年にはそのような活動はなかった。
| 75 |
純融資活動から提供された現金
2022年12月31日までの年度と比較して,2023年12月31日現在の年度では,融資活動が提供する現金純額が2,351,343ドル 増加したのは,ATM機と登録された普通株が直接公開発行された純収益によるものである。
インフレの影響
我々は、インフレが我々の業務、収入または経営業績に本報告で述べた期間に実質的な影響を与えるとは考えていない。
キー会計試算
私たちのbrは、米国公認会計原則またはGAAPに基づいて、資産負債表の日の資産、負債およびまたは資産および負債の報告金額、および報告期間内に報告された収入および費用の報告金額に影響を与えるために、我々の経営陣に推定を要求する。これらの見積もりと実際の結果との間に大きな差があれば、私たちの財務状況や運営結果は影響を受けるだろう 私たちの推定は、私たちの状況と既存の情報に基づいた未来の期待を考慮した後、私たち自身の歴史的経験と他の私たちが合理的だと思う仮定に基づいている。私たちはこのような推定数値を継続的に評価するつもりだ。
以下の場合、私たち は会計推定が重要であると考えている:(I)会計推定要求は、会計推定を行う際に高度に不確定な事項を仮定することと、(Ii)異なる時期に発生する可能性のある合理的な変化を推定すること、あるいは私たちが今期に合理的に使用する異なる推定を使用することは、私たちの財務状況或いは運営結果に重大な影響を与える。私たちの財務諸表には見積もりが必要なプロジェクトがありますが、上記で定義したように重要なプロジェクトとはみなされません。
当社の主要会計政策及び関連判断の詳細な検討については、本年報“第8項財務諸表及び補足データ”における総合財務諸表付記2を参照されたい。
最近会計公告が発表された
本年度報告第16項(“Form 10−K要約”)下の 現在の2023年12月31日と2022年12月31日までの年次連結財務諸表付記2を参照。
表外手配 表内手配
私たち は私たちの財務状況に現在または未来に影響を与える可能性のある表外手配を持っていないか、または合理的に可能であり、 財務状況、収入または支出、運営結果、流動性、資本支出または資本資源の変化は投資家にとって重要である。
| 76 |
| プロジェクト 7 A. | 市場リスクの定量的·定性的開示について. |
は適用されない.
| 第 項8. | 財務諸表と補足データ. |
本年度報告第8項に要求される財務諸表は、本年度報告第16項(“表格10−K要約”)の後に記載されている。小さな報告会社として、私たちは追加的な財務情報を提供する必要がない。
| 第 項9. | 会計·財務開示における会計担当者の変化と相違. |
ない。
| 第 9 A項。 | 制御 とプログラム. |
開示制御とプログラムの評価
我々は、“米国証券取引委員会”の規則および表に指定された期間内に、“証券取引法”または“取引法”の下の規則13 a-15(E)および15 d-15(E)に定義されている“米国証券取引委員会”の規則および表に指定された期間内の記録、処理、まとめおよび報告を確保するための開示制御および手順を維持し、状況に応じて、これらの情報が蓄積されて我々の経営陣に伝達され、状況に応じて決定される。必要な開示に関する決定をタイムリーに下すために。開示制御やプログラムを設計する際には,我々の管理層は必然的にその判断を用いて可能な開示制御とプログラムのコスト-利得関係 を評価する必要がある.任意の開示制御およびプログラムの設計もまた、将来のイベントの可能性のいくつかの仮定に部分的に基づいており、任意の設計がすべての潜在的な将来の条件でその目標を成功的に達成することを保証することはできない。任意の制御およびプログラムは、どんなに設計および動作が良好であっても、絶対的な保証ではなく、予期される制御目標を達成するために合理的な保証を提供することしかできない。
我々の経営陣(CEOや財務責任者を含む)の監督の下で、2023年12月31日までの“取引法”のルール13 a-15(E)で定義されている私たちの開示制御および手順を評価する必要があります。
経営陣 はこのような評価を完了し、私たちの開示制御およびプログラムは、“取引法”に基づいて提出または提出された報告書に基づいて、要求された開示についてタイムリーに決定するのに適した開示情報を効率的に提供することができないと結論した。以下に述べる財務報告内部統制には重大な欠陥があるため、2023年12月31日現在、我々の開示制御および手順は有効ではないと結論した。
| 77 |
経営陣財務報告内部統制年次報告書
経営陣は財務報告書の十分な内部統制の確立と維持に責任がある。私たちの財務報告の内部統制は私たちの主要幹部と主要財務官の監督の下で設計され、私たちの取締役会、管理層、その他の人員によって実施され、財務報告の信頼性 の合理的な保証 を提供し、GAAPを外部報告目的に基づいて私たちの総合財務諸表を作成する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来のいずれかの有効性評価を行う予測 は 条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
材料br財務報告内部統制の弱点
経営陣 は、テレデビル委員会後援組織委員会が発表した“内部統制-総合枠組み(2013)”で構築された枠組みに基づいて、2023年12月31日までの財務報告内部統制の有効性を評価した。この評価に基づいて、経営陣は、2023年12月31日現在の財務報告内部統制が無効であることを決定した。
“サバンズ-オキシリー法案”で確立された基準によると、重大な欠陥は財務報告内部統制の欠陥や欠陥の組み合わせであるため、我々の年度や中期連結財務諸表の重大な誤報はタイムリーな予防や発見が得られない可能性がある。
財務報告書に対する私たちの内部統制が無効になったのは次のような重大な欠陥のためだ
| ● | 公式的な政策と手続きの遵守が足りない |
| ● | 財務報告のリスクをタイムリーに発見する内部統制リスク評価プログラムが不足している |
| ● | 文書が形成された正式なプログラムおよび制御プログラムの十分な正式管理テストが不足し、日記帳分録および口座台帳の準備および審査の文書化制御を含む完全かつ正確な財務報告および開示を実現するために、制御措置の持続的な有効性を評価する時間がない。 |
経営陣が物質的弱点を補うbr計画
管理層 は、これらの制御を効率的に設計、実施、実行するために、実質的な欠陥をもたらす制御欠陥を修復するための措置 を実施し、継続して実施される。救済活動には
| ● | 私たちの最高財務官を含めて、財務報告の流れを監督し、制御と管理の実施状況を強化している管理層の人員 |
| ● | 外部財務コンサルティング会社を招聘して財務報告、財務運営、および内部統制を改善し続ける |
| ● | リスクに基づく方法を用いてキープログラムと制御を記録する。 |
| 78 |
経営陣は強力な内部統制環境の維持に取り組み,重大な欠陥を招く制御欠陥の早急な救済を支援するための措置を実施している。リスクに基づく方法を用いてキープログラムと制御プログラムを記録したため,修復が進んだ。我々は、外部財務コンサルティング会社を招聘して財務報告と運営を改善することと、制御 を設計·実施することとを含む、我々の救済計画を継続的に実施する。私たちは、適用された制御措置が十分に長く実行された後、重大な欠陥を救済することを考慮し、管理層がテストを通じて結論を出し、制御措置が有効に作動していると結論する。
我々は、財務報告の内部制御プログラムおよびプログラムに対する私たちの有効性を継続的に監視し、評価し、必要かつ資金的に許可された場合にさらに行動し、追加的な強化または改善を実施することを約束する。
本年度報告には、財務報告の内部統制に関する当社の独立公認会計士事務所の認証報告は含まれていません。米国証券取引委員会の規則によると、経営陣の報告は、我々の独立公認会計士事務所 の認証を経る必要がなく、小さな報告会社のこの要求を免除している。
財務報告内部統制変更
上述したbrを除いて、2023年第4四半期に私たちは財務報告の内部統制に重大な影響を与えなかったか、あるいは合理的に財務報告の内部制御に重大な影響を与える可能性の変化が発生しなかった。
| 第 9 B項。 | その他 情報. |
ない。
| 第 9 C項. | 検査阻止に関する外国司法管轄区域の情報を開示する. |
は適用されない.
| 79 |
第 第3部分
| 第 項10. | 役員·役員·会社管理. |
役員と役員
我々の役員と役員に関する情報 は以下のとおりである.私たちのすべての官僚たちは全身全霊で私たちにサービスを提供してくれた。
| 名前.名前 | 年ごろ | 役職: | ||
| ランス·アルストート | 53 | 最高経営責任者総裁兼取締役会長 | ||
| フランシスコシルバ | 49 | 取締役研究開発部書記·総裁副 | ||
| ロバート·E·クリストファー | 57 | 最高財務官 | ||
| ロバート·パカサシ | 55 | 品質保証·規制適合部副部長総裁 | ||
| Nickolay Kukekov博士 | 50 | 取締役、報酬委員会議長 | ||
| パトリック·F·ウィリアムズ | 51 | 取締役、監査委員会議長 | ||
| デヴィッド·ローザ | 60 | 取締役,委員会議長を指名する |
ランス·アルストート
ランス·アルストートは2020年11月以来、我々の最高経営責任者総裁と取締役会長を務めてきた。彼は2018年10月から2020年2月まで私たちの執行副総裁兼首席戦略官を務めた。Alstodtさんは2013年からMedVest Consulting Corporationの最高経営責任者(CEO)を務めており、医療業界に注力しているコンサルティング会社であり、資本企業である。MedVestに加入する前に、 彼は投資銀行で、医療投資銀行業務(M&Aを含む)で23年以上の経験を持っています。 2011年から2013年まで、アルストートさんは、Leerink Partnersで取締役社長を務め、同社の医療技術部門をリードするのを手伝っています。2009年から2011年にかけて、オベンハイマー社で取締役社長、医療技術担当者を務め、2000年から2009年にかけて、アルストートさんはメリンメディアン医療グループおよびグローバルM&Aグループの取締役社長を務めた。これまで、モルガン·チェースグローバルM&A業務部の副社長を7年間務めていたが、そこで彼は買収、レバレッジ買収、私募と公開融資、独占販売と一般コンサルティング任務に広く従事していた。Alstodtさんは、ニューヨーク州立大学オルバニ校で経済学の学位を取得し、金融とマーケティングを専攻しています。我々は、Alstodtさんは、私たちと他のヘルスケア事業の幹部レベルでの管理経験と、医療産業に関連する投資銀行の分野での彼の豊富な経験を信じて、彼が私たちの取締役の1人として働く資格を持っている。
フランシスコシルバ
フランシスコ·シルバは2013年3月から研究開発部副総裁を務め、これまでも2011年4月から2012年3月まで務めてきた。シルバさんは、2020年11月に私たちの秘書と役員のCEOに選出されました。彼は2012年3月から2012年6月まで私たちの研究科学者を務め、2012年6月から2013年3月まで私たちの首席科学者を務めた。2007年から2011年にかけて、シルバさんはDV Biologics LLCのCEOとダ·ヴィンチ生物科学会社の社長を務め、研究と治療用途のためのヒトベースの生物学的製剤の商業化に取り組んでいます。2003年から2007年まで、PrimeGen Biotech LLCで研究開発の副社長を務めたシルバさんは、細胞プラットフォームの開発に取り組んでいる会社です。2002年から2003年までの間、彼はPrimeGen Biotechの研究科学者であり、幹細胞プラットフォームの生殖系の再プログラミングに専念する実験設計の開発を担当した。シルバはかつてカリフォルニア州立理工大学で生物学、解剖学、高級組織培養コースを教授した。彼は幹細胞に関する複数の特許を取得し,幹細胞研究に関する多くの文章を発表した。シルバさんはカリフォルニア州立理工大学を卒業し、生物学の学位を取得した。カリフォルニア州立理工大学の大学院生大統領奨学金やMBRS奨学金も受けました我々は、さん2011年4月以来、当社の役員レベルでの管理経験と、当社の業務に関連する科学的知見を広く理解している彼は、当社の取締役の一人としての資格を有するようになりました。
| 80 |
ロバート·E·クリストファー
ロバート·E·クリストファーは2021年11月以来、私たちの最高財務官を務めてきた。Kristalさんは、投資銀行の複数のビジネスラインで様々な管理職を担当している経験のあるウォール街やベイストリートの専門家です。2016年から2020年までの間、H.C.ウェインwrightの株式研究担当者を務めた。Kristalさんは、2013年から2016年にかけて、H.C.ウェインwrightとT.R.ウィンストンで投資銀行および商業銀行サービスを提供しました。彼はフランチャイズ金融アナリストです。Kristalさんは、WilFrid Laurier大学で経済学の学士号、ウィンザー大学で金融ビジネス(栄誉)の学士号を取得しています。
ロバート·パカサシ
ロバート·パカサシは2021年12月から品質保証/コンプライアンス部副総裁を務め、2016年8月から2020年9月まで同ポストを務め、2015年9月から2016年8月まで品質·コンプライアンス部取締役を務めている。Paccasassiさんは、厳格な規制された製品の運営に関して20年以上の経験を持ち、GMP(巨大分子および小分子)の臨床および商業的品質保証および規制コンプライアンスのリーダーシップについて特別な専門知識を持っています。2011年から2014年にかけて、メルクドイツ·デムシュタットで品質システム担当役員を務めた。パカサシさんは、この役職の間、グローバルGMP政策、プロセス、指示の持続的な開発と実施のための会社の品質部門のリーダーを担当しました。EMD Serono,Biogen Idec,Millennium PharmPharmticals,Regeneron PharmPharmticalsで重要な品質とコンプライアンス管理職を務めてきた。パカサシさんは、2つのcGMP生物生産実験室の最高技術専門家/現場責任者であり、2つのcGMP生物生産実験室の日常技術と品質運営を監視する責任者です。マサチューセッツ州ボストンブリグラム婦人病院免疫血液学分野の医療技術の専門家でもある。Paccasassiさんは、ジョンソンとウェールズ大学の工商管理修士(MBA)の学位、およびロードアイランド大学の医学技術/生物学の学士号を所有しています。
Nickolay Kukekov博士
Nickolay Kukekov博士は2021年3月以来私たちの取締役の一人を務め、2021年11月以来私たちの取締役会報酬委員会の議長を務めてきた。ククコフ博士は過去15年以上にわたって複数の医療投資銀行の職を務めてきた。2020年以降、ポールソン投資会社の取締役高級取締役社長を務めてきた。2012年から2020年までの間、ククコフ博士はHighline研究コンサルタント有限責任会社の創設パートナーです。2010年から2012年にかけて、夏街研究組合役員の取締役社長を務めた。2007年から2009年まで、ククコフ博士はパラモン資本取締役社長を務めた。2006年から2007年まで、彼はロードマンとレンショウ副総裁を務めた。彼は脳科学会社とオムニア健康会社の取締役メンバーで、この2社の株はすでに上場している。Kukekov博士はコロラド大学ボルダー校で分子、細胞、発育生物学文学学士号を取得し、コロンビア大学内科と外科医学院から神経科学博士号を取得した。Kukekov博士の医療部門に関連する投資銀行分野での豊富な経験と,再生医学における彼の深い背景が,私たちの取締役の一人になる資格があると信じている。
| 81 |
パトリック·F·ウィリアムズ
パトリック·F·ウィリアムズは2021年11月以来、取締役の一人で取締役会監査委員会の議長を務めてきました。ウィリアムズさんは、医療機器、消費財、技術分野で20年以上の経験を持っています。ウィリアムズさんは2020年7月にSTAAR外科企業またはSTAARの財務責任者として任命され、STAARの財務業績を最適化し、高い成長拡張をサポートするために様々な機能のスケーラビリティを確保します。2016年から2019年にかけて、Sientra,Inc.の最高財務官 を務め、MiraDry業務部社長に移行した。2012年から2016年にかけて、ウィリアムズさんはZeltiq Aesthetics,Inc.の首席財務官、Zeltiq Aesthetics,Inc.はAllerganによって買収された上場医療機器会社である。これまで、彼は2007年から2012年までNuVasive,Inc.で総裁副総裁を務め、財務、戦略と投資家関係の仕事を担当し、NuVasive,Inc.はサンディエゴに本部を置く医療機器会社であり、脊柱業界にサービスしていた。彼はカラヴィゴルフ会社や京セラ無線会社で財務職も務めていた。Williamsさんは、サンディエゴ州立大学金融管理MBAの学位とカリフォルニア大学サンディエゴ校の経済学士号を持っています。私たちは、ウィリアムズさんは、財務管理の専門知識を含む医療関連事業の上層部の管理経験を持っており、私たちの取締役の一人になる資格を持っていると信じています。
デヴィッド·ローザ
Davidは2021年11月以来、私たちの取締役の一人と取締役会指名委員会の議長を務めてきた。ローザさんは2017年7月以降、神経一号医療技術会社(取締役コード:NMTC)のCEO兼CEOを務め、2016年10月から2019年12月まで神経一号(旧完全子会社)のCEOと取締役を務めてきた。NeuroOneは、てんかん、パーキンソン病、ジストニア、特発性振戦、背部手術失敗による慢性疼痛および他の関連神経疾患を有する患者に、低侵襲および高解像度の脳電気記録、脳刺激およびアブレーション解決策を提供することに取り組んでおり、これらは、患者の予後を改善し、プログラムコストを低減する可能性がある。2009年11月から2015年11月までの間に、ローザさんはサンシャイン心臓会社(ナスダック:CHFS)のCEOと社長を務め、同社は上場している初期の医療機器会社です。2008年から2009年11月までの間、彼は動物用医療機器専門会社MilkSmart,Inc.のCEOを務めている。2004年から2008年にかけて、ローザさんはサンダー医療会社の心臓外科および心臓病学のグローバルマーケティング副社長を務めた。彼はナスダック社(BTCY)と医療三角会社(ナスダック·コード:HCTI)の取締役会のメンバーである。ロッサ·さんはフィンランドの個人持株会社Neuro Event Labsの代表取締役であり、SYPS NADxの顧問委員会のメンバーでもある。メリーランド州ベセスタの個人持株会社です。我々は、ローザさんは医療機器業界の高度なリーダーシップの経験と、彼の豊富な技術、戦略、運営の専門知識を持っており、彼は私たちの取締役の一つになる資格があると信じています。
| 82 |
科学顧問委員会
以下は私たちの科学顧問委員会のメンバーです
| 名前.名前 | 主要ポスト | |
ウェイン·マラス科医学博士博士です 議長.議長 |
Dana-Farber癌研究所腫瘍免疫とエイズ学部教授 ハーバード医学院の医学教授 ハーバード幹細胞研究所の主な教職員 | |
ジェイソン·リペッツ医学博士 ディズニー諮問委員会主席 |
長島脊柱リハビリテーション医学の創始者 ノースウェル健康脊柱センター脊柱内科主任 臨床ホフストラ/ノスウェルZucker医学院物理医学とリハビリ系アシスタント教授 | |
| ウェイン·J·オランド医学博士 | 取締役、介入と血管内神経外科 ジョージワシントン大学医学センター神経外科と放射線学助教授 アメリカ国立衛生研究院放射線科医にお問い合わせください | |
喜び:カバグナロ博士 DABT, RAC |
総裁、Access Bio、L.C.;毒理科学院及び監督専門学会院士; 元食品薬品監督管理局生物製品評価と研究センター品質保証部高級薬理学者、取締役br | |
| ハヴェンダー·サンドゥー医学博士です | 特外科病院整形外科脊柱外科医 元カリフォルニア大学ロサンゼルス校医学センター脊柱外科サービス主任 | |
| クリストファー·プラスタス医学博士です | 筋肉骨格、脊柱、運動リハビリテーション医学の臨床と物理学者、モスリハビリテーション病院の取締役 元ペンシルバニア大学の脊柱リハビリセンターの役員です 元ペンシルバニア大学の脊柱、運動、筋肉骨格医学研究員取締役 |
家族関係
私たちの役員、役員、科学顧問委員会のメンバーの間には家族関係はありません。
| 83 |
任期
私たちは秘密の取締役会を持っている。取締役任期は,以下に述べる株主周年総会まで,その後継者を選出して資格を取得するまで,あるいはそれ以前に辞任または免職されるまでである。
| 名前.名前 | クラス | 期限 満期 | ||
| ランス·アルストート | (三) | 2026 | ||
| フランシスコシルバ | 第2部: | 2025 | ||
| ニコレ(Br)ククコフ | I | 2024 | ||
| パトリック·F·ウィリアムズ | (三) | 2026 | ||
| デヴィッド·ローザ | 第2部: | 2025 |
各役員の任期は、次期株主年次会議以降の第1回取締役会会議まで続き、後継者が選出されて資格を得るまで、または早期辞任または免職されるまで続く。
監査委員会
取締役会監査委員会は、私たちの会計と財務報告の流れと、私たちの財務諸表の監査を監督します。監査委員会のメンバーはさんウィリアムズ(議長)、クケコフ博士とさんロッサです。
監査委員会財務専門家
我々の取締役会は、S-K条例第407(D)項(5)で定義した“監査委員会財務専門家”の資格を満たすと判断しました。
延滞債務(Br)第16(A)節受益所有権報告
取引法第16節では、普通株の実益所有権報告及びこのような所有権の変更は、取締役、ある高級職員、発行された普通株式の10%を超える保有者、及び報告者が受託者の何らかの信託であることを含む証券取引委員会に提出しなければならないと規定されている。私たちは、2023年12月31日までの財政年度中に第16条に基づいて必要な報告書をタイムリーに提出できなかったことを知っている各報告者を本年次報告書で開示する必要がある。我々の知る限りでは、米国証券取引委員会に提出された表3、4、5のコピーの審査のみに基づき、株主の10%が2023年12月31日までの財政年度中に、当社の上級管理職、役員、および株主の10%が、第16条(A)第16条に適用される要件を遵守することを明らかにした。ただし、AlstodtさんとSilvaさんは、1人遅れて表4(1件につき1件の取引を報告)、株主のDale Broadrick氏は、3つの表4(合計8件の取引を報告)を遅延している。
“高度財務官道徳規則”
私たちの取締役会は、私たちのCEO、最高財務官、主要会計官、または主計長、または類似の機能を実行する人に適用される道徳的基準を採択しました。道徳規則のコピーは私たちのウェブサイトwww.biorestorative.comに掲示されています。 私たちのウェブサイトwww.biorestorative.comでこのような情報を配布することで、Form 8-K第5.05(C)項の私たちの道徳規則の改訂または免除に関する開示要求を満たすつもりです。
| 84 |
| 第 項11. | 役員報酬 . |
集計表 給与表
以下の報酬集計表は、2023年12月31日、2023年、2022年までの財政年度中に、(I)当社の最高経営責任者、および(Ii)最高報酬の役員2人(主要幹部を除く)が2023年12月31日までに役員を務め、S−K条例第402項に基づいて決定された2023年度の総報酬が100,000ドルを超える全報酬((I)および(Ii)クラスに属する個人を総称して指定された役員と呼ぶ)を示している
| 名称と主要ポスト | 年.年 | 賃金.賃金 | ボーナス.ボーナス | 株式大賞(1) | オプション大賞(1) | 他のすべての補償 | 合計する | |||||||||||||||||||
| ランス·アルストート | 2023 | $ | 479,167 | $ | 475,000 | (2) | $ | - | $ | 300,000 | $ | - | $ | 1,254,167 | ||||||||||||
| 最高経営責任者 | 2022 | $ | 400,000 | $ | - | (2) | $ | 52,364 | $ | - | $ | - | $ | 452,364 | ||||||||||||
| フランシスコ·シルバ | 2023 | $ | 454,167 | $ | 437,500 | (3) | $ | - | $ | 300,000 | $ | - | $ | 1,191,667 | ||||||||||||
| 研究開発部副総裁 | 2022 | $ | 375,000 | $ | - | (3) | $ | 52,364 | $ | - | $ | - | $ | 427,364 | ||||||||||||
| ロバート·クリストファー | 2023 | $ | 240,624 | $ | 127,500 | (4) | $ | - | $ | 250,000 | $ | - | $ | 618,124 | ||||||||||||
| 首席財務官 | 2022 | $ | 175,000 | $ | - | (4) | $ | - | $ | - | $ | - | $ | 175,000 | ||||||||||||
| (1) | 金額 は、株式に基づく会計規則(FASB ASCテーマ718-株式報酬)によって計算された財政年度内に付与された総付与日公正価値を反映する。これらの金額を計算する際に用いる仮定は,本年度報告に含まれる我々の 総合財務諸表付記8に含まれる. |
| (2) | 2023年ボーナス金額は、(A)2024年に支払われた2023年サービスに対する適宜ボーナス額250,000ドルと、(B)2022年に支払われた2022年サービス対価金額225,000ドルの適宜ボーナスを代表します。 |
| (3) | 2023年配当額は、(A)2023年サービスにより2024年に支払われる適宜配当225,000ドルと、(B)2022年サービスにより2023年に支払われる適宜配当212,500ドルである。 |
| (4) | 2023年ボーナス金額とは、(A)2023年サービスにより2024年に支払われる75,000ドルの適宜ボーナスと、(B)2022年サービスにより2023年に支払われる金額52,500ドルの適宜ボーナスである。 |
| 85 |
未償還の財政年末の持分奨励
次の表は、2023年12月31日現在、任命された役員の株式奨励が付与されていない情報を提供しています
| オプション大賞 | 株式大賞 | |||||||||||||||||||||||||||||||||||
| 名前.名前 | 行使可能な未行使オプション対象証券数 | 未行使オプション未行使の証券標的数 | 株式インセンティブ計画奨励:未行使未満期オプションの対象証券数 | オプション取引権価格 | オプション期日 | まだ帰属していない株式または株式単位の数 | 未帰属株式時価 | 株式インセンティブ計画奨励:帰属していない未獲得株式、単位または他の権利の数 | 配当インセンティブ計画奨励:帰属されていない未獲得株式、単位または他の権利の市場または配当価値 | |||||||||||||||||||||||||||
| ランス·アルストート | 293,479 | - | - | $ | 5.08 | 3/18/2031 | - | $ | - | - | $ | - | ||||||||||||||||||||||||
| ランス·アルストート | 34,174 | 7,885 | (1) | - | $ | 5.08 | 11/4/2031 | - | $ | - | - | $ | - | |||||||||||||||||||||||
| ランス·アルストート | 53,381 | 53,381 | (2) | - | $ | 2.91 | 2/17/2033 | - | $ | - | - | $ | - | |||||||||||||||||||||||
| ランス·アルストート | - | - | - | $ | - | - | 48,913 | (3) | $ | 85,104 | - | $ | - | |||||||||||||||||||||||
| フランシスコ·シルバ | 3 | $ | 18,800 | 2/18/2024 | - | $ | - | - | $ | - | ||||||||||||||||||||||||||
| フランシスコ·シルバ | 1 | $ | 18,800 | 3/12/2024 | - | $ | - | - | $ | - | ||||||||||||||||||||||||||
| フランシスコ·シルバ | 9 | $ | 18,800 | 10/23/2024 | - | $ | - | - | $ | - | ||||||||||||||||||||||||||
| フランシスコ·シルバ | 6 | $ | 18,800 | 9/4/2025 | - | $ | - | - | $ | - | ||||||||||||||||||||||||||
| フランシスコ·シルバ | 15 | $ | 14,920 | 6/10/2026 | - | $ | - | - | $ | - | ||||||||||||||||||||||||||
| フランシスコ·シルバ | 20 | $ | 11,200 | 7/12/2027 | - | $ | - | - | $ | - | ||||||||||||||||||||||||||
| フランシスコ·シルバ | 25 | $ | 4,920 | 10/29/2028 | - | $ | - | - | $ | - | ||||||||||||||||||||||||||
| フランシスコ·シルバ | 293,479 | - | - | $ | 5.08 | 3/18/2031 | - | $ | - | - | $ | - | ||||||||||||||||||||||||
| フランシスコ·シルバ | 34,174 | 7,885 | (1) | - | $ | 5.08 | 11/4/2031 | - | $ | - | - | $ | - | |||||||||||||||||||||||
| フランシスコ·シルバ | 53,381 | 53,381 | (2) | - | $ | 2.91 | 2/17/2033 | - | $ | - | - | $ | - | |||||||||||||||||||||||
| フランシスコ·シルバ | - | - | - | $ | - | - | 48,913 | (3) | $ | 85,104 | - | $ | - | |||||||||||||||||||||||
| ロバート·クリストファー | 10,490 | - | - | $ | 5.08 | 11/4/2031 | - | $ | - | - | $ | - | ||||||||||||||||||||||||
| ロバート·クリストファー | 44,484 | 44,484 | (2) | - | $ | 2.91 | 2/17/2033 | - | $ | - | - | $ | - | |||||||||||||||||||||||
| (1) | 2024年2月4日からオプション は3つのほぼ等しい四半期分割払いが可能です。 |
| (2) | 2024年2月17日からオプション は8つのほぼ等しい四半期分割払いで行使できる |
| (3) | 2024年3月18日の数量限定在庫ベスト。 |
雇用契約
ランス·アルストート
アルストートさんは、2020年11月16日より、同社のCEO兼取締役会長に選出される。我々は、2021年3月18日に、2026年3月18日までの期間を規定する雇用契約をAlstodtさんと締結しました。雇用契約によると、Alstodtさんは現在550,000ドルの年俸を取得する権利があります(2021年11月に取得された150,000ドルの業績収益を達成し、その雇用契約に従って毎年50,000ドルの昇給を得る)。雇用契約を実行しながら、2021年計画(I)に基づいてAlstodtさん10年オプションを付与し、1株47.60ドルの行使用価格で293,479株の我々の普通株式(その後、1株当たり13.50ドルに下げ、さらに1株当たり5.08ドルに低下する)および(Ii)146,740株の制限株式単位、またはRSUを提供する。このオプションは付与日に50%に帰属し、2021年11月4日に12.5%に帰属し、残高は2021年12月18日から6つの均等四半期分割払いに分類される。RSUは授与日の第1、第2、第3周年記念日に3等分の年間分割払いを行う。アルストートさんの雇用関係が理由なく中止された場合や、雇用契約で定義されているようにアルストートさんが“正当な理由”で雇用関係を終了した場合、アルストートさんはその年の基本年俸の倍以下の散逸料を得る権利がある。Alstodtさんと我々の雇用関係が理由なく終了した場合,Alstodtさんに付与されたオプションはその満期日まで我々の雇用関係と終了したにもかかわらず行使可能である。また、Alstodtさんに付与されたRSUは、“2021年計画”で定義されるように、理由なく雇用または制御権の変更を終了した場合にbr} 2022年3月、我々とAlstodtさんは、彼の年俸50,000ドル(彼の雇用合意に応じて)の代わりに、Alstodtさんに12,438 RSU(50,000ドル)を発行することに同意し、RSUは12ヶ月分の平均分割払いです。Alstodtさんが50,000ドルの昇給を得る権利を対価として1年遅れてしまいます。
| 86 |
フランシスコシルバ
2021年3月18日には、2026年3月18日までの雇用契約をシルバさんと締結しています。雇用契約によると、Silvaさんは現在、525,000ドルの年俸を取得する権利があります(2021年11月に150,000ドルの業績昇給とその雇用契約に従って50,000ドルの年間昇給を達成しました)。雇用契約を実行しながら、2021年計画に基づきSilvaさんに10年オプションを付与し、普通株式293,479株(行権価はその後1株13.50ドル、さらに1株5.08ドル)と(Ii)146,740株のRSUを1株47.60ドルで購入した。このオプションは付与日に50%に帰属し、2021年11月4日に12.5%に帰属し、残高は2021年12月18日から6つの均等四半期分割払いに分類される。RSUは授与日の第1、第2、第3周年記念日に3回の均等額に分けた年間分割払い。シルバさんの雇用を理由なく終了する場合や、シルバさんが“十分な理由”(雇用契約で定義されているいずれか1つ)で雇用を終了する場合、シルバさんは、その当時の基本給の倍以上の散逸料を得る権利がある。シルバさんと我々の雇用関係が理由なく終了した場合,シルバさんの選択権の付与はいつまで有効であり,その期限までには我々との雇用関係は終了したにもかかわらず。また、シルバさんに付与されたRSUは、理由なく雇用または制御権の変更が終了した場合(2021年計画参照)でbr}。 2022年3月、我々とシルバさんは、彼の年俸50,000ドルの増加(彼の雇用契約に応じた規定)の代わりに、12,438個のRSU(50,000ドルの価値)をシルバさんに発行することに同意し、これらのRSUは12ヶ月に分けて分割払いになります。この助成金はSilvaさんが50,000ドルの昇給を得る権利を考慮して1年遅れています。
役員報酬
次の表には、2023年12月31日までの会計年度非従業員役員報酬のいくつかの情報が示されています
| 名前.名前 | 費用 は現金形式で稼ぐか支払う | 株 奨励 | オプション 奨励 | 非持分インセンティブ計画報酬 | 不合格 繰延給与収入 | 他の報酬はすべて | 合計する | |||||||||||||||||||||
| ニコレ(Br)ククコフ | $ | 30,000 | $ | - | $ | 90,000 | (1) | $ | - | $ | - | $ | - | $ | 120,000 | |||||||||||||
| パトリック·F·ウィリアムズ | $ | 30,000 | $ | - | $ | 90,000 | (2) | $ | - | $ | - | $ | - | $ | 120,000 | |||||||||||||
| デヴィッド·ローザ | $ | 30,000 | $ | - | $ | 90,000 | (3) | $ | - | $ | - | $ | - | $ | 120,000 | |||||||||||||
| (1) | ククコフ博士は2023年12月31日現在、57,264株の普通株を購入するオプションを保有している。 |
| (2) | ウィリアムズは2023年12月31日現在、42,518株の普通株を購入するオプションを保有している |
| (3) | 2023年12月31日現在、ロッサさんは、普通株式42,518株のオプションを保有します |
ククコフ博士、ウィリアムズさん、ローザさんは、当社の非従業員取締役であり、それらの役員としてのサービスの報酬として、毎年30,000ドルの現金および90,000ドルのオプションを得る権利を持っています。
| 87 |
| 第 項12. | 安全な利益所有者の所有権と管理層と関連する株主のこと. |
主要株主
次の表は、2024年3月20日までに、米国証券取引委員会に提出された譲渡代理記録および報告によって、(I)実益が当時発行された普通株式の5%以上を有する者、(Ii)私たちの各取締役、(Iii)私たちが指定した各役員(定義上参照)、 および(Iv)私たちのすべての取締役および役員をグループとして有する2024年3月20日までに知られている普通株式実益所有権のいくつかの情報を示している。次の表はまた、2024年3月20日現在の私たちBシリーズ優先株の利益所有権のいくつかの情報を示しています。
この表中の 情報は,“取引法”ルール13 d-3で定義された“利得所有権”を反映している.我々の知る限り, は別の説明がない限り,個々の株主が実益として所有する株式に対して唯一の投票権と投資権を持つが,適用されるコミュニティ財産法を遵守しなければならない.百分率所有権は、6,769,919株普通株式(Auctus Fund,LLCまたはAuctusに発行可能な普通株を含まず、以下の表脚注(10)で説明される)および2024年3月20日現在発行された1,398,158株B系列優先株に基づく。
受益者の名称と住所 所有者 | 量 持っている | 約百分率 クラス | 量 シリーズの株 B優先 在庫品 有益な 持っている | 近似値 クラスパーセント | ||||||||||||
| 役員および行政員 | ||||||||||||||||
| ランス·アルストート(1) | 790,805 | (2) | 10.7 | % | - | - | ||||||||||
| フランシスコ·シルバ(1) | 756,666 | (3) | 10.3 | % | - | - | ||||||||||
| ロバート·クリストファー(1) | 205,668 | (4) | 3.0 | % | - | - | ||||||||||
| ニコレ·ククコフ | 95,510 | (5) | 1.4 | % | - | - | ||||||||||
| パトリック·F·ウィリアムズ | 82,341 | (5) | 1.2 | % | - | - | ||||||||||
| デヴィッド·ローザ | 82,341 | (5) | 1.2 | % | - | - | ||||||||||
| 全役員と執行幹事(7人) | 2,186,862 | (6) | 25.4 | % | - | - | ||||||||||
| ある実益は人を持っている | ||||||||||||||||
| デル·ブロデリック(7) | 926,126 | (8) | 13.7 | % | - | - | ||||||||||
Auctus Fund LLC(9) Auctus Fund Management LLC(9) アルフレッド·ソラミー(9) ルイス·ボスナ(9) | 679,753 | (10) | 9.99 | % | 1,398,158 | (11) | 100 | % | ||||||||
| * | 以下は1%未満 |
| (1) | 住所:c/o BioRestorative Treatures,Inc.,住所:ニューヨークメルヴェルマーカス通り40番地、郵便番号11747。 |
| (2) | 現在または60日以内に行使可能なオプション行使時に発行可能な普通株式618,933株を含む |
| (3) | 現在または60日以内に行使可能なオプション行使の場合に発行可能な597,079株の普通株式と、シルバさんが退職口座に保有する12,136株の普通株式を含む |
| (4) | 現在または60日以内に行使可能なオプション行使時に発行可能な197,674株の普通株式を含む。 |
| (5) | 現在または60日以内に行使可能なオプションを行使する際に発行可能な普通株式を代表する |
| (6) | 1,847,409株の普通株式を含み、現在または60日以内に行使可能なオプションを行使したときに発行することができる |
| (7) | 住所はテネシー州ナッシュビルBrick Church Pike 3003号です |
| (8) | 米国証券取引委員会に提出された付表13 D第9号修正案と表4に基づく。FleetCo Inc.の株式を1,109株、現在行使可能な引受権を行使する際に発行する普通株式、およびFleetCo Inc.が保有する477,972株の普通株式を含み、ブロードリックさんがFleetCo Inc.93%を保有する。 |
| (9) | 住所 はBoylston Street 545,2発送するマサチューセッツ州ボストン、郵便番号:02116。 |
| 88 |
| (10) | 米国証券取引委員会に提出された付表13 G第2号改正案と、米国証券取引委員会に提出した他の文書とに基づく。Auctusは引受権証を持っていて、最大1,257,435株の私たちの普通株を購入することができます。また、AuctusのBシリーズ優先株は合計1,398,158株の私たちの普通株に変換することができる。Auctusに株式承認証を発行する取引については、吾らはAuctusにいくつかの普通株を発行し、Auctusの通知を受けた後にAuctusに1,351,580株の私たちの普通株または追加株式を発行することに同意したが、以下に議論する制限を守らなければならない。しかし、この株式承認証 は私たちの普通株の購入には使用できず、Bシリーズ優先株は私たちの普通株 に変換できず、追加の株式は発行できません。Auctusが行使、転換、発行後に実益が9.99%を超える私たちの普通株式流通株を持っているように。Auctusによると、Auctusは2024年3月20日までに645,320株の普通株を持ち、当時6,769,919株の普通株流通株の9.5%に相当し、通知を受けた後、追加のbr株を発行することができ、このような発行によりAuctusは発行後実益が私たち普通株流通株の9.99%を超える株式を所有しないことが条件となった。上記に基づき、2024年3月20日まで、Auctusは34,433株の株式(9.99%の実益所有権制限を満たすため)を追加発行することができ、残りの追加株式 は発行できず、Auctus承認株式証は現在普通株の購入に使用することができず、そのBシリーズ優先株は現在普通株に転換することができない。Auctus実益が所有する普通株式数には、現在発行可能な34,433株の追加株式が含まれている。上記の9.99%の制限がなければ、Auctusは4,652,493株の普通株の実益所有権を持つことになる。 |
| (11) | “B系列優先株に関する優先株指定証明書”によると、Auctusは1,398,158株B系列優先株発行済み株の唯一の保有者として、これらの株式から普通株に変換可能な株式数(現在1,398,158株)に基づいてこれらの株式を投票投票する権利がある。しかし,この優先株指定証明書によると,脚注(10)に示すように,このB系列優先株は普通株に変換できないが,変換後Auctusは実益が9.99%を超える発行済み普通株を持つ.Auctusは2024年3月20日までに645,320株の普通株を持ち、発行された普通株の9.5%を占め、上記の脚注(10)に示すように、AuctusのBシリーズ優先株は現在普通株に変換できないことを通知した。そのため、Auctusは2024年3月20日現在、Bシリーズ優先株の唯一の保有者として、当該などの株に対していかなる投票権を持つ権利もない。 |
株式補償計画に基づいて発行された証券
以下の表は、2023年12月31日現在の我々の普通株の発行を許可する補償計画(個人補償 手配を含む)に関する情報を示し、以下のようにまとめられる
| ● | すべての 以前に証券保有者によって承認された補償計画;および | |
| ● | すべての 以前に証券所有者によって承認されなかった報酬計画。 |
| 89 |
資本報酬計画情報
| 提供すべき証券数 発表日: 演習をする 卓越した 代替案(A) | 加重平均 行権価格 未平倉オプション (b) | 量 証券 残り 将来のご利用が可能です 以下の条件で発行する 株権 補償する 図は(含まれない) 反映証券 (A)欄で) | ||||||||||
| 証券保有者が承認した持分補償計画 | 1,466,892 | $ | 4.11 | 2,063,311 | (1) | |||||||
| 合計する | 1,466,892 | $ | 4.11 | 2,063,311 | ||||||||
| (1) | 2023年12月31日現在の97,824個の未帰属限定株式単位を含む。 |
| 第 項13. | いくつかの関係や関連取引、および取締役の独立性. |
取締役 独立
取締役会
私たちの取締役会はLance Alstodt(議長)、Francisco Silva、Nickolay Kukekov、パトリックF.Williams、David Rosaで構成されている。独立性の定義は、上場規則5605(A)第2条に基づき、ククコフ博士、さんウィリアムズ、ロッサさんは独立ナスダックです。
監査委員会
さんウィリアムズ(座長)、ククコフ博士、ローザさんは我々の取締役会の監査委員会のメンバーです。さんウィリアムズ、ククコフ博士、ローザさんはいずれも“独立役員”で、ナスダック証券市場上場規則第5605条(A)第2条及び取引所法令第10 A−3(B)(1)条による独立性の定義を規定している。取締役会は、S-K条例第407(D)第5項に規定する“監査委員会財務専門家”の資格を満たすことを決定した。
指名委員会
ローザさん(議長)、ククコフ博士、ウィリアムズさんはわれわれの取締役会指名委員会のメンバーです。独立性の定義5605(A)役員上場規則第2条によると、ローザさん、ククコフ博士、ウィリアムズさんはいずれも“独立ナスダック”株式市場。
報酬委員会
ククコフ博士(議長)、さんウィリアムズ、ローザさんは当社の役員報酬委員会のメンバーです。独立性の定義5605(A)(2)取締役上場規則5605に従って、ククコフ博士、さんウィリアムズ、ローザさんは“独立ナスダック”です。
| 90 |
| 第 項14. | 依頼人 会計士費用とサービス. |
Marcum LLPは、2023年12月31日と2022年12月31日までの年度に独立公認公的会計士を務めています。
以下は、2023年12月31日現在、2022年12月31日までの財政年度に提供される専門サービスと、2022年12月31日までの財政年度に提供される専門サービスについて、元独立公認会計士Marcum LLPが提供する専門サービスについて、徴収または予想される費用の概要を示す
| 2023 | 2022 | |||||||||||
| 馬ゴム法律事務所 | 馬ゴム法律事務所 | フリードマン法律事務所 | ||||||||||
| 課金(1) | $ | 101,500 | $ | 65,000 | $ | 30,000 | ||||||
| 監査関連費用(2) | 37,000 | 2,500 | 4,000 | |||||||||
| 税金(3) | - | - | - | |||||||||
| その他すべての費用(4) | - | - | - | |||||||||
| $ | 138,500 | $ | 67,500 | $ | 34,000 | |||||||
| (1) | 監査費用には、2023年12月31日と2022年12月31日までの財政年度の総合財務諸表を監査するために徴収される費用と、Form 10-Q四半期報告書に含まれる総合財務諸表の審査を簡素化するための費用とが含まれています。 |
| (2) | 監査に関連する費用には、保証および関連サービスのために徴収される費用が含まれており、これらの費用は、我々の財務諸表の監査実績およびS-1、S-3およびS-8登録報告書の提出に関連しており、“監査費用”の項では報告されていません |
| (3) | Tax 費用には、私たちのアメリカ連邦と州所得税申告書およびbr}税務提案に関連する専門サービスを準備する費用が含まれています。 |
| (4) | 他のすべての費用には、私たちの独立公認会計士によって提供される製品およびサービスの料金が含まれていますが、上記開示された費用は含まれていません。 |
監査委員会は、独立公認会計士の任命、補償、監督を担当し、独立公認会計士が提供する任意のサービスを事前に承認しておき、監査に関連しているか否かにかかわらず、各提案された採用を審査して、提供されたサービスが独立公認会計士の独立性を維持することに適合しているかどうかを決定する。上記の費用は私たちの取締役会または私たちの監査委員会によって事前に承認された。
| 91 |
第4部
| 第 項15. | 表と財務諸表明細書. |
| 証拠品番号: | ||
| 3.1 | 改正及び再編成された会社定款は、2022年12月29日事件に関する登録者の8−K表の現在の報告を引用して編入され、この文書は添付ファイル3.3として識別される | |
| 3.2 | B系列優先株指定証明書は、登録者が2022年12月29日のイベントで提出した8-Kフォームの現在の報告を参照することによって組み込まれ、この文書は添付ファイル3.4として識別される | |
| 3.3 | 規約は、2022年12月29日のイベントに関する登録者のタブ8−Kの現在の報告を引用することによって組み込まれ、この文書は添付ファイル3.5として識別される | |
| 10.1 | ライセンス契約は、2012年1月27日に、再生科学有限責任会社とBioRestorative Treatures,Inc.との間のライセンス契約(“ライセンス契約”)が、登録者が2011年12月31日までの2011年12月31日年度のForm 10−K年度報告書を参照することにより編入され、添付ファイル10.44として識別される | |
| 10.2 | ライセンス契約の修正は,2012年3月21日であり,登録者を引用して2011年12月31日までのForm 10−K年度報告書に編入され,添付ファイル10.45として識別されている | |
| 10.3 | ライセンス契約の修正は、日付が2015年11月30日であり、登録者を参照して2015年12月31日までの10-Kフォーム年次報告書に組み込まれ、このファイルは添付ファイル10.20として識別される | |
| 10.4 | BioRestorative Treatures,Inc.,Regenerative Sciences,LLCとRegenexx,LLCの間で署名されたライセンス契約に関する書簡協定は,2022年11月21日であり,参照登録者による2022年12月31日までの年間Form 10−K年次報告が組み込まれており,この文書は添付ファイル10.4として識別されている | |
| 10.5 | BioRestorative Treatment,Inc.と50 Republic Road,LLCとの間のリースは、2014年8月25日に日付があり、2014年8月25日のイベントに対する登録者の8−Kフォームの現在の報告を参照することによって組み込まれ、このファイルは添付ファイル99.1として識別される | |
| 10.6 | 賃貸借修正案は、2019年6月4日に、共和大通り50号有限責任会社とBioRestorative Treatures,Inc.との間で、添付ファイル10.37として識別された2019年12月31日までの2019年12月31日までの年間10-Kフォーム年次報告を参照登録者が統合することにより作成される | |
| 10.7 | バイオレメディエーション社2021年株式インセンティブ計画改訂* | |
| 10.8 | BioRestorative Treatment,Inc.とLance Alstodtの間の役員採用協定は、2021年3月18日であり、2021年3月18日のイベントに対する登録者の8−Kフォームの現在の報告を参照することによって組み込まれ、このファイルは添付ファイル99.2として識別される | |
| 10.9 | BioRestorative Treatment,Inc.とFrancisco Silvaによって締結された2021年3月18日の日付の幹部採用協定は、2021年3月18日の事件に対する登録者の8−Kフォームの現在の報告を参照することによって組み込まれ、この文書は添付ファイル99.3として識別される |
| 92 |
| 10.10 | BioRestorative Treatment,Inc.とLance Alstodtの間の日付が2021年3月18日である非限定株式オプション奨励協定は、2021年3月18日のイベントに対する登録者の8−Kテーブルの現在の報告を参照することによって組み込まれ、このファイルは添付ファイル99.4として識別される | |
| 10.11 | BioRestorative Treatment,Inc.とFrancisco Silvaの間の日付が2021年3月18日である非限定株式オプション奨励協定は、2021年3月18日のイベントに対する登録者の8-Kフォームの現在の報告を参照することによって組み込まれ、このファイルは添付ファイル99.5として識別される | |
| 10.12 | BioRestorative Treatment,Inc.とRobert Kristalの間の役員採用協定は、2021年11月4日* | |
| 10.13 | BioRestorative Treatment,Inc.とLance Alstodtの間の日付が2021年11月4日である非限定株式オプション奨励協定は、2021年11月4日のイベントに対する登録者の8−Kテーブルの現在の報告を参照することによって組み込まれ、このファイルは添付ファイル99.2として識別される | |
| 10.14 | BioRestorative Treatment,Inc.とFrancisco Silvaの間の2021年11月4日の非限定株式オプション奨励協定は、11月4日のイベントに対する登録者の8-Kフォームの現在の報告を参照することによって組み込まれ、ファイルは添付ファイル99.3として識別される | |
| 10.15 | BioRestorative Treatment,Inc.とNickolay Kukekovとの間の日付が2021年11月4日である非限定株式オプション奨励協定は、添付ファイル10.15として識別される2021年12月31日までの登録者の年間10-Kフォームの年間報告書を参照することによって組み込まれる | |
| 10.16 | BioRestorative Treatment,Inc.とパトリックF.Williamsの間で2021年11月4日に署名された非限定株式オプション奨励協定は、2021年12月31日までの登録者のForm 10-K年度報告書を参照することによって組み込まれ、この文書は添付ファイル10.16として識別される | |
| 10.17 | 2021年11月4日現在、BioRestorative Treatment,Inc.とDavid·ローザとの間の無保留株式オプション奨励協定は、2021年12月31日までの登録者の年度10-K表の年次報告書を参照することによって組み込まれ、この文書は添付ファイル10.17として識別される | |
| 10.18 | BioRestorative Treatment,Inc.とLance Alstodtとの間の非限定株式オプション奨励協定の修正案第1号修正案は、2021年11月4日であり、登録者を参照することにより、2021年12月31日までの10−K表年次報告書が組み込まれ、この文書が添付ファイル10.18として識別される | |
| 10.19 | BioRestorative Treatment,Inc.とFrancisco Silvaとの間の非限定株式オプション奨励協定の修正案第1号修正案は、2021年11月4日であり、登録者を参照して2021年12月31日までの10-K表年次報告書を組み込んでおり、この文書は添付ファイル10.19として識別されている | |
| 10.20 | 普通株購入株式権証は、日付が2021年11月9日であり、BioRestorative Treatment,Inc.が公開発行に基づいて発行され、登録者を引用して2021年12月31日までの10-K表年次報告によって組み込まれ、この文書は添付ファイル10.20と識別される | |
| 10.21 | 2021年11月9日にBioRestorative Treatment,Inc.がAuctus Fund,LLCに発行した普通株式購入承認証は、添付ファイル10.21として識別された登録者2021年12月31日までの年度10-Kフォームの年次報告を引用して統合された | |
| 10.22 | BioRestorative Treatment,Inc.とLance Alstodtとの間の日付が2021年12月10日である非限定株式オプション奨励協定の第2号修正案は、登録者が2021年12月31日までの年間10-K表の年次報告書を参照することによって組み込まれ、この文書は添付ファイル10.22として識別される |
| 93 |
| 10.23 | BioRestorative Treatment,Inc.とFrancisco Silvaとの間の日付が2021年12月10日である非限定株式オプション奨励協定の修正案第2号修正案は、登録者が2021年12月31日までの年間10-K表の年次報告書を参照することによって組み込まれ、この文書は添付ファイル10.23として識別される | |
| 10.24 | BioRestorative Treatment,Inc.とNickolay Kukekovとの間の非限定株式オプション奨励協定の修正案第1号修正案は、2021年12月10日であり、2021年12月31日までの登録者を参照した10−K表年次報告書が組み込まれており、文書が添付ファイル10.24として識別されている | |
| 10.25 | BioRestorative Treatment,Inc.とパトリックF.Williamsとの間の非限定株式オプション奨励協定の第1号修正案は,2021年12月10日であり,登録者が2021年12月31日までの年間10-K表の年次報告書を引用して組み込まれており,この文書は添付ファイル10.25として識別されている | |
| 10.26 | 2021年12月10日,BioRestorative Treatment,Inc.とDavid·ローザとの間の非限定株式オプション奨励協定の修正案第1号修正案は,登録者が2021年12月31日までの年間10-K表年次報告を引用して組み込まれており,この文書は添付ファイル10.26として識別されている | |
| 10.27 | BioRestorative Treatment,Inc.とRobert Paccasassi間の役員採用協定は、2021年12月29日* | |
| 10.28 | BioRestorative Treatment,Inc.とLance Alstodtとの間の奨励株式オプション奨励協定は、2023年2月17日であり、登録者を参照することによって2022年12月31日までの10-K表年次報告書が組み込まれ、この文書が添付ファイル10.28として識別される | |
| 10.29 | BioRestorative Treatment,Inc.とFrancisco Silvaの間の奨励株式オプション奨励協定は、2023年2月17日であり、登録者を参照することによって2022年12月31日までの10-K表年次報告書に組み込まれ、この文書は添付ファイル10.29として識別される | |
| 10.30 | BioRestorative Treatment,Inc.とRobert Kristalとの間の奨励株式オプション奨励協定は、2023年2月17日であり、登録者を参照することによって2022年12月31日までの10-K表年次報告書に組み込まれ、この文書は添付ファイル10.30として識別される | |
| 10.31 | BioRestorative Treatment,Inc.とRobert Paccasassiとの間の奨励株式オプション奨励協定は、2023年2月17日であり、登録者を参照することによって2022年12月31日までの10-K表年次報告が組み込まれ、この文書が添付ファイル10.31として識別される | |
| 10.32 | BioRestorative Treatment,Inc.とNickolay Kukekovの間で2023年2月17日に署名された非限定株式オプション奨励協定は、登録者が2022年12月31日までの年間10-K表の年次報告書を参照することによって組み込まれ、この文書は添付ファイル10.32として識別される | |
| 10.33 | BioRestorative Treatment,Inc.とパトリックF.Williamsの間で2023年2月17日に署名された非限定株式オプション奨励協定は、登録者が2022年12月31日までの年度のForm 10−K年度報告書を引用することによって組み込まれ、この文書は添付ファイル10.33として識別される | |
| 10.34 | 2023年2月17日現在、BioRestorative Treatment,Inc.とDavid·ローザとの間の無保留株式オプション奨励協定は、登録者が2022年12月31日までの年度10-K表の年次報告書を参照することによって組み込まれ、この文書は添付ファイル10.34として識別される |
| 94 |
| 10.35 | BioRestorative Treatment,Inc.とジョーンズ取引機関サービス有限責任会社によって締結された2023年4月14日の日付のCapital On Demand販売協定は、2023年4月14日の活動に対する登録者の8−Kフォームの現在の報告を参照することによって組み込まれ、このファイルは添付ファイル1.1として識別される | |
| 10.36 | 2024年2月13日現在、BioRestorative Treatment,Inc.とLance Alstodt*の間の奨励株式オプション奨励協定 | |
| 10.37 | 2024年2月13日現在、BioRestorative Treatment,Inc.とFrancisco Silvaの間の奨励株式オプション奨励協定* | |
| 10.38 | 2024年2月13日現在、BioRestorative Treatment,Inc.とRobert Kristalとの間の奨励株式オプション奨励協定* | |
| 10.39 | 2024年2月13日現在、BioRestorative Treatment,Inc.とRobert Paccasassi間の奨励株式オプション奨励協定* | |
| 10.40 | 2024年2月13日現在、BioRestorative Treatment,Inc.とNickolay Kukekovとの間の非限定株式オプション奨励協定* | |
| 10.41 | 2024年2月13日現在、BioRestorative Treatment,Inc.とパトリックF.Williamsの間の非限定株式オプション奨励協定* | |
| 10.42 | 2024年2月13日まで、BioRestorative Treatures,Inc.David·ローザと締結された無制限株式オプション奨励協定* | |
| 14 | 道徳的規則は、添付ファイル14として識別された2011年12月31日までの登録者の年間表10−Kの年次報告書を参照することによって組み込まれる | |
| 21 | 添付ファイル21として識別された2018年12月31日までの2018年12月31日までの年間10-K表の年次報告書を参照して設立された子会社 | |
| 23 | 独立公認会計士事務所同意* | |
| 31.1 | 最高経営責任者認証* | |
| 31.2 | 最高財務官認証* | |
| 32 | 第1350条認証** | |
| 97 | 払戻政策* | |
| 101.INS | XBRLインスタンスドキュメントをイントラネット* | |
| 101.書院 | イントラネットXBRLアーキテクチャドキュメント* | |
| 101.カール | イントラネットXBRL計算リンクライブラリ文書* | |
| 101.def | XBRLを連結してLinkbaseドキュメントを定義* | |
| 101.介護会 | XBRLタグLinkbaseドキュメントをイントラネット* | |
| 101.Pre | インラインXBRLプレゼンテーションLinkbaseドキュメント* | |
| 104 | 表紙インタラクションデータファイル(イントラネットXBRL文書に埋め込む) |
* 付随アーカイブ
***br“レターで提供されます
| 第 項16. | 表 10-K要約. |
は適用されない
| 95 |
サイン
1934年の証券取引法第13または15(D)節の要求によると、登録者は、本報告が正式に許可された署名者によってその署名を代表するように正式に促進された。
| バイオレメディエーション社です。 | ||
| 日付: 2024年3月29日 | 差出人: | /S/ ランス·アルストート |
| ランス·アルストート | ||
| CEO | ||
1934年の証券取引法の要求によると、本報告は、以下の者によって登録者として指定日に署名された。
| サイン | 容量 | 日取り | ||
| /S/ ランス·アルストート | 最高経営責任者、董事局主席総裁、役員 | 2024年3月29日 | ||
| ランス·アルストート | (CEO ) | |||
| /S/ フランシスコ·シルバ | 副研究開発と取締役 | 2024年3月29日 | ||
| フランシスコシルバ | ||||
| /S/ロバート·E·クリストファー | 最高財務官 | 2024年3月29日 | ||
| ロバート·E·クリストファー | (首席財務官と首席会計官) | |||
| /S/ ニコレ·ククコフ | 役員.取締役 | 2024年3月29日 | ||
| ニコレ(Br)ククコフ | ||||
| /S/ パトリック·F·ウィリアムズ | 取締役 | 2024年3月29日 | ||
| パトリック·F·ウィリアムズ | ||||
| /S/ David·ローザ | 役員.取締役 | 2024年3月29日 | ||
| デヴィッド·ローザ |
| 96 |
第8.財務諸表および補足データ
バイオレメディエーション社です
連結財務諸表インデックス
| ページ | |
| 独立公認会計士事務所レポート(PCAOB ID) |
F-2 |
| 2023年12月31日と2022年12月31日までの連結貸借対照表2 | F-3 |
| 2023年12月31日までと2022年12月31日までの連結業務報告書2 | F-4 |
| 2023年12月31日と2022年12月31日までの株主権益連結報告書2 | F-5 |
| 2023年12月31日と2022年12月31日までの統合現金フロー表2 | F-6 |
| 連結財務諸表付記 | F-7 |
| F-1 |
独立公認会計士事務所報告{br
Br社の株主と取締役会へ
バイオレメディエーション社です。
財務諸表に対する意見
我々 は,添付BioRestorative Treatures,Inc.(“当社”)2023年12月31日現在,2023年および2022年までの総合貸借対照表,2023年12月31日までの各年度の関連総合運営報告書,株主権益およびキャッシュフロー,および関連付記(総称して“財務諸表”と呼ぶ)を監査した。財務諸表は、貴社の2023年12月31日まで、2023年12月31日と2022年12月31日までの財務状況と、2023年12月31日までの両年度の経営業績とキャッシュフローを公平に反映しており、米国公認の会計原則に適合していると考えられます。
意見を求める根拠
これらの財務諸表は会社経営陣が担当しています。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会(SEC)とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たち はPCAOBの基準に従って監査を行います。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。会社 はその財務報告の内部統制を監査する必要はなく、私たちを招いて監査を行うこともありません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性について意見を述べるためではありません。したがって、私たちはそのような意見を表現しない。
我々のbr監査には、財務諸表の重大な誤報のリスクを評価するための実行プログラムが含まれており、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行する。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。私たちの監査には、経営陣が使用する会計原則の評価と重大な推定、財務諸表の全体的なレポートの評価も含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重大監査事項
重要な監査事項とは、財務諸表を当期監査する際に生じる事項であり、これらの事項は、監査委員会に伝達または要求され、(1)財務諸表に対して大きな意味を有する勘定または開示に関連し、(2)特に挑戦的で主観的または複雑な判断に関するものである。私たちは重要な監査事項が存在しないと確信する。
私たちは2020年から当社の監査役を務めています。
2024年3月29日
| F-2 |
バイオレメディエーション社です。
合併貸借対照表
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 資産 | ||||||||
| 現在の 資産: | ||||||||
| 現金 と現金等価物 | $ | $ | ||||||
| 投資 は有価証券形式で保有している | ||||||||
| 売掛金 | ||||||||
| 前払い料金と他の流動資産 | ||||||||
| 流動資産合計 | ||||||||
| 財産と設備、純額 | ||||||||
| 使用権資産 | ||||||||
| 無形資産、純額 | ||||||||
| 総資産 | $ | $ | ||||||
| 負債 と株主権益 | ||||||||
| 流動負債 : | ||||||||
| 売掛金 | $ | $ | ||||||
| 費用とその他の流動負債を計算しなければならない | ||||||||
| レンタル負債、当期分 | ||||||||
| 流動負債合計 | ||||||||
| レンタル負債、当期分を差し引く | ||||||||
| 総負債 | ||||||||
| 支払いを受ける とあるか | ||||||||
| 株主権益: | ||||||||
| 優先株 ,$額面価値ライセンス株; | ||||||||
| Bシリーズ転換可能優先株;株式を指定しそしてそれぞれ2023年と2022年12月31日に発行·発行された株 | ||||||||
| 普通株 、$額面価値ライセンス株;何度も何度も株式はそれぞれ2023年12月31日、2023年12月31日、2022年12月31日に発行された | ||||||||
| 追加実収資本 | ||||||||
| 累積赤字 | ( | ) | ( | ) | ||||
| 株主権益合計 | ||||||||
| 総負債と株主権益 | $ | $ | ||||||
付記はこれらの連結財務諸表の構成要素である。
| F-3 |
バイオレメディエーション社です。
合併の運営報告書
| 年度まで | ||||||||
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 収入、 純額 | $ | $ | ||||||
| 運営費用 : | ||||||||
| 研究開発 | ||||||||
| 通常 と管理 | ||||||||
| 運営費総額 | ||||||||
| 運営損失 | ( | ) | ( | ) | ||||
| その他 収入: | ||||||||
| 利息収入 | ( | ) | ( | ) | ||||
| PPPローンの減免を受ける | ( | ) | ||||||
| 補助金 収入 | ( | ) | ( | ) | ||||
| その他 収入 | ( | ) | ( | ) | ||||
| その他収入合計 | ( | ) | ( | ) | ||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| 1株当たり純損失 −基本損失と希釈損失 | $ | ) | $ | ) | ||||
| 加重 未償還普通株式平均- | ||||||||
| 基本版と希釈版 | ||||||||
付記はこれらの連結財務諸表の構成要素である。
| F-4 |
バイオレメディエーション社です。
合併 株主権益変動表
2023年12月31日と2022年12月31日までの年度
| シリーズ Aオープンカー | Bシリーズオープンカー | その他の内容 | ||||||||||||||||||||||||||||||||||
| 優先株 | 優先株 | 普通株 株 | 支払い済み | 積算 | ||||||||||||||||||||||||||||||||
| 株 | 金額 | 株 | 金額 | 株 | 金額 | 資本 | 赤字.赤字 | 合計する | ||||||||||||||||||||||||||||
| 残高 -2022年1月1日 | $ | $ | $ | $ | $ | ( | ) | $ | ||||||||||||||||||||||||||||
| A系列転換優先株と交換するためにB系列転換可能優先株を発行する | ( | ) | ( | ) | ||||||||||||||||||||||||||||||||
| 許可排他性プロトコルに関する承認 | - | - | - | |||||||||||||||||||||||||||||||||
| B系列転換可能優先株を普通株に変換する | - | ( | ) | ( | ) | |||||||||||||||||||||||||||||||
| 株式報酬: | ||||||||||||||||||||||||||||||||||||
| 制限された 個の共有ユニット | - | - | ||||||||||||||||||||||||||||||||||
| オプション | - | - | - | |||||||||||||||||||||||||||||||||
| 普通株 株 | - | - | ||||||||||||||||||||||||||||||||||
| 純損失 | - | - | - | ( | ) | ( | ) | |||||||||||||||||||||||||||||
| 残高 -2022年12月31日 | ( | ) | ||||||||||||||||||||||||||||||||||
| 株式報酬: | ||||||||||||||||||||||||||||||||||||
| 制限された 個の共有ユニット | - | - | ||||||||||||||||||||||||||||||||||
| オプション | - | - | - | |||||||||||||||||||||||||||||||||
| 普通株 株 | - | - | ||||||||||||||||||||||||||||||||||
| B系列転換可能優先株を普通株に変換する | - | ( | ) | ( | ) | |||||||||||||||||||||||||||||||
| 発行 と普通株の販売は、発行コストを差し引く | - | - | ||||||||||||||||||||||||||||||||||
| 純損失 | - | - | - | ( | ) | ( | ) | |||||||||||||||||||||||||||||
| 残高 -2023年12月31日 | $ | $ | $ | $ | $ | ( | ) | $ | ||||||||||||||||||||||||||||
付記はこれらの連結財務諸表の構成要素である。
| F-5 |
バイオレメディエーション社です。
統合現金フロー表
| 年度まで | ||||||||
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 経営活動からのキャッシュフロー: | ||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| を調整し、純損失と経営活動で使用されている現金純額を照合する: | ||||||||
| 減価償却と償却 | ||||||||
| 配当金と利息収入 | ( | ) | ( | ) | ||||
| 株に基づく報酬 | ||||||||
| PPPローンの猶予権を獲得する | ( | ) | ||||||
| 非現金レンタル料 | ||||||||
| 経営資産と負債の変化 : | ||||||||
| 売掛金 | ( | ) | ( | ) | ||||
| 前払い料金と他の流動資産 | ||||||||
| 売掛金 | ||||||||
| 費用とその他の流動負債を計算しなければならない | ( | ) | ||||||
| レンタル責任 | ( | ) | ( | ) | ||||
| 純額 経営活動で使用した現金 | ( | ) | ( | ) | ||||
| 投資活動によるキャッシュフロー: | ||||||||
| 有価証券を販売する | ||||||||
| 有価証券を購入する | ( | ) | ( | ) | ||||
| 無形資産を購入する | ( | ) | ||||||
| 設備を購入する | ( | ) | ( | ) | ||||
| 純額 投資活動から提供される現金 | ( | ) | ||||||
| 資金調達活動によるキャッシュフロー: | ||||||||
| ATM取引における普通株発行の純収益 | ||||||||
| 普通株式の直接発行を登録して得られた純額 | ||||||||
| 純融資活動から提供された現金 | ||||||||
| 現金と現金等価物純減少 | ( | ) | ( | ) | ||||
| 現金と現金等価物--年明け | ||||||||
| 現金と現金等価物-年末 | $ | $ | ||||||
| 補足 キャッシュフロー情報開示: | ||||||||
| 年内に支払う現金 は: | ||||||||
| 利子 | $ | $ | ||||||
| 所得税 税 | $ | $ | ||||||
| 非現金投資と融資活動: | ||||||||
| 無形資産対価格として発行される権証 | $ | $ | ||||||
付記はこれらの連結財務諸表の構成要素である。
| F-6 |
バイオレメディエーション社です
連結財務諸表付記
注 1-組織、流動資金、業務運営
企業の歴史
Biorestorative Treatings,Inc.にはStem Pearls,LLC(“Stem Pearls”)の完全子会社である.バイオレメディエーション会社とその子会社を総称して“BRT”または“会社”と呼ぶ。
2022年12月23日、同社はネバダ州に会社規約を提出することにより、デラウェア州からネバダ州に再登録した。会社の再設立は法定合併の形で行われた。
流動性
添付されている総合財務諸表は、当社が継続的な経営企業として作成することにより作成され、正常業務過程における資産の現金化および負債の償還が期待されています。2023年12月31日まで、当社の純損失$
これらの財務諸表の発行日までの手元現金に基づいて、$を含む
上記の既存資金は、当社がその開発活動を完全に完成させたり、利益運営を実現したりするのに十分ではありません。当社が必要な追加融資をタイムリーに得ることができない場合、当社はその開発、マーケティング、販売促進活動を削減しなければならない可能性があり、これは当社の業務、財務状況、経営業績に重大な悪影響を与え、最終的に当社に運営停止と清算を迫る可能性があります。
添付されている総合財務諸表はアメリカ公認会計原則(“GAAP”)によって作成され、このような会計原則は当社を持続経営企業として持続的に経営し、正常な業務過程で資産と負債を清算することを目的としている。連結財務諸表に記載されている資産や負債の帳簿価値は、必ずしも現金化または決済価値を代表するとは限らない。添付されている連結財務諸表には必要な調整は一切含まれておらず、会社が経営を継続できなければ。
業務 運営
BRT は細胞と組織方案を利用して治療製品と医療療法を開発し、主に成人幹細胞に関連している。BRTのサイトはwww.biorestorative.comである.ウェブサイトに含まれているか、またはそれに関連する情報は、参照によって添付の財務諸表またはこれらの脚注に組み込まれることを意図していない。BRTは現在“brtxDISC”と呼ばれるディスク/脊柱計画を開発している。その主要な細胞療法候補はBRTX-100患者の骨髄から収集した自己(または個人独自の)培養間葉系幹細胞から作製した製品である。この製品は,疼痛を非手術的に治療する腰椎椎間板疾患,あるいは外科手術としての無料治療に用いることを目的としている。BRTはまた,褐色脂肪(脂肪)を用いて2型糖尿病,肥満,その他の代謝障害を治療するプラットフォーム技術の研究に取り組んでおり,このイニシアティブをThermoStem計画と呼んでいる。さらに、BRTは、細胞および/または他の治療製品または材料を脊柱および椎間板または他のbrの潜在的部位に送達することを意図した針システムである特許文献2の許可を得ている。
注: 2-重要会計政策の概要
デモベース
添付された総合財務諸表はすでに公認会計原則に基づいて作成された。以下に提供する重要な会計政策概要 は、当社の合併財務諸表の理解を支援することを目的としている。このような連結財務諸表と付記は会社経営陣の陳述であり、経営陣はその完全性と客観性に責任を負う。
| F-7 |
統合原則
連結財務諸表には、当社とその完全子会社Stem Pearlsの勘定が含まれています。すべての企業間口座と取引は合併でキャンセルされました。
見積もりを使った
公認会計原則に基づいて総合財務諸表を作成するには、管理層が資産、負債、収入及び支出に影響を与える報告金額の推定、判断と仮定、及び財務諸表関連付記に開示された金額を作成する必要がある。当社の見積もりと仮説は、歴史的経験、既知または予想される傾向と、それが合理的と思われる様々な他の仮定に基づいています。将来の事件やその影響が正確に決定できないため、実際の結果はこれらの見積もりとは異なる可能性があり、会社の将来の業績が影響を受ける可能性がある。
再分類する
一部の前期貸借対照表、経営報告書、キャッシュフロー表の金額は、会社の2023年度の列報に適合するように再分類されました。しかし、これらの再分類は、会社が以前に報告した純損失には何の影響もありません。
濃度.濃度
当社を集中信用リスクに直面させる可能性のある金融商品には、金融機関の現金口座が含まれています。当社の現金口座への預金は連邦預金保険引受限度額$を超えています
当社の再許可に関する特許権使用料は、2023年12月31日と2022年12月31日までの年間で当社の収入の100%を占めています。以下の“収入確認”を参照されたい。
収入 確認
会社は会計基準編纂(“ASC”)606に基づいて収入を会計計算した顧客と契約を結んだ収入 .
当社は幹細胞治療会社(“SCTC”)と二零一二年一月に締結したライセンス契約に基づいて全収入を取得しました。2022年11月、当社の同協定下での許可権は独占ライセンスとなった。ライセンス契約によれば、SCTCは、幹細胞ディスクプログラムに関連するいくつかの知的財産権を使用する許可を当社に付与し、当社は、SCTCに使用の再許可を付与し、米国およびケイマン諸島のある場所でその許可を使用する特定の知的財産権を第三者に付与する。SCTCは再許可 を考慮して光ディスクプログラムに従って会社に印税を支払うことに同意した。
会社の契約取引価格はそれぞれ異なる履行義務に割り当てられ、契約履行義務を履行する際に収入として確認される。当社の契約は1つの履行義務のみであり、契約中の他の約束と分離できないため、区別はありません。損失リスクが顧客に移行した後、会社の履行義務は履行される。会社が収入を確認する時間は、印税支払いを受けた時間とは異なる可能性があります。特許権使用料支払いを受け取る前に収入が確認され,会社
が特許権使用料支払いを無条件に取得する権利を持っている場合には,売掛金が記録される.あるいは、特許権使用料が関連サービスの提供よりも先に支払われた場合、会社は、義務が履行されるまで記録を繰延する。会社は2023年12月31日および2022年12月31日までの年度内に確認した
実用的方便
ASC 606の一部として、同社は、以下を含むいくつかの実際的な便宜策をとっている
| ● | 重大融資構成要素-会社は約束した対価格金額 重大融資構成要素の影響を調整しないため、会社は、契約開始時に、会社が顧客に約束した貨物またはサービスを譲渡してから、顧客がその貨物またはサービスのために支払うまでの時間は、1年以下である。 |
| ● | 未履行 履行義務−期限1年未満の契約に関するすべての履行義務 ;当社は、ASC主題606に規定されているオプション免除を適用することを選択しているため、報告期間終了時に未履行または部分的に履行された履行義務に割り当てられた取引総額 価格を開示する必要はない。 |
| ● | 開票権利 -会社は会社がこれまでに完成した業績が顧客の価値に直接対応する金額を顧客から得る権利があり, 社は実体が領収書を発行する権利がある金額で収入を確認することができる. |
| F-8 |
現金 と現金等価物
社は購入時満期日が3ヶ月以下のすべての高流動性投資を現金等価物と見なしている。
売掛金
売掛金は契約金額から当期予想信用損失準備金を差し引いて入金される。この準備金は、売掛金ポートフォリオで遭遇する可能性のある予想信用損失に対する当社の最適な推定である。経営陣は、既存の経済状況、顧客の財務状況、信用損失の歴史的傾向、および期限を超えた口座の金額と期限の継続的な審査に基づいて信用損失を推定する。残高が回収できないと判断された場合、会社は売掛金を当期予想信用損失準備金から解約する。“会社”ができた
財産 と設備
財産と設備はコストで入金される。減価償却は一般に直線法を用いて関連資産の予想耐用年数を計算する至れり尽くせり
レンタル権 は、(I)資産の使用年数または(Ii)残りのレンタル期間内の償却を改善し、少ない者を基準とする。メンテナンスとメンテナンス は発生時に費用を計上する.物件及び設備の付加価値が資産の使用年数を延長する場合、当社は物件及び設備の付加価値をコストを占めて資本化すべきである。財産および設備を廃棄またはその他の方法で処分する場合、コストおよび減価償却は勘定から抹消され、それによって生じる収益または損失(ある場合)は運営に反映される。
無形資産
会社は米国会計基準350条に従ってコスト別無形資産を抽出した無形資産-営業権とその他それは.確定された存続無形資産 使用直線法は、その推定耐用年数内に償却され、この方法は、資産のキャッシュフローが予想される期間を決定することによって決定される。
長期資産減価
イベントや状況変化が発生して長期資産の帳簿価値が回収できない可能性があることを示す限り、当社は定期無形資産および経営リースからの使用権資産を含む長期資産を審査し、減値を計算する。これらの資産の回収可能性は,資産に関する業務の予測未割引キャッシュフローと
帳票金額を比較することで決定される.その業務がその資産の帳簿価値を回収できないと判定された場合、まずこれらの資産を
に減記し、その後、その業務の他の長期資産を公正価値に減記する。公正価値は現金流量を割引するか評価価値によって確定し、資産の性質によって決定される。2023年12月31日と2022年12月31日までの年間で
が決定した
金融商品の公正価値
公正価値は、計量日の市場参加者間の秩序ある取引において資産の売却または負債の移転によって受信された金額 と定義され、以下の3つのカテゴリのうちの1つの投入を用いて計量される
レベル 1は、アクティブ市場で同じ資産または負債にアクセスする能力がある未調整見積もりに基づいています。このような物品の推定値は多くの判断を必要としない。
レベル2計量は、アクティブ市場における同様の資産または負債の見積もり、非アクティブ市場における同じまたは同様の資産または負債の見積もりまたは資産または負債に見える見積もり以外の市場データに基づく。
レベル3計量は、市場活動のサポートが少ないか、またはないか、資産または負債の公正価値に重大な意味を有する観察不可能なデータに基づく。
| F-9 |
会社は現金及び現金等価物、有価証券投資、売掛金、売掛金及び売掛金を考慮して金融商品の定義に適合する。2023年12月31日および2022年12月31日まで、現金および現金等価物、保有する有価証券投資、売掛金、売掛金および売掛金の帳簿金額は、それらの発生と予想現金または支払いとの間の時間が相対的に短いため、その公正価値 に近い。
| 報告日の公正価値計測 使用: | ||||||||||||||||
| 公正価値 | 同じ負債の活発な市場オファー (レベル1) | 重要な その他観察可能な入力(レベル2) | 重要な 観察できない入力(レベル3) | |||||||||||||
| 資産: | ||||||||||||||||
| 2023年12月31日までの有価証券 | $ | $ | ||||||||||||||
| 2022年12月31日までの有価証券 | $ | $ | ||||||||||||||
当社が確認した配当金および利息収入の合計は、2023年12月31日および2022年12月31日までの年間で$となります
1株当たり純損失は純損失を除いた期間内に発行された普通株の加重平均株式数で計算される。 株式オプションと引受権証の希薄効果(あれば)は在庫株方法を用いて計算される。IF変換の 方法により,発行されたすべての変換可能優先株は期首または発行時(遅い場合)に普通株とみなされる.普通株等価物の影響は損失の面で逆償却されているため、オプション、株式承認証、転換可能優先株 は当社で述べた期間の普通株1株当たりの純損失の計算には含まれていない。
| 年度まで | ||||||||
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 株式オプション | ||||||||
| 株式承認証 | ||||||||
| 帰属しないRSU | ||||||||
| 転換可能優先株 | ||||||||
社は,権益付与ツールの公正価値に基づいて獲得したサービスコストを計測する.報酬の公正価値は、付与された日に計量され、その後、報酬と引き換えにサービスを提供する必要がある期間(通常は授権期間)が直線的に確認される。当社はブラック·スコアーズオプション定価モデルを用いて株式分類 権証とオプションの公正価値を計算した。オプション没収先の支出金額としての減少 は発生したと記録している.
所得税 税
繰延税金資産および負債は、既存資産および負債金額とそのそれぞれの税金ベースとの差異による将来の税金項目の影響を総合財務 レポートに記載して確認した。繰延税金資産は、税項損失と信用繰越、及び負債はすべて制定税率に従って計量され、このような一時的な差額の回収或いは決済を期待する年度の課税収入に適用されることが予想される。税率変動が繰延税金資産や負債に及ぼす影響は、公布日を含む期間の収入で確認されている。
| F-10 |
会社は、連結財務諸表または納税申告書に含まれているイベントの予想される将来の税務結果の繰延税金資産および負債を確認することを要求するASC 740“所得税”を使用する。当社は貸借対照法を用いて資産と負債の計税基礎と関連財務金額との差額を計算し、現行制定された税率を用いて所得税を計算する。繰延税金資産が“もっと可能性が高い”と現金化できない場合には、推定準備を計上する。
“より可能性がある”という敷居に該当する が税務倉位を確定しない場合、会社は連結財務諸表で税務倉位を確定しないというメリットを確認します。当社のやり方は、総合経営報告書で所得税支出の不確定税務状況に関する利息と罰金(あれば)を確認することです。
賃貸借証書
Br社は1つの手配が開始時にレンタルであるかどうかを決定する。経営リース総合貸借対照表に計上されている経営リース使用権(“ROU”) 資産と経営賃貸負債。
ROU 資産は会社がリース期間内に対象資産を使用する権利を表し,リース負債はリースによるリース金の支払い義務 を表す.運営単位資産および負債は,開始日にレンタル期間内のリース支払いの現在値 によって確認される.当社の大部分の借款は暗黙的な金利を提供していないため、当社が採用している逓増借款金利は、賃貸支払い類似期限に基づく担保借款の推定金利である。レンタルROU資産を経営するには、レンタルインセンティブを含まず、支払い済みのレンタル支払いも含まれています。当社のレンタル条項 には、選択権の行使を合理的に決定した場合に、レンタル契約を延長または終了するオプションが含まれています。レンタル支払いのレンタル料金はレンタル期間内に直線的に確認します。
最近は会計公告が採用されている
2016年6月、FASBはASU 2016-13を発表した金融商品である信用損失はそれは実体が歴史経験、現在の状況及び合理的かつ支持可能な予測に基づいて、報告日に超過コストで計量されたすべての金融資産の予想信用損失を推定し、売掛金を含むことを要求する。当社は2023年1月1日に本ガイドラインを採用しました。この会計基準の採用は会社の連結財務諸表に実質的な影響を与えていない。
注: 3-財産と設備
財産および装置には以下のものが含まれる
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 医療設備 | $ | $ | ||||||
| 家具と固定装置 | ||||||||
| コンピュータソフトウェア及び装置 | ||||||||
| 事務設備 | ||||||||
| 製造設備 | ||||||||
| 賃借権改善 | ||||||||
| 減算:減価償却累計 | ( | ) | ( | ) | ||||
| 財産と設備、純額 | $ | $ | ||||||
2023年12月31日までと2022年12月31日までの年間償却費用総額は$
注: 4-無形資産
社はSCTC(改訂された)とのライセンスプロトコル(“SCTCプロトコル”)の一方である.SCTCプロトコルによれば、当社は、ある種の細胞培養方法の使用または再許可、および特定の細胞および/または細胞製品を椎間板および/または脊柱
(および身体の他の部位)に管理するために、特定の細胞および/または細胞製品を椎間板および/または脊柱
(および身体の他の部位)に管理するために、SCTCによって付与されたグローバル(アジアおよびアルゼンチンを除く)の独占的、特許権使用料を取得する許可を取得する。SCTCとのライセンス契約によると、会社はいくつかの業績マイルストーン(または業績マイルストーンに代わる配当)を満たさなければならず、ディスク/脊柱技術における独占的な権利を維持することができる。br社はこれらの業績マイルストーンのうち3つ目をタイムリーに満たすことができなかった(2022年2月までに達成する必要がある)。したがって,
これらの権利は非排他的となる.しかし、会社はSCTCと修正された合意に達し、その合意に基づいて会社は#ドルを支払った
| F-11 |
2017年2月,同社は米国食品医薬品局(FDA)の許可を得て,第2段階臨床試験を継続することができた。2022年2月、同社は、米国特許商標局が、同社BRTX-100臨床プロジェクトに関する特許出願の許可通知を発表したと発表した。この特許は2022年3月に発行される。
無形資産 は以下のものを含む:
| 特許 と商標 | 許可証 | 累計償却 | 合計する | |||||||||||||
| 2022年1月1日現在の残高 | $ | $ | $ | ( | ) | $ | ||||||||||
| ライセンスを得るための譲渡を考慮して排他的である | - | - | ||||||||||||||
| 償却費用 | - | - | ( | ) | ( | ) | ||||||||||
| 2022年12月31日現在の残高 | ( | ) | ||||||||||||||
| 償却費用 | - | - | ( | ) | ( | ) | ||||||||||
| 2023年12月31日現在の残高 | $ | $ | $ | ( | ) | $ | ||||||||||
| 加重平均2023年12月31日残余償却期間(単位:年) | ||||||||||||||||
無形資産の償却には以下の内容が含まれる
| 特許 と商標 | 許可証 | 累計償却 | ||||||||||
| 2022年1月1日現在の残高 | $ | $ | $ | |||||||||
| 償却費用 | ||||||||||||
| 2022年12月31日現在の残高 | ||||||||||||
| 償却費用 | ||||||||||||
| 2023年12月31日現在の残高 | $ | $ | $ | |||||||||
今後5年間の販売費用 は以下の通りである
| 12月31日までの年度、 | 合計する | |||
| 2024 | $ | |||
| 2025 | ||||
| 2026 | ||||
| 2027 | ||||
| 2028 | ||||
| $ | ||||
| F-12 |
注: 5-費用とその他の流動負債を計算しなければならない
計算すべき費用と他の流動負債には:
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| ボーナスを計算する | $ | $ | ||||||
| 一般と行政費用を計算する | ||||||||
| 計算すべき費用とその他の流動負債総額 | $ | $ | ||||||
注: 6-支払手形
以下は、2023年12月31日と2022年12月31日終了年度の支払手形活動の概要である
| 優秀で2022年1月1日 | $ | |||
| 発行する. | ||||
| 許してやる | ( | ) | ||
| 未返済、2022年12月31日 | ||||
| 発行する. | ||||
| 許してやる | ||||
| 未完成、2023年12月31日 | $ |
注: 7-株主権益
系列 A優先株
2021年11月8日、会社の公開発行について、会社取締役会は指定及び発行を許可する決議を採択した会社の優先株の株式、$1株当たり額面は、A系列優先株(“Aシリーズ”)に指定されています。A系列の清算優先権は#ドルである
Bシリーズ優先株
2022年9月8日から会社はB系列の条項がA系列の条項とほぼ同じである点は,B系列を普通株に変換する際の会社普通株に対する実益所有権の制限と,B系列の投票権に対する制限である
配当をする
Bシリーズ株保有者が取締役会で発表する権利がある場合、Bシリーズ株が転換可能な普通株数に基づいて、普通株を保有する保有者と同等の割合で配当を得ることができる。
| F-13 |
投票権 権利
B系列株主は、会社株主会議で会社株主会議で議決または代替株主会議で議決されたすべての事項について投票する権利があり、そのような会議で投票する権利があり、またはそのような同意に基づいて、単独のカテゴリとしてではなく、そのような同意に従って投票する権利のある普通株および他の優先株の所有者と共に投票するBシリーズ株の1株当たり株式
投票を行う権利がある。法律のほかに規定があります。
Bシリーズ所有者がBシリーズの株式1株当たり投票する権利がある投票数は、そのBシリーズが普通株式に変換できる株式数に等しくなければなりません。しかし,いずれの場合もB系列所有者は投票を超える権利がないことを前提としている
転換する
オプション
変換-
自動
変換-B系列所有者の普通株に対する利得
所有権を以下に下げるイベントが時々発生する
2022年10月25日AuctusはBシリーズ株を普通株株。今回の変換後、B系列の余剰流通株数は.
2023年4月4日AuctusはBシリーズ株を普通株株。2023年12月31日現在、このような転換を実施した後、Bシリーズ余剰流通株数は.
2021年株式インセンティブ計画
2021年3月18日、会社取締役会は“2021年生物リハビリテーション株式会社株式インセンティブ計画”(略称“2021年計画”)を採択した。2021年には2021年8月17日に会社株主の承認を得る予定です。2021年計画によると、共有 普通株は当初、株式オプション、制限株式単位、制限株式、株式付加権、その他のインセンティブ奨励の付与によって発行されていた。2021年12月10日、会社取締役会は、普通株式の認可発行数を増加させる改正案を承認した至れり尽くせりそれは.この改訂 は2022年11月3日に当社の株主承認を得ます。2023年7月13日、会社取締役会は2021年計画の修正案を承認し、普通株の認可発行数を増加させた至れり尽くせりそれは.この 改訂は2023年9月13日に会社株主の承認を得た
補償性 普通株式発行
当社は2022年12月31日までの年間で発行したすぐに帰属する普通株、総価値は$
普通株売上高
2023年4月、当社はJones Trading Institution Services LLC(“販売エージェント”)とオンデマンド資本販売協定を締結し、この合意により、当社は現在、販売エージェントを通してその普通株式を随時発行および販売する能力があり、総発行価格は最高約$に達する
2023年7月13日、同社は販売した何人かの機関のバイヤーと認可投資家に普通株
を登録して直接発行し,発行価格は$とする一株ずつです。今回の発行は2023年7月13日に終了し、純収益は1ドルだった
| F-14 |
権証 とオプション推定値
社はBlack-Scholesオプション定価モデルを用いて付与された権証とオプションの公正価値を計算した。非従業員に発行される引受権証とオプションの期待期間は契約期間であり、従業員及び取締役に発行されるオプションの期待期限は、付与されるオプションが未償還と予想される期間とする。当社は“簡略化” 方法を用いて“普通”従業員オプション付与の期待期限を試算している。当社が使用している予想変動率数字は、一定期間の歴史的波動性の回顧に基づいており、この変動率は、評価ツールの業界内での地位が類似している上場企業の期待寿命に相当する。無リスク金利は米国債ゼロ金利債券の暗黙的収益率に基づいて決定され、残り期限は推定ツールの期待期限と一致する である。
授権書 活動の概要
以下に2023年12月31日までの年間権証活動の概要を示す
| 重みをつける | ||||||||||||
| 重みをつける | 平均値 | |||||||||||
| 平均値 | 残り | |||||||||||
| 量 | トレーニングをする | 命 | ||||||||||
| 株式承認証 | 値段 | 年単位で | ||||||||||
| 未返済、2023年1月31日 | $ | |||||||||||
| 授与する | ||||||||||||
| 鍛えられた | ||||||||||||
| 期限が切れる | ( | ) | ||||||||||
| 未返済、2023年12月31日 | $ | |||||||||||
| 行使可能、2023年12月31日 | $ | |||||||||||
| この年度までに | ||||
| 2022年12月31日 | ||||
| 無リスク金利 | % | |||
| 所期期間(年) | ||||
| 予想変動率 | % | |||
| 配当を期待する | % | |||
2022年12月31日までに年度内に承認株式証が付与された加重平均推定公正価値を$とする令状によると。当社は2023年12月31日まで年度内に株式承認証を発行していません。
| F-15 |
| 未償還株式証明書 | 引受権証 を行使できる | |||||||||||||
| 重みをつける | ||||||||||||||
| 卓越した | 平均値 | 練習可能である | ||||||||||||
| トレーニングをする | 番目 | 残存寿命 | 番目 | |||||||||||
| 値段 | 株式承認証 | 年内に | 株式承認証 | |||||||||||
| $ | ||||||||||||||
| $ | ||||||||||||||
| $ | ||||||||||||||
| $ | ||||||||||||||
| $ | ||||||||||||||
| $ | ||||||||||||||
| $ | ||||||||||||||
| $ | ||||||||||||||
| $ | ||||||||||||||
株 オプション
| 重みをつける | ||||||||||||||||
| 重みをつける | 平均値 | |||||||||||||||
| 平均値 | 残り | |||||||||||||||
| 番目 | トレーニングをする | 命 | 固有の | |||||||||||||
| オプション | 値段 | 年内に | 価値がある | |||||||||||||
| 未返済、2023年1月31日 | $ | |||||||||||||||
| 授与する | ||||||||||||||||
| 鍛えられた | ||||||||||||||||
| 没収される | ( | ) | ||||||||||||||
| 未返済、2023年12月31日 | $ | $ | ||||||||||||||
| 行使可能、2023年12月31日 | $ | $ | ||||||||||||||
2023年12月31日まで及び2022年12月31日まで年度内に授受される購入権の加重平均授受日公正価値は約 $であるそして$それぞれ,である.
| オプション 未完了 | 行使可能オプション | |||||||||||||
| 重みをつける | ||||||||||||||
| 卓越した | 平均値 | 練習可能である | ||||||||||||
| トレーニングをする | 番目 | 残存寿命 | 番目 | |||||||||||
| 値段 | オプション | 年内に | オプション | |||||||||||
| $ | ||||||||||||||
| $ | ||||||||||||||
| F-16 |
| 年度まで | ||||||||
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 無リスク金利 | % | % | ||||||
| 所期期間(年) | ||||||||
| 予想変動率 | % | % | ||||||
| 配当を期待する | % | % | ||||||
制限された株式単位
“2021年計画”によると、会社は従業員、コンサルタントまたは非従業員取締役(“合資格受給者”)に制限的株式単位(“RSU”)を付与することができる。合格受助者に付与されたRSUの数、条項、条件は、2021計画管理者が個人状況に応じて決定される。割り当て日に、当社は合資格受給者に当社普通株の無制限、完全譲渡可能株式(またはそのような現金株式の公平時価)を発行し、各brの既得および没収不可能な株式と交換する。
2023年12月31日までの非帰属RSUの概要は以下のとおりである
| 株式数: | ||||
| 2023年1月1日現在帰属していません | ||||
| 授与する | ||||
| 既得 | ( | ) | ||
| 没収される | ||||
| 2023年12月31日現在帰属していません | ||||
株に基づく報酬費用
| 年度まで | 認識できない は位置する | 重み 平均残り 償却する | ||||||||||||||
| 十二月三十一日 | 十二月三十一日 | 期間 | ||||||||||||||
| 2023 | 2022 | 2023 | (年) | |||||||||||||
| 一般と行政 | $ | $ | $ | |||||||||||||
| 合計する | $ | $ | $ | |||||||||||||
注: 8-所得税
同社はその連邦納税申告書とニューヨーク州納税申告書をその“主要”税務管轄区域と確定した。会社
は2018年12月31日までの納税年度にこれらの税務機関の所得税収入審査を受けなくなりました。会社は以前のニューヨーク州所得税申告書類を審査し、前年の申告書を修正し、
分担をゼロから更に変更すると結論しました
2023年12月31日現在、同社は約$
第382条の制限により約$
| F-17 |
会社はまだ2023年12月31日までの年度を正式に分析していないが、将来このような営業純損失と税項控除を使用する能力が年間制限されていると信じており、これは国税法第 382と383節の制御条項が変化し、これらの繰延税金資産を実現する能力に深刻な影響を与える。
管理層は、既存のプラスおよび負の証拠を評価して、将来、既存の繰延税金資産を使用することを可能にするのに十分な課税収入が生じるかどうかを推定する。評価の重要な客観的負の証拠の1つは,2023年12月31日までの3年間に発生した累積損失 である。2023年12月31日までの間に、当社は繰延税金資産残高入金について全額評価値(Br)の減値準備を提出した。経営陣は経営業績 が十分な課税収入を生じず、いかなる繰延税金資産を現金化する可能性が高いと信じているからである。
本申請の日まで、当社は2023年の連邦と州企業所得税申告書を提出していません。会社は実行可能な状況でこのような書類をできるだけ早く保存することを望んでいる。
2023年12月31日、2023年12月31日、2022年12月31日までの繰延税項目の純資産、負債、減額準備の概要は以下の通り
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 繰延納税資産: | ||||||||
| 純営業損失繰越 | $ | $ | ||||||
| 株に基づく報酬 | ||||||||
| 研究と開発コスト | ||||||||
| 積分の研究と開発 | ||||||||
| ROU 資産 | ||||||||
| その他 DTA | ||||||||
| 繰延税金資産合計 | ||||||||
| 繰延納税義務: | ||||||||
| 減価償却 | ( | ) | ( | ) | ||||
| 無形資産 | ( | ) | ( | ) | ||||
| レンタル責任 | ( | ) | ||||||
| その他 DTL | ( | ) | ||||||
| 繰延負債合計 | ( | ) | ( | ) | ||||
| 純繰延税金資産 | ||||||||
| 評価値 免税額 | $ | ( | ) | $ | ( | ) | ||
| 繰延納税資産は,推定準備後の純額を差し引く | $ | $ | ||||||
| 退役軍人事務部の を変更する | $ | ( | ) | $ | ( | ) | ||
2023年12月31日と2022年12月31日までの所得税引当(割引)には、以下のものが含まれています
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| 連邦政府: | ||||||||
| 現在のところ | $ | $ | ||||||
| 延期する | ||||||||
| 州br地元: | ||||||||
| 現在のところ | ||||||||
| 延期する | ||||||||
| 所得税引当(福祉)合計 | $ | $ | ||||||
| F-18 |
A 2023年12月31日と2022年12月31日までの年度、法定連邦所得税優遇と実際の税収割引の入金状況は以下の通りです
| 2023 | 2022 | |||||||
| 連邦法定利率 | % | % | ||||||
| 国の金利純額,FRB収益純額 | % | % | ||||||
| 恒久的差異 | - | % | - | % | ||||
| 税金の払い戻し調整 | - | % | % | |||||
| 見積もり免税額を変更する | - | % | - | % | ||||
| % | % | |||||||
注: 9-賃貸借証書
会社は賃貸契約の側です
経営的賃貸に分類された賃貸賃貸負債を計量する場合、当社は2019年8月1日の推定増額借入金金利を用いて賃貸支払いを割引する。加重平均増額借入金金利は
次の表に純レンタルコストとその他の補足レンタル情報を示します
| 年度まで | ||||||||
| 十二月三十一日 | ||||||||
| 2023 | 2022 | |||||||
| レンタル料 | ||||||||
| レンタルコスト(リース支払いコスト)を経営する | $ | $ | ||||||
| 純賃貸コスト | $ | $ | ||||||
| レンタル経営-キャッシュフローの経営(固定支払い) | $ | $ | ||||||
| 経営リース-経営キャッシュフロー(負債削減) | $ | $ | ||||||
| 非現在のレンタル-資産を使用する権利 | $ | $ | ||||||
| 流動負債-経営リース負債 | $ | $ | ||||||
| 非流動負債−リース負債 | $ | $ | ||||||
未来 2023年12月31日までの次の年、レンタル残り期間を経営する賃貸キャンセル不可最低支払金額 :
| 会計年度 年 | 運営 借約 | |||
| 2024 | $ | |||
| 将来の最低賃貸支払い総額 | ||||
| 利息を表す金額 | ( | ) | ||
| 将来の最低賃貸支払純資産の現在価値 | $ | |||
| F-19 |
注: 10-後続事件
権利証 の行使と発行
2024年2月6日、当社はいくつかの既存の株式承認証所有者と合意し、行使可能な引受権証の総額は
既存の現金株式証明書を直ちに行使し、#ドルの対価格を支払う
上記の取引について、会社は2024年2月5日にRoth Capital Partners,LLC(“Roth”)と財務コンサルティングサービス協定を締結し、この合意に基づき、会社はRothに約#ドルの現金料金を支払った
オプション 付与
その後
から2023年12月31日まで、同社は購入合計を授与します会社普通株、行使価格は$各株は従業員、会社の取締役会、会社の科学顧問委員会のメンバーに支払われる。オプションの総付与日公正価値は#ドルである和付与は以下のとおりである:(I)購入合計のオプション
普通株は1年以内に月ごとに付与され,および(Ii)購入総額は普通株式
帰属
| F-20 |