カタログ表
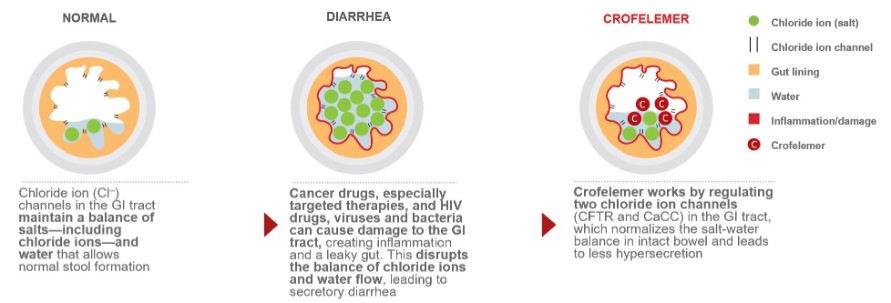
次の図では,腸管の塩素イオン分泌と液体含有量を正常化し,便の粘度を改善するクロフェラムの作用機序を説明した。
業務戦略
われわれの目標は有力な製薬会社となり,一流の持続可能なデリバティブを持ち,世界的に重大な満たされていない胃腸医療需要を満たすことである。この目標を達成するために私たちは
私たちの重要な胃腸製品の知識、経験、知的財産権の組み合わせを利用してMytesiを拡張する
Mytesi(クロフェラム125 mg徐放錠)は新型、一流の抗分泌性下痢止め剤であり、腸管内の電解質と液体バランスに対して正常化作用があり、このような作用機序は多種の胃腸疾患に有利である可能性がある。我々のMytesi(CroFelemer)製品はFDAによって承認され、抗レトロウイルス治療のための成人HIV/エイズ患者の非感染性下痢の症状は緩和された。ジャガーはNapoとNapo Treateuticsを通じてMytesiの世界的に拘束されていない権利を持っている。Mytesiは標準化学療法の使用または非使用の標的治療に関連する下痢予防を含む多くの可能な後続適応を開発している。CroFelemer徐放錠もIBS−Dと特発性/機能性下痢を評価している。
MVIDなどのSBSおよび/またはCDDを有する乳児および/または小児の孤児またはまれな疾患適応をサポートするために、経口投与液のためのクロフェル粉が開発されている。
さらに、細菌、ウイルスおよび寄生虫感染による細菌、ウイルス、および寄生虫感染を含む症状の緩和および治療中の重度下痢を緩和するためのNP-300が開発されているコレラ菌コレラの細菌を引き起こしています
私たちの管理チームは集団で処方薬開発に豊富な経験を持っている。この経験は製品開発のあらゆる面をカバーし、発見、臨床前と臨床開発、GMP製造、監督管理事務と商業化を含む。このチームの主要メンバーはMytesiの開発に成功した。
Mytesi販売とマーケティングでビジネス能力を維持する
NAPOの直販組織はMytesi現場販売代表からなり、これらの販売代表は戦略的に異なる地域に配置され、最も潜在力のある米国の地理的地域をカバーする。それに伴うマーケティング、販売促進活動、患者エンパワーメント計画(統合されたソーシャルデジタル活動を含む)、および以下に説明する医学教育イニシアティブの支援の下で、Mytesi治療を受けた患者数に比例反応が生じることが予想される。
12
