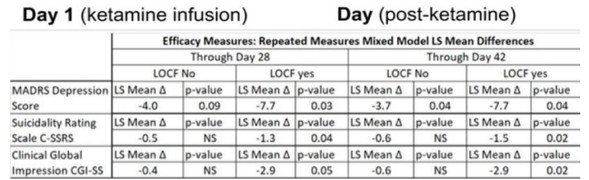
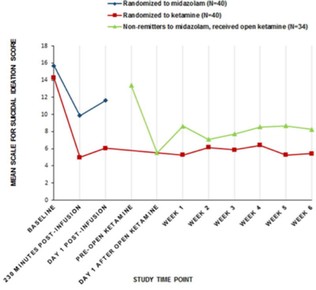
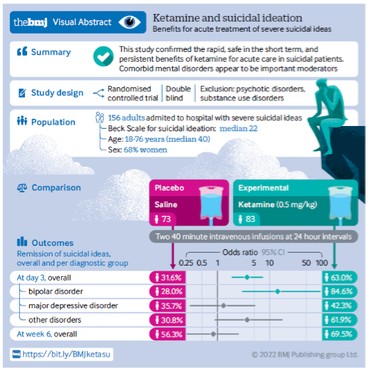
カタログ表
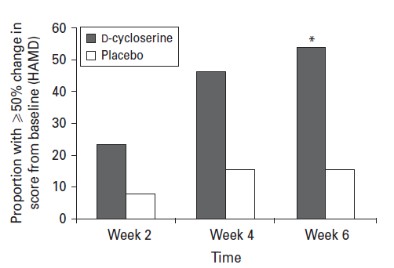
抗精神病薬)。この協同効果は現在すでに実験室げっ歯動物行動実験と複数の第二段階臨床試験で証明され、アメリカと多数の外国司法管轄区で物質組成物の特許を授与することを招いた。ジャビートはその後、うつ病患者がNMDA拮抗薬DCと抗うつ薬の併用治療を受けた時、彼らはより強い抗うつ効果を示したが、以前に報告された幻覚と他のNMDA効果を示さなかったことを観察した。彼はさらに、DCsは既知のすべての5-ヒドロキシルアミン標的抗うつ薬によく見られるいくつかの抗うつ薬の副作用を減少させたようである(安静不能)。
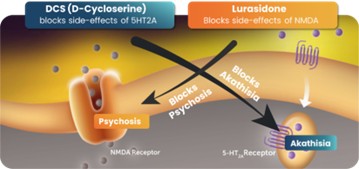
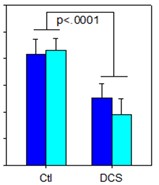
図1 NMDA受容体を抑制する薬物遮断5−ヒドロキシルアミン標的薬と5−ヒドロキシルアミン標的薬による安静不能,さらにNMDA阻害剤の幻覚作用を遮断する物質の協同組成。米国特許10583138のベース。メッセージソース:NeuroRx,Inc.
これらの特許の発見は、迅速チャネル指定および突破的治療指定を取得した最初の研究用経口抗うつ薬、およびASIB患者の重篤な二相うつに対するFDAの特別なプロトコルであるNRX-101を支持する。NRXは、二相うつおよび深刻な抑うつ障害(“MDD”)および創傷後ストレス障害(PTSD)および潜在的な慢性疼痛において自殺願望を有する患者の治療のために、製品および他の製品の研究、開発および将来の商業化に取り組んでいる。ケタミン制限を受けない脳NMDA受容体を抑制する薬物は人々の大きな興味を引き起こし、ケタミンが抑うつと自殺願望を減少させる効果があることを発見して以来、人々はずっと上述の疾病を治療するための薬物を探索している。NRX-101と我々が異なる分子を結合した知的財産権は、他の化合物が神経毒性(長期使用)、幻覚、潜在的習慣性(すなわち嗜癖特性)、血圧上昇および/または経口バイオアベイラビリティの欠如などの不利な要素によって制限される可能性があるので、NMDA阻害薬を使用したこの目的のための競争優位性を生じる可能性があると考えられる。
このような相乗効果は、以下に説明する特許の組み合わせの背後にある重要な発見である。科学的発見により、NMDA薬物のいくつかの副作用は5-HT 2 A薬物によって遮断され、逆に、NMDA成分は安静不能を阻止することができ、これは5-HT 2 A遮断薬物の既知の副作用であり、自殺を招きやすいことが知られている。このような二重目標の方法は、現在、38個の係属中の出願と、複数の管轄区域の48個の許可された特許とを含み、物質の組成および使用方法をカバーする我々の世界特許組み合わせの主な基礎である(“NRX特許組み合わせ”参照)。この組み合わせにおける関連特許および特許出願は、NeuroRxによって所有され、GlyTech、LLC(“GlyTech”)によってNeuroRxに独占的に許可され、GlyTechはデラウェア州の有限責任会社であり、Daniel·ジャヴィット博士による完全所有(“GlyTechライセンス”)、またはSarah Herzog Memory Hospital Ezrat Nashim(“SHMH”)によってNeRx uroimに独占的に許可され、後者はイスラエルの法律に基づいて組織された非営利組織(“SHMHライセンス”)である。
NeuroRxはNRX-101をカバーする米国合成物質特許を持っている。GlyTech許可下の特許は、物質の組成(NRX-101およびパイプライン治療候補薬を含む)および使用方法(NRX-101を使用して自殺願望のある躁鬱症を治療し、創傷後ストレス障害を治療する方法を含む)、米国、欧州(欧州特許条約18加盟国の検証を含む)、日本、オーストラリア、および中国で許可されている。
12