FEMASYS Inc.
表格10-K
カタログ
|
前向きに陳述する
|
1
|
|
|
第1部
|
5
|
|
|
第1項。
|
業務.業務
|
5
|
|
第1 A項。
|
リスク要因
|
29
|
|
項目1 B。
|
未解決従業員意見
|
73
|
|
第二項です。
|
属性
|
74
|
|
第三項です。
|
法律訴訟
|
74 |
|
第四項です。
|
炭鉱安全情報開示
|
74 |
|
第II部
|
74
|
|
|
五番目です。
|
登録者普通株市場、関連株主事項及び発行者による株式証券の購入
|
74
|
|
第六項です。
|
[保留されている]
|
75
|
|
第七項。
|
経営陣の財務状況と経営成果の検討と分析
|
75
|
|
第七A項。
|
市場リスクの定量的·定性的開示について
|
84
|
|
第八項です。
|
財務諸表
|
85
|
|
第九項です。
|
会計と財務情報開示の変更と相違
|
118
|
|
第9条。
|
制御とプログラム
|
118
|
|
プロジェクト9 B。
|
その他の情報
|
119
|
|
プロジェクト9 Cです。
|
検査妨害に関する外国司法管区の開示
|
119
|
|
第三部
|
119
|
|
|
第10項。
|
役員·幹部と会社の管理
|
119
|
|
第十一項。
|
役員報酬
|
119
|
|
第十二項。
|
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項
|
119
|
|
十三項。
|
特定の関係や関連取引、取締役の独立性
|
119
|
|
14項です。
|
最高料金とサービス
|
119
|
|
第4部
|
120
|
|
|
第十五項。
|
展示·財務諸表明細書
|
120
|
|
第十六項。
|
表格10-Kの概要
|
122
|
|
サイン
|
123
|
カタログ表
前向き陳述に関する特別説明
このForm 10-K年間報告書は前向きな陳述を含んでいる。本年度報告10-K表では,歴史的事実に関する陳述を除いて,他のすべての陳述は前向き陳述である.場合によっては、前向き陳述は、“可能”、“会議”、“すべき”、“予想”、“計画”、“予想”、“可能”、“意図”、“目標”、“プロジェクト”、“考慮”、“信じる”、“推定”、“予測”などの用語によって識別されることができる。すべての前向き表現がこれらの語を含むわけではないが、“潜在的”または“継続”またはこれらの用語の否定または他の同様の表現。前向きな陳述は、以下の態様に関する陳述を含むが、これらに限定されない
·現在の候補製品や計画を開発し、推進し、臨床試験の開始と完成に成功する能力があります
·私たちの臨床試験は、候補製品の安全性と有効性、および他の積極的な結果を証明する能力;
·私たちの候補製品のために被験者を募集して臨床試験を行い、臨床試験の発展を適時に推進することができます
·FemaSeedのビジネススタートを成功させ、発展させることができます
·私たちは、候補製品や製品の臨床開発と商業化に資金を提供し、運営に資金を提供する追加資金を得ることができます
·私たちの製品および候補製品の総位置決め可能な市場の推定;
·私たちの業界で競争力のある会社や技術
·米国食品医薬品局(FDA)の永久避妊制度の承認を得ることができ、女性向けの医療製品の販売を拡大し、より多くの製品を開発して商業化することができる
·私たちの候補製品のために規制許可を得て商業化する能力、または規制許可および商業化の遅延の影響;
·当社の製品、候補製品、技術およびビジネスのビジネスモデルおよび戦略計画は、私たちの実施を含む
·私たちの製品と候補製品のビジネス成功と市場受容度
·FemaSeed、FemBloc、または任意の将来の候補製品、および商業化を求めている製品のために、十分なカバーまたは精算レベルを達成し、維持することができます
·私たちは、適用された法律、法規および要求に従って、当社の製品および候補製品を生産し、適用された法律、法規および要求に基づいて、第三者サプライヤー、サービスプロバイダ、およびサプライヤーが任意の契約活動を履行することを監視する能力があります
·お客様の製品や候補製品に対する需要を正確に予測し、在庫を管理することができます
·私たちは、私たちの直販とマーケティング組織を構築し、管理し、維持し、美国内外で私たちの人工授精製品、永久避妊システム、女性専用医療製品ソリューションをマーケティングし、販売することができます
·私たちの上級管理職や他の高素質のスタッフを採用して維持する能力があります
1
カタログ表
·FDAまたは米国および国際市場の医療改革措置を含む、私たちまたは医療業界全体に影響を与える米国または外国の規制行動;
·私たちの製品および候補製品に及ぼす政治、司法、立法、または規制政策の影響
·申請および承認または承認の時間または可能性を規制する;
·私たちの製品および候補製品のための知的財産権保護を確立し、維持する能力と、侵害クレームを回避する能力
·普通株取引価格の変動;
·市場動向への期待。
本年度報告Form 10-Kの展望的な陳述は予測のみであり、主に未来のイベントおよび財務傾向に対する私たちの現在の予想と予測に基づいており、これらのイベントおよび財務傾向は私たちの業務、財務状況、および運営結果に影響を与える可能性があると考えられる。これらの前向き陳述は、本10-K年度報告が発表された日にのみ発表され、多くの既知と未知のリスク、不確実性と
仮説の影響を受け、本10-K年度報告の“リスク要因”と“経営陣の財務状況と経営成果の討論と分析”と題する章と本10-K年度報告の他の章で述べた内容を含む。展望性陳述は固有にリスクと不確実性の影響を受けているため、その中のいくつかのリスクと不確実性は予測または定量化できず、いくつかは私たちが制御できないので、あなたは未来のイベントの予測としてこれらの前向き陳述に依存してはならない。著者らの展望性陳述に反映された事件と状況は実現できない或いは発生できない可能性があり、実際の結果は展望性陳述中の予測結果と大きく異なる可能性がある。また,我々
は発展しつつある環境で運営されている.新たなリスク要因や不確定要因が時々出現する可能性があり、管理職がすべてのリスク要因や不確定要因を予測することは不可能である。Form 10-K年次報告書および本Form 10-K年次報告書で引用された完全な添付ファイルとして米国証券取引委員会(米国証券取引委員会)に提出された文書を読み、私たちの将来の実際の結果が、これらの前向き声明に明示的または示唆された任意の将来の結果と実質的に異なる可能性があることを理解しなければなりません。法律の適用に別の要求がない限り、私たちは、任意の新しい情報、未来のイベント、状況変化、または他の理由による、本明細書に含まれる任意の前向きな陳述を公開または修正するつもりはない。この10−K年度報告書に含まれる展望的陳述は、1995年の“私証券訴訟改革法”及び改正された1933年“証券法”第27 A条に提供された安全港保護から除外された。
リスク要因の概要
以下は,我々の普通株投資に関する主なリスク要因の概要である。
私たちの財務状況と追加資本需要に関連するリスク
·設立以来、深刻な運営損失が出ており、将来的にも運営赤字が予想されています。
·大量の追加資金が必要で、必要なときに資金を集めることができないかもしれない。
·私たちの財務業績は大きく変動するかもしれません。
·純営業損失と研究開発信用繰越を使用して将来の課税収入を相殺する能力が制限される可能性があります。
発見と発展に関するリスク
·臨床試験における対象の登録および保持は、高価で時間のかかるプロセスである。
·FDAは、安全上の観点から、FemBloc上場前承認(PMA)の重要な試験を継続することを許可しない可能性がある。
·我々の現在の候補製品は異なる開発段階にある.
·当社はFDAの許可に大きく依存してFemBlocシステムを販売しています。
·規制承認を得るために必要な臨床開発過程は長く高価であり、結果は不確定である。
2
カタログ表
·より多くのデータの出現に伴い、時々発表または公表される臨床試験の一時的なデータおよび予備データが変化する可能性がある。
·私たちの製品は、より多くの市場受容度を得ることができないかもしれません。
·我々のFemaSeed人工授精ソリューションは市場に認められない可能性があります。
·永続的な避妊解決策の十分なカバーや精算レベルを達成し、維持できなければ、ビジネスの成功は深刻に阻害される可能性があります。
·我々の恒久的避妊ソリューションまたは他の女性医療機器を保証または使用しない第三者支払者および医師は、FemBlocシステムを採用または維持する前に、追加の臨床データを必要とする可能性がある。
·医師が私たちの人工授精ソリューションや恒久的な避妊ソリューションを使用するために必要なトレーニングは、私たちの製品に対する市場の受容度を低下させる可能性があります。
·私たちの競争相手の中には、私たちよりも長い運営履歴とより成熟した製品またはより多くの資源を持っています。
·私たちの長期的な成長は、私たちの解決策を強化し、適応を拡大し、より多くの製品を開発し、商業化する能力にかかっています。
·お客様のニーズを正確に予測して在庫を管理できなければ、運営結果が実質的に損なわれる可能性があります。
·私たちの製品および候補製品のために部品を製造および組み立て、製造能力の損失または劣化は、当社の業務に実質的な悪影響を及ぼす可能性があります。
·当社の製品および候補製品は、限られた数の第三者サプライヤーが部品を提供することに依存します。
·当社の運航会社の性能の問題、サービス中断や値上げは、当社の業務に悪影響を及ぼす可能性があります。
·女性向けの医療製品ソリューションのマーケティングと販売で経験が限られています。
·自分たちの直販チームに頼って女性専用医療製品を販売する予定です。
·コストが高い可能性がある製品責任クレームのリスクに直面しています。
·私たちの解決策の質が医師または患者の期待に達していない場合、私たちのブランドおよび名声または私たちの業務は悪影響を受ける可能性があります。
管理成長と従業員事務に関連するリスク
·衛生流行病や疫病に関連するリスクに直面しています。
·重要な情報技術システム、プロセス、またはサイトの障害は、当社のビジネスに悪影響を及ぼす可能性があります。
·私たちの施設が損傷したり、運行できなくなる可能性があります。
·私たちが競争的な地位を維持する能力は、質の高い人材を誘致し、維持する能力にかかっています。
·私たちの組織の規模を拡大する必要があります。この成長を管理する際に困難に直面する可能性があります。
政府の規制に関連するリスク
·私たちの製品と運営は広く政府によって規制されています。
·必要な規制承認、分類、または許可が得られず、ビジネスを発展させることができない可能性があります。
·当社製品の修正には、新しいPMA承認またはPMAサプリメントの承認を得る必要がある場合があります。
·上場後の規制要件を守らなければ、法執行行動に直面する可能性がある。
·我々の製品は連邦と州の規定に従って生産されなければならない。
·永続的避妊または他の女性保健治療の治療ガイドラインが変化した場合、または看護基準が変化した場合、私たちは、私たちの1つまたは複数の製品のためのFDAの新しいマーケティング許可を再設計する必要があるかもしれません。
·私たちの製品は市場で誤用やラベル外使用がある可能性があります。
·私たちの製品は、不良医療事象を引き起こすか、または障害または障害を引き起こす可能性があります。
·私たちの製品が国際規制登録または承認を得て維持されていない場合、私たちはアメリカ以外の場所で私たちの製品をマーケティングして販売することができません。
·米国やEUの立法や規制改革は、私たちの製品が規制許可や承認を得にくくなり、コストも高くなる可能性がある。
·私たちの業務は危険材料の使用に関するものです。
3
カタログ表
知的財産権に関するリスク
·私たちの知的財産権を十分に保護できなければ、私たちの競争地位が損なわれる可能性がある。
·特許保護の獲得と維持は、政府の様々な要求に依存する。
·知的財産権侵害の訴訟または他の手続きまたは第三者クレームには、多くの時間とお金が必要となる場合があります。
·私たちは世界的に知的財産権を強制的に実行できないかもしれません。
·第三者は、私たちの従業員やコンサルタントが機密情報を誤って使用したり、漏洩したり、商業機密を流用していると主張する可能性があります。
·米国特許法の最近の変化は、特許の全体的価値を低下させる可能性がある。
·特許条項は、製品における私たちの競争地位を保護するのに十分ではないかもしれません。
私たちの普通株に関するリスクは
·私たちの役員、役員、主要株主は巨大な投票権を持っています。
·上場企業として、大きなコストを払っています。
·財務報告書の適切かつ効果的な内部統制を策定し、維持する義務があります。
·私たちの開示制御および手続きは、すべてのエラーまたは詐欺を防止または検出できない場合があります。
4
カタログ表
第1部
| 第1項。 |
公事です。
|
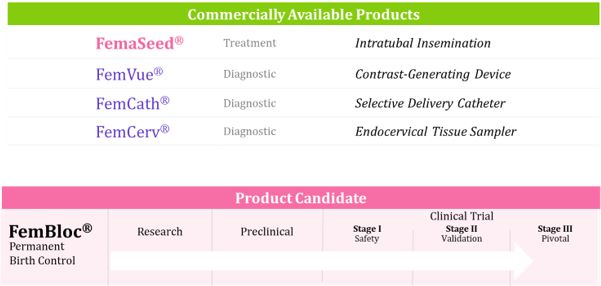
業務の概要
著者らはリードする生物医学会社であり、全世界の女性がまだ満足していない重大な需要の解決に集中し、広範な勤務、アクセス可能と革新的な治療と診断解決方案の組み合わせを持っており、リードする革命性候補製品とFDAが許可した製品を含む。私たちの使命は、女性に優れた低侵襲、非手術製品技術を提供し、オフィスで得ることができ、患者の看護と全体的な健康経済を改善し、不妊症問題の解決策を求める人に生殖健康需要(FemaSeed)を提供することに集中することである®FemVueと®)または永久避妊(FemBloc®)である。私たち
は、女性が作成·指導する会社で、膨大な内部作成の知的財産権の組み合わせを持ち、世界で180件の特許を有し、内部化学、製造·制御(CMC)および設備製造能力と検証された製品開発と商業化能力を持っています。私たちの製品および候補製品キットは、数十億ドルの価値があると考えられる世界的な細分化市場を対象としており、これらの細分化市場は長年ほとんど進歩がなく、女性が高価で女性を傷つける可能性のある薬物解決策、インプラント、および手術を避けるのを助ける。
FemaSeed-我々の人工授精ソリューションそれは.著者らのFDAが許可した人工授精解決方案は単一の卵管内精子を選択された卵管(受胎の自然部位)に直接輸送する機能を有し、現有の生殖補助方法と比較して顕著な優位性があり、コストの著しい節約と安全リスクの低減を含む。著者らの第一線の治療性不妊症解決方案FemaSeedは診断セット製品FemVue設備と結合し、FemVue設備はFDAの許可を得て発売され、この装置はFemaSeed治療を使用する前に生理食塩水と空気比較を作成し、卵管の流暢性を安全に評価することができる。FemVueは当FDAが承認し市販されているFemCathと一緒に使用することができます®この装置は卵管の選択的評価を可能にしている。少なくとも1つの開放卵管は受精成功に必要であり、FemVueは既存の診断不妊症評価の一部として、女性卵管を提供することができる超音波評価を含む他の既存の方法よりも顕著な利点があると信じている。2021年4月、FDAのIDEの承認を得て、FemaSeedデバイスのキーテストを開始することができました。最初の科目は2021年7月に採用された。2022年10月,我々はこのキーテストの最新の研究設計を発表し,男性因子不育症を経験した夫婦に重点を置いた。サービス不足の患者群である。2023年4月、私たちはカナダでFemaSeedの販売を許可された。2023年9月、FDAはFemaSeedによる卵管内人工授精を許可することを発表した。FDAから米国の規制許可を得た場合,br}臨床試験はまだ行われているが,この研究は2023年11月に登録が完了している。臨床試験のTOPLINE結果は2024年3月に公表された。Br試験では,24%の女性が重篤な男性因子(総活動精子数100万から2000万)を患った後に妊娠していることが分かった。対照的に,文献に記載されている男性因子を有する子宮内人工授精(IUI)の周期妊娠率は6.7%(100万TMSCより大きい)であった。FemaSeedの複数回の試みが許可されているにもかかわらず、妊娠している女性の多くは、最初のFemaSeed手術後に妊娠している。有害事象の多くは軽微であることが報告されている(n=127人の被験者、216サイクル)。7週間のフォローアップでは,新たな安全問題は観察されなかった。すべての副作用はIUIの既知の副作用と一致した。承認されたラベルには、卵管内授精方式で妊娠を希望する女性または夫婦が含まれる。我々は2024年3月に第1段階の商業発射を開始し,FemaSeedの第1回商業使用を発表した。
FemVueは超音波による卵管評価が可能であり,不妊症を診断する放射線学的方法(子宮卵管造影)の代替法として米国,日本,カナダでの販売が許可されている。FemChec®FemBloc術後に卵管評価を許可し,閉塞(あるいは手術成功)を確認し,FemBlocキー試験の一部として検討している。FemCathは単一卵管を選択的に評価することを許可し、伝統的な非方向性子宮内カテーテルの代替方案として、すでにアメリカとカナダでの販売を許可した。FemCerv®子宮頚管内汚染が最小の総合組織サンプルを取得することによって子宮頸癌を診断する代替方法であり、アメリカとカナダでの販売が許可されている。2023年8月、同社はカナダ衛生部が発行した医療機器設立許可証を取得し、同社がカナダでFemaSeed、FemVue、FemCath、FemCervの4種類の製品を直接販売することを許可したと発表した。2023年10月、同社はEU医療機器法規(MDR)の最終審査を完了したことを発表し、Femasysが必要な最高規制基準を遵守していることを示すMDR証明書とCE標識を取得する最後のステップである。
5
カタログ表
FemBloc-私たちの永久不妊解決策はそれは.我々の末期臨床で開発された永久避妊解決策は、2つの卵管の二重宮に対して投与および分解性バイオポリマーを同時に内定し、その後、超音波確認テストを行い、手術成功を確認する独自のFemBlocシステムを含む。承認された場合、FemBlocは、患者自身の組織成長を利用して卵管閉鎖をもたらすことを意図した低侵襲送達システムを使用して、患者自身の組織成長を利用して卵管閉鎖をもたらすことを目的とした低侵襲送達システムを使用して永久避妊(不妊)される唯一の非外科的避妊プログラムとなることが予想される。FemBlocは既存の唯一の選択である外科卵管結紮術あるいは“彼女の卵管結紮術”よりも顕著な利点を提供する可能性があり、著しいコスト節約を含むが、総コストは元の半分しかないかもしれない。FemBlocは医師室で完成できる手術であり、麻酔を必要とせず、切開或いは挿管を必要とせず、専門的な技能或いは資本設備がなく、苦痛が最小で、回復時間
であり、組織成長後の患者体内に残留したインプラントがない。FemBlocは他の一時的あるいは可逆的な方法と比較しても有意に優れており,FemBlocはホルモンを使用しないため,長期インプラントのものも残さないと考えられる。我々の永久的避妊解決策はFemBlocを超音波オフィス診断テストと組み合わせ、このテストは生理食塩水と空気比較を使用してbr}同一医師がオフィス内で卵管を評価することを可能にし、最終FemBlocプログラムの約3ヶ月後にFemBlocの成功を確認するために、患者に別のサプライヤーに放射線による検査を要求するのではなく、患者を放射線とX線染料の使用に不必要に暴露させる。
FDAが承認した各研究の研究設備免除(IDE)によると,我々はこれまでの3つの臨床試験(試験的安全性研究,キー試験と検証研究)においてFemBlocを研究し,計228名の被験者に対して安全性評価を行った。安全のため,被験者は5年間の追跡調査を受けたが,最初の49名の試験研究は5年間の追跡調査を完了していた。これまで,どの被験者においても深刻なセキュリティイベントは報告されておらず,90%を超える報告イベントはデバイス,プログラム,または両方に関連して分類されており,FemBlocプログラムの当日またはプログラム後7日以内に発生している。報告されたイベントの多くは予想されており,これらのイベントの大多数は出血や斑点および/または痛みまたは痙攣であり,75%を超える患者は医師によって軽度に分類されている。医師は,彼らの被験者はこの手術が高度に耐性であることを認め,被験者が自己報告した疼痛スコアは子宮内避妊器留置と類似していた。ほとんどの症例(96%)が手術に非常に満足しているか非常に満足しているかと医師に評価され,96%の人が卵管結紮術よりも容易であると考えている。FemBloc手術後3カ月に行った超音波確認試験では、被験者に残留バイオポリマーが検出されなかったことは、バイオポリマーが完全に分解し、月経の到来とともに被験者を離れる可能性が高いことを示している可能性がある。br}被験者は、FemBloc手術および確認試験が高度に耐性であり、痛みまたは不快スコアは、他の子宮内避妊器(例えば、子宮内避妊器)と類似していることを発見した。FemBloc手術の平均得点は4.6点,確認テストの平均得点は3.3点,視覚シミュレーションスコア(VAS)は0から10であり,そのうち10は痛み/不快感の最高測定基準であった。
前2つの臨床研究の施行中に,FemBlocに依存した被験者に意外妊娠が発生したと言われた(試験的研究では妊娠6例,キー試験では3例が妊娠)。これらの妊娠はFemChecデバイスを用いた超音波テストに対する誤解によるものであり,独立した臨床イベント委員会の審査と確認が得られた。FDAはこれらの意外妊娠を安全問題としているため,2019年2月にFemBlocのキー臨床試験(被験者が5年間の安全性追跡を行っているにもかかわらず)を休止した。その後、この機関は1組の新しい被験者の中で小型臨床研究を行い、いくつかの提案された緩和措置の十分性を評価し、超音波確認テストを検証することを提案した。研究登録は2022年9月に終了し,米国5地点の45名の被験者が2回の確認テスト(超音波と伝統放射学)を受けた。被験者は、2つのテストと2つの独立した中央リーダがプログラムが成功したことを確認した場合にのみ、FemBlocに依存すると通知された。FemBlocに依存することを正確に告げられた被験者では,妊娠していなかった。2023年6月、私たちはIDEに対するFDAの承認を得て、重要な臨床試験でFemBlocの安全性と有効性を評価することができます。FemBlocは私たちの非手術、非埋め込み性、オフィス内の永久避妊ソリューションです。2023年8月に決勝戦での募集開始を発表しました[FemBloc卵管内閉塞経子宮頚永久避妊のための展望性多中心試験]肝心な裁判。この展望性,
マルチセンター,開放ラベル,片腕研究設計は妊娠率を主な終点とし,401名の女性がFemBlocを用いて恒久的に1年間避妊し,分析を行った。また,この研究はbrにスクロールするように設計されており,まず50名の女性を募集して臨床読み取りを行い,主に残りの被験者を募集する前に初歩的な安全性データを読み取る。300名の女性がFemBlocを用いて1年間の永久避妊を行った後,臨床データの終点を中期分析する予定である。発売されてから5年以内に、毎年継続的にフォローされるだろう。
6
カタログ表
他の女性の健康解決策はそれは.また,他の女性専用医療製品とともに医師のオフィス環境で販売することを目的とした新しい組織サンプリング技術プラットフォームを開発した。我々のFDA承認とカナダ衛生部が許可したFemCerv製品は、子宮頚細胞と組織を円周サンプリングし、サンプルを装置内に含めることができ、汚染を最小限に抑えるための子宮頸部掻爬のための生組織検査装置である。著者らはFemCervの発売後の研究を賛助し、被験者はこのプログラムが相対的に無痛であり、得られたサンプルは完全に分析に用いられ、信頼できる診断に役立つ可能性があると信じている。我々のFemCerv製品は2022年9月に限定発表により米国市場に進出した。我々が開発しているFemEMB候補製品は,事務プログラムにより全面的かつ汚染のない子宮内膜細胞と組織試料を得ることを目的としている。癌、異常出血、または他の子宮治療(例えば、子宮内膜アブレーション術前)の治療中および治療後、医師は、FemEMBを使用して持続的なモニタリングを行うことができる多重サンプリングプログラムを使用することができ、市場機会であると信じている。
次の表は私たちの現在の製品と候補製品ルートをまとめています
7
カタログ表
私たちのチームは
私たちは女性が設立し、女性が率いるバイオ医薬会社で、経験豊富なバイオテクノロジーと医療機器開発チームを持っています。我々の創業者で最高経営責任者のキャシー·リー·セピアは医療機器分野で25年を超える起業家経験と管理経験を持ち、世界で100件以上の特許を持っている。私たちの最高財務官Dov Elefantは25年以上の経験を持っていて、異なる段階で公共と私営生物技術会社をリードしています。我々の首席医療官,医学博士James Liuは40年を超える生殖内分泌学者の勤務経験を持ち,医療事務や臨床戦略開発に専門的な知識を持っている。我々のチーフ運営官であるDaniel·コーリーは,初期段階や大手成熟会社の役割を含めて医療機器業界で30年以上の運営経験を有している。私たちの首席商務官Richard Spectorは、医療機器の商業化(女性の健康を含む)において25年を超える成功したリーダーと実行責任を持っている。クリスチャン·トーマス、著者らの上級副総裁、監督と臨床事務、20年以上の成功した指導経験を持ち、老舗医療機器会社のための全世界監督管理戦略と臨床運営を含む。私たちの経験豊富な指導チームは集中的な発展専門知識を持っており、女性の健康促進に揺るぎなく取り組んでいる。設立以来、私たちは機関や戦略投資家から1億25億ドル以上を集めており、美敦力と大手生命科学会社の幹部と、2021年6月の初公募株(IPO)を含む。
我々の知的財産権と生産能力は
私たちは、特許、技術的ノウハウ、商業的秘密によって保護されるように、私たちの女性健康解決策で使用される特許方法を設計し、開発した。私たちのポートフォリオの各製品と候補製品はアメリカと重要なアメリカ以外の市場で設計と実用特許を持っています。2023年12月31日現在、我々は、発行されている米国特許48件と発行済み外国特許132件、出願中の米国特許14件、出願中の外国特許25件を有している。これらの発行された特許およびこれらの出願から付与された任意の特許は、潜在的な特許期間の延長または調整を考慮することなく、2024年から2046年の間に満了すると予想される。
我々のすべての製品は我々の工場で製造または組み立てられており,製造活動はFDAとQSRに適合する重要なCMCと設備製造インフラの良好な製造規範を確保するために行われている。私たちはFDAと国際通知機関の審査を含む何度もの生産審査を通過した。
私たちの戦略
私たちの目標は、女性の健康分野のグローバルリーダーになり、安全で効果的な解決策を提供し、それが対象とする細分化された市場を覆し、発展させることである。これを実現し、私たちの将来の成功と成長に貢献するために、私たちは以下の戦略を実施しています。
女性が多くの大市場で満足されていない臨床需要を解決する私たちの最初の重点は生殖健康方面で満たされていない肝心な需要領域であり、これは女性にとって日々厳しい挑戦であり、現有の治療方法は最適な方法でこの問題を解決していない。スペクトルの両端(人工授精不妊と永久避妊)は巨大で総な潜在市場機会を代表している。妊娠リスクの制御を希望する患者は通常、一時的または可逆的選択を使用し、あるいは手術リスクと費用を負担する唯一の永久選択を選択する。我々のFemBlocシステムは,最初の非手術,br}非インプラントオプションを提供する可能性があり,オフィスでのみ行われ,麻酔を使用することなく,医師が同一部屋で複数のプログラムを実行することを潜在的に可能にすると信じている。米国におけるFemBlocシステムの市場規模は200億ドルを超える可能性があり、現在の潜在市場規模は毎年20億ドルを超えると予想される。毎年手術を選択して永久的に節育する人たちは、私たちがすぐに満足できる市場だと思います。妊娠に努めている患者は通常,高度専門の医師に紹介され,古い技術を用いて治療を行っている。私たちのFemaSeed製品は1つの方法を提供し、精子を妊娠した卵管に直接輸送する潜在力があると信じています。私たちはFemaSeedとFemVueのアメリカ市場は20億ドルを超える可能性があり、現在の潜在市場は8億ドルを超えると推定しています。
8
カタログ表
私たちの臨床計画を実行して、FDAの承認を得て、私たちのFemBlocシステムを私たちのセット診断装置と一緒に使用することを推進して、女性の永久避妊の第一選択案であることを確認した。我々はすでに早期の3つの臨床試験でFemBlocを検討しており,いずれの試験もFDAが承認したIDEによる228名の被験者の安全性評価を行い,これらの被験者は安全性追跡を継続している。我々は、IDEの重要な試験の承認を支援するために、2022年9月に登録を完了した小型IDE研究(第2段階検証研究)の結果を提出し、将来のPMA承認FemBlocの臨床支援となると予想している。2023年6月、私たちのIDEは、FemBlocの安全性および有効性を評価するためにFDAによって承認されました。FemBlocは、重要な臨床試験における永久的な避妊のための、非手術的、非埋め込み的、オフィス内解決策です。2023年8月に決勝戦での応募開始を発表しました[FemBloc卵管内閉塞経子宮頚永久避妊のための展望性多中心試験]肝心な裁判。この展望性、多中心、開放ラベル、単腕研究設計は妊娠率を主要な終点とすることを含み、一旦401名の女性がFemBlocを使用して1年間永久的に避妊し、それを分析する。また,この研究はスクロール試験として設計されており,まず50名の女性を募集して臨床読み取りを行い,主に残りの被験者を募集する前に初歩的な安全性データを研究している。300人の女性がFemBlocを用いて1年間の永久避妊を行うと、臨床データの終点の中期分析を行う予定である。後続フォローは毎年5年間のアフタータイムが続きます。
私たちのビジネス戦略を実行して、私たちのFemaSeed製品を私たちのセット診断製品FemVue生理食塩水装置と共に人工授精の第一線の選択としてマーケティングしますそれは.2023年4月、私たちはカナダでFemaSeedの販売を許可された。2023年9月、FDAがFemaSeedによる卵管内人工授精を承認することを発表した。FDAの510(K)の承認を得たところ、行われてきた臨床試験を終了し、2023年11月に登録が完了した。2024年3月、TOPLINEデータは発表され、現在行われている米国商業発射の第1段階を力強く支持した。我々は2024年3月にFemaSeedの初の商用化を発表し,商業発射の第1段階を開始した。
イノベーションを続け女性のためにより多くの製品を発売していますそれは.我々は,より多くの女性専用医療製品と,我々のFemBlocシステムや他の既存製品の改善と増強に重点を置いた研究開発活動に投資し続ける予定である。子宮内膜サンプリングのための子宮癌検出試験をサポートするための候補製品であるFemEMBの開発を継続している。私たちは、私たちの女性健康ソリューションで使用される独自の方法を設計·開発し、特許、技術的ノウハウ、ビジネス秘密を通じてこれらの内部アイデアの進歩を保護しました。私たちのチームは、アメリカ、ヨーロッパ、カナダ、日本でマーケティング許可と許可を得て、FDAや他の国際管理機関の要求に従って生産できることを証明しました。時間の経過とともに、他の製品の供給は、患者の看護を改善し、医師治療の選択肢を改善するために、数十年にわたって進歩してきたわずかな看護面の問題を解決することを目標とする、我々の生殖健康および女性健康解決キットを拡張する。
忍耐と実践意識を高めることで潜在市場を浸透させるそれは.米国だけで1000万人以上の女性
(https://www.cdc.gov/nchs/nsfg/key_Statistics/i−keystat.htm)が不妊症を患っていると推定されており、その約40%~50%の不妊症は男性因子(Kumarら、2015年)によるものであり、これは世界の男性精子数が50%以上低下したためである可能性がある(Levineら、2023年)。半分以上の女性だけが何らかの形の介入を受けており、ごく一部の女性だけがより先進的な技術を受け入れている。この軽浸透市場に影響する要因は,子宮内人工授精(IUI)と体外受精(IVF)を熟知しているにもかかわらず,既存技術のコストと負担であると考えられる。同業者評議の定期刊行物に科学データを発表し続けることで,医師の意識を高める予定である。次に,不妊症や直接患者の外展による人工授精を希望する女性や夫婦を参加させる予定である。米国だけで毎年約80万人の女性が外科的卵管結紮術(Frattarelliら,2007年)と50万人の男性が輸精管結紮術(Ostrowski,ら,2018年)を選択して永久避妊を選択していると推定されている。また1200万人の女性が非恒久的避妊オプションを使用しており,その多くは非手術であれば恒久的選択肢を好む可能性が考えられる。このような軽微な市場浸透に影響する主要な要素は既存技術の局限性であり、卵管結紮術を選択として熟知している可能性があると考えられる。私たちの不妊症製品の組み合わせのように、患者に直接触れる前に医師の意識を高める予定です。
9
カタログ表
専門的な直販とマーケティングチームによる商業化インフラの構築それは.最初から、患者と医師の調査および医師と重要なオピニオンリーダーの早期参加を通じて、患者と医師が満足していない需要を理解し、私たちの解決策を正確に位置づけるのに時間がかかった。私たちのFemaSeed製品が承認された後、私たちは私たちの商業インフラを構築している。我々がすでに発売しているFemVue装置は,FemaSeed製品とともに同じターゲット医師である生殖内分泌学者に販売されている。最初の世界の潜在的なFemaSeed/FemVueの年間売上高の90%近くがこの市場で生まれると信じているので、私たちは大部分の販売とマーケティングを北米に集中させるつもりだ。我々の第一の課題は既存のFemVue顧客を狙うことであり,次いで高販売量地域の生殖内分泌科医である。我々の計画は,我々の不妊症製品のために専門的な販売チームを招聘し,必要に応じてFemBlocシステムの販売チームを増やすことであり,FemBlocシステムでは,ターゲット医は婦人科医である。我々がすでに発売しているFemCerv機器は,FemBloc製品とともに同一ターゲット医である婦人科医に販売されている。また、私たちは引き続き私たちの内部製造能力を拡大して、brの需要を満たし、新製品を発売するとともに、潜在的なサプライヤーを評価して、私たちの製造と組み立てプロセスのアウトソーシング部分の実行可能性を評価して、著しい成長、利益、運営レバーを確保する予定です。
FemaSeedを用いた人工授精を含め,製品やサービスを多様化することにより,婦人科医の勤務能力を拡大した。現在,不妊サービスや治療を提供する婦人科医の数は限られているが,時間の経過とともに,特にFemaSeedの導入に伴い,この数字が増加する可能性があると信じている。FemaSeedはオフィス内の不妊プログラムであり、婦人科医師が彼或いは彼女の現有の技能を利用して完成することができ、それによって患者に有効な生育サービスを提供できる婦人科医師の数を増加させ、彼らを不妊専門家に紹介する必要がない。我々は,我々がFemBlocの婦人科で販売しているbr力を利用して,承認されれば,これらの医師にFemaSeedを紹介し,最初に注目していた生殖内分泌医ではなく,不妊症治療と他のキット(例えばFemVue)の販売チームを拡大する予定である。
当面の市場構造
永久性避妊に対して、卵管結紮術は侵襲性手術であり、移植、切開、入院と全身麻酔が必要であり、数十年来ずっと提供されているため、リスクは既知である。帝王切開直後に行うか,腹腔鏡手術で行うか,顕著な欠点や合併症のリスクがある。卵管結紮術による最も深刻な発病率は電気エネルギーの使用と腸管の何気ない熱損傷と関係がある。手術機器を腹膜腔に導入することは,腹内器官や血管を厳重に損傷するリスクがあり,すべての手術の約1%が意外なさらなる大手術を招く。また,麻酔リスク,出血,腸管損傷と回復時間が長いことは卵管結紮術固有の合併症リスクである。避妊と子宮内避妊器(IUD)のような一時的かつ可逆的な避妊方法は、長期的に使用されている女性を妥協案とし、これらの女性は手術リスク、切開または麻酔リスクにさらされたくないため、手術不妊プログラムを受けたくない。br}は肥満や医療条件のために手術不妊が禁止される可能性がある。ホルモン避妊や子宮内避妊器の長期使用にも欠点がある。ホルモン避妊は健康リスク、例えば乳癌や血栓のリスク増加に関連しているが、設備による避妊は子宮穿孔を招き、骨盤炎や子宮外妊娠のリスクを増加させる可能性がある。安全或いは知的財産権侵害問題のため、以前永久性インプラントを用いて卵管を閉鎖する非手術方法はすでに市場から撤去されたため、現在唯一利用可能な永久性避妊方法は外科卵管結紮術である。
人工授精に対して、伝統的な子宮腔内受精(IUI)は数十年来ずっと提供されてきた精子を子宮腔に送り込む非直接プログラムである。IUIは引き続き第一線の治療オプションとして提供され、その低コストと使いやすさ、学習曲線が短く、設備に対する要求が最も低いため、その成功率は比較的に低い。現在の人工授精装置は精子を子宮腔に入れることで精子が膣と子宮頚で遭遇する可能性のある不利な環境を解決しているが、精子輸送の生物学は複雑であり、子宮内受精の数百万精子のうち、ほとんどの精子は卵管に到達できない。子宮の不利な環境とは異なり,卵管は流動精子の貯蔵庫であり,受胎場所でもある。精子数は全世界範囲内で50%を超える速度で加速的に低下し、ますます多くの男性精子数は任意の所与の亜出産或いは不妊閾値より低い。この大幅で持続的な減少はもう重大な公衆衛生問題とされている。(Levineら、2023年)。体外受精あるいは卵胞形質内単精子注射(ICSI)は効率的な第一線の治療法であり,男性因子不妊症に対して妊娠率は約25%であることが報告されているが,顕著なコストと臨床リスクと関連している(Ravitskyら,2019年)。多くの不妊の女性と夫婦が治療を受けたくないのは主に経済的原因のためである。試験管受精(IVF)は非常に高価であり,フォーブス健康,2021年のデータによると,1試験管受精周期あたりの費用は15,000から30,000ドル(周期効率は通常25%程度)と高く,通常保険範囲内ではない。IVF/ICSIは患者の身体や感情に対する要求も高く,多胎妊娠,異所性妊娠,流産のリスクを増加させた。アメリカには1000万人以上の不妊女性がいるが、毎年20万個の試験管受精周期しか完成しておらず、このことは試験管受精は大多数の女性或いは夫婦にとって現実的な解決策ではないことを表明した。著者らのFemaSeed製品は現在すでに承認され、それは人工授精領域で新しい分類を確立した:精子を直接卵管(卵管内受精)に輸送し、これは妊娠発生の場所である。この費用効果のある在任中の解決策は不妊の第一線の治療方法になり、特に男性要素に関連する場合、女性とそのパートナーが不妊治療を受ける機会を増加させることができると信じている。
10
カタログ表
生殖健康の機会
米国だけで7200万人の出産適齢女性(国家健康統計センター、2018年)が推定されている。私たちは女性に全面的な妊娠予防と妊娠解決策を提供し、手術を避けながら経済的かつ効率的で安全な解決策を提供するつもりだ。彼女たちの生育期には、ほとんどの女性が彼女たちの妊娠のリスクをコントロールしようとしている。しかも、多くの女性たちが妊娠を望んでいるが、妊娠できない。疾病コントロール·予防センター(CDC)の報告によると、いつ妊娠と妊娠を開始するかを計画する能力は20世紀十大公衆衛生成果の一つと呼ばれている。しかし、多くの女性は平均3年の時間をかけて妊娠を求め、30年の時間をかけて妊娠を避け、現在意外な妊娠を防止し、妊娠を実現する方法に満足していない。
米国だけで毎年約80万人の女性が卵管結紮術(Frattarelliら,2007年)を受けており,1回あたりの平均費用は約6000ドル(計画出産組織,2019年)である。しかし,1200万人を超える女性が長期にわたって非恒久的避妊選択(国家衛生統計センター,2015)を受けていると推定されており,手術永久選択のみが女性に使用可能であるためと考えられる。また,毎年50万人の男性が輸精管結紮術(Ostrowskiら,2018年)を受けている。毎年永久避妊を希望する130万人の女性と彼女たちのパートナーは私たちの最初の短期市場機会であるが、私たちのbrはこれらの数字は永久避妊の真の需要を反映していないと考えている。多くの人は輸精管切除術と卵管結紮術のような侵襲的手術を受けたくないからである。女性の永久避妊の市場は大きく,また増加しており,女性が一時的あるいは可逆的な避妊代替案からより持続的な解決策に移行するにつれて,米国だけで安全で効果的なオフィスで選択することで,市場機会が200億ドルを超える可能性があると信じている。
米国と世界の出生率の全体的な低下は人口高齢化を招き、世界経済と経済安定に深刻な挑戦となっている。疾病コントロール·予防センターによると、米国だけで1000万人以上の女性が妊娠を渇望しているが妊娠できないと推定されている(2019年全国家庭成長調査)。これらの女性の中で半分以上しか何らかの形の干与を受けておらず、ごく一部の人だけが試験管受精のようなもっと先進的な生殖補助技術を受けている。不妊症例の約40−50%は男性因子(Kumarら,2015)によるものであり,世界の男性精子数が50%(Levineら,2023)を超えて低下した結果である可能性がある。人工授精は生殖医学の中で最も古い技術であり、広く受け入れられている第一線の治療方法でもあり、原因不明不妊症、軽度男性要素不妊症、性機能障害と子宮頚要素不妊症夫婦に適用されるが、その成功率は依然として比較的に低い。しかし,活動精子総数が低い夫婦では,IUIの成功率が相対的に低いことから,効率的なIVF/ICSI治療が推奨されている。IUIの代替方法はまだ提案されておらず、安全かつ有効な第一線の代替方案に対する持続的な需要を満たすために、これらの代替方案はより先進的な生殖補助方案よりコストがはるかに低く、侵襲性もはるかに小さい。生殖補助の市場は大きく,しかも増加しており,女性が不妊治療のケアを求めるようになるにつれて,米国だけでは安全で有効な1つの方法で20億ドルを超える可能性があると信じている。
臨床発展
臨床コースの概要それは.著者らは著者らの子宮内方向性送達製品の候補製品のためにますます多くの納得できる臨床証拠を開発している。
私たちの永久的な不妊解決策は-FemBlocと超音波確認
11
カタログ表
臨床前研究
バイオポリマー組織接着剤による閉塞または閉塞の有効性を支持するために、2つの動物研究を完了し、バイオポリマー組織接着剤は、FemBlocシステムで使用されているアクリレートシアン化物誘導体の分解性混合物である。1つ目はウサギ卵管モデルの有効性の探索的研究であり,ウサギ卵管はヒト女性卵管を模倣している。処理した動物はバイオポリマーを受け,対照動物は偽分娩(手術のみ)を受ける。配種後,対照群動物は1カ月後の初回配種で妊娠したが,バイオポリマー処理群の動物は配種後も妊娠していなかった。具体的には,バイオポリマー処理動物では,1カ月と2.5カ月の交尾時または4カ月と5.5カ月で交尾した場合の受精率は0%であった。このバイオポリマーを用いて生育能力が証明された雌ウサギの卵管を治療することで,妊娠5.5カ月を防ぐことができ,観察期間の長さである。第二の動物研究brは、顕微鏡により組織サンプルまたは組織病理学を評価し、52週間にわたる異なる時間点でバイオポリマーによる卵管閉塞の程度と性質を評価した。また、生体ポリマーに対する局所組織の反応および分解および分解スペクトルの特徴を評価することによって安全性を評価する。バイオポリマー分解が認められ,その存在は時間の経過とともに減少し,実質的な周囲組織の喪失は認められず,急性炎症は時間の経過とともに徐々に減少した。1週目にはバイオポリマーの存在により閉塞が認められ,時間の経過とともに治療後3カ月,6カ月または12カ月に閉塞が認められた場合には完全組織閉塞に分類され,卵管チャネルや管腔はなく,バイオポリマーも存在しなかった。
臨床試験
以下に議論するIDEによる試験に先立ち,開発計画の様々な側面を評価するために93名の患者でいくつかの臨床試験を行った。バイオポリマーの有効性については,計画中の子宮切除術を待っている10名の患者に対して臨床試験を行い,FemBlocの指定群ではない。患者は送達系を通じてバイオポリマーのFemBloc治療を受け、治療後4週間に完全子宮切除術を受け、その後卵管に対して組織病理学的分析を行い、卵管閉塞に進展する兆候とバイオポリマーの関連組織反応を探した。卵管を完全に閉鎖するには3カ月を要すると予想され,永久避妊対策としての有効性と信頼性が確認されたが,4週間では卵管の30%が完全閉塞,管腔が癒合組織反応で閉塞されるか,類似した癒合組織反応による卵管狭窄50%−90%であった。予想されるように,バイオポリマーは多くの卵管に保持されており,観察される炎症反応は通常異物の存在に関与しているようである。深刻な副作用の報告はありません。
我々は以前の3つの臨床研究でFemBlocを研究し,いずれの研究もFDAが承認したIDEに基づいて合計228名の被験者の安全性を評価した。第1の臨床研究は、5つの米国研究地点に登録された49人の被験者を含み、第2の臨床試験は、14の米国研究地点に登録された134人の被験者を含み、第3の臨床試験は、5つの米国研究地点に登録された45人の被験者を含む。第二の臨床試験の一部として,対照群中の被験者を後援し,105名の被験者に対して手術卵管結紮術を行い,将来の安全性事象の比較にのみ用いた。安全のため、被験者は5年間追跡され、最初の被験者は5年間のフォローアップ期間を完了した。以下の図に示すように,以下に検討する意外妊娠を除いて,これまでに報告されている安全事象の多く(91%)は治療当日または術後7日以内に発生し,75%の有害事象(AE)は軽度に分類される。報告された350個の装置、プログラム、または両方に関連する有害事象のうち、228名の被験者が報告した最もよく見られる有害事象は、膣出血(40.0%)、骨盤痛(34.5%)、子宮痙攣(13.5%)、および斑(13.1%)であった。FemBlocは深刻な有害事象(SAE)を報告していない。
12
カタログ表
副作用の多くは軽微であり,手術時に発生する
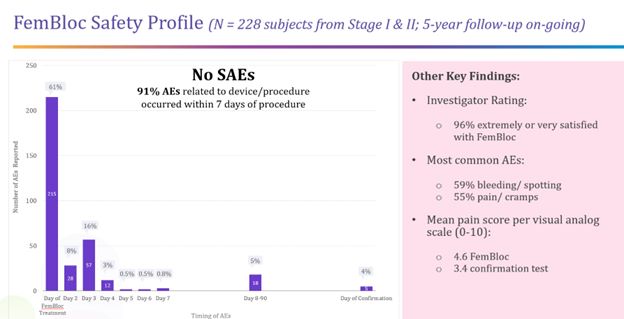
著者らは、患者は早期研究中の手術は高度に耐えられ、疼痛採点は他の子宮内避妊器(例えば子宮内避妊器)と類似していることを観察した。患者から報告されたFemBloc治療プログラムによると,視覚シミュレーションスコア(VAS)を用いた0から10までの平均疼痛と不快スコアは4.6(SD 2.85)であった。われわれの臨床試験では,FemBloc治療3カ月後にFemChec装置を用いて超音波確認を行い,患者には残りのバイオポリマーが検出されず,バイオポリマーが完全に分解し,患者に月経時に離脱する可能性が高いことが示唆された。患者報告の平均疼痛と不快スコアは3.4(SD 2.80)であり,超音波確認を行った。今まで、深刻な安全事件は報告されていない。FemBloc手術時,術後7日,術後3カ月の確認テスト,確認テスト後3カ月および年間5年間の安全性と余分な性能測定のデータを記録した。登録締め切りは2019年2月です。
この2つの臨床研究を行っている間,意外な妊娠はFemBloc依存を告げられた患者に発生した(パイロット研究では妊娠6例,キー試験では3例の妊娠)。これらの妊娠は超音波確認テストに対する誤解によるものであり,独立臨床事件委員会によって確認された。2019年2月,行われているFemBlocキー臨床試験(被験者に対して5年間の安全性追跡にもかかわらず)を一時停止した。FDAは新しい患者列の中で小型IDEの臨床研究を行い、意外な妊娠リスクを下げるためのプログラム、製品と訓練に対する改善の十分性を評価し、同時に超音波確認テストを検証することを提案した。小型IDE試験(第2段階検証研究)の設計には、2つの確認試験(超音波および放射線学)の実行が含まれており、両方の試験がプログラムの成功を確認した場合にのみ、被験者はFemBlocに依存すると言われた。この研究では,FemBlocに依存した患者は妊娠していないといわれている。2023年6月、我々はIDEに対するFDAの承認を得て、重要な臨床試験でFemBlocの安全性と有効性を評価することができ、FemBlocは私たちの非手術、非植入性、オフィス内の永久避妊ソリューションである。2023年8月に決勝戦での募集開始を発表しました[FemBloc卵管内閉塞経子宮頚永久避妊のための展望性多中心試験]肝心な裁判。この展望性,マルチセンター,開放ラベル,片腕研究設計は妊娠率を主要な終点とし,401名の女性がFemBlocを1年間使用して恒久的な避妊を行うと分析した。また,この研究はスクロール試験として設計されており,まず50名の女性を募集し,残りの被験者を募集する前に,まず臨床読み取りを行い,主に初歩的な安全データである。300名の女性がFemBlocを用いて1年間の永久避妊を行った後,臨床データの終点を中期分析する予定である。発売されてから5年以内に、毎年継続的にフォローされるだろう。
13
カタログ表
私たちの人工授精プログラムです
女性卵管内人工授精装置510(K)許可
FemaSeed卵管内人工授精は単一の子宮内方向性伝達精子製品であり、すでに2023年9月にFDA 510(K)の許可を得てアメリカで発売され、2023年4月にカナダ衛生部の許可を得た。FDAが承認した2021年4月に受け取ったIDEに基づいてFemaSeedを研究し、現地での安全性と有効性を評価しました[未来の多中心地元人工授精の指向性人工授精試験]肝心な裁判。2022年10月、男性因子不育症を経験した夫婦に重点を置いたこのキー試験の最新研究設計を発表した。FDAから米国の規制許可を得た場合,臨床試験はまだ行われているが,この研究は2023年11月に登録が完了している。臨床試験のTOPLINE結果は2024年3月に発表された。この試験は、24%の女性が深刻な男性因子(100万から2000万の総活動精子数(TMSC))を患った後に妊娠していることを示している。対照的に,文献に記載されている男性因子を有する子宮内人工授精(IUI)の周期妊娠率は6.7%(100万TMSCより大きい)であった。FemaSeedの複数回の試みが許可されているにもかかわらず、妊娠している女性の多くは、最初のFemaSeed手術後に妊娠している。副作用の多くは軽微である(n=127人の被験者、216サイクル)。7週間のフォローアップでは,新たな安全問題は観察されなかった。すべての副作用はIUIの既知の副作用と一致した。
我々は2024年3月に第1段階の商業発射を開始し,FemaSeedの第1回商業使用を発表した。
異なる子宮内配向分娩装置の510(K)ギャップ
FemCath Cornualバルーンカテーテルは単一の子宮内指向分娩製品であり、FemaSeedと類似しているが、適応は異なり、すでに北米での販売が許可されている。この製品とFemVue Saline−Air装置を用いて23名の被験者(45本の卵管)を発売後研究し,塩水−空気比較を観察し,選択的卵管輸液を評価した。89%の対象が卵管近位端に進入し、持続的な卵管流出または腹膜腔への進入を合併した。これはFemaSeed製品の予定納入先と同じだ。深刻な副作用の報告はありません。私たちは2022年12月からFemCath製品を限定的に市場で発表します。
発売後の情報
FemVue Saline−Air Deviceはコントラストを生成する製品であり,米国,カナダ,日本での販売が許可されている。著者らの人工授精解決方案の診断セット製品FemVueの支持において、すでに多数の出版物と要約は臨床証拠を提供した。結論:FemVueによる卵管流暢性の評価は子宮卵管造影(HSG)に匹敵し、便利、耐性の良い方法であり、通常の超音波と子宮腔評価と一緒に不妊症評価の一部とすることができる。他の出版物は、FemVueは卵管閉塞を診断する正確なテストであり、その性能は透視HSGと類似しており、透視HSGを代替する可能性があることを指摘した。FemVueはすでに商業化されており、米国と日本にはビジネスチームがない。
私たちの子宮頸組織サンプラー。
発売後の情報
FemCervは子宮頸癌生組織検査設備であり、すでに北米での発売が許可されている。FemCervの発売後研究に協賛し,異常子宮頚組織結果のさらなる評価を受けた112名の患者をさらに評価した。FemCervが提供したサンプルは94%の患者が組織学的評価を行う際に十分であることが観察された。医師は,95%の患者がFemCerv手術中に軽微または不快感を感じなかったと報告し,92%の医師がFemCervデバイスが挿入しやすいと報告している。不良事件の報道はありません。私たちは2022年9月に米国で限られた市場発表を開始した。
14
カタログ表
製造業
我々は,FDA品質体系法規の要求に応じた強力な医療機器品質管理システムを含む完成品医療機器の製造·流通に必要なインフラを開発·実施し,医療機器単一審査計画と国際標準化組織13485:2016年の認証を通過した。私たちは現在、すべての製品と候補製品を製造または組み立てて、契約サプライヤーから
コンポーネントを調達しています。私たちは現在、FemaSeed製品の臨床計画の需要、製品の供給と発売要求を満たすのに十分な能力があると信じており、私たちはより少ない資本投資で私たちの能力を相対的に速く拡大することができると信じている。FDAがFemBlocシステムを承認する前に、私たちの製造能力は予測可能な未来に私たちの製品に対する世界市場の需要を満たすのに十分だと信じている。私たちは私たちの製品と候補製品を生産し続けることを計画していますが、承認されたり、マーケティングの許可を得たりすれば、必要に応じていくつかの部品のアウトソーシング手配を考慮して、私たちの商業生産規模を拡大します。
FDAとISO要求および内部政策とプログラムサポートの品質基準に適合するサプライヤーに対して、厳格なサプライヤー評価、資格認証、選択プロセスを採用しました。私たちの品質保証プロセスは、資格認証と定期サプライヤー審査と監査を通じてサプライヤーの表現を監視し、維持します。ヨーロッパ経済地域で販売されている医療機器については、13485国際標準化組織認証を維持しなければならず、実施が要求される品質システムは、部品品質、サプライヤー制御、製品設計、および製造操作に適用される。著者らはすでにEU医療機器法規(MDR)の最終審査を完成し、これはMDR証明書とCE標識を獲得する最後のステップであり、Femasysが必要な最高監督管理基準を遵守したことを証明した。
私たちは重要なCMCと設備製造インフラを持つ内部政策とプログラムによってサポートされている厳格な製造プロセスの下で私たちの製品を検査、テスト、組み立てます。私たちは各製品と候補製品に対して自分の最終品質管理テストを行い、私たちは製造過程のすべての方面に対して完全な制御があり、私たちの製品に適用されるQSRの良好な製造規範を遵守します。
私たちのサプライヤーは私たちのサプライヤー管理計画によって管理されており、この計画はサプライチェーンリスクの低減に重点を置いている。この計画の重要な側面には、サプライヤーの部品在庫の管理と、特定のサプライヤーに対する第2の調達方法が含まれる。通常、私たちの外部サプライヤーは私たちの規範に基づいてコンポーネントを生産し、多くの場合私たちの設計に基づいて生産します。私たちの品質部門は定期的に私たちのサプライヤーを審査して、私たちの製品の規格、政策とプログラムに合うことを確保します。また、私たちと私たちのサプライヤーは、品質法規に適合することを確保するために、アメリカと国際規制機関の抜き打ち検査を定期的に受けています。必要であれば、比較的短い時間で商業的に合理的な条件で代替供給源を提供すると信じている。私たちはまた個人ラベルHSGカテーテルのサプライヤーと契約を結びました。これらの導管は私たちの名義で販売されています。
私たちは長期的な供給協定を持っていません。私たちは注文する方法で私たちの製品のためにいくつかの部品を買います。私たちは今私たちのbr製品を冗長に供給するいくつかのコンポーネントを手配していません。もし私たちの現在の第三者サプライヤーが合意通りに履行できなければ、私たちはこれらのサプライヤーの交換を要求されるかもしれない。いくつかの潜在的な代替サプライヤーがこれらのコンポーネントを提供することができると信じているが、そのような任意の代替コンポーネントを決定して同定する際に、追加のコストおよび遅延が生じる可能性がある。
最後に、私たちの製品と候補製品については、第三者滅菌器を使用して、これらの使い捨て製品が包装と輸送時に無菌使用されることを保証します。もし私たちの現在の契約滅菌器(S)が約束通りに実行され続けることができない場合、私たちは識別し、別の第三者契約滅菌器と契約を締結する必要があるかもしれないが、これは、任意のこのような代替滅菌器を決定および同定する際に追加コストおよび遅延が生じる可能性がある。
競争
我々が競争する市場競争は激しく、限られた分野で迅速かつ重大な技術変革を特徴としている。競争に成功するためには、成熟したおよび新しい代替プログラム、製品および技術に対する私たちの製品および候補製品の利点を引き続き示し、医師および他の医療政策決定者に、私たちの製品と技術の利点を信じてもらう必要がある。
15
カタログ表
著者らの永久性避妊解決方案の面で、著者らは外科卵管結紮術、女性パートナー輸精管結紮術、その他の非永久性避妊方法、子宮内避妊器、避妊薬、注射と植入性避妊薬とパッチなどの処方薬、及びその他の避妊と避妊方法と競争を展開する予定である。現在,直接競争する非手術,非植入性永久避妊製品は市場にはなく,開発中の製品もないことが知られている。
我々の人工授精ソリューションでは,現在市販されているIUI,IVF/ICSI,生育能力を増強する薬剤および臨床や臨床前に開発された薬物と競合する予定である。我々の人工授精製品カテゴリには1つの直接競争相手がいるが、私たちの製品だけが卵管内人工授精の現地化指向性送達を実現し、IUIとIVF/ICSIなどの代替案がある。IUI装置を生産する先行会社は、クックグループの子会社であるCook Medical LLC、Cooper Surgical,Inc.,MedGyn Products,Inc.およびRocket Medical LLCを含む。
私たちの組織サンプリング製品については、他にも女性の健康評価子宮頚組織を評価するためのプログラム、例えば巴氏試験、HPVテストと膣鏡検査、これらのプログラムはすべて成熟して普遍的である。
alysis MedicalとGuided Treeuticsなどの会社も候補子宮頚組織サンプリング製品を開発している。
私たちの多くの競争相手は競争力のある製品の開発とマーケティングに必要なよりも多くの資源を得ることができます。また、業界内の統合により、新たな競争や製品が出現する可能性があり、
他社は我々の製品や候補製品と競合する製品を開発する可能性があり、開発初期段階にある候補製品がある可能性があり、これらの製品を知らない。
販売とマーケティング
FemaSeed-我々の人工卵管内授精解決策。
FemaSeed 510(K)に対するFDAの承認とカナダ衛生部のFemaSeedに対する監督管理の承認に伴い、私たちは商業化を実現するために直売チームを募集、募集、訓練している。我々は強い販売背景と医療機器販売経験を持ち、生殖内分泌と婦人科医と既存の関係を構築する可能性のあるbr代表の募集を求める。私たちは大部分の販売とマーケティングの仕事を北米に集中させ、流通パートナーを利用して国際市場に進出し続けるつもりだ。私たちはすでにアメリカ、ヨーロッパ、カナダ、日本でFemVue設備の規制許可とマーケティング許可を得ていますが、私たちの主なビジネスの重点は北米で、そこで私たちのFemaSeed製品の商業化とマーケティングを始め、製品販売から収入を得たいと思っています。
専門的な直売組織を通じて,450診療所の約1,700人の生殖内分泌専門家に向けて訓練を受け,不妊症手術を行った経験があることを計画している。具体的には,我々は最初に現在FemVue機器を購入している約50社の顧客を狙う予定である.50%を超える実践は,実行された生殖補助周期の約60%
が8州に分布しており,これらの州を優先することに相当する。
私たちは意識を高める活動を展開して、私たちのFemaSeed製品の発売が許可された司法管轄区でのメリットを強調する予定です。また,不妊や人工授精を求める患者の第一線の治療選択として,患者や医師にFemaSeed製品を普及させる予定である。
FemBloc-私たちの永久的な不妊解決策。
承認されれば,最終的にはFemBloc婦人科医に重点を置いた販売チームを用いて,これらの医師をFemaSeedに紹介し,不妊治療の販売チームのカバー範囲を拡大し,最初のポイントは生殖内分泌学者ではなくなるようにする予定である。承認されれば、FemBlocの米国での直販チームのために、より多くの販売代表を募集、採用、訓練する予定だ。強い販売背景と医療機器販売経験を持つ代表を募集し,婦人科医と関係のある代表を求める。私たちは販売とマーケティングの大部分をアメリカに集中させ、流通パートナーを利用して国際市場に進出し続けるつもりです。私たちの専門的な直売組織を通じて、約40,000人の研修を受け、婦人科手術と計画出産経験を提供した婦人科医を狙う予定です。br}は60%を超える診療所で、60%を超える出産適齢女性を代表し、13州に位置し、優先されます。
16
カタログ表
われわれのこれまでの臨床経験から,子宮内操作(例えば子宮内避妊器)で経験豊富な医師は,我々のFemaSeed
製品のように,最低限の訓練を受けるだけで我々のFemBlocシステムの使用を開始できると信じている。超音波確認テストを支援する医療従事者や超音波技師に対する追加的な超音波検査訓練が必要となる。われわれのこれまでの臨床経験から,医師や超音波診断士は最小限の訓練が必要であり,ほぼインターネットで行うことができると信じている。私たちはFDAが候補製品を承認する前に私たちの販売組織を設立することを望んでいる。
私たちは認識を高める活動を展開し、私たちのFemBlocシステムの上場が許可された司法管轄区でのメリットを強調する予定です。著者らはまた、FemBlocシステムを最初の非手術、非インプラント永久避妊選択としての患者と医師のより広範な認識を促進するつもりである。
精算する
アメリカでは、私たちの最初のほとんどの収入は、FemaSeedとFemVue製品を含む、私たちの不妊製品の組み合わせを出産診療所に販売することから来ていると予想されています。これらの製品は、通常、患者または保険カバーのある患者、個人保険会社、健康維持組織、および他の医療関連組織を含む様々な第三者支払者に直接費用を徴収しています。保険を申請した人のために、私たちのFemaSeed製品に関連する任意の部分のコストおよび費用は、これらの第三者支払者のカバー範囲内ではなく、例えば、賠償免除または共同支払いは、提供者によって患者に直接課金されると予想される。第三者支払者(Br)は、米国医学会(AMA)によって作成され、維持されている現在のプログラム用語(CPT)コードを使用して、精算を求める製品およびサービスを識別するように医師および病院に要求する。アメリカでは、子宮内人工授精は数十年来ずっと患者に広く応用されているため、精算コードと支払いはすべて完備しており、個人医療保険計画はこの過程をカバーするかもしれない。確立された精算コードbrは卵管の診断に使用することができ、このプログラムは個人健康保険計画によって支払われる可能性がある。米国以外では,国や地域によって精算レベルが大きく異なり,特に関連国や地域によって単一支払人制度を維持しているかどうか,患者が直接支払うことも選択肢である。これらの単一支払者制度の国や地域では,年間医療予算は通常支払者が支払う子宮内人工授精治療の数を決定している。精算源は様々で、政府が支援するものと個人健康保険計画、両者の組み合わせが含まれている。
アメリカでは,我々のほとんどの収入は,Medicare,Medicaid,民間保険会社,健康維持組織,その他の医療関連組織を含む様々な第三者支払者に課金されるFemBlocシステムを婦人科オフィスに売却することから来ると予想される。さらに,我々のFemBlocシステムに関連する任意の部分のコストおよび費用は,これらの第三者支払者のカバー範囲内ではなく,例えば賠償免除額や自己支払い費用は,提供者が直接患者に請求書を発行することが予想される.FemBlocシステムは“平価医療法案”(ACA)に組み込まれ,FDAが承認した恒久的な避妊製品として独自のbrクラスに属することが予想される。ACAは宗教と道徳的例外を含め、いくつかの州と保険会社に追加的な制限がある修正案を追加した。HealthCare.govによると。ACAによれば、加入患者の計画は、患者がその免責額に達していなくても、共同支払いまたは共同保険を受けることなく、ネットワーク内提供者によって提供される避妊具を含まなければならない。
我々はこのプログラムのために2つのクラスIコードを求める予定であり、AMAによると、IクラスのCPT要求は最大5人の同業者評議の出版物に臨床治療効果を記録することを含み、そのうちの少なくとも1つはアメリカ患者集団であり、2つは異なる患者集団である。連邦医療保険制度下の医師精算は通常,定義された費用計画や医師費用計画に基づいており,この計画により,支払い金額は医師が提供するサービスの相対的価値によって決定される。Medicareは通常,病院外来予想支払いシステムと外来外科センター支払いシステムによってそれぞれ病院と外来外科センターのSNM治療に精算を提供し,この2つのシステムは必要に応じて病院または外来外科センターにバンドル金額を精算し,通常外来設置で実行されるプログラムに関連するすべての施設費用を支払うために用いられる。外来医療期待支払いシステム(OPS)の動的支払い分類(APC)は商業支払者に広く使用されており,FemBlocプログラムはAPC 4級婦人科手術をマッピングし,2,498ドル(卵管結紮術)を支払う予定である。返済率は、支払者、地理的位置、実行されるプログラム、契約条項、プログラムを実行する施設、および他の要因を含むが、これらに限定されないいくつかの要因によって異なるであろう。
米国以外では,国や地域によって精算レベルが大きく異なり,特に関連国や地域によって単一支払人制度が維持されているかどうかによって異なる。年間医療予算
は,通常,これらの単一支払者システムの国や地域で支払者によって支払われる恒久的避妊プログラムの数を決定する。精算源は様々で、政府が支援するものと個人健康保険計画、両者の組み合わせが含まれている。いくつかの国や地域は、私たちのFemBlocシステムに保険と精算を提供する前に、より多くの臨床データを収集することを要求するかもしれない。私たちは支払人と協力して、経済的に意味のある国や地域で保険や精算の承認を受けるつもりだ。
17
カタログ表
知的財産権
私たちの成功は、私たちの独自技術および知的財産権、特に私たちの特許権、私たちの商業秘密を取得、維持、保護、実行する能力、および第三者が効果的かつ強制的に実行可能な特許および他の固有の権利を侵害することなく運営される能力にある程度依存する。私たちは、特許、商標、商業秘密、著作権、および他の知的財産権と措置の組み合わせによって、私たちの業務に重要だと思う知的財産権を保護します。私たちはまた独自技術と持続的な技術革新に依存して私たちの競争地位を発展させて維持する。
私たちは、サプライヤー、従業員、コンサルタント、および当社の固有情報にアクセスできる可能性のある他の人とのセキュリティプロトコルおよび独自の情報プロトコルを含む様々な方法で私たちの固有の権利を保護することを求めています。しかし、商業秘密と固有の情報を保護することは難しいかもしれない。私たちは私たちの商業秘密と固有の情報を保護して保存するための私たちの措置に自信があるが、このような措置は違反される可能性があり、私たちはこのようないかなる違反に対応するのに十分な救済措置がないかもしれない。さらに、私たちの商業秘密と独自の情報は競争相手に知られたり独立して発見されるかもしれない。
2023年12月31日現在、我々は48件の米国特許と132件の外国特許を有しており、14件の米国特許出願が出願中であり、25件の外国特許出願が出願中である。これらの発行された特許およびこのような出願によって付与された任意の特許は、潜在的な特許期間の延長または調整を考慮せずに、2024年から2046年の間に満了すると予想される。私たちは2024年に満了した特許が私たちの業務に重要ではないと思う。
アメリカでは、私たちのFemBloc特許の組み合わせは2つの特許シリーズを含む。それらは、付与された実用プログラムおよび設計特許を含み、少なくとも2025年および2030年までの保護を提供し、任意の条件に適合した特許期間の調整および延長を含む。公共事業特許シリーズは、承認された場合、条件に適合する特許期限の調整および延長を加えて、2025年に特許が満了する可能性がある係属中の特許出願を含む。私たちのFemVue特許の組み合わせは
の5つの特許シリーズを含む。これら5つの特許シリーズには、付与された実用新案および外観設計特許が含まれており、これらの特許が提供する保護は、少なくとも2026年および2028年まで継続され、そのうちの1つは2024年に満了する。この2つの実用特許シリーズは、係属中の特許
出願を含み、承認された場合、これらの出願は、任意の条件に適合する特許期限の調整および延長を加えて、2028年に特許が満了する可能性がある。私たちのFemChec特許の組み合わせは5つの特許シリーズを含む。これら5つの特許シリーズは、実用特許の付与と、少なくとも2026年、2028年、2029年、2032年および2046年までの保護を提供する設計特許とを含む。公共事業特許シリーズは、承認された場合、2028年に特許が満了し、条件に適合する任意の特許期間の調整および延長をもたらす可能性がある係属中の特許出願を含む。私たちのFemaSeed特許の組み合わせは3つの特許シリーズを含む。2つの特許シリーズは、付与された実用新案および意匠特許を含み、少なくとも2025年および2044年までの保護を提供する。第3の(公共事業)特許シリーズは、承認された場合、少なくとも2042年に特許が満了する可能性がある係属中の特許出願を含む。私たちのFemCerv特許の組み合わせは2つの特許シリーズを含む。この2つの特許シリーズは、付与されたユーティリティおよび外観設計特許を含み、少なくとも2027年、2032年、および2033年までの保護を提供する。公共事業特許家族は、承認された場合、2033年に特許が満了する可能性がある係属中の特許出願を含む。私たちのFemEMB特許の組み合わせは特許シリーズを含む。1つの特許シリーズ
は、少なくとも2033年までの保護を提供する付与されたユーティリティ特許を含む。公共事業特許家族は、承認された場合、2033年に特許が満了する可能性がある係属中の特許出願を含む。私たちのバイオポリマー特許の組み合わせは特許シリーズを含む。この特許シリーズは、付与された実用新案および意匠特許を含み、これらの特許は、少なくとも2038年までの保護を提供し、承認されれば、2038年に特許が満了する可能性がある係属中の実用新案特許出願を含む。私たちの制御されたbr輸送装置特許の組み合わせは1つの特許シリーズを含む。特許シリーズは、付与された実用新案および意匠特許を含み、少なくとも2035年および2042年までの保護を提供する。公共事業特許シリーズは、承認された場合、2040年に特許が満了する可能性がある未解決の特許出願を含む。私たちの注射器ロック特許の組み合わせは、2つの特許シリーズを含む。特許シリーズは、少なくとも2038年および2044年までの保護を提供する付与された設計特許を含み、承認されるべき設計出願は、2038年以降に特許の満了をもたらす可能性がある。私たちのVariRock特許の組み合わせは、係属中のユーティリティおよび外観設計特許出願を含む2つの特許シリーズを含み、承認された場合、2035年以降の特許の満了をもたらす可能性がある。私たちのFemCath特許の組み合わせは、2026年に満了する外観設計特許と、条件に適合する任意の特許期限の調整および延長を含む特許シリーズを含みます。処理されている特許出願が承認される保証はない。我々の重大な国際特許および特許出願には、カナダ、中国、香港、EU、インド、日本、韓国、ブラジルを含む米国特許出願と同様の概要詳細が付与された外観設計および実用新案特許が含まれている。
18
カタログ表
個別特許の期限は,特許を付与した国の特許法的期限に依存する。米国を含む多くの国/地域では,特許期間は適用国/地域の非臨時特許出願の最初の提出日から20年である。米国では、特許期限は、特許権者が米国特許商標局の審査および特許付与時の行政遅延による特許権者の補償である特許期限調整によって延長することができ、または、1つの特許が共通所有特許または共通発明者と命名された特許によって最終的に放棄され、より早い満期日を有する場合には、特許期間を短縮することができる。私たちは、提出されたまたは将来提出される可能性のある未解決の特許出願が発行された特許が生成されるかどうかを決定することはできず、発行されたか、または将来発行される可能性のある任意の特許が、私たちの現在または未来の製品を保護し、いかなる競争優位性を提供し、挑戦、無効、回避されないことを保証することはできません。
我々の知的財産権に関連するリスクに関するより多くの情報は、“リスク要因-私たちの知的財産権に関連するリスク”というタイトルの部分を参照してください
政府の監督管理
アメリカです
私たちの製品は医療機器であり、FDAによって“連邦食品、薬物と化粧品法”(FDCA)とその実施条例及びアメリカの他の連邦と州監督管理機関及び他の国の類似機関によって他の法規と法規に基づいて広範かつ持続的な監督管理を行う。法律法規は製品の設計と開発、臨床前と臨床試験、製造、包装、ラベル、貯蔵、記録保存と報告、審査、マーケティング、流通、販売促進、輸出入と発売後の監督などの方面に対して管理を行う。適用要件を遵守しないことは、警告状の発行、輸入拘留、民事罰金および/または司法制裁、例えば、製品差し押さえ、禁止、および刑事起訴のような設備および/またはその製造業者に様々な行政制裁を受ける可能性がある。
FDAの上場前審査要件
米国で商業流通されている各医療機器は、免除を受けない限り、または承認された最初の分類要求が必要でない限り、510(K)の承認を事前に得る必要があるか、またはFDAの発売前承認を得る必要があることを求めている。医療機器は,各医療機器に関連するリスクの程度と,製品の安全と有効性の合理的な保証を提供するために必要な制御度
の3つに分類される。クラスIデバイスは、低リスクデバイスとみなされ、例えば、偽、ブランドエラー、登録および発売、修理、交換、または返金、記録および報告、および良好な製造実践を含むFDCAの一般的な制御によって制御される。米国食品薬品監督管理局第510(K)条によると、多くのI類設備は発売前通知を免除するように分類されているため、FDA 510(K)
の許可を得ずに商業流通を行うことができる。第二種類の設備は同時に一般的な制御と特別な制御を受け、その中に性能標準、発売後の監視、患者登録と指導文書を含む。クラスIIデバイスの多くについては、製造業者は、上場前通知をFDAに提出しなければならず、このデバイスを商業的に販売することを許可することを要求する。FDAが最大のリスクを構成すると考えられるデバイス、例えば、生命を維持する、生命をサポートする、または移植可能なデバイス、または以前に承認された510(K)デバイスと実質的に同等ではないと考えられるデバイスは、クラスIIIに分類される。FDAがPMAの提出後にデバイスを承認しない限り、クラスIIIデバイスは米国で販売することができない。しかし、いくつかのクラスIII修正前のデバイスFDAはまだPMAを要求していない。FDAがPMAの提出を要求する規定を発表した後にのみ、これらの装置はPMAを必要とする。PMA発効日の前に、製造業者は、これらのデバイスを商業的に流通させるために、510(K)の発売前の通知を提出し、許可を得なければならない。FDAはまた、それらが安全かつ効率的な方法で使用されることを保証するために、デバイスに販売、マーケティング、または他の制限を実施することができる。
19
カタログ表
510(K)クリーンパス
510(K)の許可が必要な場合、提案された装置が、以前に承認され、合法的に発売された510(K)装置、または1976年5月28日前に商業販売に投入された装置、またはFDCA 513(F)(2)節に従って再分類された装置である可能性があることを証明する上場前通知をFDAに提出しなければならない。実質的な等価性を証明するために,メーカは,
で提案されたデバイスは述語デバイスと同じ期待用途を持ち,同じ技術的特徴や異なる技術的特徴を持ち,市場投入前通知における情報は,そのデバイスが述語デバイスと同様に安全かつ有効であり,異なる安全性や有効性の問題を起こさないことを証明しなければならない.実質的等価性を証明するには非臨床表現データが必要であり,場合によっては臨床データも必要である。FDAが装置が以前に承認された装置と実質的に等しくないと判断した場合、FDAは装置をクラスIIIに分類する。
510(K)Sには、従来、特殊、および略語の3つのタイプがある。特別510(K)Sは、装置を合法的に許可して販売する製造業者によって修正された装置に適用され、性能データが必要とされない場合、または性能データが必要な場合には、変更を評価するために成熟した方法を使用することができ、実質的に等価(SE)をサポートするために必要な性能データを要約またはリスク分析フォーマットで検討することができる。
略語510(K)Sは、公認規格に適合する装置に適用可能である。特別項目と略称510(K)Sは簡素化審査を意図し、FDAは特別項目510(K)Sを受信した日から30日以内にそれを処理する予定である。FDAはまた、いくつかの理解しやすいデバイスタイプの簡略化510(K)経路概念の拡張であるセキュリティおよび性能に基づく経路を確立し、FDAによって決定された性能基準を使用して、デバイスが予測デバイスと同様に安全かつ有効であることを証明するオプションを提供する。
デノボ分類
FDAが従来I類,II類またはIII類に分類されていなかった医療機器タイプは,それらの構成リスクレベルにかかわらず自動的にIII類に分類される。1997年の食品·医薬品局近代化法案は、“自動III類指定の評価要求”、あるいは
と呼ばれる述語装置の不足により自動的にIII類に分類される低中リスクの医療機器のための新たな市場進出のための新しい道を確立した初めからやり直す分類プログラム。本プログラムは、その新しいデバイスがクラスIIIに自動的に分類されることを可能にする製造業者が、その医療デバイスをクラスI
またはクラスIIに再分類することを要求し、そのデバイスが低リスクまたは中程度のリスクが存在し、一般的に単独または一般的および特殊な制御を制御して、予期される用途に安全および有効性の合理的な保証を提供し、デバイスの可能な利益
が可能なリスクよりも大きいことに基づく。
FDAはすでにいくつかの指導文書を発表し、最初の分類過程と最初からの分類要求の内容に関連しているが、FDAはまだ最初の分類過程を管理する法規を発表していない。FDAは2018年12月7日、最初から分類過程の法規を確立するために提案された規則を発表した。提案条例が決定されると、最初から要求されるフォーマットおよび内容に関連する要求、ならびに最初から要求されたフォーマットおよび内容に関連する要求、ならびに最初から要求されたプログラムおよび基準を含む構造、明瞭性および透明性を最初から分類するプログラムに提供することが意図される。
食品·薬物管理局安全·革新法案(FDASIA)によると,FDAは最初の分類要求を受けてから120日以内に設備を分類する命令を発行しなければならないが,実際にFDAが最初の分類要求を審査する時間ははるかに長い。食品·医薬品局再認可法案(FDARA)により,国会は最初からの分類要求に対してユーザ費用を実施し,FDAはその審査に対してbrの目標を達成することを承諾した。製造業者がクラスIIに再分類することを求める場合、製造業者は、医療機器の安全性と有効性を合理的に保証するために必要な特殊な制御の提案草案を含まなければならない。さらに、FDAが合法的な販売のアサート装置を決定した場合、または一般的な制御または一般的および特殊な制御が、装置の安全性および有効性の合理的な保証を提供するのに不十分であると判断した場合、または装置の可能な利益が可能なリスクを超えないと判断された場合、FDAは、最初からの分類要求を拒否することができる。分類要求の最初からの開始に応答してクラスIまたはクラスIIに分類されるデバイスは、マーケティングされ、将来の販売前通知510(K)提出の述語として使用されることができる。
20
カタログ表
上場前の承認ルート
FDAは,改正前のIII系デバイスを除いて,PMAのすべてのIII系デバイスに上場前承認申請をFDAに提出しなければならないことを要求していない。上場前承認申請プロセス
は510(K)上場前通知プロセスよりもはるかに要求が高い.上場前の承認申請は大量のデータ支持が必要であり、技術、臨床前と臨床試験データ、及び生産とラベル情報を含むが、FDAがこの設備の安全性と有効性の合理的な保証を満足的に証明したことを証明する。
PMA出願を提出してから45日以内に、FDAは、FDAが審査申請を提出するかどうかを決定するために、実質的な審査を可能にするために、申請が十分に完全であるかどうかを決定する。FDAの業績目標は、諮問委員会が意見を提供する必要がない元のPMAに関する決定を180日以内に発表することであり、これには、機関が出願人に補足情報を要求する日数は含まれていない。FDAが申請を審査する総時間は通常はるかに長く、1年以上かかるかもしれない。この審査期間内に、FDAは、より多くの情報の提供を要求するか、または提供された情報を明確にすることを要求することができる。また,FDA以外の専門家コンサルタントグループを集めて申請を審査·評価し,装置の承認についてFDAに提案することも可能である。FDAは諮問グループ決定の制約を受けず,グループのアドバイスを受け入れない可能性もあるが,グループのアドバイスはFDAの全体的な意思決定過程に重要である。また,FDAは製造施設の承認前検査を行い,品質体系法規やQSRに適合することを確保する可能性がある。この機関はまた、FDAの規定に適合することを確実にするために、1つまたは複数の臨床場所を検査することができる。
FDAは、申請者がテストおよび分析を完了した直後にPMAの離散部分(モジュール)をFDAに提出して審査することを可能にする。FDAはモジュール化審査方法を用いて1種のメカニズムを提供する予定であり、このメカニズムを通じて、申請者は審査のために臨床前データと生産情報を提出することができ、同時に臨床データを収集、編集と分析することができる。したがって,モジュール化PMAは異なる時間に提出される小節または“モジュール”のアセンブリであり,
とともに完全な出願となる.さらに、モジュール化方法は、従来のPMA出願ではなく、FDAが審査中に発見した任意の欠陥を潜在的に解決することを可能にする。
薬品監督管理局の審査期間中、食品と薬物管理局は薬品監督管理局中のデータと情報が有効な科学的証拠を構成するかどうかを評価し、提案されたラベルによる設備が安全であることを確定し、その期待用途に対して有効な合理的な保証を支持する(S)。PMA審査が完了した後、FDAは、(I)商業マーケティングを許可し、1つまたは複数の適応の特定の処方情報を提供し、最初に求められた情報よりも限られていてもよいPMAを承認することができ、(Ii)FDAがPMAが承認可能であると考え、FDAがどのような追加情報を必要とするか、または承認前に
同意しなければならない承認後に約束する承認可能な書簡を発行することができる。(Iii)承認に必要なステップを概説する承認不可能な手紙を発行するが、これらのステップは、通常、承認可能な手紙のステップよりも煩雑であり、追加の臨床試験が必要とされる可能性があり、これらの試験は、通常、高価で時間がかかり、承認が数ヶ月または数年遅れる可能性があり、または(Iv)出願を拒否する。FDAが承認可能または承認不可能な手紙を発行した場合、出願人は180日の時間で応答し、その後、FDAの審査クロックがリセットされる。FDAがPMA承認を発行した場合、この承認は、ラベル、普及、販売、および流通の制限、およびPMAをサポートする臨床試験中の患者から長期フォローアップデータを収集するか、または承認後に追加の臨床試験を行う要件を含む、装置の安全性および有効性を保証するための承認後条件を含む可能性がある。
製造施設、方法または品質制御プログラムの変更、または設計性能仕様の変更など、承認されたデバイスのいくつかの変更は、デバイスの安全性または有効性に影響を与え、PMA補足材料の提出および承認が必要である。承認されたデバイスの他のいくつかの変更は、例えば、設計変更が異なる予期される用途、動作モード、および動作技術ベースをもたらす場合、または設計変更が新しい世代デバイスを開発するために非常に重大である場合、最初に提出されたデータが変更に適用されない場合など、新しいPMAを提出および承認する必要がある。
21
カタログ表
臨床試験
臨床試験はほとんど常に上場前の承認を支持する必要があり,常に再分類が必要であり,510(K)の承認が必要な場合もある。米国では、重大なリスクを有するデバイスについて、これらの実験はIDE申請をFDAに提出する必要がある。IDEアプリケーションは、動物および実験室テスト結果のような適切なデータサポートを必要とし、人体上でデバイスをテストすることが安全であり、テストスキームが科学的に合理的であることを示している。特定の研究場所の特定の数の患者に対して、IDEは事前にFDAの承認を得なければならない。試験期間中、スポンサーは調査員の選択、試験モニタリング、報告、記録に関するFDAのIDE要求を守らなければならない。調査者は患者のインフォームドコンセントを得,調査計画や研究案を厳格に遵守し,調査設備の処置を制御し,すべての報告や記録要求を遵守しなければならない。IDE申請がFDA承認を得るまで、重大なリスクデバイスの臨床試験は開始されない可能性があります。IDE申請は、FDAが受領してから30日後に承認されたとみなされ、機関が申請を受けた日から30日前に、IDEが承認されたこと、条件付きで承認されたか、または承認されていないことをスポンサーに電子メールで通知しない限り、承認されたとみなされる。しかも、この研究は機関審査委員会(IRB)の承認を得て、その監督の下で行われなければならない。IRBは適切に構成されたグループであり、被験者に関連する医学研究を審査および監督することが正式に指定されており、ヒト研究被験者の権利、安全および福祉を保護するために、研究の修正、または不承認を承認、要求する権利がある。非重大リスク設備はFDAがIDEを承認する必要はない;しかし、臨床試験は依然として簡略化されたIDE
要求に適合しなければならない。例えば、モニタリング調査、研究者のインフォームドコンセント、ラベルと記録保存要求を確保し、臨床試験場所IRBの承認を得る。FDAまたは臨床試験が行われている各場所のIRBは、対象のリスクが利益よりも大きいと考えられるか、またはFDAまたはIRBの要件を遵守できないと考えることを含む、様々な理由で臨床試験の承認を随時撤回することができる。試験が完了しても,臨床試験の結果は,その装置の安全性や有効性を証明できない可能性があり,不明である可能性があり,あるいは製品の承認や許可を得るのに不十分である可能性がある。
いくつかのデバイス臨床試験のスポンサーは、臨床試験情報の共通データベースClinicaltrials.govに登録することを要求される。登録の一部として,設備,患者群,調査段階,研究場所や研究者,臨床試験の他に関する情報が公開される。
アメリカ食品医薬品局の持続的な規制
設備が許可を得たり、承認が最初から分類されたり、承認されて市場に投入された後であっても、多くの監督管理要求が適用される。これらの措置には
| • |
登録と設備リストを設定する
|
| • |
製造プロセスのすべての点で厳格な設計、テスト、制御、文書、および他の品質保証プログラム
;製造プロセスを含む第三者契約製造業者を含む製造業者に要求する品質システム法規、またはQSR
|
| • |
ラベル条例およびFDAは、許可されていないまたは許可されていない用途(“非ラベル”用途)のための製品の普及を禁止し、装置を制限する広告を含む販促活動に関連する他の要件を禁止する
|
| • |
医療機器報告法規は、製造業者がその装置が死亡または深刻な損傷をもたらす可能性があるか、またはその装置に故障が発生した場合、故障が再び発生した場合、製造業者によって販売された装置または同様の装置が死亡または深刻な損傷をもたらす可能性があることをFDAに報告することを要求する
|
| • |
製造業者に、デバイスの健康構成のリスクを低減するため、または健康にリスクを構成する可能性のあるFDCA違反を救済するための是正または除去措置を講じた場合に、現場での是正または除去をFDAに報告することを要求する報告条例の是正および除去
|
| • |
上場後監督法規は、公衆の健康を保護するため、または装置に追加の安全性および有効性データを提供するために、必要に応じていくつかのIIまたはIII類デバイスに適用される。
|
22
カタログ表
デバイスが510(K)の許可または再分類を取得した後、その安全性または有効性に著しく影響を与える可能性のある修正、またはその予期される用途に大きな変化をもたらす可能性のある任意の修正は、新しい許可、さらには新しい再分類またはPMA補充を必要とする可能性がある。FDAは、各メーカーが最初にこの決定を下すことを要求するが、FDAは、そのような決定を検討することができ、製造業者の決定に同意しないことができる。
FDAが新しい510(K)の許可を求めない決定に同意しない場合、FDAは、510(K)の許可を求めるか、または最初から分類またはPMA補足を開始することを要求する可能性がある。FDAはまた、510(K)の許可を得るまで、最初から分類するか、または発売する前に承認されるまで、販売および配布および/または修正されたデバイスのリコールを停止することを要求することができる。しかも、このような状況で、私たちは法執行行動の影響を受けるかもしれない。
適応、ラベル、または製造プロセスまたは施設の変更を含む承認されたPMAデバイスのいくつかの変更は、変更を実施する前に、新しいPMAまたはPMAサプリメントをFDAに提出および承認する必要がある(場合によっては)。補足PMAは、通常、元のPMAに必要な同じタイプの情報を提出する必要があるが、補足は、通常、元のPMAがカバーするデバイスの提案変更をサポートするために必要な情報
に限定される。FDAはPMAサプリメントを審査する際に原始PMAを審査するのと同様のプログラムと行動を使用する。
FDAの規定は私たちがFDAで医療機器メーカーに登録することを要求する。また,カリフォルニア衛生サービス部(CDHS)は,この州で医療機器メーカーとして登録することを要求している。私たちの製造プロセスは、設計、製造、テスト、生産、プロセス、制御、品質保証、ラベル、包装、流通、設置および修理のための完成設備の方法、施設、および制御を含むQSRの適用部分に適合しなければならない。メーカーとして,我々の施設,記録,製造過程はFDA
とCDHSの定期計画や計画外検査を受けている。QSRを遵守できなかったことは、私たちの製造業務が閉鎖されたり、制限されたり、私たちの製品がリコールされたり、差し押さえられたりする可能性があります。我々はすでに我々の工場の製品生産に関する定期QSR検査を受け入れて継続する予定である。さらに、FDAは私たちにラベルと宣伝に関するFDAの様々な要求を遵守することを要求する。もし私たちまたは私たちのサプライヤーが適用された規制要件を遵守できなかった場合、FDAまたは州当局が法執行行動を取る可能性があり、その中には以下のいずれかの処罰が含まれる可能性がある
| • |
警告または無タイトル手紙、罰金、禁止、同意法令および民事処罰;顧客通知、自発的または強制的なリコールまたは差し押さえ
|
| • |
生産制限、一部生産停止、あるいは全面的な生産停止
|
| • |
新製品の提出または申請または既存製品の修正の処理を遅延させる;
|
| • |
承認されたPMA承認を撤回する;および
|
| • |
刑事起訴する。
|
医療機器報告法律および法規は、私たちが以下の情報を受信したとき、または他の方法でFDAに情報を提供することを要求する:私たちのデバイスがbrの死亡または重傷を引き起こす可能性があるか、または障害が発生した可能性があることを合理的に示し、故障が再び発生した場合、私たちが販売しているデバイスまたは同様のデバイスは、死亡または重傷を引き起こす可能性が高い。さらに、FDAは、非ラベル用途のための承認されたbr装置の使用を禁止する。FDAや他の機関は、ラベル外用途の普及を禁止する法律や法規を積極的に実行しており、ラベル外用途を不当に普及させていないことが発見された企業は、巨額の罰金や刑事起訴を含む重大な責任に直面している可能性がある。
新たに発見または開発されたセキュリティまたは有効性データは、新たな警告や禁忌症の追加を含む製品のラベルを変更する必要がある場合があり、他のリスク管理措置を実施する必要がある可能性もある。さらに、新しい立法によって生成された要求を含む新しい政府要求が確立される可能性があり、またはFDAの政策が変更される可能性があり、規制部門が私たちが開発している製品の承認または承認を延期または阻止する可能性がある。
私たちはまた安全作業条件、実験室、製造実践に関連する他の連邦、州、地方法律法規を守らなければならない。
23
カタログ表
EU.EU
我々の製品はEUで医療機器として指令93/42/EECの医療機器に関する規制を受けており,医療機器指令とも呼ばれている。“医療機器指令”は,医療機器が指令添付ファイルに列挙された基本的な要求を満たすことを要求する。これらの要求を守ることは、私たちの製品にヨーロッパ標準やCEマークを貼り付けることができる前提条件であり、このマークがなければ、私たちの製品はヨーロッパ経済区で販売したりマーケティングしたりすることができません。基本的な要求に適合していることを証明するためには,医療機器のタイプとその分類によって異なる適合性評価プログラムを実行する必要がある。
低リスク医療機器(I類非無菌,非測定機器)に加えて,メーカーはその製品がEU医療機器指令の基本的な要求に適合する自己評価に基づいてEC適合性声明を発表することができるほか,適合性評価プログラムはEEA加盟国が認める組織や通知機関の介入を必要とする。関連する合格性評価プログラムによると、通知機関は通常、私たちの設備の製造、設計、最終検査の技術文書と品質システムを審査·検査します。医療機器とそのメーカーに対する合格評価プログラムの完成に成功し,基本的な要求に適合した後,機関に合格証明書を発行することを通知した。この証明書ライセンスメーカーは,関連するEU適合性宣言に準備して署名した後,その医療機器にCEマークを貼り付ける。
一般に,医療機器とそのメーカーが基本的な要求に適合していることの証明は,製品の正常使用条件下での安全性や性能を支援する臨床データの評価などに基づいていなければならない。特に、製造業者は、デバイスが通常の使用条件下でその予期される性能を達成し、その予期される性能の利点をトレードオフする際に、既知および予測可能なリスクおよび任意の不利なイベントが最小かつ許容可能であり、デバイス性能およびセキュリティに関するいかなる宣言も適切な証拠支持を有することを証明しなければならない。
2017年4月、EUは新たな“医療機器条例(EU)2017/745”、すなわち“医療機器条例”を採択し、2021年5月26日から“医療機器指令”を廃止して代替する。医療機器法規は医療機器に対してより厳格な制御を行うことを想定し、合格評価プログラムの強化、器械の臨床データに対する期待の向上、及び高リスク機器の発売前の監督審査を含む。過渡的条項によると、2021年5月26日までに“医療機器指令”によって発行された通知機関証明書に基づく医療機器は、証明書の残存有効期間を取得するために市場に継続的に投入されることができ、遅くとも2024年5月27日まで持続可能である。すべての適用された過渡期が終わった後、“医療機器条例”によってCEマークを獲得した機器のみがヨーロッパ薬品管理局に発売されることができます
他の地域
大多数の主要市場は医療機器に対して異なる程度の規制要求がある。承認された製品または承認された製品の修正は、すべての主要市場で新しい規制文書を提出する必要があるかもしれない。規制要求と審査時間は国/地域によって異なる。製品は医療機器への要求が最も低い他の国でも販売できる。
詐欺や乱用その他の医療法規は
連邦と州政府機関および同等の外国当局は、民事と刑事法執行努力の強化を含む医療業界の厳格な監督審査を行っている。これらの法律は、私たちが病院、医者、そして私たちの製品の他の潜在的な購入者と達成可能な財務手配を制限することによって、医療機器メーカーの販売、マーケティング、その他の販売促進活動を制限します。お客様がMedicare、Medicaid、または他の連邦が援助した医療計画に従って精算されたプロジェクトまたはサービスのクレームを提出した場合、連邦医療詐欺および法律の乱用は私たちの業務に適用されます。外国、連邦、州政府が制定した患者プライバシー法規は、私たちが業務を展開している場所にも適用可能である。以下は私たちの運営能力に影響を及ぼす可能性のあるいくつかのアメリカの法律と法規の説明だ。
24
カタログ表
連邦医療保険反控除法
連邦医療保険逆控除法規は、個人またはエンティティが、個人の推薦または奨励を誘導または奨励するために、直接または間接的に、現金または実物の形態で現金または実物の形態で任意の報酬を請求、提供、受信、または支払い、または購入、レンタル、注文、手配または推薦購入、レンタルまたは任意の商品またはサービスを注文するか、または購入、レンタルまたは注文が連邦医療計画(例えば、MedicareおよびMedicaid計画のような)によって支払い可能な任意の商品またはサービスの全部または一部を手配または推薦することを禁止する。“報酬”という言葉は、任意の価値のあるものを含むと広く解釈されており、政府は、個人または実体が実際に法律を知っているか、または法律に違反する具体的な意図があることを証明することなく、“反リベート条例”に違反していると判断することができる。また、政府は、連邦民事虚偽請求法案の目的により、クレームは、反リベート法規違反による物品又はサービスを含み、虚偽又は詐欺的クレームを構成すると主張することができる。反リベート法規は絶えず変化する解釈を受け、すでに政府の法執行役人によって医療機器業界の多くのよく見られる商業手配に応用されている。“反リベート法規”によると、多くの法定例外と規制避風港保護のある商業手配は起訴されない;しかし、これらの例外とbr避難港の範囲は非常に狭く、多くのよく見られる商業活動、例えば精算支援計画、教育と研究補助金或いは慈善寄付金は、すべて例外或いは避風港がない。取引またはbr手配は、1つまたは複数の適用可能な法定例外または規制安全港に完全に適合することができず、必ずしも違法であるか、または起訴されることを意味するわけではない。しかし、安全港に適用されるすべての要求を完全に満たしていない行為および業務配置は、政府の法執行当局の審査強化を招き、すべての事実と状況の累積審査に基づいて評価される可能性がある。
連邦民事虚偽申告法
連邦民事虚偽申告法は、個人または実体が虚偽または詐欺的な政府資金支払い申請の提出を意図的に提出するか、または連邦政府への資金支払いの義務を回避、減少または隠蔽するために、虚偽または詐欺的クレームに関連する虚偽記録または陳述を作成、使用または作成または使用することを禁止する。虚偽申告法によると、“反リベート条例”違反による物品又はサービスのクレームが虚偽又は詐欺的クレームを構成することが含まれる。虚偽申告法により提起された訴訟は政府が提起することもできるし、個人が政府の名義で訴訟を起こすこともできる。これらの個人は、“親族”と呼ばれることがあり、またはより一般的には、エンティティが罰金または和解において政府に支払う任意の金額を共有することができる“通報者”と呼ばれる。近年,Qui Tam訴訟の申請数は大幅に増加している
.Qui Tam訴訟は印鑑を押した場合に提起され、米司法省にこのような疑惑の調査を強制的に要求した。ほとんどの一般市民の訴訟は司法省によって却下されたり、連邦裁判所によって却下されたりする。しかし、ある会社にとって、告発に根拠がなくても、調査コストは巨大で実質的である可能性がある。各州とも“虚偽申告法”のような法律が成立しており,その多くの州の法律の範囲が広く,すべての支払者に適用されているため,連邦政府に提出されたクレームに限られていない。医療機器メーカーおよび他の医療保健会社はまた、連邦医療詐欺刑事および非政府医療福祉計画に延長された虚偽陳述法規を含む他の連邦虚偽請求法律の制約を受けている。
医療詐欺法
連邦“健康保険転移性および責任法案”(HIPAA)およびその実施条例は、個人第三者支払者が重大な事実を偽造、隠蔽または隠蔽すること、または任意の重大な虚偽、架空または詐欺的な陳述または陳述を行うこと、または任意の重大な虚偽、架空または詐欺的な陳述または記録を含む任意の虚偽または虚偽または文書を作成または使用することを含む、任意の医療福祉計画を故意に実行または実行しようとする計画を知り、または意図的に偽造、隠蔽または隠蔽することを含む連邦刑法を作成し、または使用することを禁止している。
プロジェクトやサービス。
“連邦医支払いサンシャイン法案”
連邦医師支払い陽光法案は、ある薬品、設備、生物製品と医療用品の製造業者が毎年医師或いは教育病院への支払い或いは医者或いは教育病院の要求に応じて第三者に支払うことに関連するCMS情報を報告することを要求し、そしてbrの適用可能なメーカーと共同購入組織は毎年医師及びその直系親族が持っているCMS所有権と投資権益を報告することを要求する。2022年から適用されるメーカーは,医師アシスタント,勤務看護師,臨床看護師専門家,登録看護師麻酔科医,登録助産師への支払いと移転価値に関する情報も報告しなければならない。
25
カタログ表
患者データプライバシー
“健康情報技術促進経済及び臨床健康法案”(HITECH法案)によって改正されたHIPAA及びその実施条例は、健康計画、医療チケット交換所、および特定の医療保健提供者のようなエンティティをカバーする義務を規定し、カバーエンティティまたは代表カバーエンティティに個人健康情報の使用または開示に関するサービスを提供するビジネスパートナーを規定する。これらの義務は、保護された健康情報のプライバシーと安全の保護に関する義務的な契約条項のようなものだ。多くの州では、場合によっては健康情報のプライバシーやセキュリティを管理する法律も制定されており、その多くの法律は大きく異なり、HIPAAに先を越されないことが多い。
他州法
いくつかの州はまた、デバイス製造業者のマーケティング行動に制限を加え、および/または医療専門家およびエンティティに支払われたプレゼント、報酬、および他の報酬を追跡および報告することを要求する商業コンプライアンス計画を実施することを要求する。
州と連邦規制·法執行機関は医療法律法規違反行為を積極的に調査し続け、米国議会は法執行ツールの武器庫を強化し続けている。最近、2018年の両党予算法(BBA)は、反リベート法規を含むいくつかの連邦医療保険法違反に対する刑事と民事処罰を増加させた。法執行機関はまたこのような法律に基づいて新しい責任理論を求め続けている。特に、政府機関は最近、反リベート法規、連邦民事虚偽請求法案、および医療詐欺およびHIPAAプライバシー条項違反による刑事告発または民事法執行行動を含むメーカー精算支援活動や他の患者支援計画に対する監督審査と法執行活動を強化した。
詐欺と法律法規の乱用に対する法執行と処罰
このような連邦と州の法律法規を遵守するためには多くの資源が必要だ。もし私たちの運営が上記の任意の法律または私たちに適用される任意の他の政府法規に違反していることが発見された場合、私たちは重大な民事、刑事と行政処罰、損害賠償、罰金、監禁、返還、連邦医療保険や医療補助計画などの政府医療計画から除外され、名声損害、行政負担、利益および将来の収入減少、および私たちの業務の削減または再編に直面する可能性がある。連邦民事虚偽請求法案、反リベート法規、および他の詐欺および乱用事件を解決する会社も、連邦医療保健計画(例えば、MedicareおよびMedicaid)の参加範囲から除外されることを回避するために、米国衛生·公衆サービス部監察長オフィスと企業誠実協定を締結することを要求される可能性がある(すなわち、その製品の保険範囲を失う)。会社の誠実な合意は通常、コンプライアンスを確保するために会社に巨額のコストをもたらす。
連邦医療法律法規に規定されている義務に関する他の情報は、“リスク要因--リベートや虚偽精算に関する法規を含む米国連邦および州詐欺および乱用の法律および法規を遵守できない場合、私たちは巨額の処罰に直面する可能性があり、私たちの業務運営や財務状況は悪影響を受ける可能性がある”というタイトルを参照してください
アメリカの医療改革
連邦政府、州政府、監督機関と第三者支払人は増加した医療コストを制御或いは管理するために引き続き提案を提出し、より広く言えば、アメリカの医療システムを改革する。
例えば、米国では2010年3月に反腐敗法が公布された。ACAには、連邦医療計画の登録、精算変化、詐欺や乱用措置を管理する条項を含む多くの重要な条項が含まれており、これらは既存の政府医療計画に影響を与え、新しい計画の発展を招く。
26
カタログ表
ACAのいくつかの条項はまだ完全に施行されておらず、いくつかの条項は司法と国会の挑戦を受けている。議会はACAの全部または一部を廃止または廃止し、代替する立法を考慮した。国会はまだ全面的な廃止立法を通過していないが、ACAの次の特定の税収実施に影響を与える2つの法案が署名されて法律となっている。2017年の減税·雇用法案、または税法案は、ACAが1年の全部または一部で合格医療保険を維持できなかったある個人に対する税収ベースの分担責任支払いを、一般的に“個人強制要求”と呼び、2019年1月1日から0ドルに低下させる条項を含む。2018年12月14日,テキサス州の連邦地域裁判所は,個人強制令はACAの重要かつ不可分な特徴であるため,税法の一部として廃止され,ACAの残り条項も無効であると判断した。2019年12月18日、米国第五巡回控訴裁判所は、個人権限が違憲であると判断し、事件を下級裁判所に返送し、早期の全面ACAに対する無効を再検討した。2020年3月2日、米最高裁はこの事件の審査を求める移審令の要望書を承認し、2020年11月10日に口頭弁論を行った。2021年6月、米国最高裁は、個人原告と各州はACAの合憲性を疑問視する資格がないと判断した。
2018年1月22日、トランプ前総裁は、米国医学会が強制的に徴収したある費用の実施を延期し、ある高コスト雇用主が後援する保険計画にいわゆる“キャデラック”税を徴収し、市場シェアに応じてある医療保険提供者に年会費を徴収し、非免除医療機器に医療機器消費税を徴収することを含む2018年度支出に関する持続的な決議に署名した。しかし、2019年12月20日、トランプ前総裁は“さらなる総合支出法案”(H.R.1865)に署名し、ケディラク税、医療保険提供者税、医療機器消費税を廃止した。ACAが公布されて以来、アメリカはまた他の立法改正を提案し、採択した。BBAは他にもACAが改正され,2019年1月1日から施行され,多くの連邦医療保険薬物計画におけるカバーギャップを埋めるために,通常“ドーナツ穴”と呼ばれている
2018年12月、CMSは、CMSがこのリスク調整を決定する方法に関する連邦地域裁判所の訴訟結果に応答するために、平価医療法案リスク調整計画に基づいて、いくつかのACA合格健康計画および健康保険発行者に対してさらなる入金および支払いを可能にする最終規則を発表した。それ以来,ACAリスク調整計画の支払いパラメータは毎年更新される。また,CMSは2020年から各州により大きな柔軟性を与え,個人や小団体市場の保険会社に基準を設定し,ACA
がこのような市場で販売される保険計画に要求される基本的な健康福祉を緩和する可能性がある最終規則を公表した。
さらに、ACAが公布されて以来、他の立法改正も提案され、採択された。2011年8月2日、2011年“予算制御法”が署名され、医療保険提供者に支払う医療保険支払いを会計年度当たり2%削減することが含まれており、2013年4月1日に施行され、BBAを含む後続の立法改正により、追加の国会行動がとられない限り、2030年まで有効となる。2013年1月2日、2012年に米国納税者救済法が法律に署名し、病院を含むいくつかの医療サービス提供者に支払う医療保険を減らし、政府が提供者に多額の支払いを取り戻す訴訟時効期間を3年から5年に延長した。
前トランプ政権政権中、政府はメーカーがそのマーケティング製品に価格を設定する方式をより厳格に審査し、米国議会の数回の調査と提案を招き、製品定価の透明性を高め、政府医療計画下の製品とサービスコストを低減するための連邦と州立法を公布した。現政府が製品コストを抑制するために立法および/または行政措置を継続するかどうかは不明である。また,地域医療当局や個別病院では,どの製品を購入するかを決定し,どのサプライヤーをその医療計画に組み込むかを決定する入札プログラムが多く使用されている。
従業員と人的資本
2023年12月31日現在、私たちは32人の常勤社員と2人のアルバイトを雇用しています。私たちの職員たちの中の一人も集団交渉協定によって代表されていないし、私たちは労働停止を経験したこともない。私たちは私たちの従業員が仲がいいと信じている。
27
カタログ表
各レベルの人材を誘致、激励、維持することが私たちが引き続き成功するキーポイントであることを認識している。私たちの従業員は重要な資産であり、私たちの目標は、私たちの従業員がその中で彼らのキャリアを成長させ、向上させることができるように、公平で包容力のある環境を作ることであり、全体的な目標は、私たちの現在のルートと未来の業務目標を支持するために、私たちの従業員チームを発展、拡大、維持することである。従業員の留任と尊敬度に集中することによって、私たちはまた、私たちの臨床試験、私たちのパイプライン、私たちのプラットフォーム技術、業務と運営を支持する能力を高め、私たちの利益関係者の長期的な利益を保護した。私たちの成功はまた私たちが多様な従業員グループを引きつけ、吸引し、維持する能力にかかっている。競争力のある報酬や福祉プログラムを提供し、従業員の意見に耳を傾けることを確保するなど、多様で情熱的な従業員チームの採用と維持に努めている。
私たちは革新、情熱、データ駆動の意思決定、たゆまずと誠実さを重視し、そして多元化の環境を構築しており、私たちの従業員がすくすくと成長し、そして激励を受け、非凡な貢献をし、斬新な、独自の診断と設備解決方案をもたらし、全世界の女性の健康な方法を転覆させる。
私たちの人的資本目標には、適用、識別、採用、維持、インセンティブ、そして私たちの既存と未来の従業員を統合することが含まれています。私たちの株式インセンティブ計画の主な目的は、株に基づく報酬奨励と現金に基づく業績ボーナスを付与することによって、選択された従業員、顧問と取締役を吸引、維持、激励し、株主価値と会社の成功を増加させ、従業員を激励することで私たちの目標を実現することである。私たちは従業員たちに競争力と包括的な福祉プログラムを提供するために努力している。私たちの福祉プログラムは、従業員の個人的な健康と健康ニーズを満たすために、バランスのとれた保護と柔軟性を提供する。私たちは会社の発展に伴い、私たちの雇用、発展、激励と従業員の維持方式を改善することを含む、人的資本の使用の最適化に関する努力を引き続き改善する計画だ。
施設
私たちはジョージア州スヴァニの工場で私たちのすべての製品と候補製品を生産して、私たちの研究開発、制御環境の部屋とオフィス空間と一緒に、現在の総面積は約41,000平方フィートです。私たちのジョージア州施設は私たちの現在の需要を満たし、将来は商業的に合理的な条件で適切な追加代替空間を提供すると信じている。
法律訴訟
私たちは現在、いかなる法的手続きにも参加していませんが、その結果が私たちに不利であれば、個別または全体的に私たちの業務、運営業績、または財務状況に大きな悪影響を及ぼすと思います。私たちは特許侵害、雇用慣行違反、または商標侵害を告発する第三者からの手紙を受け取っているかもしれません。私たちは将来、br訴訟に参加して自分を弁護するかもしれません。潜在的な結果が存在するにもかかわらず、管理時間や注意の移動、およびそのような紛争の解決に関連する財務コストにより、これらの紛争の存在が私たちに悪影響を及ぼす可能性がある、このような紛争の結果を予測することはできない。
私たちと利用可能な情報について
Femasys社は2004年2月19日にデラウェア州に登録設立され、ジョージア州のスヴァニに本部を置いた。
私たちはアメリカ証券取引委員会に年度、四半期と現在の報告、依頼書、その他の情報を提出します。米国証券取引委員会は、発行者(我々を含む)が米国証券取引委員会に電子的に提出した年間、四半期、および現在の報告、依頼書、および他の情報を含むウェブサイトを維持する。アメリカ証券取引委員会のサイトはWwwv.sec.gov.
私たちのサイトはWww.femasys.com私たちのウェブサイトを通じて無料で提供します:私たちの年間報告書Form 10-K;Form 10-Q四半期報告;Form 8-K現在の報告;取締役と役員を代表して提出されたForm 3,4および5;および1934年の証券取引法(改正された“取引法”)に基づいて提出または提出された報告書の任意の改正は、これらの材料が米国証券取引委員会に電子的に提出または提供された後、合理的で実行可能な範囲でできるだけ早く提供されます。私たちはまた、当社のウェブサイトを通じて、当社のコーポレートガバナンス基準、監査委員会、指名とコーポレートガバナンス委員会、ならびに私たちの取締役会の報酬委員会の定款、私たちのビジネス行動基準、br道徳、およびその他の情報および材料を提供します。私たちのサイト上の情報は、参照によって本10-Kフォームに組み込まれていません。
28
カタログ表
| 第1 A項。 |
リスク要因です
|
私たちの普通株に投資することは高い危険と関連がある。これらのリスクは、以下に説明するリスクを含むが、これらに限定されず、各リスクは投資決定に関連する可能性がある。以下に述べるリスクと、本年度報告書の10-K表の他のすべての情報と、私たちの財務諸表および関連付記および第7項を含むすべての他の情報を慎重に考慮しなければなりません。“経営陣の財務状況と経営結果の検討と分析
”私たちの普通株に投資することを決定する前に。これらのリスクの実現は、私たちの名声、業務、財務状況、運営結果、成長、そして私たちの戦略目標を達成する能力に重大な悪影響を及ぼす可能性があります。この場合、私たちの普通株の市場価格は下落する可能性があり、あなたは投資の一部または全部を失うかもしれません。私たちが現在知らないことや私たちが現在重要ではないと考えている他のリスクや不確実性もまた、私たちの業務運営と私たちの普通株の市場価値を損なう可能性があります。
私たちの財務状況と追加資本需要に関連するリスク
私たちは設立以来重大な運営損失を出しており、将来的には運営損失が予想され、利益を実現したり維持したりすることができない可能性がある。私たちが商業会社として運営している歴史は限られている。
私たちは設立以来純損失を出しており、予見可能な未来にも赤字が続くことが予想される。2023年12月31日と2022年12月31日までの純損失はそれぞれ14,247,124ドルと11,394,170ドルであった。2023年12月31日まで、私たちの累計赤字は108,381,629ドルです。現在の運営計画によると、現在の現金と現金等価物および収入は、2025年下半期まで運営を継続するのに十分な資金を提供することが予想されています。私たちは、既存の現金と現金等価物および収入がどのくらいの間、私たちの運営に資金を提供し続けることが予想され、これは、間違っていることが証明される可能性があるという仮定に基づいて、私たちは現在予想されているよりも早く利用可能な資本資源を使用することができる。絶えず変化する状況、その中のいくつかは私たちのコントロールを超えている可能性があり、私たちの資本消費速度が私たちの現在の予想よりも大きく速くなる可能性があり、私たちは計画よりも早く追加資金を求める必要があるかもしれない。
これまで、私たちは主に初公募株、私たちの普通株と転換可能優先株を私募し、市場合意による普通株の売却、転換可能手形と株式承認証を通じて、私たちの運営に資金を提供してきました。我々はほとんどの資源を我々のFemBlocシステムやFemaSeed製品に関する開発活動に投入し,研究開発および臨床と規制措置を含む。
インフラを建設し続け、新製品を開発、強化し、それを商業化し、上場企業に関連した追加運営コストを発生させるため、私たちの運営費用は引き続き増加することが予想される。そのため、予測可能な未来には運営赤字が続き、決して利益が得られない可能性があると予想される。また、私たちが確実に利益を達成しても、私たちは収益性を維持したり向上させることができないかもしれません。もし私たちが利益を達成したり維持したりしなければ、私たちの業務融資と私たちの戦略目標を達成することを難しくし、両方とも私たちの業務、財務状況、経営業績に実質的な悪影響を与え、私たちの普通株の市場価格の下落を招くだろう。また、私たちのFemBlocソリューションが発売承認を得られなかった場合、あるいは私たちの製品が既存または新しい市場に著しく浸透しなかった場合、私たちの業務、財務状況、運営結果にマイナスの影響を与えます。
私たちは大量の追加資金が必要で、必要な時に資金を集めることができないかもしれません。これは私たちに商業化努力や製品開発計画を延期または減少させる可能性があります。
現在の運営計画によると、私たちの現在の現金、現金等価物、収入は、2025年下半期まで運営を続けるのに十分な資金を提供するのに十分であると予想されています。しかし、私たちが基づいているこのような推定は正しくないことが証明される可能性があり、私たちは現在予想されているよりも速い速度で利用可能な財務資源を使用するかもしれない。将来の資金需要は多くの要素に依存するでしょう
29
カタログ表
| • |
著者らは現在或いは未来の臨床試験の開始、範囲、入院率、進展、成功とコスト;
|
| • |
私たちの研究開発活動のコスト
|
| • |
FDAや外国の規制当局は私たちの臨床試験データを受け入れています
|
| • |
患者、医師と市場は著者らの子宮内人工授精製品と永久避妊システム女性専用医療製品の解決方案を受け入れた
|
| • |
特許出願を提出して起訴し、私たちの特許または他の知的財産権を擁護して実行する費用;
|
| • |
訴訟または他の側面で、第三者特許または他の知的財産権を侵害する任意の請求を弁護する費用;
|
| • |
追加的な規制許可、最初から許可または承認された費用と時間;
|
| • |
より多くの販売とマーケティング能力のコストとタイミングを確立する
|
| • |
起こる可能性のある製品のリコールに関するコスト
|
| • |
競争の技術と市場発展の影響
|
| • |
私たちは現在このような取引に関する約束や合意を持っていないにもかかわらず、製品、技術、および業務の程度に買収または投資している
|
| • |
上場企業の運営コストとして。
|
私たちが調達した任意の追加の持分や債務融資には、私たちまたは私たちの株主に不利な条項が含まれているかもしれない。もし私たちが追加の普通株を売却することによって、または行使可能または行使可能であるか、または私たちの普通株の他の証券に交換することによって追加資金を調達する場合、そのような証券の発行は、私たちの株主の株式を希釈させるだろう。また、私たちが将来発行する可能性のある任意の証券を購入する投資家は、私たちの普通株株主の権利よりも高い権利を持っているかもしれない。
さらに、私たちが参加する任意の未来の債務融資は、私たちの保有権または追加債務の発生、配当金の支払い、私たちの普通株の買い戻し、特定の投資、および特定の合併、合併、または資産売却取引に従事する能力の制限を含む、私たちの業務を制限する契約を適用するかもしれません。もし私たちが第三者との協力および許可手配によって追加資金を調達する場合、私たちの技術または製品に対するいくつかのbr権利を放棄するか、または私たちに不利な条項に許可を付与する必要があるかもしれない。
しかも、私たちは受け入れ可能な条件で追加資金を提供するかどうか確信できない。もし私たちが十分な資金を得ていない場合、私たちは私たちの製品の開発や商業化を延期したり、商業化を求めていた製品や技術の商業化権利を第三者に許可しなければならないかもしれない。私たちはまた、私たちの製品のための商業化作業、顧客支援、または他のbr資源を減少させたり、運営を停止しなければならないかもしれません。このような要素のいずれも私たちの業務、財政状況、そして運営結果を損なう可能性がある。
私たちの財務結果は大きく変動する可能性があり、私たちの業務の基本的な表現を完全に反映できないかもしれません。
私たちの四半期と年間運営業績は将来大きく異なる可能性があり、私たちの運営業績を期間間の比較を行うことは意味がないかもしれません。したがって,いずれの四半期や期間の業績
も将来の業績の指標とすべきではない.私たちの四半期と年度の財務結果は様々な要素によって変動する可能性があり、その多くの要素は私たちがコントロールできないため、私たちの業務の基本的な業績を完全に反映できないかもしれません。その要素の一つは販売の季節的な変化を含む。患者は年間保険免除額を全額支払っているため,将来的には第4四半期により高い売上を達成し,自己負担コストを低減する可能性がある。
私たちの四半期と年間の業績変動を引き起こす可能性のある他の要因は、
| • |
患者と医師は私たちのFemBlocシステムを採用して発売が承認されれば
|
| • |
患者と医者は私たちのFemaSeed製品を採用しました
|
| • |
第三者支払者の保証政策の変化は、私たちの製品を使った精算手続きに影響を与えます
|
| • |
予想外の価格設定圧力
|
| • |
販売代表の採用、活用、持続的な生産性
|
| • |
私たちは販売とマーケティング努力の地理的範囲を拡大することができます
|
30
カタログ表
| • |
私たちは開発中の製品や私たちの既存製品の他の適応、またはアメリカ以外の他の国のために規制の承認または承認を得ることができる
|
| • |
私たちの既存製品と開発中の製品の臨床研究と試験結果
|
| • |
予想された注文書の受け取りを遅延させる
|
| • |
サプライヤーの部品および原材料の納入遅延または失敗;および
|
| • |
メディアや臨床出版物では、私たちの製品または私たちの競争相手または私たちの業界の製品をプラスまたは否定的に報道します。
|
我々の四半期と年度業績は変動する可能性があるため,期間間の比較は我々の業務潜在結果の最適な指示ではない可能性があり,我々の業務表現を決定する1つの要因とすべきである.これらの変動は、予想される業績を達成できない可能性を増加させる可能性もあり、これは私たちの普通株の市場価格にマイナス影響を与える可能性がある。
私たちは純営業損失と研究開発信用の繰り越しを使って未来の課税収入を相殺する能力は一定の制限を受けるかもしれません。
一般的に、改正された“1986年米国国税法”第382条と383条または同法規によると、会社は“所有権変更”を経験し、一般的に3年間のスクロール期間内に、ある株主がその持分所有権の中で価値によって計算される所有権はその最低所有権パーセンテージより50ポイント以上増加し、その利用変更前の純営業損失またはNOLの能力は制限され、その研究と開発信用は将来の課税収入を相殺するために融資を結転すると定義されている。2004年2月から現在まで、私たちの所有権のいくつかの重大な変化は私たちが既存のNOLと研究開発信用転換を利用する能力を制限する可能性が高く、もし私たちがいかなる更なる所有権変更を行うならば、私たちがNOLと研究開発信用転換を利用する能力は規則382と383節の更なる制限を受ける可能性がある。また,利息が発生した年度に十分な課税所得額がない場合には,純利息支出を差し引く能力が制限される可能性があるが,このような許容されない利息繰越は,NOLや他の属性に適用される制限ルールと同様の制約ルールによって制約される.将来の私たちの株式の変化、その中のいくつかは私たちのコントロールを超えて、規則第382条による所有権の変化を招く可能性があります。これらの理由から、もし私たちがコントロール権変更が発生したら、私たちは利益を達成しても、NOL、研究開発信用の繰越、あるいは許可されていない利息支出の大きな部分を利用できないかもしれない。
発見と発展に関するリスク
臨床試験で被験者を登録·保持することは高価で時間のかかる過程であり,われわれが制御できない様々な要因によりより困難あるいは実現できなくなる可能性がある。
我々は,登録時に遅延や困難に遭遇したり,現在のスケジュールで任意の臨床試験を完了するために十分な数の被験者を登録できなかったり,登録後も十分な数の被験者を保持することができない可能性がある。例えば、新冠肺炎の大流行のため、私たちの臨床試験の現場開始と被験者登録は予想より遅く、その理由は、被験者と人員の再配置、利用可能な現場人員と人員の流れの不足、および新しい場所で人員を訓練する時間が長いからである。我々の臨床試験では,サイト起動と被験者登録の遅さが我々の開発スケジュールを遅延させ,将来的にさらなる遅延を招く可能性がある。
被験者が臨床試験に参加し、被験者のフォローアップを完了することは、被験者の集団の規模、試験レジメンの性質、被験者と臨床場所との近接度、臨床試験の資格基準、被験者コンプライアンス、競争的臨床試験、および臨床医が他の利用可能な治療法に対する研究中の製品の潜在的優位性に対する見方を含む多くの要因に依存し、brは、私たちが調査している適応のために承認される可能性のある任意の新しい療法を含む。例えば、試験レジメンが、候補製品の安全性および有効性を評価するために、広範な治療後プログラムまたは後続検査を受けることを被験者に要求する場合、または競合相手候補製品の同期臨床試験に参加するように被験者を説得する可能性がある場合、対象が私たちの臨床試験に参加することを奨励しない可能性がある。また,われわれのbr臨床試験に参加した患者は,試験終了前に退出したり,われわれの製品とは無関係な不良医療イベントを経験したりする可能性がある。被験者の登録遅延或いは被験者が臨床試験に参加し続けることができなかったことは、臨床試験の開始或いは完成を延期し、臨床試験コストの増加と遅延を招き、或いは臨床試験の失敗を招く可能性がある。
31
カタログ表
計画のサイト起動および/または科目登録または保留における遅延または失敗は、コスト増加、計画遅延、または両方をもたらす可能性があり、これは、候補製品を開発する能力に有害な影響を与える可能性があり、またはさらなる開発ができない可能性がある。また,臨床試験サイトに依存して速やかな臨床試験を確保し,彼らのサービスを管理するプロトコルを締結しているが,実際の表現を強制する能力は限られている。
私たちの現在の候補製品は違う開発段階にある。私たちの候補製品は開発に失敗したり、遅延に遭遇したりして、その商業可能性に悪影響を及ぼす可能性があります。もし私たちがFDAの承認を得たり維持できなかったら、私たちのFemBlocを市場に出して販売すれば、私たちの業務は実質的に損害を受けることになります。
監督管理の承認を求め、最初から分類または510(K)許可を付与し、医療設備を市場に投入する過程は高価で時間がかかる。承認、再分類、または510(K)許可を得ることは保証されない。もし私たちがFemBlocシステムの承認をタイムリーに得ることができなければ、私たちは決して相当な収入を得ることができず、運営を停止させることができるかもしれない。FDAの承認プロセス
は、申請者が部分的に大量のデータに基づいて、その安全性と有効性を証明することを要求しており、これらのデータは、技術、臨床前、臨床試験、生産、およびラベルデータを含むが、これらに限定されない。最初から分類手順を開始することは、一般的な制御または一般的および特別な制御が安全および有効性の合理的な保証を提供するのに十分であり、装置の可能な利益が可能なリスクよりも大きいことを申請者に証明することを要求する。最初からbr要求は、臨床データを含む可能性がある性能データによってサポートされる。FDAは、多くの理由で、承認装置を延期、制限、または拒否することができる
| • |
私たちの製品が期待される用途に安全で効果的であることをFDAに証明することはできないかもしれない
|
| • |
FDAは私たちが求めているラベルと用途を支持する臨床データに同意しないかもしれません
|
| • |
FDAは、上場許可をサポートするのに十分な臨床前研究および臨床試験のデータに同意しないかもしれない
|
| • |
私たちが使用している製造技術と設備は適用される要求を満たしていないかもしれない。
|
FDAまたは任意の外国の規制機関の承認、許可、または付与を最初から分類することは、予期せぬ巨額のコストをもたらし、管理層の時間と他の資源を消費する可能性がある。FDAは、提出された材料の補充、追加の非臨床データの収集、追加の臨床試験の実施、追加の生産データや情報の準備、または他の時間のかかる行動をとるか、またはいっそ私たちの申請を拒否することを要求するかもしれない。さらに、承認または上場が承認された場合、私たちのデバイスを何らかの修正する前にFDAの追加承認または許可を得ることが要求され、上場後のデータがセキュリティ問題や有効性の欠如を示している場合、FDAは承認を撤回したり、許可を取り消したり、他の制限を加えたりする可能性があります。私たちが必要な規制承認と許可を得て私たちの製品をマーケティングすることができなければ、私たちの財務状況は悪影響を受ける可能性があり、私たちの国内と国際的に成長する能力は制限されるかもしれない。また,承認されても,FemBlocは商業化の成功や利益に必要または必要な適応
のために承認されない可能性がある.
私たちが主に臨床開発に従事している会社から商業化にも参加する会社に発展するにつれ、事業拡大に成功する困難に直面する可能性があります。
FDAのFemaSeed承認に伴い、私たちは、私たちの開発、規制、製造、およびマーケティングおよび販売能力を拡大する必要があり、協力者、流通業者、営業業者、および他のサプライヤーのようなこれらの能力を提供するために、第三者とさらに契約を締結する必要があるかもしれません。会社として、私たちは現在、販売、マーケティング、流通における経験やインフラが限られており、私たちの運営は主に臨床開発活動に限られてきた。
私たちは技術的な専門性と流通能力を支援する販売組織を構築し、FemaSeedを商業化するつもりだ。これは高価で時間がかかるだろう。また,我々は十分な規模や目標医療市場で十分な専門知識を持つ販売チームを雇うことができないかもしれない。私たちの内部販売、マーケティング、および流通能力の発展のいかなる失敗や遅延も、FemaSeedおよび他の製品および候補製品の商業化に悪影響を及ぼすだろう。
32
カタログ表
このような目的のために第三者関係を維持することは、私たちの経営陣のメンバーや他の人たちに大きな追加的な責任をもたらすだろう。私たちは、私たちの開発作業を効率的に管理し、販売とマーケティング担当者を募集し、訓練し、私たちの候補製品と任意の未来の候補製品に参加する臨床研究を効率的に管理し、私たちの管理、開発、運営、財務システムを改善することができなければなりません。これらは、私たちの行政と運営インフラに圧力を与える可能性があります。もし私たちが販売やマーケティング能力を確立することに成功できなければ、私たち自身も第三者と協力しても、私たちの製品を商業化することに成功しません。
私たちはFDAの許可に大きく依存して私たちのFemBlocシステムをマーケティングし、アメリカでの市場受容度をマーケティングしていますが、私たちはFDA
マーケティングFemBlocシステムの許可を得ることができなかったか、またはそれが市場承認を得られなかったことは私たちの業務に否定的な影響を与えます。
設立以来,我々は子宮内分娩技術の発展に取り組んできたが,これは我々のFemBlocシステムの基礎である。私たちはまだFDAからFemBlocシステムのマーケティングと販売の許可を得ていない。しかし、FDAがシステムの販売を許可することが予想されるので、私たちの他の製品の商業化のための私たちの販売チームを構築するコストを含むコストが発生します。我々FDAが承認したFemaSeed製品のターゲット·サービスプロバイダは、FemBlocシステムに対する私たちの予想とは異なるため、私たちが現在FemaSeed製品のために構築している販売チームはFemBlocシステムに使用できなくなり、
この2つの製品を同時にマーケティングすることができれば、FemBlocの許可を得ることができれば、複数の商業化努力を同時に維持し、支援する必要がある。もし私たちがFDAの許可を得ることができなければ、アメリカでマーケティングと販売し、そしてアメリカで著しい市場受容度を得ることができ、アメリカがこの製品の主要市場になると予想されているので、私たちの経営結果は不利な影響を受けるだろう。また,
はFDA認可前に予想コストが発生したため,候補製品がFDA許可されていない場合,これらのコストを回収することはできない.私たちには他の商業製品がありますが、それらの収入は現在わずかですので、もし私たちがFemBlocシステムを商業化することに成功しなかった場合、または品質の問題のために、規制されたマーケティング許可を維持できなかったか、そのシステムに関連した意外または深刻な合併症、または他の予見できない負の影響、またはこれらのリスク要因で議論された他の要因によってFemBlocシステムを販売できなかった場合、私たちは追加の収入源を失い、私たちの業務は実質的な悪影響を受けることになります。
規制承認を得るために必要な臨床開発過程は長く高価であり、結果は不確定であり、著者らがこれらの臨床試験で開発したデータはFDAと外国の監督管理機関によって解釈されている。もし私たちのFemBlocシステムおよび未来の製品の臨床試験が米国の規制承認、新しい分類または許可を支持するために必要な結果を生成しない場合、または私たちの現在または未来の候補製品が他の場所であれば、私たちはこれらの製品を商業化することができず、完成または最終的にこれらの製品の商業化を達成することができない場合、追加のコストや遅延が生じる可能性がある。
私たちは現在PMAが私たちの永久的な避妊解決策を承認することを求めている。FemBlocシステムに対するPMAの承認を得るためには,候補製品の安全性と有効性を評価するために,制御された良好な臨床試験を行う必要がある。臨床試験は複雑で高価な過程であり,何年もかかる可能性があり,結果自体は不確定である。われわれは臨床試験に多大な費用をかけ,多くの時間を投入しているが,これらの試験が商業収入をもたらすかどうかは決定できない。われわれは臨床試験で大きな挫折を経験する可能性があり,早期の臨床試験が有望な結果を示した後でも,失敗は臨床開発過程のいつでも起こる可能性がある。私たちのどの製品も故障したり、悪影響を与えたりする可能性があり、これは私たち、機関審査委員会、IRBs、あるいは監督機関の中断、延期、または臨床試験の停止を招く可能性があります。我々、IRBs、FDA、br、または他の規制機関は、試験参加者を許容できない健康リスクに曝露することを回避するために、いつでも臨床試験を一時停止または終了することができる。
33
カタログ表
臨床前研究の成功結果は必ずしも未来の臨床試験結果を示唆しているわけではなく、しかも以前の臨床試験結果はその後の臨床試験で複製されない可能性がある。また,中期結果や背線結果は臨床試験のデータを全面的に審査した後に変化する可能性がある。さらに、IDE申請に対するFDAの承認は、IDE申請に記載された臨床研究を開始することを可能にするが、FDAが研究設計が適切であることに同意することを意味するわけではなく、または研究結果は、上場許可(すなわち、PMA承認、510(K)承認または付与を得るのに十分である)を得るのに十分である初めからやり直す
要求).FDAは著者らの臨床前研究と臨床試験データの解釈に同意しないかもしれない、あるいは臨床試験の設計、進行或いは結果が安全性或いは有効性を証明するのに十分ではないことを発見する可能性があり、そして私たちに他の臨床前研究或いは臨床試験を行うことを要求するかもしれないが、これは更に私たちの製品の承認、最初の分類或いは承認を延期するかもしれない。私たちが前臨床研究と臨床試験から収集したデータは、FDAの承認、最初からの分類の要求或いは許可を支持するのに十分ではないかもしれないが、もし私たちが臨床試験で私たちの未来の製品の安全性と有効性を証明できなければ、私たちは監督部門の承認、付与された最初から私たちの製品を分類したり、販売したりする許可を得ることができないだろう。
また、様々な臨床、規制、および他の製品開発目標の予想達成時間を推定して公開することができ、これらの目標は一般にマイルストーンと呼ばれる。これらのマイルストーンは、新製品候補の臨床試験を開始するためにFDAにIDE申請を提出すること、臨床試験患者の登録、臨床試験データの発表、および他の臨床および規制イベント、およびEUにCEマーカーを貼り付ける権利を得ることを含むことができる。私たちの推定と比較して、このようなマイルストーンの実際の時間は大きく異なる可能性があり、場合によっては、原因は私たちの統制を超えている。私たちが予想されたマイルストーンに達することを保証することはできません。もし私たちが公開発表されたこれらのマイルストーンに到達できなければ、私たちの製品の商業化は延期されるかもしれませんので、私たちの株価は下落するかもしれません。
臨床試験は、PMA適用、いくつかの最初からの分類要求、およびいくつかの510(K)販売前通知をサポートするために必要であり、PMA補充剤または後続の510(K)
をサポートするためには、我々の上場装置の修正バージョンの提出が必要である可能性がある。これは、臨床試験の参加者として決定、募集、維持することが困難である可能性がある大量の適切な被験者を登録する必要がある。早期の臨床研究は228人の被験者に関連し、IDEによる新しい重要な試験をサポートし、これは私たちのFemBlocシステムPMA応用の基礎となる。IDE承認の重要な試験または承認後の研究における不利な結果は、PMAの制限または承認撤回につながる可能性もあります。私たちは未来にもっと多くの臨床試験を行う必要があるかもしれません。私たちの製品がいくつかの外国の国で使用されることを許可することができます。臨床テストは設計·実施が困難であり,
は数年かかる可能性があり,コストが高い可能性があり,結果も確定していない。これらの研究のいずれかの起動および完了は、様々な理由で阻止、延期、または停止される可能性がある。私たちはbr臨床試験中にいくつかのイベントに遭遇する可能性があり、これらのイベントは、コスト、スケジュール、または成功の達成に悪影響を及ぼす可能性があります
|
•
|
私たちはFDAにIDE申請を提出することを要求されました。この申請は人体臨床試験を開始する前に発効しなければなりません。FDAはIDEの申請を拒否して通知するかもしれません。研究試験を始めることができません
|
|
•
|
規制機関や他の類似した外国の監督機関は、私たちの臨床試験の設計や実施について意見が一致しないかもしれない
|
|
•
|
規制機関および/またはIRBsまたは他の審査機関は、私たちまたは私たちの研究者が臨床試験を開始することを許可してはならない、または予期されたまたは特定の試験場所で実施または継続して臨床試験を継続してはならない
|
|
•
|
私たちは将来の契約研究組織やCROと臨床試験場所で受け入れられる条項と合意できないかもしれません。その条項は広範な交渉を必要とする可能性があり、異なるCROと試験場所の間に有意差があるかもしれません
|
|
•
|
臨床試験は否定的または不確定な結果をもたらす可能性があり、あるいは私たちは監督機関が私たちの臨床試験結果の解釈に同意しない可能性があり、私たちは決定または監督機関が追加の臨床試験を要求したり、製品開発計画を放棄したりすることができるかもしれない
|
|
•
|
臨床試験に必要な対象または患者の数は、私たちが予想していたよりも多い可能性があり、これらの臨床試験の登録人数は、私たちが予想していたよりも遅い可能性があり、brは、任意の所与の時間に行われる臨床試験の数が高い可能性があり、任意の所与の臨床試験の利用可能な患者がより少なくなる可能性があり、または患者がこれらの臨床試験から退出する割合が私たちの予想よりも高い可能性がある
|
|
•
|
私たちの第三者請負業者は、法規の要求を適時に遵守したり、私たちに対する契約義務を履行できなかったり、全く守らなかったりする可能性があります
|
|
•
|
様々な理由で、被験者が受け入れられない健康リスクに曝露されていることを発見することを含む、臨床試験を一時停止または終了しなければならない可能性がある
|
|
•
|
私たちは、規制要件やガイドラインの変化を反映するために、臨床試験案を修正したり、追加的な研究を行わなければならないかもしれません。私たちは、IRBおよび/または規制機関に再検討することが要求されるかもしれません
|
|
•
|
規制機関、IRBs、または他の当事者は、安全信号または規制要件を満たしていないことを含む、様々な理由で臨床研究を一時停止または終了することを要求または提案することができる
|
34
カタログ表
|
•
|
臨床試験のコストは予想以上に高いかもしれません
|
|
•
|
臨床サイトは臨床方案を遵守しない可能性があり、あるいは臨床試験から退出する可能性がある
|
|
•
|
十分な数の臨床試験場所や対象者を募集することはできないかもしれません
|
|
•
|
規制機関、IRBs、または他の審査機関は私たちのことを承認できないかもしれません
|
|
•
|
臨床および商業用品の製造プロセス、臨床試験を行うために必要な設備や他の材料の供給が不十分、不十分、あるいは受け入れ可能なコストで得られない可能性があり、あるいは供給中断に遭遇する可能性がある
|
|
•
|
FDAまたは適用される外国の規制機関の承認政策や法規が変化する可能性があり、私たちの臨床データが承認されるのに十分ではない
|
|
•
|
私たちの現在または未来の製品は副作用や他の予期しない特徴を持っているかもしれない。
|
35
カタログ表
臨床試験はFDAの法律法規や他の適用規制機関の法律要求,法規やガイドラインに基づいて行わなければならず,これらの政府機関や臨床試験を行う医療機関のIRBsの監督を受けなければならない。著者らは過去と将来に著者らの臨床試験モニタリング活動を通じて発見された臨床試験地点を中止せざるを得ない可能性があり、brは著者らの臨床試験方案或いは臨床試験の適用法律、法規、要求とガイドラインに符合しない。
また,臨床試験は我々が供給した21 CFR§820.30の設計制御要求に適合した設備を用いて行い,臨床試験サイトがわれわれの臨床試験プロトコルに基づいて蓄積·使用しなければならない。また,われわれは臨床試験サイトに依存してわれわれの臨床試験を正確かつタイムリーに行うことを確保し,それらの承諾活動に合意しているが,それらの実際の表現への影響は限られている。著者らは良好な臨床実践或いはGCP要求に符合するため、著者らのCROに依存して著者らの臨床試験を支持する。我々のCROがGCP規格に準拠した研究の進行を監視するのを助けることができなかった場合,あるいは完全登録の実現を含めて実験実行中に長い時間遅延した場合,コスト増加,計画遅延,あるいは両方の影響を受ける可能性がある.また,米国以外の国/地域で行われた臨床試験は,輸送コストの増加,追加の法規要求,非米国CROの参加により,さらなる遅延と費用に直面する可能性があり,FDA未知の臨床研究者および診断,スクリーニング,医療看護の異なる基準に関連するリスクに直面させる可能性がある。
失敗は臨床試験のどの段階でも起こる可能性がある。私たちの臨床試験は陰性または不確定な結果をもたらす可能性があり、私たちは決定または監督機関が私たちが計画したテスト以外に追加の臨床テストと非臨床テストを行うことを要求するかもしれない。我々は、我々のシステムまたは将来開発可能な任意の製品の安全性および有効性を十分に証明することができず、規制部門の承認、新しい分類、または510(K)の許可を得ることを阻止し、最終的に製品または使用指示の商業化を阻止する。私たちの将来の製品がアメリカで承認され、再分類されたり、承認されたりしても、私たちの製品の外国での商業化は、これらの国家規制機関の承認を得る必要がある。審査手続きは司法管轄区域によって異なり、追加の臨床前研究或いは臨床試験を含む米国の要求と行政審査期限とは異なる或いはそれ以上の可能性がある。これらのいずれかは、私たちの業務、財務状況、および経営結果に悪影響を及ぼす可能性がある。
著者らは時々発表或いは公表した臨床試験の一時、“背線”と初歩的なデータはより多くのデータの出現に従って変化する可能性があり、そして最終データの重大な変化を招く可能性のある確認、監査と検証プログラムの影響を受ける。
私たちは時々私たちの臨床前研究と臨床試験の初歩的或いは主要なデータを公開するかもしれない。これらのデータは当時利用可能なデータの初歩的な分析に基づいて、特定の研究或いは試験に関連するデータに対してより全面的な審査を行った後、結果と関連するbr}結果と結論は変化する可能性がある。データ分析の一部として,仮説,推定,計算,結論も行われるが,我々
はすべてのデータを網羅的かつ詳細に評価する機会がないか,または機会がない可能性がある.したがって、私たちの報告の裏線または予備結果は、同じ研究の将来の結果と異なる可能性があり、または他のデータが受信されて十分に評価されると、異なる結論または考慮要因がこれらの結果を合格させる可能性がある。バックラインデータはまだ監査と検証手続きを受ける必要があり、これは最終データが私たちが以前に公表した予備データと実質的に異なる可能性がある。したがって、最終データが利用可能になる前に、バックラインデータは慎重に表示されなければならない。私たちはまた臨床試験の中間データを時々開示するかもしれない。臨床試験の中期または初歩的なデータは、1つまたは複数の臨床結果が、被験者の登録および治療の継続およびより多くの患者データの取得に伴って実質的に変化する可能性があるか、または私たちの臨床試験の被験者がその疾患の他の治療を継続するにつれて、以下のリスクの影響を受ける。初期または中期データと最終データとの間の不利な違いは、私たちのビジネスの将来性を深刻に損なう可能性があります。しかも、私たちまたは私たちの競争相手が中間データを開示することは私たちの普通株の価格変動を招くかもしれない。
36
カタログ表
さらに、規制機関を含む他の人は、私たちの仮定、推定、計算、結論または分析を受け入れないか、またはデータの重要性を異なる方法で解釈またはトレードオフする可能性があり、これは、特定の計画の潜在力、特定の候補製品の上場承認、承認、許可または商業化の可能性、およびわが社の全体的な状況に影響を与える可能性がある。さらに、私たち
は、開示された特定の研究または臨床試験に関する情報を一般的に広範な情報に由来することを選択し、あなたまたは他の人は、
を私たちの開示に含めるために、重要な情報または他の適切な情報として決定することに同意しない可能性がある。
もし私たちが報告した中期、バックライン、または予備データが実際の結果と異なる場合、または規制機関を含む他の人が結論に同意しない場合、私たちが承認を得て私たちの候補製品を商業化する能力が損なわれる可能性があり、これは私たちの業務、運営結果、将来性、または財務状況を損なう可能性がある。
もし患者或いは医者が現在のやり方を変えたくなければ、著者らの永久的な避妊解決方案或いは人工授精解決方案を採用して、私たちの製品はもっと多くの市場受容度を得ることができない可能性があり、私たちの業務は不利な影響を受ける。
我々の収入増加の主な戦略は,我々の恒久的避妊措置の採用を推進し,超音波確認テスト付きFemBlocシステムを用いて,FemaSeed
製品と診断を組み合わせた人工授精解決策を採用し,医師に我々の製品を用いて生殖障害や癌を有する患者を治療あるいは診断させることである。医師は様々な理由で私たちの製品を女性保健に使用しないことを選んでいるかもしれません
|
•
|
十分な第三者支払者保険や補償が不足している
|
|
•
|
私たちの製品については経験が不足しており、他に広く採用されている製品、プログラム、あるいは治療方法についてはより多くの理解が不足している
|
|
•
|
私たちは主要なオピニオンリーダーに私たちの製品についてアドバイスを提供するように説得したり、医者、患者、医療支払い人に私たちの製品が現在公認されている代替品の魅力的な代替品だと信じるように説得することはできません
|
|
•
|
私たちの製品の既存の代替品の臨床的利益、安全性、または費用効果を支持する証拠が不足していると考えられている
|
|
•
|
一般的に新製品やプログラムの使用に関する責任リスク;
|
|
•
|
新製品を使うために必要な訓練。
|
FemBlocについては,我々の販売,マーケティング,研修を主に産科と婦人科医に集中させる予定である。しかしながら、看護師および医師アシスタントのような一次保健医、および他の医療専門家を含む他の学科からの医師は、避妊要求のある患者の初期接触点であることが多い。著者らは、これらの学科の医師と他の医学専門家に対して訓練を行い、彼らに著者らの永久性避妊解決方案の臨床利点、患者の利益と安全概況を理解させることは、著者らのFemBlocシステムの採用を増加させる1つの要素であると考えている。より多くの医師や他の医療専門家が何らかの理由(上記の理由を含む)で私たちの恒久的な避妊解決策を鑑賞し、推薦しない場合、私たちの成長戦略を実行する能力が損なわれ、私たちの業務は悪影響を受ける可能性がある。
さらに、患者は、私たちの永久避妊解決策を採用できない可能性があり、または、彼らの身体構造が、私たちのFemBlocシステムを使用した有効な治療を許可しないため、または彼らは、その避妊需要に対する永久的解決策を得ることを望まないため、彼らは、感染または不快感のような、私たちの永久避妊解決策の潜在的な悪影響を心配しているか、または彼らは十分な第三者保険または精算を得ることができないからである。
37
カタログ表
FemaSeedについては,まず販売,マーケティング,トレーニングの重点を生殖内分泌医に重点を置き,婦人科医に拡張することが可能であり,これらの医師は通常不妊需要のある患者の初期連絡先である。著者らは、これらの学科を教育する医師と他の医療専門家が著者らの人工授精解決方案の臨床利点と患者利益を理解することは著者らのFemaSeed製品の採用を増加させる1つの要素であると信じている。他の医師や他の医療専門家が何らかの理由で(上に挙げた理由を含む)FemaSeed製品を鑑賞し推薦しない場合、私たちの成長戦略を実行する能力は損なわれ、私たちの業務は悪影響を受ける可能性がある。
もし私たちの人工授精解決策、永久避妊解決策、あるいは私たちが商業化を求めている任意の他の製品のために十分なカバーや精算レベルを達成し、維持することができなければ、私たちの商業成功は深刻な阻害を受ける可能性がある。
私たちの製品の主な顧客は私たちの不妊製品の生殖内分泌科医師と産婦人科医、関連する医療専門家と女性保健提供者組織です。私たちの顧客は通常、私たちの製品を使用する手続きに関連するコストと費用の全部または一部を支払い、任意の賠償免除または共同支払いの請求書を患者に発行するために、異なる第三者支払者に請求書を発行します。限られた第三者支払者は不妊保険を提供し、患者の現金支払いは通常治療とサービスに使用される。多くの第三者支払者は現在、避妊関連手続きを“患者保護·平価医療法案”の一部とし、“医療·教育·和解法案”によって改正され、あるいは総称して“ACA”と呼ばれている。ACAが避妊保険に関連する変更が発生した場合、支払人が顧客に精算する金額のいかなる低下も、顧客が私たちのFemBlocシステムを選択したり、採用したりすることを困難にし、追加の価格設定圧力をもたらす可能性がある。もし私たちが製品価格の低下を余儀なくされれば、私たちの毛金利は低下し、これは私たちの業務、財務状況、運営結果に実質的な悪影響を与え、私たちの業務を成長させる能力を弱めるかもしれない。
第三者決済者は,外国でも国内でも,政府のも商業的にも,ますます複雑な方法を開発して医療コストを抑えている。また、我々の他の製品を使用する手続きについては、第三者支払者間に統一的な保証範囲や精算政策はありません。そのため、私たちの他の製品を使用する手続きの保証範囲や精算範囲は支払人によって異なる可能性があります。支払人は、新技術及び従来技術の可能なカバー範囲を継続的に検討し、通知することなく、新製品及びプログラムのカバーを拒否又はキャンセルすることができる。第三者支払者保険証書が私たちのbr製品を使用するプログラムに保険を提供することは保証されません。もし私たちが既存の非保証政策を逆転させることに成功しなかった場合、または現在、私たちの製品や関連手続きを引き受けたり、精算したりする第三者支払者が将来その保証範囲を撤回または制限する場合、または他の第三者支払者が同様の保険証書を発行した場合、これは私たちの業務に実質的な悪影響を及ぼす可能性がある。
また、米国や国際市場では、将来の保険·精算は、追加の事前許可要件など、より多くの制限を受ける可能性があると考えられる。私たちの製品または私たちが規制承認を得る可能性のある任意の開発中の製品を使用するプログラムの第三者カバー範囲および精算範囲は、米国または国際市場で使用できないか、または不十分である可能性があり、これは、私たちの業務、財務状況、および運営結果に悪影響を与え、私たちの業務を発展させる能力を弱める可能性があります。
第三者支払者と医師が私たちの人工授精解決策、永久避妊解決策、または他の女性保健設備を保証しない場合、私たちの製品の保証範囲を採用または維持する前に、他の臨床データが必要になる可能性がある。
私たちの成功は、医師および適用された第三者支払い者が、有効な治療選択として、人工授精と永久避妊解決策を受け入れるかどうか、および女性に提供する他の医療機器に依存する。医師や支払人が私たちが発表した大量の臨床証拠やデータが納得できると思わない場合、あるいは他の研究を待ちたい場合、彼らは私たちの製品を使用しないことを選択したり、私たちの製品に保険と精算を提供することができます。現在、不妊の治療とサービスは通常患者が現金を支払う必要があるが、大多数の大型第三者支払側は永久避妊をACAの一部としている。
一部の医者、病院、支払人は、私たちがすでに生成したデータではなく、私たちの永久的な避妊解決策の長期的な安全性と有効性データをもっと見たいかもしれない。私たちまたは他の人が将来生成する可能性のあるいかなるデータも、私たちの既存の臨床試験で観察されたデータと一致することは保証されない。
38
カタログ表
医者が私たちの人工授精解決方案と永久的な避妊解決方案を使用するために必要な訓練は市場の私たちの製品に対する受容度を下げるかもしれない。
どんな新しい方法や技術のように、医師は手術を行う前に全面的な訓練計画を経なければならない。研修計画の完成に成功した後であっても,医師は解決策の提供に成功する上で困難に遭遇する可能性があるため,勤務中に製品の使用を著しく制限したり,製品の使用を完全に停止したりする。
また、患者の需要が低く、各医師の訓練に要する時間が予想よりも長く、販売代表研修医の能力が予想を下回っている場合、あるいは販売組織を十分に発展させることができなければ、私たちは困難に直面し、私たちの訓練計画を完成させる医師の数を増やすことができない可能性がある。これらのすべての事件は、より少ない訓練された医師が私たちの解決策を提供することにつながり、これは私たちの業務、財務状況、運営結果に負の影響を与え、私たちの業務を発展させる能力を弱めるかもしれない。
私たちは現在、未来に他の会社と競争し続けています。その中には、いくつかの会社の運営歴史が私たちよりも長く、製品が成熟しており、資源が多く、これは私たちのより高い市場浸透率とより良い経営業績を達成することを阻害するかもしれません。
生物医薬業界の競争は激しく、変化が発生しやすく、業界参加者の新製品とその他の活動の著しい影響を受けている。私たちの競争相手は過去に取り組んできましたが、女性の生殖問題や医療を治療するために、彼らの製品や新製品や方法を開発するために大量の資源を投入し続けています。我々の主な潜在的競争相手は,女性専用医療製品を販売する他の生物医薬会社であると考えられる。FDAのFemaSeedに対する承認を得た後、著者らは北米で商業化された子宮内人工授精分類における唯一の局所配向卵管内人工授精方法であるが、伝統的な人工授精や試験管受精などの他の生育治療方法と競争している。FDAで認証された他の設備については,現在米国やカナダの他の医療機器サプライヤーと競合している。FDAの承認を得たら、私たちは商業化が許可された唯一の非手術永久避妊解決策になるだろう。他の新興企業は女性専用医療製品を開発する初期段階にある可能性も考えられる。もし1つ以上のメーカーが現地化指向性卵管内人工授精を提供する製品の開発に成功した場合、この製品は私たちの人工授精解決策よりも有効または魅力的であり、私たちFemaSeed製品の販売は著しい不利な影響を受ける可能性があり、これは私たちの業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性がある。また,他社が我々の人工授精システムよりも広い適応の製品の開発に成功すれば,さらなる競争劣勢にあり,業務,財務状況,運営結果にも影響を与える可能性がある。1つまたは複数の製造業者が、より効果的で耐性が良い、または他の態様では、我々の永久避妊解決策よりも魅力的な永久避妊を提供する製品の開発に成功した場合、私たちのFemBloc
システムの販売は、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。また,他社が我々の恒久的避妊システムよりも広い適応でbrを承認する装置の開発に成功すれば,さらなる競争劣勢にあり,我々の業務,財務状況,運営結果にも影響を与える可能性がある。
私たちが競争する可能性のある多くの会社は、女性保健市場の主要な競争要素の面で競争優位を持っているかもしれない
| • |
より大きな会社製品ブランド認知度
|
| • |
優れた製品の安全性、信頼性、耐久性
|
| • |
臨床データの質が高く、データ量が大きい
|
| • |
患者や医師により効果的なマーケティングと教育を行い
|
| • |
より多くの販売経験とより大きな市場参入
|
| • |
より良い製品支援とサービス
|
| • |
より先進的な技術革新、製品改善、革新速度
|
39
カタログ表
| • |
より効果的な価格設定と収入戦略
|
| • |
患者の手術費用を下げ
|
| • |
より効果的な精算チームと戦略
|
| • |
専心に業務を発展させる
|
| • |
より効果的な臨床訓練チームです
|
私たちはまた他の生物医薬会社と競争して、合格した販売、訓練、その他の人員を募集し、維持します。
また,恒久的な薬物療法の提供は現在のところ承認されていないにもかかわらず,将来的にはこのような治療法を開発した製薬会社からの競争に直面する可能性がある。他社がライバルの女性専用機器を開発して商業化することにより、将来の競争がさらに激しくなることも予想される。このような会社のいずれも上記のような競争優位を持っている可能性がある。
私たちの長期成長は私たちの人工授精解決策、永久避妊解決策と女性専用医療製品解決策を強化し、私たちの適応を拡大し、より多くの製品を開発し、それを商業化する能力があるかどうかにかかっている。
我々の業務にとって,我々の人工授精製品,永久避妊システム女性専用医療製品ソリューションの強化,新製品の開発と発売は我々の業務にとって非常に重要である。Br製品の開発は高価で時間がかかり、経営陣のコア業務への関心を分散させる可能性がある。すべての新製品や製品の機能向上の成功は、私たちが能力があるかどうかを含むいくつかの要素に依存する
| • |
医師や患者のニーズを正確に認識し予測します
|
| • |
新製品と製品の改善を適時に開発し、発売する
|
| • |
第三者の知的財産権の侵害を避けること
|
| • |
必要であれば、臨床前研究と臨床試験のデータを用いて新製品の安全性と有効性を証明する
|
| • |
適応拡大、新製品または製品修正のために必要な規制許可、承認または承認を得る
|
| • |
新製品または改装製品のマーケティングはFDAの要求に完全に適合している
|
| • |
私たちの製品の潜在的なユーザーに十分な訓練を提供します
|
| • |
私たちの製品に対する手術は十分な保険と補償を受けています
|
| • |
効率的で尊敬する販売とマーケティングチームを育成する。
|
もし私たちが私たちの適応を拡大し、新製品と製品を機能開発と商業化することに成功しなければ、私たちの収入を増加させる能力が損なわれる可能性があり、これは私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
お客様の人工授精ソリューション、恒久的な避妊ソリューション、女性専用医療製品に対する需要を正確に予測し、私たちの在庫を管理することができなければ、私たちの運営結果は実質的な損害を受ける可能性があります。
十分な在庫供給を確保するためには、在庫需要を予測し、製品の将来の需要の見積もりに基づいてサプライヤーに注文しなければなりません。私たちは私たちの製品の需要に対する能力が多くの要素のマイナス影響を受ける可能性があることを正確に予測して、私たちの拡張戦略、競争相手の製品の発売、顧客の私たちの人工授精製品に対する需要の増加或いは減少、br永久避妊システムと女性専用医療製品或いは私たちの競争相手の製品を正確に管理できなかったこと、私たちは顧客の新製品に対する受容度、全体の市場状況或いは監督管理事項の意外な変化、及び経済状況或いは消費者の未来の経済状況に対する自信が弱まったことを含む。例えば,出版物
に発表された研究によると,2020年12月の卵管結紮術は2019年12月に比べて18%低下した避妊する2021年に。将来の選択的生殖手術の需要が大流行前のレベルに回復するか,あるいは全く保証されないことは保証されない。在庫レベルがお客様の需要を超えると在庫減記やログアウトを招く可能性があり、これは私たちの毛金利に悪影響を与え、私たちのブランド力を損なう可能性があります。逆に、私たちの製品に対する顧客の需要を過小評価している場合、私たちの第三者サプライヤーは私たちの要求を満たすコンポーネントを提供できない可能性があり、これは私たちの名声と顧客関係を損なう可能性があります。また、私たちの需要が大幅に増加し、私たちが受け入れられる条項の要求では、追加の原材料供給や追加のbr製造能力が得られない可能性があり、あるいはサプライヤーが私たちの増加した需要を満たすために十分な生産能力を割り当てることができない可能性があり、顧客が私たちの製品や運営結果の需要を満たす能力に悪影響を及ぼす可能性があります。
40
カタログ表
私たちは供給中断から私たち自身を守るために十分な在庫と部品レベルを維持することを求めている。したがって、私たちは一部の在庫が時代遅れになったり、期限切れになったりするリスクに直面しています。これは、在庫減値費用に関連するコストと、このような在庫を交換するのに必要なコストのため、収益やキャッシュフローに大きな悪影響を及ぼす可能性があります。
私たちは私たちの製品と候補製品のためにコンポーネントを製造し、組み立てますが、私たちの製造能力の性能損失または劣化は、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性があります。
私たちは人工授精製品、永久避妊システム、女性専用医療製品のための部品を製造して組み立てています。私たちがbr製品のために十分な在庫を維持する能力は、私たちの人員の需要や生産能力の低下を正確に管理できなかったことを含む多くの要素のマイナス影響を受ける可能性があります。逆に、私たちの人工授精製品、永久避妊システム、女性専用医療製品に対する顧客の需要を過大評価すれば、私たちの生産者は必要を超える可能性があり、これは追加のコストを招く可能性があり、これは私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
私たちの製品は限られた数の第三者サプライヤーのコンポーネント、および私たちのいくつかの製品の滅菌処理に依存しており、これらのサプライヤーの業績損失または降格は私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
私たちは第三者サプライヤーに依存して、私たちの人工授精製品、永久避妊システムと女性専用医療製品に使用する原材料とコンポーネントを提供します。これらのサプライヤーは、必要な材料および構成要素を、私たちの予想または市場に必要なレベルで確実に供給することを望まないかもしれない。私たちが製品を商業的に供給し、未来の製品を開発することができるかどうかは、私たちが法規の要求に基づいてこれらの材料、部品と製品を獲得し、商業化と臨床試験に十分な数量の製品を獲得する能力があるかどうかにある程度依存する。私たちのサプライヤーは以前は通常私たちの製品とサービスに対する需要を適時に満たすことができましたが、私たちのサプライヤーは将来私たちのその製品に対する需要を満たすことができることを保証することはできません。自然な理由でも、私たちの顧客としての彼らに対する相対的な重要性のために、私たちのサプライヤーは未来に彼らと私たちとの業務レベルを停止または減少させることを決定するかもしれません。もし私たちがこれらの第三者との関係の任意の変更または終了のためにサプライヤーの交換を要求した場合、または私たちのサプライヤーが一致した価格で私たちのコンポーネントを生産するために必要なbr材料を得ることができない場合、または全く入手できない場合、追加の規制許可または承認、損失販売、製造
または他の遅延を体験し、増加したコストを発生させ、または他の方法でお客様の関係を損なうことをトリガするために、私たちの製品を修正または変更しなければならないかもしれません。私たちは私たちが似たような条件で遅延なく、さらには完全に遅延なく代替関係を作ることができるという保証はない。
私たちの製品を製造するために必要なすべての材料、部品、サービスに代替サプライヤーが存在すると信じていますが、必要であれば、これらの材料、部品またはサービスのための追加または代替サプライヤーを確立することは、時間がかかり、高価である可能性があり、私たちの運営と製品交付中断を招く可能性があり、私たちの製品の性能仕様に影響を与えるかもしれません、あるいは私たちがその設計を修正する必要があるかもしれません。たとえ私たち
が代替サプライヤーを見つけることができても、私たちは新しいサプライヤーの施設、プログラム、運営が私たちの品質予想と適用された法規要件に適合しているかどうかを確認しなければならない。さらに、私たちのサプライヤー
は代替材料やコンポーネントの使用を要求するかもしれません。これらのイベントのいずれも、変更を実施する前に新しい規制機関の承認を得ることを要求することができ、これはさらなる遅延をもたらす可能性があり、
を全く得られない可能性がある。上述したように、十分な在庫レベルを維持することを求めていますが、これらの在庫は供給中断から完全に保護できない可能性があります。
41
カタログ表
私たちは製造過程のいくつかの部品に対して限られた供給スケジュールしかありません。これらの配置は完全な商業供給まで延長されていません。私たちは注文を購入した上でいくつかの重要な材料を取得します。したがって、私たちは私たちの製品と候補製品のいくつかの材料と他の材料に関する長期的な約束の手配を持っていない。もし私たちのbr候補製品が市場承認、許可、または許可を得たら、私たちは第三者といくつかの重要な材料の商業生産協定を確立する必要があるだろう。
しかも、私たちの製造過程のいくつかの部品は独占サプライヤーに依存する。私たちは現在、これらのコンポーネントの単一サプライヤーへの依存と、十分な交換
を得る上で直面する可能性のある挑戦は、定価、供給、品質、および交付スケジュールの限られた制御を含むいくつかのリスクに関する。任意の原材料や他の材料を代替案で代替することができても、この代替案はよりコストが高く、
はより低い生産量をもたらすか、または私たちの目的に適していない可能性がある。しかも、私たちが製品候補を製造するために使用するいくつかの材料は複雑な材料であり、代替がもっと難しいかもしれない。したがって、私たちの独占的な供給者によるどんな中断も遅延と追加的な規制提出をもたらす可能性がある。私たちは現在と未来に他人が私たちの候補製品や製品を生産するいくつかのコンポーネントに依存しており、私たちの業務、財務状況、および運営結果に悪影響を及ぼす可能性があります。
また、私たちは第三者滅菌器に依存して私たちの製品と候補製品を有効に滅菌し、任意の第三者滅菌器の故障は私たちの製品と候補製品に関連する安全リスクを招き、患者や研究対象を負傷させる可能性があり、これは私たちの会社を製品責任クレームと訴訟に直面させる可能性がある。契約消毒器はFDAによって検査され、外国の監督管理機関によって検査される可能性もある。また、エチレンオキシドを用いて医療機器を滅菌する施設は使用前に閉鎖または閉鎖される可能性があり、我々の製品や候補製品のサプライチェーン遅延または中断を招く可能性がある。私たちは任意の契約滅菌器と契約して、私たちの製品と候補製品を滅菌する任意のコンプライアンスbrに失敗する可能性があり、サプライチェーンの遅延と中断を招く可能性があり、代替契約滅菌器を識別し、それと契約を締結することを要求するかもしれません。私たちは適時に、あるいは私たちに有利な条項でサービスを提供することができないかもしれません。もし私たちの契約滅菌器にどんな故障があれば、私たちの業務、財務状況、経営結果に悪影響を及ぼす可能性があります。
私たちの運航会社の性能問題、サービス中断、または価格上昇は、私たちの業務に悪影響を与え、私たちの名声と適時にサービスを提供する能力を損なう可能性があります。
迅速で信頼できる輸送は私たちの運営に必須的だ。私たちは輸送サービス提供者に大きく依存して私たちの製品を信頼性よく安全に顧客の手元に輸送し、これらの
出荷を追跡します。もし事業者がいかなるシステムの紛失、破損、破損などの配送性能の問題に遭遇した場合、このようなシステムを適時に交換するコストは高くなり、このような事件は私たちの名声を損なう可能性があり、私たちの製品に対する需要を減少させ、私たちの業務のコストと支出を増加させる可能性がある。また、運賃の大幅な向上は、私たちの運営利益率や運営結果に悪影響を及ぼす可能性があります。同様に、ストライキ、悪天候、自然災害、または私たちが使用している配送サービスに影響を与える他のサービス中断も、製品の注文をタイムリーに処理する能力に悪影響を与えます。
医療産業や共同購入組織の統合は、要求価格割引を招く可能性があり、現在の業務戦略を支援するために必要な価格で製品を販売する能力に影響を与える可能性がある。
過去10年間、医療コストは大幅に上昇し、立法者、監督機関、第三者支払人は多くのコスト改革措置を提出した。コスト改革は医療業界の統合
集約購買力を引き起こし、これは将来的により多くの定価割引要求を生じる可能性がある。また、共同購入組織、独立交付ネットワーク、大型単一口座は引き続きその市場力を使用して病院と医師業務の調達決定を統合する可能性がある。市場需要、政府規制、第三者保険·精算政策、社会的圧力は引き続き世界の医療業界を変え、顧客間のさらなる業務統合と連合を招き、わが製品の価格にさらなる下振れ圧力を加える可能性があると予想している。
42
カタログ表
私たちの女性専用医療製品解決策のマーケティングと販売の経験は限られています。もし私たちが私たちの直販とマーケティング組織を拡大、管理、維持できなければ、私たちは収入増加を達成できないかもしれません。
私たちは女性専用医療製品のマーケティングと販売経験が限られている。私たちは現在、非常に限られた直接努力を通じて、私たちのFemaSeed設備、FemVue設備、FemCerv設備とFemCath設備、北米の産婦人科医、生殖内分泌医師と医師の実践に向けて、オンライン訓練と新しい顧客支援を含み、また各種の直接患者向けのマーケティング計画を利用して、ソーシャルメディア、患者サイト上の医師の定位とオンラインビデオを含む。2023年12月31日まで、私たちはただ一人の従業員だけが販売とマーケティングに従事しています。私たちの経営業績はこの従業員たちの努力に直接かかっている。
FemaSeed製品は米国とカナダ市場に発売されているため、将来の収入増加を創出するために、直売組織の地理的範囲を開発しています。これは私たちの商業化努力、コスト、関心の著しい拡大を表していると予想されます。私たちの成功は私たちが豊富な業界経験と関連製品の技術知識を持つ熟練販売とマーケティング人員を採用、訓練、維持と激励する能力があるかどうかに大きく依存する。彼らのサービス競争が激しいため、私たちはあなたに保証することができません。私たちは優遇あるいは商業合理的な条件で多くの人員を募集し、維持することができます。合格した販売·マーケティング担当者を募集または維持できなければ、業務を拡大し、収入を創出することはできないだろう。私たちの販売やマーケティング能力を拡大できなければ、私たちのFemaSeed
製品や他の女性専用医療製品を効果的に商業化できないかもしれません。これは私たちの業務、財務状況、運営結果に悪影響を及ぼすかもしれません。FemBlocシステムが米国市場に発売された後に収入増加をさらに拡大するために,直売組織の地理的範囲を拡大する予定である。私たちの未来の成功は私たちが豊富な業界経験と関連製品の技術知識を持つ熟練販売とマーケティング人員をもっと多く募集、訓練、維持と激励する能力があるかどうかに大きく依存する。もし私たちの販売とマーケティング能力を拡大できなければ、私たちは私たちのFemBlocシステムを効果的に商業化できないかもしれません。これは私たちの業務、財務状況、運営結果に悪影響を及ぼすかもしれません。
アメリカ以外の市場で私たちの人工授精製品、永久避妊システムと女性専用医療製品の解決策を成功させ、販売するためには、私たちの経験の限られた国際ビジネスリスクを多く解決しなければならない。
私たちの戦略はヨーロッパや日本などの他の国際市場における私たちの国際影響力を増加させることであり、これはアメリカ以外の市場での私たちの収入をさらに増加させるかもしれない。国際販売は多くのリスクに直面している
| • |
流通パートナーシップの確保と私たちの国際関係の管理に困難があります
|
| • |
より多くの製品や手続きが規制の承認を受けたり、他の方法で自由に国際市場に進出したりするため、競争が激化している
|
| • |
売掛金の支払い周期が長く、入金が困難である
|
| • |
一部の国は知的財産権の保護を減らしたり変えたりしている
|
| • |
輸出制限、貿易法規、外国税法
|
| • |
通貨為替レートの変動
|
| • |
外国認証と規制部門の承認または承認の要求;
|
| • |
通関と輸送遅延
|
| • |
海外の政治、社会、経済不安定、テロ、普遍的な安全懸念
|
| • |
地元で生産された製品を好む
|
| • |
外国の付加価値税制度の複雑さを含む潜在的な不利な税収結果
|
| • |
様々な外国の法律や異なる法律基準を遵守する負担;
|
| • |
財政会計と報告書の負担と複雑さを増加させる。
|
これらのリスクのうちの1つまたは複数が実現されれば、私たちの業務、財務状況、および経営結果は悪影響を受ける可能性がある。
43
カタログ表
私たちは自分たちの直販チームに頼って私たちの女性専用医療製品を販売することを計画しています。これは固定コストが競争相手よりも高くなり、製品の需要が急に低下した場合にコストを下げる能力を遅らせることができます。
私たちは北米での直販チームとヨーロッパと他の国際諸国の第三者流通パートナーに頼って、私たちの製品をマーケティングして販売する予定です。私たちのいくつかの競争相手は主に独立販売代理店と第三者流通業者に依存している。独立した第三者による競合製品をマーケティングする会社に比べて、直販チームは、従業員の福祉、研修、販売者の管理に関するコストを負担するため、より高い固定コストを負担する可能性があります。したがって、私たちは競争的に不利になるかもしれない。また、これらの固定コストは、製品需要が急激に低下した場合にコストを低減する能力を低下させる可能性があり、これは、私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
私たちは製品責任クレームのリスクに直面しており、これは費用が高く、経営陣の注意を分散させ、私たちの名声と業務を損なう可能性がある。私たちは十分な製品責任保険を維持できないかもしれません。
私たちの業務は私たちを製品責任クレームのリスクに直面させます。これらのクレームは医療製品(無菌医療製品を含む)のテスト、製造、マーケティングに固有のリスクです。FDAによって許可または承認されて商業販売のために使用され、FDAまたは適用される外国規制機関の許可および規制された施設で生産されても、このようなリスクは依然として存在する。私たちのFemBlocシステムとFemaSeed製品は、将来のどの製品も女性生殖系のような重要な身体機能と過程に影響を与えることを目的としている。我々のFemBlocシステム、FemaSeed製品および他の女性専用医療製品に関連する任意の副作用、製造欠陥、誤用または乱用は、不妊失敗を含み、すべて患者の負傷または死亡を招く可能性がある。医療機器業界は従来,製品責任クレームにより広範な訴訟を受けており,製品責任訴訟に直面しないことは保証されていない。例えば、これまでバイエルによって販売されていた永久避妊システムEsureは、子宮鏡を介して女性の卵管にコイルを移植することを含み、そこでは永久的に保持される。2016年、FDAはバイエルに発売後のモニタリング研究を命令し、子宮および/または卵管穿孔の可能性のある警告、腹部または骨盤内挿入の識別br、持続性疼痛、およびアレルギーまたはアレルギー反応が疑われる製品ラベルにボックス警告を貼り付けることを要求した。2018年4月、FDAはEsureの販売と流通を制限した。バイエルはこの製品をすべての市場から降りて、アメリカを含めています。2018年12月から発効します。FemBlocシステムに深刻な不良セキュリティ問題が発生しない保証はない.
もし私たちの製品が表面的に患者の損傷や死亡をもたらした場合、私たちは製品責任クレームの影響を受けるかもしれません。さらに、私たちのサプライヤーの活動によるダメージ、例えば、コンポーネントや原材料を提供してくれるサプライヤー、または任意の契約消毒器が、私たちに請求する根拠になる可能性があります。私たちの製品に販売したり、他の方法で接触したりする患者、医療提供者、または他の人は、私たちに製品責任を請求するかもしれません。もし私たちが製品責任クレームで自分を弁護することに成功できなければ、私たちは重大な責任と名声の損害を招くだろう。さらに、利点または最終結果にかかわらず、製品
責任クレームは、:
| • |
訴訟費用;
|
| • |
私たちの主な業務に対する管理職の関心を分散させる
|
| • |
私たちの現在と未来の製品を商業化することはできません
|
| • |
私たちの現在と未来の製品の需要が減少しています
|
| • |
私たちのビジネス的名声を損なうことは
|
| • |
製品をリコールしたり市場から引き揚げたり
|
| • |
臨床試験参加者の脱退
|
| • |
患者や他の請求人に巨額の金銭賠償を与える;
|
| • |
販売損失。
|
私たちは自発的にリコールしたり、市場から欠陥のある製品を撤回したりすることで、私たちの製品責任リスクを管理しようとするかもしれませんが、私たちの製品に対するいかなるリコールや市場撤回も、私たちの顧客へのこれらの製品の供給を遅延させ、私たちの名声に影響を与える可能性があります。私たちが将来必要とされる可能性のある適切な市場リコールや市場撤回努力を成功させることを成功させることは保証できません。あるいはこれらの努力は、製品の故障を防止し、それに伴う製品責任の期待効果を達成することができます。このようなリコールおよび撤回は、私たちの競争相手によって私たちの安全名声を損なうために使用される可能性があり、または私たちの製品の使用を考慮する際に患者によって安全リスクとみなされる可能性があり、いずれも、私たちの業務、財務状況、および運営結果に大きな悪影響を及ぼす可能性があります。
44
カタログ表
適切と思われる製品責任保険と臨床試験責任保険がありますが、この保険は賠償免除額と保険範囲の制限を受けています。私たちの現在の製品責任保険は許容可能な条項で提供し続けることができないかもしれません。そして、もしあれば、保険範囲は未来のいかなる製品責任クレームから私たちを保護するのに十分ではないかもしれません。もし私たちが受け入れ可能な費用または許容可能な条項で保険を受けることができない場合、あるいは潜在的な製品責任クレームに対して他の方法で保障を提供することができなければ、私たちは重大な責任に直面する可能性がある。製品責任クレーム、リコール、または未保険負債または保険負債を超えた金額に関する他のクレームは、当社の業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性があります。
もし私たちの人工授精製品、永久避妊システムと女性専用医療製品の解決策の質が医者或いは患者の期待に達しなければ、私たちのブランドと名声或いは私たちの業務は不利な影響を受ける可能性がある。
業務を展開する過程で、我々の人工授精製品、永久避妊システム、女性専用医療製品解決方案に出現する可能性のある品質問題を十分に解決しなければならず、我々の製品に含まれる第三者コンポーネントの欠陥を含む。品質問題が生じる可能性のあるリスクを最大限に低減するための内部プロセスを構築しているが,これらの問題や関連責任の発生を解消または軽減できる保証はない.また,品質に問題がない場合でも,我々の製品性能が医師や患者の期待に達しなければ,クレームや責任の制約を受ける可能性がある。もし私たちの製品の質が医者や患者の期待に合わない場合、これらの医師または患者における私たちのブランドと名声、あるいは私たちの業務、財務状況、および運営結果は不利な影響を受ける可能性があります。
もし私たちが新たで相補的な業務、製品、技術を買収することを選択すれば、私たちはこれらの買収を完成させたり、経済的に効率的で中断のない方法でそれらを統合することができないかもしれない。
私たちの成功はある程度、絶えず変化する顧客の需要、競争圧力と技術進歩に対応するために、製品供給の能力を強化し、拡大することにかかっている。したがって、私たちは現在、買収や投資に関する約束はありませんが、将来的には、それらを自分で開発するのではなく、相補的な業務、製品、技術に関連する合弁企業を求めることができるかもしれません。私たちは、私たちが将来の任意の買収や合弁企業を成功させることができるかどうか、あるいは私たちが任意の買収した業務、製品または技術を統合することに成功できるかどうか、あるいはそれに関連するすべてのキーパーソンを維持することができるかどうかを知らない。私たちが買収した任意の業務、製品または技術を統合することは、高価で時間がかかる可能性があり、私たちが行っている業務を混乱させ、私たちの経営陣の注意を分散させることができる。もし私たちが買収した業務、製品、技術を効率的に統合できなければ、私たちの業務は悪影響を受けるだろう。しかも、買収コストによるいかなる償却や費用も私たちの費用を増加させる可能性がある。
管理成長と従業員事務に関連するリスク
私たちは新冠肺炎の大流行を含む衛生流行病と疫病に関連するリスクに直面しており、これは私たちの臨床試験を深刻に混乱させる可能性があるため、必要な監督管理許可、許可あるいは贈与を受けることは延期または阻止される可能性がある。
私たちは衛生流行病や伝染病の爆発と関連した危険に直面している。例えば、2019年12月、中国では新しいコロナウイルス株であるSARS-CoV-2が出現し、新冠肺炎と呼ばれる疾患を引き起こした。それ以来、新冠肺炎は米国とEU加盟国を含む世界複数の国に拡大した。2020年3月、世界保健機関は新冠肺炎疫病を大流行と発表した。このような感染症の爆発は広範囲の健康危機を招く可能性があり,一般商業活動や多くの国の経済や金融市場に悪影響を及ぼす可能性があり,新冠肺炎はこのように発生している。新冠肺炎の大流行により、各国政府は多くの抑制措置を実施し、例えば旅行禁止と制限、特に隔離、その場或いは避難所の完全閉鎖の命令及び商業制限と閉鎖などを実施した。これらの抑制措置は変化する可能性があり、関連政府当局は随時規制を引き締める可能性がある。
私たちは職場政策、やり方、手続きに関する連邦、州、地方政府の提案に引き続き従うことを計画している。私たちは遠隔臨床モニタリングを含む、私たちの臨床試験に適したすべてのガイドラインを遵守する。私たちは全体的に私たちの業務、財務状況、運営結果、見通しにどのような影響を与えるかを決定することができない。
45
カタログ表
そのほか、新冠肺炎の大流行は多くの設備と候補薬物の臨床試験に深刻な影響を与えた。いくつかの裁判はただ延期されただけで、他のいくつかはキャンセルされた。COVID 19大流行が著者らの臨床試験業務に与える影響程度は未来の事態の発展に依存し、これらの事態の発展は高度な不確定性があり、例えば疫病の持続時間と地理範囲、新冠肺炎及びその未来変異の深刻性、及びbr}制御と新冠肺炎治療の行動の有効性を把握できない。これまで,臨床試験のサイト起動と被験者登録に遅延があった。可能な遅延は私たちの臨床試験に深刻な影響を与える可能性があり、私たちの臨床試験操作に悪影響を及ぼす可能性があり、私たちの臨床試験場所への訪問と、被験者、主要な研究者、および現場スタッフの能力を採用して保留することを含むかもしれません。これらの人は医療提供者として、彼らの地域で疫病が発生した場合、暴露を増加させる可能性があります。br}私たちは試験支援を受け、臨床試験データを監視し、臨床試験を行う能力の中断、あるいは私たちが研究登録した被験者の旅行能力、または研究場所のスタッフの旅行能力、また,われわれの施設やわれわれの臨床試験パートナーおよびその契約メーカーの施設の一時閉鎖や遅延は,われわれの臨床試験活動に悪影響を及ぼす。また、私たちは独立した臨床研究者、CROと他の第三者サービスプロバイダに依存して、私たちの臨床試験からデータを収集することを含む、私たちの臨床前研究と臨床試験を管理、監視、その他の方法で実行するのを助けることができますが、新冠肺炎や変種の伝播は彼らが私たちのプロジェクトに出席することに影響を与え、私たちのプロジェクトに十分な時間と資源を投入し、あるいはウェブサイトに行って仕事を展開する能力に影響を与える可能性があります。同様に,われわれの前臨床試験は大流行により遅延および/または中断する可能性がある。したがって、私たちの臨床前研究と臨床試験およびある規制文書の予想データ読み取りの予想スケジュールは負の影響を受ける可能性があり、これは私たちが監督部門の許可を得て、私たちの候補製品を商業化する能力に不利な影響を与え、私たちの運営費用を増加させ、私たちの業務、財務状況、運営結果と将来性に重大な悪影響を与える。
重要な情報技術システム、プロセス、またはサイトの障害は、当社の業務に悪影響を及ぼす可能性があります。
私たちは情報技術システムに広く依存して業務を展開している。これらのシステムは、サプライヤーからの材料の注文と管理、顧客への製品の出荷、取引の処理、運営結果のまとめと報告、法規の遵守、法律または税金要件、データセキュリティ、および当社の業務を管理するために必要な他のプロセスに影響を与えます。もし私たちのシステムが様々な原因(壊滅的な事件、停電からセキュリティホールまで)で破損したり、正常に動作を停止したりした場合、私たちの業務連続計画はタイムリーに効果的に補償できず、運営中断に遭遇する可能性があり、これは私たちの業務に悪影響を及ぼす可能性があります。さらに、我々のITシステムにおける任意の脆弱性は、我々の患者登録所からの情報またはHIPAAおよび他の法律によって保護された他の患者情報を含む不正アクセス、開示、および非開示情報の使用をもたらす可能性がある。このような情報のアクセス、開示、または他の損失は、個人情報のプライバシーを保護する法律に基づいて責任を負い、私たちの名声を損なう法的クレームまたは訴訟を引き起こす可能性がある。
また,第三者決済プロセッサで処理されたクレジットカードとデビットカードによる取引の一部販売支払いを受け付けている.したがって、私たちはクレジットカードとデビットカード支払いと関連した多くの危険に直面している。これらの取引の結果,交換費や他の費用を支払い,これらの費用は時間の経過とともに増加する可能性があり,製品価格の向上や経験コストや費用の増加が要求される可能性がある.また、支払い処理プロセスの一部として、顧客のクレジットカードおよびデビットカード情報を第三者決済プロセッサに送信する。もし私たちの第三者クレジットカード支払いプロセッサの安全が破壊された場合、私たちは将来、顧客のクレジットカードまたはデビットカード情報が実際にまたは盗まれたと言われることによる詐欺取引の疑いがあるため、訴訟または他の訴訟を受ける可能性がある。私たちと私たちの第三者クレジットカード支払い処理業者はまた、支払カード協会の操作ルール、認証要求、電子振込ルールの制約を受けており、これらのルールや要求を遵守することが困難または不可能になる可能性があります。もし私たちまたは私たちの第三者クレジットカード支払い処理業者がこれらのルールや要求を遵守できなかった場合、罰金とより高い取引費を受け、顧客のクレジットカードやデビットカードの支払いを受ける能力を失い、私たちの業務に悪影響を及ぼす可能性があります。
46
カタログ表
もし私たちの施設が破損したり、運行できない場合、私たちは私たちの製品を研究、開発、製造、供給することができないので、私たちが新しい施設を得て在庫を再建することができるまで、私たちの業務は不利な影響を受けるだろう。
私たちには余分な施設がありません。私たちはほとんどの研究、開発、製造、バックグラウンド活動を行い、ジョージア州スヴァニの一つの場所で私たちのすべての完成品在庫を維持します。私たちの施設、設備、在庫の交換コストが高く、修復や交換に多くの準備時間が必要かもしれません。施設は自然や人為的災害の被害や運転できない可能性があり,竜巻,洪水,火災,停電を含むが,一定期間我々の研究,開発,商業化活動を困難または不可能にする可能性がある。これらの活動を実行できないことに加え、完成品の在庫を再構築するのに要する時間がかかり、顧客の流失や名声を損なう可能性があります。財産損失と業務中断保険がありますが、この保険は私たちのすべての潜在的損失をカバーするのに十分ではないかもしれませんし、その保険は許容可能な条項で継続して提供されないかもしれません。あるいは全く提供できません。
私たちが競争的な地位を維持する能力は私たちが高級管理職と他の高い素質のある人員を引き付けて維持する能力にかかっている。
私たちの成功はある程度私たちが引き続き高い素質の管理、臨床と他の人員の能力を吸引、維持と激励することにかかっている。私たちは私たちの管理チーム、特に私たちの最高経営責任者と社長、そして私たちの他の上級管理職と他の重要な人員に非常に依存している。私たちは私たちのすべての幹部と招聘契約を締結しましたが、彼らの誰もが私たちとの雇用関係をいつでも終わらせることができます。私たちの任意のキーパーソンを交換することは、大量の時間とコストに関連する可能性があり、業務目標の達成を大幅に延期または阻害する可能性がありますので、私たちの業務に悪影響を及ぼす可能性があります。また、私たちは確かに私たちのCEOと総裁のために“キーパーソン”保険を購入し、適用された場合に潜在的なサービス損失を補うことができます。
私たちは私たちの組織の規模を拡大する必要があり、私たちはこのような成長を管理する時に困難に直面するかもしれない。
2023年12月31日現在、私たちは32人のフルタイム従業員、2人のアルバイト従業員、21人のコンサルタントを持っています。私たちの開発と商業化計画と戦略の発展に伴い、私たちはより多くの管理、運営、販売、マーケティング、財務、その他の人員が必要であると予想される。今後の成長は、経営陣のメンバーにより多くの重大な責任を負わせるだろう
| • |
より多くの従業員を識別し、採用し、統合し、維持し、激励する
|
| • |
我々の候補製品の臨床およびFDA応用準備を行うとともに、請負業者および他の第三者に対する契約義務を遵守することを含む、我々の内部開発作業を効率的に管理する
|
| • |
私たちの業務、財務、管理制御、報告システム、そして手続きを改善する。
|
私たちの将来の財務業績と、私たちの製品と上場が許可されている候補製品を商業化する能力は、将来の任意の成長を効果的に管理する能力にある程度依存し、私たちの経営陣はまた、これらの成長活動を管理するために、不比例な注意を日常活動から移しなければならないかもしれない。
現在、予測可能な未来に、私たちは法律とコンプライアンス、規制マーケティング許可、臨床試験管理、製造のほぼすべての側面を含む、いくつかの独立した組織、コンサルタント、コンサルタントに依存していくつかのサービスを提供し続ける。必要に応じて独立した組織,コンサルタント,コンサルタントのサービスが継続してタイムリーに提供される保証はなく,合格した代替者を見つけることも保証されない。さらに、私たちのアウトソーシング活動を効率的に管理できない場合、あるいはコンサルタントが提供するサービスの品質や正確性が何らかの理由で影響を受ける場合、私たちの臨床試験は延長、延期、または終了される可能性があり、私たちは規制機関の候補製品の承認を得られないか、あるいは他の方法で私たちの業務を推進することができないかもしれません。私たちが既存のbrコンサルタントを経済的に合理的な条件で管理できるか、または他の適任な外部請負業者やコンサルタントを見つけることができるか、または全くできないことを保証することはできない。
新入社員の募集やコンサルタントや請負業者チームの拡大で私たちの組織を効果的に拡大できなければ、私たちの製品のさらなる開発と商業化、潜在的に私たちの候補製品を商業化するために必要な任務を実行することができない可能性があり、私たちの研究、開発、商業化の目標を達成できないかもしれません。
47
カタログ表
ソーシャルメディアプラットフォームの使用はますます多くなり、新たなリスクと挑戦をもたらしている。
ソーシャルメディアは私たちの臨床開発計画を交流するためにますます利用されており、私たちの製品商業化努力で適切なソーシャルメディアを使用し、私たちの候補製品が承認された後
を使用する予定です。生物医薬業界のソーシャルメディア実践は引き続き発展しており、このような使用に関連する法規と監督指導も絶えず発展しているが、常に明確ではない。この変化は、私たちの業務に適用される法規を遵守しない不確実性とリスクをもたらし、私たちに対して規制行動をとる可能性があり、ラベル外マーケティングや他の禁止された活動に関連する可能性のある訴訟、およびbr}FDA、米国証券取引委員会、および他の規制機関のより厳しい審査をもたらす可能性がある。例えば、患者は、進行中の臨床試験における彼らの経験をレビューするために、ソーシャルメディアチャネルを使用して、いわゆる有害事象を報告することができる。このような開示が発生した場合、試用登録は悪影響を受ける可能性があり、適用される有害事象報告義務を監視して遵守することができない可能性があり、またはソーシャルメディアによって生じる政治的および市場的圧力の下で、私たちの業務または公衆の合法的な利益を守ることができない可能性がある。さらに、任意のSNS上で敏感な情報や、私たちまたは私たちがマーケティングまたは開発している製品に関する否定的または不正確な投稿またはコメントを適切に開示しないリスクもある。さらに、私たちはソーシャルメディアで私たちの会社、管理職、候補製品、または製品に関する攻撃に遭遇するかもしれません。もしこのような事件が発生したり、私たちが適用された法規を遵守できなかった場合、私たちは責任を負い、規制行動に直面したり、私たちの業務に他の損害を与える可能性があります。
政府の規制に関連するリスク
私たちの製品と運営はアメリカと海外で広範な政府の監督と監督を受けており、私たちが適用された要求を守らなければ、私たちの業務を損なう可能性があります。
私たちと私たちの製品はアメリカと他のところで広く規制されています。FDAとその外国の同業者を含めて。他の事項を除いて、FDAと外国の監督当局は医療機器を監督する:設計、開発と製造、テスト、ラベル、臨床試験、製品安全、機関登録と器械の発売、マーケティング、販売と流通、発売前の整理と承認、クレーム処理、記録保存プログラム、広告と販売促進、リコールと現場安全是正行動、上場後モニタリングは、死亡または深刻な傷害と故障を報告することを含み、それらが再び発生した場合、死亡または深刻な損傷を引き起こす可能性が高い。発売後の審査研究;および製品の輸出入。
私たちが統制された規制は複雑で、時間が経つにつれてもっと厳しくなることが多い。規制の変化は、予想されるコストよりも高いか、または予想される売上を下回る業務を継続または拡大する能力を制限する可能性がある。FDAは定期的な抜き打ち検査を通じてこのような規制要求を実行する。FDAが将来のFDA検査や外国規制機関による検査で規定に適合していない分野を発見するかどうかはわかりません。適用された法規を遵守しないことは、私たちの製品を販売する能力を危険にさらし、例えば、警告状、罰金、禁止、民事処罰、流通の中止、製品のリコールまたは差し押さえ、市場への製品の発売の遅延、生産の完全または部分的な一時停止、将来の承認の承認の拒否、承認の撤回または一時停止の実行を招く可能性があり、最悪の場合、刑事罰を受けることになる。
48
カタログ表
FemBlocシステムや将来のデバイスおよび拡張適応の必要な承認、再分類、または許可を得ることができないかもしれませんが、これらのマーケティング許可をタイムリーに得ることができなければ、私たちの業務成長能力に悪影響を与えます。
私たちの戦略は私たちのFemBlocシステムに対するFDAの承認にかかっている。米国では,連邦食品,医薬品および化粧品法第510(K)条の許可を得なければならない,あるいは“連邦食品,医薬品および化粧品法”第513(F)(2)条に規定されているFDCAを最初に分類したり,FDAのPMAの承認を得たりしてから,新たな医療機器の販売や既存製品の新たな声明や重大な修正を行うことができ,免除
が適用されない限り,新たな医療機器を販売することができる。510(K)承認プログラムでは、装置が発売される前に、FDAは、510(K)のプロセスによって以前に承認された装置、1976年5月28日までに合法的に販売された装置(改訂前装置)、承認されたPMAに従って米国市場に進出し、その後降格した装置、FDCA第513(F)(2)節に従って再分類された装置を含む、提案された装置が合法的に販売されている“先決”装置と実質的に同等であることを決定しなければならない。あるいは510(K)免税設備。“実質的同等”を達成するためには,提案デバイスは述語デバイスと同じ期待用途を持つか,述語デバイスと同じ技術的特徴を持つか,異なる技術的特徴を持つ必要があり,述語デバイスとは異なる安全性や有効性の問題を引き起こすことはない.実質的な等価性論証を支援するために臨床データが必要となる場合がある。新しい分類プログラムは、新しい医療機器を分類する方法を提供し、これらの新しい医療機器に対して、通常の制御または通常および特殊な制御は、単独で提案された期待される用途を有する装置に合理的な安全性と有効性保証を提供するが、それに対して合法的に販売されている述語装置はない。最初のソートは、リスクに基づく分類プロセスであり、このプロセスによって、デバイスはクラスIまたはクラスIIに分類される。最初のソート要求に応答して分類されたデバイスは、販売され、将来の販売前通知510(K)によって提出される述語として使用されることができる。我々のFemBlocシステムがPMAの承認を得る必要がある過程で、FDAは技術、臨床前、臨床試験、製造、およびラベルデータを含むが、これらに限定されない大量のデータに部分的に基づいて、提案された装置がその予期される用途に対して安全かつ有効であることを決定しなければならない。最大のリスクを構成すると考えられるデバイス、例えば、生命を維持する、生命をサポートする、または移植可能なデバイスの場合、PMAプロセスが一般的に必要とされる。
PMAを通じて承認を申請した製品修正は通常FDA承認を必要とする。同様に、510(K)認証または最初から分類された製品に付与されたいくつかの修正は、新しい510(K)認証を必要とする場合があり、または新しい最初の分類要求を必要とする場合があり、PMAを必要とする場合もある。PMA承認、最初の分類、および510(K)の承認プロセスは、高価で、長く、不確実である可能性がある。FDAの510(K)承認プロセスは、通常、3~7ヶ月を要するが、より長く持続する可能性もあるが、最初から分類されるプロセスは通常より長く、通常は臨床試験が必要である。PMAを得るプロセスは,最初の承認や510(K)の承認プロセスよりもコストや不確実性がはるかに高く,通常1年あるいはそれ以上の時間を要し,FDAに申請を提出した日から計算する.さらに、PMAは通常、1つ以上の臨床試験を行うことが要求される。時間、労力、およびコストが必要であるにもかかわらず、デバイスはFDAの承認、最初からの分類、または承認を得ない可能性がある。どんな遅延や必要な規制許可を得られなかった場合も、私たちの業務を損なう可能性がある。さらに、510(K)の許可、再分類、または承認を得ても、それらは、デバイスの市場を制限することができるデバイス用途の重大な制限を含むことができる。
アメリカでは、私たちは現在、PMA経路を通じて私たちの永久避妊制度を承認することを求めている。PMAが承認されても、私たちの将来の永久避妊システムのどのような修正も、新しいPMAまたはPMA付録を提出し、いくつかの修正は年次報告で報告するか、または30日の通知で行うことができるにもかかわらず、変更を実施する前にFDAの承認を得る必要があるかもしれません。FDAは新しいPMAまたはPMAサプリメントが必要かどうかに関する私たちの決定に同意しないかもしれない。FDAが将来の製品または既存製品の修正を私たちが予想よりも長く、より厳格なプロセスを要求する場合、製品の発売または修正は延期またはキャンセルされる可能性があり、これは私たちの業務成長能力に悪影響を及ぼす可能性がある。
FDAまたは外国規制機関は、様々な理由で、装置の上場許可を延期、制限、または拒否することができる
| • |
FDAまたは適用可能な規制エンティティまたは通知機関に、私たちの製品がその予期される用途に対して安全または有効であることを証明することができないか、または510(K)デバイスの場合、それらの
は、宣言に実質的に等しい
|
| • |
FDAまたは適用される外国の規制機関は、我々の臨床試験の設計または実施、または臨床前研究または臨床試験のデータの解釈に同意しない
|
| • |
私たちの臨床試験では参加者が経験した深刻で予期せぬ不良デバイス効果は
|
| • |
私たちの臨床前研究および臨床試験のデータは、承認、最初の分類、または必要な場合の承認を支持するのに十分ではないかもしれない
|
| • |
この装置の臨床的で他の利点がリスクよりも大きいことを証明することはできません
|
| • |
私たちが使用している製造プロセスや施設は、適用される要件に適合していない可能性があります
|
| • |
FDA或いは適用される外国の監督管理機関の審査政策或いは法規は重大な変化が発生する可能性があり、著者らの臨床データ或いは監督管理文書は
上場許可を支持するのに十分ではない。
|
49
カタログ表
さらに、FDAは、その政策を変更し、追加の法規を採用したり、既存の法規を改正したり、他の行動をとることができ、これは、私たちが将来開発している製品の承認を阻止または延期したり、最初から分類したり、承認されている製品をタイムリーに修正する能力に影響を与える可能性があります。このような政策または法規の変化は、私たちに追加の要求を加えることができ、私たちが新しい承認を得ること、最初から分類すること、または510(K)の許可を得る能力を遅らせること、またはコンプライアンスコストを増加させること、または既存の510(K)の許可を維持する能力を制限することができるかもしれない。例えば、2017年FDA再認可法案(FDARA)の一部として、国会
はFDAの様々な業績目標承諾に基づいて医療機器使用料修正案を再承認し、医療機器と雑項目改革に関するいくつかの規制改善を公布し、承認前と承認後の医療機器の監督管理をさらに明確にし、改善することを目的としている。その中のいくつかの提案と改革は、私たちに追加的な規制要求を加えることができ、私たちが新しい承認を得ること、最初から分類すること、または510(K)の許可を付与する能力を延期するか、またはコンプライアンスコストを増加させるかもしれない。
医療機器条例(EU)2017/745条例は2021年5月26日に全面的に適用され,以前に存在したEU医療機器指令(理事会指令93/42/EEC)を廃止し置換した。欧州経済圏加盟国で私たちの製品を販売するためには、私たちの製品は“医療機器条例”の基本的な要求に適合しなければならず、いくつかの過渡的な条項の制約を受け、これらの条項は、ある製品が遅くとも2024年5月までに引き続き“医療機器指令”に適合することを可能にする。これらの要求を守ることは、私たちの製品にヨーロッパ標準あるいはCEマークを貼り付けることができる前提条件であり、これらのマークがなければ、私たちの製品はヨーロッパ経済区で販売したりマーケティングすることができません。基本的な要求に適合していることを証明するためには,医療機器のタイプとその分類によって異なる適格性評価プログラムを実行しなければならない。低リスク医療機器(I類非無菌、非測定機器)以外に、メーカーはその製品がEU医療機器法規の基本要求に符合する自己評価に基づいてEC適合性声明を発表することができ、適合性評価プログラムは
EEA加盟国が認めた組織或いは通知機関の干与を必要とする。関連する適合性評価プログラムによると、通知機関は通常、我々の設備の製造、設計、最終検査の技術文書と品質体系を審査·検査する。医療機器とそのメーカーに対する合格評価プログラムの完成に成功し,基本的な要求に適合した後,機関に合格証明書を発行することを通知した。この証明書ライセンスメーカーは,関連するヨーロッパ共同体適合性宣言を準備して署名した後,その医療機器にCEマークを貼り付ける。2021年5月26日から,欧州経済区で販売されているすべての医療機器メーカーは,“医療機器条例”に規定されているルールを守らなければならない。“医療機器条例”は廃止されたEUの“医療機器指令”と同様の基本的な要求を持っているが,全体的にはより厳しく,特にリスク種別や通知機関が提供する監督の面である。さらに、警戒と発売後の監督もさらに強調された。
一般に,医療機器とそのメーカーが基本的な要求に適合していることの証明は,製品の正常使用条件下での安全性や性能を支援する臨床データの評価などに基づいていなければならない。特に、製造業者は、デバイスが通常の使用条件下でその予期される性能を達成し、その予期される性能の利点をトレードオフする際に、既知および予測可能なリスクおよび任意の不利なイベントが最小かつ許容可能であり、デバイス性能およびセキュリティに関するいかなる宣言も適切な証拠支持を有することを証明しなければならない。もし私たちが適用されたヨーロッパの法律を守り続けることができなければ、私たちの製品にCEマークを貼り続けることができなくなり、これはヨーロッパ経済区内でこれらの製品を販売することを阻止します。
すべての医療機器はイギリスやGB市場に投入される前に,MHRAに登録しなければならない。FemVueはI系デバイス、FemaSeedはIIb系デバイスで、FemBlocはIII系デバイスになると予想されています。
は2023年6月30日までヨーロッパCEフラグはGBで承認され続け、その後医療機器はGBで販売するためにUKCAフラグが必要になります。しかしながら、北アイルランド議定書によれば、EUの医療機器に対する規制枠組みは北アイルランドに引き続き適用され、北アイルランドの医療機器は欧州CE標識またはCE UKNI標識を有する可能性がある(CE UKNI標識を有する装置は北アイルランド市場でしか販売されていないにもかかわらず、
はEU市場に受け入れられない)。
一般に,医療機器とそのメーカーが基本的な要求に適合していることの証明は,製品の正常使用条件下での安全性や性能を支援する臨床データの評価などに基づいていなければならない。特に、製造業者は、デバイスが通常の使用条件下でその予期される性能を達成し、その予期される性能の利点をトレードオフする際に、既知および予測可能なリスクおよび任意の不利なイベントが最小かつ許容可能であり、デバイス性能およびセキュリティに関するいかなる宣言も適切な証拠支持を有することを証明しなければならない。もし私たちが適用されたヨーロッパの法律と指示を守り続けることができなければ、私たちは引き続き私たちの製品にCEマークを貼り付けることができなくなり、これはヨーロッパ経済区内でこれらの製品を販売することを阻止します。
50
カタログ表
私たちの製品の修正は、新しいPMA承認またはPMA補充剤の承認を得る必要があるかもしれません。必要な承認を得ることなく修正された製品を販売する場合、必要な承認が得られるまで、マーケティングの停止や修正された製品のリコールを要求される可能性があります。
PMAによって承認されたデバイスのいくつかの修正は、新しいPMAまたはPMA付録を承認する必要がある場合があり、他の修正は、年次報告で報告するか、または30日の通知によって報告することができる。FDAは新しいPMAまたはPMAサプリメントが必要かどうかに関する私たちの決定に同意しないかもしれない。私たちは将来私たちが承認したデバイスを修正するかもしれません。これらの修正は新しいPMAまたはPMA補充物を承認する必要はないと思います。FDAが私たちの決定に同意せず、以前に承認された製品を修正するために新しいPMAまたはPMA付録を提出することを要求した場合、私たちは承認されるまで、マーケティングの停止や修正された製品のリコールを要求されるかもしれません。私たちはbrの巨額の規制の罰金または処罰を受けるかもしれません。新しい分類または510(K)許可されたデバイスの場合、デバイスにおけるデバイスのセキュリティまたは有効性に著しく影響を与える可能性のある任意の変更または修正、またはデバイスの予期される用途の重大な変更または修正を理解するために、新しい510(K)販売前通知を提出する必要がある。FDAは、修正が新しい510(K)を必要とするかどうかという我々の決定に同意しない可能性があり、この場合、510(K)の許可を得るまで、修正された製品のマーケティングを停止またはリコールすることが要求される可能性がある。
さらに、FDAは、商業化に成功するために必要または所望である我々の製品の適応を承認、再分類、または承認しない可能性があり、または任意のbr}修正をサポートするための臨床試験が必要である可能性がある。必要な許可を得る上でのどんな遅延や失敗も、私たちが新製品を適時に発売したり、製品の能力を強化したりすることに悪影響を与え、これは逆に私たちの未来の成長を損なうだろう。
上場後の監督管理要求を守らないと、巨額の罰金を含む法執行行動に直面する可能性があり、市場からのリコールや市場からのリコールを要求する可能性がある。
私たちの永久避妊システムが承認された後、私たちは、デバイスの製造、マーケティング、ラベル、パッケージ、広告、医療機器報告、販売、販売促進、登録、貯蔵、流通、および発売を含む持続的かつ一般的な規制要件の制約を受けるだろう。例えば、PMA承認の条件としてFDAに定期報告を提出しなければならない。これらの報告書には、デバイス承認後のセキュリティと有効性
情報が含まれている。このような報告書を提出できなかったり、報告書をタイムリーに提出できなかったりすると、FDAが法執行行動をとることになる可能性がある。定期的な報告を検討した後、FDAは、より多くの情報を提供することを要求するか、またはさらなる調査を開始することを要求する可能性がある。
また,PMAによる我々のFemBlocシステムの承認には,上場前研究キューの上場後の後続行動の延長を含むいくつかの承認条件が必要となる可能性がある.承認条件を遵守しないいかなる行為も、PMA承認を撤回し、装置を販売し続けることができない可能性がある。これらの研究の不利な結果もPMAへの承認を撤回する理由となる可能性がある。
私たちが統制された規制は複雑で、時間が経つにつれてもっと厳しくなった。規制の変化は、予想以上のコスト、または予想される売上高を超える、業務を継続または拡大する能力が制限される可能性がある。私たちが適切な規制権限を得て設備を販売した後も、FDAの規定と適用される外国の法律法規に基づいて、私たちは持続的な責任を持っている。FDA、州、そして外国の規制機関は広範囲な法執行権力を持っている。もし私たちが適用される規制要件を守らない場合、FDA、州、または外国の規制機関が法執行行動を取る可能性があり、その中には以下の任意の制裁措置が含まれている可能性がある
| • |
無見出しの手紙や警告状
|
| • |
罰金、禁止、同意法令、民事処罰
|
| • |
私たちの製品をリコール、流通中止、行政拘留、または差し押さえます
|
| • |
お客様に通知または修理、交換、または返金;
|
| • |
生産制限、一部生産停止、全面生産停止
|
| • |
新製品、新期待用途、または既存製品の将来のPMA承認または外国規制承認の承認を遅延または拒否する要求;
|
51
カタログ表
| • |
私たちの現在のPMAや外国の規制機関の承認を撤回または一時停止し、私たちの製品の販売を禁止します
|
| • |
FDAは、他国で販売するために必要な証明書を外国政府に発行することを拒否した
|
| • |
刑事起訴する。
|
これらの制裁のいずれも、予想以上のコストまたは予想よりも低い売上をもたらし、私たちの名声、業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性がある。
私たちの製品は連邦と州の法規に従って生産しなければなりません。もし私たちがこれらの法規を守らなければ、私たちあるいは私たちのどのサプライヤーも私たちの製品をリコールしたり、生産を停止させられたりする可能性があります。
私たちの製品生産に使用する方法と施設はFDAの品質体系法規或いはQSRに適合しなければならない。これは複雑な監督管理方案であり、医療機器の設計、テスト、生産、過程制御、品質保証、ラベル、包装、運搬、貯蔵、流通、設置とサービスのプログラムと文書の良好な生産実践をカバーしている。また、私たちのサプライヤーとサービスプロバイダが維持している施設、プログラム、運営が私たちの品質基準と適用された法規要件に適合しているかどうかを検証する必要があります。FDAは、医療機器製造施設を定期的に、発表されているか、または発表されていない検査を行うことによって実行し、その中には、下請けの施設を含むことができる。私たちの製品も似たような国家法規の制約を受けています。国家卸売流通要求、外国管理製造の様々な法律と法規を含んでいます。
私たちは適用された法規を遵守するために必要な段階を取らなかったかもしれないが、これは私たちの製品の配送遅延を招くかもしれない。また,適用されたFDA要求を遵守できなかったことや,後に我々の製品や製造プロセスにbr以前に未知の問題があることが発見され,他の事項に加えて,次のようになる可能性がある
| • |
警告状や見出しのない手紙
|
| • |
罰金、禁止、民事処罰
|
| • |
承認の一時停止または撤回
|
| • |
私たちの製品を差し押さえたり呼び戻したり
|
| • |
生産停止、販売停止の全部または一部
|
| • |
行政や司法制裁
|
| • |
FDAは私たちの製品に未定または未来の承認を与えることを拒否した
|
| • |
私たちの製品の輸出入を拒否し
|
| • |
私たちや私たちの職員たちを刑事起訴します。
|
このような行動のいずれも私たちの製品供給に重大で否定的な影響を及ぼすかもしれない。もしこれらの事件のいずれかが発生すれば、私たちの名声は損なわれるかもしれません。私たちは製品責任クレームに直面するかもしれません。私たちはbr顧客を失うかもしれません。売上は減少し、コストが増加します。
永久避妊または他の女性保健治療の治療ガイドラインが変化したり、看護基準が変化したりする場合、私たちは再設計し、私たちの1つまたは複数の製品のためにFDAの新しいマーケティング許可を求める必要があるかもしれない。
永久避妊や他の女性保健治療の治療ガイドラインが変化したり、これらの疾患に対する看護基準が変化したりすれば、適用される製品を再設計し、FDAの新たな承認、承認または承認を求める必要があるかもしれない。治療ガイドラインが変化すれば、異なる治療法が望ましいようになり、私たちの1つまたは複数の製品の臨床的効用が低下する可能性があり、私たちの業務は悪影響を受ける可能性がある。
52
カタログ表
誤用やラベルの外で私たちの製品を使用することは、私たちの市場での名声を損なう可能性があり、製品責任訴訟や費用の高い調査を招く可能性があり、もし私たちがこれらの用途の普及に参加していると考えられた場合、規制当局は私たちに罰金または制裁を科し、いずれも私たちの業務に高いコストをもたらす可能性がある。
我々の製品は設備設計の特定の治療のために販売されているにもかかわらず、私たちの人員は訓練を経て私たちの製品をFDA承認または承認された適応以外の用途、いわゆる“非ラベル使用”に拡張しないが、医師がその独立した専門医学的判断に基づいて適切と判断すれば、その医師が私たちの製品を使用することを阻止することはできない。もし医者がラベルの外で私たちの製品を使用しようとすれば、患者の怪我のリスクを増加させるかもしれない。さらに、FDA承認、承認または承認または任意の外国規制機関の許可以外の適応に使用することは、このような疾患を有効に治療できない可能性があり、これは、医師および患者における私たちの市場的名声を損なう可能性がある。
FDAまたは任意の外国規制機関が、私たちの宣伝材料または訓練が非ラベル使用の宣伝を構成していると判断した場合、それは、警告状または無タイトル状、禁止、差し押さえ、民事罰金または刑事罰の発行または適用を含む、私たちの訓練または宣伝材料を修正することを要求することができます。他の連邦、州、または外国の法執行機関が私たちの業務活動がラベル外使用の普及を構成していると考えていれば、他の規制機関(例えば虚偽申告法)に基づいて行動する可能性もあり、これは刑事、民事と行政処罰、損害賠償、罰金、返還、政府医療計画から除外され、私たちの業務が削減されることを含む重大な処罰を招く可能性がある。
また、医師が十分な訓練を受けていない場合、彼らは私たちの製品を乱用したり、不適切な技術を使用したりする可能性があり、これは製品の責任を傷つけ、増加させるリスクを招く可能性がある。もし私たちの製品が誤用されたり、不適切な技術と一緒に使用されたりすれば、私たちは顧客または彼らの患者から高価な訴訟を受けるかもしれない。同様に、コストを下げるために、医師も私たちの製品を再使用するかもしれません。使い捨てであるにもかかわらず、あるいは私たちから新製品を購入するのではなく、第三者再加工者から再加工製品を購入するかもしれません。これは製品の故障や責任を招く可能性があります。上述したように、製品責任クレームは、経営陣のコア業務に対する関心を分散させ、弁護コストが高く、私たちに対する巨額の損害賠償を招く可能性があり、これらの賠償は保険カバー範囲内ではない可能性がある。
私たちの製品は不良医療事件を引き起こすか、またはFDAに報告しなければならない故障や故障を引き起こす可能性があり、そうしなければ、私たちは私たちの名声、業務、財務状況、および運営結果を損なう可能性のある制裁を受けるだろう。もし私たちの製品に深刻な安全問題があることが発見された場合、あるいはFDA
や他の政府機関の指示の下で私たちの製品をリコールすることは、私たちにマイナスの影響を与える可能性があります。
我々は、FDAの医療機器報告法規および同様の外国法規によって制約されており、これらの法規は、私たちの1つまたは複数の製品が死亡または深刻な傷害または故障を引き起こす可能性があることを受信または合理的に示す場合に、故障が再び発生すれば、死亡または深刻な傷害を引き起こす可能性が高いことをFDAに報告することを要求する。我々が報告する義務がある時間は,不良イベントの日付およびイベントの性質を知ることによってトリガされる.私たちは規定された時間範囲内で私たちが知っている有害事象を報告できないかもしれない。私たちはまた、私たちが報告可能な有害事象、特にそれが有害事象として報告されていない場合、またはそれが意外である場合、または製品を使用する時に直ちに削除された有害事象を認識していないかもしれない。もし私たちが私たちの報告義務を履行できなかった場合、FDAは警告状、無見出し手紙、行政行動、刑事起訴、民事罰金、私たちの製品を差し押さえたり、将来の製品の承認や承認を延期したりする行動をとるかもしれない。
製品の設計又は製造に重大な欠陥又は欠陥がある場合、又は製品が健康に対して許容できないリスクを構成する場合、FDA及び外国監督機関は商業化製品のリコールを要求する権利がある。FDAがリコールを要求する権力は、この装置が合理的な可能性があり、深刻な健康上の不利な結果または死亡をもたらす可能性のある調査結果に基づいていなければならない。何か重大な欠陥が発見されれば、私たちは自発的に製品をリコールすることも選択できます。健康リスクは受け入れられない、部品故障、故障、製造欠陥、ラベル或いは設計欠陥、包装欠陥或いはその他の欠陥或いは適用法規を遵守できないため、私たちは政府の強制或いは自発的なリコールが発生する可能性がある。未来には製品の欠陥や他のミスが発生するかもしれない。
製品の欠陥や欠陥を是正するための我々の是正措置によると、FDAは要求する可能性があり、あるいは私たちは、修正された設備を販売または流通することができる前に、その装置の新しい許可、許可、または承認を得る必要があると決定するかもしれない。このような許可、許可、または承認を求めることは、リコール設備をタイムリーに交換する能力を遅らせる可能性があります。さらに、私たちが私たちの設備に関連する問題を十分に解決していない場合、私たちはFDA警告状、製品差し押さえ、禁止、行政処罰、または民事または刑事罰金を含む追加の規制法執行行動に直面する可能性があります。
53
カタログ表
いくつかの自発的な現場行動はFDAと他の規制機関に報告されなければならない。会社はFDAに報告する必要がなくても、いくつかのリコールと訂正の記録を保存することを要求されている。私たちは未来にFDAに通知する必要のない製品の自発的な撤回や修正を決定することができる。もしFDAが私たちの決定に同意しなければ、それは私たちにこのような行動をリコールとして報告することを要求することができ、私たちは法執行行動の影響を受けるかもしれない。将来のリコール声明はお客様の名声を損なう可能性があり、私たちの製品責任に対するクレームを招き、私たちの販売にマイナス影響を与える可能性があります。任意の是正行動は、自発的でも非自発的でも、訴訟で自分を弁護するにも、時間と資金を投入し、経営陣の業務運営への関心を分散させ、私たちの名声や財務業績を損なう可能性があります。
もし私たちの製品が国際規制登録や承認を得て維持していなければ、北米以外の地域で私たちの製品をマーケティングして販売することができません。
私たちの製品の北米以外での販売は外国の規制要求に制約されており、これらの要求は国によって異なる。また、FDAは、米国から輸出される医療機器を規制している。一部の国の法規は、私たちの製品のマーケティングや販売に障害を設けないか、または通知のみを要求する可能性があるが、他の国の法規は、指定された規制機関の承認を得ることを要求している。登録または承認を得ることを含む外国の規制要件を遵守することは、高価で時間がかかる可能性があり、私たちが製品を販売することを計画しているすべての国/地域で規制承認を得ることができない可能性があり、あるいは私たちはこれをタイムリーに行うことができないかもしれない。
他の国/地域が要求すれば、登録またはマーケティング許可を得るのに要する時間はFDAの承認、承認または承認に要する時間よりも長くなる可能性があり、このような登録およびマーケティング許可の要求はFDAの要求と大きく異なる可能性がある。もし私たちが私たちの製品を修正すれば、修正された製品を販売することを可能にするために、追加の規制承認を申請する必要があるかもしれない。さらに、私たちは、私たちが獲得した許可を維持するために必要な品質と安全基準
を満たし続けることができないかもしれない。もし私たちが特定の国/地域で私たちの許可を維持できなければ、私たちはその国/地域で適用可能な製品を販売することができなくなるだろう。
FDAの規制許可、付与または承認または承認は、他の国/地域規制機関の登録またはマーケティング許可を保証するのではなく、1つまたは複数の外国規制機関の登録、承認または承認は、他の国/地域の規制機関またはFDAの登録またはマーケティング許可を保証しない。しかしながら、1つの国/地域で登録またはマーケティング許可を得ることができなかったか、または遅延することは、他の国/地域の規制プロセスに負の影響を与える可能性がある。
アメリカやEUの立法や規制改革は、私たちが規制許可や承認を得ることを難しくしたり、承認または承認を得た後に私たちの製品を製造、マーケティング、または流通させるかもしれません。
国会は時々立法を起草し、提出することは、医療機器の規制を管理する法定条項を著しく変える可能性がある。さらに、FDAは、FDAの法規およびガイドラインをしばしば改正または再解釈し、その方法は、私たちの業務および製品に大きな影響を与える可能性がある。任意の新しい法規、法規、または既存の法規、要件、および規制プロセスの修正または再解釈は、任意の将来の製品のコストを増加させたり、審査時間を延長したり、または、私たちの製品が承認、製造、マーケティング、または流通を得ることを困難にする可能性があります。私たちは法規、法規、法律解釈、あるいは政策の変化を確定することができず、公布、公布、採用すれば、私たちの未来の業務にどのような影響を与えるかもしれません。他の事項に加えて、このような変更は、許可、承認または承認を得る前に追加テストを行うこと、製造方法を変更すること、当社製品をリコール、交換または生産停止すること、または記録を追加的に保存することを必要とする場合がある。
2017年4月5日、欧州議会は“医療機器条例”(条例2017/745)を採択し、2021年5月26日から“EU医療機器指令”と“EU能動植え込み型医療機器指令”(第90/385/EEC指令)を廃止し、代替した。欧州経済圏加盟国の国家法律で施行されなければならない指令とは異なり、“医療機器条例”は、すべての欧州経済圏加盟国に直接適用される、すなわち、これらの指令を実施する加盟国法律によって、欧州経済圏加盟国間の現在の医療機器規制における違いを解消することを目的としている。
54
カタログ表
適用されると、医療機器規約は、他の事項に加えて、以下のことが含まれる
| • |
設備を市場に投入するルールを強化し、設備が発売された後に監視を強化する
|
| • |
市場に投入された設備の品質、性能、安全に対するメーカーの追跡責任を明確に規定する
|
| • |
唯一の識別番号によって、サプライチェーン全体における医療機器のエンドユーザまたは患者の追跡可能性を向上させる
|
| • |
患者、医療専門家、公衆にEUの既存製品に関する全面的な情報を提供する中央データベースを構築する
|
| • |
インプラントのようないくつかの高リスクデバイスの評価ルールを強化し、これらのデバイスは、市場に投入される前に専門家の追加的な検査を受ける必要がある可能性がある。
|
過渡的条項によると、2021年5月26日までに“医療機器指令”によって発行された通知機関証明書に基づく医療機器は、証明書の残存有効期間を取得するために市場に継続的に投入されることができ、遅くとも2024年5月27日まで持続可能である。すべての適用の過渡期が終了した後、“医療機器条例”によってCEマークを獲得した機器のみが欧州薬品管理局に市場に投入されることができる。“医療機器条例”に導入された新しい要求brは,我々の製品のCEマークを困難にする可能性があり,ヨーロッパ経済区での業務のあり方に影響を与える可能性がある。
私たちはいくつかの連邦、州、外国の詐欺と乱用法律、医療情報プライバシーと安全法律、透明性法律の制約を受けており、これらの法律に違反すれば、私たちは重大な処罰を受けるかもしれない。さらに、これらの法律による私たちのやり方へのどんな挑戦や調査も、否定的な宣伝を招き、高い応答コストをもたらし、私たちの業務を損なう可能性があります。
アメリカには多くの医療詐欺と乱用に関連する連邦と州と外国の法律があり、反リベート、虚偽クレームと医師透明性法律を含む。これらの法律により,我々の業務実践とサプライヤーとの関係
が審査された.私たちはまた、連邦政府および私たちが業務を展開している州と外国司法管轄区の患者、顧客、従業員、その他の第三者情報のプライバシーと安全法規に制約される可能性があります。私たちの運営能力に影響を及ぼす可能性のある医療法規は含まれていますがこれらに限定されません
| • |
連邦反リベート法規は、他の事項に加えて、個人および実体がインフォームドコンセントおよび故意の場合、直接または間接的に現金または実物の形態で報酬を請求、提供、受け入れ、または提供することを禁止し、個人を導入したり、商品またはサービスを提供したりすることを禁止し、連邦医療保健計画(例えば、連邦医療保険および医療補助)に基づいてすべてまたは一部の費用を支払うことができる。個人や実体は、法規や法規違反の具体的な意図を実際に知る必要がなく、違反を実施することができる。米国政府はこの法律をメーカーのマーケティング·販売活動に適用するために広く解釈した。また、政府は、連邦民事虚偽請求法案については、連邦反リベート法規違反による物品やサービスを含むクレームが虚偽または詐欺的クレームを構成していると主張することができる。連邦反リベート法に違反すると民事罰金を招く可能性がある。連邦虚偽申告法により、このような行為に対する民事処罰をさらに評価することができる。違反は刑事罰
を招く可能性もある。同様に、規定違反は、連邦医療保険や医療補助を含む政府医療保健計画への参加から除外される可能性がある。2020年11月20日、衛生·公衆サービス部監察長弁公室(OIG)は連邦反リベート法規の更なる改正を決定した。最終規則によれば、OIGは、臨床医、提供者、および他の人との間のいくつかの調整ケアおよび価値に基づく配置を保証するために、反バックル法規の下で安全港保護を増加させる。これらの規則(例外がある)は2021年1月19日に施行される。私たちはこのような規則が私たちの業務にどのような影響を与えるかを評価し続ける
|
55
カタログ表
| • |
個人または実体が虚偽または詐欺的な連邦医療保険、医療補助、または他の連邦医療保健計画の支払い請求を意図的に提出または提出することを禁止する連邦民事および刑事虚偽請求法および民事罰金法律を含む。これらの法律は、第三者支払者に製品保険、コード、精算情報を提供するメーカーに適用される。個人的に虚偽請求法案を提起することができるのは、政府やこのような個人を代表することができ、通称“通報者”であり、実体が政府に支払う罰金または和解金額を共有することができる
|
| • |
連邦民事通貨処罰法は、他の事項を除いて、連邦医療保健受益者への報酬の提供または移転を禁止し、もし個人が知っているか、またはそれが受益者が特定の提供者またはサプライヤーから政府が精算すべき物品またはサービスを注文または受け入れる決定に影響を与える可能性があることを知っている場合、
|
| • |
連邦反リベート法規と同様に、個人または実体は法規や法規違反の具体的な意図を実際に理解する必要がなく、
違反を実施することができる
|
| • |
ACA下の連邦医師陽光法案は、Medicare、Medicaidまたは児童健康保険計画(CHIP)によって支払われた薬品、設備、生物製品と医療用品の適用メーカーが毎年DHHS MedicareとMedicaidサービスセンター(CMS)に医師への支払いと他の方法での価値移転に関する情報を報告することを要求し、広義には他の医療保健提供者と教育病院、および適用されるメーカーと共同購入組織を含み、毎年医師およびその直系親族の所有権と投資利益を報告する。適用される
メーカーはCMSに年次報告書を提出しなければならない。必要な情報を提出していないことは、すべての支払い、価値移転または所有権または投資権益がタイムリーでなく、正確ではなく、年間提出中の完全な報告書に対する民事罰金を招く可能性があり、他の連邦法律または法規に基づいて責任を負うことにつながる可能性がある。これまでACA下の医師陽光法案に基づいて報告書を提出していませんでした
|
| • |
HITECH法案によって改正されたHIPAA及びそのそれぞれの実施条例は、個人が健康情報を識別できるサービスを提供するいくつかの保証医療サービス提供者、健康計画と医療情報交換所及びそのbr}商業パートナーに対して要求を提出し、プライバシー、安全及び適切なbr許可を受けていない個人識別可能な健康情報の伝送に関連し、強制的な契約条項及び直接適用されるプライバシーと安全基準と要求を含む。HIPAAプライバシーやセキュリティ基準を守らないと民事罰金,
を招く可能性があり,場合によっては刑事罰を受ける場合もある.州総検察長は、HIPAA違反やその州に代表される住民の法定損害賠償を禁止するために民事訴訟を提起することもできる
|
| • |
上記の連邦法律と同様の州および外国の法律、例えば、任意の第三者支払人(商業保険会社または患者を含む)が精算する物品またはサービスに適用可能な逆リベートおよび虚偽クレーム法律、例えば、機器会社に業界自発的コンプライアンスガイドラインおよび連邦政府が公布した適用コンプライアンスガイドラインまたは医療保健提供者および他の潜在的な転用源への支払いを制限することを要求する州法律;機器製造業者に、医師および他の医療提供者への価値またはマーケティング支出に関する情報の支払いおよび他の方法での移転に関する情報を報告することを要求する州法;市場活動を広く規制し、顧客の活動を損なう可能性がある消費者保護および不正競争法;場合によっては健康情報のプライバシーおよび安全を管理するEU一般データ保護条例を含む外国および州法では、多くの法律が重大な点で互いに異なり、同じ効果を持たない可能性があり、コンプライアンス努力を複雑化させる。連邦政府価格報告法は、複雑な価格指標の正確かつタイムリーな計算を要求し、政府プロジェクトに報告すること、および私営保険会社に関連するクレーム事件における保険詐欺に関する州法;および
|
56
カタログ表
| • |
カリフォルニアは最近“カリフォルニア消費者プライバシー法”(CCPA)を公布し、カリフォルニアの消費者のために新しいプライバシー権(法律で定義されているような)を創造し、消費者または家庭の個人データを処理するエンティティに対してより多くのプライバシーと安全義務を規定した。CCPAは、カバーする会社に、そのデータ収集、使用、および共有アプローチに関するいくつかの開示を消費者に提供し、影響を受けたカリフォルニア住民に、特定の個人情報販売または移転から撤退することを選択する方法を提供する。CCPAは2020年1月1日に発効し、カリフォルニア州総検察長は2020年6月2日に最終法規を提出して審査に提出し、これらの法規は最終的に決定され、現在すでに発効している。カリフォルニア州総検察長は2020年7月1日から違反者に対する法執行行動を開始した。また、カリフォルニアの有権者は2020年11月3日に新しいカリフォルニアプライバシー法“カリフォルニアプライバシー権法案”(CPRA)を可決した。CPRAは2022年1月1日から消費者データに関する義務を策定し,2023年7月1日に法執行を開始した。CPRA関連の発展に引き続き注目し、CPRAコンプライアンスに関連する追加コストと費用を予想する。バージニア州(バージニア州消費者データ保護法案、VCDPA、2023年1月1日発効)、コロラド州(コロラド州プライバシー法案、2023年7月1日発効)、ユタ州(ユタ州消費者プライバシー法案、UCPA、2023年12月31日発効)、コネチカット州(コネチカット州データプライバシー法案、CDPA、2023年7月1日発効)は、CCPAおよびCPRAと同様の法律を公布している。カリフォルニア適齢設計コード法案(CAADCA)は、2022年9月15日に法律に署名し、2024年7月1日に施行された。CPRAを子供にアクセスされる可能性のあるサイトを持つ企業に拡張した。CCPAおよびCPRAはHIPAAの下で公衆衛生施設に関連するいくつかの活動の例外を含むが、CCPA、CPRA、または他のこのような将来の法律、法規、および標準
が私たちの業務に与える可能性があることを決定することはできない。
|
他の事項に加えて、これらの法律法規は、病院、医師、または他の潜在的購入者との間で達成可能な財務的手配(販売計画を含む)を制限することによって、私たちの業務、マーケティング、および他の販売促進活動を制限します。これらの法律の広範性、利用可能な法定例外、および安全港を規制する範囲が狭いこと、およびそれらが受けている解釈範囲のため、私たちの現在または未来のいくつかの接近は、そのうちの1つまたは複数の法律の挑戦を受けるかもしれない。
調査への対応に時間と資源がかかる可能性があり、経営陣の業務への関心を分散させる可能性がある。また,これらの
調査の結果として,ヘルスケア提供者や実体は,法令や会社の誠実な合意の一部である追加のコンプライアンスや報告要求に同意しなければならない可能性がある。このような調査または和解は、私たちのコストまたはbrを増加させる可能性があります。そうでなければ、私たちのビジネスに悪影響を与えます。私たちのやり方に疑問を提起したり、調査が成功しなくても、否定的な宣伝をもたらし、対応する費用が高いかもしれない。もし私たちの運営が上記の任意の医療法律または法規または私たちに適用される任意の他の医療法規に違反していることが発見された場合、私たちは行政、民事と刑事罰、損害賠償、罰金、連邦医療保険や医療補助などの政府医療計画から除外され、監禁、契約損害、名声損害、回収、および私たちの業務を削減または再編することを含む処罰を受ける可能性があります。
米国食品薬品監督管理局、米国証券取引委員会、および他の政府機関の資金不足は、政府の閉店やこれらの機関の運営の他の中断を含み、重要な指導部や他の人員の能力を雇用·保留することを阻害し、新製品やサービスの適時な開発や商業化を阻止するか、あるいはこれらの機関が私たちの業務運営に依存する可能性のある正常な業務機能を履行することを阻止する可能性があり、これは私たちの業務に負の影響を与える可能性がある。
FDAが新製品を審査·承認する能力は、政府予算と資金レベル、肝心な人員の雇用と維持及びユーザー費用の支払いを受ける能力、及び法律、法規と政策の変化を含む様々な要素の影響を受ける可能性がある。したがって、その機関の平均検討時間は近年変動している。FDAや他の機関の中断も、新製品候補製品の審査および/または必要な政府機関による承認に要する時間を延長する可能性があり、これは私たちの業務に悪影響を及ぼすだろう。また、米国証券取引委員会や私たちの運営に依存する可能性のある他の政府機関への政府の援助は、研究や開発活動に資金を提供する機関を含め、政治プロセスの影響を受け、政治プロセス自体が不安定で予測不可能である。
57
カタログ表
FDAや他の機関の中断も、新製品候補製品が必要な政府機関によって審査および/または承認されるのに要する時間を遅らせる可能性があり、これは私たちの業務に悪影響を及ぼすだろう。例えば、過去数年間、米国政府は数回閉鎖されており、食品·医薬品局や米国証券取引委員会などのいくつかの規制機関は、食品·医薬品局、米国証券取引委員会、および他の政府の重要な従業員を休暇させ、重要な活動を停止させなければならない。br}政府が長時間閉店すれば、食品·医薬品局が私たちが提出した規制文書を適時に審査して処理する能力に深刻な影響を与える可能性があり、これは私たちの業務に実質的な悪影響を及ぼす可能性がある。また、将来的に政府の閉店は、適切な資本化と事業継続のために、私たちが公開市場に進出し、必要な資本を得る能力に影響を与える可能性がある。
私たちはアメリカ、州、外国の法律法規に支配されているか、あるいは将来的には、私たちが個人情報をどのように収集、保存、処理するかに義務を課すかもしれない。私たちは実際にこのような義務を守らないと私たちの業務を損なう可能性があると思う。これらの法律の遵守を確保することは、私たちの顧客基盤の維持と拡大の努力を損なう可能性があり、私たちの収入を減らすことができる。
業務を展開する際には,健康に関する個人データを含む個人データを扱うことが可能である.米国連邦政府と各州は、個人情報の収集、配布、使用および保存に関する法律、法規、ガイドライン、および規則を採択または提案している。私たちはまた、FDAの指導を含む医療機器のデータセキュリティに関するアメリカ連邦規則、法規、指導を受ける可能性があります。各州のプライバシーやセキュリティ法律はそれぞれ異なり、場合によっては、米国連邦法律よりも厳しい要求が加えられる可能性があります。国家法がもっと保護されているところで、私たちはもっと厳格な規定を守らなければならない。州の法律を守らない個人に罰金と罰を科すほか、一部の州では個人が個人情報を悪用する個人訴権を規定している。
EUにもEU個人から得られた個人データの収集、使用、処理に関する法律と法規があり、これらの法律と法規はしばしば米国の法律や法規よりも厳しく、いくつかの要求を満たさない限り、個人データの米国への移転を制限している。これらの義務の解釈および適用は、司法管轄区域によって一致しない可能性があり、他のbr要求または私たちのやり方と衝突する可能性がある。しかも、このような規則も継続的に検討されている。例えば、2015年10月のEU裁判所の判決によると、個人データを米国安全港計画のメンバーと認証された米国会社に移し、無効と発表された。2016年7月、欧州委員会は安全港計画に代わる米国·EUプライバシーシールド枠組みを採択した。しかし、この枠組みは検討中であり、現在、EUの他の適切なデータ伝送メカニズム(すなわち標準契約条項)に疑問を提起する訴訟がある。“プライバシー保護の枠組み”および/または標準契約条項が同様に欧州裁判所によって無効に発表されるかどうかはまだ定かではない。私たちは様々なメカニズムに依存して個人データを私たちのEU業務からアメリカに移し、将来の欧州規制機関がEU“一般データ保護条例”(GDPR)によってこれらの移転メカニズムを審査する法律の変化の影響を受ける可能性があり、これらのメカニズムが現在欧州裁判所で直面している挑戦を受ける可能性がある。
私たちまたは私たちと協力している第三者が、実際にまたはプライバシーやセキュリティ法律、政策、法律義務または業界基準を遵守できていないと考えられているか、または個人識別情報の不正配布または移転を招くいかなるセキュリティ事件も、欧州データ保護機関およびアメリカ連邦および州規制機関の調査、br}罰金および処罰、消費者権益提唱団体を含む政府の法執行行動および調査を引き起こす可能性があり、私たちの顧客、彼らの患者、および他の医療保健専門家が私たちへの信頼を失うことになる可能性があります。これは私たちの名声を損なう可能性があり、私たちの業務、財務状況、そして運営結果に実質的な悪影響を及ぼすかもしれない。
EUの法律は改革されており、2018年5月25日から、EU内の個人データを処理し、および/またはEU内のbr個人に商品を提供したり、その行動を監視したりするため、GDPRの要求を遵守する。GDPRは,個人データの制御者や処理者に対してより厳しい管理要求を実施しており,たとえば,データ漏洩通知のタイムリミットの短縮,保持
情報の制限,健康データや仮名(すなわち鍵コード)データに関する要求を増加させ,サービスプロバイダと契約を締結する際に義務を増加させ,個人にその個人データに対してより強い権利を与える.GDPRは、EU加盟国が遺伝子、生体認証、または健康データの処理を制限するために独自のさらなる法律法規を制定することができ、これは私たちが個人データを使用して共有する能力を制限するか、または私たちのコストを増加させ、私たちの業務や財務状況を損なう可能性がある。もし私たちがGDPR規定の義務を履行しなければ、私たちは高い金額を基準として、20,000,000ユーロまたは前会計年度の世界年商4%までの巨額の罰金に直面する可能性がある。
58
カタログ表
医療政策の変化は,最近公布された米国の医療システムを改革する立法を含めて,我々の業務,財務状況,運営結果を損なう可能性がある。
アメリカでは、医療費用を統制するための多くの立法計画が続いているだろう。2010年3月,米国はACAを公布し,政府や民間保険会社が医療に資金を提供する方法を多くの実質的に変化させた。それが私たちの業務に影響を与える可能性がある他の方法では、ACA:
| • |
米国で販売されている医療機器を製造または輸入する任意のエンティティに2.3%の年間消費税が課されるが、支払いの実際の税率がより低い可能性があるにもかかわらず、限られた例外(以下、より詳細に説明する)。一連の立法改正により、2016年から2019年までこの税金の徴収を一時停止した。これ以上の立法行動がない場合,医療機器販売は2020年1月1日から機器消費税の徴収を再開する。2019年12月20日に法律となった“さらなる総合支出法案”(2020 H.R.1865(Pub.L.116-94))に署名し、これまで米国国内収入法4191条から徴収されていた医療機器消費税を廃止した。廃止される前に、その税金は4年間徴収を停止した。廃止とこれまでの一時停止により,2015年12月31日以降に販売された課税医療機器は納税する必要がない。未来に類似した税種を発行できるかどうかは決定できない;
|
| • |
患者を中心とした新しい結果研究所を設立し、臨床治療効果研究の優先順位を監督と確定し、このような研究の協調と発展に努力した
|
| • |
国家支払いバンドル試験計画を実施し、病院、医師、その他の提供者がバンドル支払いモードを通じてある医療サービスの協調性、質と効率を改善することを奨励する支払い制度改革を実施する
|
| • |
医療補助計画の資格基準を拡大した。
|
私たちはACAが私たちの業務にどのくらい影響を及ぼすかまだ分からない。ACAが徴収する税収や政府の米国医療業界における役割の拡大は,我々の利益減少を招く可能性があり,我々の永久避妊システムや女性専用医療機器の支払人精算が減少し,および/または医療プログラム量が減少し,これらすべてが我々の業務,財務状況,運営結果に実質的な悪影響を及ぼす可能性がある。ACAのいくつかの条項はまだ完全に施行されておらず、いくつかの条項は司法と国会の挑戦を受けている。議会はACAの全部または一部を廃止または廃止し、代替する立法を考慮した。国会はまだ全面的な廃止立法を通過していないが、ACAの次の特定の税収実施に影響を与える2つの法案が署名されて法律となっている。2017年の減税および雇用法案、または税法案は、ACAが1年の全部または一部で合格医療保険を維持できなかったある個人に対する税金ベースの分担責任を支払う条項
を含み、一般に“個人強制要件”と呼ばれ、2019年1月1日から0ドルに低下する。2018年12月14日、テキサス州の連邦地域裁判所は、個人強制令はACAの重要かつ不可分な特徴であるため、税法の一部として廃止されたため、ACAの残りの条項も無効であると判断した。2019年12月18日、米国第五巡回控訴裁判所は、個人権限が違憲であると判断し、この事件を下級裁判所に返送し、早い時期に全面ACA無効を宣言した問題を再検討した。2020年3月2日、米最高裁はこの事件の審査を求める移審令の要望書を承認し、2020年11月10日に口頭弁論を行った。バイデン政府は個人権限に対する政府の合憲性とこの条項とACAの残りの分割可能性の立場を再考し、これで米国最高裁に正式に通知し、裁決を待つ前にACAは有効であるが、これらの事態の発展がACAの地位にどのような影響を与えるかは不明である。
59
カタログ表
また、2017年1月20日、トランプ前総裁は、ACAに基づいて権力と責任を持つ連邦機関がACAの実施を放棄、延期、免除または延期することが各州に財政負担をもたらすか、あるいは個人、ヘルスケア提供者、健康保険会社または薬品または医療機器メーカーにコスト、費用、税金、罰金または規制負担をもたらす条項を指示する行政命令に署名した。2017年10月13日、トランプ前総裁は、ACAによる保険会社への費用分担補助を終了する行政命令に署名した。トランプ政権の結論は、ACAが保険会社に支払うコスト分担削減(CSR)が国会から必要な支出を受けていないことを要求し、これらの支払いを直ちに停止すると発表した。いくつかの州の検事総長は政府による補助金の中止を阻止するよう提訴したが、彼らの制限令請求は2017年10月25日にカリフォルニア州の連邦裁判官によって却下された。2020年8月14日、米国連邦巡回控訴裁判所は2つの異なる事件の中で、連邦政府はこれまで数年(2017年を含む)の未払いCSRに対して全額責任を負っていると判断した。健康保険会社が2018年以降に提出したCSRクレームについては,さらなる訴訟が必要であり,満期額(あれば)を決定する必要がある。また、2018年6月14日、米国連邦巡回控訴裁判所は、連邦政府は第三者支払者に120億ドルを超えるACAリスク回廊に支払う必要がないと判断し、これらの第三者支払者はこれらの支払いが彼らに不足していると弁明した。2020年4月27日、米国最高裁判所は米国連邦巡回控訴裁判所の裁決を覆し、事件を米国連邦クレーム裁判所に送り、関連式によると、政府はこれらのリスク回廊支払いを支払う義務があると結論した。このような判決が私たちの業務にどのような影響を与えるのかまだ分からない。また,CMSは2020年から個人や小団体市場の保険会社に基準を設定する上で各州により大きな柔軟性を与える最終規則を発表しており,このような市場で販売されている保険計画に求められる基本的な健康福祉をACAが緩和する可能性がある。
また,“平価医療法”が公布されて以来,他の立法改正が提案され,採択された。2011年8月2日、“2011年予算制御法案”が法律に署名され、他の事項を除いて、2013年4月1日から会計年度ごとに医療サービス提供者に支払われる医療保険金額が2%減少し、国会がさらに行動しない限り、その後の立法改正により2030年まで有効となる。2013年1月2日,2012年に米国納税者救済法が法律に署名し,病院を含む複数の医療サービス提供者に支払う医療保険を減少させ,政府が提供者に多額の金を取り戻す訴訟時効期間を3年から5年に延長した。2015年4月16日に公布された“2015年連邦医療保険アクセスとチップ再認可法案”(MACRA)は連邦医療保険が医師に対する年間支払い調整の公式を廃止し、固定的な年間更新と2019年に開始予定の新しい奨励支払いシステムで以前の式
を代替し、このシステムは各種の業績測定基準と医師の責任看護組織などの代替支払いモードへの参加に基づいている。新しい品質と支払い計画(Macraのような)が私たちの業務、財務状況、運営結果、あるいはキャッシュフローにどのような影響を与える可能性があるかは不明です。
私たちは将来的により多くの州と連邦医療政策と改革措置を取ることが予想され、そのいずれも医療製品やサービスの精算を制限するか、あるいは他の方法で私たちFemBlocシステムへの需要減少や追加的な価格設定圧力を招き、私たちの業界全体と私たちの顧客に実質的な悪影響を及ぼす可能性がある。将来の保証範囲や精算料率のいかなる変化や不確実性も、私たちのFemBlocシステムの需要に影響を与える可能性があり、さらに、私たちのFemBlocシステムを商業化する能力に影響を与える可能性があり、私たちの業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性があります。
私たちの業務は危険材料の使用に関連しており、私たちは環境法律と法規を守らなければならない。これは高価かもしれないし、私たちの業務方式を制限しているかもしれない。
私たちの製造業者活動は危険材料の制御された貯蔵、使用と処置に関連し、連邦、州、地方、外国の法律法規の制約を受け、これらの法律法規はこれらの危険材料の使用、生成、製造、保存、処理、処置に関するものである。私たちは現在、危険材料の使用に関する環境クレームを専門的に引き受けていない。これらの材料や廃棄物を処理·処分する安全手順は,これらの法律法規で規定されている基準に適合していると信じているが,危険材料の使用,貯蔵,処理または処分による意外な傷害や汚染のリスクを除去することはできない。事故が発生した場合、州、連邦、または他の適用機関は、これらの材料の使用を制限し、私たちの業務運営を中断する可能性があり、これは私たちの業務に悪影響を及ぼす可能性があります。
60
カタログ表
我々は、米国の“海外腐敗防止法”や、輸出規制法、税関法、制裁法、その他、我々の業務を管理する法律を含む、反賄賂、反腐敗、反マネーロンダリング法を遵守しなければならない。もし私たちがこれらの法律を守らなければ、私たちは民事または刑事処罰、他の救済措置、法的費用を受ける可能性があり、これは私たちの業務、運営結果、財務状況に悪影響を及ぼすかもしれない。
私たちが国際的な存在と世界的な業務を拡大するにつれて、私たちはますますアメリカ、EU、他の政府と組織から加えられた貿易と経済制裁、その他の制限を受けるだろう。米国司法省、商務省、国務院、財務省、その他の連邦機関や当局は、経済制裁法、輸出規制法、米国“反海外腐敗法”(FCPA)および他の連邦法規(外国資産制御弁公室(OFAC)が制定した法律や法規を含む会社や個人に広範な民事·刑事罰を加えることを求める可能性がある。また、イギリスの2010年反賄賂法は、国内と国際賄賂、そして民間および公共部門の賄賂を禁止している。組織が“組織に関連した誰の賄賂行為も阻止できない”場合、組織が賄賂防止の“適切な手続き”が実施されていることを証明できない限り、“反賄賂法”に基づいて告発することができる。これらの法律と法規、その他の反腐敗法、反マネーロンダリング法、輸出規制法、税関法、規制法、その他の私たちの業務を管理する法律によると、各政府機関は輸出許可証を必要とする可能性があり、制裁を受けた国や制裁された個人や実体との業務活動の停止、コンプライアンス計画の修正など、業務慣行の修正を求めることができ、コンプライアンスコストを増加させ、罰金、処罰、その他の制裁を受けることができるかもしれない。これらの法律や法規に違反すると、私たちの業務、財務状況、経営結果にマイナスの影響を与えます。
私たちは、私たちと私たちの役員、官僚、従業員、代表、コンサルタント、代理人が“海外腐敗防止法”、“海外腐敗防止法”、“反賄賂法”および他の輸出規制、反腐敗、反マネーロンダリング、テロ対策法律法規を遵守することを確保するための政策と手続きを実施した。しかし、私たちの政策と手続きが十分であるか、あるいは取締役、上級管理者、従業員、代表、コンサルタント、代理がなくても、私たちが責任を負う可能性のある行為に従事しないことを保証することはできません。私たちの業務パートナーがいないし、彼らが私たちの契約義務を履行する能力に大きな影響を与える可能性のある行為にも従事しないことは、私たちがこのような行為に対して責任を負うことを保証することもできません。“海外腐敗防止法”、“海外腐敗防止法”、“贈収賄法”または他の輸出規制、反腐敗、反マネーロンダリング、反テロの法律または法規に違反することは、厳しい刑事または民事制裁を招く可能性があり、他の責任を負う可能性もあり、これは私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
私たちは製品保証クレームのリスクを負います。
私たちは製品保証クレームのリスクを負います。もしお客様が保証クレームをすることに成功した場合、あるいはそのサプライヤーあるいはサプライヤーからいかなる賠償を受けることができれば十分で、私たちのサプライヤーあるいはサプライヤーが私たちに提供してくれたいかなる保証或いは賠償クレームに成功できないかもしれません。また、このようなサプライヤーに相応の保証クレームを提出する能力が満期になった後、私たちのお客様はサードパーティコンポーネントに関連する保証クレームを提出する可能性があり、これはコストをもたらす可能性があります。
知的財産権に関するリスク
もし私たちが私たちの知的財産権を十分に保護できない場合、あるいは私たちが他人の知的財産権を侵害すると告発された場合、私たちの競争地位が損なわれる可能性があり、あるいは私たちは私たちの権利を強制または擁護するために巨額の費用を支払うことを要求されるかもしれない。
私たちのビジネスの成功は、私たちが米国や他の場所で許可された特許、商標、および他の知的財産権を取得し、維持することができるかどうかにある程度依存し、私たちの独自技術を保護するだろう。もし私たちが私たちの知的財産権とノウハウを十分に保護していなければ、競争相手は私たちの技術や私たちが市場で獲得した名声を使用して、私たちのbrが持つ可能性のあるいかなる競争優位性を侵食または否定することができ、これは私たちの業務と利益を達成する能力を損なう可能性がある。
著者らは子宮内人工授精製品、永久性避妊システム、女性専用医療製品解決策に関するすでに発表され、申請されている特許を大量に持っている。2023年12月31日現在、我々は48件の米国特許と132件の外国特許、14件の米国特許出願、25件の外国特許出願を持っている。これらの発行された特許およびこのような出願から付与された任意の特許は、潜在的な特許期間の延長または調整は考慮されていない2024年から2046年の間に期限切れになると予想される。
61
カタログ表
私たちのいかなる特許もすでに、または私たちの任意の未解決特許出願が発行された特許として成熟していることを保証することはできません。私たちの子宮内人工授精製品、永久避妊システム、および女性専用医療製品解決策を保護するのに十分な範囲の権利要件、および私たちの製品のために開発された任意の追加機能を含むことになります。他の当事者は、我々の子宮内人工授精製品、永久避妊システム、および女性専用医療製品解決策に関連するか、または競争力を有する技術を開発している可能性があり、彼らは、特許出願を提出したか、または可能性があり、同じ方法または装置を要求するか、または要求によって私たちの特許地位を支配する可能性のある主題によって、私たちの特許出願と重複または衝突する特許を受けている可能性がある。医療機器会社の特許地位は,我々の特許地位を含み,複雑な法律や事実問題に関与している可能性があるため,我々が入手可能な任意の特許請求の範囲,有効性,および実行可能性は確定的に予測できない。特許が発行されると、疑問視され、実行不可能とみなされ、無効が宣言され、または回避される可能性がある。我々の特許に挑戦する訴訟は、特許の損失または特許出願の拒絶、または特許または特許出願の1つまたは複数の特許請求の範囲の損失または範囲を縮小させる可能性がある。しかも、そのような訴訟手続きは費用が高いかもしれない。したがって、私たちが持っている可能性のあるどんな特許も競争相手に対する保護を提供することができない。また、介入手続きにおける不利な決定は、第三者が我々が求める特許権を取得することを招く可能性があり、逆に製品を商業化する能力に影響を与える可能性がある。
発行された特許は、有効かつ強制的に実行可能と推定されているが、その発行は、その有効性または実行可能性を決定することができず、類似した製品を有する競合相手に対抗するために十分な独自保護または競争優位
を提供することができない可能性がある。競争相手は私たちの子宮内人工授精製品、永久避妊システムと女性専用医療製品の解決策を購入し、私たちの開発努力から得られた競争優位性の一部或いは全部を複製し、故意に私たちの知的財産権を侵害し、私たちの特許をめぐって設計を行い、あるいはより効果的な技術、設計或いは方法の開発と特許保護を獲得しようとしているかもしれない。私たちはコンサルタント、サプライヤー、サプライヤー、元従業員、および現在の従業員が私たちの技術知識または商業機密を不正に開示または使用することを阻止できないかもしれない。一部の国の法律はアメリカの法律のように私たちのbrに対する所有権を保護していません。私たちはこれらの国で私たちの所有権を保護することは重大な問題に直面するかもしれません。
私たちが特許権を行使する能力は私たちが侵害行為を検出する能力にかかっている。その製品で使用されているコンポーネントを宣伝しない侵害者を検出することは困難である可能性がある.さらに、競争相手または潜在的な競争相手の製品侵害の証拠を得ることは困難または不可能である可能性がある。私たちは私たちが起こしたどんな訴訟でも勝てないかもしれないし、もし私たちが勝てば、得られた損害賠償や他の救済措置は商業的な意味がないかもしれない。
さらに、私たちの特許を強制的に実行または保護する手続きは、私たちの特許を無効、実行不可能、または狭い解釈に直面させる危険性があるかもしれない。このような訴訟はまた、私たちの1つまたは複数の特許の一部または全部のクレームが無効であるか、または強制的に実行できないことを含む、第3の方針が私たちにクレームを提起する可能性がある。もし私たちがFemBlocシステムまたはFemaSeed製品に関連する任意の特許が失効したり、強制執行できない場合、または裁判所が第三者が持っている効果的で強制的に執行可能な特許が私たちの1つまたは複数の製品をカバーしていることを発見した場合、私たちの競争地位が損なわれる可能性があり、または私たちは私たちの権利を強制的に執行または擁護するために巨額の費用を支払う必要があるかもしれない。
未来の私たちの所有権の保護の程度は不確定で、私たちは保証できない
| • |
私たちの任意の特許、または私たちの任意の係属中の特許出願は、発行された場合、私たちを保護するのに十分な範囲のFemBlocシステムおよびFemaSeed製品を有する権利要件を含むだろう
|
| • |
私たちの任意の未解決特許出願は特許として発行されるだろう
|
| • |
承認されれば、関連特許が満期になる前に、私たちの製品を大規模に商業化することに成功するだろう
|
| • |
私たちはすべての特許と出願されている特許をカバーする最初の発明です
|
| • |
私たちはこれらの発明の最初の特許申請者です
|
| • |
他の会社は私たちの特許を侵害しない類似または代替技術を開発しない;私たちのどの特許も最終的に有効で強制的に実行可能であることが発見されるだろう
|
62
カタログ表
| • |
私たちに与えられたいかなる特許も、私たちの商業的に実行可能な製品に独占市場の基礎を提供し、いかなる競争優位性を提供してくれるか、あるいは第三者の挑戦を受けないだろう
|
| • |
私たちは、単独で特許を出願できる他の独自技術または製品を開発する;または
|
| • |
私たちの商業活動や製品は他人の特許を侵害しないだろう。
|
私たちはある程度特許を取得していない商業秘密、特許を取得していない技術ノウハウと持続的な技術革新に依存して、私たちの競争地位を発展させ、維持し、従業員とコンサルタントと秘密保持協定を締結することによって、私たちの競争地位を部分的に保護することを求めている。私たちはまた、従業員やコンサルタントと契約を結び、彼らの発明を私たちに譲渡し、私たちのいくつか(ではありません)のコンサルタントとeスポーツ禁止協定を締結する義務があることを規定しました。我々の業務に関連する可能性のある技術は、このような合意締約国ではない者によって独立して開発されるであろう。さらに、これらの合意当事者である従業員やコンサルタントがこれらのbr協定の条項に違反したり、違反したりする場合、私たちは、そのような違反や違反に対して十分な救済措置をとることができず、そのような違反または違反によって私たちの商業機密を失う可能性があります。また,我々のビジネス秘密は我々の
競争相手に知られたり独立したりする可能性がある.
特許保護の獲得と維持は、政府特許機関によって提出された様々なプログラム、書類提出、費用支払い、および他の要求を遵守することに依存し、これらの要件に適合しない場合、私たちの特許保護は減少またはキャンセルされる可能性がある。
特許及び出願の有効期限内に、米国特許商標局(USPTO)及び米国以外の各種政府特許機関に定期維持費、継続費、年会費、その他の各種特許及び出願に関する各種政府費用をいくつかの段階で支払う必要がある。米国特許商標局および各種非政府特許機関は、特許出願中および特許発行後に、いくつかのプログラム、文書、費用支払い、および他の同様の条項を遵守することを要求する。場合によっては、規定を遵守しないことは、特許または特許出願の放棄または失効をもたらす可能性があり、それにより、関連する管轄区域の特許権の部分的な喪失または完全な喪失をもたらす可能性がある。私たちのいくつかの許可条項によると、私たちは製品の組み合わせにおける特許を維持または起訴する能力がないので、これらの
要求を遵守するために第三者に依存しなければならない。
知的財産権侵害の訴訟や他の訴訟や第三者クレームには、多くの時間とお金がかかる可能性があり、私たちの製品の開発や販売を阻止したり、私たちの株価に影響を与えたりすることができます。
私たちの商業的成功は特許を侵害しないか、他人の他の固有の権利を侵害しないかにある程度依存するだろう。私たちの産業では、特許権に関する重大な訴訟が発生している。私たちはアメリカと海外の競争相手で、その多くはより大きな資源を持っていて、特許の組み合わせと競争技術に大量の投資を行って、彼らはすでに申請したり獲得したり、あるいは将来的に特許を申請して獲得する可能性があり、これらの特許は私たちの製品の製造、使用、販売の能力を阻止、制限、または他の方法で妨害するだろう。私たちはいつも第三者に発行された特許を独立して検討しているわけではない。さらに、米国および他の場所の特許出願は、発行される前に何年も待つことができるか、または意図せずに放棄した特許または出願を回復することができる可能性があり、したがって、これらの出願を待っているか、または最近回復している他の特許の出願が存在する可能性がある。これらの出願は、後に発行された特許、または以前に放棄された特許の復興をもたらす可能性があり、これは、私たちの製品を製造、使用、または販売する能力を阻止、制限、または他の方法で妨害するであろう。将来、第三者は、関連する製品収入がなく、私たち自身の特許の組み合わせが彼らに抑止力がない可能性がある競争相手または非執行実体からのクレームを含む、許可されていない場合に彼らのノウハウを使用していると主張するかもしれない。私たちが現在または更新された形で私たちの製品を商業化し、新製品を発売して新市場に進出し続けるにつれて、競争相手は私たちの1つ以上の製品が彼らの知的財産権を侵害していると主張するかもしれません。これは、私たちの商業化と新市場への進出を阻害するためのビジネス戦略の一部です。特許数が多く,新特許出願や発行速度が速く,関連する技術が複雑であり,訴訟の不確実性
が企業資源や管理層の関心を特許訴訟に移行するリスクを増加させる可能性がある。私たちは将来的に第三者からの手紙や他の脅威やクレームを受け取り、私たちに彼らの特許下の許可を得るように招待したり、私たちが彼らの特許を侵害したと主張したりする可能性がある。
63
カタログ表
さらに、私たちは将来私たちの特許の組み合わせや第三者特許に関する対抗性訴訟の側になるかもしれない。このような訴訟は、再審、再審、双方間の再審、米国特許商標局の干渉または派生訴訟、および米国地域裁判所における挑戦のような補充審査または係争のある認可後訴訟
を含むことができる。特許は,様々な外国,国,地域特許庁で反対,認可後審査または同様の訴訟を受ける可能性がある。訴訟や論争のある訴訟手続きの法的敷居が低い可能性があるため,勝訴確率の低い訴訟や訴訟手続であっても提起される可能性がある.訴訟と論争のある訴訟手続きはまた高価で時間がかかるかもしれないが、私たちのこのような訴訟手続きの中の相手は私たちよりも多くの資源を投入してこのような法的行動を起訴する能力があるかもしれない。我々
は,これらの訴訟手続きを利用して他者の特許権に挑戦することも可能である.第三者が問われている特許権を制限または除去する上で、どの特定の挑戦も成功するとは判断できません。
このような告発によって引き起こされたどんな訴訟も、私たちに重大な損害賠償責任を負わせ、私たちの所有権を無効にする可能性がある。任意の潜在的な知的財産権訴訟はまた、以下の1つまたは複数の操作を実行させる可能性がある
| • |
呼ばれる知的財産権侵害の疑いのある製品または技術の製造、販売または使用を停止すること
|
| • |
私たちの技術的許可を他人に与える機会を失ったり、私たちの知的財産権の成功した保護と主張に基づいて他人に使用料を受け取る機会を失う
|
| • |
知的財産権の侵害が発覚した可能性のある側に巨額の損害賠償や使用料を支払う
|
| • |
知的財産権侵害を発見された可能性のある方に弁護士費と訴訟費用を支払います
|
| • |
知的財産権侵害の疑いのある製品を再設計することは、費用が高く、破壊的で不可能である可能性がある
|
| • |
第三者から関連する知的財産権のライセンスを取得しようとすると、これらのライセンスは、合理的な条項または全く得られない可能性があり、または第三者から彼らが持っていない権利を取得しようと試みる可能性がある。
|
私たちに対する訴訟やクレームは、法的根拠のない訴訟やクレームであっても、巨額のコストを発生させる可能性があり、私たちの財務資源に大きな圧力を与え、経営陣のコア業務に対する注意を移し、私たちの名声を損なう可能性があります。もし私たちが第三者の知的財産権を侵害していることが発見された場合、私たちは巨額の損害賠償金(最高賠償金の3倍まで増加できる)および/または巨額の印税の支払いを要求される可能性があり、ライセンスを取得したり、権利侵害を回避するために私たちの製品を再設計することができない限り、私たちの製品の販売を禁止される可能性があります。このような許可は合理的な条項で提供されないかもしれませんし、他人の知的財産権を侵害しないように私たちの製品を再設計できる保証もありません。私たちが代替方法や製品を開発しようとする時、私たちは製品発売の遅延に遭遇するかもしれない。もし私たちが必要なライセンスを取得できなかった場合、あるいは私たちの製品や技術を必要な変更をすることができなかった場合、私たちは既存の製品を市場から撤退しなければならないかもしれないし、私たちの1つ以上の製品を商業化できないかもしれない。
また、もし私たちの製品が第三者の独占権を侵害した場合、私たちは一般的に私たちの顧客を賠償します。第三者は私たちの顧客に侵害請求をするかもしれない。これらのクレームは、これらのクレームの是非にかかわらず、私たちの顧客を代表して、長引く費用の高い訴訟を開始または弁護することを要求するかもしれない。これらのクレームのいずれかが成功または和解に達した場合、私たちは私たちの顧客に代わって損害賠償または和解金を支払うことを余儀なくされるか、または彼らが使用する製品の許可証を取得することを要求される可能性がある。もし私たちが商業的に合理的な条項ですべての必要な許可を得ることができなければ、私たちの顧客は私たちの製品の使用を停止させることを余儀なくされるかもしれない。
第三者は私たちが開発した発明の所有権または商業権を主張するかもしれない。
第三者は未来に私たちの知的財産権の発明権や所有権に疑問を提起するかもしれない。私たちは、従業員、請負業者、またはコンサルタントとの合意が無効になったり、以前または競争していた譲渡契約義務と衝突したりする第三者のクレームに直面する可能性があり、彼らは私たちに知的財産権を譲渡する義務があり、これは、私たちが開発した知的財産権に関する所有権紛争を引き起こしたり、このような知的財産権の商業的価値を取得する能力を開発して妨害したりする可能性がある。所有権紛争の解決には訴訟が必要かもしれません。もし私たちが成功しなければ、私たちは特定の知的財産権
の使用を禁止されるかもしれません。またはその知的財産権上の私たちの固有の権利を失う可能性があります。どんな結果も私たちの業務と競争の地位を損なう可能性がある。もし私たちが私たちの商業秘密の機密性を保護できなければ、私たちの業務と競争地位は損なわれるかもしれない。
64
カタログ表
特許保護に加えて、私たちは、私たちの機密および独自の情報を保護するために、著作権および商業秘密保護、および従業員、コンサルタント、および第三者と締結された秘密協定および発明譲渡協定に依存しています。契約措置に加えて、私たちは公認された物理的および技術的セキュリティ措置を使用して、私たちの固有の情報の機密性を保護しようと努力している。例えば、許可されたアクセス権限を有する従業員または第三者が商業秘密を盗用する場合、このような措置は、私たちの独自の情報を十分に保護することができない可能性がある。私たちの安全対策は、従業員やbrコンサルタントが私たちのビジネス秘密を盗用して競争相手に提供することを阻止できないかもしれませんが、私たちがこのような不正行為に対する追跡権は、私たちの利益を十分に保護するための十分な救済措置を提供できないかもしれません。許可されていない当事者たちはまた、複製または逆工程を試みる可能性があり、私たちは独自の製品のいくつかの態様であると考えられる。実行側が商業秘密を不正に漏洩したり流用したりする疑惑は困難で、高価で時間がかかる可能性があり、結果は予測できない。一般的に受け入れられている安全措置を使っても、商業秘密違反は国家の法律問題であり、司法管轄区域によって商業秘密を保護する基準が異なる可能性がある。また,ビジネス秘密は他の人が我々の法的追跡を阻止するように
独立して開発される可能性がある.もし私たちの任意の機密または独自の情報(例えば、私たちの商業秘密)が漏洩または流用された場合、またはそのような情報が競争相手によって独立して開発された場合、私たちの業務および競争地位は損なわれる可能性がある。
私たちは世界各地で私たちの知的財産権を強制的に施行できないかもしれない。
いくつかの外国の法律は知的財産権の保護の程度はアメリカの法律に及ばない。ある外国司法管轄区では、多くの会社が知的財産権の保護と保護に深刻な問題に直面している。これは私たちの外国特許の侵害や、私たちの他の知的財産権の流用を阻止することを難しくするかもしれない。例えば、一部の外国には強制許可法があり、これらの法律によると、特許権者は第三者に許可を付与しなければならない。さらに、一部の国は、政府機関または政府請負業者を含む特許の第三者への実行可能性を制限している。このような国では、特許は限られた利点を提供するかもしれないし、利益さえないかもしれない。特許保護は最終的には国ごとに求めなければならないが,これは高価で時間のかかるプロセスであり,結果は不確定である。したがって、私たちは特定の国で特許保護を求めないことを選択することができ、私たちはこれらの国で特許保護のメリットを享受することもできない。
外国の管轄区域で私たちの特許権を強制執行する訴訟は巨額のコストを招く可能性があり、私たちの努力と注意を私たちの業務の他の側面から移すことができます。したがって、このような国で私たちの知的財産権を保護するための私たちの努力は十分ではないかもしれない。さらに、米国や他の国·地域の法律·裁判所の法的裁決の変化は、私たちの技術と私たちの知的財産権の法執行のために十分に保護される能力に影響を与える可能性がある。
第三者は、我々の従業員やコンサルタントが機密情報を誤って使用または漏洩したり、商業秘密を流用したりしたと主張する可能性がある。
私たちは以前他社と協力した人を、私たちの競争相手や潜在的な競争相手を含めて雇用した。私たちの従業員およびコンサルタントが、私たちのために働いているときに他人の固有情報またはノウハウを使用しないことを保証するために努力しているにもかかわらず、私たちまたは私たちの従業員、コンサルタントまたは独立請負業者が、商業秘密
または他の固有情報を含む前の雇用主または他の第三者の知的財産権または個人データを意図的にまたは他の方法で使用または漏洩しているというクレームを受ける可能性がある。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。もし私たちがこのようなクレームを弁護したり、これらのクレームを解決できなかったら、金銭損害賠償や和解支払いに加えて、貴重な知的財産権や人員を失う可能性があります。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣や他の従業員の注意を分散させる可能性がある。
65
カタログ表
米国特許法の最近の変化は、特許の全体的な価値を低下させる可能性があり、特許を取得、保護、および/または実行する能力を制限する可能性がある。
最近の特許改革立法は、私たちの特許出願をめぐる起訴や、私たちが発行した特許の実行または保護をめぐる不確実性とコストを増加させる可能性があります。“Leahy-Smith America発明法”または“Leahy-Smith Act”は、米国特許法に複数の重大な修正を加えた。このような条項は特許出願起訴方式に影響を与える条項を含み、特許訴訟にも影響を与える。米国特許商標局は最近、Leahy-Smith法案の管理や、Leahy-Smith法案に関連する特許法の多くの実質的な改正、特に最初の提出条項の条項を管理するための新しい法規および手続きを制定し、2013年3月16日に発効した。第1の出願の条項は、発明者が発明特許を出願する権利を制限し、発明特許出願を最初に提出した者でなければ、このような発明が第1の発明であってもよい。したがって,Leahy-Smith法案が我々の業務運営にどのような影響を与えるかは不明である(もしあれば).
しかしながら、ライシー·スミス法案およびその実施は、我々が発行する特許の実行および保護をめぐる不確実性およびコストを増加させる可能性がある。例えば、ライシー·スミス法案は、特許裁判及び控訴委員会(PTAB)という行政裁判所が特許の有効性を疑問視する場を提供し、費用が地域裁判所訴訟よりもはるかに低く、時間もはるかに速いと規定されている。PTAB訴訟手続きが我々の業務運営にどのような長期的な影響を与えるかは不明であるが(あれば),PTABが2013年の設立以来提起されてきた特許挑戦訴訟の初歩的な結果は,多くの米国
特許主張を無効にしている。PTABは、コストが低く、速度が速く、より強力である可能性のある特許挑戦法廷として、私たち自身の特許が挑戦される可能性を増加させ、それによって、これらの特許の維持および実行の不確実性およびコスト
を増加させる可能性がある。
特許条項は製品に対する私たちの競争地位を十分な時間で保護するのに十分ではないかもしれない。
新製品候補製品の開発、テスト、規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化後間もなく満了する可能性がある。私たちは米国で特許期間の延長を求める予定であり,もしあれば,特許を提訴した他の国/地域でも延長を求める予定である。米国では、1984年の“医薬品価格競争および特許期限回復法”は、特許期限が特許正常満了後に最大5年間延長されることを可能にしているが、承認された適応(または延長期間中に承認された任意の他の適応)に限定されている。しかし、米国FDAとUSPTOを含む適用当局および他の国/地域の任意の同等の規制機関は、このような延期が利用可能かどうかの評価に同意しない可能性があり、私たちの特許延期の承認を拒否するか、または私たちが要求したよりも限られたbr}延期を承認する可能性があるかもしれない。
もし私たちの商標や商号が規制機関によって拒否されたり、十分に保護されていなければ、私たちは関心のある市場で知名度を作ることができないかもしれません。私たちの業務は悪影響を受ける可能性があります。
私たちは私たちの商標と商品名に依存して、私たちの製品を競争相手の製品と区別し、その中の多くの商標を登録または登録申請しました。私たちは私たちの商標申請がタイムリーまたは完全に承認されるということをあなたに保証できません。商標登録過程で、私たちは米国特許商標局の私たちの商標登録に対する反対行動を受けるかもしれない。私たちはこのような異議に答える機会があるにもかかわらず、私たちはこのような異議を克服できないかもしれない。私たちの登録または未登録商標または商号は、他の規制機関によって拒否される可能性があり、疑問、侵害、回避、または汎用商標として発表されるか、または他の商標
を侵害していると判断される可能性がある。これらの商標や商品名を使用したり、これらの商標や商品名に対する私たちの権利を保護することはできないかもしれませんが、これらの商標と商品名は、私たちが関心のある市場で潜在的なパートナーや顧客の知名度を確立するために必要です。長期的には、私たちの商標や商品名に基づいてブランド認知度を作ることができなければ、効果的に競争できない可能性があり、私たちの業務は悪影響を受ける可能性があります。他のエンティティが異なるbr管轄区で私たちの商標と類似した商標を使用したり、私たちの商標に対して優先的な権利を持っている場合、世界各地で私たちの現在の商標を使用することを妨害する可能性があります。もし私たちが代替商標の使用を要求されたら、私たちがこれらの商標のために確立したいかなる商標権と承認も失われるだろう。もしどちらかが私たちが依存している任意の商標を侵害した場合、これらの商標を強制的に実行することは困難で、高価で、時間がかかる可能性があり、最終的には成功しないだろう。
66
カタログ表
私たちの普通株に関するリスクは
私たちは“小さな報告会社”と“新興成長型会社”であり、“より小さい報告会社”に適した情報開示要求の低下は、私たちの普通株の投資家に対する魅力を低下させる可能性がある。
“雇用法案”の定義によると、私たちは“新興成長型会社”です。(I)財政年度の最終日まで(A)IPO完了5周年後、(B)私たちの年間総収入が少なくとも10.7億ドル、または(C)大型加速申請者とみなされるまで、新興成長型会社であり続ける。これは、私たちが最近完成した第2四半期まで、私たちの非関連会社が持っている普通株の時価が7.0億ドルを超え、(Ii)私たちは前3年の間に10億ドルを超える転換不可能債券を発行したことを意味する。
新興成長型会社は特定の低減報告要求や他の一般的に上場企業の負担に適用される可能性がある。これらの規定には
| • |
2年間の監査された財務諸表と2年間の関連経営陣の財務状況と経営成果の検討と分析しか提出できない
|
| • |
サバンズ·オキシリー法第404条の監査役認証要件の遵守が要求されていない
|
| • |
上場企業会計監督委員会が採択した強制監査会社のローテーションに関するいかなる新しい要求も免除する
|
| • |
私たちの定期報告書、依頼書、登録声明では、役員報酬に関する開示義務を減らすことができます
|
| • |
役員報酬に対する拘束力のない諮問投票の要求と、株主の承認を得る前に承認されなかった金パラシュート支払いの要求を免除する。
|
私たちはいくつかの減少した開示義務を利用することを選択し、将来的に他の減少した報告要件を利用することを選択するかもしれない。したがって、私たちが私たちの投資家に提供する情報は、あなたが株式を持っている非新興成長型会社の他の公開報告会社から受け取った情報とは異なる可能性があります。雇用法案では、新興成長型企業は、これらの基準が民間企業に適用されるまで、上場企業に適用される新しい会計基準または改正された会計基準を遵守することができる延長された過渡期を利用することができる。私たちは延長された過渡期を利用しないことを選択したが、これは私たちが新しい基準を発表したり改訂したりする時に新しい基準を採用することを意味する。
私たちも“小さな報告会社”であり、これは、非関連会社が保有する私たちの株の時価が7.0億ドル未満であることを意味し、最近終了した会計年度において、私たちの年収が1.00億ドル未満であるか、または私たちの株が非関連会社が保有する時価が2.5億ドル未満であることを意味する。もし私たちが新興成長型会社でなくなったときに小さな報告会社であれば、私たちはより小さな報告会社が得ることができる免除された特定の開示要求に依存し続けるかもしれない。具体的には、小さな報告会社として、最近の2つの会計年度の監査済み財務諸表のみを我々の年次報告書に表示することを選択し、役員報酬に関する開示義務を削減し、また、新興成長型企業と同様に、年収が1億ドル未満の小さな報告会社であれば、br証明報告書を得る必要はないであろう。
私たちの定款やデラウェア州法律の反買収条項は、私たちの買収をより困難にする可能性があり、これは私たちの株主に有利になる可能性があり、私たちの株主が現在の経営陣を交換または更迭しようとすることを阻止するかもしれない。
当社の登録証明書の改訂及び再記載並びに私たちの改正及び再記述の定款における条項は、私たちの買収又は私たちの経営陣の変動を延期または阻止することができます。また、これらの規定は、株主が私たちの取締役会のメンバーを交換しにくくし、brを挫折させたり、株主が現在の経営陣を交換または更迭しようとすることを阻止したりする可能性がある。私たちの取締役会は私たちの管理チームのメンバーに責任があるため、これらの規定は逆に私たちの株主が私たちの管理チームの既存のメンバーを交換するいかなる試みにも影響を与える可能性があります。これらの規定には
| • |
株主が書面の同意の下で行動することを禁止する
|
| • |
選挙は取締役会に入り、株主総会で行動可能な事項の事前通知要求を提出する
|
67
カタログ表
| • |
取締役は“理由がある”場合にのみ免職されることを要求する
|
| • |
取締役会だけが取締役数を変更し、取締役会の空きを埋める要求を変えることができる
|
| • |
私たちの取締役会を3つのレベルに分け、各レベルが3年間交互に在任している
|
| • |
取締役会は取締役会が決定した条項に従って優先株を発行する権利がある。
|
また、私たちはデラウェア州に登録して設立されたので、改正された“デラウェア州会社法”第203条の条項によって管轄されています。この条項は、規定された方法で合併または合併が承認されない限り、私たちが発行した議決権を有する株の15%以上を保有する人が取引日後3年以内に私たちと合併または合併しないことを禁止しています。提案された合併や買収が一部の株主によって有益であると考えられても、これらの規定は適用されるだろう。
上場企業として、私たちは大きなコストを発生させ、これは私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性があります。
米国証券取引委員会がサバンズ-オキシック法案、2010年ドッド·フランクウォールストリート改革、消費者保護法案、取引所法案、ナスダック規則に基づいて制定された規則や条例を含む、わが上場企業に適用されるコーポレートガバナンス要件に関するコストが発生します。これらの規則と法規は私たちの会計、法律と財務コンプライアンスコストを著しく増加させ、いくつかの活動をもっと時間をかけた。これらの規則は私たちが役員と上級管理職責任保険を維持するコストをもっと高くする。したがって、私たちは合格者を引き付けて維持することがもっと難しいかもしれないし、私たちの取締役会に参加したり、幹部になったりすることはもっと難しいかもしれない。そのため、上場企業として生じるコスト増加は、私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性があります。
私たちは財務報告書を作成し、適切かつ効果的な内部統制を維持する義務があり、これらの内部統制を維持できなかった十分性は、投資家がわが社の自信に悪影響を与え、私たちの普通株の価値に影響を与える可能性がある。
上場企業の要求に応えるために、新たな内部統制やプログラムを実施し、新たな会計や内部監査者を招聘するなど、様々な行動をとっている。“サバンズ-オキシリー法”(Sarbanes-Oxley Act)は、財務報告書に対して効率的な開示制御と手続きおよび内部統制を維持することを要求する。我々は、我々が米国証券取引委員会に提出された報告で開示を要求した情報が、米国証券取引委員会規則および表に指定された期間内に記録、処理、まとめ、報告されることを保証し、取引所法案に基づいて報告書に開示された情報が蓄積され、私たちの主要幹部および財務官に伝達されることを確実にするために、私たちの開示制御および他の手続きを継続して改善している。私たちの現在の統制と私たちが開発したどんな新しい統制も不十分になる可能性があり、将来的には財務報告書の内部統制に弱点があることが発見されるかもしれない。この要求の制約を受けた場合、有効な制御措置を策定または維持できなければ、定期管理評価の結果や、財務報告の内部統制の有効性に関する年間独立公認会計士事務所認証報告に負の影響を与える可能性があり、私たちの定期報告には、サバンズ·オクスリ法案第404条に基づいて米国証券取引委員会に提出される報告を含め、私たちの経営業績を損ない、報告義務を履行できなかったり、前財務諸表を再報告したりする必要があるかもしれない。もし私たちが“サバンズ-オキシリー法案”を遵守していることを証明できなければ、財務報告書の内部統制が不十分だと思われたり、財務諸表をタイムリーにあるいは正確に作成できない場合、投資家は私たちの経営業績に自信を失うかもしれません。私たちの普通株価格は下落するかもしれません。しかも、もし私たちがこのような要求を満たし続けることができなければ、私たちはナスダックで上場し続けることができないかもしれない。
私たちの開示統制と手続きはすべてのミスや詐欺を阻止したり検出できないかもしれない。
私たちは“取引所法案”の定期報告書の要求事項を守らなければならない。我々の開示制御および手続きは、取引所法案に基づいて提出または提出された報告書に開示された情報が蓄積されて管理層に伝達され、米国証券取引委員会の規則および表に指定された期間内に記録、処理、まとめ、報告されなければならない合理的な保証を提供するために設計されている。いかなる開示制御やプログラムも,その発想や操作がどんなに綿密であっても,絶対的な保証ではなく合理的な保証しか提供できず,制御システムの目標が実現されることを確保していると考えられる.
68
カタログ表
これらの固有の限界は,意思決定過程における判断が誤りである可能性があり,簡単な誤りや誤りによって故障が発生する可能性があるという現実を含む.さらに、ある人の個人的な行動、2つ以上の個人が結託しているか、または許可されていないカバー制御は、制御を回避することができる。したがって,我々の制御システム固有の制約により,誤りや詐欺による誤り陳述が発生し,検出できない可能性がある.
我々の会社登録証明書の改正と再記述は、デラウェア州衡平裁判所は、私たちと私たちの株主とのほとんどの紛争の独占法廷となり、これは、私たちの株主が有利な司法法廷を得ることを制限することができ、私たちまたは私たちの役員、上級管理者、または従業員との紛争を処理する能力を制限することができる。
(I)私たちのbrを代表して提起された任意の派生訴訟または訴訟、(Ii)私たちの任意の取締役、上級管理職、従業員または代理人が私たちまたは私たちの株主に提出した受託責任または他の不正行為に違反する訴訟に関連する、我々の会社登録証明書の規定を改正し、再記述する。(Iii)または当社が改訂および再記載された会社登録証明書または改正および再記載された法律の任意の条文に基づいて生成された任意の訴訟、または(Iv)内務原則またはデラウェアフォーラム条文によって管轄されている申索を主張する任意の訴訟。デラウェアフォーラム条項は、証券法または取引法に基づいて提起されたいかなる訴訟にも適用されない。私たちの改正と再記述の定款は、私たちが書面で代替裁判所を選択することに同意しない限り、米国デラウェア州地域裁判所は、会社がデラウェア州に登録されて設立されたので、証券法または連邦裁判所条項に基づいて提起された任意の訴えを解決する唯一のおよび独占的なフォーラムとなるだろう。また、私たちが改正して再記載した定款は、私たちの株式株式の権益を購入または他の方法で獲得した個人または実体は、デラウェアフォーラム条項と連邦フォーラム条項を通知し、同意したとみなされるだろう;しかし、株主ができなければ、米国連邦証券法およびその規則および法規の遵守を放棄したとみなされないだろう。
デラウェア州フォーラム条項と連邦フォーラム条項は、デラウェア州の法律適用の一貫性を高め、会社の紛争解決に特に経験のある総理によって、他のフォーラムに比べて、より速いスケジュールで効率的に事件を管理し、複数のフォーラム訴訟の負担から私たちを保護するために、私たちに利益をもたらしてくれると信じています。しかし、この規定は、株主が私たちまたは私たちの役員、上級管理者、または他の従業員と紛争することに有利だと思うクレームを司法裁判所に提出する能力を制限する可能性があり、これは、私たちと私たちの役員、高級管理者、他の従業員に対するこのような訴訟を阻止する可能性があり、br}株主がこのようなクレームを求める際の訴訟費用を増加させる可能性もある。また、デラウェア州最高裁判所は2020年3月に、デラウェア州法律によると、証券法に基づいて請求を要求する連邦裁判所選択条項は表面的に有効であると判断したが、他の裁判所が我々の連邦フォーラム条項を実行するかどうかには不確実性がある。連邦フォーラム条項が実行不可能であることが発見された場合、私たちはこのような問題の解決に関連した追加費用を発生させる可能性があります。連邦フォーラム条項はまた、その条項が実行不可能または無効であると主張する株主に追加の訴訟費用を受け取るかもしれません。デラウェア州衡平裁判所および米国デラウェア州地域裁判所もまた、訴訟の株主がいる可能性があるか、または訴訟を提起する裁判所を選択することを含む、他の裁判所とは異なる判決または結果を下す可能性があり、このような判決は、私たちの株主よりも有利または不利である可能性がある。
私たちは予測可能な未来に私たちの株に現金配当金を支払わないと予想されているので、資本増加(あれば)があなたの唯一の収益源になるだろう。
私たちは私たちの株の現金配当金を発表したり支払ったりしたことがない。私たちは現在、私たちの未来のすべての収益を維持するつもりで、もしあれば、私たちの業務の成長と発展に資金を提供します。したがって、予測可能な未来に、私たちの普通株の資本増加(あれば)があなたの唯一の収益源になるだろう。
69
カタログ表
一般リスク因子
金融サービス業の不利な発展に影響を与えることは、私たちの現在および予想されている業務運営および私たちの財務状況および運営結果に悪影響を及ぼす可能性がある。
金融機関の不利な事態の発展に影響を与え、例えば噂や実際に発生した流動性に関連した事件は、過去及び未来に銀行倒産や市場全体の流動性問題を招く可能性がある。例えば、2023年3月10日、私たちはほとんどの現金と現金等価物を持っているシリコンバレー銀行(SVB)がカリフォルニア金融保護·革新部によって閉鎖され、連邦預金保険会社(FDIC)を係に任命した。同様に,2023年3月12日にSignature BankとSilvergate Capital Corp.がそれぞれ破産管理プログラムに置かれた.財務省、FRB、FDICは、SVBのすべての預金者が、1つの仕事を閉鎖した後に、未加入預金口座に保有されている資金を含む、彼らのすべての資金を使用できることを示す声明を発表した。2023年3月13日まで、私たちは私たちがSVBで持っているすべての資金を使用することができる。米国財務省、連邦預金保険会社、および連邦準備委員会は、金融機関が保有するいくつかのこのような政府証券によって保証された金融機関に250億ドルまでの融資を提供し、このようなツールの売却による潜在的損失のリスクを低減し、金融機関の顧客引き出しの広範な需要、または金融機関の即時流動性の他の需要がこのような計画の能力を超えている可能性がある計画を発表した。しかし、米国財務省、連邦預金保険会社、連邦準備委員会が将来、他の銀行や金融機関が倒産した場合に未保険資金を提供するか、またはタイムリーにそうする保証はない。
より広範な金融サービス業の流動性に対する懸念は依然として不確実性があり、私たちの業務、私たちの業務パートナー、または業界全体は現在予測できない負の影響を受ける可能性がある。
私たちの銀行関係を必要または適切に評価する必要があると思いますが、私たちが獲得した現金の額は、私たちの現在と予想される将来の業務に資金や資本化を提供するのに十分であり、私たちと銀行関係にある金融機関に影響を与え、さらに私たち自身に影響を与える要素は、私たちが現金を得る機会を深刻に弱める可能性があります。これらの要因は、流動性制限または失敗、様々な金融、信用または流動性合意または手配に従って義務を履行する能力、金融サービス業または金融市場の中断または不安定、または金融サービス業会社の将来性に対する懸念または否定的な予想を含むことができる。これらの要素はまた、金融市場や一般金融サービス業に関連する要素を含む可能性がある。上述した1つまたは複数のbr要因に関連するイベントまたは懸念の結果は、私たちの現在および予想されるビジネス運営、ならびに私たちの財務状況および運営結果に生じる様々な重大かつ不利な影響を含む可能性がある。これらは、預金または他の金融資産または預金または他の金融資産の取得を遅延させる未保険損失、または現金管理スケジュールの終了および/または現金管理スケジュールによって制限される資金の取得または実際の損失の遅延を含むことができるが、これらに限定されない。
さらに、米国または国際金融システムに対する投資家の一般的な懸念は、より高い金利またはコスト、より厳しい財務および運営契約、または信用および流動性源の獲得に対する系統的な制限を含む、あまり有利ではない商業融資条項を招く可能性があり、それによって、私たちはより受け入れ可能な条項が融資を獲得することを困難にし、さらには融資を得ることができない。利用可能な資金または現金および流動資金資源の任意の減少は、他のリスクに加えて、運営費用、財務的義務、または他の義務を履行する私たちの能力に悪影響を及ぼす可能性があり、私たちの財務および/または契約義務の違反、または連邦または州賃金および労働法違反を招く可能性がある。上記のいずれかの影響、または上記要因または他の関連または同様の要因に起因する任意の他の影響は、我々の流動資金、私たちの現在および/または予想される業務運営、ならびに財務状態および運営結果に重大な悪影響を及ぼす可能性がある。
さらに、キープロバイダーまたはビジネスパートナーは、上記の要因のいずれかの流動性または他のリスクの悪影響を受ける可能性があり、さらに、現在および/または予想される業務運営および運営結果および財務状態に重大な悪影響を及ぼす可能性がある。いかなる業務パートナー又はサプライヤーが破産したか、又は債務を相殺しない、又は業務パートナー又はサプライヤーの任意の違約又は違約、又は任意の重要な業務パートナー又はサプライヤー関係を失うことは、私たちの現在及び/又は予想される業務運営及び財務状況に重大な悪影響を及ぼす可能性がある。
70
カタログ表
不利なグローバル経済状況は、私たちの業務、財務状況、または経営結果に悪影響を及ぼす可能性がある。
私たちの経営業績は世界経済と世界金融市場の全体的な状況の悪影響を受ける可能性があります。世界の経済·商業活動は引き続き広範な不確定性に直面しており、世界の信用·金融市場は過去数年間、流動性と信用供給の深刻な減少、インフレと通貨供給の転換、金利上昇、労働力不足、消費者自信の低下、経済成長の鈍化、失業率の上昇、景気後退リスク、および経済·地政学的安定の不確実性を含む極端な変動と中断を経験している。世界金融危機のような深刻または長期的な経済低迷は、我々の製品に対する需要の減弱や、必要に応じて許容可能な条件で追加資本を調達する能力(あれば)を含む様々なリスクを私たちの業務にもたらす可能性がある。サプライチェーン中断は私たちの供給者のタイムラインを延長し、コストを増加させました。上記のいずれの状況の発生、加速、または激怒は私たちの業務を損なう可能性があり、経済環境や金融市場の状況が私たちの業務に悪影響を及ぼす可能性のあるすべての方法を予見することはできません。
我々の内部コンピュータシステム、または任意のCRO、製造業者、他の請負業者、コンサルタント、既存または将来のパートナーのコンピュータシステムは、追加のコスト、重大な責任、私たちの名声を損なう、または私たちの運営に実質的な中断をもたらす可能性がある、またはセキュリティまたはデータの侵害または他の許可されていないまたは不正な方法でアクセス、使用、または破壊される可能性があります。
セキュリティ対策が実施されているにもかかわらず、我々の内部コンピュータシステムおよび現在および任意の未来のCRO、他の請負者、コンサルタント、潜在的な将来の協力者および他の第三者サービスプロバイダのシステムは、ネットワークセキュリティ攻撃、侵入、故意または意外なエラーまたはエラー、人工知能を使用した攻撃または他の技術障害を含む様々な方法の破壊を受けやすい。その中には、盗難または推定された第三者証拠アクセスシステムの使用、サービス拒否攻撃、ネットワークフィッシング試行、サービス中断、自然災害、火災、テロを含むコンピュータウイルス、不正アクセス試行が含まれる可能性がある。戦争、電気通信、電力故障。ネットワーク脅威構造の変化に伴い、これらの攻撃の頻度、複雑性、強度は増加しており、検出が難しくなってきている。このような事件が発生し、我々の運営を中断させたり、個人識別情報や個人識別情報の健康情報(HIPAA、またはHITECH法案、CCPA、GDPRなどの特定のプライバシー法に違反している)を取得またはアクセスさせたりする場合、候補製品開発計画および私たちの業務運営を実質的に中断させる可能性があり、重大な責任を招く可能性があります。連邦、州、および外国政府のいくつかの要求は、br社が、私たちまたは私たちのサプライヤーまたは請負業者が経験した脆弱性による可能性がある特定の個人識別情報に関連するセキュリティホールを個人に通知する義務があることを含む。セキュリティホールに関する通知および後続操作は、私たちの名声に影響を与える可能性があり、法的費用および修復費用を含む巨額のコストを発生させる可能性があります。例えば、私たちの候補製品の完了、進行中、または未来の臨床試験に関する臨床試験データの損失は、私たちの規制承認作業を遅延させ、失われたデータを回復または複製するコストを著しく増加させる可能性がある。
もしどんな中断やセキュリティホールが私たちのデータを紛失したり破損したり、あるいは機密または独自の情報を適切に開示しない場合、私たちは訴訟や政府調査に直面する可能性があり、私たちの候補製品のさらなる開発と商業化は延期される可能性があり、私たちは特定の州、連邦、または国際プライバシーとセキュリティ法律に違反することで巨額の罰金または処罰を受ける可能性がある。
私たちの保険証書は、このような中断、故障、またはセキュリティホールによって生じる私たちの潜在的な損失を補償するのに十分ではないかもしれません。しかも、私たちは将来的に経済的に合理的な条項でこのような保険を得ることができないかもしれないし、そのような保険を得ることができないかもしれない。さらに、私たちの保険には、私たちに対するすべてのクレームが含まれていない可能性があり、どんな場合でも高い免責額がある可能性があり、訴訟を弁護することは、その是非にかかわらず、費用が高く、経営陣の注意を分散させる可能性がある。
私たちが提供する市場機会推定と市場成長予測は不正確であることが証明される可能性があり、たとえ私たちが競争する市場が予測されたbrの成長を実現しても、私たちの業務は似たような速度で増加せず、さらには成長しないかもしれない。
我々が提供する市場機会推定と成長予測は、重大な不確実性の影響を受け、不正確であることが証明される可能性のある仮説と推定に基づいている。私たちの目標市場の規模と予想成長に関する推定と予測は不正確であることが証明されるかもしれない。私たちが競争する市場が規模推定と成長予測に達しても、私たちの業務は似たような速度で成長しないかもしれないし、全くそうではないかもしれない。我々の成長は,我々が我々の業務戦略を成功的に実施できるかどうかを含む多くのbr要因の影響を受けており,この戦略は多くのリスクと不確実性の影響を受けている.
71
カタログ表
当社の従業員、独立請負業者、コンサルタント、ビジネスパートナー、協力者およびサプライヤーは、規制基準および要件を遵守しないことを含む、不適切な行為または他の不適切な活動に従事する可能性があります。
私たちは、従業員、独立請負業者、コンサルタント、ビジネスパートナー、協力者、サービスプロバイダ、サプライヤーが従業員詐欺や他の不正活動を行うリスクに直面しています。これらの当事者の不正行為には、故意、無謀、および/または不注意な行為が含まれている可能性があり、FDAおよび他の同様の外国規制機関の法律を遵守せず、FDAおよび他の類似外国規制機関に真実、完全かつ正確な情報を提供し、私たちが制定した製造基準を遵守し、米国の医療詐欺および乱用法律および同様の外国詐欺不正行為法律を遵守し、または財務情報またはデータを正確に報告したり、許可されていない活動を開示したりする。私たちが私たちの製品を商業化し始めるにつれて、アメリカでFDAの候補製品の承認を得たら、私たちのこのような法律の下での潜在的なリスクは著しく増加し、私たちはこのような法律を遵守することに関連するコストも増加するだろう。これらの法律は私たちの現在の主要な研究者と患者の活動、提案と未来の販売、マーケティングと教育計画に影響を与える可能性がある。私たちは商業行為と道徳的規範を持っていて、訓練計画を維持しているが、私たちの従業員、独立請負業者、コンサルタント、商業パートナー、サプライヤーの不当な行為を常に識別し、阻止することができるわけではなく、私たちがこのような活動を発見し、防止するための予防措置は、未知または未管理のリスクや損失を効果的にコントロールできないか、あるいはこれらの法律や法規を遵守できないことによる政府の調査または他の行動や訴訟から私たちを保護することができない可能性がある。もし私たちにどんな訴訟を起こしても、私たちは私たちの権利を弁護したり、維持することに成功しなかった場合、これらの行動は、民事、刑事と行政処罰、損害賠償、罰金、br}監禁、返還、政府医療計画への参加から除外される可能性があり、追加の報告義務および監督をもたらす可能性がある(もし私たちが会社の誠実な合意または他の合意の制約を受けた場合、これらの法律違反に関する告発、契約損害、名声損害、利益減少および将来の収益、および私たちの業務の削減を解決する)。
私たちの普通株の活発な取引市場は持続できないかもしれない。
私たちはあなたに私たちの普通株の活発な取引市場が続くということを保証できません。活発な取引市場の不足はあなたの株式価値とご希望の時間に株を売却する能力を損なう可能性があります
不活発な取引市場はまた、普通株式の売却による資金調達、戦略的パートナーシップの構築、または当社の普通株式を対価格として他の相補的製品、技術または業務を買収する能力を弱める可能性があります。しかも、私たちがナスダックの持続的な上場基準を満たし続けるという保証はない。もし私たちが継続上場の基準を達成できなかったら、私たちはカードを取られるかもしれません。これは私たちの普通株の価格にマイナスの影響を与えます。
私たちは私たちの普通株の価格が大幅に変動すると予想する。
私たちの普通株の市場価格はずっと大きく変動して、多くの要素によって大幅に変動するかもしれません。その中のいくつかの要素は私たちがコントロールできないことです
| • |
規制当局が私たちのFemBlocシステムを承認または承認しないことを発表するか、またはFDAが将来私たちの製品を強化するための任意の承認または許可を承認または拒否することを決定しました
|
| • |
我々のFemBlocシステムの臨床試験は不良結果や遅延が見られた
|
| • |
私たちのFemBlocシステムを使用することに関する意外なセキュリティ問題
|
| • |
FDAまたは私たちの産業に影響を与える米国または外国の規制または法的行動または変化;
|
| • |
私たちは規制許可や承認をタイムリーに開発し、新しい強化された医療製品をマーケティングすることができます
|
| • |
自発的または強制的な製品のリコール
|
| • |
私たちのサプライヤーや任意の未来の戦略的パートナーシップに関する不利な事態の発展
|
| • |
私たちの製品の販売量と販売時間
|
| • |
新製品や製品の改善は私たちまたは業界の他の人によって発売されます
|
72
カタログ表
| • |
私たちや他人の知的財産権に関する紛争や他の事態の発展
|
| • |
製品責任クレームや他の訴訟
|
| • |
私たちの経営業績や当社の他の会社の業績の四半期変化
|
| • |
メディアは私たちの製品や業界の他の会社の製品を暴露します
|
| • |
政府の規則や精算の変化
|
| • |
証券アナリストの利益予想や提案を変えること
|
| • |
将来の収入および営業利益または損失推定または指導を満たす能力を含む財務推定または指導の変化
|
| • |
私たちが発表した財務報告、他の公開公告、および米国証券取引委員会に提出された文書に対する大衆の反応
|
| • |
取締役、上級管理職、または大株主が私たちの株を大量に売却するか、またはそのような売却が発生する可能性が予想される
|
| • |
投資家は私たちに相当する他社の経営業績と株式業績および株式市場全体の業績を考えている
|
| • |
キーパーソンの増減
|
| • |
将来の証券発行や債務の発生のような資本構造の変化
|
| • |
一般市場状況やその他の要因には、我々の経営表現や競争相手の経営表現とは無関係な要素が含まれている
|
| • |
“リスク要因”の節で述べた他の要因。
|
近年、株式市場は一般的に極端な価格と出来高変動を経験しており、これらの変動は往々にしてこれらの会社の経営業績に関係なく、あるいは比例しない。私たちの実際の経営業績にかかわらず、広い市場と業界要素は私たちの普通株の市場価格に大きな影響を与える可能性がある。
また、過去には、証券に対して市場価格変動時期を経験した会社に対して、集団訴訟が提起されることが多い。私たちの株価変動後、私たちの証券訴訟に対しては、このような訴訟の利点や最終結果にかかわらず、巨額のコストを招く可能性があり、これは私たちの財務状況や経営業績を損ない、経営陣の注意と資源を私たちの業務から移行させることになります。
証券アナリストは、私たちの業務に有利な研究や報告を継続しないかもしれないし、何の情報も発表しないかもしれません。これは、私たちの株価や取引量の低下を招く可能性があります。
取引市場は、業界や金融アナリストが発表した私たちと私たちの業務に関する研究や報告書の影響をある程度受けるだろう。私たちはこのようなアナリストを統制することができない。私たちの研究カバー範囲は一致しない可能性があり、より規模が大きく、より成熟した上場企業のように強くない可能性があり、また、私たちが商業化運営を構築し始めるにつれて、アナリストは私たちの結果を正確に予測できず、私たちは彼らの見積もりを達成できない可能性が高いかもしれない。私たちのアナリストを追跡して不正確または不利な研究を提供したり、私たちの株価に否定的な意見を発表したりすれば、私たちの株価は下落する可能性がある。もしこれらのアナリストのうちの1人以上が私たちの報告を停止したり、私たちに関する報告書を定期的に発表できなかった場合、私たちは市場で可視性を失い、ひいては私たちの株価や取引量を低下させ、あなたが私たちへの投資損失の全部または一部を招く可能性があります。
| 項目1 B。 |
未解決の従業員のコメント。
|
ない。
|
プロジェクト1 C。
|
ネットワーク·セキュリティ
|
リスク管理と戦略
私たちは、私たちが直面している潜在的なサイバーセキュリティ脅威に適していると考え、政策、プログラム、標準に基づいて、これらの政策、プログラム、標準が訓練と教育の支援を受けているネットワークセキュリティ計画を採用しました。私たちの情報システムは、異なる第三者からのローカルとクラウドストレージと回復サービスを使用しています。私たちは第三者のコンサルタントを招いて脅威情報とネットワークリスクの傾向を評価し、収集し、私たちのネットワークセキュリティプログラムと保護の評価とテストを行います。
経営陣と取締役会のガバナンスと役割
私たちの最高経営責任者は、私たちのネットワークセキュリティ計画を指導し、サイバーセキュリティ事件について会社の首席財務官に報告します。私たちの首席財務官は取締役会と監査委員会に直接報告し、監査委員会はネットワークセキュリティリスクを含む取締役会リスク管理監督を担当する主要な委員会です。最高財務責任者は、四半期ごとに取締役会および監査委員会に、私たちのネットワークセキュリティ計画の有効性を簡単に紹介します。これまで、私たちの業務に実質的な影響を与えるサイバーセキュリティの脅威や事件には遭遇していません。
73
カタログ表
| 第二項です。 |
財産です。
|
私たちはジョージア州スヴァニでの施設を借りました。私たちの研究開発、制御環境の部屋とオフィス空間と一緒に、現在の総面積は約41,000平方フィートです。2023年12月31日まで、毎月支払うレンタル料は47,029ドルで、年ごとに増加する可能性があります。私たちのレンタル契約は2029年4月に満期になります。ある条項とbr条件によって、私たちはレンタル期間を5年間連続的に延長することを選択することができます。
| 第三項です。 |
法律訴訟。
|
ありません
| 第四項です。 |
炭鉱の安全情報開示。
|
適用されない
第II部
| 五番目です。 |
登録者普通株、関連株主事項及び発行者が株式証券を購入する市場。
|
普通株市場
市場情報
私たちの普通株はナスダック資本市場に上場しています。株式コードはFMYです。
2024年3月20日、私たちの普通株式の登録保有者は142人だった。この数字には、“著名人”や“街頭”名義で株を持っている株主は含まれていない。
私たちは私たちの普通株の現金配当金を発表したり、支払ったりしていないし、予測可能な未来にもいかなる現金配当金も発表したり支払わないだろう。私たちは現在、私たちの業務の持続的な発展のために、未来の収益(あれば)を残したいと思っています。
我々の譲渡エージェントと登録者はBroadbridge Investor Communications Solutions,Inc.である.
最近売られている未登録証券
ない。
株式報酬計画情報
表格10-K第5項に要求される株式報酬計画に関する情報は、本年度報告表格10-K第3部第11項を参照することにより本報告に組み込まれる。
74
カタログ表
発行者および関連購入者が株式証券を購入する
ない。
| 第六項です。 |
[保留されている]
|
適用されない
| 第七項。 |
経営陣の財務状況と経営結果の検討と分析。
|
著者らはリードする生物医学会社であり、全世界の女性がまだ満足していない重大な需要を満たすことに集中し、広範な勤務、獲得と革新可能な治療と診断解決方案の組み合わせを持っており、リードする革命性候補製品とFDAが許可した製品を含む。私たちの使命は女性に優れた低侵襲、非手術製品技術を提供することであり、
はオフィスで得ることができ、患者の看護と全体の医療経済を改善し、不妊問題解決策(FemaSeedとFemVue)あるいは永久避妊(FemBloc)を求める人に生殖健康需要を提供することに集中することである。私たちは女性が作成し指導する会社で、巨大な内部で作られた知的財産権の組み合わせを持ち、世界で180件の特許を持ち、内部化学、製造と制御(CMC)および設備製造能力を持ち、成熟した製品開発と商業化能力を持っている。私たちの製品および候補製品キットは、数十億ドルの価値があると考えられる世界的な細分化市場を対象としており、これらの細分化市場は長年ほとんど進歩がなく、女性が高価で女性を傷つける可能性のある薬物解決策、インプラント、および手術を避けるのを助ける。
FemaSeed-我々の人工授精ソリューションそれは.著者らのFDAが許可した人工授精解決方案の特徴は単一の卵管内精子を選択した卵管
受胎の自然部位に直接輸送することであり、現有の生殖補助方法と比べて顕著な優勢があり、コストの著しい節約と安全リスクの低減を含む。著者らの第一線の不妊症治療ソリューションFemaSeedは、FemaSeed治療の前に生理食塩水と空気比較を作成し、卵管の開存性を安全に評価することができる著者らのFDAが承認し、発売された診断セット製品FemVue装置と組み合わせることができる。FemVueは、卵管の選択的評価を可能にするFDAによって承認され市販されているFemCath装置と一緒に使用することができる。少なくとも1つの開放卵管は受精成功に必要であり、FemVueは既存の診断不妊症評価の一部として、女性卵管を提供することができる超音波評価を含む他の既存の方法よりも顕著な利点があると信じている。2021年4月、FDAのIDEの承認を得て、FemaSeedデバイスのキーテストを開始することができました。最初の科目は2021年7月に採用された。2022年10月,このキーテストの最新の研究設計を発表し,男性因子不妊症を経験した夫婦に重点を置き,サービス不足の患者部分である。2023年4月、私たちはカナダでFemaSeedの販売を許可されました。2023年9月、FDAはFemaSeedによる卵管内人工授精を許可することを発表した。FDAの米国監督管理の承認を得た時、臨床試験はまだ行われているが、この研究は2023年11月に登録を完了した。臨床試験のTOPLINE結果は2024年3月に発表された。女性の24%が深刻な男性因子(総活動精子数(TMSC)100万~2000万)を患った後に妊娠していることが明らかになった。対照的に,文献に記載されている男性因子を有する子宮内人工授精(IUI)の周期妊娠率は6.7%(100万TMSCより大きい)であった。FemaSeedの複数回の試みは許可されているが、妊娠している女性の多くは、最初のFemaSeedプログラムの後に妊娠している。多くの有害事象は軽微(n=127人の被験者、216サイクル)と報告されている。7週間のフォローアップでは,新たな安全問題は観察されなかった。すべての副作用はIUIの既知の副作用と一致した。承認されたラベルには、卵管内授精方式で妊娠を希望する女性または夫婦が含まれる。我々は2024年3月にFemaSeedの初の商用化を発表し,第1段階の商業打ち上げを開始した。
FemVueは超音波による卵管評価が可能であり,不妊症を診断する放射線学的方法(子宮卵管造影)の代替法として米国,日本,カナダでの販売が許可されている。FemChecはFemBloc手術後に卵管を評価し,閉塞(あるいは手術成功)を確認することを許可しており,現在FemBlocキー試験の一部として検討されている。FemCathは単一卵管に対して選択的評価を行うことを許可し、伝統的な非方向性子宮内カテーテルの代替方案として、すでにアメリカとカナダでの販売を許可した。FemCervは子宮頚管内汚染が最も小さい総合組織サンプルを獲得することによって子宮頸癌を診断する代替方法であり、すでにアメリカとカナダでの販売が許可されている。2023年8月、同社はカナダ衛生部が発行した医療機器設立許可証を取得し、同社がカナダでFemaSeed、FemVue、FemCath、FemCervの4種類の製品を直接販売することを許可したと発表した。2023年10月、同社はEU医療機器法規(MDR)の最終審査を完了したことを発表し、Femasysが必要な最高規制基準を遵守していることを示すMDR証明書とCE標識を取得する最後のステップである。
75
カタログ表
FemBloc-私たちの永久不妊解決策はそれは.著者らの末期臨床で開発された永久性避妊解決方案は著者らの独自のFemBlocシステムを含み、このシステムは二重
子宮内配向投与を有し、同時に分解性バイオポリマーを使用し、その後超音波確認テストを行い、手術成功を確認する。承認された場合、FemBlocは、患者自身の組織成長を利用して卵管閉鎖をもたらすことを意図した低侵襲送達システムを使用して、患者自身の組織成長を利用して卵管閉鎖をもたらすことを目的とした低侵襲送達システムを使用して永久避妊(不妊)される唯一の非外科的避妊プログラムとなることが予想される。FemBlocは既存の唯一の選択である手術による卵管結紮または“彼女の卵管を結紮する”--より顕著な利点を提供する可能性があり、コストの大幅な節約を含むが、総コストは元の半分しかない可能性がある。FemBlocは医師室で完成できる手術であり、麻酔を必要とせず、切開或いは挿管を必要とせず、専門的な技能或いは資本設備がなく、苦痛が最小で、回復時間
であり、組織成長後の患者体内に残留したインプラントがない。FemBlocは他の一時的あるいは可逆的な方法と比較しても有意に優れており,女性はFemBlocがホルモンを使用しないことや長期インプラントを残すため,外科的卵管結紮術の代わりにこれらの方法を用いることができると考えられる。我々の永久的避妊解決策は、生理食塩水と空気比較を使用して、同じ医師がオフィス内で卵管を評価することを可能にし、最終的なFemBlocプログラムの約3ヶ月後にFemBlocの成功を確認するために、生理食塩水と空気比較を使用して、患者に放射線ベースの検査を要求するのではなく、患者に放射線およびX線染料の使用を不必要に曝露させるために、FemBlocを超音波オフィス診断試験と組み合わせる。
FDAが承認した各研究の研究設備免除(IDE)によると,我々はこれまでの3つの臨床試験(試験的安全性研究,キー試験と検証研究)においてFemBlocを研究し,計228名の被験者に対して安全性評価を行った。安全のため,被験者は5年間の追跡調査を受けたが,最初の49名の試験研究は5年間の追跡調査を完了していた。これまで,どの被験者においても深刻なセキュリティイベントは報告されておらず,90%を超える報告イベントはデバイス,プログラム,または両方に関連して分類されており,FemBlocプログラムの当日またはプログラム後7日以内に発生している。報告されたイベントの多くは予想されており,これらのイベントの大多数は出血や斑点および/または痛みまたは痙攣であり,75%を超える患者は医師によって軽度に分類されている。医師は,彼らの被験者はこの手術が高度に耐性であることを認め,被験者が自己報告した疼痛スコアは子宮内避妊器留置と類似していた。ほとんどの症例(96%)が手術に非常に満足しているか非常に満足しているかと医師に評価され,96%の人が卵管結紮術よりも容易であると考えている。FemBloc手術後3カ月に行った超音波確認試験では、被験者に残留バイオポリマーが検出されなかったことは、バイオポリマーが完全に分解し、月経の到来とともに被験者を離れる可能性が高いことを示している可能性がある。br}被験者は、FemBloc手術および確認試験が高度に耐性であり、痛みまたは不快スコアは、他の子宮内避妊器(例えば、子宮内避妊器)と類似していることを発見した。FemBloc手術の平均得点は4.6点,確認テストの平均得点は3.3点,視覚シミュレーションスコア(VAS)は0から10であり,そのうち10は痛み/不快感の最高測定基準であった。
前2つの臨床研究の施行中に,FemBlocに依存した被験者に意外妊娠が発生したと言われた(試験的研究では妊娠6例,キー試験では3例が妊娠)。これらの妊娠は,FemChecデバイスを用いた超音波テストに対する誤解によるものであり,独立臨床イベント委員会の審査と確認が得られた。FDAはこれらの意外な妊娠を安全問題としているため,2019年2月にFemBlocのキー臨床試験を休止した(被験者は5年間の安全性追跡を行っているにもかかわらず)。その後、この機関は1組の新しい被験者の中で小型臨床研究を行い、いくつかの提案された緩和措置の十分性を評価し、超音波確認テストを検証することを提案した。この研究の登録作業は2022年9月に終了し,米国5地点の45名の被験者が2回の確認テスト(超音波と伝統放射学)を受けた。被験者は、2つのテストと2つの独立した中央リーダがプログラムが成功したことを確認した場合にのみ、FemBlocに依存すると通知された。FemBlocに依存することが正確に通知された被験者にはbr例の妊娠はなかった。2023年6月、私たちはIDEに対するFDAの承認を得て、重要な臨床試験でFemBlocの安全性と有効性を評価することができます。FemBlocは私たちの非手術、非埋め込み性、オフィス内の永久避妊ソリューションです。2023年8月に決勝戦での募集開始を発表しました[FemBloc卵管内閉塞経子宮頚永久避妊のための展望性多中心試験]肝心な裁判。この展望性,
マルチセンター,開放ラベル,片腕研究設計は妊娠率を主な終点とし,401名の女性がFemBlocを用いて恒久的に1年間避妊し,分析を行った。また,この研究はbrにスクロールするように設計されており,まず50名の女性を募集して臨床読み取りを行い,主に残りの被験者を募集する前に初歩的な安全性データを読み取る。300人の女性がFemBlocを用いて1年間の永久的な避妊を行うと、臨床データの終点に対して中期分析を行う予定である。発売されてから5年以内に、毎年継続的にフォローされるだろう。
76
カタログ表
他の女性の健康解決策はそれは.また,他の女性専用医療製品とともに医師のオフィス環境で販売することを目的とした新しい組織サンプリング技術プラットフォームを開発した。我々のFDA承認とカナダ衛生部が許可したFemCerv製品は、子宮頚細胞と組織を円周サンプリングし、サンプルを装置内に含めることができ、汚染を最小限に抑えるための子宮頸部掻爬のための生組織検査装置である。著者らはFemCervの発売後の研究を賛助し、被験者はこのプログラムが相対的に無痛であり、得られたサンプルは完全に分析に用いられ、信頼できる診断に役立つ可能性があると信じている。私どものFemCerv製品は2022年9月に数量限定で発売されました。我々が開発しているFemEMB候補製品は,オフィスプログラムにより全面的かつ汚染のない子宮内膜細胞と組織試料
を得ることを目的としている。癌、異常出血、または他の子宮治療期間および後に、医師は、例えば子宮内膜アブレーションの前など、治療中および後にFemEMBを使用して連続的に監視することができる市場機会であると信じている。
私たちの業務に影響を与える要素
多くの要素が影響を受けており、私たちは私たちの運営と成長結果に引き続き影響を及ぼすと信じている。これらの要素には
| • |
私たちの候補製品の起動と臨床試験を行いますそれは.私たちはFemBlocの臨床試験参加者の募集と募集に成功しなければならない。この臨床試験は新冠肺炎の大流行の後遺症と公衆衛生問題によってもっと複雑になり、必要なデータを持って、アメリカ食品·薬物管理局と国際監督機関に監督報告を提出して、上場許可を得るために。
|
| • |
規制部門の候補製品の承認それは.私たちは私たちの候補製品のために適時に承認、再分類、または承認を得ることに成功しなければならない。
私たちの売上を増加させるためには、永久避妊のためのFDAのFemBlocシステムの承認を得る必要があり、米国と国際市場での私たちの他のパイプライン製品に対する規制部門の承認、承認、許可、またはマーケティングの許可を得る必要がある。
|
| • |
臨床結果それは.私たち、私たちの競争相手や他の第三者が発表した臨床結果は、医師が私たちの製品を使用するかどうか、彼らが提供するプログラムや治療方法を選択することに大きな影響を与えるかもしれません。
|
| • |
商業化と市場受容度それは.私たちの業務の成功は最終的に私たちが承認した製品を商業化し、私たちの製品に対する市場の広範な受け入れを得る能力があるかどうかにかかっており、これは医者と患者に対して広範な教育を行い、彼らに私たちの製品のメリットを理解させ、強力な販売チームのインフラを構築し、製造能力を高める必要がある。
|
| • |
競争それは.私たちの産業は資本の豊富な大型会社を持っている。私たちは競争相手の既存と未来の製品と関連定価とその資源に基づいて競争を継続しなければならず、私たちの製品を使用する医師に製品を売り込むことに成功した。
|
これらの要素は私たちに大きなチャンスをもたらすかもしれないが、それらはまた私たちが対応しなければならない重大なリスクと挑戦を構成している。詳細については、“リスクファクター”というタイトルの部分を参照されたい。
“新冠肺炎”がわが国企業に与える影響
2020年3月、世界保健機関は1種の新型コロナウイルス株による新冠肺炎疫病を大流行と発表した。この伝染性疾患の爆発はすでにアメリカ国内外で発見されたウイルス新変種を含むアメリカ全体と世界各地で伝播し続けている。全世界の新冠肺炎疫病はすでに著者らが現在の臨床前研究と臨床試験を完成し、計画中の臨床前研究と臨床試験を開始と完成し、監督活動を妨害し、或いは著者らの業務、運営結果、財務状況と将来性に他の不利な影響を与える能力に影響を与える可能性がある。また、疫病は金融市場に重大な破壊をもたらし、世界各地の経済に悪影響を及ぼす可能性があり、いずれも私たちの業務、運営、資金調達が私たちの運営を支援する能力に悪影響を及ぼす可能性がある。これまで、著者らは臨床試験のサイト起動と被験者登録に遅延に遭遇し、著者らの臨床試験は引き続きいくつかの遅延に遭遇する可能性があり、データ収集と分析も引き続き遅延する可能性がある。これまで、これらの遅延はすでに深刻な影響を与えており、新冠肺炎の全世界での持続的な伝播は更に著者らの臨床試験運営に不利な影響を与える可能性があり、著者らはサイトを起動し、被験者を採用と維持し、主要な研究者とサイトスタッフの能力を含む彼らは医療保健提供者として、もし彼らの所在地域で疫病が発生すれば、新冠肺炎への接触を増加させる可能性がある。この大流行は選択的外科手術の数を減少させ,継続すればわれわれの将来の業務に影響を与える可能性がある。例えば,この出版物に発表された研究によると,2020年12月の卵管結紮術は2019年12月に比べて18%低下している避妊する2021年に。将来の選択的生殖手術の需要が大流行前のレベルに回復するか,あるいは全く保証されないことは保証されない。私たちは大流行の潜在的な影響を監視し続けているが、全体的な影響が私たちの業務、財務状況、運営結果、見通しにどのような影響を与えるかを決定することはできない。
77
カタログ表
私たちの全面的な損失の構成要素
売上高
売上げは主に私どもFemVue製品の販売から来ています。
私たちは主に直接顧客サービスを通じて、国際市場の流通業者を選定することで、医師室に私たちの製品を販売しています。2023年12月31日と2022年12月31日まで、バイエルクッシング株式会社はそれぞれ私たちの総収入の約5%と10%を占めている。直接顧客サービスで販売されている製品については,制御権は出荷時に顧客に転送される.国際販売店に販売されている製品については、契約出荷条項に基づいて、制御権が顧客が指定した場所に出荷または交付されたときに移転する。
販売コスト
販売コストには主に私たちの製品のための部品コスト、私たちの製品を生産するための材料と労働力、生産を直接支援する製造費用が含まれています。
販売コストの絶対値は収入の増加とともに増加すると予想される。
研究開発
研究開発費には、工事費用、製品開発費用、臨床費用、規制費用が含まれる。研究開発費には
| • |
第三者サービス提供者(主に臨床研究組織またはCRO)の活動の費用および現場支払いを含む、我々の候補製品および製品増強をサポートする臨床試験コスト
|
| • |
賃金、福祉、株式報酬を含む人事関連費用のいくつか
|
| • |
内部研究開発や臨床活動のための材料や用品
|
| • |
分配された間接情報技術費用
|
| • |
外部コンサルタントの費用は,技術開発,法規制事務,臨床事務と品質保証,テスト費に協力している。
|
私たちは、特定の候補製品のアウトソーシング開発コストと他の外部研究開発コスト、CROに支払われる費用、製造、臨床開発活動を追跡することを1つずつ計画しています。しかし、私たちは、主に報酬、管理費用、早期研究、および他のコストに関連しているので、内部研究開発費用を1つずつ追跡することは計画されていません。これらのコストは、br開発下の複数の項目に配置されています。
研究開発コストは発生時に費用を計上する。将来、私たちが候補製品の開発を継続し、候補製品のパイプラインを拡大し、既存の製品と技術を改善し、追加規制の承認を得ることに関する活動を展開するにつれて、研究開発費は絶対ドルで増加すると予想される。
78
カタログ表
販売とマーケティング
販売およびマーケティング費用には、報酬、福祉、および株式ベースの報酬が含まれる関係者に関連する費用が含まれる。その他の販売およびマーケティング費用には、出張、貿易展示会、市場研究、外部コンサルタントの費用が含まれるマーケティングおよび販売促進活動が含まれる。私たちのプラットフォーム技術に基づいて私たちの製品を商業化する時、私たちは販売チームを増やして、マーケティング努力を増やしたいです。したがって、今後しばらくの販売とマーケティング費用はドル絶対値計算で増加すると予想される。
一般と行政
一般費用と行政費用には、報酬、福祉、旅費、株式報酬が含まれる人事に関する費用が含まれる。その他の一般費用と行政費用には、法律、監査、税務費用、保険料、外部コンサルタント費用、従業員募集と訓練費用が含まれています。
減価償却および償却
減価償却と償却費用には、私たちの固定資産に関する減価償却費用と、私たちの特許に関する賃貸使用権資産と償却費用が含まれています。私たちは、私たちが進行して計画している商業化努力を支援し、私たちの知的財産権に投資し続けるために、資本設備に投資する予定です。したがって、私たちは未来に私たちの減価償却と償却費用が絶対ドルで増加すると予想する。
その他の収入(費用)
その他の収入(費用)は主に私たちの現金等価物と短期投資で稼いだ利息で構成されており、利息費用と他の費用はこの部分を相殺している。
所得税費用
所得税支出には私たちが納めなければならない最低国家所得税が含まれている。著者らは繰延税金資産に対して十分な評価手当があり、主に研究開発に関連する純営業損失の繰越と税収控除を含む。
経営成果
2023年12月31日までと2022年12月31日までの年度比較
次の表に2023年12月31日と2022年12月31日までの経営実績を示します
|
十二月三十一日までの年度
|
||||||||||||||||
|
2023
|
2022
|
変わる
|
変更率
|
|||||||||||||
|
売上高
|
$
|
1,071,970
|
1,206,218
|
(134,248
|
)
|
-11.1
|
%
|
|||||||||
|
販売コスト(減価償却費用を除く)
|
380,069
|
441,938
|
(61,869
|
)
|
-14.0
|
%
|
||||||||||
|
運営費用:
|
||||||||||||||||
|
研究開発
|
7,208,701
|
5,813,755
|
1,394,946
|
24.0
|
%
|
|||||||||||
|
販売とマーケティング
|
650,126
|
558,852
|
91,274
|
16.3
|
%
|
|||||||||||
|
一般と行政
|
6,858,008
|
5,430,704
|
1,427,304
|
26.3
|
%
|
|||||||||||
|
減価償却および償却
|
483,481
|
561,233
|
(77,752
|
)
|
-13.9
|
%
|
||||||||||
|
総運営費
|
15,200,316
|
12,364,544
|
2,835,772
|
22.9
|
%
|
|||||||||||
|
運営損失
|
(14,508,415
|
)
|
(11,600,264
|
)
|
(2,908,151
|
)
|
25.1
|
%
|
||||||||
|
その他の収入(支出):
|
||||||||||||||||
|
利子収入
|
431,019
|
228,164
|
202,855
|
88.9
|
%
|
|||||||||||
|
利子支出
|
(165,390
|
)
|
(13,464
|
)
|
(151,926
|
)
|
1128.4
|
%
|
||||||||
|
その他の費用
|
—
|
(2,306
|
)
|
2,306
|
-100.0
|
%
|
||||||||||
|
その他の収入,純額
|
265,629
|
212,394
|
53,235
|
25.1
|
%
|
|||||||||||
|
所得税前損失
|
$
|
(14,242,786
|
)
|
(11,387,870
|
)
|
(2,854,916
|
)
|
25.1
|
%
|
|||||||
|
所得税費用
|
4,338
|
6,300
|
(1,962
|
)
|
-31.1
|
%
|
||||||||||
|
純損失
|
$
|
(14,247,124
|
)
|
(11,394,170
|
)
|
(2,852,954
|
)
|
25.0
|
%
|
|||||||
79
カタログ表
2023年、FemVueの売上高は134,248ドル低下し、下げ幅は11.1%となり、2022年の1,206,218ドルから1,071,970ドルに低下した。この低下は、同期の米国と国際売上高がそれぞれ76,434ドルと57,814ドル減少したためだ。2022年と比較して、2023年の米国の売上高は7.0%低下し、そのうち販売台数は9.0%低下したが、平均販売価格はやや上昇した。2022年と比較して、2023年の国際売上高は49.9%低下し、販売台数は50.1%低下したが、平均販売価格は0.4%上昇した。
販売コスト
販売コストは2022年の441,938ドルから2023年の380,069ドルに低下し、下げ幅は61,869ドル、下げ幅は14.0%だった。販売コストの低下は主に販売減少といくつかの製造効率の向上によるものである。
研究開発
次の表は、私たちが述べた期間に発生した研究開発費をまとめたものである
|
十二月三十一日までの年度
|
||||||||
|
2023
|
2022
|
|||||||
|
給与および関連人件費
|
$
|
3,733,928
|
2,935,580
|
|||||
|
臨床関連コスト
|
1,702,985
|
1,839,643
|
||||||
|
材料と開発コスト
|
1,091,930
|
548,623
|
||||||
|
専門と外部顧問費用
|
570,628
|
344,701
|
||||||
|
その他のコスト
|
109,230
|
145,208
|
||||||
|
研究開発費総額
|
$
|
7,208,701
|
5,813,755
|
|||||
研究開発費は1,394,946ドル増加し,24.0%増となり,2022年の5,813,755ドルから2023年の7,208,701ドルに増加した。1,394,946ドル増加の主な理由は、報酬費用、材料および開発費用、ならびに専門家および外部コンサルタント費用の増加であるが、減少した臨床関連費用および他の費用の一部は、増加した費用を相殺する。
販売とマーケティング
販売とマーケティング費用は91,274ドルまたは16.3%増加し、2022年の558,852ドルから2023年の650,126ドルに増加した。純成長は主に私たちの商業製品のマーケティングと出張費用の普及と関係があります。
一般と行政
一般と行政費用は1,427,304ドル,すなわち26.3%増加し,2022年の5,430,704ドルから2023年の6,858,008ドルに増加した。増加の主な原因は、給与コスト、株式ベースの給与支出、専門コストの増加であるが、施設や他の管理費用の減少分は、増加した報酬コストを相殺している。
減価償却および償却
減価償却と償却費用は2022年の561,233ドルから2023年の483,481ドルに低下し、77,752ドル減少し、減少幅は13.9%だった。この減少は、会社の固定資産に関する減価償却費用と、会社の無形資産が使用寿命終了に達したことに関する償却費用に関連する。
その他の収入(費用)
その他の収入(支出)総額は2022年の212,394ドルから2023年の265,629ドルに増加し,53,235ドル増加し25.1%と増加した。この増加は利息収入と関係があるが、一部は転換可能な手形に関連する利息支出と非現金割引償却によって相殺される。
所得税費用
私たちが納めなければならない最低純値税が減少したため、所得税支出は2022年の6,300ドルから2023年の4,338ドルに低下し、1,962ドルまたは31.1%減少した。
80
カタログ表
流動性と資本資源
流動資金源
会社が設立されてから2023年12月31日まで、私たちの運営資金は主に私たちの普通株と転換可能な優先株を売却する純収益、債務、副次的な製品収入から来ています。2023年12月31日まで、私たちは21,716,077ドルの現金と現金等価物を持っていて、累計赤字は108,381,629ドルです。
2022年7月、Piper Sandler&Co.(“Piper Sandler”または“販売代理”)と株式分配協定(“株式割当協定”)を締結し、関連する目論見書を提出し、br“市場”施設を構築し、この合意により、時々販売代理を通じて私たちの普通株の株式を提供し、販売することができる。2023年10月、募集説明書によると、販売代理は1670万ドルまでの総発行価格
で普通株を販売することを許可された。2023年12月31日現在、目論見書によると、株式分配協定によると、約330万株の普通株が売却されており、総収益は770万ドル。
2023年4月には、(I)1,318,000株の普通株および(Ii)事前融資権証を販売し、登録直接発売方式で最大1,878,722株の普通株を購入するとともに、私募方式で最大3,196,722株の普通株の引受権証を販売した。また,今回の取引では,配給エージェントに一般権証を発行し,最大191,803株の普通株を購入し,サービスへの補償として総称して
(“2023年4月融資”)と呼ぶ.普通株と事前融資株式証の1株当たりの購入価格はそれぞれ1.22ドルと1.2199ドルである。2023年4月融資の純収益は成約時に約340万ドルだった。2023年4月に融資中の引受権証はすべて現金を行使し、追加収益350万ドルを獲得した。
2023年11月、吾らはいくつかの認可投資家と証券購入協定を締結し、これにより、吾等は(I)元金総額6,850,000ドルの優先無担保転換可能手形を売却し、
は1株1.18ドルの転換価格で普通株に変換することができ、(Ii)Aシリーズ株式承認証は1株1.18ドルの使用価格で最大5,805,083株普通株を購入することができ、および(Iii)Bシリーズ株式承認証は1株1.475ドルの執行価格で最大5,805,083株普通株(総称、総称、083株普通株)を購入することができる。“2023年11月融資案”)。2023年11月の融資の純収益は630万ドル。現金を行使すれば、2023年11月の融資で発行された権証は1540万ドルにのぼる追加収益をもたらす可能性がある。
資金需要
現在の運営計画によると、現在の現金と現金等価物は、2025年下半期まで運営を続けるのに十分な資金を提供するのに十分であると予想されています。私たちは、既存の現金
および現金等価物がどのくらいの間、私たちの運営に資金を提供し続けることができると予想しており、これは、誤りであることが証明される可能性があるという仮定に基づいており、私たちは、現在予想されているよりも早く利用可能な資本資源を使用するかもしれない。変化し続ける環境、その中のいくつかは私たちがコントロールできないかもしれないし、私たちの資本消費の速度が私たちの現在の予想よりも大きく速いかもしれません。
2023年12月31日現在、私たちの現金と現金等価物は、規制部門の承認によってすべての候補製品に資金を提供するのに十分ではなく、私たちの候補製品の開発と商業化を達成するために、より多くの資金を集める必要があると予想されます。しかし、私たちは私たちの運営を支援するために追加の資金源を得ることができるという保証はないし、もし私たちがこれらの資金を得ることができれば、私たちはこれらの追加のbr資金が私たちの需要を満たすのに十分であるか、私たちが受け入れられる条項に適合することを保証することはできない。もし経済と市場状況が悪化すれば、このようなリスクは増加するかもしれない。もし私たちが必要な時に追加融資を得ることができない場合、私たちは私たちの候補製品の開発を中止したり、大幅に修正したり、延期したりする必要があるかもしれないし、あるいは協力または他の条項を通じて資金を得る必要があるかもしれません。これらの条項は、独立開発または商業化を求める可能性のある技術または候補製品の権利を放棄することを要求するかもしれません。もし私たちが未来に必要な時に十分な追加資本を集めることができなければ、私たちは開発活動を停止し、私たちの運営を中止させることを余儀なくされるかもしれません。あなたの投資は完全に損失するかもしれません。
81
カタログ表
われわれが行っている試験や,われわれの製品の安全性と有効性に臨床的証拠を提供するための他の臨床試験への大量投資を継続する予定である。また,
は今後の製品開発,製造,規制事務,臨床試験への投資を継続していく予定である。もし私たちの候補製品が承認されたら、私たちは私たちの販売とマーケティング組織に投資する必要があります。
これらや他の要因により、予測可能な未来には、運営には大量の純損失と負のキャッシュフローが引き続き発生することが予想される。
私たちの将来の資本需要は多くの要素に依存します
| • |
私たちの臨床試験と規制審査のコスト、時間、結果
|
| • |
販売、マーケティング、流通能力のコストとタイミングを確立する
|
| • |
既存製品および潜在製品の販売時間、収入、および販売金額
|
| • |
私たちは私たちの製品と候補製品を生産し続け、生産に必要な部品、サービス、供給を確保することができます
|
| • |
私たちの製品商業化の成功度は
|
| • |
競争的または相補的な技術の出現
|
| • |
任意の特許権利要件および他の知的財産権の準備、提出、起訴、保守、弁護、および
|
| • |
私たちは現在、このような取引に関する約束や合意を持っていないにもかかわらず、業務、製品、または技術の程度に買収または投資している。
|
キャッシュフロー
2023年12月31日までと2022年12月31日までの年度比較
次の表は、12月31日までの年間キャッシュフローをまとめています
|
十二月三十一日までの年度
|
||||||||
|
2023
|
2022
|
|||||||
|
経営活動のための現金純額
|
$
|
(11,280,546
|
)
|
(10,731,973
|
)
|
|||
|
投資活動のための現金純額
|
(143,917
|
)
|
(407,475
|
)
|
||||
|
融資活動提供の現金純額
|
20,178,604
|
(681,645
|
)
|
|||||
|
現金と現金等価物の純変化
|
$
|
8,754,141
|
(11,821,093
|
)
|
||||
経営活動
2023年、経営活動で使用された現金は11,280,546ドルで、純損失14,247,124ドルが原因で、非現金費用1,745,072ドルと私たちの純営業資産と負債の純変化1,221,506ドルで相殺された。
非現金費用は主に株ベースの給与675,700ドル、減価償却と償却907,985ドル、および転換手形割引の償却107,963ドルが含まれている。営業資産と負債純額の変化
は、主に売掛金と負債が1,614,647ドル増加したが、賃貸負債が440,489ドル減少し、この変化を部分的に相殺したためである。
2022年、経営活動で使用された現金は10,731,973ドルで、純損失11,394,170ドル、純運営資産と負債の純変化458,267ドルにより、非現金費用1,120,464ドルで相殺された。br}非現金費用には、主に株ベースの給与224,939ドルと減価償却889,140ドルが含まれている。私たちの純営業資産と負債の変化は主に在庫増加232,553ドルと賃貸負債が383,616ドル減少したが、前払い資産と他の資産の変化295,862ドルによって相殺された。
投資活動
2023年、設備購入のための投資活動の現金は143 917ドル。
2022年、設備購入のための投資活動の現金は407 475ドル。
82
カタログ表
融資活動
2023年、融資活動によって提供される現金は20 178 604ドルで、主に株式の発行とその後の株式承認証の行使によって得られた7 587 977ドル、市場融資メカニズムでの販売7 665 066ドル、および転換手形6 850 000ドルの発行によって提供された現金である。融資活動で使用される現金は、発売費用1,072,908ドルの支払い、支払手形610,340ドルの償還、市場融資の発行費用229,953ドル、およびリース債務項目での支払い16,193ドルを含む。
2022年の融資活動のための現金は681,645ドルであり,232,845ドルの繰延発売コストの支払い,505,205ドルの支払手形の返済,23,058ドルのリース義務が支払われたが,普通株発行による79,463ドル分で相殺されたためである。
表外手配
本報告書に記載されている間、私たちは、現在、米国証券取引委員会の規則および法規によって定義されたいかなる表外手配も持っていない。
肝心な会計見積もり
経営陣の財務状況と経営結果の検討と分析は、米国公認会計原則または公認会計原則(GAAP)に基づいて作成された我々の財務諸表に基づいている。これらの財務諸表を作成するには、報告書の資産、負債、収入、費用、および関連開示の金額を推定し、仮定する必要があります。我々の見積もりは,我々の歴史的経験と当時の状況で合理的と考えられる様々な他の要因に基づいており,これらの要因の結果は資産や負債の帳簿価値を判断する基礎を構成しているが,これらの資産や負債の帳簿価値は他の源からは明らかではないように見える。異なる仮定または条件の下で、実際の
結果は、これらの推定値とは異なる可能性があり、どのような違いも実質的である可能性がある。
我々の重要な会計政策は、本年度報告(Form 10−K)の他の部分の財務諸表付記2により包括的に記述されているが、以下の議論は、私たちの財務状況および運営結果に対して最も重要であり、最も困難で、最も主観的で、最も複雑な判断を行う必要があると信じている。
収入確認
私たちの政策は、顧客が会計基準コード606に従って約束された貨物の統制権を獲得した場合、収入を確認することです顧客との契約の収入(主題606)私たちは2018年1月1日に施行しました。確認された収入金額は,我々が獲得する権利が期待されるこれらの商品の対価格を反映しており,顧客から受け取った
すべての販売(他と類似)税の金額を取引価格から除外することを選択した.私たちはお客様の注文に多重履行義務がありませんので、収入は出荷時に契約で定められた価格確認により、標準支払条項は30日から60日まで様々です。すべての収入は時点で確認されており,時間の経過とともに確認されることはない.
米国の顧客に直接販売されている製品の多くは一般輸送者を介して出荷され,顧客が運賃や運搬費を支払い,オフショア(FOB)出荷先を制御している。我々のbr}国際総代理店に出荷される製品はそれぞれの合意に適合しているが,出荷条項は通常出荷条項であり,制御権は出荷先の総代理店が負担することを反映している.会社の事前
の許可を得た後にのみ、返品を受けることができます。返品品は未開封のオリジナル段ボール箱に入れなければなりません。30%の入荷料が加算されます。2023年12月31日まで、私たちは著しい見返りの歴史がない。
83
カタログ表
費用を計算する
我々の第三者サービスプロバイダのための研究開発活動の見積もりコストは、臨床前研究と臨床試験を含む費用を計算しなければならない。我々は,提供されているが伝票が発行されていない見積りサービス金額に基づいて
研究開発活動の見積りコストを記録する.これらのコストは研究開発費の重要な構成要素である可能性があり,会社は期間ごとの計算すべき費用を決定する際に試算する。実際のコストが既知であるため、当社はその計算すべき項目を調整します。これらの計算すべき研究開発コストは,貸借対照表上の計上すべき費用と全面損失表における研究開発費に計上される。
最近の会計公告
最近発表された会計声明に関する情報は、財務諸表第2部第8項の付記2(Ab)と2(Ac)を参照されたい。
| 第七A項。 |
市場リスクに関する定量的で定性的な開示。
|
金利リスク
2023年12月31日現在、私たちの現金と現金等価物には、21,716,077ドルの銀行預金と利息を稼ぐ通貨市場基金が含まれている。私たちはこのような利息を稼ぐ道具が低い金利リスクを持っていると思う。私たちの投資政策の目標は流動資金と保証である;私たちは取引や投機目的のために投資するのではなく、いかなる派生金融商品も使用して私たちの金利の開放を管理していない。私たちの現金と現金等価物の短期的な性質による金利の変化は、私たちの資産の公正な価値変化に重大なリスクがないと信じています。
外貨両替リスク
私たちの国際的な拡張に伴い、私たちの経営業績とキャッシュフローはますます外貨為替レートの変化の影響を受けるかもしれません。私たちの機能通貨はドルで、私たちの収入は主にドルで計算されます。2023年12月31日と2022年12月31日までの数年間、私たちのすべての売上高はドルで計算されています。私たちの費用は普通私たちの業務がある通貨で計算されます。主にアメリカにあります。2023年、10%の為替レート変動は、私たちの現金と売掛金の公正価値に実質的な変化をもたらさない。私たちのアメリカ以外の国での業務増加に伴い、私たちの業務結果とキャッシュフローは外貨為替レートの変化の影響を受ける可能性があり、これは私たちの将来の業務を損なう可能性があります。今まで、私たちは未来にそうするかもしれませんが、私たちはまだ重大な外貨ヘッジ契約を達成していません。
信用リスクが集中する
2022年12月31日まで、私たちのほとんどの現金と現金等価物はシリコンバレー銀行(SVB)に保管されており、金額はしばしば連邦保険の限度額を超えている。2023年3月10日、連邦預金保険会社(FDIC)は、カリフォルニア州金融保護·革新部がSVBを閉鎖したと発表した。米財務省はFRBとFDICとの共同声明で、2023年3月13日からSVBの預金者が連邦保険限度額を超える資金を含むすべての資金を引き出すことができると発表した。したがって、私たちがSVBに保管していた資金は何の損失も受けなかった。もし私たちの現金と現金等価物を持っている金融機関が約束を破ったら、私たちは信用リスクに直面するだろう。私たちが必要に応じて現金と現金等価物を得ることができなければ、私たちの財務状況と運営業務の能力は悪影響を受けるだろう。
新興成長型会社の地位
雇用法案の定義によると、私たちは新興成長型会社です。“雇用法案”によると、新興成長型企業は、これらの基準が民間企業に適用されるまで、“雇用法案”公布後に発表された新たなまたは改正された会計基準の採用を延期することができる。私たちはこのような延長された過渡期を利用しないことを選択し、これは私たちが基準を発表したり改訂したりする時に新しい基準を採用することを意味する。