
1 Avalo治療会社(AVTX)Avaloは抗IL-1βモノクロナル抗体を買収し、2024年3月に1.85億ドルまでの個人販売展覧会99.2を行うことを発表した

2この陳述は、1995年の個人証券訴訟改革法に基づいて行われた前向きな陳述を含むことができる。展望的陳述は非歴史的事実の陳述を意味する。このような展望的陳述は重大なリスクと不確実性の影響を受ける可能性があり、これらのリスクと不確定性は様々な要素によって変化する可能性があり(その中の多くの要素はAvaloの制御範囲内ではない)、これは実際の結果が前向き陳述と異なる可能性がある。このような陳述は、Avaloの計画、目標、予測、期待、および意図に関連する陳述、および“項目”、“可能”、“可能”、“将”、“すべき”、“継続”、“求める”、“目標”、“予測”、“信じ”、“予想”、“予想”、“推定”、“計画、を含むが、これらに限定されない。“潜在的”または同様の表現(否定で使用されることを含む)、または将来の事項の議論によって、例えば、私募に関連する常習成約条件を満たすこと;これらのリスクには、私募で得られた資金の予想される用途に限定されないが、AVTX−009と我々の業務との統合、薬物開発コスト、試験結果の公表時間、および臨床試験における研究者への依存および患者の募集、キーパーソンへの依存、規制リスク、ウクライナおよび中東戦争を引き起こすリスクを含む全体的な経済および市場リスクおよび不確実性、およびAvaloが米国証券取引委員会に提出された文書に詳細に記載されている他のリスクを含むが、これらの文書はwww.sec.govで調べることができる。実際の結果は展望的陳述で述べられた結果とは異なるかもしれない。適用される法律に別の要求があることに加えて、Avaloは、Avaloのこれに対する予期される任意の変化、または任意の陳述に基づくイベント、条件、または状況の任意の変化を反映するために、本明細書に含まれる任意の前向きな陳述を公開することを承諾しない任意の更新または修正を明示的に示す。前向きに陳述する
3つの経験豊富なチームは、末期免疫学開発において良好な業績記録があるナスダック上場:AVTXプライベート会社は主に第二段階に整った抗IL-1βモノクロナルと関連資産からなり、MOAのリスク目標適応を低下させたAlmataBio社は炎症を治療するバイオ製薬のリード企業であり、重点的にAVTX-009(抗IL-1βモノクロナル)紫斑性汗腺炎2026年発売結果:AVTXはAVTX-009を買収すると同時に、Avaloは1.85億ドルまでのパイプ融資を発表し、2027年に入る現金滑走路Avalo治療会社とAlmataBio社を提供した:長期成長に適した強力な戦略を推進する

4つの化合物適応PreClin P 1 P 2 P 3予想マイルストーンAVTX-009抗IL-1β単抗化膿性汗腺炎(HS)P 2 TOPLINE結果2026年自己免疫適応未定次世代IL-1β(延長半減期)-未定Quisvalimab AVTX-002、抗光モノクロナル抗体-戦略審査AVTX-008 BTLAアゴニスト融合タンパク質-戦略審査Avaloパイプライン治療

5.HSにおいて最適な疾患特徴を達成する可能性-効率的かつ有利な半減期は、他の自己免疫疾患における治療効果および便利な投与潜在力の改善を可能にする可能性がある·HSにおけるIL-1βの重要な臨床証拠を支持する-大型で制御が良好な第2段階試験(NCT 05139602)において、lutikizumabはHSにおいてIL-1β標的を検証した。患者はさらに深刻であるにもかかわらず、治療効果は他のHS療法に相当する1-臨床的証拠によると、抗IL-1α療法はHS 2では無効であることが示されている。3-MAC 825(IL-1β/IL-18二重特異性)は、第二段階ランダム対照研究(NCT 03827798)で陽性結果(NCT 03827798)4-単特異性IL-1β阻害作用が未検証標的(IL-18)や治療効果に貢献しないことが知られている二重特異性薬物(IL-1α)よりも優れている可能性が高いと考えられる-AVTX-009がHSで成功する可能性が高い·HSは数十億ドルの市場·HS Topline結果になりそうである。現金滑走路は2027年に要約と発展スケジュール1.金宝ABに入り、彼らの研究を待っています紹介場所:アメリカ皮膚病学会;2024年3月8日から12日;カリフォルニア州サンディエゴ。更新日:2023年11月13日。訪問期間は2024年3月24日である。3.ClinicalTrials.gov標識:NCT 04019041.更新日:2023年7月27日。訪問期間は2024年3月24日である。4.Kimball AB,et al.アメリカ皮膚病学会で発表されました2024年3月8日~12日カリフォルニア州サンディエゴ

製薬とバイオテクノロジー分野で60年間の成功指導者、製品開発と商業化経験を持ち、医学博士最高経営責任者、取締役会長Garry A.Neil、プロジェクト管理、企業インフラ、臨床運営Colleen Matkowski上級副社長、世界的な規制事務、品質保証Dino C.Miano、博士上級副総裁、CMC、技術運営最高財務責任者クリスSullivan経験豊富な管理チーム
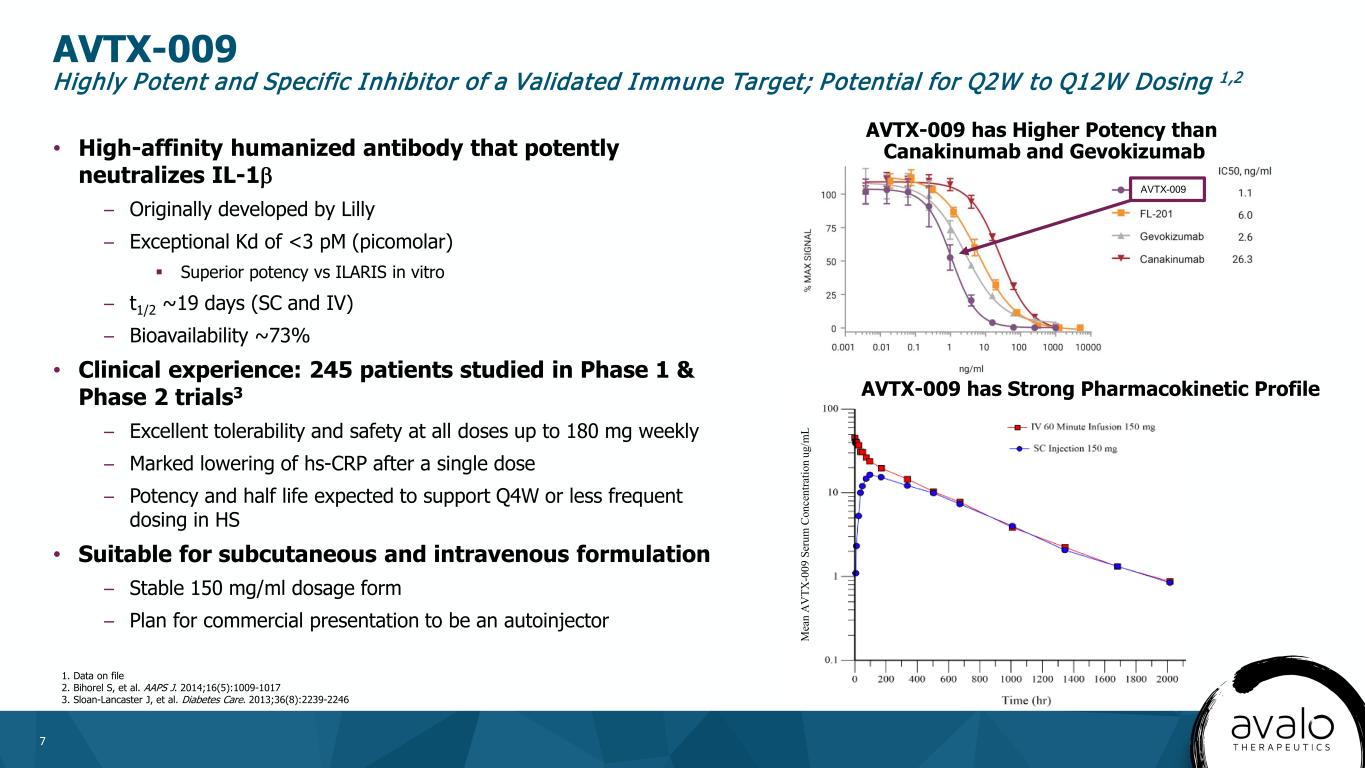
7·高親和性ヒト化抗体、IL-1β-最初に礼来社によって開発された-例外KD
に有効である
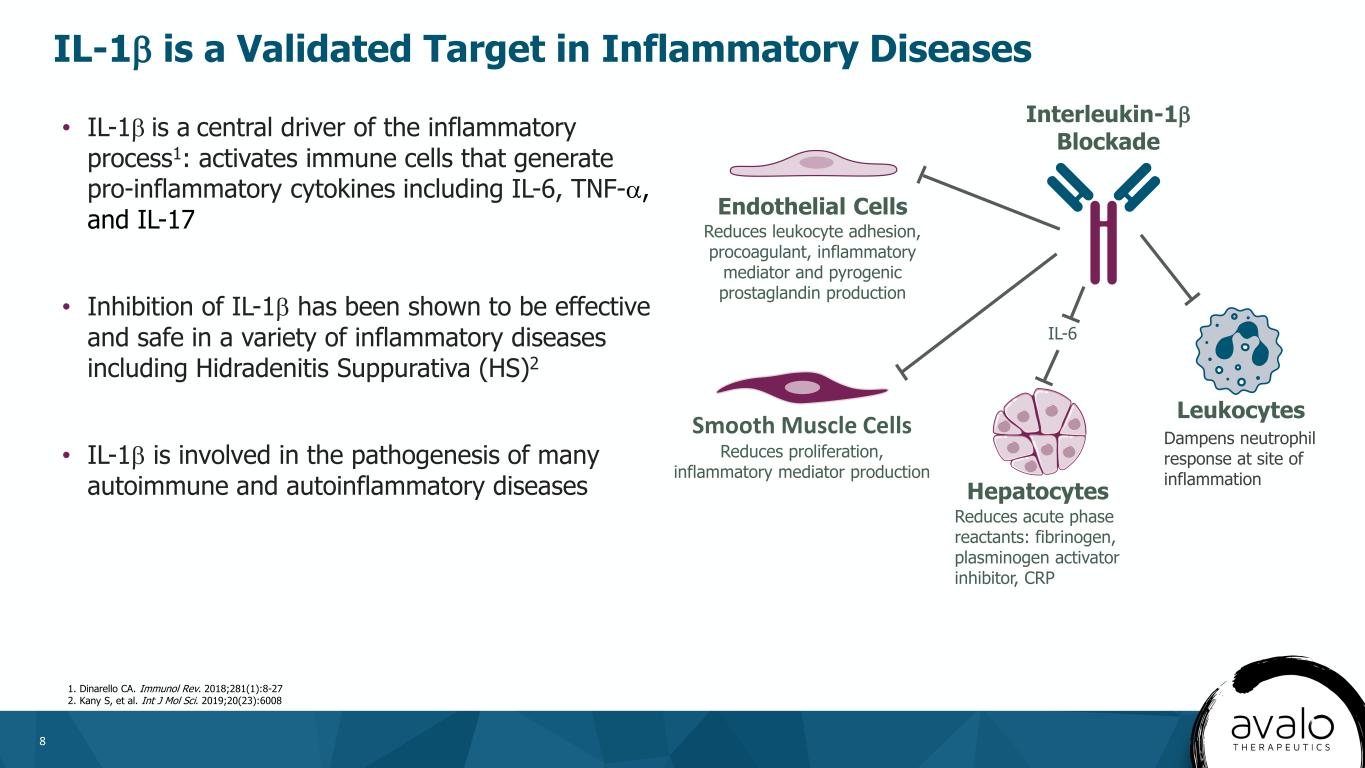
8·IL−1βは炎症過程の中心駆動力である1:IL−6、腫瘍壊死因子−αおよびIL−17を含む炎症性サイトカインを産生する免疫細胞を活性化·IL−1βを抑制することは、化膿性汗腺炎(HS)を含む多種の炎症性疾患の中で有効かつ安全な2·IL−1βが多くの自己免疫性および自己炎症性疾患の発症機序に関与することが証明されているインターロイキン1β遮断内皮細胞接着促進剤、炎症メディエーターおよび熱原プロスタグランジン産生平滑筋細胞の増殖を減少させ、炎症メディエーターが肝細胞減少急性期反応物を産生する:フィブリノーゲン、プラスミノーゲン活性化因子阻害物、C反応蛋白、白血球IL-1。“免疫雑誌”2018年版;281(1):8-27.2.ガニー·Sなど。アイティージェイエムオーエルSciです。2019;20(23):6008 IL-1βは炎症性疾患の炎症部位好中球反応を抑制する有効な標的である

9化膿性汗腺炎(HS)
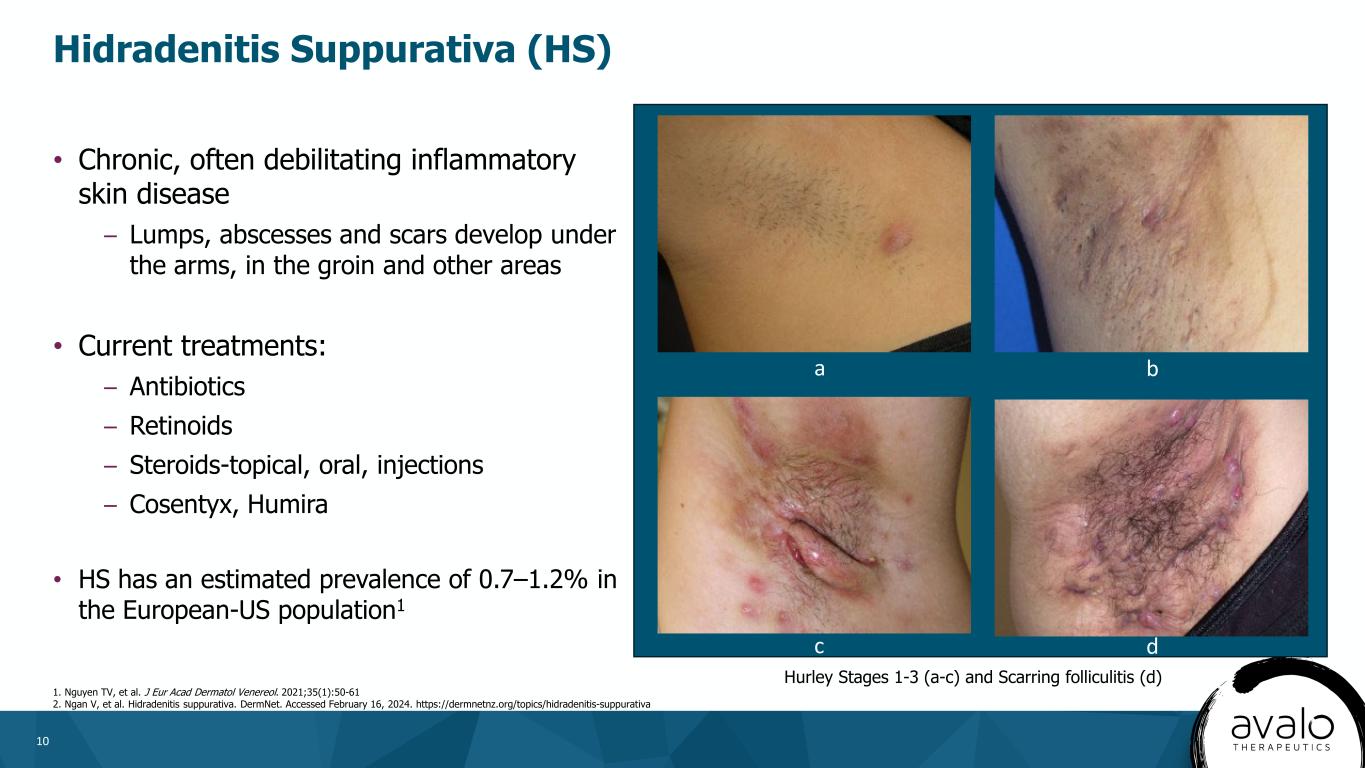
10·慢性、通常人を衰弱させる炎症性皮膚疾患である腋窩、鼠径部や他の部位に腫瘍、膿瘍、瘢痕を形成する·現在の治療法:−抗生物質−レチノイン酸−ステロイド−外用、経口、注射−Cosentyx、Humira·HSの欧米人における罹患率は0.7−1.2%と推定されている。1化膿性汗腺炎(HS)1.Nguyen TVら。J EURアカルド皮膚アルコールとヴィナノール。2021;35(1):50−61 2.顔次元等。化膿性汗管炎。DermNet。訪問期間は2024年2月16日である。瘢痕性毛嚢炎(D)c d a a b

11·HSの炎症性下落は各種の外部刺激-喫煙、生物失調或いは機械的ストレス-によって誘発された·IL-1βは毛包皮脂単位の破壊を招く炎症性下落の重要な駆動要素である-皮膚損傷中のIL-1βレベルの上昇4-抗IL-1薬物の臨床治療効果はIL-1βとHS 1の病理生理学と密接に関連する1.Calabrese L、などを観察した。生体分子です2024年;14(2):175 2.ワトソンARJVら。J·ヴィスト·ピマトです2020;140(7):1463-1466.e 2 3.Kelly GらBrJピマトールです。2015;173(6):1431-1439 4.Marzano AV,et al.皮膚科です。2022;238(5):860-869 DAMPS、損傷関連分子パターン分子;DC、樹状細胞;IL、インターロイキン性;IL-R、インターロイキン受容体;PAMPs、病原体関連分子パターン分子

12最近のHS試験の生物学的製品のベースライン患者特徴Lutik izumab試験は、競合他社試験よりも深刻な患者1.Kimball ABらを募集した。N Engl J Med.2016;375:422-34;2.Kimball ABら。柳の葉刀。2023;401:747-7613;3.米国皮膚病学会(AAD 2023),3月17-21日,ロサンゼルスニューオーリンズと2023年ヨーロッパ皮膚病と性病学学会(EADV 2023)での講演,10月11~14日,ドイツベルリン4.開発プレゼンテーション-結果Mira試験2023年6月26日https://ir.moonlaketx.com/Static-files/86 c 71 a 51-5836-4 f 1 c-9 a 2 c-45 e 440 a 50 d 75.Kimball ABら。米国皮膚病学会(AAD 2024年)での講演,2024年3月8日から12日まで,カリフォルニア州サンディエゴ,患者の特徴adalimumab Pioneer I/II 1 secukinumab日光/SUNEISE 2 bimekizumab BIRA 4 lutikizumab NCT 051396025年齢(年),平均34.9-37.8 35.5-37.3/36.7/36.6 37.6-39.5性別,女性,%59.5-69.3 54-57.0/50.7 53.8-67.6人種,白人,白人%75.8-87.7 74-81 77.8/81.5 85.0 64.9-88.9 BMI、kg/平方メートル、平均31.3-34.4-32.8 33.8/32.3 33.7 33.0-34.1喫煙、現在52.9-67.3 50-58 43.0/48.1 46.6 24.3-46.2年、平均8.8-9.9 6.6-8.2 9.0/7.0 8.5 10.0-13.2病巣、平均計数-DT 10.7-14.4 3.0-4.6 12.6-13.9 3.2-3.6 16/16.5/3.4 14.0 3.5 11.4-17.0 5.7-8.7 Hurley分期、%-I-II-III 052.3-54.6 45.4-47.7 2-6 51-60 28-46 050.3/61.1 49.7/38.9 063.7 36.3 25.6-35.1 64.9-74.4以前の生物使用,%0 20-26 25.0/13.2 17.5 100腫瘍壊死因子失敗標準に入る
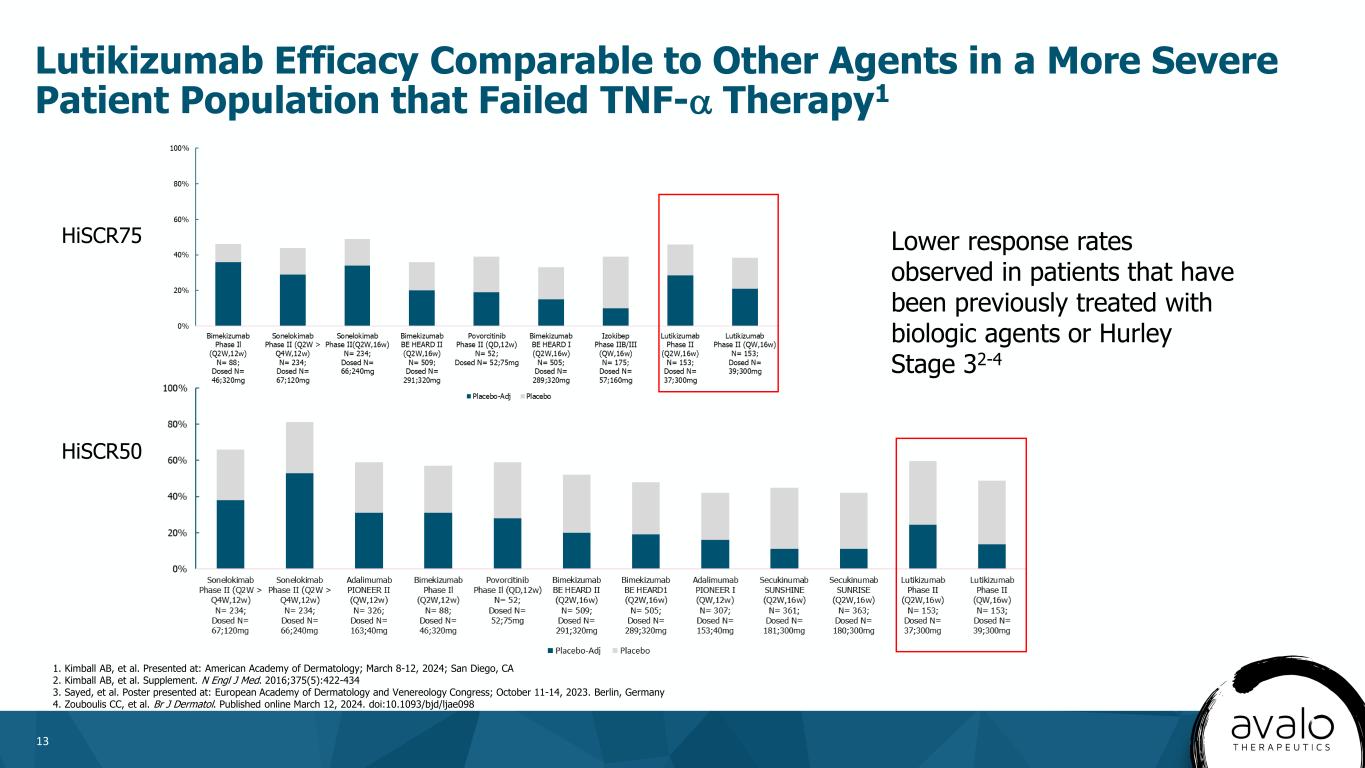
13 Lutikizumabの腫瘍壊死因子-α治療に失敗したより深刻な患者集団における治療効果は、以前に生物学的薬剤またはHurley分期32-4 1を受けた患者において他の薬剤に相当する1 HiSCR 75と比較して低い応答率を認めた。アメリカ皮膚病学会;2024年3月8日から12日まで;カリフォルニア州サンディエゴで発表された。副刊です。N Engl J Med.2016;375(5):422-434ポスターはヨーロッパ皮膚病と性病学学会大会に登場した;2023年10月11日から14日まで。ドイツベルリン4.Zouboulis CCらBrJピマトールです。2024年3月12日にオンライン配信。DOI:10.1093/bjd/ljae 098 HiSCR 50
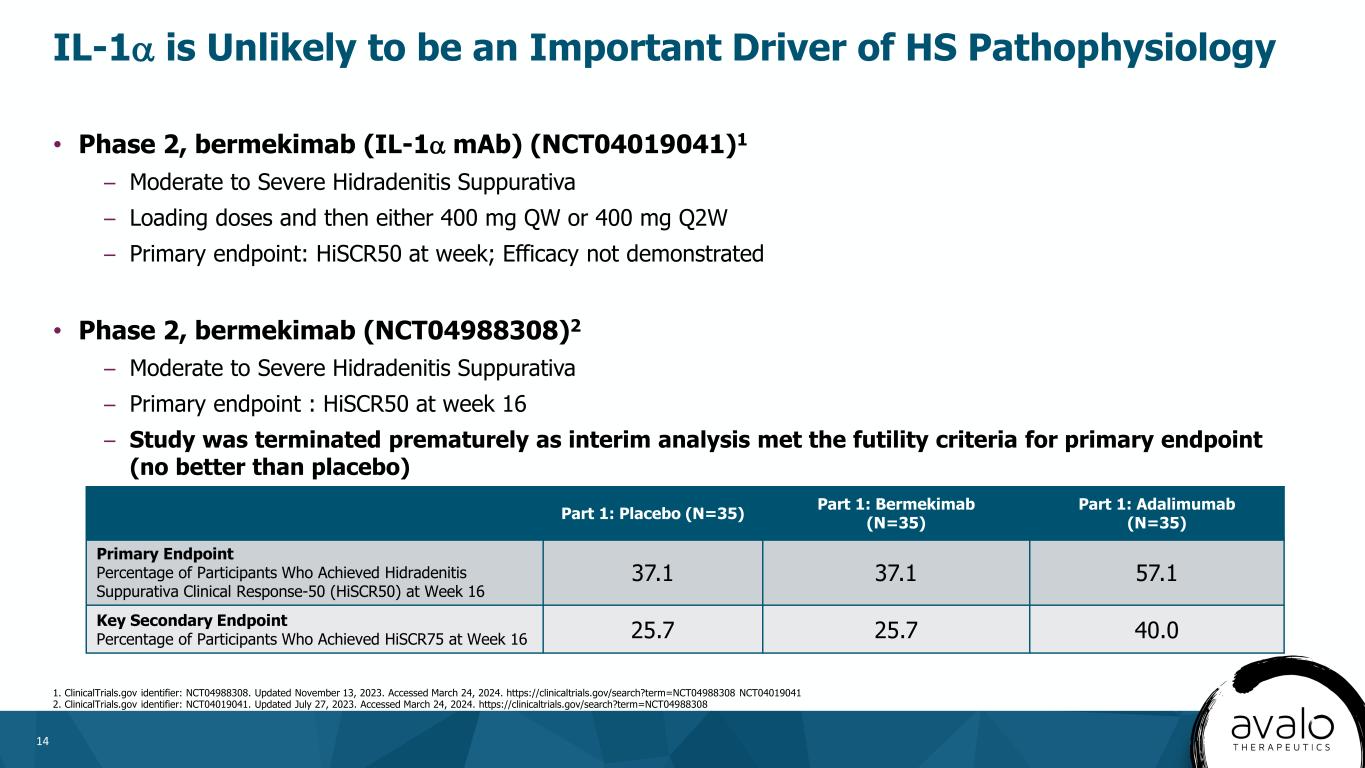
14·第2段階、Bermekimab(IL-1αモノクロナル抗体)(NCT 04019041)1-中から重度化膿性汗腺炎負荷用量、その後400 mgQWまたは400 mgQ 2 W-主要終点:毎週HSCR 50;未証明の治療効果·2期、bermekimab(NCT 04988308)2-中重度化膿性汗腺炎-主要な終点:16週時にHSCR 50-研究は早く終了し、中期分析は主要な終点の無効標準(プラセボより良くない)IL-1αを満たすため、HS病理生理学の重要な駆動要素である可能性があまりない。更新日:2023年11月13日。訪問期間は2024年3月24日である。Https://Clinicaltrials.gov/search?Term=NCT 04988308 NCT 04019041 2.ClinicalTrials.gov識別子:NCT 04019041。更新日:2023年7月27日。訪問期間は2024年3月24日である。部分1:プラセボ(N=35)部分:Bermekimab(N=35)部分:adalimumab(N=35)16週目に化膿性汗腺炎臨床反応-50(HiSCR 50)に達した参加者の主要終点パーセンテージ37.1 37.1 57.1キー二次終点参加者が16週目にHiSCR 75のパーセンテージに達した
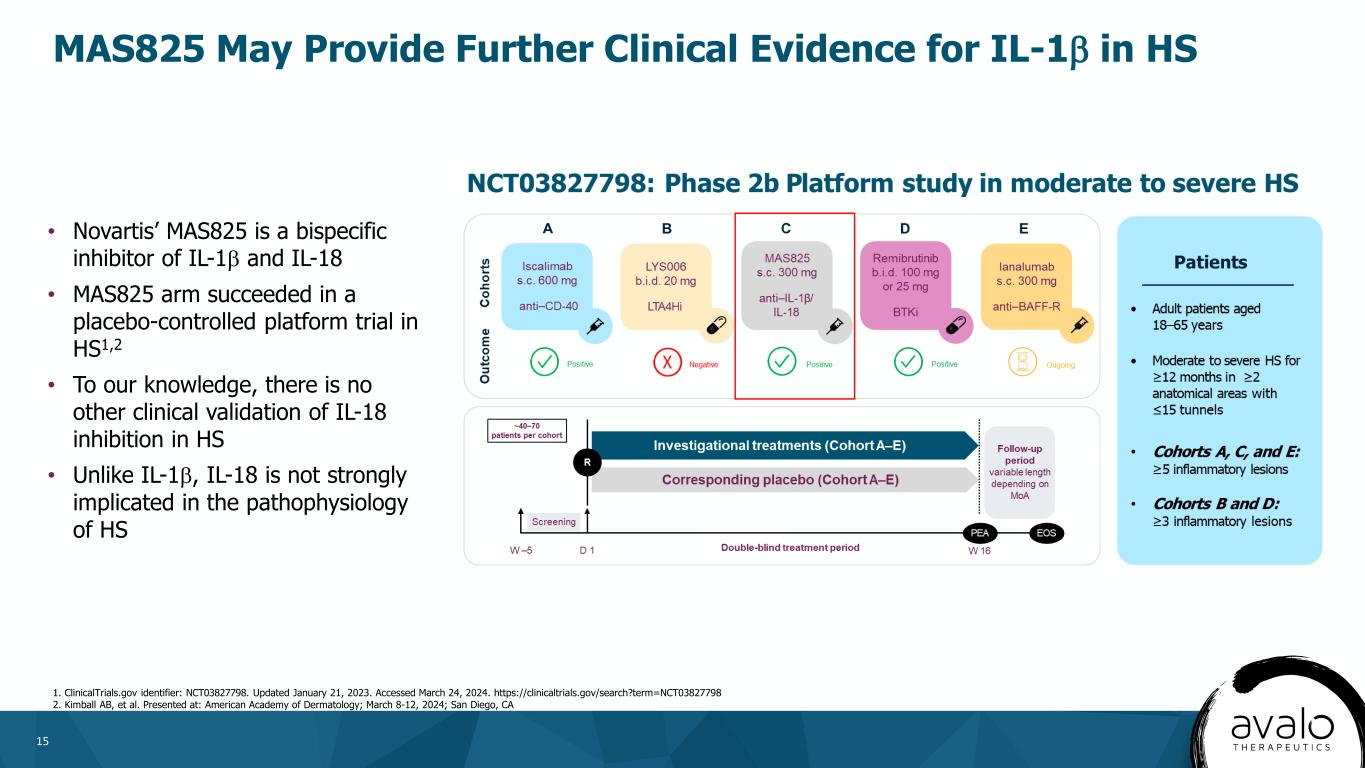
15 MAC 825は、HS 1におけるIL-1βの臨床応用にさらなる証拠を提供する可能性がある。更新日:2023年1月21日。訪問期間は2024年3月24日である。2.Kimball AB,et al.ノワール社のMAP 825はIL−1βとIL−18の二重特異性阻害剤であるMAS 825 ARMがHS 1でプラセボ対照プラットフォーム試験2·われわれの知る限り,HSではIL−18に対する抑制作用は他に検証されていない·IL−1βとは異なり,IL−18とHSの病理生理学的関係は大きくない

16·推定HS症例28%がHurley 2期,また4%がHurley 34期·多くの患者が治療案の改善を明らかに必要としている1.Biotech Value Advisors LLCの独立市場分析2.Nguyen TVら。J EURアカルド皮膚アルコールとヴィナノール。2021;35(1):50-61 3.Garg AらJAMA皮膚アルコール。2017年153(8):760-764 4.締め切り2/15/24·米国では0.7~1.2%の人がHSを患っていると推定されている。いくつかの推定2-4%2潜在的市場·HSは過小評価されて報告されているようであるが、健康記録に報告されている症例は米国人口の0.1%3を占めると推定されている·最適な結果を得るためには、量的カスタマイズされた治療には様々な療法が必要であり、HSの複数の目標を満たしていない大型未満足の需要を満たすためには、数十億ドルの販売潜在力を有するいくつかの承認された製品のスポンサーが、年間売上高1.5~3 B 1 HSが米国約240~400万人~105,000ヘルリ段階2/3~330,000人に影響すると予測されている

17個のキー二次/探索終点AVTX-009による化膿性汗腺炎治療参加者の有効性および安全性の重要な二次終点:·HiSCR 50、HiSCR 90およびHiSCR 100·安全性および耐性·PK探索終点:·バイオマーカーであるCRP、IL-6、潜在的な他のバイオマーカー·臨床診断化膿性汗腺炎(HS)は、少なくともベースラインの前年に研究者によって決定された。·ベースライン時の総膿瘍および炎症性結節(AN)数>5·HS病変は、少なくとも2つの異なる解剖学的領域に存在しなければならない。·HSキーに対して標準に組み込まれなければならない抗腫瘍壊死因子治療失敗ランダム化n=~165点(1:1:1)16 w主要終点(HiSCR 75)AVTX-009 300ミリグラムSC Q 4 Wプラセボ主な終点:16週間以内に汗腺炎化膿性臨床反応を獲得した参加者パーセンテージHiSCR 75は、化膿性汗腺炎(HS)の第2段階研究安全フォローアップ3ヶ月間の開放ラベル延長応答者AVTX-009 150 mg SC Q 2 W Lo in g D OS 600 mg 300 mg PPO試験の80%の能力が各個別腕HiSCR 75反応(Lukizumabステージ2 HiSCR 75に基づく)を示す能力があることを提案した

18個の潜在的追加適応

19·IL−1βが炎症性疾患において中心的な役割を果たす−IL−1βは炎症性小体活性化による重要なサイトカイン−調節の炎症性小体活性化異常がクローン病(CD)の発症機序·IL−1駆動に関与する間質−好中球相互作用を定義し,現在の治療が無効な患者のサブセット2,3·IBD患者とHS 4,5患者の重複IL−1βのIBDにおける役割://doi.org/10.3389/fimmu.2018.02566 1.毛L,などを定義した。前置免疫系です2018年;9:2566 2.フリードリヒ·Mら。ナイト·メード。2021年;27(11):1970-1981.3.カーデル·MZ、カーゼ·A·ナート·メド。2021年;27(11):1870-1871年4.陳衛東、遅浩田。JAMA皮膚アルコール。2019;155(9):1022-1027 5.張明など。世界J臨床症例。2021;9(15):3506-3516

20·炎症性腸疾患治療の目標は緩和である−現在の治療法は、炎症性腸疾患患者の一部のみが緩和·AbbVie計画を得ることであり、lutikizumab、UCの単一療法としてインターロイキン1α/1βアンタゴニスト、およびクローンとのSKYRIZI併用治療を評価することである。著者らはlutikizumabは連合使用の潜在力があり、転化レベルのIBD治療効果を提供すると信じている。私たちはLutikizumabとSkyrizi…の組み合わせ方法を評価する予定です。私たちの炎症性腸疾患の第二段階研究は今年の遅い時期に始まる予定です“--ロパル·タカール、グローバル治療会社首席医療官上級副社長であるAbbVie 4 Q 23収益電話会議記録·抗IL-1βを単一療法として最近開始されたIL-1炎症性腸疾患試験と組み合わせて、IBD患者の治療効果を高める機会があります

21実行概要

22.HSにおいて最適な疾患特徴を達成する可能性-効率的かつ有利な半減期は、他の自己免疫疾患における治療効果および便利な投与潜在力の改善を可能にする可能性がある·HSにおけるIL-1βの重要な臨床証拠を支持する-大型で制御が良好な第2段階試験(NCT 05139602)において、lutikizumabはHSにおいてIL-1β標的を検証した。患者はさらに深刻であるにもかかわらず、治療効果は他のHS療法に相当する1-臨床的証拠によると、抗IL-1α療法はHS 2では無効であることが示されている。3-MAC 825(IL-1β/IL-18二重特異性)は、第二段階ランダム対照研究(NCT 03827798)で陽性結果(NCT 03827798)4-単特異性IL-1β阻害作用が未検証標的(IL-18)や治療効果に貢献しないことが知られている二重特異性薬物(IL-1α)よりも優れている可能性が高いと考えられる-AVTX-009がHSで成功する可能性が高い·HSは数十億ドルの市場·HS Topline結果になりそうである。現金滑走路は2027年に要約と発展スケジュール1.金宝ABに入り、彼らの研究を待っています紹介場所:アメリカ皮膚病学会;2024年3月8日から12日;カリフォルニア州サンディエゴ。更新日:2023年11月13日。訪問期間は2024年3月24日である。3.ClinicalTrials.gov標識:NCT 04019041.更新日:2023年7月27日。訪問期間は2024年3月24日である。4.Kimball AB,et al.アメリカ皮膚病学会で発表されました2024年3月8日~12日カリフォルニア州サンディエゴ

23付録

24·2024年3月、Avaloは私募融資を行った:·総収益は1.85億ドルに達し、取引終了時の初期資金は1.156億ドル·取引終了予定時の純収益は約1.05億ドルで、2027年に現金チャネルを提供する予定·2024年3月28日に完了する予定·換算に基づいて、AlmataBio,Inc.と融資(1200万部の株式承認証の行使を除く)を計上した後、Avaloが発行した普通株の総数は約2340万株·以下のデータは12月31日までのデータである。2023年には、上記の取引は含まれていない:·現金および現金等価物-740万ドル·普通株流通株-80万株·完全希釈株式-80万ナスダック:AVTX金融および投資家情報1は1.156億ドルの前払い資金と、既承認株式証を十分に行使した際に受け取る6940万ドル。株式承認証は1株当たり約5.8ドルで行使でき,普通株または同等額(普通株に換算)の無投票権は優先株に変換可能であり,各所有者に適用されるいくつかの実益所有権制限に達した場合,発行から5年前またはAVTX−009で化膿性汗腺炎を治療する第2段階試験で初めて投与された公開発表後30日まで引受権証を行使することができる。2純収益には、私募融資およびAlmataBio,Inc.の買収推定取引コストが含まれます。推定取引コストには、私募融資終了時にAlmataBio株主が支払う750万ドルのマイルストーン支払いは含まれていません

25ナスダック:AVTX www.avalotx.com