米国
証券取引委員会です
ワシントンDC 20549
フォーム
現在のレポート
のセクション13または15(d)に従って 1934年の証券取引法
報告日(最初に報告されたイベントの日付):
(憲章に明記されている登録者の正確な名前)
| (州) または他の管轄区域 法人化の) | (委員会 ファイル番号) |
(IRS
雇用主 識別番号) |
| (住所 (主要なエグゼクティブオフィスの) | (郵便番号 コード) |
登録者の電話番号(以下を含む)
エリアコード:(
(以前の名前または以前の住所、それ以降に変更された場合は 最終報告)
Form 8-Kを提出する場合は、下の適切なボックスをチェックしてください 以下のいずれかの規定に基づく登録者の申告義務を同時に履行すること(見る一般的な指示 a.2. 以下):
| 書面によるコミュニケーション 証券法(17 CFR 230.425)に基づく規則425に従って |
| に従って資料を募る 証券取引法(17 CFR 240.14a-12)に基づく規則14a-12へ |
| 入学前のコミュニケーション 取引法(17 CFR 240.14d-2(b))に基づく規則14d-2(b)に従って |
| 入学前のコミュニケーション 取引法(17 CFR 240.13e-4(c))に基づく規則13e-4(c)に従って |
同法第12条 (b) に従って登録された証券:
| タイトル 各クラスの | 取引 シンボル (s) | 名前 登録された各取引所の | ||
登録者が本人かどうかをチェックマークで示してください は、1933年の証券法の規則405(この章の§230.405)または規則12b-2で定義されている新興成長企業です 1934年の証券取引法(この章の§240.12b-2)の。
新興国
成長会社
もし 新興成長企業です。登録者がコンプライアンスのために延長された移行期間を使用しないことを選択した場合は、チェックマークで示してください 証券取引法のセクション13(a)に従って規定された、新規または改訂された財務会計基準と一緒に。¨
| アイテム 8.01. | その他のイベント。 |
2024年3月25日に、 アストリア・セラピューティクス社(以下「当社」)は、フェーズ1b/2のアルファスターの最初の概念実証データを発表しました スター-0215の臨床試験です。
ALPHA-STARは、成人を対象とした用量範囲の概念実証試験です 遺伝性血管浮腫(「HAE」)1型または2型は、安全性、耐容性、有効性、薬物動態(「PK」)を評価するために設計されています。 STAR-0215の単回投与または複数回の皮下投与を受けた患者の薬力学(「PD」)、および生活の質 HAEでの攻撃を防ぐためです。16人の患者の目標登録が達成され、すべての用量が投与されました。すべてのコホートが始まりました ベースラインのHAE攻撃を測定するために8週間の慣らし期間を設け、安全性、有効性、PK、PDは6か月(168日目)を通して評価されます 最後に飲んだ後。有効性と安全性の最初のデータカットは、2024年3月13日現在のものです。
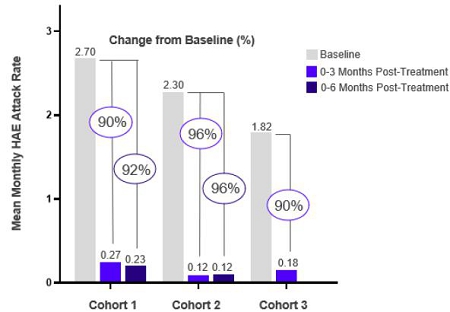
コホート1では450mgの用量を評価し、4人の患者全員が 6か月のフォローアップを完了しました。6か月のフォローアップによるベースラインと比較した有効性の観察結果は次のとおりです。
| · | 毎月の攻撃率を 92% 削減 |
| · | 中程度から重度の攻撃を 96% 削減 |
| · | 救急薬の使用量を91%削減しました |
| · | 患者の50%は、3か月のフォローアップを経ても発作はありませんでした |
コホート2では、600 mgの用量、続いて300 mgの用量を評価しました。3 数か月後の84日目に。同社はこの投与計画をフェーズ3で評価する予定です。6人の患者全員が3か月の治療を完了しました フォローアップを行い、3人の患者が6か月のフォローアップを完了しました。6か月間の有効性の観察結果をベースラインと比較しました フォローアップは以下の通りです:
| · | 毎月の攻撃率を 96% 削減 |
| · | 中程度から重度の攻撃を 98% 削減 |
| · | 救急薬の使用量を 94% 削減 |
| · | 患者の 67% は発作がありませんでした |
| · | 100% の患者さんが投薬後最初の1ヶ月で発作を起こさず、即効性が示されました |
コホート3は600 mgの用量の投与を受け、続いて600 mgの用量を投与されました 1か月後の28日目に。6人の患者のうち4人が3か月のフォローアップを完了しました。ベースラインと比較した有効性の観察結果 3ヶ月間のフォローアップは次のとおりでした:
| · | 毎月の攻撃率を 90% 削減 |
| · | 中程度から重度の攻撃を 100% 削減 |
| · | 救急薬の使用量を95%削減しました |
| · | 患者の 50% は発作がありませんでした |
次の図は、毎月の攻撃件数の減少を示しています 各コホートの料金から、必要に応じて3~6か月のフォローアップまで。
平均時間正規化月次HAE攻撃

暫定的なPKとPDのデータは、正常ではフェーズ1aのデータと一致しています 被験者で、観察された有効性と一致しています。
STAR-0215は一般的に耐容性が高く、重篤な治療法はありませんでした 有害事象(「TEAE」)で、中止はありません。治療に関連したTEAE(どちらも軽度)が2件あり、そのうちの1例が症例でした めまい、もう1つは一過性の注射部位反応(発疹)です。注射部位の痛みによる反応はありませんでした。
ALPHA-STAR試験の終了後、患者さんにはチャンスがあります 会社では3か月ごと(「Q3M」)または6か月ごと(「Q6M」)にSTAR-0215を引き続き受け取りましょう アルファソーラーの長期オープンラベルトライアル。ALPHA-SOLAR試験における第3四半期と第6四半期の投与による初期の安全性と有効性のデータが期待されています 2025年半ばに。
観察された有効性、PK、PD、安全性と耐容性のプロファイル のSTAR-0215は、STAR-0215のフェーズ3開発への進めをサポートしています。STAR-0215をできるだけ早く市場に出すために、当社は フェーズ3プログラムは、最初は第3四半期の投薬に集中し、その直後に2回目の試験を行い、第6四半期へのラベルの拡大をサポートする予定です。 規制当局からのフィードバックを待つ間、当社は2025年の第1四半期に重要な第3四半期に重要な第3四半期試験を開始し、トップラインの結果を得る予定です。 2026年末までに予定されています。
当社は、現在の現金、現金同等物、および短期を期待しています 2023年12月31日現在の2億4,650万ドルの投資に、2024年第1四半期の資金調達活動による1億3,710万ドルを加えたもの 計画されている第3四半期の完了までのすべてのSTAR-0215プログラム活動を含め、2027年半ばまでに会社に資金を提供するのに十分です 治験中の新薬申請書の提出と早期概念実証を通じて、当社のSTAR-0310 OX40プログラムを推進するとともに、フェーズ3の重要な試験を行います。 第1a相試験の結果。
将来の見通しに関する記述に関する注意事項
フォーム8-Kのこの最新レポートには 適用される証券法および規制(以下を含むがこれらに限定されない)の意味における将来の見通しに関する記述 に関する声明:フェーズ1b/2アルファスターの最初の結果の潜在的な重要性に関する私たちの期待 STAR-0215の臨床試験、そしてそのような試験から得られた良好な結果により、私たちは第3相ピボット試験に直接移行できる可能性があります HAEの潜在的な治療法としてのSTAR-0215について。第3相ピボット試験の開始と終了の予想されるタイミング STAR-0215、STAR-0310の計画された試験で予想されるデータのタイミングに関する期待、そして私たちの予想は キャッシュランウェイ。「予想する」、「信じる」、「続ける」などですが、これらに限定されません。 「できた」、「見積もる」、「期待する」、「目標」、「意図する」、「かもしれない」 「かもしれない」、「計画」、「可能性」、「予測」、「プロジェクト」 「すべき」、「ターゲット」、「意志」、「すべき」、「ビジョン」、および同様の言葉 表現は、将来の見通しに関する記述を識別するためのものです。将来の見通しに関する記述は歴史的事実でもありません 将来の業績の保証。代わりに、それらはオーストリアの現在の信念、期待、仮定に基づいています 事業の未来、将来の計画と戦略、将来の財務実績、前臨床結果と臨床結果 オーストリアの製品候補とその他の将来の状況について。実際の結果は、に示されているものと大きく異なる場合があります 次のようなリスクや不確実性を含む、さまざまな重要な要素の結果として生じるこのような将来の見通しに関する記述:変更 適用法または規制。他の経済、ビジネス、および/または競争によって悪影響を受ける可能性 要因; 医薬品の研究開発に内在するリスク、例えば:当社の創薬における有害結果、前臨床および 臨床開発活動、前臨床試験の結果が臨床試験で再現されないリスク、 臨床試験の予備的または中間的な結果は、最終結果、つまり初期段階の結果を示すものではないかもしれません 第1/第2相臨床試験の結果などの臨床試験は、後の段階の臨床試験では再現されない場合があります。 第3の重要な試験を含め、私たちの臨床試験に十分な数の患者を登録できない可能性があるというリスクがあります タイムリーに、そして当社の臨床試験のいずれかが予定通りに開始、継続、または完了しないリスク、あるいはまったく決定が下されないリスク 米国食品医薬品局およびその他の規制当局が、当社の規制について作成し、受け取ったフィードバック 潜在的な臨床試験実施施設からの臨床試験の提出物やその他のフィードバック(治験審査委員会など) STAR-0215、STAR-0310、およびその他の将来の開発候補に関するサイト、その他の審査機関。私たちの能力 STAR-0215、STAR-0310、その他の将来の製品に十分な量の原薬と製剤を製造してください 費用対効果が高くタイムリーに、そしてSTAR-0215、STAR-0310、その他の投与量と製剤を開発する候補者 患者に優しく、競争力のある将来の製品候補。バイオマーカーやその他のアッセイを開発する当社の能力、 したがって、テストプロトコル、STAR-0215、STAR-0310の知的財産権を取得、維持、行使する当社の能力、 およびその他の将来の製品候補、コラボレーションパートナーへの潜在的な依存、STAR-0215に関する競争、 STAR-0310、またはその他の将来の製品候補のいずれか。調査結果や市場調査が正確でない可能性があるというリスク HAEの商業環境の予測因子、HAEでのSTAR-0215の競争力、そして期待される位置と 現在までの臨床データ、その前臨床プロファイル、薬物動態モデリング、市場調査に基づくHAEにおけるSTAR-0215の属性 およびその他のデータ。STAR-0310の臨床試験のいずれかが予定通りに開始、継続、または完了しないリスク、またはまったくないリスク。 STAR-0310の前臨床試験の結果が臨床試験で再現されないリスクがあります。私たちの 現金使用量を管理する能力、予期せぬ現金支出の可能性を管理する能力、必要な資金を調達する能力 計画された活動を実施し、予定外の現金要件、当社の能力に関連するリスクと不確実性を管理します 追加買収、ライセンス、または同様の取引のメリット、および一般的な経済および市場状況を認識してください。 また、フォーム10-Kの年次報告書の「リスク要因」セクションで説明されているリスクと不確実性も 2023年12月31日に終了した会計年度および証券取引委員会に提出する可能性のあるその他の提出書類に記載されています。新しいリスクと 不確実性が時折現れる可能性があり、すべてのリスクと不確実性を予測することは不可能です。オーストリアは実際にはそうではないかもしれません 当社の将来の見通しに関する記述に開示されている予測または期待を達成しますが、投資家や潜在的な投資家はそうすべきではありません オーストリアの将来の見通しに関する記述に過度に依存しています。オーストリアも、その関連会社、顧問、代表者も、 新しい情報、将来の情報の結果であるかどうかにかかわらず、将来の見通しに関する記述を公に更新または改訂する義務を引き受けます 法律で義務付けられている場合を除き、イベントなど。これらの将来の見通しに関する記述は、代表的なものとして信頼されるべきではありません 本書の日付以降の任意の日付におけるオーストリアの見解。
署名
要件に従って 1934年の証券取引法について、登録者は、本書の署名者が本書に代わってこの報告書に署名するよう正式に依頼しました 正式に承認されました。
| アストリア・セラピューティクス株式会社 | ||
| 日付:2024年3月25日 | 作成者: | /s/ ベン・ハーシュバーガーさん |
| ベン・ハーシュバーガーさん | ||
| 最高法務責任者 | ||