カタログ表
製品ライン
私たちの候補製品には以下のものがあります
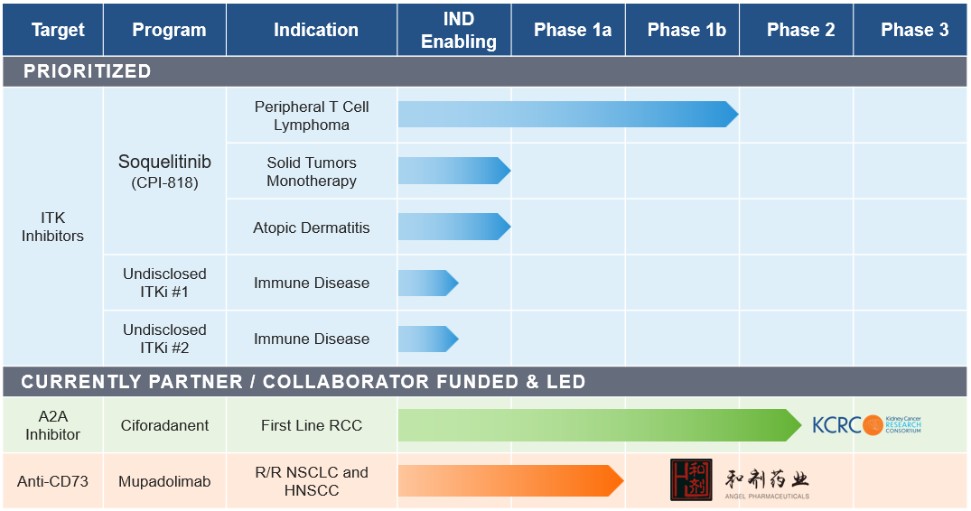
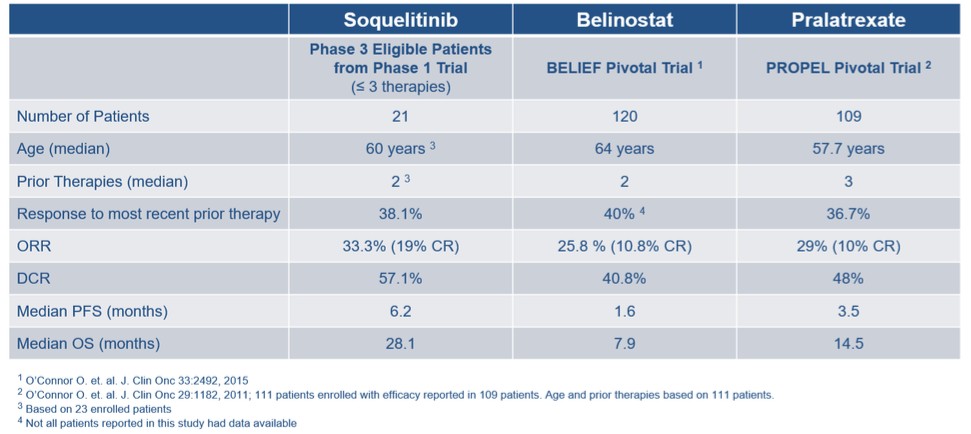
ソキリーチニブ(CPI−818),ITK阻害剤。ソキリーチニブは選択的、経口バイオアベイラビリティを研究するITK共有結合阻害剤である。ITKはT細胞シグナルや分化に作用する酵素であり,主にT細胞に発現し,T細胞は免疫反応において重要な役割を果たすリンパ球である。T細胞リンパ腫はT細胞の悪性腫瘍であり,増殖し全身に進展する。これらのリンパ腫は通常T細胞受容体経路を介して緊張性シグナルを産生し、この経路はITKに関連する。ITKを抑制することはこのシグナル経路を遮断し、腫瘍の成長を制御することができる。そのほか、リンパ腫と固形腫瘍の重要な生存機序の一つは正常T細胞の再プログラミングと考えられ、組織の中で抗腫瘍免疫反応を抑制し、腫瘍の成長に有利な環境を創造する。この酵素の高度選択性阻害剤は,正常なT細胞抗腫瘍免疫の誘導に役立ち,固形腫瘍やリンパ腫の治療に有用である可能性が信じられている。
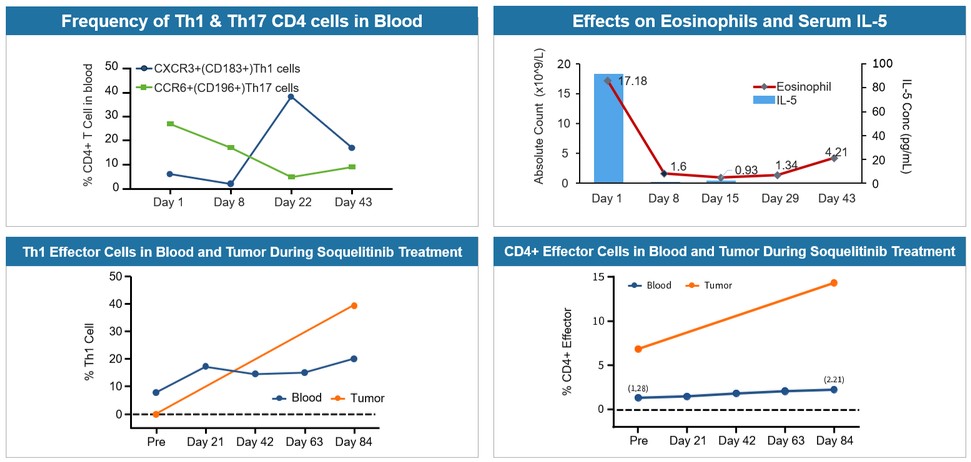
ITKを選択的に抑制することはTh 2細胞の産生や機能を遮断し,原始T細胞をTh 1細胞に分化させる傾向にある可能性があり,この過程はTh 1歪みと呼ばれる。Th 1細胞はキラーT細胞を産生し,腫瘍細胞やウイルス感染細胞を除去することができる。Th 1細胞はインターフェロン−ガンマや腫瘍壊死因子を産生し,癌細胞を破壊するサイトカインが知られている。ソキリーチニは正常免疫反応の再プログラミングを引き起こすことができ,何らかの自己免疫性やアレルギー性疾患の治療にも有用である可能性が考えられる。過剰に活発なTh 2細胞は自己免疫やアレルギー反応性疾患に作用し,Th 2機能とその炎症性サイトカインの産生を遮断することにより,ITKを選択的に抑制することが改善する可能性がある。
ITKに関連するT細胞シグナルは多くのT細胞リンパ腫の発生発展に必要である。ITK細胞のシグナル経路はB細胞中のシグナル経路に類似しており、後者はBTKと呼ばれる相同酵素によって媒介され、BTKはibrutinibの標的であり、ibrutinibはB細胞リンパ腫と白血病患者の治療方法として許可されている。ITKは多くのT細胞リンパ腫に発現し、末梢T細胞リンパ腫(PTCL)、血管免疫母細胞T細胞リンパ腫(AITL)、皮膚T細胞リンパ腫(CTCL)、間変性大細胞リンパ腫(ALCL)、ナチュラルキラーT細胞リンパ腫(NKTCL)とその他のT細胞悪性腫瘍を含む。
ITK遺伝子の発現が完全に乏しいITKノックアウトマウスでは,T細胞はT補助細胞分化やサイトカイン分泌に欠陥があるが,IL−2やIL−2を分泌する細胞傷害T細胞に分化する
2