アメリカ アメリカ証券取引委員会 ワシントンD.C.,20549
表
|
|
1934年公布の証券取引法第13又は15(D)節に基づいて提出された年次報告 |
今年度までの予算
あるいは…。
|
1934年公布の“証券取引法”第13又は15(D)節に基づいて提出された移行報告 |
中国から中国への移行期にとって、これは長い時間だった
依頼書類番号:
(登録者の正確な氏名はその定款に記載)
|
|
(米国国税局雇用主識別番号 ) |
|
|
|
|
|
|
|
(主にオフィスアドレスを実行) |
(郵便番号) |
登録者の電話番号、市外局番を含む:(
同法第12条(B)に基づいて登録された証券:
|
クラスごとのタイトル |
取引記号 |
登録された各取引所の名称 |
||
|
|
|
♪the the the |
同法第12条(G)により登録された証券:なし
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください。はい、そうです
登録者がこの法第13節または第15節(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示す。はい、そうです
再選択マークは、登録者が(1)過去12ヶ月以内に(または登録者がそのような報告の提出を要求されたより短い期間内に)1934年の証券取引法第13または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルが電子的に提出されたか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小報告会社”、“新興成長型会社”の定義を参照されたい。
|
加速ファイルマネージャ |
|
|
大規模な加速ファイルマネージャ-☐ |
規模の小さい中国報告会社です |
|
|
新興成長型企業: |
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、そうです
登録者の普通株の総時価は、関連会社実益が所有する株式を含まず、2023年6月30日現在の登録者の普通株の最終売却価格に基づいて計算すると、#ドルとなる
2024年3月22日までに
カタログ
| ページ | ||
| 前向き陳述に関する注意事項 | II | |
| 第1部 | ||
| 第1項。 | 業務.業務 | 1 |
| 第1 A項。 | リスク要因 | 29 |
| 項目1 B。 | 未解決従業員意見 | 41 |
| プロジェクト1 C。 | ネットワーク·セキュリティ | 41 |
| 第二項です。 | 属性 | 41 |
| 第三項です。 | 法律訴訟 | 42 |
| 第四項です。 | 炭鉱安全情報開示 | 42 |
| 第II部 | ||
| 五番目です。 | 登録者普通株市場、関連株主事項及び発行者による株式証券の購入 | 42 |
| 第六項です。 | [保留されている] | 42 |
| 第七項。 | 経営陣の財務状況と経営成果の検討と分析 | 42 |
| 第七A項。 | 市場リスクの定量的·定性的開示について | 54 |
| 第八項です。 | 財務諸表と補足データ | 54 |
| 第九項です。 | 会計と財務情報開示の変更と相違 | 54 |
| 第9条。 | 制御とプログラム | 54 |
| プロジェクト9 B。 | その他の情報 | 55 |
| プロジェクト9 Cです。 | 検査妨害に関する外国司法管区の開示 | 55 |
| 第三部 | ||
| 第10項。 | 役員·幹部と会社の管理 | 55 |
| 第十一項。 | 役員報酬 | 58 |
| 第十二項。 | 特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 | 62 |
| 十三項。 | 特定の関係や関連取引、取締役の独立性 | 63 |
| 14項です。 | 最高料金とサービス | 64 |
| 第4部 | ||
| 第十五項。 | 展示品、財務諸表付表 | 65 |
| 第十六項。 | 表格10-Kの概要 | 68 |
| サイン | ||
| 独立公認会計士事務所報告 | ||
| 財務諸表 | F-1 | |
i
前向き陳述に関する注意事項
本年度報告における10-K表は、1933年証券法(改正)第27 A節及び1934年証券取引法(“取引法”)第21 E節の意味に適合する前向き陳述を含む。
場合によっては、“予想”、“仮説”、“信じ”、“継続”、“可能”、“推定”、“予想”、“可能”、“進行中”、“計画”、“潜在”、“予測”、“プロジェクト”、“すべき”、“すべき”、“将”、“将”、またはこれらの用語または他の同様の用語の否定によって、前向き陳述を識別することができる。すべての展望的声明書がこのような単語を含んでいるわけではないにもかかわらず。前向き陳述は将来の業績や結果の保証ではなく、必ずしもこのような業績や結果を実現する時間や方式を正確に説明するとは限らない。展望性陳述は、陳述を行う際に得られる情報に基づいて、既知および未知のリスク、不確実性および他の要素に関連し、これらのリスク、不確実性および他の要素は、本報告における前向き陳述明示または示唆の情報とは大きく異なる結果、活動レベル、業績または成果をもたらす可能性がある。これらの要素には
|
● |
私たちは多様性とそれに応じたリスクが足りず、私たちの会社に投資しています |
|
● |
多元化が実現できなかったため、私たちの財務状況と業績は悪化する可能性がある |
|
● |
私たちは新製品候補製品の買収と統合運営に成功することができます |
|
● |
私たちは受け入れ可能な条件や根本的に不要な方法で追加資本を獲得して、私たちの業務計画を実施することができます |
|
● |
Ia/Ib期とII期臨床試験の結果 |
|
● |
無作為第3段階臨床試験の進展と成功 |
|
● |
候補製品の安全性と有効性を証明することができます |
|
● |
私たちはアメリカ、EU、または他の国際市場で私たちの候補製品の規制を承認することができます |
|
● |
私たちの候補製品の市場受容度と将来の販売状況 |
|
● |
我々の候補製品に適用される規制変更は、製品開発コストと遅延を招く可能性がある |
|
● |
第三者支払者との返済計画の進展速度 |
|
● |
競争の技術と市場発展の影響 |
|
● |
特許出願の提出及び起訴並びに特許請求の執行又は弁護に係る費用; |
|
● |
“リスク要因”というタイトルの他のリスク要因は、本報告の30ページから始まる。 |
“リスク要因”に記載されている事項および本報告書に記載されている他の警告説明を読むべきであり、これらの説明は、本報告書に出現するすべての関連する前向きな陳述に適用される。私たちはあなたに、この報告書の展望的陳述が正確であることが証明されることを保証することはできません。したがって、前向き陳述に過度に依存しないように奨励します。あなたはこの報告書を完全に読まなければならない。法的要件を除いて、私たちの状況が未来に変化する可能性があっても、このような前向きな陳述を更新したり修正したりする義務はない。
発表の日だけに意見を発表する前向きな陳述に過度に依存しないように読者に戒め,前向き陳述が将来の結果の予測であることを認識し,予想通りには起こらない可能性がある。本年度報告第I部第1 A項に記載されているリスクおよび不確実性、および我々が重要ではないと考えられているか、または現在予想されていない他の要因により、実際の結果は、前向き陳述で予想されているものおよび歴史的結果とは大きく異なる可能性がある。私たちは展望的な陳述に反映された予想が合理的だと信じているが、私たちは私たちの予想が正しいことが証明されるかどうか分からない。展望的陳述に反映される予想は、本年度報告の第1部1 A項に記載されたリスクおよび不確実性を含む、我々が行う可能性のある不正確な仮定の影響を受けるか、または既知または未知のリスクおよび不確実性の影響を受ける可能性がある。本年度報告第I部第1 A項に記載されているリスク·不確定要因は排他的ではなく、当社の財務業績や状況に大きな影響を与える可能性のある要因を含む、当社の業務に関するさらなる情報が時々出現する可能性がある。実際の結果を反映して、またはそのような前向き陳述に影響を与える要素または仮説の変化を反映するために、前向き陳述を更新する義務はない。我々は、株主および投資家が、米国証券取引委員会(“米国証券取引委員会”)に提出または提出された後続の10-Kフォーム年次報告、10-Qフォーム四半期報告、および現在の8-Kフォーム報告で作成される可能性のある関連テーマの任意のさらなる開示を参照することを提案する。
II
第1部
プロジェクト1.ビジネス活動
Panbela治療会社とその完全子会社Panbela Research,Inc.,癌予防製薬有限会社(アイルランド)と癌予防製薬会社(総称して“私たち”,“Panbela”,“会社”)が存在する主な目的は,破壊的療法を開発し,緊急医療ニーズのある患者の治療に用いることである。Panbela Treateutics Pty LtdはPanbela Research,Inc.の完全子会社です。癌予防製薬有限責任会社と癌予防製薬有限会社(イギリスとウェールズ)は癌予防製薬会社の完全子会社です。わが社のオリジナル業務実体は2011年にデラウェア州の法律に基づいて設立されました。“普通株”という用語は私たちの普通株を意味し、1株当たり0.001ドルの価値がある
がん予防製薬会社買収完了
2022年6月15日、Panbelaは合併により個人臨床段階会社を買収し、(A)2023年6月15日まで保持された普通株(合併協定の定義による)を含む304株の普通株を含み、(B)加重平均発行価格で1株6,743.41ドルで最大42株の普通株を購入する代替オプションを含む癌およびまれな疾患のリスクおよび再発を低減する療法を開発した。(D)株式承認証をリセットし、1株6720.00ドルの加重平均行権価格で最大4株の普通株を購入し、取引完了後に最高6000万ドルまたは支払いがあるが、マイルストーンの要求を満たす必要がある
持株会社再編
Panbelaは2022年6月15日からホールディングスによりPanbela Research,Inc.(前身はPanbela Treateutics,Inc.,“前身”)の後続発行者に再編され,前身はPanbelaの直接完全子会社となった。Panbelaは改正された1934年の証券取引法(“取引法”)により公布された第12 G-3(A)条規則により前身の後継者となった。
逆株分割
2024年1月18日、会社普通株の20株(1:20)の割合で逆株式分割を行った。2023年6月1日には、会社普通株の30株(1:30)の割合で逆株式分割を行い、2023年1月13日には、会社普通株の40株(1:40)の割合で逆株式分割を行った。私たちの普通株のすべての株と1株当たりの金額はこれらの逆株分割を反映するために遡及調整されている。
業務の概要
Panbelaは臨床段階の生物製薬会社であり,破壊的療法を開発し,緊急医療ニーズのある患者の治療に用いられている。著者らは現在、著者らが膵臓癌を治療する無作為二重盲検プラセボ対照臨床試験に参加する患者を募集しており、これはアメリカ国家癌研究所(NCI)が援助した第三段階の臨床試験であり、結腸癌リスクの低下と結腸腺腫治療(CAT)を研究することを目的とし、これは結腸直腸癌の生存者或いはハイリスク結腸ポリープに対する予防的治療方法である。そのほか、著者らは家族性腺腫性ポリープ症(FAP)のために第三段階登録試験を設計しており、FAPは稀な遺伝性疾患であり、数千例の結腸直腸腺腫(即ち腺腫性ポリープ)の成長を招くことができ、後者は結腸癌の重要なリスク要素と考えられている。私たちはまた、(1)青少年糖尿病研究財団によって支援された早期発症1型糖尿病治療の第1段階および第2段階臨床試験、(2)米国国立癌研究所によって援助された胃癌治療の第2段階臨床試験、(3)STK 11変異を有する非小細胞肺癌(“NSCLC”)の第1/第2段階臨床試験の治療、(4)転移性去勢抵抗前立腺癌の治療の第2段階臨床試験、および(5)孤児疾患および癌分野で支援されている我々の第2段階前研究を含む、研究者によって開始され、会社によって支援されたいくつかの前臨床試験を支持する。
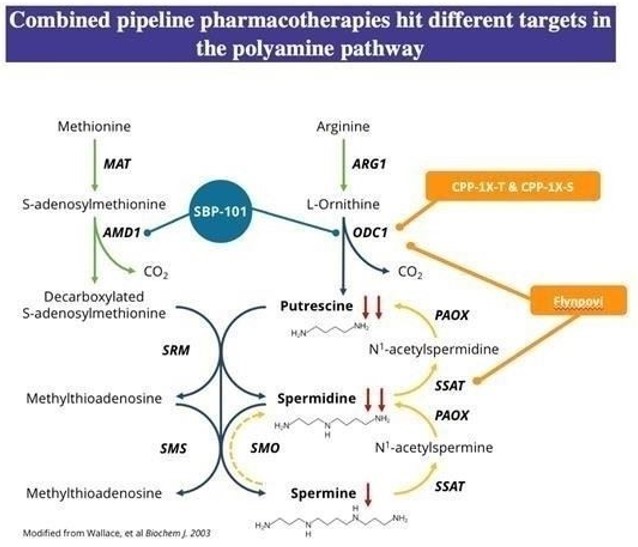
同社の主な資産はアスピリン(SBP−101),フリリンポヴィであるTMEflornithine(CPP-1 x)およびeflornithine(CPP-1 x)は、癌および自己免疫のような多くのタイプの疾患に存在する障害の生物学をリセットするための多標的の方法を提供する。多くの腫瘍はそれらの成長と生存を支持するために大量の上昇したポリアミンを必要とする。これらの薬剤は相補的なリンカーであるポリアミン経路を標的としており,これらの結合が疾患で変化することが証明されている。特に、我々の鉛資産は腫瘍の成長を抑制と防止し、他の抗癌薬の抗腫瘍活性を増強し、免疫系を調節する潜在力がある。
エピピミンはポリアミン代謝抑制を誘導することを目的とした独自のポリアミン類似体である。アスピリンは膵癌患者の臨床試験で鼓舞的な抗転移疾患活性を示す。著者らが完成したI期臨床試験において、エビスタチンはゲシタビンとNAB-パクリタキセルを併用して転移性膵臓癌を治療する有効性と安全性結果は現在の無作為、二重盲検、プラセボ対照研究に支持を提供し、この研究は以前治療を受けていない転移性膵臓癌患者に伊司アスピリンとゲムシタビンとNAB-パクリタキセルの併用に支持を提供した。開発が成功すれば,伊司アスピリンは膵癌患者を有効に治療する新しい方法を代表し,この市場の主導的な製品になる可能性があると信じている。過去10年間に、2種類の連合化学療法方案、即ちテトラフルオロウラシル、亜葉酸カルシウム、イリノテカンとオキサリプラチン(FOLFIRINOX)と二連方案、ネバパクリタキセルとゲムシタビンはすでに第一線の治療標準として使用された。1つ目はIII相に基づく試験であるが,食品·薬物管理局(FDA)の承認は得られず,後者はFDAの承認を招いたIII相試験に基づいている。最近、FDAは成人転移性膵臓癌を治療する第一線の薬物としてOnivyde(イリチコンリポソーム注射剤)とオキサリプラチン、フルオロウラシルと亜葉酸カルシウム(NALIRIFOX)の併用を許可した。FDAが一線mPDACを承認したのは10年以上ぶりだ。アスピリンは米国で膵癌治療の急速チャネル状態と孤児薬物指定状態を獲得し,ヨーロッパでも孤児薬物指定を受けている。
私たちは2022年6月にCPPを買収し、様々な形で会社の第二の主要資産であるエフルオロオルニチンを増加させた。まず,1つの研究における新薬Flynpoviは,ポリアミン合成阻害剤であるエフルオロオルニチンと非ステロイド抗炎症薬であるスリン酸の組み合わせであり,次いでエフルオロオルニチンが単一薬物として用いられている。エフルオロオルニチンは酵素活性化の不可逆的オルニチン脱炭酸酵素(ODC)阻害剤であり、ODCはポリアミン生合成における第一種の律速酵素である。スリン酸は非ステロイド性抗炎症薬(NSAID)の一種であり、ポリアミンの出口と分解代謝を促進する。Flynpoviは独特な二重作用機序を有し,新しいポリアミンの合成を抑制し,食事や微生物群におけるポリアミンの出口と分解代謝を増加させる。Flynpoviはユニークであると信じられており,FAP手術や大腸癌のリスク因子(例えばポリープ)を治療するために設計されているため,様々なタイプの大腸癌を予防することが可能である。FAP−310第3段階試験では,成人FAP患者におけるFlynpovi(エフルオロオルニチン(CPP−1 X)とスルリン酸)の治療効果と安全性を行い,いずれかの薬剤単独使用と比較した。この研究は期待に達していないが,主な複合終点(Burkeら)である。2020年),ある専門的な分析では,併用群の患者は48カ月に及ぶ下胃腸(LGI)手術が必要となっていないのに対し,シュリン酸とエフロン群の患者はそれぞれ13.2%と15.7%(Balaguerら)であった。2022年)。これらのデータは,併用療法と単一治療の間でLGI手術が必要なリスクが100%近く低下していることに対応している。LGI群の統計学的意義を考慮して、FDAに新薬申請(“NDA”)を提出したが、これは探索的分析に基づく結果であるため、完全な返信を発表した。この欠陥問題を解決するためには,同社は1つまたは複数の十分かつ良好に制御された臨床試験の結果を提出し,臨床終点への影響を証明しなければならない。FAPに対する薬物療法は現在のところ承認されていない。
他の計画は、胃癌の予防、最近発病した1型糖尿病、転移性去勢が前立腺癌およびSTK-11変異に抵抗するNSCLCを含む単剤錠剤エフルオロオルニチンまたは高用量粉末エフルオロオルニチンカプセルのいくつかの適応を評価している。臨床前研究と第一段階或いは第二段階の研究者が開始した試験により、エフルオロオルニチンの治療耐性は良好であり、潜在的な活性を有することを表明した。
Flynpoviは米国でFast Track称号を獲得し,米国とヨーロッパでFAPの孤児薬物称号を獲得した。また,エフロンは米国やヨーロッパで神経芽細胞腫治療の単一薬剤として,米国で胃癌を治療する孤児薬として指定されている。
臨床試験
アスピリン(SBP−101)
2015年8月、FDAは我々の研究新薬(IND)の私たちのIVOSPEMEN候補製品に関する申請を受けた。著者らはすでに過去に治療した局部末期或いは転移性膵臓癌患者に対する初歩的な臨床試験を完成した。これは第1段階の人類初の用量逓増安全性研究である。2016年1月から2017年9月まで,I期試験の用量増加段階で,29名の患者を6つのキューあるいはグループに組み入れた。いずれの用量レベルでも薬物に関連する骨髄毒性あるいは末梢神経病変は認められなかった。安全性評価を受ける以外に、29名の患者の中の23人は第1の治療周期の終了前或いは8週間の終了時に固形腫瘍反応評価標準(RECIST)を用いて初歩的な治療効果信号を評価することができ、RECISTは現在公認されている腫瘍の大きさの変化を評価する標準である。この完成した臨床試験の安全性と初歩的な治療効果信号の要約は後でIに含まれるボルスミン(SBP-101)の臨床研究進展–膵臓癌、第一段階臨床試験設計と完成(伊維司明単一療法)。
2018年,われわれの第2の臨床試験に参加する患者を募集し始めたのはIa/Ib期研究であり,アスピリンと2種類の標準看護化学療法薬ゲムシタビンとNAB−パクリタキセルの併用の安全性,有効性,薬物動態を検討することを目的とした。計25名の被験者が4つのキューに参加し,用量レベルとスケジュールを評価した。また25名の被験者が試験の拡張段階に参加した。中間結果は2022年1月に発表された。評価可能な被験者(キュー4とIBN=29)では,最適反応は完全緩解(CR)1例(3%),部分緩解(PR)13例(45%),安定期(SD)10例(34%),進行性疾患(PD)5例(17%)であった。1人の被験者はRECIST腫瘍評価のベースライン後スキャンを受けなかった。中位無進展生存期間(PFS)は現在最終的に6.5ケ月であり、すでに薬物投与量中断の負の影響を受けた可能性があり、潜在的な毒性を評価する。2022年1月にデータを公表したところ,キュー4+Ib期患者の平均総生存期間は12.0カ月であり,現在最終的には14.6カ月であった。列2の2人の患者は、1人の患者が30.3カ月(最終データ)であり、もう1人の患者が33.0カ月であり、2022年3月18日まで生存していることを証明している。2022年3月18日までのデータ遮断日には7名の被験者が生存しており,そのうち1名は第2群,6名は第4群プラスIbからであった。研究設計、安全性、仮治療効果信号の詳細については、以下の“ビジネス”の節を参照されたいプロポフォール(SBP−101)の臨床応用進展–膵癌、Ia/Ib期臨床試験中期結果(第一線併用治療).
われわれのIa/b期研究で示した安全性結果と腫瘍成長抑制は2022年1月に開始したアスピリン無作為研究を支持した。この試験はASPIRE試験と呼ばれ、ランダム、二重盲検、プラセボ対照試験であり、ゲムシタビンとNAB-パクリタキセルを併用し、以前治療を受けていなかった転移性膵臓癌患者に応用されている。この実験は世界的にアメリカ、ヨーロッパ、アジア太平洋地域の約95地点で行われている。ASPIRE試験は2022年に始まり,すべての国で登録が開放されている。
ASPIRE試験は全体生存率の評価を主な終点とし,中期分析で検査を行う。またPFSを分析し、追加の治療効果証拠を提供する。この試験設計はIa/Ib期の一線転移性膵臓癌試験の最終データの支持を得ており、この試験は2020年12月に登録を完了した。ASPIRE研究は600名の被験者を募集し,登録まで36カ月を要する予定であり,中期分析は2024年中に提供される。独立データセキュリティ監視委員会はすでに2回の会議を開催しており,最近では2023年11月である。DSMBメンバーは214名の患者の安全性を評価した。2回のdsmb会議の結果,セキュリティ問題がないことが確認され,実験は継続し,何の修正もなかった.同社は2024年1月25日、ASPIRE試験の登録者数が50%を超えており、2025年第1四半期に全面的に導入されると発表した。研究設計と期待時間に関するより詳細な情報は本“ビジネス”の節以降であるプロポフォール(SBP−101)の臨床応用進展–膵臓癌、無作為臨床試験設計と期待時間(ASPIRE試験)。
FDAが推奨するすべての臨床研究を成功させれば,FDA,欧州医薬品局(EMA)(EU),治療薬物管理局(TGA)(オーストラリア)の上場許可を求める予定である。米国やヨーロッパでは孤児薬に指定されているため,米国やヨーロッパでの提出費用を免除することができる。
同社は2022年4月初め、米国癌研究協会年次総会で、卵巣癌ポリアミン代謝調節剤としてのアスピリン(SBP-101とも呼ばれる)の研究結果を重点的に紹介したポスタープレゼンテーションを発表し、その後、2022年6月に“国際分子科学誌”(Holbertら)に発表した。2022年)。ポスターや出版物では,VDID 8+卵巣癌細胞を投与したC 57 BL/6マウスはアスピリン治療を受け,生存期間を有意に延長し,全体の腫瘍負担を低下させたと結論している。これらの結果は,エビスタチンが卵巣癌の臨床治療に機能している可能性を示唆しており,同社は卵巣癌の臨床前と臨床研究を継続しようとしている。2023年4月、同社は卵巣癌の追加臨床前作業を重点的に紹介するポスタープレゼンテーションを発表した。このポスターはSBP-101と標準看護化学療法薬物の併用による白金耐性卵巣癌の治療効果を強調した。ゲムシタビン、トポテカン、アドリアマイシンの治療は著しく増加したことが証明されています体外培養シスプラチンに対するSBP-101の感受性と薬剤耐性卵巣癌細胞の毒性。パクリタキセルとドセタキセルは追加的なメリットがないことが証明されています体外培養SBP-101だけですポスターの結論は,VID 8を含むC 57 BL/6マウスに対する治療である+SBP-101とアドリアマイシンを併用した卵巣癌患者は生存期間を明らかに延長し、総腫瘍負担を低下させた。
他の臨床前作業は進行中であり,多発性骨髄腫(細胞系)におけるエフロキサシンとエフルオロオルニチン(CPP−1 xあるいはDFMOとも呼ばれる)の役割を評価している。11月の“血液”誌増刊に発表されたデータは,エビアスピリンとCPP−1 Xが骨髄腫細胞系の体外成長と活力に及ぼす影響を調べた。結果により、エスプミンとCPP-1 X処理は1組の多発性骨髄腫細胞系の細胞増殖を明らかに抑制し、そのアポトーシスを誘導した。アスピリンとCPP−1 Xを併用した場合,細胞成長はほぼ完全に消失した。これらの結果はエスプミンとCPP−1 Xの抗腫瘍潜在力を証明し,その臨床開発が潜在的に有望な多発性骨髄腫治療案に納得できる理由を提供した。この仕事は,同社がテキサス大学MD Anderson癌センターの研究者と協力し,ポリアミン代謝阻害剤療法とCAR−T細胞療法の組み合わせを臨床前モデルで評価していることを反映している。
フリリンポヴィ
2009年12月、FDAは私たちの共同製品FlynpoviのIND申請を受け入れた。Flynpoviは、再発した結腸腺腫、特にハイリスク癌前ポリープを予防するために、NCIが支持する無作為、プラセボ対照のIIb/III期臨床試験で有望な結果を示した。この試験では、散発性腺腫を切除した375名の患者がエフルオロオルニチン(500 mg/d)+舒林酸(150 mg/d)の3年間の治療を受けた[N = 191])または一致するプラセボ/プラセボ(N=184)。その結果,プラセボと比較してプラセボと比較して能動併用療法は異時性腺腫発生リスク(70%),進行腺腫発生リスクは92%,多発性腺腫発生リスクは95%(Meyskensら)と有意に低下した。2008年)。この併用療法は全体的に耐性が良好であった。
散発性とFAP関連性腺腫性ポリープ症の発病機序が類似していること、及びFlynpoviが散発性腺腫とFAP患者の進行性ポリープの予防における作用機序を考慮して、FAPは第三段階計画を開始し、そして西南腫瘍学グループ(“SWOG”)とアメリカ国家癌研究所と協力して第三段階計画を開始し、結腸癌リスクの低減を研究した。
2019年に完成したFAP−310第3段階研究では,いずれかの薬剤単独と比較して,エフロンとスルリン酸の併用による家族性腺腫性ポリープ症を有する成人の治療効果と安全性を検討した(Burkeら)。2020)。患者は1:1:1の割合でランダムに分配し、エフルオロオルニチンと/またはスリン酸を毎日1回服用し、最長48ケ月間持続した。事件発生時間分析における評価の主要な終点は疾病進展であり、大手術、内視鏡下末期腺腫切除、直腸或いは直腸袋高度非典型的増殖の診断、或いは十二指腸疾患の進展と定義される。計171名の患者がランダムにグループ分けを受けた。エフロン−スルリン酸群56名中18名(32%)に疾患進展が認められ,舒林酸群58名中22名(38%),エフロン酸群57名中23名(40%)が悪化し,危険比は0.71(95%信頼区間)であった[語彙表]スリン酸と比較してエフロン−スリン酸は0.39~1.32(P=0.29)であり,エフロン酸と比較して0.66(95%CI,0.36~1.23)(Burkeら)であった。2020)。各治療群の副作用と深刻な副作用は類似している。1件後の分析では,併用群の患者は48カ月間LGI手術が必要に進展しなかったが,シュリン酸とエフロン群の患者はそれぞれ7名(13.2%)と8名(15.7%)であった(Balaguerら)。2022年)。これらのデータは,併用投与と単一投与と比較してスリン酸およびエフルオロオルニチンのHR=0.00(95%信頼区間,0.00−0.48;p=0.005)およびHR=0.00(95%信頼区間,0.00−0.44;p=0.003)の併用投与が単一投与と比較して胃腸損傷手術のリスクが100%近く低下していることを示している。LGIグループの統計学的意義を考慮して、FDAは秘密保持プロトコルを提出した。研究は主な終点に到達できなかったが,秘密保持プロトコルは探索的分析の結果に基づいているため,完全な返信を送信した.この欠陥問題を解決するためには,同社は1つまたは複数の十分かつ良好に制御された臨床試験の結果を提出し,臨床終点への影響を証明しなければならない。
NCIとSWOGの協力のもと,結腸癌生存者としてFlynpoviが使用する治療法の利点を検討するための第3段階臨床試験が開始されている。この試験は“エフルオロオルニチンとシュリン酸による腺腫や癌予防”と命名された。PACE試験はNCIが援助し,SWOGが管理している。0−III期結腸癌または直腸癌患者の高リスク腺腫および第2原発結腸直腸癌の再発を予防するための第3段階二重盲検プラセボ対照試験が行われている。この研究の目的は,Flynpovi(対応するプラセボと比較して)が1日3年間服用した後,対照ARMと比較して癌または高リスク腺腫の再発率が低下しているかどうかを評価することである。規制と商業目的のために、私たちは実験からのデータの独占的な権利を持っている。その会社は連合とアジアでのCATオプションを評価している。
2023年4月、同社は、CPPとOne-Two Treateutics Assets Limitedとの間の許可協定が2023年7月4日から終了したため、FAP患者においてFlynpoviを開発および商業化する北米権利を再取得したと発表した。
エフルオロオルニチン(CPP−1 X)とエフルオロオルニチン(CPP−1 X−S)
上には モノクロニチンのほかに,今年開始したSTK 11変異非小細胞肺癌患者のI/II期試験と,最近開始されたI型糖尿病とエフロン酸を併用した転移性去勢抵抗前立腺癌のII期試験を評価するためのエフルオロオルニチンカプセル(CPP−1 X−S)を評価する試験が行われている試験と,転移性去勢抵抗前立腺癌治療のためのII期試験が昨年から始まった。最後に,エフルオロオルニチンによる胃癌予防を評価する第2段階試験は2021年に完了し,データ解析が行われている。
2024年3月22日までに私たちは
|
● |
アスピリンの孤児薬名を米国食品·薬物管理局から得た |
|
● |
INDのエビスタット申請に対するFDAの承認を提出し、受信する |
|
● |
転移性膵管腺癌患者のIa期単剤治療の安全性研究を完成する |
|
● |
FDA指定された転移性膵癌治療のためのイビアスピリンの“迅速チャネル”を得る |
|
● |
私たちの2つ目の試験では、以前転移疾患で治療を受けていなかった膵管腺癌患者に対する第一線の研究であるIa/Ib期の臨床研究である中期結果を登録し、50人の被験者が参加し、そのうち25人がIa期、25人がIb期または拡張期であった |
|
● |
ジョンホプキンス医学院と2年間の研究協定を締結し、国際公認のポリアミン生物学研究員ロバート·カセロ教授が指導した |
|
● |
完成したプロセス改善措置は、商業用途のために普及することが予想され、いくつかの地域で、このような新しい短いアスピリン合成に関する特許の問題通知を受けた |
|
● |
無作為、二重盲検、プラセボ対照研究を開始し、ASPIREと呼ばれ、以前転移疾患で治療を受けていなかった膵管腺癌患者の中で、伊司アスピリンとゲムシタビンとNAB-パクリタキセルを連合投与した |
|
● |
完成した臨床前評価:術前に膵臓癌を切除可能な新しい補助治療のためのエビスタチン; |
|
● |
卵巣癌腫瘍成長抑制活性の早期、臨床前適応を獲得し、ASCO-GIとAACR会議で結果を公表した |
|
● |
USANがSBP−101に対して採用した非特許名伊文司普明を受信した |
|
● |
CPPを買収·統合し、多様な形で第2のリード資産を増加させ、臨床前から登録レベルまでの臨床試験の拡張臨床開発計画 |
|
● |
EMA孤児医薬製品委員会はPanbelaが孤児者の指定を申請した伊司アスピリンとゲムシタビンとNAB−パクリタキセルの併用による転移性膵管腺癌患者の治療に積極的な意見を発表した |
|
● |
インディアナ大学によるエフルオロオルニチンによる早発性I型糖尿病治療の第2段階計画の開始を発表した |
|
● |
ASPIREはノースカロライナ州、ヨーロッパ、中東、アフリカ、アジア太平洋地域の各計画国/地域に開放登録され、ASPIREのために2回の独立したDSMB会議を完了し、安全問題がないか、研究設計を修正する |
|
● |
STK 11変異を有する非小細胞肺癌のI/II期臨床試験の開始をモフェット癌センターにより開始することを発表した |
|
● |
テキサス大学MDアンダーソン癌センターと協賛研究協定を締結し、臨床前モデルにおいてポリアミン代謝阻害剤療法とCAR-T細胞療法の結合を評価した |
|
● |
SWOG癌研究ネットワークのPACE S 0820の第3段階試験が単一計画の無効性分析に合格し、継続することを発表した |
|
● |
米国WorldMeds社が小児神経芽細胞腫へのエフルオロオルニチン(DFMO)の許可を承認したことを発表し、腫瘍学で初めてポリアミンを承認した |
|
● |
ASPIRE全世界の臨床試験に参加した人数は50%を超えた。 |
すい臓がん
膵癌はヨーロッパでは約151,000人が影響を受けている(“ヨーロッパ疫学とハイリスク群スクリーニング提案”,Partykaら,2023年7月),米国では毎年約64,000人(米国癌協会。“2023年癌事実と数字”。ジョージア州アトランタ:米国癌協会;2023年膵癌概要)や世界29.3,000人−ヨーロッパや米国(GLOBOCAN 2020)は含まれていない。ヨーロッパ第4位の癌死亡原因(GLOBOCAN 2020)と米国第3位の癌死亡原因(SEER癌統計概況2021)として決定されている。平均的には,膵管腺癌(“PDA”)は所与の例年診断されたすべての膵癌の約95%を占めている。2つの最もよく用いられる治療案を考慮すると,以前治療を受けておらず状態が良好であった患者の総生存期間の中央値は8.5カ月(Von Hoff 2013)から11.1カ月(Conroy 2011)の間であり,有効なPDA治療は依然として主要な未満足医療需要である。
膵臓癌は通常早期診断ができず、最初の臨床バイタルサインと症状は曖昧で非特異的であるため。最もよく見られる症状は体重減少、上腹部(腹部中央上部)および/または背部痛と黄疸を含む。背部痛は上腹痛に比べて通常鈍感で持続的,内臓起源であり,背部に放射され,上腹痛はぼやけて間欠的である。あまり一般的でない症状は、吐き気、嘔吐、下痢、拒食および新たな糖尿病(これは早期シグナルである可能性がある)またはグルコース不耐性(Hidalgo 2010)を含む。
手術は,約20%の患者のみが診断時に手術切除に適しているにもかかわらず,唯一の治療意図を有する治療選択である。根治性手術を受けた患者の生存率は依然として限られており,平均23カ月(Macarulla T,et al Clin Transl Onol 2017)であった。
切除可能な疾患を有する少数の患者にとって、手術は治療の選択である。腫瘍の位置によって、手術過程は頭部膵臓十二指腸切除術に関連する可能性があり、“ホイップル手術”と呼ばれ、即ち遠位膵臓切除術或いは全膵臓切除術である。膵臓酵素欠乏症と糖尿病はこの病気とこれらの外科手術のよく見られる合併症である。70%に達する膵臓癌患者は胆道閉塞が存在し、経皮或いは内視鏡ステント留置術によって緩和できる。しかし,腫瘍が完全に切除されても膵癌患者の結果は失望的であった(Hidalgo 2010,Seufferlein 2012)。3つの大型無作為臨床試験(Hidalgo 2010)では,術後化学療法は無進展と総生存率を改善したが,すべての3試験で治療を受けた患者の術後生存率中央値は20−22カ月と類似していた。術前(新補助)化学療法はますます人々の注目を集め、その目的は手術切除率と長期治療効果を高めることである。
切除不能、局部末期或いは転移性疾患を有する患者では、これらの患者は大多数のPDA患者の割合を占め、治療選択範囲は単純化学療法から放射線治療と化学療法を結合する治療形式までである。しかし,併用療法の毒性が増加し,このような併用レジメンの無作為試験の登録者数が低いため,化学療法に放射線治療を増加させるいかなる利点についても確実な結論は得られない(Hidalgo 2010)。
ゲムシタビンは現代管理時代に初めてPDA患者の治療に許可された化学療法薬であり、5.65ケ月の中位生存期間(Burris 1997)を提供した。ゲムシタビン単一療法はずっと転移性膵臓癌患者の標準治療方案であり、ゲムシタビンとエルロチニブ(Tarceva)の併用は中位生存期間を2週間延長できることが証明されるまでである。この適度な利点は顕著な副作用と高いコストで緩和され,標準治療案としての採用が制限されている。その後,多剤化学療法とFOLFIRINOXの併用はゲムシタビン単独より4.3カ月の中位生存期間(総生存期間(OS)=11.1カ月)を提供することが証明されたが,その著明な副作用はこのレジメン選択が良好な患者を制限し,白血球増殖因子療法を補充する必要があることが多い。NAB−パクリタキセル(Abraxane)は,ゲムシタビンとの併用による市販認可(FDA承認,2013年)を得ており,ゲムシタビン単独使用と比較して全体的な生存期間が7週間増加していることを示している(Von Hoff,2013年)。
2024年2月13日、オニビード(イリチコンリポソーム注射剤)とオキサリプラチン、フルオロウラシルおよび亜葉酸カルシウム(NALIRIFOX)の併用は、米国食品医薬品局によって成人mPDACを治療するための第一線の薬物として承認された。これはAbraxaneが承認されて以来,PDAの第一線の治療薬として承認された最初の薬剤である。リンパルザ®2019年12月に悪性または有害胚系BRCA変異(“gBRCAm”)転移性膵癌患者の維持治療のために承認され,一線白金および化学療法レジメンで少なくとも16週間以内に進展しなかった。
家族性腺腫性ポリープ症
家族性腺腫性ポリープ症(FAP)は稀で生命に危害を及ぼす可能性のある遺伝疾患であり、アメリカでは約10,000人に1人が発生する。FAPは主に結腸腺腫性ポリープ症(“APC)腫瘍抑制遺伝子装甲運搬車突然変異は通常常染色体優性遺伝性状として遺伝するが,25%ものFAP患者は同じ種系変異を有し,家族歴はない。10,000人に1人だけがFAPにかかっています米国の年間流行率は約30,000,ヨーロッパでは約50,000と推定されている。治療しなければ,患者は結腸と直腸全体に数百から数千個のポリープを形成する。FAPは通常青少年早期に発生し、治療しなければ、40歳になると、ほぼ100%の生涯リスクが結腸直腸癌に罹患する。市場で承認されていないFAP薬。
多くの患者は腺腫が大きくなり、多くなるまで症状がなく、直腸出血、甚だしきに至っては貧血、あるいは癌が進展するまで症状がない。一般的に、癌はポリープが出現して10年後に発展し始める。非特異的症状は便秘或いは下痢、腹痛、触知可能な腹部腫瘍と体重減少を含む可能性がある。
癌の予防と良好な生活の質を維持することはFAP患者管理の主要な目標である。10代や20代前半には結腸直腸癌の予防的手術が提唱されている。予防性手術は通常全腹結腸切除回腸-直腸吻合術(“IRA”)とその後の頻繁な内視鏡モニタリングが必要であり、そして必要に応じてポリープ切除と焼灼/レーザーアブレーションを行う。広範な直腸病変の患者は全直腸切除回腸袋肛門管再建術を受けなければならない。それにもかかわらず,全直腸切除回腸袋肛門再建術を受けた患者の約50%が新直腸(回腸パウチ)に腺腫性ポリープを発症する。十二指腸癌と硬線維腫は全結腸切除術後に死亡する2つの主要な原因であり、早期発見と治療が必要である。高位内視鏡検査が必要であり,壷腹と十二指腸癌のリスクを減少させる。進行期腫瘍と切除不能疾患の患者は,細胞毒性化学療法と手術(可能であれば手術)の組み合わせで緩和あるいは安定することができる。FAP患者は100%CRCに罹患するリスクがある;しかし、患者がスクリーニング治療計画に入る時、このリスクは明らかに低下する。
FAP患者の治療において、まだ満たされていない主要な需要は1種の治療手段であり、それは重大な手術干与の需要、特にIRAを使用した結腸切除術或いはIPAA回腸外科袋を使用した直腸切除術を延期或いは回避することができる。このような干与措置はよく臨時或いは永久性回腸造口術が必要であり、そして頻繁な排便(1日平均6回)、夜間便失禁、及び女性患者の生殖潜在力の低下などの長期或いは永久性の生活の質の欠陥を伴う。重要なのは非手術代替方案を発見し、重複した内視鏡と外科手術を遅延或いは回避して患者の生活の質を維持することである。それらの結腸の特に完全な患者に対して、薬物治療は有意義にポリープの進展を制御或いは遅延する機会を提供し、そして彼らにもっと多くの選択を提供し、いつ或いは予防性結腸切除術/直腸切除術を受けるかどうかを選択し、生活の質を最適化する。
この潜在的な利点は、FAPの長期経過がほとんどの患者に最終的な結腸切除術を受けることを基本的に要求するので、実際には最も強力な潜在的利点である可能性がある。このような急進的な手術を安全に数年遅らせることは若い患者の価値をどのように強調しても過言ではない。
現在、FAP患者の治療は承認され、市販されていない。1999年、セレキシブは、FAP患者において行われた無作為二重盲検プラセボ対照研究において観察されたポリープ数の減少に基づいて、FAPの治療のためのFDAによって条件的に許可されたが、保持者ファイザー社が追加のデータを提供することを市場に許可する必要がある。2011年、FDAは、臨床的利益を検証するための発売後の研究が完了しておらず、H支部によって要求された承認条件として、Celebrex(セレキシブ)カプセルのFAP適応を自発的に市場から撤回することを要求した。2011年の手紙で、ファイザーはFDAにCelebrex(セレキシブ)カプセルのFAP適応を市場から撤回することを要求した。2012年よりCelebrexカプセルのFAP適応の承認が撤回された。2003年10月にヨーロッパ薬品管理局が科学審査を行った後、セレキシブは欧州委員会に“特殊な状況”でFAP集中治療を許可された。ライセンスは、製品ライフサイクルにおける特定の義務に基づいて付与され、主に、その有効性および安全性に関するさらなるデータを提供するためのものであるが、出願人/ライセンス保持者は、この中央ライセンス後の義務を履行することができない。公開提供された情報によると、ライセンス後の研究は2004年第1四半期に開始され、EU集中マーケティング許可は所有者が必要なデータを提供できないため撤回された。
卵巣癌
世界的に卵巣癌の年間発症率は約314,000人,年間死亡者数は約207,000人(Globocan 2020)である。米国では、卵巣癌は全新癌症例の約1%を占め、約22,000例(米国癌協会。“癌事実と数字2021年”。ジョージア州アトランタ:米国癌協会;2021年)、転移性疾患の5年生存率は約29%(SEER状況説明書卵巣2022)。米国癌協会のデータによると、卵巣癌は女性の癌死亡の5番目の原因であり、死亡者数は女性生殖系の他の任意の癌を上回っている。
早期疾患のスクリーニング法の検出に失敗したため,70%近くの患者が末期と診断された(Giornelli 2016;Partridgeら,2009;Bastら,2007;Gohaganら,2000;Chudecka−G≡az,2015)。したがって,多くの患者は確定診断後の最初の2年以内に再発し,最適な初回細胞減少術や標準的なカルボプラチン/パクリタキセル補助化学療法6周期を行った後も同様である。
二線化学療法は主に無病間隔(“DFI”)(一線化学療法の完成と臨床再発の間の時間)或いは無進展間隔(“PFI”)(最後の化学療法が再発と進行の間の時間)に依存する。白金−難治/薬剤耐性/薬剤耐性,白金治療期間中の再発(難治),あるいは最後の白金系化学療法後DFI/PFIが12カ月,あるいは白金部分に敏感であり,最後の白金ベース化学療法後の無病生存DFS/PFSが6~12カ月の3つの分類がある。
Pignataらによると。2017年,白金感受性患者では,単一薬物や非白金組み合わせと比較して,白金ベースの組み合わせ治療がPFS優位に関与していた。一部の敏感な再発患者(PFIは6ケ月から12ケ月の間)に対して、2つの選択がある:白金系薬物或いは非白金系薬物治療(単一薬物或いは連合治療)。最後に,薬剤耐性や難治性再発患者(PFI
結腸直腸癌
米国癌学会が発表した米国癌統計データによると,2022年に米国では結腸直腸癌が男性や女性に最もよく見られる第3の癌となり,癌に関連する死亡の第3の要因となると推定されている。高危険腺腫性ポリープは結腸直腸癌の重要な危険因子と考えられている。2015年に米国では5.2万人がこの病気で死亡すると推定されている。EUの発病率は更に高く、Globocan 2020概況によると、そこでは毎年約25.5万人がCRCで死亡している。
全世界で年間約1,931,000例の新診断例がある(2020年北米では約180,000例予定)。提示速度はアジアでも重要になっている(中国と日本)。結腸直腸腺腫(あるいは“ポリープ”)は結腸直腸癌の重要な危険因子と考えられている。医学界と科学界の一般的な共通認識は、これらのポリープは90%以上の結腸直腸癌の前兆であることである。
結腸癌はアメリカのすべての結腸直腸癌の4分の3近くを占めている。手術(補助化学療法を含むか、または含まない)によって結腸癌を治愈する可能性があるが、局部と局部末期結腸癌患者は依然としてかなり大きな結腸腺腫、遠隔再発、続発性結腸癌形成と結腸直腸癌関連死亡のリスクに直面している。ポリープ切除術は大腸癌死亡率を低下させる有効な方法のようであるが,コストや患者受容性に制限されている(Newcombら)。1992年;Selbyら。(1992年)。あるタイプの大腸ポリープは結腸直腸癌に進展するリスクを増加させる。ハイリスクポリープ(絨毛組織学的ポリープ,大きさ1 cm,高度非典型的増生,あるいは3または3以上と定義された多発性腺腫)が結腸直腸腫瘍発生研究の重点となっており,これらの病変の悪性の可能性が高い(Lotfiら)。1986年、スペンサーら。1984年Winawerら。1993年Martinezら。2009年)。現在、切除した結腸癌患者の看護標準は臨床検査、実験室分析と結腸鏡評価によるモニタリング(手術と必要時の補助化学療法を含まない)である。しかし、データにより、結腸鏡検査は結腸全体の範囲内で結腸直腸癌の死亡を一致的に予測することはできない--事実、右側結腸直腸癌は結腸鏡検査からいかなる死亡益も得られなかった(Baxterら)。2009年)。結腸鏡検査の他の潜在的な問題は(非常に少ない)穿孔、感染、出血と現在の提案を守らないことを含む。そのため、安全かつ有効な化学療法予防干与は現在の結腸癌モニタリング例を補充と改善するために巨大な潜在力を提供した。 CATを治療するための他の治療法と異なり、Flynpoviは非手術と非侵襲的選択であり、患者の生活の質を高め、更に高い医療保健システムの費用負担を減少する可能性がある。
独自の技術
ポリアミンの機能と特性
ポリアミンは人体細胞内の代謝の異なる実体であり、DNA複製、RNA転写と加工及び蛋白質(例えば膵臓酵素)の合成を結合し、促進する。ヒト細胞は3種類の必要な天然に存在するポリアミンであるフミン,イミノアミン,スペルミンを含む。ポリアミンは多くの細胞増殖、アポトーシスと蛋白質合成に必要な機能を有する。細胞内ポリアミンの臨界平衡はODCとイミノアミン/イミノアミンN 1アセチルトランスフェラーゼ(SSAT)などのいくつかの酵素によって維持される。これらのすべての動態酵素は、天然ポリアミンライブラリーを緊密かつ持続的に調節するために、一時的で迅速に誘導可能な細胞内タンパク質である。これらの酵素は細胞内でポリアミンを非常に狭い濃度範囲に維持し続けている。
ポリアミン代謝と癌
ポリアミンは細胞増殖に必要である。多くの癌,特に癌遺伝子が駆動する癌は,ポリアミン代謝の妨害に敏感である可能性が考えられている。天然ポリアミン腐アミン、イミノアミンとスペルミンは成長に関連する過程、傷口癒合と癌の発展と密接に関連している。通常,ポリアミンライブラリーは合成,分解代謝,輸送機構による調節が厳しく制御されている(GernerとMeyskens 2004)。このような厳密な制御を失うことはポリアミンの過剰蓄積を招き,細胞の悪性形質転換に有利である可能性がある。したがって,癌細胞の成長制御の喪失に伴い,形質転換した細胞は正常細胞のポリアミン枯渇よりも敏感である可能性がある。したがって、ポリアミン代謝経路は治療介入の合理的な目標である(Casero 2018)。
免疫系は多種の可溶性と細胞成分が必要であり、ポリアミンを含めて、正常な免疫機能を発揮することができる。したがって,ポリアミンは免疫反応の重要な調節剤であり,特に腫瘍微小環境では濃度が高い。自己免疫疾患において、腫瘍細胞および自己反応性B細胞およびT細胞には、高いレベルのポリアミンが存在する。ポリアミンの調節失調は、腫瘍免疫逃避、細胞圧力の増加、および自己免疫増強をもたらすことができる。治療干与によるポリアミン経路のリセットにより、正常な免疫機能を回復する可能性がある。
ポリアミン経路をリセットする薬物治療方法
同社の主要資産はアスピリンとエフルオロオルニチン(Flynpoviを含む)であり,この2種類の薬物は癌や自己免疫など多くの疾患に存在する失調生物学を再調整できる多標的の方法を提供している。例えば、多くの腫瘍はそれらの成長と生存を支持するために極めて高いレベルのポリアミンを必要とする。これらの薬剤はポリアミン経路を相補的結合に位置づけており,これらの結合は疾患において変化していることが証明されている。特に、これらの薬物は腫瘍の成長を抑制と防止し、他の抗癌薬の抗腫瘍活性を増強し、免疫系を調節する潜在力がある。

ポリアミン類似体–-プロポフォール(SBP-101)
多くの腫瘍は膵癌を含み,ポリアミンの摂取率が増加している。ポリアミン類似体,例えばアスピリンは,自然に産生されるポリアミンに構造的に類似しており,細胞のポリアミン摂取系によって認識され,これらの化合物が随時細胞に入ることができる。膵腺房細胞は,その非凡なタンパク質合成能により,ポリアミンやポリアミン類似体の増強摂取を示すと考えられる。膵臓腺房細胞のこのような優先摂取のため、ポリアミン類似物、例えばアスピリンは細胞のポリアミン平衡と生合成ネットワークを破壊し、そしてcaspase 3活性化とポリADPリボポリメラーゼ(PARP)切断などの過程を通じて細胞プログラム性死亡或いはアポトーシスを誘導する。概念検証は複数のヒト膵癌モデルで確認されており,両者は体内にあるそして体外培養膵管腺癌はアスピリンに敏感である。
エピピミンは特許のポリアミン類似体であり,その独特の化学構造により膵外分泌腺房細胞に蓄積していると考えられる。アスピリンはフロリダ大学薬学部のレイモンド·J·ベジェロン教授によって発見され,広く研究されている。
実験室研究所が示したように,アスピリンの主要な作用機序には,この化合物の膵外分泌の摂取促進が含まれていることが証明されており,膵癌はこの化合物の最初の発展の論理的な原因である。動物モデルでは,十分に高い用量で対応する天然ポリアミンレベルの低下,caspase 3活性化,PARP開裂,外分泌腺胞とカテーテル細胞のアポトーシス破壊(プログラム細胞死)を招き,炎症反応がない。重要なことは,インスリンを分泌する膵島細胞は構造や機能的に腺房細胞と異なり,プロポフォールの影響を受けないことである。2つの独立した実験室の動物モデルでは,エビスタチンは転移性膵癌の成長を含めて移植されたヒト膵癌細胞の有意な抑制を示した。
伊司アスピリンは膵外分泌,肝と腎および膵管腺癌細胞の天然親和性を利用しており,インスリンを産生する膵島細胞を損なうことはないと考えられている。現在の多くの癌治療方法は、化学療法、放射線治療と手術を含み、すべて深刻な副作用を伴い、更に患者の生活の質を低下させた。しかし,これまでの臨床研究で評価されたデータから,骨髄抑制や末梢神経病変をきたす場合,アスピリンの副作用は典型的な化学療法レジメンの副作用と重なったり進行したりしないと考えられる。以下に述べるように,われわれの第1段階研究の第5列で観察された用量制限毒性は低用量では観察されず,標準化学療法に通常関連する骨髄抑制や末梢神経病変の有害事象と重複しないことが予想される。最近完成したIa/Ib期拡張段階で評価された用量と投与計画は最大耐容量MTDより低く,この用量レベルではヒト膵の外分泌も内分泌も伊司アスピリンの影響を受けないことが予想されるため,治療は膵酵素やインスリンレベルに影響を与えない。新しいASPIRE試験における用量レベルと用量計画はIa/Ib研究拡張段階で評価された用量レベルと用量計画と同じである。
オルニチン脱炭酸酵素阻害剤–-エフルオロオルニチン(CPP-1 X)
オルニチン脱炭酸酵素はポリアミン生合成における最初の律速酵素であり、それはオルニチンのフミンへの変換を触媒し、哺乳動物と多くの真核細胞中のポリアミンの生合成を調節する。エフルオロオルニチンは、α-ジフルオロメチルオルニチンとも呼ばれ、オルニチン類似体である。エフルオロオルニチンは不可逆的にODC 1に結合し、天然ODC 1基質オルニチンの酵素活性部位へのアクセスを阻止した(MeyskensとGerner 1999)。エフルオロオルニチンの投与はODC活性とポリアミン濃度を低下させる。APC遺伝子変異を有する遺伝子マウスモデルでは,エフルオロオルニチン投与はODCの抑制と腫瘍進展の抑制によりポリアミン濃度を低下させ,腸癌の発生を減少させる(Erdmanら,1999年)。
エフルオロオルニチンによる動物の治療はODC活性を抑制し,特に細胞分裂の迅速な組織や器官である。ポリアミン生合成は真核細胞の成長と分化に重要であることが証明されており,ポリアミン生合成の抑制は細胞分化を刺激あるいは抑制することができ,具体的には研究したモデルに依存する(GernerとMeyskens 2004)。そのため,エフルオロオルニチンは様々なモデルにおいて細胞分化を促進あるいは抑制する。
ポリアミンの生物合成も化学発癌、細胞転化と腫瘍細胞増殖の重要なステップであり、ますます多くの証拠により、エフルオロオルニチンの細胞増殖と腫瘍発生に対する抑制作用は癌遺伝子、ポリアミン代謝とODC活性の間の複雑な相互関係に関与する可能性があることを表明した。MYCは正常細胞増殖に必要な転写因子をコードする癌遺伝子であるが,過剰発現すると細胞異常成長を引き起こす(GernerとMeyskens 2004)。また,c−MycはODC遺伝子の転写活性子(Penaら)である。1993年)(ベロ·フェルナンデス、パーカム、クリーブランド1993年)。また,エフルオロオルニチンは神経芽細胞腫細胞中のN−Myc mRNAやヒト結腸癌細胞におけるc−Myc mRNA(Celanoら)を減少させることが証明されている。イミノアミンはc-Mycの転写と発現を優先的に刺激するが、c-Fosの転写と発現を刺激しない(TabibとBachrach 1999)。以上より,これらの結果は,ポリアミンが転写レベルである癌遺伝子の発現にフィードバック作用を果たしていることを示している。
大腸腺腫性ポリープ症突然変異を持つマウス(“APC”)腫瘍阻害遺伝子発生腸管腫瘍の数は、FAP患者において発見された数と類似している。遺伝子の変異APC遺伝子はODC活性を増加させ,腸管ポリアミンレベルの増加を招く。FAP動物モデルにおける研究では,エフルオロオルニチンのみで腸管腫瘍数を有効に減少させることが示唆されている(Erdmanら)。1999年)と結腸腫瘍負担(Yerussalmiら)。2006)。エフルオロオルニチンは大腸粘膜や皮膚細胞におけるポリアミンレベルを低下させる(GernerとMeyskens 2004)。
エフルオロオルニチンの有益な主要な臨床証拠は展望性、ランダム、プラセボ対照の臨床研究から来ており、これらの研究はエフルオロオルニチン単薬によるあるタイプの癌(前立腺癌と基底細胞皮膚癌)を治療するリスクが比較的に高いことを表明した。無作為,プラセボ対照の臨床研究では,結腸ポリープ切除歴のある被験者では,エフロンが直腸粘膜組織中のポリアミンを減少させた。このマーカー研究はFAP患者に特に関連しており,FAP患者では標的組織には腸管や結腸粘膜(Meyskensら)がある。1998年)。
エフルオロオルニチンは2023年に監督部門の許可を得て、アフリカ昏睡病を治療する高用量の静脈投与として、多毛症(毛髪が通常成長していない或いは最も少ない身体部位の過剰毛髪成長)を治療する局部薬物として、2023年に経口剤形として承認され、ハイリスク神経芽細胞腫を有する成人と児童の再発リスクを低下させる。
イミノアミン/アルミンN-アセチルトランスフェラーゼ活性化剤(“SSAT 1”) –シュリン酸
ポリアミンの輸送はペルオキシソーム増殖剤活性化受容体−g(“PPARg”)によって維持される。この受容体はSSAT転写を順方向に調節し,ポリアミンアセチル化とポリアミンの細胞外への輸送を促進する。正常条件下では、K-RAS分子はPPARgに対して活性がなかった。しかし、K-RAS遺伝子の突然変異は1種の産物を産生し、PPARgのSSAT翻訳への影響を抑制し、それによってポリアミンバンクの増加と腫瘍発生(Babbarら)を招く。2003年)。スリン酸のような非ステロイド性抗炎症薬は、PPARgによってSSATの転写を増強し、それによってポリアミンの分解代謝と出力を増加させる。
シュリン酸は非ステロイド性抗炎症薬中のアリールアルキル酸類薬物の一員であり、プロスタグランジン合成過程におけるシクロオキシゲナーゼの非選択性阻害剤である。舒林酸の潜在的な作用機序を理解するために、著者らは舒林酸スルホン(シクロオキシゲナーゼ阻害活性に乏しい舒林酸代謝物)がヒト結腸腫瘍由来細胞を処理した後の遺伝子発現パターン(Babbarら)を測定した。2003年)。スルリン酸スルホン酸は細胞成長を抑制し,アポトーシスとイミノアミン/アルミンN−アセチルトランスフェラーゼ(SSAT 1)の発現を誘導し,ポリアミン出口に関連するポリアミン分解代謝酵素である(Xie,GillieとGerner 1997)。スリン酸スルホン酸は,エポキシ化酵素非依存性転写活性化SAT 1遺伝子中の特定のPPARγ反応素子PprEの転写活性化によりSAT 1の発現を誘導する。スルリム酸で処理した細胞はSAT 1発現を誘導し,ポリアミン出力を刺激することができる。
ヒト細胞とマウスモデルにおける実験結果は、シュリン酸と他の非ステロイド性抗炎症薬がポリアミン分解代謝を活性化することを示した(GernerとMeyskens,2009)。したがって、非ステロイド性抗炎症薬は、組織中のポリアミンレベルを低下させるために、エフルオロオルニチンなどのポリアミン合成の阻害剤を補充することができる。細胞培養では,シュリン酸代謝物は用量依存的に体外細胞生存を減少させ,24時間曝露時間が150ミクロンを超えた場合(Lawsonら)。2000)。
マウス,ラット大腸癌モデルにおける実験はいずれもスリン酸の予防作用(Babbarら)を証明している。2003年)。シュリン酸は多発性腸管腫瘍(Min)マウスの腫瘍形成を阻止し,MinはFAPのAPC変異関連腸管癌化を模倣したマウスモデルである。Minマウスでは,腫瘍予防用量のシュリン酸は組織中のプロスタグランジンE 2やシクロオキシゲナーゼ−2のレベルを抑制した(Boolbolら)。1996年)。他の非臨床研究において、舒林酸はラットとマウスモデル中の膀胱、肺と前胃腫瘍の形成を抑制する作用がある(Kelloff、Booneなど。1994年Kelloff Crowellらです(1994年)。
二重照準–--フリン·ボヴィ
二重作用機序を通じてポリアミンバンクの能力を減少させ、即ち合成を抑制し、分解代謝と出力を増強し、Flynpoviが腫瘍発展を予防する方面で相互に補充し、ポリアミンバンクの増加による腫瘍形成増強を招く患者群の中で仮説を招く。エフルオロオルニチンはODCの不可逆阻害剤であり,ポリアミンの一から合成を担当しているが,スリン酸はSSATを調節し,SSATはポリアミンの出力と分解代謝に作用する。したがって,このFlynpoviという組み合わせは新たなポリアミンの産生を抑制し,食事や微生物群から得られるポリアミンも除去した。
Flynpoviは臨床前,臨床環境ともに胃腸中のポリアミンを減少させる能力がある。Igantenkoらの研究では,Eflornithine単独および非ステロイド抗炎症薬であるスリン酸またはセレキシブとの併用による腸管腫瘍の数,分級およびポリアミン含有量への影響が評価されているAPC最小/+マウス(Ignatenkoら)は2008年)。エフルオロオルニチンとスリン酸の併用は単剤(PApc)より明らかに優れている最小/+ネズミです。また,この研究では,0.5%エフルオロオルニチン治療群を除いて,すべての治療群で有意な進展が認められた(PApc最小/+マウスでは高レベル腺腫の割合を低下させていない。エフルオロオルニチンとスリン酸の併用は顕著であった(P
エフロン酸とシュリン酸治療群が高レベル腺腫を抑制する能力は重要な発見であり、このモデル中の高レベル腺腫はFAP患者中の高レベル腺腫と関連しているため、臨床上切除と手術イベントの指標である。これらのデータはエフルオロオルニチンとシュリン酸の併用によるFAP患者治療の理論基礎を支持し、腸管ポリアミン含有量と高レベル腸腺腫の発生率を減少させる。
さらに重要なことに,Flynpoviとの併用治療は,以前散発性腺腫を有する患者の異時性結腸腺腫の発生率(Meyskensら)を有意に低下させた。2008年)。Meyskensと同僚はIIb/III期,散発性結腸腺腫の二重盲検薬物予防研究(PSCA研究)を行い,散発性腺腫を切除した375名の被験者が3年間のエフルオロオルニチン(1日500 mg)+スリン酸(1日150 mg)の治療を受けた[N = 191])または一致するプラセボ/プラセボ(N=184)。その結果,プラセボと比較してプラセボと比較して能動併用療法は異時性腺腫のリスク(70%),進行腺腫のリスク92%,多発性腺腫のリスク95%を有意に低下させた。この併用療法は全体的に耐性が良好であった。
散発性とFAP関連腺腫性ポリープ症の発病機序、及び散発性腺腫とFAP患者の進行性ポリープの予防におけるエフロンと非ステロイド性抗炎症薬の作用機序は、FAP関連患者におけるFAP-310試験の発展を招いた装甲運搬車生殖系突然変異。
FAP−310第三段階研究は,いずれかの薬物単独と比較して,エフルオロオルニチンと舒林酸の併用による家族性腺腫性ポリープ症の治療効果と安全性を評価した(Burkeら)。2020)。患者は1:1:1の割合でランダムに分配し、エフルオロオルニチンと/またはスリン酸を毎日1回服用し、最長48ケ月間持続した。1件後の分析では,併用群の患者は48カ月間LGI手術が必要に進展しなかったが,シュリン酸とエフロン群の患者はそれぞれ7名(13.2%)と8名(15.7%)であった(Balaguerら)。2022年)。これらのデータは,併用投与と単一投与と比較してスリン酸のHR=0.00(95%CI,0.00−0.48;P=0.005)および併用投与のHR=0.00(95%CI,0.00−0.44;P=0.003)が,いずれも100%に近い胃腸損傷手術のリスクを低下させることを示している。
エピミン(SBP-101)の発展計画
アスピリンの膵癌適応への開発には,臨床前段階と臨床段階がある。臨床前段階は2015年に基本的に完成し、4つの主要な構成部分から構成されている:化学、製造と制御(CMC)、臨床前(実験室と動物)薬理学研究、臨床前毒理学研究及びオーストラリアとアメリカの監督管理提出。
膵臓癌の治療を準備するエスピミンIndは著者らの製造、臨床前毒理学、薬物動態学と代謝専門家、著者らの監督管理事務プロジェクト管理と著者らの内部の臨床専門知識の協力が必要である。2015年8月、FDAは私たちの申請を受け入れた。
オーストラリアでは,ヒト研究倫理委員会の申請がその後の臨床試験通知CTNとともにTGAに提出されている。
著者らが以前治療した局部末期或いは転移性膵臓癌患者で行った初歩的な臨床試験はオーストラリアとアメリカの臨床地点で行われたI期臨床試験であり、これは初めての人類用量増加安全性研究である。オーストラリアメルボルンとアデレードの主要癌治療センターおよびアリゾナ州スコッツデールのMayo Clinic ScotsdaleとHonorHealthで膵癌を治療する専門臨床医を招聘した。これらの重要なオピニオンリーダーは,膵癌研究で良好であり,研究者としてわれわれの第一段階ヒト第一研究に参加することに同意した。
この実験の結果はプロポフォール(SBP−101)の臨床応用進展–膵臓癌は I期臨床試験設計と完成(イヴィ司明単一療法)以下に示す
我々は2020年12月に第2回臨床試験の患者募集を完了した。この第二項の臨床試験はIa/Ib期研究であり、エスプミンと2種類の標準看護化学療法薬物ゲムシタビンとNAB-パクリタキセルの併用の安全性、有効性と薬物動態学を研究した。2020年12月までに25名の被験者がIa段階の4つの列に入り,他の25名の被験者が拡張Ib段階に入った。この実験の安全性と中期的な治療効果はアスピリン(SBP−101) 臨床発展–-膵癌、Ia/Ib期臨床試験中期結果(第一線併用治療)下です。
2022年1月に3回目の臨床試験を開始しましたこの新しい試験は無作為、二重盲検、プラセボ対照の研究であり、エスプミンと2種類の標準看護化学療法薬物ゲムシタビンとネブ-パクリタキセルの併用の安全性と有効性を研究した。試験設計と予想時間は中で検討する臨床発展–-膵臓癌、無作為臨床試験設計と期待時間(ASPIRE試験)。
また,適切な膵癌患者に対する新たな補助治療が模索されている。アスピリンは膵癌以外の癌に対して潜在的な治療用途を有している可能性が示唆されている臨床前データもある。2021年2月、私たちはジョンホプキンス大学医学部と研究合意に達した。協力の重点はPanbelaの研究試薬エビスタットのさらなる開発であり,膵癌以外の細胞系の活性,診断に情報を提供するバイオマーカー,検査点阻害剤との潜在的な結合である。同社は2021年12月,卵巣癌細胞系におけるイビサプミンの活性を支持する積極的な臨床前データを発表し,2022年に提出し発表した(Holbertら)。2022年)。
エピミン(SBP−101)の臨床研究進展–すい臓がん
これまでの膵癌の臨床的進展には
|
● |
2017年に完成した第1段階SBP-101単一療法研究 |
|
● |
A段階Ia/Ib SBP-101の第一線の連合治療研究は、研究登録は2020年に完成し、データベースは2022年初めにロックされた |
|
● |
ASPIREは無作為、二重盲検プラセボ対照の第一線の連合治療研究であり、2022年1月にスタートした。 |
これらの計画の詳細は以下のとおりである.
I期臨床試験設計と完成(イヴィ司明単一療法)
著者らはすでに過去に治療した局部末期或いは転移性膵臓癌患者に対する初歩的な臨床試験を完成した。これは第1段階の人類初の用量逓増安全性研究である。2016年1月から2017年9月まで,I期試験の用量増加段階で,29名の患者を6つのキューあるいはグループに組み入れた。いずれの用量レベルでも薬物に関連する骨髄毒性あるいは末梢神経病変は認められなかった。安全性評価を受ける以外に、29名の患者のうち23名はRECISTを用いて第1周期の8週間終了前或いは治療終了時に初歩的な治療効果信号を評価することができ、RECISTは現在公認されている腫瘍の大きさの変化を評価する標準である。
従来の化学療法薬の使用中によく見られる有害事象と重複する可能性のない有害事象の存在は、ゲムシタビン、NAB-パクリタキセル、さらにはFOLFIRINOXのようなイスプラミンと従来の化学療法薬の併用を支持する。
Ia/Ib期臨床試験中期結果(第一線併用治療)
2018年,われわれの第2の臨床試験に参加する患者を募集し始めたのはIa/Ib期研究であり,アスピリンと2種類の標準看護化学療法薬ゲムシタビンとNAB−パクリタキセルの併用の安全性,有効性,薬物動態を検討することを目的とした。計25名の被験者が4つのキューに参加し,用量レベルとスケジュールを評価した。また25名の被験者が試験の拡張段階に参加した。中間結果は2022年1月に発表された。評価可能被験者(4列,IBN=29個)では,最適反応はCR 1(3%),PR 13(45%),SD 10(34%),PD 5(17%)であった。1人の被験者はRECIST腫瘍評価のベースライン後スキャンを受けなかった。中間PFSは、現在6.5ケ月であり、潜在的な毒性を評価するために、薬物投与量中断の負の影響を受けている可能性がある。2022年1月にデータを公表したところ,キュー4+Ib期患者の平均総生存期間は12.0カ月であり,現在最終的には14.6カ月であった。列2の2人の患者は、1人の患者が30.3カ月(最終データ)であり、もう1人の患者が33.0カ月で生きていることを証明している。
図4. SBP 101期Ib一線併用治療安全性試験評価- 最適な全体的な応答
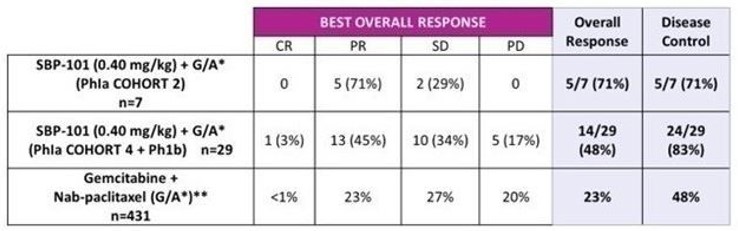
ソース:Singhal,N.,ポスタープレゼンテーション,ASCO GI 2022
無作為臨床試験設計と期待時間(ASPIRE試験)
2022年1月、同社は新しい臨床試験を開始することを発表した。この試験はASPIREと呼ばれ、無作為、二重盲検、プラセボ対照試験であり、ゲムシタビンとNAB-パクリタキセルと併用し、これは標準的な膵臓癌治療方案であり、以前転移性膵臓癌を治療したことがない患者に適している。この実験はアメリカ、ヨーロッパ、アジア太平洋地域の約88地点で行われる。
米国や世界の他地域の臨床サイトの開放速度は当初の予想より遅く,一部の原因は医学界の資源が疲弊しているが,すべてのサイトは2024年3月31日までの四半期に開放されている。
この試験は最初にII/III期試験として設計され,PFSと全生存(OS)の主要終点に基づく中期分析に必要なイベントを支援するためのサンプル量が小さい(150)。この研究は,ヨーロッパやFDA規制フィードバックへの応答として,総試験サンプル量(600)と修正された設計を含むように修正され,総生存率を主な終点とし,中期分析で検査を行っている。またPFSを分析し、追加の治療効果証拠を提供する。この改訂はIa/Ib期の一線転移性膵癌試験の最終データの支持を得ており,2020年12月に登録を完了した。この研究では600名の被験者を募集し,登録まで36カ月を要すると予想される。
2024年1月25日、同社はこの試験が登録者数の50%を超えたと発表した。同社は、全面登録は2025年第1四半期に完了し、全体の生存状況に基づく中期データ分析は2024年中に提供すべきだと予想している。
FDAが推奨するすべての臨床研究を成功させることができれば,FDA,EMA,厚生労働省(日本),TGA(オーストラリア)の上場認可を求める予定である。アスピリンが孤児薬に指定されている地域では,“孤児薬物状態”で述べたように提出費用が免除される
フルオロボイルとエフルオロオルニチンの発展計画(CPP−1 X)
FDAは2009年12月、連合製品Flynpoviに関するCPPのIND申請を受け、Flynpoviは候補製品であり、2009年11月および2018年8月にINDのエフルオロオルニチンに対する申請を受けた。
FlynpoviのCPPが実行するFAPと結腸癌予防の開発計画には,臨床前/非臨床と臨床段階がある。非臨床段階は四つの主要な部分から構成されている:CMC、臨床前(実験室と動物)の薬理学研究、臨床前毒理学研究及びアメリカとヨーロッパの監督管理提出。同様に,いくつかの異なる適応のエフロンとエフルオロオルニチン香包の開発計画には,米国規制機関が提出したほとんどの同じ主成分が含まれている。
臨床発展–フリリンポヴィ
これまでFlynpoviの臨床開発には
|
● |
FAP−310第3段階 |
|
● |
PACE第3段階試験 |
FAP−310第3段階試験
FAP-310の第三段階研究において、Flynpovi(ES併用薬)の成人FAPに対する治療効果と安全性について、エフルオロオルニチン或いはシュリン酸単独投与と比較して研究を行った。計171名の患者がランダムにグループ分けを受けた。Flynpovi群では18例(32%),舒林酸群58例中22例(38%),エフルオロオルニチン群57例中23例(40%)に疾患進展があり,Flynpovi群のリスク比はシュリン酸とEflornithine群と比較して0.71(95%CI,0.39~1.32),Flynpovi群のリスク比は0.66(95%CI,0.36~1.23)であった。1つの事後分析では,併用群の患者は48カ月以内にLGI手術が必要に進展しなかったのに対し,シュリン酸とエフロン群ではそれぞれ7名(13.2%)と8名(15.7%)の患者がLGI手術を必要とした。これらのデータは、HR=0.00(95%CI、0.00-0.48;Pに対応する =0.005)スリン酸およびHR=0.00(95%CI、0.00~0.44;P エフルオロオルニチンと組み合わせて使用するための0.003)。

LGIグループの統計学的意義を考慮して、FDAは秘密保持プロトコルを提出した。研究は主な終点に到達できなかったが,秘密保持プロトコルは探索的分析の結果に基づいているため,完全な返信を送信した.この欠陥問題を解決するためには,同社は1つまたは複数の十分かつ良好に制御された臨床試験の結果を提出し,臨床終点への影響を証明しなければならない。
結腸癌生存者のIII期臨床試験
NCIとSWOGの協力のもと,結腸癌生存者としてFlynpoviが使用する治療法の利点を検討するための第3段階臨床試験が開始されている。この試験は“エフルオロオルニチンとシュリン酸による腺腫や癌予防”と命名された。PACE試験はNCIが援助し,SWOGが管理している。これは,0−III期結腸癌または直腸癌III期患者の高危険腺腫と第二原発結腸直腸癌の再発を予防するために行われているFlynpoviの二重盲検プラセボ対照試験である。この研究の目的は,フルボイル,エプタフルオロオルニチンとスリン酸の組み合わせ,(対応するプラセボと比較して)毎日投与3年後に,対照ARMと比較して癌または高リスク腺腫の再発率が低下しているかどうかを評価することである。規制と商業目的のために、私たちは実験からのデータの独占的な権利を持っている。
臨床発展–エフルオロオルニチン(CPP)– 1X)
これまでのエフロン酸の臨床開発には
|
● |
第二段階胃癌予防試験 |
|
● |
最近発症した1型糖尿病のI期とII期試験 |
|
● |
I/II期STK−11変異型非小細胞肺癌試験 |
|
● |
前立腺癌II期抗去勢転移試験 |
第二段階胃癌予防試験
ヘリコバクター·ピロリ人類で最もよく見られる細菌感染であり、すべての人が胃炎を引き起こす。胃炎は下落胃区に沿って胃炎から癌前段階萎縮性胃炎(特殊胃上皮喪失)と腸上皮化生に進展し,胃腺癌に至る(Correa 1992)。対.の応答としてヘリコバクター·ピロリ感染宿主は強力な先天性と獲得性免疫反応を引き起こし、粘膜炎症を招くが、生物を根絶することはできない。いくつかの研究により、免疫反応の失敗はL-アルギニン代謝とポリアミンの失調と関係がある可能性があり、マクロファージがオルニチンデカルボキシラーゼ(Chaturvediら)を上方制御することを含む。2010年Chaturvedi、de Sablet、Coburnら。2012年)(Chaturvedi、de Sablet、Peekら。2012年(Chaturvediら)2011)(Xu et al.2004年)(Chaturvediら。2014年(Chaturvediら)。2004年)。体内のポリアミンレベルが増加するピロリ菌-マウス胃炎の誘導とDFMO内服治療は胃ポリアミンレベルと重症度を低下させることができるヘリコバクター·ピロリ定住と胃炎(Chaturvediら)2010)である。スナネズミのモデルではヘリコバクター·ピロリポリアミンレベルは胃炎、DNA損傷と異型増殖/癌に発展する程度と関係がある。このモデルでは,エフルオロオルニチンはポリアミンレベルとDNA損傷を低下させ,異型増殖や癌の発生率を50%以上低下させた(Chaturvediら)。2014年)。
ファンデルビルト大学の研究者とNCIの援助の下で、この研究者による第二段階試験はホンジュラスとプエルトリコで行われ、ランダム、二重盲検研究であり、毎日一回のエフロン酸とプラセボの胃癌前病変患者の18ケ月に及ぶ治療期を比較した。この実験は完了し、データ分析が行われている。同社はすでに米国でエフルオロオルニチンを用いて胃癌を治療する孤児薬の称号を得ている。
I期とII期に新しく発症した1型糖尿病(“T 1 D”)試験
T 1 Dは臓器特異的自己免疫疾患であり、慢性免疫媒介膵臓β細胞破壊であり、部分的またはほとんどの場合絶対インスリン欠乏をもたらすことを特徴とする。多くの症例は自己免疫を介した膵β細胞破壊によるものであり,この破壊は異なる速度で発生している。膵β細胞の約90%が破壊された場合,臨床症状が出現する。したがって,β細胞を保護する機能は有望な治療の目標である(Couperら)。2014年)。早期糖尿病腎症ではODCの活性が上昇し,腎臓肥大や高ろ過(Pedersenら)をきたす。1992年、トウら。2003年)生体内最近発病したT 1 Dの実験モデルにおいてエフルオロオルニチンを評価する研究により、エフルオロオルニチンは腎臓肥大と増殖の発展を抑制し、糖尿病の発生率を低下させ、β細胞集団の生存と再生を増強し、ランゲルハンス島炎を減少させ、及びT細胞亜群の免疫寛容バランスを維持する上で作用があることを表明した。
同社はインディアナ大学の研究者と協力して、最近発病した1型糖尿病患者におけるエフルオロオルニチンの投与量を増加させる安全性と有効性を評価するために、JDRFによって援助された第一段階の研究を行った。完成した第一段階試験により、エフルオロオルニチン内服3ケ月の治療コースは最近発病したT 1 D児童と成人において良好な不良事象記述を有することが分かった(Simsら、2023)。尿ポリアミンデータは,エフルオロオルニチン治療がオルニチンデカルボキシラーゼ活性を有効に抑制し,用量の増加とともに尿フミン値が低下することを反映していることを示している。また,代謝効率は検出できなかったにもかかわらず,750 mg/mの治療を受けた被験者は2/日および1000 mg/m2プラセボに比べてエフルオロオルニチン治療6カ月後にエフルオロオルニチンを毎日服用したC−ペプチドAUCの方が高く,β細胞機能の改善が示唆された(Simsら,2023)。これらのデータは、エフルオロオルニチンが、単独で、または免疫治療を含む1型糖尿病の治療または予防の組み合わせレジメンと共にβ細胞の機能を改善することができることを示している。第1段階の試験結果に基づいて、ランダム、二重盲検、プラセボ対照の第2段階研究が2023年初めに開始され、エフルオロオルニチンによる1型糖尿病保留インスリン産生の有効性と安全性を評価することを目的とした。これはインディアナ大学の研究者が指導するJDRF援助の試験である。主な目標は1000 mg/mの臨床効果を検査することである2/d新規発症T 1 D患者の混合食刺激に基づくCペプチドAUCのβ細胞機能喪失の治療群とプラセボ治療6カ月後との比較を安定または改善するためにDFMOを経口投与し、1000 mg/mの安全性および耐性を評価する2新規T 1 D患者がDFMOを内服した日数。第二の目標はDFMO治療と新発T 1 D患者の小胞体ストレス指標、ポリアミン濃度、免疫学とその他の機序結果の関係を解明し、そして新発T 1 D患者の飲食ポリアミン摂取量と尿ポリアミン排泄を表現することである。この研究は多中心、二重盲検、プラセボ対照、2:1ランダムに分配した研究であり、対象は70名の患者である。
I/II期STK−11変異型非小細胞肺癌試験
STK 11は肺腺癌の中で4番目によく見られる変異遺伝子であり,30%と高い症例で機能喪失(Laderianら)が発生している。2020)。LKB 1欠損患者の細胞毒性T細胞の浸透は減少し、PDL-1状態にかかわらず、PD 1或いは抗PDL-1治療に対する反応は比較的に悪い。CHECKMate-057試験肺腫瘍はKRASとSTK 11に共通突然変異が存在し、PD-1軸阻害剤に対する反応は比較的に悪かった(Skoulidisら。2018年)。これらの結果は,KRAS状態にかかわらず,STK 11変異の腫瘍が寒冷な免疫微小環境を有することを示唆している。
2つの注釈の良好な肺腺癌データセットを用いたバイオインフォマティクス解析では,オルニチン脱炭酸酵素(エフルオロオルニチンの標的)が上昇した。また、LKB 1欠損腫瘍はいくつかの溶質輸送体の顕著な上昇を示した(SLC 7 A 2, SLC 14 A 2そして、そしてSLC 16 A 4). SLC 7 A 2カチオン性アミノ酸アルギニン,リジン,オルニチンの膜輸送を担うことが知られている。また,LKB 1はアルギニン経路を失い,アルギニンはオルニチンと尿素(アルギナーゼによる)に変換され,オルニチンはフミン(ODC 1を介して)に変換される。以上より,これらの結果はODC 1がLKB 1欠損肺癌の重要な代謝駆動因子である可能性を示唆している。
他のモデルシステムにおいて、エフルオロオルニチン治療は腫瘍微小環境を調節できることが証明された。先行研究のキューは、ODC 1が免疫抑制(Chamaillardら)に寄与する可能性があることを示している。1997年)。エフルオロオルニチンはODc 1阻害剤であるため、エフルオロオルニチンによる代謝酵素ODc 1の抑制はLKB 1欠損腫瘍中の腫瘍浸潤性リンパ球の数を増加させ、PD(L)-1を回復してこれらの患者に対する利益を遮断すると推測される。
同社はSTK-11変異NSCLC 2024患者のエフルオロオルニチンを評価するために、研究者によるI/II期試験を開始した。
前立腺癌II期抗去勢転移試験
前立腺癌は前立腺癌の限界から逃れると一律に致命的になり,毎年約30,000人の米国人患者が死亡する(Jemalら)。2008年)。20世紀40年代にチャールズ·ハギンズ(Charles Huggins)がアンドロゲンアブレーション療法(Huggins 1941)を発見して以来、アンドロゲンアブレーション療法はずっと再発性/転移性癌患者の標準看護である。アンドロゲンアブレーション治療は顕著な姑息性メリットを提供したが、アンドロゲンアブレーションを受けたすべての患者は最終的に再発し、いずれにしても完全にアンドロゲンアブレーションを投与しても有効ではなかった(Crawfordら)。1989年ローファーは2000)。ジョンホプキンス大学の研究者の最近の臨床試験では,高用量の両極が極端に急速に循環してから去勢血清アンドロゲンレベル,双極アンドロゲン療法(“BAT”)(Denmeadeら)が示唆されている。(2010年)、耐性は良好であり、臨床的利益の兆候を示した。臨床前研究により、エフルオロオルニチンの添加はBAT療法の抗腫瘍効果を増強した。
同社はすでに研究者による第二段階試験を開始し、歴史対照と比較して、ジフルオロメチルオルニチン(DFMO或いはEflornithine)と高用量テストステロンの併用が転移性去勢抵抗型前立腺癌患者の前立腺特異性抗原(PSA)応答率を高めるかどうかを決定した。この裁判は2023年10月に始まり、被験者を募集している。
神経芽細胞腫試験
神経芽細胞腫は未成熟神経細胞から起源する稀な癌であり、児童癌死亡の15%近くを占める。Panbela治療会社の子会社癌予防製薬会社は有力な神経芽細胞腫研究グループと広範に協力し、例えば神経芽細胞腫髄芽細胞腫転化研究連盟(NMTRC)(現在すでに児童癌を破った)、神経芽細胞腫治療の新しい進展(NANT)、児童腫瘍学グループ(COG)とNCIは神経芽細胞腫治療薬物としての臨床開発におけるエフロンの臨床開発における協力を行った。
2023年7月、同社はそのエフロン小児神経芽細胞腫プロジェクトのいくつかの資産をUS WorldMedsに剥離したことを発表した®ケンタッキー州に本社を置く専門製薬会社。合意条項によると、Panbelaはエフルオロオルニチンの小児科神経芽細胞腫計画のためのいくつかの資産を売却するために、約950万ドルまでの非希釈資金を得る権利がある。PanbelaはUSWがエフロンの臨床開発、規制承認、商業販売に関連するマイルストーンを成功させた後に支払いを受ける。
2023年12月、同社はUSSMがFDAの承認を得て、緩解期神経芽細胞腫の維持療法としてエフルオロオルニチンを使用することを発表した。
総開発コスト
アスピリンの開発には臨床前と臨床開発段階がある。著者らは膵臓癌の初歩的な臨床前開発と2つのI期臨床試験を完成した。第2/第3段階試験は2022年に開始され,現在進行中である。追加的な臨床試験はFDAまたは他の外国司法管轄区の承認を得る必要があるかもしれない。追加臨床試験のコストと時間は試験の性質と規模に大きく依存する。
Flynpoviの開発はFAPや結腸癌予防の臨床前と臨床開発にも関与している。同社は開発やライセンスパートナーを求める前に、FDAとEMAが世界的な登録試験について合意に達することを確保しようとしている。
孤児薬状況
孤児薬品法は、まれな疾患を安全かつ有効に治療、診断または予防することを目的とした薬物は特殊な地位を有し、これらの疾患はアメリカでは20万人未満、あるいは20万人を超える影響を与えると規定されているが、メーカーはこのような薬物の開発と販売のコストを回収すべきではない。孤児薬物を指定する利点は,(I)FDAの承認手続きの簡略化,(Ii)薬物開発に関連する費用の税収減免,(Iii)孤児薬物メーカーのFDAの援助の許可,孤児薬物の承認に必要な臨床試験の助成,(Iv)薬物開発の促進である。さらに重要なことに,FDAは承認後7年間の米国独占営業権を付与し,この孤児薬物メーカーが薬物開発投資を回収する能力を大幅に向上させた。そのため、候補製品を孤児薬物に指定することは、そのスポンサーがより速く、より安価な方法でその製品を商業化する機会を与える可能性がある。
2014年と2023年初めに,それぞれ米国とヨーロッパでアスピリンの孤児薬の地位を獲得した。
私たちはすでに米国(それぞれ2013年と2011年)とヨーロッパ(それぞれ2013年と2011年)でFAPのFlynpoviとEflornithineの孤児薬物指定資格を取得した。また,米国(2010年)とヨーロッパ(2011年)で神経芽細胞腫単一薬物の孤児薬物指定資格を取得し,米国で胃癌治療(2015年)の孤児薬物指定資格を取得した。
快速通路
2020年6月,ゲムシタビンとNAB−パクリタキセルとの併用時に転移性PDAの第一線患者の治療に用いられるエビスタチンの開発に用いられたFDAの迅速チャネル指定を得た。
また,2017年9月にFDAの高速チャネル指定を取得し,FAP治療のためのFlynpoviを開発した。
高速チャネル指定があれば、私たちまたは私たちの北米パートナーはFDAとより頻繁に相互作用する可能性があり、FDAは申請が完了する前にNDAの内容の一部を審査するかもしれません。残りの情報を提出するスケジュールを提供し、申請者が適用された使用料を支払っていれば、スクロール審査を行うことができる。しかしながら、FDAの出願審査期間は、NDAの最後の部分が提出されてから開始される。また,FDAが高速チャネルの指定が臨床試験中に出現したデータの支持を得なくなったと考えると,FDAはその指定を撤回する可能性がある
知的財産権
我々の契約メーカーSyngene International Ltdが合成プロセスの改善に努めているため,特許(US 11,098,005 B 2)“生産(65,155)−3,8,13,18−TETRAAAAICOSANE−6,15−diolの方法”が2021年8月24日にPanbelaに発行された新たな短い合成プロセスが開発された。特許請求項は、エフズミンを製造する新しい方法をカバーし、合成ステップを19ステップから6ステップに減少させる。この特許はオーストラリア、アメリカ、ヨーロッパ(ドイツ、フランス、スペイン、イギリス、イタリア)、インド、日本で発行されており、他のいくつかの地域の特許訴訟が行われている。
また,エビスプラミンについては,特許を用いて癌を治療する方法がいくつかの異なる地域で特許訴訟を行っており,2041年までに特許を取得する可能性がある。
Flynpoviでは,エフラニチンとスリン酸の固定用量の組み合わせである物質特許の成分が広く国有化され,2037年までの潜在的保護を提供している。また,家族性腺腫性ポリープ症,神経芽細胞腫,および最近発症した1型糖尿病の治療のためのFlynpoviおよび/またはEflornithineのいくつかの使用方法特許を有している。
私たちは追加的な知的財産権を提供する他の機会を評価している。
人的資本管理
2024年3月22日現在、私たちは8人の従業員がいて、そのうち7人はフルタイム社員です。私たちの職員たちは労働組合代表もなく、集団交渉協定のカバー範囲もない。私たちは私たちが従業員と仲がいいと信じている
私たちの人的資本目標には、私たちの既存と新しい従業員、コンサルタント、コンサルタントを識別、採用、維持、激励、統合が含まれている。私たちの株式と現金インセンティブ計画の主な目的は、株と現金に基づく報酬奨励を付与することによって、これらの人員を誘致、維持、奨励し、これらの人員を激励して、私たちの目標を実現し、会社の成功を招き、私たちの株主のために価値を増加させることである。
私たちは労働力の背景と視点の多様性を重視し、私たちの政策は、人種、宗教、信仰、肌の色、民族の血統、血統、身体障害、精神障害、医療条件、遺伝情報、結婚状況、性別表現、年齢、軍人と退役軍人身分、性指向または連邦、州あるいは地方法律が確立された他の保護された特徴に基づいて差別を行わないことである。
私たちは運営責任が私たちの既存の従業員、独立コンサルタント、そして私たちのグローバルCROによって管理できると信じている。我々は従来,独立コンサルタントや請負業者のサービスを用いて様々な専門サービスを提供してきた.私たちは、第三者サービス提供者のこのような使用が、一般的で管理費用を最小限に抑える能力を強化したと信じている。私たちは、私たちの人員や人材ニーズを定期的に評価するつもりで、これがより適切な資源代替案になれば、従業員を増やすことが予想されます。
競争
癌治療の新製品の開発と商業化競争は激しく、迅速かつ重大な技術変化の影響を受けている。私たちの知識、経験、科学資源は私たちに競争優位を提供してくれると信じていますが、私たちは世界各地の主要な製薬会社、専門製薬会社、バイオテクノロジー会社からの激しい競争に直面しています。私たちの多くの競争相手は明らかにもっと多くの財力、技術、そして人的資源を持っている。規模の小さいスタートアップ企業も重要なライバルとなる可能性があり、特に大手や成熟会社との連携で手配されている。したがって、私たちの競争相手は私たちよりも早く、または成功的に製品を発見、開発、許可、または商業化することができるかもしれない。
私たちは現在の候補製品の面で競争に直面し、未来の候補製品の面でも競争に直面し、これらの競争は製薬、生物技術と他の関連市場の細分化市場から来ており、これらの市場は癌に関連する分子変化とシグナル経路に対する方法を求めている。私たちの競争相手は、私たちよりも早く規制機関のその製品の承認を得ることができ、あるいは特許保護や他の知的財産権を得る可能性があり、これは私たちの候補製品を開発または商業化する能力を制限する。私たちの競争相手はまた、私たちの製品よりも効果的で、便利で、より安価で、あるいはより安全性の高い薬物を開発することができます。これらの競争相手は、彼らの製品を製造し、マーケティングする上で、私たちよりも成功するかもしれません。
また、診断会社と協力して私たちの候補製品を開発する必要があるかもしれませんが、これらの協力を構築する際には、他社からの競争に直面します。私たちの競争相手はまた合格した科学、管理と商業人員を募集と維持し、臨床試験場と臨床試験の患者登録を確立し、著者らの計画を補充し、あるいは必要な技術を提供する方面で私たちと競争を展開する。
また、コスト効果と精算可能な癌治療を得るために、より広範な市場競争に直面している。癌患者を治療する最も一般的な方法は、化学療法、免疫治療、ホルモン治療および標的薬物治療またはこれらの方法の組み合わせを含む手術、放射線および薬物治療である。市販されている癌薬物療法は多種多様である。多くの場合、これらの薬物は治療効果を向上させるために併用される。我々の候補製品(承認されれば)は,これらの既存の薬物や他の療法と競合する可能性があるが,それらが最終的にこれらの療法と組み合わせて使用されるか,またはこれらの療法の添付ファイルとして使用される限り,我々の候補製品は,現在の療法と競合するのではなく,随伴療法として承認される可能性がある。その中のいくつかの薬物はブランド薬物であり、特許保護され、他の薬物は模倣薬である。保険会社および他の第三者支払者は、非特許製品または特定のブランド製品の使用を奨励することも可能である。もし私たちの候補製品が承認されれば、それらの価格はブランド模造薬を含む競争相手の模造薬より高くなると予想しています。したがって、私たちが市場に進出することに成功したどの候補製品も市場の承認を得て、かなりの市場シェアを得ることが課題となる。また,多くの会社が新たな治療法を開発しており,我々の候補製品の臨床開発における進歩に伴い,看護基準が何になるかは予測できない。
商業化する
私たちはまだ販売、マーケティング、あるいは製品流通インフラを構築しておらず、大量の管理資源を投入してこのようなインフラを計画していません。私たちの主要な候補製品はまだ早期臨床開発段階にあるからです。私たちは現在、これらの機能を果たす専門知識と能力を持つより大きな製薬機関と協力することを予想している。
製造業とサプライヤー
私たちは所有したり経営したりしないし、現在は製造施設を設立する計画もない。私たちは現在、臨床前および臨床試験、および商業化される可能性のある任意の製品の商業生産のために、第三者に依存して、私たちの候補製品を生産し続けると予想されている。必要であれば,供給契約の締結や他の手配により,第三者メーカーと交渉し,追加のアスピリン臨床供給を提供する予定である。FDAにセキュリティプロトコルを提出する前に、資格のある製造業者が初期候補製品に活性医薬成分および充填および完了サービスを提供することを決定し、他の候補製品に対してこの方法を継続して使用する予定である。
材料協定
我々がUFRFと2011年12月22日に締結した“標準独占ライセンス協定”(“ライセンス契約”)は、発行された米国特許番号US 5,962,533(2016年2月満了)およびUS 6,160,022(2020年7月満了)に含まれるノウハウの独占ライセンス、およびライセンス契約によって定義されたノウハウを付与し、UFRFは学術または政府用途のために保持している。この合意に基づいて、私たちはUFRFに様々な特許使用料、費用、そしてマイルストーン支払いを支払うことに同意する。ライセンス協定は2016年12月に改正(“第1改正案”)され、2019年10月に再改正される(“第2改正案”)。第二改正案によると、ライセンス契約で定義されているすべての最低特許権使用料とマイルストーン支払いは廃止される。また、特許権使用料の支払期限は、(I)第1回商業販売日から10(10)年または(Ii)各国市場排他期間の短い期間に変更される。UFRFはまた、重大な合意違反、破産、特許権使用料および他の習慣的条件の支払いができなかったなど、標準および同様の理由で本ライセンスを終了することができる。この協定は、2025年12月31日までに最初の商業販売が行われていなければ、UFRFを終了することができることを許可する
政府の規制:
FDA承認プロセス
アメリカでは、医薬品はFDAによって広く規制されている。その他の事項以外に、“連邦食品、薬品と化粧品法”及びその他の連邦と州法規と条例は薬品の研究、開発、テスト、製造、貯蔵、記録保存、承認、ラベル、販売促進とマーケティング、流通、承認後のモニタリングと報告、サンプリング及び輸出入に対して管理を行う。適用された米国の要求を遵守しないことは、FDAが未解決のNDAの承認を拒否し、警告または無見出し手紙、製品リコール、製品差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金、民事罰、および刑事起訴のような様々な行政または司法制裁を受ける可能性がある。
米国では、新製品または承認製品のいくつかの変更に対する医薬製品の開発は、通常、臨床前実験室および動物試験に関連し、臨床試験が開始される前に発効しなければならないINDと、FDA承認を求める各適応に対する薬物の安全性および有効性を決定するために、十分かつ制御された臨床試験とをFDAに提出する。FDA上場前の審査要求を満たすには通常長年の時間を要し、実際の所要時間は製品或いは疾病のタイプ、複雑性と新規性によって大きく異なる可能性がある。
臨床前試験は製品の化学、調合と毒性に対する実験室評価、及び製品特性と潜在安全性と有効性を評価する動物試験を含む。臨床前試験の進行は必ず良好な実験室実践を含む連邦法規と要求に符合しなければならない。臨床前試験の結果はINDの一部として他の情報とともにFDAに提出され,研究者のマニュアル,製品化学,製造と制御に関する情報,潜在的な副作用とリスク,提案された臨床試験案が含まれている。IND提出後,生殖毒性や発ガン性の動物試験など,長期的な臨床前試験を継続する可能性がある。
ヒト臨床試験を開始する前に,各INDの提出後30日間の待機期間が求められている。FDAがこの30日間INDにコメントもINDにも疑問を提起しなければ,INDで提案された臨床試験が開始される可能性がある。
臨床試験は合格した研究者の監督の下で、健康ボランティア或いは患者に研究用新薬を提供することに関連する。臨床試験は:(I)連邦法規に適合する;(Ii)良好な臨床実践(GCP)に適合し、患者の権利と健康を保護し、臨床試験発起人、管理者および監督者の役割を定義するための国際基準であり、(Iii)試験目標を詳細に説明し、安全性を監視するためのパラメータと評価すべき有効性基準のプロトコルに従って行われなければならない。米国患者のテストに関する各々のプログラムおよびいくつかの後続案修正案は、INDの一部としてFDAに提出されなければならない。
FDAが臨床試験がFDAの要求に沿って行われていないと考えている場合,あるいは臨床試験患者に受け入れられないリスクとなっている場合,FDAはいつでも臨床試験の一時的または永久的な停止を命じたり,他の制裁を加えたりすることができる。臨床試験における患者の研究案やインフォームドコンセント情報も機関審査委員会(“IRB”)に提出して承認しなければならない。IRBはまた、IRBの要求を遵守できなかったために、現場の臨床試験を一時的または永久的に停止することを要求することができ、または他の条件を適用することができる。
ニューノミンの発売承認を支持する臨床試験は通常3つの連続段階で行われるが、これらの段階は重なる可能性がある。第1段階、すなわち最初に健康なヒト対象/患者に薬剤を導入し、新陳代謝、薬物動態、薬理作用、用量増加に関連する副作用、および可能であれば有効性を評価するための早期証拠を評価するために試験を行った。第二段階は、一般に、特定の適応に対する薬剤の有効性、用量耐性、および最適な用量を決定し、よく見られる副作用および安全リスクを決定するために、限られた患者集団で試験を行うことに関連する。化合物が第2段階評価において有効性および許容可能な安全性を証明する場合、重要または第3段階試験は、多くの患者の臨床治療効果および安全性に関する追加の情報を得るために行われ、一般に地理的に分散された臨床試験場所であり、FDAが薬物の全体的な利益-リスク関係を評価し、薬物のラベルに十分な情報を提供することを可能にする。多くの場合、FDAはこの薬物の治療効果を証明するために、2つの十分かつ良好なコントロールの第三段階臨床試験を必要とする。研究が大規模な多中心試験であり,内部一致性が証明され,統計学的に非常に説得力があり,死亡率,不可逆的な発症率や疾患の予防に臨床的意義のある影響が発見され,潜在的な重篤な結果があり,第2回試験で結果を確認することは実際あるいは倫理的に不可能であれば,他の確認性の証拠を持つ単一第3段階試験で十分である可能性がある。NDAが承認された後、長期安全性、生活の質、またはコスト効果を評価するために、第4段階試験が行われる可能性がある。
必要な臨床試験が完了した後,NDAを用意してFDAに提出する。この製品が米国で発売される前に、FDAがNDAを承認する必要がある。NDAは、すべての臨床前、臨床および他の試験の結果、ならびに製品の薬理、化学、毒理学、製造、制御、および任意の提案されたラベルに関連するデータアセンブリを含まなければならない。機密協定の準備と提出のコストは高く、費用は通常毎年増加する。
FDAはNDAを受信した日から60日の時間があり,当該機関の敷居に基づいて申請が届出を受けているかどうかを決定し,申請が十分完全であると考え,実質的な審査を行うことができる。提出された申請が受け入れられると、FDAは深い検討を始めた。FDAはNDAを審査する際にいくつかの業績目標を設定し、即時性を奨励することに同意した。多くの標準審査薬品申請は提出後12カ月以内に審査を行い,多くの優先審査薬申請は提出後8カ月以内に審査を行う。優先審査は、FDAが治療において大きな進展を得るか、または適切な治療方法がない場合に治療を提供する薬剤を決定するのに適用することができる。優先審査を受ける場合、FDAの目標は6ヶ月以内に申請に行動することだ。FDAは、いくつかの遅延された情報を考慮するために、または提出中に提供された情報の情報を明確にするために、標準審査および優先審査の審査手続きをさらに3ヶ月延長することができる。FDAはまた、新薬製品の申請、または安全性または有効性の問題を有する医薬製品の申請を外部諮問委員会に提出することができる−通常、臨床医および他の専門家を含むグループである−審査、評価を行い、申請を承認すべきかどうかについて提案することができる。FDAは諮問委員会の提案によって制限されていないが、それは一般的にそのような提案に従っている。
NDAを承認する前に、FDAは、通常、GCPに適合することを確実にするために、1つまたは複数の臨床場所を検査する。さらに、FDAは薬物を製造する1つ以上の施設を検査するだろう。FDAは、現在の良好な生産実践(“cGMP”)に適合しない限り、製品を承認しないであろう(“cGMP”)、これは、標準生産の品質システムであり、NDAに含まれるデータは、研究された適応において安全かつ有効であることを証明する大量の証拠を提供する。
FDAがNDAと製造施設を評価した後、それは承認状または完全な返信を発行するだろう。完全な応答文は、一般に、提出中の不足点を概説し、FDAが出願を再検討するために、大量の追加のテストまたは情報を必要とする可能性がある。NDAが再提出されたとき、またはいつ、これらの欠陥がFDAによって満足的に解決された場合、FDAは承認書を発行するであろう。FDAは、含まれる情報タイプに応じて、そのような再提出された出願を2ヶ月または6ヶ月以内に検討することを約束している。
この薬物の商業マーケティングを許可し、特定の適応の具体的な処方情報を提供する。NDA承認の条件として、FDAは、薬物の利点が潜在的なリスクよりも大きいことを確実にするために、リスク評価および緩和戦略(“REMS”)を要求する可能性がある。REMSは,薬物ガイドライン,医療専門家のコミュニケーション計画,安全使用を確保する要素(“ETASU”)を含むことができる。ETASUは、処方または調剤のための特別なトレーニングまたは認証、場合によっては調剤、特殊な監視、および患者登録簿の使用を含むことができるが、これらに限定されない。REMSに対する要求はこの薬物の潜在的な市場と収益力に重大な影響を与える可能性がある。さらに、製品承認には、薬物の安全性または有効性を監視するために、大量の承認後の試験および監視が必要となる可能性がある。承認されると、規制基準が守られていない場合、あるいは最初のマーケティング後に問題が発見された場合、製品承認は撤回される可能性がある。
承認された出願において確立されたいくつかの条件の変更は、適応、ラベルまたは生産プロセスまたは施設の変更を含み、変更を実施するためには、新しいNDAまたはNDA付録を提出し、FDAの承認を得る必要がある。新適応のNDAサプリメントは通常,オリジナル申請と類似した臨床データが必要であり,FDAがNDAサプリメントを審査する際に使用するプログラムや行動は,NDAを審査する際に使用するプログラムや行動と同じである。
迅速な承認指定と承認の加速
FDAは、以下の薬剤の開発および検討の加速を促進することが求められている:(1)深刻または生命に危険な疾患の治療のための、または(2)有効な治療法がない場合、およびその状況を解決する可能性があることを証明する満たされていない医療ニーズを証明する薬剤。高速チャネル計画によれば,新候補製品のスポンサーは,候補製品のIND届出と同時にまたはその後,特定の適応の候補製品を迅速チャネル薬として指定することをFDAに要求することができる。FDAは、スポンサーの申請を受けてから60日以内に、候補製品が高速チャネル認証を受ける資格があるかどうかを決定しなければならない。
迅速チャネル計画およびFDAの加速承認規定によれば、FDAは、患者に既存の治療よりも意義のある治療利益を提供する深刻または生命に危険な疾患に対する薬物を承認することができ、その基礎は、臨床利益の代替終点を合理的に予測することができるか、または不可逆的な発病率または死亡率よりも早く測定することができる臨床終点であり、この臨床終点は、不可逆的な発病率または死亡率または他の臨床的利益への影響を合理的に予測することができ、同時に、病状の深刻性、希少性または流行率、および代替療法の利用可能性または不足を考慮することである。
臨床試験において、代替終点は1種の疾病或いは状況の実験室或いは臨床症状の測定であり、それは患者の感覚、機能或いは生存方式の直接測定の代わりになる。代替終点は通常、臨床終点よりも容易または迅速に測定される。この基礎の上で承認された候補製品は厳格な発売後のコンプライアンス要求を遵守しなければならず、IV期の完成或いは承認後の臨床試験を含めて、臨床終点への影響を確認する。必要な承認後研究を行わない場合や,発売後の研究期間中に臨床的利益が確認できなければ,FDAが市場からのリコールを加速させることが可能である。加速規制によって承認された候補製品のすべての宣伝材料はFDAの優先審査を経なければならない。
提出された申請が高速チャネル指定を受けた場合、スポンサーはFDAとより頻繁に相互作用することができ、FDAは申請が完了する前にNDAの内容の一部を審査する可能性がある。申請者が余剰情報を提出するスケジュールを提供し、申請者が適用された使用料を支払うことができれば、スクロール審査を行うことができる。しかしながら、FDA審査申請の期間目標は、NDAの最後の部分が提出されてから開始される。また,FDAが高速チャネルの指定が臨床試験中に出現したデータの支持を得なくなったと考えた場合,FDAはその指定を撤回する可能性がある。
突破的治療指定
FDAはまた、重症または生命に危険な疾患または状態を治療するための薬物承認申請の開発および検討を加速することを要求されており、初歩的な臨床証拠が示されている場合、薬剤は1つまたは複数の臨床的に重要な終点で既存の治療法よりも実質的に改善されている可能性がある。画期的な治療法計画により,新製品候補のスポンサーは,特定の適応の候補品を画期的な治療法として指定することをFDAに求めることができる。FDAはスポンサーの申請を受けてから60日以内に候補品が突破療法指定を受ける資格があるかどうかを決定しなければならない。
孤児薬の指定と排他性
孤児医薬品法は、まれな疾患または疾患の治療のための製品の開発にインセンティブを提供する。孤児医薬品法によれば、FDAは、米国では通常20万人未満に影響を与え、米国では20万人を超える影響を与え、米国ではこのような疾患または疾患を治療する薬剤の開発および生産のコストが製品の販売から回収されることが合理的に予想されていない稀な疾患または疾患を治療するための薬剤を孤児の称号を与えることができる。スポンサーが稀な疾患または疾患の治療を目的としていることをスポンサーが証明した場合、FDAは、同じ薬剤がスポンサーが孤児指定の適応を求めていることを前提として、当該製品を承認した孤児を孤児疾患適応として指定する。同じ薬物がスポンサーが孤児指定の適応を求めるために承認されていれば,スポンサーは合理的に見える臨床的優位仮説を提出しなければならず,孤児指定を得ることができる。秘密保護協定を提出する前に、孤児としての指定を要請しなければならない。FDAが孤児の称号を承認した後、FDAは治療剤のアイデンティティおよびその潜在的な孤児の使用を開示する。
孤児指定は、研究支出、税収控除、“処方薬使用料法案”(PDUFA)が費用減免を申請し、孤児薬物専門権を取得する資格など、製造業者に福祉を提供することができる。孤児として指定された製品が、その後、このような指定された疾患または疾患の活性部分を有するFDAの最初の承認を得た場合、孤児薬物排他性を得る権利があり、これは、限られた場合でなければ、FDAが同じ活性成分を含む別の製品を同じ適応のために承認することを7年以内に禁止する。場合によっては、孤児薬物独占性は、同じ適応を有する同じ活性成分を有する後続製品が、より良い治療効果または安全性に基づいて臨床的に承認された製品よりも優れていることが証明された場合、または患者ケアに重大な貢献をする場合、または孤児薬独占性を有する会社が市場ニーズを満たすことができない場合を含む別の製品の承認を阻止しない。また、FDAは、これらの製品が異なる有効成分を含む限り、1つ以上の製品を同一の孤児適応または疾患に使用することを許可することができる。また,競争相手は孤児薬に対して排他的な適応を持つ異なる製品の承認を得たり,同一製品に対して排他的であるが孤児薬物に対して排他的な異なる適応を承認したりする可能性がある。
欧州連合では,孤児薬物指定はまた,締約国に費用の削減や費用の免除などの財政的奨励を受け,薬物や生物製品の承認後10年間の市場排他性を付与する権利がある。孤児薬物指定基準が満たされなくなり、製品の利益が十分に高く、市場排他性を維持するのが合理的であることを証明するのに不十分であれば、この期間は6年に短縮される。
上場承認申請を提出する前に、孤児薬の指定を申請しなければならない。孤児薬物の指定は、監督審査と承認過程においていかなる利点も伝達されず、規制審査と承認過程の持続時間を短縮することもない。
承認後に要求する
機密協定が承認されると、製品はいくつかの承認後に要求される制約を受けるだろう。例えば、FDAは薬品の承認後のマーケティングと販売促進を密接に監督し、消費者向けの広告、ラベル外販売促進、業界賛助の科学と教育活動及びインターネットに関連する販売促進活動の基準と法規を含む。薬品は承認の適応と承認されたラベルの規定でしか販売できない。
FDAがNDAを承認した後,有害事象報告と定期報告を提出する必要がある。FDAはまた、上場後試験、いわゆる第4段階試験、リスク評価および緩和策、またはREMS、ならびに承認製品の効果を監視することを要求することができ、またはFDAは、承認時に条件を追加して、製品の流通または使用を制限する可能性がある。また、品質管理、薬品製造、包装とラベルプログラムは承認された後、現在の良好な生産実践或いはcGMPに引き続き適合しなければならない。医薬品製造業者と彼らのいくつかの下請け業者はFDAといくつかの州機関に彼らの工場を登録することを要求された。FDAの登録はその実体がFDAの定期抜き打ち検査を受けることが求められており,その間,FDAは製造施設を検査し,cGMPの遵守状況を評価している。そのため,メーカーはcGMPの遵守を維持するために,生産や品質管理の分野で時間,お金,精力をかけ続けなければならない。ある企業が規制基準を遵守できなかった場合、初期マーケティング後に問題に遭遇した場合、または後に以前に意識されていなかった問題が発見された場合、監督管理機関は製品の承認を撤回したり、製品のリコールを要求したりすることができる。
規則および環境事項を付加する
米国では、FDAに加えて、私たちの活動は、連邦医療保険や医療補助サービスセンター(CMS)、米国衛生·公衆サービス部の他の部門(例えば、監察長事務室)、米司法省(DoJ)、司法省内の個別連邦検事室、州や地方政府を含む様々な連邦、州、地方当局によって規制される可能性がある。例えば、販売、マーケティング、科学/教育支援プロジェクトは、“社会保障法”、“虚偽申告法”における反詐欺および反乱用条項を遵守しなければならず、私たちの活動は、“健康保険携行性と責任法案”(HIPAA)や同様の州法におけるプライバシー条項に関連しており、各法律が改正されている可能性がある。
他の事項に加えて、連邦反リベート法規は、任意の個人またはエンティティが、購入、レンタル、注文または購入の手配、レンタルまたは購入の手配、レンタルまたは注文として、Medicare、Medicaid、または他の連邦医療計画に従って精算可能な任意の物品またはサービスの見返りとして、故意に、または故意に現金または実物で直接または間接的に、公開または隠蔽的に提供、支払い、請求または任意の報酬を受けることを禁止する。報酬という単語は価値のあるものを含むと広く解釈されている。逆リベート法規は、一方では薬品メーカーであり、他方では処方者、購入者、処方マネージャーの間の手配に適用されると解釈される。法的な例外と規制された避難所があり、いくつかの一般的な活動を起訴されないように保護する。例外や安全港の範囲は狭く,処方,購入または推奨の報酬を誘導するために告発される可能性があるやり方に関連しており,例外や安全港の資格を満たさなければ審査される可能性がある。特定の適用された法定例外や安全港を規制するすべての要求を満たしていないことは、このような行為自体が“反リベート条例”に規定された不法行為であることを意味するわけではない。代わりに、そのすべての事実と状況の累積審査に基づいて、この手配の合法性を逐案的に評価する。私たちのやり方が“反リベート規制”に適合していると信じる理由があるが、私たちのやり方はすべての場合、法定例外や安全港保護を規制するすべての基準に適合していないかもしれない。
また、“平価医療法案”は“反リベート法規”下の意図標準を改正し、更に厳格な標準にし、個人或いは実体がこの法規或いはこの法規に違反する具体的な意図を実際に理解する必要がなく、違反を実施することができる。また,ACAは連邦“虚偽申告法”(以下さらに議論)に基づき,連邦“反リベート法令”違反による物品やサービスのクレームを含めて虚偽や詐欺的クレームを構成する判例法を編纂している。
民事金融処罰条例は、任意の個人またはエンティティに厳しい経済的処罰を科すことを許可しており、他にも、その個人またはエンティティは、連邦医療計画へのクレームを提起したか、またはそのクレームがクレームに従って提供されていないプロジェクトまたはサービス、または虚偽または詐欺的であることを知っているか、または認識すべきである。
他の事項に加えて、連邦虚偽申告法は、連邦政府の支払いまたは承認を要求するために、または虚偽または詐欺的クレームに関連する虚偽記録または陳述の作成、使用、または作成または使用を引き起こすために、任意の個人または実体が連邦政府に意図的に提出するか、または虚偽請求の提出を引き起こすことを禁止する。2009年の“詐欺法執行·回収法案”の改正により、クレームには、米国政府に提出された金銭又は財産に対する“任意の請求又は要求”が含まれている。最近,いくつかの製薬や他のヘルスケア会社がこれらの法律により起訴されており,顧客に無料製品を提供し,顧客がその製品の連邦計画に課金することを期待しているといわれている。他社も起訴され、これらの会社は未承認の用途に製品を販売し、虚偽の声明を提出したため、精算できなかった。
さらに、連邦詐欺法規は、虚偽または詐欺的な言い訳、陳述または承諾の方法で任意の医療福祉計画(プライベート第三者支払者を含む)が所有または制御または保管している任意の金銭または財産を詐欺または取得し、悪巧み、計画または装置、重要な事実によって故意に偽造、隠蔽または隠蔽し、または医療福祉、プロジェクトまたはサービスの提供または支払いに関連する重大な虚偽、架空、または詐欺的な陳述を意図的かつ意図的に実行または実行しようとすることを禁止するであろう。
また、多くの州で同様の詐欺や法律や法規の乱用があり、医療補助や他の州が計画して精算するプロジェクトやサービスに適用されたり、いくつかの州では支払者にかかわらず適用されている。
私たちは連邦政府と私たちが業務を展開している州のデータプライバシーと安全規制によって制限されるかもしれない。HIPAAは“経済と臨床健康を促進する健康情報技術法”(“HITECH”)及びその実施条例の改正により、個人が健康情報を識別できるプライバシー、安全と伝送に対して要求を提出した。他の事項に加えて、HITECHは、保護された健康情報を受信または取得するために、カバーエンティティに代わってサービスを提供する商業パートナー、独立請負業者、またはエージェントに、HIPAAのプライバシーおよびセキュリティ基準を直接適用させる。HITECHはまた4つの新しい民事罰金等級を作成し、HIPAAを改訂し、民事と刑事処罰を商業パートナーに直接適用し、州総検察長に新しい権力を与え、連邦裁判所に民事訴訟を提起し、損害賠償または禁止令を要求して連邦HIPAA法を執行し、連邦民事訴訟に関連する弁護士費と費用を求めることができる。また,州法は特定の場合に健康情報のプライバシーやセキュリティを管理しており,その多くの法律は互いに大きく異なり,同様の効果が生じず,コンプライアンス努力を複雑化させる可能性がある
さらに、ACAの範囲内の連邦医師は、Medicare、Medicaidまたは児童健康保険計画(いくつかの例外を除く)に支払うことができるいくつかの医薬品、器具、生物および医療用品の製造業者に、医師、他の指定された保健専門家および教育病院または医師、他の指定された保健専門家および教育病院への要求、またはその指定された実体または個人を代表して行われる特定の支払いまたは他の価値移転に関する情報を報告し、医師および他の指定された保健専門家およびその直系親族によって所有されるいくつかの所有権および投資権益を毎年報告する。一部の州でも同様の法律があり、製造業者にカバーされた個人および実体への移転のいくつかの価値を報告することを要求している。製品を商業的に流通させるためには、州の法律を遵守しなければならない。これらのメーカーまたは流通業者が州に営業場所がなくても、ある州で製品をその州に搬送するメーカーおよび流通業者を含む州に薬品および生物製品の製造業者および卸売業者を登録することを要求しなければならない。一部の州はまた、メーカーと流通業者が流通チェーン中で製品の系統を確立することを要求しており、いくつかの州はメーカーと他の州に流通チェーン中の製品の流れを追跡し追跡できる新しい技術を採用することを要求している。いくつかの州はすでに立法を公布し、製薬と生物技術会社にマーケティングコンプライアンス計画を確立し、州政府に定期報告を提出し、販売、マーケティング、定価、臨床試験およびその他の活動を定期的に公開し、および/またはその販売代表を登録し、薬局および他の医療保健実体が製薬および生物技術会社にいくつかの医師処方データを販売およびマーケティングのために提供することを禁止し、いくつかの他の販売およびマーケティング行為を禁止する。私たちのすべての活動は連邦と州消費者保護と不正競争法によって制限されるかもしれない
もし私たちの運営が上記のいずれかの連邦および州医療保健法律または私たちに適用される任意の他の政府法規に違反していることが発見された場合、私たちは、MedicareとMedicaid、禁止、個人通報者が政府の名義で提起した個人訴訟、または政府契約、契約損害、名声損害、名声損害、行政負担、利益減少と将来の収入減少、および私たちの業務の削減と再編を含む、民事、刑事および/または行政処罰、損害賠償、罰金、返還、MedicareおよびMedicaid、禁止、個人通報者が政府名義で提起された個人訴訟を含むが、処罰を受ける可能性がある。いずれも私たちの業務運営能力と運営結果に悪影響を及ぼす可能性があります。
保証と精算を請け負う
私たちが規制部門の承認を得た任意の候補製品のカバー範囲と精算状態には、重大な不確実性がある。米国や他の国·地域の市場では、規制部門の承認を得て商業販売を行う任意の製品の販売は、第三者支払者がそのような製品に保険を提供する程度に依存し、十分な補償レベルを確立することになる。米国では,第三者支払者には連邦や州医療計画,個人管理のヘルスケア提供者,医療保険会社,その他の組織が含まれている。第三者支払者が製品に保険を提供するかどうかを決定するプロセスは、製品価格を決定するプロセス、または第三者支払者が製品のために支払うべき支払率を決定するプロセスから分離することができる。第三者支払者は、承認されたリスト上の特定の製品にカバー範囲を制限することができ、処方表とも呼ばれ、FDAによって承認された特定の適応のすべての製品を含まない可能性がある。第三者決済者は、価格に挑戦し、医療の必要性を審査し、医療製品、療法、サービスの費用対効果を審査するとともに、それらの安全性と有効性を疑問視するようになっている。私たちは、私たちの製品の医療の必要性と費用効果、FDAの承認を得るのに必要なコストを証明するために、高価な薬物経済学的研究を行う必要があるかもしれない。私たちの候補製品は医学的に必要で費用効果があると思われないかもしれない。支払者が製品に保険を提供することを決定することは、十分な返済率を承認することを意味するものではない。また、支払者が1つの商品に保険を提供することを決定し、他の支払者もその商品に保険を提供することを保証することはできない。連邦医療保険精算も同様であり、異なるサプライヤーが支払いを処理するため、1つのサプライヤーの保険は他のすべてのサプライヤーが保険を提供することを保証することはできない。製品開発への投資の適切な見返りを実現するために、十分な価格レベルを維持することができる十分な第三者精算がないかもしれない。また、アメリカ連邦政府の薬品定価関連問題における立場は変化しており、不確定であり、いかなる変化もアメリカの薬品定価に実質的な影響を与える可能性があり、承認されれば、私たちの候補製品に実質的な影響を与える可能性もある。
他の国もまた違う価格設定と精算プログラムを持っている。EUでは,各国政府はその定価と精算規則や国家医療システムの制御により薬品の価格に影響を与え,これらのシステムは消費者にこれらの製品の大部分のコストを支払っている。いくつかの法域はプラスリストとネガティブリスト制度を実行し、補償価格を合意した後にのみ、製品を販売することができる。精算または定価の承認を得るために、その中のいくつかの国は臨床試験の完成を要求する可能性があり、特定の候補製品のコスト効果を現在利用可能な治療法と比較する。他の会員国たちは会社が自分の薬品価格を固定することを許可するが、会社の利益を監視する。英国の国家健康·介護卓越研究所(“NICE”)も費用便益分析を考慮する必要がある。医療コストの下振れ圧力は非常に大きくなっている。そのため、新製品の参入にはますます高い壁が設けられている。また、一部の国では、低価格市場からの国境を越えた輸入が一国国内の定価に商業圧力をかけている。
政府や第三者支払者が十分な保険や補償を提供できない場合、規制部門の承認を得て商業販売を行う任意の候補製品の適正性が影響を受ける可能性がある。また,米国では管理型医療への重視度が増加しており,医療定価の圧力が増加し続けることが予想される。保証政策と第三者精算料率は随時変化する可能性がある。規制部門の承認を得た1つまたは複数の製品が有利な引受·精算状態を獲得しても、将来的にはあまり有利ではない引受政策や精算料率が実施される可能性がある。
利用可能な情報
ウェブサイトはwww.Panbela.comにあります。本募集説明書に含まれている又は当社のサイトに関する情報は、本募集説明書の一部ではありません。我々はすでに我々のサイトアドレスを事実として参考にしており,我々のサイトへのアクティブなリンクとするつもりはない.
私たちは、我々の10-K表年次報告、10-Q表四半期報告、現在の8-K表報告、およびこれらの報告の修正を含む、取引法第13(A)または15(D)節に従って米国証券取引委員会に提出または提供された資料を、当社のウェブサイトを通じて無料で提供します。これらの材料は、私たちがアメリカ証券取引委員会に電子的に保存または提供した後、合理的で実行可能な状況でできるだけ早く私たちのサイトに公開されます。
公衆はアメリカ証券取引委員会の公共資料室で私たちが提出した任意の資料を読むことができます。公共資料室はワシントンD.C.20549、第五街450号にあります。公共資料室の運営状況については、米国証券取引委員会1-800-米国証券取引委員会-0330に請求することができる。米国証券取引委員会には、我々及び他の発行者に関する報告書、依頼書及び情報声明、その他の情報が含まれたウェブサイトが設けられており、これらの情報は電子的に提出されているHttp://www.sec.gov.
|
プロジェクト1 A |
リスク要因 |
私たちの普通株に投資する前に、あなたは以下のリスクに関する情報と、本報告書に含まれている他の情報をよく考慮しなければならない。次のいずれかの状況または事件が実際に発生または発生した場合、私たちの業務、経営結果、キャッシュフロー、および財務状況は損害を受ける可能性があります。
私たちの業務や財務状況に関連するリスク
私たちは営業前の会社で、キャッシュフローを責任を持って運営していた歴史があります。
設立以来,我々の経営活動のキャッシュフローは負であったが,これは主に我々の主要候補薬物の商業化に必要な投資によるものであった。株式証券の売却と本票発行の収益により、我々の融資キャッシュフローは歴史的に正視されてきた。2023年12月31日と2022年12月31日の年度までに,我々が経営活動に使用した純現金はそれぞれ2520万ドルと1530万ドルであり,2023年12月31日現在,我々の運営資本はマイナス930万ドルであり,2022年12月31日現在,我々の運営資本はマイナス600万ドルである。運営資本の定義は流動資産から流動負債を差し引くことである。
私たちの業務は新製品開発過程でよく遭遇するすべてのリスク、困難、合併症、遅延の影響を受け、私たちが競争に参加する製薬とバイオテクノロジー業界特有のリスクを受ける。投資家は新製品、サービスと技術開発市場の会社のためによく遭遇する遅延、費用、問題と不確定要素を考慮して、私たちに対して評価を行うべきである。私たちはこのような障害物を永遠に克服できないかもしれない。
私たちの財務的流動性が限られているので、私たちと監査人は私たちに引き続き“経営を続ける企業。”
私たちの現在の財務流動性が限られているため、私たちの監査人は、2023年の財務諸表の報告書(本報告の一部として)に、私たちが“持続的な経営企業”として経営を継続する能力に関する声明を含む。私たちの限られた流動資金は、私たちが受け入れられる条項に従って追加融資を獲得したり、戦略関係を構築したりすることを難しくし、私たちが獲得する可能性のある任意の融資の条項と私たちの公開株価に重大で不利な影響を与えるかもしれない。
我々の“持続経営企業”としての継続経営は,運営から正のキャッシュフローを獲得し,必要に応じて外部資源を利用してキャッシュフローを増加させ,我々の現金需要を満たすことに依存している。私たちが正のキャッシュフローを達成する計画は主に証券の発行を含む。他の潜在的な資金源には、私たちの現在および潜在的な将来の候補製品の事前支払いおよびマイルストーン支払いの交渉、または私たちの製品を販売することによって規制された承認された特許権使用料、およびそのような承認された製品に関連する任意のマイルストーン支払いが含まれる。このような現金源は資金調達や他の戦略的合意によって補完されるかもしれない。しかし、私たちはこれらの目標を達成できないかもしれないし、商業的に合理的な条件で必要な資金を得ることができないかもしれないし、これらの目標を実現できないかもしれないので、経営を続けることができないかもしれません。
私たちは事業計画を実行するために必要な追加資本を得ることができないかもしれないが、これは私たちの成長能力を制限するかもしれない。
私たちの既存資本および他の既存資源は、限られた運営資本を提供するのに十分であり、私たちが予想している持続可能な機会に資金を提供するのに十分ではないだろう。私たちの既存の資本資源は、2024年第2四半期までの臨床試験コストの増加を含めて、私たちの運営に資金を提供することが予想されますが、私たちの業務を継続し、私たちの臨床開発計画を完成させるために追加の資本が必要になります。
将来の研究開発は、臨床試験コスト、資本支出と可能な買収、そして私たちの行政要求、例えば給料、保険費用と一般管理費用、そして法律コンプライアンスコストと会計費用を含み、大量の追加資本とキャッシュフローが必要になる。私たちが商業的に合理的な条項で必要な追加資本を調達し、私たちの持続的な業務に資金を提供することができるか、あるいは根本的にできないという保証はない。
私たちは、協力手配、債務融資、株式融資、または他の方法を含めて、様々な融資取引や手配を通じて、追加資金源を求めるつもりだ。私たちは商業的に合理的な条項、必要な時間内、あるいは適切な融資取引を見つけることができないかもしれないし、他の方法で私たちに必要な資本を得ることができないかもしれない。もし私たちがもっと多くの資本を集めることに成功できなければ、私たちの資源は私たちの未来の行動が資金を提供すると思って足りないだろう。
株式を売却することで調達されたいかなる追加資本も、私たちの株主の所有権比率を希釈することができる。これはまた、私たちの資産がより大きな未償還株式プールによって所有されるので、私たちの株式証券の公平な市場価値を低下させる可能性がある。私たちが将来の資本取引で証券を発行する条項は、私たちの新しい投資家により有利になる可能性があり、割引、より高い投票権、および発行権、またはさらなる希釈効果を有する可能性のある他の派生証券を含むかもしれない。
私たちが必要な資金を得る能力は、資本市場、特に製薬と他の薬物開発業界の資本市場、私たちの活動の限られた多様性および/またはキーパーソンの流失などの要素の影響を受ける可能性がある。もし私たちが融資活動から集めた資金が私たちの資本需要を満たすのに十分でなければ、事業を減らしても、業務を停止することを要求されるかもしれません。
私たちは将来の資本融資を求める際に大量のコストが発生する可能性があり、投資銀行費、弁護士費、会課金、証券法適合費、印刷、流通費用、その他のコストを含み、これは私たちの財務状況に悪影響を及ぼす可能性がある。
私たちの候補製品の市場競争は激しく、迅速な科学的変化の影響を受けており、これは私たちの業務、運営結果、財務状況に実質的な悪影響を及ぼす可能性がある。
私たちが競争する製薬とバイオテクノロジー業界は競争が激しく、迅速で重大な技術変革を特徴としている。製薬やバイオテクノロジー会社や学術や研究機関,政府機関などからの激しい競争に直面している。その中のいくつかの組織は私たちの技術と似たような技術に基づく製品を追求している。これらの組織の他の組織は、製品を開発し、マーケティングしているか、またはこれらの競合製品が私たちの候補製品に対する疾患の治療効果において私たちの候補製品と競争力を有する製品を生産することを目的としている他の技術的方法を求めている。私たちの競争相手は、私たちが開発する可能性のある任意の製品や新技術よりも効率的で、より安全またはコストの低い製品または新技術を発見、開発、または商業化するかもしれない。私たちの競争相手はまた私たちが候補製品の承認を得るよりも早くFDAや他の規制機関の承認を得るかもしれない。
私たちの多くの競争相手は私たちよりずっと大きくて、私たちよりも多くの資本資源、研究開発者、そして施設を持っています。また、私たちの多くの競争相手は薬物の発見、開発と商業化、監督管理の承認及び薬物製造とマーケティングの方面でもっと経験がある。
私たちは、私たちの候補製品と技術との競争は、製品効率、安全性、可用性、価格を含む一連の要素に基づくと予想される。私たちが計画している将来の候補製品と競争製品の発売タイミングは製品間の競争にも影響を与えるだろう。必要であれば,我々の候補製品を開発し,必要な臨床試験を完了し,戦略的パートナーを構築し,後期試験に適切な数の候補製品の相対速度を提供することが重要な競争要因となると予想される。私たちの競争的地位はまた、私たちが現在持っていない非米国市場で特許保護を受ける能力があるかどうか、または他の方法で独自製品またはプロセスを開発し、技術構想から商業販売まで、または製薬パートナーへの許可証の発行中に十分な資本資源を有することを保証する能力があるかどうかにかかっている。もし私たちが提案された候補製品を成功的でタイムリーな方法で開発して配置できなければ、私たちは競争力がない可能性が高い。
私たちの多様性の不足はわが社への投資リスクを増加させ、私たちが多元化しなければ、私たちの財務状況と運営結果は悪化する可能性がある。
私たちの取締役会は私たちの薬物開発活動に集中しています。これらの活動は現在限られた数の候補製品に集中しています。私たちが私たちの投資を多様化できるかどうかは、私たちがより多くの資本と資金源を得ることができるかどうか、そして適切な機会を得ることができるかどうかにかかっている。
規模の大きい会社は多様な経営を通じてリスクを管理する能力がある。しかし、私たちの業務の性質と地理的範囲については、私たちは不足しており、多様性が不足し続けると予想される。したがって、私たちは、私たちの業務がより多様化し、私たちのリスク状況を向上させるために、私たちの競争に影響を与える製薬やバイオテクノロジー産業に影響を与える要素の影響を受けるかもしれない。もし私たちが私たちの業務を多様化できなければ、私たちの財務状況と運営結果は悪化するかもしれない。
もし私たちが人材を誘致して維持しなければ、私たちの業務は影響を受けるかもしれない。
私たちの成功は、私たちの経営陣や他の人たちの業務を展開する際の能力、専門知識、判断力、判断力、誠実さ、誠意に大きく依存します。私たちの管理チームは規模が小さく、キーパーソンを失ったり、適切な適格社員を引き付けることができず、私たちの業務に実質的な悪影響を及ぼす可能性があります。
私たちの成功は、適切な投資機会を見つけ、採用し、そのような投資を監視し、最終的に必要な時にそのような投資を剥離することに成功するために、私たちの経営陣、従業員、コンサルタント、戦略パートナー(できれば)が市場データを正確に解読し、対応することにかかっている。また、私たちの主要な人員が引き続き私たちに連絡したり雇用したりする保証はなく、似たような技能を持つ代替者を見つけることも保証されない。私たちは管理職とすべての重要な職員たちが適切に補償されることを確実にするために努力するつもりだが、彼らのサービスは保証されない。もし私たちが重要な人材を引きつけて維持できなければ、私たちの業務は不利な影響を受けるかもしれない。
私たちは訴訟の弁護や製品責任クレームのための損害賠償金を支払うように要求されるかもしれない。
製品責任はバイオテクノロジーと医薬製品テストとマーケティングの大きなリスクだ。人体臨床試験と監督管理許可後の製品販売において、著者らは大量の製品責任の開放に直面する可能性がある。製品責任クレームは、その是非曲直にかかわらず、保険制限を超え、経営陣の注意を移し、私たちの名声と私たちの製品の需要に悪影響を及ぼす可能性がある。このような場合でも、あなたの私たちの証券への投資は実質的な悪影響を受ける可能性があります。
新薬開発と承認に関するリスク
我々の候補製品に必要な臨床試験は高価で時間がかかり,その結果も非常に不確実である。もし私たちの任意の薬物試験が延期されたり、不利な結果が生じたりすれば、私たちは規制部門の候補製品の承認を得ることができないかもしれない。
私たちはすべての候補製品に対して広範なテストをしなければならないし、それから監督部門の承認を得て、それを市場に出して販売することができる。私たちは前臨床動物試験と人体臨床試験を行う必要がある。このような実験を行うことは長く、時間がかかり、費用がかかる過程だ。これらのテストと試験は良好な結果が得られない可能性があり、原因は非常に多く、その中には候補製品が安全性或いは有効性を証明できなかったこと、候補製品に接触することによる深刻な或いは生命に危害を及ぼす有害事象或いは副作用が発生したこと、臨床試験中に被験者を登録と維持することの困難、候補製品或いは対照薬物の供給不足、及び臨床研究者、試験監督者、請負業者、コンサルタント又は試験被験者が試験方案を遵守できなかったことを含む。測定された終点を検出するのに十分な数の患者が含まれていないため、臨床試験は失敗する可能性がある。臨床試験も失敗する可能性があり,試験に含まれる研究薬の投与量(S)が低すぎるか高すぎるため,疾患背景における薬物の最適効果を決定することはできない。多くの臨床試験は独立データモニタリング委員会(“IDMC”)の監督下で行われ、これらの独立監督機構は外部の専門家から構成され、彼らは行っている臨床試験の進展状況を審査し、現有の安全性と有効性データを含み、そして一時的、非盲目的なデータに基づいて試験の継続、修正或いは中止について提案を提出する。我々が行っているどの臨床試験も中断または修正可能であり,担当IDMCがこのような中期試験結果の審査に基づいて提案した提案に応答する。
もし私たちの候補製品のテストが良くなければ、私たちはそれらを再評価するか、高価で時間のかかる新しい試験を行うか、私たちの薬物開発計画を放棄する必要があります。われわれが前臨床試験や臨床試験から積極的な結果を得ても,将来の試験で同様の成功は得られない可能性がある。バイオ製薬業界の多くの会社は臨床試験で大きな挫折を経験し,早期の試験でも奮い立つ結果を得た。臨床試験は必要な適応の安全性と有効性を証明できず、私たちの候補製品の発展を損なう可能性があり、私たちの業務、財務状況、運営結果は実質的な損害を受ける可能性がある。
私たちは製品候補開発で重大な危険に直面している。
私たちの業務は私たちの候補製品の成功的な開発と商業化に依存する。我々は現在,PDA治療のための最初の候補製品SBP−101の開発に焦点を当てており,FDAのNDA承認を得る前に,あるいはいかなる外国司法管轄区域でも必要な承認を得るまで,米国での販売は許可されていない。新薬および/または治療製品を開発するプロセスは、本質的に複雑で予測不可能であり、時間的、高価かつ不確実である。私たちの開発計画が薬物が規制部門の承認を得て市場に受け入れられるかどうかを知るためには、長期投資を行い、大量の資源を投入しなければならない。一つは,すべての開発段階で有望に見える候補製品が出荷できない可能性があり,原因が多く,臨床計画の結果やデータからは予測できない可能性がある。候補製品は臨床試験中に無効或いは有害な副作用を招く可能性が発見される可能性があり、予想よりも長い臨床試験の進展時間を必要とする可能性があり、所定の臨床終点を実現できない可能性があり、すでに臨床利益を得ている可能性があっても、必要な監督管理の承認を得ることができない可能性があり、合理的なコストと許容可能な品質で商業量産を行うことは不可能であることが証明される可能性があり、あるいは市場の受け入れを得ることができない可能性がある。
規制部門の承認を得て私たちの候補製品を商業化するかどうかは予測できませんので、その製品や他の候補製品の将来の任意の収入時間(あれば)を予測することはできません。FDAは薬品の審査過程においてかなりの自由裁量権を持っており、多種の原因で承認候補製品を延期、制限、或いは拒否する権利があることを含む。例えばFDA:
|
● |
私たちが提供した情報が不十分で、臨床的欠陥を含むか、または私たちの任意の候補製品を証明できなかった任意の適応の安全性および有効性を決定することができる |
|
● |
臨床試験からのデータは、我々の候補製品の臨床的および他の利益がその安全リスクを超える任意の発見を含む、秘密協定の提出または米国での上場承認を支持するのに十分ではないと考えられるかもしれない |
|
● |
私たちの試験設計や臨床前研究または臨床試験データの解釈に同意しないかもしれないし、それが私たちの試験設計を審査してレビューした後であっても、承認要求を変更する可能性があります |
|
● |
私たちが候補製品を製造する契約を締結した第三者製造業者の製造プロセスまたは施設の欠陥を見つけることができる |
|
● |
私たちの候補製品が私たちが要求しているよりも少ないまたは限られた適応を承認するかもしれないし、高価な承認後の臨床試験の表現によって承認されるかもしれない |
|
● |
その承認政策を変更したり、新しい規定を採用したりすることができる |
|
● |
私たちが候補製品の商業化に成功するために必要または望ましいと思うラベル宣言を承認しないかもしれない。 |
もし私たちが開発した初期候補製品または未来の候補製品が規制部門の承認を得られなければ、私たちが収入を創出する能力を大きく制限し、適切なすべての適応とラベル宣言がこのような承認を得られなければ、私たちの潜在収入を減少させる可能性があると考えられる。
私たちの候補製品は、癌の治療のために許可されていない既存技術の新しい処方に基づいており、したがって、固有のリスクがある。私たちの候補製品の安全性と有効性に対する懸念は私たちの未来の成功を制限するかもしれない。
新技術に基づく候補製品の開発では、我々は固有の失敗リスクに直面している。これらのリスクは、私たちが作成したどの候補製品も無効になる可能性があり、私たちの現在の候補製品は安全ではない、無効であるか、必要な規制承認を得ることができないか、あるいは私たちの候補製品は大規模な生産が困難になるか、市場に割に合わないだろう。
多くの薬品は多種の潜在的な合併症と副作用を招き、すべてのものが正確に予測できるわけではなく、しかも多くの副作用は患者によって異なる可能性がある。長期的な追跡データは、私たちの候補製品に関連する追加的な合併症を明らかにするかもしれない。潜在医師や他の人の合併症に関する情報に対する反応は,市場の我々候補製品に対する受容度に実質的に影響する可能性があり,逆に我々の業務に実質的な損害を与える可能性がある。
著者らは第三者に依存して臨床試験を行うため、著者らは臨床試験の時間、進行、費用と品質を直接制御することができず、これは著者らの臨床データと結果及び関連する監督管理の承認に不利な影響を与える可能性がある。
われわれはわれわれの臨床試験活動を広く外注し,計画試験準備段階のごく一部のみを直接実行する予定である。著者らは独立した第三者CROに依存して、文書準備、場所識別、スクリーニングと準備、研究前訪問、訓練、プロジェクト管理と生物分析を含む著者らの大部分の臨床試験を実行する。CROが私たちに提供してくれた多くの重要なサービスは私たちが直接統制しているものではない。もし私たちとCROの関係に何か論争や中断があれば、私たちの臨床試験は延期されるかもしれない。また,我々が提出した規制文書では,第三者CROが行っている臨床作業の質と有効性に依存している。CROの流れ、方法、または結果が無効または不十分であると判定された場合、私たち自身の臨床データおよび結果、ならびに関連する規制承認は悪影響または無効を受ける可能性がある。
私たちは第三者サプライヤーと他の第三者に依存して私たちの候補製品を生産しますが、これらの第三者への依存は私たちの研究開発計画の進歩と私たちの候補製品の開発を損なう可能性があります。
我々は,臨床前研究や臨床試験に必要な原材料や薬品供給を第三者に依存して提供し続ける予定である。2021年の間,同社は我々の製造パートナーと協力し,新たなより短く,より安価な活性医薬物質の合成を確認した。しかし、第三者の生産遅延は、私たちの臨床試験を延期したり、任意の商業活動に悪影響を及ぼす可能性があります。また、私たちは第三者に依存して私たちの候補製品を製造し、調合することは、私たちが製品に製造欠陥が存在する可能性があるリスクに直面していることを意味し、私たちはこれらの欠陥を予防または制御する能力が限られている。私たちはこれらの活動を監視して、私たちの品質基準、予算、スケジュールに適合することを保証しているにもかかわらず、私たちは私たちの候補製品を生産するのではなく、私たちの候補製品の製造をもっと少なく制御し続けるつもりだ。また、私たちと付き合っている第三者は、人員配置が困難で、優先順位が変化したり、財務的苦境に陥ったりする可能性があり、これは私たちの候補製品の製造と生産に悪影響を及ぼす可能性があります。
臨床前研究と完成した臨床試験の結果が必ずしも将来の結果を予測できるとは限らず,我々の現在の候補製品は今後の研究や試験で有利な結果が得られない可能性がある。
臨床前研究と第一段階の臨床試験は主に普通の人群における候補製品の治療効果をテストするためではなく、初歩的な安全性をテストし、薬物動態学と薬効学を研究し、疾病群の中の少数の研究患者の限られた治療効果を研究し、及び候補製品の異なる用量と用量計画下の副作用を識別と理解することを試みた。臨床前研究或いは完成した臨床試験の成功は今後の研究或いは試験を確保することができず、持続的な臨床前研究と大規模な臨床試験が成功することを含み、必ずしも未来の結果を予測できるとは限らない。早期研究または試験における有利な結果は、後の研究または試験で重複しない可能性があるが、後期試験における候補製品は、早期試験に合格したにもかかわらず、許容可能な安全性および有効性を示すことができない可能性がある。
私たちの業務規制に関するリスク
連邦と州薬品マーケティングのコンプライアンスと報告要求は、私たちを州政府または他の政府当局の規制と法律行動に直面させるかもしれない。
食品と薬物管理局現代化法案(“FDMA”)は公開された臨床試験の公開登録を確立し、深刻或いは生命に危害を及ぼす疾病或いは疾病を治療することを目的とした薬物に関連し、公衆のこれらの臨床試験に対する認識を高め、これらの臨床試験の機会を獲得する。FDMAにより,医薬品メーカーや他の試験スポンサーは,これらの試験の一般的な目的,および試験の資格基準,場所,連絡情報を公表しなければならない。いかなる臨床試験の掲示要求を守らなければ、私たちはマイナスの宣伝、罰金とその他の処罰に直面する可能性があり、これらはすべて私たちの業務に実質的な損害を与える可能性がある。
近年、カリフォルニア州、バーモント州、メイン州、ミネソタ州、ニューメキシコ州、ウェストバージニア州を含むいくつかの州は立法を公布し、製薬会社にマーケティングコンプライアンス計画を確立し、販売、マーケティング、定価とその他の活動に関する報告を定期的に提出することを要求している。他の州も似たような立法を考慮している。その中の多くの要求事項は新しくて不確実であり、利用可能な指針は限られている。私たちがこのような法律を完全に遵守しない限り、私たちは法執行行動、罰金、その他の処罰に直面し、否定的な宣伝を受ける可能性があり、これらはすべて私たちの業務を損なう可能性がある。
もし私たちが開発した候補製品が不利な価格設定法規、第三者精算やり方、あるいは医療改革措置の制約を受けていれば、候補製品を商業化することに成功する能力が損なわれる可能性がある。
私たちの将来の収入、収益力、資本獲得の機会は、政府や個人第三者支払人が様々な手段で医療コストをコントロールしたり、低減したりする持続的な努力の影響を受けるだろう。私たちはいくつかの連邦、州、外国の提案が政府規制を通じて薬品コストを抑えることを予想している。最近の医療改革立法が私たちの業務に影響を与える可能性があるかどうかは定かではありませんし、連邦、州、外国、個人支払者が最近の改革に対応するためにどのような行動をとるかもしれません。したがって、実施されたどんな改革が私たちの業務に与える影響を予測することは難しい。私たちが成功に私たちの候補製品を商業化できるかどうかは、ある程度政府衛生行政当局(例えばアメリカのMedicareとMedicaid)、個人健康保険会社と他の組織によるこのような候補製品と関連治療費用の精算程度に依存する。新たに承認された保健製品の精算状況には大きな不確実性があり,特に現在有効な治療がないか,あるいは通常医療看護の適応が求められていない。製品研究開発への投資の適切なリターンを実現するために、十分な第三者保険がないかもしれません。もし政府と第三者支払者が候補製品の使用に十分な保険と精算レベルを提供しなければ、私たちの候補製品は市場の承認を得ることができない可能性があり、私たちの運営結果は損害を受けるだろう。
医療立法改革措置は私たちの業務と運営結果に実質的な悪影響を及ぼす可能性がある。
政府の処方薬調達や精算計画に影響を与える立法や規制行動が頻繁に発生している。米国では,ACAは2010年に公布され,医療保険のカバー範囲を拡大している。その時以来、人々は腐敗防止法の全部または一部を廃止、改正、または行政制限するために多くの努力をしてきた。例えば、トランプ総裁が2017年に法律となった減税·雇用法案に署名して個人医療保険認可を廃止したことは、ACAの重要な構成要素と考えられている。2018年12月、テキサス州の連邦地域裁判所は、この判決が保留されて控訴を待っていたにもかかわらず、個人医療保険のライセンス違憲を理由にACAを覆した。ACAが直面している持続的な挑戦と新たな立法提案はACAの将来の生存能力と医療保険市場の不安定な不確実性を招いた。これによる私たちの業務への影響は不確実であり、実質的かもしれない。
処方薬の価格を統制する努力はまた私たちの業務に実質的な悪影響を及ぼす可能性がある。例えば、2018年、トランプ総裁と米国衛生·公衆サービス部長官は“米国患者優先青写真”を発表し、いくつかの部分の実施を開始した。このイニシアティブには,後発薬と生物類似薬の競争を増加させ,医療保険計画が薬品価格をより直接交渉できるようにし,薬品価格の透明性を向上させ,消費者の自腹コストを低減する方法がある。トランプ政権はまた、コストを決定する基準として“国際価格設定指数”を構築することを提案し、連邦医療保険B部での薬品の精算を制限する可能性がある。他の製薬メーカー業界に関する提案では、連邦医療保険D部分の福祉を変更し、連邦医療保険D部分でインフレに基づくリベートを実施し、福祉構造を変更し、メーカーの破滅的な段階での支払いを増加させる法案が提案されている。今国会の指導の下で,薬品定価に関する法案数が急激に増加していることから,我々の業務への影響は不確実であり,実質的である可能性がある。
また、多くの州は立法を提出或いは公布し、間接的或いは直接に薬品定価を監督することを求め、例えば生物製薬メーカーに報告独自の価格情報を公開することを要求したり、国家機関が購入した薬品に対して最高価格上限を設定することを要求したりする。例えば、2017年、カリフォルニア州知事は、指定された敷居を超えるいくつかの薬品の値上げに対する処方薬メーカーの事前通知および解釈を要求する処方薬価格透明性州法案に署名した。国会や州立法機関は様々な法案を考慮しており,これらの法案は薬品調達と価格交渉を改革し,管理ツールをより多く利用して連邦医療保険D部分のカバー範囲を制限することを許可し,米国以外からの価格の低い薬品の輸入を促進し,模造薬の使用を奨励している。このような計画と立法は私たちの製品に追加的な価格設定圧力をもたらすかもしれない。
連邦や州レベルの医療補助計画の変化も我々の業務に実質的な悪影響を及ぼす可能性がある。我々の製品のカバー範囲や精算範囲に影響を与える可能性のある提案は,各州により大きな柔軟性を与えて医療補助計画でカバーされている薬品の管理や,カナダや他の国からの処方薬の再輸入を許可することで,我々の製品の使用やカバーを制限することで実質的な悪影響を及ぼす可能性がある。また,連邦基本医療補助税還付の増加により,州医療補助計画は我々の製品に対する追加的な補充還付を要求する可能性がある。ある程度、民間保険会社あるいは管理保健計画は医療補助カバー範囲と支払い状況を追跡し、彼らはこれらの増加したリベートの公布を利用して私たちの製品に定価圧力をかけることができ、彼らはより低い支払いスケジュールを採用することは不利な影響を拡大する可能性がある。
他の提案された影響メーカーの規制行動は私たちの業務に実質的な悪影響を及ぼすかもしれない。このような提案された立法や規制行動やそれによって生じる州行動が米国での製品の使用や精算に及ぼす影響を予測することは困難であるが,我々の運営結果は悪影響を受ける可能性がある。
私たちの知的財産権に関するリスクは
もし私たちが私たちの所有権を獲得し、維持し、実行できなければ、私たちは効果的な競争や利益運営ができないかもしれない。
エビサミンについては,フロリダ大学研究財団(UFRF)とライセンス契約を結び,Flynpoviについてはアリゾナ大学取締役会とライセンス契約を結んだ。許可された知的財産権や他の生物製薬会社の特許は通常不確定であり、複雑な法律、科学、事実の問題に関連している。
私たちが薬物を開発および商業化する能力は、(I)広範で保護可能な知的財産権を取得および/または開発すること、(Ii)必要に応じて商業的に合理的な条項で他の人の固有の権利の追加的な許可を得ること、(Iii)他人の固有の権利を侵害することなく運営すること、(Iv)他人が私たちの固有の権利を侵害することを防止すること、および(V)私たちの会社のノウハウおよび商業秘密を保護することに大きく依存する。
私たちが獲得する可能性のある特許および将来発行される可能性のある特許は、挑戦、無効、または回避される可能性があり、これらの特許によって付与される権利は、独自の保護または同様の技術を有する競争相手に対する競争優位性を提供してくれない可能性がある。また,我々の競争相手は類似した技術を独立して開発したり,我々が開発した任意の技術を複製したりする可能性がある.潜在的候補製品の開発、テスト、および規制審査には多くの時間がかかるため、私たちの任意の候補製品が商業化できる前に、どの関連特許も商業化後の一定期間以内に失効または有効に維持され、それによってこの特許の任意の利点を弱める可能性がある。
米国および多くの外国司法管轄区の特許出願は、通常、出願後少なくとも12ヶ月後に発表されるか、または場合によっては全く発表されないため、科学文献で発見された出版物は、実際の発見よりも遅れていることが多いので、私たちも私たちの許可者も、私たちまたは私たちの許可者が、発行された特許または係属中の特許出願で主張された最初の発明を提出した人であるか、またはこれらの特許出願に規定されている発明を保護する最初の人であることを決定することはできない。
さらに、UFRFはこれまで、米国でのみライセンス技術のいくつかの要素のために保護を求めることを選択しており、国際特許保護を出願する時間が経過している。これはある市場における会社の知的財産権の地位を制限し、潜在的な企業パートナーに対する会社の全体的な価値に影響を与える可能性がある。
私たちの特許保護の獲得と維持は、政府特許機関によって提出された様々なプログラム、書類提出、費用支払い、および他の要求を遵守することに依存し、これらの要求に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある
米国特許商標局と各種外国政府特許機関は,特許過程においていくつかのプログラム,文書,費用支払いなどの規定を遵守することを要求している。場合によっては、規定を遵守しないことは、特許または特許出願の放棄または失効をもたらす可能性があり、それにより、関連する管轄区域の特許権の一部または全部が失われる可能性がある。この場合、競争相手は他の場合よりも早く市場に参入するかもしれない。
私たちは第三者の権利侵害や流用クレームに直面する可能性があり、私たちに不利と判定されれば、重大な損害賠償金を支払うことになる可能性があります。
製薬やバイオテクノロジー産業では、特許や他の知的財産権に関する訴訟や他の訴訟が数多く発生している。私たちは時々様々な特許訴訟や他の知的財産権に関する訴訟の側になるかもしれませんが、私たちが訴訟に関連するいかなる知的財産権も使用しようとしない場合でもそうです。
特許訴訟や他の訴訟の費用は、私たちに有利な問題を解決しても、巨大である可能性がある。私たちの競争相手のいくつかは、私たちの競争相手がより多くの財政資源を持っているかもしれないので、このような訴訟や訴訟の費用を私たちよりも効果的に受けることができるかもしれない。もし私たちに対する任意の特許訴訟または他の訴訟が解決された場合、私たちまたは私たちの協力者は、相手の許可を得ずに私たちの薬物を開発、製造、販売、または輸入することを禁止され、重大な損害賠償責任を請求される可能性がある。私たちは商業的に受け入れられる条項や何の必要な許可も得られないかもしれない(S)。
特許訴訟または他の訴訟の開始と継続によって生じる不確実性は、市場での競争能力に重大な悪影響を及ぼす可能性がある。特許訴訟と他の訴訟もまた多くの管理時間を取るかもしれない。
従業員や他の人と締結された秘密保持協定は、当社のノウハウ、ビジネス秘密、その他の独自情報の漏洩を十分に防止できない可能性があり、知的財産権を十分に保護できない可能性があり、競争能力を阻害する可能性があります。
私たちは医療技術開発のハイテク分野で業務を展開しているため、私たちは私たちの独自の商業秘密と非特許技術を保護するために、商業秘密保護にある程度依存している。しかし、ビジネス秘密は保護することが難しく、他の人が同じまたは似たような技術を自ら開発しないと確信できない。私たちは、私たちのビジネス秘密および非特許技術を保護するために、私たちのすべての従業員、コンサルタント、会社のパートナーと秘密保護協定を締結することを含む措置を取っています。これらの合意は、一般に、その当事者によって開発されたもの、または私たちとの関係中に第三者に開示されたいかなる機密情報も第三者に開示しないことを相手に秘密にすることを要求する。私たちは一般に、当事者が私たちにサービスを提供する過程で構想された発明が私たちの独自の財産になることを規定するこれらの当事者からも合意を得る。しかし、このような合意は遵守されないかもしれないし、知的財産権を効果的に私たちに割り当てられないかもしれない。我々の商業秘密やノウハウを不正に取得して使用することを強制する側の告発は困難であり、高価で時間がかかり、結果は予測できない。しかも、米国以外の裁判所は商業秘密やノウハウを保護することをあまり望んでいないかもしれない。商業秘密保護を獲得または維持できなければ、私たちの競争的地位に悪影響を及ぼす可能性がある。
私たちは私たちの従業員がその前の雇用主によって言われた商業機密を間違って使用したり開示したりしたと告発されるかもしれない
バイオテクノロジー業界でよく見られるように、私たちが雇った個人は以前、私たちの競争相手や潜在的な競争相手を含む他のバイオテクノロジー会社に雇われていた。現在、私たちに対するクレームが解決されていないにもかかわらず、私たちは、これらの従業員または私たちが意図していない、または他の方法でその前の雇用主の商業秘密または他の固有情報を使用または漏洩するというクレームを受ける可能性がある。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。これらのクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣の注意を分散させる可能性がある。
私たちの普通株に関するリスクは
もし私たちの普通株が国家証券取引所に上場し続けることができなければ、私たちの株の流動性と私たちの資金調達能力を深刻に損なう可能性がある。
2024年3月5日、ナスダックは、ナスダック公聴会グループが私たちの普通株が退市することを決定し、私たちの普通株は2024年3月7日に停止することを決定したことを私たちに通知した。ナスダックは、適用される控訴期限が経過した後、米国証券取引委員会に表24の退市通知を提出することで退市を完了する。グループが決定したのは,当社が上場規則第5550(B)(1)条の最低250万ドルの株主権益に関する要求に違反し,かつ上場規則第5550(B)条の任意の代替要求(総称して“最低株主権益要求”と呼ぶ)を遵守できなかったためである。私たちはナスダック上場と聴聞審査委員会に上訴する期限が過ぎたが、委員会は決定に関する通知を受けて45暦以内に委員会の決定を審査することができる。最低株主権益要求を再遵守したり、全国証券取引所での代替上場を獲得したりするための可能なすべての機会を探しているにもかかわらず、すべての適用可能なナスダックの継続上場要求を再遵守することができても、ナスダックは私たちの普通株式を撤退させ続ける可能性が高いと信じている。
これまでに開示されたように、吾らは過去にナスダック上場資産部から通知を受け、当社の普通株が30営業日連続で(I)ナスダック上場規則第5550(A)(2)条に規定されている1株1.00ドルの最低終値(“最低購入価格要求”)、(Ii)最低株主権益要求、および(Ii)ナスダック上場規則第5550(A)(4)条に規定されている公開保有株式最低500,000株の最低持株量要求(“最低流通株要求”)を維持していないことを指摘した。2024年2月、私たちは最新に発見された最低入札価格要求と最低浮動要求下の欠陥を解決したことを確認するために、ナスダックから手紙を受け取った。
私たちは過去にコンプライアンスを再獲得しましたが、何らかの理由で、ナスダックは私たちの証券をナスダック資本市場の取引から撤退させ、私たちは別の評判の良い国の証券取引所に上場できない場合、以下の部分または全部の減記が発生する可能性があり、そのいずれもが私たちの株主に重大な悪影響を及ぼす可能性があります
|
● |
普通株の流動性と販売可能性 |
|
● |
普通株の市場価格は |
|
● |
私たちは私たちの業務を継続するための資金を得ています |
|
● |
私たちの普通株に投資する機関と一般投資家の数を考慮する |
|
● |
私たちの普通株式のうち市営業者の数は |
|
● |
私たちの普通株式取引価格と取引量に関する情報の可用性; |
|
● |
普通株取引を行いたい自営業者の数。 |
また、ナスダック資本市場への上場を停止した場合、私たちは認知度や認知度の低い市場で取引しなければならないかもしれません。例えば場外取引市場では、私たちの株は“細価格株”として取引される可能性があり、これは私たちの株式取引をより困難かつ煩雑にし、別の市場で取引されている会社が魅力が低く、関連リスクの高い投資とみなされる可能性があり、既存または潜在的な機関投資家が私たちの普通株に投資することにあまり興味がない、あるいは投資を禁止される可能性があります。これはまた私たちの普通株の市場価格をさらに下落させる可能性がある。
追加資本を調達することは私たちの株主を希釈したり、私たちの運営を制限するかもしれない
もし私たちが株式または転換可能な債務証券を売却することによって追加資本を調達する場合、株主の所有権権益は希釈され、条項は清算または株主としての権利に悪影響を及ぼす他の特典を含む可能性がある。債務融資が可能であれば、追加債務を招く、資本支出を行う、または配当を宣言するなど、私たちが具体的な行動をとる能力を制限または制限する契約を含むいくつかの合意が含まれる可能性がある。これらの事件のいずれも、製品開発および商業化目標を達成する能力に悪影響を与え、私たちの業務を損なう可能性がある。私たちは現在利用可能な信用配置の不足によって何の悪影響も生じないと予想する。
普通株の発行や株式購入権の行使による普通株の発行は、私たちの普通株の価格を下落させ、投資家の大部分の投資損失を招く可能性があります。
我々の株主が公開市場で我々の普通株を大量に売却したり、第144条に規定する任意の法定保有期間が満了した場合、または流通株のロック期間満了に適用された場合、または未償還オプションまたは株式承認証を行使する際に発行されるロック期間が満了した場合、通常“宙に浮いている”と呼ばれる場合があり、私たち普通株の市場価格が下落する可能性が予想される。未解決の状況が存在し、発生しているかどうかにかかわらず、将来的に合理的または適切な時間および価格で株式または株式関連証券を売却することで追加融資を調達する能力をより困難にする可能性がある。2024年3月22日現在、加重平均行権価格で1株当たり14,410.38ドルで607株の普通株を購入する未償還オプションを有し、残り契約期間は8.50年、および加重平均行権価格で1株3.13ドルで9,095,943株の普通株を購入する未償還引受権証を有し、平均残存株式期間は5.23年である。
証券アナリストは私たちの普通株を自発的に報道したり、引き続き報道したりしない可能性があり、これは私たちの普通株の市場価格にマイナス影響を与える可能性がある。
普通株価格は証券アナリストが発表した会社とその業務に関する研究と報告の重大な影響を受けることが多い。私たちはこのアナリストたちに何の統制権も持っていない。証券アナリストが私たちの普通株をカバーしたり継続したりする保証はない。もし証券アナリストが私たちの普通株をカバーしなければ、研究カバーの不足は私たちの普通株の市場価格に不利な影響を与えるかもしれない。もし私たちの普通株が証券アナリストにカバーされ、私たちの株の格付けが引き下げられたら、私たちの株価は下落するかもしれない。もしこれらのアナリストのうちの1人以上が私たちを追跡しなくなったり、私たちに関する定期的な報告書を発表できなかった場合、私たちは金融市場での可視性を失う可能性があり、これは私たちの株価や取引量を低下させる可能性がある。
私たちの定款とデラウェア州法律は株主が有利だと思う買収を阻止するかもしれない。
私たちの会社の登録証明書と定款、デラウェア州法律の適用条項は、第三者が私たちの取締役会の承認なしに私たちの支配権を得ることを難しくしたり、阻止したりするかもしれません。これらの規定には
|
● |
罷免役員に制限を設ける |
|
● |
株主特別会議を開催する人数を制限する |
|
● |
取締役会への指名または株主総会で行動可能な事項の事前通知要求を作成する |
|
● |
私たちの役員選挙での累積投票は許されません。そうでなければ、多数の株主よりも少ない取締役の選挙が許可されます |
|
● |
毎年選挙される役員の数を制限する分類取締役会を設置する |
|
● |
私たちの取締役会が株主の承認を必要とせずに条項を指定して優先株を発行する権利を持たせる。 |
さらに、デラウェア州一般会社法第203条一般的には、私たちが発行した議決権株の15%以上を保有している者、または私たちの任意の共同会社または付属会社が過去3年間に議決権を有する株式の15%以上を発行している任意の業務と合併することを制限しています。このような所有権の買収を招くことを取締役会が事前に承認していない限り、これらの規定は、我々の管理チームを強化し、現行価格よりも高い割増でその株を潜在的な買収者に売却する機会を株主に奪う可能性がある。このような制御権プレミアムが得られない可能性がある場合は、私たちの普通株の価格を下げるかもしれない。
逆株式分割が必要な時間帯に私たちの株価を上げたり、国家証券取引所での上場を維持したりする保証はありません。
私たちの最近の逆株式分割は、私たちの普通株の市場価格の最初の上昇を伴っています。しかし、逆株式分割が私たちの普通株市場価格に与える持続的な影響は何の確定的な予測もできません。他社の逆株式分割の歴史もそれぞれ違います。一部の投資家たちは1つまたは複数の逆方向株式分割に対して否定的な見方をするかもしれない。
全国的な証券取引所の規則は上場企業が逆株式分割を行う可能性のある回数に具体的な制限がないが、ナスダックなどのある取引所は、一連の逆株分割は投資家の自信を弱める可能性があり、特に最初の株式逆分割は希釈取引の後であると述べている。したがって、国家証券取引所は、私たちがすべての適用された初期または継続上場基準を遵守していても、私たちの上場を維持または受け入れても公共利益に合致しないと認定することができる。
また、逆株分割は、1株当たりの価格が低価格株を取引しない投資家を引き付けることにはならない可能性がある。逆株分割は私たちの普通株のいくつかの潜在投資家に対する適切性を高める可能性があると信じていますが、逆株式分割後の私たちの普通株は投資家にもっと魅力的になることを保証することはできません。逆株分割を実施しても、逆株式分割とは無関係な要因により、将来の業績や市場全体の傾向を含めて、普通株の市場価格が低下する可能性があります。普通株の取引価格が下落すれば、絶対数字と私たちの総時価に占める割合として、逆株分割なしの下落幅よりも下落幅が大きくなる可能性がある。
最近と将来の逆株分割は、私たちの普通株の流動性を低下させ、より高い取引コストをもたらす可能性がある。
私たち普通株の流動性は、このような逆株式分割が流通株数を減少させ、特に株価が逆株式分割によって増加しなければならないため、逆株式分割の負の影響を受ける可能性がある。また、逆株分割を実施すれば、100株未満の普通株を持つ“端数”株主の数を増やす。片手取引の委託手数料及びその他のコストは、通常、100株以上の普通株の取引コストよりも高い。したがって、逆株式分割は、上述したように我々の普通株の販売可能性を向上させる期待結果を達成できない可能性がある。
最近の逆株式分割は私たちが許可した株式の減少を伴わない。
逆方向株式分割は私たちの株主に直接希釈効果を与えていないが、逆方向株式分割による流通株の減少は、許可発行株式に対する私たちの株主が所有する株式の割合を低下させ、取締役会が発行可能な認可株式の相対数を効果的に増加させることを適宜決定することができる。取締役会は時々、当社の普通株の発行を含む取引やその他のリスク投資を行い、当社とその株主の最適な利益に合致すると考えることができる。取締役会が逆株式分割後に追加の普通株を発行することを承認した場合、私たちの既存株主の所有権権益は、このような逆株分割を行っていない場合に発生する希釈よりも大きくなる可能性がある。
もし私たちが優先株を発行すれば、私たちの普通株保有者の権利と普通株の価値は不利な影響を受けるかもしれない。
当社の取締役会は様々な種類や系列優先株を発行する権利があり、株主は何の行動もする必要がありません。取締役会も株主の承認なしに、投票権、配当権及び配当又は当社業務の清算、解散又は清算時の普通株に対する割引権及びその他の条項を含む任意の種類又はシリーズ優先株の条項を特定する権利がある。もし私たちが未来に優先株を発行する場合、配当金の支払いにおいて、または清算、解散または清算時に普通株より優先するか、または投票権を有する優先株を発行する場合、普通株の投票権を希釈し、普通株式保有者の権利または普通株の価値は不利な影響を受けるだろう。
もし私たちが財務報告書に対して効果的な内部統制を維持できなければ、私たちの普通株の価格は不利な影響を受けるかもしれない
私たちは財政報告書に対する適切な内部統制を確立して維持することを要求された。これらの制御が確立されていないか、またはこれらの制御が確立されると、業務、財務状態、または運営結果に関する開示に悪影響を及ぼす可能性がある。これらの統制のいかなるミスも、私たちが正確な会計記録を維持し、会計ミスと財務不正を発見することを阻止する可能性がある。
経営陣の財務報告内部統制の評価は、解決すべき弱点や投資家の懸念を引き起こす可能性のある他の潜在的事項を見つける可能性がある。財務報告の内部統制または経営陣の財務報告の内部統制に対する我々の評価において解決すべき任意の実際または予想される弱点は、私たちの普通株式価格に悪影響を及ぼす可能性がある
私たちは未来に私たちの運営に資金を提供するためにもっと多くの資金を集める必要があるだろう。これらの資金は受け入れられる条項で提供できないかもしれない。必要な時にこの必要な資金を得ることができなければ、私たちは私たちの製品開発努力や他の業務を延期、制限、または中止させられるかもしれません。
我々は経常的な運営損失があり,運営キャッシュフローは負であり,累積的な赤字がある。私たちは私たちの行動に資金を提供し続けるためにもっと多くの資金を集めなければならない。もし私たちが必要な時や受け入れ可能な条件で追加の資本を得ることができなければ、私たちは私たちの業務計画に従って私たちの業務を継続できないかもしれません。あるいは私たちは私たちの業務を完全に停止しなければならないかもしれません。株式や持分支援証券を売却することで調達された任意の追加資本は、私たちの株主の持株比率を希釈することが可能であり、私たちの株式証券の時価低下を招く可能性もある。私たちが将来の資本取引で発行する任意の証券の条項は、新しい投資家に有利になる可能性があり、割引、より高い投票権、および発行権証または他の派生証券を含む可能性があり、これは、当時返済されていなかった証券の保有者にさらなる希薄化効果をもたらす可能性がある。
もし私たちが必要な時や受け入れ可能な条件で追加資金を得ることができない場合、私たちは重大な計画支出の延期、減少、または廃止、一部または全部の業務の再編、削減または廃止、技術または資産を処分し、第三者が私たちの株主の投資損失を招く可能性のある価格で私たちの会社を買収し、破産または完全な運営停止を申請することを求められるかもしれない。これらの事件のいずれも、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。また、もし私たちがタイムリーに多くの資金を得ることができなければ、私たちは経営を続ける企業として経営を続ける能力が大きく疑われ、倒産リスクが増加し、私たちの株主の投資は最高で完全な損失に達することができる。
|
項目1 B。 |
未解決従業員意見 |
ない。
|
プロジェクト1 C |
ネットワーク·セキュリティ |
私たちはバイオテクノロジー分野で運営されており、この分野は様々なネットワークセキュリティリスクに直面しており、これらのリスクは、知的財産権窃盗、詐欺、恐喝、従業員または顧客への傷害、プライバシー法違反、その他の訴訟および法律リスク、名声リスクなど、私たちの業務、財務状況、および運営結果に悪影響を及ぼす可能性がある。我々は,リスクに基づく方法で,我々の業務や情報システムに影響を与える可能性のあるネットワークセキュリティ脅威を識別し評価することを実施した.我々は様々なツールや方法を用いてネットワークセキュリティリスクを管理し,定期的にテストを行っている.また、定期的な脆弱性スキャン、浸透テスト、脅威情報フィードを通じて、ネットワークセキュリティ態勢と性能を監視し、評価し続けています。私たちは、個人、機密、または独自の情報にアクセスできる第三者サービスプロバイダが、適用される法律基準および業界ベスト実践に適合する包括的なネットワークセキュリティ実践を実施し、維持することを要求します。当社のビジネスは、当社の情報システム、ネットワーク、データ、知的財産権の可用性、信頼性、セキュリティに依存しています。ネットワークセキュリティの脅威または事件によって、私たちのシステムまたはデータに与えるいかなる中断、危害、または破壊は、私たちの運営、顧客サービス、製品開発、および競争地位に悪影響を及ぼす可能性があります。これらはまた、利害関係者のプライバシーと機密性を保護する私たちの契約義務や法的義務に違反する可能性があります。このような抜け穴は、私たちを業務中断、収入損失、身代金支払い、救済コスト、影響を受けた当事者への責任、ネットワークセキュリティ保護コスト、資産損失、訴訟、監督審査と行動、名声損害、顧客不満、私たちのサプライヤー関係が損害を受けたり、市場シェアを失ったりするリスクに直面させる可能性がある。同社は現在、より本格的なサイバーセキュリティ計画を実施している。
|
第二項です |
属性 |
私たちの主な業務機能は、私たちの従業員と独立請負業者によって分散された上で実行される。したがって、私たちはどんな不動産も賃貸したり所有していません。現在、すべての従業員は家で働いています。私たちの主な郵送先はミネソタ州ワコニアVista通り712号のSuite 305です。
|
第三項です |
法律訴訟 |
私たちは現在、実質的な法的手続きに参加していない。私たちの正常な業務活動によって引き起こされた法的訴訟で、私たちは時々被告にされるかもしれない。私たちは、私たちが発生する可能性のある法的訴訟に関連した補償権を得るのに十分な保険範囲を得たと信じている。
|
第四項です |
炭鉱安全情報開示 |
ない。
第II部
|
五番目です |
登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
市場情報
私たちの普通株はナスダック資本市場に発売され、コードは“PBLA”です。2024年3月5日、ナスダックは、ナスダック公聴会グループが私たちの普通株を退市することを決定し、私たちの普通株はナスダックで2024年3月7日に取引を停止することを決定したことを私たちに通知した。ナスダックは適用された控訴期限が過ぎた後、米証券取引委員会にForm 25の退市通知を提出することで退市を完了する。この間、ナスダックは取引を一時停止したにもかかわらず、私たちの普通株は場外ピンク市場で既存のコード“PBLA”でオファーする資格があると予想しています。我々は、ナスダックに適用される持続的な上場基準を再遵守したり、別の全国的な証券取引所に上場したりする可能性のある機会を評価している。その間、私たちはOTCQB市場で見積資格を求めるかもしれない。
2024年3月22日現在、55人の普通株保有者がいる。
配当をする
私たちは私たちのどんな証券にも現金配当金を支払ったことがない。私たちは現在運営のための収益を維持するつもりで、予測可能な未来に現金配当金を支払わないと予想されている。
最近売却された未登録持分証券
ない。
会社が株式証券を購入する
ない。
|
第六項です |
[保留されている] |
|
第七項 |
経営陣の財務状況と経営成果の検討と分析 |
我々の財務状況と経営結果に関する以下の議論は,我々の財務諸表および本年度報告の他の部分に掲げる財務諸表の付記とともに読まなければならない。この議論には展望的な陳述が含まれており、これらの陳述は業務の将来に対する私たちの仮定に基づいている。私たちの実際の結果は展望的陳述に含まれている結果とは大きく違うかもしれない。どうぞお読みください“前向き陳述に関する注意事項”より多くの情報を得るために、本年度報告書の冒頭に含まれる。
概要
Panbela治療会社(“Panbela”とその直接·間接子会社“私たち”,“私たち”,“当社”,“会社”)は臨床段階の生物製薬会社であり,破壊的療法を開発し,緊急に満たされていない医療ニーズの患者の治療に用いられている。
我々の主な候補薬はエビサミン(SBP−101)であり,フロリダ大学研究財団社とFlynpovi(エフルオロオルニチン(CPP−1 X)とシュリン酸)から独占的に許可されている。Flynpoviは口頭で提供される。同社はアリゾナ大学取締役会のFlynpoviを商業化するグローバル独占ライセンスを持っている。
Panbelaはポリアミンプラットフォームを用いた破壊的療法の開発に専念し,緊急医療ニーズのある患者の治療に専念しているため,ポリアミンの各種疾患に対する治療を単独と併用で評価するための2つのスポンサーの研究合意に参加した。現在、ジョン·ホプキンス大学医学院との協力は主に作用機序と固形腫瘍に集中しているが、MD-Anderson癌センターの協力は主に血液系悪性腫瘍に集中している。アスピリンとCPP-1 X(DFMOあるいはeflornithineとも呼ばれる)の多発性骨髄腫(細胞系)における研究要約はすでにアメリカ血液学学会(ASH)会議サイト上のオンライン出版物に受け入れられ、2023年11月の補充定期刊行物“血液”に発表され、アスピリンとアドリアマイシンの併用による卵巣癌モデルの治療に関する要約が受け入れられ、2024年4月10日にAACR年度会議で発表される。
アスピリン(SBP−101)
2015年、食品医薬品局(FDA)は私たちの研究新薬(IND)の私たちのエフサミン候補製品に関する申請を受けた。2022年5月,米国ではNAMES(“USAN”)がSBP−101のUSANとして伊文アスピリンを採用しているとの通知を受けた。アンフェタミンの薬の情報 USANサイトで発表されました(Www.ama-assn.org/go/usan).
著者らはすでに過去に治療した局部末期或いは転移性膵臓癌患者に対する初歩的な臨床試験を完成した。これは第1段階の人類初の用量逓増安全性研究である。2016年1月から2017年9月まで,I期試験の用量増加段階で,29名の患者を6つのキューあるいはグループに組み入れた。いずれの用量レベルでも薬物に関連する骨髄毒性あるいは末梢神経病変は認められなかった。安全性評価を受ける以外に、29名の患者の中の23人は第1の治療周期の終了前或いは8週間の終了時に固形腫瘍反応評価標準(RECIST)を用いて初歩的な治療効果信号を評価することができ、RECISTは現在公認されている腫瘍の大きさの変化を評価する標準である。
2018年,われわれの第2の臨床試験に参加する患者を募集し始めたのはIa/Ib期研究であり,アスピリンと2種類の標準看護化学療法薬ゲムシタビンとNAB−パクリタキセルの併用の安全性,有効性,薬物動態を検討することを目的とした。投与量レベルとスケジュールを評価するために、25人の被験者が4つのキューに参加した。また25名の被験者が試験の拡張段階に参加した。中間結果は2022年1月に発表された。評価可能被験者(4列,IBN=29個)では,最適反応はCR 1(3%),PR 13(45%),SD 10(34%),PD 5(17%)であった。1人の被験者はRECIST腫瘍評価のベースライン後スキャンを受けなかった。中間PFSは、現在6.5ケ月であり、潜在的な毒性を評価するために、薬物投与量中断の負の影響を受けている可能性がある。2022年1月にデータを公表したところ,キュー4+Ib期患者の平均総生存期間は12.0カ月であり,現在最終的には14.6カ月であった。キュー2の2人の患者は、長期生存を証明している。1つは30.3カ月(最終データ)であり,もう1つは33.0カ月であり,2022年3月18日のデータベースロック時には生きている.7人の被験者はデータベースロック時に生きており、1名は2番キューから、6名は4番キューからIb期を追加した。
2022年1月、同社は新しい臨床試験を開始することを発表した。この試験はASPIREと呼ばれ、無作為、二重盲検、プラセボ対照試験であり、ゲムシタビンとNAB-パクリタキセルと併用し、これは標準的な膵臓癌治療方案であり、以前転移性膵臓癌を治療したことがない患者に適している。この実験はアメリカ、ヨーロッパ、アジア太平洋地域の約94地点で行われる。同社は2022年8月にオーストラリアで試験に参加した1人目の患者を発表した。2022年9月、同社は規制部門の承認を得て、スペイン、フランス、イタリアにサイトを開設できると発表した。2023年12月31日、85サイトが10カ国でオープンした。
米国や世界の他地域に臨床診療所を開設する速度は当初の予想より遅く,一部の原因は医療界の資源枯渇であったが,同社はすべての診療所が2024年第1四半期にオープンすると予想している。
この実験は最初に第2段階/第3段階に設計され,初期サンプル量は小さかった。欧州およびFDA規制フィードバックへの応答として,この研究は,総生存率(主要終点)を用いて中間分析で検査を行うために,総試験サンプル量(600)と修正された設計を含むように修正された。すべての国が開放されており、2024年第1四半期末までにすべてのサイトがオープンする予定です。独立したデータ安全監視委員会(DSMB)は会議を開いて予め指定されたセキュリティ分析を行い、何の修正もせずに実験を継続することを提案した。この研究は600名の被験者の登録を完了するまで36カ月かかり,中期分析は2024年中に完了すると予想されている。2024年1月25日、同社はこの試験が登録者数の50%を超えたと発表した。同社は、全面登録は2025年第1四半期に完了し、全体の生存状況に基づく中期データ分析は2024年中に提供すべきだと予想している。
2023年4月初め,同社は米国癌研究協会年次総会で卵巣癌ポリアミン代謝調節剤としてのアスピリンの研究結果を重点的に紹介したポスタープレゼンテーションを発表した。ポスターの結論は,VID 8+卵巣癌細胞を投与したC 57 BL/6マウスはアスピリン化学療法を受けた後,生存期間を有意に延長し,全体の腫瘍負担を低下させたと結論した。その結果,エスピミン併用標準看護化学療法は卵巣癌の臨床治療に有用である可能性が示唆され,同社は卵巣癌の臨床前と臨床研究を継続しようとしている。
FDAや他の国の承認を得るためには追加の臨床試験が必要かもしれない。追加臨床試験のコストと時間は試験の性質と規模に大きく依存する。
フルボイル(エフルオロオルニチン(CPP−1 X)とシュリン酸)
2009年、FDAは候補製品である私たちの共同製品FlynpoviのIND申請を受けた。
1つの第3段階の研究では,エフルオロオルニチン単独あるいはスリン酸単独と比較して,エフロンとスルリン酸の併用による家族性腺腫性ポリープ症(“FAP”)の有効性と安全性が検討されている。計171名の患者がランダムにグループ分けを受けた。Flynpovi群56名中18名(32%),シュリン酸群58名中22名(38%),エフロン群57名中23名(40%)が疾患進展を認め,危険比は0.71(95%信頼区間)であった[語彙表]0.39~1.32)、シュリン酸(p=0.29)と0.66(95%CI、0.36~1.23)は、エフルオロオルニチンと比較した。一件後の分析では,Flynpovi群の患者は48カ月に及ぶ下胃腸(LGI)手術が必要に進展しなかったのに対し,シュリン酸とエフロン(CPP−1 X)群の患者はそれぞれ7名(13.2%)と8名(15.7%)であった。これらのデータは、FlynpoviおよびHR=0.00(95%CI、0.00~0.48に対応するp =0.005)、HR=0.00(95%CI、0.00-0.44;p =0.003)フルオロボイルおよびエフルオロオルニチン。LGI群の統計学的意義を考慮して,新薬申請(“NDA”)をFDAに提出した。研究は主な終点に到達できなかったが,秘密保持プロトコルは探索的分析の結果に基づいているため,完全な返信を送信した.この欠陥問題を解決するためには,同社は臨床終点への影響を証明するために,1つまたは複数の十分かつ良好に制御された臨床試験の結果を提出しなければならない。
2023年4月、CPPとOne-Two Treateutics Assets Limitedとの間の許可プロトコルが終了したため、会社はFAP患者においてFlynpoviを開発および商業化する北米権利を再取得した
0−III期結腸癌または直腸癌患者の高危険腺腫および第二原発結腸直腸癌の再発を予防するためのFlynpovi二重盲検プラセボ対照試験が行われており、III期−エフルオロオルニチンおよびスリン酸を用いた結腸腺腫(“PACE”)の予防が行われている。この研究の目的は、エフルオロオルニチンおよびスリン酸(対応するプラセボと比較して)が、高度非典型的増殖、絨毛特徴を有する腺腫、1 cm以上の腺腫、多発性腺腫、任意>/=0.3 cmの腺腫、全進行結腸直腸事象、または全ての結腸直腸事象に対して治療効果があるかどうかを評価することである。PACE試験は国家癌研究所(“NCI”)と西南腫瘍集団(“SWOG”)が協力して援助した。同社は2023年6月28日に,PACE試験があらかじめ計画された無効性分析に合格したと発表した。
エフルオロオルニチン(CPP−1 X)/エフルオロオルニチン(CPP−1 X−S)
FDAは2009年と2018年にエフルオロオルニチンのIND申請を受けた。
STK 11変異非小細胞肺癌患者のエフルオロオルニチン香包の評価を今年から評価する試験計画がある。エフロン錠については,インディアナ大学や青少年糖尿病研究財団(“JDRF”)と協力し,2023年1月11日に早発性I型糖尿病の第二段階試験を開始した。2つのポスターは第1段階T 1 Dの結果を示し,1つは内分泌学会会議,もう1つは2023年6月の糖尿病免疫学学会会議で,2023年11月に細胞報告医学に発表された。また,あるII期試験では,エフルオロオルニチンは大量のテストステロンとベンザルアミン治療による転移性去勢抵抗前立腺癌の評価を受けている。
2023年7月17日、同社はエフルオロオルニチン児童神経芽細胞腫計画のいくつかの権利、所有権、および権益を剥離した。これらの資産には、小児腫瘍学グループ(“COG”)/米国国立癌研究所によって支持されているエフルオロオルニチン香包による再発性難治性神経芽細胞腫の治療を評価する試験が含まれている。US World Medsとの合意条項によると、同社は、これらの資産の売却と引き換えに約950万ドルの非希釈資金を得る権利がある。取引完了時に、会社は400,000ドルの初期支払いを受け取り、買収会社が臨床開発、監督許可、商業販売に関するいくつかのマイルストーンを成功させた場合、残りの支払いは受け取られる。
財務概要
2024年1月18日、会社普通株の20株(1:20)の割合で逆株式分割を実施した。2023年6月1日には、会社普通株の40株(1:30)の割合で逆株式分割を行い、2023年1月13日には、会社普通株の40株(1:40)の割合で逆株式分割を行った。私たちの普通株のすべての株と1株当たりの金額はこれらの逆株分割を反映するために遡及調整されている。
2011年以来、私たちは1億255億ドルの損失を受けた。2023年12月31日までの1年間に、2530万ドルの純損失が発生した。当年の純損失には反映されていないが,累積損失の増加を記録したのは,株式承認証の行使を促すための非現金調整価値約910万ドルであった。その間、私たちはまた経営活動から約2520万ドルのマイナスキャッシュフローを生み出した。我々が研究開発活動と商業化を継続することに伴い,引き続き重大な損失を招くことが予想され,経営活動からの負の純キャッシュフローが生じる。
2023年12月31日と2022年12月31日まで、私たちの現金はそれぞれ約260万ドルと130万ドルです。2023年12月31日までの1年間で現金が約1.3ドル増加したのは,運営している約2520万ドルからの負のキャッシュフローが純融資活動による約2610万ドルで相殺されたためである。現在の無作為臨床試験ではアスピリンのほかにAbraxaneが薬物不足にも用いられているため,同社は臨床試験のためのこの標準看護成分の調達を開始しており,2023年12月31日までの1年間に臨床サイトに提供された場合,研究·開発のための費用は約370万ドルである。同社は調達供給のすべての道を模索し続けており、将来的には前払いが必要かもしれない。これらのプリペイドは,交付前から要求されており,前払い費用として貸借対照表に残り,業務で使用されている現金期間に反映される.純融資活動には,普通株の登録公開,あらかじめ出資した引受権証,引受権証があり,純収益は約2150万ドルである。同社はまた、市場での販売手配で普通株を売却し、純収益は約160万ドルだった。同社は同時期に160万ドルのローン返済も記録した。同社は第4四半期にも自発的と誘発性株式証演習を行い、純収益は合計約470万ドルだった。
2024年1月31日、会社は普通株式と引受権証の尽力発行を完了した。今回発行された純収益総額は約820万ドル。
会社は2024年3月7日に合計約126万ドルの元金と利息を支払い、貸手延長の適用猶予期間内に支払う。
私たちは、私たちの運営を継続するためにより多くの資金を調達し、2024年第1四半期以降に必要な将来の試験を完了し、米国、EU、その他の国際市場で規制承認を求めることを含む、私たちの業務計画を実行する必要がある。歴史的に見ると、私たちの運営資金は主に株式、証券、債務の売却から来ている。私たちは過去に必要な資本を獲得して私たちの運営を支援することに成功したにもかかわらず、私たちは似たような方法で追加的な融資を求めるかもしれないが、私たちが商業的に合理的な条項と条件で追加的な融資を得ることができるか、または根本的にできないという保証はない。もし私たちの臨床データが積極的でなければ、あるいは経済や市場状況が悪化すれば、このリスクは増加するだろう。添付されている総合財務諸表の作成仮説は、継続的に経営している企業として、正常な業務過程で資産の現金化と負債の清算を考えています。
もし私たちが必要な時に追加的な融資を得ることができない場合、私たちの運営規模を削減し、外部専門サービス提供者の使用を減らすこと、従業員や従業員の報酬を減らすこと、私たちの候補製品の開発を大幅に修正または延期すること、私たちの候補製品を商業化する権利を第三者に許可すること、または運営を停止することが含まれる可能性がある。
当社は新冠肺炎の流行で私たちの業務に重大な中断をもたらしていません。
私たちの運営結果の重要な構成要素は
一般と行政費用
私たちの販売、一般、および行政費用は主に給料、福祉、および他のコストを含み、役員および行政員の株式報酬、法律および他の専門費用、出張、保険、および他の会社のコストを含む。
研究と開発費
研究開発コストには、人体臨床試験を行う際に生じる費用が含まれており、第三者サービスプロバイダが様々な試験を実行し、当社の臨床前研究に関連するデータを蓄積する費用は、当社の臨床前研究および人体臨床試験に使用される十分な数のSBP-101、FlynpoviおよびCPP-1 X化合物を生産するのに十分な数のSBP-101、FlynpoviおよびCPP-1 X化合物を生産するのに必要な費用を提供するための研究プロトコルであり、私たちの候補製品開発計画の実行に関連する専門知識のコンサルティングリソーススタッフコストを有しており、給与、福祉および株式ベースの給与および私たちの許可された知的財産権の許可および維持のコストを含む。
臨床試験の完成には数年或いはそれ以上の時間を要する可能性があり、時間の長さは通常候補製品のタイプ、複雑性、意外性と期待用途によって異なる。臨床開発過程の違いにより、臨床試験のコストはプロジェクトのライフサイクル全体で大きく異なる可能性がある
|
● |
患者1人当たりの試験コストは |
|
● |
承認に必要な試験回数 |
|
● |
実験に含まれる場所の数 |
|
● |
適切な患者を募集するのに要する時間の長さ |
|
● |
患者が受ける投与量 |
|
● |
実験に参加した患者数 |
|
● |
患者の中退率や中途停止率 |
|
● |
患者のフォローアップ時間の長さ |
|
● |
潜在的な追加的な安全監視または規制機関が要求する他の研究; |
|
● |
試験中に行われた分析および試験の数および複雑さ |
|
● |
候補製品の開発段階; |
|
● |
候補製品の有効性と安全性。 |
臨床試験費用を含めて研究開発費を徴収し、発生時に費用を計上します。われわれのヒト臨床試験は臨床試験現場で行われ,われわれがCROの協力の下で共同管理した。臨床試験地点を確立する費用は研究協定調印後に計算しなければならない。臨床試験業績に関連する費用は通常契約金額と合意マイルストーンの実現によって累積し、例えばサイト開放、患者登録、患者フォローアップなどである。著者らは臨床試験サイトとCROとのコミュニケーションを通じて、患者登録とその他の活動の程度を含む各重要な契約下の業績レベルを監視し、そして必要に応じて四半期ごとに推定数を調整し、臨床費用に各臨床試験サイトと各CROの実際の仕事支出を反映させる。
研究開発コストには知的財産権研究開発も含まれている。この資産はCPPの証券保有者から買収され、2022年6月15日に資産買収後すぐに研究開発費として抹消された。
ライセンス制約された知的財産権に将来他の用途がないと判断された場合、特許技術許可の取得に関連するコストを支払う。
その他の収入(費用)
その他の収入(支出)には、利息収入、現金及び非現金利息支出及び我々の機能通貨以外の通貨建ての取引による取引損益が含まれる。
肝心な会計見積もり
我々の経営陣の財務状況と経営結果の検討と分析は、米国公認の会計原則(“GAAP”)に従って作成された我々の財務諸表に基づいている。これらの財務諸表を作成する際には、資産、負債、費用報告金額に影響を与える見積もりと判断を行う必要があります。継続的に基づいて、以下に説明するものを含む、これらの推定および判断を評価する。私たちの見積もりは私たちの歴史的経験と私たちがこのような状況で合理的だと思う様々な他の仮定に基づいています。これらの見積りと仮定は資産や負債の帳簿価値を判断する基礎を構成しており,これらの資産や負債の帳簿価値は他のソースからは明らかに見えない.実際の結果と経験はこれらの推定とは大きく異なるかもしれない。
我々の重要な会計政策は、F−1ページからの総合財務諸表付記4により包括的に記述されているが、以下の重要な会計推定の記述は、我々の報告書の財務結果を十分に理解し評価するために最も重要であり、財務諸表を作成する際に使用するより重要な判断·推定に影響を与えると考えられる。
株に基づく報酬
株式に基づく奨励の会計計算では、付与日とこれらの奨励の公正価値に基づいて、従業員と非従業員サービスのコストを計量し、確認し、持分ツールの奨励と交換する。株式に基づく報酬費用の計算には、我々の最適な推定を代表する高度な主観的仮定を入力する必要があり、内在的な不確実性と経営陣判断の応用に関するものである。補償コストは帰属期間内に直線分配法を用いて比例的に確認され,帰属期間は必要なサービス期間と考えられる。
株式奨励の公正価値は付与された日にBlack-Scholesオプション定価モデルを用いて推定される。株式報酬の公正価値の決定は、私たちの株価といくつかの複雑かつ主観変数に関する仮定の影響を受ける。無リスク金利は米国債金利をもとに、個々の奨励の期待期限に適用される。予想変動率は会社自体の変動率に基づいている。予想される未来には何の配当も発表されないと予想されるので、配当収益率をゼロとする。付与されたオプションの予想期限は、“簡略化”方法を使用して決定される。この方法によれば、予想期限は、平均帰属日と契約期限終了との間の中間点として推定される。
私たちは私たちの役員を含めて従業員と非職員たちに選択権を付与する。新入社員に支給される補助金は具体的な状況に応じて支給される。従業員に対するオプション付与は、通常、付与された日から3年間毎年付与される。私たちの非従業員取締役に付与されるオプションは、一般に授与日から一年以内に授与されます。他の非従業員に付与されたオプションは通常3年以内に付与される。従業員と非従業員に支給されるオプションは通常最長10年である。
非従業員に対するオプション付与は、彼らの私たちの顧問としてのサービスと結合されている。これらのコンサルタントの中には私募で株を購入した人もいるが、私たちが発行した普通株の5%以上の実益を持っている人はいないことが分かった。
合併買収会計
ASC 805は、企業合併、買収が企業合併を代表するか否かを判定するモデルを提供する。一企業になるためには、買収された実体の一連の活動は投入と実質的な過程が必要であり、これらの投入と実質的な過程は共に創造産出を大きく促進する能力を有する。買収されたエンティティはまた、買収された総資産の公正価値に基づいて“実質的にすべて”が単一資産または1組の類似資産に集中しているかどうかに基づいて、買収が実質資産買収を代表するかどうかを決定することに関連する“スクリーニングテスト”に合格しなければならない。この評価は、現金、繰延税項目、および繰延税項目に関連する営業権のようないくつかの取得された資産を含まないが、確認された資産以外の任意の移転対価格を含む他のすべての総資産を含む。
同社は取引が業務合併の基準を満たしていないことを確定した後、買収CPPを資産買収として入金している。当社は、買収された総資産の公正価値は、基本的にすべて単一の識別可能資産または類似した識別可能資産に集中しており、その中で最も重要なのはCPPの候補製品に関連する知的財産権研究開発資産であることを決定した。純資産は買収の日に公正価値で入金され、知的財産権研究開発は会社の総合経営報告書に研究開発費と記入されている。
経営成果
2023年12月31日までと2022年12月31日までの経営成果比較(千計)
| 十二月三十一日までの年度 | ||||||||||||
|
2023 |
2022 |
百分率変化 |
||||||||||
|
運営費 |
||||||||||||
|
一般と行政 |
$ | 5,033 | $ | 6,044 | -16.7 | % | ||||||
|
研究開発 |
20,614 | 28,049 | -26.5 | % | ||||||||
|
総運営費 |
25,647 | 34,093 | -24.8 | % | ||||||||
|
その他の収入,純額 |
198 | (956 | ) | -120.7 | % | |||||||
|
所得税割引 |
186 | 116 | 60.3 | % | ||||||||
|
純損失 |
$ | (25,263 | ) | $ | (34,933 | ) | -27.7 | % | ||||
一般および行政(“G&A”)および研究開発(“R&D”)支出には,株式オプションの発行による非現金株報酬支出が含まれる.株式に基づく報酬の条項や授与スケジュールは、贈与タイプや被贈与者の就職状況によって異なる。2023年12月31日までの奨励は時間と表現条件に応じて付与される。私たちは未来に追加的な非現金補償費用を記録すると予想しているが、これは相当なものかもしれない。下表は、2023年12月31日と2022年12月31日までの年度の総合経営報告書と全面赤字における株式ベースの補償費用(千単位)をまとめたものである
| 十二月三十一日までの年度 | ||||||||
|
2023 |
2022 |
|||||||
|
一般性と管理性 |
$ | 643 | $ | 889 | ||||
|
研究開発 |
180 | 199 | ||||||
|
株に基づく報酬総額 |
$ | 823 | $ | 1,088 | ||||
一般と行政費用
2023年のM&A支出は16.7%減の500万ドルとなり、2022年の600万ドルを下回った。G&A費用減少の主な原因は法律と財務相談費用の減少である。
研究と製品開発費用
我々の研究開発費は2022年の2800万ドルから2023年の2060万ドルに低下し、減少幅は26.5%だった。2022年12月31日までの年間約1770万ドルの非現金知的財産権研究開発抹消を差し引くと、2023年の研究開発支出は1030万ドル増加した。この増加は主にわれわれのイビサミン無作為試験に関する臨床試験コストの増加によるものである。われわれの臨床研究の拡大に伴い,研究開発費は引き続き増加することが予想される。知的財産権の研究と開発の核販売はCPPの会計買収に関連する一次的な事件である。
その他の収入,純額
2023年12月31日までの年間では、他の純収益は20万ドルだったが、2022年12月31日までの年間では、その他の純支出は100万ドルだった。2023年の収入は主に知的財産権販売収益と関係があり、2022年の費用は主に外貨取引損失と関係がある。
所得税割引
所得税優遇は2022年の11.6万ドルから2023年の18.6万ドルに増加した。私たちの所得税優遇は主にオーストラリアで行われた研究開発活動に関する払い戻し可能な税金優遇から来ており、ASPIRE試験が2023年にオーストラリアのいくつかの地点に拡大するにつれて、この優遇は2023年に増加した。
流動資金と資本資源は引き続き増加の勢いを維持するだろう
次の表は、2023年12月31日および2022年12月31日まで、2023年12月31日および2022年12月31日までの各年度の流動性および資本資源をまとめ、以下のより詳細な議論(千単位)を補完することを目的としている
|
流動性と資本資源 |
十二月三十一日 |
|||||||
|
2023 |
2022 |
|||||||
|
現金と現金等価物 |
$ | 2,578 | $ | 1,285 | ||||
|
運営資金赤字 |
$ | (9,258 | ) | $ | (6,056 | ) | ||
|
キャッシュフローデータ |
十二月三十一日までの年度 |
|||||||
|
2023 |
2022 |
|||||||
|
現金提供側(使用): |
||||||||
|
経営活動 |
$ | (25,249 | ) | $ | (15,276 | ) | ||
|
投資活動 |
400 | (656 | ) | |||||
|
融資活動 |
26,142 | 5,354 | ||||||
|
為替レート変動が現金に与える影響 |
- | (4 | ) | |||||
|
現金と現金等価物の純変化 |
$ | 1,293 | $ | (10,582 | ) | |||
運営資金
2023年12月31日現在、私たちの現金と現金等価物の総額は260万ドルですが、2022年12月31日までの現金および現金等価物の総額は130万ドルです。2023年12月31日現在、1230万ドルの流動負債と930万ドルの負の運営資本があります。2022年12月31日現在、780万ドルの流動負債と600万ドルの負の運営資本があります。運営資本の計算方法は,流動資産から流動負債を差し引くことである。
キャッシュフロー
経営活動に使われている現金純額
2023年には、経営活動用の現金純額は2520万ドルだったが、2022年には1530万ドルだった。これらの期間に使用された現金純額は主にこれらの期間の純損失を反映しており、経営資産や負債変化の影響部分によって相殺されている。2022年12月31日までの年間で,知的財産権開発の非現金ログアウトは約1,770万ドルであり,運営に使用している現金に積極的な影響を与えている。
投資活動のための現金純額
2023年12月31日までの1年間、投資活動が提供する現金は知的財産権売却収益の結果である。2022年12月31日までの年間で、投資活動のための現金純額は70万ドル。2022年に使用される現金純額は、主にCPPプロセス終了時に発生する法律·財務顧問費用の現金支出を買収するためのものだ。
融資活動が提供する現金純額
2023年の融資活動で提供される現金純額は2,610万ドルで、主に年内に何度か公開発行された純収益と、普通株を購入するために何らかの株式承認証を行使する現金である。この募集資金は未払い手形元金165万ドルの支払いに相殺された。2022年の融資活動で提供される現金純額は約540万ドルで、2022年10月に登録発行された純収益である。
2023年12月31日以降の融資活動が提供する現金純額
2024年1月31日、会社は普通株式と引受権証の登録公開を完了した。これらの証券の総発行価格は、普通株と2つの引受権証1株当たり2,06ドル、または事前融資ごとの引受権証と2つの株式承認証2.059ドルである。今回発行された純収益総額は約820万ドル。
資本要求
私たちが引き続き業務を展開し、私たちの業務計画を実行することに伴い、私たちは膵臓癌を治療する最初の候補製品エビ司普明の臨床開発計画を完成することと、アメリカ、EUとその他の国際市場の監督管理の承認を求めて、私たちは引き続き大量と増加する損失を招くことを予想して、これは引き続き経営活動から負の純現金流を産生する。
私たちの未来の資本使用と需要は多くの現在と未来の要素にかかっている。これらの要素にはこれらに限定されない
|
● |
我々の規制承認申請を支援するために必要な臨床試験の進展状況は、2022年1月に開始されたグローバルランダムII/III相試験であるASPIRE試験の完成を含む |
|
● |
重要なサプライヤーと支払い条件を協議する能力 |
|
● |
卵巣癌におけるSBP−101開発事業のコストと、CPP買収により得られた資産の開発事業を拡大するコスト |
|
● |
北米以外の地域で私たちの候補製品Flynpoviを開発するコストは |
|
● |
早期臨床試験が行われ,第三者協力により資金が得られれば,様々な適応のエフルオロオルニチンを開発するコスト |
|
● |
私たちは候補製品の安全性と有効性を証明することができます |
|
● |
私たちはアメリカ、EU、または他の国際市場で私たちの候補製品の規制承認を得ることができる |
|
● |
私たちの候補製品に適用される規制規制の変化は、製品開発のコストと遅延を招く可能性がある |
|
● |
私たちの候補製品の市場受容度と未来の販売レベル |
|
● |
第三者支払者との返済計画の進展速度 |
|
● |
競争の技術と市場発展の影響 |
|
● |
特許出願の提出及び起訴、並びに特許請求の執行又は弁護に係る費用。 |
2023年12月31日まで、私たちは資金を借りることができる既存の信用計画を持っていない。歴史的に見ると、私たちの運営資金は主に株式、証券、債務の売却から来ている。私たちは過去に必要な資本を獲得して私たちの運営を支援することに成功したにもかかわらず、私たちは似たような方法で追加的な融資を求めるかもしれないが、私たちが商業的に合理的な条項と条件で追加的な融資を得ることができるか、または根本的にできないという保証はない。
負債.負債
CPPは2022年6月15日にSucampo GmbH(“貸金人”)に改訂及び再予約された引受票(“本票”)を発行し、元金金額は約620万ドル(“元本”)である。この手形はいずれの未返済元金を単利とし、年利率は5%である。2024年3月8日、同社は第2期支払残高1.0ドルと、約259,000ドルの未払い利息を支払った。このお金は貸手が提供した猶予期間が満了する前に支払われる。すべての余剰未払い元金は、当時のいかなる未払いおよび応算利息とともに、以下のように支払わなければならない:(I)100万元、さらに2025年1月31日および2026年1月31日またはそれまでのすべての未払い利息、および(Ii)すべての残り元金を2027年1月31日またはそれまでの未払い利息に加算する。当社は計画通り2023年1月31日に100万ドルと利息を支払うことになりました。2023年12月31日現在の未返済元金残高は約520万ドル。2023年12月31日現在,課税と未払い利息総額は約238,000ドルである。脚注7を参照してください。
Panbelaは貸主に発行された手形の全金額に貸主を受益者とする支払い保証を提供している。
2023年12月31日以降に普通株式と引受権証を発行する
2024年1月31日、同社は登録公開発行を完了し、合計794,000株の普通株を発行し、1株0.001ドルの使用価格で最大3,581,000株の普通株を購入する予備融資権証と最大8,750,000株の普通株を購入する承認証を発行した。株式承認証の初期行権価格は1株関連株式2.06ドルである。これらの証券の発行価格は普通株と引受権証1株2.06ドルの総合発行価格であり、最大2株の追加普通株、または1株当たり事前融資の引受権証と引受権証2.059ドルを購入する。今回発行された純収益総額は約820万ドル。2024年3月7日現在、未返済の事前融資権証はない。これらの証券は,S-1表中の有効登録宣言に基づいて発行される.
2023年と2022年の普通株式と引受権証の発行
2023年12月21日、私たちは既存のC類株式承認証の所有者と株式承認証取引権誘因要書を締結して、私たちの普通株の株式を購入し、これに基づいて、所持者は現金でそのC類株式承認証を行使し、既存の取引価格で1株15.60ドルで合計127,800株を購入し、それと引き換えに、C類株式証とほぼ同じ条項で新しい株式承認証を発行し、最大255,600株の私たちの普通株を購入することに同意した。我々が所有者がC類株式証を行使したことから得られた総収益は約200万ドルであった.今回発行された純収益総額は約190万ドル。C類株式承認証を行使する際に発行可能な普通株式株式は,所有者がS-1表の既存登録声明に基づいて転売を登録する.
2023年11月2日に、吾らはいくつかの現有株式証明証所有者と株式承認証取引権誘因要約書簡を締結し、普通株式を購入することに同意し、これにより、所有者は現金方式でその既存引受権証を行使し、1株15.60ドルの換算使用価格で106,500株の普通株を購入することに同意し、吾らが既存の株式承認証とほぼ同じ条項で新株式証を発行することに同意し、最大213,000株の普通株の購入及び既存株式承認証を行使する時に全数支払う現金で1株の既存株式証明書0.125ドルを支払うことに同意した。我々が所有者が既存の株式承認証と売却誘導権証を行使して得た総収益総額は約190万ドルである。今回発行された純収益総額は約180万ドルである。既存引受権証を行使する際に発行可能な当社普通株式は、S-1表の既存登録声明に基づいて登録されています。
2023年6月21日、同社は登録公開発行を完了し、合計29,300株の普通株、1株0.001ドルの使用価格で最大84,200株の普通株を購入する予備融資権証と、1株75ドルの原始行使価格で最大227,000株の普通株を購入する権利証を発行した。これらの証券の総合発行価格は普通株と引受権証1株当たり75ドル、2株を購入する引受権証、あるいは2株を購入する事前融資株式承認証と引受権証は1株当たり74.999ドルである。今回発行された純収益総額は約770万ドル。2023年12月31日まで、すべての事前資金権証が行使された。これらの証券は,S-1表中の有効登録宣言に基づいて発行される.
2023年1月31日、同社は登録公開発行を完了し、合計8,070株の普通株を発行し、1株0.001ドルの使用価格で最大3,054株の普通株を購入する予融資権証と最大22,250株の普通株を購入する引受権証を発行した。これらの株式承認証の再定価が適用された希釈性公開後の行使価格は現在1株あたり1.0992ドルである。これらの証券の総発行価格は、1株当たり普通株および2つの株式承認証1,350.00ドル、または事前融資当たりの引受証および2つの株式承認証1,349.999ドルである。今回発行された純収益総額は約1370万ドル。2022年12月31日現在、すべての事前出資の引受権証が行使されている。これらの証券は,S-1表中の有効登録宣言に基づいて発行される.
2022年10月4日、同社は登録公開発行を完了し、合計295株の普通株、予備融資権証を発行し、1株0.001ドルの使用価格で最大542株の普通株、および引受権証を購入して、最大1,256株の普通株を購入した。これらの株式承認証の再定価は、希釈公開発行とその後の逆株式分割後の発行権価格であり、1株当たり12.386ドルである。これらの証券の発行価格は、普通株1株当たり7200ドルと1.5個の引受権証、または事前融資ごとの引受権証と1.5個の株式承認証7199.999ドルである。今回発行された純収益総額は約530万ドル。2022年12月31日現在、すべての事前出資の引受権証が行使されている。これらの証券は,S-1表中の有効登録宣言に基づいて発行される.
2022年7月19日、Panbela治療会社(“会社”)は、Roth Capital Partners,LLC(“代理店”)と販売契約を締結し、総販売総価格が8,400,000ドルに達する会社普通株を時々“市場”株式発行計画(“ATM計画”)で売却する。同社は2022年12月31日までの最後の月に、ATM機で47株の普通株を発売販売し、約93,000ドルの毛収入を生み出した。会社は約44,000ドルの融資コストを発生させ、これらのコストは2022年12月に会社がATMに基づいて株を発売する際に追加の実収資本を計上し始めた。ATM計画によると、会社が代理店に支払う手数料は、ATM計画に基づいて普通株を売却する総毛収入の3.0%に相当する。2022年12月31日までの1年間の純収益は約4.6万ドル。同社は2023年12月31日までの1年間に、ATM計画に基づいて9.15億株の普通株を売却し、総収益は約160万ドルだった。2023年12月31日までの1年間の販売純収益は約160万ドルだった。
将来の資本需要
私たちは、必要な将来の試験を完了し、アメリカ、EU、その他の国際市場で規制承認を求めることを含む、私たちの業務を継続し、私たちの業務計画を実行するためにより多くの資金が必要です。歴史的に見ると、私たちの運営資金は主に株式、証券、債務の売却から来ている。私たちは過去に必要な資本を獲得して私たちの運営を支援することに成功したにもかかわらず、私たちは似たような方法で追加的な融資を求めるかもしれないが、私たちが商業的に合理的な条項と条件で追加的な融資を得ることができるか、または根本的にできないという保証はない。私たちの既存の現金と2024年1月に公募株で集めた現金は、2024年第2四半期までの運営費を支払うのに十分だと信じています。
もし私たちが必要な時に追加的な融資を得ることができない場合、私たちは私たちの業務を削減し、行動する必要があります。その中には、外部専門サービス提供者の使用を減らすこと、従業員や従業員の報酬を減らすこと、私たちの候補製品開発を大幅に修正または延期し、私たちの候補製品を商業化する権利を第三者に許可することが含まれている可能性があります。そうでなければ、他のアプリケーションを求めたり、運営を一時停止したりします。
もし私たちが株式または転換可能な債務証券を売却することで追加資本を調達すれば、私たちの既存株主の利益は希釈され、条項は清算または他の既存株主の権利に悪影響を及ぼす特典を含む可能性がある。もし私たちが優先株を発行すれば、私たちの株主の権利に影響を与えたり、私たちの普通株の価値を下げたりするかもしれない。特に、将来の優先株保有者に付与される具体的な権利には、投票権、配当金および清算の優先権、転換および償還権、債務返済基金条項、および第三者との合併または第三者への資産売却能力の制限が含まれる可能性がある。債務融資が可能であれば、追加債務を招く、資本支出を行う、または配当を宣言するなど、私たちが具体的な行動をとる能力を制限または制限する契約を含むいくつかの合意が含まれる可能性がある。これらのすべての事件は、規制承認と商業化目標を達成する能力に悪影響を与え、私たちの業務を損なう可能性がある。
私たちの将来の成功は、追加資金、第2/第3段階臨床試験、および必要な将来の試験を得る能力、および私たちの候補製品のために米国、EU、および他の国際市場でマーケティング承認を得る能力にかかっている。もし私たちが必要な時に追加の資金を得ることができなければ、もし私たちのII/III期臨床試験が成功しなければ、未来の試験に必要な規制の承認を得なければ、あるいはこれらの研究が終わると、私たちのIVOSPEMEN候補製品の発売承認を得られなければ、経営を続けることができず、運営を停止させられるだろう。本報告に含まれる財務諸表の作成仮説は、資産の回収可能性や分類に関するいかなる調整も含まれておらず、これらの不確実性の結果に起因する可能性のある負債額も含まれていない継続的な経営企業として継続すると仮定している。
許可協定
UFRFとの独占ライセンス契約によると、前回の改訂は2019年10月4日であり、ライセンス技術開発のライセンス製品の純売上高の2.5%から5%の特許権使用料の支払いが要求され、期間は短い:ライセンス製品の初商業販売から10(10)年、または各国ベースの市場独占期間。最新の修正案は未来のすべてのマイルストーン支払いをキャンセルした。その会社はまだ年間10,000ドルのライセンス維持費を支払うことを約束した。
|
第七A項。 |
市場リスクの定量的·定性的開示について |
小さな報告会社として、私たちはこれに基づいて情報を提供する必要がない。
|
第八項です |
財務諸表と補足データ |
本プロジェクトの要求に基づいて作成された財務諸表とその付記は,本年度報告シート10−KのF−1ページから始まる。
|
第九項です |
会計と財務情報開示の変更と相違 |
ない。
|
第9条。 |
制御とプログラム |
情報開示制御とプログラムの評価
私たちの経営陣は、CEOと財務責任者の参加の下、私たちの開示制御と手続きを評価しました。このような評価に基づき、我々の最高経営責任者およびCEOは、2023年12月31日現在、取引所法案に基づいて提出または提出された報告書で開示を要求している会社に関する情報が、米国証券取引委員会規則および表で指定された期間内に記録、処理、まとめ、報告されることを効果的に確保し、そのような情報が蓄積されて私たちの経営層に伝達されることを保証することを含み、必要な開示に関する決定をタイムリーに行うために、我々のCEOおよび最高財務官を含むと結論した。
財務報告の内部統制の変化
最近完了した財政四半期内に、私たちの財務報告の内部統制に重大な影響があることは発見されていません。あるいは合理的に私たちの財務報告の内部統制に大きな影響を与える可能性があります。
経営陣財務報告内部統制年次報告書
私たちの経営陣は、“取引法”ルール13 a-15(F)および15 d-15(F)で定義されている財務報告の十分な内部統制の確立と維持を担当している。財務報告の内部統制とは、公認された会計原則に基づいて財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供し、以下の政策とプログラムを含む、我々のCEOと最高財務責任者が設計または監督し、私たちの取締役会、管理層、その他の人員によって実施されるプログラムである
|
(1) |
私たちの資産を合理的、詳細、正確かつ公平に反映した取引および処置の記録を保存することと関連がある |
|
(2) |
公認された会計原則に従って財務諸表を作成するために必要に応じて取引を記録することを確保するための合理的な保証を提供し、私たちの収入と支出は私たちの経営陣と取締役の許可のみに基づいて行われる |
|
(3) |
財務諸表に重大な影響を及ぼす可能性のある不正取得、使用、または処分について、財務諸表に重大な影響を与える可能性のある資産の防止またはタイムリーな発見について合理的な保証を提供します。 |
その固有の局限性のため、財務報告の内部統制は適時な誤報防止と発見の絶対保証を提供することができない。エラー陳述がタイムリーに予防または発見されないリスクを低減するために、除去ではないにもかかわらず、保障措置をプログラム中に設計することができる。
我々の経営陣は,報告書で提案された枠組みに基づいて,財務報告の内部統制の有効性を評価した内部制御—フレームワークを統合するCOSO(2013年の枠組み)と呼ばれるテレデビル委員会の後援組織委員会が発表した。この評価に基づき、経営陣は、2023年12月31日現在、財務報告書の内部統制に有効であると結論した。
本報告書には,財務報告内部統制に関する我々の独立公認会計士事務所の認証報告は含まれていない。“ドッド·フランクウォール街改革·消費者保護法案”第989 G節によると、経営陣の報告は、当社の独立公認会計士事務所の認証を受けず、この条項は、より小さい報告会社の監査役認証要件を免除している。
|
プロジェクト9 B。 |
その他の情報 |
.
|
プロジェクト9 Cです。 |
検査妨害に関する外国司法管区の開示 |
ない。
第三部
|
第10項 |
役員·幹部と会社の管理 |
私たちの執行官に関する情報は
ジェニファー·K·シンプソン、博士、MSN、CRNP、現在55歳で、2020年7月以来総裁兼CEOと取締役を務めてきた。当社に入社する前に、シンプソン博士は2015年から2020年6月までナスダックシステム会社(デルカス:CTTH)の総裁兼最高経営責任者および取締役会メンバーを務めていた。2012年以来、彼女はDelcathで様々な他の指導者を務めてきた。2011年から2012年まで、Simpson博士はImClone Systems,Inc.(礼来社の完全子会社)でグローバルマーケティング、腫瘍学ブランド主管総裁副総裁を務め、すべての製品の商業化活動を担当し、その中の1つの後期資産の発売に準備した。2009年から2011年まで、シンプソン博士は製品チャンピオン総裁副主任を務め、2008年から2009年まで、ImClone社製品Ramucirumab副主任総裁製品チャンピオンを務めた。2006年から2008年まで、シンプソン博士はペンシルバニア州に本部を置く生物技術会社Ortho Biotech(現在ヤンソン生物技術会社)で製品取締役腫瘍学治療マーケティング専門員を務め、免疫学、腫瘍学と腎臓病領域の革新的な解決方案に専念した。彼女のキャリアの初期には,シンプソン博士は10年以上血液学/腫瘍学看護師従事者と教育家を務めていた。シンプソン博士は2019年8月からずっとEagle PharmPharmticals,Inc.の取締役会、指名と会社管理委員会のメンバーを務め、2021年7月以来CytRx Corporationの取締役会メンバーを務めている。シンプソン博士はピッツバーグ大学の疫学博士号,ロチェスター大学の看護学修士号,ニューヨーク州立大学バッファロー校の看護学学士号を有している。
現在64歳のスーザン·ホヴァトは2018年4月以来、副総裁兼首席財務官を務めてきた。ホーガスは製薬、医療、消費者組織で財務と運営職を務めていた。同社の地位を除いて、ホヴァスさんは取締役会のメンバーであり、Photonic Pharma,LLCに財務コンサルティングサービスを提供している。Photonic Pharma,LLCは個人持株会社であり、早期薬物発見の効率に集中している。Panbelaチームに加入する前に、Horvathさんは2016年から2018年1月までEnobobs,LLCの首席財務官を務め、視力矯正に専念した個人会社であり、2014年から2016年までプライベート持株を担当した安全製品会社Tensiious Holdings,Inc.(d/b/a Ergodyne)の首席財務官兼最高財務官、2011年から2014年まで、HealthSense,Inc.の首席財務官兼副社長を務め、HealthSense,Inc.は新世代技術(SaaS)と遠隔監視会社であり、高齢者と脆弱な成人のための安全と生活の質の改善を提供し、生活コストを削減し、医療コストを全体的に低下させる。彼は2008年から2010年まで首席財務官を務め、運営と人力資源部の副総裁を担当し、2008年から2010年まで商業化段階にある早期医療機器会社血球会社の運営と人力資源部副総監を務め、2004年から2007年まで強力な消費ブランドの開発とマーケティングに専念する上場消費保健品会社CNS,Inc.の副総裁とチーム責任者を務めた。Horvathさんはイリノイ大学シャンパン校の会計学学士号を持ち、公認会計士と公認会計士で、活躍していない。
私たちの取締役会に関する情報
我々の業務は、できるだけ多くの3つのレベルに分けられた取締役会が監督し、取締役は通常指定されたレベルに選ばれ、任期は3年である。以下は取締役会の現在のメンバーに関するいくつかの情報です
第二種役員--任期は2024年に満了します
マイケル·T·カレン、M.D.,M.B.A.、現在78歳で、2021年5月に当社従業員として退職して以来、当社の取締役会議長と非従業員取締役を務めてきた。クーロン博士は2011年11月の共同創業以来、会社の執行議長と取締役を務めてきた。クーロン博士は開発段階の会社と協力して候補薬物の臨床前から臨床開発までの専門知識を計画、設計、推進することを含む33年間の製薬経験をわが社にもたらした。クーロン博士は2018年10月から2020年7月までの間に私たちの総裁兼最高経営責任者を務めました。彼は2011年11月から2015年6月まで私たちの首席医療官と総裁を務めた。カレン博士は2009年から2011年まで製薬業界に職務調査相談を提供し、これまで衛材製薬で1年間の移行相談サービスを提供してきた。2000年から2008年まで、彼はMGI Pharma Inc.で首席医療官を務め、以前SunPharm社でG.D.Searle社の首席医療官を務め、そして世界第5位の契約研究機構IBAH Inc.で臨床コンサルティング副主任総裁を務め、そこで彼は商業戦略コンサルティングサービスを提供し、製薬業界のいくつかの発展段階にある会社のために発展計画、監督事項と臨床試験を設計した。クーロン博士はIDD医療会社の共同創業者とCEOでもあり、製薬スタートアップ企業である。カレン博士は1988年に3 M製薬会社に入社し、心血管、肺、リューマチと免疫反応調節薬の開発に取り組んだ。彼のキャリアの中で、クーロン博士は2004年以来の3種類のALOXI、Dacogen、Lusedraを含む10種類の薬物の承認を得た。クーロン博士は内科委員会認証を持ち,1977年から1988年までミネソタ州オワトナ診療所で勤務し,そこで総裁を務めた。カレン博士はミネソタ大学で医学博士と理学学士号を取得し、聖トーマス大学で工商管理修士号を取得し、ノースカロライナ大学教会山校とノースカロライナ大学ウィルミントン校で内科入院医師と取締役会認証を完了した。
D.ロバート·スペールは現在68歳で、2015年9月以来取締役の一員を務めている。スチュアートさんは2012年3月以来、太陽生物製薬研究会社の取締役を務めてきた。スペールさんは、農業部門で39年以上の経験を持っています。1973年から2005年まで、スペールはミネソタ州カンディヨシー県に農場を所有し、5000エーカーを経営し、トウモロコシ、大豆、テンサイを生産した。スペールさんは取締役会に勤めている間に豊富な経験を持っています。1992年から1996年までValAdCoの取締役会長を務め,1996年から2003年までフェニックスバイオ複合材料会社の取締役会長を務めた。
第3種役員-任期は2025年に満了する
アーサー·J·フラタミコは58歳で、2019年12月からわが社の取締役を務めている。登録薬剤師であり,製薬業界で30年以上の経験を持ち,Radiant BioTreateuticsの最高経営責任者を務めており,Radiant BioTreateuticsは2021年5月から多抗体開発に焦点を当てた新しい抗体プラットフォームを進めており,多価と多重特異性抗体である。Radiantに加入する前に、Fratamicoさんは、2017年1月からGalera Treateutics,Inc.の首席ビジネス官を務めてきました。同社は、癌放射線治療の発見と開発に取り組む新しいジスムターゼ模倣薬の発見と開発に取り組んでいます。Galeraに加入する前に、Fratamicoさんは、2016年12月までナスダックに上場されている臨床段階バイオテクノロジー企業であるVitae PharmPharmticals,Inc.のチーフビジネス担当を2014年5月からエルビエに販売しています。Vitae製薬会社に入社する前、複数のバイオテクノロジー会社で同様の行政職を務め、GMinin X製薬会社やMGI製薬会社の販売促進を含む業務開発を指導していた。大量のライセンス取引や買収を担当したほか、外部会社の戦略や管理のコミュニケーションを指導していた。彼はまたいくつかの高級マーケティング、製品計画、新製品開発職を務めた。フラタミコさんは、フィラデルフィア薬学科学アカデミーの薬学学士号、ドレイクセル大学の工商管理修士号を取得しています。
ジェフリー·S·マティソンは、63歳で、2015年9月からわが社の取締役を務めてきた。マティソンは取締役や上場医療機器会社NeuroOne Medical Technologies Corporationの監査委員会議長も務めている。Mathiesenさんは2021年6月以来、上場医療機器会社Helius Medical Technologies,Inc.(ナスダック株式コード:HSDT)の財務責任者、財務担当者兼秘書を務めており、神経健康に焦点を当てた非侵襲的プラットフォーム技術の開発に取り組んでおり、2022年5月から取締役を務め、2020年6月から2021年6月まで取締役兼監査委員会議長を務めている。また、Mathiesenさんは、2022年3月~2022年12月に、ヘルスケア·ライフサイエンス·データ変換プラットフォーム·ソリューションの上場プロバイダHealthcare Triangle,Inc.(ナスダック·コード:HCTI)の取締役·監査委員長を務め、2018年7月~2020年2月にeNeura、Inc.の取締役·監査委員会議長を務め、eNeuraは個人所有の医療技術企業であり、片頭痛の急性治療·予防治療を提供する。Mathiesenさんは、民間のバイオ製薬会社Teewinot Life SciencesのCEOとして2019年10月から2019年12月までの間に、純粋な医薬品レベルの大麻化合物の生合成生産に専念し、2019年3月から2019年10月までの間にCEOを務めます。2020年8月、ティビノ生命科学社は米国破産法第11章に基づいて自発的な要望書を提出した。これまで、2015年9月から2018年9月までの間に上場生物製薬会社Gphire治療会社の首席財務官を務めていた。2015年8月から2015年9月まで、彼はゲフィルの顧問だった。2011年3月から2015年1月まで、上場医療機器会社サンシャイン心臓会社の首席財務官を務めた。マティソンは1993年以来、副会長総裁と首席財務長を含む上場企業の役員職を務めてきた。さん·マティソンはナンダコタ州大学の会計学の学士号を持ち、公認会計士でもあります。
第I類取締役-任期は2026年に満了する
Daniel·J·ドノワン,59歳,2022年6月以来取締役を務めている。2011年から2022年6月までパンベラがCPPの買収を完了するまで、CPPの取締役と首席商務官(非従業員職)を務めてきた。2014年の創業以来、民間会社RreLife Solutions,Inc.のCEOを務めてきた。彼は2023年1月以来強度治療会社の取締役会メンバーを務めており、監査委員会のメンバーでもある。Rare Lifeに入社する前、ドノヴァンは2001年にオンコウェイ医薬会社を設立し、2011年まで取締役と社長の社長を務めていた。EnVision Pharmaは2008年に連合生物資源会社に買収され、ドノワンさんは連合生物源会社で高級副社長戦略と市場開発部のメンバーを務め、指導チームのメンバーになりました。ドノヴァンはファイザーでキャリアを開始し、様々な責任がますます大きくなってきた職を務め、販売から米国や国際市場の市場研究やマーケティングまで、最終的に取締役やヨーロッパチームの責任者を務めた。ファイザー在任中、彼は製薬業のいくつかの最も成功した製品発表の商業化過程において重要な役割を果たした。
ジェフリー·E·ジェイコブは現在62歳で、2022年6月以来取締役の一員を務めている。彼は2009年からCPPの最高経営責任者を務め、2022年6月までPanbelaがCPPの買収を完了した。アリゾナ州バイオ製薬コンサルティング·投資会社Tucson Pharma Ventures LLCの担当者でもあり,2004年からこの職務を担当してきた。2004年、ジェイコブはシステム生物学、予測性薬物ゲノム学、臨床試験設計革新を抗癌新薬の開発に応用したスタートアップ会社であるSystems Medicine Inc.を設立した。ジェイコブは2007年まで同社の最高経営責任者を務め、2008年末まで部門最高経営責任者を務めた。1987年から2004年にかけて、ジェイコブはResearch Corporation Technologiesに雇われ、最近の職務は上級副社長。その間、彼はResearch Corporation Technologiesを率いて特許開発と許可組織から初期段階の技術孵化とリスク展開会社に転換した。彼は研究会社の技術会社の取締役会のメンバーを務め、現在取締役会の議長を務めている。彼は創設取締役会のメンバーでもあり、これまでクリティカルパス研究所の首席プロジェクト官を務めていた。ジェイコブさんは、マサチューセッツ工科大学で工学の修士号、技術および政策の修士号、アリゾナ大学で工学の学士号を取得しています。
ジェニファー·K·シンプソン博士、マイクロソフト新聞網、CRNPは、2020年7月以来、わが社の総裁兼最高経営責任者と取締役を務めてきた。参照してください“私たちの執行官に関する情報は“以上はシンプソン博士の背景と経験に関するさらなる情報です。
延滞金第16条報告
1934年証券取引法第16条(A)条では、10%を超える普通株を保有する役員、役員及び実益所有者は、米国証券取引委員会に初期所有権報告及び所有権変更報告を提出しなければならないと規定されている。私たちの普通株式の10%以上を持っている役員、役員、および実益所有者は、彼らが提出したすべての第16(A)条の表のコピーを提供しなければなりません。我々に提供されたこのような表の写しの審査及びわが役員及び役員の書面陳述のみに基づいて、2023年12月31日の会計年度までに、すべての第16(A)条の届出要求が満たされた。
道徳的基準と商業的行動規範
当社は、当社の主要行政職、主要財務者、主要会計者又は財務総監又は類似の機能を実行する者、及び他の従業員及び取締役に適用される道徳及び商業行為規則(“規則”)を採用した。この規則は私たちのウェブサイトwww.panbela.comの投資家関係である会社管理部分に掲示されている。私たちのウェブサイトでは、Form 8-Kに要求される時間内に、当社の最高経営責任者、最高財務官、最高会計官、財務総監、または同様の機能を実行する者に適用される“規則”に、私たちの任意の条項、および米国証券取引委員会法規S-K第406(B)項に列挙された道徳的規則に定義された任意の要素に関連する任意の条項を修正または放棄する予定です。
董事局委員会に関するある資料
監査委員会
監査委員会は3人のメンバーで構成されている:議長はマティソンさん、ドノバンさん、スペールさん。その他を除いて、委員会の主な機能は、(A)監査当社の帳簿及び記録を履行し、その会計及び財務報告の慣行を監督する上での取締役会の法定及び受託責任の履行を支援すること、(B)当社及びその子会社が十分な行政及び内部会計制御を有し、規定された手順及び行動基準に従って動作することを決定するために適切な監督を行うこと、及び(C)自社が株主及び公衆に配布された財務情報を独立して審査することである。
監査委員会のすべてのメンバーは、米国証券取引委員会(“米国証券取引委員会”)が適用する規則制度の金融知識に対する要求に適合している。我々の取締役会は、Jeffrey S.Mathiesenが米国証券取引委員会の適用規則によって定義されているので、監査委員会の財務専門家として資格があることを決定した。監査委員会の各メンバーは、証券取引法第10 A-3(B)(1)条の独立性要件に適合している。
|
第十一項 |
役員報酬 |
指名された行政員の報酬
次の開示の要点は私たちが任命された幹部たちだ。2023年度には、私たちの“指定幹部”には、私たちだけの二人の幹部、シンプソン博士、ホヴァスさんが含まれています。
私たちが任命した各幹部の基本給は、最初は適用幹部との公平な交渉に基づいて決定された。私たちの取締役会の報酬委員会は毎年私たちの役員の給与を検討するだろう。基本給を交渉または審査する際には、報酬委員会は、そのメンバーの経験、役員の将来の成功への期待貢献、および他の役員の相対的な報酬および責任に基づいて市場競争力を考慮する。
報酬総額表
次の表は、2023年度の実行幹事の報酬(総称して“と呼ぶ)を提供します幹部.幹部”):
|
氏名と主要ポスト |
年.年 |
賃金.賃金 |
オプション大賞(a) |
不公平 激励計画 補償する(b) |
合計する |
|||||||||||||
|
ジェニファー·K·シンプソン |
2023 |
527,000 | 44,911 | - | 571,911 | |||||||||||||
| 社長と最高経営責任者 |
2022 |
506,000 | - | 188,324 | 694,324 | |||||||||||||
|
スーザン·ホヴァト |
2023 |
333,000 | 15,526 | 119,394 | 467,920 | |||||||||||||
| 首席財務官兼副総裁 “金融”の総裁 |
2022 |
330,200 | - | 103,459 | 423,459 | |||||||||||||
|
(a) |
この表のオプション奨励の価値は、財務会計基準委員会会計基準編纂特別テーマ718に基づいて計算された財政年度内に付与されたこのような奨励の公正価値を代表する。報酬推定値を決定するための仮定は、総合財務諸表付記9において議論される。2022年度にはいかなる持分奨励も付与されていない。 |
|
(b) |
代表が2024年にPanbelaの2023年現金インセンティブ計画に基づいて支払う支払いと、Panbelaの2022年現金インセンティブ計画に基づいて2023年に支払う支払いは、以下の通りである。2024年2月8日、給与委員会は、2023年の現金奨励案で2024年に支払う現金奨励金を決定するために、実績を認証した。シンプソン博士は2024年に支払うべきだった彼女の支払いを放棄した。 |
2023年12月31日までの未償還持分賞
|
オプション大賞 |
||||||||||||||||
|
名前.名前 |
グラント 日取り |
量 証券 潜在的な 体を鍛えていない オプション(#) 練習可能である |
量 証券 潜在的な 体を鍛えていない オプション(#)キャンセル- 練習可能である |
選択権 トレーニングをする 値段 |
選択権 満期になる 日取り |
|||||||||||
|
ジェニファー·K·シンプソン |
7/17/2020 |
8 | – | 239,760 |
7/17/2030 |
|||||||||||
|
3/30/2021 |
5 |
2(a) |
98,160 |
3/30/2031 |
||||||||||||
|
3/27/2023 |
– |
165(b) |
300 |
3/27/2033 |
||||||||||||
|
スーザン·ホヴァト |
4/17/2018 |
1 | – | 138,000 |
4/17/2028 |
|||||||||||
|
5/21/2019 |
2 | – | 70,800 |
5/21/2029 |
||||||||||||
|
9/24/2019 |
1 | – | 120,000 |
9/24/2029 |
||||||||||||
|
6/24/2020 |
1 | – | 119,520 |
6/24/2030 |
||||||||||||
|
3/30/2021 |
1 | – | 98,160 |
3/30/2031 |
||||||||||||
|
3/27/2023 |
– |
57(b) |
300 |
3/27/2033 |
||||||||||||
|
(a) |
2024年3月30日にすべての残りの株式を帰属する予定だ。 |
|
(b) |
2024年3月27日にすべての残りの株式を帰属する予定だ。 |
現金奨励的報酬
給与委員会は、2023年と2022年に、臨床発展と財務マイルストーンに基づいて各幹部の業績目標を策定した。各実行者の目標達成後の潜在的報酬は、以下にさらに説明する実行者雇用プロトコルに規定された目標に等しい。2024年第1四半期、給与委員会は、シンプソン博士の2023年のボーナス承認支払い目標の86.18%、ホガスのボーナス承認支払い目標の89.64%を決定した。シンプソン博士は彼女の2023年の現金報酬を放棄した。ホーガス2023年のボーナスは2024年第1四半期に支払われる予定だ。報酬委員会が承認した2022年の現金インセンティブは、2023年第1四半期に支払われる。
雇用協定
私たちはすべての幹部たちと雇用協定を締結した。以下に概説する具体的な条項を除いて、各役員は、私たちの他の役員(あれば)を含む、私たちの従業員が一般的に得ることができる他の報酬や福祉計画に参加する資格があります。このような雇用協定には、従来のeスポーツ禁止契約とeスポーツ禁止契約も含まれており、知的財産権の秘密保持と譲渡に関する補足協定の実行を実行機関に要求している。
雇用協定によると、私たちの取締役会の給与委員会は毎年各幹部の基本給を審査しています。雇用協定によると、委員会は適用年度の昇給を承認することができるが、役員の同意を得ない限り、役員の基本給を当時の水準以下にしてはならない。上述したように、賠償委員会は2023年の業績基準を決定し、これらの目標を達成した上で現金支払いを承認した。シンプソン博士は現金支払いを放棄し、ホガスさんの現金支払いは2024年第1四半期に支払われた。
社長と最高経営責任者
彼女の雇用契約によると、シンプソンは年間業績現金ボーナスを得る資格があり、目標金額は彼女の基本給の50%を下回らない。配当額の支払いは、我々の取締役会が策定する指標の完成状況と、適用された現金配当期間が終了したときに会社に雇用され続けていることに依存します。
財務副総裁兼首席財務官総裁
彼女の雇用協定によると、ホガスは年間業績現金ボーナスを得る資格があり、目標金額は彼女の基本給の40%を下回らない。配当額の支払いは、我々の取締役会が策定する指標の完成状況と、適用された現金配当期間が終了したときに会社に雇用され続けていることに依存します。
終了または制御権変更時の潜在的支払い
彼らそれぞれの雇用合意によれば、任意の役員の雇用が“理由”以外の任意の理由(適用される雇用協定の定義を参照)または彼または彼女の“十分な理由”(適用される雇用協定の定義参照)で終了した場合、彼または彼女は、それぞれの年収追加終了が発生した年間現金ボーナス目標(ある場合)に相当する割合で計算された金額と、終了日または前に蓄積された他の金額とを得る資格がある。“支配権変更”の前の6ヶ月以内または“支配権変更”から2年以内(適用される雇用協定で定義されているように)にこのような解雇が発生した場合、実行者は、それぞれの年収に相当する額を獲得し、終了発生当時の全額現金ボーナス目標に相当する額を得る。
役員報酬
次の表には、最近終了した財政年度に非従業員役員を務めた者のいくつかの報酬情報が示されている。
|
名前.名前 |
稼いだ費用 あるいは…。 |
選択権 賞.賞 ($) |
合計する |
|||||||||
|
マイケル·T·カレン(A) |
72,500 | 3,631 | 76,131 | |||||||||
|
アーサー·J·フラタミコ(B) |
49,000 | 3,631 | 52,631 | |||||||||
|
ジェフリー·S·マティソン(C) |
81,500 | 3,631 | 85,131 | |||||||||
|
D.ロバート·スペール |
57,500 | 3,631 | 61,131 | |||||||||
|
Daniel·J·ドノワン(E) |
52,500 | 3,631 | 56,131 | |||||||||
|
ジェフリー·ジェイコブ(F) |
40,000 | 3,631 | 43,631 | |||||||||
|
(a) |
カレン博士は2023年12月31日までに計30株を購入するオプションを持っている。 |
|
(b) |
フラタミコは2023年12月31日までに計14株を購入するオプションを持っている。 |
|
(c) |
マティソンは2023年12月31日までに計14株を購入するオプションを持っている。 |
|
(d) |
スペールは2023年12月31日現在、合計14株を購入するオプションを保有している。 |
|
(e) |
ドノヴァンは2023年12月31日現在、合計14株を購入するオプションを持っている。 |
|
(f) |
ジェイコブは2023年12月31日までに計24株を購入するオプションを持っている。 |
2023年の間、わが社は取締役会とその委員会会議に参加することによる自己負担費用を非従業員取締役に精算した。
2022年2月、給与委員会は非従業員役員の現金給与の更新を承認した。次に改正された年度額は2022年1月1日から発効し、2024年1月1日からの1年間は変更されていない。これらの毎年の金額は月ごとに支払います。
|
年間前払い金 (すべての金額は元単位) |
一般情報 |
監査委員会 |
ノミネート&指名 統治する 委員会 |
補償する 委員会 |
||||||||||||
|
非従業員取締役 |
40,000 |
|
‐ |
|
‐ |
|
‐ | |||||||||
|
議長.議長 |
32,500 | (a) | ||||||||||||||
|
独立役員をリードする |
|
22,500 | (a) |
|
‐ |
|
‐ |
|
‐ | |||||||
|
委員会議長 |
|
‐ | 15,000 | 7,500 | 10,000 | |||||||||||
|
委員.委員 |
|
‐ | 7,500 | 4,000 | 5,000 | |||||||||||
|
(a) |
非従業員役員招聘金に支払う。 |
|
第十二項 |
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
株式報酬計画情報
次の表は、2023年12月31日までに会社持分補償計画に従って発行された普通株式数を示しています
|
計画種別 |
発行予定証券数 以下の権力を行使する際に発する 未完成の選択肢は 株式証明書と権利を認める |
加重平均運動 卓越した代価 オプション、株式承認証及び 権利.権利 |
証券数量 利用可能な時間を保つ 以下の条項により将来発行される 持分補償計画 |
|||||||||
|
証券保有者が承認した持分補償計画 |
607 | (a) | $ | 14,410.38 | – | (b) | ||||||
|
証券保有者の許可を得ていない持分補償計画 |
– | – | – | |||||||||
|
合計する |
607 | - | ||||||||||
|
(a) |
2016年計画下の561株基礎普通株オプション、2011年計画下の5株基礎普通株オプション、およびCPPオプション計画下の41株を含む。2016年に株主が2016年度計画を承認した後、2011年度計画下の奨励金の発行を停止します。 |
| (b) |
2016年計画では、この計画に基づいて発行可能な普通株式数は、2021年1月1日から2025年1月1日までの毎年1月1日に増加し、金額は、(I)前年12月31日までに総配当プールを完全希薄株式総数(改正2016年計画で定義されている)の20%に増加させるのに必要な株式数と、(Ii)取締役会またはその報酬委員会が任意の例年1月1日までに決定した少ない数の株式に等しい。 |
特定の実益所有者と経営陣の保証所有権
次の表は、2024年3月22日現在の発行された普通株式の実益所有権に関するいくつかの情報を示しており、これらの情報は、(I)次の表に記載されている私たちが指名された各役員、(Ii)私たちのすべての取締役、(Iii)私たちのすべての役員、取締役、および取締役が全体として指名されている人、および(Iv)私たちが発行した普通株式の5%以上の他の実益所有者を保有している。所有権パーセンテージは、同一日終値時点で発行された4,854,861株の普通株式に基づく。米国証券取引委員会規則に基づいて実益権属を決定する。私たちが知っている限り、別の説明があり、適用されるコミュニティ財産法の制約を受けない限り、以下に掲げる株の保有者は、所有する株式に対して唯一の投票権および投資権を有する。次の表には、2024年3月22日から60日以内に行使可能な普通株式基礎権利の株式数が含まれている。以下に別途説明されない限り、表に記載されている各役員または役員の住所は、C/o Panbela Treateutics,Inc.,712 Vista Blvd#305,Waconia,Minneota 55387である。
|
名前.名前 |
金額と性質 実益所有権 |
未返済の割合 株 |
|||||
|
行政員および役員 |
|||||||
|
ジェニファー·K·シンプソン |
201 |
(a) | * | ||||
|
スーザン·ホヴァト |
84 |
(b) | * | ||||
|
マイケル·T·クーロン |
63 |
(c) | * | ||||
|
ダニエル·ドノヴァン |
25 |
(d) | * | ||||
|
アーサー·J·フラタミコ |
14 |
(e) | * | ||||
|
ジェフリー·ジェイコブ |
27 |
(f) | * | ||||
|
ジェフリー·S·マティソン |
14 |
(g) | * | ||||
|
D.ロバート·スペール |
48 |
(h) | * | ||||
|
全役員と現執行幹事(8人) |
476 |
(i) | * | ||||
|
(a) |
株式オプションに拘束されている株180株と、株式証に拘束された14株を含む。 |
|
(b) |
株式オプションに制約された63株と、株式証に拘束された14株を含む。 |
|
* |
1%以下 |
|
(c) |
Cullen Living Trustが保有する14株を含む。30株は株式オプションに拘束され、11株は権利証で拘束された。 |
|
(d) |
14株の株式オプションに制約された株が含まれている。Westport Boys,LLC(“Westport”)が持つ3株とGDB Investments,LLP(“GDB”)が持つ6株も含まれている。ドノヴァンさんは、Westportの管理メンバーとGDBの指定されたメンバーです。ドノヴァンさんは、WestportとGDBが所有する証券の実益所有権を放棄しますが、彼がその中で金銭的利益を除外しています。 |
|
(e) |
14株の株式オプションに制約された株が含まれている。 |
|
(f) |
24株のオプション制約を受けた株と、2株の株式証制約を受けた株とを含む。 |
|
(g) |
14株のオプション制約を受けた株が含まれている。 |
|
(h) |
配偶者保有19株、株式オプション制約を受けた14株、株式証制約を受けた12株を含む。 |
|
(i) |
株式オプションに制約されている株353株と、株式証制約を受けた53株を含む。 |
|
十三項 |
特定の関係や関連取引、取締役の独立性 |
特定の関係や関係者が取引する
以下は、当社が2022年1月1日以来参加している取引概要であり、関連金額は86,000ドルを超え、私たちの最後の2つの完全会計年度終了時までの私たちの総資産平均の約1%を占めており、これらの取引のうち、任意の取締役、役員、または10%を超える株式を持つ実益所有者は、直接的または間接的な重大な利益を持っていたが、タイトルに記載されている補償スケジュールは除外されている役員報酬:雇用契約“第11項にあります。
2022年6月15日、CPPはPanbela取締役のJacobさんと離職契約(“離職契約”)を締結し、CPPの買収が完了する直前にジェイコブ·さんはCEO、従業員、その他すべてのポストを辞任した。Jacobさんが別居協議で提出した確認、陳述、保証、チェーノ、解放、プロトコルを考慮すると、CPPはJacobさんに合計350,000ドルを支払うことに同意し、辞任時の基本給の倍に相当します。この金額は、(I)CPPまたはその親会社が重大な融資を完了し、(Ii)成約日の2年記念日または2024年6月15日の早い日に満期となる。残りの25000ドルは、2023年12月31日までの分割払いでジェイコブさんに支払う必要があります。このお金は2024年1月31日に支払われた。さらに考慮として、CPPはまた、12ヶ月以内に現在の医療保険を継続するために、Jacobさんによって、雇用主に支払われた保険料の一部を、“総合包括予算調整法”によって返済することに同意する。
役員及び上級職員の責任制限及び賠償
わが社の証明書はデラウェア州の法律で許可されている最高限度で役員の責任を制限しています。
私たちの定款は、法律で許容される最大程度、または賠償協定(適用される場合)に基づいて取締役および上級管理者に費用を賠償し、立て替えることを規定している。それらはまた、私たちが時々会社の他の従業員や代理人に賠償することを選択できると規定している。また、“デラウェア州会社法”と会社細則は、いかなる高級職員、取締役、従業員、あるいは他の代理人を代表して、当社にサービスを提供する際にその行為によって発生したいかなる責任も保険に加入することを許可して、会社の細則が賠償を許可するかどうかにかかわらず。私たちは役員と上級職員責任保険書を持っています。
現在、現在、現職または元役員または上級職員に関する係属中の訴訟または法的手続きは、賠償が必要または許可されていることに関連しているものではなく、任意の訴訟または法的手続きが請求の脅威を引き起こす可能性があることを知っている。
証券法による責任の賠償は、前述の条項により登録者の取締役、上級管理者、統制者が許可される可能性があり、登録者は、米国証券取引委員会が、このような賠償は証券法で表現された公共政策に違反すると考えているため、実行できないと言われている。
関連者取引承認政策
私たちの取締役会は、関連者との取引に関する書面政策を採択しており、私たちは関連側取引承認政策と呼んでいます。我々の関連側取引承認政策は、“関連側”と取引しようとするいかなる幹部も、通常、行われる取引およびそれに関連するすべての重大な事実を迅速に我々の監査委員会に開示しなければならない。取引を審査する際には,我々の監査委員会は,(1)条項の商業合理性,(2)我々に対する利益と期待利益,(3)代替取引の機会コスト,(4)関連側利益の重要性と性質,および関連側の実際または表面的利益衝突を含むすべての関連事実や状況を考慮する.
我々の監査委員会は、関連情報をすべて考慮した後、その取引がわが社および株主に有利であると判断しない限り、関連側取引を承認または承認することはなく、取引条項はわが社にとって公平である。私たちの監査委員会の承認や承認がなければ、どんな関連側の取引も完了しないだろう。我々の政策は,役員のメンバーが彼らと利害関係のある提案や実際の関連者取引に関する任意の投票を回避することになるだろう.私たちの関連側取引承認政策によると、“関連側”には、我々の取締役、取締役被著名人、役員、5%以上の普通株を持つ実益所有者、および上記のいずれかの直系親族が含まれています。私たちの政策に制約されない関連側取引には、同じ条項で私たちのすべての従業員と株主に提供される取引と、私たちと関連側との間の取引が含まれています。関連先またはその関連会社との間のすべての他の取引金額と合計した場合、関連する金額は、過去2つの完全会計年度末のわが社の平均総資産の1%未満です。
役員は自主独立している
“ナスダック株式市場継続上場規則”(以下、“ナスダック規則”と略す)の規定によると、取締役会の多くのメンバーは“ナスダック”で定義されている“独立取締役”でなければならない。我々の取締役会では、ドノヴァン·さん、フラタミコ·さん、マティソン·さん、スメルさんがいずれも“独立役員”であることをすでに決定しています
|
14項です |
最高料金とサービス |
料金を審査する
Cherry Bekairt LLP(PCAOB ID 00677)は、2023年12月31日と2022年12月31日までの年間に独立公認会計士事務所を務めています。次の表に、Cherry Bekairt LLPが提供するこの会計年度に関連する専門サービスの総費用を示す:
|
現在までの年度 |
||||||||
|
2023年12月31日 |
2022年12月31日 |
|||||||
|
料金を審査する(a) |
$ | 141,750 | $ | 124,800 | ||||
|
監査関連費用(b) |
16,327 | 5,575 | ||||||
|
合計する |
$ | 158,077 | $ | 130,375 | ||||
|
(a) |
監査費用には、当社の年間総合財務諸表を監査する費用、当社の年次報告書Form 10−Kに提出された監査された総合財務諸表、当社のForm 10−Q四半期報告書を審査する総合財務諸表、および通常独立公認会計士によって提供される会計年度の法定および規制書類または業務に関連するサービスが含まれています。このカテゴリには、非米国司法管轄区域において、中期財務諸表および法定監査の監査または審査中、または監査または審査によって生じる監査および会計事項の提案も含まれている。 |
|
(b) |
監査関連費用には、総合財務諸表監査業績に合理的に関連する担保及び関連サービス費用が含まれており、“監査費用”の項には記載されていない。 |
前置承認政策
監査委員会は私たちが独立公認会計士を使用するサービスを規範化する政策を制定した。この政策によれば、監査委員会は、当該等のサービスの提供が当該会計士の独立性を損なわないようにするために、我々の独立した公認会計士が提供するすべての監査及び許可された非監査サービスを予め承認しなければならない。2023年と2022年に、さくらんぼベカルテ有限責任会社は、米国証券取引委員会の要求に基づいて、上記の“審課金”の項目で決定されたすべての費用を承認した。
第4部
|
第十五項 |
展示品、財務諸表付表 |
|
(a) |
財務諸表、財務諸表明細書、証拠品。 |
|
(1) |
財務諸表 |
以下の財務諸表を本報告の一部として提出します
| 独立公認会計士事務所レポート(PCAOB ID 00 |
F-1 |
| 合併貸借対照表 | F-2 |
| 合併経営報告書と全面赤字 | F-3 |
| 合併株主損失表 | F-4 |
| 統合現金フロー表 | F-5 |
| 連結財務諸表付記 | F-6 |
|
(2) |
財務諸表明細書 |
記載されていない別表は省略されており、その理由は、当該別表が適用されていないか、必要ではないか、または上記の総合財務諸表およびその付記に記載されている資料が含まれているからである。
|
(3) |
陳列品 |
|
展示品 違います。 |
説明する |
|
|
3.1 |
再記載された会社登録証明書(2023年1月17日に提出されたタブ8-Kの現在の報告書の添付ファイル3.1) |
|
|
3.2 |
Panbela治療会社による証明書の改訂と再登録(2024年1月19日に提出されたForm 8-K現在の報告書の添付ファイル3.1を参照して編入) |
|
|
3.3 |
添付例の改訂および再記述(2023年4月18日に提出された現在の表8 K報告書の添付ファイル3.1参照) |
|
|
4.1 |
証券説明(2020年12月31日までの財政年度のForm 10−K年報に添付ファイル4.1を引用) |
|
|
4.2 |
2018年12月と2019年1月に発行された普通株式証券表(添付ファイル10.3を参照して2018年12月28日に提出された現在の8-K表報告書に組み込む) |
|
|
4.3 |
2019年8月から10月までに発行された普通株式証表(添付ファイルを参照して合併することにより)10.2から8月までに提出されたForm 8-K現在のレポート 29, 2019) |
|
|
4.4 |
2020年5月22日、6月5日、6月15日、6月22日に発行された引受権証フォーマット(添付ファイルを参照して編入)10.2から6月までに提出されたForm 8-K現在のレポート 11, 2020) |
|
|
4.5 |
Stock Transferとの権利証明代理プロトコルは、2020年9月1日の有限責任会社(添付ファイル4.1を参照して2020年9月1日に提出された8-Kフォームの現在のレポートに組み込まれています) |
|
|
4.6 |
普通株引受権証表(添付ファイル4.5に添付) |
|
展示品 違います。 |
説明する | |
|
4.7 |
VIStock Transferと署名された引受権証代理契約は、2022年10月4日の有限責任会社(2022年10月4日に提出された8-K表の現在報告書の添付ファイル4.1を参照して編入) |
|
|
4.8 |
普通株式引受権証表(2022年10月4日提出の8-K表現在報告書の添付ファイル4.3を参照して編入) |
|
|
4.9 |
VIStock Transferと署名された引受権証代理プロトコルは、2023年1月30日の有限責任会社(添付ファイル4.1を参照して1月31日に提出された現在の8−Kフォーム報告書に組み込まれる。2023年) |
|
|
4.9 |
普通株式引受権証表(2023年1月31日に提出された8-K表現在報告の添付ファイル4.3参照) |
|
|
4.10 |
Panbela治療会社とVstock Transfer,LLC間の承認権代理プロトコル(2023年6月21日に提出された8-Kフォームの現在の報告書の添付ファイル4.1を参照して組み込む) |
|
|
4.12 |
A類普通株引受権証表(2023年6月21日に提出された表8 Kの現在報告に関連した添付ファイル4.3 |
|
|
4.13 |
クラスB普通株式引受権証表(2023年6月21日に提出された8-K表に添付ファイル4.4を参照して現在の報告に組み込む) |
|
|
4.14 |
C類普通株引受権証表(2023年11月3日に提出された8-K表の現在報告書の添付ファイル4.1) |
|
|
4.15 |
D類普通株引受権証フォーマット(“誘導令”)(添付ファイル4.1を参照して2023年12月21日に提出された8-Kフォームの現在の報告書の添付ファイル4.1に組み込まれています) |
|
|
4.16 |
Panbela治療会社とVstock Transfer,LLC間の引受権証代理プロトコルテーブル(添付ファイル4.16を参照して2024年1月4日に提出されたS-1フォーム登録声明に組み込まれている) |
|
|
4.17 |
E類普通株引受権証表(2024年1月29日に提出された8-K表現在報告の添付ファイル4.3を参照して編入) |
|
|
4.18 |
F類普通株引受権証表(添付ファイル4.4を参照して2024年1月29日に提出された8−K表の現在の報告書に組み込む) |
|
|
4.19 |
普通株引受権証表を事前計画する(添付ファイル4.17を参照して2024年1月4日に提出されたS-1フォーム登録説明書に編入) |
|
|
10.1 |
2015年1月1日現在改訂された2011年株式オプション計画(添付ファイル10.1を参照して2015年9月11日に提出された8-Kフォームの現在の報告書に組み込む) |
|
|
10.2* |
2011年計画報酬のインセンティブ株式オプション協定表(添付ファイル10.2を参照して2015年9月11日に提出されたタブ8-Kの現在の報告書に組み込む) |
|
|
10.3* |
2020年4月9日までに改訂·再記述された2016年総合インセンティブ計画(添付ファイル99.1を参照して2020年5月26日に提出された8−K表の現在の報告書に組み込む) |
|
|
10.4* |
2016年度計画奨励株式オプションプロトコルフォーマット(添付ファイル10.4を参照して2016年6月30日までの第10-Q四半期報告書) |
|
|
10.5* |
2016年総合インセンティブ計画で奨励された非制限株式オプションプロトコル表(添付ファイル10.5を参照して2016年6月30日までの四半期報告Form 10-Q) |
|
|
10.6* |
2016年度総合インセンティブ計画奨励の業績株式オプションプロトコル表(添付ファイル10.7を参照して2016年12月31日現在の財政年度Form 10-K年報) |
|
|
10.7** |
フロリダ大学研究財団社との標準独占許可協定は、2011年12月22日(添付ファイル10.5を参照して2015年9月11日に提出されたForm 8-K現在の報告書に組み込まれている) |
|
展示品 違います。 |
説明する | |
|
10.8 |
2016年12月12日にフロリダ大学研究財団と署名したライセンス契約第1修正案表(添付ファイル10.10を参照して2019年12月31日までの財政年度Form 10-K年度報告書に組み込む) |
|
|
10.9 |
フロリダ大学研究財団社とのライセンス契約第2修正案は、2019年10月3日(添付ファイル10.1を参照して2019年10月9日に提出されたForm 8-K現在の報告書の添付ファイル10.1に組み込む) |
|
|
10.10* |
Susan Horvathとの雇用契約は、2018年4月17日(添付ファイル10.4を参照して2018年3月31日までの四半期Form 10-Q四半期報告に組み込まれています) |
|
|
10.11* |
ジェニファー·K·シンプソンと2020年7月15日に署名された雇用協定(添付ファイル10.1を参照して2020年7月16日に提出されたForm 8-K現在の報告書に組み込む) |
|
|
10.12 |
証券購入契約表は、2018年12月21日と31日、2019年1月14日、25日、31日(2018年12月28日に提出された現在の8-K表報告書の添付ファイル10.1を参照して編入されます) |
|
|
10.13 |
2021年7月19日にSuzanne Gagnonと署名された医療専門サービス協定(添付ファイル10.27を参照して2022年12月31日までの財政年度Form 10-K年度報告書に組み込まれる) |
|
|
10.14* |
改正癌予防製薬会社2010年株式インセンティブ計画(添付ファイル10.1を参照して2022年6月16日に提出された8−K表の現在の報告書に組み込む) |
|
|
10.15* |
株式オプション負担通知表(添付ファイル10.2を参照して2022年6月16日に提出された8-Kフォーム現在報告に組み込む) |
|
|
10.16 |
株式承認証表の交換(添付ファイル10.3を参照して2022年6月16日に提出された現在の8-K表報告書に組み込む) |
|
|
10.17 |
Sucampo GmbH(f/k/a Sucampo AG)を受益者とする転換可能な本票は、2017年9月6日、2022年4月7日に修正された(添付ファイル10.4を参照して2022年6月16日に提出された現在の8−K表報告書に組み込まれる) |
|
|
10.18 |
Sucampo GmbH(f/k/a Sucampo AG)を受益者とする保証は、日付は2022年6月15日(添付ファイル10.5を参照して2022年6月16日に提出された8−K表の現在の報告書に組み込まれる) |
|
|
10.19 |
ジェフリー·E·ジェイコブスと締結された別居·解放協定は、2022年6月15日(添付ファイル10.6を参照して2022年6月16日に提出された現在の8-K表報告書に組み込まれている) |
|
|
10.20 |
癌予防薬会社と壱二治療資産有限会社が2021年6月16日に署名した許可協定 |
|
|
10.21 |
証券購入契約表(2022年10月4日に提出された8-K表の現在報告書の添付ファイル10.2) |
|
|
10.22 |
Roth Capital Partnersとの配給代理プロトコルは、2022年9月29日まで(2022年10月4日に提出された8-Kフォーム現在報告の添付ファイル10.1を参照して組み込む) |
|
|
10.23 |
Roth Capital Partners,LLCとの配信エージェントプロトコルは,2023年1月26日(統合内容は2023年1月31日に提出された8_Kテーブル現在報告の添付ファイル10.1参照) |
|
|
10.24 |
2023年1月26日の証券購入契約(2023年1月31日に提出された8-K表の現在報告書の添付ファイル10.2を参照して編入) |
|
|
10.25 |
Roth Capital Partner,LLCとの配信エージェントプロトコルは,2023年6月16日(統合内容は2023年6月21日に提出された8-Kテーブル現在報告の添付ファイル10.1を参照)) |
|
|
10.26 |
2023年6月16日の証券購入契約(2023年6月21日に提出された8-K表の現在報告書の添付ファイル10.2を参照して編入) |
|
|
10.27 |
Roth Capital Partner,LLCとの配給エージェントプロトコルは,2024年1月28日(2024年1月29日に提出された8−K年度現在報告を参照した添付ファイル10.1合併)である |
|
展示品 違います。 |
説明する | |
|
10.28 |
2024年1月28日の証券購入協定(2024年1月29日に提出された8-K表現在報告書の添付ファイル10.2を参照して編入) |
|
|
21.1 |
付属会社名簿 |
|
|
23.1† |
独立公認会計士事務所の同意 |
|
|
24.1† |
授権書 |
|
|
31.1† |
2002年サバンズ·オキシリー法第302節で可決された取引法第13 a-14条に規定する最高経営責任者認証 |
|
|
31.2† |
2002年サバンズ·オキシリー法第302節で可決された“取引法”第13 a-14条に規定する首席財務官認証 |
|
|
32.1 |
2002年“サバンズ·オックススリー法案”906節で可決された“アメリカ法典”第18編1350節に規定された最高経営責任者認証 |
|
|
32.2‡ |
2002年“サバンズ·オックススリー法案”906節で可決された“米国法典”第18編1350節に規定される首席財務官認証 |
|
|
97† |
補償補償政策 |
|
|
101† |
当社2023年12月31日現在の年次報告10-K表の財務諸表は、イントラネットXBRL:(1)連結貸借対照表、(2)合併全面損失表、(3)合併株主権益表、(4)連結キャッシュフロー表、(5)連結財務諸表付記 |
|
|
104† |
表紙データファイル(添付ファイル101に含まれるイントラネットXBRL形式) |
|
* |
管理職補償計画または手配は、本報告書の証拠品として提出されなければならない。 |
|
† |
同封アーカイブ |
|
‡ |
同封して提供する |
|
** |
証券取引委員会が発表した機密待遇を与える命令により漏れた一部の証拠品。 |
|
第十六項 |
表格10-Kの概要 |
ない。
サイン
1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、2024年3月26日に以下の署名者がその代表を代表して本報告に署名することを正式に許可した。
|
PANBELA治療会社は |
||
|
差出人: |
/S/ジェニファー·K·シンプソン |
|
|
ジェニファー·K·シンプソン社長と最高経営責任者 |
||
1934年の証券取引法の要求に基づき、本報告は、以下の者が登録者を代表して、2024年3月26日に指定された身分で署名された。
|
/S/ジェニファー·K·シンプソン |
/投稿S/スーザン·ホヴァス |
|
|
ジェニファー·K·シンプソン |
スーザン·ホヴァス |
|
|
* |
* |
|
|
マイケル·T·カレンは取締役会長兼最高経営責任者 |
アーサー·J·フラタミコ役員.取締役 |
|
|
* |
* |
|
|
ダニエル·J·ドノヴァン役員.取締役 |
ジェフリー·S·マティソン, 役員.取締役 |
|
|
* |
* |
|
|
ジェフリー·E·ジェイコブ, 役員.取締役 |
D.ロバート·スペールは役員.取締役 |
|
* |
ジェニファー·K·シンプソンはここに署名し、上記登録者の各取締役を代表して本文書に署名し、上記取締役が正式に授権書に署名する。 |
|
差出人: |
/S/ジェニファー·K·シンプソン |
|
|
ジェニファー·K·シンプソン |
独立公認会計士事務所報告
取締役会と株主へ
パンバラ治療会社は
ミネソタ州ワコニア
財務諸表のいくつかの見方
Panbela Treateutics,Inc.とその子会社(“当社”)2023年12月31日と2022年12月31日までの総合貸借対照表と,この日までの各年度に関する総合経営報告書と全面赤字,株主赤字とキャッシュフロー,および関連付記(総称して“財務諸表”と呼ぶ)を監査した。財務諸表は,当社の2023年12月31日と2022年12月31日までの財務状況,および同年度までの各年度の経営結果とキャッシュフローをすべての重要な面で公平に反映しており,米国公認の会計原則に適合していると考えられる。
会社の継続経営企業としての継続経営能力に大きな疑いがある
添付財務諸表の作成は、同社が引き続き経営を継続する企業であると仮定している。財務諸表付記2に記載されているように、同社には経常赤字と業務からのマイナスキャッシュフローがあり、継続経営企業としての能力が大きく疑われている。付記3は、これらの事項に関する管理職の評価および管理職の計画を説明します。財務諸表には、このような不確実性に起因する可能性のある調整は含まれていません。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性について意見を述べるためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項−株式にリンクした取引
以下に述べる重要な監査事項は、当社監査委員会が伝達または要求を伝達する当期財務諸表監査によって生じる事項を指すものである:(I)財務諸表に対して大きな意味を有する勘定または開示に関するものであり、(Ii)特に挑戦的、主観的または複雑な判断に関するものである。重要監査事項の伝達は、財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、次の重要な監査事項を伝達することによって、重要な監査事項又はそれに関連する勘定又は開示について個別の意見を提供することもない。
重要な監査事項の説明
総合財務諸表の付記4、9及び10に開示されたように、当社は株式を基礎とする報酬及び株式証の誘因を含む各種の株式とリンクした取引があり、管理層が公正な価値推定を行う必要がある。これらの公正価値推定には,ブラック·スコアーズオプション定価モデルの使用が含まれており,経営陣に基礎投入についていくつかの仮定が求められている。
オプション定価モデルと取引会計で使用される重大な仮定の主観性のため、監査会社が株式とリンクして取引する会計は監査員の判断が必要である。
監査で重要な監査事項をどのように処理するか
この取引に対する会社の会計処理をテストするために、以下の監査手続きを実行しました
|
● |
私たちは経営陣の推定過程、これらの株式リンクツールの公正価値を推定する過程を含むことを理解した。 |
|
● |
株式に基づく報酬や株式承認証インセンティブ、およびこれらの取引を支援する経営陣の会計分析を含むすべての持分取引のリストを取得した。我々は、これらの結論が関連する会計基準に従って記録されることを確実にするために、得られた結論を評価した。 |
|
● |
著者らは関連する取締役会会議記録と合意を読むことによって、年内の株式リンク取引の正確性と完全性を評価する。 |
|
● |
私たちは経営陣が株式取引の公正価値を計算するための重要な仮定を評価した。この評価はブラック-スコアーズオプション価格モデルを独立して計算する重要な投入を含む。 |
|
● |
これらの開示が関連する会計基準に適合することを確実にするために、株式ベースの報酬および株式承認証インセンティブを含む株式リンク取引をめぐる開示を評価した。 |
/s/
2014年以来、当社の監査役を務めてきました。
2024年3月26日
パンバラ治療会社は
合併貸借対照表
(千元、株式を含まない)
|
2023年12月31日 |
2022年12月31日 |
|||||||
|
資産 |
||||||||
|
流動資産: |
||||||||
|
現金と現金等価物 |
$ | $ | ||||||
|
前払い費用と他の流動資産 |
||||||||
|
課税所得税 |
||||||||
|
流動資産総額 |
||||||||
|
他の非流動資産 |
||||||||
|
総資産 |
$ | $ | ||||||
| 負債と株主赤字 | ||||||||
|
流動負債: |
||||||||
|
売掛金 |
$ | $ | ||||||
|
費用を計算する |
||||||||
|
支払利息 |
||||||||
|
支払手形 |
||||||||
|
債務、流動部分 |
||||||||
|
流動負債総額 |
||||||||
|
債務,現在分の純額を差し引く |
||||||||
|
非流動負債総額 |
||||||||
|
総負債 |
||||||||
| 株主赤字: | ||||||||
|
優先株、$ |
||||||||
|
普通株、$ |
||||||||
|
原価計算の在庫株 |
( |
) | ||||||
|
追加実収資本 |
||||||||
|
赤字を累計する |
( |
) | ( |
) | ||||
|
総合収益を累計する |
||||||||
|
株主総損失額 |
( |
) | ( |
) | ||||
|
総負債と株主赤字 |
$ | $ | ||||||
すべての期間の株式と1株データは、2023年1月13日に発効した40株1株逆株式分割、2023年6月1日に発効した30株逆株分割と、2024年1月18日に発効した20株1株逆株分割を反映するように調整されている。
連結財務諸表付記はこれらの報告書の構成要素である。
パンバラ治療会社は
合併経営報告書と全面損失br}(千元、1株および1株当たり金額は含まれていません)
|
十二月三十一日までの年度 |
||||||||
|
2023 |
2022 |
|||||||
|
運営費用: |
||||||||
|
一般と行政 |
$ | $ | ||||||
|
研究開発 |
||||||||
|
営業損失 |
( |
) | ( |
) | ||||
|
その他の収入(支出): |
||||||||
|
利子収入 |
||||||||
|
知的財産権を売却する収益 |
||||||||
|
利子支出 |
( |
) | ( |
) | ||||
|
その他の費用 |
( |
) | ( |
) | ||||
|
その他収入合計 |
( |
) | ||||||
|
所得税割引前損失 |
( |
) | ( |
) | ||||
|
所得税割引 |
||||||||
|
純損失 |
( |
) | ( |
) | ||||
|
外貨換算調整 |
( |
) | ||||||
|
総合損失 |
$ | ( |
) | $ | ( |
) | ||
|
1株当たりの基本と償却純損失 |
$ | ( |
) | $ | ( |
) | ||
|
加重平均流通株−基本と希釈 |
||||||||
すべての期間の株式と1株データは、2023年1月13日に発効した40株1株逆株式分割、2023年6月1日に発効した30株逆株分割と、2024年1月18日に発効した20株1株逆株分割を反映するように調整されている。
連結財務諸表付記はこれらの報告書の構成要素である。
パンバラ治療会社は
株主合併報告書
(単位は千で、シェアは含まれていない)
|
2023年12月31日まで及び2022年12月31日まで年度 |
||||||||||||||||||||||||||||||||
|
普通株 |
在庫株 |
その他の内容 すでに納めた |
積算 |
積算 全面的に |
合計する 株主の |
|||||||||||||||||||||||||||
| 株 | 金額 | 株 | 金額 | 資本 |
赤字.赤字 |
収入.収入 |
赤字.赤字 |
|||||||||||||||||||||||||
|
2022年1月1日の残高 |
$ | $ | $ | $ | ( |
) | $ | $ | ||||||||||||||||||||||||
|
普通株式·オプション·引受権証の発行-CPP買収 |
||||||||||||||||||||||||||||||||
|
公開発行-普通株式と引受権証の発行 |
||||||||||||||||||||||||||||||||
|
普通株を売る |
||||||||||||||||||||||||||||||||
|
現金持分証を行使する |
||||||||||||||||||||||||||||||||
|
株に基づく報酬 |
- | - | ||||||||||||||||||||||||||||||
|
純損失 |
- | - | ( |
) | ( |
) | ||||||||||||||||||||||||||
|
未発行の断片的な株式調整、株式分割 |
||||||||||||||||||||||||||||||||
|
外貨換算調整 |
- | - | ||||||||||||||||||||||||||||||
|
2022年12月31日の残高 |
( |
) | ( |
) | ||||||||||||||||||||||||||||
|
公開発行-普通株式と引受権証の発行 |
||||||||||||||||||||||||||||||||
|
普通株を売る |
||||||||||||||||||||||||||||||||
|
株式証明書の行使は現金なし |
||||||||||||||||||||||||||||||||
|
現金持分証を行使する |
||||||||||||||||||||||||||||||||
|
在庫株 |
( |
) | ( |
) | ||||||||||||||||||||||||||||
|
株に基づく報酬 |
- | - | ||||||||||||||||||||||||||||||
|
純損失 |
- | - | ( |
) | ( |
) | ||||||||||||||||||||||||||
|
株式承認証の行使を誘導するための価値を調整する |
- | - | ( |
) | ||||||||||||||||||||||||||||
|
未発行の断片的な株式調整、株式分割 |
( |
) | ( |
) | ( |
) | ||||||||||||||||||||||||||
|
外貨換算調整 |
- | - | ( |
) | ( |
) | ||||||||||||||||||||||||||
|
2023年12月31日の残高 |
$ | $ | ( |
) | $ | $ | ( |
) | $ | $ | ( |
) | ||||||||||||||||||||
すべての期間の株式と1株データは、2023年1月13日に発効した40株1株逆株式分割、2023年6月1日に発効した30株逆株分割と、2024年1月18日に発効した20株1株逆株分割を反映するように調整されている。
連結財務諸表付記はこれらの報告書の構成要素である。
パンバラ治療会社は
キャッシュフロー表統合レポート (千)
|
十二月三十一日までの年度 |
||||||||
|
2023 |
2022 |
|||||||
|
経営活動のキャッシュフロー: |
||||||||
|
純損失 |
$ | ( |
) | $ | ( |
) | ||
|
純損失と経営活動で使用される現金純額の調整: |
||||||||
|
核販売が行っている研究と開発(IPR&D) |
||||||||
| 知的財産権を売却する収益 | ( |
) | ||||||
|
株に基づく報酬 |
||||||||
|
非現金利子支出 |
||||||||
|
経営性資産と負債変動状況: |
||||||||
|
課税所得税 |
( |
) | ||||||
|
前払い費用と他の流動資産 |
( |
) | ||||||
|
臨床試験費用の保証金 |
( |
) | ( |
) | ||||
|
売掛金 |
||||||||
|
負債を計算すべきである |
( |
) | ||||||
|
経営活動のための現金純額 |
( |
) | ( |
) | ||||
|
投資活動によるキャッシュフロー: |
||||||||
| 知的財産権を売却して得た収益 | ||||||||
|
知的財産権研究開発への投資 |
( |
) | ||||||
|
合併で得た現金 |
||||||||
|
投資活動のための現金純額 |
( |
) | ||||||
|
資金調達活動のキャッシュフロー: |
||||||||
|
普通株を売る収益、手数料と発行コストを差し引いて、$ |
||||||||
|
普通株と引受権証を公開発行した収益は,引受業者割引と発行コストを差し引いて$とする |
||||||||
|
株式承認証の行使を誘導して得られた収益は,コスト#ドルを差し引く |
||||||||
|
自発的に株式証明書を行使して得られた収益 |
||||||||
|
支払手形への支払い |
( |
) | ||||||
|
こまごました株に支払われた現金 |
( |
) | ||||||
|
融資活動が提供する現金純額 |
||||||||
|
為替レート変動が現金に与える影響 |
( |
) | ||||||
| 現金純変動額 | ( |
) | ||||||
|
年初現金および現金等価物 |
||||||||
| 年末現金および現金等価物 | $ | $ | ||||||
|
キャッシュフロー情報の追加開示: |
||||||||
|
利子計算期間中に支払った現金 |
$ | $ | ||||||
|
非現金取引の追加開示: |
||||||||
|
資産買い入れ対価として発行される普通株·株式オプションと引受権証の公正価値 |
$ | $ | ||||||
|
株式承認証の行使を誘導するための価値を調整する |
$ | $ | ||||||
連結財務諸表付記はこれらの報告書の構成要素である。
Panbela治療会社連結財務諸表付記
|
1. |
業務.業務 |
Panbela治療会社(“Panbela”)とその直接完全子会社:癌予防製薬会社(“CPP”)とPanbela Research,Inc.(“Panbela Research”)と癌予防製薬有限会社(アイルランド)とそれぞれの子会社が全額所有しており,破壊的療法の開発が主な目的であり,緊急医療ニーズがあるが満足されていない患者の治療に用いられている。Panbela Treateutics Pty LtdはPanbela Researchの完全子会社で、オーストラリアの法律に基づいて設立された。CPPは2つの完全子会社を持っている:イギリス実体癌予防製薬有限責任会社とアリゾナ州有限責任会社癌予防製薬有限責任会社。Panbelaとその直接的で間接的な子会社は“私たち”、“私たち”、“私たちの”、“会社”と呼ばれている
われわれのパイプラインの主な目標は,薬物療法を利用し,薬物療法を補充することで増加した疾患関連ポリアミンを減少あるいは正常化することである。私たちの主要な候補薬はエフルオロオルニチン(CPP-1 X)とシュリン酸の混合物Flynpoviであり、私たちはすでにフロリダ大学研究基金社からこの薬の世界的な独占許可を得た。私たちはアリゾナ大学アリゾナ州取締役会からFlynpoviを商業化する独占的な許可権を得た。
CPPを買収する
2022年6月15日に、吾らは2022年2月21日にPanbela、CPP、Panbela Research、Canary合併付属会社I,Inc.(“合併付属会社I”)およびCanary Merge付属会社II,Inc.(“合併付属会社”)が締結した合併合意および計画(“合併合意”)に基づき、先に公表されたCPPに対する戦略的業務再編および買収(“合併合意”)を完成させた。合併合意の条項によると、(I)Sub I(当時Panbelaの全資付属会社Panbela自身がPanbela Researchの完全子会社であった)がPanbela Researchと合併してPanbela Research(“第1次合併”)、Panbela Researchが1回目の合併で生き残ったこと、および(Ii)Merge Sub II(当時Panbelaの全資付属会社)がCPPと合併してCPP(“第2次合併”、1回目の合併とともに“合併”)に合併し、CPPが2回目の合併で生き残ったことが明らかになった。合併の結果,Panbela ResearchとCPPはそれぞれPanbelaの完全子会社となった。また、合併の完了と関連があれば、“Panbela治療会社”だ。“Panbela Research,Inc.”と改名しましたそして“カナリア合併持株会社”です。“パンバラ治療会社”と改名しましたその他の情報については、付記6、“資産購入”を参照されたい。
逆株分割
2023年1月13日、2023年6月1日、2024年1月18日から、会社の取締役会が承認した30株1株と20株1株の普通株を逆分割する。同社の普通株の額面と認可株式は逆株式分割の影響を受けない。本文に別段の規定がない限り、当社の普通株のすべての株式および1株当たりの金額は、すべての逆株分割を反映するように遡及調整されている。詳細については、注釈9を参照されたい。
|
2. |
リスクと不確実性 |
その会社は高度な規制と競争の環境で運営されている。薬品の開発,製造,マーケティングは米国食品·薬物管理局,オーストラリア治療用品管理局,EUの欧州薬品管理局および他の国の類似機関の承認を得,これらの機関の持続的な監督を受ける必要がある。新しい薬品の承認を得ることは決して確定的ではなく、何年もかかるかもしれないし、通常は大量の支出が予想される。
1ドルの損失を受けました
付随する総合財務諸表を作成する際には、継続的に経営している企業として、正常な業務過程で資産や清算負債を現金化することを考慮し、資産の回収可能性や分類に関するいかなる調整も含まれておらず、これらの不確実性の結果による負債額も含まれていないと仮定する。私たちが通常の業務過程で継続的に経営し、資産の帳簿価値と債務を返済する能力は、私たちが追加融資を得る能力、私たちの開発仕事の成功、アメリカ、オーストラリア、EUまたは他の市場での候補製品であるエフルオロオルニチン(CPP-1 X)とエフルオロオルニチン香包(CPP-1 X-S)が上場承認を得る能力、そして最終的に私たちの候補製品をマーケティングし、販売する能力を含む複数の要素に依存する。他の要因を除いて、これらの要因は、私たちが継続的に経営している会社として運営を続ける能力を大きく疑わせている。“流動性と管理計画”というタイトルの付記3を参照。
|
3. |
流動資金と管理計画 |
私たちは私たちの現在の事業計画を支援するために追加的な資金源を求める必要があるだろう。株式や債務融資、あるいは戦略的協力や許可協定など、様々なルートでより多くの資金を調達することを求めることができる。私たちは私たちの運営を支援するために追加の資金源を得ることができるという保証はないし、もし私たちがそのような資金を持っている場合、私たちはこれらの追加資金が私たちの需要を満たすのに十分であるか、私たちが受け入れられる条件で十分になるという保証はない。私たちの臨床データが積極的でなければ、あるいは経済や市場状況が悪化すれば、このリスクは増加するだろう。
もし私たちが必要な時に追加の融資を得ることができない場合、私たちは私たちの業務を削減する必要があり、外部の専門サービス提供者への使用を減らすこと、従業員や従業員の報酬を減らすこと、私たちの候補製品の開発を大幅に修正または延期すること、第三者が私たちの候補製品を商業化することを許可すること、癌や自己免疫疾患の治療、または私たちが本来追求または運営を停止しようとしていた応用のための行動が含まれるかもしれない。
2023年12月31日以降、会社は普通株式と引受権証の登録公開を完了し、普通株式を購入し、総収益は約$となる
会社は2023年12月31日までの年度内に、普通株と引受権証の登録発行を2回完了し、普通株を購入した。2023年6月21日、発売総収益は約$
当社はいくつかの株主に誘導権証を提供してその株式承認証を行使する。2023年11月2日、総収益は約$
同社は2023年から2022年までの間にAt The Market(ATM)施設で普通株も売却した。2023年12月31日までの年間純収益は約$となっている
2022年10月4日、会社は普通株と引受権証の登録公開を完了し、普通株式を購入し、総収益は約$となった
CPP買収で買収された資産について行われている多くの開発作業は,ライセンスパートナーから資金を提供しており,付記8,“Flynpoviの開発と商業化ライセンス契約”,あるいは国立癌研究所(“NCI”)や青少年糖尿病研究基金(“JDRF”)を含む外部組織との協力を参照されたい。
2024年1月発売の収益によると、私たちの現金は2024年第2四半期まで続くと予想されています。
私たちの将来の成功は、私たちがより多くの資金を得る能力、私たちの開発仕事の成功、私たちがアメリカまたは他の市場のイフサミン(SBP-101)、フリンポヴィ、エフルオロオルニチン(CPP-1 X)、エフロン酸香包(CPP-1 X-S)の上場承認を得る能力、そして最終的に私たちの候補製品をマーケティングし、販売する能力にかかっている。もし私たちが必要な時に追加の融資を得ることができなければ、もし私たちの臨床試験が成功しなければ、あるいは上場承認を得ることができなければ、私たちは経営を続けることができなくなり、私たちの会社の運営を停止し、清算することを余儀なくされるだろう。
私たちは私たちが商業的に合理的な条件で追加的な融資を受けることができるか、あるいは根本的に保証できないという保証はない。追加の持分証券や転換可能な債券を売却することは、私たちの既存株主の持分を希釈する可能性がある。
|
4. |
重要会計政策の概要 |
陳述の基礎
当社はすでに米国公認会計原則(“公認会計原則”)に従って付随する総合財務諸表を作成している。私たちの財政年度は12月31日に終わるだろう。
合併原則
添付されている連結財務諸表には、Panbela治療会社とその直接および間接子会社の資産、負債、費用が含まれている。すべての重大な会社間取引と残高は合併で販売された。
予算の使用
連結財務諸表の作成は、連結財務諸表の日に報告された資産及び負債額、又は有資産及び負債の開示及び報告期間内に報告された収入及び支出に影響を与えるために、管理層に推定及び仮定を要求する。実際の結果はこれらの推定とは異なる可能性がある。
企業合併と資産買収
私たちは買収会計方法を用いて買収された企業に対して会計計算を行い、この方法の要求は、買収が企業合併の定義に符合すれば、買収した資産と負担した負債は買収の日にそれぞれの公正価値で入金しなければならない。買収が企業合併の定義に適合していない場合は、資産買収に計上し、購入対価格を買収した資産に割り当てる。
ASC 805は、企業合併、買収が企業合併を代表するか否かを判定するモデルを提供する。一企業になるためには、買収された実体の一連の活動は投入と実質的な過程が必要であり、これらの投入と実質的な過程は共に創造産出を大きく促進する能力を有する。買収されたエンティティはまた、買収された総資産の公正価値に基づいて“実質的にすべて”が単一資産または1組の類似資産に集中しているかどうかに基づいて、買収が実質資産買収を代表するかどうかを決定することに関連する“スクリーニングテスト”に合格しなければならない。この評価は、現金、繰延税項目、および繰延税項目に関連する営業権のようないくつかの取得された資産を含まないが、確認された資産以外の任意の移転対価格を含む他のすべての総資産を含む。
信用リスクが集中する
会社を深刻な集中信用リスクに直面させる可能性のある金融商品は主に現金です。現金は商業銀行の普通口座に入れます。時々、このような預金は保険限度額を超える可能性がある。2023年12月31日までにドル
現金と現金等価物
現金等価物には、期限が3ヶ月を超えない短期·高流動性投資が含まれる。
他の非流動資産
その他の非流動資産は主に契約研究機関(“CRO”)の長期預金からなる。これらの金額は試験終了時に運営費や研究開発費であることが確認された。
研究開発コスト
研究開発コストには、人体臨床試験を行う際に生じる費用が含まれており、第三者サービスプロバイダが様々な試験を実行し、当社の臨床前研究に関連するデータを蓄積する費用は、当社の臨床前研究および人体臨床試験に使用される十分な数のSBP-101、FlynpoviおよびCPP-1 X化合物を生産するのに十分な数のSBP-101、FlynpoviおよびCPP-1 X化合物を生産するのに必要な費用を提供するための研究プロトコルであり、私たちの候補製品開発計画の実行に関連する専門知識のコンサルティングリソーススタッフコストを有しており、給与、福祉および株式ベースの給与および私たちの許可された知的財産権の許可および維持のコストを含む。
臨床試験費用を含めて研究開発費を徴収し、発生時に費用を計上します。われわれのヒト臨床試験は臨床試験現場で行われ,われわれがCROの協力の下で共同管理した。臨床試験地点を確立する費用は研究協定調印後に計算しなければならない。臨床試験業績に関連する費用は通常契約金額と合意マイルストーンの実現によって累積し、例えばサイト開放、患者登録、患者フォローアップなどである。著者らは臨床試験サイトとCROとのコミュニケーションを通じて、患者登録とその他の活動の程度を含む各重要な契約下の業績レベルを監視し、そして必要に応じて四半期ごとに推定数を調整し、臨床費用に各臨床試験サイトと各CROの実際の仕事支出を反映させる。
研究と発展コストも知的財産権の研究と発展を含む。この資産はCPPの証券所有者から購入し、資産を買収した後すぐに研究と発展のためにログアウトする。
ライセンス制約された知的財産権に将来他の用途がないと判断された場合、特許技術許可の取得に関連するコストを支払う。
臨床試験は費用を計算しなければならない
臨床前研究と臨床試験活動のコストはサプライヤーが特定の任務を達成する上での進展を評価した上で確認したものであり、使用するデータは臨床サイトの活性化、患者登録或いはサプライヤーが会社に提供するその実際のコストに関する情報を含む。これらの活動の支払いは個別契約の条項に基づいており,支払い時間はサービスを提供する期間と大きく異なる可能性がある.当社は、進捗又は完了状態又は完了したサービスに関する適用者及び外部サービスプロバイダの報告及び検討により、計算すべき推定を決定する。各貸借対照表日までの課税費用の推定は、当時知られていた事実と状況に基づいている。
株に基づく報酬
株式インセンティブ奨励の会計計算において、私たちは付与日とその等の奨励の公正価値に基づいて、従業員と非従業員サービスのコストを計量し、確認し、株式ツールの奨励と交換する。補償コストは帰属期間内に直線分配法を用いて比例的に確認され,帰属期間は必要なサービス期間と考えられる。私たちは発生した時間帯に記録を没収します。業績に基づく株式オプション奨励の補償費用は、“業績”が発生した場合または発生する可能性がある場合に確認する。
株式奨励の公正価値は付与された日にブラック·スコルスオプション定価モデルを用いて推定される。株式報酬の公正価値の決定は、私たちの株価といくつかの複雑かつ主観変数に関する仮定の影響を受ける。無リスク金利は米国債金利をもとに、個々の奨励の期待期限に適用される。予想変動率は主に会社普通株の変動率に基づいている。配当収益率をなぜなら、私たちは予測可能な未来に何の配当も発表しないと予想しているからだ。付与されたオプションの予想期限は、“簡略化”方法を使用して決定される。この方法によれば、予想期限は、平均帰属日と契約期限終了との間の中間点として推定される。
制限株式単位の公正価値は、付与された日に標的普通株の公正価値に基づいて計算される。
所得税
所得税は貸借対照法で計算される。繰延税項資産及び負債は、総合財務諸表中の既存資産及び負債の帳簿価額とそのそれぞれの課税基礎との間の差額及び営業損失及び税項相殺繰越間の差額に基づいて確認された将来の税項結果を推定する。繰延税金資産と負債は、当社が経営している管轄区ごとの法定税率で計量され、これらの仮差額の回収または決済が予想される年度の課税所得額に適用される予定です。税率変動が繰延税金資産や負債に及ぼす影響は、公布日を含む期間の経営で確認されている。繰延税金資産を最も顕在化する可能性のある額に減らすために、必要に応じて推定準備を設ける。当社は2023年12月31日および2022年12月31日までの繰延税項目総資産について全額推定を提供する準備をしています。当社の政策は、所得税に関する利息と罰金を総合経営報告書と全面赤字報告書の所得税費用に分類することです。
外貨換算
Panbera Treateutics Pty Ltdの機能通貨はオーストラリアドル(“AUD”)である.したがって,Panbela Treateutics Pty Ltdの資産と負債および株式取引は期末レートでドルに換算される.料金はその期間有効な平均為替レートに換算します。これにより発生した換算損益は,総合経営報告書と全面赤字報告書に累積総合損益の構成要素として入金される。2023年12月31日と2022年12月31日までの年度内に、累積された他の総合収益から業務のどの再調整までどうでもいい。
当社は当日有効為替レートで外貨建ての取引を記録しています。取引日と決算日の間の変動は取引損益であることが確認された。
1株当たり純損失
1株当たり純損失を計算する方法は,当期に発行された普通株の加重平均(分母)を純損失(分子)で割ることである。この間に発行された株式とその間に再買収された株式(あれば)は,その流通期間の部分に応じて重み付けを行う.希釈1株当たり収益(EPS)の計算は基本1株当たり収益の計算と類似しており、希釈性潜在普通株が発行された場合、発行される追加普通株の数を含むように分母が増加しているだけである。私たちの希釈1株当たり収益は基本的に1株当たり収益と同じである。普通株の同値株は計算に含まれていないので、それらの影響は逆希釈されているからである。
分子は2023年12月31日までの年間で,権利証明誘因費用によって約#ドル調整されている
以下に発行された潜在的普通株は、それらの影響が希釈されていないので、希釈後の1株当たり純損失の計算には含まれない
|
十二月三十一日 |
||||||||
|
2023 |
2022 |
|||||||
|
従業員と非従業員株式オプション |
||||||||
|
普通株引受権証により発行可能な普通株 |
||||||||
再分類する
今年度の新聞と一致するように,前年のある額を再分類した。これらの改訂は報告の業務結果に影響を与えなかった。具体的には$を再分類しました
最近発表された会計公告
2023年11月、FASBはASU 2023-07:支部報告(テーマ280)を発表し、報告可能な支部開示の改善を発表した。今回の更新は、重大部門の支出に関する開示とCODMをめぐる開示を強化することによって、損益を評価するための測定基準と、これらの測定基準を部門の業績を評価するために使用する報告可能部門の開示要求を改善する。これらの修正案は財務報告を改善し、すべての公共実体の年間と中期逓増分部情報の開示を要求するだろう。ASU 2023−07は,公共実体2023年12月15日以降に開始される財政年度および2024年12月15日以降に開始される財政年度内の中期に適用される。同社には報告可能な部門が1つしかないため、このASUを採用することは財務諸表や関連開示に実質的な影響を与えない。
最近採用されていない会計公告
契約販売制限下における持分証券の公正価値計量
2022年6月、FASBはASU 2022-03、ASC分テーマ820“契約販売制限された株式証券の公正価値計量”を発表した。FASBは、主題820におけるガイドラインを明らかにするために、本更新(1)を発表している
公正価値計量は、持分証券の売却が禁止されている契約によって制限された持分証券の公正価値を計量する際に、(2)関連する例示的な例を改訂し、(3)主題820に応じて契約販売制限された持分証券に新たな開示要求を導入する。公共企業実体については、本更新中の改訂は、2023年12月15日以降の会計年度と当該会計年度内の移行期間内で有効である。未印刷または印刷可能な中期および年度財務諸表については、早期採用が許可されている。当社は本指針を採択することがその総合財務諸表に大きな影響を与えないと予想しています。
所得税開示を改善する
2023年12月、財務会計基準委員会は、所得税開示を改善するために、有効な税率調整および司法管轄区域別に分類されて納められた所得税のうち、一致したカテゴリを維持し、情報をより大きく分解することを要求し、所得税開示の透明性を向上させることを要求する米国会計基準委員会第2023-09号を発表した。所得税の有効性を向上させるための他の修正案も含まれている
開示する。本ガイドラインは2025年12月31日までの年度から発効する。早期養子縁組を許可する。ガイドラインが採択されると,前向きにあるいは遡及的に適用することができる.当社は、このガイドラインを採用することが連結財務諸表に実質的な影響を与えないと予想している。
|
5. |
費用を計算する |
計算すべき費用には、以下の項目が含まれる
|
十二月三十一日 |
||||||||
|
2023 |
2022 |
|||||||
|
臨床試験および関連費用 |
$ | $ | ||||||
|
奨励的報酬 |
||||||||
|
解散費その他の賃金に関する金 |
||||||||
|
専門サービス |
||||||||
|
他にも |
||||||||
|
負債総額を計算すべきである |
$ | $ | ||||||
|
6. |
資産買い入れ |
2022年6月15日、会社は合併により、これまで発表されていたCPPの戦略的業務再編と買収を完了した。合併合意の条項によると、合併直前にCPPが発行した持株の保有者は、合併完了時にPanbelaの普通株式を取得する。Panbela Researchの株主は合併後のホールディングスPanbelaの大部分の流通株を保持している。CPP株主は合計#ドル以下の支払いまたは支払いを受ける資格があるだろう
私たちは、合併で買収された総資産の公正価値が、単一の識別可能資産または同様の識別可能資産のセットに実質的にすべて集中しているかどうかを決定するために“スクリーニングテスト”を行った。CPPの主要資産は、Flynpovi(CPP-1 X)とスリン酸)、エフルオロオルニチン(CPP-1 X)およびエフルオロオルニチン香包(CPP-1 X-S)を含む3つの形態のエフルオロオルニチンであり、知的財産権および開発からなる単一識別可能資産として確認されている。
資産を買収する契約の対価格にはいくつかの対価格が含まれており、これらの対価格は購入日に発生する可能性もなく、合理的に見積もることもできない。したがって,このまたは対価のある価値は以下の購入価格の割当てから除外されている.買収に関連する取引コストはすでに知的財産権研究開発への追加投資として入金されている。
以下は、CPP資産買収に関する購入対価格とその購入対価格の割り当て概要である
|
株 |
価値(千) |
|||||||
|
CPP株主に普通株式を発行する |
$ | |||||||
|
普通株式入札オプション継続 |
||||||||
|
普通株関連株式承認証が置換されている |
||||||||
|
現金ではありません |
$ | |||||||
|
発生する取引コスト |
$ | |||||||
|
総掛け値 |
$ | |||||||
|
プロセス研究と開発で* |
$ | |||
|
現金 |
||||
|
その他流動資産 |
||||
|
売掛金と売掛金 |
( |
) | ||
|
利子と支払手形 |
( |
) | ||
| $ |
*
|
7. |
支払手形 |
スキャンブ本券
CPPの未返済残高は2023年12月31日と2022年12月31日現在約#ドルである
普通寝台の切符
CPPの未返済残高は2022年12月31日現在約#ドルである
|
8. |
引受金とその他の事項 |
フロリダ大学研究財団と許可合意に達しました
2011年12月22日、フロリダ大学研究財団(UFRF)と独占ライセンス契約を締結した。本ライセンス協定は、2016年12月12日に改正(“第1修正案”)され、2019年10月3日に再改正される(“第2改正案”)。ライセンス契約は、同社がUFRFに支払う特許権使用料から
修正された許可協定は相変わらず慣行と慣用的な終了条項によって制限されている。同社は毎年$のライセンス維持費も支払わなければならない
アリゾナ大学とのライセンス契約は
CPPはアリゾナ大学(“大学”)アリゾナ州取締役会と署名したライセンス契約の一方である。機関間合意によると、カリフォルニア大学取締役会は、カリフォルニア大学オーウェン校を代表して、いくつかの特許、臨時特許、臨床試験データ、および化学的癌予防、ポリープ予防および他の技術に関連する他の知的財産権をCPPに許可することに同意した。同大学は,同大学がカリフォルニア大学オーウェン校と共同で保有する特許権を管理する権利がある。このライセンス契約は、CPPに知的財産権ベースの製品を独占的に商業化する権利を与える。知的財産権の交換として,CPPは大学に一定の費用と特許費用の補償を支払い,CPP株式を買収する引受権証を大学に付与した。合併の結果、権利証は購入権証に取って代わられる
CPPは大学に合計#ドルまでの追加マイルストーンを支払うことにも同意した
ジョン·ホプキンス大学との協賛研究協定は
2023年4月1日、同社はジョン·ホプキンス大学と協賛研究協定を締結した。同社が約束した資金総額は
|
9. |
株主権益 |
権利証誘因とD類株式証の私募
2023年12月21日、吾らはいくつかの既存のC類承認持分証所持者と持分証行使誘因申立書簡を締結して、当社の普通株を購入し、これに基づいて所有者は現金購入と引き換えにその既存の株式承認証を行使することに同意した
権利証執行権誘因とC類権証私募
2023年11月2日、吾らはいくつかの既存のA類及びB類承認持分証所持者と持分証取引権誘因申立書簡を締結して、当社の普通株を購入し、これに基づいて、所持者は現金方式でその既存のA類及びB類承認持分証を行使して購入することに同意した
普通株式と引受権証を公開発売2023年6月
2023年6月21日、当社は登録公開を完了し、発行合計
余剰権証のうち,購入権証
2023年12月31日まで、引受権証
普通株式および株式承認証を公開発売2023年1月
2023年1月30日、当社は登録公開を完了し、発行合計
すべての事前資本権証は2023年2月3日までに行使される。残りの株式証明書には別のキャッシュレス行使条項があり,この条項によれば,所有者は(X)現金行使時に発行可能な普通株式総数と(Y)の積に相当する株式総数を通知して受け取ることができる
普通株式および株式承認証を公開発売する
2022年10月4日、当社は登録公開を完了し、発行合計
市場で計画する
2022年7月19日、Panbela治療会社(“会社”)はRoth Capital Partners,LLC(“代理人”)と販売契約を締結し、会社の普通株の株式を売却し、総販売価格は最高$に達する
当社は2023年12月31日まで及び2022年12月31日までに販売しております
逆株分割
2023年12月19日、当社は株主特別総会を開催し、株主は改訂された自社登録証明書の改訂を提案し、8対1(1:1)の任意の整数割合で株式逆分割を実施した
同社は30株1株の逆株分割(1:
同社は40株1株の逆株分割(1:
保留株
|
2023年12月31日現在、将来の発行のために予約された普通株式は以下の通り |
||||
|
未償還株式オプション |
||||
|
持分インセンティブ計画の下で付与可能な株 |
||||
|
発行済み普通株引受権証により発行可能な普通株 |
||||
|
10. |
株に基づく報酬 |
2016総合インセンティブ計画
2020年4月9日に施行された2016年総合インセンティブ計画(“2016計画”)は、我々の取締役会の承認を得て、株主の承認を得ています。2016年計画では、条件を満たす従業員、取締役、コンサルタントに奨励性および非法定株式オプション、制限株式、株式付加価値権、業績単位、業績株、およびその他の株式奨励を付与することが可能になります。我々は2016年計画に基づいて普通株を購入するオプションを付与し、行使価格は付与された日に関する普通株の公平な市場価値を下回らない。2016年計画により付与されたオプションの最長期限は何年もです。2023年12月31日現在、購入オプション
2011年株式オプション計画
2016年計画が承認される前に、2011年株式オプション計画(“2011年計画”)に基づいて株式奨励が付与された。株主が2016年計画を承認すると同時に、取締役会は2011年計画の条項に基づいて、2011年計画の下で支払われていない賠償金は支払われていないにもかかわらず、2011年計画を終了した。2011年計画に基づいて付与されたオプションの最長期限は数年で一般的に至れり尽くせり従業員にとっては数年です。2023年12月31日現在、購入オプション
CPP’S 2010持分インセンティブ計画
合併の結果,当社は代替オプションの発行によりCPPの二零一零年持分インセンティブ計画(“CPP計画”)に関するすべての余剰権利と義務を担った。2023年12月31日現在、購入オプション
私たちはブラック·スコアーズオプション推定モデルによって推定された各報酬の公正価値に基づいて株に基づく報酬を確認した。結局、帰属中に確認された実際の費用は、実際に帰属した株のみに向けられるだろう。
オプション活動の概要は以下のとおりである
|
関連株 オプション |
加重平均 行権価格/ 共有 |
骨材 内在的価値 |
||||||||||
|
2022年1月1日の残高 |
$ | $ | ||||||||||
|
CPP計画の後続オプション |
||||||||||||
|
鍛えられた |
||||||||||||
|
キャンセルします |
||||||||||||
|
没収する |
( |
) | ||||||||||
|
2022年12月31日の残高 |
$ | $ | ||||||||||
|
授与する |
||||||||||||
|
鍛えられた |
||||||||||||
|
キャンセルします |
||||||||||||
|
没収する |
||||||||||||
|
2023年12月31日の残高 |
$ | $ | ||||||||||
各期間の株式ベースの報酬支出は以下のとおりである(千単位)
|
十二月三十一日までの年度 |
||||||||
|
2023 |
2022 |
|||||||
|
一般性と管理性 |
$ | $ | ||||||
|
研究開発 |
||||||||
|
株に基づく報酬総額 |
$ | $ | ||||||
2023年12月31日までの2年間、当社の未帰属株式状況の概要は以下の通りです
|
以下の株 選択権 |
加重平均補助金 期日公正価値 |
|||||||
|
2022年1月1日に帰属していない |
$ | |||||||
|
授与する |
||||||||
|
既得 |
( |
) | ||||||
|
没収する |
( |
) | ||||||
|
2022年12月31日に帰属していない |
$ | |||||||
|
授与する |
||||||||
|
既得 |
( |
) | ||||||
|
没収する |
||||||||
|
2023年12月31日に帰属していません |
$ | |||||||
2023年12月31日現在、発行され、帰属され、帰属されると予想される株式オプション情報は以下の通りである
| 未償還、既帰属、所期帰属 |
帰属し行使可能なオプション |
|||||||||||||||||||||||
|
1株当たりの権益 |
株 |
加重平均 余剰契約 寿命(年) |
重みをつける 平均値 行権価格 |
オプション 練習可能である |
重みをつける 平均値 残り 契約期限 (年) |
|||||||||||||||||||
| $ |
$ | |||||||||||||||||||||||
| $ |
- | $ |
$ | |||||||||||||||||||||
| $ |
- | $ |
$ | |||||||||||||||||||||
| $ |
- | $ |
$ | |||||||||||||||||||||
| 合計する | $ | |||||||||||||||||||||||
2023年12月31日現在、未確認従業員の株式オプション付与に関する報酬支出総額は$
購入するオプション
次の表は,2023年12月31日までの年度内に付与されたオプションの公平市場価値を計算する際に用いられる主な仮定を反映している
|
2023 |
|||||
|
普通株主公正価値 |
$ |
||||
|
無リスク金利 |
|
至れり尽くせり | |||
|
期待配当収益率 |
$ |
||||
|
期待オプション寿命(年) |
|
至れり尽くせり | |||
|
株価の変動を予想する |
|
- | |||
非従業員株報酬
我々は会計基準更新(“ASU”)に基づいて非従業員に付与された株式オプションを計算する2019-07,“報酬--株式報酬(テーマ718)である。非従業員に付与された株式オプションについて、私たちは約#ドルを記録した
|
11. |
所得税 |
設立以来、私たちは純運営損失が発生した。私たちは添付の財務諸表に純営業損失の利益を反映しておらず、私たちの繰延税金資産について全額推定値を設定しています。
2023年12月31日と2022年12月31日には、会社の課税所得税は約$となる
繰延所得税は、財務報告目的のための資産および負債の帳簿価値と所得税目的のための金額および営業損失と税収控除の繰越との一時的な違いによる純税収の影響を反映している。
私たちの繰延税金資産と負債の重要な構成要素は以下の通りです(千で計算)
|
十二月三十一日 |
||||||||
|
繰延税金資産(負債) |
2023 |
2022 |
||||||
|
純営業損失が繰り越す |
$ | $ | ||||||
|
研究単位繰り越し |
||||||||
|
株に基づく報酬 |
||||||||
|
第174節償却 |
||||||||
|
他にも |
||||||||
|
繰延税金資産 |
||||||||
|
推定免税額 |
( |
) | ( |
) | ||||
|
繰延税項目純資産 |
$ | $ | ||||||
将来の税金優遇の実現は、私たちが繰越期間内に十分な課税収入を生み出す能力があるかどうかにかかっている。私たちの経営赤字の歴史のため、管理層は上述した未来の税金優遇による繰延税金資産は現在実現不可能であると考えているため、私たちはすでに全額評価を提供しています。
法定税率と実際の税率の入金は以下の通り
|
十二月三十一日までの年度 |
||||||||
|
2023 |
2022 |
|||||||
|
法定料率 |
% | % | ||||||
|
恒久的差異 |
( |
) | ||||||
|
実際の税率変動 |
||||||||
|
州政府 |
||||||||
|
推定免税額 |
( |
) | ( |
) | ||||
|
海外研究激励措置 |
||||||||
|
他にも |
||||||||
|
有効率 |
% | % | ||||||
| 2023 |
2022 |
|||||||
|
税金: |
||||||||
|
現在のところ |
( |
) | ( |
) | ||||
|
延期する |
||||||||
|
非電流 |
||||||||
| ( |
) | ( |
) | |||||
2023年12月31日までの純営業損失と税収控除は以下の通り
|
(単位:千) |
金額 |
期限が切れる年限 |
|||
|
純営業損失-連邦 |
|
||||
|
2018年から2022年までの純営業損失-連邦 |
いつまでも期限が切れない |
||||
|
2023年-連邦 |
使用率を80%に制限する |
||||
|
税金控除-連邦 |
|
||||
IRCが提供する所有権変更制限や類似した国の規定により,繰越や貸記に対する純営業損失の利用はかなりの年次制限を受ける可能性がある。私たちはまだIRC第382条の下で所有権変更が発生したかどうかを決定するために詳細な分析を行っていない。所有権変更の影響は,変更前期間に起因する純営業損失繰越の使用に年度制限を加えることである。
その会社はアメリカとオーストラリアで税金を払わなければなりません。2018年12月31日現在の年度及び以降の納税申告書は連邦と州税務機関が審査しなければならない。Panbela Treateutics Pty Ltd 2016年12月31日現在および以降年度の納税申告書はオーストラリア税務当局の審査を経なければならない。
|
12. |
後続事件 |
2024年1月に普通株式及び株式承認証を発行する
2024年1月31日、当社は登録公開を完了し、発行合計