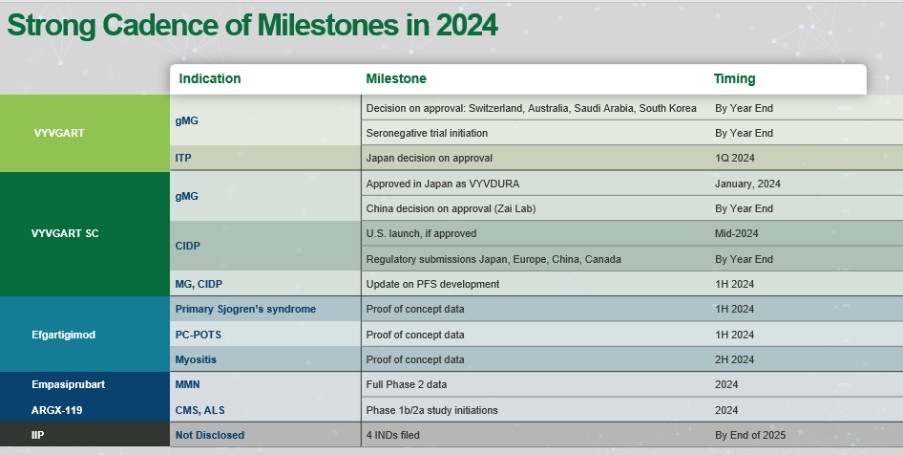
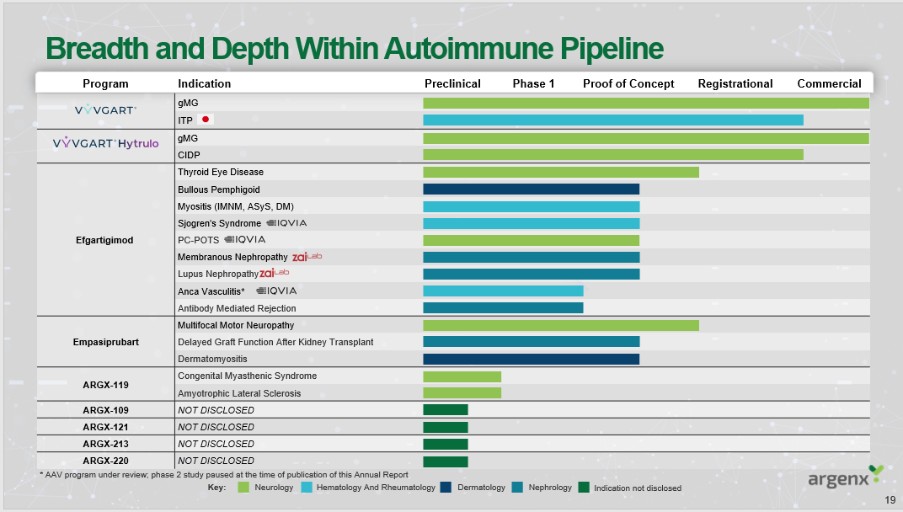
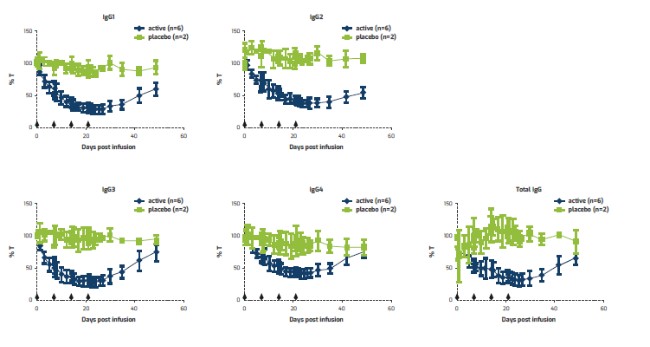
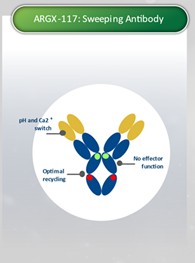
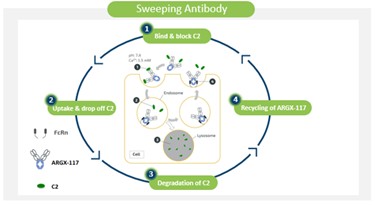
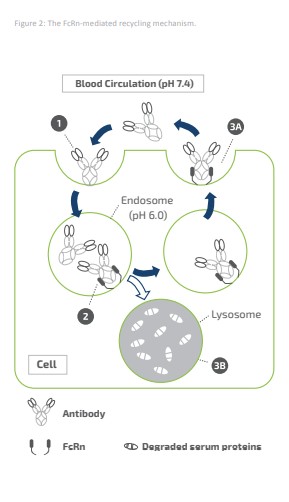
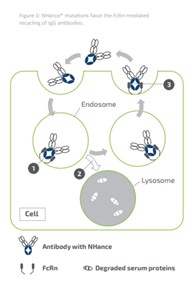
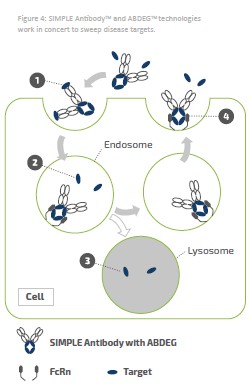
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表20-F
(マーク1)
| |
☐ | 1934年証券取引法第12(B)又は(G)条に基づく登録声明 |
あるいは…。
| |
☒ | 1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで2023年12月31日
あるいは…。
| |
☐ | 1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
中国から日本への過渡期については、日本政府は中国政府を中国政府に転換し、中国政府は中国政府を中国政府に転換した
あるいは…。
| |
☐ | 1934年証券取引法第13条又は15(D)条に基づいて提出された幽霊会社報告 |
事件の日付は参考までに当社に報告書を提出することを要求します
手数料書類番号001-38097
|
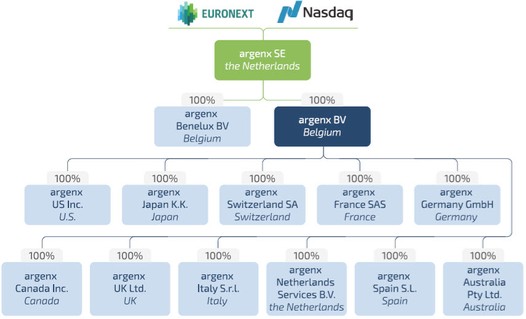
ARGENXとSE |
(登録者の正確な氏名及び登録者名の英文訳) |
♪the the theオランダ |
(登録成立または組織の司法管轄権) |
|
Laarderhoogtweg 25 1110 EB, アムステルダムですVtの..オランダ |
(主にオフィスアドレスを実行) |
|
ティム·ヴァン·ハウウォーメレン
Argenx BV
工業団地ズヴィナルド7号
C号館
9052*ズヴィナルド (ゲント)
ベルギー
+31 (0) 10 70 38 441 メール:TvanHauwermeiren@argenx.com |
(会社の連絡先名、電話、電子メールおよび/またはファックス番号および住所) |
この法第12(B)項に基づいて登録又は登録される証券:
| | |
授業ごとのテーマ: | 商品番号: | 登録されている各取引所の名前: |
アメリカ預託株式は1株当たり普通株に相当し,1株当たり額面0.10ユーロである | ARGX | ナスダック世界ベスト市場 |
1株当たり0.10ユーロの普通株* | | ナスダック世界ベスト市場* |
*取引はできませんが、米国預託株式の登録のみに関連しています。
同法第12(G)項に基づいて登録又は登録される証券:なし。
同法第15(D)項により報告義務を有する証券:なし。
年次報告で述べた期間終了までの発行者が属する各種資本または普通株の流通株数を明記する
2023年12月31日まで
59,194,488普通株は流通株であり、米国預託株式に代表される普通株を含む。
登録者が証券法規則第405条で定義されている有名な経験豊富な発行者であるかどうかをチェックマークで示す。
はい、そうですX番号◻
この報告が年次報告または移行報告である場合、登録者が1934年“証券取引法”第13または15(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示してください。
はい、そうです◻ 違います。 X
再選択マークは、登録者が、(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求された短い期間内)に、1934年の証券取引法第13節または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す。
はい、そうですX番号◻
再選択マークは、登録者が過去12ヶ月以内に(または登録者がそのような文書の提出を要求されたより短い時間以内に)S−T規則405条(本章232.405節)に従って提出されることを要求した各対話データファイルを電子的に提出したかどうかを示す。
はい、そうですX番号◻
登録者が大型加速ファイルサーバ,加速ファイルサーバ,非加速ファイルサーバであるか新興成長型会社であるかをチェックマークで示す.取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“新興成長型会社”の定義を参照されたい。
| | | |
大型加速ファイルサーバ X | 加速ファイルマネージャ◻ | 非加速ファイルマネージャ◻ | 新興成長型企業:☐ |
もしある新興成長型会社が米国公認会計原則に従ってその財務諸表を作成した場合、登録者が延長された過渡期間を使用しないことを選択したかどうかを再選択マークで示す場合、取引法第13(A)節に提供される任意の新しいまたは改正された財務会計基準を遵守する◻
新又は改正財務会計基準とは、財務会計基準委員会が2012年4月5日以降に発表したその会計基準編纂の任意の更新を意味する。
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われるX
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する☐
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す☐
登録者が本文書に含まれる財務諸表を作成する際にどのような会計基盤を使用しているかをチェックマークで示す
アメリカは会計原則を公認している◻ | 国際財務報告基準発行済みの国際会計基準理事会Xが | 他にも◻ |
前の質問に答えたときに“その他”をチェックした場合は、登録者がどの財務諸表項目に従うかをチェックしてください。
プロジェクト17◻プロジェクト18◻
これが年次報告書である場合は、登録者が空殻会社であるか否かをチェックマークで表示してください(取引法第12 B-2条で定義されているように)。
はい、そうです☐第X号
(過去5年間破産手続きに参加した発行者にのみ適用される。)
裁判所が確認した計画に基づいて証券を割り当てた後、登録者が1934年“証券取引法”第12、13又は15(D)節に提出されたすべての書類及び報告を提出したか否かを再選択マークで示す。
はい、そうです☐違います◻