2024年3月20日にアメリカ証券取引委員会に提出された書類によると
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表
1934年証券取引法第12(B)又は(G)条に基づく登録声明 |
あるいは…。
1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで
あるいは…。
1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
あるいは…。
1934年証券取引法第13条又は15(D)条に基づいて提出された幽霊会社報告 |
移行期になります_
手数料書類番号
(登録者の正確な氏名はその定款に記載)
(登録成立または組織の司法管轄権)
電話番号:+44(0)131 357 1111
(主にオフィスアドレスを実行)
電話:+44(0)
メール:info@nucana.com
(会社の連絡先名、電話、電子メールおよび/またはファックス番号および住所)
この法第12条(B)に基づいて登録又は登録される証券:
クラスごとのタイトル |
|
取引コード |
|
登録された各取引所の名称 |
|
|
この法第十二条(G)に基づいて登録又は登録される証券:ありません
同法第15条(D)に基づいて報告義務を有する証券:ありません
年次報告で述べた期間終了までの発行者が属する各種資本または普通株の流通株数を明記する
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください。はい☐
本報告が年次報告又は移行報告である場合は、登録者が1934年“証券取引法”第13又は15(D)節に基づいて報告を提出する必要がないか否かを勾印で示してください。はい☐
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
再選挙マークで登録者が大型加速申請者、加速申請者、非加速申請者か新興成長型会社かを示す。取引法第12 b-2条の規則における“大型加速申請者”、“加速申請者”、“新興成長型会社”の定義を参照されたい。
大型加速ファイルサーバ☐ |
|
ファイルマネージャを加速する☐ |
|
|
|
|
|
|
新興成長型会社 |
もしある新興成長型会社が米国公認会計原則に従ってその財務諸表を作成した場合、登録者が延長された過渡期間を使用しないことを選択したかどうかを再選択マークで示し、取引法第13(A)節によって提供された任意の新しいまたは改正された財務会計基準を遵守する☐
C“新たな又は改訂された財務会計基準”という言葉は、財務会計基準委員会が2012年4月5日以降に発表したその会計基準編纂の任意の更新を意味する。
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す☐
登録者が本文書に含まれる財務諸表を作成する際にどのような会計基盤を使用しているかをチェックマークで示す
アメリカは会計原則を公認している☐ |
|
国際会計基準委員会☒ |
|
他にも☐ |
前の質問に答えたときに“その他”をチェックした場合は、登録者がどの財務諸表項目に従うかをチェックしてください。プロジェクト17☐プロジェクト18☐
これが年次報告書である場合は、登録者が空殻会社であるか否かをチェックマークで示してください(取引法第12 b-2条で定義されているように)。はい☐違います
A
カタログ
|
|
|
ページ |
||
|
|
|
|
||
一般情報 |
四 |
||||
財務やその他のデータの列報 |
四 |
||||
前向き陳述に関する情報 |
四 |
||||
サイト情報開示 |
v |
||||
第1部 |
|
|
1 |
||
第1項。 |
|
役員·上級管理職·コンサルタントの身分 |
1 |
||
第二項です。 |
|
割引統計データと予想スケジュール |
1 |
||
第三項です。 |
|
重要な情報 |
1 |
||
|
A. |
|
選定された財務データ |
1 |
|
|
B. |
|
資本化と負債化 |
2 |
|
|
C. |
|
収益を提供し使用する理由は |
2 |
|
|
D. |
|
リスク要因 |
2 |
|
第四項です。 |
|
会社についての情報 |
59 |
||
|
A. |
|
会社の歴史と発展 |
59 |
|
|
B. |
|
業務.業務 |
59 |
|
|
C. |
|
組織構造 |
100 |
|
|
D. |
|
不動産·工場および設備 |
100 |
|
プロジェクト4 Aです。 |
|
未解決従業員意見 |
100 |
||
五番目です。 |
|
経営と財務回顧と展望 |
101 |
||
|
A. |
|
経営実績 |
101 |
|
|
B. |
|
流動性と資本資源 |
106 |
|
|
C. |
|
研究開発、特許、ライセンスなど。 |
108 |
|
|
D. |
|
トレンド情報 |
108 |
|
|
E. |
|
肝心な会計見積もり |
109 |
|
|
F. |
|
[保留されている] |
109 |
|
|
G. |
|
[保留されている] |
109 |
|
|
H. |
|
非公認会計基準財務指標 |
109 |
|
第六項です。 |
|
役員、上級管理者、従業員 |
110 |
||
|
A. |
|
役員と上級管理職 |
110 |
|
|
B. |
|
補償する |
112 |
|
|
C. |
|
取締役会の慣例 |
121 |
|
|
D. |
|
従業員 |
123 |
|
|
E. |
|
株式所有権 |
123 |
|
|
F. |
|
開示登録者が誤って判決された補償を追及する行動 |
123 |
|
第七項。 |
|
大株主と関係者が取引する |
124 |
||
|
A. |
|
大株主 |
124 |
|
|
B. |
|
関係者取引 |
126 |
|
|
C. |
|
専門家と弁護士の利益 |
127 |
|
第八項です。 |
|
財務情報 |
128 |
||
|
A. |
|
連結報告書およびその他の財務情報 |
128 |
|
|
B. |
|
重大な変化 |
128 |
|
第九項です。 |
|
見積もりと看板 |
128 |
||
|
A. |
|
割引と発売詳細 |
128 |
|
|
B. |
|
配送計画 |
128 |
|
|
C. |
|
市場 |
128 |
|
|
D. |
|
売却株主 |
128 |
|
|
E. |
|
薄めにする |
128 |
|
|
F. |
|
債券発行の支出 |
128 |
|
II
カタログ
(続)
第10項。 |
|
情報を付加する |
128 |
|
|
A. |
|
株本 |
128 |
|
B. |
|
定款の大綱および定款細則を組織する |
128 |
|
C. |
|
材料契約 |
144 |
|
D. |
|
外国為替規制 |
144 |
|
E. |
|
税収 |
144 |
|
F. |
|
配当金と支払代理人 |
152 |
|
G. |
|
専門家の発言 |
152 |
|
H. |
|
展示された書類 |
153 |
|
I. |
|
子会社情報 |
153 |
第十一項。 |
|
市場リスクの定量的·定性的開示について |
153 |
|
第十二項。 |
|
株式証券を除くその他の証券説明 |
154 |
|
|
A. |
|
債務証券 |
154 |
|
B. |
|
株式証明書と権利を認める |
154 |
|
C. |
|
その他の証券 |
154 |
|
D. |
|
アメリカ預託株 |
154 |
第II部 |
|
|
156 |
|
十三項。 |
|
違約、延滞配当金、延滞配当金 |
156 |
|
14項です。 |
|
保証所有者の権利と収益使用の実質的な改正 |
156 |
|
第十五項。 |
|
制御とプログラム |
156 |
|
|
A. |
|
制御とプログラムを開示する |
156 |
|
B. |
|
経営陣財務報告内部統制年次報告書 |
156 |
|
C. |
|
公認会計士事務所認証報告 |
156 |
|
D. |
|
財務報告の内部統制の変化 |
156 |
プロジェクト16 A。 |
|
監査委員会財務専門家 |
156 |
|
プロジェクト16 B。 |
|
道徳的規則 |
157 |
|
プロジェクト16 Cです。 |
|
チーフ会計士費用とサービス |
157 |
|
プロジェクト16 Dです。 |
|
監査委員会の上場基準の免除 |
157 |
|
プロジェクト16 E。 |
|
発行者および関連購入者が株式証券を購入する |
157 |
|
プロジェクト16 Fです。 |
|
登録者の認証会計士を変更する |
157 |
|
プロジェクト16 Gです。 |
|
会社の管理 |
157 |
|
16 H項です。 |
|
炭鉱安全情報開示 |
158 |
|
プロジェクト16 I。 |
|
検査妨害に関する外国司法管区の開示 |
158 |
|
プロジェクト16 Kです。 |
|
ネットワーク·セキュリティ |
158 |
|
第三部 |
|
|
161 |
|
プロジェクト17 |
|
財務諸表 |
161 |
|
プロジェクト18 |
|
財務諸表 |
161 |
|
プロジェクト19 |
|
陳列品 |
162 |
|
三、三、
一般入力編隊
本年度報告Form 20−F(“年次報告”),“NuCana”,“NuCana plc”では,文意に加えて,“グループ”,“会社”,“我々”はNuCana plcとその合併子会社を指す。
NuCanaとAcelarinは私たちの登録商標と製品ですTM私たちの商標です。
フィンタンを紹介する社会保障やその他のデータは
2023年12月31日まで、2022年12月31日、2021年12月31日、2021年12月31日、2021年12月31日、2021年12月31日、2021年12月31日、2021年12月31日、2021年12月31日、2021年12月31日、2021年12月31日、2021年12月31日および2019年12月31日までの総合財務諸表データは、国際会計基準委員会が発表した国際財務報告基準またはIFRSに基づいて作成され、米国上場会社会計監督委員会の基準に基づいて監査される総合財務諸表に由来する。2021年,2020年,2019年12月31日までの財務諸表データおよび2020年と2019年12月31日までの年度の財務諸表データは,我々の総合財務諸表に由来しており,これらの報告書も国際会計基準委員会が発表した国際財務報告基準に基づいて作成されており,本稿では報告していない。
本年度報告では、“$”と言及するのはすべてドルを指し、“GB”と言及するのはすべてポンドを指す。
FOに関する情報RWARD-Look文
本年度報告には見積もりと展望性陳述が含まれており、主に“リスク要因”、“経営と財務回顧と展望”と“業務”というタイトルの部分にある。我々の業務及び財務業績に関するいくつかの検討事項は、改正された1933年の証券法及び改正された1934年の“証券取引法”に基づく前向きな陳述及び推定を含む。“信じる”、“可能”、“そうなる”、“推定する”、“継続する”、“予想する”、“意図する”、“予想する”、および同様の言葉は、前向き陳述および推定を識別することを意図している。前向きな陳述は、以下の態様に関する陳述を含むが、これらに限定されない
これらの展望的陳述は、既知および未知のリスク、不確実性、仮説および他の要因の影響を受けることができ、これらの要因は、私たちの実際の運営結果、財務状況、流動性、業績、見通し、機会、業績または業界結果、およびこれらの前向き陳述で表現または示唆された内容とは大きく異なる可能性がある。実際の結果、財務状況、流動性、業績、見通し、機会、業績、あるいは業界結果が大きく異なる要素は、本年度報告の“リスク要素”の項目で議論された要素を含むが、これらに限定されない。私たちは現在重要ではないと考えているかもしれませんし、私たちが現在知らない他のリスクは、本年度報告で議論された前向きな事件が起こらない可能性もあります。これらの展望的な陳述は、私たちの現在と未来の業務戦略と私たちが予想している未来の運営環境に対する仮定に基づいている。
前向きな陳述および推定は、その日にのみ発表され、私たちは、新しい情報、未来のイベント、または他の要因のために、任意の前向きな陳述または推定を更新または検討する義務がない。展望性陳述と推定はリスクと不確定要素に関連し、未来の業績の保証ではない。私たちの未来の結果はこのような前向きな陳述と推定で表現された結果と大きく違うかもしれない。
四
“信じる”、“可能”、“会する”、“推定する”、“継続する”、“予想する”、“意図する”、“予想する”、および同様の言葉は、推定および前向き陳述を識別することを意図している。推定および展望的陳述は、その日にのみ発表され、私たちは、新しい情報、未来のイベント、または他の要因によって、任意の推定および/または展望的陳述を更新または検討する義務を負わない。上述のリスクと不確定性を考慮して、本年度報告で議論された推定と展望性陳述は発生しない可能性があり、私たちの未来の結果と表現はこれらの展望性陳述に表現されているものと大きく異なる可能性があり、原因は上述の要素を含むがこれらに限定されない。このような不確実性のため、あなたはこのような推定と展望的陳述に基づいてどんな投資決定もしてはいけない。
サイトDISCLOSURE
私たちは公共サイトを維持していますHttp://www.nucana.com報道原稿、アナリストプレゼンテーション、財務情報を補完し、重大な非公開情報を開示する手段として、当社の情報を配信する通常のチャネルとして使用し、FD法規に基づく開示義務を遵守します。私たちのウェブサイトは投資家欄を含み、この欄を通じて、私たちの20-F年間報告書、6-K表報告書を無料で提供し、私たちが電子的にアメリカ証券取引委員会に材料を提出した後、合理的で実行可能な範囲内で取引所法案に基づいて提出または提供された報告書の任意の修正をできるだけ早く提供します。したがって,投資家はニュース原稿,米国証券取引委員会の届出文書,公開電話会議やインターネット放送に注目するほか,我々のサイトにも注目すべきである.
私たちのウェブサイト、プレスリリース、または公開電話会議、ネットワーク放送、またはソーシャルメディア上で提供されるいかなる情報も、本年度報告または米国証券取引委員会に提出された私たちの任意の他の報告または文書の一部とみなされ、このサイトへの任意の言及は、非能動的な文字参照にすぎない。
v
部分 I
プロジェクト1.取締役の身分、高度な管理とコンサルタント
適用されません。
項目2.見積統計予想されたスケジュールと
適用されません。
プロジェクト3.ポイント1情報
次の表は、示した日付と期間までの総合財務データをまとめたものです。2023年12月31日まで、2022年12月31日、2021年12月31日、2021年12月31日、2021年12月31日、2020年12月31日および2019年12月31日までの年度の総合財務データは、国際会計基準委員会が発表した国際財務報告基準に基づいて作成され、米国上場会社会計監督委員会の基準に基づいて監査される総合財務諸表から来ている。
私たちの歴史的結果は必ずしも未来に得られる可能性のある結果を暗示するわけではない。以下で選定した総合財務データは、本年度報告の他の部分に含まれる第5項“経営·財務回顧及び展望”と我々の総合財務諸表と併せて読まなければならない。
|
|
十二月三十一日までの年度 |
|
|||||||||||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
2019 |
|
|||||
|
|
(単位は千、1株当たりのデータは除く) |
|
|||||||||||||||||
連結業務報告書 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
研究開発費 |
|
£ |
(25,062 |
) |
|
£ |
(36,426 |
) |
|
£ |
(36,834 |
) |
|
£ |
(25,899 |
) |
|
£ |
(19,728 |
) |
行政費 |
|
|
(6,063 |
) |
|
|
(7,291 |
) |
|
|
(8,529 |
) |
|
|
(7,050 |
) |
|
|
(5,953 |
) |
無形資産減価準備 |
|
|
(503 |
) |
|
|
(292 |
) |
|
|
(2,809 |
) |
|
|
— |
|
|
|
— |
|
純為替収益 |
|
|
(1,156 |
) |
|
|
4,887 |
|
|
|
267 |
|
|
|
(3,472 |
) |
|
|
(1,019 |
) |
営業損失 |
|
|
(32,784 |
) |
|
|
(39,122 |
) |
|
|
(47,905 |
) |
|
|
(36,421 |
) |
|
|
(26,700 |
) |
財政収入 |
|
|
754 |
|
|
|
669 |
|
|
|
103 |
|
|
|
246 |
|
|
|
1,049 |
|
税引き前損失 |
|
|
(32,030 |
) |
|
|
(38,453 |
) |
|
|
(47,802 |
) |
|
|
(36,175 |
) |
|
|
(25,651 |
) |
所得税控除 |
|
|
4,398 |
|
|
|
6,432 |
|
|
|
7,269 |
|
|
|
5,493 |
|
|
|
4,239 |
|
本年度の赤字 |
|
|
(27,632 |
) |
|
|
(32,021 |
) |
|
|
(40,533 |
) |
|
|
(30,682 |
) |
|
|
(21,412 |
) |
その他の総合(費用)収入: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
その後、損益項目に再分類することができる: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
渉外業務翻訳のコミュニケーションの違い |
|
|
(41 |
) |
|
|
61 |
|
|
|
5 |
|
|
|
(12 |
) |
|
|
(11 |
) |
本年度の総合損失総額 |
|
£ |
(27,673 |
) |
|
£ |
(31,960 |
) |
|
£ |
(40,528 |
) |
|
£ |
(30,694 |
) |
|
£ |
(21,423 |
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
1株当たりの基本損失と赤字 |
|
£ |
(0.53 |
) |
|
£ |
(0.61 |
) |
|
£ |
(0.78 |
) |
|
£ |
(0.81 |
) |
|
£ |
(0.66 |
) |
1
|
|
12月31日まで |
|
|||||||||||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
2019 |
|
|||||
|
|
(単位:千) |
|
|||||||||||||||||
合併報告書 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
現金と現金等価物 |
|
£ |
17,225 |
|
|
£ |
41,912 |
|
|
£ |
60,264 |
|
|
£ |
87,356 |
|
|
£ |
51,962 |
|
総資産 |
|
|
27,811 |
|
|
|
58,254 |
|
|
|
77,474 |
|
|
|
107,792 |
|
|
|
70,268 |
|
株本 |
|
|
2,114 |
|
|
|
2,095 |
|
|
|
2,087 |
|
|
|
2,047 |
|
|
|
1,299 |
|
株式割増 |
|
|
141,306 |
|
|
|
141,108 |
|
|
|
141,050 |
|
|
|
140,890 |
|
|
|
79,541 |
|
赤字を累計する |
|
|
(207,706 |
) |
|
|
(180,573 |
) |
|
|
(149,726 |
) |
|
|
(110,594 |
) |
|
|
(80,055 |
) |
資本積立金(1) |
|
|
42,466 |
|
|
|
42,466 |
|
|
|
42,466 |
|
|
|
42,466 |
|
|
|
42,466 |
|
純資産/権益総額を占めるべき |
|
|
14,887 |
|
|
|
38,502 |
|
|
|
65,548 |
|
|
|
99,230 |
|
|
|
63,522 |
|
総負債 |
|
|
(12,924 |
) |
|
|
(19,752 |
) |
|
|
(11,926 |
) |
|
|
(8,562 |
) |
|
|
(6,746 |
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
株式数 |
|
|
52,860 |
|
|
|
52,373 |
|
|
|
52,180 |
|
|
|
51,175 |
|
|
|
32,479 |
|
B.資本化負債があります
適用されません。
C.退職原因Rと収益の使用
適用されません。
D.リスク要因
私たちの業務には重大な危険がある。閣下は、当社の総合財務諸表及び関連付記を含む、以下のリスク要因及び当社が2023年12月31日までのForm 20−F年次報告(“年報”)及びその後Form 6−Kで提出された報告書に掲載されている他のすべての資料を詳細に考慮すべきである。以下に説明するリスクおよび不確定要因は、私たちが現在知られており、私たちに特定されている重大なリスク要因であり、これらの要因は、私たちの業務、運営結果、および財務状況に関連していると考えられる。これらのリスクのいずれかが現実になれば、我々の業務、運営結果、または財務状況が影響を受ける可能性があり、米国預託株(ADS)の価格が下落する可能性がある。私たちは今知らないか、あるいは私たちが今どうでもいいと思っている他のリスクと不確実性も私たちを傷つけ、私たちの業務、経営結果、財務状況に悪影響を及ぼす可能性がある。
リスク要因の概要
私たちに投資するアメリカ預託証明書は、私たちの業務や業界に関連するリスク、私たちの候補製品開発に関するリスク、私たちのアメリカ預託証明書に関連するリスクを含む多くのリスクに直面します。以下にその中のいくつかのリスクをまとめたが、すべてではない。これらのリスクおよび他のリスクをより全面的に説明するために、私たちの年間報告書とForm 6-Kで提出された後続の報告書で議論されているすべての情報をよく考慮してください。
私たちのビジネスや産業に関するリスクは
2
私たちの候補製品開発に関するリスク
私たちの候補製品の市場承認に関するリスク
私たちの第三者への依存に関するリスク
私たちの候補製品の商業化に関するリスク
3
私たちの知的財産権に関するリスクは
従業員事務に関するリスク、管理成長、および私たちの業務に関するその他のリスク
ADSSに関するリスク
私たちのビジネスや産業に関するリスクは
設立以来、私たちは深刻な運営損失が発生した。私たちは予測可能な未来に損失が出て、永遠に達成されたり利益を維持したりしないかもしれないと予想している。
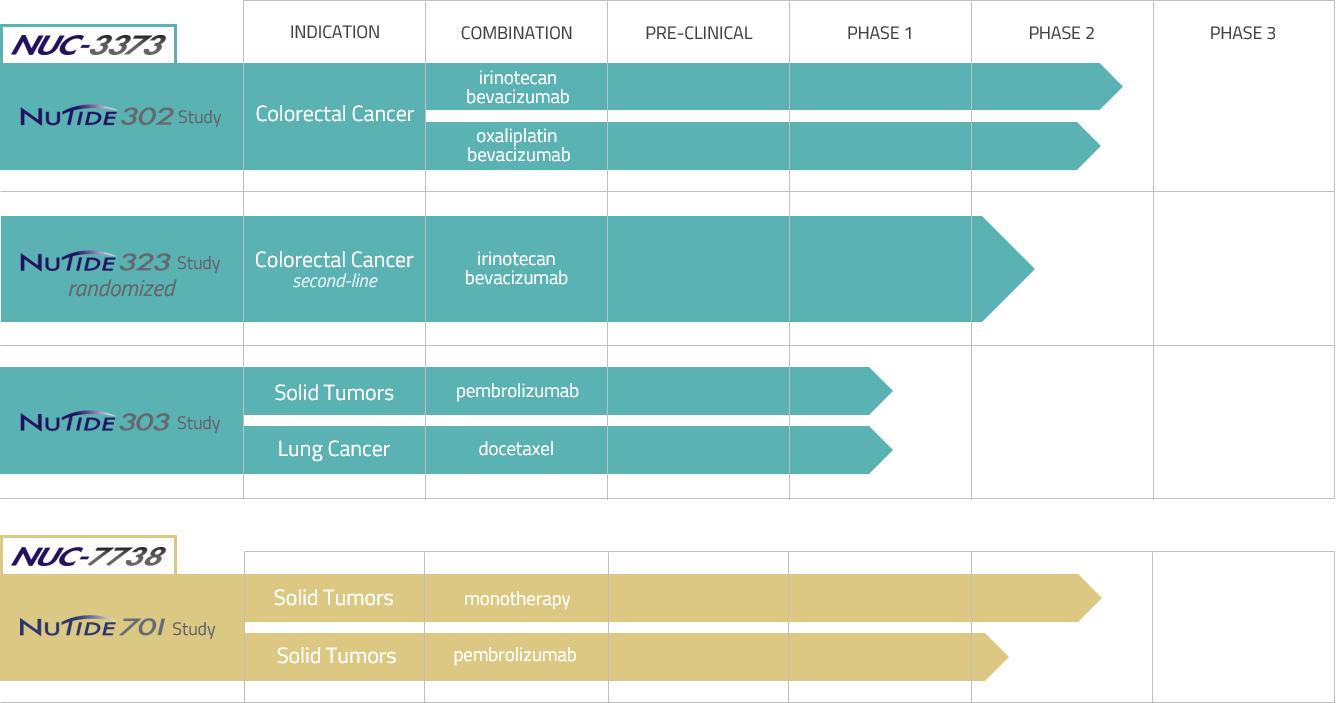
設立以来、私たちは深刻な運営損失が発生した。当社は2019年12月31日までに純損失2,140万GBを記録し、2020年12月31日までに純損失3,070万GBを記録し、2021年12月31日までに純損失4,050万GBを記録し、2022年12月31日までに3,200万GBの純損失を記録し、2023年12月31日までに2,760万GBの赤字を計上した。2023年12月31日現在、累計2.077億GBの赤字を計上しています。著者らの候補製品NUC-3373は現在3つの実施中の臨床試験で評価されている:1 b/2期試験(NuTide:302)と他の薬物と併用して末期結腸直腸癌患者のためのランダムな第2期臨床試験;NUC-3373(NuTide:323)と承認された抗癌薬は亜葉酸カルシウム、イリノテカンとベバシズマブを併用して末期結腸直腸癌患者の二線治療のためのランダムな第2期臨床試験;および1 b/2期臨床試験(NuTide:303)とPD-1阻害剤ペクロニブとの併用による末期結腸直腸癌患者の治療
4
末期固形腫瘍、ドセタキセルと併用して肺癌を治療した。我々の候補製品NUC−7738は現在,末期固形腫瘍患者に対する1/2期臨床試験(NuTide:701)の第2段階部分にあり,NUC−7738は単一療法としてのNUC−7738とペブロリズマブとの併用治療の効果を評価している。数年かかるかもしれませんが、あれば、商業化された候補製品を準備することができます。これまで、私たちは主に私たちの株式証券を公開し、個人的に販売することで、私たちの運営に資金を提供してきました。私たちは予測可能な未来に巨額の費用と運営損失が続くと予想している。私たちの純損失は四半期ごとに大きく変動するかもしれません。私たちの費用は大幅に増加すると予想されています
しかも、私たちの知的財産権を保護することは、私たちの特許を強制的に執行または保護するための訴訟につながるかもしれない。知的財産権訴訟は高価であり、もし私たちがこのような訴訟に負けたら、私たちは相手の法的費用を支払う必要があるかもしれないなど、追加の重大な法的費用の影響を受ける可能性がある。
新薬開発に関連する多くのリスクや不確実性のため,将来の損失の程度やいつ利益を達成するかは予測できない(あれば)。さらに、食品·薬物管理局、FDA、欧州医薬品局、欧州医薬品局または他の外国規制機関が、現在予想されている基礎の上で研究および臨床試験を行うことを要求する場合、または計画中の臨床試験または任意のProTideの開発に遅延が生じた場合、私たちの費用は予想を超える可能性がある。
利益を実現し、維持するためには、巨大な市場潜在力を持つ製品を開発し、最終的に商業化しなければならない。これは私たちが一連の挑戦的な活動で成功することを要求します
私たちはこのような活動で決して成功しないかもしれないし、たとえ私たちが成功しても、利益を達成するのに十分な収入や十分な収入が生まれないかもしれない。もし私たちが利益を達成すれば、維持したり向上させることができないかもしれない
5
季節ごとか年ごとに計算します。私たちが達成できず、利益を維持することは、会社の価値を低下させ、私たちの資金調達、私たちの発見と臨床前開発努力を維持し、私たちの業務を拡大し、あるいは私たちの運営を継続する能力を損なう可能性があり、追加の資本を集める必要があるかもしれません。これはあなたの所有権利益を希釈するかもしれません。会社の価値の低下はまたあなたの投資損失の全部または一部を招く可能性があります。
私たちは私たちの候補製品NUC-3373とNUC-7738の成功に大きく依存している。私たちはこれらの候補製品が規制部門のどんな適応も承認されることを保証することはできない。これはそれらが商業化できる前に必要だ。もし私たちおよび私たちがこれらの候補製品の開発および商業化協定を締結する可能性のあるいかなるパートナーもそれを商業化できない、あるいは商業化を実現する上で大きな遅延があれば、私たちの創造能力と私たちの財務状況は不利な影響を受けるだろう。
私たちは現在どんな製品の販売からも何の収入も得ていません。私たちは永遠に適切な製品を開発したり商業化することができないかもしれません。我々はこれまで,NUC−3373とNUC−7738,Acelarinの開発にほとんどの精力と財力を投入してきたため,2022年3月にNuTide:121臨床試験を中止した。私たちが製品収入を作る能力は、少なくとも今後数年以内には起こらないと予想され、もしあれば、これらの候補製品の成功開発と最終商業化に大きく依存し、承認されれば、これは決して起こらないかもしれない。NUC-3373およびNUC-7738の各々は、追加の臨床開発、臨床前および製造活動の管理、複数の司法管轄区域の規制承認、製造供給の調達、商業化、大量の追加投資、および重大なマーケティング作業を必要とし、その後、製品販売から任意の収入を生成することができる。FDA、EMA、または同様の外国規制機関の規制承認を得る前に、私たちは、米国、ヨーロッパ、または他の国/地域でどんな候補製品をマーケティングまたは普及させることも許可されておらず、私たちはNUC-3373、NUC-7738、または任意の未来の候補製品の規制承認を決して得ないかもしれない。私たちの任意の候補製品について、私たちは新薬申請またはNDAをFDAに提出していないし、EMAにマーケティング許可申請またはMAAを提出していないか、または他の規制機関に同様の申請を提出しておらず、予測可能な未来にそうすることも望んでいない。私たちの候補製品の成功は以下の要素を含む多くの要素に依存するだろう
6
NUC−3373およびNUC−7738の各々について、我々または我々の供給者が、これらの要因のうちの1つまたは複数をタイムリーまたは根本的に克服できない場合、私たちは、重大な遅延に遭遇するか、または候補製品の商業化に成功することができない可能性がある。
NUC-3373またはNUC-7738または任意の将来の候補製品が臨床試験で成功するか、または規制部門の承認を得ることは決定できない。さらに、NUC−3373またはNUC−7738または任意の将来の候補製品は、臨床試験で成功しても、規制部門の承認が得られない可能性がある。もし私たちがNUC-3373またはNUC-7738または任意の未来の候補製品の規制承認を受けていない場合、私たちは運営を継続できないかもしれない。NUC-3373またはNUC-7738または任意の将来の候補製品の製造および販売の規制承認を得ることに成功したとしても、私たちの収入は、私たちが規制承認を得て商業権を持つ地域の市場規模にある程度依存するだろう。もし私たちが対象としている患者集団の市場が私たちが予想しているほど重要でなければ、承認されれば、このような製品の販売から大量の収入を得ることはできないかもしれない。
我々は,NUC−3373とNUC−7738を米国とEUで商業化し,より多くの国で商業化する可能性がある規制部門の承認を求める予定である。多くの国の規制承認範囲は似ているが、複数の国で単独の規制承認を得るためには、安全性と有効性、NUC-3373とNUC-7738の管理に関するこれらの国の臨床試験、商業販売、定価、流通などの多くのかつ異なる規制要求を遵守する必要があり、これらの管轄区域で成功するかどうかを予測することはできない。
研究された製品は、深刻または生命に危険な疾患の治療における安全性および有効性、および既存の治療方法よりも意義のある治療効果を提供する製品は、FDAの加速承認を得る可能性があり、十分かつ制御された臨床試験によって承認される可能性があり、これらの試験は、代替終点に対する医薬製品の影響が臨床的利益を合理的に予測することができるか、または中間臨床終点への影響を不可逆的な発症率または死亡率への影響よりも早く測定することができることを証明している。FDAとの承認加速の可能性に関する議論は、適切な代替品または中間臨床終点などを決定するために、新薬または生物製品開発の早期に開始されるのが一般的である。
7
しかしながら、私たちが生成した臨床データが、任意の候補製品のための加速的な承認を求めるNDA提出をサポートするのに十分であっても、このようなマーケティング申請がFDAによって実質的な審査を受けるか、またはタイムリーに承認されるかどうか、または全く保証されないことは保証されない。また、他の会社がFDAの完全承認を得た場合、私たちの候補製品と類似した適応を治療するための製品を販売することができ、承認を加速させて承認を得る能力が実質的に悪影響を受ける可能性がある。FDAまたは外国規制機関は、私たちの申請または任意のタイプの上場を考慮する前に、さらなる研究または試験を行うことを要求することもできる。私たちはFDAの要求をすぐに満たすことができないかもしれないが、これは遅延を招くかもしれないし、FDAが私たちが提出した材料が不完全だと思って承認されないかもしれない。もし私たちの候補製品が加速的な承認を得られなければ、承認されて商業化される時間が長くなり、このような候補製品の開発コストが増加し、市場での競争地位を損なう可能性がある。
私たちの他の候補製品がFDAの加速承認を得ても、私たちはこの製品の臨床的利益を証明する臨床データの提出を含む厳格な発売後の要求を受けるだろう。承認セキュリティ協定の下で販売される医薬品も、すべての宣伝材料が配布前に少なくとも30日前にFDAに提出されなければならないという要件を遵守しなければならない。FDAは様々な理由で承認の撤回を求めることができ、もし私たちが必要な職務調査を行っていない場合の上場後の研究、発売後の研究がこの製品の臨床的利益を検証できなかった場合、他の証拠はこの製品が使用条件下で安全でないことを示しているか、あるいはFDAに虚偽と誤解性が発見された宣伝材料を伝播することを含む。
私たちには承認された製品は何もありません。これは私たちの業務のこれまでの成功度を評価することを難しくし、私たちの将来の生存能力を評価することも困難になるかもしれません。
生物製薬薬物開発は投機性の強い仕事であり、大きなリスクに関連している。これまで,我々の業務は組織と我々を備えた会社,業務計画,資金調達,我々の技術の開発,潜在的な候補製品の決定,臨床前研究および候補製品の臨床試験に限られてきた。私たちは看護標準と比較した大規模、ランダム、肝心な臨床試験を成功させ、市場の許可を得て、商業規模の製品を製造したり、第三者代表が私たちを手配したり、成功した製品の商業化に必要な販売とマーケティング活動を行う能力があることを証明していません。通常,1つの新薬が発見されてから患者の治療に利用できるまでに数年を要する。また、私たちは予見できない費用、困難、合併症、遅延などの既知と未知の要素に直面する可能性がある。私たちは研究開発に専念する会社からビジネス活動を支援する能力のある会社に移行する必要がある。そのような移行で、私たちは成功しないかもしれない。
私たちは受け入れ可能な条件で私たちに提供できないか、または全く提供できないかもしれない大量の追加資金が必要になるだろう。もし私たちが追加融資を受けることができなければ、私たちは候補製品の開発と商業化を達成できないかもしれないし、私たちの開発計画を続けることもできないかもしれない。
医薬業界の発展は資本集約型である。私たちが行っている活動に伴い、私たちの費用は増加すると予想しています。特に私たちの候補製品に対してより大規模な臨床試験を行い、マーケティングの承認を求める時。また、いずれかの候補製品が市場承認されれば、製品販売、マーケティング、製造、流通に関連した巨額の商業化費用が発生すると予想される。もし私たちが私たちの候補製品のためにより多くの兆候や地理的位置を求めることを選択したり、他の方法で私たちが現在予想しているよりも早く拡張するならば、私たちはまたもっと早く追加資金を調達する必要があるかもしれない。また、上場企業として、運営に関連したコストを発生させていきます。したがって、私たちは私たちの持続的な業務と関連した多くの追加資金を得る必要があるだろう。
2023年12月31日現在、私たちは1720万GBの現金と現金等価物を持っている。私たちの現在の運営計画によると、私たちの手元の現金と現金等価物は、私たちが予想している少なくとも今後12ヶ月の運営に資金を提供するのに十分ではないと信じている。私たちの将来の資本需要と私たちは既存の資源が私たちの運営を支援する期限が私たちが予想しているのとは大きく違うかもしれないと予想しています。私たちの毎月の支出レベルは新しいものと行っている研究開発や他社の活動によって違います。我々の候補製品の成功した研究や開発に関連する時間や活動の長さは非常に不確定であるため、開発および任意の承認されたマーケティングおよび商業化活動のためにどれだけの実際の資金が必要かを推定することはできない。さらに、私たちの将来の資本需要は多くの要素に依存し、多くの要素によって大幅に増加する可能性がある
8
臨床前研究と臨床試験を行うことは時間がかかり、高価と不確定な過程であり、完成するのに数年かかるかもしれず、しかも著者らは永遠に発売許可を得て製品販売を実現するために必要なデータ或いは結果を生成できないかもしれない。しかも、私たちの候補製品が承認されれば、商業的成功を得られないかもしれない。私たちの商業収入は、もしあれば、数年以内に商業販売できないかもしれない製品を販売することから来ます。したがって、私たちは追加的な資金調達に依存して私たちの業務目標を達成し続ける必要があるだろう。
いかなる追加的な拠出努力も、私たちの経営陣の日常活動に対する関心を移すかもしれません。これは、私たちの候補製品を開発し、商業化する能力に悪影響を及ぼすかもしれません。金融市場の変動は通常、株式や債務融資を得ることを難しくし、資金調達需要を満たす能力を損なう可能性がある。私たちは未来の融資が十分な金額または私たちが受け入れられる条項で提供されることを保証できない。
もし私たちがタイムリーに資金を得ることができなければ、私たちは私たちの1つ以上の研究開発計画や任意の候補製品の商業化を大幅に削減、延期、または停止することを要求されるかもしれないし、私たちの業務を拡大したり、他の方法で私たちのビジネスチャンスを利用することができないかもしれない。
私たちはいくつかの条件や事件を決定しており、これらの状況や事件は、私たちが継続的に経営している企業として経営を継続する能力に大きな疑いを抱かせ、将来の融資を受ける能力を阻害する可能性がある。
医薬業界の発展は資本集約型である。当社の経営には2023年12月31日までに経常赤字が発生し、累計損失は2.077億GB、経営活動に用いられるキャッシュフローは2640万GBに達している。2023年12月31日現在、私たちは1720万GBの現金と現金等価物を持っている。私たちが行っている活動に伴い、私たちの中長期費用は増加すると予想されています。特に私たちの候補製品に対してより大規模な臨床試験を行い、マーケティング承認を求めれば。また、いずれかの候補製品が市場承認されれば、製品販売、マーケティング、製造、流通に関連した巨額の商業化費用が発生すると予想される。また、上場企業として、運営に関連したコストを発生させていきます。したがって、私たちは私たちの持続的な業務と関連した多くの追加資金を得る必要があるだろう。また、私たちは私たちの現金滑走路の推定に基づいて、私たちの将来の費用とコストに対する期待を含むが、私たちはイギリスで研究開発税の免除を受ける資格があると仮定しています。このような仮定が正しいという保証はないので、私たちは現在予想されているよりも早く利用可能な資本資源を使用するかもしれない。これらの資金需要と関連リスクおよび手元の現在の現金残高により、継続経営中に現金残高が枯渇する前に十分な追加資本を調達する能力に不確実性があり、持続的な経営評価期間で発生する。これらの事件や状況は、私たちが経営を続ける能力に大きな疑いを抱かせるため、私たちの資産を現金化し、私たちの債務を返済することができないかもしれない
9
正常な業務の過程で。もし私たちがタイムリーに資金を得ることができなければ、私たちは私たちの1つ以上の研究開発計画や任意の候補製品の商業化を大幅に削減、延期、または停止することを要求されるかもしれないし、私たちの業務を拡大したり、他の方法で私たちのビジネスチャンスを利用することができないかもしれない。もし私たちが私たちの候補製品を開発して商業化するために、より多くの兆候や地域を求めることを選択したり、他の方法で私たちが今予想しているよりも早く拡張することを選択すれば、私たちはまた追加の資金を調達する必要があるかもしれない。
以上のような状況を受けて、財務諸表の付記に開示されており、継続経営期間中に追加資本を調達する能力には不確実性があり、我々の独立公認会計士事務所は、企業を継続的に経営する能力として大きな疑問があると結論したと結論している。これらの条項を組み込むことは、私たちの証券の取引価格にマイナス影響を与える可能性があり、私たちと業務往来のある第三者(私たちの顧客、サプライヤー、従業員を含む)との関係に悪影響を与え、必要な追加株式や債務融資を調達することを困難にする可能性があり、これらはすべて私たちの業務、運営結果、財務状況、見通しに実質的な悪影響を与える可能性があります。
追加資本の調達は私たちの株主に希釈し、私たちの運営を制限したり、私たちの技術や候補製品に対する権利を放棄することを要求するかもしれません。
これまで、相当な製品収入を生み出すことができれば、株式と債務融資を組み合わせた方法で現金需要に融資する予定です。追加的な株式または転換可能な債務証券の売却は私たちのすべての株主の権利を希釈するだろう。債務の発生は固定支払義務の増加を招く可能性があり、私たちは、私たちが追加債務を発生させる能力の制限、私たちが知的財産権を得ることができるかもしれない能力の制限、配当発表の制限、および私たちの業務を展開する能力に悪影響を及ぼす可能性のある他の運営制限のようないくつかの限定的な条約に同意する必要があるかもしれない。さらに、任意の融資条項は、私たちの株主の持株または権利に悪影響を及ぼす可能性があり、私たちが発行した追加証券(株式または債務にかかわらず)、またはそのような発行の可能性は、私たちの米国預託証明書の市場価格の下落を招く可能性がある。
私たちは協力、戦略連合、または第三者との許可手配を通じて資金を求めることを決定することができ、私たちはもっと早い段階でそうすることを要求されるかもしれない。そうでなければ望ましい。このような協力、戦略同盟、または許可手配のいずれにおいても、私たちは、私たちの知的財産権、将来の収入源、研究計画、または候補製品に対する貴重な権利を放棄することを要求されるかもしれません。私たちは、私たちが自分で開発およびマーケティングしたい候補製品を開発およびマーケティングする権利を付与するか、または他の方法で私たちに不利な条項に同意することができます。
もしアメリカ食品と薬物管理局、アメリカ証券取引委員会と他の政府機関の資金が不足していれば、これらの機関が重要な指導部と他の人員を採用し、維持する能力を阻害し、新製品とサービスの適時な開発或いは商業化を阻止し、あるいは他の方法でこれらの機関が私たちの業務運営に依存する可能性のある正常な業務機能を履行することを阻止し、それによって私たちの業務に負の影響を与える可能性がある。
FDAが新製品を審査·承認する能力は、政府予算と資金レベル、肝心な人員の雇用と維持及びユーザー費用の支払いを受ける能力、及び法律、法規と政策の変化を含む様々な要素の影響を受ける可能性がある。したがって、その機関の平均検討時間は近年変動している。また、政府が米国証券取引委員会や我々の業務に依存する可能性のある他の政府機関に提供する資金は、研究開発活動に資金を提供する機関を含め、政治プロセスの影響を受けており、政治プロセス自体が不安定で予測不可能である。
FDAや他の機関の中断も、新薬が必要な政府機関によって審査および/または承認されるのに要する時間を遅らせる可能性があり、これは私たちの業務に悪影響を及ぼすだろう。例えば、ここ数年間、米国政府は何度か閉鎖されており、食品·薬物管理局や米国証券取引委員会などのいくつかの規制機関は、食品·薬物管理局、米国証券取引委員会、および他の政府従業員を休暇させ、重要な活動を停止しなければならない。また、公衆衛生突発事件は機関の正常な仕事の停止や減速を招き、機関が審査を完了したり、最終承認や他の行政決定を下すのに要する時間を増加させる可能性がある。政府が長期的に停止したり減速したりすれば、FDAが提出した規制文書をタイムリーに審査して処理する能力に深刻な影響を与える可能性があり、これは私たちの業務に実質的な悪影響を及ぼす可能性がある。また、当社の上場企業としての運営では、将来的に政府の閉鎖が公開市場に参入し、必要な資本を得る能力に影響を与える可能性があり、適切な資本化と運営を継続することができます。
10
私たちは純営業損失と税収控除といくつかの固有損失を使用して、将来の納税を減らしたり、有利なイギリス税法から利益を得ることができないかもしれません。
イギリスに住んでいる会社として、私たちはイギリスの会社税を払わなければならない。設立以来、私たちはずっと赤字をしてきた。2023年12月31日まで、私たちは累計繰越税金損失9850万GBを損失しました。任意の関連制限の規定の下で、会社収入損失制限および会社資本損失制限を含め、基本的に繰り越しに利用可能な赤字金額はグループ利益の50%または各課税年度に発生する5百万GBを超える収益に制限され、これらは将来の営業利益を繰り越して相殺することができると予想される。
広範な研究·開発活動を展開している会社として、私たちはイギリスの中小企業に対する研究と開発税収免除制度の恩恵を受けており、この制度によると、2023年4月1日から2024年3月31日までの間に発生した支出に対して、私たちの合格した研究と開発活動による貿易損失を支払うことができ、最高18.6%の支払うべき税金控除を得ることができる(あるいはその間に研究開発集約型会社の標準を満たす場合、最高26.97%に達する)。2023年12月31日までの会計年度における条件に適合した研究開発支出額および本年度の条件に適合した研究開発支出額の予想によると、2023年までに研究開発集約型企業になる資格があると考えられる。我々の合格支出には,主に研究者の雇用コスト,消耗品,研究項目の一部として発生する下請けコストがある。研究開発集約型会社に対して、2023年4月1日から2024年3月31日までの間に発生した支出について、ある下請けの合格研究支出は17.53%に達する現金リベートを得る資格がある。著者らの大部分のパイプライン研究、臨床試験管理と製造開発活動は現在これらの税収控除現金還付申請の条件に符合している。2021年4月1日以降に開始される会計期間については、20,000 GBを超えるクレジットクレームに上限があり、会社の総報酬(PAYE)と国民保険支払い(NIC)負債の約3倍を指す。免除が適用されない限り、これは私たちが申請できる信用対策金額を制限するかもしれない。また、研究開発税控除を受ける資格があるためには、ある会社は申請時に継続的に経営している会社でなければならない。もしある会社が最近発表した勘定が持続的な経営に基づいて作成された場合、HMRCは同社が持続的に経営していると考えているが、勘定には研究開発減免または税収控除を受けるかどうかにかかっている形跡はない。我々は、最近の会計期間または将来の会計期間において、研究開発税控除を受ける資格があるか、または引き続き研究開発税控除を受ける資格があることを保証することはできない。2024年4月1日以降に開始される会計期間については、英国の既存の研究開発税制は、既存の研究開発支出控除(RDEC)計画のような新税制に置き換えられ、上記中小企業計画の適用を停止する。新たな制度のほか、研究開発集約型赤字中小企業のために独立した制度を設立する。私たちはまだこれらの制度の条項と、これらの制度を享受する資格があるかどうかを検討していますが、それらの適用は、将来の会計期間中に発生するコスト申請研究や開発税減免に影響を与える可能性があります。
私たちは将来、いくつかの特許製品収入からの利益を10%の実際の税率で課税することを可能にするイギリスの“特許箱”制度に恩恵を受けるかもしれない。私たちの製品は多くの異なる特許を持っているので、将来の前払い、マイルストーン費用、製品収入と特許使用料はこの優遇された低税率で課税されるかもしれません。私たちの研究開発支出が強化された減免と組み合わせた場合、長期的に低い会社税率が適用されることが予想されます。しかし、イギリスの研究開発税収控除制度の変化(上記で概説したイギリスの研究開発税収制度改革の結果であっても、その他の理由でも)、あるいは“特許箱”制度に予期せぬ不利な変化が生じたため、あるいは何らかの理由で、このような優遇された税収立法を得ることができない、あるいは純運営損失と税収控除の繰越、およびいくつかの内在的な損失を利用して将来の納税を減少させることができない場合、私たちの業務、運営結果、および財務状況は悪影響を受ける可能性がある。
税務機関はいくつかの税収に対する私たちの立場と結論に同意しないかもしれないし、独断的または予見できない方法で既存の規則を適用する可能性があり、意外なコスト、税収、あるいは予想される収益を達成できない可能性がある。
税務機関は私たちが取った税金の立場に同意しないかもしれないが、これは税金負担の増加を招くかもしれない。例えば、イギリスの税務税関総署、米国国税局、または他の税務機関は、当社の会社間手配と譲渡定価政策(開発された技術と私たちの知的財産権開発に関する金額を評価する評価方法を含む)に基づいて、税務管轄権による収入分配および関連会社間の支払い金額に疑問を提起する可能性がある。同様に、税務当局は、私たちが課税関係が確立されていないと考えている司法管轄区域で納税し、国際税務条約によると、このような関連は一般に“常設機関”と呼ばれ、成功すれば、この断言が1つ以上の司法管轄区での予想納税義務を増加させる可能性があると断言することができる。
11
税務機関は、私たちが重大な所得税債務、利息、罰金を支払う立場を取ることができ、例えば、比較的新しい、広範な審査や解釈されていない相互矛盾した法律法規に技術的に違反している場合、このような評価に異議を唱える可能性があると予想される。このような評価に異議を唱えるには長い時間とコストがかかる可能性があり,評価に異議を唱えることが成功しなければ,その影響は適用された場合に予想される実際の税率を上げる可能性がある.
私たちが事業を展開している国では、税制の変化や不確実性が私たちの財務状況や経営結果に大きな悪影響を与え、株主の純利益を減少させる可能性があります。
将来どのような税制改革が提案され、実施されるか、またはこれらの変化が私たちの業務にどのような影響を与えるかは予測できませんが、これらの変化は、私たちの経営管轄区または私たちの販売製品の将来の税金立法、法規、政策、または実践に組み込まれていれば、私たちがこれまで支出し、貸借対照表で支払いまたは計算すべき推定納税義務を増加させ、他の方法で私たちの財務状況、将来の経営業績、特定の時期のキャッシュフロー、および製品を経営または販売する可能性のある国の将来の全体的または有効な税率に影響を与えるかもしれません。私たちの株主の税引後リターンを減らし、税務コンプライアンスの複雑さ、負担、コストを増加させる。
私たちの業務は国際業務に関連する経済、政治、規制、その他のリスクの影響を受ける可能性がある。
イギリスに本社を置く会社として、私たちの業務は国際業務の展開に関連するリスクを受けています。私たちの多くのサプライヤーと協力と臨床試験関係はアメリカ以外に位置している。したがって、私たちの将来の業績は様々な要素の影響を受けるかもしれない
12
私たちはインフレの影響を受けるかもしれない。
インフレは私たちの全体的なコスト構造を増加させ、私たちの流動性、業務、財務状況、そして運営結果に悪影響を及ぼすかもしれない。経済におけるインフレの存在は、より高い金利と資本コスト、輸送コスト、供給不足、労働力コストの増加、為替レートの疲弊、その他の類似の影響を招き続ける可能性がある。インフレのせいで、私たちはコスト上昇を経験し続けるかもしれない。インフレの影響を緩和する措置をとる可能性がありますが、これらの措置が奏効しなければ、私たちの業務、財務状況、経営業績、流動性は実質的な悪影響を受ける可能性があります。これらの措置が有効であっても,これらの有益な行動がいつ我々の運営結果に影響を与えるか,あるいはいつコスト膨張が発生するかが異なる可能性がある.
金融サービス業の不利な事態の発展に影響を与え、例えば流動資金、金融機関又は取引相手の違約又は不履行に係る実際の事件又は懸念は、我々が現在及び予想している業務運営及びその財務状況及び運営結果に悪影響を及ぼす可能性がある。
流動性が限られている、契約違反、業績が悪い、または金融サービス業または金融サービス業の他の不利な発展に影響を与える実際の事件、または任意のこのような事件または他の類似のリスクに対する懸念または噂は、過去および未来に市場全体の流動性問題を引き起こす可能性がある。例えば、2023年3月10日、シリコンバレー銀行(SVB)はカリフォルニア州金融保護·革新部によって閉鎖され、後者は連邦預金保険会社(FDIC)を担当者に指定した。同様に,2023年3月12日,Signature BankとSilvergate Capital Corp.はそれぞれ破産管理プログラムに巻き込まれた.財務省、FRB、およびFDICが2023年3月12日に発表した声明によると、SVBのすべての預金者は、無保険預金口座内の資金、信用プロトコル下の借り手、SVB、Signature BankまたはFDICが接収した任意の他の金融機関の信用状およびいくつかの他の金融商品を含むすべての資金を抽出することができる。英国では、2023年3月13日、イングランド銀行(BoE)が、英国中央銀行が慎重監督局(PRA)、英国財務省(HMT)、金融市場行動監視局(FCA)と協議した後、(2009年銀行法で規定された倒産寸前銀行の安定決議権力を利用して)SVBの英国付属会社シリコンバレー銀行英国有限公司(SVBUK)をHSBC英国銀行(HSBC UK Bank Plc)に売却することを決定したプレスリリースを発表した。プレスリリースによると、イギリス中央銀行とHMTは、この取引の結果として、預金者がSVBUKで彼らのすべての資金を抽出できることを確認した。しかし、私たちの他のツールの取引相手、例えば保険のない預金口座、信用協定、信用状、およびいくつかの他の金融商品が接収された場合、私たちはこれらの資金を得ることができないかもしれない。また、吾等と業務往来のあるいずれか一方が当該等のツールや当該等の金融機関との貸借手配に基づいて資金を取得できない場合には、当該等の当事者が吾等に債務を支払ったり、新たなビジネス手配を締結して吾等に追加金を支払うことを要求する能力が悪影響を受ける可能性がある。この点で、SVB信用協定や手配された取引相手、および信用証受益者(など)のような第三者は、SVB閉鎖の直接的な影響を受ける可能性があり、より広範な金融サービス業の流動性懸念の不確実性を受ける可能性がある。同様の影響は、例えば2008-2010年の金融危機の間に過去にも発生したことがある。
インフレと金利の急速な上昇は、以前に発行された金利が現在の市場金利よりも低い国債の取引価値を低下させる。米国財務省、連邦預金保険会社、連邦準備委員会は、金融機関が保有するいくつかのこのような政府証券を担保とした金融機関に250億ドルまでの融資を提供し、このようなツールの売却による潜在的損失のリスクを低減する計画を発表しているが、金融機関の顧客引き出しや他の流動性需要に対する広範な需要は、この計画の能力を超える可能性がある。米国財務省、FDIC、連邦準備委員会が将来他の銀行や金融機関が倒産した場合に未保険資金を提供する保証はなく、適時にそうする保証もない。
私たちの銀行関係が必要または適切であることを評価しているにもかかわらず、私たちが現在および予想されている将来の業務運営に資金または資本化を提供するのに十分な資金源および他の信用手配を得た金額は、私たちと直接手配された金融機関または金融サービス業全体または経済全体に影響を与える深刻な損害を受ける可能性がある。他にも、これらの要因には、流動性の緊張または失敗、様々な金融、信用または流動資金協定または手配された義務を履行する能力、金融サービス業または金融市場の中断または不安定、または金融サービス業会社の将来性に対する懸念または否定的な予想が含まれる可能性がある。これらの要素は
13
我々と金融や業務関係にある金融機関や金融サービス業界会社を含むが、金融市場や金融サービス業界に関連する一般的な要因も含まれている可能性がある。
1つまたは複数のこれらの要因に関連するイベントまたは懸念の結果には、現在および予想されているビジネス運営、ならびに私たちの財務状況および運営結果に生じる様々な重大かつ悪影響が含まれている可能性がある。これらは、以下を含むことができるが、これらに限定されない
さらに、米国、イギリス、または国際金融システムに対する投資家の懸念は、より高い金利またはコスト、より厳しい財務および運営契約、または信用および流動性源を得るための体系的な制限を含む、あまり有利ではない商業融資条項を招く可能性があり、それにより、私たちがより受け入れられない条項や根本的に受け入れられない条件で融資を受けることができる。他のリスクに加えて、利用可能な資金または現金および流動資金源の減少は、運営費用、財務義務、または他の義務を履行する能力に悪影響を及ぼす可能性があり、私たちの財務および/または契約義務に違反したり、連邦または州賃金および労働時間法違反を招いたりする可能性がある。上記のいずれかの影響、または上記の要因または他の関連または同様の要因に起因する任意の他の影響は、我々の流動資金、私たちの現在および/または予想される業務運営、ならびに財務状態および運営結果に重大な悪影響を及ぼす可能性がある。
また、マクロ経済や金融サービス業のいずれのさらなる悪化も、私たちと業務を展開している当事者との損失や違約を招く可能性があり、さらに、現在および/または予想される業務運営および運営結果および財務状況に重大な悪影響を及ぼす可能性がある。例えば、私たちと業務を展開している側は、満期時に支払うことができず、私たちと合意した合意に基づいて違約し、破産したり、破産を宣言したりする可能性があります。私たちのいかなる取引相手のいかなる破産や資本も債務不履行、または満期時に支払うことができなかったり、いかなる重大な関係を失っても、私たちの重大な損失を招き、私たちの業務に重大な悪影響を及ぼす可能性がある。
未来の大流行或いは公衆衛生危機は著者らの臨床前研究と臨床試験を含む著者らの業務に不利な影響を与える可能性がある。
大流行や流行のような公衆衛生危機は私たちの業務に悪影響を及ぼすかもしれない。私たちは、第三者メーカー、流通業者、情報技術およびソフトウェアサービス提供者、法律および会計会社、CROおよびコンサルタントに依存しており、彼らは大流行に関連した制御を受けているか、または制御されている可能性がある。流行病は影響を受けた地域に位置する第三者CROの従業員にも影響する可能性があり,これらの機関に依存して臨床試験を行っている。これらの第三者が必要なサービスをタイムリーに提供できなければ、交換や解決策を成功的に実施することができず、私たちの業務、運営結果、財務状況が損なわれる可能性があります。未来の潜在的な大流行のため、私たちは将来私たちの業務、臨床前研究と臨床試験に深刻な影響を与える可能性のある中断に遭遇する可能性があります
14
これらの要素とその他の要素は更に著者らの臨床試験を行う能力と著者らの全体業務に不利な影響を与える可能性があり、そして私たちの運営、財務状況と業績に重大な不利な影響を与える可能性がある。
また,大流行により,われわれの米国預託証明書や他の生物製薬会社の証券の取引価格は,ある時期には非常に不安定になる可能性がある。したがって、私たちは、私たちのアメリカ預託証明書を売却することで資金を調達する困難に直面したり、このような売却は不利な条項で行われる可能性があります。大流行が私たちの業務、臨床前研究および臨床試験に与える影響の程度は未来の事態の発展に依存し、これらの事態の発展は高度に不確定であり、自信を持って予測できない、例えば新変種疾患の出現、重症度と伝播、大流行の持続時間と未来の変種のいかなる爆発、イギリス、アメリカ、その他の国での社会的距離と隔離または封鎖、企業閉鎖または商業中断、および連合王国、アメリカと他の国が疾病をコントロールと治療するための行動の有効性などの旅行制限と行動を実施することができる。
ウクライナの持続的な紛争は、特にウクライナ、ロシア、またはベラルーシで行われた任意の候補製品の臨床試験の登録およびデータ収集において、私たちの業務に悪影響を及ぼす可能性がある。
ウクライナの持続的な軍事衝突は私たちの臨床試験を混乱させ、この地域での私たちのコストを増加させるかもしれない。いかなる軍事行動の持続時間と影響は非常に予測不可能であるにもかかわらず、ウクライナ、ロシア、ベラルーシ、隣国の臨床試験地点は彼らの試験への参加を一時停止または終了する可能性があり、患者と医師は撤退を余儀なくされるか、あるいは自発的に臨床試験場所から離れた場所に移動することを選択し、彼らが得られないようにし、データ収集をより困難または不可能にする可能性がある。臨床試験地点のいかなるこのような困難、或いはこのような臨床試験地点の使用不可能は、登録或いは臨床試験の完成の遅延を招く可能性があり、代替臨床試験地点を探し、そして全体的な開発コストを増加させる必要がある。また、米国とその欧州同盟国は、ロシアの主要金融機関に対する禁輸、制裁、その他の制限を含むロシアとベラルーシに対して重大な制裁を実施した。適用される制裁法によると、将来の臨床試験を行うか、またはロシア、ベラルーシ、ウクライナの一部地域、その地域の他の地域に位置するサプライヤーから製品を購入する能力が制限されている。これらのすべてがわれわれの臨床開発計画の実行を阻害する可能性があり,これはわれわれの業務に実質的な損害を与える可能性がある。
不安定な市場や経済状況は、私たちの業務、財務状況、株価に深刻な悪影響を及ぼす可能性がある。
ここ数年来、全世界の信用と金融市場は流動性と信用供給の深刻な減少、消費者自信の低下、経済成長の低下、失業率の上昇及び経済安定の不確定性を含む極端な変動と破壊を経験した。金融市場と世界経済はまた、中東とロシアとウクライナとの間の衝突、テロ、または他の地政学的事件を含む軍事衝突の現在または予想される悪影響を受ける可能性がある。米国、連合王国、その他の国が中東やウクライナを含むこのような紛争に対応するために実施した制裁は、金融市場や世界経済に悪影響を及ぼす可能性もあり、影響を受けた国や他の国のいかなる経済対策も市場や経済の不安定を悪化させる可能性がある。信用と金融市場のさらなる悪化と経済状況への自信が起こらない保証はない。私たちの全体的な業務戦略は、このような経済低迷、不安定なビジネス環境、または持続不可能で不安定な市場状況のいずれかの悪影響を受ける可能性がある。現在の株式と信用市場が悪化すれば、任意の必要な債務や株式融資をより困難にし、コストがより高く、希釈程度をより高くする可能性がある。適時かつ有利な条件で必要な融資を得ることができなければ、私たちの成長戦略、財務業績、株価に実質的な悪影響を与える可能性があり、私たちに要求することができるかもしれません
15
私たちの製品開発または将来の商業化努力を延期、制限、減少または終了するか、または私たちが選択した条件よりも不利な条項で、私たちの候補製品を開発、販売する権利を与え、または私たちが選択した条件よりも不利な条項で、これらの候補製品を自ら開発し、マーケティングすることを望んでいたとしても。また、現在の1つまたは複数のサービスプロバイダ、製造業者、および他のパートナーは経済低迷を克服できない可能性があり、これは私たちの時間通りと予算で臨床開発目標を達成する能力に直接影響する可能性がある。
世界経済状況の不確実性は、私たちの候補製品の生産に関連するコスト増加を招く可能性があり、もし私たちの候補薬物が承認され、販売可能であれば、顧客は信用緊縮、失業、負の財務情報および/または収入または資産価値の低下および他のマクロ経済要素に対応するために、私たちの候補薬物の購入を延期する可能性があり、これは私たちの候補薬物の需要に重大な悪影響を与える可能性がある。
為替レートの変動は私たちの経営業績と財務状況に悪影響を及ぼす可能性がある。
私たちの業務の国際範囲により、為替レートの変動、特にポンドとドルの間の変動は、私たちに悪影響を及ぼす可能性があります。私たちはイギリスに本部を置いていますが、私たちはアメリカ、EU、インドを含む世界各地から私たちの活性医薬成分や原料薬とその他の原材料、私たちの研究開発、製造、コンサルティング、その他のサービスを調達しています。このような他の管轄区域の通貨に対するポンドのいかなる切り下げも、私たちがこのような商品とサービスを購入するコストをもっと高くするだろう。さらに、将来の潜在的収入は海外、特にアメリカから来るかもしれない。したがって、私たちの業務と私たちのアメリカ預託証明書の価格はポンドとドルの為替レート変動の影響を受けるだけでなく、他の国の通貨為替レートの変動の影響を受ける可能性があり、これは私たちの運営業績やキャッシュフローに大きな影響を与える可能性があります。現在、私たちは為替レートのヘッジスケジュールを持っていません。
私たちの業務は未来に適用される規制制度の変化の否定的な影響を受けるかもしれない。
私たちは新しい規制コストと挑戦に直面するかもしれないが、これは私たちの運営に悪影響を及ぼすかもしれない。FDAやEMAに関する規制枠組みを含む、我々の運営や候補製品開発に適した規制枠組みは、いつでも政治的決定によって変更される可能性がある。適用法規の枠組みのいかなる変化も私たちの研究用薬品の供給を含む、私たちの計画と発展戦略に実質的な影響を与える可能性がある。また、連合王国の欧州連合脱退と他のいかなる重大なヨーロッパ政治変化の影響は混乱を招く可能性があり、更にヨーロッパ薬品管理局の新薬の承認を延期する可能性がある。
私たちの候補製品開発に関するリスク
完成と進行中の早期臨床試験の初歩的な成功は、これらの試験の完成後或いは後期試験で得られた結果を示していないかもしれない。
NUC-3373は現在、転移性結腸直腸癌患者の治療のための三項目の臨床試験の評価を受けている:1 b/2期試験(NuTide:302)と亜葉酸カルシウム、イリノテカン、オキサリプラチンとベバシズマブの併用;無作為2期試験(NuTide:323)と亜葉酸カルシウム、イリノテカンとベバシズマブの併用による末期結腸直腸癌患者の治療、1 b/2期モジュール試験(NuTide:303)とPD-1阻害剤ベーブロマイズマブの併用による末期固形腫瘍患者、およびドセタキセルとの併用による肺癌患者のための。われわれが行っているNUC−3373の進行固形腫瘍患者に対する第1期臨床試験,われわれが行っているNUC−3373の転移性結腸直腸癌患者の1 b/2期臨床試験,われわれが行っている第2期無作為NuTide研究は良好な結果が得られた:323件の研究でNUFIRI+BEVとグローバルケア基準,5−FUと亜葉酸カルシウム,イリノテカンとベバズマブまたはFOLFIRI+BEVの併用,および進行中の進行固形腫瘍患者に対するNUC−3373 1 b/2期モジュール化試験は,将来のいずれの臨床試験でも重複しない可能性がある。同様に,NUC−7738は現在進行固形腫瘍患者の1/2期臨床試験の第2段階部分を評価しており,NUC−7738を単一療法として評価し,PD−1阻害剤pembrolizumabと併用しているが,これまでに得られた有利な結果は将来の臨床試験で複製されない可能性がある。また、特にこれらの早期試験で生成されたデータは、FDAや同様の外国規制機関の上場承認を求める基礎ではない。そのほか、著者らの臨床試験結果はFDA或いは類似の外国監督管理機関が上場許可に対して要求する統計的意義レベルに符合しない可能性がある。統計学的意義は何らかの影響が偶然に起こる可能性が低いことを意味する。臨床試験結果が統計学的意義があると考えられた場合,結果が発生する確率が偶然であり,候補製品からの奏効率でなければ十分低いと考えられる。私たちは私たちのいかなる臨床試験が最終的に成功することを保証することができなくて、私たちのいかなる候補製品の更なる臨床開発を保証することもできない。臨床試験を通過した薬物は高い失敗率を示した。世界のいくつかの会社は
16
製薬とバイオテクノロジー業界は臨床開発において大きな挫折を経験し,早期の研究においても奮い立つ結果を得ている。
私たちが時々発表または公表する臨床試験の初歩的および中期データは、患者登録の継続、患者データのさらなる検査、およびより多くの患者データの獲得に伴って変化する可能性がある。
転移性結腸直腸癌患者に対する1 b/2期臨床試験、末期結腸直腸癌患者に対するNUC-3373第2段階臨床試験、末期固形腫瘍患者に対するNUC-3373段階1 b/2モジュール式臨床試験、末期固形腫瘍患者のためのNUC-7738第1/2段階試験の第2段階部分、および任意の候補製品の任意の未来の臨床試験を含む、我々の臨床研究の予備または中期データを時々発表または公表することができる。臨床試験の初歩的と中期データは常に最終データを完全に代表するわけではない。初歩的と中期データが直面するリスクは、患者登録の継続、患者データの更なる検査、より多くの患者データが利用可能であること、及び著者らは最終臨床試験報告を準備と発表することに伴い、1つ或いは複数の臨床結果は実質的に変化する可能性がある。したがって、最終データを得る前に、初期データと中期データを慎重に見なければならない。最終データの重大な不利な変化は、初期データまたは中間データと比較して、我々の業務の将来性を深刻に損なう可能性がある。
私たちの開発努力はまだ比較的早い段階にある。もし私たちが私たちの候補製品の開発と商業化に成功しなかったり、そうしている過程で重大な遅延に遭遇したら、私たちの業務は損害を受けるだろう。
私たちは今のところ発売許可を得た製品は何もありません。我々はNUC−3373やNUC−7738,Acelarinのような我々のProTideを決定·開発するためにほとんどの精力と財力を投入しており,2022年3月にNuTide:121臨床試験を中止した。著者らが製品収入を産生できるかどうかは著者らの候補製品の成功開発と最終商業化に依存する:NUC-3373は転移性結腸直腸癌患者の1 b/2期臨床試験を行っており、NUC-3373は末期結腸直腸癌患者の二次治療に用いられ、NUC-3373とPD-1阻害剤Pembrolizumabは末期固形腫瘍患者或いはドセタキセルと併用して肺癌患者の1 b/2期モジュール化臨床試験に使用されている。単一療法としてNUC−7738,1/2期試験の第2段階が行われており,末期固形腫瘍患者にPD−1阻害剤pembrolizumabと併用している。私たちは現在どんな製品の販売からも何の収入も得ていません。私たちは決して適切な薬を開発したり商業化することができないかもしれません。私たちが薬品販売から任意の収入を得る前に、私たちのすべての候補製品は開発、開発と製造活動を管理し、複数の司法管轄区でマーケティングの許可を得て、製造供給を獲得し、商業組織を構築し、大量の投資と重大なマーケティング努力を必要とする。
我々は,企業が新たかつ急速に発展する分野でしばしば遭遇する多くのリスクや不確実性を克服することに成功した能力,特にバイオ製薬分野での能力を示していない。例えば私たちの業務計画を実行するには成功する必要があります
17
もし私たちがこれらの要素のうちの1つまたは複数をタイムリーにまたは根本的に達成できなければ、私たちは重大な遅延に遭遇したり、私たちの候補製品を商業化することに成功しなかったりする可能性があり、これは私たちの業務を損なうだろう。もし私たちの候補製品が市場の承認を得られなければ、私たちは運営を続けることができないかもしれない。
もし私たちが臨床試験の患者登録過程で遅延や困難に遭遇すれば、私たちの候補製品の開発は延期または阻止される可能性がある。
患者に著者らの候補製品に参加する資格を有する臨床試験を確定し、参加させることは著者らの成功に重要である。これらの試験に十分な数の合格患者を見つけて募集できなければ、私たちの候補製品の臨床試験を開始したり、継続することができないかもしれない。患者登録は多くの要素の影響を受ける可能性がある
もし著者らが患者を募集して臨床試験に参加する上で遅延或いは困難に遭遇すれば、どのような原因であっても、著者らの臨床試験は延期或いは終了される可能性がある。臨床試験を完成するいかなる遅延も私たちのコストを増加し、私たちの候補製品の開発と審査過程を延期或いは阻止し、そして私たちの製品販売と収入を創造する能力を危険にさらす。
臨床薬物開発は長くて高価な過程に関連し、結果は不確定である。私たちは、開発完了過程で追加コストが発生したり、遅延が発生したり、最終的に開発が完了できなくなり、候補製品の承認を得る上で遅延に遭遇したり、最終的に承認を得ることができない可能性があります。
薬物開発に失敗するリスクが高い。NUC−3373は現在2段階1 b/2試験と1段階2試験を行っており,NUC−7738は段階1/2試験の段階2部分にある。規制部門から任意の候補製品を販売する市場承認を得る前に、私たちの候補製品の患者における安全性と有効性を証明するために、臨床前開発を完成し、広範な臨床試験を行わなければならない。臨床試験は高価であり,設計と実施が困難であり,完成には数年かかる可能性があり,その結果自体は不確定である。臨床試験では,いつでも失敗する可能性がある。また,我々の候補製品の臨床前研究や早期臨床試験の結果は後期臨床試験の結果を予測できない可能性があり,臨床試験の中期結果も予測できない
18
必然的に最終結果が予測される。そのほか、臨床前と臨床データはよく異なる解釈と分析の影響を受けやすく、多くの会社は彼らの候補製品が臨床前研究と臨床試験で満足できると考えているが、しかし依然としてその製品のマーケティング許可を得られなかった。私たちの候補製品がいつ、人体で有効または安全を証明するか、あるいは発売許可を得るかどうかを予測することはできません。
臨床試験期間中あるいは臨床試験の結果において、私たちは多くの予見できない事件に遭遇する可能性があり、これらの事件は私たちの上場許可を得たり、私たちの候補製品を商業化することを延期したり阻止したりする可能性がある。臨床試験は、コストが予想以上であるか、または様々な理由で延期され、一時停止され、または早期に終了される可能性がある
多くの原因或いは臨床試験の開始或いは完成遅延を招く要素は、最終的に私たちの候補製品が上場承認を拒否される可能性もある。FDAは臨床試験の設計や臨床試験データの解釈に同意しないかもしれませんまたは承認要求を変更するかもしれません
19
我々の臨床試験の設計について審査とレビューを行った。例えば,FDAは2022年に“最適プロジェクト”に関する指導意見を発表し,腫瘍学的薬物開発における用量選択を改革するイニシアティブである。FDAが我々が研究製品のために選択した用量が研究製品の有効性を最大限に向上させるだけでなく,安全性と耐性を最大限に向上させていると十分に証明されていなければ,新たな研究を開始する能力は延期される可能性がある。私たちが追加的な研究を行ったり、要求された追加情報を生成したりしても、FDAは私たちが彼らの要求を満たすことに同意しないかもしれないが、これらはすべて私たちの計画の著しい遅延と支出をもたらすだろう。
また,NUC−3373は長年広く使用されてきた化学療法薬の転換であり,現在われわれが臨床的に求めているすべての適応は明らかな未満足の医療需要があるにもかかわらず,FDAが大量の患者群で重要な臨床試験を開始することをより早く許可することは保証されていない。さらに、NUC−7738は、ヌクレオシド類似体であり、化学療法のための開発または承認に成功したことがなく、承認された化学療法薬変換よりも多くの臨床前研究または臨床試験を必要とする可能性がある3‘-デオキシアデノシンの変換である。
もし私たちの候補製品に対して、現在予想されている以上の追加の臨床試験または他の研究を行うことを要求された場合、もし私たちが候補製品の臨床試験または他の研究を成功させることができなければ、もしこれらの試験または試験の結果が陽性でないか、またはわずかな陽性である場合、または安全問題がある場合、私たちは:
もし私たちが臨床前と臨床開発の面で遅延に遭遇したり、必要なマーケティング承認を得たりすれば、私たちの製品開発コストも増加する。我々のいかなる臨床前研究や臨床試験が再構成が必要かどうか,あるいは計画どおりに完成するかどうか,あるいは全く知られていない。重大な臨床前または臨床試験遅延は、候補製品を商業化する独占的な権利を持つ可能性のある任意の期限を短縮することができ、または私たちの競争相手が私たちの前に製品を市場に出すことを可能にし、候補製品を商業化することに成功する能力を弱化させ、私たちの業務と運営結果を損なう可能性がある。
私たちは、私たちまたは私たちの協力者が後援する臨床試験から得られた健康情報のプライバシーに関する規制と潜在的な責任に直面している。
情報セキュリティやプライバシーをめぐる規制環境はますます厳しくなっており,これらの法律法規の複雑さや数が増加しており,頻繁に変化し,時には衝突する可能性もある.我々は、医療記録、クレジットカードデータおよび金融情報に関連する法規を含む、臨床試験被験者、臨床研究者および従業員の個人情報および機密情報の保護に関する多くの法規を遵守し、州プライバシーおよび秘密法(違反行為の開示を要求する州法を含む)、連邦および州消費者保護および雇用法、健康保険携帯性および責任法、またはHIPAA、ならびにヨーロッパおよび他の外国データ保護法を含む。例えば、EU一般データ保護条例(GDPRと略す)は、すべてのEU加盟国および欧州経済圏(E.E.A)加盟国に適用される。イギリスのEU離脱後、GDPRのデータ保護義務は、イギリスに関する個人データ処理(イギリス法では“イギリスGDPR”として保持されている)にほぼ不変の形で適用され続ける。
私たちは、イギリスまたは東アジア地域のデータ被験体に関連する臨床試験(試験が私たちによって直接行われるか、または臨床サプライヤーまたは協力者によって行われるかにかかわらず)、またはイギリスまたは東アジア地域のデータ被験体に承認された製品(または任意の他の製品またはサービス)を提供する場合(イギリスまたは東アジア地域の子会社または業務に関連するか否かにかかわらず)、GDPRおよび/またはイギリスGDPRによって制限される。英国または欧州経済地域におけるデータオブジェクトの行動を監視する際、および/またはイギリスまたは欧州経済地域に本部を置く子会社、運営機関、または他の機関によって行動する場合。
GDPR(および英国GDPR)は、適切な合法的な基盤を有する処理と、“特殊カテゴリ”個人データを処理する際の関連条件とを含む、個人データ(すなわち、識別または識別可能な存命個人に関するデータ)を処理する際に遵守しなければならない複数の要件を示している
20
健康に関連する個人データ、一意の識別目的のための生体特徴データおよび遺伝子情報)、場合によってはデータ保護官を任命する義務、記録を責任および保存する義務、データ管理者の透明性義務、場合によっては“データ保護影響評価”を行う義務、データ当事者の権利(例えば、個人が“忘却権”、データ携帯権、反対権など)、データ当事者が同意する厳格な基準、および関係監督機関および影響を受けた個人に特定の重大な個人資料違反行為を通報する義務が含まれる。さらに、GDPRは、個人データが何であるかについて非常に広い定義を提供する(例えば、GDPRは、“仮名”(すなわち、鍵符号化された)データに適用されることを明示的に示す)。規制当局のいくつかの意見は、個人データの概念を非常に広く解釈することをさらに支持し、GDPRの適用を支援する。EU監督当局とEU裁判所の最近の裁決は、GDPRによって個人に与えられた権利が広く適用されなければならず、法律自体が個人の権利の保護を保証するために厳格に解釈されなければならないことを確認した。
GDPRとイギリスGDPRはまた、個人データを東アジアやイギリスから米国や他の第三国に移転することを厳しく規定している。最近の法律発展は、個人データを欧州経済共同体や連合王国から米国に移す上でさらなる複雑性と不確実性をもたらしている(この点でもいくつかの積極的な発展があるにもかかわらず)。欧州委員会は2023年7月10日に、個人データをEUからデータプライバシーの枠組みに基づいて自己認証する米国エンティティへの個人データの移転を可能にする新たな“EU-米国データプライバシー枠組み”の“十分性決定”を採択した。2023年10月12日、英米データブリッジ(英国のデータプライバシーフレームワークの延長)が発効した。“データプライバシーの枠組み”と“データブリッジ”は原則として個人データを欧州経済区とイギリスから米国に移すことを容易にしているが、欧州ではすでに“データプライバシーの枠組み”に法的挑戦が行われており、他の有名な欧州プライバシー権活動者は、2024年にこの決定に挑戦する意向を示している。同様に、イギリスの情報専門家事務室は、データブリッジが挑戦される可能性のある分野を強調する意見を発表した。
データプライバシーの枠組みは米国の認証参加者への移行に限られているため,多くの移行は標準契約条項に依存し続けている.目的国で適用される法制度、特に適用される監督法および個人権利、および制定が必要となる可能性のある追加措置および/または契約条項を考慮しながら、標準契約条項の使用状況を逐次評価しなければならないが、これらの追加措置の性質は現在のところ確定されていない。2023年5月,アイルランドデータ保護委員会はMetaに対して12億ユーロの罰金を発行したが,Metaが標準契約条項に基づいて個人データを米国に移行した理由は,これらの個人データが米国で十分に保護されていないからである。これらすべての事態を考慮して、データ転送をめぐる不確実性は2024年以降まで続くと予想される。
法的課題の継続および/または規制機関が法執行活動を強化するにつれて、私たちは、追加的なコスト、クレームおよび/または規制審査、調査または罰金を受ける可能性があり、および/または、私たちが業務を展開している国と地域の間で個人データを転送できない場合、これは、私たちがサービスを提供する方法、地理的位置、または私たちの関連システムと業務の隔離に影響を与え、私たちの財務業績に悪影響を与え、コンプライアンスリスクを普遍的に増加させる可能性がある。
GDPRはまた、欧州経済共同体加盟国は、健康に関する個人データ、一意のアイデンティティ識別目的のための生体特徴データおよび遺伝情報、および刑事犯罪または有罪判決に関連する個人データを含む“特殊カテゴリの個人データ”を導入するために、独自のさらなる法律および条例を制定することができると規定している。この事実は、EUとイギリスがこのようなデータタイプを処理するために適用される法律により大きな相違がある可能性があり、適用すれば、これらの法律を遵守することは私たちのコストを増加させ、私たちの全体的なリスクを増加させる可能性がある。
過去12ヶ月間、全面的な人工知能の監督管理が不足している中で、ヨーロッパのデータ保護機関は特に人工知能の監督管理を積極的に求めている。人工知能法案がEUに適用されるまでは,このような関心が続くことが予想されるため,欧州プライバシー法により,医療分野で人工知能を用いることはより高いリスクに直面する。
連合王国は欧州連合のメンバーではなくなったため、連合王国と欧州連合のデータ保護法の適用、解釈、執行における相違はますます大きくなっている。英国政府は2023年3月8日、英国のデータ保護制度の様々な側面を修正するための“データ保護とデジタル情報法案”を議会に提出した。この法案はまだ議会で議論されており、その法案がいつ成立するかを示す兆候はない。現在の起草では、この法案はイギリスGDPRの実質内容をわずかに修正するだけであるため、連合王国はこの点で欧州連合と非常に密接な関係を保つことになる。しかし、データ保護法におけるイギリスとEUの立場に関するいかなる変化も、追加のコンプライアンスコストを招き、私たちの全体的なリスクを増加させる可能性がある。イギリスの変化を心配する人もいる。
21
制度、特にデータ伝送規則の変化は、連合王国に関する欧州委員会の十分性決定が2025年(またはそれ以前、法律的挑戦の場合)に審査される際に無効または撤回されるリスクを増加させる可能性がある。イギリス総選挙は2024年下半期に開催される予定であることを指摘すべきである:当時の法案が置かれていた立法手続き段階および/または選挙結果によると、この法案は決して法律にならない可能性がある。
GDPR以外にも、EUには現在、欧州衛生データ空間(EHDS)条例を含む立法手続きが行われている新しい法律がある。例えば、EHDS条例は、(匿名の形態で)部門の他の組織および患者自身に健康データを提供することを要求することができる。この法律は連合の立法手続きの最終段階に近づいているので、私たちはそれを理解して準備するために多くの資源を投入しなければならないかもしれない。
これらの法律法規の複雑さと数量はすべて増加しており、新しい監督管理ガイドラインと判例法は規制構造が常に変化することを意味する。このような多く、複雑でよく変化する規制を遵守することは費用が高くて難しい。もし、私たち、任意のパートナー、私たちのサービスプロバイダ、または私たちの従業員または請負業者がGDPRを遵守できなかった場合、規制調査、法執行通知、および/または2000万ユーロまで、または私たちの世界の年商4%までの罰金をもたらす可能性があります。また、イギリスのEU離脱後、私たちは現在、GDPRとイギリスGDPRをそれぞれ遵守しなければならず、各制度はそれぞれ最高2000万ユーロ/GBまたは世界売上高の4%の罰金を科すことができる。また、近年、規制機関が発行した罰金額は大幅に増加している:EU各地の規制機関とイギリス情報専門家事務室は数百万ユーロ/GBの罰金を無数に発行し、アイルランド規制機関は2023年5月にMetaに対して最初の12億ユーロの罰金を発行した。欧州データ保護委員会の指導では,罰金開始額を決定する際には,売上高を考慮し,大きな組織への罰金が高くなることが示唆されている。したがって、私たちは罰金額が引き続き上昇すると予想する。行政罰金に加えて、主管当局は、広範な監査および検査権、および不正行為者の個人データ処理のすべてまたは一部を一時的または永久的に禁止することを命令する権限を含む、潜在的およびGDPR違反の疑いのある行為に対して、様々な他の潜在的な実行権を行使することができる。
上記に加えて、プライバシー法またはデータセキュリティ法に違反し、特に重大なネットワークセキュリティ事件または流用、腐敗、修正、紛失、または他の不正使用または機密患者または消費者情報の漏洩を引き起こす行為は、私たちの業務、名声、および財務状態に重大な悪影響を及ぼす可能性がある。また,EUでは,広く知られているセキュリティホールの後,大規模な“集団訴訟”式のクレームを提起しようとする人が増えており,欧州裁判所の最近の裁決確認データ対象が軽微な非物質的損害であっても賠償を受ける権利があることから,この傾向が続く可能性がある。このような“集団訴訟”式のクレームはまだいかなる重大な賠償令でも勝訴していないにもかかわらず、これらのクレームを弁護する費用が高く、大量の賠償と法的費用の責任を招く可能性がある。データ制御員として、私たちが依頼した代表は、私たちのCROを含む個人データを処理する任意の第三者サービスプロバイダに責任を負います。私たちは、サプライヤーのセキュリティ評価と職務調査を行い、このようなデータアクセス権限を持つすべての第三者プロバイダに協定に署名することを求め、私たちの説明だけに基づいてデータを処理し、そのようなデータを保護するのに十分なセキュリティ措置をとることで、関連リスクを低減することを求めています。これらの契約措置および私たち自身のプライバシーおよび安全保障措置は、第三者がこのような情報を処理、保存、送信することに関連するリスクから私たちを保護することができません。当社のサードパーティプロセッサのデータまたはセキュリティ法律に違反するいかなる行為も、当社の業務に重大な悪影響を与え、上述した罰金、処罰、および/または他の法執行行動をもたらす可能性があります。
私たちはすべての適用された法律を遵守しようと努力しているが、それらは互いに衝突し、1つの管轄区域の法律や法規を遵守する可能性があり、私たちは他の管轄区域の法律または法規に違反していることが発見されるかもしれない。私たちが努力したにもかかわらず、私たちは過去に完全に守られていなかったかもしれないし、未来もそうではないかもしれない。私たちが私たちに適用される法律や法規によって責任を負うと、巨額の罰金と罰金(上記の罰金や罰金を含む)の支払いが要求される可能性があり、私たちの名声が損なわれる可能性があり、私たちの運営方法の変更を余儀なくされるかもしれません。これは私たちが巨額の費用を発生させたり、いくつかのサービスを停止する必要があるかもしれないし、これは私たちの業務に否定的な影響を与えるかもしれない。
私たちは限られた資源と資金を得る方法のために、私たちは過去に決定され、他の潜在的な候補ではなく、特定のProTide候補を優先的に開発することが決定された。このような決定は間違っていることが証明され、私たちの業績に悪影響を及ぼすかもしれない。
私たちは私たちの行動を支援するために限られた資源と資金しかないので、私たちはどのProTideと各ProTideに割り当てられた資源を追求するかを決定しなければならない。私たちは研究、協力、管理分配の決定について
22
特定のProTideや治療分野のための財政資源は、実行可能な商業製品の開発を招くことがなく、より良い機会から資源を移転する可能性がある。同様に、製品開発計画の延期、終了、または第三者との協力の決定も最適ではないことが証明され、予想される貴重な機会を逃す可能性があります。もし私たちがProTideの市場潜在力について間違った判断をしたり、バイオ製薬業界の傾向、特に私たちのLead ProTdesを誤読したりすれば、私たちの業務は不利な影響を受けるかもしれない。
より多くのProTide候補薬のパイプラインを構築するために私たちの技術プラットフォームを使用して拡張する努力は成功しないかもしれない。
私たちの戦略の重要な要素の一つは、より多くのProTide候補薬の導管を構築し、癌治療の臨床開発を通じてこれらのProTide候補薬を進歩させるために、私たちの独自のProTide技術を使用して拡張することである。これまで,われわれの研究と開発は多くの固形腫瘍や血液悪性腫瘍に対する一連のProTide候補薬を産生してきたが,安全かつ有効なProTide候補薬を開発できない可能性がある。私たちが私たちのルートを構築することに成功しても、有害な副作用や他の特徴が証明されたため、市場の承認を得て市場から受け入れられる製品ではないことを示す潜在的候補製品が臨床開発に適していない可能性がある。
私たちの候補製品の市場承認に関するリスク
もし私たちが必要なマーケティング承認を得ることができない場合、あるいは必要なマーケティング承認を遅延させると、私たちの候補製品を商業化することができなくなり、私たちが収入を作る能力が損なわれるだろう。
私たちの候補製品とその開発と商業化に関連する活動は、それらの設計、テスト、製造、安全、効果、記録保存、ラベル、貯蔵、承認、広告、販売促進、販売、流通、輸出入を含み、すべてアメリカFDAと他の規制機関、その他の国の類似機関の全面的な監督管理を受けている。
これらの要件には、安全および他の上場後の情報および報告の提出、登録および上場要件、現在の良好な製造仕様またはcGMP、製造、品質管理、品質保証および記録およびファイルの対応する維持に関する要求、FDAおよび他の規制機関の定期検査、医師へのサンプルの配布および記録の保存に関する要求が含まれる。私たちの任意の候補製品を商業化することができる前に、各候補製品は商業化前にFDAの米国NDAによる承認を得なければならず、EMAはEUのMAAによって承認され、米国以外の同様の規制機関の承認を受けなければならない。
米国でも海外でも上場承認を得る過程は高価であり、承認されれば数年を要し、関連する候補製品のタイプ、複雑性、新規性を含む様々な要因によって大きく異なる可能性がある。候補製品のマーケティング承認を得られなかったことは私たちが候補製品を商業化することを阻止するだろう。私たちはまだどの管轄区の規制機関からも私たちの候補製品を販売する承認を得ていない。われわれは計画と上場承認に必要な臨床試験の経験が限られており,この過程で第三者CROに依存して支援していきたい。上場承認を得るためには、広範な臨床前と臨床データ及び各治療適応の支持情報を監督機関に提出し、候補製品の安全性と有効性を確定する必要がある。上場承認を得るには製品の製造過程に関する情報を提出する必要があり,多くの場合,監督当局が製造施設の検査を行う必要がある。私たちの候補製品は効果がないかもしれないし、中程度の効果しかないかもしれないし、あるいは不良または意外な副作用、毒性、または他の特徴があることが証明される可能性があります。これらは私たちの上場承認を阻止するか、または商業用途を阻止または制限するかもしれません。われわれの多くの臨床試験は他の承認された療法と組み合わされるため、他の療法またはそれと我々の候補製品との組み合わせは、不良または意外な副作用、毒性、または他の特徴を生じる可能性がある。
さらに、我々の候補製品は、承認された化学療法薬および化学療法薬として承認されていないヌクレオシド類似体を含むヌクレオシド類似体の変種であるため、これらの既存のヌクレオシド類似体の中で発見された任意の新しい不良または予期しない副作用、毒性または他の特徴は、特に化学療法薬として承認されていないヌクレオシド類似体に悪影響を及ぼす可能性がある。
23
監督管理部門は新薬の審査過程においてかなりの自由裁量権を持っており、いかなる申請を受け入れることを拒否することができ、著者らのデータが承認を得るのに十分ではないことを決定することができ、追加の臨床前研究或いは臨床試験を行う必要がある。私たちの候補製品は、以下のような理由を含む、様々な原因で市場の承認を得るのが遅れたり、得られなかったりする可能性がある
さらに、私たちが承認されても、規制機関は、私たちが要求しているものよりも少ないか制限されているか、高価な発売後の臨床試験の表現によって承認される可能性があり、流通または他のREMS要素に制限された候補製品が承認される可能性があり、または候補製品のラベルが候補製品の商業化に成功するために必要または必要なラベル宣言が含まれていないことが承認される可能性がある。上記のいずれの状況も私たちの候補製品の商業的な見通しを損なう可能性がある。
もし私たちが承認を得る上で遅延に遭遇した場合、あるいは私たちの候補製品の承認を得られなかったら、私たちの候補製品のビジネスの見通しが損なわれる可能性があり、私たちの収入を作る能力も損なわれるだろう。
私たちの候補製品は不良な副作用を招く可能性があり、その上場承認を延期または阻止し、承認されたラベルのビジネスイメージを制限したり、上場承認後に重大な負の結果を招く可能性があります(あれば)。
私たちの候補製品による副作用は、私たちまたはFDAまたは他の規制機関が私たちの臨床試験を中断、延期、または停止させる可能性があり、より厳しいラベル制限、またはFDAまたは他の規制機関が私たちの候補製品の上場承認を延期または拒否する可能性がある。われわれの臨床試験結果は,これらや他の副作用の重症度や流行度を明らかにする可能性があり,受け入れられない。この場合、私たちの実験は一時停止または終了される可能性があり、FDAまたは同様の外国規制機関は、私たちの任意またはすべての目標適応を承認する候補製品の開発を停止または拒否するように命令することができます。薬物に関連する副作用は、患者が試験を完了する能力を募集したり、組み入れたり、あるいは潜在的な製品責任クレームを引き起こす可能性もある。
また,臨床試験の本質は潜在的な患者集団のサンプルを利用することである。患者数が限られているため、私たちの候補製品はまれで深刻な副作用は、候補製品に接触する患者数が著しく増加した場合にのみ暴露される可能性がある。もし私たちの候補製品が発売許可を得て、私たちまたは他の人が承認を得た後にこのような候補製品あるいは任意の他の類似薬物による不良副作用を発見すれば、多くの潜在的な重大な負の結果を招く可能性がある:
24
また,我々は現在,我々の候補製品の適応における患者プロファイルや,多くの患者が治療開始時に重篤に罹患しており,副作用や不良予後や結果が我々の候補品に関連していると主張するリスクを増加させる可能性がある。このような副作用、予後、または結果が最終的に我々の候補製品に関連して決定されるか否かにかかわらず、クレーム自体は、前述の一部または全ての負の結果をもたらす可能性がある。
これらのいずれの事件も、影響を受けた候補製品に対する市場の受容度を達成または維持することを阻止する可能性があり、承認されれば、候補製品の商業化コストを大幅に増加させ、候補製品を商業化し、収入を創出する能力に著しく影響する可能性があると考えられる。
FDAの迅速なチャネル指定は、私たちに任意の候補製品を付与しても、より速い開発や規制審査や承認過程を招くことはなく、私たちの候補製品が上場承認される可能性を増加させることはありません。
重症または生命に危険な疾患の治療に使用される薬剤が使用され、そのような疾患が満たされていない医療ニーズを解決する可能性を示す場合、薬物スポンサーはFDA迅速チャネル認証を申請することができる。FDAは広い自由裁量権を持っていて、この称号が与えられているかどうか。ある特定の候補製品がこの認証を受ける資格があると信じていても、FDAがこの認証を承認することを保証することはできません。私たちが高速チャネル認証を受けたとしても、私たちは従来のFDAプログラムよりも速い開発過程、審査、または承認を経験しないかもしれない。FDAが我々の臨床開発プロジェクトのデータが高速チャネルの指定をサポートしなくなったと考える場合,その指定を撤回する可能性がある。高速道路指定された多くの薬物は薬物承認を受けられなかった。
私たちが上場承認を得た任意の候補製品は、広範な発売後の規制要求の制約を受け、発売後に市場から制限されたり、撤退したりする可能性があり、もし私たちが規制要求を遵守していない場合、あるいは私たちの製品が予期せぬ問題に遭遇した場合、その中のどの製品も承認された場合、処罰を受ける可能性がある。
FDAまたは同様の外国規制機関が私たちの任意の候補製品を承認する場合、製品の製造過程、ラベル、包装、流通、有害事象報告、貯蔵、広告、販売促進および記録などの活動は、広範かつ持続的な規制要件の制約を受けるだろう。FDA或いは類似の外国の監督管理機関もまた、製品の安全性或いは有効性を監視するために、高価な発売後の臨床前研究或いは臨床試験とモニタリング計画を要求する可能性がある。FDAは薬品の承認後のマーケティングと販売促進を密接に監督し、薬品が承認された適応のみに対する販売を確保し、承認されたラベルの規定に基づいて販売する。FDAはメーカーがその製品を使用するコミュニケーションに厳しい制限を加えており、もし私たちの製品が彼らが承認した適応を超えていることを宣伝したり、FDAによって承認されたラベルと一致しない方法で宣伝したりすれば、私たちはラベル外宣伝によって法執行行動や起訴を受けるかもしれない。処方薬の普及に関するFD&C法案の違反は調査につながる可能性があり、連邦や州医療詐欺や乱用やその他の法律、州消費者保護法違反を告発する可能性がある。
医薬品メーカーおよびメーカーの工場も、品質管理および製造プロセスがcGMP規定および対応する外国規制製造要件に適合することを確保することを含む、FDAおよび同様の外国規制機関の要求を引き続き遵守することが求められている。したがって、私たちと第三者サプライヤーは、cGMPの遵守状況および任意のセキュリティプロトコルまたは他のマーケティング許可申請で行われた約束の遵守状況を評価するために、持続的な審査および検査を受けるだろう。
25
さらに、後に、私たちの製品、製造業者、または製造プロセスに以前に未知の不良事件や他の問題が発生したり、監督要求を遵守できなかったりすることが発見され、様々な結果が生じる可能性があります
安全監視や薬物警戒に関するEUの要求を守らないことも重大な経済的処罰を招く可能性がある。同様に、個人情報保護に関するEUの要求を守らないことはまた重大な処罰と制裁につながる可能性がある。
FDAまたは他の規制機関の政策は変わる可能性があり、私たちの候補製品の上場承認を阻止、制限、または延期するための追加の政府法規が公布されるかもしれない。もし私たちが既存の要求の変化に緩やかに適応できない場合、あるいは新しい要求や政策を採用することができない場合、あるいは私たちがコンプライアンスを維持できない場合、私たちは私たちが得る可能性のあるマーケティング承認を失う可能性がある。
顧客と第三者支払者との関係は、刑事制裁、民事処罰、契約損害、名声損害、利益および将来の収益の減少に直面する可能性がある反リベート、詐欺および乱用、および他の医療法律法規の制約を受けることになります。
私たちは現在何の薬も発売されていませんが、私たちの候補製品を商業化し始めると、追加の医療法律と監督管理の要求を受け、私たちが業務を展開する司法管轄区のアメリカ連邦と州政府、外国政府の強制執行を受けます。医療提供者、医師、第三者支払者は、私たちが市場で承認された任意の候補製品の推薦と処方において主な役割を果たすだろう。私たちの将来の第三者支払者や顧客との手配は、私たちがマーケティング、販売、流通を制限するかもしれない幅広い適用された詐欺や乱用、その他の医療法令に直面する可能性があります。マーケティングの承認を得た任意の製品の業務または財務スケジュールと関係を制限しています。アメリカ連邦と州医療保健法律法規に適用される制限は
26
同様の州および外国の法律、例えば州反リベートおよび虚偽請求法は、非政府第三者支払者(私営保険会社を含む)によって精算される医療項目またはサービスの販売またはマーケティング手配およびクレームに関連する場合がある。
私たちが第三者の業務配置と適用される医療法律や法規に適合するように努力することは、多くのコストに関連することを確実にします。政府当局は、私たちの業務実践が現在または未来に適用される詐欺および乱用または他の医療保健法律および法規に関連する現行または未来の法規、法規または判例法に適合していない可能性があると結論するかもしれない。もし私たちの運営がこれらの法律または任意の他の私たちに適用される可能性のある政府法規に違反していることが発見された場合、私たちは重大な民事、刑事と行政処罰、損害賠償、罰金、返還、監禁、私たちの製品を政府援助の医療計画(例えばMedicareおよびMedicaid)から除外し、追加の報告要件および監督に直面する可能性があります(もし私たちが会社の誠実な合意または同様の合意の制約を受けて、これらの法律違反に関する告発、名声損害、および私たちの業務の削減または再編を解決するために)。さらに、私たちがそれと業務を展開することを期待している任意の医師または他のヘルスケア提供者またはエンティティが、適用された法律に適合していないことが発見された場合、彼らは、政府が援助する医療計画から除外されることを含む重大な刑事、民事または行政制裁を受ける可能性がある。
現在と将来の立法は、候補製品の発売承認を得て商業化する難しさとコストを増加させ、入手可能な価格に影響を与える可能性がある。
米国や一部の外国司法管轄地域では、医療システムに関する立法や規制変更、提案された変更は、候補製品の上場承認を阻止または延期し、承認後の活動を制限または規制し、マーケティング承認された候補製品を収益的に販売する能力に影響を与える可能性がある。もし私たちが既存の要求の変化に適応できない場合、あるいは新しい要求や政策を採用することができない場合、あるいは規制コンプライアンスを維持できない場合、私たちが本来得る可能性のあるマーケティング承認を失う可能性があり、私たちは利益を達成したり維持することができない可能性があり、これは私たちの業務、将来性、財務状況、運営結果に悪影響を及ぼすだろう。
また,米国連邦と州レベルでは,医療コストの低減と医療の質の向上を図る取り組みが継続されている。例えば,2010年3月,米国はACAを公布し,政府や民間保険会社が医療保健に資金を提供する方式を大きく変え,製薬業に大きな影響を与えた。ACAには、連邦医療計画の登録、補償調整、および詐欺および乱用の法律の改正を含むいくつかの条項が含まれている。別の人として
27
例えば、2021年総合支出法案は2020年12月27日に署名されて法律となり、連邦医療保険B部分に含まれるすべての薬品メーカーに製品の平均販売価格を連邦政府に報告することを含む広範な医療条項と既存の法律の改正が盛り込まれている。
もう一つの例は,2021年3月11日に総裁·バイデンが“2021年米国救援計画法案”に署名し,2024年1月1日から単一源と革新多源薬に対する法定医療補助薬品還付上限を廃止し,現在この上限は薬品AMPの100%であることである。支払い方法はまた医療立法と規制措置の影響を受ける可能性がある。例えば、CMSは、バンドル支払いモードのような新しい支払いおよび配信モードを開発することができる。最近、政府はメーカーが製品の価格設定の方式をより厳格に審査した。このような審査により、アメリカ議会は最近数回の調査を行い、連邦と州立法を提出し、採択し、薬品定価の透明性を高め、連邦医療保険下の処方薬のコストを下げ、定価とメーカー患者計画との関係を審査し、政府計画の薬品精算方法を改革することを目的とした。例えば、2022年8月、“2022年インフレ削減法案”(IRA)が署名されて法律となった。他の事項を除いて、アイルランド共和軍はある薬品のメーカーに連邦医療保険との価格交渉(2026年から)を要求し、価格は交渉できるが上限があり、連邦医療保険B部分と連邦医療保険D部分に基づいてリベートを実施し、インフレを超えた価格上昇を処罰し(2023年に初めて満期)、D部分の代わりにギャップ割引計画を新しい割引計画でカバーする(2025年から)。アイルランド共和軍はCMSが最初の数年に規制ではなく指導によってその多くの条項を施行することを許可した。CMSはこれらの新しい許可の実施を開始し、2023年10月に製薬業者と第1セットの合意を締結し、価格交渉を行った。しかし,アイルランド共和軍の米国バイオ製薬業界への影響はまだ不確定であり,一部の原因は複数の大手製薬会社や他の利害関係者(例えば米国商会)がCMSに対して様々な理由で違憲,その他の苦情を訴えていることである。このような訴訟は現在も進行中だ。このような理由やその他の理由で、アイルランド共和軍がどのように実施されるかは不明であり、アイルランド共和軍が私たちの業務に与える影響も不明である。
また、アメリカ各州も立法を通過し、薬品の価格設定を制御するための法規を実施し、価格或いは患者の精算制限、割引、ある製品への参入の制限とマーケティングコストの開示及び透明性措置を含み、地域医療当局と個別病院はますます入札プログラムを使用して、処方薬と他の医療保健計画にどのような薬品とどのサプライヤーが含まれるかを決定する。2020年12月、米国最高裁判所は、連邦法律は各州の監督薬局福祉マネージャー或いはPBMと医療保健と薬品サプライチェーンの他のメンバーの能力を妨害しないと一致し、この重要な決定は各州がこの分野でより積極的な努力をすることを招いた。2022年中に、米国連邦貿易委員会(Federal Trade Commission、FTCと略称する)もPBM業界のやり方について全面的な調査を展開し、これはこのような実体の運営、薬局ネットワークまたは財務手配に対する追加の連邦と州立法または規制提案を招く可能性がある。今国会の会期内に、衆参両院は多くのPBM改革を審議している;その中にはリベートの取り消しなどの各種の立法提案が含まれている;サービス料を薬品、割引或いはリベートの価格から分離する;価格差の定価を禁止する;行政費用を制限する;PBMに処方の配置理由を報告することを要求する;透明性を促進する。現在アメリカに存在するPBM業界を変える重大な努力は薬品サプライチェーンと他の利益関係者の業務に影響を与える可能性があり、著者らのような薬品開発業者を含む。
EUでは、似たような政治、経済、規制発展は、私たちが製品を利益にして商業化する能力に影響を及ぼすかもしれない。価格とコスト制御措置の持続的な圧力に加えて、EUまたはEU加盟国レベルの立法発展は、著しい追加的な要求や障害を招く可能性があり、これは私たちの運営コストを増加させる可能性がある。
ACAとIRA,および将来とりうる他の医療改革措置は,より厳しいカバー基準をもたらす可能性があり,我々が受け取る任意の承認された製品の価格に追加の下り圧力を構成する可能性が予想される。連邦医療保険または他の政府計画支払いのいかなる減少も、個人支払者支払いの同様の減少をもたらす可能性がある。コスト抑制措置や他の医療改革を実施することは、収入を創出し、利益を達成することができ、あるいはマーケティングの承認を得た任意の製品を商業化することを阻止することができるかもしれない。
近年は承認後の要求を拡大し、医薬品の販売や販売促進活動を制限するための立法や規制も提案されており、FDAの法定権力機関も定期的に国会で改正される。例えば、国会は最近、ヒト薬物や生物製品の承認経路の加速に関する追加権力をFDAに提供した。最近のFD&C法案のこれらの改正により,承認を加速させた製品のスポンサーに承認前に検証的実験を行うことが求められる。♪the the the
28
修正案はまた、FDAがスポンサーの検証性試験が製品主張の臨床的利益を検証できなかった場合に、迅速なプログラムを使用して製品承認を撤回することを選択することを可能にする。私たちは、より多くの立法変化が公布されるかどうか、あるいはFDAの法規、ガイドライン、解釈が変わるかどうか、あるいはこれらの変化が私たちの候補製品の上場承認にどのような影響を与える可能性があるかどうかを決定することはできない。また、米国議会のFDA承認過程に対するより厳格な審査は、上場承認を著しく延期または阻止し、より厳しい製品ラベルと上場後の条件とその他の要求の制約を受ける可能性がある。
私たちの将来の成長は私たちが外国市場に進出する能力にある程度依存するかもしれないが、そこでは追加の規制負担と他のリスクと不確定要素の影響を受けるだろう。
私たちの将来の収益性は候補品を海外市場で商業化する能力にある程度依存するかもしれません。EUや他の多くの司法管轄地域で私たちの製品をマーケティングして販売するためには、私たちまたは私たちの第三者パートナーは単独のマーケティング承認を得て、多くの異なる規制要件を遵守しなければならない。承認手続きは国や経済分野によって異なり、追加的なテストが含まれる可能性がある。承認を得るのに要する時間は、FDA承認を得る時間とは大きく異なる可能性がある。米国以外の上場承認プロセスには、通常、FDA承認の取得に関するすべてのリスクが含まれている。また、米国以外の多くの国では、製品がその国での販売を許可される前に、精算承認を受けなければならないことが求められている。私たちやこれらの第三者は(あれば)米国以外の規制機関の承認をタイムリーに得ることができないかもしれない。FDAの承認は、他国又は管轄区域の規制機関の承認を確保するものではなく、米国以外の1つの規制機関の承認も、他の国又は司法管区の規制機関又はFDAの承認を確保することができない。また、1つの司法管轄区で上場承認を獲得できなかったり、遅延したりすることは、他の司法管轄区の上場審査の流れにマイナス影響を与える可能性がある。審査手続きは司法管轄区域によって異なり、追加の臨床前研究或いは臨床試験を含む米国と異なる、甚だしきに至ってはより長い要求と行政審査期限に関連する可能性がある。外国市場の承認を得て外国の規制要求を遵守することは、私たちに重大な遅延、困難、コストをもたらす可能性があり、私たちの製品がある国/地域で発売されることを延期または阻止する可能性がある。もし私たちが国際市場の規制要求を遵守できなかったり、適用されたマーケティング承認を得られなかったら、私たちの目標市場は減少し、私たちの候補製品の市場潜在力を十分に発揮する能力は損なわれるだろう。
私たちはマーケティング承認を申請できないかもしれないし、どの市場でも私たちの製品を商業化するために必要な承認を得ることができないかもしれない。もし私たちの候補製品が承認され、最終的に私たちの候補製品を海外市場で商業化すれば、私たちは追加のリスクと不確実性に直面するだろう
29
私たちの候補製品の海外販売は、政府規制、政治的·経済的不安定、貿易制限、関税変化の悪影響を受ける可能性もある。
米国以外の政府は厳しい価格制御を実施する傾向があり、これがあれば私たちの収入に悪影響を及ぼす可能性がある。
一部の国、特に欧州連合国では、処方薬の価格設定は政府によって統制されている。これらの国では、製品の発売許可を受けた後、政府当局との定価交渉にかなりの時間がかかる可能性がある。一部の国で精算或いは定価の承認を得るためには、私たちの候補製品のコスト効果を他の利用可能な治療法と比較する臨床試験を行う必要があるかもしれない。もし私たちの製品が精算を受けられない場合、あるいは範囲や金額が制限されている場合、あるいは定価レベルが満足できなければ、私たちの財務業績は影響を受けます。
私たちはイギリスの反収賄法、米国の反海外腐敗法、その他の反腐敗法、そして輸出規制法、輸入法と税関法、貿易·経済制裁法、その他私たちの業務を管理する法律を守らなければならない。
我々の業務は、イギリスの“2010年収賄法”または“収賄法”、“海外腐敗防止法”または“海外腐敗防止法”、米国“米国法典”第18編201節に含まれる米国国内賄賂法規、米国旅行法、および私たちが業務を展開している国/地域に適用される他の反腐敗法律を含む反腐敗法を遵守しなければならない。“贈収賄法”、“海外腐敗防止法”およびその他の法律は、一般に、業務を獲得または保留し、またはいくつかの他の業務的利点を得るために、私たちおよび私たちの従業員および中間者が直接または間接的に許可、承諾、提供、誘致、要請、または公的または民間部門の人員に不正または禁止された金または任意の他の価値のあるものを支払うことを禁止している。
反収賄法によると、私たちはまた、私たちと関連のある人が賄賂犯罪を犯すことを阻止できなかったために責任を負う可能性がある。私たちと私たちを代表して行動する人たちは複数の司法管轄区域で業務を行っています。これらの司法管轄区域は“収賄法”や“海外腐敗防止法”に違反するリスクがある可能性があり、私たちも第三者との協力や関係に参加しています。これらの第三者の腐敗や不法活動は、私たちが明確に権限を持っていなくても、実際にこのような活動を理解していなくても、“収賄法”、“海外腐敗防止法”または現地反腐敗法に基づいて責任を負う可能性があります。また、将来の規制要求の性質、範囲、影響を予測することはできず、私たちの国際業務はこれらの要求によって制約される可能性があり、現行の法律が管理または解釈される可能性がある方式を予測することもできない。
“収賄法”、“海外腐敗防止法”及びその他の法律を遵守することは高価で困難であり、特に腐敗は公認問題である国である。また,腐敗防止法は製薬業に特別な挑戦をもたらしており,多くの国では病院が政府によって運営されているため,反腐敗法により医師や他の病院従業員が外国人官僚とされている。臨床試験やその他の仕事に関連して医療提供者に支払われるいくつかの金は、政府関係者に支払われた不正金と考えられ、法執行行動につながっている。
私たちの業務は2017年の刑事金融法やCFA 2017にも制約されており、英国や海外での脱税を阻止できなかった犯罪も含まれている。この立法は、組織がその職員が故意かつ不誠実に他人の脱税の便宜を提供するために果たしたいかなる役割にも責任を負うことを要求しているが、これらの組織はこのような便利さを防ぐために合理的な努力をしていない。
私たちはまた、私たちの国際業務を管理する他の法律と法規を遵守しなければなりません。アメリカとイギリス政府及びヨーロッパ連合当局が管理する法規を含み、適用される輸出規制法規、ある国と個人に対する経済制裁と禁輸、反マネーロンダリング法、輸入と税関要求及び貨幣両替法規を含み、総称して貿易規制法と呼ばれます。このような貿易規制法は、禁輸国または制裁を受けている国、政府、個人、および実体への特定の製品およびサービスの販売または供給を制限または禁止することを含む。
私たちが適用されるすべての反腐敗法律、“収賄法”、“海外腐敗防止法”、“2017年CFA法”、あるいは貿易統制法を含む他の法律要件を遵守することを完全かつ効果的に確保することは保証されない。もし私たちが“収賄法”、“反海外腐敗法”、“CFA 2017”および他の腐敗防止法または“貿易規制法”を守らなければ、私たちは刑事と民事処罰、返還と他の制裁と救済措置、そして法律費用を受ける可能性があり、これは私たちの業務、財務状況、運営結果と
30
流動性です。同様に、米国、イギリス、または他の当局が“収賄法”、“海外腐敗防止法”、“2017年CFA法”、他の腐敗防止法または貿易統制法に違反する可能性があるいかなる調査も、私たちの名声、私たちの業務、運営結果、財務状況に悪影響を及ぼす可能性がある。また、国際ビジネス慣行を管理する法律を遵守しないことは、重大な民事·刑事罰および政府契約の一時停止または廃止を招く可能性がある。
もし私たちが環境、健康、安全の法律法規を守らなければ、罰金や処罰を受けたり、私たちの業務を損なう可能性のあるコストが発生するかもしれません。
私たちは多くの環境、健康と安全法律と法規の制約を受けて、それらの研究室の手続きと危険材料と廃棄物の処理、使用、貯蔵、処理と処理を管理する法律と法規を含む。私たちの業務および私たちが契約した第三者の業務は、化学品および生物材料を含む危険かつ可燃性材料の使用に関連する可能性があります。このような材料が汚染や傷害をもたらす危険は除去できない。もし危険な材料の使用によって汚染や損傷が生じた場合、私たちはそれによるいかなる損害に責任を負う可能性があり、責任金額は私たちの資源または私たちが契約した第三者の資源を超える可能性がある。民事や刑事罰金やこのような法律や法規を遵守しない罰に関する巨額の費用を招く可能性もある。
従業員の負傷によって発生する可能性のある費用と支出を支払うために労災賠償保険を維持しますが、この保険は十分な保険を提供できないかもしれません。私たちは私たちが提起した環境責任や有毒侵害請求に保険を提供することはできない。また、現在または未来の環境、健康、安全法律法規を遵守するためには、巨額のコストが生じる可能性がある。これらの現在または未来の法律法規は私たちの発見、臨床前開発、または生産努力を損なうかもしれない。私たちがこのような法律を守らないことはまた巨額の罰金、処罰、または他の制裁につながるかもしれない。
私たちの第三者への依存に関するリスク
私たちは依存し、引き続き第三者に依存して私たちの候補製品の臨床試験を行う予定です。これらの第三者が契約義務の履行、法規要件の遵守、または予想される最終期限までに完了できない場合、候補製品のマーケティング承認を得ることができないか、商業化される可能性があり、私たちの業務は深刻な損害を受ける可能性がある。
私たちは独立して臨床試験を行うことができない。私たちは医療機関、臨床研究者、契約実験室と他の第三者、例えばCROに依存して、私たちの候補製品の臨床試験或いは他の方法で支持します。私たちの候補製品の臨床試験性能はこれらの側に大きく依存すると予想される。しかし、私たちのすべての臨床試験が適用される案、法律と法規の要求、および科学的基準に基づいて行われることを確認する責任があります。
私たち、私たちの研究者と私たちのCROは、良好な臨床実践またはGCP、および臨床試験結果を行い、監視、記録、報告する他の関連要求を含む法規の遵守を要求され、データと結果が科学的に信頼性と正確であることを保証し、そして試験患者が臨床試験に参加する潜在的リスクを十分に理解し、彼らの権利が保護されることを保証する。これらの規定はFDA、欧州経済圏加盟国の主管当局と類似した外国の監督管理機関によって臨床開発中の任意の薬物に対して実行される。FDAは臨床試験スポンサー,主要研究者,試験地点を定期的に検査することでGCPを実行している。もし私たち、私たちの研究者、または私たちのCROが適用されたGCPを遵守できなかった場合、私たちの臨床試験で生成された臨床データが疑問視される可能性があり、FDAまたは同様の外国の規制機関は、私たちの上場申請の承認を考慮する前に追加の臨床試験を行うことを要求するかもしれない。検査後、FDAは将来のどの臨床試験もGCPに適合しているかどうかを確認することは保証できません。
また,われわれの臨床試験はcGMP製候補品を用いて行わなければならない。著者らの研究者或いはCROはこれらの要求を遵守できなかったか、或いはこれらの要求を遵守できなかった場合、著者らは臨床試験を繰り返す必要があるかもしれないが、これは上場承認過程を延期し、また私たちに法執行行動の影響を受ける可能性がある。私たちはまた、いくつかの臨床試験を登録し、これらの完了した臨床試験の結果を一定の時間範囲で政府援助データベースClinicalTrials.govに公表することを要求されており、これらの試験は、マーケティングによって承認された候補製品に関連している。そうしないと罰金、否定的な宣伝、そして民事と刑事制裁につながるかもしれない。
我々の候補製品のための臨床試験を設計する予定であるが,CROと個別現場調査者は臨床試験を管理する。したがって、私たちの開発計画の多くの重要な側面は、それらの実施とタイミングを含めて、私たちの直接制御範囲内ではないだろう。我々の第三者への将来の臨床試験への依存も,臨床試験により開発されたデータの管理の直接制御が我々が依存する場合よりも少なくなるであろう
31
完全に私たち自身のスタッフが担当します。外部の当事者とのコミュニケーションも挑戦的である可能性があり、ミスや協調活動の困難を招く可能性がある。外部の当事者は
これらの因子は第三者の臨床試験の意思や能力に悪影響を及ぼす可能性があり,われわれの制御範囲を超える意外なコスト増加に直面する可能性がある。もしCROが満足できる方法で臨床試験を行わなかった場合、彼らの私たちに対する義務に違反したり、規制要求を遵守できなかった場合、私たちの候補製品の開発、マーケティング承認、商業化が遅れる可能性があり、私たちはマーケティング承認を得られず、私たちの候補製品を商業化することができないかもしれません。あるいは私たちの開発計画は不可逆的な損害を受ける可能性があります。CROが収集した臨床データに依存できなければ,我々が行った任意の臨床試験の規模を繰り返し,延長あるいは増加させる必要がある可能性があり,商業化を著しく遅らせる可能性があり,支出を著しく増加させる必要がある。
もし私たちがこれらの第三者CROとのいかなる関係も終了すれば、私たちは代替CROと合意できないかもしれない。もしCROがその契約の義務または義務を成功裏に履行できなかった場合、または予想された最終期限内に完了した場合、彼らが交換する必要がある場合、または彼らが得た臨床データの品質または正確性が、我々の臨床方案、規制要件または他の理由を遵守できないことによって影響を受け、CROに関連する任意の臨床試験が延長、延期または終了される可能性があり、私たちは私たちの候補製品のマーケティング承認または商業化に成功することができないかもしれない。したがって、私たちの財務業績と私たちの候補製品のテーマ指示におけるビジネスの見通しが損なわれ、私たちのコストが増加する可能性があり、私たちの収益能力が遅れる可能性があると思います。
第三者と契約を結び,臨床前研究や臨床試験の候補製品の製造·出荷を行い,商業化を継続する予定である。このような第三者への依存は、許容可能なコストで十分な数の候補製品または薬物またはそのような数を得ることができないリスクを増加させ、これは、私たちの開発または商業化努力を延期、阻止、または損害する可能性がある。
私たちは現在所有したり運営したりしていないし、未来にどんな製造施設や人員を設立する計画もない。私たちは依存し、引き続き第三者に依存して、臨床前研究および臨床試験のための候補製品の製造と輸送、および任意の候補製品が発売承認された場合、私たちの薬物の商業生産に使用されることが予想される。このような第三者への依存は、許容可能なコストまたは品質で十分な数の候補製品または薬物またはそのような数を得ることができないリスクを増加させ、これは、私たちの開発または商業化努力を延期、阻止、または損害する可能性がある。
我々の候補製品を生産するための施設はFDAが検査に基づいて評価しなければならず,検査はcGMPに適合することを確保するためにFDAにマーケティング申請を提出した後に行われる.私たちは私たちの候補製品の製造と輸送過程を制御しません。私たちの契約メーカーは私たちの候補製品の製造と輸送に関連するcGMPに完全に依存します。もし私たちの契約メーカーが私たちの規格やFDAや他の機関の規制要件に合った材料の製造と輸送に成功しなければ、私たちは彼らの製造施設で生産された製品を使用することができないだろう。しかも、私たちの契約製造業者が十分な品質管理、品質保証、合格者の能力を維持することを制御することはできません。FDAや同様の外国規制機関がこれらの施設がcGMPに適合していないことが発見された場合、承認されれば、私たちの候補製品を開発、獲得、またはマーケティングする能力に深刻な影響を与える代替製造施設を探す必要があるかもしれない。さらに、私たちまたは私たちの第三者製造業者がこれらまたは他の適用法規を遵守できなかったことは、臨床隔離、罰金、禁止、民事処罰、遅延、承認の一時停止または撤回、許可証の取り消し、候補製品の差し押さえまたはリコールまたは薬物(承認された場合)、運営制限、および刑事起訴を含む制裁を実施する可能性があります。
私たちは第三者製造業者とどんな合意も確立できないかもしれないし、受け入れられる条項でそうすることができないかもしれない。たとえ第三者製造業者と合意できても、第三者メーカーに依存することは、追加的なリスクをもたらす
32
私たちの候補製品と私たちが開発する可能性のある他の任意の薬物は、他の候補製品や承認された薬物と生産施設を競争するかもしれない。CGMP法規の下で運営されているメーカーの数は限られており、私たちのために製品を製造する能力があるかもしれない。
私たちの既存または未来のメーカーのどんな業績失敗も、臨床開発やマーケティング承認を延期する可能性がある。もし私たちの現在の契約製造業者が合意通りに履行できなければ、私たちはこれらのメーカーの交換を要求されるかもしれない。いくつかの潜在的な代替メーカーが私たちの候補製品を生産できると信じていますが、そのような代替製品を決定して同定する際に、追加のコストと遅延が生じる可能性があります。
私たちの候補製品や薬物の生産と輸送における将来の他者への依存は、私たちの将来の利益率と、私たちが適時かつ競争力のある上場承認された薬物商業化の能力に悪影響を及ぼす可能性があることを現在と期待しています。
私たちまたは私たちの第三者製造業者は、私たちの候補製品の開発を遅延または阻止し、承認された製品を商業化するのに十分な品質と数量で私たちの候補製品の生産を成功させることができないかもしれません。
私たちの候補製品の大規模な臨床試験を行うためには、それらを大量に生産する必要がある。私たちまたは私たちの任意の製造パートナーは、私たちの任意の候補製品の製造能力をタイムリーに、または費用効果的に向上させることに成功できないかもしれない、または全くできないかもしれない。また,拡張活動中に品質の問題が生じる可能性がある.もし私たちまたは任意の製造パートナーが私たちの候補製品の生産規模を十分な品質と数量で成功的に拡大することができなければ、その候補製品の開発、テスト、および臨床試験は延期または不可能になる可能性があり、任意の最終製品の規制承認や商業発表は延期または獲得できない可能性があり、これは私たちの業務を深刻に損なう可能性がある。
私たちはある候補製品に活性薬物成分、調合と薬品を提供する第三者は私たちの唯一の供給源であり、生産能力は限られており、その中のどのサプライヤーを失っても私たちの業務を損害する可能性がある。
私たちのいくつかの候補製品の原料薬、調合と薬物製品はすべて生産能力の限られた単一供給者から提供されました。著者らは著者らの候補製品の開発に成功し、そして最終的に十分な数量の商業薬物を提供して市場需要を満たすことができるかどうかは、ある程度私たちがcGMP要求に基づいて原料薬、調合と薬物製品を獲得できるかどうかに依存し、そして商業化と臨床試験に十分な数量がある。
私たちのサプライヤーが私たちの需要を満たすことができるかどうかは、私たちがこれらのサプライヤーと合意した性質のせいか、私たちが現在これらのサプライヤーとの経験から、あるいは私たちの顧客としてのこれらのサプライヤーに対する相対的な重要性のためである。過去の表現によると、私たちは彼らが未来に私たちの需要を満たす能力を評価することが難しいかもしれない。私たちのサプライヤーは過去に彼らの製品に対する私たちの需要を適時に満たすことができますが、彼らは将来私たちの需要を彼らの他の顧客に従属するかもしれません。
私たちのすべての候補製品について、私たちはFDAに秘密保持協定を提出する前に、またはEMAにMAAを提出する前に、より多くの製造業者に原料薬、調合、および医薬製品を提供することを決定し、資格を得るつもりだ。必要であれば、私たちの候補製品原料薬、調合、および薬物製品のための追加または交換の供給者を確立することは、すぐには完了しないかもしれない。もし私たちが代替サプライヤーを見つけることができれば、この代替サプライヤーは合格する必要があり、そうでなければ、私たちは比較研究を行い、新しいメーカーの薬物製品とすべての完成した臨床試験で使用された製品を比較しなければならないかもしれない。このすべてのことは追加的なマーケティング承認を必要とするかもしれないが、これはさらに遅延を招くかもしれない。私たちの候補製品のために十分な原料薬、調合、および薬品在庫を維持することを求めているが、任意の構成要素または材料供給の中断または遅延、または代替源からこのような原料薬、調合および薬品を許容可能な価格で得ることができず、私たちの開発努力を阻害、遅延、制限または阻害する可能性がある。
33
私たちは候補製品を発見したり開発したりするために未来に第三者と協力する可能性がある。もしこのような協力が成功しなければ、私たちの業務は不利な影響を受けるかもしれない。
私たちはすでに未来に第三者と協力することができた。2021年12月31日、ProTdesの設計、合成、表現、評価についてカーディフ大学および大学アカデミーカーディフコンサルティング株式会社(またはカーディフコンサルティング)と合意した研究、協力および許可協定、またはカーディフ合意は、その条項によって満了しました。満了に関連して、私たちは、カーディフ協定項目の下の権利を行使し、カーディフ大学がカーディフ協定の日に所有または制御されたProTide関連知的財産権、またはこのプロトコルの有効期間内にカーディフ大学によって所有または制御されたProTide関連知的財産権(我々はカーディフ知的財産権と呼ぶ)を行使し、カーディフ協定に従って3ヶ月間NuCanaに付与され、カーディフ協定の満了から計算して、カーディフ協定に従って生成された追加のProTideを評価し続ける。この期限は2022年3月31日に満期となる。協定条項及びその満期に関するより多くの情報は、本年度報告書の“連携·許可協定−カーディフ大学許可”を参照されたい。私たちはこれ以上カーディフ協定を更新しないことを選択したが、カーディフ協定の満了は私たちがより多くのProTideを識別し開発する能力を低下させるかもしれない。
我々が参加可能な任意の連携において,ProTideの開発(適用すれば)を含めて,我々の協力者が協調作業に用いる資源の数や時間を限られた制御を行う予定である.私たちがそのような計画の中から潜在的な追加のProTideを生成する能力は、私たちと私たちの協力者がこれらの手配の中で私たち一人一人に割り当てられた機能を成功的に履行する能力に依存するだろう。また,我々の協力者は研究や開発プロジェクトを放棄し,適用されるプロトコルを終了する権利がある.私たちの以前の協力と私たちが未来に行ったどんな協力も、以下のリスクを含むいくつかのリスクをもたらすかもしれない
34
もし私たちの協力が製品の開発と商業化に成功しなかった場合、あるいは私たちの協力者が私たちとの合意を終了した場合、私たちは協力によって未来の研究資金、マイルストーン、印税支払いを得ることができないかもしれない。もし私たちがこれらの合意に基づいて期待した資金を受け取っていなければ、私たちの候補製品の開発は延期されるかもしれません。私たちは私たちの候補製品を開発するために追加の資源が必要かもしれません。また、私たちの協力者が私たちとの合意を終了すれば、私たちは新しい協力者を引き付けることがもっと難しくなるかもしれませんが、ビジネスや金融界での私たちのイメージは悪影響を受ける可能性があります。本年度報告書に記載されている製品開発、規制承認、商業化に関するすべてのリスクは、我々の協力者の活動にも適用される。
私たちは将来、製薬やバイオテクノロジー会社や他の組織と協力して、私たちの候補製品を開発し、潜在的な商業化を行うことにするかもしれない。これらの関係、または同様の関係は、非日常的な費用や他の費用を発生させ、短期的および長期的な支出を増加させ、既存の株主を希釈したり、私たちの管理や業務を混乱させたりする証券を発行する必要があるかもしれない。また、適切な協力者を探す上で、私たちは激しい競争に直面する可能性があり、交渉過程は時間がかかり複雑である。我々が最終的な協力合意を達成できるかどうかは,他の事項に加えて,協力者の資源や専門知識および提案協力の条項や条件の評価に依存する.もし私たちが候補製品に許可すれば、私たちがこれらの取引を私たちの既存の運営と戦略と組み合わせることに成功できなければ、私たちはこのような取引の利点を実現できないかもしれない。
もし私たちがカーディフProTdes株式会社との許可と協力協定で規定された義務を履行しなければ、私たちはいくつかの潜在的な候補製品の開発と商業化に必要な許可と知的財産権を分配する権利を失う可能性がある。
私たちはAcelarinおよび他の潜在的なProTideに関連するいくつかの特許を得るために、カーディフProTdes株式会社と独占的なグローバル譲渡、許可、および協力協定を締結した。この協定は私たちに様々な開発、商業化、特許権使用料の支払い、勤勉さ、その他の義務を課している。他の義務では、私たちは特に要求されている:カーディフProTideの潜在的なマイルストーン支払い;このような製品の売上の中の上位数パーセントに相当するカーディフProTide特許権使用料を支払うこと;再許可された人の売上を含む;商業的に合理的な努力を使用して製品を市場に出すこと;カーディフProTdesに開発および財務報告を提供すること;特許権を提出、起訴、弁護および維持すること;特定のクレームに対してカーディフProTdesを賠償し、保険カバー範囲を維持すること;および特定の化合物に関連する未来の薬物化学作業を優先的に指導すること。
もし私たちがこれらの義務のいずれかに違反した場合、カーディフProTdesは許可を終了する権利がある可能性があり、本プロトコルに従って私たちに割り当てられた知的財産権をカーディフProTdesに再譲渡することを要求することは、許可された知的財産権または知的財産権の譲渡または競争相手が許可された知的財産権を獲得したり、知的財産権を譲渡したりすることによってカバーされた製品を開発、製造、販売することができないことになる。
私たちの候補製品の商業化に関するリスク
たとえ私たちのすべての候補製品が市場の承認を得ても、医師、患者、第三者支払人、医学界の他の人が商業成功に必要な市場受容度を得ることができない可能性がある。
もし私たちのすべての候補製品が市場の承認を得たら、それはまだ医者、患者、第三者支払人と医学界の他の人の十分な市場受容度を得ることができないかもしれない。もし私たちの候補製品が十分な受容度に達していなければ、著しい製品収入が生じないかもしれませんし、できないかもしれません
35
利益が高い。もし私たちの候補製品が商業販売に使用されることが許可されれば、市場の受け入れ度は多くの要素に依存するだろう
私たちは激しい競争に直面していますが、これは他の人たちが私たちよりも製品の発見、開発、商業化に成功する可能性があります。
新薬製品の開発と商業化競争は激しい。私たちの現在の候補製品は競争に直面しており、将来的に開発または商業化を求める可能性のある任意の候補製品も、世界各地の主要な製薬会社、専門製薬会社、バイオテクノロジー会社からの競争に直面するだろう。現在,多くの大手製薬やバイオテクノロジー会社が製品をマーケティング·販売しているか,あるいは我々が開発している候補製品の疾患適応を治療するための製品を開発している。競争力のある製品および療法のいくつかは、私たちの方法と同じまたは類似した科学的方法に基づいており、他のいくつかは完全に異なる方法に基づいている。潜在的な競争相手はまた学術機構、政府機関とその他の公共と個人研究組織を含み、これらの組織は研究を展開し、特許保護を求め、研究、開発、製造と商業化のための協力手配を確立する。
具体的には、多くの主要な製薬会社やバイオテクノロジー会社を含む多くの会社が癌治療法を開発またはマーケティングしている。NUC−3373が承認された場合、(A)5−FUを含む既存の化学療法薬、(B)既存の標的療法または免疫療法、承認された場合、標的療法または免疫療法が癌患者の臨床試験に使用され、(C)将来承認される可能性のある複数の承認された薬剤、またはNUC−3373の適応を開発することが可能な薬剤となる。NUC−7738が承認された場合、それは、既存の化学療法薬および複数の承認された薬剤または将来承認される可能性のある薬物と競合し、NUC−7738の適応を開発する可能性がある。我々が競合する可能性のある既存の化学療法薬は,5−FUやゲムシタビンを含め,特許下になく,多くの後発薬メーカーによって生産されている。したがって,承認されれば,これらの化学療法薬は患者にとってわれわれのProTide候補薬を含む多くの他の潜在療法よりもはるかに安価になり続ける。
もし私たちの競争相手が私たちが開発する可能性のある任意の製品よりも安全で、より効果的で、より便利で、より安価で、あるいは副作用が少なく、または深刻でない製品を開発し、商業化すれば、私たちのビジネス機会は減少または消失する可能性がある。私たちの競争相手も私たちよりも早くFDAや他の製品の発売承認を得ることができ、これは私たちの競争相手が市場に参入したり、私たちのマーケティング承認を遅らせることができる前に強力な市場地位を確立することができるかもしれません。競争の成功に影響するいくつかの重要な競争要素
36
私たちのすべての候補製品は、承認されれば、それらの治療効果、安全性、利便性、価格及び政府と他の第三者支払人が精算できるかどうかによる可能性が高いです。
私たちと比較して、私たちが競争しているか、あるいは将来競争する可能性のある多くの会社は、研究開発、製造、臨床前研究、臨床試験を行い、マーケティング許可とマーケティング承認製品を獲得する上で、より多くの財務資源と専門知識を持っている。製薬とバイオテクノロジー産業の合併と買収は、私たちの数の少ない競争相手により多くの資源を集中させる可能性がある。規模の小さいスタートアップ企業も重要なライバルとなる可能性があり、特に大手や成熟会社との連携で手配されている。これらの第三者は合格した科学と管理人員を募集と維持し、臨床試験場と臨床試験患者の登録を確立し、著者らの計画を獲得し、あるいは必要な技術を提供する方面で私たちと競争を展開する。
私たちがどんな候補製品を商業化することができても、これらの薬物は不利な価格設定法規や第三者保険と清算政策の制約を受ける可能性がある。
新薬の発売承認、定価と精算を管理する規定は国によって異なる。一部の国は薬品の販売価格が承認されてから発売されることを要求している。多くの国で、定価審査期間は発売が承認された後から始まる。一部の外国市場では、処方薬の定価は初歩的な承認を得た後も、政府の持続的なコントロールを受けている。したがって、特定の国/地域で候補製品のマーケティング承認を得ることができるかもしれないが、その後、価格法規の制約を受け、これらの規制は、私たちの候補製品の商業発表を遅らせることができ、長い間延期される可能性があり、その国/地域で候補製品を販売することによって生じる収入に悪影響を及ぼす可能性がある。不利な価格設定制限は、私たちの候補製品が市場承認を得ても、1つ以上の候補製品への投資を回収する能力を阻害する可能性がある。
私たちは任意の候補製品を商業化することに成功しているかどうか、承認されれば、政府当局、個人健康保険会社、および他の組織がこれらの候補製品および関連治療に提供する保険範囲と十分な補償にある程度依存するだろう。米国では,連邦医療保険下の新薬のカバー範囲と精算に関する主な決定は米国衛生·公衆サービス部(HHS)内の1機関CMSによって行われている。個人支払者は最終的に彼らがどの薬を保証するかと、彼らが保険薬に提供する精算金額を決定します。支払者間には保険や補償決定のための統一的な制度はないが,個人支払者はCMSに大きく従うことが多い。CMSが精算にどのような決定を下すのか予測するのは難しい。ヨーロッパの清算機関はCMSよりもっと保守的かもしれない。例えば、一部の抗がん剤はアメリカでは通常保険と費用の支払いがありますが、一部のヨーロッパ諸国ではまだ精算が許可されていません。アメリカの医療業界と他の地域の主な傾向の一つはコストコントロールだ。政府当局と第三者支払者は、特定の薬品のカバー範囲と支払金額を制限することでコストを抑制しようとしている。ますます多くの第三者支払人は製薬会社に価格に基づいて所定の割引を提供し、薬品の定価に挑戦することを要求している。FDAや他の同様の規制承認を得るために必要な高価な研究に加えて、カバーと精算を確保するために、その製品の医療必要性と費用効果を証明するために、高価な薬物経済学研究を行う必要があるかもしれない。私たちが商業化したどの候補製品にもカバー範囲があることを確実にすることはできません。カバー範囲が利用可能であれば、支払いレベルを決定することはできません。精算は私たちが市場で承認された任意の候補製品の需要や価格に影響を及ぼすかもしれない。清算が得られない場合や限られたレベルに限られていれば、マーケティングの承認を得た任意の候補製品を商業化することに成功できないかもしれません。さらに、上述したように、2022年のIRAは、2026年の支払い年度からCMSに対していくつかの薬品価格の交渉を開始することを含む、連邦医療保険計画および米国全体の薬品価格に影響を与える可能性のある複数の条項を含む。CMSは最近これらの新しい認可を実施し始めたにもかかわらず,米国の製薬業や薬物開発活動への影響はまだ確定していない。
新たに承認された薬物は精算を得る上で大きな遅延がある可能性があり,カバー範囲はFDAや米国以外の同様の規制機関がこの薬物を承認する目的よりも限られている可能性がある。さらに、補償を受ける資格があるということは、いかなる薬物もすべての場合に支払われることを意味するわけではなく、または支払いの費用は、研究、開発、製造、販売、および流通を含む私たちのコストをカバーするであろう。もし適用されれば、新薬の一時精算レベルも私たちのコストを支払うのに十分ではないかもしれないし、永久的にならないかもしれない。販売率は薬物の使用や臨床環境によって異なる可能性があり,すでに低コスト薬物のために設定された精算レベルに基づいている可能性があり,他のサービスの既存支払いにも組み込まれている可能性がある。医薬品の正味価格は、政府医療計画または個人支払者が要求する強制的な割引またはリベート、および将来、米国価格よりも低い価格で販売される可能性のある国から医薬品を輸入することを制限する法律の緩和によって低下する可能性がある。政府の資金援助や
37
私たちが開発した承認された薬物の個人支払者は、私たちの経営業績、薬品の商業化に必要な資金を調達する能力、および私たちの全体的な財務状況を損なう可能性があります。
私たちには現在マーケティング能力や販売チームがありません。有効な販売能力またはマーケティング能力を確立することができない場合、または当社の候補製品を販売またはマーケティングするために第三者と合意できない場合、(承認された場合)、または製品収入を効率的に販売またはマーケティングすることができない可能性がある。
私たちには現在マーケティング能力や販売チームはありませんが、主要市場(例えばアメリカやヨーロッパ)で規制承認された候補製品を商業化したり、商業化に参加したりするつもりです。これはこのような市場に専門的な販売チームと他の商業能力を構築する必要があるかもしれない。販売およびマーケティングの責務を保持する任意の承認された候補製品をビジネスに成功させるためには、私たちの販売、マーケティング、管理、および他の非技術的能力を確立するか、または第三者とこれらのサービスを実行することを手配しなければならない。私たち自身の販売とマーケティング能力の確立、および第三者とこれらのサービスを実行する計画を達成することはリスクに関連している。例えば、販売チームの採用と訓練は高価で時間がかかり、どんな薬の発売も延期される可能性がある。販売チームを募集し、マーケティング能力を確立する候補製品の商業発表が何らかの理由で延期または発生していない場合、これらの商業化費用を早期または不必要に発生させる。これは費用が高いかもしれません。もし私たちが私たちの販売とマーケティング担当者を維持したり再配置できなければ、私たちの投資は損失します。
候補製品の商業化を阻害する可能性がある要素は
もし私たちが第三者と販売、マーケティング、流通サービスの手配を達成すれば、私たちの薬品収入またはこれらの薬品収入は私たちの収益性が私たち自身が開発した任意の候補製品をマーケティングし、販売する場合よりも低いかもしれません。さらに、私たちは、私たちの候補製品の販売およびマーケティングの手配を第三者と成功的に達成できないかもしれないし、必要なときに、または私たちに有利な条項でそうすることができないかもしれません。私たちはこれらの第三者に対して支配権がほとんどない可能性が高く、彼らのいずれも必要な資源と注意力を投入して、私たちの候補製品を効果的に販売し、マーケティングすることができないかもしれません。もし私たちが販売やマーケティング能力を確立することに成功しなければ、私たち自身も第三者と協力しても、私たちがマーケティング承認を得た候補製品を商業化することに成功しない、あるいはそのような商業化は遅延や制限に遭遇する可能性があります。
我々の内部コンピュータシステム、または我々のCROまたは他の請負業者またはコンサルタントのシステムは、障害が発生したり、ネットワークセキュリティイベントが発生したりする可能性があり、これは、私たちの製品開発計画が実質的に破壊され、私たちに責任を負わせる可能性があります。
許可を得て運営するシステム及びネットワークを含む情報技術システム及びネットワークを使用する
当社のトラフィック·アクティビティに関連する電子情報を処理、送信、および格納するために、サード·パーティによってホストされる。デジタル技術の使用がますます多くなるにつれて、意図的な攻撃と不正なコンピュータシステムおよびネットワークへの不正アクセスの試みを含むネットワークセキュリティイベントは、頻度および複雑性において増加し、発見がますます困難になっている。これらの脅威は,我々のシステムとネットワークのセキュリティ,および我々のデータの機密性,可用性,信頼性,十分性,完全性にリスクを構成する.私たちがサイバー攻撃を防ぐことに成功したり、その影響を軽減することに成功する保証はない。
セキュリティ対策が実施されているにもかかわらず、我々の内部コンピュータシステムおよび私たちのCROおよび他の第三者請負者およびコンサルタントのコンピュータシステムは、ハッカー、コンピュータウイルス、マルウェア(恐喝ソフトウェア、ソフトウェアエラー、許可されていないアクセス、自然災害、テロ、戦争および電気通信、デバイスおよび電気故障を含む)の破損または中断を受けやすい。
我々は,必要に応じてこのようなネットワークセキュリティイベントやプライバシーやセキュリティタスク違反行為の発見と対応を防止し,対応するための措置をとっている.私たちの予防、発見、対応、そしてこのようなリスクをできるだけ減らす措置は成功しないかもしれない。私たちの知る限りでは重大なシステム故障や事故は経験していませんが
38
これまで、重大なネットワークセキュリティ事件が発生し、私たちの運営や私たちと契約した第三者の運営中断を招くと、法的損害を招き、私たちの計画、業務運営、および私たちの財務状況に実質的な中断をもたらす可能性があります。例えば、私たちの任意の候補製品の完成または行われている臨床試験における臨床試験データの損失は、私たちの開発および規制承認作業の遅延を招き、データを回復または複製するコストを著しく増加させる可能性がある。そのような損失はまた私たちを規制法執行、民事責任、そして名声被害に直面させるかもしれない。任意の中断またはネットワークセキュリティイベントが、私たちのデータまたはアプリケーションの損失または破損、または不適切な開示、損失、腐敗、機密または独自の情報、個人データ、臨床試験データまたは健康情報を修正または窃取した場合、責任を招くことに加えて、候補製品のさらなる開発が延期される可能性があり、または私たちの競争地位が損なわれる可能性がある。さらに、このような中断またはネットワークセキュリティイベントは、個人訴訟、巨額の救済費用、私たちの開発計画、業務運営および協力の中断、管理作業の移転、および私たちの名声への損害など、米国、イギリス、または外国規制機関の法執行行動、規制処罰、および他の法的責任をもたらす可能性があり、これらすべてが私たちの業務および運営を損なう可能性がある。
私たちに対する製品責任訴訟は、私たちが重大な責任を負い、私たちが開発する可能性のある任意の製品の商業化を制限する可能性があります。私たちが十分な保険を受けることができない場合、あるいは私たちの保険範囲から除外されたり、私たちの保険範囲を超えたクレームによって生じる責任の支払いが要求された場合、重大な責任クレームは私たちの財務状況に悪影響を及ぼす可能性があります。
人体臨床試験では、私たちの候補製品の評価に関連する固有の製品責任リスクに直面しており、私たちが開発可能な任意の製品を商業化販売すれば、より大きなリスクに直面する。もし私たちが私たちの候補製品や製品に被害を与えるクレームを自己弁護することに成功できなければ、私たちは大きな責任を招くだろう。是非曲直や最終結果にかかわらず、賠償責任は
私たちは製品責任保険の範囲を維持しているにもかかわらず、私たちの製品責任保険は私たちが発生する可能性のあるすべての責任をカバーするのに十分ではないかもしれない。私たちの臨床試験の拡大に伴い、あるいは候補製品を商業化し始めたら、私たちの保険カバー範囲を増やす必要があるかもしれません。保険範囲はますます高くなっています。私たちは可能などんな責任にも対応するために、合理的な費用や十分な金額で保険範囲を維持することができないかもしれない。
私たちの知的財産権に関するリスクは
もし私たちが私たちの技術や製品のために知的財産権保護を獲得して維持することができない場合、あるいは獲得された知的財産権保護範囲が十分でなければ、私たちの競争相手は私たちと似たような技術や製品を商業化する可能性があり、私たちの技術と製品を商業化することに成功する能力は損なわれる可能性がある。さらに、私たちが他人の有効な特許権を侵害した場合、私たちは私たちの製品の製造、使用、または販売を阻止されるか、または損害賠償または処罰を受ける可能性があります。
私たちの成功は、私たちのノウハウや製品を十分に保護しているアメリカや他の国で特許を取得し、維持する能力に大きく依存している。私たちの特許地位を保護するために、私たちはアメリカと外国で特許出願を提出し、私たちの新製品候補とその用途、薬物調合と投与量、およびそれらの製造プロセスをカバーした。私たちの特許の組み合わせは現在特許と特許出願を含んでいる。
特許訴訟過程は高価で時間がかかる。私たちは必要または望ましいすべての特許出願を合理的な費用またはタイムリーに提出して起訴することができないかもしれない。特許を申請しないことを選ぶことができます
39
特定の革新を保護し、特定の司法管轄区域で特許保護を求めないことを選択することができる。特定の管轄区域の法律によると、特許または他の知的財産権は入手できないか、または範囲が限られている可能性がある。我々は,特許保護を受けるのが遅くなるまで,我々の研究や開発の可能な特許面を特定できない可能性もある.
私たちは現在、私たちの特許と特許出願を独占的に所有または独占的に許可しており、私たちは許可内の特許出願の起訴を制御する権利がある。将来的には、私たちは、私たちのビジネス目標に有用または必要な追加特許、または第三者からの特許出願を許可することを選択するかもしれない。私たちはこのような特許出願の準備、提出、起訴、または維持を制御する権利がないかもしれない。したがって、もし私たちが将来的により多くの特許または特許出願を許可した場合、これらの特許および出願は、私たちの業務の最適な利益に合った方法で起訴され、強制的に実行されないかもしれない。
バイオテクノロジーと製薬会社の特許地位は通常高度に不確定であり、複雑な法律と事実問題に関連しており、近年多くの訴訟のテーマとなってきた。科学文献で発表された発見は往々にして実際の発見に遅れており、米国と他の司法管轄区の特許出願は通常、申請18ヶ月後に発表され、時には全く発表されないこともある。したがって、私たちは、私たちが所有または許可している特許または出願中の特許出願において最初に要求された発明であるか、またはそのような発明のための最初の特許保護であるかを正確に知ることができない。したがって,我々の特許権の発行,範囲,有効性,実行可能性,商業的価値は高い不確実性を持っている.私たちの未解決および未来の特許出願は、私たちの技術または製品の全部または一部を保護するために、または他社が競争相手の技術および製品を商業化することを効果的に阻止するために、特許の発行を招くことができないかもしれない。米国や他の国の特許法や特許法解釈の変化は,我々の特許の価値を低下させたり,我々の特許保護の範囲を縮小したりする可能性がある。
特許改革立法は、私たちの特許出願をめぐる起訴と、私たちが発表した特許の実行または保護の不確実性とコストを増加させるかもしれない。2011年9月16日、“ライシー·スミス米国発明法”または“ライシー·スミス法案”が法律に署名された。“ライシー·スミス法案”は米国特許法を多くの重大な改正を行った。このような条項は特許出願起訴方式に影響を与える条項を含み、特許訴訟に影響を及ぼす可能性もある。米国特許商標局(USPTO)は、Leahy-Smith法案の管理を管理するための新しい法規や手続きを制定し、Leahy-Smith法案に関連する多くの特許法が実質的に改正され、特に最初の提出条項の改正が2013年3月16日に施行された。“ライシー·スミス法案”には、いくつかの新たな行政対抗プログラムも生まれており、以下ではこれについて議論する。Leahy-Smith法案が我々の業務運営にどのような影響を与えるかは不明である(もしあれば)。しかしながら、“ライシー·スミス法案”およびその実施は、我々の特許出願をめぐる起訴および我々が発行した特許の実行または保護の不確実性およびコストを増加させる可能性がある。
過去数年間、米国最高裁判所は特許事件においていくつかの意見を発表し、多くの人はこれらの意見が米国の特許保護を弱める可能性があると考えているか、ある場合に利用可能な特許保護範囲を縮小し、いくつかのタイプの革新は特許を申請できないと考えているか、または通常は他の方法で裁判所が特許を無効にしやすいようにしている。また,最近では米国や他の国の特許法をより多く改正することが提案されており,採択されれば,我々のノウハウのために特許保護を受ける能力,あるいは我々のノウハウを実行する能力に影響を与える可能性がある。米国議会、米国裁判所、米国特許商標局、および他の国の関連立法機関の将来の行動によれば、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、それによって、私たちが新しい特許を獲得したり、私たちの既存の特許と将来獲得可能な特許を実行する能力を弱める可能性がある。
私たちの特許出願が特許の形で発表されても、それらの発表形態は私たちに何の意味のある保護を提供してくれず、競争相手が私たちと競争することを阻止したり、他の方法で私たちにどんな競争優位性を提供してくれたりしないだろう。私たちの競争相手は、非侵害的に類似または代替技術または製品を開発することによって、私たちの所有または許可された特許を迂回することができるかもしれない。
特許の発行は、その発明性、範囲、有効性、または実行可能性に対して決定的ではなく、私たちが所有し、許可している特許は、米国および他の国の裁判所または特許庁で挑戦される可能性がある。このような挑戦は、排他性喪失、または特許主張の全部または部分的な縮小、無効、または実行不能をもたらす可能性があり、これは、他人が類似または同じ技術および製品を使用することを阻止するか、またはそれを商業化する能力を制限するか、または我々の技術および製品の特許保護期間を制限する可能性がある。特に、疑似製薬会社のような第三者は、配合やプロセス事項に関する知的財産権を含む我が国特許に近い知的財産権の開発や取得を求めることができ、非侵害的に行うことができる可能性がある。さらに、新製品候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。私たちは所有し許可を得ました
40
特許の組み合わせは、他の会社が私たちと似ているか同じ製品を商業化することを排除するのに十分な権利を提供してくれないかもしれない。同様に、裁判所は私たちが侵害した第三者特許を決定し、それを支持して実行することができ、これは私たちが私たちの製品を製造、使用、または販売することを損害または阻止するだろう。
米国及び大多数の外国の特許訴訟中に、第三者は、競争相手の特許発行を阻止しようとする以前の技術又は論拠を審査特許庁に提出することができる。例えば、我々の係属中の特許出願は、第三者が以前の技術の発行前に米国特許商標局またはヨーロッパの第三者に提出する必要がある可能性がある。このような提出は特許庁がその特許を発行しないように説得するかもしれない。さらに、我々の特許および特許出願によって提供される保護の広さまたは強度がしたがって、このような第三者が提出されて減少した場合、それによって生じる特許の価値に影響を与えるか、または企業が現在または将来の候補製品を許可、開発、商業化することを阻止するか、または会社が私たちと協力し、許可し、開発または商業化することを阻止する可能性がある。私たちはまた、私たちの特許地位を強化するために特許の再発行を求めることができるが、このような再発行の請求は新しい特許の発表を招くことはなく、最初に発表された特許の損失を招く可能性がある。
ここに記載されている私たちの特許および他の知的財産権に関連するリスクは、現在許可されているか、または将来許可される可能性のある任意の知的財産権にも適用される。場合によっては、私たちは私たちが許可した特許の起訴、保守、または強制執行を制御できない可能性があり、私たちの許可者は、許可された特許を取得、維持、および強制執行するために必要または適切だと思うステップを取ることができないかもしれない。
我々の技術および製品の知的財産権を獲得することを求める第三者は、米国および他の司法管轄区域で特許出願を付与することによって、このような権利を得ることに成功する可能性があり、もし私たちの任意の候補製品のために付与された知的財産権を守ることを余儀なくされた場合、私たちは、米国特許商標局または同様の非米国規制機関のコストの高い訴訟や他の行政訴訟に巻き込まれる可能性があり、これは、現在または将来の候補製品の開発および商業化を延期または阻止する可能性がある。
我々のような急速に発展する技術環境では,生物製薬薬の開発は本質的に不確実であり,このような環境では,いつでも多くの特許出願が複数の管轄区域で待機している可能性があり,その多くは提出時に秘密であり,同じまたは同様の技術に関連している。第三者に発行される任意の特許は、私たちの特許と衝突する主張を含む可能性があり、私たちの製品および技術の商業的可能性に制限を与える可能性があります。例えば、米国を含むいくつかの国と地域において、光遺伝子生物医療技術有限会社または蘇州に本部を置く製薬会社光明遺伝子中国は、Acelarin製造プロセスの様々な側面に関連して、発表され、許可されている、または出願されているいくつかの特許出願を提出していることが知られている。BrightGeneのプロセス特許出願は無効であると考えられているが、このような出願に挑戦することは、米国特許商標局、米国連邦裁判所、または他の国の裁判所または特許庁にコストの高い特許訴訟またはいくつかの他の行政訴訟を提起させる可能性がある。これらの活動は私たちに大きなコストをもたらす可能性があり、私たちの管理者と技術者の仕事の分流を招く可能性がある。
また,光明遺伝子は米国や他のいくつかの国でアクラリンの成分に対して特許要求を行っている。私たちはアクラリン物質の構成に関する彼らの表現が無効だと思う。米国特許商標局は、我々が以前出願した特許と比較して新規性に乏しいため、米国における光明遺伝子のAcelarinに対する声明を拒否した。日本やカナダではBrightgeneに特許が発行され,物質成分クレームがAcelarinに提出されており,これらの特許は無効であり,原因は米国特許商標局が述べた原因と同様であると考えられる。これらの特許は、日本およびカナダで処理され、他の管轄区域で発行される可能性のある任意の同等の特許は、異議、特許訴訟、または他の必要な行政訴訟を行う必要がある可能性があり、これは高価で時間がかかる可能性がある。このような付与された特許に挑戦したり,挑戦に成功しなかったりすることを選択しなければ,Brightgeneは特許侵害訴訟を起こす可能性があり,我々にとっては,その特許の無効性を決定するための挑戦も高価で時間がかかる可能性がある.これらの活動はまた、私たちの大量のコストを招く可能性があり、私たちの管理と技術者の努力の大量の移転を招く可能性がある。
このような訴訟や訴訟の不利な結果は、第三者から論争のある権利を得る必要があり、または合理的な条項で提供されない可能性がある)、または私たちの技術の使用を停止することを要求するかもしれません。これは、現在または将来の候補製品の開発および商業化を延期または阻止する可能性があります。もし私たちが特許訴訟や他の行政訴訟に従事して私たちの特許を守ることができなければ、私たちが私たちの特許を守ることに成功する保証はありません。これは、私たちが疑問視されている特許権を失い、私たちの業務に悪影響を及ぼすことになります。
41
私たちは、第三者がUSPTOまたは外国特許庁で提起した行政対抗手続きに巻き込まれ、私たちの特許権をキャンセルまたは無効にしようとする可能性があり、これは高価で時間がかかり、特許権の損失を招く可能性がある。
Leahy-Smith Actは、ライセンス後の審査と各方面間審査手順では、いくつかの第三者は、競合他社が発行した特許の一部または全ての権利要件をキャンセルするために、これらのプログラムを利用してきた。優先日が2013年3月16日以降の特許については、第三者は、特許発行後9ヶ月の窓口内でライセンス後審査出願を提出することができる。請願書1部各方面間特許が2013年3月16日までに提出された場合は,特許発表後すぐに審査を提出することができる。請願書1部各方面間優先権日が2013年3月16日以降の特許については、ライセンス提出後の審査出願の9ヶ月の期限が満了した後に審査を提出することができる。贈与後の審査手続きはどんな疑問の理由でも提起することができます各方面間公開された既存技術に基づいて疑問を提起してこそ、検討手続きを提起することができる。米国特許商標局のこれらの行政対抗訴訟は、米国連邦裁判所訴訟における米国特許の有効性を推定することなく特許主張を審査し、米国連邦裁判所が使用するよりも低い立証責任を使用し、裁判所訴訟で使用される“簡単かつ一般的な意味”ではなく、“最も広範な合理的解釈”を使用して特許主張を解釈する。米国の行政と司法が特許手続きとの間のこれらの違いに対抗するため、競争相手または第三者の方が特許庁の許可後に審査または検討しやすいと考えられる各方面間再審査手続きは、アメリカ連邦裁判所の訴訟で無効を宣言するのではない。もし私たちのどの特許もこのようなアメリカ特許庁訴訟で第三者の挑戦を受けていれば、私たちがその特許を守ることに成功する保証はありません。これは私たちが挑戦された特許権を失うことになります。
ほとんどの外国では、反対や無効手続きも利用可能だ。欧州特許庁(European Patent Office,略称EPO)のような外国当局の多くは,特許付与後にのみ反対手続きを行っている。しかし、インドのような特定の国には、支出前の反対手続きもあれば、支出後の反対手続きもある。このような手続きは海外でよく薬品特許に対抗するために使用される。例えば、一部の外国では、これらのプログラムは、模造薬会社によって革新者の特許権を保有するために使用され、擬似製薬会社の市場進出を許可する手段として使用されている。このような活動はインド、中国、南米で特に一般的であり、ある国がより成熟した経済体に達するにつれて、このような活動はアフリカやアジアの他の地域でより一般的になる可能性がある。もし私たちのいかなる特許も外国の反対や無効手続きで挑戦されたら、私たちは私たちの特許を守るために巨額の費用に直面し、成功しないかもしれない。しかも、多くの外国司法管轄区では、敗訴側は勝訴側の弁護士費を支払わなければならず、これは相当な費用になるかもしれない。
私たちは、第三者が私たちの特許を侵害する方法で製品を販売または使用することを防止するために、裁判所に1つ以上の訴訟を提起しなければならないかもしれないが、これは高価で、時間がかかり、成功していない可能性があり、最終的には私たちが独自の市場を失うことになるかもしれない。
我々の業界の競争は非常に激しいため、競争相手は私たちが発行した特許、私たちの許可側の特許、または他の知的財産権を侵害したり、他の方法で侵害したりする可能性がある。権利侵害や不正使用に対抗するために、私たちは費用が高く時間がかかるかもしれない侵害訴訟を提起することを要求されるかもしれない。私たちは侵害者と思われるいかなるクレームも、私たちが彼らの特許を侵害していると主張するように、これらの当事者たちに反クレームを促す可能性があります。さらに、特許侵害訴訟では、裁判所は、私たちの特許の全部または一部が無効または強制的に実行できないと判断し、その特許の権利要件を狭く解釈するか、または私たちの特許が関連する技術をカバーしないことを理由に、他方の関連技術の使用を阻止することを拒否することができる。どんな訴訟手続きの不利な結果も、私たちの1つ以上の特許を無効または狭義に解釈されるリスクに直面させる可能性がある。特許侵害請求を解決するために、または訴訟の前に紛争を解決するために、ライセンス契約を締結することを選択することもでき、このようなライセンス契約は、印税および他の可能性のある高額な費用の支払いを要求する可能性がある。さらに、知的財産権訴訟に関連する大量の開示要求により、私たちのいくつかの機密情報が開示によって漏洩する可能性がある。
私たちのProTideは小分子であるため、商業化後、彼らは生物学的同等性データのみを使用して私たちの薬物を販売する承認を得るために、模倣製薬会社がFDAに簡略化された新薬申請またはANDAを提出することを可能にする“ハッジ·ワックスマン法案”の特許訴訟手続きの制約を受ける。“ハッジ·ワックスマン法案”によると、私たちの候補は新しい化学物質とみなされるので、私たちは私たちの薬物製品またはその使用方法をカバーするすべての特許をFDAの“承認された治療同等性評価医薬製品略編”に入れる機会があり、FDAのオレンジブックと呼ばれることがある。イミテーション製薬会社は私たちの薬物承認から4年後にFDAにANDAを提出することができる。模造製薬会社がANDAを提出することは特許侵害の技術行為とされている。模造製薬会社は、私たちがリストした特許の自然満了日まで待って、私たちの製品の模造薬バージョンを販売することができますか、あるいは私たちが列挙した1つ以上の特許が無効で、強制的に実行できないか、または侵害されていないことを証明することができます。後者であれば、私たちは45日間模造製薬会社に特許侵害訴訟を提起するだろう。これは私たちがOrange Bookに列挙した1つ以上の特許に挑戦しますなぜならジェネリック医薬品会社は
42
特許は無効で、実行できない、または侵害されていない。ハッジ·ワックスマン法によると、訴訟が提起された場合、FDAは、私たちの薬物が承認されたか、または裁判所が主張した特許主張が無効、実行不可能、または侵害されていない7年半前まで、後発薬の最終承認を発表してはならない。もし私たちがOrange Bookに私たちの関連特許を正確に列挙していなければ、ANDAによる後発薬会社の認証を直ちに提訴しなかった場合、あるいはそれによる特許訴訟で勝利すれば、私たちは私たちの独自の市場を失うかもしれないが、特許市場はすぐに模倣薬になるかもしれない。しかも、私たちがOrange Bookに私たちの関連特許を正確に列挙し、直ちに訴訟を提起して訴訟で勝利しても、私たちは非常に大きな弁護士費と従業員時間の代価を払って、長い間気を配ることができる。また、1つ以上の模造製薬会社が1種の革新的な薬物を同時に販売しようとするのはよく見られるため、私たちは多くの訴訟のコストと気晴らしに直面する可能性がある。私たちはまた、模造製薬会社が私たちの特許が満期になる前に私たちの市場に参入することを可能にする方法で、あるいは私たちの特許の強度、有効性、または実行可能性に悪影響を与える方法で訴訟を解決する必要があると判断することができるかもしれない。
FTCまたは他の国のそれぞれの機関がどのように薬品特許訴訟を行ったり、解決したりするかによると、いくつかの製薬会社はFTCまたは対応機関の厳格な審査の対象となっており、いくつかの審査は反独占違反の告発を招き、罰金や権利喪失を招くことがある。私たちは私たちがまたそのような審査を受けないか、あるいは審査の結果が私たちに有利であることを確認することができなくて、これは罰金や処罰につながるかもしれない。
過去数年、連邦貿易委員会は連邦裁判所で複数の訴訟を提起し、反競争を理由に革新会社と後発薬会社の間のHatch-Waxman ANDA訴訟和解協定に挑戦した。連邦貿易委員会はどんな価値のあるものも支払うかどうかにかかわらず、攻撃的な立場を取っている。彼らのやり方によれば、イノベーターが特許和解の一部として、Orange Book上場特許に最初に挑戦した後発薬会社に付与された180日以内にライセンス後発薬の発売を開始または延期しないことに同意した場合、または支払いなしに交渉が延期される場合、FTCは受け入れられない逆支払いであると考える可能性がある。バイオ製薬業界は,このような合意はリスクを除去する理性的な商業決定であり,和解条項が特許の排除潜在力の範囲内であれば,反独占攻撃を受けないと弁明している。2013年、米国最高裁判所は賛成5票、反対3票で裁決されたFTCはActavis,Inc.を訴える.いわゆる逆支払いに関する生物製薬業界および連邦貿易委員会の論点を却下し、遅延進入を交換するための“逆支払い”和解が反競争分析を受けるべきかどうかは、(A)競争に真の悪影響を及ぼす可能性、(B)支払いの理由、(C)特許権者が反競争損害をもたらす能力、(D)支払いの規模が特許弱点の実行可能な代替物であるかどうか、の5つの考慮に依存すると考えられる。(E)多額の不合理な支払いに対する反独占責任は、訴訟当事者がその訴訟を解決することを妨げるものではなく、例えば、模造薬が特許満了前に市場に参入することを許可し、特許権者は後発薬に費用を支払わない。さらに、逆支払いが合理的であるかどうかは、その規模、特許権者が予想する将来の訴訟費用に対するその割合、アトビス事件のようなその支払いを表す可能性のある他のサービスから独立しているかどうか、および任意の他の納得できる理由が不足している。裁判所は,逆支払和解は独占禁止法に違反する可能性があり,基準を遵守した反独占理由規則分析が必要であり,その責任は連邦貿易委員会で合意が不正であることを証明し,この理由規則分析の構造を下位裁判所に残すことであると考えている。もし私たちが医薬品会社とのHatch-Waxman訴訟を含む薬物特許訴訟に直面した場合、私たちはどのように事件を解決するか、または解決するかどうかを含むこの活動に基づくFTC挑戦に直面するかもしれません。たとえFTCの立場に強く反対しても、私たちは巨額の費用や罰金に直面するかもしれません。
もし私たちの商標と商号が十分に保護されていなければ、私たちは興味のある市場で知名度を作ることができないかもしれません。私たちの業務は悪影響を受けるかもしれません。
NuCanaは私たちの登録商標であり、Acelarinもそうだ。ProTdesTM私たちの商標です。アメリカ、ヨーロッパ、そして私たちが提出する可能性のある他の外国司法管轄区の任意の他の商標出願は許可されないかもしれないし、その後反対される可能性がある。提出されて登録されると、私たちの商標または商号は、挑戦、侵害、回避、または汎用商標として宣言されるか、または他の商標を侵害していると判断される可能性がある。さらに、FDAが候補製品のために提案した商標名の使用を承認する保証はなく、投与ミスのリスクの低減や他の規制の考慮に関連する機関基準を満たすために、このような医薬製品のための様々な独自名を開発することが要求される(商標法に基づいてこのような新しい固有名詞を保護する)。私たちの商標権を強化し、侵害を防止する手段として、第三者に商標クレームを提出したり、商標異議訴訟を提起することを要求される可能性があります。これは高価で時間がかかるかもしれないが、特に私たちのような規模の会社には。私たちはこれらの商標や商品名に対する私たちの権利を保護できないかもしれません。私たちは私たちが関心のある市場の潜在的なパートナーや顧客の中で知名度を確立するために必要です。時々、競争相手は私たちと似たような商品名や商標を採用して、ブランド表示を確立する能力を阻害し、市場の混乱を招く可能性があります。さらに、他の登録商標または商標の所有者は、我々の登録または未登録商標または商号の変異体を含む商号または商標侵害クレームを提出することができる。長期的には、私たちの商標や商号に基づいて名称を確立することができなければ、効果的に競争できない可能性があり、私たちの業務は悪影響を受ける可能性があります。私たちは、商標、商業秘密、ドメイン名、著作権または他の知的財産権に関連する独自の権利を実行または保護するために努力しています
43
財産は無効になる可能性があり、大量のコストと資源移転を招く可能性があり、私たちの業務、財務状況、運営結果、または将来性に悪影響を及ぼす可能性があります。
第三者は私たちが彼らの知的財産権を侵害したことを告発する法的訴訟を提起する可能性があり、その結果は不確定であり、私たちの業務を損なう可能性がある。
私たちのビジネス成功は、NUC-3373およびNUC-7738および私たちの他の潜在的候補製品を開発、製造、マーケティング、および販売する能力に依存し、第三者の固有の権利を侵害することなく、当社の独自技術を使用する。我々の候補製品は臨床前研究と臨床試験段階にあるが、これらの前臨床研究と臨床試験で使用される候補製品は米国法典第35 US C.第271(E)条に規定されている免除範囲に属し、この条項は開発とFDAへの情報の合理的な提出に関する特許侵害責任を免除していると信じている。NUC−3373、NUC−7738、および我々の他の潜在的候補製品が商業化に向かうにつれて、私たちの特許侵害請求の可能性が増加している。しかし、私たちの候補製品が他の当事者の特許や他の独占権を侵害しないという保証はなく、競争相手または他の当事者は、私たちがどんな状況でも彼らの独占権を侵害していると主張するかもしれない。
私たちは、米国特許商標局、米国連邦裁判所、または他の国/地域の裁判所または特許庁で行われる妨害または派生訴訟を含む、我々の製品および技術の知的財産権に関する将来の対抗訴訟または訴訟の一方または脅威になる可能性がある。第三者は、既存の特許または将来付与される可能性のある特許に基づいて、私たちの候補製品自体、私たちの処方および製造プロセス、または私たちの薬品管理方法を含む権利侵害請求を行うかもしれない。特に、NUC−3373は、広く使用されている承認された化学療法薬の改造であるため、これらの既存の薬剤の処方および製造において、第三者が重要な知的財産権を有していることは、これらの第三者が私たちの候補製品の処方および製造過程において私たちの権利侵害を告発するリスクを増加させる可能性がある。また,我々の将来の任意のProTideが特許状態にある既存の化学療法薬の改造であれば,このような特許保有者から侵害される可能性がある。
もし私たちが第三者の知的財産権を侵害していることが発見された場合、私たちは第三者からライセンスを取得して、私たちの製品や技術の開発とマーケティングを継続することを要求される可能性があります。しかし、私たちは商業的に合理的な条項や必要な許可証を得ることができないかもしれない。我々が許可を得ることができても,非排他的である可能性があり,我々の競争相手が我々に許可された同じ技術にアクセスできるようにする.あるいは、私たちは侵害製品を再設計する必要があるかもしれないし、それは不可能かもしれないし、大量の時間とお金の支出が必要かもしれない。場合によっては、裁判所の命令を含めて、侵害技術や製品の商業化を停止させることを余儀なくされる可能性がある。さらに、もし私たちが故意に特許を侵害したことが発見された場合、私たちは3倍の損害賠償と弁護士費を含む金銭損害賠償責任を負われる可能性がある。権利侵害の発見は、候補製品を商業化することを阻止したり、いくつかの業務運営を停止させたりする可能性があり、これは私たちの業務を損なう可能性があります。我々が第三者の機密情報や商業秘密を盗用したと主張することは,我々の業務に類似した負の影響を与える可能性がある.
私たちは世界各地で私たちの知的財産権を効果的に実行できないかもしれない。
私たちは一般的にイギリス知的財産権局で私たちの最初の特許出願を提出するか、または優先的に申請する。特許協力条約(PCT)に基づく国際出願は、通常、優先権出願後12ヶ月以内に提出される。PCTの出願によると、国および地域特許出願は他の管轄区域に提出される可能性があり、私たちの候補製品はこれらの管轄区域で上場または製造される可能性があると考えられる。世界のすべての国で私たちの候補製品の申請、起訴、特許保護の費用は目を引くほど高いので、私たちは選択された国でしか特許保護を申請していない。特許可能な要求は特定の国では、特に発展途上国では異なる可能性がある。また、私たちが知的財産権を保護し、実行する能力は、外国の知的財産法の意外な変化の悪影響を受ける可能性がある。
外国の法律はアメリカの法律のように私たちの権利を保護しないかもしれない。例えば、ヨーロッパ、インド、中国、他のいくつかの国では人体を治療する方法が特許を取得することを許可していない。一部の薬品特許保護を支持しない外国司法管轄区では、多くの会社が知的財産権の保護と保護に深刻な問題に直面している。これは私たちが私たちの特許を侵害したり、私たちの他の知的財産権を流用することを防ぐことを難しくするかもしれない。競争相手は私たちが特許保護を受けていない司法管轄区域で私たちの技術を使用して自分の薬物を開発することができ、また、もし私たちが特許を実行して権利侵害活動を阻止する能力が不足していれば、競争相手は他の権利侵害薬を私たちが特許保護を持っている地域に輸出するかもしれない。これらの薬物は私たちの候補製品と競争するかもしれないが、私たちの特許や他の知的財産権はそれらの競争を効果的にまたは阻止するのに十分ではないかもしれない。
44
外国司法管区で私たちの特許権の訴訟を強制的に執行することは、成否にかかわらず、巨額のコストを招き、私たちの努力と資源を私たちの業務の他の側面から移転させる可能性があります。また、私たちの候補製品のために主要市場で私たちの知的財産権を保護するつもりですが、候補製品をマーケティングしたいかもしれないすべての司法管轄区域で同様の努力を開始または維持できることを保証することはできません。したがって、このような国で知的財産権を保護するための私たちの努力は十分ではないかもしれない。
一部の外国の国は、革新会社が保有する承認された薬物の特許に対して強制許可を発行し、政府または1つ以上の第三者会社が外国政府が公共利益に適合していると考えている場合には、革新会社の特許権者の許可なしに承認された薬物を販売することを可能にすると表明している。例えば、インドはこのようなプログラムを使用して、国内会社が革新者の承認なしに特許薬を製造·販売することを許可している。私たちのいかなる薬物をカバーする特許が外国で強制許可されないことも保証されず、私たちがこのような強制許可を与えるかどうか、あるいはどのように影響を与えるかどうかを保証することはできない。また、ブラジルは、その規制機関ANVISAがブラジルで薬物特許を付与するか否かの決定に参加することを許可しており、特許付与決定は、特許が特許の要求に適合しているか否か、このような特許が国益に適合しているか否かを含むいくつかの要因に基づいて行われている。また,他のいくつかの国でも薬物特許の実行が他のタイプの技術特許よりも困難になるように法律が制定されている。また、ドーハ宣言で説明された“貿易関連知的財産権条約”によると、麻薬生産国は十分な製造能力に乏しい発展途上国への麻薬輸出を許可しなければならない。したがって、米国や他の国における医薬品市場は、医療分野の特許発行、強制執行、または非自発的許可に関する現在の公共政策の影響を受ける可能性がある。
2015年11月、貿易に関する知的財産権協定の管理を担当する世界貿易機関(WTO)のメンバー投票で、後発開発途上国が薬品特許の免除を強制執行しないことを2033年に延長することが決定した。私たちは現在、後発開発途上国で特許出願を提出していません。私たちの現在の意図は、今後これらの国で特許出願が提出されないことであり、少なくともある程度はWTOの薬品特許免除のためです。
また,一部の国には強制許可法があり,これらの法律により特許権者は第三者に許可を強制的に付与される可能性がある。さらに、いくつかの国は、政府機関または政府請負業者に対する特許の実行可能性を制限している。これらの国では,特許権者の救済措置は限られている可能性があり,このような特許の価値を大幅に低下させる可能性がある。もし私たちまたは私たちのいかなる許可者も私たちの業務に関連する任意の特許の許可を第三者に付与することを余儀なくされた場合、私たちの競争地位は損なわれる可能性があります。
私たちの特許保護の獲得と維持は、政府特許機関によって提出された様々なプログラム、書類提出、費用支払い、および他の要求を遵守することに依存し、これらの要求に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある。
特許または出願の定期維持費、継続費、年会費および様々な他の政府費用は、特許または出願の有効期間内にいくつかの段階で米国特許商標局および米国以外の様々な政府特許機関に支払われる。私たちはこれらの費用を支払うようにシステム的に注意して、私たちは外部会社を招聘し、私たちの外部弁護士に依存して非アメリカの特許代理機関にこれらの費用を支払います。私たちは評判の良い法律事務所や他の専門家を招いて私たちの遵守を助けてくれました。多くの場合、不注意は滞納金を支払うことによって、あるいは規則を適用する他の方法で是正することができます。しかしながら、場合によっては、規定を遵守しないことは、特許または特許出願が放棄または失効される可能性があり、それにより、関連法ドメインの特許権の一部または全部が失われる可能性がある。この場合、私たちの競争相手は市場に入るかもしれないし、これは私たちの競争地位を損なうかもしれない。
知的財産権訴訟は私たちに大量の資源を費やし、私たちの人員の正常な義務に対する注意を分散させるかもしれない。
正当な理由があるかどうかにかかわらず、知的財産権クレームに関連する訴訟や他の法律手続きは予測できず、通常コストが高く、時間がかかり、私たちの核心業務から大量の資源を分流し、私たちの技術と管理者の正常な職責を分散することを含むかもしれない。さらに、知的財産権訴訟に関する開示が必要であるため、私たちのいくつかの機密情報は、このような訴訟中に開示によって漏洩される可能性がある。さらに、公聴会、動議、または他の一時的な手続きまたは事態の発展の結果が公表される可能性があり、証券アナリストまたは投資家がこれらの結果がマイナスであると考える場合、私たちの米国預託証明書の価格に大きな悪影響を及ぼす可能性がある。このような訴訟または訴訟は、私たちの運営損失を大幅に増加させ、開発活動または任意の将来の販売、マーケティング、または流通活動に使用することができるリソースを減少させる可能性がある。
45
例えば、2018年、私たちは欧州特許庁から、ソ伐地ブランドで販売されているソソブビルを含むホスホアミドヌクレオチド化合物のような物質組成を含むEPO、EP 2955190またはEP 190を取得した®C型肝炎を治療する主要な薬は、ジリッド科学社によって販売されています。ソソブビルもハヴォニの重要な成分です®Vosevi® Epclusaと®.
2022年9月、私たちは、ソモブビルを含むより小さいタイプのホスホアミドヌクレオチド化合物の物質組成を含む別の欧州特許EP 3904365またはEP 365を欧州特許庁から取得した。
これらの特許について,我々とギレドは2018年から2023年までの数年間,イギリスの欧州特許庁とその後ドイツでの特許侵害訴訟で訴訟を行った。この訴訟の結果,欧州特許庁はEP 190を撤回し,連合王国におけるEP 190とEP 365の無効を決定した。これらの裁決の結果として、私たちはギレアデと彼らの連合王国とドイツでのそれぞれの訴訟手続きの法的費用について和解した。
2023年12月31日現在、イギリスとドイツの特許侵害訴訟によるすべての義務が解決された。
私たちは知的財産権請求に関連する訴訟や法的手続きを適切に行うのに十分な財政的または他の資源がないかもしれない。私たちのいくつかの競争相手は、彼らがより多くの財政資源とより成熟して発展した知的財産権の組み合わせを持っているので、このような訴訟や法的手続きの費用を私たちよりも効率的に負担するかもしれない。したがって、私たちは努力したにもかかわらず、私たちは第三者の知的財産権の侵害、流用、または成功的な挑戦を防ぐことができないかもしれない。
私たちと第三者の知的財産権許可は契約解釈に食い違いが生じる可能性があり、これは関連する知的財産権や技術に対する私たちの権利範囲を縮小したり、ライセンシーに対する私たちの財務または他の義務を増加させたりする可能性がある。
私たちと第三者の知的財産権許可は契約解釈に食い違いが生じる可能性があり、これは関連する知的財産権や技術に対する私たちの権利範囲を縮小したり、ライセンシーに対する私たちの財務または他の義務を増加させたりする可能性がある。我々は現在、第三者から知的財産権や技術許可を得るプロトコルは複雑であり、このようなプロトコルのいくつかの条項は様々な解釈の影響を受ける可能性がある。可能性のある契約解釈の相違の解決は、関連する知的財産権または技術に対する私たちの権利の範囲を縮小するか、または関連する合意の下で私たちの財務または他の義務であると考えられる私たちの義務を増加させるかもしれません。
もし私たちの任意の許可または物質関係、または私たちの許可に基づく任意の許可が終了または違反された場合、私たちは:
これらのリスクは、私たちが未来に私たちの現在または未来の製品候補製品のために締結する可能性のある任意の合意に適用される。もし私たちが上記のいずれかの状況に遭遇すれば、私たちの業務、財務状況、業績または運営、見通しに悪影響を及ぼす可能性がある。
もし私たちが第三者に知的財産権を許可する合意の義務を履行できなかった場合、あるいは私たちとライセンス者との業務関係が妨害された場合、私たちは私たちの業務に非常に重要な許可権を失う可能性があります。
私たちは第三者とライセンス契約を締結しており、私たちの研究を進めたり、候補製品の商業化を可能にするために、1つまたは複数の同じ第三者または他の第三者から追加の許可を得る必要があるかもしれません。以下の場合、合理的なコストまたは合理的な条項で追加のライセンスを得ることができないかもしれません
46
全部です。この場合、私たちは、私たちの候補製品を再設計したり、それらを製造する方法を再設計するために多くの時間と資源を必要とするかもしれないし、代替技術を開発または許可する必要があります。これらはすべて技術的にも商業的にも不可能かもしれません。もし私たちがそれができなければ、私たちは私たちの候補製品を開発したり商業化することができないかもしれないし、これは私たちの業務を損なうだろう。私たちは、第三者特許や他の知的財産権が存在しないことを保証することはできません。これらの特許または他の知的財産権は、私たちの現在の製造方法、候補製品、または未来の方法を強制的に実行し、それによって、私たちの製造または販売を禁止したり、私たちの販売について、第三者に印税または他の形態の賠償を支払う義務があるかもしれません。
将来のいずれのライセンス契約においても、我々がライセンスしている技術の特許訴訟は完全にライセンス側によって制御される可能性があり、私たちはライセンス側の特許訴訟費用の償還を要求される可能性がある。もし私たちのライセンス者が彼らから私たちが許可した独自知的財産権の特許や他の保護を獲得し、維持できなかった場合、私たちは知的財産権に対する私たちの権利やこれらの権利に関する排他性を失う可能性があり、私たちの競争相手はこれらの知的財産権を使用して競争製品をマーケティングするかもしれない。ライセンス契約によると、知的財産権に関する論争が発生する可能性があります
私たちが許可している知的財産権をめぐる紛争が許容可能な条項で現在の許可手配の能力を維持していることを阻害したり損害したりすれば、私たちは私たちの候補製品を開発して商業化することに成功できないかもしれません。
私たちは、私たちの従業員や私たちが彼らの知的財産権を流用したと主張したり、私たち自身の知的財産権の所有権を要求したりする第三者のクレームを受けるかもしれない。
私たちの多くの従業員は以前、私たちの競争相手や潜在的な競争相手を含む大学や他のバイオテクノロジーや製薬会社に雇われていた。私たちは、私たちの従業員が私たちのために働いているときに他人の固有情報やノウハウを使用しないことを保証するために努力しているが、私たちは、これらの従業員または私たちが商業秘密または他の固有情報を含む任意のそのような従業員の前の雇用主の知的財産権を使用または開示しているという疑惑を受ける可能性がある。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。
また、私たちの政策は、知的財産権開発に参加する可能性のある私たちの従業員と請負業者が、このような知的財産権を私たちに譲渡する協定に署名することを要求していますが、実際に私たちが自分たちの知的財産権を開発しているすべての側とこのような合意を実行することができないかもしれません。私たちと彼らの譲渡協定は自動的に実行されないかもしれないし、違反される可能性があります。私たちは第三者にクレームをつけさせられたり、私たちが私たちの知的財産権の所有権とみなされていることを確認するために、私たちが提起するかもしれないクレームを弁護したりすることができます。
もし私たちがこのようなクレームを起訴したり、弁護することができなければ、金銭的損害賠償を支払う以外に、私たちは貴重な知的財産権や人員を失う可能性がある。このようなクレームの起訴や抗弁に成功しても、訴訟は巨額の費用を招き、経営陣の注意を分散させる可能性がある。
もし私たちが私たちの商業秘密の機密性を保護できなければ、私たちの商業と競争の地位は損なわれるだろう。
私たちのいくつかの候補技術と製品のための特許を求める以外に、私たちは特許を取得していないノウハウ、技術、その他の独自の情報を含めて、私たちの競争地位を維持するために商業秘密に依存している。私たちは、これらの商業秘密を保護することを求めています。部分的には、これらの商業秘密に触れることができる当事者と秘密保護協定を締結することによって、例えば、私たちの従業員、会社協力者、外部科学協力者、契約メーカー、コンサルタント、コンサルタント、および他の第三者です。私たちは私たちの機密固有の情報を保護しようとしているが、一方が商業秘密を不正に開示したり流用したりするクレームを実行することは困難で、高価で時間がかかる
47
結果は予測できない。しかも、米国国内外のいくつかの裁判所は商業秘密をあまり望んでいないか、または保護したくない。もし私たちの任意の商業秘密が競争相手によって合法的に取得または独立して開発された場合、私たちは彼らまたは彼らが情報を伝達する人がその技術や情報を使用して私たちと競争することを阻止する権利がないだろう。もし私たちのビジネス秘密が競争相手に漏れたり、競争相手によって独立して開発されたりすれば、私たちの競争地位は損なわれるだろう。
私たちの固有の情報や私たちのサプライヤーと任意の未来のパートナーの固有の情報が失われる可能性があり、または私たちはセキュリティホールを受ける可能性があります。
私たちの正常な業務過程で、私たちのCROと私たちが依存する他の第三者は、知的財産権、臨床試験データ、独自の業務情報、私たちの従業員の個人識別情報を含む敏感なデータを収集し、保存し、将来的にはまた私たちのデータセンターおよびネットワークにおいて、私たちの臨床試験被験者の個人識別情報を収集し、保存するかもしれない。このような情報の安全な処理、維持、そして伝達は私たちの行動に必須的だ。私たちはセキュリティ措置を取っているにもかかわらず、私たちの情報技術とインフラはハッカーの攻撃を受けやすいか、あるいは従業員のミス、汚職、その他の中断によって破られる可能性があります。私たちの知る限り、私たちはこれまでこのような重大なネットワークセキュリティイベントを経験したことがありませんが、どのようなイベントも、私たちのネットワークを危険にさらし、そこに格納された情報がアクセス、公開、開示、修正、破壊、紛失、または盗まれる可能性があります。このようなアクセス、開示、あるいは他の情報の損失は、法律クレームや訴訟、個人情報のプライバシーを保護する法的責任、監督管理処罰、私たちの運営を乱し、私たちの名声を損なう可能性があり、人々が私たちと私たちの臨床試験を行う能力と私たちの競争優位に対して自信を失うことを招き、これは私たちの名声に不利な影響を与え、私たちの候補製品の臨床開発を延期する可能性がある。
知的財産権は必ずしも私たちの競争優位に対するすべての潜在的な脅威を解決できるとは限らない。
私たちの知的財産権が提供する将来の保護の程度は不確定であり、知的財産権には限界があるため、私たちの業務を十分に保護できないか、あるいは競争優位性を維持することができるかもしれない。以下の例は例示的である
従業員事務に関するリスク、管理成長、および私たちの業務に関するその他のリスク
私たちの現在の従業員の数は限られており、私たちの未来の成功は私たちが肝心な幹部を維持し、合格者を吸引、維持、激励する能力にかかっている。
我々は臨床開発段階の会社であり,2023年12月31日現在,役員4名を含む28名の従業員を有している。私たちは最高経営責任者のヒュー·グリフィスと私たちの管理チームの他の主要なメンバーと私たちの協力者の科学と臨床チームの研究開発、臨床、業務発展、商業化の専門知識に高く依存しています。私たちは顧客とサービス契約を締結したにもかかわらず
48
私たちの執行官、彼らは誰もがいつでも通知を出して、彼らの私たちの雇用関係を終わらせることができます。グリフィスさんのほかに、当社は役員や他の従業員に“キーパーソン”保険を提供しておりません。また、私たちは、科学と臨床コンサルタントを含むコンサルタントとコンサルタントに依存して、私たちの研究開発と商業化戦略の制定を助けてくれます。私たちのコンサルタントやコンサルタントは、私たち以外の雇用主に雇われる可能性があり、他のエンティティと締結された相談または相談契約に基づいて約束することができ、これは、私たちが彼らを得る機会を制限するかもしれない。もし私たちや私たちの協力者が高い素質の人材を引きつけ、維持することができなければ、私たちが成長戦略を実施する能力は制限されるだろう。
合格した科学、臨床、製造、財務、販売とマーケティング人員を募集と維持することも私たちの成功の鍵となるだろう。幹部や他の重要な従業員を失ったサービスは、私たちの研究開発と商業化目標の実現を阻害し、業務戦略を成功させる能力を深刻に損なう可能性がある。また、幹部やキーパーソンを交換することは困難かもしれませんし、私たちの業界では開発に成功し、マーケティング承認や製品商業化に必要なスキルや経験を持っている個人数が限られているので、時間がかかるかもしれません。この限られた人材バンクから募集する競争は非常に激しく、多くの製薬と生物技術会社の間の類似人員に対する競争を考慮して、私たちは受け入れ可能な条件でこれらの肝心な人員を採用、訓練、維持或いは激励することができないかもしれない。私たちはまた、大学や研究機関から科学や臨床人を募集する競争に直面している。臨床試験で成功できなかったことは、合格した科学者の採用と維持をもっと挑戦的になる可能性がある。もし私たちや私たちの協力者が高い素質の人材を引きつけ、維持することができなければ、私たちが成長戦略を実施する能力は制限されるだろう。
私たちは私たちの開発と規制能力を拡大し、販売、マーケティング、流通能力を実施する可能性があると予想されているので、私たちは私たちの成長を管理することが困難になるかもしれません。これは私たちの運営を混乱させるかもしれません。
私たちが予想していた発展と拡張を管理するためには、私たちの管理、運営、財務制度を継続して実施し、改善し、私たちの施設を拡大し、より多くの合格者を募集し、訓練し続けなければならない。また、私たちの経営陣は、不比例な注意を日常活動から移し、これらの開発活動を管理するために多くの時間を使う必要があるかもしれない。私たちの資源が限られているため、私たちは私たちの業務の拡張を効果的に管理できないかもしれませんし、より多くの合格者を募集して訓練することもできません。これは、私たちのインフラが弱く、操作上のミスを招き、ビジネス機会を失い、従業員を失い、残りの従業員の生産性を低下させる可能性がある。私たちの業務の実際の拡張は巨大なコストを招く可能性があり、他のプロジェクトから財務資源、例えば私たちの候補製品を開発することが可能です。私たちの経営陣が私たちの予想した発展と拡張を効果的に管理できなければ、私たちの費用は予想以上に増加する可能性があり、私たちの収入を創出したり増加させる能力が低下する可能性があり、私たちは私たちの業務戦略を実施できないかもしれない。私たちの将来の財務業績と、候補製品を商業化し、効果的に競争する能力は、当社の将来の発展と拡張を効果的に管理する能力にある程度依存するだろう。
英国のEU離脱の影響は、世界の経済状況、金融市場、私たちの業務にマイナス影響を与える可能性があり、これは私たちのアメリカ預託証明書の価格を下げる可能性がある。
2020年1月31日、イギリスはEUから離脱した。離脱協定の条項は、EU規則が2020年12月31日まで英国に適用され続ける過渡期を規定している。英国とEUの将来関係を管理する貿易·協力協定、あるいはTCAと呼ばれ、2020年12月に合意し、過渡期終了時に発効する“2020年EU(未来関係)法”によりイギリスで実施される。TCAは、イギリスとEU加盟国間の貨物(医薬製品を含む)のゼロ関税/ゼロ割当貿易を規定しており、イギリスとEUが知的財産権、競争、税金など多くの分野で共通の高い基準を維持する約束や、イギリスが地平線ヨーロッパ研究計画に参加し続けることを約束するなど、多くの他の利点を規定している(欧州委員会とイギリス政府が合意した政治合意によると、2024年1月1日からイギリスの研究者はこの計画に参加することができる)。しかし、連合王国のEU単一市場からの離脱は、連合王国とEUの間の人員、貨物、サービスの自由な移動を終了し、EU離脱前に連合王国とEUの市民および企業に提供されたいくつかの他の福祉、例えば、専門資格または金融サービスパスポートの相互承認など、連合王国とEU企業に大きな変化をもたらした。また、連合王国はEUの法律または欧州裁判所の管轄権によって管轄されなくなったため、連合王国とEU加盟国の法律と条例の間の差の余地はますます大きくなり、(A)改正案、適用、解釈、
49
(I)2023年12月31日までの期間において、国内法の施行は、移行期間終了時に連合王国に適用される欧州法に基づくEU法を保持し、(Ii)2024年1月1日以来の期間、移行期間終了時に連合王国に適用される直接適用されるEU立法と前EU義務に関する連合王国国内法に基づく同一法を保持し、(B)1月1日から連合王国政府によって廃止される。2024 EU法律では、移行期間の終了時に連合王国において直接的な効力を有し、同化法の他の権利および原則(例えば、国籍差別を受けない権利)を有している。
これらの事態の発展と、連合王国と欧州連合の法律、政治、経済関係がEU離脱後にどのように発展するかに関する不確実性は、世界経済状況と世界金融市場の安定に重大な悪影響を与え続け、世界市場の流動性を大幅に減少させる可能性がある。資産評価、通貨レートと信用格付けは特に市場変動の激化の影響を受けやすいかもしれない。これらの発展はまた、私たちと私たちの協力者の研究開発に重要な科学者と他の従業員を含む、従業員を引き付け、維持する能力に重大な影響を与える可能性がある。
スコットランドが連合王国からの離脱と、スコットランドとイギリスの他の地域との所得税率の違いを決定すれば、私たちの業務は不利な影響を受けるかもしれない。
私たちの本部はスコットランドにあります。2014年9月18日にスコットランドが連合王国から独立した国民投票が行われ、国民投票の結果、スコットランドはまだ連合王国の一部であった。未来にスコットランドについて連合王国から独立して二回目の国民投票が行われるかもしれない。このような国民投票は、最終的にスコットランドが連合王国に残ることを再び招いても、不確実性を招き、私たちが運営している市場を混乱させ、私たちまたは私たちの協力者が雇った科学者と他の重要な従業員を含む潜在的な顧客、サプライヤー、協力者、従業員を失う可能性がある。スコットランドが連合王国からの離脱を決定すれば、どのような変化が起こるかを正確に予測することは不可能であり、国民投票後の交渉や、スコットランド政府と連合王国の他の組織(おそらくEU)との合意にかかっている。独立は通貨システム、通貨、税収、そして規制と法的枠組みの変化を招く可能性があり、スコットランドがEU加盟国のアイデンティティの回復を求めることにもつながるかもしれない。独立したいくつかの可能な結果は、私たちに適用される税金レベルを含めて、私たちのコストに著しく影響を与え、私たちの業務、財務状況、および将来の運営結果に悪影響を及ぼす可能性があります。
スコットランドの課税個人に適用される所得税税率は、連合王国の他の地域に適用される課税個人の税率よりも複雑で高い。これは私たちの研究開発に重要な科学者と他の従業員を含む、スコットランドで従業員を引き付け、維持する能力に否定的な影響を与えるかもしれない。なぜなら彼らは収入が減少してスコットランドに住みたくないかもしれないからだ。
不利なグローバル経済状況は、私たちの業務、財務状況、または経営結果に悪影響を及ぼす可能性がある。
私たちの経営業績は世界経済と世界金融市場の全体的な状況の悪影響を受ける可能性があります。例えば、2008年の世界金融危機と新冠肺炎の大流行はそれぞれ資本と信用市場の変動と中断を招いた。2008年の世界金融危機と2020年の新冠肺炎の流行による深刻または持続的な経済低迷は、必要に応じて許容可能な条件で追加資本を調達する能力(あれば)を含む様々なリスクを私たちの業務にもたらす可能性がある。経済が疲弊したり下落したりすることは、私たちのサプライヤーに圧力を与え、供給中断を招く可能性もある。
情報技術や他の内部インフラシステムが故障すれば,我々の業務や運営が影響を受ける可能性がある.
セキュリティ対策が実施されているにもかかわらず、当社の情報技術および他の内部インフラシステム、ならびに当社の第三者CROおよび他の請負者およびコンサルタントのシステムは、会社のファイアウォール、サーバ、レンタル回線およびインターネット接続を含み、攻撃、ハッカー、コンピュータウイルス、不正アクセス、自然災害、テロ、戦争、および電気通信および電子障害の破壊を受けやすい。また,我々は,我々の第三者CROや他の請負者やコンサルタントのセキュリティ対策やコンピュータシステムに対してほとんど制御権を持たない.これまで,このようなシステム障害,事故,あるいは重大なネットワークセキュリティイベントを経験したことはないが,このようなイベントが発生して我々の運営が中断されると,我々の計画が実質的に中断される可能性がある.例えば、私たちの候補製品の臨床試験データの紛失は、私たちのマーケティング承認作業を遅延させ、データを回復または複製するコストを著しく増加させる可能性があります。どのような中断またはセキュリティホールによる損失または損害の範囲内で
50
私たちのデータまたはアプリケーションまたは当社の技術または候補製品に関連する他のデータまたはアプリケーション、または機密または独自の情報を適切に開示しない場合、私たちは責任を招く可能性があり、私たちの候補製品のさらなる開発は延期される可能性があります。
私たちの従業員、首席調査員、CRO、コンサルタントは、規制基準と要求を守らないこと、インサイダー取引を含む不正行為や他の不適切な活動に従事する可能性があります。
私たちは従業員、首席調査員、CRO、そしてコンサルタントが詐欺や他の不法活動に従事する可能性があるというリスクに直面している。これらの当事者の不正行為は、意図的、無謀または不注意な行為、またはFDAおよび他の規制機関に規定された不正活動を開示すること、これらの機関に真実、完全かつ正確な情報を報告することを要求する法律、米国および海外の医療詐欺および法律法規の乱用、または財務情報またはデータの正確な報告を要求する法律を含む可能性がある。特に、医療業界の販売、マーケティング、商業配置は、詐欺、不正行為、リベート、自己取引、その他の乱用行為を防止するための広範な法律法規によって制約されている。これらの法律法規は、広範な価格設定、割引、マーケティングおよび販売促進、販売手数料、顧客インセンティブ計画、および他のビジネス計画を制限または禁止する可能性があります。これらの法律の制約を受けた活動はまた、臨床試験過程で得られた情報の不適切な使用、あるいは著者らの臨床前研究或いは臨床試験において虚偽のデータを作成することに関連し、これは規制制裁を招き、著者らの名声に深刻な損害を与える可能性がある。従業員や他の第三者の不正行為を常に識別し、阻止することができるわけではなく、このような活動を検出し、防止するための予防措置は、未知または管理不可能なリスクや損失を効果的に制御することができないか、またはこれらの法律や法規を遵守できないことによる政府調査または他の行動または訴訟から私たちを保護することができない可能性がある。また、私たちは、起きていなくても、このような詐欺や他の不正行為を告発する可能性があるというリスクに直面している。もし私たちにこのような訴訟を提起し、私たちが自分の権利を弁護したり、維持することに成功しなかった場合、これらの行動は、民事、刑事および行政処罰、損害賠償、罰金、返還、Medicare、Medicaidおよび他の連邦ヘルスケア計画から除外される可能性があり、契約損害、名声損害、利益減少および将来の収益減少、これらの法律違反に関する告発を解決し、私たちの業務を削減し、私たちの業務運営能力および運営結果に悪影響を及ぼす可能性があることを含む、私たちの業務に大きな影響を与える可能性があります。
私たちは、より利益的またはより成功する可能性の高い候補製品を利用することなく、特定の候補製品を追求するために限られた資源を使うかもしれない。
私たちの財務と管理資源が限られているので、私たちは特定の候補製品に集中している。したがって、私たちは他の候補製品を探す機会を放棄したり延期したりするかもしれないが、これらの製品は後により大きな商業潜在力を持っていることが証明された。私たちの資源配分決定は私たちが実行可能な商業製品や利益のある市場機会を利用できないかもしれない。現在および将来の研究開発計画および特定の適応の候補製品への支出は、いかなる商業的に実行可能な候補製品も生じない可能性がある。もし私たちが特定の候補製品の商業的潜在力や目標市場を正確に評価しなければ、私たちは協力、許可、または他の印税手配によって候補製品に価値のある権利を放棄するかもしれないが、この場合、候補製品の独占開発権と商業化権利を維持することは私たちに有利だ。
将来的に企業や薬品を買収したり、戦略同盟を結成したりするかもしれませんが、これらの買収のメリットを意識していないかもしれません。
私たちは、より多くの業務や薬品を買収し、第三者と戦略連合を結成したり、合弁企業を設立したりする可能性があり、これらは私たちの既存の業務を補完または拡大すると信じています。将来性のある市場や技術のビジネスを買収すれば、既存の運営や戦略と組み合わせることに成功しなければ、これらの事業を買収するメリットは実現できないかもしれません。私たちは戦略連合や買収によって生まれた任意の新薬を開発、製造、マーケティングする際に、多くの困難に直面し、予想される利益を達成したり、私たちの業務を強化したりすることを延期したり阻止したりする可能性があります。このような買収の後、取引が合理的であることを証明するために、予想される相乗効果を達成することを保証することはできません。
私たちまたは私たちが依存している第三者は自然災害の悪影響を受ける可能性があり、私たちの業務の連続性と災害復旧計画は深刻な災害から私たちを十分に保護できないかもしれません。
自然災害は私たちの運営を深刻に混乱させ、私たちの財政状況を損なうかもしれない。自然災害、停電、その他の事件が発生すれば、本社の全部または大部分を使用することができなくなります
51
もし私たちの第三者契約製造業者の製造施設のような私たちの重要なインフラが、あるいは他の方法で運営を中断したら、私たちは難しいかもしれないし、場合によっては、かなり長い間私たちの業務を継続することはできません。深刻な災害や同様の事件が発生した場合、我々の既存の災害復旧および業務連続計画は十分ではないことが証明される可能性がある。私たちの災害復旧と業務連続計画の性質が限られているため、私たちは多くの費用を発生させるかもしれない。
ADSSに関するリスク
私たちのアメリカ預託証明書の価格は変動する可能性があり、私たちがコントロールできない要素によって変動するかもしれません。
米国預託証券の取引価格は変動しており、大幅な変動が続く可能性がある。これらの証券の取引価格は本“リスク要素”の節で述べた要素を含む多くの要素に依存し、その中の多くの要素は私たちの制御範囲を超えており、私たちの経営業績とは関係がないかもしれない。また、米国預託証券がナスダック資本市場やナスダックに上場しているにもかかわらず、これらの証券の取引市場が変わらないことを保証することはできません。
2017年10月に米国預託株式1株当たり15.00ドルで初公開株式(IPO)で米国預託証券を売却して以来、2024年3月1日現在、新浪米国預託株式の終値は0.25ドルまで低下し、29.84ドルに達している。私たちのアメリカ預託証明書の市場価格は様々な要素によって大幅に変動する可能性があります。その中の多くの要素は私たちがコントロールできません
また、もし私たちが最低終値要求を含めてナスダックの持続的な上場要求を遵守できなければ、ナスダックは私たちのアメリカ預託証明書を取得する措置を取るかもしれない。このような退市は、私たちのアメリカ預託証明書の価格にマイナスの影響を与える可能性があり、投資家が私たちのアメリカ預託証明書を売却または購入することを望む時に、私たちのアメリカ預託証明書を販売または購入する能力を弱める可能性がある。退市事件が発生すれば、吾らはナスダックの上場要求の遵守を回復する行動をとる可能性があるが、吾らがとったいかなる行動も、吾らの米国預託証券の再上場を許可し、市場価格を安定させたり、吾などの米国預託証明書の流動性を高めたり、将来的にナスダックの上場要求に違反することを防止する保証はない。2023年5月12日、ナスダックの書面通知を受け、ナスダック上場規則第5450(A)(1)条に規定されている1株1.00ドルの最低入札要件を遵守していないことを指摘した。180日間の猶予期間内にコンプライアンスを再獲得するためには、私たちのアメリカ預託証明書の最低入札価格は10取引日連続で1.00ドル以上に達する必要があります。2023年11月9日、私たちは米国預託証明書をナスダック世界ベスト市場からナスダック資本市場に移した。ナスダック資本市場への移転については、ナスダックは、ナスダック上場規則第5450(A)(1)条に規定する要件を再遵守するために、2番目の180日期限(または2024年5月6日まで)を与えている。もし私たちがナスダック資本市場の持続的な上場の要求を満たすことができなければ、アメリカ預託株式と普通株の割合を変更したり、普通株の逆分割を行ったりして、コンプライアンスを再獲得する必要があるかもしれません。そうでなければ、ナスダックから退市する必要があるかもしれません。もし私たちがナスダックから退市したら、私たちは場外市場あるいは他の見積媒体に移って取引するかもしれない。したがって、投資家は私たちの株の正確な見積もりを得ることがもっと難しいことを発見するかもしれない。退市はまた私たちのアメリカ預託証明書の可視性、流動性と価値を低下させ、機関投資家のわが社に対する興味を低下させ、そして私たちのアメリカ預託証明書の波動性を増加させる可能性がある。退市は潜在的な業界パートナー、融資者、
52
従業員、これは私たちの業務と私たちの未来の見通しをさらに損なうかもしれない。このような重大な不利な結果の一部または全部は私たちの株価をさらに下落させるかもしれない。
これらおよび他の市場と業界要素は、私たちのアメリカ預託証明書の市場価格と需要を大幅に変動させる可能性があり、私たちの実際の経営業績にかかわらず、これは投資家が彼らのアメリカ預託証明書を随時販売することを制限または阻止し、他の方法で私たちのアメリカ預託証明書の流動性に負の影響を与える可能性がある。また,株式市場,特にバイオ製薬会社は,極端な価格や出来高変動を経験しており,これらの変動はこれらの会社の経営業績に関係なくあるいは比例しないことが多い。従来、1株の市場価格が変動した場合、その株の保有者は発行者に対して証券集団訴訟を起こすことがあった。もし私たちのアメリカ預託証明書所持者が私たちにこのような訴訟を起こしたら、私たちは巨額の訴訟弁護費用が生じるかもしれません。私たちの上級管理職の注意は私たちの業務運営から移っていきます。訴訟のどんな不利な判決もまた私たちに重大な責任を負わせるかもしれない。
米国上場企業として、私たちの運営コストは引き続き増加し、私たちの経営陣は新しいコンプライアンス措置とコーポレートガバナンス実践を実施するために多くの時間を投入する必要がある。
上場企業として、その米国預託証明書は2017年9月に米国で取引を開始し、これまで招かなかった巨額の法律、会計、その他の費用を招き続け、特に現在では“新興成長型会社”やEGCの資格を持たなくなっている。2002年のサバンズ-オクスリ法案、ドッド-フランクウォール街改革と消費者保護法、ナスダックの上場要求、その他の適用された証券規則と条例は、有効な開示、財務制御、会社管理やり方の確立と維持を含む非米国上場企業に対して様々な要求を提出した。私たちの上級管理職たちと他の人たちはこのようなコンプライアンス計画を実施するために多くの時間を投入しなければならない。しかも、このような規則と法規は引き続き私たちの法律と財務コンプライアンスコストを増加させ、いくつかの活動をより時間的で高価にするだろう。例えば、これらの規則は私たちが取締役と高級管理者責任保険を獲得する難度とコストを増加させ、これは逆に私たちが合格した高級管理者或いは取締役会メンバーを誘致し、維持する難しさを増加させた。
しかし,これらの規則や条例は異なる解釈を受けることが多く,特殊性に欠ける場合が多いため,規制機関や理事機関が新たな指導意見を提供するにつれて,実践における適用は時間とともに変化する可能性がある。これは遵守事項に関する持続的な不確実性と、開示と統治慣行を絶えず修正するために必要なより高いコストをもたらす可能性がある。
2002年サバンズ-オキシリー法404条または404条によると、私たちは私たちの上級管理職が私たちの財務報告書について内部統制している報告書を提出しなければならない。私たちはもうEGCではなく、私たちは今、私たちの独立公認会計士事務所によって発表された財務報告書の内部統制に関する認証報告書を含むことを要求されるだろう;しかし、私たちの現在の非加速申告身分のため、私たちはまだこの要求に制限されていない。私たちは2022年の最後の日にもうEGCではない。404(B)条を遵守する準備をするために、私たちが非加速申告者になる資格がなくなったら、私たちは財務報告書に対する私たちの内部統制を記録して評価する過程に参加します。これは高価で挑戦的です。この点では、外部コンサルタントを招聘し、詳細な作業計画により財務報告内部制御の十分性を評価·記録し、適宜ステップ改善制御プログラムを採用し、制御がファイルのように機能しているかどうかをテストにより検証し、財務報告内部制御の継続報告及び改善手順を実施する必要がある。私たちは努力したにもかかわらず、私たちは規定された時間内に結論を出すことができないか、すなわち財務報告書の内部統制に有効であり、404(B)条の要求に適合する可能性がある。1つまたは複数の重大な弱点を発見すれば、財務諸表の信頼性に対する自信を失った金融市場の不良反応を招く可能性がある。
私たちのいくつかの既存の株主、取締役会のメンバー、そして上級管理職はまだ私たちに重大な統制権を行使する能力がある。あなたの利益はこのような既存の株主の利益と衝突するかもしれない。
2023年12月31日現在、我々の上級管理職、取締役会、5%を超える株主とそれぞれの関連会社の合計は、私たちの普通株の38.8%(米国預託証券形式の普通株を含む)を持っています。これらの株主は、単独投票であっても、集団投票としても、任意の株主総会が決定した結果を決定または著しく影響することができる可能性がある。50%以上の株主または株主団体が私たちの株主総会に出席し、株主総会で投票することを制御しても、取締役会メンバーの任命、私たちの資本構造に関連するいくつかの決定を含む簡単な多数の採択を必要とする任意の株主決議を制御することができる
53
特定の重大な会社の取引を承認する。他の結果を除いて、このような所有権集中は制御権変更を延期または阻止する効果がある可能性があるため、私たちのアメリカ預託証明書の市場価格にマイナスの影響を与える可能性がある。
F-3表の棚登録声明によると、アメリカ証券取引委員会の規則と法規は、乳児棚制限の影響を受ける可能性があるので、任意の12ヶ月の間に調達できる資金金額を制限するかもしれません。
F-3表の棚登録声明によると、米国証券取引委員会の規則と法規は、公募株金額が7,500万ドル未満の会社の任意の12ヶ月以内の融資金額を制限し、これを乳児棚制限と呼ぶ。私たちは現在乳児棚制限の制限を受けており、私たちの公衆流通株がまだ7500万ドル(乳児棚制限によって測定されている)を下回っている限り、私たちはいかなる12ヶ月の間も最初の公開発行で私たちの公衆流通株の3分の1を超える価値のある証券を売ることはできない。乳児棚制限のため、私募やF-1表に登録された発売方法で株を売却し、追加資本を調達する必要があるかもしれない。
私たちの大量のアメリカ預託証明書または普通株の将来の販売または将来の販売の可能性は、私たちのアメリカ預託証明書の価格に悪影響を及ぼすかもしれません。
将来的に私たちのアメリカ預託証明書や普通株を大量に売却したり、このような売却が発生すると考えられたりして、私たちのアメリカ預託証明書の市場価格を低下させる可能性があります。もし私たちの大株主や私たちの管理チームのメンバーが公開市場で私たちの証券を大量に販売したり、市場がこのような売却が発生する可能性があると考えた場合、私たちのアメリカ預託証券の市場価格と、将来的に株式証券を発行することで資金を調達する能力は不利な影響を受ける可能性があります。吾らも登録権協定を締結しており、これにより吾らは、既存株主が保有する普通株(米国預託証券に変換可能)の転売の一部を登録し、当該等の株式の指定公開発売について協力するために、指定された場合に登録声明を提出することに同意している。
予測可能な未来には、私たちの米国預託証明書または普通株に現金配当金は支払われないと予想されるので、資本付加価値(あれば)は、このような証券に関連する潜在的収益の唯一の源となる。
イギリスの現行法律によると、会社の累積実現利益は非合併に基づく累計で損失を達成しなければならず、配当金を支払うことができる。したがって、配当金を発行する前に、私たちは分配可能な利益を持っていなければならない。私たちは過去に私たちの普通株に配当金を支払ったことがない。私たちは収益を維持して、私たちの業務のために、予測可能な未来に現金配当金を支払わないつもりです。したがって、予測可能な未来には、私たちの米国預託証明書または普通株の資本増加は、このような証券の潜在的収益の唯一の源となるだろう。
私たちのアメリカ預託証明書保持者は、私たちの普通株式保有者と同じ投票権を持っていないかもしれないし、彼らの投票権を行使するために投票材料をタイムリーに受け取ることができないかもしれない。
当社の米国預託証券保有者は、当社の米国預託証明書が証明した普通株に関する投票権を個人名義で行使することはできません。当社は米国預託証券保有者が受託者またはその代有名人をその代表として委任し、預託協定に基づいて米国預託証明書の形で普通株の投票権を行使する。米国預託証明書保持者は、直ちに投票材料を受け取ることができず、信託機関に投票を指示することができない可能性があり、彼らまたはブローカー、取引業者、または他の第三者によって米国預託証明書を持っている人は投票権を行使する機会がない可能性がある。場合によっては、米国預託証明書に代表される株式は、所有者の指示に違反して投票する可能性があり、保有者は、ホスト機関に、当該米国預託証明書に代表される株式に投票するように指定された者に適宜委任するように指示されたとみなされる可能性がある。さらに、保管人は、いかなる採決指示、いかなる採決方法、または任意のそのような採決を実行できなかった効果に対しても責任を負わないであろう。したがって、米国預託証明書所持者の米国預託証明書が要求通りに投票していなければ、投票権を行使できない可能性もあり、追徴権もない可能性がある。また、米国預託株式保有者として、我々の米国預託証券の購入者は株主総会を開催することができない。
もし米国預託証明書所有者に普通株を提供することが違法または非現実的であれば、私たちのアメリカ預託証明書所有者はアメリカ預託証明書の形で私たちの普通株の分配またはそのいかなる価値を得ることができない。
私たちアメリカ預託証券の受託者は、私たちの普通株式または他の預金証券から受け取った現金配当金または他の分配を、私たちのアメリカ預託証明書所持者に支払うことに同意し、その費用と支出および特定の税金を差し引くことに同意しました。私たちのアメリカ預託証明書の保有者は、そのアメリカ預託証明書に代表される私たちの普通株式数の割合でこれらの分配を受けます。しかし、預金協定に規定されている制限により、米国預託証明書保持者に流通を提供することは不法または非現実的である可能性がある。私たちは私たちのアメリカ預託証明書、普通株式、権利、または他のものを私たちのアメリカ預託証明書所有者に配布することを可能にする他の行動を取る義務はない。つまりアメリカの預託証明書所持者は
54
もし彼らに普通株を提供することが不法または非現実的なら、私たちは彼らから普通株に対する私たちの分配または彼らの任意の価値を得るだろう。このような制限は私たちのアメリカ預託証明書の市場価値に否定的な影響を及ぼすかもしれない。
私どものアメリカ預託証明書保持者はそのアメリカ預託証明書を譲渡する際に制限される可能性があります。
アメリカ預託証明書は預かり人の帳簿に譲渡することができます。しかし,保管人は,職務遂行に関与していると考えられる場合には,その譲渡帳簿を随時あるいは随時閉鎖することができる。さらに、私たちの帳簿または委託者の帳簿が閉鎖されたとき、または私たちまたは係の人が、法律または任意の政府または政府機関の任意の要求から、またはホスト契約の任意の規定に基づいて、またはホスト契約の条項に従った任意の他の理由で、任意の場合、受託者は、米国預託証明書の交付、譲渡または登録を拒否することができる。
私たちの株主の権利はアメリカの会社の株主に通常提供される権利とは異なるかもしれない。
私たちはイギリスの法律登録に基づいて設立された。普通株式所有者の権利、及びアメリカ預託証明書所有者のいくつかの権利は、2006年の会社法の規定、及び著者らの組織定款を含むイギリスの法律によって管轄されている。このような権利はいくつかの側面で典型的なアメリカ会社の株主権利とは違う。本年度報告第10.B項“発行された株式説明--会社法の違い”を参照して、当社に適用される2006年の会社法条文と、例えば株主権利および保護に関するデラウェア州一般会社法との間の主な違いを理解する。
もし我々の管理·制御場所がイギリス以外の場所に変更されたと考えられた場合、イギリス都市買収·合併規則または買収規則の条項における株主保護は適用されない。
私たちはイングランドとウェールズに登録して設立された公共有限会社で、私たちの中央管理と制御場所をイギリスに設置します。そのため、我々は現在買収規則に支配されているため、私たちの株主は買収規則が提供するいくつかの買収契約保障を享受する権利がある。“買収規則”は、会社の買収を監督·進行する枠組みを提供する。買収要約を提出する際に、買収·合併委員会またはその委員会が、イギリスに中央管理·制御のない場所にいると判断した場合、買収規則は我々に適用されず、我々の株主は買収規則が提供する様々な保護を受ける権利がないだろう。特に、私たちは強制的な買収要約に関する規則によって制限されないだろう。グループは“買収規則”のいくつかの最も重要な規則の簡単な要約を発表し、ここで以下のように引用した
55
アメリカの民事責任に対するクレームは私たちに強制的に施行できないかもしれない。
私たちはイギリスの法律登録に基づいて設立された。私たちのほとんどの資産はアメリカ以外に位置している。私たちのほとんどの上級管理職と取締役会はアメリカ以外に住んでいる。したがって、投資家は、米国内でそのような人々に法的手続き文書を送達することができないか、または米国連邦証券法民事責任条項に基づく判決を含む、米国裁判所で得られた彼らまたは私たちに不利な判決を実行することができないかもしれない。
米国と連合王国は現在、民商事判決(仲裁裁決を除く)の相互承認と執行について規定した条約を下していない。したがって、米国裁判所による最終支払い判決は、米国証券法に完全に基づいているか否かにかかわらず、自動的にイングランドやウェールズで認められたり強制されたりすることはない。また、イングランドとウェールズ裁判所がイングランドとウェールズで私たちまたは私たちの役員や上級管理職に米国やアメリカの任意の州の証券法に基づいて提起した原始訴訟を受理するかどうかには、不確実性も存在する。米国の裁判所で得られたいかなる最終的かつ決定的な金銭判決も、イギリスの法律や公共政策のいくつかの要求に合致すれば、イングランドとウェールズ裁判所はそれ自体を訴訟理由と見なし、債務として訴訟を提起するため、これらの問題を再審する必要はない。米国証券法の民事責任条項による判決がこれらの要求に適合しているかどうかは、英国裁判所がこのような裁決を下す問題である。もしイギリスの裁判所が米国の判決に基づいて支払うべき金額について判決を下した場合、イギリスの判決は通常この目的に使用可能な方法で実行されるだろう。
したがって、米国の投資家は、米国連邦証券法による判決を含む、私たちまたは私たちの上級管理職、取締役会、または本明細書で言及したいくつかの専門家(彼らはイギリスまたはアメリカ以外の国/地域の住民)に対して、米国裁判所で得られた民商事判決を実行することができないかもしれない。
私たちは外国の個人発行者の資格に適合しているため、私たちはアメリカの依頼書規則の制約を受けず、“取引法”の報告義務の制約を受けており、ある程度、これらの義務は米国国内の上場企業よりも緩やかで、発生が少ない。
私たちは、改正された1934年の証券取引法または取引法に基づいて、外国の個人発行者の地位を有する非米国会社として報告した。私たちは“取引法”に規定されている外国の個人発行者の資格に適合しているため、(I)“取引法”に基づいて登録された証券募集依頼書、同意書、または許可の条項を含む“取引法”に適用される米国国内上場企業に適用されるいくつかの条項の制約を受けない。(I)“取引法”では、株式所有権および取引活動に関する公開報告書の提出を内部者に要求する条項、および短時間で取引から利益を得る内部者の責任、(Iii)“取引法”に規定された規則は、監査されていない財務及び他の指定された情報を含むForm 10-Q四半期報告を提出するか、又は指定された重大なイベントが発生した場合に現在のForm 8-K報告を提出するように米国証券取引委員会に要求する。また、外国人個人発行者は、各事業年度終了後120日までにForm 20−F年次報告書を提出する必要はなく、加速提出者である米国内発行者は、各事業年度終了後75日以内にForm 10−K年次報告書を提出することが要求される。外国の個人発行者も公平な開示規則の制約を受けず、この規則は発行者が重大な情報を選択的に開示することを防ぐことを目的としている。したがって、我々の株主は、非外国民間発行者会社の株主に同等の保護を受けることができない可能性がある。
外国の個人発行者として、私たちは会社の管理事務の面でいくつかのナスダック会社の管理上場基準とは大きく異なる母国のやり方を採用することを許可された。我々がナスダック社の上場基準を完全に遵守している場合に比べて、これらのやり方は株主の保護が少ない可能性がある。
ナスダックに上場する海外私募発行者として、私たちは会社管理上場基準の制約を受けています。しかし、ナスダック規則は私たちのような外国の個人発行者がその母国の会社統治のやり方に従うことを可能にします
56
ナスダック社は上場のいくつかの基準を管理している。私たちの母国イギリスのある会社のガバナンスのやり方はナスダックのコーポレートガバナンス上場基準と大きく異なるかもしれません。例えば、イギリスの会社法と私たちの組織規約の細則は、私たちのほとんどの役員が独立しなければならないことを規定していない;私たちは非独立取締役を私たちが指名したメンバーとすることができ、私たちの独立取締役は独立役員だけが出席する会議を定期的に開催することを要求されていない。そのため、米国国内発行者に適用されるナスダック社の上場基準に比べて、我々の株主が得る可能性のある保護は少ない。
私たちは外国の個人発行者の身分を失う可能性があり、これは私たちに取引法の国内報告制度を遵守することを要求し、巨額の法律、会計、その他の費用を発生させるだろう。
外国の個人発行者として、米国国内発行者に適用される“取引法”に適用されるすべての定期的な開示および現在の報告要件を遵守する必要はない。2024年6月30日(私たちの次の第2四半期終了)から、私たちはもはや外国の個人発行者ではないかもしれませんが、2025年1月1日から米国国内発行者に適用される取引所法案のすべての定期開示と現在の報告要件を遵守することが求められます。私たちの現在の外国個人発行者としての地位を維持するためには、(A)私たちの投票権のある証券の大多数は非アメリカ住民が直接または間接的に所有しなければならない、または(B)(I)私たちの幹部または役員の多くはアメリカ市民または住民ではなく、(Ii)私たちの資産の50%以上はアメリカ以外に位置しなければならず、(Iii)私たちの業務は主にアメリカ以外の地域で管理されなければならない。もし私たちが外国の個人発行者の地位を失ったら、私たちは外国の個人発行者の要求よりも詳細で広い米国内発行者の要求に適用される“取引法”報告書や他のアメリカ国内発行者の要求を遵守することが要求されるだろう。私たちはまたアメリカ証券取引委員会とナスダックの様々な規則に基づいて私たちの会社のガバナンスのやり方を変えることを要求されるかもしれません。米国証券法によると、米国内の発行者に適用される報告書の要求を遵守することが要求されれば、私たちが直面している規制やコンプライアンスコストは、外国の個人発行者として発生するコストよりもはるかに高くなる可能性がある。したがって、私たちは外国の個人発行者の地位を失うことは、私たちの法律と財務コンプライアンスコストを増加させ、いくつかの活動を非常に時間的で高価にするだろうと予想している。また、米国国内発行者に適用される規制を遵守することが要求されれば、取締役や上級管理者責任保険を獲得することがより困難かつ高価になり、低減された保証範囲の受け入れや大幅な保証コストの発生が要求される可能性があると予想される。このような規制はまた私たちが合格した取締役会のメンバーを引き付けて維持することをもっと難しくするかもしれない。
私たちはもう“新興成長型会社”ではなく、追加的な報告書要求によって制限されるだろう。
2022年の最後の日、私たちはJumpStart Our Business Startups ActやJOBS Actで定義されたEGCではなくなった。したがって、私たちはこれ以上EGCが入手可能な様々な報告書要求の免除に依存することはできないが、404(B)節の監査人認証要件の遵守が要求されないことを含む;しかし、私たちの現在の非加速申告者身分のため、私たちはまだこの要求に制約されていない。私たちはこれ以上2年間の財務結果と選択された財務データだけを報告することができず、それぞれ3年と5年を報告しなければならない。
もし私たちが効果的な財務報告内部統制制度を維持できなければ、私たちは私たちの財務結果を正確に報告したり、不正を防ぐことができないかもしれない。したがって、株主は私たちの財務や他の公開報告に自信を失う可能性があり、これは私たちの業務と私たちのアメリカ預託証明書の取引価格を損なうことになる。
財務報告に対する効果的な内部統制は、信頼できる財務報告を提供するために必要であり、適切な開示制御や手順とともに詐欺を防止することを目的としている。必要な新しい制御措置や改善された制御措置を実施できなかったり、実行中に遭遇した困難は、私たちの報告義務を履行できない可能性があります。さらに、第404条に基づいて実施される任意のテスト、または私たちの独立公認会計士事務所がその後に行う任意のテストは、財務報告の内部統制における私たちの欠陥を明らかにすることができ、これらの欠陥は、重大な弱点と考えられるか、または私たちの財務諸表を前向きまたは追跡的に変更する必要がある場合があり、またはさらなる関心または改善が必要な他の分野を発見することができる。内部統制不足は、投資家が私たちが報告した財務情報に自信を失う可能性もあり、これは私たちのアメリカ預託証明書の取引価格に負の影響を与える可能性がある。
管理職たちは毎年私たちの内部統制の有効性を評価しなければならない。雇用法案によると、私たちはもはやEGCではなく、私たちの独立公認会計士事務所は、第404(B)条に基づいて、財務報告書の内部統制に対する私たちの有効性を証明することを要求されるだろう;しかし、私たちの現在の非加速申告身分のため、私たちはまだこの要求に制約されていない。私たちは2022年の最後の日にもうEGCではない。私たちの内部統制の有効性の独立した評価は、私たちの経営陣の評価では発見できないかもしれない問題を発見するかもしれません。私たちの内部統制で発見されなかった重大な弱点は、財務諸表の再説明を招く可能性があり、救済費用が必要であり、私たちの財務諸表の信頼性に対する信頼性の喪失によって金融市場の不利な反応を招く可能性があります。
57
証券又は業界アナリストが我々の業務に関する研究報告を発表しない場合、又は不正確又は不利な研究報告を発表しなければ、我々の米国預託証明書の価格及び取引量が低下する可能性がある。
私たちのアメリカ預託証券の取引市場は、証券や業界アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存しています。証券と産業アナリストは現在持っていないし、決して私たちの研究を発表しないかもしれない。もし証券や業界アナリストが私たちを報道し始めていなければ、私たちのアメリカ預託証明書の取引価格はマイナスの影響を受ける可能性がある。証券または業界アナリストがカバーを開始した場合、1人以上の追跡アナリストが私たちのアメリカ預託証券格付けを引き下げたり、私たちの業務の不正確または不利に関する研究報告を発表したりすれば、私たちのアメリカ預託証券の価格が低下する可能性がある。もしこれらのアナリストのうちの1人以上が私たちの報告を停止したり、私たちに関する報告書を定期的に発表できなかったら、私たちのアメリカ預託証明書に対する需要が低下する可能性があり、これは私たちのアメリカ預託証明書の価格と取引量を低下させる可能性がある。
私たちはどの納税年度にも受動的な外国投資会社やPFICであるかもしれませんが、もしあなたがアメリカの投資家であれば、これは実質的なアメリカ連邦所得税の結果を招く可能性があります。
一般に、任意の納税年度において、私たちの総収入の少なくとも75%が受動的収入である場合、または私たちの資産価値の少なくとも50%が、受動的収入を生成する資産または受動的収入(現金を含む)を生成するために保有する資産に起因することができる場合、米国連邦所得税の目的で、受動的外国投資会社またはPFICと同定される。私たちがPFICであるかどうかを決定することは、特定の事実と状況に依存する(例えば、私たちの資産の推定値、商業権および他の無形資産、および連合王国政府から得られたいくつかの研究開発税収控除が総収入を構成するかどうかを含む私たちの収入の特徴を含み、構成すれば、それらがPFIC収入テストの受動的収入を構成するかどうか)、PFICルールの適用によって影響され、これらの規則は異なる解釈の影響を受ける可能性がある。また,PFIC資産テストを行うために,我々の資産価値は我々の普通株の市場価格にある程度依存し,普通株の市場価格は大幅に変動する可能性がある。私たちの推定総収入、私たちの資産平均価値(営業権を含む)と私たちの活発な業務の性質から、2023年12月31日までの納税年度、私たちはアメリカ連邦所得税のPFICだと思います。PFICの地位は事実的であり、完全に我々の制御範囲内ではない要因に依存して、通常、関連納税年度が終了するまでは確定できず、毎年決定されるため、本課税年度または将来の任意の特定年度におけるPFICの地位は保証されない。そのため、アメリカ投資家はPFICへの投資に関連するアメリカ連邦所得税の結果を負担したい場合にのみ、私たちのアメリカ預託証明書に投資すべきである。
もし私たちが個人私募株式投資会社であれば、私たちのアメリカ預託証明書のアメリカ保有者は、資本利益やアメリカ個人の実際または配当とみなされる任意の優遇税率を受けることができないなど、不利なアメリカ連邦所得税の結果の影響を受ける可能性があり、利息は、私たちの分配およびアメリカ預託証明書の販売収益、およびアメリカ連邦所得税の法律および法規に規定された追加申告要求に適用される。投資家はアメリカ預託証明書規則を私たちのアメリカ預託証明書に適用するすべての方面について彼ら自身の税務顧問に相談しなければならない。私たちは私たちに合格した選挙基金選挙を行うためにアメリカの投資家に必要な情報を提供するつもりだ。より多くの情報については、本年度報告の“税収−重要な米国連邦所得税考慮事項−受動型外国投資会社考慮事項”を参照されたい。
58
項目4.情報N入株会社
A. 歴史と発展会社の財産
私たちは1997年にイングランドとウェールズ法に基づいて登録され、2008年に運営を開始した。2008年4月28日、私たちはNuCana BioMed Limitedと改名した。2017年8月29日、上場株式会社に再登録し、NuCana plcと改称しました。2017年10月2日、米預託株式(ADS)の初公募株をナスダック世界ベスト市場で完成させた。2023年11月9日、上場先をナスダック資本市場に移します。私たちのアメリカ預託証券取引コードは“NCNA”です。
私たちの登録事務所はイギリスロンドンEC 4 N 6 AFカンノン街77/78番地にあります。我々の主な実行事務所はイギリスEH 12 9 DT,3 Lochside Way,EH 12 9 DTにあり,我々の一般電話番号は+44(0)131 357 1111,我々のインターネットアドレスはhttps://www.nucana.comである.本年度報告には、当社のサイトおよび当社のサイトに掲載されている、または本サイトで取得可能な情報は含まれていません。私たちのアメリカでの加工サービス代理は会社サービス会社、郵便番号:19808、郵便番号:19808です。米国証券取引委員会には、米国証券取引委員会に電子的に提出された報告書、依頼書、情報声明、その他の発行者に関する情報が含まれた相互接続サイトが設けられている。
B.バス性質.性質
概要
私たちは臨床段階のバイオ製薬会社で、私たちのProTideを応用することで癌患者の治療結果を著しく改善することに集中しています いくつかの処方の最も広範な化学療法薬物、ヌクレオシド類似体を、より有効かつ安全な薬物に変換する技術。これらの伝統的な薬物は多くの固形腫瘍と血液系悪性腫瘍を治療する核心薬物であるが、それらの治療効果は以下の要素によって制限される可能性がある:迅速に分解し、有毒副産物を産生する可能性がある;細胞膜トランスポーターの摂取不足;有効な抗癌代謝物の代謝効率の低下;及び薬物動態学或いはPKは比較的に悪く、これらの特性は通常挑戦的な投与プログラムが必要である。我々の特許技術を利用して,これらすべての重要な制限を克服し,癌細胞中の活性抗癌代謝物の濃度をより高くし,従来の化学療法に関連する標的外毒性を回避するためのProTideという新薬を開発している。
NUC−3373はヌクレオシド類似体である5−フルオロウラシルや5−FUから誘導される新しい化学実体であり,5−FUは広く使用されている化学療法薬であり,5−FUに代わって多くの癌を治療する標準薬となる可能性が信じられている。5-FUは世界で最も広く処方されている抗癌薬の一つであり、世界保健機関の基本薬物リストの一員でもある。NUC−3373はすでに末期固形腫瘍患者の1期臨床試験で評価されている。NUC-3373は現在行われている三つの臨床試験で評価を行っている:他の薬物と併用して転移性結腸直腸癌患者の1 b/2期臨床試験;NUC-3373と他の薬物と併用して末期結腸直腸癌患者の二次治療のための無作為第二段階臨床試験;およびNUC-3373とPD-1阻害剤Pembrolizumabの併用による末期固形腫瘍患者およびドセタキセルとの併用による肺癌患者の1 b/2期モジュール化臨床試験。
Nuc-7738は新型抗癌ヌクレオシド類似体3‘-デオキシアデノシン或いは3’-daのProTide変換産物であり、臨床前研究ですでに強力な抗癌活性を示したが、その迅速な分解のため、抗がん剤としての開発或いは承認に成功していない。NUC−7738は進行固形腫瘍患者に対する1/2期臨床試験の2期部分であり,単一療法としてNUC−7738とPembrolizumabを併用した場合を評価している。
癌の治療は手術、放射線治療、治療の3つに大別できる。治療方法は、化学療法、免疫治療、細胞ベースの治療、および標的およびホルモン性薬物を含む。癌患者治療の柱は化学療法薬であり,2030年までに世界の収入は約979億ドルに達すると予想される。新療法の開発に大きな進展があったにもかかわらず,多くの患者は化学療法を継続しており,他の治療と併用するか,治療中のある時点で単一薬物として化学療法を受けている。したがって,予測可能な未来において,より有効かつ安全な化学療法薬が癌患者の治療に重要な役割を果たすと信じている。著者らは重要な化学療法薬物、ヌクレオシド類似体を転換しており、十分に検証された薬物化学方法を応用することによって、それらの局限性を克服している。
リン酸エステル化学の力を利用して、ヌクレオシド類似体を活性ヌクレオチド類似体に変換し、アリール基、エステルおよびアミノ酸基の特定の組み合わせによって保護されたリン酸基を添加する。このリン酸基を添加して保護することで、これらの制限を回避または克服するためにProTideを設計しました
59
ヌクレオシド類似体の分解,摂取,活性化,投与に関与している。抗ウイルス分野では、このリン酸エステル化学方法はすでに医学史上最も成功した薬物の発売、ジリッドのソブウェルあるいはSovaldiを招いた® これもハヴォニの重要な構成要素です®Vosevi® Epclusaと®Genvoyaの重要な成分であるフマル酸テノホビルプロピルアミノアミドまたはTAF®Descovy®オデッシーと®それは.また,GIleadのredesivirやVekluryにはホスファミド化学を用いた®新冠肺炎患者の治療に用いられる。
臨床前研究では,NUC−3373は5−FUに関する重要な制限を克服し,5−FUよりも高いレベルの活性抗癌代謝物を細胞内で産生するとともに,通常5−FU副作用に関与する有毒代謝物を産生しない。NUC-3373はすでに一期臨床試験で評価されており、この試験はNuTide:301試験とも呼ばれ、末期固形腫瘍患者に使用されている。この試験の登録は完了し,59名の患者がNUC−3373治療を受けた。NUC−3373単一療法の最大耐容量とスケジュールは2500 mg/mに決定された2週に一回です。NUC−3373は、患者の細胞内で高いレベルの活性抗癌代謝物を産生し、良好な薬物動態および安全性を示す。持続的な抗癌活性が認められた証拠は,少なくとも10名の患者が4カ月以上治療を受けており,そのうち3名は長期安定した疾患を実現し,無進展生存(PFS)は9カ月以上持続している。この試験の結果,NUC−3373は5−FUに関連する限局性を克服する可能性があり,抗癌活性が可能であり,先にフルオロピリミジン治療が進展した患者においても同様であることが示唆された。
NUC−3373は,転移性結腸直腸癌患者でNuTide:302という1 b/2期試験を行っており,NUC−3373は亜葉酸カルシウム,イリノテカン,オキサリプラチン,ベバズマブを含む通常5−FUと併用されている薬剤で評価されている。2019年10月,AACR−NCI−EORTC分子標的と癌治療国際会議でこの試験の中間データを公表した。これらの一時的データは、以前に報告されたNUC−3373の有利な薬物動態特性をサポートする。2021年4月、我々は仮想AACR年次総会でこの実験のさらなる中間データを発表した。これらの中期データは,NUC−3373単独治療または亜葉酸カルシウムとの併用治療を受けた38名の患者を強調している。11人の患者ケース研究により、NUC-3373のSは大量の前治療を受けた末期結腸直腸癌患者の疾患を安定し、PFSの持続時間を延長することができることが示された。いくつかの患者は、以前のレジメンよりも長いPFS周期を獲得し、すべての以前のフルオロピリミジンレジメンに対して無効であることが知られている患者を含む腫瘍体積の縮小を観察した。NUC−3373も良好な安全性が証明されており,有毒代謝物FBALに関連する手足症候群は認められず,有毒代謝物FUTPに関連する好中球減少症,レベル3または4級粘膜炎や下痢不良も認められなかった。 2022年9月、私たちはESMO年次総会でこの試験のデータを発表した。これらのデータは、大量の前治療を受けた転移性結腸直腸癌患者において、亜葉酸カルシウム、イリノテカン或いはNUFIRI或いはオキサリプラチン或いはNUFOXと併用し、良好な抗腫瘍活性と良好な安全性と薬物動態学的特徴を有することを表明した。NuTide:302試験は現在1 b/2期試験の第3部分にあり、NUFIRIとNUFOXとベバシズマブの併用による末期結腸直腸癌患者の二線治療を評価している。2023年10月,我々は2023年AACR−NCI−EORTC分子標的と癌治療国際会議でこの臨床試験のデータを公表した。この実験では,NUC−3373はNUFIRIおよびベバシズマブ(またはNUFIRI+BEV)およびNUFOXおよびベバシズマブ(NUFOX+BEV)と併用した場合に良好な安全性を示した。さらに、2つの方案とも、以前のフルオロピリミジン治療が無効または進行した患者の腫瘍体積の縮小を含む鼓舞的な治療効果の兆候を示した。5−FUをベースとした第一線治療と比較して,数名の患者はNUFIRI+BEVとNUFOX+BEV治療でより長いPFSが得られた。2024年に1 b/2期NuTide:302で第3部分のより多くのデータを報告する予定です。
2022年にNuTide:323というランダム第2段階試験を開始し、NUC-3373とNUFIRI+BEVおよび5-FUとの併用によるイリノテカン、亜葉酸カルシウムおよびベバシズマブまたはFOLFIRI+BEVの末期結腸直腸癌患者の二次治療の使用を比較した。2023年10月、我々は、2023年AACR-NCI-EORTC分子標的と癌治療国際会議でNuTide:323試験のデータを公表した。この試験募集は良好であり,最初に組み入れられた40名の患者のまとめた安全データから新たなセキュリティ信号は観察されなかった。私たちは2024年にNuTide:323試験のより多くのデータを報告する予定だ。
NUC−3373の抗癌作用機序は臨床前研究で明らかにされており,5−FUに対するNUC−3373の生物学的優位性をさらに支持していると考えられる。NUC−3373は巨大なビジネス潜在力を有していると信じており,北米では年間約50万人の患者が5−FU静注を受けていると推定されているからである。NUC-3373を5-FUの代わりに結腸直腸癌患者を治療することは巨大な商業機会を提供した。結腸直腸癌は全世界の第三種の最もよく見られる癌タイプであり、全世界の癌の年間総発病率の10%を占める。米国だけで毎年15万例を超える新たに確定診断された結腸直腸癌症例がある。全世界の結腸直腸癌負担は2020年の約190万例から2040年の約310万例に増加し,60%に増加することが予想される。結腸直腸癌は局所で発生するため、多くの患者で診断が遅いからである
60
末期或いは転移性疾患、及び14%しかない4期疾病患者は5年間生存し、より有効な治療方案に対する需要は高度に満たされていない。
他の癌適応における5−FUの広範な使用およびより効率的かつ安全なフルオロピリミジンの重大なグローバルビジネス機会を利用するために,NuTide:303試験と呼ばれる1/2期モジュール化試験を行っている。NuTide:303試験は、末期固形腫瘍患者のためのNUC-3373とPD-1阻害剤Pembrolizumabとの併用、および肺癌患者のためのドセタキセルとの併用を評価している。私たちは2024年にNuTide:303試験の予備データを報告する予定だ。
臨床前研究では,NUC−7738が母体ヌクレオシド類似体3‘−daに比べて癌細胞内で産生される重要な抗癌代謝物3’−デオキシアデノシン三リン酸や3‘−dATPレベルが有意に高く,癌細胞損傷が増加した。NUC−7738の細胞毒作用は3‘−dATP干渉RNAポリアデニル化に大きく起因し,各種の細胞過程に関与する遺伝子発現の変化を引き起こし,癌細胞を死亡させる。
Nuc-7738は進行固形腫瘍患者のためのNuTide:701試験と呼ばれる1/2期臨床試験を行っている。2021年9月,ESMOでこの試験を行った最初の29名の患者の中期データを公表した。これらの一時的なデータは、NUC−7738が良好な薬物動態および安全性を有することを示している。さらに、3つのケーススタディは、より長い間NUC−7738を使用して治療を継続した腫瘍が減少した鼓舞的な患者を強調した。2022年9月、ESMOの38人の患者において行われたNuTide:701試験の第1段階用量発現部分のデータを公表した。NUC−7738は良好な安全性を有し,治療に関連する副作用(TRAE)の発生率は低く,3級TRAEは少なく,4級や5級TRAEを経験していない。最大耐容量は1350 mg/mであった2それは.一連の腫瘍タイプにおいて鼓舞的な抗腫瘍活性シグナルが観察され、多くの患者が治療時間を延長し、その中に転移性黒色腫患者を含み、彼はNUC-7738治療11ケ月後に完全手術切除を受ける資格がある。2023年4月、我々がAACR年次総会で発表したデータは、NUC-7738が黒色腫細胞株および患者における可溶性PD-L 1および細胞外体PD-L 1を減少させることを示している。PD−L 1の可溶性および細胞外発現はPD−L 1およびPD−1阻害剤の耐性に関与しており,これらのデータはNUC−7738が免疫増感剤やPD−L 1経路阻害剤の有効な結合パートナーとして有用である可能性を示唆している。2023年10月、我々は、2023年AACR-NCI-EORTC分子標的および癌治療国際会議でNuTide:701試験の第2段階の中間データを公表した。NUC−7738は単一療法および臭化リビーズとの併用とも耐性が良好であった。単一治療と連合治療の列には腫瘍体積の縮小と治療時間の延長を含む鼓舞的な治療効果の兆候が観察された。以前に抗PD-1治療を受けた黒色腫患者の連合行列において、多くの患者は腫瘍体積の縮小と治療時間の延長を実現した。PD-1+抗CTLA-4とnivolumab+ipilimumabの併用による治療が無効な1例の患者は、NUC-7738+pembrolizumab治療において腫瘍体積が50%縮小した。報告のデータ締め切り時には,募集した11名中7名が治療を受けていた。患者の腫瘍生検資料により、NUC-7738とペブロモリズマブの併用治療後、PD-1発現は減少し、CD 8+T細胞は増加し、NUC-7738は免疫治療を強化する能力を有する可能性が示唆された。この発見はなぜNUC-7738ガベブロマイズマブが過去の免疫治療が進展した患者に対して有効に1つの理論基礎を提供したかもしれない。私たちは2024年にNuTide:701試験のより多くのデータを報告する予定だ。
刺五加素はヌクレオシド類似物であるゲムシタビンがProTideを経て転化したものである。臨床試験ではアクラリン耐性は良好であり,先のゲムシタビン治療が無効あるいは進行した患者で抗癌活性を示した。挑戦的な適応では,卵巣癌や胆道癌を含め,部分的および完全な反応を含む疾患コントロールや腫瘍縮小が認められた。2022年3月、著者らは3期臨床試験の中止を発表し、NuTide:121試験とも呼ばれ、アクラリンとシスプラチンとギシタビンプラスシスプラチンの併用治療標準治療標準を研究し、以前未治療の局部末期或いは転移性胆道癌患者に対する治療効果を研究した。この決定は,実験の独立データモニタリング委員会があらかじめ計画した無駄な分析を行った後に行ったものである。アキシラリン連合シスプラチン治療群でもっと高い客観的緩和率が観察されたが、これは全体の生存利益に転化できなかった。われわれはAcelarinによる胆道癌治療の将来の開発選択を評価しており,より低用量のAcelarin,代替パートナーあるいは胆道癌患者の特定の亜群を探索する可能性がある。胆道癌以外の適応も評価されており,Acelarinの将来開発選択となっている。
私たちの独自のProTide技術は、私たちの首席科学官Christopher McGuigan教授がカーディフ大学の実験室で発明し、私たちの最初のProTideの原始物質からなる特許を構想し、提出した。彼が発見した唯一無二の特徴は、活性化ヌクレオシド類似体またはリン酸化ヌクレオシド類似体を保護することができるアリール基、エステルおよびアミノ酸基の特定の組み合わせである。このリン化化学的方法は
61
ProTide技術です。各ProTideグループは異なり、McGuigan教授と彼のチームは、各潜在的ヌクレオシド類似体の最適なProTideグループを決定するために、数千種類の化合物を合成して試験した。
われわれはリンアミド化学の腫瘍学への応用と考えられる基礎的特許を付与した。我々は米国,ヨーロッパ,日本を含むキー市場にライセンス特許を有し,我々の候補製品NUC−3373,NUC−7738,Acelarinなどの物質組成を保護した。McGuigan教授の仕事は、ソブビルやSovaldiを含むいくつかのFDAによって承認されたProTideを含む抗ウイルス薬の開発に先立って助けられた®これもハヴォニの重要な構成要素です®Vosevi® Epclusaと®Genvoyaの重要な成分であるフマル酸テノホビルプロピルアミノアミドまたはTAF®Descovy®オデッシーと®RedesivirやVekluryと®.
私たちは、アボット(現エバービー社)での勤務経験を含め、バイオ製薬業界で30年以上の経験を持つ創業者で最高経営責任者のヒュー·グリフィス氏が率いる。パーカー·デイビス·ワーナー·ランバートもいますNuCanaを作成する前に、BioenVision,Inc.は起動からGenzyme Corporationによって買収されるまでの運営をリードしていた。Bioenvision勤務中,小児急性白血病の治療のためのヌクレオシド類似体であるクロロファラビンの開発と商業化を支援した。
私たちの戦略
われわれの目標は,広範な適応下で癌患者の生存結果と治療の安全性を改善することである。私たちの戦略には以下の重要な構成要素が含まれている
2023年10月、我々は、進行結腸直腸癌患者のためのNuTide:302試験と呼ばれるAACR-NCI-EORTC 2023年分子標的および癌治療国際会議で、NuTide:302試験と呼ばれるlb/2期試験の追加データを報告した。この試験では,NUC−3373は安全性評価と推奨されている第二段階用量を受けており,通常5−FUに結合している多くの薬剤と組み合わせた場合,亜葉酸カルシウム,イリノテカン,オキサリプラチン,ベバズマブが含まれている。
著者らはNUC−3373の無作為第二段階臨床試験を開始し、NuTide:323試験と呼ばれ、亜葉酸カルシウム、イリノテカンとベバシズマブ(NUFIRI+BEV)と標準治療標準FOLFIRI+BEV(5-FU、亜葉酸カルシウム、イリノテカンとベバシズマブ)を併用して二線末期結腸直腸癌患者を治療した。2023年10月,我々は2023年AACR−NCI−EORTC分子標的と癌治療国際会議でNuTide:323試験の予備集約セキュリティデータを報告した。
我々は,2024年に我々のlb/2期試験NuTide:302と我々のランダム2期試験NuTide:323のより多くのデータを報告する予定である。
5-FUの広範な使用及びより有効、より安全なフルオロピリミジンを開発する重要な全世界商業機会を十分に利用するため、著者らはNuTide:303と呼ばれる1 b/2期モジュール化試験を開始し、NUC-3373とPD-1阻害剤pembrolizumabを末期固形腫瘍患者に併用し、ドセタキセルを肺癌患者に応用した。
2024年に我々の1 b/2段階試験NuTide:303のデータを報告する予定である。
末期固形腫瘍患者においてNUC−7738が行っている1/2段階試験の第1段階用量発現部分、すなわちNuTide:701試験を完了した。NUC-7738は現在NuTide:701試験の第二段階にあり、この試験は単一療法としてNUC-7738を評価し、末期固形腫瘍患者のためにPD-1阻害剤pembrolizumabと組み合わせている。2023年10月、我々は、2023年AACR-NCI-EORTC分子標的および癌治療国際会議でNuTide:701試験の第2段階の中間データを公表した。
私たちは2024年に私たちの1 b/2段階試験NuTide:701のより多くのデータを報告する予定だ。
62
成熟し広く使用されているヌクレオシド類似体や新しいヌクレオシド類似体の変換が求められており,これらの類似体は腫瘍学的に満たされていない医療ニーズの他の分野を解決する可能性があると信じている。
私たちはProTide技術プラットフォームの背後にあるコア技術の独占的な権利を持っているか、または持っている。我々は米国,ヨーロッパ,日本などのキー市場で特許を取得しており,候補製品NUC−3373,NUC−7738,Acelarinなどの物質組成を保護している。私たちは私たちの知的財産権の地位をさらに拡大して向上させるつもりだ。私たちは、必要に応じて私たちの知的財産権の地位をさらに拡大し、私たちの特許を守るために、出現した新しい知的財産権の機会を積極的に評価している。
私たちは私たちが開発しているすべての候補製品の世界的な権利を持っている。私たちは、私たちが最初にProTideを使用してほとんどの癌患者を治療した医療専門家は、比較的集中した販売とマーケティングチームによって解決できると信じている。私たちは現在、アメリカとヨーロッパで専門的な販売チームを使用して、独立して、あるいは商業化パートナーと協力して、規制マーケティングの承認を得た任意の候補製品を商業化する予定です。
63
私たちのパイプは
私たちは科学的に駆動する方法を用いてProTideを設計し、これはより良い耐性を持つ効率的な癌治療を引き起こす可能性があると信じている。著者らの臨床開発における候補製品と現在の開発段階のパイプラインを以下にまとめる。

癌と治療計画の改善の必要性
癌は米国で2番目に大きな死因であり,米国癌協会のデータによると,2024年に米国の新規症例は200万例を超え,死亡者数は約60万人となる。
癌の治療は手術、放射線治療、治療の3つに大別できる。治療方法は、化学療法、免疫治療、細胞ベースの治療、および標的およびホルモン性薬物を含む。
癌患者治療の柱は化学療法薬であり,2030年までにこれらの薬物の収入は約979億ドルに達すると予想される。毎年化学療法を必要とする新規患者数も増加すると予想され,2018年の980万人から2040年には1500万人に増加する予定である。化学療法薬は癌細胞を死滅させたり,癌細胞の複製を阻止したりすることで機能し,他の療法と組み合わせて使用されることが多い。化学療法のより広い範囲では,ヌクレオシド類似体,例えば5−FUが重要な役割を果たしている。ヌクレオシド類似体は臨床で50年以上使用されており,癌患者治療の礎となっている。FDAはすでに16種類のヌクレオシド類似体を癌治療に許可し、その多くはすでに全世界の患者の標準看護になっている。FDAが承認した抗癌ヌクレオシド類似体としては,5−FU,カピタビン,ゲムシタビン,フルオロウラシド,クロロファラビン,フルダラビン,アグリコシド,アゾシトシン,ジシタビン,ネラビン,クラドビン,ペンタスタチン,6−チオプリン,チピラン,6−チオグアニン,トリフルオロチオピリミジンがある。世界保健機関は5−FUを含む7種類のヌクレオシド類似体を基本薬物に分類しており,人々の優先医療ニーズを満たし随時提供すべき薬物と定義している。
多くの化学療法薬は相当な売り上げを生み出した。米国では,毎年約275,000人の患者が5−FUの静注を受けており,この薬物は結腸直腸癌,乳癌,胃癌,頭頸部癌,膵癌を含む多くの癌の治療に広く用いられている。カペタビン5−FU誘導体の経口バージョンは,カペタビンと呼ばれ,市場名はヒロダである® 2012年、後発薬競争相手が発売される前、同社の世界での売上高は15億ドルで、結腸直腸癌や乳癌の治療に用いられた。カペタビン治療を受けた患者数は,5−FU治療を受けた患者総数のわずかな部分にすぎないと考えられる。
64
ヌクレオシド類似体の欠点
ヌクレオシド類似体は広く使用されているにもかかわらず、それらの有効性と安全性は主要な欠点の深刻な制限を受けており、分解、比較的に悪い薬物動態学性質、トランスポーターに対する摂取要求及び活性抗癌代謝物を産生する代謝経路の低効果を含む。
ヌクレオシド類似体は、細胞複製中に欠陥のあるDNAおよびRNA構築ブロックを提供することによって、またはこれらのDNAおよびRNA構築ブロックを製造するために必要な酵素を遮断することによって、癌細胞の複製を阻止する。これらの過程はDNAとRNAの複製を中断させ、癌細胞の死亡、いわゆるアポトーシスを招く。しかし、いくつかの主要な欠陥は、既存のヌクレオシド類似体の治療効果を制限する
65
私たちのProTide技術とその主な利点は
NuCanaのProTideは既存のヌクレオシド類似体に関連する肝心な挑戦を克服するために専門的に設計された新しい化学実体であり、以下に示す
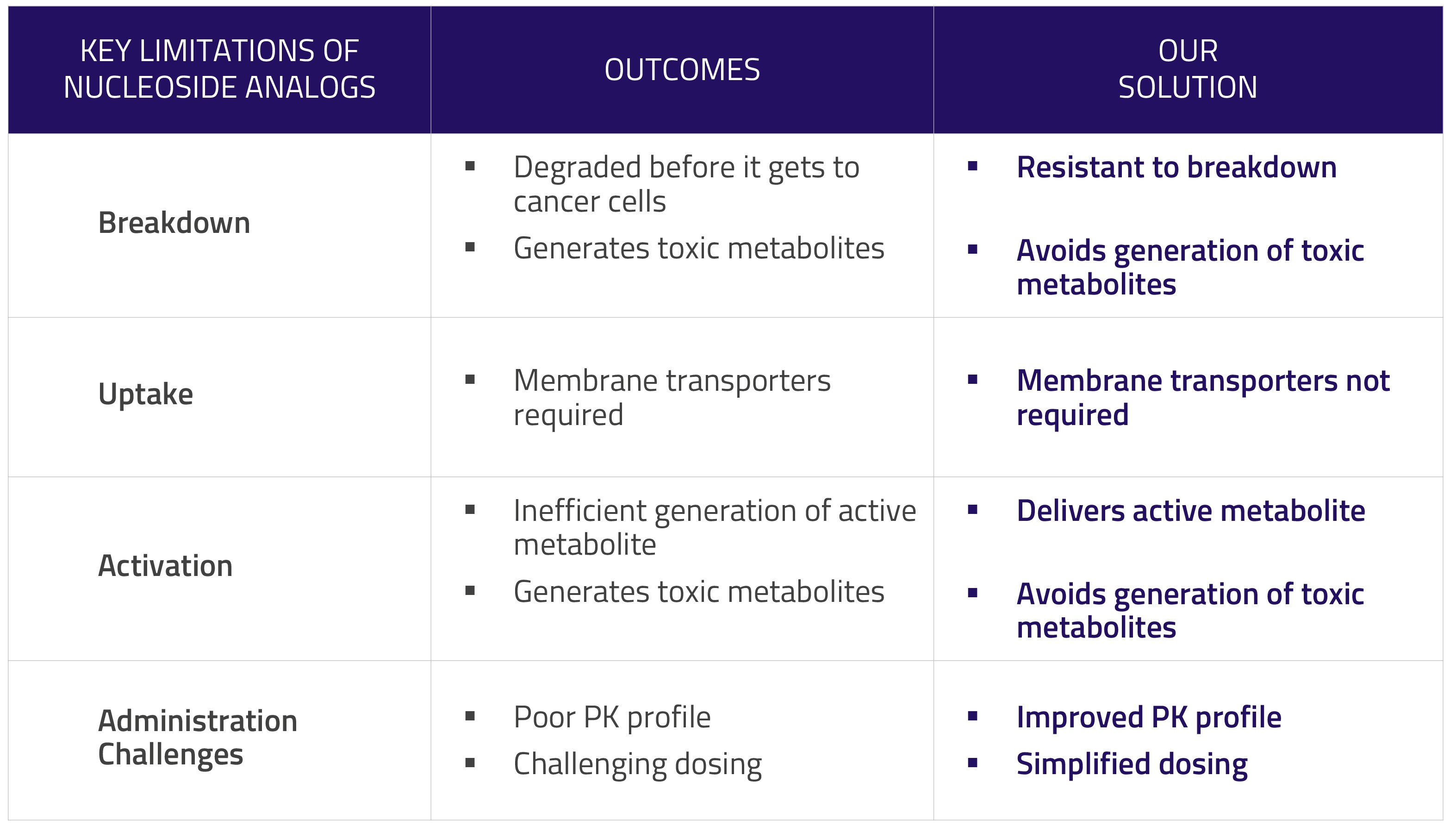
ホスホアミド化学の力を利用することにより、ヌクレオシド類似体を活性ヌクレオチド類似体に変換し、アリール基、エステルおよびアミノ酸基の特定の組み合わせによって保護されたリン酸基を添加する。これらの化合物をProTideと呼ぶ。我々は,癌患者の治療のために現在承認されているヌクレオシド類似体,および分解,摂取,活性化および/または投与上の挑戦により開発に成功していないヌクレオシド類似体にProTide技術を適用している。
66
ヌクレオシド類似体、ヌクレオチド類似体、およびタンパク質の化学構造のパターンは以下のように表される
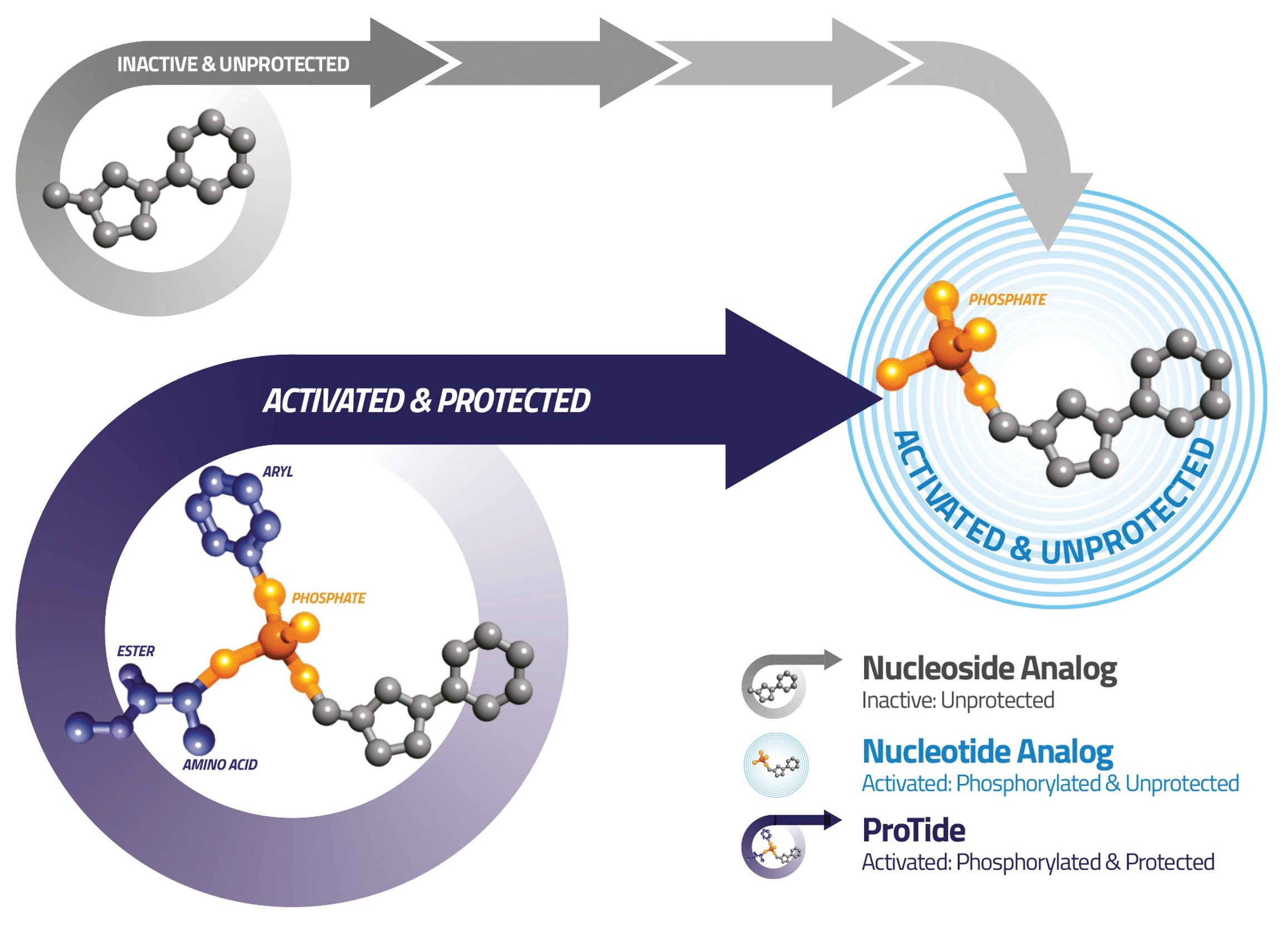
著者らの研究者はProTideの設計、合成とスクリーニングに20年以上の仕事を投入し、著者らはヌクレオシド類似物の癌患者治療の肝心な制限を克服するために設計した最適な製品であると信じている。我々は我々の科学創始者と幹部からかなりの洞察力を得て,ホスファミド化学とヌクレオチド類似体がどのようにその抗癌作用を発揮できる生物学を知ることができた。このような学習に基づいて、私たちは数百万人の潜在的な候補者の中から数百人の目標候補者を効率的に作ることができる。そして私たちの鉛ProTideを選択するためにこれらの目標候補を生物学的にテストしました
NUC−3373:5−FUの改造
われわれの主要候補製品NUC−3373は,5−FUの臨床応用を制限する主な欠点と薬理学的挑戦を克服することを目的としている。5−FUは世界で最も重要で最も広く用いられている癌療法の一つであるため,NUC−3373は巨大なビジネス潜在力を有していると信じている。NUC−3373の設計目的は,5−FUに関する奏効率と安全性を向上させ,投与負担を軽減することである。我々はNUC−3373の臨床応用を進めており,このような新しい化学実体を結腸直腸癌や他の固形腫瘍患者の潜在的治療法として開発している。
5−フルオロウラシルとその限界
5-FUは1957年に初めて発売され、今でも多くのタイプの癌患者治療の礎石であり、すべての胃腸悪性腫瘍(結腸直腸、胃、膵臓と小腸を含む)、乳癌と頭頸部癌を含む。
67
他の2つの薬剤は、5−FUと同様の活性抗癌代謝物:フルオロデオキシウリジン、またはフルオロウラシルを産生することを目的としており、市場名はFUDRであることが承認されている ®カペタビンと市場名はヒロダです ®それは.カルペタビンは5−FUのプロドラッグであり,ヌクレオシド環の化学修飾を含み,経口投与量を許容する。
5-FUおよびその他の形態のFUDRおよびカペタビンの抗癌活性は、リン酸化活性抗癌代謝物FUDR-MPによるところが大きく、細胞内酵素チミジン合成酵素(TS)に結合して阻害される。TSは重要な酵素です初めからやり直すヌクレオチド合成と細胞生存は、尿配糖体、特にデオキシウリジン一リン酸、あるいはDUMPをチミジン、特にデオキシチミジン一リン酸、あるいはDTMPに変換し、DNAを構成する4つのヌクレオチドの一つである。そのため,TSの抑制はヌクレオチド転送とDTMPの割合の不均衡を招き,DNAの合成や修復を撹乱し,癌細胞を死亡させる。
いくつかの重要な制限は5-FU治療方案の予後不良と関係がある。NUC−3373はこれらの制限を克服し,5−FUに関連した投与挑戦を信じている。
1.障害が発生する可能性があります。5−FUの約85%はジヒドロピリミジン脱水素酵素(DPD)によって分解され,DPDは主に肝臓に発現する酵素である。この分解は,プロドラッグが癌細胞に入る機会があり,活性化され,任意の治療効果を発揮する前に,プロドラッグの大部分を破壊してしまう。そのほか、この分解は1種の有毒な副産物FBALを産生し、それは非標的毒性と関係があり、“手足症候群”を含み、各種の源の報告によると、25%~75%のフルオロピリミジン治療を受けた患者が影響を受けた。手足症候群は衰弱の副作用であり,手掌や足底の発赤,腫脹,しびれや皮膚弛緩や脱皮が特徴であり,通常5−FU治療を受けている患者の投与量の減少や治療中止を招く。また,高レベルのDPDも5−FU耐性腫瘍での上昇が認められた。
2.能動的な輸送が必要です。5−FUは、細胞膜を通過する特定のトランスポーターに依存する。これらの輸送体が存在しない場合や発現レベルが低い場合には,5−FUが癌細胞に入る能力が制限される。例えば,ヌクレオシドトランスポーターhENT 1の低発現は癌細胞の5−FUに対する耐性に関与している。
3.非効率的な代謝活性化経路。5−FUが細胞に入ると,一連の酵素処理を経なければ活性な抗癌代謝物FUDR−MPを産生する。FUDR-MPはTSを結合し、抑制し、尿配糖体レベルの上昇とチミン酸ヌクレオシドレベルの低下を招き、それによって癌細胞の死亡を招く。5−FUのFUDR−MPへの変換には,いくつかのキー酵素が関与している。その1つは輪転酸リン酸リボトランスフェラーゼ,あるいはOPRTである。腫瘍細胞中の低レベルのOPRTは5−FU耐性に関与している。もう一つの細胞内酵素,チミジンホスホリラーゼ,あるいはTPは,5−FUをフルデオキシウリジン,あるいはFUDRに可逆的に変換することができ,FUDR−MPを形成する中間産物である。ヒト癌細胞におけるTPの低発現は5−FU耐性に関与している。また,チミジンキナーゼ,あるいはTKは,FUDRを活性抗癌代謝物FUDR−MPに変換する酵素である。ヒト癌細胞におけるTKの低発現は5−FU耐性に関与している。5−FUの代謝経路も代謝物FUTPの産生を招き,好中球減少,粘膜炎,下痢などの用量制限毒性に関与している。
4.薬物動態曲線が悪い。5−FUの薬物動態特性も投与に挑戦した。5−FUは血漿中で半減期が8~14分と短い。細胞が5−FUに曝露される短時間に対応するために,医療提供者は通常5−FUを長時間注入し続ける。例えば,結腸直腸癌治療を受けている患者は,通常,携帯型ポンプを用いて46時間以上持続注入することで5−FUを受ける。この投与量要求は提供者に負担を与え,患者に不便をもたらし,医療システムのコストを増加させた。また,5−FUの薬物動態曲線は予測不可能であり,何らかの特徴を持つ患者は危険な高いレベルの5−FUを経験する可能性があり,致命的,あるいは無効な5−FUレベルである可能性がある。
我々の解決策:NUC-3373
NUC-3373は活性抗癌代謝物FUDR-MPの保護性形式であり、フルオロピリミジン類薬物の臨床応用を制限する重要な欠点を克服するために専門的に設計されている。Nuc−3373は5−FUが癌細胞内で産生されるのと同様の活性抗癌代謝物FUDR−MPを放出するヌクレオチド類似体であるが,細胞内濃度ははるかに高い。NuC-3373はすでに一期の臨床試験で評価され、NuTide:301は末期固形腫瘍患者に使用されている。Nuc-3373は現在行われている3つの臨床試験で評価を行っている:1 b/2期臨床試験NuTide:302は転移性結腸直腸癌患者のために他の薬物と併用した;ランダム化第2段階臨床試験NuTide:323は末期結腸直腸癌患者の二線治療に他の薬物と併用した;および
68
NUC-3373とPD-1阻害剤Pembrolizumabの併用による末期固形腫瘍患者の治療及びドセタキセル併用による肺癌患者の1 b/2期モジュール化臨床試験。
NUC−3373は5−FUと異なり,活性抗癌代謝物FUDR−MPと保護性ホスファミド部分からなる。この部分はFUDR-MPを保護し、DPD酵素の分解に抵抗させ、DPD酵素はFBALのような有毒副産物の産生を減少させた。より長い半減期を含み、血漿中で6~14時間と推定され、より良い組織分布を含む、より予測可能な薬物動態曲線を提供する。これらの特性は,NUC−3373を約2時間の短時間輸液で投与できるようにした。ProTideの化学構造は分子の親油性を変化させ、膜輸送体を必要とすることなく、NUC−3373が癌細胞に入ることを可能にする。癌細胞に入ると、ホスファミド部分が切断され、脱保護およびFudr−MPの放出をもたらす。これはいずれの活性化酵素の需要を迂回し,活性抗癌代謝物のレベルを有意に向上させ,5−FUと比較して奏効率を向上させると考えられる。また,NUC−3373が利用する代謝経路は有毒代謝物FUTPの産生を回避しているため,好中球減少,粘膜炎,下痢などの毒性は有意に減少すべきである。
以上のように,NUC−3373と5−FUの代謝状況を以下の図に示す。
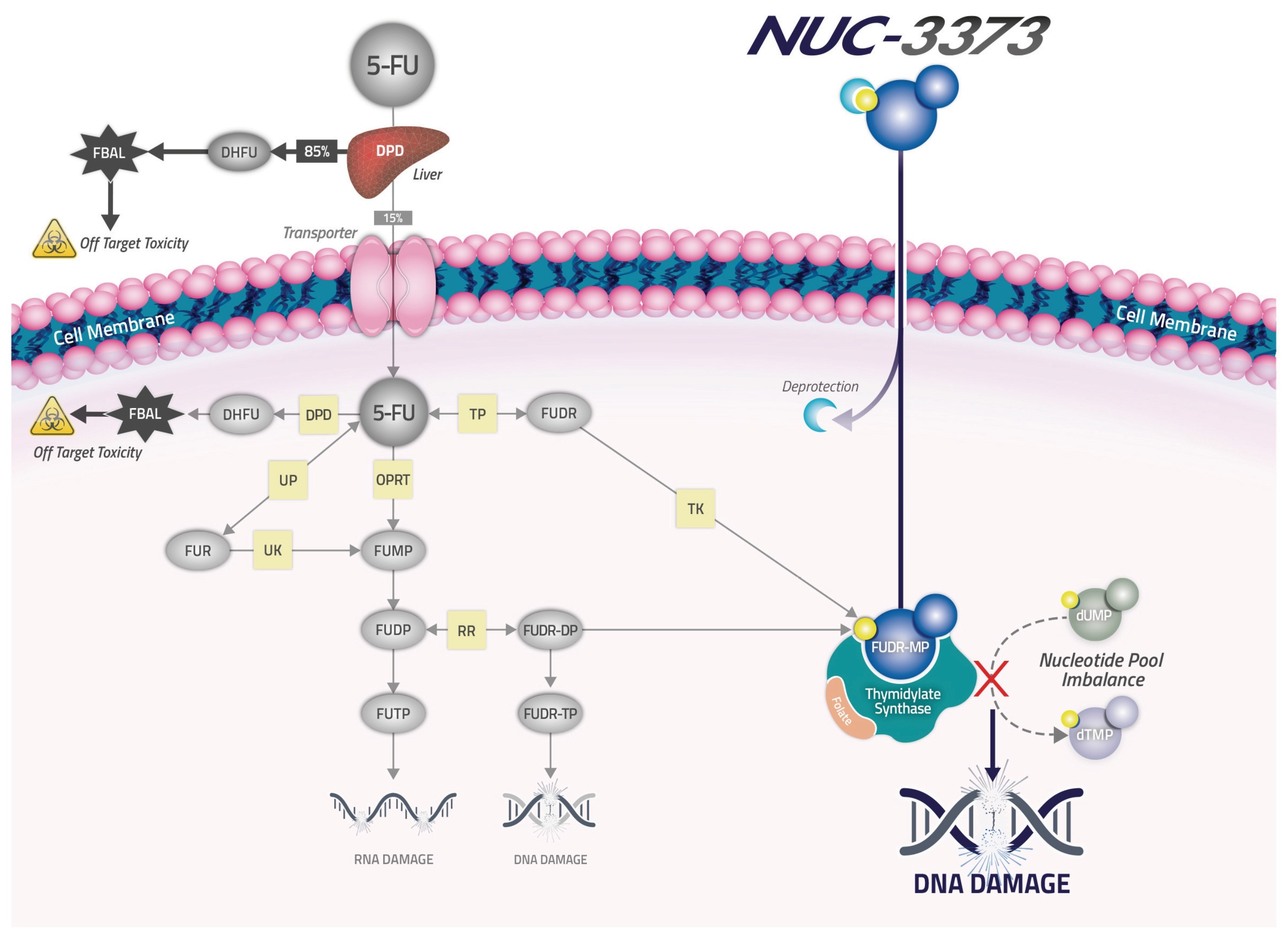
NUC-3373臨床前データ
Nuc−3373は5−FUよりも強い抗癌活性を有するそれは.臨床前研究では,NUC−3373はOPRT,TP,TKを含む活性化酵素に依存せず,これらすべてが5−FU活性化に必要であった。また,一連のヒト腫瘍細胞株におけるNUC−3373と5−FUの抗癌活性,結腸直腸癌,卵巣癌,肺癌を測定した。NUC−3373の活性は5−FUの330倍であった。次の図はNUC-3373または
69
異なる腫瘍細胞系では,5−FUは癌細胞の半分を殺す必要があり,短い条形がより有効な活性を表す。

ヒト結腸直腸癌細胞の臨床前研究では,NUC−3373産生細胞内活性抗癌代謝物FUDR−MPレベルは同用量の5−FU投与より366倍高いことが示唆された。これらの細胞内FUDR−MPレベルの増加は,NUC−3373が5−FUよりもはるかに低い等モル用量で種々の癌細胞を死滅させる能力に変換できると考えられる。また,臨床前の結腸直腸癌異種移植研究では,NUC−3373は5−FUよりも腫瘍重量と体積を軽減する能力を示した。
Nuc−3373は多くの潜在的な抗癌作用機序を有するそれは.ヒト結腸直腸癌細胞系における実験により,NUC−3373はいくつかの異なる機序で癌細胞を死滅させる可能性が示唆された。細胞では,チミジン合成酵素,またはTSは,ウロシド,特にデオキシウラシル一リン酸,あるいはDUMPをチミジン,特にデオキシチミジル一リン酸またはDTMPに変換する必要がある。チアデノピリミジンヌクレオシドはDNAを構成するヌクレオチドの一つである。そのため,TSの抑制はヌクレオチド転送とDTMPの割合の不均衡を招き,DNAの合成や修復を撹乱し,癌細胞を死亡させる。癌患者の腫瘍細胞ではTS酵素レベルが異なる可能性があり,5−FUなどの薬剤の効果に影響すると考えられる。しかし,われわれの実験では,異なる結腸直腸癌細胞におけるTSレベルはNUC−3373が癌細胞を死滅させる能力を予測できないことが分かった。このことは,NUC−3373がTSレベルが高くても腫瘍に対して抗癌活性を有する可能性を示唆している。別の実験では、癌細胞にチミン酸ヌクレオシドを添加することは、NUC−3373が細胞死を引き起こす能力を低下させる。このことは,NUC−3373がTSを抑制し,チミジンレベルを低下させることにより癌細胞が死亡することを明らかにしている。また,癌細胞をNUC−3373で処理した場合,未処理細胞よりも多くの細胞質にTSがあり,後者は核にTSがあることが多い。NUC−3373は,TSを細胞質に残し核への移動を阻止することにより,DUMPとDTMPレベルのさらなる不均衡を招いていると考えられる。
もう一つの実験では,NUC−3373の活性と代謝は,結直腸癌細胞系における5−FUの活性と代謝と直接比較した。活性抗癌代謝産物であるFUDR−MPは,TSに結合しTSと三元錯体を形成することによりチミジンの合成を抑制する。これは,DUMPのDTMPへの変換を阻止することにより,細胞ヌクレオチドプール中の不平衡を招き,DNA合成や修復の中断を招く。これらの実験では,NUC−3373は5−FUよりもTS複合体の形成を引き起こすことが証明されており,低い薬物濃度でも同様である。このことは,NUC−3373が5−FUよりも有効なTS阻害剤である可能性を示唆している。また,これらの細胞系で抗癌代謝物の産生を評価したところ,NUC−3373産生FUDR−MPレベルが5−FUより有意に高く,ダンプレベルにより有意な影響が認められ,ヌクレオチド池への影響が大きいことが示唆された。NUC−3373のSは細胞内高レベルのFUDR−MPを産生し,抗癌代謝物である三リン酸形式のFUDR−TP(FdUTPとも呼ばれる)を産生し,癌細胞のDNAに統合されていることが証明された。一方,5−FUではこの作用は認められなかった。これらの結果は,NUC−3373がより有効なTS阻害剤であるだけでなく,5−FUよりも有効なDNA損傷剤である可能性を示唆している。最後に,5−FU処理によりこれらの細胞に有毒代謝物FUTPが産生されるが,これらの細胞をNUC−3373で処理したところ,FUTPは検出されなかった。
70
もう一つの実験により、NUC−3373はまた癌細胞において小胞体、あるいはERストレスと呼ばれる長期的な細胞ストレスを引き起こすことが示唆された。これは,癌細胞が死亡時に損傷関連分子パターンやDAMPSと呼ばれる分子,あるいはいわゆる免疫原性細胞死,あるいはICDを放出することをもたらす。ICDのこの過程の特徴は,死亡細胞表面曝露や細胞外放出カルシウム網蛋白(CRT)と高遊走率族蛋白1(HMGB 1)であり,次図に示すようになる。これらの遮断薬は免疫系が体内の癌細胞を認識することに役立ち、免疫細胞が癌細胞をさらに殺すことを促進する。

全体的に,これらの非臨床研究は,NUC−3373が免疫系を腫瘍を容易に見ることにより,免疫治療薬の活性を増強する可能性を示唆している。このことは一連の実験で証明されており,これらの実験では,NUC−3373で処理した癌細胞が免疫治療薬であるnivalumab(PD−L 1阻害剤)と併用して免疫細胞に曝露されている。これらの実験は,NUC−3373とnivalumabの併用がいずれの薬剤単独よりも多くの癌細胞死をもたらすことを示唆しており,NUC−3373が免疫治療活性を増強していることを示している。
NUC-3373臨床データ
NuC-3373はすでに末期固形腫瘍患者の第一段階試験で評価を行い、即ちNuTide:301試験であり、現在3つの試験を行っている。NUC-3373は他の薬物と併用して転移性結腸直腸癌患者の1 b/2期試験、NuTide:302試験に用いられた。NUC−3373は他の薬剤と併用して結腸直腸癌患者の二線薬物を治療する無作為第二段階臨床試験,NuTide:323試験である。NUC-3373とPD-1阻害剤pembrolizumabの併用による末期固形腫瘍患者の治療、およびドセタキセルとの併用による肺癌患者の1 b/2期モジュール化試験NuTide:303試験。
NUC-3373:第1段階臨床試験を完了(NuTide:301)それは.NUC-3373は一期臨床試験(NuTide:301試験とも呼ばれる)において良好な安全性と薬物動態学的特徴を示し、臨床活性の将来性は有望である。この試験はすべての治療を尽くして選択した末期固形腫瘍患者を対象としている。この試験では,最大耐容量とスケジュールは2500 mg/mに決定された2週に一回です。また,種々の薬物動態や薬効学を測定した
71
これらのパラメータは、NUC−3373の血漿濃度、抗癌活性代謝物FUDR−MPの細胞内濃度、NUC−3373とその標的酵素TSとの結合能、およびDTMPレベルに対する下流の影響を含む。NUC−3373の抗癌作用機序はこれまで臨床前研究で観察されており,NuCanaは5−FUに対するNUC−3373の生物学的優位性をさらに支持していると考えられている。
2021年9月,ESMOでは,NUC−3373を用いて治療した患者のPKデータを示し,500 mg/mの範囲であった23,250 mg/mまで2それは.以下のグラフはAUCにより測定したNUC−3373の経時的血漿濃度を示し,用量割合の増加を示している。NUC−3373の血漿半減期も6~14時間と長く,5−FUの半減期は8~14分であった。抗癌活性代謝物FUDR-MPの細胞内レベルも用量割合の増加を呈し、文献で報告されている5-FUレベルより明らかに高かった。

全体的に,59名の進行癌患者は他の利用可能な治療選択をすべて使い切り,試験に参加した。これらの大量の予備治療を受けた患者は平均3回の化学療法を受けており,様々な原発腫瘍タイプがある。43名の患者は28日周期の1、8、15、22日目に週計画的にNUC-3373治療を受け、投与量は125 mg/mから様々であった23,250 mg/mまで216名の患者は1週間または2週間ごとにNUC−3373治療を受け,28日周期の1日目と15日目に1500 mg/mから行う予定である22,500 mg/mまで2それは.持続的な抗癌活性の証拠に注目すると,少なくとも10名の患者は4カ月を超える治療を受けており,そのうち3名はPFSが9カ月以上持続した場合に長期安定した疾患を実現している。両投与レジメンの耐性は良好であり,意外な有害事象や累積毒性は認められなかった。重要なのは,手足症候群(レベル1)が1人しか出現しないことである。しかしながら、この患者は、NuTide:301試験に入る前にフルオロピリミジン系薬剤の治療を受けており、これらの以前の治療において手足症候群を経験しており、これは、NUC−3373治療とは無関係に以前の毒性に関連している可能性を強く支持している。NUC−3373のS血漿半減期は6~14時間であり,5−FU連続注入46時間に比べて注入時間が30分から4時間とはるかに短かった。
NUC−3373:行われている1 b/2期臨床試験(NuTide:302)それは.転移性結腸直腸癌患者の1 b/2期試験は,NuTide:302試験とも呼ばれ,NUC−3373は通常5−FUと併用した薬物併用療法である
72
現在、亜葉酸カルシウム、イリノテカン、オキサリプラチンとベバズマブを含む結腸直腸癌患者を治療している。これは、以下の試験スキームに示すように、NUC-3373の推奨される組み合わせ用量およびスケジュールを決定するために、3つの部分からなる用量アップグレードおよび拡大試験である。第1部では,NUC−3373と亜葉酸カルシウムの併用投与の安全性と耐性を評価した。第1部では亜葉酸カルシウムがNUC−3373の薬物動態や安全性に影響しないことを確認した。第2の部分は、NUC-3373プラス亜葉酸カルシウムとオキサリプラチン(NUFOX)またはイリノテカン(NUFIRI)との併用投与の用量増加を評価した。この部分試験の目的は,1 b/2段階試験の第3部分において,NUFOXおよびNUFIRIレジメンにおいてさらに検査される用量を決定することである。1 b/2期試験の第3の部分は、NUFOXおよびNUFIRIとベバシズマブの二線結腸直腸癌患者に対する併用治療を評価することである。

2021年4月,AACR年次総会において,NuTide:302試験の第1部でNUC−3373プラスまたは亜葉酸を加えない38名の厳密な前治療を受けた患者の中間データ(4つの先行治療経路の中央値)を報告した。NUC−3373は良好な安全性が証明され,手足症候群は認められず,有毒代謝物FBALに関与しており,有毒代謝物FUTPに関連するレベル3や4級粘膜炎や下痢不良もなかった。 治療効果信号が観察され,数名の患者が以前のレジメンよりも長いPFS周期を実現した(次図に示す)。腫瘍縮小も観察され、以前のすべてのフルオロピリミジンレジメンに無効な患者を含む。
73

2022年9月,ESMOでは厳密に予備治療された転移性結腸直腸癌患者46名のデータを報告し,NuTide:302試験の第2部でNUC−3373と亜葉酸カルシウム,イリノテカン(NUFIRI)またはオキサリプラチン(NUFOX)との併用治療を受けた。これらのデータは,5−FUを含むFOLFIRIやFOLFOXレジメンの履歴データに比べて,NUFIRI,NUFOXレジメンともに安全性が良く,好中球減少症や胃腸機能障害など毒性発生率が低いことを示している。NUFIRIまたはNUFOX治療を受けた46名の患者のうち,12名(各キュー6名)のPFSは3カ月を超え,PFSが6カ月以上に達した患者3名を含む。NUFIRIとNIFOXレジメンの疾患コントロール率はそれぞれ55%と80%であった。NUFIRIおよびNUFOXスキームの一部として、NUC−3373の推奨される第2段階用量が決定された。
2023年10月、AACR-NCI-EORTC 2023年の分子標的および癌治療国際会議において、1 b/2 NuTide:302期試験の第3部分でNUFIRIまたはNUFOXとベバズマブとの併用治療を受けた14名の転移性結腸直腸癌患者のデータを報告した。NUC−3373はイリテカン,亜葉酸カルシウムとベバシズマブ(NUFIRI+BEV)およびオキサリプラチン,亜葉酸カルシウムとベバシズマブ(NUFOX+BEV)と併用した場合良好な安全性を示した。さらに、2つの方案とも、以前のフルオロピリミジン治療が無効または進行した患者の腫瘍体積の縮小を含む鼓舞的な治療効果の兆候を示した。5−FUをベースとした第一線治療と比較して,数名の患者はNUFIRI+BEVとNUFOX+BEV治療でより長いPFSが得られた。
私たちは2024年にNuTide:302実験のさらなるデータを報告する予定だ。
NUC−3373開発戦略と進行中·計画中の臨床試験
我々の目標は多様な適応のためのNUC−3373の開発であり,最初のポイントは結腸直腸癌である。末期固形腫瘍の第一段階試験は研究者によって賛助され、臨床試験申請(CTA)下で行われた。進行中の転移性結腸直腸癌患者の1 b/2期試験はイギリス,フランス,スペインのCTAおよび米国のINDで行った。2022年、著者らはNUC-3373と他の薬物と併用して末期結腸直腸癌患者の二次治療のための無作為第二段階臨床試験を開始した。2022年、著者らはNUC-3373とPD-1阻害剤pembrolizumabの併用による固形腫瘍患者の治療およびドセタキセルとの併用による肺癌患者の1 b/2期臨床試験を開始した。
NUC−3373:無作為第二段階臨床試験(NuTide:323)それは.2022年,NUC−3373とNUFIRI+BEVとFOLFIRI+BEVを併用した無作為二期臨床試験を開始し,二次治療に用いた
74
第一線のFOLFOX治療を受けた末期結腸直腸癌患者。この試験は、1週間に1回および2週間に1回または1週間おきの投与計画を評価するための2つのNUC−3373治療アームを含む。
2023年10月、我々は、2023年AACR-NCI-EORTC分子標的と癌治療国際会議でNuTide:323試験のデータを公表した。この試験募集は良好であり,最初に組み入れられた40名の患者のまとめた安全データから新たなセキュリティ信号は観察されなかった。私たちは2024年にNuTide:323試験のより多くのデータを報告する予定だ。
NUC−3373:計画的無作為第3段階臨床試験(NuTide:333)それは.無作為第2段階臨床試験(NuTide:323)の後,NUFIRI+BEVの第3段階臨床試験を開始し,NuTide:323試験で決定されたスケジュールを用い,FOLFIRI+BEVは一線のFOLFOXで進展した末期結腸直腸癌患者の二線治療に用いる予定である。
NUC−3373:行われている1 b/2期臨床試験(NuTide:303)それは.2022年には,さらに開発された他の適応と治療の組み合わせを決定するために1 b/2期試験を開始した。これはモジュール化、多腕、平行列の用量発見および拡張試験であり、NUC-3373は異なるタイプの末期固形腫瘍患者の治療のために他の薬物と組み合わせて使用される。本試験の各モジュールは、用量検証段階(段階1)と用量拡張段階(段階2)とを含む。第1段階は、各モジュールの第2段階でさらなる臨床評価を行うために、適切な組み合わせ用量を決定するであろう。約6~20人の評価可能な患者は、NUC-3373と他の薬剤との併用の安全性、予備治療効果、および最大耐性を決定するために、各モジュールの第1の段階に組み込まれるであろう。次いで、各モジュールは、セキュリティおよび有効性のさらなる評価を達成するために、第2の段階に進むことができる。著者らはNUC-3373とPD-1阻害剤pembrolizumabの併用による固形腫瘍患者の治療、及びNUC-3373とドセタキセルの併用による肺癌患者の治療を評価する予定である。私たちは2024年にNuTide:303試験のデータを報告する予定だ。
結腸直腸癌の概要
結腸直腸癌は全世界の第三種の最もよく見られる癌タイプであり、全世界の癌の年間発病率の約10%を占める。米国では,毎年150,000例を超える新たな結腸直腸癌症例と約53,000人がこの疾患で死亡している。世界的には、2020年には190万人の新しい結腸直腸癌症例と91.6万人が死亡すると推定され、2040年には世界的な負担が60%増加し、毎年約310万人の新症例と160万人の死亡に達すると予想されている。多くの結腸直腸癌の治療レジメンには,治療の基盤として5−FUが含まれており,単一治療として,あるいは別の化学療法薬と併用されており,典型的にはオキサリプラチンやイリノテカンである。しかし,5−FUは治療の基準であるにもかかわらず,その有効性は高くない。全体的な回復率は10%から15%の間だ。また,結腸直腸癌は通常すでに局所末期あるいは転移時に晩期と診断され,確定診断時に4期疾患を有する患者の14%のみが5年間生存している。したがって,現在の治療基準5−FUよりも有効で安全な治療法が満たされていない需要が高い。
NUC−7738:3‘−daの転換
Nuc-7738は3‘-デオキシアデノシンまたは3’-daのProTide変換産物であり、虫草素とも呼ばれ、これは真菌から最初に分離されたヌクレオシド類似体である冬虫夏草1950年。それ以来,3‘−daは臨床前研究で強力な抗癌活性を示したが,癌患者の治療の開発や承認には成功していない。3‘-daの細胞毒作用は、その主要な抗癌活性代謝物3’-デオキシアデノシン三リン酸或いは3‘-dATPの産生に大きく起因し、それはRNAのポリアデニル化を妨害し、各種の細胞過程に参与する遺伝子発現の変化を引き起こし、それによって癌細胞の死亡を招く。我々の他のProTideと同様に、NUC−7738は、分解、輸送および活性化に関連する重要な制限を迂回して、細胞内で3‘-daの活性抗癌代謝物を直接産生することを意図している。
3‘-DAとその限界
他のヌクレオシド類似体と同様に,3‘−daの主な欠点は臨床の成功発展を制限している。
1.障害が発生する可能性があります。3‘-DAはアデノシンデアミナーゼ或いはADA酵素によって迅速に分解され、その活性化と活性抗癌形式の産生を阻止する。したがって,3‘−daの抗癌作用はADAによって否定されやすい。この迅速な分解は3‘-DAの臨床上の成功発展を阻害する重要な制限要素である。
2.能動的な輸送が必要です。3‘-DAは、ヌクレオシド輸送体hENT 1が癌細胞膜を通過することを必要とする。したがって,hENT 1欠損癌細胞は3‘−DAに対して高い耐性を有する。
75
3.癌細胞内で活性化する必要がある。癌細胞に入ると、3‘-DAはその活性形態に変換されなければならない。活性化の律速工程は、最初のリン酸基を添加する必要があり、この場合、アデノシルキナーゼまたはAKと呼ばれる酵素が添加される。このリン酸化形態の3‘−da,3’−da一リン酸または3‘−DAMPはその後3’−da二リン酸または3‘−dADPに変換され,その後3’−da三リン酸または3‘−dATPに変換される。
4.PK性能が悪い。アデノシンデアミナーゼ(ADA)の急速な脱アンモニア作用により,3‘−DAは血漿,細胞内で半減期が短い。これらの悪いPK特性は投与の挑戦を招き,3‘−daの癌治療としての臨床発展も阻害している。
私たちの解決策:NUC-7738
Nuc−7738は3‘−daのProTide変換産物であり,癌細胞で活性抗癌代謝物3’−dATPを産生するために設計されている。重要なことは,NUC−7738はADAの基質ではないため,この酵素によって分解されないことである。これはより大きな安定性とより多くの3‘−dATPの産生をもたらす。Nuc−7738は高度な親油性であり,hENT 1を含むヌクレオシドトランスポーターとは独立して細胞に入ることができる。癌細胞に入るとNUC−7738は3‘−DAMPのリン酸化形態で出現し,AKが活性抗癌代謝物3’−dATPを産生するために必要な第1の律速リン酸化工程を迂回する。これらの属性は,癌細胞内活性抗癌代謝物3‘−dATPレベルが3’−daより有意に高いことをもたらした。まず、3‘-dATPはRNAのポリアデニル化を妨害し、新陳代謝、分化とアポトーシス関連遺伝子発現の変化を引き起こし、最終的に代謝ストレス、癌細胞の成長停止と細胞死を招く。
以上のように,NUC−7738と3‘−DAの代謝を以下の図に示す。

76
NUC-7738臨床前データ
NUC-7738耐障害それは.われわれのヒト白血病細胞系に対する臨床前研究では,NUC−7738は3‘−daと異なりADA酵素の分解に抵抗し,ADA酵素は3’−daを迅速に不活性代謝物に分解することが3‘−daの潜在的な臨床的利益を低下させる要因である。NUC−7738がADA分解に抵抗する能力は,より大きな安定性とより高い活性抗癌代謝物3‘−dATPの細胞内濃度をもたらすはずである。また,NUC−7738は用量投与への挑戦がなく,3‘−daの臨床応用も制限されている。
NUC−7738ヌクレオシド輸送体に依存せず癌細胞に入るそれは.ヒト白血病細胞系では,ヌクレオシドトランスポーター活性を抑制することはNUC−7738の細胞毒性や抗癌活性代謝物である3‘−dATP産生能に影響せず,NUC−7738の活性はヌクレオシドトランスポーターに依存しないことが示唆された。逆に,ヌクレオシド輸送体阻害剤が存在する場合には,3‘−daの活性が低下し,細胞毒性や3’−dATP産生能の低下を示す。
NUC-7738 3‘-湿気に代謝する必要はありませんそれは.NUC−7738は3‘−DAMPの形で存在するため,酵素AKの最初の律速リン酸化工程を迂回し,AKは3’−daが活性抗癌代謝物3‘−dATPを産生するために必要である。
Nuc−7738は3‘−daよりも強い抗癌活性を有するそれは.ある臨床前研究で私たちは体外培養3‘-daと比較して、NUC-7738は一連の異なるヒト癌細胞株において細胞傷害活性を有し、白血病、非ホジキンリンパ腫、ホジキンリンパ腫、T細胞白血病、多発性骨髄腫、膵臓癌、結腸癌、肝癌と乳癌を含む。この研究で検査された20種類の細胞系のうち,16種類のNuc−7738が3‘−daよりも有効であることが認められ,癌細胞の50%を死滅させるのに必要な対応する化合物の濃度を比較したところ。3つの白血病細胞系では,NUC−7738は3‘−daより50倍以上効力が認められた。
NUC−7738開発戦略と臨床試験
臨床前研究でみられた広範な活性に基づいて,実体あるいは血液系悪性腫瘍患者のためのNUC−7738を開発している。
NUC−7738:進行中の1/2期臨床試験(NuTide:701)それは.すべての治療を尽くして選択した末期固形腫瘍患者で行われた第一段階のヒト用量のアップグレードと拡大臨床試験は、NuTide:701試験とも呼ばれ、進行中であり、現在臨床試験の第二段階にある。試験の第1段階の目標は、以下のスキームに示すように、NUC−7738の推奨用量およびスケジュールを決定することである。第2段階試験の目標は,単一療法としてNUC−7738およびPD−1阻害剤Pembrolizumabと併用した推奨第2段階用量の治療効果と安全性を評価することである。
77

2021年9月,ESMOでは,この試験で治療を受けた最初の29名の患者の中期データを公表した。これらの中期データは、NUC−7738が良好な薬物動態および耐性を有することを示している。NUC−7738治療を受けた患者の血漿試料では,曝露量に比例した増加が認められた。高レベル3‘−dATPが検出された患者の白血球では,NUC−7738は活性抗癌代謝物3’−dATPへの変換に有効であった。細胞内で産生される3‘−dATPも長い半減期を有し,一部の患者では注入後50時間以上でこのレベルを検出することができる。NUC−7738は耐性が良好であることが認められた。さらに、3つのケーススタディは、より長い間NUC−7738を使用して治療を継続した腫瘍が減少した鼓舞的な患者を強調した。
2022年9月、私たちはESMOにNuTide:701第1段階の追加データを示しました。これらのデータは、一連の腫瘍タイプ、特に黒色腫において、鼓舞的な抗腫瘍活性シグナルを有することを示している。様々な固形腫瘍に有望なデータが観察され、多くの患者は、NUC-7738を用いた治療11カ月後に完全手術切除の条件を満たした転移性黒色腫患者を含む治療期間を延長した。4つのケーススタディは、以下に示すように、NUC−7738治療を継続する腫瘍減少の鼓舞的な患者を強調した。NUC−7738も良好な安全性があり,TRAE発生率は低く,3級TRAEは少なく,4級や5級TRAEを経験していない。最大耐容量は1350 mg/mと決定された2週に一回薬を投与します。
2023年4月、我々がAACR年次総会で発表したデータは、NUC-7738が黒色腫細胞系およびNuTide:701試験患者試料中の可溶性PD-L 1および外体PD-L 1を減少させたことを示している。PD−L 1の可溶性および細胞外発現はPD−L 1およびPD−1阻害剤の耐性に関与しており,これらのデータはNUC−7738が免疫増感剤やPD−L 1経路阻害剤の有効な結合パートナーとして有用である可能性を示唆している。
2023年10月、我々は、2023年AACR-NCI-EORTC分子標的および癌治療国際会議でNuTide:701試験の第2段階の中間データを公表した。NUC−7738は単一療法および臭化リビーズとの併用とも耐性が良好であった。単一治療と連合治療の列には腫瘍体積の縮小と治療時間の延長を含む鼓舞的な治療効果の兆候が観察された。以前に抗PD-1治療を受けた黒色腫患者の連合行列において、多くの患者は腫瘍体積の縮小と治療時間の延長を実現した。PD-1+抗CTLA-4とnivolumab+ipilimumabの併用による治療が無効な1例の患者は、NUC-7738+pembrolizumab治療において腫瘍体積が50%縮小した。報告のデータ締め切り時には,募集した11名中7名が治療を受けていた。患者の腫瘍生検資料により、NUC-7738とペブロモリズマブの併用治療後、PD-1発現は減少し、CD 8+T細胞は増加し、NUC-7738は免疫治療を強化する能力を有する可能性が示唆された。この発見はなぜNUC-7738ガベブロマイズマブが過去の免疫治療が進展した患者に対して有効に1つの理論基礎を提供したかもしれない。私たちは2024年にNuTide:701試験のより多くのデータを報告する予定だ。
78

アセチルコリン:ゲムシタビンの変換は
アクラリンの設計目的はヌクレオシド類似体ゲムシタビンに関連する重要な抗癌機序を克服することである。
ゲムシタビンとその限界
ゲムシタビンはヌクレオシド類似体であり、多種の腫瘍の化学療法に応用されている。ゲムシタビン治療の生存予後は比較的に悪く、いくつかの重要な制限が存在する
1.障害が発生する可能性があります。ゲムシタビンはその活性形態にリン酸化される前に,代謝酵素(例えばシトシンデアミナーゼやCDA)によって化学分解されやすく,後者は90%までのゲムシタビンを不可逆的に不活性形態に分解することができる。
2.能動的な輸送が必要です。ゲムシタビンは膜輸送体hENT 1が癌細胞に入る必要がある。ゲムシタビン治療を受けたhENT 1レベルの低い患者は,hENT 1レベルの高い患者に比べて全体的な生存率が低かった。
3.癌細胞内で活性化する必要があるゲムシタビンは細胞に入るとリン酸基で活性化されなければ,そのキラー細胞の役割を果たす。第1リン酸基の律速添加後、第2及び第3リン酸基の添加が続いた。このリン酸化の最終結果は,活性を産生する抗癌代謝物であるdFdCTPである。第1の律速リン酸化工程を担当する特定の酵素、デオキシシトシンキナーゼ、またはDCK。当初,癌細胞DCKレベルの約3分の1が低下し,ゲムシタビンの治療効果に負の影響を与えた。
ゲムシタビンは半減期が短いため,42分から94分まで様々であり,癌細胞にDCKが存在しても,多くのゲムシタビンはその活性抗癌代謝物dFdCTPに変換する前に分解していた。
79
私たちの解決策:アクラリン
Acelarinは、ゲムシタビンと比較して、腫瘍内でより高濃度の活性抗癌代謝物を産生および維持することによって、ゲムシタビンに関連する重要な制限を克服することを目的としている。Acelarinはゲムシタビンの予備リン酸化形式,dFdCMPと保護性ホスファミド部分からなる。この部分はCDAから刺五加素を破壊しないように保護し,hENT 1トランスポーターの存在とは独立して癌細胞に入ることができるようにした。アクラリンが細胞に入ると保護基が分解され,dFdCMPが放出されることは,癌細胞が活性化酵素DCKに乏しく,ゲムシタビンのようにアクラリンに耐性を生じないことを意味する。この活性化ヌクレオチド類似体dFdCMPは、その後、dFdCDPに迅速に変換され、次いで重要な抗癌代謝物dFdCTPである。
アクラリンとゲムシタビンの代謝状況は上述したように,次の図のようになる。

臨床資料
Acelarinは,進行固形腫瘍患者に対するAcelarin単一療法の第1段階臨床試験,再発卵巣癌患者に対するAcelarin併用カルボプラチンの1 b段階用量範囲臨床試験,胆道癌患者に対するAcelarin併用シスプラチンの1 b段階臨床試験,白金耐性卵巣癌患者に対するAcelarin単一治療の第2段階臨床試験,併用治療を受けられない膵癌患者に対するAcelarin単一治療の第3段階臨床試験で評価されている
80
化学療法;アクラリンとシスプラチンの併用による胆道癌患者の3期試験。
臨床試験では多くの患者は予後が非常に悪いが,アクラリン治療では有意な腫瘍消退や病態安定が高い割合で得られている。早期臨床試験において、患者群は大量の前治療を受けたにもかかわらず、アクラリンの耐性はずっと良好であり、以前のゲムシタビン治療に対する薬剤耐性或いはすでに進展した患者において抗癌活性を示した。
アクラリン:1期臨床試験(PRO-001)
第一段階試験では、68名の他の標準治療方案を使い切った末期固形腫瘍と転移性疾患患者はアクラリンの単一治療を受け、投与量は375 mg/mから様々であった 21,000 mg/mまで 2それは.これらすべての患者は急速に進展した再発疾患を有し,平均2.7回の既往化学療法を受けていた。49人の患者のうち、彼らは、2ヶ月以上の治療に相当する2つ以上の周期のアクラリン治療を受け、腫瘍サイズの変化を測定するために、少なくとも1回のフォローアップ放射線学的評価を行った。5名の患者が部分応答を得ており,これら5名の患者全員がRECIST標準技術要求の最終確認性スキャンを受けているわけではないにもかかわらず,部分応答に分類した。他の33例の患者は病状が安定していると評価された。これにより、合計49人の患者が評価可能な人口のうち、全体的な疾患コントロール率は78%であった。
アクラリン:カルボプラチン併用1 b期臨床試験(PRO−002)
1 b期試験では,再発卵巣癌患者25名に酢酸エチルを投与し,用量は500 mg/mからであった 2750 mg/mまで2 カルボプラチンと併用し,最大6クール,1クールあたり3週間であった。患者は平均4種類の以前の化学療法を受けた。組み入れられた25名の患者のうち,23名が評価可能であり,これらの患者の白金状態は,7名の患者が白金に難治であり,10名の患者が白金耐性,3名の患者が白金部分に敏感であり,3名の患者が白金に敏感であることを特徴としている。評価可能な23人の患者は、1つ以上の周期のアクラリン併用カルボプラチン治療を受け、少なくとも1つのフォローアップ放射線学的評価を行った。評価可能な患者では,1名の患者で完全な緩解が確認され,8名の患者が部分寛解(確定診断患者4名)を得た。これにより,全体応答率は39%(確認22%)となった.他の13例の患者は病状が安定していると評価された。これにより病気のコントロール率は96%に達した。中位PFS持続期間は6.2カ月であった。
アクラリン:2期臨床試験(PRO-105)
Acelarinは白金耐性卵巣癌患者に対する第二段階臨床試験で評価した。試験の第1部は500 mg/mを比較した2酢酸エチルの用量は750 mg/mであった2重症前治療患者のアクラリン投与量。試験の第2の部分は、拡大キュー内の第1の部分によって決定された最適用量を調査することを目的としている。2019年12月、私たちが前に発表したキー計画にリソースを優先するという声明と一致して、PRO-105実験の第2部を継続しないことにしました。試験の第1部では,50名の患者が評価可能であり,すべての応答者が確認的走査を行った。第1部に含まれる患者群は大量の予備治療を受け,中央値は5つの既往治療経路であり,72%の患者に潜在的な合併症があった。それにもかかわらず,NUC−1031の耐性は良好であった。盲法独立センター評価により、抗癌活性が観察され、その中の1例の患者は完全に緩和し、2例の患者は部分的に緩和し、16例の患者の病状の安定は最適な反応であった。両治療腕のうち,11名の患者の腫瘍サイズは少なくとも10%減少した。
アクラリン:シスプラチン併用1 b期臨床試験(ABC−08)
2020年11月にABC-08試験の最終結果が発表されました腫瘍学者それは.この1 b期マルチセンター開放ラベル試験では,Acelarinとシスプラチンを併用した場合,末期胆道癌患者の一次治療薬として高い応答率と良好な耐性が得られた。21例の患者はアクラリン(625 mg/m)治療を受けた2725 mg/m2)およびシスプラチン(25 mg/m2)21日間のうちの1日目および8日目。治療またはITTを希望する人群のうち21名の患者のうち、16名の測定可能な疾患の患者は少なくとも1周期の研究治療を受け、少なくとも1回のフォローアップ放射線スキャンを行ったため、治療効果は評価できる。奏効率が評価可能な群では,OOR(未確認応答による)は44%(1つの完全応答と6つの部分応答)に達した。また,6例は安定しており,疾患コントロール率は81%であった。すべての5種類の胆道癌サブタイプに反応が見られた。
81
アクラリン:3期臨床試験(ACELARATE)
ACELARATEはイギリス国家癌研究所が促進した3期、開放ラベル、無作為試験であり、Acelarinとゲムシタビンを連合化学療法条件を満たさない転移性膵臓癌患者の第一線の治療方法として比較することを目的としている。酢酸エチル(825 mg/m2ゲムシタビン(1,000 mg/m)2)28日サイクルにおける第1、8および15日目の投与。計200名の患者が入選し、その中の100名の患者はアクラリン治療を受けた。
この試験には,あらかじめ指定された無効性分析が含まれており,Acelarin単一療法は,ゲムシタビンと比較して死亡リスクを少なくとも42%低下させる主要な治療目標が,この治療困難な患者集団では達成されにくいことを示している。裁判は2021年6月に終了した。
アクラリン:3期臨床試験(NuTide:121)
第三段階臨床試験は,NuTide:121試験とも呼ばれ,アクラリン併用シスプラチンとゲムシタビン併用シスプラチンを局所末期あるいは転移性胆道癌患者の第一線の治療法として比較し,1回目の事前計画の中期分析を行ったところ,2022年3月に終了した。
NuTide:121は世界的,マルチセンター,ランダムな第3段階試験であり,北米,ヨーロッパ,アジア,オーストラリアの約125地点で行われている。患者はランダムに1:1に分けられ,それぞれアクラリン(725 mg/m)とアクラリン(725 mg/m)の治療を受けた2)シスプラチン(25 mg/m)2)または現在の標準ケアレジメンゲムシタビン(1,000 mg/m2)シスプラチン(25 mg/m)2)である。実験の2つの主要終点は総生存率(OS)と総有効率(ORR)である。
最終分析に加え,中期治療効果分析を3回行う予定である。第1の中期分析は、ベースラインレベルで測定可能な疾患の418人の患者をランダムに行い、28週間後に独立データ監視委員会によって行われた。この分析はORRの主な終点を評価し,あらかじめ計画された無効性分析も含めている。
1回目の中期分析後,試験の独立データモニタリング委員会の提案に基づき,2022年3月にNuTide:121試験を停止することにした。研究データセットの分析では,ブラインド法独立センター評価では,アキシラリン+シスプラチン群のOORは18.7%(3例は完全緩解,50例は部分緩解),ゲムシタビン+シスプラチン群のOORは12.4%(0例は完全緩解,34例は部分緩解)であった。しかし,OORのこのような改善はOSの改善には反映されていない.アカリン併用シスプラチン治療群の中位OSは9.2カ月,ゲムシタビン併用シスプラチン治療群の中位OSは12.6カ月,リスク比は1.79であった。アクラリン+シスプラチン群の治療曝露は低く、これは少なくとも部分的にアクラリン+シスプラチン群の緊急不良事象(TEAE)の治療によるより高い停止率(30%~16%)である可能性がある。アキシラリン併用シスプラチン治療の30日前には,より多くの患者が治療を中止し(11%比1%),これは主に肝臓関連TEAEによるものであった。この試験で観察された肝臓関連TEAEの評価は,薬物誘導肝毒性の評価が疾患進展と進行胆道癌患者に対応する高頻度肝機能障害との混同を潜在的に受けており,これらを薬物関連肝毒性のパターンと区別することは困難であることを示している。NuTide:121で観察された肝臓に関連するTEAEsパターンは胆道癌特有であり,シスプラチンと併用する可能性が考えられる。NuTide:121で観察された肝臓関連TEAEのパターンは,単一療法(PRO−001,PRO−105およびACELARATE)としてAcelarinを評価するか,カルボプラチン(PRO−002)と併用した試験では認められなかった。
全体的に,アクラリンの安全性はゲムシタビンとほぼ類似している。有害事象に関連する早期中止により,Acelarinプラスシスプラチン群の治療曝露が低く,これは,なぜ増加したOORが生存利益に変換されなかったのかを部分的に説明している可能性がある。われわれはAcelarinによる胆道癌治療の将来の開発選択を評価しており,より低用量のAcelarin,代替パートナーあるいは胆道癌患者の特定の亜群を探索する可能性がある。胆道癌以外の適応も評価されており,Acelarinの将来開発選択となっている。
分子図譜
医療保健専門家はよく分子マップツールを用いて癌患者の最適な治療方案の選択を助ける。患者によって治療反応が異なり,癌が異なるため,身体同一部位からの腫瘍でも同様である。分子診断分析により特定のバイオマーカーを検出するフレームワークを提供することができ、腫瘍の分子特徴に基づいて分類することができる。逆に,癌プロファイルは特定の患者の治療選択を指導することができる。
82
われわれの臨床開発戦略の一部として,現在のヌクレオシド類似体治療基準と比較して,どの患者がわれわれのProTideから最大の利点を得る可能性があるかを決定することを目的とした癌細胞の分子スペクトルを検討している。NUC−3373,NUC−7738およびアクラリンに関連する重要なバイオマーカーの識別および定量化に努め,治療に対する予測性を評価している。さらに、既存のヌクレオシド類似体が顕著な利益を提供する可能性が低い患者を予め識別することを容易にすることによって、このような分析は、私たちの最終的な商業および精算戦略に関連する可能性がある。
製造業
我々は現在依存しており、NUC−3373、NUC−7738およびAcelarinの臨床試験材料、ならびにFDAおよび他の規制組織によって指定されたcGMP下の任意の将来の候補製品を供給する第三者契約製造組織またはCMOに引き続き依存すると予想される。CGMPはヒトの薬物生産のための規制基準である。将来、承認されれば、私たちはまた私たちのCMOに頼って十分な商業数量のProTideを生産するつもりだ。私たちはサプライヤーから直接または私たちのCMOを通じて間接的に第三者から重要な材料を調達します。これらの原材料は通常、複数のサプライヤーから入手でき、強力で費用効果のあるサプライチェーンを提供してくれます。
どの候補製品の製造も広範な法規を遵守しなければならず、これらの法規は記録保存、製造過程と制御、人員、品質管理と品質保証などの方面に対して各種のプログラムと文書要求を提出した。我々は,すべてのCMOがcGMP条件下でNUC−3373,NUC−7738,Acelarinを生産し,米国以外の任意の類似した法規要件を遵守することを予想している。
競争
新薬療法の開発と商業化競争は激しい。私たちは私たちの科学知識、独自のProTide技術と開発経験が私たちに競争優位を提供してくれると信じているが、私たちは主要な製薬、生物技術と専門製薬会社、学術機関、政府機関及び公共と個人研究機関を含む多くの異なる源からの潜在的な競争に直面している。私たちが開発と商業化に成功したどのProTide候補製品も、既存製品や将来発売される可能性のある新製品と競争するだろう。他の治療法との有効な競争能力を影響する重要な製品機能は有効性、安全性、価格、投与利便性と販売促進活動レベルを含む。
癌患者を治療する最もよく見られる方法は手術、放射線と薬物治療であり、化学療法、ホルモン治療、免疫治療と標的薬物治療を含む。市場には多くの併用して治療効果を高める薬剤を含む多くの癌治療薬がある。われわれの候補品が承認されれば,主に他の化学療法,免疫療法,標的薬物療法からの競争に直面すると信じている。化学療法分野では,我々の競争相手には,非特許化学療法薬を生産する会社,5−FUを含む,新たな化学療法薬を開発または改善する会社がある。
また,我々の候補製品が承認されれば,ホスファミド化学を用いて他社から開発された癌療法の競争や,他の承認された薬物や将来承認される可能性のある製品候補製品の適応を開発するための薬物の競争に直面する可能性がある。
政府や他の第三者支払者の精算も私たちの製品の定価と競争力に大きな影響を与えるだろう。私たちの競争相手も私たちよりも早くFDAや他の規制機関のその製品の承認を得ることができ、これは私たちの競争相手が私たちが市場に入る前に強力な市場地位を確立することをもたらすかもしれない。私たちと比べて、私たちが競争する可能性のある多くの会社は研究開発、製造、臨床前テスト、臨床試験を行い、監督管理の許可とマーケティング承認製品を獲得する方面でより多くの財務資源と専門知識を持っている。規模が小さいかスタートアップ段階にある会社も重要な競争相手になる可能性があり、特に大手や成熟会社との協力で手配する。これらの競争相手はまた、合格した科学と管理者を募集と維持し、臨床試験場と臨床試験の患者登録を確立し、そして私たちの計画と相補的或いは必要な技術を獲得する上で私たちと競争している。
知的財産権
私たちは、内部開発でも第三者から許可を得ても、私たちの治療法や方法のために、特許権を求め、維持し、強制執行し、擁護することを含む、私たちの業務に非常に重要と考えられる知的財産権およびノウハウの保護を積極的に求めています。私たちの成功は、私たちの候補製品とプラットフォーム技術のデータ/市場独占性、保護を含む、特許および他の保護を獲得し、維持する能力にかかっている
83
第三者の効果的かつ強制的に実行可能な特許および独自の権利を侵害することなく、当社のノウハウおよび運営を秘密にする。“リスク要因-私たちの知的財産権に関するリスク”を見てください
私たちの政策は私たちの固有の地位を保護することを求めることであり、一般的にイギリス知的財産権局に予備優先権申請を提出することによって行われる。次に特許協力条約に基づいて特許出願を提出し、最初の出願(S)よりも優先し、その後米国、欧州、日本を含む地域に特許付与出願を提出することを要求する。それぞれの場合、私たちは、私たちと私たちの製品候補製品に重要なビジネス的意義を持つ地域で関連カバーを得るために、特許弁護士と議論した後、必要な戦略および地域を決定します。また,データ独占性,市場独占性,特許期間の延長(利用可能であれば)にも依存している。私たちはまた、私たちの底辺プラットフォーム技術や候補製品に関するビジネス秘密と技術ノウハウに依存しています。任意の特許出願の提出について決定する前に、私たちは、特許保護が発明を保護するかどうかに関する最も賢明な戦略、またはその発明が秘密にされるべきかどうかを、私たちの特許弁護士と検討する。
2024年2月22日現在、私たちは587件のライセンス特許(うち28件は米国発行の特許)と114件の出願中の特許(うち7件は米国が出願している特許)を持っている。私たちがビジネスまたは戦略的に重要な意味を持つ非米国司法管轄区域が発表または処理すべき特許出願を持っているのは、オーストラリア、カナダ、中国、ユーラシア大陸(地域特許形式)、ヨーロッパ(地域特許形式)、香港、インド、イスラエル、日本、韓国、マレーシア、メキシコ、フィリピン、シンガポール、南アフリカを含む。
NUC-3373
我々は、NUC-3373の物質組成、NUC-3373の周囲の1つの属、およびNUC-3373の具体的な使用に関連する102の認可された特許および3つの係属中の出願を有する。これらの特許は米国、ヨーロッパ、日本を含む主要地域で付与されている。これらの付与された特許および係属中の出願からの特許が発表された場合、いかなる特許期限調整およびいかなる特許期限の延長も含まず、2032年に満了する予定である。
我々が所有する特許出願は、NUC−3373の製剤(臨床試験で使用されるものを含む)、NUC−3373を製造する方法、およびNUC−3373の特定の使用をカバーする。NUC-3373臨床処方を主張する特許が日本で承認された。これらの特許およびこれらの係属中の出願によって生成された特許は、いかなる特許期限調整およびいかなる特許期間の延長も含まず、2036年、2037年、2038年、および2043年に満了すると予想される。
NUC-7738
我々は、NUC 7738の物質組成、NUC−7738付近の1つの属、およびNUC−7738の特定の使用に関する81の許可された特許および8つの係属中の出願を有する。NUC-7738に対する特許は、米国、ヨーロッパ、および日本を含む主要な司法管轄区域で許可されている。これらの付与された特許およびこれらの係属中の出願によって生成された特許は、発行された場合、いかなる特許期限調整およびいかなる特許期限の延長も含まず、2035年に満了すると予想される。
我々が所有する特許出願は、NUC−7738の調製、NUC−7738の製造方法、およびNUC−7738の具体的な使用をカバーする。これらの係属中の出願によって生成された特許は、いかなる特許期限調整およびいかなる特許期間の延長も含まず、2036年および2038年に満了する予定である。
アクラリン
私たちは66件の許可された特許と、単一のジアステレオマーに対するアクラメクチンの5つの特許出願を持っている。Acelarinを必要とするより可溶性単一のジアステレオマーの特許が米国およびヨーロッパで承認されており、日本を含む他の主要地域も対応する特許出願を待っている。これらの付与された特許および係属中の出願からの特許が発表された場合、いかなる特許期限調整およびいかなる特許期限の延長も含まず、2035年に満了する予定である。
我々は、Acelarinの処方(臨床試験で使用されるものを含む)、Acelarinの製造方法(単一のジアステレオマーとして含む)、およびAcelarinとカルボプラチンおよびAcelarinとシスプラチンとの併用を含むAcelarinの特定の使用に関する許可された特許および特許出願を有する。これらの未解決の出願は、上記のような商業的または戦略的重要性を有する地域に提出されたものであり、米国、欧州、日本を含む。アクラリン臨床処方の特許は米国、ヨーロッパ、日本で許可されていると主張している。これらの特許およびこれらの係属中の出願によって生成された特許は、いかなる特許期限調整およびいかなる特許期限の延長も含まず、2035年および2036年に満了する予定である。
84
特許用語に関する法律法規
個別特許の期限は特許を取得した国の法的期限に依存する。私たちが出願したほとんどの国では,特許期間は非臨時特許出願が提出された最初の日から20年である。米国では,ある特許が別の特許によって最終的に放棄された場合,または特許権者が特許訴訟を遅延させたため,特許期限が短縮される可能性がある。特許期限の調整は、特許権者による米国特許商標局の特許付与時の行政遅延による損失を補償するために、特許の期限を延長することができる。欧州特許の特許期間はその発効出願日から20年であり,米国と異なり,欧州特許は米国特許のように特許期間調整の影響を受けない。
FDAによって承認された薬物または生物をカバーする特許期間も延長する資格があり、これは、FDA規制審査中に失われた特許期間の補償として特許期限の回復を可能にする。1984年の“医薬品価格競争および特許期限回復法”または“ハッジ·ワックスマン法”は、特許期間を特許満了後最大5年間延長することを可能にしている。特許期間の延長の長さは,薬物又は生物が規制審査を受ける時間の長さと関係がある。特許延期は、1つの特許の残り期間を製品承認日から合計14年間延長することができず、承認された薬物に適用される特許を延長することしかできない。欧州および他の司法管轄区域にも同様の規定があり、承認された薬物をカバーする特許の期限を延長し、例えば補充保護証明書を提供する。将来、私たちの製品がFDAの承認を得たら、私たちはこれらの製品の特許出願のために特許期間を延長する予定です。私たちのいくつかの発行された特許は特許期間を延長する資格がある可能性があるが、このような延長は利用できない可能性があるため、私たちのビジネス排他性は制限される可能性があると予想される。
協力と許可協定
カーディフ大学免許証
2009年8月、私たちはカーディフ大学と大学学部カーディフコンサルティング株式会社またはカーディフコンサルティング会社と研究、協力、許可協定を締結し、私たちはカーディフ協定と呼ばれる。カーディフ協定はその後更新され、2022年3月末に満期になる。
カーディフ協定が満期になる前に、私たちはカーディフ大学とカーディフコンサルティング会社に私たちが選択したProTideを潜在的な商業製品開発に通知した。カーディフ協定に規定されている条項によると、カーディフ大学およびカーディフコンサルティング会社は、私たちが選択したProTideヌクレオシドシリーズに関連するカーディフ知的財産権をすべての目的で使用することを可能にするグローバル独占許可を付与している。このライセンスはカーディフ協定の満了後も有効だ。ライセンス期間内に、カーディフ大学およびカーディフコンサルティング会社は、許可によってカバーされるヌクレオシドファミリーに関する任意の研究を競合するいかなる第三者にも負担してはならず、そのような研究がカーディフ知的財産権を使用する場合、またはライセンスによってカバーされるヌクレオシドに関連する使用のために、カーディフ知的財産権の権利を任意の第三者に付与してはならない。
私たちまたは再許可者がカーディフ協定に基づいて行われた研究によって生じた特許出願を提出する場合、私たちは追加された夫にいくつかの無形のお金を問い合わせます。もし私たちまたは私たちの再許可者がこのような研究製品を開発して商業化すれば、このようなマイルストーン支払いは、各ヌクレオシドシリーズにおいてマイルストーンの最初の製品のみを実現することを前提とした1,875,000 GBまでの臨床開発マイルストーン支払いが不足しています。私たちはまた、このような研究製品を販売している1桁分のパーセントに相当する印税をカーディフコンサルティング会社に支払います。もし私たちが研究成果を商業化する権利を再許可すれば、私たちは再許可の対価格として高い桁数パーセントのお金をカーディフコンサルティング会社に支払うだろう。
カーディフ保護潮汐協定
2009年10月、私たちはカーディフProTdes株式会社またはカーディフProTdesと協定を締結し、その後改訂され、2012年3月に譲渡、許可、協力協定として再記述され、2012年5月にさらに改訂され、ProTdes協定と呼ばれている。ProTdesプロトコルによると、私たちはカーディフProTdesと発見、薬物設計、体外培養プリンとピリミジンに基づくヌクレオシドを潜在候補薬物のスクリーニングとした。私たちはカーディフProTdesのいくつかの仕事を支援し、カーディフProTdesはProTdes協定に従ってその研究結果のすべての権利を私たちに譲渡した。カーディフProTdesはまた、Acelarinに関連する特許を含む特定の関心化合物に関連する特許を米国に譲渡し、再許可を付与する権利、および特定の非特許化合物に関連する権利および技術情報を含む独占的な世界的許可を付与し、すべての治療、診断、予測および予防用途のために付与した。
もし私たちまたは再許可者によって開発された1つまたは複数の特許の有効な権利要件がカバーされた1つまたは複数の譲渡特許またはカーディフProTdesの研究所によって生成された特許、例えばAcelarinの場合、私たちは、カーディフProTidsの最初のそのような製品の開発および承認マイルストーン支払いに合計約450万ドルを支払うだろう。他の開発と
85
新しいヌクレオシドシリーズにおける第1の追加製品の承認マイルストーンは、このようなマイルストーン支払いの最大潜在的価値が第1の製品に関連するマイルストーン支払いの価値の約半分であるにもかかわらず、割り当てられた特許の有効な権利要件またはカーディフProTdes社の研究によって生成された特許に支払われるであろう。また、このような製品の販売について、場合によっては減少する可能性がある上位桁数パーセントに相当する印税をカーディフProTideに支払います。ライセンス者に分けて販売される特許権使用料は、特許使用料の1桁の中央値をもたらす可能性がある式によって決定される。
ProTdesプロトコルは、各国に基づいて満了し、カーディフProTdes研究によって生成された割り当てられた特許または特許の最後の有効な権利要件の失効、失効、放棄、失効、または却下の日から失効するか、またはカーディフProTdesから許可されたいくつかの技術情報が依然として秘密にされている場合、または製品がデータ独占期間内に、製品がその国で初めて商業販売された日から10年以内に満了する。譲渡された特許またはカーディフProTdes研究によって生成された特許の有効性または所有権に疑問または協力を提起するか、またはProTdesプロトコルの下での対応金額を支払うことができない場合、ProTdesプロトコルは、治癒されていない重大な違約、一方の破産、またはカーディフProTdesが疑問を提起するか、または協力して疑問を提起することによって、より早く終了する可能性がある。もし私たちが関連金の期限が過ぎたことに対するカーディフProTdesの通知を受けたら、私たちが支払わなければならないお金は45日以内に支払われず、すぐに終了されるかもしれない。ProTdes協定の終了後、私たちの許可権は、違約がカーディフProTdesのいくつかの違反によって引き起こされない限り、私たちの許可権は継続されるが、支払い義務は減少している。ProTdes協定が終了すると、私たちの違約のため、私たちはカーディフProTdesが最初に私たちに譲渡した特許をカーディフProTdesに譲渡する義務がある。
政府規制と製品審査
FDA承認プロセス
アメリカでは、医薬品はFDAによって広く規制されている。アメリカ連邦食品、薬物と化粧品法案、あるいはFD&C法案、及びその他の連邦と州の法律法規は、その他の以外に、薬品の研究、開発、テスト、製造、貯蔵、記録保存、承認、ラベル、普及とマーケティング、流通、承認後のモニタリングと報告、サンプリング及び薬品の輸出入を管理する。適用された米国の要求を遵守しないことは、FDAが未解決の新薬申請またはNDAの承認を拒否し、警告状、自発的な製品のリコール、製品の差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金、民事罰、および刑事起訴のような様々な行政または司法制裁を受ける可能性がある。
米国では,薬品開発は通常,臨床前実験室や動物試験を行い,臨床試験開始前に発効しなければならないINDと,FDA承認を求める各適応に対する薬物の安全性と有効性を決定するために十分に制御された良好な臨床試験をFDAに提出することを含む。FDA上場前の審査要求を満たすには通常長年の時間を要し、実際の所要時間は製品或いは疾病のタイプ、複雑性と新規性によって大きく異なる可能性がある。
臨床前試験は製品の化学、調合と毒性に対する実験室評価、及び製品特性と潜在安全性と有効性を評価する動物研究を含む。臨床前と他の非臨床試験の進行は良好な実験室実践を含むある連邦法規と要求に符合しなければならない。臨床前試験の結果はINDの一部として他の情報とともにFDAに提出され,製品化学,製造,制御に関する情報,提案された臨床試験案が含まれている。IND提出後,生殖毒性や発ガン性の動物試験など長期的な非臨床試験が継続される可能性がある。
臨床試験は合格した研究者の監督の下で、健康ボランティア或いは患者に研究用新薬を提供することに関連する。臨床試験は、(I)連邦法規に適合し、(Ii)良好な臨床実践またはGCPに適合し、患者の権利と健康を保護し、臨床試験発起人、管理者および監督者の役割を定義するための国際標準であり、(Iii)臨床試験目標を詳細に説明し、安全性を監視するためのパラメータと評価すべき有効性基準のプロトコルに従って行われなければならない。各案および後続案修正案はINDの一部としてFDAに提出されなければならない。
ヒト臨床試験を開始する前に,各INDの提出後30日間の待機期間が求められている。FDAがこの30日間INDにコメントもINDにも疑問を提起しなければ,INDで提案された臨床試験が開始される可能性がある。
FDAが臨床試験がFDAの要求に従って行われていないと考えている場合、または臨床試験患者に対して受け入れられないリスクとなっている場合、FDAは、いつでも(最初のIND提出に対して臨床試験を開始する前に含む)臨床試験の一時的または永久的な停止を命令するか、または他の制裁を実施することができる。臨床試験案や臨床試験における患者のインフォームドコンセント情報も機関に提出しなければならない
86
審査委員会、またはIRBは、審査および承認のために使用される。IRBはまた、IRBの要求を遵守できなかったために、現場の臨床試験を一時的または永久的に停止することを要求することができ、または他の条件を適用する可能性がある。IRBの運営はFDAの規定に適合しなければならない。
ニューノミンの発売承認を支持する臨床試験は通常3つの連続段階で行われるが、これらの段階は重なる可能性がある。第1段階、すなわち、最初に健康なヒト対象または患者に薬物を導入した場合、新陳代謝、薬物動態、薬理作用、用量増加に関連する副作用、および可能であれば有効性を評価するための早期証拠を評価するために、薬物が試験される。第2段階は、一般に、特定の適応、用量耐性、および最適用量での薬剤の有効性を決定し、よく見られる副作用および安全リスクを決定するために、限られた患者集団で臨床試験を行うことを含む。化合物が第2段階評価において有効性および許容可能な安全性を証明した場合、第3段階臨床試験は、より多くの患者の臨床的有効性および安全性に関する追加の情報を得るために行われ、一般に地理的に分散された臨床試験場所であり、FDAが薬剤の全体的な利益-リスク関係を評価し、薬物のラベルに十分な情報を提供することを可能にするために行われる。多くの場合、FDAはこの薬物の治療効果を証明するために、十分かつ良好にコントロールされた2つの3期臨床試験を必要とする。少数の場合、もし臨床試験が大型多中心試験であり、内部一致性を証明し、しかも統計学的に非常に説得力があり、死亡率、不可逆的な発病率或いは潜在的に深刻な結果を有する疾病の予防に臨床意義の影響を発見し、第二回の臨床試験で結果を確認することは実際或いは倫理的に不可能であれば、他の確実な証拠を持つ単一3期臨床試験で十分である可能性がある。場合によっては、4期または承認後の臨床試験は、予想される治療適応患者の治療からより多くの経験を得るために、特に長期安全フォローアップにおいて、最初の発売承認後に行われる可能性がある。場合によっては,FDAはNDA上場を承認する条件として4期臨床試験を強制的に要求する可能性がある。
国会は最近,FD&C法案を改正し,3期臨床試験や新薬の他の“キー研究”のスポンサーにこのような臨床試験のための多様な行動計画を設計·提出し,マーケティング許可を支援することを求めている。行動計画には,スポンサーの多様な学生募集目標と,目標の理由やスポンサーがこれらの目標をどのように達成するかの記述が含まれなければならない。スポンサーはスポンサーが関連する臨床試験案をFDA審査に提出する前にFDAに多様な行動計画を提出しなければならない。FDAは多様な行動計画の一部またはすべての要求を免除することができる。多様性行動計画が第三段階試験計画と時間スケジュールにどのように影響するかは不明であり、FDAがこのような計画の中でどのような具体的な情報を期待するかも不明であるが、FDAがスポンサーの多様性行動計画に反対したり、重大な変更を要求したりすれば、関連臨床試験の開始を遅らせる可能性がある。
必要な臨床試験が完了した後,NDAを用意してFDAに提出する。米国でこの医薬製品の販売が開始される前に,FDAがNDAを承認する必要がある。NDAは、すべての臨床前、臨床および他の試験の結果、および製品の薬理、化学、製造および制御に関連するデータアセンブリを含まなければならない。秘密協定を準備して提出する費用は巨大だ。連邦法によると、NDAの多くの提出はまた、高額な出願使用料(例えば、2024年度の出願料が400万ドルを超える)を支払う必要がある。これらの費用は通常毎年増加します。
FDAの審査は通常、NDAがFDA提出日から12ヶ月(標準審査)とNDA提出日から8ヶ月(“優先審査”)が必要であり、FDAはNDA提出後約2ヶ月または60日で“届出”決定を下すためである。FDAはNDAを受信した日から60日の時間があり,当該機関の敷居に基づいて申請が届出を受けているかどうかを決定し,申請が十分完全であると考え,実質的な審査を行うことができる。提出された申請が受け入れられると、FDAは深い検討を始めた。FDAが“処方薬使用料法案”(PDUFA)に基づいて達成した目標と政策によると、FDAは非処方薬を審査する際のいくつかの業績目標に同意した。第1の分子実体に関連する出願の多くの場合、FDAは、標準出願の予備審査を完了し、出願人に応答するのに10ヶ月の時間があり、優先審査の出願については、6ヶ月間で完了する。優先審査は、重篤な疾患の治療を目的とし、FDAが、安全性または有効性を著しく向上させることによって治療において大きな進展を得ることを決定する薬剤、または適切な治療方法なしに治療を提供する薬剤に適用することができる。FDAが常にPDUFAの目標日を達成するわけではなく、FDAは、いくつかの遅提出情報を考慮するために、または提出中に提供された情報の情報を明らかにするために、標準および優先新薬出願の審査手続きをさらに3ヶ月延長する可能性がある。
FDAは,新薬製品の申請や安全性や有効性の問題を提起した薬物製品の申請を諮問委員会に提出することも可能であり,この委員会は通常独立臨床医や他の専門家からなるグループで審査·評価を行い,申請を承認すべきかどうかについて提案する。FDAは諮問委員会の提案に制限されていないが、最終承認決定を下す際にこれらの提案を考慮する。FDAが、薬物の利点がそのリスクよりも大きいことを保証し、薬物またはバイオ製品の安全な使用を確保するために、リスク評価および緩和戦略またはREMS計画を提出する必要があると判断した場合、FDAはまた、リスク評価および緩和戦略またはREMS計画の提出を要求する可能性がある。REMS計画は、制限された分配方法、患者登録、または他のリスク最小化ツールのような薬物ガイドライン、医師コミュニケーション計画、評価計画、および/または安全使用を保証する要素を含むことができる。
87
FDAは具体的な状況に応じてREMSに対する要求および具体的なREMS条項を決定する。FDAがREMS計画が必要であると結論した場合、NDAのスポンサーは提案されたREMSを提出しなければならない。必要であれば、FDAはREMSなしのNDAを承認しないだろう。
NDAを承認する前に、FDAは、通常、GCPに適合することを確実にするために、1つまたは複数の臨床場所を検査する。さらに、FDAは薬物を製造する1つ以上の施設を検査するだろう。FDAは、現在の良好な製造仕様要件またはcGMPに適合しない限り、この製品を承認せず、NDAに含まれるデータは、研究された適応において安全かつ有効であることを証明する大量の証拠を提供する。
承認プロセスが長く、しばしば困難であり、適用される規制基準が満たされていない場合、または追加の臨床または他のデータおよび情報が必要とされる可能性がある場合、FDAはNDAの承認を拒否する可能性がある。NDAに対するFDAの評価および付随する情報によると、製造施設の検査結果を含み、承認状または完全な返信状を発行する。完全な応答文は、一般に、提出中の不足点を概説し、FDAが出願を再検討するために、大量の追加のテストまたは情報を必要とする可能性がある。NDAが再提出されたとき、またはいつ、これらの欠陥がFDAによって満足的に解決された場合、FDAは承認書を発行するであろう。FDAは、含まれる情報タイプに応じて、そのような再提出された出願を2ヶ月または6ヶ月以内に検討することを約束している。しかしながら、この補足情報を提出しても、FDAは最終的に、その申請が承認された規制基準を満たしていないと決定する可能性がある。
NDAは、医薬の商業マーケティングを許可し、出願に記載された特定の適応に従って具体的な処方情報を提供する。さらに、必要に応じて解決される具体的なリスク(S)に応じて、FDAは、承認後に製品の安全性をさらに評価するための4期の臨床試験を含む承認後試験の実施を要求し、製品の商業化後に製品を監視するための試験および監視計画を要求するか、または流通および使用制限またはREMS下の他のリスク管理機構を含む他の条件を適用することを要求する可能性があり、これらの条件は、薬剤の潜在的な市場および収益性に大きな影響を与える可能性がある。また、FDAは発売後の試験やモニタリング計画の結果に基づいて、製品のさらなるマーケティングを阻止または制限する可能性がある。承認が得られると、初期マーケティング後またはその後の任意の時間に規制要件の遵守または問題の発見が維持されていない場合、製品承認は撤回される可能性があり、新しい適応の追加、製造変更、および追加のラベル宣言のような製品のいくつかのタイプの変更を承認することは、さらなるテスト要件およびFDA審査および承認の制約を受けることになる。
臨床試験情報の開示
処方薬を含むいくつかのFDA規制製品の臨床試験のスポンサーは、米国国立衛生研究院が維持しているClinicalTrials.govという公共ウェブサイトに特定の時間枠内で登録され、特定の臨床試験情報を開示しなければならない。臨床試験登録の一部として,臨床試験の製品,患者群,調査段階,臨床試験地点と調査員,その他に関する情報が公開されている。候補製品が最終的に承認されれば,スポンサーも完成後にこれらの臨床試験の結果を開示する義務があるが,これらの臨床試験の結果は承認されてから公表されることになる。競争相手は,これらの公開された情報を用いて,我々の開発計画の設計や進捗に関する知識を獲得する可能性がある.対象となる臨床試験を速やかに登録できなかったり、法律で規定された試験結果を提出しなかったりすると民事罰金を招く可能性があり、違反側が連邦政府の将来の贈与資金を得ることも阻止される。連邦政府は,ClinicalTrials.govの最終規則の登録と報告の要求を遵守できなかった臨床試験スポンサーに対して法執行行動をとっている。
“ハッジ·ワックスマン法案”
オレンジ色の図書リスト秘密協定を介して薬物の承認を求める場合、出願人は、その特許請求が出願人製品をカバーする各特許をFDAにリストすることを要求される。1つの薬剤が承認されると、医薬出願に列挙された各特許は、一般にオレンジブックと呼ばれるFDAによって承認された治療同等性評価を有する医薬製品に開示される。Orange Bookにおいて決定されたFDA承認薬(一般に参照市販薬または上場薬と呼ばれる)は、新薬申請またはANDAの簡略化された承認をサポートするために、潜在的な模倣薬競争者によって参照されることができ、または505(B)(2)NDAをサポートするために他の後続製品開発者によって参照されることができ、NDA部分は、部分的に依存する FDA以前の1つまたは複数の承認された医薬製品の安全性および有効性に関する調査結果、ならびに他の可能な支援情報。ANDAが規定して販売されている医薬製品は,列挙した薬剤と同じ強度と剤形の同じ活性成分を有し,生物学的同等性試験により治療上列挙された薬剤と同じであることが証明されている。生物学的同等性試験の要求を除いて、ANDA申請者は臨床前或いは臨床試験或いは提出結果を必要としないか、或いは提出して、その薬物製品の安全性或いは有効性を証明する。このようにして承認された薬物は、一般に列挙された薬物の“非特許等価物”と呼ばれ、一般に薬剤師によって根拠されることができる
88
元発売された薬品のために処方する.対照的に、505(B)(2)調節経路は、後続の申請者が追加の臨床試験または臨床前研究を必要とする可能性を排除しない;例えば、彼らは、安全性または有効性を証明するために新しい臨床データを必要とする新しい患者集団のために、以前に承認された薬剤を新しい適応に使用することを承認することを求めている可能性がある。
任意のANDAまたは505(B)(2)NDA申請者は、その(全部または一部)依存するNDAによって承認された医薬製品のFDAオレンジブックに記載された任意の特許をFDAに証明しなければならない。具体的には、後続の出願人は、(1)要求された特許情報がまだ提出されていないこと、(2)に記載されている特許が満了していること、(3)記載された特許が満了していないが、特定の日に満了し、特許が満了した後に承認を求めること、または(4)に記載された特許が無効であるか、または新製品の侵害を受けないことを証明しなければならない。ANDA出願人はまた、記載された使用方法特許を証明するのではなく、その提案されたANDAタグが特許使用方法に関連するいかなる言語も含まないか、または彫刻することを証明する第8の部分宣言を提出することを選択することができる。
後続の出願人が列挙された特許に挑戦していない場合、ANDAまたは505(B)(2)出願は、参照薬剤を必要とするすべての特許が満了するまで承認されないであろう。新製品が承認された製品の上場特許又はそのような特許を侵害しない無効な認証を第4項認証と呼ぶ。ANDAまたは505(B)(2)出願人が第4項の認証をFDAに提供した場合、FDAが後続の出願を受け入れると、出願人はまた、NDAおよび特許所有者に第4項の認証の通知を送信しなければならない。そして、引用された秘密保護協定及び特許所有者は、第4項の証明の通知に対して特許侵害訴訟を提起することができる。第四項の認証を受けてから45日以内に特許侵害訴訟を提起することは、より早い30ヶ月、特許満了、訴訟和解または侵害事件においてANDAまたは505(B)(2)出願人に有利な裁決まで、FDAがANDAまたは505(B)(2)NDAを承認することを自動的に阻止する。
ANDAまたは505(B)(2)の出願も、オレンジブックに記載されている参照製品の任意の適用可能な非特許専有権が満了するまで承認されない。
排他的である。NDAが新しい化学物質またはNCEを承認すると、医薬は、FDAが任意の他のNDAで以前に承認された活性部分を含まず、NCEは5年間の市場排他性を得ることができ、その間にFDAは、後続の出願人が承認するために必要なすべてのデータの権利を有していない場合、または承認するために必要なすべてのデータを合法的に参照する権利を有さない場合、FDAが任意の他のNDAで以前に承認された活性部分を含まない。
しかしながら、第4項の認証が提出された場合、ANDAまたは505(B)(2)NDAは、NCE排他的満了の前年に提出することができる。“オレンジブック”に参照薬剤の特許が記載されていない場合には、第4段落の認証がない可能性があり、この場合、参照NDA製品に添付されている排出期間が満了するまで、ANDAまたは505(B)(2)NDAを提出することはできない。
FD&C法案はまた,FDAが出願人が行ったり賛助したりする新たな臨床研究(バイオアベイラビリティ研究を除く)が承認申請に重要であると考えている場合,例えば既存薬物の新たな適応,用量または強度であれば,NDA,505(B)(2)NDAまたは既存NDAの補完製品の市場排他性は3年と規定されている。この3年間の排他性には,新たな臨床研究に関する使用条件のみが含まれており,FDAが原始活性物質を含む薬物のANDAを承認することは禁止されていない。5年および3年の排他性は、FD&C法案505(B)(1)条に従って提出された完全な従来のセキュリティ協定の提出または承認を延期または承認しない。しかしながら、完全な従来のセキュリティプロトコルを提出する出願人は、安全かつ有効であることを証明するために、必要なすべての臨床前研究および十分かつ良好に制御された臨床試験を参照する権利を行うか、または得ることを要求されるであろう。
特許期間が延長される。NDA承認後,関連薬物特許の所有者は最長5年間の特許延期を申請することができる。許容される特許期間延長は、薬物試験段階の半分−IND提出とNDA提出との間の時間、およびすべての審査段階−NDA提出と承認との間の時間として計算され、最長5年である。FDAが出願人が職務調査を経て承認を求めていないと判断した場合、時間を短縮することができる。展示期間後の総特許期間は14年を超えてはならない。
出願審査段階で満了する可能性のある特許については,特許権者は臨時特許延期を請求することができる。臨時特許の延期は特許期間を1年間延長し,最大4回延長することができる.暫定特許の承認が延期されるごとに、承認後の特許延期は1年減少する。米国特許商標局の取締役は、特許延期を求めている特許に含まれる薬物が承認される可能性が高いことを確認しなければならない。秘密保護協定が提出されていない薬物は一時的な特許延期を受けることができない。
89
発売後要求
NDAが承認されると、製造業者および新薬製品は、監視および記録保存活動、不良経験の報告、および承認された薬物の未承認用途または患者集団への普及を制限することを含む宣伝および広告要件の遵守を含むFDAによって持続的に規制されるであろう(“ラベル外使用”と呼ばれる)。FDAは薬品の審査後のマーケティングと販売促進を密接に監督し、直接消費者向けの広告、ラベル外販売促進、業界賛助の科学と教育活動及びインターネットに関連する販売促進活動の標準と法規を含む。医師はラベル外の用途に合法的な薬品を処方することができるが,メーカーは承認された適応と承認されたラベルの規定に基づいて彼らの薬物を販売するしかない。FDAや他の機関はラベル外用途の普及を禁止する法律法規を積極的に実行しており,ラベル外用途の普及が不適切であることが発見された会社は重大な責任を負う可能性がある。処方薬宣伝材料も初回使用時にFDAに提出されなければならない。さらに、承認申請において確立されたいくつかの条件の変更は、適応、ラベル、またはいくつかの生産プロセスまたは施設の変更を含み、変更を実施するために、FDAと新しいNDAまたはNDA付録を提出および承認する必要がある。新適応のNDAサプリメントは通常,オリジナル申請と類似した臨床データが必要であり,FDAがNDAサプリメントを審査する際に使用するプログラムや行動は,NDAを審査する際に使用するプログラムや行動と同じである。
FDAがNDAを承認した後,NDAごとの年間マーケティング報告に加えて,有害事象報告や定期報告を提出する必要がある。FDAはまた、承認製品の効果を監視するために、第4段階試験、REMSおよび監視と呼ばれる場合があり、またはFDAは、承認時に条件を付加して、その製品の流通または使用を制限する可能性がある。
また,品質管理,薬品製造,包装,ラベルなどのプログラムは承認された後も引き続きcGMPに適合しなければならない。CGMP条例には、人員、建物および施設、設備、アセンブリおよび薬品容器および閉鎖的な制御、生産およびプロセス制御、包装およびラベル制御、保有および分配、実験室制御、記録および報告、ならびに返品または回収された製品に関する要件が含まれる。医薬品製造業者とそのいくつかの下請け業者はFDAとある州機関に彼らの工場を登録することを要求された。FDAの登録要求エンティティはFDAの定期抜き打ち検査を受け,その間,FDAは製造施設を検査し,cGMPの遵守状況を評価する。そのため,メーカーはcGMPの遵守を維持するために,生産,品質管理,記録保存に時間,金銭,労力をかけ続けなければならない。規制当局は、裁判所で差し押さえと禁止を提出することを含む一連の法執行行動を実施することができ、会社がcGMP要求を遵守できなかった場合、製品の承認を撤回したり、製品のリコールを要求したりすることができ、承認後に製品問題が発見されると、リコールを含む製品、製造業者、または承認されたNDA所持者への制限を招く可能性がある。
薬物が承認されると、規制要件や基準の遵守が維持されていない場合、または製品発売後に問題が発生した場合、FDAは承認を撤回する可能性がある。その後、製品には、予期されない深刻度または頻度の不良事象、または生産プロセス、または法規要件を遵守できなかったことを含む、以前に未知の問題が存在することが発見され、新しいセキュリティ情報を追加するために承認されたラベルの強制改訂につながる可能性がある;発売後または臨床試験を実施して新しい安全リスクを評価するため、またはREMS計画に従って流通または他の制限を実施することが可能である。他の他の潜在的な結果には
小児科情報と小児科排他性
“小児科研究公平法”または“FD&C法”の改正によると、NDAまたはNDAのサプリメントは、すべての関連小児科亜群において主張される適応の安全性および有効性を評価するために十分なデータを含まなければならず、各安全な小児科亜群に対する薬剤の投与および投与を支持する
90
そして効果的です。スポンサーが、新しい有効成分、新しい適応、新しい剤形、新しい投与レジメンまたは新しい投与経路を含む医薬のマーケティング申請を提出することを計画している場合、第2段階会議の終了後60日以内に、またはスポンサーとFDAとの間の合意に従って予備的な小児科研究計画またはPSPを提出しなければならない。最初のPSPは、研究目標および設計、年齢群、関連する終点および統計方法、またはそのような詳細な情報を含まない理由、ならびに小児科研究データおよび支援情報の提供を延期または完全または部分的に免除することを要求する任意の要件を含む、スポンサー計画によって行われる1つまたは複数の小児科研究の概要を含まなければならない。FDAとスポンサーはPSPについて合意しなければならない。臨床前研究,早期臨床試験あるいは他の臨床開発計画から収集したデータから小児科計画の変化を考慮する必要があれば,スポンサーは合意した初期PSPに対する修正案を随時提出することができる。FDAは、小児科データの提出の全部または一部の免除または延期を許可することができる。2017年にFDA再認可法案はFD&C法案を改正し、FDAが小児癌の成長や進展に密接に関連する分子標的を決定し、FDAがこの要求を放棄または延期しない限り、成人癌を治療するための薬物の小児科調査を要求した。
さらに、小児科専門権は、米国が提供する別の非特許マーケティング専用権であり、承認された場合、任意の既存の規制専用権または上場特許の期限上に6ヶ月の市場保護を追加的に提供することができる。NDAスポンサーから提出された小児科データがこのようなデータに対するFDAの書面要求に公平に応答すれば,この6カ月の排他性を与えることができる。これらのデータは,この製品が研究されている小児科群で有効であることを証明する必要はなく,逆に臨床試験がFDAの要求に公平に応答していると考えられれば,追加的な保護が得られる。要求された小児科研究報告が法定期限内にFDAに提出され、FDAによって受け入れられた場合、製品の法定または規制排他性または特許保護期間にかかわらず6ヶ月間延長される。これは特許期間の延長ではないが、FDAが別の出願を承認できない規制期間を効果的に延長する。書面申請を出すことは、スポンサーにその研究を要求しない。
国会は定期的に小児科薬物開発に適した新しい激励措置或いは許可を公布することを考慮し、小児科薬物開発業者に適用する監督管理要求は未来に変化する可能性がある。例えば、2023年に衆議院で提出された両党立法は、小児科試験への資金を増加させ、まれな疾患を治療することを強制的に要求する薬物を児童に検討することと、必要な小児科研究が完了していない会社に対するFDA評価を許可することとを許可する。
特殊プロトコル評価
ある会社は、特別合意評価(SPA)プログラムに従ってFDAと、治療効果宣言の主な基礎を形成するための臨床試験の必要な設計と規模について合意することができる。FDA法案およびFDAが法定要求を実施する指導によれば、SPAは、限定された場合を除いて、例えば、FDAが臨床試験開始後に安全性または有効性を決定するために重要な重大な科学的問題が発見された場合、レジメン評価時に意識されていない公衆衛生問題が発生し、スポンサーおよびFDAが書面で変更に同意しない限り、または臨床試験スポンサーがFDAと合意された案に従わなかった場合、通常、FDAに拘束力がある。
開発と審査計画を加速する
FDAは特定の製品を指定して加速開発或いは審査を行う権利があり、もしこれらの製品が深刻な或いは生命に危害を及ぼす疾病或いは状況の治療において満たされていない医療需要を解決することを目的としている場合。これらの計画には、高速チャネル指定、画期的な治療指定、優先審査指定が含まれる。1つの薬剤がこれらの加速開発および審査計画のうちの1つまたは複数に適合していても、FDAは後で、その薬剤がもはや資格条件に適合していないことを決定することができ、またはFDAの審査または承認の期間が短縮されず、指定を撤回する可能性がある。
迅速なチャネル認証を取得する資格があるために、FDAはスポンサーの要求に基づいて、深刻なまたは生命に危害を及ぼす疾患または状態を治療することを目的とした製品を決定し、存在しない治療法または治療効果または安全要素に基づく既存の治療法よりも優れている可能性があることを証明することによって、満たされていない医療需要を満たす可能性があることを証明した。高速チャネル指定は、FDA審査チームとより頻繁な相互作用を行うための機会を提供し、製品の開発と審査を加速する。FDAはまた、Fast Track製品を審査するNDA部分を完全な出願を提出する前にスクロールすることができ、スポンサーとFDAが出願部分のスケジュールについて合意し、スポンサーがNDAの第1の部分を提出する際に必要な使用料を支払うことを前提としていてもよい。申請はIND提出時に提出することができ,一般に秘密保持プロトコル前の会議より遅くない.FDAは要請を受けてから60日以内に対応するだろう。
91
優先審査は、治療において大きな進展が得られたか、または適切な治療なしに治療を提供する薬剤を6ヶ月以内に予備審査することを目的としたNDA提出時に要求され、標準審査期間は10ヶ月である(新しい分子実体またはNME申請が提出された日から、または非NME申請を受けた日から)。FDAは具体的な状況から,他の利用可能な治療法と比較して,推奨されている薬物が治療,予防あるいは疾患の診断において有意な改善を示しているかどうかを決定している。顕著な改善は,ある疾患の治療の有効性の向上,治療を制限する薬物反応の除去あるいは大幅な減少,記録されている患者のコンプライアンスの向上,重篤な結果の改善,あるいは新亜群の安全性と有効性の証拠に現れる可能性がある。優先審査を指定する目的は,機関全体の注意と資源をこのような申請の評価に導き,FDAがそのPDUFAプロトコルに基づいて行動する目標を短縮することである.
また、2012年、INDスポンサーの要求に応じて、国会はFDAが“画期的療法”に指定した候補製品のために新たな規制計画を策定した。画期的な治療法指定は、薬物の開発と審査を加速することを目的としており、これらの薬物は単独または他の治療法との併用による深刻または生命に危害を及ぼす疾患または状況を治療することを目的としており、初歩的な臨床証拠は、この薬物が1つ以上の臨床重要な終点で既存の治療法よりも実質的な改善を示す可能性があることを示している。スポンサーは、INDの提出時または第2段階の会議の終了までに画期的な治療指定を申請することができる。FDAは、治療指定を突破する要求を受信してから60日以内にこの要求に応答する。画期的な治療指定を獲得した薬物は,すべての迅速チャネル指定機能の獲得,高効率薬物開発計画への密な指導(最初の段階から),およびFDAは高度管理者の承諾に関与する資格がある。
腫瘍薬の応用に対して,FDAの腫瘍学卓越センターはリアルタイム腫瘍学審査(RTOR)と呼ばれる計画を開発した。RTORは、データベースロック後にTOPLINE結果(すなわち、研究報告が完了する前の臨床研究の有効性および安全性結果)およびデータセットをより早く提出して、機関がマーケティング申請審査の審査をより早く開始することをサポートするのに役立つ。RTORの目的は、FDAの審査員がより早くデータにアクセスし、データ品質および潜在的な審査問題を識別し、潜在的に可能な限り早期に申請者にフィードバックを提供することであり、製品のNDAのより簡素化された効率的な審査プロセスを可能にすることである。キー試験のデータベースがロックされており、腫瘍学製品がFDAの計画基準に適合している場合、申請者はRTORに従って審査を申請することができる。資格要件に適合する:(A)臨床的証拠は、既存の療法と比較して、1つまたは複数の臨床関連終点を実質的に改善する可能性があることを示し、(B)簡単な研究設計および説明しやすい臨床試験終点(例えば、総生存率、反応率)を使用すること、(C)NDAのいずれの態様も、より長い審査時間を必要とする可能性が低い(例えば、新しいREMSの要求または諮問委員会の意見)。2023年11月、この機関は最終的にRTORに関する業界指導意見を決定した。
迅速チャネル指定、突破的治療指定、優先審査は承認基準を変更することはなく、最終的に開発やNDA承認過程を加速しない可能性がある。
承認を加速する
研究された製品は、深刻または生命に危険な疾患の治療における安全性および有効性、および既存の治療方法よりも意義のある治療利益を提供する製品は、FDAの加速承認を得る可能性があり、十分かつ制御された臨床試験によって承認される可能性があり、これらの試験は、医薬製品が臨床的利益を合理的に予測する可能性のある代替終点に影響を及ぼすことを証明する。中間臨床終点に対する製品の影響が不可逆的な発病率または死亡率またはIMMへの影響よりも早いことができ、病状の重症度、希少性または流行率、および代替治療が利用可能または不足している場合を考慮すると、IMMまたは他の臨床的利益への影響を合理的に予測する可能性がある場合、FDAは、このような薬物または生物学的製剤の承認を加速することを許可することもできる。FDAとの承認加速の可能性に関する議論は,適切なゴールを決定するために薬物開発の早期に開始されるのが一般的である。承認の1つの条件として、FDAは、IMMまたは他の臨床終点に対する予期される効果を検証および記述するために、承認を加速させた薬物のスポンサーに発売後の臨床試験を要求することができ、迅速な退出手順を必要とする可能性がある。加速的に承認された薬品および生物製品は、従来承認された薬物および生物製品と同じ安全と有効性法定基準に適合しなければならない。
承認を加速するために、代替終点は1つの標識であり、例えば実験室測定、放射画像、バイタルサイン或いは他の臨床利益を予測できると考えられる指標であるが、それ自体は臨床利益の測定基準ではない。代替終点は通常、臨床終点よりも容易または迅速に測定される。中間臨床終点は治療効果の測定であり、1種の薬物の臨床利益、例えばIMMに対する効果を合理的に予測することが可能であると考えられる。FDAの承認加速に関する経験が限られている理由は
92
中間臨床終点、しかしすでに表明した、もし終点が測定した治療効果自体が臨床利益と伝統的な承認の基礎でなければ、このような終点は一般的に加速承認を支持することができ、前提は根拠が結論を出すことであり、治療効果は合理的に1種の薬物の最終長期臨床利益を予測する可能性がある。
加速承認経路は病気経過が長く、薬物の期待される臨床利益を測定するために比較的に長い時間を必要とする環境に最もよく用いられ、代用或いは中間臨床終点への影響が非常に速く発生した。例えば、加速承認は、様々な癌を治療するための薬剤の開発および承認に広く使用されており、治療の目標は、通常、生存率を向上させること、または発症率を低下させることであり、典型的な病気経過の持続時間は、臨床または生存上の利点を証明するために長い、場合によっては大型の臨床試験を必要とする。
承認を加速する方法は、一般に、薬物の臨床的利益を検証および説明するために、勤勉な方法で追加的な承認後の検証的研究を行うことにスポンサーが同意することに依存する。そのため、この基礎の上で承認された候補製品は必ず厳格な発売後のコンプライアンス要求を守らなければならず、4期或いは承認後の臨床試験を完成し、臨床終点への影響を確認することを含む。さらに、国会は最近、マーケティングを継続する前に加速された承認された無効薬の患者への潜在的リスクを軽減するために、FDAに追加の法定権力を提供した。FD&C法案のこれらの改正案によると,この機関は,承認を加速させた製品のスポンサーに承認前に検証的実験を行うことを要求することができる。スポンサーはまた、試験が完了するまで、検証性試験の進捗報告を6ヶ月ごとに提出しなければならず、これらの報告はFDAのウェブサイトで発表される。必要な承認後研究を行わない場合、あるいは発売後の研究期間中にこの製品の期待される臨床的利益が確認できなければ、FDAがこの薬剤の承認を撤回することを許可する。国会はまた、スポンサーの検証性試験が製品主張の臨床的利益を検証できなかった場合、FDAは迅速なプログラムを使用して製品承認を撤回することを選択することができる法律を改正した。国会で最近可決された法定改正案に先立ち,いくつかの腫瘍学スポンサーが加速承認により発売された薬物製品の特定適応を自発的に撤回し,FDAの腫瘍学卓越センターは腫瘍学適応加速承認領域の透明性の向上を目的とした確認項目というイニシアティブを開始した。承認経路の見直しを加速させることは、今後数年間継続する可能性があり、今後さらなる立法および/または行政改革を招く可能性がある。
加速承認手続きにより検討·承認されているすべての候補製品の宣伝材料はFDAの事前審査を経なければならない。
随行診断装置の規制
もし診断テストが将来の薬物製品の商業化後の患者選択に有用な情報を提供すると考えている場合、あるいはFDAがこのようなテストの開発を要求し、将来承認された医薬製品の処方情報にスクリーニング要求を含む場合、協力者と協力して開発する可能性がある体外培養診断テストやペアテストですアメリカ食品医薬品局によると体外培養診断テストは医療機器として,商業化前に単独の規制認可が必要である。このようなテストがどのようなタイプの規制を受けるかは,FDAのリスク評価や,処方医の理解に役立つ結果を生み出すことを目的としているかどうか,FDAや我々が開発している薬剤を安全に有効に使用するために必要な結果であると考えられる。
同時診断および補足診断は、特定の治療製品から利益を得る可能性が最も高い患者を決定することができ、特定の治療製品を使用することによって治療によって深刻な副作用のリスクを増加させる可能性がある患者を決定すること、またはより良い安全性または有効性を達成するために治療を調整することを目的とする特定の治療製品の治療の反応を監視することができる。診断と補充診断に伴うFDAは医療機器として規制されている。リスクを低減するための新しい診断試験および利用可能な制御措置と組み合わせて、セットの診断装置がFDAの上場前承認またはPMAを必要とするかどうか、または商業的に入手可能な装置との基本的な等価性の証明に基づいて、510(K)の上場前通知プログラムを通過できるかどうかを決定する。診断装置および対応する治療製品のラベルには、治療製品の任意の汎用等価物のラベルに含まれ、使用説明では、治療製品と共に使用されるIVD随伴診断装置が規定される。新しい治療製品の場合、そのセット診断装置は、製品の安全かつ有効な使用に重要であり、FDAは、治療スポンサーが、その治療製品開発計画において、承認または承認されたIVDキット診断装置の需要を解決することを期待し、多くの場合、治療製品およびその対応するセット診断は、診断装置が治療製品と同時にPMA承認または510(K)承認を得るために同時に開発されることを期待する。
93
ヨーロッパ/世界の他の地域の政府規制
アメリカの法規を除いて、承認されれば、私たちは、臨床試験と私たちの製品の商業販売と流通を含む他の司法管轄区域の様々な法規を直接または私たちの流通パートナーを通じて遵守しています。
私たちの製品がFDAの承認を得たかどうかにかかわらず、私たちは米国以外の国の規制機関で臨床試験を開始したり、これらの国でその製品を販売する前に必要な承認を得なければならない。さらに、他国および管轄地域で承認を得るのに要する時間は、FDA承認を得るのに要する時間とは異なり、FDA承認を得るのに要する時間よりも長くなる可能性がある。1つの国または管轄区域で規制承認を得ることは、他の国または管轄区域で規制承認を得ることを保証することはできないが、1つの国または管轄区域で規制承認を得ることができなかったか、または遅延して監督管理許可を得ることは、他の国または司法管轄区の規制手続きに悪影響を及ぼす可能性がある。
米国以外のある国には,ヒト臨床試験を開始する前にCTAの提出を要求する流れがあり,INDに似ている。例えば,ヨーロッパではCTAは主管する国家衛生当局と各社が臨床試験を計画している国の独立倫理委員会に提出しなければならない。CTAが一国の要求に応じて承認されると,臨床試験はその国で行うことができる。
臨床試験、製品許可、定価と精算を管理する要求と手続きは国によって異なり、加盟国が自国で基本的なEU立法を実施するにもかかわらず、すでにある程度法律上の協調を実現した。いずれの場合も,臨床試験はGCPや他の適用法規の要求に従って行われた。“臨床試験条例”(EU)536/2014)は、2022年1月31日に施行されると、既存のEU臨床試験指令(EC)2001/20/ECと、この指令を実施するために制定された国家立法とを廃止するEU全体の臨床試験の評価と監督手続きの調整を開始する。新しい臨床試験条例はEUの臨床試験の審査を簡略化と簡素化することを目的としている。この法規の主な特徴は、単一入口点による申請手続きの簡略化、すなわち臨床試験情報システム(CTIS)と呼ばれる“EUポータルサイト”、申請のための準備と提出のための単一文書セット、および簡略化された臨床試験スポンサー報告プログラム、および臨床試験申請評価の統一プログラムである。2023年2月1日より,新たな臨床試験申請を提出する際にはCTIを使用しなければならない。
EUで新薬或いは医薬製品の監督管理許可を得るためには、スポンサーは上場許可申請或いはMAAの許可を得なければならない。EUで医薬製品が承認される方法は、その医薬製品の性質に依存する。
集中化手続きの結果、欧州委員会はEU全体およびアイスランド、リヒテンシュタイン、ノルウェーで有効な単一MAAを承認した。以下のヒト薬剤に強制的である:(I)遺伝子工学のようなバイオテクノロジープロセスに由来する;(Ii)HIV/エイズ、癌、糖尿病、神経変性疾患、自己免疫および他の免疫機能障害およびウイルス性疾患などの特定の疾患の治療に使用可能であることを示す新しい活性物質を含む;(Iii)公式に指定された“孤児薬”(まれなヒト疾患のための薬剤)、および(Iv)遺伝子治療、体細胞治療または組織工学薬などの高度治療薬。出願人の請求に応じて、集中プロセスは、(A)ヒト薬剤が本条例の施行日に共同体によって承認されていない新しい活性物質を含むこと、または(B)出願人が医薬製品が重大な治療、科学的または技術革新であることを証明するか、または集中プロセスにおいて欧州共同体レベルの患者または動物の健康に適合する利益に適合することを承認することを条件として、上記のカテゴリに属さないヒト薬剤のためにも使用することができる。
欧州連合の中央手続きによると、欧州医薬品局がMAAを評価する最長期限は210日(タイマーを含まず、申請者が人用医薬品委員会(CHMP)からの質問に答える際に追加の書面または口頭情報を提供する場合)であり、その後、欧州委員会によって実際のマーケティングによって許可される。特殊な場合、治療革新の角度から見ると、1種の医薬製品は重大な公共健康利益を有することが期待され、3つの累積標準によって定義される:治療すべき疾病の深刻性;適切な代替治療方法の不足、および極めて高い治療効果が期待される場合、CHMPは加速評価を与える可能性がある。この場合,環境管理協会はCHMP意見の評価を150日以内に完了することを確保し,その後意見を発表する。
ヒト薬物承認の相互認識プログラム、あるいはMRPと呼ばれることは、EU内部の個別国家の販売許可を促進するもう一つの方法である。基本的にMRPは,強制的な集中プログラムではないすべてのヒト薬物に適用可能である。MRPはほとんどの伝統医学に適しています
94
製品は、1つまたは複数の会員国が既存の国家販売許可を認める原則に基づいている。
MRPの特徴は、EU加盟国の既存のマーケティング許可に基づいて、他の加盟国でマーケティング許可を得るための参考として確立されていることである。MRPでは、1つの薬物のマーケティング許可が1つまたは複数の会員国に存在し、その後、他の加盟国で初期マーケティング許可を参照することによってマーケティング許可申請を提出する。最初にマーケティング許可を受けた会員国はその後、参考会員国になるだろう。その後、関連会員国として販売許可された会員国を申請する。
MRPは、加盟国がそれぞれの国家マーケティング許可を相互承認する原則に基づいている。会員国のマーケティング許可を参考にして、出願人は他の会員国でマーケティング許可を申請することができる。この場合、参照会員国は、その薬剤に関する既存の評価報告書を90日以内に更新しなければならない。評価が完了すると、報告書のコピーと、承認された製品特性要約、ラベル、および包装チラシがすべての会員国に送信される。そして、関連加盟国は、加盟国の決定と製品特性、ラベル、包装チラシの要約を参照する90日間の期間がある。国家マーケティング許可は、合意を確認してから30日以内に付与されなければなりません。
もしどの会員国も潜在的な深刻な公衆衛生リスクを理由に加盟国の販売許可を参照することを拒否した場合、この問題は調整グループに提出されるだろう。60日間の期限内に、会員国は調整グループ内ですべての努力をして合意に到達しなければならない。もし失敗したら、手続きはEMA科学委員会に仲裁に提出されるだろう。EMA委員会の意見はその後、決定過程を開始するために委員会に渡された。集中手続きのように、この過程は欧州委員会の各本部長と人間薬品または獣薬製品常設委員会に適宜相談する必要がある。
2023年4月、欧州委員会は既存の一般薬品立法を改正し、代替する新しい指令と新法規に関する提案を発表した。現在の提案に従って採択され実施されれば、これらの改正はEUの薬物開発と承認のいくつかの側面を大きく変えるだろう。
イギリスは2020年1月31日にEUから正式に離脱した。当時,イギリスの薬品立法は様々なプログラム上の変化を反映するように更新された。これまでイギリスの薬品立法は連合王国がEUから離脱する前に適用された法律から実質的に外れていなかった。イギリス政府は新薬の発売許可を獲得または維持する要求を実質的に修正することを提案していない。
イギリスがEUを離脱して以来、イギリスの監督管理機関の薬品と保健品監督機関(MHRA)はどのようにマーケティング許可を申請するかに関する指導意見を発表した。この手続きは連合王国が欧州連合から正式に脱退する前の手続きとほぼ同じだ。しかし、MHRAは、イギリスが英国のマーケティング許可を迅速に付与するために、いくつかの“参照規制機関”による決定に依存する可能性がある国際認可手続きを概説している。ほとんどの場合、マーケティング許可がイギリスの出願提出前2年以内に参照規制機関によって承認された場合、審査期間は60日となる。参照規制機関はFDA、EMA、そしてEUの各加盟国の主管当局を含む。
EU以外の他の国,例えば東欧,ラテンアメリカ,アジアの国では,臨床試験,製品許可,定価,精算を行う要求は国によって異なる。繰り返しますが,すべての場合,臨床試験はGCPや他の適用法規の要求に基づいて行われています。
もし私たちが適用される外国の規制要求を遵守できない場合、私たちは罰金、臨床試験の一時停止、監督管理の許可の一時停止または撤回、製品のリコール、製品の差し押さえ、運営制限、刑事起訴などに直面する可能性がある。
保証範囲·定価·精算
FDAから規制承認を受ける可能性のある任意の製品のカバー範囲や精算状態には、大きな不確実性がある。我々の任意の候補製品の販売は,承認されれば,政府医療保健計画(MedicareやMedicaidなど)や個人支払者(商業健康保険会社や管理医療機関など)を含む第三者支払者が製品コストを支払う程度にある程度依存するであろう。第三者支払人は彼らがどの薬を保証するか、そして彼らが保険薬に提供する精算金額を決定する。はい
95
米国では支払者間に保険や補償決定を下す統一された制度はない。また、支払者が商品に保険を提供するか否かを判定する過程は、価格又は販売率を設定する過程と分離する可能性があり、保険が承認されると、支払者は製品に料金を支払う。第三者支払者は、承認されたリストまたは処方表上の特定の製品に保証範囲を制限することができ、FDAによって承認された特定の適応のすべての製品を含まない可能性がある。
我々の製品の保証範囲と精算を確保するためには,販売が許可されれば,その製品の医療必要性とコスト効果を証明し,FDAや他の同様の規制承認を得るために必要な高価な研究を行う必要があるかもしれない。私たちが薬物経済学の研究を行っても、私たちの候補製品は支払人に医学的に必要あるいは費用効果が高いと思われないかもしれない。また、支払者が製品に保険を提供することを決定することは、十分な返済率を承認することを意味するものではない。
医療コストの抑制はすでに連邦、州と外国政府の優先事項になり、薬品価格はずっとこの努力の重点である。米国政府、州立法機関、外国政府はコスト制御計画の実施に大きな興味を示し、これらの計画は政府が支払う医療コストの増加を制限することを目的としており、価格制御、精算制限とブランド処方薬の代わりに模造薬を要求することを含む。例えば、米国では、ACAは、製品の収益性を低下させる可能性のある条項を含み、例えば、連邦医療補助計画に販売されている製品のリベートを増加させ、医療補助リベートを医療補助管理保健計画に拡大し、ある連邦医療保険Dの一部の受益者に強制的に割引し、連邦医療計画における製薬会社の販売シェアに基づいて年会費を徴収する。政府の統制と措置、既存の統制·措置の管轄区域で制限的な政策を強化することで、将来の私たちの製品への支払いを制限する可能性がある。2021年3月11日、総裁·バイデンは2024年1月1日から単一源と革新者多源薬に対する法定医療補助薬品還付上限を廃止した“2021年米国救援計画法案”に署名し、現在この上限は薬品メーカー平均価格の100%である。支払い方法はまた医療立法と規制措置の影響を受ける可能性がある。例えば、CMSは、バンドル支払いモードのような新しい支払いおよび配信モードを開発することができる。処方薬や生物製品価格の上昇を受けて、米国政府も薬品定価の見直しを強化している。このような審査により、アメリカ議会は最近数回の調査を行い、連邦と州立法を提出し、採択し、薬品定価の透明性を高め、連邦医療保険下の処方薬のコストを下げ、定価とメーカー患者計画との関係を審査し、政府計画の薬品精算方法を改革することを目的とした。例えば、2022年8月には、“2022年インフレ削減法案”や“アイルランド共和軍”が法律に署名した。他の事項を除いて、アイルランド共和軍はある薬品のメーカーに連邦医療保険との価格交渉(2026年から)を要求し、価格は交渉できるが上限があり、連邦医療保険B部分と連邦医療保険D部分に基づいてリベートを実施し、インフレを超える価格上昇を処罰し(2023年に初めて満了)、D部分のカバーギャップ割引計画の代わりに新しい割引計画を用いる(2025年から)。アイルランド共和軍はCMSが最初の数年に規制ではなく指導によってその多くの条項を施行することを許可した。CMSはこれらの新しい許可の実施を開始し、2023年10月に製薬業者と第1セットの合意を締結し、価格交渉を行った。しかし,アイルランド共和軍の米国製薬業への影響は不明であり,一部の原因は複数の大手製薬会社や他の利害関係者(例えば米国商会)がCMSに対して様々な理由で違憲,その他の苦情を訴えていることである。このような訴訟は現在も進行中だ。このような理由やその他の理由で、アイルランド共和軍がどのように実施されるかは不明であり、アイルランド共和軍が私たちの業務に与える影響も不明である。
政府や第三者支払者が十分な保険や補償を提供できない場合、規制部門の承認を得て商業販売を行う任意の製品の適正性が影響を受ける可能性がある。米国のコスト抑制措置への関心は増加しており、薬品価格の圧力を増加させ続けることが予想される。保証政策と第三者精算料率は随時変化する可能性がある。規制部門の承認を得た1つまたは複数の製品が有利な引受·精算状態を獲得しても、将来的にはあまり有利ではない引受政策や精算料率が実施される可能性がある。
また、一部の外国の国では、薬品の提案価格は必ず承認されなければならず、合法的に発売されることができる。各国の薬品定価に対する要求は大きく異なる。一部の国では、補償価格を合意した後にのみ、薬品を販売することができると規定されている。一部の国では、清算または定価承認を得るために、私たちの候補製品の費用対効果を現在利用可能な治療法(いわゆる健康技術評価、またはHTA)と比較することを要求する可能性がある。例えば、欧州連合は、その国の健康保険制度が補償を提供する医療製品の範囲を制限し、人が使用する医療製品の価格を制御するために、その加盟国に様々な選択を提供している。会員国は医薬製品の具体的な価格を承認することができ、直接或いは間接規制制度を採用することもできる
96
薬品を市場に投入する会社の収益性。他の加盟国は会社が自分の薬品価格を固定することを許可したが、処方量を監視し、医師に指導意見を発表し、処方を制限した。薬品に対して価格制御や精算制限を実行する国が私たちのいかなる製品にも有利な精算と定価手配を許可することは保証されません。歴史的に見ると、EUで発売された製品は米国の価格構造に従わず、通常大幅に低下する傾向がある。
アメリカの他の医療法律法規
医師、他の医療提供者、そして第三者支払者は、私たちが市場の承認を得た任意の候補製品の推薦と処方において主な役割を果たすだろう。私たちは現在何の製品も発売されていませんが、私たちは現在と未来の業務運営をしており、様々なアメリカ連邦、州、その他の外国詐欺と乱用法律、その他の医療保健法律と法規の制約を受けています。これらの法律と法規は、第三者支払者、私たちの臨床研究計画に参加する医療専門家、医療専門家、および承認された製品を購入、推薦、または発行する他の人との手配、および私たちが提案した販売、マーケティング、流通、教育計画に影響を与える可能性があります。私たちの運営能力に影響を与えるかもしれないアメリカ連邦と州医療法律は
もし私たちの候補製品がアメリカで承認されれば、私たちは第三者の業務手配と適用された医療法律と法規に適合することを保証するために、多くの時間とお金をかけて要求されるだろう。はい
97
米国では,医療改革立法はこれらの連邦と州医療保健法を強化している。例えば、ACAは、これらの法規の下での責任が、個人または実体が法規を実際に理解することを要求しないか、または法規違反の具体的な意図を有することを明確にするために、連邦反バックル法規および刑事医療詐欺法規の意図要件を改正する。また、“反リベート法”では、政府は、“民事虚偽請求法”については、連邦“反リベート法令”違反による物品やサービスを含むクレームが虚偽または詐欺的クレームを構成していると断言できる。これらの法律の範囲が広く、法定例外状況と選択可能な避難港が限られていることから、私たちのいくつかの商業活動は1つ以上のこのような法律の挑戦を受けるかもしれない。
これらの法律に違反することは、罰金、損害賠償、罰金、返還、個人監禁、およびMedicareおよびMedicaidなどの政府援助に参加する医療計画から除外されることを含む刑事、民事、および行政制裁に直面する可能性があり、もし私たちが会社の誠実な合意または同様の合意の制約を受けて、これらの法律を遵守しない疑惑、名声の損害を解決し、私たちが私たちの業務の削減または再編を要求される可能性がある場合、追加の報告要求および監視を受ける可能性がある。また、私たちは、私たちの将来の運営や業務に影響を及ぼす可能性がある連邦と州の法律法規が提出され、施行されることが予想される。
医療改革と医療保健法の潜在的変化
FDAや他の規制機関の政策は変わる可能性があり、私たちの候補製品に対する規制承認を阻止、制限、または延期するための追加の政府法規が公布されるかもしれない。もし私たちが既存の要求の変化に適応できない場合、あるいは新しい要求や政策を採用することができない場合、あるいは規制コンプライアンスを維持できない場合、私たちが本来得る可能性のあるマーケティング承認を失う可能性があり、私たちは利益を達成したり維持することができない可能性があり、これは私たちの業務、将来性、財務状況、運営結果に悪影響を及ぼすだろう。
アメリカの医療業界と他の地域の主な傾向の一つはコストを抑えることだ。政府の価格設定制御を実施し,処方薬コストを含む医療コストの増加を制限するために,複数の連邦や州提案が継続されると予想される。例えば、2010年3月、“患者保護と平価医療法案”(ACA)は、医療補助薬品還付計画の下で大多数のメーカーが不足している最低医療補助税金還付を増加させ、この方法に基づいて、吸入、輸液、点滴、インプラントまたは注射の薬物計算メーカーが医療補助薬品還付計画の下で不足している返金を導入し、医療補助薬品還付計画を医療補助管理看護計画に参加する個人の処方に拡大し、ある連邦医療保険D部分の受益者に対して強制割引を導入し、メーカーが連邦医療保険D部分での外来薬物カバー範囲の条件として、そして、CMSに医療保険革新センターを設立し、革新的な支払いとサービス交付モードをテストし、医療保険と医療補助支出を低減する。
政府はメーカーがその販売する製品に価格を設定する方式に対して更に厳格な審査を行い、これは最近の数回の国会調査を招き、連邦と州立法を提出し、公布し、製品定価の透明性を高め、薬品コストをコントロールし、定価とメーカー患者計画との関係を審査し、政府の薬品の精算方法を改革することを目的とした。
州レベルでは、立法機関は、価格または患者の精算制限、割引、特定の製品参入およびマーケティングコスト開示の制限、および透明性措置を含む、価格または患者の精算制限、割引、特定の製品参入およびマーケティングコスト開示の制限および透明性措置を含む医薬品および生物製品の定価を制御するための法規を立法および実施することが増えており、場合によっては、他の国からの輸入および大量購入を奨励することが目的である。2020年12月、アメリカ最高裁判所は、連邦法律は各州の監督薬局福祉マネージャー(PBM)と医療保健と薬品サプライチェーンの他のメンバーの能力を妨害しないと一致し、この重要な決定は各州がこの領域でより積極的な努力をすることを招いた。2022年中に、連邦貿易委員会はPBM業界のやり方に対して全面的な調査を展開し、これはこのような実体の運営、薬局ネットワーク或いは財務手配に対するより多くの連邦と州立法或いは規制提案を招く可能性がある。今国会の会期内に、衆参両院は多くのPBM改革を審議している;その中にはリベートの取り消しなどの各種の立法提案が含まれている;サービス料を薬品、割引或いはリベートの価格から分離する;価格差の定価を禁止する;行政費用を制限する;PBMに処方の配置理由を報告することを要求する;透明性を促進する。現在アメリカに存在するPBM業界を変える重大な努力は薬品サプライチェーンと他の利益関係者の業務に影響を与える可能性があり、著者らのような薬品開発業者を含む。また,地域医療当局や個別病院では,どの薬品やサプライヤーが処方薬や他の医療計画に含まれるかを決定するために入札プログラムが使用されるようになってきている。これは私たちの製品の最終需要を減らしたり、私たちの製品の価格設定に圧力を与える可能性があります。これは私たちの業務、運営結果、財務状況、将来性にマイナスの影響を与えるかもしれません。
98
EUやイギリスでは、同様の政治、経済、規制発展が承認されれば、任意の候補製品を商業化する能力に影響を与える可能性がある。価格やコスト制御措置に圧力をかけ続けるほか、イギリスや欧州連合や加盟国レベルの立法発展は大量の追加要求や障害を招く可能性があり、私たちの運営コストを増加させる可能性がある。欧州連合で保健サービスを提供することは、保健サービスの確立と運営、薬品の定価と精算を含み、ほぼ完全に国家の法律と政策の問題であり、欧州連合の法律や政策の問題ではない。この点で,各国政府と保健サービス提供者は,保健および製品定価や補償を提供する上で異なる優先順位や方法を持っている。しかし、全体的に、大多数の加盟国と連合王国の保健予算制限は、関連保健サービス提供者の薬品の定価と精算が制限されている。加えて、製品の開発とマーケティングを希望する人は、ますます大きな監督管理負担に直面しており、これは、私たちの候補製品の上場承認を阻止または延期し、承認後の活動を制限または規制し、上場承認を獲得する任意の製品を商業化する能力に影響を与える可能性がある。国際市場では,精算や医療保険支払い制度は国によって異なり,多くの国で特定製品や治療法に価格上限が設定されている。
米国や海外の将来の立法や行政または行政行動によって生じる可能性のある政府規制の可能性、性質、程度を予測することはできない。将来的にはより多くの州と連邦医療改革措置がとられ,いずれも処方薬を含む医療製品やサービスのための連邦·州政府の支払い額が制限される可能性が予想される。
法律訴訟
時々、私たちは正常な業務過程で起きた訴訟に参加するかもしれない。以下に述べる以外に、当社には未解決の訴訟は何もないが、経営陣は、当該等の訴訟が単独又は合算することが当社の経営業績、財務状況又はキャッシュフローに重大な悪影響を及ぼすと考えている。
2018年、Sovaldiブランドで販売されているソソブビルを含むホスホアミドヌクレオチド化合物の組成を含む欧州特許庁から欧州特許、すなわちEPO、EP 2955190またはEP 190を取得した®Gilead Sciences,Inc.によって販売されているC型肝炎治療の先行薬である。2018年遅く、Gileadは欧州特許庁に我々の特許に対する反対意見を提出し、この特許を撤回しようとした。2021年2月,欧州特許庁反対部はジリッドの意見に同意せず,ソソブビルをカバーした改訂された特許主張を支持した。2021年6月,欧州特許庁反対部は我々のEP 190を維持することを決定し,ジリッドは欧州特許庁技術控訴委員会に上訴した。また,欧州特許庁技術控訴委員会に上訴し,欧州特許庁反対部が形式の特許のみを修正することを許可した決定に反対した。2023年3月24日,欧州特許庁技術控訴委員会はEP 190を撤回する口頭決定を発表した。本決定は終局決定であり,追跡力を持つ.欧州特許庁反対部の決定の後も,2021年2月にGilead Sciences,Inc.とGilead Sciences Limitedがイングランドとウェールズ高等裁判所特許裁判所に訴訟を起こし,EP 190のイギリス部分の撤回を求めた。2021年3月,我々はSIvaldiの売却を含む行為が我々の特許を侵害したことを告発するために,GIlead Sciences,Inc.とGilead Sciences Limitedを反訴した®そしてその組み合わせはハヴォニです®Vosevi®Epclusaと®イギリスでは。2022年には、欧州特許庁から別の欧州特許、EP 3904365、またはEP 365、ソソブビルを含むより小さいタイプのホスファミドヌクレオチド化合物を含む物質組成を取得した。GIlead Sciences,Inc.とGIlead Sciences Limitedはその後,彼らのクレームを修正し,EP 365のイギリス部分の撤回を求め,侵害行為を反訴した。英国特許裁判所のこの事件に対する裁判は2023年1月20日から2023年2月3日まで行われ,裁判所は2023年3月21日に判決を下した。その判決では,高等裁判所はEP 190とEP 365が連合王国で無効であると判断した。この決定の結果、私たちはイギリスでの彼らのこれらの法的訴訟の法的費用についてギレドと和解した。
さらに、2021年4月、私たちはドイツのデュッセルドルフ地域裁判所で、Sovaldiの販売による特許侵害を告発するために、Gilead SciencesアイルランドUCとGilead Sciences GmbHに対して法的訴訟を起こした®そしてその組み合わせはハヴォニです®Vosevi®Epclusaと®ドイツで。2022年7月、ドイツのデュッセルドルフ地方裁判所は、ジリッド科学アイルランド大学とジリッド科学有限公司がEP 190を侵害したと判断した。ギレドはこの決定を上訴し、デュッセルドルフ高裁の控訴公聴会は2023年8月17日に行われる予定だった。しかし,欧州特許庁技術控訴委員会が2023年3月に下した決定により,我々は2023年5月にドイツでのすべての訴訟手続きを放棄したため,ジリッドとドイツのこれらの法的手続きの法的費用について和解した。
2023年12月31日現在、イギリスとドイツの特許侵害訴訟によるすべての義務が解決された。
これらの訴訟はすでに発生しており、将来的には私たちの知的財産権に関するいかなる訴訟も、私たちに巨額の法的費用を負担させる可能性がある。“リスク要因--知的財産権訴訟は、私たちに大量の資源を費やし、私たちの人員の正常な職責に対する注意を分散させる可能性がある”と見ている
99
上記の訴訟は、この訴訟に関与しない個々の特許によってカバーされる我々の任意の候補製品に対する特許保護に影響を与えない。
C.組織Al構造
以下は我々の重要な子会社のリストです
企業名 |
|
国/地域 |
|
活動する |
|
パーセント |
|
|
NuCana,Inc. |
|
アメリカです |
|
バイオテクノロジーの研究と発展 |
|
|
100 |
|
NuCana有限公司 |
|
アイルランド |
|
バイオテクノロジーの研究と発展 |
|
|
100 |
|
NuCana BioMed信託有限公司 |
|
スコットランド人 |
|
従業員福祉信託基金 |
|
|
100 |
|
D. 物業·工場装置があります
タイプ |
|
位置 |
|
大きさ(平方フィート) |
|
|
満期になる |
|
行政事務室 |
|
イギリスエディンバラ |
|
|
4,236 |
|
|
2024年12月5日 |
行政事務室 |
|
イギリスエディンバラ |
|
|
3,900 |
|
|
2027年8月14日 |
行政事務室 |
|
マサチューセッツ州ニュートン市アメリカ |
|
312 |
|
|
2024年12月31日 |
|
私たちのすべての不動産は借りたものです。私たちは私たちの事務施設が私たちの現在の需要を満たすのに十分だと信じている。
プロジェクト4 Aです。取消解析Dスタッフコメント
適用されません。
100
プロジェクト5.運営と財務社会的回顧と展望
閣下は、以下の財務状況及び経営業績に関する議論及び分析、及び“総合財務データ精選”及び当社総合財務諸表中の資料、及び本年報の他の部分に掲載されている当該等の報告書に関する付記を読むべきである。当社はポンド単位で、国際会計基準委員会が発表した国際財務報告基準に基づいて総合財務諸表を作成し、この基準は他の司法管轄区の公認会計原則(アメリカ公認会計原則またはアメリカ公認会計原則を含む)と重大な点で異なる可能性がある。
今回の討論中の関連業界の将来性、著者らの未来の業績、流動性と資本資源に対する期待及びその他の非歴史的陳述の陳述はすべて展望性陳述である。これらの展望性陳述は、“リスク要素”の節で述べたリスクと不確定要素を含む多くのリスクと不確定要素の影響を受ける。私たちの実際の結果は、任意の前向きな陳述に含まれたり暗示されたりする結果とは大きく異なるかもしれない。
A.運行G結果
財務運営の概要
収入.収入
私たちは承認された製品は何もありません。したがって、私たちは何の収入も発生しておらず、規制部門から任意の候補製品の承認を得て商業化されない限り、どの製品の販売からも何の収入も生じないと予想される。将来的には、主に製品販売と戦略パートナーとの潜在的な地域や世界的な協力によって収入を創出することを求める。
運営費
私たちは私たちの運営費用を2つに分類します:研究開発費と行政費用です。人件費は、賃金、福祉、ボーナス及び株式に基づく支払費用を含み、これらの費用種別の1つの構成要素を構成する。私たちはそれぞれの従業員が履行した職能に応じて人員コストに関する費用を分配する。
研究と開発費それは.設立以来,我々の総運営費の最大の部分は,我々の研究·開発活動に関連するコストであり,我々の候補製品の臨床前と臨床開発を含む。
研究·開発コストは発生時に費用を計上する。研究開発費は主に
101
私たちのProTdesが開発に成功するかどうかは非常に不確実だ。臨床開発後期段階にある候補製品は通常,臨床開発早期段階の候補品よりも高い開発コストを有しており,これは主に後期臨床試験の規模と持続時間が増加しているためである。しかし、私たちは現在、商業化によって計画の具体的な総支出を正確に予測する可能性があるとは思わない。私たちの候補製品がいつ(もしあれば)大量の現金純流入を始めて、これらの費用を相殺することも予測できません。現在と未来の臨床前と臨床開発計画への支出は時間と完成コストの多くの不確実性の影響を受ける。
私たちの候補製品の臨床試験と開発の持続時間、コスト、時間は様々な要素に依存します
我々はプロジェクトごとに臨床段階と臨床前候補製品の研究と開発費用を追跡した。適切な場合には、製造及び非臨床研究及び開発費用が個別候補製品に分配又は分配される。
行政費それは.行政費用には、人件費、減価償却、償却、外部専門サービスの他の費用が含まれ、法律、監査、会計サービスが含まれる。人員コストには、賃金、ボーナス、福祉、株式ベースの支払い費用が含まれる。他の行政費用には、オフィス関連の費用、専門費用、私たちの情報システム費用が含まれています。将来的には、研究開発と潜在的な候補製品の商業化を支援するために、従業員数を増やしているため、今後も管理費が増加することが予想される。私たちは上場企業としても費用が発生し、米国証券取引委員会やナスダックのルールや規定に関連する費用、追加の保険料、投資家関係や他の行政や専門サービスに関連する費用を含む。
純為替収益
純為替収益(損失)は主に保有するドル現金と関係がある。
財政収入
財政収入は私たちの現金と現金同等物が稼いだ利息と関連がある。
102
所得税控除
私たちはイギリスで会社税を納めて、私たちの完全子会社NuCana、Inc.はアメリカで会社税を払います。私たちの業務の性質のため、私たちは設立以来、私たちはイギリスで損失を出した。我々が確認した所得税控除とは,イギリスと米国で回収可能な研究開発税収控除および米国で納付すべき所得税の総和である。
広く研究開発活動を展開している会社として、私たちはイギリスとアメリカの研究開発税免除制度の恩恵を受けている。英国では,2023年4月1日以降に発生した条件に適合した研究開発プロジェクト支出の26.97%(2023年4月1日までは33.35%)を一部返還することができる。アメリカでは、私たちは研究開発を補償する会社税と相殺することができる。我々のイギリスでの合格支出には,主に臨床試験と製造コスト,関連従業員の雇用コスト,研究開発プロジェクトの一部として発生する消耗品がある。イギリスでは、より大きな割合の研究開発ポイントを獲得しており、2023年4月1日から、一部の下請けの合格研究開発支出は17.53%にのぼる現金リベートを得る資格がある(2023年4月1日までは21.68%)。これらの税率は地域規制の影響を受け、英国以外で行われている研究·開発活動について救済を申請する能力を制限する可能性があり、2024年4月1日以降の会計期間に適用される。私たちの研究開発、臨床試験、製造活動に関連する大部分のコストは、これらの税金の現金払い戻し申請に含まれる資格があります。
現在の研究開発税収控除計画によると、将来的にイギリスで研究開発税免除を申請することはできないかもしれません。中小企業になる資格がないかもしれません。しかし、この場合、私たちは大企業計画に基づいて申請を提出することができるかもしれない。
未納の課税損失は将来の課税利益を相殺するために繰り越します。課税控除を計上した後、2023年12月31日現在、イギリスで累計の繰越税金損失は9850万GBである。株式ベースの給与スケジュールにも一時的な差があり、60万ポンドだった。将来の利益が確定していないため、累計税金損失や株式に基づく給与スケジュールの一時的な違いについて繰延税金資産を確認することはない。
もし私たちが将来収入を生むならば、私たちは特許または特許製品の収入に起因することができる利益に他の収入よりも低い税率を課すことを可能にする“特許箱”イニシアティブから利益を得るかもしれない。現在、この減免を受けた会社の関連収入源の実際の税率は10%である。
経営成果
2022年12月31日までと2023年12月31日までの年次比較
下表は2022年12月31日までと2023年12月31日までの年間運営結果をまとめたものである。
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
|
|
(単位:千) |
|
|||||
研究開発費 |
|
£ |
(25,062 |
) |
|
£ |
(36,426 |
) |
行政費 |
|
|
(6,063 |
) |
|
|
(7,291 |
) |
無形資産減価準備 |
|
|
(503 |
) |
|
|
(292 |
) |
純為替収益 |
|
|
(1,156 |
) |
|
|
4,887 |
|
営業損失 |
|
|
(32,784 |
) |
|
|
(39,122 |
) |
財政収入 |
|
|
754 |
|
|
|
669 |
|
税引き前損失 |
|
|
(32,030 |
) |
|
|
(38,453 |
) |
所得税控除 |
|
|
4,398 |
|
|
|
6,432 |
|
本年度の赤字 |
|
|
(27,632 |
) |
|
|
(32,021 |
) |
その他の総合(費用)収入: |
|
|
|
|
|
|
||
その後再分類されるかもしれません |
|
|
|
|
|
|
||
外来語翻訳におけるコミュニケーションの違い |
|
|
(41 |
) |
|
|
61 |
|
本年度の総合損失総額 |
|
£ |
(27,673 |
) |
|
£ |
(31,960 |
) |
103
研究と開発費
2023年12月31日までの年間研究開発費は2,510万GBで、2022年12月31日までの年度3,640万GBより1,130万GB減少した。2023年の臨床試験費用は2022年と比較して320万GB減少したが,これは主にAcelarinの3期臨床試験が2022年3月に停止したが,一部はNuTide:323の支出増加によって相殺されたためである。2023年の製造コストが2022年に比べて190万GB減少したのは,主にNUC−3373製造活動の段階的なためである。2022年と比較して、2023年に特許コストが500万GB減少したのは、主に2022年に410万GBを認める総規定と、2023年の特許抗弁活動が減少したためである。その他の研究開発コストは2023年に120万GB減少したが、主に人員コストの低下とシェア別の支払い費用によるものである。
次の表に、2023年12月31日と2022年12月31日までの年度の製品支出別研究開発コストの内訳を示す
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
|
|
(未監査) |
|
|||||
NUC-3373 |
|
£ |
17,754 |
|
|
£ |
12,045 |
|
NUC-7738 |
|
|
3,603 |
|
|
|
3,711 |
|
アクラリン |
|
|
2,204 |
|
|
|
19,315 |
|
他にも |
|
|
1,501 |
|
|
|
1,355 |
|
|
|
£ |
25,062 |
|
|
£ |
36,426 |
|
行政費
2023年12月31日までの年度の行政費用は610万GBであったが,2022年12月31日までの年度の行政費用は730万GBと120万GB減少した。減少の主な原因は、株式による支払費用、専門費用、保険コストが低いことである。
無形資産減価準備
私たちは定期的に私たちの特許の組み合わせを審査し、2023年の間に限られた数の特許に関する更なる開発を停止し、主に臨床前候補薬に関連している。経営陣の結論は、減値の兆しであり、減価費用50万英ポンドは、2023年12月31日現在のこれらの特許の全帳簿価値に相当することが確認された。これに対し,2022年12月31日までに確認された減価償却費は30万GBである.
純為替収益
当社は2023年12月31日までに120万GBの純損失を記録したが、2022年12月31日までは純為替収益490万GBを記録した。2023年、損失は主にドルを持つ現金残高とポンドに対するドルの切り下げによるものだ。逆に、2022年には、収益はドルで持っている現金残高と、ポンドに対するドルの値上がりから来ている。
財政収入
財務収入は銀行利息を代表し、2023年12月31日までの年度は80万GB、2022年12月31日までの年度は70万GBである。銀行の利息が増加したのは、現金預金の利息が高いからです。
所得税控除
所得税控除には主に研究開発税収控除が含まれ、2023年12月31日までの年度は440万GB、2022年12月31日までの年度は640万GBである。所得税控除の減少は主に著者らの合資格研究と開発支出の減少、税収控除比率の低下及び前のいくつかの時期に関する調整20万英ポンドによるものである。
104
2021年12月31日までと2022年12月31日までの年次比較
下表は2021年12月31日までと2022年12月31日までの年間運営結果をまとめたものである。
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
|
|
(単位:千) |
|
|||||
研究開発費 |
|
£ |
(36,426 |
) |
|
£ |
(36,834 |
) |
行政費 |
|
|
(7,291 |
) |
|
|
(8,529 |
) |
無形資産減価準備 |
|
|
(292 |
) |
|
|
(2,809 |
) |
純為替収益 |
|
|
4,887 |
|
|
|
267 |
|
営業損失 |
|
|
(39,122 |
) |
|
|
(47,905 |
) |
財政収入 |
|
|
669 |
|
|
|
103 |
|
税引き前損失 |
|
|
(38,453 |
) |
|
|
(47,802 |
) |
所得税控除 |
|
|
6,432 |
|
|
|
7,269 |
|
本年度の赤字 |
|
|
(32,021 |
) |
|
|
(40,533 |
) |
他の全面的な収入: |
|
|
|
|
|
|
||
その後再分類されるかもしれません |
|
|
|
|
|
|
||
外来語翻訳におけるコミュニケーションの違い |
|
|
61 |
|
|
|
5 |
|
本年度の総合損失総額 |
|
£ |
(31,960 |
) |
|
£ |
(40,528 |
) |
研究と開発費
2022年12月31日までの年間研究開発費は3,640万GBで、2021年12月31日までの3,680万GBより40万GB減少した。減少の原因は,2021年の2,040万GBと比較して,2022年の1,650万GBの臨床試験に関する費用が減少したためである。2022年の製造コストは220万GBだったが、2021年には330万GBと110万GB減少した。臨床試験と製造コストの低下は主にアクラリンの3期臨床試験が2022年3月に停止したためである。2021年に比べて2022年の特許コストが510万GB増加したのは,主に特許保護活動によるものである。510万GBの増加は、Gilead Sciences,Inc.,Gilead Sciences Limited,Gilead SciencesアイルランドUCおよびGIlead Sciences GmbHに支払うべき総コスト補償を推定するための2022年12月31日までの年間で確認された410万GBの総支出を含み、以下の点に関連している
他の研究開発コストは2022年に50万GB減少し、主に株式による支払い費用と非臨床コストが低いが、一部は高い人員コストで相殺されている。次の表に、2022年12月31日と2021年12月31日までの年度別製品支出の研究開発コストの内訳を示す
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
|
|
(未監査) |
|
|||||
|
|
(単位:千) |
|
|||||
NUC-3373 |
|
£ |
12,045 |
|
|
£ |
7,303 |
|
NUC-7738 |
|
|
3,711 |
|
|
|
4,029 |
|
アクラリン |
|
|
19,315 |
|
|
|
22,800 |
|
他にも |
|
|
1,355 |
|
|
|
2,702 |
|
|
|
£ |
36,426 |
|
|
£ |
36,834 |
|
行政費
2022年12月31日までの年度の行政費用は730万GBであるのに対し,2021年12月31日までの年度の行政費用は850万GBと120万GB減少した。減少の主な原因は、株式による支払い費用、専門費用、保険、償却費用が減少したが、高い人員コストによって部分的に相殺されたことである。
105
無形資産減価準備
私たちは定期的に私たちの特許の組み合わせを審査し、2022年の間に限られた数の更なる開発を停止し、主に臨床前候補薬と関係がある。経営陣の結論は、2022年12月31日までのこれらの特許の全帳簿価値に相当する減価費用30万GBが確認された減値の兆候であることである.
2022年3月2日,試験の独立データモニタリング委員会(IDMC)があらかじめ計画された無効性分析を行った後,Acelarinの進行胆道癌患者への3期臨床試験が停止することを発表した。経営陣は損害の兆候であると結論したため,臨床試験やアクラリンに関連する資産を審査した。この審査によると、2021年12月31日までの年度確認減価費用280万英ポンドは、2021年12月31日までのAcelarin関連特許の全帳簿価値に相当する。
純外国為替収益
2022年12月31日までに純為替収益490万GBを記録したが,2021年12月31日までは純為替収益30万GBを記録した。2022年、収益は主にドルで保有する現金残高と、ポンドに対するドルの上昇速度が2021年を上回ったことに由来する。
財政収入
財務収入は銀行利息を代表し、2022年12月31日までの年度は70万GB、2021年12月31日までの年度は10万GBである。銀行の利息が増加したのは、現金預金の利息が高いからです。
所得税控除
所得税控除には主に研究開発税収控除が含まれ、2022年12月31日までの年度は640万GB、2021年12月31日までの年度は730万GBである。所得税控除の減少は主に私たちが条件を満たした研究開発費の減少に起因する。
B. 流動性とC資本資源
概要
設立以来、私たちは深刻な運営損失と負の運営キャッシュフローを受けた。私たちは少なくとも今後数年以内に、私たちが引き続き損失を受けると予想している。したがって、私たちは私たちの運営を支援するための追加の資本が必要になり、私たちは追加の株式融資、債務融資、研究資金、協力、契約、および贈与収入、または他の源からこれらの資金を得ることができるだろう。
2023年12月31日と2022年12月31日まで、それぞれ1720万GBと4190万GBの現金と現金等価物を持っています。私たちは現在どんな承認された製品もなく、製品販売から何の収入も得たことがない。これまで、私たちは主に株式証券を発行することで私たちの業務に資金を提供してきた。
2021年8月、私たちはJefferies LLCまたはJefferiesと“市場”(ATM)販売協定を締結し、この協定によると、私たちは時々Jefferiesを通じて私たちの代理販売総発行価格1.00億ドルまでの米国預託証明書を販売することができる。本現金自動支払機計画によると私どものアメリカ預託証明書の販売は販売契約に規定されているいくつかの条件を守らなければなりません。ATM計画による販売登録は、2021年8月にアメリカ証券取引委員会に提出されたF-3表の棚登録声明にあります。この声明は、ATM機計画に基づいて販売される私たちのアメリカ預託証明書を含む、最高合計4.0億ドルの私たちの証券を発売、発行、販売することを許可します。2023年12月31日までの年間で,ATM計画に基づいて408,015枚の米国預託証明書を販売·発行し,408,015株の普通株に相当し,20万GBの毛収入を調達した。
106
次の表は,2022年12月31日までと2023年12月31日までの年間キャッシュフロー結果をまとめたものである。
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
|
|
(単位:千) |
|
|||||
経営活動のための現金純額 |
|
£ |
(26,439 |
) |
|
£ |
(23,158 |
) |
投資活動の現金純額 |
|
|
2,888 |
|
|
|
120 |
|
融資活動のための現金純額 |
|
|
(53 |
) |
|
|
(161 |
) |
現金と現金等価物の純減少 |
|
£ |
(23,604 |
) |
|
£ |
(23,199 |
) |
経営活動それは.2023年に経営活動に用いられた現金純額は2,640万GBだったが、2022年には2,320万GB、現金流出純は320万GB増加した。2023年の営業損失キャッシュフローは330万GB減少し、主に研究開発コストの低下を反映し、一部は割り当てられた変動によって相殺された。2023年12月31日までの年度運営資本流出は130万GBであったが,2022年12月31日までの年度運営資本流入は370万GBであった。また,2023年には560万GBの還付を受けたが,2022年には720万GBとなった。
投資活動それは.2023年の投資活動からの純現金は290万GBだったが、2022年には10万GBだった。2023年12月31日までの年間で、他の資産の返済総額は260万GBであり、2022年には似たような返済はない。2023年に受け取った利息は80万GBだったが、2022年には60万GBと20万GB増加した。
融資活動それは.2023年に融資活動に用いられた現金純額は10万GBだったが、2022年には20万GBとなり、株式発行収益の増加を反映している。
下表は2021年12月31日までと2022年12月31日までの年間キャッシュフロー結果をまとめたものである。
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
|
|
(単位:千) |
|
|||||
経営活動のための現金純額 |
|
£ |
(23,158 |
) |
|
£ |
(23,824 |
) |
投資活動からの純現金 |
|
|
120 |
|
|
|
(3,561 |
) |
融資活動のための現金純額 |
|
|
(161 |
) |
|
|
(98 |
) |
現金と現金等価物の純減少 |
|
£ |
(23,199 |
) |
|
£ |
(27,483 |
) |
経営活動それは.2022年に経営活動に用いられた現金純額は2320万GBだったが、2021年には2380万GB、現金流出純は60万GB減少した。2022年の運営損失キャッシュフローは370万GB減少し、主に研究開発コストの低下を反映している。2022年12月31日までの年度の運営資本流入は370万GBであるのに対し,2021年12月31日までの年度の運営資本流入は410万GBである。また,2022年に720万GBの還付を受けたが,2021年には990万GBであった。
投資活動それは.2022年の投資活動からの純現金は10万GBだったが、2021年の投資活動のための現金純額は360万GBだった。2021年12月31日までの年度には他の非流動資産への支払い260万GBが含まれており、2022年には同様の支払いはない。2022年に受け取った利息は60万GBだったが、2021年には10万GBと50万GB増加した。2022年、無形資産を取得するための現金は2021年より50万GB減少した。
融資活動それは.2022年の融資活動のための現金純額は20万GBであるのに対し、2021年は10万GBであり、発行株収益の減少を反映している。
契約義務
次の表は2023年12月31日までの私たちの契約賃貸約束と義務をまとめています。
|
|
期限どおりの支払い |
|
|||||||||||||||||
|
|
合計する |
|
|
少ないです |
|
|
1 - 3 |
|
|
3 - 5 |
|
|
超過 |
|
|||||
|
|
(単位:千) |
|
|||||||||||||||||
経営リース義務 |
|
£ |
429 |
|
|
£ |
224 |
|
|
£ |
164 |
|
|
£ |
41 |
|
|
|
— |
|
107
経営賃貸義務はオフィススペースのレンタル料と関係がある。
私たちは、様々な許可や関連協定に基づいて第三者に記念碑的な支払いを支払い、第三者に特許使用料と年間維持費を支払うことに同意し、様々なCROと製造協定に基づいてCROや製造業者に支払うことにも同意します。このような支払いの金額、時間、可能性は固定されていないか、または確定できないので、私たちはどのような支払い責任や支払い責任を上の表に含めていません。
運営及び資本支出規定
設立以来、年間利益を達成しておらず、今後も純損失が続くことが予想される。
現在の予想に沿って我々の研究·開発活動を進めるために必要な経費を評価する際には,業務活動を支援するためにより多くの資金を求める必要がある。もし私たちが追加資本を得ることができなければ、私たちは私たちの研究開発計画を延期または減少させることを要求され、これは私たちの将来の業務見通しと持続的な経営企業としての私たちの能力に悪影響を及ぼすかもしれない。私たちの現在の運営計画によると、私たちの手元の現金と現金等価物は、今後12ヶ月の予想運営に資金を提供するのに十分ではないと思います。
これらの問題により、私たちの現金残高が枯渇する前に、私たちが経営を続けている間に十分な追加資本を調達する能力には不確実性がある。これらの事件や状況は、私たちの持続経営企業としての持続的な経営能力を大きく疑っているため、正常な業務過程で私たちの資産を現金化し、負債を返済することができないかもしれません。連結財務諸表には、この不確実性の結果がもたらす可能性のあるいかなる調整も含まれていない。
しかし、私たちの資本資源を慎重に管理し、私たちの持続的な経営評価によると、2023年12月31日までの年度の現金流出は、Acelarin第三段階臨床試験に関連する臨床試験費用の課税項目の支払いおよびイギリスとドイツ特許侵害訴訟債務の弁済の影響を受けるため、今後12ヶ月間の現金支出稼働率は2023年12月31日までの年度よりも低下することが予想される。
しかし、私たちの未来の資金需要は多くの要素に依存するだろうが、これらに限定されない
C. 研究開発、特許、ライセンスなど。
我々の研究·開発活動および支出のすべての詳細は、“プロジェクト4.会社情報-Bビジネス”および“プロジェクト5 A”に掲載されている。今年度中の“経営実績”を報告する。
D. トレンド情報
プロジェクト5 Aを参照してください。今年度中の“経営実績”を報告する。
108
E. 肝心な会計見積もり
適用されません。
F. [ 事由立てられている]
G. [事由立てられている]
H.非GAAP FIN財務措置
適用されません。
109
プロジェクト6.ベテラン取締役経営陣と従業員
A.取締役とS上級管理職
以下の表に、私たちの執行幹事と役員の名前、年齢、ポストを示します
名前.名前 |
|
年ごろ |
|
ポスト |
行政員 |
|
|
|
|
ヒュー·グリフィス |
|
56 |
|
取締役CEO兼最高経営責任者 |
ドナルド·ムニオス |
|
55 |
|
首席財務官 |
ジェフリー·ブロス |
|
67 |
|
首席医療官 |
デヴィッド·ハリソン |
|
64 |
|
翻訳研究部主任 |
非執行役員 |
|
|
|
|
アンドリュー·ケイ |
|
68 |
|
董事非執行役員兼会長 |
マーティン·メリッシュ |
|
66 |
|
非執行役員 |
アダム·ジョージ |
|
54 |
|
非執行役員 |
シリル·レパーリエ |
|
70 |
|
非執行役員 |
エリオト·リヴィ |
|
65 |
|
非執行役員 |
バリ島ムラリダール |
|
44 |
|
非執行役員 |
行政員
ヒュー·グリフィス 私たちの共同創業者で、2008年3月に運営を開始して以来、私たちのCEOと取締役会のメンバーを務めてきました。また、彼は現在医薬付属品有限会社の非執行役員を務めている。グリフィスさんは、2018年から2023年まで株式会社の非執行役員を務め、2009年から2023年までConvatec Groupによって買収されたエディクソン医療株式会社の非執行役員を務めています。NuCanaの創設に先立ち,グリフィスさんは2004年7月から2007年12月までの間にバイオ製薬会社Bioenvision,Inc.の首席運営官を務め,2007年12月にGenzyme Corporation(現サイノフィ)に買収された。2002年9月から2004年6月までBioenVision社のビジネス役員を務めた。これまで、グリフィスさんは、2002年1月から2002年7月までの間に、バイオ製薬会社Quantanova Limited(現エバービー社)でいくつかの高度なビジネスポストを担当しました。1995年10月から2001年12月までワーナー·ランバート社(現在はファイザー)。1992年4月から1995年10月まで。彼は現在スコットランド生命科学協会の顧問委員会に勤めている。グリフィスさんは、2018年にスコットランド政府から終身雇用賞を受賞し、生命科学への貢献を果たしました。グリフィスさんは、398件以上の特許および300件以上の係属中の特許出願について知られている発明者です。彼はカーディフビジネススクールの商工管理修士号と理科学士号を取得した。スターリング大学の生物学の栄誉です私たちは、グリフィスさんは、CEOとしての彼の視点と経験を含む取締役会のメンバーとしての特別な品質を有していると信じており、これは、当社の取締役会に歴史的知識、運営の専門知識、連続性を提供し、CEO、CEO、役員役員を含むバイオ製薬業界での彼の重要な経験を提供します。
ドナルド·ムニオス 2015年10月以来、私たちの最高財務責任者を務めてきた。ムニオスは2021年4月からEnter,Inc.の取締役を務めている。Munozさんは、NuCanaに加入する前に、2014年9月から2015年9月まで、バイオ製薬会社NOXXON Pharma AG(現NOXXON Pharma N.V.)でグループ最高財務責任者を務めた。これまでは、2012年8月から2014年9月までの間にSummer Street Research Partnersの投資銀行業務担当を務めており、医療に専念した投資銀行や機関証券会社であった。ムーニオスさんは、2009年から2011年まで取締役社長を務め、コーエン社の医療技術投資銀行業務をリードし、2005年から2009年までLeerink Partners LLCの医療技術投資銀行業務をリードしていた。これまで、彼はAlexの医療投資銀行部門で約10年間働いていた。ブラウン父子とその後継者であるドイツ銀行証券。ムーニオスさんは、コロンビア大学ビジネススクールで金融および会計ビジネスマネジメントの修士号、ダートマス大学の学士号を取得しています。
110
ジェフリー·ブロス医学博士かつて務めたことがある 2021年8月から私たちの首席医療官を務めています。また,複数の製薬/生物製薬会社で20年を超える腫瘍学的リーダー経験を有しており,礼来社,遺伝子テーク,Xencor,GSK,Astellas,Aegarieを含む。NuCanaに加入する直前に,ブロス博士は2018年8月から2021年8月までの間にTarveda Treateuticsの首席医療官を務め,リスク投資によって支援された臨床段階腫瘍学会社である。タールウェダに入社する前に、ブロス博士は2017年6月から2018年8月までの間にアグリス製薬会社の首席医療官と医療事務担当上級副社長を務めた。ブロス博士はアメリカ空軍ウィルフォード·ホール医学センターで産婦人科入院医師資格を完成し、カリフォルニア大学オーウェン校で婦人科腫瘍学研究員の学位を完成した。ブロス博士はトーマス·ジェファーソン大学医学部で医学博士号を取得し、ジュニア塔学院で学士号を取得した。
David·ハリソン医学博士です 2017年12月以来私たちの形質転換医学の責任者を務めてきました。ハリソン博士は2012年5月からセントアンドルーズ大学で病理学教授,2003年からエジンバラ大学で名誉教授,フロリダ大学で兼任教授を務めている。彼はまたエジンバラのロシオンNHS大学病院で人体組織の使用に関する道徳規範を監督し、そこで彼は名誉顧問病理学者である。ハリソン博士は2015年5月からイギリス政府発癌委員会諮問委員会の議長を務めており、彼は突然変異を引き起こす委員会のメンバーである。ハリソン博士は、2019年2月から2023年4月まで、人工知能のデジタル診断への応用の研究開発を促進するために、政府や業界が支援するイニシアティブであるiCARDを創設し、指導した。また、ハリソン博士はILC治療有限会社の非執行役員でもある。ハリソン博士はロンドン王立病理学者学院、エジンバラ王立内科学院とエジンバラ王立外科学院の院士である。彼はエジンバラ大学で医学と医学博士の訓練を受けた。
非執行役員
アンドリュー·ケイ2020年12月から私たちの取締役会長を務めてきた。Kayさんは2017年9月よりWalkSafe Chaperhome Limited会長、2014年から取締役または愛茉莉コンサルティング会社の理事長を務め、2017年9月からNeRRe治療会社の取締役会長を務めています。ケイさんは、2015年8月から2023年10月までの間、ブルーベリー治療会社の取締役会長を務めています。2019年1月から2020年9月まで、バイエルに買収されたバイオテクノロジー会社コンディ治療会社で同じ職務を担当している。2015年9月から2018年6月にかけて、ケイさんは、2018年にAlexion社に買収されたバイオ製薬会社であるウィルソン治療会社の取締役会長を務めています。これまで、ケイさんは2009年1月から2014年5月までの間にアルゲータの総裁兼CEOを務めていた。Algetaに参加する前に、Kayさんは、1999年から2003年までのグローバルマーケティングおよび販売担当者、ならびに医療委員会と製薬実行委員会のメンバーであり、ヨーロッパとアメリカで他のいくつかの高級ビジネスポストを担当しました。Renovo、アスリーカン、礼来、Sandoz、Botsで働いたことがあります。Kayさんはノッティンガム大学で薬学の栄誉ある学士号を取得した。私たちは、カイさんはバイオテクノロジーと製薬会社での彼の経験を含む、私たちの取締役会のメンバーになる資格を持っていると信じています。
マーティン·メリッシュ2009年12月から私たちの取締役会のメンバーを務めてきた。メリッシュさんはまた、急性熱傷および慢性糖尿病の創傷を評価するための医療人工知能技術;Levitronix Technologies Inc.半導体および生命科学分野で高純度の液体を処理するための技術会社、スペクトル人工知能会社(ナスダック·コード:MDIC;旧ロンドンターゲット市場コード:SMD)の監査委員会の議長を務めています。また、メリッシュさんは、ケンジントングリーンマネジメント株式会社、アルトゥーキホールディングス、サウジReadyMixコンクリの取締役のメンバーです。メリッシュは取締役の創業者でアスペンコンサルティングサービス有限公司の会長で、同社の本社はロンドンにあり、1994年から北米、ヨーロッパ、アジアの投資管理を担当してきた。メリシュは理学修士号を持っています。ダートマス大学ゲゼル医学院とタッカービジネススクールを持つヘルスケア提供科学修士号、マサチューセッツ工科大学の管理学修士号、理学修士号。東北大学出身。我々は、メリッシュさんは、会計および金融面での彼の経験を含む、我々の取締役会のメンバーになる資格を備えていると信じています。
アダム·ジョージ2018年4月から私たちの取締役会のメンバーを務めてきました。ジョージ·さんは、2017年3月から2020年12月までの間にGW Pharmticsイギリス取締役社長兼取締役秘書を務め、2012年から2017年3月まで首席財務官を務め、2007年から2012年まで財務総監を務めた。GW製薬会社は生物製薬会社であり、その独自のカンナビノイド製品プラットフォームから広範な疾患分野の新しい治療法を発見、開発、商業化することに集中している。また、ジョージさんは、2021年12月からPsi製薬有限公司の取締役会長兼CEOを務め、2021年6月からBeckley心理技術有限公司の取締役会メンバーを務めています。さらに、ジョージさんは、民間製薬開発会社PsiClone Ltd、Neurone Ltd、Kanna Health Ltdの取締役のメンバーです。GW製薬会社に入社する前に、Georgeさんは上場企業と非上場企業で複数の高級財務職を務めていた。ジョージさんは理科の学士号を持っている。ブリストル大学生物学専攻
111
フランチャイズ会計士です。彼はまたNuCana監査委員会の議長を務めた。我々は、ジョージさんは、上場企業および非上場企業におけるバイオ製薬業界の豊富な管理経験を含む、我々の取締役会のメンバーになる資格を備えていると信じています。
シリル·レパーリエ 医学博士です。2018年5月から私たちの取締役会のメンバーを務めてきました。彼はNuCanaに製薬とバイオテクノロジー産業で40年以上の経験をもたらした。Leperlier博士は2020年6月から2022年11月までの間にDivlal SASの最高経営責任者を務めたこともある。2009年から2019年にかけて、Leperlier博士はセノフィ企業の業務発展やM&Aグループ企業戦略医学評価副主任総裁も務め、サイノフィによるGenzymeの買収などの取引に参加した。これまで,Leperlier博士は2007年から2009年までセノフィで日本医療役員を務め,2004年から2007年まで国際地域医療事務担当者を務めていた。セノフィに入社する前,Leperlier博士は医療役員会社とロン·プレンツバラー社の臨床開発のグローバル責任者であり,これまで武田社で様々な運営や医療事務を担当してきた。Leperlier博士はパリ大学サンアントワン医学院医学博士号とパリ医科大学人間生物学修士号(生理学を専攻)を持っている。彼は腫瘍学薬物開発、戦略組み合わせ優先順位と業務発展方面の公認専門家であり、多くの全世界の生物技術と製薬会社で豊富な指導経験を持っている。Leperlier博士は、世界的な薬物開発とマーケティングの経験を含む、私たちの取締役会のメンバーを務める資格を持っていると信じています。
医学博士エリオト·リヴィ 2021年11月以来、私たちの取締役会のメンバーを務めてきた。Levy博士は2021年5月からボストンコンサルティンググループの上級顧問を務め、2022年4月から5 AM Venturesのリスクパートナーを務めてきた。リヴィ博士は2020年6月から2021年5月までの間に安進生物技術会社の研究開発、戦略と運営部門の高級副総裁を務めた。リーヴィ博士は2020年6月まで、グローバル発展部に安進する上級副総裁でもある。リーヴィ博士は、将来の大流行薬の小分子療法の開発を促進し、取締役やTransCelerate Biophma,Inc.の取締役会長を務め、非営利団体が新たな療法の開発の改善と加速に取り組むことを目標としている非営利組織の責任者を務めている。また,リヴィ博士は現在オメガ治療会社,Editas Medicines社(ナスダックコード:EDIT),Kinaset治療会社の取締役メンバーである。リーヴィ博士は生物製薬業界の薬物研究の臨床開発と監督管理の承認において24年間の経験を持っている。リヴィ博士はエール医学院の医学博士号とエール大学の歴史学学士号を持っています。著者らは、リーヴィ博士は生物製薬業界の臨床開発と薬物監督許可の研究における豊富な経験を含む、著者らの取締役会のメンバーを務める資格を備えていると信じている。
バリ島ムラリダルは 医学博士、博士2020年10月から私たちの取締役会のメンバーを務めてきた。ムラリダル博士は生命科学に取り組む大西洋横断投資グループAbingworth LLPやAbingworthの管理パートナーです。Abingworthに加入する前に、Muralidhar博士は2012年11月から2019年3月までの間にMVM Partners LLP(MVMと略称する)の上級パートナーであった。彼はアビンボスを代表して雲杉生物科学会社(ナスダックコード:SPRB)、ルノー製薬会社、ウガン社、Ascend GmbH社とAnjarie生物科学会社の取締役会に勤めている。MVMに加入する前は、ベインキャピタル株式会社のレバレッジ買収チームのメンバーで、2011年4月から2012年11月まで医療業務に専念していた。ムラリダル博士は以前フランス生物技術会社Valneva SEの監督会のメンバーを務め、Valneva SEは汎欧取引所に上場したフランス生物技術会社であり、ウィルソン治療会社はナスダックOMXに上場した。ムラリダル博士はオックスフォード大学で臨床医学学位を取得し,ケンブリッジ大学MRC癌細胞研究センターで転化型癌研究博士号を取得した。ミュラリダル博士は、医療分野での投資経験を含めて、私たちの取締役会のメンバーを務める資格を持っていると信じています。
B.報酬ホーム.ホーム
以下では、2023年12月31日までの年度を提供し、吾等及び吾等の付属会社が、吾等及び吾等の付属会社に様々な身分でサービスを提供するために、予等の取締役及び管理職メンバーの補償額及び実物利益を支払うこと、及び吾等又は吾等の付属会社が吾等の役員及び執行管理委員会メンバーに退職金、退職又は類似福祉を提供するために2023年12月31日までの年間の現金購入計画に貢献した金額を検討する。
役員および行政職の報酬
役員報酬
グリフィスさんについては、2023年12月31日現在、取締役への給与の支払いを下表に掲げており、CEOとしてサービスを提供する報酬を反映している。
112
2023年12月31日までの年間役員報酬(1)
名前.名前 |
|
賃金·費用 |
|
|
年に1回 |
|
|
効果がある |
|
|
年金.年金 |
|
|
合計する |
|
|||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|
£ |
|
|
£ |
|
|||||
ヒュー·グリフィス |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
役員役員 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
最高経営責任者 |
|
|
573,688 |
|
|
|
339,738 |
|
|
|
3,791 |
|
|
|
57,369 |
|
|
|
974,586 |
|
アンドリュー·ケイ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
取締役会長兼非執行役員 |
|
|
78,774 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
78,774 |
|
マーティン·メリッシュ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
非執行役員 |
|
|
47,852 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
47,852 |
|
アダム·ジョージ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
非執行役員 |
|
|
56,555 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
56,555 |
|
シリル·レパーリエ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
非執行役員 |
|
|
65,080 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
65,080 |
|
エリオト·リヴィ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
非執行役員 |
|
|
54,232 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
54,232 |
|
上級管理職の報酬
私たちの各執行役員と役員の報酬は、基本給、年間ボーナス、個人福祉、年金、401(K)計画からなる。2023年12月31日までの1年間、役員であるか否かにかかわらず、役員に支払われる報酬と実物福祉総額は250万GB。
ボーナス計画
私どもの役員や役員は報酬委員会が適宜決定した年間ボーナスを得る資格があります。ボーナスボーナスは、例年の終了ごとに審査され、どのような奨励金も、個人や会社が年明けに決定した戦略目標の実現状況に基づいて決定される。
113
未償還株式奨励、奨学金、オプション行使
2023年12月31日までに,執行役員および非執行役員に1,986,639株の普通株を購入する選択権を付与した。
|
|
タイプ: |
|
|
|
|
名目上の |
|
|
トレーニングをする |
|
|
最初の日付は |
|
|
|||
名前.名前 |
|
図は(1) |
|
授与する |
|
|
価値がある |
|
|
値段 |
|
|
(2)の練習 |
|
有効期限が満了する |
|||
役員および行政員 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
ヒュー·S·グリフィス |
|
2020長期インセンティブ計画 |
|
|
673,600 |
|
|
£ |
0.04 |
|
|
£ |
1.23 |
|
|
2024年1月11日 |
|
2033年1月11日 |
|
|
2020長期インセンティブ計画 |
|
|
336,800 |
|
|
£ |
0.04 |
|
|
£ |
0.04 |
|
|
2024年1月11日 |
|
2033年1月11日 |
ドナルド·ムニオス |
|
2020長期インセンティブ計画 |
|
|
228,438 |
|
|
£ |
0.04 |
|
|
£ |
1.23 |
|
|
2024年1月11日 |
|
2033年1月11日 |
|
|
2020長期インセンティブ計画 |
|
|
114,219 |
|
|
£ |
0.04 |
|
|
£ |
0.04 |
|
|
2024年1月11日 |
|
2033年1月11日 |
ジェフリー·ブロス |
|
2020長期インセンティブ計画 |
|
|
209,888 |
|
|
£ |
0.04 |
|
|
£ |
1.23 |
|
|
2024年1月11日 |
|
2033年1月11日 |
|
|
2020長期インセンティブ計画 |
|
|
104,944 |
|
|
£ |
0.04 |
|
|
£ |
0.04 |
|
|
2024年1月11日 |
|
2033年1月11日 |
デヴィッド·ハリソン |
|
2020長期インセンティブ計画 |
|
|
100,000 |
|
|
£ |
0.04 |
|
|
£ |
1.23 |
|
|
2024年1月11日 |
|
2033年1月11日 |
|
|
2020長期インセンティブ計画 |
|
|
50,000 |
|
|
£ |
0.04 |
|
|
£ |
0.04 |
|
|
2024年1月11日 |
|
2033年1月11日 |
非執行役員 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
マーティン·メリッシュ |
|
2020長期インセンティブ計画 |
|
|
18,750 |
|
|
£ |
0.04 |
|
|
£ |
1.23 |
|
|
2024年1月11日 |
|
2033年1月11日 |
|
|
2020長期インセンティブ計画 |
|
|
9,375 |
|
|
£ |
0.04 |
|
|
£ |
0.04 |
|
|
2024年1月11日 |
|
2033年1月11日 |
アダム·ジョージ |
|
2020長期インセンティブ計画 |
|
|
9,375 |
|
|
£ |
0.04 |
|
|
£ |
0.04 |
|
|
2024年6月16日 |
|
2033年6月16日 |
|
|
2020長期インセンティブ計画 |
|
|
18,750 |
|
|
£ |
0.04 |
|
|
£ |
0.62 |
|
|
2024年7月12日 |
|
2033年7月12日 |
シリル·レパーリエ |
|
2020長期インセンティブ計画 |
|
|
18,750 |
|
|
£ |
0.04 |
|
|
£ |
1.23 |
|
|
2024年1月11日 |
|
2033年1月11日 |
|
|
2020長期インセンティブ計画 |
|
|
9,375 |
|
|
£ |
0.04 |
|
|
£ |
0.04 |
|
|
2024年1月11日 |
|
2033年1月11日 |
アンドリュー·ケイ |
|
2020長期インセンティブ計画 |
|
|
18,750 |
|
|
£ |
0.04 |
|
|
£ |
1.23 |
|
|
2024年1月11日 |
|
2033年1月11日 |
|
|
2020長期インセンティブ計画 |
|
|
9,375 |
|
|
£ |
0.04 |
|
|
£ |
0.04 |
|
|
2024年1月11日 |
|
2033年1月11日 |
|
|
2020長期インセンティブ計画 |
|
|
28,125 |
|
|
£ |
0.04 |
|
|
£ |
0.04 |
|
|
2024年6月16日 |
|
2033年6月16日 |
エリオト·リヴィ |
|
2020長期インセンティブ計画 |
|
|
9,375 |
|
|
£ |
0.04 |
|
|
£ |
0.04 |
|
|
2024年6月16日 |
|
2033年6月16日 |
|
|
2020長期インセンティブ計画 |
|
|
18,750 |
|
|
£ |
0.04 |
|
|
£ |
0.62 |
|
|
2024年7月12日 |
|
2033年7月12日 |
2023年12月31日現在、私たちの役員と取締役は10097,737株の普通株を購入するオプションを持っています。
私たちは定期的に従業員、役員、コンサルタントに株式オプションを付与し、彼らが私たちの成功を共有し、彼らの利益を私たちの株主の利益と一致させる企業文化を強化することができるようにしています。2023年12月31日までの年度中に、執行役員および非執行役員に1,986,639株の普通株を購入する選択権を付与した。2023年12月31日までの年度内に、746,500株の普通株購入の選択権を非取締役または執行役員29名の従業員·コンサルタントに付与する。
退職金、退職、同様の福祉
当社は2023年12月31日までに、当社とその付属会社が合計93,584英ポンドを貨幣購入計画に出資し、当社の幹部及び取締役に退職金、退職又は類似福祉を提供している。
保険と賠償
2006年に“会社法”が許可された範囲では、私たちの取締役が取締役を務めたために負ったいかなる責任も賠償することが許されました。私たちは、これらの人員が何らかの責任を負うことを確保するために、取締役と上級管理者の保険を維持し、私たちのすべての取締役と上級管理者と賠償契約を締結する予定です。
当社の取締役、行政者、又は前述の条文に基づいて吾等を統制している者が証券法により発生した責任を弁済することができる場合、米国証券取引委員会は、当該等の代償行為が証券法で表現された公共政策に違反するため、強制的に執行することができないと通知されている。
114
持分補償計画
2023年12月31日現在、本項でまとめた4つの株式オプション計画に基づいて、私たちの株を購入するオプションを付与しています。
2009年株式購入計画
2009年8月1日、私たちは、私たちの従業員、コンサルタント、取締役、および私たちの子会社の従業員、コンサルタント、取締役を激励するために、株式購入計画を採択しました。当社の取締役会及び株主はそれぞれ二零一一年十一月十五日、二零一年十一月十七日、二零一七年九月十四日及び二零一七年十月二日に2009年株式購入計画を改訂及び承認します。
2009年の株式オプション計画は、(I)2003年の英国所得税(収入及び年金)法案付表5の条項に基づいて、イギリスで税収割引を受ける可能性のある企業経営陣インセンティブオプション(会社及び引受人が満たす関連条件に依存する)及び(Ii)“未承認”のオプションを付与することを許可する(イギリス税務機関HMRCの“承認”を受けていないため、税金優遇は得られない)。
2023年12月31日まで、私たちは2009年の株式購入計画に基づいて取締役、従業員、コンサルタントに1,032,500株の普通株を購入するオプションを授与した。このうち10,000個のオプションは2023年12月31日までに失効し,1,022,500オプションは2021年に行使された437,500個を含む2023年12月31日までに行使された.2021年に残りの株式購入権を行使した後、2023年12月31日に、2009年に株式購入計画の下で残りの株式購入はなかった。
株式種別。2009年の株式購入計画に基づいて付与された購入権は、購入持分所有者に、特定の行使条件を満たし、免除または加速した場合に普通株を引受する権利を付与する。
条件を鍛える私たちの2009年の株式購入計画に基づいて授与された購入権は、権利を行使する前に満たさなければならない帰属スケジュール、業績目標、あるいはその他の条件に支配される可能性がある。行使条件は当社取締役会が撤回または変更することができますが、いかなる変更も元の行使条件よりも満たすことはできません(当社取締役会は合理的に考えています)。
各オプション付与はオプションプロトコルによって記録される.2009年株式オプション計画が締結したオプション協定の大部分によれば、行使されていないすべてのオプションは、以下の1つまたは複数の場合に行使することができる:(I)発行された株式の一部または全部をイギリス上場管理局の正式リストに上場することを許可し、ロンドン証券取引所上場証券の市場で取引するか、またはロンドン証券取引所の市場AIMで取引するか、または任意の公認投資取引所で取引することができる(1988年収入および会社税法第841条に定義されている)。そして現在は“2010年会社税法”(CTAと略す)第1137節に含まれている。(Ii)制御権の変更;又は.(Iii)当該会社の販売。
買収と会社活動(A)誰か又はグループの一致した行動をした者が会社の支配権(ICTA第840条で定義されているように、現在第995条所得税法又はITAに含まれている)を取得した場合、その結果、(I)会社が発行した株式の50%以上に相当する株式を取得する要約を提出し、その人又はグループを信認する場合には、又は(Ii)全要約買収会社のすべての発行株式(又は会社が発行したすべての普通株)を取得すること。又は(B)1985年会社法第428~430 F条(現在廃止され、2006年“会社法”第974~991条に置き換えられている)に基づいて会社株式を取得する権利又は義務がある。又は(C)1985年“会社法”第425条(現在廃止され、2006年会社法第895~901条に置き換えられている)によれば、イングランド及びウェールズ裁判所は、会社再編又は会社が任意の他の会社と合併する計画又はそれに関連して提案された妥協又は手配として承認され、それぞれの場合、オプション所有者のオプション合意は、そのオプションまたは指定期間内に失効していない任意の部分を随時行使することができることが明確に規定されている。これらのオプションを行使しなければ,これらのオプションは指定された行使期限終了時に失効する.
選択権の欠如。2009年の株式購入計画の規定に従って失効していない場合、2009年の株式購入計画に基づいて付与された株式購入権は午後5時に失効する。この選択権が付与される10周年の前日に。
115
オプション所有者が死亡した場合,その遺産エージェントは,(1)死亡日から満12カ月と(2)午後5時(早い者を基準)の期限内にオプションを行使することができる.オプション付与10周年の前日には,死亡時に任意の行使条件を満たしている範囲に限られている.行使できなければ,故オプション保持者のオプションは無効となる.
賞の調整。もし当社の株に任意の株購入価値に影響を与える変動が発生した場合、当社の取締役会は2009年の株式購入計画の規則に基づいて、各株式購入或いは株購入価格の規定によって制限された株式数及び行権価格或いは株式購入価格に対して取締役会が適切と思う調整を行う。
譲渡可能性。2009年の株式購入計画下の任意の株式購入は、譲渡、譲渡、または任意の押記を生成してはならず、譲渡しようとしたときに直ちに無効になる。
修正案です当社の取締役会は2009年の株式購入計画を改訂することができ、いかなる改正も株式購入者の同意を得ずにその負債を大幅に増加させたり、株式購入項目の下で存続する権利を行使していない価値を大幅に減少させてはならない。
法律の適用または我々の証券が上場する任意の証券取引所の規則が別途要求されない限り、本計画のいかなる改正も、事前にわれわれの株主の承認を得ることなく発効しなければならない。
2012年株式購入計画
二零一二年七月三日、吾らは株式購入計画或いは二零一二年の株式購入計画を採用して、株を購入して当社の従業員及び取締役及び付属会社の従業員及び取締役を激励するために株式を購入する。我々の取締役会と株主はそれぞれ2017年9月14日と2017年10月2日に2012年株式購入計画の改訂と承認を行った。
2012年の株式オプション計画は、(I)英国で税収割引を受ける可能性がある企業経営陣にインセンティブオプションを付与することと、(Ii)“未承認”のオプションを付与することを許可し、英国税務管理委員会の“承認”を受けていないため、税金優遇を受けないことである。
二零二三年十二月三十一日、私たちはすでに二零一二年の株式購入計画に従って取締役と従業員に1,908,935株の普通株を購入するオプションを授与した。このうち、2023年12月31日現在、112,688株購入のオプションが取り消されている。2016年には購入オプション37,500株、2018年には購入オプション42,500件、2020年には購入オプション32,500件、2021年には購入オプション549,999件、2022年には購入オプション139,905件を行使した。2023年に、2012年の株式購入計画に基づいて授与された212,594件のオプションが失効した。残りの781,249株の購入オプションが付与され、行使可能となった。
株式種別。二零一二年の株式購入計画に基づいて授与された株式購入権は、株式購入所有者に特定の行使条件を満たし、免除し、或いは加速した場合に普通株を引受する権利を与える。
条件を鍛える私たちの二零一二年の株式購入計画によって授与された株式購入権は、権利を行使する前に必ず符合或いは放棄しなければならない帰属スケジュール、業績目標或いはその他の条件に支配される可能性があります。行使条件は当社取締役会が撤回または変更することができますが、いかなる変更も元の行使条件よりも満たすことはできません(当社取締役会は合理的に考えています)。各オプション付与はオプションプロトコルによって記録される.
離任条項。正当な理由がなければ解雇され、オプション所有者はオプションを保留し、彼らが会社や子会社の従業員や取締役でなくなったら。オプション所有者が事件により即時解雇された場合、そのオプション保有者の未行使オプションは、直ちに行使を停止し、90日後に失効しなければならない。当社取締役会が当該90日以内に当該オプション保有者が指定された期間内にその全部または一部のオプションを行使することができると決定しない限り。
選択権の欠如。二零一二年の株式購入計画の規定に従って失効していない場合、二零一二年の株式購入計画によって付与された株式購入権は午後五時に無効になります。この選択権が付与される10周年の前日に。
116
オプション所有者が死亡した場合,その遺産エージェントは,(I)死亡日から満12カ月と(Ii)午後5時(早い者を基準)に終了する期間内にオプションを行使することができる.オプション付与10周年の前日には,死亡時に任意の行使条件を満たしている範囲に限られている.行使できなければ,故オプション保持者のオプションは無効となる.
買収と会社活動。(A)誰か又は一致して行動した者団体が当該会社の支配権(ICTA第840条に規定されているように、現在国際投資貿易協定第995条に記載されている)を取得し、その結果、(I)当該会社の発行済み株式の50%以上に相当する株式を要約買収することを提案し、その者又は当該団体が当該会社を制御することを信納する場合、又は(Ii)当該会社の全発行株式(又は当該会社が発行したすべての普通株)を全面的に買収することを提案する。又は(B)1985年会社法第428~430 F条(現在廃止され、2006年“会社法”第974~991条に置き換えられている)に基づいて会社株式を取得する権利又は義務がある。又は(C)1985年“会社法”第425条(現在廃止され、2006年会社法第895~901条に置き換えられている)によれば、イングランド及びウェールズ裁判所は、会社再編又は会社が任意の他の会社と合併する計画又はそれに関連して提案された妥協又は手配として承認され、それぞれの場合、オプション所有者のオプション合意は、そのオプションまたは指定期間内に失効していない任意の部分を随時行使することができることが明確に規定されている。これらのオプションを行使しなければ,これらのオプションは指定された行使期限終了時に失効する.
賞の調整。もし当社の株に何かの株式購入価値に影響を与える変動が発生した場合、当社の取締役会は二零一二年の株式購入計画の規則に基づいて、各株の購入或いは株購入価格に制限された株式数及び行使価格或いは株式購入価格に対して取締役会が適切と思う調整を行う。
譲渡可能性。二零一二年の株式購入計画の下のいかなる購入持分も譲渡、譲渡、あるいはいかなる押記を発生してはならず、譲渡しようとした時に直ちに無効になる。
修正案です。当社の取締役会は二零一二年の株式購入計画を改訂することができるが、いかなる改訂も株式購入者の同意を得ずにその負債を大幅に増加させたり、株式を行使していない項目の存続権利の価値を大幅に減少させてはならない。
法律の適用または我々の証券が上場する任意の証券取引所の規則が別途要求されない限り、本計画のいかなる改正も、事前にわれわれの株主の承認を得ることなく発効しなければならない。
2016年度株式購入計画
2016年1月14日、私たちは、私たちの従業員と取締役および私たちの子会社の従業員および取締役を激励するために、株式購入を許可することを目的とした株式購入計画、すなわち2016年株式購入計画を採択した。2016年の株式オプション計画には、米国で納税されたオプション保有者に対するサブプラン、または2016年の米国サブプランが含まれている。2016年の株式購入計画は、その後、2017年9月14日と2017年10月2日に当社の取締役会と株主によって改訂·承認されます。
2016年株式オプション計画は、2016年の米国二次計画に基づいて、(I)企業経営陣インセンティブオプション、(Ii)“未承認”オプション、および(Iii)奨励株式オプションおよび非適格株式オプションを付与することを許可する。
2023年12月31日現在、私たちは2016年の株式購入計画に基づいて取締役および従業員に5,638,435株の普通株を購入するオプションを付与した。2018年12月31日現在、92,312株を購入するオプションが行使され、2019年には23,437株のオプションが行使された。この計画に従って付与された残りのオプションのうち、2023年12月31日に帰属された4,236,805件のオプションのうち、792,165件は没収またはキャンセルされ、残りの493,716件は帰属されていない。
株式種別。2016年の株式購入計画に基づいて付与された購入権は、特定の行使条件が満たされ、免除または加速された後、株式購入者は普通株を引受する権利がある。
条件を鍛える。私たちの2016年の株式購入計画に基づいて授与された購入権は、権利を行使する前に満たさなければならない帰属スケジュール、業績目標あるいはその他の条件に支配される可能性がある。行使条件は当社取締役会が撤回または変更することができますが、いかなる変更も元の行使条件よりも満たすことはできません(当社取締役会は合理的に考えています)。
各オプション付与はオプションプロトコルによって記録される.2016年の株式購入計画が締結した大部分の株式購入協定の規定によると、すべての帰属していない株式購入権は、以下の場合に直ちに帰属しなければならない:買収と
117
以下の会社の事件が発生した後、株式購入所有者(I)は依然としてこの計画の合資格従業員である;及び(Ii)授出日に対応する基本的な給与は大幅に減少し、或いは権力、職責、報告或いは責任の面で重大な変化或いは減少を経験する。
離任条項。オプション所有者が様々な特定の原因(健康不良、退職を含む、付属会社または一部の業務を第三者に売却する、またはその雇用/取締役職務が詐欺または深刻な不正行為によって即時解雇されるわけではない)によって、もはやその会社または付属会社の従業員または取締役ではない場合、オプション所有者は、雇用/取締役職を終了する際に任意の行使条件に適合する範囲内でのみ、雇用/取締役職を終了した日から12ヶ月以内にそのオプションを行使することができる。オプションのいずれかの部分は、オプション所有者がその雇用/役員職を終了したときに、関連する行使条件がまだ満たされていない場合、その部分は無効となる。
選択権の欠如。2016年の株式購入計画の規定に従って失効していない場合、2016年の株式購入計画に基づいて付与された株式購入権は午後5時に失効する。この選択権が付与される10周年の前日に。
オプション所有者が死亡した場合,その遺産エージェントは,(I)死亡日から満12カ月と(Ii)午後5時(早い者を基準)に終了する期間内にオプションを行使することができる.オプション付与10周年の前日には,死亡時に任意の行使条件を満たしている範囲に限られている.行使できなければ,故オプション保持者のオプションは無効となる.
買収と会社活動。(A)誰か又は一致して行動した者団体が当該会社の支配権(ICTA第840条に規定されているように、現在国際投資貿易協定第995条に記載されている)を取得し、その結果、(I)当該会社の発行済み株式の50%以上に相当する株式を要約買収することを提案し、その者又は当該団体が当該会社を制御することを信納する場合、又は(Ii)当該会社の全発行株式(又は当該会社が発行したすべての普通株)を全面的に買収することを提案する。又は(B)任意の者が2006年会社法第974~991条に基づいて会社の株式を買収する権利又は義務となった者、又は(C)2006年会社法第895~901条に基づいて、イングランド及びウェールズ裁判所は、会社再編計画又は任意の他の会社と合併する計画又はその計画に関連して提出された妥協又は手配として認められており、いずれの場合も、購入持分者の株式購入契約明文に基づいて、購入持分者は、指定された期間内に失効していない株式購入権又はその任意の部分を随時行使することができる。これらのオプションを行使しなければ,これらのオプションは指定された行使期限終了時に失効する.
賞の調整。もし当社の株に任意の株購入価値に影響を与える変動が発生した場合、当社の取締役会は2016年の株式購入計画の規則に基づいて、各株の購入或いは株購入価格に制限された株式数及び行使価格或いは株購入価格に対して取締役会が適切と思う調整を行う。
譲渡可能性。二零一六年の株式購入計画の下のいかなる購入持分も譲渡、譲渡、又はいかなる押記を発生してはならず、譲渡しようとした時に直ちに無効になる。
修正案です。当社の取締役会は2016年の株式購入計画を改訂することができるが、いかなる改正も株式購入者の同意を得ずにその負債を大幅に増加させたり、株式購入項目の下で存続する権利を行使していない価値を大幅に減少させてはならない。
法律の適用または我々の証券が上場する任意の証券取引所の規則が別途要求されない限り、本計画のいかなる改正も、事前にわれわれの株主の承認を得ることなく発効しなければならない。
2016年アメリカサブプロジェクト
2016年の米国サブプランは、米国連邦所得税を納付しなければならない被贈与者に適用される。2016年の米国二次計画では、米国の被贈与者に付与されたオプションは、米国国税法第422条に規定された奨励的株式オプションまたは非限定的株式オプションとなると規定されている。以下に述べるいくつかの刺激的株式オプションを除いて、オプションの発行価格は、付与日関連株の公平時価の100%を下回らなければならない。付与日から10年以内に行使されていない奨励株式オプションが満期になり、私たちの10%を超える投票権を持つ人に付与される奨励的株式オプションが付与日から5年以内に満期になり、発行日関連株の公平な市場価値の110%に少なくとも等しくなければならない。二零一六年の株式購入計画によると、奨励株を購入することができる株式の数は5,008,284株の普通株を超えてはならないが、二零一六年の株式購入計画による資本変動によるいかなる適用調整所の制限を受けなければならない。米国連邦所得税を納付しなければならない被贈与者については、2016年株式オプション計画、2016年米国サブ計画、およびこれらの計画に基づいて発表されたすべてのオプションは、米国国税法第409 a条の規定を遵守または免除することを目的としており、それに応じた解釈を行う。任意のオプションが国税法第409 a条の制約を受けている場合、私たちの取締役会または私たちの総法律顧問は、2016年の株式オプションの改正を自ら決定することができます
118
当社又は当社の取締役会又は我々の法律総顧問は、2016年度株式購入計画、2016年度米国二次計画又は任意のオプションを米国国税法第409 a条の制約を受けず、当該等オプションの予想税務処理を保持し、又は米国国税法第409 a条の要求を遵守し、又は適切な政策及び手続をとるか、その他の適切な行動をとるための適切な他の措置をとると考えている。
2020長期インセンティブ計画(2020 LTIP)
2020年6月25日、私たちは、従業員、取締役、コンサルタント、および私たちの子会社の従業員、取締役、コンサルタントを奨励するために、株式オプションを付与することを可能にすることを目的とした株式オプション計画、すなわち2020 LTIPを採択した。
2020年の長期投資協定は、普通株式または米国預託株式に関連するオプションまたは条件付き奨励を付与することを可能にし、オプションについては、(1)“通常オプション”;(2)“短期オプション”、または(3)“米国預託株式式オプション”のいずれかを付与することを可能にする。帰属条件が満たされた場合,RSU式オプションとして付与されたオプションは自動的に行使される.
2023年12月31日現在、私たちは2020年のLTIPに基づいて普通株式を購入するために、取締役、従業員、コンサルタントに8,363,982件の一般オプションと674,942件のRSU式オプションを付与した。2021年12月31日現在で27,440件の購入オプションが行使され,2022年には79,315件の購入オプションが行使され,2023年には102,957件が行使された。この計画に従って付与された残りのオプションのうち、2023年12月31日に帰属する2,558,601個のオプションのうち、339,760個は没収またはキャンセルされ、残りの5,930,851個は帰属されていない。
株式種別。2020 LTIPに付与されたオプションにより、特定の行使条件が満たされ、免除または加速された場合、オプション所有者は普通株を承認する権利がある。
現金代替品です2020 LTIPにより付与されたオプションは、普通株権利を承認する代替案として現金で決済することができる。現金で決済するかどうかの決定は報酬委員会の決定に持ち越される。
条件を鍛える。私たち2020 LTIPによって付与されたオプションは、発行前に満たされなければならない、または放棄されなければならないホームスケジュール、業績目標、または他の条件で付与される可能性があります。行使条件は当社取締役会が撤回または変更することができますが、いかなる変更も元の行使条件よりも満たすことはできません(当社取締役会は合理的に考えています)。
各オプション付与はオプションプロトコルによって記録される.2020 LTIPが締結したオプション協定の大部分によれば、すべての未帰属オプションは、以下の買収および会社イベントのうちの1つに直ちに帰属した後、オプション所有者(I)は依然としてこの計画の適格社員であり、(Ii)付与日に支払われるべき基本的な報酬は大幅に減少するか、または認可、職責、報告、または責任に関して重大な変化または減少を経験すべきである。
離任条項。オプション所有者が様々な特定の原因(健康状態の不良、退職、付属会社または一部の業務を第三者に売却すること、またはその雇用/取締役職務が詐欺または深刻な不正行為によって即時解雇されるわけではない)によって即時解雇された場合、当該オプション保持者は、その雇用/取締役職を終了する際に任意の行使条件に適合した範囲内でのみ、雇用/取締役職を終了した日から12ヶ月以内にそのオプションを行使することができる。オプションのいずれかの部分は、オプション所有者がその雇用/役員職を終了したときに、関連する行使条件がまだ満たされていない場合、その部分は無効となる。
選択権の欠如。2020年長期譲渡価格協定の規定に従って失効しなければ、2020年長期譲渡価格協定により付与された選択権は午後5時に失効する。この選択権が付与される10周年の前日に。
オプション所有者が死亡した場合,その遺産エージェントは,(I)死亡日から満12カ月と(Ii)午後5時(早い者を基準)に終了する期間内にオプションを行使することができる.オプション付与10周年の前日には,死亡時に任意の行使条件を満たしている範囲に限られている.行使できなければ,故オプション保持者のオプションは無効となる.
買収と会社活動。(A)誰か又は一致して行動した者団体が当該会社の支配権(ICTA第840条に規定されているように、現在国際投資貿易協定第995条に記載されている)を取得し、その結果、(I)当該会社の発行済み株式の50%以上に相当する株式を要約買収することを提案し、その者又は当該団体が当該会社を制御することを信納する場合、又は(Ii)当該会社の全発行株式(又は当該会社が発行したすべての普通株)を全面的に買収することを提案する。又は(B)会社法第974条から第991条のいずれかに基づいて当該会社の株式を取得する権利又は義務がある者;又は(C)第895条に基づいて
119
2006年会社法901条によれば、イングランド及びウェールズ裁判所は、会社再編又は会社が任意の他の会社と合併する計画又はそれに関連して提案された妥協又は手配を承認し、それぞれの場合、オプション所有者のオプション協定は、オプション所有者が指定された期間内に失効していないオプションまたはその任意の部分を任意の時間に行使することができることを明確に規定する。これらのオプションを行使しなければ,これらのオプションは指定された行使期限終了時に失効する.
賞の調整。もし当社の株がいかなる株購入価値に影響する変動が発生した場合、当社の取締役会は2020 LTIP規則に基づいて、各株式購入或いは株式購入価格に制限された株式数及び行権価格に対して当社が適切と思われる調整を行う。
譲渡可能性。2020 LTIPでのオプションは、譲渡、譲渡、または任意の費用が発生することができません。そうしようとすると、すぐに無効になります。
修正案です。当社取締役会は2020 LTIPを改訂することができますが、いかなる改正もオプション所有者の同意なしにその負債を大幅に増加させたり、オプションを行使していない場合の存続権利の価値を大幅に減少させたりすることはできません。
法律の適用または我々の証券が上場する任意の証券取引所の規則が別途要求されない限り、本計画のいかなる改正も、事前にわれわれの株主の承認を得ることなく発効しなければならない。
2020年会社株式オプション計画(2020 CSOP)
2020年6月25日、私たちは株式オプション計画、すなわち2020年CSOPを採択した。CSOPは,2003年の所得税(収入と年金)法案付表4に基づいて会社株式オプション計画に基づいてオプションを付与するオプション計画であり,オプション所有者に何らかの税収割引を提供している。私たちは税金優遇のEMIオプション計画規則に適合しなくなったが、CSOP計画の資格を満たす。CSOP計画は税収優遇の面でほぼ似ているが、奨励数量の面ではより限られている。CSOP下の寄付金はイギリスの納税者たちにのみ適用されるだろう。2023年12月31日現在、私たちは2020年CSOP下のいかなるオプションも付与していない。
要点:
120
従業員福祉信託基金
二零一一年十二月十九日に、私たちは信託契約書或いは従業員福祉信託の条項に基づいて適宜従業員福祉信託を設立して、私たちの株式購入計画に合わせて運営します。従業員福祉信託の受益者は、我々の従業員および元従業員(執行役員を含む)とその配偶者、民事パートナー、生きている配偶者および民事パートナー、子供、および18歳以下の継子である。従業員福祉信託の受託者は、NuCana BioMed Trust Company Limited、または受託者、すなわち我々の完全子会社である。2023年12月31日まで、受託者は信託契約書の条項に基づいて信託形式で500,000株の普通株を保有し、私たちの3つの株式購入計画の条項に基づいて、受託者の選択の下で、これらの普通株は私たちの株式購入計画下での奨励を支払うために使用することができる。信託契約書の条項によると、私たちが別途指示がない限り、受託者は、受託者が全実益権益を保有する信託基金に保有する任意の株式の投票権を株主総会で放棄しなければならない。
払戻政策
2023年12月1日、当社取締役会は、当社が取引所法案に基づいて米国証券取引委員会に提出した任意の財務諸表が再記述を要求された場合に、以前に発表された財務諸表に重大な意味を有する誤りを訂正するために、自社の現職および前任幹部に何らかのインセンティブに基づく報酬を取り戻すことを規定している。取引所法案規則10 D-1に基づいて発売された新ナスダック上場基準に基づいて払戻政策を強制的に採用する。回収政策は、2002年のサバンズ-オキシリー法案第304条の補足であり、米国証券取引委員会が登録発行者の最高経営責任者および最高経営責任者が任意の財務諸表を提出してから1年以内に稼いだボーナスとインセンティブに基づく報酬の返還を命令することを許可し、発行者が不適切な行為によりその財務諸表を再報告し、これらの資金を発行者に返済しなければならない。現在、返却ポリシーのコピーを添付ファイル97.1アーカイブとして保存します。
C.取締役会P軸.軸
取締役会構成と取締役独立性
私たちの業務は取締役会の指導の下で管理されており、取締役会は現在7人のメンバーで構成されている。ナスダックの規則や条例によると、私たちの取締役会が彼または彼女が私たちと実質的な関係がないと肯定的に判断すれば(私たちと関係のある組織のパートナー、株主または上級管理者として)取締役は“独立した”と呼ぶ資格がある。私たちの取締役会は、取締役にこのような実質的な関係があるかどうかを決定するためのガイドラインを策定しました。私たちの大量の株式を所有すること自体は実質的な関係にはならない。
ナスダック規則によると、私たちが雇っている役員は“独立した役員”とみなされてはいけないため、ヒュー·グリフィスは独立役員の資格を満たしていない。
私たちの取締役会は私たちのすべての役員と私たちとの間の任意の直接的または間接的な関係の重要性を検討しました。今回の審査に基づき、我々の取締役会は、以下の取締役がナスダック適用規則と条例で定義された“独立取締役”と決定した:マーティン·メリッシュ、アダム·ジョージ、シリル·レパーリエ、バリ島·ムラリダール、エリオト·リヴィ、アンドリュー·ケイ。
役員および行政職の任期
私たちの上級管理職は取締役会が選択し、取締役会が適宜決定します。私たちの取締役会は3つのレベルに分かれており、各レベルのメンバーは3年間交互に在任している。取締役の各任期についての説明は,本年度報告における“会社定款大綱−取締役−分類取締役会”を参照されたい。
当社と当社取締役会のどのメンバーとの間には何の手配や了解もなく、そのサービスを終了する際の利益については何の規定もありません。
取締役会委員会と会社管理
一部の例外を除いて、ナスダックの規則は、ナスダックの上場要求ではなく、外国の個人発行者が自国のやり方に従うことを許可する。
私たちの取締役会の委員会は監査委員会、報酬委員会、指名委員会、開発委員会で構成されている。母国の慣例によると、私たちの給与と指名委員会は非独立役員を含むことができる。このような委員会のすべては次に説明する義務を持っている。私たちの取締役会はまた時々他の委員会を設立して、その義務の履行を支援することができる。
121
監査委員会
私たちの監査委員会のメンバーは現在私たちの3人の非執行役員、アダム·ジョージ、マーティン·メリシュ、シリル·レパーリエです。これらのメンバの各々は“独立した取締役”であり,この用語は“取引法”の下のルール10 A-3で定義されている.ジョージさんは監査委員会の議長を務めた。取締役会はすでに決定しており、ジョージさんは金融専門家であり、2002年のサバンズ·オキシリー法案第407条米国証券取引委員会実施規則の規定に適合する。我々の監査委員会は、毎年少なくとも4回の会議を開催し、我々の内部統制、会計政策及び財務報告の監督を監督し、外部監査人及び独立公認会計士事務所報告のためのフォーラムを提供する。私たちの監査委員会は、執行取締役会メンバーが出席することなく、少なくとも外部監査人と私たちの独立公認会計士事務所との会議を毎年開催しています。監査委員会はまた、彼らの任命、再任命または罷免、および彼らの客観性と独立性を監督することを含む、外部監査役と私たちの独立公認会計士事務所の活動を監督する責任がある。監査委員会はまた、外部監査人及び独立公認会計士事務所に支払われる費用を審査·承認し、個別であっても全体的であっても、監査費用の水準に対して適切であるか否かを判断し、独立性を損なわないように非監査サービスの費用水準を決定する。
報酬委員会
報酬委員会のメンバーは私たちの2人の非執行役員、バリ·ムラリダールとエリオット·リヴィだ。これらの非執行役員会員の各々は、取引所法案第166-3条に規定する非従業員取締役及び1986年に改正された“国税法”第162条(M)条に規定する外部取締役である。ムラリダル博士は報酬委員会の議長を務めている。他の事項を除いて、私たちの給与委員会は行政員の表現を検討し、株主の利益を十分に考慮して、彼らの報酬レベルと構造、そして彼らのサービス合意基盤を決定します。報酬委員会の政策は、どの個人もそれ自身の報酬に関する議論や決定に参加しないということだ。
指名と統治委員会
指名·統治委員会のメンバーはヒュー·グリフィスと私たちの2人の非執行役員アンドリュー·ケイとバリ·ミュラリダールだ。アンドリュー·ケイは指名と統治委員会の議長を務め、取締役会のパフォーマンスの評価を監督した。指名と管理委員会は毎年少なくとも2回の会議を開催し、取締役会の構造、規模と構成を審査し、取締役の選抜と任命過程を監督し、任意の変動について取締役会に提案を提出し、そして適切と思われる場合に外部ヘッドハンティング顧問を招聘する。新たな任命については、指名·統治委員会が取締役会に最終推薦を行い、取締役会は任命を承認する前に候補者に会う機会がある。任命されると、指名·管理委員会は、新役員の勤務を監督し、1年間に取締役会に適切な訓練を提供し、効率的な運営に必要な知識や技能を確保する。指名と管理委員会はまた、個人と取締役会全体の業績を含む毎年取締役会の業績を評価し、出席率記録、取締役会会議期間の貢献、1年間の取締役会事務に特化した時間などの要素を考慮する。
発展委員会
開発委員会のメンバーは我々の2人の非執行役員,Elliott LevyとCyrile Leperlierである。レパーリエ博士は開発委員会の議長を務めている。発展委員会は毎年少なくとも2回の会議を開催し、会社のパイプと製品研究開発における戦略方向と投資について取締役会に審査と提案を提供する。開発委員会の政策は、委員会の大多数のメンバーは独立した非従業員取締役でなければならず、メンバー資格に必要な独立性基準を除いて、このような利益が発生すると、すべてのメンバーは開発委員会が知っている任意の個人財務利益を開示しなければならない。
ビジネス行為と道徳的基準
私たちは“商業行為と道徳基準”を採択し、利益衝突、コンプライアンス問題、他の会社の政策、例えば機会平等と無差別基準の処理を含む幅広い事項をカバーしている。
122
取締役会の多様性
次の表は、本年度報告日までの取締役会の多様性に関するいくつかの情報を提供します。
取締役会多元化行列(2024年3月1日現在) |
||||||||
役員総数 |
|
7 |
||||||
|
|
女性は |
|
男性 |
|
非バイナリ |
|
ありません 開示する 性別 |
第1部:性別同意 |
||||||||
役員.取締役 |
|
- |
|
7 |
|
- |
|
- |
第2部:人口統計的背景 |
||||||||
アフリカ系アメリカ人や黒人 |
|
- |
|
- |
|
- |
|
- |
アラスカ原住民あるいは原住民 |
|
- |
|
- |
|
- |
|
- |
アジア人 |
|
- |
|
1 |
|
- |
|
- |
スペイン系やラテン系 |
|
- |
|
- |
|
- |
|
- |
ハワイ先住民や太平洋島民 |
|
- |
|
- |
|
- |
|
- |
白 |
|
- |
|
6 |
|
- |
|
- |
2つ以上の人種や民族 |
|
- |
|
- |
|
- |
|
- |
LGBTQ+ |
|
|
|
|
|
- |
|
|
人口統計の背景は明らかにされていない |
|
|
|
|
|
- |
|
|
D.Emplo賛成する
2021年、2022年、2023年12月31日までの財政年度末まで、職能と地理的位置別の従業員数は以下の通り
|
|
十二月三十一日 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
機能別: |
|
|
|
|
|
|
|
|
|
|||
研究開発 |
|
22 |
|
|
25 |
|
|
27 |
|
|||
管理と行政 |
|
6 |
|
|
6 |
|
|
6 |
|
|||
合計する |
|
|
28 |
|
|
|
31 |
|
|
|
33 |
|
地理的な位置によって分けられます |
|
|
|
|
|
|
|
|
|
|||
イギリス.イギリス |
|
26 |
|
|
29 |
|
|
30 |
|
|||
北米.北米 |
|
2 |
|
|
2 |
|
|
3 |
|
|||
合計する |
|
|
28 |
|
|
|
31 |
|
|
|
33 |
|
2023年12月31日現在、私たちは25人のフルタイム従業員と3人のアルバイト従業員がいます。私たちは一度も労働を停止したことがなく、私たちの従業員は一人も集団交渉協定によって保護されていないし、労働組合の代表者も一人もいない。私たちは私たちの従業員が仲がいいと信じている。
当社役員および役員の株式所有権に関する情報は、“6.B-報酬”および“7.A-大株主”を参照されたい
F.開示登録者が誤って判決された賠償を取り戻す行動
追跡政策に関する情報は、“第6.B項--賠償”を参照されたい
123
以下の表と関連する脚注には、2023年12月31日までの普通株式の実益所有権情報が記載されています
米国証券取引委員会の規則と規定に基づいて受益権属を決定する。ある人が所有する普通株式の数とその人の所有権のパーセンテージを計算する際に、私たちは、任意のオプションの行使、株式承認証、または他の権利の転換、または任意の他の証券を含む、2023年12月31日から60日以内に取得する権利を有する株式を計算している。しかし、このような普通株は他のいかなる人の持株率にも計上されていないが、全体としてすべての取締役会メンバーと行政人員の持株率を計算するのは除外する。私たちの株式登録簿と私たちの一部の株主が私たちに提供した他の情報によると、2023年12月31日まで、一人のアメリカ記録保有者が154,760株の普通株を持っていて、私たちが発行した普通株の0.29%を占めている。
別に説明しない限り,次の表中の各株主のアドレスはC/o NuCana plc,3 Lochside Way,EH 12 9 DT,UKである.
|
|
普通株 有益な (1)を持つ |
|
|||||
実益所有者の氏名または名称 |
|
番号をつける |
|
|
パーセント |
|
||
5%以上の株主 |
|
|
|
|
|
|
|
|
Sofinnova Investmentsに関連するエンティティ(2) |
|
|
7,084,120 |
|
|
13.4 |
|
|
Sofinnova Capital VI FCPR(3) |
|
|
4,978,993 |
|
|
9.4 |
|
|
ベイリー·ギフォード社 |
|
|
3,659,030 |
|
|
6.9 |
|
|
クレイグループやAbingworth LLPに関連するエンティティ(5) |
|
|
3,333,333 |
|
|
6.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
任命された行政員と役員 |
|
|
|
|
|
|
|
|
ヒュー·グリフィス(6) |
|
|
5,800,484 |
|
|
11.0 |
|
|
ドナルド·ムニオス(7) |
|
|
1,342,098 |
|
|
2.5 |
|
|
バリ島ムラリダール(8) |
|
|
3,396,199 |
|
|
6.4 |
|
|
マーティン·メリッシュ(9) |
|
|
175,658 |
|
|
* |
|
|
エリオト·リヴィ(10点) |
|
|
59,063 |
|
|
* |
|
|
アダム·ジョージ(11歳) |
|
|
151,374 |
|
|
* |
|
|
シリル·レパーリエ(12) |
|
|
158,409 |
|
|
* |
|
|
アンドリュー·ケイ(13歳) |
|
|
171,095 |
|
|
* |
|
|
ジェフリー·ブロス(14歳) |
|
|
252,572 |
|
|
* |
|
|
デイビッド·ハリソン(15歳) |
|
|
192,500 |
|
|
* |
|
|
私たちのすべての現執行幹事と役員は、団体(10人)として |
|
|
11,699,452 |
|
|
|
22.1 |
% |
*実益は、当社の普通株式の1%未満を保有していることを示します。
124
125
我々の知る限り、上の表、米国証券取引委員会に提出された他の文書、本年度報告を除いて、2021年1月1日以降、いずれの大株主が保有する株式比率にも大きな変化はない。
上記の主要株主はその普通株に対して投票権を持っておらず、当社の普通株の他の所有者の投票権とは異なる。
以下は、2021年1月1日以降、任意の取締役会メンバーまたは役員、または当社の株式を5%以上保有している者との関連先取引について説明する。
私たちの執行者や役員との合意
私たちはそれぞれの幹部とサービス協定を締結しました。具体的には、ヒュー·グリフィス、ドナルド·ムニオス、David·ハリソンは2017年、ジェフリー·ブロスは2021年に設立されました。
賠償協定
私たちは私たちのすべての役員と上級管理職と賠償契約を結びました。“管理-補償-保険と賠償”を参照してください
Abingworth LLP付属会社との合意
我々は以前,一般授業でCFGI,LLCまたはCFGIと金融コンサルティングサービス契約を締結し,Curia Global,Inc.(旧オルバニ分子研究会社)やCuriaと契約研究·製造サービス契約を締結してきた.この両社は現在、クレイグループ(Carlyle Group Inc.)の所有である。その後に
126
このような契約を締結した後、ケリーは2022年8月にAbingworth LLPを買収し、後者はNuCanaの5%を超える株主であり、私たちの非執行役員の一人であるバリミュラリダルの付属会社でもある。
関連者取引政策
私たちは、取引法に基づいて外国の個人発行者に開示を要求するすべての関連者取引が、監査委員会または我々の取締役会の他の独立機関の承認を受けなければならないことを要求する関連者取引政策をとった。
C.元従業員の利益PERTSと弁護士
適用されません。
127
プロジェクト8財務L情報
A.統合レポートとDその他財務情報
“プロジェクト18.財務諸表”を参照
配当政策
私たちは配当金を発表したり支払ったりしたことがなく、私たちは予測可能な未来にも配当金を発表したり支払わないと予想している。私たちはすべての利用可能な資金と未来のどんな収益も残し、私たちの業務の発展と拡張に資金を提供するつもりだ。
イギリスの法律によると、私たちが十分な分配準備金(非合併ベース)を持っている場合にのみ、配当金を支払うことができます。分配準備金は、私たちが以前に分配または資本化されていなかった累積達成利益から私たちが累積した達成損失を引いたものであり、これらの損失が以前に資本減少や再編で解約されなかった限りです。
B.意味があるNT変更
2023年12月31日以降の任意の重大な変化は、本年度報告書の他の部分に含まれる総合財務諸表の付記20に開示される。
第9項:非執行役員Rと発売
A.OfferとLi細かいところに突き刺さる
これらのアメリカ預託証明書は2017年10月2日からナスダック全世界の精選市場に上場し、取引コードはNCNAである。2023年11月9日、上場先をナスダック資本市場に移します。
B.発展計画分布
適用されません。
C.Ma市場
これらのアメリカ預託証明書は2017年10月2日からナスダック全世界の精選市場に上場し、取引コードはNCNAである。2023年11月9日、上場先をナスダック資本市場に移します。
適用されません。
E.DilUT
適用されません。
F.支出この問題では
適用されません。
プロジェクト10.追加NAL情報
適用されません。
B.メモとArti定款細則を組織する
当社の定款コピーは添付ファイル1.1として本年度報告書の後に添付されています。
一般情報
当社は1997年1月28日にイングランドおよびウェルズに登録設立され、登録名はBIOMED(UK)Limited、プライベート株式会社、会社番号は03308778。
128
2008年4月28日、私たちはNuCana BioMed Limitedと改名した。2017年8月29日、上場株式会社に再登録し、NuCana plcと改称しました。この再登録には、私たちの株主が特別決議を採択し、公共有限会社への再登録を承認し、NuCana plcと改名し、私たちの組織規約をいくつか修正する必要があります。
私たちの登録事務所は77/78カン農街、ロンドン、EC 4 N 6 AF、イギリスにあります。私たちが株式を運営して発行する主な法律は2006年の“会社法”だ。
発行済み株
2023年12月31日現在、私たちの発行済み株はGB 2,114,413であり、52,860,335株のGB 0.04株当たりの普通株に分けられる。我々の登録成立以来,我々が発行した株式の増加と変化の要約は以下のとおりである.
登録成立後、私たちはそれぞれロンドン法律サービス有限会社とロンドン法律秘書有限会社にそれぞれ4分の1普通株1株4.00 GBを発行した。
2008年3月20日、著者らは1株当たり額面4.00の発行済み普通株を1株額面0.04の50株普通株に細分し、残りの1株額面0.04の普通株を1株額面0.04の普通株2,450株に分割した。また、1株当たり額面0.04 GBの12,497,500株の新しい普通株を発行することにより、我々の法定株式はGB 100からGB 500,000に増加した。2008年3月20日、私たちは4,499,950株の普通株を発行し、1株当たり額面0.04 GBを発行した。
2008年7月27日、私たちはまた20万株の普通株を発行し、1株当たり額面0.04 GB。
2009年8月20日、私たちは35万株の普通株を発行し、1株当たり額面0.04 GB。
2000年12月18日、当社は1株当たり0.04 GBの普通株1,816,976株を発行した(うち500,000株は発行可能で、以前は1人の株主に発行されていたが、その後1人の株主が提出した)。
2010年12月14日、私たちは1株当たり0.04 GBの普通株1,566,359株を発行した。
2011年11月24日、私たちは7,483,334株のAシリーズ転換参加株式を発行し、1株当たり額面0.04 GB。
2012年3月28日、私たちは222,222株の普通株を発行し、1株当たり額面0.04 GB。
2014年3月31日、私たちは8,462,500株のBシリーズ転換参加株を発行し、1株当たり額面0.004 GB。
二零一六年十一月三十日に、二零一二年の株式購入計画に基づいて株式を購入し、当社は37,500株の1株当たり額面0.04英ポンドの普通株を発行した。
二零一六年十二月三十一日、二零一六年の株式購入計画に基づいて株式を購入し、当社は45,750株の1株当たり額面0.04英ポンドの普通株を発行した。
二零一七年八月十七日に、二零一六年の株式購入計画に基づいて株式を購入し、当社は30,000株を発行し、1株当たり額面0.04英ポンドの普通株を発行する。
2017年9月14日、私たちは4株1株の逆分割と関連する優先配当分配、すなわち3株普通株と5株Aシリーズ転換参加株を完成させ、断片的な権利を除去した。本年度報告書で言及された4株交換逆分割には、関連する配当分配が含まれている。上記株式数および額面は、前述の株式の逆分割を反映するように調整されている(株式名義部分を参照し、いくつかの株式数が四捨五入されていることになる)。したがって、これらの株式番号及び額面は、例えば、私たちの法定登録簿又は私たちがイギリス会社登録所に提出した書類のうち、関連時間に作成された記録を表すものではない。
2017年10月2日、初公募が終了する前に、発行されたすべてのAシリーズ転換参加株、Bシリーズ転換参加株、方正普通株1株、方正普通株2株を1対1で普通株に変換した。Bシリーズ1株あたりの転換参加株式(1株当たり0.004 GB)を直ちに普通株式(1株当たり0.04 GB)に変換することを容易にするために、
129
これに先立ち、2017年10月2日に、Bシリーズ転換参加株式を保有する毎に、Bシリーズ転換参加株式所有者に9株のBシリーズ転換参加株式を追加配布した。
2017年10月2日、初公募株(IPO)に基づいて7596,505株の普通株を発行した。
2018年、私たちは株式購入権の行使に基づいて415,312株の普通株を発行した。
2019年、私たちは株式購入権行使に基づいて252,187株の普通株を発行した。
2020年9月21日、私たちの後続公開発行により、私たちは17,888,889株の普通株を発行した。
2020年には、我々の“市場で”(ATM)販売協定に基づいて774,511株の普通株を発行した。
2020年以内に、私たちは購入株式の行使に基づいて32,500株の普通株を発行した。
2021年に、私たちは株購入権の行使に基づいて1,005,434株の普通株を発行した。
2022年に、私たちは株式購入権の行使に基づいて192,908株の普通株を発行した。
2023年には、我々の“市価別”(ATM)販売協定に基づいて408,015株の普通株を発行し、購入株式の行使に基づいて79,433株の普通株を発行した。
普通株
2023年12月31日まで、私たちは52,860,335株の普通株を発行し、1株当たり額面0.04 GBを発行した。発行された普通株1株当たり全額支払われました。
普通株保有者は、株主投票投票を提出するすべての事項において、登録されている株式を1株保有するごとに、1票を投じる権利があるが、累積投票権はない。
当社の清算、解散又は清算のために行われた任意の分配及び発表された任意の配当金は、持分普通株の数に比例して分配される。
登録権
吾等は登録権協定を締結しており、当該合意に基づいて、吾等は、既存株主が保有する普通株の転売の一部を登録し、当該等株式の指定公開発売において協力するために、特定の場合に登録声明を提出することに同意している。これらの権利は以下のとおりである.
登録権を請求するそれは.フォームF−3レジストリを使用する資格がある任意のときに、その時点で償還されていない登録可能証券の保有者の少なくとも25%が、そのような登録可能証券に関するフォームF−3レジストリを提出することを要求する権利がある。これらの登録権利は、ある場合、そのような登録に含まれる株式の数を特定の場合に制限する権利を含む、特定の条件および制限された制約を受ける。この要求をする時、私たちはこの登録を達成するために商業的に合理的な努力をしなければならない。
会社登録それは.私たちが証券法に従って私たちの任意の持分証券を登録することを提案する場合、特定の登録に関連するものではなく、当社の従業員持分インセンティブ計画のみに関連する登録を含むか、または私たちのいくつかの業務の組み合わせまたは合併にのみ関連する登録を含む場合、これらの登録すべき証券の所有者は、そのような登録通知を得る権利があり、その普通株を登録に組み込む権利がある。場合によっては、引受業者(ある場合)は、そのような任意の登録に含まれる普通株式数を制限することができる。
登録権の終了それは.登録権協定により付与された登録権は、(I)当社の初公開発売完了5周年及び(Ii)登録権協定により証券を登録する必要がない日(早い者を基準とする)で終了する。
130
“会社規約”
以下はわが社規約のいくつかの規定の概要である。これはただの要約であり、余すところなく詳細ではないということに注意してください。より多くの情報を知るためには、本年度報告の添付ファイルとして、当社の組織規約の完全バージョンを参照してください。
株式とそれに付属する権利は
将軍。すべての普通株式は様々な側面で同等の権利と同等の地位を持っている。2006年の会社法及びその他の関連法例条文の規定の下で、当社取締役会は時々株主が取締役に株式を配布することを許可する一般決議案に基づいて株式を配布及び発行することができる(及び適用が適用され、適用が終了していない優先購入権を解除する特別決議案)。
吾等の株式は、配当金、資本リターン、投票権又はその他に関連する権利又は制限にかかわらず、任意の優先、繰延、留保又は他の特別な権利又は制限を伴うか、又は添付することができ、当社の組織規約の細則に記載されているか、又は株主が通常の決議案で決定されるようにすることができる(又は株主がこのように決定していない場合は、当社取締役会によって決定される)。
投票権。当社組織定款細則の他の条文の規定の下、及び当社の株式を構成する任意の株式に付随する投票に関するいかなる特別な権利、特権又は制限を損なうことなく、株主の投票権は以下のとおりである。投票を要求しない限り、株主は手を挙げてすべての決議案を投票しなければならない。当社の組織定款細則は、以下の挙手投票結果の前又は投票結果を発表する際に、(A)株主総会議長、(B)会議に出席し、投票権を有する少なくとも5人の株主、又は(C)会議に出席するいずれか1人以上の株主、その代表投票権が総投票権の10%以上であるか、又は議決権を有するすべての議決権株式の総額の10%以上を代表することができると規定している。このような目的については、株主が自ら、代表を派遣して会議に出席する場合、あるいは株主が会社(定義は2006年会社法参照)であれば、正式な許可代表が会議に出席する。
手を挙げて投票する時、直接出席したすべての株主と正式に許可されたすべての代表は投票権を持っている。挙手採決では,1人または複数の株主が正式に委任された個々の代表が1票であったが,1人以上の株主が代表に決議案投票を指示し,異なる方法でその決議案について投票するよう指示された場合,その代表は1票の賛成と1票の反対があった.
投票方式で採決する場合、自ら出席または被委員会代表が出席する株主、または正式に許可された代表が出席する株主は、株式1株を保有するごとに投票権を有する。私たちは私たちが在庫株として保有している任意の株式について会議に出席したり、会議で投票する権利を行使することを禁止されています。
株式の金額が期限を過ぎた時の投票に対する制限。当社のいかなる株主も、その株式について対応するすべての催促配当金またはその他の金が支払われない限り、任意の株主総会または任意の単独株主総会でその保有する任意の株式について投票する権利がない。
株を引受する。取締役は時々、その株式のいかなる未払い金についても、株式額面やプレミアムについても、株主に配当金を催促することができる。株主は、支払い時間と場所を指定する最低14日の通知を受けた後、株式について引渡し配当金を支払う必要がある。当社の定款によると、“一日中”の期限には、通知が発行されたか又は発行されたとみなされる日、通知又は発効の日は含まれていない。株主が引渡し配当金のいずれの部分も支払わない場合、取締役会は、支払いを要求するさらなる通知日から14日以上の別の日を指定することができ、株主が支払わないように説明すると、配当金に関連する株式は没収されることができる。その後の没収は取締役会の決議案を必要とする。
配当金。2006年の会社法及びその他のすべての関連法律条文の規定の下で、吾らは普通決議案を通じて株主それぞれの権利に応じて分配可能な利益から配当金を派遣することを発表することができるが、配当金は取締役会が提案した額を超えてはならない。取締役会が、私たちが分配可能な利益がそのような配当金を支払う理由があると証明した場合、取締役会は、固定日に任意のカテゴリ株の所有者に支払うべき固定配当金を支払うことができ、優先権利は半年または他の時間であり、任意のカテゴリ株の所有者に中間配当金を時々支払うことができる。任意の株式に付随する任意の特別な権利又は発行条項の規定の下で、すべての配当金は、配当金を支払う株式の実納金額に従って宣言及び支払いされなければならない。当社は当社が在庫株として保有しているどの株式についても当社に配当金を支払いません。
131
取締役会の提案によると、私たちは通常の決議によって、特定の資産を分配する方法で配当金を支払うことを指示することができる。
すべての発表後1年以内に受取人がいない配当金は取締役が適宜投資したり、他の方法で吾などの利益に使用したりして、認知されるまで(組織定款細則で規定されている規定の制限を受ける)、配当金が満期になって支払う日から12年後にすべての受取人がいない配当金は没収され、吾などに返還される。
任意の株主総会で採択された普通株主決議案の許可を得た場合、取締役会は任意の普通株式所有者に権利を提供し、入金入金を十分な配当金とする普通株式分配を選択し、当該配当の代わりに選択することができる。
吾等は、任意の小切手又は株式証明書の郵送を停止することができ、又は任意の銀行又は他の資金振込システムが吾等の任意の株式について対処する任意の配当金の郵送を停止することができ、少なくとも2回の連続配当金について、小切手又は承認配当証が返送されたが、送達されていない又はまだ償還されていない又は譲渡に失敗した場合、又は1回の配当金について小切手又は承認持分証が返送されたか、又は譲渡に失敗した場合、吾等は合理的な照会を行った後に所有者の任意の新しい住所を決定できなかった場合、通常当該等の株式について当該等の配当金を支払うことができる。
吾等又は取締役は、株式所有者として登録された者が任意の配当金を受け取る権利を有する“登録日”を指定することができる。
清算時の資産配分。会社清算時に付随する任意の特別権利又は任意の株式の発行条項の規定の下で、債務返済後に残った余剰資産は、株主がそれぞれ保有する株式と当該株式の実納金額との割合で株主に分配される。
会社の清算時(清盤が自動清盤であるか、監督下で清算するか、または裁判所が清算するかにかかわらず)、清盤人は会社の特別決議の許可の下、いかなる関連法例に規定されている任意の他の制裁の下で、吾等の全部又は任意の部分資産(吾等の後日発行された任意の株式に付随する任意の特別な権利規約)を実物又は実物で吾等の株主(任意の株式又は在庫株を保有して株主となる者は、会社自体を含まない)に割り当てることができ、その目的のために任意の種類又は複数の財産に公平とされる価値を設定し、株主又は異なる種類の株主の間でどのようにこの分割を行うかを決定することができる。清算人はこの承認の下で、すべて或いは一部の資産を清算人から関係当局に決定した信託受託者に振り替えて、株主に利益を与えることができ、清盤人は会社の清算及び解散会社を終了することができるが、株主に法的責任のある株式又はその他の財産を強制することはない。
権利の変更。任意のカテゴリ株式に付随する権利または特権(カテゴリ株式を発行する条項が別途規定されていない限り)は、カテゴリ発行済み株式を保有するために必要な額面の4分の3の所有者の書面で同意することができる(カテゴリ株式として保有するいかなるカテゴリ株式も含まない)、またはカテゴリ株主が別の株主総会で可決した特別決議案によって承認されることができるが、他の方法で変更または撤回してはならない。
株式譲渡。私たちのすべての株式は登録形式であり、任意の一般的または一般的な形態の譲渡によって、または取締役会は、2006年の会社法および任意の他の関連法律によって許可された任意の形態の譲渡を受け入れて得ることができる。
取締役会は、次の株式の譲渡を拒否することができる
132
大文字の変化。吾等は、通常決議案により、当社の全部又は任意の株式を既存株式よりも額面が大きい株式に分割するか、又は自社又は任意の株式を既存株式よりも額面の小さい株式に再分割することができる。2006年会社法及び任意の他の適用法の規定の下で、吾らは特別決議案を通じて株式、任意の資本償還準備基金或いは任意の株式割増口座を減少させ、そして吾など自身の任意の株式を償還或いは購入することができる。
購入権を優先する。我々の組織定款細則によると、発行された普通株の譲渡に優先引受権はない。場合によっては、2006年の“会社法”によると、私たちの株主は、分配会社の新株について法定優先購入権を持つ可能性がある。適用されれば、これらの法定優先引受権は、他の人に新株を配信する前に、既存の株主に比例して新株を配信することを要求する。この場合,当該等法定優先購入権を行使するプログラムは,我々の株主に当該等普通株を発売するファイルに掲載される.2006年の会社法の規定によると、株主総会で採択された特別決議は、これらの法定優先購入権を廃止することができる。
役員.取締役
番号です。吾らが株主総会で別の決定があるまでは、吾らの取締役会を構成する取締役数はいかなる上限も受けないが、二人以下であってはならない。
秘密の取締役会です。我々の取締役会は、2026年に開催される株主総会で任期が満了し、第2種類の任期が2025年に開催される年度株主総会で満了する第1種類の取締役会の任期が2024年に開催される年次株主総会で満了するという3種類に分類される。第一種役員はヒュー·グリフィス、アンドリュー·ケイ、バリ·ムラリダール、第二類取締役はエリオト·リヴィ、シリル·レペリエ、第三種取締役はアダム·ジョージとマーティン·メリッシュ。
借入権。私たちの取締役会は、会社のすべての権力を行使し、そのすべてまたは一部の業務、財産および未納資本を資金、担保または担保に借入し、直接または会社または任意の第三者の任意の債務、債務または義務の付属保証として、債券および他の証券を発行することができる。
取締役の利益と制限
(A)取締役会は、当社の組織規約及び2006年会社法の要求に基づいて、許可されていない場合には、取締役が2006年会社法第175条の下での義務に違反し、彼又は彼女が私たちの利益と衝突する直接的又は間接的な利益を所有しているか、又は所有している可能性がある場合を回避することができる。取締役は取締役であるために、取締役会が許可した利益衝突または可能な利益衝突に関する関係から得られた報酬または他の利益を会社に説明する必要はない。
(B)任意の関連法条文の規定の下で、および彼または彼女が彼または彼女の任意の重大な権益の性質および程度を取締役に開示した限り、取締役は任意の取引、契約または手配の当事者になる可能性があり、またはそのような取引、契約または手配において他の権益を有し、取締役はその地位のために、その任意の取引または手配から得られた任意の利益について会社に責任を負わなければならず、いかなる取引または手配も、そのいかなる権益または利益によっても覆されることはない。
(C)当社の組織規約の細則に別段の規定があるほか、取締役は、取締役会議において、その所有するいかなる取引又は手配又は任意の他の提案について投票してはならず、その取引又は手配又は提案がその所有する利益(それに関連するいかなる者も、2006年“会社法”第252条に示すものとする)であるが、次の場合を除く:(I)当該会社の株式、債券又は他の証券の権益、(Ii)任意の利益衝突許可の条項が許可されている場合、又は(Iii)以下(D)項に記載の場合を除く。その議決権のないいかなる決議案と関連した会議では、定足数を計上してはならない。
133
(D)取締役(次の事項以外の重大な利益がない場合)は、次のいずれかの事項に係るいかなる決議案の採決(定足数に計上する)を有する権利がある
(I)吾等又は吾等の任意の付属会社に貸した金又はそれが吾等又は吾等の任意の付属会社の要求又はその利益のために招いた債務について、それに任意の保証、保証又は補償を提供する
(Ii)当社又は当社の任意の付属会社の債務又は義務について第三者に任意の保証、保証又は補償を提供し、当該債務又は義務は、その本人が担保又は補償又は保証の提供に基づいて全部又は一部の責任を負う
(Iii)会社またはその任意の付属会社の株式、債権証または他の証券の要約に関連する任意の提案または契約であり、彼または彼女は、株式、債権証または他の証券の所有者として参加する権利があるか、または彼または彼女がその要約のパッケージ販売、パケット販売または保証に参加する権利があるために参加する可能性がある
(Iv)彼または彼女に直接的または間接的に利害関係のある任意の他の会社に関する任意の提案があるが、彼または彼女の知る限り、彼または彼女(彼または彼女に関連する人と一緒に)は、その会社の任意のカテゴリで発行された株式の1%以上に相当する権益を保有してはならず、会社の株主が享受可能な投票権に関する権益も保有していない
(V)従業員に利益を提供することに関する任意の提案は、従業員にいかなる特権または利益も与えず、この特権または利益は、通常、手配に関連する従業員に付与されない
(Vi)取締役は、当社の組織規約の細則に基づいて、当社の取締役または他の上級社員に補償の任意の提案を提供する権利があり、このような提案は、彼または彼女に利益を得ることができる
(Vii)彼または彼女が、当社の任意の取締役または他の上級者の保険を購入または維持することによって利益を得ることができる任意の提案;
(Viii)抗弁訴訟費用を支払うために取締役に資金を提供する任意の提案について、彼または彼女は、その提案から利益を得ることができる。
(E)2人以上の取締役が吾等又は吾等の権益を有する任意の会社に職務又は雇用を委任し、又は委任条項を決定又は変更することを提案した場合、当該等の提案は、取締役毎に別々に考慮することができるが、この場合、各取締役(上記(D)(Iv)段落により投票が禁止されていなければ)は、各決議案について投票(定足数に計上)する権利があるが、それ自体の委任に関する決議案は除く。
(F)任意の会議において取締役権益の重要性又は任意の取締役の議決権に関する問題が発生し、関連問題が自発的な同意による投票放棄によって解決されなかった場合、その問題は大会議長に処理されなければならない(又は当該権益が議長本人に関連していれば、会議副議長が処理しなければならない)、任意の取締役についての裁決は、関連取締役の権益の性質又は程度が公平に開示されていない限り、最終的かつ決定的な裁決となる。
報酬.報酬
(A)各取締役(候補取締役を除く)は、(以下(B)及び(C)段落又は当社組織定款細則に基づいて任意の他の条文に基づいて支払わなければならないものを除く)会社の資金から取締役会が時々決定した取締役会報酬として支払うことができる。
(B)任意の取締役が、吾等の任意の仕事又は執行職を委任された場合、又は当社等の要求に応じて会社の任意の目的のために海外に行ったり、又は取締役会がその一般的な職責範囲を超えていると考えられるサービスを提供したりする場合には、取締役会(又は任意の正式に許可された取締役会)によって決定された追加報酬金(賃金、手数料、利益又は他の方法を問わず)を支払うことができ、任意の他の細則規定又は任意の他の定款細則に基づいて規定された報酬金を補完又は置換することができる。
(C)各取締役は、取締役または委員会会議または株主総会、任意の種類の株式所有者の任意の個別会議、または取締役として出席する権利のある任意の他の会議の合理的な出張費(宿泊費および雑費を含む)を支払い、会社の業務を経営するか、または取締役の職責を履行することによって適切かつ合理的に引き起こされるすべての支出を支払うことができる。
134
年金と他の福祉。取締役会は、報酬金、年金、保険、または任意の他の方法を支払うことによって、前述と類似しているか否かにかかわらず、任意の取締役または前取締役、または以下の会社で役員または他の職務または給与職に雇用された者に利益を提供することができる。当該会社又は現在又は当該会社の付属会社であった任意の法人団体、又は当該会社又は任意の当該付属会社の業務の前身、並びに当該会社の任意の利益を提供するために、任意の計画、信託又は基金に出資又は任意の保険料を支払う家族及び者。
役員の委任と退任
(A)取締役会は、臨時の空き又は取締役としての追加メンバーを埋めるために取締役に就任したい者を委任する権利があるが、取締役総数は、当社の組織定款に規定されている又は当社の定款に規定する最高人数(ある場合)を超えてはならない。このように任命された取締役は、委任後に株主周年大会で退任し、その有資格当選種別の残りの任期で再選する資格がある。
(B)吾などの組織定款細則の規定の下で、株主は普通決議案を通じて任意の取締役に就任したい者を選出し、臨時の空きを埋め、既存の取締役を補充し、あるいは吾などの組織定款細則によって免職された取締役に代わることができ、しかし取締役総数はいつでも吾などの組織定款細則が定めたいかなる最高人数を超えてはならない。
(C)上記(A)段落及び“発行済み株式説明-組織定款-取締役-分類取締役会”に記載された予備条項の規定の下で、各カテゴリ内の各取締役は、その選任又は最後に再任された株主周年大会後に開催された第3回株主周年総会で退任しなければならない。取締役数が増加しない限り(この場合、新たに設立された取締役職は、当社の既存カテゴリに当社取締役会が割り当てられる)、または上記(A)項の規定により、株主総会で選択または再選択された取締役は、当該会議で任期満了のカテゴリに委任されなければならない。
(D)株主総会で退任した取締役は再選する資格がある。退任した取締役が再任されていない場合、彼または彼女の任期は、会議が誰かが彼または彼女の後任を選ぶまで続き、会議が彼または彼女の後任を選ばなければ、任期は会議が終わるまで続く。
会社名です。
取締役会はわが社の名前を変更することを決定するかもしれません。
上級乗組員の代償。
いかなる関連法律条文の規定の下で、吾らは各取締役及びその他の高級職員がその職責を執行及び履行し、或いはその等の職責に関連するすべての費用、料金、損失、支出及び法的責任について弁済することができる。2006年“会社法”では、取締役がその所在会社のいかなる不注意、過失、失職又は信託違反行為に対して負ういかなる責任の代償も無効と規定されており、詳しくは“-会社法の差異-取締役と上級管理者の責任”を参照されたい
株主総会
年度株主総会。その年の任意の他の株主総会を除いて、吾らは毎年株主周年大会を開催し、株主周年大会開催の通告でその会議を株主周年大会とすることを示している。年次株主総会は取締役会が指定した時間と場所で開催されなければならない。
株主総会を開く。取締役会は株主総会を招集することができる。株主と2006年の“会社法”が取締役会に株主総会の開催を要求した場合、取締役会はそうしなければならない。株主総会開催の予定は以下の“−会社法の違い-株主総会通告”である。
会議の定足数。いずれの株主総会においても、会議が事務処理を開始する際に十分な定足数が出席しない限り、いかなる事務も処理することはできないが、定足数に達していないのは議長委任を妨げるものではなく、議長は会議事務の一部とみなされてはならない。会議に出席した1人以上の合資格者および共同所有者(または所有者としての被委員会代表または会社代表)の少なくとも3分の1の発行済み株式(在庫株として保有する株式を含まない)の少なくとも3分の1を有し、処理された業務について投票する権利を有する者が定足数を構成する。予選戦
135
これなどの目的については,個人が株主であり,その会議について株主(例えば会社)の代表として行動することを許可されている人や,その会議について株主代表に任命されている人である.
イギリスの法律の他の考慮要素
強制購入と買収。2006年会社法第979条から991条によると、例えば吾らはすでに買収契約を提出したが、要人がすでに買収或いは無条件に契約買収契約を締結した場合に関連する株式価値は90%以上であり、当該等の株式に付随する投票権は90%以上であり、要約者は要約者がまだ買収していないか、又は無条件に契約買収を締結していない任意の株式所有者に通知することができ、一般契約と同じ条項で当該等の株式を買収し、買収する権利があることを表明した。小株主の“排除”は、通知を出した日から6週間以内に完成することができ、小株主がこの6週間の終了前のいつでも裁判所に申請できなかったことを前提として、このような排除を防止し、その後、要人はそれを受益者とする流通株譲渡を実行し、私たちに対価を支払い、まだ発行されていない少数株主に信託方式で保有することができる。2006年に“会社法”によりその株式を強制的に買収された発行された少数株主に提出された対価格は、一般に買収要約が提供する対価格と同じでなければならない。
入場券は売り切れました。2006年に会社法はまた、私たちの少数株主に、場合によっては私たちのすべての株を買収する要人が購入する権利を与えられた。要約に関連する株式保有者が他の方法で要約を受け付けていなければ、(I)要人が吾等の議決権を有する株式の90%以上を買収または同意したこと、および(Ii)当該等の株式に付随する90%以上の投票権を有することを条件として、要人が要約受付期間満了前にその株式を買収することを要求することができる。要人は,買収された少数株主の権利に対して,受入期間終了後3か月以上の期限を設定することができる。株主が買収された権利を行使する場合、要人は買収要約の条項又は他の合意可能な条項に従ってこれらの株式を買収しなければならない。
株式権益を開示する。2000年会社法第22部及び吾等の組織定款細則によると、吾等は書面通知により、吾等の株式権益を有すると信じている任意の者、又は通知日の直前の3年以内の任意の時間に、当該者自身の権益の詳細及び(当該者の知る限り)当該等の株式を保有して付与された任意の権利の行使に関する任意の他の権益、合意又は手配の詳細を合理的な時間内に吾等に開示する権利がある。
当社の定款によると、いかなる者も当社に株式(ここでは“違約株式”と呼ぶ)に関する必要な資料を提供できなかった場合、取締役会は通知を出すことができ、指示を出すことができる
自分の株を購入する。イギリスの法律によると、有限責任会社はその分配可能な利益や買収融資のために発行された新株の収益の中から自分の株を購入することしかできず、その会社がその定款細則の制限を受けないことを前提としている。有限責任会社は自己の株式を購入することができず、株式を購入した結果、償還可能株式又は在庫株として保有している株式を除いて、当該会社はこれ以上発行済み株式を有しない。株は全額支払わなければ買い戻しできません。
購入する前に、株主決議により付与された購入契約に基づいて、認可された投資取引所以外の場所で自己の全額払込株式を購入することができる。もし私たちが株式を購入したいかなる株主に決議案に投票することを提案すれば、いかなる許可も無効になり、もし彼がそうしなければ、決議案は採択されないだろう。購入を許可する決議案は、決議案が採択されてから5年後に遅れてはならない購入許可の失効日を指定しなければならない。
136
購入権を優先するイギリスの法律では、新株が現金形式で発行された場合、株主は優先購入権を享受することができると規定されているが、会社の定款や株主は株主総会で優先購入権を排除する可能性もある。優先購入権を除外する期間は最長で定款が採択された日から5年とし,定款から除外すれば株主決議の日から除外すれば株主決議を採択することができる。いずれの場合も、この除外は、満期時に私たちの株主によって更新される必要があります(すなわち、少なくとも5年に1回)。2023年6月15日、私たちの2023年度株主総会で、私たちの株主は、以下に関連する優先購入権を排除することを許可しました:(I)株式を配布するか、または任意の証券を株式に変換する権利を付与し、総額面は最大4,000,000 GBに達し、2024年の次の年度株主総会の終了まで。および(Ii)取締役が時々承認する任意の既存、改訂または新しい株式購入計画、奨励計画または共同持分計画(税務優遇の有無にかかわらず)に関連する任意の既存、改正または新しい購入権計画、奨励計画または共通持分計画(税務優遇を有しているか否かにかかわらず)に基づいて株式を分配するか、または任意の証券を株式に変換する権利を付与するが、これらの計画または計画は、合資格参加者として、当社または当社の任意の付属企業の取締役、上級者または従業員および/または当社またはその任意の付属企業が招聘する任意のコンサルタントを含む。2023年株主総会5周年(すなわち2028年6月15日午後11時59分)までの期間。上記の許可に加えて、私たちの株主は、2021年6月24日に2021年の株主周年総会で優先購入権の排除を承認した:(I)NuCana 2016株式購入計画、NuCana 2020長期インセンティブ計画、NuCana 2020会社の株式購入計画、または実質的に承認された共同持分計画の形態で署名された任意の連合持分計画協定に基づいて、NuCana 2016との株式購入計画、NuCana 2020長期インセンティブ計画、NuCana 2020会社の株式購入計画または任意の共同持分計画協定に基づいて、株式を譲渡または付与する権利を付与し、各合意ごとに時々改訂することができる。または取締役が時々承認する任意の新しい株式購入計画または奨励計画(税務優遇を受けているか否かにかかわらず)に関連しており、これらの計画または計画は、当社または当社の任意の付属企業の取締役、上級者または従業員および/または当社または任意の付属企業が採用する任意のコンサルタント(すべての株式購入計画または奨励計画を総称して“承認株購入計画”と呼ぶ)を含み、これらの計画または計画は、当社または当社の任意の付属企業の取締役、上級者または従業員を資格参加者として含み、これらの計画または計画の総額面は80,000 GB以下である。2021年株主総会5周年(2026年6月23日午後11時59分)までの期間。(Ii)2020年6月25日に当社の2020年株主総会において、株式の発行又は付与権利について、株式購入計画に基づいて又は承認された株式に関連する任意の証券を株式に変換し、総額面160,000 GB以下で、当社の2020年株主総会日5周年まで(すなわち、2025年6月24日夜11:59)。及び(Iii)は、2022年6月23日に当社の2022年株主総会において、取締役と時々承認された承認された株式購入計画又は任意の共同持分計画(税務優遇の有無にかかわらず)に基づいて株式を配信するか、又は任意の証券を株式に変換する権利を付与する権利であり、総額面は最高200,000 GBであり、当社の2022年株主総会日までの5周年(すなわち、2027年6月23日夜11:59分)までである。このような許可は、有効化を継続するために満了時(すなわち、少なくとも5年に1回)が必要であるが、5年間の期間(またはより短い期間)の延長がより頻繁に求められる可能性がある。
買収と合併に関する都市コード、または接収コード。イングランドとウェールズに登録して設立され、イギリスで集中的に管理と制御されている上場企業として、私たちはイギリスの都市買収と合併規則(本稿では買収規則と呼ぶ)の制約を受けている。“買収規則”には、会社の買収契約行為に関する規則が含まれている。例えば“買収規則”第9条によると、もし誰かが
(A)われわれの株式の権益を取得し、その権益と彼又は彼と一致して行動する者が所有する権益の株式との合計は、わが株式の投票権の30%以上を有する
(B)当該者は、一致して行動した者と共に、30%以上50%以下の会社の投票権を有する株式に権益を有し、その人が所有する投票権付き株式の割合を増加させるために、追加の株式権益を取得する
買収側とその演奏者は(場合によっては)買収委員会の同意を得ない限り、買収側またはその歌唱会側が過去12ヶ月以内に株式権益に支払う最高価格を下回らない現金カプセルで我々の流通株を買収することが要求される。買収規則のいくつかの条項は逆買収効果がある可能性があり、買収が株主に有利であっても、他社が私たちを買収することを阻止する可能性がある。
分配と配当。2006年の“会社法”によると、会社が合法的に分配または配当を行うことができる前に、(非合併に基づいて)十分な分配可能な備蓄を持っていることを確実にしなければならない。基本的なルールは,会社が分配に利用可能な利益は,その蓄積された実現利益であり,そうでなければ
137
以前分配または資本化に用いられていたものは,その累積したものを差し引いて損失を達成し,以前適切な資本減少や再編でログアウトしていなかった限りである。割り当てまたは配当金を支払う前に、私たちおよびイギリスの法律に基づいて設立された各子会社に適用される十分な分配可能な備蓄の要求がなければならない。
上場企業として、私たちは分配のために分配可能な利益を稼ぐだけでは十分ではない。私たちに追加的な資本維持要求を加えて、会社の純価値が少なくともその資本額に等しいことを確実にする。上場企業は流通しかできません
(A)分配が行われた場合、その純資産額(すなわち、負債に対する資産の超過総額)は、配当金および分配不可能備蓄の合計よりも少なくない
(B)配布時に、当該配布自体が純資産額を当該総資産額よりも少なく減少させていなければ、その範囲内で、当該等純資産額は減少しない。
外国為替規制。イギリスには、私たちが使用できる現金、現金等価物、短期預金を含む、政府の法律、法令、法規、または他の立法は、資本の輸出入に影響を与える可能性があり、または非住民普通株式またはアメリカ預託証明書保持者に配当金、利息、または他の支払いを支払うことに影響を与える可能性がありますが、源泉徴収税要件は除外されます。イギリスの法律や会社の定款は非住民が株式を保有または投票する権利に何の制限もない。
会社法の違い
2006年の“会社法”の適用条項は、米国会社及びその株主に適用される法律とは異なる。以下は、我々の“2006年会社法”とデラウェア州“会社法”における株主権利と保護に関する規定との間のいくつかの差異に適用される要約である。本要約は、それぞれの権利に対する完全な議論ではなく、その全文は、デラウェア州法律およびイギリス法律を参照して保持されている。
138
|
|
イングランドとウェールズ |
|
デラウェア州 |
役員数 |
|
2006年の“会社法”によると、上場有限会社は少なくとも二人の取締役がいなければならず、取締役数は会社定款規定或いは会社定款規定の方式で確定することができる。 |
|
デラウェア州の法律によると、一つの会社は少なくとも一社の取締役を持たなければならず、取締役数は定款又は定款に規定された方法で確定しなければならない。 |
|
|
|
||
役員の免職 |
|
2006年の会社法によると、株主は普通決議案(直接または委任代表が株主総会で簡単な多数で通過する)によって取締役を除名することができ、取締役が会社と締結したいかなるサービス契約のいかなる条項も考慮することなく、会社及びその株主に決議案28の一日中の通知を出したことを前提としている。取締役除去の意向決議に関する通知を受けた後、当該会社は直ちに当該通知の写しを関係取締役に送信しなければならない。また、取締役が会議でまたは書面でその解任に反対する陳述を提出することを可能にするなど、2006年の“会社法”に規定されているいくつかの他の手続き要件を遵守しなければならない。 |
|
デラウェア州法律によると、当時取締役選挙で投票する権利があった多数の株式の所有者は、理由がなく、または理由がある場合には、任意の取締役または取締役会全体を罷免することができるが、以下の場合を除く:(A)会社規約が別途規定されていない限り、取締役会が機密に属する会社については、株主は、理由がある場合にのみ罷免することができ、または(B)累積投票権を有する会社については、罷免する取締役会の人数が取締役会全体より少ない場合、いずれの取締役も、罷免反対票が彼を選挙するのに十分であれば、理由なく罷免することはできず、取締役会選挙全体で累計投票し、または取締役種別が存在する場合は、彼の所属カテゴリの役員選挙で投票する。 |
|
|
|
||
取締役会の空き |
|
イギリスの法律によると、取締役(会社の初期取締役を除く)を委任する手続きは、一般に会社の組織定款細則に記載されているが、上場企業については、会議が事前に決議を行うことに同意していない限り、誰も反対票を投じていない場合は、単一決議動議で2人以上の者を取締役に委任してはならない。
|
|
デラウェア州法律によると、空席及び新たに設立された取締役職は、(A)会社登録証明書又は定款に別段の規定がない限り、当時在任している大多数の取締役(定足数に満たなくても)又は唯一の残りの取締役によって補填することができ、又は(B)会社登録証明書が特定のカテゴリの株式が当該取締役を選挙することを示す場合は、当該カテゴリ選挙の他の取締役の大多数又は当該カテゴリ選挙の唯一の残り取締役が空席を埋めることができる。 |
|
|
|
|
|
株主周年大会 |
|
2006年の“会社法”によると、上場有限会社は会社の年度会計参考日の翌日から、6ヶ月ごとに年次株主総会を開催しなければならない。 |
|
デラウェア州の法律によると、株主総会は取締役会が時々指定した場所、日時、または会社登録証明書または定款に規定された時間に開催されなければならない。 |
|
|
|
||
株主総会 |
|
2006年の“会社法”によると、上場有限会社の株主総会は取締役が招集することができる。
株主総会において、会社実収資本の少なくとも5%を有し投票権を有する株主は、取締役に株主総会の開催を要求することができ、取締役が所定の期限内にそうしていない場合には、自ら株主総会を開催することができ、又は全体の投票権総数の半分以上を占める取締役が株主総会を開催することができる。 |
|
デラウェア州の法律によると、株主特別会議は取締役会によって開催されるか、または会社の登録証明書または定款によって許可された一人または複数人によって開催されることができる。 |
|
|
|
||
139
株主総会の通知 |
|
2006年の“会社法”によると、年次株主総会と会議で提出されたいかなる決議も21日前に通知を出さなければならない。会社組織定款細則が長い期限を規定している場合には、特定の条件を満たす公衆株式会社の他の任意の株主総会は、少なくとも14日前に通知を出さなければならない。さらに、特定の事項、例えば取締役または監査役を罷免する決議は、28日中の通知である特別通知が必要である。いずれの場合も,会社株主は短い通知期間に同意することができ,年次株主総会では,必要な株主同意割合は出席および議決権のある株主の100%であり,任意の他の株主総会については,総会に出席して会議に投票する権利のある株主の過半数,すなわち95%以上の株式額面を共有する多数の株主であり,当該等の株主は総会に出席して総会に投票する権利がある. |
|
デラウェア州法律によると、会社の登録証明書又は定款に別段の規定がない限り、任意の株主会議の書面通知は、会議の期日前に10日以上60日以下で会議で投票する権利を有する各株主に発行され、会議の場所、日時、目的を具体的に説明しなければならない。 |
|
|
|
|
|
代理.代理 |
|
2006年の“会社法”によると、どの株主総会でも、株主は他の人の代表を派遣して会議、発言、投票に出席させることができる。 |
|
デラウェア州の法律によると、任意の株主会議において、株主は、他の人が委託により当該株主を代理することを指定することができるが、このような委託は、その日付から3年後に投票又は代理を行うことができない。デラウェア州の役員は取締役の投票権の代理として代表取締役を出してはいけません。 |
|
|
|
|
|
優先購入権 |
|
2006年の“会社法”、“株式証券”、すなわち(1)会社の株式(配当及び資本に関する株式を除く)、所定額の割り当て(“普通株”)にのみ参加する権利、又は(2)証券を普通株に変換する権利を引受し、現金で分配することを提案し、まずその保有株式の額面割合で会社の既存株式株主に要約しなければならない。又は例外を適用し、又は株主総会でそれとは逆の特別決議を採択したか、又は定款に別段の規定がある(いずれの場合も2006年“会社法”の規定に基づく)。 |
|
デラウェア州法律によれば、株主は、会社登録証明書がそのような権利を明示的に規定しない限り、追加発行された株またはそのような株に変換可能な任意の証券を優先的に承認する権利を有さない。 |
|
|
|
|
|
140
割り当てられた権限 |
|
2006年“会社法”によると、会社役員は、株式を分配したり、株式を引受したり、株式に変換する権利を付与してはならない。例外的な状況または株主が株主総会でそれとは逆の一般決議を採択しない限り、または定款には別の規定がある(いずれの場合も“2006年会社法”の規定に適合する)。 |
|
デラウェア州の法律によると、会社の定款又は会社登録証明書にこの規定がある場合、取締役会は株の発行を許可する権利がある。それは、現金、任意の有形または無形財産、または会社の任意の利益、またはそれらの任意の組み合わせを対価格とする株式を発行することを許可することができる。それは公式を承認することでこのような対価格の金額を決定することができる。取引に実際の不正がない場合には、取締役はこのような対価格の価値の判断が決定的である。 |
|
|
|
|
|
役員および上級者の法的責任 |
|
2006年の“会社法”によると、会社役員が会社に関連するいかなる不注意、過失、失職または背信行為によって会社役員が負う責任をどの程度免除することを目的とした条項(定款に含まれているか否かにかかわらず)は無効である。
いかなる規定も、会社は直接的または間接的に補償を提供し、いかなる程度においても、任意の法律的責任が彼の所属する会社の不注意、失責、失職または信託に関連する不注意、失責、失職または違反信託に添付され、彼は取締役の会社または共同経営会社であり、無効であるが、“2006年会社法”が許可された例外の場合、会社は:(A)このような責任を購入して維持する保険;(B)“資格を合わせた第三者による補償”(その会社または連合会社以外の人に対して取締役が招くいくつかの法的責任の補償)を提供することができる。及び(C)“合資格退職金計画補償”(すなわち、会社が職業退職金計画受託者としての活動によって招いた法的責任についての弁済)を提供する。 |
|
デラウェア州法律によると、会社の会社登録証明書は、取締役が取締役としての受託責任に違反して会社及びその株主に与える損害の個人責任を取り消し又は制限する条項を含むことができる。しかし、どの条項も、以下の点で取締役の責任を制限することはできません
*会社または株主に対する取締役の忠誠義務に違反します
善意でない行為やしないこと、または故意の不正行為に関連しているか、または違法であることを知っている
不正な配当金の支払い、株式の購入または償還を故意にまたはおろそかにすること;または
取締役が不当な個人的利益を得るような取引は禁止されています。 |
|
|
|
||
141
投票権 |
|
上場会社の定款の手本によると、会社の株主要求或いは会議議長或いは会社定款の要求が投票方式で採決されない限り、株主は手を挙げてすべての決議を採決しなければならない。2006年の会社法によれば、以下の者は、(A)当該決議案について投票する権利を有する5人以上の株主、(B)任意の株主(S)が、当該決議案について投票する権利を有するすべての株主の総投票権の10%を占めること、又は(C)当該決議案の投票権を付与する会社の株式を有する任意の株主(S)を要求することができ、これらの株式の払込済持分総額は、この権利を付与された全株式の払込済株式総額の10%以上である。ある会社の定款は株主により広い投票権利を提供するかもしれない。
イギリスの法律によると、一般決議が出席(自らまたは委員会代表)に出席して投票する権利のある株主の簡単な多数(50%を超える)が可決されれば、手を挙げて採決することができる。投票方式での採決が要求された場合、一般決議は、代表が出席する株主(自らまたは委員会代表)の総投票権を代表する単純多数の保持者によって承認され、その株主は決議について投票する権利がある。特別決議案は会議に出席した株主が自らまたは委任代表に75%以上の賛成票を投じることを要求する。 |
|
デラウェア州の法律では、会社の登録証明書が別に規定されていない限り、各株主が保有する各株は一票を投じる権利があると規定されている。 |
|
|
|
|
|
ある取引に対する株主の投票 |
|
2006年“会社法”は、特定のタイプの再編、合併、資本再編、または接収のための、会社と任意のカテゴリの株主または債権者との間の手配または妥協である手配計画を規定している。これらの計画には
裁判所が開催を命令した株主総会又は債権者会議において、代表が出席して投票に参加する株主種別又は種別の株主又は債権者が保有する資本又は債務の75%の過半数の株主又は債権者が自ら又は受委代表によって投票すること;
裁判所の承認を受ける。 |
|
一般的に、デラウェア州の法律によると、会社登録証明書が株式の大部分の投票権を規定していない限り、会社のすべてまたはほとんどの資産の合併、合併、販売、レンタル、または交換または解散を完了する必要がある
取締役会の承認を受ける
この事項について投票する権利のある会社の発行済み株式の過半数の所有者が投票して承認するか、または会社登録証明書が1株当たり1票以上またはそれ以下であることを規定する場合は、その件について投票する権利のある会社の発行済み株式の多数の投票権によって承認される。 |
|
|
|
|
|
142
役員行為準則 |
|
イギリスの法律によると、取締役は会社に対して様々な法定と受託責任を持っている
*会社の成功を株主全体に利益をもたらす方法で行動することを促進する可能性が最も高いと考えているが、特定の場合には、会社債権者の利益または会社債権者の利益を考慮して行動しなければならない
彼が会社の利益と衝突するか、または衝突する可能性のある直接的または間接的な利益を回避する場合
*会社の規約に従って、付与された目的のためにのみ権力を行使します
--独立した判断能力を行使する
合理的な慎重さと技巧と勤勉さを学ぶことができます
*彼が董事者であること、または董事者として何もしないことによる第三者の利益は受け入れられません
彼がその会社との提案または既存の取引または手配において直接的または間接的に所有している任意の利益を申告する義務がある。
|
|
デラウェア州の法律は役員の行動基準を具体的に規定していない。取締役の受託責任の範囲は一般的にデラウェア州裁判所によって決定される。一般的に、取締役には、知っている上で、株主の最適な利益に合っていると合理的に考えて、自分の利益に触れずに行動する責任がある。
デラウェア州会社の取締役は会社とその株主に対して注意と忠誠の受託責任を負っている。注意義務は一般的に取締役に善意に基づいて行動することが求められており、通常慎重な人が似たような場合には慎重な態度をとることが求められる。この義務により、取締役は重大な取引に関するすべての合理的に利用可能な重要な情報を自分に通知しなければならない。忠実な義務は取締役に会社の最良の利益に合っていると合理的に判断するように要求します。彼は自分の会社のポストを利用して私利や利益を図ってはいけません。一般に,ある例外を除いて,取締役の行為は,知っているうえで善意に基づいて,とった行為が会社の最良の利益に合致すると誠実に信じていると推定される.しかし,この推定は,いずれかの受託責任に違反した証拠によって覆される可能性がある.デラウェア州裁判所はまた、デラウェア州のある会社の役員に対してより高い行動基準を実施し、これらの取締役は会社のコントロール権変更の脅威を挫折させるためのいかなる行動をとっている。
また、デラウェア州法律によると、デラウェア州会社の取締役会が支社の売却または解体を許可した場合、場合によっては、取締役会は株主が合理的に利用できる最高価値を得る責任がある可能性がある。 |
|
|
|
||
株主訴訟 |
|
イギリスの法律によると、一般的に、会社が受けた不正行為や社内管理に違反行為があることについて提起された訴訟では、その株主ではなく会社が適切な請求人である。この一般的な立場にもかかわらず、2006年に“会社法”は、(I)裁判所は、株主が取締役の不注意、過失、失職または信託違反に関連するものとして、派生クレーム(すなわち、会社または代表会社に対する訴訟)を提起することを許可することができ、および(Ii)株主は、以下の場合、裁判所命令のクレームを提出することができる |
|
デラウェア州の法律によると、会社自身が権利を強制執行できなかった場合、株主は会社の権利を強制的に執行するために派生訴訟を提起することができる。苦情は必要です
原告が原告からクレームされた取引の際に株主であるか、その後法律の施行により株式を原告に譲渡すること
特に原告が裁判所から得たい訴訟を得るための努力を指す |
143
|
|
その一部またはすべての株主を不公平に損害する方法で事務が行われているか、または行われている。 |
|
取締役及び原告が訴訟を取得できなかった理由
彼らは努力しなかった理由を述べた。
また、原告はデリバティブ訴訟中に株主として保持しなければならない。デラウェア州衡平裁判所の承認なしに、この訴訟は却下されたり妥協されたりしないだろう。 |
C. 材料契約書
本年度報告(その添付ファイルを含む)が別に開示されている以外に、正常な業務過程で締結された契約を除いて、吾らは現在及び過去2年間にいかなる重大な契約も締結していない。
D. 取引所制御する
源泉徴収要件を除いて、イギリスは、私たちが使用可能な現金および現金等価物の供給を含む、資本の輸出入に影響を与える可能性がある政府の法律、法令、法規、または他の立法は、または非住民普通株または米国預託証明書保持者に配当金、利息、または他の支払いを支払うことに影響を与える可能性がある。イギリスの法律または私たちの会社の定款は非住民が保有または投票した株式の権利に何の制限もありません。
E. 分類群設ける
アメリカ連邦所得税の重要な考慮要素
以下の討論はアメリカ預託証明書の購入、所有権と処分の現行法律に基づいて、アメリカ連邦所得税のアメリカ所有者(以下の定義)に対する重大な結果を述べた。本議論は、1986年に改正された“米国国税法”または本議論の目的である“国税法”に基づいており、本年度報告の発表日から施行される“米国国税法”と、本年度報告の発行日から発効または場合によっては実施が提案されている米国財務省法規と、本年度報告の発表日またはそれ以前に施行された司法·行政解釈とに基づいている。上述したすべての主管部門は変化する可能性があり、これらの変化は追跡力を持つ可能性があり、以下に述べる税収結果に影響を与える可能性がある。
この議論は、米国連邦所得税目的で米国預託証明書を資本資産として保有する米国保有者にのみ適用される。それは、いかなる特定の投資家が米国預託証明書を購入するかの決定に関連する可能性のあるすべての税務考慮事項を全面的に説明することを目的としていない。特に、本議論は、証券または通貨取引業者、時価ベースの証券保有者、銀行、貯蓄機関または他の金融機関、保険会社、免税組織、税収目的で米国預託証明書を保有する人、税収目的で米国預託証明書を保有する人、その機能通貨がドルではない人、特定の前の米国市民または住民または直接所有者を含む、特殊な税収ルールによって拘束される可能性のある米国保有者に適用可能な税収考慮要因については言及しない。間接又は建設的株式は、投票権又は価値に基づいて代表会社の10%以上の株式を計算する。さらに、本説明は、米国預託証明書を購入、所有、処分する米国連邦財産、贈与または代替最低税額結果、または任意の州、現地または非米国の税務結果に関するものではない。また、米国連邦所得税の目的は、米国預託証明書を保有すること、またはこのような組合企業のパートナーであることが目的であるため、組合企業の実体または手配とみなされる税収結果には触れない。このような組合員のすべてのパートナーのアメリカ連邦所得税待遇は一般的にその地位に依存するだろう
144
パートナーと共同企業の活動。米国預託証明書を持つ共同企業のパートナーである潜在的な買い手は、自分の税務コンサルタントに相談するように促されている。
以下で議論する米国連邦所得税の“米国保有者”への影響は、米国預託証明書実益所有者である投資家、すなわち米国連邦所得税の目的で適用される
米国連邦所得税の目的で、米国預託証明書の実益所有者は、通常、そのような米国預託証明書に代表される関連普通株の所有者とみなされる。そのため、アメリカ預託証明書に関連する普通株の預金や引き出しは一般的にアメリカ連邦所得税を支払う必要がない。以下の議論では,預金プロトコルに記載されている陳述が事実であると仮定し,預金プロトコルおよび任意の関連プロトコルの義務がその条項に従って遵守されると仮定する.米国財務省は、米国預託株式の米国保有者と米国預託株式関連証券の発行者との間の所有権チェーンにおいて、株式が預託管理人または中間者に交付される前に米国預託証券を解放される側が、米国預託証券保有者が外国税収相殺を申請する行為と一致しない可能性を懸念している。これらの行動はまた、以下に述べるいくつかの非会社米国所有者が受信した配当金の税率引き下げに適用されるクレームと一致しないであろう。したがって,非米国源泉徴収税(あれば)の信頼性や,ある非米国会社所有者が受け取った配当金が低減された税率を獲得できるかどうかは,以下のような当事者や中間者の行動の影響を受ける可能性がある.そのため、アメリカ預託証明書に投資することを考慮したアメリカ人は彼ら自身の税務顧問に相談し、アメリカ預託証明書の購入、所有と処分に関連する特定の税収結果を理解し、アメリカ連邦、州と地方税法及び非アメリカ税法の適用性を含む。
特定の場合の米国連邦所得税規則の適用状況、および米国預託証明書によって生成された州、地方、非米国、および他の税金結果を購入、所有、処分することをお勧めします。
受動型外商投資会社が注意すべき問題
一般的に、米国国外で設立された会社は、ある課税年度において、(I)当該会社の当該課税年度の総収入の75%以上が受動収入であるか、または(Ii)平均少なくとも50%の会社の資産価値が受動収入を発生させるか、または受動収入を発生させるために保有する場合、受動外国投資会社とされたり、受動収入を発生させるために保有されている。この目的のために、受動的収入に加えて、受動的収入を生成するいくつかの配当金、利息、特許権使用料、レンタル料、ならびに商品および証券取引、ならびに財産の売却または交換の収益が一般的に含まれる。
この決定を下す時、私たちは任意の収入で私たちの比例シェアを稼ぎ、私たちが25%以上の資本(価値で計算)を持っている任意の会社の資産の中で私たちの比例シェアを持っているとみなされるだろう。PFICの地位は毎年事実性質のテストによって確定しなければならないため、私たちのPFIC地位は連合王国政府から獲得したいくつかの研究と開発税収相殺が総収入を構成するかどうかを含む、著者らの毎年の収入、資産と活動に依存し、もしそうであれば、それらがPFIC収入テストの受動収入を構成するかどうかを含む。また、PFIC資産テストについては、私たちの資産の価値は私たちの普通株の市場価格にある程度依存し、普通株の市場価格は大幅に変動する可能性がある。いずれの課税年度にPFICに分類されれば、米国保有者は、米国預託証明書を有することによる不利な米国連邦所得税の結果を軽減することができる可能性があり、その米国保有者が以下に述べる“時価建て”選択を行う資格があることを前提としている。場合によっては、米国所有者は“合格選挙基金”選挙を行うことができ、PFIC収入における現在のシェアを収入に計上することによって、PFIC所有権権益に関連するいくつかの不利な税収結果を軽減することができる。私たちは、適格な選挙基金や選挙、あるいは“QEF選挙”を行うために、米国の投資家に必要な情報を提供するつもりだ。米国所有者は、このエンティティが米国所有者のPFICに対する最初の納税年度にQEF選挙を行うと見なすことができる。第1課税年度以外の第1課税年度にQEF選挙に参加した米国保有者は,PFICの持分を保有しているとみなされ続ける
145
米国の保有者がこのPFICについて“売却とみなす”選択をしない限り、上記のPFIC一般規則に基づいて当該PFIC株がQEF選挙の年度前の付加価値を行うために課税される収益を確認しない限り、前項で述べたPFIC株に関する規則を遵守する必要がある。
私たちは私たちのウェブサイトで良質な教育基金選挙に必要な情報を発表することを期待している。もし私たちが任意の納税年度のPFICであれば、任意の米国保有者に対する結果は、米国所有者が以下に述べる有効なQEF選挙または時価建て選挙を行ったかどうかにある程度依存する。
もしアメリカの所持者がPFICについてQEF選挙をすれば、アメリカの所有者はそれを比例するこの実体はPFICの課税年度ごとの一般収益と純資本収益のシェアである(それぞれ一般収入と資本利益税で計算)。もしアメリカの所有者が私たちについてQEF選挙を行う場合、私たちは私たちの収入と利益から支払われたいかなる分配も、以前QEF選挙に含まれていたアメリカの所有者の収入に含まれていて、アメリカの所有者に課税されません。米国持株者は、QEF選挙に含まれる任意の収入に相当する税ベースを、その米国預託証明書または普通株式に増加させ、米国預託証明書または普通株式に割り当てられた米国保有者の収入に含まれない任意の金額からその課税基数を減算する。さらに、米国持株者は、米国預託証明書または普通株を売却する資本収益または損失を確認し、その金額は、ドルで決定された米国預託証明書または普通株現金化金額と、米国保有者の米国預託証明書または普通株における調整税ベースとの間の差額に等しい。米国の保有者は私たちがPFICではないどの年でも、QEF規則に基づいて一般収入と純資本収益に課税しない。
米国保有者が米国預託証明書を保有しているいかなる年度においてもPFICに分類され、課税対象の米国保有者がQEF選挙も行われておらず、以下に述べる時価建ての選択も行われていない場合、当該米国保有者には、(A)米国預託証明書によって達成された任意の収益を売却または処分すること、および(B)米国保有者に(一般的には、)米国保有者に特殊税制度が適用される。米国所有者が任意の年度に受信した割り当てられた米国所有者は、米国所有者が以前の3年または米国保有者が米国預託証明書を保持している間に短い1年以内に受信した平均年間割り当ての125%)よりも税部分を評価すべきである。米国の保有者が米国の預託証明書を販売または他の方法で処理する際に確認された任意の収益および任意の超過割当は、米国の保有者が米国の預託証明書を所有している間に比例して割り当てられる。販売またはその他の処分に割り当てられた課税年度およびPFICになるまでのいずれかの年度の金額は一般収入として課税される。他の課税年度に割り当てられた額は、個人や会社(場合によっては)に適用される当該課税年度の最高税率で納税されますが、一般的に少ない税金に適用される利息料金には、関連課税年度に支払うべき税金とみなされます。PFICとして分類されることはまた、米国保有者が個人である場合に、このような米国保有者の死亡時の米国預託証明書(ADS)による増加を拒否することを含む、他の不利な税金結果を生じる可能性がある。
我々の推定毛収入,商誉を含む資産平均価値と我々の活発な業務の性質から,2023年12月31日までの納税年度では,米国所得税面のPFICであると考えられる。PFICの地位は事実的であり、完全に我々の制御範囲内ではない要因に依存して、通常、関連納税年度が終了するまでは確定できず、毎年決定されるため、本課税年度または将来の任意の特定年度におけるPFICの地位は保証されない。私たちは、他の要素を除いて、現金を含む大量の受動資産を持っているため、本課税年度または将来の任意の課税年度がPFICになるかどうかは不確定であり、私たちがPFIC目的で非受動的収入を生成する資産の推定値は、私たちの営業権や他の無形資産を含めて不確定であり、時間の経過とともに大きく変化するかもしれない。また,我々の資産や収入の構成は時間の経過とともに大きく変化する可能性がある.任意の納税年度におけるPFICの地位(適用範囲内)を決定するために、私たちの資産の平均四半期価値は、通常、私たちの時価を部分的に参考にして決定され、時価は変動し、時間の経過とともに大幅に変動し続ける可能性がある。したがって、本課税年度または将来のいかなる課税年度内に、個人投資会社にはならないことは保証されません。そのため、アメリカの保有者はPFICへの投資に関連するアメリカ連邦所得税の結果を負担したい場合にのみ、私たちのアメリカ預託証明書に投資すべきである。
時価で選挙する
もし我々が米国保有者が米国預託証明書を保有する任意の納税年度のPFICであれば,米国保有者は米国預託証明書の収益を時価に応じた一般収入に計上することを選択することができ,米国預託証明書は上記の特殊な税収制度や利息課金規則の制約を受けるのではなく,“合格取引所”で“定期取引”とみなされることを前提としている。一般的にアメリカの預託証明書はある日例年に“定期取引”とされます極小のこの例年のカレンダー四半期ごとに、少なくとも15日間の米国預託証明書の数が合格取引所で取引されている。米国国税局(IRS)は、“適格取引所”を構成する可能性のある具体的な取引所を特定できる権威機関を公表していないが、財務省の法規では、合格取引所は、(A)米国証券取引委員会(SEC)または米国証券取引委員会(Sequoia Ital Capital)に登録されている米国証券取引所、(B)米国市場システムである
146
1934年の証券取引法第11 A条に基づいて設立された非米国証券取引所、または(C)市場所在国政府当局によって監督または監督されている非米国証券取引所であり、条件は、(I)このような非米国取引所が取引量、上場、財務開示、監視およびその他の詐欺的および操作的行為およびやり方を防止し、障害を除去し、自由、開放、公平かつ秩序ある市場メカニズムを改善し、投資家を保護することを目的としていることである。一方、当該等の非米国取引所の所在国の法律及び当該等の非米国取引所の規則を確保して当該等の要求が実際に実行され、及び(Ii)当該等の非米国取引所の規則が上場株の活発な取引を効果的に促進する。私たちはアメリカ証券取引委員会に登録されたアメリカ証券取引所であるナスダック資本市場への私たちのアメリカ預託証明書の上場を許可されました。しかし、米国の預託証明書が時価ベースの選挙で“定期取引”とされる要求に適合する保証はない。また、私たちが所有する可能性のある任意の低レベルのPFICに対して時価での選挙を行うことができないため、米国保有者の私たちが持っている任意の投資における間接的権益(米国連邦所得税目的でPFICとみなされる株式)は、将来PFICの任意の子会社とみなされる株を含む特殊な税収制度の制約を受け続ける可能性がある。
米国の保有者が時価で価格を計算することを選択した場合、私たちがPFICである任意の年に、米国の保有者は、年末の米国預託証明書の公平な市場価値が、これらの米国預託証明書に基づく部分を一般収入とすることを要求されるだろう。また、当該米国保有者の米国預託証明書における基準が年末に当該米国保有者の公平な市場価値を超える部分は、一般損失として差し引くことができ、その額は、(I)超過した金額又は(Ii)当該米国保有者が前年の収入に計上した時価当たりの純収益額に等しい。当該米国所有者が当該米国保有者の米国預託証明書を売却する際に確認した任意の収益は、販売年度に一般収入として納税される。一般収入とみなされる金額は、適格配当収入や長期資本利益に適用される優遇税率を受ける資格がない。米国保有者の米国預託証明書における調整税ベースは、任意の収入に含まれる金額を増加させ、時価計算規則による任意の控除金額を差し引く。米国の保有者が時価建ての選択をした場合、それは、米国預託証明書がもはや合格取引所で定期的に取引されていないか、または米国国税局が選択を取り消すことに同意しない限り、選択された納税年度およびその後のすべての納税年度に有効である。
統制された外国の会社
減税及び雇用法案又は税法は、制御された外国企業又はフロン化炭素規則に基づいて推定持分を決定することを目的として、“税法”第958条(B)(4)条に基づいて非米国人の“下方帰属”を禁止する米国人の規定を廃止する。したがって、我々の米国子会社は、会社がフルオロカーボン目的で保有しているすべての非米国子会社の株を所有しているとみなされる。ある非米国子会社がいかなる課税年度においてもCFCとみなされている場合、この納税年度の最終日に、非米国エンティティ(当社を含む)を介して私たちの普通株を直接または間接的に保有するCFCsについては、すべての米国人が“10%米国株主”とみなされ、通常、CFCのある投資収入に比例して総収入を一般収入として計上する必要があり、その収入が実際に米国人に割り当てられているか否かにかかわらず(ある調整により)。非米国会社の“10%米国株主”は、非米国会社株を所有(または所有とみなされる)を含むいずれかの米国人を含み、当該米国人は、非米国会社株の総投票権または総価値の10%以上を所有している。税法の立法歴史によると、この変化は、私たちの非米国子会社が私たちのアメリカ子会社とは関係のない10%の米国株主のCFCsとみなされるためではないことを示している。しかし、米国国税局や裁判所がこのような明確な意図と一致した方法で税法の変更を解釈するかどうかは不明である。
アメリカ預託証明書を持っていることがアメリカの10%の株主になるかどうか、この分類の影響を確認するために、自分の税務コンサルタントにお問い合わせすることを強くお勧めします。
147
情報報告要求
もし私たちが米国保有者が米国預託証明書の任意の課税年度のPFICを持っている場合、各米国保有者は通常、米国財務省が要求する可能性のある情報が含まれている米国国税局表8621の年間情報申告書の提出を要求される。IRS表8621を提出できなかった場合、米国連邦所得税に処罰を加え、訴訟時効を延長する可能性がある。
PFICに関するアメリカ連邦所得税規則は複雑です。米国保有者に、米国預託証明書の購入、所有権および処分、時価計算選挙の可用性、その特定の状況下で選択が望ましいかどうか、および米国国税局の米国預託証明書の購入、所有権および処置に関する情報報告義務についてその税務顧問に相談するよう促す。
アメリカ預託証明書への配当金とその他の分配への課税
上記のタイトル“受動型外国投資会社の考慮事項”の議論によると、一般的には、このように控除された任意の非米国税項を減額する前に、米国預託証明書について米国保有者への分配総額(あれば)を配当金として毛収入に計上し、その割り当てが私たちが現在または累積している収益と利益(米国連邦所得税原則に基づいて決定されている)から支払われていれば。もし任意の現金分配の金額が私たちの現在と累積の収益と利益を超えた場合、それはまずそのアメリカ預託証明書の中でそのアメリカ所有者の納税基礎の免税リターンとみなされ、分配された金額がそのアメリカ所有者の納税基礎を超えた場合、超えた部分は資本利益として課税される。私たちはアメリカ連邦所得税の原則に基づいて私たちの収入と利益を計算するつもりはない。したがって、米国所有者は、分配は通常配当金とみなされ、その分配がそうでなくても免税資本収益とみなされるか、または上記の規則に従って資本収益とみなされることを期待すべきである。米国預託証券に関する配当金は、他の米国会社から受け取った配当金について会社が許可した配当金控除に該当しない。特定の保有期間要件および何らかのリスク低減が存在しない取引を含むいくつかの条件が満たされている場合、非会社米国保有者は、長期資本利益(すなわち、1年以上保有する資本資産を売却する収益)に適した米国預託証券配当金のより低い税率を享受する資格がある。しかし,配当金を支払う課税年度がPFIC,あるいは前の課税年度がPFICであれば,このような低減税率は適用されない。本文“配当政策”の節で述べたように、私たちは私たちの業務のためにどんな収益も維持するつもりで、現在は私たちの普通株に配当金を支払うつもりはありません。
以下の段落の規定によれば、配当金は、通常、米国以外の源からの収入を構成することになり、これは、米国保有者の外国税控除限度額の計算に関連する可能性がある。そのため、私たちが通常分配する配当金は“受動的カテゴリ収入”を構成しなければならない、あるいは、あるアメリカの保有者にとっては、“一般カテゴリ収入”を構成すべきである。配当金の支払いは、英国税によって源泉徴収されないか、控除されなくてもよい。
上記の規定にもかかわらず、50%以上の米国預託証明書が米国人が保有しているとみなされれば、“米国が所有する外国会社”とみなされる。この場合、米国の外国税収控除については、配当金は米国以外の源からの収入と見なすことができるが、我々の非米国由来の収入および利益から支払われる程度、我々の米国由来の収入および利益から支払われる程度は、米国内からの収入とみなされる。私たちがアメリカが所有している外国の会社とみなされないという保証はない。配当金が長期資本利益に一般的に適用されるより低い税率で課税される場合(上述したように)、米国の外国税収相殺限度額を計算する際に考慮される配当金金額は、通常、配当金に適用される最高税率で割った配当総額に割引税率を乗じることに限定される。外国の税収控除を決定することに関する規則は複雑で、米国の所有者に彼らの税務顧問に相談して、これらのアメリカの所有者が外国の税金免除をどの程度享受する権利があるかを決定するように促す。
148
アメリカ預託証券処分の課税
上記の“受動外国投資会社注意事項”の議論によると、米国所有者は、任意の米国預託株式の売却、交換または他の課税処分の課税損益を確認し、米国預託株式の実現済み金額(現金金額(ドルで計算)に受信した任意の財産の公平な市場価値)と、当該米国保有者の米国預託株式における納税ベース(ドルで計算)との差額に等しい。収益または損失は一般的に資本収益または損失だ。このような資本収益または損失は、一般に、非会社の米国保有者に対して低い税率で納税されるか、または販売、交換または他の処置の日に、米国預託証明書保持者が1年を超える米国預託証明書を保有する場合、長期資本損失である。資本損失の控除には制限がある。このような収益または損失のいずれかは、一般に、米国の外国税控除の米国源収入または損失とみなされる。
外貨の処置
私たちは、アメリカの保有者に、私たちのアメリカ預託証明書で配当金として受け取った任意の非米国通貨、またはアメリカ預託株式を売却または退役する際の税金結果について、彼らの税務顧問に相談するように促します。
純投資所得税
米国の保有者の一部または全部の“純投資収入”は3.8%の連邦医療保険税が追加徴収される可能性がある。純投資収入は、一般に、そのような収入が貿易またはビジネスを行う通常のプロセスで得られない限り、米国預託証明書からの収入を含む(いくつかの受動的または取引活動からなる貿易またはビジネスを除く)。あなたはあなたの税務顧問に相談して、この連邦医療保険税があなたのアメリカ預託証明書の買収、所有権、あるいは処置に与える影響を理解すべきです。
情報報告とバックアップ減納
米国預託証明書と売却、交換または処分に関する米国預託証明書の収益の分配は、米国国税局に情報を報告し、可能な米国予備控除の影響を受ける可能性がある。しかしながら、バックアップバックルは、正しい納税者識別子を提供し、任意の他の必要な証明を行う米国の所有者、または他の方法でバックアップ源泉徴収を免除する人には適用されない。免除身分の確立を要求された米国の保有者は、通常、米国国税局W-9表上でこのような証明を提供しなければならない。米国の保有者に、米国の情報報告とバックアップ源泉徴収ルールの適用について彼らの税務顧問に相談するよう促す。
予備源泉徴収は付加税ではありません。予備源泉徴収の源泉徴収金額は、米国所有者の米国連邦所得税債務に記入することができ、米国所有者は、適切な返金申請を米国国税局に提出し、任意の必要な情報を提供することによって、予備源泉徴収規則に従って源泉徴収された任意の超過額の返金を得ることができる。
対外金融資産情報報告
個人またはいくつかの国内実体である米国保有者は、米国預託証明書に対する保有者の実益所有権に関するいくつかの情報を米国国税局に提出することを要求される可能性があり、もしこれらの米国預託証明書が金融機関によって保持者を代表して保有されていない場合、私たちの普通株式は“特定の外国金融資産”とみなされるからである。もしアメリカの保有者がアメリカ国税局にこのような情報を提出することを要求されたが、そうしなければ、この法律は罰や他の潜在的な不利な税金結果も加えるだろう。米国の保有者に、米国預託証明書の所有権と処置に適用される可能性のある潜在的な情報報告義務について税務コンサルタントに相談することを促す。
上記の説明は、米国預託証明書の買収、所有権と処分に関連するすべての税務結果の完全な分析を構成することを目的としていない。潜在的購入者は、その特定の状況に関連する税金結果について彼らの税務コンサルタントに相談するように促されている。
イギリスの税務面の考慮
以下は米国預託証明書の所有権と処分に関連するいくつかの連合王国税務考慮事項の一般的な要約であり、米国預託証明書への投資に関するすべての可能な税務結果には触れていない。英国の現行税法をもとに、今年度の報告書発表日から公表されている“イギリス税務と税関慣行”(HMRC)は、両者とも変化する可能性があり、追跡力がある可能性がある。
149
本イギリスの税収部分の執筆根拠は,会社が税収目的のみでイギリスに住んでいるため,米国税制ではなくイギリス税制の制約を受けることである(上記タイトルが“重要な米国連邦所得税考慮事項”の節で議論されている場合を除く)。これに基づいて、会社が支払った配当金はアメリカの配当金ではなくイギリスの配当金とみなされるだろう。
別の規定に加えて、本要約は、税務目的のためにイギリスに居住する(個人的には、その居住またはイギリスを居留とみなされる)だけであり、他の任意の司法管轄区に居住しているわけではなく、米国の預託証明書を所有することに関連する任意の他の司法管轄区域に常設機関または固定基地を有していない者にのみ適用される。このような人々はここでは連合王国保持者と呼ばれている。以下の者(A)は税務目的で連合王国に居住しているのではなく(又は住民であれば、イギリスを居籍とみなされているわけではない)、米国預託証明書が属するイギリス支店、代理又は常設機関を介して連合王国で貿易を行う個人及び会社、又は(B)連合王国以外の司法管轄区に居住している又は他の方法で納税しなければならない者を含むことを提案し、その税務責任について専門顧問の意見を聞くことを提案する。
本要約は、一般的な参考に供するだけであり、任意の特定の投資家に対する法律または税務提案とみなされることも意図されていない。それは、特定の投資家の特定の状況またはイギリス税法によって特殊な待遇を受ける可能性のある投資家に関連するすべての税金考慮要因を解決していない。特に:
本要約では、英国税務監察委員会の指針によれば、米国預託証明書保持者は、英国税務監査委員会によって関連普通株の実益所有者とみなされ、関連普通株について支払われる任意の配当金(英国税務については、配当金は、その者自身の収入(他の者の収入ではなく)の実益所有者とみなされると仮定する。
アメリカ預託証明書の潜在投資家は投資前に、それ自身の税務顧問に相談し、その全体の税務結果を確認し、特にイギリス税法及びイギリス税務管理委員会の慣例に基づいて、その特定の情況下でアメリカ預託証明書の結果を買収、所有及び処分すべきである。特に、非イギリス住民または居留者には、任意の関連する二重課税協定の潜在的な影響を考慮することを提案する。
配当の課税
税金を前納する。米国預託証明書または普通株の配当金支払いは英国税によって差し引かれたり控除されなくてもよい。
イギリスの所得税です。会社から配当金を受け取った英国個人所有者(税務目的で連合王国に住む個人)は、配当金について所得税を納めるのが一般的だ。2023/2024課税年度には、イギリス個人所有者が受け取った配当金の最初の1,000 GB(“配当手当”)は一般に0%の税率で所得税を納付する。0%課税された配当収入は、免税免税額を超える収入の税率が決定された場合(任意の所得税個人免税額があるか否かに応じて)考慮される。配当手当は2024年4月6日に1000 GBから500 GBに引き下げられる。
基本税率で所得税を納めたイギリス個人所有者は、現在の8.75%の限界税率で配当金に課税される。高い税率(ただし追加税率を含まない)で所得税を納付しなければならないイギリス個人所有者は、現行税率33.75%で配当金を所得税を納付しなければならないが、その金が所持者収入の最高部分とみなされている場合、高い税率所得税の徴収点を超える。
150
追加税率で所得税を納める責任がある英国個人所有者は、その収入(配当を含む)が追加税率のハードルを超えた場合、現在の39.35%の税率で配当金所得税を支払う。
スコットランドの納税者である個人は、スコットランド納税者に適用される徴収点を参照するのではなく、英国所得税の徴収点を参照して所得税を納めるように、他の英国納税者と同じ配当税率で配当税を支払う。
非イギリス所有者(米国預託証明書が属する支店または機関を介してイギリスで業界、専門または職業を経営する個人を除く)は、税務目的でイギリス以外の場所に住んでいる場合、その会社から取得した配当金についてイギリス税を支払う必要はない。
イギリスの会社税です。イギリスの会社税を納めた場合、イギリスの所有者は配当金の支払いについてイギリスの会社税の免除を受ける権利がある。免税条件を満たしていない場合、または当該イギリスの保有者が他の方面の免税配当金を選択して納税しなければ、任意の配当金の金額に連合王国会社税を徴収する。年間利益が250,000 GB以上のイギリス企業(または会社グループ)については、2023/2024社税年間イギリス法人税の主要税率は25%である。潜在的な投資家が自分の立場に何か疑問があれば、彼らは自分の専門顧問に相談すべきだ。
米国預託証明書を保有していない会社所有者は、米国預託証明書が帰属する常設機関を介してイギリスで取引を行わない限り、会社から取得した配当金はイギリス会社税を支払う必要がない。この場合、持株者は、その個人状況に応じて、及び上記イギリス会社税を免除する規定が適用されない場合には、会社から取得した配当金に対してイギリス会社税を徴収することができる。
財産権処分の課税
イギリス所有者です。イギリス資本利得税について言えば、イギリス個人所有者がアメリカ預託証明書を売却あるいは売却するとみなされ、課税収益或いは許容損失が生じる可能性があり、その個人状況に依存する。米国預託証明書の売却を決定する資本利益税状況の主な要因は、イギリスの保有者が米国預託証明書を売却する課税年度に任意の他の資本収益を現金化する程度、所持者の当該課税年度又は任意の早い課税年度における資本損失程度、及び当該課税年度の年間免税収益免税額レベル(“年度免除”)である。2023/2024納税年度の年間免税額は6000 GB、2024年4月6日には3000 GBに低下する。すべての許可された控除額の後、高い税率またはそれ以上の税率で英国所得税を納付する英国個人所有者が、米国預託証明書を売却する際にイギリス資本利益税を納付しなければならない場合、現在適用されている税率は20%である。基本税率でイギリス所得税を納付するイギリス個人所有者については、すべての許可された控除後、このような売却についてイギリス資本利得税を納付すべきであり、現在適用されている税率は10%であり、いかなる資本利益が未使用の基本税率税級を超えない限り、現在適用される税率は10%となる。この場合、現在超過部分に適用される税率は20%だ。
5年以内に連合王国に居住しなくなった場合(または二重課税猶予の場合、彼または彼女は連合王国以外の地域に居住しているとみなされなくなる)、この一時的な非滞在中に彼または彼女の米国預託証明書を処分する場合、彼または彼女は連合王国に戻る際(または二重課税猶予の場合は連合王国以外の住民とみなされなくなる)の課税収益であり、その処分によって得られた課税収益について連合王国資本利得税を支払うことができる(ただし、獲得可能な免除または猶予の規定を受けなければならない)。
イギリスの会社税については、会社の所有者がアメリカの預託証明書を売却または売却するとみなされ、課税収益や許容損失が生じる可能性がある。指数付け手当(歴史的に会社税を支払うべき利益額を減らすための)は、2018年1月1日以降に買収した米国預託証明書を処分して英国社の所有者に与えるいかなる収益も減少しない。
英国所有者ではないそれは.以下,非イギリス所有者が課税収益について英国税を納付する段落については,会社はイギリスの土地から75%以上の総資産価値を獲得しないと仮定する。
英国の保有者でない個人所有者は、その米国預託証明書を売却するために現金化された資本収益のために英国資本利得税を納付する必要はない。当該所持者が当該等の米国預託証明書が属するイギリス常設機関を通じてイギリスで(単独または共同経営を問わず)貿易、専門または職業に従事しない限り。この場合、当該所持者は、その個人状況に応じて、その米国預託証明書を売却することによる課税収益に対してイギリス資本利益税を徴収することができる。
151
英国保有者でない米国預託証明書の会社所有者は、米国預託証明書が所属する常設機関を介してイギリスで貿易を行わない限り、その米国預託証明書を売却するために現金化された課税収益にイギリス会社税を納める必要はない。この場合、当該保有者が米国預託証明書を処分することは、課税収益やイギリス会社税が許可する損失が生じる可能性がある。
印紙税および印紙税備蓄税
英国印紙税と印紙税備蓄税(SDRT)に関する以下の声明は、関連する米国預託証明書所持者がイギリスに居住しているか否かにかかわらず、適用される。
普通株の発行と譲渡
発行(ホストまたは決済サービス機関を含む)。普通株の発行はイギリス印紙税を支払う必要がありません。
普通株式を発行する場合は、預託証明書システムや決済サービスに特別引き出し権を支払うことはありません。我々の知る限り,HMRCは預託信託会社またはDTCがイギリス印紙税と特別引き出し権目的の清算サービスであることを認めている。
預かりサービスまたは清算サービスに移行します。一般株式を預託証明書の発行又は決済サービスを提供する者を含むか、又はその人の代理者又は代理人に譲渡する無条件合意は、一般に、イギリス税務及び先物事務監察委員会によって、対価金額又は価値の1.5%(場合によっては、又は場合によっては)の対価又は価値の1.5%の比率で普通株式を譲渡する(譲渡が書面で行われている場合は、印紙税を納付しなければならない)、決済サービスについては、当該会社が“1986年財務法令”第97 A(1)条に基づいて選択されたものとみなされる。又は(B)この項の譲渡は、ある項の免除集資手配又はある項の免除上場手配の過程で行われる。普通株式の預託証明システムと清算サービスとの間の譲渡は、一般に、清算サービスについて、1986年の金融法第97 A(1)条に基づいて選択されない限り、印紙税および特別引き出し権を免除する。私たちの理解はDTCがそのような選択をしなかったということだ。
振込は販売しています。書面譲渡文書で普通株を譲渡する場合、一般的に譲渡対価金額または価値の0.5%でイギリス印紙税を徴収しなければならない。購入者は通常印紙税を支払う。
預託証明システムまたは清算サービスにおいて普通株を譲渡することは、清算サービスが1986年の金融法第97 A(1)条に基づいて選択されない限り、印紙税または特別引き出し権を徴収してはならない。私たちの理解はDTCがそのような選択をしなかったということだ。
普通株を預託証明システムや決済サービス以外に移行するプロトコルは,通常,購入方向SDRTが対価格金額や価値0.5%の割合で責任を負うことになる.このような特別引出税は、押記が発生した月の翌月の7日目に支払うべきであるが、譲渡文書が契約日から6年の満了前に署名され、適切な印紙を押した場合、(1)任意の未払い特別引出税は支払いを停止し、(2)支払われた任意の特別引出税は、イギリス税務および税関総署に回収することができ、一般に利息を含む。
米国預託証明書/米国預託証明書の発行または譲渡
イギリス税務及び税関総署が現行公表している慣例によると、発行又は譲渡(無条件譲渡協定を含む)はイギリス印紙税又は特別引き出し税を支払うべきではない 預託証券およびそれに関連する米国預託株式は、イギリス印紙税については、預託証券は“株”や“有価証券”とはみなされず、特別引き出し権については“課税証券”ともみなされないという根拠である。
F. 配当金と有料代理店
適用されません。
G.声明専門家が紹介する
適用されません。
152
H. 書類陳列中
私たちは取引法の情報要求事項を守らなければならない。したがって、我々は、Form 20-F年次報告およびForm 6-K報告を含む報告書およびその他の情報を米国証券取引委員会に提出することを要求される。ワシントンD.C.20549号NE.100 F Streetの公共資料室でアメリカ証券取引委員会に提出された報告書やその他の情報を閲覧してコピーすることができます。公共資料室の運営状況については、アメリカ証券取引委員会に電話して請求することができる。また、米国証券取引委員会は、発行者に関する報告書や他の情報を含むインターネットサイトを維持しており、これらの発行者は、私たちと同様に、米国証券取引委員会に電子的に記録されている。このサイトのサイトはwww.sec.govです。
我々はまた、米国証券取引委員会または米国証券取引委員会に電子的に提出された文書を電子的に提出した後、これらの報告書の任意の修正、およびいくつかの他の米国証券取引委員会文書を含む、我々のウェブサイト上で、これらの報告書の任意の修正を含む、我々のウェブサイト上でできるだけ早く当社の年報およびForm 6-K報告書のテキストを無料で提供する。私たちのサイトの住所はwww.nucana.comです。当社のサイトに掲載されている資料は参考に本年報に組み込まれていません。
I. 子会社情報
適用されません。
プロジェクト11.数量化と品質VE市場リスクの開示について
市場リスクは私たちの金利と通貨レートの変動に対する私たちのリスクの開放から来ている。これらのリスクを管理する方法は、我々が業務を運営している2つの主要通貨のうち適切な現金預金の組み合わせを維持し、予想される流動性要求に応じて異なる時期に様々な金融機関に保管することである。
金利リスク
会社は2023年12月31日現在、現金および現金等価物1720万GB(2022年:GB 4190万)を保有している。金利感度リスクは主に基礎銀行の金利変化の影響を受ける。会社の黒字現金と現金等価物は、利息計算口座および定期預金に投資され、これらの口座と預金証書は、各口座で合意された条項に基づいて固定または可変の金利で利息を稼ぐ。当社は取引や投機目的のための投資はしていません。
銀行金利が0.5ポイント上昇するごとに、変動および短期固定金利預金に使用可能な現金および現金等価物の年間純利息収入は45,000 GB増加する (2022: £169,000).
貨幣リスク
当社の機能通貨はイギリスポンドで、私たちの取引は通常この貨幣で価格を計算します。しかし、一部の費用は他の通貨で発生し、主にドルであり、この為替レートの影響を受ける。
同社はイギリスに本部を置いているが,米国,EU,インドを含む世界各地から活性薬物成分,原材料,研究·開発,製造,コンサルティング,その他のサービスを調達している。上記の他の管轄区域通貨に対するポンドのいかなる切り下げも、当社がこのような商品やサービスを購入するコストをより高くすることになる。同社は、これらの他の通貨で計算される予測可能な中短期支出を満たすために、通貨現金残高を適切なレベルに維持することで、このリスクを最小限にしようとしている。そこで,同社はかなりの現金と現金等価物をドルとし,為替変動がこれらの残高に及ぼす影響を報告している。当社はデリバティブツールを使用して為替リスクを管理していません。ポンドのドルに対する価値が1%増加するごとに、2023年12月31日に外貨で計算される金融資産と純負債の帳簿価値は74,000 GB(2022:283,000 GB)減少する。
私たちの数量と品質リスクに関するより多くの情報は、本年度報告書の他の部分の総合財務諸表付記18を参照してください
153
第12項.証券化の説明株式証券を除くS
A. 債務問題物置
適用されません。
B. 株式承認証権利があります
適用されません。
C. 他の人S成績表
適用されません。
シティバンク(Citibank,N.A.)は米国預託証明書の信託機関を務めることに同意した。シティバンクの預かり事務所はニューヨークグリニッジ街388番地にあり、郵便番号:10013。米国預託証明書は信託機関に保管されている証券の所有権権益を代表する。米国の預託証明書は、米国の預託証明書またはADRと一般的に呼ばれる証明書によって表すことができる。預かり人は通常、保管されている証券を保管するために預かり人を指定します。この場合、預かり人はシティバンクロンドン支店です。
預金協定によると、私たちはシティバンクを信託銀行として指定した。預金契約の写しは、米国証券取引委員会のF-6表登録声明の表紙の下に保存されている。米国証券取引委員会公共資料室(郵便番号:20549)または米国証券取引委員会ウェブサイト(www.sec.gov)から預金プロトコルのコピーを取得することができます。このコピーを検索する際には、登録番号333−220392を参照してください。
費用と料金
米国預託株式の保有者として、預金契約の条項により、以下の費用を請求されます
サービス.サービス |
|
料金を取る |
米国預託証券(例えば、米国預託株式預託普通株または米国預託株式(S)と普通株式比率が変化した場合に発行される)は、普通株式分配により発行された米国預託株式は含まれていない |
|
アメリカの預託株式1匹当たり最高$0.05 |
|
|
|
米国預託証券の解約(例えば、米国預託財産の交付または米国預託株式(S)と普通株式比率の変化により米国預託証明書を解約する) |
|
米国預託株式1件につき最高0.05ドルを廃止 |
|
|
|
現金配当金または他の現金分配(例えば、権利および他の権利を売却する場合) |
|
保有するアメリカ預託株式は最高$0.05を得ることができます |
|
|
|
(I)株式配当金又はその他の分配、又は(Ii)追加の米国預託証明書を購入する権利を行使して米国預託証明書を分配する |
|
保有するアメリカ預託株式は最高$0.05を得ることができます |
|
|
|
米国預託証券以外の証券を流通したり、追加の米国預託証明書を購入する権利(例えば、分割時) |
|
保有するアメリカ預託株式は最高$0.05を得ることができます |
|
|
|
アメリカ預託株式サービス |
|
信託銀行に設立された適用記録日(S)に保有する米国預託株式は、最高0.05ドルに達する |
154
アメリカ預託株式の保有者として、例えば、いくつかの費用を支払う責任が必要です
米国預託株式の手数料及び料金は、(I)米国預託証明書の発行及び(Ii)米国預託証明書の解約により、米国預託株式を発行された者(例えば、米国預託株式に属する)及びその米国預託証明書が抹消された者(例えば、米国預託株式の抹消)から徴収される。米国預託証明書がホスト銀行から預託証明書に発行される場合、米国預託株式の発行およびログアウト手数料は、預託証明書による分配から差し引くことができ、状況に応じて利益者(S)を代表して、発行中の米国預託証明書を受信した預託証明書参加者(S)またはログアウトされた預託証明書参加者(S)に受け取り、預託証明書参加者(S)がその時点で有効な預託証明書参加者(S)の手続きおよび慣例に従って適用される実益所有者(S)の口座に計上することができる。米国預託株式の流通に関する費用と料金及び米国預託株式サービス料は適用される米国預託株式記録日から保有者から徴収される。現金を配布する場合には,適用される米国預託株式手数料と手数料は配布された資金から差し引かれる。(I)非現金の配布および(Ii)米国預託株式サービス料であれば、米国預託株式記録日までの所持者は、米国預託株式発行者への配布から差し引くことができる米国預託株式費用および有料領収書を受け取る。DTCを通じて保有する米国預託証明書については、非現金で発行された米国預託株式手数料と米国預託株式手数料はDTCによる配布から差し引くことができ、DTCが規定する手続きとやり方に従ってDTC参加者に受け取ることができ、DTC参加者はさらにADSを持つ受益者にこのような米国預託株式費用と課金を受け取ることができる。
受託費用の支払いを拒否した場合、受託者は、信託契約の条項に従って、支払いを受信する前に要求されたサービスを拒否することができ、または米国預託株式所有者への任意の分配から、ホスト費用および課金の金額を相殺することができる。
お支払いが必要な料金や料金は時間とともに変化する可能性があり、私たちやホスト機関によって変更される場合がありますのでご注意ください。このような変更に関する事前通知を受けることになります。受託者は、吾等と係の者とが時々合意した条項や条件に基づいて、ADRプロジェクトに関連する一部の米国預託株式費用やその他の方法を提供することにより、吾等のADRプロジェクトによる何らかの費用を補償することができる。
155
部分第2部:
第13項.違約、配当A家賃と借金
ない。
プロジェクト14.右翼の材料修正証券保有者の証券と収益の使用
適用されません。
プロジェクト15.制御プログラムがあります
A.開示制御LSとプログラム
我々の経営陣は、最高経営責任者及び最高財務責任者の参加の下、本年度報告の期間終了までの開示制御及び手順(取引所法案規則13 a−15(E)及び15 d−15(E)で定義されるような)の有効性を評価した。このような評価に基づいて、我々のCEOおよび財務官は、取引所法案に基づいて提出または提出された報告で開示を要求した情報が、米国証券取引委員会規則および表で指定された期間内に記録、処理、まとめ、報告され、必要な開示について決定するために、我々の経営陣に蓄積され、伝達されることを保証するために、我々の開示制御および手続きが有効であると結論した。
B.国際ミラノに関する経営陣の年次報告NALによる財務報告の制御
我々の経営陣は、取引所法案第13 a-15(F)条の規定に基づいて、財務報告書の十分な内部統制を確立·維持する責任がある。我々の財務報告に対する内部統制は、国際会計基準委員会が発表した国際財務報告基準に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供する過程である。我々は、“取引所法案”と2002年の“サバンズ·オキシリー法案”第404条の要件の遵守を確保するために、財務報告の内部統制を検討する計画を持っている。その固有の限界により、財務報告の内部統制はすべての誤報を防止または発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
我々の経営陣は、最高経営責任者と財務責任者の参加の下、2023年12月31日までの財務報告書の内部統制に対する有効性を評価した。財務報告の内部統制を評価する際に、経営陣の評価に基づく内部制御-統合フレームワーク(2013年)テレデビル委員会(COSO)後援組織委員会は2023年12月31日に発表された。評価によると、我々の経営陣は、財務報告書の内部統制に2023年12月31日まで有効であると結論した。
C.登録機関の認証報告公認会計士事務所
本報告書には、私たちの公認会計士事務所の認証報告は含まれていません。私たちは現在加速申請者ではないからです。
D.内部制御の変化財務報告を述べる
本年度報告がカバーする期間中、財務報告の内部統制(外国為替法案第13 a-15(F)条参照)に大きな影響を与えるか、または合理的に財務報告の内部統制に大きな影響を与える可能性のある変化は発生しない。
プロジェクト16 A。審査提出TEE財務の専門家
私たちの監査委員会は3人の非執行役員Adam George、Martin Mellish、およびCyrille Leperlierで構成されており、各メンバーは規則10 A-3、取引所法案、およびナスダック株式市場の上場基準で定義されている“独立した役員”である。アダム·ジョージが委員会の議長を務めています当社の取締役会は、ジョージさんが20-F表の16 A項で定義した“監査委員会財務の専門家”であることを決定しました。
156
プロジェクト16 B。コード倫理学のE
私たちの商業行為と道徳基準は私たちのすべての従業員、高級管理者、役員に適用され、私たちのウェブサイトhttp://www.nucana.comで見つけることができます。私たちは、本規則の任意の修正またはその要求に対するいかなる免除も、私たちのウェブサイトで開示されると予想している。当サイトに含まれている情報や当サイトを介してアクセスできる情報は、引用的に本年度報告書に組み込まれることはありません。私たちのサイト上の情報は、本年度報告の一部とみなされてはなりません。
プロジェクト16 Cです。主な取引先暫定料金とサービス
我々の財務諸表は、国際財務報告基準に基づいて作成され、米国上場企業会計監督委員会に登録された独立公認会計士事務所安永会計士事務所が監査する。
安永法律事務所は,2021年12月31日,2022年12月31日,2023年12月31日までの各年度に独立公認会計士を務めており,その監査報告書は本年度報告に見られる。
次の表に私たち(いくつかの子会社を含む)に受け取った安永法律事務所サービスの総費用を示します。
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
|
|
(単位:千) |
|
|||||
料金を審査する |
|
£ |
353 |
|
|
£ |
407 |
|
監査関連費用(1) |
|
|
277 |
|
|
|
128 |
|
合計する |
|
£ |
630 |
|
|
£ |
535 |
|
我々の監査委員会は、我々に関連する監査サービスの範囲及び費用、並びに独立監査師が提供する許容可能な非監査サービスを審査及び事前承認しているが、次のサービスを除く極小の監査委員会が監査完了前に承認したサービス。安永法律事務所が過去2会計年度に提供したわが社関連のサービスはすべて監査委員会の承認を得ています。
プロジェクト16 Dです。Listiから免除を受ける監査委員会のNG基準
適用されません。
プロジェクト16 E。株式証券を購入する発行者と関連購入者によって
適用されません。
プロジェクト16 Fです。“ルール”における変化ランド認証会計士
適用されません。
プロジェクト16 Gです。体ATEガバナンス
米国証券取引委員会が定義した“海外個人発行者”としては、ナスダック株式市場やナスダックの国内発行者に対する他の要求ではなく、イングランドやウェールズのいくつかの会社統治実践に従うことが許可されているが、外国の個人発行者に適用されるナスダック社管理規則に従う予定である。大多数のナスダック社のガバナンス規則を自発的に遵守していますが、以下の限られた免除を利用するつもりです
157
また、ナスダック第5615(A)(3)条には、ナスダック第5600シリーズ規則及び第5250(D)条のいくつかの規則の代わりに、ナスダックの“コンプライアンス通知”要件(第5625条)、投票権要件(第5640条)、及び第5605(C)(3)条を満たす監査委員会を有することを前提として、ナスダックの“コンプライアンス通知”要件(第5625条)、投票権要件(第5640条)、及び第5605(C)(3)条を満たす監査委員会を有しており、この委員会は、第5605(C)(2)(A)(Ii)条の独立性要件に適合する委員会メンバーからなる。多くのナスダックのコーポレートガバナンス規則の代わりに、イギリスの要求に適合したいくつかのコーポレートガバナンス規則に従うことが許可されているにもかかわらず、前の文で述べた外国のプライベート発行者に適用されるナスダック社ガバナンス規則を遵守するつもりである。したがって、私たちの株主はナスダックのすべての会社の管理要求に制約された会社の株主と同じ保護を受けないだろう。私たちが外国の個人発行者の資格を持ち続ける限り、私たちはこの免除を利用することができる。2002年のサバンズ-オキシリー法案の適用会社統治要求、米国証券取引委員会が採用した規則、およびナスダックのコーポレートガバナンス規則と上場基準に基づいて、私たちの外国個人発行者としてのコンプライアンスを維持するために必要なすべての行動をとるつもりだ。
我々は外国個人発行者であるため、上述したように、我々の役員及び上級管理者は、取引法第16節に規定された短期運転利益及びインサイダー取引報告義務の制約を受けないが、取引法第13節及び関連する米国証券取引委員会規則に基づいて、株式変更を報告する義務を負う。
16 H項です。坑道SaFYY開示
適用されません。
プロジェクト16 I。外国会社の情報開示について妨害検査の管轄区域
適用されません。
プロジェクト16 Kですネットワーク·セキュリティ
私たちは、患者、業務パートナー、従業員の私たちの業務に対する信頼と信頼を維持することが重要であることを認識し、私たちの業務運営とシステムの機密性、完全性、可用性を保護するために努力している。私たちの取締役会は私たちのリスク管理活動を監督することに積極的に参加して、ネットワークセキュリティは私たち全体のリスク管理方法の重要な構成要素です。我々のネットワークセキュリティ政策、標準、プロセス、実践は、イギリス国家ネットワークセキュリティセンター(NCSC)が構築した公認フレームワークと他の適用可能な業界標準に基づいている。全体的に、私たちは、ネットワークセキュリティ脅威を識別、予防、緩和し、ネットワークセキュリティイベントが発生したときに効率的に対応することによって、私たちが収集し、格納している情報の機密性、安全性、および利用可能性を維持することに重点を置いている包括的で機能的な方法によってネットワークセキュリティリスクに対応することを求めている。
158
ネットワークセキュリティリスク管理と戦略
不正アクセス、ネットワークセキュリティ攻撃、およびハッカーによって実装されたセキュリティイベント、およびハードウェアおよびソフトウェアシステムへの意図しない破損または中断、データ損失、および機密情報が流用されるなど、ネットワークセキュリティに関連するリスクに直面しています。ネットワークセキュリティ脅威からの重大なリスクを識別し評価するために、包括的なネットワークセキュリティ計画を維持し、我々のシステムが有効であることを保証するために、ネットワークセキュリティ管理チーム(CSMT)を実施し、我々のプロジェクトを定期的に監視して、内部および外部脅威のセキュリティを監視し、私たちの情報資産の機密性および完全性を確保することを含む情報セキュリティリスクに対応するために準備した。中国移動運営総監取締役、財務総監取締役、戦略とライフサイクル管理副総裁、臨床運営総監高級副総裁。
我々は,ネットワークセキュリティ脅威のリスクを他社リスクとともに考え,我々全体のリスク評価プロセスの一部としている.私たちは、脆弱性評価を含む一連のツールと第三者サービスプロバイダのサービスを使用して、私たちのリスク識別と評価に情報を提供します。以下の“ネットワークセキュリティ管理”で詳細に議論されているように、我々の取締役会の監査委員会は、我々のネットワークセキュリティリスク管理と戦略的流れをリードし、実行する我々のCSMTを監督する。
我々のプロセスをNCSCが策定した基準と比較し,専門家を招いて我々の情報システムに浸透させリスク管理評価を行うことで,我々のネットワークセキュリティ脅威リスクを決定する.キーデータとシステムの可用性を提供し、監督管理のコンプライアンスを維持し、ネットワークセキュリティの脅威を受ける重大なリスクを管理し、ネットワークセキュリティ事件を防止と対応するために、私たちは以下の活動を行った
私たちのイベント応答計画は、イベントの分類、評価の深刻さ、報告、抑制、調査と修復の流れ、および潜在的に適用される法的義務を遵守し、私たちの業務と名声に対する損害を軽減することを含む、私たちが準備、検出、応答、回復するために取った活動を調整する。
上記の流れの一部として、私たちは、継続的な関心、改善、およびコンプライアンスが必要な分野の決定を支援するために、当社のネットワークセキュリティ計画を定期的に第三者審査することを含む、コンサルタントおよび他の第三者と定期的に接触している。
私たちは、当社のプロバイダおよび製造業者を含む、第三者サービスプロバイダの使用に関連するネットワークセキュリティ脅威リスクに対応し、患者および従業員データまたは私たちのシステムにアクセスすることができ、私たちに重大なネットワークセキュリティリスクをもたらす可能性のある第三者が、個人および患者データの処理および送信を含む、契約を通じて彼らのネットワークセキュリティリスクを特定の方法で管理することを要求することを含む。私たちは第三者サプライヤーとサプライヤーのネットワークセキュリティプロトコルについて職務調査を行うつもりだ。
私たちは、“当社の独自の情報または当社のサプライヤーおよび任意の将来の協力者の独自の情報が失われる可能性があるか、またはセキュリティホールを受ける可能性がある”というタイトルの下で、識別されたネットワークセキュリティ脅威からのリスクを記述し、私たちまたは私たちの協力者によって支援された臨床試験によって得られた健康情報のプライバシー、私たちに重大な影響を与えたか、またはどのように重大な影響を与えるか、および私たちまたは私たちの協力者が提供する臨床試験によって得られた健康情報のプライバシーに関する法規および潜在的な責任に直面している
159
情報技術や他の内部インフラシステムが故障した場合には、我々の業務や運営が影響を受ける可能性がある。
私たちは何の重大なサイバーセキュリティ事件も発生していないし、サイバーセキュリティ事件に関する費用も発生していない。これには処罰と和解が含まれているが、どんな処罰も和解もない。
サイバーセキュリティ?ガバナンス
ネットワークセキュリティは私たちのリスク管理プロセスの重要な構成部分であり、私たちの取締役会と経営陣が注目している分野でもある。全体的に、我々の取締役会の監査委員会と執行管理層は、我々の経営陣によって設計·実施されたリスク管理活動を監督し、特定のリスク、例えば、私たちの戦略計画、業務運営、資本構造に関連するリスクを考慮するCSMTを監督する。我々の取締役会と執行管理層の監査委員会は、リスク管理に対する監督責任を直接履行し、その中のいくつかのリスクの監督を私たちのCSMTに許可し、取締役会は私たちの監査委員会とCSMTがネットワークセキュリティ脅威からのリスクを監督することを許可した。
我々の監査委員会は、少なくとも四半期ごとに、データセキュリティ状況、第三者評価のいずれかの結果、予め定められたリスク緩和に関する目標を達成するための進捗状況、我々のイベント対応計画、重大なネットワークセキュリティ脅威リスクまたは事件および事態の発展、および管理層がこのようなリスクに対応するためのステップを含む、我々のCSMTからネットワークセキュリティ脅威リスク管理および戦略プロセスの最新状況を受信する。このような会議で、私たちの監査委員会は、通常、現在および新たに出現した重大なネットワークセキュリティ脅威リスクを含む材料を受け取り、これらのリスクを緩和する能力と、私たちの同業者および第三者に関連する最新の発展、持続的な発展の基準、技術発展、および情報セキュリティ考慮要素を記述する。我々の監査委員会および実行管理層はまた、確立報告のハードルに適合するネットワークセキュリティイベントに関するタイムリーな情報と、イベントが解決されるまで、そのようなイベントの継続的な更新についての情報を受信する。
また、監査委員会と取締役会のメンバーが定期的に実行管理層とネットワークセキュリティに関連するニュースイベントについて対話し、ネットワークセキュリティリスク管理と戦略計画の任意の更新について検討することを奨励します。重大なネットワークセキュリティ脅威リスクも単独の取締役会会議で企業リスク管理、運営予算、業務連続性計画、合併と買収、ブランド管理とその他の関連事項を討論する際に考慮する。
私たちは上で私たちのネットワークセキュリティリスク管理と戦略の流れをより詳しく討論しました。私たちのCSMTは運営部門の取締役、財務部門の取締役、戦略とライフサイクル管理部門の総裁副主任と臨床業務部門の上級副総裁が指導します。これらの人たちは合計16年以上の勤務経験を持ち,情報セキュリティの管理,ネットワークセキュリティ戦略の策定,有効な情報やネットワークセキュリティ計画の実施など,様々な職務を担当している.これらのチームメンバーは、上述のネットワークセキュリティリスク管理と戦略プロセスに管理と参加することによって、私たちのイベント応答計画の実行を含めて、ネットワークセキュリティイベントの予防、緩和、検出と修復を理解し、監視する。上述したように、これらの管理チームのメンバーは、四半期ごとに、ネットワークセキュリティ脅威リスクおよび他のネットワークセキュリティに関する事項を取締役会監査委員会および実行管理層に報告する。
160
部分(三)
プロジェクト17.融資ALIレポート
私たちはプロジェクト18に従って財務諸表を提供することを選択した。
プロジェクト18.融資ALIレポート
財務諸表は本年度報告書の一部として提出され、F-1ページから始まる。
161
プロジェクト19.EXhibit
展示品 |
|
説明する |
|
スケジュール/ 表 |
|
ファイル.ファイル 番号をつける |
|
展示品 |
|
ファイル.ファイル 日取り |
|
|
|
|
|
|
|
|
|
|
|
1.1 |
|
登録者会社定款 |
|
表S-8 |
|
333-223476 |
|
3.1 |
|
03/07/2018 |
|
|
|
|
|
|
|
|
|
|
|
2.1 |
|
登録者と登録者との間の預金契約 シティバンクN.A.そしてすべての所有者と受益者は 本契約に基づいて発行された米国預託証明書の所有者は、日付は 2017年10月2日 |
|
表格20-F |
|
001-38215 |
|
2.1 |
|
03/22/2018 |
|
|
|
|
|
|
|
|
|
|
|
2.2 |
|
米国預託証明書フォーマット(添付ファイル2.1に添付) |
|
表格20-F |
|
001-38215 |
|
2.1 |
|
03/22/2018 |
|
|
|
|
|
|
|
|
|
|
|
4.1 |
|
登録者とその中に列挙された投資家との間の登録権協定は,日付は2017年9月20日である |
|
表格20-F |
|
001-38215 |
|
4.1 |
|
03/22/2018 |
|
|
|
|
|
|
|
|
|
|
|
4.2# |
|
2009年株式購入計画(改訂された)及びこの計画に基づいて締結された株式購入契約フォーマット |
|
表F-1/A |
|
333-220321 |
|
10.1 |
|
09/18/2017 |
|
|
|
|
|
|
|
|
|
|
|
4.3# |
|
2012年株式購入計画(改訂された)及び当該計画に基づいて締結された株式購入契約フォーマット |
|
表F-1/A |
|
333-220321 |
|
10.2 |
|
09/18/2017 |
|
|
|
|
|
|
|
|
|
|
|
4.4# |
|
2016年株式購入計画(改訂された)及び当該計画に基づいて締結された株式購入契約のフォーマット |
|
表F-1/A |
|
333-220321 |
|
10.3 |
|
09/18/2017 |
|
|
|
|
|
|
|
|
|
|
|
4.5# |
|
2020長期インセンティブ計画 |
|
表S-8 |
|
333-227624 |
|
10.1 |
|
08/19/2020 |
|
|
|
|
|
|
|
|
|
|
|
4.6# |
|
2020年会社株式オプション計画 |
|
表S-8 |
|
333-227624 |
|
10.2 |
|
08/19/2020 |
|
|
|
|
|
|
|
|
|
|
|
4.7 |
|
登録者とカーディフProTdes株式会社との間で2012年3月15日に署名された変更協定及び日付が2012年5月15日であることに関する付状 |
|
表F-1/A |
|
333-220321 |
|
10.5 |
|
09/18/2017 |
|
|
|
|
|
|
|
|
|
|
|
4.8 |
|
譲渡、許可及び協力協定は、日付が2009年10月13日で、登録者とカーディフProTdes株式会社によって署名された |
|
表F-1/A |
|
333-220321 |
|
10.6 |
|
09/18/2017 |
|
|
|
|
|
|
|
|
|
|
|
4.9 |
|
登録者とカーディフProTdes株式会社との間の特許譲渡協定は,日付は2012年3月15日である |
|
表F-1/A |
|
333-220321 |
|
10.7 |
|
09/18/2017 |
|
|
|
|
|
|
|
|
|
|
|
4.10 |
|
研究、協力及び許可協定は、登録者カーディフ大学と大学学院カーディフ諮問有限会社が署名し、日付は2017年12月21日、登録者間の合意は、2018年2月1日の改正案により改正される |
|
表格20-F |
|
001-38215 |
|
4.10 |
|
03/22/2018 |
|
|
|
|
|
|
|
|
|
|
|
4.11+ |
|
登録者カーディフ大学と大学学部カーディフ諮問有限会社が2017年12月21日に署名した研究·協力·許可協定の改正案第4号改正案は、2020年2月20日となっている |
|
表格20-F |
|
001-38215 |
|
4.11 |
|
03/10/2020 |
|
|
|
|
|
|
|
|
|
|
|
4.12+ |
|
登録者カーディフ大学と大学学部カーディフ諮問有限会社が2017年12月21日に署名した研究·協力·許可協定の改正案第5号改正案は、2020年12月11日となっている
|
|
表格20-F |
|
001-38215 |
|
4.12 |
|
03/04/2021 |
|
|
|
|
|
|
|
|
|
|
|
4.13 |
|
登録者とDrum Income Plus Limitedとの間のリースは,2017年9月21日となっている |
|
表格20-F |
|
001-38215 |
|
4.11 |
|
03/22/2018 |
|
|
|
|
|
|
|
|
|
|
|
162
4.14# |
|
役員および上級者の弁済証文形式 |
|
表F-1/A |
|
333-2220321 |
|
10.10 |
|
09/18/2017 |
|
|
|
|
|
|
|
|
|
|
|
4.15 |
|
登録者の証券記述 |
|
表格20-F |
|
001-38215 |
|
4.14 |
|
03/10/2020 |
|
|
|
|
|
|
|
|
|
|
|
4.16* |
|
登録者と受託者REIT PLC間の変更紀要は,期日は2022年10月27日である |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8.1 |
|
登録者の子会社リスト |
|
表F-1/A |
|
333-220321 |
|
21.1 |
|
09/01/2017 |
|
|
|
|
|
|
|
|
|
|
|
12.1* |
|
ルール13 a-14(A)/15 d-14(A)2002年の“サバンズ-オキシリー法案”302節に基づいて可決されたCEO証明書。 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12.2* |
|
細則13 a-14(A)/15 d-14(A)首席財務官証明書は、2002年の“サバンズ-オキシリー法案”第302節に基づいて可決された。 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13.1* |
|
第1350条最高経営責任者証明書は、2002年サバンズ-オキシリー法第906節に基づいて可決された。 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13.2* |
|
第1350節首席財務官証明書は、2002年の“サバンズ-オキシリー法案”第906節に基づいて可決された。 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15.1* |
|
安永法律事務所が同意した |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
97.1* |
|
返還政策は,登録者が2023年12月1日に採択された |
|
|
|
|
|
|
|
|
101.INS XBRLを連結したインスタンスドキュメント |
|
|
|
|
|
|
|
|
||
101.Linkbaseドキュメントに埋め込まれたイントラネットSCH XBRL分類拡張アーキテクチャ |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
104. IイントラネットXBRL 表紙相互データファイル |
|
|
|
|
|
|
|
|
||
*アーカイブをお送りします。
#は、管理契約または補償計画を示します。
展示品の一部の内容については,これまでに秘密保持処理を要求している.機密資料は漏れて、米国証券取引委員会に個別に提出された。
+実質的ではなく、開示されている場合、競争に有害な部分が編集されています。編集されていない証拠品のコピーはアメリカ証券取引委員会に提供されることを要求されなければならない。
163
標札本当だよ
登録者は、それが20-F表を提出するすべての要求に適合し、本年度報告書に署名するために以下の署名者を正式に手配し、許可したことを証明する。
|
NuCana PLC |
||
|
|
|
|
|
差出人: |
/S/ヒュー·S·グリフィス |
|
|
|
名前: |
ヒュー·S·グリフィス |
|
|
タイトル: |
最高経営責任者 |
日付:2024年3月20日 |
|
|
|
164
|
|
|
連結財務諸表索引
独立公認会計士事務所レポート(PCAOB ID: |
|
F-1 |
|
2023年,2022年,2021年12月31日までの年度の総合業務報告書 |
|
F-3 |
|
2023年,2022年,2021年12月31日までの年度総合全面損失表 |
|
F-4 |
|
2023年12月31日と2022年12月31日総合財務状況表 |
|
F-5 |
|
2023年,2022年,2021年12月31日までの総合権益変動表 |
|
F-6 |
|
2023年,2022年,2021年12月31日終了年度までの統合キャッシュフロー表 |
|
F-7 |
|
連結財務諸表付記 |
|
F-8 |
|
独立地域登録所の報告書イギリス特許会計士事務所
NuCana plc株主と取締役会へ
財務諸表のいくつかの見方
当社は、添付NuCana plc(当社)が2023年12月31日及び2022年12月31日までの総合財務状況表、2023年12月31日までの各年度の関連総合経営表、全面赤字、権益及び現金流量変動及び関連付記(総称して“総合財務諸表”と呼ぶ)を監査している。総合財務諸表は、すべての重要な点において、2023年12月31日、2023年12月31日、2022年12月31日までの会社の財務状況、および2023年12月31日までの3年度の経営結果とキャッシュフローを公平に反映しており、国際会計基準委員会(IASB)が発表した国際財務報告基準(IFRS)に適合しており、イギリスで採用されている国際会計基準にも適合していると考えられる。
会社が経営を続ける企業として経営を続ける能力
添付されている総合財務諸表の作成仮説会社は引き続き経営を継続する企業となる。総合財務諸表付記2で述べたように、当社は経営により経常赤字を被っており、当社の持続経営企業としての持続経営能力に大きな疑問を抱いていることを示している。付記2はまた、これらの事項に関する経営陣のイベントや条件の評価、経営陣の計画について説明しています。合併財務諸表には、このような不確実性の結果生じる可能性のある調整は含まれていません。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性について意見を述べるためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項とは、監査委員会に伝達または要求が監査委員会に伝達された当期財務諸表監査によって生じる事項である:(1)財務諸表に対して重大な意義を有する勘定または開示に関するものであり、(2)特に挑戦的で主観的または複雑な判断に関するものである。重要監査事項の伝達は、総合財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、以下の重要な監査事項を伝達することによって、重要な監査事項またはそれに関連する勘定または開示について個別の意見を提供することはない。
F-1
臨床試験研究者費用の確認
関係事項の記述 |
2023年12月31日現在、同社は臨床試験研究者の費用は480万GB、その中で臨床試験費用は620万GBであることを確認した。総合財務諸表付記2に開示されているように,当社は臨床試験費用が発生している間に運営説明書内で臨床試験を確認する調査員費用であり,これらの費用は経営陣の期末における臨床試験進展の評価に依存する。
監査臨床試験調査員費用の会計は挑戦的であり、管理層の臨床試験進展に対する調査員費用の評価は判断と主観性、特に第三者サービスプロバイダが展開する活動と、関連する計算すべき費用を推定するためのデータの完全性と正確性を評価することに関連するからである。
|
私たちは監査でこの問題をどのように処理するか |
臨床試験研究者費用の会計処理を評価するために、私たちの監査プログラムは、関連契約を検査し、第三者サービスプロバイダとの契約を修正することによって生じる研究者費用の基礎データの完全性および正確性を推定し、契約料率を管理職推定に適用されるレートと比較するためのテスト管理層を含む。期末臨床試験活動の進展を評価するために,研究·開発者に進捗状況を尋ね,臨床試験の進展を詳細に説明した第三者報告との比較を行った。著者らは第三者サービスプロバイダと独立して臨床試験状態報告の正確性と完全性を確認した。取締役会が審査した臨床試験の進捗状況に関する材料と,管理職が計上すべき項目を記録する際に適用される判断との整合性を考慮した。第三者サービスプロバイダから受け取った領収書もチェックし,2023年12月31日以降に支払われた金額を2023年12月31日までの臨床試験研究者補助金課税費用と比較した。
|
/s/
2014年以来、当社の監査役を務めてきました。
2024年3月20日
F-2
NuCana PLC
合併状態運営部
十二月三十一日までの年度
|
|
備考 |
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|
||||
|
|
|
|
|
(単位は千、1株当たりのデータは除く) |
||||||||||||
|
|
|
|
|
£ |
|
|
£ |
|
|
£ |
|
|
||||
研究開発費 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
行政費 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
無形資産減価準備 |
|
|
8 |
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
純為替収益 |
|
|
|
|
|
( |
) |
|
|
|
|
|
|
|
|||
営業損失 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
財政収入 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
税引き前損失 |
|
|
5 |
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
所得税控除 |
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|||
本年度は当社の権益保有者が損失を占めるべきである |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1株当たりの基本損失と赤字 |
|
|
4 |
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
付記はこれらの総合財務諸表の不可分の一部である。
F-3
NuCana PLC
合併報告書総合損失の
十二月三十一日までの年度
|
|
備考 |
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
|
|
(単位:千) |
|
|||||||||
|
|
|
|
£ |
|
|
£ |
|
|
£ |
|
|||
本年度の赤字 |
|
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
その他の総合(費用)収入: |
|
|
|
|
|
|
|
|
|
|
|
|||
その後、損益項目に再分類することができる: |
|
|
|
|
|
|
|
|
|
|
|
|||
渉外業務翻訳のコミュニケーションの違い |
|
|
|
|
( |
) |
|
|
|
|
|
|
||
本年度その他総合収入 |
|
|
|
|
( |
) |
|
|
|
|
|
|
||
本年度の総合損失総額 |
|
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
なぜなら: |
|
|
|
|
|
|
|
|
|
|
|
|||
当社の持分所有者 |
|
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
付記はこれらの総合財務諸表の不可分の一部である。
F-4
NuCana PLC
合併報告書財務状況
十二月三十一日
|
|
備考 |
|
|
2023 |
|
|
2022 |
|
|||
|
|
|
|
|
(単位:千) |
|
||||||
|
|
|
|
|
£ |
|
£ |
|
||||
資産 |
|
|
|
|
|
|
|
|
|
|||
非流動資産 |
|
|
|
|
|
|
|
|
|
|||
無形資産 |
|
|
8 |
|
|
|
|
|
|
|
||
財産·工場·設備 |
|
|
9 |
|
|
|
|
|
|
|
||
繰延税金資産 |
|
|
7 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
流動資産 |
|
|
|
|
|
|
|
|
|
|||
前金、売掛金、その他の売掛金 |
|
|
11 |
|
|
|
|
|
|
|
||
当期所得税 |
|
|
7 |
|
|
|
|
|
|
|
||
その他の資産 |
|
|
10 |
|
|
|
— |
|
|
|
|
|
現金と現金等価物 |
|
|
17 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
総資産 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
権益と負債 |
|
|
|
|
|
|
|
|
|
|||
資本と備蓄 |
|
|
|
|
|
|
|
|
|
|||
株と株の割増 |
|
|
12 |
|
|
|
|
|
|
|
||
その他の備蓄 |
|
|
13 |
|
|
|
|
|
|
|
||
赤字を累計する |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
当社の株主は権益総額を占めなければならない |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
非流動負債 |
|
|
|
|
|
|
|
|
|
|||
条文 |
|
19 |
|
|
|
|
|
|
|
|||
賃貸負債 |
|
15 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
流動負債 |
|
|
|
|
|
|
|
|
|
|||
貿易応払い |
|
|
|
|
|
|
|
|
|
|||
賃金税と社会保障 |
|
|
|
|
|
|
|
|
|
|||
支出を計算すべきである |
|
|
|
|
|
|
|
|
|
|||
賃貸負債 |
|
15 |
|
|
|
|
|
|
|
|||
条文 |
|
19 |
|
|
|
— |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
総負債 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
権益と負債総額 |
|
|
|
|
|
|
|
|
|
|||
付記はこれらの総合財務諸表の不可分の一部である。
F-5
NuCana PLC
合併報告書持分変動に関する
12月31日までの年度
|
|
共有 |
|
|
共有 |
|
|
身内の人 |
|
|
共有 |
|
|
外国.外国 |
|
|
資本 |
|
|
積算 |
|
|
総株 |
|
||||||||
|
|
(単位:千) |
|
|||||||||||||||||||||||||||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|
£ |
|
|
£ |
|
|
£ |
|
|
£ |
|
|
£ |
|
||||||||
2021年1月1日の残高 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|
|
( |
) |
|
|
|
|
|
( |
) |
|
|
|
|||||
本年度の赤字 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
本年度その他全面収入 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
本年度の総合損失総額 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
|
株式ベースの支払い |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
||
購入権を行使する |
|
|
|
|
|
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||||
株式引受権が失効する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
2021年12月31日の残高 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|
|
( |
) |
|
|
|
|
|
( |
) |
|
|
|
|||||
本年度の赤字 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
本年度その他全面収入 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
本年度の総合損失総額 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
|
株式ベースの支払い |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
||
購入権を行使する |
|
|
|
|
|
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||||
株式引受権が失効する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
2022年12月31日の残高 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|
|
( |
) |
|
|
|
||||||
本年度の赤字 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
本年度その他の総合支出 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
本年度の総合損失総額 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
株式ベースの支払い |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
||
購入権を行使する |
|
|
|
|
|
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
( |
) |
|||
株式引受権が失効する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
株を発行する |
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
株式発行費 |
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
2023年12月31日の残高 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|
|
( |
) |
|
|
|
||||||
付記はこれらの総合財務諸表の不可分の一部である。
F-6
NuCana PLC
合併状態キャッシュフロープロジェクト
12月31日までの年度
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|||
経営活動のキャッシュフロー |
|
|
|
|
|
|
|
|
|
|||
本年度の赤字 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
以下の項目を調整する |
|
|
|
|
|
|
|
|
|
|||
所得税控除 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
償却·減価償却·損失の処分 |
|
|
|
|
|
|
|
|
|
|||
無形資産減価準備 |
|
|
|
|
|
|
|
|
|
|||
食糧面での変動 |
|
|
( |
) |
|
|
|
|
|
— |
|
|
財政収入 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
賃貸負債利息支出 |
|
|
|
|
|
|
|
|
|
|||
株式ベースの支払い |
|
|
|
|
|
|
|
|
|
|||
純為替損失 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
運営資金の変動: |
|
|
|
|
|
|
|
|
|
|||
前金、売掛金、その他の入金が減少しました |
|
|
|
|
|
|
|
|
|
|||
貿易売掛金の増加 |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
賃金税·社会保障·課税支出の増加 |
|
|
( |
) |
|
|
|
|
|
|
||
運営資金の流れ |
|
|
( |
) |
|
|
|
|
|
|
||
運営に使われている現金 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
受け取った所得税純額 |
|
|
|
|
|
|
|
|
|
|||
経営活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
投資活動によるキャッシュフロー |
|
|
|
|
|
|
|
|
|
|||
受け取った利息 |
|
|
|
|
|
|
|
|
|
|||
財産·工場·設備の支払い |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
無形資産の支払い |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
その他資産の償還 |
|
|
|
|
|
— |
|
|
|
( |
) |
|
投資活動からの純現金 |
|
|
|
|
|
|
|
|
( |
) |
||
融資活動によるキャッシュフロー |
|
|
|
|
|
|
|
|
|
|||
賃貸負債を支払う |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
株を発行して得た金-購入権を行使する |
|
|
|
|
|
|
|
|
|
|||
株を発行して得た金 |
|
|
|
|
|
— |
|
|
|
— |
|
|
株式発行費 |
|
|
( |
) |
|
|
— |
|
|
|
— |
|
融資活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
現金と現金等価物の純減少 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
年初現金および現金等価物 |
|
|
|
|
|
|
|
|
|
|||
現金および現金等価物に及ぼす為替レート変動の影響 |
|
|
( |
) |
|
|
|
|
|
|
||
年末現金および現金等価物 |
|
|
|
|
|
|
|
|
|
|||
付記はこれらの総合財務諸表の不可分の一部である。
F-7
NuCana PLC
連結財務諸表付記
1.1番将軍情報
当社は米国証券取引委員会(“米国証券取引委員会”)に米国預託株式(“ADS”)を登録し、2017年10月2日からナスダックに上場している。2023年11月9日から、会社はナスダック資本市場に移った。当社は設立されました
その会社は所有している
2.材料計算政策
準備の基礎
この等財務諸表は、国際会計基準委員会(“IASB”)が公布した“国際財務報告基準”(“IFRS”)及びイギリスが採択した国際会計基準に基づいて作成されたものである。
当社の財務諸表は、当社とその子会社が2023年12月31日までの財務諸表からなります。財務諸表はポンドで表され、ポンドも会社の機能通貨です。別の説明がない限り、すべての値は最も近い千ビットに丸められる。
経営を続ける企業
同社の総合財務諸表は、経営を続けている会社であることに基づいて提出されている。これまで、会社は運営から何の収入も生まれておらず、予見可能な未来にも何の収入も生じない。そのため,会社には経常的な純損失が発生し,累計損失はGBに達した
持続経営評価を審査する際には、会社取締役会は、当該等財務諸表の発表日から12ヶ月の継続経営期限を考慮している。私たちの現在の運営計画によると、私たちの手元の現金と現金等価物は、持続的な経営評価期間全体にわたって予想される運営に資金を提供するのに十分ではないだろう。会社はその研究·開発活動を引き続き推進しようとしているため、継続経営中に追加資本を求めて運営に資金を提供する必要があり、会社は追加の株式融資、債務融資、または他の出所からこれらの資金を得ることができるかもしれない。もし会社が追加資本を得ることができない場合、会社はその研究と開発計画を延期または減少させることを要求され、これは将来の持続可能な運営収入と利益をもたらす能力にマイナスの影響を与える可能性がある。
これらの問題から、当社は現金残高が枯渇する前に、経営を続けている間に十分な追加資本を調達する能力に不確実性がある。これらの事件や状況は、当社の持続経営企業としての持続的な経営能力を大きく疑っているため、当社は正常な業務過程でその資産を現金化し、その負債を返済することができない可能性がある。連結財務諸表には、この不確実性の結果がもたらす可能性のあるいかなる調整も含まれていない。
F-8
NuCana PLC
連結財務諸表付記
2.材料会計政策(継続)
判断と見積もり
財務諸表作成は、資産負債表の日報告の資産および負債額および年内報告の収入および支出に影響を与える判断、推定、仮定を管理層に要求する。推定の性質は,実際の結果がこれらの推定と異なる可能性があることを意味する.
以下の判決は、財務諸表で確認された額に最も大きな影響を与えた
研究開発費
同社は研究開発費が発生している間に経営報告書で研究·開発費用を確認している。開発活動が国際会計基準(“IAS”)38の具体的な基準に規定された高度な段階に達すると、無形資産このような費用を無形資産に資本化することが要求される。経営陣は研究と開発費用の適切な処理について引き続き判断するだろう。
税収
将来の課税利益の可能な時間とレベルに応じて、経営陣は確認すべき繰延税金資産金額を決定するために判断する必要がある。詳細は付記7に記載する。
以下の見積もり数は、財務諸表で確認された額に最も大きな影響を与えます
臨床試験費用の確認
連結財務諸表を作成する過程の一部として,われわれの臨床試験に関連する計算すべき費用や前払い費用を見積もる必要があるかもしれない。合理的な推定を得るために、私たちは未平倉契約と総サービス協定を検討します。また、執行されているが領収書が発行されていないサービスを確認するために、関係者とコミュニケーションを取っている そして私たちが事前に領収書を発行した未履行サービス。ほとんどの場合、私たちのサプライヤーは私たちに毎月延滞したサービス領収書を提供してくれる。以下に計算すべき費用の例を示す
臨床試験費用の算定費用は、上記政策により確認された推定金額を含めて、ギガである
臨床試験費用の前払金は、上記政策により確認された推定金額を含めて、GBである
契約製造費用の確認
連結財務諸表を作成する過程の一部として、契約製造費用に関する計算すべき費用または前払い費用を見積もる必要があるかもしれない。合理的な推定を得るために、私たちは未平倉契約と総サービス協定を検討します。また,伝票が完了しているサービスと発行されていないサービスと,完了していないがあらかじめ伝票を発行しているサービスを決定するために関係者と協議した.
契約製造費の課税費用は、上記政策により確認された推定金額を含めて、ギガである
契約製造費用の前金は、上記政策に基づいて確認された推定金額を含み、GBである
F-9
NuCana PLC
連結財務諸表付記
2.材料会計政策(継続)
株式ベースの支払い
株式に基づく支払取引の公正価値を推定するには、付与された条項および条件に依存する最適な推定モデルを決定する必要がある。この推定には,株式購入の期待寿命,株価の歴史的変動性,配当率とその仮定,日会社普通株に付与された実際の時価値など,推定モデルにおける最適な投入を決定する必要がある。日株決済取引の公正価値を付与する計量については,当社ではブラック·スコルスモデルを用いた。株式ベースの支払取引の公正価値を推定するための仮定の詳細は付記14を参照されたい。
法律手続き
当社はいくつかの訴訟と他の法的手続きの一方かもしれません。当社は、法律訴訟において他の当事者に支払うべき任意の費用補償充当を確認し、貸借対照表の日に過去の事件による法律や推定債務が存在する場合、債務を返済するために経済資源流出が必要となる可能性が高く、債務の時間や金額が不確定であっても債務金額を合理的に推定することができる。すべての費用精算の最終金額は経営陣の見積もりと大きく異なるかもしれない。
同様に、当社は、当社の法的訴訟に対応するための任意の和解または費用返済のための資産を確認し、当社が収入をほぼ確実に受け取ることを前提としている。
経済資源の流出または経済資源の不確定流入が不可能な場合、当社はそれぞれ開示または負債または資産を有する。
当社は2023年12月31日までにGBの配布を行っております
強固な基礎
総合財務諸表は当社とその子会社の財務諸表からなる。
子会社は当社が支配権を獲得した日から合併し、支配権が終了した日まで合併を続ける。子会社の財務諸表は親会社の報告期間と同様に、一致した会計政策で作成されている。グループ内取引と配当によるすべてのグループ内残高、取引、未実現損益はすべてすべて除外した。
今年度中に買収または売却した付属会社の資産、負債、収入および支出は、当社がコントロール権を取得した日から当社が当該付属会社のコントロールを停止した日まで、総合財務諸表に計上する。
外貨?外貨
同社の連結財務諸表はポンドで表され、ポンドも親会社の機能通貨である。各グループエンティティについて、当社はビットコインを決定し、各エンティティの財務諸表に含まれる項目は、そのビットコインを用いて計量する。
取引記録と残高
外貨取引は最初に会社の実体が取引初の資格確認の日にそれぞれの機能通貨即期為替レートで記録する。
外貨建ての貨幣資産と負債は報告日の本位貨幣即期為替レートで換算する。貨幣項目の決済または換算による差異は連結経営報告書で確認する。
F-10
NuCana PLC
連結財務諸表付記
2.材料会計政策(継続)
外貨履歴コストで計測された非貨幣的項目は,初期取引日の為替レートを用いて換算する.
グループ会社
細分化市場報告
同社は以下の地域で運営している
株式発行費
発行株式によるものおよび発行株式に直接帰属する増分コストは,発行株式に関する収益から差し引かれる.純額は当該等の株式を発行している間の実納株主権益に計上される。非増分であり、新株発行のコストに直接起因することができ、総合経営報告書に費用として記すことができる。
財産·工場·設備
物件、工場及び設備はコスト、減価償却累計及び減価償却損失(あればある)の純額で帳簿に記載されている。資産所有権と債務保証としての設備には何の制限もない。
不動産、工場と設備がその予想経済年限内に計算できる減価償却は以下の通りである
資産種別 |
|
減価償却方法と期間 |
オフィス及びコンピュータ装置 |
|
|
固定装置及び取付具 |
|
|
使用権資産 |
|
無形資産
無形資産はコスト、累積償却純額、累積減価損失(あればある)に記載されている。特許に関連する費用には、特許取得に関連する登録、書類、その他の法的費用が含まれる。コンピュータソフトウェアコストは資産の初期購入価格を表す.
主なカテゴリー無形資産の償却方法と償却期間は以下の通り
資産種別 |
|
償却方法と期間 |
特許 |
|
|
コンピュータソフト |
|
F-11
NuCana PLC
連結財務諸表付記
2.材料会計政策(継続)
その会社の各主要特許の有効期限は
無形資産は減値指標がある場合に減値テストを行う。
現金と現金等価物
研究開発
研究と開発費用は発生当時の営業報告書で確認した。会社が証明できる場合、個々のプロジェクトの開発支出は無形資産として確認される
所得税
当期所得税
当期所得税資産と負債は、予想されるように税務機関に回収または支払うことができる金額で計量する。金額を計算するための税率及び税法とは、報告日に当社が税制内で運営する国が公布又は実質的に公布した税率及び税法をいう。
F-12
NuCana PLC
連結財務諸表付記
2.材料会計政策(継続)
所得税控除
同社は英国と米国の研究開発税収控除制度の恩恵を受けている。イギリスでは、同社の一部の損失は返金できます。現金のリベートは最高です
賃貸借証書
その会社は契約開始時に契約がレンタルまたはレンタルを含むかどうかを評価する。すなわち、契約が一定期間内に確定された資産の使用権を譲渡した場合、対価格と交換する。
短期賃貸および低価値資産賃貸を除いて、当社はすべての賃貸に対して単一確認および計量方法を採用している。当社は、リース金を支払うリース負債と、対象資産の使用権を代表する使用権資産を確認します。
使用権資産
当社はレンタル開始日(すなわち対象資産が使用可能な日)に使用権資産を確認します。使用権資産は、コストに応じて任意の減価償却および減価償却損失を差し引いて計量し、リース負債の任意の再計量に基づいて調整する。使用資産コストには、確認されたリース負債額、生成された初期直接コスト、および有効日または前に支払われた賃貸支払いから受信された任意のレンタル報酬が差し引かれることが含まれる。オフィススペースのみに関する使用権資産は、レンタル期間が短い上で直線的に減価償却され、レンタル期間は2年と2年の間である
レンタルする 責任
レンタル開始日に、当社はレンタル支払いの現在価値で計量されたレンタル負債を確認し、その負債はレンタル期間内に支払います。レンタル支払いには、固定支払いから任意の受取レンタル報酬を差し引くことと、ある指数に依存する任意の可変レンタル支払いが含まれます。
賃貸支払いの現在値を計算する際には、当社はレンタル開始日の逓増借入金金利を使用しており、レンタルに隠れている金利が確定しにくいためです。発効日後、賃貸負債額が増加し、利息の増加を反映し、支払われる賃貸支払いを減少させる。また、賃貸負債が修正され、賃貸期限の変化や賃貸支払いが変化した場合、賃貸負債の帳簿価値が再計量される。
当社は、借地期間をリースの取消不可期限とし、行使すると合理的に決定した場合には、リースの選択権がカバーする任意の期限を延長するか、行使しないことを合理的に決定した場合には、テナントの選択権に含まれる任意の期限を終了する。
その会社は延期と終了オプションを含む多くの賃貸契約を持っている。当社は、更新または賃貸借終了の選択権を行使するか否かを合理的に決定するか否かを評価する際に、判断します。つまり、それはすべての関連要素を考慮しており、これらの要素は契約更新または契約終了の経済的動機を行使している。発効日後、その制御範囲内の重大なイベントや状況変化が発生し、継続権を行使または行使しない能力、例えば重大なリース改善を行う能力に影響を与える場合、当社はレンタル期間を再評価する。
付記15を参照して、選択権の行使延期日以降に賃貸負債が含まれていない期間に関する将来的にレンタル料を支払う可能性がある場合をご参照ください。
条文
貸借対照表の日に過去の事件による法律や推定債務が存在する場合、債務を返済するために経済資源を流出させる必要があり、債務の時間や金額が不確定であっても、債務金額を合理的に推定することができる。
F-13
NuCana PLC
連結財務諸表付記
2.材料会計政策(継続)
非金融資産減価準備
当社は報告日ごとに資産が減値する可能性があるかどうかを評価します。何か兆候があれば、当社は資産の回収可能金額を推定します。
1つの資産またはその現金発生単位の帳簿金額がその回収可能金額を超えた場合には、減価損失を確認する。減価損失は総合経営報告書で確認します。
現金生成単位は、識別可能な最小資産グループであり、その生成された現金流入は、他の資産または資産グループとは大きく独立した現金流入である。
回収可能金額の計算
資産と現金発生単位の回収可能金額は,その公正価値から売却コストと使用価値を差し引いた高い金額である。使用価値を評価する際には,現在の市場の貨幣時間価値と資産特有リスクの評価を反映した将来のキャッシュフローを税前割引率を用いて現在値に割引する。独立した現金流入がほとんど生じない資産については,その資産が属する現金発生単位の回収可能金額を決定する.
減価償却
以前に確認された減価損失がもはや存在しないか、または減少した可能性があることを示す兆候があるかどうかを決定するために、各報告日に評価が行われる。もしそのような兆候があれば、回収可能な金額を推定する。
以前に確認された減価損失は,前回減価損失を確認した後に回収可能金額を決定するための推定が変化した場合にのみ打ち消される.この場合、帳簿価値は回収可能な金額まで増加するだろう。減価損は、資産の帳簿金額が減価損失が確認されていない場合に減価償却または償却後に確定すべき帳簿金額を差し引いた範囲内でのみ打ち消される。
株式ベースの支払い
当社の従業員、取締役及びコンサルタントは株式購入の形で報酬を受け取り、これにより個人がサービスを提供することを権益ツールの対価とし、コストについては国際財務報告基準第2号により株式ベースの支払いであることを確認した。
“国際財務報告基準2”によると株式支払持分に基づく支払いは、付与日持分ツールの公正価値に基づいて計量される。株式決済株式取引の公正価値に関する詳細は付記14に記載されている。
授出日センチ定の公平価値は仮定没収比率を調整した後、授出日センチ定の公正価値は帰属期間に直線的に計算し、相応に株本を増加して株式購入準備に至る。
F-14
NuCana PLC
連結財務諸表付記
2.材料会計政策(継続)
公正価値計量
金融資産および負債の公正価値には、強制清算または売却ではなく、意欲のある当事者間の現在の取引で交換可能な手形の金額が含まれる。
公正な価値は、資産を売却するために請求された価格または計量日市場参加者間の秩序ある取引において負債を移動させて支払われた価格に基づく。公正価値計量の一致性と比較可能性を高めるために、“国際財務報告準則”第13号は公正価値等級を確立し、公正価値を計量するための観察可能と観察不可能な投入を3つの大きなレベルに分け、具体的には以下の通りである
第1レベル:同じ資産または負債がアクティブ市場での見積(未調整)価格。
第2レベル:記録された公正価値に重大な影響を与えるすべての投入が直接または間接的に観察できる他の技術。
第3レベル:観察可能な市場データに基づく技術ではなく、記録の公正価値に大きな影響を与える投入を使用する。
現金および現金等価物,その他の売掛金および貿易支払金の公正価値は,その額面とほぼ一致しており,主にこれらのツールの短期満期日によるものである。
会計基準
これらの財務諸表を作成する際には、会社は、これらの財務諸表を承認した日までのすべての関連国際会計基準、国際財務報告基準、国際財務報告解釈委員会(“IFRIC”)の解釈を採用しており、これらの解釈は2023年12月31日までの財政年度に強制的である。
これらの財務諸表は、2023年1月1日から以下の修正を通過した
F-15
NuCana PLC
連結財務諸表付記
2.材料会計政策(継続)
会社の結論は、これらの措置は最初の申請期間中に会社の勘定に実質的な影響を与えなかったが、将来の取引の会計処理に影響を与える可能性がある。
国際会計基準委員会および国際会計基準委員会は、これらの財務諸表の日付の後に、以下の基準および修正案を発表した
当社は発効日に上記の基準及び改訂を採択し、当社は上記の基準及び改訂を検討しているにもかかわらず、当該等の基準及び改訂は当社に適用されないか、又は将来的には大きな影響を与えないと考えられる。
F-16
NuCana PLC
連結財務諸表付記
3.従業員コスト
研究開発費に含まれています
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|||
給料と賃金 |
|
|
|
|
|
|
|
|
|
|||
社会保障費 |
|
|
|
|
|
|
|
|
|
|||
年金コスト |
|
|
|
|
|
|
|
|
|
|||
株式ベースの支払い |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
行政費用に含まれています
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|||
給料と賃金 |
|
|
|
|
|
|
|
|
|
|||
社会保障費 |
|
|
|
|
|
|
|
|
|
|||
年金コスト |
|
|
|
|
|
|
|
|
|
|||
株式ベースの支払い |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
従業員福祉支出総額 |
|
|
|
|
|
|
|
|
|
|||
サービス契約に基づいて雇用されたスタッフの平均人数は、
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(数字) |
|
|||||||||
研究と開発活動 |
|
|
|
|
|
|
|
|
|
|||
行政活動 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
役員報酬その他の福祉
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|||
役員報酬 |
|
|
|
|
|
|
|
|
|
|||
退職金その他の福祉 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
2023年に株式購入権を行使する役員数は
F-17
NuCana PLC
連結財務諸表付記
3.人件費(継続)
上記の報酬額に最高報酬を含む取締役の報酬は以下のとおりである
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|||
役員報酬 |
|
|
|
|
|
|
|
|
|
|||
退職金その他の福祉 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
4.1株当たりの基本的な損失と赤字
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(単位は千、1株当たりのデータは除く) |
|
|||||||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|||
本年度の赤字 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
基本と希釈加重平均株数 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
£ |
|
|
£ |
|
|
£ |
|
|||
1株当たりの基本損失と赤字 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
1株当たりの基本損失の算出方法は、今年度当社の権益保有者を占めるべき損失を今年度の発行済み株式の加重平均で割ったものである。
株式決済取引は逆償却とされており、1株当たりの損失を減少させるため、1株当たりの赤字の計算には計上しない。
5.税引前損失
税引前損失は費用を計上して述べた
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|||
行政費用: |
|
|
|
|
|
|
|
|
|
|||
償却する |
|
|
|
|
|
|
|
|
|
|||
減価償却 |
|
|
|
|
|
|
|
|
|
|||
F-18
NuCana PLC
連結財務諸表付記
6.資本負担および事項
他の約束
協力と許可協定
カーディフ大学免許証
2009年8月、私たちはカーディフ大学と大学学部カーディフコンサルティング株式会社またはカーディフコンサルティング会社と研究、協力、許可協定を締結し、私たちはカーディフ協定と呼ばれる。カーディフ協定はその後更新され、2022年3月31日に満期になる。
カーディフ協定が満期になる前に、私たちはカーディフ大学とカーディフコンサルティング会社に私たちが選択したProTideを潜在的な商業製品開発に通知した。カーディフ協定に規定されている条項によると、カーディフ大学およびカーディフコンサルティング会社は、私たちが選択したProTideヌクレオシドシリーズに関連するカーディフ知的財産権をすべての目的で使用することを可能にするグローバル独占許可を付与している。このライセンスはカーディフ協定の満了後も有効だ。ライセンス期間内に、カーディフ大学およびカーディフコンサルティング会社は、そのような研究がカーディフ知的財産権を利用するか、またはカーディフ知的財産権の権利を任意の第三者に付与する場合、関心のあるヌクレオシドに関連する使用のための任意の第三者に関心のあるヌクレオシドファミリーの任意の研究を競合する第三者のために負担してはならない。
私たちまたは再許可者がカーディフ協定に基づいて行われた研究によって生じた特許出願を提出する場合、私たちは追加された夫にいくつかの無形のお金を問い合わせます。もし私たちまたは私たちの分が許可されてこのような研究製品を開発し、商業化すれば、私たちはカーディフコンサルティング会社の臨床開発マイルストーンに最大GBまでの支払いを不足します
カーディフ保護潮汐協定
2009年10月、私たちはカーディフProTdes株式会社またはカーディフProTdesと協定を締結し、その後改訂され、2012年3月に譲渡、許可、協力協定として再記述され、2012年5月にさらに改訂され、ProTdes協定と呼ばれている。ProTdesプロトコルによると、我々はカーディフProTideと協力して、プリンおよびピリミジンに基づくヌクレオシドを潜在的な候補薬物として発見、薬物設計、およびインビトロでスクリーニングした。私たちはカーディフProTdesのいくつかの仕事を支援し、カーディフProTdesはProTdes協定に従ってその研究結果のすべての権利を私たちに譲渡した。カーディフProTdesはまた、Acelarinに関連する特許を含む特定の関心化合物に関連する特許を米国に譲渡し、再許可を付与する権利、および特定の非特許化合物に関連する権利および技術情報を含む独占的な世界的許可を付与し、すべての治療、診断、予測および予防用途のために付与した。
F-19
NuCana PLC
連結財務諸表付記
6.資本負担及び又は事項(継続)
もし私たちまたは再許可者が1つ以上の製品を開発した場合、これらの製品は、カーディフProTdesによって研究された割り当てられた特許または特許の有効な権利要件によってカバーされ、例えばAcelarin、私たちはカーディフProTdesが約$まで不足するだろう
ProTdesプロトコルは、各国に基づいて満了し、カーディフProTdes研究によって生成された割り当てられた特許または特許の最後の有効な権利要件の失効、失効、放棄、失効、または却下の日から失効するか、またはカーディフProTdesから許可されたいくつかの技術情報が依然として秘密にされている場合、または製品がデータ独占期間内に、製品がその国で初めて商業販売された日から10年以内に満了する。譲渡された特許またはカーディフProTdes研究によって生成された特許の有効性または所有権に疑問または協力を提起するか、またはProTdesプロトコルの下での対応金額を支払うことができない場合、ProTdesプロトコルは、治癒されていない重大な違約、一方の破産、またはカーディフProTdesが疑問を提起するか、または協力して疑問を提起することによって、より早く終了する可能性がある。もし私たちが関連金の期限が過ぎたことに対するカーディフProTdesの通知を受けたら、私たちが支払わなければならないお金は45日以内に支払われず、すぐに終了されるかもしれない。ProTdes協定の終了後、私たちの許可権は、違約がカーディフProTdesのいくつかの違反によって引き起こされない限り、私たちの許可権は継続されるが、支払い義務は減少している。ProTdes協定が終了すると、私たちの違約のため、私たちはカーディフProTdesが最初に私たちに譲渡した特許をカーディフProTdesに譲渡する義務がある。
CROと製造約束
私たちは様々なCROと製造協定に従ってCROと製造業者に支払うことに同意した。支払いの金額、時間、および可能性が固定されているか、または確定可能ではないので、私たちはこのような種類または支払い義務のあるさらなる詳細を含まない。
他にも負債がある
英国株式に基づく支払計画によると、同社は完全に付与された未承認株式オプションを付与した。これらの株式オプションが行使された場合、会社は、雇用主がイギリスHMRCに支払う第1種国民保険に責任を負う。このまたは負債は、行使時の株式の市場価値からオプション保有者が支払う行使価格を差し引いて、雇用主国民保険の現行レート(現在)で決定される
F-20
NuCana PLC
連結財務諸表付記
7.所得税控除
2023年12月31日まで、2022年と2021年12月31日までの年度の所得税の主要構成部分は以下の通り
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
£ |
|
£ |
|
|
£ |
|
||||
当期税額: |
|
|
|
|
|
|
|
|
|
|||
本年度のイギリスについて |
|
|
|
|
|
|
|
|
|
|||
今年度のアメリカについて |
|
|
( |
) |
|
|
( |
) |
|
|
— |
|
数年前のイギリスでは |
|
|
( |
) |
|
|
|
|
|
|
||
当期税額総額 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
繰延税金: |
|
|
|
|
|
|
|
|
|
|||
今年度のアメリカについて |
|
|
|
|
|
|
|
|
|
|||
数年前のアメリカについて |
|
|
( |
) |
|
|
— |
|
|
|
— |
|
繰延税金総額 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
所得税控除 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
課税当期所得税: |
|
|
|
|
|
|
|
|
|
|||
イギリスの税収 |
|
|
|
|
|
|
|
|
|
|||
アメリカの税収 |
|
|
|
|
|
|
|
|
|
|||
当期所得税 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
繰延税金: |
|
|
|
|
|
|
|
|
|
|||
アメリカの税収 |
|
|
|
|
|
|
|
|
|
|||
F-21
NuCana PLC
連結財務諸表付記
7.所得税控除(継続)
本年度の貸金は業務表の損失と照合することができ、具体的には以下の通りである
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
£ |
|
£ |
|
|
£ |
|
||||
税引き前損失 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
イギリス標準税率で計算される損失税 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
以下の要因の影響: |
|
|
|
|
|
|
|
|
|
|||
差し引かれない費用 |
|
|
|
|
|
|
|
|
|
|||
研究開発費控除 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
研究開発税収控除のため赤字を放棄する |
|
|
|
|
|
|
|
|
|
|||
繰延税金--前年調整 |
|
|
|
|
|
— |
|
|
|
— |
|
|
海外課税額-今年度 |
|
|
|
|
|
|
|
|
— |
|
||
研究開発税収控除-アメリカ |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
研究開発税収控除-今年度 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
研究開発税収控除は数年前 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
未確認繰延税金資産 |
|
|
|
|
|
|
|
|
|
|||
所得税控除 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
イギリスでは、当社は2023年12月31日に税金損失や株式補償手配の一時的な差異について繰延税金資産を確認していません。税金損失や一時的な差異を合理的に決定できないため、将来課税されるべきオーバーフローによって回収できる時間と見なすことができます。米国では、研究開発税収控除に関連する繰延税金資産は、経営陣が将来の課税利益が繰延税金資産の実現に十分な将来の課税利益があると考えている場合に確認されている。
繰延税額の一時的な差が確認されなかったことと累積繰越税損額はGBである
2023年4月1日からイギリスの会社の税率は
F-22
NuCana PLC
連結財務諸表付記
8.無形資産
|
|
特許 |
|
|
電気計算機 |
|
|
合計する |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
£ |
|
£ |
|
|
£ |
|
||||
コスト: |
|
|
|
|
|
|
|
|
|
|||
2021年12月31日 |
|
|
|
|
|
|
|
|
|
|||
足し算 |
|
|
|
|
|
— |
|
|
|
|
||
処置する |
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2022年12月31日 |
|
|
|
|
|
|
|
|
|
|||
累計償却: |
|
|
|
|
|
|
|
|
|
|||
2021年12月31日 |
|
|
|
|
|
|
|
|
|
|||
年単位で料金を取る |
|
|
|
|
|
|
|
|
|
|||
処置する |
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
減損する |
|
|
|
|
|
— |
|
|
|
|
||
2022年12月31日 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
コスト: |
|
|
|
|
|
|
|
|
|
|||
2022年12月31日 |
|
|
|
|
|
|
|
|
|
|||
足し算 |
|
|
|
|
|
— |
|
|
|
|
||
2023年12月31日 |
|
|
|
|
|
|
|
|
|
|||
累計償却: |
|
|
|
|
|
|
|
|
|
|||
2022年12月31日 |
|
|
|
|
|
|
|
|
|
|||
年単位で料金を取る |
|
|
|
|
|
— |
|
|
|
|
||
減損する |
|
|
|
|
|
— |
|
|
|
|
||
2023年12月31日 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
帳簿純価値: |
|
|
|
|
|
|
|
|
|
|||
2023年12月31日 |
|
|
|
|
|
|
|
|
|
|||
2022年12月31日 |
|
|
|
|
|
|
|
|
|
|||
同社はその特許組合せを定期的に審査し,2023年に限られた数の特許に関するさらなる開発を停止し,主に臨床前候補薬に関与している。経営陣の結論は、これは減値の兆しであり、減価費用はGBである
F-23
NuCana PLC
連結財務諸表付記
9.不動産、工場、設備
|
|
の権利です |
|
|
オフィスと |
|
|
固定装置 |
|
|
合計する |
|
||||
|
|
(単位:千) |
|
|||||||||||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|
£ |
|
||||
コスト: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
2021年12月31日 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
足し算 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
再測定する |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
処置する |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
外貨為替レート差異の影響 |
|
|
|
|
|
|
|
|
— |
|
|
|
|
|||
2022年12月31日 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
減価償却: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
2021年12月31日 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
年単位で料金を取る |
|
|
|
|
|
|
|
|
|
|
|
|
||||
処置する |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
外貨為替レート差異の影響 |
|
|
|
|
|
|
|
|
— |
|
|
|
|
|||
2022年12月31日 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
コスト: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
2022年12月31日 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
足し算 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|||
再測定する |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
処置する |
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
外貨為替レート差異の影響 |
|
|
( |
) |
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
2023年12月31日 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
減価償却: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
2022年12月31日 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
年単位で料金を取る |
|
|
|
|
|
|
|
|
|
|
|
|
||||
処置する |
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
外貨為替レート差異の影響 |
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
2023年12月31日 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
帳簿純価値: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
2023年12月31日 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
2022年12月31日 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
F-24
NuCana PLC
連結財務諸表付記
10.その他の資産
|
|
2023 |
|
|
2022 |
|
||
|
|
(単位:千) |
|
|||||
|
|
£ |
|
£ |
|
|||
その他の資産 |
|
|
— |
|
|
|
|
|
2021年4月、当社はドイツのデュッセルドルフ地方裁判所(“デュッセルドルフ地方裁判所”)において、Sovaldiおよびその組合せ製品ハヴォニ、Vosevi、およびEpclusaの特許が侵害されたことを告発するために、Gilead SciencesアイルランドUCおよびGilead Sciences GmbHを提訴した。2021年遅く、同社はユーロの保証を提供しました
2023年5月,当社はドイツでのすべての訴訟手続きを放棄し,Gilead SciencesアイルランドUCとGIlead Sciences GmbHと別注19で開示されたように和解合意に達したため,保証金は2023年7月に全額返済された。
11.前金、売掛金、その他の入金
|
|
2023 |
|
|
2022 |
|
||
|
|
(単位:千) |
|
|||||
|
|
£ |
|
£ |
|
|||
前払い--製造業と臨床 |
|
|
|
|
|
|
||
前払金--その他 |
|
|
|
|
|
|
||
収益を計算する |
|
|
|
|
|
|
||
付加価値税 |
|
|
|
|
|
|
||
その他売掛金 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
F-25
NuCana PLC
連結財務諸表付記
12.配当金および株式割増
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|||
株本 |
|
|
|
|
|
|
|
|
|
|||
株式割増 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
番号をつける |
|
|
番号をつける |
|
|
番号をつける |
|
|||
|
|
(単位:千) |
|
|||||||||
発行された株式には、 |
|
|
|
|
|
|
|
|
|
|||
GB普通株 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
番号をつける |
|
|
共有 |
|
|
共有 |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
|
|
|
£ |
|
|
£ |
|
|||
全額配当金を支払う: |
|
|
|
|
|
|
|
|
|
|||
2021年12月31日の残高 |
|
|
|
|
|
|
|
|
|
|||
購入権を行使する |
|
|
|
|
|
|
|
|
|
|||
2022年12月31日の残高 |
|
|
|
|
|
|
|
|
|
|||
購入権を行使する |
|
|
|
|
|
|
|
|
|
|||
株を発行する |
|
|
|
|
|
|
|
|
|
|||
2023年12月31日の残高 |
|
|
|
|
|
|
|
|
|
|||
普通株
普通株保有者は、株主投票投票を提出するすべての事項において、登録されている株式を1株保有するごとに、1票を投じる権利があるが、累積投票権はない。
資本管理
当社の資本管理について言えば、資本には既発行資本、株式割増及び当社の株式所有者が占めるべき他のすべての持分備蓄が含まれている。会社資本管理の目的は、株主価値を最大化し、中期運営計画を満たすのに十分な資本を確保することである。業務と引受金の審査は将来の資本管理を決定する鍵であり、四半期ごとに全面的な審査を行う。
資本管理の目標、政策、プログラムは、2023年、2022年または2021年12月31日までの年間で変化していない。
F-26
NuCana PLC
連結財務諸表付記
13.その他の備蓄
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|||
自己株式備蓄 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
外貨換算備蓄 |
|
|
|
|
|
|
|
|
( |
) |
||
資本公積 |
|
|
|
|
|
|
|
|
|
|||
株式オプション備蓄 |
|
|
|
|
|
|
|
|
|
|||
年初残高 |
|
|
|
|
|
|
|
|
|
|||
株式ベースの支払い |
|
|
|
|
|
|
|
|
|
|||
購入権を行使する |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
株式オプションの喪失 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
株式引受権が失効する |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
年末残高 |
|
|
|
|
|
|
|
|
|
|||
その他の総埋蔵量 |
|
|
|
|
|
|
|
|
|
|||
外貨換算備蓄
外貨換算準備金は、対外経営企業の財務諸表換算による為替差額を記録するために用いられる。
自己株式備蓄
自分の株式備蓄とは
資本公積
資本積立金残高は、2017年6月30日までに当社が公衆有限会社に再登録して反映した株式割増帳の減少及び資本積立金帳の増加によるものである。
株式オプション備蓄
株式購入備蓄は、彼らの報酬の一部として、従業員、取締役、およびコンサルタントに提供される株式決済に基づく株式ベースの支払いの価値を確認するために使用される。詳細は付記14を参照されたい。
F-27
NuCana PLC
連結財務諸表付記
14.株式支払
その会社は所有している
2021年、2022年、2023年オプション
2021年、2022年、2023年には、以下の株式ベースの支払い計画に基づいて株式オプションが付与された
2020長期インセンティブ計画
本計画により付与されたオプションは,オプション所有者が合意した授権期間内にそれぞれの雇用契約またはサービス契約を遵守していれば,オプションを付与する.本計画により付与された株式オプションは最長期限内に授与されます
帰属時に、各オプション所有者は、付与日に決定された特定のオプション価格で普通株式を購入することを許可する。RSU式オプションとして付与されたオプションは,帰属時に自動的に行使される.当社が2020年の長期インセンティブ計画に基づいて適宜手配し、株式を買収する権利の代わりに同値現金で代替することを決定した。
本報告で述べた期間の株式オプションおよび加重平均行権価格は以下のとおりである
|
|
量 |
|
|
重みをつける |
|
||
|
|
|
|
|
£ |
|
||
2021年1月1日に返済されません |
|
|
|
|
|
|
||
授与する |
|
|
|
|
|
|
||
没収される |
|
|
( |
) |
|
|
|
|
無効になりました |
|
|
( |
) |
|
|
|
|
鍛えられた1 |
|
|
( |
) |
|
|
|
|
2021年12月31日現在の未返済債務 |
|
|
|
|
|
|
||
授与する |
|
|
|
|
|
|
||
没収される |
|
|
( |
) |
|
|
|
|
無効になりました |
|
|
( |
) |
|
|
|
|
鍛えられた2 |
|
|
( |
) |
|
|
|
|
2022年12月31日に返済されていません |
|
|
|
|
|
|
||
授与する |
|
|
|
|
|
|
||
没収される |
|
|
( |
) |
|
|
|
|
無効になりました |
|
|
( |
) |
|
|
|
|
鍛えられた3 |
|
|
( |
) |
|
|
|
|
2023年12月31日現在の未返済債務4 |
|
|
|
|
|
|
||
2023年12月31日に帰属して行使可能です |
|
|
|
|
|
|
||
2022年12月31日に帰属して行使可能です |
|
|
|
|
|
|
||
2021年12月31日に帰属し、行使可能です |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
1.等買株権行使当日の加重平均株価はGB |
|
|||||||
2.等買株権行使当日の加重平均株価はGB |
|
|||||||
3.等買株権行使当日の加重平均株価はGB |
|
|||||||
4.発行済み株式オプションの行権価格GBから |
|
|||||||
2023年12月31日までに購入持分を行使していない加重平均残存契約期間は
F-28
NuCana PLC
連結財務諸表付記
14.株式ベースの支払い(継続)
2021年の株式オプションの推定値は、以下の主な仮定を採用している
|
|
付与したオプション |
|
|||||||||
|
|
2021年1月13日 |
|
|
2021年2月10日 |
|
|
2021年2月10日 |
|
|||
帰属日 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
波動率1 |
|
|
% |
|
|
% |
|
|
% |
|||
配当率 |
|
|
% |
|
|
% |
|
|
% |
|||
無リスク投資率1 |
|
|
% |
|
|
% |
|
|
% |
|||
日オプションの公正価値を付与する1 |
|
£ |
|
|
£ |
|
|
£ |
|
|||
付与日の株式公正価値 |
|
£ |
|
|
£ |
|
|
£ |
|
|||
授権日の行使価格 |
|
£ |
|
|
£ |
|
|
£ |
|
|||
失効日 |
|
|
|
|
— |
|
|
|
||||
期待オプション寿命(年)1 |
|
|
|
|
|
|
|
|
|
|||
付与オプション数 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
2021年2月10日 |
|
|
2021年8月11日 |
|
|
2021年9月15日 |
|
|||
帰属日 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
波動率1 |
|
|
% |
|
|
% |
|
|
% |
|||
配当率 |
|
|
% |
|
|
% |
|
|
% |
|||
無リスク投資率1 |
|
|
% |
|
|
% |
|
|
% |
|||
日オプションの公正価値を付与する1 |
|
£ |
|
|
£ |
|
|
£ |
|
|||
付与日の株式公正価値 |
|
£ |
|
|
£ |
|
|
£ |
|
|||
授権日の行使価格 |
|
£ |
|
|
£ |
|
|
£ |
|
|||
失効日 |
|
|
|
|
|
|
— |
|
||||
期待オプション寿命(年)1 |
|
|
|
|
|
|
|
|
|
|||
付与オプション数 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
2021年9月15日 |
|
|
2021年9月15日 |
|
|
2021年12月15日 |
|
|||
帰属日 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
波動率1 |
|
|
% |
|
|
% |
|
|
% |
|||
配当率 |
|
|
% |
|
|
% |
|
|
% |
|||
無リスク投資率1 |
|
|
% |
|
|
% |
|
|
% |
|||
日オプションの公正価値を付与する1 |
|
£ |
|
|
£ |
|
|
£ |
|
|||
付与日の株式公正価値 |
|
£ |
|
|
£ |
|
|
£ |
|
|||
授権日の行使価格 |
|
£ |
|
|
£ |
|
|
£ |
|
|||
失効日 |
|
|
|
|
|
|
||||||
期待オプション寿命(年)1 |
|
|
|
|
|
|
|
|
|
|||
付与オプション数 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
1.付与されたオプションの平均値を示す |
|
|||||||||||
F-29
NuCana PLC
連結財務諸表付記
14.株式ベースの支払い(継続)
付与されたオプションの公正価値は,株式インセンティブ計画特有の要因を考慮したBlack-Scholesモデルを用いて決定され,例えばオプションが最高で到達可能であると仮定する
2021年12月31日までの年間で、1つの従業員報酬支出は、すべて株式決済の株式支払いに関係している
2022年の株式オプションの推定値は、以下の主な仮定を採用している
|
|
付与したオプション |
|
|||||
|
|
2022年3月9日 |
|
|
2022年3月9日 |
|
||
帰属日 |
|
|
|
|
||||
|
|
|
|
|
||||
|
|
|
|
|
||||
|
|
|
|
|
||||
波動率1 |
|
|
% |
|
|
% |
||
配当率 |
|
|
% |
|
|
% |
||
無リスク投資率1 |
|
|
% |
|
|
% |
||
日オプションの公正価値を付与する1 |
|
£ |
|
|
£ |
|
||
付与日の株式公正価値 |
|
£ |
|
|
£ |
|
||
授権日の行使価格 |
|
£ |
|
|
£ |
|
||
失効日 |
|
|
|
|
||||
期待オプション寿命(年)1 |
|
|
|
|
|
|
||
付与オプション数 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
2022年7月12日 |
|
|
2022年7月12日 |
|
||
帰属日 |
|
|
|
|
||||
|
|
|
|
|
||||
|
|
|
|
|
||||
|
|
|
|
|
||||
波動率1 |
|
|
% |
|
|
% |
||
配当率 |
|
|
% |
|
|
% |
||
無リスク投資率1 |
|
|
% |
|
|
% |
||
日オプションの公正価値を付与する1 |
|
£ |
|
|
£ |
|
||
付与日の株式公正価値 |
|
£ |
|
|
£ |
|
||
授権日の行使価格 |
|
£ |
|
|
£ |
|
||
失効日 |
|
|
|
|
— |
|
||
期待オプション寿命(年)1 |
|
|
|
|
|
|
||
付与オプション数 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
1.付与されたオプションの平均値を示す |
|
|
||||||
F-30
NuCana PLC
連結財務諸表付記
14.株式ベースの支払い(継続)
付与されたオプションの公正価値は,株式インセンティブ計画特有の要因を考慮したBlack-Scholesモデルを用いて決定され,例えばオプションが最高で到達可能であると仮定する
2022年12月31日までの年間で、1つの従業員報酬支出は、すべて株式決済の株式支払いに関係している
2023年の株式オプションの推定値は、以下の主な仮定を採用した
|
|
付与したオプション |
|
|
|||||||||
|
|
2023年1月11日 |
|
|
2023年1月11日 |
|
|
2023年1月11日 |
|
|
|||
帰属日 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
波動率1 |
|
|
% |
|
|
% |
|
|
% |
|
|||
配当率 |
|
|
% |
|
|
% |
|
|
% |
|
|||
無リスク投資率1 |
|
|
% |
|
|
% |
|
|
% |
|
|||
日オプションの公正価値を付与する1 |
|
£ |
|
|
£ |
|
|
£ |
|
|
|||
付与日の株式公正価値 |
|
£ |
|
|
£ |
|
|
£ |
|
|
|||
授権日の行使価格 |
|
£ |
|
|
£ |
|
|
£ |
|
|
|||
失効日 |
|
|
|
|
|
|
— |
|
|
||||
期待オプション寿命(年)1 |
|
|
|
|
|
|
|
|
|
|
|||
付与オプション数 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
2023年6月16日 |
|
|
2023年6月16日 |
|
|
2023年7月12日 |
|
|
|||
帰属日 |
|
|
|
|
|
|
|
||||||
波動率1 |
|
|
% |
|
|
% |
|
|
% |
|
|||
配当率 |
|
|
% |
|
|
% |
|
|
% |
|
|||
無リスク投資率1 |
|
|
% |
|
|
% |
|
|
% |
|
|||
日オプションの公正価値を付与する1 |
|
£ |
|
|
£ |
|
|
£ |
|
|
|||
付与日の株式公正価値 |
|
£ |
|
|
£ |
|
|
£ |
|
|
|||
授権日の行使価格 |
|
£ |
|
|
£ |
|
|
£ |
|
|
|||
失効日 |
|
|
|
|
— |
|
|
|
|
||||
期待オプション寿命(年)1 |
|
|
|
|
|
|
|
|
|
|
|||
付与オプション数 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
1.付与されたオプションの平均値を示す |
|
|
|||||||||||
F-31
NuCana PLC
連結財務諸表付記
14.株式ベースの支払い(継続)
付与されたオプションの公正価値は,株式インセンティブ計画特有の要因を考慮したBlack-Scholesモデルを用いて決定され,例えばオプションが最高で到達可能であると仮定する
2023年12月31日までの年間で、1つの従業員報酬支出は、すべて株式決済の株式支払いに関係している
15.レンタル証書
同社は以下の会社とのみオフィススペース賃貸契約を締結している
使用権資産の帳簿金額および年内変動が確認された場合を付記9に示す。
年内賃貸負債の帳簿金額および変動状況は以下の通り
|
2023 |
|
|
2022 |
|
||
|
(単位:千) |
|
|||||
|
£ |
|
|
£ |
|
||
一月一日 |
|
|
|
|
|
||
負債の再計量 |
|
|
|
|
|
||
利子が増額する |
|
|
|
|
|
||
支払い |
|
( |
) |
|
|
( |
) |
外貨為替レート差異の影響 |
|
( |
) |
|
|
( |
) |
十二月三十一日 |
|
|
|
|
|
||
|
|
|
|
|
|
||
分類は: |
|
|
|
|
|
||
現在のところ |
|
|
|
|
|
||
当面ではない |
|
|
|
|
|
||
|
|
|
|
|
|
||
賃貸負債の満期日分析は以下の通りである
|
2023 |
|
|
2022 |
|
||
|
(単位:千) |
|
|||||
|
£ |
|
|
£ |
|
||
契約未割引払い |
|
|
|
|
|
||
1年遅れではない |
|
|
|
|
|
||
1年遅れだが3年ではない |
|
|
|
|
|
||
3年後ですが5年ではありません |
|
|
|
|
|
||
契約未割引支払総額 |
|
|
|
|
|
||
減算:割引の影響 |
|
( |
) |
|
|
( |
) |
割引済賃貸負債 |
|
|
|
|
|
||
F-32
NuCana PLC
連結財務諸表付記
15.賃貸証書(継続)
以下の額は、リース契約に関連する業務報告書で確認されます
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|||
使用権資産減価償却費用 |
|
|
|
|
|
|
|
|
|
|||
賃貸負債利息支出(行政費計上) |
|
|
|
|
|
|
|
|
|
|||
財務諸表で確認した総金額 |
|
|
|
|
|
|
|
|
|
|||
同社のレンタルGBの現金純流出総額
現在のレンタルコストに基づいて、レンタル負債に計上されていない潜在的延期オプションの未割引将来の賃貸料支払いは以下の通りである
|
2023 |
|
|
2022 |
|
||
|
(単位:千) |
|
|||||
|
£ |
|
|
£ |
|
||
延期選択権は行使されない見通しです |
|
|
|
|
|
||
5年遅れない |
|
|
|
|
|
||
合計する |
|
|
|
|
|
||
16.関連するパーティの開示
会社の重要な管理者の報酬
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
(単位:千) |
|
|||||||||
|
|
£ |
|
|
£ |
|
|
£ |
|
|||
短期従業員福祉 |
|
|
|
|
|
|
|
|
|
|||
退職金その他の福祉 |
|
|
|
|
|
|
|
|
|
|||
株式ベースの支払い |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
F-33
NuCana PLC
連結財務諸表付記
17.現金および現金同等物
|
|
2023 |
|
|
2022 |
|
||
|
|
(単位:千) |
|
|||||
|
|
£ |
|
|
£ |
|
||
現金と現金等価物 |
|
|
|
|
|
|
||
現金と現金等価物には預金満期日が三ヶ月以下の銀行現金が含まれています。銀行の現金は各口座で合意された条項に基づいて、固定または可変の金利で利息を稼ぐ。
流動性リスクはわずかであり,即時性と可変固定期限日を持つ預金を用いて管理されている。
18.金融商品のリスク管理
当社は金利や通貨レートの変動の影響で市場リスクに直面しています。これらのリスクを管理する方法は、会社が運営する2つの主要通貨の中で適切な現金預金の組み合わせを維持し、予想される流動性要求に応じて異なる時期に様々な金融機関に保管することである。
金利リスク
2023年12月31日現在、会社は現金と現金等価物GBを持っています
固定金利または変動金利の金融資産は以下のとおりである
|
|
2023 |
|
|
2022 |
|
||
|
|
(単位:千) |
|
|||||
|
|
携帯する |
|
|
携帯する |
|
||
|
|
£ |
|
|
£ |
|
||
短期固定金利の金融資産 |
|
|
|
|
|
|
||
現金と現金等価物 |
|
|
|
|
|
|
||
変動金利の金融資産 |
|
|
|
|
|
|
||
現金と現金等価物 |
|
|
|
|
|
|
||
無利子現金残高 |
|
|
|
|
|
|
||
現金と現金等価物 |
|
|
|
|
|
|
||
銀行の金利の引き上げ幅は
F-34
NuCana PLC
連結財務諸表付記
18.金融商品リスク管理(継続)
貨幣リスク
当社の機能通貨はイギリスポンドで、私たちの取引は通常この貨幣で価格を計算します。しかし、一部の費用は他の通貨で発生し、主にドルであり、この為替レートの影響を受ける。
同社はイギリスに本部を置いているが,米国,EU,インドを含む世界各地から活性薬物成分,原材料,研究·開発,製造,コンサルティング,その他のサービスを調達している。上記の他の管轄区域通貨に対するポンドのいかなる切り下げも、当社がこのような商品やサービスを購入するコストをより高くすることになる。同社は、これらの他の通貨で計算される予測可能な中短期支出を満たすために、通貨現金残高を適切なレベルに維持することで、このリスクを最小限にしようとしている。そこで,同社は現金と現金等価物の大部分をドルとしているため,為替変動がこれらの残高に及ぼす影響を報告する。
当社はデリバティブツールを使用して為替リスクを管理していません。
主にドルで保有する外貨金融資産と負債は以下の通り
|
|
2023 |
|
|
2022 |
|
||
|
|
(単位:千) |
|
|||||
|
|
携帯する |
|
|
携帯する |
|
||
|
|
£ |
|
|
£ |
|
||
金融資産 |
|
|
|
|
|
|
||
前金、売掛金、その他の売掛金 |
|
|
|
|
|
|
||
当期所得税 |
|
|
|
|
|
|
||
現金と現金等価物 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
金融負債 |
|
|
|
|
|
|
||
貿易応払い |
|
|
|
|
|
|
||
賃貸負債 |
|
|
|
|
|
|
||
支出を計算すべきである |
|
|
|
|
|
|
||
A
信用リスク
同社は複数の銀行の現金と現金等価物を積極的に管理し、異なる満期日の預金を持っている。その会社はこの銀行の信用評価を監視している。
2023年12月31日まで、会社の大部分の現金と現金等価物はGBより高い
F-35
NuCana PLC
連結財務諸表付記
19.条文
|
法律手続き |
|
|
ひどく破れた |
|
|
合計する |
|
|||
|
(単位:千) |
|
|||||||||
|
£ |
|
|
£ |
|
|
£ |
|
|||
2023年1月1日 |
|
|
|
|
|
|
|
|
|||
足し算 |
|
— |
|
|
|
|
|
|
|
||
未使用を押し出す |
|
( |
) |
|
|
— |
|
|
|
( |
) |
すでに利用している |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
前金、売掛金、その他の受取金から送金します |
|
( |
) |
|
|
— |
|
|
|
( |
) |
外貨為替レート差異の影響 |
|
( |
) |
|
|
— |
|
|
|
( |
) |
2023年12月31日 |
|
— |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
分類は: |
|
|
|
|
|
|
|
|
|||
当面ではない |
|
— |
|
|
|
|
|
|
|
||
|
|
— |
|
|
|
|
|
|
|
||
法律手続き
2021年2月、ジリッド科学会社およびジリッド科学株式会社は、EP 2955190またはEP 190のイギリス部分の撤回を要求するために、イングランドおよびウェールズ高等裁判所特許裁判所に訴訟を提起した。その後、2021年3月に、私たちは、イギリスでソワルディとその組み合わせ製品ハヴォニ、ウォセヴィ、およびEpclusaを販売する行為が私たちの特許を侵害したことを含む、2つのジリッドエンティティを反訴した。2022年9月、私たちは欧州特許庁から別の欧州特許、EP 3904365またはEP 365を取得し、ソソブビルを含むより小さい種類のホスファミド化合物の組成をカバーした。GIlead Sciences,Inc.とGIlead Sciences Limitedはその後,彼らのクレームを修正し,EP 365のイギリス部分の撤回を求め,侵害行為を反訴した。イングランドとウェールズ高等裁判所特許法廷は2023年1月20日から2023年2月3日までこの事件を審理し、2023年3月21日に判決を下した。高裁はその判決で、EP 190とEP 365はイギリスでは無効だと判断した。判決が下された後、この2つのgilead実体は同社に法的費用の一部を取り戻す権利がある。この判断は貸借対照表後の調整イベントであるため,GBの準備である
さらに、欧州特許庁技術控訴委員会が2023年3月24日にEP 190の撤回を決定した後、同社は、付記10に開示された、GBなど、ドイツ特許侵害訴訟結果および財務影響の推定値を再評価した
2023年12月31日現在、イギリスとドイツの特許侵害訴訟によるすべての義務が解決された。
ひどく破れた
同社にはオフィススペースの賃貸契約があり、レンタル終了時にすべての固定装置や設備の撤去を要求している。当社は2023年12月31日までにGBの配布を行っております
F-36
NuCana PLC
連結財務諸表付記
20.本報告に記載された期間後のイベント
年末以来、会社の状況に大きな変化はなかった。
F-37