アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表
(マーク1)
|
|
1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで
|
|
1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
2008年からしばらくの間 今から
手数料書類番号
(登録者の正確な氏名はその定款に記載)
|
|
|
|
|
(明またはその他の司法管轄権 会社や組織) |
アメリカ国税局の雇用主は 識別番号) |
|
|
|
|
|
(主にオフィスアドレスを実行) |
(郵便番号) |
登録者の電話番号、市外局番を含む:(
同法第12条(B)に基づいて登録された証券:
|
クラスごとのタイトル |
取引コード |
登録された各取引所の名称 |
|
|
|
♪the the the |
|
|
|
♪the the the |
同法第12条(G)により登録された証券:なし
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください。はい、そうです
登録者が法案第13節又は第15(D)節に基づいて報告書を提出する必要がない場合は、複選マークで示してください。:はい
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出および掲示を要求されたより短い時間)に、S−Tルール405(本章232.405節)に従って提出を要求した各対話データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
|
大型加速ファイルサーバ |
☐ |
ファイルマネージャを加速する |
☐ |
|
|
☒ |
規模の小さい報告会社 |
|
|
新興成長型会社 |
|
新興成長型企業である場合、登録者が、取引法第13(A)節に従って提供された任意の新しいまたは改正された財務会計基準を遵守するために、延長された移行期間を使用しないことを選択したか否かを再選択マークで示す。☐
登録者が報告書を提出したかどうかを再選マークで示し、その経営陣が“サバンズ·オクスリ法案”(“米国法典”第15編7262(B)節)第404(B)条に基づいて、その監査報告書を作成または発表する公認会計士事務所の財務報告内部統制の有効性を評価した
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
再選択フラグは、これらのエラーのより真ん中に登録者の任意の幹部が関連回復中に§240.10 D−1(B)に従って受信されたインセンティブベースの報酬に基づいて回復分析を行う必要があるかどうかを示す。☐
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、そうです
2023年6月30日現在,非関連会社が保有する登録者普通株の総時価は$である
2024年3月15日までに
引用で編入された書類
登録者の最終委託書のうち,2024年株主総会に関連する部分は,本年度報告の10−K表の第3部に引用的に組み込まれている。登録者の最終委託書は,本報告に関連する財政年度終了後120日以内に米国証券取引委員会に提出される
Cycle治療会社は
表格10-Kの年報
2023年12月31日までの年度
カタログ表
前向きな陳述に関する警告的声明
|
プロジェクト |
説明する |
ページ |
||
|
第1部 |
||||
|
1. |
業務.業務 |
1 |
||
|
1A. |
リスク要因 |
20 |
||
|
1B. |
未解決従業員意見 |
32 |
||
|
1C. |
ネットワーク·セキュリティ |
32 |
||
|
2. |
属性 |
32 |
||
|
3. |
法律訴訟 |
32 |
||
|
4. |
炭鉱安全情報開示 |
32 |
||
|
第II部 |
||||
|
5. |
登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
33 |
||
|
6. |
選定された財務データ |
33 |
||
|
7. |
経営陣の財務状況と経営成果の検討と分析 |
33 |
||
|
7A. |
市場リスクの定量的·定性的開示について |
38 |
||
|
8. |
財務諸表と補足データ |
F-1 |
||
|
9. |
会計と財務情報開示の変更と相違 |
39 |
||
|
9A. |
制御とプログラム |
39 |
||
|
9B. |
その他の情報 |
39 |
||
|
9C. |
検査妨害に関する外国司法管区の開示 |
|||
|
第三部 |
||||
|
10. |
役員·幹部と会社の管理 |
41 |
||
|
11. |
役員報酬 |
41 |
||
|
12. |
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
41 |
||
|
13. |
特定の関係や関連取引と取締役の独立性 |
41 |
||
|
14. |
チーフ会計士費用とサービス |
41 |
||
|
第IV部 |
||||
|
15. |
展示·財務諸表明細書 |
42 |
||
|
サイン |
このForm 10-K年次報告書は、1933年証券法(改正)第27 A節および1934年証券取引法(“取引法”)第21 E節の意味に適合するいくつかの前向き陳述を含み、これらの条項によって作られた安全港の制約を受ける。詳細は“をご覧ください”前向きな陳述に関する警告的声明.”
私たちのウェブサイトに含まれているまたは私たちのウェブサイトに関連する情報は、参照によって本報告書に組み込まれていません。
私たちは“小さな報告会社”であり、この用語は取引法に基づいて公布された第12 b-2条の規則に定義されている。したがって,本報告は,取引法により公布されたS−K条例に規定されている比較的小さい報告会社の比例報告要求を反映している。
前向きな陳述に関する警告的声明
このForm 10-K年度報告書には前向きな陳述が含まれており、将来の業績、業績、見通し、機会に対する私たちの現在の予想を反映している。これらの展望性陳述は、上記の“リスク要素”で確定されたそれらの要素を含む重大なリスク、不確定要素、および他の要素の影響を受けることができ、これらの要素は実際の結果が任意の前向き陳述中の表現または示唆の結果と大きく異なることを招く可能性がある。本年度報告におけるForm 10−Kに関する前向き記述は、“信じる”、“予想”、“予想”、“意図”、“可能”、“将”、“将”などの同様の表現によって識別することができる。しかし、このような単語はこのような宣言を識別する唯一の手段ではない。さらに、未来のイベントまたは状況の予期、予測、または他の説明への言及は、前向きな陳述である。連邦証券法が明確に要求しない限り、本年度報告が米国証券取引委員会に10-Kフォームを提出した後、または任意の他の理由で発生したイベントまたは状況を反映するために、任意の前向きな陳述を公開または修正する義務はない。貴社は、本報告および米国証券取引委員会に提出された他の報告書で行われた様々な開示を慎重に検討し、考慮しなければなりません。これらの報告書は、関心のある当事者に、私たちの業務に影響を与える可能性のあるリスク、不確実性、および他の要因の提案を提供しようとしています。
第1部
第一項:企業業務。
概要
Cyclo治療会社(“私たち”,“私たち”,“私たち”または“会社”)は1990年8月9日にフロリダ州の会社として設立され,1992年7月から運営を開始した。2000年の再編で、私たちはシクロデキストリン技術開発会社からCTDホールディングスに変更しました。2019年9月、私たちは現在の業務をよりよく反映し、2020年11月6日にフロリダ州からネバダ州に再登録するためにCyclo治療会社に改名しました。
2023年9月21日、我々はデラウェア州の完全子会社Cameo Merger Sub,Inc.とデラウェア州のアプリケーション分子輸送会社(AMTI)と合併協定と計画(“合併協定”)を締結した。合併は2023年12月27日に全株式取引方式で完了した。以下の統合プロトコルのさらなる議論を参照されたい。
著者らは臨床段階の生物技術会社であり、シクロデキストリンを基礎とした製品を開発し、神経変性疾患の治療に応用している。2014年,我々はニマン−ピックC型疾患(“”)を治療する薬剤として,米国食品医薬品局(FDA)に第2種類の薬物主文書を提出した。鼻咽頭癌は稀な致命的常染色体劣性遺伝病であり、コレステロール代謝の乱れを招き、脳、肺、肝臓、脾臓と他の器官に影響を与える。2015年、鼻咽頭癌の治療のために、トラプソール周期国際臨床プロジェクトを開始した。2016年、私たちは米国のある臨床地点で行われたランダム、二重盲検、平行グループ化研究のI期臨床計画を記載した新薬研究申請(IND)を米国食品医薬品局に提出した。I期研究は、トリプソールCycloおよびコレステロール代謝マーカーおよび鼻咽頭癌マーカーの18歳および以上の参加者がトリプソールCycloを2週間毎に静脈内投与する12週間の治療期間内の安全性および薬物動態を評価した。INDは2016年9月にアメリカ食品と薬物管理局の許可を得て、2017年1月にアメリカ食品と薬物管理局によってトラプソルCycloによる鼻咽頭癌治療の迅速な通路として承認された。米国第一段階研究の初期患者登録は2017年9月に開始され,2020年5月に我々が公表したトップラインデータは,この研究ではトラプソール周期が良好な安全性と耐性を有することを示している。
欧州規制機関によって承認されたI/II期臨床研究も完了し,イギリス,スウェーデン,イスラエルに臨床試験センターを設立した。このI/II期研究は一連の臨床結果、神経系、呼吸、コレステロール代謝と鼻咽頭癌マーカーの測定を含み、トリプソールCycloの安全性、耐性と有効性を評価した。12週間の第1段階研究(単一アメリカサイト)と一致し、ヨーロッパ/イスラエル研究は二重盲検無作為試験において2週間ごとに鼻咽頭癌患者にトリプソール環化を静脈注射したが、異なる点は研究周期が48週間(24剤)であった。2021年3月、著者らは試験を完成した患者100%(12人中9人)の病状が改善或いは安定を維持し、89%の患者が少なくとも17領域の鼻咽頭癌重症度尺度の2つの領域で改善の治療効果結果測定基準を達成したと発表した。
また,2020年2月に米国食品医薬品局と対面した“C型”会議を行い,これまでに得られた臨床データに基づいて,われわれの鍵となる第3段階臨床試験TrappsolCycloを開始することについて検討した。その会議では,トリプソールCycloを有する小児および成人患者の鼻咽頭癌の治療のために,連邦食品,薬物,化粧品法案第505(B)(1)条に提出された新薬申請を米国食品医薬品局と検討した。2020年2月にも欧州医薬品局(“EMA”)に類似した要請を提出し,EMAの科学的提案と案援助を求め,欧州での第3段階臨床試験を継続した。2020年10月,米国食品医薬品局から提案された第3段階臨床試験の“研究が可能”という通知を受け,2021年6月にTransportNPCへの参加を開始し,TrappsolCycloによる鼻咽頭癌治療の鍵となる第3段階研究である。
著者らが完成した臨床研究の初歩的なデータは、TrappsolCycloは細胞中のコレステロールと他の脂質の有毒沈着を除去でき、周辺に一致した薬物動態学特徴を有し、そして鼻咽頭癌患者の血液脳関門を越え、そして鼻咽頭癌患者の神経と神経認知方面のメリットとその他の臨床改善を招くことを表明した。これらの発見のすべての意義は,われわれの臨床試験(完了して行われているものを含む)データの最終分析の一部として決定される。
2010年5月17日、FDAはTrappsolCycloを鼻咽頭癌治療のための孤児薬として指定し、これにより、FDA薬の承認後7年以内に鼻咽頭癌治療のためのTrappsolCycloを独占的に販売することになる。2015年4月には,規制部門の承認後10年間の市場独占経営権を提供するTrappsolCycloのヨーロッパにおける孤児薬名も取得し,欧州医薬品局の小児科委員会が小児科調査計画(PIP)を受け入れた場合,この期間は12年に延長され,TrappsolCycloが小児科人口に対してあることが証明された。2017年1月12日、著者らはFDAの高速車線の称号を獲得し、2017年12月1日、FDAは鼻咽頭癌を小児科稀な疾患とした。
アルツハイマー病治療におけるシクロデキストリンの応用も探索されている。2018年1月、米国食品医薬品局は、TrappsolCycloを用いてアルツハイマー病を治療する単一患者IND拡張アクセス計画を承認した。この遅発性老年病患者は18ケ月の治療を経て、病状は安定し、薬物耐性は良好である。患者は改善の兆しも示し,単語を探す際の変動性は小さく,潜伏期が短かった。2021年1月に米国食品医薬品局に提出されたトリプソール静注によるアルツハイマー病治療の早期計画の概要を用意した。我々は2021年4月に米国食品医薬品局からこの概要のフィードバックを受け,これらのフィードバックを2021年11月に米国食品医薬品局に提出したTrappsolCycloによるアルツハイマー病治療の第2段階研究のINDに組み込んだ。2021年12月、私たちは食品医薬品局のINDの承認を得て、トリプルソール環化によるアルツハイマー病治療の第二段階研究を継続することを可能にした。この研究の米国サイトは2022年下半期に活性化され,患者投与量は2023年第1四半期から開始された。
2024年1月29日、私たちはアルツハイマー病の治療に関する米国特許商標局(USPTO)の特許出願の許可通知を受けた。特許出願第17/289,137号についてアルツハイマー病の治療法’S病“我々は2019年10月に特許協力条約に基づいてシクロデキストリンによるアルツハイマー病治療のための国際特許出願を提出し,この国際出願に基づいて国·地域段階出願を行っている。2023年6月12日、欧州特許出願番号19805439.7に関する欧州特許庁(EPO)から通信を受けたアルツハイマー病の治療法’S病.“欧州特許庁の書簡称”[t]彼の新しいクレームは許容できると考えられている[t]したがって、申請者はこのような権利要件と一致することを説明してください“と述べた。必要なすべての維持費が支払われた場合、これらの国または地域の段階で出願された任意の特許の条項は2039年に満了すると予想される。
私たちはまた、製薬、栄養、その他の業界へのシクロデキストリンと関連製品の販売を含む、私たちが残した微細化学工業業務を経営し続け、主に診断と特殊な薬物に応用されている。しかし,我々の中核業務は,基本シクロデキストリン製品を主に転売する事業から,シクロデキストリンに基づく疾患治療に主に専念するバイオ製薬のバイオテクノロジー会社に変化している。
ニマン·ピックC型疾患
鼻咽頭癌は極めて稀な遺伝性と進行性疾患であり、それは身体循環コレステロールと他のタイプの脂質の能力を損害し、脳を含む身体組織の損害を招く。鼻咽頭癌の発病時の症状は異なり、生後1ケ月目の早死から、主に末期肝疾患のため、成年後に進行性疾患と診断された。この病気は脳や様々な内臓に影響を及ぼす。鼻咽頭癌の症状は通常児童の早期から末期まで発生し、嚥下困難、言語と認知障害、運動協調と歩行を含む。この間,影響を受けた個人には知的障害,精神障害,進行性記憶力喪失も出現する可能性がある。症状は、肝および/または脾臓および肺疾患、てんかん発作およびジストニアを含む。鼻咽頭癌の全身症状は乳児期あるいは児童期によりよく見られ、成人後に症状が出現する人の進展速度は通常はるかに遅い。神経系症状が出現する年齢は疾患の重症度の予測因子の一つである。約半分の鼻咽頭癌患者は成人であり、この疾患の侵襲性は比較的に弱く、進展は比較的に遅く、最初はよく誤診され、これらの患者は更に認知症、精神症状と他の症状が出現する可能性があるからである。米国では,50歳のSと60歳のSと診断される患者が増えている。
鼻咽頭癌はNPC 1(95%の患者)或いはNPC 2という2つの遺伝子の1つの突然変異によって引き起こされ、この2つの遺伝子は細胞がコレステロールと他の脂質を正確に処理することを阻止し、そして脂質のリソソームへの蓄積を招き、細胞毒性、炎症、細胞機能喪失或いは細胞死亡を招く。中枢神経系では,進行性運動や脳損傷を引き起こす。遺伝病は父親と母親から得られた一対の特定形質の遺伝子の組み合わせによって決定される。鼻咽頭癌は常染色体劣性遺伝病である即異常遺伝子の2つのコピーは疾病や特徴を発展させるために存在しなければならない。NPC 1とNPC 2蛋白産物の正確な機能はまだ確定されていないが、細胞内のリソソーム間のコレステロールの輸送に関与していることが知られている。そのため、変異した遺伝子はNPC蛋白の欠陥を引き起こす可能性があり、それによってコレステロールと他の脂質が肝臓、脾臓、脳などの最もよく見られる器官で異常に蓄積する。また、アルツハイマー病やパーキンソン病などの他の神経変性疾患と同様に、鼻咽頭癌患者の脳脊髄液中のアミロイドとtau蛋白レベルは上昇する。
潜在市場
著者らは鼻咽頭癌の発病率は100,000名の生産児に1例であると推定し、現在全世界で現在3,000名の鼻咽頭癌患者は、毎年約1,370例の新しい鼻咽頭癌病例がある。孤児疾患を治療するための静脈投与の年平均価格は約404,750ドルであり、TRAPPSOLCycloを用いた鼻咽頭癌治療の年間潜在市場総額は約5.5億ドルと推定される。
鼻咽頭癌の治療選択
現在の多くの治療案はすべての人に対する明らかな特定の症状である。例えば,これらの対策には,セラピストに嚥下機能の最適化を推奨すること,てんかん発作を防止するための抗てんかん薬の処方を処方すること,不眠や他の疾患による睡眠問題を治療するためのメラトニンの処方を行うことがある。対症療法には専門家チームの協調努力が必要かもしれない。
Zavesca(ミルスター)は当初Actelion製薬会社によって開発され,現在はジョンソン社が所有しており,現在では後発薬としていくつかの国で発売されており,現在では鼻咽頭癌治療を許可する唯一の薬剤である。ヨーロッパ、カナダ、オーストラリア、ニュージーランド、そしてアジアと南アメリカのいくつかの国でのみZavescaとして承認され、日本ではBraavesとして承認された。ヨーロッパでは、ミルセタンは成人と児童鼻咽頭癌疾患患者の進行性神経症状の治療に使用されている。FDAは2010年にNPCのためのミルスターの承認を拒否し、より多くのデータを提供することを要求した。ミルスターに関連する一連の副作用として,体重減少,食欲低下,下痢,嘔気,血小板減少が知られている。ミルスタタンは鼻咽頭癌治療のためにFDAによって承認されていないが,Gaucher I型疾患の治療にFDAによって承認されている。また,他の治療案の安全性と有効性をテストするための研究が行われており,以下では“競合”の節でこれらの案をより詳細に検討する
現在の治療方案の獲得性、有効性と副作用が限られているため、著者らは鼻咽頭癌に対する治療は依然として大量の満足されていない需要が存在すると考え、著者らは鼻咽頭癌の全身と神経表現を治療する候補薬物を持つ唯一の会社であるかもしれない。
シクロデキストリン
シクロデキストリンはグルコース(糖)分子からなるドーナツ状環である。シクロデキストリンは細菌酵素がデンプンに作用して自然形成される。彼らは1891年に初めて注目されて隔離された。細菌酵素は、分子圏にいくつのグルコース単位が含まれているかに応じて、少なくとも3つの異なるシクロデキストリンの混合物を自然に産生し、6つのグルコース単位がαシクロデキストリンを生成し、7つの単位がβシクロデキストリンを生成し、8つの単位がガンマシクロデキストリンを産生する。分子ループ中のグルコース単位が多いほど,ループ中心のキャビティが大きくなる。このリングの内部は“油性”分子に良い休憩場所を提供しているが、リングの外部は水と互換性があり、“油性”分子がリング内に担持されている場合であっても、シクロデキストリンの透明で安定した溶液を水環境中に存在させることができる。最終的な結果は、小、中、大の3種類のサイズを持ち、白水を溶媒として使用して“油性”物質を輸送·輸送することができる分子担体である。化合物の分子封入能力がシクロデキストリンを化学的かつ薬学的に有用であるのである。
鼻咽頭癌治療におけるシクロデキストリンの使用
天然シクロデキストリンは、米国を含む世界の多くの国で一般的に安全(GRAS)とされている。また、2001年以降、FDAによるシクロデキストリン含有製品の承認は、将来的に新製品の規制承認を得やすい可能性が示唆されている。2001年、ジョンソンの子会社である楊森製薬会社は、ヒドロキシプロピルβ-シクロデキストリンを賦形剤として含む抗真菌薬である米国食品医薬品局の許可を得て、スポラノールを販売することができる。2009年、私たちの製品はFDAによって鼻咽頭癌治療のための同情投与研究新薬プログラムに承認された。“孤児薬物法案”によると、米国では、20万人未満の病気に影響を与える病気のために薬を開発している会社は、孤児薬として指定することを求めることができる。このような指定が承認されれば、会社はFDA薬承認後7年以内にその薬を独占販売することができ、同社は臨床試験税優遇を受ける可能性がある
TrappsolCycloは、不活性製剤賦形剤としてだけでなく、シクロデキストリンを活性薬剤として初めて使用した。2010年5月17日、FDAはトラプソールCycloを鼻咽頭癌治療の孤児薬として指定した。私たちはまたヨーロッパでトリプソールCycloの孤児薬名を獲得した。世界各地で,米国,ブラジル,スペインを含む20人以上の鼻咽頭癌患者がトラプソルCycloの慈悲治療を受けている。これらの同情使用計画に参加した患者は以下の1つ以上の利点を示した:肝臓の大きさの縮小;言語技能の回復;間質性肺疾患の解決;精密と粗大運動技能の改善、疾病の行為面の改善、及び生活の質の向上。これらの計画に参加した医師や患者は,トラプソルCycloの静脈内投与5年以上の患者を含めてデータを提供しており,これらのデータを用いて米国や海外で我々の臨床研究を設計し,同業者評議誌に発表し,治療医を共同著者としている。
私たちの臨床研究は
以下のより詳細に述べるように、これまで、著者らの臨床研究は、トリプソールとシクロホスファミドが異なる用量群の鼻咽頭癌治療において安全かつ有効であることを初歩的に証明している。鼻咽頭癌患者の治療効果を測定する時、著者らはアメリカ国立衛生研究院(NIH)が開発したNPC臨床重症度尺度を用い、この尺度は“主要領域”と“副次領域”の臨床バイタルサインと症状を測定し、以下の通りである
|
● |
9大領域:歩行、認知、眼球運動、精密運動、聴力、記憶、てんかん、言語と嚥下。 |
|
● |
8つの小さい領域:聴覚脳幹反応、行為、粘弾性消光、反射亢進、大小便失禁、発作性睡眠病、精神医学と呼吸器問題。 |
主要領域のスコアは0から5,0は障害がないことを表し,サブ領域ごとの重症度を合わせて2点である。
世界第3段階臨床研究(TransportNPC)
著者らが行っている第三段階臨床試験(CTD-TCNPC-301)TransportNPCは展望性、無作為、二重盲検、プラセボ対照治療研究であり、93名の3歳以上のNPC 1と診断された患者に適している。本研究の目的はトリプソール(ヒドロキシプロピルベタシクロデキストリン)2 0 0 0 mg/kg投与量の2週間ごとのゆっくり静脈注射の安全性、耐性と有効性を評価することである。患者はトリプソール、シクロホスファミド、またはプラセボをランダムに受け、割合は2:1であった。研究持続期間は96週,48週は非盲法中期分析であった。介入研究後,開放ラベルは96週間に延長された。36週目から、疾患進展は臨床全体印象重症度尺度で2つのレベルが12週を超える悪化した患者は開放ラベル治療に移行することができる。48週目と96週目に主要な疾病特徴の総合採点を通じて治療効果を測定する。1つのサブ研究が行われており,米国以外で行われており,対象は年齢0−3歳の無症状の可能性のある12名である。子研究の結果,安全性,臨床と介護者の疾患に対する印象であった。
ヨーロッパとイスラエルI/II期臨床研究
私たちはヨーロッパ、イギリス、スウェーデンでI/II期臨床研究を完成させた。本研究は3つの用量群(1,500 mg/kg、2,000 mg/kgと2,500 mg/kg)を通じて曲普ソールとCycloの安全性、耐性と有効性を評価し、コレステロール代謝と鼻咽頭癌マーカーを測定する以外に、神経系と呼吸器系の一連の臨床結果を含む。この研究の最初の患者は2017年7月に用量治療を受け,2020年2月にこの研究を完了した12名の患者の募集を発表した。この研究の治療効果、結果、測定基準と結果は以下の通りである
治療効果の評価基準1:NPC臨床重症度尺度測定の17領域のうち、2つ以上の領域が少なくとも1点減少(または改善)した。
結果は…:
|
● |
7名中6名がこのゴールに達した(試験を終えた患者のうち86%)。 |
|
● |
嚥下,歩行,てんかん発作を制御する能力,眼球拍動,精密運動スキル,認知に改善した。(個々の患者の状況が異なる、すなわち患者の改善状況が異なる。) |
|
● |
看護基準を超えた介入を受けていない患者は,1年間で総得点が1.5点悪化すると予想される。 |
治療効果の評価基準248週の“全世界疾患イメージ”からのベースライン変化。
結果は…:
|
● |
臨床医の全体改善印象尺度を用いて,試験を終えた7名中5名が改善し,他の2名の患者は安定していた |
|
● |
7人中5人は、歩行、話す、嚥下、細かい運動、認知のうちの少なくとも1つが改善された。この5つの特徴は鼻咽頭癌患者と彼らの介護者によって生活の質に最も重要であることが確定された。この5つの特徴の総合的な改善は私たちの重要な第3段階試験の主要な結果の測定基準になるだろう。 |
その他のデータ:
|
● |
全体として、臨床試験を完成した第1陣の7名の患者は研究の2つの治療効果結果指標に符合した。 |
|
● |
すべての用量群で個別患者は改善を示した。 |
|
● |
TrappsolとCycloは非常に有利な安全状況を示している。 |
|
● |
トラプソルとCycloは血液脳関門を越えていることが証明された。 |
|
● |
トリプルソールとシクロホスファミドの連続投与はtauレベルを低下させ,神経保護に有用であることが示唆された。 |
|
● |
TrappsolとCycloは運動失調を含む鼻咽頭癌の神経特徴を改善し、患者の生活の質を高めることができる。 |
|
● |
提供したデータから,キーとなるIII期試験の2000 mg/kg用量を選択した。 |
アメリカI期臨床研究
FDAは2016年9月、米国で行われた無作為、二重盲検、平行グループ化研究のI期臨床計画を承認した。I期研究は、トラプソールCycloおよびコレステロール代謝マーカーおよび鼻咽頭癌マーカーの安全性を評価し、18歳以上の被験者は、14週間の治療期間中に2週間ごとにトラプソルCyclo、2用量群(1500 mg/kgおよび2500 mg/kg)を静脈内投与した。この研究の登録は2019年10月に完了し、2020年5月に私たちが発表したトップラインデータは、この研究でトラプソルCycloが良好な安全性と耐性を持っていることを示している。この研究の他のデータには以下のデータが含まれている
|
● |
肝臓生検とコレステロール恒常性に関する生化学的データは,TrappsolとCycloが肝細胞から捕捉されたコレステロールを除去し,コレステロール恒常性に影響することを示している。 |
|
● |
多くの患者では,7回投与後tauが低下し,トラプソールとシクロホスファミドの静脈内投与が鼻咽頭癌患者の神経変性を予防していることが示唆された。 |
|
● |
TrappsolおよびCycloからの治療信号は、神経改善、より高いエネルギー、および患者がより大きな注意を示すことを含む。 |
|
● |
すべての条件を満たす患者は,在宅輸液による延長案でトラプソールとシクロホスファミドの使用を継続することが求められている。 |
|
● |
今年1月,このプログラムに参加した全8名の患者の陽性奏効率データを報告した。 |
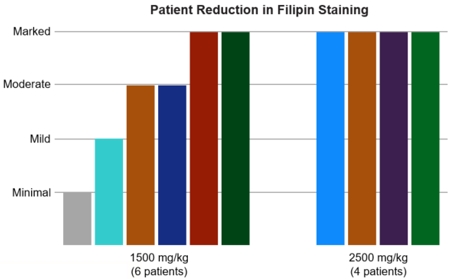
トラプソル®サイクロン™ 肝細胞中のコレステロールを除去する
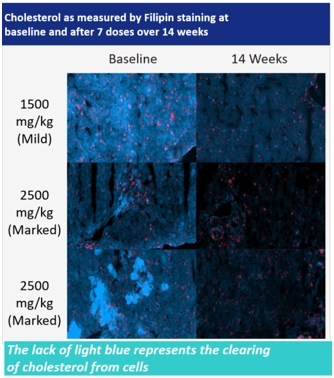
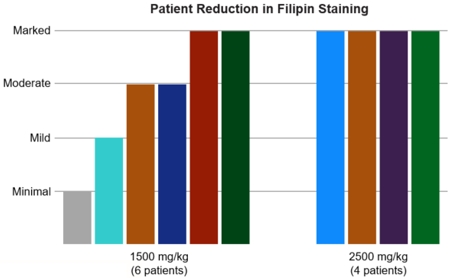
鼻咽頭癌患者の細胞内コレステロールは異常に蓄積した。われわれの臨床研究によると,TrappsolCycloはnpc 1蛋白のように機能し,コレステロールや他の脂質の細胞中での正常な移動を可能にすると信じられている。われわれの臨床試験では,1500 mg/kgと2500 mg/kgの用量のトラプソール環状投与を同時に投与し,トラプソールは末梢器官中のコレステロールを除去できることを示した。経営陣は,この疾患の全身や神経系表現を治療する経路の証拠であると考えている。生組織検査とフィブリン染色により肝細胞にコレステロールの低下を直接観察することができ,以下に示す。

トラプソル®サイクロン™ Tauを減らす
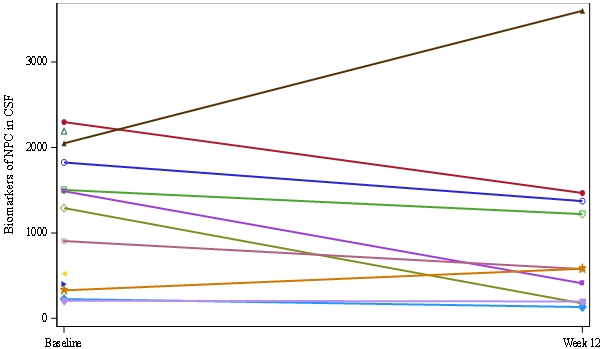
Tauは1種のタンパク質であり、鼻咽頭癌患者及びその他の神経変性疾患患者(例えばアルツハイマー病とパーキンソン病)の脳脊髄液(CSF)中に含有量の上昇を発見した。われわれの臨床研究データでは,トラプソル環化はtauレベルを低下させることが示されている。以下のグラフは,われわれの第1段階研究において,腰椎穿刺術を受けた鼻咽頭癌患者10名がトラプソルCyclo治療を受ける前と14週間以内に7剤服用後の脳脊髄液で測定したtauレベルを示し,そのうち10名中6名の患者のtauレベルが低下し,2名の患者が安定しており,2名の患者がtauレベルが上昇していることを示している。われわれI/II期研究からの3名の患者のデータは,この3名の患者が24週と48週でtauが減少したパターンが類似していることを示している。
陶(呉昌俊/L)
アルツハイマー病治療におけるシクロデキストリンの使用
鼻咽頭癌とアルツハイマー病は多くの共通の特徴があるため、著者らはTrappsolCycloを用いたアルツハイマー病の治療を探索してきた。特に、鼻咽頭癌とアルツハイマー病患者はすべて認知能力の低下を示し、脳脊髄液中tauレベルの上昇、脳中アミロイドβ蛋白プラーク、脳中神経原線維交絡、及び脳ニューロン中のリソソーム増大を示した。
ヒドロキシプロピル−β−シクロデキストリン(“HPBCD”)を用いてアルツハイマー病を治療する細胞および動物研究により示された
|
● |
HPBCDをアミロイドβ蛋白前駆体蛋白を過剰発現する細胞に添加することは、アミロイドβ蛋白プラークを低下させることができる |
|
● |
HPBCD過剰発現アプリに皮下注射したマウス: |
|
■ |
APPの溶解を減少させることでアミロイドβプラークを減少させる |
|
■ |
標準的な水迷路テストのように記憶力を向上させる |
|
■ |
ミクログリア細胞の増加(炎症のマーカー)を減少させる;および |
|
■ |
コレステロール輸送とアミロイドβ蛋白除去に関連する蛋白質(例えばNPC 1)を上昇させる。 |
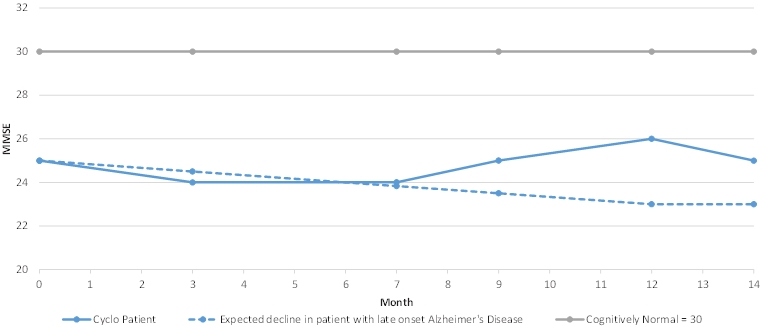
2018年1月、米国食品医薬品局は、TrappsolCycloを用いてアルツハイマー病を治療する単一患者IND拡張アクセス計画を承認した。毎月18ケ月静脈注射した後、アルツハイマー病患者が応用した標準臨床認知ツールに従って測定し、患者の疾病は進展しなかった。患者はトラプソルCycloの安全性に関係なくこの治療を中止した。次の表は、治療中の患者のミニ精神状態評価(アルツハイマー病患者を評価するための測定基準)を測定した。
知的財産権と規制の排他性
2024年1月29日、私たちはアルツハイマー病の治療に関する米国特許商標局の特許出願の許可通知を受けた。特許出願第17/289,137号についてアルツハイマー病の治療法’S病2019年10月、私たちは特許協力条約に基づいてアルツハイマー病のシクロデキストリン治療のための国家および国際特許出願を提出し、私たちはこの国際出願に基づいて国家·地域段階出願を行っている。2023年6月12日、欧州特許庁がこの特許出願を承認する通知を受けた。必要な維持費がすべて支払われた場合、これらの国または地域段階で出願された任意の特許の条項は2039年に満了する予定である。また、fdaと欧州規制機関はTrappsolCycloを鼻咽頭癌治療孤児薬に指定し、規制部門の承認を得た後、それぞれ7年と10~12年の市場排他性を得ることになる。私たちのTrappsolCycloの処方と製造過程は商業秘密によって保護されていると信じている。私たちは私たちのTrappsolを保護した。®Aquaplex商標は,米国特許商標局に登録されている。
競争
鼻咽頭癌を治療する方法はまだ知られていない。著者らは鼻咽頭癌治療の薬物製品の商業化の面で競争に直面しているが、著者らは鼻咽頭癌の全身と神経表現の候補薬物を同時に治療する唯一の会社である可能性が信じられている。ジョンソンの子会社Actelionは、米国で承認されていない薬物ミフェストタンを有し、この薬はいくつかの患者のいくつかの神経系症状を治療することができる。Orphazymeはデンマークに本社を置く上場企業であり、現在1種の候補薬物Arimoclomalが開発中であり、NPC群亜群の限られた神経利益に基づいて、FDAに転動NDA申請を提出した。また,IntraBioは鼻咽頭癌治療の候補薬物を開発しており,神経学的特徴のサブセットに有利であり,主に運動失調であることが初歩的に報告されている。IntraBioはまだ重要な実験段階に達していない。私たちの臨床進展、私たちとアメリカとヨーロッパの患者権益提唱団体との密接な関係、そして私たちが現在人類患者に使用している完成品という事実は、すべて潜在的な競争相手に対して競争優位を持たせると信じている。
私たちはまた、少量のシクロデキストリン流通に対する競争がますます激しくなっていることに注目している。我々が考察しているのは,規模の大きい流通業者の小業務や小製品であり,我々が提供する専門知識の重点と深さに欠けている.私たちの製品と比べて、それらの価格は一般的に競争力がありません。シクロデキストリンの一般的な経験が乏しいため,シクロデキストリン業界への進出には明らかな障害があると考えられる。私たちは世界各地の多くのシクロデキストリンメーカーと消費者と業務関係を構築し、30年以上の間に比類のない経験データベースを開発した。私たちはこのような関係と市場知識が顕著な商業的利点を提供すると信じている。
研究と開発
著者らは現在アメリカ、ヨーロッパ、北アフリカ、オーストラリアとイスラエルで臨床プロジェクトを展開しており、鼻咽頭癌治療のための生物製薬製品が市場の許可を得るように努力している。鼻咽頭癌治療のための製品の販売許可を求めているので、私たちはすでに私たちの曲普ソールCyclo製品の研究と開発に大量の投資を行っている。アルツハイマー病治療におけるシクロデキストリンの応用も探索されている。私たちが2017年に開始した臨床試験の進展に伴い、これらの努力を支援するために多くの資金を投入していきます。2023年には研究開発費は約14,200,000ドル,2022年は9,000,000ドルと変わらない。
政府の監督管理
生物製薬製品の開発、生産と販売は、トラプソールCycloの使用を提案して鼻咽頭癌を含む疾病を治療することを含み、アメリカ連邦、州と地方各級政府当局及びその他の国家政府当局の監督を受けている。その他の事項以外に、これらの規定は生物製薬製品の研究、開発、テスト、製造、包装、貯蔵、記録保存、ラベル、広告、販売促進、流通、マーケティングと輸出入を管理する。米国や他の国で規制の承認を得る過程や、その後適用される法規や条例の遵守には、多大な時間と財力がかかる。
アメリカ政府の規制
米国では,FDAは連邦食品,薬物と化粧品法案(FDCA)とその実施条例とガイドラインに基づいて薬品を規制している。規制承認を得る過程、その後適切な連邦、州、地方、その他の非米国連邦法規、法規、指導意見を遵守する過程には、多くの時間と財力が必要である。薬物開発過程のいずれかの場合、臨床前および臨床試験、承認過程または承認後プロセスを含み、適用される米国の要求を遵守できない場合、出願人は、臨床前研究または臨床試験、規制審査、承認、FDAが未解決のNDAの承認を拒否する、他の申請、販売または免許の取り消し、承認の撤回、臨床一時停止の実施、警告または無見出しの手紙の発行、製品のリコール、製品の差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金、政府契約の拒否、原状回復、FDA、米国司法省及びその他の政府実体が提起した民事又は刑事調査は、国家機関及び関連する民事又は刑事罰を含む。
FDAが米国で発売される前に要求することができるプログラムは、一般に、以下のようなものを含む
|
• |
FDAの良好な実験室操作規程に従って臨床前実験室テスト、動物研究と調合研究を完成した |
|
|
• |
CGMP条件下で、スポンサーが臨床試験に使用しようとしている薬物物質と薬物製品の製造を完成し、必要な分析と安定性試験を完成させる |
|
|
• |
ヒト臨床試験が開始される前に発効しなければならない臨床試験の研究新薬またはIND出願をFDAに提出する |
|
• |
各臨床試験が開始される前に、各臨床場所で独立した機関審査委員会またはIRBによって承認される |
|
|
• |
各提案された適応によって提案された薬物の安全性、効力、純度および有効性を決定するために、良好な臨床実践またはGCP要求に基づいて、十分かつ制御された臨床試験を行う |
|
|
• |
使用料を支払う |
|
|
• |
臨床開発および提案ラベル中の製品の製造および成分に関する詳細な情報を提出することを含む、1つまたは複数の提案された適応の販売を要求するNDAをFDAに作成して提出すること; |
|
|
• |
適用されれば、FDA諮問委員会の審査が満足的に完了する |
|
|
• |
CGMP要件に適合する状況を評価するための製品またはその構成要素を製造する第三者の検査を含む1つまたは複数の製造施設に対するFDAの検査を良好に完了させ、施設、方法、および薬剤の特性、強度、品質、および純度を維持するのに十分な制御を保証すること; |
|
|
• |
GCPおよび臨床データの完全性を保証するために、選択された臨床場所に対するFDAの検査を満足的に完了させる |
|
|
• |
NDAに対するFDAの審査と承認; |
|
|
• |
リスク評価の実施および戦略またはREMSの潜在的要件の緩和、およびFDA要件の任意の承認後の研究または他の上場後のコミットメントを含む、任意の承認後の要求を遵守する。 |
臨床前研究
臨床前研究は製品の化学、毒性と調合に対する実験室評価、及び潜在的安全性と有効性を評価する動物研究を含む。INDスポンサーは,臨床前試験の結果を製造情報,分析データ,任意の利用可能な臨床データや文献などとともにINDの一部としてFDAに提出しなければならない。IND提出後も,いくつかの臨床前試験が継続される可能性がある。INDはFDCAの免除であり、未承認候補製品が州間商業で臨床研究のために輸送されることを許可し、FDAにこのような研究製品をヒトに使用することを許可することを要求する。INDはFDAが受信した30日後に自動的に発効し、それ以前にFDAが1つまたは複数の提案された臨床試験に対して懸念または問題を提起しなければ、臨床試験を保留する。この場合,INDスポンサーやFDAは臨床試験開始前に未解決の問題を解決しなければならない。
したがって,INDの提出はFDAが臨床試験の開始を許可しない可能性がある。FDAが最初の30日間の保留期間内に、またはINDプロセスのいつでも懸念または問題を提起した場合、それは、臨床的保留の一部または全部を実施することを選択することができる。患者の安全に懸念があり、しかも臨床、臨床前及び/或いは化学、製造と対照方面の新しいデータ、発見或いは発展のために、FDAは強制的に臨床一時停止を実施する可能性がある。FDAが発表したこの命令は,提案された臨床試験の延期や進行中の試験の一時停止を招き,すべての懸案問題が十分に解決されるまで,FDAは調査が継続可能であることを通知した。これは私たちが計画中の臨床試験或いは未来の臨床試験を適時に完成させる重大な遅延或いは困難を招く可能性がある。
治療のための薬を研究する機会を広げる
使用を拡大することは、“同情的使用”と呼ばれることがあり、臨床試験以外に研究製品を使用し、比較可能または満足できる代替治療案がない場合には、重篤または直ちに生命を脅かす疾患または条件を有する患者を治療する。参入拡大に関する規則や条例は,研究療法の恩恵を受ける可能性のある患者が研究製品を獲得する機会を改善することを目的としている。FDAの規定は、個別患者(緊急時および非緊急時に治療された単一の患者IND申請)、中規模の患者集団、および治療レジメンまたは治療INDに従って研究製品の使用を申請するより大きな集団のために、会社または治療医がINDの治療目的のためにINDを逐次取得することを可能にする。
INDが患者または患者のグループを治療するために研究製品の拡大使用を申請することを審議するとき、スポンサーおよび治療医または調査者は、患者(S)が深刻または直ちに生命に危険な疾患または状態があり、疾患または状態を診断、監視または治療するための類似または満足できる代替療法がなく、潜在的な患者利益は治療の潜在的リスクが合理的であることを証明し、潜在的リスクは治療すべき背景または条件の下で不合理ではないことを決定するであろう。要求された治療に対して、研究薬物の拡大使用は、製品の発売許可を支持する臨床研究の起動、進行または完成、または他の方法で製品の潜在的開発を損害する可能性がある。
スポンサーは医薬品を拡大獲得できるようにする義務はないが、2016年に採択された“21世紀治療法”の要求に応じて、スポンサーが獲得要請にどのように応えるかという政策があれば、この政策を公開しなければならない。このような要求は時間の経過とともに発売されたが、それらは今全面的に施行された。この規定は,製薬会社に彼らの政策を公開し,個人患者が重篤な疾患のための製品を獲得する機会を拡大することを求めている。スポンサーは、第2段階または第3段階の臨床試験の開始が早いとき、または研究薬が突破的療法、迅速チャネル製品、または再生医学高度療法として指定された後15日以内に、そのような政策を開示しなければならない。
また、2018年5月30日には、“裁判権法案”が法律に署名された。他の事項に加えて、この法律はある患者に連邦フレームワークを提供し、いくつかのI期臨床試験が完了し、FDAの許可を得た研究製品を使用することを許可している。条件に適合した患者は,臨床試験に参加せず,FDA拡大参入計画によりFDA許可を得ることなく,研究製品を用いた治療を求めることができる場合がある。“試用権法案”によると,メーカーはその研究製品を条件に適合した患者に提供する義務はない。
臨床試験
臨床試験は、GCP要求に基づいて、合格した研究者の監督の下で、健康ボランティアまたは疾患または状態を有する患者を含む研究用新薬をヒト対象に投与することに関連し、すべての研究対象に任意の臨床試験に参加することを要求するインフォームドコンセントを書面で提供することを含む。臨床試験は,臨床試験の目標を詳細に説明し,基準を組み込むと排除し,安全性をモニタリングするためのパラメータと評価する有効性基準を提案した下で行った。INDの一部として,各臨床試験の案と任意の後続の案修正案をFDAに提出しなければならない。
米国国外での臨床試験のスポンサーが望ましいが,必要なくFDAの認可を得,INDによる臨床試験を行っている。IND下で外国臨床試験を行う場合,放棄しない限り,FDAのすべてのIND要求を満たさなければならない。外国の臨床試験がINDの下で行われない場合、スポンサーは臨床試験をIND或いは上場承認申請の支持として使用するために、試験がFDAのある法規の要求に符合することを確保しなければならない。具体的には,FDAは,独立した倫理委員会による審査·承認,参加者のインフォームドコンセントなど,このような臨床試験をGCPに従って行わなければならないことを求めている。GCPは臨床試験の倫理とデータ完全性基準を含むことが要求される。FDAの規定は、非INDと外国の臨床試験に参加したヒト被験者の保護、および結果データの質と完全性を確保することを目的としている。これらはまた、米国の臨床試験に匹敵する方法で非INDと外国試験を行うことを確保するのに役立つ。
また,臨床試験に参加する各機関の内部審査委員会は,その機関が臨床試験を開始する前に任意の臨床試験の計画を審査·承認しなければならず,臨床試験が行われている間,内部審査委員会は臨床試験を監視し続けなければならない。IRBは臨床試験設計、患者インフォームドコンセント、倫理要素と人類被験者の安全などの要素を考慮する。製品の臨床試験を監督研究するIRBはFDAの規定に符合しなければならない。FDA、IRB或いは臨床試験スポンサーは随時各種の原因で臨床試験を一時停止或いは中止することができ、臨床試験がFDAの要求に従って行われていないことを発見すること、或いは参加者は受け入れられない健康リスクに直面していることを含む。臨床検査はまた広範なGCP規則とインフォームドコンセントの要求を満たさなければならない。いくつかの臨床試験に関する情報は,そのClinicalTrials.govサイト上で公開伝播するために,特定の時間枠で米国国立衛生研究院に提出されなければならない。
人体臨床試験は通常3つの連続段階に分けて行われ、この3つの段階は重なる可能性があり、合併する可能性もある。承認された後に追加的な研究が必要かもしれない。
|
• |
第1段階:この薬剤は、限られた数の健康なヒト対象または標的疾患または状態を有する患者に最初に導入され、安全性、用量耐性、吸収、代謝、分布、排泄を試験し、可能であれば、その有効性の初歩的な兆候を得る。 |
|
|
• |
第二段階:薬物は、通常、可能な副作用および安全リスクを決定するために限られた患者集団に使用され、特定の標的疾患に対する製品の治療効果を初歩的に評価し、用量耐性および最適用量を決定する。スポンサーは、より規模が大きく、コストの高い第2段階臨床試験を開始する前に情報を得るために、複数の第2段階臨床試験を行うことができる。第2段階臨床試験が候補製品のある用量範囲が潜在的に有効であり、許容可能な安全性を有することが証明されると、それは第3段階臨床試験に入る。 |
|
|
• |
第3段階:良好に制御された臨床試験では、薬剤は、より多くの患者集団に使用され、一般に地理的に分散された臨床試験場所であり、承認のために製品の安全性および有効性を統計的に評価するのに十分なデータを生成し、製品の全体的なリスク·利益プロファイルを確立し、製品のラベルに十分な情報を提供する。コントロールが良好で、統計的に穏健な第3段階試験は、承認されたかどうかを決定し、承認された場合、どのように薬物を適切に標識するかを決定するために規制機関を提供することを目的としている可能性があり、このような第3段階研究は“キー”と呼ばれる |
|
|
• |
第4段階:場合によっては、FDAは、スポンサーがNDA承認後に追加の臨床試験を行うことに同意することを条件として、候補製品のNDAを条件付きで承認する可能性がある。他の場合、スポンサーは、承認後に追加の臨床試験を自発的に行うことができ、その薬剤に関するより多くの情報を得ることができる。この承認後の試験は一般に第4段階臨床試験と呼ばれる。 |
臨床試験結果を詳細に説明する進捗報告は少なくとも毎年FDAに提出しなければならず,重篤な有害事象やSAEが発生すればより頻繁に提出される。第1段階、第2段階、および第3段階の臨床試験は、任意の指定された時間内に成功しないか、または全く成功しない可能性がある。また、FDAやスポンサーは、研究対象が受け入れられない健康リスクに直面していることを発見することを含む、随時様々な理由で臨床試験を一時停止または終了することができる。同様に、1つの臨床試験が委員会の要求に従って行われない場合、または薬物が患者に意外な深刻な傷害に関連している場合、IRBは、その所在機関の臨床試験の承認を一時停止または終了することができる。
臨床試験と同時に、会社は通常追加の動物研究を完成し、製品の化学と物理特性に関する追加情報を開発し、cGMP要求に基づいて商業大量生産製品のプロセスを最終的に決定しなければならない。製造過程は一貫して高品質の候補製品ロットを生産することができなければならず、その中で、メーカーは最終製品の特性、強度、品質、純度をテストする方法を開発しなければならない。また,適切な包装を選択·テストし,候補製品が賞味期限内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない。
CGMPの要件に合致する
秘密協定を承認する前に、FDAは通常、製品を生産する1つまたは複数の施設を検査する。FDAは、製造プロセスおよび施設がcGMP要件に完全に適合していることを決定し、要求された仕様の下で製品が一貫して生産されることを保証するのに十分であると判断しない限り、申請を承認しないであろう。“公衆衛生サービス法”は属性が正確に定義できない製品の生産制御の重要性を強調した。製造業者や他の製品の製造と流通に参加する人たちもまたFDAと特定の州機関に彼らの工場を登録しなければならない。国内でも海外の製造企業でも,最初に生産過程に参加する際には,FDAに登録して追加的な情報を提供しなければならない。登録されていない工場で製造または輸入されたどの製品も、外国でも国内でも、FDCAの下に誤ったブランドが貼られているとみなされている。機関はcGMPや他の法律の遵守を確保するために、政府当局の定期的な抜き打ち検査を受ける可能性がある。検査は“リスクに基づくスケジュール”に従わなければならないが、これはいくつかの機関がより頻繁に検査されることを招く可能性がある。メーカーはまた、その工場に関する電子または実物記録の提供を要求しなければならないかもしれない。FDAの検査の延期、拒否、制限、または拒否は、製品が偽とみなされる可能性がある。
上場承認
必要な臨床試験,臨床前研究や臨床試験の結果,製品の化学,製造,制御,提案されたラベルなどに関する詳細な情報を想定し,NDAの一部としてFDAに提出し,1つまたは複数の適応の市場への承認を要請した。ほとんどの場合、秘密保持協定を提出するには高額な申請使用料を支払う必要がある。現在発効しているPDUFAガイドラインによると,FDAは10カ月の時間で基準NDAを審査して行動し,6カ月の時間で優先NDAを審査して行動し,NMEに基準NDAを提出した日から計算することを目標としている。今回の審査には通常8カ月を要するが,FDAは約2カ月で“届出”決定を下すことができるため,時期は定かではなく,特にFDAの現在の重点は新冠肺炎であることを考慮するとよい。
さらに、改正および再許可された2003年の“小児科研究公平法”によれば、いくつかの新薬または新薬補充剤は、すべての関連する小児科亜群において主張される適応の安全性および有効性を評価し、安全で有効な各小児科亜群に対するこの製品の投与および投与をサポートするのに十分なデータを含まなければならない。スポンサーはまたデータを評価する前に小児科研究計画を提出しなければならない。これらの計画は、提案された1つまたは複数の小児科研究の大綱、出願人が実施する研究、研究目標および設計、任意の延期または免除請求、および法規要件の他の情報を含む計画を含まなければならない。そして,申請者,FDA,FDAの内部審査委員会は提出された情報を審査し,相互に協議し,最終計画について合意しなければならない。FDAまたは出願人はいつでも計画の修正を要求することができる。
深刻なまたは生命を脅かす疾患または状態を治療するために使用されることを意図している製品については、FDAは、申請者の要求に応じて会議を開催し、初期小児科研究計画の準備を検討するか、または小児科評価を延期または放棄しなければならない。また,FDAは開発過程の早期に会議を開催し,小児科研究計画をスポンサーと検討し,FDAは重篤あるいは生命に危害を及ぼす疾患の第1段階会議が終了する前と,FDAが研究計画を受け取ってから90日遅れずにスポンサーと面会しなければならない。
FDAは、成人のために製品が使用されるか、または小児科データ要件を完全にまたは部分的に免除するまで、申請者の要求に応じて、または小児科データの一部または全部の提出を延期することを許可することができる。延期請求および延期請求に関する他の要求および手順は、“食品·薬物管理局安全·革新法”に記載されている。法規が別途要求されない限り、小児科データ要求は孤児の称号を有する製品には適用されない。
FDAはまた、薬剤の利点がそのリスクよりも大きいことを確実にするために、REMS計画の提出を要求する可能性がある。REMS計画は、制限された分配方法、患者登録、または他のリスク最小化ツールのような薬物ガイドライン、医師コミュニケーション計画、評価計画、および/または安全使用を保証する要素を含むことができる。
FDAは、届出を受ける前に、提出後の最初の60日以内にすべてのNDAを予備審査して、それらが十分に完全であるかどうかを決定し、実質的な審査を行うことができる。FDAは秘密協定の申請を受け入れるのではなく、より多くの情報を提供することを要求するかもしれない。この場合、申請は追加情報と共に再提出されなければならない。再提出された申請はFDAが届出を受ける前にも審査を行わなければならない。提出された書類が届出を受けると、FDAは深い実質的な審査を開始する。FDAは、薬物が安全かつ有効であるかどうか、および薬物を製造、加工、包装、または保有する施設が、製品の持続的な安全、品質、および純度を確保するための基準に適合しているかどうかを決定するために、秘密保持プロトコルを検討する。
FDAは新薬の申請を諮問委員会に提出するかもしれない。諮問委員会は,臨床医や他の科学専門家を含む独立した専門家からなるグループであり,申請を審査,評価し,申請を承認すべきかどうか,どのような条件でアドバイスを提供すべきかを担当する。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を慎重に考慮するだろう。
秘密協定を承認する前に、FDAは通常、製品を生産する1つまたは複数の施設を検査する。FDAは、製造プロセスおよび施設がcGMP要件に適合していることを決定し、要求された仕様の下で製品が一貫して生産されることを保証するのに十分でない限り、申請を承認しないであろう。さらに、NDAを承認する前に、FDAは、GCP要件に適合することを確実にするために、通常、1つまたは複数の臨床試験場所を検査する。
試験がIND下で行われる場合,FDAは通常外国からの臨床試験のデータを受け,NDAを支持する。外国の臨床試験がINDで行われていなければ,研究がGCP要求に基づいて行われ,FDAが現場検査でデータを検証することができれば,必要であればFDAはNDAを支持するデータを受け入れることができる。FDAは通常、上場申請は国内の臨床研究のいくつかのデータの支持を得なければならないことを要求しているが、外国データがアメリカに適用されれば、FDAは外国データを上場許可の唯一の根拠として受け入れる可能性がある。
秘密保持プロトコルのテストと承認過程には多大な時間,精力,財力が必要であり,完成には数年かかる.臨床前と臨床試験から得られたデータは常に決定的ではなく、異なる解釈の影響を受ける可能性があり、これは監督管理部門の承認を延期、制限或いは阻止する可能性がある。FDAはNDAをタイムリーに承認しないか、または全く承認しないかもしれない。
NDAとすべての関連情報を評価した後,諮問委員会のアドバイス(あれば)や製造施設や臨床試験地点に関する検査報告を含めて,FDAは承認状を発行する可能性があり,場合によっては完全な返信が発行される可能性がある。完全な返信手紙は、一般に、NDAの最終承認を保証するために満たされなければならない特定の条件の宣言を含み、FDAが出願を再検討するために、追加の臨床または臨床前試験、製造または処方修正、または他の変更が必要となる可能性がある。この補足情報を提出しても、FDAは最終的にその申請が承認された規制基準を満たしていないと決定する可能性がある。もしこのような条件がFDAの満足を得たら、FDAは通常承認書を発行するだろう。この薬物の商業マーケティングを許可し、特定の適応の具体的な処方情報を提供する。
FDAが製品を承認したとしても、製品の承認適応を制限することができ、製品ラベルに禁忌症、警告または予防措置を含むことを要求し、承認後に薬物の安全性をさらに評価するための第4段階の臨床試験を含む承認後の研究を要求することができ、製品の商業化後に製品を監視するための試験および監視計画を要求するか、または流通および使用制限またはREMS下の他のリスク管理メカニズムを含む他の条件を適用することが、製品の潜在的な市場および収益性に大きな影響を与える可能性がある。FDAは発売後の研究或いはモニタリング計画の結果に基づいて、製品の更なるマーケティングを阻止或いは制限することができる。承認後、新たな適応の追加、製造変更、および追加のラベル宣言など、承認された製品のいくつかのタイプの変更は、さらなるテスト要件およびFDAの審査および承認を受けるであろう。
孤児薬名
トラプソルCycloはすでにアメリカ食品と薬物管理局によって孤児薬物の地位を授与された。FDAによって承認された調査新薬(IND)プログラムによると、限られた数の顧客によって内科医の監督の下でNPCの治療に使用されている。孤児薬物法によると、FDAは、米国で20万人未満の影響を与える、または20万人を超える場合、米国での販売が米国での薬剤の開発および販売のコストを相殺するのに十分な、まれな疾患または状態を治療するための薬物孤児薬名を付与する可能性がある。秘密保持協定を提出する前に、指定孤児薬を申請しなければならない。規制規定により提出された受け入れ可能な機密要求によると、1つの製品がFDA孤児製品開発事務所の孤児薬物指定を受けた場合、その製品は孤児となる。そして、その製品はどんな他の製品のように審査と承認手続きを通過しなければならない。指定孤児薬は、規制審査と承認過程でいかなる利点も伝達されず、規制審査と承認過程の持続時間を短縮することもない。
スポンサーは、以前承認されていなかった製品を孤児薬として指定したり、すでに発売されている製品のために新たな孤児適応を申請することを要求することができる。FDAが、指定されたまれな疾患または疾患を治療するための指定された孤児薬のマーケティング申請を承認した場合、スポンサーは、税金控除および7年間の市場排他期間を得る資格があり、その間、FDAは、後続のスポンサーがその製品が臨床的に優れていることを証明するような限られた場合でなければ、承認された孤児薬と同じ活性部分を有し、同じ用途または適応のための薬物のマーケティング申請を許可してはならない。しかし,スポンサーのまれな薬専門期間内に,参加者は活性部分の異なる薬剤が承認された孤児薬と同じ適応,あるいは活性部分が承認された孤児薬と同じ薬剤を承認することができるが,承認の適応は異なる。もし競争相手が私たちの前に同じ適応のための同じ活性部分を有する薬物の承認を得た場合、孤立薬物独占性は、孤立薬物独占性を撤回する理由があることが証明できない限り、7年以内に私たちの製品の承認を阻止する可能性がある。また,指定された孤児薬が市販承認された場合,その適応の範囲は孤児薬が指定されたまれな疾患や疾患の適応範囲よりも広く,排他性を得る資格がない可能性がある。
専門期間はFDAが上場申請を承認した日から,この製品が指定した適応にのみ適用される。FDAは、同じ製品の第2の出願を異なる使用のために承認することができ、または同じ使用のために製品の臨床的により優れたバージョンを申請することができる。しかしながら、スポンサーの同意またはスポンサーが十分な数を提供できない限り、FDAは、他のメーカーが生産した同じ製品が市場排他期間内に同じ適応のために使用されることを許可することはできない。
FDAは特に迅速な審査と承認計画
FDAには、迅速チャネル指定、加速承認、優先審査、突破的治療指定を含む様々な計画があり、深刻または生命に危険な疾患または状態を治療するための薬物の開発とFDA審査過程を加速または簡略化し、未満足の医療需要を解決する潜在力を示すことを目的としている。これらの計画の目的は,FDA標準審査プログラムよりも早く患者に重要な新薬を提供することである。2017年1月、米国食品医薬品局はTrappsolCyclo迅速チャネルによる鼻咽頭癌の治療を許可した。
迅速なチャンネル認証を取得する資格があるため、FDAはスポンサーの要求に基づいて、深刻な或いは生命に危害を及ぼす疾病或いは状況を治療することを目的とした製品を確定し、満足されていない医療需要を満たす潜在力を示しなければならない。FDAは、製品が存在しない療法を提供するか、または治療効果または安全要因に基づく潜在的に既存の療法よりも優れた治療法を提供する場合、満たされていない医療需要を満たすことを決定するであろう。完全な出願を提出する前に、FDAは、NDA内の高速チャネル製品を審査する部分をスクロールする可能性がある。スポンサーが機密協定部分を提出するスケジュールを提供した場合、FDAは、秘密協定の部分を受け入れることに同意し、スケジュールが許容可能であると判断し、スポンサーは、秘密協定の第1の部分を提出する際に必要な使用料を支払う。
FDAは、重篤な疾患の治療を目的とした薬剤を優先的に検討する可能性があり、承認されれば、これらの薬剤は、治療において有意な改善を提供するか、または適切な治療法なしに治療を提供するであろう。優先審査は、現在のPDUFAガイドライン下の標準審査10ヶ月ではなく、FDA審査申請の目標が6ヶ月であることを意味する。現在のPDUFAプロトコルによれば、この6ヶ月および10ヶ月の審査期間は、受信日ではなく、新しい分子実体の“提出”日から計算され、これは、通常、提出日から審査および決定を行うために、約2ヶ月のタイムラインを増加させる。高速チャネル指定を受ける資格がある製品の多くは、優先審査を受けるのに適していると考えられるかもしれない。
さらに、重篤または生命を脅かす疾患の治療における研究された製品の安全性および有効性、ならびに既存の治療方法よりも意義のある治療効果を提供する製品は、加速承認を得る資格がある可能性があり、十分かつ制御された臨床試験に基づいて、代替終点に対する薬物製品の影響を決定することができ、臨床利益を合理的に予測することができ、または臨床終点では不可逆的な発症率または死亡率よりも早く測定することができ、不可逆的な発症率または死亡率または他の臨床的利益への影響を合理的に予測することができ、同時に、病状の重症性、希少性または流行率、ならびに代替治療の利用可能性または不足を考慮することができる。承認された条件として、FDAは、不可逆的な発症率または死亡率または他の臨床終点に対する予想される影響を検証および説明するために、加速承認された薬物のスポンサーの発売後の研究を要求することができ、この薬剤は、加速中止手順を必要とする可能性がある。
画期的な治療法は、単独または1つまたは複数の他の薬物との併用治療が深刻または生命に危険な疾患または状態を治療することを目的とした薬物であり、初歩的な臨床証拠は、1つまたは複数の臨床的重要な終点において、既存の治療法よりも実質的な改善を示す可能性があり、例えば、臨床開発早期に観察される実質的な治療効果を示す可能性があることを示している。FDAは、画期的な治療法の承認申請の開発と審査を加速するために、会議を適時に開催し、提案を提供するなど、何らかの行動を取らなければならない。
1つの製品がこれらの計画のうちの1つまたは複数に適合していても、FDAは、製品がもはや資格条件に適合していないことを後で決定することができ、またはFDAの審査または承認を決定する期間が短縮されないことができる。私たちは私たちの候補製品のためのいくつかの機会を適切に探索するかもしれない。
2017年12月1日、FDAは鼻咽頭癌を稀な小児科疾患とした。FDAが指定した稀な小児科疾患は人々がアメリカ市場で稀な小児科疾患の指定薬物の治療を許可した後に優先審査証明書の資格を得ることができる。まれな小児科疾患優先審査クーポン計画は稀な小児科疾患の予防と治療の治療方法の開発を奨励することを目的としている。NDA承認後にまれな小児科疾患スポンサーを指定するクーポン券を他のエンティティに売却または譲渡することができ,保有者はこのクーポン券を用いて将来のNDA提出の優先審査を受けることができ,FDAが将来提出する審査期間を10カ月から6カ月に減少させることができる。
保証と精算を請け負う
任意の承認された候補製品の将来の商業成功は、MedicareおよびMedicaid、個人健康保険会社、および他の第三者支払者が私たちの候補製品に保険を提供し、十分な精算レベルを確立することを含む連邦および州レベルの政府支払者計画にある程度依存するだろう。政府衛生行政部門、個人健康保険会社、その他の組織は通常、彼らがどのような薬物を支払い、医療保健の精算レベルを確立するかを決定する。特に米国では、個人健康保険会社および他の第三者支払者は、通常、政府が連邦医療保険または医療補助計画を介してそのような治療に補償を提供するレベルに基づいて、製品およびサービスに補償を提供する。米国、EU、またはEU、ならびに私たちの候補製品の他の潜在的に重要な市場では、政府当局および第三者支払者は、医療製品およびサービスの価格、特に新しいおよび革新的な製品および療法を制限または規制しようとするようになっており、これは、通常の場合の販売価格よりも平均販売価格を下回ることが多い。また、米国の制御された医療保健およびEUの国と地域の価格設定と精算制御への重視は、製品の価格設定、精算、使用に追加的な圧力をもたらすことになり、これは私たちの将来の製品販売と運営結果に悪影響を及ぼす可能性がある。これらの圧力は管理型医療グループの規則と実践、連邦医療保険、医療補助と医療改革、薬品カバーと精算政策及び全体定価に関する司法裁決と法律法規から来る可能性がある。
医療改革が私たちの業務に与える影響
米国や一部の外国司法管轄区域は、医療システムを変更するための追加立法·規制提案を検討または公布しており、承認されれば、これらの提案は私たちの候補製品販売の収益性に影響を与える可能性がある。米国や他地域の政策立案者や支払者の中には,医療コストを抑え,質の向上と医療サービスのカバー範囲を拡大するために医療システムの変革を推進することに大きな興味がある。米国では、製薬業はずっとこれらの努力の重点であり、その中には、医療システムの改革を通じて医療コストを低減する重大な立法措置が含まれており、薬品と生物製薬製品の価格設定、カバー範囲と精算を制限し、特に政府が援助する医療保健計画の下で、政府の薬品価格の制御を強化することが含まれている。
過去数年間、米国政府は、2010年の“患者保護と平価医療法案”(Patient Protection And Affordable Care Act)に基づいて、2010年の“医療·教育調整法案”(Health Care And Education Consolation Act)によって改正され、または総称してACAと呼ばれる患者を中心とした結果研究所を設立するいくつかの措置を講じてきた。比較有効性研究は競争相手の製品にメリットがあることを示しており、候補製品の販売に悪影響を及ぼす可能性もある。もし第三者支払者が私たちの候補製品が他の利用可能な療法と比較して費用対効果があると思わない場合、彼らは私たちの候補製品を彼らの計画下の福祉としてカバーしないかもしれない、あるいは、もし彼らが支払いレベルが利益に基づいて私たちの製品を販売するのに十分ではないかもしれないと思う場合。
ACAは2010年3月に法律となり,政府や民間保険会社が医療に融資する方式を大きく変えた。私たちの業務に影響を及ぼす可能性のある他の措置では、ACAは、指定されたブランドの処方薬および生物製剤の任意の生産または輸入の実体に徴収される控除不可能な年会費を確立し、新しいMedicare Part D Coverage Gap割引計画;およびMedicaid薬品返却計画に従って製造業者が支払わなければならない戻り点を増加させる新しい式を確立する。また,ACAはメーカーの医療補助リベート責任を延長し,医療補助計画の資格基準を拡大し,公衆衛生サービス薬品定価計画に基づいて割引を受ける資格を有する実体を拡大した。ACAのいくつかの側面は、司法と国会の挑戦を受けており、ACAのいくつかの側面を廃止または代替するための現大統領政府の最近の努力は、このような挑戦と修正案が続くと予想される。トランプ総裁は2017年1月以降、ACAの任意の特定の条項の実施を延期したり、ACAが許可しているいくつかの医療保険要求を回避したりするための行政命令に署名した。行政命令は、ACAによる権限および責任を有する連邦機関がACAの実施を放棄、延期、免除、または延期することによって、州、個人、医療提供者、健康保険会社または医薬品または医療機器製造業者に財政的または規制的負担をもたらす条項を示す。二番目の行政命令はACAによって保険会社に返済された費用分担補助金を終了した。いくつかの州の検事総長は政府による補助金の中止を阻止するよう提訴したが、彼らが提出した制限令請求は2017年10月25日にカリフォルニア州の連邦裁判官によって却下された。また,CMSは最近,個人や小団体市場の保険会社に基準を設定する上で各州により大きな柔軟性を与える法規を提案しており,このような市場で販売されている保険計画に要求される基本的な健康福祉をACAが緩和する可能性がある。2018年12月、CMSは、ACAリスク調整計画に基づいて、ACA資格に適合するいくつかの健康計画および医療保険発行者に、CMSがこのリスク調整の方法を決定したことに関する連邦裁判所の訴訟結果に応答するための新たな最終規則を発表した。-2020年4月27日、米国最高裁は、ACA資格に適合するいくつかの健康計画および医療保険発行者への120億ドルのACAリスク廊下支払いの拒否を支持する連邦巡回裁判所の裁決を覆した。この精算格差が第三者支払者,ACA市場,プロバイダおよび潜在的な我々の業務の生存能力に及ぼすすべての影響は不明である。また、2019年12月、第5巡回控訴裁判所の3人の裁判官からなる陪審員は、地域裁判所がACA全体の無効を宣言する裁決を部分的に確認した。この法律の合憲性が挑戦され、#年に米国最高裁で審議されるため、ACAの未来はまだ確定していないカリフォルニア州はテキサス州を訴えますそれは.この進行中の訴訟はACAの最低基本保険条項(個人強制令と呼ぶ)に挑戦し,法律全体の存続に疑問を投げかけている。訴訟が解決されている間、ACAはまだ有効だ。しかし,最終的にすべてまたは大部分の法律が廃止されれば,米国の医療システムに複雑で深遠な結果をもたらす可能性がある。
州レベルでは、立法機関は、価格または患者の精算制限、割引、特定の製品参入およびマーケティングコスト開示の制限、および透明性措置を含む、価格または患者の精算制限、割引、特定の製品参入およびマーケティングコスト開示の制限および透明性措置を含む医薬品および生物製品の定価を制御するための法規を立法および実施することが増えており、場合によっては、他の国からの輸入および大量購入を奨励することが目的である。さらに,地域医療当局や個別病院では,どの生物製薬製品およびどのサプライヤーが処方薬や他の医療計画に含まれるかを決定するために入札プログラムが使用されるようになってきている。これらの措置が承認されると、私たちの製品に対する最終的な需要を下げたり、私たちの製品の価格設定に圧力をかけるかもしれません。
外国、連邦と州の各レベルはすでにより多くの立法と監督管理提案を提出し続ける可能性があり、医療保健の獲得性を拡大し、医療保健コストをコントロール或いは低減することを目的としている。これらの改革は、市場で承認された候補製品の予想収入の開発に成功し、我々の全体的な財務状況や候補製品を開発する能力に影響を与える可能性がある。
他の医療保険法
アメリカ以外では、私たちが製品をマーケティングする能力は適切な規制機関のマーケティング許可を得ることにかかっている。市場許可、定価、精算を管理する要求は国によって異なる。アメリカ国外で任意の製品をマーケティングするために、私たちは他の国/地域の安全性と有効性に関する多くのと異なる監督管理要求、及び私たちの候補製品に対する臨床試験、マーケティング許可、商業販売と流通などの方面の監督管理要求を遵守する必要がある。薬物が米国で発売されたかどうかにかかわらず、これらの国で臨床試験を開始したり、販売したりするためには、外国の類似規制機関の必要な承認を得る必要がある。承認過程は国によって異なり、追加の製品テストと追加の行政審査期限が関連する可能性があります。他国で承認を得るのに要する時間は、米国で承認を得るのに要する時間とは異なり、米国で承認されるのに要する時間よりも長い可能性がある。一方の国の規制承認は他の国の規制承認を確保することはできないが、1つの国で規制承認を得られなかったり、遅延したりすることは、他の国の規制過程に悪影響を及ぼす可能性がある。
私たちの伝統的な精密化学工業事業は
私たちの現在のほとんどの収入は、シクロデキストリンの販売、シクロデキストリン複合体、顧客の仕様に応じて他社製シクロデキストリンを転売し、私たち自身の許可シクロデキストリン製品を含む伝統的な微細化学工業業務から来ています。私たちはすでにTrappsolとAquaplex製品ラインの下のいくつかの製品に商標を登録しました。トラプソール製品ラインには基本シクロデキストリンと異なる化学付加物を有するシクロデキストリンが含まれているため、261種類を超える異なるシクロデキストリン製品を販売することができる。Aquaplex製品ラインには各種シクロデキストリンと80種類以上の異なる活性成分が含まれており,これらの成分は錯体としてのみ水溶性となり,116種類の異なるAquaplex製品を示している。歴史的に見ると、私たちのほとんどのAquaplex製品は化学品サプライヤーであるシグマ-オドリッチ精密化学工業会社に販売されています。TrappsolとAquaplexの売上はそれぞれ2022年の製品売上の約99%と1%を占めています。--TrappsolとAquaplex®製品は多くの産業に使用することができ、その中で最大のものは食品と製薬産業だ
世界には少なくとも4つの主要な商業メーカーが天然および化学修飾シクロデキストリンを提供し、バク化学株式会社(ドイツ)傘下のバク生物ソリューション会社を含み、その生産施設はミシガン州ミンホ、三菱化学(日本)、フランスロクト(フランス)、および杭州医薬化学株式会社(中国)を提供している。2008年まで、私たちのすべてのAquaplexシクロデキストリン複合製品はハンガリーのブダペストにあるシクロデキストリン研究開発実験室から購入された。現在の良好な製造規範(c-GMP)シクロデキストリン複合体の商業バッチは世界にほとんど他の源がない。私たちはシクロデキストリン研究開発実験室から多くのシクロデキストリン材料を購入し続けると同時に、私たち自身のAquaplex材料も生産した。また、ジョージア州オルバニのEquinox化学社のような第三者メーカーを用いてシクロデキストリン複合体を開発しました。私たちはサプライヤーから天然および化学修飾シクロデキストリンを得ることは従来困難ではありませんでしたが、現在および予想されている将来の拡張需要を満たすために十分なシクロデキストリンを得ることは困難ではないと予想されています
シクロデキストリン製品背景
シクロデキストリンは油と水を結合させた分子であり,油性物質を水に可溶にし,油と水を一緒に使用しなければならないどこでも潜在的な応用がある。シクロデキストリンは多種の薬物の溶解度と安定性を改善できる。多くの有望な医薬化合物は、不安定であるか、水に難溶であるため、使用できないか、または重篤な副作用がある。現在承認されている化合物を投与する戦略は、pH調節を必要とする製剤の注射および/または有機溶媒の使用を含む。その結果は患者の苦痛、怒り或いは有害であることが多い。これらの副作用はシクロデキストリンにより改善することができる。シクロデキストリンは眼部や皮膚の局所投与においても多くの潜在的な用途がある
シクロデキストリンはすでに生物技術、製薬、農薬、分析化学、化粧品、診断、電子、食品と有毒廃棄物処理に成功した。食品香料と香料の安定化は現在シクロデキストリンが応用されている最大の世界市場である。我々は他社とシクロデキストリンに基づく応用を開発し,食品の風味を安定させ,不良な味とにおいを除去し,食品と薬品の抗真菌複合体を調製し,香料と染料を安定させ,食品,化粧品,洗面用品中の泡立ちを減少させ,食品の品質,安定性,貯蔵性を改善した。
精製した酵素をデンプン溶液と混合することにより,シクロデキストリンを大量に商業的に製造することができる。この酵素を精製した天然酵素でデンプンを修飾することにより,α,βとガンマシクロデキストリンの混合物を製造することができることから,天然産物と考えられる。単独シクロデキストリンを分離および分離するために追加の処理が必要である。精製されたα、βおよびガンマシクロデキストリンは、天然または天然シクロデキストリンと呼ばれる。
シクロデキストリン分子中の各グルコース単位上のヒドロキシ化学基は、化学者にシクロデキストリンの性質を変化させる方法を提供し、たとえそれが水に溶解しやすく、または水に溶解しにくくても、特定の化学物質のより良い担体とする。化学修飾によるシクロデキストリンは天然とは考えられなくなり,化学修飾シクロデキストリンと呼ばれる。実現された財産修正は、通常、特定のアプリケーションに有利であるため、同社は、天然製品分類を失うことが最終的な製薬用途を阻止するとは考えていない。しかし、それはより大きな規制負担をもたらした。
シクロデキストリンの他の用途
個人製品および工業へのシクロデキストリンの応用は、多くの特許および特許出願に登場している。シクロデキストリンは織物柔軟剤と空気清浄剤を含む多くのブランド家庭用品に使用されている。製造能力や供給の増加に伴い,天然シクロデキストリンの価格は最も価格に敏感な商品でもこれらの材料を使用することが考えられる程度に低下している。
日本では現在、少なくとも12種類のシクロデキストリン含有医薬製剤が発売されており、ヨーロッパやアメリカでも多くの製品があります。より多くのシクロデキストリンはすべての投与経路を許可しています。ニトログリセリン,デキサメタゾン,プロスタグランジンE(1と2)やセファロスポリンなどの有名な薬物の容易性やバイオアベイラビリティの向上により,これらの“老”薬物は新たな市場シェアを獲得し,新たな特許寿命を得ることもある。付加価値のため、経営陣はシクロデキストリンを含む製品とシクロデキストリン錯体の世界市場でのドル価値はシクロデキストリン自体の市場売上高を大きく上回ると考えている。
顧客
私たちは現在、伝統的な精密化学工業製品を製薬、診断、工業化学業界の顧客および化学品供給流通業者に直接販売しています。2023年12月31日までの1年間、私たちの収入には、基本的な天然と化学修飾シクロデキストリンの99%と1%のシクロデキストリン複合体が含まれています。
私たちのシクロデキストリン販売は従来少量(すなわち1.0キロ未満)しか扱っていませんでした。私たちは直接お客様に販売して、私たちの施設で注文を包装して、普通の運送人を使って出荷します。
私たちの収入の大部分は五から十個の歴史上ずっとリピーターの顧客です。2023年、2023年、2022年12月31日までの年間で、2人と3人の顧客がそれぞれ私たちの売上高の72%と68%を占めています。シグマ-オドリッチ精密化学工業はそれぞれ2023年と2022年のAquaplexの年間売上高の96%と85%を占めています。与えられた1年間、私たちは一般的に200人未満の個人顧客に製品を販売する。私たちの工業顧客は、主に製品開発目的のために必要に応じて私たちから製品を購入しています。そのため、これらの顧客の将来の売上を予測することは困難であり、他社の現在のシクロデキストリンに関する研究開発活動に依存しているため、私たちは過去にアメリカや他の地方の特許発行や申請を追跡することでこれらの活動を監視していました。
トラプソルとAquaplex製品の既存や新規顧客の研究や製品開発活動における使用を引き続き推進していきたいと考えています。
従業員
私たちは現在8人のフルタイム従業員を雇用している。私たちの従業員はみんな労働組合に属していません。私たちは従業員と仲がいいと信じています。
項目1 A:リスク要因。
私たちの財務状況と資本需要に関連するリスク
私たちは最近損失を受けて、未来の収益性も確定していない。
2023年12月31日と2022年12月31日までの年間で、それぞれ約2,010万ドルと1,550万ドルの純損失が発生した。私たちの最近の損失は主に私たちのTrappsolCyclo製品の研究開発費用と他の一般的な運営費用、人員コストを含むためです。私たちが臨床試験を行い、規制部門の承認を求め続けることに伴い、トラプソールCycloによる鼻咽頭癌やアルツハイマー病の治療に伴い、私たちの費用は増加し続けると信じている。したがって、私たちの運営損失は、製品販売、許可料、印税、その他の源が十分な収入を出して私たちの運営に資金を提供するまで続くと予想されています。私たちがいつ(もしあれば)利益が達成されるかどうかは予測できないし、利益が実現すれば、私たちが利益を持続できるかどうかも確信できない。
私たちが最近発行した証券の収益があっても、私たちは計画通りに私たちの運営に資金を提供するための追加の資本が必要だ。
2023年12月31日までの1年間、私たちの運営には約1620万ドルの現金が使われています。2023年12月31日現在、会社の現金残高は約920万ドル、流動負債は約850万ドル。私たちは私たちの運営を維持し、私たちの研究開発計画を継続し、臨床試験を行い、規制部門の承認を求め、私たちの製品を製造し、マーケティングするために追加の資金が必要になるだろう。私たちは公共または個人株または債務融資と他の供給源を通じてこのような追加資金を求めるつもりだ。もし受け入れられるなら、私たちは私たちが使用できる十分な追加資金があるかどうかを確認できない。もし私たちが予想される運営に必要な追加資金を集めることができなければ、私たちの研究開発計画を縮小または廃止し、私たちの臨床試験を延期し、規制承認を求める能力を延期し、私たちの一般的かつ行政的インフラを削減したり、破産を回避するための代替措置を求めたりすることが要求されるかもしれない。将来的に普通株や他の証券を発行することでより多くの資金を調達すれば、このような発行により、現在の株主の会社における持株比率が希釈されることになり、これはかなり大きい可能性がある。未来の発行はまた私たちの普通株の価格に実質的な悪影響を及ぼすかもしれない
私たちの独立公認会計士事務所の報告は私たちが経営を続けている企業として存在し続ける能力を大きく疑っています。
我々の監査役WithumSmith+Brown,PC.は,我々の2023年12月31日までの財政年度の連結財務諸表に関する報告で,我々の経常的な運営損失と深刻な累積赤字により,我々が継続的に経営している会社として経営を継続する能力に大きな疑いを抱かせることがあると述べている.しかも、私たちは運営からの負のキャッシュフローを経験し続けている。“持続的な経営”の観点は、株式売却による運営融資の能力を弱める可能性がある。私たちが経営を続ける能力は株式融資の可用性に依存し、これはキャッシュフローの主要な源であり、満期時に財務義務を履行し、私たちの研究と開発を継続できるようにする。
私たちはまだ商業販売のための候補薬の承認を得ていないため、バイオ製薬製品の販売から何の収入も得られておらず、将来も重大な財務損失を招くことが予想され、将来の生存能力を評価することが困難になる。
多くの業界や研究のためのシクロデキストリンを販売しているが、生物製薬製品の商業販売に必要な規制承認は得られていない。生物製薬製品の開発は投機性の強い仕事であり、監督管理の審査過程と関連するリスクを含む大きな程度のリスクに関連する。私たちの業務の重点はシクロデキストリンをベースとした疾患治療製品の開発に移行しているため、私たちの費用は大幅に増加すると予想されています
|
● |
トラプソルやCycloの様々な適応の開発を続けています |
|
● |
現在と未来の候補製品のために行われている、予想されている、または未来の臨床前研究と臨床試験を開始し、進行し、完成させる |
|
● |
臨床試験に成功した候補製品のために市場承認を求める |
|
● |
販売、マーケティング、流通インフラを構築し、市場の承認を得る可能性のある製品を商業化する。 |
私たちが候補薬物を商業化することができるまで、私たちは引き続き大きな損失を受けるだろう。もし私たちがこれができなければ、私たちは実行可能な業務を維持できないかもしれない。
製品開発,規制承認,商業化に関するリスク
私たちはTrappsolの成功に大きく依存しています®サイクロン™製品は、規制部門の承認を決して得られないかもしれない。
私たちの主要な候補薬TrappsolCycloは私たちの管理チームの大部分の開発の重点である。この製品は現在アメリカとヨーロッパで鼻咽頭癌治療の孤児薬に指定されている。私たちは、鼻咽頭癌およびアルツハイマー病の治療のための製品のマーケティング承認を得るために、TrappsolCyclo製品の持続的な研究開発に引き続き大量の投資を行う予定だ。鼻咽頭癌患者の潜在人口は非常に少なく、著者らは薬物を研究以外の使用のために市場に投入する能力は規制制限の深刻な制限を受けている。開発過程において、私たちのTrappsolCyclo薬物製品はEUのヨーロッパ薬品管理局とアメリカの食品と薬物管理局を通じて広範かつ厳格な政府規制を受ける。どんな管轄区域の規制承認も保証されない。私たちの製品が鼻咽頭癌、アルツハイマー病或いは任意の他の疾病を治療する時に有効かつ安全であることを保証することはできず、またそれがいかなる司法管轄区の監督機関によって有効かつ安全であると考えられることを保証することはできない。候補薬物の開発は時間と費用に関連するが、候補薬物の失敗は開発の任意の段階で発生する可能性があり、原因は多くあるが、臨床前データまたは臨床試験の否定または不確定な結果に限定されない。製品の承認の前または後に、任意の管轄区域で適用される法規の要求を遵守できなかった場合、私たちは行政または司法制裁を受ける可能性がある。
トラプソルでも®サイクロン™規制部門の承認を得たら、私たちの商業化努力とTrappsolは成功しないかもしれない®サイクロン™医師、患者、医療支払者、医学界の他の人の商業成功に必要な市場受容度を達成できないかもしれない。
TrappsolCycloでも™ 監督部門の承認を得られれば、私たちの商業化努力は成功しない可能性があり、医師、患者、第三者支払人、医学界の他の人の市場に対する受容度は予想を下回る可能性がある。市場受け入れは著者らが鼻咽頭癌治療に参与する医療保健専門家と強固な関係を確立し、維持することを要求する。鼻咽頭癌問題を解決する治療センターに関連する医療専門人員の数は限られている。これらの医療専門家や治療センターとこれらの重要な関係を構築あるいは維持できなければ,市場受容度の低下を招く可能性がある。私たちはTrappsolCycloのメリットを理解するために医師、患者、第三者支払者、医療界の他の人を教育するために努力しています 多くの資源が必要かもしれないし、絶対に成功しないかもしれない。トラプソルCycloに対する市場の受け入れ度は、商業販売への使用が許可されれば、多くの要素に依存する
|
● |
その効果 |
|
● |
トラプソール、および他の薬剤の使用の制限または警告または任意の制限、ならびに任意の副作用の流行および重症度; |
|
● |
代替治療の可能性と有効性 |
|
● |
販売とマーケティングの有効性とマーケティングと流通支援の実力 |
|
● |
代替療法と比較して、トラプソールおよびCycloの費用対効果および競争力のある価格でこのような薬物販売を提供する能力; |
|
● |
政府支払者,管理式医療計画や他の第三者支払者の可用性と引受額および精算額。 |
私たちの臨床試験結果は私たちの製品声明を支持しないかもしれません。あるいは副作用の発見につながる可能性があります。
私たちの臨床試験が計画通りに完了しても、彼らの結果が私たちの製品声明を支持するかどうか、あるいは私たちがどの地域で私たちの製品をマーケティングして販売するか、その承認を得る必要があるいかなる規制機関も私たちの結論に同意するかどうかを確認することはできません。臨床前研究と早期臨床試験の成功は後の臨床試験も成功することを確保できず、著者らも臨床試験が先の試験と臨床前研究の結果を複製することを確定できない。臨床試験過程は、私たちの候補製品が提案の指定用途に対して安全かつ有効であることを証明できない可能性があり、これは私たちが1つの製品を放棄し、他の製品の開発を遅延させる可能性がある。私たちの臨床試験のいかなる遅延や終了も私たちが提出した規制文書を延期し、最終的に候補製品を商業化し、収入を創出する能力を延期する。臨床試験に参加した患者も,現在候補製品プロファイルにない不良副作用を経験する可能性がある。
臨床試験は長くて高価な過程に関連し、結果は不確定であり、早期研究と試験の結果は未来の試験結果を予測できないかもしれない。
規制部門の承認(FDA承認を含む)を行うことと管理するために必要な臨床試験の経験は限られている。臨床試験は高価で複雑であり、長年の時間を要する可能性があり、結果も確定していない。私たちが完成した、進行中あるいは計画中の臨床試験で問題に遭遇するかどうかを予測することはできません。それによって、私たちあるいは監督機関が臨床試験を延期または一時停止したり、完成したか進行中の臨床試験のデータ分析を延期したりすることができません。トラプソールCycloによる鼻咽頭癌治療の臨床試験は数年持続すると予想されるが,完成するにはより長い時間がかかるかもしれない。失敗は試験の任意の段階で発生する可能性があり、私たちは臨床試験中または臨床試験過程のために多くの予見不可能な事件を経験する可能性があり、これらの事件は、これらに限定されないが、これらに限定されない、現在または将来の候補治療薬の商業化を延期または阻止する可能性がある
|
● |
臨床試験のための臨床調査員或いは試験場所を探す上で遅延が発生した |
|
● |
臨床試験を開始するために機関審査委員会と他の規制機関の許可を得ることを遅延させる |
|
● |
患者の募集や登録よりも遅く |
|
● |
臨床試験結果は陰性または不確定であった |
|
● |
予測不可能な安全問題 |
|
● |
不確実な投与量の問題 |
|
● |
治療中や治療後に患者を十分に監視することができない; |
|
● |
研究者や患者が試験案を遵守する問題。 |
製薬やバイオテクノロジー業界の一部の会社は高度臨床試験で大きな挫折を経験しており,早期の臨床試験でも有望な結果が見られている。早い時期にTRAPSOLCycloの臨床試験は結果を報告したが、著者らは著者らが行う可能性のあるいかなる第三段階の臨床試験或いは他の臨床試験が十分な有効性と安全性を証明するかどうかを知らず、それによって監督管理機関がTRAPPSOLCycloの発売を許可することを招いた。後期臨床試験に有利な結果が生じなければ,規制部門の承認を得たトラプソルCycloの能力は悪影響を受ける可能性がある。
以前知られていなかった問題は私たちのマーケティングやTrappsolの販売能力を制限するかもしれません®サイクロン™たとえそれが最初に承認されても、私たちは製品責任クレームに直面する可能性がある
その後、予想されなかった重症度または頻度の不良事象、または任意の第三者製造業者または製造プロセスに関連する問題、または規制要求を遵守できなかったことを含む製品に以前に未知の問題が存在することが発見され、他に加えて、以下のようなことが生じる可能性がある
|
● |
承認された出願を拒否または遅延させるか、または承認された出願を補充すること |
|
● |
規制当局は、承認されるべき市場承認申請または承認された申請の補充申請を審査することを拒否する |
|
● |
製品の販売または製造を制限し、製品を市場から撤回するか、または自発的または強制的に製品をリコールまたは差し押さえること |
|
● |
罰金や警告状や臨床試験を一時停止した者は |
|
● |
輸入や輸出制限 |
|
● |
民事または刑事処罰を禁令または適用する |
|
● |
製品管理の制限、追加の臨床試験の要求、または製品ラベル要件の変更; |
|
● |
規制当局は私たちと政府契約を締結する提案に反対する。 |
私たちの製品に関連する以前の未知の問題やリスクを発見することは、製品責任クレームを通じて潜在的な責任を負わせる可能性もあります。
もし私たちが製品を販売しようとしている他の国で必要な承認を得なければ、私たちがこれらの市場で製品を輸出または販売する能力は制限されるだろう。
いずれの管轄区でも臨床試験を行った経験が不足しており,TRAPPSOLCycloの承認を求めたい司法管轄区の承認過程に悪影響を及ぼす可能性がある。もし私たちが1つ以上の外国司法管轄区域の必要な承認を得て維持できなければ、私たちはTrappsolCycloを販売することができなくなり、私たちは予想通りに製品を販売することができなくなり、私たちの国際市場機会は制限され、私たちの運営結果は損なわれるだろう。
Trappsolを用いた製品の研究と臨床試験部分は第三者に依存している®サイクロン™.
著者らは契約研究組織(“CRO”)、学術機関、企業パートナーとその他の第三者に依存して、著者らの管理、監視と臨床試験と研究活動の展開に協力している。私たちはこれらの各方面に依存するか、またはこれらの各方面に大きく依存して、私たちの臨床研究を実行し、彼らの活動のいくつかの側面だけを制御する。したがって,完全にわれわれ自身による臨床試験よりも,これらの臨床試験の時間や他のコントロールが少ない可能性がある。これらの第三者に依存して臨床試験のデータを管理しているにもかかわらず,それぞれの臨床試験がその全体的な研究計画と案に沿って行われていることを確認する。私たちまたは私たちが依存している第三者は、臨床試験結果の進行、記録、報告に関する厳格な要求を遵守できなかったり、良好な臨床実践に従わなかったり、監督管理の承認過程を遅延させたり、トラプソルCycloの規制承認を得ることができない可能性がある。
私たちはまだ私たちの候補薬物に対するマーケティングや販売組織がなく、これらの能力を開発するために大量の資源を投入する必要があるかもしれない。もし私たちがマーケティングと販売能力を確立できない場合、あるいは第三者と合意して私たちの候補製品をマーケティングして販売することができなければ、製品収入を生み出すことができないかもしれません。
私たちはバイオ製薬製品を販売する内部販売、マーケティング、または流通能力を持っていない。もし私たちのすべての候補薬が最終的に規制部門の承認を得たら、私たちはそれを効果的にマーケティングして流通することができないかもしれない。私たちはパートナーを探しなければならないかもしれません。特にアメリカ以外のマーケティングと販売の面で、あるいは大量の財務と管理資源を投入して、内部販売、流通、マーケティング能力を発展させなければなりません。私たちは、受け入れ可能な財務条項で協力することができないか、またはコンサルタントまたは外部サービスプロバイダを招いて、私たちの販売、マーケティング、および流通機能を支援することができないかもしれません。また、私たちが第三者に依存してこれらの機能を実現すれば、私たちの製品の収入と収益性(あれば)は、私たちが開発した製品をマーケティング、販売、流通するよりも低いかもしれません。私たちはこのような第三者に対して支配権がほとんどないかもしれません。彼らのいずれも必要な資源と注意力を投入して、私たちの製品を効果的に販売し、マーケティングすることができないかもしれません。私たちが自分で販売、マーケティング、流通機能を実行することを決定しても、私たちはいくつかの追加的なリスクに直面する可能性があります
|
● |
効果的なマーケティング部門や販売チームを誘致して作ることはできないかもしれません |
|
● |
マーケティング部門または販売チームを構築するコストは、私たちが利用可能な財務資源と、私たちが開発、許可、または買収する可能性のある候補製品によって生じる収入を超える可能性があります |
|
● |
私たちの直販とマーケティング努力は成功しないかもしれない。 |
私たちは第三者に依存してコウプソールを生産しています®サイクロン™
TrappsolCycloは精密で高品質な製造が必要だ。C-GMP(現行の良好な製造仕様)に準拠できなかったこと、または予期または予期しない製造ミスまたはそのようなエラーの頻繁な発生を検出または制御することができなかったこと、または計画中の臨床試験の中断または遅延、製品試験または交付中の遅延または失敗、コスト超過、製品リコールまたは撤回、患者の負傷または死亡、および我々の業務を深刻に損なう可能性のある他の問題を含む、より高い製造基準を達成し、維持することができなかった。契約薬品メーカーは生産生産量、品質管理と品質保証及び合格者不足などの方面の困難によく遭遇する。これらのメーカーは、FDAのc-GMP法規と同様の外国の法律と基準を含む厳格な規制要求を受けている。もし私たちの契約製造業者がいつでも持続的なコンプライアンスを維持できなければ、私たちの候補製品の生産は中断され、私たちの臨床試験の遅延または中断、追加のコストと潜在収入の損失を招く可能性がある。
私たちは資金の豊富な会社からNPCを治療する競争に直面している。
私たちは製薬とバイオテクノロジー会社、鼻咽頭癌神経表現に対する孤児薬物指定と臨床試験を支持する政府機関を含む他の実体からの競争に直面している。その中のいくつかの実体資金は十分であり、私たちより多くの財政、技術と人員資源を持っており、臨床試験の設計と実施の面で私たちよりもっと経験がある。もし私たちが現在または未来の競争相手と効果的に競争できなければ、私たちトラプソールの販売はCyclo製品は成長しないかもしれないし、私たちの財政状況は影響を受けるかもしれない。
コンピュータシステムの故障やセキュリティホールが発生した場合、私たちの業務と運営は影響を受けるだろう。
私たちの通常のビジネスプロセスでは、知的財産権、独自業務情報、個人情報を含む機密情報を収集、保存、送信します。セキュリティ対策が実施されているにもかかわらず、私たちの内部コンピュータシステム、私たちの契約研究組織またはCROのコンピュータシステム、および私たちが依存する他の第三者は、コンピュータウイルス、許可されていないアクセス、ネットワーク攻撃、自然災害、火災、テロ、戦争、および電気通信および電気故障の破壊を受けやすい。サイバー攻撃の頻度、複雑さ、強度が増加している。ネットワーク攻撃には、サービスの信頼性に影響を与え、情報の機密性、完全性、および利用可能性を脅かすために、有害なマルウェアの配備、サービス拒否攻撃、社会工学、および他の手段が含まれる可能性がある。当社の情報技術システムの重大な中断またはセキュリティホールは、当社の業務運営に悪影響を及ぼす可能性があり、および/または、機密情報(商業秘密または他の知的財産権、独自業務情報および個人情報を含む)の損失、流用および/または不正アクセス、使用または開示、またはアクセスを阻止し、私たちの財務、法律、商業および名声に損害を与える可能性があります。このような中断が発生し、私たちの運営中断を招いても、私たちの製品開発計画が実質的に破壊される可能性があります。例えば、完成した、進行中、あるいは計画中の臨床試験における臨床試験データの損失は、私たちの監督管理の承認作業を遅延させ、データを回復または複製するコストを著しく増加させる可能性がある。そのほか、新冠肺炎の疫病はすでに私たちの大量の従業員とパートナーの遠隔作業を招き、これはデータ漏洩或いはデータとネットワーク安全問題のリスクを増加させた。もし任意の中断またはセキュリティホールが私たちのデータやアプリケーションを紛失したり、破損したり、機密または独自の情報を適切に開示しない場合、私たちは責任を招く可能性があり、私たちの将来の候補製品のさらなる開発が延期される可能性がある。
私たちの知的財産権に関するリスクは
私たちが依存している私たちの非特許商業秘密を保護する権利は十分ではないかもしれない。
TrappsolCycloを製造·生産するためには,我々は主に保護が困難な非特許商業秘密,技術ノウハウ,技術に依存しており,特に製薬業界では,規制承認過程において,製品に関する多くの情報を公開しなければならない。私たちは、第三者メーカー、従業員、コンサルタント、他の人と秘密保護協定を締結することで、ビジネス秘密の保護を求めています。これらの当事者たちは、これらの合意を違反または終了するか、または私たちとそのような合意を締結することを拒否する可能性があり、私たちは、そのような違反に対応するための十分な救済措置を持っていないかもしれない。さらに、これらのプロトコルは、私たちの商業秘密または他の固有情報に意味のある保護を提供することができず、機密情報または他の合意違反を不正に使用または開示する場合に十分な修復措置を提供することができない可能性がある。私たちは私たちのビジネス秘密を保護しようと努力しているにもかかわらず、私たちまたは他の人たちは競争相手に私たちの固有の情報を意図的にまたは意図的に開示するかもしれない。
もし私たちが商業秘密の保護を維持しなければ、私たちの競争地位は不利な影響を受けるかもしれない。競争相手はまた私たちのビジネス秘密を独立して発見するかもしれない。第三者による商業秘密の不法取得と使用の主張の実行は高価で、時間がかかり、不確実である。もし私たちの競争相手が同等の知識、方法、ノウハウを独立して開発すれば、私たちは彼らに対して私たちのビジネス秘密を主張することができなくなり、私たちの業務は損なわれる可能性があります。
私たちは、私たちの係属中の特許出願に記載され、要求された発明に関連する特許が付与されるか、または私たちの特許出願に基づく特許が挑戦および無効および/または実行不可能であることを保証することはできない。
私たちはアルツハイマー病治療方法に関する米国特許商標局とヨーロッパ特許庁から特許出願の補助金通知を受けている。私たちはトリプソールCycloを用いたアルツハイマー病治療の特許を申請している。しかし予測できません
|
● |
私たちの特許出願に基づいていつ特許を発行できるかどうか |
|
● |
私たちの特許出願に基づいて発表された任意の特許の保護範囲 |
|
● |
私たちの特許出願に基づく任意の特許出願の請求項が、競争相手から保護されるかどうか; |
|
● |
第三者が私たちの特許権を無効にしたり、私たちの特許権を回避したり、特許権の共同所有権を要求することができるかどうかは、第三者に私たちの特許権を強制的に執行する能力に影響を与える可能性があります |
|
● |
他の人は、私たちの特許および特許出願がカバーしている態様と同様の特許を要求するかどうか;または |
|
● |
私たちは私たちの特許権を実行および/または守るために訴訟や行政訴訟を提起する必要があるかどうか、私たちが勝つか負けるかにかかわらず、高い代価を払うだろう。 |
私たちが係属中の特許出願中の特許請求が米国特許商標局または外国特許庁によって出願可能特許とみなされることを確認することはできない。特許が確かに我々の特許出願に基づいて発行されていても、第三者はその有効性、実行可能性、または範囲に疑問を提起する可能性があり、これは、このような特許が縮小され、無効にされ、または実行できない可能性がある。さらに、それらが挑戦されていなくても、私たちの特許は、第三者が関連技術を実践することを排除したり、私たちの権利要件をめぐる他の人の設計を阻止するのに十分ではないかもしれない。私たちと協力している第三者は、彼らが共同で私たちが提出した特許権を持っていると主張するかもしれませんが、これが正しければ、逆の合意がない場合には、競争相手に特許権を主張することを阻止するかもしれません。さらに、訴訟や行政訴訟では、私たちが発行した任意の特許における権利要件が米国または他の国の裁判所によって有効とみなされるかどうかを判断することはできません。
私たちは知的財産権訴訟の影響を受けやすいです。これらの訴訟は私たちに巨額のコストを発生させたり、大量の損害賠償を支払ったり、候補製品の販売を禁止したりする可能性があります。
バイオテクノロジー産業では、特許と他の知的財産権に関する多くの訴訟がある。1つの製品が特許を侵害しているかどうかは複雑な法律および事実考慮に関連しており、これらの考慮事項の決定はしばしば不確実である。一般に第三者が侵害される可能性のある特許を識別するために実行される検索は、通常決定的ではなく、特許出願が発行されるのに数年かかる可能性があるため、審理中の出願がある可能性があり、これは、私たちの現在または未来の製品が侵害または侵害されている可能性のある発行された特許を引き起こす可能性がある。さらに、私たちの競争相手または他の当事者は、私たちの候補製品および使用方法が彼らが持っている特許に含まれている可能性があると主張することができる。もし私たちのすべての製品が有効な特許を侵害した場合、私たちは許可証を得ることができるか、または侵害を避けることができる方法で製品を再設計することができない限り、その製品の製造または販売を禁止されるかもしれない。ライセンスはいつも利用可能ではないかもしれないし、私たちが大量の印税を支払う必要があるかもしれない。私たちも権利侵害を避けるために私たちの製品を再設計することに成功できないかもしれません。これからの再設計も以前の侵害から会社を守ることができません。私たちは第三者の米国特許と特許出願を知っており、これは私たちがニマン-ピックC型疾患を治療する主導的な製品候補に関連しているかもしれない。それらの特許や未解決特許出願の有効なクレームを侵害しないと考えられるが,発行されれば,特許権所有者は我々の評価に同意せず,侵害訴訟を提起する可能性がある。裁判所が侵害や有効性の問題で私たちに有利な判決を下すことは保証されない。権利侵害や他の知的財産権クレームは、正当な理由の有無にかかわらず、訴訟を起こすのは高価で時間がかかる可能性があり、私たちの経営陣の業務運営への関心を分散させる可能性がある。
私たちは私たちの知的財産権を保護または実行するために訴訟を提起する必要があるかもしれないが、これは費用がかかるかもしれないし、もし私たちが負けたら、私たちがいくつかの知的財産権を失う可能性があり、これは私たちの市場での競争能力を損なうだろう。
私たちの知的財産権を保護または実行するために、私たちは第三者に対して特許、商標、および関連訴訟、例えば侵害訴訟または禁止救済を請求することができる。私たちは競争的地位を確立し、維持する能力は、私たちがその権利を侵害していると思う他の人たちを起訴することによって達成されることができる。私たちが始めたどんな訴訟も費用が高く、多くの時間がかかる可能性があり、私たちの経営陣の関心を他の商業問題から移すことができますが、特許、商業秘密、または商標の面で私たちの知的財産権を実行する訴訟結果は非常に予測できません。訴訟はまた、私たちの特許を無効または狭義の解釈が発表されるリスクに直面させ、私たちの特許出願は発表されないリスクに直面したり、そのような訴訟を受けた製品を流通させる能力に悪影響を与えたりする。しかも、私たちは第三者が私たちにクレームをつけることを誘発するかもしれない。私たちは私たちが始めたどんな訴訟でも勝てないかもしれないし、判決された損害賠償や他の救済措置は、弁護士費を含めて、商業的価値がないかもしれない。
法律と規制コンプライアンスに関するリスク
製薬業務は価格制御、精算と薬品獲得の監督管理と改革を含むますます多くの政府の監督管理と改革を受けており、これは私たちの将来の収入と収益能力に不利な影響を与える可能性がある。
私たちの製品が開発され、商業化され、市場への投入に成功した限り、それらは費用効果があるとは思われない可能性があり、第三者や政府は十分な補償を受けることができないかもしれない。世界的には、政府や他の第三者支払者がますます積極的になっており、直接または間接的に価格設定や精算を厳格に制御しようとしており、場合によっては様々な理由に基づいて保証を制限または拒否し、医療コストを直接または間接的に制御しようとしており、米国国内外の政府や個人支払者からの定価や精算圧力が引き続き存在することが予想される。
もし私たちが候補薬を販売するために必要な監督管理の承認を得たら、私たちは州医療補助計画、個人保険計画、薬局福祉マネージャーからの巨大な定価、精算と参入圧力、そしてアメリカの医療改革立法の実施はこれらの価格設定圧力を増加させている。“医療·教育負担能力調整法”により改正された“患者保護·平価医療法案”は、医療保険の精算の削減および/または制限、新たなおよび/または増加した税収の徴収を含む包括的な医療改革を実施している。“平価医療法案”とその構成要素の未来は現在のところ確定していない。
ほとんどの市場で、処方薬の価格設定と選択は政府によって統制されている。したがって、私たちの製品の価格とヨーロッパや他の国での精算は、各国の監督管理部門によって決定されている。1つ以上のヨーロッパ市場の精算決定は、他のヨーロッパ市場の精算決定に影響を及ぼす可能性がある。補償決定を行う際には、この製品を使用する治療が現在の治療よりも有効であるかどうか、製品が提供する医療サービスに値があるかどうか、および製品の治療効果が少なくとも既存の治療方法と同じであることを示す十分な証拠があるかどうかを含む様々な要因が考慮される。
政府および保険会社、医療機関および他の医療費支払者が医療コストをコントロールまたは低減する持続的な努力は、私たちの将来の収入および収益性、または私たちの潜在的な顧客、サプライヤーおよびパートナーの収入および収益性、ならびに資本の利用可能性に影響を与える可能性がある。
アメリカ連邦と州プライバシー法や他の国の似たような法律は私たちの運営コストを増加させ、民事と刑事制裁に直面させるかもしれません。
連邦、州、外国政府が既存の法律と法規を新たに採用したり、修正したりすることに伴い、データプライバシーとセキュリティ、およびデータの収集、処理、記憶、転送、使用に関連して、データ処理の法規が進化している。これらの新しいまたは提案された法律および法規は、異なる解釈の影響を受け、異なる司法管轄区域間で一致しない可能性があり、実施およびコンプライアンスに関する指導意見は、個人データを処理する複雑さを増加させるために、しばしば更新または他の方法で改正される。これらの要件および他の要件は、コンプライアンスを達成し、私たちの競争力を制限し、契約におけるより重い義務を受け入れる必要があるように、私たちまたは私たちの協力者に追加コストを発生させることを要求するかもしれません。私たちの使用、保存、転送、およびデータ処理の能力を制限し、私たちの製品提供を支援するために私たちまたは私たちの協力者がデータを処理または使用する能力に影響を与え、私たちまたは私たちの協力者が特定の場所で私たちの製品を提供する能力に影響を与え、または規制機関が私たちの臨床試験活動を拒否、制限、または中断させることにつながります。
私たちと私たちの協力者は、連邦、州、および外国のデータ保護法令(すなわちプライバシーおよびデータセキュリティに関する法律法規)によって制約されるかもしれない。米国では、連邦医療情報プライバシー法、州個人情報法、州データ漏洩通知法、州健康情報プライバシー法、連邦および州消費者保護法律法規を含む健康関連情報および他の個人情報の収集、使用、開示および保護を管理する多くの連邦および州法律法規が、私たちの運営または私たちの協力者の運営に適用される可能性がある。さらに、連邦1996年の“健康保険携帯性·責任法案”(HIPAA)(2009年の“健康情報技術促進経済·臨床健康法案”(HITECH)改正)のプライバシーおよびセキュリティ要件に制約された第三者(臨床試験データを取得した研究機関を含む)から健康情報を取得することができる。事実および状況によると、もし私たちがHIPAAによって許可されていない方法で故意に使用または開示した場合、HIPAAによってカバーされたエンティティによって維持された個別に識別可能な健康情報を使用または開示する場合、私たちは民事または刑事罰を受ける可能性がある。
従業員事務に関するリスク
私たちは私たちの幹部に依存して、彼らを失ったら、私たちは現在の業務戦略を効果的に実施できないかもしれない。
これまで、私たちの成功は、私たちの役員の努力と能力、すなわち私たちのCEO N.Scott Fine、私たちの最高経営責任者Jeffrey L.Tate博士、そして私たちの最高財務責任者Josh Fineに大きく依存しています。何らかの理由で、これらの役人が私たちのところに残っていなければ、私たちの運営を管理し、私たちの業務目標を達成する能力は悪影響を受ける可能性があります。
著者らの従業員、臨床試験研究者、CRO、コンサルタント、サプライヤーと任意の潜在的な商業パートナーは監督基準を遵守しないことを含む不当な行為或いはその他の不当な活動に従事する可能性がある。
私たちは、従業員、臨床試験調査者、CRO、コンサルタント、サプライヤー、および任意の潜在的なビジネスパートナーの詐欺または他の不正行為のリスクに直面しています。これらの当事者の不適切な行為は、(I)真実、完全かつ正確な情報の報告を要求する法律、(Ii)製造基準、(Iii)連邦および州の健康およびデータプライバシー、セキュリティ、詐欺および乱用、政府価格報告、透明性報告要件、ならびに米国および海外の他の医療保健法律法規、または(Iv)財務情報またはデータを真に、完全かつ正確に報告することを要求する法律を含む、故意、無謀および/または不注意な行為、または許可されていない活動を開示することを含む可能性がある。このような不正行為はまた臨床試験過程で得られた情報を不当に使用する可能性があり、これは監督部門の制裁を招き、著者らの名声に深刻な損害を与える可能性がある。我々は、すべての従業員に適用される行動基準および開示計画および他の適用可能な政策および手順を通過したが、常に従業員の不適切な行為を識別し、阻止することができるわけではなく、このような行為を発見し、防止するための予防措置は、未知または未管理のリスクまたは損失を効果的に制御することができないか、またはこれらの法律や法規を遵守できないことによる政府の調査または他の行動または訴訟から私たちを保護することができないかもしれない。もし私たちにこのような訴訟を提起し、私たちが自分の権利を弁護したり、維持することに成功しなかった場合、これらの行動は、Medicare、Medicaidおよび他の連邦医療保健計画、契約損害、名声損害、利益および将来の収益の減少、追加の誠実な報告と監督義務、および私たちの業務を削減または再編することを含む、重大な民事、刑事および行政処罰、損害賠償、罰金、個人監禁、Medicaidおよび他の連邦医療保健計画、契約損害、利益および将来の収益の減少、および私たちの業務を削減または再構成することを含む、私たちの業務に重大な影響を与える可能性があります。
もし私たちがアメリカ連邦反リベート法規や類似の州や外国の法律を守らなければ、私たちは刑事と民事処罰を受け、連邦医療保険と医療補助計画、同等の第三国計画を含む連邦援助医療計画から除外される可能性があり、これは私たちの業務と運営結果に実質的な悪影響を及ぼすだろう。
社会保障法の条項は、一般に、連邦反バックル法規と呼ばれ、故意に提供、支払い、勧誘、または任意の形態の報酬を提供し、故意に提供し、または誘致することを禁止し、直接または間接的に現金または実物の形態で、転転、注文、レンタル、購入または手配または推薦注文、購入またはレンタルの全部または一部が連邦医療保険、医療補助、または任意の他の連邦医療保健計画によって支払われる物品またはサービスを誘導または奨励することを禁止する。連邦反リベート条例の範囲は非常に広く、その多くの条項は既存の判例法や条例の統一または明確な解釈を得ていない。さらに、多くの州は連邦反リベート法規のような法律を採択し、これらの州の活動に適用され、その中のいくつかの法律は連邦反リベート法規よりも広く、それらの禁止は連邦医療補助および他の州によって精算されるプロジェクトやサービスに適用される可能性があるため、またはいくつかの州では、支払い元にかかわらず適用される。連邦反リベート法違反は、重大な刑事、民事または行政処罰、損害賠償、罰金、連邦医療計画から除外される可能性がある。
私たちの運営は連邦反リベート法規や同様の州法律に適合すると信じていますが、これらの法律違反を告発した調査や訴訟を受けないことは確認できません。これは私たちにとって時間と費用がかかる可能性があり、経営陣の私たちの業務運営に対する関心を移す可能性があり、逆に私たちの業務に実質的な悪影響を及ぼす可能性があります。さらに、私たちの計画が連邦反リベート法規または同様の州法律に違反していることが発見された場合、このような違反の結果は、私たちの業務、運営結果、および財務状況に実質的な悪影響を及ぼす可能性がある。
私たちの微細化学工業事業に関連するリスク
私たちの顧客の一部は私たちの収入の大部分を占めていますが、これらの顧客のいずれを失っても私たちの収入を大幅に減少させます。
2023年、二大顧客の収入は総収入の72%を占めた。2023年12月31日現在、これらの主要顧客の売掛金残高は売掛金総額の77%を占めている。私たちはただ私たちの主要な顧客と供給契約を締結しただけだ。もし私たちがこのような顧客を代替できなければ、その中の一つの顧客を失うことは私たちの収入を大幅に減少させるだろう。
私たちは特定の第三者供給者たちに依存している。
私たちは第三者サプライヤーから販売しているTrappsolシクロデキストリン製品を購入し、これらのサプライヤーに依存してAquaplex製品で使用されているシクロデキストリンを提供します。私たちはまた凍結乾燥技術を使った外部メーカーに依存して私たちのAquaplex製品を生産しています。私たちのほとんどの製品はアメリカ、日本、中国、ヨーロッパのバルクメーカーとディーラーから購入しました。製品には様々な供給源があるにもかかわらず、意外な供給中断または製品価格の実質的な上昇、例えば監督管理要求、輸入制限、証明書損失、電力中断、火災、ハリケーン、戦争またはその他の事件は、私たちの業務、運営業績、財務状況、およびキャッシュフローに実質的な悪影響を及ぼす可能性がある
私たちは通貨為替レートの変動の否定的な影響を受けるかもしれない。
私たちのサプライヤーの地域多様性により、私たちの収益とキャッシュフローは通貨変動の影響を受け、これは私たちの財務業績に大きな影響を与える可能性があります。私たちが外国のサプライヤーから在庫を購入する時、ユーロ、円、人民元に対するドルの価値変化は私たちの在庫コストに影響を与え、引き続きそうします。私たちの製品の大部分はアメリカ以外のところからドルで買いました。我々の専門シクロデキストリンと複合体の主要な供給者、シクロデキストリン研究と開発実験室は、ハンガリーに位置し、その価格はユーロで決定された。私どもの大口在庫コストはドルの変動によってよく変わります。これらの製品は現在私たちの収入の大きな部分を占めている。為替変動やサプライヤー価格の上昇の短期的な増加を経験すると、私たちは往々にして価格を十分に高めて私たちの歴史的利益率を維持することができないので、これらの販売における利益率は下がるかもしれません。ドル建て外貨が弱くなれば、これらの外貨建て取引の換算は私たちの運営結果や財務状況に悪影響を及ぼす可能性がある。
私たちの普通株に関するリスクは
私たちの普通株の市場価格は大きく変動する可能性があります。あなたは投資の全部または一部を失うかもしれません。
私たちの普通株式と株式承認証の取引価格は変動するかもしれない。この変動性はあなたが証券を購入したか、あるいはそれ以上の価格であなたの証券を売ることを阻止するかもしれません。私たちの株価と株式証明書価格は様々な要素によって大幅に変動する可能性があります
|
● |
私たちが期待していた会社の目標を達成したかどうか |
|
● |
財務またはビジネスの推定または予測の変化; |
|
● |
ロックプロトコルを終了するか、または私たちの株主および他の証券所有者が今回の発行後に株式を売却する能力に対する他の制限; |
|
● |
アメリカや他の地域の一般的な経済や政治状況。 |
また、株式市場、特に臨床段階のバイオテクノロジー会社の株は、極端な価格や取引量の変動を経験しており、これらの変動は往々にしてこれらの会社の経営業績に関係なく、あるいは比例しない。私たちの実際の経営業績にかかわらず、広範な市場と業界要素は私たちの普通株の市場価格にマイナス影響を与える可能性がある。
もし私たちがナスダック資本市場から撤退すれば、私たちの株は細価格株規則に制限され、私たちの株はもっと取引が難しくなるだろう。
アメリカ証券取引委員会はすでに規則を発表し、低価格株取引に関連する自営業行為を規範化した。細価格株は、通常、5.00ドル未満の価格を有する株式証券であるが、特定の国の証券取引所に登録されている証券または特定の自動見積システム上でオファーを許可する証券を除いて、取引所またはシステムがそのような証券取引に関する現在の価格および取引量情報を提供することを前提としている。もし私たちがナスダックで上場を維持しなければ、もし私たちの普通株価格が五ドル以下なら、私たちの普通株は細株とみなされます。細価株規則は、取引業者がこれらの規則に拘束されない細価格株取引を行う前に、特定の情報を含む標準化リスク開示文書を提出することを要求する。また、“細価格株規則”は、取引業者は、任意の細価格株の取引を行う前に、特に書面で当該細価格株が買い手の適切な投資項目であることを決定し、(I)買い手がリスク開示声明の書面確認を受けたこと、(Ii)細価格株の取引に関する書面合意、及び(Iii)署名及び明記された日付の書面妥当性声明の写しを受けなければならないと規定している。これらの開示要求は、二級市場での私たちの普通株の取引活動を減少させる可能性があるため、株主は彼らの株を売却することが困難かもしれない。
私たちはナスダック資本市場の持続的な上場要求を満たすことができず、私たちの証券が銘柄を取られる可能性があります。
2023年度には、ナスダック規制要件に適合していないことに関する通知を受けた。もし私たちがナスダックの継続上場の要求、例えば会社の管理要求や最低終値要求を満たすことができなければ、ナスダックは私たちの証券を撤退させる措置を取るかもしれない。このような退市は、私たちの普通株の価格にマイナス影響を与える可能性があり、私たちの普通株の売却または購入を希望する時に私たちの普通株を売却または購入する能力を弱める可能性があります。退市事件が発生した場合、私たちはナスダックの上場要求を遵守するために行動しますが、私たちが取ったこのような行動が、私たちの普通株の再上場、市場価格の安定、あるいは私たちの証券の流動性を高め、私たちの普通株がナスダックの最低購入価格要求を割ることを防ぐことを保証することはできません。あるいは将来ナスダックの上場要求に合わないことを防止します。
ネバダ州の法律で許可された最大限に私たちの高級管理者と役員を保護し、無害にします。
私たちの定款は、ネバダ州の法律で許容される最大範囲内で、私たちの活動によるクレームに対して、私たちの上級管理者と役員に賠償して無害にすることを規定しています。もし私たちが私たちの賠償協定を履行することを要求されたら、私たちがこの目的にかかる資産部分は私たちの業務の他の利用可能な金額を減少させるだろう。
予測可能な未来に配当金を支払わないことが予想されるため、現金配当金を求める投資家は普通株を購入すべきではない。
私たちは普通株式に対するどんな現金配当金も発表したり支払ったりしたことがない。私たちは現在、将来の収益を維持するつもりで、もしあれば、私たちの業務拡張に資金を提供します。したがって、私たちは予測可能な未来に何の現金配当金も支払わないと予想する。私たちの将来の配当金支払いは、私たちの取締役会が様々な要素を考慮して適宜決定します。これらの要素は、私たちの財務状況、経営業績、現金需要、成長計画、私たちが当時署名する可能性のある任意の信用協定の条項を含んでいますが、これらに限定されません。したがって、現金配当金を求める投資家は私たちの株を購入してはいけない。
項目1 B。未解決の従業員のコメント。
適用されません。
プロジェクト1 C。ネットワークセキュリティです。
リスク管理と戦略
我々は,ネットワークセキュリティ脅威リスクを評価,識別,管理する政策とプロセスを策定し,これらのプロセスを我々の全体的なリスク管理システムとプロセスに統合した.私たちは、私たちの情報システム上または私たちの情報システムによって発生する任意の潜在的な許可されていないイベントを含むネットワークセキュリティ脅威からのリスクを定期的に評価し、これらのイベントは、私たちの情報システムまたはその中に存在する任意の情報のセキュリティ、完全性、または利用可能性に悪影響を及ぼす可能性がある。
我々は定期的にリスク評価を行い,ネットワークセキュリティ脅威を決定し,我々の業務慣行が大きく変化した場合に評価を行い,このようなネットワークセキュリティの脅威を受けやすい情報システムに影響を与える可能性がある.これらのリスク評価は、合理的に予測可能な内部および外部リスク、そのようなリスクがもたらす可能性および潜在的損害、および既存の政策、プログラム、システム、および保障措置がそのようなリスクを管理するのに十分であるかどうかを決定することを含む。
これらのリスク評価の後、私たちは、決定されたリスクを最小限に抑えるために、合理的な保障措置をどのように設計、実施、維持するかを評価し、既存の保障措置で発見された任意の差を合理的に解決し、私たちの保障措置の有効性を定期的に監視する。私たちは、リスク評価と緩和プロセスを管理するために、大量の資源を投入し、上級者を指定し、首席財務官に報告する財務副総裁を含む。
私たちの全体的なリスク管理システムの一部として、私たちは私たちの保障措置を監視し、これらの保障措置について私たちの従業員を訓練します。新入社員の入社プロセスに統合した訓練と年度従業員の再訓練を通じて、各級と部門の人員に私たちのネットワークセキュリティ政策を理解させる。
私たちはコンサルタント、専門家、あるいは他の第三者を招いて私たちのリスク評価手続きに参加する。これらの第三者は、私たちのネットワークセキュリティ政策とプログラムを設計し、実施し、私たちの保障措置を監視してテストするのを助けてくれます。
我々は、当社のシステムおよび/または私たちの敏感なデータにアクセスする可能性のある各第三者サービスプロバイダに、すべての適用可能な法律に適合した適切なセキュリティ対策を実施および維持する能力があることを確認し、私たちの協力に関連する合理的なセキュリティ対策を実施し、維持し、当社に影響を与える可能性のある疑わしいそのセキュリティ対策に違反する任意の行為をタイムリーに報告することを要求します。
私たちは過去に実質的なサイバーセキュリティと認定された事件を経験したことがありませんが、他の生命科学技術会社のように、私たちはサイバーセキュリティ事件を経験したことがあり、将来も経験し続けるかもしれません。ネットワークセキュリティ脅威に関する任意のリスク、以前の任意のネットワークセキュリティイベントが当社の会社に重大な影響を与えるかどうか、または合理的に当社に重大な影響を与える可能性がある他の情報を含む他の情報、例えば“と題する本年報10-K表の1 A項目”リスク要因“を参照してくださいコンピュータシステムの故障やセキュリティホールが発生すれば、私たちの業務と運営は影響を受けます..”
統治する
私たちの取締役会の主な機能の一つは、ネットワークセキュリティ脅威からのリスクを含む、私たちのリスク管理過程を知ることです。私たちの取締役会は戦略リスクの監視と評価を担当し、私たちの幹部は私たちが直面している重大なリスクの日常管理を担当しています。私たちの取締役会は全体としてそのネットワークセキュリティリスク監視機能を直接管理する。
我々の財務副総裁と我々のネットワークセキュリティ管理委員会は、我々の最高財務官および外部コンサルタントを含み、セキュリティおよび他のリスク(ネットワークセキュリティリスクを含む)の評価、管理、緩和について豊富な経験を有しており、彼らは主に私たちのネットワークセキュリティ脅威による重大なリスクの評価と管理を担当している。
私たちの財務副総裁と私たちのネットワークセキュリティ管理委員会は、上記の“リスク管理と戦略”で述べた政策とプロセスを含む、私たちのネットワークセキュリティ政策とプロセスを監視する責任があります。私たちの財務副総裁と私たちのネットワークセキュリティ管理委員会の代表は、ネットワークセキュリティイベントの予防、検出、緩和、修復の流れを理解し、監視しています
|
● |
会社のコンピュータおよび情報システムの潜在的マルウェア、恐喝ソフトウェア、および他の悪意のある活動を監視し、決定されたリスクを軽減し、任意のマルウェアを抑制および除去することを含む、発見された問題を修復する |
|
● |
強制サイバーセキュリティ訓練は、新入社員の入社の一部として、年間従業員のネットワークセキュリティ再訓練を要求する |
|
● |
セキュリティ情報およびイベント管理アプリケーションを介してシステムおよびネットワークインフラストラクチャを監視する |
|
● |
迅速に会社の首席財務官Lに事件を報告し、 |
|
● |
確定された問題の性質に基づいて、会社監査委員会と取締役会に報告する。 |
我々の財務副社長および/または我々のネットワークセキュリティ管理委員会の代表は、最近発生した任意のネットワークセキュリティイベントや関連対応措置、ネットワークセキュリティシステムテスト、第三者活動などを含む会社のネットワークセキュリティリスクおよび活動を定期的に私たちの取締役会に通報する。
項目2.政府財産。
私たちの会社の本社はフロリダ州のゲーンズビルにあります。そこで借りて、約二千二百平方フィートのオフィスと倉庫空間を占有しました。私たちのこの空間のレンタル契約は2026年1月31日に期限が切れます。3年間継続できて、毎月1,700ドルです。この賃貸物件は現在私たちの運営需要を満たすのに十分だと信じています。もし賃貸契約が満期になった時に契約を更新できなければ、私たちの需要に合った代替空間を見つけることができます。AMTIとの合併協定が2023年12月27日に完了することに伴い、当社はオフィススペースの経営賃貸を担当し、このオフィススペースを第三者に転貸する。レンタルと転貸協定は2024年8月に満了する。
第三項:法的訴訟。
我々の法律手続きは、本年度報告書10-K表の総合財務諸表付記における付記13--引受およびまたはある事項で検討される。
私たちは時々通常の業務過程で発生したクレームと法的手続きに参加する。私たちの経営陣は、これらのクレームや訴訟に対するリスクを評価し、損失金額と損失金額を推定する可能性がある場合には、このような訴訟の潜在的損失に追加資金を支出します。上記のほか、吾らは現在何の訴訟にも触れておらず、吾らの知る限り、吾等に脅威となる訴訟は何もないが、吾等が現在把握している資料に基づいて判断すると、訴訟結果は吾等の財務状況や経営業績に重大な悪影響を与える。
四番目の項目:炭鉱の安全情報開示。
適用されません。
第II部
第五項:登録者普通株市場、関連株主事項及び発行者が株式証券を購入する。
我々の普通株式と引受権証はナスダック資本市場で取引され、コードはそれぞれ“CYTH”と“CYTHW”である。
所持者
2024年3月11日現在、普通株式登録所有者数は185人であり、その証券が街頭名義で保有している利益所有者数は含まれていない。
配当政策
会社は2023年に配当金を発行しておらず、2024年にはその普通株もいかなる現金配当も発行されないと予想されている。会社は利益を保留し、業務拡張に資金を提供しようとしているからだ。将来の任意の配当発表は、会社の財務状況、資本要求、業務状況を含むが、これらに限定されない当時の条件に基づいて取締役会によって決定される。
株式証券の未登録販売
2023年11月28日、会社は現金給与の代わりに、合計63,781株の完全に帰属する普通株を非従業員取締役に発行した。これらの支出は役員の2023年第4四半期の報酬を反映している。受け取った現金代わりの株式数は、会社普通株の2023年11月28日の終値に基づいて計算される、すなわち1株1.34ドルである
発行者および関連購入者が株式証券を購入する
2023年12月31日までの年度中に、吾らは当社のいかなる普通株または他の株式証券も購入していない
項目6.改訂[保留されている]
適用されません。
プロジェクト7.財務管理部門の財務状況と経営成果の検討分析
この管理は’S財務状況及び経営成果検討分析、及び本年度報告10-K報告書の他の部分は前向き表現を含み、リスクと不確定性に関連している。本年度報告に含まれるすべての前向き陳述は,本年度報告の発表日に得られた情報に基づいており,このような前向き陳述を更新する義務はない。多くの要素の影響により、私たちの実際の結果は、タイトル部分で説明されたそれらの要素を含む、これらの前向き陳述において予想される結果と大きく異なる可能性がある“リスク要因”本年度報告で。以下の内容は、当社監査後の財務諸表と併せて読まなければなりません。
概要
著者らは臨床段階の生物技術会社であり、シクロデキストリンを基礎とした製品を開発し、神経変性疾患の治療に応用している。2014年,我々はニマン−ピックC型疾患(“”)を治療する薬剤として,米国食品医薬品局(FDA)に第2種類の薬物主文書を提出した。鼻咽頭癌は稀な致命的常染色体劣性遺伝病であり、コレステロール代謝の乱れを招き、脳、肺、肝臓、脾臓と他の器官に影響を与える。2015年、鼻咽頭癌の治療のために、トラプソール周期国際臨床プロジェクトを開始した。2016年、私たちは米国のある臨床地点で行われたランダム、二重盲検、平行グループ化研究のI期臨床計画を記載した新薬研究申請(IND)を米国食品医薬品局に提出した。I期研究は、トリプソールCycloおよびコレステロール代謝マーカーおよび鼻咽頭癌マーカーの18歳および以上の参加者がトリプソールCycloを2週間毎に静脈内投与する12週間の治療期間内の安全性および薬物動態を評価した。INDは2016年9月にアメリカ食品と薬物管理局の許可を得て、2017年1月にアメリカ食品と薬物管理局によってトラプソルCycloによる鼻咽頭癌治療の迅速な通路として承認された。米国第一段階研究の初期患者登録は2017年9月に開始され,2020年5月に我々が公表したトップラインデータは,この研究ではトラプソール周期が良好な安全性と耐性を有することを示している。
欧州規制機関によって承認されたI/II期臨床研究も完了し,イギリス,スウェーデン,イスラエルに臨床試験センターを設立した。このI/II期研究は一連の臨床結果、神経系、呼吸、コレステロール代謝と鼻咽頭癌マーカーの測定を含み、トリプソールCycloの安全性、耐性と有効性を評価した。12週間の第1段階研究(単一アメリカサイト)と一致し、ヨーロッパ/イスラエル研究は二重盲検無作為試験において2週間ごとに鼻咽頭癌患者にトリプソール環化を静脈注射したが、異なる点は研究周期が48週間(24剤)であった。2021年3月、著者らは試験を完成した患者100%(12人中9人)の病状が改善或いは安定を維持し、89%の患者が少なくとも17領域の鼻咽頭癌重症度尺度の2つの領域で改善の治療効果結果測定基準を達成したと発表した。
また,2020年2月に米国食品医薬品局と対面した“C型”会議を行い,これまでに得られた臨床データに基づいて,われわれの鍵となる第3段階臨床試験TrappsolCycloを開始することについて検討した。その会議では,トリプソールCycloを有する小児および成人患者の鼻咽頭癌の治療のために,連邦食品,薬物,化粧品法案第505(B)(1)条に提出された新薬申請を米国食品医薬品局と検討した。2020年2月にも欧州医薬品局(“EMA”)に類似した要請を提出し,EMAの科学的提案と案援助を求め,欧州での第3段階臨床試験を継続した。2020年10月,米国食品医薬品局から提案された第3段階臨床試験の“研究が可能”という通知を受け,2021年6月にTransportNPCへの参加を開始し,TrappsolCycloによる鼻咽頭癌治療の鍵となる第3段階研究である。
著者らが完成した臨床研究の初歩的なデータは、TrappsolCycloは細胞中のコレステロールと他の脂質の有毒沈着を除去でき、周辺に一致した薬物動態学特徴を有し、そして鼻咽頭癌患者の血液脳関門を越え、そして鼻咽頭癌患者の神経と神経認知方面のメリットとその他の臨床改善を招くことを表明した。これらの発見のすべての意義は,われわれの臨床試験(完了して行われているものを含む)データの最終分析の一部として決定される。
2010年5月17日、FDAはTrappsolCycloを鼻咽頭癌治療のための孤児薬として指定し、これにより、FDA薬の承認後7年以内に鼻咽頭癌治療のためのTrappsolCycloを独占的に販売することになる。2015年4月には,規制部門の承認後10年間の市場独占経営権を提供するTrappsolCycloのヨーロッパにおける孤児薬名も取得し,欧州医薬品局の小児科委員会が小児科調査計画(PIP)を受け入れた場合,この期間は12年に延長され,TrappsolCycloが小児科人口に対してあることが証明された。2017年1月12日、著者らはFDAの高速車線の称号を獲得し、2017年12月1日、FDAは鼻咽頭癌を小児科稀な疾患とした。
アルツハイマー病治療におけるシクロデキストリンの応用も探索されている。2018年1月、米国食品医薬品局は、TrappsolCycloを用いてアルツハイマー病を治療する単一患者IND拡張アクセス計画を承認した。この遅発性老年病患者は18ケ月の治療を経て、病状は安定し、薬物耐性は良好である。患者は改善の兆しも示し,単語を探す際の変動性は小さく,潜伏期が短かった。2021年1月に米国食品医薬品局に提出されたトリプソール静注によるアルツハイマー病治療の早期計画の概要を用意した。我々は2021年4月に米国食品医薬品局からこの概要のフィードバックを受け,これらのフィードバックを2021年11月に米国食品医薬品局に提出したTrappsolCycloによるアルツハイマー病治療の第2段階研究のINDに組み込んだ。2021年12月、私たちは食品医薬品局のINDの承認を得て、トリプルソール環化によるアルツハイマー病治療の第二段階研究を継続することを可能にした。この研究の米国サイトは2022年下半期に活性化され,患者投与量は2023年第1四半期から開始された。
我々は2019年10月に特許協力条約に基づいてシクロデキストリンによるアルツハイマー病治療のための国際特許出願を提出し,この国際出願に基づいて国·地域段階出願を行っている。2024年1月の年末後、会社はアルツハイマー病の治療に関する既存の特許出願に関する米国特許商標局(USPTO)の手当通知を受けた。必要なすべての維持費が支払われた場合、これらの国または地域の段階で出願された任意の特許の条項は2039年に満了すると予想される。
20024年1月、私たちは米国特許商標局から、私たちの特許出願第17/289,137号からアルツハイマー病治療の特許出願を承認する通知を受けたアルツハイマー病の治療法’S病.”
私たちはまた、製薬、栄養、その他の業界へのシクロデキストリンと関連製品の販売を含む、私たちが残した微細化学工業業務を経営し続け、主に診断と特殊な薬物に応用されている。しかし,我々の中核業務は,基本シクロデキストリン製品を主に転売する事業から,シクロデキストリンに基づく疾患治療に主に専念するバイオ製薬のバイオテクノロジー会社に変化している。
合併協定
2023年9月21日、我々はデラウェア州の完全子会社Cameo Merger Sub,Inc.とデラウェア州のアプリケーション分子輸送会社(AMTI)と合併協定と計画(“合併協定”)を締結した。合併は2023年12月27日に全株式取引方式で完了した。合併及び合併協定条項に関するより多くの資料は、本年報10-K表の他の部分に掲載されている合併財務諸表に付記されている付記1-組織及び業務説明及び付記12-が応用分子輸送会社と合併していることを参照されたい。
ナスダック退市公告
当社は2023年5月14日、上場資格スタッフ(“ナスダック従業員”)から手紙を受け取り、2023年3月31日の四半期まで、最低株主権益250万ドルに関する規則(“株主権益規則”または“規則”)を遵守していないと指摘した。同社はこの規則を再遵守するためにコンプライアンス計画をナスダックに提出した。2023年8月1日, ナスダックは、コンプライアンス計画の審査に基づいて、その規則を再遵守するために延期を許可されたことを同社に通知した。
以上のように、合併完了後、会社の株主権益は規則に定められた最低要求を超えている。2024年1月17日、吾らはナスダックからのコンプライアンス通知書を受け取り、株主権益規則の下での不足点が是正されたことを当社に通知し、当社はすべての適用されるナスダック上場基準を満たしている。したがって、会社の証券はナスダックに上場して取引を続けるだろう。
12月末現在の年度 2023年3月31日と2022年12月31日までの年度
2023年の純損失は約20,057,000ドルですが、2022年の純損失は約15,451,000ドルです。2023年の総収入は約1,076,000ドルですが、2022年の純損失は約1,376,000ドルです
私たちの2023年と2022年の製品販売組み合わせの変化は以下の通りです
トラプソル® サイクロン™ HPBCDsTrappsol、Cyclo、およびHPBCDの第1世代および第2世代の医薬製剤(液体および粉末形態)は、鼻咽頭癌患者に同情するためにブラジルに輸出された顧客に販売されている。2023年の売上高は2022年の約5,000ドルから約1,000ドルに減少した。孤児薬に指定されている。同情に基づいて使用する患者の数は少ない。
トラプソル® HPB
我々のTrappsolHPBの売上高は2022年の約852,000ドルから2023年の約650,000ドルに低下し,減少幅は24%であった
トラプソル® その他の製品
我々の他のトラップソール製品の売上高は2022年の約501,000ドルから2023年の約411,000ドルに低下し、減少幅は18%だった
Aquaplex®
我々のAquaPlexの売上高は2023年に約10,000ドルに増加したが,2022年の売上高は約5,000ドルであり,主に単一の顧客のおかげである。売上高の低下は、私たちの主要なAquaplex顧客の定期購入モデルを表しています。過去5年間、Aquaplexのこの顧客に対する売上高は2023年には約10,000ドル、2022年には約5,000ドル、2021年には約185,000ドル、2020年には約7,000ドル、2019年には約150,000ドルです
私たちの伝統的な精密化学工業業務の最大の顧客は引き続き歴史的製品の注文傾向に沿って、定期的に大注文をして、私たちの年間収入の大きなシェアを占めています。2023年、私たちの2つの最大顧客(Charles River実験室、Inc.とVentana Medical Systems,Inc.)私たちの収入の72%を占め、最大は私たちの収入の45%を占める。2022年、私たちの3つの最大顧客(Charles River実験室、Inc.,Ventana医療システム会社、Uno Healthcare)は私たちの収入の68%を占め、最大の顧客は私たちの収入の35%を占めている。歴史的には、私たちが定期的に受け取った多額の販売よりも、通年で比較的小規模なHPB販売を頻繁に行っています。私たちがいつこの2つの販売を受け取り、完成できるかのタイミングは、私たちの四半期収入と経営業績に大きな影響を与え、期間間の比較を困難にしています
私たちの製品販売コストは2023年に約84,000ドルに下がりますが、2022年には約139,000ドルになります。2023年、我々の製品販売コストは製品販売に占める割合は8%であり、2022年は10%である。*この割合は、製品組合せと顧客注文規模からなる販売構成の関数である。*歴史的には、大顧客への販売タイミングと製品組み合わせは、私たちの売上、販売製品のコスト、関連利益率に大きな影響を与えている。2023年から2022年までの間、私たちは材料コストの大幅な上昇を経験しなかった。
いくつかの実体は、その流通ネットワークに関連するすべてのコストを販売商品コストに計上するので、私たちの毛金利は他の実体と比較できないかもしれない。私たちの販売コストには製品を販売するコストだけが含まれており、駅に入ったり駅を出たりする運賃、間接管理費用、倉庫と流通費用、または減価償却費用のいかなる分担も含まれていません。私たちの職員たちは私たちに受け入れ、検査、倉庫、そして輸送業務を提供してくれる。私たちの従業員の費用は人件費に含まれています。私たちの倉庫と輸送機能の他の費用は事務室と他の費用に含まれている。
私たちが外国のサプライヤーから在庫を購入する時、ユーロ、円、人民元に対するドルの価値変化は私たちの在庫コストに影響を与える。我々の専門シクロデキストリンと複合体の主要な供給者、シクロデキストリン研究と開発実験室は、ハンガリーに位置し、その価格はユーロで決定された。私どもの大口在庫コストはドルの変動によってよく変わります。アメリカ以外からの輸送コストは私たちの在庫調達コストにも大きな影響を与えます。為替変動や仕入先の価格上昇の短期的な増加を経験すると、私たちは往々にして価格を十分に高めて、私たちの歴史的利益率を維持することができません。したがって、これらの販売における利益率は下がるかもしれません
人事支出は2022年の約3,969,000ドルから2023年の約3,383,000ドルに低下し、減少幅は15%となった。*人員支出が減少した原因は従業員の離職であり、彼の時間は一般行政目的と我々の研究開発計画との間に割り当てられている。私たちは短期的に私たちの従業員水準と関連費用を維持する予定だ。
2023年には,研究開発費は2022年の約9,000,000ドルから約14,182,000ドルに増加し,58%に増加した。2023年12月31日までの1年間に、我々の総運営費に占める研究開発費の割合は、2022年12月31日現在の53%から67%に増加した。研究と開発費の増加は,鼻咽頭癌治療に用いられるトリプソール環状第三段階研究の活性増加によるものである。
2023年には,修理·メンテナンス費用は2022年の約11,000ドルから約14,000ドルに増加し,28%に増加した。私たちは2024年に私たちの修理と維持費用が変わらないと予想する
専門費は2022年の約2,417,000ドルから2023年の約1,944,000ドルに低下し、減少幅は20%となっている。資金調達や製品開発への新たな取り組みにより、専門費は将来的に増加する可能性がある。
オフィスやその他の費用は2022年の約1,026,000ドルから2023年の約1,161,000ドルに増加し,13%に増加した。
取締役会費用とコストは2022年の約394,000ドルから2023年の約335,000ドルに低下し、下げ幅は15%となった。取締役会費用及びコストには、我々の取締役及び科学顧問委員会メンバーに支払われる費用、我々取締役会メンバーの費用精算、及び関連費用が含まれる。彼は言いました
2023年と2022年の償却と減価償却は変わらず、約19,000ドルです。しかし、これらの費用は設備調達や処分によって少し変動する可能性があります
2023年の運賃と輸送費用は約4,000ドルであるのに対し,2022年の運賃と輸送費用は約13,000ドルである。送料と出荷は在庫製品を注文する頻度と販売製品の出荷頻度に依存します。
私たちは2023年の繰延税金資産総額24,827,000ドルの増加を100%満たすための推定準備金を追加し、2023年と2022年の所得税優遇や支出を確認しなかった。
流動性と資本資源
2023年12月31日現在、現金は約9,247,000ドルに増加していますが、2022年12月31日現在、私たちの現金は約1,543,000ドルであり、これは主に株式取引と2023年12月の合併の結果です。2023年12月31日現在、私たちの流動資産から流動負債を引くと約3850,000ドルですが、2022年12月31日現在、私たちの流動資産から流動負債を引くと約678,000ドルです。2023年12月31日までの1年間で,運営に使用された現金は約16,185,000ドルであったのに対し,2022年には約15,114,000ドルであった。運営に使用されている現金は主に我々の純損失と候補薬の臨床試験の持続費用によるものである。これまで、私たちは主に私たちの証券を公開と非公開で発行することで、私たちの業務に資金を提供してきました
合併の結果、同社は第三者に転貸するオフィススペースのレンタルを獲得した。借約は2024年1月1日から8月までの間に約100万ドルの支払いを要求しており、受け取る転貸収入よりも少ない。転貸払いを徴収しないことに関するリスクは借約残期限のキャッシュフローにマイナス影響を与える可能性があり、賃貸借契約は2024年8月に満期となる。
2023年1月3日、同社は機関投資家に930,000株の普通株を直接発売することで約370万ドルの純収益を調達し、1株購入価格は1.61ドル、および事前資本金権証は、1株1.61ドルの購入価格で合計1,678,696株の普通株を購入した。事前資金権証の行使価格は1株0.0001ドルで、すべての行使前に行使することができる。同時に行われた私募では、会社は投資家にA-1シリーズ株式承認証を発行し、1株1.36ドルの使用価格で最大2,608,696株の普通株を購入し、発行日から5年以内に行使できる;A-2シリーズ株式承認証は、1株1.36ドルの行使価格で最大2,608,696株の普通株を購入し、発行日から3年間行使できる。もし事前融資権証所有者及びその関連会社が権利証を行使した後、実益が9.99%を超える発行済み普通株を持っている場合、その権利証所有者はこの株式承認証を行使することができない。事前融資権証保有者は、この割合を増加または減少させるために、少なくとも61日前に当社に通知することができるが、9.99%を超えてはならない。A-1およびA-2シリーズの株式承認証所有者およびその関連会社が権利証を行使した直後に4.99%を超える発行された普通株式を所有している場合、A-1およびA-2シリーズの株式承認証所有者はこの株式承認証を行使することができず、当社に少なくとも61日間の事前通知を提供することによって、この割合を増加または減少させることができるが、9.99%を超えてはならない。
H.C.Wainwright&Co.,LLCは当社の登録直接発売および同時私募に関する配給代理を担当し,発売総収益7.5%に相当する現金費用,発売総収益1.0%に相当する管理費を支払い,当社から35,000ドルの非実売支出,法律顧問の費用および支出,50,000ドルの他の自己負担費および15,950ドルの決済支出を精算した。同社はまた、配給代理の指定者に5年間の引受権証を発行し、1株2.0125ドルの使用価格で合計156,522株の普通株を購入した。
2023年1月25日、投資家は一部の予融資権証を行使し、400,696株の普通株を買収し、本店権価格は40ドルであった;2023年2月27日、投資家は一部の予融資権証を追加的に行使し、741,000株の普通株を買収し、本店の権利価格は74ドルであった。2023年4月3日、投資家は残りの予融資権証を行使し、54ドルの本店権価格で537,000株の普通株を買収した。
2023年4月20日、当社はナスダック株式市場規則に基づき、私募によりその証券を市場価格に応じて、当社の取締役数名と管理職メンバー及びその付属会社を含む認可された投資家たちに1,305,000ドルの総収益を調達した。私募の投資家は1,562,883株の普通株を購入し、引受権証を取得して1,562,883株の普通株を購入した。普通株1株と普通株購入権証の購入価格は0.835ドルである。これらの株式承認証の使用価格は0.71ドル、期限は7年である。
2023年5月2日、同社はデラウェア州のラファエルホールディングス(“ラファエルホールディングス”)への証券私募を完了し、2,514,970株の普通株の売却と2,514,970株の普通株の追加購入の承認証により2,100,000ドルを調達した。株式承認証の行使価格は1株0.71ドルで、行使可能期間は7年で、2023年8月1日から、すなわち当社はナスダック証券市場上場規則第5635(B)及び5635(D)条に基づいて株主の承認を得て引受権証の行使を許可した日である。取引を完了するには、当社(I)はラファエルホールディングスの要求に応じて、ラファエルホールディングスと登録権利協定を締結し、自社に米国証券取引委員会に登録声明を提出し、株式証関連株式及び普通株株式を登録転売することを要求する。(Ii)ラファエル·ホールディングスのウィリアム·コンクリン最高経営責任者を取締役会メンバーに任命しました
2023年8月1日、当社とラファエルホールディングスが2023年6月1日に締結した証券購入契約に基づき、ラファエロホールディングスへの追加私募を完了し、500万ドルを調達しました。Rafael Holdingsは1株1.25ドルで400万株の普通株と7年間の引受権証を購入し、400万株の普通株を追加購入し、総購入価格は500万ドルだった。ナスダック上場規則第5635(B)及び5635(D)条の規定によると、当社株主は2023年8月1日に開催された株主周年総会でラファエロホールディングスへの株式及び株式承認証の発行を許可する。
2023年10月20日、当社は2023年4月及び5月にいくつかの認可投資家と証券購入協定を締結した。投資家は株式承認証を行使して3,359,297株の普通株を購入し、総収益は2,388,077ドルであった。交換として、投資家は新しい株式引受証を獲得し、行使価格は1株当たり0.95ドルに相当し、元の株式承認証がカバーする会社の普通株数の110%を購入することができる。新株式証明書の公平価値は2,387,117ドルであり、現金でしか行使できず、有効期間は4年で、自発的な行日から計算される。投資家には、当社の大株主ラファエロホールディングス、当社の取締役数名、経営陣が含まれています。
2023年12月27日、当社はAMTIとの合併を完了し、終値時に発行されたAMTI株と引き換えに5,725,306株の普通株を発行した。AMTI株は0.1331の為替レートで自動的に会社普通株に変換される。合併所得収益は発行コスト688,480ドルを差し引くと,純額は9,354,006ドル,負担する純負債は547,770ドルである.
同社は運営から赤字を達成し続けている。AMTIとの合併と最近の非公開発行が完了したため、少なくとも今後6ヶ月で予想される運営コストと資本支出要件を満たす十分な現金があると信じています。私たちは未来に私たちが行っている運営を支援し、私たちの臨床試験を継続するためにもっと多くの資金を集める必要があるだろう。予測可能な未来には、私たちは時々私たちの証券を売却することでより多くの資金を集め、臨床開発、製造、商業化を通じて私たちの候補薬物製品の開発に資金を提供し続ける予定だ。私たちがこれらの追加資本を得ることができるかどうかは、私たちの全体的な業務パフォーマンスや市場状況を含む様々な要素の影響を受ける可能性がある。同社が資本調達に成功し、将来の運営·発展計画に資金を提供することは保証されない。
我々は、2023年、2023年、2022年12月31日までの年度の総合財務諸表を継続経営に基づいて作成しており、この継続経営は、正常な業務過程で資産と負債を返済することが期待されている。上述したように、私たちが経営を続ける能力は株式融資の利用可能性にかかっている。
2023年12月31日まで、2024年から2037年まで、約49,807,000ドルの州と連邦純営業損失の繰越満期があります。その中には41,409,000ドルが満期になりません。現在と未来の課税純収入を相殺し、私たちの所得税負債を減らすことができます。私たちはすでに私たちの臨床試験や他の開発計画に関連する予想される将来費用に基づいて、私たちの繰延税金資産に100%の推定手当を提供しました
2023年12月31日まで、私たちは表外の予定がありません。
重要な会計政策と試算
業務成果は米国で一般的に受け入れられている会計原則に基づいて作成された連結財務諸表である。連結財務諸表の作成は、管理層が重要な会計分野のために会計政策を選択し、連結財務諸表に報告された金額に影響を与える推定と仮定を行うことを要求する。当社の会計政策は、2023年12月31日現在の今年度の連結財務諸表付記1でより全面的に説明されています。我々の重要な会計政策における仮定および/または条件の重大な変化は経営業績に重大な影響を与える可能性がある。私たちは以下の会計政策と関連判断が私たちの運営結果を理解するために重要であることを確認した
収入確認
私たちの顧客が約束した商品やサービスのコントロール権を獲得すると、収入が確認され、金額はこれらの商品やサービスと交換したい対価格を反映しています。我々は,米国会計基準2014−09号に規定されている5ステップパターンに従って収入を確認する:(I)顧客との契約を決定する(S),(Ii)契約中の履行義務を決定する,(Iii)取引価格を決定する,(Iv)契約に取引価格を割り当てる履行義務,および(V)(または)履行義務を満たしている場合に収入を確認する。
製品収入
アメリカでは、私たちは製品をエンドユーザーや卸売業者に販売します。他の国では、私たちは主に卸売業者と他の第三者流通パートナーに私たちの製品を販売します。これらの顧客はその後、私たちの製品を医療提供者と患者に転売する。
製品販売収入は,顧客が我々の製品に対する制御権を獲得したときに確認され,これはある時点で発生し,通常は顧客に渡す際である.もし私たちが確認すべき資産の予想償却期間が1年以上かそれ以下の金額であれば、契約が発生したときに契約を得るための増額コストを支出する。顧客が製品制御権を獲得した後の輸送や運搬コストを履行コストと見なしている。私たちは、お客様との契約で、お客様に製品を渡すという履行義務を決定しました。お客様に製品を納品する際に、取引価格が全額確認され、これが契約履行義務を履行する時点です。
繰延税金資産の評価準備
2023年12月31日まで、私たちは私たちの繰延税純資産の全額に約24,827,000ドルの評価を保留しました。私たちは2023年に私たちの推定準備金を約1,659,000ドル増加させて、私たちが確認した繰延税金資産をゼロに減らした。
私たちは、私たちの臨時控除差額と純営業損失の繰越が実現できない可能性があることを確認しました。私たちは2023年12月31日に100%の評価を提供しました。
現行会計基準は繰延税金資産の将来の現金化を評価し、部分的に現金化しないと考えられる程度で減値することが求められている。私たちの繰延税金資産の将来の現金化の可能性を評価する際には、私たちの最近の累積損失、経験、将来の研究開発と製品開発費用の予想、将来の課税収入の予想、納税申告目的に利用可能な繰越期間、その他の関連要素を多く考慮します。そのため、私たちの繰延税金資産の推定値に関する可能性の判断範囲は非常に広いです。この評価を行う際には重大な判断が必要であり、私たちの評価がいつ(あれば)私たちの繰延税金資産が現金になる可能性があるかを予測することは困難です
研究と開発
研究·開発コストは、発生した費用とします。サービス提供前に支払われた金額を、個別に前払い資産として使用する金額と、サービスを提供する際に確認された費用として記録します。研究·開発コストには、主に、人員に関連する費用と、契約研究組織やコンサルタントなどの第三者との手配による外部研究·開発費用が含まれています。各報告期間の終了時に、各サービスプロバイダに支払われる金額と、関連項目の完了推定進捗とを比較する。同社がこれらの見積りを準備する際に考慮した要因は,研究参加患者数,実現のマイルストーン,そのサプライヤーの努力に関する他の基準である。これらの推定値は、より多くの情報が得られるにつれて変化する可能性がある。仕入先への支払い時間と見積もりに基づいて提供されるサービスに基づいて、これらのコストに関連する純前払いまたは計算費用を記録します。私たちとサプライヤーとの契約によると、前払い臨床費用は有効な未来の経済利益を代表し、正常な業務過程で実現する。
株に基づく報酬
私たちが発行したオプションに割り当てられた価値はブラック-スコアーズ定価モデルに基づいて計算された公平な市場価値です。オプションの価値を計算するためには,株価変動率の推定値を決定する必要がある.私たちの株は適切な変動性測定基準を決定するのに十分な取引量がないので、変動性を推定する必要がある。私たちは私たちの変動率の推定が合理的だと信じていて、私たちは新しい株式ツールを発行するたびに、私たちはこれを決定するための仮定を検討する。もし私たちの株の変動性の推定に重大なミスがあれば、私たちの費用は過小評価されたり誇張されたりするかもしれない。株式ベースの報酬はすべてオプションの帰属期間内に直線的に計算される.
項目7 A:市場リスクに関する定量的で定性的な開示。
適用されません。
項目8.財務諸表および補足データ。
Cycle治療会社はそして付属会社
連結財務諸表
カタログ表
|
ページ |
|
|
独立公認会計士事務所報告 |
F-2 |
|
2023年12月31日と2022年12月までの連結貸借対照表 |
F-4 |
|
2023年12月31日までと2022年12月31日までの総合業務報告書 |
F-5 |
|
2023年まで、2023年、2022年12月31日まで年度株主権益総合レポート |
F-6 |
|
2023年,2023年,2022年12月31日までの連結キャッシュフロー表 |
F-7 |
|
連結財務諸表付記 |
F-8 |
独立公認会計士事務所報告
当社の株主および取締役会へ
Cyclo治療会社:
連結財務諸表に対するいくつかの見方
2023年12月31日現在、2023年12月31日現在、2022年12月31日現在のCyclo治療会社とその子会社(“当社”)の連結貸借対照表と、2023年12月31日までの2年度の関連総合経営報告書、株主権益と現金流量、および関連合併手形(総称して“総合財務諸表”と呼ぶ)を監査した。総合財務諸表は,当社の2023年12月31日と2022年12月31日までの財務状況,および2023年12月31日までの2年度の経営結果とキャッシュフローをすべての重要な面で公平に反映しており,米国公認の会計原則に適合していると考えられる。
持続経営への実質的な疑い
添付の連結財務諸表の作成は、当該エンティティが継続的に経営を継続する企業であると仮定する。総合財務諸表付記1に記載されているように、この実体は経営上経常赤字を受け、経営から使用されている現金が現在の現金状況を超え、累積赤字となっており、持続経営企業としての能力が大きく疑われている。付記1は、これらの事項における経営陣の計画も説明しています。連結財務諸表には、このような不確実性の結果によって生じる可能性のあるいかなる調整も含まれていません。この件について、私たちの意見は変わっていません。
意見の基礎
これらの連結財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいてこのような連結財務諸表に意見を発表することだ。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、合併財務諸表に重大なミスがないかどうかに関する合理的な保証を得るために、監査を計画し、実行することが要求されています。会社はその財務報告の内部統制を監査することを要求されていません。私たちは監査を要求されていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、会社の財務報告内部統制の有効性について意見を述べることを目的としていません。したがって、私たちはそのような意見を表現しない。
我々の監査には、連結財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれる。これらの手続きは、連結財務諸表中の金額および開示に関する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、合併財務諸表の全体列報の評価も含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項は、監査委員会が監査委員会に伝達または要求する当期総合財務諸表監査によって生じる事項を指すことである:(1)総合財務諸表に対して大きな意味を有する勘定または開示に関するものであり、(2)私たちが特に挑戦的で主観的または複雑な判断に関するものである。重要監査事項の伝達は、総合財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、以下の重要な監査事項を伝達することによって、重要な監査事項またはそれに関連する勘定または開示について個別の意見を提供することはない。
研究と開発費用、臨床試験負債と前払い研究と開発コストを計算すべき
関係事項の記述
同社は発生した研究と開発費用を確認した。将来の研究·開発活動の前払いは、関連サービスを提供する際に延期され、費用が計上される。当社は,当社を代表して臨床試験を行って管理する研究機関と臨床研究組織(総称して“CRO”)と締結した契約に基づいて提供するサービスに基づき,その臨床試験費用を確認した。2023年12月31日までの1年間の研究·開発費総額は約14,182,000ドルであった。2023年12月31日までの前払い臨床費用は約2,310,000ドルであり,2023年12月31日までの売掛金と売掛金に含まれる臨床試験負債は約1,979,000ドルである。
各合併貸借対照表の日付において、会社はCROの報告を取得することによって、内部人員および外部サービスプロバイダとサービス完了の進捗または段階を検討し、これらの情報を適用契約、作業説明書または購入注文の中でこのようなサービスのために支払う支払い、受信した領収書および合意された支払い費用と比較し、前払い研究および開発コストおよび計算すべき臨床試験負債を入金する。完了した仕事量の調整は、主に実行されたサービスの状態と時間、登録された患者数と登録患者の比率に基づく。
研究と開発費用、計算すべき臨床試験負債と前払い研究と開発コストの見積もりを考慮して、著者らは研究開発費用、計算すべき臨床試験負債と前払い研究と開発コストを重要な監査事項として決定した。これは研究と開発費用を見積もり、臨床試験負債と前払い臨床費用を計算する上で広範な監査を行う必要がある。
私たちが監査でどのようにこの問題を解決したのか
研究開発費、計算すべき臨床試験負債、前払い臨床費用に関する監査プログラムには、以下の内容が含まれている
|
● |
研究·開発費,臨床試験負債,前払い研究·開発費を確認するサンプルを選択し,選択された各項目に対して以下の手順を実行した |
|
● |
CROと締結された関連プライマリサービス協定、作業説明書、調達注文、および/または他のサポートプロトコルを取得して読みました。 |
|
● |
監督活動を担当する会社の臨床運営者に,実行された仕事の性質と状態に関する確実な問い合わせを行った。 |
|
● |
第三者サプライヤーが提供する支払いおよび提供されたサービスの状態とスケジュールに関する証拠をチェックしました。 |
|
● |
内部と外部から得られたデータと証拠を会社分析に使用した投入と比較し,関連研究開発費,前払い研究開発費,計算すべき臨床負債残高を再計算した。 |
2011年以来、当社の監査役を務めてきました。
/s/
2024年3月17日
PCAOB ID番号
Cycle治療会社はそして付属会社
合併貸借対照表
|
十二月三十一日 |
||||||||
|
2023 |
2022 |
|||||||
|
資産 |
||||||||
|
流動資産 |
||||||||
|
現金と現金等価物 |
$ | $ | ||||||
|
売掛金、準備金純額#ドルを差し引く |
||||||||
|
在庫、純額 |
||||||||
|
前払い保険とサービス |
||||||||
|
臨床費用を前払いする |
||||||||
|
流動資産総額 |
||||||||
|
家具と設備、網具 |
||||||||
|
賃貸資産純額を使用する |
||||||||
|
総資産 |
$ | $ | ||||||
|
負債と株主権益 |
||||||||
|
流動負債 |
||||||||
|
賃貸負債の流動部分 |
$ | $ | ||||||
|
売掛金と売掛金 |
||||||||
|
流動負債総額 |
||||||||
|
長期負債 |
||||||||
|
賃貸負債、当期分を差し引く |
||||||||
|
長期負債総額 |
||||||||
|
株主権益 |
||||||||
| 優先株、額面$一株一株 |
- | - | ||||||
|
普通株、額面$一株一株 |
||||||||
|
追加実収資本 |
||||||||
|
赤字を累計する |
( |
) | ( |
) | ||||
|
株主権益総額 |
||||||||
|
総負債と株主権益 |
$ | $ | ||||||
連結財務諸表付記を参照してください。
Cycle治療会社はそして付属会社
連結業務報告書
|
締切り年数 |
||||||||
|
2023 |
2022 |
|||||||
|
収入.収入 |
||||||||
|
製品販売 |
$ | $ | ||||||
| 製品販売コスト(直接·間接管理費用および手数料は含まれていない) | ||||||||
| 毛利 | ||||||||
|
費用.費用 |
||||||||
|
人員 |
||||||||
|
研究開発 |
||||||||
|
メンテナンスとメンテナンス |
||||||||
|
専門費 |
||||||||
|
オフィスやその他 |
||||||||
|
董事局費用及び訴訟費 |
||||||||
|
減価償却 |
||||||||
|
運賃と船便 |
||||||||
|
信用損失費用 |
||||||||
|
総費用 |
||||||||
|
運営損失 |
( |
) | ( |
) | ||||
|
その他の収入(費用) |
||||||||
|
投資やその他の収入(費用)、純額 |
( |
) | ||||||
|
PPPローンの猶予権を得る |
||||||||
|
所得税準備前の損失を差し引く |
( |
) | ( |
) | ||||
|
所得税支給 |
||||||||
|
純損失 |
$ | ( |
) | $ | ( |
) | ||
|
普通株は基本と希釈して純損失 |
$ | ( |
) | $ | ( |
) | ||
|
基本と希釈後に発行された普通株の加重平均 |
||||||||
連結財務諸表付記を参照してください。
Cycle治療会社はそして付属会社
合併株主権益報告書
2023年12月31日と2022年12月31日までの年度
|
普通株 |
その他の内容 |
合計する |
||||||||||||||||||
|
株 |
パル |
支払い済み |
積算 |
株主権益 |
||||||||||||||||
|
バランス、2021年12月31日 |
$ | $ | $ | ( |
) | $ | ||||||||||||||
|
社員に発行した株 |
||||||||||||||||||||
|
非従業員に発行する株 |
- | |||||||||||||||||||
|
株に基づく報酬 |
- | |||||||||||||||||||
|
純損失 |
- | ( |
) | ( |
) | |||||||||||||||
|
バランス、2022年12月31日 |
( |
) | ||||||||||||||||||
|
売却持分および株式承認証 |
||||||||||||||||||||
|
合併資本再編における株式発行 |
- | |||||||||||||||||||
|
株式売却承認証 |
- | - | ||||||||||||||||||
|
株式証の行使 |
||||||||||||||||||||
|
株式オプションの行使 |
||||||||||||||||||||
|
コンサルタントへの株 |
||||||||||||||||||||
|
非従業員に発行する株 |
||||||||||||||||||||
|
株に基づく報酬 |
- | |||||||||||||||||||
|
M&A資本再編に関する想定株式オプション |
- | |||||||||||||||||||
|
純損失 |
- | - | - | ( |
) | ( |
) | |||||||||||||
|
バランス、2023年12月31日 |
$ | $ | $ | ( |
) | $ | ||||||||||||||
連結財務諸表付記を参照してください。
Cycle治療会社はそして付属会社
統合現金フロー表
|
締切り年数 |
||||||||
|
2023 |
2022 |
|||||||
|
経営活動のキャッシュフロー |
||||||||
|
純損失 |
$ | ( |
) | $ | ( |
) | ||
|
純損失と経営活動で使用される現金純額の調整: |
||||||||
|
減価償却および償却 |
||||||||
|
PPPローンの猶予権を得る |
( |
) | ||||||
|
信用損失準備金 |
||||||||
|
在庫廃棄準備金 |
||||||||
|
従業員の株への補償 |
||||||||
|
非従業員への株補償 |
||||||||
|
株に基づく報酬 |
||||||||
|
以下の態様では、増加または減少: |
||||||||
|
売掛金 |
( |
) | ||||||
|
在庫品 |
( |
) | ( |
) | ||||
|
臨床費用を前払いする |
( |
) | ( |
) | ||||
|
前払い保険とサービス |
( |
) | ||||||
|
他にも |
||||||||
|
売掛金と売掛金 |
( |
) | ||||||
|
総額を調整する |
||||||||
|
経営活動のための現金純額 |
( |
) | ( |
) | ||||
|
投資活動によるキャッシュフロー |
||||||||
|
家具と設備を買う |
( |
) | ( |
) | ||||
|
受取住宅ローン手形入金 |
||||||||
|
投資活動提供の現金純額 |
( |
) | ||||||
|
融資活動によるキャッシュフロー |
||||||||
|
株を売却して得た純収益 |
||||||||
|
合併資本再編純収益 |
||||||||
|
M&A資本再編取引コスト |
( |
) | ||||||
|
株式オプションの行使 |
||||||||
|
株式取得証明書の売却純額 |
||||||||
|
株式証の行使 |
||||||||
|
購買力平価ローンを支払う |
( |
) | ||||||
|
購買力平価ローンを払い戻す |
||||||||
|
融資活動が提供する現金純額 |
||||||||
|
現金および現金等価物の純増加(減額) |
( |
) | ||||||
|
現金と現金等価物、年明け |
||||||||
|
現金と現金等価物、年末 |
$ | $ | ||||||
|
キャッシュフロー情報を補足開示する |
||||||||
|
利子を支払う現金 |
$ | $ | ||||||
|
サービス普通株を発行する |
$ | $ | ||||||
|
負担した負債、合併資本再編で受け取った非現金資産を差し引く |
$ | $ | ||||||
連結財務諸表の付記を参照
|
(1) |
ビジネスの組織と説明: |
Cyclo治療会社(“会社”,“私たち”,“私たち”または“私たち”)は1990年8月にフロリダ州の会社として設立され,名称はシクロデキストリン技術開発会社であり,1992年7月から運営されている。2000年の再編で、私たちはCTDホールディングスと改名しました。2019年9月、私たちは現在の業務をよりよく反映するためにCyclo治療会社に改名しました。2020年11月6日、私たちはフロリダ州からネバダ州に再登録しました。当社は2023年9月に先に定義された合併協定を締結し、2023年12月27日に全株式取引方式で完成し、詳細は付記10、株式取引を参照されたい。
2023年12月27日に、当社は2023年9月21日のいくつかの合併合意および計画(“合併合意”)に基づいて戦略統合を完了し、Cyclo、Cycloの全額付属会社およびデラウェア州会社および全資付属会社Cameo Merge Sub,Inc.(“合併付属会社”)およびデラウェア州の応用分子輸送会社(“AMTI”)によって戦略合併を完了し、SubとAMTIの合併およびAMTIの合併を規定し、AMTIは合併後もCycloの全資本付属会社(“合併”)として存在し続ける(“合併”を参照)。
著者らは臨床段階の生物技術会社であり、シクロデキストリンを基礎とした製品を開発し、神経変性疾患の治療に応用している。2014年,我々はニマン−ピックC型疾患(“”)を治療する薬剤として,米国食品医薬品局(FDA)に第2種類の薬物主文書を提出した。鼻咽頭癌は稀な致命的常染色体劣性遺伝病であり、コレステロール代謝の乱れを招き、脳、肺、肝臓、脾臓と他の器官に影響を与える。2015年、鼻咽頭癌の治療のために、トラプソール周期国際臨床プロジェクトを開始した。2016年、私たちは米国のある臨床地点で行われたランダム、二重盲検、平行グループ化研究のI期臨床計画を記載した新薬研究申請(IND)を米国食品医薬品局に提出した。I期研究は、トリプソールCycloおよびコレステロール代謝マーカーおよび鼻咽頭癌マーカーの18歳および以上の参加者がトリプソールCycloを2週間毎に静脈内投与する12週間の治療期間内の安全性および薬物動態を評価した。INDは2016年9月にアメリカ食品と薬物管理局の許可を得て、2017年1月にアメリカ食品と薬物管理局によってトラプソルCycloによる鼻咽頭癌治療の迅速な通路として承認された。米国第一段階研究の初期患者登録は2017年9月に開始され,2020年5月に我々が公表したトップラインデータは,この研究ではトラプソール周期が良好な安全性と耐性を有することを示している。
欧州規制機関によって承認されたI/II期臨床研究も完了し,イギリス,スウェーデン,イスラエルに臨床試験センターを設立した。このI/II期研究は一連の臨床結果、神経系、呼吸、コレステロール代謝と鼻咽頭癌マーカーの測定を含み、トリプソールCycloの安全性、耐性と有効性を評価した。12週間の第1段階研究(単一アメリカサイト)と一致し、ヨーロッパ/イスラエル研究は二重盲検無作為試験において2週間ごとに鼻咽頭癌患者にトリプソール環化を静脈注射したが、異なる点は研究周期が48週間(24剤)であった。2021年3月、著者らは試験を完成した患者100%(12人中9人)の病状が改善或いは安定を維持し、89%の患者が少なくとも17領域の鼻咽頭癌重症度尺度の2つの領域で改善の治療効果結果測定基準を達成したと発表した。
また,2020年2月に米国食品医薬品局と対面した“C型”会議を行い,これまでに得られた臨床データに基づいて,われわれの鍵となる第3段階臨床試験TrappsolCycloを開始することについて検討した。その会議では,トリプソールCycloを有する小児および成人患者の鼻咽頭癌の治療のために,連邦食品,薬物,化粧品法案第505(B)(1)条に提出された新薬申請を米国食品医薬品局と検討した。2020年2月にも欧州医薬品局(“EMA”)に類似した要請を提出し,EMAの科学的提案と案援助を求め,欧州での第3段階臨床試験を継続した。2020年10月,米国食品医薬品局から提案された第3段階臨床試験の“研究が可能”という通知を受け,2021年6月にTransportNPCへの参加を開始し,トラプソルCycloによる鼻咽頭癌治療の鍵となる第3段階研究である。
アルツハイマー病治療におけるシクロデキストリンの応用も探索されている。2018年1月、米国食品医薬品局は、TrappsolCycloを用いてアルツハイマー病を治療する単一患者IND拡張アクセス計画を承認した。この遅発性老年病患者は18ケ月の治療を経て、病状は安定し、薬物耐性は良好である。患者は改善の兆しも示し,単語を探す際の変動性は小さく,潜伏期が短かった。2021年1月に米国食品医薬品局に提出されたトリプソール静注によるアルツハイマー病治療の早期計画の概要を用意した。我々は2021年4月に米国食品医薬品局からこの概要のフィードバックを受け,これらのフィードバックを2021年11月に米国食品医薬品局に提出したTrappsolCycloによるアルツハイマー病治療の第2段階研究のINDに組み込んだ。2021年12月、私たちは食品医薬品局のINDの承認を得て、トリプルソール環化によるアルツハイマー病治療の第二段階研究を継続することを可能にした。この研究の米国サイトは2022年下半期に活性化され,患者投与量は2023年第1四半期から開始された。
私たちはまた、製薬、栄養、その他の業界へのシクロデキストリンと関連製品の販売を含む、私たちが残した微細化学工業業務を経営し続け、主に診断と特殊な薬物に応用されている。しかし,我々の中核業務は,基本シクロデキストリン製品を主に転売する事業から,シクロデキストリンに基づく疾患治療に主に専念するバイオ製薬のバイオテクノロジー会社に変化している。
持続的な経営と流動資金
当社は2023年12月31日および2022年12月31日までに純損失$を記録しました
2023年12月31日までの年間で、会社の運営に$が使用されています
私たちは、株式証券の時々の売却、債務証券の発行、既存の資産または開発中かもしれない資産の売却、または他の非償却融資メカニズムによってこのような資本を調達し続けるつもりだ。私たちがこれらの追加資本を得ることができるかどうかは、私たちの全体的な業務パフォーマンスや市場状況を含む様々な要素の影響を受ける可能性がある。もし私たちが予想される運営に必要な追加資金を集めることができなければ、私たちの研究開発計画を縮小または廃止し、私たちの臨床試験を延期し、規制承認を求める能力を延期し、私たちの一般的かつ行政的インフラを削減したり、破産を回避するための代替措置を求めたりすることが要求されるかもしれない。将来的に普通株や他の証券を発行することでより多くの資金を調達すれば、このような発行により、現在の株主の会社における持株比率が希釈されることになり、これはかなり大きい可能性がある。未来の発行はまた私たちの普通株の価格に実質的な悪影響を及ぼすかもしれない。
我々は、2023年、2023年、2022年12月31日までの年度の総合財務諸表を継続経営に基づいて作成しており、この継続経営は、正常な業務過程で資産と負債を返済することが期待されている。上述したように、私たちが経営を続ける能力は株式融資の利用可能性にかかっている。これらの要因は、私たちが経営を続けている会社として経営を続ける能力を大きく疑わせています。財務諸表にはこのような不確実性の結果がもたらす可能性のあるいかなる調整も含まれていない。
|
(2) |
重要な会計政策の概要: |
以下は、同社が連結財務諸表に影響を与えるより重要な会計政策の概要である
(A)レポートベースである総合財務諸表には、当社およびその完全子会社が含まれています。合併で、すべての重要な会社間口座と取引はキャンセルされた。
(B)現金および現金等価物--現金および現金等価物は、現金および最初に購入された任意の満期日が3ヶ月以下の高流動性投資を含む。現金と現金等価物とは、主にいつでも利用可能な小切手や通貨市場口座に投資する資金のことです。同社の金融機関での預金は連邦保険限度額250,000ドルを超え、金額は約1ドルです
(C)売掛金--売掛金は無担保かつ無利子であり、未済残高から受け取ると予想される金額に応じて列記する。インボイス日付が90日を超える顧客口座残高は期限を超えているとみなされます。当社は期限を過ぎた勘定で利息を発生させません。顧客支払いは、顧客送金通知上で決定された特定の領収書に割り当てられるか、または、指定されていない場合には、最も早い未払い伝票に適用される。2022年1月1日現在の売掛金は約ドルである
売掛金の帳簿金額は、予想される信用損失に対する管理層の最適な推定を反映した信用損失準備を差し引く。会社はすべての残高または一部の残高を審査して、領収書の日付から90日を超える顧客残高を審査します。当社の顧客の現在および予測信用の評価によると、当社は残高のうち回収されない部分(ある場合)を見積もり、経営陣が売掛金の価値がない可能性があると推定した場合には、クレジット損失準備の費用として売掛金を解約する。同社は予想信用損失準備金を#ドルと推定している
(D)金融商品--2016年6月、FASBはASU 2016-13、金融商品である信用損失(CECL)を発表した。今回の更新中の改訂は新しい会計モードを導入し、余剰コストで計量した金融資産の信用損失を計量する。FASBはまた、ASU 2016-13年度の範囲を明らかにし、追加的な指導を提供するための追加のASUを発表した。余剰コストによって計量された金融資産の信用損失は、当該金融資産或いは金融資産グループの寿命内の当期予想信用損失総額に基づいて決定されなければならない。実際、金融資産または金融資産グループは、予想通りに受領した純額を列記しなければならない。余剰コストによって計量された金融資産に対しては、現行の発生した損失モードに基づいて信用損失を計上しない。修正案はまた、売却可能な債務証券の会計計算を修正し、即ち信用損失は信用損失準備によって記録され、証券のコスト基礎を減記するのではなく、信用損失の低下を推定する時に信用損失を逆転させることを可能にする。債務証券を売却できる信用損失は現行公認会計基準に類似した方法で計量されなければならない。
改正案は2023年1月1日に会社に施行され、改正された遡及方法を採用し、必要に応じて会計年度開始時の利益剰余金による累積効果調整を行わなければならない。基準は信用損失準備の計量を修正したが、売掛金の信用リスクを変更していない。2023年1月1日に発効した場合、CECL法の適用には何の影響もない。
CECL減値モデルでは、同社は1つのポートフォリオによって細分化されている:国内顧客は、その貿易売掛金の信用損失準備を作成して記録している。ポートフォリオの細分化の決定は主に顧客の地理的位置に基づいている。
我々がCECLから推定した信用損失の定量的準備は,帳票スケジュールを用いた方法を用いて決定した.当社はまた、独自のリスク、現在の経済状況の変化が数量化結果に反映できない可能性がある定性調整、あるいはその他の関連要素を考慮して、信用損失の見積もりをさらに教えてくれる。
(E)販売製品の在庫およびコスト--在庫は、コスト(先出し)または換金可能正味価の低いもので記録されたシクロデキストリン製品と、転売のために購入された化学複合体とを含む。製品販売コストには、駅構内または駅出運賃、間接管理費用、倉庫および流通費用または減価償却および償却費用のいずれの分担も含まれない販売された製品の調達コストが含まれる。同社は時代遅れと判断された在庫品のために特定の備蓄を記録した。その会社は決定した2023年12月31日現在、古い在庫のための資金を確保する必要がある。備蓄金は約#ドルだ
会社の古い在庫備蓄は製品販売と顧客ニーズに対する会社の最適な見積もりに基づいています。同社がその在庫減記準備を決定するための見積もり数は実際の減記とは大きく異なる可能性がある。これらの違いは、在庫準備や関連コストが予想を大幅に上回っている可能性があり、短期的には会社の経営業績や財務状況に大きな悪影響を及ぼす可能性がある。
(F)前払い臨床費用--前払い臨床費用は、私たちの活性医薬成分および私たちの薬物TRAPSOLCycloの他の原材料を含み、コストで記録するために私たちの臨床試験計画に使用されると予想される。さらに、将来の研究·開発活動のための商品またはサービスの前払いも前払いの臨床費用に含まれる。前払いした臨床費用は,貨物が関連サービスを交付または実行する際に研究·開発コストとして支出される。
(G)家具および設備--家具および設備は、コストから減価償却累計を差し引いて入金される。減価償却は、主に資産の推定耐用年数内に直線法で計算される(一般至れり尽くせりコンピュータと車両の耐用年数と至れり尽くせり機械、設備、オフィス家具の使用年数)。私たちは定期的に私たちの長期資産を審査して、資産の帳簿価値が回収できない可能性があるかどうかを確認します。減値を確認すれば,資産の帳簿価値と見積公正価値との差額の損失を確認する.
|
(2) |
重要会計政策概要:(続) |
(H)レンタル--会社がオフィスと倉庫スペースをレンタルします。会社は最初から賃貸契約かどうかを確定しています。当社がテナントであれば、レンタルを含む契約は、その条項に基づいて経営的または融資リースとさらに評価され、あるいは当社がレンタル者である場合は、経営性、販売型または直接融資リースとなります。経営リースは、会社総合貸借対照表の使用権(“ROU”)、賃貸資産、賃貸負債に計上される。当社は既存の賃貸契約に基づいてオフィススペースを第三者に転貸します。転貸収入は総合経営報告書に他の収入として記載されている。二零二三年十二月三十一日現在の年度では分譲収入は確認されておらず、関連賃貸は付記1及び12に記載された合併契約完了時に二零二三年十二月二十八日に負担されている。
純益資産は会社がリース期間内に対象資産を使用する権利を代表し,リース負債は会社を代表してリースによるリース金の支払いを義務付けている。経営リースROU資産および負債は、開始日にレンタル期間内のリース支払いの現在値によって確認されます。当社の賃貸借契約は暗黙的な金利を提供していないため、当社は開始日に得られた資料に基づく逓増借款金利を採用して賃貸支払いの現在値を決定している。レンタルROU資産には、レンタルインセンティブを含まない支払いされた任意のレンタル料金も含まれています。当社の賃貸条項には、当社がその選択権を行使することを合理的に決定した場合に賃貸借契約を延長または終了する選択権が含まれています。レンタル支払いのレンタル料金はレンタル期間内に直線法で確認します。可変レンタル支払いは発生時に料金を計上します。当社の賃貸契約には重大な残存価値保証や重大な制限的な契約は含まれていません。
契約を評価してリース資格を満たしているかどうかを決定する際に、当社が排他的に対象資産の基本的なすべての権利を獲得したかどうか、資産の使用方法や用途を決定することで資産の使用を指導できるかどうか、レンタル者が実質的な代替権を持っているかどうかを考慮する要因がある。この評価は重大な判断を下す必要があるかもしれない。
(I)収入確認--私たちの顧客が約束された商品またはサービスのコントロール権を獲得した場合、収入は、これらの商品またはサービスと交換することが予想される対価格を反映していることが確認されます。(I)顧客との契約の決定(S)、(Ii)契約における履行義務の決定、(Iii)取引価格の決定、(Iv)契約に取引価格を割り当てる履行義務、および(V)(または)履行義務を履行した場合に収入を確認する、会計基準に従って2014-09号に規定されている5ステップモード確認収入を更新する。
製品収入
アメリカでは、私たちはエンドユーザーや卸に私たちの製品を販売します。他の国では、私たちは主に卸売業者と他の第三者流通パートナーに私たちの製品を販売します。これらの顧客はその後、私たちの製品を医療提供者と患者に転売する。
製品販売収入は,顧客が我々の製品に対する制御権を獲得したときに確認され,これはある時点で発生し,通常は顧客に渡す際である.もし私たちが確認すべき資産の予想償却期間が1年以上かそれ以下の金額であれば、契約が発生したときに契約を得るための増額コストを支出する。顧客が製品制御権を獲得した後の輸送や運搬コストを履行コストと見なしている。私たちは、お客様との契約で、お客様に製品を渡すという履行義務を決定しました。お客様に製品を納品する際に、取引価格が全額確認され、これが契約履行義務を履行する時点です。
|
(2) |
重要会計政策概要:(続) |
私たちの収入に関するより多くの情報は、これらの連結財務諸表の付記3、収入を読んでください。
(J)送料および手数料--お客様から送料および手数料を受け取る場合は、製品販売に含まれます。入港運賃に関する運賃と運搬費は発生した費用に応じて運賃と運賃を計上する。
(K)広告--広告料金は、発生時に運営費用に計上される。私たちが招いた広告費用が一番安い。
(L)研究開発コスト--研究開発コストは、発生時に費用を計上するか。同社は,サービス提供前に支払った金額を前払い資産として記録し,サービス提供時に確認した費用を記録している。研究·開発費用には,主に人員に関する費用と,契約研究組織やコンサルタントなどの第三者の手配によって発生する外部研究·開発費用が含まれる。各報告期間の終了時に、会社が各サービスプロバイダに支払う金額を、関連項目の完了推定進捗と比較する。同社がこれらの見積りを準備する際に考慮した要因は,研究参加患者数,実現のマイルストーン,そのサプライヤーの努力に関する他の基準である。これらの推定値は、より多くの情報が得られるにつれて変化する可能性がある。サプライヤーへの支払い時間と推定提供されたサービスに基づいて、会社はこれらのコストに関連する純前払いまたは計算費用を記録する。私たちとサプライヤーとの契約によると、前払い臨床費用は有効な未来の経済利益を代表し、正常な業務過程で実現する。
(M)繰延税金資産および負債は、既存の資産および負債の帳簿金額とそれぞれの所得税ベースとの間の差額の推定将来の税金結果に起因することが確認されている。繰延税項資産と負債は公布された税率計量を採用し、これらの臨時差額の回収または決済が予想される年度の課税所得額に適用される予定だ。また、不確定とされている頭寸に関する税収割引は、税務機関の審査後にその頭寸を維持する可能性が高い場合にのみ確認される。当該等の税務倉位は、最初及びその後に当該倉位及び関連事実を完全に知った場合に、税務機関と最終決済を達成する際に実現される可能性が50%を超える最大税務割引金額計量である。当社は2023年12月31日および2022年12月31日までに、その繰延税金資産入金全額推定について準備しています。
(N)普通株当たり純損失--1株当たり基本的かつ完全償却純損失の算出方法は、列報期間中に発行された普通株の単純加重平均値を発行済株式権証として購入する
(O)株式ベースの報酬--会社は定期的に従業員、役員、コンサルタントに株を奨励します。従業員及びコンサルタントの場合には、確認された費用は株式の公正価値に等しく、株式の付与日の終値に基づいて決定される。取締役については、会社は会社史上の役員報酬政策に基づいて四半期ごとに株式報酬費用を計上し、四半期ごとに当該四半期の普通株の取引価格に基づいてその費用を確認する。そして取締役に株式を発行する際には、発行時の取引価格に応じてこの費用を調整する。
会社はその2021年株式激励計画に基づいて定期的に株式オプションを発行する。当社はブラック·スコアーズ推定法を用いて株式オプションの付与日における公正価値を推定しています。補償費用は必要なサービス期間内に直線的に確認され,サービス期間は通常授権期間である.
|
(2) |
重要会計政策概要:(続) |
(P)公正価値計量及び開示--820号会計基準編纂(“ASC”)、“公正価値計量及び開示”は、会社に、資産売却によって受信された価格または市場参加者に負債を移転した価格に基づいて公正価値を決定することを要求する。ASC 820は、公正な価値は、エンティティに固有の計量ではなく、市場に基づく計量であることを強調する。
指導意見は、公正価値台帳の資産と負債を以下のカテゴリのうちの1つに分類して開示することを要求する
|
● |
第1レベル:同じ資産や負債の活発な市場見積もり。 |
|
|
|
||
|
● |
第2レベル:市場データによって確認された観察可能な市場への投入または観察不可能な投入。 |
|
|
|
||
|
● |
レベル3:市場データによって確認されていない観察できない投入。 |
私たちは、2023年12月31日、2023年12月31日、または2022年12月31日に公正価値で計量された資産または負債を要求していません。これらの長期資産は、非日常的に公正価値に基づいて計量され、減価証拠がある場合には公正価値調整が行われます。
私たちの短期金融商品カテゴリには、現金と現金等価物、売掛金、および売掛金が含まれており、公正価値で報告されておらず、その短期的な性質のため、帳簿金額は公正価値に近い
貨幣市場基金は、2023年12月31日現在、当社の総合貸借対照表の中で唯一、公正な価値に応じて恒常的に計量·記録されている金融商品である。通貨市場基金は現金と現金同等物を計上する。次の表に示す期間の通貨市場基金の公正価値レベル内のレベルを示す。いくつありますか2022年12月31日に保有する通貨市場基金。
|
公正価値 階層構造 水平 |
償却する コスト |
毛収入 実現していない 収益.収益 |
毛収入 実現していない 損 |
公正価値 |
||||||||||||||
|
現金等価物: |
|
|||||||||||||||||
| アメリカ政府債券に投資する通貨市場基金 | レベル1 | $ | $ | $ | $ | |||||||||||||
| 合計する | $ | $ | $ | $ | ||||||||||||||
(Q)推定数の使用-アメリカ合衆国で一般的に受け入れられている会計原則に従って連結財務諸表を作成し、合併財務諸表および付記報告書の額に影響を与えるために、合併財務諸表および付記報告の額に影響を与えるために、管理層に推定および仮定を要求する。同社の最も重要な推定は在庫の古い、株式に基づく補償、株式証の負債推定値、発行された株式証明書の公正価値、合併に関連する負担負債(付記12参照)と信用損失準備に関連する。経営陣の見積もりは歴史的経験に基づいており、この場合は合理的な仮定とされているにもかかわらず、実際の結果はこれらの見積もりとは大きく異なる可能性がある
(R)最近の会計声明--2016年6月、財務会計基準委員会(“FASB”)は、実体が金融商品の信用損失をどのように計量すべきかについて指導を提供したASU 2016-13年の“金融商品--信用損失”(特別テーマ326)を発表した。この基準は、実体が予想損失に基づく展望的方法を使用して、大多数の金融資産およびいくつかの他のツールの信用損失を推定することを要求する減値モデルを修正し、これらのツールは、純収入によって公正な価値によって計量されるのではない。ASUは2023年第1四半期に規模の小さい報告会社に有効であった。当社は2023年1月1日から新たな指針を採用しており、その連結財務諸表に実質的な影響を与えていない。
2020年8月、財務会計基準委員会は、ASU 2020-06を発表し、“債務-転換および他のオプションを有する債務(主題470-20)とデリバティブおよびヘッジ-エンティティ自己持分契約(主題815-40)”(“ASU 2020-06”)を発表した。ASU 2020-06は、変換可能なツールおよびエンティティの自己資本契約を含む、負債および権益の特徴を有するいくつかの金融商品の会計処理を簡略化する。ASU 2020-06改正案は、2023年12月15日以降の会計年度およびこれらの年度内の移行期間内に発効する。早期採用は許可されているが、2020年12月15日以降の財政年度より早く、これらの財政年度内の過渡期を含めてはならない。同社は2023年1月1日からこの基準を採用し、その連結財務諸表に実質的な影響がないことを確定した。
FASBは2023-09“所得税(主題740)-所得税開示の改善”を2023年12月に発表した。新しいガイドラインは、報告エンティティの有効税率入金に関する分類情報および支払われた所得税に関する情報の提供を要求することによって、所得税開示の透明性および意思決定の有用性を向上させることを目的としている。この改正案は2024年12月15日以降の会計年度に発効し、早期成立を許可している。今回の更新における修正案は予想に基づいて適用され、遡及適用を許可しなければならない。当社は、ASU 2023-09の採用が連結財務諸表や関連開示に及ぼす影響を評価しています。
|
(2) |
重要会計政策概要:(続) |
2022年6月、FASBはASU 2022-03号、公正価値計量(特別テーマ820):契約販売制限された株式証券の公正価値計量(“ASU 2022-03”)を発表し、契約販売制限された持分証券の公正価値計量ガイドラインを明らかにし、そしてこのような持分証券のために新しい開示要求を確立した。ASU 2022−03は2023年12月15日以降の財政年度内に有効であり,これらの財政年度内の移行期間で有効であるが,早期採用を許可している。会社は現在、ASU 2022-03の連結財務諸表への影響を評価している。
|
(3) |
収入: |
同社は以下の地域で運営している業務部門は、主にシクロデキストリンに基づく革新製品の開発と商業化に集中し、深刻かつ生命に危害を及ぼすまれな疾患や医療条件を有する人の治療に用いられている。しかし、同社のほとんどの収入は製薬、栄養、その他の業界へのシクロデキストリンと関連製品の販売から来ており、主に診断と特殊な薬物に用いられている。
当社は、純製品収入が総合製品純収入の10%を超える地域には収入集中のリスクがあると考えている。2023年の間に
|
(3) |
収入:(続) |
製品別の収入の概要は以下のとおりである
|
締切り年数 |
||||||||
|
十二月三十一日 |
||||||||
|
2023 |
2022 |
|||||||
|
トラップソルカム™ |
$ | $ | ||||||
|
曲普ソールHPB |
||||||||
|
トラプソル精密化学品 |
||||||||
|
AquaPlex® |
||||||||
|
他にも |
||||||||
|
総収入 |
$ | $ | ||||||
|
(4) |
主な顧客とサプライヤー: |
私たちの収入は主にアメリカとカナダにある化学品の供給と製薬会社から来ています。2023年には主要取引先占
基本的にすべての在庫購入は2023年と2022年の調達量;しかし、同社は、市場の他の既製のサプライヤーを通じて調達量を同様のレベルに維持できると信じている。その会社は国内と国際サプライヤーを持っている。
2023年12月31日と2022年12月31日までの年間、私たちが収入する製品の組み合わせは含まれています
|
(5) |
信用リスクの集中度: |
同社が所有するすべての金融商品の信用リスクは以下のように著しく集中している
会社が集中的な信用リスクに直面している金融商品には主に現金と現金等価物および売掛金が含まれている。現金等価物とは、購入日満了日が90日以下である高流動性投資を意味する。現金や現金等価物に関する信用リスクは、これらの資金を保有する金融機関の信用に基づいている。同社の金融機関における現金残高は年間を通じて連邦保険の250,000ドルの上限を超える可能性がある。発生したいかなる損失やこのような資金を得ることができないことは、会社の財務状況、経営業績、キャッシュフローに重大な悪影響を及ぼす可能性がある。当社は、このような金融機関の倒産に関するリスクを低減するために、預金を持っている金融機関の格付けを評価します。当社が将来遭遇する可能性のあるいかなる重大な損失も、運営費の支払いや他のお金を支払う能力に悪影響を及ぼす可能性があり、当社にその現金を他の良質な金融機関に移転することを要求する可能性があります。現在、同社は銀行との関係を検討しており、そのリスクの開放が連邦預金保険会社の保護限度額に制限または減少されていることを確保するためにリスクを低減している。
同社は通常の業務過程で顧客に信用を提供している。売掛金に関する信用リスクは、連結財務諸表に記載されている全金額に集中している。同社は顧客が売掛金を保証するために担保を提供する必要はない。
当社には外国為替契約、オプション契約、その他のヘッジ手配などの重大な表外リスクはありません。
|
(6) |
家具と設備: |
12月31日現在、家具と設備には以下のものが含まれている
|
2023 |
2022 |
|||||||
|
機械と設備 |
$ | $ | ||||||
|
事務家具 |
||||||||
|
減算:減価償却累計 |
||||||||
|
家具と設備、網具 |
$ | $ | ||||||
2023年12月31日までと2022年12月31日までの減価償却費用は
|
(7) |
売掛金と売掛金: |
12月31日現在、売掛金および売掛金には、以下の内容が含まれている
|
締切り年数 |
||||||||
|
十二月三十一日 |
||||||||
|
2023 |
2022 |
|||||||
|
売掛金 |
$ | $ | ||||||
|
ボーナス報酬に計上すべきである |
||||||||
|
取締役会の費用を計算する |
||||||||
|
転貸保証金負債 |
||||||||
|
合併責任 |
||||||||
|
他にも |
||||||||
|
売掛金と売掛金の総額 |
$ | $ | ||||||
|
(8) |
賃貸借契約: |
当社は2023年1月にオフィスと倉庫運営賃貸契約を締結し、レンタル期間は2026年1月に満了し、追加延長を選択することができます何年もです。当社が延長選択権を行使するかどうかを合理的に決定できないため、追加の3年間はレンタル期間に含まれていません。このリースは2023年1月に満期となった既存の運営リースに代わっている。
付記1および付記12に記載の合併協定が完了した場合、当社はオフィス空間の経営リースを担当し、そのオフィス空間は第三者に正分レンタルされる。レンタルと転貸協定は2024年8月に満了する。
賃貸資産を使用して累計償却純額#ドルに記入します
|
(8) |
賃貸借契約:(続) |
2023年、2023年、2022年12月31日終了年度のレンタルに関するその他の資料は以下の通り
|
2023 |
2022 |
|||||||
|
賃貸負債に含まれる金額を計量するために支払う現金: |
$ | $ | ||||||
|
M&A資本再編で得られた経営リース資産 |
||||||||
|
合併資本再編における経営リース責任 |
||||||||
|
加重-平均残余賃貸期間-営業リース(年) |
||||||||
|
加重平均割引率-レンタル経営 |
% | % | ||||||
2024年12月31日までの将来の転貸収入は$
2023年12月31日まで、レンタルをキャンセルできない将来の最低レンタル支払いは以下の通りです
|
十二月三十一日までの年度 |
金額 |
|||
|
2024 |
$ | |||
|
2025 |
||||
|
2026 |
||||
|
将来の最低賃貸支払い総額 |
||||
|
差し引く:推定利息 |
( |
) | ||
| $ | ||||
|
(9) |
支払手形: |
2020年5月4日、同社の完全子会社であるシクロデキストリン技術開発会社がドルを借り入れる
PPPによると、この融資はCARE法案に記載されているいくつかの条件を満たす費用を援助するために使用されるため、計算すべき利息を含む全融資金額は2022年3月に免除される。したがって、減免された残高は、添付されている総合業務報告書に購買力平価ローン減免の収益として単独で記載されている。
|
(10) |
株式取引: |
2023年3月3日と2023年12月26日、会社株主特別会議で承認された後、会社定款は改正され、普通株式の法定株式数を
2023年に同社はどの従業員にも株を発行する。2022年に同社はドルを支出しました
|
(10) |
株式取引:(継続) |
2023年に同社は科学顧問委員会のどのメンバーにも株を発行する。2022年に会社は
当社は稼いでいる間は取締役会の報酬支出を計算しなければなりません。取締役会メンバーの取締役会報酬支出は、我々の総合経営報告書の“取締役会費用とコスト”に含まれています。2023年に会社は
2023年1月3日、同社は登録直接発行方式で機関投資家に販売
当社は株式承認証の公正価値を権益に分類し、この等株式証は自身の株式とリンクし、ASCの派生ツール及びヘッジに関する815-40題目の案内に基づいて権益分類を行うために必要な条件を満たしているからである。
H.C.Wainwright&Co.,LLCは当社の登録直接発売および同時私募に関する配給エージェントを担当し,支払いを受けたことに等しい
2023年1月25日、投資家は一部の事前融資権証を行使し、獲得した
2023年4月20日、当社はナスダック株式市場規則に基づき、当社の取締役数名と経営陣メンバー及びその関連会社を含む一群の認可投資家に市場価格による証券私募を完了した。投資家は私募で購入する
|
(10) |
株式取引:(継続) |
2023年5月2日、同社はデラウェア州のラファエルホールディングス(Rafael Holdings,Inc.)への証券の私募を完了し、同社の株式を購入した
2023年8月1日、当社とRafael Holdingsが2023年6月1日に締結した証券購入契約に基づき、Rafael Holdingsへの追加私募を完了しました。ラファエロホールディングスが買収された
2023年10月20日、当社は2023年4月と5月に方向性増発したある投資家と証券購入協定を締結した。投資家は株式承認証を行使して購入する
2023年12月27日、同社は応用分子輸送会社との戦略統合を完了した。
株式承認証
以下の表に発行された一般株式承認証の数を示す
|
引受権証の未返済、2021年12月31日 |
||||
|
発表されました |
||||
|
鍛えられた |
||||
|
期限が切れる |
( |
) | ||
|
引受権証の未返済、2022年12月31日 |
||||
|
発表されました |
||||
|
鍛えられた |
( |
) | ||
|
期限が切れる |
( |
) |
||
|
引受権証の未返済、2023年12月31日 |
|
(10) |
株式取引:(継続) |
次の表は、2023年12月31日に発行された普通株式証の数量、行使価格、満期日を示している
|
発行された引受権証 |
行権価格 |
期日まで |
||||
| $ |
2024年2月 |
|||||
| $ |
2024年10月 |
|||||
| $ |
2024年10月 |
|||||
| $ |
2024年11月 |
|||||
| $ |
2025年4月 |
|||||
| $ |
2025年12月 |
|||||
| $ |
2025年9月 |
|||||
| $ |
2027年8月 |
|||||
| $ |
2025年12月 |
|||||
| $ |
2025年12月 |
|||||
| $ |
2026年1月 |
|||||
| $ |
2027年12月 |
|||||
| 2028年1月 | ||||||
| $ |
2028年10月 |
|||||
| $ |
2030年4月 |
|||||
| $ |
2030年8月 |
|||||
またまだ完成していないものもあります株式購入承認証(1)
|
(11) |
優先株: |
会社の定款規定
|
(12) |
応用分子輸送会社と合併しました |
2023年12月27日に、当社は2023年9月21日のいくつかの合併合意および計画(“合併合意”)に基づいて戦略合併を完了し、当社、当社の全資付属会社およびデラウェア州の全資付属会社Cameo Merge Sub,Inc.およびデラウェア州の応用分子輸送会社(“AMTI”)が戦略合併を完了し、合併SubとAMTIおよびAMTIの合併について規定したが、AMTIは合併後も当社の全資本付属会社(“合併”)として存在し続けている(“合併”)
|
(12) |
応用分子運送会社と合併する:(継続) |
合併完了時に、合併完了直前に発行および発行されたAMTI 1株当たり普通株((I)在庫株および(Ii)を含まずに自社または合併付属会社が直接保有するAMTI普通株)は、0.1331(“交換比率”)に相当するいくつかの自社普通株を受け取る権利に自動的に変換される。合併により当社普通株の断片的な株式を発行することはなく、AMTI株主に発行する自社普通株の株式数は、最も近い全体株式に上方丸め込まれる。終値直前に発行され、1株当たりの権利価格が$以下のAMTI普通株を購入する1株当たりオプション
合併は会社の資本再編とみなされ、この取引は本質的に会社の普通株を現金と現金等価物に交換し、最低限の資産と負債を負担するためである。成約時には、当社は既存のAMTIビルの賃貸借と関連分譲を担当した。リースは使用権資産と関連賃貸負債として報告され、約#ドルである
|
現金と現金等価物 |
$ | |||
|
リース資産を使用する |
||||
|
保証金 |
||||
|
前払い金とその他の資産 |
||||
|
リース責任 |
( |
) | ||
|
転貸保証金負債 |
( |
) | ||
|
その他負債 |
( |
) | ||
|
純資産 |
$ |
合併所得収益は,発行コストを差し引いて#ドルである
同社が発行したのは
2023年12月、AMTIに対する2件の訴訟は合併と関連がある。同社は既存の最適な情報に基づいて潜在的負債を推定した。結果はまだ確定していないが、会社はこれらの訴訟がキャッシュフロー、財務状況、あるいは経営結果に実質的な悪影響を与えないと予想している。
|
(13) |
所得税: |
繰延所得税は、財務報告目的のための資産および負債の帳簿金額と所得税目的のための金額との間の一時的な差異の純税影響を反映する。繰延税項純資産の実現は将来の収益に依存し、もしあれば、ASC 740によれば、繰延税金資産の時間と金額は不確定であり、繰延税金資産の全部または一部が実現できない可能性が高い場合には、推定準備金を差し引かなければならない。2023年12月31日には、一時的な控除可能差額と純営業損失の繰越が実現できない可能性が高いことが確認され、提供された
私たちが評価において重要性と重みの順に評価した肯定的な証拠には、前10年間の当期所得税負債に対する4年間の純運営損失の繰越額と、純運営損失の満期までに利用可能な期間の長さが含まれています。私たちの評価において重要性と重みの順に考慮した負の証拠には、最近の純損失、臨床試験や製品開発費用の計画、使用前に繰り越された純運営損失の満期時間、将来の販売と利益の予測不可能性、他社からの競争が含まれています。評価では,われわれの持続臨床試験と製品開発費用計画,費用増加傾向と純運営損失を最大限に考慮すべきであることにした。私たちは現在と予想される未来の売上と利益率の変化、プラスと負の証拠の他の要素の変化に基づいて、四半期ごとに私たちの推定値を再評価します。
|
(13) |
所得税:(続) |
2023年12月31日現在、未使用の連邦と州の純営業損失繰越総額は約$です
使用しなければ、繰り越しの純営業損失は以下のように満期になる
|
年末.年末 十二月三十一日 |
金額 |
|||
|
2024 |
$ | |||
|
2028 |
||||
|
2030 |
||||
|
2031 |
||||
|
2032 |
||||
|
2034 |
||||
|
2035 |
||||
|
2036 |
||||
|
2037 |
||||
|
不定である |
||||
|
合計する |
$ | |||
以前に発生あるいは未来に発生する可能性のある所有権変更のため、NOLと税収控除繰越を利用して未来の課税所得額を相殺することは年間制限を受ける可能性がある。“国内税法”(IRC)第382及び383条によれば、会社所有権変更後、その利用変更前のNOL及びその他の将来の課税所得額及び/又は納税義務を相殺するために使用することができる税務属性の能力が制限される可能性がある。所有権変更は、転記された3年間の間に、特定の株主の所有権状況が50%以上累積的に変化すると定義される。当社は、IRC第382条及び383条に示される所有権変更が発生したか否かを決定するための正式な研究を完了していない。所有権変更が発生した場合、会社がそのNOLまたは税収控除を使用する能力が制限される可能性があり、これは会社がこのような制限よりも無効な場合に連邦または州所得税を早期に支払うことを要求する可能性がある。
同社の費用は孤児薬物信用の条件を満たしている。孤児薬品相殺はいかなる現在の納税義務を相殺するために使用されることができる。未使用の単位は20年間繰り越すことができる。控除が20年の繰越期間終了時にまだ使用されていない場合、連邦所得税の費用として控除することができる。累計未使用信用決済は#ドルに転換した
2023年には所得税の福利厚生を確認したり支出したりする。減価準備前の繰延税項目純資産は#ドル増加した
私たちが延期した連邦所得税の重要な構成要素は以下の通りです
|
2023 |
2022 |
|||||||
|
繰延税金資産: |
||||||||
|
純営業損失が繰り越す |
$ | $ | ||||||
|
税収控除,純額 |
||||||||
|
減価準備 |
||||||||
|
株に基づく報酬 |
||||||||
|
他にも |
||||||||
|
ボーナスを計算する |
||||||||
|
法律性を計算すべきである |
||||||||
|
賃貸負債 |
||||||||
|
研究と開発費、純額 |
||||||||
|
推定免税額を差し引く |
( |
) | ( |
) | ||||
|
繰延税金資産は評価後の純額を差し引く |
||||||||
|
繰延税金負債: |
||||||||
|
財産と設備 |
( |
) | ( |
) |
||||
| 使用権資産 | ( |
) | ||||||
|
繰延税金負債 |
( |
) | ( |
) |
||||
|
納税純資産 |
$ | $ | ||||||
|
(13) |
所得税:(続) |
所得税給付(準備金)に反映される実際の所得税率と、2023年12月31日、2023年12月31日、2022年12月31日の21%の連邦法定所得税率を適用することで決定される金額との差の概要は以下の通り
|
2023 |
2022 |
|||||||
|
連邦法定税率で計算される税収割引 |
% | % | ||||||
|
国家税収の影響 |
% | % | ||||||
|
他にも |
% | % | ||||||
|
準備金控除後の税収控除 |
( |
)% | % | |||||
|
差し引かれない費用 |
( |
)% | ( |
)% | ||||
|
評価免税額--繰延税金資産 |
( |
)% | ( |
)% | ||||
|
税収優遇総額 |
$ | $ | ||||||
同社はアメリカ連邦司法管区と三つの州で所得税申告書を提出した。納税目的で繰り越したNOLのため、同社は2004年からの例年の納税年度に米国連邦と州所得税の審査を受けなければならない。
2021年12月31日以降の納税年度から,納税者はIRC第174条に規定する研究·実験(R&E)活動によって生じる任意の費用を資本化しなければならない。納税者は従来,IRC第174条に基づいてこれらの費用を控除することを選択することができたが,税法は2021年12月31日以降の納税年度から資本化と償却を要求してきた。R&E活動に関する費用は米国で発生すれば5年以内に償却しなければならず,米国以外で発生した場合は15年以内に償却しなければならない。R&E活動の範囲は,IRC第41条(研究·開発税収免除目的のため)での合格研究活動の計算範囲よりも広い。当社は2022年12月31日までにすべての既存指針に基づいて分析を行い、R&E資本化を考慮して引き続き赤字状態にあることを決定した。当社は引き続きこの立法の効果を監視していますが、当社はこの変化で現金税を支払うことはないと予想されていますが、R&E費用を含まない余剰運営費用が大きいため、近い将来も税収面の損失が生じ続ける予定です。
当社はすでに米国で一般的に受け入れられている会計原則に基づいて、所得税中の不確実性について審査及びその各税項の関連技術的利点を評価している。
不確定納税状況における私たちの変化を以下の表にまとめます
|
2023 |
2022 |
|||||||
|
残高、1月1日 |
$ | $ | ||||||
|
本年度に関連する納税状況に基づいて計算される増加額 |
||||||||
|
バランス、十二月三十一日 |
$ | $ | ||||||
適用されれば、利息と罰金は所得税費用の構成要素として反映されるだろう。当社は本報告日から12ヶ月以内に大きな変化はないと予想しています。
|
(14) |
従業員福祉計画: |
ある資格要件に適合する会社員は、会社の専門雇用主組織を通じて401(K)計画に参加する権利がある。従業員の支払いは自由に支配できる。会社は従業員の支払いをマッチングすることができ、従業員の総給与に応じてすべての条件を満たす従業員に適宜支払いを提供することもできる。2023年と2022年には、会社は従業員の貢献にマッチすることを選択し、それを超えない
|
(15) |
持分インセンティブ計画: |
2019年8月29日、会社株主は株主特別総会で2019年総合持分インセンティブ計画(“2019年計画”)を採択した。2019年は最大の配布を予定しております
2021年6月24日、会社株主は年次株主総会で会社2021年株式激励計画(“2021年計画”)を採択した。2021年計画では最大配布が規定されている
|
(15) |
持分インセンティブ計画:(継続) |
同社はブラック·スコアーズ推定モデルを用いて付与日における株式オプションの公正価値を推定している。この推定モデルは、オプション取引価格および会社の株価予想価格変動性、無リスク投資収益率、オプションが未償還となる予想期間および会社普通株の期待配当率に関する推定と仮定を用いて、付与日における株式オプションの公正価値を推定する。推定値仮定は以下のように決定される
|
● |
予想株価変動:会社普通株の市場は限られており、付与された株式オプションを評価するために、会社の株価の予想変動率を推定する基礎を提供している。あるいは、当社は、当社が経営している第一産業部門を代表するある上場企業の歴史的波動性を使用しています。 |
|
● |
無リスク金利:同社の無リスク金利は,付与時に有効な米国国庫券の対応金利をもとに,期限は想定した期待オプション期限に見合っている。 |
|
● |
オプションの期待期限:オプションの期待期間は、オプション予想未償還期間を表す。 |
|
● |
年度配当金を予想する毎年の配当金は$と推定される |
株式ベースの補償費用は、通常、帰属期間である必要なサービス期間内に直線的に記録される。
次の表は,2023年12月31日と2022年12月31日までの年間公正価値を計算する際に用いた重み付き平均仮定をまとめたものである
|
|
2023 |
2022 |
||||||||||
|
配当率 |
-% | -% | ||||||||||
|
予想変動率 |
– | – | ||||||||||
|
無リスク金利 |
– | – | ||||||||||
|
予想寿命(年) |
- | - | ||||||||||
2023年12月31日までの年度に与えられたオプションの加重平均公正価値は,Black-Scholes推定値パターンで#ドルとした
AMTIとの合併と同時に、会社は
|
配当率 |
- | % | ||
|
予想変動率 |
% | |||
|
無リスク金利 |
% | |||
|
予想寿命(年) |
仮定されたAMTIオプションの推定総公正価値は、2023年の連結財務諸表に重要ではない。
|
(15) |
持分インセンティブ計画:(継続) |
以下に2023年12月31日までおよび2022年12月31日までの年次の株式オプション活動の概要を示す
|
|
|
重みをつける |
|
重みをつける |
|||||||||||||||
|
|
|
|
平均値 |
骨材 |
平均値 |
||||||||||||||
|
|
|
|
トレーニングをする |
固有の |
残り |
||||||||||||||
|
|
株 |
|
値段 |
価値がある |
契約期限 |
||||||||||||||
|
2021年12月31日現在の未償還株式オプション |
|
$ |
|
$ | - |
|
|||||||||||||
|
授与する |
|
|
- |
|
|||||||||||||||
|
鍛えられた |
|
$ | - | ||||||||||||||||
|
期限が切れる |
|
$ | - | ||||||||||||||||
|
没収される |
( |
) |
|
- | |||||||||||||||
|
2022年12月31日現在の未償還株式オプション |
|
$ |
|
||||||||||||||||
|
授与する |
|
- | |||||||||||||||||
|
想定した選択肢 |
|||||||||||||||||||
|
鍛えられた |
( |
) |
|
|
$ | - |
|
|
|||||||||||
|
期限が切れる |
|
- | |||||||||||||||||
|
没収される |
( |
) |
|
|
- |
|
|
||||||||||||
|
2023年12月31日現在の未償還株式オプション |
|
$ |
|
$ |
|
||||||||||||||
|
2023年12月31日に行使可能な株式オプション |
|
$ |
|
$ |
|
||||||||||||||
未帰属株式オプションに関する未確認報酬支出は#ドルである
|
(16) |
1株当たり純損失: |
以下の表に普通株基本純損失と償却純損失の計算方法を示す
| 締切り年数 | ||||||||
|
十二月三十一日 |
||||||||
|
2023 |
2022 |
|||||||
|
分子.分子 |
||||||||
|
純損失 |
$ | ( |
) | $ | ( |
) | ||
|
分母.分母 |
||||||||
|
加重平均発行済み普通株式、基本普通株式、希釈後普通株 |
||||||||
|
1株当たり基本と希釈して純損失 |
$ | ( |
) | $ | ( |
) | ||
当社は2023年および2022年に純損失を記録したため、潜在普通株に組み入れると逆償却作用が生じるため、1株当たりの基本損失および償却後の1株当たり純損失はそれぞれの期間で同じである。希釈加重平均流通株計算に計上されていない潜在的普通株は以下の通りである
|
締切り年数 |
||||||||
|
十二月三十一日 |
||||||||
|
2022 |
2021 |
|||||||
|
株式オプション |
||||||||
|
株式承認証 |
||||||||
|
(17) |
支払いを受けることと事項があります |
当社は通常業務の過程で提出された請求と法的訴訟に時々参加しています。私たちの経営陣は、これらのクレームと訴訟手続きに対するリスクを評価し、損失金額を推定する可能性があれば、損失金額が可能であれば、このような訴訟の潜在的損失費用を記録する。
その会社はその役員と雇用協定を締結した。2023年12月31日現在、これらの合意は、1人の幹部が理由なく解雇されれば、以下の解散費給付を受ける資格があるが、会社が合理的に満足した形でクレーム解除を行うことを前提としている
会社が理由なく雇用を終了すれば、役員は終了日まで比例して計算された未払い基本給と法律要求を適用する他の福祉(総称して“課税金額”と呼ぶ)を得る権利がある。また、役員は(I)その年収に相当する金額を獲得し、終了日に発効し、終了前に基本給を支払う同じ条項と頻度で1年間支払い、(Ii)終了後12ヶ月以内のすべてのコブラ費用を返済する。(Iii)行政官が稼いでいるが、終了日までに支払われていないボーナス(総称して“解散料”と呼ぶ)(総称して“解散料”と呼ぶ)(累積金額に解散費を加えたものを総称して“解散料”と呼ぶ)。また、CEOが理由なく解雇された場合、CEOに付与されたすべての非帰属持分報酬は終了日に自動的に加速されます
また、もし会社がコントロール権変更後12ケ月以内に理由なく採用幹部の採用を終了した場合(合意で定義されたように)、離職金以外に、各幹部はこの幹部に付与されたいかなる非帰属持分奨励の全面的なスピードアップを獲得する資格がある
2022年1月にAshland,Inc.と調印された協定について、同社は、あるマイルストーンを達成した上で、その正常な運営のための最低数の商品を購入することを約束した。最初の2つのマイルストーンは2023年と#年の間に実現された
|
(18) |
関係者取引: |
2016年10月以来毎月$を支払っています
2019年6月、私たちは最高経営責任者の息子Joshua M.FineをCEOに雇いました。Fineさん年俸は#ドル
ケビン·J·ストラタンC.E.リック·ストラタンの息子は2008年から私たちに雇われています2014年以来私たちの副社長、財務-報酬です彼の年収は$
コーリー·E·ストラタンC.E.リック·ストラタンの息子の嫁は、2011年以来私たちに雇われ、書類の専門家と後方勤務コーディネーターを務め、年収は$
2023年4月20日にCEO Scott Fineと一部の取締役会メンバーおよび付属会社が購入しました
2023年10月20日、Scott Fine最高経営責任者と一部の取締役会メンバーおよび付属会社は引受権証を行使し、交換として新たな引受権証を取得した。もっと多くの情報については、付記10、株式取引を読んでください。
|
(19) |
その後の活動: |
当社は2024年1月17日、ナスダック証券市場有限責任会社(“ナスダック”)総法律顧問事務室から通知(“コンプライアンス手紙”)を受け取り、上場規則第5550(B)条に基づく不足点が是正され、当社はすべての適用されるナスダック上場基準を満たしていることを通知した。そのため、コンプライアンス通信社は、ナスダック公聴会グループで予定されていた公聴会が廃止され、会社の証券はナスダックで上場·取引を継続すると規定されている。
2024年2月13日、会社発表
第九項:会計及び財務開示における会計担当者との変更及び相違
ない。
プロジェクト9 A.管理制御とプログラム
情報開示制御と手続きの評価。
開示制御及び手続は、1934年に改正された証券取引法(“取引法”)に基づいて提出又は提出された報告書において、開示を要求する情報が米国証券取引委員会規則及び表に指定された期間内に記録、処理、まとめ、報告されることを保証するための会社の制御プログラム及び他の手続である。開示制御及び手続は、取引所法案に基づいて提出された報告書に開示すべき情報が蓄積され、我々の経営陣に伝達されることを確実にするために、取引所法案に基づいて提出された報告書に開示すべき情報が蓄積され、我々の経営陣に伝達されることを保証するために、制御及び手続に限定されない。我々の経営陣は,どのような制御やプログラムも,どんなに設計や操作が良くても,その目標を実現するために合理的な保証を提供するしかないことを認識しており,管理層は,可能な制御やプログラムを評価する際に,その判断を運用しなければならないと認識している.
我々の経営陣は、CEOおよびCEOの参加の下で、本報告で述べた期間終了までの開示制御および手順(この用語が“取引所法”の下の規則13 a-15(E)および15 d-15(E)で定義されている)の有効性を評価した。この評価によれば,我々の経営陣は,我々のCEOやCEOを含め,本報告で述べた期間が終了するまで,企業の開示制御や手続きは合理的な保証レベルで有効であると結論した。
特定された実質的な弱点
2023年12月31日までの年度総合財務諸表作成期間中、複雑株式ツールの会計に関する内部統制に重大な欠陥があることが分かった。重大な欠陥は財務報告内部統制の欠陥または欠陥の組み合わせであり、私たちの年度または中期財務諸表の重大なミス報告は合理的な可能性があり、適時に防止または発見できないようにする。具体的には、株式証の適切な会計分類を評価することに関連して、関連する制御措置を開示する必要がある。
救済計画
経営陣は、私たちの監査委員会と取締役会の監督の下で、私たちの内部統制を更新し、技術会計専門家による株式取引の契約審査を行うことで、私たちの内部手続きを補完して、重大な弱点を救済します。
我々がとっている行動が財務報告における内部統制の大きな弱点を完全に補うことができるかどうかは、更新された制御が十分な時間が実行されるまで、管理層がテストにより、これらの制御が効率的に動作していると結論することができるかどうかは判断できない。財務報告の内部統制における私たちの大きな弱点を解決するために、より多くの措置が必要かもしれないと結論することもできます。これはさらなる行動が必要かもしれません。
経営陣財務報告内部統制年次報告書
会社の経営陣は財務報告書の十分な内部統制の確立と維持に責任がある。財務報告内部統制とは、公認された会計原則に基づいて財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供するために、著者らの主要幹部と主要財務官が設計或いはその監督の下で、会社の取締役会、管理層及びその他の人員によって実施されるプログラムであり、以下の政策とプログラムを含む
|
● |
会社の資産を合理的、詳細、正確かつ公平に反映した取引および処置の記録の保存に関連している |
|
● |
公認された会計原則に基づいて財務諸表を作成するために、必要に応じて取引を記録することを確保するための合理的な保証を提供し、会社の収入および支出は、会社の管理層および取締役の許可のみに基づいて行われる |
|
● |
財務諸表に重大な影響を及ぼす可能性のある無許可買収、使用または処分会社の資産を防止または適時に発見することについて合理的な保証を提供する。 |
固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。将来の間にどのような有効性評価を行うかの予測には,条件の変化により制御が不十分になる可能性や,政策やプログラムの遵守度が悪化する可能性があるというリスクがある.
経営陣は、2023年12月31日までの社内財務報告の内部統制の有効性を評価した。評価には、トレデビル委員会後援組織委員会が発表した“内部統制-総合枠組み(2013)”に規定されている基準を用いた
内部統制の変化。
吾らは、当社の財務報告の内部統制(外国為替法案第13 a-15(F)及び15 d-15(F)条を参照)に対して何の変更もなされておらず、このような内部統制は、当社が前の財政四半期に発生した内部統制の評価に関連しており、このような内部統制は、当社の財務報告の内部統制に重大な影響を与えているか、または可能性がある。私たちは今、この重大な弱点を救済するために行動していますが、これは2023年12月31日以降の財務報告に対する私たちの内部統制を変化させる可能性があります。
項目9 B:その他の情報。
2023年12月31日までの財務期では我々の役員または上級管理者(1934年証券取引法第16条の定義参照)は、規則10 b 5-1(C)の積極的な弁護条件またはS-K規則第408(A)項で定義された任意の“非規則10 b 5-1取引手配”を満たすための任意の証券売買契約、命令または書面計画を通過または終了する。
プロジェクト9 C.は検査を妨害する外国司法管轄区域を開示する。
適用されません。
第三部
プロジェクト10.取締役、上級管理者、および企業管理
行政員および役員
以下の表に、私たちの役員、役員、役員指名人選の名前、年齢、ポスト(2024年3月1日現在の年齢)を示します
|
名前.名前 |
年ごろ |
登録者の役職と役職 |
1年目 変化しました |
||||||
|
N·スコット·ファイン |
67 |
最高経営者役員 |
2014 |
||||||
|
ジェフリー·L·テット博士 |
65 |
首席運営官取締役 |
2010 |
||||||
|
C.E.リック·ストラタン(2) |
77 |
役員.取締役 |
1990 |
||||||
|
マーカス·W·シガー(1)(2)(3) |
57 |
取締役と取締役会長 |
2014 |
||||||
|
F·パトリック·オストロン(1) |
67 |
取締役と取締役会副議長 |
2014 |
||||||
|
ウィリアム·シャナハン |
83 |
役員.取締役 |
2016 |
||||||
|
ランデル·M·トーガー博士(1)(3) |
72 |
役員.取締役 |
2018 |
||||||
|
ウィリアム·コンクリン(2) |
52 |
役員.取締役 |
2023 |
||||||
|
フェレイ·ワン |
66 |
役員.取締役 |
2023 |
||||||
|
ショーン·クロス(3) |
55 |
役員.取締役 |
2023 |
||||||
|
ジョシュア·M·ファーン |
41 |
首席財務官兼秘書 |
適用されない |
||||||
|
マイケル·リスカーク |
49 |
最高監督官兼業務発展上級副総裁 |
適用されない |
||||||
|
(1) |
監査委員会のメンバー。 |
|
(2) |
会社の管理と委員会のメンバーを指名する。 |
|
(3) |
報酬委員会のメンバー。 |
役員および上級職員の伝記
N·スコット·ファインは2014年2月から取締役を務め、2015年9月14日に私たちのCEOとなった。2004年から2014年まで、ニューヨーク市にある投資銀行Scarsdale Equitiesの担当者だった。
Fineさんは、35年以上にわたって投資銀行事業に従事しており、様々な債務や株式融資、売り手のM&A、戦略的コンサルティング、企業再編に従事しています。彼のほとんどの時間は医療と消費財分野の取引に集中している。彼は医療機器、後発薬と遺伝学を含む医療保健分野の全世界取引を指導したことがある。また、Fineさんとその家族がジャカルタに住むときは、インドネシアのジャカルタのTempoグループに勤めていたこともある。
Fineさんは、グローバルウィルスネットワーク(GVN)の取締役会長であり、グリーンマウンテンコーヒーベーカリー会社や中欧流通会社(CEDC)の首席投資銀行家でもあり、CEDCは数十億ドル相当の酒類会社です。1996年から2014年にかけて、Fineさん取締役は引き続き中国酒業開発会社の業務に関与し、その間、2013年には中国酒業開発会社取締役会を率いて、予め梱包された第11章プロセス再編成会社を通じて中国酒業開発会社をロシア標準アルコール集団に買収することに成功した。最近、Fineさんは、2017-2018年の間に太平洋掘削会社の再編委員会の副議長兼議長を務め、独立した役員を率いての再編に成功しました。2013年から2015年にかけて、Better Place Inc.の唯一の取締役も務めた。このポストに就く間、Fineさんは会社のグローバルディスクをタイムリーかつ効率的に管理することに成功し、これはデラウェア州とイスラエルの裁判所の承認を得ました。
Fineさんは現在、KENホールディングス(ニューヨーク証券取引所コード:KEN)の取締役会に勤めています。Fineさんはまた、イギリスIWM米国航空博物館の取締役会で彼を介してサービスを行うことを含むいくつかの非営利団体に取り組んでいます。ファインさんは、オハイオ州立大学モリッツ法学部とフォーテハム大学法学部の客員講師です。
フィンさんはニューヨークと世界中の金融界との関係において、株式や債務融資の面で重要な経験を有しており、取締役として貴重な貢献者とされている。ineさんは2014年2月に会社の私募普通株に関する事項で取締役会のメンバーに任命された。Fineさんは私たちの最高財務官Joshua M.fineの父親である。
ジェフリー·L·テット博士は2010年8月から会社役員首席運営官を務め、2015年9月14日から会社首席運営官を務めた。FineさんがCEOに任命される前に、Tate博士がCEO(2010年8月から)とCEO(2014年7月から)を務めていた。2007年1月から2010年2月までの間に、J−Jireh Products,Inc.の社長であり、パルス乾燥技術を用いて製造された工業、食品、化粧品、栄養製品の開発·マーケティングを行う会社である。1995年1月から2006年12月まで、J.Benson Tate Consulters LLCの担当者を務めるTate博士は管理コンサルティング会社である。1999年7月から2005年1月まで、テット博士は製薬会社の天然生物製品科学と監督事務総裁の副主任を務め、その後理学学士号を取得した。ミネソタ大学植物学部から来ました彼は理科の修士号を取得しましたミネソタ大学大学院の技術管理と植物生理学博士号
テット博士が私たちの取締役会メンバーに選ばれたのは、Cyclo治療会社での職と、生物製薬開発、製造、規制コンプライアンスでの経験からである。
C.E.リック·ストラタンは1990年以来会社の取締役を務めている。ストラタンさんは1990年から代表取締役兼CEOを経て、2014年に退職し、1990年8月から1995年5月まで財務担当を務めていた。1987年11月から1989年7月まで、ストラタンさんはPharmatec,Inc.に勤め、シクロデキストリンのマーケティング·ビジネス開発部の役員を務めていた。ストラタンさんは、シクロデキストリンの販売と関連するビジネス開発の仕事を担当しています。1985年11月から1987年5月までの間に、ストラタンさんはBoots-Celltech Diagnostics,Inc.の首席技術者を務め、米国病院供給会社の配下の米国生物科学研究所の製品販売マネージャーも務めた。ストラタムさんは、フロリダの大学を卒業し、化学および数学の学士号を取得し、同じ大学で薬理学の修士号およびマーケティング/コンピュータ情報科学MBAの学位を取得しています。ストラタンさんはシクロデキストリンに関する多くの文章と本の章を執筆し、発表した。
ストラタンさんが取締役会のメンバーに選ばれたのは、シクロデキストリンに関して豊富な経験、長年の行政管理経験、および薬理学上の高度な学位を有するためである
マーカス·W·シガーは2014年2月から取締役を務め、取締役会長を務めている。シガーさんは、スタンフォード大学ビジネススクールのOBで、チューリッヒの工商管理応用科学大学の経済学の学位を持っています。彼は経験豊富な企業家と高級管理者で、アメリカ、スイス、ポーランドと他の中東欧諸国の医療保健、情報技術、デジタルメディアと急速消費財などの新興業界で多業界経験を持っている。チューリッヒ保険グループ(スイス)、TVN(ポーランド)などで管理職を務めていた。彼は以前は、現在もアメリカとヨーロッパの様々な公共·民間会社の取締役会のメンバーだった。Siegerさんは2016年6月以来、PolPharmaグループ(オランダ)のCEOを務めており、中東欧/独体地域をリードするヘルスケア企業の一つです。シガーさんは、ジェネリック医薬品産業を代表して欧州医薬品実行委員会の副社長でEUに向かいました。この機能では、シガーさんは、医療のデジタル化と予防的な側面に焦点を当てています。
Siegerさんの医療その他の産業の戦略、運営、投資に関する豊富な経験は、当社の取締役会の貴重なメンバーとなりました。Siegerさんは2014年2月、会社の私募普通株式について取締役会のメンバーに任命されました。
F.パトリック·Ostronicは2014年4月から取締役の弁護士を務めている。Ostronicさんは2006年11月から米国の製薬会社の上級管理職を務めており、米国の製薬会社の子会社である。OstronicさんはNovit US,Inc.のパートナーでもあり、Novit LPの一般パートナーでもある。Ostrat Ostronicさんは聖十字経済学、会計学士、旧道明大学で会計修士号、メリーランド大学法学博士号を取得し、公認会計士資格を取得している。
Ostronicさんは、金融·製薬業界において豊富な経験を有しており、これは取締役会の貴重なメンバーになります。Ostronicさんは、2014年4月に会社の私募普通株式について取締役会のメンバーを委任しました
ウィリアム·S·シャナハンは2016年6月以来取締役の一員だった。シャナハンさんは現在引退しており、1992年から2005年9月30日まで高露潔褐色公司の社長を務めている。最近,彼はサンフランシスコValueAct Capital LLCの管理コンサルタントである。シャナハンさんはダートマス大学で学士号を持っている。
シャナハンさんの豊富な経験は、会社がそのグローバル成長計画の実行を求める時に非常に勉強になり、彼を取締役会の価値のあるメンバーにすることになります。
ランデル·M·トーガー博士は2018年3月以来取締役の一員だった。最近個人勤務を退職するまで,Toig博士はゴールドコースト婦人科でCEOを務め,産科,婦人科,婦人科外科で35年以上勤務していた。Toig医師は現在西北大学、西北記念病院と西北医学院実習女性病院の臨床産科と婦人科助教授である。彼は以前、西北記念病院で実習、教育、現役従業員に奉仕していた。トイグ博士はミシガン大学の学士号を持ち、ピッツバーグ大学で医学博士号を取得した。
トイグ博士の医療経験は彼を取締役会の価値のあるメンバーにした。
ウィリアム·コンクリンは2023年5月以来取締役の一員だった。コンクリンさんは、2022年2月以来、ラファエル·ホールディングスのCEOを務め、2021年3月8日から2022年1月31日まで同社のCEOを務めています。これまで、2018年5月から2021年3月までの間に、免疫医学会社のビジネス副社長およびギリダサイエンス社の副社長を歴任しています。コンクリンさんは製薬およびバイオテクノロジー業界で20年以上の経験を有しています。彼の経験はマーケティング、販売、市場参入、商業運営、業務開発を含む商業化のすべての分野を越えている。コンクリンは免疫医療会社Trodelvyの発売を手伝った(同社は2020年10月にジリッドに買収された)。Conklingさんはまた、10年以上にわたってノルウェイ腫瘍学で働いており、そこでは彼が米国で初めて承認されたCAR-T療法の導入を支援し、世界的なビジネスリーダーであるKymahになりました。コンクリンさんは、現在3日目の実験室および礎石製薬会社の取締役会に勤めています。コンクリンさんは1998年にフォーテハム大学で学士号を取得し、ニューヨーク大学のストーンビジネススクールでビジネスマネジメントの修士号を取得しました。
コンクリンさんは製薬とバイオテクノロジーの分野で豊富な経験を持っており、これにより彼は取締役会の中で価値のあるメンバーになりました。当社の取締役会メンバーには、ラファエルが2023年5月に当社の証券に投資することにより、コンクリンさんは、2023年6月1日にラファエルと締結した証券購入契約に基づき、取締役に指名されました。
フェレイ·Wong博士は,2023年8月以来取締役医師を務めている。彼女は薬物や診断の研究と開発で20年以上の製薬幹部経験を持っている。Wong博士は2022年以来、複数の製薬会社とリスク投資会社の独立顧問と製品開発顧問を務めており、(I)ヴェルコネル医学バークレー神経学研究所の取締役会に勤務し、(Ii)NeuroCures NY,Inc.,生物科学任務グループ、ウェストチェスター県経済発展会社の科学顧問委員会に勤務している。2007年から2021年まで、Wong博士はProgenics PharmPharmticals,Inc.で多数のポストを担当し、研究開発実行副総裁を務め、腫瘍重点開発プロジェクトの臨床と法規研究開発戦略を担当し、そして各種の機能を監督し、プロジェクト管理、臨床開発、製造、品質管理と法規遵守性を含む。Wong博士はメリーランド大学医学部の解剖学と神経生物学博士号,南イリノイ大学カベンデール校の生理学修士号,ミシシッピ女子大学の生物学学士号を有している
Wong博士は製薬や生物科学技術業界で幹部を務めた豊富な経験が彼女を貴重な取締役会のメンバーにした。2023年6月1日の証券購入協定により、Wong博士はラファエルの指定取締役に任命された。
ショーン·クロスは2023年12月27日以来取締役役を務めている。クロスさんは、AMTIのCEO兼CEOを2023年3月から2023年12月27日まで、AMTIのCEO兼CEOを2022年5月から2023年3月まで、AMTIのCEO兼CEOを2020年3月から2022年5月にそれぞれ担当する。JMP Securities LLCに加入する前に、クロスさんは臨床段階で免疫腫瘍学会社GT BioPharma,Inc.で働き、2017年11月から2018年2月までの間に社長兼CEO、2018年2月から2018年7月まで取締役会長兼CEOを務めました。2021年12月以来、BioPlus買収会社の取締役会メンバーを務めてきた。クロスさんは、カリフォルニア大学ロサンゼルス校でスポーツ学士号、コロンビア大学ビジネススクール、ビジネスマネジメント修士号を取得しています。
クロスさんはバイオテクノロジー業界の幹部や医療分野の投資銀行家としての経験から取締役会の貴重なメンバーとなった。江楽士さんは、合併契約に基づき、当社の取締役会メンバーに任命されました。
Joshua M.Fineは2019年6月11日に私たちの最高財務官に任命され、2014年から私たちの秘書を務めてきました。2011年から私たちの首席財務官に任命され、スカスデール証券医療資本市場部総裁/取締役副総裁を務めた。バイオテックは、2017年から2020年11月までの間に資産売却に成功した後、FineさんがICAGEN社の財務·運営部門の上級副社長を務めています。FineさんはIcagenの在任中、CEOと密接に協力し、ロー氏、サイノフィ、嚢胞性線維症財団との交渉に成功し、ライセンス契約を実行し、2020年4月にIcagenの資産をLigandに戦略的に売却する管理チームのメンバーを完成させた。Fineさんは、ハトウィック大学で政治学の学士号を取得しています。Fineさんは私たちのCEO N.Scott Fineの息子です
2019年7月、Michael Lijakは私たちに参加し、世界的な規制事務担当を務め、上級副総裁が業務発展を担当し、2020年9月に首席監督官に任命された。彼は生物製薬とコンサルティング業界で20年以上の規制戦略と運営経験を持ち、心血管、代謝、神経科学と痛みと炎症を含む複数の治療分野に関連している。李嘉誠さんは入社前、2015年7月~2016年6月にセノフィ·グローバル·サーベイランス担当取締役を務め、内分泌学·神経筋のまれな疾患分野を指導し、その後、セノフィ成熟製品および全世界的健康規制当局を2019年7月まで担当していた。セノフィに加入する前に、リジャーク·さん氏はアクセンチュア生命科学部グローバル監督·サービス担当、アクセンチュア·グローバル監督製品、能力、上場戦略の成長戦略·監督を担当していた。アクセンチュアに入社する前に、ファイザーや恵氏で複数のリーダーを務め、開発、保守、戦略を担当していた。監督管理指導と届出を提供する面で全世界の監督管理戦略と資源を指導し、全世界/地区衛生当局との最適な監督管理相互作用を確保する。
家族関係
上述した以外に、当社のどの取締役や行政者の間にも家族関係はありません。
会社の管理
役員は自主独立している
我々の取締役会は現在10人の取締役から構成されており、そのうちの7人の取締役は当社の従業員や幹部ではないため、ナスダック資本市場規則で定義されている“独立”取締役であり、過去3年間、12ヶ月連続で12万ドルを超える報酬を支払ったことがない。私たちの最高経営責任者N·スコット·ファインと最高経営責任者のジェフリー·L·テット博士は独立取締役ではありません。彼らは私たちに幹部として採用されています。リック·ストラタンは会社の創業者兼元CEOで、会社とコンサルティング契約を結んでいるため、独立役員ではありません。
取締役会各委員会
私たちは監査委員会、報酬委員会、そして指名委員会を持っている。我々の監査委員会は2024年3月1日現在、パトリック·Ostronic(会長)、Markus Sieger氏、Randall M.Toig博士である3人の独立した役員で構成されており、Ostronicさんは米国証券取引委員会ルールS-Kを指す“監査委員会財務の専門家”とみなされています。2024年3月1日現在、私たちの報酬委員会は3人の独立役員で構成されており、マーカス·シガー(議長)、ショーン·クロス、ランデル·M·トグ博士である。2024年3月1日現在、私たちの指名委員会はC.E.リック·ストラタン(会長)、ウィリアム·コンクリン、マーカス·シガーの3人の独立役員で構成されている。
道徳的規則
我々は、我々のCEO、最高財務官、最高会計官または財務総監、または同様の機能を実行する者、およびコンサルタントを含む、我々の取締役、上級管理者、および従業員に適用されるビジネス行動および道徳的基準を採択した。道徳と行動基準のコピーはwww.Cycle Treateutics.comのウェブサイトで取得されます。
延滞金第16条報告
私たちは、私たちの最近の財政年度内に私たちの上級管理者、取締役、または実益所有者であるすべての人が、1934年の証券取引法第16条(A)の要求に従って報告書をタイムリーに提出できなかった人を識別しなければならない。2023年12月31日までの年度に米国証券取引委員会に提出された表3及び4及びその改正案の審査のみに基づいて、2023年12月31日までの年度内に、2023年12月31日までの年度内に取締役が10%を超える普通株式の取締役、上級管理者又は実益所有者であれば、2023年12月31日までの年度内に取引法第16(A)節に要求された報告を速やかに提出することができなかった。
第11項:管理職の報酬。
次の表には、2023年12月31日現在と2022年12月31日までの財政年度内に(I)2023年に私たちのCEOを務める人と、(Ii)2023年12月31日現在で最高報酬の役員2人に支払われる情報が含まれています。
報酬総額表
|
氏名と主要ポスト |
年.年 |
賃金.賃金 |
ボーナス.ボーナス |
在庫品 |
選択権 |
他のすべての補償 |
合計する |
|||||||||||||||||||
|
N·スコット·ファイン |
2023 |
540,750 | - | -0- | 102,969 | 29,169 | 672,887 | |||||||||||||||||||
|
最高経営責任者 |
2022 |
540,750 | 262,500 | -0- | 184,716 | 77,435 | 1,065,401 | |||||||||||||||||||
|
マイケル·リスカーク |
2023 |
342,990 | 36,013 | -0- | 42,808 | 51,399 | 473,211 | |||||||||||||||||||
|
首席監督官 |
2022 |
342,990 | 128,205 | -0- | 76,792 | 36,489 | 584,476 | |||||||||||||||||||
|
ジョシュア·M·ファーン |
2023 |
335,780 | 40,293 | -0- | 42,808 | 45,101 | 463,982 | |||||||||||||||||||
|
首席財務官 |
2022 |
335,780 | 143,440 | -0- | 76,792 | 31,749 | 587,761 | |||||||||||||||||||
|
(1) |
(I)近地天体が2022年に稼いだが2023年に財政年度に支払われたボーナス支払いと,(Ii)近地天体が2023年に稼いで2023年に支払うボーナス支払いを反映する |
|
(2) |
(I)が2023年にオプションを付与し,Scott Fineに98,706株,Scott FineさんおよびJoshua Fineに41.036株を1.28ドル,および(Ii)が2022年にオプションを付与し,Scott Fineに74,907株,Scott FineおよびJoshua Fineにそれぞれ31,141株を付与したことを反映して,執行価格は3.26ドルであった。これらの報酬が付与され、行使され、販売されるまで(状況に応じて)任命された幹部は、これらの報酬の推定値を現金形式で実現することはない。 |
|
(3) |
会社401(K)計画下の相応の支払い、および健康、歯科、視力の保険料を反映する。 |
財政年度終了時の優秀株奨励
私たちが任命された役員は、2023年12月31日現在、以下に述べる未行使オプションを持っています。2023年12月31日現在、私たちが任命された役員には、未行使の株式奨励はありません。
| 名前.名前 |
量 証券 潜在的な 体を鍛えていない オプション (#)行使可能 |
量 証券 潜在的な 体を鍛えていない オプション (#)行使できない |
選択権 トレーニングをする 値段 |
オプション 期限切れ日 ($) (2) | |||||||||
|
N·スコット·ファイン |
(1) | 37,454 | 37,454 | 3.26 |
2032年2月28日 |
||||||||
| (2) | 18,507 | 80,199 | 1.28 |
2033年3月1日 |
|||||||||
|
マイケル·リスカーク |
(1) | 15,571 | 15,571 | 3.26 |
2032年2月28日 |
||||||||
| (2) | 694 | 33,342 | 1.28 |
2033年3月1日 |
|||||||||
|
ジョシュア·M·ファーン |
(1) | 15,571 | 15,571 | 3.26 |
2032年2月28日 |
||||||||
| (2) | 694 | 33,324 | 1.28 |
2033年3月1日 |
|||||||||
|
(1) |
これらのオプションは2022年2月28日の付与日から4年間月額分割払いになります。 |
|
(2) |
これらのオプションは2022年2月28日の付与日から4年間月額分割払いになります。 |
雇用協定
2022年2月28日、私たちはスコット·ファイン、マイケル·リスカーク、ジョシュア·ファインとそれぞれ雇用協定を締結しました。私たちが任命したCEOと締結した雇用協定には、以下の実質的な条項が含まれています
|
● |
Scott Fineの初期基本給540,750ドル、Lisjakさんの初期基本給342,990ドル、Joshua Fineの初期基本給335,780ドル。 |
|
● |
会社が承認した任意の追加昇給を除いて、各幹部は3%の基本給年度昇給を得る資格がある。 |
|
● |
各雇用契約は2年間であり、いずれか一方が期限終了前に更新しない通知を出さない限り、自動的に1年連続の期限を更新することができる。 |
|
● |
Scott Fineはその基本給の50%に相当する年間現金ボーナスを得る権利があり、リズジャークさんはその基本給の35%を年間現金ボーナスとする権利を有し、Joshua Fineはその基本給の40%に相当する年間現金ボーナスを得る権利を有する。 |
|
● |
Scott Fineは,日社流通株の0.89%を目標とした年間株価オプションを付与する権利を有しており,リスキャさんとJoshua Fineは,それぞれ,日社流通株0.37%付与を目標とした年間株式オプションを付与する権利を有している。すべてのオプションは,付与日から10年以内に行使可能であり,普通株式の終値に等しい価格を行使し,付与日以降4年間に月等分割で48回発行する.
もし私たちが非雇用協定で定義された理由で役員の雇用を終了した場合、幹部は終了日後の1年以内に基本給を支払い続ける権利があり、終了日後の1年以内にすべてのCOBRA費用を返済する権利があり、役員は終了日までに支払われたが支払われていないボーナスの支払いを稼ぎ、“支配権変更”が発生した後12ヶ月以内に終了した場合、終了された役員のすべての付与されていない株式オプションは直ちにすべて帰属しなければならない。 |
|
● |
Scott Fineの雇用を終了する際には、統制権変更の理由でなければ、終了後12ヶ月以内に付与されるすべての付与されていない株式オプションが直ちに付与されるだろう。 |
|
● |
どの幹部も秘密、競業禁止、競業禁止、雇用仕事の規定を守らなければならない。 |
役員の報酬
次の表は、2023年12月31日までの私たちのすべての非従業員役員の給与のいくつかの情報を示しています。
|
名前.名前 |
稼いだ費用 あるいはすでに入金されている 現金 |
株式大賞 (1) |
合計する |
|||||||||
|
C.E.リック·ストラタン |
-0- | 33,000 | 33,000 | |||||||||
|
マーカス·シガー |
-0- | 66,375 | 66,375 | |||||||||
|
F·パトリック·オストロン |
-0- | 41,250 | 41,250 | |||||||||
|
ウィリアム·シャナハン |
-0- | 40,125 | 40,125 | |||||||||
|
ランデル·M·トルガー博士 |
-0- | 35,625 | 35,625 | |||||||||
|
ウィリアム·コンクリン(2) |
-0- | 13,333 | 13,333 | |||||||||
|
フェレイ·Wong(2) |
-0- | 3,333 | 3,333 | |||||||||
|
ショーン·クロス(2) |
||||||||||||
|
(1) |
株式奨励数字は、授与日にFASB ASCテーマ718に基づいて計算された株式奨励価値を表す。これらの株式報酬の推定値で我々が行った仮定については、2023年12月31日までの年度監査財務諸表の付記15を参照されたい。 |
|
(2) |
コンクリンさん、Wong博士、クロスさんはそれぞれ2023年7月、2023年8月、2023年12月に取締役会に参加します。 |
2020年6月、取締役会は非従業員取締役に対する報酬計画を承認した。この計画によると、各取締役は(I)6,700株の普通株を購入する初期選択権、(Ii)3,350株の普通株を購入する年間選択権、および(Iii)すべての取締役の以下の年間現金報酬を獲得する権利があり、各取締役の選択に応じて、現金の代わりに株で支払うことができる
|
メンバー |
椅子 |
|||||||
|
取締役会 |
$ | 40,000 | $ | 70,000 | ||||
|
監査委員会 |
$ | 7,500 | $ | 15,000 | ||||
|
報酬委員会 |
$ | 5,500 | $ | 11,000 | ||||
|
指名と統治委員会 |
$ | 4,000 | $ | 8,000 | ||||
第12項:特定の実益所有者と管理職の保証所有権及び関連株主事項。
次の表は、2024年3月1日までのCyclo普通株式の実益所有権に関するいくつかの情報を示しており、この情報は、日付までに発行された28,608,054株普通株式、締め切り:
|
● |
実益はCyclo普通株式の5%以上を有する各人または関連者のグループであることが知られている |
|
● |
Cycloのすべての幹部が任命された |
|
● |
Cycloのすべての役員と役員の指名者 |
|
● |
グループとして、Cycloのすべての幹部と役員。 |
取締役一人一人の実益所有者、管理者または実益所有者は、自転車会社の普通株式の5%以上に関する情報を提供している。Cycloは米国証券取引委員会規則に基づいて実益権属を決定した。これらの規則は、一般に、有価証券の実益所有権を、これらの有価証券に対して単独または共通の投票権または投資権を有する者に帰属する。また、これらの規則には、株式承認証の行使に応じて発行可能なCyclo普通株も含まれている。その人の所有権百分率を計算する場合、当該株式等の株式は発行されたものとみなされ、当該等株式証を所有する者が実益を有するとみなされるが、他のいかなる者の所有権百分率を計算するかについては、当該株式は発行済み株式とはみなされない。別の説明がない限り、本表に記載されている個人またはエンティティは、その実益が所有するすべての株式に対して独占投票権および投資権を有するが、適用されるコミュニティ財産法を遵守しなければならない。
|
個人又は団体の氏名又は名称及び住所(1) |
金額と 性質: 有益な 所有権 |
パーセント クラス |
|||||||
|
任命された行政員と役員 |
|||||||||
|
N·スコット·ファイン |
1,203,087 | (2 | )(3) | 4.14 | % | ||||
|
C.E.リック·ストラタン |
541,682 | (2 | )(3) | 1.89 | % | ||||
|
ジェフリー·L·テット |
172,619 | (2 | )(3) | * | |||||
|
マーカス·シガー |
435,167 | (2 | )(3) | 1.51 | % | ||||
|
F·パトリック·オストロン |
422,537 | (2 | )(3) | 1.47 | % | ||||
|
ウィリアム·S·シャナハン |
170,582 | (2 | )(3) | * | |||||
|
ランデル·M·トルガー博士 |
127,224 | (2 | )(3) | * | |||||
|
ウィリアム·コンクリン |
15,819,352 | (2 | )(3)(4) | 44.71 | % | ||||
|
フェレイ·ワン |
15,518 | (2 | )(3) | * | |||||
| 161,507 | (2 | )(3) | * | ||||||
|
ジョシュア·M·ファーン |
66,270 | (2 | )(3) | * | |||||
|
マイケル·リスカーク |
60,042 | (2 | )(3) | * | |||||
|
全役員及び行政員(12名) |
19,195,587 | (2 | )(3)(4) | 64.63 | % | ||||
|
5%保有者 |
|||||||||
|
ラファエルホールディングス ブロード通り520号 ニュージャージー州ニューアーク07102 |
15,796,407 | (4 | ) | 38.70 | % | ||||
|
停戦資本有限責任会社 マディソン通り510号、7階 ニューヨーク市郵便番号10022 |
1,501,625 | (5 | ) | 4.99 | % | ||||
|
* |
1%未満です |
|
|
|
|
(1) |
|
|
|
|
|
(2) |
以下に掲げる者については、以下のCyclo普通株式を含み、これらの人が現在行使可能であるか、または2024年3月1日から60日以内に行使可能なオプションの制限を受ける |
|
名前.名前 |
普通株式目付株式 |
|||
|
N·スコット·ファイン |
114,633 | |||
|
C.E.リック·ストラタン |
9,255 | |||
|
ジェフリー·L·テット |
47,642 | |||
|
マーカス·シガー |
9,255 | |||
|
F·パトリック·オストロン |
9,255 | |||
|
ウィリアム·S·シャナハン |
9,255 | |||
|
ランデル·M·トルガー博士 |
9,255 | |||
|
ウィリアム·コンクリン |
6,700 | |||
|
フェレイ·ワン |
6,700 | |||
|
ショーン·クロス |
88,901 | |||
|
ジョシュア·M·ファーン |
47,642 | |||
|
マイケル·リスカーク |
47,642 | |||
|
全役員及び行政員(12名) |
406,135 | |||
|
(3) |
以下に掲げる者が保有する次のCyclo普通株を含むが、これらの人が保有している引受権証は現在行使可能である |
|
名前.名前 |
普通株関連引受権証株式 |
|||
|
N·スコット·ファイン |
344,650 | |||
|
C.E.リック·ストラタン |
59,881 | |||
|
ジェフリー·L·テット |
32,935 | |||
|
マーカス·シガー |
115,233 | |||
|
F·パトリック·オストロン |
75,254 | |||
|
ウィリアム·S·シャナハン |
43,396 | |||
|
ランデル·M·トルガー博士 |
13,078 | |||
|
ウィリアム·コンクリン |
0 | |||
|
フェレイ·ワン |
0 | |||
|
ショーン·クロス |
0 | |||
|
ジョシュア·M·ファーン |
1,728 | |||
|
マイケル·リスカーク |
0 | |||
|
全役員及び行政員(12名) |
686,155 | |||
|
(4) |
ラファエロは2023年10月24日に米国証券取引委員会に提出された付表13 D第2号改正案で報告されている。RafaelのCEOとして、ConklingさんはRafaelが所有するCyclo普通株式に対して投票権と処分権を持つと考えられている可能性があり、Cyclo普通株式を所有しているとみなされる可能性がある。コンクリンはラファエロが持っている証券の実益所有権を否定した。Cyclo普通株6,766,467株の購入を含む現在行使可能な引受権証 |
|
|
|
|
(5) |
停戦資本マスター基金株式会社(“停戦”)が2024年2月14日に米国証券取引委員会に提出した付表13 G第2号改正案で述べられているように。停戦会社が保有しているこれらの株式は4.99%の阻止条項によって制限されている。 |
情報持分補償計画
次の表は、2023年12月31日現在、当社の株式補償計画に基づいて、従業員、コンサルタント、取締役に付与された未償還オプションと権利の数、および将来発行可能な普通株式数をまとめています
|
計画種別 |
番号をつける 証券の受取人 発表される 運動中に 卓越した オプション、株式承認証及び 請求項(A)(#) |
重みをつける 平均値 未償還発行権価格 選択肢は、 株式引受証及び 権利(B)($) |
証券数量 適用することができます 権益の下で発行する 報酬計画 (証券は除く) 列に反映される (a)) (c) (#) |
|||||||||
|
証券保有者の承認を得ていない持分補償計画(1) |
17,682 | $ | 26.86 | 0 | ||||||||
|
証券保有者が承認した持分補償計画(2) |
790,945 | 3.16 | 1,811,063 | |||||||||
|
合計: |
808,627 | 1,811,063 | ||||||||||
|
(1) |
(I)7年期株式承認証を含み、25.00ドルの使用価格で4,800単位を購入し、各単位は普通株と追加普通株の権証を含み、行使価格は1株25.00ドルであり、Scarsdale Equitiesおよびその関連会社に発行され、2016年6月の私募に関するサービスを提供し、(Ii)7年権証、行権価格35.00ドルで1,641単位を購入し、単位当たり普通株と追加普通株の権利証を含み、行権価格は1株35.00ドルである。私たちの2017年2月の私募に関するサービスを提供するためにScarsdale Equitiesおよびその連合会社に発行し、および(Iii)Scarsdale Equitiesおよびその連合会社に発行して、私たちの2017年10月の私募に関するサービスを提供し、(Iii)Scarsdale Equitiesおよびその連合会社に7年権証を発行し、100ドルの使用価格で600単位を購入し、単位当たり4株普通株と1株追加4株普通株の承認株式証を含み、行使価格は1株25.00ドルである。 |
|
(2) |
当社の“2021年株式インセンティブ計画”(以下、“インセンティブ計画”と略す)は、普通株、株式オプション又はその他の奨励を付与することにより、当社とその子会社の従業員、高級管理者又は取締役及びコンサルタントに最大3,000,000株の普通株を発行することが規定されている。2023年12月31日現在、396,837株の普通株を付与し、720,945株の普通株を購入するオプションを付与しており、インセンティブ計画下の奨励として、1,811,063株の普通株が将来奨励可能である。 |
第13項:特定の関係と関連取引、および取締役の独立性を確立する。
私たちは、2016年10月以降、ストラタンさんが私たちに提供しているコンサルティングサービスを考慮して、C.E.リック·ストラタンがこの組織の執行役員である非営利団体に毎月5,000ドルの費用を支払います。ストラタンさんは私たちの創始者、元CEO、役員の一人です。
2019年6月、私たちは最高経営責任者の息子Joshua M.FineをCEOに雇いました。Fineさんは、“役員報酬”という見出しで当社の最高財務責任者の報酬を過去2年度にわたって担当してきました
ケビン·J·ストラタンC.E.リック·ストラタンの息子は2008年から私たちに雇われています2014年以来私たちの副社長、財務-報酬です2023年と2022年、彼の年収はそれぞれ184,625ドル、184,625ドルだった。また、彼は2023年と2022年にそれぞれ16,823ドルと57,750ドルの現金ボーナスを獲得した。ストラタンは2023年と2022年にそれぞれ23140ドルと16833ドルの株式オプションを獲得し、オプション期間は4年となった。
コーリー·E·ストラタンの息子の嫁コーリー·E·ストラタンは2011年以来私たちに雇われており、文書専門家や後方勤務コーディネーターを務めており、2023年の年収は92,700ドル。また、彼女は2023年に4172ドルの現金ボーナスを獲得した。2022年、ストラタンの年収は92,700ドル、現金ボーナスは14,850ドル。
関連者取引政策と手続き
“関連者取引”の識別、審査、検討、承認または承認に関する会社の政策や手順が規定されている書面関連者取引政策があります。私たちの政策だけで言えば、“関連者取引”とは、当社と任意の“関連者”が関与する25,000ドルを超える金額の取引、手配または関係(または任意の一連の類似した取引、手配または関係)を意味する。関係者が従業員、役員、コンサルタント、または同様の身分で当社に提供するサービスに係る補償に関する取引は、本保険書の範囲内ではありません。関係者とは,任意の役員,役員または当社の5%以上の株主であり,彼らの任意の直系親族,およびそのような者が所有または制御する任意の実体を含む。
この方針によれば、ある取引が関連者取引として決定された場合、管理層は、審議及び承認又は承認のために、提案された関連者取引に関する情報(又は監査委員会の承認が不適切な場合には、取締役会の別の独立機関に提出されなければならない)を監査委員会に提出しなければならない。陳述には、(その他の事項を除く)重大な事実、関連者の直接的および間接的利益、取引が会社にもたらすメリット、および任意の代替取引が存在するか否かが含まれなければならない。関連者取引を事前に識別するために、同社はその役員や取締役が提供する情報に依存している。関連者取引を審議する際に、委員会は、(A)当社が直面しているリスク、コストおよび収益を含むが、これらに限定されない既存の関連事実および状況を考慮し、(B)関連者が取締役、取締役の直系親族または取締役の関連実体の直系親族である場合の取締役独立性への影響、(C)取引の条項、(D)同様のサービスまたは製品の他のソースを得ることができ、および(E)無関係な第三者または一般従業員に提供または提供することができる条項を含む。取締役が提案された取引と利害関係があれば、取締役は審議と承認を回避しなければならない。この政策要求は,委員会が関連者の取引を承認,承認または拒否することを決定する際には,既知の状況に応じて,委員会がその適宜決定権を誠実に行使して決定されたように,当該取引が会社及びその株主の最適な利益に適合しているか否かを考慮しなければならない。
役員は自主独立している
私たちの取締役会は現在10人の取締役で構成されており、そのうちの7人はナスダック資本市場規則で定義された独立取締役であり、当社の従業員や役員ではなく、過去3年間の任意の12ヶ月間、当社は12万ドルを超える報酬を支払ったことがないからである。私たちの最高経営責任者N·スコット·ファーンと最高経営責任者のジェフリー·L·テット博士は独立取締役ではありません。彼らは私たちに幹部として採用されています。リック·ストラタンは創始者で、元CEOで、会社とのコンサルティング合意のため、ストラタンは独立役員ではありません。
プロジェクト14.チーフ会計士費用とサービス。
必要な情報本プロジェクトは、2024年年度株主総会に関する委託書に含まれ、参考にして本明細書に組み込まれる
第4部
項目15.すべての展示品、財務諸表の添付表
|
陳列品 |
||
|
2.1 |
フロリダ州のCyclo治療会社とネバダ州のCyclo治療会社の間で2020年11月4日に署名された合併協定と合併計画(合併内容は、同社が2020年11月10日に証券取引委員会に提出した8−K表の現在の報告書の添付ファイル2.1参照)。 |
|
| 2.2 | Cyclo治療会社、Cameo合併子会社会社と応用分子輸送会社の間で2023年9月21日に署名された合併協定および計画(合併内容は、2023年9月21日に証券取引委員会に提出された8-K表の現在の報告書の添付ファイル2.1参照)。 | |
|
3.1 |
改訂されたネバダ州会社Cyclo Treateutics,Inc.の会社規約* |
|
|
3.2 |
ネバダ州社Cyclo Treateutics,Inc.の定款(同社が2020年11月10日に証券取引委員会に提出した8−K表現在報告書の添付ファイル3.2を引用して合併した)。 |
|
|
4.1 |
終戦資本総基金株式会社に発行されたA-1シリーズ株式承認証表(会社が2023年1月3日に証券取引委員会に提出した現在の8-K表報告書の添付ファイル4.1を参照して編入)。 |
|
|
4.2 |
停戦資本総基金株式会社に発行されたA-2シリーズ株式承認証表(会社が2023年1月3日に米国証券取引委員会に提出した現在の8-K表報告書の添付ファイル4.2を参照して編入) |
|
|
4.3 |
2023年8月1日にラファエルホールディングスに発行された引受権証(2023年8月1日に米国証券取引委員会に提出された8-K表の現在の報告書の表4.1を参照することによって組み込まれる)。 |
|
|
4.4 |
株式承認証表は、2019年5月31日に、CTD Holdings,Inc.が投資家およびFordham Financial Management,Inc.の子会社ThinkEquityおよびその指定者に発行する(2019年6月4日に提出された会社の現在の8-K報告書の添付ファイル4.1を参照して編入)。 |
|
|
4.5 |
Cyclo治療会社が2020年8月に行った非公開配給で投資家に発表した2020年8月27日の引受権証表(同社が2020年9月2日に提出した現在の8−K表報告の添付ファイル4.1を引用して組み込む)。 |
|
|
4.6 |
株式証明書フォーマットを公開する(2020年11月16日に提出されたS-1会社登録説明書添付ファイル4.5を参照)。 |
|
|
4.7 |
当社とVIStock Transfer LLCの引受権証代理契約書フォーマット(会社が2020年11月16日に提出したS−1の登録説明書添付ファイル4.6を参照して組み込む)。 |
|
|
4.8 |
授権書表を代表する。(2020年11月16日に提出された会社S-1登録説明書添付ファイル4.7を参照)。 |
|
|
4.9 |
2023年1月3日に終戦資本総基金有限公司に発行された事前出資株式証表(2023年1月3日に証券取引委員会に提出された会社現在の8-K表報告の添付ファイル4.3を参照して編入)。 |
|
|
4.10 |
2023年1月3日に発行された配給代理権証(2023年1月3日に米国証券取引委員会に提出された会社の現在の8-K表報告書の添付ファイル4.4を参照して編入)。 |
|
|
4.11 |
登録者の証券説明* |
|
|
10.1† |
2019年総合持分インセンティブ計画(会社が2019年7月19日に提出した付表14 A依頼書付録Bを参照)。 |
|
|
10.2† |
2021年株式インセンティブ計画(当社が2021年6月24日に提出した8-Kフォームの添付ファイル10.1を参照することによって組み込まれます)。 |
|
|
10.3† |
会社とN.Scott Fineとの間の雇用協定は、期日は2022年2月28日である(2022年3月2日に提出された会社の現在の8-Kレポートの添付ファイル10.1を参照して編入)。 |
|
10.4† |
会社とマイケル·リスカークとの間の雇用協定は、2022年2月28日(2022年3月2日に提出された会社の現在の8-Kレポートの添付ファイル10.2を参照して組み込まれている)。 |
|
|
10.5† |
会社とJoshua Fineとの間の雇用協定は、期日は2022年2月28日である(2022年3月2日に提出された会社の現在の8-Kレポートの添付ファイル10.3を参照して編入)。 |
|
|
10.6† |
会社とジェフリー·テットとの間の雇用協定は、2022年2月28日(添付ファイル10.4を参照して2022年3月2日に提出された現在の8-K表報告書に組み込まれている)。 |
|
|
10.7 |
当社と停戦資本総基金有限会社が2022年12月29日に締結した証券購入協定(当社が2023年1月3日に証券取引委員会に提出した8−K表の添付ファイル10.1参照) |
|
|
10.8 |
証券購入契約は、日付が2023年6月1日であり、Cyclo Treateutics,Inc.およびRafael Holdings,Inc.(2023年6月5日に米国証券取引委員会に提出された会社の現在の8-Kレポートの添付ファイルI 0.1を参照して編入される) |
|
| 10.9 | 証券購入協定は、日付が2023年5月2日であり、Cyclo Treateutics,Inc.およびRafael Holdings,Inc.(2023年5月4日に米国証券取引委員会に提出された会社の現在の8-K表報告書の添付ファイル10.1を参照して編入される)。 | |
| 10.10 | 日付は2023年6月1日のCyclo治療会社とラファエルホールディングスとの間の証券購入協定である(2023年6月5日に証券取引委員会に提出された会社の現在の8−K表報告書の添付ファイル10.1を参照して組み込まれる)。 | |
| 10.11 | 登録権利協定は、2023年5月2日に、Cyclo治療会社およびラファエルホールディングスによって達成される(当社が2023年5月4日に証券取引委員会に提出した8-K表の添付ファイル10.3を参照することによって組み込まれる)。 | |
| 10.12 | 2023年6月引受協定第5(E)節に記載された2023年6月1日までの登録権協定改正案(当社が2023年6月5日に米国証券取引委員会に提出した8-K表の現在報告書の添付ファイル10.1を引用して組み込む)。 | |
| 10.13 | 投票プロトコル表(当社が2023年9月21日に証券取引委員会に提出した8-K表の現在報告書の添付ファイル10.1を参照)。 | |
|
21.1 |
付属会社* |
|
|
23.1 |
スミス+BrownでPC*の同意を得ました |
|
|
31.1 |
細則13 a-14(A)/15 d-14 a(A)特等実行幹事の証明書* |
|
|
31.2 |
細則13 a-14(A)/15 d-14 a(A)最高財務幹事の証明* |
|
|
32.1 |
第1350条首席行政官の証明書* |
|
|
32.2 |
第1350条首席財務官の証明* |
|
|
97.1 |
|
Cyclo治療会社は政策を取り戻す* |
|
101.INS* |
XBRLインスタンスドキュメントを連結する |
|
|
101.SCH* |
イントラネットXBRL分類拡張アーキテクチャ文書 |
|
|
101.カール* |
インラインXBRL分類拡張計算リンクライブラリ文書 |
|
|
101.定義* |
インラインXBRL分類拡張Linkbase文書を定義する |
|
|
101.ラボ* |
XBRL分類拡張ラベルLinkbase文書を連結する |
|
|
101.前* |
インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
|
|
104 |
表紙相互データファイル(内蔵XBRLに埋め込まれ、添付ファイル101に含まれる) |
|
* |
本局に提出します。 |
|
† |
契約または補償計画または手配を管理する |
サイン
1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、本報告が正式に許可された署名者がその署名を代表して署名することを促す。
|
Cycle治療会社は |
||
|
差出人: |
/S/N.Scott Fine |
|
|
スコットは元気だ 最高経営責任者 (首席行政主任) 日付:2024年3月17日 |
||
本報告は、1934年の証券取引法の要求に基づき、以下の者によって登録者として指定日に署名された。
| サイン | タイトル | ||||
| 差出人: | /S/N.Scott Fine | 取締役最高経営責任者 | 2024年3月17日 | ||
| N·スコット·ファイン | (首席行政主任) | ||||
| 差出人: | /S/Joshua M.Fine | 首席財務官 | 2024年3月17日 | ||
| ジョシュア·M·ファーン | (首席財務会計官) | ||||
| 差出人: | /S/ジェフリー·L·テット | 役員首席運営官 | 2024年3月17日 | ||
| ジェフリー·L·テット | |||||
| 差出人: | 寄稿S/マーカス·W·シガー | 取締役取締役会長 | 2024年3月17日 | ||
| マーカス·シガー | |||||
| 差出人: | /投稿S/ウィリアム·コンクリン | 役員.取締役 | 2024年3月17日 | ||
| ウィリアム·コンクリン | |||||
| 差出人: | /S/ショーン·クロス | 役員.取締役 | 2024年3月17日 | ||
| ショーン·クロス | |||||
| 差出人: | /S/F.パトリック·Ostronic | 役員.取締役 | 2024年3月17日 | ||
| F·パトリック·オストロン | |||||
| 差出人: | /投稿S/ウィリアム·S·シャナハン | 役員.取締役 | 2024年3月17日 | ||
| ウィリアム·シャナハン | |||||
| 差出人: | /S/C.E.リック·ストラタン | 役員.取締役 | 2024年3月17日 | ||
| C.E.リック·ストラタン | |||||
| 差出人: | /S/ランデル·M·トーガー | 役員.取締役 | 2024年3月17日 | ||
| ランデル·M·トーガー | |||||
| 差出人: | /S/Wong | 役員.取締役 | 2024年3月17日 | ||
| フェレイ·ワン | |||||