
ライセンス及び供給協定修正案本ライセンス及び供給修正案(本“修正案”の付表とともに)2023年3月27日(“本修正案の発効日”)は、主な営業場所がニュージャージー州ウォーレン30 Technology Drive,Warren,New Jersey 07059に位置するデラウェア州社Aqomtive Treeutics,Inc.(以下“Aqqutive”)とイングランドとウェールズに登録され、主要営業場所がSovereign House,Miles Gray Road,Basildon,Essex SS 14 3 FR(以下“Pharmanovia”)のAtnahs Pharma UK Limited(以下“narahed Pharmania”)を締結する。AqutiveやPharmanoviaは以下では単独で“当事者”と呼ばれ,総称して“当事者”と呼ばれることがある.概要:A.AqutiveとPharmanoviaは2022年9月26日にその中で指定されたいくつかの地域で製品に関する許可と供給協定(以下、協定と略称する)を締結した。B.AqutiveおよびPharmanoviaは、他の地域Cを含む許可および供給協定の範囲を拡大するために、本修正案を締結することに同意している。前述と本修正案に含まれる相互陳述、保証、および契約を考慮すると、双方は、ここで法的制約を受け、以下のように同意する:1.本修正案で使用される大文字用語は、プロトコルにそれらを与える意味を有する。2.修正案2.1本修正案の発効日から、AqutiveおよびPharmanoviaは、本プロトコルの製品添付表1を本修正案の製品添付表1に置き換えて再宣言することに同意する。2.2本協定4.1.1.2節は、“元の領土に関連する合格者に必要な技術相談および臨床研究支援;Pharmanoviaが要求する拡張領土に関する任意の技術相談または臨床研究支援は、本協定の単独作業説明書で決定されるが、必要なデータまたは情報はAqutiveに提供できない(この場合、この情報は無料で共有されなければならない)”2.3第5.2.2節に全て置き換えて再記述すべきである。本プロトコルのすべての内容を置き換え、その全文を以下のように再記述すべきである:“上記の規定があるにもかかわらず、本プロトコルの第4の契約年度終了後の任意の時間に、Pharmanoviaは、元の領土(以下に定義する)のすべての国の製品が12ヶ月間のスクロールに基づく利益/純売上高が30%以下に低下したことを能力的証拠によって証明することができる場合、Pharmanoviaの要求に応じて、将来の調達注文に同意することができる:DocuSign封筒ID:7 AC 3 E 746-C 57 A-4 A 9 B-A 131-8165582 FB 518

2 5.2.2.1元地域製品の製品譲渡価格はCOGSプラス10%に等しくなければならない;5.2.2.2 Pharmanoviaはもはや元地域製品に特許使用料を支払うのではなく、第7.3節でさらに規定されたように、Aqutiveに元地域製品の利益シェアを支払わなければならない。上記の規定があるにもかかわらずいつでも、Pharmanoviaは、拡張地域のすべての国で、その製品の12ヶ月連続の利益/純売上高が30%以下に低下したことを能力的な証拠によって証明することができる。双方は、地域を拡張する製品譲渡価格と製品の特許権使用料支払いについて誠実に検討しなければならない。2.4本協定第5.3.4条の全ては置き換えられなければならず、以下のとおりである。“AqutiveおよびPharmanoviaは、90%(90%)を下回らず、100%を超えない限り、個々の調達注文を考慮する。10%(110%)の数量は、単一の購入注文に従って出荷されます。Pharmanoviaは、最大110(110)分の要求された調達注文の交付を受けることに同意した。“2.6本合意第12.2.1.5条はすべて置き換えなければならない。”Pharmanoviaが本改正案の発効日から3(3)年以内に元の領土内の国がLibervantのために第1回規制承認を提出しなければ、いずれか一方が3(3)ヶ月以上の書面で終了通知を出していないが、双方は少なくとも3(3)年間の誠実な議論を行うべきである。このような通知が届くまで、数ヶ月間この問題の解決策を検討しています“2.7本プロトコル13.1.1条はすべて置き換えるべきであり、以下の通りである。無効特許の提出、起訴、メンテナンス(満期支払継続費を含む)。原領土内で無係争特許を準備、提出、起訴、維持する費用は、無係争特許会社が負担しなければならない。拡張された領域内の任意の国/地域におけるライセンス特許の任意の準備、提出、起訴、および維持は、本プロトコルの別個のSOWで決定されなければならない。“3.条項および条件は、本プロトコルに別の規定があることを除いて、本プロトコルの他のすべての条項および条件は完全な効力を維持しなければならない。4.コピー;署名本修正案は、複数のコピーに署名することができ、署名された場合、すべてのコピーは、原本とみなされるべきであり、すべてのコピーは、一緒に1つのDocuSign封筒ID:7 AC 3 E 746-C 57 A-4 A 9 B-A 131-8165582 FB 518を構成する

3つのファイル。ファックスまたは電子メール送信によって提供される署名は、元の署名とみなされるべきである[署名ページは以下のとおりです]DocuSign封筒ID:7 AC 3 E 746-C 57 A-4 A 9 B-A 131-8165582 FB 518

[ライセンス、開発、供給契約の署名ページ]本改正案は,双方の正式に許可された代表が署名し,本改正案の発効日から発効することを証明する.AQUESTIVE治療会社作者:Daniel美容師肩書:社長兼最高経営責任者アルテナス製薬イギリス有限会社:名前:ニッシュ·ウィリアムズ役職:総法律顧問DocuSign封筒ID:7 AC 3 E 746-C 57 A-4 A 9 B-A 131-8165582 FB 518

製品付表1許可と供給協定(“合意”)の製品付表日は2022年9月26日であり,2023年3月27日にAqutive Treateutics,Inc.(“Aqumtive”)とAtnahs Pharma UK Limited(“Pharmanovia”)によって改正された。ここで使用する大文字用語と別途定義されていないタームは,本プロトコルで与えられた意味を持つべきである.1.製品、原料薬、用量強度、分野、地域1.1“原料薬原料薬”とは、活性医薬成分が安定していることを意味する。1.2“商業化年とは、最初の商業販売から計算された1年間の期間と、その後の各年間期間を指すものとする。1.3用量強度は、製品の5 mg、7.5 mg、10 mg、12.5 mg、15 mg、17.5 mg、20 mgの用量強度を意味する。1.4.“領域”とは、(I)すべての年齢層の長期的または急性、けいれん発作、または各当事者の誠実な書面の同意を経て、前述の規定に適合する他の定義、および(Ii)現在安定して製品が承認されていない地域、Pharmanoviaが現在承認している安定(安定)ラベルに列挙されている医学的適応を含むすべての地域を意味する。1.5“製品”とは、口腔膜安定剤を意味する。1.6.“製造施設”とは、発効日からAQUATINTの生産拠点がインディアナ州(IN)46368ボティッチameriplex Drive 6465号、米国(米国)、FDA機関番号3004395604に位置することを意味する。1.7.1“領土”とは、以下のすべての地域を意味する:1.7.1欧州連合国(発効日現在)、スウェーデン、スイス、ノルウェー、(2)連合王国(イングランド、スコットランド、ウェールズおよび北アイルランド)、(3)中東および北アフリカ(アルジェリア、バーレーン、エジプト、イラン、イラク、イスラエル、ヨルダン、クウェート、レバノン、リビア、モロッコ、オマーン、カタール、サウジアラビア、シリア、チュニジア、アラブ首長国連邦、イエメン)(“旧領土”)。1.7.2世界のすべての国には、原領土、米国、カナダ、中国は含まれていない(“延長領土”)。2.製品譲渡価格エージェントは、単位製品当たりの数量をPharmanoviaに供給し、本プロトコル5.2節に従ってさらに調整しなければならない:用量強度製品譲渡価格ファイル署名封筒ID:7 AC 3 E 746-C 57 A-4 A 9 B-A 131-8165582 FB 518

低用量(5 mg、7.5 mg、10 mg)5.49ドル/箱*用量(12.5 mg、15 mg)5.71ドル/箱高用量(17.5 mg、20 mg)5.95ドル/箱*各段ボール箱に2つの単位を含む。3.AQUESTIVE製品マーク合格製品マークは以下の通りである:LIQUEVANT 4.PHARMANVOIAマーク安定5.製品賞味期限が承認賞味期限の80%である6.AQUESTIVE製品特許説明は以下の通りである:なし。7.支払い7.1旧領土のマイルストーン支払い払い戻し不可は、次の表に示すように、元の領土に関連してPharmanoviaによってAqutiveに支払われます:マイルストーン支払い(ドル)マイルストーン支払い期日1.合意実行$3,500,000 2022年9月30日2.中東および北アフリカ諸国を含まず、元の領土製品の最初のマーケティング許可を受けました。元の地域(中東および北アフリカ諸国を除く)で製品の最初のマーケティング許可を受けてから5(5)営業日以内に2,000,000ドルを支払います。3.価格設定および精算マイルストーンは、製品の価格設定および精算が元の国·地域関連規制機関の承認を得た5営業日以内に500,000ドルに達する。DocuSign封筒ID:7 AC 3 E 746-C 57 A-4 A 9 B-A 131-8165582 FB 518
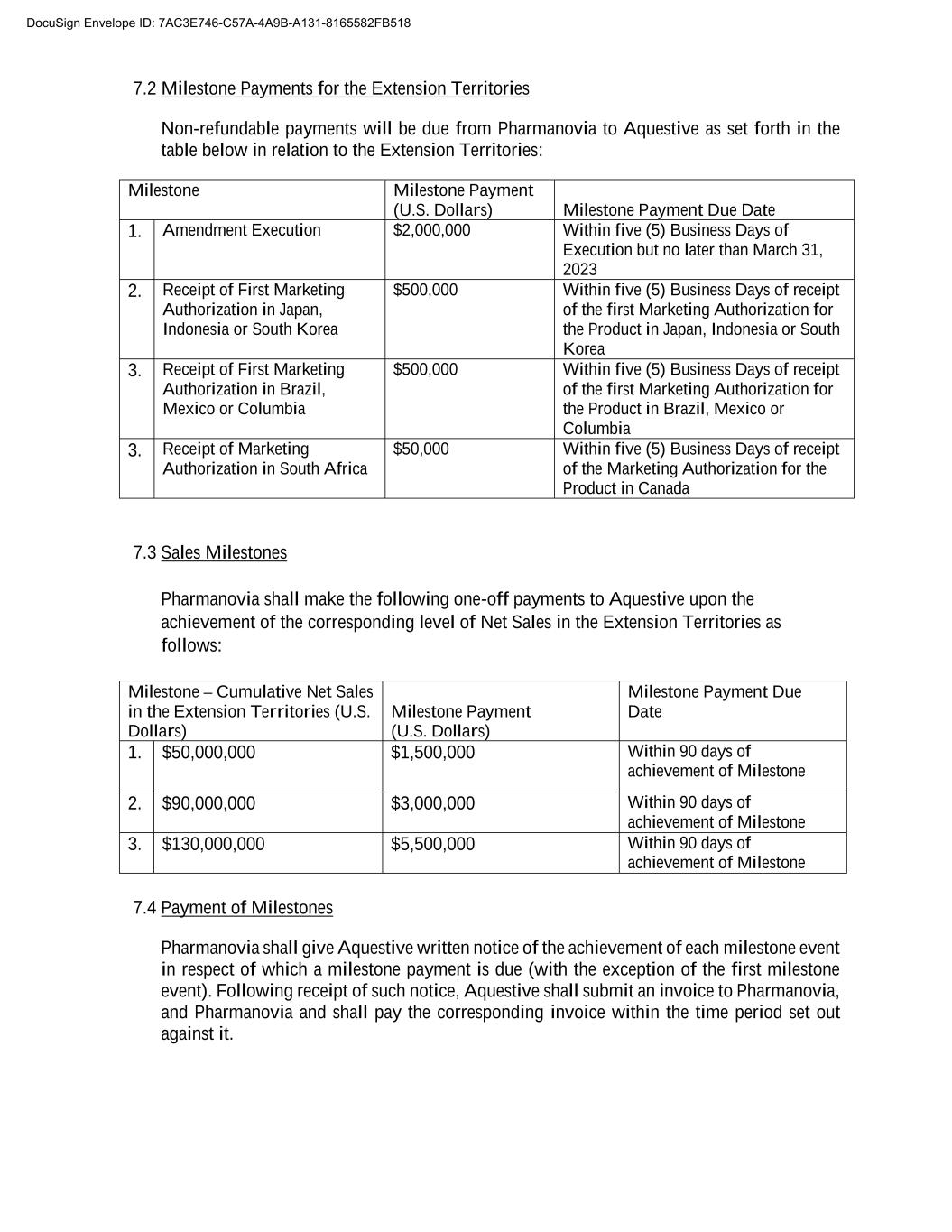
7.2延期区域のマイルストーン支払い払い戻しできない金額は、PharmanoviaによってAqutiveに支払われ、具体的には以下の表に示される:マイルストーン支払い(ドル)マイルストーン支払い満期日1.修正実行は、署名後5営業日以内に$2,000,000であるが、2023年3月31日2.日本、インドネシアまたは韓国で最初のマーケティング許可を受けてから5(5)営業日以内に日本、インドネシア、または韓国の最初のマーケティング許可$500,000 3.ブラジルで最初のマーケティング許可を受け、メキシコやコロンビアはブラジルでの製品の最初のマーケティング許可を受けてから5営業日以内に500,000ドルを支払いますメキシコまたはコロンビア3.南アフリカでの販売許可5,000ドルを受け取り5(5)営業日以内にカナダでの製品の販売許可7.3販売マイルストーンPharmanoviaは、拡張地域の純売上高が対応するレベルに達した後、Aqutiveに以下の一括払いを支払わなければならない:マイルストーン-拡張地域の累計純売上高(ドル)マイルストーン支払い(ドル)マイルストーン支払い期日1.マイルストーン2を達成した90日以内に$50,000,000$1,500,000ドル。$90,000,000$3,000,000マイルストーン3に達した90日以内に。$130,000,000$5,500,000マイル7.4のマイルストーン支払いを実現してから90日以内に、Pharmanoviaは各マイルストーンイベント(最初のマイルストーンイベントを除く)の完了状況について書面で通知しなければなりません。通知を受けた後、AqutiveはPharmanoviaとPharmanoviaに領収書を提出し、所定の時間内に対応する領収書を支払わなければならない。DocuSign封筒ID:7 AC 3 E 746-C 57 A-4 A 9 B-A 131-8165582 FB 518
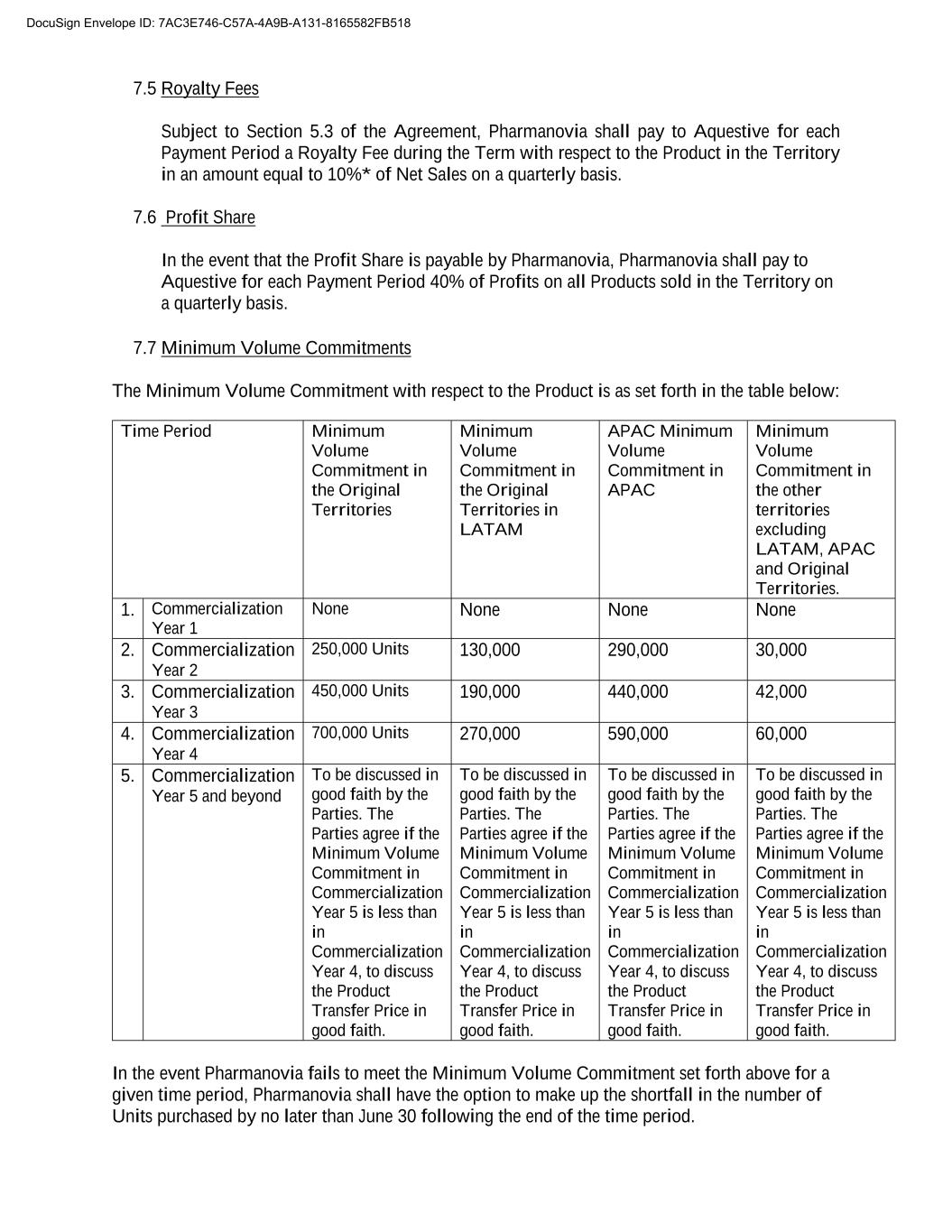
7.5特許使用料本協定第5.3条の規定によれば、Pharmanoviaは、支払期間毎にAqutiveに特許権使用料を支払わなければならず、金額は四半期の純売上高の10%に相当する*.7.6利益シェア利益シェアがPharmanoviaによって支払われる場合、Pharmanoviaは、地域内で販売されているすべての製品の四半期当たり利益の40%を各支払い中にAqutiveに支払わなければならない。7.7最小数量コミットメント製品の最小数量コミットメントは、以下の表に示される:期間の元の領土の最小数量コミットメント元領土の最小数量コミットメントアジア太平洋地域の最小数量コミットメントアジア太平洋地域の最小数量コミットメント他の地域(ラテンアメリカおよびカリブ地域および元の領土を含まない)の最小数量コミットメント。1.商品化年1なし2.商品化年2 250,000単位130,000 29,000 30,000 3.商品化年3 450,000単位190,000 440,000 42,000 4.商品化年4 700,000単位270,000 59,000 60,000 5.商品化年5以降は当事者が誠実に議論する.商業化5年目の最小一括承諾が商業化4年目の最小一括承諾量を下回れば、双方は製品譲渡価格を誠実に検討することで合意した。双方が誠実に協議する.商業化5年目の最小一括承諾が商業化4年目の最小一括承諾量を下回れば、双方は製品譲渡価格を誠実に検討することで合意した。双方が誠実に協議する.商業化5年目の最小一括承諾が商業化4年目の最小一括承諾量を下回れば、双方は製品譲渡価格を誠実に検討することで合意した。双方が誠実に協議する.商業化5年目の最小一括承諾が商業化4年目の最小一括承諾量を下回れば、双方は製品譲渡価格を誠実に検討することで合意した。Pharmanoviaが指定された時間帯で上記の最低数量約束を達成できなかった場合、Pharmanoviaはその時間帯終了後6月30日までに調達数の不足を補う権利がある。DocuSign封筒ID:7 AC 3 E 746-C 57 A-4 A 9 B-A 131-8165582 FB 518

8.追加条項Pharmanoviaは、用量強度単位数5 mg 165,000 7.5 mg 110,000 10 mg 85,000 12.5 5 mg 65,000 15 mg 55,000 17.5 mg 45,000 20 mg 40,000 Pharmanoviaが要求される場合、Aqutive缶はフィルムロット当たり最大10個の異なる印刷紙カセットまたはSKUを製造し、最初の5つのSKUは5,000ドル、任意の他のSKUは5,000ドル、最大10個のSKUを課金する単位で購入注文を発行しなければならない。SKUあたりの最小補助数は3,000箱である.DocuSign封筒ID:7 AC 3 E 746-C 57 A-4 A 9 B-A 131-8165582 FB 518