

別紙99.1 全般性不安障害(GAD)フェーズ2bのMM120フル トップラインデータ ODT PK ブリッジングスタディブレークスルーセラピー指定 2024年3月
免責事項このプレゼンテーション(以下「プレゼンテーション」)は、マインドメディシン(MindMed)株式会社(「MindMed」、「当社」、「当社」、「当社」または「当社」)が情報提供のみを目的として作成しました。MindMed、その関連会社、またはそれぞれの従業員、 の取締役、役員、請負業者、顧問、メンバー、後継者、代表者または代理人のいずれも、本プレゼンテーションに含まれる情報の正確性または完全性について一切の表明または保証を行わず、本プレゼンテーションに含まれる 表明(明示または黙示を問わず)または本プレゼンテーションからの省略について一切責任を負わないものとします。このプレゼンテーションは、MindMedの有価証券の募集または購入の申し出を勧誘するものではなく、いかなる場合でも、 証券の目論見書、広告、または公募と解釈されるべきではありません。ここに含まれる商標はすべてその所有者に帰属し、参照目的でのみ使用されています。このような使用は、MindMedの製品またはサービスを推薦するものと解釈されるべきではありません。特に明記されていない限り、金額はすべて米ドルです。MindMedの証券は、証券取引委員会(SEC)または州、州、その他の 証券規制当局によって承認または不承認されていません。また、SECまたは州、州、その他の証券規制当局がこのプレゼンテーションの正確性または妥当性を伝えたこともありません。反対の表現は刑事犯罪です。将来の見通しに関する記述に関する注意事項 このプレゼンテーションには、1995年の米国民間 証券訴訟改革法およびその他の適用される証券法のセーフハーバー条項の意味の範囲内で、「将来の見通しに関する記述」が含まれており、当社の役員および代表者は随時作成できます。将来の見通しに関する記述は、「計画」、「期待」、「期待」、 「予算」、「予定」、「見積もり」、「予測」、「意図」、「予想する」、「予定」、「プロジェクト」、「信じる」、またはそのような単語やフレーズのバリエーション(否定的な バリエーションを含む)などの言葉で識別できますが、常にではありません行動、出来事、結果、条件は「起こりうる」、「できる」、「できる」、「するかもしれない」、「起こるかもしれない」、「達成される」、そして 将来の期間への同様の言及。歴史的事実の記述を除き、将来の見通しに関する記述の例には、とりわけ、医薬品や治療法の開発と商品化、または前述のいずれかの の有効性、開発活動の成功とタイミング、計画された臨床試験の成功と時期、ここに記載されているマイルストーンを達成する当社の能力、任意の臨床試験の成功の可能性、任意の臨床試験の成功の可能性 に関する記述が含まれます。FDAまたはその他の規制当局の承認を取得、主要な臨床施設を通じた当社のキャッシュランウェイ資金調達業務読み上げと2026年まで。特許取得の可能性または付与後のそのような特許の有効性、およびMindMedが参入すると予想している市場への可能性 。将来の見通しに関する記述は、歴史的事実でも将来の業績を保証するものでもありません。代わりに、これらは、このプレゼンテーションの日付現在の 事業の未来、将来の計画と戦略、予測、予想される出来事と傾向、経済およびその他の将来の状況に関する現在の信念、期待と仮定のみに基づいています。MindMedはこれらの仮定は妥当であると考えていますが、 は本質的に予測が難しいビジネス、社会、経済、政治、規制、競争、その他のリスクや不確実性の影響を受けやすく、その多くはMindMedの管理外であり、実際の結果と の財政状態は、将来の見通しに関する記述に示されているものと大きく異なる場合があります。したがって、これらの将来の見通しに関する記述はどれも信用しないでください。 の実際の業績と財政状態が将来の見通しに関する記述に示されているものと大きく異なる原因となる可能性のある重要な要因には、とりわけ、計画を完成させ、研究に資金を提供するための資金調達能力、開発中の検討中の 医薬品および治療法の医学的および商業的実行可能性、MindMedのマイナスキャッシュフローの歴史、MindMedの限られた営業履歴、将来の損失の発生、法律の遵守などがあります。と規制、研究と 開発に関連する難しさ、臨床試験や研究に関連するリスク、規制当局による精査の強化、製品開発の初期段階、臨床試験のリスク、規制当局の承認プロセス、サイケデリックにインスパイアされた医薬品業界の目新しさ。また、MindMedがSECに提出したForm 10-Kに関する最新の年次報告書や、今後SECやSECに提出するその他の書類の「リスク要因」セクションで議論または言及されているリスク要因 カナダのすべての州と準州の証券規制当局、以下で入手可能セダーに関する会社のプロフィールは、www.sedar.comにあります。このプレゼンテーションでMindMedが行った将来の見通しに関する記述は、会社が現在入手可能な情報 のみに基づいており、作成された日付の時点でのみ述べられています。MindMedは、新しい情報、将来の動向、その他の結果であるかどうかにかかわらず、随時作成される可能性のある将来の見通しに関する記述を、書面または口頭を問わず、公に更新する義務を負いません。規制事項に関する注意事項米国連邦政府は、規制物質法により薬物を規制しています。MM120は独自の医薬品に最適化された 形態のリゼルギドD-酒石酸塩で、MM402、またはR (-)-MDMAは当社独自のMDMAのR-エナンチオマー(3,4-メチレンジオキシメタンフェタミン)です。リセルギドとMDMAは、規制物質法に基づくスケジュールIの物質です。 は、MM120、MM402、その他の製品候補を含め、サイケデリックまたは幻覚誘発性化合物、およびこれらの化合物の非幻覚誘導体を使用するプログラムに焦点を当てていますが、事業を展開する管轄区域における物質の違法な販売、生産、流通という には直接的または間接的に関与していません。同社は神経医薬品開発会社であり、承認された規制の枠組み内で実施される の実験室および臨床試験環境を除き、サイケデリックまたは幻覚誘発物質を扱っていません。会社の製品は、該当する規制当局の承認を受ける前に商品化されることはありません。規制当局の承認は、意図した用途における安全性と有効性 の臨床的証拠が正常に開発された場合にのみ付与されます。市場と業界のデータこのプレゼンテーションには、業界の出版物を含む第三者の情報源から入手した市場と業界のデータが含まれています。MindMedは、業界データ は正確で、推定値と仮定は妥当だと考えていますが、このデータの正確性や完全性については保証できません。第三者の情報源によると、そこに含まれる情報は信頼できると思われる情報源 から入手されたものですが、含まれている情報の正確性や完全性については保証されません。データは信頼できると考えられていますが、MindMedは、このプレゼンテーションで で言及されている第三者の情報源からのデータを独自に検証したり、そのような情報源が信頼する基礎となる経済的仮定を確認したりしていません。このプレゼンテーションでの調査レポートや記事、出版物への言及は、参照先のレポートまたは記事全体の の完全な調査結果を示すものとして解釈されるべきではありません。MindMedは、そのような情報の正確性についてはいかなる表明もしません。投資家向けプレゼンテーション | 2024年3月 2

今日の議題スピーカートピック Rob Barrow 紹介挨拶最高執行責任者 MindMed Rakesh Jain MD MD MPH KOL テキサス工科大学全般性不安障害 (GAD) および医学部の精神医学および行動科学の臨床教授における満たされていないニーズについての視点 — 二畳紀盆地フェーズ 2b試験結果ダニエル・R・カーリン、MD、マサチューセッツ州トップライン全結果の概要 GADでのMM120のMindMed治験フェーズ2b、最高医療責任者、医学博士フランソワ・リリエンタール、MBAコマーシャル・オポチュニティ最高商務責任者、マインドメッド・ロブ・バローより。まとめ コメントMM120開発計画の最高経営責任者、MindMedの閉会の辞と質疑応答(Q&A)すべてのプレゼンター投資家向けプレゼンテーション | 2024年3月 3日

紹介挨拶ロバート・バロウ最高経営責任者

私たちは、脳健康パイプライン管理のグローバルリーダーになることを目指しています。 重要な満たされていない医療ニーズをターゲットにして商品化する医薬品開発プログラムにおける臨床専門知識の多様なパイプライン研究期待ランウェイ研究を通じた数十年にわたる前臨床および臨床での期待されるキャッシュランウェイを活用し、フェーズ2bの臨床データアウトと2026年に向けて有望な結果をもたらしました * 市場保護戦略市場の独占権と保護を最大化することを目的とした知的財産と研究開発戦略*会社の現金と現金 12月時点で9,970万ドル相当です2023年31日、そしてコミットド・クレジット・ファシリティは、2026年までの事業資金を調達する予定です。投資家向けプレゼンテーション | 2024年3月 5日

確かな実績を持つ経験豊富なリーダーシップ 1. ブレイン・ヘルス・イノベーション 1.投資家向けプレゼンテーションを含む | 2024年3月 6日

MM120は、全般性不安障害(GAD)におけるGADの大きな未解決のニーズに応える可能性を秘めています 1 • GADは成人の間で2番目に多い精神障害ですが、治療法の選択肢は限られています。新しいMOAによる治療 • 症状は衰弱させることがあり、治療法の効果がないと、寛解が不完全になり、副作用が耐えられなくなります。1 大規模市場 650万は GAD 3 1 2の第一選択治療を受けた米国の成人1,300万〜2,000万人に応答します。機会 77% 中等度から重度の1 SSRI/SNRI:50%しばしば望ましくない副作用を伴う失敗率ベンゾジアゼピン:中毒、耐性リスク、一般的に短期的に使用される新しい治療法の必要性が高い4ブスピロン:効力の低い抗精神病薬:短期および長期のリスク、 耐容性が低い 1.精神障害や薬物使用障害の有病率調査(MDPSU):調査結果レポート2023。2.ケスラーRC、チウ WT、デムラー O 他。全国併存疾患における12か月のDSM-IV障害の有病率、重症度、併存症 調査-複製。2005年の第一世代精神医学; 62 (6): 617-627。投資家向けプレゼンテーション | 2024年3月 7 3.アンサラ、治療抵抗性全般性不安障害の管理、メントヘルスクリン 2020年11月10日(6)326-334)米国国勢調査局、 企業計算。4.ガラカニAら(2020)不安障害の薬物療法:現在および新たな治療法の選択肢。正面。精神医学 11:595584。doi: 10.3389/fpsyt.2020.595584

MindMed研究開発パイプライン製品候補適応症 前臨床フェーズ 1 フェーズ 2 フェーズ 3 登録精神医学プログラム全般性不安神経症 MM120 1 障害 (GAD) (リゼルギドD-酒石酸塩) その他の精神医学 2 適応症 MM402 自閉症スペクトラム 1 障害 (ASD) (R (-)-MDMA) 早期研究と コラボレーション IITs 1 いろいろ (UHB コラボレーション) 初期研究いろいろ (マインドシフトコラボレーション) 1.臨床試験の詳細とclinicaltrials.govのリンクは、mindmed.co/clinical-digital-trials/2にあります。調査および/または計画段階での研究。 投資家向けプレゼンテーション | 2024年3月 8日 LSD:リセルギド、MDMA:3,4-メチレンジオキシメタンフェタミン。IIT:治験責任医師主導試験(結果は規制当局の承認申請に使用される予定はありません); UHB:バーゼル大学病院

MM120プログラムアップデートの主なハイライト 1 のGADの第2b相試験で12週間の持続性がプラス • 主要評価項目と副評価項目は統計的に有意でした • 主要評価項目と副評価項目は統計的に有意でした • プラセボより7.7ポイント改善されました(d=0.81; p=0.003)• 12週目の画期的治療指定での臨床的寛解率は 48% • SOCよりも大幅に改善されたという予備的な証拠を認めています • FDAの組織的コミットメントと効率的な開発サポート強化製品 MM120 ODTsのプロファイル • PKブリッジ研究の結果は、差別化された プロファイルを示しています • 吸収が速く、より良いバイオアベイラビリティとより優れた治療薬AUC商用モデルとスケーラブルな立ち上げのための戦略 • GADにおける負担と満たされていないニーズに対する幅広い認識 • 市場保護戦略と知的財産ポートフォリオの潜在的な ゲームチェンジャーとしてのMM120への熱意 • 市場保護の可能性を最大化するための知的財産主導の研究開発戦略 • 最近および短期的な主要助成金による知的財産ポートフォリオの推進 1.ソース:MMED008の内部調査 の文書と計算を調べてください。投資家向けプレゼンテーション | 2024年3月 9 2.ソース:https://www.fda.gov/patients/fast-track-breakthrough-therapy-accelerated-approval-priority-review/breakthrough-therapy

GADのMM120の結果は、 単回投与1,2後に対象製品プロファイルで得られました。すべてのエンドポイントで有意な改善が見られ、24時間以内にCGI-Sが1.8ポイント減少しました(p

効果量が1,3の標準 の2倍を超える場合に観察された12週間の持続性ケア第2b相12の主なハイライト GAD週の結果における効果量の比較 • 観察された最大効果量は0.81 2 MM120 100 µg 0.81は標準の2,3ケアの2倍以上 4 ベンゾジアゼピン 0.38 • 迅速で 持続的な臨床反応 3 単回投与後に観察された 4 SSRI 0.36 • 臨床活性が観察されたが心理療法的介入 4 ブスピロン 0.17 ビヨンド治験薬 0 0.2 0.4 0.6 0.8 1.出典:MMED008の内部調査 の文書と計算を調べてください。2.HAM-AスコアはANCOVA LS平均に基づいています。MMED008の調査で。LSを使用した事後計算に基づく効果量は、グループ間の平均変化と、グループ間の12週目のHAM-Aスコアの併合標準偏差に基づいています。投資家 プレゼンテーション | 2024年3月 11 3.100 µgの用量グループに基づいています。4.出典:RBイダルゴ、Jサイコファーマコール。2007年11月21日; 21 (8): 864-72。

FDAは、MM120をGADの画期的な治療法として指定しました。MM120にブレークスルーセラピーの画期的な利点1療法指定• • FDAの組織的取り組みにより、GADは上級管理職が関与する重篤な状態として認識されています • フェーズ2bの結果が実証されています。• 効率的な薬剤に関する集中的なガイダンス。GAD用MM120には実質的な開発プログラムがある可能性があるという予備的エビデンス。2. GADに利用可能な治療法よりも改善されているという予備的エビデンス • 迅速承認の適格性、優先順位 3 レビュー4 • NDAのローリングレビュー 1.その他の詳細は、FDAのウェブサイトでご覧いただけます。https://www.fda.gov/patients/fast-track-breakthrough-therapy-accelerated-approval-priority-review/breakthrough-therapy 2.臨床的に重要なエンドポイントに基づきます3.関連基準が満たされれば 投資家向けプレゼンテーション | 2024年3月 12 4.製薬会社が、新薬申請(NDA)のすべてのセクションが完了してから申請書全体を審査するのではなく、完成した新薬申請(NDA)のセクションをFDAの審査に提出できるということです。NDAの審査は通常、製薬会社が申請書全体をFDAに提出するまで開始されません。

PKブリッジ調査は、MM120 ODTsの強化された製品プロファイルを示しています 1の比較PKプロファイル 2.5 MM120カプセル MM120 DOTの差別化された性能 MM120 ODT 2 2 50% 作用の開始 1.5 3 17% バイオアベイラビリティの向上 1 4 0.5 23% のターゲットコンシーでのAUCの増加AUC 0 5 0 2 4 6 8 10 12 14 16 18 20 22 24 消化管副作用の軽減時間 (時間) 1.MM120-101試験の薬物動態データを企業で分析しています。両方の投与セッションを完了したn=24人の被験者に基づくPK分析。2.1 ng/mLを超える目標濃度に達するまでの時間に基づいています。3.曲線下の総面積の幾何平均比の 比較に基づいています。投資家向けプレゼンテーション | 2024年3月 13 4.平均AUCの比率に基づいています。目標濃度は、それを超えると知覚効果が現れるレベルとして定義されます。>1ng/mL 5.GADのMM120カプセルを対象とした第2b相試験とMM120 ODTを対象としたPKブリッジ試験の 比較に基づいています。AUC: 曲線下領域、GI: 胃腸、ODT: 経口溶解錠剤、PK: 薬物動態 MM120濃度 (ng/mL)
MM120の魅力的な商業的機会は、未だ満たされていない大きなニーズと、大幅に満たされていないニーズ市場を拡大するための実証済みの道筋です。大幅に確立されたクラス最高の償還コマーシャル・プロファイル・フレームワーク潜在的大規模で力強く成長し続けるインフラストラクチャの提案投資家向けプレゼンテーション | 2024年3月 14

GADにおける影響と満たされていないニーズに関するKOLの見解 Rakesh Jain、MD、MPH テキサス工科大学医学部・ペルム紀盆地精神医学および行動科学の臨床教授

GADにおける影響と満たされていないニーズに関する視点 • GADは患者生活の多くの側面に負の影響を及ぼし、重症度とともに増加します • GADは本質的に慢性的で、時間とともに悪化し、しばしば他の精神障害に先行します 1 • 不安は脳 健康障害の主な要因として再び注目されています • 患者は現在の薬では十分なサービスを受けていません 1 • GAD患者は新しい治療法の選択肢への要望を表明しています 2 • GAD患者は新しい治療法の選択肢への要望を表明しています 2 • GAD患者は新しい治療法の選択肢への要望を表明しています 2 • GAD患者は新しい治療法の選択肢への希望を表明しています 2 • GAD患者は数十年で限られたイノベーションしか見られませんでした-シンバルタが最後にGADに承認された薬(2007年2月) • 現在の治療法はそうではないことが多いです有効または耐容性があり、切り替えや投与量の調整を何度も繰り返す必要があります。3 • 数十年にわたる精神疾患に関するLSDの臨床研究は、LSDのユニークな可能性を裏付けています 1. 「子供と青年の不安:スクリーニング」(2022).米国予防サービスタスクフォース;「成人の不安障害:スクリーニング」勧告草案(2022)。米国予防サービスタスク フォース。2.2023年にマインドメッドが実施した患者調査に基づいています。投資家向けプレゼンテーション | 2024年3月 16 3. https://investor.lilly.com/news-releases/news-release-details/fda-approves-cymbaltar-treatment-generalized-anxiety-disorder #. 4.ラッカー 2016、 ガセット 2014、ホルツェ、ガッサーら 2022、UHB プレゼンテーション 2023年4月。

全般性不安障害 (GAD) の概要全般性不安障害 (GAD) 不安の疫学 •• 10%の持続的な有病率が過去20年間で3倍になり、生活のさまざまな側面について過度に心配していることを特徴とする一般的な障害は、男性よりも女性に多い(〜2:1)• GADの人は不安をコントロールするのが難しいと感じることが多い • 不安をコントロールすることが難しく、特に思春期や思春期に発症します成人期初期と日常機能の障害 • 一般的な併存する精神疾患、 など • 一般的には症状が現れます落ち着きのなさ、疲労、大うつ病、その他の不安障害、集中力の低下、いらいら、筋緊張、睡眠障害、そして•18〜65歳の 成人に最も一般的な2つの精神障害投資家向けプレゼンテーション | 2024年3月17日

GADは患者の生活の多くの側面に悪影響を及ぼし、 は重症度とともに増加し、GADの重症度によって平均健康効用指数も増加します。重症度(GADの患者への影響)40(25)日常生活における障害 Revicki et al。(2008)投資家向けプレゼンテーション | 2024年3月18日

GADは本質的に慢性的で、時間とともに悪化し、しばしば 次の1精神障害に先行します。薬物使用パニック障害 MDD 発症からの時間 1.不安と抑うつの重要な関係-2020年5月1日 https://doi.org/10.1176/appi.ajp.2020.20030305 投資家向けプレゼンテーション | 2024年3月 19 重症度と併存疾患

主流が不安神経症に注目する傾向が回復するにつれて、 現在の薬では患者は引き続き十分なサービスを受けていません。人口推奨グレード:8歳から8歳の子供と青年。USPSTFは、B 1、18歳の小児および8歳から18歳の青年を対象に、不安神経症のスクリーニングを推奨しています。USPSTFは、成人、妊娠中や産後の人を含む64歳以下の成人(B 2)の 不安神経症のスクリーニングを推奨しています。USPSTFのグレード「B」の推奨内容は次のとおりです。「USPSTFはサービスを推奨しています。純利益が中程度である確率は高いですが、純利益が中程度から相当なものであるという確率は中程度です。」一般的に最前線で、失敗率は50%、性的副作用は3つは長続きします 1.「子供と青年の不安:スクリーニング」 (2022)。米国予防サービスタスクフォース。2.「成人の不安障害:スクリーニング」勧告草案(2022)。米国予防サービスタスクフォース。1.「子供と青年の不安: スクリーニング」(2022)。米国予防サービスタスクフォース投資家向けプレゼンテーション | 2024年3月 20 2.「成人の不安障害:スクリーニング」勧告草案(2022)。米国予防サービスタスク フォース。3.メントヘルスクリニック、アンサラ。2020年11月10日; 10 (6): 326-334)。FDA.gov/。米国国勢調査局、会社の計算。

GAD患者は、新しい治療法の選択肢1への希望を表明しています。GAD患者からの現在のSOCの見積もりの制限 彼らは、薬が効くのを遅らせるには6週間かかると言っていました。もう6週間はこのような気分になりたくありませんでした。薬に一貫性がない場合や、持続性のない 活動が1日続くと、1日休むとひどい気分になります。私の目標は寛解です。リミテッド・レスポンスの錠剤を機能させることには関わりたくありません。性的な副作用が嫌いで、薬のせいでゾンビに負担がかかったような気がしました。1.2023年にマインドメッドが実施した患者調査に基づいています。投資家向けプレゼンテーション | 2024年3月21日:全般性不安障害、SOC:標準治療

現在の治療法は効果的でない、または許容されないことが多く、 何度も切り替えたり用量を調整したりする必要があります。プライマリケアのフォローアップ訪問、毎日の経口診断、毎日の経口診断 + Rx切り替えと用量患者治療調整投資家向けプレゼンテーション | 2024年3月 22 出典:。会社の市場 リサーチ。

精神疾患に関する数十年にわたるLSDの臨床研究が、その 独自の潜在的投資家向けプレゼンテーションを裏付けています | 2024年3月23日

MM120 全般性不安障害(GAD)用LSD-酒石酸塩第2b相試験の 全トップライン結果のまとめダニエル・R・カーリン医学博士、マサチューセッツ州最高医療責任者

GADの第2b相試験から得られた12週間のトップライン結果:MM120 2を単回投与した後の効果の強い 持続性1 • 主要評価項目とすべての副次評価項目を統計的に有意に満たしました。MCP-Mod分析の結果は、GADにおけるMM120の用量反応関係を裏付けています 3,4 • 12週間で観察された 効果量が大きいことは標準治療の2倍以上です o 少なくとも3か月の耐久性 MM120の単回投与が観察されました • 12週目のHAM-Aスコアの統計的および臨床的に有意な21.9ポイントの改善(p=0.0025)は3を表します4週間のトップラインデータからのさらなる改善 o 12週目でも継続的な改善が見られた迅速で持続的な臨床活動 12週間の観察期間を通じて臨床的・統計的に臨床的・統計的に臨床的・統計的に有意な改善が見られました MM120は忍容性が高く、関連する重篤な有害事象はありませんでした o 薬物クラスと先行研究と一致する、ほとんど一過性の軽度から中等度の有害事象 6 o No drug-関連する重篤な有害事象(SAE)があり、自殺関連の安全信号はありません • 長期的にサポートします単回投与MM120の耐久性と、100 µgのMM120をGAD 1のフェーズ3開発に進めることをさらにサポートすると考えています。 出典:MMED008の内部調査文書と計算を調べてください。100µgの用量群とプラセボを比較して、個々のグループの結果が報告されました。2.HAM-A、CGI-S、MADRSを含む、12週目のトップライン分析で分析されたすべての二次エンドポイントを表します。 3。100 µgの用量グループに基づいています。HAM-AスコアはANCOVA LS平均に基づいています。LSを使用した研究統計学者による事後計算に基づく効果量グループ間の平均変化と、グループ全体のHAM-A終了スコアの併合標準偏差です。4. すべての研究(HAM-A(ハミルトン不安尺度)を利用した20件の研究と、PARS(小児不安尺度)を使用した1件の研究の一次アウトカム測定におけるベースライングループ割り当ての検査です。出典:RB Hidalgo、J Investor プレゼンテーション | 2024年3月25日サイコファーマコール。2007年11月21日; 21 (8): 864-72。5.寛解は、HAM-Aスコアが7.5以下と定義されています。6.報告された有害事象に基づく自殺傾向の評価。

MM120の第2b相試験では、標準のGAD設計とエンドポイントが使用され、 はFDAの医薬品クラス向けのガイダンス草案と一致していました。• 承認された薬剤の登録をサポートしているエンドポイントを含む標準GAD研究のデザイン • 無作為化、二重盲検、プラセボ対照試験、12週間のランダム化、二重盲検、プラセボ対照試験、o MM120またはプラセボの単回投与 o 心理療法的介入なし 2 o その後発行されたFDA 20と密接に連携した試験デザイン 23 ランダム化の前に不安薬物療法で打ち切られた患者に関するガイダンス草案 • GAD の198人の患者を登録しました • 5群の1:1:1:1 のランダム化による用量最適化設計 • 主要評価項目:4週目のハミルトン不安尺度(HAM-A)の変化は、治療割り当てと訪問番号1を認識していない中央評価者による評価。出典:MMED008の内部調査文書と計算を調べてください。投資家向けプレゼンテーション | 2024年3月 26 2.FDA 2023ドラフトガイダンス:サイケデリックス薬:臨床研究に関する考慮事項。

1フェーズ2b試験の概略図合計198人の参加者(実績)研究 MMED008 | GAD第8週のMM120 12 -5から-1 1 1 2 4 A フェーズ 2b 一般用量フォローアップスクリーニングにおけるMM120の単回投与に関する投与最適化研究 MM120 200 µg 主な入力基準 MM120 100 µg • 男性と女性 • 年齢 18-74 MM120 50 µg • G診断 AD MM120 25 µg • HAM-A ≥ 20プラセボ追加エンドポイント • MADRS• EQ-5D-5L • CGI-S/I• PSQIランダム化プライマリエンドポイントの二次エンドポイント • PGI-S /C• ASEX (HAM-A) (HAM-A) • SDS 1.出典:研究MMED008の内部研究文書。μg:マイクログラム、HAM-A:ハミルトン不安評価尺度、MADRS:モンゴメリー-アスバーグうつ病評価尺度、CGI-S:臨床グローバルインプレッション- 重症度; PGI-S:患者グローバルインプレッション-投資家向けプレゼンテーション | 2024年3月27日重症度; SDS:シーハン障害尺度; EQ-5D-5L:EuroQQ OL-5ディメンション、PSQI:ピッツバーグ睡眠品質指数、ASEX:アリゾナ州性的体験尺度

フェーズ2bの治療パラダイム:1番の精神療法的介入を伴うスタンドアロンの薬物効果 • 室内の投与セッションモニター(DSM)には心理療法的介入はありません 2 • 2023年のFDAドラフトガイダンスに沿ったデリバリープロトコル • フェーズ 2とフェーズ3の間の薬物送達に変更は予定されていません。治療後の治療中 ✓ 包括的なインフォームドコンセントプロセス ✓ DSMによる継続的なモニタリング ✓ 評価のみを目的としたフォローアップ訪問 ✓ 適格性評価 ✓ 音楽、アイ シェード、リーディング、ライティング Journey in MMED008 ✓退院基準が満たされたときに結論を出します x「準備」なし x「介助療法」なし x「統合」が患者ジャーニーに含まれていない x 治療前の活動 が x 心理療法も治療もない x 継続的な治療的関与なし x MMED008 としての治験薬以外の包括的なインフォームドコンセントプロセスの介入 1.ソース:MMED008の内部調査 文書を調べてください。投資家向けプレゼンテーション | 2024年3月 28 2.FDA 2023ドラフトガイダンス:サイケデリックス薬:臨床研究に関する考慮事項。
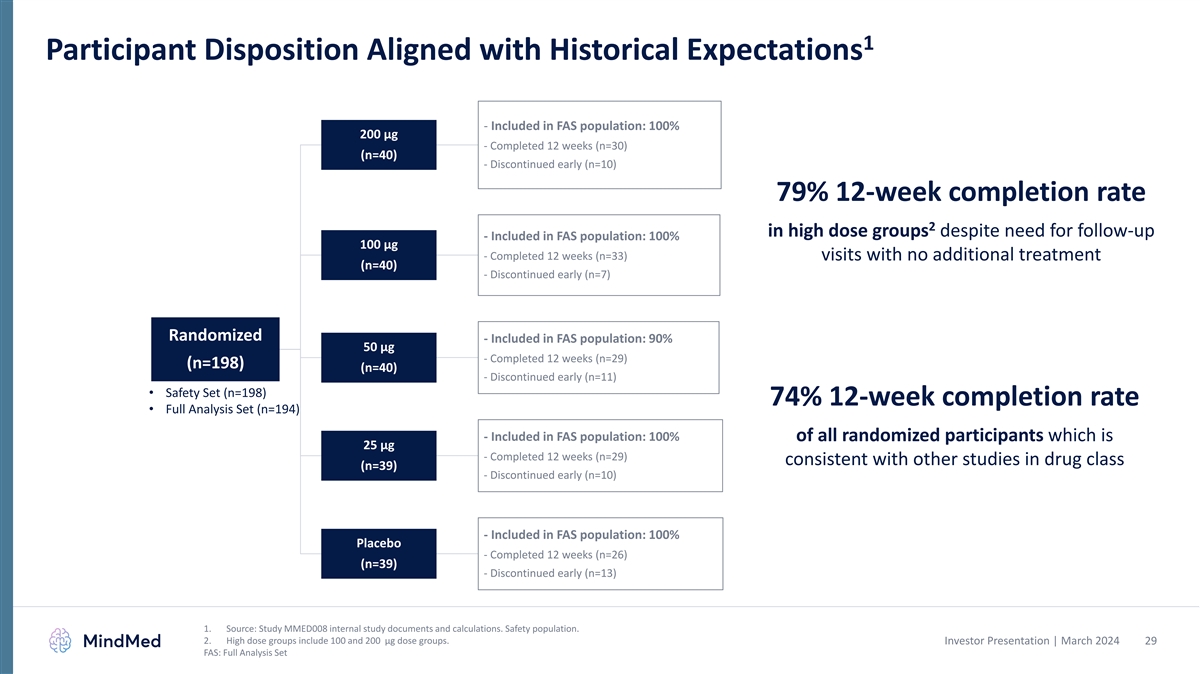
1 参加者の過去の期待に沿った配置- FAS集団に含まれる:100% 200 µg-12週間完了 (n=30) (n=40)-早期中止 (n=10)-早期中止 (n=10)-フォローアップが必要なにもかかわらず12週間の修了率 79%-FAS集団に含まれる:100% 100 µg-追加治療なしで12週間 (n=33) の訪問を完了しました (n=40)-解消早期継続(n=7)ランダム化-FAS集団に含まれる:90% 50 µg-12週間完成(n=29)(n=198)(n=40)-早期廃止(n=11)• 安全セット(n=198)-12週間の 修了率 74% • フル分析セット(n=194)-FAS集団に含める:25µgの全ランダム化参加者の100%-薬物クラスの他の研究と同様に12週間(n=29)完了(n=39)-早期中止(n=10)- FAS対象集団:100%プラセボ-12週間完了(n=26)(n=39)-早期中止(n=13)1。出典:MMED008の内部調査文書と計算を調べてください。安全人口。2.高用量グループには、100および200 µgの用量 グループが含まれます。投資家向けプレゼンテーション | 2024年3月29日 FAS:フル分析セット

参加者の人口統計とベースラインの特徴一般的に バランスが取れています 1 グループ全体 MM120 プラセボ人口統計 (n=194) 25 µg 50 µg 100 µg 200 µg (n=39) (n=36) (n=40) (n=40) (n=39) 平均年齢 (年) 38.0 45.3 42.7 42.1 38.7 38.7 38.7 性別、女性 (%) 51.3% 55.6% 40.0% 70.0% 66.7% 人種 (白人の割合) 84.6% 80.6% 90.0% 82.5% 76.9% ベースライン HAM-A スコア 30.2 30.3 29.3 31.0 30.3 ベースライン CGI-Sスコア 4.9 4.9 4.8 5.1 4.9 1.出典:MMED008の内部調査文書と計算を調べてください。全分析セットの母集団。投資家向けプレゼンテーション | 2024年3月30日

HAM-Aスコア の統計的および臨床的に有意な低下は1週目から2週目まで続きました 12週目からHAM-Aベースライン2への変化 0 ベースラインからの変化 • 4週目:-21.3ポイント • 12週目:-21.3ポイント • 12週目:-7.6ポイント、p=0.0004 • 12週目:-7.7ポイント、p=0.003 -15 -20*** ****** -25 ** ** ** p
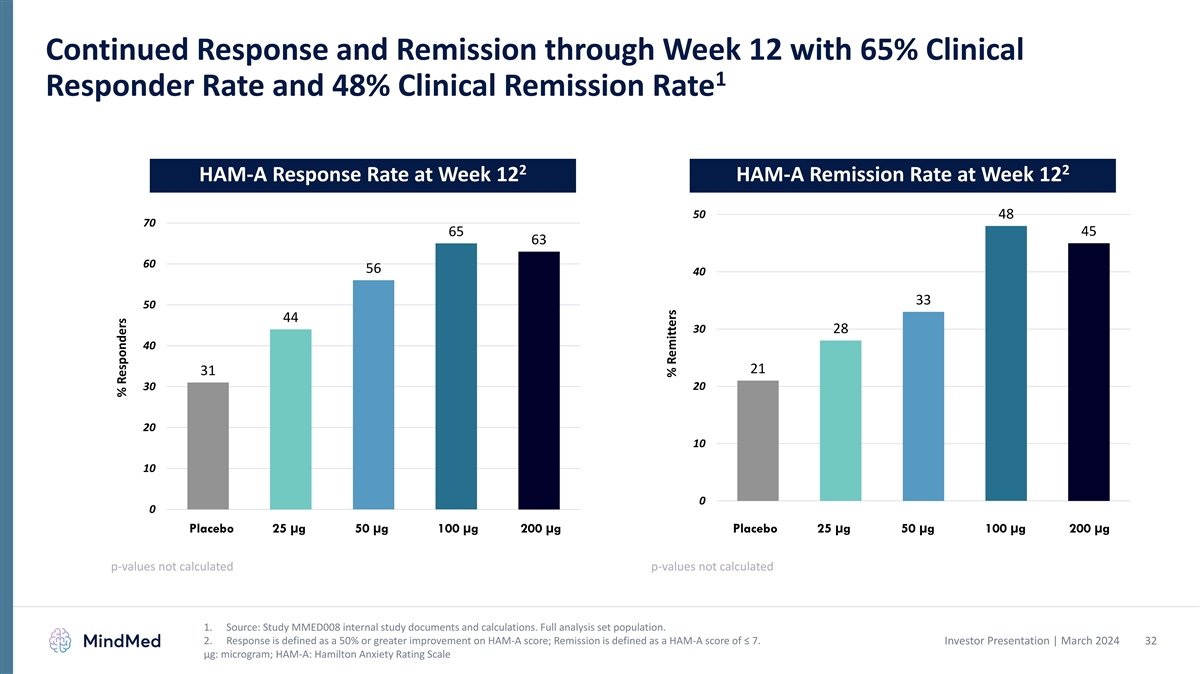
12週目までの継続的な奏効と寛解 2、12週目のHAM-A反応率、12週目のHAM-A反応率 12週目のHAM-A寛解率 12週目のHAM-A寛解率 50 48 70 65 45 63 60 56 40 33 50 44 30 28 40 21 31 30 20 20 10 10 0 プラセボ 25 µg 50 µg 100 µg 200 µg 200 µg µgのp値が計算されていません p値は計算されていません 1.出典:MMED008の内部調査文書と計算を調べてください。完全な分析セットの母集です。2.反応は HAM-Aスコアが50%以上向上したことと定義され、寛解とはHAM-Aスコアが7以下と定義されます。投資家向けプレゼンテーション | 2024年3月 32 μg: マイクログラム; HAM-A: ハミルトン不安評価尺度% 回答者% 送金者

一次および主要二次分析(MCP-Mod)は、GADにおけるMM120の用量反応1の関係 2つのMCP-Mod分析からの重要なポイント •複数のモデル適合による統計的に有意な用量反応関係 •GADの今後の研究のために100 µgの用量選択をサポートします • 事前に指定されたモデル推定と観察された反応が、第3相試験の用量選択につながります Dose 1です。出典:MMED008の内部調査文書と計算を調べてください。完全な分析セットの母集です。2.出典:ノバルティス。「MCP-Mod方法論 — 用量反応の統計的方法論です。投資家向けプレゼンテーション | 2024年3月 33 `モデル・メーンズ

臨床的グローバル印象の迅速かつ持続的な改善 — 重症度1(CGI-S)2日目から12週目まで続く 2週目、12週目、6週目に100µgのCGI-Sスコアが改善しました-重症 • 2日目と5日目までに統計的および臨床的に有意な改善 — 著しく 12週目まで維持されました 4 — 中等度の病気 • CGI-S の2単位以上の改善 12週目までのGI-Sスコア**** 3 — 軽症*** ** • 参加者の平均は2人 — の境界線が 週12で軽症に境界線になる 1 — 正常、まったく病気ではない。ベースライン2日目4週目 12週目プラセボ 100 µg*p
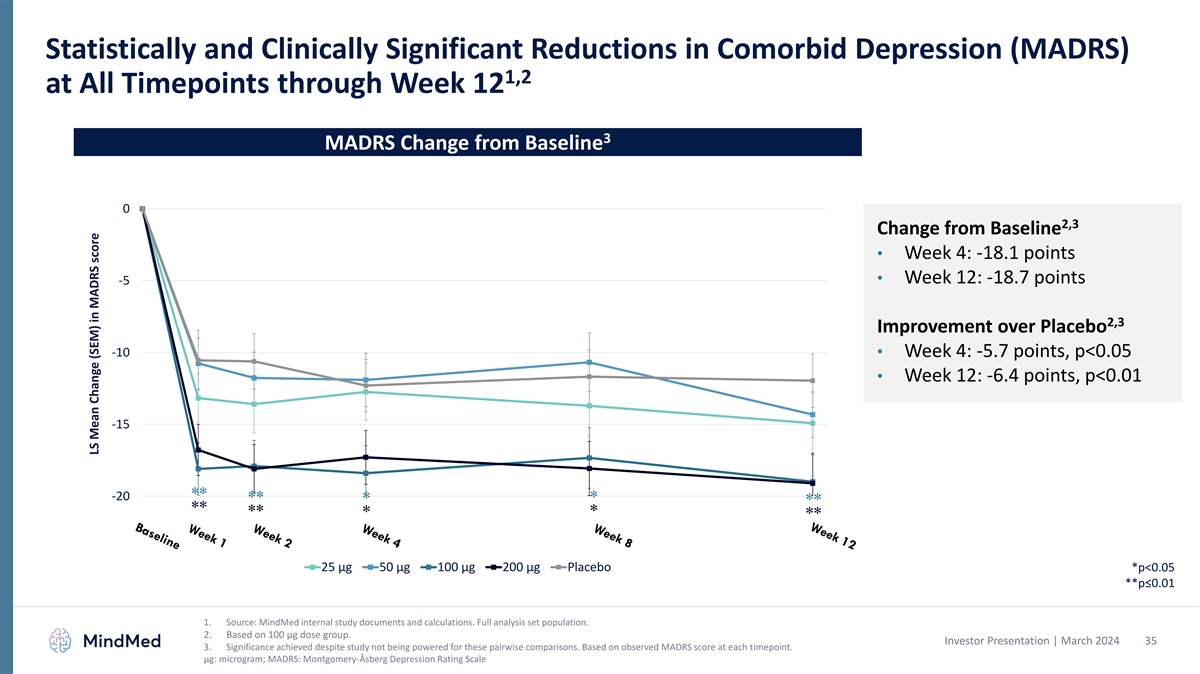
12週目までのすべての時点での併存疾患 うつ病(MADRS)の統計的および臨床的に有意な減少 3 MADRSベースライン0からの変化 2,3 ベースラインからの変化 • 4週目:-18.1ポイント • 12週目:-18.7ポイント -5 2,3 プラセボ-10からの改善 • 4週目:-5.7ポイント、p

MM120は、ほとんどが一過性の軽度から中等度 の有害1イベントで耐容性が高かった • ほぼすべてのAE(99%)が重症度が軽度から中等度でした。耐容性は良好でした。• 最小限(2.5%)のTEAEにより研究中止プロファイル2 •薬物関連の重篤な有害事象 イベント(SAE)に関連するSAEはありませんでした •50 µgの用量群に属し、無関係な研究と見なされました薬物 • 過去の研究と薬物クラスと一致する有害事象プロファイル • 自殺や自傷行為はない自殺行為 行動なし • 1群あたり参加者2人以下研究中に報告された自殺念慮3または自殺願望シグナル • 自殺傾向または自殺関連リスクの増加の兆候はない 1.ソース:MMED008の内部調査文書と 計算を調べてください。安全人口。2.50 µgの用量群で1つの重篤な有害事象(SAE)が観察されました。研究98日目のパニック発作で、治療とは関係がないと判断されました。投資家向けプレゼンテーション | 2024年3月 36 3.報告された有害事象に基づく自殺傾向評価

高用量群で最も一般的な(10%以上)TEAEは 良好で、1,2耐容性プロファイル MM120推奨用語:プラセボ(n=39)25 µg 50 µg 100 µg 200 µg(n=39)(n=40)(n=40)(n=40)、AE DD AFT DD ADFT イリュージョン 12(31)1(2.6)(45) 1 (2.5) 24 (60) 1 (2.5) 30 (75) — 3 (7.7) — 吐き気 3 (7.7) — 11 (28) — 16 (40) 1 (2.5) 24 (60) 2 (5.0) 1 (2.6) 2 (5.1) 頭痛 4 (10) 2 (5.1) 9 (23) 2 (5.0) 10 (25) 4 (10) 10 (25) (2.5) 8 (21) (2.6) 幻覚、ビジュアル 6 (15) 1 (2.6) 9 (23) — 9 (23) — 6 (15) — 1 (2.6) — ユーフォリアムード 2 (5.1) — 5 (13) — 11 (28) — 6 (15) — 1 (2.6) — 不安 1 (2.6) 3 (7.7) 3 (7.5) 3 (7.5) 4 (10) — 5 (13) 1 (2.5) — 2 (5.1) ミドリアシス 1 (2.6) — 7 (18) — 8 (20) — 4 (10) — 1 (2.6) — 多汗症 1 (2.6) — 4 (10) — 9 (23) — 5 (13) — — 知覚異常2 (5.1) — 2 (5.0) — 2 (5.0) — 8 (20) — 2 (5.1) 1 (2.6) 血圧上昇 3 (7.7) — 5 (13) — 4 (10) — 4 (10) — — — めまい 3 (7.7) — 2 (5.0) — 3 (7.5) — 5 (13) — 1 (2.6) — 震え — 3 (7.5) — 2 (5.0) 1 (2.5) (20) — — — — 思考の異常 1 (2.6) — 2 (5.0) — 4 (10) 1 (2.5) 5 (13) — — PSEE 幻覚— — 3 (7.5) — 3 (7.5) — 4 (10) — — — — 異常な感じ 1 (2.6) — 2 (5.0) — — — 4 (10) 1 (2.6) 1 (2.6) COVID-19 — 1 (2.6) — 1 (2.6) — 4 (10) — — 1.出典:MMED008の内部調査文書と計算を調べてください。 安全人口。2.高用量グループには、100および200 µgの用量グループが含まれます。投資家向けプレゼンテーション | 2024年3月 37 AFT:投与日の後、DD:投薬日、TEAE:治療によって生じる有害事象。

MM120 LSD-酒石酸全般性不安障害(GAD)MM120 ODT PK ブリッジ研究ダニエル・R・カーリン、MD、マサチューセッツ州最高医療責任者
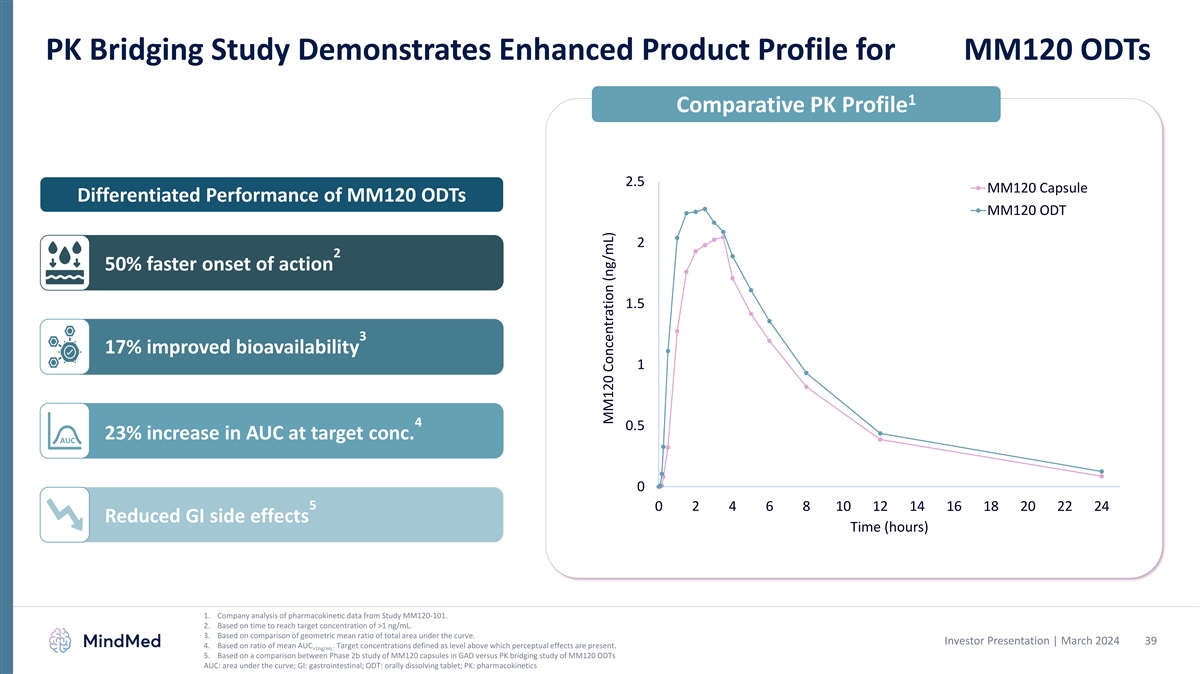
PKブリッジ調査は、MM120 ODTsの強化された製品プロファイルを示しています 1の比較PKプロファイル 2.5 MM120カプセル MM120 DOTの差別化された性能 MM120 ODT 2 2 50% 作用の開始 1.5 3 17% バイオアベイラビリティの向上 1 4 0.5 23% のターゲットコンシーでのAUCの増加AUC 0 5 0 2 4 6 8 10 12 14 16 18 20 22 24 消化管副作用の軽減時間 (時間) 1.MM120-101試験の薬物動態データを企業で分析しています。2.1 ng/mLを超える目標濃度に達するまでの時間に基づいています。3.曲線下の総面積の幾何平均比率の比較に基づいています。 投資家向けプレゼンテーション | 2024年3月 39 4.平均AUCの比率に基づいています。目標濃度は、それを超えると知覚効果が現れるレベルとして定義されます。>1ng/mL 5.GAD中のMM120カプセルの第2b相試験とMM120 ODTを対象としたPK ブリッジング研究の比較に基づいています。AUC:曲線下領域、GI:胃腸、ODT:経口溶解錠剤、PK:薬物動態 MM120濃度(ng/mL)

1 MM120 ODT PK ブリッジング研究概略研究 MM120-101 | ODT-PK ブリッジング 29人の参加者合計(実績)2つの製剤の薬物動態を比較するための第1相非盲検試験2つの製剤の薬物動態を比較するための第1相試験健康なボランティアのMM120の21日目から-1 1 2-13 14日目15-29日目投与量 2回のフォローアップウォッシュアウト用量 1スクリーニング MM120 MM120エントリー基準 Zydis ODT Zydis ODT • 男性と女性(100 µg)(100 µg)• 18〜55歳 • 健康なボランティア • 禁止薬なし MM120 MM120カプセルカプセル(100 µg)(100 µg)登録 1.MM120-101インベスタープレゼンテーションに関する社内調査 文書に基づいています | 2024年3月 40 ODT:経口溶解錠剤

MM120 ODTとカプセルの比較PKは、1 MM120ドットの良好なプロファイル を示しています 2.5 MM120 カプセル MM120 MM120 1 2 PK パラメーター MM120 MM120 2 PK パラメーター MM120 ODT カプセル 1.5 T (hr) 2.25 2.0 max C (ng/mL) 2.63 2.68 1 max AUC (ng*hr/ml) 15.7 18.7 0-∞ 0.5 AUC (ng*hr/ml) 9.7 12.7 12.7 0 >1ng/mL 0 0 2 4 6 8 10 12 14 16 18 20 22 24 時間 (時間) 1.MM120-101試験の薬物動態データを企業で分析しています。両方の投与セッションを完了したn=24人の被験者に基づくPK分析。投資家向けプレゼンテーション | 2024年3月 41 AUC:曲線の下の面積、C:最大達成濃度、 ODT:経口溶解錠剤、PK:薬物動態、T:最大濃度までの時間(最大MM120濃度)(ng/mL)

MM120 ODTは、吸収が速く、 目標濃度に達するまでの時間が短いことを示しています 1.2 MM120カプセル 1 MM120 ODTsの差別化されたPKプロファイル MM120 ODTS MM120 ODTS 1 2 50% 作用の開始 0.8 0.6 3 17% バイオアベイラビリティの向上 0.4 4 0.2 23% AUCが目標濃度を上回りましたAUC 0 0 10 20 30 時間 (分) 1. MM120-101試験から得られた薬物動態データを企業で分析しています。両方の投与セッションを完了したn=24人の被験者に基づくPK分析。2.1 ng/mLを超える目標濃度に達するまでの時間に基づいています。3.曲線の下の 総面積の幾何平均比の比較に基づいています。投資家向けプレゼンテーション | 2024年3月 42 4.平均AUCの比率に基づいています。目標濃度は、知覚効果が現れるレベルとして定義されます。>1ng/mL AUC:曲線の下の面積、ODT:経口溶解錠剤、 PK:薬物動態 MM120濃度(ng/mL)
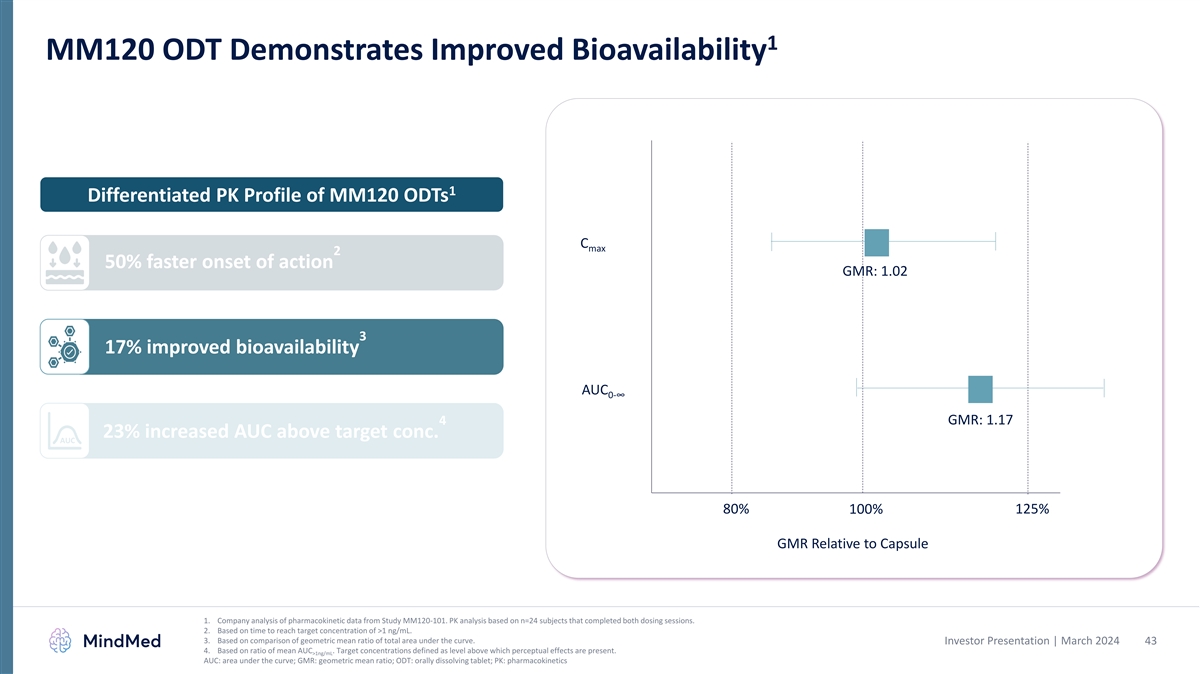
1 MM120 ODTはバイオアベイラビリティの改善を実証します 1 MM120 DOTの分化PK プロファイル C 最大2:作用の開始が最大で 50% 速い GMR:1.02 3 17% バイオアベイラビリティの向上 AUC 0-∞ GMR:1.17 4 23% AUCが目標濃度を上回りました。カプセル1と比較して、AUC 80% 100% 125% GMR。MM120-101試験の薬物動態データ の企業分析。両方の投与セッションを完了したn=24人の被験者に基づくPK分析。2.1 ng/mLを超える目標濃度に達するまでの時間に基づいています。3.曲線下の総面積の幾何平均比率の比較に基づいています。投資家 プレゼンテーション | 2024年3月 43 4.平均AUCの比率に基づいています。目標濃度は、知覚効果が現れるレベルとして定義されます。>1ng/mL AUC:曲線の下の面積、GMR:幾何平均比、ODT:経口溶解錠剤、PK: 薬物動態
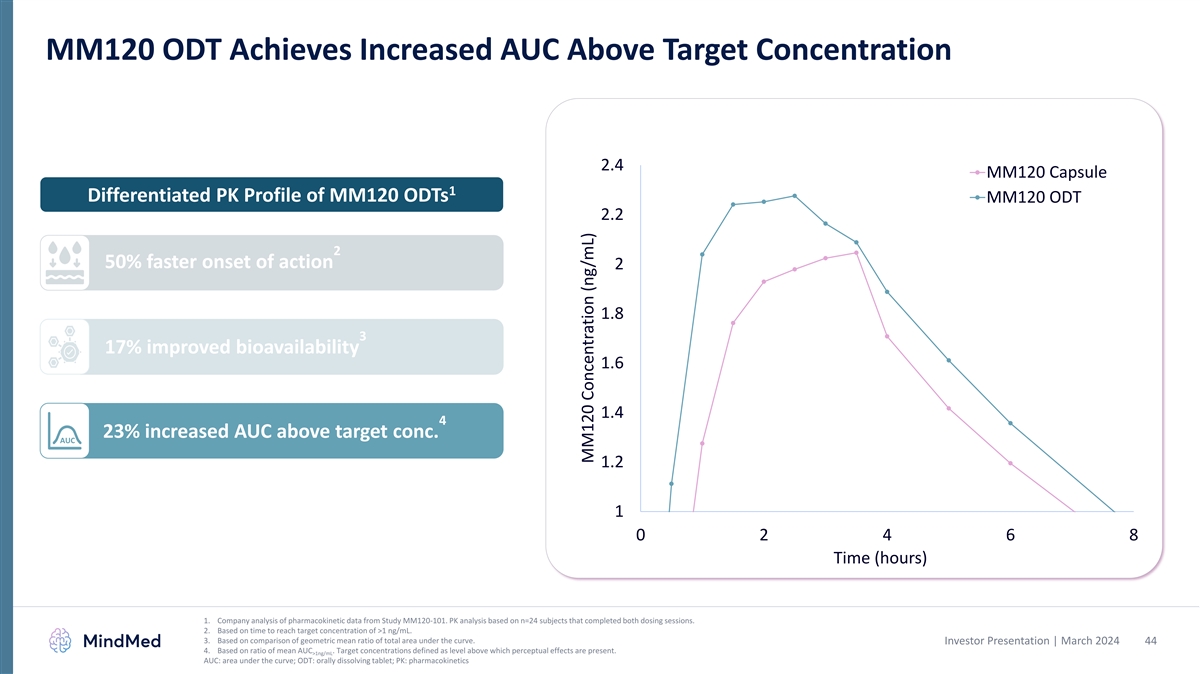
MM120 ODTは目標濃度を上回るAUCの増加を実現します 2.4 MM120カプセル 1 MM120ドットの差別化されたPKプロファイル MM120 ODT 2.2 2 作用の開始が 50% 速くなります 2 1.8 3 17% バイオアベイラビリティの向上 1.6 1.4 4 23% AUCが目標濃度を上回りましたAUC 1.2 1 0 2 4 6 8 時間 (時間) 1.MM120-101試験で得られた薬物動態 データの企業分析。両方の投与セッションを完了したn=24人の被験者に基づくPK分析。2.1 ng/mLを超える目標濃度に達するまでの時間に基づいています。3.曲線下の総面積の幾何平均比率の比較に基づいています。投資家 プレゼンテーション | 2024年3月 44 4.平均AUCの比率に基づいています。目標濃度は、それを超えると知覚効果が現れるレベルとして定義されます。>1ng/mL AUC:曲線の下の面積、ODT:経口溶解錠剤、PK:薬物動態 MM120濃度(ng/mL)

MM120 LSD-D-酒石酸塩商業機会フランソワ・リリエンタール、医学博士、 MBA 最高商務責任者

MM120に大きな商業的機会をもたらす主な要因が整っています 重要な大規模で満たされていないニーズ市場が大幅に確立されたクラス最高の償還コマーシャル・プロファイル・フレームワーク潜在的大規模で堅調に価値が高まるインフラ提案投資家向けプレゼンテーション | 2024年3月 46

精神科医療従事者は、サイケデリックが1つの不安神経症とうつ病の 治療を根本的に変えることを期待しています。% GAD提供者全員が同意しています 2人のSpravatoプロバイダー 86% 84% 78% 74% 73% 62% FDA承認のサイケデリック治療は貴重なものになるでしょう。不安神経症やうつ病の根本的な 治療へのサイケデリック治療は、将来不安神経症の治療選択肢となるでしょう不安神経症の治療法を変え、不安神経症や抑うつ、うつ病へのアプローチ方法を変えましょう 1.精神科医と精神科ナースプラクティショナー 2.出典:MindMedのプライマリーマーケットリサーチ — Spravato® プロバイダーとGAD処方者の間での主な顧客認識(2024年2月)。Spravato® 以外のプロバイダーの総数(n=125)、投資家向けプレゼンテーション | 2024年3月 47人のSpravato® プロバイダー(n=50)。3.Spravatoプロバイダー:Spravato® 治療を推奨、紹介、または処方し、Spravato® 治療を個人的に、または彼女/彼のクリニックやオフィスで監視または投与しました。

精神科医の大多数は、MM120の臨床活動と の全体的なプロファイルに感銘を受けています 1,2% MM120に感銘を受けた精神科医の87% 87% 86%* 73%全体的な臨床活動開始活動の持続性(HAM-Aの減少)活動全体の印象の持続性(HAM-Aの減少)(2日目のCGI-S)(12週目のHAM-A)1.出典:MindMed 一次市場調査 — Spravato® プロバイダーとGAD処方者の間での主な顧客認識(2024年2月)。スプラヴァート® 以外のプロバイダーの総数 (n=125)、スプラヴァート® プロバイダー (n=50)。投資家向けプレゼンテーション | 2024年3月 48 2. 精神科医と精神科ナースプラクティショナー CGI-S:臨床グローバルインプレッション — 重症度; HAM-A:ハミルトン不安尺度
MM120商用モデルは、Spravato® によって確立された、実証済みで急速に拡大している インターベンショナル精神医学モデルを活用しています • Spravato® の認定分娩クリニックが3,500件を超えています • 実証済みの償還、書類、物流経路 • ブロックバスター の予測により急速に拡大しています。出典:J&Jインベスターデーのプレゼンテーション、2023年12月、ジョンソン・エンド・ジョンソンスプラヴァート® のウェブサイト。会社ごとに編集されています。投資家向けプレゼンテーション | 2024年3月 49

患者ケアと償還のための実証済みの経路はすでに存在しています 診断+ Rx治療セッション薬物患者精神科医 /専門分野を通じてライセンスによる監視 1 2 処方HCP HCP薬局の償還支払者 1.患者に薬を処方する免許を持つ医療従事者。2.医師、臨床心理学者、ナースプラクティショナー、看護師、看護師、認可された臨床ソーシャルワーカー、認可を受けた家族および投資家向けプレゼンテーション | 2024年3月 50人の結婚療法士など。

すべての利害関係者のために、医薬品とセッションデリバリーの両方の を含むすべての利害関係者のために、年間費用Spravato® ステークホルダーへの償還/コーディング活動ローカルまたはテレヘルスの医療給付 3 最大1,200ドルの評価と処方:処方者E&Mコード(992XX)またはGコード4~25,000ドル — 薬局給付薬(割引を除く)および専門薬局のJまたはSコードを除いた62,000メーカー + 調剤料のリベート医療給付金2 地域のHCPからE&Mコード5まで最大17,000ドルセッションデリバリーモニター治療長期の場合は時間単位 で払い戻し臨床セッションスタッフサービス 1.患者に薬を処方する免許を持つ医療従事者。2.医師、臨床心理学者、ナースプラクティショナー、看護師、看護師、認可された臨床 ソーシャルワーカー、認可された家族および結婚療法士などが含まれる場合があります。3.1回の訪問につき150ドルの想定費用で、最大8回の評価訪問に基づいています。MM120のCPTコードと払い戻しは設定されていません。投資家向けプレゼンテーション | 2024年3月 51 4. メーカー価格は、1セッションあたりキャニスター2つか3つ、年間34〜56セッションを掛けたものです。MM120のCPTコードと払い戻しは設定されていません。5.最長112時間のモニタリングが必要で、1時間あたり約150ドルが支給されます(出典:MindMedのプライマリーリサーチ)。MM120のCPTコードと払い戻しは設定されていません。

MM120は、 臨床プロファイルとセッションデリバリープロファイルの両方でSpravato® よりも大きな利点があります。1 2 MM120 活動の持続時間 1週間以内 3か月 + 最大112時間 ~ 8〜32時間の治療を受けるのに費やした時間 /年最大112時間 ~ 8〜32時間の治療を受けるのに費やした時間。治療回数 56 1〜4セッション/年最大56件の提出。保険やレムス保険への書類への提出 1〜4回、REMSに必要 REMSに必要な良好な耐容性生理学的側CVモニタリングフェーズ2b、研究効果のモニタリング 1.Spravatoの処方情報と https://www.spravatorems.com にあるSpravato REMSに含まれる情報 に基づいています。2.MM120がFDAの承認を受けて市販されれば。投資家向けプレゼンテーションでの統計的に有意な減少 の実証に基づく、耐久性、耐容性、および関連する治療間隔の仮定| 2024年3月、第2b相臨床試験MMED008の第12週目の52HAM-A。MM120の投与セッションあたり平均8時間のモニタリングを想定しています。
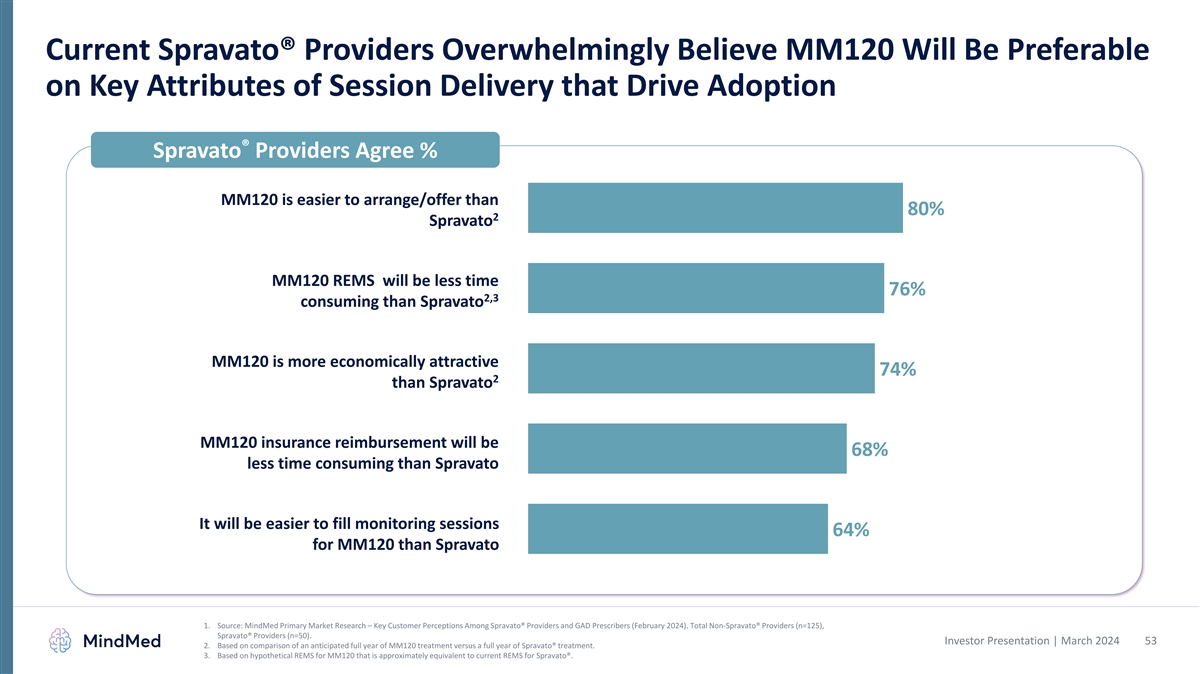
現在のSpravato® プロバイダーは、採用を促進するセッション配信の主要な属性から、MM120が 好まれると圧倒的に信じています® Spravatoプロバイダーは、MM120が80%よりも手配/提供が容易であることに同意しています。SpravatoMM120 REMSは、Spravato MM120よりも76%、消費電力は76%短く、消費量はSpravatoMM120よりも3%経済的です 魅力的です。68%の払い戻しは Spravatoよりも% 時間がかからないMM120の方がSpravato1よりもモニタリングセッションを 64% 簡単に埋めることができます。出典:MindMedの一次市場調査 — Spravato® プロバイダーとGAD処方者における主要な顧客 の認識(2024年2月)。スプラヴァート® 以外のプロバイダーの総数 (n=125)、スプラヴァート® プロバイダー (n=50)。投資家向けプレゼンテーション | 2024年3月 53 2.通年の予想される MM120治療と1年間のSpravato® 治療の比較に基づいています。3.現在のSpravato® のREMSとほぼ同等の、MM120の仮想REMSに基づいています。

® 現在のSpravatoプロバイダーの大多数は、 MM120を紹介、1、処方、投与する可能性が高いと回答しています。92% 現在のSpravato® プロバイダーは、現在のSpravato® プロバイダーを紹介する可能性が高いです。2 2人の患者をMM120に処方し、MM120 1を投与する可能性が高いです。出典:MindMedのプライマリーマーケットリサーチ — Spravato® プロバイダーとGAD処方者の間での主な顧客認識(2024年2月)。スプラヴァート® 以外のプロバイダーの総数 (n=125)、スプラヴァート® プロバイダーの総数 (n=50)。投資家向けプレゼンテーション | 2024年3月 54 2.MM120がFDAの承認 になり、市販されれば。

MM120の潜在的価値に関する支払者の視点 対応の予測可能性とコンプライアンス治療コースにおける不安の永続的な軽減により、プロファイルが低廃棄物と併存疾患をサポートできるようになり、資源の効率的な使用が軽減されます。予算への影響、医療利用およびコスト負担 2 1 3 治療コースの初期段階での対応の予測可能性行動上の健康問題はコストを押し上げます... 行動衛生の開発はスペースの効率的な利用を可能にします。すべての雇用主が関心を持っているのはそれです。 はいくら言っても足りません。... 観察報道、資源、心理評価補償、E&Mコード... そして判例には、Spravatoや睡眠「研究」などがあります... 満たされていないニーズがあり、FDAの承認を受ければカバーされます... 1 — BCBS地域支払者出典:会社は米国の支払者を対象に定性調査を実施しました。MindMed 2023アナリストデー。投資家向けプレゼンテーション | 2024年3月 55

GADは、従業員の離職を促し、仕事の生産性低下と重度1グループコントロール 2GADと診断され、雇用主に大きな影響を与えます • MM120の潜在的な影響は、直接的な健康上の利益にとどまらず、幅広い価値の欠勤を促します 6.0% 21.0% 提案 • 雇用主はプレゼンティーズムにおいて重要な役割を果たしています 14.1% 47.5% 支払者の主要な利害関係者としての報酬の促進 16.4% 53.0% 生産性の低下情報源:NHWS 2022年次調査 1.GAD-7投資家向けプレゼンテーションで測定されたGAD症状のない一般集団 | 2024年3月 56 2 GAD-7で測定した重篤な症状

MM120の商業的機会を実現するための焦点を絞った戦略の推進 ステークホルダーへの教育とアクセスの最大化、GADとMM120の償還について MM120バリュープロポジション MM120セッション提供を現在のインフラに統合する投資家向けプレゼンテーション | 2024年3月 57

MM120開発計画チーフ 執行役員ロバート・バロウに対するコメントのまとめ

複数の研究がMM1201のフェーズ3開発を支持しています • フェーズ2開発の目標の達成 o GADにおける用量選択に役立つ特徴的な用量反応 o 検証済みのエンドポイントに対する迅速で持続的な治療効果のGADにおける統計的に有意で臨床的に有意な大きな効果 o 心理療法的介入なしでの単独の薬物効果 • MM120 oフェーズ2bの活性を裏付ける複数の二重盲検プラセボ対照試験 GADでの対照投与量最適化試験(MMED008研究)または1つの 以前の現代、不安障害におけるリゼルギドの無作為化プラセボ対照IIT o 不安障害やその他の神経障害におけるリゼルジドに関する20件以上の過去の研究 • 第2b相データは、用量の選択と第3相開発1への進めに役立ちます。出典:MMED008の内部調査文書と計算を調べてください。投資家向けプレゼンテーション | 2024年3月 59

MM120開発経路1 • 2つの第3相臨床試験 、12週間のランダム化プラセボ対照一次有効性試験デザインまたは再治療パラメーターを確立するための非盲検延長を計画中、2024年後半に第3相開発を開始する予定です • 主要な設計要素は、4週目にハミルトン不安尺度(HAM-A)の第2b相試験と第3相試験の間で一貫性があると予想されます o 主要な包含/除外基準への限定的な変更 o 投与セッションモニタリングプロトコルに予定された変更はありません 1.フェーズ3と その後の臨床試験デザインは、規制当局との話し合いと審査の対象となります。フェーズ2の終了会議なども含まれます。投資家向けプレゼンテーション | 2024年3月 60

MM120とパイプラインプログラムの次のステップと予想されるマイルストーン Q1 2024年Q3 2024年第4四半期 MM120 GAD MM120 GAD フェーズ2b/12週間トップライン科学会議での全データプレゼンテーション MM120 GAD Zydis ODT PKブリッジングデータ MM120 GAD MM120 GAD フェーズ3の開始 FDAとのフェーズ2の終了ミーティング MM120 MM402/R-MDMAフェーズ1 IIT(UHB主催)の追加の臨床適応症を評価します(UHB主催)トップライン投資家向けプレゼンテーション | 2024年3月 61

質疑応答投資家向けプレゼンテーション | 2024年3月

付録

1,3 65% 12週目に達成されたHAM-A反応率(HAM-A)2 HAM-A 回答率長期にわたるHAM-A 回答率 90 78 78 80 75 70 68 70 65 63 58 60 56 54 53 51 51 50 49 50 47 44 38 40 33 31 31 31 30 20 10 0 週 1 週 2 週 4 週 8 週 12 p値は計算されませんでしたプラセボ 25 µg 50 µg 1。 出典:MMED008の内部調査文書と計算を調べてください。完全な分析セットの母集です。2.回答とは、HAM-Aスコアが 50% 以上向上したことと定義されています。投資家向けプレゼンテーション | 2024年3月 3.100 µgの用量群に基づいています。μg: マイクログラム; HAM-A:ハミルトン不安評価尺度。回答者の割合

1,3 48% 12週目に達成された寛解率(HAM-A)2 HAM-A の長期にわたる寛解率 60 50 50 48 45 45 45 43 40 38 35 33 33 33 33 33 31 30 28 28 26 25 21 21 20 18 15 10 0 週 1 週 2 週 4 週 8 週 12 p値は計算されませんでしたプラセボ 25 µg 50 µg 100 µg 100 µg 200 µg 1.出典: MMED008の内部調査文書と計算式を調べてください。完全な分析セットの母集です。2.寛解は、HAM-Aスコアが7以下と定義されています。投資家向けプレゼンテーション | 2024年3月 3.100 µgの用量群に基づいています。μg: マイクログラム、HAM-A: ハミルトン 不安評価尺度。送金者の割合

臨床的グローバルインプレッションの統計的に有意な改善 — 重症度(CGI-S)1,2スコアが2日目までに達成され、12週目まで持続しました 6 — 重症5 — 重症 5 — 著しい病気 4 — 中等症 * *** 3 — 軽症 * *** * * * * * 2 — 境界疾患1 — ベースライン2日目ではなく正常週 1 週 2 週 4 週 8 週 12 全然病気になりません*p
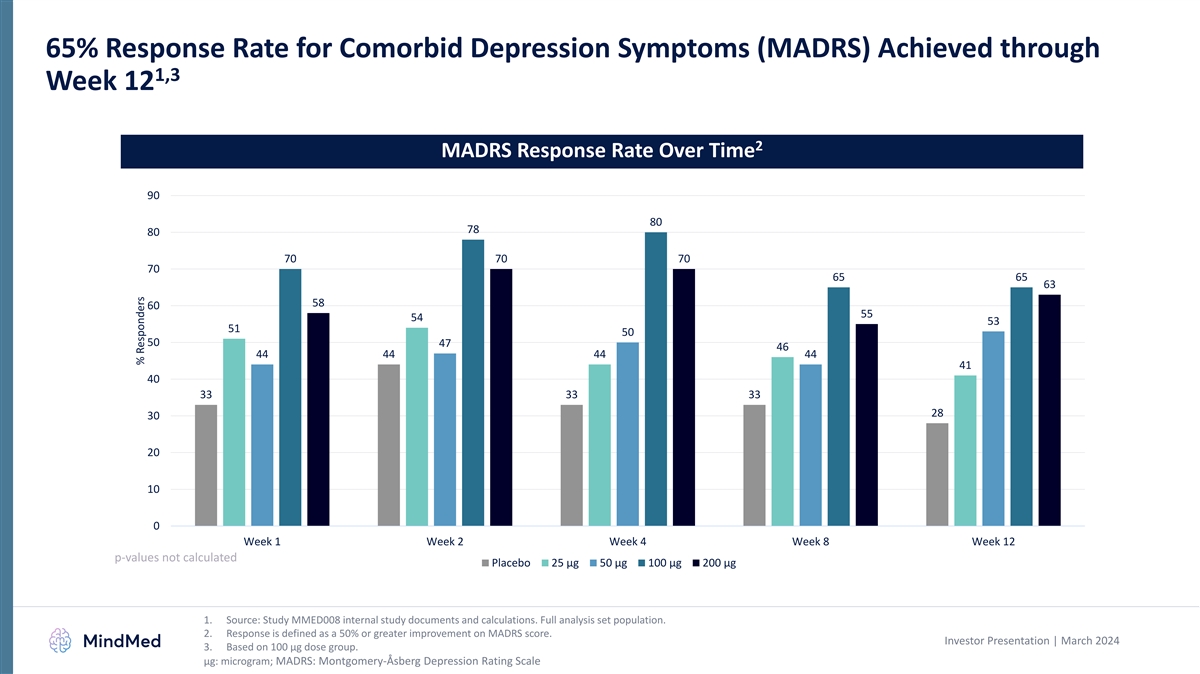
1,3週目までの併存するうつ病症状(MADRS)に対する65%の回答率 12 2 MADRS回答率の経時変化 90 80 78 80 70 70 70 70 70 70 65 65 63 58 60 55 54 53 51 50 50 47 46 44 44 44 44 44 44 44 41 40 33 33 33 33 28 30 20 10 0 週 1 週 2 週 4 週 8 週 12 p値は計算されませんでしたプラセボ 25 µg 50 µg 50 µg µg 1.出典:MMED008の内部調査文書と計算を調べてください。完全な分析セットの母集です。2.回答とは、MADRSスコアが 50% 以上向上したことと定義されています。投資家向けプレゼンテーション | 2024年3月 3.100 µg 用量群に基づいています。μg: マイクログラム; MADRS: モンゴメリー・アスベルグうつ病評価尺度反応者の割合
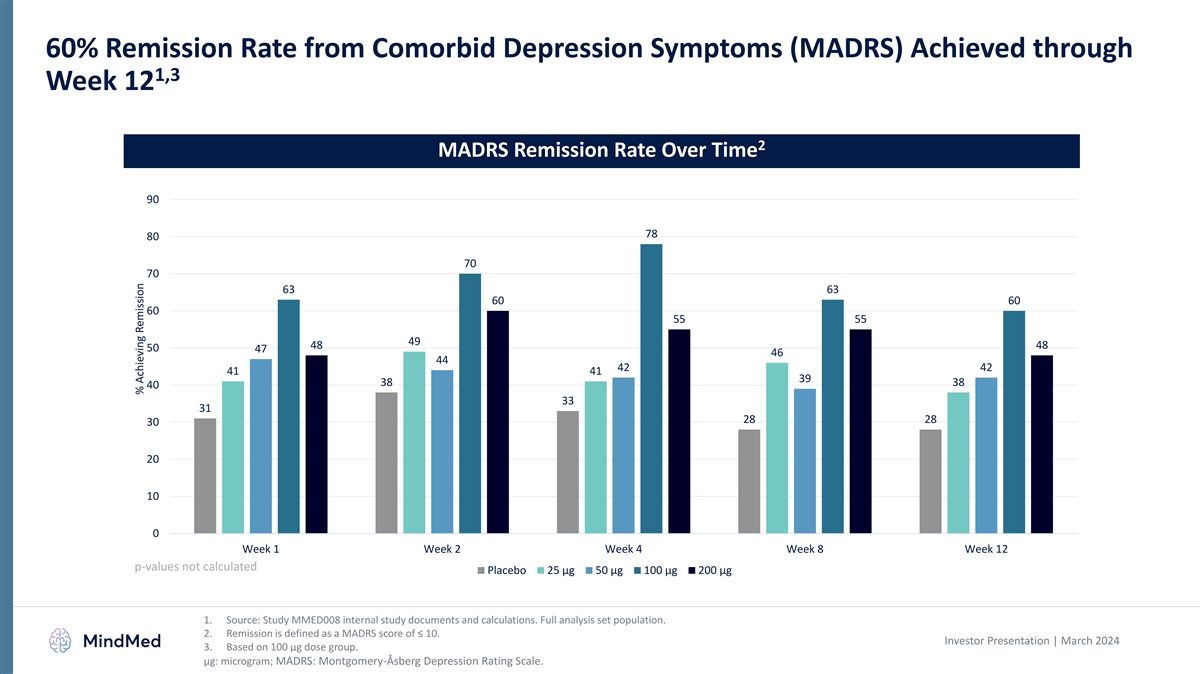
から1,3週目までの併存するうつ病症状(MADRS)からの60%の寛解率 12 2 MADRSの長期にわたる寛解率 90 78 80 70 70 63 63 60 60 60 55 55 49 48 48 50 47 46 44 42 41 41 39 38 38 40 33 31 28 30 20 10 0 週 1 週 2 週 4 週 8 週 12 p値は計算されませんでしたプラセボ 25 µg 50 µg 100 µg 200 µg 1.出典:MMED008の内部調査文書と計算を調べてください。完全な分析セットの母集です。2.寛解とは、MADRSスコアが10以下のものとして定義されます。投資家向けプレゼンテーション | 2024年3月 3.100 µgの用量グループに基づいています。 μg: マイクログラム; MADRS: モンゴメリー・オスベルグうつ病評価尺度。寛解を達成した%
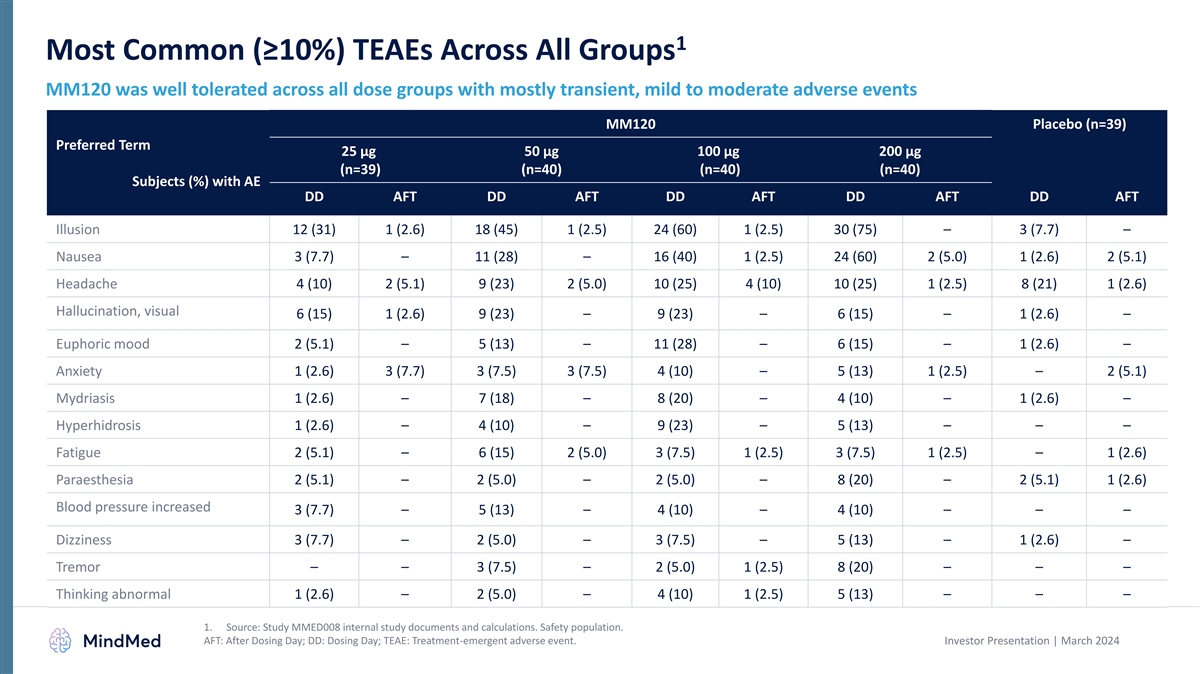
1 すべてのグループで最も一般的な(10% 以上)TEAE MM120は、ほとんどが一過性の軽度から中等度の有害事象を伴うすべての用量群で良好な 耐容性を示しました MM120 プラセボ(n=39)推奨期間 25 µg 50 µg 200 µg(n=39)(n=40)(n=40)AE DD aft DD AFT DD AFT DDの被験者(%) AFT イリュージョン 12 (31) 1 (2.6) 18 (45) 1 (2.5) 24 (60) 1 (2.5) 30 (75) — 3 (7.7) — 吐き気 3 (7.7) — 11 (28) — 16 (40) 1 (2.5) 24 (60) 2 (5.0) 1 (2.6) 2 (5.1) 頭痛 4 (10) 2 (5.1) 9 (23) 2 (5.0) 10 (25) 4 (10) 10 (25) (2.5) 8 (21) (2.6) 幻覚、ビジュアル 6 (15) 1(2.6) 9 (23) — 9 (23) — 6 (15) — 1 (2.6) — 陶酔感 2 (5.1) — 5 (13) — 11 (28) — 6 (15) — 1 (2.6) — 不安 1 (2.6) 3 (7.7) 3 (7.7) 3 (7.5) 4 (10) — 5 (13) 1 (2.5) — 2 (5.1) ミドリア症 1 (2.6) — 7 (18) — 8 (20) — 4 (10) — 1 (2.6) — 多汗症 1 (2.6) — 4 (10) — 9 (23) — 5 (13) — — 疲労 2 (5.1) — 6 (15) 2 (5.0) 3 (7.5) 1 (2.5) — 1 (2.6) 感覚異常 2 (5.1) — 2 (5.0) — 2 (5.0) — 8 (20) — 2 (5.1) 1 (2.6) 血圧上昇 3 (7.7) — 5 (13) — 4 (10) — 4 (10) — 4 (10) (10) — — — めまい 3 (7.7) — 2 (5.0) — 3 (7.5) — 5 (13) — 1 (2.6) — 震え —— 3 (7.5) — 2 (5.0) 1 (2.5) 8 (20) — — — 考え方が異常 1 (2.6) — 2 (5.0) — 4 (10) 1 (2.5) 5 (13) — — 1.出典:MMED008の内部調査文書と計算を調べてください。安全人口。AFT:投与日の後、DD:投与日、TEAE:治療によって生じる有害事象。投資家向けプレゼンテーション | 2024年3月

1 すべてのグループで最も一般的な(10% 以上)TEAE(続き)MM120は すべての用量群で耐容性が高く、ほとんどが一過性の軽度から中等度の有害事象を伴いました MM120 プラセボ(n=39)推奨期間 25 µg 50 µg 100 µg 200 µg(n=39)(n=40)(n=40)AE DD AFT DDの被験者(%)AFT DD AFT DD AFT バランス障害 — 4 (10) — 3 (7.5) — 2 (5.0) — 1 (2.6) — 疑似幻覚 — — 3 (7.5) — 3 (7.5) — 4 (10) — — 嘔吐 — 2 (5.0) — 5 (13) — — — 注意障害 1 (2.6)) — 5 (13) 1 (2.5) — 1 (2.5) — — — — 異常な感じ 1 (2.6) — 2 (5.0) — — — 4 (10) 1 (2.6) COVID-19 — 1 (2.6) — 2 (5.0) — 1 (2.5) — 4 (10) — — 1.出典:MMED008の内部調査文書と計算を調べてください。安全人口。AFT:投薬日の後、DD:投与日、TEAE:治療によって誘発される有害な イベント。投資家向けプレゼンテーション | 2024年3月