エキシビション 99.2

ナスダック:ABUS www.arbutusbio.com 2024年2月29日コーポレートプレゼンテーション © 2024 アービュートス・バイオファーマ株式会社

将来の見通しに関する記述このプレゼンテーションには、Uの意味における将来の見通しに関する記述が含まれています。S。1995年の民間証券訴訟改革法とカナダの証券法。歴史的事実ではないすべての記述は、この目的のための将来の見通しに関する記述としてここに特定され、とりわけ、HBVの潜在的な市場機会、満たされていない重大な医療ニーズを満たすArbutusの能力、予想される期間におけるArbutusの現金および現金同等物の十分性、Arbutusの臨床開発計画および臨床試験の予想費用、時期、および結果に関する記述が含まれます。第三者との臨床コラボレーション。Arbutusの製品候補が達成する可能性希望または予想される結果、Arbutusの製品候補のタイミングと臨床開発に関するArbutusの期待(明確な臨床目標を含む)、HBVの併用治療までのタイムライン、第三者にライセンスされた技術に関するArbutusの期待、戦略契約および/またはライセンス契約に関連する予想される時期と支払い、特許侵害訴訟、およびArbutusの将来の事業、将来の財務実績に関するその他の声明、将来の財政状態、見通し、その他将来のイベント。このプレゼンテーションに含まれる将来の見通しに関する記述に関して、Arbutusは、とりわけ、予想される支払いの適時受領、臨床前の研究と臨床試験の有効性と適時性、およびデータの有用性、規制当局の承認の適時性、Arbutusの資産に対する継続的な需要、経済と市場の状況の安定性など、多くの仮定を立てています。アービュートスはこれらの仮定は妥当だと考えていますが、これらの仮定は本質的に、ビジネス、経済、競争、市場、社会における重大な不確実性と、特許訴訟問題に関連する不確実性や不測の事態などの不測の事態の影響を受けます。ここに記載されている将来の見通しに関する記述には、既知および未知のリスク、不確実性、およびその他の要因が含まれており、実際の結果、出来事、または進展が、そのような将来の見通しに関する記述によって表明または暗示される将来の結果、出来事、または進展と大きく異なる可能性があります。このような要因には、とりわけ、予想される前臨床試験および臨床試験は、予想よりも費用がかかったり、完了するまでに時間がかかったり、開始または完了できなかったり、試験薬候補の将来の開発を保証する結果が得られない可能性がある、製品候補と臨床開発活動に関するArbutusの戦略の変更、Arbutus製品の臨床開発に必要な規制当局の承認を受けていない可能性がある、経済性などがあります。そして市況は悪化する可能性があります。不確実性が伴います訴訟全般、特に特許訴訟。市場の変化により、戦略的焦点の変更が必要になる場合があり、両当事者はコラボレーションから期待される利益を決して実感できない可能性があります。Arbutusが直面しているリスクと不確実性についてのより詳細な議論は、Arbutusのフォーム10-Kの年次報告書、フォーム10-Qの四半期報告書、およびArbutusの定期開示書類に記載されています。これらはwww. sec.govとwww. sedar.comにあります。ここに記載されているすべての将来の見通しに関する記述は、すべてこの注意書きの対象となります。Arbutusは、法律で義務付けられている場合を除き、将来の見通しに関する記述を改訂または更新する義務、または将来の結果、出来事、進展を反映するためにここに含まれる将来の見通しに関する記述の改訂結果を公表する義務を一切負いません。2 © 2024 Arbutus Biopharma, Inc.

私たちの価値創造戦略は、慢性HBVを標的とする差別化された治療パイプラインを発見して開発することにより、ウイルス感染の理解と治療における私たちのチームの専門知識によって確立された成功の実績を活用します。抗ウイルス薬と免疫薬を含む併用療法を開発して、chBV患者に治療期間が限定され、機能的治癒率が20%以上になるようにします。HBV:B型肝炎ウイルス | CHBV:慢性 HB V 3 © 2024 アービュートスバイオファーマ株式会社

投資のハイライト堅調な財政状態未だ満たされていない医療ニーズと大きな市場機会がある特許取得済みのLNP技術特有のMOAを含む社内で発見された資産のポートフォリオ複数のフェーズ2a併用臨床試験におけるRNAi治療複数のフェーズ2a併用臨床試験におけるRNAi治療ウイルス学の専門知識と確かな実績を持つチーム 2026年第1四半期までのHBVキャッシュランウェイの機能的治療法の開発に注力データによると、imdusiranは一般的に安全で耐容性が高く、オンまたはオフのときにHBsAgを有意に抑制することが示されています治療 RNAi 治療薬 PD-L1阻害剤 AlnylamのOnpattro® から生じたライセンス料を受け取り、Moderna&Pfizer/BionTechに対してCOVID-19ワクチンを販売複数の薬を発見、開発、商品化しました。MOA:作用機序 | PD-L1:プログラム死-リガンド1 | HBsAg:B型肝炎表面抗原 4 © 2024 アービュートス・バイオファーマ株式会社

パイプライン AB-101 CHBV NA: ヌクレオシド類似体 5 イムドゥシラン (AB-729) chBV RNAi 治療用 PD-L1 阻害剤 AB-101-001 単回/複数-昇順投与 © 2024 Arbutus Biopharma, Inc. プレ?$#@$ニカルフェーズ 1 フェーズ 2 フェーズ 3 市販品 AB-729-201 コンボトライアル (イムデュシラン+ ペグ-IFI) α-2a + NA) AB-729-202 コンボ試験 (イムデュシラン+ワクチン + NA +/-チェックポイント阻害薬) AB-729-001 単回投与-昇順/複数-昇順投与量

HBVの概要 B型肝炎ウイルス(HBV)による生命を脅かす肝臓感染症体液を介して母から子供に感染する長期慢性感染症(ChBV)は、肝硬変や肝臓がんのリスクを高めます。原因と症状の診断 HBsAgの検出疾患の段階を決定するために必要な追加のバイオマーカー治療 NA療法 — HBV DNAと肝硬変のリスクを減らすことを目的とした生涯にわたる毎日の治療、および/または HCCペグ-IFN α — 毎週投与。耐容性が低い
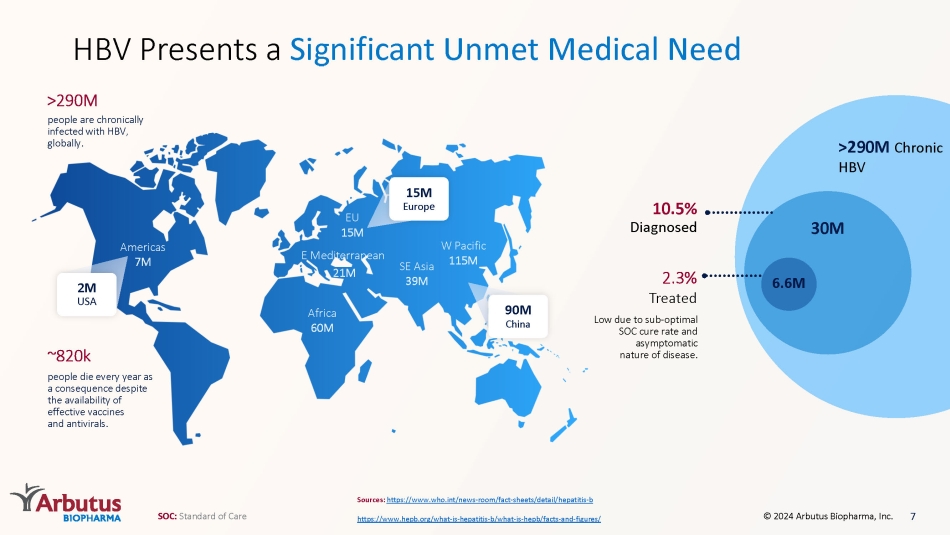
アフリカ 6000万東地中海 2100万東南アジア 3900万西太平洋 1100万人 EU 1500万南北アメリカでは、効果的なワクチンや抗ウイルス薬が入手できるにもかかわらず、毎年700万人〜82万人が死亡しています。人々は世界中で慢性的にHBVに感染しています。>29億>9億人の慢性HBV感染源:https://www.who.int/news-部屋/事実-シート/詳細/肝炎-b https://www.hepb.org/what-is-肝炎-b/何-は-ハーブ/事実-そして-数字/ HBVは満たされていない重大な医療ニーズ 3,000万 660万 2.3% のSOC治癒率と病気の無症候性のために低く治療されています。10.5% が診断されました 200万米国、1500万ヨーロッパ、9000万中国 7 SOC:標準治療 © 2024 アービュートスバイオファーマ株式会社

抑制抑制ブーストウイルスDNAとcccDNAプールウイルス抗原-HBsAg宿主免疫システム、HBV治癒につながるHBsAg宿主免疫システム 3-治療成功への長期的アプローチ治療を成功させるには、相補的なMOAを含む薬剤の組み合わせが必要です。HBV DNAを抑制するウイルス抗原を減らす宿主の免疫応答を高める 8 NA RNAi RNAi PD-L1阻害剤インターフェロン治療ワクチン © 2024 Arbutus Biopharma, Inc.

9 RNAi治療薬 © 2024 アービュートス・バイオファーマ株式会社

独自のGalNAC-コンジュゲートデリバリー技術により、肝臓をターゲットにし、皮下投与を可能にします。すべてのHBV転写産物を標的とするシングルトリガーRNAiエージェントは、HBV複製を抑制し、すべてのHBV抗原を低下させます。HBV遺伝子型全体の汎遺伝子型活性を低下させます。他の薬剤との相補性が実証された肝臓を積極的に標的にしますccDNA由来で統合されたHBsAg転写産物に対して活性用語前臨床安全性研究 RNAi 治療薬 Imdusiran GalNAc n リンカーポリメラーゼ、コアAg、eAg、pgRNA Sag Sag HBx 10 © 2024 Arbutus Biopharma、株式会社。
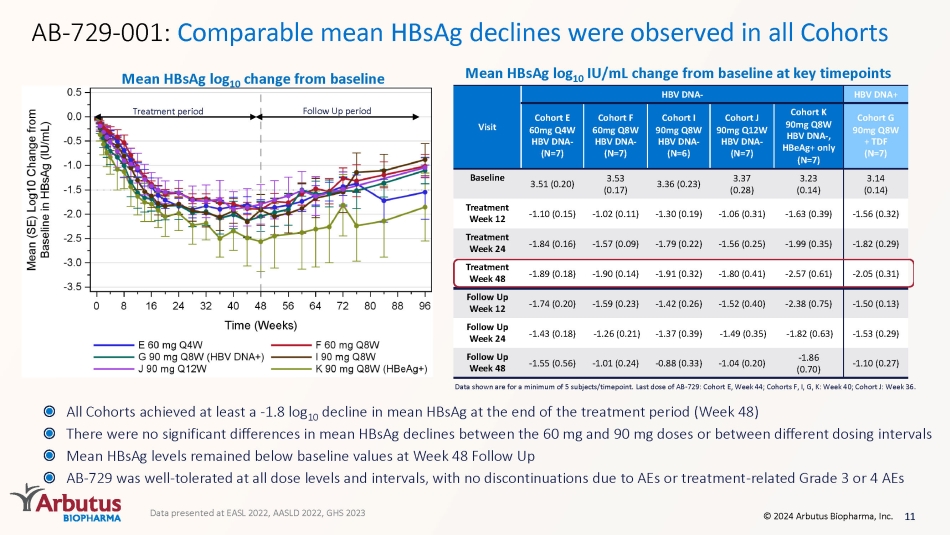
11 © 2024 Arbutus Biopharma, Inc. AB-729-001:すべてのコホートで同等の平均HBsAg低下が観察されました。すべてのコホートは、治療期間の終わり(48週目)に平均HBsAgが少なくとも-1.8対10の低下を達成しました。60mgと90mgの投与量の間、または異なる投与量の間で、平均HBsAg低下に有意差はありませんでしたで比較すると、平均HBsAgレベルは48週目でもベースライン値を下回っていました。フォローアップAB-729は、すべての用量レベルと間隔で十分に許容され、AEや治療関連のグレード3または4のAEによる中止はありませんでした。表示されているデータは、1タイムポイントあたり最低5つの件名のものです。ABの最終投与量-729:コホートE、44週目、コホートF、I、G、K:40週目、コホートJ:36週目。平均HBsAgログ10のベースラインからの変化平均HBsAgログは、主要な時点でのベースラインからの10 IU/mlの変化治療期間のフォローアップ期間のデータは平均(SE)ログ10 IU/mlとして表示されます。最低5件/時点。AB-729の最終投与コホートE: 第4週、コホートF、I、G、K: 40週目、コホートJ: 36週目; HBsAgアッセイLLOQ = 0.07 IU/ml; *N=6; # N=5 HBV DNAを訪問-HBV DNA+ コホート 60mg Q4W HBV DNA-(N=7) Cohr C 60mg Q8W HBV DNA-(N=7) コホートI 90mg Q8W HBV DNA-(N=6) コホートJ 90mg Q12W HBV DNA-(N=7) コホートK 90mg Q8W HBV DNA-(N=7) コホートK 90mg Q8W HBV DNA-、HBeag+ のみ (N=7) コホート G 90mg Q8W + TDF (N=7) =7) ベースライン 3.51 (0.20) 3.53 (0.17) 3.36 (0.23) 3.37 (0.28) 3.23 (0.14) 3.14 (0.14) 治療週 12 -1.10 (0.15) -1.02 (0.11) -1.30 (0.19) -1.06 (0.31) -1.63 (0.39) -1.56 (0.32) 治療週 24 -1.84 (0.16) -1。57 (0.09) -1.79 (0.22) -1.56 (0.25) -1.99 (0.35) -1.82 (0.29) トリートメントウィーク 48 -1.89 (0.18) -1.90 (0.14) -1.91 (0.32) -1.80 (0.41) -2.57 (0.61) -2.05 (0.31) フォローアップウィーク 12 -1.74 (0.23) -1.42 (0.26) -1.52 (0.26) -1.52 (0.52) 40) -2.38 (0.75) -1.50 (0.13) フォローアップ週 24 -1.43 (0.18) -1.26 (0.21) -1.37 (0.39) -1.49 (0.35) -1.82 (0.63) -1.53 (0.29) フォローアップ週 48 -1.55 (0.56) -1.01 (0.24) -0.88 (0.33) -1.04 (0.20) -1.86 (0.70) -1.10 (0.27) EASL 2022、AASLD 2022、GHS 2023で発表されたデータ

AB-729-001: イムドゥシランによる治療は、一部の患者のHBV特異的免疫を再活性化します 12 0 4 8121624283236404448525660 0 1 2 3 4 5 0 20 40 60 H B s A g (L o g 1 0 I U/m L) 患者 43 60 mg Q4W 0 4 8 1216202428323640444852 0 1 2 4 0 10 20 30 40 50 60 H B S A g (L o g 1 0 I U/m L) 患者 48 60 mg Q8W これまでに評価した7人の患者すべてでHBV-特異的T細胞活性化マーカーのアップレギュレーションが観察されました HBVの2つのプロファイル-特異的T細胞IFN-γ反応が観察されました HBsAg減少の最下点と一致する16〜28週間の上昇*イムドゥシランの投与が完了した後の48〜60週目のEASL 2022患者で発表されたデータ 42* 60 mg Q4W イムドゥシランHBVの増加-特異的T-細胞活性化イムドゥシランは消耗したT-細胞B a s e l i n E O T W k 3 2 ^ F/U W k 5 B a s e l i n e E O T W k 3 2 ^ F/u w k 5 6 0 10 20 30 F r e q u e n c y (%) 患者 43 ^ 最後の治療-治療用PBMCサンプルは、4週44週で最後の投与前に入手可能です。B a s e l i n e E O T k 4 0 F/U W k 5 2 2 B a s e l i n e e O T W k 4 0 F/U W k 5 2 0 10 20 30 F r e u u e n c y (%) 患者 48 B a s e l i n e EO T W k 4 4 F /U W k 6 0 B a s e l i n e E O T W k 4 F/U W k 6 0 0 10 20 30 F r e q u e n c y (%) 患者 42 © 2024 Arbutus Biopharma, Inc.

AB-729-001 臨床試験の重要なポイントイムドゥシランは、投与量、投与間隔、HBeAg、またはDNAの状態に関係なく、強固で同等のHBsAg低下を示しました。イムドゥシランとNAの両方の中止-治療の結果、大多数の患者のHBsAgとHBV DNAの持続的な減少につながりました。イムドゥシランは、41人の患者への投与を完了した後、一般的に安全で耐容性が高かったです。で、HBV-特異的T細胞免疫の回復と一部の患者さんの消耗T細胞の減少 13 © 2024 Arbutus Biopharma, Inc.

ChBV患者を対象とした継続的なNA療法とペグ-IFN α-2aの短期コースと組み合わせた第2a相POC臨床試験 AB-729-201:フォローアップ(24-週間)イムドゥシラン+ NA + IFN(n=12)NA + IFN(n=12)イムドゥシラン +NA+IFN(n=8)NA + IFN(n=8)Imdus+ NA(60mg Q8W)n=43 HBeAg-ランダム化フォローアップ(24-週間)1 52 28 24 40週間POC:概念実証主な目的:NA-ChBV抑制患者におけるペグ-iFNA-2aと併用したイムドゥシランの安全性と耐容性を評価します 24週間のフォローアップの後、患者は以下のように評価されます。セラピーをやめてください。NA療法を中止した患者は、さらに48週間追跡されます。最初の12人の被験者の12週間のIFN治療に関する予備データは、EASLコングレス2023マルチセンター、オープンラベルのフェーズ2a 14で発表されました。2024年上半期に予定されている治療データ © 2024 Arbutus Biopharma, Inc.

コホートごとの個人および平均HBsAg結果 15 AB-729-201:イムドゥシラン治療は一貫したHBsAg低下につながりました。IFNはさらなる低下の一因となる可能性があります。EASL 2023で発表されたデータ:IFN治療中、一部の患者でHBsAgの低下が続いたため、治療は概ね良好な忍容性を示しました。期間:リード期間中の平均HBsAg減少期-治療24週目のインフェーズは1.6 log 10でした。患者の93%(ランダム化された41人中38人)がHBsAgレベルでした
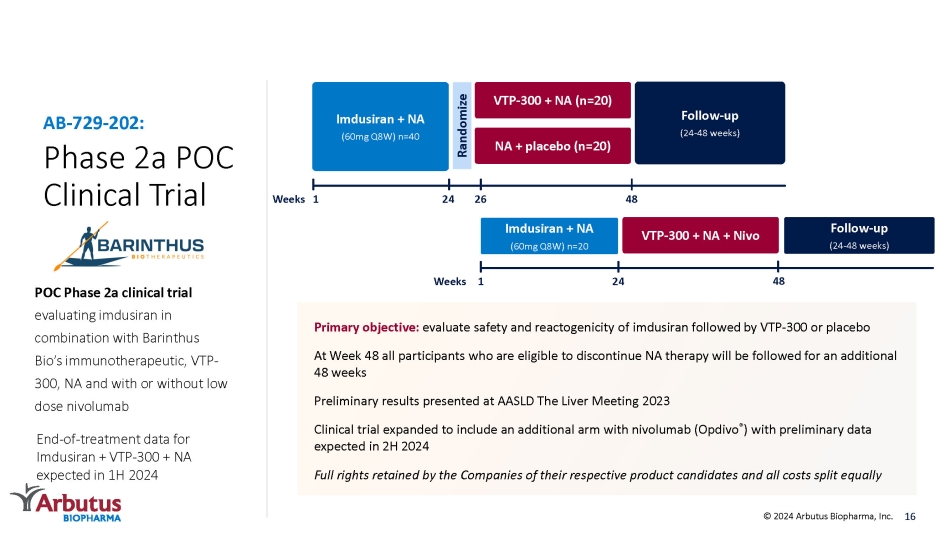
フェーズ2a、POC臨床試験、POCフェーズ2a臨床試験で、イムデュシランをBarinthus Bioの免疫療法薬VTP-300、NAと併用し、低用量ニボルマブAB-729-202を併用または併用しないかどうかを評価します。主な目的:イムデュシランとそれに続くVTP-300またはプラセボの安全性と反応原性を評価し、48週目にNA療法を中止する資格のあるすべての参加者はさらに48週間続きました AASLD The Liver Meeting 2023で発表された暫定結果臨床試験は、ニボルマブ(Opdivo®)を投与した別の治療群を含むように拡大されました2024年下半期に予定されている予備データそれぞれの製品候補について企業が保有する完全な権利とすべての費用を均等に分配します 16フォローアップ(24〜48週間)VTP-300+ NA(n=20)NA +プラセボ(n=20)1イムドゥシラン+ NA(60mg Q8W)n=40ランダム化週間イムデュシラン+ NA(60mg Q8W)n=20 24 VTP-300 + NA + Nivo 1 48 26 24 週 48 フォローアップ (24-48週間) © 2024 Arbutus Biopharma, Inc. イムドゥシラン+VTPの治療終了データ-300+ NAは2024年上半期に予定されています

17 © 2024 Arbutus Biopharma, Inc. AB-729-202: ImdusiranとVTPでHBsAgレベルが低下し持続しました-300治療平均HBsAgベースラインからの変化と主なマイルストーン AASLD 2023で発表されたデータ:イムデュシラン治療期間中にHBsAgの大幅な減少が見られました、患者の33/34(97%)に対して

18 © 2024 Arbutus Biopharma, Inc. AB-729-202:HBV-VTP-300の投与後に特異的T細胞反応と可溶性免疫バイオマーカーが増加しました。暫定結果:これまでにプロファイリングされたn=7人の患者を対象に、イムドゥシラン鉛中およびワクチン接種後にHBV(特異的T細胞IFN)産生の上昇が観察されました VTPのHBsAg、Pres1/S2ペプチド-300人の治療患者(n=4)イムドゥシランのリードインおよびワクチン接種期間中に、他の血漿免疫バイオマーカーの一時的な増加も観察されました。データAASLD 2023で発表されました。患者30人(グループA/VTP-300)は、VTP-300の後、48週目にかけてHBsAgの低下とIFN-γ産生の増加(EliSpot経由)を経験しました

戦略的コラボレーション独占ライセンス*と戦略的パートナーシップ中国本土、香港、マカオ、台湾でイムドゥシランを開発、製造、商品化イムドゥシラン前払い(2022年に受領)4,000万ドルの株式投資(2022年に受領)1500万ドルの商品化およびマイルストーン支払い年間売上高に対する最大2億4500万ドルの段階的ロイヤルティ*ABUSは、以下に対する非独占的な権利を保持します世界の他の地域でAB-729を利用するために、Qilu地域で開発および製造しています。Arbutusのディール経済学:Qilu Pharmaceutical:中国の大手製薬会社の1つが、このパートナーシップに開発、製造、商品化の専門知識を提供しています。China 19 © 2024 Arbutus Biopharma, Inc.

経口PD-L1阻害剤 20 © 2024 アービュートス・バイオファーマ株式会社

AB-101: 経口PD-HBV免疫再活性化のL1阻害剤 PD-1: プログラムされたデスリガンドタンパク質 | Abs: 抗体現在第1a/1b相臨床試験中です。理論的根拠 • HBV免疫耐性はChBV感染の重大な要因です • PD-1: PD-L1チェックポイント軸は、ChBVの免疫寛容に重要な役割を果たします • PD-PD-L1チェックポイント軸は、ChBVの免疫寛容に重要な役割を果たします。• PD-L1チェックポイント軸は、ChBVの免疫寛容に重要な役割を果たします。• PD-L1チェックポイント軸はChBVの免疫寛容に重要な役割を果たします HBV感染時に調節されます • PD-1はHBV(特異的T細胞とB細胞)でアップレギュレートされます • 一部のChBV患者のHBsAg喪失に伴う抑制 AB-10 • PD-L1/PD-1の相互作用をnM以下の濃度で遮断します •活性化しますHBV-インビトロでのChBV患者のT細胞における特異的免疫応答 • 新しいMOAが同定された • 生体内での強固なチェックポイント媒介効果を示す • HBV-特異的T細胞およびB細胞応答を生体外小分子阻害剤で改善する • チェックポイント遮断を制御できる • 経口投与が可能 • Abs 21 © 2024 Arbutus Bivoで見られる全身の安全性の問題を軽減するように設計されていますファーマ株式会社

AB-101: 小分子経口PD-HBV用のL1阻害剤 AB-101は非常に強力で、慢性HBV患者のHBV特異的免疫細胞を活性化します AB-101はHBV-特定のCHBV患者T細胞 PBMC N= 9人のChBV患者の細胞*p
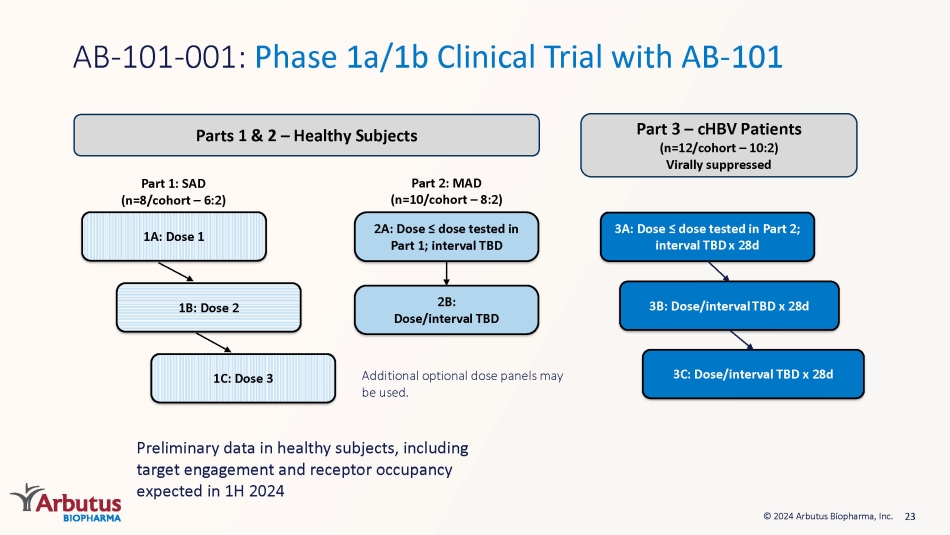
23 © 2024 Arbutus Biopharma, Inc. パート1:SAD(n=8/cohort — 6:2)1C:投与量3 1B:投与量2 1A:投与量1パート2:MAD(n=10/cohort — 8:2)2A:投与量≤パート1で試験した用量; 間隔未定 2B:投与量/間隔未定 3A:投与量≤パートで試験した用量 2; 間隔未定 x 28日 3B: 用量/間隔未定 x 28日 AB-101-001: 投与量/間隔未定 x 28日 AB-101-001: ABを用いたフェーズ1a/1b臨床試験-101パート1および2 — 健康な被験者パート3 — ChBV患者 (n=12/コホート — 10:2) ウイルス抑制追加のオプション用量パネルを使用できます。2024年上半期に予想されるターゲットの関与や受容体の占有率を含む、健康な被験者を対象とした予備データ

24 LNP訴訟:Modernaの最新情報-公判日 2025年4月21日* • マークマン公聴会が2024年2月8日に開催 — 裁判官はクレーム構築に関する議論を審理し、審理日から60日以内に命令を出す予定です • 次のステップ — 専門家の証言/宣誓供与 80% Genevantへの寄託 ArbutusはGenevantの株式の16%を所有していますArbutusのロイヤルティ/訴訟関連の20% 損害賠償 *上記の日付は、2024年2月27日の裁判所のスケジュール命令延長に含まれており、変更される可能性があります。© 2024 Arbutus Biopharma, Inc. Pfizer • 訴訟進行中 • 日付クレーム構築のヒアリングは設定されていません

2024の主要なマイルストーン *現金、現金同等物、有価証券で構成されています 25 予想タイミング 2024マイルストーン 1H AB-729-201 フェーズ 2a (imdusiran + IFN): 治療終了データ 1H AB-729-202 フェーズ 2a (imdusiran + VTP-300): 治療終了データ 1H AB-729-203 (imdusiran + デュルバルマブ):フェーズ2a臨床試験を開始 1H AB-101-001:健康な被験者コホート2H AB-729-202 フェーズ2a(イムドゥシラン+ VTP-300+ニボルマブ):暫定データ © 2024 Arbutus Biopharma、Inc.12月31日現在の現金残高*は1億3200万ドル2023年、2026年第1四半期へのキャッシュランウェイ、2024年の純キャッシュバーンは6300万ドルから6,700万ドルの間

ありがとう
© 2024 アービュートス・バイオファーマ株式会社