SDGR-2023123100014909782023会計年度誤りHttp://Fasb.org/us-GAAP/2023#IncreaseDecreeInEquitySecuritiesFvNiHttp://Fasb.org/us-GAAP/2023#IncomeLossFromEquityMethodInvestmentsHttp://Fasb.org/us-GAAP/2023#IncreaseDecreeInEquitySecuritiesFvNi後続事件[未定-潜在的なサブイベントへの開放]
42137400014909782023-01-012023-12-3100014909782023-06-30ISO 4217:ドル0001490978アメリカ-アメリカ公認会計基準:普通株式メンバー2024-02-21Xbrli:共有0001490978SDGR:有限株式保有メンバー2024-02-2100014909782023-12-3100014909782022-12-31ISO 4217:ドルXbrli:共有0001490978SDGR:未割当公有株式メンバ2023-12-310001490978SDGR:未割当公有株式メンバ2022-12-310001490978SDGR:有限株式保有メンバー2022-12-310001490978SDGR:有限株式保有メンバー2023-12-310001490978SDGR:ソフトウェア製品とサービスメンバー2023-01-012023-12-310001490978SDGR:ソフトウェア製品とサービスメンバー2022-01-012022-12-310001490978SDGR:ソフトウェア製品とサービスメンバー2021-01-012021-12-310001490978SDGR:DrugDiscoveryメンバー2023-01-012023-12-310001490978SDGR:DrugDiscoveryメンバー2022-01-012022-12-310001490978SDGR:DrugDiscoveryメンバー2021-01-012021-12-3100014909782022-01-012022-12-3100014909782021-01-012021-12-310001490978アメリカ-アメリカ公認会計基準:普通株式メンバー2020-12-310001490978SDGR:有限株式保有メンバー2020-12-310001490978US-GAAP:AdditionalPaidInCapitalMembers2020-12-310001490978アメリカ-公認会計基準:前払いメンバーを保留2020-12-310001490978アメリカ公認会計原則:他の総合収入メンバーを累計2020-12-310001490978アメリカ公認会計基準:非制御的利益メンバー2020-12-3100014909782020-12-310001490978アメリカ公認会計原則:他の総合収入メンバーを累計2021-01-012021-12-310001490978アメリカ-アメリカ公認会計基準:普通株式メンバー2021-01-012021-12-310001490978US-GAAP:AdditionalPaidInCapitalMembers2021-01-012021-12-310001490978アメリカ公認会計基準:非制御的利益メンバー2021-01-012021-12-310001490978アメリカ-公認会計基準:前払いメンバーを保留2021-01-012021-12-310001490978アメリカ-アメリカ公認会計基準:普通株式メンバー2021-12-310001490978SDGR:有限株式保有メンバー2021-12-310001490978US-GAAP:AdditionalPaidInCapitalMembers2021-12-310001490978アメリカ-公認会計基準:前払いメンバーを保留2021-12-310001490978アメリカ公認会計原則:他の総合収入メンバーを累計2021-12-310001490978アメリカ公認会計基準:非制御的利益メンバー2021-12-3100014909782021-12-310001490978アメリカ公認会計原則:他の総合収入メンバーを累計2022-01-012022-12-310001490978アメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-12-310001490978US-GAAP:AdditionalPaidInCapitalMembers2022-01-012022-12-310001490978アメリカ-公認会計基準:前払いメンバーを保留2022-01-012022-12-310001490978アメリカ公認会計基準:非制御的利益メンバー2022-01-012022-12-310001490978アメリカ-アメリカ公認会計基準:普通株式メンバー2022-12-310001490978SDGR:有限株式保有メンバー2022-12-310001490978US-GAAP:AdditionalPaidInCapitalMembers2022-12-310001490978アメリカ-公認会計基準:前払いメンバーを保留2022-12-310001490978アメリカ公認会計原則:他の総合収入メンバーを累計2022-12-310001490978アメリカ公認会計基準:非制御的利益メンバー2022-12-310001490978アメリカ公認会計原則:他の総合収入メンバーを累計2023-01-012023-12-310001490978アメリカ-アメリカ公認会計基準:普通株式メンバー2023-01-012023-12-310001490978US-GAAP:AdditionalPaidInCapitalMembers2023-01-012023-12-310001490978アメリカ-公認会計基準:前払いメンバーを保留2023-01-012023-12-310001490978アメリカ公認会計基準:非制御的利益メンバー2023-01-012023-12-310001490978アメリカ-アメリカ公認会計基準:普通株式メンバー2023-12-310001490978SDGR:有限株式保有メンバー2023-12-310001490978US-GAAP:AdditionalPaidInCapitalMembers2023-12-310001490978アメリカ-公認会計基準:前払いメンバーを保留2023-12-310001490978アメリカ公認会計原則:他の総合収入メンバーを累計2023-12-310001490978アメリカ公認会計基準:非制御的利益メンバー2023-12-310001490978SRT:最小メンバ数2023-12-310001490978SRT:最大メンバ数2023-12-310001490978US-GAAP:顧客集中度リスクメンバーアメリカ公認会計基準:売掛金メンバーSDGR:お客様のメンバー2023-01-012023-12-31Xbrli:純0001490978US-GAAP:顧客集中度リスクメンバーアメリカ公認会計基準:売掛金メンバーSDGR:お客様BMembers2023-01-012023-12-310001490978US-GAAP:顧客集中度リスクメンバーアメリカ公認会計基準:売掛金メンバーSDGR:お客様のメンバー2022-01-012022-12-310001490978US-GAAP:顧客集中度リスクメンバーSDGR:お客様のメンバーSDGR:契約資産のメンバー2023-01-012023-12-310001490978US-GAAP:顧客集中度リスクメンバーSDGR:お客様BMembersSDGR:契約資産のメンバー2023-01-012023-12-310001490978US-GAAP:顧客集中度リスクメンバーSDGR:お客様のメンバーSDGR:契約資産のメンバー2022-01-012022-12-310001490978US-GAAP:顧客集中度リスクメンバーSDGR:お客様BMembersSDGR:契約資産のメンバー2022-01-012022-12-310001490978US-GAAP:顧客集中度リスクメンバーSDGR:お客様のメンバー米国-GAAP:SalesRevenueNetMembers2023-01-012023-12-310001490978US-GAAP:顧客集中度リスクメンバーSDGR:お客様BMembers米国-GAAP:SalesRevenueNetMembers2023-01-012023-12-310001490978US-GAAP:顧客集中度リスクメンバーSDGR:お客様のメンバー米国-GAAP:SalesRevenueNetMembers2022-01-012022-12-310001490978US-GAAP:顧客集中度リスクメンバーSDGR:お客様のメンバー米国-GAAP:SalesRevenueNetMembers2021-01-012021-12-310001490978US-GAAP:TransferredAtPointInTimeMemberSDGR:ソフトウェア製品とサービスメンバー2023-01-012023-12-310001490978US-GAAP:TransferredAtPointInTimeMemberSDGR:ソフトウェア製品とサービスメンバー2022-01-012022-12-310001490978US-GAAP:TransferredAtPointInTimeMemberSDGR:ソフトウェア製品とサービスメンバー2021-01-012021-12-310001490978SDGR:ソフトウェア製品とサービスメンバーUS-GAAP:転送時間を超えるメンバ2023-01-012023-12-310001490978SDGR:ソフトウェア製品とサービスメンバーUS-GAAP:転送時間を超えるメンバ2022-01-012022-12-310001490978SDGR:ソフトウェア製品とサービスメンバーUS-GAAP:転送時間を超えるメンバ2021-01-012021-12-310001490978SDGR:DrugDiscoveryメンバーUS-GAAP:TransferredAtPointInTimeMember2023-01-012023-12-310001490978SDGR:DrugDiscoveryメンバーUS-GAAP:TransferredAtPointInTimeMember2022-01-012022-12-310001490978SDGR:DrugDiscoveryメンバーUS-GAAP:TransferredAtPointInTimeMember2021-01-012021-12-310001490978SDGR:DrugDiscoveryメンバーUS-GAAP:転送時間を超えるメンバ2023-01-012023-12-310001490978SDGR:DrugDiscoveryメンバーUS-GAAP:転送時間を超えるメンバ2022-01-012022-12-310001490978SDGR:DrugDiscoveryメンバーUS-GAAP:転送時間を超えるメンバ2021-01-012021-12-310001490978SDGR:OnPremiseSoftwareMember2024-01-012023-12-310001490978SRT:最大メンバ数Sdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバ2023-01-012023-12-310001490978Sdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバ2023-01-012023-12-310001490978Sdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバSDGR:第1および第2周年記念メンバー2023-01-012023-12-310001490978SRT:最大メンバ数Sdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバ2023-07-012023-09-300001490978Sdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバ2023-07-012023-09-300001490978Sdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバ2023-12-310001490978アメリカ公認会計基準:売掛金メンバーSdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバ2022-01-012022-12-310001490978アメリカ公認会計基準:売掛金メンバーSdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバ2023-01-012023-12-310001490978SDGR:OnPremiseSoftwareMember2023-01-012023-12-310001490978SDGR:OnPremiseSoftwareMember2022-01-012022-12-310001490978SDGR:OnPremiseSoftwareMember2021-01-012021-12-310001490978SDGR:ホストソフトウェアのメンバー2023-01-012023-12-310001490978SDGR:ホストソフトウェアのメンバー2022-01-012022-12-310001490978SDGR:ホストソフトウェアのメンバー2021-01-012021-12-310001490978US-GAAP:保守メンバー2023-01-012023-12-310001490978US-GAAP:保守メンバー2022-01-012022-12-310001490978US-GAAP:保守メンバー2021-01-012021-12-310001490978SDGR:専門サービスメンバー2023-01-012023-12-310001490978SDGR:専門サービスメンバー2022-01-012022-12-310001490978SDGR:専門サービスメンバー2021-01-012021-12-310001490978SDGR:クライアントとの契約の収入がソフトウェア貢献メンバーよりも先に2023-01-012023-12-310001490978SDGR:クライアントとの契約の収入がソフトウェア貢献メンバーよりも先に2022-01-012022-12-310001490978SDGR:クライアントとの契約の収入がソフトウェア貢献メンバーよりも先に2021-01-012021-12-310001490978SDGR:ソフトウェア貢献メンバー2023-01-012023-12-310001490978SDGR:ソフトウェア貢献メンバー2022-01-012022-12-310001490978SDGR:ソフトウェア貢献メンバー2021-01-012021-12-310001490978SDGR:DrugDiscoveryServicesMembers2023-01-012023-12-310001490978SDGR:DrugDiscoveryServicesMembers2022-01-012022-12-310001490978SDGR:DrugDiscoveryServicesMembers2021-01-012021-12-310001490978SDGR:DrugDiscoveryContributionMembers2023-12-310001490978SDGR:DrugDiscoveryContributionMembers2022-12-310001490978SDGR:DrugDiscoveryサービス収入顧客と契約したメンバー2023-01-012023-12-310001490978SDGR:DrugDiscoveryサービス収入顧客と契約したメンバー2022-01-012022-12-310001490978SDGR:DrugDiscoveryサービス収入顧客と契約したメンバー2021-01-012021-12-310001490978SDGR:DrugDiscoveryContributionMembers2023-01-012023-12-310001490978SDGR:DrugDiscoveryContributionMembers2022-01-012022-12-310001490978SDGR:DrugDiscoveryContributionMembers2021-01-012021-12-310001490978Sdgr:百時美施貴宝メンバーSDGR:連携とライセンスプロトコルのメンバー2020-11-22SDGR:目標SDGR:計画0001490978Sdgr:百時美施貴宝メンバーSDGR:連携とライセンスプロトコルのメンバー2022-12-012022-12-310001490978Sdgr:百時美施貴宝メンバーSDGR:連携とライセンスプロトコルのメンバー2020-11-012020-11-300001490978Sdgr:百時美施貴宝メンバーSDGR:連携とライセンスプロトコルのメンバーSDGR:OncologyProductMember2020-11-220001490978Sdgr:百時美施貴宝メンバーSDGR:連携とライセンスプロトコルのメンバーSDGR:神経学的および免疫学的製品のメンバー2020-11-220001490978Sdgr:百時美施貴宝メンバーSDGR:連携とライセンスプロトコルのメンバーSDGR:腫瘍学的神経学と免疫学的製品のメンバー2023-01-012023-12-31SDGR:義務0001490978Sdgr:百時美施貴宝メンバーSDGR:連携とライセンスプロトコルのメンバー2020-11-222020-11-220001490978Sdgr:百時美施貴宝メンバーSDGR:連携とライセンスプロトコルのメンバー2023-01-012023-12-310001490978Sdgr:百時美施貴宝メンバーSDGR:連携とライセンスプロトコルのメンバー2022-01-012022-12-310001490978Sdgr:百時美施貴宝メンバーSDGR:連携とライセンスプロトコルのメンバー2021-01-012021-12-310001490978Sdgr:百時美施貴宝メンバーSDGR:連携とライセンスプロトコルのメンバー2023-12-310001490978Sdgr:百時美施貴宝メンバーSDGR:連携とライセンスプロトコルのメンバー2022-12-310001490978SDGR:ソフトウェア製品とサービスメンバー2023-12-310001490978SDGR:ソフトウェア製品とサービスメンバー2022-12-310001490978SDGR:DrugDiscoveryメンバー2023-12-310001490978SDGR:DrugDiscoveryメンバー2022-12-310001490978SRT:最小メンバ数2023-01-012023-12-310001490978SRT:最大メンバ数2023-01-012023-12-310001490978US-GAAP:ComputerEquipmentMembers2023-12-310001490978US-GAAP:ComputerEquipmentMembers2022-12-310001490978アメリカ-公認会計基準:リース改善メンバー2023-12-310001490978アメリカ-公認会計基準:リース改善メンバー2022-12-310001490978アメリカ-GAAP:家具と固定機器のメンバー2023-12-310001490978アメリカ-GAAP:家具と固定機器のメンバー2022-12-310001490978SDGR:LabEquipmentMembers2023-12-310001490978SDGR:LabEquipmentMembers2022-12-310001490978SDGR:XTAL生体構造増加メンバー2023-01-012023-12-310001490978SDGR:XTAL生体構造増加メンバー2023-12-310001490978SDGR:XTAL生体構造増加メンバーSdgr:Backlogメンバー2023-12-310001490978SDGR:XTAL生体構造増加メンバーUS-GAAP:クライアント関係メンバ2023-12-310001490978SDGR:XTAL生体構造増加メンバー米国-公認会計原則:商標メンバー2023-12-310001490978SDGR:現金等価物および制限された現金メンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001490978SDGR:現金等価物および制限された現金メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001490978SDGR:現金等価物および制限された現金メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2023-12-310001490978SDGR:現金等価物および制限された現金メンバー2023-12-310001490978アメリカ-公認会計基準:公正価値入力レベル1メンバー米国-公認会計基準:証券資産メンバー2023-12-310001490978アメリカ-公認会計基準:公正価値入力レベル2メンバー米国-公認会計基準:証券資産メンバー2023-12-310001490978アメリカ-公認会計基準:公正価値投入レベル3メンバー米国-公認会計基準:証券資産メンバー2023-12-310001490978米国-公認会計基準:証券資産メンバー2023-12-310001490978米国-GAAP:株式投資方法のメンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001490978アメリカ-公認会計基準:公正価値入力レベル2メンバー米国-GAAP:株式投資方法のメンバー2023-12-310001490978米国-GAAP:株式投資方法のメンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2023-12-310001490978米国-GAAP:株式投資方法のメンバー2023-12-310001490978アメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001490978アメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001490978アメリカ-公認会計基準:公正価値投入レベル3メンバー2023-12-310001490978SDGR:現金等価物および制限された現金メンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001490978SDGR:現金等価物および制限された現金メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001490978SDGR:現金等価物および制限された現金メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001490978SDGR:現金等価物および制限された現金メンバー2022-12-310001490978アメリカ-公認会計基準:公正価値入力レベル1メンバー米国-公認会計基準:証券資産メンバー2022-12-310001490978アメリカ-公認会計基準:公正価値入力レベル2メンバー米国-公認会計基準:証券資産メンバー2022-12-310001490978アメリカ-公認会計基準:公正価値投入レベル3メンバー米国-公認会計基準:証券資産メンバー2022-12-310001490978米国-公認会計基準:証券資産メンバー2022-12-310001490978米国-GAAP:株式投資方法のメンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001490978アメリカ-公認会計基準:公正価値入力レベル2メンバー米国-GAAP:株式投資方法のメンバー2022-12-310001490978米国-GAAP:株式投資方法のメンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001490978米国-GAAP:株式投資方法のメンバー2022-12-310001490978アメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001490978アメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001490978アメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001490978SDGR:Nimbus治療LLCMメンバー2023-01-012023-12-3100014909782023-02-132023-02-1300014909782023-04-062023-04-0600014909782023-11-092023-11-090001490978SDGR:構造治療メンバー2023-01-012023-03-31SDGR:レンタル0001490978SDGR:デバイスリースプロトコルのメンバー2023-01-012023-12-310001490978米国-GAAP:国内/地域メンバー2023-12-310001490978アメリカ-公認会計基準:州と地方法律法規のメンバー2023-12-310001490978SDGR:VotingCommonStockMember2023-12-31SDGR:投票0001490978SDGR:TwentyTwentyStockPlanMember2022-06-150001490978米国-GAAP:販売コストメンバー2023-01-012023-12-310001490978米国-GAAP:販売コストメンバー2022-01-012022-12-310001490978米国-GAAP:販売コストメンバー2021-01-012021-12-310001490978米国-公認会計基準:研究·開発費メンバー2023-01-012023-12-310001490978米国-公認会計基準:研究·開発費メンバー2022-01-012022-12-310001490978米国-公認会計基準:研究·開発費メンバー2021-01-012021-12-310001490978アメリカ公認会計基準:販売とマーケティング費用メンバー2023-01-012023-12-310001490978アメリカ公認会計基準:販売とマーケティング費用メンバー2022-01-012022-12-310001490978アメリカ公認会計基準:販売とマーケティング費用メンバー2021-01-012021-12-310001490978アメリカ-公認会計基準:一般と行政費用メンバー2023-01-012023-12-310001490978アメリカ-公認会計基準:一般と行政費用メンバー2022-01-012022-12-310001490978アメリカ-公認会計基準:一般と行政費用メンバー2021-01-012021-12-310001490978米国-GAAP:制限株式単位RSUメンバー2023-01-012023-12-310001490978SDGR:共有ベースの報酬で4人のメンバーを奨励米国-GAAP:制限株式単位RSUメンバー2023-01-012023-12-310001490978米国-GAAP:制限株式単位RSUメンバー米国-GAAP:共有による補償補償TracheOneMember2023-01-012023-12-310001490978US-GAAP:共有補償に基づいて3人のメンバを送信米国-GAAP:制限株式単位RSUメンバー2023-01-012023-12-310001490978US-GAAP:共有ベースの補償報酬送信2人のメンバ米国-GAAP:制限株式単位RSUメンバー2023-01-012023-12-310001490978米国-公認会計基準:制限された株式メンバー2022-12-310001490978米国-公認会計基準:制限された株式メンバー2023-01-012023-12-310001490978米国-公認会計基準:制限された株式メンバー2023-12-310001490978米国-GAAP:制限株式単位RSUメンバー2022-01-012022-12-310001490978米国-GAAP:制限株式単位RSUメンバー2023-12-310001490978SDGR:EligiblePerformanceBasedRestratedStockUnitsMembers米国-GAAP:共有による補償補償TracheOneMember2023-02-012023-02-280001490978SDGR:EligiblePerformanceBasedRestratedStockUnitsMembersUS-GAAP:共有ベースの補償報酬送信2人のメンバ2023-02-012023-02-280001490978US-GAAP:共有補償に基づいて3人のメンバを送信SDGR:EligiblePerformanceBasedRestratedStockUnitsMembers2023-02-012023-02-280001490978SDGR:EligiblePerformanceBasedRestratedStockUnitsMembers2022-08-012022-08-310001490978SDGR:性能に基づく制限された株式単位メンバ2022-08-012022-08-310001490978SDGR:性能に基づく制限された株式単位メンバ2023-03-012023-03-310001490978SDGR:性能に基づく制限された株式単位メンバ2023-03-310001490978SDGR:性能に基づく制限された株式単位メンバ2023-12-310001490978SDGR:PerformanceRestratedStockUnitsMembers2022-12-310001490978SDGR:PerformanceRestratedStockUnitsMembers2023-01-012023-12-310001490978SDGR:PerformanceRestratedStockUnitsMembers2023-12-310001490978SDGR:性能に基づく制限された株式単位メンバ2023-01-012023-12-310001490978SDGR:性能に基づく制限された株式単位メンバ2022-01-012022-12-310001490978US-GAAP:共有ベースの補償報酬送信2人のメンバ2023-01-012023-12-310001490978米国-GAAP:共有による補償補償TracheOneMember2023-01-012023-12-310001490978US-GAAP:共有補償に基づいて3人のメンバを送信2023-01-012023-12-310001490978SDGR:共有ベースの報酬で4人のメンバーを奨励2023-01-012023-12-310001490978米国-公認会計基準:従業員株式オプションメンバー2023-02-012023-02-280001490978アメリカ公認会計基準:CoVenturerMembersSDGR:Faxian TreeuticsLLC JointVentureMembers2019-04-300001490978SDGR:Faxian TreeuticsLLC JointVentureMembersアメリカ-公認会計基準:可変利益実体の主要利益メンバー2019-04-300001490978SDGR:Nimbus治療LLCMメンバー2023-12-310001490978SDGR:Nimbus治療LLCMメンバー2022-12-310001490978SDGR:Nimbus治療LLCMメンバー2021-01-012021-12-310001490978SDGR:Nimbus治療LLCMメンバー2022-01-012022-12-310001490978SDGR:MorphicHoldingIncMember2023-01-012023-12-310001490978SDGR:MorphicHoldingIncMember2022-01-012022-12-310001490978SDGR:MorphicHoldingIncMember2021-01-012021-12-310001490978SDGR:MorphicHoldingIncMember2023-12-310001490978SDGR:MorphicHoldingIncMember2022-12-310001490978アメリカ-アメリカ公認会計基準:シリーズBPferredStockMemberSDGR:AjaxTreateuticsIncMember2021-05-012021-05-310001490978SDGR:AjaxTreateuticsIncMember2022-12-310001490978SDGR:AjaxTreateuticsIncMember2023-12-310001490978SDGR:構造治療メンバーアメリカ-アメリカ公認会計基準:シリーズBPferredStockMember2021-07-012021-07-310001490978SDGR:構造治療メンバーアメリカ-アメリカ公認会計基準:シリーズBPferredStockMember2022-04-012022-04-300001490978SDGR:構造治療メンバーアメリカ-アメリカ公認会計基準:シリーズBPferredStockMember2023-02-070001490978SDGR:構造治療メンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2023-12-310001490978SDGR:構造治療メンバーDei:AdrMembers2023-12-310001490978SDGR:構造治療メンバーDei:AdrMembers2023-01-012023-12-310001490978SDGR:構造治療メンバー2023-12-310001490978SDGR:構造治療メンバー2022-12-310001490978SDGR:構造治療メンバー2023-01-012023-12-310001490978SDGR:構造治療メンバー2022-01-012022-12-310001490978SDGR:構造治療メンバー2021-01-012021-12-310001490978SRT:役員メンバー2023-01-012023-12-310001490978SRT:役員メンバー2022-01-012022-12-310001490978SRT:役員メンバー2021-01-012021-12-310001490978米国-公認会計基準:関連側メンバーSDGR:BillAndMelindaGatesFoundationTrustMember2023-01-012023-12-310001490978米国-公認会計基準:関連側メンバーSDGR:BillAndMelindaGatesFoundationTrustMember2022-01-012022-12-310001490978米国-公認会計基準:関連側メンバーSDGR:BillAndMelindaGatesFoundationTrustMember2021-01-012021-12-310001490978米国-公認会計基準:関連側メンバーSDGR:BillAndMelindaGatesFoundationTrustMember2023-12-310001490978米国-公認会計基準:関連側メンバーSDGR:BillAndMelindaGatesFoundationTrustMember2022-12-310001490978米国-公認会計基準:関連側メンバーSDGR:DrugDiscoveryメンバーSDGR:BillAndMelindaGatesFoundationTrustMember2023-01-012023-12-310001490978米国-公認会計基準:関連側メンバーSDGR:DrugDiscoveryメンバーSDGR:BillAndMelindaGatesFoundationTrustMember2022-01-012022-12-310001490978米国-公認会計基準:関連側メンバーSDGR:DrugDiscoveryメンバーSDGR:BillAndMelindaGatesFoundationTrustMember2021-01-012021-12-310001490978米国-公認会計基準:関連側メンバーSDGR:DrugDiscoveryメンバーSDGR:BillAndMelindaGatesFoundationTrustMember2023-12-310001490978米国-公認会計基準:関連側メンバーSDGR:DrugDiscoveryメンバーSDGR:BillAndMelindaGatesFoundationTrustMember2022-12-310001490978米国-公認会計基準:関連側メンバーSdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバSDGR:GatesVenturesLLCMメンバーSRT:最小メンバ数2023-12-310001490978米国-公認会計基準:関連側メンバーSdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバSDGR:GatesVenturesLLCMメンバー2021-06-012022-05-310001490978米国-公認会計基準:関連側メンバーSdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバSDGR:GatesVenturesLLCMメンバー2020-06-012021-05-310001490978米国-公認会計基準:関連側メンバーSdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバSDGR:GatesVenturesLLCMメンバー2022-06-012023-05-310001490978Sdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバ2023-08-012023-08-310001490978米国-公認会計基準:関連側メンバーSdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバSDGR:GatesVenturesLLCMメンバー2022-12-310001490978米国-公認会計基準:関連側メンバーSdgr:ゲートウェイとの合意VenturesLimitedLiablityCompanyメンバSDGR:GatesVenturesLLCMメンバー2023-12-310001490978米国-公認会計基準:関連側メンバーSDGR:ソフトウェア製品とサービスメンバー2021-12-310001490978米国-公認会計基準:関連側メンバーSDGR:ソフトウェア製品とサービスメンバー2023-01-012023-12-310001490978米国-公認会計基準:関連側メンバーSDGR:ソフトウェア製品とサービスメンバー2022-01-012022-12-310001490978米国-公認会計基準:関連側メンバーSDGR:ソフトウェア製品とサービスメンバー2021-01-012021-12-310001490978米国-公認会計基準:関連側メンバーSDGR:構造治療メンバー2023-01-012023-12-310001490978米国-公認会計基準:関連側メンバーSDGR:構造治療メンバー2023-12-310001490978米国-公認会計基準:関連側メンバーSDGR:構造治療メンバー2022-12-31SDGR:細分化市場0001490978SDGR:ソフトウェア細分化市場のメンバーアメリカ公認会計基準:運営部門メンバー2023-01-012023-12-310001490978SDGR:ソフトウェア細分化市場のメンバーアメリカ公認会計基準:運営部門メンバー2022-01-012022-12-310001490978SDGR:ソフトウェア細分化市場のメンバーアメリカ公認会計基準:運営部門メンバー2021-01-012021-12-310001490978SDGR:DrugDiscoverySegmentMembersアメリカ公認会計基準:運営部門メンバー2023-01-012023-12-310001490978SDGR:DrugDiscoverySegmentMembersアメリカ公認会計基準:運営部門メンバー2022-01-012022-12-310001490978SDGR:DrugDiscoverySegmentMembersアメリカ公認会計基準:運営部門メンバー2021-01-012021-12-310001490978国:アメリカ2023-01-012023-12-310001490978国:アメリカ2022-01-012022-12-310001490978国:アメリカ2021-01-012021-12-310001490978SDGR:アジア太平洋地域のメンバー2023-01-012023-12-310001490978SDGR:アジア太平洋地域のメンバー2022-01-012022-12-310001490978SDGR:アジア太平洋地域のメンバー2021-01-012021-12-310001490978アメリカ-GAAP:ヨーロッパ中東アフリカメンバー2023-01-012023-12-310001490978アメリカ-GAAP:ヨーロッパ中東アフリカメンバー2022-01-012022-12-310001490978アメリカ-GAAP:ヨーロッパ中東アフリカメンバー2021-01-012021-12-310001490978アメリカ-GAAP:非アメリカのメンバー2023-01-012023-12-310001490978アメリカ-GAAP:非アメリカのメンバー2022-01-012022-12-310001490978アメリカ-GAAP:非アメリカのメンバー2021-01-012021-12-3100014909782023-10-012023-12-310001490978SDGR:RobertAbelMembers2023-10-012023-12-310001490978SDGR:RobertAbelMembers2023-12-310001490978SDGR:マーガレット·デュガンのメンバー2023-10-012023-12-310001490978SDGR:GeoffreyPorgesMembers2023-10-012023-12-310001490978SDGR:GeoffreyPorgesMembers2023-12-31 アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
_______________________________________
表10-K
_______________________________________
(マーク1)
| | | | | |
| x | 1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで十二月三十一日, 2023
あるいは…。
| | | | | |
| ¨ | 1934年証券取引法第13条又は15(D)条に基づいて提出された2010年1月1日から3月1日までの移行期間に関する移行報告 |
依頼書類番号:001-39206
_______________________________________
シュレーディンガーInc.
(登録者の正確な氏名はその定款に記載)
_______________________________________
| | | | | |
| デラウェア州 | 95-4284541 |
(明またはその他の司法管轄権
会社や組織) | (税務署の雇用主
識別番号) |
ブロードウェー1540, 24これは…。フロア.フロア ニューヨークです, ニューヨークです。 | 10036 |
| (主にオフィスアドレスを実行) | (郵便番号) |
登録者の電話番号、市外局番を含む:(212) 295-5800
_______________________________________
同法第12条(B)に基づいて登録された証券:
| | | | | | | | | | | | | | |
| クラスごとのタイトル | | 取引コード | | 登録された各取引所の名称 |
| 普通株は、1株当たり0.01ドルです | | 特別引き出し権 | | ナスダック株式市場有限責任会社 |
同法第12条(G)に基づいて登録された証券:ありません
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してくださいはい、そうですx 違います¨
登録者が当該法第13条又は第15条(D)に従って報告書を提出する必要がないか否かを、再選択マークで示す。はい、そうです¨ 違います。x
登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13または15(D)節に提出されたすべての報告を提出したかどうか、および(2)このような提出要求を過去90日以内に遵守してきたかどうかを、再選択マークで示すはい、そうですx違います¨
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示すはい、そうですx違います¨
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
| | | | | | | | | | | |
| 大型加速ファイルサーバ | x | ファイルマネージャを加速する | ¨ |
| 非加速ファイルサーバ | ¨ | 規模の小さい報告会社 | ¨ |
| 新興成長型会社 | o | | |
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する¨
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われるx
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する☐
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す☐
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、そうです☐ 違いますx
2023年6月30日まで,すなわち登録者が最近完成した第2財期の最終営業日であり,登録者の非関連会社が保有する投票権と無投票権普通株の総時価は#ドルである1,758,532,189当日登録者普通株の終値で計算する。
2024年2月21日現在登録者は63,146,419普通株と普通株9,164,193発行された有限普通株式。
引用で編入された書類
登録者は,2023年12月31日までの財政年度終了後120日以内に,2024年株主総会に関する第14 A条に基づいて最終的な依頼書を提出する予定である。この最終依頼書の内容の一部は、本明細書に記載された範囲内の本年度報告のForm 10−Kの第3の部分に参照されて組み込まれる。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| 監査役事務所ID: | 185 | | 監査役の名前: | ピマウェイ会計士事務所 | | 監査役位置: | ポートランド、あるいは |
カタログ表
| | | | | | | | |
| | ページ |
第1部 | | |
第1項。 | 業務.業務 | 6 |
第1 A項。 | リスク要因 | 64 |
項目1 B。 | 未解決従業員意見 | 115 |
| プロジェクト1 C。 | ネットワーク·セキュリティ | 115 |
第二項です。 | 属性 | 115 |
第三項です。 | 法律訴訟 | 115 |
第四項です。 | 炭鉱安全情報開示 | 116 |
| | |
第II部 | | |
五番目です。 | 登録者普通株市場、関連株主事項及び発行者による株式証券の購入 | 117 |
第六項です。 | [保留されている] | 118 |
第七項。 | 経営陣の財務状況と経営成果の検討と分析 | 118 |
第七A項。 | 市場リスクの定量的·定性的開示について | 138 |
第八項です。 | 財務諸表と補足データ | F-1 |
第九項です。 | 会計と財務情報開示の変更と相違 | 140 |
第9条。 | 制御とプログラム | 140 |
プロジェクト9 B。 | その他の情報 | 141 |
プロジェクト9 Cです。 | 検査妨害に関する外国司法管区の開示 | 142 |
| | |
第三部 | | |
第10項。 | 役員·幹部と会社の管理 | 143 |
第十一項。 | 役員報酬 | 143 |
第十二項。 | 特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 | 143 |
十三項。 | 特定の関係や関連取引、取締役の独立性 | 143 |
14項です。 | チーフ会計士費用とサービス | 143 |
| | |
第4部 | | |
第十五項。 | 展示品と財務諸表の付表 | 144 |
第十六項。 | 表格10-Kの概要 | 147 |
前向き陳述と業界データに関する警告説明
本Form 10−K年次報告又は本年度報告には前向き陳述が含まれている “米国個人証券訴訟改革法”及び改正された1934年証券取引法第21 E条に示されるリスク及び不確実性。歴史的事実の陳述を除いて、本年度報告に含まれるすべての陳述は、私たちの戦略、未来の運営、未来の財務状況、未来の収入、予想コスト、見通し、計画と管理目標に関する陳述を含み、すべて前向きな陳述である。“目標”、“予想”、“信じる”、“考慮”、“継続”、“可能”、“見積もり”、“期待”、“目標”、“予定”、“可能”、“可能”、“潜在”、“予測”、“計画”、“すべき”、“目標”、“意志”“将”またはこれらの語の否定または他の同様の表現は、すべての前向き陳述がこれらの識別語を含むわけではないが、前向き陳述を識別することを意図している。
本年度報告書の展望的な陳述は、以下の側面に関する陳述を含む
•私たちは物理的計算プラットフォームの潜在的な利点に基づいています
•私たちの戦略計画はソフトウェア事業の成長を加速させて新しい顧客を獲得することです
•私たちの特許薬物発見計画と計算プラットフォームのための研究開発は
•このような協力の開始、時間、進展、結果を含む私たちの薬物発見協力
•私たちは、百時美施貴宝社との協力協定に基づいて、薬物発見協力が受け取る可能性のある任意のマイルストーンまたは他の支払いの推定または予想を含む
•私たちの特許薬物発見計画は、著者らの臨床前研究と臨床試験の開始、時間、進展と結果を含む
•私たちは特許薬物発見計画を実現するためにアメリカ食品医薬品局に研究新薬申請を提出する予定です
•我々は候補製品を発見·開発し,以下のようにビジネスの潜在力を最大限に発揮する予定である
自分でまたは他の人と協力してこのような候補製品を推薦します
•私たちは私たちの業務間の協同効果を利用する予定です
•私たちまたは私たちのパートナーが開発する可能性のある任意の候補製品の提出申請の時間、申請を提出する能力、および規制部門の承認を得て維持する能力
•私たちの薬物発見協力と特許薬物発見計画の潜在的な利点は
•私たちのソフトウェア解決策が市場に受け入れられている速度と程度
•私たちまたは私たちのパートナーが開発する可能性のある任意の製品の市場受容度と臨床的実用性の速度と程度
•私たちのソフトウェア解決策と私たちまたは私たちの任意の協力者が開発する可能性のある候補製品の潜在的な市場機会の推定
•私たちの販売とマーケティング能力と戦略は
•知的財産権の地位は
•私たちはビジネス目標に一致した大きなビジネス潜在力を持つ技術を識別することができます
•私たちは現金、現金等価物、有価証券を使って私たちの運営費用と資本支出需要に資金を提供する能力を期待しています
•私たちの期待は現金、現金等価物、および有価証券の使用と関連がある
•私たちの期待は私たちの業績の重要な駆動要素と関連がある
•政府の法律法規の影響
•私たちの競争地位と、私たちの競争相手に関連する発展と予測、ならびに既存またはこれから発売される任意の競争製品、技術、または療法に対する期待
•私たちは協力関係を維持したり、追加資金を得る能力を維持したりする
•私たちのキーパーソンへの依存と技術者を識別し募集し維持する能力は
•公衆衛生流行病或いは大流行、新冠肺炎大流行の潜在的影響を含む
•地政学的で世界的な経済発展の潜在的な影響。
私たちは私たちの展望声明で開示された計画、意図、または予想を実際に達成できないかもしれません。あなたは私たちの展望的声明に過度に依存してはいけません。実際の結果または事件は、私たちが前向きな陳述で開示した計画、意図、および予想とは大きく異なるかもしれない。我々は,本年度報告における警告的陳述に重要な要因が含まれており,特に以下の“リスク要因要約”や“リスク要因”では,これらの要因が実際の結果やイベントを我々が行った前向き陳述と大きく異なる可能性があると考えられる.しかも、私たちは競争が激しく急速に変化する環境で運営されている。新しいリスクと不確定要素が時々出現し、私たちは本年度報告に掲載された展望性陳述に影響を与える可能性のあるすべてのリスクと不確定要素を予測できない。私たちの前向きな陳述は、私たちが行う可能性がある任意の未来の買収、合併、処置、協力、許可手配、合弁企業または投資の潜在的な影響を反映していない。
あなたは本年度の報告書と私たちがアメリカ証券取引委員会またはアメリカ証券取引委員会に提出した文書を読んで、私たちの将来の実際の結果が私たちが予想していたものと大きく異なるかもしれないことを理解しなければなりません。本年度報告に含まれる前向き陳述は、本年度報告の日までに行われ、法的要件が適用されない限り、新しい情報、未来の事件、または他の理由でいかなる前向き陳述を更新する義務も負いません。
また、“私たちが信じている”という声明と類似した声明は、関連テーマに対する私たちの信念と意見を反映している。これらの陳述は,本年度報告日までに我々が把握した情報に基づいており,これらの情報はこのような陳述の合理的な基礎を構成していると考えられるが,このような情報は限られているか不完全である可能性がある.私たちの声明は、私たちが入手可能なすべての関連情報について詳細な調査や検討が行われたことを示すものとして解釈されてはならない。これらの陳述は本質的に不確実であり、投資家にこのような陳述に過度に依存しないように注意する。
本年度報告には、業界出版物と研究、調査、第三者による研究から得られた統計データと他の業界と市場データ、および私たち自身の潜在市場機会の推定が含まれている。本年度報告で使用したすべての市場データはいくつかの仮定や制限に触れているので、このようなデータを過度に重視しないでください。業界出版物および第三者研究、調査および研究は一般に、彼らの情報はこのような情報の正確性または完全性を保証しないにもかかわらず、信頼できると考えられるソースから得られたものであることを示している。候補製品の潜在的な市場機会の推定は、著者らの業界知識、業界出版物、第三者研究、調査と研究に基づくいくつかの重要な仮定を含み、これらの仮定は小サンプルに基づく可能性があり、市場機会を正確に反映できないかもしれない。私たちは私たちの内部仮定が合理的だと信じているが、これらの仮定を証明する独立したメッセージ源はない。
そうでない限り文脈そうでなければ本年度報告では、シュレーディンガー社およびその合併子会社を指す用語“会社”、“私たち”、“私たち”および“私たち”を使用することを要求する。
リスク要因の概要
私たちの業務は多くのリスクに直面しており、投資決定を下す前に、あなたはこのようなリスクを認識しなければならない。以下では、私たちが考えている主要なリスク要因をまとめますが、これらのリスクは私たちが直面している唯一のリスクではありません。“リスクファクター”の節での私たちのリスク要因の全面的な議論と、今年度の報告書の他の情報をよく検討して考慮してください。
•私たちは重大な運営赤字の歴史があり、私たちは今後数年も赤字になると予想している。
•もし私たちのソフトウェアの売上を増やすことができなければ、私たちの薬物発見協力から収入を増やすことができない、あるいは私たちと現在と未来の協力者が薬物製品の開発と商業化に成功できなければ、私たちの収入は私たちが利益を達成したり維持したりするのに十分ではないかもしれない。
•私たちの四半期と年間業績は大幅に変動する可能性があり、これは私たちの普通株の価値に悪影響を及ぼす可能性があります。
•もし私たちの既存の顧客が彼らの許可証を更新しなければ、私たちからもっと多くの解決策を購入しない、あるいはもっと低い価格で更新しなければ、私たちの業務と経営業績は影響を受けるだろう。
•私たちの収入の大部分は生命科学業界の顧客への販売から来ており、その業界に悪影響を与える要素は私たちのソフトウェア販売に悪影響を及ぼす可能性があります。
•私たちが参加する市場競争は激しく、もし私たちが効果的に競争できなければ、私たちの業務と経営業績は不利な影響を受けるかもしれない。
•私たちは私たちの薬物発見協力で資源と現金投資の見返りを絶対に達成しないかもしれない。
•私たちの計算プラットフォームは伝統的な方法よりも将来性のある分子を識別し、薬物発見を加速する潜在力があると信じているが、私たちは私たちのプラットフォーム技術を使用して治療潜在力のある分子を発見と設計することに集中して、私たちあるいは私たちの協力者のために商業的に実行可能な製品を発見し、開発することはできないかもしれない。
•私たちは候補製品の決定、発見、または開発に成功できないかもしれないし、より大きなビジネス機会またはより成功する可能性の高い計画、協力、または候補製品を利用できないかもしれない。
•会社として、私たちの臨床開発における経験は非常に限られており、私たちの計画を成功させる可能性に悪影響を及ぼすかもしれません。
•私たちは私たちの運営を支援するために追加的な資本が必要かもしれない。もし私たちが受け入れられる条項で追加資本を調達できない場合、あるいは私たちの業務を維持または拡大するために必要なキャッシュフローが生じなければ、私たちは競争に成功できないかもしれません。これは私たちの業務、運営、そして財務状況を損なうことになります。
•成功した臨床試験を行うには十分な数の患者を募集する必要があり,適切な患者の識別や募集は困難である可能性がある。
•我々は、締め切り前にこのような試験を完了できないことを含む第三者に依存して臨床試験を継続することを計画しているが、これらの第三者の表現は、候補製品のマーケティング承認を求めたり、商業化する能力を求めたり、延期したり、他の方法で私たちの業務を損なう可能性がある。
•臨床前研究と早期臨床試験の結果は後の臨床試験の成功を予測できない可能性があり、著者らの臨床試験結果はFDA或いは他の類似の外国監督機関の要求に符合しない可能性がある。
•もし私たちがコロンビア大学との既存の許可協定、私たちの任意の他の知的財産権許可、または任意の未来の知的財産権許可下の義務を履行できなかった場合、または私たちと現在または任意の未来の許可者との業務関係が妨害された場合、私たちは私たちの業務に重要な知的財産権を失うかもしれない。
•もし私たちの技術や候補製品のために特許保護を獲得し、維持し、実行し、保護することができない場合、または取得された特許保護範囲が十分でなければ、私たちの競争相手は、私たちと同様または同じ技術および製品を開発し、商業化する可能性があり、私たちの技術および候補製品の開発と商業化に成功する能力は不利な影響を受ける可能性がある。
•私たちの内部情報技術システムまたは私たちの第三者サプライヤー、請負業者、またはコンサルタントのシステムは、障害やセキュリティホール、データ損失または漏洩、および他の中断を受ける可能性があり、これは、私たちのサービスの深刻な中断を招き、私たちの業務に関連する敏感な情報を危険にさらし、または私たちの重要な情報へのアクセスを阻止し、それによって、私たちが責任を負うか、または他の方法で私たちの業務に悪影響を及ぼす可能性があります。
•私たちの未来の成功は私たちが肝心な幹部を維持し、合格者を吸引、維持、激励する能力にかかっている。
•私たちは多様な業務戦略を実施しており、私たちの発展と規制能力の拡大を望んでいますので、私たちの複数の業務部門や私たちの成長を管理する上で困難に直面する可能性があり、これは私たちの運営を混乱させる可能性があります。
•我々の役員、取締役、主要株主は、彼らが共同行動を選択すれば、株主に承認されたすべての事項に影響を与える能力がある。
•私たちの実際の運営結果は私たちの指導意見と大きく違うかもしれない。
第1部
プロジェクト1.ビジネス
概要
私たちは発見療法と材料の方法を変えている。
伝統的な方法と比べ、著者らは物理的な差別化計算プラットフォームに基づいて、薬物開発と材料応用のための高品質、新しい分子をより迅速、低コストで発見できるようにした。私たちのソフトウェアプラットフォームは世界各地の生物製薬と工業会社、学術機関と政府実験室の許可を得た。我々は我々のコンピューティングプラットフォームを応用して,有力なバイオ製薬会社と協力し,広範な薬物発見計画を進めている。また,我々の計算プラットフォームを用いて我々の特許薬物発見計画パイプラインのために新たな分子を発見し,臨床前と臨床開発によりこれらの計画を進めている。
伝統的な薬物発見と開発仕事は複雑で、時間と資本密集型であり、しかも高い失敗率が出現しやすい。伝統的な薬物発見は高価で時間のかかる人工分子設計、化学合成と実験テストの複数回の反復に依存する。薬物発見時間が長く、コストが高く、失敗率が高い主要な原因の一つは化学合成前に分子の性質を予測することが極めて複雑であり、伝統的な方法に符合しないことである。
また,より最適化された属性プロファイルを持つ開発候補は,臨床開発においてより高い成功確率を得ると信じている.
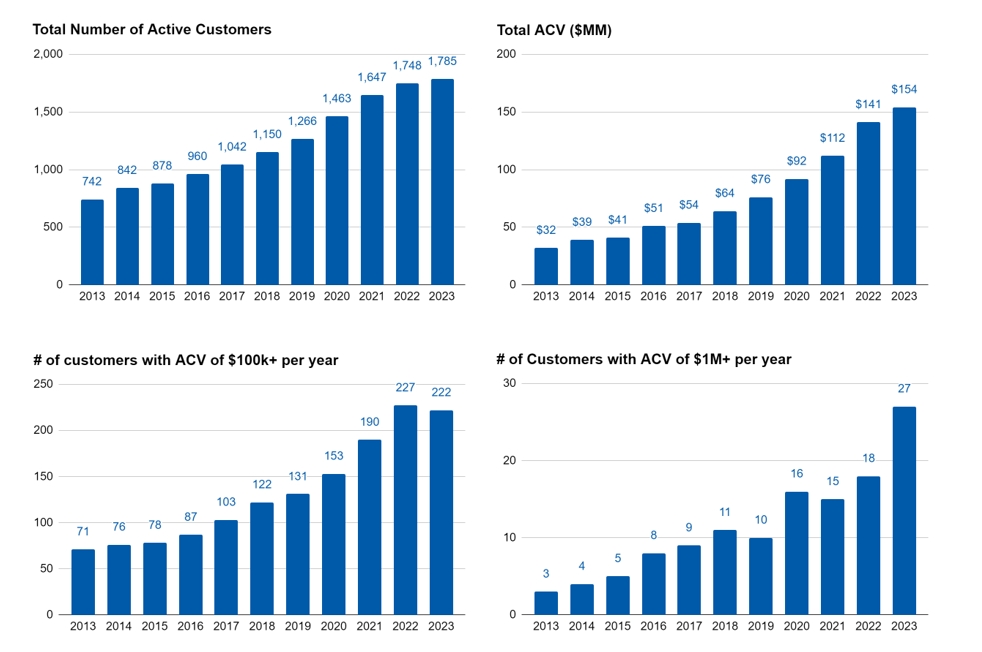
我々は顧客に各種のソフトウェア解決策を提供し、分子発見、設計、最適化のすべての段階を加速する。2023年、2022年、2021年12月31日までの年間で、222、227、190人の顧客の年間契約価値(ACV)は少なくとも100,000ドルで、それぞれ私たちの総ACVの83%、82%、80%を占めています。私たちのグローバル販売、技術、科学者チームの支持の下で、私たちのソフトウェアの広範な採用は私たちのソフトウェア収入の着実な増加を推進しました。バイオ製薬会社はより広い範囲で我々のソフトウェアを採用することが増えており,この規模の拡大が将来の収入増加を推進することが予想される。2023年12月31日までの1年間に、54人のお客様のACVは少なくとも500,000ドルですが、2022年12月31日までの年間52人のお客様がいます。また,ACVが少なくとも100万ドルの顧客数は2023年12月31日までの年度で27社に増加したが,2022年12月31日と2021年12月31日までの年度はそれぞれ18社と15社であった。私たちの大きな顧客数の増加は、会社が私たちのプラットフォームを大規模に使用する力をますます認識し、その科学と財務的利益を意識していることを示していると信じています。私たちの顧客基盤の保持は、私たちのプラットフォームの持続的な価値を示しています。ACVおよび顧客保持率に関するより多くの情報は、“経営陣の財務状況や経営結果の検討と分析--我々の業績に影響を与える重要な要因”を参照されたい。
私たちはまた、私たちのプラットフォームと能力を利用して、一連の協力と独自の薬物発見計画において役割を果たし、これらの計画は広範な疾病標的と適応をカバーしている
早期臨床開発。著者らは生物製薬会社と薬物発見協力を展開し,著者らの協力者は腫瘍学,抗真菌疾患,線維化,炎症性腸管疾患,代謝性疾患,自己免疫疾患,免疫腫瘍学,心肺疾患,結核を含む多くの治療分野で研究を行っている。これらの協力者と一緒に薬物発見に従事する場合、私たちは通常、私たちのプラットフォームとプラットフォームの専門家との関連を提供し、彼らは薬物発見協力者が1つ以上の指定されたタンパク質標的に活性を有する分子を認識するのを助ける。私たちの協力計画は、事前支払い、研究資金支払い、および発見と開発マイルストーンを含む薬物発見収入を生成し、追加の商業マイルストーン支払い、オプション費用、印税を生成する可能性がある。我々はまた,パートナーに依存して我々の内部で発見された候補製品を開発し,潜在的に商業化することは,候補製品の臨床的およびビジネス的機会を最大化するのに役立つと考えられるからである。
例えば、2020年11月、私たちは百時美施貴宝社(Bristol-Myers Squibb Company、BMSと略称する)と独占的なグローバル協力と許可協定を達成し、この合意に基づいて、私たちとBMSは協力して腫瘍学、神経学、免疫学治療領域の生物標的のための小分子化合物を発見、研究開発することに同意した。双方が興味のある標的(S)について合意した後,シュレーディン療法集団は候補薬物の発見開発を担当した。特定の目標基準に適合する開発候補が決定されると、BMSは単独でその開発候補の開発、製造、商業化を担当する。私たちは現在協力の影響を受けている潜在的な目標で15億ドルに達する総マイルストーン支払いを得る資格があり、その中で2023年12月31日までに2500万ドルと、BMSが商業化した各製品の純売上高の等級別パーセント印税を受け取り、その範囲はそこから2桁まで低いが、いくつかの指定された減免を守らなければならない。本協定の詳細については、“-百時米施貴宝社との協力協定”を参照されたい。
2018年には,我々のプラットフォームを用いて一連の斬新で価値の高い治療薬の生産を目指した一連の特許薬物発見計画の開発を開始した。また、73人の健常ボランティアにおいて、SGR−1505の第1段階臨床試験を完了し、SGR−1505の安全性、耐性および薬物動態に関連するデータ、ならびに食品および薬物相互作用の影響を含むより多くのデータを収集した。健康ボランティア試験では,SGR−1505全体の耐性は良好であり,薬物に関連する重篤な有害事象や用量制限毒性は認められなかった。試験では,SGR−1505の活性化T細胞全血検出では,1日2回100 mg(n=4)のIL−2分泌抑制率が90%を超えることが観察され,目標参加が確認され,試験の薬効学的目標を達成した。IL-2の分泌抑制はMALT 1と下流のNF-κBシグナルと密接に関連しているため、標的参与と経路制御のマーカーである。これらのデータは,進行中の1期臨床試験において再発または難治性B細胞リンパ腫患者のSGR−1505の評価を継続することを支持している。さらに、FDAは最近SGR-1505孤児薬物の称号を授与し、マントル細胞リンパ腫の潜在的治療に使用した。
2023年7月、FDAはSGR-2921と呼ばれるCDC 7阻害剤を承認した。再発または難治性急性骨髄性白血病またはハイリスク骨髄異形成症候群患者の第1段階臨床試験におけるSGR−2921の投与量を開始しており,2024年末または2025年に試験の予備データを報告する予定である。著者らはまた、固形腫瘍の治療に用いる新しいWEE 1/MYT 1阻害剤SGR-3515を開発している。我々は,進行中のIND有効研究の有利なデータに応じて,2024年上半期にSGR−3515のINDをFDAに提出する予定であり,規制部門の承認を得ることを前提として,2024年末までにSGR−3515の第1段階臨床試験を開始する予定である。
2023年、2022年、2021年、私たちの総収入はそれぞれ2.167億ドル、1.81億ドル、1億379億ドルで、それぞれ20%と31%増加した。2023年12月31日までの年度純収益は4,070万ドルであり,2022年12月31日および2021年12月31日までの年度純損失はそれぞれ1.492億ドルおよび1.012億ドルであった。
戦略.戦略
私たちの使命は,療法や材料の発見の仕方を変えることで,人間の健康と生活の質を改善することである。私たちの目標は以下のようにすることです
•私たちの計算プラットフォームを支える科学を推進しています私たちは物理に基づく計算薬物発見分野でリードしており、私たちの計算プラットフォームは私たちの最も近い競争相手をはるかにリードしていると信じている。私たちは新しい製品を発売することで、私たちの業界のトップを維持するつもりです
•私たちのソフトウェア事業を発展させ拡大しています我々のソフトウェア収入は着実に増加し,2023年には1.591億ドルの収入を実現し,2022年に比べて17%増加したが,これは主にバイオ製薬業界が我々のソフトウェアソリューションを広く採用していることと我々の材料科学業務の拡張によるものである。バイオ製薬会社はより広い範囲で我々のソフトウェアを採用することが増えており,この規模の拡大が将来の収入増加を推進することが予想される。
▪私たちの協力計画を進めています私たちは引き続き私たちの協力者と協力して、探索研究段階で私たちの協力計画を推進するつもりです。私たちの協力計画は、前金、研究資金、臨床前と臨床マイルストーン、および潜在的なオプション費用、ビジネスマイルストーン、および将来の特許権使用料によって収入を生成する。我々は2023年に5750万ドルの薬物発見収入を達成し,2022年に比べて27%増加したが,これは主に我々の協力計画がマイルストーンを実現したためである。私たちはまた特定の協力者での私たちの株式から利益を得ている。たとえば,2023年12月31日までの財政年度中に,武田薬品株式会社または武田がNimbusの完全子会社Nimbus Lakshmi,Inc.とTYK 2阻害剤NDI-034858を含むTYK 2計画の買収を完了した後,Nimbus Treateutics,LLCまたはNimbusの株式を持つことで合計1.472億ドルの現金分配を得た.
▪私たちの特許薬物発見計画を進めています:我々は、SGR-1505、SGR-2921、およびSGR-3515を含む私たちの特許薬物発見計画の開発を推進する予定であり、新しい計画を引き続き推進することができ、これらの計画では、私たちのコンピューティングプラットフォームを使用して新しい分子を識別することができる。これらの計画の進展に伴い,我々は個々の計画に基づいて戦略的評価を行い,彼ら自身の臨床前と臨床開発を推進し,有力な業界パートナーと共同開発したり,臨床やビジネス機会を最大限に増加させるために,より多くの許可を与えたりする予定である
•私たちのビジネス間の相乗効果を利用して私たちは私たちの業務が著しい協同効果を持っていると信じている。私たちは、私たちのソフトウェア顧客、協力者、および内部薬物発見の専門家から受け取ったフィードバックを利用して、私たちのプラットフォームの機能を改善し、これは顧客が私たちの解決策をより多く採用し、私たちの協力と独自の薬物発見計画をより迅速に推進することを支持すると信じている。また、私たちの協力者の薬物発見計画の推進における成功は、私たちのプラットフォームと方法に重要な検証を提供し、これは私たちのプラットフォームの顧客に対する魅力を増加させ、私たちの新しい協力関係を構築するのを助け、私たち自身の特許薬物発見計画の潜在力を検証したと信じている。私たちがこれらの異なる業務に従事できる核心はファイアウォール政策であり、この政策は完備されたプロトコルと技術措置からなり、私たちのソフトウェア顧客と薬物発見協力者の知的財産権の秘密と隔離を確保することを目的としている。
業界の概要
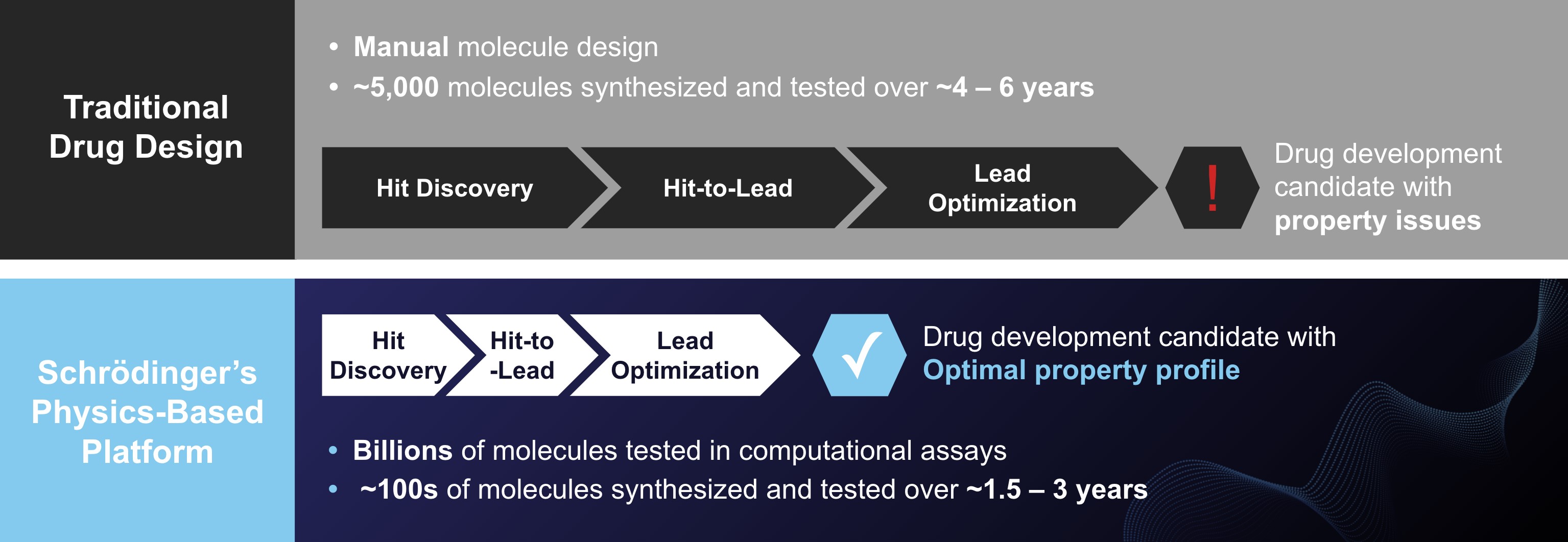
伝統的な薬物発見と開発仕事は複雑で、時間と資本密集型であり、しかも高い失敗率が出現しやすい。伝統的な薬物発見には、既存の分子バンクを試験的にスクリーニングし、検出可能な活性を有する分子、すなわち“ヒット分子”を見つけ、その後、複数回の化学合成反復を行い、これらのヒット分子を最適化し、ヒト臨床試験まで進めることができる開発候補分子とすることが含まれている。薬物発見プロジェクトのための最初の人気分子を最適化する努力は、高価で反復的な分子合成および試験を含み、これらの分子は、所望の性質の特徴を有する分子の識別を求める。最適化された製剤は力価,選択性,溶解性,バイオアベイラビリティ,半減期,透過性,薬物−薬物相互作用特性,合成性と毒性などの面で許容可能なバランスを達成した。これらの属性は、一般に逆相関であり、これは、1つの属性を最適化することが、一般に他の属性の最適化をキャンセルすることを意味する。HIT分子を最適化する挑戦は限られた数の分子によって増幅され,これらの分子は従来の方法でこれらの性質上実行可能なテストを行うことができる。そのため,このような最適化過程は往々にして満足できる性質の特徴を持つ分子を開発候補とすることができず,多くの薬物発見計画が臨床開発に入らなかったためである。
高価で時間のかかる実験合成を開始する前に分子性質を予測できれば,薬物発現を加速させ,コストを低減し,成功の可能性を高めることができる。分子の重要な性質を正確に予測することが可能であれば,実験合成やテストを必要とする分子はさらに少なくなる。したがって,より大きな分子セルを解析することができ,より選択的に分子を合成することができ,より高品質な分子を生成することができる。また,予測計算方法により,より良い分子選択が合成される
より大部分の化学空間を探索することによって、より高品質の分子を招き、逆にもっと高い可能性が臨床開発に進展し、そして監督部門の商業販売許可を得る。
計算法を用いて分子の性質を予測することで,薬物発見過程の効率を向上させる試みが多くなされている。多くの会社が展開しようとしている主な計算方法の1つは機械学習であり,一般に人工知能やAIと呼ばれている.機械学習の主な利点の1つは,大規模なデータを高速に処理できることである.しかし,機械学習自体には大きな限界があるため,薬物発見過程の効率向上への影響は限られている。機械学習には,予測モデルを構築するためのデータ,いわゆる訓練セットを入力する必要がある.このモデルは訓練集合に類似した分子の性質を正確に予測することが期待できるが,訓練集に類似していない分子に外挿することはできない。したがって,合成可能な分子の数は実際には無限であるため,機械学習は潜在的に合成可能な分子総数のごく一部しかカバーできない.
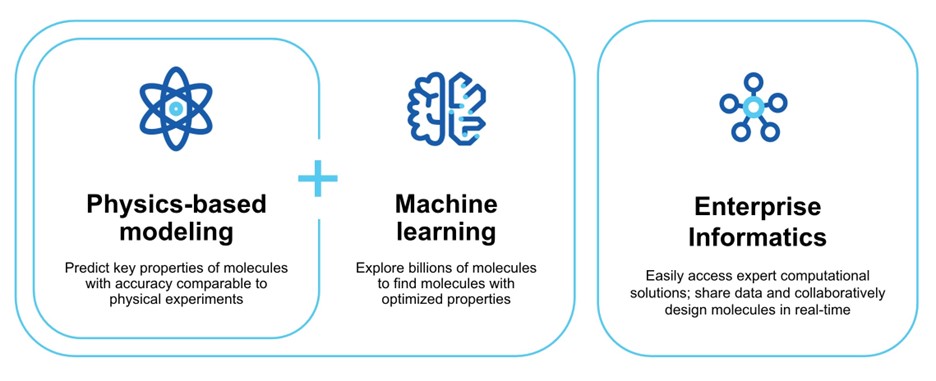
薬物発見を改善するために探索する別の主要な計算方法は、計算すべき特定の性質を深く、徹底的に理解する必要がある基本的な物理ベースの“第一原理”を使用する方法に関する。しかし,物理に基づく手法の開発は困難であり,機械学習に比べて遅い可能性がある.さらに、この方法を適用して、特定のタンパク質標的に高親和性に結合する分子を設計するためには、このタンパク質の3次元構造は、“構造イネーブル”と呼ばれるこれらの物理ベースの方法を適用することができるように、十分な原子詳細で生成されなければならず、このような構造は歴史的に入手が困難であり、今日ではヒトタンパク質宇宙における比較的小さいサブセットにのみ利用可能である。計算化学がその約束を達成することを阻害するもう一つの要素は限られた計算速度だ。しかしながら、これらの課題があるにもかかわらず、物理ベースの方法は機械学習よりも顕著な利点があり、訓練セットを必要としないので、原則として既存の業界の経験およびデータをはるかに超える分子の性質を計算することができる。
私たちのプラットフォームは
過去数十年間、私たちは数百人の科学者とソフトウェアエンジニアの共同努力の下で、分子の重要な性質を高度に正確に予測できる計算プラットフォームを開発した。我々のプラットフォームは,厳密で物理的な手法に基づいて,機械学習の高速なデータ処理とスケーラビリティの利点を組み合わせており,これらの利点は従来手法に対する顕著な利点を提供している.大規模計算能力の増加に加え,モデルやアルゴリズムのより複雑な理解や,高分解能タンパク質構造の利用が可能になってきていることに加え,物理によるシミュレーションが1つの変曲点に達していると考えられる。
私たちのソフトウェアプラットフォームは以下のように薬物発見過程に変化的な影響を与えることを証明しました
•開発候補を決定するのに要する平均時間およびコストを低減すること
•薬物発見計画が臨床開発に入る可能性を増加させる。
我々のこれまでの薬物発見努力によると,我々の協力計画に含まれており,我々のプラットフォームを用いて発見された候補開発者が臨床開発に成功する可能性は業界平均よりも高いと信じている。
以下に示すように,予測物理に基づく手法と高度に拡張可能な機械学習を密接に組み合わせることで,これらの結果を実現した.また,我々のプラットフォームは薬物発見プロジェクトのリアルタイム連携を実現し,意思決定に情報を提供し,我々の計算プラットフォームの予測能力の影響を最大限に発揮することができる。
伝統的な薬物発見方法と比較して、私たちの計算プラットフォームは以下の顕著な技術優勢を提供し、これは薬物発見の仕事の時間が短く、コストが低く、成功確率が高いと信じている
•スピードです。私たちのプラットフォームは通常数週間を要するのではなく、数時間以内に分子を評価することができ、実験室で分子をスクリーニング、合成、試験することができる。
•割合です。我々のプラットフォームは毎日数十億個の分子を明示的に評価することができるが,従来の薬物発見プロジェクトでは毎年約1000個の分子しか合成·評価できず,必要な性質を持つ新しい分子を見つける可能性が増加している。
•品質です。同業者評議の研究において、著者らのプラットフォームは緊密に結合する分子を選択する伝統的な方法とテストを行い、その結果、必要な親和性を持つ分子の数は8倍に増加した。
私たちのコンピューティングプラットフォームには様々な機能があります
•潜在的な顧客をより早く発見することは:大きな分子バンクおよび物理ベースの分子中心コア置換(ステントジャンプと呼ばれる)を仮想的にスクリーニングすることによって、Hit-to-LeadおよびLead最適化作業に適した有効な分子を迅速に識別し、図書館所蔵品にはない新しい高効率な分子を識別する
•正確な性能予測:物理的計算に基づいてクラス薬物分子の重要な性質を評価する能力を使用し、その正確性は、薬物効力、選択性およびバイオアベイラビリティを含む薬物性質の最適化を促進するために実験室実験分析に相当する
•タンパク質構造を最適化する:構造に基づく薬物設計の標的数を増加させるために、タンパク質構造モデルの能力を改善および最適化すること;
•大規模分子探査:計算列挙と生成性機械学習技術を利用して新しい、高品質の類薬物分子に対して計算構想と探索を行う能力を利用して、発見プロジェクトチームの考えに供する。これらの技術は訓練と構築を経て、合成上実行可能な分子を産生する
•大スケール分子評価重要な薬物特性の計算を数十億個の分子の超巨大な理想的な集合に拡張することができ、高品質の候補薬物分子をより迅速かつより成功的に認識することができる
•統合データ管理と可視化:複雑な計算から得られたデータを、機能的かつユーザに優しいグラフィックインターフェースを介して生成、アクセス、分析し、アッセイデータと統合することができる。
著者らの科学進歩に対する認可は顧客採用、同業者審査定期刊行物の引用及び著者らの協力と独自薬物発見計画の進展によって実現された。例えば,2004年に発表された我々のリガンド−タンパク質ドッキング計画Glideを記述した最初の論文は,最も多く引用された論文の1つである薬物化学雑誌この分野では随一のジャーナルですGlideは引き続き私たちの顧客によってバイオ製薬業界全体の人気のある検索技術として広く使用されている。著者らは薬性評価、親和性計算、蛋白質構造最適化及び分子構想と設計などの領域で多くの類似した科学進展を得た。これらの進展は数百人の博士レベルの科学者とソフトウェアエンジニアからなるチームによって実現され、彼らは私たちの科学諮問委員会から広く投入され、その中には計算化学、物理に基づくシミュレーション、統計力学と機械学習における思想指導者が含まれている。
我々のコンピューティングプラットフォームは,興味のある新しい問題や新しい研究分野にも適用される.駆動生物とその目標結合の基本物理と駆動薬物小分子とタンパク質結合の物理はあまり変わらないため、著者らの技術を生物製品の発見に応用することができ、私たちのプラットフォームの生物製品方面の能力を高めていくことができる。同様に,材料性質の背後にある物理学は薬物分子の性質の背後にある物理学とあまり変わらない。そこで,我々のコンピューティングプラットフォームを航空宇宙,エネルギー,半導体,電子ディスプレイの分野を含む材料科学応用に応用した。
ソフトウェア業務
概要
私たちは生物製薬業界の薬物発見計算ソフトウェア解決策のリード的な供給者だ。2023年、2022年の収入で評価すると、上位20位の製薬会社はすべて私たちの解決策を許可し、2023年のソフトウェア収入の7180万ドルを占め、私たちのソフトウェア収入の45%を占めている。また,2023年には,我々のソフトウェアは世界各地の1760以上の学術機関の研究者によって使用されている.我々のソフトウェアの広範な採用は,約240人のグローバル販売,技術,科学者チームの支持を得ている.私たちの直販業務はアメリカ、EU、イギリス、日本、インド、韓国に及び、中国を含む他の重要な市場で販売流通業者がいます。
私たちは多元化と巨大な既存の顧客基盤、スタートアップバイオテクノロジー会社から最大の世界製薬会社まで、ますます多くの材料科学顧客を持っている。2023年、私たちの10大ソフトウェア顧客は私たちのソフトウェア収入の約42%を占め、そのうちの1つはソフトウェア総収入の14%を占めています。私たちは引き続き私たちの顧客基盤を拡大し、同時に教育と情報を提供し、人々の異なる業界における私たちのコンピューティングプラットフォームの潜在力に対する認識を高める。2023年12月31日現在、アクティブなお客様1,785人を有しており、所与の会計年度においてACVが少なくとも1,000ドルのお客様数と定義しています。
2023年、2022年、2021年12月31日までの年間で、それぞれ222、227、190人のお客様のACVは少なくとも100,000ドルです。私たちは私たちの顧客群の中で、私たちのプラットフォームを拡大する重要な機会があると信じている。たとえば,2023年11月には,礼来社(Eli Lilly and Company,略称礼来社)と3年間の拡張ソフトウェアプロトコルを締結した.この3年間の合意は2022年に設立された協力に基づいており、この協力は“--協力協定この協定は、私たちの全技術を大規模に使用する機会を礼来会社に提供し、薬物発見のすべての段階を有効にし、加速し、標的の有効化と標的制御可能性の評価から標的発見まで、開発候補を決定することによって最適化活動をリードする。私たちは礼来会社の研究サイトのプラットフォームの完全な統合と最適化を確保するために先進的な支援を提供する
バイオ製薬会社はより広い範囲で我々のソフトウェアを採用することが増えており,この規模の拡大が将来の収入増加を推進することが予想される。私たちが顧客群で拡張する能力は、ACVが少なくとも50万ドルまたは100万ドルの顧客を含むACVのハードルが高いことをますます多くの顧客に現れている。2023年12月31日までの1年間に、54人のお客様のACVは少なくとも500,000ドルですが、2022年12月31日までの年間52人のお客様がいます。また,2023年12月31日,2022年12月31日,2021年12月31日までの1年間に,それぞれ27,18,15の顧客を有しており,ACVは少なくとも100万ドルである.また、2023年12月31日までの年間ACVは少なくとも500万ドルですが、2022年12月31日と2021年12月31日までの年間でそれぞれ4名と2名のお客様がいらっしゃいます。2023年12月31日までの1年間で私たちの
ACVによると、10人のお客様が私たちの総ACVの5,100万ドルを占めていますが、2022年12月31日までの年間は4,650万ドルです。私たちは生物製薬会社が私たちのプラットフォームを大規模に使用する科学と経済的利益をますます認識し、鑑賞していると信じている。
また、私たちの販売とマーケティング方法、そして私たちのソフトウェア解決策の品質は、最大の顧客と長期的な関係を構築し、高い保持率を維持すると信じています。私たちの重要な関係の持続時間はこれを証明しており、2023年に私たち最大の10人のソフトウェア顧客の平均任期は19年に近い。また,時間の経過とともに,我々がクライアント関係を拡大する能力は,ACVが少なくとも100,000ドルのクライアントを維持できることに現れている.2023年12月31日までの年間で、ACVが少なくとも100,000ドルの顧客に対する前年比顧客保持率は92%であり、前の9年度は毎年96%以上であった。2023年12月31日までの1年間の顧客保持率は98%であり、2022年12月31日までの1年間の顧客保持率は100%であった。私たちは、顧客基盤に対する高い保留率に加え、顧客が私たちのソフトウェアを使用する能力を拡大し、収入増加を推進していくと信じています。次の数字は私たちが成長を加速させる様々な方法を示している。
ACVおよび顧客保持率に関するより多くの情報は、“経営陣の財務状況や経営結果の検討と分析--我々の業績に影響を与える重要な要因”を参照されたい。
私たちの薬物発見ソフトウェア解決策は
我々は、通常1年間のプロトコルに基づいて、分子発見、設計、最適化のすべての段階を加速する様々なソフトウェアソリューションをお客様に提供します。私たちのライセンスは、私たちの顧客が指定されたソフトウェアソリューションで一定数の計算を実行できるようにします。以下に著者らのいくつかの重要なソフトウェア解決策と、これらの解決策を用いた薬物発見の特定段階を重点的に紹介した。
•目標認識と検証:薬物発見活動のテーマとして、追求すべきタンパク質標的の同定と評価に値するかもしれない。
◦水図目的タンパク質結合点または溶媒和水分子を占める位置およびエネルギーを特徴付ける。この分析から,タンパク質の薬性が推定された
結合部位中の水構造を利用することにより結合親和性を有意に増加させる機会を見出した。
◦ウェブサイト地図アロステリック部位を含む潜在的なタンパク質結合部位の局在化を容易にし、これらの部位の実質的な薬性を予測するために、結合部位の識別および評価を可能にする。
◦GlideEM、PrimeX、Phenix/OPLS 4中品質の実験タンパク質構造を最適化することができ、その品質が構造に基づく薬物発見を推進するのに十分である。
•人気のある探索Hit分子の認識です
◦FEP+私たちの自由エネルギー計算ソフトです。HIT発見では、ソフトウェアは、図書館所蔵品にはない新しい高度に有効な分子を識別するために、以前に知られていた緊密結合分子の中心コアの代わりに使用することができる。一般に、これらの分子は典型的なHIT分子よりも高い結合親和性およびより良い性質を有する。FEP+はまた、絶対結合親和性を計算するために使用することができ、これにより、ソフトウェアは、ヒット発見環境において共通の周辺特徴を有さない異なる分子を評価および分類することができる。
◦滑走する特定のコンホメーション中の特定のタンパク質標的に結合する可能性のあるヒット分子を見つけるために、分子ライブラリーをスクリーニングするための我々の仮想スクリーニングプログラムである。
◦WScoreタンパク質-リガンド相互作用溶媒和効果のより正確で信頼性の高い記述を利用した我々の次世代仮想スクリーニングプログラムである。この特性や他の新しい特性は,WScoreが分子ライブラリーをスクリーニングする際に,タンパク質標的に挑戦するヒット分子をより確実に見つけることができるようにした。
◦形状分子バンクをスクリーニングする際には,早期に知られているHit分子の3次元構造と形状を用いて新たなHitを探す。
◦深度自動定量構造効果の関係現代機械学習手法を用いて,比較的早く知られているヒット分子を訓練し,分子バンクをスクリーニングする際に新たなヒットを見つけるように訓練した.
◦IFD-MD予測分子とタンパク質結合部位の結合パターンを計算することで,タンパク質結合部位のコンホメーションが結合分子時にどのように組換えされるかを予測することができる。
•Hit to LeadとLead最適化:Hit to Leadは小分子Hitを評価し,将来性のある鉛分子を決定するために限られた最適化を行う段階である。鉛最適化は新しい類似物を設計することによって鉛分子の性質を改善し、これらの類似物はより高い効力、より少ない脱標的活性と良好な物理化学/代謝性質を有する。
◦FEP+私たちの自由エネルギー計算ソフトです。薬物発見のHit−to−LeadとLead最適化段階では,FEP+はリガンドとタンパク質の結合親和性を予測するために用いられ,精度は物理実験に近い。これは、プログラム中で最も強力な分子のみを合成するために、大型仮想分子ライブラリを正確に順序付けすることを可能にし、時間の節約とコストの低減を図ることができる。FEP+はまた分子の結合選択性、溶解度と突然変異抵抗性曲線を計算するために使用することができ、これらはすべて生物利用度、毒理学と治療効果を最適化する重要な属性である。
◦深度自動定量構造効果の関係現代機械学習手法を用いて予測可能な定量的構造-活性関係やQSARモデルを生成する.これにより,FEP+のようなより正確な方法をより大規模に適用することができるが,他の方法に比べてより大きな分子集合に対する正確性が低く,他の性質の予測QSARモデルを薬物発見プロジェクトに開発·展開することができる。
◦自動設計器合成された処理しやすいリガンドを迅速に探索することができる計数ツールである。AutoDesignerがマルチパラメータ最適化、機械学習、およびFEP+シミュレーションと共に導入されると、合成しやすい大量の鉛クラスの効率的なリガンドを作成して評価するための簡略化された方法を提供する。
•薬物発見の過程で使用されるソフトウェア解決策:
◦LiveDesign私たちのユーザーに優しい企業情報学的解決策であり、相互作用と協力の分子設計、データ集約と共有、及び化学者、モデル師と生物学者の間のエンドツーエンド発見プロジェクトの協調を実現することができる。
◦大師私たちのユーザーに優しいモデリング環境であり、専門家モデリング者が私たちの高度なモデリングソリューションを使用することを可能にします。
私たちの材料科学ソフトウェアソリューションは
また,工業用途の分子設計に従事する顧客にソフトウェアライセンスを販売している。我々が材料科学顧客に提供するソフトウェアソリューションは,我々のバイオ製薬用ソフトウェアとほぼ同様の技術を利用している
会社です。また,従来の薬物発見作業と同様に,これらの領域で新分子を発見する従来の方法にも時間が長いという問題があり,新材料を市場に出すには10年から20年かかる可能性がある。私たちは私たちの技術を利用して新しい材料を発見する方法を変えることに集中して、私たちは材料科学業界は計算方法の潜在力を認識し始めたばかりだと信じています。私たちは、現在業務を展開している以下の各分野での当社のコンピューティングプラットフォームの採用をさらに推進するために、テーマ専門家チームを構築し続けています
•モバイル電子製品及びディスプレイ−有機エレクトロニクス(OLED);
•−ポリマー、複合材料;
•−半導体、薄膜加工;
•石油と天然ガス−触媒、反応性;
•エネルギー?エネルギー-代替エネルギー、電池、および
•-ソフト、レシピ。
我々が材料科学応用ソフトウェアソリューションをさらに推進する持続的な努力の一部として、2020年6月、私たちはGates Ventures、LLCまたはGates Venturesと3年間の合意を締結し、原子シミュレーション方法を開発し、応用して電池性能を向上させる。2023年8月、ゲイツベンチャーとの合意期間を拡大し、3年間延長した。また、2022年3月には、より安全で高エネルギー密度のリチウムイオン電池の材料の発見と設計を加速するために、Eonix LLCまたはEonixと3年間の協力を達成した。今回の協力の条項によると、私たちはEonixの株式を獲得し、いくつかの技術マイルストーンを成功させた後に追加の株式を獲得する資格がある。
薬物発見業務
概要
私たちは協力と特許薬物発見プロジェクトで私たちの計算プラットフォームを使用した。次の図は,従来の薬物発見方法と比較して,我々の計算薬物設計方法の時間,コスト,分子質量における優位性を示している。
私たちの協力計画は、前払い、研究資金支払い、および発見と開発マイルストーンを含む薬物発見収入を生成し、追加のマイルストーン支払い、オプション費用、および将来の特許使用料を生成する可能性がある。2023年12月31日現在,われわれは19の協力薬物発見プロジェクトを行っている。私たちは、能動的協力薬物発見計画を、私たちの協力者または私たちの協力者と共に積極的に推進している計画、または私たちの協力者が進行しており、マイルストーン支払い、オプション費用、および/または将来の印税を得る資格がある計画と定義している。また,2023年12月31日までに計12件の連携計画があり,マーケティング承認を得た連携計画の商業販売(あれば)から将来の印税を得る資格があり,2022年12月31日までに15計画がある。
我々は,2018年以降,薬物発見·開発において協力または協力してきた協力者の総数を追跡し,2023年12月31日までに17名の協力者を得た。量
協力者は累積数字であり、2018年12月31日現在の会計年度以降に収入を得ている協力者のみを含む
私たちの薬物発見創収協力は私たちの業務の重要な構成要素であるが、私たちの戦略はまた、SGR-1505、SGR-2921およびSGR-3515を含む当社の独自の薬物発見プロジェクトに投資し、これらの項目を以下の“-私たちの独自の薬物発見業務”でより詳細に説明した。私たちは単独で私たちの特許薬物発見計画を評価して、自分が臨床に入る前と臨床開発を決定して、リードする業界のパートナーと共同開発し、協力或いは許可計画を脱退して、その開発及び臨床と商業潜在力の実行可能性を最適化する
既存の計画が発見過程で進展し開発段階に入るにつれて、内部またはパートナーと共により多くの特許薬物発見計画を推進する予定であり、私たちの選択基準に適合した新しい協力計画と、協力者の特定の専門知識、資源、または知的財産権が実質的な価値を創造する潜在力を有する新しい協力計画を引き続き評価していく。
この10年間、私たちは私たちのプラットフォームと専門知識を利用して、一連の協力プロジェクトを着実に開発した。我々はすでに有力なバイオ製薬会社と多くの協力を達成しており,これらの協力の下で,腫瘍学,抗真菌疾患,線維化,炎症性腸管疾患,代謝性疾患,自己免疫疾患,免疫腫瘍学,心肺疾患,結核の様々な項目を含む複数の治療分野の研究が行われている。これらの計画の多くは新たな標的を探すためであり,これらの標的は低用量の小分子阻害剤や活性化剤であり,最適な薬物特性を有しているか,あるいは他のタンパク質に対して標的に対する選択性が困難であった。我々は,有力なバイオ製薬会社との薬物発見協力を選択的に行うことにより,我々の協力プロジェクトパイプラインを開発した。我々が協力を開始するための要因としては,目標が良好に検証されているかどうか,高い治療可能性があるかどうか,我々の計算プラットフォームの優位性に従うかどうか,協力者が相補的な能力をもたらすかどうかがあり,これらすべてが成功の可能性を増加させるのに役立つと考えられる。その中のいくつかの計画は私たちに相当な収入を提供し、将来的により多くのマイルストーン支払い、オプション費用、および特許使用料を生成する可能性がある。
私たちの計算プラットフォームと私たちの薬物発見とソフトウェア開発チームの最大潜在規模を使用することによって、私たちの協力者は以下の主な利点を得るだろう
•私たちのプラットフォームをすぐに使用しますトレーニングや加速時間を必要とすることなく、我々のコンピューティングプラットフォームのすべての利点を直ちに有効に利用することができ、薬物発見の加速を実現する。
•膨大な量の計算能力を獲得する:我々の計算ソフトウェアを大規模に実行することができ,このような計算インフラを自ら構築するのに要する時間やコストを回避した.
•先端機能を早期にアクセスする:開発中の新しい解決策にリアルタイムでアクセスします。
•目標排他性:私たちの協力協定によれば、私たちは、私たちのコンピューティングプラットフォームおよび技術を使用して、協力者のための1つまたは複数の特定のタンパク質標的のための薬剤を設計することに同意します。
協力協定
我々の現在のパートナーには,AJAX治療会社,BMS社,Bright Angel治療会社,礼来社,礼来社,モルフィホールディングス,大塚製薬株式会社,サイノフィ社,構造治療会社(前身はShti,Inc.)と武田が含まれているが,これらに限定されない。私たちがこれらの協力の下の任意のプロジェクトから潜在的な収入を得る機会は、通常、研究資金の支払い、開発、規制、商業マイルストーン、および商業販売の印税(あれば)に限られる。
武田、BMS、大塚和礼との協力協定(以下に述べる)に加えて、我々の協力協定には、通常、以下のような特徴がある
支配権/所有権これらの協力の下で行われるすべてのプロジェクトは,それぞれの協力者が完全に所有し,制御している.承認されれば、私たちはそれらの臨床前や臨床開発や商業化を推進する責任はありません。
株式買い入れそれは.私たちはいくつかの協力者の株式対価格を受け取り、私たちはまた時々いくつかの協力者に追加的な株式投資を行う。別の説明がない限り、次の表に2023年12月31日までの発行および未償還持分を示します
| | | | | | | | |
| 会社 | | 所有権パーセント |
| アジャックス治療会社は | | 6.3% |
アポロ有限責任会社(1) | | 7.9% |
| 光天使治療会社です。 | | 31.5% |
法賢治療有限責任会社(合弁企業)(2) | | 50.0% |
Lakshmi,LLC(3) | | 5.3% |
モニック·ホールディングス(4) | | 1.7% |
Nimbus治療有限責任会社(5) | | 1.5% |
| | |
構造治療会社です(6) | | 2.9% |
(1)私たちのこのエンティティにおける持分を代表して、このエンティティは完全に薄くした上で、将来的に受け取ったジリード科学会社‘SがNimbus’ACC阻害剤計画を買収することに関連する任意の支払いの権利を保持する。
(2)株式の半分ずつを占める合弁企業を代表します。
(3)完全希釈の基礎に基づいて、武田がNimbusのTyk-2阻害剤計画を買収することに関連する任意の将来の支払いの権利を有するエンティティにおける私たちの権益を表す。
(4)Morphiが2024年2月22日に米国証券取引委員会に提出した2023年12月31日までのForm 10−K年度報告に基づいて報告された2024年2月20日現在の発行済み普通株数。
(5)完全に希釈した上で
(6)構造治療会社Sが2023年11月17日に米国証券取引委員会に提出した2023年9月30日までの四半期報告10−Q表に報告されている2023年10月31日現在の発行済み普通株数。
時々、私たちはまた私たちの協力者たちの株式によって配布されるかもしれない。例えば,2023年2月,Nimbusは武田がNimbusの完全子会社Nimbus Lakshmi,Inc.とそのTYK 2計画の買収を完了したことを発表し,TYK 2阻害剤NDI−034858を含み,乾癬の2 b期臨床試験で陽性結果を得た後,多くの免疫介在性疾患の治療の評価を受けている。2023年2月13日、2023年4月6日、2023年11月9日に、武田買収に関する1.113億ドル、3580万ドル、10万ドルの現金配分をそれぞれ受けた。
財務権。私たちはいくつかの協力者の中の持分以外に、私たちは個々の協力者の合意に基づいて様々な支払いを獲得する権利があり、資金支払い、発見、開発と商業マイルストーン、および数桁の範囲内の潜在的な印税を研究する権利がある。私たちのいくつかの協力協定によると、私たちは私たちの協力者の子許可収入から一定の割合の収入を得る資格がある。私たちの多くの協力プロジェクトは現在も発見と臨床前開発段階にある。一般的に、私たちが協力計画から得る資格がある支払い金額は計画が進むにつれて増加します。
重要なのは,我々の現在の協調プロトコルは,通常,我々の現在の協調プロトコルでの計画数を潜在的に増加させることを可能にする追加の計画目標を追加することも考慮しており,これは我々が以前に存在していた排他的な義務と利益に依存する.
しかし、これらの協力は私たちの統制下にないので、私たちは、私たちがいつ、これらの協力の下で、事件に基づく研究資金支払い、マイルストーン支払い、印税、または他の支払いの増加を達成することができるかどうかを予測することができず、そのような支払いのすべての金額を推定することもできず、私たちはそのような支払いを決して受けないかもしれない。このような支払いを受けたときに直面するリスクのさらなる議論については,“リスク要因−薬物発見に関連するリスク−薬物発見協力に投入された資源や現金は決して見返りを達成しない可能性がある”を参照されたい。
私たちはどうやって私たちの協力者と協力するか。一般的に、私たちの既存の協力協定は、私たちのコンピューティングプラットフォームを使用して、協力者に特化した技術を使用して1つまたは複数の特定の目標のための薬剤を設計することに同意する。協力者は協力して開発された任意の分子に関連する知的財産権を保持する。一般的に、私たちの協力者は契約上私たちに提供する必要はなく、これらの協力プロジェクトの推進に関連する重要な進展の非公開情報、例えば、安全性および有効性データ、規制コミュニケーションまたは商業化計画および戦略を含む臨床試験結果を得ることも期待していない。私たちがこのような情報を受信した範囲では、私たちの協力協定は、通常、協力によって受信した情報を秘密にすることを要求します。
上記の協力に加えて、武田、BMS、大塚和礼と以下のように協力合意に達した
武田です。われわれは武田と協力して腫瘍学的目標に焦点を当てた計画を進めている。この協力の下で,先行最適化段階により何らかの薬物発見研究や薬理学的活動を行い,この段階では武田はこのような計画の独占的権利を獲得する選択権を行使したが,引き続き協力して候補薬を開発する必要がある。
BMSそれは.2020年11月、著者らはBMSと独占的な全世界協力と許可協定に調印し、この協定に基づき、著者らとBMSは腫瘍学、神経学と免疫治療領域の生物標的のための小分子化合物の発見、研究と開発に協力することに同意した。双方が興味のある標的(S)について合意した後,シュレーディン療法集団は候補薬物の発見開発を担当した。特定の目標基準に適合する開発候補が決定されると、BMSは単独でその開発候補の開発、製造、商業化を担当する。我々がBMSと合意した合意によると,最初の協力目標はHIF−2 AlphaとSOS 1/KRASを含み,これは我々の2つの独自プロジェクトである。2021年11月、我々はBMSと共同で、HIF-2アルファ標的を別の正確な腫瘍学標的で置換することに同意した。交代選挙の後、HIF-2アルファ目標計画のすべての権利が私たちの手に戻った。2022年9月、BMSはこれ以上別の目標を開発しないことを決定し、このプロジェクトのすべての権利は私たちの所有になった。2022年12月,我々とBMSはプロトコルを改訂し,条項が元のプロトコルと類似した場合に神経学的領域に目標を追加した。2023年9月,BMSは2つの関連腫瘍学プロジェクトの開発を継続しないことを決定し,これらのプロジェクトのすべての権利が我々の手に回復し,これらのプロジェクトに関連する義務の達成を加速したため,収入確認が増加した。改正された合意条項によると、私たちは2020年11月にBMSから5500万ドルの前金を受け取り、2022年12月に追加の前払いを受けた。我々はBMSから現在協力している目標の合計15億ドルのマイルストーンを得る資格があり,その中で2023年12月31日現在,我々はKRAS変異腫瘍治療のSOS 1計画のために開発候補を選択したことを前提として2500万ドルを受け取った。BMSは現在自費でこのような候補薬物の更なる臨床前と臨床開発、製造と商業化を担当している。協定によると、BMSが商業化する各製品の純売上高の階層的特許権使用料を得る資格があり、範囲の中央値から1桁から2桁まで低いが、いくつかの特定の割引によって制限されている。本協定の詳細については、“-百時米施貴宝社との協力協定”を参照されたい。
我々のBMSとの協力の下,BMSは我々が発見したKRAS駆動癌の治療に用いられるSOS 1タンパク質相互作用阻害剤を開発している。SOS 1,あるいはSeven less-1の息子は,KRASの活性化と調節に関与している。癌遺伝子突然変異KRASは肺癌、膵臓癌と結腸癌などの最も治療しにくい腫瘍の成長を刺激する。SOS 1の抑制はKRAS駆動癌を治療する潜在的な治療策略であると考えられている。
リリーそれは.2022年9月、私たちは礼来会社と協力して、免疫学的標的に対する小分子化合物の発見と最適化を担当した。礼来会社は臨床前開発、臨床開発と商業化を担当する。合意条項によると、私たちは4.25億ドルまでの発見、開発、商業マイルストーンの支払いを受ける資格がある前金を受け取った。私たちにはすべての市場の協力で生まれたどの製品の純売上高から低い1桁から低い2桁の印税を得る資格があります。
大塚それは.2022年12月、私たちは大塚およびその子会社Astex PharmPharmticalsと協力して新興中枢神経系(CNS)疾患標的に集中するプロジェクトの発見と開発を含む複数の部分からなる合意に達した。協力により,先行最適化による薬物設計を担当し,大塚は他のすべての薬物発見や臨床開発活動を担当する。私たちは前金を受け取り、発見、開発、規制マイルストーンを取得し、すべての市場で薬物発見協力から生まれた任意の製品の純販売から分級印税を得る資格がある。
私たちの特許薬物発見計画は
2018年には,我々のプラットフォームを用いて一連の斬新で価値の高い治療薬の生産を目指した一連の特許薬物発見計画の開発を開始した。我々の最初の計画は,DNA損傷反応経路や遺伝子定義癌標的に対する阻害剤の発見と開発に焦点を当てていた。それ以来,免疫学や神経学を含めて他の治療領域に拡張されてきた。私たちの戦略はいくつかの独自の計画を追求し、一つずつ計画した上で戦略的評価を行い、それらの臨床前と臨床に入ることを推進することです
私たちは独自に開発し、有力な業界パートナーと共同開発したり、ライセンスを彼らにアウトソーシングしたりして、彼らの臨床的·ビジネス的機会を最大限に増やすことができる。
以下は私たちの特許薬物発見計画の概要です
私たちの目標選択方法は
我々の目標の選択は,人間の目標と薬物発見計画の広範な分析に基づいている。我々は,自動化手法を用いて目標の大規模な分析を行った.私たちが計画の優先順位を決定する際に取る重要なステップは
•構造とモデリングをサポートそれは.我々の計算プラットフォームを用いて,タンパク質の構造質量および数千個の目的タンパク質の結合部位の薬性を解析した。興味のある高品質な構造のサブセットに対して,我々の計算プラットフォームへの適応性を確認する.
•治療可能性の評価それは.著者らの標的に対する選択は標的検証レベルの強い影響を受け、人類遺伝学と以前の臨床データの分析を含む。
•未解決の設計課題を決定するそれは.著者らは著者らの計算プラットフォームを応用することによって解決できる物件概況の挑戦が存在するかどうかを確定し、そして臨床意義のある差別化、斬新、高価値の製品機会を提供する。
•経路とメカニズムの潜在的価値を評価する。私たちは業界と商業利益および臨床効用を評価し、高い商業と治療潜在力を持つプロジェクトを優先することを目的としている。
この総合解析を用いて,我々の技術に適していると考えられるタンパク質標的が多く確認されている。私たちはこの分析を使用していくつかの追加的な目標を評価し続ける。
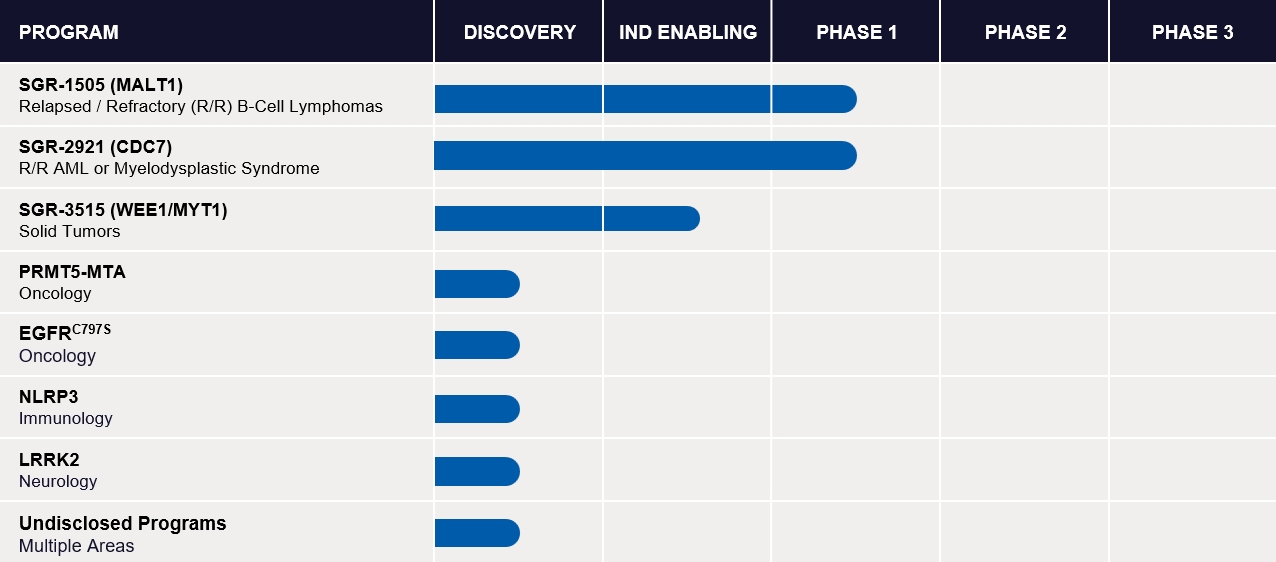
SGR-1505:MALT 1阻害剤
再発または難治性B細胞リンパ腫の治療のための新規MALT 1阻害剤SGR−1505を開発している。核因子-kappaB或いは核因子-κBはB細胞中の重要なシグナル分子であり、その持続活性化はいくつかの亜型リンパ腫の特徴である。MALT 1はNF−κBシグナル経路の重要なメディエーターであり,B細胞リンパ腫亜群の主要な駆動力であり,CARMA 1(Caspase募集ドメインに蛋白11を含み,カードを含むMaguk蛋白1とも呼ばれる)とBcl 10(B細胞リンパ腫/白血病10)と複合体を形成することにより抗原受容体誘導リンパ球活性化を媒介する。MALT 1はいくつかの亜型リンパ腫と白血病の潜在的な治療標的とされている。
活性化B細胞、またはABC、びまん性大B細胞リンパ腫のサブタイプ、またはABC-DLBCLは、最も一般的な侵襲性非ホジキンリンパ腫である。ABC-DLBCLは多くの突然変異に関連しており、これらの突然変異は構造的に活性化されたNF-κBシグナル経路を誘発し、この経路は通常MALT 1プロテアーゼ活性の増加によって媒介される。そのうち
これらの変異はMALT 1の機能変異や増幅であり,ABC−DLBCL患者でも発見されている。
我々は,我々の物理に基づく計算プラットフォームを用いて,複数の新しいMALT 1阻害剤シリーズを識別·推進することができ,HIT発見から最適化までリードしている。多パラメータ最適化、FEP+と機械学習を結合し、著者らは薬物性質を有する緊密な結合化合物を優先的に選択することができ、そして強力な抗腫瘍活性を有する複数の斬新かつ独特な化学系を決定し、最終的に2年未満の間にSGR-1505を著者らの開発候補化合物として選択することができた。
SGR-1505の臨床前研究の進展
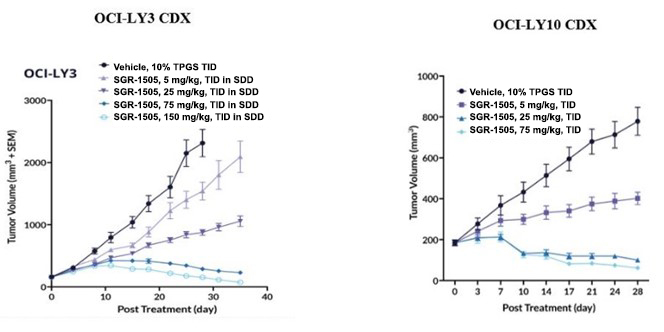
以下の図に示すように,臨床前研究では,共有結合BTK阻害剤イブルチニブと比較してSGR−1505はMALT 1酵素解析で抗腫瘍活性を示し,ブルートンチロシンキナーゼ(BTK)阻害剤耐性のOCI−LY 3 B細胞非ホジキンリンパ腫細胞系で強い抗増殖作用を示した。
以下の図に示すように,臨床前研究では,SGR−1505はBTK阻害剤に耐性のOCI−LY 3細胞やBTKに感受性のOCI−LY 10 B細胞性非ホジキンリンパ腫においても強い抗腫瘍活性を示した体内にある細胞系由来の異種移植モデル
TPGS=D−α−トコフェノールポリエチレングリコールブチレート、動物併用投与のための溶媒;TID=1日3回投与;SDD=噴霧乾燥分散液;SEM=走査電子顕微鏡、細胞体積測定方法
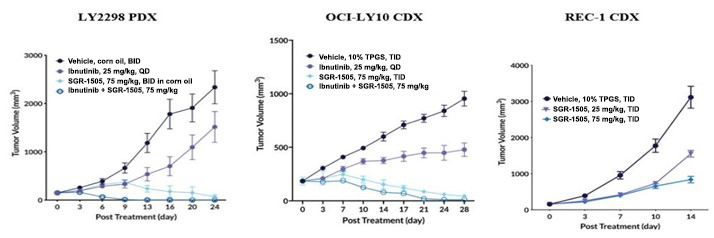
また,次の図に示すように,SGR−1505はBTK阻害剤に感受性でイブルチニブとの併用が強い抗腫瘍活性を示した活動中にABC-DLBCL患者由来の異種移植(PDX)モデルLY 2298とOCI-LY 10 CDXモデルのようなOモデル。ABC−DLBCL疾患モデルに加え,次図に示すように,SGR−1505は単剤抗腫瘍活性を示した体内にあるマントル細胞リンパ腫REC-1 CDXモデル。SGR-1505返し
OCI−LY 10 CDXモデルでは,ベンソニド(抗アポトーシス蛋白B細胞リンパ腫2(BCL 2)の阻害剤)が癌細胞活性を強く阻害する作用を示した。
Qd=1日1回投与;Bid=1日2回投与
これらのデータは、SGR-1505を用いたMALT 1の標的化はABC-DLBCLのような特定のB細胞リンパ腫患者の治療選択を拡大し、マントル細胞リンパ腫のような他のB細胞リンパ腫に拡張する可能性があることを示している。また,SGR−1505はBTK阻害剤と併用して再発/難治性B細胞リンパ腫患者から抽出した試料において,薬物誘導BTK阻害剤耐性を克服する可能性を示した。
また,一連の生化学と細胞による検出では,SGR−1505とJNJ−6633の効力を比較し,JNJ−6633はMALT 1 I期阻害剤であり,ジョンソンから臨床開発段階に入り,ICにより検出された50ICと90特定の生物学的機能を阻害するための化合物の効力の測定値である。以下の図に示すように、SGR-1505は、すべてのテストにおいてより良い効力を示す。
すべての競争相手のデータは契約研究機関内部で生成され,商業的に利用可能なツールを用いて,または第三者研究化学者によって公開されて利用可能な構造情報を用いて合成される.
SGR−1505の臨床応用の進展
SGR−1505再発性または難治性B細胞リンパ腫治療の1期臨床試験
FDAは2022年6月に私たちINDのSGR-1505を承認した。著者らはすでにSGR-1505の第一段階臨床試験を開始し、これは再発或いは難治性B細胞リンパ腫患者に対する開放ラベル、多中心用量増加臨床試験である。18歳以上、期待寿命が12週以上である成熟B細胞リンパ腫と診断された患者52名まで米国とヨーロッパに登録される予定である。SGR−1505経口投与。この試験は、SGR-1505の安全性、薬物動態、薬効学、最大耐性および/または推奨用量を評価することを目的としている。探索性行列は追加の薬物動態学、薬効学、初歩的な抗腫瘍活性と安全性を評価し、推薦用量を決定し、サブ研究はまた食品と薬物-薬物相互作用の影響を評価する。2024年2月14日現在,われわれのSGR−1505第1段階臨床試験で服用しているすべての患者は研究薬を服用しており,これまでに報告されている有害事象に基づいて,その安全性と
患者におけるSGR-1505の耐性は、健常ボランティアで観察されたSGR-1505第1段階臨床試験で観察された安全性および耐性と一致する。私たちは2024年末か2025年に試験の予備データを報告する予定だ。FDAは最近SGR-1505孤児薬物の称号を与え、マントル細胞リンパ腫の潜在的治療に用いられた。
健康ボランティアにおけるSGR−1505の一期臨床試験
我々は最近,SGR−1505の安全性,耐性,薬物動態,食品および薬物相互作用の影響に関するデータを含むより多くのデータを収集するために,73人の健常ボランティアでSGR−1505の第1段階臨床試験を完了した。SGR-1505の全体的な耐性は良好であり、薬物に関連する深刻な副作用或いは用量制限毒性は観察されなかった。副作用は主に1級であり,治療とは無関係であった。健常ボランティアのビリルビンの27%は上昇しているが,臨床的に関連しているとは考えられていない。これらの高さは主に1級で、レベル3や4級はありません。すべてのビリルビンレベルはSGR-1505停止後に逆になっています。
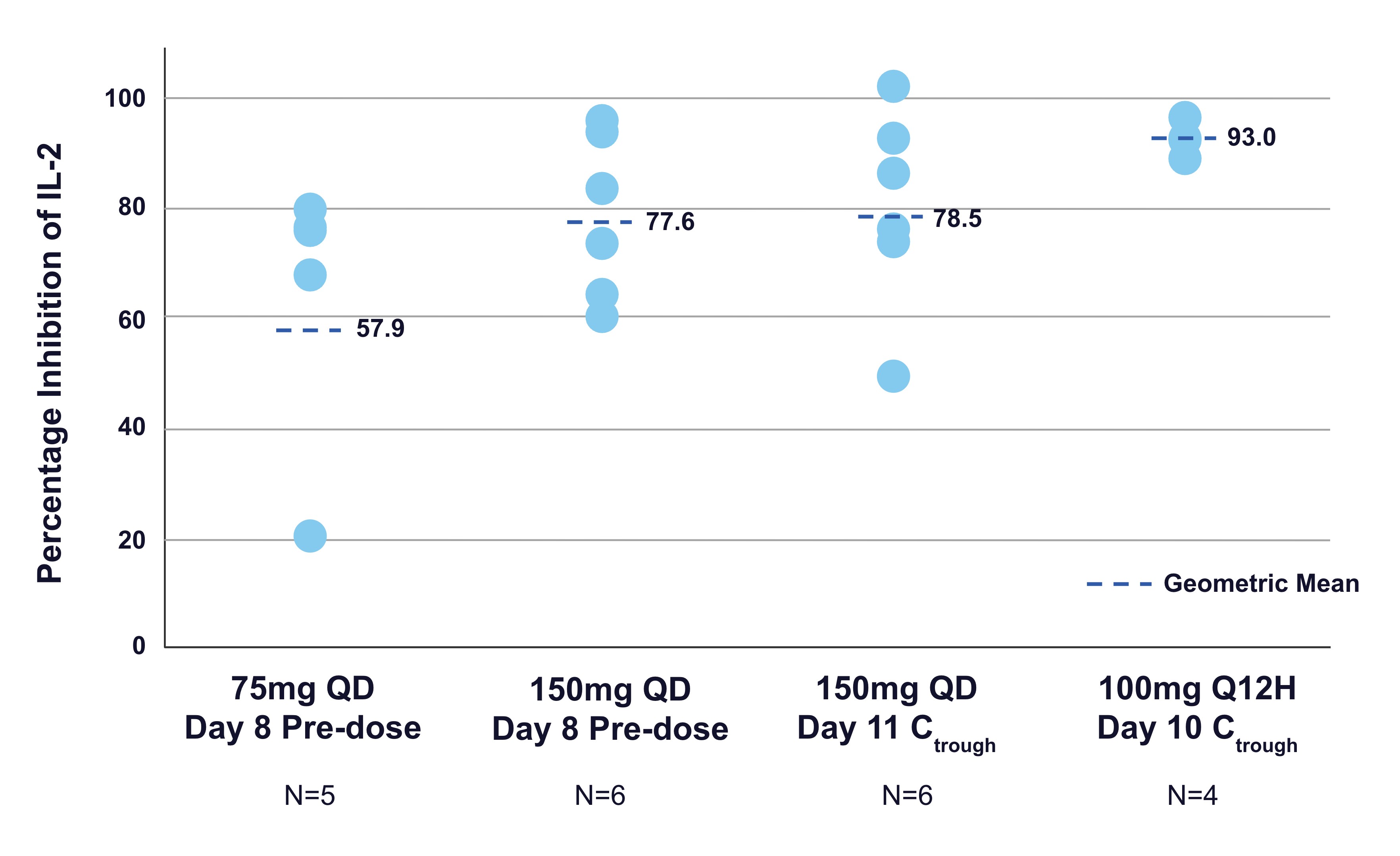
以下の図に示すように,活性化したT細胞全血検出ではIL−2の分泌が90%以上抑制されており,これらのボランティアはSGR−1505を1日2回服用し,10日間(n=4)連続して目標関与を確認し,研究の薬効学的目標を達成していることが健常ボランティアキューで観察された。IL-2の分泌抑制はMALT 1と下流のNF-κBシグナルと密接に関連しているため、標的参与と経路制御のマーカーである。
QD=1日1回,Q 12 H=1日2回
健常ボランティア試験からのデータは,われわれが行っている再発または難治性B細胞リンパ腫患者の第1段階臨床試験におけるSGR−1505の継続評価を支持している。
SGR-2921:CDC 7阻害剤
再発または難治性急性骨髄性白血病またはハイリスク骨髄異形成症候群の治療のための新規CDC 7阻害剤SGR−2921を開発している。CDC 7はセリン/トレオニンプロテインキナーゼの一種であり、すでにDNA複製の起動と複製圧力とDNA損傷への対応に重要な役割を果たしていることが証明された。CDC 7はある腫瘍でレベルが高く,急性骨髄性白血病やAMLを含み,これらの癌細胞の増殖能や正常DNA損傷反応を迂回する能力に関与していると考えられている。
CDC 7はリン酸化してDNA複製開始を担う酵素と複製ストレスに関与するタンパク質を活性化する。癌細胞におけるCDC 7活性の破壊はDNA複製遅延,複製圧力の増加,細胞周期異常,細胞死を引き起こす。
CDC 7阻害剤の第1段階臨床試験では,第三者はCDC 7阻害剤の抗増殖ポテンシャルを検証し,十二指腸癌,食道癌,子宮頸癌を含む反応を患者に認めた。この積極的な結果の前に、既存のCDC 7阻害剤は、(標的との親和性によって測定される)十分な密接な結合がなく、選択性に乏しく、より悪い薬物動態特性を示す。
CDC 7阻害剤の抗癌活性を最大限に発揮するためには,非常に密接に結合した阻害剤が単一療法としてあるいは臨床併用治療を背景に持続的な臨床効果を達成する必要がある。我々のコンピューティングプラットフォームを用いて、複数の密接に結合した、選択的、および新しいCDC 7阻害剤シリーズを決定し、我々の開発候補としてSGR-2921を選択した。
SGR−2921の臨床前研究の進展
表1と表2に示すように,SGR−2921は生酵素試験と生物物理試験において組換えヒトCDC 7の阻害を示し,平均ICにより測定した50価値は、特定の生物機能を抑制するための化合物の効力の測定である。表1はまた、SGR-2921とCDC 7が非常に強い結合親和性を有し、平均平衡解離定数Kdはタンパク質と結合パートナー間の結合親和性を測定する指標であり、皮モル範囲内であることを示している。さらに、SGR−2921は、結腸直腸癌細胞系COLO 205および2つの急性骨髄性白血病細胞株MV−4−11およびMOLM−16において、CDC 7下流基質MCM 2またはpMCM 2の53位またはS 53位セリンのリン酸化を阻害することを示した。
表1平均集積回路50SGR-2921細胞CDC 7キナーゼ活性及びCDC 7との結合親和性の研究
| | | | | | | | |
化合物 | 平均IC50 [ニム!] | クウェートディナール[午後.午後] |
SGR-2921 | 0.0277±0.0054 | 10 |
表2離体するセルベースIC50PMCM 2に対するSGR−2921の測定(S 53)
| | | | | | | | | | | |
細胞系 | COLO 205[集積回路50(海)] | MV-4-11[集積回路50(海)] | MOLm-16[集積回路50(海)] |
PMCM 2(S 53) | 1.19±0.41 | 0.92±0.40 | 1.62±0.52 |
SGR−2921も抗増殖活性を示した体外培養COLO 205、MV−4−11およびMOLm−16細胞株。表3に平均集積回路をまとめる50単項検査の価値。
表3離体する細胞に基づく活性IC50SGR-2921の値
| | | | | | | | | | | |
| 細胞系 | COLO 205[集積回路50(海)] | MV-4-11[集積回路50(海)] | MOLm-16[集積回路50(海)] |
細胞生存率 | 9.90±3.72 | 107.55±12.42 | 20.81±7.29 |
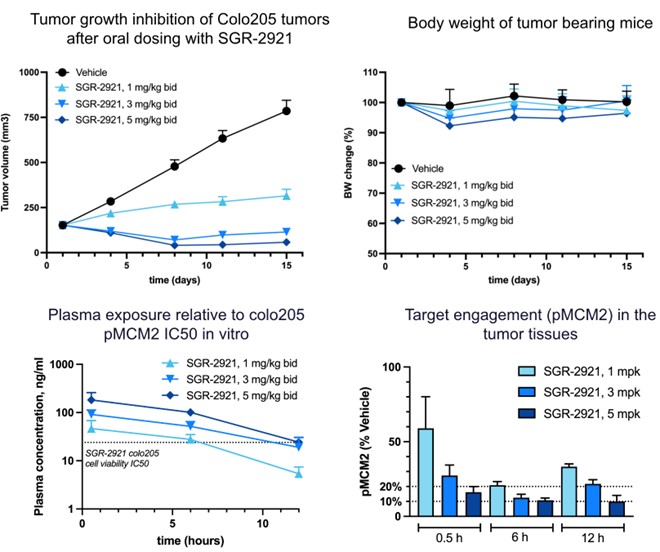
以下の図に示すように、SGR-2921はCOLO 205結腸直腸癌CDXモデルにおいて腫瘍成長抑制を示し、腫瘍消退をもたらし、COLO 205結腸直腸癌CDXモデルは結腸直腸癌細胞系由来の異種移植モデルであり、有意な体重減少を引き起こさない用量である。COLO 205 CDXモデルでは、SGR−2921はまた、血漿薬物濃度の用量依存性の増加および腫瘍内pMCM 2の用量依存性の減少を示した。急性骨髄性白血病マウスモデルにおいても,SGR−2921は耐性用量で強い抗腫瘍活性を示した。
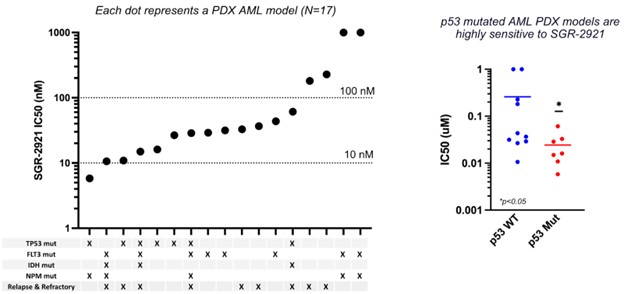
SGR-2921はまた、臨床的AML特徴として重要な遺伝子(TP 53、Flt 3、IDHまたはNPMを含む)のドライバ変異の変異状態に従って変化するAML患者からの白血病細胞試料において強力な抗増殖活性を示し、患者試料が治療を受けていない患者からか、以前のAML治療後に再発または難治性患者からのものであるか。細胞試料は通常SGR−2921に敏感であり,そのIC測定により観察された50TP 53またはp 53変異を含む患者サンプルは、SGR-2921に特に感受性が認められた。
SGR-2921は、AML患者由来試料において、p 53変異のAMLに含まれるドライバ変異に依存することなく、強力な抗増殖活性を示す
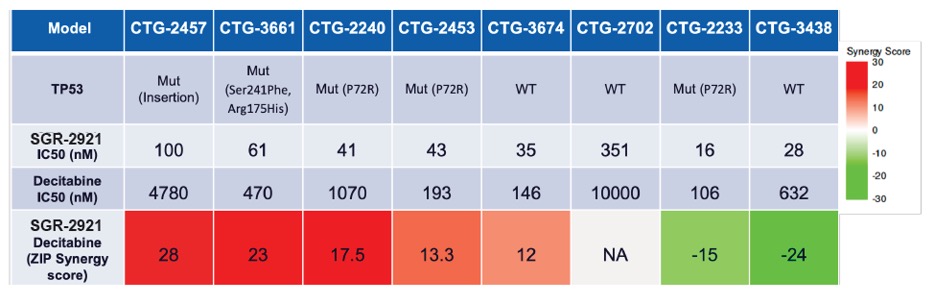
また,次の図に示すように,臨床前モデルでは,SGR−2921は難治性疾患を代表する標準看護耐性モデルにおいて,ジシタビン(骨髄異形成症候群治療用化学療法薬)に結合した単剤活性と活性を示した。
患者由来のAMLサンプルでは、SGR-2921とジシタビンとの併用治療は、インビトロで相乗活性、特にp 53変異モデルにおいて産生されることができる
ZIP、またはゼロ相互作用効力、協同スコアは、単一の薬剤およびそれらの組み合わせ間の用量-反応曲線効力の変化を比較することによって、薬物相互作用関係を捕捉するためのモデルである
SGR−2921の臨床研究の進展
FDAは2023年7月に私たちのINDのSGR-2921を承認した。著者らはすでにSGR-2921の第一段階臨床試験を開始し、これは開放ラベルの多中心用量増加臨床試験であり、再発或いは難治性急性骨髄性白血病或いはハイリスク骨髄異形成症候群患者に適している。我々は米国とヨーロッパで難治性急性骨髄性白血病またはハイリスク骨髄異形成症候群と診断された144名の患者を募集する予定であり、彼らの年齢は18歳以上であり、期待寿命は8週間以上である。SGR-2921を経口投与した。SGR-2921曝露に対するCYP 3 A 4の阻害の影響を評価するために、患者は、2つの交差する平行研究治療アームのうちの1つに登録されるであろう。治療アームAは、SGR-2921の増加用量レベルを評価するであろう。治療群Bは、強力なCYP 3 A 4阻害剤であるアゾール系抗真菌薬を使用しながら、SGR-2921の増加用量レベルを評価する。治療アームBを開始する前に、治療アームAの前の2つの用量レベルの安全性および耐性を証明しなければならない。
患者は、すべての用量レベルの調査が完了するまで、または任意の用量レベルが最大耐性用量を超えることが発見されるまで、増加用量のSGR-2921治療を受けるであろう。提案された第2段階用量は、最大許容用量を超えない許容用量レベルから選択される。この試験は、単一療法としてのSGR-2921の安全性および耐性を評価し、最大を含む推奨される第2段階用量を決定することを目的としている
耐容量。試験の副次的および探索的目標は、SGR-2921の薬物動態学と薬効学を評価し、初歩的な抗腫瘍活性を調査することを含む。2024年末または2025年にSGR−2921の第1段階臨床試験の予備データを報告する予定である。
SGR-3515:WEE 1/MYT 1阻害剤
著者らは固形腫瘍治療のための新しいWEE 1/MYT 1阻害剤SGR-3515を開発している。Wee 1はキーパー検査点キナーゼであり,細胞周期における細胞の進展を阻止し,細胞分裂が発生する前にDNA修復を行う時間がある。WEE 1の抑制はDNA損傷の蓄積を可能にし、腫瘍細胞のDNA断裂とアポトーシスを誘発する。第三者WEE 1阻害剤は臨床試験において、卵巣癌と子宮癌の腫瘍消退は臨床意義があり、一部は有効であり、病状は安定していることを示した。化学療法,PARP阻害剤,免疫療法と組み合わせた第三者WEE 1阻害剤が研究されている。MYT 1を抑制することは潜在的な癌治療方法であり、MYT 1を抑制することは細胞を早期の無制限有糸分裂に進入させ、細胞死を招くからである。
WEE 1とMYT 1の生物学的機能は互いに独立しているが,部分的に重なっている。新たに出現したデータは,MYT 1はWEE 1と合成致死関係があり,高MYT 1蛋白レベルはWEE 1阻害剤に対する耐性に関与していることが示唆された。WEE 1とMYT 1機能の同時喪失は癌細胞に選択的な脆弱性を持たせ,より強い抗腫瘍活性を提供することができる。
我々は我々の計算プラットフォームを用いていくつかの密接に結合した選択的WEE 1/MYT 1阻害剤シリーズを決定し、最終的にSGR-3515を開発候補として選択した。SGR-3515‘Sの理化学特性はDNA損傷反応阻害剤(例えばPARPとATR阻害剤)及び他の卵巣、結腸直腸、乳腺と他の固形腫瘍を標的治療する薬物との併用に非常に適していると考えられる。
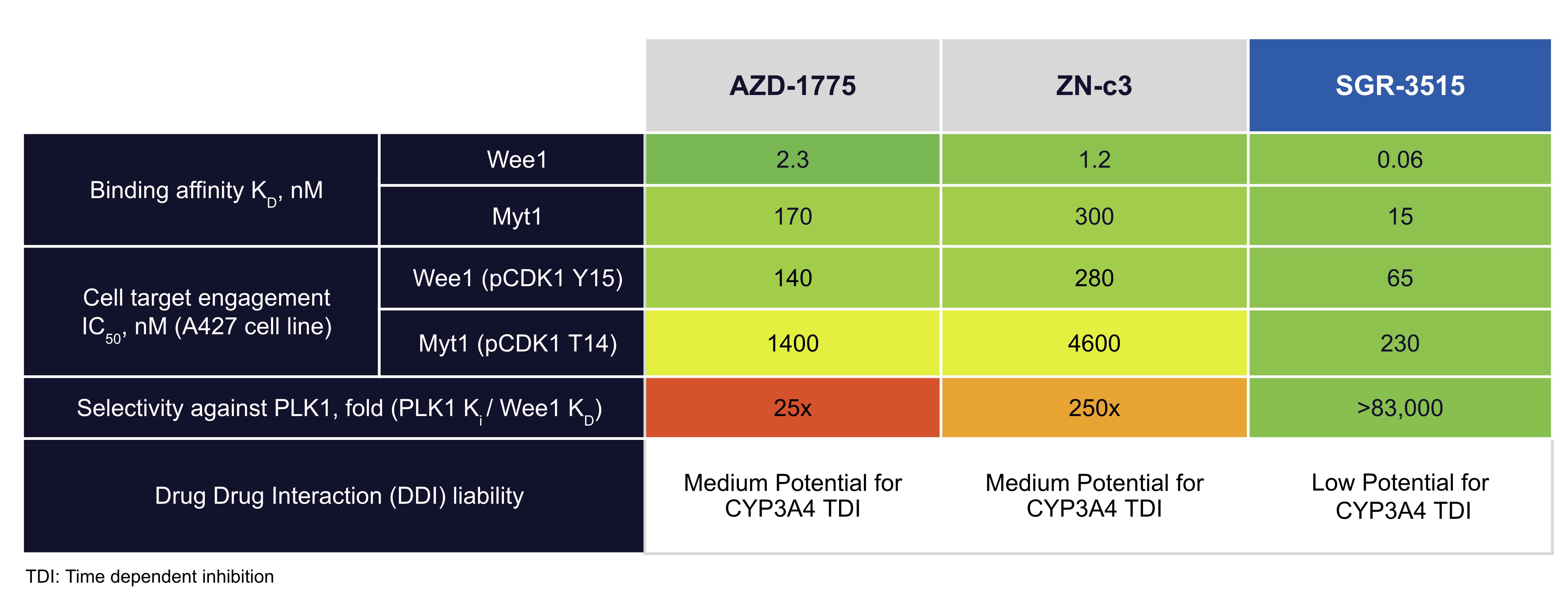
既存の第三者WEE 1阻害剤は、他のキナーゼおよびタンパク質を阻害することによって非標的効果を生じる可能性があり、その中のいくつかは、薬物および薬物代謝物の体内からの除去を担当する肝酵素であり、用量および組み合わせをより挑戦的にする可能性がある。表に示すように,SGR−3515をアスリコン由来のWEE 1阻害剤AZD 1775とZentalis製薬社が発売したWEE 1阻害剤ZN−c 3を基準に比較したところ,SGR−3515の方が良い選択性を示した。SGR−3515は低い薬物−薬物相互作用やDDIの潜在力を有し,肝酵素不活化に関与していると考えられる。
われわれの臨床前研究において,A 427非小細胞肺癌細胞系の腫瘍細胞活力に対するSGR−3515の影響もAZD 1775やZN−C 3と同等かそれ以上であった。SGR-3515はまた強力で持続可能な抗腫瘍活性を示した体内にあるA 427およびOVCAR 3腫瘍モデルであった。以下の表に示すように、SGR−3515は細胞においてWEE 1およびMYT 1に対してより良好な結合親和性を示し、SGR−3515はより低いICを示す50 A 427非小細胞肺癌モデルはAZD 1775とZN-c 3と比較した価値がある。
すべての競争相手のデータは契約研究機関内部で生成され,商業的に利用可能なツールを用いて,または第三者研究化学者によって公開されて利用可能な構造情報を用いて合成される.
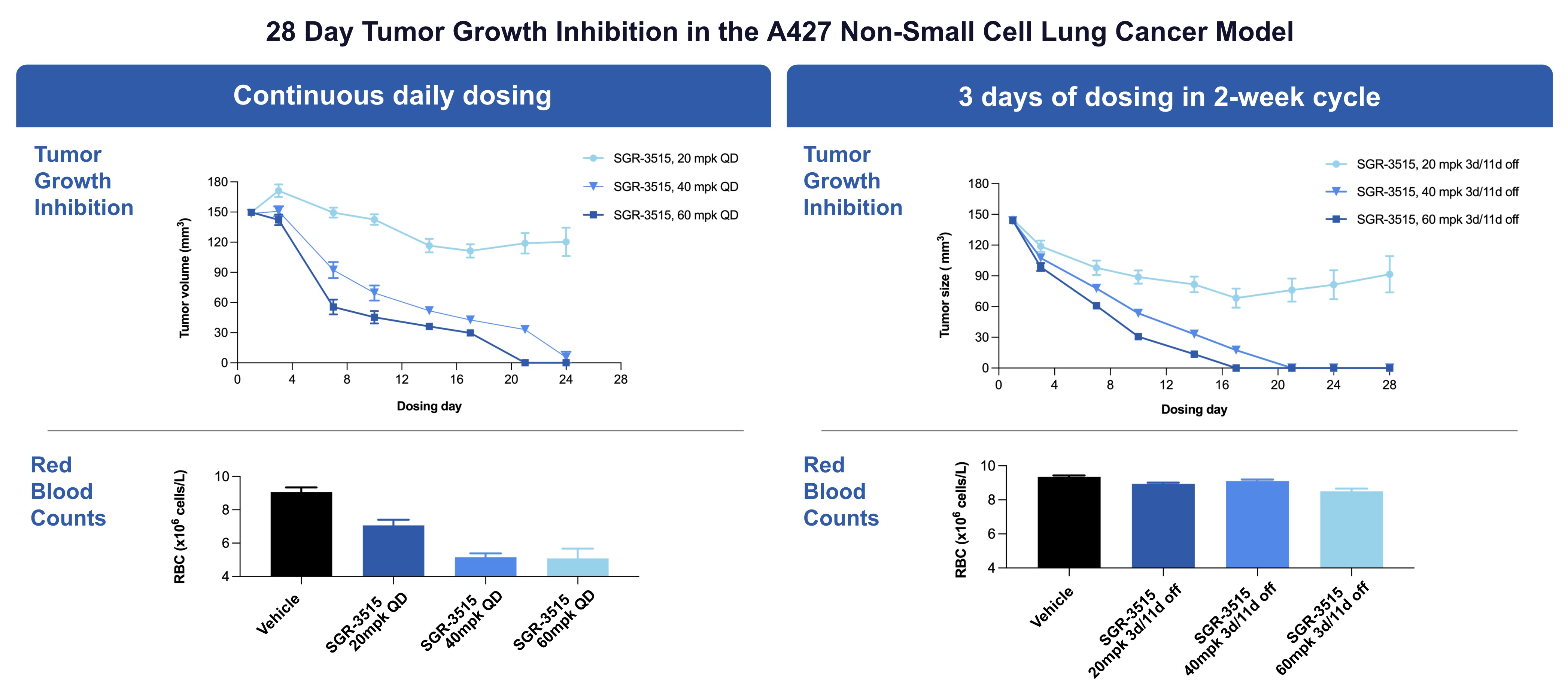
以下の図に示すように,A 427非小細胞肺癌モデルでは,SGR−3515は1日連続投与と比較して2週間周期で3日間(開3日/休11日)に抗腫瘍活性を維持していた。また,間欠投与では赤血球数の回復が認められた。
N=1グループあたり6個
我々は、INDが研究を支援する有利なデータを条件として、2024年上半期にSGR−3515のIND申請をFDAに提出する予定であり、規制部門の承認を得ることを前提として、2024年末までにSGR−3515の第1段階臨床試験を開始する予定である。
発見計画
腫瘍学,免疫学,神経学分野の他の項目,複数の治療領域のいくつかの未開示項目も進めている。このすべてのプロジェクトは現在発見段階にあり、私たちはまだどのプロジェクトの開発候補も決定していない。2025年に少なくともINDをFDAに提出するために、これらの発見段階の計画を引き続き推進することを目標としている。我々の最先端の発見段階計画は以下のとおりである.
PRMT 5-MTA。PRMT 5−MTAの抑制はすでに血液と固形腫瘍において臨床反応を示しており,PRMT 5阻害剤と比較してMTAP欠損の合成致死性標的癌細胞により安全性が改善された。著者らはすでに選択的、有効なPRMT 5-MTA阻害剤を確定し、固形腫瘍、脳転移腫瘍と原発中枢神経系腫瘍に潜在的な応用の将来性がある。
EGFR.EGFRC 797 S.EGFR阻害剤はEGFR突然変異を活性化する末期非小細胞肺癌患者の第一線の標準看護薬物である。いくつかのEGFRが発見されましたC 797 S第一線の治療後に病状が悪化した患者の抑制剤を治療する潜在力があり、新しい連合方案を通じてもっと深く、もっと持続的な反応を実現する可能性がある。
NLRP 3です。NLRP 3は有効な標的であり、NLRP 3遺伝子の突然変異は広範な炎症性と自己免疫性疾患と関係がある。われわれはすでに臨床前モデルにおいて構造特異的で選択的で抗炎症活性を有するNLRP 3阻害剤を決定しており,末梢と脳貫通鉛分子の最適化を継続している。
LRRK 2.LRRK 2は遺伝子検証の標的であり、大型多機能キナーゼであり、LRRK 2遺伝子の突然変異はパーキンソン病の発生と関係があることが証明された。2022年には、新しいLRRK 2阻害剤の同定を加速させるのに役立つLRRK 2の凍結電子顕微鏡構造を産生した。
大量のタンパク質標的が決定されており,これらの標的は我々の計算プラットフォームに適していると考えられ,現在では大量の標的があり,潜在的に発見計画に進めることができる。薛定治療集団はまた強力な生物学的有効性と治療潜在力を持つ標的を探すつもりであるが、これらの標的は現在十分な高品質の蛋白質構造が不足しており、著者らの計算プラットフォームを用いて薬物発見を行うことができない。我々は,パートナーとの戦略同盟を積極的に求め,これらの目標のために質の高いタンパク質構造を生成できるように内部イニシアティブを進めており,より多くの発見努力を開始できるようになる。例えば、これらの努力の一部として、私たちは2022年1月にXtal BioStructures,Inc.を買収した。これは、生物物理的方法、タンパク質生産と精製、およびX線結晶学を含む構造生物学的サービスを提供する会社であり、これは、私たちの特許薬物発見計画のために高品質な標的構造を生産する能力を増強する。
我々の最初の計画は,DNA損傷反応経路や遺伝子定義癌標的に対する阻害剤の発見と開発に焦点を当てていた。悪性細胞のゲノム不安定は遺伝子突然変異を招き、これらの突然変異はキナーゼ阻害剤に対する耐性を引き起こす可能性があり、それによって同一疾患に対する第二世代と第三世代薬物の需要を産生した。著者らの計算プラットフォームはすでにキナーゼドメイン変異が薬物結合、効力と薬物感受性に与える影響を予測できることを証明した。著者らのプラットフォームを用いて、臨床突然変異が薬物効力に与える影響を評価し、評価することは薬物発見の有力なツールになることができる。著者らは、著者らのプラットフォームを大規模に配置し、患者のゲノムマップデータにアクセスし、著者らを有利な地位に立たせ、臨床関連の正確性で活性部位の薬剤耐性突然変異の影響を予測でき、それによってよく見られる薬剤耐性突然変異に対する穏健な分子設計を最適化できると信じている。
私たちの重要な技術の詳細は
物理的な方法で薬物の重要な性質を計算する
過去数十年間、数百人の科学者とソフトウェアエンジニアの共同努力の下で、著者らは物理に基づく計算プラットフォームを開発し、薬物分子の結合親和性を高度に正確に予測することができる。薬物分子と標的蛋白の結合親和性はその体内の薬効の重要な駆動力である。具体的には,1つの薬物が目的タンパク質に結合する場合,それとの結合親和性はタンパク質機能の調節の程度に直接影響する。そのため、薬物分子と標的蛋白の結合親和性を高精度に予測することができ、新薬の発見を著しく加速することができる。
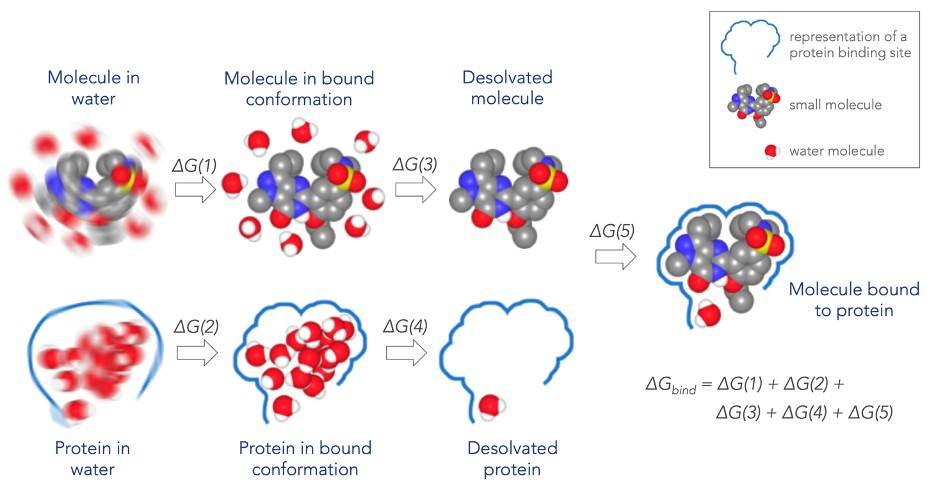
薬物分子とタンパク質の結合親和性を正確に計算することは非常に複雑であり,結合のすべての物理的作用を十分に特徴付ける必要がある。これらの寄与は、小分子変形および/または硬化結合コンホメーション(下図中のΔG(1))と結合コンホメーション中のタンパク質の硬化(ΔG(2))、分子周囲の水の除去(ΔG(3))とを含む
タンパク質結合部位内の水(ΔG(4)),最後に結合時の分子とタンパク質との相互作用により,タンパク質−分子複合体が形成される(ΔG(5)).
我々はすでに,“自由エネルギー摂動”という方法をもとに,これらすべての結合への貢献を高精度に一貫して評価する解決策を開発している.自由エネルギー摂動または初期分子を別の関心分子に変換し、この変換が特定のタンパク質標的との結合親和性をどのように変化させるかを評価する。これらの計算を行う解決策をFEP+と呼ぶ.FEP+は、以下の異なる構成技術によって実現される:
•典型的な分子力学力場は広範なカバー面を持ち、類薬物分子に対して高度な正確性を持っている
•正確な量子力学ソフトウェアを用いて力場カバー範囲を動的に拡張することができるようにワークフローを自動化します
•グラフ処理ユニット上で動作する計算効率的な分子動力学エンジン;
•計算が収束し、シミュレーション時間を低減することを可能にする、効率的で強化されたサンプリング方法
•自動原子マッピングおよび相互作用マッピング割り当て;および
•これらの計算を拡張して大型クラウドコンピューティング環境を利用することができる.
これらすべての構成技術は,我々の自由エネルギー摂動実施の正確性,スケーラビリティ,適用性を実現するために必要である.
ある有名な同業者評議研究において、約90個の異なるプロジェクト中の約3000個の分子を含み、FEP+は1つの間違った輪郭を示し、その親和性予測が実験室実験を実行する正確性に近いことを表明した。FEP+も実験分析よりもこれらの計算を高速に実行することができる.FEP+を用いた分子の計算評価には数時間しかかからなかった。対照的に、薬物分子を合成し、関心のある標的との結合親和性を実験室で試験するのには通常数週間を要する。したがって,我々のFEP+解決策は,実験方法のみを用いたよりも迅速に候補薬剤を認識するために,非常に大量の分子を探索するために用いることができる。
ある大手バイオ製薬会社と協力して発表した同業者評議の文章では,FEP+はFEP+が合成分子を優先的に選択する能力を他のいくつかの業界標準方法と比較し,これらの分子は最初の成功よりも緊密に結合することが予想される。FeP+は改善されたものを優先的に合成することに成功していることが分かった
結合親和性はどの他のテスト技術よりも8倍成功率が高い.この証拠は,FEP+が薬物発見計画の推進に果たす重要な役割を支持している。
超高分子文庫のカウント
AutoDesignerソフトウェアソリューションを用いて大きな興味のある分子バンクを列挙する方法を開発し,我々のソフトウェアクライアント,我々の薬物発見協力者,シュレーディンガー療法グループがプロジェクトに関する化学空間を探索することが,手動設計よりもはるかに大きいことを可能にした。我々が開発した化学計数技術は,最もよく用いられる化学反応を組み合わせて,興味のある分子の数十億種類の変化を全自動で計算探索することができる。
物理に基づく正確な計算を大きな分子バンクに拡張します
FEP+の計算は正確であることが証明されているが、現在の計算リソースの利用可能性を考慮すると、これらの計算を数十億個の分子に適用することは不可能である。この問題を解決するために,FEP+の精度を利用した手法を開発したが,機械学習を利用することで数十億個の分子を高速に探索することを可能にした.我々は物理に基づく分子スコアを計算効率の極めて高い現代の機械学習手法と組み合わせることに成功している.この結合の方法は,他の方法で計算するのではなく,物理的な計算に基づく計算をより大きな分子集合に適用することができる.これにより,臨床的に可能な分子を認識する速度と可能性を向上させることができる。
ディープラーニングは機械学習の一種であり,過去数年間,ディープラーニングの進歩には非常に大きなデータセットが入力としてモデルを訓練する必要がある.薬物発見プロジェクトにおいて、実験データは通常稀で獲得コストが高く、関連する類薬物化学空間は実際には無限大であることを考慮すると、10 ̄60個の分子が推定されることは特に問題がある。そのため,薬物発見プロジェクトでは,機械学習やディープラーニングに特化したプラットフォームを用いることで競争優位を実現することは極めて困難であると考えられる。代わりに,我々は,機械学習モデルが追加の分子を交互に物理ベースの解析,いわゆる能動学習を行うことを可能にする物理と機械学習に基づくスコア付け手法を統合する手法を開発した.能動学習は機械学習の計算効率を残すとともに,物理的手法に基づく正確性も利用している.人間は,任意の特定の予測手法の実用性を精度と計算効率の両面から評価することができる.現代機械学習手法,たとえばディープラーニングは,確かに従来の機械学習手法よりやや改善された効果を提供している.しかし,その歴史の大部分の時間では,従来の分子シミュレーションは機械学習よりも計算効率がはるかに低いが,精度もそれほど高くない.
FEP+を開発する過程で,物理に基づく手法の開発を早期に試みる不足を解決することができる.訓練集合データ構造とは異なる分子を採点した場合,FEP+計算は従来の機械学習や現代機械学習よりもはるかに正確である.また,FEP+を我々の機械学習実現(DeepAutoQSARと呼ぶ)と統合することにより,我々が能動学習FEP+と呼ぶ解決策を開発した.能動学習FEP+は,自由エネルギー計算の正確性と機械学習計算の速度を組み合わせて,1日に数十億個もの分子を探索することができる.さらにこの機能を,我々が探索者が提供する大量の分子集合を列挙する能力と,クラウド資源を用いて複雑なワークフローを構築·管理する能力を組み合わせることで,これらの機能を大規模に展開してプロジェクトを進めることができる.
アクティブ学習FEP+を次の図に示す.
FEP+は,実験データに依存して機械学習モデルに訓練セットを提供するのではなく,大型分子ベースのための局所モデルを構築するために用いられる.そして,機械学習モデルを用いて膨大な分子バンクをスクリーニングし,FEP+を優先的に扱うことができるように十分小さい数字を抽出した.その結果、100万日ではなく、わずか1日で10億個の分子の優先順位を決定することができた。
Hit-to-LeadとLead最適化作業を開始するのに適した新しい活性HIT分子を迅速に同定する
我々が開発したいくつかのヒット発見技術は、一般に、小分子薬物発見計画を開始するために、活発なヒット分子を識別するために使用される。私たちの人気検索活動では、私たちはソフトウェア顧客と一般的に利用しています
•我々のソフトウェア解決策DeepAutoQSARを使用して、現代機械学習モデルを既知の活性分子の2次元構造に訓練した
•形状ベースの方法は、既知または導出された既知の活性分子の三次元生物活性コンホメーションを計算することによって、私たちのソフトウェア解決策、形状を使用するように訓練される
•構造に基づくドッキング方法は、我々のソフトウェア解決策GlideとWScoreを用いて、実験的に決定された標的タンパク質受容体の3次元構造の静的原子表現を用いて、相互作用可能な数および種類を評価する
•我々のソフトウェアソリューションFEP+を用いた自由エネルギー計算は,目的タンパク質受容体の完全な動的原子表現を提供する。
タンパク質中の分子結合位を占める水分子のエネルギー性質の計算解析
分子中の微細な構造変化はタンパク質標的の結合親和性に深い影響を与えることができる。これらの構造変化の影響は,結合位における水分子置換による自由エネルギー変化を含む結合熱力学の詳細な研究によって解釈できる。我々の計算ソフトSolution Water Mapは,タンパク質結合位置を占める水分子の位置とエネルギー属性をプロットし,結合位置属性への洞察を提供し,小分子結合を駆動する水介在力を定量的に記述した。また,この解析は,薬物様分子が高親和性のタンパク質標的に結合する傾向を評価するために用いることができる。水図は計算結果をグラフ化して示し,結合位置を占める水分子とそのエネルギー性質を直感的に表示することが容易である。これは,結合親和性データの解釈をより直感的にし,効力と選択性を向上させる可能な設計経路に知見を提供した.
競争
ソフトウェア業務
分子発見と設計ソフトウェアの全体市場は世界的であり,発展が迅速で,競争が激しく,変化する技術や変化する顧客の興味や優先順位の影響を受けている。私たちの競争相手が提供する解決策と応用は規模、広さ、範囲がそれぞれ異なる。
私たちの市場における主要な競争要素は、計算の正確性、顧客満足度と機能レベル、使いやすさ、解決策とアプリケーション機能の広さと深さ、ブランド知名度と名声、現代と適応技術プラットフォーム、アプリケーションの集積性、安全性、拡張性と信頼性、総コスト、迅速な革新と顧客ニーズに応答する能力、および伝統的な企業インフラおよび第三者アプリケーションと統合する能力を含むと信じている。
我々は,これらの要因に基づいて有利な競争を行い,我々の計算に基づく物理プラットフォームの開発に必要な努力や投資が新規参入者を阻害し,これらの新規参入者は必要な資本や時間を投入できず,競争技術を開発するために必要な技術専門知識の広さや深さにも欠けると考えられる.私たちが競争力を維持する能力は、私たちが私たちの計算プラットフォームを改善し続け、私たちの薬物発見努力で成功した能力を示すことに大きく依存するだろう。
我々のソフトウェアソリューションは、バイオ製薬会社にシミュレーションおよびモデリングソフトウェアを販売または提供する業務において、競争相手からの競争に直面している。これらの競争相手は、ダソーシステム会社のブランドBiovia、あるいはBiovia、化学計算グループ(米国)会社、Cresset生体分子発見有限会社、Cadence設計システム会社、Optibrium株式会社、サイラスバイオテクノロジー会社、Molsoft LLC、Insilo Medicine,Inc.,Iktos,XtalPI Inc.,Inductive Bio,Inc.,ChemAxon,PerkinElmer,Inc.およびSimulations Plus,Inc.を含む。
著者らは材料科学の面でもBioviaと材料設計会社のような競争相手があり、生命科学の企業ソフトウェアの面、例えばBiovia、Certara USA、Inc.,ChemAxon、Revrate,Inc.とDotmatics,Inc.はある場合、これらの競争相手はこれらの解決策の成熟サプライヤーであり、そして私たちの多くの既存と潜在顧客と大型生物製薬会社を含む長期的な関係を維持している。また,生命科学や材料応用のための物理に基づくシミュレーションプログラムを開発する学術連盟もある。生命科学業界で最も有名な学術シミュレーションパッケージは、Amber、CHARMm、GROMACS、GROMOS、OpenMM、OpenFFを含む。これらのバッグは主に大学院生やポストドクター研究者によって維持·開発されており,通常商業化の意図はない.
我々はまた,我々の目標よりも具体的な市場に対して製品やサービスを提供する小さな会社に対して,これらの競争相手がより大きな割合の努力や資源をこれらの市場に集中させることができるように,バイオ製薬会社内部から開発された解決策の競争に直面している。また,人工知能や他の計算方法を用いて薬物発見を行う会社からの激しい競争に直面している。その中のいくつかの競争者は、自身および/またはパートナーと薬物発見に参加し、別の競争者は、人工知能を利用して、薬物発見のために直接または間接的に使用することができるソフトウェアまたは他のツールを開発する。
薬物発見業務
生物製薬業界の特徴は技術が迅速に進歩し、競争が激しく、独自と革新製品と候補製品を高度に重視していることである。私たちは私たちの計算プラットフォーム、技術、知識、経験と科学資源が私たちに競争優位を提供すると信じているが、私たちの薬物発見業務は大型製薬会社、専門生物製薬会社、技術会社、学術機関と政府機関、そして公共と個人研究機関を含む多くの源からの潜在的な競争に直面している。私たちまたは私たちのパートナーが開発に成功して商業化された任意の候補品は、既存の療法や将来出現する可能性のある新しい療法と競争するだろう。
私たちが開発した候補製品が承認された場合、その成功に影響を与える重要な競争要素は、それらの有効性、安全性、耐性、利便性および価格、ブランドおよび後発薬競争のレベル、および第三者支払い者が十分な補償を持っているかどうかである可能性がある。もし私たちの候補製品が承認されて商業化に成功すれば、他の会社が類似製品や類似疾患に対する製品の開発を求めているため、ますます激しい競争に直面する可能性が高い。
特に,腫瘍学分野での競争は非常に激しく,これがわれわれの薬物発見の重点である。私たちはアメリカと国際に競争相手がいて、大型国際製薬会社、老舗バイオテクノロジー会社、専門製薬会社、新興とスタートアップ会社、大学とその他の研究機関を含みます。また、これらの組織と競合して管理者、科学者、臨床開発者を募集しており、これは私たちの専門レベルや業務計画を実行する能力に悪影響を及ぼす可能性があります。著者らはまた、臨床試験場所の探しと構築、臨床試験被験者の募集、共同研究の獲得及び肝心な臨床学科と学術センターから信頼できる主要な研究者と顧問を募集する競争に直面している。
例えば,我々のMALT 1阻害剤SGR−1505については,再発や難治性B細胞リンパ腫患者の治療に推進されており,エバービー社,小野製薬株式会社,HotSpot Treeutics,Exelixis,Inc.など,いくつかのMALT 1阻害剤が臨床開発されていることが知られている。また,承認され臨床開発されている二重特異性薬剤やCARTなどのB細胞リンパ腫の治療薬も知られている。
われわれのCDC 7阻害剤SGR−2921については,再発や難治性急性骨髄性白血病や高リスク骨髄異形成症候群の治療のための薬剤が開発されており,チャ泰天青薬業集団有限会社,LIN生物科学社,イギリス癌研究社が開発したCDC 7阻害剤の第一段階臨床開発がいくつか知られている。
われわれのWEE 1/MYT 1阻害剤SGR−3515については,固形腫瘍治療用薬剤を開発しており,Zentalis,Debiamm International SA,Impact Treateutics,Inc.,初代ホールディングス,BioCity Biophma,Aprea治療会社,Repare治療社が進めているMYT 1阻害剤を含むいくつかのWEE 1阻害剤が臨床開発されていることが知られている。また,Acrivon治療会社が臨床前開発中のWEE 1/MYT 1阻害剤を進めていることが知られている。
特に大手製薬と生物技術会社は、専門家調査ネットワークの構築と利用、設計と臨床試験の実施、監督管理の許可及び生物技術製品の製造と商業化の面で豊富な経験を持っている。これらの会社の研究開発やマーケティング能力も私たちよりはるかに優れており、承認されたり、開発後期の段階にある製品や、私たちのターゲット市場でリーディングカンパニーや研究機関との協力手配もあるかもしれません。古い製薬会社やバイオテクノロジー会社も、新しい化合物の発見と開発を加速させたり、私たちが開発した候補製品を時代遅れにする可能性のある新しい化合物の使用を許可したりするために投資する可能性がある。もし私たちの競争相手が私たちの製品よりも安全で、より効果的で、副作用が少なく、より便利で、より安い製品を開発し、商業化すれば、私たちのビジネス機会は減少または消失するかもしれない。規模が小さい、または初期段階にある企業も、特に大型および成熟会社との協力を通じて、私たちの計画の補完または必要な技術を得る上で重要な競争相手であることが証明される可能性がある。これらのすべての要因により、私たちの競争相手は、私たちの前にFDAや他の同様の外国規制機関の承認を得ることに成功したり、私たちの前に私たちの分野の製品を発見、開発、商業化することに成功するかもしれない。
百時米施貴宝社との協力協定
2020年11月、我々はBMSと独占的な全世界協力と許可協定に調印し、この協定に基づいて、著者らとBMSは協力して小分子化合物(タンパク質分解化合物を除く)を発見、研究と臨床開発することに同意し、腫瘍学、神経学と免疫治療領域の生物標的に使用した。
合意に基づき,限られた研究期間内に,最初に双方が合意した目標ごとの研究計画を担当し,5つの特定の生物標的に対する小分子化合物(タンパク質分解化合物を除く)を自費で発見した。最初の連携目標は,HIF−2αとSOS 1/KRASを含み,これは我々の2つの早期計画である。2021年11月、我々はBMSと共同で、HIF-2アルファ標的を別の正確な腫瘍学標的で置換することに同意した。交代選挙の後、HIF-2アルファ目標計画のすべての権利が私たちの手に戻った。2022年9月、BMSはこれ以上別の目標を開発しないことを決定し、このプロジェクトのすべての権利は私たちの所有になった。2022年12月,我々とBMSはプロトコルを改訂し,条項が元のプロトコルと類似した場合に神経学的領域に目標を追加した。2023年9月,BMSは2つの関連腫瘍学プロジェクトの開発を継続しないことを決定し,これらのプロジェクトのすべての権利が我々の手に回復し,これらのプロジェクトに関連する義務の達成を加速したため,収入確認が増加した。
特定の双方で合意された基準に適合する標的化合物を発見または決定するか、またはBMSが開発候補化合物として化合物を選択すると、BMSは独自に候補化合物のさらなる臨床前および臨床開発、製造および商業化を担当し、費用を自費で支払う。研究期間は4年の早い時期に終わるか、または指定された目標ごとに候補者を提供するまで。私たちは特定の目標の候補者に渡すために、研究期間を限られた時間を延長することを選択することができる。また,双方は最初の研究期間をさらに1年間延長することに共同で同意することができる.協定によると、百時米施貴宝は、商業的に合理的な努力を使用して、米国、日本、EUの各目標のために少なくとも1つの許可化合物を含む製品を開発し、規制部門の承認を得て商業化することに同意した。協力の研究部分は、私たち一人一人とBMSの同等数の代表で構成された共同指導委員会によって監督されるだろう。最初に規定された目標に加えて、各当事者は4つの保留目標のリストを合意した。研究期間内の限られた代替期間において、BMSは、初期指定された目標のうちの1つを予約された目標で置き換えることができる。
合意によれば、与えられた目標に対して、我々はBMSに独占許可を付与し、特定の特許権に基づいて再許可を付与する権利があり、我々が制御する技術および材料は、臨床的に開発、製造、使用、販売、要約販売、輸出および輸入、および他の方法で開発され、他の会社に世界各地でこの目標のために同様の開発、任意の化合物、分子または製品を行わせる権利がある。
合意条項によると、BMSは私たちに5500万ドルの第1期費用を支払い、2022年12月に修正案に関する追加前払い費用を受け取った。私たちはまた、現在の協力の潜在的な目標で15億ドルに達するマイルストーン支払い総額を得る権利がある。これらのマイルストーンは各腫瘍学目標が5.85億ドルに達する総マイルストーンを含み、ある特定の研究、開発と規制マイルストーンのための合計3.6億ドル、ある特定の商業マイルストーンのための合計2.25億ドル、および各神経学と免疫学目標が4.89億ドルに達する総マイルストーンを含む
いくつかの特定の研究、開発、および規制マイルストーンのための合計2.64億ドルと、特定の商業マイルストーンのための合計2.25億ドルを含む。WEとBMSが2022年12月改正案により増加した追加神経学的目標については,オリジナルプロトコルと同様の研究,開発,規制マイルストーン,ビジネスマイルストーンを得る権利があり,これらは上記の総数に含まれている。
2023年12月31日現在、私たちはKRAS変異腫瘍のSOS 1計画の開発候補を選択したので、BMSから2500万ドルの記念碑的支払いを受けた。BMSは現在自費でこのような候補薬物の更なる臨床前と臨床開発、製造と商業化を担当している。
また,ライセンス製品の年間グローバル純売上高に対して階層パーセントの印税を徴収する権利があり,範囲は下位から下位に2桁まで数えられているが,何らかの特定の減免を行わなければならない。特許使用料は、当該ライセンス製品に関連する特定の特定特許権が当該国/地域における最後の有効権利主張の満了、当該ライセンス製品の当該国/地域におけるすべての適用される規制排他的満了、及び当該ライセンス製品が当該国/地域で初めて商業販売されて10周年になるまで、BMSによってライセンス製品および国/地域によって支払われる。
このプロトコルはタンパク質分解物に関連するいかなる活動も排除している。しかし、協定の条項によると、協定締結後の限られた時間内に、我々はBMSと単独の最終合意を交渉することに同意し、この合意によれば、BMSが合意下の目標のための分解剤化合物の研究、開発、商業化活動を行う権利があることに同意する。2021年8月、私たちはBMSと最終合意に達し、初歩的な協力合意に記載された条項に基づいて、二機能性タンパク質分解剤を発見、開発、商業化した。
個々の標的に基づいて、特定の標的のプロトコル期間内に、任意の核酸、抗体、生物学的、化合物、小分子または他の分子、またはこれらのいずれかを含む任意の製品を、我々自身または第三者と臨床的に開発または商業化することを禁止し、これらの製品は、標的の主要な作用機構を具体的に調節するか、または標的を調節するために特別に設計されている。この禁止には、協定の発効日までに列挙された最初の具体的な目標も含まれ、有限代替期間保持目標リストに列挙された目標も含まれる。
事前に終了しない限り、協定は、そのようなライセンス製品がその国に適用されるライセンス使用料期限が満了したときにライセンス製品および国/地域によって期限が満了し、最終ライセンス製品の最終ライセンス製品の最終ライセンス使用料期限が満了した後にすべて満了する。いずれの当事者も、他方の当事者が治癒していない実質的な合意違反の場合には、1つの目標ごとに合意を終了するか、または他方の当事者に何らかの破産事件が発生した場合には、事前に合意を終了することができる。
さらに、BMSは、書面通知を送信した後、本プロトコルを任意の理由なく、またはすべてまたは1つずつ終了することができる。BMSはまた、セキュリティ上の理由で目標ごとにプロトコルを終了することができる。私たちは、BMSがプロトコルに従ってBMSに許可されたいくつかの特許に挑戦することを開始または参加する限り、目標ごとにプロトコルを終了することができる。
BMSが任意に合意を終了した場合、またはBMSが違約、破産、または特許挑戦によって終了した場合、私たちは、適用される終了目標(S)のいくつかの化合物および製品に対して特定の復元権を有する権利がある。
BMSが私たちが治癒していない実質的な違約または私たちに関連する破産事件においてすべてまたは特定の目標について合意を終了する権利がある場合、BMSは合意を終了するのではなく、合意を終了することを選択する権利があるが、BMSはその後、適用対象(S)について私たちに支払うすべての使用料およびマイルストーンを50%減少させるべきである。
コロンビア大学とのライセンス契約
私たちはコロンビア大学といくつかの許可協定、またはコロンビア許可協定を締結した。コロンビア許可プロトコルは、いくつかの特許、ソフトウェアコード、技術およびその改善における私たちの権利と義務を確立し、これらの特許、ソフトウェアコード、技術およびその改善は、コロンビア大学から許可を得て、私たちのソフトウェア解決策および物理ベースの計算プラットフォームで使用および統合される。私たちの権利と義務そして条項と
我々の業務運営に重要な意味を持つコロンビア許可協定の条件は以下でより全面的に説明すると考えられる。
2008年11月1日、私たちはコロンビアのいくつかの許可協定、すなわち印税改正案に署名し、以下に述べるすべての合意を含む。印税修正案は、コロンビア大学から許可を得た任意のコードまたはソフトウェア、または任意の特許がカバーする製品、またはサービス協定に関連する許可製品を含む、各合意に従って任意の製品を使用して生成された毛収入について支払う印税を簡略化する。私たちはまたコロンビア許可協定に基づいて、私たちの許可製品を販売、許可あるいはレンタルした毛収入のために印税を支払います。これらの収入は製品に基づいて計算されます。1つ以上のライセンス製品が他の製品と共に販売され、単一のライセンス料を徴収する場合、私たちは、ライセンス料がカバーする各製品の相対価格表価格に基づいて、各ライセンス製品の毛収入の適用印税をコロンビア大学に支払うことに同意した。
コロンビア大学に支払う我々のサービス契約に関する印税の説明については、次の“-サービス版税改正案”を参照されたい。
PS-GVBライセンスプロトコル
1994年5月5日、2004年9月9日と2008年11月1日に改訂されたコロンビア大学と許可協定、すなわち1994年コロンビア協定を締結した。1994年のコロンビア協定によって許可された技術がジャガー量子力学計画に組み込まれ、この計画を物理ベースの計算プラットフォームの一部としてマーケティングと配布した。1994年の“コロンビアプロトコル”は、コロンビア大学によって開発され、電子構造ソフトウェアプログラムPS-GVB v 1.0またはPS-GVBコードに統合されたソフトウェアコードのグローバル独占許可、およびコロンビア大学によって開発されたPS-GVB v 1.0ソフトウェアプログラムおよびPS-GVBコードのすべての改善、またはソフトウェアに関連する任意の新しい製品、新しいバージョン、および新しいバージョンに組み込まれたすべてのPS−GVBコードおよびPS−GVBコードの改善、または様々な場合、複製、使用、実行、複製、操作、再許可、または新しいPS-GVBモジュールコードを付与してくれた。私たちの製品やサービスをマーケティング·販売する際に流通を行い、製品やサービスを改善し、災害復旧の研究とバックアップを行う。PS-GVBコード、PS-GVB改善、新しいPS-GVBモジュールコード、または許可されたPS-GVBソフトウェアを、私たちが直接販売または代表して配布された製品に統合することしかできません。1994年の“コロンビア協定”によると,コロンビア大学は許可されたPS−GVBソフトウェアを用いて研究を行う権利を保持し,他の学術や非営利研究機関の研究を許可している。
1994年のコロンビア協定締結の代償として、コロンビア大学生が作成したコードによる、PS-GVB v 1.0ソフトウェアプログラムへのPS-GVB v 1.0ソフトウェアプログラムへの貢献に基づいて、コロンビア大学に版税を支払い、PS-GVB v 1.0ソフトウェアプログラムの販売、許可またはレンタルの総収入を含む、PS-GVB v 1.0ソフトウェアプログラムの任意の改善および修正を含み、このような改善または修正にかかわらず、コロンビア大学のいかなる販売およびサービス協定に従って生成された収入も含まれていない。
私たちまたはコロンビア大学は、他方が合意に深刻に違反し、このような違約を是正できなかった場合にのみ、1994年の“コロンビア協定”およびそれによって付与された許可を終了することができる。終了後、PS-GVBソフトウェアを許可する任意の第三者は、そのようなソフトウェアを使用する権利を保持し、永続的な権利を有して、そのようなソフトウェアを使用することに関連するサポートを任意の第三者に提供し続ける。
FAST多極RESPAライセンスプロトコル
1998年7月15日、2004年9月4日と2008年11月1日に改訂されたコロンビア大学と許可協定、すなわち1998年コロンビア協定を締結した。1998年の“コロンビアプロトコル”は、Glideリガンド-タンパク質ドッキングプログラム、PrimeXタンパク質モデリングプログラム、QSite QM/MMプログラム、およびCombglide自動ライブラリ生成プログラムで使用されるImpactソフトウェアプログラム、およびコロンビア大学が開発したImpactソフトウェアプログラムのすべての改善に組み込まれたコロンビア大学によって開発された高速多極RESPAコードまたはRESPAコードのグローバル非独占許可を与え、任意の新しいバージョンおよび新しいリリース、またはImpact改善を含み、それぞれの場合、私たちの製品およびサービスのマーケティングおよび販売に関連する複製、使用、実行、複製、コンパイル、操作、再許可および配布、それを改善し、研究と予備災害回復を行った。RESPAコードを再許可することができます
Impact Imagesまたは許可されたImpactソフトウェアは、私たちが直接販売または代表して配布される製品に統合される限り。1998年の“コロンビア協定”によると,コロンビア大学は許可されたImpactソフトウェアを用いて研究を行う権利を保持し,他の学術や非営利研究機関の研究を許可している。
1998年のコロンビア協定締結の代償として、コロンビア大学生が作成したコードによる適用されたImpactソフトウェアプログラムへの貢献に基づいて、コロンビア大学へのいかなる販売、許可またはレンタルImpactソフトウェアプログラムから生成された毛収入を、コロンビア大学へのいかなる販売およびサービス協定によって生成された収入を含まず、コロンビア大学に印税を支払うことを含む、コロンビア大学が作成したコードによるImpactソフトウェアプログラムへの貢献に同意する。
私たちまたはコロンビア大学は、他方が合意に深刻に違反し、このような違約を是正できなかった場合にのみ、1998年の“コロンビア協定”およびそれによって付与された許可を終了することができる。終了後、1998年の“コロンビア協定”に従って私たちからソフトウェア許可を得た任意の第三者は、そのようなソフトウェアを使用する権利を保持し、そのようなソフトウェアを使用することに関連するサポートを任意の第三者に提供し続ける。
蛋白質フォールディング許可プロトコル
2001年9月、2004年9月9日と2008年11月1日に改訂されたコロンビア大学とライセンス契約、すなわち2001年コロンビア協定を締結した。2001年の“コロンビア協定”によって許可された技術は、私たちのPrime Proteinモデリングプログラムに組み込まれ、このプログラムを物理ベースの計算プラットフォームの一部としてマーケティングおよび配布します。2001年の“コロンビア協定”は、コロンビア大学によって開発されたタンパク質フォールディングコードまたはフォールディングコードの世界的に独占的な許可を与え、フォールディングコードおよび私たちの任意の製品、ソフトウェア、またはフォールディングコードの任意の部分を含むコードのすべての改善、コロンビア大学によって開発されたフォールディングコードの任意の改善およびその新しいバージョンまたは新しいリリース、または折り畳みコードの改善を含む。折り畳みコードをカバーする発行された特許、または折り畳みコード特許は、それぞれの場合、当社の製品およびサービスのマーケティングおよび販売に関連する製品およびサービスを複製、使用、実行、複製、コンパイル、運営、再許可および配布し、それを改善し、災害復旧を研究およびバックアップする権利がある。私たちは、私たちが直接販売または代表して配布された製品に統合される限り、折り畳みコード、折り畳みコード改善および折り畳みコード特許、または許可された折り畳みコードソフトウェアを再許可することができる。2001年の“コロンビア協定”によると,コロンビア大学は許可されたフォールディングコードソフトウェアを用いて研究を行う権利を保持し,他の学術や非営利研究機関の研究を許可している。
私たちは、2001年のコロンビア協定に基づいて任意の特許使用料を支払う義務に基づいて、特許権使用料改正案に基づいて支払う任意の特許権使用料を含み、2001年の“コロンビア協定”によって許可された最後の満期特許は、2014年1月に満了した時点で終了する。
コロンビア大学は2001年の“コロンビア協定”とその協定によって付与された許可証を終了することができるが、私たちがこの合意に深刻に違反し、私たちがこのような違反を是正できなかったことを前提としている。終了後、2001年の“コロンビア協定”に従って、私たちからソフトウェア許可を得た任意の第三者は、そのようなソフトウェアを使用する権利を保持し、そのようなソフトウェアを使用することに関連するサポートを任意の第三者に提供し続ける。
PLP許可プロトコル
2003年6月19日、2008年11月1日に改訂されたコロンビア大学とライセンス契約または2003年コロンビア協定を締結した。2003年のコロンビアプロトコルにより許可された技術は我々のPrimeとPrimeXタンパク質モデリングプログラムおよび我々の膜透過性モデルに組み込まれており,これらのモデルを物理に基づく計算プラットフォームの一部としてマーケティング·配布している。2003年の“コロンビアプロトコル”は,コロンビア大学とカリフォルニア大学が開発したタンパク質ローカル最適化プログラムソフトウェアコードやPLPコードのグローバル独占許可と,PLPコードの改善を含むすべてのソフトウェアコードを付与した
コロンビア大学またはカリフォルニア大学によって開発された、またはPLP改良は、それぞれの場合、当社の製品およびサービスのマーケティングおよび販売に関連する製品およびサービスを複製、使用、実行、複製、コンパイル、操作、再許可および配布し、災害復旧の研究およびバックアップを行う。コロンビア大学とカリフォルニア大学との間の機関間協定によると、カリフォルニア大学は、コロンビア大学にPLPコードとPLP改善を独占的に許可する権利を付与し、機関間プロトコルが依然として有効である限り、PLPコードやPLP改善許可を第三者に許可しないことに同意する。私たちが直接販売したり、私たちに代わって配布されている製品に統合されていれば、PLPコードとPLPの改善を許可することができます。コロンビア大学の事前書面による同意なしに、PLPコードとPLP改良ソースコードを発表することはできません。
コロンビア大学およびカリフォルニア大学は、他の学術および非営利研究機関がPLAP仕様およびPLPを使用して教育および学術研究目的のために改善する権利を保持し、許可する。
2003年にコロンビア協定を締結した対価格として,コロンビア大学に象徴的な一次許可料を支払った。さらに、コロンビア大学またはカリフォルニア大学への販売およびサービスプロトコルに従って生成された収入は、コロンビア大学の学生が作成したコードのうち、当社およびその付属会社の適用製品、ソフトウェアプログラムまたはコードへの貢献に基づいて、下位2桁から低い2桁の割合でコロンビア大学に印税を支払い、PLPコードまたは任意のPLP改善を含む任意の商業製品、ソフトウェアプログラムまたはコードを販売、許可、レンタルまたはレンタルすることに同意した。我々は、特許権使用料改正案に基づく任意の特許権使用料を含む2003年のコロンビア協定に基づいて任意の特許権使用料を支払う義務を含め、2023年6月19日に満了した。
コロンビア大学では、“PLPコード”および“PLP改良”の著作権登録を担当している。私たちはこのような著作権登録に関連するすべての合理的な著作権登録と弁護士費を支払う責任がある
私たちまたはコロンビア大学は、他方が合意に深刻に違反し、このような違約を是正できなかった場合にのみ、2003年の“コロンビア協定”およびそれによって付与された許可を終了することができる。終了後、2003年の“コロンビア協定”に従って私たちからソフトウェア許可を得た任意の第三者は、そのようなソフトウェアを使用する権利を保持し、そのようなソフトウェアを使用することに関連するサポートを任意の第三者に提供し続ける。
水場分析許可証
2008年5月27日、2008年11月1日に改訂されたコロンビア大学とソフトウェアおよび特許許可協定、または2008年コロンビア協定と呼ばれる協定を締結した。2008年の“コロンビア協定”は、(A)水ステーション分析方法または水ステーションソフトウェアを実装するいくつかのソフトウェア、(B)水ステーションソフトウェアまたは水ステーション特許をカバーするすべての特許権、計算化学ソフトウェアおよび関連サービス分野における私たちのグローバル独占許可を付与する。(C)水ステーションソフトウェアを含むか、または含む任意の製品、または水ステーション特許によってカバーされる任意の製品、または水ステーション製品は、それぞれの場合、当社の製品およびサービスに関連する製品を複製、修正、配布、実行および表示し、我々の製品およびサービスに関連する製品を販売し、水ステーションソフトウェアを使用して研究し、災害復旧をバックアップする。我々のWater Site製品には我々のWater Map Coreプログラムが含まれており,物理ベースの計算プラットフォームの一部としてマーケティングと配布を行っている.コロンビア大学の事前書面の同意なしに、Water Siteソフトウェアのソースコードを配布することはできません。2008年の“コロンビア協定”によれば、コロンビア大学は、計算化学ソフトウェアおよび関連サービス分野において、学術的および非商業的教育目的のために、他のエンティティおよび個人がウォーターサイトソフトウェアおよび水サイト特許を使用することを可能にする権利を保持する。
2008年にコロンビア協定を締結した対価格として、私たちはコロンビア大学に象徴的な一次許可料を支払った。さらに、私たちは、私たちおよびその付属会社の販売、許可、レンタル、または任意のWater Site製品の毛収入(コロンビア大学へのいかなる販売も含まず、サービス契約によって生成された収入を含まない)に従ってコロンビア大学に2桁から数百分低い印税を支払うことに同意します。2008年のコロンビア協定に規定された特許使用料は、製品によって支払われ、毛収入が水地製品が水地特許で覆われた製造または販売国で発生するか否かによって異なる。単一製品が複数の特許使用料を支払う必要がある場合、(I)2つの特許使用料のうちの高い1つを支払う必要があり、特定の水域製品が2つを超えない特許権使用料を支払う必要がある場合、または(Ii)特定水域製品が2つ以上の特許権使用料を支払う必要がある場合、コロンビア大学と単一特許権使用料について善意で協議する必要がある
もし私たちが任意の水域サイトの特許の有効性または実行可能性についてコロンビア大学に対して行動すれば、いかなる防御的な行動やクレームも含まず、2008年コロンビア協定によって支払われた印税は指定された金額を増加させる。我々は、2008年の“コロンビア協定”に基づいて任意の特許権使用料を支払う義務に基づいて、特許権使用料改正案に基づいて支払う任意の特許権使用料を含め、2028年5月27日に終了する。
コロンビア大学は私たちが指定した司法管轄区域内でWater Site特許の起訴と維持を担当している。もし私たちが任意の管轄区域で任意の水道特許の起訴を停止または維持することを決定した場合、コロンビア大学は中止に反対し、私たちがこの水道特許を使用する許可証はその管轄区で終了する;もし私たちが論争のある司法管轄区で水道特許や水地ソフトウェアを使用すれば、コロンビア大学は許可証が非排他的であるべきかどうかを誠実に検討する義務がある。コロンビア大学は自費で立地特許の実行を自ら判断しており,コロンビア大学に第三者による水地特許侵害の証拠を提供し,コロンビア大学が適切な法執行行動をとらなかった場合,告発された侵害者に対して法的訴訟を起こす可能性がある。私たちはコロンビア大学の起訴とWater Site特許の維持に関する合理的な費用を補償する責任がある。
事前に終了しない限り、2008年のコロンビア協定は、(I)最後に発行されたWater Site特許が満了し、(Ii)特定の国/地域でWater Site製品が初めて商業販売された日から15年および(Iii)Water Siteソフトウェアの著作権が満了した日(遅い者を基準に)、製品および国/地域によって終了する。もし私たちが重大な違約を正すことができず、自発的または非自発的な破産請願書や破産、接収または清算に関連する任意の他の手続き、または任意の手続きを開始したり、Water Site特許の有効性または実行可能なクレームを主張することができない場合、コロンビア大学は2008年のコロンビア協定を終了することができる。終了後、私たちから水ステーション製品の許可を得た第三者は、その製品を使用する権利を保持しますが、彼らと私たちとの間の既存のライセンス契約の条項を遵守し、彼らのライセンス契約中にそのような第三者に支援を継続する権利があります。
“サービス使用料修正案”
2008年11月1日、コロンビア大学と“印税改正案”を締結し、上記各節で述べたコロンビア許可協定下での印税義務を改正し、簡略化した。印税改正案によると、私たちは、第三者との合意に基づいて1つ以上の許可製品を使用して提供されるサービスを使用して、コロンビア大学との合意によって生成された収入を含むいくつかの毛収入を含まない1桁の中央値パーセントの印税をコロンビア大学に支払うことに同意する。任意のコロンビア許可協定が私たちの重大な違約以外の任意の理由で終了した場合、私たちは、このような合意が満了または終了するまで、既存の第三者サービス協定に従ってライセンス製品を使用し続ける権利があるだろう。
知的財産権
我々は、内部開発または共同開発のいずれも、第三者から許可を得ることを含む、当社の業務発展に重要なビジネス的意義を有するノウハウ、発明、および改善を保護し、強化するために努力している。私たちはまた、ビジネス秘密、技術ノウハウ、持続的な技術革新、協力機会、許可内の機会に依存して、当分野における当社の独自の地位を強化、維持しています。
私たちの将来のビジネス成功のためには、私たちの業務に関連するビジネス上重要な技術、発明およびノウハウの特許および他の独自保護を取得し、維持することが重要であり、私たちの知的財産権、特に私たちの特許、商標および著作権を擁護し、実行することは、私たちのビジネス秘密を秘密にし、第三者が効果的かつ強制的に実行可能な特許および独自の権利を侵害、流用または違反することなく運営されることである。私たちが開発した任意の製品を製造、使用、販売、提供、または輸入することを阻止する能力は、これらの活動をカバーする効果的かつ強制的に実行可能な特許または商業秘密に基づいて権利を有する私たちの程度に依存するかもしれない。
私たちのような会社の特許地位は通常不確定であり、複雑な法律、科学、事実の問題に関連している可能性がある。私たちが現在求めている特許出願が任意の特定の司法管轄区域で特許として発行されるかどうか、または任意の発行された特許の権利主張が競争相手の影響を受けないように十分な特許保護を提供するかどうかを予測することはできない。私たちはまた私たちまたは私たちの許可者が将来提出する可能性のあるどの特許出願も特許を発行することを保証することはできません。私たちは私たちが所有したり許可したりする任意の特許や未来の特許が商業特許になるという保証もありません
私たちのソフトウェア、技術、計算プラットフォーム、そして私たちが開発した任意の候補製品を保護するのに役立ちます。また,特許出願で要求されるカバー範囲は特許発行前に大幅に縮小される可能性があり,その範囲は特許発行後に再解釈でき,挑戦することも可能である.したがって、私たちは私たちが開発したどの製品も強制的に実行可能な特許によって保護され、または引き続き保護されることを保証することはできない。さらに、私たちが持っているか、持っている可能性のあるどの特許も、第三者によって挑戦され、回避され、または無効にされる可能性がある。私たちの知的財産権に関するリスクのより全面的な説明については、“リスク要因-私たちの知的財産権に関するリスク”を参照されたい。
私たちの戦略は、このソフトウェアとこれらのプログラムに対する私たちの知的財産権の地位を確保するために、私たちのキーソフトウェアと私たちのキープログラムに対して特許出願を提出することです。私たちのソフトウェアビジネスの特許の組み合わせは、少なくとも12個の公開された特許シリーズを含む。2024年1月31日現在、我々は、少なくとも14件の発行または許可された米国特許出願、5つの係属中の米国非一時特許出願、15件の発行または許可された非米国特許出願、複数の個々の欧州特許条約国間で検証された7つの認可された欧州特許および8つの非欧州特許、および我々のコンピューティングプラットフォームに関連する6つの未解決外国特許出願を含む約40の特許および特許出願の独占許可権を有するか、または保有する。我々が完全に所有して許可を得ている係属米国および非米国アプリケーションに含まれる特定および一般的な宣言は、我々の計算プラットフォームの様々な側面を保護していると考えられるが、第三者はこのような声明に疑問を提起することができる。これらの家族が発行または発行可能な任意の特許は、2026年から2038年までの間に満了すると予想され、いかなる調整や延期も行われない。
2024年1月31日現在、私たちの特許薬物発見業務に関連する公表された特許ファミリーは約10個であり、私たちのいくつかの薬物発見協力者は、2010年以降の100個以上の化合物特許および特許出願を含む私たちの従業員を発明者として含む私たちの協力関連特許出願を提出している。私たちはこのような発明に関連したどんな知的財産権も持っていない。2024年1月31日現在、私たちの完全資本は、特許協力条約に基づいて提出された私たちの特許薬物発見業務に関連する国際特許出願を含む約12件の係属中の米国特許出願、米国仮および米国非仮特許出願、および約75件の係属中の非米国特許出願を有している。
特許訴訟は長い過程であり、その間、最初に米国特許商標局によって提出された審査の権利請求の範囲は、本当に発表されていれば、発表前に大幅に縮小される可能性がある。私たちは私たちのいくつかの未解決特許出願がこのような状況になるかもしれないと予想している。
個別特許の期限は特許を取得した国の法的期限に依存する。我々が出願を提出したほとんどの国では,特許期間は非臨時特許出願を提出する最も早い日から20年であり,何の調整や延期もない。
さらに、米国では、場合によっては、FDAによって承認された薬物の特許期限は、FDA規制審査中の特許期限損失の補償として、1984年の“医薬品価格競争および特許期限回復法”に従って特許期間を延長する資格がある可能性がある。延長期間は最長5年に達するが、特許の残り期間を製品承認日から合計14年間延長することはできない。延期する資格のある特許のうち、1つの特許のみを延期することができ、承認された薬物、その使用方法、または製造方法に関する権利要件のみを延期することができる。ヨーロッパおよび他のいくつかの管轄区域にも同様の規定があり、承認された薬物をカバーする特許の期限を延長する。私たちが将来獲得する可能性のある発行されたアメリカ特許は特許期間を延長する権利があるかもしれない。もし私たちが候補製品の使用または候補製品自体がFDAの承認を得た場合、私たちは承認された用途または候補製品をカバーする特許期間を延長するために特許期間の延長を申請するつもりだ。私たちはまた、利用可能な司法管轄区で特許期間の延長を求める予定ですが、FDAを含む適用当局が、このような延長を承認すべきかどうか、そのような延長の長さを承認すべきかどうかの評価に同意する保証はありません。
特許保護に加えて、2024年1月31日現在、私たちは約64件の著作権登録があり、私たちの独自のソフトウェアコードをカバーしており、私たちは非特許商業秘密と機密知識と持続的な技術革新に依存して、私たちの競争地位を発展させ、維持しています。しかし、商業秘密と機密技術は保護することが難しい。私たちは、任意の協力者、科学コンサルタント、サービスプロバイダ、従業員、コンサルタントとの秘密協定、および私たち従業員との発明分配プロトコルを部分的に使用する、私たちの独自の情報を保護することを求めています。私たちはまた、選定されたコンサルタント、科学コンサルタント、協力者と発明の分配を要求する協定を締結した。このような合意は意味のある保護を提供しないかもしれない。このような合意はまた違反される可能性があり、私たちはこのような違反に対応するのに十分な救済策がないかもしれない。さらに、私たちの商業秘密および/または機密技術は、第三者によって知られたり、独立して開発されたり、またはそのような情報を開示する任意の協力者によって悪用される可能性がある。私たちの知的財産権を保護するための任意の措置が取られているにもかかわらず、許可されていない当事者は、私たちの製品のいくつかの態様をコピーしようとしたり、私たちが独自と考えている情報を取得したり、使用したりするかもしれない。私たちが採用したのは
私たちの固有情報を保護するために、サードパーティは、同じまたは同様の固有情報を独立して開発するか、または他の方法で私たちの固有情報にアクセスすることができる。したがって、私たちは私たちの商業秘密と固有の情報を意味的に保護することができないかもしれない。私たちの知的財産権に関するリスクのより全面的な説明については、“リスク要因-私たちの知的財産権に関するリスク”を参照されたい。
私たちはまた、“Schrödinger”や“LiveDesign”など、米国や外国の司法管轄区域に登録されている商標を多く持っている。私たちは私たちがそうすれば私たちの競争地位に有利だと思う限り、もっと多くの商標登録を求めている。
販売とマーケティング
ソフトウェア業務
私たちは私たちのソフトウェア販売組織を通じて世界各地の異なる司法管轄区域で私たちのソフトウェア解決策を商業化しています。私たちはアメリカ、ヨーロッパ、日本、インド、韓国で販売業務をしています。私たちはまた中国を含む他の重要な市場に流通ルートを構築しました。これらの努力は約240人がリードしています 販売技術科学者で構成されたグローバルチームです私たちのマーケティング戦略は私たちの豊富な科学出版物の基礎を利用して、私たちの計算プラットフォームの全世界の各業界と学術界の計算化学市場の持続的な成長を支持します。
薬物発見業務
私たちの特許薬物発見計画の現在の発展段階を考慮して、私たちはまだ商業組織を設立したり、流通能力を発展させていません。私たちはバイオ製薬会社と合意する予定で、これらの合意は、私たちが内部で私たちの計算プラットフォームを使って発見した候補開発プロジェクトを商業化することを効果的に推進することに役立ちます。私たちは、これらの第三者のうちの1つまたは複数との様々なタイプの連携、配布、および他の手配を利用して、私たちの候補開発製品を開発し、最終的に商業化したい。時間が経つにつれて、私たちが自分たちを商業化することを決定した候補製品の開発を何でも進めば、医薬品販売のビジネス組織を作ることもできます。
製造業
私たちは候補製品を生産するための製造施設を持ったり運営したりしていませんし、私たち自身の製造業務を発展させる計画もありません。我々は,我々自身が開発した任意の開発候補薬物の臨床前および臨床開発のために,我々が必要とするすべての原材料,薬物物質,完成品を第三者契約メーカーに依存して提供し続けることが予想される。
政府の監督管理と製品審査
その他の事項以外に、アメリカ連邦、州と地方各級及びEUを含む他の国と司法管轄区の政府当局は生物製薬製品の研究、開発、テスト、製造、定価、精算、品質管理、承認、包装、貯蔵、記録保存、ラベル、広告、販売促進、流通、マーケティング、承認後の監視と報告及び輸出入などの方面に対して広範な監督管理を行っている。米国や他の国や管轄地域で上場承認された手続きや、適用される法律や法規、その他の規制機関を遵守するには、多大な時間と財力が必要である。
アメリカの薬品審査と規制
米国では,薬品は“連邦食品,薬品と化粧品法”(FDCA)および適用される実施条例とガイドラインに基づいて承認·規制されている。このような製品の臨床開発計画の開始と管理を担当し、その規制承認を担当する会社、機関、または組織は、一般にスポンサーと呼ばれる。スポンサーが製品開発中のいつでも、非臨床試験、臨床試験、承認過程または承認後の過程を含み、適用される法規要件を遵守できない場合、研究の進行、規制審査および承認、および/または行政または司法制裁の遅延を招く可能性がある
米国における新薬の販売と流通の承認を求めるスポンサーは、通常、以下の各ステップを満足して完成させなければならず、その後、候補製品がFDAの承認を得ることができる
•臨床前試験は、実験室試験、動物研究と調合研究を含み、FDAの良好な実験室実践或いはGLP法規と標準に従って行わなければならない
•臨床方案を設計し、人体臨床試験のためのINDをFDAに提出し、この方案は人体臨床試験が開始される前に発効しなければならない
•各臨床試験を開始する前に、各臨床場所を代表する独立した機関によって委員会またはIRBによって承認される
•現在の良好な臨床実践或いはGCPに基づいて、各提案適応の候補製品の安全性と有効性を決定するために、十分かつ制御された人体臨床試験を行った
•臨床試験結果だけでなく、候補製品の化学、製造および品質管理の詳細な情報、および1つまたは複数の推奨適応の提案ラベル(S)を含む、医薬製品のための新薬申請、または新薬申請を準備し、提出する
•候補製品は、適切な場合、または適切な場合には、FDA諮問委員会によって検討される
•現在の良好な製造実践またはcGMP要件に適合する状況を評価し、施設、方法、および製品の特性、強度、品質、および純度を維持するのに十分な施設、方法、および制御を保証するために、FDAによる製造候補製品またはその構成要素の1つまたは複数の製造施設(サードパーティを含む)の検査を良好に完了させること;
•GCPに適合し、NDAをサポートする臨床データの完全性を保証するために、非臨床および臨床試験場所に対するFDAの任意の監査を満足的に完了させる
•使用料を支払い、FDAが新薬製品の販売を可能にするためにNDAを承認することを確実にする
•リスク評価および緩和策またはREMSの潜在的要件を実施すること、およびFDA要件の任意の承認後研究を行う潜在的要件を含む、任意の承認された要件を遵守する。
臨床前研究
スポンサーが潜在的な治療価値を有する候補製品のテストを開始する前に、候補製品は臨床前試験段階に入る体外培養薬物の安全性及び活性を評価するための動物研究と、ヒトで予備試験を行い、治療使用の理論的基礎を確立するための動物研究とを備える。臨床前試験は製品の化学成分、調合と安定性に対する実験室評価、及び候補製品の毒性評価などの他の研究を含む。これらの研究は一般にINDを支援する研究と呼ばれる.
臨床前試験の進行および試験に用いる化合物の配合は、GLP規制および基準、米国農務省の動物福祉法(適用される場合)を含む連邦法規および要求に適合しなければならない。臨床前試験の結果は,製造情報,分析データ,任意の利用可能な臨床データや文献,臨床試験計画などとともにINDの一部としてFDAに提出される。
INDとIRBプロセス
臨床試験は、GCP要求に従って合格した研究者の監督の下でヒト対象に研究製品を服用することを含み、すべての研究対象に任意の臨床試験に参加する前に書面で自発的なインフォームドコンセントを提供することを含む。臨床試験は書面による研究案に基づいて行い,その中で組み入れと排除の基準,研究の目標,安全性モニタリングのためのパラメータ,評価すべき有効性基準を詳細に説明した。INDの一部として,各臨床試験の案と任意の後続の案修正案をFDAに提出しなければならない。
INDはアメリカ食品薬品監督管理局の免除であり、未承認の候補製品が州間商業で臨床研究に輸送されることを許可し、FDAにこのような研究の管理を許可する
人間への製品です承認された機密協定の対象に属さない候補製品を州間輸送·管理する前に、このような許可を得なければならない。FDAは、患者の安全と権利を確保するためにINDを審査するほか、調査の質に重点を置き、薬物の安全性と有効性の評価を可能にするのに十分かどうかを調査する。INDの申請を支援するためには、スポンサーは各臨床試験にプログラムを提出しなければならず、任意の後続のプログラム修正はINDの一部としてFDAに提出されなければならない。FDAは各IND提出後30日間の待機期間を求め,臨床試験を開始することが求められている。この待機期間は、ヒト研究対象が不合理な健康リスクに直面するかどうかを決定するために、FDAがINDを審査することを可能にすることを目的としている。この30日間のいつでも、FDAはINDで概説された試験の進行に対して懸念または問題を提起し、臨床保留または一部の臨床保留を強制的に実施する可能性がある。これらの場合,INDスポンサーやFDAは臨床試験や一部試験が開始される前に未解決の問題を解決しなければならない。
IND下での臨床試験開始後,FDAもこの試験を臨床放置あるいは一部の臨床放置を実施することができる。患者の安全に懸念があり、しかも臨床、非臨床及び/或いは化学、製造と対照方面の新しいデータ、発見或いは発展のために、FDAは強制的に臨床一時停止を実施する可能性がある。臨床保留はFDAがスポンサーに発表した命令であり,提案された臨床研究の延期や進行中の研究の一時停止が要求されている。一部の臨床保留はIND要求の一部の臨床仕事を遅延或いは一時停止することである。例えば、特定のプロトコルまたはプロトコルの一部は継続が許可されない可能性があり、他のプロトコルは許可される可能性がある。臨床保留或いは一部の臨床保留を実施した後30日を超えない後、FDAはスポンサーに棚上げ根拠に関する書面解釈を提供する。臨床保留或いは一部の臨床保留を発表した後、FDAがこのようにスポンサーに保留取り消しの決定を通知した後、臨床試験は回復することができる。FDAは、スポンサーによって提供された以前に引用された欠陥を修正する情報に基づいて、またはFDAが臨床試験を継続することができるようにする他の方法でこの決定を決定するであろう。
上述したIND要件に加えて、臨床試験に参加する各機関を代表するIRBは、機関が任意の臨床試験を開始する前に計画を審査および承認しなければならず、IRBは少なくとも年に1回の継続的な審査および再承認を行わなければならない。他の事項以外にも,IRBは研究対象に提供される研究案とインフォームドコンセント情報を審査·承認しなければならない。IRBの運営はFDAの規定に適合しなければならない。臨床試験がIRBの要求に従って行われない場合、または候補製品が患者の予期しない深刻な損傷に関連している場合、IRBは、その機関またはその代表機関の臨床試験の承認を一時停止または終了することができる。
さらに、いくつかの試験は、データ安全監視委員会または委員会と呼ばれる試験スポンサーによって組織された独立した合格専門家グループによって監督される。このグループは,そのグループのみが保守している研究から利用可能なデータへのアクセスに基づいて,許可試験が指定されたチェックポイントで行えるかどうかを判定する.参加者または患者が受け入れられない健康リスクに直面していると判定された場合、臨床試験の任意の段階で開発を一時停止または終了することができる。我々は、変化するビジネス目標および/または競合環境に応じて、一時停止または終了の他の理由を提示する可能性がある。
拡張的アクセス
使用を拡大することは、“同情的使用”と呼ばれることがあり、臨床試験以外に研究性新製品を使用し、比較可能または満足できる代替治療案がない場合には、重篤または直ちに生命に危害を及ぼす疾患または条件を有する患者を治療する。参入拡大に関する規則や条例は,研究療法の恩恵を受ける可能性のある患者が研究製品を獲得する機会を改善することを目的としている。FDAの法規は、個別患者(緊急時および非緊急時に治療された単一の患者IND);中規模の患者集団、および治療レジメンまたは治療INDに従って研究製品の使用を申請したより大きな集団のために、会社または治療医がINDの研究製品を治療目的で使用することを可能にする。
患者または患者のグループを治療することを目的として研究製品を獲得するINDを拡大することを考慮すると、スポンサーおよび治療医または調査者は、患者(S)が深刻または直ちに生命に危険な疾患または状態を有し、疾患または状態を診断、監視または治療するための類似または満足できる代替療法がなく、潜在的な患者利益が治療の潜在的リスクが合理的であることを証明し、潜在的リスクが治療すべき背景または条件の下で不合理ではないことを決定するであろう。研究製品の要求される治療の拡大使用は、製品の発売承認を支持する可能性のある臨床研究の開始、進行または完了、または他の方法で製品の潜在的開発を損害する可能性がある。
スポンサーは参入を拡大するためにその研究製品を提供する義務はないが、2016年に採択された“21世紀治療法案”におけるFDCAの修正案の要求に基づいて、開発中の重篤な疾患や疾患を治療する候補製品に対する拡大参入要求にどのように対応するかに関する政策があれば、この政策を公開しなければならない。スポンサーは、カバーされた研究製品の第2段階または第3段階試験の開始が早いとき、または研究製品がFDAによって画期的な治療法、高速チャネル製品、または再生医学高度療法として指定された15日後に、そのような政策を開示することを要求されている。
また、2018年5月30日には、“裁判権法案”が法律に署名された。他の事項に加えて、この法律は、ある患者に連邦フレームワークを提供し、彼らが第1段階の臨床試験を完了し、FDAの承認を得るために調査を行っているいくつかの研究製品を使用することを可能にする。場合によっては、条件を満たす患者は、臨床試験に参加することなく、FDA拡大参入計画に従ってFDA許可を得ることなく治療を求めることができる。“試用権法案”によると,メーカーはその研究製品を条件に適合した患者に提供する義務はない。
NDAを支持するヒト臨床試験
臨床試験は、GCP要求に従って合格した研究者の監督の下でヒト対象に候補研究製品を提供することを含み、すべての研究対象に任意の臨床試験に参加する前に書面でインフォームドコンセントを提供することを含む。臨床試験は書面による臨床試験案に基づいて行い,試験の目標,組み入れと排除基準,安全性モニタリングのためのパラメータ,評価すべき有効性基準を詳細に説明した。INDの一部として,各臨床試験の案と任意の後続の案修正案をFDAに提出しなければならない。
人体臨床試験は通常3つの連続段階に分けて行われるが、これらの段階は重複あるいは組み合わせられる可能性がある。承認された後、追加的な研究が必要かもしれない。
ステップ1臨床試験は最初に限られた人の群れの中で行われ、候補製品の安全性をテストし、副作用、用量耐性、吸収、代謝、分布、排泄と健常人或いは患者における薬効学を含む。第一段階の臨床試験期間中に、薬物製品の薬物動態学と薬理作用に関する情報を得ることができ、良好かつ科学的に有効な第二段階の臨床試験を設計制御することができる。
第二段階臨床試験は通常限られた患者集団で行われ、可能な副作用と安全リスクを決定し、特定の標的適応に対する候補製品の治療効果を評価し、用量耐性と最適用量を決定する。スポンサーは、より規模が大きく、コストの高い3期臨床試験を開始する前に情報を得るために、複数の2期臨床試験を行うことができる。2期臨床試験は非常に良いコントロールと密接なモニタリングを得て、そして限られた患者群で行った。2期試験はさらに2 a期と2 b期試験に細分化できる。2 a期試験は、通常、臨床治療効果、薬効学または生物活性を主要な終点とする探索性(非キー)研究である。2 b期試験は治療効果を主要な終点とする確定投与量範囲の探索研究である。
第3段階第二段階の臨床試験が候補製品の一定量の範囲が潜在的に有効であり、許容可能な安全性を有することを証明した場合、臨床試験は引き続き行われる。第三段階の臨床試験は拡大した患者群で行われ、更に投与量を評価し、臨床治療効果の実質的な証拠を提供し、そして複数の地理的に分散した臨床試験地点で拡大と多様化した患者群に対して更なる安全性テストを行う。コントロールが良好で、統計的に穏健な3期臨床試験は、データを提供することを目的としている可能性があり、規制機関は、これらのデータを使用して承認するかどうかを決定し、承認された場合、どのように適切に薬物を標識するかを決定する。このような第3段階の研究は“重要な段階”と呼ばれる
1つの臨床試験は複数の段階の要素を結合する可能性があるが、FDAは通常、候補製品の発売承認を支持するために複数の第3段階試験を必要とする。ある会社が臨床試験を特定の段階に指定することは、この研究がFDAのこの段階に対する要求を満たすのに十分であるとは限らない。なぜなら、FDAに方案とデータを提出し、FDAによって審査する前に、この決定を下すことができないからである。一般的に、重要な試験は3期試験であるが、設計が臨床利益の良好な制御と信頼できる評価を提供すれば、特に医療需要を満たしていない領域では、それらは2期試験である可能性がある。
2022年12月、食品·薬物総合改革法案(FDORA)の成立に伴い、国会は、各新薬または生物製品の第3段階臨床試験または任意の他の“重要な研究”のための多様な行動計画の制定と提出をスポンサーに要求した。これらの計画はより多くの異なる患者群がFDA監督製品の後期臨床試験に参加することを奨励することを目的としている。具体的には,行動計画には,スポンサーの募集目標,これらの目標の基本原理,スポンサーがこれらの目標をどのように実現しようとしているかの解釈が含まれなければならない。このような要求に加えて、立法はFDAに多様な行動計画に関する新しいガイドラインを発表するように指示した。FDAは2024年1月に指導意見草案を発表し、臨床試験において人種と民族データを収集する政策を示した。
2023年6月、FDAはガイドライン草案を発表し、GCPに対する提案を更新し、臨床試験の設計と現代化を目指した。これらの更新は,より効率的な臨床試験の道を開き,医療製品の開発を促進することを目的としている。このガイドライン草案は国際調整理事会が最近更新したE 6(R 3)ガイドライン草案から採択されたものであり、このガイドライン草案の制定は迅速に発展した技術と方法の革新を臨床試験企業に組み込むためである。また,FDAはガイドライン草案を発表し,分散臨床試験の実施について概説した。
場合によっては、FDAは候補製品の秘密協定を承認する可能性があるが、承認後の候補製品の安全性および有効性をさらに評価するために、スポンサーに追加の臨床試験を行うことが要求される。この承認後試験は通常発売後臨床試験と呼ばれる。これらの研究は、予想される治療群におけるより多くの患者の治療から追加的な経験を得るために使用され、さらに加速承認条例によって承認された薬物の臨床的利益を証明するために使用される。FDAが製品を承認し、ある会社が承認を必要としない臨床試験を行っている場合、会社は、上場後の臨床試験のすべてまたは一部の要求を満たすために、これらの臨床試験のデータを使用することができ、または製品ラベルの変更を要求することができる。発売後の臨床試験での職務調査ができなかったことは,製品の承認撤回につながる可能性がある。
FDAは2022年3月、スポンサーが腫瘍製品開発の初期段階でどのように適応試験設計を利用するかについて概説した“拡張行列:初のヒト臨床試験のための腫瘍薬と生物製品の開発を加速するための”と題する最終ガイドラインを発表した即最初のヒト臨床試験)は,従来の3段階の試験を1つの連続試験に圧縮し,拡張行列試験と呼ぶ。個人拡張キュー設計をサポートする情報はINDに含まれ,FDAによって評価される.コホート試験を拡大することは,製品開発の効率を向上させ,開発コストや時間を削減する可能性がある.
FDAが承認したアメリカの海外臨床研究をサポートします
われわれの臨床開発計画については,将来的に米国以外の地点で試験を行う可能性がある。ある国外の臨床研究がIND下で行われる時、放棄しない限り、すべてのIND要求を満たさなければならない。外国の臨床研究がINDの下で行われていない場合、スポンサーは、この研究をINDまたは上場承認申請の支持として使用するために、この研究がFDAのいくつかの法規要件に適合することを確実にしなければならない。具体的には,独立倫理委員会の審査·承認を受けること,被験者のインフォームドコンセントを求めて受けることなど,GCPに従って行わなければならない。GCPは臨床研究の倫理とデータ完全性基準を含むことが要求される。FDAの規定は、非IND外国臨床研究に参加したヒト被験者の保護、及び結果データの質と完全性を確保することを目的としている。これらはまた、非IND外国研究がIND研究に匹敵する方法で行われることを確保するのに役立つ。
FDAは米国国外で行われた臨床試験の研究データを受け入れて米国の承認が何らかの条件で制限される可能性があり,まったく受け入れられない可能性もある。もし外国の臨床試験のデータがアメリカでの発売承認の唯一の根拠としようとする場合、FDAは通常、(I)データがアメリカの人口とアメリカの医療実践に適用されない限り、外国のデータのみに基づいて申請を許可しない;(Ii)試験は公認能力を有する臨床研究者によって行われ、CGCP規定に符合する。および(Iii)データは、FDAによる現場検査を必要とすることなく、有効であると考えることができ、またはFDAがこのような検査を行う必要があると考えた場合、FDAは、現場検査または他の適切な手段によってデータを検証することができる。
また,海外の研究データが承認の唯一の根拠としようとしなくても,FDAはこれらのデータを上場承認申請の支援として受け入れず,研究設計が良好でない限り,GCP要求に応じて良好な操作を行い,FDAは研究データを現場検証することができる
必要であれば検査を行うことができる。多くの外国の規制機関もまた似たような承認要求を持っている。また、このような外国裁判は、裁判を行う外国司法管轄区に適用される現地法によって管轄されている。
臨床開発計画中のFDAとの相互作用
INDが承認され臨床試験を開始した後,スポンサーはFDAとの相互作用を継続する。臨床試験結果を詳細に説明する進捗報告は少なくとも毎年FDAに提出しなければならず,深刻な有害事象が発生すればより頻繁に提出される。さらに、以下のうちの1つのINDセキュリティ報告書は、深刻かつ意外な疑わしい副作用、他の研究または動物からの報告書に提出されなければならない体外培養この製品に接触する人体に重大なリスクがあることを表明したテスト;及び方案或いは研究者マニュアルに記載されている場合と比較して、深刻な副作用が疑われる場合にはいかなる臨床上重要な増加が出現した。第1段階、第2段階、および第3段階の臨床試験は、任意の指定された時間内に成功しないか、または全く成功しない可能性がある。FDAは、通常、GCPおよび提出された臨床データの完全性を保証するために、1つまたは複数の臨床場所を検査する。
また,スポンサーは臨床開発計画のあるときにFDAと会う機会がある。具体的には、スポンサーは、INDまたはINDを提出する前に会議を申請し、2期臨床試験またはEP 2会議の終了時に、NDAを提出する前またはNDA前の会議でFDAと会うことができる。他の時間に会議を開催することを要求することもできる。スポンサーとFDAの間には5種類の会議がある。Aクラス会議は,もともと停滞していた製品開発計画を継続したり,重要なセキュリティ問題を解決したりするために必要な会議である.クラスB会議には,IND申請前会議とNDA前会議,EOP 2会議のようなB段階終了会議がある.クラスC会議とは,AクラスまたはBクラス会議以外のいずれかの製品開発やレビューに関する会議である.最後に、D類会議は一連の狭い問題(2つの重点議題を超えないことに限定されるべき)に重点を置き、3つの学科あるいは分部を超える投入を要求すべきではない。最後に,インタラクティブ会議は,研究製品の早期開発において独自の挑戦を提示する新製品と開発計画を目指している.
これらの会議はスポンサーにこれまで収集してきたデータの情報をFDAと共有する機会を提供し,FDAに次の段階の開発に関する提案を提供した。例えば,EOP 2会議では,スポンサーがその2期臨床結果を検討し,その鍵となる3期臨床試験計画(S)を提案し,新製品の承認を支援すると考えられる。この会議は自ら行うことができ,電話会議/ビデオ会議や書面回答で行うことができ,議事録はスポンサーからFDAへの質問とFDAからの回答のみを反映している.FDAは、議事録および諮問書簡で伝達された応答は、スポンサーに対する提案および/または提案のみを構成するため、スポンサーは、そのような提案および/または提案の制約を受けないと述べている。しかし、実践的な観点から見ると、スポンサーはFDAの臨床計画設計に関する提案に従わず、この計画を大きな失敗リスクに直面させる可能性がある。FDAは2023年9月に指導草案を発表し、このような会議の条項をより詳細に概説した。
臨床試験結果を報告する
特に,臨床試験登録の一部として,臨床試験の製品,患者群,調査段階,研究場所,調査者,その他に関する情報が公開されている。これらの違反通知は民事罰金を招くことはないが,FDCAの規定により,Clinicaltrials.govに臨床試験情報を要求通りに提出できなかったことは禁止されており,違反行為は毎日10,000ドルまでの民事罰金を受け続ける可能性がある。民事罰金に加えて、違反は禁止および/または刑事起訴や連邦支出資格の取り消しなど、他の規制行動を招く可能性がある。
CGMP要件の製造と遵守
臨床試験と同時に、会社は通常追加の臨床前研究を完成する。彼らはまた,薬物の化学的および物理的特性に関するより多くの情報を開発し,cGMPの要求に応じて最終的に商業量産製品のプロセスを決定しなければならない。製造過程は一貫して高品質の候補薬物ロットを生産することができなければならず、特に最終薬物の識別、強度、品質、純度と効力をテストするための方法を開発しなければならない。また、適切な包装
選択とテストを行い,候補薬物が賞味期限内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない。
FDAの規定では,薬品は承認された施設内で生産され,cGMPに適合しなければならないことが求められている。CGMP条例には、人員、建物および施設、設備、部品および製品容器および閉鎖的な制御、生産およびプロセス制御、包装およびラベル制御、保有および分配、実験室制御、記録および報告、ならびに返品または回収された製品に関する要件が含まれる。薬品の生産と流通を許可するメーカーと他の実体はFDAの定期抜き打ち検査を受けて、cGMPと他の要求に符合するかどうかを理解する。2022年12月に公布された“大流行病予防法”は、1種の薬物または生物が米国に輸入または提供される前に、米国国外の別の機関でさらなる製造、製造、繁殖、複合または加工を行っても、外国の薬品製造機関は登録と発売要求を守らなければならないことを明らかにした。
製造業者や他の製品の製造と流通に参加する人たちもまたFDAと特定の州機関に彼らの工場を登録しなければならない。国内でも海外の製造企業でも,最初に生産過程に参加する際には,FDAに登録して追加的な情報を提供しなければならない。登録されていない工場で製造または輸入されたどの製品も、外国でも国内でも、FDCAの下に誤ったブランドが貼られているとみなされている。承認された製品の製造プロセス,仕様や容器閉鎖システムの変更は厳しく規制されており,通常はFDAの承認を得て実施する必要がある。FDAの規定はまた、cGMPから外れたいかなる状況の調査と是正を要求し、スポンサーと生産承認製品の生産に参加する任意の第三者メーカーに対して報告と文書要求を提出することを要求している。
小児科研究
小児科研究公平法またはPREAによれば、アプリケーションおよびいくつかのタイプのサプリメントは、すべての関連する小児科亜集団において主張される適応の安全性および有効性を評価し、各安全で有効な小児科亜集団に対する製品の用量および投与をサポートするのに十分なデータを含まなければならない。スポンサーは、EP 2会議後60日以内に、またはスポンサーとFDAとの間で合意した場合に、初歩的な小児科研究計画を提出しなければならない。スポンサーはまたデータを評価する前に小児科研究計画を提出しなければならない。これらの計画は、研究目標および設計、年齢グループ、関連終点および統計方法、またはそのような詳細な情報を含まない理由、および小児科研究データを提供するための要求および情報をサポートする要件を含む、提案された小児科研究またはスポンサー計画によって行われる研究の大綱を含まなければならない。スポンサー、FDA、FDAの内部審査委員会はその後、提出された情報を審査し、協議し、最終計画について合意しなければならない。FDAやスポンサーはいつでも計画の修正を要求することができる。
深刻な或いは生命に危害を及ぼす疾病或いは状況を治療することを目的とした研究製品に対して、FDAはスポンサーの要求に応じて会議を開催し、初期小児科研究計画の準備或いは討論を討論し、小児科評価を延期或いは放棄しなければならない。また,FDAは開発過程の早期に会議を開催し,小児科研究計画をスポンサーと検討し,FDAは重篤あるいは生命に危険な疾患よりも遅くない第1段階会議が終了する前と,FDAが研究計画を受け取ってから90日後にスポンサーと面会しなければならない。
FDAは、成人のために製品が使用されるか、または小児科データ要件を完全にまたは部分的に免除するまで、スポンサーの要求に能動的にまたは対応することができ、承認は、小児科データの一部または全部の提出を延期することができる。延期は、小児科試験が完了する前に、製品または候補治療薬が成人で使用を許可する準備ができていることを発見するか、または小児科試験が開始される前に追加の安全性または有効性データを収集する必要があることを含むいくつかの理由があるかもしれない。2012年の食品·薬物管理局安全·革新法案(FDASIA)によると、FDAは、PREA要求を提出できなかった小児科評価、求められなかった、または延期または延期を求めることができなかった、または必要な小児科処方の承認を要求できなかったスポンサーにPREA不適合書簡を送信しなければならない。FDASIAはさらに,PREAが手紙やスポンサーに従わない応答を公開することをFDAに求めている.
規制が別途要求されない限り、小児科データ要件は、孤児として指定された製品には適用されないが、FDAは最近、PREAにおいてこの法定免除を乱用すると考えられる行為を制限する措置を講じているにもかかわらず、まれな小児科亜群に追加的な孤児薬物指定を付与することを意図していないことを宣言し、一般的な疾患である。FDAは免除を維持しています
小児科群の疾患罹患率は低いため,あらかじめ緊急救援を行う必要がある。2023年5月、FDAは新しいガイドライン草案を発表し、さらにPREA下の小児科研究要求を述べた。
計画を迅速に審査する
FDAはいくつかの方法で申請の検討を加速させることを許可された。これらの加速計画はいずれも承認基準を変更することはないが,候補製品の開発や承認過程の加速に役立つ可能性がある.
•高速通路指定。候補製品のスポンサーは,INDの届出と同時にまたは後に,特定の適応の製品を高速チャネル製品として指定することをFDAに要求することができる。もし候補製品が深刻な或いは生命に危害を及ぼす疾患を治療することを目的とし、このような疾病が満たされていない医療需要を満たす潜在力を示す場合、迅速なチャンネル認証を受ける資格がある。高速チャネルは,候補製品と研究中の特定の適応に適した組合せを指定する.他の利点に加えて、FDAとより大きな相互作用が可能であれば、FDAは、申請が完了する前にFast Track申請の部分の審査を開始する可能性があり、この過程をローリング審査と呼ぶ
•画期的な治療指定。画期的な治療計画の資格を得るためには、候補製品は深刻な或いは生命に危害を及ぼす疾患或いは状況の治療に使用されなければならず、初歩的な臨床証拠は、これらの候補製品が1つ以上の臨床顕著な終点で既存の治療法よりも著しく改善されている可能性があることを示しなければならない。FDAは突破的な候補治療製品のスポンサーが高効率開発計画に関する深い指導を得ることを確保し、高級管理者と経験豊富な従業員が積極的、協力と学際的な審査と転動審査に深く参与することを確保する
•優先的に審査する。候補製品が重篤な疾患を治療した場合、優先審査を受ける資格があり、承認されれば、市販されている製品と比較して、治療、診断または予防の安全性または有効性の重大な改善となる。FDAの目標は、標準審査の10ヶ月間ではなく、優先審査申請の審査を6ヶ月以内に完了させることである
•承認を速める。研究された医薬製品は、重篤または生命に危険な疾患の治療における安全性および有効性、および既存の治療法よりも意義のある治療効果を提供する医薬製品が加速的に承認される可能性がある。承認を加速することは、候補製品が十分かつ良好に制御された臨床試験に基づいて、候補製品が臨床利益を合理的に予測する可能性のある代替終点に影響を与えるか、または生存または不可逆的な発病率または死亡率または他の臨床利益ではなく、臨床終点への影響を決定することができ、病状の重症度、希少性および流行度、ならびに代替治療の利用可能性または不足を考慮することを意味する。承認の一つの条件として,FDAは承認を加速させた候補薬物のスポンサーに十分かつ良好に制御された上場後臨床試験を要求する可能性がある。また、FDAは現在、承認を加速する条件として宣伝材料を事前承認することを要求している。
FDORAの2022年12月の採択に伴い、国会は薬品や生物製品の承認を加速させるためのいくつかの条項を改正した。具体的には、新しい立法許可FDA:加速承認を得る前に検証的臨床試験を行うことをスポンサーに要求し、加速承認された製品のスポンサーが、研究が完了するまで承認後の研究の進捗報告を6ヶ月ごとにFDAに提出することを要求し、検証試験が製品の臨床的利益を検証できなかった後、加速手順を使用してNDAまたはBLAの加速承認を撤回する。また,FDORAがFDAに承認加速承認後にこのような研究を要求しないことを決定した場合には,“なぜ承認後に検討が適切でないのか不必要な理由”をそのサイト上に公表する。2023年3月、FDAは指導意見草案を発表し、現在承認を加速する構想と方法を概説した。FDAによると、癌の深刻性と生命に危害を及ぼす性質のため、加速承認経路は通常腫瘍薬物の審査に用いられる。単一アーム試験は通常加速承認を支持するために使用されるが、無作為対照試験はより信頼性の高い治療効果と安全性評価を提供し、利用可能な治療との直接比較を可能にするため、第一選択方法である。そのため、FDAは実験データの設計、進行と分析の考慮要素を概説し、これらの試験は腫瘍治療薬物の加速承認を支持することを目的としている。このガイドラインは現在草案形式にすぎず,最終的に決定されても法的拘束力はないが,スポンサーはFDAのガイドラインを密接に遵守し,彼らの研究製品が加速的な承認を得る資格を確保するのが一般的である。
•再生性先進療法。2016年12月に採択された“21世紀治療法”に伴い,再生性先進療法に指定された製品の審査と承認がFDAに認可された。製品が深刻なまたは生命を脅かす疾患または状態を治療、修正、逆転または治癒することを目的とした再生医学療法であり、予備臨床証拠が、候補製品がそのような疾患または状態の満たされていない医療需要を満たす可能性があることを示す場合、製品はこの称号を得る資格がある。再生性高度治療指定の利点は、開発および審査を加速するためのFDAとの早期相互作用、画期的な治療の利点、潜在的な優先審査資格、および代替または中間終点に基づく加速承認を含む。
秘密保持協定の届出と審査
米国での上場承認を得るためには,医薬品の安全性と有効性を証明し,期待される適応を証明するために十分なデータを提供しなければならないNDAをFDAに提出しなければならない。この出願には,陰性または不明確な結果および陽性結果,および製品の化学,製造,制御および推奨のラベルなどに関する詳細な情報を含む関連する前臨床試験および臨床試験から得られたすべての関連データが含まれている。データは、製品の安全性および有効性を試験することを目的とした会社のスポンサーからの臨床試験から来ることができ、独立した調査者によって開始された研究を含む多くの代替源から来ることもできる。上場審査を支持するために、提出したデータは品質と数量で十分でなければならず、薬物製品の安全性と有効性を確定し、FDAを満足させる必要がある。
NDAは、スポンサーがFDAに米国での新製品の発売および販売を承認することを正式に提案する1つまたは複数の適応のツールである。すべての新薬候補は米国で商業化されるために承認された機密協定を得なければならない。バイオライセンス申請、又はBLASは、公衆衛生サービス法に基づいて提出されたバイオ製品ライセンス申請である。連邦法によると、ほとんどのNDAの提出には申請使用料を支払う必要がある。承認された守秘契約のスポンサーは年度計画費も払う必要があります。その中のいくつかの費用には、特定の例外および免除、例えば、孤児指定製品を有する申請料例外があり、特定の財政年度内に薬物生産に従事しないことが計画されている場合、計画費用例外、およびいくつかの小企業の免除がある。
FDAは、申請を受けてから60日以内に申請を予備審査し、実質的な審査のためにスポンサー申請が十分に完全であるかどうかをこの期間内に通知しなければならない。FDAが申請がこの基準を満たしていないと判断した場合、それはスポンサーに提出拒否またはRTF決定を発行する。FDAは、申請を受け入れるのではなく、追加の情報の提供を要求することができ、申請は追加の情報と共に再提出される可能性がある。再提出された申請はFDAが届出を受ける前にも審査を行わなければならない。
提出された申請が受け入れられると、FDAは深い実質的な審査を開始する。FDAはNDAの審査過程で具体的な業績目標を設定することに同意した。このプロトコルによれば、新しい分子実体(NME)の承認を求める申請の90%は、FDAが出願を受けた日から10ヶ月以内に審査され、90%が優先審査に指定されたNME申請は、提出日から6ヶ月以内に審査される。非NME製品の承認を求める出願については、10ヶ月と6ヶ月の審査期間がFDAが申請を受けた日から開始される。FDAは、スポンサーが提供する新しい情報を考慮したり、明確にしたりして、FDAが最初の提出後に発見した顕著な欠陥を解決するために、審査プロセスおよび処方薬使用料法案(PDUFA)の目標日をさらに3ヶ月延長する可能性がある。これらの審査目標にもかかわらず,FDAによる申請の審査がPDUFA目標日を超えることは珍しくない。
審査申請時に、FDAは、通常、製品を製造しているか、または製品を製造する1つまたは複数の施設を検査する。これらの承認前検査は、部品製造、完成品製造、および制御試験実験室を含むNDA提出に関連するすべての施設をカバーすることができます。FDAは、製造プロセスおよび施設がcGMP要件に適合していることを決定し、要求された仕様の下で製品が一貫して生産されることを保証するのに十分でない限り、申請を承認しないであろう。
さらに、NDAを承認する前に、FDAは、GCPおよびアプリケーションにおけるデータの完全性に適合することを保証するために、通常、1つまたは複数の臨床サイトを検査する。FDORAの成立に伴い,国会はFDAによる検査の権限を明らかにし,FDAへの臨床·非臨床研究への提出を許可する準備,進行や分析に係る施設,研究記録を持ったり研究に参加したりする他の人を明確にしている
研究過程を研究する。その従業員と第三者請負者がcGMPやGCPを遵守することを確保するために、スポンサーは訓練、記録保存、生産、品質管理に多くの時間、お金、エネルギーを費やす可能性がある。
また,承認の条件として,FDAはスポンサーにREMSの開発を要求する可能性がある。REMSは、製品の利点が潜在的なリスクよりも大きいことを保証するために、専門ラベル以外のリスク最小化戦略を使用する。REMSが必要かどうかを決定するために、FDAは、製品を使用する可能性のある集団の規模、疾患の深刻さ、製品の予期される利益、予期される治療持続時間、既知または潜在的な有害事象の深刻さ、および製品がNMEであるかどうかを考慮するであろう。FDAは具体的な状況に応じてREMSに対する要求および具体的なREMS条項を決定する。FDAがREMSが必要であると考えている場合、申請されたスポンサーは提案されたREMSを提出しなければならず、FDAはREMSのない出願を承認しないであろう。
FDAは、新製品の申請を諮問委員会に提出したり、なぜそのような推薦がないのかを説明したりすることもできる。通常,諮問委員会は臨床医や他の科学専門家を含む独立した専門家からなるグループであり,申請を審査,評価し,申請を承認すべきかどうか,どのような条件でアドバイスを提供すべきかを担当する。FDAは諮問委員会の提案に制約されていないが,FDAは決定を下す際にこれらの提案を慎重に考慮する。
FDAの秘密保持協定に関する決定
食品·医薬品局審査申請は,他の事項に加えて,製品が安全であるかどうか,およびその期待用途に有効であるかどうかを決定し(S),後者の決定は大量の証拠に基づいている。FDAのこのエビデンス基準の解釈は,新製品の有効性を確認するためには,少なくとも2回の十分かつ良好な制御の臨床調査が必要である。しかしながら、場合によっては、FDAは、いくつかの特徴および追加情報を有する単一の実験がこの基準を満たす可能性があることを示している。最終的に、FDAは、医薬製品の予期される利益が、患者に対する潜在的リスクを超えるかどうかを判断し、機関は、完全な返信またはCRL、または承認状を発行する。
CRLは,申請の審査周期が完了したことを示しており,申請は現在の形で承認されない.CRLは、通常、提出中の不足点を列挙し、FDAが申請を再検討するために、大量の追加のテストまたは情報を必要とする可能性がある。CRLは、追加の臨床または他のデータ、追加の重要な第3段階臨床試験、および/または臨床試験、臨床前研究または生産に関連する他の重要で時間のかかる要件を必要とする可能性がある。CRLを発行すれば,スポンサーはFDAが決定した欠陥に1年間応答することができ,FDAは申請が撤回されたと考えたり,スポンサーの追加延長を適宜承認したりすることができる.FDAのCRL決定に挑戦しようとする人に対して、FDAは、スポンサーがCRLについての正式な公聴会を要求することができるか、または協議要求または紛争解決の正式な要求を行うことができることを示している。
FDAが新製品を承認した場合、製品ラベルに禁忌症、警告または予防措置を含むことを要求するか、または承認後の臨床試験を含む承認後の研究を要求し、承認後の薬剤の安全性をさらに評価するために、製品の承認適応を制限する可能性がある。この機関はまた、製品が商業化された後にそれを監視するために、またはREMSを含む流通制限または他のリスク管理機構を含む他の条件を適用して、製品の利益が潜在的リスクよりも大きいことを保証するために、テストおよび監視計画を要求することができる。REMS計画は、薬物ガイドライン、衛生保健専門家のコミュニケーション計画、安全使用を確保する要素、またはETASUを含むことができる。ETASUは、処方または調剤に限定されないが、特殊なトレーニングまたは認証、場合によっては調剤、特殊監視、および特許登録所の使用を含むことができる。FDAは発売後の研究或いはモニタリングプロジェクトの結果に基づいて、製品の更なるマーケティングを阻止或いは制限することができる。FDAが製品の使用に関連する深刻なリスクを認識している場合、それは承認の前または後にREMSを要求する可能性がある。REMSへの要求は製品の潜在的な市場と収益力に大きな影響を与える可能性がある。承認後、承認製品の多くのタイプの変更、例えば、新しい適応の増加、製造プロセスの変更、ラベル宣言の追加など、さらなるテスト要件とFDAの審査と承認を受けなければなりません。
承認後に要求する
新しい処方薬が承認された後、製造業者、承認された製品および製品の製造場所は、監視および保存活動の監視および記録、製品に関連する不良経験および製品問題、製品サンプリングおよび流通、製造および販売促進、および広告を含むFDAによって一般的かつ持続的に規制される。医者が処方するかもしれませんが
許可されていない用途または患者集団が合法的に入手可能な製品(すなわち、“ラベル外用途”)については、製造業者は、そのような用途を販売または普及させてはならない。FDAや他の機関はラベル外用途の普及を禁止する法律法規を積極的に実行しており,ラベル外用途の普及が不適切であることが発見された会社は重大な責任を負う可能性がある。2021年9月、FDAは、医薬製品の予期される用途を決定する際にFDAが考慮すべき証拠タイプが記載された最終法規を公表した。米国では、衛生保健専門家は、FDAが医薬品実践を規制していないので、ラベルに記載されていないこのような用途のための製品処方、いわゆるラベル外用途を発行することが一般的に許可されている。しかし,FDAは2023年10月にガイドラインを発表し,FDA管理が未承認用途の科学情報をヘルスケア提供者に配布する拘束力のない政策について概説した。本ガイドライン草案は、このような通信が真実で、誤解性がなく、事実と偏らないことを要求し、医療保健提供者が許可されていない使用に関する情報の利点および欠点、ならびに有効性および実用性に必要なすべての情報を説明することを含む。
非常に具体的で狭い条件下では、製造業者が、科学または医学定期刊行物情報の配信のようなラベル外情報に関する非販売促進、非誤解的伝播に従事することを可能にすることができる。また,2022年12月に“承認前情報交換法”(PIE Act)が成立するにつれ,承認されていない製品のスポンサーは,製品承認後に患者の接触を加速させるために,開発中の製品に関する何らかの情報を支払者に能動的に伝達することができる。これまで,このような通信はFDAの指導の下で許可されていたが,新たな立法はスポンサーの保護を明確にしており,これらのスポンサーは未承認の製品用途を含む開発中の製品に関するいくつかの情報を支払者に伝えてきた。
ある会社がラベル外の使用を促進することが発見された場合、それはFDA、司法省、または衛生·公衆サービス部監察長事務室、および州当局の行政および司法執行を受ける可能性がある。これは、民事および刑事罰金、企業の製品の宣伝または流通の方法を実質的に制限する協定、および不利な公共関係および名声の損害を含む一連の重大な商業的影響を及ぼす可能性のある一連の処罰を企業に受ける可能性がある。連邦政府は、不当な販売促進の疑いのある会社に対して巨額の民事と刑事罰金を科し、企業に同意法令または永久禁止令を締結し、これらの法令または永久禁止に基づいて、特定の販売促進行為を変更または制限することを要求する。
孤児薬の指定と排他性
米国の孤児薬物指定は,スポンサーにまれな疾患や疾患の治療のための製品の開発を奨励することを目的としている。米国では、法律は、まれな疾患または疾患を、米国で20万人未満または米国で20万人を超える影響を及ぼす疾患と定義しており、米国での製品の販売からその疾患または疾患に対する生物製剤の開発および提供のコストを回収することができる合理的な期待はない。
FDAが承認すれば、孤児薬物指定は会社が製品発売許可日から7年以内に税収控除と市場排他性を得る資格を持つことになる。孤児製品に指定された出願は、当該製品の発売を承認する申請を提出する前のいつでも提出することができる。規制規定により提出された受け入れ可能な機密要求によると、1つの製品がFDA孤児製品開発事務所の孤児薬物指定を受けた場合、その製品は孤児となる。そして、その製品はどんな他の製品のように審査と承認手続きを通過しなければならない。
スポンサーは、以前承認されていなかった製品を孤児薬として指定したり、すでに発売されている製品のために新たな孤児適応を申請することを要求することができる。さらに、1つの製品が他の態様で承認された孤児薬物と同じ製品である場合、製品が信頼できる仮定を提示することができる場合、すなわち、その製品が第1の薬剤よりも臨床的に優れている可能性がある場合、製品の発起人は、同じ稀な疾患または疾患の後続製品に対する孤児薬物名を求めることができ、取得することができる。複数のスポンサーは、同じ製品のために同じまれな疾患または疾患の孤児薬物指定を得ることができるが、孤児薬物指定を求める各スポンサーは、完全な指定申請を提出しなければならない。
孤児として指定された製品が、このような指定された疾患または条件を有するFDAの最初の承認を受けた場合、またはまれな疾患または条件下での特定の適応または使用として指定された場合、製品は、通常、孤児薬物排他性を得る。孤立薬物排他性とは、いくつかの限られた場合を除いて、FDAが同じ適応に対する別のスポンサーの同一の製品に対するマーケティング申請を7年以内に承認しない可能性があることを意味する。孤児薬として指定された製品が最終的に発売承認された場合,その適応範囲は孤児薬物申請で指定された範囲よりも広く,排他性を得る資格がない可能性がある。
専門期間はFDAが上場申請を承認した日から,この製品が指定した適応にのみ適用される。FDAは、同じ製品の第2の出願を異なる使用のために承認することができ、または同じ使用のために製品の臨床的により優れたバージョンを申請することができる。場合によっては、孤児薬物排他性は、孤児薬物排他性を有する会社が市場需要を満たすことができない場合、または同じ場合に同じ薬物を使用する後続製品が、より良い治療効果または安全性に基づいて臨床的に承認された製品よりも優れていることが証明された場合、または患者ケアに大きく貢献することを含む、別の製品の承認を阻止しない。孤児薬物法案は孤児薬物の排他性を認めることをFDAに明確に要求していたが,その臨床的優位性にかかわらず,早い時期の裁判所の意見であった。トランプ総裁が2020年12月27日に署名した総合的な立法によると、製品の臨床的優位性を示す要求は、2017年のFDA再認可法案が公布される前に孤児薬物指定を受けたが、FDAの承認や許可を得ていない薬物や生物製品に適用される。
2021年9月,第11巡回控訴裁判所は,排他的範囲を決定するために,法規中の“同一疾患または状況”という言葉は指定された“まれな疾患または状況”を指すと判断し,FDAはそれを“適応または使用”と解釈することはできない。したがって,裁判所は孤児薬物は“適応や使用”ではなく,指定された疾患や状況全体に排他的に適用されると結論した。この決定を覆すための立法提案があったが、それらはまだ法律になっていない。2023年1月、FDAは、裁判所の命令範囲を超える事項において、FDAは、孤児薬の独占性と孤児薬の使用または適応とをバンドルするために、その既存の法規を適用し続けると発表した。
特許期限の回復と延長
ハッジ·ワックスマン法案によると、新薬製品を持つ特許は、FDA規制審査中に失われた特許期間が5年間に及ぶ特許を回復することを可能にする限られた特許期間延長を受ける資格がある可能性があると主張している。1つの製品をカバーする特許付与の回復期は、通常、IND発効日と出願提出日との間の時間の半分であり、出願提出日と最終承認日との間の時間を加える。特許期間回復は特許の残存期間の延長には利用できず,製品承認日から合計14年を超える。承認された製品に適用される特許は1つのみ延期する資格があり、承認された製品、その使用方法、または製造方法に関する権利要件のみを延期することができる。しかも、延期申請は関連特許が満期になる前に提出されなければならない。複数の製品をカバーする特許は、そのうちの1つの承認に関連して延期することしかできない。米国特許商標局は,FDAと協議した後,任意の特許期間の延長または回復の出願を審査·承認する。
医療適合性
米国では、バイオ製薬メーカーおよびその製品は、医療業界の詐欺や乱用を防止するための法律など、連邦や州レベルで広く規制されている。医療保健提供者と第三者支払人は推薦と処方が発売承認された薬品の面で主要な役割を果たしている。提供者、コンサルタント、第三者支払者および顧客との間の配置は、広く適用される可能性のある詐欺および乱用、リベート、虚偽請求法律、医療提供者への支払いの報告、および患者のプライバシー法律法規および他の、我々の業務および/または財務的手配を制限する可能性のある医療法令の制約を受ける可能性がある。私たちが発売されている製品がある場合にのみ適用されるいくつかの法律と法規を含む、連邦および州医療保健法律および法規の制限を適用する
•連邦虚偽声明、虚偽声明、および民事罰金法律は、他の者に加えて、政府資金を支払うために虚偽声明を故意に提出または提出させることを禁止するか、または虚偽クレームを得るために虚偽声明を作成または誘導することを禁止する
•連邦医療計画逆控除法は、他に加えて、個人が直接または間接的に提供、請求、受け入れ、または報酬を提供することを禁止し、連邦医療保険と医療補助などの連邦医療保健計画によって支払うことができる商品やサービスを個人に紹介または購入または注文させることを誘導する
•1996年の連邦健康保険携行性および責任法案、またはHIPAAは、医療提供者および他のエンティティのプライバシー保護に適用されることに加えて、詐欺の任意の医療福祉計画の実行または医療事項に関する虚偽陳述を禁止する
•連邦法律は、製薬業者に、特定の計算された製品価格を政府に報告するか、または政府当局または個人実体に、通常、政府医療計画下の精算条件として何らかの割引またはリベートを提供することを要求している
•連邦公開支払い(または連邦“陽光”法)は、製薬および医療機器会社に、特定の医療保健提供者との特定の財務的相互作用を監視し、特定の医療保健提供者およびその直系親族が所有する所有権および投資権益を再開示するために、米国衛生·公衆サービス部内の医療保険および医療補助サービスセンター(CMS)に報告することを要求する
•市場活動を広く規制し、消費者の活動を損なう可能性がある連邦消費者保護法と不正競争法
•州逆リベートおよび虚偽申告法、州法律は、製薬会社が特定のコンプライアンス基準を遵守することを要求し、製薬会社と医療保健提供者との間の財務的相互作用を制限すること、または製薬会社に医療提供者への支払いまたはマーケティング支出に関する情報を報告することを要求すること、およびプライバシー、安全、および場合によっては健康情報に違反する州法律を要求することを含む同様の州法律および法規であり、多くの法律は、しばしばHIPAAによって先制されず、コンプライアンス努力を複雑化させることが多い、および
•米国の“海外腐敗防止法”のような賄賂および腐敗を禁止する法律および法規は、米国の会社およびその従業員および代理人が、外国政府官僚、国際公共機関または外国政府の所有または付属実体の従業員、外国公職候補者およびその外国政党または官僚への権限、約束、腐敗または不当な支払いまたは任意の他の価値のあるものを提供または提供または提供することを禁止する。
これらの法律に違反する行為は、連邦医療保険および医療補助のような連邦医療保険および州医療計画から除外される場合も含まれる刑事および/または民事制裁を受けることになる。コンプライアンスが時間がかかって費用がかかることを確実にする。EUおよび他の司法管轄区域にも同様の医療法律法規が存在し、医療保健提供者との相互作用やその支払いの報告要件の詳細な説明、個人情報のプライバシーと安全を規制する法律を含む。
プライバシー要求
プライバシーとデータセキュリティ要求はアメリカですでに到着されているか、進行中だ。様々なデータ保護法が我々の活動に適用される可能性があり,州と連邦の2レベルの一連の法執行機関は,一般消費者保護法に基づいて会社のプライバシーやデータセキュリティ問題を審査することができる.連邦貿易委員会と州総検察長は消費者のプライバシーとデータ安全保護を積極的に検討している。州と連邦の二級も新しい法律を考慮している。例えば、2020年1月1日に施行される2018年カリフォルニア消費者プライバシー法、またはCCPAは、カリフォルニア住民情報を処理する会社が、消費者にデータ収集、使用、および共有方法を開示することを要求し、消費者が第三者と特定のデータを共有しないことを選択し、データ漏洩に新たな訴訟理由を提供することを可能にする。また、2023年1月1日から、カリフォルニアプライバシー権法案(CPRA)は、ある敏感な個人情報に対する消費者の権利を拡大することを含むCCPAを大きく改正する。CPRAはまた、CCPAおよびCPRAを実施し実行する権限を付与される新しい国家機関を作成した。CCPAやCPRAは我々の業務活動に影響を与える可能性があり,これをどのように解釈するかに依存し,我々の業務はネットワークの脅威を受けやすいだけでなく,個人データや個人が識別できる健康情報に関する変化する規制環境の影響を受けることを示している。このような規定は私たちのいくつかの商業活動に適用されるかもしれない。カリフォルニア以外のいくつかの州でもCCPAやCPRAのような全面的なプライバシー法が採択されている。このような法律は施行されたか、2026年末までに施行されるだろう。これらの法律は,CCPAやCPRAと同様に,個人情報の処理に関する義務と,“敏感”データ(場合によっては健康データを含む)を処理する特殊な義務を規定している。このような法律のいくつかの規定は私たちの商業活動に適用されるかもしれない。2025年以降に施行されるプライバシー法を強く考慮している州もある。他の州は未来にこれらの法律を考慮し、国会もずっと考慮している
連邦プライバシー法に関する討論が行われた。私たちの業務の健康情報に影響を及ぼすかもしれないいくつかの州の専門的な規制もある。これらの法律は、私たちの研究対象の決定、業務パートナーとの関係、最終的に私たちの候補製品のマーケティングおよび流通(承認されれば)を含む、私たちの業務活動に影響を与える可能性があります。
医薬保険カバー面と医療改革
米国や他の国の市場では,処方治療を受けた患者や処方サービスを提供する提供者は,通常,第三者支払者に依存して関連する医療費の全部または一部を精算する。FDAや他の政府当局が承認した製品のカバー範囲や精算状態には大きな不確実性がある。したがって、私たちの候補製品または私たちのパートナーのうちの1つが承認されても、この製品の販売は、米国の政府医療計画(例えばMedicareおよびMedicaid)、商業健康保険会社および管理医療組織を含む第三者支払者にある程度依存し、製品に保険を提供し、十分な精算レベルを確立する。支払者が製品に保険を提供するか否かを決定するプロセスは、保険が承認された後に支払者が製品に支払う価格または販売率を設定するプロセスと分離することができる。第三者支払者は、徴収された価格に挑戦し、医療の必要性を審査し、医療製品およびサービスの費用対効果を審査し、コストを管理するために制御を実施することが増えている。
第三者支払者は、承認リスト上の特定の製品に保証範囲を制限することができ、特定の適応のすべての承認製品を含まない可能性があるレシピ表とも呼ばれる。
販売が承認される可能性のある任意の製品の保険·精算を確保するためには、企業は、製品の医療必要性および費用効果、およびFDAまたは他の同様の市場承認を得るために必要なコストを証明するために、高価な薬物経済学的研究を行う必要があるかもしれない。それにもかかわらず、候補製品は医学的に必要または費用効果があると考えられないかもしれない。第三者支払者が製品を保証しない決定は、製品が承認された後に市場受容度を低下させ、販売、運営結果、財務状況に重大な悪影響を及ぼす可能性がある。また、支払者が製品に保険を提供することを決定することは、十分な返済率を承認することを意味するものではない。また、1つの支払者が1つの製品に保険を提供する決意は、他の支払者も当該製品に保険·精算を提供することが保証されておらず、支払者によって保険や精算レベルが大きく異なる可能性がある。
国際市場では,精算や医療保険支払い制度は国によって大きく異なり,多くの国で特定製品や療法に価格上限が設定されている。いくつかの国では、処方薬の価格設定は政府によって統制されている。これらの国では、製品の発売許可を受けた後、政府当局との定価交渉にかなりの時間がかかる可能性がある。一部の国でカバー範囲と十分な精算或いは定価の承認を得るためには、著者らの製品のコスト効果を他の利用可能な治療法と比較する臨床試験を行う必要があるかもしれない。
医療費の抑制も連邦,州,外国政府の優先順位となっており,製品価格はこの努力の重点となってきた。各国政府はコスト制御計画の実施に大きな興味を示し、価格制御、カバー範囲の制限、精算と後発薬の代替要求を含む。価格制御及びコスト制御措置を講じ、既存の制御及び措置を有する司法管区においてより厳しい政策をとることにより、任意の承認された製品(我々又は我々の協力者が開発可能な製品を含む)の販売から生じる企業の収入をさらに制限することができる。保証政策と第三者精算料率は随時変化する可能性がある。1つの会社またはその協力者がマーケティング承認を得た1つまたは複数の製品が有利な保証·精算状態を獲得しても、将来的にはあまり有利ではない保証政策および精算料率を実施することが可能である。
もし私たちが将来アメリカで私たちが開発する可能性のある任意の候補製品を販売することを許可されたら、私たちは連邦医療計画(例えばMedicaid)の保険を得るために、政府医療計画に基づいて、または特定の政府および個人購入者に割引またはリベートを提供する必要があるかもしれない。このような計画に参加することは私たちが特定の薬品価格を追跡して報告する必要があるかもしれない。もし私たちがそのような価格を正確に報告しなければ、私たちは罰金と他の処罰を受けるかもしれない。
アメリカ以外では、私たちが開発可能な任意の候補製品に十分なカバー範囲と支払いを提供することを確保することは挑戦に直面するだろう。多くの国で、処方薬の価格設定は政府によって規制されている。政府当局との価格交渉は製品の監督マーケティング許可を受ける範囲をはるかに超えている可能性があり、そして私たちに臨床試験を要求して、私たちの任意の候補製品のコスト効果を比較することができるかもしれません
他の利用可能な治療法に発展するかもしれない。このような臨床試験を行うことはコストが高く、私たちの商業化努力の遅延を招く可能性がある。
医療改革
2010年3月、国会は“患者保護·平価医療法案”を公布し、“医療·教育負担能力調整法案”(PPACAと略す)によって改正され、その中には他にも、政府医療計画下の薬品のカバー範囲と支払い方法の改正が含まれている。PACAが公布されて以来、他の立法改正も提案され、採択された。2011年8月、“2011年予算制御法案”(Budget Control Act Of 2011)などの法案は国会のための支出削減措置を制定した。赤字削減合同特別委員会の任務は、2013年から2021年までの間に少なくとも1.2兆ドルの赤字削減を提案することであるが、同委員会は必要な目標を達成できず、立法をいくつかの政府プロジェクトに自動的に削減することを触発した。これらの変化は,各年度にプロバイダに支払われた連邦医療保険総額が2%と高く減少し,2013年4月に施行された。現在の立法によると、連邦医療保険支払いの実際の減少幅は4%に達する可能性がある。総合支出法案は2022年12月に総裁·バイデンが署名して法律となり、医療保険計画の自動減額にいくつかの改正がなされた。総合支出法案第1001条は、2010年の4%の法定現金支払法またはPAYGO自動減額を2024年末まで2年延期する。2021年の米国救援計画法案の公布により,医療保険計画を4%削減する計画が2023年1月に発効する。総合支出法案の医療補償タイトルには、2011年の連邦医療保険自動減額の2%予算制御法案を6ヶ月から2032年に延長し、2030年と2031年の支払い減免率を低下させる4163条が含まれている
2012年の“米国納税者救済法”は,いくつかの医療サービス提供者に支払う連邦医療保険を減少させ,政府が提供者に多額の金を取り戻す訴訟時効を3年から5年に延長した。これらの法律は、連邦医療保険および他の医療資金のさらなる減少をもたらし、他の方法で、規制によって承認される可能性のある任意の候補製品の価格、またはそのような任意の候補製品の処方または使用頻度に影響を与える可能性がある。
PACAが公布されて以来、この法律の条項を廃止し、代替するために、多くの法的挑戦や国会行動が続くだろう。例えば、税法は“個人強制令”を廃止した。この条項は、ほとんどのアメリカ人が最低レベルの医療保険を購入することを要求する条項が2019年に施行される。また、2018年12月14日、テキサス州北区の米国地域裁判所裁判官は、PPACAの個人権限部分はPACAの基本的かつ不可分な特徴であるため、この許可は税法の一部として廃止され、PPACAの残りの条項も無効であると判断した。米国最高裁は2020年11月10日にこの事件を審理し、原告がPPACAの合憲性に挑戦する資格がないことが分かったため、2021年6月17日にこの訴訟を却下した。PACAをめぐる訴訟と立法は継続される可能性があり、結果は予測不可能で不確実だ
トランプ政権はまた、PPACAの実施を破壊または延期するための行政行動をとっており、PPACAに基づいて権力および責任を有する連邦機関がPPACAの実施を放棄、延期、免除、または延期することを指示する任意の条項を含み、これらの条項は、各州、個人、医療保健提供者、医療保険会社または医薬品または医療機器製造業者に財政的または規制的負担をもたらす。しかし、2021年1月28日、バイデン総裁はこれらの命令を撤回し、連邦機関に米国人の医療保険取得を制限するルールや他の政策を再考するよう指示し、この獲得を保護·強化するための行動を検討するように指示した。この命令によると、連邦機関は、新冠肺炎に関連する合併症を含む以前の疾患を有する人の保護の政策を弱めること、連邦医療補助計画および“全米政治行動計画”に基づくデモおよび免除は、仕事要件を含むカバー範囲または破壊計画を減少させる可能性のある政策、健康保険市場または他の医療保険市場を破壊する政策、連邦医療補助計画および汎米政治行動計画への参加の難しさを増加させる政策、および扶養者に対する負担能力を含む保険または経済援助の負担能力を低下させる政策を含む、再検討を指示されるであろう。
薬品価格
アメリカでも処方薬の価格はずっと話題になっています。アメリカ議会は最近数回の調査を行い、州と連邦立法を提案し、公布し、薬品定価の透明性を高め、定価とメーカー患者計画との関係を審査し、連邦医療保険と医療補助下の薬品コストを下げることを目的とした。2020年にトランプ政権は処方箋コストを削減するためのいくつかの行政命令を発表した
このような注文の中の製品といくつかの条項は規制に含まれている。これらの規定には、価格最恵国モデルを実施し、連邦医療保険B部分のある医師が管理する薬品に対する支払いを他の経済先進国が支払う最低価格とリンクさせ、2021年1月1日から発効する臨時最終規則が含まれている。しかし、この規則は全国的な初期禁止によって制限され、2021年12月29日、CMSはそれを廃止するための最終規則を発表した。CMSは、この規則の発表に伴い、それは価値をMedicare B部分の薬品支払いのすべての選択に組み入れ、そして受益者が根拠に基づく看護を獲得する機会を改善することを探索する。
また、2020年10月、HHSとFDAは、各州と他の実体が第804条の輸入計画を制定し、ある処方薬をカナダから米国に輸入することを許可する最終規則を発表した。この規定は米国薬物研究やメーカー協会(PhRMA)の訴訟で挑戦されたが,裁判所でPhRMAがHHSを起訴する資格がないことが発見された後,2023年2月に連邦地域裁判所に却下された。いくつかの州はカナダからの麻薬の輸入を許可する法律を採択した。いくつかの州は第804条輸入計画提案を提出しており、FDAの承認を待っている。FDAは2024年1月にフロリダ州のカナダ薬物輸入計画を承認した。
また、2020年11月20日、HHSは薬品メーカーのD部分下でスポンサーの値下げを計画する安全港保護を廃止し、法律が値下げを要求しない限り、直接或いは薬局福祉マネージャーを通過する法規を決定した。最終規則は現在の医療保険薬品を廃止して避風港をリベートし、利益を得た販売所割引と薬局福祉マネージャーサービス料のために新しい避難港を創造する。2022年1月1日に発効する予定だったが、2022年のインフレ削減法案(IRA)の成立に伴い、国会は2032年1月1日に発効することを延期した。
最近、2022年8月16日に“アイルランド共和軍”が総裁·バイデンによって法律に署名された。新しい立法は連邦医療保険D部分に影響を与え、D部分は計画であり、連邦医療保険A部分または連邦医療保険B部分に加入する個人は毎月外来処方薬保険料を支払うことを選択することができる。他の事項を除いて、アイルランド共和軍はある薬品のメーカーに連邦医療保険との価格交渉(2026年から)を要求し、価格は交渉できるが上限があり、連邦医療保険B部分と連邦医療保険D部分に基づいてリベートを実施し、インフレを超える価格上昇を処罰し(2023年に初めて満了)、D部分のカバーギャップ割引計画の代わりに新しい割引計画を用いる(2025年から)。アイルランド共和軍は衛生·公衆サービス部長官が最初の数年に規制ではなく指導によってその多くの規定を実施することを許可した。
具体的には、価格交渉において、国会はMedicareが、競合する模倣薬または生体模倣薬を有さず、Medicare B部分およびD部分によって精算されるいくつかの高価な単一由来薬剤および生物製品のための低い価格を交渉することができる。CMSは、2026年からMedicare D部分によって支払われる10種類の高コスト薬剤の価格を交渉することができ、その後、2027年の15種類のD部分薬剤、2028年の15種類のB部分またはD部分薬剤、および2029年以降の20種類のB部分またはD部分薬剤の価格を交渉することができる。この規定は、少なくとも9年間承認された医薬品および許可13年の生物製品に適用されるが、単一のまれな疾患または疾患のための許可された医薬および生物製品には適用されない。また、この立法は、製薬業者が提供する価格が法律で規定された交渉で達成された“最高公平価格”以下でない場合、または値上げ幅がインフレを超える場合、製薬業者は民事罰金と潜在的な消費税を受けることになると規定している。この立法はまた、メーカーに連邦医療保険D部分の価格上昇幅がインフレを超えた薬品にリベートを支払うことを要求している。新法律では,2024年の連邦医療保険の自己払い薬品コスト上限は年間4000ドルと規定されており,その後2025年から年間2000ドルが上限となっている。
IRAには,残留孤児薬が連邦医療保険価格交渉の影響を受けないことが規定されているが,CMSは2023年7月に発表された最終指導では,この除外を単一のまれな疾患や疾患の承認適応(または複数の適応)を有する孤児薬にのみ適用されると解釈している。最終ガイドラインは,CMSが薬物排除を評価する際に有効な名称/承認のみを考慮するため,選定された薬物公表日までに撤回された名称/適応は考慮されないことを明らかにした。CMSはまた、ある薬物が孤児の薬物排除状態を失った場合、機関は最初の承認/許可日を使用して、製品が条件に適合する単一由来薬物であるかどうかを決定するが、価格交渉を行う必要があると明確に述べた。
2023年6月,メルク社はHHSとCMSを提訴し,アイルランド共和軍の医療保険に対する薬品価格交渉計画が憲法第5改正案違反の無償請求となったと主張した。その後、米国商会や製薬会社を含む他の一部の当事者も異なる裁判所に訴訟を提起し、HHSとCMSに対して類似した憲法クレームを提出した。Ireland共和軍のこのような条項と他の条項に関連した訴訟は継続され、結果は予測できず、不確実だ。
州レベルでは、各州はますます積極的に、価格または患者の精算制限、割引、ある製品への参入の制限、マーケティングコストの開示および透明性措置を含む薬品および生物製品の価格設定を制御するための法規を立法と実施し、場合によっては、他の国からの輸入と大量購入を奨励することを目的としている。例えば、いくつかの州は、健康担体、薬局福祉マネージャー、卸売流通業者を含む医薬品製造業者と薬品サプライチェーン中の他のエンティティに要求し、薬品定価に関する情報を開示する。さらに、地域医療機関および個別病院は、どの薬品およびどのサプライヤーが彼らの処方薬および他の医療計画に含まれるかを決定するために入札プログラムを使用するようになってきている。
EUの医薬製品の審査と承認
アメリカ国外で任意の製品をマーケティングするために、スポンサーはまた他の国と司法管轄区の品質、安全性と有効性に関する多くの異なる監督管理要求、及び臨床試験、マーケティング許可、商業販売と製品流通などの方面に対する監督管理要求を守らなければならない。FDAによる製品の承認を得るか否かにかかわらず、スポンサーは米国の監督管理機関のような必要な承認を得なければならず、その後、これらの国または司法管轄区でこの製品の臨床試験やマーケティングを開始することができる。承認過程は最終的に国と司法管轄区によって異なり、追加の製品テストと追加の行政審査期限に関連する可能性がある。他の国や管轄地域で承認を得るのに要する時間は、FDAの承認を得るのに要する時間とは異なり、さらに長くなる可能性がある。1つの国または管轄区域で規制承認を得ることは、他の国または管轄区域で規制承認を得ることを保証することはできないが、1つの国または管轄区域で規制承認を得ることができなかったか、または遅延して監督管理許可を得ることは、他の国または司法管轄区の規制手続きに悪影響を及ぼす可能性がある。EUの医薬製品に対する承認の流れはアメリカとほぼ同じだ。製品の安全性と有効性の各提案の適応を決定するために、臨床前研究と十分かつ良好に制御された臨床試験を満足できるように完成させる必要がある。また、関係主管当局にマーケティング許可申請を提出し、これらの主管部門からマーケティング許可を付与し、その後、その製品を欧州連合で販売·販売することを要求している。
臨床試験許可
2022年1月31日、新しい臨床試験条例(EU)第536/2014号、または臨床試験条例は、EUで発効し、以前の臨床試験指令2001/20/EC、または臨床試験指令の代わりになった。“臨床試験規則”はEUの臨床試験の許可、進行と透明性を簡略化と簡素化することを目的としている。新しい臨床試験承認調整手続きによると、1つ以上のEU加盟国またはEU加盟国で行われる臨床試験の発起人は、承認申請を提出するだけでよい。提出された材料は臨床試験情報システムを通じて提出され、これは欧州薬品管理局(EMA)が監督する新しい臨床試験ポータルサイトであり、臨床試験スポンサー、EU加盟国の主管部門と公衆に使用することができる。
EUが先の臨床試験指令(CTD)によって承認されたすべての行われている臨床試験は2025年1月31日までに臨床試験情報システムに移行しなければならない。この日付は3年間の過渡期の終了を示しており、過渡期は2022年1月31日の臨床試験条例からEUに適用され始めた。2025年1月31日までに、“臨床試験指令”によって開始され、“臨床試験条例”に移行する臨床試験は、これらの義務が先行研究案に含まれていなくても、例えば(I)臨床試験情報システムによって通知される義務、(Ii)安全報告規則、(Iii)アーカイブ要件、および(Iv)透明性要件を遵守しなければならない。2025年1月31日までに行われている臨床試験を“臨床試験条例”に移行できなかった場合、臨床試験の認可の撤回や臨床試験の一時停止、EU加盟国の国の法律による刑事制裁や罰金など、臨床試験条例第77条に基づく是正措置がとられる可能性がある。
手続きの簡略化に加えて,“臨床試験規約”には,申請のための準備と提出のための単一文書と,簡略化された臨床試験スポンサー報告プログラムと,臨床試験申請を評価するための統一プログラムがあり,このプログラムは2つに分けられる。第1部は、臨床試験許可申請が提出されたすべてのEU加盟国(EU加盟国に関する)の主管当局によって評価される。二番目の部分は関連されたすべての連合会員国によって個別的に評価される。臨床試験申請の評価には厳しい期限が設定されている。評価手続きにおける道徳管理委員会の役割は、EU加盟国に関する国家法律によって引き続き管轄されるだろう。しかし、全体的に関連するスケジュールは臨床試験条例によって定義されるだろう。
臨床試験条例は、スポンサーが事前に臨床試験を行うEU加盟国の主管国当局の承認を得なければならないという以前の要求を変更していない。もし臨床試験が異なるEU加盟国で行われた場合、これらのEU加盟国の主管当局は臨床試験の承認を提供しなければならない。また,スポンサーは適用された倫理委員会が賛成の意見を発表した後のみ,特定の研究地点で臨床試験を開始することができる。
米国と同様に,ある臨床試験を行う締約国はEU臨床試験登録簿にEUの臨床試験情報を公表しなければならない。
EUのトップクラスの呼称
2016年3月,EMAは適応候補の開発を促進するイニシアティブを開始したが,これらの適応はまれであり,現在のところ治療法はほとんどない。優先薬物計画、又はPrimeは、満たされていない医療需要分野の薬物開発を奨励し、中央プログラムの下で審査された重大な革新を代表する製品に対して加速評価を提供することを目的としている。中小企業の製品は大企業よりも早くPrime計画に参加する資格があるかもしれません。Primeの称号を持つ候補製品のスポンサーは多くのメリットを得ることができ、しかし限らず、早期にEMAと積極的な監督対話を行い、臨床試験設計とその他の開発計画要素を頻繁に討論し、及びファイルを提出した後にマーケティング許可申請の評価を加速する。重要なのは、EMA委員会レベルでの製品のより多くの理解を促進するために、ヒト医薬製品委員会(CHMP)または高度治療委員会の専門機関連絡先および調査委員がPrime計画の早期に任命されていることである。会議を開始してこれらの関係を開始し、EMAを含む1つの多学科専門家チームは、全体発展と監督戦略に関する指導を提供する。
マーケティング許可
EU規制制度下の製品マーケティング許可を得るためには、スポンサーは、欧州市場管理局が管理する中央プログラムまたはEU加盟国主管当局が管理するプログラムのうちの1つ(分散プログラム、国家プログラムまたは相互認識プログラム)に基づいてMAAを提出しなければならない。マーケティング許可は連合に設立されたスポンサーだけに付与されることができる。(EC)第1901/2006号条例は、EUのマーケティング許可を得る前に、スポンサーは、(1)特定の製品免除、(2)カテゴリ免除、または(3)PIPに含まれる1つまたは複数の措置を延期しない限り、EMAによって承認された小児科人口のすべてのサブクラスをカバーする小児科調査計画(PIP)に含まれるすべての措置を証明しなければならないと規定している。
集中手続きは、欧州委員会によって、欧州経済区全体(すなわち、欧州連合およびアイスランド、リヒテンシュタイン、ノルウェー)または欧州経済区において有効な単一マーケティング許可を付与することを規定する。(EC)第726/2004号条例によると、特定の製品、いくつかのバイオテクノロジーで生産された薬品、孤児薬品に指定された製品、高級治療薬、および特定の疾患を治療するための新しい活性物質を含む製品については、集中手順を実行しなければならない。他の疾患の治療のための新しい活性物質を含む製品、および高度な革新性または集中処理を有する患者の利益に有利な製品については、集中処理がオプションである可能性がある。他の場合には、発信者の要求に応じて、集中プログラムを使用することもできる。
中央手続きの下で、CHMPは、製品の予備評価を担当し、既存のマーケティング許可の修正または拡張を評価するなど、いくつかの許可後および保守活動を担当する。欧州連合の中央プログラムによると、1つの重大な影響評価を評価する最長期限は210日であるが、タイマポーズ時間は含まれていないが、提案国が補足資料或いは書面或いは口頭解釈を提供して、気候変動管理計画の問題に答える必要がある。特殊な場合、公衆衛生の観点、特に治療革新の観点から見ると、1種の医薬製品が重大な利益を持っている場合、CHMPは加速的な評価を与える可能性がある。CHMPがこの要求を受け入れた場合、210日の制限時間は150日に減少するが、CHMPが加速評価にもはや適していないと考える場合、中央プログラムの標準時限に回復することができる。この期限終了時に,CHMPは医薬製品に関する販売許可を承認すべきかどうかについて科学的な意見を提供する。CHMPの最終意見を受け取ってから15日以内に、欧州委員会は上場許可申請に関する決定草案を準備しなければならない。その決定草案はこの意見と欧州連合の法律の任意の関連規定を考慮しなければならない。医薬製品の集中認可申請について最終決定を下す前に、欧州委員会は必ず
人が薬品を使うか、または常務委員会。常設委員会はEU加盟国代表で構成され、投票権のない欧州委員会代表が議長を務める。欧州議会にも関連した“権利”がある。欧州議会の役割は、欧州委員会がマーケティング許可の承認または拒否を決定する上で越権していないことを保障することだ。
欧州委員会はいわゆる“特別な場合のマーケティング許可”を承認するかもしれない。このようなライセンスは,スポンサーが正常な使用条件下で治療効果や安全性に関する包括的なデータを提供できないことを証明できる製品に適用され,製品に関する適応が非常にまれであるため,スポンサーが全面的な証拠を提供することを合理的に期待することができない,あるいは現在の科学的知識状態では全面的な情報を提供できない,あるいはそのような情報を収集することは公認された医学道徳原則に反する。したがって、特別な場合には、いくつかの特定の義務の制約の下でマーケティング許可を承認することができ、これらの義務は、以下を含むことができる
•スポンサーは、主管当局が規定した時間内に決定された研究計画を完成させなければならず、その結果、収益/リスクプロファイルの再評価の基礎を構成しなければならない
•薬品は医療処方に基づいてしか供給できず、場合によっては厳格な医療監督の下でしか使用できず、病院では可能性があり、放射性薬物であれば許可者が使用する
•包装チラシと任意の医療情報は医者に注意しなければならず、関連する薬品の現有の詳細はある具体的な面ではまだ不十分である。
特別な場合、上場許可は年度見直し手続きでリスクと収益のバランスを再評価するために年間審査を受けなければならない。ライセンスの継続は年間再評価と関連があり、否定的な評価はマーケティング許可が一時停止または撤回される可能性がある。しかし、特殊な場合、医薬製品の発売許可の継続は“正常”販売許可と同じ規則に従う。したがって、特別な場合のマーケティング許可は最初は5年であり、その後のライセンスは、EMAがセキュリティ理由を決定しなければ、さらに5年間延長する価値がある限り、無期限に発効する。
欧州委員会はまた、包括的なマーケティング許可を申請するために必要な包括的な臨床データを得る前に、いわゆる“条件付きマーケティング許可”を承認することができる。(I)候補製品のリスク-収益バランスが正である場合、(Ii)スポンサーが必要な全面的な臨床試験データを提供することができる可能性が高い場合、(Iii)この製品は、満たされていない医療需要を満たしており、(Iv)関連医薬製品の即時発売による公衆健康への利益が、依然として追加データが必要であるという事実に固有のリスクを超えている場合、このような条件付きマーケティング許可を候補製品(孤児薬品として指定された薬品を含む)に付与することができる。条件付き販売許可には,現在行われているあるいは新たな研究の完了や薬物警戒データの収集義務など,販売許可保持者が履行しなければならない具体的な義務が含まれていることができる。条件付きマーケティング許可の有効期間は1年であり、リスク−収益バランスが正のままであり、追加または修正された条件および/または特定の義務の必要性が評価された後、毎年更新することができる。上記の集中プログラムのスケジュールは、条件付きマーケティング許可申請の審査にもCHMPに適用される。
欧州連合薬品規則は、EU加盟国が国家立法によって、胚性幹細胞のような特定のタイプのヒトまたは動物細胞を含む任意の医療製品の販売、供給または使用を禁止または制限することを明確に可能にする。我々が開発している製品は胚性幹細胞を使用していないが、いくつかのEU加盟国の法律は、EUのマーケティング許可を得ていても、製品を商業化することを禁止または制限する可能性がある。
集中認証プログラムとは異なり、分散マーケティング許可プログラムは、製品販売が存在する各EU加盟国の主管当局に個別に申請し、それによって単独で承認する必要がある。この申請は,中央プログラムを介して環境管理機関に提出して許可する申請と同様である。EUは加盟国が有効な申請を受けてから120日以内に評価草案と関連材料の草稿を作成することを参考にする。これにより生成された評価報告書は関係EU加盟国に提出され、これらの加盟国は評価報告を受けてから90日以内に評価報告書を承認するかどうかを決定し、評価報告書を承認するかどうかを決定しなければならない
関連する材料。もしEU加盟国が公衆健康の潜在的な深刻なリスクに対する懸念から評価報告書や関連材料を承認できない場合、論争内容はすべてのEU加盟国に対して拘束力を持つことを決定する欧州委員会に提出することができる。
相互承認手続きの基礎は、同じくEU加盟国の主管当局がEUの他の加盟国の主管当局によるある医薬製品の販売許可を受け入れることである。国家マーケティング許可の所有者は、EU加盟国の主管当局に申請を提出することができ、その主管部門に、他のEU加盟国の主管当局が提供するマーケティング許可を認めるように要求することができる。
米国と同様に,上場申請を支援する臨床試験情報は,特定の時間枠内でEU(EudraCT)サイト:https://eudract.ema.Europa.eu/および他の国/地域に提出されなければならない。
EUの規制データ保護
EUでは、2001/83/EC指令に基づいて、完全な独立パケットによって承認された革新医薬製品は8年間のデータ独占権と他の2年間の市場独占権を獲得する資格がある。(EC)726/2004条例は、集中認可手順に従って許可された医薬品に対してこの権利を繰り返している。データ排他性防止これらの革新製品を認可した後発薬の発起人は、8年以内にイノベーターのデータを参照して模倣薬(削除)申請を評価する。追加の2年間の市場排他期間内に、後発薬の発売許可申請を提出し、許可することができ、革新者のデータを参考にすることができるが、市場排他性が満期になるまで、いかなる後発薬もEU市場に入ることができない。この10年の最初の8年間に、マーケティング許可保持者が1つまたは複数の新しい治療適応の許可を得た場合、10年全体の期間は最大11年に延長され、許可前の科学的評価では、これらの適応は既存の療法と比較して有意な臨床的利益をもたらすことができると考えられる。ある化合物が新しい化学物質であると考えられても、革新者が所定のデータ独占期間を得るために、別の会社は、薬物試験、臨床試験、および臨床試験の完全な独立したデータパケットを有するMAAベースのマーケティング許可を取得したことを前提として、別の製品の別のバージョンを販売することができる。
授権期間と継続期間
上場授権書の初期有効期限は原則として5年である。欧州市場管理局またはEU加盟国の主管当局によるリスク-収益バランスの再評価によると、マーケティング許可は5年後に更新することができる。このため、マーケティング許可所有者は、マーケティング許可が無効になる少なくとも6ヶ月前に、マーケティング許可が付与されてから導入されたすべての変化を含む、品質、セキュリティ、および有効性に関するファイルの統合バージョンをEMAまたは主管当局に提供しなければならない。欧州委員会やEU加盟国の主管当局は、薬物警戒に関する正当な理由に基づいて、5年間の上場許可期間を継続することを決定することができる。その後最終的に更新されると、上場許可の有効期限は無期限となる。いかなる認可の後も、認可が失効してから3年以内に医薬製品が実際にEU市場(集中手続きであれば)または許可されたEU加盟国の市場に投入されていない場合は無効である。
営業許可後の規制要件
承認を得た後、上場許可の保有者は医薬製品の製造、マーケティング、普及と販売に適用される一連の要求を守らなければならない。これらの措置には,欧州連合の厳格な薬物警戒や安全報告規則の遵守が含まれており,これらの規則により,認可後の研究や追加的なモニタリング義務を実施することができる。また、許可製品の製造は、欧州薬品管理局のGMP要求とEUの他の規制機関の類似した要求を厳格に遵守しなければならず、これらの要求は、薬品の製造、加工、包装に使用される方法、施設、制御措置を規定し、その安全性と身分を確保する。最後に、EUは改訂された2001/83 EC号指令に基づいて、許可製品のマーケティングと普及、業界賛助の継続医学教育と薬品処方者及び/或いは公衆向けの広告を含み、厳格な管理を行った。
製品の定価決定を承認する
連合では、様々な国の価格設定と補償プログラムの差が大きい。一部の国では、補償価格を合意した後にのみ、製品を販売することができると規定されている。いくつかの国は、特定の候補製品のコスト効果を現在利用可能な治療法またはいわゆる衛生技術評価と比較して、精算または価格設定の承認を得るために、追加の研究を達成することを要求するかもしれない。例えば、EU加盟国は、その国の健康保険制度が精算を提供する製品範囲を制限し、人が使用する医療製品の価格を制御することを選択することができる。EU加盟国は製品の具体的な価格を承認することができ、その製品を市場に投入する会社の収益力を直接または間接的に制御する制度をとることもできる。他のEU加盟国は会社が自分の製品価格を固定することを許可したが、処方量を監視と制御し、医師に指導を発表して処方を制限した。最近,欧州連合の多くの国で医薬品割引が増加し,各国が保健支出の管理を試みているに伴い,特に欧州連合の多くの国が深刻な財政危機や債務危機を経験した場合,これらの努力が継続される可能性がある。全体的には,医療コスト,特に処方薬の下り圧力が大きくなっている。そのため、新製品の参入にはますます高い壁が設けられている。政治、経済、規制の発展は定価交渉をさらに複雑化させる可能性があり、補償を受けた後、定価交渉は継続される可能性がある。EUの各加盟国が使用する参考定価と平行貿易、すなわち低価格と高価なEU加盟国間の裁定は、価格をさらに下げることができる。薬品に対して価格規制や精算制限を実施することが保証されていない国は、これらの国で承認されれば、任意の製品に対して有利な精算と定価手配を許可する。
一般資料保障規程
アメリカ以外の多くの国では個人情報のプライバシーと安全を管理する厳しい法律があります。一般的なデータ保護条例は範囲が広く、健康および他の敏感なデータを処理する会社に対してより高い要求を提出することを含む個人データを処理する会社に多くの要求を提出しており、例えば、多くの場合、そのようなデータを処理する前に敏感な個人データに関連する個人の同意を得なければならないことが要求される。GDPRがGDPRの範囲内に属する個人データを処理する会社に課す義務は、個人にデータ処理活動に関する情報を提供すること、個人データのセキュリティおよび機密性を保護するための保障措置を実施すること、データ保護幹事を任命すること、データ違反イベントについて通知を提供すること、および第三者プロセッサを採用する際に何らかの措置をとることである。
GDPRはまた、米国を含む欧州経済圏以外の国への個人データの移転に厳しいルールを実施し、データ保護当局が2000万ユーロや世界の年収の4%に達する可能性のある罰金を含む、GDPR違反行為に巨額の罰金を科すことを許可している。GDPRはまた、データ主体と消費者協会に個人訴訟権利を与え、監督当局に苦情を提出し、司法救済を求め、GDPR違反による損害について賠償を受けることができる。GDPRを守ることは厳格で時間のかかる過程であり,ビジネスコストを増加させたり,会社にそのビジネスやり方を変更して完全な遵守を確保したりする可能性がある.2020年7月、欧州連合裁判所(Court of the European Union、略称CJEU)は、個人データを欧州経済地域から米国に移転するための合法化メカニズムの一つである欧州連合-米国プライバシー遮蔽枠組みの無効を宣言した。CJEUの決定は、個人データを欧州経済圏から米国に移転する標準契約条項である別のデータ伝送手段の長期的な可能性も疑問視される。
また、2022年10月、総裁·バイデンはEU-米国プライバシーの盾に代わるEU-米国データプライバシーの枠組みを実施する行政命令に署名した。欧州委員会は2023年7月に充足性決定を採択した。十分な決定は、EU-米国データプライバシーフレームワークを自ら認証する米国社が、EUから米国にデータを送信するための有効なデータ転送機構とすることを可能にする。しかし、いくつかのプライバシー提唱団体は、EU-米国のデータプライバシーの枠組みに挑戦すると表明している。これらの挑戦が成功すれば、EU-米国のデータプライバシーの枠組みに影響を与えるだけでなく、標準契約条項や他のデータ伝送機構の生存能力もさらに制限される可能性がある。
イギリスの離脱とイギリスの規制枠組み
イギリスは2020年1月31日にEUから離脱した。EUと英国は、2021年1月1日に臨時発効し、2021年5月1日に発効する貿易·協力協定における新たなパートナーシップについて合意した。この協定は主に自由貿易に注目し,医療製品を含む商品貿易に関税や割当を徴収しないことを確保している。その後EUと連合王国は2つを構成します
異なる市場は二つの異なる規制と法的制度によって管理されている。そのため、この協定は貨物貿易障壁を最大限に減らすことを図るとともに、連合王国が単一市場の一部ではないため、国境検査は避けられないことを認めている。2021年1月1日から、薬品と保健品規制機関(MHRA)はイギリスの薬品と医療機器の監督を担当し始め、国内法によると、イギリスはイングランド、スコットランド、ウェールズを含み、北アイルランドは北アイルランド議定書によってEU規則の制約を受け続けている。
2023年2月27日、イギリス政府と欧州委員会は、北アイルランド議定書、すなわち“ウィンザー枠組み”と呼ばれる新たな手配の代わりに、原則的な政治的合意を発表した。この新しい枠組みは“北アイルランド議定書”下の現行制度を根本的に変え、特に連合王国の医薬製品の監督管理において、MHRAはイギリス市場(すなわち大ブリテンと北アイルランド連合王国)に輸送されたすべての医薬製品を承認することを担当し、EMAは北アイルランドへの医薬製品の承認にいかなる役割を果たすことはなくなった。MHRAは、イギリスで販売されているすべての医薬製品のイギリス範囲での単一マーケティング許可を付与し、単一パッケージの下でイギリス全体で販売できるようにする。ウィンザー枠組みは2023年3月24日にEU-イギリス連合委員会の承認を得たため、イギリス政府とEUは立法措置を制定し、法律にする。2023年6月9日,MHRAはウィンザーフレームワークの薬品について2025年1月1日から適用すると発表した。“2012年人類薬品条例”(SI 2012/1916)(改正された)、あるいはHMRと呼ばれ、連合王国が薬品を管理する主要な法律文書である。HMRはすでに連合王国がEUを離脱する前から存在していた医薬製品を管理するEU法律文書主体を国内法に組み入れた。
二次立法によって連合王国法律に転換された欧州連合法律は引き続き“保留EU法”として適用されている。しかし、臨床試験条例のような新しい立法はイギリスに適用されないだろう。イギリスの薬品監督管理の枠組みの中で薬品の品質、安全性と有効性、臨床試験、マーケティング許可、商業販売と流通をカバーする大部分はEU指令と法規に由来するため、イギリスの離脱はイギリスの候補製品の開発、製造、輸入、承認と商業化における私たちの規制制度に実質的な影響を与える可能性がある。例えば、イギリスはEMAからEU範囲のマーケティング許可を得る集中的な手続きによって保護されなくなり、イギリスで販売される私たちの候補製品は単独のマーケティング許可を必要とする。新しい国際認可フレームワークは2024年1月1日から実施され、この枠組みに基づいて、MHRAはイギリスで新しいマーケティング許可を申請することを決定する際に、EMAおよびいくつかの他の規制機関のマーケティング許可の承認決定を考慮する。
連合王国のEU離脱に関する他の問題と同様に,個人データがイギリスでどのように保護されるか,個人情報がEUから連合王国に移行できるかどうかについては,未解決の問題がある。連合王国のEU離脱後,2018年にイギリスデータ保護法は連合王国で行われた個人データ処理に適用され,GDPRが規定している義務と平行した義務が含まれている。英国が“施行”しGDPRを補完する“2018年データ保護法”は2018年5月23日に王立で承認され、現在イギリスで施行されているが、GDPRによってデータを欧州経済地域からイギリスに移しても合法であるかどうかは不明である。イギリス政府は、すべてのEUと欧州経済圏加盟国がデータ保護において十分であり、連合王国からEU/欧州経済区に流れるデータが影響を受けないことを確保することを決定した。また、欧州委員会の最近の決定は、連合王国が欧州連合から連合王国にデータを移すのに“ほぼ十分”と考えているようだが、この決定は今後再評価される可能性がある。
人力資本
2024年2月5日現在、私たちは867人の常勤従業員を持っており、うち博士号を持つ従業員の総数は378人。これらの常勤従業員のうち、612人の従業員がアメリカに位置し、そのうち255人の従業員が私たちのアメリカ以外の事務所に位置している。また,2024年2月5日現在,常勤社員の33.3%が女性,0.3%の自己承認が非二元,0.9%が性別を開示しないことを選択し,42.1%の幹部チームが女性と自己認識している。また、2023年1月1日以降、37.3%の新入社員が女性、0%が非二重身分であり、1.9%が自分の性別を開示しないことを選択した。2024年2月5日現在、米国の全従業員の60.3%が白人、26.1%がアジア系、4.4%が2つ以上の人種、3.3%が黒人またはアフリカ系アメリカ人、2.6%がスペイン系またはラテン系、0.2%と自認している
アメリカインディアンやアラスカ先住民だと思っている人は、0.2%の人がハワイ先住民や他の太平洋島民を自称し、2.9%の人が自分の人種や族を明かさないことを選択した。私たちの従業員は私たちの最大の資産であり、私たちは包容的で挑戦的で見返りのある労働環境を作るために努力している。
我々は、我々のサービスに長期的、正式な環境、社会、およびガバナンス戦略、すなわちESGを組み込むことに取り組んでおり、この約束を企業の持続可能な発展と呼ぶ。2022年には、当社や利害関係者にとって最も重要なESG関連テーマを決定した“二重重要性評価”を完成させました。評価は、内部および外部利益関係者およびグローバル報告イニシアティブ、持続可能な会計基準理事会、国連持続可能な開発目標などの重要なESG基準とフレームワークによって情報を提供する。この評価は、私たちが2023年4月に発表した初の企業持続可能な開発報告の基礎であり、引き続き私たちの全面的でデータ駆動的な企業の持続可能な発展戦略の基礎となる。
わが社や利害関係者にとって最も重要と決定されたESG関連テーマのうち,多様性,公平,包容,あるいはDEIと呼ばれ,我々が長年取り組んできた分野である.私たちのDei理念は、私たちの従業員が安全を感じ、聞かれ、快適さを感じ、重要視されていることを確保することに集中している。私たちは引き続き採用の重点を私たちの候補ルートを多様化し、特定の会議に参加し、科学技術業界の人種と性別多様性、例えば、女性と非二次元エンジニアのためのハッカーマラソン、女性と非二元博士生のための活動を促進するために、私たち自身の活動を開催し続けている。また、標準化された面接モデルを利用して無意識の偏見を減らし、空きポストに一致した求人の流れを確立しています。
私たちのDei理事会は上級指導者、従業員資源グループあるいはERG、代表と情熱的な従業員から構成され、彼らは毎月会議を開いて、私たちのDei戦略、優先事項と目標について提案を提供します。経済·社会部理事会はまた、経済·社会部の案作成作業を改善するために、定期的に従業員のフィードバック意見を求め、本組織の各レベルで声を聞くことができる常設フォーラムを提供する。我々は現在、包括性を促進し、教育や意識の機会を創出し、持続的な業務目標に貢献するために、従業員に安全かつ公平な空間を提供する6つのERGを有している。私たちのERGはSchrödinger、Schrödinger連合協会、Schrödinger有色人種、Schrödinger性別平等、Schrödinger国際コミュニティと健康心連盟の保護者と両親を含み、資源共有を支持し、同時に特定のERGとその盟友の利益を会社に代表して伝達する。私たち6人のERGのメンバーは私たちの従業員の約3分の1を直接占めていますが、これらのフォーラムは私たちのすべての従業員にコミュニティ支援、専門発展、教育機会の環境を提供しています。私たちのERGは様々な候補者の募集や業界会議にも参加し、わが社以外の場所に触角を伸ばしています。また,我々のDei抱負を推進するために,包括性,偏見,職場で成長心理をどのように利用するかを議論するために,我々の従業員にキーツールや言語をより良く整備するための学習計画を神経リーダーシップ研究所と協力して行った。
人材競争が激しい業界で、私たちは高い滞在率と低流出率を維持することができてきた。2023年12月31日までの年間、私たちの従業員保持率は93.1%だった。
私たちの財力を考慮して、私たちは物理に基づく計算薬物発見と材料科学研究分野の業界のリードであり、私たちが開発している特許薬物発見計画は、私たちが引き続き穴を埋め、私たちのソフトウェア、薬物発見、材料科学業務を支持することができると信じている。
私たちは従業員たちに市場と業界規範に合った予想された報酬を提供するために努力している。私たちは、全面的な業界調査とデータを使用して、私たちの報酬計画を密接に監視するように指導し、競争力のある給料とボーナス、雇用主マッチング支払いを有する401(K)退職計画、私たちの株式計画、医療と福祉に参加することを含む競争力があると考えられるインセンティブの組み合わせを提供します。例えば、アメリカの従業員に様々な心理的健康、家庭ケア、生殖健康福祉を提供することができます。私たちは定期的に私たちの給与実践を検討し、すべての従業員の給与決定に対する私たちの公平性を分析します。私たちのヨーロッパと日本の一部の従業員はあるタイプの集団交渉協定によって保護されている。私たちは私たちが従業員と仲がいいと思う。
我々は対面連携や関係構築の価値を認識するとともに,職場以外での従業員のニーズや優先順位にも注目している.私たちは長い間混合勤務スケジュールを支持してきて、私たちの従業員は週3日間遠隔勤務を選択することができる。これは私たちの職員たちが彼らの個人的な要求に最も適した勤務スケジュールを作ることができるようにする。
私たちの会社文化は従業員たちの間と私たちの生活と仕事の地域社会での参加を奨励する。内部では、評価された指導者がハードスキルやソフトスキルを学習する機会を計画している。著者らはまた各種のコミュニケーションルートを持ち、従業員が関係と連絡を保つことができ、そして年間業績評価の流れがあり、従業員とマネージャーの間の定期的な連絡とリアルタイムフィードバックを強調した。私たちの地元のコミュニティでは,学生や教育従事者への教育展開を通じて社会に還元し,STEMに対する認識,興味,識字能力を向上させることに取り組んでいる。私たちのコミュニティ参加努力をさらに推進するために、年間有償ボランティアの日福祉とセットプレゼント計画を提供し、2023年に新しい社会影響プラットフォームを発売し、従業員に様々な現地通貨や言語の現地ボランティアの機会を提供した。
私たちの会社情報は
私たちの主な実行事務所はニューヨークブロードウェイ154号24階にあります。郵便番号:New York 10036、電話番号は(212295800)。私たちのサイトの住所はwww.schrodinger.comです。本年度報告または我々が米国証券取引委員会または米国証券取引委員会に提出する任意の他の報告または文書に含まれる、または本ウェブサイトを介してアクセス可能な情報は、本年度報告または任意の他の報告または文書に参照的に組み込まれることはなく、本ウェブサイトのアドレスに対する任意の言及は、非アクティブなテキスト参照のためにのみ使用される。
当社の会社名、ロゴ、サイト名を含む、当社の業務運営に関連する商標、サービスマーク、商品名を所有または使用する権利があります。本年度報告に登場する他の商標,サービスマーク,商号は,それぞれの所有者の財産である。便宜上、本年度報告で言及されたいくつかの商標、サービスマーク、および商号は、未使用および記号である。
利用可能な情報
我々は、当社のウェブサイトを通じて、Form 10-K年間報告、Form 10-Q四半期報告、Form 8-K現在の報告、および改正された1934年証券取引法第13(A)および15(D)節または取引法に基づいて提出または提出されたこれらの報告書の修正案を無料で提供します。私たちがアメリカ証券取引委員会に電子的に提出したり、このような報告書を提出したりした後、私たちは合理的で実行可能な範囲でできるだけ早く私たちのウェブサイトを通じてこれらの報告を提供します。私たちも執行者、取締役、および10%株主が私たちに書類のコピーを提供した後、合理的で実行可能な範囲内でできるだけ早く合理的で実行可能な範囲内で、私たちの行政者、取締役および10%株主が取引所法案第16条に基づいてアメリカ証券取引委員会に提出した報告を無料で提供します。
私たちはまた、一般に広く、非排他的に情報を配信することを可能にするために、様々な開示チャネルを介して、私たちのソフトウェア、薬物発見計画、コンピューティングプラットフォーム、および他の項目に関する情報を公衆に開示することができる。このような開示チャネルを通じて発表されたいくつかの情報は重要な情報とみなされるかもしれない。投資家たちと他の人たちが私たちが以下の位置で発表した情報を確認することを奨励する。このリストは時々更新される可能性があります。
•私たちのソフトウェア、薬物発見計画、計算プラットフォームに関する情報は、www.schrodinger.comにアクセスしてください。
•投資界への提供に関する情報は、プレスリリース、イベント、プレゼンテーション、およびアメリカ証券取引委員会に提出されたファイルを含めて、ir.schrodinger.comにアクセスしてください。
•もっと知りたいのは、LinkedInやInstagramで私たちに注目したり、私たちのブログExtrapolations.comにアクセスしたりしてください。
これらのウェブサイトとソーシャルメディアルートとその内容は引用を通じて本年報に組み込まれておらず、すでにアメリカ証券取引委員会に記録されているともみなされていない。
第1 A項。リスク要因です
以下に説明するリスクおよび不確実性、ならびに本年度報告書および米国証券取引委員会に提出された他の公開文書に含まれるすべての他の情報を慎重に考慮しなければなりません。以下に説明するリスクはわが社が直面している唯一のリスクではない。以下のいずれかのリスクが発生したり、私たちが現在未知であるか、または私たちが現在どうでもいいと考えている他のリスクと不確定要素が発生したり、私たちの業務、将来性、経営業績、財務状況が重大な影響を受ける可能性があります。
私たちの財務状況と追加資本需要に関連するリスク
私たちは重大な運営赤字の歴史があり、私たちは今後数年も赤字になると予想している。
私たちは重大な運営損失の歴史を持っている。2023年12月31日までの年間の純収入は4,070万ドルです。2022年12月31日と2021年12月31日までの年度の純損失はそれぞれ1.492億ドルと1.012億ドルだった。2023年12月31日現在、私たちの累計赤字は3億384億ドルです。2023年12月31日までの年間純収入は、主にNimbus Treeutics、LLCまたはNimbusから得られた1億472億ドルの現金分配、その後、武田製薬株式会社または武田がNimbusの完全子会社Nimbus Lakshmi,Inc.およびそのTYK 2阻害剤NDI-034858を買収し、Structure Treateutics Inc.またはStructure Treeuticsに投資した非現金収益に基づいて、Structure Treateuticsに基づいて2023年2月に初公開株を公開した後、米国株式の2023年12月31日までの終値に決定した。しかしながら、このような分配または収益のイベントの内在的不確実性を引き起こす可能性があるため、薬物発見協力者における持分の将来の分配の可能性または公平な価値の収益を予測することは困難である。そのため、株式投資収益と公正価値損益は今後の期間に大幅に変動すると予想される。
私たちは予測可能な未来に、私たちが私たちの特許薬物発見計画、販売とマーケティングインフラ、そして私たちの計算プラットフォームに投資し続けるにつれて、私たちの運営費用は大幅に増加すると予想している。私たちはまだ自分の薬物発見計画を開発する初期段階にある。私たちは商業販売に使用できるかもしれない薬品が許可されていないので、今まで、私たちはまだ自分たちの薬品販売から何の収入も発生していません。私たちは今後数年間巨額の費用と運営損失が発生すると予想している。私たちの運営費用と純収益または損失は四半期ごとに毎年大きく変動する可能性があります。今後の業績の指標として、いかなる四半期や年度の業績にも依存してはいけません。私たちの費用は大幅に増加すると予想されています
•私たちのコンピューティングプラットフォームやソフトウェアソリューションへの投資と開発を続けています
•私たちの特許薬物発見プロジェクトの研究と開発を続けています
•臨床前研究を展開し、著者らの任意の候補製品の起動と臨床試験を行った
•私たちの候補品のために準備して規制意見書を提出します
•私たちの知的財産権を維持し、拡大し、実行し、保護し、
•私たちのソフトウェア業務および他のビジネス運営を支援するために、より多くのソフトウェアエンジニア、プログラマ、販売およびマーケティング担当者、および他の人員を招聘する
•臨床、品質管理、監督管理、化学、製造と制御、その他の科学者を増任する
•上場企業としての私たちの運営を支援するために、運営、財務、管理情報システムや人員を増やします。
もし私たちのソフトウェアの売上を増やすことができなければ、私たちの薬物発見協力から収入を増やすことができない、あるいは私たちと現在と未来の協力者が薬物製品の開発と商業化に成功できなければ、私たちの収入は私たちが利益を達成したり維持したりするのに十分ではないかもしれない。
利益を達成し、維持するためには、私たちのソフトウェア売上を大幅に増加させることに成功し、私たちの薬物発見協力による収入を増加させなければならない。そうでなければ、私たちと私たちの現在または未来の協力者は、大量の収入をもたらす1つまたは複数の医薬製品を開発し、最終的に商業化することに成功しなければならない。私たちの現在の収入は私たちのソフトウェア解決策の販売と私たちの協力薬物発見計画の下でマイルストーンを実現することから来て、私たちの収入の大部分は私たちのソフトウェアの販売と
このようなマイルストーンに達して、私たちまたは私たちの協力者の薬物開発と商業化努力が成功するまで、もしあれば。そのため、私たちのソフトウェアの既存顧客への販売を増やし、新しい顧客に私たちのソフトウェアをマーケティングすることに成功し、私たちの薬物発見協力の下でマイルストーンを実現することが、私たちの成功の鍵です。私たちのソフトウェアソリューションの需要は、生物製薬業界が引き続き市場に受け入れられていること、バイオ製薬業界以外の市場で採用されていること(材料科学応用のためのことを含む)、私たちのプラットフォームがより有望な分子を識別し、従来の方法と比較して発見コストを加速および低減する能力、当社の競争相手が新製品を開発·発表する時間、技術変化、および私たちの目標市場の成長速度を含む複数の要素の影響を受ける可能性がある。私たちが引き続き顧客のニーズを満たすことができなければ、私たちの業務運営、財務業績、成長見通しは不利な影響を受けるだろう。
薬物開発に成功するためには、私たちまたは私たちの現在または未来のパートナーは、候補製品の臨床前テストおよび臨床試験の完了、これらの候補製品の監督管理許可を得ること、および私たちまたは彼らが規制承認を得る可能性のある任意の製品を製造、マーケティングおよび販売することを含む一連の挑戦的な活動において機能する必要があるであろう。私たちはこれらの活動の初期段階にありますが、現在の薬物発見協力者の中で候補製品の臨床開発は一つも完成していません。私たちと彼らはこのような活動で決して成功しないかもしれない。たとえ私たちが成功しても、私たちは利益を達成し維持するのに十分な収入を生むことができないかもしれないし、あるいは私たちの協力者が成功しても、私たちは彼らから私たちが利益を達成し、維持するのに十分なオプション費用、マイルストーン支払い、または特許使用料を得ることができないかもしれない。私たちのソフトウェアソリューション市場競争が激しいことや、バイオ製薬製品開発に関連する多くのリスクと不確実性のため、私たちがいつ、あるいは利益を維持できるかどうかを正確に予測することができません。
私たちが利益を達成しても、私たちは四半期や年度の収益性を維持したり向上させることができないかもしれない。もし私たちが実現して利益を維持できなければ、会社の価値を下げ、資金調達、業務拡大、研究開発努力の維持、ソフトウェア販売量の増加、候補製品パイプラインの開発、協力、さらには運営を継続する能力を弱める可能性がある。わが社の価値の低下は私たちの株主に彼らの投資の全部または一部を損失させる可能性もあります。
私たちの収入は四半期ごとと年ごとに変動し続ける可能性がある。我々の総収入は20%増加し、2022年12月31日現在の前期の1.81億ドルから2023年12月31日までの会計年度の2兆167億ドルに増加し、2021年12月31日現在の前期の1兆379億ドルから2022年12月31日までの会計年度の1.81億ドルに増加し、31%増加した。私たちはある時期に収入増加を経験したが、私たちは収入増加を持続できないかもしれないし、私たちはある時期の収入低下を経験するかもしれない。あなたは私たちの最近のいくつかの時期の収入増加を私たちの未来の業績の指標としてはいけない。私たちの事業が成長するにつれて、私たちの収入成長率は未来に減速するかもしれない。
私たちの四半期と年間業績は大幅に変動する可能性があり、これは私たちの普通株の価値に悪影響を及ぼす可能性があります。
私たちの運営結果は、私たちの収入、毛金利、収益力、キャッシュフローを含めて、歴史的に異なる時期に変化してきて、私たちはそれらが引き続きそうすることを予想しています。したがって、私たちの経営業績を期間間の比較を行うことは意味がないかもしれませんが、私たちの四半期と年度業績は将来の業績の指標と見なすべきではありません。私たちの四半期と年間の財務業績は様々な要素によって変動する可能性があり、その多くの要素は私たちがコントロールできない。当社の四半期および年度財務業績の変動を招く可能性のある要因には、本“リスク要因”の一部の他の部分に記載されている要因および以下に掲げる要因が含まれているが、これらに限定されない
•顧客更新率および顧客更新の時間および条項は、我々のローカルソフトウェアによって手配された顧客更新の季節性を含み、その収入は、従来、各財政年度の第1四半期および第4四半期の単一時点で確認されてきた
•私たちのソフトウェアは新しい顧客を引き付ける能力があります
•このような顧客を買収または合併することを含む大顧客を増加または失う
•私たちの業務、運営、インフラの維持と拡張に関連する運営費用の金額と時間
•ネットワークの中断やセキュリティホール
•生命科学業界の内部を含めた業界と市場状況
•インフレと金利上昇または低下の影響を含む全体的な経済状況
•顧客から売掛金を受け取る能力は
•一定期間販売されているローカルソフトウェアとホストソフトウェアとの組み合わせを含む、お客様が購入したソフトウェアの数
•私たちのソフトウェア販売時間の変化は予測が難しいかもしれません
•私たちの解決策の価格と私たちや競争相手の価格政策の変化
•私たちまたは私たちの競争相手が新しいソフトウェア解決策を発売するタイミングと成功、または競争相手、顧客、または戦略パートナー間の統合を含む、私たちの業界の競争動態の任意の他の変化
•Morphy Holding、Inc.またはMorphy、Structure TreateuticsおよびNimbusの株式、分配または収益の公正な価値、または受け取った変化など、私たちの薬物発見協力者に保有されている株式のおかげで、
•私たちの薬物発見協力者は記念碑的支払いや特許権使用料を得る権利のある医薬品の開発と商業化に成功しました
•私たちの協力計画の下で達成されたマイルストーン承認のスケジュール
•私たちの協力計画の下で達成されたマイルストーンの数と規模の変化
•私たちと百時美施貴宝(Bristol-Myers Squibb Company、略称BMS)との協力協定に基づいて、私たちの特許薬物発見計画との協力または許可停止による任意の支払いの収入確認時間を確認した
•私たちの薬物発見計画、技術または業務の開発または買収に関連する費用のスケジュール、および将来発生する可能性のある被買収会社の営業権減価費用。
また,契約有効期間内にエスクローソフトウェアソリューションの収入を比例的に確認しているため,ホストソフトウェアソリューションの売上高の著しい回復や低下は,我々の運営結果に即座に反映されない可能性がある.これらの要因により、私たちの経営業績の期間間比較は私たちの未来の業績の良い指示ではなく、私たちの中期財務業績は必ずしも通年またはその後のどの中期の業績を示すとは限りません。
私たちは私たちの運営を支援するために追加的な資本が必要かもしれない。もし私たちが受け入れられる条項で追加資本を調達できない場合、あるいは私たちの業務を維持または拡大するために必要なキャッシュフローが生じなければ、私たちは競争に成功できないかもしれません。これは私たちの業務、運営、そして財務状況を損なうことになります。
薬物発見計画の開発と私たちの計算プラットフォームへの持続的な投資を含む、私たちが行っている活動と計画中の活動に大量の財源を投入したい。私たちが行っていることと計画中の活動に関連する費用は大幅に増加することが予想され、特に私たちの特許薬物発見計画、開始または進展臨床前とINDイネーブル研究、IND申請の提出、開始と進展臨床試験、および私たちの計算プラットフォームのさらなる発展に投資した場合。また,自分で臨床開発を完了し,規制部門の承認を求めることにした場合,多くの追加費用が発生することが予想される。また、私たちが民間会社の場合に比べて、上場企業として運営するには追加のコストが発生します。
私たちが彼らと締結した協力協定によると、私たちの現在の薬物発見協力者は、様々な開発、監督、商業マイルストーンを実現する際に記念碑的な支払いを得る権利があり、商業販売の特許権使用料(あれば)を得る権利があり、彼らは臨床前と臨床試験を行い、監督管理の承認を得、製品販売を実現することを含む薬物開発において多くのリスクに直面している。また、これらのマイルストーンを実現する際に、私たちが獲得する権利のある金額は、最近の開発マイルストーンでは少なく、協力候補製品が規制開発によって商業化されれば、獲得する権利がある金額が増加し、取得したビジネスの成功度(あれば)によって異なることになる。私たちは数年以内に私たちの多くの薬物発見協力者から重大なマイルストーンの支払いを受けないと予想され、私たちの薬物発見協力者は私たちに大量の現金を支払うマイルストーンを決して実現しないかもしれない。また、私たちは多くのパートナーの中で持分を持っていますが、これらの持分の価値は多くの私たちがコントロールできない要素によって著しく異なる可能性があり、これらの要素に依存できる保証はありません
株式は資本として、私たちの運営に資金を提供する。このような理由で、私たちは追加資本を獲得したり、私たちの持続的な運営に資金を提供する必要があるかもしれない。
2023年12月31日現在、私たちは4.688億ドルの現金、現金等価物、制限現金、および有価証券を持っています。私たちは、2023年12月31日まで、私たちの既存の現金、現金等価物、および有価証券が、少なくとも今後24ヶ月の運営費用および資本支出要件を支払うのに十分になると信じている。しかし,我々のこの推定は誤りであることが証明される可能性があるという仮定に基づいており,我々の運営計画は現在我々が知らない多くの要因によって変化する可能性がある.したがって、私たちは現在予想されているよりも早く私たちの資本資源を枯渇させるかもしれない。
私たちの将来の資本需要は多くの要素に依存します
•私たちのソフトウェア収入の増加は
•研究と開発を支援するための支出のタイミングと程度
•ソフトウェア販売やマーケティング活動を拡大し続けました
•私たちの薬発見協力から支払いの時間と収入を得ます
•私たちの特許薬物発見計画を支援し、推進し、拡大するための支出;
•私たちは私たちの薬物発見協力者の株式から得られた任意の配布または収益の時間と受信することができる。
もし私たちが追加的な資金調達が必要なら、私たちは私たちが受け入れられる条項やそのような資金を調達できないかもしれない。また、有利な市場条件や戦略的考慮により、現在または将来の運営計画を実行するのに十分な資金があると考えても、追加の資本を求めることができる。もし私たちが受け入れられる条項で追加資本を調達できない場合、あるいは私たちの業務と私たちの計算プラットフォームに投資するために必要なキャッシュフローを維持したり拡大したりすることができなければ、私たちは競争に成功できないかもしれません。これは私たちの業務、運営、そして財務状況を損なうことになります。
追加資本を調達することは、私たちの株主を希釈し、私たちの運営を制限したり、私たちの技術や薬物計画の権利を放棄することを要求するかもしれない。
もし私たちが株式または転換可能な債務証券を売却することで追加資本を調達すれば、私たちの株主の所有権権益は希釈され、これらの証券の条項は清算または他の特典を含む可能性があり、普通株主としての私たちの権利に悪影響を及ぼす。債務融資および優先株融資に関与する可能性のあるプロトコルは、追加債務の生成、我々の資産の売却、製品買収、資本支出、または配当の発表など、私たちの特定の行動をとる能力を制限または制限する契約を含む。
もし私たちが第三者との協力、戦略連合またはマーケティング、流通または許可手配を通じてより多くの資金を調達するならば、私たちは私たちの技術、未来の収入源、研究計画または候補製品に対する貴重な権利、または付与を放棄しなければならないかもしれない許可証条項は私たちに不利かもしれないし、あるいは私たちが自分のために薬物開発目標を追求したいかもしれない時、私たちの協力者の一人のために薬物開発目標を開発することに同意する。
もし私たちが重要な会計政策に関連する推定、判断、または仮定が正しくないことが証明されたり、財務報告基準や解釈が変化したりすれば、私たちの経営結果は悪影響を受ける可能性がある。
米国公認の会計原則に基づいて財務諸表を作成することは、経営陣に合併財務諸表と付記された報告金額に影響を与える判断、推定と仮定を行うことを要求する。私たちの推定は、歴史的経験、既知の傾向、事件、未来に起こりうることに対する私たちの信念に基づいており、既存の情報と、このような場合に合理的であると考えられる様々な他の要因を考慮している。これらの見積りの結果は資産や負債の帳簿価値を判断する基礎を構成しており,これらの資産や負債の帳簿価値は他のソースからは明らかではないように見える.我々の連結財務諸表を作成する際に用いる重要な判断,仮定,推定には,収入について,取引価格の分配と進捗を決定する測定があり,(1)可変対価格の制限,(2)履行義務を用いた独立販売価格配分取引価格の測定が含まれる
(3)協調収入とこれまでの進捗度を確認する適切な投入または産出に基づく方法。
もし私たちの仮説が変化した場合、あるいは実際の状況が私たちの仮定と異なる場合、私たちの運営結果は悪影響を受ける可能性があり、これは私たちの運営結果が証券アナリストや投資家の予想を下回って、私たちの普通株の取引価格を低下させる可能性がある。
また、私たちは定期的に財務報告基準の適用に対する遵守状況を監視し、私たちに関連する新しい公告と草案を検討します。新しい基準、既存の基準の変化、およびその解釈の変化のために、私たちの会計政策を変更し、私たちの運営政策を変更し、新しいまたは修正された財務報告基準を反映するために、新しいまたは既存のシステムを改善する必要があるかもしれません。または、私たちが公表した財務諸表を再陳述することを要求されるかもしれません。既存の基準のこのような変更またはその解釈の変更は、私たちの名声、業務、財務状態、および利益に悪影響を及ぼす可能性がある。
私たちのソフトウェアに関するリスクは
もし私たちの既存の顧客が彼らの許可証を更新しなければ、私たちからもっと多くの解決策を購入しない、あるいはもっと低い価格で更新しなければ、私たちの業務と経営業績は影響を受けるだろう。
私たちは、私たちのソフトウェア収入の大部分が既存のライセンス契約を更新し続けると予想している。したがって、既存の顧客の契約更新率を維持し、追加のソフトウェアソリューションを販売することは、私たちの将来の運営実績に重要です。私たちの顧客の契約更新率と他の解決策を販売する能力に影響を与える可能性がある要素は:
•私たちのソフトウェアソリューションの価格、性能、機能
•ソフトウェアソリューションの可用性、価格、性能、および機能を競合する
•私たちの専門サービスの効果は
•私たちは補完ソフトウェアソリューション、アプリケーション、サービスの能力を開発または取得します
•競争力のある製品や技術の成功
•私たちの技術インフラの安定性、性能、安全性
•顧客の経営環境
•我々の顧客は、顧客管理および/または科学者の変動の影響を受ける可能性がある計算方法を用いて薬物発見を行う意思を継続している
•私たちの顧客は彼らが内部で行っている薬物発見数を停止または減少させることを決定した。
(I)私たちの顧客が自分の内部ハードウェアにソフトウェアソリューションを直接インストールし、指定された期間内にそれを使用することを可能にする製品ライセンス、または(Ii)加入して、ライセンスを制御することなく、自分のハードウェアでクラウドベースのソフトウェア解決策にアクセスすることを可能にする製品ライセンス。私たちの顧客は許可期間の満了後に彼らの製品許可証を予約したり、私たちのソフトウェア解決策を加入したりする義務はありません。通常、1年後に、私たちの多くの契約は直ちに終了したり、範囲を縮小したり、通知を受けた後に終了する可能性があります。また、私たちの顧客は更新時に私たちにあまり有利ではない条項を協議する可能性があり、これは私たちがこれらの顧客から得た収入を減らすことができるかもしれない。私たちの制御範囲内にない要素は私たちのソフトウェア収入を減少させるかもしれない。例えば、私たちの顧客は、私たちのソフトウェアを研究して使用する従業員の数を減少させるかもしれません。これは、私たちのいくつかの解決策に必要なユーザライセンス数を減少させ、それによって総契約費を低減します。大規模契約の損失、範囲縮小または遅延、または複数の契約の損失または遅延は、我々の業務に実質的な悪影響を及ぼす可能性がある。
私たちの将来の経営業績は既存の顧客に新しいソフトウェアソリューションとライセンスを販売する能力にもある程度依存しています。例えば、既存のクライアントが私たちのソフトウェアを許可してくれるかどうかは、お客様の性能や他の要求を満たすために既存のソフトウェアソリューションを拡張して調整する能力に依存し、私たちはそれに成功できないかもしれません。もし私たちの顧客が彼らの合意を更新しなければ、あまり優遇されない条項やより低い費用レベルで彼らの合意を更新したり、私たちから新しいソフトウェア解決策やライセンスを購入しないと、私たちの収入は低下する可能性があり、私たちの将来の収入は制限されるかもしれません。
私たちのソフトウェア販売周期は異なるかもしれませんし、長くなるかもしれませんし、予測できません。
私たちのソフトウェアソリューションの販売時間は予測が難しいです。私たちの販売周期が長く、予測できないからです。私たちは主にバイオ製薬会社に私たちの解決策を販売しています。私たちの販売周期は9ヶ月から12ヶ月以上に及ぶかもしれません。また,潜在顧客がテストや評価,契約交渉,予算プロセスにかかる時間の長さも大きく異なり,組織の規模や需要の性質に依存する.また、ある成功しない販売努力に多くの時間と労力を費やす可能性があるため、他の販売機会を失ったり、収入増加が相殺できない費用が発生したりする可能性があり、これは私たちの業務を損なう可能性があります。
私たちの収入の大部分は生命科学業界の顧客への販売から来ており、その業界に悪影響を与える要素は私たちのソフトウェア販売に悪影響を及ぼす可能性があります。
我々の現在のソフトウェア販売の大部分は生命科学業界向けの顧客,特に生物製薬業界の顧客である。我々のソフトウェアソリューションの需要は生命科学業界に悪影響を及ぼす要因の影響を受ける可能性がある。生命科学業界は高度な監督管理を受け、競争が激しく、かなりの整合期を経験した。私たちの顧客間の統合は、私たちの顧客を失い、私たちの解決策の利用可能な市場を減少させ、私たちの業務に悪影響を及ぼす可能性があります。また、規制の変化は、生命科学業界の投資吸引力や薬物開発のコストを低下させる可能性があり、これは、我々のソフトウェア解決策の需要に悪影響を及ぼす可能性がある。これらや他の理由から、生命科学会社へのソフトウェアの販売は競争性、高価、時間がある可能性があり、通常は大量の前期時間と費用が必要であり、ソフトウェア販売の成功を保証することはできない。したがって,生命科学業界に普遍的に影響を与える要因により,我々の経営業績や生命科学会社への効率的な解決策の提供や,我々の顧客基盤を拡大または維持する能力が悪影響を受ける可能性がある。
我々はまた,我々の解決策を利用して,航空宇宙,エネルギー,半導体,電子ディスプレイ分野を含む分子設計分野の工業的挑戦に広く応用していく予定である.しかし,材料科学業界は計算方法の分子発見の潜在力を認識する非常に早い段階にあり,我々のプラットフォームのような計算方法を採用することは保証されていないと考えられる。私たちが生命科学業界以外の顧客に私たちのソフトウェア解決策をマーケティングする能力に悪影響を及ぼす要素は、これらの新しい分野を含めて、生命科学業界への依存を増加させ、私たちの収入、経営業績、および業務の成長率に悪影響を及ぼす可能性があります。
私たちが参加する市場競争は激しく、もし私たちが効果的に競争できなければ、私たちの業務と経営業績は不利な影響を受けるかもしれない。
分子発見と設計ソフトウェアの全体市場は世界的であり,発展が迅速で,競争が激しく,変化する技術や変化する顧客の興味や優先順位の影響を受けている。我々のソフトウェアソリューションは、バイオ製薬会社にシミュレーションおよびモデリングソフトウェアを販売または提供する業務において、競争相手からの競争に直面している。これらの競争相手は、ダソーシステム会社のブランドBiovia、あるいはBiovia、化学計算グループ(米国)会社、Cresset生体分子発見有限会社、Cadence設計システム会社、Optibrium株式会社、サイラスバイオテクノロジー会社、Molsoft LLC、Insilo Medicine,Inc.,Iktos,XtalPI Inc.,Inductive Bio,Inc.,ChemAxon,PerkinElmer,Inc.およびSimulations Plus,Inc.を含む。
著者らは材料科学の面でもBioviaと材料設計会社のような競争相手があり、生命科学の企業ソフトウェアの面、例えばBiovia、Certara USA、Inc.,ChemAxon、Revrate,Inc.とDotmatics,Inc.はある場合、これらの競争相手はこれらの解決策の成熟サプライヤーであり、そして私たちの多くの既存と潜在顧客と大型生物製薬会社を含む長期的な関係を維持している。また,生命科学や材料応用のための物理に基づくシミュレーションプログラムを開発する学術連盟もある。生命科学業界で最も有名な学術シミュレーションパッケージは、Amber、CHARMm、GROMACS、GROMOS、OpenMM、OpenFFを含む。これらのバッグは主に大学院生やポストドクター研究者によって維持·開発されており,通常商業化の意図はない.
バイオ製薬会社内部で開発されたソリューションからの競争や,我々が目標よりも具体的な市場に対する製品やサービスを提供する小さな会社からの競争に直面しており,これらの小さな競争相手がより大きな割合の努力や資源をこれらの市場に集中させることができ,機械学習技術の薬物発見への応用を目指して設立された会社が多い。
私たちの多くの競争相手は彼らのソフトウェア解決策とサービスを開発、普及、販売するためにより多くの資源を投入することができる。私たちの特許薬物発見への関心は、私たちのソフトウェア業務に関連する管理重点と資源を失うことを招き、私たちのソフトウェア業務の収入を減少させる可能性がある。さらに、より多くの利用可能なリソースを有し、激しい価格競争を開始または耐えることができる第三者は、私たちの既存または潜在的な競争相手を買収することができる。我々の競争相手は、彼らの製品供給または資源をさらに強化するために、彼らの間または第三者との協力関係を確立することも可能である。もし私たちの競争相手の製品、サービス、または技術が私たちの解決策よりも容易に受け入れられ、もし私たちの競争相手が私たちよりも早く彼らの製品またはサービスを市場に出すことに成功した場合、もし私たちの競争相手が新しいまたは変化する機会、技術または顧客の需要により速く、より効果的に応答することができれば、または彼らの製品やサービスが私たちの技術能力よりも強い場合、私たちのソフトウェア収入は不利な影響を受ける可能性がある。
また,人工知能(AI)や他の計算方法を用いて薬物発見を行う会社からの激しい競争に直面している。その中のいくつかの競争者は、自身および/またはパートナーと薬物発見に参加し、別の競争者は、人工知能を利用して、薬物発見のために直接または間接的に使用することができるソフトウェアまたは他のツールを開発する。これらの他の人工知能薬物発見方法が成功していることが証明されたり、私たちの方法よりも成功したりすれば、私たちのプラットフォームの需要に悪影響を及ぼす可能性があり、これは私たちのソフトウェア需要に影響を与え、薬物発見協力者としての私たちの需要を減少させる可能性がある。
競争が激化するため、私たちは価格を下げたり、価格設定を修正したりして、新しい顧客を誘致したり、既存の顧客を維持したりすることを要求される可能性があります。定価圧力や競争の激化は、売上高の低下、利益率の低下、損失、あるいは私たちの競争市場の地位を維持または改善できない可能性があり、これらはいずれも私たちの業務に悪影響を及ぼす可能性がある。
私たちはすでに研究と開発に投資して、私たちの計算プラットフォームをさらに強化することを予想しています。このような投資は私たちの経営業績に影響を与えるかもしれません。もしこれらの投資のリターンが私たちの期待や発展速度よりも遅くなれば、私たちの収入と経営業績は影響を受けるかもしれません。
私たちはすでに投資しており、一般的に顧客の要求に応えるために、私たちのコンピューティングプラットフォームをさらに強化するために、研究開発に投資していく予定です。これらの投資は、これらの投資に関連する費用が私たちの利益率および経営業績に影響を及ぼす可能性があること、およびこれらの投資によって生じる可能性のある収入が、負担する債務およびこれらの新しい投資に関連する費用のリスクを相殺するのに十分ではないことを含む大量の時間、リスク、および不確実性に関連する可能性がある。技術や製品の発展に伴い、ソフトウェア業界の変化が速く、これは私たちの解決策をあまり望ましくないかもしれない。例えば、近年、多くの会社が異なる人工知能方法を利用して薬物発見業界に進出している。私たちの物理ベースの計算プラットフォームと機械学習能力を組み合わせることで、競争において有利な地位にあり、このような方法と意味的に区別されると信じているが、他のこのような人工知能方法の薬物発見における成功は、私たちの解決策の需要に影響を与える可能性がある。私たちは私たちの競争地位を維持し、向上させるために、私たちのプラットフォームとソフトウェア解決策に大量の時間と資源を投入し続けなければならないと信じている。もし私たちがこれらの投資の期待収益を達成していなければ、これらの収益の実現が遅れていれば、技術発展が私たちの解決策をあまり望ましくない、あるいは汎用計算能力の減速が電力および分野適用性の物理的シミュレーションに基づく成長速度に影響を与える場合、私たちの収入と運営結果は悪影響を受ける可能性がある。
お客様から売掛金を回収できなければ、私たちの経営業績は不利な影響を受ける可能性があります。
私たちの現在のお客様の多くは成熟した大企業や大学ですが、小さい会社にもソフトウェアソリューションを提供しています。私たちの財務成功は、私たちの財務資源の少ない小さな顧客を含む、私たちの顧客の信頼性と最終受取金にかかっています。もし私たちが顧客から満期金を回収できない場合、大量の売掛金を解約して不良債権支出を確認する必要があるかもしれません。これは私たちの経営業績に大きな悪影響を及ぼす可能性があります。
私たちの解決策の欠陥や中断は、私たちの解決策に対する需要の減少、私たちの収入の減少を招き、私たちに重大な責任を負わせるかもしれない。
私たちのソフトウェア業務とお客様の私たちのソフトウェアに対する受容度は、私たちのソフトウェアおよび関連ツールと機能の持続的、効率的かつ信頼性のある動作に依存します。私たちのソフトウェア解決策は本質的に複雑で、欠陥やエラーを含むかもしれない。エラーは我々自身の技術,あるいは我々のソフトウェア解決策とレガシーシステムやデータとのインタフェースから来る可能性があり,これらのシステムやデータは我々が開発したものではない.新しいソフトウェアソリューションが初めて導入された場合、または既存のソフトウェアソリューションの新しいバージョンまたは拡張バージョン
釈放されました。私たちは時々私たちのソフトウェアの欠陥を発見して、未来に私たちの既存のソフトウェアの新しいエラーを検出するかもしれません。私たちのソフトウェアのどんなエラー、欠陥、中断、または他の性能問題は、私たちの名声を損なう可能性があり、私たちの顧客の業務を損なう可能性があります。もしこのような状況が発生したら、私たちの顧客は私たちへの支払いを遅延或いは差し押さえて、彼らと私たちの合意を取り消して、更新しないことを選択して、私たちにサービス信用クレーム、保証クレーム或いは他のクレームを提出して、私たちは未来の販売を失うかもしれません。このような事件の発生は、当社のソフトウェアに対する需要の減少、当社の収入の減少、売掛金の回収サイクルの増加、保証条項の増加、または訴訟費用または重大な責任を招くことを要求する可能性があります。
私たちはクラウドベースのインフラの第三者プロバイダに依存して、私たちのソフトウェア解決策を管理しています。これらのサード·パーティ·プロバイダが運営するいかなる中断、容量制限、または私たちの使用に対する干渉は、私たちのトラフィック、財務状態、および運営結果に悪影響を及ぼす可能性があります。
我々は,我々のホストソフトウェア解決策に関連するほとんどのインフラストラクチャを第三者ホストサービスにアウトソーシングする.ソフトウェアソリューションをホストするお客様は、中断や性能を低下させることなく、いつでも当社のコンピューティングプラットフォームにアクセスでき、正常な実行時間に関するサービスレベルの約束を提供する必要があります。我々のホスト·ソフトウェア·ソリューションは、サード·パーティ·ホスト·サービス·ホストを保護する仮想クラウドインフラストラクチャに依存し、方法は、その構成、アーキテクチャ、機能、および相互接続仕様を維持し、第三者インターネットサービスプロバイダによって送信されるこれらの仮想データセンターに格納された情報を維持することである。当社の第三者エスクローサービス容量のいかなる制限も、新規顧客の受け入れを阻害したり、既存の顧客の使用能力を拡大したりする可能性があり、これは、当社の業務、財務状況、および運営結果に悪影響を及ぼす可能性があります。さらに、ネットワーク攻撃、自然災害、火災、洪水、深刻な嵐、地震、停電、電気通信障害、テロまたは他の攻撃、および他の我々が制御できない同様のイベントによって引き起こされる任意の影響は、私たちのクラウドベースの解決策に否定的な影響を与える可能性があります。上記のいずれの理由でも、クラウドベースの解決策に影響を与える長期サービス中断は、顧客サービスの能力に悪影響を与え、既存および潜在的顧客における私たちの名声を損なう可能性があり、私たちに責任を負わせ、顧客を失ったり、他の方法で私たちの業務を損害したりする可能性があります。私たちはまた、代替デバイスを使用したり、当社が使用するサード·パーティ·ホスト·サービスを損なうイベントを準備または対応するために他の行動をとることによって、重大なコストを生じる可能性があります。
第三者ホストサービスとのサービスプロトコルが終了したり、サービス中断、私たちが使用しているサービスまたは機能がキャンセルされたり、インターネットサービスプロバイダ接続が中断されたり、そのような施設が破損したりする場合には、私たちのプラットフォームへのアクセスの中断、および新しい施設およびサービスの手配または作成および/または異なるクラウドインフラストラクチャサービスプロバイダ上での配備のための私たちのホストソフトウェア解決策の再構築の大きな遅延および追加料金に遭遇する可能性があり、これは、私たちの業務、財務状況、および運営結果に悪影響を及ぼす可能性があります。
もし私たちのセキュリティ措置が破壊されたり、他の方法で顧客データへの不正アクセスが得られた場合、私たちの解決策は安全ではないとみなされる可能性があり、顧客は私たちの解決策の使用を減らしたり、停止したりする可能性があり、私たちは重大な責任を招く可能性があります。
当社のソリューションは、お客様の固有情報およびお客様の発見作業に関連する敏感な独自データの収集、分析、およびストレージに関するものです。したがって、第三者行為、従業員エラー、汚職、または他の理由による不正アクセスまたはセキュリティホールは、情報損失、訴訟、賠償義務、私たちの名声損害、および他の責任をもたらす可能性があります。不正アクセスまたはシステム破壊を取得するための技術はしばしば変化し、通常、目標に対して攻撃を開始する前に識別されないため、これらの技術を予測したり、十分な予防措置を実施することができない可能性がある。また、もし私たちの従業員が私たちの薬物発見チーム(薛定療法チームと呼ぶ)とソフトウェア顧客と協力するチームとの間のファイアウォールを維持するために設立したやり方に従わなかった場合、あるいはファイアウォールの故障を維持するために採用した技術的解決策が故障した場合、私たちの顧客と協力者は彼らの知的財産権を秘密にする能力に自信を失う可能性があり、私たちは新しい顧客や協力者を引き付けることが困難かもしれません。私たちは顧客と協力者の違約クレームを受ける可能性があり、名声やその他の損害を受ける可能性があります。これらのすべての問題は、私たちが新しい顧客を誘致する能力に悪影響を及ぼす可能性があり、既存の顧客が彼らのライセンスを更新しないことを選択し、名声を損なわせたり、第三者訴訟や他の訴訟や責任に直面させたりすることができ、これは私たちの経営業績に悪影響を及ぼす可能性があります。私たちの保険は、このようなイベントに関連する損失をカバーするのに十分ではないかもしれませんし、いずれの場合も、このような保険は、セキュリティホールに対応して救済するために私たちが招く可能性のあるすべてのタイプのコスト、費用、および損失をカバーしないかもしれません。
質の高い技術支援サービスを提供できなければ、私たちと顧客との関係や私たちの経営業績に悪影響を及ぼす可能性があります。
我々のクライアントは,我々の解決策に関する技術的問題を解決するために我々の支援組織に依存しており,我々のソフトウェアはその機能を十分に発揮するために専門家が使用する必要があるからである.私たちのいくつかの顧客はまた、ソフトウェア性能の問題を解決するために私たちに依存して、特定の顧客プロジェクトに必要な新しい機能を紹介し、様々なタイプのシミュレーションの最適な方法を確立し、分析することを教え、公開された利用可能なデータセットの例を用いて私たちの薬物発見技術を説明した。私たちは十分に迅速に対応できないかもしれないし、これらの支援サービスに対する顧客の短期的な増加を満たすことができないかもしれない。顧客は私たちのサービスに対する需要が増加し、それに応じた収入がなく、コストを増加させ、私たちの経営業績に悪影響を及ぼす可能性がある。また、私たちの販売プロセスは、私たちの解決策や業務の名声、既存の顧客の積極的な推薦に高く依存しています。質の高い技術支援を提供できなかったり、市場が高品質な支援を提供していないと考えられたりすることは、私たちの名声、既存および潜在的な顧客に私たちの解決策を販売する能力、および私たちの業務および運営結果に悪影響を及ぼす可能性があります。
私たちの解決策は第三者オープンソースソフトウェアを使用しており、1つ以上のこのようなオープンソースソフトウェアライセンス条項を遵守しない行動は、私たちの業務またはソフトウェア解決策を販売する能力に悪影響を与え、私たちを訴訟したり、潜在的な責任を生じさせたりする可能性があります。
私たちの解決策には、GNU汎用共通ライセンス、GNU Lesser汎用共通ライセンス、Affero汎用共通ライセンス、BSDライセンス、MITライセンス、アパッチライセンス、および他のライセンスを含む第三者によって任意の1つ以上のオープンソースライセンスで許可されたソフトウェアが含まれており、将来的にオープンソースソフトウェアを私たちの解決策に取り入れていきたいと思います。また、私たちがオープンソースソフトウェアの使用を効果的に監視していること、あるいは私たちが適用されているオープンソースライセンスの条項や私たちの現在の政策とプログラムを遵守していることを確実にすることはできません。その製品やサービスにオープンソースソフトウェアを使用している会社にクレームがあり,このようなオープンソースソフトウェアを使用することはクレーム者の知的財産権を侵害していると主張している.したがって、私たちと私たちの顧客は第三者から訴訟を受ける可能性があり、許可されたオープンソースソフトウェアがこれらの第三者の知的財産権を侵害していると主張し、このようなクレームについて私たちの顧客に賠償を要求される可能性があります。さらに、このようなオープンソースソフトウェアを配布する著者または他の第三者が、私たちがそのうちの1つ以上のライセンスの条件を遵守していないと主張した場合、私たちまたは私たちの顧客は、そのような疑惑に対して巨額の法的費用を招き、重大な損害賠償を受ける可能性があり、オープンソースソフトウェアを含む解決策を含む販売が禁止され、これらの解決策に対する厳しい条件または制限を遵守することが要求される可能性があり、これは、これらの解決策の配布および販売を混乱させる可能性がある。訴訟は私たちに高い弁護費用を払わせ、私たちの業務、財務状況、運営結果に否定的な影響を与え、あるいは私たちの解決策を変えるために追加の研究開発資源を投入する必要があるかもしれない。
オープンソースソフトウェアの使用は、オープンソースソフトウェアを使用することよりも第三者商業ソフトウェアを使用するよりも大きなリスクをもたらす可能性がある。なぜなら、オープンソースライセンシーは、通常、セキュリティホールを含む権利侵害主張またはコード品質について、保証または他の契約保護を提供しないからである。さらに、いくつかのオープンソースコードライセンスは、そのようなオープンソースコードソフトウェアと相互作用するソフトウェアプログラムのソースコードを公衆に無料で提供することを要求し、そのようなオープンソースコードソフトウェアの任意の修正または派生作品は、オープンソースコードソフトウェアライセンスと同じ条項に従って許可され続ける。関連する司法管轄区域の裁判所は様々なオープンソースライセンスの条項を説明しておらず、このようなライセンスの解釈方法は、私たちの解決策を販売する能力に予期せぬ条件や制限を加える可能性がある。いくつかのオープンソース許可の条項によると、私たちの独自ソフトウェアをオープンソースコードソフトウェアと何らかの方法で組み合わせると、私たちの独自ソフトウェアのソースコードを発行し、私たちの独自ソフトウェアをオープンソースコード許可の下で利用できるように要求される可能性があります。もし私たちの独自ソフトウェアの一部がオープンソース許可の制約を受けていると決定された場合、私たちは、私たちのソースコードの影響を受けた部分を公開し、私たちのすべてまたは部分的な解決策を再設計すること、または他の方法で私たちの解決策の許可を制限することを要求されるかもしれません。どれも、私たちの解決策の価値を低下または除去することができます。独自のソースコードを開示することは、競合他社がより少ない開発作業量と時間で類似した製品を作成することを可能にし、最終的に販売損失を招く可能性があります。これらの事件のいずれも私たちに責任を与え、私たちの名声を損なう可能性があり、これは私たちの収入、業務、運営結果、財務状況、および私たちの株式の市場価格に実質的な悪影響を及ぼすかもしれない。
薬物発見に関連するリスク
私たちは私たちの薬物発見協力で資源と現金投資の見返りを絶対に達成しないかもしれない。
我々は我々のコンピューティングプラットフォームを用いて,薬物発見と開発に従事する協力者に薬物発見サービスを提供した。これらの協力者には、スタートアップ企業、商業化前のバイオテクノロジー会社、大手製薬会社が含まれる。これらの協力者と一緒に薬物発見に従事する場合、私たちは通常、私たちのプラットフォームとプラットフォームの専門家との関連を提供し、彼らは薬物発見協力者が1つ以上の指定されたタンパク質標的に活性を有する分子を認識するのを助ける。私たちがBMSと協力協定を締結した時にBMSから受信した5500万ドルの前金を除いて、私たちはこれまでこれらのサービスの重大な初期現金対価格を受け取っていなかった。しかし、私たちは、いくつかの協力者の株式対価格および/またはオプション費用、薬物発見目標の特定の開発、規制、および商業販売マイルストーン達成時の現金マイルストーン支払い、および潜在的な特許使用料の権利を受信した。私たちはまた時々私たちの薬物発見協力者に追加的な株式投資をする。
私たちは私たちの薬物発見協力で資源と現金投資の見返りを絶対に達成しないかもしれない。臨床薬物開発は長くて高価な過程に関連し、結果は不確定である。我々の薬物発見協力者は、任意の候補製品の開発および商業化を完了または最終的に達成できない場合に、追加のコストまたは遅延が生じる可能性がある。また,薬物発見協力からリターンを実現する能力は,以下のリスクの影響を受ける
•薬物発見協力者は、彼らが私たちの協力に適用する努力と資源の数と時間を決定する上で大きな裁量権を持っており、予想通りに彼らの義務を履行しないかもしれない
•薬物発見協力者は、オプション費用、マイルストーン支払いまたは特許権使用料を得る権利がある任意の候補製品を開発または商業化してはならない、または臨床試験または他の研究の結果、協力者の戦略的重点または利用可能な資金の変化または外部要因(例えば、買収)に基づいて、開発または商業化計画を継続または更新しないことを選択することができる
•薬物発見協力者は記念碑的支払いの臨床試験を遅らせることができるかもしれません
•私たちは、私たちの協力者が開発または商業化している候補製品に関するいくつかの情報をアクセスできないか、または開示することができないかもしれません。したがって、私たちは、このような協力のマイルストーン支払いまたは印税の状況および可能性に関する能力が限られている可能性があることを株主に通報します
•薬物発見協力者は、第三者開発と直接または間接的に任意の候補製品と競合する製品を独立して開発または間接的に開発することができ、競争製品がより成功する可能性がある、またはより経済的に魅力的な条項で商業化できると考えることを前提として、記念碑的支払いまたは印税の製品を得る権利がある
•私たちの薬物発見との協力で発見された候補製品は、私たちの協力者によって彼ら自身の候補製品または製品と競争するとみなされるかもしれません。これは、私たちの協力者がこのような候補製品の商業化への資源投入を停止させる可能性があります
•既存の薬物発見協力者と潜在的な未来の薬物発見協力者は、特に私たちの特許薬物発見計画を推進する時、私たちとの既存の協力を続けたり、私たちと新しい協力に入りたくないかもしれない
•薬物発見協力者は候補製品や製品の開発、製造、流通、マーケティングに関する適用法規要件を遵守できない可能性があり、これは私たちがマイルストーン支払いを得る能力に影響を与える可能性がある
•知的財産権または特許権、契約解釈または第一選択の開発プロセスにおける相違を含む薬物発見協力者との相違は、マイルストーン支払いを得る資格のある候補製品の研究、開発または商業化の遅延または終了、または訴訟または仲裁を引き起こす可能性がある
•薬物発見協力者は、私たちの知的財産権または固有の権利を正確に取得、維持、強制実行、保護することができないか、または紛争や法的手続きを引き起こす可能性がある方法で私たちの固有の情報を使用して、私たちまたは彼らの知的財産権または固有の情報を危険にさらしたり、私たちと彼らを潜在的な訴訟に直面させたりする可能性がある
•薬物発見協力者は、第三者の知的財産権または独自の権利を侵害、流用、または他の方法で侵害する可能性があり、これは、私たちを訴訟および潜在的な責任に直面させる可能性がある
•薬物発見協力者は世界の健康影響によって業務遅延の影響を受ける可能性があり、例えば最近の新冠肺炎が大流行している
•私たちが協力から何か大きな価値を得る前に、薬物発見協力は中止されるかもしれないが、これは過去に私たちに起こり、未来に再び私たちに起こるかもしれない。
私たちの薬物発見協力は候補製品の開発や商業化を招くことがなく、オプション費用、マイルストーン支払い、あるいは印税をタイムリーに受け取ることができないかもしれません。私たちが参加した任意の薬物発見協力が薬物製品の開発と商業化に成功しなかった場合、オプション費用、マイルストーン支払い、または特許使用料の支払いにつながり、薬物発見協力に投資された資源は報われない可能性がある。また,薬物発見協力が最初にマイルストーンを達成し,費用を支払っても,そうし続けることはできないかもしれない。
我々はまた,パートナーに依存して我々の内部で発見された候補製品を開発し,潜在的に商業化することは,候補製品の臨床的およびビジネス的機会を最大化するのに役立つと考えられるからである。例えば,我々とBMSとの協力合意に基づき,双方が興味のある標的(S)について合意した後,シュレーディン療法集団は候補薬物の開発を担当している。特定の目標基準に適合する開発候補が決定されると、BMSは単独でその開発候補の開発、製造、商業化を担当する。例えば,SOS 1計画の開発候補を選択した後,BMSは現在,さらなる臨床前と臨床開発,製造,商業化を完全に担当しており,費用はBMSが自費している。私たちは私たちの協力合意に基づいてBMSの開発と商業化の他の候補開発案を決定することに成功したかどうかを決定することはできない。さらに、BMSは、開発候補製品の研究、開発、規制、販売マイルストーンを実現できず、追加料金を支払うことになる可能性があります。
私たちは薬物発見協力者への株式投資収益を達成できないかもしれない。
私たちは薬物発見協力者への株式投資収益を達成できないかもしれない。私たちが株式を持っている薬物発見協力者はいずれも薬物製品の商業販売から収入を得ていない。したがって、それらは有利な条件下での資本供給に依存して運営を継続する。さらに、もし私たちが株式を持っている薬物発見協力者が追加の資本を調達した場合、私たちはこれらの薬物に対する協力者の所有権権益と制御程度が希釈され、私たちが十分な資源があり、さらなる投資を選択しない限り、または私たちの株式投資に契約逆希釈保護を提供することに成功した。私たちの任意の協力者への株式投資の財務成功は、公募株、買収、あるいは私たちの保有株式価値の増加を反映する有利な市場事件のような流動性イベントに依存する可能性が高い。公開·買収の資本市場は動的であり、わが持分を保有する会社で流動性事件が発生する可能性が著しく悪化する可能性がある。また,既製の市場データが不足しているため,個人持株会社の評価自体が複雑である.もし私たちがこのような会社でのいかなる投資も価値低下を経験していると判断すれば、私たちは減価を記録する必要があるかもしれません。これは私たちの財務業績にマイナスの影響を与えるかもしれません。私たちの上場企業における株式の公正価値は、これらの会社の特定の報告日における普通株式市場価値に基づいて、このような株式の公正価値を決定するため、今後一定期間にわたって大幅に変動する可能性がある。私たちが薬物発見協力者の中で持っているすべての持分は私たちの投資の一部または全部の損失のリスクに直面している。
我々の薬物発見協力者は、臨床開発と協力計画の推進に関するスケジュールを含む、私たちの協力状態をいつ発表するかを決定する上で大きな裁量があり、私たちの普通株の価格は意外な結果を発表したり、発展したりすることによって低下する可能性がある。
われわれの薬物発見協力者は,臨床前と臨床発展および協力計画の推進に関するスケジュールを含む,我々の協力状態をいつ発表するかを決定する上で大きな自由裁量がある。一般的には,我々の協力状態を定期的に報告する予定であるが,我々の薬物発見協力者,特に我々個人が保有している協力者は,このような情報を報告する頻度が我々が報告しようとしている頻度よりも高いか低いか,あるいはそのような情報を報告することをまったく望まないかもしれない。私たちの協力における意外な結果や進展を公開的に発表したり、私たちの協力者がこれらの情報を隠しているため、私たちの普通株の価格は下がる可能性があります。
私たちの計算プラットフォームは伝統的な方法よりも将来性のある分子を識別し、薬物発見を加速する潜在力があると信じているが、私たちは私たちのプラットフォーム技術を使用して治療潜在力のある分子を発見と設計することに集中して、私たちあるいは私たちの協力者のために商業的に実行可能な製品を発見し、開発することはできないかもしれない。
我々の科学的方法は我々のプラットフォーム技術を用いて“計算分析”を行うことに集中し、著者らの物理に基づくモデリングと理論化学の深い理解を利用して分子を設計し、その重要な性質を予測し、時間がかかり高価な物理実験を行う必要がない。私たちのコンピューティングプラットフォームは私たちのソフトウェア解決策、私たちの薬物発見協力、私たち自身の特許薬物発見計画を支えている。
著者らのいくつかの薬物発見協力者の結果は、私たちのプラットフォームは薬物発見を加速し、高品質の候補製品を決定することができることを示しているが、これらの結果は私たちの薬物発見協力者あるいは私たちの特許薬物発見計画が将来成功することを保証することはできない。
たとえ我々あるいは我々の薬物発見協力者が臨床前研究で潜在力を示す候補製品を開発できたとしても、我々あるいは彼らは人体臨床試験において候補製品の安全性と有効性を証明することに成功できない可能性がある。例えば、我々との協力において、Nimbusは一連の独特なアセチルCoAカルボキシラーゼ、あるいはACC、アロステリックタンパク質-タンパク質相互作用阻害剤を認識することができ、良好な薬学特性を有し、ACC酵素の活性を抑制することができる。NimbusはそのACC阻害剤FirsoCost1 b期臨床試験で概念証明を獲得し,その後この計画をGilead Sciences,Inc.あるいはGilead Sciencesに売却し,前金と収益を含む取引価値は約12億ドルであった。このうち、これまでにNimbusに6億013億ドルを支払い、2016年と2017年に合計4600万ドルの現金分配を受けた。2019年12月,Gilead SciencesはFirst−Costatを含む第2段階臨床試験のTOPLINE結果を発表し,単一療法として他の研究療法と併用し,主要終点に達していない非アルコール性脂肪性肝炎による進行線維化の治療に用いた。ジリッド科学社は現在,FirsoCostatとノとノドA/SのSemagluideの併用を評価し,非アルコール性脂肪性肝炎による代償性肝硬変を治療する2 b期臨床試験を行っている。そのほか、臨床前と臨床データはよく異なる解釈と分析の影響を受けやすく、多くの会社は彼らの候補製品が臨床前研究と臨床試験で満足できると考えているが、しかし依然としてその候補製品のマーケティング許可を得られなかった。
私たちは候補製品の決定、発見、または開発に成功できないかもしれないし、より大きなビジネス機会またはより成功する可能性の高い計画、協力、または候補製品を利用できないかもしれない。
新製品候補製品を決定する研究計画には大量の技術、財政、人的資源が必要である。組織として,臨床段階のMALT 1阻害剤SGR−1505,臨床段階のCDC 7阻害剤SGR−2921,臨床前段階のWEE 1/MYT 1阻害剤SGR−3515を進めている。我々はまだ臨床開発やINDを有効にする研究に他の計画を進めておらず,より多くの候補製品を決定して開発することはできないかもしれない。同様に、私たちのビジネス計画の重要な要素の一つは、ソフトウェア販売と薬物発見協力を増やすことで、私たちのコンピューティングプラットフォームの使用を拡大することです。もし私たちが自分で私たちのプラットフォームを成功的に使用することによって、内部製品候補製品を発見してその効用を示すことができなければ、私たちの業務の将来性を損なう可能性があります。
我々は資源が限られているため,研究プロジェクトをタンパク質標的に集中させており,我々の計算解析は実験解析の良い代替品であると考えられ,分子が薬物になるために必要な特性を有する分子を理論的に発見する可能性があり,有意義なビジネス機会などが存在すると信じている。われわれの最初の特許薬物発見計画の重点は腫瘍学分野であり,我々は最近神経学や免疫学を含めて他の治療領域に拡張し始めた。私たちは、いくつかの計画、協力、または候補製品、またはその後、より大きなビジネス潜在力を持つことを証明する指示によって機会を求めることを放棄または延期するかもしれない。しかし、私たちが追求している任意の候補製品の開発は、最終的には成功していないことが証明されるかもしれないし、より積極的な資本資源で追求される別の潜在的な製品候補を選択するかもしれない。もし私たちがある候補製品の商業的潜在力を正確に評価しなければ、私たちは戦略的協力、パートナー関係、許可、または他の手配を通じて候補製品に価値のある権利を放棄するかもしれないが、この場合、候補製品の独占的な開発権と商業化の権利を維持することは私たちに有利だ。あるいは,ある治療領域の候補製品に内部資源を割り当てることができ,その分野で協力した方が有利である。
私たちの研究計画は、内部またはパートナーとの潜在的な候補製品を決定する上で初歩的な将来性を示す可能性があるが、様々な理由で臨床開発のための候補製品を生成できなかった
•私たちの研究方法または任意の協力者の研究方法は臨床開発に成功した潜在的な候補製品を決定することに成功できないかもしれない
•潜在的な候補製品は、有害な副作用を有することが証明される可能性があり、または他の特徴を有する可能性があり、候補製品が販売できないか、または上場承認を得ることができない可能性がある
•私たちの現在または未来の協力者は、潜在的な候補製品の開発プロファイルを変えたり、ある治療分野を放棄したりするかもしれない
•新しい競争的発展は私たちの候補製品を時代遅れにしたり競争力を失ったりするかもしれない。
これらの事件のいずれかが発生した場合、私たちは、1つまたは複数の計画のための開発作業を放棄することを余儀なくされる可能性があり、これは私たちの業務に大きな悪影響を及ぼすだろう。
私たちは私たちが発見した治療可能性のある分子を合成するために契約研究機関に頼っている。もしそのような組織が私たちの供給要求に適合していない場合、あるいはそのような組織が他の面で満足できる表現がなければ、私たちが開発する可能性のある任意の候補製品の開発が延期される可能性がある。
我々は、SGR-1505、SGR-2921、およびSGR-3515を含む、我々が発見した治療可能性を有する任意の分子を合成するために第三者に依存し、引き続き依存すると予想される。第三者に依存することは私たち自身が分子を合成するのとは違う危険に直面させるかもしれない。このような第三者に対する私たちの依存はこのような活動に対する私たちの統制を減少させるだろうが、私たちの責任を軽減しないだろう。これらの第三者が法規の要求に基づいてその契約義務の履行に成功し、予想される期限内に分子を完成または合成することができない場合、これらの当事者との間に相違がある場合、またはこれらの当事者が生産能力を拡張できない場合、供給要求を満たすために十分な候補製品の生産を満たすことができないか、または遅延する可能性があり、必要な臨床前研究の完了を完了または遅延させることができず、INDに提出された実行可能な候補製品または必要な臨床試験の進展を得ることができ、そのような候補製品の開発を成功させ、商業化することができないか、または努力を遅らせる可能性がある。これらの第三者の施設は、洪水や火災、あるいは地政学的事態の発展や新冠肺炎のような公衆衛生の大流行、または規制検査後に汚染や規制面の懸念などの生産問題に直面する可能性があるなど、自然災害の影響を受ける可能性もある。この場合、適切な代替第三者施設を見つけ、契約関係を確立する必要があるかもしれませんが、これは既製品または許容可能な条項で提供されていない可能性があり、追加の遅延および増加した費用をもたらし、私たちの業務に実質的な悪影響を及ぼす可能性があります。
原料または原料薬市場の生産能力の制限または遅延または中断のため、私たちまたは任意の第三者も、私たちが発見する可能性のある臨床前研究または臨床試験に必要な任意の分子を合成するために必要な原材料または有効な薬物成分または原料薬の不足に遭遇する可能性がある。原材料や原料薬があっても、私たちは許容可能なコストや品質で十分な量を得ることができないかもしれない。私たちまたは第三者が、私たちが発見する可能性のある十分な数の分子を合成するのに必要な原材料または原料薬を得ることができない場合、私たちの開発努力を延期、阻止、または損害し、私たちの業務に重大な悪影響を及ぼす可能性がある。
もし私たちが内部で発見された任意の候補製品を開発して商業化するために協力を確立したり維持したりすることができなければ、私たちはこれらの候補製品の開発と商業化計画を変えなければならないかもしれません。私たちの業務は悪影響を受ける可能性があります。
候補製品の臨床的·ビジネス的機会を最大限に拡大するのに役立つと信じている場合には、将来のパートナーに依存して内部で発見された候補製品を開発し、潜在的に商業化することが予想される。私たちはこれらの活動のために適切な協力者を探す上で激しい競争に直面しており、いくつかのより成熟した会社もこのような協力を求めているかもしれない。これらの老舗会社は私たちより競争優位を持っているかもしれません。それらの規模、財務資源及びもっと多くの臨床開発と商業化専門知識のためです。我々がこのような協力について最終的に合意するかどうかは,協力者の資源や専門知識の評価,協調の条項や条件の提案,提案された協力者のいくつかの要因の評価に依存する.これらの要因は、臨床前研究および臨床試験の設計または結果、FDAまたは米国国外の同様の規制機関によって承認された可能性、候補被験者製品の潜在的市場、そのような候補製品の製造および患者への配送のコストおよび複雑性、競争製品の潜在性、技術所有権の不確実性、挑戦の利点を考慮せずにこのような所有権に挑戦する場合、存在する可能性のある不確実性、および一般的な業界および市場状況を含むことができる。協力者はまた、同様の協力可能な指示を得るための代替候補製品または技術を考慮することができ、そのような連携が、私たちと私たちとの連携よりも私たちの候補製品に魅力的であるかどうかを考慮することができる。協力の交渉と記録は複雑で時間がかかる。また,最近では大手バイオ製薬会社間の大量の業務合併により将来の潜在的パートナー数が減少している。
もし私たちが適時に、受け入れ可能な条項によって、または適切なパートナーと合意できない場合、私たちは候補製品の開発を削減し、その開発計画や私たちの1つまたは複数の他の開発計画を減らしたり、あるいは私たちの支出を増加させ、自費で開発または商業化活動を行わなければならないかもしれない。もし私たちが自分で援助して開発や商業化活動に従事することを選択すれば、私たちはより多くの専門知識と追加的な資本を得る必要があるかもしれないが、これらは私たちが受け入れられない条件や根本的には得られないかもしれない。私たちが協力できず、必要な開発や商業化活動を展開するのに十分な資金や専門知識がなければ、どの候補製品をさらに開発したり、市場に出すことができないかもしれません。
会社として、私たちの臨床開発における経験は非常に限られており、私たちの計画を成功させる可能性に悪影響を及ぼすかもしれません。
我々は2018年に独自の特許薬物発見作業を開始したばかりであり,会社としての臨床開発における経験は非常に限られている。われわれの臨床開発活動の設計,進行,達成に関する限られた経験は,われわれの計画推進に成功した可能性に悪影響を及ぼす可能性がある。また、もし私たちが臨床試験を行い、完成し、私たち自身の候補製品を開発した歴史があれば、私たちの特許薬物発見計画の将来の成功や実行可能性のどの予測もそんなに正確ではないかもしれません。
また,われわれが既存の要求の変化に緩やかあるいは適応できない場合や,新たな要求や臨床試験を管理する政策を採用すれば,われわれの発展計画は影響を受ける可能性がある。例えば、2022年12月、食品·薬物総合改革法案(FDORA)の成立に伴い、国会は、各新薬や生物製品の第3段階臨床試験または任意の他の“重要な研究”のための多様な行動計画の策定および提出をスポンサーに要求する。これらの計画はより多くの異なる患者群がFDA監督製品の後期臨床試験に参加することを奨励することを目的としている。具体的には,行動計画には,スポンサーの募集目標,これらの目標の基本原理,スポンサーがこれらの目標をどのように実現しようとしているかの解釈が含まれなければならない。このような要求に加えて、立法はFDAに多様な行動計画に関する新しいガイドラインを発表するように指示した。
また,欧州連合(EU)の臨床試験に関する規制構造が最近変化している。EU臨床試験条例(CTR)は2022年1月31日に施行された。臨床試験指令は、各加盟国で主管する国家衛生当局および独立した倫理委員会に単独の臨床試験申請(CTA)を提出することを要求しているが、CTRは集中的なプロセスを導入し、すべての関連加盟国に申請を提出することのみを要求している。CTRは、スポンサーが各会員国の主管当局と道徳委員会に文書を提出することを可能にし、各会員国が決定を下すことを可能にする。CTAの評価手続きも統一されており、すべての関連加盟国による共同評価を含み、道徳基準を含む各加盟国が個別にその領土に関する具体的な要求を評価する。各会員国の決定は集中されたEUポータルサイトを通じてスポンサーに伝達される。CTAが承認されると,臨床研究開発は継続可能である。CTRは3年間の過渡期が予想される。進行中の臨床試験と新たな臨床試験がCTRによってどの程度制御されるかはそれぞれ異なる。2022年1月31日までに“臨床試験指令”によるCTAの臨床試験については,“臨床試験指令”は過渡期に基づいて3年間適用される。また,スポンサーは2023年1月31日までに臨床試験指令やCTRに基づいてCTAを提出することを選択することが許可されており,許可されれば,これらのCTAは2025年1月31日までに臨床試験指令の管轄を受ける。その時まで、行われているすべての裁判は拷問禁止条約の規定に制限されるだろう。
私たちの特許薬物発見業務の増加に伴い、私たちは予見できない費用、困難、合併症、遅延と他の既知と未知の要素に直面する可能性がある。我々の特許薬物発見業務は,重大な臨床開発活動を支援できる業務に移行する必要がある。そのような移行で、私たちは成功しないかもしれない。
成功した臨床試験を行うには十分な数の患者を募集する必要があり,適切な患者の識別や募集は困難である可能性がある。
成功した臨床試験を行うには十分な数の患者を募集する必要があり,適切な患者の識別や募集は困難である可能性がある。 著者らが開発した任意の他の候補製品に対して、患者が未来の臨床試験に参加する資格を確定し、参加させることは著者らの成功に重要である。患者が臨床試験に参加し、患者の参加とフォローアップを完了することは、疾患の重症度を含む多くの要素に依存する;患者集団の規模、試験方案の性質;被験者が治療を受ける吸引力またはそれに関連する不快感とリスク;適切な能力と経験を有する臨床試験調査員の利用可能性;支持者;同じ患者の同一適応を競争している臨床試験の数;患者と臨床場所との近接度;試験地点の数と利用可能性;臨床試験に参加する資格と排除基準を遵守する能力;患者の同意を得て維持する能力;患者コンプライアンス;治療期間および治療後に患者の能力を監視する;および任意の健康大流行または流行病の影響。例えば、試験プランが患者に広範な治療後のプログラムや後続検査を受けて、私たちの候補製品の安全性と有効性を評価することを要求する場合、患者が私たちの臨床試験に参加することを阻止する可能性がある。もし患者が私たちより多くの臨床開発経験を持つ競争相手と一緒に競争製品の同期臨床試験に参加することを選択すれば、患者も著者らの臨床試験に参加しない可能性がある。
著者らは十分な数の患者を発見し、著者らの臨床試験に参加することができず、重大な遅延を招き、1つ以上の臨床試験を完全に放棄し、必要な監督管理許可を得ることを延期或いは阻止する必要があるかもしれない。私たちの臨床試験の登録遅延は私たちの候補製品の開発コストを増加させる可能性があり、これはわが社の価値を低下させ、追加融資を受ける能力を制限する。
我々は、締め切り前にこのような試験を完了できないことを含む第三者に依存して臨床試験を継続することを計画しているが、これらの第三者の表現は、候補製品のマーケティング承認を求めたり、商業化する能力を求めたり、延期したり、他の方法で私たちの業務を損なう可能性がある。
私たちは、SGR-1505およびSGR-2921を含む、第三者の臨床研究機関、および他の第三者、例えば、研究協力および連合、臨床データ管理組織、医療機関および臨床研究者に依存し、引き続き依存し、計画している。これらの契約研究組織と他の第三者はこれらの実験の進行とスケジュール及びその後のデータ収集と分析において重要な役割を果たしている。これらの第三者配置は、第三者が義務を履行できなかったことを含む様々な理由で終了する可能性がある。もし私たちが代替計画を達成する必要があれば、私たちの製品開発活動は延期されるかもしれない。
我々の第三者研究開発活動への依存は,これらの活動に対する我々の制御を減少させたが,我々の責任を軽減していない.例えば、私たちは私たちのすべての研究が適用された議定書と法律、法規、そして科学的基準に従って行われていることを確実にする責任があり、私たちの第三者への依存は私たちがこのような基準を遵守する責任を免除しないだろう。我々とこれらの第三者は,現在の良好な臨床実践やCGCPを遵守しなければならないが,これはFDAが我々の臨床開発におけるすべての製品に対して実行している法規とガイドラインである。ヨーロッパと他の管轄区域の規制機関も似たような要求を持っている。監督管理当局は定期的に試験スポンサー、主要な調査者、試験地点を検査することでこれらのCCCPを実行する。もし私たちまたはこれらの第三者のいずれかが適用されたCCCPを遵守できなかった場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられる可能性があり、FDAまたは同様の外国の規制機関は、私たちの上場申請を承認する前に追加の臨床試験を行うことを要求するかもしれない。特定の規制機関が私たちの臨床試験がCGCP法規に適合しているかどうかを確認することは保証できません。われわれはまた,行われている臨床試験を一定の時間範囲で登録し,米国政府が援助しているデータベースClinicaltrials.govで完成した臨床試験結果を公表することが求められている。そうしないと罰金、否定的な宣伝、そして民事と刑事制裁につながるかもしれない。
さらに、私たちが依存する第三者も他のエンティティと関係がある可能性があり、その中のいくつかは私たちの競争相手かもしれない。また、これらの第三者は私たちの従業員ではなく、私たちがこれらの第三者と合意した合意に基づいて私たちに提供した救済措置を除いて、彼らが私たちが行っている臨床、非臨床、臨床前プロジェクトに十分な時間と資源を投入しているかどうかを制御することができない。これらの第三者がその契約の義務または義務の履行に成功しなかった場合、または予想された期限内に完了できなかった場合、交換が必要である場合、または彼らが取得した臨床データの品質または正確性が影響を受ける場合、私たちの臨床試験は延長、遅延または終了される可能性があり、私たちは候補製品の発売承認を得ることができないか、または私たちの薬物を商業化することに成功できないか、または私たちの努力を遅らせることができるかもしれない。
私たちは第三者に依存して私たちの候補製品を生産し、これは私たちが許容可能なコストで十分な数の候補製品や製品、またはそのような数量を得ることができないリスクを増加させ、これは私たちの開発や商業化努力を延期、阻止、または損害する可能性がある。
私たちは候補製品を生産するための製造施設を持ったり運営したりしていませんし、私たち自身の製造業務を発展させる計画もありません。私たちは、私たちが開発した任意の開発候補薬の臨床前および臨床開発、および任意の承認された製品の商業供給(あれば)のために、私たちが必要なすべての原材料、薬品、および完成品を提供する第三者契約メーカーに依存し、引き続き依存することが予想される。私たちは薬物製造経験を持つ人員が限られていて、臨床規模でも商業規模でも、私たちの任意の候補製品を生産する資源と能力が不足している
我々の候補製品の臨床前研究と臨床試験を行うためには,既存の法規に適合した方法で我々の化合物を大量に生産できる適切なメーカーを見つける必要がある。私たちの第三者製造業者は、私たちの任意の候補製品の製造能力をタイムリーに、または費用効果的に向上させることに成功できないかもしれません。さらに、拡張活動中および他の任意の時間に品質の問題が発生する可能性がある。もし私たちのメーカーが十分な品質と数量で私たちの候補製品の生産規模を拡大することに成功できなければ、候補製品の開発、テスト、臨床試験は延期または不可能になる可能性があり、候補製品の規制承認や商業発表は延期または獲得できない可能性があり、これは私たちの業務を深刻に損なう可能性がある。
私たちは現在、第三者製造業者と私たちの候補製品の長期供給について何の合意も達成していない。将来、私たちは第三者製造業者と私たちの候補製品の商業供給について合意できないかもしれないし、受け入れ可能な条項でそうすることができないかもしれない。
たとえ私たちが第三者製造業者と合意を確立し、維持することができても、第三者製造業者に依存することは、第三者のコンプライアンスおよび品質保証に依存することを含むリスクをもたらす;第三者は製造協定に違反する可能性がある;私たちの固有情報は、私たちの商業秘密およびノウハウを含む流用される可能性があり、第三者は、私たちにとってコストが高いか不便なときに合意を終了または更新しない可能性がある。
第三者メーカーは、米国以外のcGMP法規や同様の規制要件を遵守できない可能性がある。私たちまたは私たちの第三者メーカーが適用された法規を遵守できなかったことは、罰金、禁止、民事処罰、遅延、休職、撤回を含む私たちへの制裁を招く可能性があります
承認、許可証の取り消し、候補製品または製品の差し押さえまたはリコール、運営制限、刑事起訴は、いずれも私たちの候補製品の供給に重大な悪影響を及ぼす可能性がある。
私たちの候補製品と私たちが開発する可能性のあるどの製品も他の候補製品や製品と製造施設を競争する可能性があります。CGMP法規の下で運営されているメーカーの数は限られており、私たちのために製品を製造する能力があるかもしれない。もし私たちが私たちの臨床前試験と臨床試験に任意の材料あるいは製品を提供する第三者がいかなる理由でこのようなことを停止することを雇用された場合、私たちは代替サプライヤーを確定し、同定すると同時に、これらの試験を推進する上で遅延があり、私たちに有利な条項で代替供給を得ることができないかもしれない。また、十分な候補製品やそれらを製造するための物質、または共同試験で使用される可能性のある任意の承認された薬剤を得ることができなければ、私たちの候補製品を開発し、効率的に競争することはより難しくなる。
私たちの現在と予想されている将来の他の候補製品生産への依存は、私たちの将来の運営結果や、私たちが候補製品を開発し、タイムリーで競争力に基づいてマーケティング承認を得た任意の製品を商業化する能力に悪影響を及ぼす可能性があります。
私たちの候補製品の開発または商業化の過程で深刻な不良または許容できない副作用が発見された場合、私たちは、そのような候補製品の開発および/または商業化努力を放棄または制限する必要があるかもしれない。
もし私たちの任意の臨床試験において深刻な有害事象または副作用が観察された場合、私たちは患者を私たちの臨床試験に参加することが困難になる可能性があり、患者は私たちの試験から撤退するかもしれない、または私たちは1つまたは複数の候補製品の試験または私たちの開発努力を完全に放棄することを要求されるかもしれない、または深刻な有害事象、副作用または他の特徴をリスク効果の観点からそれほど一般的ではなく、あまり深刻ではない、またはより受け入れやすいいくつかの用途または亜集団の開発をこれらの用途または集団に制限する。我々、FDA、同様の外国規制機関、または独立した機関審査委員会は、そのような試験における対象または患者が許容できない健康リスクまたは副作用に曝露されていると考えることを含む、様々な理由で候補製品の臨床試験を随時一時停止することができる。生物技術業界で開発されたいくつかの潜在療法は最初に早期試験で治療の将来性を示したが、その後副作用が発生することが発見され、それらの更なる発展を阻害した。副作用が候補製品の発売承認を阻止したり保持したりしなくても,他の療法と比較して承認製品の耐性により,副作用が市場の受け入れを阻害する可能性がある。また,最初に研究治療とは無関係と考えられていた有害事象は,その後研究治療によるものである可能性があり,承認および/または商業化後も同様である。このような事態のどのような発展も、私たちの業務、財務状況、そして見通しに実質的な損害を与える可能性がある。
臨床前研究と早期臨床試験の結果は後の臨床試験の成功を予測できない可能性があり、著者らの臨床試験結果はFDA或いは他の類似の外国監督機関の要求に符合しない可能性がある。
私たちの任意の候補製品の商業販売が規制部門の承認を得る前に、厳格に制御された臨床試験を通じて、私たちの候補製品がその期待用途に対して安全かつ有効であることを大量の証拠で証明するように要求されるだろう。臨床試験費用は高価であり,完成まで数年かかる可能性があり,その結果自体も確定していない。臨床試験では,いつでも失敗する可能性がある。臨床前研究と早期臨床試験の成功は未来の臨床試験が成功することを意味しない。我々の候補製品の臨床前研究における結果は、著者らが行っている臨床試験あるいは後期臨床試験の将来の結果を予測できないかもしれない。臨床前研究と早期臨床試験を通じて進展を得たが、後期臨床試験中の候補製品は十分な安全性と有効性を証明できない可能性があり、FDAと他の類似した外国の監督管理機関を満足させる。
ある場合、多くの要素のため、同じ候補製品の異なる臨床試験間の安全性と有効性結果は有意差が存在する可能性があり、試験方案の変化、患者群の大きさとタイプの差異、投与方案と他の試験方案の差異と遵守及び臨床試験参加者の退学率を含む。私たちの候補製品治療を受けた患者は、まだ手術、放射線、および化学療法を受けている可能性があり、他の承認された製品を使用したり、新薬を研究したりする可能性があり、これらは、私たちの候補製品とは無関係な副作用または有害事象をもたらす可能性がある。したがって,特定の患者の治療効果評価は大きく異なる可能性があり,臨床試験では患者や場所が異なる。この主観性は著者らの臨床試験結果の不確実性を増加させ、それに不利な影響を与える。私たちが行う可能性のある任意の臨床試験が一致または十分な有効性と安全性を証明するかどうか、マーケティング承認を得て私たちの候補製品を販売するのに十分であるかどうかはわかりません。臨床試験を開始した候補製品の多くは規制機関の商業化承認を得たことがない。
そのほか、臨床前研究と臨床データはよく異なる解釈と分析の影響を受けやすく、多くの会社は彼らの候補製品が臨床前研究と臨床試験で満足できると考えているが、依然としてFDA或いは類似の外国監督管理機関の許可を得られなかった。FDAや同様の外国規制機関が私たちのように実験結果を説明する保証はありませんし、私たちの候補製品の承認を求める申請を提出することができる前に、私たちが予想していたよりも多くの試験が必要かもしれません。試験結果がFDAまたは同様の外国規制機関を満足させてマーケティング申請を支援することができない場合、私たちの候補製品の潜在的な承認を支援するために、追加の試験を行うために、入手できない可能性のある大量の資源を費やしてしまう可能性がある。たとえ私たちの候補製品が規制部門の承認を得ても、このような承認の条項は私たちの候補製品の範囲と用途を制限する可能性があり、これはその商業的潜在力を制限する可能性がある。さらに、FDAや同様の外国規制機関の承認政策や規制が大きく変化する可能性があり、私たちの臨床データが承認されるのに十分ではなく、FDAや同様の外国規制機関が私たちの候補製品の承認を延期、制限、または拒否する可能性がある。
私たちが未来に発表或いは公表した臨床試験の一時、初期、“背線”と初歩的なデータはより多くの患者データの獲得に従って変化する可能性があり、そして監査と検証手続きの制限を受け、これは最終データの実質的な変化を招く可能性がある。
私たちは時々私たちの臨床試験の中期、初期、初歩またはバックラインデータを公開するかもしれない。これらのデータは当時利用可能なデータの初歩的な分析に基づいており、結果および関連する発見と結論は特定の試験に関連するデータをより全面的に検討した後に変化する可能性がある。私たちが完成する可能性のある臨床試験の中期データは、患者登録の継続とより多くの患者データの獲得に伴い、あるいは私たちの臨床試験の患者が彼らの疾患の他の治療を継続するにつれて、1つまたは複数の臨床結果が実質的に変化する可能性があるというリスクを受ける可能性がある。私たちはまた、私たちのデータ分析の一部として、すべてのデータを全面的かつ詳細に評価する機会がないか、または受け取る機会がないかもしれない仮説、推定、計算、および結論を出さなければならない。したがって、私たちの報告の中期、初期、バックライン、または予備結果は、同じ試験の将来の結果とは異なる可能性があり、またはより多くのデータを受信して十分な評価を行うと、異なる結論または考慮要因がこれらの結果を合格させる可能性がある。予備データまたはバックラインデータは依然として監査および確認手続きを受ける必要があり、これは最終データが私たちが以前に公表した予備データまたはバックラインデータと実質的な差がある可能性がある。したがって、最終データを取得する前に、中間データ、初期データ、バックラインデータ、および予備データを慎重に見るべきである。
中間データと最終データとの不利な違いは、私たちの名声と業務の将来性を深刻に損なう可能性があり、私たちの普通株式価格の変動を招く可能性があります。
私たちは将来アメリカ以外の場所で私たちの候補製品の臨床試験を行うつもりです。FDAはこれらの地点で行われた試験のデータを受け入れない可能性があり,米国以外で試験を行うことで余分な遅延や費用に直面する可能性がある。
将来的には米国以外の試験地点で候補製品の臨床試験を行う予定である。FDAは米国国外で行われた臨床試験のデータを受け入れることができるが、これらのデータの受け入れはFDAによって適用されるいくつかの条件に依存する。
外国の臨床試験のデータが米国での上場承認の唯一の根拠としようとする場合、FDAは通常、(I)データがアメリカの人口とアメリカの医療実践に適用されない限り、(I)データが米国の人口とアメリカの医療実践に適用されない限り、(I)試験はCGCP規定に基づいて公認された能力を有する臨床研究者によって行われる;および(Iii)データは有効であると考えられ、必要としない
FDAの現場検査,あるいはFDAがこのような検査が必要であると考えた場合,FDAは現場検査や他の適切な手段でデータを検証することができる。
また、外国の研究データが承認の唯一の根拠としようとしなくても、FDAは、この研究が何らかの条件を満たさない限り、上場承認申請の支援としてこれらのデータを受け入れない。例えば、臨床試験は、合格した研究者がcGCPに基づいて行われ、実施されなければならない。FDAは現場検査を含め,必要に応じて試験データを検証できる必要がある。試験群も米国人口に類似した特徴を持たなければならず,データは米国人口や米国医療実践に適用されなければならず,FDAが臨床的意義があると考えている方式は除外し,研究中の疾患が通常米国で発生しない限り。また,これらの臨床試験は適用される現地法に制限されているが,FDAがこれらのデータを受け入れるかどうかは,試験がすべての適用された米国の法律や法規にも適合しているかどうかに依存する。FDAが米国国外で行った試験データを受け入れる保証はない。もしFDAが私たちがアメリカ国外で行ったいかなる試験のデータも受け入れなければ、追加の試験が必要になる可能性が高く、これは高価で時間がかかり、未来の私たちの候補製品や潜在的な候補製品の開発を延期または永久的に停止するだろう。
また,米国以外での臨床試験はわれわれに重大な悪影響を及ぼす可能性がある。国際臨床試験を行う固有のリスクは:臨床実践モードと看護標準は国家によって異なる;非アメリカ監督機構の要求は著者らの臨床試験を行う能力を制限或いは制限する可能性がある;複数の非アメリカ監督機関モードで臨床試験を行う行政負担;為替レートの変動;及びいくつかの国家の知的財産権保護力の弱まりを含む。
もし私たちが現在または未来のパートナーと臨床開発に成功できなければ、規制部門の任意の候補製品の承認を得ることができない、あるいは任意の候補製品を商業化することができない、あるいはそうする過程で遅延に遭遇した場合、私たちの業務は実質的な損害を受ける可能性がある。
私たち自身の薬物発見プロジェクトの開発はまだ初期段階にある。私たちが製品収入を作る能力は私たちの候補製品の成功と最終商業化に大きく依存します。私たちは製品収入が何年も起こらないと予想しています。私たちおよび現在または未来のパートナーの開発と商業化計画の成功は以下のいくつかの要素に依存する
•臨床試験を開始するために必要な臨床前研究を成功させた
•患者の募集に成功し、臨床試験を完了した
•FDAまたは他の規制機関は、私たちと現在または未来の協力者が開発する可能性のある任意の候補製品の規制記録を受け入れている
•任意の候補製品の開発を継続するために、経験豊富な科学者と他の技術専門家チームを拡大し、維持する
•私たちと現在または未来のパートナーのために開発される可能性のある任意の候補製品は、知的財産権保護および規制の排他性を獲得し、維持する
•第三者製造業者と臨床的および商業的製造能力を手配または確立する
•薬品の販売、マーケティングと流通能力を確立し、許可を得た後に商業販売に成功した
•もし患者、医療界、第三者支払者が承認すれば、私たちと私たちの現在または未来のパートナーは任意の製品候補を受け入れるかもしれない
•他の治療法と効果的に競争し
•政府支払者を含む第三者支払者から、保険範囲、適切な価格設定、適切な補償を獲得し、維持する
•第三者支払い者が保証および/または十分な補償を受けていない場合、患者が自己負担料金を支払うことを望むかどうか
•衛生流行病または大流行およびそれに付随する結果による任意の制限は、内部および外部業務の遅延および制限をもたらす可能性がある
•どんな規制の承認を受けた後も、持続的に許容可能な安全状況を維持する。
その中の多くの要素は私たちがコントロールできないことであり、臨床結果、監督審査過程、私たちの知的財産権に対する潜在的な脅威、および任意の現在または未来のパートナーの製造、マーケティングと販売努力を含む。臨床薬物開発は長くて高価な過程に関連し、結果は不確定である。もし、私たちまたは私たちの現在または未来のパートナーが、任意の候補製品のマーケティング承認を開発し、それを商業化することに成功した場合、または私たちまたは彼らが上記の任意の要因または他の理由で遅延に遭遇した場合、私たちは、私たちの業務、将来性、財務状況、および運営結果に悪影響を及ぼす多くの追加の時間と資源を必要とするかもしれない。
我々が開発可能な任意の候補製品が市場承認を得ても,医師,患者,第三者支払者,医学界の他の人がビジネス成功に必要な市場受容度を達成できない可能性がある。
もし私たちが開発したすべての候補製品が市場の承認を得たら、それは依然として医者、患者、第三者支払人、医学界の他の人の十分な市場受容度を得ることができないかもしれない。また,異なる医師団体による治療ガイドラインや影響力のある医師の観点から製品を取り入れたり排除したりすることは,他の医師が治療処方を処方する意思に影響する可能性がある。医師、医師組織、病院、他の医療保健提供者、政府機関、あるいは個人保険会社が確定するかどうかを予測することはできません。競争相手の治療と比較して、私たちの任意の候補製品が商業販売を獲得すれば、安全で、治療効果があり、費用効果があります。教育医療界や第三者支払者は,我々が開発可能な任意の候補製品の利点を知るために大量の資源を必要とする可能性があり,成功しない可能性がある。もし私たちが開発する可能性のあるすべての候補製品が十分な受容度に達していなければ、私たちは著しい製品収入が生じないかもしれませんし、利益を上げることができないかもしれません。もし私たちが開発したすべての候補製品が商業販売に使用されることが許可された場合、市場のその製品に対する受け入れ度は複数の要素に依存する
•臨床試験で証明されたこれらの候補製品の有効性と安全性
•代替療法と比較した潜在的な利点と限界
•販売とマーケティング努力の有効性
•代替治療に関連する治療費
•臨床適応を承認しています
•代替療法と比較して投与の利便性と簡易性
•対象患者群が新たな療法を試みる意欲と,医師がこれらの治療法を処方する意欲
•有力なマーケティングと流通支援
•製品が市場に投入されるタイミングを競う
•第三者保険と適切な補償を提供する
•どんな副作用の流行や重症度も
•私たちの製品が他の薬と一緒に使用されることに対する制限は、承認されれば。
私たちの臨床試験と製品責任訴訟は私たちの資源を移転する可能性があり、私たちが重大な責任を負うことを招き、そして私たちの候補製品の商業化を制限する可能性があります。
私たちは、臨床試験で私たちの候補製品をテストすることに関連する固有の臨床試験と製品責任暴露のリスクに直面しており、私たちが開発可能な任意の製品を商業的に販売すれば、より大きなリスクに直面するだろう。現在、商業販売のための候補製品は承認されていませんが、臨床試験で候補製品を使用したり、将来承認された製品を販売したりすることで、責任クレームに直面する可能性があります。これらの声明は、製品を使用する患者、医療提供者、製薬会社、または他の人によって提起される可能性がある
このような製品を販売します。もし私たちが私たちの候補製品や製品に被害を与えるクレームを自己弁護することに成功できなければ、私たちは大きな責任を招くだろう。是非曲直や最終結果にかかわらず、賠償責任は
•私たちが開発する可能性のある候補製品の需要が減少しています
•私たちの名声とメディアの深刻な否定的な関心を損なう
•臨床試験参加者の脱退
•関連訴訟を正当化するための巨額の費用
•実験参加者や患者に多額の報酬を与え
•収入損失
•経営陣の資源を減らして業務戦略を推進する
•私たちが開発する可能性のある候補製品を商業化することはできない。
私たちが臨床試験を行っている国/地域に保険カバー範囲があり、他の国やより多くの候補製品で臨床試験を行う場合、あるいは任意の候補製品の商業化を開始すれば、保険カバー範囲を増やす必要があります。保険範囲はますます高くなっています。私たちは可能などんな責任にも対応するために、合理的な費用や十分な金額で保険範囲を維持することができないかもしれない。成功した臨床試験または製品責任クレームまたは一連のクレームが、保険に加入していない負債または保険を超える負債によって私たちに提起された場合、私たちの資産はそのようなクレームを支払うのに十分ではない可能性があり、私たちの業務運営は損害を受ける可能性がある。
私たちは激しい競争に直面しています。これは他の人が私たちよりも製品の発見、開発、商業化に成功し、それによって私たちの製品が競争力を失い、時代遅れになったり、私たちの市場規模を縮小したりする可能性があります。
私たちは多くの生物製薬とバイオテクノロジー会社からの私たちと私たちの協力者の候補製品の競争に直面している。生物技術と製薬業界の特徴は技術が迅速に進歩し、競争が激しく、特許と新製品及び候補製品を非常に重視していることである。私たちの競争相手はすでに開発していて、開発していますか、あるいは私たちの候補製品と競争しているか、あるいは私たちの候補製品よりも優れています。私たちは内部で、または私たちの協力者と開発と商業化に成功した任意の候補製品は、既存の療法や将来発売される可能性のある新しい療法と競争するだろう。
特に,腫瘍学分野での競争は非常に激しく,これがわれわれの薬物発見の重点である。私たちはアメリカと国際に競争相手がいて、大型国際製薬会社、老舗バイオテクノロジー会社、専門製薬会社、新興とスタートアップ会社、大学とその他の研究機関を含みます。また、これらの組織と競合して管理者、科学者、臨床開発者を募集しており、これは私たちの専門レベルや業務計画を実行する能力に悪影響を及ぼす可能性があります。著者らはまた、臨床試験場所の探しと構築、臨床試験被験者の募集、共同研究の評価及び肝心な臨床学科と学術センターから信頼できる主要な研究者と顧問を募集する競争に直面している。
例えば,我々のMALT 1阻害剤SGR−1505については,再発や難治性B細胞リンパ腫患者の治療に推進されており,エバービー社,小野製薬株式会社,HotSpot Treeutics,Exelixis,Inc.など,いくつかのMALT 1阻害剤が臨床開発されていることが知られている。また,承認され臨床開発されている二重特異性薬剤やCARTなどのB細胞リンパ腫の治療薬も知られている。
われわれのCDC 7阻害剤SGR−2921については,再発や難治性急性骨髄性白血病や高リスク骨髄異形成症候群の治療のための薬剤が開発されており,チャ泰天青薬業集団有限会社,LIN生物科学社,イギリス癌研究社が開発したCDC 7阻害剤の第一段階臨床開発がいくつか知られている
われわれが開発しているWEE 1/MYT 1阻害剤SGR−3515については,固形腫瘍治療用薬剤を開発しており,Zentalis製薬社,Debiamm International SA,Impact Treateutics,Inc.,初代ホールディングス,BioCity BiophmaおよびAprea治療会社,Repare治療社が進めているMYT 1阻害剤を含むいくつかのWEE 1阻害剤が臨床開発されていることが知られている。また,Acrivon治療会社が臨床前開発中のWEE 1/MYT 1阻害剤を進めていることが知られている。
特に大手製薬と生物技術会社は、専門家調査ネットワークの構築と利用、設計と臨床試験の実施、監督管理の許可及び生物技術製品の製造と商業化の面で豊富な経験を持っている。これらの会社の研究開発やマーケティング能力も私たちよりはるかに優れており、承認されたり、開発後期の段階にある製品や、私たちのターゲット市場でリーディングカンパニーや研究機関との協力手配もあるかもしれません。古い製薬会社やバイオテクノロジー会社も、新しい化合物の発見と開発を加速させたり、私たちが開発した候補製品を時代遅れにする可能性のある新しい化合物の使用を許可したりするために投資する可能性がある。もし私たちの競争相手が私たちの製品よりも安全で、より効果的で、副作用が少なく、より便利で、より安い製品を開発し、商業化すれば、私たちのビジネス機会は減少または消失するかもしれない。規模が小さい、または初期段階にある企業も、特に大型および成熟会社との協力を通じて、私たちの計画の補完または必要な技術を得る上で重要な競争相手であることが証明される可能性がある。これらのすべての要因により、私たちの競争相手は、私たちの前にFDAや他の同様の外国規制機関の承認を得ることに成功したり、私たちの前に私たちの分野の製品を発見、開発、商業化することに成功するかもしれない。
私たちの運営に関わるリスクは
国際的な業務展開は私たちの業務に運営と財務リスクをもたらすだろう。
2023年12月31日までの会計年度では、米国以外の顧客向け売上高が私たちの総収入の約25%を占めています。国際市場での運営には大量の資源と管理層の関心が必要であり、米国とは異なる規制、経済、政治リスクに直面させている。いくつかの国際市場での私たちの経営経験は限られており、他の国際市場での私たちの拡張努力が必ず成功することは保証できない。私たちが米国や他のすでに業務を持っている国際市場での経験は、他の市場での私たちの拡張能力とは関係がないかもしれない。私たちの国際拡張努力は、アメリカ以外で私たちの解決策のさらなる需要を作ることに成功しないか、あるいは私たちが参入した国際市場で私たちの解決策を効果的に販売することに成功しないかもしれない。また、私たちは国際的に業務を展開する際に、私たちの業務に悪影響を及ぼす可能性のあるリスクに直面しています
•外国語への翻訳を含む具体的な国の現地化と私たちの解決策を調整する必要がある
•データプライバシー法は、指定された地域で顧客データを格納および処理するか、または我々が通常顧客データを処理する方法とは著しく異なる方法で処理することを要求する
•従業員の法律と法規を含む外国人業務員の配置と管理の困難
•異なる価格設定環境、長い販売サイクル、長い売掛金支払い周期、および入金の問題
•医療保健制度、薬品監督と精算及び薬品発見と開発やり方と技術面の違い
•新しい競争源があります
•知的財産権やその他の法的権利の保護は米国より弱く、米国国外で知的財産権や他の権利を実行することは実際的に困難である
•地元の競争者に有利な法律とビジネス慣行
•雇用、税収、精算と価格設定、プライバシーとデータ保護、反賄賂法律法規など、複雑で、衝突し、変化し続ける政府の法律法規に関連するコンプライアンス挑戦
•財務会計と報告書の負担と複雑さを増加させる
•資金移転の制限
•外交と貿易関係の変化は、新関税、貿易保護措置、輸出入許可要求、貿易禁輸、その他の貿易障壁を含む
•国内及びその他の国及び司法管轄区域内の対外貿易、製造、発展及び投資に関する社会、政治及び経済条件又は法律、法規及び政策の変化;
•源泉徴収税を支払う必要がある可能性があることを含む不利な税金の結果
•最近の新冠肺炎のような世界的な衛生大流行や流行病
•不安定な地域、経済、そして政治状況。
私たちの国際協定は現地通貨で支払うことを規定するかもしれませんが、私たちの現地運営コストは現地通貨で価格を計算します。そのため、ドルに両替する際、ドルと外貨価値の変動が私たちの経営業績に影響を与える可能性があります。
また,我々の特許薬物発見計画については,ロシアとウクライナの間で行われている戦争は,この地域での契約研究組織やCRO生産がいくつかの臨床前研究所に必要な材料を行う能力に影響する可能性がある。もし私たちが必要なこのような材料の代替源を得ることができなければ、私たちがいくつかの臨床前研究を適時に実行し、完成する能力は不利な影響を受ける可能性がある。
しかも、イギリスのEU離脱によって、私たちは一般的にイギリスの離脱と呼ばれるより高いリスクに直面するかもしれない。イギリスの薬品に対する監督管理の枠組みは薬品の品質、安全性と有効性、臨床試験、マーケティング許可、商業販売と流通をカバーしているため、EUの指令と法規に由来し、イギリスの離脱の結果及びイギリス製品と候補製品の承認に適用される未来の監督管理制度はまだ不明である。
疾病やその他の公衆衛生流行病や流行病の広範な爆発(例えば最近の新冠肺炎の大流行)は私たちの業務の様々な方面にマイナス影響を与える可能性があり、私たちは顧客への義務を履行することを難しくし、顧客の需要の減少と私たちの薬物発見と開発計画の遅延を招く可能性がある。
私たちの業務と運営は、最近の新冠肺炎疫病を含む公衆衛生流行病の悪影響を受ける可能性があり、私たちおよび私たちの顧客と協力者が運営する市場や業界に影響を及ぼす可能性がある。
新冠肺炎関連突発公共衛生事件の申告締め切りは2023年5月11日である。突発的な公共衛生事件が終了した時、アメリカ食品薬品監督管理局はいくつかの新冠肺炎と関連する政策を終了し、他の政策を保留した。現在、これらの発展が私たちの候補製品の開発と商業化の努力にどのように影響するかは不明である。
最近の新冠肺炎の大流行を含む公衆衛生流行病あるいは大流行は、私たちと私たちの協力者のいくつかの薬物発見と開発計画の進展遅延、特に臨床前研究と臨床試験を行っているか、あるいは臨床試験に入る準備をしている薬物を招く可能性がある。我々と我々の協力者の薬物発見計画と比較して、最近の新冠肺炎の大流行は、将来的に現在および未来のINDイネーブル研究および臨床試験中断、製造中断、試験地点中断を招き、必要な機関審査委員会、機関生物安全委員会、または他の必要な場所の承認を得る能力に影響を与える可能性がある。このような妨害はすでに引き起こされ、未来に私たちと私たちの協力者のいくつかの薬物発見計画の遅延をもたらす可能性がある。例えば、私たちの契約製造組織またはCMOと私たちのCROは研究規模生産を担う能力の低下を経験し、私たちが完成したSGR-2921に対するINDイネーブル研究を含む臨床前研究を実行する上で遅延に遭遇した。このような削減と遅延は未来に再び起こるかもしれない。また,我々の協力者が彼らの薬物発見や開発計画において類似した遅延に遭遇すれば,マイルストーンや関連収入のさらなる遅延をもたらす可能性がある。公衆衛生の大流行による経済的影響により、私たちのある顧客は自分の業務で低迷や不確実性を経験する可能性があり、これは私たちのソフトウェア製品とサービスへの支出を減少させるかもしれない。
新冠肺炎の灰再発、新冠肺炎変異ウイルスの出現或いは任意の他の広範囲の公共衛生疫病の発生の最終的な影響は高度に不確定で、予測できず、しかも変化が発生する可能性があるが、最近の新冠肺炎の大流行の灰再発は著者らの業務、財務状況、運営結果と将来性に不利な影響を与える可能性がある。
もし私たちの技術運営インフラを管理できなければ、私たちの既存の顧客と内部薬物発見チームはサービス中断に遭遇する可能性があり、私たちの新しい顧客は私たちの解決策を展開する時に遅延に遭遇する可能性があります。
私たちの運営インフラでサポートされているユーザーとデータの数は著しく増加している。私たちは、私たちのすべての顧客のニーズを満たすために、私たちの運営インフラにおいて十分な過剰能力を維持し、私たちの特許薬物発見計画を支援することを求めています。新たな顧客展開の迅速な提供と既存の顧客導入の拡張を促進するために、過剰生産能力を維持することも求めています。さらに、バージョン制御、ハードウェア、およびソフトウェアパラメータの変更、および私たちのソリューションの発展をサポートするために、私たちの技術運営インフラを適切に管理する必要があります。しかし、新しいホストインフラを提供するには十分な準備時間が必要だ。私たちは、将来的にもサイト中断、停止、その他の性能問題を経験する可能性があることを経験した。これらのタイプの問題は、インフラ変更、人為的またはソフトウェアエラー、ウイルス、セキュリティ攻撃、詐欺、使用量の急増、およびサービス拒否の問題を含む様々な要因によって引き起こされる可能性がある。場合によっては、私たちは、許容可能な期間内にこれらの性能問題の1つまたは複数の理由を決定することができないかもしれない。もし私たちのインフラ需要を正確に予測していなければ、私たちの既存の顧客はサービス中断を経験するかもしれません。これは私たちを経済的処罰、財務負債、顧客損失に直面させるかもしれません。もし私たちの運営インフラが販売と使用の増加についていけなければ、顧客と私たちの内部薬物発見チームは、私たちがより多くの容量を得ることを求めた時に私たちの解決策の配置を遅延させる可能性があり、これは私たちの名声に悪影響を与え、私たちの収入に悪影響を及ぼすかもしれない。
中の変更税金.税金法律またはその実施または説明は私たちの業務と財務状況に悪影響を及ぼすかもしれない。
税法の変化は私たちの業務や財務状況に悪影響を及ぼすかもしれない。コロナウイルス援助、救済·経済安全法案またはCARE法案によって改正された減税·雇用法案、あるいは2017年の税法は、改正後の1986年の国内収入法または同法の重大な改正を行った。その他の事項を除いて、2017年の税法には、会社税率を最高限界税率の35%から21%の統一税率に引き下げ、純営業損失(NOL)の控除額を今年度の課税所得額の80%に制限することが含まれている(いずれのNOLも無期限に繰り越すことができる)。また、2022年から、2017年税法は現在の研究開発支出を差し引く選択を廃止し、企業に5年または15年以内に資本化と償却(外国研究のための支出)を要求している。
CARE法案に加えて,国会の新冠肺炎対策の一部として,2020年と2021年には税収条項を含む経済救済立法が公布された。2022年8月には、“インフレ低減法案”(IRA)も法律に署名した。アイルランド共和軍は、上場企業のある株の買い戻しに1%の消費税を課すことを含む新たな税金条項を導入した。1%の消費税は、一般に、金銭または他の財産(会社自体の株式を除く)と交換するために、上場企業(またはそのいくつかの付属会社)が会社株主から株を買収するのに適用されるが、極めて最低限の例外がある。したがって、消費税は非伝統的な株の買い戻しのいくつかの取引に適用される可能性がある。2017年の税法、アイルランド共和軍、およびこのような追加立法によって提供される規制指導は継続されており、このような指導は、最終的には、これらの法律が私たちの業務や財務状況に与える影響を増加または減少させる可能性がある。追加的な税金立法が公布されるかもしれないし、どんな追加立法も私たちの会社に影響を及ぼす可能性がある。また,各州が2017年税法,アイルランド共和軍,追加税法をどの程度遵守するかは不明である。
私たちはNOLと研究開発税収控除を使用して未来の課税収入を相殺する能力は一定の制限を受けるかもしれない。
2023年12月31日までに、連邦NOLは約179.1ドルです 百万ドルと州NOLは約98.6ドルです 100万ドルは、利用しなければ2025年に満期になるのが一般的だ。2023年12月31日までに、約23.3ドルの連邦研究開発税控除があります 100万ドルと州の研究開発税は約160万ドルに振り替えられます 百万ドルです。未使用の信用限度額は2024年に満期になり、未使用を継続すれば、通常は時間の経過とともに満期になる。これらのNOLと研究開発税収の繰越免除は満期になる可能性があり、未使用であり、将来の所得税負債を相殺するためにも使用できない。
また、“法典”第382条と383条及び州法律の関連条項によると、会社は“所有権変更”を経験し、通常、ある株主が3年以内にその持分所有権の変化が50ポイントを超え(価値によって計算される)と定義され、その変更前のNOLと研究開発税収の繰越免除を利用して将来の課税所得額を相殺する能力が制限される。私たちは2023年12月31日に分析を行い、所有権変更が2021年3月31日に発生したことを確定した。このような所有権変更や将来の所有権変更のため、私たちがNOLと研究開発税収を使用して繰越を免除する能力は実質的に制限される可能性がある。
もう一つのリスクは、NOLの使用停止や他の予測不可能な理由のような法規の変化により、私たちの既存のNOLが満期になるか、または他の方法で将来の所得税債務を相殺できない可能性があるということだ。上述したように、税法またはその実施または解釈の変化は、私たちの業務および財務状況に悪影響を及ぼす可能性があり、CARE法案によって改正された2017年の税法には、米国連邦税率およびNOL繰越管理規則の変化が含まれており、これらの変化は、将来的にNOLを用いて課税収入を相殺する能力に著しく影響する可能性がある。さらに、一方の州で生成された州NOLは、他の州から発生した収入を相殺するために使用することはできない。このような理由で、私たちは私たちのNOLと他の税金属性の実質的な部分を使用できないかもしれない。
私たちの国際事業は私たちを潜在的な不利な税金結果に直面させる。
私たちは世界の異なる司法管轄区での業務運営状況に基づいて、これらの管轄区での課税収入を報告します。このような管轄区域はドイツ、イギリス、日本、インド、韓国を含む。私たちの業務活動の国際的性質と組織は、異なる司法管轄区の税務機関によって実行される複雑な譲渡定価法規の制約を受けている。税務機関は特定の管轄区域に帰属できる収入と支出の決定に同意しないかもしれない。もしこのような相違があって、私たちの地位が維持できなければ、私たちは追加の税金、利息、罰金を支払う必要があるかもしれません。これは一度の税金、より高い有効税率、キャッシュフローの減少、そして私たちの業務全体の収益力の低下を招く可能性があります。
税務機関は成功的に断言するかもしれないが、私たちは販売と使用、付加価値税または類似税を徴収すべきであり、私たちは過去または未来の販売によって税務責任を負うかもしれない。これは私たちの経営業績に悪影響を及ぼすかもしれない。
私たちは販売業務を持っているすべての管轄区域で販売と使用税、付加価値税、および似たような税金を徴収しているわけではありません。このような税金は適用されないと思いますが、私たちはその管轄区域についてこのような税金を徴収する必要がありません。販売と使用、付加価値税および類似した税法と税率は司法管轄区域によって大きく異なる。私たちがこのような税金を徴収しないいくつかの司法管轄区域は、このような税金が適用されると断言するかもしれないが、これは納税評価、罰金、利息を招く可能性があり、私たちは将来このような税金を徴収することを要求されるかもしれない。このような納税評価、罰金、および利息または将来の要求は、私たちの運営結果に悪影響を及ぼす可能性があります。
私たちの実際の税率の意外な変化は私たちの未来の業績を損なうかもしれない。
私たちはアメリカと各外国の管轄区で所得税を納めなければなりません。私たちの国内と国際納税義務も司法管轄区の費用分配状況によって決められます。予測される年間有効税率は複雑で、不確実性の影響を受け、私たちの予測税率と実際の税率の間には大きな差がある可能性がある。私たちの有効税率は、法定税率の異なる国/地域の損益組み合わせの変化、買収によるいくつかの相殺不可能な費用、繰延税金資産と負債の推定値、連邦、州または国際税法と会計原則の変化によって悪影響を受ける可能性がある。私たちの有効税率を上げることは私たちの収益性を下げ、場合によっては私たちの損失を増加させるだろう。
しかも、私たちは世界各地の多くの税務管轄区域の所得税監査を受けるかもしれない。我々の所得税負債は適用された法律や原則に基づいて合理的に推定·計算されていると考えられるが、任意の時期の1つまたは複数の不確定な税収状況の不利な解決は、その時期の経営業績に大きな影響を与える可能性がある。
私たちは将来的に会社、業務、解決策、技術を再買収する可能性があり、これは私たちの経営陣の関心を分散させ、私たちの株主へのさらなる希釈を招き、他の方法で私たちの運営を混乱させ、私たちの経営業績に悪影響を及ぼす可能性があります。
私たちは、将来的に私たちの解決策を補完または拡張することができると考え、私たちの技術力を強化し、または他の方法で成長機会を提供することができると考えられるビジネス、解決策、または技術を再び得ることができます。適用することができます
例えば、2022年1月、私たちはXtal BioStructures,Inc.またはXtalを買収し、生物物理的方法、タンパク質生産と精製、およびX線結晶学を含む構造生物学的サービスを提供する会社であり、これは私たちが薬物発見計画のために高品質な標的構造を生産する能力を増強した。潜在的な買収の追求は経営陣の注意をそらす可能性があり、これらの買収が完了しているかどうかにかかわらず、適切な買収を識別、調査、求める際に様々な費用が発生する可能性がある。
また、我々がXtalを買収する以外に、他の事業を買収する上での経験は限られている。私たちが他の業務を買収すれば、買収した人員、運営、技術の統合に成功できない可能性があり、買収後に合併後の業務を効率的に管理することができず、現在存在すると考えられる業務部門間の運営協同効果を維持することもできない。いかなる買収後も、取引が合理的であることを証明するために、予想される相乗効果を達成することは保証できません。これは、多くの要素が含まれているからです
•得られた技術またはサービスを利益を得るために利益を得ることができない
•買収に関連した意外なコストや負債
•買収に関連するコスト
•買収された企業の会計制度、業務、人員の統合が困難である
•買収された企業のレガシー製品およびホスト·インフラをサポートすることに関連する困難および追加費用
•買収された企業の顧客を収入、許可、サポート、または専門サービスモデルの違いを含む、買収された企業の解決策と契約条項に変換することは困難である
•経営陣の関心を他の業務から移す
•事業パートナーと顧客との既存の業務関係に対する買収の悪影響
•重要な従業員の潜在的な流出
•私たちの業務の他の部分に必要な資源を使用して
•私たちが使える現金の大部分を使って買収を完成させる。
また、我々が買収した会社の買収価格の大部分は、買収された営業権や他の無形資産に分配される可能性があり、これらの資産は少なくとも毎年減値評価を行わなければならない。将来、私たちの買収に予想されるリターンが生じなければ、この減価評価過程に基づいて私たちの経営業績を計上することが要求されるかもしれません。これは私たちの経営業績に悪影響を及ぼす可能性があります。
買収は株式証券の希釈発行や債務の発生を招く可能性もあり、我々の経営業績に悪影響を及ぼす可能性がある。また、買収された企業が私たちの予想に達しなければ、私たちの経営業績、業務、財務状況が影響を受ける可能性があります。
私たちの主要施設で自然災害や他の悲劇的な事件が発生した場合、私たちの運営は中断されるかもしれない。
私たちの業務は主にニューヨーク、ニューヨーク、オレゴン州ポートランドとインドハイデラバードの施設とニュージャージー州クリフトンにある内部ホスト施設で行われます。自然災害や他の悲劇的な事件の発生は私たちの行動を混乱させるかもしれない。私たちの施設やその地域で発生したどんな自然災害や悲劇的な事件も、私たちの運営に大きなマイナス影響を及ぼす可能性がある。
私たちの知的財産権に関するリスクは
もし私たちがコロンビア大学との既存の許可協定、私たちの任意の他の知的財産権許可、または任意の未来の知的財産権許可下の義務を履行できなかった場合、または私たちと現在または任意の未来の許可者との業務関係が妨害された場合、私たちは私たちの業務に重要な知的財産権を失うかもしれない。
私たちは複数のライセンス協定に署名し、これらの合意に基づいて、いくつかの特許、ソフトウェアコード、およびソフトウェアプログラムの独占的および非独占的なグローバルライセンスを取得し、当社のソフトウェアソリューションのマーケティングおよび販売に関するライセンス技術を複製、使用、実行、複製、運営、再ライセンスおよび配布し、改善した。特に,我々はコロンビア大学とのライセンス契約に基づいて彼らから許可を得た技術を我々の多くのソフトウェア解決策に適用し,我々の多くのソフトウェア解決策に統合し,これらの解決策を顧客にマーケティングし許可する.コロンビア大学とのライセンス契約の詳細については、“項目1.コロンビア大学とのビジネスライセンス契約”を参照されたい。私たちはコロンビア大学と他の許可者との許可協定が私たちに適用され、私たちは未来の許可が私たちに特定の印税と他の義務を課すと予想している。
私たちは最善を尽くしたにもかかわらず、私たちの現在または未来の許可者は、彼らとのライセンス合意に深刻に違反している可能性があり、したがって、ライセンスプロトコルを終了し、既存のソフトウェアソリューションのマーケティングおよび販売、およびこれらのライセンスプロトコルがカバーする技術を開発および商業化するための新しいソフトウェア解決策を開発および商業化する能力を遅延させる可能性がある。これらの許可が終了した場合、または基礎知的財産権が予想される排他性を提供できなかった場合、競合他社は、我々と同様の製品および技術を販売する可能性がある。これは私たちの競争地位、業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすかもしれない。
ライセンス契約によると、知的財産権に関する論争が発生する可能性があります
•ライセンス契約に従って付与された権利範囲および他の解釈に関する問題;
•私たちの技術およびプロセスは、ライセンス契約に拘束されていないライセンス側の知的財産権をどの程度侵害しているか
•特許および他の権利は、任意の協力開発関係の下で再許可される
•私たちの現在または未来のライセンシー、ならびに私たちと私たちの協力者が知的財産権によって生成された発明および独自技術の発明および所有権を共同で創造または使用すること;
•特許技術発明の優先権。
また,ライセンスプロトコルは複雑であり,このようなプロトコルのいくつかは様々な解釈の影響を受ける可能性がある.可能性のある契約解釈の相違の解決は、関連する知的財産権または技術に対する私たちの権利の範囲を縮小するか、または関連協定の下での私たちの財務または他の義務を増加させることができるかもしれません。例えば、私たちの相手側は過去に支払い義務に基づいて彼らの借金を議論していましたが、今後も議論される可能性があります。我々が許可している知的財産権をめぐる紛争が、ビジネス的に許容可能な条項で現在の許可スケジュールの能力を維持していることを阻害または損害すれば、新しいソフトウェアソリューションの開発および商業化、既存のソフトウェアソリューションをマーケティングおよび販売する能力に遅延が生じる可能性があり、これは、私たちの業務、財務状況、運営結果、および将来性に大きな悪影響を及ぼす可能性がある。
私たちは既存または未来の薬物発見協力協定によって負担される義務によって、私たちの業務に重要な知的財産権を制限するかもしれません。さらに、既存または将来の協力協定の下での義務を履行できなかったり、以前、現在、または未来のパートナーとの業務関係が妨害された場合、私たちは私たちの業務に非常に重要な知的財産権を失う可能性があります。
私たちはバイオ製薬会社と協力して合意する側であり、協定によると、薬物発見サービスを提供していますが、協力によって生じるいくつかの知的財産権には所有権がないか、あるいは共同所有権のみです。我々はまた、内部で発見された候補製品を開発し、潜在的な商業化を行うための協力協定にBMSと署名し、場合によっては協力によって生成されるいくつかの知的財産権の共同所有権を規定する。私たちは将来的に追加的な協力協定を締結するかもしれませんが、合意によると、私たちは未来の協力によって生じるいくつかの知的財産権に所有権がないか、または共通の所有権しか持っていないかもしれません。私たちの以前、現在、または未来の協力によって生成されたこのような知的財産権の所有権または許可を得ることができず、私たち自身の独自技術または製品候補プロジェクトと重複または関連している場合、私たちの業務、財務状況、運営結果、および見通しは深刻な損害を受ける可能性がある。
私たちの既存の協力協定は、特定の期間内に特定の目標に対して私たちの協力者のために化合物を設計することを要求するいくつかの排他的義務を含む。我々の将来の協力協定は,このような協力のテーマである将来の協力者に目標(S)に関する類似排他的権利を付与する可能性がある.既存または未来の協力協定はまた職務調査義務を私たちに強要するかもしれない。例えば、既存または将来の協力協定は、私たちが現在または未来の他のパートナーのために薬物開発目標を追求することを制限し、それによって、私たちが開発および商業化できない、または他の現在または未来のパートナー、候補製品、および薬物開発目標に関連する技術の共同開発および商業化を制限する可能性がある。例えば、我々のBMSとの協力によれば、我々は、その目標が合意内のより早い者またはその目標に関連する計画の最後の印税期限が満了するまで、合意に指定された目標の候補製品を世界のどこでも開発および商業化することを禁止される。私たちが最善を尽くしたにもかかわらず、私たちの以前、現在、または未来の協力者は、私たちが協力協定に深刻に違反していると結論を出すかもしれない。これらの協力協定が終了した場合、または基礎知的財産権が私たちの所有または許可の範囲内で予想される排他性を提供できなかった場合、競争相手は規制部門の承認を求め、私たちと同じ製品や技術を市場に出す権利があるだろう。これは私たちの競争地位、業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすかもしれない。
協力協定によると、知的財産権に関する論争が発生する可能性がある:
•協力協定に従って付与された所有権または許可範囲、ならびに解釈に関連する他の問題;
•私たちの技術および製品候補は、私たちが協力協定の下で所有権または許可を持っていない協力者の知的財産権をどの程度侵害しているか
•知的財産権およびその他の権利の譲渡または再許可協力協定
•協力協定の下での私たちの職務義務と、どのような活動がこれらの職務義務を満たしているのか
•私たちは、現在または未来の協力者と共同で知的財産権を創造または使用することによって生成された発明およびノウハウの発明および所有権を有する。
また、協力協定は複雑であり、このようなプロトコルのいくつかの条項は様々な解釈の影響を受ける可能性がある。可能性のある契約解釈の相違の解決は、関連知的財産権に対する私たちの権利と考えられる範囲を縮小するか、または関連協定の下での私たちの義務を増加させる可能性があり、いずれも、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性があります。さらに、私たちが協力協定によって所有、共同所有、または許可された知的財産権紛争が、商業的に許容可能な条項で現在の協力計画を維持する能力を阻害または弱化させた場合、影響を受ける技術や候補製品の開発に成功し、商業化することができない可能性があり、これは、私たちの業務、財務状況、運営結果、および将来性に大きな悪影響を及ぼす可能性がある。
もし私たちの技術や候補製品のために特許保護を獲得し、維持し、実行し、保護することができない場合、または取得された特許保護範囲が十分でなければ、私たちの競争相手は、私たちと同様または同じ技術および製品を開発し、商業化する可能性があり、私たちの技術および候補製品の開発と商業化に成功する能力は不利な影響を受ける可能性がある。
私たちの成功は、私たちが開発した任意の独自技術および候補製品について、私たちが単独で他人と共同で所有する可能性のある知的財産権の保護、または他の人から許可、特にアメリカおよび他の国/地域での特許を取得し、維持する能力があるかどうかに大きく依存する。我々は,我々の技術や我々が開発可能な我々の業務に重要な任意の候補製品に関する特許出願を米国や海外に提出し,我々の技術や候補製品に関連する知的財産権を付与することで,我々の独自の地位を保護することを求めている.もし私たちが任意の独自技術または候補製品の特許保護を獲得または維持できない場合、私たちの業務、財務状況、運営結果、および見通しは実質的な損害を受ける可能性がある。
特許訴訟過程は高価で、時間がかかり、複雑であり、私たちは合理的なコストまたはタイムリーな提出、起訴、維持、弁護、またはすべての必要または望ましい特許出願を許可することができないかもしれない。我々は,特許保護を得るのが遅くなるまで,我々の研究開発成果で特許を申請できることを確認できない可能性もある.さらに、場合によっては、私たちは、第三者と共同で所有する技術、または第三者から取得された許可を含む、特許出願の準備、提出および起訴を制御する権利がないか、または特許を維持、実行および擁護する権利がないかもしれない。したがって、これらの共同所有および許可内の特許および出願は、私たちの業務の最良の利益に適合する方法で準備、提出、起訴、維持、弁護、実行されてはならない。
ソフトウェアと生物製薬会社の特許地位は通常高度に不確定であり、複雑な法律と事実問題に関連しており、近年多くの訴訟のテーマとなってきた。また、米国以外の特許保護範囲は不確定であり、米国以外の国の法律は米国の法律のように私たちの権利を保護できない可能性があり、その逆も同様である。所有および許可内の特許権については,我々,我々の協力者,および我々の許可者が現在求めている特許出願が任意の特定の司法管轄区域で特許として発行されるかどうか,または任意の発行された特許の権利主張が競争相手の攻撃から十分な保護を提供するかどうかを予測することはできない.さらに、私たちは、私たちのコンピューティングプラットフォーム、技術、および私たちが開発する可能性のある任意の候補製品に関連するすべての第三者知的財産権または既存技術を知らないかもしれません。さらに、科学文献に発表された発見は、実際の発見よりも遅れがちであり、米国および他の司法管轄区域の特許出願は、通常、優先権出願を提出してから18ヶ月後に公表されるか、または場合によっては全く公表されない。したがって、私たち、私たちの協力者、または私たちのライセンシーは、私たち、私たちの協力者、または私たちの許可者が、私たちの現在または将来所有または許可された特許および特許出願において要求された最初の発明であること、または私たち、私たちの協力者または私たちの許可者が、そのような発明のために特許保護を申請する最初の人であることを正確に知ることはできない。そのため,我々が所有,共有,授権された特許権の発行,範囲,有効性,実行可能性,商業的価値は非常に不確定である.さらに、私たちが所有し、共同所有し、許可している保留および将来の特許出願は、私たちの技術および候補製品の全部または一部を保護するために、または他社が競争相手の技術および製品を商業化することを効果的に阻止するために、特許発行を招くことができないかもしれない。米国および他の国/地域特許法または特許法解釈の変化は、私たちが所有している、共同所有または許可されている現在または未来の特許の価値を低下させる可能性があり、また、私たちの特許権を獲得、保護、維持、擁護、実行する能力は、私たちの特許保護範囲を縮小し、より広く言えば、私たちの特許権の価値に影響を与えるか、または縮小する可能性がある。例えば,最高裁の最近の裁決は,米国が特許保護を受ける資格がある主題の範囲を縮小し,それ以来,多くのソフトウェア特許が抽象概念に関連して無効と宣言されている.
未解決の仮特許出願に基づいて保護を求めるためには、適用される期限までに特許協力条約出願、非米国出願、および/または米国非仮特許出願を提出する必要がある。上述したように、その時点でも、私たちの特許出願は決して特許を発行しない可能性があり、または任意の特許の範囲が競争優位性を提供するのに不十分である可能性がある。
さらに、私たち、私たちの協力者、または私たちの許可者は、既存技術を米国特許商標局またはUSPTOの第三者に事前発行したり、反対、派生、撤回、再審査に参加したりするかもしれません各方面間私たちの特許権または他人の特許権の介入手続きを審査、許可後に審査または挑戦します。このような提出、訴訟、または訴訟における不利な裁決は、私たちの特許権の範囲を縮小したり、無効にしたり、第三者が私たちの技術または候補製品を商業化し、私たちに支払うことなく、直接私たちと競争することを可能にする可能性があります。もし私たちが所有している、共同所有または許可されている現在または未来の特許および特許出願によって提供される保護の広さまたは強度が脅かされている場合、結果にかかわらず、会社が現在または将来の候補技術または製品を許可、開発、または商業化することを阻止することができる。
また、特許出願において要求されるカバー範囲は、特許発行前に大幅に縮小することができ、その範囲は特許発行後に再解釈することができる。私たちが所有し、共同所有し、許可している現在および未来の特許出願が特許の形で発表されても、それらの発表形態は私たちに意味のある保護を提供してくれ、競争相手が私たちと競争することを阻止したり、他の方法で私たちにどんな競争優位性を提供してくれたりしないだろう。特許の発行は、その発明性、範囲、有効性、または実行可能性に対して決定的ではなく、私たちが持っている特許および許可されていない特許は、米国および海外の裁判所または特許庁で挑戦される可能性がある。このような挑戦は、排他性喪失、または特許主張の全部または部分的な縮小、無効、または実行不能をもたらす可能性があり、それにより、同様のまたは同じ技術および製品を使用することを阻止するか、またはそれを商業化する能力を制限するか、または我々の技術および候補製品の特許保護期間を制限する。最終的な結果が私たちに有利であっても、このような訴訟は巨額のコストを招く可能性があり、私たちの経営陣や従業員に時間がかかる必要がある。特に、新製品候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。さらに、我々の競争相手は、同様の技術または代替技術または製品を非侵害的に開発することによって、私たちが所有している、共通所有または許可中の現在または将来の特許を回避することができるかもしれない。したがって、私たちが所有し、共同所有し、許可している現在または将来の特許の組み合わせは、他社が私たちの任意の候補技術および製品と類似しているか、または同じ技術および製品を商業化することを阻止するために、十分な権利を提供してくれないかもしれない。
米国や他の管轄地域の特許法の変化は,特許の全体的な価値を低下させ,製品を保護する能力を弱める可能性がある。
“Leahy-Smith America発明法”や“Leahy-Smith Act”のような特許改革立法を含む米国特許法または特許法解釈の変化は、私たちの所有および認可内の特許出願をめぐる起訴および私たちの所有および認可内の認可された特許をめぐる不確実性およびコストを増加させる可能性がある。“ライシー·スミス法案”は米国特許法を多くの重大な改正を行った。これらの変化には、特許出願起訴方式に影響を与える条項、既存技術を再定義し、競争相手に特許の有効性を疑問視するためのより効果的かつ費用対効果的な経路を提供し、特許起訴中に米国特許商標局が以前の技術を第3の方向に提出することを可能にすることと、付与後審査を含む米国特許商標局が管理する付与後プログラムにおいて特許有効性を攻撃する追加プログラムとが含まれる各方面間審査と派生手続き。特許性の他の要件が満たされていると仮定すると,2013年3月までに,米国では,まず発明により保護された発明を発明した者が特許を取得する権利があり,米国以外では,最初に特許出願を提出した者が特許を取得する権利がある。2013年3月以降、“ライシー·スミス法案”(Leahy-Smith Act)によれば、米国は先に出願を提出する制度に移行し、この制度の下で、特許性の他の法定要件が満たされたと仮定すると、最初に特許出願を提出した発明者は、第三者が最初にその発明を発明した者であるか否かにかかわらず、発明の特許を取得する権利がある。したがって、Leahy-Smith法案およびその実施は、私たちの特許出願をめぐる起訴および私たちが発行された特許の実行または保護の不確実性およびコストを増加させる可能性があり、これらのすべては、私たちの業務、財務状況、運営結果、および見通しに大きな悪影響を及ぼす可能性がある。
また、ソフトウェア、生物製品、薬品の開発と商業化における会社の特許地位は特に不確定である。米国最高裁判所の最近の裁決は、場合によっては入手可能な特許保護範囲を縮小し、場合によっては特許所有者の権利を弱める。この一連の事件は特許取得後の有効性と実行可能性の面で不確実性をもたらしている。米国議会、連邦裁判所、および米国特許商標局の将来の行動によれば、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、私たちの特許権および私たちの将来の特許権の保護、擁護、執行能力に実質的な悪影響を及ぼす可能性がある。
米国最高裁判所の裁決のいくつかの案件は、保護を要求する主題が他の面で新規性および創造性を有するかどうかにかかわらず、抽象概念、自然法則、自然現象および/または自然製品の権利要件がいつ特許を取得する資格があるかどうかを引用する問題に関連する。これらの事件には、“分子病理学協会がMyriad Genetics,Inc.”[“米国最高裁判例アセンブリ”第569巻、第12-398ページ(2013)またはMyriad;アリス社がCLS国際銀行を訴えた[2014年“米国最高裁判例アセンブリ”第573巻、13-298ページ]、およびメオ協力サービス会社がプロメテウス実験室会社を訴えた[2012年“米国最高裁判例アセンブリ”第566巻、第10-1150ページ]がある。これらの案件への対応として,連邦裁判所は多くの特許が主題が特許保護資格を満たしていないと主張して無効であると判断した。また,米国特許商標局は,これらのケースを試験にどのように適用するかに関する指導意見を視察隊に発表した。これらの決定により、米国ではソフトウェア革新をカバーする広範な特許を取得することは以前よりも挑戦的である。
我々が将来の特許を取得する能力に関する不確実性の増加に加えて,このような事件の結合は,いったん特許を取得する価値に関する不確実性をもたらしている.議会、連邦裁判所、および米国特許商標局のこれらおよび他の決定によれば、特許を管理する法律および法規は、予測不可能な方法で変更または解釈される可能性があり、それにより、私たちが新しい特許を取得したり、将来私たちに発行される可能性のある任意の特許を実行する能力を弱めるかもしれない。さらに、これらの事件は、米国特許商標局または裁判所の手続きにおいて発行される可能性のある任意の特許を弁護する能力に悪影響を及ぼす可能性がある。
私たちの以前、既存、または未来の協力者、ならびに私たちの既存または未来のライセンシーは、高価で、時間がかかり、成功しない可能性がある私たちの特許または他の知的財産権を保護または強制する訴訟に巻き込まれるかもしれない。
競争相手および他の第三者は、私たち、以前、現在、および将来のパートナー、または私たちの現在および未来のライセンシーが発行する特許または他の知的財産権を侵害、流用、または他の方法で侵害する可能性がある。したがって、私たち、以前、現在、または将来の協力者、または私たちの現在または将来の許可者は、権利侵害、流用、または他の知的財産権に関するクレームを提出する必要があるかもしれません。これは高価で時間がかかるかもしれません。私たちが認定された侵害者に対するいかなるクレームも、私たちが侵害、流用、あるいは他の方法で彼らの知的財産権を侵害していると主張するように、このような当事者に反訴を促す可能性がある。さらに、特許侵害訴訟では、このような当事者は、私たち、私たちの協力者、または私たちの許可者が主張する特許が無効であるか、または強制的に実行されないことを主張することができる。米国の特許訴訟では,無効または実行不可能と主張する抗弁が一般的である。有効性を疑問視する理由は、新規性の欠如、明らかな、または実施できないことを含む、いくつかの法定要件のいずれかを満たしていないと言われているからかもしれない。主張を実行できない理由は,特許起訴に関連する者が起訴中に米国特許商標局に関連情報を隠蔽したり,誤った声明をしたりしたためかもしれない.第三者は、訴訟範囲外であっても、米国や海外の行政機関にこのようなクレームを提起することができる。この仕組みには再審査、贈与後審査、各方面間審査、介入訴訟、派生訴訟、および非米国司法管轄区域の同等の訴訟(例えば、反対訴訟)。法的に無効と実行不可能と断言された後の結果は予測できない。
このような訴訟における不利な結果は、私たちが所有している、共通所有または許可されていない現在または未来の特許が無効または狭義に解釈されるリスクに直面し、私たちが所有している、共同所有または許可されていない現在または未来の特許出願を、発行された特許を生成できないリスクに直面させる可能性がある。裁判所はまた、私たちが所有している、共同所有または許可中の現在または未来の特許がそのような技術をカバーしていないので、訴訟において論争のある技術を使用することを阻止することを拒否することができる。さらに、知的財産権訴訟は大量の開示を必要とするため、このような訴訟では、私たちのいくつかの機密情報または商業秘密が開示によって漏洩される可能性がある。上記のいずれの条項も、第三者が非侵害的な方法で競争技術と製品を開発および商業化することを可能にし、私たちの業務、財務状況、運営結果、および将来性に重大な悪影響を及ぼす可能性がある。
第三者によって引き起こされ、我々または我々の協力者または許可者によって提起された干渉または派生プログラム、またはUSPTOによって発表された干渉または派生プログラムは、我々の特許または特許出願に関連する発明の優先権を決定するために必要である可能性がある。不利な結果は、私たちが関連技術の使用を停止することを要求するか、または勝利者から許可を得ようとすることを要求するかもしれない。もし勝利者が商業的に合理的な条項で私たちに許可を提供しない場合、あるいは私たちに許可を全く提供しない、あるいは非独占的な許可を提供し、私たちの競争相手が同じ技術を獲得した場合、私たちの業務は損害を受ける可能性がある。私たちの訴訟、介入、または派生訴訟の弁護は失敗する可能性があり、成功しても巨額のコストを招き、私たちの経営陣や他の従業員の注意を分散させる可能性がある。また,訴訟に関連する不確実性は,臨床試験に必要な資金を調達し,我々の研究計画を継続し,第三者から必要な技術許可を得たり,開発協力を行ったりして,任意の候補製品を市場に出す能力に実質的な悪影響を与える可能性がある。
第三者は、私たちが知的財産権を侵害、流用、または他の方法で侵害したことを告発する法的訴訟を提起する可能性があり、その結果は不確実であり、私たちの業務成功に実質的な悪影響を及ぼす可能性がある。
私たちのビジネス成功は、私たちの開発可能な任意の候補製品を開発、製造、マーケティング、販売する私たちの能力と、当社の協力者、ライセンシー、顧客、およびパートナーが、第三者の知的財産権および独自の権利を侵害、流用、または侵害することなく、私たちのノウハウを使用する能力に依存します。ソフトウェア、製薬、そしてバイオテクノロジー産業では、かなり多くの特許と他の知的財産権訴訟がある。私たちは、妨害訴訟、認可後の審査、各方面間米国特許商標局の審査及び派生手続、並びに欧州特許庁の反対意見のような米国司法管轄区域でない類似手続。我々が開発候補を求める分野には,第三者が所有する米国と非米国が発行する特許や係属中の特許出願が多く存在する.バイオテクノロジーや製薬業界の拡張や特許の発行に伴い、第三者特許権侵害の疑いを受ける可能性のある技術または製品候補が増加する可能性がある。
提訴や論争のある訴訟手続きの法的敷居が低いため,勝訴確率の低い訴訟や訴訟手続きが提起される可能性があり,弁護には大量の資源が必要である.訴訟と論争のある訴訟手続きはまた高価で時間がかかるかもしれないが、私たちのこのような訴訟手続きの中の相手は私たちよりも多くの資源を投入してこのような法的行動を起訴する能力があるかもしれない。いずれかの候補製品が商業化に近づき、上場企業に関するより大きな知名度を得るにつれて、このような訴訟や訴訟に巻き込まれるリスクが高まる可能性がある。第三者は、既存の特許または将来付与される可能性のある特許に基づいて、是非曲直を考慮することなく、侵害請求を私たちに提起する可能性がある。我々は、我々の技術および製品候補およびその用途に関連する可能性のあるすべてのこのような知的財産権を知らないかもしれない、または第三者知的財産権が無効であるか、または私たちの活動および製品候補がそのような知的財産権を侵害していないという誤った結論を誤って導出する可能性がある。したがって、私たちの技術と製品候補、あるいは私たちの開発と商業化は、いかなる第三者の知的財産権を侵害、流用、あるいは他の方法で侵害することもないことを確実に知ることはできない。
第三者は私たちが許可されていない状況で彼らのノウハウを使用していると主張するかもしれない。我々の技術に関連する候補製品の発見、使用または製造に関連する第三者特許または特許出願が存在する可能性があり、これらの特許または特許出願には、製造方法または治療方法のような材料、処方または方法が存在する可能性がある。特許出願は、発行するのに数年かかる可能性があるので、現在処理されている特許出願が存在する可能性があり、これらの出願は、私たちが決定する可能性のある候補製品が侵害される可能性のある発行された特許をもたらす可能性がある。さらに、第三者は将来的に特許を取得し、私たちの技術を使ってこれらの特許を侵害したと主張するかもしれない。さらに、上述したように、私たちが知らない既存の特許、または私たちが誤って導出した無効または私たちの活動によって侵害されていない特許が存在する可能性がある。管轄権のある裁判所が、我々が識別する可能性のある候補製品の製造プロセス、製造プロセス中に形成された任意の分子または任意の最終製品自体をカバーするような任意の第三者特許を所有している場合、そのような特許の所有者は、適用特許に基づいてライセンスを取得したか、またはそのような特許が満了するまで、その候補製品を商業化する能力を阻止することができるかもしれない。
我々にクレームをつけた当事者は、禁止または他の公平な救済を受ける可能性があり、これは、私たちが決定する可能性のある候補製品をさらに開発し、商業化する能力を効果的に阻止することができるかもしれない。これらのクレームの弁護は、その是非にかかわらず、巨額の訴訟費用がかかり、当社の業務における従業員資源を大量に移転することになる。もし私たちに対する侵害クレームが成功した場合、私たちは故意に侵害された3倍の損害賠償と弁護士費、特許権使用料の支払い、私たちの侵害製品の再設計、私たちの顧客、ライセンシーまたは協力者の賠償を余儀なくされたか、または第三者から1つ以上の許可を得ることを含む巨額の損害賠償を支払わなければならないかもしれない。
私たちは許可を受けることを選択することができます。あるいは、私たちが第三者の知的財産権を侵害していることが発見され、流用された場合、私たちはまた、当社の技術および候補製品の開発、製造、およびマーケティングを継続するために、第三者から許可を得ることを要求される可能性があります。しかし、私たちは商業的に合理的な条項や必要な許可証を得ることができないかもしれない。私たちが許可を得ることができても、それは非排他的である可能性があり、私たちの競争相手や他の第三者が私たちに許可された同じ技術にアクセスできるようにし、大量の許可と印税の支払いを要求することができるかもしれない。私たちは裁判所の命令によって、権利侵害技術や製品の開発、製造、商業化を中止することを余儀なくされるかもしれない。権利侵害の発見は、私たちが任意の候補製品を商業化することを阻止したり、いくつかの業務運営を停止させたりする可能性があり、これは私たちの業務に実質的な損害を与える可能性がある。また、任意の候補製品を再設計し、新たな規制承認を求め、契約協定に基づいて第三者を賠償することを余儀なくされる可能性がある。第三者の機密情報や商業秘密を盗用したと主張することは、当社の業務、財務状況、運営結果、見通しに類似した重大な悪影響を及ぼす可能性があります。
私たちは、私たちの従業員、コンサルタント、または請負業者が第三者の機密情報を誤って使用または開示したと主張する第三者のクレームを受けるかもしれないし、私たちは彼らの現在または前任雇用主のいわゆる商業機密を誤って使用または開示したり、私たちが彼らの知的財産権を流用したと主張したり、私たち自身の知的財産権の所有権を要求したりすることができる。
私たちの一部の従業員、コンサルタント、および請負業者は以前、私たちの競争相手または潜在的な競争相手を含む大学または他のソフトウェアまたは生物製薬会社に雇われていた。私たちは、私たちの従業員、コンサルタント、および請負業者が、私たちのために働いているときに他人の固有情報またはノウハウを使用しないことを保証するために努力しているが、私たちは、商業秘密または他の固有情報を含む任意のそのような個人の現職または前任雇用主の知的財産権を使用または開示していると告発される可能性がある。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。
また、私たちの政策は、知的財産権開発に参加する可能性のある従業員、コンサルタント、請負業者が、このような知的財産権を私たちに譲渡する協定に署名することを要求していますが、実際に私たちが自分たちの知的財産権を開発しているすべての側とこのような合意を実行することができないかもしれません。私たちと彼らの知的財産権譲渡協定は自動的に実行されないかもしれないし、違反される可能性があります。私たちは第三者にクレームを出させたり、私たちが私たちの知的財産権の所有権だと思うことを確認するために、私たちが提起したクレームを弁護することを余儀なくされるかもしれません。このようなクレームは、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性があります。
もし私たちがこのような任意のクレームを起訴または弁護できなければ、金銭損害賠償の支払いに加えて、貴重な知的財産権や人員を失う可能性があり、これは私たちの競争業務の地位と将来性に実質的な悪影響を及ぼす可能性がある。このような知的財産権は第三者に付与することができ、私たちは、私たちの技術または製品を商業化するために、第三者から許可を得る必要があるかもしれません。この許可は、商業的に合理的な条項では得られないかもしれません、または全く存在しないかもしれません。このようなクレームの起訴や抗弁に成功しても、訴訟は巨額のコストを招き、経営陣や従業員の注意を分散させる可能性がある。
もし私たちが私たちの商業秘密の機密性を保護できなければ、私たちの業務と競争地位は損なわれるかもしれない。
任意の候補製品および技術のための特許出願に加えて、私たちは、私たちの競争地位を維持するために、ビジネス秘密および秘密協定に依存して、私たちの非特許ノウハウ、技術、および他の固有情報を保護します。私たちは、当社の従業員、会社協力者、外部科学協力者、契約研究組織、契約製造業者、コンサルタント、コンサルタント、協力者、および他の第三者のような、これらの秘密にアクセスする権利のある当事者と秘密協定を締結することによって、私たちの商業秘密および他のノウハウを保護することを求めています。私たちはまた、私たちの従業員やコンサルタントと秘密および発明または特許譲渡協定を締結していますが、私たちが私たちの商業秘密またはノウハウに接触している可能性があるか、または接触したことがあるすべての当事者とこのような合意を締結した保証はありません。このような努力にもかかわらず、どちらか一方が意図的にまたは故意に合意に違反し、私たちのビジネス秘密を含む私たちの固有の情報を漏洩する可能性があり、私たちはそのような違反について十分な救済措置を得ることができないかもしれない。商業秘密の漏洩や流用を検出し、当事者に商業秘密の不正開示や流用を要求することは困難であり、高価で時間がかかり、結果は予測できない。しかも、米国国内外のいくつかの裁判所は商業秘密をあまり望んでいないか、または保護したくない。もし私たちの任意の商業秘密が競争相手または他の第三者によって合法的に取得または独立して開発された場合、私たちは彼らまたは彼らが情報を伝達する人がその技術や情報を使用して私たちと競争することを阻止する権利がないだろう。もし私たちの任意の商業秘密が競争相手または他の第三者に漏洩された場合、または競争相手または他の第三者によって独立して開発された場合、私たちの競争地位は実質的かつ不利な損害を受ける可能性がある。
規制やその他の法律的コンプライアンスに関するリスク
たとえ著者らが必要な臨床前研究と臨床試験を完成しても、監督管理の審査過程は高価で、時間と不確定であり、私たちが一部或いはすべての候補製品の商業化の許可を得ることを阻止するかもしれない。そのため、いつ、どの地域にあるか、どの地域であるかを予測することはできず、候補製品を商業化するマーケティング承認を得ることになる。
製品の研究、テスト、製造、ラベル、承認、販売、マーケティング、普及と流通はすべてFDAと類似外国の監督管理機関の広範な監督管理を受けている。FDAの新薬申請承認または米国以外の関連規制機関のマーケティング承認を得るまで、我々の候補製品を米国または他の国/地域で販売することは許可されていない。我々の候補製品は異なる開発段階にあり,薬物開発固有の失敗リスクの影響を受けている。私たちはまだアメリカや他の任意の司法管轄区で私たちの任意の候補製品の申請を提出したり、マーケティングの許可を得ていません。会社としては、マーケティング承認を得るために必要な申請の提出と支援には経験がなく、その過程で第三者CROに依存して助けてくれると予想されています。
米国でも海外でも、上場承認を得る過程は長く、高価で不確実だ。最終的に承認される場合、これは数年を要する可能性があり、関連する候補製品のタイプ、複雑性、および新規性を含む様々な要因によって大きく異なる可能性がある。上場承認を得るためには、候補製品の安全性と有効性を決定するために、広範な臨床前と臨床データ及び支持情報を監督機関に提出する必要がある。FDAまたは他の規制機関は、私たちの候補製品が安全で有効ではなく、適度に有効であるか、あるいは不良または意外な副作用、毒性または他の特徴を持っていると認定し、上場承認を得ることができないようにしたり、商業用途を阻止したり制限したりする可能性がある。
さらに、開発中の市場承認政策の変化、追加法規、法規またはガイドラインの制定または公布の変化、または各提出された製品申請に対する規制審査の変化は、申請の承認または拒否の遅延を招く可能性がある。監督管理機関は審査過程中にかなりの自由裁量権を持っており、臨床前と臨床試験で得られたデータに対する異なる解釈は候補製品の上場承認を延期、制限或いは阻止する可能性がある。私たちが最終的に得たどのマーケティング承認も限られているかもしれないし、制限されたり、承認された後の約束は、承認された製品が商業的に実行できないようにすることができる。
また,我々が新製品を開発·販売する能力は,行われている挑戦FDAによるミフェプリストン承認訴訟の影響を受ける可能性がある。具体的には、2023年4月、アメリカテキサス州北区地区裁判所はFDAのミフェプリストンに対する許可を保留し、ミフェプリストンは1種の薬物製品であり、最初は2000年に承認され、その流通はREMS下で採用された各種条件の制約を受けた。この決定を下す過程で、地区裁判所はいくつかのアメリカ薬品の開発、承認と流通にマイナス影響を与える可能性のある調査結果を下した。2023年4月、米国第5巡回控訴裁判所は地域裁判所の裁決をある程度棚上げした
その後,米国最高裁判所は地域裁判所のすべての決定を棚上げにし,第5巡回控訴裁判所が地域裁判所裁決の控訴を処理するのを待ち,最高裁にいかなる移審命令を要求する請願書を処理した。2023年8月、控訴裁判所はミフェプリストンの市場からの除去を拒否し、FDAが2000年に最初に承認した挑戦が訴訟時効で禁止されていることが分かった。しかし控訴裁判所は、原告は彼らの訴訟で勝つ可能性が高く、FDAが2016年と2021年にミフェプリストンの使用範囲を拡大することを許可した変化は独断的で気まぐれだと考えている。2023年12月、最高裁はこれらの控訴裁判所の裁決の移審命令請願書を承認した。
EUや他の外国司法管轄地域で我々の製品をマーケティング·販売するためには、単独のマーケティング承認を得、多くの異なる規制要件を遵守しなければならない。承認手続きは国によって異なり、追加的なテストが含まれるかもしれない。承認を得るのに要する時間は、FDA承認を得る時間とは大きく異なる可能性がある。米国以外の上場承認プロセスには、通常、FDA承認の取得に関するすべてのリスクが含まれている。もしあれば、私たちはアメリカ以外の規制機関から直ちに承認されないかもしれない。FDAの承認は、他国又は管轄区域の規制機関の承認を確保するものではなく、米国以外の1つの規制機関の承認も、他の国又は司法管区の規制機関又はFDAの承認を確保することができない。マーケティング承認を申請するかもしれませんが、どの市場でも私たちの製品を商業化するために必要な承認は得られません。
私たちは、アメリカでの画期的な治療、迅速なチャネル、優先審査指定、EUでの主な指定を含む特定の指定を私たちの候補製品に求めるかもしれませんが、私たちはそのような指定を受けないかもしれませんが、そのような指定を受けても、そのような指定はより速い開発や規制審査や承認過程をもたらすことができません。
私たちはFDAの審査と承認を加速させるために、私たちの1つまたは複数の候補製品のためのいくつかの指定を求めるかもしれない。画期的な治療製品は、重篤な疾患の治療のために単独でまたは1つまたは複数の他の製品と組み合わせて使用することを意図した製品として定義され、初期臨床証拠は、製品が1つまたは複数の臨床的重要終点において、臨床開発早期に観察された実質的な治療効果のような既存の療法よりも実質的に改善された効果を示す可能性があることを示す。画期的な治療法として指定された製品に対して,FDAと試験スポンサーとの相互作用やコミュニケーションは,臨床開発の最も有効な方法を決定するのに役立つとともに,無効なコントロールレジメン中の患者数を最小限に抑えることができる。
FDAはまた、深刻なまたは生命に危険な疾患または状態を治療するために1つまたは複数の他の製品と単独でまたは組み合わせて使用することが意図されている場合、迅速なチャネル審査のための製品を指定することができ、そのような疾患または状態が満たされていない医療需要を解決する可能性を示す。Fast Track製品については,スポンサーがFDAとより多くのインタラクションを行う可能性があり,FDAは申請完了前にFast Track製品申請部分の審査を開始する可能性がある。FDAがスポンサーから提出された臨床データを初歩的に評価した後にFast Track製品が有効である可能性があると判断すれば,スクロール審査が可能である。
私たちはまた私たちの1つ以上の候補製品のための優先検討指定を求めることができる。FDAが候補製品が治療において大きな進展を遂げたと判断した場合、または適切な治療方法が存在しない治療方法を提供する場合、FDAは候補製品を優先的に検討するように指定する可能性がある。優先審査指定は、FDA審査申請の目標が6ヶ月であり、標準的な10ヶ月の審査期間ではないことを意味する。
このような指定はFDAの裁量権だ。したがって,我々の候補製品の1つがこれらの指定の基準を満たしていると考えても,FDAは同意せず,このような指定を行わないことにする可能性がある.また、指定を受けても、FDAの従来の手順に従って承認を考慮した製品と比較して、候補製品の指定を受けることは、より速い開発や規制審査や承認過程につながらない可能性があり、FDAの最終承認を確保することはできない。さらに、我々の1つまたは複数の候補製品がこれらの認証を取得する資格があっても、FDAは、これらの候補製品がもはや資格条件を満たしていないと後で決定することができ、またはFDAの審査または承認を決定する期間が短縮されないことができる。
連合で、私たちは未来に私たちの候補製品のための良質な称号を求めるかもしれない。PRIMEはEMAの役割を強化し、科学と監督管理支持を強化し、開発を最適化し、未満足の医療需要を解決する潜在力を有する重大な公衆衛生利益の新薬の評価を加速することを目的とした自発的計画である。この計画は,EUで満足できる治療法がない疾患に対する薬物に集中しているか,あるいはそのような方法が存在しても,既存の治療法よりも大きな治療利点を提供することが可能である。Primeは開発中でEUで許可を得ていない薬品に限られており,出願人は集中手順で初期上場許可申請を申請しようとしている。Primeとして受け入れられるためには、候補製品はその主要な公共健康利益と治療革新方面の資格基準に適合しなければならず、この基準は声明を実証できる情報に基づいている。Prime指定の利点は、マーケティング許可申請の前に継続的な支援を提供し、知識の蓄積を支援するCHMP調査委員を任命することと、重要な開発マイルストーンで早期対話および科学的提案を行うことと、製品の加速的な審査を行う可能性があることとを含み、これは、申請中に承認の程度に関する意見をより早く発表するために、審査時間を減少させることを意味する。PRIMEは申請者が同時にEMA科学提案と衛生技術評価提案を要求することができ、適時な市場進出を促進することができる。いずれの候補製品の良質な認証を得ても,従来のEMAプログラムと比較して,この認証は実質的に速い開発過程,審査または承認をもたらさない可能性がある。さらに、Prime称号を取得することは、EMAがマーケティング許可を付与する可能性を保証または増加させることを保証しない。
現在と未来の立法は、私たちの任意の候補製品が確かにマーケティング承認を得たので、精算の難しさとコストを増加させるかもしれない。
米国や他の管轄地域では、医療システムに関する立法や法規の変更、提案された変更は、候補製品の上場承認を阻止または延期し、承認後の活動を制限または規範化し、マーケティング承認された候補製品を収益的に販売する能力に影響を与える可能性がある。現在の法律、および将来取られる可能性のある他の医療改革措置は、より厳しいカバー基準をもたらす可能性があり、私たちが受け取る可能性のある任意の承認製品の価格に追加の下振れ圧力をもたらす可能性があると予想しています。もし私たちの製品が清算や範囲が限られていなければ、私たちの業務は実質的な損害を受けるかもしれません。
2010年3月、オバマ総裁は“医療·教育負担能力調整法”により改正された“患者保護·平価医療法案”、または総称して“平価医療法案”に署名した。さらに、ACAが公布されて以来、他の立法改正も提案され、採択された。2011年8月、“2011年予算制御法案”(Budget Control Act Of 2011)などの法案は国会のための支出削減措置を制定した。赤字削減合同特別委員会の任務は、2013年から2021年までの間に少なくとも1.2兆ドルの赤字削減を提案することであるが、同委員会は必要な目標を達成できず、立法をいくつかの政府プロジェクトに自動的に削減することを触発した。これらの変化には,コロナウイルス援助,救済,経済安全法案やCARE法案により,プロバイダに支払う医療保険総金額が前期ごとに2%削減され,2013年4月に発効し,2032年上半期まで有効となる。その後の立法により,これらの連邦医療保険の自動減額は2021年と2022年に一時停止·減少したが,2022年7月1日現在で2%削減が完全に回復した。2012年の“米国納税者救済法”は,いくつかの医療サービス提供者に支払う連邦医療保険を減少させ,政府が提供者に多額の金を取り戻す訴訟時効を3年から5年に延長した。これらの法律は、連邦医療保険および他の医療資金のさらなる減少をもたらし、他の方法で、規制によって承認される可能性のある任意の候補製品の価格、またはそのような任意の候補製品の処方または使用頻度に影響を与える可能性がある。
実際、現在の立法によると、医療保険支出の実際の減少幅は4%に達する可能性がある。総合支出法案は2022年12月に総裁·バイデンが署名して法律となり、医療保険計画の自動減額にいくつかの改正がなされた。総合支出法案第1001条は、2010年の4%の法定現金支払法の自動減額を2024年末まで2年延期する。“2021年米国救援計画法案”の公布により,医療保険計画を4%削減する計画が2023年1月に発効する。総合支出法案の医療補償タイトルには、2011年の連邦医療保険自動減額の2%予算制御法案を6ヶ月から2032年に延長し、2030年と2031年の支払い減免率を低下させる4163条が含まれている。
ACAが公布されて以来、この法律の条項を廃止し、代替するために、多くの法的挑戦と国会行動が続くだろう。例えば、2017年の税法の公布に伴い、国会は“個人強制令”を廃止した。この条項は、ほとんどのアメリカ人が最低レベルの医療保険を購入することを要求する条項が2019年に施行される。また、2018年12月、テキサス州北区の米国地域裁判所裁判官は、ACAの個人権限部分はACAの基本的かつ不可分な特徴であるため、2017年の税法の一部として廃止されたため、ACAの残りの条項も無効であると判断した。米国最高裁はこの事件を審理し、原告がACAの合憲性に挑戦する資格がないことを発見したため、2021年6月にこの訴訟を却下した。ACAに関する訴訟と立法は継続される可能性があり、結果は予測不可能で不確実である。
トランプ政権はまた、ACAに基づいて権力および責任を有する連邦機関にACAの実施を放棄、延期、免除、または延期を指示する任意の条項を含むACAの実施を延期するための行政行動をとっており、これらの条項は、各州、個人、医療保健提供者、医療保険会社または薬品または医療機器メーカーに財政的または規制的負担をもたらす。しかし、2021年1月28日に、バイデン総裁はこれらの命令を撤回し、連邦機関に米国人の医療保険取得を制限するルールや他の政策を再検討するよう指示し、この獲得を保護し強化するための行動を検討するように指示した。この命令によれば、連邦機関は、新しい冠肺炎に関連する合併症を含む以前の疾患を有する人の保護の政策を弱めること、医療補助およびACAによるデモおよび免除によって、作業要求を含むカバー範囲または破壊計画を減少させることが可能な政策、医療保険市場または他の医療保険市場を破壊する政策、連邦医療補助およびACAに参加しにくくする政策、および扶養者の負担能力を含む保険または経済援助の負担可能性を低減する政策を再検討するように指示されるであろう。
2021年12月13日,EUは衛生技術評価又はHTAに関する第2021/2282号条例を採択し,第2011/24/EU指令を改正した。HTAは2022年1月に発効するが,2025年1月から適用が開始され,その間に実行に関する準備と手順がとられる。適用されると、それは関連製品に従って段階的に施行されるだろう。HTAは、新しい医薬製品およびいくつかの高リスク医療機器を含む衛生技術の評価におけるEU加盟国の協力を促進し、これらの分野のEUレベルの共同臨床評価に基礎を提供することを目的としている。これは、EU加盟国がEU範囲内で汎用的なHTAツール、方法、およびプログラムを使用することを可能にし、患者に最大の潜在的影響を有する革新的な衛生技術の共同臨床評価、共同科学相談、開発者がHTA当局にアドバイスを求め、新興衛生技術および早期発見の将来性のある技術を決定し、他の分野で自発的な協力を継続することを含む4つの主要分野で協力することを可能にする。EUの各加盟国は、衛生技術の非臨床(例えば、経済、社会、倫理)の評価を引き続き担当し、定価と補償について決定する。
我々は,これらの医療改革,および将来とりうる他の医療改革措置は,連邦医療保険や他の医療資金のさらなる減少,より厳しいカバー基準,新たな支払い方法,および任意の承認された製品のために得られる価格および/または医師が市場に進出する可能性のある任意の承認された製品を管理することによって得られる補償レベルの追加的な下振れ圧力をもたらす可能性があると予想している。精算レベルの低下は私たちが受け取った価格や私たちの製品の処方や管理頻度に悪影響を及ぼす可能性があります。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。したがって、これらの改革が発効すれば、市場で承認された候補製品の期待収入の開発に成功する可能性があり、我々の全体的な財務状況および候補製品の開発または商業化の能力に影響を与える可能性がある。
米国や外国の司法管轄地域における処方薬の価格はかなりの立法や行政行動の影響を受けており、許可を得ると、私たちの製品の価格に影響を与える可能性があり、商業的に許容できる条項で私たちの薬物発見計画のためにパートナーを探す能力に影響を与える可能性がある。
アメリカでは、処方薬の価格が話題になってきた。最近いくつかの国会調査、提案と公布された州と連邦立法は、薬品定価の透明性を高め、価格設定とメーカー患者計画との関係を審査し、連邦医療保険と医療補助下の薬品コストを下げることを目的としている。2020年には、総裁·トランプ氏が処方薬のコスト削減を目的としたいくつかの行政命令を発表し、これらの命令のいくつかが条例に盛り込まれている。これらの規定には、価格最恵国モデルを実施し、連邦医療保険B部分のある医師が管理する薬品に対する支払いを他の経済先進国が支払う最低価格とリンクさせ、2021年1月1日から発効する臨時最終規則が含まれている。しかし、この規則は全国的な予備禁止令によって制限され、2021年12月29日、医療保険·医療補助サービスセンター(CMS)はそれを廃止するための最終規則を発表した。CMSは、この規則の発表に伴い、それは価値をMedicare B部分の薬品支払いのすべての選択に組み入れ、そして受益者が根拠に基づく看護を獲得する機会を改善することを探索する。
また、2020年10月、衛生·公衆サービス部(Department of Health and Human Services、HHSと略称する)とFDAは、各州と他の実体が第804条の輸入計画を制定し、ある処方薬をカナダからアメリカに輸入することを許可する最終規則を発表した。この規定は米国薬物研究やメーカー協会(PhRMA)の訴訟で挑戦されたが,裁判所でPhRMAがHHSを起訴する資格がないことが発見された後,2023年2月に連邦地域裁判所に却下された。いくつかの州はカナダからの麻薬の輸入を許可する法律を採択した。 いくつかの州は第804条輸入計画提案を提出しており、FDAの承認を待っている。 FDAは2024年1月にカナダからフロリダ州への大規模な薬物の輸入を許可した。また、2020年11月20日、HHSは現在の医療保険薬品を廃止して避風港を引き戻し、利益を得た販売所割引と薬局福祉マネージャーサービス料のために新しい避風港を作る規定を決定した。この法案は2022年1月1日に発効する予定だったが、アイルランド共和軍の成立に伴い、国会は2032年1月1日に延期された。
2022年8月16日、“アイルランド共和軍”は総裁·バイデンによって法律に署名された。新しい立法は連邦医療保険D部分に影響を与え、D部分は計画であり、連邦医療保険A部分または連邦医療保険B部分に加入する個人は毎月外来処方薬保険料を支払うことを選択することができる。他の事項を除いて、アイルランド共和軍はある薬品のメーカーに連邦医療保険との価格交渉(2026年から)を要求し、価格は交渉できるが上限があり、連邦医療保険B部分と連邦医療保険D部分に基づいてリベートを実施し、インフレを超える価格上昇を処罰し(2023年に初めて満了)、D部分のカバーギャップ割引計画の代わりに新しい割引計画を用いる(2025年から)。アイルランド共和軍は衛生·公衆サービス部長官が最初の数年に規制ではなく指導によってその多くの規定を実施することを許可した。
具体的には、価格交渉において、国会はMedicareが、競合する模倣薬または生体模倣薬を有さず、Medicare B部分およびD部分によって精算されるいくつかの高価な単一由来薬剤および生物製品のための低い価格を交渉することができる。CMSは、2026年からMedicare D部分によって支払われる10種類の高コスト薬剤の価格を交渉することができ、その後、2027年の15種類のD部分薬剤、2028年の15種類のB部分またはD部分薬剤、および2029年以降の20種類のB部分またはD部分薬剤の価格を交渉することができる。この規定は、少なくとも9年間承認された医薬品および許可13年の生物製品に適用されるが、単一のまれな疾患または疾患のための許可された医薬および生物製品には適用されない。それにもかかわらず、CMSは価格交渉においてこれらの製品の最高価格を決定する可能性があるため、もし私たちまたはパートナーの製品がMedicare価格交渉の対象であれば、私たちは政府行動のリスクに完全に直面するだろう。また、存在する可能性のあるリスクを考慮すると、金利協定のこれらの条項は、もし私たちの薬物製品が市場に発売されて9年後に価格を制定しなければ、医薬品の期待リターンや私たちの製品の特許のすべての価値を保護することができないというリスクをさらに増加させる可能性がある。
また、IRAのこれらの規定は、一部の会社が彼らの研究の組み合わせと優先順位を小分子ではなく、より多くの巨大分子(すなわち抗体などの生物製剤)に転換させる可能性がある。私たちは確かに私たちの技術を生物製品に応用しているにもかかわらず、私たちはまだ巨大分子の発見に対する検証や価値と私たちの小分子発見の検証や価値を持っていない。したがって,IRAにより製薬業が投資やポートフォリオ戦略を小分子薬物発見から生物製剤に移行させると,われわれの薬物発見計画の期待価値や我々のソフトウェア開発候補製品を用いた知覚価値に大きな悪影響を及ぼす可能性がある。また,小分子療法の投資レベルや開発興味が低下すれば,ビジネス的に許容可能な条項の連携が困難になったり,独自のプロジェクトの協力がまったく行われなくなる可能性がある。私たちの計画のために適切な協力者および/またはパートナーを見つけることができなければ、より多くの計画に資金を提供し、自ら開発または商業化活動を展開することを余儀なくされる可能性があり、これは私たちの業務や財務状況に悪影響を及ぼす可能性がある。
2023年6月6日、メルク社はHHSとCMSを提訴し、アイルランド共和軍の連邦医療保険に対する薬品価格交渉計画が米国憲法第5改正案に違反した無償徴収を構成したと主張した。その後,米国商会や他の製薬会社を含む他の当事者も異なる裁判所に訴訟を起こし,HHSとCMSに対して類似した憲法クレームを提出した。2023年7月12日、商会は予備禁止救済を申請し、アイルランド共和軍の薬品定価条項の執行停止を求めた。2023年9月29日,この訴訟の第1回実質的な裁決で,米国オハイオ州南区地域裁判所は商会の動議を却下し,商会はその憲法議論で大きな成功の可能性を示さなかったと認定した。連邦医療保険は自発的であったからである。米オハイオ州南区地方裁判所も政府の却下動議を却下し、各方面からより多くの情報を得て、その動議を裁く必要があることを示している。私たちはIreland共和軍のこのような条項と他の条項に関連した訴訟が継続され、結果的に予測可能で不確実だと予想する。
また、この立法は、製薬業者が提供する価格が法律で規定された交渉で達成された“最高公平価格”以下でない場合、または値上げ幅がインフレを超える場合、製薬業者は民事罰金と潜在的な消費税を受けることになると規定している。この立法はまた、メーカーに連邦医療保険D部分の価格上昇幅がインフレを超えた薬品にリベートを支払うことを要求している。新法律では,2024年の連邦医療保険の自己払い薬品コスト上限は年間4000ドルと規定されており,その後2025年から年間2000ドルが上限となっている。さらに、Medicare Part D処方薬計画に参加した個人については、彼らが計画の高いハードルや“悲劇的な時期”に達する前に要求された保証範囲がその初期の年間保証限度額を超えていれば、アイルランド共和軍は個人に関する法的リスクを増加させる可能性がある。最初の年間保証限度額を超え、悲劇的な時期を下回るサービスを必要とする個人は、壊滅的な時期に達するまで100%の処方費用を支払わなければならない。他にも、アイルランド共和軍には、共同保険と共同支払いコストの削減、低所得補助金計画の資格の拡大、年間自己負担費用に価格上限を設定することで、個人の財務負担を軽減するための多くの条項が含まれており、各規定は定価と報告書に潜在的な影響を与える可能性がある。
したがって,アイルランド共和軍がどのように実施されるかは不明であるが,どの連邦や州医療改革が我々にどのような影響を与えるかは確定できないが,このような変化は我々の活動に新たなあるいはより厳しい規制要求を加えたり,承認製品の精算を減少させたりする可能性があり,いずれも我々の業務,運営結果,財務状況に悪影響を及ぼす可能性がある。
州レベルでは、各州はますます積極的に、価格または患者の精算制限、割引、ある製品への参入の制限、マーケティングコストの開示および透明性措置を含む薬品および生物製品の価格設定を制御するための法規を立法と実施し、場合によっては、他の国からの輸入と大量購入を奨励することを目的としている。さらに,地域医療機関や個別病院では,どの薬品やサプライヤーが処方薬や他の医療計画に含まれるかを決定するために入札プログラムが使用されるようになってきている。これらの措置が承認されると、私たちの製品に対する最終的な需要を下げたり、私たちの製品の価格設定に圧力をかけるかもしれません。私たちは将来、より多くの州と連邦医療改革措置を取ることが予想され、そのいずれも連邦と州政府が医療製品やサービスのために支払う金額を制限する可能性があり、これは私たちの候補製品に対する需要の減少または追加の価格設定圧力を招く可能性がある。
EUでは、承認されれば、同様の政治、経済、規制発展が候補製品を利益的に商業化する能力に影響を与える可能性がある。米国やEU以外の市場では,精算や医療保健支払い制度は国によって異なり,多くの国で特定製品や療法に価格上限が設定されている。欧州連合を含む多くの国では、処方薬の定価は政府の統制と参入を受けている。これらの国·地域では
政府当局は製品の発売承認を受けてからかなりの時間がかかるかもしれない。いくつかの国で精算或いは定価の承認を得るために、私たち或いは私たちの協力者は臨床試験を行い、私たちの製品の費用効果を他の利用可能な治療法と比較する必要があるかもしれない。精算が得られない場合や範囲や金額が制限されている場合、あるいは定価レベルが満足できない場合、私たちの業務は実質的な損害を受ける可能性があります。
グローバルなプライバシーやデータセキュリティ要件を遵守することは、追加的なコストと責任をもたらしたり、グローバルでデータを収集して処理する能力を抑制したりする可能性があり、これらの要求を守らないことは、私たちを巨額の罰金と処罰に直面させる可能性があり、これは、私たちの業務、財務状況、または運営結果に大きな悪影響を及ぼす可能性があります。
世界的な情報収集、使用、保護、共有、伝送、および他の処理の規制枠組みは急速に変化しており、予測可能な未来にはまだ不確定である可能性がある。世界的に、私たちが業務を展開しているほとんどの管轄区域は、自分のデータセキュリティとプライバシーの枠組みを構築しており、これらの枠組みを守らなければならない。例えば、個人健康データおよび従業員データを含むEU個人に関する個人データを収集、使用、開示、移転、または他の方法で処理し、2018年5月に欧州経済地域(EEA)のすべての加盟国で発効するEU一般データ保護条例またはGDPRによって制限される。GDPRの範囲は広く,個人データを処理する会社に対して多くの要求がなされており,健康や他の敏感なデータの処理,個人データに関する個人の同意の取得,個人へのデータ処理活動に関する情報の提供,個人データの安全と機密性の保護のための保障措置の実施,データ漏洩に関する通知の提供,第三者処理者の採用時に何らかの措置をとるなどの要求がある。GDPRは,ヨーロッパ経済圏で行われている任意の臨床試験に対する義務を増加させ,個人データの定義を拡大し,コードデータを含め,インフォームドコンセントの変更を求め,臨床試験被験者や研究者により詳細な通知を行う。また,GDPRは米国を含むEU以外の国への個人データの移行にも厳しいルールを加えているため,このようなルールは個人データをヨーロッパ経済区に位置する任意の臨床試験地点から米国に移行する審査に適用すべきであることを強化した。2022年10月、EU·米国プライバシーの盾の代替品として、EU-米国のデータプライバシーの枠組みを実施する行政命令に署名した。欧州委員会は2022年12月にEU-米国データプライバシー枠組み充足性決定を採択するプロセスを開始し、欧州委員会は2023年7月10日に十分性決定を採択した。十分な決定は、EU-米国データプライバシーの枠組みにおいて自己認証を可能にする米国社が、EUから米国にデータを送信するための有効なデータ転送機構とすることを可能にする。しかし、いくつかのプライバシー提唱団体は、EU-米国のデータプライバシーの枠組みに挑戦すると表明している。これらの挑戦が成功すれば、EU-米国のデータプライバシーの枠組みに影響を与えるだけでなく、標準契約条項や他のデータ伝送機構の生存能力もさらに制限される可能性がある。この問題をめぐる不確実性は私たちの国際業務に影響を及ぼす可能性がある。
連合王国のEU離脱後、連合王国の“2018年データ保護法”は、連合王国で行われた個人データ処理に適用され、GDPRが定めた義務と平行する義務が含まれている。データ転送については,連合王国と欧州連合ともに単独の“十分性”によって決定され,2つの司法管区間のデータ転送はそれぞれ連合王国2018年データ保護法とGDPRに適合している.2023年10月、英国と米国は、EU-米国データプライバシーの枠組みに類似した機能を有する米英データブリッジを実施し、会社がイギリスから米国にデータを送信するための追加の法的メカニズムを提供した。 このような開発のどんな変化や更新も私たちの業務に影響を及ぼす可能性がある。
GDPRはまた、データ保護当局が、不正に収集または使用された個人情報の廃棄および/またはGDPR違反行為に巨額の罰金を科すことを要求し、罰金金額が最大で世界収入の4%または2000万ユーロに達することを許可し、金額が大きい者を基準に、データ主体と消費者協会がデータ主体と消費者協会に対して個人訴訟を提起する権利を与え、監督当局に訴え、司法救済を求め、GDPR違反による損害について賠償を得ることを可能にする。また、GDPRは、EU加盟国は、遺伝、生物識別、または健康データを含む個人データの処理を制限する独自のさらなる法律と法規を制定することができる。
データ保護義務の変化の広さと深さを考慮して、GDPRの要求を準備と遵守することは厳格で時間がかかり、大量の資源と私たちの技術、システムとやり方、ならびにEUで収集した個人データを処理または移転する任意の第三者協力者、サービスプロバイダ、請負業者またはコンサルタントの技術、システムとやり方を審査する必要がある。GDPRやその他、特定のタイプの敏感なデータ(例えば、医療データや他の個人情報)の保護を強化することに関連する法律や法規の変化は、私たちの業務慣行を変更し、追加のコンプライアンスメカニズムを確立することを要求する可能性があり、私たちの開発、規制、商業化活動を中断または延期し、私たちの業務コストを増加させ、政府の法執行行動、個人訴訟、および私たちへの巨額の罰金および処罰を招き、私たちの業務、財務状況、または運営結果に大きな悪影響を及ぼす可能性があります。
アメリカでは、似たようなプライバシーとデータセキュリティ要求がすでに到着しているか、実施されている。様々なデータ保護法が私たちの活動に適用される可能性があり、州と連邦の2レベルの一連の法執行機関は、会社のプライバシーとデータセキュリティ問題を審査することができる。米国連邦貿易委員会(Federal Trade Commission、FTCと略称する)と州総検察長は消費者プライバシーとデータ安全保護の審査に非常に積極的である。例えば、連邦貿易委員会は、その最近の法執行行動を通じて、特に健康および遺伝子データの不正処理に注目し、連邦貿易委員会法案第5条に基づいて“不公平”と解釈されるプライバシー侵害のタイプと、健康違反通知ルールをトリガすることができると考えられる活動タイプを拡大している(連邦貿易委員会もこのルールを実行する権利がある)。その機関はまた、私たちの業務に影響を及ぼす可能性のある商業監視とデータセキュリティに関する規則を制定している。私たちは、私たちが取る可能性のある法執行行動のリスクを低減するために、連邦貿易委員会が進化していく規則と適切なプライバシーとデータセキュリティ慣行の指導を考慮する必要があるだろう。もし私たちが潜在的なFTC法執行行動の影響を受けたら、私たちは非常に具体的なプライバシーとデータセキュリティ慣行を遵守することを要求する和解命令の制約を受けるかもしれません。これは私たちの業務に影響を与える可能性があります。和解の一部として、私たちはまた罰金の支払いを要求される可能性がある(告発された違反の性質に依存する)。もし私たちが連邦貿易委員会と合意したすべての同意命令に違反したら、私たちは追加的な罰金とコンプライアンス要求を受けるかもしれない。
各国では個人情報処理に関する具体的なルールも積極的に制定されている。例えば,2020年1月1日に施行されたカリフォルニア消費者プライバシー法(California Consumer Privacy Act,略称CCPA)は,GDPRに類似したリスクと義務を創出している。したがって、私たちは、私たちが収集している個人情報を決定し、そのような情報を収集する目的を決定するために、他の活動(例えば、データマッピング)に参加する必要があるかもしれない。さらに、私たちの政策は、消費者にその個人情報を販売しないことを選択する権利を付与することを含むことができる企業連絡情報を含むことができるCCPAに広く定義されているので、消費者に付与される権利を認める必要がある。他の多くの州も似たような立法を考慮している。2020年11月、カリフォルニア州有権者は、2023年1月1日に施行されるカリフォルニアプライバシー権法案(CPRA)を採択し、CCPAを大幅に拡大し、カリフォルニア州住民に個人情報の使用、保持、共有を要求することが合理的に必要であり、収集または処理の目的に応じて、敏感な個人情報の追加保護を提供し、住民への保留情報の通知に関する内容をより多く開示することを含むGDPRのような追加条項を盛り込んだ。カリフォルニア以外のいくつかの州でもCCPAやCPRAのような全面的なプライバシー法が採択されている。このような法律は施行されたか、2026年末までに施行されるだろう。これらの法律は,CCPAやCPRAと同様に,個人情報の処理に関する義務と,“敏感”データ(場合によっては健康データを含む)を処理する特殊な義務を規定している。このような法律のいくつかの規定は私たちの商業活動に適用されるかもしれない。2025年以降に施行されるプライバシー法を強く考慮している州もある。他の州は未来にこれらの法律を考慮すると同時に、連邦レベルでも一連の広範な立法措置を導入するだろう。したがって、現在および将来の個人情報のプライバシーとセキュリティに関する任意の連邦や州法律を守らなければ、罰金と処罰に直面する可能性があります。私たちはまた、これらの法律や個人データの全面的な保護に関する消費者集団訴訟の脅威に直面している。私たちがこれらの法律に違反していると判断されなくても、これらの問題の調査には通常、大量の資源がかかり、否定的な宣伝が生じ、これは私たちの名声や業務を損なう可能性がある。
私たちと私たちの計算プラットフォームを使用する協力者は、適用されるリベート、詐欺および乱用、虚偽声明、透明性、健康情報プライバシーおよび安全、および他のヘルスケア法律法規の制約を受ける可能性があります。このような法律法規を守らない人は、重大な処罰を受けるかもしれない。
私たちと私たちの計算プラットフォームを使用する協力者は、私たちのマーケティング、販売、流通、私たちのソフトウェア解決策、およびマーケティングの許可を得た任意の製品の業務または財務スケジュールと関係を制限する可能性がある広範に適用される医療法令の制約を受ける可能性があります。このような医療法律法規は連邦医療反減税法規を含んでいますが、連邦民事と刑事虚偽です
連邦虚偽請求法案のようなクレーム法律;1996年連邦健康保険携帯性および責任法案、またはHIPAA;連邦食品、医薬品および化粧品法案、連邦医師支払い陽光法案、および州反リベートおよび虚偽クレーム法律および透明性法律のような同様の州および外国の法律。
私たちが第三者の業務配置と適用される医療法律や法規に適合するように努力することは、多くのコストに関連することを確実にします。政府当局は、私たちの業務実践が現在または未来に適用される詐欺および乱用または他の医療保健法律および法規に関連する現行または未来の法規、法規または判例法に適合していない可能性があると結論するかもしれない。適用される医療法律および法規の違反は、重大な民事、刑事および行政処罰、損害賠償、返還、罰金、監禁、医療計画(MedicareおよびMedicaidなど)から製品を除外すること、追加的な報告要件および/または監督(企業誠実協定または同様の協定に署名して、これらの法律違反に関する告発および削減または再構成運営を解決するために署名された場合)をもたらす可能性がある。しかも、違反はまた名声被害、利益減少、そして未来の収益をもたらす可能性がある。
私たちは反腐敗法、そして輸出規制法、税関法、規制法、その他私たちの業務を管理する法律を守らなければならない。もし私たちがこれらの法律を遵守しなければ、私たちは民事または刑事処罰、他の救済措置、法律費用を受け、米国以外で特定の製品の開発、製造、販売が禁止されたり、費用の高いコンプライアンス計画の開発と実施が要求される可能性があり、これは私たちの業務、運営結果、財務状況に悪影響を及ぼすかもしれない。
私たちの業務は、イギリスの“2010年収賄法”、米国の“海外腐敗防止法”、および私たちが業務を展開し、将来業務を展開する可能性のある国/地域に適用される他の反腐敗法律を含む反腐敗法を遵守しなければならない。“贈賄法”、“海外腐敗防止法”およびその他の法律は、一般に、業務を獲得または保留し、またはいくつかの他の業務的利点を得るために、私たち、私たちの職員、および中間者が政府官僚または他の人に贈賄、贈賄され、または他の禁止されたお金を他の人に支払うことを禁止している。“反海外腐敗法”を遵守することは特に高価で困難であり、特に腐敗は公認問題である国である。また、“海外腐敗防止法”は、多くの国で病院が政府によって運営されているため、医師や他の病院従業員が外国人官僚とされているため、バイオ製薬業界に特別な挑戦をもたらしている。臨床試験やその他の仕事に関連して病院に支払われた何らかの金は、政府関係者に支払われた不正金と考えられ、“海外腐敗防止法”の法執行行動につながった。
私たちは将来的に反収賄法や“海外腐敗防止法”に違反する可能性のある高リスク司法管轄区域で業務を展開する可能性があり、私たちは第三者との協力や関係に参加する可能性があり、これらの第三者の行為は私たちに“反収賄法”、“海外腐敗防止法”または現地反腐敗法に規定された責任を負わせる可能性がある。また、将来の規制要求の性質、範囲、影響を予測することはできず、私たちの国際業務はこれらの要求によって制約される可能性があり、現行の法律が管理または解釈される可能性がある方式を予測することもできない。私たちがアメリカ以外での業務をさらに拡大すれば、私たちが各管轄区域で事業を展開することを計画している多くの法律や法規を遵守するために、追加の資源を投入する必要があるだろう。
私たちはまた、私たちの国際業務を管理する他の法律と法規、イギリスとアメリカ政府及びEU当局が管理する法規を含み、適用される輸出規制法規、国と人員に対する経済制裁、税関要求と貨幣両替法規を含み、総称して貿易規制法と呼ばれる。さらに、様々な法律、法規、および行政命令は、国家安全目的のための米国国外での機密情報の使用および伝播、または特定の非米国国民との機密情報の共有、および特定の製品およびこれらの製品に関連する技術データを制限する。もし私たちがアメリカ以外での業務を拡大すれば、これらの法律を遵守するためにもっと多くの資源を投入する必要があります。これらの法律は、私たちがアメリカ以外で特定の製品や候補製品を開発、製造、販売することを阻止するかもしれません。これは、私たちの成長潜在力を制限し、私たちの開発コストを増加させるかもしれません。
私たちが貿易統制法を含む“反収賄法”、“海外腐敗防止法”または他の法律要件を含むすべての適用された反腐敗法律を遵守することを完全かつ効果的に保証することはできない。私たちが“反収賄法”、“海外腐敗防止法”および他の腐敗防止法または貿易統制法を遵守しなければ、私たちは刑事および民事処罰、返還および他の制裁および救済措置、および法的費用を受ける可能性があり、これは私たちの業務、財務状況、運営結果、流動性に悪影響を及ぼす可能性がある。米国証券取引委員会(SEC、略称米国証券取引委員会)も、発行者が“海外腐敗防止法”の会計条項に違反したため、発行者の米国取引所での証券取引を一時停止または禁止する可能性がある。イギリス、米国、または他の当局が“反収賄法”、“反海外腐敗法”、他の腐敗防止法または貿易統制法に違反する可能性があるいかなる調査も、私たちの名声、私たちの業務、運営結果、財務状況に悪影響を及ぼす可能性がある。
私たちの従業員、独立請負業者、コンサルタント、サプライヤーは、規制基準と要求およびインサイダー取引法律を遵守しないことを含む、不適切な行為または他の不適切な活動に従事する可能性があり、これは私たちに重大な責任をもたらし、私たちの名声を損なう可能性があります。
私たちは従業員、独立請負業者、コンサルタント、そしてサプライヤーの詐欺または他の不適切な行為のリスクに直面している。これらのパートナーの不正行為は、FDA法規または外国規制機関と比較することができる類似の法規を故意に遵守しないこと、FDAまたは外国規制機関よりも正確な情報を提供すること、製造基準を遵守すること、連邦および州医療詐欺および法律法規を乱用すること、および外国規制機関よりも制定および実行可能な類似の法律法規、財務情報またはデータを正確に報告すること、または許可されていない活動を開示することを含むことができる。従業員の不当行為はまた臨床試験過程で得られた情報を不当に使用する可能性があり、これは規制制裁と著者らの名声に深刻な損害を与える可能性がある。これには、EUデータ保護命令を含むHIPAA、他の米国連邦、州法律、およびEUデータ保護命令を含む非米国司法管轄区域の要求が含まれる可能性がある。私たちはまた従業員や私たちと関連のある他の人たちがインサイダー取引に違反するリスクに直面している。従業員の不正行為を常に識別し、阻止できるわけではなく、このような行為を発見し、防止するための予防措置は、未知または未管理のリスクまたは損失を効果的に制御することができない可能性があり、または、このような法律、基準、法規、ガイドラインまたは行動基準に準拠できないことによる政府の調査または他の行動または訴訟から私たちを保護することができるかもしれない。また、私たちの従業員は時々雇用問題で私たちに訴訟を起こして、怪我、差別、賃金と工数紛争、セクハラ、敵対的な労働環境、または他の雇用問題を含むかもしれません。もし私たちにこのような行動を取って、私たちが自分の権利を弁護したり、維持したりすることに成功しなかったら、これらの行動は、巨額の罰金や他の制裁を加えることを含む、私たちの業務および業務結果に大きな影響を及ぼすかもしれない。
私たちの内部情報技術システムまたは私たちの第三者サプライヤー、請負業者、またはコンサルタントのシステムは、障害やセキュリティホール、データ損失または漏洩、および他の中断を受ける可能性があり、これは、私たちのサービスの深刻な中断を招き、私たちの業務に関連する敏感な情報を危険にさらし、または私たちの重要な情報へのアクセスを阻止し、それによって、私たちが責任を負うか、または他の方法で私たちの業務に悪影響を及ぼす可能性があります。
私たちはますます情報技術システム、インフラ、データに依存して私たちの業務を運営している。通常のビジネスプロセスでは、機密情報(知的財産権、独自のビジネス情報、および個人情報を含むがこれらに限定されない)を収集、格納、および送信する。重要なのは、私たちはこのような機密情報の機密性と完全性を維持するために、安全な方法でそうしなければならないということだ。私たちはまた私たちの運営要素を第三者にアウトソーシングしているので、私たちは多くの第三者サプライヤーと他の請負業者と顧問を管理しています。彼らは私たちの機密情報にアクセスすることができます。
セキュリティ対策を実施しているにもかかわらず、我々の内部情報技術システムおよび我々の第三者サプライヤーおよび他の請負業者およびコンサルタントの規模および複雑さ、および彼らが維持している機密情報の数が増加していることを考慮すると、私たちの情報技術システムは、サービス中断、システム障害、自然災害、テロ、戦争、電気通信および電気故障によって故障または他の損害または中断が発生しやすい可能性があり、ならびに私たちの従業員、第三者サプライヤー、請負業者、コンサルタント、業務パートナーおよび/または他の第三者の不注意または意図的な行為、または悪意のある第三者からのネットワーク攻撃(有害なマルウェア、恐喝ソフトウェア、恐喝ソフトウェアを含む)の配備を含む。サービス攻撃の拒否、社会工学、および他の方法は、サービスの信頼性に影響を与え、情報の機密性、完全性、および利用可能性を脅かす)、これは、私たちのシステムインフラ、または私たちの第三者サプライヤーおよび他の請負業者およびコンサルタントのシステムインフラを危険にさらし、またはデータ漏洩を引き起こす可能性がある。世界各地からの未遂攻撃と侵入の数、強度と複雑性の増加に伴い、セキュリティホールや破壊のリスクは普遍的に増加し、特にコンピュータハッカー、外国政府とネットワークテロリストを含むネットワーク攻撃或いはネットワーク侵入を介している。私たちはすべての種類の安全脅威を予見できないかもしれないし、これらすべての安全脅威に対して効果的な予防措置を取ることができないかもしれない。例えば、サードパーティは、過去および将来、我々のソフトウェアを不正に海賊版し、ピアツーピアファイル共有ネットワークまたは他の態様でソフトウェアを公開して提供する可能性がある。ネットワーク犯罪者が使用する技術は常に変化し、起動前に識別されない可能性があり、外部サービスプロバイダ、組織犯罪分岐機関、テロ組織または敵対する外国政府や機関などの外部団体を含む様々なソースから来る可能性がある。任意の中断またはセキュリティホールが、私たちのデータまたはアプリケーション、または当社の第三者サプライヤー、他の請負業者およびコンサルタントのデータまたはアプリケーションを紛失または破損させたり、機密または独自の情報を適切に開示しない場合、私たちは責任および名声の損害を招く可能性があり、私たちのソフトウェアのさらなる開発および商業化は延期される可能性があります。重大なセキュリティホールや中断に関連するコストは巨大である可能性があり、このようなリスクに対して提供されるネットワークセキュリティ保険の制限を超える可能性がある。もし私たちの第三者サプライヤー、他の請負業者、コンサルタントの情報技術システムが中断またはセキュリティホールの影響を受けた場合、私たちはこのような第三者に対抗するのに十分な追跡権がない可能性があり、私たちはこのような事件の影響を軽減し、将来のこのような事件の発生を防止するために保護措置を制定し、実施しなければならないかもしれない。
私たちはこれまで重大なシステム障害、事故、セキュリティホールを経験しておらず、私たちのデータ保護努力と情報技術への投資は、将来このような事件が発生する可能性を低下させると信じていますが、私たちのデータ保護努力と情報技術への私たちの投資は、私たちのシステムの重大な故障、データ漏洩、侵入、または私たちの名声、業務、運営、または財務状況に重大な悪影響を及ぼす可能性のある他のネットワークイベントを防止することを保証することはできません。例えば、このような事件が発生して私たちの運営が中断されたり、私たちの第三者サプライヤーや他の請負業者やコンサルタントの運営が中断されたりすると、私たちの計画が実質的に中断される可能性があり、私たちのサービスや技術の開発が延期される可能性があります。さらに、我々の内部情報技術システムまたは第三者サプライヤー、他の請負業者およびコンサルタントのシステムは深刻に中断されているか、またはセキュリティホールは、機密情報(商業秘密または他の知的財産権、独自業務情報および個人情報を含む)の損失、流用および/または不正アクセス、使用または開示、またはアクセスを阻止する可能性があり、これは、財務、法律、商業および名声を損なう可能性がある。例えば、不正アクセス、使用または個人情報(私たちの顧客または従業員に関する個人情報を含む)をもたらすこのような事件は、私たちの名声を直接損なう可能性があり、連邦および/または州の違反通知法および外国等価法律に遵守させ、是正措置を強制することができます。そうでなければ、個人情報のプライバシーや安全を保護する法律および法規に基づいて責任を負うことになり、重大な法律や財務リスクおよび名声被害を招き、私たちの業務に悪影響を及ぼす可能性があります。また,経験豊富なネットワーク攻撃者(工業スパイ活動に従事する外国相手を含む)は,既存のセキュリティ技術に適応し,組織の敏感なビジネスデータを取得するための新たな方法を開発することを得意としており,ビジネス機密を含む敏感な情報の損失を招く可能性がある.たとえば,攻撃者は人工知能や機械学習を用いてターゲットに対してより自動化され,より的確で的確な攻撃を仕掛けている.さらに、実際的、潜在的、または予想される攻撃は、より多くの人員および保護技術を配置すること、従業員を訓練すること、および第三者専門家およびコンサルタントを招聘するコストを含む、私たちのコストを増加させる可能性がある。
気候変動に関連するリスクと不確定性及び気候変動に対応する法律或いは規制措置は私たちの業務、財務状況、運営結果、将来性と名声にマイナスの影響を与える可能性がある。
私たちはますます多くの気候関連のリスクと不確実性に直面しており、その中の多くのリスクと不確実性は私たちがコントロールできない。気候変化はより頻繁な悪天候事件、降水パターンの潜在的な変化、および天気パターンの極端な変動を招く可能性があり、これは私たちおよび私たちのサプライヤー、サプライヤーと協力者の運営を乱す可能性がある。
気候に関連するマクロ経済傾向は、低炭素経済への移行、炭素価格の影響、公衆感情の変化、および気候に関連する規則と法規を制定する可能性があり、発展を続けており、私たちの法律、コンプライアンス、商業コストを増加させる可能性がある。また、会社が提起した気候関連訴訟の増加、保険料コストの増加、およびよりロバストな業務連続計画および災害復旧計画の実施は、私たちの運営を維持したり、私たちが行う可能性のある任意の持続可能な約束を実現するのに必要なコストを増加させる可能性があり、これは私たちの業務を損なう可能性がある。
私たちは毎年私たちの運営と私たちの顧客が気候に及ぼす影響を評価する。私たちが未来に行う可能性のあるいかなる約束も、私たちが制定する可能性のある気候変動に関連する任意の目標の実行と実現は、リスクと不確定要素の影響を受ける。持続可能な投資と会社の持続可能性を重視していることから、環境イニシアチブを強化するために政策ややり方を取らなければ、私たちの名声と私たちの顧客と利害関係者の関係はマイナスの影響を受ける可能性があり、これは私たちがより効果的な競争をしにくく、あるいは必要な時に受け入れ可能な条件で融資を受けることを可能にし、これは私たちの業務、財務状況、運営結果、将来性、名声にマイナスの影響を与えるだろう。
従業員の事務と管理成長に関するリスク
私たちの未来の成功は私たちが肝心な幹部を維持し、合格者を吸引、維持、激励する能力にかかっている。
私たちは私たちの幹部と私たちの管理、科学、臨床とソフトウェア工学チームの他の主要なメンバーの研究開発、臨床、財務、運営、科学、ソフトウェア工学とその他の業務の専門知識に高度に依存している。私たちは私たちの幹部と雇用協定を締結したが、彼らの誰もが私たちとの雇用関係をいつでも終わらせることができる。私たちは私たちの役員や他の職員たちに“キーパーソン”保険を提供しない。
私たちの役員や他の重要な従業員を失ったサービスは、私たちのソフトウェア業務開発と販売目標の実現を阻害し、私たちの薬物発見業務研究、開発、商業化目標の実現を阻害する可能性があります。いずれの場合も、役員や他のキーパーソンのサービスを失うことは、業務戦略を成功させる能力を大きく損なう可能性があります。また、幹部と肝心な従業員を交換することは困難かもしれないし、開発に成功し、監督部門の許可を得て、生命科学業界の製品を商業化するために必要な技能と経験を備えた個人数が限られているため、長い時間を要するかもしれない。
合格した科学、臨床、製造、会計、法律、販売とマーケティング人員、及びソフトウェアエンジニアと計算化学者を募集と維持することも、著者らの成功のキーポイントとなる。技術業界では,設計,開発と管理ソフトウェアや関連サービスにおいて高いレベルの専門知識を持つエンジニアや販売主管,データ科学者,運営者に対する競争が激しく続いている.これらの人員を募集する競争は非常に激しく、多くの生物製薬と技術会社の間の類似者に対する競争を考慮すると、私たちは受け入れ可能な条件でこれらの肝心な人員を採用、訓練、維持或いは激励することができないかもしれない。私たちはまた、大学や研究機関から科学や臨床人を募集する競争に直面している。また、私たちはコンサルタントやコンサルタントに依存して、私たちの研究開発と商業化戦略を策定し、私たちのコンピューティングプラットフォームを推進してくれます。私たちのコンサルタントやコンサルタントは、私たち以外の雇用主に雇われる可能性があり、他のエンティティと締結された相談または相談契約に基づいて約束することができ、これは、私たちが彼らを得る機会を制限するかもしれない。もし私たちが高い素質の人材を引きつけ、維持することができなければ、成長戦略を実施する能力は制限され、私たちの業務は悪影響を受けるだろう。
私たちは多様な業務戦略を実施しており、私たちの発展と規制能力の拡大を望んでいますので、私たちの複数の業務部門や私たちの成長を管理する上で困難に直面する可能性があり、これは私たちの運営を混乱させる可能性があります。
現在,研究開発,ソフトウェア販売および協力と特許薬物発見の活動を含む多様なビジネス戦略を同時に実施している。私たちは、これらの多様な業務戦略を実施することは財務と運営協同効果を提供することができると信じているが、これらの多元化された業務は私たちの限られた資源に対してより高い要求を提出している。また、私たちは最近経験して、特に薬物開発、臨床、規制事務の分野で、私たちの従業員数と業務範囲の著しい増加を経験し続けることが予想される。私たちの複数の業務部門と私たちの持続的で予想される将来の成長を管理するためには、私たちの管理、運営、財務システムを継続して実施し、改善し、私たちの施設を拡大し、より多くの合格者を募集し、訓練し続けなければならない。私たちの財務資源が限られていることと、私たちの管理チームの管理会社側の注意力や経験が限られているため、会社の持続的かつ予想成長がこんなに速いため、私たちの複数の業務部門と私たちの業務拡張を効果的に管理したり、より多くの合格者を募集したりすることができないかもしれません。私たちの業務の拡張は巨大なコストを招き続け、私たちの管理と業務発展資源を移転する可能性があります。私たちの管理、人員、そしてシステムは未来の成長を支持するのに十分ではないかもしれない。私たちの複数の業務部門や成長を管理できない状況は、私たちの業務計画の実行を遅延させたり、私たちの運営と現在の私たちの業務部門との間に存在する相乗効果を乱したりする可能性があります。しかも、事業部門の不利な発展の中の一つはこのような協同効果を混乱させるかもしれない。
私たちの普通株式所有権に関連するリスク
私たちの普通株の活発な取引市場は持続できないかもしれない。
私たちの普通株は2020年2月6日にナスダック世界ベスト市場で取引を開始した。2020年2月6日まで、私たちの普通株は公開市場を持っていません。私たちの株の活発な取引市場が続くことを保証することはできません。したがって、私たちの株主は、私たちの普通株の市場価格を下げることなく、彼らの株を売ることが難しいかもしれません。
我々の役員、取締役、主要株主は、彼らが共同行動を選択すれば、株主に承認されたすべての事項に影響を与える能力がある。
2024年2月21日現在、私たちの役員、取締役、実益は私たちが発行した普通株式総数の5%を超える株主を保有しており、実益所有株式は私たちの普通株とすべての有限普通株の約44.2%を占めています。あるいは、もし私たちの有限普通株式の所有者がその権利を行使すれば、その1株当たりの有限普通株を私たちの普通株に転換し、私たちの普通株の約51.3%を占めます。したがって、これらの株主が共同行動を選択すれば、彼らは私たちの株主に提出されたすべての事項と、私たちの管理と事務に影響を与えることができるだろう。例えば、この人たちが共同行動を選択した場合、取締役の選挙と、任意の合併、合併、または売却のすべてまたはほとんどの資産の承認に影響を与えるだろう。
このような所有権制御の集中可能性:
•制御権の変更を延期、延期、または阻止する
•私たちの経営陣や取締役会を強化する
•私たちの他の株主が望む可能性のある合併、合併、接収、または他の業務合併に関連することを延期または阻止する。
このような所有権の集中はまた私たちの普通株の市場価格に悪影響を及ぼすかもしれない。
私たちの普通株の価格変動は大きく、これは私たちの株主に大きな損失をもたらすかもしれない。
私たちの株価はずっと変動していて、変動し続ける可能性が高い。2020年2月の初公募株から2024年2月21日まで、我々普通株の盤価格は15.85ドルの安値から高値に変動しました
117.00ドル。変動性のため、私たちの株主は普通株を購入したかそれ以上の価格で普通株を売ることができないかもしれません。私たちの普通株の市場価格は多くの要素の影響を受けるかもしれません
•私たちのソフトウェアソリューションへの投資と成功
•私たちの特許薬物発見プロジェクトの開発に成功しました
•私たちが開発する可能性のある任意の候補製品の臨床前研究および臨床試験の開始と進展
•私たちまたは私たちの競争相手または潜在的パートナーが開発する可能性のある任意の候補製品の臨床前研究および臨床試験の結果または発展;
•私たちの薬は協力者の成功を発見しこれらの協力者から得たマイルストーンや他の支払いは
•競争力のある製品や技術の成功
•アメリカや他の国の法規や法律の発展
•キーパーソンの採用や退職
•私たちの財務結果や私たちに似ていると思われる会社の財務結果の変化
•私たちが予想している財務や経営業績に対する指導や公告
•私たち、私たちの役員、取締役または主要株主または他の人は普通株を売却するか、または普通株の売却を期待しています
•バイオ製薬業界の市場状況
•一般的な経済、業界、市場状況
•最近の新冠肺炎のような公衆衛生流行病の社会と経済的影響
•“リスク要因”の節で述べた他の要因。
過去には、ある会社の証券市場価格が変動した後、同社に対して証券集団訴訟が提起されることが多かった。私たちは一方としてのいかなる訴訟も、正当な理由の有無にかかわらず、不利な判決を招く可能性がある。私たちはまた不利な条件で訴訟を解決することに決定するかもしれない。このような負の結果は、巨額の損害賠償または罰金の支払い、私たちの名声を損なう、または私たちの製品または業務実践に悪影響を及ぼす可能性があります。このような訴訟は、このようなクレームを弁護し、経営陣の注意と資源を移転させるために、他の巨額の費用を発生させる可能性もある。
私たちの実際の運営結果は私たちの指導意見と大きく違うかもしれない。
当社の年度または四半期収益電話会議、年度または四半期収益発表またはその他の面で、私たちの将来の業績に関する指導を発表することが可能であり、これらの指導は、私たちの経営陣の指導発表日までの推定を表しています。私たちの指導は展望的な陳述を含めて、私たちの経営陣が準備した予測に基づいている。私たちの公認会計士、他の独立した専門家、または外部の人たちはこのような予測を作成したり検討したりしません。したがって、このような人々は、そのような予測についていかなる意見を発表したり、任意の他の形態の保証をしたりしてはならない。
予測は、いくつかの仮定および推定に基づいており、これらの仮説および推定は、数字の特殊性で示されているが、本質的には、重大な商業、経済、および競争不確実性および予期しないイベントの影響を受け、その多くは、将来の業務決定に関する特定の仮定に基づいており、その中のいくつかは変化するであろう。私たちが発表し、指導を継続する主な理由は、アナリストや投資家と私たちの業務の将来性を議論するために、私たちの経営陣に基礎を提供することです。このような第三者が発表したいかなる予測や報告書についても、私たちは何の責任も負わない。
指導意見は必然的に投機的であり,我々が提供するどの指導意見に基づいている部分やすべての仮説が現実にならないか,あるいは実際の結果とは大きく異なることが予想される.したがって,我々の指導は,管理職が発表日までに実現可能であると考えている内容の見積もりにすぎない。実際の結果は私たちの指導とは違うかもしれないし、変化は実質的かもしれない。
私たちと私たちの協力者は、私たちまたは彼らが発表した時間範囲で予想される発見と開発マイルストーン、および他の予想された重要なイベントを達成できないかもしれません。これは私たちの業務に悪影響を与え、私たちの株価を下落させる可能性があります。
私たちは時々いくつかのマイルストーンと重要な事件の予想時間について公開声明を発表し、例えば、私たちの特許薬物発見計画における臨床前とINDを有効にする研究と臨床試験、そして私たちの協力下での発展とマイルストーンを開始し、完成することを予想する。例えば,MorphyやStructure Treateuticsも公開声明を発表し,我々との協力開発プロジェクトへの期待を表明しており,彼らや他の協力者は将来,彼らが我々と協力する目標や期待についてより多くの声明を発表するかもしれない.これらの活動の実際の時間は大きく異なるかもしれないが、これは、私たちまたは私たちの現在と未来の協力者の薬物発見と開発計画の遅延や失敗、私たちと私たちの現在と未来の協力者が投入している時間、エネルギー、資源の数、および薬物開発に固有の多くの不確実性のためである。したがって、私たちまたは私たちの現在と未来の協力者の計画が私たちまたは彼らが発表または予想された時間範囲内で推進または完了することを保証することはできない。もし私たちまたは任意の協力者が計画通りにその中の1つまたは複数のマイルストーンまたは他の重要な事件を達成できなかった場合、私たちの業務は実質的な悪影響を受ける可能性があり、私たちの普通株価格は下落する可能性がある。
証券アナリストが研究報告書を発表したり停止したりしなければ、私たちの業務の誤解性、不正確または不利な研究報告を発表したり、彼らが私たちの株に対する否定的な評価を発表したりすると、私たちの株式の価格や取引量が低下する可能性がある。
私たちの普通株の市場価格と取引量は、業界または金融アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存する。私たちはこのようなアナリストを統制できない。既存のアナリストが私たちを追跡し続ける保証はなく、新しいアナリストが私たちを追跡し始めるという保証もない。どんなカバーアナリストも有利な報告書を提供するという保証はない。私たちはアナリストの報告を得ていますが、1人以上の私たちの業務を追跡しているアナリストが私たちの株の評価を下方修正したり、私たちの業務の不正確または不利な研究報告を発表したり、私たちの競争相手に関するより有利な相対的な提案を提供したりすれば、私たちの株価は下落する可能性があります。もしこのようなアナリストの一人以上が私たちの株を追跡しなければ、私たちは市場での私たちの株の可視性を失うかもしれません。これは逆に私たちの株価と取引量を低下させる可能性があります。
我々は現金,現金等価物,有価証券の使用に広範な自由裁量権を有しており,それらを有効に使用できない可能性がある.
私たちの経営陣は、私たちの現金、現金等価物、および有価証券の配備と使用において広範な自由裁量権を持っており、これらの資金を使用することができる方法は、私たちの運営業績を改善したり、私たちの普通株の価値を高めたり、あるいは私たちの株主が同意しないかもしれない方法で使用します。もし私たちの経営陣がこれらの資金を有効に運用できなければ、私たちの業務、財務状況、経営結果、見通しを損なう可能性があり、私たちの普通株価格の下落を招く可能性があります。
私たちは予測可能な将来に私たちの普通株に現金配当金を支払わないと予想されるので、資本付加価値(あれば)が私たちの株主の唯一の収益源になるだろう。
私たちは普通株の現金配当金を発表したり支払ったりしたことがない。私たちは現在、私たちの未来のすべての収益を維持し、私たちの業務の発展と拡張に資金を提供するつもりだ。未来に配当金を送るかどうかは、私たちの取締役会が自ら決定するだろう。したがって、私たち普通株の資本増価(あれば)は私たちの株主が予測可能な未来に唯一の収益源になるだろう。
公開市場で私たちの普通株を売却する大量の株は、私たちの業務が良好であっても、私たちの普通株の市場価格を大幅に低下させる可能性がある。
公開市場で私たちの普通株の大量株を売ったり、市場で大量の株を持っていると思っている人が株を売却しようとしているという見方は、私たちの普通株の市場価格を下げ、追加株式証券を売却することで資金を調達する能力を弱める可能性があり、私たちの株主が彼らが適切だと思う時間と価格で普通株を売却することを困難にする可能性がある。2024年2月21日現在、私たちは63,146,419株の発行済み普通株と9,164,193株の有限普通株を持っている。私たちが発行した普通株は、私たちの限られた普通株の株式を転換する際に発行可能な普通株を含めて公開市場で販売することができますが、当社の付属会社については、1933年の証券法(改正)第144条の制限のみを受けています。また、我々の一部の役員、取締役、および関連株主は、時々私たちの普通株の株式を売却することを規定している規則10 b 5-1に加入しているか、または加入する可能性がある。規則10 b 5-1計画によれば、ブローカーは、役員、取締役、または関連株主のさらなる指示を必要とせずに、計画に入る際に確立されたパラメータに従って取引を実行する。規則10 b 5−1計画は、場合によっては修正または終了される可能性がある。我々の役員、取締役、関連株主も、重大な非公開情報を把握することなく、ルール10 b 5-1計画以外の追加株式を購入または売却することができる。
また、S-3表の汎用棚登録声明を提出し、販売時に決定された価格と条項に基づいて、時々1つ以上の発売に基づいて、不確定数量の普通株、優先株、預託株式または株式承認証、または元本を確定しない債務証券を発売することを可能にした。さらに、特定の条件の下で、私たちの普通株式および限られた普通株式のいくつかの所有者は、私たちが自分または他の株主に提出した登録声明に彼らの株式を含む権利があり、彼らの株式に関するS-3登録表を提出することを要求することができる。
私たちは販売エージェントであるLeerink Partners LLC(SVB Securities LLC)やLeerink Partnersと販売契約を締結し、“市場”発売計画やATMに関する販売契約を締結し、この計画によると、私たちの表S-3に基づいて時々Leerink Partnersを通じて私たちの普通株の株を提供し、販売することができ、総発行価格は最大2.5億ドルに達する。我々が売却を要求した後,Leerink Partnersが売却する株式数は,我々の販売期間内の普通株の市場価格と我々がLeerink Partnersと設定した制限によって変動する.したがって,販売プロトコルにより,我々が最終的に発行する株式数(あれば)を予測することはできない.今まで、私たちはATMでどんな普通株も売っていません。
私たちはまたS-8表に登録声明を提出して、株式補償計画に従って発行する可能性のある普通株を登録しました。この等の登録声明に基づいて登録された株式は発行時に公開市場で販売することができるが、共同会社、帰属手配及び購入持分の行使に適用される数量制限に制限されなければならない。
上場企業として、我々はコストを増加させ続けており、我々の経営陣は、新たなコンプライアンスやコーポレートガバナンスを実施するために多くの時間を投入し続けることが求められている。
上場企業として、私たちはすでに大量の法律、会計、その他の費用を発生させ続けており、これらの費用は私たちが民間会社として発生していない。改正された1934年証券取引法或いは取引法、2002年サバンズ-オクスリ法案、ドッド-フランクウォール街改革と消費者保護法、ナスダックの上場要求及びその他の適用された証券規則と法規は上場企業に対して各種の要求を提出し、有効な開示、財務制御と会社管理やり方の確立と維持を含む。私たちの経営陣や他の人たちは、これらのコンプライアンス計画を実施するために多くの時間と資源を投入し続ける必要があります。これは、他の業務を犠牲にして、私たちの業務、財務状況、運営結果、将来性を損なう可能性があります。さらに、これらの規則と法規は、私たちの法律と財務コンプライアンスコストを増加させ続け、いくつかの活動を私たちが個人会社の場合に比べてもっと時間的で高価にし続けるだろう。
私たちは、これらの規制の遵守状況を常に評価しており、私たちが発生する可能性のある追加コスト金額やそのようなコストの時間を予測したり、推定することができません。これらの規則や条例は往々にして異なる解釈を持ち,多くの場合特殊性に欠けるため,規制機関や理事機関が新たな指導意見を提供するにつれて,実践における適用は時間とともに変化する可能性がある。これは遵守事項に関する持続的な不確実性と、開示と統治慣行を絶えず修正するために必要なより高いコストをもたらす可能性がある。
上場企業として、財務報告書の適切かつ効果的な内部統制を発展させ、維持する義務がある。これらの内部統制を維持できなかった十分性は、投資家がわが社の自信に悪影響を与え、私たちの普通株の価値に影響を与える可能性がある。
サバンズ·オキシリー法404条によると、私たちは経営陣が毎年、私たちの財務報告書の内部統制に関する報告書を提出しなければならない。この評価には、財務報告書の内部統制で発見された私たちの経営陣の重大な弱点を開示する必要がある。第404条によると、私たちはまた、財務報告書の内部統制に対する私たちの独立公認会計士事務所に毎年意見を発表させなければならない。
私たちの内部統制を評価する際に、私たちの財務報告内部統制に1つ以上の重大な弱点があることが発見された場合、私たちの財務報告内部統制が有効であるとは断言できないだろう。また、補完できない重大な弱点があれば、私たちの独立公認会計士事務所から財務報告の内部統制に対する否定的な意見を受けることになります。例えば、2022年12月31日までの年度の総合財務諸表を監査したところ、我々と独立公認会計士事務所は、財務報告の内部統制に大きな弱点があることを発見しました。私たちは2023年12月31日にこの重大な欠陥を補完しましたが、将来的に財務報告書の内部統制に重大な欠陥や重大な欠陥が発生しないことを保証することはできません。もし私たちが未来に重大な弱点を再び発見したら、私たちが未来に取る可能性のあるいかなる措置も、この重大な弱点を修復したり、未来により多くの重大な弱点を発見しないように保証することはできません。もし私たちが取った措置が未来の重大な欠陥を適時に是正できなければ、このような制御欠陥や他の欠陥は私たちの年度や中期財務諸表に重大なミスが発生し、適時に予防や発見できない可能性が高い。
財務報告を内部統制できなかったいかなる行為も、財務状況や経営結果を正確に報告する能力を深刻に抑制する可能性がある。もし私たちが将来的に財務報告の内部統制に有効であると判断できなければ、あるいは私たちまたは私たちの独立公認会計士事務所が私たちの財務報告の内部統制に重大な弱点があると判断した場合、私たちは投資家が私たちの財務報告の正確性と完全性に自信を失う可能性があり、適用された証券取引所の上場要求を除いて、定期報告の提出に関する証券法の要求を引き続き遵守できない可能性があり、私たちの普通株式市場価格は下落する可能性があり、私たちはナスダック、アメリカ証券取引委員会、または他の規制機関の制裁や調査を受ける可能性がある。財務報告の内部統制のいかなる重大な欠陥を補うことができなかったり、上場企業に必要な他の効果的な制御システムを実施または維持できなかったりすることは、将来的に資本市場に参入する機会を制限する可能性もある。
私たちの開示統制と手続きはすべてのミスや詐欺を阻止したり検出できないかもしれない。
上場企業として、私たちは取引法のいくつかの報告要件を守らなければならない。我々の開示制御および手続きは、取引所法案に基づいて提出または提出された報告書において、開示を要求する情報が蓄積され、米国証券取引委員会規則および表で指定された期間内に管理層、記録、処理、まとめおよび報告に伝達されることを合理的に確保することを目的としている。任意の開示制御およびプログラムまたは内部制御およびプログラムは、発想および動作がどのように完全であっても、絶対的な保証ではなく、合理的な保証を提供することしかできず、制御システムの目標が達成されることを確保することしかできないと信じている。これらの固有の限界は,意思決定過程における判断が誤りである可能性があり,簡単な誤りや誤りによって故障が発生する可能性があるという現実を含む.さらに、ある人の個人的な行動、2人以上の結託、または無許可超越制御は、制御を回避することができる。したがって,我々の制御システム固有の制限により,誤りや詐欺による誤った陳述や開示不足が発見されることなく発生する可能性がある.
わが社の定款書類やデラウェア州法律の条項は、わが社の買収をより困難にする可能性があり、これは私たちの株主に有利になる可能性があり、私たちの株主が現在の取締役や経営陣のメンバーを交換または罷免しようとすることを阻止するかもしれません。
会社登録証明書及び定款における条項は、株主がその株式から割増取引を得る可能性があることを含む、株主が有利であると考えられる会社の合併、買収又はその他の制御権変更を阻害、延期又は阻止する可能性がある。これらの条項はまた、投資家が将来私たちの普通株に支払いたいかもしれない価格を制限し、それによって私たちの普通株の市場価格を下げる可能性がある。また、我々の取締役会が責任を持って我々の管理チームのメンバーに命じているため、これらの規定は、株主が取締役会のメンバーを交換する難しさを増やすことで、現在の経営陣の任意の試みを交換または罷免することを阻害または阻止する可能性がある。他にもこれらの条項には
•毎年3種類の取締役のうちの1種類しか選出されない分類された取締役会を設立する
•取締役会の決議を経て、当社が許可した取締役数を変更することができる
•株主が取締役会から取締役を除名することを制限する方法
•株主提案の事前通知要求を作成し、株主会議と取締役会の指名で行動することができる
•株主に要求する行動は、正式に開催される株主総会で行われ、株主の書面同意の下での行動を禁止しなければならない
•取締役会または秘書への株主会議の人数を制限するために、発行された普通株および有限普通株を少なくとも25%保有する株主の要求を制限しなければならない
•我々の取締役会が株主の承認を得ずに優先株を発行することを許可することは、潜在的な敵意の買収者の株式を希釈し、わが取締役会の承認されていない買収を効果的に防止するための“毒丸”を制定するために使用される可能性がある。
また、私たちはデラウェア州に登録して設立されたので、私たちはデラウェア州会社法第203条の規定によって管轄されています。この条項は、規定された方法で合併または合併が承認されない限り、私たちが発行した議決権のある株を15%以上保有している人が取引日後3年以内に私たちと合併または合併することを禁止しています。
私たちの会社登録証明書は、デラウェア州の州裁判所が私たちの株主のために起こしうるいくつかのタイプの訴訟および訴訟の唯一のおよび独占フォーラムを指定し、これらの訴訟および訴訟は、会社および私たちの役員、役員、および従業員に対する訴訟を阻止するかもしれない。
私たちの会社登録証明書は、私たちが書面で別のフォーラムを選択することに同意しない限り、デラウェア州衡平裁判所(または、デラウェア州衡平裁判所に管轄権がない場合、デラウェア州連邦地域裁判所)は、以下の唯一のフォーラムとなります:(1)私たちが提起した任意の派生訴訟または法的手続きを代表して、(2)私たちのいかなる取締役、上級管理職、従業員または株主のわが社または私たちの株主に対する受託責任に違反すると主張するいかなる訴訟も、(3)当社の登録証明書または別例(各ケースにおいて、随時改訂することができる)の任意の条文によって引き起こされる任意の訴訟、または(4)当社の会社登録証明書または別例(各ケースにおいて、随時改訂することができる)の任意の条文によって生成される申立の任意の訴訟、または(4)当社の会社登録証明書または附例のいずれかの条文に従って生成された請求書を主張する訴訟、または(4)当社の会社登録証明書または添付例のいずれかの条文に基づいて生成された請求書を主張する訴訟。これらの裁判所条項の選択は、1933年の証券法(改正された証券法)、取引法、または連邦裁判所が排他的管轄権を有する任意の他のクレームを執行するために提起された訴訟には適用されない。
この排他的な裁判所条項は、私たちの株主が司法フォーラムでこのような株主が、私たちまたは私たちの役員、役員、または従業員との紛争のクレームに有利だと思う能力を制限する可能性があり、これは、私たちと私たちの役員、役員、および従業員に対するこのような訴訟を阻止するかもしれない。あるいは、裁判所が私たちの会社登録証明書に含まれる裁判所条項の選択が訴訟で適用されないか、または実行できないことを発見した場合、私たちは、他の管轄区域でこのような訴訟の解決に関連する追加費用を発生させる可能性があり、これは、私たちの業務、財務状況、および経営業績に大きな悪影響を及ぼす可能性があります。
項目1 B。未解決の従業員のコメント。
ない。
プロジェクト1 C。ネットワークセキュリティです。
我々は,我々の全体的な情報技術機能に内蔵され,我々の情報資産や運営を内部および外部ネットワークの脅威から保護し,我々のネットワークやシステムのセキュリティを確保するためのネットワークセキュリティリスクを評価,識別,管理する特定のプロセスを持っている.これらのプロセスは、リスクを識別し、私たちのやり方を改善するために、物理、プログラム、および技術保障、応答計画、私たちのシステムの定期的なテスト、イベントシミュレーション、および私たちの政策およびプログラムの定例審査を含む。私たちはコンサルタント、コンピュータセキュリティ会社とリスク管理コンサルタント、同業者会社、業界団体と管理専門家を招いて、私たちのネットワークセキュリティ監督を強化する。第三者サービスプロバイダと接触する前に、関連する抜け穴から当社の会社を保護するのを助けるために、彼らの内部リスク監視計画を考慮します。私たちの全体的なリスク緩和戦略の一部として、私たちはまたネットワークセキュリティ保険のカバー範囲を維持します。しかし、このような保険のタイプまたは金額は、セキュリティホール、ネットワーク攻撃、および他の関連する違反に対する私たちのクレームをカバーするのに十分ではないかもしれません。
我々は現在、ネットワークセキュリティ脅威からの既知のリスクが存在するとは考えておらず、これらのリスクは、合理的にわが社または当社の業務戦略、運営結果、または財務状況に重大な影響を与える可能性がある。
我々の取締役会の監査委員会はネットワークセキュリティリスクを直接監督し、定期的にこのような監督の最新状況を取締役会に通報する。監査委員会は、管理層からネットワークセキュリティ事項に関する最新の状況を定期的に受け取り、更新中に新たな重大なネットワークセキュリティ脅威またはイベントに関する通知を受ける。
我々の情報セキュリティ副総裁は全会社のネットワークセキュリティ戦略、政策、標準とプロセスの運営監督を指導し、そして関連部門の間で仕事を展開し、私たちの会社と従業員がネット釣り攻撃、恐喝ソフトウェア、データ漏洩と内部脅威を含むネットワークセキュリティリスクに対応する準備をしていることを評価し、助ける。我々の情報セキュリティ副総裁は、情報技術の開発、監督、管理、情報セキュリティチームを含む15年以上の情報セキュリティ経験を持っている。彼は2017年からわが社で働き、2023年4月から私たちの情報セキュリティ副社長を務めています。彼はこれまで2022年1月から2023年4月まで我々の情報セキュリティ担当取締役を務め、2019年2月から2022年1月まで情報セキュリティ上級取締役、2017年6月から2019年2月まで情報セキュリティ取締役を務めてきた。わが社に入社する前に、私たちの情報セキュリティ副総裁はいくつかの科学技術会社で働いていましたが、在任中は情報セキュリティの面でますます多くの責任を担当していました。
ネットワーク脅威を阻止し、発見するために、我々は毎年、社会工学およびネットワーク釣りを含むタイムリーかつ関連するテーマを含む全従業員(アルバイトおよび臨時従業員を含む)にネットワークセキュリティ意識計画を提供し、従業員にすべての事件の重要性を直ちに報告するように教育する。我々はまた,我々の情報セキュリティシステム全体のネットワークセキュリティリスクを低減するために技術ベースのツールを用いている.これらのツールは,我々の全面的なセキュリティフレームワークに統合され,我々の従業員ベースのネットワークセキュリティ計画を支援し,変化する脅威に対応するために定期的に更新される.
項目2.財産
私たちの主な施設には事務空間が含まれている。2037年12月に満期になった賃貸契約によると、私たちはニューヨークで約136,047平方フィートのオフィス空間を占有し、2026年9月に満期になった賃貸契約によると、オレゴン州ポートランドで約35,000平方フィートのオフィススペースを占有し、2028年4月に満期になったレンタルによって、インドハイデラバで約48,987平方フィートのオフィススペースを占有しました。また、私たちは世界各地の他のオフィスでオフィススペースをレンタルしている。私たちは私たちの施設が十分で、私たちの現在の必要に適していると信じています。もし必要であれば、私たちは私たちの業務を収容するために適切な追加または代替空間を提供します。
項目3.法的訴訟
時々、私たちは正常な業務過程で発生した法的訴訟に巻き込まれるかもしれない。私たちは現在、実質的な法的手続きの影響を受けていない。
第4項鉱山安全情報開示
適用されません。
第II部
項目5.登録者普通株式市場、関連株主事項、発行者による株式証券の購入
市場情報
私たちの普通株は2020年2月6日からナスダック全世界精選市場で公開取引され、取引コードはSDGRである。その前に、私たちの普通株は市場を公開しなかった。私たちの限られた普通株はどんな証券取引所にも上場したり取引したりしない。
[パフォーマンスチャート]
1934年の証券取引法(改正本)第18節または“取引法”については、以下の業績グラフおよび関連情報は、“募集材料”または米国証券取引委員会に“保存されている”とみなされてはならないし、この条項に規定されている他の責任の制約を受けても、このような情報を引用することによって、このような情報を“取引法”または“1933年証券法”(改正本)または“証券法”に基づいて提出された任意の将来の文書に組み入れてはならない。
次の図は、我々の普通株の累積総リターンとナスダック総合指数とナスダックバイオテクノロジー指数の2020年2月6日(ナスダック全世界ベスト市場公開取引初日)から2023年12月31日までの累積総リターンを比較したものである。同図は、2020年2月6日の上記各指数と我々の普通株への投資を100ドルと仮定している。各指数と私たちの普通株のデータは、すべての配当金が発行当日に再投資されたと仮定し、もしあれば。これらの比較は,我々の普通株の未来表現を予測するためでもなく,我々の普通株の未来表現を示すためでもない.
記録保持者
2024年2月21日現在、私たち普通株の記録保持者は約104人と、私たちの限られた普通株式の記録保持者が1人います。実際の持株者数は登録されている持株者数よりも大きい
実益所有者であるがその株は街頭名義で仲介人や他の被命名者が所有する株主も含まれる.この数の登録所有者は、その株式が他のエンティティが信託形式で保有する可能性のある株主も含まれていない。
配当をする
私たちは普通株式または限られた普通株の現金配当金を発表したり支払ったりしたことがない。私たちは現在、すべての利用可能な資金と任意の将来の収益を維持し、私たちの業務の発展と拡張に資金を提供するつもりで、私たちは予測可能な未来に現金配当金を支払わないと予想しています。将来配当金の発表と支払いの任意の決定は、私たちの取締役会が適宜決定し、私たちの運営結果、財務状況、契約制限、資本要求、業務見通し、および私たちの取締役会が関連すると考える可能性のある他の要素を含む当時の条件に依存するだろう。
最近売られている未登録証券
適用されません。
発行人が株式証券を購入する
適用されません。
第六項です[保留します。]
第7項:経営陣の財務状況と経営成果の検討と分析。
以下の財務状況と経営結果の検討と分析、および私たちの総合財務諸表と本年度報告書の他の部分に関する付記を読むべきです。本議論および分析に含まれるいくつかの情報または本年度報告の他の部分に記載された情報は、リスクおよび不確実性に関する前向きな陳述を含む、我々の業務計画および戦略に関する情報を含む。
以下、我々の財務状況及び運営結果を検討·分析し、2023年度と2022年度の項目、並びに2023年度と2022年度の同比比較をカバーする。本10-K表に含まれていない2021年度の項目の検討および2022年度と2021年度の同比較については、2023年2月28日に米国証券取引委員会に提出された2022年12月31日現在の会計年度10−K表年次報告の第2部、すなわち“経営陣の財務状況および経営成果の検討·分析”で見出すことができる。
本年度報告“リスク要因”に列挙された要因を含む多くの要因の影響により、我々の実際の結果は、以下の議論および分析に含まれる前向き陳述に記載または示唆された結果とは大きく異なる可能性がある。 前向き陳述に関するより多くの情報を知るためには、本年度報告書の“前向き陳述および業界データに関する警告説明”を参照されたい。
概要
私たちは発見療法と材料の方法を変えている。伝統的な方法と比べ、著者らは物理的な差別化計算プラットフォームに基づいて、薬物開発と材料応用のための高品質、新しい分子をより迅速、低コストで発見できるようにした。私たちのソフトウェアプラットフォームは世界各地の生物製薬と工業会社、学術機関と政府実験室の許可を得た。我々は我々のコンピューティングプラットフォームを応用して,有力なバイオ製薬会社と協力し,広範な薬物発見計画を進めている。また,我々の計算プラットフォームを用いて我々の特許薬物発見計画パイプラインのために新たな分子を発見し,臨床前と臨床開発によりこれらの計画を進めている。
会社設立以来、分子の重要な性質を高度に正確に予測し、私たちの協力者と一緒に薬物発見計画を進めることができる当社のコンピューティングプラットフォームの開発に注力してきました。私たちはほとんどの資源を投入して、新しい機能を導入し、私たちのソフトウェアを改善し、研究開発活動を行い、熟練した人員を募集し、これらの業務に一般的かつ行政的な支援を提供します。
過去10年間、私たちは有力なバイオ製薬会社と多くの協力を行い、これらの会社は私たちに相当な収入を提供し、より多くのマイルストーン支払い、オプション費用、未来の特許権使用料を生成する可能性がある。2018年には,我々のプラットフォームを用いて一連の斬新で価値の高い治療薬の生産を目指した一連の特許薬物発見計画の開発を開始した。2022年6月、米国食品医薬品局(FDA)は、我々のMALT 1阻害剤(SGR-1505と呼ばれる)の最初の研究新薬出願またはINDを承認した。再発または難治性B細胞リンパ腫患者の第1段階臨床試験におけるSGR−1505の投与量を開始しており,2024年末または2025年に試験の予備データを報告する予定である。また、73人の健常ボランティアにおいて、SGR−1505の第1段階臨床試験を完了し、SGR−1505の安全性、耐性および薬物動態に関連するデータ、ならびに食品および薬物相互作用の影響を含むより多くのデータを収集した。健常ボランティア試験ではSGR−1505耐性は良好であり,薬物に関連する重篤な有害事象や用量制限毒性は認められなかった。試験では,SGR−1505の活性化T細胞全血試験におけるIL−2分泌抑制率が90%を超えることが観察され,目標が関与して試験の薬効学的目標を達成したことが確認された。IL-2の分泌抑制はMALT 1と下流のNF-κBシグナルと密接に関連しているため、標的参与と経路制御のマーカーである。これらのデータは,進行中の1期臨床試験において再発または難治性B細胞リンパ腫患者のSGR−1505の評価を継続することを支持している。さらに、FDAは最近SGR-1505孤児薬物の称号を授与し、マントル細胞リンパ腫の潜在的治療に使用した
2023年7月、FDAはSGR-2921と呼ばれるCDC 7阻害剤を承認した。再発または難治性急性骨髄性白血病またはハイリスク骨髄異形成症候群患者の第1段階臨床試験におけるSGR−2921の投与量を開始しており,2024年末または2025年に試験の予備データを報告する予定である。著者らはまた、固形腫瘍の治療に用いる新しいWEE 1/MYT 1阻害剤SGR-3515を開発している。我々は,進行中のIND有効研究の有利なデータに応じて,2024年上半期にSGR−3515のINDをFDAに提出する予定であり,規制部門の承認を得ることを前提として,2024年末までにSGR−3515の第1段階臨床試験を開始する予定である。
これまで、私たちの運営資金は、主に私たちの株式証券の売却、私たちの初公募株と後続公募株、次いで私たちのソフトウェア解決策の販売、そして私たちの薬物発見協力の事前支払い、研究資金とマイルストーン支払い、そして私たちの協力者の株式の分配または売却によって得られました。2023年2月13日、2023年4月6日、2023年11月9日、Nimbus Treateutics、LLCまたはNimbusにおける株式のため、それぞれNimbusから1.113億ドル、3580万ドル、10万ドルの現金分配を得たことは、武田がNimbusの完全子会社Nimbus Lakshmi,Inc.およびそのTYK 2阻害剤NDI-034858を買収したことに関連している。
私たちは現在、二つの報告可能な部門を通じて業務を展開している:ソフトウェアと薬物発見。ソフトウェア部門は、生命科学業界全体の薬物発見を変更し、材料科学業界の顧客に販売するために、私たちのソフトウェアの販売に専念しています。薬物発見部門の重点は,内部と連携による様々な臨床前と臨床計画の組み合わせから収入を創出することであり,これらの計画は発見と開発の異なる段階に入っている。
当社のソフトウェア部門は、ソフトウェア製品ライセンス、ホストソフトウェア購読、ソフトウェアメンテナンス、専門サービス、貢献から収入を得ています。私たちがソフトウェアソリューションを通じて各顧客から得た収入は、お客様が私たちから購入したソフトウェアライセンス数に大きく依存します。私たちの顧客が私たちから購入したライセンスは、薬物発見や材料科学の分子設計のための一定数の計算を実行する能力を提供してくれた。(I)お客様が自分の内部ハードウェアにソフトウェアソリューションを直接インストールし、指定された期間内にそれを使用することを可能にする製品ライセンス、または(Ii)加入して、お客様が自分のハードウェアでライセンスを制御する必要がなく、クラウドベースのソフトウェアソリューションにアクセスすることを可能にすることによって、私たちのソフトウェアを配信します。
私たちは現在、前金、研究資金、および発見と開発マイルストーンを含む、私たちの協力から薬物発見収入を得ている。将来的には、オプション費用、規制およびビジネスマイルストーンの実現、商業薬物販売の特許使用料など、私たちの協力から薬物発見収入を得ることも可能です。私たちの協力収入に加えて、私たちの臨床とビジネスの機会を最大限に増加させるのに役立つと信じている場合、私たちは協力したり、特許薬物発見計画の許可を得たりすることから薬物発見収入を得ることも可能である。
2020年11月、著者らは百時美施貴宝会社(Bristol-Myers Squibb Company、BMSと略称する)と独占的な全世界協力と許可協定を達成し、この合意に基づき、著者らとBMSは腫瘍学、神経学と免疫治療領域の生物標的のための小分子化合物の発見、研究と開発に協力することに同意した。その後… 双方は興味のある目標(S)について合意し,シュレーディンガー治療集団が責任を負う
開発候補を発見する。特定の目標基準に適合する開発候補が決定されると、BMSは単独でその開発候補の開発、製造、商業化を担当する。私たちは現在協力の影響を受けている潜在的な目標で15億ドルに達する総マイルストーン支払いを得る資格があり、その中で2023年12月31日までに2500万ドルと、BMSが商業化した各製品の純売上高の等級別パーセント印税を受け取り、その範囲はそこから2桁まで低いが、いくつかの指定された減免を守らなければならない。本プロトコルの詳細については、我々の連結財務諸表付記3の“連携·ライセンスプロトコル”を参照されたい。
2022年9月、著者らは礼来会社あるいは礼来会社と協力し、免疫学的標的に対する小分子化合物の発見と最適化を担当した。礼来会社は臨床前開発、臨床開発と商業化を担当する。合意条項によると、私たちは4.25億ドルまでの発見、開発、商業マイルストーンの支払いを受ける資格がある前金を受け取った。私たちにはすべての市場の協力で生まれたどの製品の純売上高から低い1桁から低い2桁の印税を得る資格があります。
私たちは2023年と2022年にそれぞれ2兆167億ドルと1.81億ドルの収入を創出し、前年比20%増加した。2023年12月31日までの年間純収入は40.7ドルです 2022年12月31日までの年度の純損失は1.492億ドル。
私たちの業績に影響を与える重要な要素
私たちのソフトウェアソリューションから既存の顧客からより多くの収入を得ることができます
我々の膨大な既存クライアント群は,ソフトウェア利用率を向上させることで収入を拡大する重要な機会を提供している.2023年12月31日と2022年12月31日までの年間で、それぞれ1,785人と1,748人のアクティブ顧客を持っています。アクティブ顧客の数を、本年度の年間契約価値(ACV)が少なくとも1,000ドルの顧客数と定義します。アクティブなクライアントを定義するためのハードルとして1,000ドルを使用していますが、この金額は通常、私たちのPyMOLソフトウェアのみを許可する顧客を含まないので、低コストで広く提供されているオープンソース分子可視化システムです。私たちが私たちのソフトウェアソリューションを通じて各顧客から得た収入は、各お客様が私たちに購入してくれた各ソフトウェアソリューションのライセンス数によって異なります。そこで、私たちは顧客と協力して、彼らの体験を改善し、私たちのプラットフォームの実用性を増加させ、彼らがその業務に私たちのプラットフォームを配置する規模を拡大します。バイオ製薬会社はより広い範囲で我々のソフトウェアを採用することが増えており,この規模の拡大が将来の収入増加を推進することが予想される。私たちが顧客群で拡張する能力は、ACVが少なくとも50万ドルまたは100万ドルの顧客を含むACVのハードルが高いことをますます多くの顧客に現れている。2023年12月31日までの1年間に、54人のお客様のACVは少なくとも500,000ドルですが、2022年12月31日までの年間52人のお客様がいます。また、2023年12月31日、2022年12月31日、2021年12月31日までの1年間に、それぞれ27、18、15人のお客様のACVは少なくとも100万ドルです。2023年12月31日までの年間では、4人のお客様のACVは少なくとも500万ドルですが、2022年12月31日と2021年12月31日までの年度にはそれぞれ4人と2人のお客様がいます。
期間が1年以下の契約、または期限が1年を超える契約については、ACVを適用期間内に課金される契約価値と定義する。事前に発行された期限が1年を超える契約については、期間ごとのACVは、開書契約の総価値を期限で割ったものである。ACVは収入から独立して見るべきであり、米国公認会計原則または米国公認会計原則に基づいて年率で計算される収入を表すものではなく、運営指標であるため、契約実行開始と終了日および契約率の影響を受ける可能性がある。ACVは収入を代替したり予測したりするつもりはない。2023年12月31日と2022年12月31日までの年間で、ACVはそれぞれ1億542億ドルと1兆406億ドル。
私たちのソフトウェア解決策のために顧客群を保存することができます
私たちの業績のもう一つの重要な駆動力は私たちが顧客基盤を維持する能力だ。2023年、2022年、2021年12月31日までの年間で、それぞれ222、227、190人のお客様のACVは少なくとも100,000ドルです。2023年12月31日までの1年間、このような顧客に対する顧客保持率は前年比92%であり、前9年度の顧客保持率はいずれも96%以上であった。2023年12月31日までの1年間の顧客保持率は98%であり、2022年12月31日までの1年間の顧客保持率は100%であった。我々は、前期に所有していた顧客数から、ACVが少なくとも100,000ドルまたは500,000ドルの顧客の年間顧客保持率を計算した。そしてこれらの顧客のどれだけが活躍しているかを計算します
本年度のお客様数。そして,この数字をACVが少なくとも100,000ドルまたは500,000ドル(場合によっては)の顧客数で割って,これらの顧客の前期比顧客保持率を得た.
私たちの販売とマーケティング方法と私たちのソフトウェア解決策の品質は私たちが最大の顧客と長期的な関係を構築し、高い保留率を維持すると信じています。私たちの重要な関係の持続時間はこれを証明しており、2023年に私たち最大の10人のソフトウェア顧客の平均任期は19年に近い。さらに、私たちは製薬業界に著しく浸透しており、2022年の収入で測定して、上位20位の製薬会社は2023年に私たちのソフトウェアを許可しました。私たちがソフトウェア収入を持続的に増加させる能力は、私たちの販売とマーケティングの継続的な支援と投資と、私たちのソフトウェアソリューションの継続的な変更を通じて顧客を維持する能力にかかっています。
われわれの協力計画を推進する
私たちは薬物発見を推進するために、有力なバイオ製薬会社と多くの協力を行ってきた。私たちは、私たちのプラットフォームと私たちの潜在的な協力者の能力と専門知識との間で相乗効果を達成するために、より多くの協力協定を締結することを求めます。私たちの協力は、株式、研究費用、臨床前、臨床と商業マイルストーン支払い、オプション費用、および将来の任意の潜在的製品販売の特許権使用料(承認されれば)を含む私たちの価値の重要な駆動力になると信じています。我々は,現在の協力者と連携し,探索研究段階で既存プロジェクトを推進し,より多くのプロジェクトを開始する予定である.しかし,我々は通常我々の協力者の開発計画を制御するのではなく,臨床開発と商業化に関する我々の協力者の決定に依存する。我々が連携から価値を獲得し続ける能力は,これらの計画で我々が進展する能力,我々の協力者がこれらの計画を発見段階に進めることに成功したかどうか,および我々のパートナーの戦略的優先順位に依存する.販売から任意の金額の印税を取得する資格がある連携計画の総数を追跡し,2023年12月31日現在で12件の協力計画が将来の印税を取得する資格があるのに対し,2022年12月31日現在で15件の連携計画がある。
特許薬物発見計画のルートを改善し拡大することができます
私たちは臨床前と臨床開発を通じて私たちの独自のプロジェクトパイプラインを推進している。我々の最初の計画は,DNA損傷反応経路や遺伝子定義癌標的に対する阻害剤の発見と開発に焦点を当てていた。それ以来,免疫学や神経学を含めて他の治療領域に拡張されてきた。われわれはすでに再発あるいは難治性B細胞リンパ腫患者に対するSGR−1505の第1期臨床試験と,再発あるいは難治性急性骨髄性白血病あるいは高リスク骨髄異形成症候群患者に対するSGR−2921の第1期臨床試験を開始しており,2024年末あるいは2025年にこの2つの臨床試験の初歩的なデータを報告する予定である。また,INDが研究を支援する有利なデータであることを条件に,2024年上半期にSGR−3515のIND申請をFDAに提出する予定であり,規制部門の承認を受けることを前提として,2024年末までにSGR−3515の第1段階臨床試験を開始する予定である。私たちは新しい計画を続けて、私たちの計算プラットフォームを利用して新しい分子を発見することができて、私たちは最近新しい発見段階計画を発表しました。目標はPRMT 5-MTA、EGFRですC 797 SNLRP 3と。我々の特許計画の進展と拡張に伴い、個々の計画に基づいて戦略的評価を行い、これらの計画を自ら推進し、有力な業界パートナーと共同でこれらの計画を開発したり、彼らにより多くの許可を与えたりして、その臨床的および商業的成功の可能性を最大限に高める
経営成果の構成部分
ソフトウェア製品とサービス収入
我々のソフトウェア業務収入は,(I)内部ソフトウェア許可料,(Ii)ホストソフトウェア購読料,(Iii)ソフトウェア保守費,(Iv)専門サービス料,および(V)支払いの5つのソースからのものである.
ソフトウェアを内部配備する。我々の内部ソフトウェアライセンスプロトコルは、近年、数年間の大型内部ソフトウェアライセンスプロトコルを少量締結しているにもかかわらず、指定された期間内(通常は1年)にその内部サーバまたはクラウドインスタンス上で私たちのソフトウェアを使用する権利をクライアントに付与する。ローカルソフトウェア許可料の収入をあらかじめ確認しておき,制御権移行を許可する場合もプロトコル発効日の場合も遅い者を基準とした.
ホスティングソフトホストソフトウェア収入は、主に、ライセンスを制御することなく、彼ら自身のハードウェア上で許可証を制御することなく、プロトコル期間内に比例して確認されることを可能にするホスト·ソフトウェア·ライセンスの費用を含み、これらのクライアントは、近年、少量の数年間の大型ホスト·ソフトウェア許可プロトコルを締結しているにもかかわらず、プロトコル期間が通常1年であることを可能にする。顧客が時間とともに収入を確認する信託手配を達成した場合、今期確認されなかった前払い額は、その金額が確認されるまで、当社の財務状況表の繰延収入に計上されます。
ソフトウェアメンテナンスです。ソフトウェアメンテナンスには、当社の内部ソフトウェアライセンスに関連する技術的サポート、更新、およびアップグレードが含まれています。ソフトウェア保守収入はプロトコル期限内に比例して確認する.ソフトウェア保守活動は,我々の内部配備ソフトウェアの使用に関連しており,時間帯によって変化する可能性がある.
専門サービスです。専門サービスには、トレーニング、技術設定、インストール、お客様のモデリングサービスの提供支援が含まれており、私たちのソフトウェアを使用してお客様の代わりに仮想フィルタリングなどのタスクを実行しています。これらのサービスは通常,我々のソフトウェアのコア機能に関係なく,資源を消費する際に収入として確認される.各専門サービスプロトコルは独特な一時的な約束を代表するため、専門サービス収入は異なる時期に変動する可能性がある。
ソフトウェア貢献収入それは.ソフトウェア貢献収入には、2020年6月に最初に締結され、2026年8月にさらに延長されたゲイツベンチャーとの非互恵協定に基づいて受け取った資金が含まれている。その協定は無条件で制限されない非交換貢献だ。収入は2020年6月から2022年6月まで毎年確認され、2023年8月の合意延長時に、会計基準に基づいてコード化またはASCテーマ958に領収書を発行する, 非営利団体なぜならこの合意は交換取引ではないからだ。
薬物発見収入
薬物発見サービスです著者らは現在発見協力手配から薬物発見収入を得ており、前金、研究開発支払い及び発見と開発マイルストーンを含む。私たちの現在の協力の大部分は発見と臨床前開発段階にある。マイルストーン支払いは一般的に計画が進むにつれて増加するだろう。しかし、私たちの重点は、私たちの独自の薬物発見計画にますます投資しており、時間が経つにつれて、協力計画の数が減少する可能性があり、そのため、これらの協力計画によりマイルストーン支払いも減少する。我々の協力による収入に加えて,この計画の臨床的および商業的成功の可能性を最大化するのに役立つと信じている場合には,我々の特許薬物発見計画よりも多くの許可を得た場合から薬物発見収入を得ることも可能である。全体的に、私たちの薬物発見収入が異なる時期に変動することが予想されるのは、記念碑的成果の時間自体に不確実性があり、私たちの協力者の計画決定への依存があるからである。
薬物発見は収入に貢献する寄付収入には、ビルやメリンダ·ゲイツ財団との合意に基づいて費用返済に基づいて受け取った資金が含まれており、女性保健薬の発見を加速させるためのサービスを提供している。収入はASCトピック958の条件を満たしたときに確認された非営利団体.
収入コスト
ソフトウェア製品とサービスです。ソフトウェア収入コストには、ソフトウェアソリューション、保守および専門サービスの提供に直接参加する従業員の人事関連費用(賃金、福祉、および株式ベースの報酬を含む)、販売された製品および第三者許可ソフトウェア機能を使用して実行されるサービスによって支払われる印税、および割り当てられた間接管理費用(施設および情報技術サポート)が含まれる。様々な第三者プロトコルに基づいて、私たちは私たちのソフトウェアで使用する技術を許可します。これらの手配は,売上高に応じて印税を支払うことを要求しており,2023年12月31日と2022年12月31日までの年度では,このような印税はそれぞれソフトウェア収入の4.1%と4.8%を占めている.
薬物発見薬物発見の収入コストには,人員関連の費用と,我々の協力における発見活動を支援する第三者契約研究組織(CRO)のコスト,第三者許可ソフトウェア機能を用いて実行されるサービスが支払う印税,分配の計算能力,管理コストが含まれる。2017年末以降、発見作業に関するコストが発生していますが、認識し、認識し続けていく予定です
マイルストーンが可能または達成されると考えられた時、未来の収入。一般的に、協力した薬物発見コストの収入は収入のマイルストーン達成前に発生する。
2023年12月31日と2022年12月31日までの年度では,第三者に支払われる特許権使用料はそれぞれ薬物発見収入の3.5%と4.8%を占めている。独自の薬物発見項目に重点を向けるにつれて,われわれの薬物発見収入コストは時間とともに低下傾向にあると予想される。
毛利と利回り
毛利は収入から収入コストを引くことを表す。毛利とは収入のパーセントを占める毛利のことだ。当社のソフトウェア製品とサービス利益率は、当社の収入の変動や、内部配備ソフトウェアソリューションとホストソフトウェアソリューションとの販売組み合わせが確認時間の変化によって変動する可能性があります。例えば,我々のホストソフトウェアプロトコルの販売に支払うべき印税コストはあらかじめ確認されているが,これらのプロトコルの関連ホストソフトウェア収入は基本プロトコルの期限内に確認されている.
我々の薬物発見業務の毛金利はマイルストーンの確認時間などによって時期によって大きく変動するが,より多くのプロジェクトが開発の後期段階に入るにつれてマイルストーンの規模が増加し,このようなプロジェクトに対する継続的な研究や開発義務が低下し,毛金利は通常時間とともに上昇することが予想される。
研究開発費
研究開発費は私たちの運営費用の大きな部分を占めている。私たちは発生した研究と開発費用を確認した。研究と開発費用には、薬物発見と開発計画コストと、私たちの計算プラットフォームを支援する技術と科学の持続的な開発コストが含まれている
•研究開発に従事している従業員の賃金、福祉、ボーナス、株式給与などの人員に関する費用
•特許薬物発見計画に参加した第三者CROおよびコンサルタントとの合意による費用;
•我々の特許薬物発見計画には計算能力と管理費用(施設と情報技術支援)が割り当てられている。
私たちの研究開発費は絶対ドルで増加することが予想されます。私たちは引き続き私たちの特許薬物発見計画の発見と開発に関する活動に投資し、私たちの計算プラットフォームを推進し、このような努力に直接参加している人をより多く雇用することに関連する費用を発生させます。私たちの研究開発費が将来増加する可能性のある金額は、任意の協力または脱退許可決定の時間を含む、特許薬物発見計画の開発計画にも依存するだろう。現在、私たちは知らず、私たちのいかなる特許薬物発見計画を完成させるために必要な努力の性質、時間、あるいはコストを合理的に推定することもできない。
販売とマーケティング費用
販売とマーケティング費用には、主に私たちの販売とマーケティング担当者、私たちの販売を支援する応用科学者の人事関連コストが含まれています。給料、福祉、ボーナス、株式ベースの報酬が含まれています。他の販売およびマーケティングコストには、業界会議および活動、米国とヨーロッパでの年間ユーザーグループ会議、広告、分配の管理費用を含む、わが社およびプラットフォームに対する理解を宣伝および拡大する販売促進活動が含まれています。私たちのソフトウェアソリューション固有の科学的複雑性のため、私たちの販売とマーケティングを支援するために、高いレベルの科学専門知識が必要です。私たちは、既存の顧客へのソフトウェア販売を拡大し、顧客基盤を増加させることを目標としているので、予測可能な将来に販売やマーケティングに重点投資を行い、当社の業務の成長を促進する予定です。
一般と行政費用
一般的かつ行政的費用には、賃金、福祉、ボーナスなど、私たちの行政、法律、財務、人的資源、情報技術、その他の行政機能に関する人件費が含まれています
株の報酬に基づいています一般および行政費用には、外部法律、会計、その他のコンサルティングサービスの専門費用、分担された間接費用、その他の一般運営費用も含まれる。
上場企業としての運営には、米国証券取引所に上場する企業に適用される規則や法規を遵守するコストや、米国証券取引委員会(米国証券取引委員会)規則や法規に規定されているコンプライアンスおよび報告義務に関連するコストなど、追加費用が引き続き発生することが予想される。また、上場企業として、保険や専門サービスなどの費用が引き続き増加することが予想される。したがって、私たちは予測可能な未来に、私たちの一般的で行政的な費用のドルの額が増加すると予想する。
株式投資収益
持分投資収益には、現金分配形態で持分投資から得られた実現された収益が含まれる。
価値変動を公平に承諾する
公正価値損益は、私たちの株式投資に対する公正価値の調整を含み、その中には、Nimbus、Structure Treateutics Inc.またはStructure Treateutics、およびMorphy Holding,Inc.が含まれる可能性がある。
私たちは公正な価値損益が未来の間に大きく変動すると予想する。
その他の収入
その他の収入には、現金等価物と有価証券の利息、利息支出、取引性為替損益が含まれる。
所得税費用
所得税支出にはアメリカ連邦と州所得税と私たちが業務を展開しているいくつかの外国司法管轄区の所得税が含まれています。私たちは私たちの連邦と州繰延税金資産に対して全額推定手当を維持しています。繰延税金資産が実現する可能性は大きくないと結論したからです。
経営成果
2023年まで、2023年と2022年12月31日までの年度比較
次の表は、2023年12月31日と2022年12月31日までの年間運営データの結果をまとめたものです
| | | | | | | | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | 変わる |
| 2023 | | 2022 | | $ | | % |
| (単位:千) | | |
| 収入: | | | | | | | |
| ソフトウェア製品とサービス | $ | 159,124 | | | $ | 135,578 | | | $ | 23,546 | | | 17% |
| 薬物発見 | 57,542 | | | 45,377 | | | 12,165 | | | 27% |
| 総収入 | 216,666 | | | 180,955 | | | 35,711 | | | 20% |
| 収入コスト: | | | | | | | |
| ソフトウェア製品とサービス | 29,514 | | | 29,576 | | | (62) | | | —% |
| 薬物発見 | 46,460 | | | 50,357 | | | (3,897) | | | (8)% |
| 収入総コスト | 75,974 | | | 79,933 | | | (3,959) | | | (5)% |
| 毛利 | 140,692 | | | 101,022 | | | 39,670 | | | 39% |
| 運営費用: | | | | | | | |
| 研究開発 | 181,766 | | | 126,372 | | | 55,394 | | | 44% |
| 販売とマーケティング | 37,226 | | | 30,642 | | | 6,584 | | | 21% |
| 一般と行政 | 99,148 | | | 90,825 | | | 8,323 | | | 9% |
| 総運営費 | 318,140 | | | 247,839 | | | 70,301 | | | 28% |
| 運営損失 | (177,448) | | | (146,817) | | | (30,631) | | | 21% |
| その他の収入(支出): | | | | | | | |
| 株式投資収益 | 147,213 | | | 11,825 | | | 135,388 | | | |
| 価値変動を公平に承諾する | 53,461 | | | (18,084) | | | 71,545 | | | |
| その他の収入 | 19,693 | | | 3,950 | | | 15,743 | | | |
| その他収入合計 | 220,367 | | | (2,309) | | | 222,676 | | | |
| 所得税前収入 | 42,919 | | | (149,126) | | | 192,045 | | | |
| 所得税費用 | 2,199 | | | 63 | | | 2,136 | | | |
| 純収益(赤字) | 40,720 | | | (149,189) | | | 189,909 | | | |
| 非持株権益の純収益(損失)に帰することができる | — | | | (3) | | | 3 | | | |
| シュレーディンガー株主は純収益(損失)を占めなければならない | $ | 40,720 | | | $ | (149,186) | | | $ | 189,906 | | | |
収入.収入
| | | | | | | | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | 変わる |
| 2023 | | 2022 | | $ | | % |
| (単位:千) |
| 収入: | | | | | | | |
| ソフトウェア | | | | | | | |
| 内部配備ソフトウェア | $ | 104,511 | | | $ | 84,487 | | | $ | 20,024 | | | 24% |
| ホスティングソフト | 20,381 | | | 14,890 | | | 5,491 | | | 37% |
| ソフトウェアメンテナンス | 23,066 | | | 19,996 | | | 3,070 | | | 15% |
| 専門サービス | 9,366 | | | 15,205 | | | (5,839) | | | (38)% |
| ソフトウェア貢献 | 1,800 | | | 1,000 | | | 800 | | | 80% |
| ソフトウェア製品とサービス総量 | 159,124 | | | 135,578 | | | 23,546 | | | 17% |
| 薬物発見 | | | | | | | |
| 薬物発見サービス | 54,720 | | | 43,427 | | | 11,293 | | | 26% |
| 薬物発見貢献 | 2,822 | | | 1,950 | | | 872 | | | 45% |
| 総薬物発見 | 57,542 | | | 45,377 | | | 12,165 | | | 27% |
| 総収入 | $ | 216,666 | | | $ | 180,955 | | | $ | 35,711 | | | 20% |
ソフトウェア製品とサービス収入
ソフトウェアを内部配備する。2022年12月31日までの年度と比較して,2023年12月31日までの年度でローカルソフトウェアの収入が増加したのは,主に2023年12月31日までの年度請求書までに収入を確認する長年手配の増加と,2022年12月31日現在の年度と比較して,2023年12月31日までの年度で既存と新規顧客からの増加によるものである。
ホスティングソフト。2022年12月31日までの年度と比較して,2023年12月31日までの1年間におけるホストソフトウェア収入の増加は,主に既存のホストクライアントの支出の増加と,ホストソフトウェアを購入して購読する新規クライアントの増加により,これらの購読の収入は契約期間内に比例して確認された.
ソフトウェアメンテナンスです2022年12月31日までの年度と比較して,2023年12月31日までの年度でソフトウェア保守収入が増加しているのは,主に本年度と前年の内部ソフトウェア販売の増加によるものである.ソフトウェア保守収入は契約期間内に比例して確認する.
専門サービスです2022年12月31日までの年度と比較して,2023年12月31日までの1年間で専門サービスからの収入が減少したのは,主に構造生物学的サービスが約310万ドル減少し,技術やモデリングサービスプロジェクトの進展や完成に関する収入が約270万ドル減少したためである。
ソフトウェア貢献収入それは.2023年12月31日までの年度と2022年12月31日までの年度の寄付収入は,Gates Ventures,LLCとの合意に基づいて受け取った資金であり,この協定は2020年6月に始まり,2023年8月に延期される。
薬物発見収入
薬物発見サービスです。2022年12月31日までの年度と比較して,2023年12月31日までの年間で薬物発見サービスの収入が増加しているのは,BMSから受け取った2500万ドルを含む協力マイルストーンの実現時期と金額と,2022年と比較して2023年に完成した既存の協力と新たな協力の進展によるものである。私たちは、マイルストーンが達成された時間自体の不確実性と、パートナー計画決定への私たちの依存によって、私たちの収入が異なる時期に変動すると予想する。
薬物発見は収入に貢献する寄付収入は、2023年12月31日までの1年間、ビルとメリンダ·ゲイツ財団との合意に基づいて提供されたサービスであり、女性の健康分野の薬物発見を加速させることを目的としており、2021年11月に始まった。
収入コスト
| | | | | | | | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | 変わる |
| 2023 | | 2022 | | $ | | % |
| (単位:千) |
| 収入コスト: | | | | | | | |
| ソフトウェア製品とサービス | $ | 29,514 | | | $ | 29,576 | | | $ | (62) | | | —% |
| 毛利率 | 81 | % | | 78 | % | | | | |
| 薬物発見 | 46,460 | | | 50,357 | | | (3,897) | | | (8)% |
ソフトウェア製品とサービスです。2022年12月31日までの年度と比較して,2023年12月31日までの年度でソフトウェア製品やサービスの収入コストが低下したのは,人員関連費用が約90万ドル減少し,その他の費用が約10万ドル減少したが,クラウドコンピューティング費用が約90万ドル増加したためである
ソフトウェア製品とサービス毛利です。2022年12月31日までの年度と比較して,2023年12月31日までの年度でソフトウェア毛金利が増加したのは,主にソフトウェア収入が増加し,固定コストが相対的に横ばいであったのは,資源を収入コストから研究開発活動に再分配したためである。
薬物発見。2023年12月31日までの1年間で,薬物発見の収入コストが2022年12月31日までの年度と比較して低下したのは,人員関連費用が約460万ドル減少したことが原因であり,我々の発見組織の独自薬物発見計画への再配置を反映し,クラウド費用は約50万ドル,印税費用は約10万ドル減少したが,協力計画の拡張や進展に関するCROコストは約110万ドル増加し,その他の費用は約20万ドル減少した。
研究開発費
われわれの研究開発コストの大部分は外部臨床前と臨床CROコストであり,候補製品が決定されると,これらのコストを1つずつ計画的に追跡する。我々の内部研究開発コストは主に人員に関するコスト,レンタル料費用,その他の間接コストであり,計画通りに追跡しない。他のすべての研究や開発コストはプロジェクトとは無関係なコストに関連している.次の表は、2023年12月31日と2022年12月31日までの年間研究開発費をまとめています
| | | | | | | | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | 変わる |
| 2023 | | 2022 | | $ | | % |
| (単位:千) |
| 計画的に列挙された外部コスト: | | | | | | | |
| SGR-1505 | $15,337 | | $7,635 | | $7,702 | | 101% |
| SGR-2921 | 6,090 | | | 4,430 | | | 1,660 | | | 37% |
| SGR-3515 | 6,363 | | | 8,533 | | | (2,170) | | | (25)% |
| 他の初期開発候補や未分配のコストは | 30,880 | | | 14,621 | | | 16,259 | | | 111% |
| 臨床前と臨床開発プロジェクトの総外部コスト | 58,670 | | 35,219 | | 23,451 | | 67% |
| 発見臨床前臨床開発の内部コスト: | | | | | | | |
| 従業員補償と福祉 | 32,949 | | 19,273 | | 13,676 | | 71% |
| 施設やその他 | 2,015 | | 661 | | 1,354 | | 205% |
| 内部総コスト | 34,964 | | 19,934 | | 15,030 | | 75% |
| 他の全ての研究や開発は | 88,132 | | 71,219 | | 16,913 | | | 24% |
| 研究と開発費用総額 | $181,766 | | $126,372 | | $55,394 | | 44% |
2023年12月31日までの年間で,2022年12月31日までの年度と比較して外部コストが2,350万ドル増加したのは,主に行われているSGR−1505第1段階臨床試験や他の開発活動に関連するコストの増加と,我々の早期候補製品(SGR−2921およびSGR−3515を含む)を支援する他の外部研究コストによるものである。
2023年12月31日までの1年間で,臨床·臨床前開発プロジェクトの内部コストが2022年12月31日までの年度に比べて1500万ドル増加したのは,主に人員関連の費用やレンタル料の増加によるものである。
2023年12月31日までの年度では,2022年12月31日までの年度と比較して,他のすべての研究開発費が増加したのは,人員関連費用が約840万ドル増加し,クラウドコンピューティング費用が約410万ドル増加し,オフィスレンタル料が約340万ドル増加し,出張や娯楽費が約60万ドル増加し,専門サービスが約30万ドル増加し,その他の費用が約10万ドル増加したためである。
販売とマーケティング費用
| | | | | | | | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | 変わる |
| 2023 | | 2022 | | $ | | % |
| (単位:千) |
| 販売とマーケティング | $ | 37,226 | | | $ | 30,642 | | | $ | 6,584 | | | 21% |
2022年12月31日までの年度と比較して、2023年12月31日までの1年間で、販売·マーケティング費用は約460万ドル増加し、オフィス賃貸料に関する費用は約90万ドル増加し、出張や娯楽費用は約70万ドル増加し、クラウドコンピューティング費用は約40万ドル増加した。
一般と行政費用
| | | | | | | | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | 変わる |
| 2023 | | 2022 | | $ | | % |
| (単位:千) |
| 一般と行政 | $ | 99,148 | | | $ | 90,825 | | | $ | 8,323 | | | 9% |
2022年12月31日までの年度と比較して、2023年12月31日までの年度では、一般·行政費は約850万ドル増加し、Nimbusから受け取った現金分配に関する特許権使用料は約220万ドル増加し、クラウドコンピューティング費用は約80万ドル増加し、オフィスレンタル料は約80万ドル増加し、出張や娯楽費用は約50万ドル増加し、顧客関係無形資産加速に関する償却は約50万ドル増加したが、専門サービスに関する減少約240万ドルはこの増加を相殺した。約110万ドルは使い捨て非日常性州や地方税プロジェクトに関連しており,約150万ドルは他の費用に用いられている。
株式投資収益
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | |
| 2023 | | 2022 | | 変わる |
| (単位:千) |
| 株式投資収益 | $ | 147,213 | | | $ | 11,825 | | | $ | 135,388 | |
2023年12月31日までの年度の持分投資収益は,武田がNimbusの完全子会社Nimbus Lakshmi,Inc.とそのチロシンキナーゼ2阻害剤NDI−034858の買収を完了した後,Nimbusの株式投資で収益を実現したためである。2022年12月31日までの年度の持分投資収益は、買収契約に基づいて潜在的な割増の権利を獲得する権利の終了と引き換えに、第三者から受け取った現金によるものである。
価値変動を公平に承諾する
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | |
| 2023 | | 2022 | | 変わる |
| (単位:千) |
| 価値変動を公平に承諾する | $ | 53,461 | | | $ | (18,084) | | | $ | 71,545 | |
2023年12月31日までの年度における公正価値の変化は,Structureへの投資により4980万ドルの未実現収益が生じ,Nimbusへの投資で190万ドルの未実現収益と,Morphiへの投資で180万ドルの未実現収益が生じたためである。2022年12月31日までの年間で、公正価値の変化は、主にモルフィーへの投資が未実現損失になったためである。
その他の収入
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | |
| 2023 | | 2022 | | 変わる |
| (単位:千) |
| その他の収入 | $ | 19,693 | | | $ | 3,950 | | | $ | 15,743 | |
2023年12月31日までの年度内に、2022年12月31日までの年度に比べて他の収入が増加しているのは、主に我々のポートフォリオ金利が上昇しているためである。
所得税費用
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 | | |
| 2023 | | 2022 | | 変わる |
| (単位:千) |
| 所得税費用 | $ | 2,199 | | | $ | 63 | | | $ | 2,136 | |
2023年12月31日までの年間所得税支出は、私たちが業務を行っている外国司法管轄区の連邦と特定の州の所得税義務と税金を代表しています。2022年12月31日までの年間所得税支出は、特定の州での所得税義務と、我々が業務を行っている外国司法管轄区の税収を代表しています。2023年12月31日現在、私たちはアメリカ連邦と州逓延税資産に対して全額推定手当を持っています。
2023年12月31日まで、私たちの連邦と州の純営業損失はそれぞれ約1.791億ドルと9860万ドルだった。利用しなければ、繰り越しの国の純営業損失は2025年から2042年の間に満期になる。繰り越しの連邦純営業損失は、ある年に発生した課税収入の80%を超えてはならず、無期限繰り越しとなっている。2023年12月31日まで、私たちの連邦と州の研究開発税収はそれぞれ約2330万ドルと160万ドルです。利用しなければ、これらの繰り越しは2024年から2043年の間に満期になる。
アメリカ会計基準第740号所得税の要求に基づいて、私たちの管理層は私たちの繰延税金資産の現金化に影響を与える積極的と消極的な証拠を評価し、これらの証拠は主に純営業損失の繰越と研究開発信用の繰越から構成されている。経営陣は、連邦と州繰延税金資産のメリットを達成できない可能性があることを確認したため、2023年12月31日と2022年12月31日にそれぞれ1.36億ドルと1.38億ドルの推定値を設定した。2023年12月31日までと2022年12月31日までの年間推定手当変動はそれぞれ190万ドルと4,270万ドルであった。2023年12月31日と2022年12月31日までの会計年度には、それぞれ220万ドルと10万ドルの所得税支出を記録した。
四半期運営実績
以下の表は、2023年12月31日現在の8四半期の運営データを含む、我々が厳選した監査されていない四半期運営データをまとめたものです。これらの四半期の情報は,我々が監査した年度連結財務諸表と同じ基礎に基づいて作成されており,経営陣は,これらの時期の経営業績を公正に報告するために必要な正常で恒常的なすべての調整を反映していると考えている。これらのデータは、本年度報告書の他の部分に含まれる監査された総合財務諸表とともに読まなければならない。歴史的結果は必ずしも財政年度全体または任意の他の期間の予想結果を代表するとは限らない。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 3か月まで |
| 十二月三十一日 | | 九月三十日 | | 六月三十日 | | 3月31日 | | 十二月三十一日 | | 九月三十日 | | 六月三十日 | | 3月31日 |
| 2023 | | 2023 | | 2023 | | 2023 | | 2022 | | 2022 | | 2022 | | 2022 |
| (単位:千) |
| 収入: | | | | | | | | | | | | | | | |
| ソフトウェア製品とサービス | $ | 68,655 | | | $ | 28,904 | | | $ | 29,352 | | | $ | 32,213 | | | $ | 47,819 | | | $ | 24,667 | | | $ | 30,011 | | | $ | 33,081 | |
| 薬物発見 | 5,471 | | | 13,665 | | | 5,837 | | | 32,569 | | | 9,024 | | | 12,313 | | | 8,458 | | | 15,582 | |
| 総収入 | 74,126 | | | 42,569 | | | 35,189 | | | 64,782 | | | 56,843 | | | 36,980 | | | 38,469 | | | 48,663 | |
| 収入コスト: | | | | | | | | | | | | | | | |
ソフトウェア製品とサービス(1) | 8,670 | | | 7,034 | | | 6,695 | | | 7,115 | | | 8,098 | | | 6,866 | | | 7,101 | | | 7,511 | |
薬物発見(1) | 7,906 | | | 11,896 | | | 14,684 | | | 11,974 | | | 10,041 | | | 12,913 | | | 14,234 | | | 13,169 | |
| 収入総コスト | 16,576 | | | 18,930 | | | 21,379 | | | 19,089 | | | 18,139 | | | 19,779 | | | 21,335 | | | 20,680 | |
| 毛利 | 57,550 | | | 23,639 | | | 13,810 | | | 45,693 | | | 38,704 | | | 17,201 | | | 17,134 | | | 27,983 | |
| 運営費用: | | | | | | | | | | | | | | | |
研究開発(1) | 51,487 | | | 46,833 | | | 42,705 | | | 40,741 | | | 34,542 | | | 32,885 | | | 31,123 | | | 27,822 | |
販売とマーケティング(1) | 9,950 | | | 9,109 | | | 9,022 | | | 9,145 | | | 9,382 | | | 7,161 | | | 7,428 | | | 6,671 | |
一般と行政(1) | 25,734 | | | 23,890 | | | 23,216 | | | 26,308 | | | 23,318 | | | 23,318 | | | 22,056 | | | 22,133 | |
| 総運営費 | 87,171 | | | 79,832 | | | 74,943 | | | 76,194 | | | 67,242 | | | 63,364 | | | 60,607 | | | 56,626 | |
| 運営損失 | (29,621) | | | (56,193) | | | (61,133) | | | (30,501) | | | (28,538) | | | (46,163) | | | (43,473) | | | (28,643) | |
| その他(費用)収入: | | | | | | | | | | | | | | | |
| 株式投資の収益 | (109) | | | — | | | — | | | 147,322 | | | — | | | (3) | | | 11,828 | | | — | |
| 価値変動を公平に承諾する | (8,408) | | | (14,522) | | | 40,654 | | | 35,737 | | | (1,493) | | | 5,273 | | | (15,700) | | | (6,164) | |
| その他の収入(費用) | 6,626 | | | 5,804 | | | 4,326 | | | 2,937 | | | 2,687 | | | 1,231 | | | (296) | | | 328 | |
| その他の収入総額 | (1,891) | | | (8,718) | | | 44,980 | | | 185,996 | | | 1,194 | | | 6,501 | | | (4,168) | | | (5,836) | |
| 所得税前収入 | (31,512) | | | (64,911) | | | (16,153) | | | 155,495 | | | (27,344) | | | (39,662) | | | (47,641) | | | (34,479) | |
| 所得税(福祉)費用 | (842) | | | (2,887) | | | (20,431) | | | 26,359 | | | (136) | | | 194 | | | 33 | | | (28) | |
| 純収益 | (30,670) | | | (62,024) | | | 4,278 | | | 129,136 | | | (27,208) | | | (39,856) | | | (47,674) | | | (34,451) | |
| 非持株権益の純収入に帰することができる | — | | | — | | | — | | | — | | | (1) | | | (3) | | | 12 | | | (11) | |
| シュレーディンガー株主は純収入を占めなければならない | $ | (30,670) | | | $ | (62,024) | | | $ | 4,278 | | | $ | 129,136 | | | $ | (27,207) | | | $ | (39,853) | | | $ | (47,686) | | | $ | (34,440) | |
(1)次の表に示すように、株ベースの報酬が含まれている。
収入:
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 3か月まで |
| 十二月三十一日 | | 九月三十日 | | 六月三十日 | | 3月31日 | | 十二月三十一日 | | 九月三十日 | | 六月三十日 | | 3月31日 |
| 2023 | | 2023 | | 2023 | | 2023 | | 2022 | | 2022 | | 2022 | | 2022 |
| (単位:千) |
| 収入: | | | | | | | | | | | | | | | |
| ソフトウェア | | | | | | | | | | | | | | | |
| 内部配備ソフトウェア | $ | 53,947 | | | $ | 13,806 | | | $ | 16,814 | | | $ | 19,944 | | | $ | 33,627 | | | $ | 12,579 | | | $ | 16,595 | | | $ | 21,686 | |
| ホスティングソフト | 6,016 | | | 5,463 | | | 4,451 | | | 4,451 | | | 4,125 | | | 3,914 | | | 3,596 | | | 3,255 | |
| ソフトウェアメンテナンス | 5,687 | | | 5,752 | | | 5,877 | | | 5,750 | | | 5,255 | | | 5,063 | | | 4,952 | | | 4,726 | |
| 専門サービス | 3,005 | | | 2,083 | | | 2,210 | | | 2,068 | | | 4,812 | | | 3,111 | | | 3,868 | | | 3,414 | |
| 契約収入 取引先と連絡を取り合う | 68,655 | | | 27,104 | | | 29,352 | | | 32,213 | | | 47,819 | | | 24,667 | | | 29,011 | | | 33,081 | |
| ソフトウェア貢献 | — | | | 1,800 | | | — | | | — | | | — | | | — | | | 1,000 | | | — | |
| ソフトウェア製品の総量 *販売およびサービスの収益 | 68,655 | | | 28,904 | | | 29,352 | | | 32,213 | | | 47,819 | | | 24,667 | | | 30,011 | | | 33,081 | |
| 薬物発見 | | | | | | | | | | | | | | | |
| 薬物発見サービス | 4,955 | | | 12,730 | | | 5,232 | | | 31,803 | | | 8,450 | | | 11,717 | | | 8,019 | | | 15,241 | |
| 薬物発見貢献 | 516 | | | 935 | | | 605 | | | 766 | | | 574 | | | 596 | | | 439 | | | 341 | |
| 薬物発見総収入 | 5,471 | | | 13,665 | | | 5,837 | | | 32,569 | | | 9,024 | | | 12,313 | | | 8,458 | | | 15,582 | |
| 総収入 | $ | 74,126 | | | $ | 42,569 | | | $ | 35,189 | | | $ | 64,782 | | | $ | 56,843 | | | $ | 36,980 | | | $ | 38,469 | | | $ | 48,663 | |
繰延収入:
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 自分から |
| 十二月三十一日 | | 九月三十日 | | 六月三十日 | | 3月31日 | | 十二月三十一日 | | 九月三十日 | | 六月三十日 | | 3月31日 |
| 2023 | | 2023 | | 2023 | | 2023 | | 2022 | | 2022 | | 2022 | | 2022 |
| (単位:千) |
| 収入を繰り越す | $ | 65,274 | | | $ | 55,415 | | | $ | 62,294 | | | $ | 71,926 | | | $ | 83,529 | | | $ | 65,897 | | | $ | 67,545 | | | $ | 78,353 | |
毛利率:
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 3か月まで |
| 十二月三十一日 | | 九月三十日 | | 六月三十日 | | 3月31日 | | 十二月三十一日 | | 九月三十日 | | 六月三十日 | | 3月31日 |
| 2023 | | 2023 | | 2023 | | 2023 | | 2022 | | 2022 | | 2022 | | 2022 |
| ソフトウェア製品とサービス **毛の利回りが低下 | 87 | % | | 76 | % | | 77 | % | | 78 | % | | 83 | % | | 72 | % | | 76 | % | | 77 | % |
株式ベースの報酬:
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 3か月まで |
| 十二月三十一日 | | 九月三十日 | | 六月三十日 | | 3月31日 | | 十二月三十一日 | | 九月三十日 | | 六月三十日 | | 3月31日 |
| 2023 | | 2023 | | 2023 | | 2023 | | 2022 | | 2022 | | 2022 | | 2022 |
| (単位:千) |
| 株式ベースの報酬: | | | | | | | | | | | | | | | |
| 収入コスト: | | | | | | | | | | | | | | | |
| ソフトウェア製品と サービスを提供する | $ | 671 | | | $ | 654 | | | $ | 625 | | | $ | 600 | | | $ | 580 | | | $ | 596 | | | $ | 584 | | | $ | 485 | |
| 薬物発見 | $ | 585 | | | $ | 580 | | | $ | 765 | | | $ | 699 | | | $ | 626 | | | $ | 764 | | | $ | 944 | | | $ | 803 | |
| 研究開発 | $ | 4,070 | | | $ | 4,101 | | | $ | 3,807 | | | $ | 3,514 | | | $ | 3,231 | | | $ | 3,026 | | | $ | 2,977 | | | $ | 2,582 | |
| 販売とマーケティング | $ | 935 | | | $ | 914 | | | $ | 941 | | | $ | 851 | | | $ | 867 | | | $ | 728 | | | $ | 699 | | | $ | 524 | |
| 一般と行政 | $ | 6,272 | | | $ | 6,405 | | | $ | 5,635 | | | $ | 5,217 | | | $ | 4,902 | | | $ | 4,750 | | | $ | 5,223 | | | $ | 4,740 | |
| 総在庫をもとに 補償費用を減らす | $ | 12,533 | | | $ | 12,654 | | | $ | 11,773 | | | $ | 10,881 | | | $ | 10,206 | | | $ | 9,864 | | | $ | 10,427 | | | $ | 9,134 | |
減価償却と償却:
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 3か月まで |
| 十二月三十一日 | | 九月三十日 | | 六月三十日 | | 3月31日 | | 十二月三十一日 | | 九月三十日 | | 六月三十日 | | 3月31日 |
| 2023 | | 2023 | | 2023 | | 2023 | | 2022 | | 2022 | | 2022 | | 2022 |
| (単位:千) |
減価償却と償却 償却前の利益: | | | | | | | | | | | | | | | |
| 収入コスト: | | | | | | | | | | | | | | | |
| ソフトウェア製品とサービス | $ | 124 | | | $ | 109 | | | $ | 101 | | | $ | 112 | | | $ | 113 | | | $ | 106 | | | $ | 118 | | | $ | 99 | |
| 薬物発見 | $ | 83 | | | $ | 110 | | | $ | 130 | | | $ | 116 | | | $ | 97 | | | $ | 117 | | | $ | 127 | | | $ | 112 | |
| 研究開発 | $ | 710 | | | $ | 591 | | | $ | 525 | | | $ | 518 | | | $ | 425 | | | $ | 384 | | | $ | 351 | | | $ | 308 | |
| 販売とマーケティング | $ | 151 | | | $ | 172 | | | $ | 141 | | | $ | 140 | | | $ | 114 | | | $ | 101 | | | $ | 118 | | | $ | 79 | |
| 一般と行政 | $ | 286 | | | $ | 291 | | | $ | 268 | | | $ | 874 | | | $ | 393 | | | $ | 399 | | | $ | 412 | | | $ | 371 | |
減価償却および償却総額 支出を減らす | $ | 1,354 | | | $ | 1,273 | | | $ | 1,165 | | | $ | 1,760 | | | $ | 1,142 | | | $ | 1,107 | | | $ | 1,126 | | | $ | 969 | |
四半期収入傾向
内部配備ソフトウェア収入は季節的要因の影響を受け、通常は毎年の第1四半期および第4四半期に有利であり、これは主に内部配備ソフトウェアによって手配された顧客の更新時間によるものであり、その収入は単一の時点で確認される。既存のクライアントおよび新しいクライアントのホスト·ソリューションへの支出の増加に伴い、ホスト·ソフトウェア収入は、本報告に記載されている間により安定して増加し、その収入は、契約期間内に比例して確認される。したがって、私たちが各時期に報告したソフトウェア製品とサービス収入の一部は、前の時期の販売に起因することができます。ソフトウェア保守収入は内部ソフトウェア販売に関するものであり,基本プロトコル期間内に比例して確認する.したがって、一定期間の顧客売上、顧客拡張、または更新の増加または減少は、その期間の収入に直ちに反映されない可能性がある。私たちの専門サービススケジュールは通常プロジェクトに基づいていますので、個別顧客のニーズや継続的なプロジェクト支援に応じて変動します。具体的な協力マイルストーンの成果及び協力サービスの進歩により、薬物発見収入は異なる時期に変動する。
マイルストーン支払いは一般的に計画が進むにつれて増加するだろう。
四半期繰延収入傾向
繰延収入には,我々の収入確認政策によって収入として確認された顧客請求書における未稼ぎ部分と,実際に実現される前に可能とされた未開票連携マイルストーンの未稼ぎ部分がある.繰延収入残高は,サービス項目達成進捗の測定,販売時間,製品組合せの変化,および実際の実現前に実現可能と考えられるマイルストーンの数や規模の変動によって変動する.
四半期毛利回り傾向
私たちのソフトウェア製品およびサービス利益率は、その間に変動を経験したが、これは、私たちのホストソフトウェアの販売に支払うべき印税コストが予め確認されているので、従業員数およびソフトウェアおよびサービスの製品の組み合わせが増加したためであり、関連収入は関連合意の期限内に確認されたからである。現在、毛金利は私たちの薬物発見業務の経営結果を評価することに対する意義は大きくない。
四半期運営費傾向
本報告で述べた期間中、運営費用は、研究開発、販売およびマーケティング、一般的および行政活動に関連する従業員数および人員関連費用の増加、および我々の特許薬物発見計画に関連するCROコストが一般的に増加している。私たちの業務部門全体の従業員数の増加は私たちの業務全体の成長と管理を支持しています。CROコストの増加は我々の特許薬物発見計画の拡大と進展によって推進されている。
四半期別収入傾向
本報告に記載されている期間の他の(費用)収入は、主にMorphyおよびStructure Treeuticsにおける私たちの株式投資に関連する公正な価値収益と損失、およびより少ない程度の利息収入を含む。
市場情報を細分化する
下表は,2023年12月31日までと2022年12月31日までの年度支部情報をまとめたものである。弊社支部の詳細については、監査された連結財務諸表に添付されている16分部レポートを参照してください。
分部毛利は米国公認会計基準収入から研究開発、販売とマーケティング、一般と行政活動以外の運営支出を差し引くことで得られた。業務支出は報告されなければならない部分の支出に直接起因する。多くの場合、このような支出は人数に応じて各部門に割り当てられる。報告されるべき部分支出には、報酬、用品、および契約研究機関が提供するサービスが含まれる。
いくつかの費用項目は私たちの報告可能な部門に割り当てられないだろう。これらのコスト項目には,主に薬物発見計画に関する補償と,我々の研究開発,販売とマーケティング,一般や行政活動に関する一般運営費用が含まれている。これらのコストはこの2つの部門によって生じており,また,我々のソフトウェアと薬物発見部門の総合的な性質のため,どの分配方法も任意であり,有意義な分析を提供することはできない。また、私たちは合併に基づいて資産を報告し、部門の業績を評価したり、資源を割り当てたりするために、私たちの報告可能な部門に資産を割り当てません。
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| (単位:千) |
| 細分化市場収入: | | | |
| ソフトウェア | $ | 159,124 | | | $ | 135,578 | |
| 薬物発見 | 57,542 | | | 45,377 | |
| 部門総収入 | $ | 216,666 | | | $ | 180,955 | |
| 部門毛利益: | | | |
| ソフトウェア | $ | 129,610 | | | $ | 106,002 | |
| 薬物発見 | 11,082 | | | (4,980) | |
| 部門毛利総額 | $ | 140,692 | | | $ | 101,022 | |
| 未分配(費用)収入: | | | |
| 研究開発 | (181,766) | | | (126,372) | |
| 販売とマーケティング | (37,226) | | | (30,642) | |
| 一般と行政 | (99,148) | | | (90,825) | |
株式投資収益 | 147,213 | | | 11,825 | |
| 価値変動を公平に承諾する | 53,461 | | | (18,084) | |
その他の収入 | 19,693 | | | 3,950 | |
| 所得税 | (2,199) | | | (63) | |
合併純収益 | $ | 40,720 | | | $ | (149,189) | |
流動資金、資本資源、資金需要
我々は重大な運営損失の歴史があり,運営から2023年12月31日までの1年間に負のキャッシュフローが生じている。2023年12月31日現在、私たちの累計赤字は3億384億ドルです。
これまで、私たちの運営資金は、主に私たちの株式証券を販売し、私たちの初公募株と後続公募株、次いで私たちのソフトウェア解決策の販売、そして私たちの薬物発見協力からの前払い、研究資金とマイルストーン支払い、そして流通から来ました
私たちが協力者の中で株式を販売したり、私たちの協力者の株式を売ったりして得られたからです。私たちの運営キャッシュフローは私たちのソフトウェア販売の規模とタイミングの影響、そして私たちの薬物発見マイルストーンの成果と研究資金費用の規模とタイミングの影響を受けています。
2021年3月4日、我々は、1つ以上の発売に基づいて、販売時に決定された価格および条項に従って、不確定数量の普通株、優先株、預託株式または株式承認証、または元本不確定債務証券を時々発行および販売することを可能にするS-3表の汎用棚上げ登録声明を提出した。2023年12月31日現在、S-3の形でいかなる証券も販売されていない。
2023年5月、私たちはLeerink Partners LLC(SVB Securities LLC)またはLeerink Partnersと販売エージェントとして販売契約を締結し、市場発売計画またはATMに関する販売契約を締結し、この計画によると、私たちの表S-3に基づいて時々Leerink Partnersを通じて普通株を発売することができ、総発行価格は2.5億ドルに達する。ATMでは2023年12月31日までの3カ月間、普通株は販売されておらず、2023年12月31日現在、ATMで2億5千万ドルの普通株が販売されている。
2023年12月31日現在、私たちは4.688億ドルの現金、現金等価物、制限現金、および有価証券を持っています。
私たちは、2023年12月31日まで、私たちの既存の現金、現金等価物、および有価証券が、少なくとも今後24ヶ月の運営費用および資本支出要件を支払うのに十分になると信じている。私たちの将来の資本需要は、私たちのソフトウェア収入の増加、研究開発努力の支出の時間と程度、ソフトウェア販売とマーケティング活動の持続的な拡大、私たちの協力から記念碑的支払いの時間と収入を獲得し、独自の薬物発見計画の支出を支援、推進、拡大することを含む多くの要素に依存するだろう。さらに、私たちの資本要求も変化し、これは、私たちが薬物発見協力者の株式から得られる可能性のある任意の分配の時間と受け入れ状況に依存するだろう。これらの割当てのイベント自体の不確実性を引き起こす可能性があるため,これらの割当ての可能性や我々が獲得する権利がある可能性のある金額の予測は困難である.
私たちは主に手元にある現金、現金等価物、有価証券を利用して、私たちのソフトウェアと薬物発見活動に資金を提供する予定です。我々の特許薬物発見計画については,我々の戦略の一部として,臨床前および臨床開発を自ら推進し,有力な業界パートナーと共同でそれらを開発するか,あるいはそれらよりも多くの許可を得て,その臨床やビジネス機会を最大限に拡大することを選択することが可能である。
私たちは追加的な株式や債務融資を求めることを要求されるかもしれない。もし私たちが追加的な資金調達が必要なら、私たちは私たちが受け入れられる条項やそのような資金を調達できないかもしれない。もし私たちが追加資本を調達したり、私たちの業務を維持または拡大し、私たちのプラットフォームに投資するために必要な現金フローを生成できなければ、私たちは競争に成功できないかもしれません。これは私たちの業務、運営、財務状況を損なうことになります。また、有利な市場条件や戦略的考慮により、現在または将来の運営計画を実行するのに十分な資金があると考えても、追加の資本を求めることができる。
2023年12月31日現在、私たちの契約義務には、2037年12月までの持続賃貸義務が含まれており、主にニューヨークにあるオフィス1.454億ドル、マサチューセッツ州カンブリッジの1640万ドル、マサチューセッツ州フレミンガムの1130万ドルが含まれており、それぞれ2037年12月、2032年6月、2033年3月に満期になります。2022年12月、インドのハイデラバードに独自の総合薬物発見専用施設を設立することで第三者と合意した。この協定には最低支払義務が含まれており,初入居日から5年間で合計2180万ドルである。また、当社の経営リース義務に関するより多くの情報は、本年度報告第8項に付記されている7-当社の総合財務諸表の承諾及び又は事項を参照されたい。
2020年12月、我々は第三者クラウドプロバイダと5年間の計算能力協定を締結した。この協定には最低支払義務が含まれており、私たちが合意した日から5年間、総金額は6000万ドルです。年間約束はありません。
著者らはまた正常な業務過程中にCROサプライヤーと研究、臨床前研究と臨床試験協定を締結し、専門顧問と専門家の提案を提供し、そして他のサプライヤーと各種の製品とサービスの協定を締結した。これらの契約には最低購入約束は含まれていません。私たちはいつでもキャンセルすることができます。通常は30日前に書面で通知された場合ですので、これらの合意の下でのキャンセル不可義務は実質的ではないと思います。また,様々な許可や関連プロトコルに基づいて,ソフトウェア機能を利用する第三者に数量別の印税を支払うことにも同意した.当社の特許使用料義務に関するより多くの情報は、本年報第8項に記載されている付記2-我々が監査した総合財務諸表の重要な会計政策を参照してください。
キャッシュフロー
次の表は私たちが示した期間のキャッシュフローをまとめています
| | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2023 | | 2022 |
| (単位:千) |
| 経営活動のための現金純額 | $ | (136,733) | | | $ | (119,683) | |
| 投資活動が提供する現金純額 | 193,034 | | | 90,023 | |
| 融資活動が提供する現金純額 | 9,048 | | | 2,110 | |
| 現金および現金等価物と制限現金純増加(マイナス) | $ | 65,349 | | | $ | (27,550) | |
経営活動
2023年12月31日までの年間では、株式投資収益1.472億ドルにより、経営活動は約1.367億ドルの現金を使用しており、その中で受け取った現金は投資活動に含まれている,5,350万ドルの公正価値変動非現金収益、2,240万ドルの運営資産と負債の変化、および210万ドルの非現金運営費用。これらのプロジェクトは、減価償却と投資付加価値費用、4780万ドルの株式報酬を含む4070万ドルの純収入によって相殺される。
2022年12月31日までの年間で、経営活動は約1.197億ドルの現金を使用しており、主な原因は純損失1.492億ドルであり、その中には1180万ドルの株式投資収益が含まれており、一部は純損失に含まれる500万ドルの非現金運営費用(減価償却と投資増加コストを含む)、3960万ドルの株式報酬、1810万ドルの公正価値変動非現金損失によって相殺されている。私たちの営業資産と負債の変化は約2140万ドルの現金を使った。
投資活動
投資活動は2023年12月31日までに,Nimbusの株式投資についてNimbusから受け取った現金について吾らが1.472億ドルを割り当て,武田がNimbusを買収した完全子会社Nimbus Lakshmi,Inc.とそのTYK 2阻害剤NDI−034858に関連し,有価証券から提供された6,330万ドル(控除購入)を含む約1.93億ドルの現金を提供している。これらのプロジェクトは資産および設備を購入するための1340万ドルの現金によって部分的に相殺され、410万ドルはStructure Treeutics社の株式投資を購入するために使用される。
投資活動は、2022年12月31日までの年間で、有価証券から提供された9,320万ドル、購入後の純額、および第三者から1,180万ドルの現金を差し引くことを含む約9,000万ドルの現金を提供し、当社などが買収合意に基づいて潜在的なプレミアムを受け取る権利の終了と引き換えに、吾らの持分を持つ協力者を先に買収した。これらのプロジェクトは、財産および設備を購入するための800万ドルの現金、Structure Treeuticsへの株式投資のための60万ドル、Xtalを買収するための640万ドル(取得された現金を差し引く)によって部分的に相殺される。
融資活動
融資活動は2023年12月31日までの1年間に約900万ドルの現金を提供し、主に株式オプションを行使する収益から来ている。
季節性
一般的に、毎年第1四半期と第4四半期は通常、私たちのソフトウェア製品とサービス収入が最も高い四半期であり、これは主に顧客が内部配備ソフトウェアスケジュールを更新する時間によって、収入は単一の時点で確認されるからである。我々のホストソフトウェアプロトコルにとって,季節性はあまり重要ではない要素であり,その収入は時間の経過とともに比例して確認されてきた.季節性は私たちの薬物発見収入の一つの要素ではない。歴史の季節性は未来の時期を暗示してはいけないかもしれない。
重要な会計政策と試算
肝心な会計政策は、会社の財務状況と業績を記述する最も重要な政策であり、管理層に最も困難で、最も主観的で複雑な判断を要求する政策でもあり、通常は本質的に不確定な事項の影響を推定する必要があるからである。私たちの経営陣は私たちの財務状況と経営結果の討論と分析は私たちの総合財務諸表に基づいています。これらの報告書はアメリカ公認会計原則に基づいて作成されています。これらの連結財務諸表を作成する際には、私たちの連結財務諸表および付記に報告されている資産、負債、収入および費用、または資産および負債の開示に影響を与える判断と推定を行う必要がある。私たちの推定は、歴史的経験、既知の傾向、および事件、および未来に起こりうることに対する私たちの信念に基づいて、利用可能な情報を考慮する。異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある。持続的な基礎の上で、私たちは環境、事実、経験の変化に基づいて私たちの判断と推定を評価する。重大な改訂が予想される場合、その影響は推定変動の日から連結財務諸表に反映されると予想される.
我々の主要会計政策は、本年報第8項に記載されている付記2-我々の総合財務諸表の重要な会計政策により詳細に記載されているが、私たちの総合財務諸表を作成する際に使用される以下の重要な会計推定は、最も困難で、最も主観的で複雑な判断と推定を必要とし、すでに、または合理的に私たちの財務状況や経営業績に大きな影響を与える可能性があると信じている。
収入.収入
我々は、ASC主題606に基づいて、顧客の契約収入または主題606と収入を確認するが、他の標準範囲内の契約は、例えば、寄付金およびいくつかの協力手配を除く。主題606によれば、私たちの顧客が約束された商品またはサービスの制御権を取得すると、その金額は、これらの商品またはサービスと交換することが予想される対価格を反映していることを確認する。主題606の範囲内に属するスケジュールの収入確認を決定するために、(I)顧客との契約を決定するステップ(S)、(Ii)契約における履行義務を決定するステップ、(Iii)取引価格を決定するステップ、(Iv)契約の履行義務に取引価格を割り当てるステップ、および(V)契約義務を満たしたときに収入を確認するステップの5つのステップを実行する
重要な管理判断は,取引価格の分配や進捗を決定するための測定であり,(1)可変対価格の制限,(2)履行義務を用いた独立販売価格(SSP)取引価格を履行義務に割り当てること,(3)適切な投入や産出の方法に基づいて連携収入とこれまでの進捗度を確認することである.
可変注意事項:私たちは制限されない推定可変対価金額を取引価格に計上します。その後報告期間ごとに終了すると,吾らは取引価格に含まれる推定変動の価格や何らかの関連制限を再評価し,必要に応じて全体の取引価格の見積りを調整する.
私たちの協力協定の研究開発、規制、またはビジネスマイルストーンは、以下のタイプのイベントの一部を含むことができますが、必ずしもすべてを含むとは限りません
•臨床前の研究と開発を完成し、それによって候補製品を選択する
•1期、2期、3期の臨床試験を開始した
•米国、欧州、日本で上場承認の規制申請を提出する
•アメリカ、ヨーロッパ、日本などの主要市場で市場承認を得た
•商業マイルストーンおよび/または商業使用料;および
•いくつかの他の技術、科学、または開発基準を達成する。
マイルストーン支払いの研究、開発、または規制を含む各手配の開始時に、マイルストーンが達成可能であると考えられているかどうかを評価し、最も可能な金額方法を使用して取引価格に含まれる金額を推定する。大きな収入逆転が起こらない可能性が高い場合、関連するマイルストーン価値は取引価格に含まれるだろう。規制承認のような我々または被許可者の制御範囲内でのマイルストーン支払いは、これらの承認を受ける前に実現可能であるとは考えられない。取引価格はSSPに基づいて履行義務ごとに割り当てられ,そのため,収入が契約下の履行義務が履行された場合であることを確認する.その後の各報告期間終了時には,このような発展マイルストーンや任意の関連制限を達成する可能性を再評価し,必要に応じて全体の取引価格の見積りを調整する.このような調整は、累積追跡に基づいて記録されており、これは、調整中の許可証、連携、および他の収入および収益に影響を与える可能性がある。マイルストーン支払い基準に成功的に到達する過程は大きな不確実性を持っている。したがって、私たちはすべての協力者からすべての記念碑的な支払いを得ることができないかもしれない。2023年12月31日と2022年12月31日までの年間で,それぞれ薬物発見マイルストーンから2770万ドルと1470万ドルを確認した。
ソフトウェア性能義務と取引価格配分:契約開始時に、異なる履行義務を決定するために、特別テーマ606の範囲に属する各契約で約束された貨物またはサービスを評価し、これは、各取引の性質に基づいて重大な判断を行う必要がある。我々はSSPに基づいて取引価格をそれぞれ異なる履行義務に割り当てる.私たちは、履歴割引実践、市場状況、コストプラス分析、および他の観察可能な投入を含む情報を使用してSSPを決定します。これらの項目はクライアント種別や状況ごとに階層化されているため,我々は通常1つ以上のSSPが個人の履行義務を果たしている.これらの場合、クライアント規模や地理的領域などの情報を用いてSSPを決定することが可能である。経営陣の判断に基づいて、内部コストおよび利益率目標、定価戦略、市場/競争状況、履歴収益性データ、および他の観察可能な投入などの利用可能なデータを考慮することで、SSPを推定することもできる。私たちは私たちの製品とサービスのためにSSP範囲を構築し、それらを定期的に再評価します。SSPの決定には重要な経営陣の判断が必要である。
協調プロトコル取引価格分配と進捗測定:個々のスケジューリング開始時には,判断を用いて履行義務の性質を評価し,それらが独立しているか単一の総合履行義務であるかを決定する.履行義務ごとの開始時の相対SSPに基づいて履行義務ごとに取引価格を割り当て,その価格は履行義務ごとの推定SSPに基づいて決定する.我々は、契約開始時にサービスを実行するコスト(合理的な利益率を含む)の内部推定に基づいてSSPを決定する。研究活動を実行するための総コストの投入は、重大な判断を用いて決定され、その中には、所要時間長、サービスが予想される内部時間数、および第三者が研究計画を達成するために行う様々な研究の数およびコストが含まれる可能性がある。収入はサービス期間中に比例業績で確認され,投入に基づく測定基準を用いて業績を見積もる。これらの仮定の変化は,収入確認の金額や時間に大きな影響を与える可能性がある.2023年12月31日と2022年12月31日までに,それぞれ比例業績別連携協定に関する収入5,220万ドルと2,430万ドルを確認した。
最近の会計公告
第七A項。市場リスクに関する定量的で定性的な開示。
私たちの市場リスクに対する主な開口は金利感受性であり、金利感受性はアメリカ金利全体レベルの変化の影響を受けており、特に私たちの投資は、現金等価物と有価証券、アメリカ国債と社債の形で、アメリカ国債と社債に投資する通貨市場基金を含むからである
これらの投資の性質により、金利が直ちに10%変化することは、このポートフォリオの公平な市場価値に実質的な影響を与えない。
私たちはまた外貨為替レートの変化と関連した市場リスクに直面している。私たちはまたアメリカ以外のあるサプライヤーと契約を結びます。これらのサプライヤーの領収書は外貨で価格を計算します。私たちはこれらの手配に関連した外貨為替レートの変動の影響を受けるだろう。私たちは為替レートの危険と関連したヘッジキャンペーンはどうでもいい。2023年12月31日と2022年12月31日まで、私たちの現金残高と外貨建ての未返済仕入先領収書は重要ではなく、外貨為替レートに関連する市場リスクは取るに足らないと考えられている。為替レートが直ちに10%変化したことは、私たちの総合財務諸表に実質的な影響を与えません。
項目8.財務諸表と補足データ
連結財務諸表索引
| | | | | |
独立公認会計士事務所報告 | F-2 |
| |
2023年12月31日と2022年12月31日までの連結貸借対照表 | F-5 |
| |
2023年12月31日まで、2022年と2021年12月31日までの年度の総合業務報告書 | F-6 |
| |
2023年,2022年,2021年12月31日までの年度総合総合収益(損失表) | F-7 |
| |
2023年、2022年、2021年12月31日までの株主権益総合レポート | F-8 |
| |
2023年12月31日現在、2022年12月31日現在、2021年12月31日までの統合現金フロー表 | F-9 |
| |
連結財務諸表付記 | F-10 |
独立公認会計士事務所報告
株主や取締役会に
シュレーディンガー社:
連結財務諸表に対するいくつかの見方
私たちは薛定騰会社とその子会社(当社)の2023年12月31日と2022年12月31日までの連結貸借対照表、2023年12月31日までの3年間の各年度の関連総合経営表、全面収益(損失)、株主権益と現金流量、および関連付記(総称して総合財務諸表と呼ぶ)を監査した。総合財務諸表は、すべての重要な面で、会社の2023年12月31日と2022年12月31日までの財務状況、および2023年12月31日までの3年間の毎年の経営結果と現金流量を公平に反映しており、米国公認会計原則に適合していると考えられる。
我々はまた、米国上場企業会計監督委員会(PCAOB)の基準に基づき、以下の基準に基づいて、会社が2023年12月31日までの財務報告内部統制を監査した内部統制--統合フレームワーク(2013)トレデビル委員会後援組織委員会が発表した報告書と、2024年2月28日の私たちの報告書は、社内財務報告の内部統制の有効性について保留されていない意見を表明した。
意見の基礎
これらの連結財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいてこのような連結財務諸表に意見を発表することだ。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、連結財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。我々の監査には、連結財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれる。これらの手続きは、連結財務諸表中の金額および開示に関する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、合併財務諸表の全体列報の評価も含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項は、監査委員会が監査委員会に伝達または要求する当期総合財務諸表監査によって生じる事項を指すことである:(1)総合財務諸表に対して大きな意味を有する勘定または開示に関するものであり、(2)私たちが特に挑戦的で主観的または複雑な判断に関するものである。重要監査事項の伝達は、総合財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、以下の重要な監査事項を伝達することによって、重要な監査事項またはそれに関連する勘定または開示について個別の意見を提供することはない。
複雑または異常な収入計画における履行義務を確定する
総合財務諸表付記3(A)で述べたように,2023年12月31日までの年度における社内ソフトウェア収入は104,511,000ドル,ホストソフトウェア収入は20,381,000ドルであった。付記3(D)に記載されているように、会社が顧客と締結する契約は、一般に、トレーニング、専門サービス、技術支援サービス、および指定されていない更新権を含む様々なソフトウェア製品およびサービスの譲渡を承諾することを含む。契約開始時には、会社は、各契約で約束された製品及びサービスを評価し、個別に計算すべき異なる履行義務を決定する。
複雑または異常な収入配置において異なる業績義務を決定することが重要な監査事項であると考えられる。約束された製品とサービスが合っているかどうかを評価しています
複雑または異常な収入配置は単独の業績義務または合併業績義務の投入である。
以下は私たちがこの重要な監査問題を解決するために実行した主な手続きだ。我々は設計を評価し、異なる業績義務の決定に関する制御を含む収入プロセスに関するいくつかの内部制御の動作効果をテストした。いくつかの複雑または異常な収入スケジュールについて、会社の製品とサービスを理解し、契約を取得し、検査し、収入を評価して選択された契約における会計基準の適用状況を確認することで、会社が決定した履行義務が契約範囲内で区別できるかどうかを評価した。
/s/ピマウェイ法律事務所
2010年以来、当社の監査役を務めてきました。
オレゴン州ポートランド
2024年2月28日
独立公認会計士事務所報告
株主や取締役会に
シュレーディンガー社:
財務報告の内部統制については
我々はシュレーディンガー社とその子会社(当社)の2023年12月31日までの財務報告内部統制を監査し、根拠とした内部統制--統合フレームワーク(2013)テレデビル委員会が主催して委員会が発表された。2023年12月31日現在、当社はすべての重要な面で財務報告に対する有効な内部統制を維持しており、その根拠は内部統制--統合フレームワーク(2013)テレデビル委員会が主催して委員会が発表された。
また、米国上場会社会計監督委員会(PCAOB)の基準に従って、当社の2023年12月31日まで、2022年12月31日と2022年12月31日までの総合貸借対照表、2023年12月31日までの3年間の各年度の関連総合経営表、総合収益(損失)、株主権益と現金流量および関連付記(総称して総合財務諸表と呼ぶ)を監査し、2024年2月28日の報告でこのなどの総合財務諸表に対して無保留意見を表明した。
意見の基礎
当社経営陣は、効果的な財務報告内部統制を維持し、付随する経営陣財務報告内部統制年次報告に含まれる財務報告内部統制の有効性の評価を担当する。私たちの責任は私たちの監査に基づいて、会社の財務報告書の内部統制に意見を述べることです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務報告の有効な内部統制がすべての重要な面で維持されているかどうかを決定するために、合理的な保証を得るために監査を計画し、実行することを要求する。我々の財務報告の内部統制の監査には、財務報告の内部統制を理解すること、重大な弱点があるリスクを評価すること、評価されたリスクテストに基づいて内部統制の設計と運営有効性を評価することが含まれる。私たちの監査はまた、私たちがこのような状況で必要だと思う他の手続きを実行することを含む。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
財務報告の内部統制の定義と限界
会社の財務報告に対する内部統制は、公認された会計原則に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的としたプログラムである。会社の財務報告に対する内部統制には、(1)合理的で詳細かつ正確かつ公平に会社の資産を反映した取引および処分に関する記録の保存、(2)公認された会計原則に従って財務諸表を作成するために必要な取引が記録されている合理的な保証を提供し、会社の収入および支出は会社の経営陣と取締役の許可のみに基づいて行われる。(三)財務諸表に重大な影響を及ぼす可能性のある不正買収、使用、または処分会社の資産を防止またはタイムリーに発見する合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
/s/ピマウェイ法律事務所
オレゴン州ポートランド
2024年2月28日
シュレーディンガーInc.そして付属会社
合併貸借対照表
(千単位で、1株当たりおよび1株当たりの金額は含まれていない)
| | | | | | | | | | | |
| 資産 | 2023年12月31日 | | 2022年12月31日 |
| 流動資産: | | | |
| 現金と現金等価物 | $ | 155,315 | | | $ | 90,474 | |
| 制限現金 | 5,751 | | | 5,243 | |
| 有価証券 | 307,688 | | | 360,613 | |
売掛金、不良債権を差し引いて純額#ドルを用意する220そして$125 | 65,992 | | | 55,953 | |
未開票売掛金とその他の売掛金、未開票売掛金を差し引いて純額#ドル100そして$100 | 23,124 | | | 13,137 | |
| 前払い費用 | 9,926 | | | 8,569 | |
| 流動資産総額 | 567,796 | | | 533,989 | |
| 財産と設備、純額 | 23,325 | | | 14,244 | |
| 株式投資 | 83,251 | | | 25,683 | |
| 商誉 | 4,791 | | | 4,791 | |
| 無形資産、純額 | — | | | 587 | |
| 使用権資産--経営リース | 117,778 | | | 105,982 | |
| その他の資産 | 6,014 | | | 3,311 | |
| 総資産 | $ | 802,955 | | | $ | 688,587 | |
| 負債と株主権益 | | | |
| 流動負債: | | | |
| 売掛金 | $ | 16,815 | | | $ | 9,470 | |
| | | |
| 給料·税金·福祉を計算すべきだ | 31,763 | | | 24,882 | |
| 収入を繰り越す | 56,231 | | | 57,931 | |
| レンタル負債--レンタル経営 | 16,868 | | | 11,006 | |
| その他負債を計算すべき | 11,996 | | | 5,510 | |
| 流動負債総額 | 133,673 | | | 108,799 | |
| 収入を繰延し,長期 | 9,043 | | | 25,598 | |
| リース負債--長期経営リース | 111,014 | | | 105,485 | |
| その他長期負債 | 667 | | | 800 | |
| 総負債 | 254,397 | | | 240,682 | |
引受金及び又は有事項(付記7) | | | |
| 株主権益: | | | |
優先株、$0.01額面価値。授権10,000,000株式;ゼロそれぞれ2023年12月31日と2022年12月31日に発行された株式 | — | | | — | |
普通株、$0.01額面価値。授権500,000,000株式;62,977,316そして62,163,739それぞれ2023年12月31日と2022年12月31日に発行された株式 | 630 | | | 622 | |
有限普通株、$0.01額面価値。授権100,000,000株式;9,164,193それぞれ2023年12月31日と2022年12月31日に発行された株式 | 92 | | | 92 | |
| 追加実収資本 | 885,973 | | | 828,700 | |
| 赤字を累計する | (338,418) | | | (379,138) | |
| その他の総合損失を累計する | 281 | | | (2,382) | |
| シュレーディンガー社の株主権益総額 | 548,558 | | | 447,894 | |
| 非持株権益 | — | | | 11 | |
| 株主権益総額 | 548,558 | | | 447,905 | |
| 総負債と株主権益 | $ | 802,955 | | | $ | 688,587 | |
連結財務諸表の付記を参照。
シュレーディンガーInc.そして付属会社
連結業務報告書
(千単位で、1株当たりおよび1株当たりの金額は含まれていない)
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| 収入: | | | | | |
| ソフトウェア製品とサービス | $ | 159,124 | | | $ | 135,578 | | | $ | 113,236 | |
| 薬物発見 | 57,542 | | | 45,377 | | | 24,695 | |
| 総収入 | 216,666 | | | 180,955 | | | 137,931 | |
| 収入コスト: | | | | | |
| ソフトウェア製品とサービス | 29,514 | | | 29,576 | | | 26,495 | |
| 薬物発見 | 46,460 | | | 50,357 | | | 45,816 | |
| 収入総コスト | 75,974 | | | 79,933 | | | 72,311 | |
| 毛利 | 140,692 | | | 101,022 | | | 65,620 | |
| 運営費用: | | | | | |
| 研究開発 | 181,766 | | | 126,372 | | | 90,904 | |
| 販売とマーケティング | 37,226 | | | 30,642 | | | 22,150 | |
| 一般と行政 | 99,148 | | | 90,825 | | | 64,009 | |
| 総運営費 | 318,140 | | | 247,839 | | | 177,063 | |
| 運営損失 | (177,448) | | | (146,817) | | | (111,443) | |
| その他の収入(支出): | | | | | |
| 株式投資の収益 | 147,213 | | | 11,825 | | | (1,781) | |
| 価値変動を公平に承諾する | 53,461 | | | (18,084) | | | 11,359 | |
| その他の収入 | 19,693 | | | 3,950 | | | 1,057 | |
| その他収入合計 | 220,367 | | | (2,309) | | | 10,635 | |
| 所得税前収入 | 42,919 | | | (149,126) | | | (100,808) | |
| 所得税費用 | 2,199 | | | 63 | | | 411 | |
| 純収益(赤字) | 40,720 | | | (149,189) | | | (101,219) | |
| 非持株権益の純収益(損失)に帰することができる | — | | | (3) | | | (826) | |
| シュレーディンガー普通株と有限普通株株主の純収益(損失) | $ | 40,720 | | | $ | (149,186) | | | $ | (100,393) | |
| シュレーディンガー普通株と有限普通株株主の1株当たり純収益(損失) | $ | 0.57 | | | $ | (2.10) | | | $ | (1.42) | |
| シュレーディンガー普通株と有限普通株株主の1株当たり純収益(損失)を計算するための加重平均株 | 71,776,301 | | 71,173,419 | | 70,594,950 |
| シュレーディンガー普通株と有限普通株株主の1株当たり純収益(損失)に起因し、希釈した | $ | 0.54 | | | $ | (2.10) | | | $ | (1.42) | |
| シュレーディンガー普通株と有限普通株株主の1株当たり純利益(損失)の加重平均株式を計算し、希釈した後、 | 74,986,816 | | 71,173,419 | | 70,594,950 |
連結財務諸表の付記を参照。
シュレーディンガーInc.そして付属会社
総合総合収益表(損益表)
(単位:千)
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| シュレーディンガー普通株と有限普通株株主の純収益(損失) | $ | 40,720 | | | $ | (149,186) | | | $ | (100,393) | |
| 税額控除後の投資時価変動: | | | | | |
| 有価証券の未実現収益 | 2,663 | | | (1,731) | | | (968) | |
| 総合収益(赤字) | $ | 43,383 | | | $ | (150,917) | | | $ | (101,361) | |
連結財務諸表の付記を参照。
シュレーディンガーInc.そして付属会社
株主権益合併報告書
(単位は千であるが、株式金額は含まれていない)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | 普通株 | | 有限公有 在庫品 | | その他の内容 支払い済み | | 積算 | | 積算 他にも 全面的に | | ありません 制御管 | | 合計する 株主の |
| | | | | | | | | | | | | | | | | | | | | 株 | | 金額 | | 株 | | 金額 | | 資本 | | 赤字.赤字 | | 収入(損) | | 利子 | | 株権 |
2020年12月31日の残高 | | | | | | | | | | | | | | | | | | | | | 60,713,534 | | $ | 607 | | | 9,164,193 | | $ | 92 | | | $ | 752,558 | | | $ | (129,559) | | | $ | 317 | | | $ | 4 | | | $ | 624,019 | |
| 有価証券は赤字変動を実現していない | | | | | | | | | | | | | | | | | | | | | — | | — | | | — | | — | | | — | | | — | | | (968) | | | — | | | (968) | |
| 株式オプション行使時の普通株の発行 | | | | | | | | | | | | | | | | | | | | | 1,120,981 | | 11 | | | — | | — | | | 7,916 | | | — | | | — | | | — | | | 7,927 | |
| 株に基づく報酬 | | | | | | | | | | | | | | | | | | | | | — | | — | | | — | | — | | | 26,490 | | | — | | | — | | | — | | | 26,490 | |
| 非持株権益の出資 | | | | | | | | | | | | | | | | | | | | | — | | — | | | — | | — | | | | | | | — | | | 836 | | | 836 | |
| 純損失 | | | | | | | | | | | | | | | | | | | | | — | | — | | | — | | — | | | — | | | (100,393) | | | — | | | (826) | | | (101,219) | |
2021年12月31日の残高 | | | | | | | | | | | | | | | | | | | | | 61,834,515 | | 618 | | | 9,164,193 | | 92 | | | 786,964 | | | (229,952) | | | (651) | | | 14 | | | 557,085 | |
| 有価証券は赤字変動を実現していない | | | | | | | | | | | | | | | | | | | | | — | | — | | | — | | — | | | — | | | — | | | (1,731) | | | — | | | (1,731) | |
株式オプション行使時の普通株の発行 | | | | | | | | | | | | | | | | | | | | | 329,224 | | 4 | | | — | | — | | | 2,106 | | | — | | | — | | | — | | | 2,110 | |
| 株に基づく報酬 | | | | | | | | | | | | | | | | | | | | | — | | — | | | — | | — | | | 39,630 | | | — | | | — | | | — | | | 39,630 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 純損失 | | | | | | | | | | | | | | | | | | | | | — | | — | | | — | | — | | | — | | | (149,186) | | | — | | | (3) | | | (149,189) | |
2022年12月31日の残高 | | | | | | | | | | | | | | | | | | | | | 62,163,739 | | 622 | | | 9,164,193 | | 92 | | | 828,700 | | | (379,138) | | | (2,382) | | | 11 | | | 447,905 | |
| 有価証券は収益変動を実現していない | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | 2,663 | | | | | 2,663 | |
| 非持株権益の再分類 | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | (11) | | | (11) | |
株式オプション行使時の普通株の発行 | | | | | | | | | | | | | | | | | | | | | 800,336 | | | 8 | | | — | | | — | | | 9,432 | | | — | | | — | | | — | | | 9,440 | |
| 帰属制限株式単位の場合に普通株式を発行する | | | | | | | | | | | | | | | | | | | | | 13,241 | | | — | | | — | | | — | | | — | | | — | | | — | | | | | — | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 株に基づく報酬 | | | | | | | | | | | | | | | | | | | | | — | | | — | | | — | | | — | | | 47,841 | | | — | | | — | | | — | | | 47,841 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 純収入 | | | | | | | | | | | | | | | | | | | | | — | | | — | | | — | | | — | | | — | | | 40,720 | | | — | | | — | | | 40,720 | |
2023年12月31日の残高 | | | | | | | | | | | | | | | | | | | | | 62,977,316 | | | $ | 630 | | | 9,164,193 | | | $ | 92 | | | $ | 885,973 | | | $ | (338,418) | | | $ | 281 | | | $ | — | | | $ | 548,558 | |
連結財務諸表の付記を参照。
シュレーディンガーInc.そして付属会社
統合現金フロー表
(単位:千)
| | | | | | | | | | | | | | | | | |
| | 2013年12月31日までの年度 |
| | 2023 | | 2022 | | 2021 |
| 経営活動のキャッシュフロー: | | | | | |
| 純収益(赤字) | $ | 40,720 | | | $ | (149,189) | | | $ | (101,219) | |
| 純収益(損失)と業務活動で使用される現金純額を調整する: | | | | | |
| 株式投資(収益)が損する | (147,213) | | | (11,825) | | | 1,781 | |
| 株式投資の非現金収入 | — | | | — | | | (107) | |
| 公正価値調整 | (53,461) | | | 18,084 | | | (11,359) | |
| 減価償却および償却 | 5,552 | | | 4,344 | | | 2,847 | |
| 株に基づく報酬 | 47,841 | | | 39,630 | | | 26,490 | |
| 非現金研究開発費 | — | | | — | | | 811 | |
| 非現金投資(付加価値償却) | (7,761) | | | 629 | | | 5,270 | |
| 財産と設備処分損失 | 142 | | | 19 | | | 140 | |
| | | | | |
| 資産減少額、買収控除: | | | | | |
| 売掛金純額 | (10,039) | | | (23,697) | | | (321) | |
| 未入金とその他の売掛金 | (9,987) | | | (4,253) | | | (5,187) | |
| 使用権資産の帳簿金額を減らす−リースを経営する | 7,766 | | | 7,287 | | | 5,799 | |
| 前払い費用と他の資産 | (8,462) | | | (7,067) | | | (1,121) | |
| 負債の増加(減少)、買収を差し引く: | | | | | |
| 売掛金 | 7,321 | | | 1,179 | | | (411) | |
| | | | | |
| 給料·税金·福祉を計算すべきだ | 6,881 | | | 6,477 | | | 6,405 | |
| 収入を繰り越す | (18,256) | | | (1,903) | | | (1,028) | |
| レンタル負債--レンタル経営 | (3,694) | | | 1,900 | | | (2,949) | |
| その他負債を計算すべき | 5,917 | | | (1,298) | | | 3,490 | |
| 経営活動のための現金純額 | (136,733) | | | (119,683) | | | (70,669) | |
| 投資活動によるキャッシュフロー: | | | | | |
| 財産と設備を購入する | (13,403) | | | (8,014) | | | (7,167) | |
| 株式投資を購入する | (4,125) | | | (600) | | | (3,700) | |
| 株式投資分配 | 147,213 | | | 11,825 | | | 375 | |
| 株式投資で得られた収益 | — | | | — | | | 15,735 | |
| 買収,買収現金の純額を差し引く | — | | | (6,427) | | | — | |
| 有価証券を購入する | (320,624) | | | (271,472) | | | (414,802) | |
| 有価証券の満期収益 | 383,973 | | | 364,711 | | | 392,747 | |
| 投資活動提供の現金純額 | 193,034 | | | 90,023 | | | (16,812) | |
| 資金調達活動のキャッシュフロー: | | | | | |
| 株式オプション行使時の普通株の発行 | 9,440 | | | 2,110 | | | 7,927 | |
| 要約費用を支払う | (373) | | | — | | | — | |
| 融資リース元金支払い | (19) | | | — | | | — | |
| 非持株権益の出資 | — | | | — | | | 25 | |
| | | | | |
| 融資活動が提供する現金純額 | 9,048 | | | 2,110 | | | 7,952 | |
| 現金および現金等価物と制限現金純増加(マイナス) | 65,349 | | | (27,550) | | | (79,529) | |
| 現金および現金等価物と制限現金、年明け | 95,717 | | | 123,267 | | | 202,796 | |
| 現金および現金等価物と制限された現金、年末 | $ | 161,066 | | | $ | 95,717 | | | $ | 123,267 | |
| | | | | |
| キャッシュフローと非現金情報の追加開示 | | | | | |
| 所得税の現金を納める | $ | 2,828 | | | $ | 787 | | | $ | 448 | |
| 非現金投資·融資活動の追加開示 | | | | | |
| | | | | |
| 売掛金の中で財産と設備を購入する | 192 | | | 169 | | | 705 | |
| 負債中の財産と設備購入を計算しなければならない | 457 | | | 293 | | | — | |
| 使用権資産の取得--経営リース、応急処置 | 514 | | | 1,513 | | | — | |
| 使用権資産を取得する--経営リース | 15,085 | | | 34,763 | | | 71,054 | |
| 賃貸負債の購入--レンタルを経営する | 15,085 | | | 34,430 | | | 71,054 | |
| 賃貸負債と引き換えに使用権資産を取得する−融資リース | 279 | | | — | | | — | |
| | | | | |
| | | | | |
連結財務諸表の付記を参照。
シュレーディンガーInc.そして付属会社
連結財務諸表付記
2023年12月31日まで、2022年12月31日、2021年12月31日までの年度
(千単位で、1株当たりおよび1株当たりの額および付記3(C)は含まれていない)
(1) 業務説明
シュレーディンガー社(“当社”)は物理に基づく差別化計算プラットフォームを開発し、伝統的な方法と比べ、このプラットフォームはもっと速く、より低コストで薬物開発と材料応用のための高品質、新型分子を発見することができる。同社のソフトウェアプラットフォームは、世界各地のバイオ製薬と工業会社、学術機関、政府実験室の許可を得た。同社はまた,その計算プラットフォームを応用し,有力なバイオ製薬会社と協力し,広範な薬物発見計画を進めている。また,同社はその計算プラットフォームを用いてその特許薬物発見計画のパイプラインに新たな分子を発見し,臨床前と臨床開発によりこれらの計画を進めている。
(2) 重大会計政策
(a) 未採用会計公告
2023年11月、財務会計基準委員会(FASB)は会計基準更新(ASU)第2023-07号を発表した細分化市場報告(話題280)-報告できる部門が開示した改善はこれは主に重要な部門の費用の開示を強化することによって、報告可能な部門の開示要求を改善する。本基準は,2023年12月15日以降の年次期間と2024年12月15日以降の年次期間内の移行期間に適用し,早期採用を許可する。当社はまだASU 2023−07を採用しておらず,ASU 2023−07を用いた総合財務諸表への影響を評価している。
FASBは2023年12月にASU 2023-09を発表しました所得税(話題740)-所得税開示を改善するそれは、公共商業エンティティが税率調整において特定のカテゴリを開示し、量子化しきい値に適合する項目により多くの情報を提供することを要求する。本基準は,2024年12月15日以降の年次期間と2025年12月15日以降の年度期間の中期に適用され,早期採用が許可されている。同社はまだASU 2023-09を採用しておらず、ASU 2023-09を採用した総合財務諸表への影響を評価している。
(b) 予算の列報と使用根拠
米国公認会計原則(“米国公認会計原則”)に基づいて財務諸表を作成し、報告期間内の資産及び負債の報告金額、合併財務諸表の日付又は有資産及び負債の開示及び報告期間中の収入及び費用に影響を与えるように管理層に推定及び仮定を要求する。重大推定数には,収入を分配する際に用いる仮定と,連携協定が規定する履行義務を達成する進捗状況に関する推定数が含まれる.実際の結果はこれらの見積もりとは異なる可能性があり、このような違いは連結財務諸表に大きな影響を与える可能性がある。
(c) 合併原則
同社の総合財務諸表はシュレーディンガー社、その完全子会社及び可変利息実体の勘定を含む。すべての会社間の残高と取引はすでに合併中に販売されている。外国実体の機能通貨はドルである。当社はそれに重大な影響を与えるが持株権を持たない投資は、権益法を用いて計算する。
(d) 現金および現金等価物、有価証券および限定現金
現金および現金等価物は現金等価物#ドルを含む85,497そして$78,0662023年12月31日まで、2023年12月31日と2022年12月31日まで、それぞれ通貨市場基金と預金証書からなり、コスト別に報告し、時価に近い。同社はすべての元の期限が90日以上の高流動性投資を分類している
現金等価物ではありません同社は固定収益証券からなるすべての有価証券を販売可能な証券に分類している。
金融機関が保有する現金残高は連邦預金保険会社の保険限度額を超えることがあるが、同社は主に高信用品質の金融機関に現金を保管している。
限定現金は、会社金融機関が保有する融資リースに関する信用状を含み、関連信用状の満期日に基づいて会社貸借対照表において流動現金として分類される。また、ある贈与から受け取った資金は用途が制限されているため、制限された現金に分類される。
(e) 売掛金
売掛金は元の領収書金額から不良債権を差し引いて列報を用意する.経営陣は、個別顧客の売掛金を評価し、顧客の財務状況、信用記録、現在の経済状況を考慮することで不良債権準備を推定する。満期日までに支払いを受けていない場合、口座残高は延滞していると考えられる。売掛金は回収できないと思われた場合は返金します。以前に査定された売掛金は受け取った時に記録されています。2023年12月31日と2022年12月31日現在、回収できないとされている口座残高の変化は取るに足らないとされている。売掛金は利息を取りません。
(f) 金融商品の公正価値
現金および現金等価物,売掛金,売掛金および売掛金の帳簿価値は満期日が短いため公正価値に近い。
(g) 財産と設備
財産と設備はコストに応じて列記する.“会社”ができた注釈2023年から2022年までのどのような興味も利用します。維持費と修理費は発生時に計上される。
減価償却は資産の推定耐用年数内に直線法で計算され、その範囲は3至れり尽くせり10何年もです。リース改善償却は、賃貸残期限または資産使用年数(短い者を基準)に直線法で計算する。
以下に述べる長期資産減価会計項の下で述べたように、財産と設備の減価審査を行う。
(h) 商誉
営業権とは、純資産の購入価格がその公正な価値を超える部分を買収し、単独で確認できない無形資産に割り当てることができないことである。他の識別可能な無形資産が契約または他の法的権利によって取得された場合、または無形資産が売却、譲渡、許可、または交換することができる場合、無形資産は個別に確認される。
営業権は償却されないが、少なくとも毎年減値テストを行い、イベントや状況が帳簿価値が公正な価値を超える可能性が高いことを示す場合、より頻繁に減値テストを行う。当社はその減価商誉を定性的または定量的に評価する権利がある。
同社は毎年10月1日に営業権減価テストを行っている。2023年、同社は定性方法を用いてその名声を評価した。定性要素が公正価値が帳簿価値を超える可能性が高いことを確定すれば、商業権は損害を受けない。定性的評価により、公正価値が帳簿価値よりも帳簿価値よりも低い可能性があると判断された場合、当社はさらに潜在的減値を評価する。当社は2023年12月31日までの年間営業権に欠陥はないと考えています。
(i) 長期資産減価の会計処理
長期資産,たとえば物件や設備や償却すべき無形資産は,事件や状況変化が発生してある資産の帳簿金額が回収できない可能性があることを示す場合には,減値について審査を行う.もし状況が長期資産または資産グループに対して潜在的な減値テストを行う必要がある場合、当社はまずその資産または資産グループが予想する未割引キャッシュフローをその帳簿価値と比較する。長期資産や資産グループの帳票価値が未割引キャッシュフロー法で回収できなければ,帳票価値が公正価値を超えた範囲で減値を確認する.公正な価値は様々な推定値を使用して決定される
技術は、割引キャッシュフローモデル、オファー市場価値、および第三者独立評価を含み、資産の性質に依存する。違います。2023年12月31日まで,2022年と2021年12月31日までの年度の減値を確認した。
(j) 保証付き
同社は通常、その製品が30日以内に顧客に提供される製品仕様と一致するように動作することを保証している。歴史的に、その会社はこのような義務に基づいてお金を支払うことを要求されなかった。したがって、連結財務諸表にはこのような債務の負債が記載されていない。
(k) 濃度.濃度
会社を集中的な信用リスクに直面させる可能性のある金融商品には、主に貿易売掛金と契約資産が含まれており、これらの資産は契約未開勘定書の売掛金を代表する。
当社は売掛金を支援するために顧客に担保を要求しません。必要であれば,信用を発行する前に重要な新規顧客の信用審査を行うことができる.顧客の支払い能力を決定するには判断が必要であり、顧客から受け取ることができないことは、収入、キャッシュフロー、運営結果に悪影響を及ぼす可能性がある。
2023年12月31日現在、2社の顧客占有率15%和11それぞれ売掛金総額の%を占めている。2022年12月31日までに、ある顧客が26売掛金総額のパーセントを占める。2023年12月31日現在、2社の顧客占有率42%和22契約総資産の%を占めています。2022年12月31日現在、2社の顧客占有率23%和17契約総資産の%を占めています。2023年12月31日までの年間で、2人のお客様がいらっしゃいます26%和11それぞれ総収入の%を占めている。2022年12月31日までの年間で、顧客が1人を占めています16総収入の%を占める。2021年12月31日までの1年間で、1人の顧客の収入が14総収入の%を占める。
(l) 印税
印税は収入コストの構成要素であり、当社のソフトウェアまたはそれを束ねた知的財産権所有者に支払う印税からなる。一般に、特許権使用料は、顧客が拘束力のある購入契約を締結する際に生成され、記録されるが、一部の特許権使用料協定は現金に基づいて徴収される。特許使用料は$13,349, $9,191そして、そして9,8262023年12月31日まで、2022年12月31日、2021年12月31日までの年度。
(m) ソフトウェア開発コスト
新ソフトウェア製品の開発と既存ソフトウェア製品の重大な改善のコストは発生時に費用を計上する。歴史的に見ると、同社はソフトウェア開発コストを資本化していない。ソフトウェア開発過程は基本的に技術の実行可能性を確定しながら完成しているからである。
(n) 研究と開発と広告
研究開発と広告コストは発生時に費用を計上する。同社は2023年、2022年、2021年に重大な広告費用を発生させていない。
(o) 株に基づく報酬
当社は公正価値に基づく方法で株式に基づく報酬支出を計算し、このような奨励帰属期間の支出を確認した。業績に基づく限定的な株式単位については、当社は業績条件が実現可能と考えられた場合に株式による報酬支出を累積的に記録し、業績基準に達することが期待される残りの期間を直線的に記録する。
(p) 手数料
手数料は販売とマーケティング費用の構成要素であり、会社の販売代表に支払われる可変報酬からなる。一般に,販売手数料は,顧客が拘束力のある購入契約を締結したときに稼いで費用として記録される.販売代表に支払われる手数料は、販売注文に関するいかなる請求書費用からも会社が受け取ることができない場合にのみ回収できます。手数料支出は$1,636, $2,291、と$1,829それぞれ2023年、2022年、2021年に。
(q) 所得税
当社は、財務諸表の帳簿金額と資産及び負債の課税基礎との一時的な差異による予想される将来の税務結果について、繰延税金資産及び負債を記録する。一部の繰延税金資産がさらに現金化できない可能性があると推定された場合、繰延税金項目資産減計の推定値が準備される。そこで、当社は現在、既存の繰延税項純資産について全額評価を維持するために準備しています。
所得税頭寸が“もっと可能性がある”とされ続けている場合にのみ、会社はこれらの頭寸の影響を確認する。税額割引が確認されていない場合は、利息と罰金を連結財務諸表の所得税支出に計上しなければなりません。
(r) 総合収益(赤字)
総合収益(損失)には,純収益(損失)と有価証券未実現収益や損失変化に関する権益変動がある。
(s) 株式投資
通常の業務過程において、当社は、同社等の株式と交換するために、同社と協力協定を締結し、同社等に薬物設計サービスを提供することが可能となっている。当社が被投資先に対して支配権を持っていることが確定した場合、被投資先は財務諸表に統合される。投資先が当社と合併され、かつ当社が所有する持分が100%未満である場合、当社は、他の投資家が所有する被投資先部分を代表する非持株権益を提出する。当社が被投資者に対して支配権がないと判断した場合、当社はその投資に重大な影響を与える能力があるかどうかを評価します。
会社に重大な影響を与える株式投資は権益法で計算することができる会計基準編纂(“ASC”)主題323によると、権益法と合弁企業それは.当社が被投資者に大きな影響を与えず、かつ投資がいつでも確定できる公正価値がないことが確定した場合、株式投資はコストを差し引いた減値で入金することができるASCトピック321(“トピック321”)によれば、株式証券.
会社の持分投資に関するより多くの情報を知るためには、付記6、公正価値計量と付記13、株式投資を参照してください。
(t) 普通株と有限責任普通株株主の1株当たり純収益(損失)
会社の流通株には普通株と有限普通株が含まれています。会社の会社登録証明書によれば、普通株式及び有限普通株式所有者の権利は、投票権及び転換権を除いて同じである。限られた普通株式の保有者は、いかなる役員選挙または取締役罷免の際に投票してはならない。有限普通株は株主の選択に応じて随時普通株に変換することができる。
参加証券に割り当てられた未分配収益は、普通株と有限普通株株主が純収益(損失)を占めるべきであることを決定した場合に純収益から減算する。1株当たりの基本純収入(損失)の計算方法は、普通株と有限普通株株主が純収益(損失)を当期発行普通株と有限普通株で割った加重平均である。
希釈純収入を計算する際には、普通株と有限普通株株主が基本純収入を占めるべき純収入は希釈性証券の影響によって調整され、会社の持分下の奨励を含む
補償計画。普通株と有限普通株株主が1株当たりの純収入を占めるべき計算方法は、普通株と有限普通株株主は純収益を普通株と有限普通株既発行株の完全償却を除いた加重平均を占めるべきである。
(3) 収入確認
収入は、約束された製品またはサービスの制御権を顧客に譲渡する際に確認され、金額は、約束された商品またはサービスと交換するために、会社が獲得する権利があると期待されている対価格を反映している。会社の業績義務は時間の経過やある時点で履行されており、これは異なる収入確認パターンを招く可能性がある。
次の表は、同社の収入確認モードのスケジュールを説明した
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| ソフトウェア製品とサービス-時点 | 49.1 | % | | 47.3 | % | | 55.5 | % |
| ソフトウェア製品とサービス-時間が経つにつれて | 24.3 | | | 27.6 | | | 26.6 | |
| 薬物発見-時点 | 12.7 | | | 8.8 | | | 3.3 | |
| 薬の発見は時間とともに | 13.9 | | | 16.3 | | | 14.6 | |
(A)ソフトウェア製品およびサービスのサポート
同社が締結した契約には、ライセンス、製品、およびサービスの様々な組み合わせが含まれていてもよく、その中のいくつかは、単独の履行義務として入金されている。複数の契約義務がある契約については、当社は相対独立販売価格(“SSP”)に従って契約の取引価格を履行義務ごとに割り当てる。収入は顧客から受け取った任意の販売税と付加価値税を差し引いて政府当局に送金されることが確認された。
同社のソフトウェア業務収入は、(I)内部ソフトウェア許可料、(Ii)ホストソフトウェア購読費、(Iii)ソフトウェア保守費、(Iv)専門サービス料、および(V)入金の5つのソースから来ている。
ソフトウェアを内部配備する同社の内部ソフトウェア許可スケジュールは、通常、その内部サーバまたはクラウドインスタンス上でそのソフトウェアを使用する顧客に特定の期限内にそのソフトウェアを使用する権利を与える1年近年、同社は数年間の大型ローカルソフトウェアライセンス契約を少量締結しているにもかかわらず。ライセンス制御権移転時においても,プロトコル発効日(遅い日を基準とする)においても,企業はローカルソフトウェアライセンス料の収入をあらかじめ確認しておく.交付時間と領収書発行時間が異なる場合、会社は重要な融資部分が存在するかどうかを考慮する。 当社は実際の便宜策を選択しており、期限が1年未満の場合は、重大な融資を評価しない。会社の更新とアップグレードはソフトウェアライセンスの効用を維持するために不可欠なものではない。支払いは通常事前に受け取ったものや毎年受け取ったものだ。
ホスティングソフト。ホストソフトウェア収入は、主に、会社の顧客にホスト許可を提供する費用を含み、これは、これらの顧客が、許可を制御することなく、自分のハードウェア上で会社のクラウドベースのソフトウェア解決策にアクセスすることを可能にし、契約期間内に比例して確認され、契約期間は通常1年であるが、近年、会社は少量の長年の大型ホストソフトウェア許可プロトコルを締結しているにもかかわらず、少ない数年間の大型ホストソフトウェア許可プロトコルを締結している。顧客が経時的に確認された信託手配を達成した場合、今期確認されなかった前払い額は、その期間が確認されるまで、会社の財務諸表中の繰延収入に計上される。
ソフトウェアメンテナンス. ソフトウェアメンテナンスには、社内ソフトウェアライセンスに関する技術的サポート、更新、アップグレードが含まれています。ソフトウェア保守収入はプロトコル期限内に比例して確認するソフトウェア保守活動は社内ソフトウェアの使用に関連しており,時間帯によって変化する可能性がある.
専門サービス. 専門サービスには、トレーニング、技術設定、インストール、または顧客のモデリングサービスの提供支援、会社はそのソフトウェアを使用して会社の顧客を代表して仮想スクリーニングなどのタスクを実行します。これらのサービスは通常,会社のソフトウェアのコア機能に関係なく,資源消費時に収入として確認される.各専門サービスプロトコルは独特な一時的な約束を代表するため、専門サービス収入は異なる時期に変動する可能性がある。
ソフトウェアが収入に貢献するソフトウェア貢献収入には、ゲイツベンチャーとの非互恵協定に基づいて受け取った資金が含まれています最初は2020年6月に締結され、2026年8月にさらに延長されたそれは.その協定は無条件で制限されない非交換貢献だ。収入が確認された毎年2020年6月から2022年6月まで、2023年8月に合意を延長する際には、領収書を発行する際には、ASCテーマ958によると、非営利団体なぜならこの合意は交換取引ではないからだ。
Gates Ventures,LLCとの協定は最初に2020年6月23日から2023年6月22日までをカバーしており,総対価は最高$に達する3,000それは.同社が確認した収入は#ドル1,000契約締結時に$と1,000協定1周年と2周年の際に。この協定は、2023年9月30日までの間、2026年8月13日まで延長され、総追加価格は最高$に達することが規定されている6,000それは.同社が確認した収入は#ドル1,800合意が延期された時。2023年12月31日までに会社は違います。この合意に関連した繰延収入残高。2023年、2023年、2022年12月31日まで、会社は違います。本契約に関連する売掛金。
次の表にソフトウェア製品とサービス収入源から確認された収入を示します
| | | | | | | | | | | | | | | | | |
| | 2013年12月31日までの年度 |
| | 2023 | | 2022 | | 2021 |
| 内部配備ソフトウェア | $ | 104,511 | | | $ | 84,487 | | | $ | 74,598 | |
| ホスティングソフト | 20,381 | | | 14,890 | | | 11,076 | |
| ソフトウェアメンテナンス | 23,066 | | | 19,996 | | | 17,294 | |
| 専門サービス | 9,366 | | | 15,205 | | | 9,268 | |
| 取引先と契約した収入 | 157,324 | | | 134,578 | | | 112,236 | |
| ソフトウェア貢献 | 1,800 | | | 1,000 | | | 1,000 | |
| ソフトウェア総収入 | $ | 159,124 | | | $ | 135,578 | | | $ | 113,236 | |
(B)薬物発見の支援
薬物発見サービスです薬物発見および協働サービス契約の収入は、時間とともにまたはある時点で確認され、通常は、発生したコストを使用して、進行時間数を測定することによって、またはマイルストーンの実現によって確認される。サービス支払いは、通常、契約開始時、契約に規定されたマイルストーンを実現する際、または資源を消費する際に前払いされる。サービスには可変対価格が含まれる場合があり、会社は可能金額法を用いて可変対価格の金額を推定している。同社はケースベースでマイルストーンを評価し、会社のコントロール以外の要素が収入の大幅な逆転を招く可能性があるかどうか、潜在的な逆転の可能性と程度を含む。マイルストーンを実現する可能性があると考えられない場合、それが実現する可能性があるまで、会社は可変対価格を制限(減少)してマイルストーン支払いを排除する。可変価格の制限を除去した後、ある時点で、または時間とともに、顧客との契約からの収入(“主題606”)からのASCトピック606の割り当て指示を適用することによって、収入を確認することができる。
2023年12月31日現在,2023年,2022年,2021年までに実現可能と決定された未実現のマイルストーン総額は$である350, $4,000、と$2,250、と$350, $3,939、と$2,250このうち,これらのマイルストーンはそれぞれ2023年12月31日,2022年,2021年12月31日までの年間収入として確認されている。
薬物発見貢献収入. 薬効.薬効発見寄付収入には、ビルとメリンダ·ゲイツ財団との合意に基づいて費用返済に基づいて受け取った資金が含まれており、女性の健康薬の発見を加速させるためのサービスを提供する。最初の合意は2021年11月、2023年9月に満了した。同社は2023年9月、ビルとメリンダ·ゲイツ財団と新たな協定を締結し、2025年10月に満了する女性の健康薬発見を加速させるためのサービスを提供する。収入はASCトピック958の条件を満たしたときに確認された非営利団体. 会社は、2023年12月31日、2023年12月31日、2022年12月31日まで、これらの合意に関連した収入残高を1ドル延期している1,581そして$1,718それぞれ,である.
次の表に薬物発見収入源から確認された収入を示します
| | | | | | | | | | | | | | | | | |
| | 2013年12月31日までの年度 |
| | 2023 | | 2022 | | 2021 |
| 薬物発見サービス収入はお客様との契約からです | $ | 54,720 | | | $ | 43,427 | | | $ | 24,584 | |
| 薬物発見貢献 | 2,822 | | | 1,950 | | | 111 | |
| 薬物発見総収入 | $ | 57,542 | | | $ | 45,377 | | | $ | 24,695 | |
(C)国際協力·許可協定への署名
2020年11月22日、同社は百時美施貴宝会社(“百時美施貴宝”、“百時美施貴宝”と略称する)と独占的な全世界協力と許可協定を締結し、同協定に基づき、会社と百時美施貴宝は協力して発見、研究と臨床前に新しい小分子化合物を開発し、腫瘍学、神経学と免疫治療領域の疾病適応に応用することに同意した。この協定によると、同社は最初に小分子化合物の発見、費用と費用を自負していたが、目的は5人双方が合意した個々の生物目標の研究計画に基づいて具体的な生物目標を決定した。最初のターゲットはHIF-2αとSOS 1/KRASであり二つ同社の独自の手続き。2021年11月、同社とBMSは共同で、HIF-2アルファ標的を別の正確な腫瘍学標的で置換することに同意した。交代選挙後、HIF-2アルファ目標計画のすべての権利が会社の手に戻った。2022年9月、BMSはさらなる開発を継続しないことを選択し、この計画のすべての権利が会社に回復し、会社がこの計画に関連する義務の達成を加速したため、2022年第3四半期に収入確認を増加させた。2022年12月,同社とBMSは協定を改訂し,神経学分野に目標を追加し,条項は最初の合意と類似していた。2023年9月、BMSは開発を継続しないことを決定した二つ関連する腫瘍学計画とこれらの計画のすべての権利が会社に回復し,会社がこれらの計画に関する義務の達成を加速したため,2023年第3四半期に収入確認が増加した。
会社が合意下の目標の指定基準を満たす開発候補を決定すると、BMSは独自にその開発候補のさらなる開発、製造、商業化、費用、費用を自負する。
改正された合意条項によると、BMSは会社に第1期費用#ドルを支払った55.02020年11月には100万ドル、2022年12月には追加前払いとなる。その会社には最高$を得る資格がある1.5現在連携の影響を受けている潜在的目標のマイルストーン支払い総額は10億ドルであり,a)最高で$を含む585.0腫瘍学的目標ごとのマイルストーン支払いは$を含む百万ドルです360.0特定の研究、開発、規制のマイルストーンを実現するための合計百万ドルです225.0特定のビジネスマイルストーンを実現するための合計百万ドルですb)最高で489.0それぞれの神経学的および免疫学的目標の記念碑的支払いは百万ドルです264.0特定の研究、開発、規制のマイルストーンを実現するための合計百万ドルです225.0特定のビジネスマイルストーンを実現するために合計100万ドルです2023年12月31日現在、会社はドルを確認しました25.0この協定によると、マイルストーンと関連した収入は100万ドルだ。
同社はまた、年間純売上高に対して中央値から1桁から2桁までの階層パーセント特許権使用料を徴収する権利があるが、ある特定の減額を遵守しなければならない。印税は、当該ライセンス製品の同国での最後の有効クレーム満了、当該ライセンス製品の同国でのすべての適用に関する規制排他的満了、及び当該ライセンス製品が同国で初めて商業販売されて10周年になるまで、BMSによって許可製品および国/地域によって支払われる。
同社は、主題606に基づいて連携および許可プロトコルを評価し、プロトコル構造に基づいて、BMSは顧客であると結論付けた。設立当初,会社は確定した1つは約束の履行義務
一人一人5人協定が最初にカバーしたプロジェクトは、各プロジェクトの研究活動と基礎知的財産権の許可付与を含む。当社は,知的財産権許可付与は研究活動と分離できないことを決定しており,研究活動はサービス期間中に許可付与を大幅に修正または増強する予定であるため,契約背景に違いはない。
同社は、協議開始時の取引価格は#ドルと確定した55.0百万ドルです。将来のマイルストーン支払いを実現する際に当社に支払う追加対価格は取引価格から除外されており、マイルストーン支払いであるため、設立日から可能とは考えられないため、収入逆転の重大なリスクは存在しない。
会社は出来高を$に割り当てた55.0履行義務ごとの推定SSPが決定した履行義務ごとの開始時のSSPは,履行義務ごとの1000万ユーロである.当社は,サービス提供コストの内部見積り(合理的利益率を含む)に基づいて,研究活動の契約開始時に推定されるSSPを決定する.研究活動を行うための総コストを決定するための重要な投入には,所要時間の長さ,サービスが予想される内部時間数,研究計画を達成するための各種研究の数と費用がある。
研究活動に関する収入は,研究活動のサービス期間に比例業績で確認し,投入に基づく研究総コスト計測を用いて行った割合を推定した。各報告期間の終わりに完了作業の進捗状況を再測定する。
会社は2023年12月31日、2022年12月31日、2021年12月31日までの年間で確認した43.2百万、$22.1百万ドルと$13.7展開された研究活動と実現のマイルストーンにより,それぞれプロトコルに関する収入は100万ドルであった.2023年12月31日と2022年12月31日までに7.3百万ドルとドル25.5プロトコルに関連する繰延収入は、統合貸借対照表においてサービスが提供されると予想される期間に基づいて流動または非流動収入に分類される。いくつありますか違います。2023年12月31日現在、この協力の未払い売掛金。
(D)重大な判決の審査
特別テーマ606項の下で重要な判断と推定が必要である。いくつかの契約の複雑さのために、主題606に応じて会社の手配に要求される実際の収入確認処理は、契約特定の条項に依存する可能性があり、場合によっては異なる可能性がある。
同社と顧客との契約には、一般に、トレーニング、専門サービス、技術支援サービス、および指定されていない更新権を含む様々なソフトウェア製品およびサービスの譲渡を承諾することが含まれる。許可証とサービスが異なる履行義務であるか、単独で計算すべきか、異なるかを決定するため、一緒に計算すべきであり、これには重大な判断が必要である。いくつかのスケジュールでは、例えば、会社のほとんどは期限ベースのソフトウェア許可スケジュールであり、会社は、ライセンスと関連サービスとは互いに異なると結論している。他のスケジュールでは、協調サービススケジュールを含み、ライセンスおよびいくつかのサービスは、互いに異なる可能性がある。同社の時間ベースのソフトウェア配置は、複数のソフトウェアライセンスと、許可されたソフトウェア製品を更新またはアップグレードする権利と、技術的サポートとを含むことができる。当社の結論は、このような約束された貨物とサービスは単独で、異なる履行義務である。
会社は顧客と締結した契約から予想される総対価格を推定しなければならない。協力手配については、会社はマイルストーン支払いの形で可変対価格を得る資格があり、マイルストーンが実現可能とされているかどうかを評価する判断が必要だ。重大な収入逆転が生じない可能性があれば、制限を取り消し、契約要求と歴史的経験に基づく可能性のある金額法を用いて関連マイルストーンの価値を推定取引価格に計上する。推定された取引価格が確定すると,確定した履行義務に金額を割り当てる.主題606の割り当て目標に一致する相対SSPに基づいて、取引価格は、個々の履行義務毎に割り当てられる。
それぞれの義務履行SSPを決定するために判断する必要がある.同社は製品を単独でライセンスしたり販売したりすることが少ないため、契約義務ごとのSSP範囲を推定することを求めている。企業が単独販売許可証、製品またはサービスを持っていないため、SSPを直接観察できない場合、会社は、履歴割引手法、市場状況、コスト加算分析、および他の観察可能な入力を含む情報を使用してSSPを決定する。同社には通常複数のSSPが使用されている
これらの項目を販売量,顧客種別,その他の状況に応じて階層化することによる個人履行義務である。これらの場合、会社は、顧客規模や地理的領域等の情報を用いてSSPを決定することができる。専門サービス収入確認は発生コストと工数であり,項目状態や発生コストやかかる工数を見積もる際に判断する必要がある.
プロトコルのセットが、それらが実際に単一のスケジュールの一部であるように、互いに密接に関係している場合、収入確認の場合、そのようなプロトコルは、スケジュールとみなされる。当社は、関連事実及び状況を評価し、当該等の独立合意が分離すべきか否か又は実質的に単一手配として入金すべきか否かを決定するための重大な判断を行使する。当社は、1組の契約に単一手配が含まれているか否かの判断が、異なる履行義務に対する対価格配分に影響を与える可能性があり、関連期間の経営結果に影響を与える可能性がある。
研究活動を行う総コストを決定するためには,所要時間長,サービスが予想される内部時間数,第三者が研究計画を達成するために可能な様々な研究の数とコストが含まれていると判断する必要がある。
一般的に、当社はお客様に顕著な返金や払い戻しを提供していません。
会社の収入確認に関する見積もりには重大な判断が必要かもしれませんが、これらの見積もりの変化は会社の関連時期の経営業績に影響を与える可能性があります。
(E)ドルの契約残高
収入確認の時間は、顧客に請求書を発行する時間とは異なる可能性があり、これらの時間差は、連結貸借対照表上の売掛金、契約資産、または契約負債(繰延収入)をもたらす。収入が開票前に確認された場合、会社は契約資産を記録する。開票後に収入が確認されることが予想される場合は、繰延収入負債を記録しなければならない。会社の時間ベースのソフトウェアプロトコルでは、顧客は通常、期限全体の手配開始時に領収書を発行しますが、期限が数年を越えた場合、顧客は年ごとに領収書を発行する可能性があります。いくつかの薬物発見協定について、マイルストーンが実現する前の一定期間に発生する可能性があると考えられた場合、会社はマイルストーンの全価値で契約資産を記録する。
契約資産は、合併貸借対照表内の未入金およびその他の入金に含まれ、会社が顧客に請求書を発行する際に入金に移行する。
契約残高は以下の通り
| | | | | | | | | | | |
| | 自分から 十二月三十一日
2023 | | 自分から 十二月三十一日
2022 |
| 契約資産 | $ | 21,107 | | | $ | 11,378 | |
| 繰延収入短期: | | | |
| ソフトウェア製品とサービス | 44,218 | | | 37,085 | |
| 薬物発見 | 12,013 | | | 20,846 | |
| 繰延収入、長期: | | | |
| ソフトウェア製品とサービス | 2,407 | | | 2,526 | |
| 薬物発見 | 6,636 | | | 23,072 | |
当社は2023年、2023年および2022年12月31日までに年度を確認します64,120そして$60,039前の数期間末にそれぞれ繰延収入の収入を計上します。上述したように、他のすべての繰延収入活動は、領収書の発行時間が収入のスケジュールに関係しているためである。同社は収入約を確認する予定だ862023年12月31日の繰延収入残高の%は、次の12ヶ月以内に、残りの部分を延長する。また、顧客に請求書または繰延収入に含まれる契約が発行されていないが履行されていない履行義務は#ドルである36,3572023年12月31日まで。
支払い条項と条件は契約のタイプによって違います。条項は通常要求されていますが30至れり尽くせり60何日ですか。収入を確認する時間と領収書を発行する時間が異なる場合、会社はその契約には一般に重要な融資部分が含まれていないことが確認されている。領収書条項を発行する主な目的は、融資手配の便宜を提供するのではなく、顧客に会社の製品やサービスの購入の簡略化と予測可能な方法を提供することである。
(F)繰延販売手数料を廃止する
当社は販売手数料費用に対して実際の便宜的な計を採用しており、契約を得るために販売代表に支払ういかなる物質補償も1年以下の期限に関連している。その会社はまだ販売手数料に関する費用を資本化していない。
(4) 財産と設備
財産と設備は:
| | | | | | | | | | | |
| 2013年12月31日まで |
| 2023 | | 2022 |
| コンピュータと装置 | $ | 22,122 | | | $ | 20,387 | |
| 賃借権改善 | 3,787 | | | 2,229 | |
| 家具と固定装置 | 6,230 | | | 5,665 | |
| 実験室装置 | 8,757 | | | 76 | |
| 使用権--資産融資リース | 579 | | | — | |
| 41,475 | | | 28,357 | |
| 減価償却累計を差し引く | (18,150) | | | (14,113) | |
| $ | 23,325 | | | $ | 14,244 | |
2023年、2022年、2021年の減価償却費用は$4,965, $3,831、と$2,847収入及び研究開発、販売及び市場普及のコスト、及び総合経営報告書内の一般及び行政支出をそれぞれ計上した。
(5) 業務買収
2022年1月14日、同社はXtal BioStructures,Inc.(“Xtal”)の全流通株を手元の現金で買収し、Xtalは生物物理的方法、タンパク質生産と精製、およびX線結晶学を含む構造生物学的サービスを提供する会社である。会計目的に応じた企業合併取引は、ASC 805で述べた買収方法を適用することに関連している企業合併(“主題805”)。現金で購入した価格は約$です7,429$も含まれています6,427前払い購入価格で、得られた現金を差し引く。Xtalに対する買収は同社が構造生物学領域の科学進歩を追求でき、その特許薬物発見計画のために高品質の目標構造を生産する能力を強化し、そしてその製品範囲を拡大し、先進的な差別化サービスを含み、顧客に計算検証された蛋白質構造を提供し、そして構造に基づく仮想スクリーニングと鉛最適化の準備を行い、獲得した名誉金額を支持する期待的なメリットをもたらす。
下表は、2022年1月14日までの買収日に同社が買収した資産と負担した負債の公正価値をまとめたものである。2022年6月30日までの3ヶ月間、テーマ805下の業務合併会計が最終的に今回の買収に決定し、2022年3月31日までの3ヶ月間の仮開示金額に変化はなかった同社はASU 2021-08号で提供されている2つの実用的な方便を使用することを選択した
顧客と締結した契約による契約資産と契約負債を推定することは、連結財務諸表に実質的な影響を与えない。
| | | | | |
| 現金 | $ | 1,002 | |
| 売掛金 | 588 | |
| その他流動資産 | 95 | |
| 財産·工場·設備 | 297 | |
| 無形資産 | 1,100 | |
| 商誉 | 4,791 | |
| 買収した総資産 | 7,873 | |
| 流動負債 | 209 | |
| 繰延税金負債 | 235 | |
| 負担総負債 | 444 | |
| 取得した純資産 | $ | 7,429 | |
次の表は,2022年1月14日までの買収日までの識別可能無形資産の購入価格配分とその推定使用寿命をまとめたものである。2023年12月31日現在、すべての無形資産はすべて償却されている
| | | | | | | | | | | |
| 金額 | | 使用寿命
(年) |
| たまっている | $ | 270 | | | 1 |
| 取引先関係 | 710 | | | 5 |
| 商号·商標 | 120 | | | 1 |
| $ | 1,100 | | | |
2022年1月14日までの買い取り日に開始されたXtal運営結果は、これらの連結財務諸表に含まれている。2022年12月31日までの財政年度では、Xtalの収入と純収入は連結財務諸表全体にとって重要ではない。当社が同社等の総合財務諸表に提出している期間の予想経営業績は買収事項によって大きな差はないため、このような資料は記載されていない。Xtal買収によるコストは重要ではなく,全額支出され,総合業務報告書に一般的かつ行政費用が計上されている。無形資産の償却は#ドルです587そして$5132023年12月31日と2022年12月31日までの一般·行政費。
(6) 公正価値計量
会社の金融資産と負債の公正価値を決定する際には様々な投入が使用されている。これらの投入は以下の3つに要約できる
レベル1-アクティブ市場における同じ証券の見積もり
第2級--その他の重要な観察可能な投入は、類似証券の見積、金利、信用リスクなどを含む。
第3級-重大な観察不可能な投入は、会社が公正な価値を決定する際の自分の仮説を含む
証券の評価のための投入や方法は、必ずしもこれらの証券への投資に関連するリスクを示すとは限らない。主に会社とアメリカ政府機関債券からなる有価証券は販売可能に分類され、2023年12月31日、2023年と2022年12月31日まで、公正価値と帳簿価値に有意差はなかった以下の表には、2023年12月31日までに、同社が公正価値で計測した資産情報を示す
| | | | | | | | | | | | | | | | | | | | | | | |
| レベル1 | | レベル2 | | レベル3 | | 合計する |
| 資産: | | | | | | | |
| 現金および現金等価物および限定現金 | $ | 161,066 | | | $ | — | | | $ | — | | | $ | 161,066 | |
| 有価証券 | — | | | 307,688 | | | — | | | 307,688 | |
| 株式投資 | 79,623 | | | — | | | 1,928 | | | 81,551 | |
| 合計する | $ | 240,689 | | | $ | 307,688 | | | $ | 1,928 | | | $ | 550,305 | |
以下の表には、2022年12月31日までに、同社が公正価値で計測した資産情報を示す
| | | | | | | | | | | | | | | | | | | | | | | |
| レベル1 | | レベル2 | | レベル3 | | 合計する |
| 資産: | | | | | | | |
| 現金および現金等価物および限定現金 | $ | 95,717 | | | $ | — | | | $ | — | | | $ | 95,717 | |
| 有価証券 | — | | | 360,613 | | | — | | | 360,613 | |
| 株式投資 | 22,335 | | | — | | | 1,629 | | | 23,964 | |
| 合計する | $ | 118,052 | | | $ | 360,613 | | | $ | 1,629 | | | $ | 480,294 | |
以下の表は、同社の第3級投資の公正価値変化を示している
| | | | | |
| 金額 |
2021年12月31日まで | $ | 1,887 | |
| 現金寄付 | 600 | |
| 未実現損失 | (858) | |
2022年12月31日まで | 1,629 | |
| すでに収益を実現している | 147,213 | |
| 現金分配 | (147,213) | |
| レベル1に移行する | (1,629) | |
| 未実現収益 | 1,928 | |
2023年12月31日まで | $ | 1,928 | |
当社のNimbus Treateutics,LLC(“Nimbus”)への投資の公正価値は,公正価値レベルでは3段階に分類され,ASCテーマ323項目では権益法投資として記録されている投資- 権益法と合弁企業は仮想清算帳簿価値法(“HLBV法”)を用いて2023年6月30日まで、付記13のように、株式投資にさらに記載されている。HLBV法の下でNimbus公正価値を決定するための重大な観察不可能な入力は,このエンティティの年次財務諸表と当社の清算優先事項である。2023年12月31日までに、当社は収益$を記録しました147,213武田によるNimbusの完全子会社Nimbus Lakshmi,Inc.及びそのチロシンキナーゼ2阻害剤NDI−034858の買収により,武田はNimbusの持分を保有している。2023年2月13日、同社はドルを受け取ったと報告した111,328販売に関するNimbusの現金分配。2023年4月6日、同社はドルを受け取ったと報告した35,789販売に関するNimbusの現金分配。2023年11月9日、同社はドルを受け取ったと報告した96販売に関するNimbusの現金分配。2023年12月31日までの年間で,第3級投資の実現収益はNimbusのこれらの現金分配に関係している。2023年9月30日までの3ヶ月間、会社のNimbusへの投資が希釈された後、会社投資の公正価値はASC科目321項目に記録されている 非流通株証券として、当社はNimbusに大きな影響を与えなくなった。この会計方法の変化は未達成収益#ドルを招いた1,928.
2023年3月31日までの3ヶ月間に会社は$を記録しました1,629構造治療会社の初公募株の完成により、構造治療会社への投資は3級投資から1級投資に変更された。会社の構造治療会社への投資は以前はHLBV法で記録されていた。構造治療会社の初公募が完了した後、構造治療会社への投資記録はテーマ321に記録されており、投資には観察可能な価格が存在するためである.2022年12月31日までの年次では、1級、2級、3級投資の間に移転はなかった。
当社の株式投資が価値変動を公平にすることによる未実現損益は、総合経営報告書の公正価値変動に分類される。当社の持分投資当収分配による実現済み収益は、総合経営報告書において持分投資収益に分類される。
会社の持分投資に関するより多くの情報を知るためには、付記13、株式投資を参照してください。
(7) 引受金とその他の事項
(A)新しいリース契約に署名する
同社には複数のオフィススペースの運営リースと1つの設備の融資リースがあり、これらのテナントは2037年まで異なる日に満期となる。会社はASCテーマ842の移行指導の下で実用的な方便案を選択した賃貸借証書短期賃貸を貸借対照表から除外し、リースと非リース構成要素とを統合する。当社は、融資リース使用権を財産と設備資産項目に分類し、融資短期·長期賃貸負債を他の計算すべき負債と他の長期負債項目に分類する。
リース開始時に、当社は、レンタルであるか否か、運営又は融資リースに分類されるか否か、賃貸の延長又は終了の選択権を含むか否か、及び当社が当該等の選択権を行使することを合理的に決定する。リースコスト、すなわちリース期間内のリース支払いと任意の資本化可能な直接コストから受信した任意のインセンティブを減算し、レンタル期間内に直線原則でレンタル費用として確認する。
賃貸支払いの現在価値を定める際には、賃貸契約に隠されている金利を簡単に決定することができず、当社はレンタル開始日に得られた資料に基づいて、逓増借款金利を採用します。新規借款を締結する際には、当社はその現行の借入金利で分析を行い、その逓増借款金利を決定し、様々な要因(担保程度や借入期間を含む)に応じて調整する。2023年12月31日現在、経営性と融資性賃貸の残り加重平均レンタル期間は12何年もです。
2023年12月31日までに、運営リース使用権(“ROU”)資産が増加$15,173記帳を始めたので5人新規賃貸借契約と増加$4,388オフィスビルのレンタルに関する緊急決議案のせいで。同期、経営リース負債は#ドル増加した15,085新規契約に応じた会計が計上され始める。2023年12月31日までの年間で、融資リース使用権資産が増加しました$579融資リース負債は#ドル増加した279マサチューセッツ州フレミンガム研究所設備レンタルの会計が始まったからです
2023年12月31日までの年間では、会社運営や融資リースの可変·短期賃貸コストは重要ではない以下の表に、同社の経営と融資リースの詳細を示す
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| レンタル料 | $ | 16,769 | | | $ | 11,999 | | | $ | 7,627 | |
| レンタルのための現金 | 12,263 | | | 3,275 | | | 4,561 | |
2023年12月31日現在、取消不可経営リース項下の経営と融資リース負債満期日は以下の通りである
| | | | | |
12月31日までの年度: | |
| 2024 | $ | 17,537 | |
| 2025 | 17,595 | |
| 2026 | 17,280 | |
| 2027 | 16,097 | |
| 2028 | 14,984 | |
| その後… | 112,034 | |
| 将来の最低賃貸支払い総額 | 195,527 | |
| 差し引く:推定利息 | (67,377) | |
| 将来の最低レンタル支払いの現在価値 | 128,150 | |
| 差し引く:レンタル支払いの現在の部分 | (16,954) | |
| 長期賃貸負債 | $ | 111,196 | |
(B)すべての法律事項の処理
当社は通常業務中の定例訴訟に時々巻き込まれる可能性があります。このような訴訟の結果は正確には予測できないが、経営陣は、このような事件の最終結果が会社の財務状況、経営業績、あるいはキャッシュフローに重大な悪影響を与える可能性は低いと信じている。
(C)突発的事象の予防
同社は現在、特許使用料パートナーの監査を受けている。当社は2023年12月31日現在、意外な事態が発生する可能性があると考え、累計$を集計しています2,500今回の監査と関係があります。
(8) 所得税
所得税支出は以下の部分からなる
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| 現在: | | | | | |
| 連邦制 | $ | 727 | | | $ | (195) | | | $ | — | |
| 状態.状態 | 509 | | | (280) | | | 67 | |
| 外国.外国 | 963 | | | 538 | | | 344 | |
| 当期所得税支出 | 2,199 | | | 63 | | | 411 | |
| 延期: | | | | | |
| 連邦制 | — | | | — | | | — | |
| 状態.状態 | — | | | — | | | — | |
| 外国.外国 | — | | | — | | | — | |
| 所得税を繰延する | — | | | — | | | — | |
| 所得税費用 | $ | 2,199 | | | $ | 63 | | | $ | 411 | |
税務管区別の所得税前収入(赤字)は以下のように構成される
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| アメリカです | $ | 39,076 | | | $ | (150,147) | | | $ | (101,341) | |
| 外国.外国 | 3,843 | | | 1,021 | | | 1,359 | |
| 所得税前収入 | $ | 42,919 | | | $ | (149,126) | | | $ | (99,982) | |
適用される法定所得税率で計算される所得税費用と有効所得税率の入金は以下のとおりである
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| 法定連邦所得税率 | 21.0 | % | | 21.0 | % | | 21.0 | % |
| 連邦福祉を差し引いた州税 | 5.8 | | | 5.1 | | | 4.9 | |
| 第百六十六条の制限 | 1.2 | | | (1.1) | | | (5.2) | |
| 株の報酬 | 1.7 | | | 0.6 | | | 12.4 | |
| 戻り調整 | (3.3) | | | 0.2 | | | (1.7) | |
| 信用を研究開発する | (14.1) | | | 3.1 | | | 6.3 | |
| 税収または事項がある場合は,償却後の純額を差し引く | 1.4 | | | (0.3) | | | (0.7) | |
| 評価免除額を変更する | (4.4) | | | (28.6) | | | (37.2) | |
| 他にも | (4.2) | | | — | | | (0.2) | |
| 有効所得税率 | 5.1 | % | | — | % | | (0.4) | % |
2023年12月31日までの年間所得税支出は、私たちが業務を行っている外国司法管轄区の連邦と特定の州の所得税義務と税金を代表しています。2022年12月31日と2021年12月31日までの年間所得税支出は、特定の州での所得税義務と、事業を行う外国司法管区の税収を代表しています。会社は2023年12月31日現在、米国連邦と州繰延税金資産に対して全額推定手当を持っている。
2023年12月31日までの年間推定手当変動総額は$1,926これは主に資本化研究開発費と株式による報酬の一時的な差が原因だが、権益法投資の調整部分によって相殺されている。
繰延所得税資産と繰延所得税負債の一時的な差をもたらす税収の影響は以下のとおりである
| | | | | | | | | | | | | | | | | |
| 2013年12月31日まで |
| 2023 | | 2022 | | 2021 |
| 繰延所得税資産: | | | | | |
| 純営業損失が繰り越す | $ | 44,116 | | | $ | 67,758 | | | $ | 67,985 | |
| 資本化研究と開発 | 13,224 | | | 5,511 | | | — | |
| 費用を計算する | 71,676 | | | 43,362 | | | 10,309 | |
| 収入を繰り越す | 5,296 | | | 6,532 | | | 10,632 | |
| 賃貸負債 | 32,491 | | | 28,952 | | | 18,773 | |
| 単位 | 21,903 | | | 18,456 | | | 14,559 | |
| 繰延税項目総資産 | 188,706 | | | 170,571 | | | 122,258 | |
| 推定免税額を差し引く | (136,031) | | | (137,957) | | | (95,304) | |
| 繰延税項目純資産 | 52,675 | | | 32,614 | | | 26,954 | |
| 繰延所得税負債: | | | | | |
| 株式投資の未実現収益 | (18,553) | | | (4,439) | | | (8,545) | |
| 前払い費用 | (1,554) | | | (1,435) | | | (969) | |
| 減価償却および償却 | (32,568) | | | (26,740) | | | (17,440) | |
| 所得税純資産を繰延する | $ | — | | | $ | — | | | $ | — | |
2023年12月31日現在、会社の連邦と州の純営業損失(NOL)は$に転換している179,076そして$98,576それぞれ,である.使用しなければ、国のNOL繰り越しは2025年から2042年の間に満期になる。連邦NOL繰越はある年に発生する課税収入の80%に限られ、無期限繰り越しとなっている。2023年12月31日現在、会社は連邦と州の研究開発税収控除控除額を$としています23,336そして$1,598それぞれ,である.利用しなければ、これらの繰り越しは2024年から2043年の間に満期になる。
国内税法第382及び383節の規定によると、所有権変更の累計が50%を超えるため、適用されるテスト期間内にすでに発生又は発生する可能性のある所有権変更により、NOL及び他の税収属性の使用が大きく制限される可能性がある。同社は2023年12月31日までの分析を行い、所有権変更は2021年3月31日に発生したと確定した。この所有権変更は財務諸表に実質的な影響を与えない。
同社は海外業務の未分配収益の繰延税金負債を確認しておらず、同社はこれらの収益を無期限に再投資できると考えているからだ。
同社は総合経営報告書の中で、税収割引が確認されていない利息と罰金を所得税支出に分類している。以下は、税収割引総額が確認されていない入金である
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| 残高、1月1日 | $ | 2,142 | | | $ | 1,702 | | | $ | 1,046 | |
| 数年前に取得した税務頭寸の増加 | 89 | | | 35 | | | 282 | |
| 数年前の減税頭寸 | (4) | | | (24) | | | (20) | |
| 今年度に関連する税務職の増加 | 515 | | | 429 | | | 394 | |
残高、十二月三十一日 | $ | 2,742 | | | $ | 2,142 | | | $ | 1,702 | |
同社はその不確定な税務状況が今後12ヶ月以内に大きな増加や減少はないと予想している。
同社とその子会社はアメリカ連邦所得税申告書と各種州、地方、外国所得税申告書を提出した。2023年12月31日から、会社の訴訟時効法規はすべての連邦と州税収年度に適用されます
2020年12月31日までと2019年12月31日までの年度後にそれぞれ提出された申告書。すべての年度のNOLと貸記繰越は繰越当年使用後3年以内に検査と調整を行う必要がある。同社は現在、米国国税局や州政府の審査を受けていない。
(9) 株主権益
(A)普通株式を発行する
2023年12月31日まで、当社は許可しました500,000,000額面$の普通株0.01一株ずつです。普通株保有者には権利がある1つは取締役会が発表した場合、1株当たりの投票権で配当金を徴収し、清算又は解散時に株主に分配可能な資産の一部を徴収するが、自社の優先株保有者(ある場合)に不足している優先額の制限を受けなければならない。
普通株株主には優先引受権や他の引受権がなく、このような株式の償還や債務超過基金条項もない。普通株式保有者の権利、優先権、特権は、当社が将来指定·発行する可能性のある任意の一連の優先株の株式保有者の権利に支配され、その悪影響を受ける可能性がある。
(B)Limited普通株式
2023年12月31日まで、当社は許可しました100,000,000額面$の有限普通株0.01一株ずつです。有限普通株保有者には権利がある1つはしかし、限られた普通株式の保有者は、任意の役員選挙や取締役罷免時に投票する権利がない。取締役会が、有限普通株式保有者が配当金を取得する権利があると発表した場合、清算又は解散時には、株主に割り当てられた資産に部分的に使用する権利があるが、会社優先株式保有者に不足している金額を優先的に支払わなければならない。会社有限普通株保有者は1株当たりの有限普通株を転換する権利がある1つは会社の普通株のシェア。
有限普通株株主には優先引受権やその他の引受権はなく、このような株式の償還や債務超過基金に関する規定もない。有限普通株式保有者の権利、優先および特権は、当社が将来指定および発行可能な任意の系列優先株の株式保有者の権利に支配され、悪影響を受ける可能性がある。
(C)優先株増発
2023年12月31日まで、当社は許可しました10,000,000額面$の非指定優先株株0.01一株ずつです。会社の取締役会は、投票権、配当権、転換権、償還権、清算優先株を含む一連の優先株の権利、優先株、特権と制限を決定する権利がある.
(10) 株に基づく報酬
株式激励計画
2023年12月31日現在、会社の持分激励計画には、2010年株式激励計画(“2010年計画”)、2020年株式激励計画(“2020年計画”)、改訂された2021年株式激励計画(“2021年計画”)、2022年株式激励計画(“2022年計画”)(合わせて“計画”)が含まれている。
2022年計画では、従業員、取締役、コンサルタントまたはコンサルタントに奨励的株式オプション、非法定株式オプション、株式付加権、制限株式奨励、制限株式単位、その他の株式ベースの奨励、現金ベースの奨励を付与することが規定されている。2020年計画と2010年計画に基づいて付与された未償還奨励金の普通株式の満期、終了、または会社に他の方法で提出、解約、没収、または買い戻しされた普通株は、2022年計画に従って発行することができる。
2021年計画では、以前当社または役員従業員ではなかった、または実際に失業した後に当社に雇用された人に奨励的株式オプション、非法定株式オプション、株式付加権、制限株式奨励、制限株式単位およびその他の株式ベースの奨励を付与し、この人が当社に就職する誘因材料とすることが規定されている
ナスダック証券市場規則第5635(C)(4)条の要求に従う。コンサルタントもコンサルタントも2021年計画に参加する資格がない。
2020年計画では奨励奨励性株式オプション、非法定株式オプション、株式付加価値権、制限株式奨励、制限株式単位、その他の株式ベースの奨励を規定する 従業員、役員、コンサルタント、コンサルタントに。2022年6月15日、2022年計画が発効した日から違います。2020年計画によると、もっと多くの奨励金が提供されるだろう。2020年計画の下で完成していない任意のオプションまたは報酬は、2020年計画の条項によって管轄されています。
2010年計画では、従業員、取締役、コンサルタント、またはコンサルタントに奨励株式オプションおよび非法定株式オプションを付与することが規定されています。2020年計画が施行された日から、2010年計画は何の奨励も支給されないだろう。2010年計画の未完了の選択または報酬は、2010年計画の条項によって管轄されています。
2023年12月31日までに3,472,195計画に基づいて付与可能な株式以下の表に連結業務報告書における在庫別報酬費用分類を示す
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| 販売コスト | $ | 5,177 | | | $ | 5,382 | | | $ | 3,858 | |
| 研究開発 | 15,493 | | | 11,816 | | | 7,440 | |
| 販売とマーケティング | 3,639 | | | 2,818 | | | 1,281 | |
| 一般と行政 | 23,532 | | | 19,614 | | | 13,911 | |
| 株に基づく報酬総額 | $ | 47,841 | | | $ | 39,630 | | | $ | 26,490 | |
限定株単位
各制限株式単位(“RSU”)は、帰属時に会社の普通株を取得する権利を表す。当社が付与したRSUの公正価値は、当社の付与日の終値に基づいて計算され、帰属期間中に株式による補償費用が確認される。RSUは通常付与されます4年使用251年目の終了時に帰属される贈与の割合と、次の3年間に毎年残りの贈与に帰属する。
制限株式単位の活動状況は以下のとおりである
| | | | | | | | | | | |
| 量
株 | | 加重平均付与日1株当たり公正価値 |
| 開始、2023年1月1日 | 48,800 | | $ | 26.69 | |
| 授与する | 773,240 | | 26.09 | |
| 既得 | (13,241) | | 26.81 | |
| 没収される | (34,985) | | 24.36 | |
バランス、2023年12月31日 | 773,814 | | 26.19 | |
2023年および2022年12月31日までに年度内にロットされたRSUごとの加重平均払出日の公正価値は$である26.09そして$26.86それぞれ,である.
2023年12月31日までに1ドルあります15,375計画的に配布されたRSUに関する未確認補償費用は,#年加重平均期間内に確認される予定である3何年もです。2023年12月31日までの年間で13,241RSUが授与されました。2023年12月31日までの年度内に帰属するRSUの公正価値は355. 違います。2022年12月31日までの年度内に帰属するRSU。
業績に基づく限定株式単位
2023年2月、会社は2022年計画に基づいて業績に基づく制限株式単位(PRSU)を付与した。各PRSUは、特定の条件が達成されたときに普通株式を取得する権利を表す1つまたは複数の権利を表す
業績目標を達成する。会社が付与したPRSUの公正価値は、付与日の終値に基づいて計算され、株式に基づく報酬支出は、付与日が確定し、業績条件が実現可能な場合に確認される。
2023年2月、会社はある役員PRSUに最高位を授与した62,693共有(ベースベース)150報酬に概説した適用実績条件のパーセンテージ)を達成し,目標報酬を41,795PRSU(ベース100適用されるパフォーマンス条件の割合)と20,898PRSU(ベース50適用される性能条件のパーセンテージを達成する).すべてのPRSUはASC 718によって付与されたと考えられている報酬--株式報酬(“話題718”)、2023年2月。2023年2月に付与されたPRSUは、2025年12月31日までの財政年度Form 10-K年度報告を会社に提出した後、会社報酬委員会により適用された業績条件に達したことを証明して付与する予定です(あれば)。
2022年8月に会社は90,000PRSUを実行幹事に渡す30,150貧困削減戦略単位は貧困削減戦略単位を付与する際に特別テーマ718の下で授与されたと考えられる。2023年3月90,0002022年8月にPRSU、追加45,000貧困削減戦略単位は特別テーマ718の下で授与されたと考えられている。まとに命中する45,0002023年3月に付与されたPRSUとされている18,000PRSUは,2023年12月31日までの財政年度のForm 10−K年度報告書を提出した後,会社報酬委員会により適用された業績条件に達したことを証明した後,PRSUを付与する予定である27,000PRSUは,2025年12月31日までの財政年度のForm 10−K年度報告を会社が提出した後,会社報酬委員会が適用実績条件に達したことを証明した後,PRSUを付与する予定である。
業績に基づく限定的な株式単位活動は以下のとおりである
| | | | | | | | | | | |
| 量
株 | | 加重平均付与日1株当たり公正価値 |
| 開始、2023年1月1日 | 30,150 | | $ | 28.55 | |
| 授与する | 86,795 | | 22.48 | |
| 既得 | — | | — | |
| 没収される | — | | — | |
バランス、2023年12月31日 | 116,945 | | 24.05 | |
2023年と2022年12月31日までの年間で,PRSUごとの加重平均バッチ日の公正価値は$である22.48そして$28.55それぞれ,である違います。2023年12月31日と2022年12月31日までの年間で帰属するPRSU。
株式オプション
株式オプションは下回らないようにしなければならない100授出日は1株当たり公平市価の%である.取締役会または報酬委員会は、当日ナスダック世界精選市場報告書に付与された普通株終値に基づいて、会社株オプションの執行価格を決定する。計画によって付与されたオプションの最大契約期限は通常10数年間、オプションは通常授与されます4年使用25第一年末に帰属するオプション関連株式の割合と、次の三年間に月ごとに帰属する残りの株式とを比較する。2023年2月に、当社は行政総裁にプレミアム株購入権を授与しました65,525行権価格は同じだ110当社の普通株は授権日終値の%になります。
2023年12月31日、2022年、2021年12月31日までの年間で、800,336, 329,224そして、そして1,120,981これらの計画によりオプションが行使され,総収益は#ドルとなった9,440, $2,110、と$7,927それぞれ,である.
各オプション報酬の公正価値は、付与された日にブラック·スコルス·マートンオプション定価モデルを使用して決定される。公正価値の計算には管理職の判断を必要とするいくつかの仮定が含まれている。従業員のオプションを付与する予想条項は,2023年12月31日,2022年,2021年12月31日までの年間で,履歴演習の平均値を用いて算出した。2023年、2022年、2021年の推定変動率には、類似エンティティの普通株の履歴終値から算出された変動率が含まれており、これらのエンティティの株価は
オプションの予想期間内に利用可能であることを公開する.無リスク金利は、オプション期待期限が付与されたときに有効な米財務省の一定満期日に基づく。当社は没収発生時に会計処理を行いますので、当社は付与時に没収を見積もりません。
以下は、本報告で述べた期間におけるオプション報酬のための加重平均推定値仮定である
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| 推定値仮定 | | | | | |
| 期待配当収益率 | — | % | | — | % | | — | % |
| 予想変動率 | 66 | % | | 57 | % | | 59 | % |
| 所期期間(年) | 4.92 | | 4.78 | | 4.66 |
| 無リスク金利 | 3.77 | % | | 2.13 | % | | 0.71 | % |
株式オプション活動は以下のとおりである
| | | | | | | | | | | | | | | | | | | | | | | |
| 量
株 | | 重みをつける
平均値
トレーニングをする
値段 | | 重みをつける
平均値
残り
契約書
期限(年) | | 骨材
固有の
価値がある |
| 開始、2023年1月1日 | 10,934,227 | | $ | 29.56 | | | | | |
| 授与する | 1,487,340 | | 27.15 | | | | | |
| 鍛えられた | (800,336) | | 11.80 | | | | | |
| 没収される | (251,444) | | 35.07 | | | | | |
| 期限が切れる | (95,510) | | 67.20 | | | | | |
バランス、2023年12月31日 | 11,274,277 | | 30.06 | | | 6.99 | | $ | 154,266 | |
行使可能、2023年12月31日 | 7,279,345 | | 27.88 | | | 6.22 | | $ | 121,382 | |
2023年まで、2023年、2022年および2021年12月31日までに年度内に授受される購入権の加重平均授受日1株当たりの公正価値は$15.79, $13.67、と$45.07それぞれ,である.2023年12月31日,2022年および2021年12月31日までの年度内に行使されたオプションの内的価値は$である16,213, $6,548、と$71,308それぞれ,である
2023年12月31日までに1ドルあります62,992 計画により付与された未帰属株式オプションに関する未確認補償コストは,加重平均期間中に確認される予定である2.10何年もです。2023年12月31日まで、2022年12月31日および2021年12月31日までの年度内に帰属する株式の公正価値は$46,877, $43,559、と$19,080それぞれ,である.
(11) 非持株権益
当社は、当社がエンティティ内に可変資本を有するかどうか、およびエンティティがASCトピック810による可変利益エンティティ(VIE)の定義に適合するかどうかを決定するために、当社に関連する当事者からなる各法律エンティティを検討する整固するそれは.当該エンティティがVIEであれば、当社は、複数の要因に基づいて、当社がVIEの主要な受益者であるか否かを評価し、これらの要因は、(I)どの方がVIEの経済表現に最も影響を与える活動を指揮する権利があるか、(Ii)任意の契約合意に基づいて、各当事者の契約権利及び責任、及び(Iii)どちらが損失を負う義務があるか、又はVIEから利益を得る権利があるかを含む。当社がVIEの主な受益者であると判断した場合、当社は決定時にVIEの財務諸表を会社の総合財務諸表に統合する。当社は四半期ごとにそれが任意の合併VIEの主要な受益者であるかどうかを評価する。もし当社が合併VIEの主要な受益者ではないと判断した場合、またはVIEにおいて可変権益を持たなくなった場合、決定された間にVIEの統合を解除する。
もし当社が業務定義に適合するVIEの主要な受益者であると判断した場合、当社は報告実体が初めて主要な受益者となった日の第805テーマに基づいて、公正な価値に基づいて新合併実体の資産、負債、非持株権益を計量する。
2018年10月、米国はファヒョン治療有限責任会社(略称ファヒョン)を設立した。二零一九年四月、共同経営が完成した後、当社及び無錫応用科学技術(“無錫”)はそれぞれ1部を受け取った50%の株式は、エンティティへの彼らの貢献と交換されます。当社は先にVIEであることを決定し,VIEの主な受益者であると結論した。そのため、当社はすでに発賢の業績を総合財務諸表に組み込み、無錫の非持株権益としての所有権を除去した。
(12) 普通株と有限責任普通株株主の1株当たり純収益(損失)
♪the the the本年度の普通株と有限普通株株主の1株当たり基本と希釈後の純収益(損失)の計算(千単位であるが、1株および1株当たりのデータは含まれていない)を以下の表に示す
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| 分子: | | | | | |
| シュレーディンガー普通株と有限普通株株主の純収益(損失) | $ | 40,720 | | | $ | (149,186) | | | $ | (100,393) | |
| 分母: | | | | | |
| シュレーディンガー普通株と有限普通株株主の1株当たり純収益(損失)を計算するための加重平均株 | 71,776,301 | | 71,173,419 | | 70,594,950 |
| 加重平均普通株式と有限普通株に対する普通株式オプションの行使と既得RSUの影響 | 3,210,515 | | — | | — |
| シュレーディンガー普通株と有限普通株株主の1株当たり純利益(損失)の加重平均株式を計算し、希釈した後、 | 74,986,816 | | 71,173,419 | | 70,594,950 |
| | | | | |
| シュレーディンガー普通株と有限普通株株主の1株当たり純収益(損失) | $ | 0.57 | | | $ | (2.10) | | | $ | (1.42) | |
| シュレーディンガー普通株と有限普通株株主の1株当たり純収益(損失)に起因し、希釈した | $ | 0.54 | | | $ | (2.10) | | | $ | (1.42) | |
2023年12月31日までの年度では,1株当たりの純利益を算出するために,純収益を算出するための加重平均株式は,希釈証券の影響に応じて計画下の奨励を含めて調整される。1株当たり純収入の計算方法は,得られた純収入を完全に薄くした普通株と有限流通株の加重平均で割ったものである。
会社は2022年12月31日と2021年12月31日までの年度に赤字状態にあるため、1株当たりの基本純損失は希釈後の1株当たり純損失と同じであり、すべての潜在普通株と発行済み有限普通株を含めて逆希釈となるからである。各償却計算に含まれていない潜在的希薄化証券は以下の通りである
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| 発行された普通株式オプションとRSUに帰属していない株 | 6,351,996 | | 11,013,177 | | 7,680,341 |
(13) 株式投資
(A)インドとNimbus
同社はこれまで、2010年5月18日に署名された改訂されたプライマリサービス協定条項に基づいてNimbusに協力サービスを提供してきた。協力協定は持分所有権をもたらす取引とは別に、関連費用は現金で会社に支払われる。Nimbusは以前、HLBV法下の持分方法投資として記録されていたが、このエンティティは有限責任会社であるため、会社とNimbusの複数の薬物発見目標への協力およびNimbusにおける会社の所有権レベルにより、会社は大きな影響力を持っていることが決定された。2023年9月30日までの期間内に、会社の株式
Nimbusの所有権は、同社がそのエンティティに大きな影響力を持たなくなった程度に希釈されている。当社はNimbusに対して大きな影響力を持たなくなったため、2023年6月30日以降、Nimbusの株式投資を非流通株証券として推定した。
Nimbus投資の帳簿価値は$1,928そしてゼロそれぞれ2023年12月31日と2022年12月31日まで。当社はNimbusの損失にその投資を超える資金を提供する義務はありません。当社は2023年12月31日までに収益を達成した$を記録した147,213Nimbusの投資については,武田がNimbusの完全子会社Nimbus Lakshmi,Inc.とそのチロシンキナーゼ2阻害剤NDI−034858を買収したことにより,会社がNimbusから得た現金分配総額と,収益#ドルを実現していないことを反映している1,928会計方法の変更による。その会社の報告違います。Nimbus投資の収益または損失は、2022年12月と2021年12月までの年間である。
(B)*
♪the the the会社モルフェイ·ホールディングス(“モルフェイ”)の投資は公正価値で計算され、モルフェイの普通株株価をベースとしている。
2023年12月31日までの年間で、会社は時価収益を$と報告している1,778モールフィーの投資について。2022年12月31日までに、当社は損失$を記録しました17,226モールフィーの投資について。2021年12月31日までの年間で、会社は収益を$と報告しています11,548モールフィーの投資について。2023年12月31日と2022年12月31日まで、Morphiにおける会社の投資の帳簿価値は$24,114そして$22,335それぞれ,である.
(C)アジャックスとの協力
2021年5月、会社は購入した631,377アジャックス治療会社(“アジャックス”)Bシリーズ優先株、価格はドル1,700現金で払います。当社はAJAXへの持分投資はAJAXに大きな影響を与えないため、非流通持分証券として評価すべきであると結論した。2023年12月31日と2022年12月31日までの会社のアジャックス投資の帳簿価値は$1,700.
(D)Structure Treeutics
2021年7月、会社は購入した494,035Structure TreateuticsのBシリーズ優先株価格はドルです2,000現金で払います。2022年4月、会社は別の台を購入しました148,210B系列優先株の価格は$600現金で払います。2023年2月7日、Structure TreateuticsがIPOを完了しました。構造治療会社の初公募が終了した後、すべての発行されたBシリーズ優先株はすぐに1つは-1を基本とする。2023年12月31日までに会社は3,260,495構造治療会社の普通株。会社が購入した275,000米国預託証券(“米国預託株式”)は、1株当たり1ドル15.00米国預託株式は初公募株でそう語っている。すべてのアメリカ預託株式代表は三つ普通株です。
Structure Treateuticsの初公募が完了した後、当社は初回公募後にStructureに重大な影響を与えなくなったため、当社はStructure Treateutics投資の評価方法をHLBV法下の権益法投資から公正価値で報告する株式投資に変更した。Structure TreateuticsのADSには既製の市場価格があるため,会社はStructure TreateuticsのADS報告日までの終値に基づいてその投資を推定している.
Structure Treeuticsの帳簿価値は$55,509 そして$1,629それぞれ2023年12月31日と2022年12月31日まで。2023年12月31日までの年間で、会社は時価ベースの収益$を記録した49,755治療投資に関する構造的な問題。当社は2022年12月31日および2021年12月31日までに赤字を計上した$858そして$113HLBV法での構造的治療投資について。
(14) 従業員福祉計画
同社は米国の従業員に401(K)従業員貯蓄計画を提供している。同社は以下の額に相当する情状酌量の供出をした100最初の割合は4従業員貢献報酬の割合は、2023年12月31日、2022年、2021年12月31日までの年度。2023年、2022年、2021年の相応の寄付金は$4,135, $3,243、と$2,592それぞれ,である.
(15) 関係者取引
(A)取締役会メンバー
会社が支払う相談料は、2023年12月31日、2022年12月31日、2021年12月31日までの年度です420, $410、と$390取締役会のメンバーにそれぞれ提出されます。
(B)ビルとメリンダ·ゲイツ財団を援助する
ビルとメリンダ·ゲイツ財団はビルとメリンダ·ゲイツ財団信託基金と共同で制御するエンティティであり、ビルとメリンダ·ゲイツ財団は同社の株主の一人であり、同基金は贈与を発表し、この贈与に基づいて、特定の第三者組織に提供されるいくつかの許可証とサービスを同社に直接支払うことに同意する。当社がこの支出により提供したサービスで確認された収入は$です253, $387、と$1,1602023年12月31日まで、2022年12月31日、2021年12月31日までの年度。2023年12月31日までに会社は違います。ビルとメリンダ·ゲイツ財団は債権を請求しなければならない。2022年12月31日現在の会社の売掛金純額は20ビルとメリンダ·ゲイツ財団が支払うべきです。
2023年12月31日現在、2022年12月31日と2021年12月31日までの年度、会社は2,822, $1,949、と$111ビルとメリンダ·ゲイツ財団との合意によると、女性の健康薬物発見を加速させるための合意によると、薬物発見寄付収入は受け取った資金に関連している。2023年12月31日現在、2023年12月31日現在、2022年12月31日現在、会社はビルとメリンダ·ゲイツ財団の金を受け取っていない。この手配に関する手元制限現金は、2023年12月31日、2023年12月31日、2022年12月31日までで1ドルとなる2,251そして$1,742それぞれ,である.
ゲイツリスク投資有限責任会社はウィリアム·H·ゲイツ三世の支配下の実体であり、彼は超えているとみなされるかもしれない5会社が投票権を持っている証券の%です。同社は$を受け取りました1,000ゲイツリスク投資会社との協定締結に関する寄付収入は、2020年6月から2022年6月まで年に1回。2023年8月、同社はゲイツリスク投資有限責任会社と契約を更新し、ドルを確認した1,800寄付収入の中で。2023年、2023年、2022年12月31日まで、会社は違います。ゲイツリスク投資会社の売掛金。
(C)Structure Treateutics
2021年12月31日までの年間で、会社はStructure Treeuticsとその子会社と複数のソフトウェア協定を締結し、金額は約650それは.会社が確認した収入は、2023年12月31日、2022年12月31日、2021年12月31日までの年間で約10%となっている221, $297、と$129これらのソフトウェアプロトコルに関する全体的にはそれぞれである
同社は、特定の薬物発見サービスおよびソフトウェアアクセスを提供するために、2023年12月31日までの年間でStructure Treeuticsとその子会社と協力協定を締結した。この協力で確認された収入は$である433この年度までに2023年12月31日. 2023年12月31日、2023年12月、2022年12月31日までの会社の売掛金純額はドルである494そしてゼロ構造治療会社から来ました
(16) 細分化市場報告
当社はその最高経営責任者(“CEO”)がその運営意思決定者(“CODM”)であることを決定した。会社のCEOは以下の基準に基づいて会社の財務業績を評価する二つ報告が必要な部分:ソフトウェアと薬物発見。ソフトウェア部門の重点は、分子発見を変更するために同社のソフトウェアを許可することだ。薬物発見部門の重点は内部と協力を通じて一連の臨床前と臨床薬物計画を構築することである。
CODMはソフトウェアと薬物によって報告可能な部門の収入と部門の毛利を発見し、部門の業績を審査し、資源を分配する。部門毛利益はアメリカ公認会計基準収入から運営支出を差し引いたが、研究開発、販売とマーケティング及び一般と行政活動は除外した。業務支出は報告されなければならない部分の支出に直接起因する。これらの支出は人数に応じて各部門に割り当てられている。報告されるべき部分支出には、報酬、用品、および契約研究機関が提供するサービスが含まれる。
いくつかの費用項目は会社の報告可能な部門に割り当てられない。これらのコスト項目には,主に非薬物発見計画に関する補償と,会社の研究開発,販売,マーケティングに関する一般運営費用,一般と行政費用が含まれている。両部門ともこれらのコストが発生しており,会社ソフトウェアと薬物発見部門の総合的な性質により,どの分配方法も独断的であり,有意義な分析は提供されない
部門収入は主にアメリカで稼いでおり、部門間収入はない。また、会社は、合併に基づいて資産を報告し、その報告可能な部門に資産を割り当てず、部門の業績を評価したり、資源を割り当てたりする。
以下は、当社が報告すべき部門に関する財務情報である
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| 細分化市場収入: | | | | | |
| ソフトウェア | $ | 159,124 | | | $ | 135,578 | | | $ | 113,236 | |
| 薬物発見 | 57,542 | | | 45,377 | | | 24,695 | |
| 部門総収入 | $ | 216,666 | | | $ | 180,955 | | | $ | 137,931 | |
| 部門毛利益: | | | | | |
| ソフトウェア | $ | 129,610 | | | $ | 106,002 | | | $ | 86,741 | |
| 薬物発見 | 11,082 | | | (4,980) | | | (21,121) | |
| 部門毛利総額 | 140,692 | | | 101,022 | | | 65,620 | |
| 未分配(費用)収入: | | | | | |
| 研究開発 | (181,766) | | | (126,372) | | | (90,904) | |
| 販売とマーケティング | (37,226) | | | (30,642) | | | (22,150) | |
| 一般と行政 | (99,148) | | | (90,825) | | | (64,009) | |
| 株式投資の収益 | 147,213 | | | 11,825 | | | (1,781) | |
| 価値変動を公平に承諾する | 53,461 | | | (18,084) | | | 11,359 | |
| その他の収入 | 19,693 | | | 3,950 | | | 1,057 | |
| 所得税費用 | (2,199) | | | (63) | | | (411) | |
| 合併純収益 | $ | 40,720 | | | $ | (149,189) | | | $ | (101,219) | |
地理的地域別の収入は、会社の顧客とパートナーが提供する住所に基づいて決定される。次の表は、2023年12月31日、2022年12月31日、2021年12月31日までの年間収入を示しています
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
| アメリカです | $ | 161,961 | | | $ | 123,556 | | | $ | 90,398 | |
| APAC | 24,569 | | | 21,680 | | | 17,778 | |
| ヨーロッパ中東アフリカ地域では | 29,135 | | | 34,451 | | | 28,880 | |
| 世界の他の地域 | 1,001 | | | 1,268 | | | 875 | |
| $ | 216,666 | | | $ | 180,955 | | | $ | 137,931 | |
第九項会計及び財務開示に関する変更と相違。
ない。
第9条。制御とプログラムです
情報開示制御とプログラムの評価
我々の経営陣は、最高経営者及び最高財務官の参加の下、2023年12月31日現在の開示制御及び手続(改正された1934年証券取引法又は取引法下の規則13 a−15(E)及び15 d−15(E)で定義されるような)の有効性を評価している。“開示制御及び手続”という言葉は、会社が“取引法”に基づいて提出又は提出された報告において開示を要求する情報が、米国証券取引委員会の規則及び表に指定された期間内に記録、処理、集約及び報告されることを確実にするための会社の制御及びその他の手続を意味する。開示制御および手続は、必要な開示に関する決定をタイムリーに行うために、会社が取引所法に基づいて提出または提出された報告書に開示を要求する情報が蓄積され、会社管理層(その主要幹部および主要財務官を含む)または同様の機能を果たす者に伝達されることを保証することを目的とした制御および手順を含むが、これらに限定されない。経営陣は、どのような制御やプログラムが、どんなに設計や操作が良くても、その目標を実現するために合理的な保証を提供するしかないことを認識しており、管理部門は、可能な制御とプログラムのコスト-利益関係を評価する際にその判断を運用しなければならない。
2023年12月31日までの開示統制及び手続の評価によると、我々の最高経営責任者及び最高財務官は、その日までに、我々の開示制御及び手続が合理的な保証レベルで有効であると結論した。
経営陣財務報告内部統制年次報告書
我々の経営陣は、“取引法”ルール13 a-15(F)および15 d-15(F)に定義されている会社財務報告の十分な内部統制の確立と維持を担当している。私たちの財務報告の内部統制は、私たちの主要幹部と主要財務官によって設計または監督され、私たちの取締役会、管理層、その他の人員によって実施されるプログラムであり、公認された会計原則に基づいて財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供する
経営陣は2023年12月31日までの財務報告の内部統制を評価し、使用内部統制--統合フレームワーク(2013)テレデビル委員会が後援して組織委員会によって提案された
評価結果によると、経営陣は、財務報告に対する内部統制は2023年12月31日から有効であると結論した。我々の独立公認会計士事務所ピマウェイ会計士事務所は、本年度報告書の第8項に含まれる財務報告書に対する内部統制の有効性に関する証明報告書を発表した。
財務報告の内部統制の変化
我々が先に2023年2月28日に米国証券取引委員会に提出した2022年12月31日までの財政年度Form 10−K年度報告で開示されたように、財務報告の内部統制に大きな弱点があることが分かった。この重大な弱点は著者らの収入過程における制御設計の不足と関係があり、この制御は新しく実行された薬物発見手配中の業績マイルストーンが実現可能かどうか、及びマイルストーン支払い形式の可変対価格の制限を取り消すことができるかどうかを決定することを目的としている。この欠陥は,我々の当時の既存の制御措置の設計が,新たに実行された契約における業績マイルストーンの時間変化を決定するのに不十分であったため,リスク評価の無効によるものである.この重大な疲弊は170万ドルの薬物発見収入と関連契約資産の少なさを招き、これらは2022年12月31日までの連結財務諸表の発表前に是正された。
2023年12月31日までの年度中に、財務報告の内部統制を改善するための措置を実施し、業績マイルストーンが薬物発見スケジュールで達成される可能性のある時間変化をタイムリーに決定し、報告終了時にこのような決定を行うことを確実にすることを含む、この大きな弱点を補うために、収入過程における制御およびプログラムの再設計を含む
ピリオド。新たに実行された発見スケジュールにおけるすべてのマイルストーンが収入への影響を考慮していることを確実にするために、業績のスケジュールを調整するために、既存の制御措置を再設計した
2023年に採択され完了した救済行動と、新たに実施された統制活動と財務報告の内部統制に対する私たちのテストと評価によると、2023年12月31日までに実質的な弱点が修復されたと結論した。
我々が上述した救済措置の実施に関する変化に加えて、2023年第4四半期には、取引法ルール13 a-15(F)および15 d-15(F)で定義されているように、財務報告の内部統制に大きな影響を与える可能性があり、または合理的に財務報告の内部統制に大きな影響を与える可能性がある変化は発生していない。
内部統制の内在的限界
私たちの経営陣は、私たちのCEOやCEOを含めて、財務報告に対する開示制御や手続き、または財務報告に対する私たちの内部統制が内部統制の固有の制限によってすべてのエラーやすべての詐欺を防止することを期待していません。これらの制限により、財務報告または開示制御およびプログラムの内部統制は、重大な誤報をタイムリーに防止または発見できない可能性がある。しかし、このような固有の制限は開示と財務報告過程の既知の特徴だ。したがって、(除去ではないにもかかわらず)このリスクを低減するために、プロセス中に保障措置を設計することが可能である。
プロジェクト9 B。他の情報。
(B)役員及び上級者の売買手配
我々役員および上級管理者の報酬(取引法第16 a-1(F)条で定義されるように)の大部分は、株式報酬の形態で支払われており、取締役および上級管理者は、株式報酬の帰属または行使時に源泉徴収義務を履行すること、および多様化またはその他の個人的な理由で、多様化された個人のための公開市場取引を含む、そのような株式報酬または我々の他の証券から得られた証券について時々公開市場取引を行う。
取締役や上級管理者による我々証券の取引は、適用される米国連邦証券法に適合することを要求する我々のインサイダー取引政策に適合しなければならず、重大な非公開情報を有する場合の取引を禁止する法律である。取引法の下の10 b 5-1規則は、重大な非公開情報を持った場合に取引を開始する懸念を回避するために、取締役や上級管理者が私たちの証券の取引を事前に手配できるように肯定的な抗弁を提供している。
次の表は、(1)規則10 b 5-1(C)の肯定的な弁護条件を満たすための契約、指示または書面計画、または(1)規則10 b 5-1(C)の肯定的な弁護条件を満たすための契約、指示または書面計画、または2023年第4四半期に私たちの役員および上級管理者によって当社の証券の売却または購入の各取引スケジュールを説明しますルール10 b 5-1取引スケジュールまたは(2)“非ルール10 b 5-1取引スケジュール“(S-K条例第408(C)項で定義されるように):
| | | | | | | | | | | | | | | | | |
| 名前と肩書き | 取る行動(行動日) | 取引手配の種別 | 取引手配の性質 | 取引手配の継続時間 | 普通株式総株式数 |
ロバート·アベルプラットフォーム首席科学官執行副総裁 | 養子縁組 (2023年11月6日) | 規則第10 b 5−1条株式オプションの行使及び株式売却の取引手配 | 販売する | 2024年12月31日まで、またはそれ以上の日付、すなわちすべてのトランザクションが完了または満了して実行されない | …まで48,772株 |
マーガレット·デュガン, 首席医療官 | 養子縁組 (2023年11月13日) | 永続的規則10 b 5-1付与されたまたは付与可能なすべての持分報酬に関連する売却から販売取引への取引スケジュール | 販売する | 保険を受けたRSUが最終的に決済されるまで | 確定できない(1) |
ジェフリー·ボギス, 執行副総裁、首席財務官 | 養子縁組 (2023年11月28日) | 規則第10 b 5−1条株式オプションの行使及び株式売却の取引手配 | 販売する | 2024年12月6日まで、またはすべてのトランザクションが完了または満了して実行されていないより早い日 | …まで23,946株 |
(1)帰属条件の満足度、決済時の我々普通株の市場価格、および将来追加のRSUが付与される可能性があるため、帰属時に適用される源泉徴収義務を満たすために、RSUを保証する株式数が未知であることに制限される。この取引スケジュールは、RSUに適用され、帰属が時間の推移および/または業績目標の実現に基づいているにもかかわらず、RSUを保証する各決済日本で発行可能な株式を自動的に売却することを規定しており、適用される源泉徴収義務を満たすのに十分な金額で、適用される源泉徴収義務を満たすために販売されている。
プロジェクト9 Cです。検査を妨害する外国司法管轄区域を開示する。
適用されません。
第三部
プロジェクト10.取締役、行政、企業管理
本10項で要求される情報は,2024年株主総会に関する依頼書に含まれる情報から引用され,Form 10−Kの一般指示G(3)に基づいて2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会にこの依頼書を提出する予定である。
我々は、我々のCEO、最高財務官、最高会計官または財務総監、または同様の機能を実行する者を含む、我々の役員、上級管理者、および従業員に適用される書面商業行為および道徳基準を採択した。私たちはすでに私たちのウェブサイトwww.schrodinger.comでコードの最新コピーを公開しました。さらに、私たちは、本規則の任意の条項の任意の改正または免除に関連するすべての開示を、法律またはナスダック上場基準によって要求されるすべての開示を私たちのウェブサイトで公表する予定です。本サイトは引用で本年度報告に組み込まれているわけではありません。閣下は、本サイトに掲載されているか、または本サイトから取得可能ないかなる資料も、本年度報告の一部と見なすべきではありません。
第11項.行政職報酬
本第11項で要求される情報は,2024年株主総会に関する依頼書に含まれる情報から引用され,Form 10−Kの一般指示G(3)に基づいて2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会にこの依頼書を提出する予定である。
第12項:特定の実益所有者の保証所有権及び管理職及び関連株主事項。
本第12項で要求される情報は,2024年株主総会に関する依頼書に含まれる情報から引用され,Form 10−Kの一般指示G(3)に基づいて2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会にこの依頼書を提出する予定である。
第十三条特定関係及び関連取引、並びに取締役の独立性。
本第13項で要求される情報は,2024年株主総会に関する依頼書に含まれる情報から引用され,Form 10−Kの一般指示G(3)に基づいて2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会にこの依頼書を提出する予定である。
プロジェクト14.チーフ会計士費用とサービス
本第14項で要求される情報は,2024年株主総会に関する依頼書に含まれる情報を引用しており,Form 10−Kの一般指示G(3)に基づいて2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会にこの依頼書を提出する予定である。
第4部
プロジェクト15.証拠品および財務諸表の添付表
(1)財務諸表
ページには以下の文書が含まれているS F-2からF-11戦闘機これに添付し,本年度報告の一部としてアーカイブした。
| | | | | |
| ページ |
独立公認会計士事務所報告 | F-2 |
| |
2023年12月31日と2022年12月31日までの連結貸借対照表 | F-5 |
| |
2023年12月31日まで、2022年と2021年12月31日までの年度の総合業務報告書 | F-6 |
| |
2023年,2022年,2021年12月31日までの年度総合総合収益(損失表) | F-7 |
| |
2023年、2022年、2021年12月31日までの株主権益総合レポート | F-8 |
| |
2023年12月31日現在、2022年12月31日現在、2021年12月31日までの統合現金フロー表 | F-9 |
| |
連結財務諸表付記 | F-10 |
(2)財務諸表明細書
これらは、適用されない、必要ではない、または要求される情報が連結財務諸表またはその付記に表示されるので、すべての財務諸表の添付表は省略される。
(3)陳列品
本年度報告書の一部として提出された証拠品は以下のとおりである。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
展示品
番号をつける | | 展示品説明 | | 表 | 書類番号. | 展示品 | 提出日 | 同封アーカイブ |
| 3.1 | | 再記載の会社登録証明書 | | 8-K | 001-39206 | 3.1 | 2/10/2020 | |
| 3.2 | | シュレーディンガー社の定款を改訂して再制定する. | | 8-K | 001-39206 | 3.1 | 4/13/2023 | |
| 4.1 | | 普通株式の証明書証明書サンプル | | S-1/A | 333-235890 | 4.1 | 1/27/2020 | |
| 4.2 | | 登録者とビルとメリンダ·ゲイツ財団信託基金との間で2020年1月24日に改正·再署名された株式交換協定 | | S-1/A | 333-235890 | 4.2 | 1/27/2020 | |
| 4.3 | | 取引法第12条により登録された証券説明 | | 10-K | 001-39206 | 4.3 | 3/4/2021 | |
| 10.1 | | 登録者及びその他の当事者が2018年11月9日に改訂及び再署名した“投資家権利協定”は、改訂された | | | | | | X |
| 10.2+ | | 改訂された2010年株式計画 | | S-1 | 333-235890 | 10.2 | 1/10/2020 | |
| 10.3+ | | 2010年株式計画下で株式オプションおよび株式オプション協定を付与する通知フォーマット | | S-1 | 333-235890 | 10.3 | 1/10/2020 | |
| 10.4+ | | 2020年株式インセンティブ計画 | | S-1/A | 333-235890 | 10.4 | 1/27/2020 | |
| 10.5+ | | 2020年株式インセンティブ計画の下で米国参加者の株式オプション協定と限定株式単位合意の形態 | | 10-K | 001-39206 | 10.5 | 2/24/2022 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| 10.6+ | | 2020年株式インセンティブ計画の下で米国参加者ではない株式オプション協定フォーマット | | 10-Q | 001-39206 | 10.2 | 11/12/2020 | |
| 10.7+ | | 2020年株式インセンティブ計画の下で米国参加者ではない制限株式単位プロトコルフォーマット | | 10-K | 001-39206 | 10.6 | 2/24/2022 | |
| 10.8+ | | 2020年従業員株購入計画 | | S-1/A | 333-235890 | 10.6 | 1/27/2020 | |
| 10.9+ | | 第4回役員補償政策の改正と再調整 | | 10-Q | 001-39206 | 10.3 | 5/4/2023 | |
| 10.10+ | | 高度管理者奨励報酬計画 | | S-1 | 333-235890 | 10.8 | 1/10/2020 | |
| 10.11+ | | 改正された経営陣の離職·コントロール福祉計画変更の改訂と再起動 | | 8-K | 001-39206 | 10.2 | 8/18/2022 | |
| 10.12+ | | 登録者とラミー·ファリードの間の雇用協定は、2010年5月11日 | | S-1 | 333-235890 | 10.10 | 1/10/2020 | |
| 10.13+ | | 登録者とジェフリー·ボギスとの雇用契約は、2022年8月16日となっている | | 8-K | 001-39206 | 10.1 | 8/18/2022 | |
10.14+ | | 登録者とジェニー·ヘルマンとの雇用契約は,2003年3月17日であった | | 10-K | 001-39206 | 10.15 | 2/28/2023 | |
| 10.15+ | | 登録者とKaren Akinsanyaとの間の雇用契約、日付は2018年5月14日 | | S-1 | 333-235890 | 10.14 | 1/10/2020 | |
| 10.16+ | | 登録者とイフォン·チェン間の雇用協定は,2010年4月27日である | | S-1 | 333-235890 | 10.16 | 1/10/2020 | |
| 10.17+ | | 登録者とパトリック·ロートンの間の雇用協定は2006年9月11日 | | S-1 | 333-235890 | 10.17 | 1/10/2020 | |
10.18+ | | 登録者とロバート·アベルとの間の雇用協定は,2009年3月9日である | | S-1 | 333-235890 | 10.19 | 1/10/2020 | |
10.19+ | | 登録者とマーガレット·デュガン間の雇用契約は、2023年7月28日となっています | | | | | | X |
10.20+ | | 1999年7月1日登録者とRichard A.Friesnerとの間の修正されたコンサルタント協定 | | 10-Q | 001-39206 | 10.1 | 8/2/2023 | |
| 10.21+ | | 登録者とその執行者と取締役との間の賠償協定フォーマット | | S-1 | 333-235890 | 10.21 | 1/10/2020 | |
| 10.22 | | オフィス賃貸契約は、日付は2021年4月5日で、登録者とSPUSV 5 1540ブロードウェー有限責任会社が締結します | | 8-K | 001-39206 | 10.1 | 4/8/2021 | |
| 10.23 | | “賃貸借第一修正案”は,期日は2022年5月19日であり,登録者とSPUSV 5 1540ブロードウェー有限責任会社の間で締結されている | | 10-Q | 001-39206 | 10.1 | 8/4/2022 | |
| 10.24 | | 2008年8月6日One Main Placeポートランド-オレゴン州会社(大家)と登録者(テナント)との間の賃貸契約は2008年8月6日 | | S-1 | 333-235890 | 10.23 | 1/10/2020 | |
| 10.25 | | オフィス賃貸修正案、期日は2021年5月6日、登録者とマディソンの間の修正案-OFC One Main PlaceまたはLLC | | 10-Q | 001-39206 | 10.2 | 8/12/2021 | |
10.26† | | 1994年5月5日ニューヨーク市コロンビア大学取締役会と登録者の間の合意が改訂されました | | S-1 | 333-235890 | 10.24 | 1/10/2020 | |
10.27† | | ニューヨーク市コロンビア大学の取締役会と登録者の間の合意は1998年7月15日で、改訂されました | | S-1 | 333-235890 | 10.25 | 1/10/2020 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | |
10.28† | | 2001年9月ニューヨーク市コロンビア大学取締役会とシュレーディンガー有限責任会社との間の合意は修正されました | | S-1 | 333-235890 | 10.26 | 1/10/2020 | |
10.29† | | ニューヨーク市コロンビア大学取締役会とシュレーディンガー有限責任会社が2003年6月19日に署名した協定 | | S-1 | 333-235890 | 10.27 | 1/10/2020 | |
10.30† | | 2008年5月27日ニューヨーク市コロンビア大学取締役会がシュレーディンガー有限責任会社と締結したソフトウェアと特許許可協定 | | S-1 | 333-235890 | 10.28 | 1/10/2020 | |
10.31† | | サービス版税改正案は、2008年11月1日、ニューヨーク市コロンビア大学の受託者と薛定騰有限責任会社の間の | | S-1 | 333-235890 | 10.29 | 1/10/2020 | |
| 10.32+ | | グローバルボーナス計画 | | S-1/A | 333-235890 | 10.33 | 1/27/2020 | |
10.33† | | 登録者とゲイツリスク投資有限責任会社との間の独立請負者協定は,期日は2020年6月23日である | | 10-Q | 001-39206 | 10.2 | 8/10/2020 | |
10.34† | | 登録者とゲイツリスク投資有限責任会社との間で2023年8月14日に署名された“独立請負者合意”の改正案第1号 | | 10-Q | 001-39206 | 10.1 | 11/1/2023 | |
10.35† | | 登録者と百時美施貴宝会社との間の協力と許可協定は,期日は2020年11月22日である | | 10-K | 001-39206 | 10.37 | 3/4/2021 | |
10.36† | | 登録者と百時美施貴宝会社との間の協力及び許可協定第一改正案、期日は2022年12月21日 | | 10-K | 001-39206 | 10.40 | 2/28/2023 |
|
| 10.37+ | | 改正された2021年インセンティブ持分インセンティブ計画 | | 10-Q | 001-39206 | 10.4 | 11/3/2022 | |
| 10.38+ | | 2021年株式インセンティブ計画下の非法定株式オプション協定 | | 10-K | 001-39206 | 10.39 | 3/4/2021 | |
10.39+ | | 2021年の株式インセンティブ計画の下での非米国参加者のオプション協定フォーマット | | 10-Q | 001-39206 | 10.3 | 8/4/2022 | |
| 10.40+ | | 2021年株式インセンティブ計画の下で米国参加者限定株式単位合意の形態 | | 10-Q | 001-39206 | 10.1 | 5/4/2023 | |
| 10.41+ | | 2021年株式インセンティブ計画の下で米国参加者ではない制限株式単位プロトコルフォーマット | | 10-Q | 001-39206 | 10.2 | 5/4/2023 | |
10.42+ | | シュレーディンガー社の2022年株式激励計画 | | 8-K | 001-39206 | 99.1 | 6/16/2022 | |
10.43+ | | 2022年株式インセンティブ計画の下で米国参加者のオプション合意形式 | | 10-Q | 001-39206 | 10.4 | 8/4/2022 | |
10.44+ | | 2022年株式インセンティブ計画の下で米国参加者ではないオプションプロトコルフォーマット | | 10-Q | 001-39206 | 10.5 | 8/4/2022 | |
10.45+ | | 2022年株式インセンティブ計画の下で米国参加者限定株式単位合意の形式 | | 10-Q | 001-39206 | 10.6 | 8/4/2022 | |
10.46+ | | 2022年株式インセンティブ計画の下で非米国参加者向けの限定株式単位プロトコルフォーマット | | 10-Q | 001-39206 | 10.7 | 8/4/2022 | |
| 10.47+ | | 登録者とSVB Securities LLCとの間の販売契約は,期日は2023年5月24日である | | 8-K | 001-39206 | 1.1 | 5/24/2023 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| 21.1 | | 登録者の子会社 | | 10-K | 001-39206 | 21.1 | 2/28/2023 | |
| 23.1 | | 独立公認会計士事務所ピマウェイ会計士事務所同意 | | | | | | X |
| 31.1 | | 2002年サバンズ-オキシリー法第302節で可決された1934年“証券取引法”第13 a-14(A)及び15 d-14(A)条に従って発行された最高経営責任者証明書 | | | | | | X |
| 31.2 | | 2002年サバンズ-オキシリー法第302節で可決された1934年“証券取引法”第13 a-14(A)及び15 d-14(A)条による首席財務官の証明 | | | | | | X |
| 32.1# | | 2002年にサバンズ·オクスリ法案第906条で可決された“米国法典”第18編1350条による主要行政官の証明 | | | | | | X |
| 32.2# | | 2002年サバンズ·オキシリー法第906条で可決された“米国法典”第18編1350条による首席財務官の証明 | | | | | | X |
| 97.1+ | | Schrödinger Inc.政策を取り戻す | | | | | | X |
| 101.INS | | 連結されたXBRLインスタンス文書−インスタンス文書は、そのXBRLタグがイントラネットXBRL文書に埋め込まれているので、相互作用データファイルには表示されない。 | | | | | | X |
| 101.書院 | | インラインXBRL分類拡張アーキテクチャ文書. | | | | | | X |
| 101.カール | | インラインXBRL分類拡張計算リンクライブラリ文書 | | | | | | X |
| 101.def | | XBRLソート拡張を連結してLinkbase文書を定義する. | | | | | | X |
| 101.介護会 | | XBRL分類拡張ラベルLinkbase文書を連結する. | | | | | | X |
| 101.Pre | | インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント | | | | | | X |
| 104 | | 表紙フォーマットは、添付ファイル101に含まれるイントラネットXBRLである。 | | | | | | X |
| | | | | |
| † | S-K法規第601(B)(10)(Iv)項によれば、本展示品の一部の内容は省略されている。 |
| # | 本年度報告に付随して添付された証拠物32.1及び32.2に添付された証明は提供されたものとみなされ、米国証券取引委員会に届出されておらず、1933年“証券法”(改訂本)又は1934年“証券取引法”(改訂版)に基づいてシュレーディンガー社が提出したいかなる文書も、当該文書に含まれる任意の一般登録言語にかかわらず、本年度報告日の前又は後に提出されたものを参照することができない。 |
| |
| + | 表格10-K年次報告に基づいて、第15(A)(3)項に提出された管理契約または補償計画または手配を指示する。 |
項目16.表格10-Kの概要
ない。
サイン
改正された1934年証券取引法第13又は15(D)節の要求に基づいて、登録者は、正式に許可された次の署名者がその代表を代表して本報告書に署名することを正式に手配した.
| | | | | | | | |
| シュレーディンガーInc. |
| | |
日付:2024年2月28日 | 差出人: | /投稿S/ラミー·フリード |
| | |
| | ラミー·ファリード博士です |
| | 社長と最高経営責任者 |
本報告書は、改正された1934年の証券取引法の要求に基づき、以下の登録者によって登録者として指定日に署名された。
| | | | | | | | | | | | | | |
| 名前.名前 | | タイトル | | 日取り |
| | | | |
| /投稿S/ラミー·フリード | | 社長と取締役CEO | | 2024年2月28日 |
| ラミー·ファリード博士です | | (首席行政主任) | | |
| | | | |
| /S/ジェフリー·ボギス、MBBS | | 常務副総裁兼首席財務官 | | 2024年2月28日 |
| ジェフリー·ボギス | | (首席財務官) | | |
| | | | |
| /S/ジェニー·ヘルマン | | 上級副社長、財務·会社総監 | | 2024年2月28日 |
| ジェニー·ヘルマン | | (首席会計主任) | | |
| | | | |
| 寄稿S/マイケル·リントン | | 取締役会議長 | | 2024年2月28日 |
| マイケル·リントン | | | | |
| | | | |
| /S/ジェフリー·ジョダクヴィッツ | | 役員.取締役 | | 2024年2月28日 |
| ジェフリー·ジョダクヴィッツ医学博士 | | | | |
| | | | |
| 寄稿S/リチャード·フリスナー | | 役員.取締役 | | 2024年2月28日 |
| リチャード·フリスナー博士です | | | | |
| | | | |
| /S/ゲイリー·キングスバーグ | | 役員.取締役 | | 2024年2月28日 |
| ゲイリー·キングスバーグ | | | | |
| | | | |
| /S/ロザナ·カペラー-リーバーマン | | 役員.取締役 | | 2024年2月28日 |
| Rosana Kapeller-Libermann医学博士 | | | | |
| | | | |
| 寄稿S/アルン·オベロイ | | 役員.取締役 | | 2024年2月28日 |
| アルン·オベロイ | | | | |
| | | | |
| /S/ゲイリー·サンダー | | 役員.取締役 | | 2024年2月28日 |
| ゲイリー·サンダー | | | | |
| | | | |
| /S/ナンシー·サンバリー | | 役員.取締役 | | 2024年2月28日 |
| ナンシー·サンバリー | | | | |