
l
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表
(マーク1)
1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで
あるいは…。
1934年証券取引法第13条又は15(D)条に基づいて提出された |
手数料書類番号
(登録者の正確な氏名はその定款に記載)
(明またはその他の司法管轄権 会社や組織) |
(税務署の雇用主 識別番号) |
(主にオフィスアドレスを実行) |
(郵便番号) |
登録者の電話番号は市外局番を含んでいます
(
同法第12条(B)に基づいて登録された証券:
クラスごとのタイトル |
|
取引 記号 |
|
登録された各取引所の名称 |
|
|
同法第12条(G)に基づいて登録された証券:ありません
登録者が証券法第405条に規定する有名な経験豊富な発行者である場合は、再選択マークで表示してください
登録者がこの法第13又は15(D)条に従って報告書を提出する必要がないか否かを、再選択マークで示す。はい。☐
登録者が(1)過去12ヶ月以内(または登録者がそのような報告を提出する必要があるより短い期間)に1934年の証券取引法第13条または15(D)条に提出されたすべての報告書を再選択マークで示すかどうか、および(2)このような提出要求を過去90日以内に遵守してきた
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
|
☒ |
|
ファイルマネージャを加速する |
|
☐ |
|
|
|
|
|
|||
非加速ファイルサーバ |
|
☐ |
|
規模の小さい報告会社 |
|
|
|
|
|
|
|
|
|
|
|
|
|
新興成長型会社 |
|
|
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
これらのエラーのより真ん中に登録者の任意のエンタルピーCER幹部が相関回復期間内に§240.10 D−1(B)に基づいて受信したインセンティブベースの補償に基づいて回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、そうです
2023年6月30日の普通株の終値によると、登録者の非関連会社が保有する普通株の総時価は約#ドルである
2024年2月21日現在、登録者が発行した普通株の数は
引用で編入された書類
登録者の最終委託書のうち2023年株主総会に関連する部分は,本年度報告の10−K表第III部分に引用的に組み込まれており,範囲は本明細書で述べた範囲内である。最終委託書は登録者が2022年12月31日までの財政年度の120日以内に提出する。引用により本10-Kテーブルに明示的に含まれる情報を除いて,依頼書は本10-Kテーブルの一部として提出されるとはみなされない.
前向き陳述に関する警告説明
このForm 10−K年次報告書には、1934年“証券取引法”(改正)第21 E節又は“取引法”及び“1933年証券法”(改正)第27 A条又は“証券法”の意味に適合する前向きな陳述が含まれている。歴史的事実の陳述を除いて、本年度報告に含まれるすべての陳述は、私たちの将来の運営結果と財務状況、業務戦略、市場規模、潜在的成長機会、非臨床および臨床開発活動、私たちの候補製品の治療効果と安全性、私たちの候補製品の潜在的な治療効果と経済的価値、公開された純収益の使用、候補製品が受けた特定の指定された利益を維持し、確認する能力、非臨床研究および臨床試験の時間と結果、第三者とのビジネス協力、商業化協定のマイルストーンおよび特許権使用料支払いの能力、グローバル業務またはマクロ経済状況の潜在的影響、本プレスリリースに含まれる展望的表現は、インフレ、金利変化、ネットワークセキュリティ事件、グローバル銀行システムの潜在的不安定、連邦債務上限と予算の不確実性、およびこれに関連する潜在的政府の閉店、私たちの業務のグローバル地域衝突および潜在的規制指定、製品候補の承認と商業化の受信と時間スケジュールを含み、すべて前向き声明である。“信じる”、“可能”、“そうなる”、“可能”、“推定”、“継続”、“予想”、“予測”、“目標”、“意図”、“可能”、“会議すべき”、“プロジェクト”、“計画”、“予想”、および未来のイベントまたは結果の不確実性を表す他の同様の表現は、すべての前向き表現がこれらの識別可能な言葉を含むわけではないが、前向き表現を識別することを意図している。
これらの展望的陳述は、第1の部分1 A項“リスク要因”および本年度報告の他の部分で説明されたリスク、不確定要素、および仮説を含む多くのリスク、不確定要素および仮説の影響を受ける。また、私たちは競争が非常に激しく、変化が迅速な環境で運営されており、新たなリスクが時々発生している。私たちの経営陣はすべてのリスクを予測することはできませんし、すべての要素が私たちの業務に与える影響を評価することもできません。あるいは任意の要素や要素の組み合わせは、実際の結果が私たちが行う可能性のある任意の前向きな陳述に含まれる結果と大きく異なる程度をもたらす可能性があります。これらのリスク、不確定性と仮定を考慮して、本年度報告で議論された前向き事件と状況は発生しない可能性があり、実際の結果は展望性陳述中の予想或いは示唆の結果と大きく異なる可能性がある。
あなたは未来の事件の予測として前向きな陳述に依存してはいけない。私たちは展望性陳述に反映された予想は合理的であると考えているが、私たちは展望性陳述に反映された未来の結果、活動レベル、業績或いは事件と状況が実現或いは発生することを保証できない。法律の要件を除いて、本報告書の発行日後に、これらの陳述が実際の結果または私たちが予想する変化に適合するように、任意の理由で任意の前向き陳述を公開更新する義務はありません。あなたが本年度報告書を読む時、私たちの未来の実績、活動レベル、業績、事件、状況は私たちの予想とは大きく違うかもしれません。
文脈が別に説明されていない限り、本Form 10−K年次報告で使用される用語“初日”、“会社”、“私たち”、“私たち”および“私たち”は、別の説明がない限り、最初の日にバイオ製薬会社、デラウェア州の会社およびその合併子会社を全体として意味する。“初日”およびすべての製品候補名は、私たちの一般法商標です。本年度報告書には,他社の他の商号,商標,サービスマークが含まれており,これらはそれぞれの所有者の財産である。私たちは、これらの他社との関係、またはこれらの他の会社の私たちへの支援または賛助を示唆するために、他社の商標、商標またはサービスマークを使用または展示するつもりはありません。
カタログ表
|
|
ページ |
第1部 |
|
|
第1項。 |
業務.業務 |
1 |
第1 A項。 |
リスク要因 |
42 |
項目1 B。 |
未解決従業員意見 |
111 |
プロジェクト1 C。 |
ネットワーク·セキュリティ |
111 |
第二項です。 |
属性 |
114 |
第三項です。 |
法律訴訟 |
114 |
第四項です。 |
炭鉱安全情報開示 |
114 |
|
|
|
第II部 |
|
|
五番目です。 |
登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
115 |
第六項です。 |
保留されている |
116 |
第七項。 |
経営陣の財務状況と経営成果の検討と分析 |
117 |
第七A項。 |
市場リスクの定量的·定性的開示について |
128 |
第八項です。 |
連結財務諸表と補足データ |
128 |
第九項です。 |
会計と財務情報開示の変更と相違 |
128 |
第9条。 |
制御とプログラム |
128 |
プロジェクト9 B。 |
その他の情報 |
129 |
プロジェクト9 Cです。 |
検査妨害に関する外国司法管区の開示 |
130 |
|
|
|
第三部 |
|
|
第10項。 |
役員·幹部と会社の管理 |
131 |
第十一項。 |
役員報酬 |
131 |
第十二項。 |
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
131 |
十三項。 |
特定の関係や関連取引、取締役の独立性 |
131 |
14項です。 |
最高料金とサービス |
131 |
|
|
|
第4部 |
|
|
第十五項。 |
展示·財務諸表明細書 |
132 |
第十六項。 |
表格10-Kの概要 |
134 |
i
第1部
情報技術EM 1.ビジネス。
概要
設立初日は重要な満足されていない需要を解決するためである:児童癌治療発展の深刻な不足。私たちの名前のインスピレーションは、医師と患者とその家族が初歩的な癌診断と治療計画について行った“初日トーク”に由来している。われわれの目標は,1日目から抗癌剤の開発を再想定し,年齢にかかわらずすべての癌患者の可能性を再定義することである。
我々は臨床段階の生物製薬会社であり,生命にかかわる疾患を有するすべての年齢層の人のための標的治療の開発と商業化に取り組んでいる。我々は最初の臨床開発努力を癌を有する小児科患者に集中させており,これは脆弱な集団であり,最近の標的治療や免疫腫瘍学革命では十分なサービスが得られていない。
我々の主要候補製品tovorafenibは経口、脳浸透、高選択性II型急速加速線維肉腫、またはRAF、キナーゼ阻害剤である。トヴォラファニーは450人以上の患者で検討されており,単一療法として全体的な耐性が良好であることが証明されている。Tovorafenibはすでに児童と成人群の中で鼓舞的な抗腫瘍活性を示し、その特定の遺伝子変化はマイトジェン活性化プロテインキナーゼ(MAPK)の過剰活性化を招き、細胞成長の暴走を招く。
Tovorafenibは2020年8月にアメリカ食品と薬物管理局(FDA)によって再発或いは難治性児童低レベルグリオーマ(PLGG)の治療に許可され、これは一期試験に基づく初歩的な結果であり、この試験はpLGG患者が迅速な抗腫瘍活性と持続的な反応を有することを表明した。児童低レベルグリオーマは児童に最もよく見られる脳腫瘍である。最近pLGG患者に使用できる新しい標的治療方案があるが、現在合意されていない看護標準はなく、大多数のpLGG患者はまだ承認されていない治療法である。著者らは2020年9月にFDAから悪性グリオーマ治療の孤児薬物指定を受け、2021年5月にEUグリオーマ治療委員会から指定された孤児薬物を獲得した。そのほか、FDAは2021年7月にtovorafenibによる低レベルグリオーマ(LGG)の治療の稀な小児科疾患の称号を授与し、この腫瘍は活性化されたRAF変化が存在する。
我々は,BRAF変化の再発または難治性LGGを活性化する小児科患者のための単一療法としてFirefly−1の重要な2期試験を開始し,完全に募集した。最初の患者は2021年5月にFirefly−1の用量治療を受け,2022年5月にARM登録を完了した。Firefly-1試験はまた、(A)主要なキューの登録が完了した後、条件に適合する患者により多くの機会を提供するための他の2つの研究枝を含み、(B)6ヶ月~25歳までの再発または進行性頭蓋外固形腫瘍を有し、RAF融合を活性化する患者におけるtovorafenibの初歩的な治療効果を評価する。
われわれは2023年6月の米国臨床腫瘍学会年次総会で2期Firefly−1試験登録部門からの新しいデータを報告した。また,他の6カ月の安全性と有効性データを含む更新された臨床研究報告書をFDAに提出した。データによると,69名の評価可能な患者のうち,神経腫瘍学−高レベルグリオーマ反応評価(RANO−HGG)により,総有効率(OOR)は67%であり,確認された完全応答(CR)12名と部分応答(PR)34名を含む。著者らは他の18名の病状安定(SD)の患者を観察した結果、臨床受益率は93%(任意の病気経過のCR+PR+未実証のPR+SD)であった。
その他の二次分析と探索性終点分析は小児科神経腫瘍学低レベルグリオーマ反応評価(RAPNO-LGG)と神経腫瘍学低レベルグリオーマ反応評価(RANO-LGG)による反応評価を含む。RAPNO−LGGデータによると、RAPNO−LGG評価可能な76名の患者のうち、ORRは51%であり、28名のPRおよび11名の軽微な反応を含むか、または他の23人の患者のSD最適反応が観察され、臨床受益率82%(PR+未確認PR+MR+未確認MR+任意のSD)をもたらした。
RANO−LGGデータでは,RANO−LGG評価可能な76名の患者のうち,PR 20名とMRS 20名を含め,ORRは53%であった。著者らは他の23名のSDに対して最も良い反応がある患者を観察し、臨床受益率は83%(PR+未実証のPR+MR+未実証のMR+任意の病気経過のSD)であった。137名の治療を受けた患者の安全性データによると,ボルラフェニの単一療法は全体的に耐性が良好であった。ほとんどの不利な要素は
1
イベントはレベル1またはレベル2であり,tovorafenibに関連する副作用が最もよく報告されているのは,発色変化(76%),貧血(59%),クレアチンホスホキナーゼ上昇(58%),疲労(55%),嘔吐(50%)であった。
腫瘍減少はいかなる抗癌治療の重要な目標であるが、腫瘍安定はpLGG患者に対して同様の臨床意義があり、両者とも疾病の即時と長期後遺症のリスクを低下させるため、そうでなければこの疾病の生存率は合理的である。PLGGのような慢性で通常手術できない腫瘍の場合、1つの重要な治療目標は、腫瘍が自発的老化状態に入るまで、少なくとも数年以内に疾患の安定を達成し、それによって、腫瘍が自発的老化状態に入るまで、隣接する脳構造への不可逆的な損害を防止することであり、これは通常、若い成人で発生する。このような数年以内に腫瘍制御を実現する特殊な背景の下で、多くのpLGG患者は承認された治療法が不足していることから、標的治療は有益であると考えられている。2023年9月、再発または難治性pLGG患者の治療のための錠剤製剤およびtovorafenib粉末溶液製剤の転動新薬出願(NDA)申請を完了した。FDAは2023年10月にNDAの届出を受け優先審査権限を付与し,処方薬使用料法案(PDUFA)の目標行動日を2024年4月30日とした。本文書提出日までにFDAは,諮問委員会会議を開催してNDAを検討するつもりはないと述べている。
2022年6月、著者らは6ケ月から25歳までのpLGG患者を治療する第一線の治療法としてtovorafenibを評価する重要な3期試験、すなわちFirefly-2を開始した。2023年3月,1人目の患者はFirefly−2を服用した。これまで,患者は米国,カナダ,ヨーロッパ,オーストラリア,アジアに登録を継続し,約80サイトを活性化してきた。
私たちの第二の候補製品pimasertibは経口的、高選択的なマイトジェン活性化プロテインキナーゼ1と2またはMEKの小分子阻害剤であり、MEKはMAPK経路中の重要なシグナルノードである。Pimasertibはすでに850名を超える異なる腫瘍タイプの患者の10個以上の1/2期臨床試験で検討されており,単一療法としても標準看護療法とも組み合わせている。すでに発表された臨床前研究から,Pimasertibは他のMEK阻害剤と比較して高い中枢神経系浸透率を有することが示唆された。
我々は、tovorafenibの単一治療または併用治療として、開放ラベル、多中心、1 b/2 a期の傘式主試験、または火光-1を開始し、この試験は2つのサブ研究を含む。サブ研究1は,12歳以上のMAPK経路変化を有する再発,進行性あるいは難治性固形腫瘍患者に単一療法としてトボルフェニが用いられた2 a期試験である。全体的な耐性の良好な治療反応が認められたにもかかわらず,このようなまれな患者群で観察される反応持続時間は限られていた。われわれは2023年11月にこの単一療法の亜研究を中止し,資源を他の項目に再配向することを決定した。最終データセットが利用可能になった後、サブ研究の結果は、プレゼンテーションまたは発表のために共有される。第二の研究は,トヴォラフィニとピマチニブが12歳以上で種々のMAPK変化を有する固形腫瘍患者における1 b/2期併用試験である。臨床前モデルでは,RAFとMEKの同時抑制は協同抗腫瘍活性を引き起こすことが証明されている。この組み合わせは、NRAS変異黒色腫および肺癌、クラスII BRAF変化によって駆動される腫瘍、BRAF野生型融合を有する腫瘍、およびKRAS変化によって駆動される腫瘍を含む、MAPK変化によって駆動される様々な成人固形腫瘍において増強された抗腫瘍活性を示す可能性がある。そのほか、いくつかの小児科腫瘍もMAPK経路の協同抑制から利益を得る可能性がある。1人目の患者は2022年5月に用量治療を受け,現在患者参加子研究の共同用量選択部分を積極的に募集している。私たちは、特定の患者集団の拡張キューのために、2024年下半期に推奨される第2段階用量およびスケジュールを決定する予定である。
2023年8月、私たちはSprint Bioscience ABまたはSprintと研究協力および許可協定、またはSprint許可協定を締結し、Sprintはスウェーデンのハディンガーに位置するスウェーデン会社である。Sprint許可プロトコルによると、Sprintは著者らに独占的な全世界許可を授与し、複数のレベルを通じて再許可を授与し、薬物製品を研究、開発と商業化する権利があり、そしてVRK 1或いはVRK 1の発見、最適化と開発を目的とした研究に従事している。VRK 1は細胞分裂とDNA損傷修復の調節に参与する新しい目標である。多くの成人と児童癌において、VRK 1の過剰発現は予後不良と関係があり、VRK 1はすでにその類似遺伝子VRK 2発現欠損腫瘍の合成致死標的と考えられている。多くの高レベルグリオーマとハイリスク神経芽細胞腫において、プロモーターメチル化によりVRK 2の発現を沈黙化することが注目されており、これはVRK 1抑制に敏感な腫瘍患者を選択するために具体的な方法を提供した。VRK 1計画を進める臨床前研究活動が行われている。
私たちの業務開発能力は腫瘍学薬物開発における著者らの豊富な経験と研究と患者権益提唱コミュニティとの深いつながりと結合しており、特に小児科では
2
このような背景から,すべての年齢層患者に適した治療法を識別·取得·開発するリーダーとなる。私たちはすべての治療分野でtovorafenibとpimasertibの世界的な独占権利を持っているが、いくつかのマイルストーンと特許権使用料を支払わなければならない。
毎年,米国では約15,500人の18歳以下の児童が癌と診断され,世界には約300,000名がいる。また、癌は依然としてアメリカの児童に最もよく見られる疾病の死亡原因であり、毎年1700人以上が癌で死亡している。児童癌はもっと安全、もっと有効な治療方法が必要であるが、児童患者に応用される新薬は非常に少ない。1997年から2017年までの間にFDAの許可を得た117種類の非ホルモン腫瘍学薬物の中で、6種類のみが初歩的な承認を得ており、その中に児童を含む。通常,小児の薬品テストは成人試験が臨床開発に達する後期段階に延期される。そのため、腫瘍学製品候補の第1回小児科試験は通常成人初臨床試験後約6年後に開始される。
また,小児科腫瘍学でアドレス可能な亜群を定義するために必要な大規模分子マップデータセットの産生は最近発生している。著者らは小児科癌生物学に対する理解が進展し、薬物遺伝変化を有する患者群を掲示した。著者らの管理チームは豊富な小児科腫瘍学と稀な疾病薬物開発経験を持っており、彼らはtovorafenibのような標的療法を信じて、もっと早く児童の中で研究を行い、児童癌の中で大量に満足されていない需要を満たす可能性があり、この場合、腫瘍の特定の遺伝駆動要素に対する新しい薬物は長期予後を著しく改善することができる。
著者らのチームの小児科腫瘍学における広範な能力と経験、及び著者らと小児科医学界のすべての肝心な利益関係者との関係は、著者らが小児科薬物開発の挑戦とニュアンスを有効に制御できるようにした。児童の臨床発展は簡単に小成人の臨床発展と見なすべきではないことを理解している。有利な制御経路の潜在力、即ち突破性治療と孤児薬物指定を考慮して、著者らは著者らの独特な専門知識を利用して著者らの初歩的な開発努力を小児科患者に集中した。
私たちは児童やその家族が癌と戦うのを助けるとともに、長期にわたって満たされていない医療ニーズを解決するように駆り立てられている。著者らは小児科患者の中で新しい腫瘍候補製品を開発することは多くの独特な優勢があると信じている
3
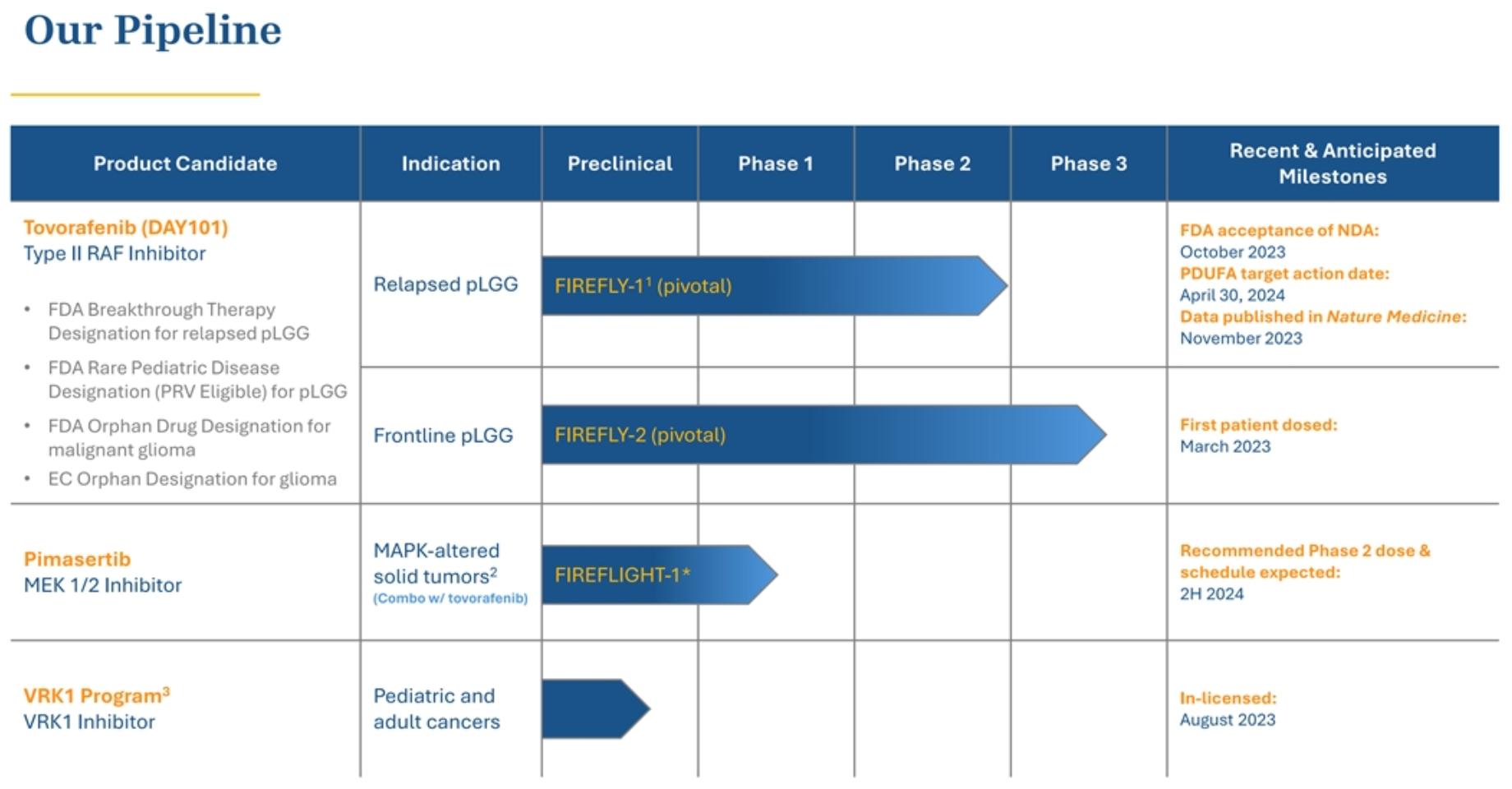
著者らは高需要癌に対する高価値発癌駆動要素の候補製品の識別、獲得と開発を求め、最初の重点は小児科患者である。次の表に私たちの候補製品ルートをまとめました。

著者らの主要な候補製品tovorafenibは経口、脳浸透、高選択性のII型RAFキナーゼ阻害剤であり、単量体RAFキナーゼを抑制することもでき、ダイマーRAFキナーゼも抑制できる。Vemurafenibやencorafenibなどの承認されたBRAF製品は,I型RAF阻害剤と呼ばれ,RAFモノマーのみを抑制するため,BRAF V 600改変のための腫瘍に限られている。I型RAF阻害剤とは異なり,トレフラフィニは臨床有効量でRAF野生型細胞の矛盾した活性化を引き起こすことが証明されていない−この現象では,望ましくないMAPKシグナルの増加が腫瘍再成長を引き起こす可能性がある。RAF単量体と二量体に対するTovorafenibの抑制はRAS或いはRAF変化を治療する固形腫瘍アレイの潜在的な臨床応用を拡大した。また,tovorafenibは他のMAPK経路阻害剤よりも高い脳浸透率,分布,曝露を有することが示唆された。以上より,tovorafenibはpLGGの高影響標的治療薬となる可能性があり,pLGGではpLGGの半分以上がRAF変化による異常信号によって駆動されていると考えられる。
この理論的基礎は,Dana−Farber癌研究所の研究者がpLGGにおいてtovorafenibを開発し始めた基礎である。1つの第1段階用量増加研究において、9名の小児科患者(
私たちの第二の候補製品pimasertibは経口的な高選択性小分子阻害剤MEK 1と2であり、それはMAPK経路中の重要なシグナルノードである。いくつかのMEK阻害剤が規制されています
4
BRAF V 600変異腫瘍に対するI型RAF阻害剤との併用が承認された。臨床前実験により、MEK阻害剤とII型RAF阻害剤の併用の潜在的利益はもっと大きい可能性があり、II型阻害剤の下流シグナル伝達に対する矛盾した影響が乏しいためである。TovorafenibがRAF単量体と二量体を選択的に抑制する能力はその潜在的な臨床応用の将来性を広げる可能性があり、MEKと結合してRAS変化、非BRAF V 600突然変異とRAF融合によって駆動される固形腫瘍を抑制する。
著者らは生物製薬会社の設立に成功記録を持つ指導チームと、小児科薬物開発において独特な経験と能力を持つ薬物開発チームを結成した。我々の最高経営責任者Jeremy Bender,Ph.D.,M.B.A.は15年以上のバイオ製薬リーダー経験を会社にもたらした。彼は以前ジリード科学会社で企業発展副総裁を務め、そこで彼の指導チームはギリッド社の買収、協力と株式投資を担当し、そして40余りの取引を監督し、前払いは100億ドルを超え、その中にForty Seven,Inc.の買収を含む。サミュエル·ブラックマン医学博士、著者らの共同創業者兼研究開発担当は、小児科血液学/腫瘍学と神経腫瘍学の訓練を受けた内科科学者であり、10種類以上の新型癌療法の早期臨床開発を指導し、Dradfenibの小児科開発を担当した。それによって、業界が賛助した最初の小児科腫瘍学“バスケット試験”を産生した。チャールズ·ヨーク二世は私たちの首席運営と財務官で、Aeglea BioTreateutics,Inc.(現在のSpyre Treateutics,Inc.)で首席財務官と企業発展主管を務め、20年以上の戦略資本形成と指導経験を持っている。私たちの首席商務官Lauren Merendinoは以前Myovant Sciences Ltd.(現在のSumitovant Biophma Ltd.)で首席ビジネス官を務めていた間、3つの適応の2種類の製品の成功発表を指導したことがあり、彼女は経験豊富な商業リーダーであり、25年以上の製薬とバイオテクノロジーの指導経験を持ち、商業チームの創立と指導の専門知識を持ち、そして製品の発売に成功した記録がある。著者らの首席開発官、PharmDのDavy Chiodinは成人と児童腫瘍薬物開発において15年以上の経験を持ち、Acerta Pharma B.V.(現在アスリカン)でacalabrutinibを開発し、羅氏/遺伝子テークで小児科腫瘍学の全世界監督管理責任者を務めた。Elly Barry医学博士,我々の首席医療官は,最近わが社で臨床開発担当を務め,わが社の臨床計画を実行する上で不可欠な役割を果たしている。2021年にわが社に加入する前に、バリー博士は輝瑞小児科腫瘍学の全世界の臨床主管であり、輝瑞小児科腫瘍学指導チームの責任者でもあり、多数の腫瘍学臨床プロジェクトの監督を担当している。我々の技術運営ディレクターであるマイク·プリー博士は製品開発において25年以上の経験を持ち,アレイバイオ製薬会社(すなわち現在のファイザー社)でCMC担当者を10年以上務め,20件以上の新薬研究申請を提出し,ビニチニブやツカチニブなどの上場薬の開発を支援している。アダム·ドゥボは私たちの総法律顧問兼首席コンプライアンス官で、20年以上の業界経験を持ち、最近では百時美施貴宝社で首席コンプライアンスと道徳官を務め、アメリカ、アジア、ヨーロッパで様々な法律や政策の職務を担当している。Jaa Roberson、私たちの首席人事官は、バイオ製薬、医療保険、小売業界で20年間の人材経験を持っています。彼女は以前Bellicum PharmPharmticals,Inc.の人的資源担当を務めており,細胞免疫腫瘍学に焦点を当てた臨床段階バイオ製薬会社である。
私たちの戦略
私たちはサービス不足の患者群を解決するために、治療薬を識別、開発と商業化することによって、差別化された全世界の生物製薬会社を構築する使命駆動の戦略があり、最初の重点は小児科患者である。私たちの戦略の主な内容は
5
6
私たちの方法:小児癌や他の高度に満たされていない需要分野を優先する
わが社は小児科患者のために新たな標的治療薬を優先的に開発することに集中している。歴史的には,多くの製薬会社が新たな癌療法の発見と開発の努力を成人腫瘍型に集中させている。したがって,1997年から2017年の間にFDAが初歩的に承認された腫瘍学的適応の126薬剤については,初回成人試験と初回小児試験の間の中位期間は6.5年であり,化学療法薬,生物製剤,標的治療薬であった。
小児科腫瘍学的薬物開発に関する歴史的仮定を見直し,是正するのに適したタイミングであると考えられる。このようにすると同時に、小児科患者の中で新しい腫瘍候補製品を開発することは独特の優位性があり、成人適応と並行して、成人適応よりも先になると信じている
わが社は小児科腫瘍患者に緊急の標的治療を提供する上で恵まれた優勢を持っている。著者らはこれらの患者の面で広範な能力と経験を持っており、著者らと小児科医学界のすべての重要な利益関係者との信頼できる関係は、小児科薬物開発の挑戦とニュアンスを有効に制御することができる。小児科腫瘍学の機会を成功的に識別し、利用することができる主な利点は以下の通りである
7
これらの能力は著者らが的確な治療方法を開発し、小児科患者に利益を得ることができる。我々はこの発展分野のリーダーであると信じており,この地位をさらに推進するために,バイオ製薬会社,学術小児科腫瘍学者や科学者および患者権益団体と相談と戦略協力を継続し,小児科腫瘍学で満足されていない領域を決定し,影響力の高い資産を買収し,これらのサービス不足患者を解決する予定である。われわれは最初は小児科患者に重点を置いていたが,成人群にも同等の強度の標的治療の臨床開発を求めている。
私たちの候補製品
著者らは高需要癌に対する高価値発癌駆動要素の候補製品の識別、獲得と開発を求め、最初の重点は小児科患者である。われわれの臨床開発は,小児科腫瘍学環境における我々の独自の専門知識の利用から始まったが,成人癌患者に対する標的治療を同等の強度で進めることに取り組んでいる。次の表に私たちの候補製品ルートをまとめました。
トヴォラファニー
私たちの主要な候補製品tovorafenibは経口、脳透過、高選択性II型RAFキナーゼ阻害剤である。トヴォラファニーは325名の患者で検討されており,単一療法として良好な耐性を示した
8
そして、特定のMAPK経路の変化を有する児童と成人群の抗腫瘍活性を奨励する。TovorafenibはすでにFDAによってpLGG患者の治療のための突破的な治療指定を許可されており、これは第1段階試験の初歩的な結果に基づいており、この試験はpLGG患者が迅速な抗腫瘍活性と持続的な反応を有することを示している。われわれは現在,pLGG患者の単一療法としてtovorafenibのキー2期Firefly−1試験を完全に募集しており,pLGGは小児で最もよく見られる脳腫瘍であり,現在のところ承認されていない治療法であり,多くの患者の看護基準も認められていない。Firefly-1試験はまた、(A)主要なキューが登録されているので、合格患者のアクセス範囲を拡大するための他の2つの研究分枝を含み、(B)6ヶ月~25歳までの再発または進行性頭蓋外固形腫瘍を有し、RAF融合を活性化する患者におけるtovorafenibの初歩的な治療効果を評価する。われわれは2022年6月にこの試験の中期分析の予備データを報告し,2023年1月に全患者の主なデータを報告した。著者らは2023年6月のアメリカ臨床腫瘍学会年会で2期Firefly-1試験登録部門からの新しいデータを報告し、2023年11月の神経腫瘍学会年会で精選分析を報告した。2023年9月、再発または難治性pLGG患者の治療のための錠剤製剤およびトボルフェニ粉末製剤の転動NDA提出を完了した。FDAは2023年10月にNDAの届出を受け優先審査を承認し,PDUFAの目標行動日は2024年4月30日であった。FDAはこの申請を議論するために諮問委員会会議を開催するつもりはないと述べた。
2022年6月、著者らは6ケ月から25歳までのpLGG患者を治療する第一線の治療法としてtovorafenibを評価する重要な3期試験、すなわちFirefly-2を開始した。2023年3月,1人目の患者はFirefly−2を服用した。これまで,患者は米国,カナダ,ヨーロッパ,オーストラリア,アジアに登録を継続し,約80サイトを活性化してきた。
Tovorafenib単独で他の薬剤との併用も検討されており,これらの薬剤はMAPK経路における重要なシグナルノードに対して,患者群において各種RASやRAF変化が疾患推進に重要な役割を果たしていると考えられている。
RAFキナーゼ駆動細胞増殖と癌化
細胞の成長、生存と分化などの機能は下落などのシグナルイベントの調節を受け、RAFキナーゼはその中の重要な構成部分である。RAFはプロテインキナーゼであり、通常RASによって活性化され、RASは活性化シグナルを細胞外受容体からRAFに伝達するタンパク質である。RAFの活性化はMEKキナーゼやMAPK下流経路の活性化を引き起こす。この経路の過剰活性化を招く遺伝子改変、例えばRAS或いはRAF変化は、長い間ずっと発ガンと考えられてきた。
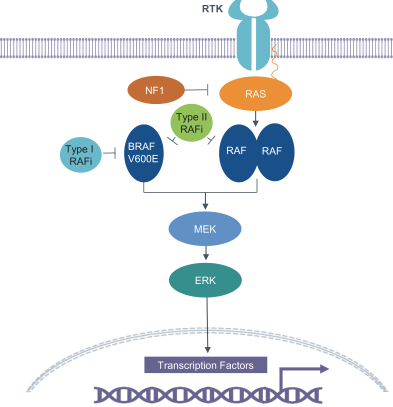
9
図1.RAFキナーゼ(ARAF、BRAF、CRAF)はMAPK経路の重要な構成部分である。BRAF V 600 Eは、モノマーとしてシグナルを発することができ、I型およびII型RAF阻害剤に感受性である。野生型RAFダイマーはII型RAF阻害剤にのみ敏感である。原作はソレットとローソン癌発見2014です
この経路の中で最もよく見られる改変遺伝子の一つはBRAFであり、それはヒト細胞中の三つのRAF遺伝子の一つであり、RAFが最もRASによって活性化されやすい形式でもある。BRAFの多くの変化はV 600と呼ばれる変異である。V 600の変異は、非変異型または野生型BRAFをBRAFの一形態に変換し、この形態のBRAFはシグナル活性を増加させ、RASに依存しなく活性化する。V 600変異体BRAFの豊富さ及び腫瘍成長における核心作用はそれを歴史上の薬物発見努力の焦点にした。
もう一つの重要な発癌BRAF変化はBRAF野生型遺伝子融合である。BRAFに関与する遺伝子融合は染色体内や染色体間の再配置によって起こり,その中で無関係タンパク質の遺伝子が物理的に結合し,キメラタンパク質の合成を引き起こす。BRAFはBRAF活性を調節する制御ドメインと1つの触媒活性化領域からなり、触媒活性化領域は下流シグナルを活性化し、それによって細胞成長を促進する。BRAF融合において、BRAFの調節ドメインは異なる配列で置換され、BRAFはRAS活性化とは独立してシグナルを発することができる。BRAF調節ドメインと触媒ドメインのこのような脱共役は重要な結果がある:そこから産生された新しい癌遺伝子は異常に発現し、組成或いは常に活性化された活性化ドメインも示した。このキナーゼ活性は下流の発癌シグナルの活性化を招き、腫瘍の成長を悪化させることができる。BRAF遺伝子融合はすでに前立腺癌、黒色腫、放射線誘導甲状腺癌およびpLGG患者に観察されている。
FDAは、黒色腫、非小細胞肺癌、間変性甲状腺癌および結腸直腸癌を含むBRAF V 600 EまたはV 600 K変異のみを含むいくつかの固形腫瘍の治療に3種類のBRAF阻害剤を許可した。これらの第1世代BRAF阻害剤は,I型RAF阻害剤であり,ベモラファニーであり,遺伝子テークによってZelborafの名称で販売されていること,ノワール社による名称で販売されているダプラファニ,およびファイザー社がBraftoviの名称で販売していることがより知られている。しかし,単一治療1型RAF阻害剤は最初に臨床反応があったにもかかわらず,多くの患者は治療開始後1年以内に再発した。
I型RAF阻害剤に対する耐性の一つの様式は,細胞における正常RAF活性化の機序に関与している。モノマー活性であるV 600 EやV 600 K変異体とは異なり,正常なRAF機能はRAFの二量体を形成する必要がある。許可されたV 600 E/K BRAF阻害剤は、RAFダイマーまたは他の非V 600 BRAF変異の活性を阻害することができない。実際、これらのインヒビターのいくつかがV 600 E/K BRAFに結合することは、二量体の形成を刺激し、RAF野生型細胞における矛盾した活性化(MAPキナーゼシグナルの意外な増加)をもたらす-この現象は新しい腫瘍成長を引き起こす可能性がある。野生型RAFの矛盾活性化は非腫瘍組織でも発生する。これはこれらの薬物に関連するよく見られる不良イベントである増殖性、癌前と悪性皮膚病変の発展を招く。薬剤耐性や矛盾の活性化を避けるためには,I型RAF阻害剤はMEK阻害剤と併用する必要があることが多いが,同様にBRAF V 600 E/K変異患者にのみ適用される。
10
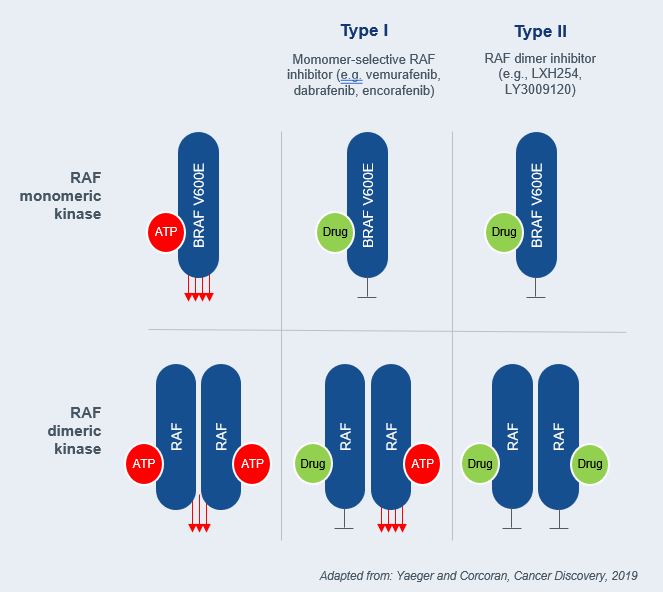
[図2]モノマーRAFキナーゼ(すなわち、BRAF V 600 E;上部)またはダイマーRAFキナーゼ(下部)に対する異なるRAF阻害剤の影響を示す模式図である。ERK活性化はBRAF V 600 E下流で強く活性化され,ダイマーRAFキナーゼシグナルよりも強い。単量体選択的I型RAF阻害剤はBRAF単量体中のATP部位に結合し,下流シグナル伝達を抑制する。RAFダイマーキナーゼでは,薬物の結合が結合したRAF原型を抑制したが,二量体中のもう一つの原型の立体構造変化とこの原型の強いトランス活性化を招き,ERKの全体活性化(矛盾活性化)を招いた。II型RAF阻害剤は,変異RAF単量体および二量体に同じ用量で結合することができるため,変異RAF単量体および二量体を同じ用量で抑制することができる。イェーガーとコクランが原作で、“癌発見”、2019年。
V 600 E/K改変に対するI型RAF阻害剤はKIAA 1549−BRAF遺伝子融合における野生型RAF作動域を抑制できないため,この融合による過活性化シグナル伝達を効果的に抑制することができなかった。また,矛盾した活性化の可能性があるため,これらのRAF阻害剤はBRAF遺伝子融合患者では禁忌である。
トヴォラフィニの作用機序は
Tovorafenibは、野生型RAF、BRAFおよびCRAF融合タンパク質、ダイマーとしての変異体(クラスII変異)、およびBRAF V 600 Eおよび非V 600 E変異(クラスI変異)などのモノマーとしての変異体を含む複数の形態のRAF活性を阻害することができる選択的小分子RAF阻害剤である。Tovorafenibは単量体と二量体RAFキナーゼを同時に阻害するように設計されているII型RAF阻害剤と考えられている。RAF単量体と二量体に対するTovorafenibの抑制は一連のRAF変化の腫瘍の治療における潜在的な臨床応用を拡大した。
11
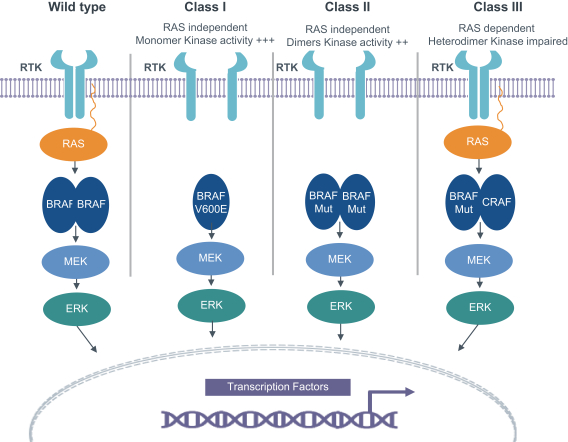
[図3]異なるタイプのBRAF変異におけるシグナル経路。BRAF V 600突然変異(第I類)はRASシグナルとは独立し、単体の形式で作用を発揮する。BRAF非V 600第二類突然変異もRASと独立しているが、構造的二量体としてシグナルを発している。クラスII変異はBRAF野生型融合を含む。非V 600 IIIクラスBRAF変異は低いまたはないキナーゼ活性を有し、RASの活性化に依存してRASシグナル経路の増幅器として機能する。Tovorafenibは、BRAF野生型融合および非V 600 E/K変異を含むクラスIおよびクラスII RAF変化を阻害することができる。FontanaとValeri、臨床癌研究、2019年から修正された。
児童低レベル脳グリオーマ疾患と治療概要
児童低レベルグリオーマは児童に最もよく見られる脳腫瘍であり、すべての中枢神経系腫瘍の30%-50%を占める。ほとんどの場合、このような腫瘍の成長は遅く、慢性的で非情だ。PLGGsの悪性転化と拡散は希であるが、この疾患は多くの長期的な結果がある。PLGGの成長は高度に病態であり,pLGG腫瘍は占拠性病変であるため,脳中の重要な神経血管構造を圧迫する可能性がある。腫瘍の位置や周囲組織にかかる圧力の大きさによって患者の症状が異なる可能性がある。これらの症状は、特に腫瘍の位置に依存する頭痛、吐き気、嘔吐、傾眠、第六脳神経麻痺、てんかん発作、および行動変化を含む可能性がある。PLGGを有する大多数の児童は長期の生存者であり、成人まで生きている;しかし、児童グリオーマの生存者は通常彼らの疾病および/または治療のために長期的な機能、神経と内分泌合併症を受ける。これらの患者はもっと有効な治療策略が必要であり、長期発病率と治療関連毒性を最小限に下げる。
PLGG患者は歴史上手術、放射線治療と化学療法を受けたことがある。手術によるpLGG切除は90%以上の10年総生存率と関係があるが、大多数の児童は完全切除を受けることができず、場合によっては、このような手術は顕著かつ長期的な発病率と関係があるかもしれない。不完全切除或いは切除できないpLGGは疾病の進展或いは再発率と高い相関がある。大部分切除患者の10年無進展生存率は55%であった。より現代的な放射線治療法は無進展生存率を改善できることが証明されているが,歴史的には,放射線治療は小児の神経認知結果が著しく低下するリスク,内分泌機能障害,二次性悪性腫瘍と脳卒中リスクの増加に関与している。したがって,現代放射線治療技術であっても,他のすべての治療法が失敗した場合に使用するために保持され続けている。
12
多くのpLGG患者は最初の系統的な治療が必要であり、カルボプラチンとビンクリスチンなどの連合化学療法を採用し、ある国では、ビンクリスチンは単一薬物として治療を行う。新たに診断されたpLGG児に対する最大規模のランダム3期研究の結果,ビンクリスチン/カルボプラチンの5年無事象生存率は47%であった。神経線維腫症と関係のないpLGG患者亜群、BRAF変化を含む患者の結果は比較的に悪く、39%の5年無事象生存率を示した。新たに診断されたpLGG患者の化学療法に対する全体応答率は30%−35%であったことに注意されたい。化学療法の治療効果の制限以外に、治療に関連する発病率も非常に高く、95%を超える患者は少なくとも1回の3級或いは4級の不良事件を経験したことがある。MAPK経路上に分子変化が存在する腫瘍型では,以下に述べるように,BRAFやMEKを含む多くの標的経路の治療法が評価されている。その中のいくつかの薬物は、pLGGを有する小児を含むBRAF V 600変異を含む腫瘍の治療のために許可されているが、これらの化学療法レジメンまたは標的治療失敗後の腫瘍進展の患者については、まだ合意されていない治療標準治療である。
多くのpLGGは患者の年齢が20歳に達した時に老化が出現するため、治療の目標は腫瘍を最大限にコントロールすることであり、同時に手術、化学療法と放射線治療に関連する毒性を最小限に下げることである。そのため、大量のpLGG患者は彼らの疾病過程中に複数の一連のシステム治療を受ける。
学術誌に発表された発症結果によると,毎年約1100名の25歳以下の患者がBRAF改変pLGGと新たに診断されていると推定される。2017年1月1日現在,米国の25歳以下のpLGG患者のSEER罹患率は26,000人と推定されている。トラフラフィニの再発,進行性あるいは難治性pLGG患者の定常状態では年間約2,000から3,000人がアドレス指定可能であると推定されている。
過去10年間に50%から60%のpLGGsがRAF変化による異常シグナルによって駆動されることが発見され,その約85%から90%がKIAA 1549−BRAFと呼ばれる遺伝子融合である。このような遺伝子改変は、その正常な調節ドメインではなく、野生型BRAF触媒ドメインの発現をもたらし、BRAFに構造的活性を持たせる。また,pLGGsを有する小児では5%から17%の腫瘍がBRAF V 600 E活性化変異を有していた。
BRAF V 600 E/K変異を持つ再発/進行期腫瘍患者への6歳以上のBRAF V 600 E/K変異を持つ再発/進行期腫瘍患者の併用薬にはダプラファニブ−トリメチニブが用いられているほか,現在のところこの群への薬剤は承認されていないため,臨床試験やラベル外処方でしか得られない。ラベル外使用は小児科腫瘍学環境によく見られるが,小児を潜在的なリスクに曝露し,長期安全モニタリングや薬物警戒活動などの包括的な臨床開発活動に伴う保障措置を伴わない副次的な方法と考えられている。PLGGに対する脳透過療法の開発は,これらの患者の予後改善に重要であり,特にBRAF融合を有する患者,BRAF V 600 E変異を有する患者の開発が信じられている
PLGGの臨床試験結果
Tovorafenibは現在,Dana−Farber癌研究所がPNOCと協力し,再発あるいは難治性グリオーマ(高レベルと低レベル)や他の腫瘍患者で評価する多中心研究(PNOC 014,NCT 03429803)を行っている。この試験はまだ開放されているが、新しい患者に対する費用は閉鎖されている。2023年6月までに44名の患者がこの第1段階用量逓増試験のB部分(A部分9例,B部分35例)に参加し,PNOCネットワーク内の複数の機関で行った。トヴォラフェニは週に1回、高用量は420 mg/mに達します2/週耐性良好、患者150万2530 mg/mまでの投与量です2/週は患者における耐性が良好であることが発見された2それは.2022年の神経腫瘍学会会議でB部分研究の35名の患者のデータが発表された。このグループの患者のうち、2名が完全に緩和し、7名が部分的に緩和し、15名の病状が安定し、8名が進行した。6種類の用量制限毒性があり、いずれも530 mg/m2/週は,いずれもグレード3,および5つの既知の副作用(2疲労,3つの皮疹,1カ月経過多)であった。
以下の図5に示すように、最初に2018年2月に開始された第1段階試験は、小児科患者の最大耐容量を決定することを目的としている。この試験のA部分は,単一療法の初期用量として3+3で設計されたトレフラフィニを用いて増加した。280 mg/平方メートルの開始用量は、成人によって推奨される第2段階用量の80%、すなわち、身体表面積調整後に600 mgを週1回経口投与する第2段階用量である。病人.病人
13
この試験に参加した患者は2年間にわたる治療を受けた。この試験は2019年12月に修正され、適応性設計を採用し、用量制限毒性或いはDLTS或いはMTDが観察されるまで用量が増加し続けた。
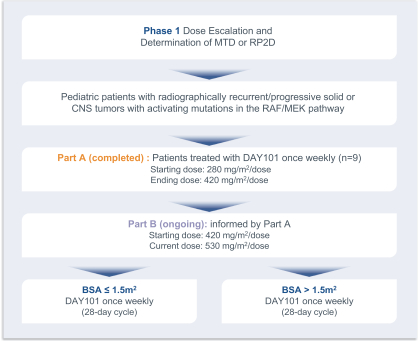
図4.pLGGにおけるtovorafenibの1期実験設計
Tovorafenibは研究者によって開始された第1段階試験(PNOC 014;NCT 03429803)で行われた研究であり、この試験では、Tovorafenibは経口速放錠として週1回、LGGsと他のRAS/RAF/MEK/ERK経路活性化腫瘍の再発或いは難治性腫瘍患者に用いられる。この研究A部分のデータは2020年11月に発表され、トレフラフィニは3つの異なる用量レベルで評価され、280 mg/m 2、350 mg/m 2、および420 mg/m 2であり、各用量レベルに3人の患者がいる。Tovorafenibは試験のすべての用量で耐性が良好であり、420 mg/m 2以下の用量を受けた患者は用量の減少または中断を有さなかった。これらの患者の中にDLTを経験した人は一人もいなかった。ほとんどの治療で発生する有害事象(TEAE)はレベル1またはレベル2である。眼科や心臓不良は観察されていない。A部分のすべての用量列の中で、最もよく見られるTEAEはすべて1級或いは2級であり、皮疹(89%)、髪灰白(無毛症)(78%)、色素母斑(78%)、貧血(67%)と掻痒(67%)を含む。1例の患者は単一の3級不良事件(クレアチンホスホキナーゼ上昇)が出現し、4級不良事件の報告がなかった。これらの副作用は可逆的で制御可能であることが発見された。
420 mg/平方メートルは最初はRP 2 Dと考えられていたが、A部分にすべての用量レベルの抗腫瘍活性が認められたため、本研究のB部分では引き続き用量が増加し、MTDの決定を試みた。この試験のB部分回復用量増加部分の後、用量増加は、身体表面積に応じて、530 mg/m 2以上の用量レベルで、所与の用量レベルで成人MTDを超える可能性があり、より小さい子供はそうではない可能性があることを考慮するために、2つのサブグループに分けられる。本研究B部分のデータは2022年11月に公表された。他に35名の患者がB部分PNOC 014:21名KIAA 1549:BRAF融合遺伝子を持つグリオーマ患者9名,BRAFV 600 E変異遺伝子を持つ腫瘍患者9名,新たなRAF遺伝子を持つ患者4名,FGFR 1遺伝子変異を有する腫瘍患者1例に参加した。組織学的には,行列は30個のLGG,4つの高レベルグリオーマと1つの軟組織肉腫を含む。6つのDLT:1個体当たり表面積またはBSA亜群が3個あり,いずれも530 mg/m 2/用量であり,いずれも3級,および5つの既知の副作用(2つの疲労,3つの皮疹,1カ月経過多)であった。この35名の患者では,トレフラフィニを毎週経口投与する耐性は良好であった。Tite−Boin持続再評価モデルはBSA 1.5 m 2の患者に週530 mg/m 2またはPOの経口投与を推奨しているが,BSA患者がDLTを受ける可能性がある
14
キーフェーズ2 Firefly-1とキーフェーズ3 Firefly-2研究.
全体的には,現在完成しているA部分からのデータであり,患者は2年間にわたる連続治療を受け,B部分のデータ支持を得ており,tovorafenibの耐性は420 mg/m 2であり,tovorafenibの長期使用の可能性を支持していることが示唆された。
FDAが受けた脳腫瘍治療効果の標準客観的な測定標準はRANOと呼ばれる放射線学的測定標準である。Rano基準は、治療または疾患の進行に対する反応を追跡するために、腫瘍次元の様々な測定を考慮する。PNOC 014 A部分患者からのデータは,独立した神経放射線科医がRANO基準を用いて審査した。9名の患者のうち8名の患者はRAF融合pLGG(7名の融合KIAA 1549-BRAF,1名は融合SRGAP 3-CRAF)が存在し、1名の患者の神経線維腫症1(NF 1)遺伝子は機能喪失変異を起こした。以下の図6に示すように、RAF融合を受けた8名の患者のうち5名は、RANO基準に従って完全に緩和または部分的に緩和され、ベースラインと比較して50%低下すると定義され、すべての測定可能な強化病変の垂直直径積の合計は少なくとも4週間持続する。RAF融合を受けた8名中2名の患者の病態は長期的に安定していた。RAF融合患者はトレフラフィニに反応しなかった。NF 1関連pLGGを有する1人の患者は、トレフラフィニに反応しなかった。探索的イメージング法(例えば体積画像分析)や最近発表されているが臨床的に検証されていない小児科神経腫瘍学的反応評価(RAPNO)標準を用いた放射線学的反応は,RANOスコアとほぼ一致していると考えられる。
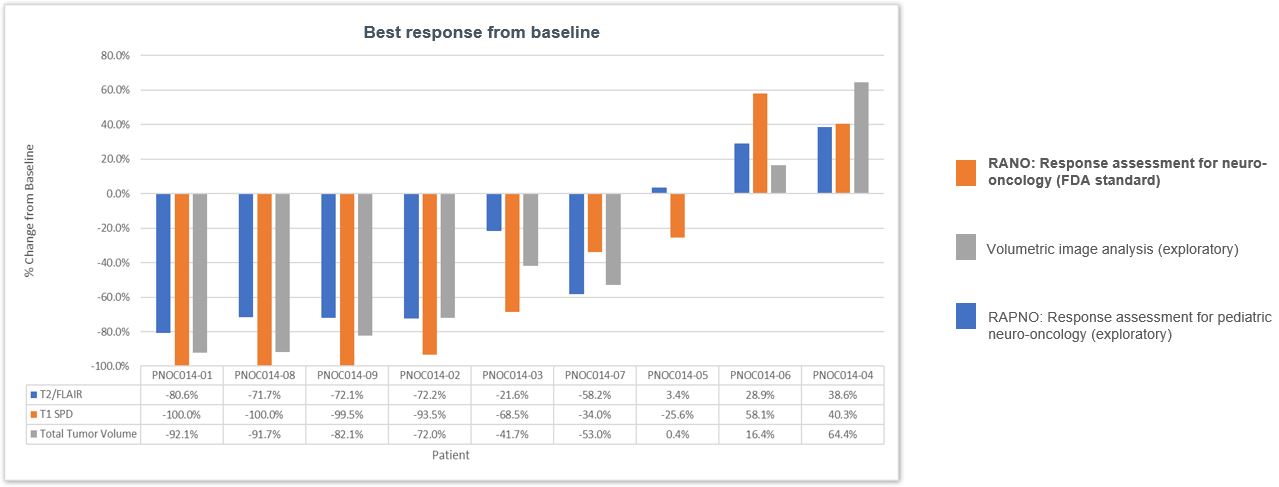
図5.pLGGのtovorafenib 1期試験では,9名中5名が完全(100%減少)または部分的に有効であった(腫瘍2次元測定減少>50%)。
治療に対する反応を評価する以外に、スクリーニングと以前の放射線学画像からベースライン成長動力学を計算する過程において、すべての患者は目標皮膚損傷を識別した。9名中8名については,試験登録前に腫瘍成長歴が記録されていた。図7に示すように,トロフラフィニ投与開始後に得られた1枚目の放射線学的画像では,9名中6名に病変の大きさの縮小を認めた。中位有効時間は10.5週間であり,pLGGは不活性で成長の遅い腫瘍であるため注目すべき所見である。2名の患者は完全に緩和され,2年間の投与期間は不変であった。3名の患者は部分的に緩和し、2名の患者の病状は長期的に安定し、2名の患者は反応しなかった。この試験は最長2年間の治療を可能にする。
15
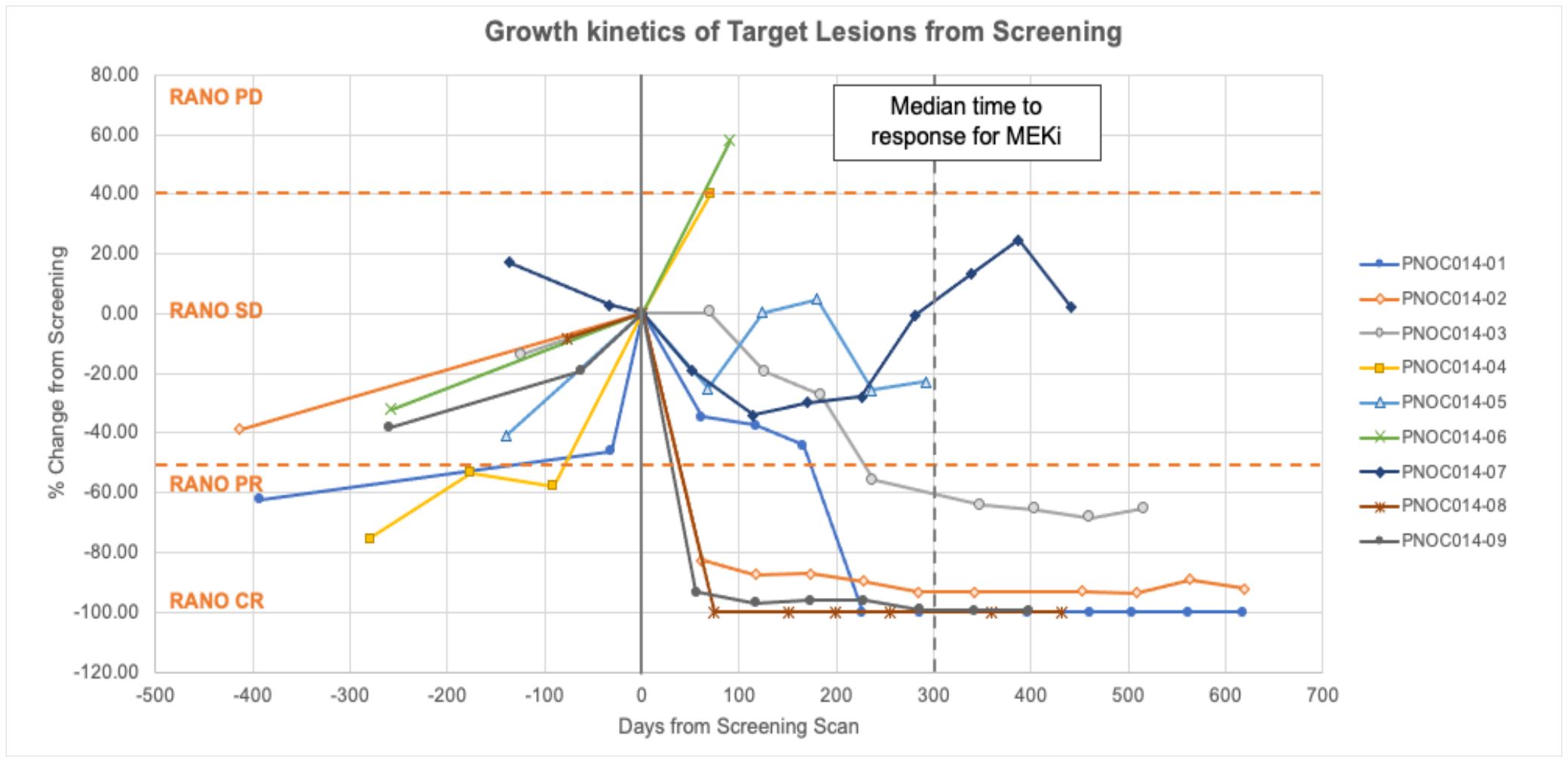
図6.pLGGにおけるtovorafenibステージ1試験における個別患者反応を示す。
PNOC 014 A部分の結果によれば、トレフラフィニは、活性化RAF変化が存在するpLGG小児患者の治療のためのFDAの画期的な治療指定を得、これらの患者は、系統的な治療を必要とするか、または以前の治療後に病状が悪化するか、または満足できる代替治療選択を有さない。TovorafenibはFDA指定の悪性グリオーマ治療孤児薬も獲得した。
PLGGの臨床発展計画
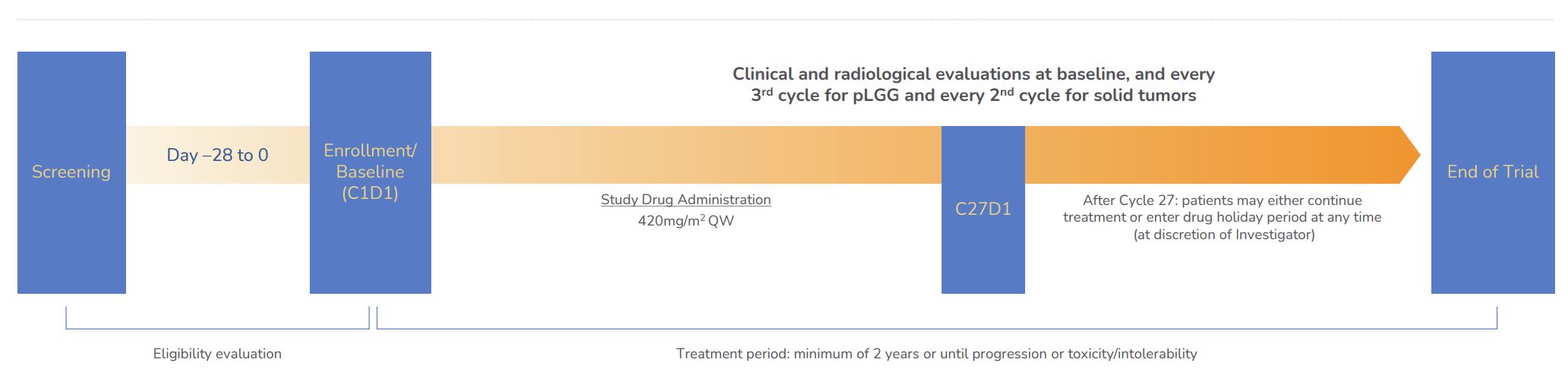
我々は、6ケ月から25歳までの再発または難治性pLGGがBRAF活性化変化を伴う小児患者、例えばKIAA 1549-BRAF融合またはBRAF活性化変異、例えばV 600 Eのための重要な2期Firefly-1試験を完了した。これはオープンラベルで世界的に登録されている単一アーム経口トロヴォラフェニ試験であり,週1回投与され,420 mg/m 2である。放射線学的証拠が治療研究者によって決定されたRANO標準疾患の進行、許容できない毒性、患者の同意撤回または死亡を示すまで、患者はtovorafenibの使用を継続することが許可された。最初の患者は2021年5月にFirefly−1の用量治療を受け,2022年5月にARM登録を完了した。Firefly-1試験はまた、(A)主要なキューが登録されているので、合格患者のアクセス範囲を拡大するための他の2つの研究分枝を含み、(B)6ヶ月~25歳までの再発または進行性頭蓋外固形腫瘍を有し、RAF融合を活性化する患者におけるtovorafenibの初歩的な治療効果を評価する。この実験は,規制承認の基礎となる既存のセキュリティデータベースと組み合わせたデータセットを生成した.主な終点は総緩解率であり,独立審査で決定した最適な総確認緩解率を有する患者の割合(RANO基準に基づく完全緩解率と部分緩解率)と定義した。副次的および探索的終点は、RAPNOと容量分析に基づく全体応答率、無イベント生存率、安全性、機能結果、および生活の質測定を含む。
16
図7.pLGGにおけるtovorafenibの2期実験設計
トヴォラファニーは現在速放錠として服用されている。私たちはすでに6ヶ月の子供の経口投与に適した小児科処方を開発し、私たちの重要な第2段階Firefly-1試験で患者にこの小児科処方を服用した。
CLIA/アメリカ病理学者学会或いはCAP、認可された病院実験室或いは第三者商業サプライヤーを利用して、新しい診断或いは再発/進展性pLGGに対して全面的なゲノムマップ分析を行うことは全米小児科神経腫瘍学プロジェクトの標準的なやり方である。また、2021年に改訂されたWHO中枢神経系腫瘍分類は現在、LGGs診断の一部としてBRAF変異或いは融合状態の評価を含む。したがって,新たに診断·再発したBRAF変化を伴うpLGG患者の多くが認識されることが予想される。個別の研究者が現在使用しているBRAF V 600 E突然変異とBRAF野生型融合を同定するための技術プラットフォームと解決方案は臨床試験登録標準を満たすために使用され、同時に著者らは引き続き監督機関と協力して、任意のセットの診断分析或いは設備の要求を満たすことを保証し、そのため、著者らはすでにFoundation Medicine,Inc.と協力して開発した
われわれはすでにtovorafenibのキー3期Firefly−2試験を開始し,pLGGの第一線の治療とした。1人目の患者は2023年3月に薬物治療を受けた。患者が多輪毒性化学療法を受ける前に治療を行うことは,tovorafenibの治療効果を高める可能性があり,現在使用されている細胞毒薬物の使用に関する全体的な治療負担や関連毒性を減少させることができると考えられる。
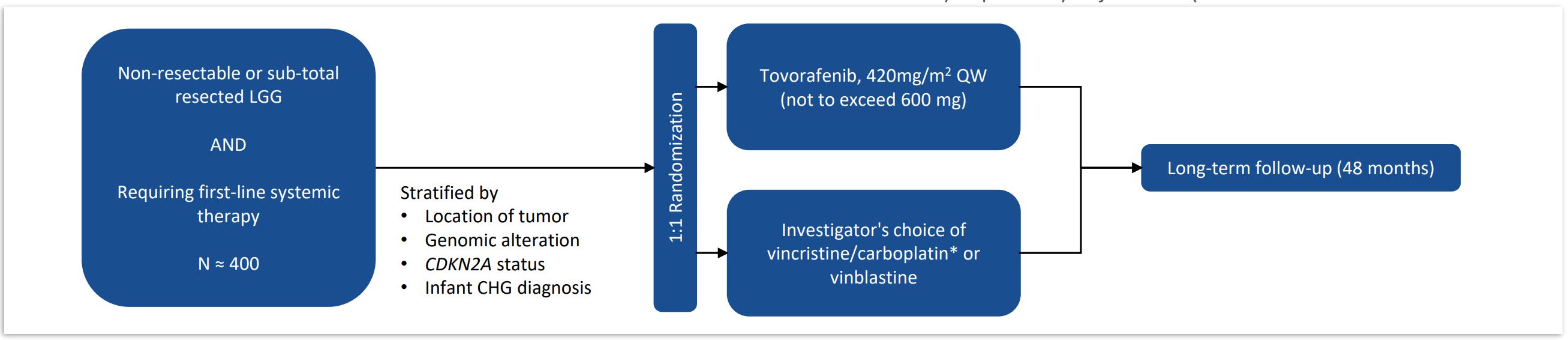
図8.pLGGにおけるtovorafenibの3期実験設計
PLGGにおけるTovorafenibの潜在的市場機会
脳腫瘍は児童に最もよく見られる固形腫瘍である。PLGGは最もよく見られる脳腫瘍と診断され、すべての児童脳腫瘍の約30%を占めるが、アメリカではpLGGの年間発病率は1.3‰から2.1‰と推定されている。この疾患の発症率を考慮して,我々のチームは,この患者集団においてtovorafenibを開発する市場機会を以下の理由で認識している
承認されれば,tovorafenibはpLGG治療の標準的なケアになる可能性があると信じている。長期投与の需要により、長年を必要とする可能性があり、看護の標準は有効で、長期的な治療であるべきであり、同時に耐性概況を提供し、長期発病率と治療関連毒性を最低に下げる。私たちはトヴォラファニーが似たような効果的な治療法の長期的な利益を提供する可能性があると信じている
17
より伝統的な慢性稀な疾患-pLGG患者である。私たちはまたtovorafenibの週1回の経口投与プログラムが医者、患者、そして彼らの両親を引き付けると信じている。
他のMAPK駆動腫瘍におけるトボルフェニの潜在的応用
小児科患者における著者らの初歩的な臨床開発を拡大するために、青少年と成人患者群におけるtovorafenibの他の適応を探索する予定であり、これらの群の中で、各種MAPK経路の変化は疾患を駆動する上で重要な役割を果たしていると考えられている。武田以前に行った2つの独立した第1段階試験では,225名を超える成人患者がtovorafenibを服用したデータがこれを支持していた。これらの試験はまた、進行中のpLGG肝心な段階2試験を含む未来の臨床試験に開始用量レベルと毎週用量方案を提供する。これらの試験の結果,トロフラフィニは進行癌患者では耐性が良好であり,単独でも他の抗癌剤との併用も示唆されているが,トレフラフィニ単一治療に反応すると期待されるRAF変化は豊富ではなく,併用研究も行われておらず,これらの薬剤の方が抗腫瘍活性をきたす可能性があることが知られており,軽微な奏効率しか認められていない。
臨床前研究のデータに基づいて、武田指導者の第一段階試験の初期データに基づいて、開放ラベル、多中心、1 b/2 a期火光-1傘式tovorafenib単一療法または併用療法の主試験を開始し、この試験は2つのサブ研究を含む。サブ研究1は,12歳および12歳以上のRAF変化に単一療法として用いられた腫瘍患者の第2段階臨床試験であり,第1名の患者は2021年11月に治療を受けた。2023年11月,サブ研究1の登録が完了し,最後の患者の最後の受診は2024年6月に発生する予定であることが発表された。グループ化研究は2024年末に終わる予定だ。
第二の研究は,トヴォラフィニとピマチニブが12歳以上で種々のMAPK変化を有する固形腫瘍患者における1 b/2期併用試験である。臨床前モデルでは,RAFとMEKの同時抑制は協同抗腫瘍活性を引き起こすことが証明されている。この組み合わせは、NRAS変異黒色腫と肺癌、クラスII BRAF変化によって駆動される腫瘍、およびKRAS変化によって駆動される腫瘍を含むMAPK変化によって駆動される様々な成人固形腫瘍において増強された抗腫瘍活性を示す可能性がある。1人目の患者は2022年5月に用量治療を受け,現在患者参加子研究の共同用量選択部分を積極的に募集している。私たちは、特定の患者集団の拡張キューのために、2024年下半期に推奨される第2段階用量およびスケジュールを決定する予定である。
将来的には,tovorafenibと他のMAPKシグナル経路の重要なノードの選択的阻害剤との併用を探索する可能性がある。例えば、II型RAF阻害剤は、ERKまたはSHP 2阻害剤と組み合わせて使用することができ、相乗的利益を提供することができる。Tovorafenibは、承認されたI型raf阻害剤によって観察される矛盾活性化のリスクを誘発することなく、野生型rafおよびrafダイマーを含む様々な形態のraf遺伝子変化を抑制することができ、癌MAPKシグナル伝達を抑制するための併用治療の潜在的バックボーンとしてのイメージを増強すると信じている。
トヴォラフェニの研究者による臨床試験
著者らは学術研究者及び小児科腫瘍学協力団体と連合との関係を利用して、他の稀な小児科腫瘍タイプにおけるトボルフェニの応用潜在力を探索するつもりである。
再発性ランゲルハンス細胞組織細胞増殖症の2期試験は2022年3月に児童腫瘍学グループによって開始され,国立癌研究所が支援する臨床試験グループであり,世界最大の小児と青少年癌研究に特化した組織でもある。書面申請の一部として、FDAからのフィードバックを待つ前に、この研究計画は単一アーム非ランダム試験として43名の参加者が参加すると推定され、彼らはボルラフィニ治療を受けて、再発または進行性ランゲルハンス細胞組織細胞増加症児童および若年者の全体応答率を決定する。
太平洋小児科神経腫瘍学連盟は2022年7月に頭蓋咽頭腫の第二段階試験を開始した。この研究はランダム多群試験であり、56名の患者が参加すると推定され、彼らはnivalumabとtovorafenibとnivolumabの連合治療を受け、PD-1(Nivolumab)と汎RAF-Kinase(Tovorafenib)阻害剤の連合治療による児童と若者の頭蓋咽頭腫の耐性と有効性を評価する。
ピマチニブ
Pimasertibは経口的な高選択性MEK 1および2のアロステリック小分子阻害剤である。Pimasertibは他のMEK阻害剤よりも中枢神経系透過率が高いことが発表されている。私たちは1部を獲得しました
18
2021年2月、PimasertibはドイツDarmstadtのMerck KGaAから独占的な許可を得て、2022年3月にMAPK改変腫瘍の1 b/2期傘式主試験を開始し、tovorafenibとpimasertibの12歳及び以上の患者における潜在的に有益な組み合わせを研究する。ドイツダムシュタットのメルクKGaA社はこれまで第二段階で広範な非臨床と臨床開発を行い,日本で行われた固形腫瘍試験やpimasertibを他の薬物と組み合わせた。前向きな無作為第二段階試験では、Pimasertibはダカバヒドラジンと比較して、NRAS変異黒色腫患者において、客観応答率と無進展生存率の改善を含む単一療法の臨床活性を示したが、総生存率の改善ではなかった。Pimasertibの臨床開発過程で観察される主要な有害事象は,他のアロステリックMEK阻害剤と同様に典型的であり,胃腸に関連する有害事象,CPK上昇,皮疹,視力障害を含む。
臨床前研究
MEKはMAPK経路中のRAS下流に位置する重要なシグナル伝達ノードであり、1種の独特な二重特異性蛋白加水分解酵素であり、セリン/トレオニンとチロシン残基をリン酸化することができる。MEKは2つのサブタイプMEK 1とMEK 2からなり,MEK 1とMEK 2はERK 1とERK 2を順次リン酸化する。活性化ERK 1/2は、細胞膜、細胞質、核中に位置する多くの基質(>160)によって一連の異なる細胞過程を制御している。その中の多くは転写因子であり、細胞の増殖、分化、生存、血管新生と遷移に重要な役割を果たしている
以下の図9に示すように、RAS或いはRAFシグナル上昇によって駆動される癌において、MEKを抑制することはRASの遮断を放出することができ、そしてRASを介したシグナルと経路活性化を増加させ、MEK抑制に対する細胞の敏感性を更に低下させることに役立つ。単一療法として、MEK阻害剤はRAS或いはRAFシグナルが上昇する臨床前腫瘍モデルにおいて限られた抗腫瘍活性を示した。MEK阻害剤に耐性を産生し増殖を継続する癌の多くは,MAPK経路の再活性化とその後ERKの再活性化によって達成される。ERKの再活性化はRAS、RAF、NF 1またはMEKなどのMAPK経路中のERK上流の分子を変化または変異させることによって実現できる。このような腫瘍モデルにおいてRASシグナルの過剰活性化を回避する1つの方法はRAF阻害剤とMEK阻害剤を結合し、2つの異なる結節でこの経路を抑制することであり、複数のグループは細胞と腫瘍モデルの成長を抑制する上で相乗効果があることを証明した。

図9:二重抑制BRAFとMEKはMAPK駆動の腫瘍を解決する重要な策略である。
19
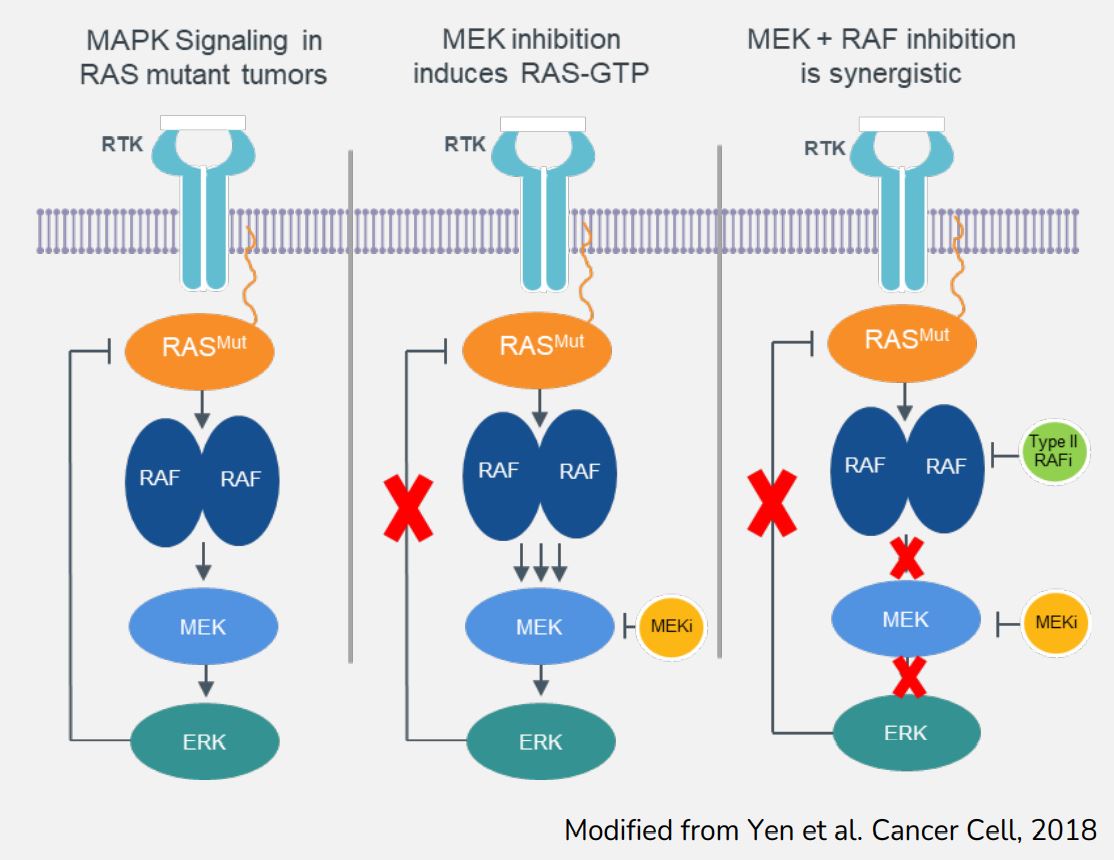
[図10]RAF阻害剤感受性を誘導する提案機序モデル。左パネル:基礎条件下で、MAPK経路はRas-GTPレベルとRAF活性化を含む負方向に上流経路の活性化を調節するフィードバックループが複数あり、最適な経路信号を確保する。中板:MEK阻害剤治療を受けた後、これらのフィードバックループは無効にされ、RAS-GTP誘導、BRAF/CRAF二量体化、およびRAFキナーゼ活性化を引き起こす。右図:MEK阻害剤とII型RAF阻害剤の併用治療は相乗効果が期待できる。Yenらによって修正された。2018年の癌細胞です
この方法と一致したのは,臨床前実験では,II型RAF阻害剤とpimasertibの組み合わせが確実に協同細胞傷害活性を引き起こすことが示唆されたことである。CALU−6細胞はKRAS G 12 C変異を含むヒト肺腺癌細胞系であり,II型RAF阻害剤BGB−283やpimasertibの細胞傷害に感受性が認められた。これらの阻害剤の組み合わせによるCALU−6細胞の処理は、pimasertibの存在下で3ミクロン用量のBGB−283のEC 50が約60倍低下したため、より大きな細胞殺傷率をもたらすことができる。これらの結果は,RAF阻害剤の存在下でのMEK阻害剤の使用は,いずれの阻害剤単独よりも多くの細胞傷害利益が得られることを示している。
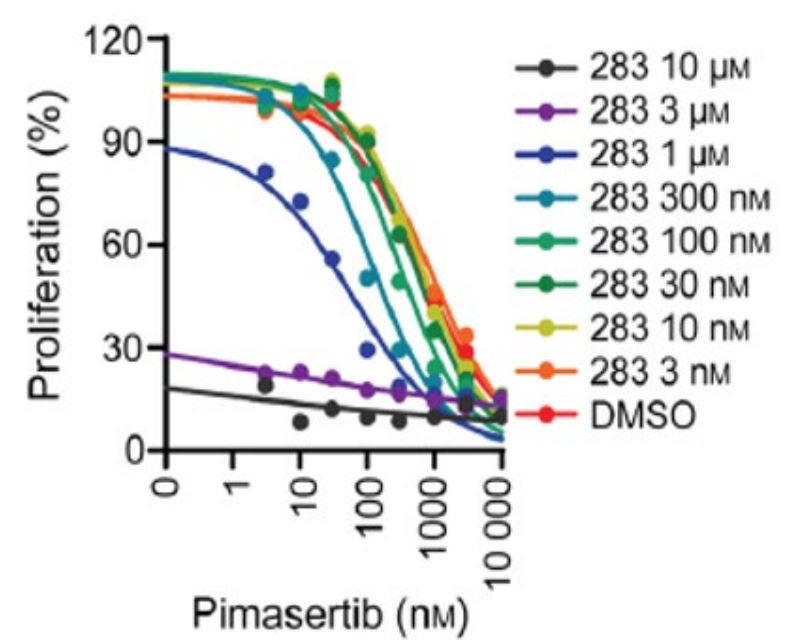
図11.CALU−6細胞のPimasertibに対する感受性はII型RAF阻害剤BGB−283で処理した場合に増強した。
同様に,KRAS G 12 C変異を含むCALU−6細胞とNCI−H 1792細胞の実験では,細胞株はtovorafenibやMeki−1に単一療法として敏感であることが証明されているが,これらの阻害剤の組み合わせはこれら2つの阻害剤単独よりも大きな細胞傷害作用を産生する。これらのデータは
20
MEK阻害剤を101日目のようなII型RAF阻害剤と組み合わせることが、特定のMAPK駆動成人固形腫瘍の治療戦略としての潜在的な追加的利益をさらに支持する。
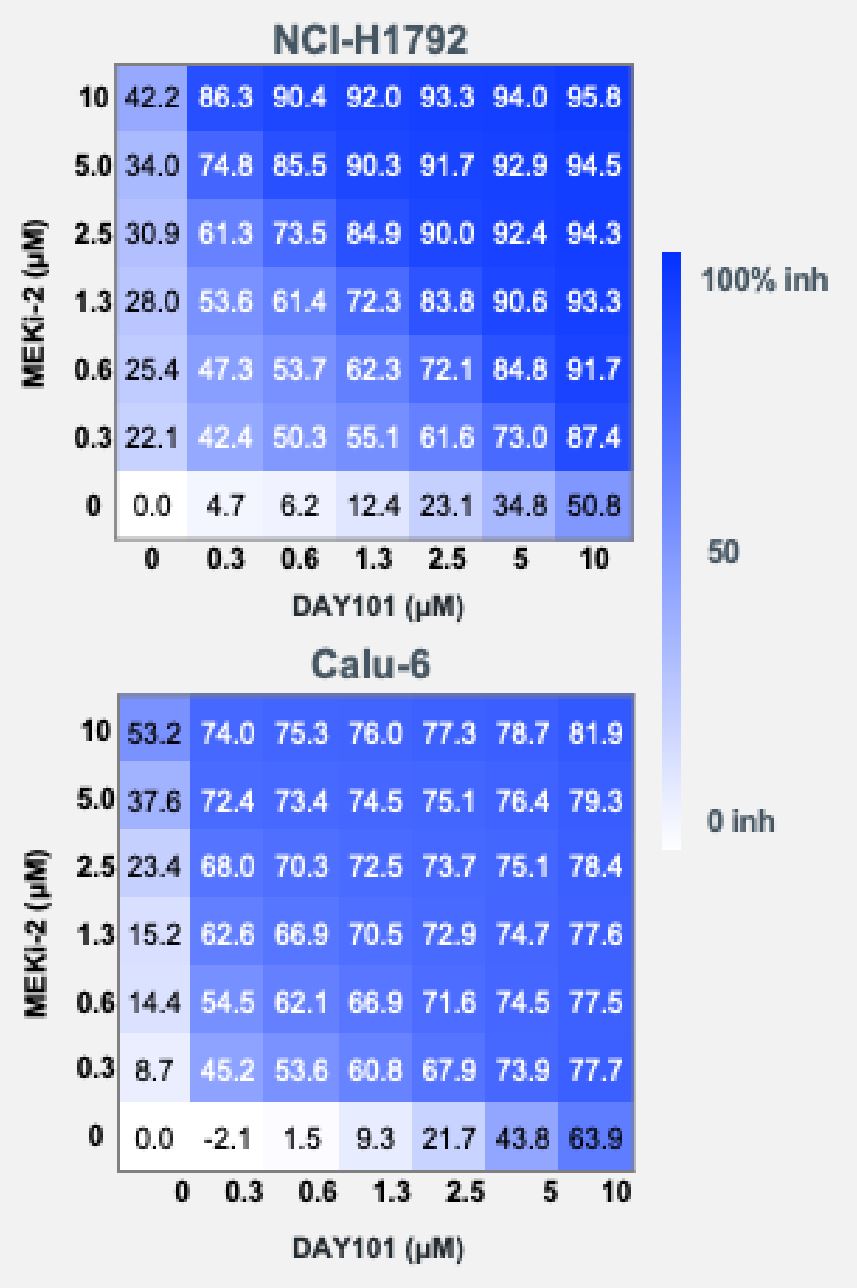
図12:インビトロKRAS G 12 C或いはQ 61変異腫瘍細胞系において、トロボラフェニとMEK阻害剤を併用した場合の協同作用が観察された。
臨床結果
ドイツのメルクKGaA社が後援した試験では,Pimasertibは850人以上の癌患者に使用されており,単一療法としても標準看護療法の併用としても使用されており,ゲムシタビン,ダカバ津,結腸直腸癌レジメンFOLFIRI,および選定された研究薬(Hdm 2阻害剤SAR 405838,PI 3 K/mTOR阻害剤SAR 245409)である。これまでpimasertibとRAF阻害剤の併用の可能性は臨床試験で検討されていない。
Pimasertibの初期1期試験は、結腸直腸癌、黒色腫、前立腺癌、肺および中皮腫を含む様々な固形腫瘍患者における異なるスケジュールと漸増用量のPimasertib単一療法の使用を評価することを目的としている。この試験の主な目標は安全性と薬物動態学を確立し、更なる研究の最適な投与量とスケジュールを決定することである。初歩的な治療効果は腫瘍反応によって評価された。異なる腫瘍タイプではいくつかの安定型疾患の例が認められたが,黒色腫患者では様々な部分反応が認められ,このような腫瘍タイプのさらなる検討が引き起こされた。この試験の用量拡張アームでは、89人の黒色腫患者が、4つの用量レジメンにおいて28 mg~255 mg/日の薬理活性用量を受けた。OORは12.4%であり,その中の1例は完全に軽快し,10例は部分的に軽快し,46例は病状が安定していた。第一段階単一療法試験において、用量制限毒性は主に120 mg/日以上の用量が観察され、皮疹/ざ瘡皮膚炎と眼イベント、例えば漿液性網膜剥離を含む。最もよく見られる薬物関連不良事件は他のMEK阻害剤の治療効果と一致し、下痢、皮膚疾患、眼疾患、虚弱/疲労と末梢水腫を含む。単一療法第1段階臨床試験に参加した黒色腫患者の結果によると,69名中8人がレベル3以上のTEAEを経験していた。TEAEは皮膚のものです
21
イベント(n=4),眼イベント(n=2),下痢(n=2)。すべての4種類の皮膚イベントは1日2回(R 3)群で発生したが,眼と下痢イベントは1日2回連続群と不連続群で報告されている。高用量のpimasertibは網膜剥離症例と関連しているが、このような他のすべての毒性は、支持性看護および治療中断または用量を減少させることによって処理することができる。
ドイツのダムシュタットのメルクKGaA社はまた194名のNRAS突然変異の局部末期或いは転移性皮膚黒色腫患者の中で1種の多中心、開放ラベル、ランダム2期試験を行い、投与量60 mgの単剤pimasertibとダカルバジドを比較した。治療群の中位無進展生存期間(PFS)は13.0週であり、ダカバヒドラジン群の6.9週より有意に長かった。
臨床発展計画
著者らはすでに開放ラベル、多中心、1 b/2 a期の火光-1傘式主試験を開始し、この試験は2つのサブ研究から構成されている。サブ研究1は,12歳および12歳以上のRAF変化に単一療法として用いられた腫瘍患者の第2段階臨床試験であり,第1名の患者は2021年11月に治療を受けた。この項の研究は2023年11月に終了し,条件を満たす患者が少なく,入選患者に観察される反応持続時間が限られていることが原因である。二次研究2はtovorafenibとpimasertibの1 b/2期連合試験であり、12歳以上のNRAS突然変異、BRAFwt融合と他のBRAF突然変異(V 600 EとV 600 K突然変異を除く)を有する患者に用いられた;第1名の患者は2022年5月に治療を受けた。連合亜研究はtovorafenibとpimasertibを組み合わせて使用する2期用量を決定するための1 b期用量範囲試験を含む。この用量が決定されると、患者は、NRAS変異またはBRAFwt融合のような遺伝子改変によって定義される少なくとも1つのキューに、この試験に参加する組み合わせ用量拡張部分を登録する。連合亜研究1 b期部分の主な終点は安全性である。第2段階拡張キュー(S)の主な終点は、全体応答率および応答持続時間である。臨床前モデルでは,RAFとMEKの同時抑制は協同抗腫瘍活性を引き起こすことが証明されている。この組み合わせは、NRAS変異黒色腫および肺癌、クラスII BRAF変化によって駆動される腫瘍、BRAF野生型融合を有する腫瘍、およびKRAS変化によって駆動される腫瘍を含む、MAPK変化によって駆動される様々な成人固形腫瘍において増強された抗腫瘍活性を示す可能性がある。そのほか、いくつかの小児科腫瘍もMAPK経路の協同抑制から利益を得る可能性がある。
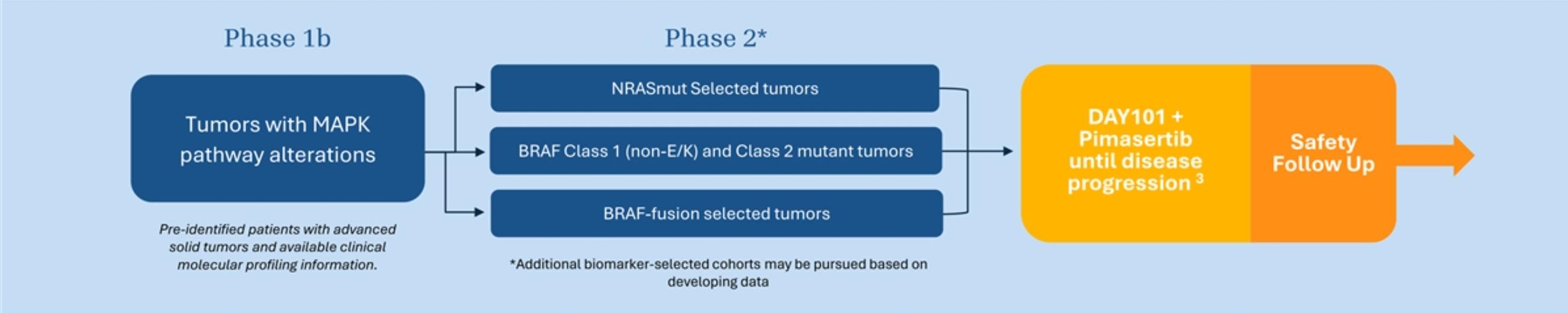
図13.傘形主試験-DAY 101-102(主レジメン)からボリビアおよびMAPK経路への変化、サブ研究2 MEK組み合わせ(DAY 101-102 B)。
複数のグループからの臨床前データは、pimasertibとII型RAF阻害剤の組み合わせなどのMEK阻害剤が様々なMAPK駆動腫瘍環境において有益な活性を有することを示しており、これは、予期されるpimasertib濃度未満で単一治療によって産生されるデータから強力な細胞傷害活性が得られることを意味する。生物活性用量の組み合わせを定義できるため,適切な用量のpimasertibとtovorafenibの併用は,MTD単独でpimasertibで観察される有害事象の頻度や重症度を制限できると考えられる。成人患者で余分な投与量と安全性データを収集すると,小児科連合試験が探索されることが予想される。
製造業
私たちは所有したり経営したりしないし、現在は製造施設を設立する計画もない。私たちは依存し、引き続き第三者に依存して私たちの候補臨床試験製品を生産し、私たちの任意の候補製品が市場の承認を得た場合、商業製造に使用されることが予想される。私たちはまた依存して、私たちの研究候補製品、および私たちのビジネス製品を包装、マーク、記憶、配布する第三者に依存し続けることが予想されます(マーケティングの承認が得られれば)。この戦略は、私たち自身の製造施設、設備、人員に投資する必要がなくなり、より効率的なインフラを維持することができ、同時に、私たちの専門知識と資源を私たちの候補製品の開発に集中させることができると信じている。
22
これまで、著者らはそれぞれSTA Pharmtics Hong Kong Limited、Quantient Sciences-Philadelphia LLC、Experic、LLCとSharp Packaging Services LLCから活性薬物成分或いはAPI、薬品製品と包装サービスを獲得する契約を締結し、著者らは現在これらの会社に単一源契約として組織或いはCMOを製造することに依存している。合意があります。合意によると、第三者CMOは通常私たちの発展需要に応じて、注文に応じて必要な数量の原料薬、薬品と包装製品を提供します。トヴォラフェニの商業供給について、私たちは製品の予想される商業需要を満たすために供給協定を交渉しました。私たちが開発を通じて私たちの候補製品を推進することに伴い、私たちはすべての候補製品に原料薬、薬物製品、包装と調合の予備供給者を増加させ、任意の潜在的な供給中断を防止することを探索する。
私たちは一般的に私たちが開発可能などんなセットの診断プログラムを作るために第三者に依存することを望んでいる。
競争
製薬と生物技術業界の特徴は技術の迅速な進歩、競争の激しいことと独自製品に対する高度な重視である。私たちは私たちの技術、私たちのチームの専門知識、そして私たちの開発経験と科学知識が私たちに競争優位を提供してくれると信じていますが、私たちは製薬とバイオテクノロジー会社、学術機関、政府機関、そして公共と個人研究機関を含む多くの異なる源からの日々の激しい競争に直面しています。我々が開発·商業化に成功した候補製品は,既存療法や将来出現する可能性のある新しい療法と競争する可能性がある。
私たちの多くの競争相手は、単独でも彼らとのパートナーでも、私たちより多くの財務資源を持って、市場で足場を立ち、そして研究開発、製造、臨床前と臨床テストの方面で専門知識を持って、監督部門の許可を得て、そして精算とマーケティングの許可を得た製品です。これらの競争相手はまた、合格した科学と管理者を募集と維持し、臨床試験場と臨床試験の患者登録を確立し、そして私たちの計画と相補的或いは必要な技術を獲得する上で私たちと競争している。規模が小さいかスタートアップ段階にある会社も重要な競争相手になる可能性があり、特に大手や成熟会社との協力で手配する。より多くの合併と買収は私たちの競争相手により多くの資源を集中させるかもしれない。
もし私たちの競争相手が私たちが開発する可能性のある製品よりも安全かつ効率的で、副作用が少なく、より便利で、より安価な製品を開発·商業化すれば、私たちのビジネス潜在力は減少または解消されるかもしれない。私たちの競争相手も私たちよりも早くFDAや他の規制機関からその製品の承認を得ることができるかもしれません。これは、私たちの競争相手が市場に入る前に強力な市場地位を確立することができ、そうでなければ、私たちの開発をより複雑にするかもしれません。私たちのすべてのプロジェクトの成功に影響を与える重要な競争要素は、有効性、安全性、患者の利便性である可能性があると信じている。
TovorafenibはFDAが承認したpLGG患者の治療のための最初のII型RAF阻害剤となる可能性があると信じており,どのような競争の候補製品が開発中であるかは不明である。しかし、これはtovorafenibが規制部門の承認を受けるということを見せてくれない。
3つのBRAF阻害剤は、V 600 EまたはV 600 K変異を含む腫瘍の治療のためにFDAによって承認されている。これらの第1世代BRAF阻害剤は、より一般的にI型RAF阻害剤と呼ばれ、遺伝子テークによってZelborafの名称で販売されているヴィモラファニーであり、ノワール社によって販売されているダプラファニー、およびBraftoviの名称で輝瑞社によって販売されている。ダプラファニブとトリメチニブを併用し、ノファ社はそれをMekinistと命名し、切除できないまたはBRAF V 600 E変異を有する転移性固形腫瘍を有する6歳の成人および小児患者の治療のために許可されており、これらの患者は以前の治療後に病状が進展し、満足できる代替治療方案がない。これは、tovorafenib開発計画におけるより大きなRAF変化のpLGG臨床範囲のサブセット(約10%~20%)であるBRAF V 600 E pLGGを含む。
FDAは4種類のMEK阻害剤を承認した。このうち3つは、コビミチニブを含むBRAF V 600 EまたはV 600 K変異を含む腫瘍の治療のために許可されており、遺伝子テーク社によってCotelicの名前で販売されている;トリメチニブは、ノバ社によってMekinistの名前で販売されている;および比ニミチニブは、ファイザー社によってMektoviの名前で販売されている。第4の脳微小アンギオテンシン変換酵素阻害剤セルミチニブは、アスリコン社によってKoselugoと呼ばれ、1型神経線維腫を有する2歳以上の小児患者の治療に許可されており、これらの患者は、症状があり、手術できない叢状神経線維腫を有する。
23
Erascaは次世代BRAF阻害剤Naporafenib(LXH 2 54)を開発し,様々な薬剤と組み合わせて計画の第1段階と第3段階の臨床試験を行っている。百済神州には2つの次世代BRAF方案がある:リフェラファニー(BGB-283)とBGB-3245であり、前者は現在ミダミニと連合した1/2期試験中であり、後者は現在1期用量増加研究の単剤中にある。HanmiとGenentechはBelvarafenibとcobimetinibを併用して1 b期の臨床試験を開発している。Fre Treateutics社(Forelly NovellusDx)はRAFダイマー破砕剤plixorafenib(Fre−8394/PLX 8394)を開発しており,コビシタンと組み合わせて1/2期試験を行っている。KinnateはKIN−2787を開発しており,単一療法の第1段階臨床試験にある。ブラックダイヤモンド治療会社が臨床前に開発した異なる段階には次世代BRAF阻害剤がある。
PLGGの治療については,ノ華社が協賛した無作為第二段階臨床試験では,新たに診断されたBRAF V 600変異pLGG患者が評価されており,ダプラファニーとトリメチニブが併用されている。ノワール社は2023年3月にこの適応でダプラ·フェニ−トリメチニブ連合の完全承認を得た。さらに,いくつかのMEK阻害剤やいくつかのI型RAF阻害剤や他の標的治療が学術研究者による臨床試験で研究されており,一部の地域では非タグ方式で使用されている可能性がある。Tovorafenibが市場に入った時、このようなエージェントはその競争を代表するかもしれない。
重要な合意
武田資産協定と千年証券取引所協定
2019年12月16日、DOT Treateutics-1,Inc.または当社の子会社DOT-1は、武田製薬株式会社の関連先および関連会社ミレニアム製薬会社と資産購入契約または武田資産協定を締結した。武田資産プロトコルによれば、DOT-1はTAK-580(現在tovorafenib)に関連するいくつかの技術的権利とノウハウを購入し、原発性脳腫瘍または固形腫瘍脳転移患者の治療に新しい方法を提供した。DOT−1はまた,われわれのこのようなRAF−阻害剤の研究·開発活動のための臨床在庫用品を受け取り,指定された調査者臨床試験プロトコルを得た。武田はViracta治療会社(F/k/a Sunesis PharmPharmticals,Inc.)やViractaの独占ライセンスプロトコルやViractaライセンスプロトコルとDOT-1にも割り当てている.武田はまた、武田資産協定に基づいてDOT−1に指定特許項下のグローバル再許可独占許可と、武田資産協定に基づいて生成された他の特許及び独自技術項下の非独占許可とを付与した。DOT-1はまた、武田資産協定で定義されている帰還許可を武田に付与し、武田資産協定が規定する適用時間範囲内で指定された開発マイルストーンを実現できなければ、この許可を自動的に終了またはDOT−1で終了することができる。この武田に付与された帰還許可証は転換時に終了し、ミレニアム証券取引所協定と関係がある。
DOT-1は、資産の売却と譲渡および武田資産協定によるライセンス付与の代償として、100万ドルの現金を前払いし、2019年12月にDOT-1で9,857,143株のAシリーズ償還可能転換優先株を発行した。他の投資家がDOT-1のAシリーズ融資で発行済み株式に支払った価格によると、発行済み株の公正価値は990万ドルと推定される。ミレニアム証券取引所協定の条項によると、武田は転換発効後、2021年5月26日にDOT-1の9,857,143株Aシリーズ償還可能転換可能優先株を我々の普通株6,470,382株に交換した
武田資産協定の有効期限は、各国のすべての譲渡特許権とすべてのライセンス特許権が満期になった後、国ごとに終了します。武田は我々が初めて商品を商業販売する前に武田資産協定を終了する可能性があり、一定期間連続して指定された時間内にいかなる開発活動も停止すれば、この停止は当事者の同意を得ておらず、規制当局の指導に応えるためでもない。また、武田は我々が破産した場合に武田資産協定を終了することができる。武田が我々の開発停止や破産により武田資産協定を終了すれば、譲渡されたすべての特許、ノウハウ、契約(Viractaライセンス契約を除く)が武田に譲渡され、武田は特許やノウハウに基づいて回復許可を得て、これ等で終了したすべての製品を利用する。
DOT-1は2021年12月31日から当社と合併して当社に組み込まれ、当社は既存の会社であり、武田資産購入協定に基づいてDOT-1‘Sの義務を負う。
24
Viracta許可協定
2019年12月16日、DOT-1は、武田資産協定に従って譲渡されたViractaライセンス協定を修正し、再確認した。Viractaライセンスプロトコルによると,DOT−1は特定の特許権やノウハウにより世界的に独占的に許可されており,RAFタンパク質ファミリーに結合した化合物を含む製品を開発,使用,製造,商業化することができる。
DOT−1はViractaに200万ドルの現金を前払いしており,このお金は研究開発費として記録されており,この技術には将来代替用途がないためである。2023年12月31日現在、私たちは、2つの適応のうち、許可製品ごとに指定された開発と規制マイルストーンを実現する際に、4900万ドルまでのマイルストーン支払いを追加的に支払うことを要求される可能性があり、第2の適応のマイルストーン支払いは、第1の適応のマイルストーン支払いよりも低い。また、DOT−1が許可製品に関する優先審査券を取得し、その優先審査券を第三者に販売するか、またはその優先審査券を使用する場合、DOT−1は、そのような販売のいずれかから受信したすべての純対価格または使用済み優先審査券の価値の特定のパーセンテージをViractaに支払う義務がある。DOT−1は,特許製品の1カ国/地域での初商業販売から,特許製品の純売上高の中央値から1桁パーセントまでの分級印税(あれば)の支払いを義務付けている。印税の支払い義務は、国/地域およびライセンス製品のライセンス製品をもとに、1つの国/地域での最初の商業販売から、(I)我が国/地域でその製品を使用または販売することをカバーするViractaライセンス特許、共通所有の協力特許または指定特許の最後の有効権利主張が満了したとき、(Ii)当該製品とその国/地域での最後の法定独占経営権が満了したとき、または(Iii)当該製品が当該国/地域で初めて商業販売されて10周年になるまで続く。上記で議論した以外に、2023年12月31日現在、達成すべき他のマイルストーンは実現されていない。
Viractaライセンス契約の期限は,このような製品の当該国/地域での印税に関する義務期間が満了した後,ライセンス製品ごとに国/地域ごとに終了する.DOT-1は、指定された通知期間内に任意またはすべてのライセンス製品に関連するViractaライセンスプロトコルを任意に終了する権利がある。
2021年12月31日から、DOT-1は当社と合併して当社に組み込まれ、当社はまだ残っている会社であり、ヴィアクタ許可協定に従ってDOT-1‘Sの義務を負う。
メルクKGaA社とライセンス契約を結び、ドイツのダムシュタット
2021年2月10日、DOT Treateutics-2,Inc.または我々の子会社DOT-2は、ドイツのダムシュタットに位置するメルクKGaA製薬会社と、MRKDG許可協定であるライセンス契約を締結した。MRKDGライセンス協定によると、ドイツのダムシュタットのMerck KGaAは独占的なグローバルライセンスを付与し、特定の特許権利と技術ノウハウに基づいて、複数のレベルで再許可を付与する権利があり、PimasertibとMSC 2015103 Bの化合物を含む製品を研究、開発、製造し、商業化することができる。私たちはまた、私たちの研究と開発活動のための臨床在庫用品を受け取った。著者らの独占許可はメルクKGaAが付与した非独占許可の制約を受けなければならず、メルクKGaAはドイツの癌研究組織の付属会社であり、ドイツDarmstadtメルクKGaAはいくつかのpimasertibに関連する臨床研究を直接或いは間接的に行う権利を保持する。
MRKDGライセンス協定によると、2029年までに商業的に合理的な努力を使用し、少なくとも2つの指定された主要市場国で少なくとも2つのライセンス製品を開発して商業化する義務がある。
MRKDG許可協定により付与された権利や臨床用品を考慮すると,800万ドルが前払いされており,将来的には代替用途がなく,研究活動に用いられているため,研究開発費として記録されている。2023年12月31日現在、特定の開発、規制、ビジネスマイルストーンの実現状況、および将来のライセンス製品の純売上高の高ビット数印税パーセンテージに応じて、3兆645億ドルの追加料金を支払う必要があるかもしれません。マイルストーンと特許使用料は未来の事件に依存し、マイルストーンと満期支払いが達成されたときに記録される。
MRKDGライセンス契約の期限は,その国·地域のライセンス製品についてライセンス側への印税支払い義務期間が満了した後,ライセンス製品と国/地域で期限が切れ,すべての支払義務期間が満了することになる
25
MRKDGライセンス協定下のすべてのライセンス製品とすべての国/地域について。
2021年12月31日よりDOT−2は当社と合併して当社に合併し,当社は既存の会社であり,MRKDG許可協定によりDOT−2‘Sの義務を負う。
Sprint Bioscience ABとの研究協力と許可プロトコル
2023年8月15日、私たちは、スウェーデンのハディンガーにあるスウェーデン社Sprint Bioscience ABまたはSprintと研究協力および許可協定、またはSprintライセンス契約を締結した。Sprint許可協定によると、Sprintは著者らに独占的な全世界許可を授与し、複数のレベルを通じて再許可を授与し、医薬製品を研究、開発と商業化し、そしてニキビ苗関連Kinase 1或いはVRK 1の発見、最適化と開発を目的とした研究に従事する。
私たちはSprintに300万ドルの現金を前払いしました。このお金は研究開発費として記録されています。この技術は将来代替用途がないからです。2023年12月31日現在、各ライセンス製品の特定の開発、規制、ビジネスマイルストーンの実現状況に応じて3.09億ドルまでのマイルストーン支払いと、将来のライセンス製品の純売上高の1桁パーセントで等級付けされた印税(あれば)の支払いが要求される可能性があります。マイルストーンと特許使用料は未来の事件に依存し、マイルストーンと満期支払いが達成されたときに記録される。
Sprintライセンス契約の期限は、ライセンス製品およびその国/地域のライセンス使用料期限が満了したときに、事前に終了しない限り、ライセンス製品および国/地域に基づいて満了します。指定された通知期間内にSprint許可プロトコルのすべての内容を任意に終了するか、または製品の終了を1つずつ許可する権利があります。
知的財産権
私たちのビジネスの成功は、私たちの候補薬物、技術およびノウハウの独自または知的財産権保護を獲得し、維持する能力があるかどうか、他人の独自または知的財産権を侵害することなく運営できるかどうか、および他の人が私たちの独自または知的財産権を侵害することを防止することができるかどうかにある程度依存する。我々は,米国や米国以外の管轄地域で独自の技術,発明,改善,候補薬物に関する特許保護などの方法を求めて獲得することで,我々の独自および知的財産権の地位を保護することが予想され,これらは我々の業務の発展と実施に重要である。私たちはまた、ビジネス秘密、技術ノウハウ、商標、持続的な技術革新、許可機会に依存して、私たちの独自と知的財産権の地位を発展させ、維持しています。現在、私たちの特許の組み合わせは、私たちによって許可され、所有され、および/または共同所有されている発行された特許および係属中の特許出願を含む。
私たちは現在、私たちの候補薬剤に関連するかもしれない特許出願および発行特許を有し、共同所有し、様々な疾患(例えば、小児科癌)の治療におけるそれらの使用を継続していることが予想される。私たちの候補薬物については、物質の組成、使用方法、製造方法を含む多段階の特許保護が求められている。私たちはより多くの特許出願を通じて私たちの候補薬物と技術の特許保護を強化するつもりだ。
2024年1月1日現在、ドイツ·ダムシュタット·メルクKGaAからの独占ライセンス内特許シリーズと、武田薬業株式会社からの非独占ライセンス内特許シリーズ1つの特許シリーズとを含む11個の特許シリーズからなる特許組み合わせを所有または共同所有している。私たちが所有または共同所有する11個の特許シリーズは、物質成分、医薬成分、合成方法、合成中間体、治療方法、および我々の候補製品のうちの1つであるtovorafenibまたはpimasertibに関連する併用療法を含む特許出願および発行された特許を含む。武田薬業株式会社の非独占ライセンス特許シリーズは、我々の候補製品tovorafenibを製造するために使用することができる触媒を含む。ドイツのダムシュタットからのメルクKGaAの3つの独占ライセンス特許シリーズは、私たちの候補製品pimasertibの物質組成と使用方法をカバーしている。私たちがここで議論しているすべての、共同所有または許可された特許の特許条項は、利用可能な特許期間延長を含まない。
2024年1月1日現在、私たちが所有または共同所有する特許の組み合わせは、tovorafenibの物質組成および使用方法について、ドイツ、フランス、イギリス、ベルギーを含む4つの発行された米国特許および複数の外国特許および出願を有する共通所有特許シリーズを含む
26
スイス、デンマーク、スペイン、アイルランド、イタリア、オランダ、オーストラリア、ブラジル、カナダ、中国、インド、日本、韓国、メキシコ、シンガポール、南アフリカ、台湾、香港は、2028年から2031年にかけて満期になる予定だ。
私たちが所有または共同所有している特許の組み合わせには、ドイツ、フランス、イギリス、ベルギー、ブラジル、カナダ、スイス、スペイン、インド、アイルランド、イタリア、ルクセンブルク、モナコ、日本、中国のライセンス特許を含むtovorafenib製薬製剤に対する特許シリーズが含まれており、これらの特許は2035年に満了する予定だ。私たちが所有しているか、または共同所有している特許の組み合わせは、米国、ヨーロッパ、中国、香港、および日本における係属中の出願を含むtovorafenibに対する製剤の追加的な医薬製剤特許シリーズを含み、発表されれば2040年に満了する予定である。私たちが所有または共同所有する特許の組み合わせには、tovorafenibの他のレシピに対する特許シリーズが含まれており、発行されれば、2043年に満了すると予想される米国出願、および国有化されて発行される場合、2043年に満了する予定のPCT出願が含まれる。私たちが所有または共同所有している特許の組み合わせは、合成tovorafenib方法に対する特許シリーズをさらに含み、発表された米国特許と、オーストラリア、ユーラシア大陸、イスラエル、日本、インド、中国、メキシコのライセンス特許とを含み、2038年に満了する予定であり、米国、日本、中国、ブラジル、韓国、ヨーロッパ、カナダ、香港、シンガポールの未解決出願が発行されれば、2038年に満了する予定である。私たちが所有または共同所有する特許の組み合わせには、tovorafenib併用ドセタキセルを使用して癌を治療する方法に対する特許シリーズと、2035年に満了する予定の中国、ドイツ、フランス、イギリス、ベルギー、スイス、スペイン、アイルランド、イタリア、ルクセンブルク、モナコを含む複数の外国特許が含まれている。私たちが所有または共同所有する特許の組み合わせは、米国、シンガポール、メキシコ、韓国、日本、香港、ヨーロッパ、中国、カナダ、およびオーストラリアにおける係属中の出願を含むpLGG治療方法のための特許シリーズを含み、これらの出願は一旦発表され、2041年に満了する予定である。私たちが所有しているか、または共同所有している特許の組み合わせは、米国、南アフリカ、シンガポール、ニュージーランド、メキシコ、韓国、日本、イスラエル、ヨーロッパ、中国、カナダ、ブラジル、オーストラリアにおける係属中の出願を含むtovorafenibとpimasertibのようなMEK阻害剤とを組み合わせた癌治療方法に対する特許シリーズを含み、これらの出願が発行されると、2042年に満了する予定である。私たちが所有または共同所有する特許の組み合わせは、PCT出願が未解決であり、tovorafenib治療を受ける患者を選択する方法を含む特許シリーズを含み、国有化されて発表されれば、2042年に満了する予定である。私たちが所有しているか、または共同所有している特許の組み合わせは、pimasertibのようなMEK阻害剤に対する米国仮出願の治療方法のうちの1つを含み、非一時的出願に変換されて発行される場合、2044年に満了する予定である。私たちが所有または共同所有する特許の組み合わせは、pLGGを治療する方法のための米国仮出願であり、非仮出願に変換されて発行される場合、2044年に満了する予定である追加の特許シリーズをさらに含む。
2024年1月1日現在、私たちの特許組み合わせは、物質の組成およびpimasertibの使用方法をカバーするドイツのダムシュタットメルクKGaAによって独占的に許可された特許シリーズを含む。この特許シリーズは、アルゼンチン、オーストリア、オーストラリア、ベルギー、ブルガリア、ブラジル、カナダ、スイス、中国、キプロス、チェコ共和国、ドイツ、デンマーク、ユーラシア大陸、エストニア、スペイン、フィンランド、フランス、イギリス、ギリシャ、香港、ハンガリー、アイルランド、イスラエル、インド、アイスランド、イタリア、日本、韓国、リトアニア、ルクセンブルク、ラトビア、モナコ、メキシコ、オランダ、ノルウェー、ポーランド、ポルトガル、ルーマニア、ロシア連邦、スウェーデン、シンガポール、スロベニア、スロバキア、トルコ、ウクライナ、南アフリカの認可された特許を含む4つの発行された米国特許および/または複数の外国特許および/または出願を含む。私たちの特許の組み合わせは、固体形態のpimasertibを対象としたドイツDarmstadtのMerck KGaAによって独占的に許可された特許シリーズを含む。この特許シリーズは、オーストリア、オーストラリア、ベルギー、カナダ、スイス、チェコ共和国、ドイツ、デンマーク、ユーラシア大陸、スペイン、フランス、イギリス、イタリア、日本、ルクセンブルク、メキシコ、オランダ、ポーランド、ポルトガル、ロシア連邦、スウェーデン、シンガポール、台湾、南アフリカでのライセンス特許を含むライセンスされた米国特許および/または複数の外国特許および/または出願を含み、これらの特許は2033年に満了する予定である。私たちの特許組み合わせには、アルゼンチン、オーストリア、オーストラリア、ベルギー、ブラジル、カナダ、スイス、中国、チェコ共和国、ドイツ、デンマーク、ユーラシア大陸、エストニア、スペイン、フィンランド、フランス、イギリス、香港、クロアチア、ハンガリー、アイルランド、イスラエル、インド、アイスランド、イタリア、韓国、リトアニア、ルクセンブルク、ラトビア、北マケドン、マルタ、メキシコ、オランダ、ノルウェー、ニュージーランド、フィリピン、ポーランド、ポーランド、ドイツ、オーストリア、オーストラリア、アイスランド、イタリア、韓国、リトアニア、ルクセンブルク、ラトビア、マルタ、メキシコ、オランダ、ノルウェー、ニュージーランド、フィリピン、ポーランド、ドイツのダムシュタットKGaA社が独占的に許可した特許シリーズも含まれている。ポルトガル、ルーマニア、ロシア連邦、スウェーデン、シンガポール、スロベニア、スロバキア、トルコ、ウクライナ、南アフリカは、2029年に期限が切れる予定だ。
個別特許の期限は,特許を付与した国の特許法的期限に依存する。私たちが特許を出願しているほとんどの国では,特許期間は一般に最初に特許出願を提出した日から20年である
27
非臨時特許出願。米国では、場合によっては、特許期間を特許期限調整によって延長することができ、これは、特許権者が米国特許商標局(USPTO)の特許の審査および付与時の行政遅延による損失を補償するか、または1つの特許が共通所有特許または共通発明者と命名された特許によって最終的に放棄され、有効期限が早い場合には、特許期限が短縮される可能性がある。さらに、1984年の“医薬品価格競争および特許期限回復法”または“ハッジ·ワックスマン法案”は、薬剤の特許有効期間中に規制審査を受ける時間長の部分補償として、米国特許満了後に最大5年間の特許期間の延長を可能にしている。特許期間の延長の長さは,薬物が規制審査を受ける時間の長さと関係がある。1つの特許の残り期間は、製品が承認された日から14年を超えてはならず、各規制審査期間は、1つの特許のみを延長することができ、承認された薬物、その使用方法、またはその製造方法に関する請求項を延長することしかできない。
EUおよび他のいくつかの外国司法管轄区域にも同様の規定があり、承認された薬物をカバーする特許の期限を延長する。将来、私たちの候補薬がFDAや外国規制機関の承認を得たら、これらの製品をカバーする発行された特許の期間(あれば)を延長することを申請する予定です。しかし,米国FDAを含む適用当局が,このような延期を承認すべきかどうか,承認された場合のこのような延期の期限の評価に同意する保証はない.我々の知的財産権に関連するリスクに関するより多くの情報は、“リスク要因-私たちの知的財産権に関連するリスク”というタイトルの部分を参照してください。以上言及した満期日は,我々が入手可能な潜在的特許期間の延長や他の市場排他性とは無関係である。
私たちのような生物製薬会社の特許地位は通常不確定であり、複雑な法律、科学、事実の問題に関連している。私たちのビジネス成功はまた第三者の独占権を侵害しないことにある程度依存するだろう。いかなる第三者特許を発行することが、私たちの開発または商業戦略を変更し、私たちの薬物やプロセスを変更し、許可証を取得したり、いくつかの活動を停止することを要求するかどうかはまだ確定されていません。私たちは、任意のライセンス契約に違反したり、将来の製品を開発または商業化するために必要な独自の権利の許可を得ることができず、私たちに実質的な悪影響を及ぼす可能性があります。もし第三者が米国で準備して提出した特許出願も権利の技術を要求する場合、私たちは発明の優先権を決定するために、米国特許商標局の干渉または派生プログラムに参加しなければならないかもしれない。より多くの情報については、“リスク要因-私たちの知的財産権に関連するリスク”というタイトルの節を参照してください
特許保護に加えて、私たちは、ビジネス秘密、技術的ノウハウ、商標、その他の独自の情報、および持続的な技術革新に依存して、私たちの競争地位を発展させ、維持しています。私たちの商標組み合わせは、現在、米国の初日、初日にバイオ製薬および抗癌薬開発の出願および/または登録、および米国、カナダ、EU、アイスランド、リヒテンシュタイン、ノルウェー、スイスおよびイギリスにおけるOJEMDA(トヴォラフェニのマーケティング名)の出願を含む。私たちは、私たちの業務において特許保護から保護されているか、または特許保護に適していないと考えられる側面を保護し、保護し、独自の情報の機密性を維持することを求めている。私たちは、当社の従業員やコンサルタントと契約を締結することを含む、当社の独自情報およびビジネス秘密を保護する措置をとっていますが、第三者は、実質的に同じ独自の情報および技術を独立して開発したり、他の方法で私たちのビジネス秘密を取得したり、当社の技術を開示したりすることができます。したがって、私たちは私たちの商業秘密を意味的に保護することができないかもしれない。私たちの政策は、私たちの従業員、コンサルタント、外部科学協力者、協賛研究者、および他のコンサルタントに、私たちとの雇用や相談関係を開始する際に秘密協定を実行することを要求します。これらの合意は、個人と私たちとの関係中に開発または開示された当社の業務または財務に関するすべての機密情報は、特定の場合を除いて第三者に開示されてはならないことを規定している。私たちと従業員の合意はまた、従業員が私たちに雇われた過程で構想されたすべての発明または従業員が私たちの機密情報を使用することによって生成されたすべての発明が私たちの固有財産であることを規定している。しかしながら、このようなセキュリティプロトコルおよび発明譲渡プロトコルは違反される可能性があり、このような違反に対応するための十分な救済措置がない可能性がある。我々の知的財産権に関連するリスクに関するより多くの情報は、“リスク要因-私たちの知的財産権に関連するリスク”を参照されたい
政府の監督管理
その他の事項を除いて、アメリカ連邦、州と地方の各レベル、その他の国と司法管轄区の政府当局は研究、開発、テスト、製造、品質、
28
薬品の審査、包装、貯蔵、記録保存、ラベル、広告、販売促進、マーケティング、流通、承認後のモニタリング、研究と報告、サンプリング及び輸出入。米国や他の国や管轄区域で規制の承認を得る手続きや、その後適用される法規や条例、その他の規制当局の遵守には、多くの時間と財力が必要だ。
FDA承認プロセス
アメリカでは、“連邦食品、薬物と化粧品法”或いは“FD&C法”及びその他の連邦と州法規と法規に基づいて、薬品はFDAの広範な監督管理を受け、これらの法規と法規は薬品の研究、開発、テスト、製造、品質、承認、包装、貯蔵、記録保存、ラベル、広告、販売促進、マーケティング、流通、承認後のモニタリング、研究と報告、サンプリング及び輸出入などの方面で管理を行う。適用されない米国の要求を遵守しないことは、臨床封印、FDAが新しいマーケティング申請または承認保留の申請の受け入れを拒否する、警告または無タイトル手紙、製品リコール、製品差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金、民事罰金、刑事起訴、処罰および罰金のような様々な行政または司法制裁を受ける可能性がある。
米国では、新製品の医薬品開発または承認製品のいくつかの変更は、通常、臨床前実験室および動物試験に関連し、IND(臨床試験が開始される前に発効しなければならない)をFDAに提出し、FDA承認を求める各適応に対する薬剤の安全性および有効性を決定するために、十分かつ制御された臨床試験を含む。FDAの承認前の要求を満たすには通常長年の時間を要し、実際の所要時間は製品或いは疾病のタイプ、複雑性と新規性によって大きく異なる可能性がある。
臨床前試験は製品の化学、調合と毒性に対する実験室評価、及び製品特性と潜在安全性と有効性を評価する動物試験を含む。臨床前試験の進行は必ず良好な実験室操作規範を含む連邦法規と要求に符合しなければならない。臨床前試験の結果はINDの一部として他の情報とともにFDAに提出され,製品化学,製造,制御に関する情報,提案された臨床試験案が含まれている。IND提出後,生殖毒性や発ガン性の動物試験など,長期的な臨床前試験を継続する可能性がある。ヒト臨床試験を開始する前に,各INDの提出後30日間の待機期間が求められている。FDAがこの30日間INDにコメントもINDにも疑問を提起しなければ,INDで提案された臨床試験が開始される可能性がある。臨床試験は合格した研究者の監督の下で、健康ボランティア或いは患者に研究用新薬を提供することに関連する。臨床試験は:(I)連邦法定要求と法規に適合する;(Ii)良好な臨床実践(GCP)、すなわち研究対象の権利と健康を保護し、臨床試験発起人、管理者と監督者の役割を定義するための国際標準、および(Iii)試験目標を詳細に説明し、安全性を監視するためのパラメータと評価すべき有効性基準の方案に基づいていなければならない。米国ではヒト臨床試験に関連する各案およびその後の案修正案はINDの一部としてFDAに提出されなければならない。
FDAが臨床試験がFDAの要求に沿って行われていない,あるいは臨床研究対象に対して受け入れられないリスクと考えられている場合,FDAはいつでも臨床試験の一時的または永久的な停止を命じたり,他の制裁を加えたりすることができる。臨床的保留はすべてであってもよく、部分的であってもよい。臨床試験における被験者の研究案やインフォームドコンセント情報も機関審査委員会やIRB承認に提出しなければならない。IRBは完成するまで臨床試験も監視する。IRBはまた、IRBの要求を遵守できなかったために、現場の臨床試験を一時的または永久的に停止することを要求することができ、または他の条件を適用することができる。また、ある臨床試験は臨床試験スポンサーによって組織された独立した合格専門家グループによって監督され、このグループはデータ安全と監視委員会或いはデータ監視委員会と呼ばれる。これらのグループはセキュリティ評価を行い,実験のあるデータへのアクセス状況に応じて,指定されたチェックポイントで実験を行うことができるかどうかを提案する.
ニューノミンの発売承認を支持する臨床試験は通常3つの連続段階で行われるが、これらの段階は重なる可能性がある。第1段階、すなわち、最初に健康なヒト対象または患者に薬物を導入した場合、新陳代謝、薬物動態、薬理作用、用量増加に関連する副作用、および可能であれば有効性を評価するための早期証拠を評価するために、薬物が試験される。第2段階は、一般に、特定の適応、用量耐性、および最適状態における薬剤の有効性を決定するために、限られた患者集団で試験を行うことを含む
29
投与量、そしてよく見られる副作用と安全リスクを確定する。薬剤が第2段階評価において有効性および許容可能な安全性を証明する場合、第3段階試験は、FDAが薬剤の全体的な利益-リスク関係を評価し、薬剤のラベルに十分な情報を提供することを可能にするために、より多くの患者の臨床治療効果および安全性に関する追加の情報を得るために実施される。多くの場合、FDAはこの薬物の治療効果を証明するために、十分かつ良好にコントロールされた2つの3期臨床試験を必要とする。ごく少数の場合、単一の試験で十分である可能性があり、(1)研究は大型多中心試験であり、内部一致性を表明し、統計学的に非常に説得力があり、死亡率、不可逆的な発病率或いは疾病の予防に臨床的意義のある影響を発見し、潜在的な深刻な結果を持っているが、第二回の試験で結果を確認することは実際に或いは倫理的に不可能であり、あるいは(2)他の確認性証拠と結合している。
これらの段階は、重ねたり、組み合わせたりすることができる。例えば、1/2期臨床試験は用量増加段階と用量拡張段階を同時に含む可能性があり、後者は将来の臨床試験で推奨される拡張用量の耐性(従来の1期臨床試験と同様)を確認し、選択された亜群で研究療法の抗腫瘍効果(S)を深く理解することができる。通常,腫瘍学療法の開発過程では,第一段階臨床試験に参加したすべての被験者が疾患の影響を受けた患者であることから,非腫瘍学的療法の第一段階臨床試験よりも,このような試験期間中に臨床活動に関する情報がより多く収集される可能性がある。
深刻または生命に危険な疾患の2期または3期臨床試験を行う研究薬剤の製造業者は、例えば、そのウェブサイト上に掲示することによって、その評価およびアクセス拡大要求に応答するためのその政策を提供しなければならない。
必要な臨床試験が完了した後,NDAを用意してFDAに提出する。この製品が米国で発売される前に、FDAのNDAの承認を得る必要がある。NDAは、すべての臨床前、臨床および他の試験の結果、および製品の薬理、化学、製造および制御に関連するデータアセンブリを含まなければならない。
秘密協定を準備して提出する費用は巨大だ。新開発計画の提出の多くは高額な申請使用料を支払う必要があります。場合によっては、小企業が初めて出願した出願料を免除することを含む、費用を免除または減免することができる。また,孤児薬として指定された製品については,NDAに対して使用料を評価せず,非孤児適応も含まれていない限りである。承認された秘密保持協定によると、申請者は計画年会費を支払う必要がある。FDAは毎年ユーザー料金を調整し、費用は通常毎年増加する。
FDAは、NDAを提出するか否かを決定する前に、各提出されたNDAを審査し、これは、機関が実質的な審査を可能にするのに十分に完全であると判断したことに基づいて、FDAは、より多くの情報の提供を要求する可能性がある。FDAは、受信後60日以内にNDAを提出するか否かについて決定しなければならず、このような決定には、FDAが提出を拒否することが含まれる可能性がある。もし申請が提出されれば、FDAはNDAの深い検討を開始するだろう。FDAはNDAのレビューでいくつかのパフォーマンス目標を設定することに同意した。ほとんどの標準的な審査薬物製品の申請は10~12ヶ月以内に審査され、ほとんどの優先審査薬の申請は6~8ヶ月以内に審査される。優先審査は、FDAが治療において大きな進展を得るか、または適切な治療方法がない場合に治療を提供する薬剤を決定するのに適用することができる。FDAは、いくつかの遅延された情報を考慮するために、または提出中に提供された情報の情報を明確にするために、標準審査および優先審査の審査手続きをさらに3ヶ月延長することができる。FDAは、常に基準および優先NDAの目標日を達成するわけではなく、FDAは、より多くの情報を提供することを要求するか、または明確にすることができ、審査プロセスを延長することができる。
FDAはまた、新薬製品の申請、または安全性または有効性の問題の医薬製品の申請を諮問委員会に提出することができ、一般に臨床医および他の専門家を含むグループであり、審査、評価を行い、申請を承認すべきかどうか、およびどのような条件下で提案するべきかについて提案することができる。FDAは諮問委員会の提案によって制限されていないが、それは一般的にそのような提案に従っている。
NDAを承認する前に、FDAは、現在の良好な製造仕様またはcGMPに適合するかどうかを決定するために、新製品の製造施設を承認前に検査する。FDAは、製造プロセスおよび施設がcGMP要件に適合していると判断しなければ、製品が要求された範囲内で一貫して生産されることを保証するのに十分であることを決定しない限り、この製品を承認しない
30
規格です。FDAは、一般に、GCP要件に適合し、安全性および有効性をサポートするデータの完全性を保証するために、1つまたは複数の臨床試験地点を検査する。
FDAがNDAおよび製造施設を評価した後、それは、承認書または完全な返信、すなわちCRLを発行する。CRLは、通常、提出文書の不足点を列挙し、FDAが、追加の臨床データ、追加の重要な臨床試験(S)、および/または臨床試験、臨床前研究、または生産に関連する他の重要かつ時間的な要件を再検討するために、大量の追加の試験または情報を必要とする可能性がある。CRLを発行すれば,申請者は手紙で決定されたすべての不足点を解決するNDAを再提出し,申請を撤回し,正式な論争解決を行うか,聴聞機会を要求することができる.FDAは、含まれる情報の種類に応じて、2ヶ月または6ヶ月以内に再提出された出願を検討することを約束している。このようなデータや情報を提出しても,FDAはNDAが承認基準を満たしていないと認定する可能性がある。
NDAが再提出された場合、またはいつ、CRLで決定された欠陥がFDAによって満足的に解決された場合、FDAは承認書を発行する。この薬物の商業マーケティングを許可し、特定の適応の具体的な処方情報を提供する。NDA承認の条件として、FDAは、薬剤の利点が患者への潜在的リスクよりも大きいことを保証するために、リスク評価および緩和戦略、またはREMSを必要とする可能性がある。REMSは、薬物ガイドライン、医療専門家のコミュニケーション計画、および安全な使用を確保する要素、またはETASUを含むことができる。ETASUは、処方または調剤のための特殊トレーニングまたは認証、特定の場合にのみ調剤、特殊モニタリング、および患者登録簿の使用を含むことができるが、これらに限定されない。REMSに対する要求はこの薬物の潜在的な市場と収益力に重大な影響を与える可能性がある。さらに、製品承認には、薬物の安全性または有効性を監視するために、大量の承認後の試験および監視が必要となる可能性がある。承認されると、FDAが承認された使用条件で安全かつ有効ではないと判断した場合、またはスポンサーが何らかの規制要件を遵守していない場合、製品承認は撤回される可能性がある。
承認申請において確立されたいくつかの条件の変更は、適応、ラベルまたは製造プロセスまたは施設の変更を含み、変更を実施する前に、NDA付録を提出してFDAの承認を得る必要があり、場合によっては、新たなNDAを承認する必要がある。新適応のNDAサプリメントは通常,オリジナル申請と類似した臨床データが必要であり,FDAがNDAサプリメントを審査する際に使用するプログラムや行動は,NDAを審査する際に使用するプログラムや行動と同じである。
臨床試験情報の開示
FDA規制製品(医薬品を含む)のいくつかの臨床試験のスポンサーは、Clinicaltrials.govに登録され、いくつかの臨床試験情報を開示しなければならない。介入措置(例えば、医薬製品)、患者集団、調査段階、研究場所および調査者、ならびに臨床試験の他の態様に関する情報は、その後、登録の一部として開示される。スポンサーはまた、試験の初歩的な完成日から1年以内に臨床試験結果を提出しなければならない。場合によっては、認証をタイムリーに提出した後に、これらの試験の結果の開示を遅延させることができるが、認証を提出してから2年以内に結果を提出しなければならない。延期は正当な理由で利用できるかもしれない。競争相手はこれらの公開された情報を用いて開発計画の進捗状況を知ることができる.
孤児薬
孤児医薬品法によれば、FDAは、米国では通常20万人未満、または米国では20万人を超える影響を与えるまれな疾患または疾患の治療のための薬剤を孤児薬として指定することができるが、このような疾患または疾患のための製品の開発および製造コストは、米国での販売から回収されるという合理的な予想はない。
秘密保持協定を提出する前に、指定孤児薬を申請しなければならない。FDAが孤児薬物指定を承認した後、FDAは、薬物の識別情報およびその潜在的な孤児用途を開示する。孤児薬物の指定は、監督審査と承認過程においていかなる利点も伝達されず、規制審査と承認過程の持続時間を短縮することもない。
FDAの承認を得た最初の特定の活性部分は、FDAが孤児に指定されたまれな疾患を治療するためのNDA申請者であり、米国で特定の製品および孤児に指定された特定の適応に対して7年間の排他期を有する権利がある。7年間の専門期間内に、FDAは、他のいかなるスポンサーも同じ価格で同じ薬物を販売する申請を許可してはならない
31
限定された場合でなければ、例えば、より効果的、より安全、または患者ケアに大きな貢献をすることによって、孤児薬物排他性を有する製品に対する臨床的優位性を示すか、または医薬品供給問題または排他的保持者が同意する場合に適応される。孤立薬物の排他性は,FDAが同一適応を承認する異なる薬物,あるいは同一薬物の異なる適応を阻止しない。孤児薬を指定する他の利点には,何らかの研究の税収免除と,NDA提出に必要な使用料の免除があり,NDAが承認を求めず孤児薬物指定の適応を得ていないことを前提としている。
2021年9月米国第11巡回控訴裁判所はCatalyst製薬会社はBecera事件を訴えましたFirdapse(アミノフェニルプリジン)の孤児薬物独占範囲はこの製品の承認適応に限られており,これはFDAがその解釈“孤児薬物法”の規定に基づいた行動であり,FDAの誤りである。裁判所は,孤児薬品法により,FirdapseのS孤児薬物専営権は逆に孤児薬物指定を得るまれな疾患や疾患を保護しているとしている。Catalyst事件に対して裁判所がこの判決を下した後,FDAは2023年1月にFDAの規定を引き続き適用し,孤立薬物の独占的範囲を製品の承認用途や適応範囲に制限すると発表した。FDAの声明により,孤児薬物排他性の範囲や,FDAが以前に承認されたおよび将来の製品に対する“孤児薬物法”の施行に関する他の問題は,さらなる訴訟や立法のテーマとなる可能性がある。
突破的治療指定
FDAはまた、重症または生命に危険な疾患または疾患を治療するための薬物承認申請の開発および検討を加速することを要求されており、初歩的な臨床証拠が示されている場合、薬剤は1つまたは複数の臨床的に重要な終点で既存の治療法よりも実質的に改善されている可能性がある。画期的療法計画によると,新候補製品のスポンサーは,候補製品のIND提出と同時にあるいはその後,特定適応の候補品を画期的療法として指定することをFDAに求めることができる。FDAはスポンサーの申請を受けてから60日以内に候補品が画期的な治療指定を受ける資格があるかどうかを決定しなければならない。FDAは突破的な治療法の面で何らかの行動をとる可能性があり、全体の開発過程中にスポンサーと会議を行い、適時に製品スポンサーに開発と承認に関する提案を提供し、より多くの高級者を審査過程に参加させ、審査チームのために1つの学際的なプロジェクト担当者を指定し、他のステップを取って効率的に臨床研究を設計することを含む。
承認を加速する
深刻なまたは生命を脅かす疾患または状態の治療のために使用されることを意図している製品の場合、臨床的利益が合理的に予測される可能性のある代替終点に基づいて、または不可逆的な発症率または死亡率よりも早く測定することができる臨床的終点に基づいて、病状の重症度、希少性または流行率、および代替治療の利用可能性または不足を考慮して、NDAの承認を加速することができる。加速承認を得た薬物は通常、既存の治療方法より患者に意義のある治療優勢を提供した。
加速承認経路は、通常、病気経過が比較的長い環境で使用され、代用または中間臨床終点への影響が速く発生しても、製品の予期される臨床的利益を測定するために長い時間を必要とする。加速承認は、様々な癌を治療するための製品の開発および承認によく使用され、その中で、治療の最終目標は、全体的な生存率を向上させること、または深刻な長期発症率を低下させることであり、典型的な病気経過の持続時間は、生存または長期の臨床的利益を証明するために長い、時に大型の研究を必要とする。
承認経路を加速するには、一般に、製品の臨床的利益を検証および説明するために、追加の承認後の検証的研究または複数の研究を行うことにスポンサーの同意が必要である。このような検証試験はいずれも職務調査の場合に完了しなければならず、FDAは試験が承認前に行われることを要求する可能性がある。このような必要な承認後研究を職務的に行わない場合、またはそのような研究中に臨床的利益が確認されない場合、FDAが製品の市場からのリコールを加速させることが可能である。また、FDAは現在、承認を加速させる条件として、製品商業発売の時期に悪影響を及ぼす可能性がある宣伝材料を事前に提出することを求めている。承認経路を加速することは、常により速い開発や監督審査や承認過程を招くわけではなく、承認を加速させることは、最終的にFDAの完全な承認を得ることを保証することはできない。
32
小児科情報
“小児科研究公平法”によると、新薬または新薬補充剤は、すべての関連小児科亜群において薬物が主張する適応の安全性と有効性を評価し、薬物に対して安全かつ有効な各小児科亜群の投与量および投与をサポートするための十分なデータを含まなければならない。代替的に、新しい活性成分の元のNDAについて、医薬が成人癌の治療を意図し、FDAに対して小児癌の増殖または進行に実質的に関連する分子標的を決定する場合、分子標的小児癌に関する研究を含む報告を申請することが要求されることができる。FDAは、任意の要件にすべてまたは部分的な免除または延期を与えることができる。規制が別途要求されない限り、PREAは孤児の称号が付与されたいかなる適応薬にも適用されない。この免除は新たな活性成分の原始NDAには適用されず,NDAが分子標的小児科癌調査要求に従うと孤児が指定するためである。
児童最優秀薬品法案、またはBPCAは、ある条件が満たされれば、期限が切れていない排他的延長を6ヶ月提供する。NDAの場合、小児科固有性は、承認された医薬製品に記載されている未期限切れの非特許および特許固有性に付加され、研究薬と同じ活性部分を含む任意の薬物の治療同等性評価が行われる。小児科専門権を取得する条件は、FDAが小児科集団における新薬の使用に関連する情報がその集団に健康利益をもたらす可能性があることを決定することを含み、FDAは小児科研究の書面請求を行い、出願人がこれらの研究を行うことに同意し、達成することと、申請者が小児科専門権を付与された法定時間の枠組み内で要求された研究を報告することとを含む。BPCAによる小児科研究結果に基づいてラベル変更の申請やサプリメントを提示することは優先申請とみなされ,与えられたすべての利点を指定することができる。
承認後に要求する
機密協定が承認されると、製品はいくつかの承認後に要求される制約を受けるだろう。例えば、FDAは、消費者向けの広告、ラベル外販売促進、業界スポンサーの科学的および教育活動、ならびにソーシャルメディアおよびインターネット上の通信を含む、承認された医薬品に関連する広告、販売促進、マーケティングおよび通信を密接に規制する。薬品はその承認の適応とFDA承認のラベルが一致するようにしか販売できない。
FDAがNDAを承認した後,有害事象報告と定期報告を提出する必要がある。FDAはまた、いくつかの上場後の監視、研究、および/またはテストを行うことをスポンサーに要求または要求する可能性がある。これらの承認後の義務は上場後要求または上場後承諾と呼ばれ,具体的にはこれらの要求を実施する権力機関に依存する.FDAはまた、承認された製品に関連する潜在的な有害事象を監視するために、またはREMSを実施して、製品の利点がリスクよりも大きいことを確実にするために、安全監視を強化することを要求する可能性がある。REMSは、セキュリティ問題の深刻さに応じて、製品の流通や使用に制限条件を加える可能性がある。
また,品質管理,薬品製造,包装,ラベルプログラムは承認された後もcGMPに適合し続けなければならない。医薬品製造業者とある下請け業者はFDAといくつかの州機関に彼らの工場を登録することを要求された。FDAの登録要求エンティティはFDAの定期抜き打ち検査を受け,その間,FDAは製造施設を検査し,cGMPの遵守状況を評価する。そのため,メーカーはcGMPの遵守を維持するために,生産や品質管理の分野で時間,お金,精力をかけ続けなければならない。
ある会社が特定の承認後の義務や規制基準を遵守できなかった場合、監督管理機関は製品の承認を撤回したり、製品のリコールを要求したりすることができる。
まれな小児科疾患指定と優先審査証明書
まれな小児科疾患優先審査クーポン計画によれば、FDAは、承認された珍しい小児科疾患の治療又は予防製品のマーケティング申請のスポンサーに優先審査クーポン券を発行することができる。まれな小児科疾患は、米国では200,000人未満の深刻または生命に危害を及ぼす疾患または状態であり、米国では200,000人を超える影響を与えるが、米国では薬物の回収および提供のコストが合理的に予想されていない、または疾患または状態の孤児であり、そうでなければ米国の200,000人以上に影響を与える。まれな小児科疾患製品申請が承認された後にのみ,クーポン券を発行することができる。まれな小児科疾患の応用は
33
以下の基準に適合するマーケティング申請:まれな小児科疾患の治療または予防のための製品の申請;申請は資格優先審査とみなされなければならない;申請は成人適応の承認を求めてはならない;製品は以前にFDAによって承認された活性部分または成分を含んではならない;申請は“食品·医薬品局法案”505(B)(1)節に基づいて提出されなければならない;申請は小児科集団およびその集団に対する薬物用量を研究して得られた臨床データに依存しなければならず、許可された製品は小児科集団に対して適切なラベルを行うことができる。スポンサーの要求の下で、FDAは、まれな小児科疾患を治療する製品として製品を指定することができ、新しい製品の出願を稀な小児科疾患製品として指定することができる。
スポンサーは,まれな小児科疾患申請を提出した後にFDAにその申請証明書の意図を通知しなければならない。受賞した製品が製品が承認されてから365日以内に米国に発売されなければ、FDAは珍しい小児科疾患優先審査証明書を撤回する可能性がある。この証明書は、別の保険者に譲渡することができ、その後、引き続き申請を一緒に提出し、保有者に優先的に当該申請を審査する権利を持たせることができる。まれな小児科疾患優先審査クーポン券を使用するスポンサーは、申請提出の少なくとも90日前に、クーポン券をNDAに提出する意向をFDAに通知し、FDAが決定した優先審査使用料および任意の他の必要な使用料を支払わなければならない。FDAの現在の業績目標によると、FDAの目標は6ヶ月以内に優先審査申請に行動することだ。
2020年12月,国会はまれな小児科疾患優先審査クーポン計画を再認可した。再認可された条項によると、FDAは2024年9月30日以降、指定された日または前にクーポン券しか付与できない。現在の法律によると、FDAは2026年9月30日以降に稀な小児科疾患の優先審査証明書を授与しない可能性がある。
“ハッジ·ワックスマン修正案”
オレンジ図書リスト
1984年の“医薬品価格競争および特許条項回復法”(一般に“ハッチワックスマン改正案”または“ハッジ·ワックスマン修正案”と呼ばれる)によれば、NDA申請者は、各特許に関する情報をFDAに提出しなければならず、一人の人が薬物の製造、使用または販売に従事する特許所有者の許可を得ず、出願人の薬物(すなわち、薬物物質または医薬品特許である)を要求するか、または提案されたラベルに従って薬物の使用方法または発売要件を要求する場合、特許侵害クレームを合理的に主張することができる。薬物が承認された後、出願人は、承認されたラベルに基づいて、当該薬剤の発売要件を満たす特許に関する特許情報を直ちにFDAに提出し、その後、これらの特許の情報をFDAの承認された治療同等性評価を有する医薬製品において、一般にオレンジブックと呼ばれるものに公表しなければならない。
オレンジマニュアルに記載されている薬物は、後発薬メーカーによって新薬申請またはANDAにおける参考市販薬として簡略化される可能性がある。ANDAは参考発売薬物と同じ有効成分(S)、濃度、投与経路、剤形とラベルを有する薬品の販売を規定しているが、ある例外的な情況は除外し、しかも参考発売薬物と生物学的同等性がある。承認されたANDA製品は通常,治療上参考に市販されている薬剤と同様と考えられている。生物学的同等性を示す任意のデータを提出する以外に、ANDA申請者は、その医薬製品の安全性または有効性を証明するために、臨床前または臨床試験または提出結果を行う必要がない。ANDA経路により承認された薬物は通常市販薬を参考にした“模倣等価物”と呼ばれ,通常薬剤師が各州の薬物代替に関する法律に基づいて市販薬を参考にして処方された処方で代替することができる。
ANDA申請者は、オレンジブックに記載された参照薬に関連する各特許の適切な証明または宣言をFDAに提出することを要求される。具体的には、出願人は、(I)必要な特許情報が提出されていないこと、(Ii)特許が満了していること、(Iii)に記載されている特許が満了していないが、特定の日に満了し、特許が満了した後に承認を求めること、または(Iv)に列挙された特許が無効であり、強制的に実行できないか、または提案された製品の製造、使用または販売によって侵害されることがない(第4項の認証と呼ばれる認証)の4つの特許証明を作成することができる。承認された使用方法を要求する上場特許については、場合によっては、ANDA出願人は、特許証明ではなく、特許証明ではなく、提案されたANDAタグが使用方法特許カバーの指示または他の使用条件を含まないことを証明することを選択することができる(または彫刻された)。ANDA出願人は、薬物ラベルの関連部分を切断することによって、ANDA出願人がFDAがその模倣薬を承認する能力を確保することに影響を与えない使用方法特許に関連する特許訴訟を回避することができる。そうでなければ,出願人が第4項を通じて特許に疑問を提起しなければ
34
この薬品が認証を受けていない場合、ANDAは上場薬物を参考にしたすべての上場特許が満期になるまで承認を得る資格がない。ANDA出願人が第4項の認証をFDAに提出した場合、FDAがANDA届出を受けた後、出願人はまた、NDA所持者及び特許権者(S)に第4項の認証の通知(略称通知状)を送信しなければならない。そして、国家特許庁及び特許所持者は、通知状に対して特許侵害訴訟を提起することができる。第4項の認証を受けてから45日以内に特許侵害訴訟が提起され、いくつかの要件が満たされた場合、FDAは、通知状、特許満了、裁判所が和解命令または同意法令声明を第4項の認証の対象とする特許無効または侵害されていないことを署名し、または特許訴訟において特許が無効または侵害されていないと判断される日から30ヶ月前まで、ANDAを承認することができない。
ANDA出願も,市販薬のオレンジブックに記載されているいずれの適用も参照される非特許排他性満了まで承認されないであろう。場合によっては、ANDA出願人が求め、FDAがANDA処方情報から排他的に保護された情報を省略することを許可する場合、ANDA出願人は、いくつかの非特許排他性が満了する前に承認を得ることができる。
排他性
NDAが新しい化学物質またはNCEを承認すると、すなわち、FDAが任意の他のNDAで承認された活性部分を含まない薬剤は、5年間の排他性を得るであろうが、その間、FDAは、申請が第4の段落の証明を含む限り、NCE排他性失効の前年に提出することができない限り、薬剤の模倣バージョンの承認を求めるANDAを受け取ることができない。Orange Bookに記載されている特許がなければ,第4段落の認証がない可能性があるため,排他期が満了するまでは,その薬剤の後発薬にANDAを申請してはならない。
出願人が、承認のために重要な承認された薬剤のいくつかの変化を行うか、または開始するか、新しい適応の承認、新しい用量の承認、または新しい使用条件を承認することが含まれる可能性があり、これらの変化は、承認日から3年間の排他期間に関連しており、その間にFDAは、このような変化を含む後発薬のANDAを承認することができない。場合によっては、ANDA出願人が求め、FDAがANDA処方情報からこのような排他的に保護された情報を省略することを許可する場合、ANDA出願人は、3年の排他的満了前に承認を得ることができる。
特許期間を延長する
Hatch-Waxmanは、FDA規制審査中の薬剤に関連する特許期間の損失の補償として、製品を承認した後に特許をさらに延長することを可能にする。しかしながら、特許期間の延長は、製品承認日から14年間の有効特許寿命を特許に提供する日を超えてはならない。NDAの承認後、1つまたは複数の特許期限延長出願を提出することができるが、最終的には1つの特許しか延長できない。許容される特許期間の延長は、薬剤試験段階の半分(IND出願の発効からNDAの提出まで)とすべての審査段階(NDA提出と承認との間の時間)を含む特許発行後の期限から計算され、最長5年までである。FDAが出願人が職務調査を行っていないと判断して承認を求めるいつでも、時間を短縮することができる。
米国特許商標局はFDAと協議し,任意の特許期間の延長または回復の出願を審査·承認する。しかし,適用要求を満たしていないため,米国特許商標局は延期を承認しないことを決定した可能性がある.さらに、適用期間または提供される特許保護範囲は、要求されたものよりも短い可能性がある。
特許延期出願は,特許が満了する前に提出されなければならず,出願段階で満了する可能性のある特許については,特許権者は一時特許延期を申請することができる。承認された場合,臨時特許延期は特許期間を最大1年延長し,出願人が獲得する権利のある延期数に応じて最大4回延長することができる.NDA承認前に満了する可能性のある特許については、一時特許延期を行うこともできるが、このような一時特許延期は、FDAに製品承認出願が提出された場合にのみ適用される。
FDAの診断に伴う規定は
体外診断の使用が薬品の安全かつ有効な使用に不可欠であれば,FDAは通常,随伴診断と呼ばれる承認や診断の承認を要求する
35
FDAはこの医薬製品を承認した。特に抗癌薬に関しては、FDAは通常、特定の癌治療に反応する可能性のある患者を選択して、発売前の承認またはPMAを得ることを目的としたセット診断を要求し、限られた場合を除いて薬物承認を得る。癌治療法の審査を行うとともに,これらの随伴診断を審査するには,FDA薬物評価と研究センターおよびFDA装置と放射線健康センターの審査を協調させる必要がある。薬物の承認および診断に伴う相応の承認または承認も、異なる会社であれば、薬物製造業者と設備製造業者との間の高度な調整を必要とする。
臨床前および臨床データの収集およびFDAおよびFDAへの提出の審査を含むPMAプロセスは、数年またはそれ以上を要する可能性がある。これは、厳格な上場前審査を含み、その間、出願人は、装置の安全性および有効性に関する合理的な保証と、装置設計、製造、およびラベルを含む装置およびその構成要素に関する情報とをFDAに準備して提供しなければならない。PMA申請は相当な申請料を支払う必要があり、通常毎年増加する。
さらに、PMASは、一般に、FDA承認を求める各適応に対する装置の安全性および有効性を決定するために、広範な前臨床試験および十分かつ良好に制御された臨床試験の結果を含まなければならない。特に、診断の場合、出願人は、診断が十分な感度および特異性を有し、十分な試料および試薬の安定性を有し、同じ試料が複数の実験室の複数のユーザによって複数回検出されたときに再現可能な結果を生成することを証明しなければならない。PMA審査の一部として、FDAは通常、メーカーの施設が品質体系法規(QSR)に適合しているかどうかを検査し、この法規は詳細なテスト、制御、文書、その他の品質保証要求を規定している。
PMAの承認は保証されず、FDAは最終的に申請中の欠陥に基づいてPMA提出を承認できない決定を下し、追加の臨床試験または他のデータを要求する可能性があり、これらのデータの生成は高価で時間がかかる可能性があり、承認を大幅に遅らせる可能性がある。PMA出願に対するFDAの評価が有利である場合、FDAは、PMAの最終承認を保証するために、ラベルの変更などの特定の条件に同意すること、または最終ラベルを提出するような特定の条件に同意することを要求する承認可能な書簡を発行することができる。FDAが適用基準を満たしていると結論すれば,FDAは承認された適応にPMAを発行し,申請者が最初に求めた適応よりも限られている可能性がある。PMAは、ラベル、販売促進、販売、および流通の制限を含むFDAが、装置の安全性および有効性を保証するために必要と考えられる承認後条件を含むことができる。
設備が市場に投入された後、それは依然として厳格な規制要求を受けている。医療機器の販売は,その許可や承認の用途や適応にしか利用できない。デバイス製造業者はまた、年間機関登録料を支払い、FDAに彼らのデバイスをリストすることを含む、彼らの機関(S)を登録しなければならない(S)。医療機器製造業者の製造プロセスおよび任意の契約製造業者の製造プロセスは、医療機器の設計、テスト、生産、プロセス、制御、品質保証、ラベル、包装および輸送の方法および文書を含むQSRの適用部分に準拠しなければならない。米国食品医薬品局は定期的に国内工場の記録や製造プロセスを不定期に検査する。FDAはまた、米国に製品を輸出する外国施設を検査する可能性がある。医療機器製造業者はまた、装置に関連するいくつかの不良事象および故障を報告し、その装置のいくつかの修正および解体を報告しなければならない。
他の医療保険法
FDAの薬品に対する監督管理以外に、他のいくつかのタイプの州と連邦法律は製薬業界のいくつかの一般的な商業とマーケティング実践を管理している。これらの法律には、反リベート、虚偽声明、透明性、健康情報プライバシー法、および他の医療法律法規が含まれる。
他の事項に加えて、連邦反バックル法規は、Medicare、Medicaid、または他の連邦によって援助された医療計画に従って精算可能な任意の医療項目またはサービスを誘導または見返りとして購入、レンタル、注文または購入、レンタル、またはMedicaid、または他の連邦によって援助された医療計画に従って精算することを誘導または発注することを意図的に提供、支払い、請求または受け取ることを禁止する。“保健と教育和解法案”によって改正された“患者保護と平価医療法案”は、総称してACAと呼ばれ、連邦の“反リベート法規”の意図内容を改正し、個人或いは実体がこの法規或いはこの法規に違反する具体的な意図を実際に理解する必要がなく、違反を実施することができる。この法規は,薬品メーカーと処方者,購入者,処方管理人などの間の手配に適用されると解釈されている。
36
いくつかの法定例外と規制避風港はいくつかの一般的な活動を起訴や他の規制制裁から保護しているが、例外と避風港の範囲は狭く、処方、購入または推薦を誘導するための報酬に関するやり方が例外や避風港の資格に適合していなければ、審査される可能性がある。また,ACAは連邦反リベート法規を改正し,この法規に違反した行為を連邦民事虚偽クレーム法案の規定の責任基盤とすることができるようにした。
連邦民事虚偽請求法案を含む連邦民事および刑事虚偽請求法は、任意の個人または実体が虚偽請求を意図的に連邦政府に提出するか、または虚偽請求を故意に行うか、または虚偽請求を支払うために虚偽陳述を引き起こすことを禁止する。これには,連邦政府が連邦供給スケジュール外で購入した場合のように,連邦政府が直接購入者である項目(例えば連邦医療保険や医療補助など)の精算項目に対するクレームが含まれる.これらの法律によると、製薬会社や他の医療保険会社は起訴されており、価格設定サービス機関に報告された薬品価格をつり上げた疑いがあり、価格設定サービス機関は逆に連邦医療保険や医療補助販売率を設定するために使用されており、顧客に製品を無料で提供する疑いがあり、顧客が製品の連邦計画に料金を請求することが予想される。さらに、ラベル外販売促進を含むいくつかのマーケティング行為は、虚偽クレーム法律に違反する可能性もある。ほとんどの州にも連邦反リベート法規や民事虚偽請求法案のような法規や法規があり、医療補助や他の州で計画されている精算プロジェクトやサービスに適用されたり、いくつかの州では支払者にかかわらず適用されています。
医療詐欺および乱用に関連する他の連邦法規は、医療補助または医療保険受益者への報酬の提供または支払いが禁止された民事罰金法規を含み、提供者または支払人は、これらの計画によって精算された物品またはサービスの提供者、従事者またはサプライヤーの選択に影響を及ぼす可能性があることを知っているか、または知るべきであり、1996年の“健康保険携帯性および責任法”(HIPAA)によって作成された追加連邦刑法では、任意の医療福祉計画または虚偽または詐欺的な言い訳によって得られた計画を意図的かつ故意に実行または実行しようとすることを禁止し、任意の医療福祉計画が、医療福祉、プロジェクトまたはサービスの交付または支払いに関連する任意の金銭または財産を所有または制御することを陳述または承諾する。
さらに、2009年に“健康情報技術促進経済·臨床健康法案”またはHITECH改正されたHIPAAおよびそのそれぞれの実施条例により、特定の医療保健提供者、健康計画および医療チケット交換所は、カバーエンティティと呼ばれ、その業務パートナーおよび下請け業者は、個人が識別可能な健康情報のプライバシー、セキュリティおよび送信を保護する上で、個人が識別可能な健康情報を記憶、使用または開示することに関連するいくつかのサービス(強制的契約条項を含む)に義務を課し、特定の個人識別可能な健康情報セキュリティに違反した場合に影響を受けた個人および規制当局に通知することを要求する。また、多くの州の法律は、場合によっては健康情報のプライバシーやセキュリティを管理しており、その中の多くの法律は互いに大きく異なり、同じ効果が生じない可能性があり、HIPAAに先を越されないことが多い。
さらに、ACAによれば、医療保険および医療補助サービスセンター(CMS)は、ある処方薬メーカーが、ある処方医師および教育病院に支払いまたは移転価値の情報、および医師およびその直系親族が保有する所有権および投資権益を収集し、毎年報告することを要求する。報告されたデータは毎年公共サイト上で検索可能な形で提供される。必要な情報を提出できなかったことは民事罰金を招く可能性がある。
私たちはまた、販売またはマーケティング計画、および非政府第三者支払者(個人保険会社を含む)によって精算される医療項目またはサービスに関するクレームに適用されるか、または支払者にかかわらず適用される可能性がある同様の州および外国の反リベートおよび虚偽請求法律によって制約される可能性がある。また、いくつかの州は、医薬品マーケティングや販売促進に関するいくつかの費用を処方薬会社に報告し、これらの州の個人保健事業者に支払うプレゼントや支払いを報告することを要求している。他の州では、いくつかのタイプのプレゼントや食事を提供するなど、マーケティング関連の様々な活動が禁止されている。一部の州は値上げに関する情報と値上げを弁護する情報を含むいくつかの薬品の定価情報を報告することを要求している。さらに、いくつかの州は、製薬会社にコンプライアンス計画および/またはマーケティングコードを実施することを要求する。他のいくつかの州も似たような提案を考慮している。いくつかの州と地方司法管轄区域もまた薬品販売代表の登録を要求する。また、私たちは国と外国に支配されるかもしれません
37
健康情報のプライバシーやセキュリティを管理する法律は,多くの法律が互いに大きく異なり,HIPAAに先制されず,遵守作業を複雑にすることが多い場合がある.
第三者の業務手配と適用される州、連邦、外国の医療保健法律法規に適合するようにする努力は大量のコストに関連している。製薬会社の運営がこのような要求に違反していることが発見された場合、民事、刑事および行政処罰、損害賠償、罰金、返還、監禁、削減または再構成、その業務の削減または再構築、FDAの承認を得た資格を失うこと、連邦医療保険と医療補助、誠実監督と報告義務、監禁、名声損害を含む、民事、刑事·行政処罰、損害賠償、罰金、罰金、または州政府医療保健計画などの重大な処罰を受ける可能性がある。有効なコンプライアンス計画は,これらの法律違反による調査·起訴のリスクを低減することができるにもかかわらず,これらのリスクを完全に解消することはできない。容疑や違反の疑いのあるいかなる行動も製薬会社に巨額の法的費用を招き、このような行動が成功しても経営陣の業務運営への注意を移す可能性がある。
アメリカの医療改革
米国では、連邦政府、州政府、監督機関、第三者支払者は、医療コストの増加を制御または管理するために引き続き提案を提出し、より広く言えば、米国の医療システムを改革する。製薬産業はこのような努力の特別な重点であり、重大な立法計画の重大な影響を受けてきた。例えば、2010年3月、ACAは、医療保険の許容性を拡大し、医療支出の増加を減少または制限し、詐欺や乱用に対する救済措置を強化し、医療保健と医療保険業界の新たな透明性要求を増加させ、医療業界に新たな税費を徴収し、追加の医療政策改革を実施し、医療保健が政府と民間保険会社によって融資される方式を大きく変え、米国製薬業に大きな影響を与えた。
ACAの公布以来、米国はまた、医療支出を減少させるために、他の立法改正を提出し、採択した。米国連邦政府機関は現在、潜在的な大幅な支出削減に直面しており、医療支出にさらに影響を与える可能性がある。2011年8月2日、2011年予算統制法案などで支出削減措置が制定され、連邦医療保険を含むいくつかの政府計画の支出が2%減少した。この削減は2032年度の連邦医療保険支出に有効であるだろう。また、2013年1月2日、2012年に“米国納税者救済法”が署名され、病院、画像形成センター、がん治療センターを含むいくつかのタイプの提供者に支払われる医療保険をさらに減少させ、政府が提供者に多額の支払いを取り戻す訴訟時効を3年から5年に延長した。連邦支出がさらに減少すれば、予想される予算不足は、FDAや国家衛生研究院が現在のレベルで運営し続ける能力のような関連機関にも影響を与える可能性がある。連邦贈与と契約に割り当てられた金額は減少またはキャンセルされる可能性がある。これらの削減は、関連機関が研究開発、製造、マーケティング活動を適時に審査·承認する能力にも影響を与える可能性があり、私たちが開発、マーケティング、販売する可能性のある任意の製品を開発、販売する能力を遅らせる可能性があります。
最近、政府はメーカーが販売する製品の価格設定方式をより厳格に審査し、いくつかの大統領行政命令、国会調査を招き、製品定価の透明性の向上、定価とメーカー患者計画との関係の審査、政府の薬品の精算方法の改革を目的とした連邦と州立法を提出し、採択した。FDAはまた、2020年9月24日にカナダからの薬物輸入計画の制定と提出に指導を提供する最終規則を発表した。バイデン政権もトランプ政権も、国内メーカーからの政府調達を支援するための行政命令を発表した。また、トランプ政権は薬品調達に特化した行政命令を発表し、連邦政府に“基本”薬品リストを作成し、原料薬の製造を含む他の米国で製造された医療用品を購入するよう指示した。バイデン政府がこの行政命令や同様の命令を実行するかどうかは不明である。
また、2020年11月20日、アメリカ衛生と公衆サービス部は1つの法規を決定し、薬品メーカーのD部分下でスポンサーの値下げを計画する避風港の保護を取り消し、直接にも薬局福祉マネージャーを通じても、法律が値下げを要求しない限り、。この規則はまた、販売所での値下げを反映するための新しい避風港を作り、特定の固定された製品のための避風港を作った
38
薬局福祉マネージャーとメーカーの間の費用手配。裁判所の命令により,上記安全港の除去と増加は延期され,最近の立法は同規則の実施を2026年1月1日に一時停止した。この最終期限は、両党の“より安全なコミュニティ法案”によって2027年1月1日に延期された。2022年のインフレ削減法案、あるいはアイルランド共和軍は、さらにこの規則の実施を2032年1月1日に延期する。また、総裁·バイデンは2021年3月11日に“2021年米国救援計画法案”に署名し、2024年1月1日から単一源と革新多源薬に対する法定医療補助薬品還付上限を廃止し、現在この上限は薬品メーカー平均価格の100%である。
最近、総裁·バイデンは2022年8月に“アイルランド共和法”に署名し、米国衛生·公衆サービス部(HHS)に、連邦医療保険B部分とD部分に基づいてCMSに価格上限交渉を行うよう指示した。具体的には、IRAの価格交渉計画は、高支出の単一由来薬物や生物製品、その他の交渉基準に適用され、まず2026年から連邦医療保険D部分から支払われる10種類の高コスト薬物、次いで2027年の15種類のD部分薬である。2028年に15個のB部分またはD部分薬剤、2029年以降に20個のB部分またはD部分薬剤。交渉価格は法定最高価格を上限とするだろう。アイルランド共和軍の価格交渉プログラムには、孤児薬名のみの薬物のようないくつかの法定免除があり、その名称範囲内の1つ以上の適応のみが承認されている。アイルランド共和軍の価格交渉計画は現在法的挑戦を受けている。アイルランド共和軍は2023年10月からインフレ率よりも高い速度で連邦医療保険B部分とD部分の薬物価格を向上させた製薬業者を処罰した。また,2025年から受益者の最高自己負担コストを大幅に低減することにより,メーカーに新たに設立されたメーカー割引計画により,D一部参加者ブランド薬物処方コストの10%を自己払い最高限度額を下回り,自己最高限度額に達すると20%補助することを求め,連邦医療保険D部分下の“ドーナツ穴”を解消した。アイルランド共和軍は衛生·公衆サービス部長官が最初の数年に規制ではなく指導によってその多くの規定を実施することを許可した。IRAを守らないメーカーは民事罰金を含めて様々な処罰を受ける可能性がある。アイルランド共和軍はまた、ACA市場で医療保険を購入した個人に2025年まで強化された補助金を提供する。
州レベルでは、政府は薬品と生物製品の価格設定を制御するための立法と実施条例を引き続き審議し、採択する。その中のいくつかの措置は、価格の制限、精算、割引、製品参入およびマーケティング、薬品価格、コストおよびマーケティング開示および透明性要件の実施、他の国からの輸入を許可すること、および大量購入を奨励することを含む。また、ますます多くの州総検察長は様々なサプライチェーン実体(例えば薬局福祉マネージャー)に対して薬品の定価と精算に関する法律的挑戦(使用州反独占法を含む)を提起しており、このような訴訟は将来的に薬品メーカーに大きく関連する可能性がある。
私たちは未来にもっと多くの州と連邦医療改革措置を取ると予想している。
保証と精算を請け負う
米国や他の地域では,患者は通常第三者支払者によって処方薬に関する費用の一部または全部を精算する。そのため、市場の私たちの薬品に対する受け入れ度は、政府衛生行政当局(アメリカのMedicareとMedicaidなどの政府医療保健計画に関連する項目を含む)、個人医療保険会社と他の医療資金調達組織が第三者保険と精算を提供する程度に依存する。私たちが規制承認を受ける可能性のある任意の薬品のカバー範囲と精算状態には、大きな不確実性が存在する。カバー範囲の決定は新薬製品に不利である可能性があり、特にもっと成熟或いは更に低コストの治療代替方案があれば使用可能である。患者が私たちの薬品の全部あるいは大部分のコストを支払うのに十分でなければ、私たちの製品を使用することはあまりできません。
薬品の保証範囲と精算政策は支払人によって異なるが,米国では第三者支払側の間に統一された薬品保証と精算政策がないためである。保証の獲得と精算には重大な遅延が生じる可能性がある。なぜなら、保証と精算を決定する過程は通常時間がかかり、高価である--私たちはそれぞれの支払人に私たちの製品を使用した科学的、臨床的、経済的支援を提供することを要求することを含むが、保証を受けたり、十分な精算を受ける保証はないからだ。政府当局と第三者支払人が私たちの薬品の保険や精算についてどのように決定するか予測するのは難しい。また、私たちは自分であるいは協力者と一緒に製品のための診断テストを開発することができます
39
特定の適応の候補者です承認されると、私たちまたは私たちの協力者(ある場合)は、私たちの候補製品のために求められているカバー範囲と精算を除いて、これらのテストのカバー範囲と精算を個別に取得することを要求されます。
我々の候補製品の市場は,第三者支払者の薬物処方や第三者支払者が保険と精算の薬物リストを提供できるかどうかに大きく依存する。このような公式に組み込まれた競争は往々にして定価引き下げの圧力を招く。特に、コストの低い後発薬または他の代替品が利用可能な場合、第三者支払者は、その処方に1つの薬剤を含むことを拒否するか、または他の方法で患者が薬剤を得ることを制限する可能性がある。
アメリカ政府、州立法機関と外国政府実体はコスト制御計画の実施に大きな興味を示し、政府が支払う医療コストの増加を制限し、価格制御、精算とカバー範囲の制限、及びブランド処方薬の代わりに模倣薬を使用することを要求している。政府のコントロールと措置を採用して実施することは、私たちの製品を保険範囲から除外したり、私たちの製品を制限したり、薬品の支払いを制限するかもしれません。
また,米国の第三者支払者と政府当局の管理的医療保健とコスト制御措置の日々の重視が継続し,薬品定価やカバー範囲に圧力となることが予想される。保証政策と第三者精算料率は随時変化する可能性がある。規制部門の承認を得た1つ以上の薬品が有利な引受·精算状態を獲得したとしても、将来的にはあまり有利ではない引受政策や精算料率が実施される可能性がある。
従業員と人的資本
私たちは、私たちの従業員が毎日彼らの最高の自己を発揮できるように、多様で包容的で安全な労働環境を創造し、維持するために努力している。多様性に対する私たちの約束は、私たちの採用、維持、学習、そして参加、そして地域社会のパートナーシップによって延長される。私たちは、多様化、公平、包容、帰属感戦略の一部として、学習と参加の機会を求め、異なる背景の人を集めて対話を行う積極的な決定を下した。
2023年12月31日現在、155人のフルタイム従業員を持っています。これらの従業員のうち,44人が博士,薬学あるいは医学博士号を有し,80人が研究,開発,技術運営に従事している。私たちはまた時々私たちの組織を支援するために独立請負業者を雇う。私たちの約30%の従業員はカリフォルニア州ブリスベンにある本社で働いていて、残りの従業員は遠隔で働いています。私たちは停止を経験したことがありません。私たちの従業員の中には労働組合代表や集団交渉合意に含まれている従業員がいません。私たちは長期的な仕事関係を育成するために、適格な従業員を誘致し、維持するために努力しています。
私たちは従業員の発展、従業員の尊敬度及び多様性と包容性に集中して、最も優秀な人材を確定、採用、発展と維持する。我々のインセンティブ株式計画の主な目的は、インセンティブ株に基づく報酬奨励と現金に基づく業績ボーナス奨励を付与することによって、選定された従業員、顧問、取締役を誘致、維持、激励することである。私たちは競争力のある給与と福祉を提供し、従業員の需要と要求のためにカスタマイズして、私たちが合格した人材を誘致、採用し、維持する目標を実現することを目的としています。
施設
私たちの主な行政事務室はカリフォルニア州ブリスベンにあり、私たちはそこで約12,000平方フィートのオフィス空間を借りました。レンタル契約は2024年12月に満期になります。賃貸契約期間を延長する選択もなく、賃貸契約が満期になる前に賃貸契約を終了する選択もない。私たちはこれらの施設が私たちの持続的な需要に対応するのに十分だと信じており、もし私たちがもっと多くの場所が必要なら、私たちは商業的に合理的な条件でより多くの施設を得ることができるだろう。
法律訴訟
時々、私たちは正常な業務過程で法的訴訟に巻き込まれるかもしれない。私たちは現在、経営陣が私たちの業務に重大な悪影響を及ぼすと考えているいかなる法的手続きにも参加していません。結果にかかわらず、訴訟は弁護と和解費用、管理資源の移転、負の宣伝と名声損害などの要素によって私たちに不利な影響を与える可能性がある。
40
企業情報
我々は2018年11月にデラウェア州法律に基づいて有限責任会社として設立され、名称は英雄治療持株会社である。その後,2018年12月に初日治療ホールディングスに改称し,2020年3月に初日バイオ製薬ホールディングスに改称した。私たちの最初の公募株では、私たちはデラウェア州の有限責任会社からデラウェア州の会社に転換し、私たちの名前をDay One BiopPharmticals、Inc.,またはThe Convertionに変えた。私たちの主な実行オフィスはカリフォルニア州ブリスベン501 Suit 501 Sierra Point Parkway 2000番地にあります。私たちの電話番号は(94005)484-0899です。私たちのサイトの住所はwww.Day oneBio.comです
利用可能な情報
私たちのサイトはhttp://www.Day oneBio.comです。私たちが電子的にアメリカ証券取引委員会またはアメリカ証券取引委員会にこのような材料を提出または提供した後、私たちは、このような報告書の改訂を含む、合理的で実行可能な範囲内でできるだけ早く合理的で実行可能な範囲内で、私たちの年間、四半期、依頼書、および現在の報告を無料で提供します。米国証券取引委員会は、米国証券取引委員会に資料を電子的に提出した会社に関する報告書やその他の情報を含むウェブサイトwww.sec.govを保持している。
当社のウェブサイトでは、当社のコーポレート·ガバナンス基準、私たちのビジネス行動および道徳的基準(私たちの取締役、上級管理者、従業員の使用のため)、および私たちの取締役会規約を含む会社管理および取締役会に関する情報も提供されています。書面の要求があれば、上記のいずれかの情報を当社の秘書に無料で提供します。初日はバイオ製薬会社、住所は2000年Sierra Point Parkway、Suite 501、Brisbane、CA 94005です。
我々は,重大な非公開情報を開示する手段として投資家関係サイトを用い,米国証券取引委員会が公布したFD法規規定の開示義務を遵守している.これらの開示内容は、私たちのサイトの“プレスリリース”および“イベントおよびプレゼンテーション”の部分に含まれています。したがって,投資家は我々のニュース原稿,米国証券取引委員会の届出文書,公開電話会議やインターネット放送に注目するほか,我々のサイトのこれらの部分にも注目すべきである.
我々のサイトに含まれる情報は構成されておらず、本10-K年報を構成するもの、または米国証券取引委員会に提出または提出された任意の他の報告書の一部を構成するものとみなされてはならない。我々のサイトURLへの参照は,非アクティブテキスト参照のみに用いられる.
41
第1 A項。リスク要因です
私たちの普通株に投資することは高い危険と関連がある。私たちの普通株への投資を決定する前に、以下に述べるリスクおよび不確実性、および当社の財務諸表および関連説明、ならびに“経営陣の財務状況および経営業績の検討および分析”を含む本年度報告書に含まれる他の情報をよく考慮しなければなりません。以下に説明するリスクと不確実性は私たちが直面している唯一の危険と不確実性ではない。私たちは意識していない、あるいは私たちは現在実質的な他のリスクや不確実性ではないと考えており、私たちに影響を与える重要な要素になる可能性もある。私たちはあなたに次のように議論されたどんな事件も起こらないという保証がありません。これらの事件は、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすかもしれない。もしこのような状況が発生したら、私たちの普通株の取引価格は下がるかもしれません。あなたはあなたの全部あるいは一部の投資を損失するかもしれません。
リスク要因の概要
我々の業務は、本要約に続くリスクおよび不確実性を含むいくつかのリスクおよび不確実性の影響を受ける。いくつかのリスクは
42
私たちの財務状況と追加資本需要に関連するリスク
われわれの経営歴史は限られており、第二期以降のいかなる臨床試験も完成しておらず、製品が商業販売を許可されておらず、何の収入も生じておらず、投資家が現在の業務および成功と生存の可能性を評価することを困難にする可能性がある。
私たちは臨床段階の生物製薬会社で、運営の歴史が限られていますので、それに基づいて私たちの業務と将来性を評価することができます。私たちは2018年に運営を開始し、いかなる製品も商業販売を許可されておらず、何の収入も生じていない。薬物開発への投資は投機性の高い仕事であり、大きなリスクに関連している。これまで、私たちはほとんどの資源を投入して、私たちの候補製品を決定し、獲得し、開発し、私たちのパイプラインを構築し、私たちの会社を組織し、そのための人員、業務計画、私たちの知的財産権の組み合わせを確立し、維持し、第三者と私たちの候補製品の製造手配を確立し、資金を調達し、これらの業務に一般的かつ行政的な支援を提供してきた。
私たちの設立以来、私たちは私たちのすべての努力と財政資源を私たちの主要な候補製品tovorafenibの臨床開発に集中してきて、この製品は最初に再発または難治性の小児科低レベルグリオーマ、またはpLGGsの治療に使用され、私たちの現在の別の候補製品pimasertib、私たちはtovorafenibとRASとRAF依存性腫瘍の併用治療を研究している。これまで、私たちは主に償還可能な転換可能な優先株、転換可能な手形、私たちの初公開(IPO)を完成させ、私たちの普通株の後続公開を発行することで、私たちの業務に資金を提供してきました。
私たちは、第2段階以外のいかなる臨床試験を成功させ、マーケティング許可を得て、商業規模の製品を製造したり、第三者代表がそうしたり、成功した製品の商業化に必要な販売やマーケティング活動を行うことができることを証明していない。したがって、あなたは私たちがより長い運営歴史を持っているよりも、私たちの成功と生存の可能性を正確に予測することが難しいかもしれない。
また、私たちは予見できない費用、困難、合併症、遅延と他の既知と未知の要素とリスクに遭遇する可能性があり、これらはすべて臨床段階の生物製薬会社が急速に発展する領域でよく遭遇する。研究開発に専念している会社から、ビジネス活動を支援できる会社に転換する必要もあるかもしれません。私たちはこのような危険と困難を成功的に克服したり、そのような移行を達成する能力があるということを見せていない。これらのリスクや困難に十分に対応できなかったり、そのような転換を成功させたりすることができなければ、私たちの業務は影響を受けるだろう。
設立以来、私たちは重大な純損失が発生し、何の収入も生じなかった。私たちは予測可能な未来に損失が続き、永遠に達成されたり利益を維持したりしないかもしれないと予想している。
会社設立以来、各報告期間中に重大な純損失が発生し、これまで何の収入も生じておらず、主に私たちの償還可能な転換可能優先株、私たちの転換可能な手形、私たちの初公開株の完成とその後の私たちの普通株の発行を通じて私たちの運営に資金を提供してきた。2023年,2022年,2021年12月31日までの年度において,我々が報告した純損失はそれぞれ1兆889億ドル,1.422億ドル,7280万ドルであった。2023年12月31日現在、私たちの累計赤字は4兆586億ドルです。私たちは予測可能な未来に、私たちの運営損失レベルはますます高くなり、特に臨床開発でボルラフィニとペマチニブに発展した時を予想している。私たちのこれまでの損失は、予想された将来の損失に加え、私たちの株主権益や運営資本に悪影響を与え続けるだろう。我々は,我々の主要候補製品や他の候補製品のための追加的な臨床試験を計画しているため,我々が行っているtovorafenibのキー2期Firefly−1試験を含め,我々が行っているtovorafenibのキー3期Firefly−2試験は,pLGGの潜在的な第一線療法として行われていると予想される
43
我々が行っている1 b/2期Firelight-1成人RAS/RAFは固形腫瘍を変化させるtovorafenib傘型マスター試験、単一療法としてpimasertibと併用し、そして私たちが選択する可能性のある任意の未来の候補製品の開発と後続の研究性新薬応用、あるいはINDを選択した。2023年10月,米国食品医薬品局(FDA)はわれわれの新薬申請を受け,再発または難治性pLGGを治療する単一療法としてtovorafenibを優先的に検討した。Tovorafenib、pimasertib、または他の候補製品のマーケティング許可を得た場合、私たちはtovorafenib、pimasertib、または他の候補製品の商業化に関連する巨額の販売、マーケティング、およびアウトソーシング製造費用を生成するだろう。上場企業として、私たちは運営に関連した追加費用を負担し続けていくつもりだ。
したがって、予測可能な未来に、私たちは引き続き重大で増加していく純損失を受けることが予想される。医薬品開発に関連する多くのリスクや不確実性により,将来の損失の程度やいつ利益が達成されるかは予測できない(あれば)。私たちが本当に利益を達成したとしても、私たちは四半期や年度の収益性を維持したり向上させることができないかもしれない。また、様々な要因により、当社の財務状況や経営業績は四半期と年度の間に大幅に変動し、その多くの要因は制御できないと予想されています。したがって、今後の経営業績の指標として、いかなる四半期や年度の業績にも依存してはいけません。
私たちは私たちの主要候補製品tovorafenibの成功に大きく依存し、FDAは私たちのNDAを受け入れて優先的に検討した。FDAが私たちのNDAを承認しない場合、またはtovorafenibが商業的に成功しない場合、私たちの業務、財務状況、および運営結果は実質的な悪影響を受け、私たちの普通株価格は低下するかもしれない。
私たちの未来の成功は私たちが適時に成功した臨床試験を完成し、私たちの候補製品のマーケティング許可を得て、それを商業化する能力に非常に依存している。私たちの開発はまだ初期段階にあり、私たちの主要な候補製品tovorafenibは現在重要な第二段階と第三段階の臨床試験にある。私たちの現在のもう一つの候補製品pimasertibは比較的早い開発段階にある。私たちは現在どの管轄区でも販売を許可していない。Tovorafenib、pimasertib、または私たちが開発した任意の未来の候補製品(もしあれば)がその臨床試験で成功するか、または発売許可を得ることは保証されない。
私たちが製品収入を作る能力は、私たちの主要候補製品tovorafenibの成功した開発と最終商業化に大きく依存するだろう。Tovorafenibの発売や商業化が成功しなかったり、失望させられたりすれば、私たちの株価は大幅に下落する可能性があり、候補製品やわが社の長期的な成功は損なわれる可能性がある。
Tovorafenibの成功はいくつかの要因に依存する
44
その中の多くの要素は私たちがコントロールできないことであり、もし私たちがその中のいずれかの要素をタイムリーにあるいは根本的に解決できなければ、私たちは重大な遅延に遭遇したり、私たちの候補製品を商業化することに成功できなくなり、これは私たちの業務に実質的な損害を与えるだろう。私たちのいくつかまたはすべての候補製品も、私たちがこのような承認を求めるのに時間と資源を費やしても、決してマーケティング許可を得ないかもしれない。
45
私たちが収入を創出し、利益を達成する能力は、私たちの候補製品の発見や識別、開発、商業化に関連するいくつかの目標を達成する能力に大きく依存する。
私たちの業務は候補製品の成功的な発見や識別、開発、商業化に完全に依存する。私たちはtovorafenib、pimasertib、または他の候補製品のマーケティング許可を得て販売を開始しない限り、商業販売のための製品を承認されていません。私たちが収入を創出し利益を達成する能力はいくつかの要素に依存しますがこれらに限らず私たちの能力は
利益を実現し、維持するためには、大量の収入を生み出す製品の設計、開発、商業化に成功しなければならない。これは私たちの候補製品のために臨床試験を完成し、より多くの候補製品を設計および/または獲得し、第三者と私たちの候補製品を生産する臨床用品の手配を確立し、私たちの候補製品のためにマーケティング許可を獲得し、特許、商業秘密、法律を獲得し、保留することを含む一連の挑戦的な活動で成功することを要求するだろう
46
排他性、および他の知的財産権保護、および私たちがマーケティング許可を得ることができる製品のマーケティングおよび販売(ある場合)。私たちはほとんどこのような活動の初期段階にいる。私たちはこのような活動で決して成功しないかもしれないし、たとえ私たちが成功しても、利益を達成するのに十分な収入が生まれないかもしれない。
もし私たちがマーケティング許可を得て私たちの1つ以上の候補製品をマーケティングすることに成功すれば、私たちの収入は私たちがマーケティング許可を得た地域の市場規模、製品の価格設定、製品の治療持続時間、治療ガイドラインで私たちの製品と処方者が私たちの製品を採用すること、保険と精算を得る能力、そして私たちがその地域の商業権を持っているかどうかに部分的に依存するだろう。私たちの潜在的な患者数が私たちが推定しているほど多くなければ、承認された適応は予想より狭い、あるいは治療者たちは競争、医師選択、支払人決定、または治療ガイドラインによって縮小され、承認されても、このような製品の販売から相当な収入を得ることができないかもしれない。
もし私たちがFDAや他の管轄区域の規制機関が現在予想されている基礎の上で研究や臨床試験を行うことを要求したり、進行中または計画中の臨床試験を修正したり、あるいは私たちの任意の候補製品のための適切な製造計画を確立し、現在および計画されている臨床試験または開発を開始または完成させることに遅延が生じた場合、私たちの費用は大幅に増加する可能性があり、利益はさらに遅れる可能性がある。
私たちが実現して利益を維持できなかったことは、会社の価値を弱める可能性があり、資金調達、業務拡大、研究開発努力の維持、製品供給の多様化、さらには運営を継続する能力を弱める可能性がある。わが社の価値の低下はあなたの投資損失の全部または一部を招く可能性もあります。
私たちは私たちの運営と私たちの目標を達成するために多くの追加資本が必要になるだろう。もし私たちが必要な時や私たちが受け入れられる条件で資金を集めることができなければ、私たちは私たちの研究や製品開発計画、将来の商業化努力、または他の運営を延期、減少または廃止することを余儀なくされるかもしれない。
臨床前研究と臨床試験を含む薬物製品を開発することは、非常に時間がかかり、高価かつ不確定な過程であり、完成するのに数年かかる。設立以来、私たちの業務は大量の現金を消費し、特に臨床開発を通じて私たちの主要な候補製品tovorafenib、pimasertib、および任意の未来の候補製品を推進する際に、私たちが行っている活動に関連する費用が大幅に増加することが予想される。私たちは、私たちが引き続き研究開発し、より多くの臨床試験を開始し、私たちの製品ラインの拡大を求め、私たちの主要な計画と未来の候補製品のためにマーケティング許可を求め、私たちの組織に投資することに伴い、費用が増加すると予想される。また、私たちがすべての候補製品のためにマーケティングの許可を得たら、製品の製造、マーケティング、販売、流通に関連した巨額の商業化費用が発生すると予想されます。また、経験豊富な人員の獲得と維持、新たな情報技術システムの開発、その他の上場企業に関するコストなど、上場企業の運営に関する追加コストを負担し続けている。さらに、私たちは、特許出願の準備と提出、私たちの知的財産権の維持、および私たちのオフィス施設の拡大に関連する持続的かつ追加的なコストに直面することが予想されます。したがって、私たちは私たちの持続的な業務と関連した多くの追加資金を得る必要があるだろう。
2023年12月31日現在、私たちは3億663億ドルの現金、現金等価物、短期投資を持っている。私たちは私たちの既存の現金、現金等価物、そして短期投資が2026年までの運営費用と資本支出需要に資金を提供できると信じている。私たちは間違っていることが証明される可能性があるという仮定に基づいてこの推定をして、私たちは現在予想されているよりも早く私たちの資本資源を使用することができる。私たちがコントロールできない変化が起こる可能性があり、それまで私たちの薬物開発活動の変化と進展、規制の変化を含めて、私たちの利用可能な資金を使用することができます。私たちの将来の資本需要は多くの要素に依存します
47
私たちは私たちが計画した臨床開発計画を完成させるために追加の資金が必要になり、現在の候補製品のマーケティング許可を得るために、私たちの候補製品の開発と商業化を達成するために追加の資金を集める必要があると予想される。私たちが追加資金を調達する能力は金融、経済、そして市場状況、そして他の要素に依存し、私たちはこれらの要素をコントロールできないか、あるいは限られているかもしれない。必要に応じて商業的に許容可能な条項で十分な資金を得ることができない場合、私たちは私たちの研究計画や候補製品の開発または商業化の全部または一部を延期、減少または終了させることを余儀なくされるかもしれないし、将来のビジネス機会を利用できないかもしれない。さらに、任意の追加的な資金調達努力は、現在および将来の候補製品を開発および商業化する能力(承認されれば)を含む、私たちのチームの日常活動への関心を移す可能性があります。変化する状況-その中のいくつかは私たちの制御を超えているかもしれない--私たちの資本消費速度は私たちの現在の予想よりも大きく速く、私たちは計画よりも早く追加資金を求める必要があるかもしれない。
私たちは公共または私募株式融資、債務融資、協力協定、許可手配、または他の融資源を通じてより多くの資金を得ることが要求され、これは私たちの株主を希釈したり、私たちの経営活動を制限したりするかもしれない。私たちは約束された外部資金源を持っていない。私たちは、市場発売計画(ATM)に基づいて2.5億ドルまでの総発行価格で私たちの普通株を発行し、売却することに関連して、パイパー·サンダーラー社とジョーンズ貿易機関サービス有限責任会社と株式分配協定を締結した。2023年12月31日まで、私たちの普通株はATM機で販売されていません。各投資家の所有権権益は、現金自動支払機による追加資本を含む株式または変換可能な債務証券の売却によって調達される範囲内で希釈され、条項は、清算または他の各投資家の株主としての権利に悪影響を及ぼす特典を含むことができる。債務融資は、債務契約の強制実施、固定支払義務の増加、または他の我々の業務の制限に影響を及ぼす可能性がある。もし私たちが第三者との戦略的協力に基づいて前金やマイルストーン支払いによって追加資金を調達すれば、私たちは私たちの候補製品に対する貴重な権利を放棄したり、私たちに不利な条項で許可証を授与しなければならないかもしれない。私たちの追加資金調達能力は、潜在的な世界経済状況の悪化と中断の悪影響を受ける可能性がある
48
インフレ、金利変化、全世界銀行システムの潜在的不安定、連邦債務上限と予算の不確定性及びそれに関連する政府が閉店する可能性があり、全世界地域の衝突、公衆衛生流行病、新冠肺炎の大流行などを含み、すべてアメリカと世界各地の信用と金融市場に変動を招く可能性がある。
私たちは必要な時や受け入れ可能な条件下で資金を調達することができず、私たちの財務状況と私たちの業務戦略を実施する能力に負の影響を与え、私たちは延期、縮小、一時停止、または私たちの1つまたは複数の研究または薬物開発計画、臨床試験、または将来の商業化努力を延期しなければならないかもしれない。
私たちの候補製品の開発と商業化に関するリスク
臨床試験は非常に高価で、時間、設計と実施が困難であり、しかも不確定な結果に関連している。また、早期臨床前研究と臨床試験の結果は未来の臨床前研究或いは臨床試験の結果を予測できない可能性がある。私たちの候補製品は今後の臨床試験で有利な結果がないかもしれません。もしあれば、あるいはマーケティング許可を得ることができます。もし私たちが候補製品の安全性と有効性を証明できなければ、私たちの名声は損なわれる可能性があり、私たちの業務は影響を受けるだろう。
私たちの候補製品には、失敗のリスクが高い。私たちの候補製品がいつ、人体で有効または安全を証明するか、あるいはマーケティング許可を得るかどうかを予測することはできません。必要なマーケティング許可を得て、私たちの任意の候補製品をマーケティングし、販売するために、広範な臨床前研究と臨床試験を通じて、私たちの候補製品は人体上で各目標適応に使用することが安全かつ有効であることを証明しなければならない。臨床試験費用は高価であり,完成まで数年かかる可能性があり,結果自体も確定していない。臨床試験では,いつでも失敗する可能性がある。
また、臨床前研究と早期臨床試験の結果は後期臨床前研究或いは臨床試験の結果を予測できない可能性がある。私たちの候補製品の臨床データは限られている。臨床前と早期臨床試験で進展が得られたにもかかわらず、臨床試験後期段階の候補製品は類似或いは期待される安全性と有効性特徴を示すことができないかもしれない。
いくつかの場合、多くの要素のため、同一候補製品の異なる臨床試験間の安全性或いは有効性結果は有意差が存在する可能性があり、方案に規定されている臨床試験プログラムの変化、患者群の大きさとタイプの差異、投与方案と他の臨床試験方案に対する堅持及び臨床試験参加者の中止率を含む。もし私たちが計画した任意の候補製品の臨床試験が積極的な結果を生むことができなければ、私たちの候補製品の開発スケジュール、マーケティング許可と商業化の見通し、そしてそれに応じた私たちの業務と財務の見通しは、実質的で不利な影響を受けるだろう。
トヴォラファニーは限られた数の患者でのみ研究を行った。FDAが発売を承認すれば,tovorafenibはより多くの患者に使用可能であり,このような多くの患者におけるtovorafenibの使用結果がわれわれの臨床研究結果と一致するかどうかは不明である。
臨床研究では,トヴォラフェニは限られた数の患者にのみ適用される。FDAは我々の非処方薬を受け入れ,tovorafenibの優先審査を承認したが,FDAがtovorafenibを承認するかどうかは不明であり,FDAが承認すれば,その製品の真の安全性と有効性が臨床研究で見られる安全性と有効性と一致するかどうかは不明である。Tovorafenibに関する新しいデータは、米国からの有害事象報告および私たちの上場後の約束、および他の行われている臨床研究からのデータを含み、製品ラベルの変化を招き、販売に悪影響を及ぼす可能性があり、またはtovorafenibの市場撤退を招く可能性がある。FDAおよび他の管轄区の規制機関は、tovorafenibの追加適応および/または他の司法管轄区の上場申請を審査する際に、新たなデータを考慮したり、承認後の要求を実施したりすることもできる。これらの操作のいずれかが発生した場合、巨額の費用、遅延、および/または販売収入を創出する能力を制限する可能性がある。
49
われわれが第一段階の臨床試験を行っているように,研究者による研究のデータに依存することができ,試験操作やそのような試験結果の報告は制御していない。
時々,研究者が後援する臨床研究のいくつかの臨床データに依存する可能性があり,試験操作やそのような試験結果の報告を制御しない。われわれの主要候補製品tovorafenibの第一段階研究は,再発や難治性pLGG患者に対する多中心試験であり,Dana Farber癌研究所と太平洋小児科神経腫瘍連合会(PNOC)が協力して行った。この実験の最後のデータ報告は2023年1月である。より多くのデータは報告時に似たような結果を示さないかもしれない。私たちはこのような臨床データが発表される時間をコントロールできない。我々のキー2期Firefly-1試験tovorafenibは初日に賛助された実験である.私たちがpLGGで行った重要な2期FIREFELY-1試験は、規制機関との予備的な議論に基づいて十分なデータセットを提供して承認をサポートすることが予想されるが、FDAがより多くの患者のデータまたは既存の患者の追加的な後続データを要求しないことを保証することはできない。また,後期臨床試験では,完成した早期臨床試験よりも厳しい統計分析を受ける可能性がある。製薬業界のいくつかの会社は後期臨床試験において治療効果の不足或いは副作用のために重大な挫折を受け、早期試験で良好な結果を得たにもかかわらず、私たちは類似した挫折に直面しないことを確定できない。そのほか、臨床前と臨床データはよく異なる解釈と分析の影響を受けやすく、多くの会社は彼らの候補製品が臨床前研究と臨床試験で満足できると考えているが、しかし依然としてその候補製品のマーケティング許可を得られなかった。
さらに、研究者が後援する試験の設計や管理を制御することはなく、これらの試験を行うために必要なINDまたは海外の同種の試験の提出または承認も制御せず、研究者が後援する試験は、これらの第三者の行動によって生じる臨床データの有効性を脅かす可能性があり、私たちの研究結果や臨床試験に影響を及ぼす可能性のある私たちの候補製品に対する重大な懸念を識別し、FDAまたは他の適用可能な規制機関からマーケティング許可を得る能力に悪影響を及ぼす可能性がある。この試験または他の研究者が後援する試験の結果が、我々が計画している会社支援試験の結果と一致しないか、または異なる場合、または我々の候補製品に対する懸念を引き起こす場合、FDAまたは外国規制機関は、企業支援試験の結果を疑問視したり、そのような結果を他の場合よりも厳しい審査を行う可能性がある。この場合、FDAまたはこのような外国規制機関は、候補製品の臨床開発またはマーケティング許可を遅らせる可能性がある追加の臨床データを取得して提出することを要求する可能性がある。研究者が後援する試験は、私たち自身の臨床開発に情報を提供するのに役立つかもしれませんが、研究者が試験のデータやデータを発表する時間を制御することはできませんし、これらの試験のデータを使用して、候補製品のマーケティング許可の基礎を形成できる保証もありません。
私たちの同情使用計画は私たちを追加的なリスクに直面させるかもしれません。臨床試験計画の遅延、私たちの供給能力への影響、あるいは否定的な宣伝を含む。
一部の患者は同情的な使用計画を通じて臨床試験以外の研究薬を獲得し、これは獲得または試みの権利を拡大することを指す。これらの患者は通常、代替療法がなく、または他の利用可能なすべての治療法を使い切っている生命を脅かす疾患を患っている。私たちの慈悲の使用計画のせいで、私たちは多くの危険に直面するかもしれない。例えば、これらの患者集団で深刻な有害事象が発生するリスクは非常に高く、もしこれらの有害事象が薬物と関連していると決定された場合、私たちの候補薬物の安全性に負の影響を与え、および/または重大な遅延を招き、私たちの候補薬物の商業化に成功できず、および/または私たちの業務に実質的な損害を与える可能性がある。また,同情的使用計画に基づいて任意の候補薬を患者に提供すれば,われわれの供給能力は,その計画に参加できる患者数を登録できることに制限される可能性がある。拡大参入計画に基づいて候補製品を患者に提供すると,患者をランダム試験に組み込むことも挑戦的になる可能性がある。これらの要因は、私たちの臨床試験において十分な数の患者を私たちの臨床試験に参加させるために、任意の同情使用計画を再構成または一時停止する必要がある可能性があり、これは、私たちの候補薬物の商業化に成功するために必要である。もし私たちが私たちの同情的な使用計画を再構成したり中断したりすれば、私たちは私たちの計画の現在または潜在的な参加者と関連した否定的な宣伝や中断に直面するかもしれない。
50
私たちの臨床試験は、私たちの任意の候補製品の安全性と有効性を一時停止、延期、または十分に証明できないかもしれません。これは、開発、マーケティング許可、および商業化を阻止または延期します。
FDAまたは同様の外国規制機関から現在の候補製品を販売するマーケティング許可を得る前に、私たちの候補製品が各目標適応において安全かつ有効であることを、長い、複雑で高価な臨床試験によって証明しなければならない。臨床試験は費用が高く,設計や実施が困難であり,完成まで数年かかる可能性があり,その最終結果も確定していない。失敗は臨床試験中のいつでも発生する可能性があり,原因は多く,また我々の候補製品は開発の初期段階にあるため,失敗のリスクが高く,適切な製品の開発には決して成功しない可能性がある。
臨床試験中または臨床試験の結果では、私たちは、マーケティング許可を得るか、または候補製品を商業化する能力を遅延または阻止する可能性がある多くの挑戦および予見不可能なイベントに遭遇する可能性がある
私たちはまた、私たちの薬物開発計画において予期せぬ規制障害に直面する可能性があり、これらの障害は、追加のデータ生成を必要とするか、または私たちの既存または計画の試験および上場許可を申請する時間を遅らせるかもしれない。例えば、私たちの候補製品を調合や製造面で変更するかもしれませんが、この場合、修正された候補製品を早期バージョンに関連付けるために、追加の臨床前研究を行う必要があるかもしれません。また,FDAは我々の試験に疑問や懸念があることを確認する可能性があり,提案された臨床研究が強制的またはすべての臨床休止で行われることを許さない可能性がある。
51
さらに、私たちまたは私たちの協力者が規制要件(GCP規定を含む)に基づいて試験を行うことができなかった場合、参加者が受け入れられない健康リスクに直面している場合、またはFDAが我々のINDまたはこれらの試験の進行に欠陥があることを発見した場合、我々FDAまたは機関審査委員会またはIRBは、いつでも臨床試験を一時停止することができる。したがって,将来の臨床試験の開始と完了スケジュールを確実に予測することはできない。
私たちは海外で臨床試験を行うことも可能であり、これは追加のリスクをもたらし、私たちの臨床試験の完成を遅らせるかもしれない。これらのリスクには,外国に登録された患者が医療サービスや文化的慣習の違いにより臨床案を遵守できなかったこと,外国規制計画に関する追加行政負担を管理すること,およびこのような外国に関連する政治的·経済的リスクがある。さらに、米国国外で行われた試験のデータは、FDAの追加審査を受ける可能性があり、これは、より多くの米国データを生成する必要があるかもしれない。
私たちの候補製品は最初は小児科の人たちを対象としていたので、私たちは追加の障害に直面し、監督機関のより厳格な審査を受けるかもしれない。小児科群に関連した試験は困難である可能性があり,かなり高価である可能性があり,他の臨床試験のように期待した結果が生じない可能性がある。また,小児科研究はより数の少ない専門臨床試験地点に依存することが多く,逆に地点の有用性を制限し,試験の進行コストをより高くする可能性がある。また,“加速治療と公平児童研究法案”や他の市場力の小児科適応への興味の増加に伴い,合格患者への競争により試験募集が困難になる可能性がある。そのほか、児童或いは青少年患者が臨床試験方案を遵守することを確保することは挑戦的であるかもしれない。著者らは十分な数の小児科患者を著者らの臨床試験に参加することができず、重大な遅延を招く可能性があり、私たちは1つ以上の臨床試験を完全に放棄し、私たちの追加資金を集める能力に影響を与え、そして任意の候補薬物製品のために必要なマーケティング許可を得ることを延期或いは阻止することを要求する。
私たちの臨床試験の結果を予測することもできませんし、臨床試験から発生したデータが規制機関によって受け入れられ、マーケティング許可を支持することも保証できません。
臨床試験の結果は不確実であり,また我々の候補製品は開発の初期段階であるため,大きな失敗リスクがある。もし私たちの臨床試験が完了したら、私たちの臨床試験結果は決定的ではないか、あるいはある程度の陽性ではありません。もし私たちの候補製品に安全問題や深刻な有害事象がある場合、あるいは私たちの臨床試験が延期されたり、計画外の変更が必要な場合、私たちはかもしれません
もし私たちの臨床試験の開始が遅れたり完成したりすれば、もし私たちが完成する前に臨床試験を終了すれば、私たちの候補製品の商業的将来性は負の影響を受ける可能性があり、候補製品から収入を創出する能力は延期または完全に消失する可能性がある。
また,われわれの臨床試験の首席研究員は時々私たちの科学コンサルタントやコンサルタントを務め,このようなサービスに関する報酬を得る可能性がある。場合によっては、私たちはFDAまたは同様の外国規制機関にいくつかの関係を報告することを要求されるかもしれない。アメリカ食品医薬品局や
52
似たような外国の規制機関は、私たちと主要調査者との財務関係が利益の衝突をもたらしたり、研究の進行や解釈に影響を与えたりすると結論するかもしれない。したがって,FDAや同様の外国の規制機関は,適用された臨床試験地点で発生するデータの完全性を疑問視する可能性があり,臨床試験自体の効用が脅かされる可能性がある。これは、FDAまたは同様の外国規制機関が私たちのマーケティング申請の承認または拒否を遅延させる可能性があり、最終的には、私たちの1つまたは複数の候補製品のマーケティング許可が拒否される可能性がある。
もし私たちが行っているまたは計画中の臨床試験に患者を募集する時に遅延や困難に遭遇した場合、私たちの任意またはすべての候補製品が必要なマーケティング許可を得ることを延期または阻止するかもしれません。
FDAや同様の外国規制機関の要求に応じて、これらの試験に参加するのに十分な数の合格者を決定し、募集することができなければ、私たちが行っているまたは計画中の候補製品の臨床試験を開始または継続することができないかもしれない。われわれのtovorafenib計画では,患者腫瘍のゲノムマップを用いて,われわれの臨床試験に適した患者を決定する。(I)我々の臨床試験に組み込むために必要な変更を行う患者がどれだけいるか、(Ii)各計画に登録された患者数が上場許可を得るのに十分であるか、または(Iii)各特定のBRAF変異が承認された薬物タグに含まれるかどうかを決定することはできない。もし私たちの患者の識別と登録戦略が成功しないことが証明されたら、私たちの製品候補に適した患者を募集したり維持したりすることは困難かもしれません。患者の入選は他の要素の影響を受けています
また、著者らは現在、著者らの候補製品の条件は孤児或いは稀な疾患であり、臨床試験に供することができる患者プールが限られていることを評価する予定である。われわれの臨床試験の資格基準が確立されると,利用可能な試験参加者をさらに制限する。さらに私たちの競争相手の中には
53
現在行われている候補製品の臨床試験は,われわれの臨床候補と同じ患者を治療するが,本来われわれの臨床試験に参加する資格のある患者は,競争相手の候補製品の臨床試験に参加することができる。また,いずれの競合他社もFDAのある製品の承認を得ていれば,患者が承認された製品を用いて治療を求めることを決定すれば,患者の臨床試験参加能力を制限する可能性がある。例えば,2023年3月,ノバ社はダプラファニとトリメチニブの併用が承認され,将来的にトレフラフィニ臨床試験に参加する患者を募集する能力を制限する可能性がある。
私たちは私たちの臨床試験に参加するのに十分な数の患者を募集し、維持することができず、これは重大な遅延を招くか、あるいは1つ以上の臨床試験または臨床計画を完全に放棄する必要があるかもしれない。相互競争の試験、及び小児科腫瘍学機構の運行試験の限られた帯域幅が存在する可能性があり、これはある試験の優先順位を招き、著者らの臨床試験の遅延を招く可能性がある。さらに、私たちの候補製品は最初に小児科の人々を対象としているので、私たちは追加的な挑戦に直面するかもしれない。例えば、親は彼らの子供を私たちの臨床試験に参加させたくないかもしれないし、他の治療法を求めるために、彼らの子供を私たちの臨床試験から退出させることを決定するかもしれない。
著者らが時々発表或いは公表した臨床試験の初歩、中期、初期と背線データはより多くの患者データの獲得に従って変化する可能性があり、そして監査と検証プログラムの影響を受け、これは最終データの重大な変化を招く可能性がある。
私たちは時々私たちの臨床試験の初歩的、中期的、またはバックラインデータを公開するかもしれない。これらの更新は,当時入手可能なデータの初歩的な分析に基づいており,特定の研究に関するデータをより網羅的に審査したところ,結果や関連する調査結果や結論が変化する可能性がある.また,我々が達成可能な臨床試験の中期データは,患者登録の継続とより多くの患者データの獲得に伴い,1つまたは複数の臨床結果が実質的に変化する可能性があるというリスクに直面している。したがって,いずれの進行中の臨床試験においても,積極的な中期的あるいは初歩的な結果は,完成した研究におけるこれらの結果を予測できない可能性がある。初期データやバックラインデータも監査や確認手続きを受ける必要があり、最終データは以前に公表された予備データと大きく異なる可能性がある。
さらに、規制機関を含む他の人は、私たちの仮定、推定、計算、結論または分析を受け入れないか、またはデータの重要性を異なる方法で解釈またはトレードオフする可能性があり、これは、特定の計画の価値、特定の候補製品または製品の承認または商業化、およびわが社の全体的な状況に影響を与える可能性がある。例えば,われわれのFirefly−1臨床試験は神経腫瘍学−高レベルグリオーマ反応評価(RANO−HGG)を用いて全体応答率(OOR)の主要な終点を測定し,FDAと一致し,総反応率(OOR)を小児科神経腫瘍学−低レベルグリオーマ反応評価(RAPNO−LGG)を副次的終点とすることを目的としている。FDAと検討し,2023年3月にダプラファニブとトリメチニブのBRAF V 600 E pLGGへの併用を許可した後,Firefly−2/LOGGIC試験の主要な終点を構築し,神経腫瘍学−低レベルグリオーマ反応評価(RANO−LGG)を用いて評価を行い,RANO−LGGをFirefly−1の探索的終点とした。
さらに、私たちが開示する特定の研究または臨床試験に関する開示を選択する情報は、一般に広範な情報に基づいており、あなたまたは他の人は、私たちが開示すべき重大な情報または他の適切な情報を含むことに決定したことに同意しないかもしれないが、私たちが開示しないことを決定した任意の情報は、最終的には、特定の薬剤、候補薬剤、または私たちの業務に関する将来の決定、結論、観点、活動、または他の側面に対して大きな意味を有すると考えられるかもしれない。もし私たちが報告したバックラインデータが実際の結果と異なる場合、あるいは規制機関を含む他の人が結論に同意しない場合、私たちが承認を得て私たちの候補製品を商業化する能力が損なわれる可能性があり、これは私たちの業務、経営業績、見通し、または財務状況を損なう可能性がある。
私たちは激しい競争に直面しており、これは他の人たちが私たちよりも製品の発見、開発、商業化に成功する可能性がある。
製薬と生物技術業界の特徴は技術が迅速に進歩し、競争が激しく、特許と新製品及び候補製品を非常に重視していることである。私たちの競争相手は、私たちの候補製品と競争する製品、候補製品、およびプロセスを開発し、開発しているか、または開発しているかもしれません。私たちはtovorafenibを含む任意の候補製品の開発と商業化に成功し、既存の治療法および将来出現する可能性のある新しい療法と競争する可能性がある。私たちは信じています
54
相当数の競合候補製品が現在開発中であり、将来的に商業的に使用される可能性があり、我々が開発中または将来開発可能な候補製品の条件を治療するために使用される可能性がある。また、私たちの候補製品は、承認を求める適応を治療するために、非ラベル処方の薬物と競争する必要があるかもしれない。これは私たちが既存の治療法を代替するために私たちの候補製品を使用することを難しくするかもしれない。
また、これらの組織と競争して、合格した科学、管理と販売、および商業·マーケティング担当者を募集し、維持することは、私たちの専門レベルと業務計画を実行する能力にマイナスの影響を与える可能性がある。臨床試験場所や臨床試験の患者登録の確立や,われわれの計画の補完やわれわれの計画のために必要な技術的競争にも直面する。
特に腫瘍学分野の競争は非常に激しい。私たちはアメリカと国際に競争相手がいて、大型国際製薬会社、老舗バイオテクノロジー会社、専門製薬会社、新興とスタートアップ会社、大学とその他の研究機関を含みます。
私たちは各プロジェクトが既存製品と開発中の製品からの競争に直面することを予想しています。V 600突然変異に集中した薬物発見はすでにいくつかの癌の臨床で成功した。3つのBRAF阻害剤は、V 600 EまたはV 600 K変異を含む腫瘍の治療のためにFDAによって承認されている。これらの初代BRAF阻害剤は,I型RAF阻害剤であり,ビモラフェニであり,市場名はZelborafであることがより知られている®Genentech提供;dradfenib,Tafinlarの名称で販売®ノーファ社とアンコラフィニはBraftoviという市場名を持っています®ファイザー社が提供しています。ダプラファニブとトリメチニブを併用し、ノファ社はそれをMekinistと命名し、切除できないまたはBRAF V 600 E変異を有する転移性固形腫瘍を有する6歳の成人および小児患者の治療のために許可されており、これらの患者は以前の治療後に病状が進展し、満足できる代替治療方案がない。これは、tovorafenib開発計画におけるより大きなRAF変更のpLGG臨床範囲のサブセットであるBRAF V 600 E pLGGを含む。現在のデータは,BRAF V 600 E亜群がBRAF変化のpLGGの10−20%を代表していることを示していると考えられるが,より多くの患者の記述に伴い,追加の疫学データが出現する可能性がある。また、ダプラファニブとトリメチニブの併用は2023年3月にBRAF V 600 E pLGG適応で完全に承認され、1歳以上のBRAF V 600 E変異を有する低レベルグリオーマ或いはLGGの児童患者の治療を含み、これらの患者は初歩的な系統的治療が必要である。
FDAは4種類のMEK阻害剤を承認した。BRAF V 600 EまたはV 600 K変異を含む腫瘍の治療のための3つの薬剤が承認されており、Cobimetinibを含み、市場名はCotelicである®遺伝子テークによって販売されています®ノバ社が提供する;ビニミチニブはMektoviの名前で販売されている®ファイザー社が提供しています。4つ目のMEK阻害剤-selumetinib、市場名はKoselugo®アスリコン-2歳以上の1型神経線維腫症またはNF 1を有する小児患者の治療に許可されており、これらの患者は症状があり、手術できない。MEK阻害剤は単一療法としてBRAF改変pLGG(BRAF V 600 E変異体pLGGとBRAF融合駆動pLGG)に有効であることが証明されているが,MEK阻害剤はFDAによって単一療法としてpLGG患者の治療が承認されていない。
多くの次世代BRAF阻害剤が臨床開発されている。百済神州には2つの次世代BRAF方案がある:リフェラファニー(BGB-283)とBGB-3245であり、前者は現在ミダミニと連合した1/2期試験中であり、後者は現在1期用量増加研究の単剤中にある。Hanmi/GenentechはBelvarafenibとcobimetinibを併用した1 b期臨床試験を開発している。FORE Treateutics社(前身はNovellusDx)はRAFダイマー切断剤PLX 8394を開発しており,1/2期試験であり,Cobicistatと併用している。Kinnateは単一療法の第1段階臨床試験であり,MEK阻害剤ビニチニブと併用した1 b段階臨床試験でもあるKIN−2787を開発している。ブラックダイヤモンド治療会社が臨床前に開発した異なる段階には次世代BRAF阻害剤がある。Jazz製薬会社とRedx社は,汎RAF阻害剤JZP 815が臨床開発段階に入り,第一段階試験にあると発表した。Erascaは最近、それはすでにノワール社とNaporafenibの全世界独占許可協定を達成し、Naporafenibは第2段階の枢軸が整った汎RAF阻害剤であり、NRAS変異黒色腫と他のRAS/MAPK経路によって駆動される腫瘍の治療において潜在的な一流と最適な特徴を持っていることを発表した。
PLGGの治療に関しては、いくつかのMEK阻害剤およびいくつかのI型RAF阻害剤の他の標的治療が学術研究者によって開始された臨床試験が研究されており、一部の地域ではラベル外で使用されている可能性がある。Tovorafenibが承認されて市場に進出すれば、これらの薬物の非ラベル使用はtovorafenibの競争を表すかもしれない。
私たちの多くの競争相手は、単独でも、彼らとのパートナーでも、著しく大きな財務資源を持っていて、市場に存在を確立し、研究開発、製造、臨床前と
55
臨床テストは、マーケティングの許可と清算とマーケティングの許可を得た製品は私たちよりもっと多くのことをしました。
特に大手製薬とバイオテクノロジー会社は、臨床テスト、マーケティング許可の獲得、患者の募集とバイオテクノロジー製品の候補製品の製造において豊富な経験を持っている。これらの会社の研究、マーケティング、販売能力も私たちよりはるかに優れており、承認されたり、開発後期の段階にある候補製品や、私たちのターゲット市場でリーディングカンパニーや研究機関との協力手配もあるかもしれません。古い製薬会社やバイオテクノロジー会社も、新しい化合物の発見と開発を加速させたり、私たちが開発した候補製品を時代遅れにする可能性のある新しい化合物の使用を許可したりするために投資する可能性がある。規模が小さい、または初期段階にある企業も、特に大型および成熟会社との協力を通じて、私たちの計画の補完または必要な技術を得る上で重要な競争相手であることが証明される可能性がある。
これらのすべての要因により、私たちの競争相手は、FDAや同様の外国規制機関の承認を得ることに成功したり、私たちの前に私たちの分野の候補製品を発見、開発、商業化したりすることができ、これは、私たちの競争相手が市場に入る前に強力な市場地位を確立したり、私たちの開発をより複雑にしたりする可能性があります。
もし私たちの競争相手がtovorafenibや私たちの他の候補製品よりも安全で、より効果的で、副作用が少ない、より便利で、より広いラベル、より効果的なマーケティング、より広範な精算、またはより安い製品を開発し、商業化すれば、私たちの潜在的なビジネス機会は減少または消滅するかもしれない。私たちが開発した候補製品がマーケティングの許可を得ても、その時に何かの競争製品が承認されていれば、それらの価格は競争相手の製品よりもはるかに高くなり、競争力が低下する可能性がある。私たちの競争相手が開発した技術の進歩や製品は、私たちの技術や候補製品を時代遅れにし、競争力に欠けたり、経済的ではないかもしれません。もし私たちが効果的に競争できなければ、私たちが開発する可能性のある候補製品の販売から収入を得る機会が承認されれば、悪影響を受ける可能性がある。
Tovorafenib、pimasertib、または私たちが開発する可能性のある任意の将来の候補製品に関連する安全リスクまたは他の副作用は、承認を延期または阻止する可能性があり、臨床試験の一時停止またはさらなる開発の放棄、承認された製品の使用を制限する、または上場許可を得た後に重大な負の結果をもたらす可能性がある(ある場合)。
一般薬品と同様に,我々の主要候補製品tovorafenibと我々の他の候補製品に関連する副作用や有害事象が観察された。これまでtovorafenibを用いて観察された最もよく見られる副作用(有害事象)は,斑丘疹,貧血,頭痛,血筋酸ホスファターゼ上昇,嘔気,皮膚と髪の変色および疲労である。
われわれが行って計画中の臨床試験の結果は,副作用や意外な特徴の高さと受け入れられない重症度と流行率を明らかにする可能性がある。これらの副作用または予期しない特徴は、承認前および/または後に、規制された報告書によって要求される制約を受ける可能性がある。私たちの候補製品による不良副作用は私たち或いは監督機関が多種の原因で臨床試験を延期、一時停止或いは中止することを招く可能性がある。また,臨床試験の本質は潜在的な患者集団のサンプルを利用することである。被験者の数および曝露時間が限られているため、私たちの候補製品または競合他社製品のまれかつ深刻な副作用は、薬物に接触した患者数が著しく増加した場合にのみ発見される可能性がある。
さらに、私たちの候補製品を使用して治療された患者は、内科、外科、放射線、および化学療法治療を受けている可能性があり、これらの治療は、私たちの候補製品とは無関係な副作用または有害事象をもたらす可能性があるが、依然として私たちの臨床試験の成功に影響を及ぼす可能性がある。重篤な患者を著者らの臨床試験に組み入れることは死亡或いはその他の不良医療事件を招く可能性があり、原因はこれらの患者は他の治療方法或いは薬物を使用している可能性があり、或いはこれらの患者の病状が深刻であるためである。例えば、私たちの将来の臨床試験に登録される予定のいくつかの患者は、私たちの臨床試験中に、またはそのような試験に参加した後に非治療関連原因で死亡したり、重大な臨床イベントを経験したりすることが予想され、これは、tovorafenib、pimasertib、または私たちの他の候補製品の開発に影響を与える可能性がある。もし私たちが任意の臨床試験を延期、一時停止、または終了することを選択または要求された場合、私たちの候補製品の商業的将来性は損なわれ、候補製品から製品収入を創出する能力は延期またはキャンセルされるだろう。臨床試験で観察された深刻な有害事象またはSAEは、任意の承認された製品に対する市場の受け入れを阻害または阻止するか、または低下する可能性がある
56
医者は特定の患者に私たちの製品を使用する持続時間を期待している。このようなどんな状況でも、私たちの業務、見通し、財政状況、そして経営結果を深刻に損なう可能性がある。
さらに、私たちの候補製品が臨床試験において副作用に関連しているか、または予期しない特徴を有する場合、私たちは、その開発をより狭い用途または集団に制限することを選択することができ、リスク-利益の観点から、副作用または他の特徴は、それほど一般的ではなく、それほど深刻ではない、またはより容易に受け入れられ、これは、承認されれば、候補製品の商業的期待を制限する可能性がある。私たちはまた臨床試験の結果に基づいて私たちの研究計画を修正することが要求されるかもしれない。このような副作用は、患者の募集或いは入選患者が試験を完成する能力にも影響する可能性がある。最初に早期テストで希望を示した薬物の多くはその後副作用が認められ,さらなる開発を阻害した。さらに、規制当局は、これらの決定を確認するために追加的なテストを行うことを要求し、より厳しいラベルを要求するか、または候補製品のマーケティング許可を拒否することを要求する異なる結論を得る可能性がある。
異なる用量レジメンの使用を含む、より大きな、より長い時間、およびより広い臨床試験において、私たちの候補製品を試験するにつれて、または私たちの候補製品の使用が任意のマーケティング許可後により広くなるにつれて、患者は、早期試験で観察された、発生していない、または検出されていない疾患、傷害、不快感、および他の有害事象を報告するかもしれない。これらの副作用が開発後期にまたは承認された後に知られた場合(あれば)、これらの発見は、私たちの業務、財務状況、運営結果、および将来性に深刻な損害を与える可能性があります。
もし私たちの候補製品がマーケティングの許可を得て、私たちまたは他の人が後にこの薬物治療による不良副作用を発見したら、多くの潜在的な重大な負の結果を引き起こす可能性があります
これらの事件のいずれも、私たちの候補製品に対する市場許可または受容度を獲得または維持することを阻止または維持することができ、承認されれば、私たちの業務、財務状況、運営結果、および将来性を深刻に損なう可能性がある。
私たちは、より利益的または成功可能性の高い候補製品または適応を利用することなく、特定の候補製品または適応を追求するために限られたリソースを費やす可能性がある。
私たちの財務と管理資源が限られているため、私たちは私たちが確定した特定の適応の研究プロジェクトと製品に重点を置いています。したがって、私たちは他の候補製品を探す機会を放棄または延期するか、または後により大きな商業潜在力を有することが証明された他の兆候を探す機会を放棄または延期するかもしれない。私たちの資源配分決定は私たちが実行可能な商業製品や利益のある市場機会を利用できないかもしれない。私たちの現在と未来の研究開発計画および特定の適応候補製品への支出はいかなる商業的に実行可能な製品も発生しないかもしれない。もし正確に評価できなければ
57
特定の候補製品の商業的潜在力または目標市場について、候補製品の独占的開発および商業化権利を保持することが私たちにより有利である場合、私たちは、協力、許可、または他の特許権使用料手配によって、候補製品に対する貴重な権利を放棄する可能性がある。
私たちが開発した任意の候補製品の市場機会は、承認されれば、いくつかの小さい患者亜群に限られる可能性があり、私たちが推定したものよりも小さいかもしれない。
再発や難治性pLGGの治療法としてtovorafenibの承認を求め,その後現場環境で使用する予定である。FDAは2023年10月にわれわれの非処方薬を受け,再発性あるいは難治性pLGGとしてトボルフェニの単一療法を優先的に検討した。しかしながら、tovorafenibまたは私たちの他の候補製品が任意の治療方法のために承認されることは保証されず、任意のそのような承認を得る前に、コストが高く、時間がかかり、リスクがある可能性がある追加の臨床試験を行わなければならないかもしれない。
私たちの目標癌患者数の予測と、特定の治療経路を受けることができ、私たちの候補製品治療から利益を得る可能性があるこれらの癌患者のサブセットは、私たちの信念と推定に基づいている。例えば、pLGGはまれな疾患であり、このような疾患を有する人数および候補製品治療から利益を得る可能性があるpLGG患者のサブセットの予測は、推定に基づいている。これらの推定は様々な源から来ており、科学文献、診療所調査、患者基金と/或いは市場研究を含む。これらの推定は正しくないことが証明されるかもしれない。また、新しい研究や情報は、私たちの目標癌の推定発症率や流行率を変える可能性があり、これは、特定の適応の孤児指定を取得する資格があるかどうかに影響を与える可能性がある。私たちの候補製品の潜在的にアドレス指定可能な患者集団は限られているかもしれないし、あるいは私たちの候補製品の治療を受け入れられないかもしれない。したがって,候補製品が承認されても,我々の候補品を用いて治療を行う資格がある患者数は予想よりもはるかに少ない可能性がある。また,腫瘍タイプごとに異なる承認療法があれば,治療医が複数の腫瘍タイプのために承認された製品をどのように開発することが期待されるかを決定するための市場研究は行われていない。私たちの製品がかなりの市場シェアを獲得していても、承認されれば、潜在的なターゲット層が少なく、追加適応のマーケティング許可を得ていなければ、決して利益を達成しないかもしれない。
我々の臨床開発活動は,主にゲノム定義された癌患者のための標的療法の開発に集中しており,急速に発展している科学分野であり,我々が講じている薬物の発見·開発方法は斬新であり,承認または販売可能な製品は決して生じない可能性がある。
遺伝子定義癌患者に対する標的療法の発見と開発は新興分野であり,候補製品の発見·確定·開発に努める基礎となる科学的発見が比較的新しい。これらの発見に基づく候補製品の開発可能性を支持する科学的証拠は初歩的であり、限られている。著者らは、著者らの候補製品の臨床前試験結果と著者らの臨床仕事に基づいて、著者らが計画したゲノム変化は発ガン要素であると信じているが、臨床結果はこの仮説を実証しないかもしれない、あるいはある変化或いはある腫瘍タイプに対してのみこの仮説を実証する可能性がある。われわれの候補製品の患者集団は,特定の標的改変を有する患者に限られており,完全に定義されていない可能性があるが,一般的に治療されている癌群よりもはるかに少ない。場合によっては、ターゲット患者集団は完全に確定されていない可能性がある。私たちは的確に変化した適切な患者をスクリーニングして識別する必要があるだろう。患者の識別に成功することは、特定の変化が私たちの候補製品にどのように応答するかを決定することと、そのような変化を識別する能力とを含むいくつかの要因に依存する。また,患者の識別に成功しても,各変異による患者集団が十分大きいかどうかを決定することはできず,各変異型の承認を得ることに成功し,候補製品を商業化して利益を得ることができる。また,われわれの方法がRAF駆動癌に対するtovorafenib計画の臨床的利益を示すことに成功しても,tovorafenibに敏感な他の発癌変化を他のMAPK駆動腫瘍に発見することは決して成功しない可能性がある。したがって,遺伝子定義癌を有する患者を治療する方法が成功するかどうかは不明であり,我々の方法が成功しなければ,我々の業務は影響を受けるであろう。
58
Tovorafenibを含む候補製品は、医師、医療専門家、患者またはその家族、医療支払者、および医療コミュニティにおいて商業成功のために必要な他の人において十分な市場受容度を得ることができない可能性がある。
私たちの候補製品がマーケティング許可を得ても、それらは医師、患者、または彼らの家族、第三者支払人、および医学界の他の人の間で十分な市場受容度を得ることができないかもしれない。私たちが承認した候補製品の市場受容度は多くの要素に依存するだろう
もし私たちのすべての候補製品が承認されたが、医師、病院、医療支払者、および患者の十分な程度の受け入れを得られなければ、私たちはその候補製品から十分な収入を得ることができないかもしれず、私たちの財務業績は否定的な影響を受けるかもしれない。具体的には,tovorafenibについては,成功した商業化が第三者支払者との交渉や保証,精算,選択および/または買収決定に依存することは予測できない.これらの決定は、逆に、様々な要因(tovorafenibの価格を含む)を考慮した様々なエンティティ(例えば、薬局および治療委員会、医療システムおよび薬局など)による価値評価に依存する可能性があり、結果を予測することができない。
私たちが開発したどの候補製品も不利な第三者の保証と精算のやり方や価格制限の影響を受ける可能性があります。
第三者支払人は、政府衛生行政当局、個人健康保険会社、管理性医療組織と他の第三者支払人を含み、その保険範囲と範囲及び適切な精算は大多数の患者に高価な治療を負担できることに重要である。Tovorafenibを含む任意の候補製品の販売は、処方薬治療を受けた患者が通常、その処方薬に関連する費用の全部または一部を精算するために、米国および国際的にこれらの候補製品の費用がどの程度第三者支払者によって支払いおよび精算されるかに大きく依存する。また,政府医療計画(連邦医療保険や医療補助など)や商業支払者のカバー範囲と十分な補償は,新製品の受容度に重要である。精算が得られない場合、あるいは限られたレベルに限られていれば、候補製品を商業化することに成功できないかもしれません。保険を提供しても、承認された精算金額は私たちが設立するのに十分ではないかもしれません
59
十分な投資収益を達成するために十分な価格設定を維持する。保証範囲と精算は、マーケティング許可を得た任意の候補製品の需要や価格に影響を与える可能性があります。
新たに承認された製品、特に小児科製品は、第三者支払者のカバー範囲と精算に重大な不確定性が存在する。米国では,小児科製品の支払者組合は各州特定の医療補助政策と広範な民間保険会社の支離滅裂な組み合わせである。他の価格設定エンティティに通知するための一貫した政策や主要支払者はいない。公共と個人支払者政策は私たちが広範囲な支払いカバーを達成する能力に必須的だと予想される。また、私たちの1つ以上の製品が第三者支払者の保険を受けた場合、他の支払者もその製品に保険を提供する保証はありません。したがって、カバー範囲を決定するプロセスは、しばしば時間がかかり、高価である。この過程は、各第三者支払者にそれぞれ私たちの製品を使用する科学的かつ臨床的支援を提供することを要求するが、保険と適切な精算を一貫的に適用すること、または最初に十分な精算を得ることを保証することはできない。
連邦政府と州政府が処方薬の定価を下げる措置を含む追加の医療コスト制御措置を実施することに伴い、私たちの製品が承認された場合、個人または公共支払者が保証を受け、保険を受けた場合、精算金額が十分かどうか、あるいは他の市場製品と競争するかどうかを決定することはできない。連邦や州政府および医療計画のこれらおよび他の行動は、薬品定価や医療コストに追加の下振れ圧力をもたらす可能性があり、これは、私たちの製品(承認されれば)の保証範囲と清算、私たちの収入、および他の市場製品との競争や私たちの研究開発コストを回収する能力に悪影響を及ぼす可能性がある。
ますます多くの第三者支払人は製薬会社が価格に基づいて所定の割引を提供することを要求し、医療製品の価格に挑戦し、医療の必要性の審査と候補医療製品の費用効果を審査することを含む。新たに承認された薬物の保険や補償には,特に重大な遅延が生じる可能性がある。第三者支払者は、承認されたリスト上の特定の製品、いわゆる処方表にカバー範囲を制限することができ、FDAによって承認された特定の適応のすべての薬剤を含まない可能性がある。私たちは、私たちの製品の医療の必要性と費用効果を証明するために薬物経済学の研究を計画しています。これは高価かもしれません。それにもかかわらず、私たちの候補製品は医学的に必要で費用効果的だと思われないかもしれない。さらに、第三者支払者のカバー範囲の決定は臨床および経済基準に依存する可能性があり、より成熟またはより低コストの治療代替案が使用可能になった場合、またはその後利用可能な場合、これらの基準は新薬製品に不利である。私たちが商業化したどの製品も保険と精算を受けることができることを確実にすることはできません。もし精算できるなら、清算レベルはいくらですか。
また,補充性と随伴診断テストは,関連薬品や生物製品の保険や精算に加えて,単独で保険と精算を受けることが求められている。医薬品や生物製品に適用される保険獲得や精算に適した類似課題は随伴診断にも適用される。さらに、任意のセット診断提供者が精算や精算不足を得ることができない場合、このようなセット診断の可用性を制限する可能性があり、承認されれば、候補製品の処方に負の影響を与える。
米国以外では,治療薬の商業化は通常広範な政府価格規制や他の市場規制の制約を受けている。私たちは、ヨーロッパ、カナダ、その他の国のコスト制御措置の重視がますます重視され、私たちの候補製品などの治療薬の価格設定と使用に圧力をかけ続けると信じている。多くの国、特に欧州連合或いはEU諸国では、国家衛生システムの一部として、薬品価格は異なる価格制御メカニズムの制約を受けている。これらの国では、製品がマーケティングの許可を得た後、政府当局と価格交渉を行うのにかなりの時間がかかるかもしれない。一部の国で精算或いは定価の承認を得るためには、私たちの候補製品のコスト効果を他の利用可能な治療法と比較する臨床試験を行う必要があるかもしれない。一般的に、この制度での製品価格はアメリカよりずっと低い。他の国は会社が自ら価格を設定することを許可しているが、会社の利益を監視する。追加の外国価格規制や定価規制の他の変化は、私たちの候補製品に受け取ることができる費用を制限するかもしれません。そのため、米国以外の市場では、米国に比べてわが製品の精算が減少する可能性があり、商業的に合理的な収入や利益を生み出すには不十分である可能性がある。
保証政策と第三者支払人の販売率はいつでも変化する可能性があります。マーケティング許可を得た1つまたは複数の製品が有利な保証範囲および精算状態を獲得したとしても、将来的にはあまり有利ではない保証政策および精算料率が実施される可能性がある。
60
第三者支払者の任意の製品のために保証範囲および十分な補償を確立または維持することができない場合、これらの製品の採用および販売収入は悪影響を受け、承認されれば、これは逆にこれらの製品をマーケティングまたは販売する能力に悪影響を及ぼす可能性がある。
私たちの業務には製品責任の重大なリスクがあり、十分な保険範囲を得ることができなければ、このような保証ができなければ、私たちの業務や財務状況に悪影響を及ぼす可能性があります。
私たちの業務は、tovorafenibの開発、テスト、製造、商業化、および任意の未来の製品および治療薬のマーケティング過程において、重大な製品責任リスクに直面させます。製品責任クレームは私たちの開発計画の完了を延期または阻止する可能性があります。もし私たちがマーケティング製品の面で成功すれば、このような声明はFDAまたは他の規制機関が私たちの製品、私たちの製造プロセス、施設、または私たちのマーケティング計画の安全性と有効性を調査することにつながるかもしれない。FDAまたは他の規制機関の調査は、これらの製品が使用可能な承認適応を制限するか、または承認を一時停止または撤回するために、我々の製品をリコールするか、またはより深刻な法執行行動をとることをもたらす可能性がある。是非曲直あるいは最終結果にかかわらず、責任クレームは私たちの製品に対する需要の減少、私たちの名声に対する損害、関連訴訟の弁護コスト、管理層の時間と資源の分流及び試験参加者或いは患者への巨額の金銭奨励を招く可能性がある。私たちは現在、製品責任保険があります。これは私たちの開発段階に適していて、私たちの候補製品が臨床試験に入ったり、私たちの任意の候補製品をマーケティングしたりする前に、より高いレベルを得る必要があるかもしれません。私たちが持っているか得ることができるどんな保険も潜在的な責任に十分な保険を提供できないかもしれない。しかも、臨床試験と製品責任保険はますます高くなっている。したがって、私たちは製品責任クレームによる損失から私たちを保護するために合理的なコストで十分な保険を得ることができないかもしれません。これらの損失は私たちの業務や財務状況に悪影響を及ぼす可能性があります。
政府の規制に関連するリスク
医薬品の開発と商業化は広く規制されており、私たちはtovorafenib、pimasertib、または任意の未来の候補製品のマーケティング許可をタイムリーにまたは根本的に得られないかもしれない。
臨床開発、製造、ラベル、包装、保存、記録保存、広告、販売促進、輸出、輸入、マーケティング、流通、有害事象報告、安全性および他の発売後の情報と報告の提出、およびtovorafenibとpimasertibに関連する可能性のある他の活動を含み、現在私たちが計画あるいは行っている臨床試験でしかない候補製品、および私たちが将来開発する可能性のある任意の他の候補製品は、広く監督されている。アメリカでは、医薬品の発売許可はFDAに機密協定を提出する必要がある。NDAは大量の臨床や臨床前データ,薬理学,化学,製造,制御に関する大量の情報によって支持されなければならない。私たちはこの製品に対するFDAのNDAの承認を得るまで、アメリカでいかなる候補製品も販売することを許可されません。
FDAは私たちが提出した任意の申請を諮問委員会に提出するかもしれない。諮問委員会は,臨床医や他の科学専門家を含む独立した専門家からなるグループであり,申請を審査·評価し,申請を承認すべきかどうか,どのような条件下でFDAにアドバイスやアドバイスを提供すべきかについて担当する。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を慎重に考慮するだろう。
NDAに対するFDAの承認は保証されておらず、審査および承認プロセスは高価で不確実なプロセスであり、FDAはこれに対して大きな裁量権を持っている。FDAの承認過程もまた数年かかるかもしれない。NDAの承認に必要な臨床前研究および臨床試験の数量およびタイプは、候補製品、疾患または候補製品設計のための条件、および任意の特定の候補製品に適用される法規によって異なる。米国で大量に開発されている薬物のうち,一部のみがFDAの上場認可プロセスに成功し,商業化が実現される。FDAはわれわれのNDAを受け,再発性あるいは難治性pLGGとしてのトボルフェニの単一療法を優先的に検討した。しかし、tovorafenibまたは私たちの他の任意の候補製品が米国または他の司法管轄区でマーケティング許可を受けることは保証されない。さらに、fdaがtovorafenibまたは私たちの他の候補製品を承認した場合、fdaは、tovorafenibまたは任意の他の製品を商業化する能力を制限するために、制限、発売後の要求、または発売後の約束を加える可能性があります
61
製品です。FDAの強制的な要求を遵守できなかった場合、あるいはいくつかの必要な発売後の研究結果が陰性であれば、FDAは承認を撤回し、警告を追加し、承認の適応を縮小する可能性があり、これは私たちの製品の商業成功に影響を与える可能性がある。
さらに、将来の立法や行政行動における追加的な政府規制、または製品開発、臨床試験、審査過程における規制機関の政策の変化による遅延や拒否に遭遇する可能性がある。例えば、2022年5月、FDAに属する腫瘍学卓越センターはOptimusプロジェクトを推進し、このプロジェクトは腫瘍学薬物開発中の用量最適化と用量選択範式を改革し、最適な用量を選択することを強調し、即ち薬物の治療効果を最大化するだけでなく、安全性と耐性を最大化する1つ或いは複数の用量を強調する。このような転換は、従来一般的に最大耐性用量を決定する方法とは異なり、ターゲット集団における最適な用量選択を促進するために、候補製品の用量-反応関係をさらに探索するために、スポンサーがより多くの時間と資源を費やす必要があるかもしれない。腫瘍学卓越センターの最近の他の計画は、多くの以前の一連の治療を受けたか、または利用可能な治療選択を使い切った患者を治療するための、より早い末期環境において初期臨床開発のための候補薬剤を決定するための枠組みを制定することを目的とした新しい計画であるProject Foretrunnerを含む。
臨床試験失敗は多種の要素によって引き起こされる可能性があり、試験設計、用量選択、プラセボ効果、患者登録標準、データ完全性挑戦、或いは良好な安全性或いは有効性特徴を証明できなかった。臨床試験の失敗はどんな段階で起こる可能性がある。製薬業界の会社は,早期の試験で良好な結果が得られたにもかかわらず,治療効果や不良安全性の欠如により臨床試験の進展に挫折することが多い。陰性または不確定の結果から、私たちは決定することができますか、あるいは監督機関は追加の臨床試験または臨床前研究を要求するかもしれません。また、臨床試験から得られたデータは異なる解読の影響を受けやすく、監督管理機関は著者らのように著者らのデータを有利に解読しない可能性があり、これは更に上場許可を延期、制限或いは阻止する可能性がある。我々の臨床試験によれば、FDAは、FDAが可能であるため、承認候補製品を多くの理由で延期、制限、または拒否することができる
私たちはまだ候補製品に対するFDAの承認を得ていない。このような経験の欠如は,我々がFDA承認をタイムリーに得る能力を阻害する可能性があり,もしあれば,我々の臨床製品候補となる。またたとえ私たちが
62
FDAの承認を得た場合、外国司法管轄区域の比較可能な規制機関から同様の承認を得ることは保証されず、これは私たちの潜在市場を制限し、私たちの業務、将来性、財務状況、運営結果に悪影響を及ぼす可能性がある。
もし私たちが承認を得る上で遅延に遭遇した場合、あるいはtovorafenibやpimasertibまたは私たちの未来の製品候補製品の承認を得られなかった場合、私たちのビジネスの見通しは損なわれ、私たちの収益能力は実質的に損なわれ、これは私たちの業務、将来性、財務状況、および運営結果に悪影響を及ぼすだろう。
FDAを使用したいかなる加速計画も求めていれば、FDAは私たちの候補製品がこれらの計画に参加する資格があることを発見しないかもしれませんが、承認されれば、これらの計画は私たちの候補製品のより速い開発、規制審査、または承認につながらないかもしれません。
FDAには、迅速通路、優先審査、突破療法、加速承認を含むいくつかの迅速計画があり、これらの計画は連邦食品、薬物と化粧品法案またはFD&C法案によって許可され、FDAの法規とガイドラインに基づいて実施される。このような計画はFDAが薬品を承認する基準を変えなかった。私たちはまだマーケティング許可を得るために、有効な大量の証拠と受け入れ可能なセキュリティプロファイルを証明しなければならない。
私たちはFDAの1つ以上の迅速なプロジェクトを利用することを求めるかもしれない。例えば、私たちは私たちの1つまたは複数の候補製品のための高速チャネル認証を求めることができる。
FDAは、重篤または生命を脅かす疾患を治療するための薬物の迅速なチャネル指定を付与する可能性があり、非臨床的または臨床的データは、このような疾患が満たされていない医療要件を解決する可能性があることを示す。FDAは幅広い裁量権を有しており,この称号が付与されているかどうか,したがって,ある特定の候補製品がこの称号を得る資格があると考えても,FDAがそれを付与することを決定することを保証することはできない。FDAが我々の臨床開発プロジェクトのデータが高速チャネルの指定をサポートしなくなったと考える場合,その指定を撤回する可能性がある。
われわれはすでにtovorafenibの末期pLGG患者に対する画期的な治療指定を申請し、獲得し、将来的には他の候補製品や適応のための突破的治療指定を申請する可能性がある。候補薬剤が単独で、または1つまたは複数の他の薬剤または候補薬剤と組み合わせて、深刻なまたは生命を脅かす疾患または状態の治療のために使用される場合、予備臨床証拠は、候補薬剤が1つまたは複数の臨床的に重要な終点で既存の療法よりも実質的に改善されている可能性があることを示している場合、FDAは候補薬剤を潜在的な突破的療法として指定することができる。画期的な治療法に指定された候補薬に対して,FDAと試験スポンサーとの相互作用やコミュニケーションは,臨床開発の最も有効な方法を決定するのに役立つとともに,無効制御案中の患者数を最小限にすることができる。FDAから画期的な治療法の候補薬に指定されており,NDA提出時に臨床データの支持を得ていれば,優先審査の資格もある。FDAがこれ以上指定基準を満たしていないと判断した場合、画期的な治療指定を撤回する可能性がある。
FDAは2023年10月にわれわれの非処方薬を受け,再発性あるいは難治性pLGGとしてトボルフェニの単一療法を優先的に検討した。私たちは、私たちの1つまたは複数の他のマーケティング許可申請の優先審査を求めることができるか、または1つまたは複数の他の候補製品の他の指定の一部を求める可能性があるとして、優先審査を得ることができる。申請された薬物が重篤な疾患を治療し、承認された場合、安全性または有効性の面で有意な改善を提供する場合、FDAは、申請を優先的に審査することができる。FDAはFD&C法案第505 A節の小児科研究に関する報告に基づき,ラベル変更を提示したサプリメントを優先的に審査することも可能である。さらに、FDAは、優先審査証明書と共に提出された任意の薬物申請またはサプリメントを優先的に審査することができる。私たちはFDAが私たちの候補製品を優先的に検討することを決定することを保証することはできません。
任意の候補製品の迅速なチャネル指定、画期的な治療指定、または優先審査を取得しても、そのような指定されていない製品と比較して、私たちのマーケティング許可申請の迅速な開発、審査、またはより速い行動を経験しないかもしれません。
63
承認経路を加速することは利用できない可能性があり、または利用可能であれば、より速い開発、規制審査、またはマーケティング許可をもたらすことができない可能性があり、加速承認経路の使用は、必ずしも私たちの候補製品がマーケティング許可を得る可能性を増加させるとは限らない。
FDAの加速承認計画に基づいて、FD&C法案第506(C)節とFDA法規に規定されている条件を遵守し、FDAは製品の代替終点への影響(合理的に臨床利益を予測する可能性が高い)、あるいは不可逆的な発病率或いは死亡率よりも早く測定できる臨床終点への影響を合理的に予測し、不可逆的な発病率或いは死亡率或いは他の臨床利益への影響を合理的に予測し、生命に深刻な疾病或いは状況を脅かすための製品を承認することができ、同時に病状の深刻性、希少性或いは流行度及び代替治療があるかどうかを考慮する。FDAは、通常、既存の治療方法よりも議論されている候補製品が有意な治療利益を提供する場合に使用促進承認を保持する。
私たちは、私たちが合理的に臨床的利益を予測する可能性があると考えられる代替終点(例えばORR)に基づいて、私たちの1つまたは複数の候補製品の承認を加速することを求めるかもしれない。FDAは、我々が選択した終点が合理的に臨床的利益を予測する可能性があるという我々の結論に同意しない可能性があり、したがって、FDAは、終点に基づく加速承認が適切であることに同意しない可能性がある(終点の結果が統計的に意味があっても)、加速承認を延期または排除する可能性がある。
加速された承認を得た製品は、一般に、製品の臨床的利益を確認するために、1つまたは複数の承認後の研究を行うことを要求することを含むいくつかの発売後に要求される制約を受けており、これは、職務調査で達成されなければならない。この製品を承認する際には、FDAは発売後の研究の条件を説明しなければならず、その中には、研究案、登録目標、目標達成日、その他のマイルストーンに関する具体的な条件と締め切りが含まれている可能性がある。FDAは、一般に予想され、1つまたは複数の検証的研究が、承認を加速する際に、または承認後の特定の時間フレームワーク内で行われることを適宜要求する可能性がある。FDAは、私たちが提案した発売後の検証的研究の臨床研究設計に同意しない可能性があり、承認を遅らせるか、承認経路で承認された製品の撤回を加速させる可能性がある私たちに不利な研究条件を要求するかもしれません。
さらに、FDAの規定は、承認を加速させた製品のスポンサーが、承認前審査中に、上場承認後120日以内に使用される予定のすべての宣伝材料のコピーを提出することを要求する。上場承認後120日後、FDAが別途通知しない限り、スポンサーは少なくとも使用30日前にすべての宣伝材料を提出しなければならない。
承認経路の加速はFDA内部、国会、および他の利害関係者で審査されている。FDAはより多くの重点を責任を果たして検証的な研究を行うことに重点を置き、最終的にこのような研究が利益を実証することを確保した。例えば、FDAは、FDAによって呼ばれる“懸案”または“滞納”の加速承認を検討するために、その腫瘍薬物諮問委員会を招集し、これらの承認は、検証的研究が完了していない場合、または結果が有益であることが確認されていない場合に行われる。また、2021年、腫瘍学卓越センターは、腫瘍学適応の加速承認に関連する結果の透明性を促進し、承認と発売後のプロセスにおける議論、研究、革新を促進するための枠組みを提供することを目的とした確認プロジェクトを発表し、癌と血液悪性腫瘍患者の利用可能な治療の獲得と利益検証のバランスを強化することを目的としている。
最後に、国会は最近、承認後の研究をめぐる要求の強化、迅速な承認経路で承認された製品の撤回手続きの編纂、機関内の承認加速委員会の構築、加速承認政策の解決など、2022年の食品·薬物総合改革法案、またはFDORAを可決した。FDORAはまた、承認後の研究を行うことができなかったこと、またはこのような研究の進捗報告をFD&C法案の禁止行為リストに提出することができなかったことを意味し、これは、私たちの行動によっても第三者の行動によっても、私たちが提起した法執行行動に根拠を提供する可能性があり、これは、弁護コストが高くなる可能性があり、または私たちの弁護が成功しない可能性があることを意味する。
FDAはまた、迅速な撤回手続きを使用して、承認経路の下で承認された製品を撤回する権利がある。このような撤回を招く可能性がある場合には、
64
もし私たちの競合他社が加速承認を得る前に加速承認を求めている適応の完全な承認を得た場合、私たちが求めている適応はもはや条件を満たしていない可能性があり、満たされていない医療ニーズが存在し、候補製品の加速承認がより困難になるか、全く起こらないであろう。
Tovorafenib治療pLGGに対するFDAの画期的な治療指定を取得したとしても、このような指定は、より速い開発または規制審査または承認プロセスをもたらすことはないかもしれないが、tovorafenibが上場許可を得る可能性は増加せず、他の候補製品の画期的な治療指定を得ることはできないかもしれない。
われわれはすでにFDAから画期的な治療指定を得ており,末期pLGG患者のトロヴォラフィニに用いられている。私たちはこの称号を獲得したにもかかわらず、従来のFDAプログラムと比較して、より速い開発時間やより速い審査や承認を達成することを経験しないかもしれない。例えば、製造および制御に関連する問題を識別および解決するのに要する時間、臨床試験目的のために十分な製品供給を得るか、または追加の非臨床的または臨床的研究の必要性を行うことは、製品が画期的な治療指定を得る資格があるかどうかにかかわらず、または任意の他の加速計画を得る資格があるかどうかにかかわらず、マーケティング許可申請の提出または審査を延期する可能性がある。FDAが我々の臨床開発計画のデータがこの指定を支持しなくなったと考える場合,加速計画へのアクセスを撤回する可能性もある。さらに、任意の画期的な治療指定またはFDAの任意の他の加速計画の資格は、最終的にそのような候補製品のマーケティング許可を得ることを保証しない。さらに、候補製品の画期的な治療指定を得ることは、他の候補製品の画期的な治療指定を得る可能性を増加させることはない。
私たちは私たちの候補製品の孤立した薬物指定または独占経営権を獲得したり維持できないかもしれない。
われわれは米国とEUでそれぞれ悪性グリオーマとグリオーマの治療のためのトヴォラフェニの孤児薬物指定を得た。私たちは、トヴォラファニーの孤児薬物名を、より多くの地域または適応の中で求めることができるか、またはピマ司または私たちが将来開発する可能性のある任意の候補製品のために孤児薬物名を求めるかもしれない。米国を含むいくつかの管轄区の規制機関は、患者数が相対的に少ない薬物を“孤児薬”とする可能性がある。孤児医薬品法によれば、1つの薬剤がまれな疾患または疾患の治療を目的としている場合、または米国における疾患または疾患の影響が20万人を超え、米国での製品の販売から開発および提供されるコストを回収することができるという合理的な期待がない場合、FDAは、その薬剤を孤児薬として指定することができる。米国では、まれな疾患または疾患の定義は、通常、患者数が20万人未満である。
一般的に、米国孤児薬物の称号を有する候補製品がその後、この薬剤がこの称号を有する適応の最初の発売許可を得た場合、この製品は市場排他期を有する権利があり、これにより、FDAは7年以内に同じ薬物の同じ適応に対する別のマーケティング申請を承認することができない。FDAが指定要求に重大な欠陥があると判断した場合、または指定された要求を提出する際に、その薬剤が実際に孤児薬として指定される資格がない場合、または製造業者がこのようなまれな疾患または疾患を有する患者の需要を満たすのに十分な薬剤数を保証できない場合、米国における孤児薬の排他性を失う可能性がある。
場合によっては、FDAは、後続製品が臨床的利点を示す場合(すなわち、後続製品が孤児排他性を有する製品よりも安全で、より効果的であるか、または患者ケアに重大な貢献がある場合)のように、排他的期間内に同じ適応で同じ薬剤を販売する後続の出願を許可することができる。しかし,競争相手は孤立製品が排他的な同一適応の承認を得るか,あるいは同じ製品の承認を得るために異なる製品の承認を得ることができるが,その適応は異なる
65
孤児製品はそれに対して排他的な製品だ。孤児薬物指定は,一方に臨床試験費用,税収割引,ユーザ費用減免のための贈与資金の機会を提供するなど,財政的インセンティブを得る権利がある。
EUでは、ある薬品が孤児薬品としてのマーケティング許可を与えられた場合、それは孤児市場独占期の恩恵を受けることになり、その間、ヨーロッパ薬品管理局、ヨーロッパ薬品管理局或いは国家監督管理機関は同じ孤児適応における類似薬品のマーケティング許可申請を受け入れることができない。EUでは,孤児専有権の適用期間は10年であるが,1つの薬物が孤児薬物指定の基準を満たしていなければ,この期間は6年に短縮できる。EMAまたは国家規制機関は、申請を受け入れ、孤児適応のための排他期間内の類似薬品の販売許可を許可することができ、類似製品が孤児製品よりも安全で、より効果的である場合、または他の点で孤児製品よりも優れている場合がある。
私たちはあなたに未来の他の候補製品に対する孤児薬物指定申請が承認されるということを保証することができません。米国や他の管轄地域の他の候補製品の孤児薬物指定を得ることができない場合、孤児薬物指定による市場排他期を取得する資格がない場合や、孤児薬物指定に関連する他のインセンティブを得る資格がない。
さらに最近第11巡回裁判所はCatalyst PharmPharmticals Inc.FDAを訴える“孤児薬品法”の解釈については,孤児適応として承認された薬物に適用される排他的条項は薬物の孤児名よりも狭く,このような製品の孤児薬物排他性の範囲を大きく拡大する可能性が高い。具体的には、第11巡回裁判所は、孤児薬物の排他性により、FDAは、同じ薬物が同一の孤児が疾患または条件下で別のマーケティング申請を指定することを7年以内に承認できないと考えている。FDAは,本件における論争事実以外にCatalystの決定を適用しないことを発表しているが,Catalystは将来的にFDAと孤児薬物に関する決定に挑戦する前例となる可能性があり,したがって,会社が米国孤児の薬物排他性の解決を依存または求める方法を根本的に変更する可能性がある。Catalystの決定を覆す可能性のある立法も提案されているが、このような立法はまだ採択されていない。
著者らはある法律要求とFDAの政策を遵守しなければならず、“小児科研究公平法”と“児童最適薬品法”を含むいくつかの小児科患者の薬物開発に関連する法律に基づいて激励措置を求める可能性がある。
改訂された“小児科研究公平法”(PREA)は、安全かつ有効と評価された各小児科亜群の用量および投与をサポートするために、いくつかのNDA、生物学的ライセンス申請またはBLASおよびNDA/BLAサプリメントが、すべての関連する小児科亜群において主張される製品の安全性および有効性に関する評価報告を含むことを要求する。さらに、候補製品が成人癌の治療を意図し、FDAに対して小児癌の増殖または進行に密接に関連する分子標的を決定する場合、PREAは、新たな活性成分の原始NDAまたはBLAの分子標的小児癌研究を要求し、これは、成人癌適応とは異なる可能性がある。PREAはこれらの小児科研究が各研究年齢層に適した処方を使用することを要求し、出願人は使用された任意の小児科製剤の承認を求めなければならない。FDAはPREA要求の延期を承認するか、またはすべてまたは部分的な免除を与えることができる。法規が別途要求されない限り、PREAは孤児に指定された適応が付与された薬剤には適用されないが、PREAは小児科癌調査の分子標的化によって制限される元のNDAまたはBLAに適用される。我々のアプリケーションの1つがPREA要求を免除するとみなされても,我々の他のアプリケーションはPREA要求の制約を受ける可能性がある.
児童最優秀薬品法案によると、FDAは、FDAが書面請求という文書で要求した小児科研究を行うスポンサーに小児科独占経営権を付与することができる。私たちはこのような独占経営権を獲得しないかもしれないが、BPCAに基づいて私たちの1つ以上の候補製品のために小児科独占経営権を求めるかもしれない。小児科専用権が付与された場合、いくつかの未満期の法定専有期間は6ヶ月増加し、具体的には出願がNDAかBLAかに依存して、未満期の特許期間を延長する可能性がある。この6カ月の延期が承認されるかどうかは,小児科研究の自発的な完成状況とこのような研究に対する書面請求の応答に依存し,BPCA要求の時間範囲でFDAに研究報告を提出し,FDAが研究報告を受ける。FDAは,PREA(適用される場合)のみを要求する小児科研究以外および/または異なる研究に書面で請求する傾向が強いことを示している。
66
全体的に言えば、小児科薬物開発は最近ずっと絶えず変化する法律要求と監督管理標準の制約を受ける可能性のある領域であるため、小児科薬物開発の全体的な期待に対していくつかの不確定性が存在する。
私たちはFDAの小児科珍しい病気優先審査クーポン計画に従って、私たちの1つまたは複数の候補製品のために珍しい小児科疾患の称号を求めるかもしれません。たとえ私たちが稀な小児科疾患の称号を有する製品のためにマーケティング許可を得ても、稀な小児科疾患優先審査クーポン券計画は承認された時に有効ではなくなる可能性があり、あるいは私たちは稀な小児科疾患優先審査クーポン計画の価値を得ることができないかもしれない。
2021年5月、Tovorafenibは、小児に比例しない影響をもたらす活性化RAF変化が存在するLGGsを治療するための稀な小児科称号をFDAに付与された。Tovorafenib NDASをまれな小児科指定マーケティング申請として提出し,FDAは条件付きにマーケティング申請を“まれな小児科疾患製品申請”に指定し,承認や許可を待った場合に申請がFD&C法案第529(A)(4)節に規定するすべての資格基準を満たしているかどうかを最終的に決定した。
国会はFDAが特定の基準を満たすいくつかの稀な小児科疾患製品申請のスポンサーに優先審査クーポン券を付与することを許可した。これらのクーポン券はある稀な小児科疾患の予防と治療のための新薬と生物製品の開発を奨励することを目的としている。
具体的には、この計画によれば、スポンサーが薬物または生物製剤の承認を得た場合、異なる製品の後続マーケティング申請の優先審査に交換することができるクーポン券を得ることができる。優先審査証明書を取得したまれな小児科疾患医薬製品の発起人は、(販売を含む)証明書を別の発信者に譲渡することができる。譲渡を行うスポンサーがまだ申請を提出していない限り、その証明書を使用する前に、その証明書は、さらに任意の回数譲渡されることができる。クーポン券は第三者に売却または譲渡することができるが,クーポン券を受け取って販売すれば,このようなクーポン券を受け取ったり,任意の価値を実現したりすることは保証されない.
本計画において、稀な小児科疾患は(I)深刻或いは生命に危害を及ぼす疾患であり、その深刻或いは生命に危害を及ぼす表現は主に新生児、乳児、児童と青少年と呼ばれる年齢層を含む出生から18歳までの個人に影響を与える;および(Ii)“孤児薬物法”が指す稀な疾病或いは状況を含む。FDAは、承認後、私たちの1つまたは複数の候補製品の申請が優先審査券の資格基準を満たしていないと判断することができる。
また、現在の法定日没条項によると、FDAは一般的に2024年9月30日以降に稀な小児科疾患の優先審査証明書を授与しない。しかしながら、スポンサーが2024年9月30日までに稀な小児科疾患指定を受けた場合、その薬剤が2026年9月30日までに承認された場合、FDAは稀な小児科疾患優先審査証明書を付与する可能性がある。
私たちまたはビジネスパートナーが、任意のセットの診断テストのマーケティング許可を成功的に開発、検証し、取得することができず、それを商業化することができない場合、これらのテストは、私たちの任意の候補製品を使用するために必要であると考えられている場合、またはそうする際に大きな遅延に遭遇した場合、私たちは、私たちの1つまたは複数の候補製品のマーケティング許可を得ることができないか、またはそのすべてのビジネス潜在力を達成することができないかもしれません。
診断テストは,他の潜在的用途に加えて,特定の治療薬製品から利益を得る可能性が最も高い患者を決定する上でも有用である。規制当局が判断した場合、対応する治療製品を安全かつ効率的に使用するためには、体外診断試験が必要であり、この試験は“随伴診断”と呼ばれる。治療製品の安全かつ有効な使用は不可欠な診断ではないが、治療製品の使用に関する利益−リスク決定(例えば、治療製品を識別する指示患者集団において特に有効である可能性のあるサブセット)の診断を容易にすることは、一般に“補足診断”と呼ばれる。将来、私たちは私たちの候補製品のために特定の適応を開発する機会を評価するかもしれません。私たち自身もパートナーと一緒に開発し、セットにしたり、診断テストを補充したりします。
治療製品に伴う診断が必要な場合には,関連治療製品の臨床プログラムを組み合わせて随伴診断を開発するのが一般的である。これまで、FDAは大多数の癌治療のセット診断方法が発売前に承認されることを要求してきた。通常1つの
67
診断に伴う診断は、医薬製品の安全かつ有効な使用に不可欠であるが、FDAは、通常、治療製品を承認する前に、または同時に随伴診断を承認し、製品が商業化される前(限られた場合を除く)に要求される。治療製品から利益を得る可能性のある患者を識別するために付随診断を使用しなければならない場合、治療製品のタグは、一般に、診断開発に伴う検出のための特定の遺伝子変化または他のバイオマーカーを発現する患者にのみ治療製品の使用を限定する。対照的に、治療製品の適応では、補足診断は通常参照されない(すなわち、治療製品はバイオマーカー陽性患者のための使用に限定されない)、補足診断は、例えば、バイオマーカー陽性および陰性患者サブセットの臨床研究結果が記述されている場合のように、治療製品タグの他の領域に記載されてもよい。補充診断も通常,関連治療製品の臨床計画とともに開発されているが,FDAは治療製品を承認する前または同時に補充診断を承認することを要求しない可能性がある。
セットまたは補足診断の開発は、提出前会議のような規制機関との追加会議と、診断に関連する臨床研究がFDAの研究装置免除規定に準拠することを要求することとを含むことができる。“重大リスク機器”に指定された研究診断については,この診断を対応する候補製品の臨床試験と組み合わせて使用する前に,IRBおよびFDAによる研究設備免除申請の承認を得る必要がある。
開発、検証、承認のセットまたは補充診断を成功的に開発し、それを商業化するために、私たちあるいは私たちの協力者はいくつかの科学、技術、監督と後方勤務方面の挑戦を解決する必要がある。私たちはこれまで医療設備や診断テスト開発の経験がありません。もし私たちが独自に開発し、FDAのセット診断テストの承認を求めることを選択すれば、私たちは追加の人員が必要になるだろう。私たちは、セットの診断テストを必要とするか、または補充診断、申請および任意の必要なマーケティング許可およびこれらの診断の商業的供給から利益を得るために、セットの診断テストを必要とする第三者に依存する可能性があります。これらの候補治療製品の開発に成功した場合、あるいは開発を遅延させることができない場合、私たちは現在および計画されている臨床試験のために十分な患者を募集することができない可能性があり、これらの候補治療製品の開発は不利な影響を受ける可能性があり、これらの候補治療製品はマーケティング許可を得ることができない可能性があり、私たちはマーケティング許可を得たこれらの治療薬のすべての商業的潜在力を実現できないかもしれない。製品候補製品の使用から利益を得る可能性のある患者の候補製品を選択するためにセット診断を必要とする任意の候補製品について、セット診断の開発に成功しなかったいかなる場合も、著者らの臨床試験の遅延登録を招くか、或いは促進する可能性があり、そして著者らが肝心な試験を開始することを阻止する可能性がある。さらに、セット診断を必要とする候補製品のビジネス成功は、必要なマーケティング許可を得るかどうかに依存し、そのような第三者は、関連する地域で合理的な条項でセット診断の持続的な能力を提供してくれる。医師がどのような特定の随伴診断を採用するか,それをどのように使用したいか,どのように補償を得るか,それを患者にどのように説明するか,あるいはスタッフを指定して使用することは保証されない。これができなかったすべてのことは、私たちの業務、運営結果、そして財務状況に実質的な損害を与える可能性がある。
私たちの候補製品のためにマーケティング許可を得ても、承認された条項、私たちの製品の持続的な規制、あるいは他の承認後の制限は、私たちの製品の製造とマーケティングの方法を制限する可能性があり、これらの要求を遵守することは大量の資源に関連する可能性があり、これは私たちの創造能力を深刻に弱めるかもしれない。
Tovorafenibのような候補製品のマーケティング許可が承認されても、承認された製品およびマーケティング許可保持者は、FDAおよび他の規制機関によって持続的に規制されている。規制機関は上場後の要求を強制的に実施し、上場後の約束を要求する可能性があり、これは深刻な可能性があり、持続的な審査と広範な監督管理を受けることができる。例えば、FDAは、承認時または承認後に上場後の臨床研究、薬物警戒計画の強化、追加の報告要求、その他の義務を要求または要求することができる。FDAはまた、FD&C法案505-1条に基づいてREMSを実施して、私たちの候補製品のメリットが彼らのリスクよりも大きいことを確実にすることができる。また、FDAは、当時も承認された後も、FD&C法案505(O)条の下の権力を援用し、臨床試験および/または疫学モニタリングを含む高価な発売後の安全性研究を要求することができます
68
製品に関連する既知のリスクを評価するために、製品に関連する深刻なリスクの信号を評価するか、または既存のデータが深刻なリスクが存在する可能性があることを示す場合に、予期しない深刻なリスクを決定する。
さらに、FDAの加速承認を得た任意の候補製品は、この製品の臨床的利益を確認するために、1回または複数回の臨床試験を行う必要がある。検証性研究がその治療効果の終点に達しなかった場合、FDAは迅速な脱退許可によってこの製品の承認を撤回する可能性がある。このような製品がその検証性臨床試験(S)に成功することは保証されない。したがって,候補製品がFDAの加速承認を得ても,この承認は以降の日に撤回される可能性がある。
私たちはまた私たちがマーケティング許可を得た任意の候補製品に関する広告と販売促進要求を守らなければならない。また、私たちの製品が承認手続きを加速することで承認された場合、販促コミュニケーションに追加的な要求があります。処方薬に関する販売促進情報は様々な法律や法規によって制限されており,製品が承認されたラベル中の情報と一致しなければならない。したがって、私たちが開発した未承認の適応や用途のための製品を広めることはできません。
さらに、承認された製品の製造業者およびその工場は、品質管理および製造プロセスが現在の良好な製造実践、すなわちcGMPに適合することを確実にしなければならず、その中には、品質管理および品質保証に関連する要求、および対応する記録および文書の維持および報告要件が含まれている。私たちと私たちのCMOはFDAの定期的な抜き打ち検査を受けて、商業生産のために提案された任意の候補製品の製造施設の承認前検査を含むcGMPに適合することを監視し、確保する可能性があり、これらの検査は商業製品が発売される前に成功する必要がある。したがって、私たちが1つ以上の候補製品のマーケティング許可を得たと仮定すると、私たちと私たちのCMOは、製造、生産、製品監視、および品質管理を含むすべてのコンプライアンス分野で時間、お金、エネルギーをかけ続けるだろう。
すべての承認後の規制要求を遵守できなければ、規制機関によって私たちの製品に対するマーケティング許可を撤回される可能性があり、将来の製品をマーケティングする能力が制限される可能性があり、利益を達成したり維持したりする能力に悪影響を及ぼす可能性があります。また、承認後の法規を遵守するコストは、私たちの経営業績や財務状況に悪影響を及ぼす可能性があります。
私たちが発売許可を得た任意の候補製品は、tovorafenibを含め、規制機関が発売後の要求を継続的に実行することによって制約され、もし私たちがすべての規制要求を遵守できなかった場合、あるいは私たちの製品が予期しない問題に遭遇した場合、いずれかが承認された場合、私たちの製品を市場から撤回することを含む重大な処罰を受ける可能性がある。
私たちが発売許可を得た任意の候補製品、例えばtovorafenib、およびこのような製品の製造プロセス、承認された臨床データ、ラベル、広告、販売促進活動は、FDAと他の規制機関の持続的な要求と審査を受けるだろう。これらの要件には、承認された製品の普及、安全および他の発売後の情報および報告の提出、登録および上場要件、生産、品質管理、品質保証および記録および書類の対応する維持に関するcGMP要件、ならびに薬品の流通および医師へのサンプルの配布および記録の保存に関する要件が含まれるが、これらに限定されない。
FDAおよび他の連邦および州機関は、司法省を含み、処方薬製品に対するすべての要求の遵守を厳格に規制し、承認されたラベル規定による薬物の販売および普及の要求、およびcGMP要求に基づいて製品を生産する要求を含む。例えば,FDAや他の機関はラベル外用途の普及を禁止する法律法規を積極的に実行しており,ラベル外用途の普及が不適切であることが発見された会社は重大な責任を負う可能性がある。これらの要求に違反すると調査につながる可能性があり、虚偽請求法案や他の連邦や州医療詐欺や法律乱用、州消費者保護法など、FD&C法案や他の法規に違反していると告発される可能性がある。私たちはすべての法規を守れませんでした
69
要求、および後に、私たちの製品、製造業者、または製造過程において以前に未知の有害事象または他の問題が発見され、様々な結果が生じる可能性があります
もし私たちまたは任意の未来のパートナーが安全モニタリングまたは薬物警戒、および小児科群の製品開発に関連する要求を含む法規要件を遵守しなければ、重大な経済的処罰を招く可能性もある。さらに、いずれかの行動が発生した場合、tovorafenibを含む候補製品の商業化を停止しなければならない可能性があり、私たちの販売およびマーケティング努力を制限し、さらなる承認後の研究および/または他の行われている任意の臨床研究を停止または変更することは、逆に巨額の費用および遅延および/または販売収入を創出する能力を制限することをもたらす可能性がある。
もし私たちが外国の管轄区域でマーケティングの許可を得ることができなければ、私たちの候補製品はこれらの管轄区で販売することができません。私たちがアメリカで得た私たちの候補製品に対するいかなる承認も、私たちの候補製品が外国の管轄区域で承認されることを保証することはできません。
アメリカ以外のいかなる司法管轄区でも私たちの製品をマーケティングして販売するためには、単独のマーケティング許可を得て、多くの異なる規制要求を守らなければなりません。承認手続きは国によって異なり、追加的なテストが含まれるかもしれない。承認を得るのに要する時間は、FDA承認を得る時間とは大きく異なる可能性がある。米国以外の市場許可プロセスは、通常、FDA承認の取得に関連するすべてのリスクを含む。また、米国以外の多くの国では、製品がその国での販売を許可される前に、精算承認を受けなければならないことが求められている。もしあれば、私たちはアメリカ以外の規制機関から直ちに承認されないかもしれない。FDAの承認は、他国又は管轄区域の規制機関の承認を確保するものではなく、米国以外の1つの規制機関の承認も、他の国又は司法管区の規制機関又はFDAの承認を確保することができない。私たちはマーケティング許可を提出できないかもしれないし、どの市場でも私たちの製品を商業化するために必要な承認を得ることができないかもしれない。
私たちの現在と将来の顧客および第三者支払者との関係は、刑事、民事と行政処罰、契約損害、名声損害、利益および将来の収入の減少を含む重大な処罰に直面する可能性があり、反リベート、詐欺および乱用、透明性、健康プライバシーおよび他の医療保健法律および法規の制約を受ける可能性があります。
70
医師を含む医療提供者と第三者支払者は、マーケティングの許可を得た任意の候補製品の推薦および処方において主な役割を果たすだろう。私たちの現在と将来の医療保健提供者、第三者支払者、顧客との手配は、私たちがマーケティングの許可を得た任意の製品の業務または財務配置と関係を制限する可能性があり、広範に適用される詐欺と乱用、その他の医療法律法規に直面する可能性があります。私たちの業務に適用される連邦と州医療法律法規の制限は
71
我々の内部業務プロセスと第三者の業務配置に適用される医療法令に適合することを確保する努力は、多くのコストに関連する。政府当局は、私たちの業務やり方が現在または未来に適合していないと結論するかもしれないが、詐欺および乱用または他の医療保健法律および法規の適用に関する現行または未来の法規、法規または判例法に関連している。もし私たちの運営がこれらの法律または他の私たちの政府法規に適用される可能性があることが発見された場合、私たちは重大な民事、刑事と行政処罰、損害賠償、罰金、返還、監禁、連邦医療保険と医療補助計画および他の連邦医療計画、契約損害、名声損害、利益減少および将来の収益減少、追加の誠実な報告と監督義務、および私たちの業務を削減または再編することに直面する可能性があり、これらはいずれも私たちの業務運営能力と私たちの運営結果に悪影響を及ぼす可能性がある。もし私たちがそれと業務を展開することを期待している任意の医師または他の医療提供者または実体が適用されない法律を遵守していないことが発見された場合、彼らは政府の援助された医療計画から除外されることを含む重大な刑事、民事、行政制裁を受ける可能性があり、これは私たちの業務、運営結果、財務状況、および見通しに実質的な悪影響を及ぼす可能性がある。
既存の、最近公布された法律と将来の法律は、候補製品のマーケティング許可を獲得し、それを商業化する難しさとコストを増加させ、私たちが獲得する可能性のある価格を下げるかもしれない。
米国や一部の外国司法管轄地域では、医療システムに関する立法や規制改革、提案された改革は、候補製品のマーケティング許可を阻止または延期し、承認後の活動を制限または規制し、マーケティング許可を得た任意の製品を収益的に販売する能力に影響を与える可能性がある。
例えば、2010年3月、ACAは法律に署名された。ACAは医療保険の許容性を拡大し、医療支出の増加を減少または制限し、詐欺と乱用に対する救済措置を強化し、医療保健と医療保険業界の新しい透明性要求を増加させ、医療業界に新しい税金を徴収し、追加の医療政策改革を実施することを目的とした全面的な法律である。
ACAの条項の中で、私たちの潜在的な製品候補製品に非常に重要な条項は以下の通りです
72
ACAの廃止や代替のいくつかの面では、トランプ政権中の措置を含め、行政、司法、国会面の課題が存在してきた。トランプ政権は、ACAのいくつかの条項の実施を延期したり、ACAが規定しているいくつかの医療保険要件を迂回したりするための行政命令や他の指令を発表した。同時に、国会はACAの全部または一部を廃止または廃止し、代替する立法を審議した。議会はまだ立法を全面的に廃止していないが、ACAのいくつかの条項を改正し、例えば2019年1月1日以来、ACA個人が医療保険の購入を許可していないという処罰を取り消し、ACAに規定されているいくつかの費用の実施を廃止し、連邦医療保険Dの一部に参加する製薬メーカーが不足している販売時点割引を増加させた。2020年11月、米国最高裁は米国第5巡回控訴裁判所の判決について口頭弁論を行い、個人ライセンスは違憲と判断した。2021年2月10日、バイデン政府はACA打倒への連邦政府の支持を撤回した。2021年6月、米国最高裁はこの事件を再審に戻し、法的地位の欠如を理由にこの事件を却下するよう指示した。しかし、米国最高裁判所は個人権限の有効性という最終的な問題について裁決を下していない。したがって、個人の権限や挑戦、腐敗防止条約に挑戦したり、廃止したり、代替する他の努力があるかもしれない。米国最高裁の裁決,その他のこのような訴訟,現大統領政府の医療改革措置がACAや我々の業務にどのように影響するかは不明である。
さらに、ACAが公布されて以来、他の立法改正も提案され、採択された。2011年8月2日、赤字削減合同特別委員会を設立し、国会に支出削減提案を提案することを含む“2011年予算制御法案”が法律に署名された。合同特別委員会は的確な赤字削減を実現せず、立法をいくつかの政府プロジェクトに自動的に減少させた。これらの変化には、2013年から提供者に支払われる医療保険総金額を前期ごとに2%削減することが含まれており、その後の法規改正により、これらの削減は2030年まで有効となるが、新冠肺炎の大流行により、国会が追加行動しない限り、2020年5月1日から2021年12月31日まで支払いを停止することが含まれている。2013年1月、“2012年米国納税者救済法”が署名され、いくつかの医療サービス提供者に支払う連邦医療保険を減らし、政府が提供者に多額の支払いを取り戻す訴訟時効が3年から5年に延長された。このような法律は医療保険と他の医療資金のさらなる減少を招くかもしれない。
そのほか、政府は最近薬品メーカーがその上場製品の価格設定の方式に対して更に厳格な審査を行い、国会が数回の調査を行い、そして連邦と州立法を提出し、製品定価の透明性を高め、定価とメーカー患者計画との関係を審査し、政府の薬品に対する計画精算方法を改革することを提出し、公布した。連邦レベルでは、前大統領政府はいくつかの手段を用いて、連邦予算提案、行政命令と政策措置を含む薬品定価改革を提出或いは実施した。現大統領政府はまた薬品の価格設定に集中している。例えば、2021年9月9日、バイデン政府は、連邦医療保険交渉価格の許可および価格上昇の抑制、サプライチェーンの強化、生体模倣薬および模倣薬の促進、および価格透明性の向上を含む処方薬価格を低下させるための範囲の広い政策提案リストを公表した。これらの取り組みは最近ピークに達し、2022年8月に“インフレ低減法案”(IRA)が公布され、米国衛生·公衆サービス部(HHS)は、CMSが連邦医療保険B部分とD部分で精算されたいくつかの薬物や生物製品の価格について交渉することを許可する。IRAの交渉計画は、少なくとも7年(生物製品は11年)の高支出単一由来薬の承認、その他の交渉選択基準に適用される。交渉計画の法定免除は、孤児薬剤名のみであり、その名称範囲内の1つ以上の適応のための薬剤のみが承認される。2023年8月29日に発表された第1回選定薬物の交渉価格は2026年に発効し、法律で決定された最高価格を上限とする。アイルランド共和軍はまた、インフレ率よりも高い速度で連邦医療保険B部分とD部分の薬品価格を向上させた製薬業者を処罰した。また,2025年から受益者の最高自己負担コストを大幅に低減することにより,メーカーに新たに設立されたメーカー割引計画により,D一部参加者ブランド薬物処方コストの10%を自己払い最高限度額を下回り,自己最高限度額に達すると20%補助することを求め,連邦医療保険D部分下の“ドーナツ穴”を解消した。アイルランド共和軍は衛生·公衆サービス部長官が最初の数年に規制ではなく指導によってその多くの規定を実施することを許可した。IRAを守らないメーカーは民事罰金を含めて様々な処罰を受ける可能性がある。アイルランド共和軍はまた、ACA市場で医療保険を購入した個人に2025年まで強化された補助金を提供する。アイルランド共和軍の薬物交渉条項は現在法的挑戦を受けているにもかかわらず、これらのアイルランド共和軍条項は2023年から徐々に施行されるだろう。また、政務司長
73
HHSは最近3種類の新しい定価効率モードをテストすることを提案し、その中の1つのモードはFDAと協議し、承認された薬物開発支払い方法を加速するために、適時に検証性試験を完成し、そして発売後の安全性と有効性データの獲得を改善することを奨励し、臨床治療効果が確認されていない薬物への医療保険の支出を減少することを目標としている。さらに、州レベルでは、各州は、価格、精算、割引、製品参入およびマーケティングを制限すること、薬品の価格とコスト開示と透明性要件を規定すること、他の国からの輸入を許可すること、および大量購入を奨励することを含む、立法および実施を通じて薬品および生物製品の価格設定を制御するための条例をますます多く制定し、実施している。
将来的には、現在の薬品の価格設定や精算構造の重大な追加改革、特に大統領政府が変化すれば、より多くの州と連邦医療改革措置が取られることが予想される。現在と未来の改革措置は、より厳しいカバー基準をもたらし、私たちが承認された任意の製品の価格に追加的な下振れ圧力をもたらす可能性がある。コスト抑制措置や他の医療改革を実施することは、私たちの収入の創出、利益の実現、あるいは私たちの製品の商業化を阻止するかもしれない。
承認後の要求を拡大し、医薬品の販売や販売促進活動を制限するための立法·規制提案がなされている。私たちは、より多くの立法変化が公布されるかどうか、またはFDAの法規、ガイドライン、または解釈が変わるかどうか、またはこれらの変化が私たちの候補製品のマーケティング許可にどのような影響を与える可能性があるかどうかを決定することはできない。また、米国議会のFDA承認過程に対するより厳格な審査は、上場許可を著しく延期または阻止し、より厳しい製品ラベルと上場後のテストとその他の要求の影響を受ける可能性がある。
米国以外の政府は厳しい価格制御を実施する傾向があり、これがあれば私たちの収入に悪影響を及ぼす可能性がある。
一部の国では、カナダといくつかのEU加盟国を含め、処方薬の価格設定は政府によって統制されている。これらの国では、製品のマーケティング許可を受けた後、政府当局と価格交渉を行うのにかなりの時間がかかるかもしれない。一部の国で精算或いは定価の承認を得るためには、私たちの候補製品のコスト効果を他の利用可能な治療法と比較する臨床試験を行う必要があるかもしれない。もし私たちの製品が精算を受けられない場合、あるいは範囲や金額が制限されている場合、あるいは定価レベルが満足できなければ、私たちの業務は損害を受ける可能性があります。政治、経済、規制面の事態は定価交渉をさらに複雑化させる可能性があり、補償を受けた後、定価交渉が継続される可能性がある。EUの各加盟国が使用する参考価格と、低価格と高価な加盟国の間の裁定のような平行貿易は、価格をさらに下げることができる。薬品に対して価格規制や精算制限を実施することが保証されていない国は、これらの国で承認されれば、任意の製品に対して有利な精算と定価手配を許可する。第三者支払者または主管当局が割引を公表することは、公布国または他の国の価格または補償レベルにさらなる圧力を与える可能性がある。
私たちが将来所有する可能性のある任意の国際業務を管理する法律法規は、米国以外でいくつかの候補製品や製品を開発、製造、販売することを阻止し、コストの高いコンプライアンス計画の開発と実施を要求するかもしれない。
私たちの業務をアメリカ以外の地域に拡張すれば、私たちは各管轄区域で事業を展開することを計画している多くの法律と法規を遵守するために追加の資源を投入しなければならない。反海外腐敗法(FCPA)は、個人または企業が業務を獲得または保持するのを助けるために、任意の米国人または企業およびその政党代理人が、任意の外国人官僚、政党または候補者に直接的または間接的に支払い、提供、許可支払い、または任意の価値のあるものを提供することを禁止している。“海外腐敗防止法”はまた、米国に上場する証券会社にある会計条項を遵守することを要求し、これらの条項は、会社(国際子会社を含む)のすべての取引の帳簿と記録を正確かつ公平に反映し、国際業務のために適切な内部会計制御システムを設計し、維持することを要求する。
“反海外腐敗法”を遵守することは高価で困難であり、特に腐敗は公認問題である国である。また、海外腐敗防止法は多くの場合、製薬業に特別な挑戦をもたらしている
74
一部の国では、病院は政府が運営しており、医師や他の病院従業員は外国人官僚とされている。
様々な法律、法規、および行政命令はまた、米国国外での使用および伝播を制限するか、または国家セキュリティ目的のために秘密にされた情報と、特定の製品およびこれらの製品に関連する技術データとを特定の非米国国民と共有する。私たちはまた、輸出規制に関する米国の法律法規と、特定の国と個人に対する経済制裁と禁輸を受けている。もし私たちがアメリカ以外での業務を拡大すれば、これらの法律を遵守するためにもっと多くの資源を投入する必要があります。これらの法律は、私たちがアメリカ以外でいくつかの候補製品や製品を開発、製造、または販売することを阻止するかもしれません。これは、私たちの成長潜在力を制限し、私たちの開発コストを増加させるかもしれません。
国際ビジネス慣行に関する法律を遵守しなければ、重大な民事·刑事罰を受け、政府契約の資格を一時停止または廃止する可能性がある。米国証券取引委員会(Securities and Exchange Commission,略称米国証券取引委員会)も、発行者が“反海外腐敗法”の会計条項に違反したため、発行者の米国取引所での証券取引を一時停止または禁止する可能性がある。
もし私たちが環境、健康、安全の法律法規を守らなければ、罰金や処罰を受けたり、私たちの業務を損なう可能性のあるコストが発生するかもしれません。
私たちと私たちの第三者請負業者は、実験室手続きおよび危険材料および廃棄物の処理、使用、貯蔵、処理、および処理を管理する法律法規を含む、多くの外国、連邦、州、地方環境、健康および安全法律法規の制約を受けている。私たちの行動は化学物質と生物学的材料を含む危険で燃えやすい材料の使用に関するものだ。私たちの業務はまた危険な廃棄物製品を発生させるだろう。私たちは一般的に第三者と契約を結び、このような材料と廃棄物を処理する。私たちはこのような材料が汚染や傷害をもたらす危険を除去することができない。もし私たちが危険な材料を使用して汚染や損傷をもたらしたら、私たちはそれによるいかなる損害に責任を負うかもしれません。どんな責任も私たちの資源を超えて、任意の利用可能な保険を含むかもしれません。私たちはまた私たちの商業オフィスで発生する可能性のある意外な安全事件に責任を負うことを要求されるかもしれない。
しかも、いくつかの法律や法規によると、私たちの不動産賃貸と運営は私たちに責任を負わせるかもしれない。米国の既存の環境法律や法規によると,危険物質を処分する不動産や実体の現または前任所有者や経営者は,危険物質漏洩による汚染を調査または救済する費用を厳格,連帯,個別に負担することが要求される可能性があり,知らなくても危険物質漏洩に責任を負わない。
私たちは、民事または刑事罰金と処罰、財産損失および人身傷害クレーム、私たちの施設のアップグレード、または私たちの操作手順の変更または制限、または私たちの運営の禁止に関連するコストを含む、このような法律および法規を遵守できないことによって重大なコストと責任を招く可能性があります。
従業員の負傷により発生する可能性のあるコストと費用を支払うために責任保険を維持していますが、潜在的な責任に十分な保険を提供できない可能性があります。私たちは私たちが生物、危険または放射性物質を貯蔵したり処分したりすることによって、私たちが提起した環境責任や有毒侵害に対して保険を維持することはできません。
また、現在または未来の環境、健康、安全法律法規を遵守するためには、巨額のコストが生じる可能性がある。これらの現行または未来の法律法規はますます厳しくなっており、私たちの研究、開発、あるいは生産努力を損なう可能性がある。私たちがこのような法律を守らないことはまた巨額の罰金、処罰、または他の制裁につながるかもしれない。
私たちはアメリカと外国のいくつかの反腐敗、反マネーロンダリング、輸出規制、制裁、その他の貿易法律法規の制約を受けている。私たちは違反によって深刻な結果に直面するかもしれない。
米国および外国の反腐敗、反マネーロンダリング、輸出規制、制裁および他の貿易法律法規は、会社およびその従業員、代理人、CRO、CMO、法律顧問、会計士、コンサルタント、請負業者および他のパートナーの許可、約束、提供、公的または民間部門の受取人の腐敗または不当な支払い、または任意の他の価値のあるものを請求、または直接または間接的に受け入れることを禁止する。これらの法律に違反すると巨額の刑事罰金や民事罰につながる可能性があります
75
禁固、貿易特権の喪失、除名、税務再評価、契約違反と詐欺訴訟、名誉損害、その他の結果。私たちは政府機関や政府付属病院、大学、その他の組織の役人や従業員と直接または間接的な相互作用を持っている。私たちはまた、時間が経つにつれて、アメリカ以外での私たちの活動が増加すると予想している。我々は、第三者に依存した研究、臨床前研究および臨床試験、および/または必要な許可、ライセンス、特許登録、および他のマーケティング許可を得ることが予想される。私たちは、私たちがそのような活動を明確に許可していなくても、私たちの人員、代理、またはパートナーの腐敗や他の不法活動に責任を負うことを要求されるかもしれない。
上記の法律および条例に違反するいかなる行為も、重大な民事と刑事罰金と処罰、監禁、輸出入特権の喪失、資格取り消し、税額の再評価、契約違反および詐欺訴訟、名誉損害、およびその他の結果を招く可能性がある。
我々は現在の候補製品を開発しており,将来の候補製品の開発を継続し,他の療法と組み合わせることが可能であり,追加のリスクに直面するであろう。
現在承認されている1つ以上の癌療法や開発中の治療法に合わせて現在の候補製品を開発している。他の既存療法と併用するために、現在または将来の任意の候補製品がマーケティング許可または商業化されていても、FDAまたは同様の外国規制機関が、私たちの任意の候補製品との併用療法の承認を取り消す可能性があるか、またはこれらの既存療法が安全性、有効性、製造、または供給の問題になる可能性があるというリスクに直面するであろう。また,我々の候補製品の使用が承認された既存の療法自体も,寵愛を失ったり,より遅い治療経路に降格されたりする可能性がある。これは私たちの候補製品または私たち自身の製品のための他の組み合わせ療法を決定する必要があるかもしれません。これらの製品は市場から撤退されるか、または商業的にはあまり成功しません。
我々はまた、FDAまたは同様の外国規制機関が発売されていない1つまたは複数の他の癌療法を組み合わせて、現在の候補製品を評価することも可能である。私たちは、どんな候補製品も、最終的にマーケティング許可を得ていない任意の許可されていない癌療法と組み合わせてマーケティングおよび販売を行うことができない。
FDAまたは同様の外国の規制機関がこれらの他の療法の承認を承認または撤回していない場合、または私たちが現在または将来の候補製品に関連して評価する療法を選択した場合、安全性、有効性、商業採用、製造、または供給の問題が生じた場合、私たちは、私たちが開発した現在または未来の候補製品のいずれか1つまたはすべての承認または成功したマーケティングを得ることができないかもしれない。さらに、現在または将来の候補製品と組み合わせて使用されている療法または開発中の療法の第三者プロバイダが、臨床試験のために十分な数の薬剤を生産できない場合、または現在または将来の候補製品を商業化するか、または併用療法のコストが懸念されるほど高い場合、私たちの開発および商業化努力は損なわれ、これは、私たちの業務、財務状態、運営結果、および成長の見通しに悪影響を及ぼすであろう。
会社として、私たちはこれまで候補製品を商業化したことがなく、現在は全面的、全員の専門知識、人員と資源が不足しており、単独あるいは適切なパートナーと一緒に任意の製品の商業化に成功することはできない。
会社として、私たちは候補製品を商業化したことがない。私たちは私たちの候補製品に関連するいくつかの権利を協力者に許可し、これらの協力者の助けと指導に依存するかもしれない。私たちが商業化権利とマーケティング許可を保持する候補製品については、私たちは自分の販売、マーケティング、市場参入、商業計画、供給組織を制定するか、またはこれらの活動を第三者にアウトソーシングしなければならない。私たちはマーケティング許可を確保し、私たちの製品をアメリカ以外で商業化するための協力を探すことを計画しています。私たちはどんな協力も会社に短期的または長期的な利益をもたらすという保証はない。
承認されれば、私たちの候補製品の自己商業化に影響を与える可能性のある要素は、十分な数の有効な販売、マーケティング、市場参入者の募集と保持、十分な教育およびマーケティング計画を策定し、作成して、私たちが承認した候補製品に対する大衆の受容度を向上させ、私たちの会社、販売促進分野のすべての通信および材料、医療保健法の適用下の従業員および第三者が法規を遵守し、独立した販売およびマーケティング組織の作成に関連する他の予見できないコストを確保することを含む。販売とマーケティングを発展させる組織は
76
価格が高くて時間がかかり、私たちの候補製品が承認された後に発売されることを延期するかもしれません。私たちは効果的な販売とマーケティング組織を作ることができないかもしれない。あるいは、私たちが直接販売チームと構築された流通システムを持つ第三者と協力することを選択すれば、世界的にも地域ごとに基づいて、私たち自身の販売チームと流通システムを強化するか、または私たち自身の販売チームや流通システムの代わりに、これらの第三者と提案された協力について交渉して合意することを要求され、このような配置は、私たち自身が製品を商業化する利益よりも低いことが証明されるかもしれない。もし私たちが自分の流通やマーケティング能力を確立できない場合、あるいは適切なパートナーを見つけて私たちの候補製品を商業化することができなければ、私たちはこれらの製品から収入を得ることができず、利益を達成したり維持することもできないかもしれない。
私たちの第三者への依存に関するリスクは
著者らは引き続き第三者に依存して臨床試験を行い、著者らのいくつかの研究と潜在的な臨床前研究を実行するつもりである。これらの第三者がその契約義務を満足に履行できず、適用された法規要件を遵守できなかった場合、または予期された期限内に完了できなかった場合、私たちの開発計画は延期されたり、コストが増加したりする可能性があり、またはマーケティング許可を得ることができない可能性があり、いずれも、私たちの業務、財務状況、運営結果、および見通しに悪影響を及ぼす可能性がある。
私たちは臨床試験のすべての側面を自分で独立して行うことができない。したがって,我々は第三者に依存して我々が行っているおよび計画中のtovorafenibとpimasertib臨床試験,および任意の将来の候補製品の臨床前研究と臨床試験を行う。したがって,これらの実験の起動と完了時間はこれらの第三者によって部分的に制御され,我々の開発計画が遅延する可能性がある.これらの第三者部分はこれらの実験の進展を制御しているため,これらの実験に関するデータを取得または承認せずに公表することも可能である.具体的には,CRO,独立した臨床調査者,コンサルタントがこれらの試験の進行とその後のデータ収集と分析に重要な役割を果たすことが予想される。例えば,Dana Farber癌研究所がPNOCと協力して行った一期臨床試験のほか,小児腫瘍学グループは,国立癌研究所が支援する臨床試験グループであり,世界最大の小児や青少年癌研究に特化した組織でもあり,トボルトが再発性ランゲルハンス細胞組織細胞増殖症を治療するグループ範囲の臨床試験を開発している。しかし、このような調査者たち、CRO、そして他の第三者は私たちの従業員ではなく、私たちは彼らの活動のすべての側面を制御することができない。しかし、私たちはすべての臨床試験が適用された方案と法律、法規と科学基準に従って行われることを保証する責任があり、私たちの研究者、CROと他の第三者への依存は私たちの監督責任を免除しない。我々と我々のCROはGCP要求の遵守が求められており,これらの要求はFDAが臨床開発において候補製品に対して実行する法規とガイドラインである。監督管理機関は定期的に試験スポンサー、臨床試験研究者、臨床試験地点を検査することによって、これらのGCP要求を実行する。もし私たちまたは私たちの任意のCROまたは臨床試験サイトが適用されたGCP要求を遵守できなかった場合、私たちの臨床試験で生成されたデータは信頼できないと考えられる可能性があり、FDAは私たちのマーケティング申請を承認する前に追加の臨床試験を行うことを要求するかもしれない。検査後,FDAはわれわれの臨床試験がGCPに適合していることを確認することは保証できない。また,われわれの臨床試験はcGMP法規により生産された候補製品を用いて行わなければならない。私たちの失敗または私たちが依存している第三者がこれらの規定を遵守できなかった場合、マーケティング許可プロセスを延期する臨床試験を停止および/または繰り返す必要があるかもしれません。
私たちが依存しているどのようなCRO、臨床試験研究者、または他の第三者が、私たちの開発活動に十分な時間および資源を投入するか、または契約の要求に従ってタスクを実行することは保証されない。さらに、これらの第三者はサプライチェーンやインフレ圧力の影響を受ける可能性があり、これらの圧力は彼らが予想されるスケジュールを達成する能力を制限し、あるいは私たちにより大きなコストをもたらす。例えば,臨床前研究に利用可能な非ヒト霊長類の不足は,現在の業務に影響を与えないことが予想されるが,新たな製品開発計画を開始すれば,より長い開発時間や必要な研究を達成することが困難になる可能性があることを認識した。これらの第三者のいずれかが予想される期限内に完了できなかった場合、私たちの臨床計画を遵守し、または法規の要件を満たし、基準を満たさない方法で私たちとの契約を実行または終了した場合、私たちの開発計画のスケジュールは延長または延期される可能性があり、または私たちの開発活動は一時停止または終了する可能性があります。われわれの臨床試験サイトが何らかの理由で終了した場合,これらの対象を別の合格した臨床試験サイトに移すことができない限り,このような臨床試験に関与している被験者の後続情報を失う可能性がある。
77
さらに、可能な研究者が支援する試験については、これらの試験の設計または実施を制御することはなく、FDAは、試験設計または実行の要素、安全問題、または他の試験結果を含むいずれか1つまたは複数の理由で、これらの研究者が後援する試験は、将来の臨床試験または市場承認に十分な支援を提供すると考えられ、我々によっても第三者によって制御されても、これらの研究者が支援する試験は、将来の臨床試験または市場承認に十分な支援を提供すると考えられる。私たちは、調査員が支援する実験に関するいくつかの情報権を提供してくれることを期待しており、調査員によって支援された実験によって生成されたデータにアクセスし、参考にすることができ、私たち自身が提出した規制材料を含む。しかし,研究者が試験のデータを賛助する時間や報告を制御することはなく,研究者が試験を支援するデータを持つこともない。研究者が後援した試験結果を確認したり複製したりできなければ,陰性結果が得られれば,さらなる臨床開発をさらに延期または阻止する可能性がある。また,研究者や機関が候補製品の臨床開発における義務に違反している場合,あるいは我々が得られる可能性のある第1次知識と比較してデータが不十分であることが証明された場合,我々自身が任意の将来の臨床試験を設計·行う能力が悪影響を受ける可能性がある。われわれ自身が設計した臨床試験と比較して,より実現が困難な臨床終点を有する臨床試験を設計したり,臨床試験結果が陰性となるリスクを他の方法で増加させたりする可能性がある。研究者が後援する臨床試験の負の結果は、候補製品のマーケティング許可を得るための私たちの努力と、私たちの候補製品に対する大衆の見方に実質的な悪影響を及ぼすかもしれない。さらに、FDAは、これらの研究者が後援する試験によって生じる臨床前、生産または臨床データの参照権利の十分性、またはこれらの研究者が後援する試験の臨床前、生産または臨床データの説明に同意しない可能性がある。もしそうであれば,FDAは追加の臨床前,生産,または臨床データを取得して提出することを要求するかもしれない。
さらに、これらの第三者は他のエンティティと関係がある可能性もあり、その中のいくつかは私たちの競争相手である可能性があり、彼らはまた、これらの競争相手のための臨床試験または私たちの競争地位を損なう可能性のある他の薬品開発活動を行っているかもしれない。これらの第三者が規制要件または私たちが宣言した規程に従ってその契約義務を成功裏に履行し、予想される期間内に私たちの臨床試験を完了または実施できなかった場合、私たちはtovorafenib、pimasertib、または任意の将来の候補製品のマーケティング許可を得ることができないか、または遅延する可能性があり、私たちの製品の商業化の成功を遅らせることができないか、または遅延する可能性がある。
Tovorafenibのような私たちの候補製品を含む製薬製品の生産は複雑だ。私たちの第三者製造業者は生産中に困難に直面する可能性があり、これは、(承認された場合)臨床試験または商業販売のための私たちの候補製品の供給を延期または完全に停止する能力があるかもしれない。
私たちは何の生産施設もなく、現在私たちは中国のいくつかの第三者メーカーと契約を締結している。私たちは依存し、規制申請の提出を支援し、商業製造のために、臨床試験、製品開発目的のために、第三者に当社の候補製品を生産し続けることが予想されます(任意の候補製品がマーケティング許可を得た場合)。また,分析実験室と契約を結び,我々の候補製品の放行と安定性テストを行いたい。このような第三者への依存は、許容可能なコストまたは品質で十分な数の候補製品または製品またはそのような数を得ることができないリスクを増加させ、これは、私たちの開発または商業化努力を延期、阻止または損害し、孤児薬物指定を含むFDAに特定の指定を撤回させる可能性がある。例えば、地政学的不確実性や公衆衛生流行病(例えば、新冠肺炎流行)によるサプライチェーン問題が、私たちの候補製品を開発するのに十分な供給を得る能力にどの程度影響を与える可能性があるかどうかを決定することはできませんし、生産減少や中断、生産コストの増加、またはサプライチェーンにおける他の中断を含む、地域の施設や業務に与える可能性のある影響が存在するかどうかは決定できません。また、生産の中断や私たちのメーカー、特に中国のメーカーは、自然災害でも他の理由でも、私たちのニーズを満たすのに十分な数を生産することができず、私たちの日常業務運営能力と候補製品を開発し続ける能力を損なう可能性があります。また、これらのメーカーが中国に位置しているため、米国や中国政府の政策が変化し、中国の政治的動揺や経済状況が不安定であれば、製品供給の中断やコスト増加の可能性に直面する。これらの事項のいずれも、私たちの業務、財務状況、および経営結果に重大な悪影響を及ぼす可能性がある。しかも、物流経路と輸送能力の中断は私たちのサプライチェーンを混乱させるかもしれない。そして、時間が経つにつれて、私たちの需要が予期せぬ急増を見せたら、必要な供給を使い果たしてしまう可能性があります。
78
Quitientとtovorafenib薬の生産·供給協定を締結し,シャープ社(Sharp Corporation)と包装·シリーズ化tovorafenibを締結した。サプライチェーン問題、例えばある包装材料に関する問題は、効率的な管理を行わなければ、候補製品を包装·納入する能力に悪影響を及ぼす可能性がある。さらに、私たちの既存または将来の任意の契約製造業者やサプライヤーが満足に表現できなければ、候補薬剤の開発や規制承認を延期したり、私たちの薬物の商業化を延期したりする可能性があり、これは私たちの運営や業務結果に悪影響を及ぼす可能性がある。
私たちは第三者製造業者やサプライヤーと他の合意に到達できないかもしれないし、割引条項でそうすることができないかもしれない。限られた数の第三者製造業者やサプライヤーへの依存は、以下のリスクに直面することが予想されます
第三者メーカーは、cGMP法規や米国以外の類似した法規要件を遵守できない可能性がある。FDAが、我々のCMOがFDAの法律および法規に適合していないと判断した場合、cGMPを管理する法律および法規を含む場合、FDAは欠陥が是正されるまでNDAを承認しない可能性があり、または申請中の製造業者を要求に適合する製造業者に置き換える。さらに、私たちまたは私たちの第三者製造業者とサプライヤーが適用された法規を遵守できなかったことは、臨床隔離、罰金、禁止、民事処罰、候補製品または製品の差し押さえまたはリコール、運営制限、および刑事起訴を含む制裁を実施する可能性があり、いずれも私たちの製品供給に重大な悪影響を及ぼす可能性があります。また、承認された製品およびその製造施設は、品質管理および製造プロセスがcGMP要件に適合することを確保することを含む、FDAの広範な要求および他の類似機関の要求に継続的に適合しなければならない。したがって,我々のCMOはcGMPの要求に適合するかどうかを評価するために継続的な審査と定期的な検査を受ける.また,我々のCMOの運営には日常的な制御がないにもかかわらず,cGMPを含めて適用される法律や法規の遵守を確保する責任がある。
さらに、私たちの第三者製造業者と供給者は、廃棄物製品を管理、使用、貯蔵、処理、処分する法律法規を含む多くの環境、健康、安全な法律法規の制約を受けており、これらの法律法規を遵守しなければ、このような第三者の民事または刑事罰金および処罰に関連する巨額のコストをもたらす可能性がある。将来的にこれらの第三者に対して取られる可能性のある規制行動の深刻さに基づいて、私たちの臨床または商業薬品供給および包装および他のサービスは中断または制限される可能性があり、これは私たちの業務を損なう可能性がある。
私たちの候補製品と私たちが開発する可能性のあるどの製品も他の候補製品や製品と製造施設を競争する可能性があります。したがって、私たちはこのような施設を優先的に使用することができないかもしれないし、全く使用できないかもしれない。CGMP法規の下で運営されているメーカーの数は限られており、私たちのために製品を製造する能力があるかもしれない。
後期臨床試験と潜在的な商業化に備えて、候補製品の生産規模を増加させる措置が必要である。私たちはまだ生産過程のいずれも拡大していません
79
私たちの製品はtovorafenibに加えて、私たちの任意の候補製品の将来の供給需要を支援するために、さらに規模を拡大する必要があるかもしれません。第三者製造業者は、私たちの任意の候補製品の製造能力をタイムリーにまたは費用効果的に向上させることに成功できないかもしれない、または全くできないかもしれない。また、規模の拡大や商業活動の間に品質の問題が発生する可能性がある。例えば、私たちの候補製品または私たちの候補製品を製造する製造施設において微生物、ウイルス、または他の汚染が発見された場合、そのような製造施設は、汚染を調査および修復するために長い間閉鎖される必要があるかもしれない。
私たちの既存または未来のメーカーのどんな業績ミスも、臨床開発やマーケティング許可を延期する可能性があります。私たちは現在大量の麻薬物質のための余分な供給や二番目の供給源の手配を提供していない。現在臨床試験に用いられているCMOが約束どおりに実行できなければ,このようなCMOを交換する必要があるかもしれない。いくつかの潜在的な代替メーカーが私たちの候補製品を生産できると考えているにもかかわらず、任意のそのような代替製造業者を決定し、同定したり、任意の代替製造業者と合意することができる場合には、追加のコストおよび遅延が生じる可能性がある。さらに、私たちの第三者メーカーは、資源制限や自然災害、労使紛争、不安定な政治環境または公衆衛生流行病(例えば、新冠肺炎)によって製造や輸送困難に遭遇する可能性がある。もし私たちの現在の第三者製造業者が合意通りに履行できなければ、私たちはこれらのメーカーの交換を要求されるかもしれません。私たちは彼らをタイムリーにあるいは交換できないかもしれません。
私たちの現在と未来の他人が私たちの候補製品や製品を生産することへの依存は、私たちの将来の利益率と、私たちが適時かつ競争力を持ってマーケティング許可を得る製品の商業化能力に悪影響を及ぼす可能性があると予想しています。
私たちは限られた数量のサプライヤーに原材料を提供することに依存して、私たちの独占的なサプライヤーによるいかなる中断も私たちの臨床試験の遅延を招く可能性があり、あるいは他の方法で私たちの業務と運営結果に悪影響を与える可能性がある。
私たちは限られた数量のサプライヤーに依存していて、その中のいくつかは私たちのある材料の唯一の源であり、いくつかのサプライヤーは外国司法管轄区に位置している。私たちの数少ないサプライヤーは、サプライヤーの能力制限、コンポーネントの可用性、価格上昇、タイムリーな納品、コンポーネントの品質、キーサプライヤーが経営を継続できず、市場状況に応じて調整できなかったリスクを含む多くの追加的なリスクに関連しており、インフレと金利変化、グローバル銀行システムの潜在的な不安定、連邦債務上限と予算の不確定性、およびそれに関連する潜在的な政府閉鎖、自然災害、火災、テロ行為、流行病、例えば新冠肺炎の大流行またはその他の悲劇的な事件を含む。また、独占サプライヤーの材料がある場合、任意の原材料や他の材料の代わりに代替案を用いることができても、この代替案はコストが高く、生産量が低い、あるいは私たちの目的に合わない可能性があります。しかも、私たちが製品候補を製造するために使用するいくつかの材料は複雑な材料であり、代替がもっと難しいかもしれない。したがって、当社の独占サプライヤーによるいかなる中断も遅延や追加的な規制提出を招く可能性があり、これは私たちの業務や運営結果に悪影響を及ぼす可能性があります。
私たちは私たちの候補製品を開発して商業化するために第三者と協力するかもしれない。もしこのような協力が成功しなければ、私たちはこの候補製品の市場潜在力を利用できないかもしれない。
私たちは選定に基づいて私たちのいくつかの候補製品の開発と商業化のために第三者パートナーを探すかもしれない。今まで、私たちは何の協力も達成していない。私たちの将来の任意の協力パートナーには、大中型製薬会社、地域的、全国的な製薬会社、バイオテクノロジー会社が含まれる可能性がある。私たちは適切な協力者を探すことで激しい競争に直面している。私たちが未来の協力について最終的な合意に到達できるかどうかは、他に加えて、未来のパートナーの資源と専門知識の評価、提案協力の条項と条件、提案パートナーの多くの要素の評価にかかっている。
もし私たちがどの第三者ともこのような計画を達成すれば、私たちの将来のパートナーが私たちの候補製品の開発または商業化に投入する資源の数と時間を限られた制御を行う可能性が高い。私たちがこれらの計画から収入を作る能力は、私たちの未来の協力者がこれらの計画の中で彼らに割り当てられた機能を成功的に履行する能力と努力にかかっているだろう。
80
私たちの候補製品に関連する未来のパートナーとの協力は、以下の点を含む多くのリスクをもたらすだろう
私たちが1つまたは複数の協力関係を構築する場合、本明細書で説明される製品開発、マーケティング許可、および商業化に関連するすべてのリスクは、そのような任意の将来のパートナーの活動にも適用されるであろう。
従業員の事務と私たちの運営に関するリスク
私たちの未来の成功は私たちが幹部と肝心な従業員を維持する能力、及び合格者を吸引、維持と激励及び私たちの人力資本を管理する能力に依存する。
私たちが競争の激しい生物技術と製薬業界の中で競争できるかどうかは、私たちが高い素質の管理、科学、医療と商業人員を誘致、激励と維持できるかどうかにかかっている。私たちは最高経営責任者Jeremy Bender博士と研究開発担当Samuel Blackman博士及び私たちの管理チームの他のメンバー、その他の肝心な従業員と顧問の開発と管理専門知識に高度に依存している。私たちは今重要な人員を維持していません
81
この人たちに保険を提供します。私たちは私たちの幹部と雇用協定を締結したが、彼らの誰もが私たちとの雇用関係をいつでも終わらせることができる。
近年、私たちの産業は高い流出率を経験している。競争の激しい製薬業における競争の能力は私たちが科学、臨床、監督、製造、商業と管理技能と経験を持つ高い技能と経験者の能力を吸引、維持と激励することに依存する。
著者らは主に旧金山湾区で業務を展開し、この地区には他の製薬会社及び多くの学術と研究機関があり、合格人材に対する激しい競争を招いた。薬企業間の限られた数量の合格人材に対する激しい競争のため、私たちは未来に合格した人材を引き付けることができないかもしれない。私たちと競争している多くの他の製薬会社はより多くの財務と他の資源、異なるリスク状況、そして私たちよりも長い業界の歴史を持っている。私たちの競争相手は、より高い報酬、より多様な機会、および/またはより良い職業昇進の機会を提供するかもしれない。また、私たちの業務の変化に伴い、キーパーソンはより大きなビジネス企業のために働きたくないかもしれません。これらすべての競争要因は、私たちが高素質の人材を誘致し、維持し続ける能力を制限する可能性があり、これは、私たちの候補製品の開発と商業化に成功し、現在の想定に沿って私たちの業務と運営を発展させる能力にマイナスの影響を与えるかもしれない。私たちは採用実践の中でより大きな柔軟性を採用して、旧金山湾区以外の応募者を誘致し、採用することを目的としています。これは留任率を増加させることを目的としていますが、従業員の尊敬度に悪影響を与え、より大きな従業員流出率を招く可能性があります。
私たちは私たちの組織の規模と能力を拡大する必要があり、私たちはこのような成長を管理する時に困難に直面するかもしれない。
2023年12月31日現在、155人のフルタイム従業員がいます。私たちは、特に臨床開発、臨床運営、製造、規制、および私たちの任意の候補製品がマーケティング許可、販売、マーケティング、流通を獲得すれば、私たちの従業員の数と業務範囲が大幅に増加すると予想しています。私たちが予想している将来の成長を管理するためには、私たちの管理、運営、財務システムを継続して実施し、改善し、私たちの施設を拡大し、より多くの合格者を募集し、訓練し続けなければならない。私たちの財務資源が限られているため、私たちの管理チームは、このような成長を期待している会社や開発販売、マーケティング、流通インフラの管理における経験が限られているため、私たちの業務の拡張を効果的に管理することができず、より多くの合格者を募集し、訓練することもできないかもしれません。私たちの業務の拡張は巨大なコストを招き、私たちの管理と業務発展資源を移転する可能性があります。
さらに、私たちは現在、予測可能な未来に、主に特定の第三者契約組織、コンサルタント、およびコンサルタントに依存して、私たちの臨床試験の進行およびtovorafenib、pimasertib、または任意の未来の候補製品の製造に重大な責任を負うことを含むいくつかのサービスを提供し続けるだろう。必要に応じて、このような第三者契約組織、コンサルタント、コンサルタントのサービスがタイムリーに提供されていくか、あるいは適格な代替者を見つけることができることを保証することはできません。さらに、私たちのアウトソーシング活動を効率的に管理できない場合、または私たちのサプライヤーまたはコンサルタントが提供するサービスの品質または正確性が何らかの理由で影響を受ける場合、私たちの臨床試験は延長、延期、または終了される可能性があり、私たちはtovorafenib、pimasertib、または任意の将来の候補製品のマーケティング許可を得ることができないか、または他の方法で私たちの業務を促進することができないかもしれない。私たちは、私たちの既存のサプライヤーやコンサルタントを経済的に合理的な条件で適切に管理することができるか、または他の適任な外部サプライヤーとコンサルタントを見つけることができるか、または全くできないことを保証することはできません。
もし私たちが成長を効率的に管理し、私たちの組織を拡大することができなければ、私たちはさらなる開発と商業化tovorafenib、pimasertib、私たちの他の候補パイプライン製品、または任意の未来の候補製品に必要な任務を実行することに成功できないかもしれないので、私たちの研究、開発、商業化目標を達成できないかもしれない。
私たちの従業員、臨床試験研究者、CRO、CMO、コンサルタント、サプライヤー、および任意の潜在的な商業パートナーは、規制基準と要求を遵守しないこと、およびインサイダー取引を含む不正行為または他の不正活動に従事する可能性がある。
82
私たちは、臨床試験研究者、CRO、CMO、コンサルタント、サプライヤー、および任意の潜在的なビジネスパートナーを含む、従業員および私たちが依存する第三者の詐欺または他の不適切な行為のリスクに直面している。これらの当事者の不正行為は、(I)FDA法規または真実、完全かつ正確な情報の報告を要求する法律、(Ii)製造(例えば、cGMP)および臨床実践(例えばGCP)基準、(Iii)連邦および州の健康およびデータプライバシー、セキュリティ、詐欺および乱用、政府価格報告、透明性報告要件、ならびに米国および海外の他の医療保健法律および法規、(Iv)セクハラおよび他の職場における不適切な行為を含む、故意、無謀、および/または不注意な行為、または以下の規定に違反する不正活動を開示することを含むことができる。または(V)財務情報またはデータを実際に、完全かつ正確に報告することを要求する法律。特に、私たちの業界の研究、販売、マーケティング、ビジネス配置は、詐欺、不正行為、リベート、その他の乱用を防止するための様々な法律·法規によって制限されています。このような不正行為はまた臨床試験過程で得られた情報を不当に使用する可能性があり、これは監督部門の制裁を招き、著者らの名声に深刻な損害を与える可能性がある。
我々は、すべての従業員に適用される行動基準および開示計画および他の適用可能な政策および手順を通過したが、常に従業員の不適切な行為を識別し、阻止することができるわけではなく、このような行為を発見し、防止するための予防措置は、未知または未管理のリスクまたは損失を効果的に制御することができないか、またはこれらの法律や法規を遵守できないことによる政府の調査または他の行動または訴訟から私たちを保護することができないかもしれない。
また,第三者については,第三者が我々の従業員ではなく,我々の合意に基づいて我々に提供された救済措置に加えて,このような第三者が我々の臨床前研究や臨床試験に使用する資源を制御する能力は限られている。私たちがこれらのサービスに依存している第三者も他のエンティティと関係があるかもしれませんが、その中のいくつかは私たちの競争相手である可能性があり、彼らもこれらの実体のための薬物開発活動を行っているかもしれません。これは彼らが私たちを代表する表現に影響を与えるかもしれません。我々が第三者に依存して薬物開発活動を行うことは,研究の進行,時間,完成,およびこれらの研究によるデータの管理の直接制御が減少することを意味する。それにもかかわらず、私たちの研究と実験が適用された合意、法律と法規の要求、および科学的な基準に従って行われることを確実にする責任がある。言い換えれば、私たちの第三者への依存は私たちの規制責任を免除することができない。例えば,我々のすべての臨床試験が研究計画や関連案に従って行われており,いずれの試験もGCP基準に適合していることを確認していきたい。もし我々または我々の任意のCROまたは任意の臨床試験地点が適用されるGCP要求を遵守できなかった場合、これらの試験で生成された臨床データは信頼できないと考えられる可能性がある。これは、FDAまたは他の同様の外国の規制機関が、上場申請を承認する前に追加の臨床試験を行うことを要求する可能性がある。もし私たちが依存している任意の第三者が連邦または州の詐欺と乱用または虚偽声明法律法規または医療プライバシーと安全法または他の法律に違反した場合、私たちに訴訟を提起する可能性がある。
もし私たちの行為、私たちの従業員の行為、または第三者の行為によって私たちに訴訟が提起され、私たちは自分の弁護や私たちの権利の維持に成功できなかった場合、これらの訴訟は、連邦医療保険、医療補助および他の連邦医療計画、禁止、個人通報者が政府名義で提起した個人訴訟、禁止または拒否、政府契約、契約損害、名声損害、利益減少、将来の収益など、私たちの業務に重大な影響を与える可能性があります。追加的な誠実な報告書と監督義務、および私たちの業務の削減または再編は、いずれも、私たちの業務運営能力および私たちの運営結果に悪影響を及ぼす可能性があります。
さらに、我々が依存する第三者は、適用される規制要件の違反により、FDAまたは他の同様の外国規制機関によって資格取り消し、取り締まり、停職、または他の方法で処罰される可能性があり、この場合、代替者を招聘する必要がある可能性があり、そのような請負業者が提供するデータの一部または全部を使用してマーケティングアプリケーションを支援することができない可能性がある。
83
もし私たちのセキュリティ対策が破壊された場合、または私たちの情報技術システムまたは私たちのCRO、CMO、サプライヤー、請負業者、コンサルタント、または他の第三者パートナーの情報技術システムに障害が発生したり、セキュリティホール、ネットワーク攻撃、データ損失または漏洩、または他の中断を受けたりすることは、私たちの開発計画に重大な中断をもたらし、私たちの業務または他の個人情報に関連する敏感な情報を危険にさらしたり、重要な情報へのアクセスを阻止したりすることで、私たちの責任を負い、私たちの名声を損なう、あるいは他の方法で私たちの業務に悪影響を及ぼす可能性があります。
通常のビジネスプロセスでは、独自、機密および敏感な情報(知的財産権、商業秘密、固有商業情報、個人情報、および保護された健康情報またはPHIを含むが、これらに限定されない)を収集、処理、記憶および送信することができる。重要なのは、私たちはこのような情報の機密性、完全性、そして利用可能性を維持するために、安全な方法でそうしなければならないということだ。我々の業務の重要な構成要素は、情報技術および電気通信システムに依存しており、我々は、人的資源、財務報告および制御、顧客関係管理、コンプライアンス、および他のインフラ業務を処理するシステムなど、幅広いビジネスプロセスおよび機能分野に影響を与えるいくつかの企業ソフトウェアシステムを実装し、拡大することが予想される。私たちは、アクセス権限を失うリスク、不適切な使用または開示、不適切な修正、および重要な情報の制御を十分に監視、監査、修正できないリスクを含む、これらの重要な情報の保護に関連する多くのリスクに直面している。このようなリスクは、私たちの重要なビジネスシステムを操作し、機密、独自、および敏感な情報を処理するために、複数の第三者に依存しているので、私たちと協力する第三者に延びている。
セキュリティ対策が実施されているにもかかわらず、私たちの内部情報技術システムおよび当社のCRO、CMO、サプライヤー、請負業者、コンサルタント、および他の第三者パートナーが維持する独自、敏感かつ機密情報の規模、複雑さ、および数が増加しているため、私たちは、故障、サービス中断、システム障害、私たちの人員または第三者パートナーの事故、自然災害、テロ、世界的流行病、戦争、電気通信および電気故障、ならびに私たちの人員または私たちのCRO、CMO、サプライヤー、請負業者、コンサルタント、業務パートナーおよび/または他の第三者パートナーの不注意または意図的な行動によるセキュリティホールの影響を受けやすいかもしれません。または悪意のある第三者のネットワーク攻撃(ウイルス、ワーム、悪意のあるコード、マルウェア、恐喝ソフトウェア、サービス拒否攻撃、社会工学、および他の方法によってサービスの信頼性および情報の機密性、完全性および利用可能性に影響を与えることを含む)は、私たちのシステムインフラ、または私たちのCRO、CMO、サプライヤー、請負業者、コンサルタント、および他の第三者パートナーのシステムインフラに危害を及ぼす可能性があり、またはデータ漏洩を引き起こす可能性がある。
世界各地からの未遂攻撃と侵入の数、強度と複雑性の増加に伴い、セキュリティホール或いは破壊のリスクは普遍的に増加し、特にコンピュータハッカー、ウイルス、外国政府とネットワークテロリストを含むネットワーク攻撃或いはネットワーク侵入を含む。近年,ますます多くの会社や個人がオンライン勤務や遠隔作業にともない,“在宅勤務”の増加により通常利用可能な攻撃面が増加しているため,ネットワークセキュリティ事件が発生する可能性のあるリスクが増加しており,このような事件に対するリスク緩和投資も増加している.たとえば,インターネット釣りや迷惑電子メールの増加や,遠隔作業を利用して自分の優位性に増加したい“ハッカー”の社会工学の試みである.私たちはすべての種類の安全脅威を予見できないかもしれないし、これらすべての安全脅威に対して効果的な予防措置を取ることができないかもしれない。サイバー犯罪者が使用する技術は常に変化し,起動前には認識されない可能性があり,外部サービスプロバイダ,組織犯罪分岐機関,テロ組織や敵対する外国政府や機関などの外部団体を含む様々なソースから来ている可能性がある.任意の中断またはセキュリティホールが、私たちのデータまたはアプリケーションまたは私たちのCRO、CMO、サプライヤー、請負業者、コンサルタント、および他の第三者パートナーのデータまたはアプリケーションの損失または破損、または機密、敏感または独自の情報を適切に開示しない場合、私たちは責任および名声の損害を招く可能性があり、tovorafenib、pimasertib、または任意の将来の候補製品のさらなる開発および商業化が延期される可能性がある。独自、敏感、または機密情報の任意の違反、紛失、または漏洩は、HIPAAおよび米国の他の関連州および連邦プライバシー法による民事罰金および処罰に直面する可能性もあります。例えば、カリフォルニアプライバシー権法案(CPRA)によって改正された2018年カリフォルニア消費者プライバシー法(CCPA)は、安全違反行為に個人訴権を適用し、規制審査、罰金、個人訴権和解、その他の結果を含む何らかの形の救済措置をもたらす可能性がある。
重大なセキュリティホールや中断に関連するコストは巨大である可能性があり、このようなリスクに対して提供されるネットワークセキュリティ保険の制限を超える可能性がある。もし私たちのCRO、CMO、サプライヤー、請負業者、コンサルタント、および他の第三者パートナーの情報技術システムが中断またはセキュリティホールの影響を受けた場合、私たちはこれらの第三者に対抗するのに十分な追跡権がないかもしれません。私たちは大量の資源を必要とするかもしれません
84
このようなイベントの影響を軽減し,今後このようなイベントの発生を防ぐための保護措置を策定·実施する。
私たちのデータ保護努力と情報技術への私たちの投資は、私たちのシステムまたは私たちのCRO、CMO、サプライヤー、請負業者、コンサルタント、および他の第三者パートナーの重大な故障、データ漏洩、侵入、または私たちの名声、業務、運営、または財務状況に重大な悪影響を及ぼす可能性のある他のネットワークイベントを防止することを保証することはできません。例えば、このようなイベントが発生して私たちの運営中断を招いたり、第三者CRO、CMO、サプライヤー、他の請負業者、コンサルタントの運営中断を招いたりすると、私たちの計画が深刻に中断される可能性があり、私たちの候補製品の開発が延期される可能性があります。さらに、tovorafenib、pimasertib、または任意の他の候補製品の臨床試験データの損失は、私たちのマーケティング許可作業の遅延を招き、データを回復または複製するコストを著しく増加させる可能性があります。さらに、当社の内部情報技術システムまたは当社の第三者CRO、CMO、サプライヤーおよび他の請負業者およびコンサルタントのシステムが深刻に中断されているか、またはセキュリティホールは、財務、法律、商業および名声をもたらす可能性がある機密情報(商業秘密または他の知的財産権、専有業務情報および個人情報を含む)の損失、流用、および/または不正アクセス、使用または開示、またはアクセスを阻止する可能性があります。例えば、不正アクセス、使用または個人情報(私たちの臨床試験対象または人員に関連する個人情報を含む)をもたらすこのような事件は、私たちの名声を直接損なう可能性があり、連邦および/または州の違反通知法および外国と同等の法律を遵守させ、強制的な是正措置を強要する可能性があり、そうでなければ、私たちは個人情報のプライバシーおよび安全を保護する法律および法規に従って責任を負うことになり、これは重大な法律および財務リスクおよび名声の損害を招き、私たちの業務に悪影響を及ぼす可能性がある。
私たちは私たちが個人情報の安全を維持することを要求する法律、規則、そして規制を遵守することを要求された。私たちは契約と他の法的義務を持っていて、セキュリティホールを関連する利害関係者に通知するかもしれない。ネットワーク攻撃を予防または軽減できない場合、敏感、機密、または独自の情報を不正に取得することをもたらす可能性がある。ほとんどの管轄区域は法律を制定し、会社にあるタイプのデータのセキュリティホールに関連する時に個人、監督機関、その他の人に通知することを要求している。さらに、CRO、CMO、サプライヤー、請負業者、コンサルタント、および他の第三者パートナーとの合意は、セキュリティホールが発生した場合に通知することを要求する可能性があります。このような強制開示はコストが高く、否定的な宣伝を招く可能性があり、私たちの顧客が私たちのセキュリティ対策の有効性に自信を失ってしまう可能性があり、実際または予想されるセキュリティホールによる問題に対応および/または緩和するために大量の資本と他の資源を必要とすることが要求される。
セキュリティホールに対応し、および/または発見される可能性のある任意のセキュリティホールに対応するコストは高くなる可能性があり、これらの問題を解決するための努力は成功しない可能性があり、これらの問題は、中断、遅延、負の宣伝、顧客の信頼を失ったり、私たちの製品の使用を減少させたり、私たちの業務および競争地位に対する他の損害をもたらす可能性があります。どんな潜在的なセキュリティホールを修復するには多くの時間、資源、そして費用がかかるかもしれない。どんなセキュリティホールも、規制調査、訴訟、または他の調査を招き、私たちの財務と運営状況に影響を及ぼす可能性がある。
セキュリティホールによる訴訟は私たちの業務に悪影響を及ぼすかもしれない。私たちのシステム、ネットワーク、または物理施設への不正アクセスは、私たちの顧客または他の関係者との訴訟を引き起こす可能性があります。これらの訴訟は、私たちにお金をかけて弁護や和解を強要し、経営陣の時間と注意を分散させ、私たちの経営コストを増加させ、あるいは私たちの名声に悪影響を及ぼすかもしれない。
私たちは、罰金、判決、和解、処罰、費用、弁護士費、および事件または違反による他の影響を含む安全事件または違反行為に十分な保険を提供していないかもしれない。利用可能な保険範囲を超える1つまたは複数の多額のクレームの提示に成功したり、保険証券の変化(保険料の増加または多額の免責額または共同保険要件の実施を含む)をもたらしたりすることは、私たちの業務に悪影響を及ぼす可能性がある。さらに、私たちの既存の保険範囲とミスと漏れ保険が受け入れ可能な条項で提供され続けるか、あるいは私たちの保険会社は未来のいかなるクレームも拒否しないと確信できません。私たちが顧客群を拡大し続けるにつれて、専門的で敏感なデータがますます多く処理、保存、転送され、私たちのリスクが増加するかもしれない。
85
私たちは厳格で変化していく法律、法規、基準、プライバシー、データ保護、データセキュリティに関する契約義務を受けています。実際にまたはそのような義務を履行できなかったと考えられることは、政府の法執行行動(民事または刑事罰を含む可能性がある)、罰金および制裁、個人訴訟および/または負の宣伝を招き、私たちの経営業績および業務に負の影響を与える可能性がある。
我々と協力する第三者は、多くの国内外のデータ保護法律および法規(すなわち、プライバシーおよびデータセキュリティに関連する法律および法規)によって制約されている可能性があり、その範囲は変化しており、異なる適用および解釈の影響を受け、異なる国間で一致しないか、または他の規則と衝突している可能性がある。私たちはプライバシー、データ保護、およびデータセキュリティに関連する契約義務条項の制約を受けているか、または制限されているかもしれない。私たちまたは関連する第三者が実際にまたはこのような義務を履行できなかったことは、私たちのコンプライアンスと運営コストを増加させ、規制審査、行動、罰金、処罰に直面させ、名声被害を招き、顧客の流失を招き、訴訟や責任を招き、他の方法で私たちの業務、財務状況、運営結果に重大な悪影響を与える可能性がある。
米国では、健康関連情報および他の個人情報の収集、使用、開示および保護を管理する多くの連邦および州法律法規、連邦健康情報プライバシーおよびセキュリティ法、連邦および州データ漏洩通知法、州健康情報プライバシー法および連邦および州消費者保護法(例えば、連邦貿易委員会法第5条)は、我々の業務または私たちの協力者の業務に適用される可能性がある。さらに,プライバシーおよびセキュリティ要件に制約された第三者(臨床試験データを取得した研究機関を含む)から保護された健康情報をHIPAA(HITECH改訂)から取得する可能性がある。事実および状況によると、HIPAAによって許可されていない方法でHIPAAによってカバーされているエンティティによって維持されている個別に識別可能な健康情報を取得、使用、または開示する場合、民事および刑事罰を受ける可能性がある。
ワシントン州は最近、消費者の健康データの収集に専念する“私の健康私のデータ法案”を採択した。“私の健康私のデータ法案”はHIPAAよりも範囲が広く、個人的な訴権を含む。“私の健康データ法案”が2024年初めに施行されると、多くの規制行動や訴訟があるかもしれない。
カリフォルニア州は最近CCPAを公布し、カリフォルニアの消費者のために新しいプライバシー権を創造し、消費者または家庭の個人情報を処理するエンティティに対してより多くのプライバシーとデータ安全義務を規定した。CCPAは2020年1月1日に施行され、最近CPRA改正により、現在2023年1月1日に施行され、2023年7月1日から強制執行されているが、新たに設立された執行機関であるカリフォルニアプライバシー保護局(CPPA)が公布した規定を遵守しなければならない。CCPAは、カリフォルニア州住民に、彼らの個人情報の訂正、アクセス、および削除を要求する権利、特定の個人情報を共有しない権利を選択する権利、およびカリフォルニア州住民の雇用主を含む、彼らの個人情報がどのように処理されているかに関する詳細な情報を取得する権利を含む、カリフォルニア住民に拡大されたプライバシー権を与える。CCPAとCPRAはデータ漏洩に対する民事処罰と個人訴権を規定しており,データ漏洩訴訟が増加すると予想される。CCPAとCPRAは私たちのコンプライアンスコストと潜在的な責任を増加させるかもしれない。CCPAはいくつかの州にネバダ州、ニューハンプシャー州、オハイオ州、ニューヨーク州、ワシントン州、イリノイ州、ネブラスカ州、バージニア州、バージニア州で消費者データ保護法(VCDPA)が可決され(2023年1月1日施行)、コロラド州でコロラド州プライバシー法(COPA)が公布された(2023年7月1日施行)など、いくつかの州に新たな連邦と州レベルのプライバシー立法を促進している。VCDPA、COPA、および他のこのような提案された立法が採択されれば、私たちの潜在的な責任とコンプライアンスコストを増加させ、私たちの業務に悪影響を及ぼす可能性がある。
一般データ保護条例(GDPR)と呼ばれる2016/679号法規を含む外国データ保護法は、欧州経済地域(EEA)およびスイスの個人から取得された個人情報(健康関連データを含む)に適用可能である。GDPRとそのEU各地で実施されている立法は,インフォームドコンセントのやり方を変更して臨床試験対象や調査者により詳細な通知を要求し,データ処理を制限し,個人情報を処理する法的基盤を構築し,データ処理義務を通知し,適切なデータ保護機関やデータ主体にセキュリティイベントを通知し,個人情報のセキュリティと秘密を保護し,データ主体がその個人情報に関する権利を行使する手段を構築することを含む企業に厳しい義務を課している。GDPRは,規格外の会社に対して最高2000万ユーロまたはその世界年収4%の罰金を科し,個人情報(臨床試験を含む)の処理や個人訴訟の処理を禁止する可能性がある。適用可能な範囲では、GDPRは個人情報を処理する上での私たちの責任と責任を増加させ、EUデータ保護ルールの遵守を保証するために追加的なメカニズムを構築し、より多くの時間と資源を費やす必要があるかもしれません。またイギリスでは
86
“データ保護法”は2018年5月に施行され,2019年に法に基づいて改正され,実質的にGDPRが施行され,英国特有の減税を含む英国でのGDPRの適用に関する条項が含まれている。これらの規制の変化は、追加の複雑性、要求の変化、制限、および潜在的な法的リスクを増加させる可能性があり、コンプライアンス計画のリソースへの追加的な投資が必要であり、戦略および以前の有用なデータの利用可能性に影響を与える可能性があり、コンプライアンスコストの増加および/またはビジネス実践および政策の変化をもたらす可能性がある。また、欧州経済圏、スイス、イギリスの規制当局がデータ保護立法を実行する状況は一致しておらず、一部の地方司法管轄区にのみ適用される規則や指導を遵守するために追加の資源を使わなければならない可能性がある。
また,欧州データ保護法では,欧州経済圏以外の国,イギリス,スイス,米国のような個人情報の移動を禁止するのが一般的であり,欧州委員会はこれらの国は十分なデータ保護を提供できないと考えている。スイスはまた似たような制限措置を取った。個人情報をヨーロッパ経済地域、イギリス、スイスからアメリカや他の国に移すことができる法的メカニズムがありますが、それらは法的挑戦を受けているかもしれません。成功すれば、これらの挑戦はこれらのメカニズムを無効にし、ヨーロッパ以外のヨーロッパ人の個人情報を処理する能力を制限し、私たちの業務に悪影響を与える可能性があります。例えば、2020年7月、EU裁判所は、EU-米国プライバシー盾の無効を宣言し、EU-米国プライバシー盾が米国に移転したEU個人情報に十分な保護を提供できなかったため、プライバシー盾に認証した会社が個人情報をEUから米国に移転することを許可した。CJEUは標準契約条項のような他のデータ転送機構の使用無効を宣言していないが,この決定はこの機構を用いて米国へのデータ転送に関する不確実性を招き,CJEUはすべての場合,標準契約条項だけで十分とは限らないことを明らかにしている.欧州データ保護委員会(EDPB)は,CJEUが2020年11月11日に下した決定について,国境を越えたデータ転送に標準契約条項などのデータ転送機構を使用することにより高い負担をかけている追加指導意見を発表した。2021年6月、欧州委員会はGDPRに基づいて新たな標準契約条項を採択し、個人データをEU以外の国に移したが、欧州委員会はこれらの国がこのような個人データを十分に保護していないと考えている。2023年7月10日から、EU法は、新たなEU-米国データプライバシー枠組み(DPF)が、個人データをEUから米国の認証会社に移転することを可能にするのに十分であることを認めた。しかし、DPFはさらなる法的課題に直面しており、EUから米国への個人データの移転の法的要求が再び不確実になる可能性がある。DPFは英国には適用されないが,2023年10月12日,英国政府は十分な決定を採択し,英国のEU−米国データプライバシー枠組み(UK DPF)の拡張により,米国はイギリスから米国への十分なレベルの保護を確保していると結論した。私たちはスイス政府(Swiss DPF)も似たような充足率決定を下すと予想する。イギリスとスイスのDPFはまた、EU-米国DPFの任意の挑戦や他の方法で影響を受ける可能性がある。もし私たちが国境を越えたデータ転送のために有効なコンプライアンスメカニズムを実施できなければ、私たちはより多くの規制行動、巨額の罰金、処理の禁止、またはヨーロッパや他の外国司法管轄区域からの個人データの転送禁止に直面する可能性がある。EUや他の市場では、データの国境を越えた流れの潜在的な新規や制限が、これらの地域で事業を展開するコストと複雑さを増加させる可能性がある。
また、英国が2020年1月31日にEUを離脱したのに続き、GDPRは2020年12月31日の過渡期終了時に英国での適用を停止した。しかし、2021年1月1日現在、イギリスの2018年“EU(離脱)法案”は、GDPR(2020年12月31日に存在するものと同様であるが、あるイギリス特有の改正)をイギリスの法律、すなわちイギリスGDPRに組み入れなければならない。英国GDPRと2018年の英国データ保護法は,EUのデータ保護制度から独立した英国のデータ保護制度を規定しているが,EUのデータ保護制度と一致している。イギリスのGDPR違反は、金額が高い者を基準に、1750万GBまたは世界収入4%の罰金を招く可能性があります。個人データをEUからイギリスに移すことについて、2021年6月28日、欧州委員会は、領土間で個人データを合法的に移転するために、組織に契約や他の措置を要求することなく、EU加盟国から英国へのデータの移転を許可する英国データ保護枠組みに関する十分な決定を発表した。計画は少なくとも4年間継続されているにもかかわらず、欧州委員会はいつでも一方的に充足率決定を撤回することができ、このような状況が発生すれば、追加的なコストを招き、私たちの全体的なリスクを増加させる可能性がある。
例えば、中国、ブラジル、オーストラリア、日本を含む他の国は、データのローカルな記憶および処理、ならびに個人情報の国境を越えた伝送に対して、いくつかの法的要件を採用しており、これらのすべては、前臨床試験および臨床試験を行うこと、または私たちの将来のコストおよび複雑性を提供する可能性がある
87
製品があれば、私たちの業務を経営しています。このような義務の解釈と適用は異なる司法管轄区域の間で一致しない可能性があり、他の要求や私たちの接近と衝突する可能性がある。
また、2023年7月26日、米国証券取引委員会は、Form 10-K年度報告においてネットワークセキュリティリスク管理を開示することを要求する新しい上場企業ネットワークセキュリティ開示規則を採択した(ネットワークセキュリティリスクを監視する上での取締役会の役割、ネットワークセキュリティリスクの評価および管理における管理層の役割と専門知識およびネットワークセキュリティリスクを評価、識別、管理するプロセスを含む)。これらの新しいネットワークセキュリティ開示規則はまた、イベントが重大イベントであることを決定してから4営業日以内に、8−Kフォームに従って重大なネットワークセキュリティイベントを開示することを要求する。
私たちは、プライバシーおよびセキュリティに関連する外部および内部プライバシーおよびセキュリティポリシー、陳述、認証、および出版物の条項の制約を受けているか、または制限されている可能性がある。
国内外のプライバシー、データセキュリティ、データ保護の法律、法規、契約およびその他の義務を遵守することは、私たちがデータを収集、使用、開示する能力を制限し、あるいは場合によっては、ある司法管轄区域で運営する能力に影響を与えることを契約の中でより重い義務を負うことを要求するかもしれません。実際または国内外のプライバシー、データプライバシー、およびデータ保護法律法規を遵守しないと考えられることは、政府の法執行行動(民事、刑事および行政処罰を含む可能性がある)、個人訴訟および/または負の宣伝を招く可能性があり、私たちの経営業績および業務に負の影響を与える可能性がある。また,我々または我々の潜在的協力者が情報を取得する臨床試験対象,およびこれらの情報を共有する提供者は,我々の情報の使用や開示能力を契約的に制限する可能性がある。プライバシー、データセキュリティ、データ保護法を遵守できなかった、または私たちの契約義務に違反したと主張しています。たとえ私たちが責任を負わないと判断されても、弁護はコストが高く、時間がかかり、マイナスの宣伝を招き、私たちの業務を損なう可能性があります。
私たちまたは私たちが依存している第三者は自然災害の悪影響を受ける可能性があり、私たちの業務の連続性と災害復旧計画は深刻な災害から私たちを十分に保護できないかもしれません。
私たちの現在の業務は主にサンフランシスコ湾区にあります。地震、洪水、火災、爆発、極端な天気条件、医療疫病または大流行、電力不足、電気通信故障または他の自然または人為的事故または事件などの計画外の事件は、私たちの施設や私たちの第三者契約製造業者の製造施設を十分に利用できず、特に日常生活において、私たちの財務および運営状況に大きなマイナス影響を与える可能性がある。また,気候変動が一般経済条件,特に製薬業に及ぼす長期的な影響は不明であり,既存の自然災害リスクを増加あるいは悪化させる可能性がある。これらの施設を使用できないことは、コスト増加、候補製品の開発遅延、当社の業務運営中断を招き、当社の業務、財務状況、運営結果、将来性に大きな悪影響を及ぼす可能性があります。自然災害、停電、または他の事件が発生した場合、本社の全部または大部分を使用することができず、私たちの研究施設や私たちの第三者契約メーカーの製造施設のような重要なインフラを損傷させたり、他の方法で運営を中断したりすることは難しいかもしれません。場合によっては、かなり長い間私たちの業務を継続することはできません。深刻な災害や同様の事件が発生した場合、我々の既存の災害復旧および業務連続計画は十分ではないことが証明される可能性がある。私たちの災害復旧と業務連続計画の限られた性質のため、私たちは大量の費用を発生する可能性があり、これは私たちの業務に実質的な悪影響を及ぼす可能性があります。私たちのリスク管理政策の一部として、私たちは私たちの業務に適していると思うレベルに保険範囲を維持します。しかし、これらの施設で事故や事件が発生した場合、保険金額がどんな損害や損失を補うのに十分な保証はできません。もし私たちの工場や私たちの第三者契約メーカーの製造施設が事故や事件あるいは他のいかなる理由でも作動できなければ、短い時間であっても、私たちのいかなる研究開発プロジェクトも損害を受ける可能性があります。どの業務中断も、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性があります。
私たちに不利な税金法律または法規の変化は、私たちの業務、キャッシュフロー、財務状況、または経営結果に大きな悪影響を及ぼすかもしれません。
新しい収入、販売、使用、または他の税金法律、法規、規則、法規または条例はいつでも公布される可能性があり、これは私たちの業務運営および財務業績に悪影響を及ぼす可能性があります。さらに、既存の税金法律、法規、規則、法規または条例は、私たちに解釈、変更、修正、または適用される可能性がある。例えば
88
2017年の減税·雇用法案、あるいは減税·雇用法案と呼ばれ、米国税法に多くの重大な改正が行われた。米国国税局や他の税務機関が将来的に減税や雇用法案についての指導を提供することは私たちに影響を与える可能性があり、減税や雇用法案のいくつかの側面は将来の立法で廃止または改正される可能性がある。例えば、CARE法案は減税と雇用法案のいくつかの条項を修正する。また、各州が減税や雇用法案、CARE法案、または新たに公布された任意の連邦税収立法をどの程度遵守するかどうかは定かではない。会社税率の変化、私たちの業務に関連する繰延税純資産の現金化、外国収益の課税、減税と雇用法案、CARE法案または将来の改革立法による費用の控除は、私たちの繰延税金資産の価値に実質的な影響を与える可能性があり、重大な一次費用を招き、将来のアメリカ税費を増加させる可能性があります。
私たちの純営業損失の繰越と他の税務属性を使用する能力は限られているかもしれません。
私たちは歴史的に大きな損失を受けて、近い将来の利益を期待していませんし、私たちは永遠に利益を達成しないかもしれません。2017年12月31日までの納税年度に発生した未使用損失は、このような未使用損失が満期になるまで、将来の課税所得額を相殺するために繰り越されます。CARE法案により改正された減税と雇用法案によると、2017年12月31日以降の納税年度に発生した未使用の米国連邦純営業損失は満期にならず、無期限繰り越しとなる可能性があるが、2020年12月31日以降の課税年度では、このような連邦純営業損失の控除額は今年度の課税収入の80%を超えてはならない。各州が減税や雇用法案やCARE法案をどの程度遵守するかは定かではない。さらに、もし私たちが“所有権変更”を経験したか、または経験した場合、私たちの現在および未来の未使用損失および他の税務属性は、改正された1986年の国税法第382条および383条の制限を受ける可能性があり、この変更は、通常、特定の株主が3年以内に私たちの株式所有権(価値別)に対する変化が50ポイントを超えると定義される。私たちは、所有権変更が発生したかどうかを評価するために、まだ第382条の研究を完了していない、あるいは私たちの設立以来、このような研究の複雑さとコスト、および将来より多くの所有権変更がある可能性があるという事実から、複数回の所有権変更が発生したかどうかを評価する。したがって、2017年12月31日以降の課税年度に発生した純営業損失の繰越は使用前に満期になる可能性があり、2017年12月31日以降の課税年度に生じる純営業損失繰越の控除は制限される可能性があり、所有権変更(またはこのような所有権変更を経験した場合)を経験した場合、変更後の収入や税収を相殺する能力が制限される可能性があります。州税法の似たような規定はまた私たちが累積的な州税収属性を使用することを制限するのに適用されるかもしれない。また、州レベルでは、一定期間使用を一時停止したり、他の方法で純営業損失を制限したりする可能性があり、これは州の課税税を加速または永久的に増加させる可能性がある。したがって、私たちが利益を達成しても、私たちの純営業損失と他の税金属性の全部または大部分を使うことができないかもしれません。これは私たちの将来のキャッシュフローに悪影響を及ぼすかもしれません。
私たちはすでに戦略取引に従事しています。これらの取引は私たちの流動性に影響を与え、私たちの費用を増加させ、私たちの経営陣に大きな妨害をもたらす可能性があります。
武田薬業株式会社、ビラクタ治療会社、メルクKGaA(ドイツダムシュタット)との関連会社などの戦略的取引に従事したことがあり、会社、業務または資産の買収、製品、候補製品または技術の外部許可または内部許可などのさらなる戦略的取引も時々考慮される可能性がある。私たちが考慮する可能性のある他の潜在的な取引には、剥離、戦略パートナー関係、合弁企業、再編、資産剥離、業務合併と投資を含む様々な異なる商業計画が含まれる。このような取引は、私たちが非日常的または他の費用を発生させることを必要とする可能性があり、私たちの短期的または長期的な支出を増加させる可能性があり、重大な統合課題をもたらしたり、私たちの管理や業務を妨害したりする可能性があり、これは私たちの運営や財務業績に悪影響を及ぼす可能性がある。例えば、これらの取引は、多くの業務および財務リスクをもたらす可能性がある
89
私たちの知的財産権に関するリスクは
もし私たちが私たちの製品や技術のために特許保護や他の必要な権利を獲得し、維持することができない場合、あるいは取得された特許保護範囲が十分でない場合、あるいは私たちの特許(所有、共同所有可能かもしれない)による権利が十分に広くない場合、私たちの競争相手は私たちと類似または同じ製品および技術を開発し、商業化する可能性があり、私たちの製品および技術を商業化することに成功する能力は悪影響を受ける可能性がある。
私たちのビジネス成功は、米国や他の国で現在の候補製品や将来の製品の独自または知的財産権保護を獲得し、維持する能力があるかどうか、私たちの製造技術を含む私たちのコア技術にある程度依存しています。私たちは、私たちの知的財産権を求め、維持し、守ることによって、内部開発でも第三者から許可を得ても、私たちの業務発展に重要なビジネス的意義を持つノウハウ、発明、改善の保護と強化に努めています。私たちはまた商業秘密、技術ノウハウ、持続的な技術革新と許可内の機会に依存して、抗癌薬物開発領域における私たちの特許地位を強化し、維持している。また,希少薬物指定,データ排他性,市場排他性および特許期限延長(可能であれば)による規制保護に依存する予定である。
バイオテクノロジーと製薬会社の特許地位は通常高度に不確定であり、複雑な法律と事実問題に関連しており、近年多くの訴訟のテーマとなってきた。私たちが市場で競争に成功するために必要な特許保護の程度は、場合によっては入手できないかもしれないし、深刻に制限されている可能性があり、私たちの権利を十分に保護できないかもしれないし、どんな競争優位性を獲得または維持することを可能にするかもしれません。私たち自身または許可された任意の特許出願が発行された特許に成熟することを保証することはできず、このような特許が発行されると、現在および将来の候補製品を保護するのに十分な、または他の方法で任意の競争優位性を提供するのに十分な権利要件を含むことも保証されない。しかも、特許は発行された特許の管轄区域でのみ強制的に施行されることができる。しかも、特許の寿命は限られている。米国では、特許の自然失効期間は、通常、米国で初めて非臨時出願されてから20年となる。適用される現地法の規定によると、米国国外特許の自然失効時間は異なるが、通常は最初の現地出願日から20年である。様々な延期があるかもしれない;しかし、特許の有効期限とその提供される保護は限られている。新製品候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。
しかも、私たちの独占ライセンスは分野によって制限され、保留される権利を受ける可能性があり、これは私たちの競争的地位に悪影響を及ぼすかもしれない。“経営陣の財務状況と経営成果の討論と分析--重要な合意”を参照。私たちが許可を得た特許の組み合わせは、他社が私たちの候補製品と同様の製品をそのような製品の模造バージョンを含めて商業化することを阻止するのに十分かつ持続的な特許保護を提供してくれないかもしれない。さらに、私たちに付与された特許の組み合わせは、一定の強制執行権を有する可能性がある許可分野以外の第三者に付与される可能性がある。したがって、私たちに付与された特許は、別の許可者によって提起された、または別の許可者に対して提起された訴訟において、または別の許可者がそのような訴訟または他の理由に応答して提起された行政訴訟において、無効または狭義に解釈されるリスクに直面する可能性がある。
他の当事者は、発明が私たち自身の特許出願または発行された特許において要求された発明と重複または衝突する可能性があると主張する、私たち自身の技術に関連するか、または競争力を有する可能性のある技術を開発し、または特許出願を提出したか、または特許を受信した可能性がある。科学文献における発見発表は米国や#年の実際の発見や特許出願に遅れていることが多い
90
他の管轄区域は通常申請後18ヶ月以内に公表されるか、場合によっては全く公表されない。したがって、私たちの特許及び出願の発明者が、それらの特許又は未解決特許出願で主張された発明を最初にした者であるか、又はこれらの発明のために特許保護を出願した最初の者であるかを決定することはできない。さらに、私たちの特許および特許出願に関連する可能性のあるすべての既存技術が見つかったことを保証することはできません。そのような従来技術が存在する場合、それは、特許を無効にするか、または係属中の特許出願から特許を発行することを阻止することができる。したがって、私たちの特許権の発行、範囲、有効性、商業価値は何の確定的な予測もできません。さらに、私たちの特許および特許出願によって提供される保護の広さまたは強度が脅かされている場合、結果にかかわらず、会社が現在または将来の候補製品を許可、開発、または商業化することを阻止することができる。
さらに、特許起訴過程は高価で時間がかかり、私たちまたは私たちの許可者は、すべての必要または望ましい特許出願を合理的なコストまたはタイムリーに提出して起訴することができないかもしれない。また、最初に審査に提出されたクレームの範囲は、発行時に大幅に縮小する可能性があり、本当にあれば。我々や我々の許可側も,特許保護を得るのが遅くなるまで,我々の研究開発成果の特許可能性を識別できない可能性がある.私たちが私たちの研究開発努力に基づいて追加の特許保護を求めたり、あるいは私たちが生成した任意のこのような特許や他の知的財産権がいかなる競争優位性を提供するかを保証することはできません。さらに、私たちは、第三者から許可された技術を含めて、特許出願の準備、提出、起訴を制御する権利がありません。したがって、これらの特許および出願は、私たちの業務の最良の利益に適合した方法で提出、起訴または維持されてはならない。
競争優位を保ちたい特許保護を得ても,特許の発行はその発明性,範囲,有効性,あるいは実行可能性に関する決定的な結論ではない.競争者を含む第三者は、特許の発明性、範囲、有効性、または実行可能性に疑問を提起する可能性があり、これは、そのような特許の範囲の縮小、無効、または強制実行をもたらす可能性がある。もし私たちの特許が発表されたら、私たちの特許はアメリカと海外の特許庁で挑戦されるか、または法廷で挑戦されるかもしれない。例えば、私たちは、第三者が既存技術を米国特許商標局(USPTO)に提出し、私たちの1つ以上の特許主張が発表された後の有効性に疑問を提起することに直面する可能性がある。このような提出は、我々の特許出願に基づいて特許を付与することを排除するために、特許が発行される前に提出されてもよい。私たちは反対に巻き込まれ再審されるかもしれません各方面間私たちの特許が発表されると、米国または海外で私たちの特許主張に疑問を提起する審査、許可後の審査、派生、妨害、または同様の手続きが行われる。しかも、特許が発表されると、法廷で挑戦されるかもしれない。競争相手は、彼らが我々の特許発明者の前にそのような特許または特許出願で主張された発明を発明したと主張するか、または我々の特許発明者の前に特許出願を提出した可能性がある。競争相手はまた私たちがその特許を侵害していると主張するかもしれないので、私たちは私たちの特許出願や特許で主張されている技術(発行すれば)を実践することができません。したがって、私たちの1つ以上の特許請求書は縮小または失効する可能性がある。訴訟では、競争相手は、もし私たちの特許が発行されたら、様々な理由で、私たちの特許は無効だと主張するかもしれない。もし裁判所が同意すれば、私たちはこのような疑問視された特許の権利を失うだろう。
挑戦されていなくても、私たちの特許および処理されている特許出願(発行されている場合)は、私たちの特許声明をめぐる競争相手の設計を阻止し、類似または代替技術または療法を非侵害的に開発して私たちの特許を回避することができないかもしれません。例えば、私たちが有効かつ強制的に実行可能な特許を持っていても、相手が私たちの出願日前に発明を商業に使用していることを証明したり、相手が強制許可から利益を得たりすることができれば、他の人が私たちの発明を実践していることを排除できないかもしれません。候補製品の保有または出願の特許および特許出願に提供される特許保護が十分に広くなく、このような競争を阻害するのに不十分であれば、候補製品を商業化することに成功する能力は負の影響を受ける可能性があり、これは私たちの業務を損なうことになる。いくつかの規制排他性が存在する可能性があるが、このような規制排他性の範囲は変化する可能性があり、他の人が私たちの候補製品と類似した製品を商業化することを排除するために、十分かつ持続的な保護を提供してくれないかもしれない。
もし私たちが獲得した任意の特許保護の範囲が十分に広くない場合、あるいは私たちがいかなる特許保護を失った場合、競争相手が類似または同じ候補製品を商業化する能力が悪影響を受けることを阻止する。
生物製薬会社の特許地位は通常高度に不確定であり、複雑な法律と事実問題に関連しており、近年多くの訴訟のテーマとなっている。したがって,我々の特許権の発行,範囲,有効性,実行可能性,商業的価値は高い不確実性を持っている.私たちの懸案と未来は
91
特許出願および我々許可側の特許出願は、我々の候補製品を保護する特許の発行や、他の候補競合製品の商業化を効果的に阻止する特許の発行につながらない可能性がある。
また,特許出願に要求されるカバー範囲は特許発行前に大幅に縮小することができ,その範囲は特許発行後に再解釈することができる.私たちが所有しているまたは将来の許可中の特許出願が特許の形態で発表されても、それらの発表形態は、競争相手や他の第三者が私たちと競争することを阻止したり、他の方法でいかなる競争優位性を提供してくれたりすることを提供してくれない。私たちが所有または許可している任意の特許は、第三者の挑戦または回避される可能性があり、または第三者の挑戦のために範囲を縮小したり、無効にしたりする可能性がある。したがって、私たちは私たちの候補製品が保護可能なのか、まだ効果的で実行可能な特許によって保護されているのか分からない。我々の競争相手または他の第三者は、同様の技術または代替技術または製品を非侵害的に開発することによって、私たちの特許または私たちの許可者の特許を回避することができ、これは、私たちの業務、財務状況、運営結果、および将来性に大きな悪影響を及ぼす可能性がある。
特許の発行は、その発明性、範囲、有効性、または実行可能性に対して決定的ではなく、我々の特許またはわれわれライセンシーの特許は、米国および海外の裁判所または特許庁で挑戦される可能性がある。第三者が既存技術の発行前に米国特許商標局に提出したり、反対、派生、撤回、再審査、付与後の審査に参加したりすることを受け入れる可能性があります各方面間審査、または他の同様の手続きは、私たちが所有する特許権に挑戦する。このような提出、訴訟、または訴訟における不利な裁決は、特許期限の調整または他の方法での特許期間の短縮、私たちの特許権の範囲を縮小すること、または無効にすること、または実行できないようにすること、または第三者が私たちに支払うことなく、私たちの候補製品を商業化し、直接私たちと競争することを可能にする可能性がある。さらに、我々の特許又は我々ライセンシーの特許は、例えば外国特許庁の反対、我々の発明優先権又は我々の特許及び特許出願及び我々許可者の特許に関する他の特許的特徴に挑戦することができる後の挑戦手続を受けることができる。このような挑戦は、特許権の喪失、排他性の喪失、または特許主張の縮小、無効または実行不能をもたらす可能性があり、これは、他人が類似または同じ技術および製品を使用することを阻止するか、またはそれを商業化する能力を制限するか、または候補製品の特許保護期間を制限する可能性がある。最終的な結果が私たちに有利であっても、このような手続きは大量のコストを招く可能性があり、私たちの科学者と経営陣に多くの時間がかかる必要がある。さらに、我々の特許および特許出願または我々の許可側の特許および特許出願によって提供される保護の広さまたは強度が脅かされている場合、結果にかかわらず、会社が現在または将来の候補製品を許可、開発、または商業化することを阻止することができる。
しかも、特許の発行は私たちに特許発明を実践する権利を与えない。第三者は私たち自身の特許製品の販売を阻止し、私たち自身の特許技術を実践する特許を持っているかもしれない。
知的財産権は必ずしも私たちの競争優位に対するすべての潜在的な脅威を解決できるとは限らない。
私たちの知的財産権が提供する未来の保護の程度は不確定であり、知的財産権には限界があるため、私たちの業務を十分に保護できないか、あるいは競争優位性を維持することができるかもしれない。例えば:
92
このような事件が発生した場合、私たちの業務、運営結果、そして将来性を深刻に損なう可能性がある。
私たちのビジネスの成功は、第三者の特許や他の固有の権利を侵害することなく運営する私たちの能力に大きく依存する。第三者は私たちが彼らの専有権を侵害し、損害賠償責任を招いたり、私たちの開発と商業化努力を阻害したり延期したりする可能性があると主張している。
私たちの商業的成功は第三者の特許と固有の権利の侵害を避けることにある程度依存する。しかし、私たちの研究、開発、および商業化活動は、第三者が所有または制御している特許または他の知的財産権を侵害または他の方法で侵害される可能性がある。他のエンティティは、特許または独自の権利を有しているか、または取得することができ、これは、私たちの候補製品および将来承認される可能性のある製品を製造、使用、販売、提供、または輸入する能力を制限し、または私たちの競争的地位を損なう可能性がある。アメリカ国内外では、生物製薬業界の特許とその他の知的財産権に関する訴訟数は大きく、特許侵害訴訟、異議、再審、各方面間米国特許商標局及び/又は対応する外国特許庁において審査手続及び認可後審査手続を行う。我々が候補製品を開発している分野には,第三者米国や外国から発行された特許や係属中の特許出願が多く存在する.我々の候補製品の使用または製造に関連する第三者特許または材料、配合、製造方法または治療方法の請求項に記載の特許出願が存在する可能性がある。
特許として発行されれば、私たちに不利になるかもしれない特許出願もあるかもしれない。米国および他の地方の特許出願は、通常、優先権を要求する最初の出願の約18ヶ月後に発行され、このような最も早い出願日は、一般に優先権日と呼ばれる。米国国外で提出されないいくつかの米国特許出願は、特許が発行される前に秘密にすることができる。したがって、私たちの候補製品に関する特許出願は、私たちが知らずに第三者によって提出されたかもしれない。さらに、開示された保留特許出願は、いくつかの制限された場合に、我々の候補製品およびその用途または製造プロセスをカバーするために、後に修正することができる。特許請求の範囲は、法的解釈、特許における書面開示、および特許の起訴履歴によって決定され、専門家の意見のような他の要因に関連する可能性がある。特許または係属中の特許または請求項の関連性または範囲の説明は正しくない可能性があり、これは私たちの候補製品をマーケティングする能力に負の影響を与えるかもしれない。さらに、我々は、我々の候補製品およびその用途および製造プロセスが第三者特許のカバー範囲内にないかどうか、または第三者の係属特許出願が関連範囲の特許請求を提出するかどうかを誤って予測する可能性がある。私たちが関連する特許の満期日の決定は、アメリカまたは海外のどのようなものでも正しくないかもしれません。これは、私たちの候補製品を開発し、マーケティングする能力に悪影響を及ぼす可能性があります。第三者知的財産権所有者は、私たちの候補製品および関連用途および方法のために特許保護を受けていても、侵害または他の知的財産権に関するクレームを積極的に提起することができるかもしれない。
バイオ製薬業界の拡張や特許の発行に伴い、我々の候補品が第三者特許権侵害の告発を受けるリスクが高まる可能性がある。特許出願は一定期間秘密であるため、関連出願が公表される前に、任意の候補製品の商業化が第三者特許を侵害する可能性があることを知らない可能性があり、製品候補又は技術に関連する特許出願を初めて提出した会社であることも確認できない。さらに、特許出願が発行されるまでに数年かかる可能性があるため、現在処理されている特許出願が存在する可能性があり、これらの出願は、私たちの候補製品が発行された特許を侵害する可能性がある。さらに、特許検索は、特許間の用語の違い、不完全なデータベース、および評価の困難さによって不完全であるため、我々の技術に関連する可能性のある第三者特許権を識別することは困難である
93
特許請求の意味。私たちが知っていない保証もありませんが、私たちの業務とは関係のない既存技術だと思いますが、それにもかかわらず、これらの技術は最終的には、私たちが将来承認される可能性のある製品を製造、使用、販売、提供、または輸入する能力を制限したり、私たちの競争的地位を損なう可能性があります。さらに、第三者は将来的に特許を取得し、私たちの技術を使ってこれらの特許を侵害したと主張するかもしれない。第三者が主張するいかなる特許侵害請求も非常に時間がかかり、可能性がある
2023年12月31日現在、第三者が私たちに特許侵害請求をしていないにもかかわらず、他の人は独自の権利を持っている可能性があり、私たちの候補製品の発売を阻止する可能性がある。第三者は私たちの任意の候補製品に対して特許侵害請求をするかもしれない。私たちの特許関連法律訴訟に対して損害賠償を要求し、私たちの候補製品、治療適応、またはプロセスに関連する商業活動を禁止しようと努力しても、故意に侵害されたと判断された場合、3倍賠償し、私たちの候補製品を製造またはマーケティングする許可証を取得することを含む重大な損害賠償責任を負うことができます。これらのクレームの弁護は、その是非にかかわらず、巨額の訴訟費用がかかり、当社の業務における従業員資源を大量に移転することになる。私たちがこのような訴訟に勝つかどうかは予測できませんし、これらの特許に必要ないかなる許可が商業的に受け入れられる条項で提供されるかどうかも予測できません。さらに、私たちまたは私たちの現在および/または未来の戦略パートナーが許可を得ることができても、これらの権利は非排他的である可能性があり、これは、私たちの競争相手が同じ知的財産権を獲得することをもたらす可能性がある。さらに、必要であれば、権利侵害を回避するために、私たちの候補製品、治療適応、またはプロセスを再設計できるかどうかを決定することはできません。したがって、司法や行政訴訟で不利な裁決を下したり、必要なライセンスを取得できなかったりすることで、私たちの候補製品の開発と商業化を阻止することができ、これは私たちの業務、財務状況、経営業績を損なう可能性があります。また、知的財産権訴訟は、その結果にかかわらず、負の宣伝をもたらす可能性があり、私たちの候補製品や技術をマーケティングまたは他の方法で商業化することを禁止する可能性があります。
私たちにクレームを出した当事者は、彼らがより多くの資源を持っているので、私たちよりも複雑な特許訴訟の費用を効果的に維持することができるかもしれない。さらに、知的財産権訴訟や行政訴訟に関連する大量の開示要求により、私たちのいくつかの機密情報が開示によって漏洩される可能性がある。さらに、任意の訴訟の開始および継続によって生じる任意の不確実性は、追加資金を調達する能力に重大な悪影響を及ぼすか、または私たちの業務、運営結果、財務状況、および将来性に重大な悪影響を及ぼす可能性がある。
私たちの現在のいくつかの候補製品と研究プロジェクトは第三者から許可を得ている。もしこれらの許可プロトコルが終了されたり、私たちの権利を縮小したと解釈された場合、私たちはこれらの技術に基づいて既存の候補製品を開発したり、新製品候補製品を開発する能力が実質的に悪影響を受けるだろう。
私たちは現在、Viracta治療会社、武田製薬有限会社、Dana Farber癌研究所、ミレニアム製薬会社、ドイツダムシュタットのMerck KGaAに少なくともある程度依存しており、Viracta治療会社、武田製薬有限会社、Dana Farber癌研究所、ミレニアル製薬有限会社、メルクKGaA、ドイツDarmstadtのライセンスと転授許可証、および潜在的に第三者との他の戦略関係に依存して、現在の候補製品の研究、開発、製造、商業化を行っている。もし私たちの任意のライセンスまたは関係、または私たちのライセンスに基づく任意のライセンス内のライセンスが終了または破壊された場合、私たちは:
94
さらに、終了または違反がなくても、私たちの知的財産権許可または再許可は、契約解釈上の相違を受ける可能性があり、これは、関連する知的財産権または技術に対する私たちの権利範囲を縮小したり、私たちの財務的または他の義務を増加させたりする可能性がある。
もし私たちが上記のいずれかの状況に遭遇した場合、私たちの業務に実質的な悪影響を及ぼす可能性があり、運営を停止させ、あなたのすべての投資損失を招く可能性があります。
もし私たちが許可協定に違反すれば、私たちの候補製品の商業化努力に実質的な悪影響を及ぼすかもしれない。
もし私たちがどんな合意にも違反したら、私たちはこれらの合意に従って私たちの候補製品または第三者に使用、開発、商業化の権利を許可し、私たちは私たちの業務に非常に重要な許可権を失うかもしれない。あるいは、私たちが第三者に知的財産権を許可する契約の義務を履行できなかった場合、あるいは私たちとライセンス者との業務関係が妨害された場合、私たちは私たちの業務に非常に重要な許可権を失う可能性があります。
私たちの現在の主要候補製品は、Viracta治療会社(F/K/a Sunesis PharmPharmticals,Inc.)によって独占的に許可されている特許および特許出願によって保護されている。私たちの現在の主要な候補製品とパイプライン、ならびに私たちが予想している最近のパイプラインは、例えば、ドイツのダムシュタットのメルクKGaAを含む他の第三者から許可を得る技術を含むことができる。
ライセンス契約によると、開発や商業化義務、潜在的な特許使用料支払いその他の義務など、職務遂行義務を含めた様々な義務を負わなければならない。もし私たちがこのような義務を履行できなかったり、他の方法で私たちの許可協定に違反した場合、私たちの許可者は適用された許可を全部または部分的に終了する権利があるかもしれない。一般的に、私たちの現在のどのライセンスも失われたり、私たちが将来獲得する可能性のある他のライセンスは、私たちの業務、見通し、財務状況、および運営結果を損なう可能性があります。
知的財産権許可は複雑な法律、商業、そして科学的な問題に関する私たちの業務に重要だ。ライセンス契約によると、私たちとライセンシーとの間で知的財産権紛争が発生する可能性があります
私たちが許可している知的財産権をめぐる紛争が、許容可能な条項で現在の許可手配の能力を維持しているか、または全くできない場合、影響を受けた候補製品の開発に成功し、商業化することができないかもしれない。さらに許可された知的財産権の所有権に議論があれば
95
特許権を追求または実行する能力が脅かされる可能性がある。もし私たちまたは私たちの許可者がこの知的財産権を十分に保護できなければ、私たちの製品商業化能力は影響を受ける可能性がある。
また,我々とViracta治療会社,武田製薬有限会社,Dana Farber癌研究所,ミレニアム製薬会社,ドイツダムシュタットのMerck KGaA社との許可を含む第三者から知的財産権や技術の許可を得るかどうかに基づいて,これらの合意のいくつかの条項は様々な解釈の影響を受ける可能性がある。可能性のある契約解釈の相違の解決は、関連する知的財産権または技術に対する私たちの権利と考えられる範囲を縮小するか、または関連協定の下での私たちの財務または他の義務を増加させる可能性があり、いずれも、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性があります。また、私たちが許可している知的財産権紛争が、商業的に許容可能な条項で許可スケジュールを維持する能力を妨害したり、損害を与えたりすれば、影響を受けた候補製品の開発や商業化に成功できない可能性があり、これは、私たちの業務、財務状況、運営結果、および見通しに大きな悪影響を及ぼす可能性があります。
私たちが最善を尽くしたにもかかわらず、私たちの許可側は、許可協定に深刻に違反していると結論するかもしれませんので、許可協定を終了し、これらの許可協定がカバーする製品や技術を開発し、商業化することができません。これらの許可が終了した場合、または基礎特許が予期される排他性を提供できなかった場合、競争相手は、私たちと同じ製品のマーケティング許可を求め、市場に押し出す権利があるであろう。これは私たちの競争地位、業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすかもしれない。
将来の製品の販売にどのくらいの印税義務が支払われるかは確定できませんが、金額は大きいかもしれません。私たちの将来の印税義務の金額は、開発や商業化に成功した製品で使用される技術や知的財産権にかかっています(あれば)。したがって、私たちが製品を開発して商業化することに成功しても、私たちは利益を達成したり維持することができないかもしれない。
将来的には、私たちは第三者技術の追加許可を得る必要があるかもしれません。これらの許可は私たちに提供できないかもしれないし、商業的に不合理な条項でしか得られないかもしれません。これは、私たちがより高価で不利な方法で私たちの業務を運営することにつながるかもしれません。
私たちは私たちの候補製品パイプラインを拡大することを求めており、一部の方式は重要な技術を付与する権利だ。私たちのビジネスの将来の成長は、私たちが許可する能力があるかどうか、または他の方法でより多くの候補製品または技術を獲得する権利があるかどうかにある程度依存するだろう。私たちは許容可能な条項で、または第三者から任意の候補製品または技術の許可または権利を得ることができることを保証することはできません。
他の会社や学術機関も、私たちの業務に関連する可能性のある特許出願をすでにまたは計画している可能性があります。時々、これらの第三者特許の侵害を避けるために、私たちは、既存または将来の候補製品をさらに開発したり、商業化するために、第三者から技術許可を得ることを要求される可能性があります。もし私たちが既存または未来の候補製品を製造、使用または販売するために必要な任意のそのような特許を含む、任意の第三者技術の許可を得ることを要求された場合、私たちは、商業的に合理的な条項でそのような許可を得ることができないか、またはそのような許可を得ることができないかもしれない。私たちの既存または将来の任意の候補製品を開発または商業化するために必要ないかなる第三者ライセンスも取得できず、関連する努力を放棄する可能性があり、これは私たちの業務と運営を深刻に損なう可能性があります。
これらの技術の内部ライセンスや買収は競争分野であり、一部のより成熟した企業も戦略を実施しており、魅力的と考えられる候補製品や技術を許可または買収することができる。これらの老舗会社は私たちより競争優位を持っているかもしれません。それらの規模、現金資源及びより強い臨床開発と商業化能力のためです。しかも、私たちを競争相手だと思っている会社は私たちに権利を権限を与えたくないかもしれない。さらに、私たちは私たちの重点分野で適切な候補製品や技術を決定できないかもしれない。もし私たちが適切な候補製品や技術の権利を得ることに成功できなければ、私たちの業務、財務状況、および見通しは影響を受ける可能性がある。
96
私たちは私たち自身の特許または私たちの許可者の特許を保護または強制する訴訟に巻き込まれるかもしれないが、これは高価で、時間がかかり、成功しないかもしれない。さらに、法廷で疑問視された場合、私たち自身が発行した特許または私たちの許可者の特許は無効または実行不可能と認定される可能性がある。
競争相手は私たちの知的財産権を侵害するかもしれない。権利侵害や不正使用を防ぐために、私たちは権利侵害請求を要求されるかもしれません。これは高価で時間がかかるかもしれません。さらに、特許侵害訴訟では、裁判所は、私たちが所有しているまたは許可中の特許が無効であること、強制執行できないこと、および/または侵害されていないと判断することができる。もし私たちまたは私たちの任意の協力者が第三者に対して法的訴訟を提起して、私たちの候補製品に対する特許を強制的に執行しなければならない場合、被告は私たちの特許または私たちの許可者の特許の全部または一部が無効であり、および/または強制的に実行できないことを反訴することができる。米国の特許訴訟では,被告が無効および/または実行不可能と主張する反訴が一般的である。有効性を疑問視する理由は、新規性の欠如、明らかな、十分な書面記述の欠如、実施できない、または明らかなタイプの二重特許を含む、いくつかの法定要件のいずれかを満たすことができなかったといわれるものを含む。主張を実行できない理由には,特許訴訟に関連する者が米国特許商標局に関連情報を隠蔽したり,起訴中に誤った陳述をしたりした疑惑が含まれている可能性がある.
第三者は、訴訟の範囲外であっても、米国特許商標局または海外特許庁に類似した無効クレームを提出することができる。この仕組みには再検討が含まれています各方面間審査プログラム,付与後審査プログラム,派生プログラムは外国法ドメインと同等のプログラム(たとえば,反対プログラム)である.法的に無効および/または実行不可能と断言された後の結果は予測不可能である。例えば、有効性の問題については、私たちは無効な以前の技術がないことを確認することはできないが、私たち、私たちの許可者、特許審査員は起訴中にこれを知らない。我々が知っていることがない保証もないが,我々の特許や特許出願が人間であるかもしれない特許や特許出願におけるクレームの有効性や実行可能な既存技術に影響を与えないと考えられるにもかかわらず,最終的にはクレームの有効性や実行可能性に影響を与える可能性がある.もし第三者が無効または強制不可能な法的主張を獲得した場合、私たちは私たちの技術または私たちが開発する可能性のある任意の候補製品の少なくとも一部またはすべての特許保護を失うだろう。このような特許保護の喪失は、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすだろう。
さらに、我々の特許および特許出願または我々の許可側の特許および特許出願によって提供される保護の広さまたは強度が脅かされている場合、会社が現在または将来の候補製品を許可、開発、または商業化することを阻止する可能性がある。
解決策が私たちに有利であっても、私たちの知的財産権に関する訴訟や他の法的手続きは、私たちに巨額の費用を発生させ、私たちの技術や管理者の正常な責任を分散させる可能性があります。このような訴訟または訴訟は、私たちの運営コストを大幅に増加させ、開発活動または任意の将来の販売、マーケティング、または流通活動に使用することができるリソースを減少させる可能性がある。私たちはそのような訴訟や訴訟手続きを適切に行うのに十分な財政的または他の資源がないかもしれない。私たちのいくつかの競争相手は、彼らがより多くの財政資源を持っているので、私たちよりもこのような訴訟や訴訟の費用を効率的に負担するかもしれない。特許訴訟や他の訴訟の開始と継続による不確実性は、市場での私たちの競争能力を損なう可能性がある。
さらに、知的財産権訴訟または私たちの知的財産権に関連する他の法的手続きが大量の開示を必要とするため、私たちのいくつかの機密情報は、そのような訴訟または他の手続きで開示によって漏洩される可能性がある。
知的財産権訴訟は不利な宣伝を招き、私たちの名声を損ない、私たちの普通株の市場価格を下落させる可能性がある。
任意の知的財産権訴訟過程において、訴訟開始に関する公告及び公聴会の結果、動議及び他の臨時手続に対する裁決又は訴訟の発展がある可能性がある。もし証券アナリストや投資家がこれらの公告が否定的だと思う場合、私たちの既存の候補製品、承認された製品、計画、または知的財産権の知覚価値は低下する可能性がある。したがって、私たちの普通株の市場価格は下がるかもしれない。このような声明はまた私たちの名声や私たちの候補製品の市場を損なう可能性があり、これは私たちの業務に実質的な悪影響を及ぼすかもしれない。
発明の優先度を決定するためには、派生プログラムが必要である可能性があり、不利な結果は、関連技術の使用を停止すること、または勝利者から権利許可を得ようと試みることを要求することができる。
97
第三者によって開始されるか、または我々によって提起されるか、または米国特許商標局によって発表される派生プログラムは、我々の特許または特許出願または我々の許可者の発明に関連する発明の優先度を決定するために必要である可能性がある。不利な結果は、私たちが関連技術の使用を停止することを要求するか、または勝利者から許可を得ようとすることを要求するかもしれない。もし勝利者が商業的に合理的な条件で私たちにライセンスを提供しなければ、私たちの業務は損害を受ける可能性があります。私たちの派生手続きの弁護は失敗する可能性があり、成功しても巨額のコストを招き、私たちの経営陣や他の従業員の日常的な責任を分散させる可能性がある。また、このようなプログラムに関連する不確実性は、私たちの臨床試験を継続するために資金を調達し、私たちの開発計画を継続し、第三者から必要な技術的許可を得たり、パートナー関係を開発または製造する能力に実質的な悪影響を及ぼす可能性があり、これらの資金は、候補製品を市場に出すのを助けるだろう。
訴訟の費用と不確実性のため、私たちは第三者に対して私たちの知的財産権を強制的に実行できないかもしれない。
訴訟の費用と不確実性のため、第三者が私たちが発表した特許を侵害しても、私たちの未解決または将来の特許出願または他の知的財産権によって発行される可能性のある任意の特許は、そのようなクレームや訴訟を提起して実行するリスク調整コストが高すぎるか、わが社または私たちの株主の最適な利益に適合していないか、または他の方法で特定の第三者に私たちの知的財産権を強制的に実行することは非現実的または望ましくない可能性があると結論するかもしれません。より多くの財力とより成熟して発展した知的財産の組み合わせを持っているので、私たちの競争相手または他の第三者は、複雑な特許訴訟または訴訟の費用を私たちよりも効果的に負担することができる。この場合、私たちは、状況を簡単に監視するか、または他の非訴訟の行動または解決策を開始または求めることで、より慎重なやり方を決定するかもしれない。また、訴訟に関連する不確実性は、私たちの製品開発、許可に必要な技術を継続し、または開発パートナー関係を構築するために必要な資金を調達する能力に影響を与える可能性があり、これらのパートナーは、私たちの候補製品を市場に出すのを助けるだろう。
最近の特許改革立法は、私たちの特許出願および/または私たちのライセンシーの特許出願をめぐる起訴、ならびに私たちが発行した特許および/または私たちのライセンシーの特許の実行または弁護の不確実性およびコストを増加させる可能性がある。
2011年9月16日、“ライシー·スミス米国発明法”または“ライシー·スミス法案”が法律に署名された。“ライシー·スミス法案”は米国特許法を多くの重大な改正を行った。このような条項は特許出願起訴方式に影響を与える条項を含み、特許訴訟に影響を及ぼす可能性もある。特に、“ライシー·スミス法案”によれば、米国は2013年3月に“最初に特許出願を提出した発明者”制度に移行し、この制度の下で、他の特許性要件を満たすと仮定して、最初に特許出願を提出した発明者は、要求された発明が第三者が最初に発明したものであるか否かにかかわらず、特許を取得する権利がある。したがって、2013年3月以降であるが、我々が以前に米国特許商標局に特許出願を提出した第三者は、たとえ第三者が発明を行う前に本発明を作成したとしても、我々の発明をカバーする特許を付与することができる。これは私たちが発明から特許出願までの提出時間を認識することを要求するだろう。さらに、有効かつ強制的に実行可能な特許を取得して維持する能力は、我々の技術と従来技術との差が、我々の技術が従来技術よりも特許を取得することを可能にするか否かに依存する。米国およびほとんどの他の国/地域の特許出願は、提出後または発行前の一定期間秘密であるため、私たちまたは私たちの許可者が、(1)私たちの候補製品に関連する特許出願または(2)発明特許または特許出願に要求される任意の発明を提出した最初の会社であることを確認しない可能性がある。
ライシー·スミス法案には、特許出願の起訴方法に影響を与え、特許訴訟に影響を与える可能性もあるいくつかの重大な変化も含まれている。これらの措置には、第三者が特許訴訟中に米国特許商標局に以前の技術を提出することを可能にすることと、特許の有効性を攻撃するために、ライセンス後審査を含む米国特許商標局によって管理される認可後手続きとが含まれる各方面間審査と派生手続き。このような提出または手続きにおける不利な裁決は、私たちの特許権の範囲を縮小したり、実行可能にしたり、無効にしたりして、私たちの競争的地位に悪影響を及ぼす可能性があります。
USPTO手続きの証拠基準は、米国連邦裁判所が特許請求の無効を宣言するために必要な証拠基準よりも低いため、第三者は、USPTO手続において、USPTOが権利請求を無効にするのに十分な証拠を提供する可能性があり、同じ証拠が最初に地域裁判所訴訟で提出された場合には、権利請求を無効にするのに十分ではない。したがって、第三者はUSPTOプログラムを使用して私たちの特許主張を無効にしようとするかもしれないが、これらの権利要件は最初に疑問視されても無効ではない
98
地裁訴訟で第三者に被告とされた。したがって、“ライシー·スミス法案”およびその実施は、私たちを起訴する特許出願および/または私たちのライセンシーをめぐる特許出願を増加させ、私たちが発行した特許または私たちのライセンシーの特許の実行または保護の不確実性およびコストを増加させる可能性があり、これらのすべては、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。
米国特許法や他の国の法律の変化は、特許の全体的な価値を低下させ、候補製品を保護する能力を弱める可能性がある。
他の製薬会社と同様に、私たちの成功は知的財産権、特に特許に大きく依存する。生物製薬産業で特許を取得して実施することは高度な技術と法律の複雑さに関連している。したがって、生物製薬特許を取得して実行することは高価で、時間と固有の不確実性だ。米国及び他の国の特許法又は特許法解釈の変化は、我々の知的財産権の価値を低下させる可能性があり、特許出願をめぐる起訴及び特許出願の実行又は保護の不確実性及びコストを増加させる可能性がある。私たちは、私たちの特許または第三者特許が許容または強制的に施行される可能性のある権利要件の広さを予測することができない。さらに、アメリカ議会や他の外国立法機関は、私たちに不利な特許改革立法を通過するかもしれない。
例えば、米国最高裁判所は近年、いくつかの特許事件に対して裁決を下しているが、場合によっては利用可能な特許保護範囲を縮小するか、場合によっては特許所有者の権利を弱めるかである。連邦巡回裁判所は最近、特許期限調整(PTA)、端末免責声明と明顕型二重特許との相互作用に関連する裁決を発表した。この判決は、いくつかの米国特許の特許条項に不確実性をもたらし、これらの特許は、同じ優先権要求を共有し、そのうちの1つの特許は、累積PTAによって別の特許の満了よりも遅れている。我々の将来の特許取得能力に関する不確実性の増加に加えて,このようなイベントの結合は,いったん特許を取得する価値に関する不確実性をもたらしている.米国議会、米国連邦裁判所、米国特許商標局または外国司法管轄区の類似機関の決定によると、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、それによって、私たちが新しい特許を獲得したり、私たちの既存の特許と私たちが将来獲得または許可する可能性のある特許を実施する能力を弱める可能性がある。
また,2023年6月1日からヨーロッパの出願は,特許付与後に統一特許裁判所(UPC)の管轄を受ける統一特許となることを選択することができる。これは欧州特許実践の大きな変化になるだろう。UPCは新しい裁判所制度であるため、裁判所には前例がなく、いかなる訴訟の不確実性も増加している。UPC実施前に付与された特許は,UPCの管轄から脱退することを選択し,UPC国の国家特許として保持することができる。まだUPC管内にある特許は,UPCによる単一撤回挑戦を受けやすい可能性があり,成功すれば,UPC署名国のすべての国の特許を無効にする可能性がある.私たちは新しい単一特許制度の長期的な影響を確実に予測することができない。
私たちは私たちの特許と他の知的財産権の発明権または所有権のクレームに疑問を受けるかもしれない。
私たちおよび/または私たちの許可者は、元従業員、協力者または他の第三者が、発明者または共同発明者として、私たちの特許または他の知的財産権において権益を有するクレームの制約を受ける可能性がある。さらに、私たちが一生懸命働いているにもかかわらず、私たちおよび/または私たちの協力者がすべての発明者の身分を確認したか、または確認することを保証することはできません。特許出願上適切な発明者が示されていないことは、その上で発行された特許が強制的に実行できない可能性がある。発明権紛争は、発明者として指定された異なる個人の貢献に関する相互矛盾した意見、外国国民が特許標的開発に参加する外国法律の影響、我々の候補製品の開発に参加する第三者の義務衝突、または潜在的な共同発明の共同所有権に関する問題によるものである可能性がある。訴訟は、これらおよび他の挑戦在庫および/または所有権のクレームを解決するために必要である可能性がある。代替または追加として、私たちはこのような知的財産権上の私たちの権利範囲を明確にするために協定を締結することができる。もし私たちがこのようなクレームを弁護することができなければ、金銭損害賠償を支払うことに加えて、貴重な知的財産権、例えば貴重な知的財産権の独占所有権や使用権を失う可能性がある。このような結果は私たちの業務に実質的な悪影響を及ぼすかもしれない。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣や他の従業員の注意を分散させる可能性がある。
99
私たちのライセンス者は第三者コンサルタントや協力者に依存する可能性がありますので、私たちのライセンス者は私たちが許可を得た特許の唯一および独占所有者ではありません。もし他の第三者が私たちが許可した特許の所有権または他の権利を持っている場合、彼らはこれらの特許を私たちの競争相手に許可することができ、私たちの競争相手は競争製品を販売することができるかもしれない。これは私たちの競争地位、業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすかもしれない。
また、私たちの政策は、知的財産権の概念や開発に参加する可能性のある私たちの従業員と請負業者が合意に署名し、このような知的財産権を私たちに譲渡することを要求しているにもかかわらず、実際に私たちが自分の知的財産権と見なしているすべての当事者とこのような合意を実行することができないかもしれない。知的財産権の譲渡は自動的に実行されない可能性があり、あるいは譲渡協定が違反される可能性があり、私たちは第三者にクレームをつけさせられたり、私たちが私たちの知的財産権の所有権だと思うことを決定するために、私たちが提起する可能性のあるクレームを弁護したりすることができます。このようなクレームは、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性があります。
特許条項は候補製品に対する私たちの競争地位を十分に長く保護するのに十分ではないかもしれない。
特許の寿命は限られている。米国では、すべての維持費が適時に支払われる場合、特許の自然失効時間は、通常、米国で最初の非臨時出願日から20年である。様々な延期があるかもしれないが、特許の有効期限とその提供される保護は限られている。私たちの候補製品をカバーする特許を取得しても、特許有効期限が切れたら、競争製品からの競争を受け入れるかもしれません。新製品候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。したがって、私たちの特許の組み合わせは、他社が私たちと似ているか同じ製品を商業化することを排除するために、私たちに十分な権利を提供していないかもしれない。
もし私たちが私たちの候補製品のために特許期間を延長しなければ、私たちの業務は実質的な損害を受けるかもしれない。
我々の候補製品のFDA上場許可の時間、期限および詳細によれば、私たちの1つ以上の米国特許または私たちの許可側の特許は、1984年の“薬品価格競争および特許期限回復法”または“ハッジ·ワックスマン修正案”に従って限られた特許期間を回復する資格がある可能性がある。ハッジ·ワックスマン改正案は、製品開発およびFDA規制審査中に失われた特許期間の補償として、特許回復期間を最長5年とすることを許可している。各FDAが承認した製品は、FDA規制審査中に失われた特許期間の補償として最大1つの特許を延長することができる。特許期間の延長は、製品承認日から計14年の期間を超えてはならず、当該承認された薬品、その使用方法又はその製造方法に関連する請求項のみが延長することができる。もし私たちの候補製品が市場許可を得たら、特定の国/地域でも特許期間を延長することができる。しかし,適用の最終期限内に出願を提出できなかったこと,関連特許の満了前に出願を提出できなかったことや適用の要求を満たしていなかったことなどにより延期が得られなかった可能性がある.しかも、特許保護の適用期間や範囲は私たちが要求しているものよりも短いかもしれない。もし私たちが特許期間の延長や回復を得ることができない場合、あるいはどのような延長の期限が私たちが要求したよりも短い場合、私たちの競争相手は私たちの特許が満期になった後に競争製品の承認を得ることができ、私たちの収入は減少する可能性があり、実質的である可能性がある。また、このような状況が発生すれば、私たちの競争相手は、私たちの臨床と臨床前データを参考にすることで、私たちの開発と試験への投資を利用し、他の場合よりも早く彼らの製品を発売する可能性がある。
私たちは世界各地で私たちの知的財産権を保護できないかもしれない。
私たちはアメリカや他の国で未解決の特許出願を持っているにもかかわらず、世界のすべての国で特許を提出、起訴、保護することは恐ろしいほど高価であり、私たちのアメリカ以外のいくつかの国の知的財産権は米国の知的財産権を広く持っていないかもしれない。また、いくつかの外国の法律は知的財産権の保護の程度はアメリカの連邦や州法律に及ばない。したがって、私たちは、米国以外のすべての国/地域で第三者が私たちの発明を実施したり、米国または他の管轄区域で私たちの発明を使用して製造された製品を販売または輸入することを阻止することができないかもしれない。競争相手は次の管轄区で私たちの技術を使うかもしれません
100
特許保護を受けずに自分の製品を開発し、他の侵害製品を私たちの特許保護のある地域に輸出するかもしれないが、法執行力はアメリカに及ばない。これらの製品は私たちの候補製品と競争する可能性があり、私たちの特許、ライセンシーの特許、または他の知的財産権は彼らの競争を効果的にまたは阻止するのに十分ではないかもしれない。
多くの会社は外国の管轄区域の知的財産権の保護と保護に重大な問題に直面している。多くの国の法制度は特許や他の知的財産権保護の強制執行を支持しておらず、これは私たちの特許が人かもしれない特許を侵害したり、私たちの独占権を侵害する方法で競争製品をマーケティングすることを阻止することを困難にするかもしれない。外国の管轄地域で私たちの特許権を強制的に執行する訴訟は、大きなコストを招く可能性があり、私たちの努力と注意を私たちの業務の他の側面から移すことは、私たちの特許または私たちのライセンシーの特許が無効または狭義に解釈されるリスクに直面する可能性があり、私たちの特許出願または私たちのライセンシーの特許出願は発行できないリスクに直面し、第三者が私たちにクレームを請求する可能性がある。私たちは私たちが起こしたどんな訴訟でも勝てないかもしれないし、判決された損害賠償や他の救済措置(もしあれば)は商業的な意味がないかもしれない。したがって、私たちが世界各地で私たちの知的財産権を実行する努力は、私たちが開発または許可した知的財産権から顕著なビジネスメリットを得るのに十分ではないかもしれません。
多くの国に強制許可法があり,これらの法律により特許権者は第三者に強制的に許可を付与される可能性がある。また、多くの国は政府機関や政府請負業者に対する特許の実行可能性を制限している。これらの国では,特許権者の救済措置は限られている可能性があり,このような特許の価値を大幅に低下させる可能性がある。もし私たちが第三者に私たちの業務に関連する任意の特許の許可を与えることを余儀なくされた場合、私たちの競争地位は損なわれる可能性があり、私たちの業務、財務状況、運営結果、および将来性は不利な影響を受ける可能性がある。
私たちの特許保護の獲得と維持は、法規および政府特許機関によって提出された様々な手続き、文書、費用支払い、および他の要求に依存しており、これらの要求に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある。
我々の特許及び/又は出願及び我々のライセンシーの特許及び/又は出願の生命期間内に、定期維持費、継続費、年会費及び各種他の政府費用は、USPTO及び各外国特許庁の異なる時間点で支払われる。私たちはシステムが私たちにこれらの費用を支払うことを注意して、私たちは私たちの外部特許年金サービスが満期になった時にこれらの費用を支払うことに依存します。また、米国特許商標局および各外国特許庁は、特許出願過程において、いくつかのプログラム、文書、費用支払い、および他の同様の条項を遵守することを要求する。私たちは名声の良い法律事務所や他の専門家を招いて私たちの遵守を助け、多くの場合、不注意は滞納金を支払うことによって、あるいは特定の管轄区域に適用される規則に従って他の方法で是正することができる。しかしながら、場合によっては、規定を遵守しないことは、特許または特許出願の放棄または失効をもたらす可能性があり、それにより、関連する管轄区域の特許権の一部または全部が失われる可能性がある。このような事件が発生すれば、私たちの業務に実質的な悪影響を及ぼす可能性がある。
もし私たちの商標と商号が十分に保護されていなければ、私たちは興味のある市場で知名度を作ることができないかもしれません。私たちの業務は悪影響を受けるかもしれません。
私たちは登録または未登録の商標または商号を使用して、私たち自身と私たちの製品をブランドしてマーケティングするつもりです。私たちの商標または商号は、挑戦、侵害、回避、または汎用商標として発表されるか、または他の商標を侵害していると判断される可能性がある。私たちはこれらの商標や商品名に対する私たちの権利を保護できないかもしれません。私たちは私たちが関心のある市場の潜在的なパートナーや顧客の中で知名度を確立するために必要です。時々、競争相手は私たちと似たような商品名や商標を採用して、ブランド表示を確立する能力を阻害し、市場の混乱を招く可能性があります。さらに、他の登録商標または商標の所有者は、我々の登録または未登録商標または商号の変異体を含む商号または商標侵害クレームを提出することができる。長期的には、私たちの商標や商号に基づいて名称を確立することができなければ、効果的に競争できない可能性があり、私たちの業務は悪影響を受ける可能性があります。商標、商業秘密、ドメイン名、著作権または他の知的財産権に関連する専有権を実行または保護する努力は無効である可能性があり、大量のコストおよび資源移転を招き、私たちの財務状況または運営結果に悪影響を及ぼす可能性があります。
101
もし私たちが私たちの商業秘密の機密性を保護できなければ、私たちの商業と競争の地位は損なわれるだろう。
私たちは、私たちの競争地位を維持するために、非特許技術的ノウハウ、技術、および他の独自の情報を含む、私たちのビジネス秘密を保護することにある程度依存しています。第三者との秘密協定の締結や、従業員、コンサルタント、コンサルタントとの秘密情報および発明協定の締結など、当社のビジネス秘密および非特許ノウハウを保護する措置を講じていますが、そのようなすべての合意が正式に実行されている保証はありません。いずれも契約に違反し、私たちのビジネス秘密を含めて独自の情報を漏洩する可能性があり、このような違反について十分な救済措置を得ることができない可能性があります。強制執行側が商業秘密を不正に開示したり流用したりする主張は困難であり、高価で時間がかかり、結果は予測できない。しかも、米国国内外のいくつかの裁判所は商業秘密をあまり望んでいないか、または保護したくない。
さらに、第三者は、この情報を取得する可能性があり、またはこの情報または同様の情報を独立して取得する可能性があり、私たちは、彼らが技術または情報を使用して私たちと競合することを阻止する権利がない。もしこのような事件が発生した場合、あるいは私たちが他の方法で私たちの商業秘密の保護を失った場合、これらの情報の価値は大幅に低下し、私たちの競争的地位は損なわれるかもしれない。もし私たちが特許発表前に特許保護を申請しない場合、または私たちの独自技術および他の機密情報を他の方法で秘密にすることができない場合、私たちが特許保護または私たちの商業秘密情報を保護する能力が脅かされる可能性がある。
私たちは私たちまたは私たちの職員たちがいわゆる機密情報や商業秘密を誤って使用または漏洩したと告発されるかもしれない。
私たちは、外部科学協力者、CRO、サードパーティ製造業者、コンサルタント、コンサルタント、潜在的パートナー、および他の第三者のような第三者の独自の地位を保護するために、将来的にセキュリティおよびセキュリティ協定を締結することができます。第三者が私たちまたは私たちの従業員が無意識にまたは他の方法で合意に違反し、第三者の独自の商業秘密または他の情報を使用または開示したと主張した場合、私たちは訴訟を受ける可能性がある。このような問題の弁護は、その是非曲直にかかわらず、巨額の訴訟費用がかかり、私たちの業務から従業員資源を大量に移転する可能性がある。私たちは私たちがこのようなどんな行動でも勝つかどうか予測できない。また、知的財産権訴訟は、その結果にかかわらず、負の宣伝をもたらす可能性があり、私たちの候補製品や技術をマーケティングまたは他の方法で商業化することを禁止する可能性があります。このようなクレームに抗弁しなければ、重大な金銭的損失責任を負わせたり、開発や商業化努力を阻害したり、延期したりする可能性があり、これは私たちの業務に悪影響を及ぼす可能性がある。私たちがこれらのクレームを弁護することに成功しても、訴訟は巨額のコストを招き、私たちの管理チームや他の従業員の注意を分散させる可能性がある。
私たちにクレームをつけた当事者は、彼らがより多くの資源を持っているので、私たちよりも複雑な知的財産訴訟の費用を効率的に負担することができるかもしれない。さらに、知的財産権訴訟に関連する大量の開示要求により、私たちのいくつかの機密情報が開示によって漏洩する可能性がある。さらに、任意の訴訟の開始および継続によって生じる任意の不確実性は、追加資金を調達する能力に重大な悪影響を及ぼすか、または私たちの業務、経営業績、財務状況、および見通しに重大な悪影響を及ぼす可能性があります。
私たちは競争相手から従業員を誤って雇用したか、または私たちまたは私たちの従業員が彼らの前の雇用主の機密情報や商業秘密を間違って使用または開示したという非難を受けるかもしれない。
バイオ製薬業界では、私たちの従業員のほかに、コンサルタントを招いて候補製品の開発を手伝ってくれていますが、これはバイオ製薬業界ではよく見られます。これらのコンサルタントの多く、および私たちの多くの従業員は、以前に他の製薬会社に雇用されていたか、または以前に他の製薬会社に提供されていた可能性があり、または現在、私たちの競争相手または潜在的な競争相手を含む他の製薬会社にコンサルティングサービスを提供している可能性がある。私たちは、私たち、私たちの従業員またはコンサルタントが無意識に、またはその前の雇用主またはその前の顧客または現在の顧客の商業秘密または他の固有の情報を使用または漏洩したという疑惑の影響を受けるかもしれない。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。もし私たちがこのようなクレームを弁護することができなければ、金銭損害賠償の支払いに加えて、貴重な知的財産権や人員を失う可能性があり、これは私たちの業務に悪影響を及ぼす可能性がある。
102
私たちがこれらのクレームを弁護することに成功しても、訴訟は巨額のコストを招き、私たちの管理チームや他の従業員の注意を分散させる可能性がある。
私たちのいくつかの候補製品の特許保護と特許起訴は第三者にかかっているかもしれない。
私たちは通常、私たちの候補製品に関連する特許の起訴、維持、および実行を制御する権利を得ることを求めているが、時々私たちの候補製品に関連する特許および特許出願の提出および起訴活動は、私たちの許可者またはパートナーによって制御される可能性がある。もし私たちのいかなる許可者やパートナーも私たちの業務の最適な利益に合った方法でこのような特許および特許出願を起訴、維持、強制実行できなかった場合、私たちの候補製品に適用されるすべての特許費用を支払うことを含めて、私たちはこれらの権利に対する私たちの知的財産権やこれらの権利に対する私たちの排他性を失う可能性があり、私たちがこれらの候補製品を開発し、商業化する能力は悪影響を受ける可能性があり、私たちは競争相手が競合製品を製造、使用、販売することを阻止できないかもしれない。また、第三者から許可された特許および特許出願の特許起訴を制御する権利があっても、特許起訴の日までの私たちの許可者およびその弁護士の行動または不作為の悪影響または損害を受ける可能性がある。
現在、私たちの知的財産権保護には、Viracta治療会社、武田製薬有限会社、ドイツダムシュタットのメルクKGaAから取得した特許と特許出願が含まれています。私たちの独占ライセンスと非独占ライセンスはいくつかの保留権利によって制限される可能性があり、これは私たちの競争地位に悪影響を及ぼすかもしれない。私たちはいくつかのライセンス特許の組み合わせの起訴と維持を制御しません;したがって、私たちは私たちの業務の最適な利益に合った方法で特許シリーズを準備、提出、起訴、または維持することを保証することはできません。“経営陣の財務状況と経営成果の討論と分析--重要な合意”を参照。私たちが許可を得た特許の組み合わせは、他社が私たちの候補製品と類似した製品の商業化を阻止するのに十分で持続的な特許保護を提供してくれないかもしれない。
政府が援助したプロジェクトによって発見された知的財産権は、“進行権”、いくつかの報告要件、および米国会社の選好のような連邦法規の制約を受ける可能性がある。これらの規定を遵守することは、私たちの独占権を制限し、非アメリカメーカーと契約を締結する能力を制限するかもしれない。
私たち自身の発行されたいくつかの特許または未解決の特許出願は、米国政府資金を使用することによって生成される可能性があり、私たちは将来、米国政府資金や贈与を使用することによって生じるかもしれない知的財産権を獲得するかもしれない。1980年の“ベハ·ドール法案”によると、米国政府は政府が援助して開発した発明に対して何らかの権利を持っている。米国政府のこれらの権利は、任意の政府の目的のために発明を使用する非排他的、譲渡不可能、撤回不可能な世界的許可を含む。さらに、ある限られた場合、米国政府は、(1)発明を商業化するのに十分なステップが取られていない場合、(2)政府は、公衆衛生または安全需要を満たすために行動しなければならない、または(3)政府は、公共使用に対する連邦法規の要求を満たすために行動しなければならない、または(3)政府は、公共使用に対する連邦法規の要求を満たすように行動しなければならない、という権利を第三者に付与する権利がある。もし米国政府が米国政府の資金や贈与を使用することによって生じる既存または将来の知的財産権の進行権を行使した場合、私たちは私たちが開発した知的財産権を許可または再許可することを余儀なくされるか、または私たちに不利な条項で許可される可能性があり、このような権利の行使によって米国政府の補償を受けることは保証されない。付与者が政府に発明を開示していない場合、又は所定の期限内に知的財産権登録申請を提出していない場合、米国政府もこれらの発明の所有権を取得する権利がある。政府援助の計画の下で生成された知的財産権もいくつかの報告要求によって制約されており、この要求を守るには大量の資源が必要かもしれない。さらに、米国政府は、これらの発明を含む任意の製品、またはこれらの発明を使用することによって製造された製品のいずれも、実質的に米国で製造されなければならないことを要求する。もし知的財産権所有者または譲受人が合理的ではあるが成功していない努力をしたことを証明することができ、同様の条項で潜在的な被許可者に許可を付与することができ、これらの許可が米国で大量に生産される可能性が高い場合、またはこの場合、資金を提供する連邦機関は、米国産業のこのような選好を放棄する可能性がある
103
国内製造は商業的に不可能だ。このような米国工業への偏愛は、このような知的財産権がカバーする製品について非米国製品メーカーと契約する能力を制限するかもしれない。
米国および外国の地政学的行動は、私たちの特許出願または任意の既存または将来のライセンシーの特許出願をめぐる起訴または維持、ならびに私たちが発行した特許または任意の既存または将来のライセンシーの特許の維持、強制執行または保護の不確実性およびコストを増加させる可能性がある。
米国または他の国または地域のいくつかの地政学的行動は、混乱をもたらす可能性があり、私たちが発行した特許または私たちの現在または未来のライセンシーの特許を維持、実行および保護する可能性があるので、私たちの特許出願または私たちの現在または未来のライセンシーの特許出願の起訴または維持に関連する不確実性およびコストを増加させる可能性がある。例えば、ロシアのウクライナ侵攻に関連する米国と外国政府の行動は、ロシアでの特許出願の提出、起訴、維持を制限または阻止する可能性がある。政府の行動はまたロシアで発行された特許を維持することを阻止するかもしれない。これらの行動は、ロシアにおける特許権の一部または全部の喪失を招く可能性がある私たちの特許または特許出願を放棄または失効させる可能性がある。このような事件が発生すれば、私たちの業務に実質的な悪影響を及ぼす可能性がある。また、ロシア政府は、2022年3月に、ロシアの会社や個人がロシアで友好的でないと考えている米国や他の国で、同意または補償なしに、米国および他のロシアが友好的でないと考えている国を有する公民権または国籍、米国および他の国に登録されている、または主にこれらの国で商業または利益活動を行う特許権者が所有する発明を利用することを可能にする法令を採択した。したがって、私たちは、第三者がロシアで私たちの発明を実践したり、私たちの発明を使用して製造された製品をロシア国内で販売したり輸入したりすることを防ぐことができないだろう。さらに、私たちは2023年10月に開始されたイスラエルの武力衝突の事態に集中している。この紛争はまだ発展しているが,これまで紛争は我々の業務や運営結果に悪影響を与えていない.しかし、これらの矛盾が悪化したり悪化したりすれば、私たちの競争地位が損なわれる可能性があり、私たちの業務、財務状況、経営業績、見通しは不利な影響を受ける可能性がある。
私たちの普通株に関するリスクは
私たちの普通株の活発さと流動性取引市場は永遠に続かないかもしれない。したがって、買い取り価格や買い取り価格以上の価格で普通株を転売することができないかもしれません。
私たちの普通株の活発な取引市場は永遠に続かないかもしれない。私たちの普通株の時価は買い取り価格から下落するかもしれない。これらと他の要素のため、あなたが持っている普通株を買い取り価格以上の価格で転売することができないかもしれません。活発な市場の不足は株を売りたいときや合理的だと思う価格で株を売る能力を弱めるかもしれません。活発な市場の不足はまたあなたの株の公平な市場価値を下げるかもしれない。
また、活発でない市場は、普通株を売却することで資金を調達する能力を弱める可能性があり、戦略的協力を達成したり、私たちの普通株を対価格で会社や製品を買収する能力を弱める可能性があります。
私たちの四半期の経営業績は大幅に変動する可能性があり、あるいは投資家や証券アナリストの予想を下回る可能性があり、すべての状況は私たちの株価の変動や下落を招く可能性がある。
私たちの経営業績は四半期変動の影響を受けると予想されています。私たちの純損失と他の経営業績は様々な要素の影響を受けます
104
もし私たちの四半期の経営業績が投資家や証券アナリストの予想を下回れば、私たちの普通株の価格は大幅に低下する可能性がある。また、私たちの経営業績のどの四半期の変動も、私たちの普通株の価格を大幅に変動させる可能性があります。私たちの財務業績を四半期比較することは必ずしも意味があるわけではなく、私たちの将来の業績としての指標に依存すべきではないと考えられます。
私たちの普通株の市場価格は非常に不安定になる可能性があり、これは私たちの普通株の購入者に大きな損失をもたらすかもしれない。
私たちの普通株の市場価格は引き続き高度に変動し、様々な要素の広範な変動を受ける可能性があり、その中のいくつかの要素は私たちがコントロールできない。このような変動のため、あなたは支払う価格以上で普通株を売ることができないかもしれません。私たちの普通株の市場価格は、本“リスク要因”の部分に記載されている他のリスクと以下を含む多くの要素の影響を受ける可能性がある
105
そのほか、株式市場、特に製薬、生物製薬と生物技術株式市場は、極端な価格と出来高の変動を経験し、新冠肺炎の疫病、インフレ激化と金利変化及びサプライチェーンの中断を含み、これらは往々にして発行者の経営業績と関係がない或いは比例しない。また、我々普通株の取引価格は、第三者が市場価格を押し下そうとする悪影響を受ける可能性がある。もし私たちの株が下落すれば、空売り者や他の人たち--その中の一部の人はソーシャルメディアに匿名で投稿して利益を得るかもしれません。彼らの活動は私たちの株価に悪影響を及ぼすかもしれません。これらの広範な市場と業界要素は、私たちの実際の経営業績にかかわらず、私たちの普通株の市場価格を深刻に損なうかもしれない。本“リスク要因”部分に記載されたリスクを含む、上記の任意のリスクまたは任意の広範な他のリスクを達成することは、私たちの普通株の市場価格に重大かつ不利な影響を与える可能性がある。
106
過去、証券集団訴訟は上場企業の証券市場価格が下落した後に提起されることが多かった。このリスクは生物製薬会社と特に関連しており,これらの会社は近年大幅な株価変動を経験している。私たちがこのような訴訟に直面すれば、巨額のコストを招き、経営陣の注意と資源を移転させる可能性があり、これは私たちの業務を損なう可能性があります。
私たちは現在、私たちの普通株に配当金を支払うつもりはありませんので、私たちの株主が投資リターンを達成する能力は私たちの普通株の価値増加に依存します。
私たちは普通株の現金配当金を発表したり支払ったりしたことがない。私たちは現在、運営を支援し、私たちの業務の成長と発展に資金を提供するために、すべての利用可能な資金と未来の任意の収益を維持するつもりです。予測可能な未来に、私たちは私たちの株のいかなる現金配当金も発表したり支払うつもりはない。したがって、私たちの普通株のどんな投資収益も私たちの普通株価値の増加にかかっていることは確実ではない。
私たちの普通株を売る大量の株は私たちの普通株の価格を下落させるかもしれない。
公開市場で私たちの大量の普通株を売ることはいつでも起こる可能性がある。もし私たちの株主や市場が私たちの株主が公開市場で私たちの普通株を大量に販売しようとしていると思うなら、私たちの普通株の市場価格は大幅に低下する可能性があります。
2023年12月31日現在、私たちが発行した普通株式総数87,227,132株を保有する保有者は、いくつかの条件に適合する場合、彼らの株式に関する登録声明を提出する権利があるか、または彼らの株式を私たち自身または私たちの株主のために提出する可能性のある登録声明に含めることを要求する。私たちはまた登録された普通株を持っていて、私たちは私たちの株式激励計画に基づいて発行することができる。これらの株は発行されると公開市場で自由に取引することができる。
公開市場で私たちの株や売却可能な株が私たちの普通株の市場価格にどのような影響を与えるか予測できません(あれば)。しかし、将来的には、私たちの未償還オプションの行使や未償還制限株式単位の奨励を付与する際に発行される株を含む、我々の普通株を公開市場で大量に販売したり、このような売却が発生する可能性があると考えられたりして、私たちの普通株の市場価格に悪影響を及ぼす可能性がある。
私たちはまた、未来に私たちが計画している業務を継続するために多くの追加資本が必要かもしれないと予想している。資本を調達するために、私たちは1回または複数回の取引で時々決定された価格および方法で普通株、転換可能証券、または他の株式証券を販売することができる。株式または他の株に変換可能な証券を売却して発行することで追加資本を調達すれば、我々の株主は希釈されるだろう。これらの売却、あるいは市場で大量の株式保有者が株を売却しようとしているとの見方は、我々の普通株の市場価格を低下させる可能性がある。
私たちの主要株主と経営陣は私たちのかなりの割合の株を持っており、株主の承認が待たれる事項に大きな制御を加えることができるだろう。
2023年12月31日現在の私たちの普通株の実益所有権によると、私たちの役員、取締役、5%以上の株式の所有者と、それぞれの関連会社の実益は、私たちの49.5%の議決権付き株を持っています。このグループの投票権は、彼らが持っている無投票権を普通株に転換する程度に増加する可能性がある。したがって、これらの株主が一緒に行動すれば、取締役の選挙、私たちの組織文書の修正、任意の合併、合併、または私たちのほとんどの資産、および任意の他の重大な会社取引を含む、株主の承認を必要とする会社の行動の結果に大きな影響を与え続ける。これらの株主の利益はあなたの利益とは違うかもしれないし、あなたの利益と衝突する可能性もある。例えば、これらの株主は、わが社の支配権の変更を延期または阻止することができ、たとえこのような制御権の変更が私たちの他の株主に利益をもたらすとしても、私たちの株主が私たちの会社や私たちの資産を売却する際に普通株のプレミアムを得る機会を奪い、私たちの普通株の現行の市場価格に影響を与える可能性がある。
107
私たちの定款書類やデラウェア州法律によると、反買収条項は私たちの買収を阻止または延期する可能性があり、これは私たちの株主に有利になる可能性があり、私たちの株主が現在の経営陣を交換または更迭しようとすることを阻止することができるかもしれない。
私たちが再記述した会社登録証明書と私たちの改訂と再記述の定款には、わが社の制御権変更を延期または阻止する可能性のある条項が含まれています。これらの規定は、我々の取締役会の現職メンバーが指名した取締役や他の会社の行動ではなく、株主が我々の経営陣を変動させることを含めて、株主を選挙することを困難にする可能性もある。これらの規定には
また、デラウェア州会社法(DGCL)第203条は、わが社への支配権変更を阻止、延期、または阻止する可能性がある。第203条私たちと15%以上の普通株式を保有する者との間の合併、業務合併、その他の取引には、いくつかの制限が加えられている。
私たちの組織文書の独占法廷条項は、司法フォーラムで、私たちまたは私たちの任意の取締役、上級管理者または他の従業員、またはそのようなクレームを引き起こす任意の発行引受業者とトラブルを引き起こすクレームに有利であると考える株主の能力を制限する可能性があり、これは、そのようなクレームに関連する訴訟を阻害する可能性がある。
私たちが再記述した会社登録証明書は、法律で許容される最大範囲内で、デラウェア州衡平裁判所は、私たちを代表して提起された任意の派生訴訟または訴訟、受託責任に違反した任意の訴訟、DGCL、私たちが再記載した会社登録証明書、または私たちの改正と再記載された定款に基づいて私たちにクレームを提起した任意の訴訟、または内部事務原則によって管轄されている私たちのクレームに対する任意の訴訟であることが規定されている。この排他的裁判所条項は、1934年に改正された“証券取引法”または“取引法”に規定された義務または責任を執行するための訴訟には適用されない。しかし、排他的裁判所の規定によって列挙された1つまたは複数のカテゴリに属する訴訟に適用することができる。
このような裁判所条項の選択は、我々または私たちの任意の取締役、上級管理者または他の従業員、またはそのようなクレームを引き起こす任意の発行された引受業者と紛争を引き起こすと考えられる株主のクレームを司法裁判所で提出する能力を制限する可能性があり、これは、そのようなクレームに関連する訴訟を阻害する可能性がある。代替的に、裁判所が、私たちが再記載した会社登録証明書に含まれる裁判所条項の選択が訴訟において適用されないか、または実行できないことを発見した場合、私たちは、他の司法管轄区域でこのような訴訟を解決することに関連する追加費用を生じる可能性があり、これは、私たちの業務、運営結果、および財務状態を損なう可能性がある。
改正された1933年証券法又は証券法第22条によると、連邦裁判所及び州裁判所は、証券法又はその下の規則及び条例を執行するために生じた任意の義務又は責任について提起されたすべてのクレームに対して同時管轄権を有する。私たちの改正と重述の付則は、アメリカ合衆国の連邦地域裁判所は法律の許容の最大程度で解決となるであろう
108
起訴状に指名された任意の被告に対して提起されたすべての訴因を含む、証券法または連邦フォーラム規定に基づいて訴因を提出する起訴状。本条文は、疑問を生じさせないために、吾等に恩恵を受け、吾等、吾等の上級者及び取締役、苦情を招く任意の発売の引受業者、及び任意の他の専門実体(その専門が当該者又は実体になされた声明を発行し、発売書類の任意の部分を作成又は証明した)によって実行することを目的としている。私たちが連邦フォーラムの規定を採択することを決定する前に、デラウェア州最高裁判所は、デラウェア州の法律によると、これらの規定は事実上有効であると判断した。連邦または州裁判所はデラウェア州最高裁判所の裁決に従わないかもしれないし、特定の事件で連邦フォーラム条項を実行することを決定する可能性があるが、連邦フォーラム条項の適用は、私たちの株主が証券法を実行するために生じるいかなる義務や責任のために提起された訴訟は連邦裁判所で提起されなければならず、州裁判所で提起することはできず、私たちの株主は連邦証券法とその下の規則と法規を遵守することを放棄することはできないことを意味する。
取引法第27条は,連邦政府が取引法又はその下の規則及び条例を実行するために生じた任意の義務又は責任に対して提起されたすべてのクレームに対して排他的連邦管轄権を有すると規定されている。また,排他的裁判所条項も連邦裁判所条項も,取引法で規定されているいかなる義務や責任を実行するための訴訟にも適用されない.したがって、私たちの株主は、取引法またはその下の規則と法規によって生じるいかなる義務または責任を実行するために連邦裁判所に訴訟を提起しなければならず、私たちの株主は連邦証券法とその下の規則と法規を遵守することを放棄することはできない。
任意の個人またはエンティティが、私たちの任意の証券の任意の権益を購入または他の方法で取得または保有することは、連邦フォーラム条項を含む、私たちの独占フォーラム条項を通知し、同意したとみなされなければならない。これらの条項は、株主がクレームを出す能力を制限する可能性があり、株主が、私たちまたは私たちの役員、役員または他の従業員、またはそのようなクレームの発行を引き起こす任意の引受業者と紛争した場合、彼らが選択した司法裁判所でそのようなクレームを提出するコストが増加する可能性があり、これは、私たちと私たちの役員、役員、および他の従業員に対する訴訟を阻止する可能性がある。
証券や業界アナリストが私たちの業務に関する研究や報告を発表していない場合、または彼らが私たちの会社に不利または誤った意見を発表した場合、私たちの普通株価格と取引量は低下する可能性がある。
私たちの普通株の取引市場は、業界や証券アナリストが発表した私たちまたは私たちの業務に関する研究と報告の影響を受けています。私たちはアナリストや彼らの報告書に含まれている内容と意見に対して何の統制権もない。もし私たちのどのアナリストが私たち、私たちのビジネスモデル、私たちの知的財産権、あるいは私たちの株式表現に否定的または誤った意見を発表した場合、あるいは私たちの臨床前研究と未来の臨床試験と運営結果がアナリストの期待に達しなかったら、私たちの株価は下落するかもしれない。1人以上のそのようなアナリストが私たちへの報告を停止したり、私たちに関する報告書を定期的に発表できなかったりすれば、私たちは金融市場で可視性を失う可能性があり、これは逆に私たちの株価や取引量を低下させる可能性がある
一般リスク因子
上場企業として、私たちの運営コストが増加し、私たちの経営陣は、新しいコンプライアンス措置やコーポレートガバナンス実践を実施するために多くの時間を投入する必要があります。
上場企業として、私たちは多くの法律、会計、その他の費用を負担していますが、これは私たちが民間会社として起きていないことです。サバンズ-オクスリ法案、ドッド-フランクウォール街改革と消費者保護法、ナスダック世界選りすぐりの市場またはナスダックの上場要求、その他の適用される証券規則と法規は、有効な開示、財務制御と会社管理やり方の確立と維持を含む上場企業に対して様々な要求を提出した。私たちの経営陣と他の人たちはこのようなコンプライアンス計画を実施するために多くの時間を投入する必要があるだろう。さらに、私たちはこれらの規則と法規が私たちの法律と財務コンプライアンスコストを大幅に増加させ、いくつかの活動をより時間的で高価にすると予想する。例えば、これらの規制は、取締役や上級管理者責任保険をより難しく、より高価に得ることができ、十分な保険範囲を維持するために多くの費用を発生させることが要求される可能性があると予想されます。私たちは、これらの要求に応答して生成される可能性のある追加コストの金額や時間を予測または推定することができない。これらの要求の影響は、私たちの取締役会、取締役会委員会、または役員に参加することをより難しくし、合格した人を引き付け、維持することを可能にするかもしれない。増加の
109
コストは他の業務分野でコストを下げたり、製品の商業化後に価格を上げたりすることが要求されるかもしれません。また,これらの規則や条例は異なる解釈を持つことが多く,特殊性に欠ける場合が多いため,規制機関や理事機関が新たな指導意見を提供するにつれて,実践における適用は時間とともに変化する可能性がある。これは遵守事項に関する持続的な不確実性と、開示と統治慣行を絶えず修正するために必要なより高いコストをもたらす可能性がある。
財務報告書を適切かつ効果的な内部統制を維持することができなければ、正確かつタイムリーな財務諸表を作成する能力が損なわれる可能性がある。
サバンズ·オキシリー法第404条によると、私たちの経営陣は財務報告書の内部統制に対する私たちの有効性を報告しなければならず、私たちの独立公認会計士事務所は私たちの10-K表年次報告書で財務報告書の内部統制に対する私たちの有効性を証明しなければならない。私たちの経営陣と独立公認会計士事務所を管理して財務報告内部統制を評価するために達成しなければならない基準のルールは複雑で、大量の文書、テスト、可能な救済措置が必要です。我々と独立公認会計士事務所が財務報告内部統制を評価する際には、外部コンサルタントを招聘し、財務報告内部統制の十分性を評価·記録するために、外部コンサルタントを招聘し、財務報告内部統制の十分性を評価·記録するために、引き続き適切な措置を講じて制御プログラムを改善し、検証制御が文書に沿って機能しているかどうかをテストすることにより、財務報告内部統制の継続的な報告及び改善手順を実施する必要がある。この過程は時間がかかり、高価で複雑になるだろう。
財務報告の内部統制を維持することができず、必要な新しいまたは改善された制御を実施できなかったか、または実施中に困難に遭遇した場合、財務状態、運営結果、またはキャッシュフローを正確に報告する能力を深刻に抑制する可能性がある。もし私たちまたは私たちの独立公認会計士事務所が財務報告の内部統制に有効であると結論できない場合、あるいは私たちの独立公認会計士事務所が私たちの財務報告の内部統制に重大な弱点や重大な欠陥があると判断した場合、投資家は私たちの財務報告の正確性と完全性に自信を失う可能性があり、私たちの普通株式市場価格は下落する可能性があり、私たちはナスダック、米国証券取引委員会、または他の規制機関の制裁または調査を受ける可能性がある。財務報告の内部統制のいかなる重大な欠陥を補うことができなかったり、上場企業に必要な他の効果的な制御システムを実施または維持できなかったりすることは、将来的に資本市場に参入する機会を制限する可能性もある。
私たちの開示統制と手続きはすべてのミスや詐欺を阻止したり検出できないかもしれない。
私たちは“取引所法案”の定期報告書の要求事項を守らなければならない。我々の開示制御および手続きは、取引所法案に基づいて提出または提出された報告書に開示されなければならない情報が蓄積され、管理層に伝達され、米国証券取引委員会規則および表に指定された期間内に記録、処理、まとめ、報告されなければならないことを合理的に確保するために設計されている。任意の開示制御およびプログラムまたは内部制御およびプログラムは、発想および動作がどのように完全であっても、絶対的な保証ではなく、合理的な保証を提供することしかできず、制御システムの目標が達成されることを確保することしかできないと信じている。
これらの固有の限界は,意思決定過程における判断が誤りである可能性があり,簡単な誤りや誤りによって故障が発生する可能性があるという現実を含む.例えば、私たちの役員または役員は、意図せずに新しい関係または手配を開示できなかった可能性があり、関連するいかなる取引も開示できなかった。さらに、ある人の個人的な行動、2人以上の結託、または無許可超越制御は、制御を回避することができる。したがって,我々の制御システム固有の制限により,誤りや詐欺による誤り陳述が発生し,発見されない可能性がある.しかも、私たちは他の分野での私たちの業務のリスクを識別して解決するための正式なリスク管理計画を持っていない。
私たちは証券訴訟の影響を受けるかもしれませんが、これは高価で、経営陣の注意をそらすかもしれません。
私たちの普通株の市場価格は変動するかもしれない。株式市場全体、特にナスダックとバイオ製薬会社は、極端な価格と出来高変動を経験しており、これらの変動は往々にしてこれらの会社の経営業績に関係なく、あるいは比例しない。過去に、株式市場の価格変動を経験した会社は証券集団訴訟の影響を受ける。
110
私たちは未来にこのような訴訟の目標になるかもしれない。私たちに対する証券訴訟は巨額のコストを招き、私たちの経営陣の注意を他の業務から移す可能性があり、これは私たちの業務を深刻に損なう可能性があります。
不利なグローバル経済状況は、私たちの業務、財務状況、株価、経営業績に悪影響を及ぼす可能性があります。
私たちの経営業績は世界経済と世界金融市場の全体的な状況の悪影響を受ける可能性があります。例えば、2007-2008年の世界金融危機は資本と信用市場の激しい変動と混乱をもたらした。同様に、新冠肺炎疫病に関連する変動は資本と信用市場の深刻な不安定と混乱を招き、ここ数ケ月以来、全世界経済は金利とインフレ上昇の影響を受け、衰退或いは経済が更に低下する可能性がある。また、最近では世界の銀行システムの安定性に対する懸念が出ている。例えば、2023年3月10日、私たちの銀行業パートナーの一つであるシリコンバレー銀行(SVB)は、カリフォルニア州金融保護·革新部によって閉鎖され、連邦預金保険会社(FDIC)を係に任命した。SVBではごく少量の現金しかありませんし、その時以来、FDICはSVBのすべての預金者が保護されることを示していますが、連邦政府がSVB預金者のようにすべての預金者を保証し、さらなる銀行倒産やグローバル銀行システムの持続的な不安定が私たちの業務や財務状況に悪影響を及ぼす可能性があるという保証はありません。同様に、資本と信用市場は世界的な地域紛争の悪影響を受ける可能性があり、より広範またはより多くの世界的な衝突、衝突に対応するために実施される世界的な制裁またはエネルギー危機が発生する可能性がある。世界金融危機のような深刻または長期的な経済低迷は、候補薬の需要減少や、必要に応じて許容可能な条件で追加資金を調達する能力(あれば)を含む様々なリスクを私たちの業務にもたらす可能性がある。経済が疲弊したり下落したりすることは、私たちのサプライヤーに圧力を与え、供給中断を招く可能性もある。このような状況や現在の経済環境や金融市場状況が私たちの業務に悪影響を及ぼす可能性のあるすべての方法を予想することはできません。また、私たちの株価は下落する可能性があり、一部の原因は株式市場の変動といかなる一般的な経済低迷でもある。
項目1 B。未解決の従業員のコメント。
ない。
プロジェクト1 C。ネットワークセキュリティです。
会社の取締役会は患者、投資家、ビジネスパートナー、従業員の信頼と信頼を維持することが重要であることを認識している。取締役会は会社のリスク管理計画に対する監督に積極的に参与し、ネットワークセキュリティは会社企業のリスク管理全体の方法の重要な構成部分である。会社のネットワークセキュリティ政策、標準、プロセスと実践は完全に会社のERM計画に組み込まれ、国家標準と技術研究所、国際標準化組織とその他の適用する業界標準に基づいて確立された公認枠組みである。全体的に、会社は、ネットワークセキュリティ脅威を識別、予防、緩和、救済し、ネットワークセキュリティイベントが発生したときに有効に対応することによって、会社が収集し、格納している情報の機密性、安全性、および可用性を維持することに重点を置いている包括的、機能を越えた方法でネットワークセキュリティリスクに対応することを求めている。
リスク管理と戦略
会社の全面ERM手法の重要な要素の1つとして、会社のネットワークセキュリティ計画は以下の重要な分野に重点を置いている
統治する:“ガバナンス”というタイトルの下でより詳細に議論されているように、取締役会のネットワークセキュリティリスク管理の監督は、管理層のデータプライバシーおよびセキュリティ委員会メンバーを含む会社の情報技術担当者および他の管理層メンバーと定期的に相互作用する取締役会監査委員会の支持を得ている。
協力方法:同社はネットワークセキュリティ脅威と事件を識別、予防、緩和するための全面的かつ機能的な方法を実施するとともに、制御と制御を実施した
111
管理層がこのようなイベントの公開開示および報告に関する決定をタイムリーに行うことができるように、特定のネットワークセキュリティイベントを迅速にアップグレードする手順を規定する。
情報セキュリティ:我々はビジネス上の合理的なプログラムに基づいて組織、行政と技術措置を実施し、(I)国家標準と技術研究所が使用する業界標準情報セキュリティ措置を使用し、(Ii)ISO/IEC 27000シリーズ標準に適合するセキュリティ措置、(Iii)サバンズ-オクスリ法案とSSAE 18/ISAE 3402、(Iv)EUの一般データ保護条例とカリフォルニア消費者プライバシー法、(V)ISO/IEC 22301規格に適合する業務連続性管理措置と(Vi)その他の公認された業界標準を使用し、それぞれの場合、機密性、完全性を保護することを目的としている。私たちのインフラとデータの利用可能性と私たちが運営している柔軟性。
技術保障措置:会社は、ファイアウォール、侵入防御および検出システム、アンチマルウェア機能、アクセス制御など、会社の情報システムをネットワークセキュリティ脅威から保護するための技術保障措置を配備しており、これらの措置は、脆弱性評価およびネットワークセキュリティ脅威情報による評価と改善を行っている。
イベント応答と復旧計画:会社は、ネットワークセキュリティ事件に対する会社の応答に全面的に対応し、このような計画を定期的にテストし、評価するために、全面的なイベント応答と回復計画を策定し、維持しています。
第三者リスク管理:当社は、当社のシステムのプロバイダ、サービスプロバイダ、および他の外部ユーザ、および第三者システムに影響を与えるネットワークセキュリティイベントが発生した場合に、当社の業務に悪影響を及ぼす可能性のある第三者システムを含む、リスクに基づく方法で第三者が提案したネットワークセキュリティリスクを識別し、監視することを堅持する。
教育と意識:会社は従業員と請負業者にネットワークセキュリティ脅威に関する定期的な強制訓練を提供し、1つの手段として、会社の人員にネットワークセキュリティ脅威に対応する有効なツールを把握させ、会社が発展していく情報セキュリティ政策、基準、プロセスとやり方を伝達する。
リスクと情緒的評価:会社はネットワークセキュリティの脅威と事件に対応するための政策、基準、プロセス、やり方を定期的に評価し、テストする。これらの努力は、監査、評価、デスクトップ演習、脅威モデリング、脆弱性テスト、および我々のネットワークセキュリティ対策および計画の有効性を評価するための他の演習を含む幅広い活動を含む。当社は定期的に第三者を招いて、情報セキュリティ成熟度評価、監査、および我々の情報セキュリティ制御環境と運営有効性の独立審査を含む当社のネットワークセキュリティ対策を評価しています。この等の評価、監査及び検討の結果は監査委員会及び取締役会に報告されるが、当社も当該等の評価、監査及び検討により提供された資料に基づいて、必要に応じてネットワークセキュリティ政策、基準、プロセス及びやり方を調整する。
保険:私たちは情報安全リスク保険の範囲を維持する。
統治する
取締役会は、監査委員会と協調して、ネットワークセキュリティ脅威によるリスク管理を含む会社の機関リスク管理プログラムを監督する。取締役会と監査委員会は定期的にネットワークセキュリティリスクに関する紹介と報告を受けており、これらの報告は最近の発展、絶えず発展する基準、脆弱性評価、第三者と独立審査、環境脅威、技術傾向及び会社の同業者と第三者に関連する情報セキュリティ考慮要素を含む広範なテーマに関連している。監査委員会および監査委員会はまた、既定の報告のハードルに適合するネットワークセキュリティ事件に関するタイムリーな情報と、問題が解決されるまで、このような事件の継続的な最新状況を受信した。取締役会および監査委員会は、毎年、会社の情報技術担当者を含む会社のネットワークセキュリティリスク管理の方法について、データプライバシーおよびセキュリティ委員会のメンバーと議論する。
情報技術担当者は、データプライバシー·セキュリティ委員会(当社の最高経営責任者、財務責任者、最高経営責任者および財務責任者を含む)および総法律顧問と調整し、企業情報システムをネットワークセキュリティの脅威から保護するための計画を会社全体で連携して実施し、会社のイベント応答および回復計画に基づいて任意のネットワークセキュリティイベントに迅速に対応する。会社の成功に便宜を図る
112
ネットワークセキュリティリスク管理計画によると、会社全体が多学科チームを配置してネットワークセキュリティ脅威に対応し、ネットワークセキュリティ事件に対応している。これらのグループとの継続的なコミュニケーションを通じて、情報技術担当者とデータプライバシー·セキュリティ委員会はリアルタイムでネットワークセキュリティ脅威と事件の予防、検出、緩和、修復状況を監視し、適切な時に監査委員会にこれらの脅威と事件を報告する。
この情報技術担当者は情報技術と情報セキュリティ分野で20年以上様々な職務を担当しており、3社の上場企業で情報技術部副主任総裁を務めている。情報技術学部主任は工商管理·管理情報システム専攻の学部学位を持っている。会社の最高経営責任者、最高経営責任者、最高財務責任者、総法律顧問は、それぞれの分野の学部や大学院生の学位を持ち、会社や同様の会社ではネットワークセキュリティ脅威からのリスクを含む豊富なリスク管理経験を持っている。
私たちは、以前のいかなるサイバーセキュリティ事件も含めて、既知のネットワークセキュリティ脅威からいかなるリスクも発見しておらず、これらの脅威は、私たちの運営、業務戦略、運営結果、または財務状況を含む、または合理的に私たちに重大な影響を与える可能性がある。もし私たちが将来重大なサイバーセキュリティ事件に遭遇すれば、このような事件は私たちの運営、業務戦略、運営結果、あるいは財務状況に実質的な影響を与えるかもしれない。私たちが直面しているネットワークセキュリティリスクおよびそれに関連する私たちの業務に潜在的な影響に関するより多くの情報については、“私たちのセキュリティ対策が破壊された場合、または私たちの情報技術システムまたは私たちのCRO、CMO、サプライヤー、請負業者、コンサルタント、または他の第三者パートナーのシステムが故障したり、セキュリティホール、ネットワーク攻撃、データ損失または漏洩、または他の中断を受けたりすると、私たちの開発計画が実質的に破壊され、私たちの業務や他の個人情報に関連する敏感な情報を危険にさらしたり、重要な情報へのアクセスを阻止したり、私たちの名声や他の方法で私たちの業務に悪影響を与える可能性があり、私たちのビジネスに悪影響を及ぼす可能性があります
113
情報技術EM 2.財産.
私たちの主な行政事務室はカリフォルニア州ブリスベンにあり、私たちはそこで約12,000平方フィートのオフィス空間を借りました。レンタル契約は2024年12月に満期になります。賃貸契約期間を延長する選択もなく、賃貸契約が満期になる前に賃貸契約を終了する選択もない。私たちはこれらの施設が私たちの持続的な需要に対応するのに十分だと信じており、もし私たちがもっと多くの場所が必要なら、私たちは商業的に合理的な条件でより多くの施設を得ることができるだろう。
イットM 3.法的訴訟
当社は時々正常な業務過程で発生する訴訟の当事者になる可能性があります。当社はいかなる重大な法律手続きの影響も受けておらず、その知る限り、現在のところ重大な法的手続きが待っていることや脅かされていることはない。
情報技術EM 4.鉱場安全を開示する
適用されません。
114
第II部
情報技術EM 5.登録者普通株、関連株主事項、発行者が株式証券を購入する市場
普通株式市場情報
私たちは2021年5月26日に上場企業になった。私たちの普通株はナスダック資本市場で看板取引され、取引コードは“曙光”です
記録保持者
我々の譲渡エージェントが提供する情報によると,2024年2月21日現在,我々普通株の登録株主は約87,384,856人である.株主の実際の数は受益者である株主を含む記録保持者の数を超えているが、その株は仲介人や他の被著名人が街頭名義で保有している。この数の登録所有者は、その株式が他のエンティティが信託形式で保有する可能性のある株主も含まれていない。
配当政策
私たちは普通株の現金や株式配当金を発表したり支払ったりしたことがない。私たちは現在、すべての利用可能な資金と任意の将来の収益を維持し、私たちの業務運営のために、予測可能な未来に私たちの普通株にいかなる配当も支払わないと予想している。将来的に普通配当金を発表する任意の決定は私たちの取締役会が適宜決定し、私たちの財務状況、経営業績、資本要求、一般業務状況と私たちの取締役会が関連する他の要素に依存するかもしれない。
株式補償計画に基づいて発行された証券
本プロジェクトに要求される情報は、本10−Kフォーム年次報告の修正案に含まれるか、または本テーブル10−K年次報告に含まれる財政年度終了後120日以内に、参照により第14 A条に基づいて提出された最終依頼書に盛り込まれる。
株式表現グラフ
取引法第18節の規定によれば、本業績グラフは、特定の参照によって明確に規定されない限り、“募集材料”または米国証券取引委員会への“保存”とみなされてはならないし、参照によって特定されない限り、証券法または一般取引法に従って提出された任意の文書に組み込まれてはならない。
次の図は、私たちの普通株が2021年5月27日(私たちの普通株がナスダック全世界ベスト市場で取引を開始した日)から2023年12月31日までの間に株主にもたらした累積総リターンを示し、ナスダックバイオテクノロジー指数、ナスダック総合指数と標準プール500指数と比較した。100ドルの初期投資および配当金の再投資は、我々の普通株式および各普通株で行われたと仮定されている
115
指数です。業績グラフに示されている我々の普通株の歴史的株価表現は、必ずしも未来の株価表現を指示したり予測したりすることを意図しているわけではない。
最近売られている未登録証券
ない。
登録証券を使って収益を得る
ない。
発行者および関連購入者が株式証券を購入する
ない。
情報技術EM 6.保留
116
情報技術経営陣の財務状況と経営結果の検討と分析。
当社の財務状況と経営業績の検討と分析、本年度報告書でForm 10-K形式で提供されている連結財務諸表および関連付記をお読みください。本議論および分析に含まれるまたは本Form 10-K年次報告の他の部分に記載されている情報は、リスクおよび不確定要因に関する前向きな陳述を含む、我々の業務および関連融資の計画および戦略に関する情報を含む。本年度報告10-K表の“リスク要因”の部分に列挙された要素を含む多くの要因の影響により、我々の実際の結果は、以下の議論および分析に含まれる前向き陳述に記載または示唆された結果とは大きく異なる可能性がある。2022年12月31日までの財政年度と2021年12月31日までの財務業績の比較については、2023年3月6日に米国証券取引委員会に提出された2022年12月31日までの財政年度報告の第7項、すなわち経営陣の財務状況と経営成果の検討と分析を参照されたい。本報告で使用されるように、文脈が別に説明されていない限り、“私たち”、“当社”または“初日”は、初日のバイオ製薬会社を意味する。
概要
設立初日は重要な満足されていない需要を解決するためである:児童癌治療発展の深刻な不足。私たちの名前のインスピレーションは、医師と患者とその家族が初歩的な癌診断と治療計画について行った“初日トーク”に由来している。われわれの目標は,1日目から抗癌剤の開発を再想定し,年齢にかかわらずすべての癌患者の可能性を再定義することである。
我々は臨床段階の生物製薬会社であり,生命にかかわる疾患を有するすべての年齢層の人のための標的治療の開発と商業化に取り組んでいる。我々は最初の臨床開発努力を癌を有する小児科患者に集中させており,これは脆弱な集団であり,最近の標的治療や免疫腫瘍学革命では十分なサービスが得られていない。
我々の主要候補製品tovorafenibは経口、脳浸透、高選択性II型急速加速線維肉腫、またはRAF、キナーゼ阻害剤である。トヴォラファニーは450人以上の患者で検討されており,単一療法として全体的な耐性が良好であることが証明されている。Tovorafenibはすでに児童と成人群の中で鼓舞的な抗腫瘍活性を示し、その特定の遺伝子変化はマイトジェン活性化プロテインキナーゼ(MAPK)の過剰活性化を招き、細胞成長の暴走を招く。
Tovorafenibは2020年8月にアメリカ食品と薬物管理局(FDA)によって再発或いは難治性低レベルグリオーマ(PLGG)の治療に許可され、これは一期試験の初歩的な結果に基づいており、この試験はpLGG患者が迅速な抗腫瘍活性と持続的な反応を有することを表明した。児童低レベルグリオーマは児童に最もよく見られる脳腫瘍である。最近pLGG患者に使用できる新しい標的治療方案があるが、現在合意されていない看護標準はなく、大多数のpLGG患者はまだ承認されていない治療法である。著者らは2020年9月にFDAから悪性グリオーマ治療の孤児薬物指定を受け、2021年5月にEUグリオーマ治療委員会から指定された孤児薬物を獲得した。そのほか、FDAは2021年7月にtovorafenibによる低レベルグリオーマ(LGG)の治療の稀な小児科疾患の称号を授与し、この腫瘍は活性化されたRAF変化が存在する。
我々はすでに重要な2期試験、あるいはFirefly-1を開始し、完全に募集し、tovorafenibの単一療法として、活性化されたBRAF変化の再発または難治性低レベルグリオーマを有する小児患者に使用した。最初の患者は2021年5月にFirefly−1の用量治療を受け,2022年5月にARM登録を完了した。Firefly-1試験はまた、(A)主要なキューの登録が完了した後、条件に適合する患者により多くの機会を提供するための他の2つの研究枝を含み、(B)6ヶ月~25歳までの再発または進行性頭蓋外固形腫瘍を有し、RAF融合を活性化する患者におけるtovorafenibの初歩的な治療効果を評価する。
われわれは2023年6月の米国臨床腫瘍学会年次総会で2期Firefly−1試験登録部門からの新しいデータを報告した。また,他の6カ月の安全性と有効性データを含む更新された臨床研究報告書をFDAに提出した。データによると,69名の評価可能な患者のうち,神経腫瘍学−高レベルグリオーマ反応評価(RANO−HGG)により,総有効率(OOR)は67%であり,その中には12名の確認された完全応答(CR)が含まれていた
117
34個の部分反応やPRです著者らは他の18名の病状安定(SD)の患者を観察した結果、臨床受益率は93%(任意の病気経過のCR+PR+未実証のPR+SD)であった。
その他の二次分析と探索性終点分析は小児科神経腫瘍学低レベルグリオーマ反応評価(RAPNO-LGG)と神経腫瘍学低レベルグリオーマ反応評価(RANO-LGG)による反応評価を含む。RAPNO−LGGデータによると、RAPNO−LGG評価可能な76名の患者のうち、ORRは51%であり、28名のPRおよび11名の軽微な反応を含むか、または他の23人の患者のSD最適反応が観察され、臨床受益率82%(PR+未確認PR+MR+未確認MR+任意のSD)をもたらした。
RANO−LGGデータでは,RANO−LGG評価可能な76名の患者のうち,PR 20名とMRS 20名を含め,ORRは53%であった。著者らは他の23名のSDに対して最も良い反応がある患者を観察し、臨床受益率は83%(PR+未実証のPR+MR+未実証のMR+任意の病気経過のSD)であった。137名の治療を受けた患者の安全性データによると,ボルラフェニの単一療法は全体的に耐性が良好であった。大多数の副作用は1級或いは2級であり、最もよく見られる副作用は髪の色変化(76%)、貧血(59%)、クレアチンホスホキナーゼ上昇(58%)、無力(55%)と嘔吐(50%)である。
腫瘍減少はいかなる抗癌治療の重要な目標であるが、腫瘍安定はpLGG患者に対して同様の臨床意義があり、両者とも疾病の即時と長期後遺症のリスクを低下させるため、そうでなければこの疾病の生存率は合理的である。PLGGのような慢性で通常手術できない腫瘍の場合、1つの重要な治療目標は、腫瘍が自発的老化状態に入るまで、少なくとも数年以内に疾患の安定を達成し、それによって、腫瘍が自発的老化状態に入るまで、隣接する脳構造への不可逆的な損害を防止することであり、これは通常、若い成人で発生する。このような数年以内に腫瘍制御を実現する特殊な背景の下で、多くのpLGG患者は承認された治療法が不足していることから、標的治療は有益であると考えられている。2023年9月、再発または難治性pLGG患者の治療のための錠剤製剤およびtovorafenib粉末溶液製剤の転動新薬出願(NDA)申請を完了した。FDAは2023年10月にNDAの届出を受け優先審査権限を付与し,処方薬使用料法案(PDUFA)の目標行動日を2024年4月30日とした。FDAはこの申請を議論するために諮問委員会会議を開催するつもりはないと述べた。
2022年6月、著者らは6ケ月から25歳までのpLGG患者を治療する第一線の治療法としてtovorafenibを評価する重要な3期試験、すなわちFirefly-2を開始した。2023年3月,1人目の患者はFirefly−2を服用した。これまで,患者は米国,カナダ,ヨーロッパ,オーストラリア,アジアに登録を継続し,約80サイトを活性化してきた。
私たちの第二の候補製品pimasertibは経口的、高選択性のマイトジェン活性化プロテインキナーゼ1と2或いはMEKの小分子阻害剤であり、MEKはMAPK経路中の特徴が明確な重要なシグナルノードである。Pimasertibはすでに850名を超える異なる腫瘍タイプの患者の10個以上の1/2期臨床試験で検討されており,単一療法としても標準看護療法とも組み合わせている。すでに発表された臨床前研究から,Pimasertibは他のMEK阻害剤と比較して高い中枢神経系浸透率を有することが示唆された。
我々は、tovorafenibの単一治療または併用治療として、開放ラベル、多中心、1 b/2 a期の傘式主試験、または火光-1を開始し、この試験は2つのサブ研究を含む。サブ研究1は,12歳以上のMAPK経路変化を有する再発,進行性あるいは難治性固形腫瘍患者に単一療法としてトボルフェニが用いられた2 a期試験である。全体的な耐性の良好な治療反応が認められたにもかかわらず,このようなまれな患者群で観察される反応持続時間は限られていた。われわれは2023年11月にこの単一療法の亜研究を中止し,資源を他の項目に再配向することを決定した。最終データセットが利用可能になった後、サブ研究の結果は、プレゼンテーションまたは発表のために共有される。第二の研究は,トヴォラフィニとピマチニブが12歳以上で種々のMAPK変化を有する固形腫瘍患者における1 b/2期併用試験である。臨床前モデルでは,RAFとMEKの同時抑制は協同抗腫瘍活性を引き起こすことが証明されている。この組み合わせは、NRAS変異黒色腫および肺癌、クラスII BRAF変化によって駆動される腫瘍、BRAF野生型融合を有する腫瘍、およびKRAS変化によって駆動される腫瘍を含む、MAPK変化によって駆動される様々な成人固形腫瘍において増強された抗腫瘍活性を示す可能性がある。そのほか、いくつかの小児科腫瘍もMAPK経路の協同抑制から利益を得る可能性がある。1人目の患者は2022年5月に用量治療を受け,現在患者参加子研究の共同用量選択部分を積極的に募集している。楽しみにしています
118
2024年下半期の特定の患者集団の拡張キューのための推奨される第2段階用量およびスケジュールが決定される。
2023年8月、私たちはSprint Bioscience ABまたはSprintと研究協力および許可協定、またはSprint許可協定を締結し、Sprintはスウェーデンのハディンガーに位置するスウェーデン会社である。Sprint許可プロトコルによると、Sprintは著者らに独占的な全世界許可を授与し、複数のレベルを通じて再許可を授与し、薬物製品を研究、開発と商業化する権利があり、そしてVRK 1或いはVRK 1の発見、最適化と開発を目的とした研究に従事している。VRK 1は細胞分裂とDNA損傷修復の調節に参与する新しい目標である。多くの成人と児童癌において、VRK 1の過剰発現は予後不良と関係があり、VRK 1はすでにその類似遺伝子VRK 2発現欠損腫瘍の合成致死標的と考えられている。多くの高レベルグリオーマとハイリスク神経芽細胞腫において、プロモーターメチル化によりVRK 2の発現を沈黙化することが注目されており、これはVRK 1抑制に敏感な腫瘍患者を選択するために具体的な方法を提供した。VRK 1計画を進める臨床前研究活動が行われている。
著者らの業務開発能力は、腫瘍学薬物開発における著者らの豊富な経験と、研究と患者権益提唱コミュニティにおける深いつながりに加え、特に小児科環境において、すべての年齢の患者のための識別、獲得と治療方法の開発においてリードしていると信じている。私たちはすべての治療分野でtovorafenibとpimasertibの世界的な独占権利を持っているが、いくつかのマイルストーンと特許権使用料を支払わなければならない。
次の表に私たちの候補製品ルートをまとめました。

2018年11月の設立以来、私たちは、私たちの候補製品を決定、取得、開発し、私たちのルートを確立するためにほとんどの資源を使用しています。私たちの会社を組織し、そのための人員を配置しています。業務計画、私たちの知的財産権の組み合わせを確立し、第三者と私たちの候補製品の生産計画を確立し、資金を調達し、商業発表の準備をし、これらの業務に一般的かつ行政的な支援を提供しています。私たちは商業販売に許可された製品もなく、製品販売や他の源から何の収入も得ておらず、私たちが運営を開始して以来純損失が発生した。2023年12月31日と2022年12月31日の年度までに、それぞれ1兆889億ドルと1兆422億ドルの純損失を報告した。2023年12月31日と2022年12月31日までの累計赤字はそれぞれ4.586億ドルと2.697億ドルだった。私たちは予測可能な未来に、私たちが引き続き私たちの候補製品を開発し、規制部門の承認を求め、任意の承認された製品を商業化し、私たちの製品パイプラインを拡大し、投資することを求めている
119
私たちの組織ですまた、重大な法律、監査、会計、規制、税務関連、取締役·役員保険、投資家関係、その他の民間会社として招かれていない費用など、上場企業の運営に関する追加コストが引き続き発生する見通しです。
私たちはこれまで、私たちの償還可能な優先株、変換可能手形、普通株を初回公募株とその後の公募株で売却することで、私たちの運営に資金を提供してきました。
2023年12月31日現在、現金と現金等価物および短期投資総額は3億663億ドル。私たちの現在の運営計画によると、経営陣は2026年までの予想運営に資金を提供する十分な資本資源を持っていると信じている。製品開発に関連する多くのリスクや不確実性により、決して利益を実現しない可能性があり、それまで追加資本を調達し続ける必要があります。私たちが私たちの業務計画を支援するために十分な資金を得ることに成功するという保証はない。もし私たちが必要な時や魅力的な条項で資金を調達できない場合、私たちは候補製品の開発と商業化を大幅に延期、減少または停止したり、新しいライセンス内と買収の追求を縮小または終了しなければならないかもしれない。
私たちは所有したり経営したりしないし、現在は製造施設を設立する計画もない。私たちは依存し、引き続き第三者に依存して私たちの候補臨床試験製品を生産し、私たちの任意の候補製品が市場の承認を得た場合、商業製造に使用されることが予想される。私たちが開発を通じて私たちの候補製品を推進することに伴い、私たちは各候補製品のために活性薬物成分或いは原料薬、薬物製品、包装と調合の予備供給者を増加させ、任意の潜在的な供給中断を防止することを探索する。
“インフレ低減法案”
総裁·バイ登は2022年8月16日、会社調整後の財務諸表収入に基づく代替最低税率を含む2022年インフレ率低減法案に署名した。私たちはインフレ削減法案が私たちの所得税条項と現金税に実質的な影響を及ぼすとは思わない。私たちは私たちの業務に対するそれらの潜在的な影響を評価するために、税金法律法規の変化に注目し続けている。
重要な合意
武田資産購入協定
2019年12月16日、DOT Treateutics-1,Inc.または当社の子会社DOT-1は、武田製薬株式会社の関連先および関連会社ミレニアム製薬会社と資産購入契約または武田資産協定を締結した。武田資産プロトコルによれば、DOT-1はTAK-580(現在tovorafenib)に関連するいくつかの技術的権利とノウハウを購入し、原発性脳腫瘍または固形腫瘍脳転移患者の治療に新しい方法を提供した。DOT−1はまた,われわれのこのようなRAF−阻害剤の研究·開発活動のための臨床在庫用品を受け取り,指定された調査者臨床試験プロトコルを得た。武田はViracta治療会社(F/k/a Sunesis PharmPharmticals,Inc.)やViractaの独占ライセンスプロトコルやViractaライセンスプロトコルとDOT-1にも割り当てている.武田はまた、武田資産協定に基づいてDOT−1に指定特許項下のグローバル再許可独占許可と、武田資産協定に基づいて生成された他の特許及び独自技術項下の非独占許可とを付与した。DOT-1はまた、武田資産協定で定義されている帰還許可を武田に付与し、武田資産協定が規定する適用時間範囲内で指定された開発マイルストーンを実現できなければ、この許可を自動的に終了またはDOT−1で終了することができる。この武田に付与された帰還許可証は転換時に終了し、ミレニアム証券取引所協定と関係がある。
DOT-1は、資産の売却と譲渡および武田資産協定によるライセンス付与の代償として、100万ドルの現金を前払いし、2019年12月にDOT-1で9,857,143株のAシリーズ償還可能転換優先株を発行した。他の投資家がDOT-1のAシリーズ融資で発行済み株式に支払った価格によると、発行済み株の公正価値は990万ドルと推定される。ミレニアム証券取引所協定の条項によると、武田は転換発効後、2021年5月26日にDOT-1の9,857,143株Aシリーズ償還可能転換可能優先株を我々の普通株6,470,382株に交換した。
武田資産協定の有効期限は、各国のすべての譲渡特許権とすべてのライセンス特許権が満期になった後、国ごとに終了します。武田は武田資産を打ち切る可能性があります
120
もし私たちが持続的で特定の時間内にいかなる開発活動も停止し、この停止は当事者の同意でもなく、規制機関の指導に基づいて行われなければ、私たちは私たちが初めて製品を商業販売する前に合意した。また、武田は我々が破産した場合に武田資産協定を終了することができる。武田が我々の開発停止や破産により武田資産協定を終了すれば、譲渡されたすべての特許、ノウハウ、契約(Viractaライセンス契約を除く)が武田に譲渡され、武田は特許やノウハウに基づいて回復許可を得て、これ等で終了したすべての製品を利用する。
DOT-1は2021年12月31日から当社と合併して当社に組み込まれ、当社は既存の会社であり、武田資産購入協定に基づいてDOT-1‘Sの義務を負う。
Viracta許可協定
2019年12月16日、DOT-1は、武田資産協定に従って譲渡されたViractaライセンス協定を修正し、再確認した。Viractaライセンスプロトコルによると,DOT−1は特定の特許権やノウハウにより世界的に独占的に許可されており,RAFタンパク質ファミリーに結合した化合物を含む製品を開発,使用,製造,商業化することができる。
DOT−1はViractaに200万ドルの現金を前払いしており,このお金は研究開発費として記録されており,この技術には将来代替用途がないためである。2023年12月31日現在、私たちは、2つの適応のうち、許可製品ごとに指定された開発と規制マイルストーンを実現する際に、4900万ドルまでのマイルストーン支払いを追加的に支払うことを要求される可能性があり、第2の適応のマイルストーン支払いは、第1の適応のマイルストーン支払いよりも低い。また、DOT−1が許可製品に関する優先審査券を取得し、その優先審査券を第三者に販売するか、またはその優先審査券を使用する場合、DOT−1は、そのような販売のいずれかから受信したすべての純対価格または使用済み優先審査券の価値の特定のパーセンテージをViractaに支払う義務がある。DOT−1は,特許製品の1カ国/地域での初商業販売から,特許製品の純売上高の中央値から1桁パーセントまでの分級印税(あれば)の支払いを義務付けている。印税の支払い義務は、国/地域およびライセンス製品のライセンス製品をもとに終了し、1つの国/地域での最初の商業販売から、(I)当該国/地域で当該製品を使用または販売するViractaライセンス特許、共通所有の協力特許または指定特許に関する最後の有効主張が満了するまで続く。(Ii)当該国/地域での最後の法定独占経営権の満了、または(Iii)当該製品の国/地域での初商業販売の10周年である。上記で議論した以外に、2023年12月31日現在、達成すべき他のマイルストーンは実現されていない
Viractaライセンス契約の期限は,会社がViractaにその製品の当該国/地域での印税を支払う義務期間が満了した後,ライセンス製品と国/地域で終了する.DOT-1は、指定された通知期間内に任意またはすべてのライセンス製品に関連するViractaライセンスプロトコルを任意に終了する権利がある。
2021年12月31日から、DOT-1は当社と合併して当社に組み込まれ、当社はまだ残っている会社であり、ヴィアクタ許可協定に従ってDOT-1‘Sの義務を負う。
メルクKGaA社とライセンス契約を結び、ドイツのダムシュタット
2021年2月10日、DOT Treateutics-2,Inc.または我々の子会社DOT-2は、ドイツのダムシュタットに位置するメルクKGaA製薬会社と、MRKDG許可協定であるライセンス契約を締結した。MRKDGライセンス協定によると、ドイツのダムシュタットのMerck KGaAは独占的なグローバルライセンスを付与し、特定の特許権利と技術ノウハウに基づいて、複数のレベルで再許可を付与する権利があり、PimasertibとMSC 2015103 Bの化合物を含む製品を研究、開発、製造し、商業化することができる。臨床在庫品も受け取り,その研究や開発活動に用いられている。著者らの独占許可はメルクKGaAが付与した非独占許可の制約を受けなければならず、メルクKGaAはドイツの癌研究組織の付属会社であり、ドイツDarmstadtメルクKGaAはいくつかのpimasertibに関連する臨床研究を直接或いは間接的に行う権利を保持する。
121
MRKDGライセンス協定によると、2029年までに商業的に合理的な努力を使用し、少なくとも2つの指定された主要市場国で少なくとも2つのライセンス製品を開発して商業化する義務がある
MRKDG許可協定により付与された権利や臨床用品を考慮すると,800万ドルが前払いされており,将来的には代替用途がなく,研究活動に用いられているため,研究開発費として記録されている。2023年12月31日現在、特定の開発、規制、ビジネスマイルストーンの実現状況、および将来のライセンス製品の純売上高の高ビット数印税パーセンテージに応じて、3兆645億ドルの追加料金を支払う必要があるかもしれません。マイルストーンと特許使用料は未来の事件に依存し、マイルストーンと満期支払いが達成されたときに記録される。
MRKDGライセンス契約の期限は,当該国/地域内の当該ライセンス製品についてライセンス側への印税支払い義務期間が満了した後,個々のライセンス製品と国/地域に基づいて満期となり,すべてのライセンス製品とMRKDGライセンス契約下のすべての国/地域に対する全支払義務期間が満了する。
2021年12月31日よりDOT−2は当社と合併して当社に合併し,当社は既存の会社であり,MRKDG許可協定によりDOT−2‘Sの義務を負う。
Sprint Bioscience ABとの研究協力と許可プロトコル
2023年8月15日、私たちは、スウェーデンのハディンガーにあるスウェーデン社Sprint Bioscience ABまたはSprintと研究協力および許可協定、またはSprintライセンス契約を締結した。Sprint許可協定によると、Sprintは著者らに独占的な全世界許可を授与し、複数のレベルを通じて再許可を授与し、医薬製品を研究、開発と商業化し、そしてニキビ苗関連Kinase 1或いはVRK 1の発見、最適化と開発を目的とした研究に従事する。
私たちはSprintに300万ドルの現金を前払いしました。このお金は研究開発費として記録されています。この技術は将来代替用途がないからです。2023年12月31日現在、各ライセンス製品の特定の開発、規制、ビジネスマイルストーンの実現状況に応じて3.09億ドルまでのマイルストーン支払いと、将来のライセンス製品の純売上高の1桁パーセントで等級付けされた印税(あれば)の支払いが要求される可能性があります。マイルストーンと特許使用料は未来の事件に依存し、マイルストーンと満期支払いが達成されたときに記録される。
Sprintライセンス契約の期限は、ライセンス製品およびその国/地域のライセンス使用料期限が満了したときに、事前に終了しない限り、ライセンス製品および国/地域に基づいて満了します。指定された通知期間内にSprint許可プロトコルのすべての内容を任意に終了するか、または製品の終了を1つずつ許可する権利があります。
経営成果の構成部分
運営費
研究開発費
研究開発費には,我々の研究活動による外部と内部費用,我々の発見と許可内業務,および我々の候補製品tovorafenib,pimasertib,VRK 1計画の開発が含まれている。
外部費用には、
122
内部費用には、
私たちは発生した金額に基づいて研究と開発費用を計上します。我々は計画的に外部コストを追跡し,現在我々のtovorafenib,pimasertib,VRK 1計画の費用を含んでいる.我々は,プランに特定された間接コストを追跡しないが,これらのコストは複数のプランに配置されているため,単独では分類されない.
研究開発活動は私たちのビジネスモデルの核心だ。予測可能な未来には,我々の業務戦略の継続に伴い,臨床試験によりtovorafenib,pimasertibとVRK 1を推進し,より大規模な臨床試験を行うこと,我々の研究開発努力を拡大すること,およびより多くの候補製品を識別,獲得,開発すること,特に我々のより多くの候補製品が臨床開発と後期臨床開発段階に入るにつれて,我々の研究開発費が大幅に増加することが予想される。
私たちの候補薬の開発成功は不確実であり、いくつかのリスクの影響を受けている。臨床試験の結果が有利であるか、または私たちのいかなる製品開発計画を支持するのに十分なマーケティング許可であるかは保証できません。私たちは開発を放棄することにしたり、もともと考慮されていなかった大量の資源を使うことを要求されるかもしれない。当社の研究及び発展計画のリスク及び不確定要因の他の検討については、本年報10−K表第I部第1 A項“リスク要因”を参照されたい。
一般と行政費用
一般と行政費用には主に従業員に関連する費用、専門サービス、その他の業務費用が含まれる。従業員に関連するコストには、一般および行政者の賃金、ボーナス、福祉、株式ベースの給与支出が含まれる。専門サービス料には弁護士費、会計、監査、税務、人力資源、業務発展などのコンサルティングサービスの専門費が含まれる。その他の業務費用には、レンタル料と施設メンテナンス、出張、保険、情報技術費用が含まれています。
私たちは、予想される未来に、私たちの一般的かつ行政的費用が大幅に増加することを予想しています。私たちの従業員数は、私たちの候補製品の研究開発作業の拡大と商業能力の建設を支援し、私たちの全体的な運営を支援することが予想されます。ナスダックのグローバルベスト市場(ナスダック)や米国証券取引委員会(米国証券取引委員会)要求の遵守に関するコスト、投資家や広報コストなど、上場企業に関連する持続費用も予想される。
123
行動の結果
2023年12月31日までと2022年12月31日までの年次比較
次の表は、2023年12月31日までと2022年12月31日までの年間経営結果をまとめています
|
|
現在までの年度 |
|
|
|
|
|
|
|
|||||||
|
|
2023 |
|
|
2022 |
|
|
$Change |
|
|
変更率 |
|
||||
運営費用: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
研究開発 |
|
$ |
130,521 |
|
|
$ |
85,618 |
|
|
$ |
44,903 |
|
|
|
52.4 |
% |
一般と行政 |
|
|
75,543 |
|
|
|
61,291 |
|
|
|
14,252 |
|
|
|
23.3 |
% |
総運営費 |
|
|
206,064 |
|
|
|
146,909 |
|
|
|
59,155 |
|
|
|
40.3 |
% |
運営損失 |
|
|
(206,064 |
) |
|
|
(146,909 |
) |
|
|
(59,155 |
) |
|
|
40.3 |
% |
投資収益、純額 |
|
|
17,187 |
|
|
|
4,746 |
|
|
|
12,441 |
|
|
* |
|
|
その他の費用、純額 |
|
|
(40 |
) |
|
|
(18 |
) |
|
|
(22 |
) |
|
* |
|
|
普通株主は純損失を占めなければならない |
|
$ |
(188,917 |
) |
|
$ |
(142,181 |
) |
|
$ |
(46,736 |
) |
|
|
32.9 |
% |
*金額および/またはパーセンテージは意味がありません
研究開発費
研究開発費は2022年12月31日現在の8,560万ドルから2023年12月31日現在の1億305億ドルに増加し、4490万ドルに増加した。2023年12月31日までの年度では,2022年12月31日と比較して第三者費用が2,110万ドル増加したが,これは主に臨床試験,製造,その他の製品開発費の増加,人員関連費用(株式ベースの報酬を含む)が従業員数の増加により1340万ドル増加し,前払いとマイルストーン費用が支払い時間のため550万ドル増加したためである。
下表は、2023年12月31日と2022年12月31日までの年度の外部·内部研究開発費をまとめたものである
|
|
現在までの年度 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
|
|
(単位:千) |
|
|||||
外部コスト: |
|
|
|
|
|
|
||
第三者CRO,CMO等第三者臨床試験費用(1) |
|
$ |
71,294 |
|
|
$ |
50,175 |
|
Viractaライセンス契約に関するマイルストーン支払い |
|
|
5,000 |
|
|
|
— |
|
MRKDG許可協定に関するマイルストーン支払い |
|
|
— |
|
|
|
2,500 |
|
Sprintライセンス契約に関する前金 |
|
|
3,000 |
|
|
|
— |
|
他の研究と開発コスト |
|
|
8,465 |
|
|
|
3,598 |
|
内部コスト: |
|
|
|
|
|
|
||
従業員関連費用 |
|
|
42,762 |
|
|
|
29,345 |
|
研究開発費総額 |
|
$ |
130,521 |
|
|
$ |
85,618 |
|
一般と行政費用
一般·行政費は1420万ドル増加し、2022年12月31日現在の年度の6130万ドルから2023年12月31日までの年度の7550万ドルに増加した。2023年12月31日までの年間で、2022年12月31日と比較して、株式給与を含む人事関連支出が1,400万ドル増加したのは、従業員数や専門サービスが増加し、法律や保険支出が100万ドル増加したことが原因であり、商業能力の増強と業務運営の持続的な拡張によるものである。
124
流動性と資本資源
流動資金源
2023年6月、私たちは後続発行を完了し、引受割引、手数料、発行コストを差し引いた後、13,269,231株の普通株(引受業者が1,730,769株の追加購入の選択権を行使することを含む)を1株13.00ドルで大衆に発行·売却し、純収益は約1.614億ドルであった。
私たちは、市場発売計画(ATM)に基づいて2.5億ドルまでの総発行価格で私たちの普通株を発行し、売却することに関連して、パイパー·サンダーラー社とジョーンズ貿易機関サービス有限責任会社と株式分配協定を締結した。2023年12月31日まで、私たちの普通株はATM機で販売されていません。
2022年6月、私たちは後続発行を完了し、引受割引、手数料、発行コストを差し引いた後、1株15.00ドルで11,500,000株の普通株(引受業者が追加1,500,000株の普通株を購入する選択権を含む)を発行·売却し、純収益は約1.616億ドルだった。
2021年6月には、2021年5月に引受業者が追加普通株購入の選択権を十分に行使して発行した150万株を含む、1株16.00ドルで合計1150万株の普通株を一般公開株式(IPO)を完成させた。引受割引、手数料、発行コスト1700万ドルを差し引いた後、IPOから得られた純収益総額は1.67億ドルだった。初めて公募する前に、償還可能な転換可能な優先株と転換可能な手形を売ることで、私たちの運営に資金を提供します。私たちはこれまでAシリーズとBシリーズの償還可能な優先株と転換可能な手形を売却して発行することで約1.92億ドルの毛収入を集めた。
2023年12月31日までの累計赤字は4.586億ドル、現金、現金等価物、短期投資は3億663億ドルだった。私たちは私たちの現金、現金等価物、そして短期投資が今後12ヶ月と2026年の現金需要を満たすのに十分になると信じている。
私たちの現金の主な用途は研究開発支出と一般と行政支出を含む運営費用に資金を提供することです。運営費に資金を提供するための現金は、これらの費用を支払う時間の影響を受けており、これは私たちの未払い売掛金や売掛金の変化に反映されている。私たちの物質的現金需要には以下の契約義務と他の義務が含まれている。
賃貸借証書
私たちはオフィス空間に対してレンタル経営義務があります。2023年12月31日まで、約40万ドルの固定レンタル支払い義務があり、12ヶ月以内に支払わなければなりません。
契約研究機関と契約製造機関
著者らは正常な業務過程においてCRO、CMOと他の第三者サプライヤーと臨床試験、製造、テストとその他の研究と開発活動の契約を締結した。これらの契約は一般的に通知後に終了することに規定されていますが、一部の費用はプロジェクト承認後にキャンセルできないため、サプライヤーの例外があります。2023年12月31日現在、終了やキャンセル費用に関する課税額はありません。これらは発生しにくいためです。
許可協定
私たちは具体的な活動の満足状況に応じてマイルストーン費用を支払うことを要求する許可協定を締結した。2023年12月31日までの1年間にViractaに500万ドルを支払い,FDAが我々のNDAを受け入れたことに関連してマクに250万ドルを支払ったが,2022年12月31日までの1年間にpimasertibを含む製品が第1回臨床試験を行い,患者に第1剤を投与したためである。私たちはこれらのライセンス契約に基づいて開発された製品の販売に印税を支払うことを要求された。2023年12月31日まで、私たちのすべての製品は開発中で、このような印税を支払う必要はありません。2023年12月31日まで、私たちは支払い義務がありません。このような支払いの金額、時間、可能性はまだわかりません。
125
キャッシュフロー
次の表は、私たちが列挙した期間の現金源と用途をまとめています
|
|
現在までの年度 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
経営活動のための現金純額 |
|
$ |
(146,853 |
) |
|
$ |
(109,874 |
) |
投資活動提供の現金純額 |
|
|
128,378 |
|
|
|
(255,074 |
) |
融資活動が提供する現金純額 |
|
|
163,997 |
|
|
|
165,901 |
|
現金および現金等価物の純増加(減額) |
|
$ |
145,522 |
|
|
$ |
(199,047 |
) |
経営活動
2023年12月31日現在、経営活動で使用されている現金純額は1兆469億ドルで、1億889億ドルの純損失、約950万ドルの純営業資産と負債変動、3260万ドルの非現金費用が含まれており、主に3930万ドルの株式ベースの給与支出が含まれている。業務資産と負債の変化は、主に課税費用およびその他の流動負債の1060万ドルの増加および売掛金の230万ドルの増加、預金およびその他の長期資産の30万ドルの減少に関連する。前払い費用とその他の流動資産は330万ドル増加し、経営リース負債は40万ドル減少し、この減少額を部分的に相殺した。
2022年12月31日現在、経営活動で使用されている現金純額は1.099億ドルで、1.422億ドルの純損失、約660万ドルの純営業資産と負債変動、2570万ドルの非現金費用が含まれており、主に2720万ドルの株式ベースの給与支出が含まれている。業務資産と負債の変化は、主に課税費用やその他の流動負債の920万ドルの増加と関係がある。売掛金は150万ドル減少し、経営リース負債は30万ドル増加し、預金やその他の長期資産は30万ドル増加し、前払い費用とその他の流動資産は50万ドル増加し、この減少額を部分的に相殺した。
投資活動
2023年12月31日までの年度、投資活動が提供する現金純額は1兆284億ドルで、5.754億ドルの短期投資満期収益に帰することができる。4.438億ドルの短期投資を購入し、進行中の研究·開発資産の現金300万ドルを支払い、不動産や設備を購入した現金20万ドルを支払い、この減少額を部分的に相殺した。
2022年12月31日までの1年間、投資活動のための現金純額は2.551億ドルで、短期投資の購入および40万ドルの財産·設備支出によるものとなる。これは10万ドルの短期投資満期収益部分によって相殺される。
融資活動
2023年12月31日までの年間で、融資活動が提供する現金純額は1.64億ドルで、主に普通株発行の純収益によるものであり、2023年6月の普通株後続発売と関係がある。また、260万ドルの現金純額は融資活動から来ており、これらの活動は株式オプションを行使する際に普通株を発行する収益と、私たちの2021年の従業員株式購入計画による購入に関係している。
2022年12月31日までの1年間、融資活動が提供した現金純額は1兆659億ドルで、主に我々の後続の普通株発行に関連する普通株発行純収益によるものである。また,430万ドルの現金純額は融資活動から来ており,これらの活動は株式オプションを行使する際に普通株を発行する収益と,我々の2021年の従業員株式購入計画による購入に関係している.
資金需要
設立以来、私たちは重大な運営損失を受けた。予見可能な未来には,我々が行っている活動に関する費用は引き続き大幅に増加し,運営損失も増加していくと予想される。
126
私たちは私たちの既存の現金、現金等価物、そして短期投資が2026年までの運営費用と資本支出需要に資金を提供できると信じている。私たちのこの推定は、不正確であることが証明される可能性があるという仮定に基づいており、私たちは現在予想されているよりも早く私たちが利用できる資本資源を使用することができる。
予想された支出の結果として、私たちは私たちの持続的な運営に関連した多くの追加資金を得る必要があるだろう。私たちが大量の収入を生み出すことができる前に、私たちは株式発行、債務融資、協力、戦略連合とマーケティング、流通、または許可手配の組み合わせで私たちの現金需要を満たす予定です。受け入れ可能な条件で、私たちは十分な追加資金を得ることができないかもしれないし、全くないかもしれない。もし私たちが必要な時や魅力的な条件下で資金を調達できない場合、私たちは私たちの研究、製品開発計画、あるいは未来の商業化努力を延期、制限、減少または終了することを要求されるかもしれません。あるいは私たちが自分で開発し、マーケティングすることをより望んでいた候補製品の権利を与えることができます。
私たちが株式または転換可能な債務証券を売却することで追加資本を調達する場合、株主所有権権益は希釈され、これらの証券の条項は清算または他の特典を含む可能性があり、普通株主である株主権利に悪影響を及ぼす。債務融資および優先株融資に関与する可能性のある協定は、追加債務を招く、買収または資本支出を行う、または配当を宣言するなど、私たちが具体的な行動をとる能力を制限または制限する契約を含む。
もし私たちが第三者との協力、戦略連合またはマーケティング、流通または許可手配を通じてより多くの資金を調達するならば、私たちは私たちの技術、将来の収入源、研究計画、または候補製品に対する貴重な権利を放棄しなければならないかもしれないし、私たちに不利になる可能性のある条項でライセンスを付与しなければならないかもしれない。
私たちがより多くの資金を調達する能力は、潜在的な世界経済状況の悪化と、米国と世界各地の信用と金融市場のインフレ、金利の変化、グローバル銀行システムの潜在的な不安定、連邦債務上限と予算の不確定性、連邦予算に関連する潜在的な政府の停止、世界地域の衝突、公衆衛生流行病、またはその他の原因による中断と変動の影響を受ける可能性がある。製品開発に関連する多くのリスクや不確実性のため、費用増加の時間や金額を予測することはできず、永遠に利益を上げたり、経営活動から正のキャッシュフローが生じる保証もありません。
重要な会計政策と試算の使用
私たちの経営陣は財務状況と経営結果の討論と分析は私たちの連結財務諸表に基づいています。これらの連結財務諸表はアメリカ公認会計原則あるいはGAAPに基づいて作成されています。公認会計基準に従って連結財務諸表を作成することは、連結財務諸表の日付の資産、負債及び又は有資産及び負債の報告金額及び報告期間内に報告された費用金額に影響を与えるために、管理層に推定及び仮定を要求する。我々は,歴史的経験,既知の傾向や事件,および当時の状況で合理的と考えられる様々な他の要因に基づいて推定し,これらの要因の結果は資産や負債の帳簿価値の判断の基礎を構成しているが,これらの資産や負債の帳簿価値は他の源から容易に見られるものではない.私たちは持続的な基礎の上で私たちの推定と仮定を評価する。異なる仮定や条件の下で、私たちの実際の結果はこれらの推定とは異なる可能性がある。
我々の主な会計政策は、本年報第8項内の総合財務諸表付記により詳細に記載されているが、以下の会計政策は、我々の総合財務諸表の作成に使用する判断と推定に最も重要であると信じている。
研究と開発費用を計算すべきである
第三者サービスプロバイダによる臨床試験の見積もりコストの計上すべき負債を記録した。我々は,提供されているが領収書が発行されていない見積りサービス金額に基づいて,臨床試験の見積りコストを研究と開発費用として記録した。私たちは、完了した仕事の見積もりなどに基づいて、私たちの第三者サービスプロバイダとサービス契約に基づいて決定された条項に基づいて、これらの費用を計算しなければならない。
127
われわれの臨床試験を行って管理しているCROとの契約に基づき,臨床試験に関する費用を支払っている。これらの契約の財務条項は交渉する必要があり、これらの条項は契約によって異なり、材料やサービスを提供する期限と一致しない支払いを招く可能性がある。一般に、これらのプロトコルは、固定料金、単価、または時間および材料で実行される動作範囲を規定する。われわれは,各試験が完了した推定作業量からCROによる臨床試験活動のコストを計算した。臨床試験では,費用を評価する際に使用すべき重要な要因として,登録された患者数,患者ごとの活動,活発な臨床サイトの数,および患者が試験参加継続時間を登録することがあげられる。我々は,内部審査,CROとの通信や契約条項の審査により,患者の登録レベルや関連活動を可能な限りモニタリングした。私たちの推定はその時得られる最高の情報に基づいている。
発生し始めたコストを決定しない場合、または提供されるサービスのレベルまたはこれらのサービスのコストを過小評価または過大評価した場合、実際の費用は私たちの推定とは異なる可能性がある。今まで、私たちは計算すべき費用と実際の費用の間のどんな大きな違いにも遭遇しなかった。しかし,推定の性質から,われわれの臨床試験の状態や進行に関するより多くの情報が分かった場合,将来的にわれわれの推定を変えることは保証されない。
新会計公告
最近発表·採択された会計声明の概要については、本年度報告書の他の場所のForm 10-Kに含まれる我々の総合財務諸表付記2を参照されたい。
イットM 7 A。市場リスクに関する定量的で定性的な開示。
金利リスク
私たちは2023年12月31日と2022年12月31日までに、それぞれ3億663億ドルの現金、現金等価物、3.423億ドルの短期投資を持っている。これには利上げ通貨市場基金や米国債や米政府機関証券への投資が含まれており、これは金利リスクをもたらす。2023年12月31日、2023年12月31日と2022年12月31日に金利が100ベーシスポイント上昇または低下したと仮定すると、我々の現金、現金等価物、短期投資の公平な市場価値に実質的な影響を与えない。私たちは取引や投機目的に投資しないし、派生金融商品を使って私たちの金利リスクを管理していません。
イットM 8.財務諸表および補足データ。
本プロジェクトに必要な資料は連結財務諸表とその付記に掲載し,本年度報告表格10−KのF−1ページから開始した。
情報技術EM 9.会計及び財務開示面の変更と会計士との相違。
ない。
ITEM 9 Aです。制御とプログラムです
開示制御とプログラムの評価
我々の経営陣は、我々の最高経営責任者及び総裁、並びに我々の最高経営責任者及びCEO、我々の最高経営責任者及びCEO、2023年12月31日までの開示制御及び手続を評価した(1934年証券取引法下の規則13 a-15(E)及び15 d-15(E)で定義される)。この評価に基づき、我々の最高経営責任者および最高財務責任者は、2023年12月31日までに、我々の開示統制および手続きが有効であると結論した。
経営陣財務報告内部統制年次報告書
経営陣は、取引法規則13 a-15(F)および15 d-15(F)によって定義されるように、財務報告の十分な内部統制の確立と維持を担当する。私たちの財務報告書の内部統制は
128
財務報告の信頼性に合理的な保証を提供し、公認された会計原則に基づいて外部目的の連結財務諸表を作成することを目的とする。その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
経営陣は、トレデビル委員会後援組織委員会(COSO)が#年に提案した枠組みに基づき、財務報告書の内部統制に対する我々の有効性を評価した内部統制--統合フレームワーク(2013年フレームワーク)それは.我々の評価によると、経営陣は、2023年12月31日現在、財務報告の内部統制が合理的な保証水準で有効であると結論している。
我々の2023年12月31日現在の財務報告内部統制の有効性は、本稿に示すように、独立公認会計士事務所の普華永道会計士事務所が監査している。
財務報告の内部統制の変化
最近の四半期内に、財務報告の内部統制に大きな影響を与えていないか、または合理的に財務報告の内部統制に大きな影響を与える可能性のある変化が発生しています。
情報技術EM 9 B。他の情報。
インサイダー取引政策と手配
第十六条会社役員及び高級社員(取引法第16 a−1(F)条に規定されるように)は、取引法10 b 5−1(C)規則の積極的な抗弁を満たすことを目的とした予め手配された取引計画(“10 b 5−1計画”)に基づいてのみ会社の証券を取引する。2023年12月31日までの3ヶ月間、会社第16条の3人の役員は、会社取締役会メンバーを兼任する会社最高経営責任者を含め、新たな規則10 b 5-1計画を採用した。これらの計画(以下の定義)は,会社のインサイダー取引政策と取引計画政策に基づいて開放された取引窓口内で策定される.
開ける
開ける
129
♪the the theブラックマン規則10 b 5-1計画は、2024年1月9日から2024年12月31日まで。したがって、本開示については、売却可能な普通株式の総数は約
開ける
情報技術EM 9 Cです。検査を妨害する外国司法管轄区域を開示する。
ない。
130
第三部
情報技術EM 10.取締役、行政者、会社管理。
本プロジェクトが要求する情報は、2023年12月31日までの財政年度の120日以内に米国証券取引委員会に提出され、引用的に本明細書に組み込まれる2024年株主総会のために準備された委託書に含まれる。
情報技術EM 11.役員報酬。
本プロジェクトが要求する情報は、2023年12月31日までの財政年度の120日以内に米国証券取引委員会に提出され、引用的に本明細書に組み込まれる2024年株主総会のために準備された委託書に含まれる。
情報技術EM 12.特定の実益所有者の保証所有権および管理層および関連する株主事項。
本プロジェクトが要求する情報は、2023年12月31日までの財政年度の120日以内に米国証券取引委員会に提出され、引用的に本明細書に組み込まれる2024年株主総会のために準備された委託書に含まれる。
情報技術EM 13.何らかの関係や関連取引,および取締役の独立性.
本プロジェクトが要求する情報は、2023年12月31日までの財政年度の120日以内に米国証券取引委員会に提出され、引用的に本明細書に組み込まれる2024年株主総会のために準備された委託書に含まれる。
イットM 14.主な会計費用およびサービス。
本プロジェクトが要求する情報は、2023年12月31日までの財政年度の120日以内に米国証券取引委員会に提出され、引用的に本明細書に組み込まれる2024年株主総会のために準備された委託書に含まれる。
131
第4部
情報技術EM 15.証拠物、財務諸表明細書
(1)連結財務諸表:
第15項(A)項に要求される連結財務諸表は、本年度報告書10-K表第8項“連結財務諸表及び補足データ”の一部として提出される
(2)連結財務諸表の付表
15(A)項に要求される財務諸表明細書は、適用されない、不要、または要求された資料が、本年度報告シートの第10-K第8項に記載されている連結財務諸表または付記に含まれているので省略される。
(3)展示品。
展示品 |
|
説明する |
|
表 |
|
書類番号. |
|
展示品 |
|
アーカイブ済み/搭載済み |
|
|
|
|
|
|
|
|
|
|
|
3.1 |
|
再記載された会社登録証明書は、日付は2021年6月1日で、2023年6月22日に改訂された。 |
|
10-Q |
|
001-40431 |
|
2023年8月7日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2 |
|
付例を改訂して再制定し,日付は2023年2月17日である。 |
|
8-K |
|
001-40431 |
|
2023年2月23日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3.3 |
|
所有権と合併証明書、日付は2021年12月23日です |
|
10-K |
|
001-40431 |
|
2022年3月7日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4.1 |
|
普通株の書式 |
|
S-1/A |
|
333-255754 |
|
2021年5月24日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4.2 |
|
2021年2月1日日の投資家権利協定が改訂され、再署名され、初日にバイオ製薬ホールディングスLLCとその特定の株主の間で合意された。 |
|
S-1 |
|
333-255754 |
|
2021年5月4日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4.3 |
|
登録者の証券説明 |
|
10-K |
|
001-40431 |
|
2022年3月7日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
10.1^ |
|
役員及び上級者と締結した弁済協定の書式 |
|
S-1 |
|
333-255754 |
|
2021年5月4日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
10.2^ |
|
支配権および離職契約のフォーマットを変更する |
|
10-K |
|
001-40431 |
|
2022年3月7日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
10.3^ |
|
2021年株式インセンティブ計画と奨励協定の形式 |
|
S-8 |
|
333-276372 |
|
2024年1月4日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
10.4^ |
|
2021年従業員株購入計画および奨励契約フォーマット |
|
S-8 |
|
333-276372 |
|
2024年1月4日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
132
10.5^ |
|
2022年株式インセンティブ計画と合意形式 |
|
S-8 |
|
333-268071 |
|
2022年10月31日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
10.6 |
|
オフィスレンタルは,2022年4月1日で,カリフォルニア航空機技術出版社と初日バイオ製薬会社の間でレンタルされている。 |
|
10-Q |
|
001-40431 |
|
2022年8月4日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
10.7 |
|
DOT治療−1社とミレニアム製薬会社との間の資産譲渡と許可協定は,2019年12月16日から発効した。 |
|
S-1 |
|
333-255754 |
|
2021年5月4日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
10.8 |
|
ロイヤル空軍の許可協定は、2019年12月16日から発効し、Sunesis製薬会社とDOT治療-1社が署名した。 |
|
S-1 |
|
333-255754 |
|
2021年5月4日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
10.9 |
|
ライセンス契約は,2021年2月10日にドイツ·ダムシュタット·メルクKGaA社と初日バイオ製薬会社が署名した。 |
|
S-1 |
|
333-255754 |
|
2021年5月4日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
10.10 |
|
株式交換協定は,期日は2021年5月4日であり,初日にバイオ製薬ホールディングスとミレニアル製薬会社が署名した。 |
|
S-1 |
|
333-255754 |
|
2021年5月4日 |
|
|
|
|
|
|
|
|
|
|
|
|
|
21.1 |
|
登録者の子会社 |
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
23.1 |
|
独立公認会計士事務所普華永道会計士事務所同意 |
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
23.2 |
|
独立公認会計士事務所安永法律事務所同意 |
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
31.1 |
|
2002年のサバンズ·オキシリー法第302節で可決された1934年の証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて発行された首席執行幹事証明書。 |
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
31.2 |
|
2002年サバンズ−オキシリー法第302節で可決された1934年証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて首席財務幹事が認証された。 |
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
32.1** |
|
アメリカ法典第18編第1350条に基づいて首席行政官及び首席財務官を証明する |
|
|
|
|
|
|
|
X |
133
|
|
2002年のサバンズ-オキシリー法第906条に基づいて可決された。 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
97.1 |
|
賠償追討政策 |
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
101.INS |
|
XBRLインスタンスドキュメントを連結する |
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
101.書院 |
|
イントラネットXBRL分類拡張アーキテクチャ文書 |
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
101.カール |
|
インラインXBRL分類拡張はリンクベース文書を計算する. |
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
101.def |
|
XBRLソート拡張を連結してLinkbase文書を定義する. |
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
101.介護会 |
|
XBRL分類拡張ラベルLinkbase文書を連結する. |
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
101.Pre
|
|
XBRL分類拡張プレゼンテーションLinkbaseドキュメントを内部接続する. |
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
104 |
|
表紙対話データファイル(イントラネットXBRL文書に埋め込まれ、添付ファイル101に含まれる) |
|
|
|
|
|
|
|
X |
登録者が見落としたS−K条例第601(B)(10)項に許可された部分展示品。
^管理契約または補償計画を示します。
**この証明書は、証券取引法第18条の規定に基づいて提出されていないものとみなされ、またはこの条項の責任によって制限されているものとみなされ、証券法または取引法の下に引用されたいかなる出願ともみなされてはならない。
情報技術EM 16.表格10-Kの概要
ない。
134
サイン
改正された1934年証券取引法第13又は15(D)節の要求に基づいて、登録者は、正式に許可された次の署名者がその代表を代表して本報告書に署名することを正式に手配した.
|
|
初日生物製薬会社です。 |
|
|
|
|
|
日付:2024年2月26日 |
|
差出人: |
/S/ジェレミー·ベンデル博士、商工管理修士 |
|
|
|
ジェレミー·ベンデル博士商工管理修士 |
|
|
|
CEO兼社長 (首席行政主任) |
|
|
初日生物製薬会社です。 |
|
|
|
|
|
日付:2024年2月26日 |
|
差出人: |
S/チャールズ·N·ヨーク2世M.B.A |
|
|
|
チャールズ·ヨーク2世M.B.A. |
|
|
|
最高経営責任者と首席財務官 (首席財務会計官) |
135
授権依頼書
このような陳述を通じてすべての人を認識し、以下の署名のすべての人はここでJeremy Bender,Ph.D.,M.B.A.とCharles N.York II,M.B.A.を構成して任命し、彼らはそれぞれ完全な代替と再代替の権力を持ち、他の人なしに行動する権利があり、彼または彼女の真実と合法的な事実代理人と代理人として、彼または彼女の名義、場所、代替、そしてすべての人の名義と代表で各人を代表し、単独で以下に述べる身分で行動する。本年度報告の任意およびすべての修正をForm 10−Kの形態で提出し、本年度報告およびそのすべての証拠物および他の関連文書を米国証券取引委員会に提出し、上記の代理弁護士および代理人、ならびに彼ら一人一人に各行為および事柄の完全な権限および許可を行い、すべての上述の代理弁護士および代理人または彼らまたはそれらの代替者または代替者が合法的にまたはそれに至るすべてのことを和として行うことができることを承認および確認する。
本報告書は、改正された1934年の証券取引法の要求に基づき、以下の登録者によって登録者として指定日に署名された。
名前.名前 |
|
タイトル |
|
日取り |
|
|
|
|
|
/S/ジェレミー·ベンデル博士、商工管理修士 |
|
CEO兼社長 (首席行政主任) |
|
2024年2月26日 |
ジェレミー·ベンデル博士商工管理修士 |
|
|
|
|
|
|
|
|
|
S/チャールズ·N·ヨーク2世M.B.A |
|
最高経営責任者と首席財務官 (首席財務会計官) |
|
2024年2月26日 |
チャールズ·ヨーク2世M.B.A. |
|
|
|
|
|
|
|
|
|
S/ゲイリー·ニコルソンM.B.A. |
|
椅子と役員 |
|
2024年2月26日 |
ゲイリー·ニコルソン |
|
|
|
|
|
|
|
|
|
S/ダン·ベッカー医学博士博士 |
|
役員.取締役 |
|
2024年2月26日 |
ダン·ベッカー医学博士博士 |
|
|
|
|
|
|
|
|
|
/S/ハビブ·ダブル |
|
役員.取締役 |
|
2024年2月26日 |
ハビブ·ダブル |
|
|
|
|
|
|
|
|
|
/投稿S/スコット·ガランド |
|
役員.取締役 |
|
2024年2月26日 |
スコット·ガランド |
|
|
|
|
|
|
|
|
|
/投稿S/マイケル·グラストン |
|
役員.取締役 |
|
2024年2月26日 |
マイケル·グラストン |
|
|
|
|
|
|
|
|
|
S/ウィリアム·グロスマン医学博士 |
|
役員.取締役 |
|
2024年2月26日 |
ウィリアム·グロスマン医学博士博士です |
|
|
|
|
|
|
|
|
|
/S/ナタリー·ホルス |
|
役員.取締役 |
|
2024年2月26日 |
ナタリー·ホルス |
|
|
|
|
|
|
|
|
|
S/ジョン·A·ジョシ博士、工商管理修士 |
|
役員.取締役 |
|
2024年2月26日 |
ジョン·A·ジョシー博士商工管理修士 |
|
|
|
|
|
|
|
|
|
書名/著者Saira Ramasastry,M.S.,M.Phil. |
|
役員.取締役 |
|
2024年2月26日 |
Saira Ramasastry M.S.,M.Phil. |
|
|
|
|
136
137
連結財務諸表索引
独立公認会計士事務所レポート(PCAOB ID: |
F-2 |
独立公認会計士事務所レポート(PCAOB ID: |
F-4 |
合併貸借対照表 |
F-5 |
連結業務報告書 |
F-6 |
合併全面損失表 |
F-7 |
償還可能な転換可能優先株、償還可能な非持株権益と株主権益/メンバー(損失)連結報告書 |
F-8 |
統合現金フロー表 |
F-9 |
連結財務諸表付記 |
F-10 |
F-1
独立公認会計士事務所報告
初日のバイオ製薬会社の取締役会と株主へ
財務諸表と財務報告の内部統制に関するいくつかの見方
我々は、2023年12月31日までの初日のバイオ製薬会社(“当社”)の貸借対照表と、同年度までの関連経営報告書、全面損失表、償還可能転換可能優先株、償還可能非持株権益と株主権益/メンバー(損失)表とキャッシュフロー表を監査した(総称して“財務諸表”と呼ぶ)。テレデビル委員会(COSO)協賛組織委員会が発表した“内部統制-総合枠組み(2013)”で確立された基準に基づき、2023年12月31日までの財務報告内部統制を監査した。
上記財務諸表は,すべての重要な点で当社が2023年12月31日までの財務状況と,同年度までの経営結果とキャッシュフローを公平に反映しており,米国公認の会計原則に適合していると考えられる。また、2023年12月31日現在、当社はすべての実質的な面で財務報告に対する有効な内部統制を維持しており、その根拠は内部制御--統合フレームワーク(2013)COSOによって発表されます。
意見の基礎
当社経営陣は、当該等の財務諸表の作成を担当し、財務報告に対して有効な内部統制を維持し、9 A項の経営陣の財務報告内部統制年次報告に含まれる財務報告の内部統制の有効性を評価する。私たちの責任は、私たちの監査に基づいて、会社の財務諸表と会社が財務報告の内部統制に対して意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大なミスがないかどうか、エラーによるものであっても詐欺であっても、すべての重大な点で財務報告の有効な内部統制が維持されているかどうかを決定するために、合理的な保証を得るために監査を計画し、実行することを要求する。
財務諸表の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。我々の財務報告の内部統制の監査には、財務報告の内部統制を理解すること、重大な弱点があるリスクを評価すること、評価されたリスクテストに基づいて内部統制の設計と運営有効性を評価することが含まれる。私たちの監査はまた、私たちがこのような状況で必要だと思う他の手続きを実行することを含む。私たちは私たちの監査が私たちの意見に合理的な基礎を提供すると信じている。
財務報告の内部統制の定義と限界
会社の財務報告に対する内部統制は、公認された会計原則に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的としたプログラムである。会社の財務報告に対する内部統制には、(1)合理的で詳細かつ正確かつ公平に会社の資産を反映した取引および処分に関する記録の保存、(2)公認された会計原則に従って財務諸表を作成するために必要な取引を記録するための合理的な保証を提供すること、および会社の収支が会社の管理層および取締役の許可のみに基づいて行われること、および(3)許可されていないことを防止またはタイムリーに発見するための合理的な保証を提供すること、またはタイムリーに許可されていないことを防止またはタイムリーに発見するための政策および手順が含まれる
F-2
財務諸表に重大な影響を及ぼす可能性のある会社資産の買収、使用または処分。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
重要な監査事項
以下に述べる重要な監査事項とは、財務諸表を当期監査する際に生じる事項であり、監査委員会に伝達または要求され、(I)財務諸表に対して大きな意味を有する勘定または開示に関するものであり、(Ii)は、我々が特に挑戦的で主観的または複雑な判断に関するものである。重要な監査事項のコミュニケーションは何の方法でも私たちを変えることはできません 財務諸表を全体として、次の重要監査事項を伝達することにより、重要監査事項又はそれに関連する勘定又は開示について個別の意見を提供することはない。
臨床試験費用を計算しなければならない
財務諸表付記2及び付記4に記載されているように、当社は第三者サービスサプライヤーによる臨床試験推定コスト記録に負債を計上している。経営陣が開示しているように、これらの費用は、完了した作業見積もり数などの要因と、サービス協定に基づいて第三者サービス提供者と締結した条件に基づいて計算されるべきである。管理層は、各報告期間の臨床試験推定コストの計算すべき負債を確定する際に判断と推定を行い、内部審査、臨床研究機関(“CRO”)との通信と契約条項審査を通じて、患者の登録レベルと関連活動を可能な限り監視する。課税費用やその他の流動負債のうち,2023年12月31日現在,管理職は1260万ドルの計算すべき研究·開発費を記録しており,その一部には計算すべき臨床試験費用が関与している。
計算すべき臨床試験費用に関するプログラムを実行することが重要な監査事項であることを決定する主な考慮要因は,(I)管理職が計算すべき臨床試験費用推定を策定する際の重大な判断と,(Ii)監査人の管理層対応臨床試験費用推定に関するプログラムを実行する際の高度な判断力と努力である。
この問題を処理することは、財務諸表に対する私たちの全体的な意見を形成するための実行手順と監査証拠の評価に関するものである。これらのプログラムは、管理層が臨床試験費用の推定に対応することに関連する制御措置の有効性を試験することを含み、サービスプロトコルと第三者サービスプロバイダが決定した条項に基づいて完了した作業の推定値を制御することを含む。これらのプログラムは、(I)試験管理層が計算すべき臨床試験費用を推定するためのプログラム、(Ii)評価管理層が推定方法を作成するために使用する適切性を評価するプログラム、(Iii)試験管理層が、契約に従って請求書を発行するためにこれまでに使用されてきたデータの完全性および正確性を作成するために使用され、(Iv)適用された場合、基礎契約、請求書、およびある第三者サービスプロバイダから受信した情報のような基礎支援文書をたどることによって、請求書が発行されていないサービスの推定コストの合理性を評価することをさらに含む。
/s/
2024年2月26日
2023年以来、私たちは会社の監査役を務めてきた。
F-3
独立公認会計士事務所報告
初日にバイオ製薬会社の株主、メンバー、取締役会に。
財務諸表のいくつかの見方
我々は、初日のバイオ製薬会社(当社)の2022年12月31日と2021年12月31日までの連結貸借対照表、2022年12月31日までの各年度の関連総合経営表、全面赤字、償還可能転換可能優先株、償還可能非持株権益と株主権益/メンバー(赤字)と現金流量、および関連付記(総称して“総合財務諸表”と呼ぶ)を監査した。総合財務諸表は、すべての重要な面で、2022年12月31日と2021年12月31日までの会社の財務状況と、2022年12月31日までの2年度の経営結果とキャッシュフローを公平に反映しており、米国公認会計原則に適合していると考えられる。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性について意見を述べるためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
/s/
私たちは2021年から2023年まで同社の監査役を務めています。
2023年3月6日
安永グローバル株式会社会員事務所
F-4
初日生物製薬会社です。
円錐体合併貸借対照表
(単位は千で、1株当たりおよび1株当たりの金額は含まれていない)
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金と現金等価物 |
|
$ |
|
|
$ |
|
||
短期投資 |
|
|
|
|
|
|
||
前払い費用と他の流動資産 |
|
|
|
|
|
|
||
流動資産総額 |
|
|
|
|
|
|
||
財産と設備、純額 |
|
|
|
|
|
|
||
経営的リース使用権資産 |
|
|
|
|
|
|
||
預金とその他の長期資産 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
負債と株主権益 |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
売掛金 |
|
$ |
|
|
$ |
|
||
費用とその他の流動負債を計算しなければならない |
|
|
|
|
|
|
||
賃貸負債の当期部分を経営する |
|
|
|
|
|
|
||
流動負債総額 |
|
|
|
|
|
|
||
賃貸負債の長期部分 |
|
|
|
|
|
|
||
総負債 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
株主権益: |
|
|
|
|
|
|
||
普通株、$ |
|
|
|
|
|
|
||
実収資本を追加する |
|
|
|
|
|
|
||
他の総合損益を累計する |
|
|
|
|
|
( |
) |
|
赤字を累計する |
|
|
( |
) |
|
|
( |
) |
株主権益総額 |
|
|
|
|
|
|
||
総負債と株主権益 |
|
$ |
|
|
$ |
|
||
付記はこれらの連結財務諸表の構成要素である。
F-5
初日生物製薬会社です。
会社連結業務報告書
(単位は千で、1株当たりおよび1株当たりの金額は含まれていない)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
運営費用: |
|
|
|
|
|
|
|
|
|
|||
研究開発 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
一般と行政 |
|
|
|
|
|
|
|
|
|
|||
総運営費 |
|
|
|
|
|
|
|
|
|
|||
運営損失 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
投資収益、純額 |
|
|
|
|
|
|
|
|
|
|||
その他の費用、純額 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
純損失 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
転換可能な非持株権益を償還するには純損失を占めなければならない |
|
|
|
|
|
|
|
|
( |
) |
||
償還可能な非持株権益株式を交換する−配当とする− |
|
|
|
|
|
|
|
|
( |
) |
||
普通株主/メンバーは純損失を占めるべきである |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
1株当たり基本と希釈して純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
加重-計算に使用される普通株式平均 |
|
|
|
|
|
|
|
|
|
|||
付記はこれらの連結財務諸表の構成要素である。
F-6
初日生物製薬会社です。
合併全面損失表
(単位:千)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
他の全面的な収入: |
|
|
|
|
|
|
|
|
|
|||
証券売却可能な未実現収益 |
|
|
|
|
|
( |
) |
|
|
|
||
全面損失総額 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
付記はこれらの連結財務諸表の構成要素である。
F-7
初日生物製薬会社です。
短所償還可能な転換可能な優先株、償還可能な非持株権益と
株主権益·会員権益(赤字)
(単位は千で、シェアは含まれていない)
|
|
償還可能両替 |
|
|
償還可能である |
|
|
|
普通株 |
|
|
普通株 |
|
|
激励株 |
|
|
その他の内容 |
|
|
その他を累計する |
|
|
積算 |
|
|
株主の |
|
|||||||||||||||||||||||||
|
|
株 |
|
|
金額 |
|
|
利子 |
|
|
|
株 |
|
|
金額 |
|
|
株 |
|
|
金額 |
|
|
株 |
|
|
金額 |
|
|
資本 |
|
|
総合損失 |
|
|
赤字.赤字 |
|
|
(赤字) |
|
|||||||||||||
2020年12月31日残高 |
|
|
|
|
$ |
|
|
$ |
|
|
|
|
— |
|
|
$ |
— |
|
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
( |
) |
|||||||
Bシリーズを発行して償還可能な優先株を発行して現金と交換し、発行コストを差し引くことができる$ |
|
|
|
|
|
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
||
激励株を発行する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
奨励株を廃止する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
償還可能な転換可能優先株、普通株、奨励株を普通株に変換する |
|
|
( |
) |
|
|
( |
) |
|
|
— |
|
|
|
|
|
|
|
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
償還可能な非制御的権益を普通株に変換する |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
IPOで発行された普通株は,発行コストを差し引いて$となる |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
従業員の株購入計画に基づいて株を発行する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
株式ベースの給与費用 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
償還可能な非持株権益は純損失を占めなければならない |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
普通株主/メンバーは純損失を占めるべきである |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2021年12月31日の残高 |
|
|
— |
|
|
$ |
— |
|
|
$ |
— |
|
|
|
|
|
|
$ |
|
|
|
— |
|
|
$ |
— |
|
|
|
— |
|
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
|
||||
後続発行により普通株を発行し、発行コスト#ドルを差し引く |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
株式オプション行使時に普通株を発行する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
制限株式単位を解除して普通株を発行する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
従業員の株式購入計画に基づいて普通株を発行する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
普通株に帰属せず没収する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
株式ベースの給与費用 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
証券売却可能な未実現損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
普通株主/会員は純損失を占めるべきである |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2022年12月31日の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|||||||||||
後続発行により普通株を発行し、発行コスト#ドルを差し引く |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
株式オプション行使時に普通株を発行する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
制限株式単位を解除して普通株を発行する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
従業員の株式購入計画に基づいて普通株を発行する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
普通株に帰属せず没収する |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
株式ベースの給与費用 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
証券売却可能な未実現収益 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
普通株主は純損失を占めなければならない |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2023年12月31日の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||||||||||
付記はこれらの連結財務諸表の構成要素である。
F-8
初日生物製薬会社です。
コンソール.コンソールキャッシュフロー表統合レポート
(単位:千)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
経営活動のキャッシュフロー |
|
|
|
|
|
|
|
|
|
|||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
純損失と経営活動で使用される現金純額の調整: |
|
|
|
|
|
|
|
|
|
|||
買収している研究開発資産は |
|
|
|
|
|
|
|
|
|
|||
株式ベースの給与費用 |
|
|
|
|
|
|
|
|
|
|||
減価償却費用 |
|
|
|
|
|
|
|
|
|
|||
短期投資割引の増加、純額 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
経営的使用権資産の償却 |
|
|
|
|
|
|
|
|
|
|||
経営性資産と負債変動状況: |
|
|
|
|
|
|
|
|
|
|||
前払い費用と他の流動資産 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
預金とその他の長期資産 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
売掛金 |
|
|
|
|
|
( |
) |
|
|
|
||
費用とその他の流動負債を計算しなければならない |
|
|
|
|
|
|
|
|
|
|||
リース負債を経営する |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
経営活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
投資活動によるキャッシュフロー |
|
|
|
|
|
|
|
|
|
|||
短期投資購入のための現金 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
短期投資満期収益 |
|
|
|
|
|
|
|
|
|
|||
財産と設備を購入して支払った現金 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
買収している研究開発資産のために支払った現金 |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
投資活動での純現金の提供 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
融資活動によるキャッシュフロー |
|
|
|
|
|
|
|
|
|
|||
Bシリーズを発行して転換可能な優先株を償還して得た金は,発行コストを差し引くことができる |
|
|
|
|
|
|
|
|
|
|||
普通株発行で得られた金の純額 |
|
|
|
|
|
|
|
|
|
|||
株式オプション行使時に普通株で得られた金を発行する |
|
|
|
|
|
|
|
|
|
|||
ESPP購入時に普通株を発行する収益 |
|
|
|
|
|
|
|
|
|
|||
融資活動が提供する現金純額 |
|
|
|
|
|
|
|
|
|
|||
現金および現金等価物の純増加(減額) |
|
|
|
|
|
( |
) |
|
|
|
||
期初現金及び現金等価物 |
|
|
|
|
|
|
|
|
|
|||
期末現金と現金等価物 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
非現金活動の補足開示 |
|
|
|
|
|
|
|
|
|
|||
使用権資産と引き換えに賃貸負債 |
|
|
|
|
$ |
|
|
$ |
|
|||
転換に関する45,331,483株優先株、普通株と奨励株の交換(注1) |
|
$ |
|
|
$ |
|
|
$ |
|
|||
償還可能な転換可能な非持株資本を6,470,382株普通株に交換する(付記11) |
|
$ |
|
|
$ |
|
|
$ |
|
|||
付記はこれらの連結財務諸表の構成要素である。
F-9
初日生物製薬会社です。
連結財務諸表付記
1.ビジネスおよび組織機関の説明
組織と業務
第一日バイオ製薬会社、又は同社は、生命を脅かす疾患を有する全年齢層の人々のための目標療法の開発及び商業化に取り組んでいる臨床段階の生物製薬会社である。同社は2018年11月にデラウェア州法律に基づいて有限責任会社として設立され、名称は英雄治療持株会社。その後、同社は2018年12月に初日治療ホールディングスに改称し、2020年3月に初日バイオ製薬ホールディングスまたは初日ホールディングス有限責任会社に改称した。
2021年5月26日、同社は、デラウェア州国務長官に変換証明書を提出することにより変換を完了し、その名称をDay One BiopPharmticals,Inc.に変更した。2021年12月31日までに、DOT Treateutics-2,Inc.(前身はHero Treateutics Inc.およびDay One BiopPharmticals,Inc.)の2つの子会社があり、またはDOT-2は、2018年11月にデラウェア州に登録され、DOT Treateutics-1,Inc.,またはDOT-1は、2019年12月に華トラ州に登録される。DOT-2とDOT-1はここで総称して子会社と呼ばれる.
2021年12月、当社取締役会は、子会社が当社と合併または合併することを許可し、当社は既存の会社であり、2021年12月31日から発効する。連結が財務諸表に及ぼす影響に関するより多くの情報は、“列報基礎”の節を参照されたい
武田株の初公開、会社転換と交換
2021年6月1日、同社は初公募株式(IPO)を完了し、IPOで合計販売された
初公募株を行うため、会社は2021年5月26日に法人転換を完了し、初日にホールディングス有限責任会社(I)がデラウェア州州務卿に変換証明書を提出することでデラウェア州有限責任会社からデラウェア州会社に変換し、(Ii)を初日バイオ製薬会社に変更した。
変換の一部として:
F-10
初公募株と転換については,ミレニアム証券取引所協定と転換の条項に基づき,ミレニアム製薬会社が交換した
同社は初日ホールディングス有限公司のすべての財産と資産を保有し、初日持株有限責任会社のすべての債務と義務を負担する。転換日から、初日に持株有限公司の各取締役会メンバーと各上級管理者が取締役会メンバーと当社の上級管理者となる。変換は免税再編であり、株式の発行許可を含み、
初公募が終わった後、
株式分割
2021年5月23日、Day One Holding LLC取締役会は、会社の株式の長期分割を実現するために、その運営協定の改訂を承認した
リスクと不確実性
同社は生物製薬業界の早期会社によく見られるリスクに直面しており、製品の臨床有効性、製品商業化、監督管理承認、キー製品、キーパーソンと契約研究機関(CRO)などの第三者サービスプロバイダへの依存、知的財産権保護、および任意の許可、協力または供給協定に従ってマイルストーン、特許使用料または他のお金を支払う能力に関する不確実性を含むが、これらに限定されない。
2.重要な会計政策の概要s
陳述の基礎
添付されている総合財務諸表は、米国公認会計原則またはアメリカ公認会計原則に基づいて作成され、その中に会社子会社の勘定を含む。すべての会社間取引と残高は合併で販売された。
2021年12月31日までに、会社は子会社を合併した。2021年12月31日から、当社取締役会は、子会社が当社と当社に合併することを承認し、当社はまだ存在する会社である(“組織と業務”の節参照)。統合は、会計基準編纂またはASC,250で定義された報告エンティティの変化を構成していないため、会計変更と誤り訂正当社は2021年12月31日より、子会社から移転した資産と負債を歴史的帳簿価値で報告している。
F-11
2021年12月31日以降、会社に子会社がないため、財務諸表に記載されている金額は連結されていません。
本説明における適用ガイドの任意の言及は、財務会計基準委員会(FASB)のASCおよび会計基準更新(ASU)における権威GAAPを意味する。
経営を続ける企業
会社は、ASCテーマ205-40の規定に基づいて、持続的な経営企業としての経営を継続する能力を評価し、決定する財務諸表の列報−継続経営−これは、当社がその年度と中期財務諸表発表日から1年以内に経営を継続する能力を重大な疑いを抱かせる条件や事件があるかどうかを評価することを求めている。これらの条件またはイベントが決定された場合、いくつかの追加の財務諸表が開示される必要がある。確定条件や事件がどの程度会社の持続経営企業としての持続的な経営能力に対する重大な疑いを引き起こすか、あるいは緩和計画がどの程度このような重大な疑念をどの程度緩和するか、および清算が行われるかどうかは、管理層が重大な判断を下す必要がある。
予算の使用
米国公認会計原則に基づいて連結財務諸表を作成することは、連結財務諸表の日付の資産、負債及び又は資産及び負債の報告金額、及び報告期間内に報告された費用金額に影響を与えるために、管理層に推定と仮定を要求する。添付されている総合財務諸表に作成されている推定および仮定には、株式ベースの報酬の推定値、繰延税金資産および所得税の不確実性の推定値、および研究開発活動の課税項目が含まれているが、これらに限定されない。同社の見積もりは歴史的経験や様々な他の合理的な仮定に基づいている。実際の結果は,これらの推定や仮定とは異なる可能性がある.
細分化市場
同社はその最高経営責任者を最高経営決定者、CODMと略称することを決定した。同社は、全年齢の遺伝子定義癌を有する者のための的確な治療を決定し、推進する事業である報告及び運営部門の形態で業務を経営·管理している。同社のCODMは、まとめた上で財務情報を審査し、資源を割り当て、財務業績を評価する。その会社のすべての資産はアメリカにあります。
信用リスクその他のリスクと不確定要因が集中している
会社を高度な集中信用リスクに直面させる金融商品は主に現金、現金等価物、短期投資を含む。預金金額は連邦保険の限度額を超える場合があります。その貸借対照表に記録されている現金、現金等価物、短期投資を持つ金融機関が違約すれば、当社は信用リスクに直面する。政策によると、同社はハイレベルツールに投資し、いずれかの発行者への集中を制限することでリスクを低減し、そのリスクの開放を制限している。同社の現金、現金等価物、短期投資は何の損失も出ていない。
当社はいくつかのリスクと不確定要素の影響を受け、以下のいずれの変化も当社の将来の財務状況または経営結果に重大な悪影響を及ぼす可能性があると考えられる:将来の融資を得る能力、候補製品の承認と市場受け入れおよび補償の規制要求;当社が依存する第三者臨床研究機関とメーカーの表現、販売ルートの発展、当社の知的財産権の保護、知的財産権、特許、製品、監督管理またはその他の要素による当社の訴訟またはクレーム;市場構造の変化;企業が成長を支援するために必要な従業員の能力を引き付けて維持することができます
F-12
同社は第三者メーカーに依存してその計画中の研究·開発活動に製品を提供している。特に,同社は少数のメーカーがこれらの計画に関連する活性医薬成分や処方薬の供給要求に依存していることに依存し続けると予想される。これらのプロジェクトは活性薬物成分や製剤薬物供給の深刻な中断の悪影響を受ける可能性がある。
現金と現金等価物
当社は購入時の原始満期日が三ヶ月以下のすべての高流動性投資を現金等価物と見なしています。同社の現金等価物には、通貨市場基金、米政府機関証券、米国国債への投資が含まれている。現金等価物は公正価値に近い分担コストで確認した。
投資する
同社の投資には米国債と米政府機関証券が含まれる。投資は、購入時に管理職の意図に応じて、保有から満期まで、販売または取引可能に分類される。その会社のすべての投資は販売可能に分類されている。売却可能な証券は推定公正価値に従って帳簿に記載されており、この等投資の未実現保有量損益(税項の影響を差し引く)は他の全面収益の中で総合全面損益表の単独構成部分として報告されている。公正価値は、見積、金利、および収益率曲線のような観察可能な見積市場金利に基づいて、または観察可能なデータ点を利用することによって決定される。
販売可能な証券について、当社は、任意の減価が信用損失または非信用損失に関連しているかどうかを判断する。損失が信用或いはその他の要素から来ているかどうかを評価する時、管理層は公正価値が償却コストより低い程度、格付け機関の証券格付けに対するいかなる変化及び証券関連の不利な条件などの要素を考慮する。この評価が信用損失が存在することを示す場合、証券から受け取るキャッシュフローの現在値と証券の余剰コストベースを比較することが予想される。もし現金流量の現在値が余剰コスト基礎より低い場合、信用損失が存在し、そして減値準備を計上するが、公正価値が余剰コストベースより小さい金額を限度とする。解約または回収の形態で信用損失部分に関連する後続活動は、証券信用損失を売却するための準備可能な一部として確認された。
金融商品の公正価値
総合貸借対照表では,公正価値で常時記録されている資産と負債は,その公正価値を計測するための投入に関する判断レベルに基づいて分類される.公正価値は、計量日に市場参加者間の秩序ある取引において資産または負債の元本または最も有利な市場の負債を移動させるために、受信される交換価格または支払いされる退出価格として定義される。公正価値を計量するための推定技術は,観察可能な投入を最大限に利用し,観察不可能な投入を最大限に減少させなければならない。“公正価値計量に関する権威指針”は公正価値計量の開示のために三級公正価値等級を確立し、具体的には以下の通りである
第1レベル--観察可能な投入、例えば、計量日と同じ資産または負債のアクティブ市場における未調整オファー;
第2レベル-資産または負債の投入を直接または間接的に観察することができる(第1レベルに含まれる見積を除く)。これらのオファーは、アクティブ市場における同様の資産または負債の見積もりと、非アクティブ市場における同じまたは同様の資産または負債の見積もりとを含む
第三レベル-市場活動が少ないか、または市場活動支援の観察できない投入がなく、資産または負債の公正な価値に大きな意義を持っている。
F-13
ある程度、推定値は市場で観察または観察できないモデルや投入に基づいており、公正価値の決定にはより多くの判断が必要である。そのため、当社が価値を公平に判断する際に下した判断は、第3級に分類されたツールに対する判断度が最も高く、公正価値レベル内の金融商品レベルは、公正価値計量に大きな意味を持つ任意の投入の中で最低レベルに基づいている。
現金等価物,前払い費用,その他の流動資産,売掛金,売掛金およびその他の流動負債の短期的性質により,付随する総合貸借対照表に反映される帳簿金額はその公正価値に近い。
財産と設備、純額
財産と設備はコストから減価償却と償却を差し引いて入金される。減価償却は直線法で関連資産の推定耐用年数(3~5年)で確認され、リース収益は賃貸期間または資産の推定耐用年数の短いもので償却される。2023年12月31日と2022年12月31日までの財産·設備純資産額は実質的なものではない。2023年12月31日まで、2022年、2021年12月31日までの年間当たりの減価償却費用は微々たるものである。
賃貸借証書
リース定義に適合する契約スケジュールは、経営的または融資的賃貸に分類され、総合貸借対照表に使用権資産またはROU資産、およびリース負債として記録され、レンタル期間内の固定賃貸支払いをリースに暗黙的な金利または会社の増分借入金利(IBR)で割引する計算方法である。レンタルROU資産およびレンタル責任は、発効日レンタル期間内の将来の最低レンタル支払いの現在値で確認します。当社には現在融資リースは何もありません。
経営リースROU資産は、(I)開始日または以前に支払われた金、(Ii)による初歩的な直接コスト、および(Iii)リース下のテナント激励措置に基づいて調整される。運営リースの隠れた金利は特定できないため、当社はレンタル開始日を適用した資料に基づいて内部収益率を決定します。IBRは,当社が資産が存在する類似経済環境下で,類似期限に相当する賃貸金を抵当に借入して支払う金利に基づいて決定される.当社はリース期間を対象資産を使用する権利がある取消不可期間と見なし、当社が任意の選択権を行使して契約の任意の期間を延長することを決定する理由がある。
運営リースの最低賃貸支払いのリースコストは直線法でレンタル期間内に確認する。賃貸負債は毎期利息を増加させ、支払いを減少させ、ROU資産はレンタル期間内に償却する。可変レンタルコストは発生時に入金されます。ROU資産とリース負債を計量する際には、会社は合併リースと非レンタル組成物を選択する。当社では、リース開始時の初期期限が12ヶ月以下の短期賃貸は含まれておらず、会計政策選択として、このようなレンタルのレンタル期間内の賃貸料支出を直線的に確認しています。
長期資産減価準備
当社は、物件及び設備及び使用権資産からなる長期資産グループの減値を評価し、イベントや状況変化が当該等の資産の額面が回収できない可能性があることを示している場合。保有·使用する資産の回収可能性は,資産の帳簿価値と資産予想による将来の未割引現金流量を比較することで測定した。当該等の資産は減値とみなされ、確認すべき減値は、当該資産の帳簿価値が当該資産の公正価値を超える金額で計量される。これまで、連結財務諸表では減値は確認されていません。
F-14
研究と開発費
研究および開発費用には、会社を代表して臨床試験を行う第三者契約研究機関、契約製造機関、および他の第三者との合意によって生成された技術および知的財産許可証の取得に関連するコスト、実験室材料および用品を含む研究および開発プロジェクトに関連する他のコスト、会社の研究開発者の給料、福祉および株式ベースの報酬支出、および賃貸料および施設維持費用および償却費用を含む従業員に関するコストが含まれる。当社は発生した研究と開発費用を負担します。会社はある研究と開発協定に署名する際に前払い金を支払う義務がある。将来の研究開発活動のための商品またはサービスのための事前支払いは、払い戻し不可能な金額を含めて延期されます。この金額は、関連貨物が提供されたり、関連サービスが提供されたりする際に費用として確認されたり、会社が貨物またはサービスを提供しないことが予想される場合に費用として確認されたりします。
研究と開発費用を計算すべきである
当社は第三者サービスプロバイダによる臨床試験の見積もりコストの計上すべき負債を記録している。同社は,提供されているが領収書が発行されていない見積サービス金額に基づいて,臨床試験の見積もりコストを研究·開発費用として記録している。当社は,完了した仕事の見積もりなどの要因や,サービス契約に基づいて第三者サービスプロバイダと締結した条項に基づいて,これらの費用を計上しなければならない。当社は各報告期間の計上すべき負債残高を決定する際に判断と見積もりを行います。実際のコストが既知であるため、会社はその負債を調整した。当社の計算すべきコストと実際に発生したコストとの間には大きな差はありません。
同社は,我々の臨床試験を指導·管理する契約研究機関との契約に基づき,臨床試験に関する費用を支払っている。これらの契約の財務条項は交渉する必要があり、これらの条項は契約によって異なり、材料やサービスを提供する期限と一致しない支払いを招く可能性がある。一般に、これらのプロトコルは、固定料金、単価、または時間および材料で実行される動作範囲を規定する。会社が将来の研究·開発活動のための商品やサービスを前払いする場合、支払いは延期され、前払い費用として資本化され、貨物を受け取ったり、関連サービスを提供したりする際に費用として確認される。このような支払いは、予期される達成された時間に基づいて、現在または長期的な分類評価を行う。
特許費用
特許出願の提出及び起訴に関するすべての特許に関する費用は、支出回収状況が不確定であることによる費用に基づいて計上される。発生した金額は,連結業務報告書では一般費用と行政費用に分類される。
転換可能優先株を償還する
当社は発行日の公正価値に基づいて発行コストを差し引いた償還可能転換優先株入金を行います。償還可能な転換可能優先株は株主損失以外に入金される。当該等優先株は強制償還できないが、当社がコントロールできないものとみなされる清算事件が発生した場合、得られた金は償還可能転換優先株株主の清算優先順位に応じてまず償還可能な転換可能優先株株主に割り当てられるからである。当社は転換可能な優先株を償還可能な帳簿価値をその清算優先株に調整していません。いつ清算事件が発生するかどうかが確定していないので、当社には償還可能な転換可能な優先株保有者に清算優先株を支払う責任があります。2021年5月のIPO終了時に、償還可能な転換可能優先株はすべて普通株に変換することができる。
F-15
償還可能な非持株権益
償還可能な非持株権益とは、DOT-1の非直接または間接的に当社の株式(純資産)部分に帰属することである。償還可能な非持株権益は一時株式に分類され、所有者に発行される優先株には、自社の制御範囲内に完全にはない償還特徴が含まれているからである。取引所の一部として償還可能な非持株権益は2021年5月に廃止された。
株式ベースの報酬
初公募前に、当社は株式に基づくすべての奨励、奨励株式、制限的株式奨励の推定公正価値に基づいて、オプション定価モデルを採用し、付与日に株式に基づく報酬支出を確認した。オプション定価モデルは主観的仮定を入力する必要があり、標的普通株の公正価値、奨励の期待期限、期待変動率、無リスク金利と配当収益率を含む。普通株式の公正価値を決定する際に、企業価値を推定するための方法は、米国公認会計士協会会計および推定ガイドラインと一致する方法、方法、および仮定を用いて実行される補償として発行された個人持株会社株式証券の推定値それは.有限責任会社の利益権益の参加敷居金額は、取締役会が付与したときに決定される。この間に付与された賠償金の期待期限は,クリーニング終了イベントまでの期待時間に基づいて決定される.同社は付与時に発効した米国債収益率をもとに、付与期限と一致した無リスク金利を採用している。予想変動率は、当社が業務を展開している業界同業グループが予想される流動資金時間と一致することに基づいている。配当収益率を
初めての公募終了後、会社はBlack-Scholes推定モデルを用いて従業員と非従業員のオプションを付与する公正価値を推定し、内在価値は制限性株式奨励の公正価値を推定し、及び制限性株式単位は日会社普通株の公正価値を授与した。
ブラック·スコアーズオプション定価モデルは、株式オプション報酬の公正価値を推定するために使用され、以下の仮定を使用することが要求される
F-16
サービス条件のある奨励については、会社は直線帰因法を用いて株式報酬費用を確認した。業績条件のある報酬が条件を満たす可能性がある場合には、会社は株式ベースの報酬支出を確認し、報酬が付与される。当社は没収が発生した同時期に費用を減らすことで没収を確認します。当社は総合経営報告書において株式をもとに報酬支出を分類しており,受賞者の賃金コストや受賞者のサービス支払いを分類する方式と同様である。
所得税
初公募の前に、国内税法によると、同社と2社の子会社は税務面で共同企業とされていた。転換前に、会社のメンバー(前身は初日バイオ製薬ホールディングス、LLC)は、初日にバイオ製薬ホールディングスのそれぞれの所有権と活動について直接課税した。当社の連結会社子会社は、貸借対照法の下で所得税を計上し、以下のようになる。
初公募および株式交換が完了した後、当社の所得税は貸借対照法で入金されます。繰延税項資産及び負債は、既存資産及び負債の帳簿金額及びそのそれぞれの税ベースと営業損失純額及び税額相殺繰越との差額による将来の税項影響を確認することができる。繰延税項資産と負債は総合財務諸表の帳簿額面と資産及び負債の課税基準との差額に基づいて決定され、予想差額に予想される年度に適用される課税収入の公布税率計量を採用する。繰延税金資産の一部または全部が現金化できない可能性が高い場合、繰延税金資産減価準備。
不確定な所得税は最大金額で確認され、その金額は関連税務機関の審査を経てさらに維持される可能性がある。確認や計測の変化は判決が発生した期間に反映される.同社の政策は、所得税の減納に関する利息と罰金を所得税として確認するための構成要素である。これまで、未確認の税収割引に関する利息や罰金は記録されていない。
1株当たり純損失
当社は証券参加に必要な二段階法に基づいて1株当たりの基本純損失と希薄化純損失を計算します。2種類の法の下で、1株当たりの基本純損失の計算方法は、純損失を期間中に発行された普通株の加重平均数量で割ることであり、潜在的な希釈証券を考慮しない。1株当たり純損失の算出方法は、任意の償還可能な非持株権益の損失を差し引いた後、純損失を期内に発行された普通株の加重平均に期内の潜在的希薄化証券の希薄化影響の和を加えたものである。潜在的希釈証券は、初回公募前の激励株、帰属していない制限的な普通株、および償還可能な転換可能な優先株を含む。IPO後、希釈可能な証券は、未付与制限株式奨励、未付与制限株式単位、および株式オプションを含む。列報のすべての期間において、1株当たり純損失は1株当たりほぼ純損失と同じであり、これは潜在普通株計上の影響が逆薄であり、激励株の参加ハードルが達していないためである。
総合損失
総合損失とは株主権益のすべての変動であるが,株主による変動や株主に割り当てられた変動は含まれていない.同社が証券を売却できる未実現収益と損失は他の全面損失の唯一の構成部分であり、報告の純損失に含まれず、総合全面損失表に記載されている。
最近発表された会計公告
2023年11月、FASBはASU番号2023-07、支部報告(テーマ280)-を発表しました報告可能な部分に開示された改善これは、中期と年度に基づいて支部情報を段階的に開示することを要求する。本ASUは,2023年12月15日以降の財政年度内に公共実体に有効であり,かつ
F-17
2024年12月15日以降に開始される財政年度内の移行期間。公共エンティティは、財務諸表に記載されている以前に適用されたすべての期間を遡らなければならない。同社は現在、この更新がその財務諸表開示に及ぼす影響を評価している。
2023年12月、FASBはASU 2023-09号、所得税(主題740)を発表した所得税開示を改善するそれは、支払われた分類所得税の開示を要求することによって、所得税開示の透明性および意思決定の有用性を向上させ、有効な税率調整の構成要素の標準カテゴリを規定し、他の所得税に関する開示を修正する。ASUは2024年12月15日以降の会計年度に有効であり、前向きに採用することが可能であり、遡及オプションを有している。同社は現在、この更新がその財務諸表開示に及ぼす影響を評価している。
3.経常的公正価値計測
次の表は会社の12月31日までの金融商品を示しています2023年と2022年には、公正価値階層構造内で公正価値毎に定期的に計量する(千計)
|
|
2023年12月31日 |
|
|||||||||||||
|
|
レベル1 |
|
|
レベル2 |
|
|
レベル3 |
|
|
合計する |
|
||||
金融資産: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
貨幣市場基金 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
アメリカ国債 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ政府機関証券 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
公正価値に応じて計量された総資産 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
|
|
2022年12月31日 |
|
|||||||||||||
|
|
レベル1 |
|
|
レベル2 |
|
|
レベル3 |
|
|
合計する |
|
||||
金融資産: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
貨幣市場基金 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
アメリカ国債 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ政府機関証券 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
公正価値に応じて計量された総資産 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
同社の通貨市場基金は、活発な市場からの同じ資産の観察可能な投入を用いて測定されているため、レベル1に分類されている。
同社の米国債および米国政府機関証券は、活発な市場における類似資産の見積もりと、非アクティブ市場における同じまたは類似した資産の見積もりを含む資産の直接的または間接的に観察可能な投入を用いて測定されるため、2段階に分類される。
2023年12月31日と2022年12月31日現在、レベル3に分類されている資産や負債はない。
いくつありますか
以下の表は、会社の現金等価物、短期投資に分類された売却可能証券、および関連する未実現損益の推定公正価値(単位:千):をまとめている
|
|
2023年12月31日 |
|
|||||||||||||
|
|
原価を償却する |
|
|
未実現収益 |
|
|
未実現損失 |
|
|
公正価値を見積もる |
|
||||
現金等価物: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
貨幣市場基金 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
アメリカ政府機関証券 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ国債 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
現金等価物合計 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
短期投資 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ国債 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
短期投資総額 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
F-18
|
|
2022年12月31日 |
|
|||||||||||||
|
|
原価を償却する |
|
|
未実現収益 |
|
|
未実現損失 |
|
|
公正価値を見積もる |
|
||||
現金等価物: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
貨幣市場基金 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
アメリカ政府機関証券 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
現金等価物合計 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
短期投資 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ国債 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
アメリカ政府機関証券 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
短期投資総額 |
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
次の表は、私たちの現金等価物と売却可能証券の満期日(単位:千)をまとめています
|
|
2023年12月31日 |
|
|||||
|
|
原価を償却する |
|
|
公正価値 |
|
||
1年以下で成熟しています |
|
$ |
|
|
$ |
|
||
合計する |
|
$ |
|
|
$ |
|
||
|
|
2022年12月31日 |
|
|||||
|
|
原価を償却する |
|
|
公正価値 |
|
||
1年以下で成熟しています |
|
$ |
|
|
$ |
|
||
合計する |
|
$ |
|
|
$ |
|
||
当社は定期的にその証券格付けの変動を検討し、周囲の経済状況を監査し、期待される信用損失のリスクを評価する。2023年12月31日と2022年12月31日までいくつありますか
4.貸借対照表項目
前払い費用と他の流動資産
前払い料金および他の流動資産には、以下のものが含まれている(千計)
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
研究開発費を前払いする |
|
$ |
|
|
$ |
|
||
前払い保険 |
|
|
|
|
|
|
||
他の前払い費用と他の資産 |
|
|
|
|
|
|
||
前払い費用とその他の流動資産総額 |
|
$ |
|
|
$ |
|
||
F-19
費用とその他の流動負債を計算しなければならない
計算すべき費用および他の流動負債には、以下の項目が含まれる(千で計算)
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
研究と開発費用を計算すべきである |
|
$ |
|
|
$ |
|
||
給与明細に関連する費用を計算しなければならない |
|
|
|
|
|
|
||
専門サービス費用を計算する |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
費用とその他の流動負債総額を計算しなければならない |
|
$ |
|
|
$ |
|
||
5.重要なプロトコル
武田資産協定
2019年12月16日、DOT Treateutics-1,Inc.,またはDOT-1,会社の子会社は、ミレニアム製薬会社と資産購入契約を締結したか、または武田資産協定を締結し、ミレニアム製薬会社は武田製薬株式会社の関連先および付属会社である。武田資産プロトコルによれば、DOT-1はTAK-580(現在tovorafenib)に関連するいくつかの技術的権利とノウハウを購入し、原発性脳腫瘍または固形腫瘍脳転移患者の治療に新しい方法を提供した。DOT−1は,同社のようなRAF−阻害剤の研究·開発活動のための臨床在庫供給と,指定された調査者臨床試験プロトコルも受け取っている。武田はViracta治療会社(F/k/a Sunesis PharmPharmticals,Inc.)やViractaの独占ライセンスプロトコルやViractaライセンスプロトコルとDOT-1にも割り当てている.武田はまた、武田資産協定に基づいてDOT−1に指定特許項下のグローバル再許可独占許可と、武田資産協定に基づいて生成された他の特許及び独自技術項下の非独占許可とを付与した。当社も武田資産協定の定義に基づいて、武田資産協定が規定する適用時間範囲内で指定された発展マイルストーンに到達できなかった場合に自動的に終了またはDOT-1で終了する許可を武田に付与します。この武田に付与された帰還許可証は転換時に終了し、ミレニアム証券取引所協定と関係がある。
DOT−1は,資産の売却·譲渡および武田資産協定によるライセンス付与の代償として#ドルを前払いした
武田資産協定の有効期限は、各国のすべての譲渡特許権とすべてのライセンス特許権が満期になった後、国ごとに終了します。武田は、会社が初めて商品を商業販売する前に武田資産協定を終了することができ、会社が連続して指定された期間内にいかなる開発活動を停止すれば、この停止は当事者の同意を得られず、規制当局の指導に応えるためでもない。また、武田は会社倒産時に武田資産協定を終了することができる。武田が当社の開発停止や破産により武田資産協定を終了すれば、譲渡されたすべての特許、ノウハウ、契約(Viractaライセンス契約を除く)が武田に譲渡され、武田は当該等で終了した製品をすべて開発するために発生した特許やノウハウに基づいて回復許可を得る。
DOT-1は2021年12月31日から当社と合併して当社に組み込まれ、当社は既存の会社であり、武田資産購入協定に基づいてDOT-1‘Sの義務を負う。
Viracta許可協定
2019年12月16日、DOT-1は、武田資産協定に従って譲渡されたViractaライセンス協定を修正し、再確認した。Viractaライセンスプロトコルによると,DOT−1は特定の特許権やノウハウにより世界的に独占的に許可されており,RAFタンパク質ファミリーに結合した化合物を含む製品を開発,使用,製造,商業化することができる。
F-20
DOT-1支払いました$
Viractaライセンス契約の期限は,会社がViractaにその製品の当該国/地域での印税を支払う義務期間が満了した後,ライセンス製品と国/地域で終了する.DOT-1は、指定された通知期間内に任意またはすべてのライセンス製品に関連するViractaライセンスプロトコルを任意に終了する権利がある。
DOT-1は2021年12月31日から当社と合併して当社に合併し、当社は既存の会社であり、ヴィアクタ許可協定に従ってDOT-1‘Sの義務を負う。
メルクKGaA社とライセンス契約を結び、ドイツのダムシュタット
2021年2月10日、DOT治療-2社または同社の子会社DOT-2は、ドイツのダムシュタットに位置するメルクKGaA製薬会社と許可協定、すなわちMRKDG許可協定を締結した。MRKDG許可協定によると、ドイツのダムシュタットのメルクKGaAは同社に独占グローバルライセンスを付与し、特定の特許権利と技術ノウハウに基づいて、複数のレベルで再許可を付与し、PimasertibとMSC 2015103 B化合物を含む製品を研究、開発、製造、商業化する権利がある。同社は臨床在庫用品も受け取り,その研究や開発活動に用いられている。同社が付与した独占許可は、メルクKGaAが付与した非独占許可によって制限されている。メルクKGaAはドイツの癌研究機関の付属会社であり、ドイツのダムシュタットメルクKGaAはいくつかのPimasertibに関する臨床研究を直接または間接的に行う権利を保持している。
MRKDGライセンス協定によると、同社はビジネス上合理的な努力を使用し、2029年までに少なくとも2つの指定された主要市場国で少なくとも2つのライセンス製品を開発して商業化する義務がある。
MRKDGライセンス契約により付与された権利と臨床用品の代償として,同社は#ドルを前払いした
MRKDGライセンス契約の期限は,会社がその国/地域のライセンス製品についてライセンス側に印税を支払う義務期間が満了した後,ライセンス製品と国/地域で満期となり,会社がMRKDGライセンス契約に基づいてすべてのライセンス製品とすべての国/地域のすべての支払い義務が満了したときにすべて満期となる。
DOT−2は2021年12月31日より当社と合併して当社に合併し,当社は既存の会社であり,MRKDG許可協定に基づいてDOT−2‘Sの義務を負う。
F-21
Sprint Bioscience ABとの研究協力と許可プロトコル
2023年8月15日、同社は、スウェーデンのハディンガーのスウェーデン社Sprint Bioscience ABまたはSprintと、Sprintライセンス契約である研究協力および許可協定を締結した。Sprint許可協定によると、Sprintは同社に独占的な全世界許可を授与し、複数の階層を通じて再許可を授与し、医薬製品を研究、開発と商業化する権利があり、そしてワクシニアウイルスに関連するKinase 1或いはVRK 1の発見、最適化と開発を目的とした研究に従事している。
その会社は$を支払った
Sprintライセンス契約の期限は、ライセンス製品およびその国/地域のライセンス使用料期限が満了したときに、事前に終了しない限り、ライセンス製品および国/地域に基づいて満了します。当社は、指定された通知期間内にSprintライセンスプロトコルのすべての内容を勝手に終了するか、または製品を1つずつ許可して終了する権利があります。
6.
賃貸借証書
同社は2020年3月にカリフォルニア州サンフランシスコ南部にある会社のオフィス施設について賃貸契約を締結した。このようなプロトコルは、確定された資産使用を制御する権利が一定期間、価格と交換するために会社に譲渡されたので、レンタルとして決定される。当社はレンタル期間を一年間延長することができます
2022年4月、当社は賃貸契約を締結した
当社のリース契約は暗黙金利を提供していないため、当社はレンタル開始日を適用する利用可能情報に基づいてレンタル逓増借入金金利、またはIBRを決定しました。IBRは,当社が資産が存在する類似経済環境下で,類似期限に相当する賃貸金を抵当に借入して支払う金利に基づいて決定される.2023年12月31日まで加重平均残存賃貸年限と加重平均割引率は
同社のレンタルは何の支払いや賃貸料も要求せず、財務制限を加えず、残額保証も含まれていない。
資産を使用する賃貸費用は、適用されるリース期間内に直線法で確認される。レンタル料金は$
F-22
それぞれ分析を行ったレンタル負債を計上した金額で支払われた現金は#ドルです
自分から2023年12月31日、将来のレンタル義務は以下の通り(千単位)
|
十二月三十一日 |
|
|
2024 |
$ |
|
|
将来の最低賃貸支払い総額 |
|
|
|
差し引く:推定利息 |
|
( |
) |
リース負債現在価値を経営する |
|
|
|
差し引く:経営リース負債の当期分 |
|
( |
) |
リース負債を経営する |
$ |
|
|
研究と開発協定
同社は正常な業務過程中に臨床研究機構、代理工組織とその他の第三者サプライヤーと臨床試験、製造、テストとその他の研究と開発活動について契約を締結した。これらの契約は一般的に通知後に終了することに規定されていますが、一部の費用はプロジェクト承認後にキャンセルできないため、サプライヤーの例外があります。2023年12月31日と2022年12月31日までいくつありますか
許可協定
当社は、付記5に開示されているように、当該等の合意に基づいて、特定の事件を満たした後にマイルストーン費用を支払う必要があるライセンス契約を締結します。ドルの最初のマイルストーン
購入承諾
Tovorafenibの製品需要を支援するため、会社は2023年7月にQuantient Sciences-Philadelphia,LLCと製造と供給協定を締結し、会社に毎年最低購入義務を満たすことを要求した。今後5年間の製造·供給協定によると、将来最低購入義務の金額は約#ドルである
法律訴訟
当社は通常の業務過程で発生した訴訟、クレーム、評価に時々参加する可能性があります。将来支出が発生する可能性があり、その等の支出が合理的に見積もることができる場合、当社はその等の事項について負債を計上しなければならない。当社はいかなる重大な法律手続きの影響も受けておらず、その知る限り、現在のところ重大な法的手続きが待っていることや脅かされていることはない。
賠償協定
はい正常な業務過程において、会社は各種の陳述と保証を含む契約と協定を締結し、特定の責任に対して賠償を行うことを規定している。これらのプロトコルでのリスクの開口は未知であり,将来それに提起される可能性があるがまだクレームされていないことに関連しているからである.これまで、同社は何のクレームも支払っておらず、その賠償義務に関するいかなる訴訟も弁護されていない。しかし、このような賠償義務のため、会社は未来に費用を記録するかもしれない。会社はまた、その役員と高級管理者の特定の事件や事件における賠償義務があるが、彼らがその要求に応じているときは一定の制限がある
F-23
容量です今までクレームはありませんでしたが、同社はこれらの賠償協定の公正価値が最も低いと考えています。そのため同社には
7.転換可能優先株式償還可能
2021年6月1日、会社は初公募株を完成し、全発売
2021年2月、当社は発表
8.普通株式
その会社の登録証明書によると,当社は発行する権利がある
2018年11月、当社は当社と普通株購入契約を締結しました
同社は未来の発行のために普通株式を予約しており、具体的には以下の通りである
|
|
十二月三十一日 |
|
|
発行済みと未償還普通株式オプション |
|
|
|
|
将来の贈与に使える普通株 |
|
|
|
|
ESPPに使える普通株式 |
|
|
|
|
発行済みおよび未発行の限定株式単位 |
|
|
|
|
合計する |
|
|
|
|
2023年6月に後続サービスを提供
2023年6月、同社は後続発行と発行·販売を完了した
市場で製品を提供する
会社はすでにパイパー·サンドラー社とジョーンズ貿易機関サービス有限責任会社と、会社の普通株の株式の発行と売却に関連し、総発行価格は最高$に達する持分分配協定を締結した
2022年6月に後続サービスを提供
2022年6月、同社は後続発行と発行·販売を完了した
F-24
よくあることだ株式)、公衆に公表されている価格は$
9.株式の給与
連結業務報告書に記録されている株式別給与費用は以下の通り(千単位)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
研究開発費 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
一般と行政費用 |
|
|
|
|
|
|
|
|
|
|||
株式に基づく報酬総支出 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
2023年12月31日まで一ドルあります
2023年12月31日まで一ドルあります
2022年株式インセンティブ計画
2022年10月、会社取締役会は2022年株式インセンティブ計画、または2022年計画を承認した。2022年計画では、非法定株式オプションと制限株式単位の付与が規定されている。“2022年計画”によると予約発行された普通株式数は
下表は2022年までの年度の株式オプション活動をまとめたものである2023年12月31日。
|
|
オプション |
|
|
加重平均 |
|
|
加重平均 |
|
|
骨材 |
|
||||
2022年12月31日に返済されていません |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
授与する |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
鍛えられた |
|
|
— |
|
|
$ |
— |
|
|
|
|
|
$ |
— |
|
|
没収する |
|
|
— |
|
|
$ |
— |
|
|
|
|
|
|
|
||
2023年12月31日現在の未返済債務 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
すでに帰属しており、2023年12月31日に帰属する予定です |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
2023年12月31日に行使できます |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
総内在価値は、関連する普通株の推定公正価値と発行された現金オプションの行権価格との差を表す。
2023年12月31日までの年度内に帰属するオプションの総公正価値はい$です
2023年12月31日現在の株式オプション未確認株式報酬はい$です
F-25
同社はブラック·スコアーズオプション定価モデルを用いて、付与された株式オプション報酬の公正価値を推定し、以下のように仮定した
|
|
現在までの年度 |
||||
|
|
2023 |
|
2022 |
|
2021 |
予想期限(年単位) |
|
— |
|
|
— |
|
予想変動率 |
|
|
|
|||
無リスク金利 |
|
|
|
|||
期待配当収益率 |
|
|
|
|||
下表は、2022年までの年内に“2022年計画”に基づいて展開されている限定的な株式単位活動をまとめたものです2023年12月31日:
|
|
量 |
|
|
加重平均 |
|
||
2022年12月31日現在の未帰属制限株式単位 |
|
|
|
|
$ |
|
||
授与する |
|
|
|
|
$ |
|
||
既得 |
|
|
( |
) |
|
$ |
|
|
没収する |
|
|
|
|
$ |
|
||
2023年12月31日現在の未帰属制限株式単位 |
|
|
|
|
$ |
|
||
2023年12月31日現在確認されていない限定株式単位の株式ベース報酬はい$です
2021年株式インセンティブ計画
IPOが完了する前に、発行されたすべての奨励株は普通株奨励に変換される
|
|
量 |
|
|
加重平均 |
|
||
2022年12月31日現在の未帰属普通株 |
|
|
|
|
$ |
|
||
既得 |
|
|
( |
) |
|
$ |
|
|
没収する |
|
|
( |
) |
|
$ |
|
|
2023年12月31日現在の未帰属普通株 |
|
|
|
|
$ |
|
||
2021年5月、IPOについて、取締役会と株主は2021年株式インセンティブ計画、すなわち2021年計画を承認し、IPO発効日の前日に発効した。2021年計画では、奨励的株式オプション、非法定株式オプション、株式付加価値権、制限株式奨励、制限株式単位、その他の株式ベースの奨励を付与することが規定されている。“2021年計画”により発行保留のための普通株式数は:(X)
F-26
下表は本年度までの2021計画下の株式オプション活動をまとめたものである2023年12月31日。
|
|
オプション |
|
|
加重平均 |
|
|
加重平均 |
|
|
骨材 |
|
||||
2022年12月31日に返済されていません |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
授与する |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
鍛えられた |
|
|
( |
) |
|
$ |
|
|
|
|
|
$ |
|
|||
没収する |
|
|
( |
) |
|
$ |
|
|
|
|
|
|
|
|||
2023年12月31日現在の未返済債務 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
すでに帰属しており、2023年12月31日に帰属する予定です |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
2023年12月31日に行使できます |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
総内在価値は、関連する普通株の推定公正価値と発行された現金オプションの行権価格との差を表す。
2023年12月31日,2022年12月31日および2021年12月31日までの年度内に帰属するオプションの公正価値総額はい$です
2023年12月31日現在の株式オプション未確認株式報酬はい$です
同社はブラック·スコアーズオプション定価モデルを用いて、付与された株式オプション報酬の公正価値を推定し、以下のように仮定した
|
|
現在までの年度 |
||||
|
|
2023 |
|
2022 |
|
2021 |
予想期限(年単位) |
|
|
|
|||
予想変動率 |
|
|
|
|||
無リスク金利 |
|
|
|
|||
期待配当収益率 |
|
— |
|
— |
|
— |
下表は,2021年年度までに“2021年計画”に基づいて展開されている限定的な株式単位活動をまとめたものである2023年12月31日:
|
|
量 |
|
|
加重平均 |
|
||
2022年12月31日現在の未帰属制限株式単位 |
|
|
|
|
$ |
|
||
授与する |
|
|
|
|
$ |
|
||
既得 |
|
|
( |
) |
|
$ |
|
|
没収する |
|
|
( |
) |
|
$ |
|
|
2023年12月31日現在の未帰属制限株式単位 |
|
|
|
|
$ |
|
||
2023年12月31日現在確認されていない限定株式単位の株式ベース報酬はい$です
F-27
演技賞
2022年6月、会社は2021年計画に基づいて非実行従業員にPSOとPSUからなる業績賞を授与した。各成績賞は、会社の取締役会報酬委員会が決定した業績期間内に業績に基づく指標を実現することによって獲得された。当社が業績条件を達成する可能性があると判断した場合、業績条件を含む株式奨励の見積公正価値を確認します。
2021年末までの年間PSO活動を表にまとめました2023年12月31日。
|
|
オプション |
|
|
加重平均 |
|
|
加重平均 |
|
|
骨材 |
|
||||
2022年12月31日に返済されていません |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
授与する |
|
|
— |
|
|
$ |
— |
|
|
|
|
|
|
|
||
鍛えられた |
|
|
— |
|
|
$ |
— |
|
|
|
|
|
$ |
— |
|
|
没収する |
|
|
( |
) |
|
$ |
|
|
|
|
|
|
|
|||
2023年12月31日現在の未返済債務 |
|
|
|
|
$ |
|
|
|
|
|
$ |
— |
|
|||
すでに帰属しており、2023年12月31日に帰属する予定です |
|
|
|
|
$ |
|
|
|
|
|
$ |
— |
|
|||
2023年12月31日に行使できます |
|
|
|
|
$ |
|
|
|
|
|
$ |
— |
|
|||
総内在価値は、関連する普通株の推定公正価値と発行された現金プライベート株式会社の行権価格との差額を表す。
2023年12月31日までの年度内に帰属する民間企業の公正価値総額はい$です
2023年12月31日まで一ドルあります
同社はブラック·スコアーズオプション定価モデルを用いてPSO報酬の公正価値を推定しており、以下の仮定を前提としている
|
|
現在までの年度 |
||||
|
|
2023 |
|
2022 |
|
2021 |
予想期限(年単位) |
|
— |
|
|
— |
|
予想変動率 |
|
— |
|
|
— |
|
無リスク金利 |
|
— |
|
|
— |
|
期待配当収益率 |
|
— |
|
— |
|
— |
次の表は2021年までの年内PSUの2021年計画での活動をまとめています2023年12月31日:
|
|
量 |
|
|
加重平均 |
|
||
2022年12月31日現在の未帰属制限株式単位 |
|
|
|
|
$ |
|
||
授与する |
|
|
— |
|
|
$ |
— |
|
既得 |
|
|
( |
) |
|
$ |
|
|
没収する |
|
|
( |
) |
|
$ |
|
|
2023年12月31日現在の未帰属制限株式単位 |
|
|
|
|
$ |
|
||
F-28
2023年12月31日まで一ドルあります
2021年従業員株購入計画
2021年5月、取締役会は2021年従業員株購入計画を採択し、株主は2021年5月26日に発効する計画を承認した。合計する
ESPPによって発行された普通株式の公正価値は、付与された日にブラック·スコアーズオプション定価モデルを使用して以下の仮定の下で推定される
|
|
現在までの年度 |
||||
|
|
2023 |
|
2022 |
|
2021 |
予想期限(年単位) |
|
|
|
|||
予想変動率 |
|
|
|
|||
無リスク金利 |
|
|
|
|||
期待配当収益率 |
|
|
|
|||
奨励的株式計画
転換前に、初日に持株有限責任会社は奨励株式計画に基づいて奨励株式を付与し、発行を許可した
奨励株の公正価値は、以下の仮定を有するオプション定価モデルを用いて推定される
|
|
十二月三十一日までの年度 |
|
|
2021 |
普通株主公正価値 |
|
$ |
参加のハードル |
|
$ |
無リスク金利 |
|
|
波動率 |
|
|
流動性を実現する時間(年単位) |
|
|
付与日公正価値 |
|
$ |
転換期間中、会社はすべての奨励株式を既得株式および非帰属普通株に変換する。そのため、2023年12月31日までの年間奨励株式活動はありません。
当社はオプション定価モデルを用いて付与日の各奨励株の公正価値を試算しています。メンバーの権益価値は最近行われた企業推定分析と普通株公正価値に基づいている。参加敷居の金額は取締役会が付与された時に決定される。この間に付与された報酬の期待寿命は予想時間に基づいて決定される
F-29
事件を清算する。同社は付与時に有効な米国債収益率に基づく無リスク金利を採用している。
普通株主公正価値
初めて公募する前に、経営陣が普通株式の公正価値を推定する方法は、米国公認会計士協会の業務援助で概説した方法と一致している補償として発行された個人持株会社株式証券の推定値あるいは、あるいは 実践援助は、独立第三者評価専門家の協力の下で普通株に対する評価;会社の発展段階と業務戦略、研究開発仕事の状況、及び商業と工業に関連する重大なリスクを含む;会社の経営結果と財務状況、利用可能な資本資源のレベルを含む、生命科学と生物技術領域の上場会社の評価、及び最近完成した同業者会社の合併と買収;普通株は市場性が不足している;いくつかの客観的と主観的要素を考慮した。公平な取引において投資家に販売される償還可能な転換可能な優先株の価格、および会社が普通株に対する転換可能な優先株を償還する権利、優先権、および特権;当時の市場条件の下で、普通株および償還可能な転換可能な優先株保有者が流動性イベントを実現する可能性、例えば、初回公募株または売却。普通株の公正価値は、会社株が既定の証券取引所または全国市場システムに上場するまで、取締役会によって承認される。
奨励株式は株式奨励に分類され、株式の報酬費用に基づいて付与日奨励の公正価値に基づいている。
以下の表は、株式奨励活動の概要を提供します
|
|
量 |
|
|
加重平均 |
|
||
2020年12月31日現在の未返済債務 |
|
|
|
|
$ |
|
||
授与する |
|
|
|
|
$ |
|
||
没収される |
|
|
( |
) |
|
$ |
|
|
普通株式に帰属していないものに転換する |
|
|
( |
) |
|
$ |
|
|
2021年12月31日現在の未返済債務 |
|
|
|
|
$ |
|
||
10.1株当たり純損失
転換後の普通株株主は1株当たり基本と希釈後の純損失を以下のように計算する(株と1株当たりの金額を除いて千で計算)
|
|
現在までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
転換可能な非持株権益を償還するには純損失を占めなければならない |
|
|
|
|
|
|
|
|
( |
) |
||
償還可能な非持株権益株式を交換する−配当とする− |
|
|
|
|
|
|
|
|
( |
) |
||
普通株主/メンバーは純損失を占めるべきである |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
1株当たり基本と希釈して純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
加重-1株当たり純損失の普通株平均、基本損失および赤字を計算するために使用される |
|
|
|
|
|
|
|
|
|
|||
F-30
次のように発行された潜在的希薄化証券は、それらの影響が逆薄であるため、1株当たりの純損失の計算から除外されている
|
|
12月31日まで |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
株式オプション |
|
|
|
|
|
|
||
普通株に属していない |
|
|
|
|
|
|
||
制限株式単位 |
|
|
|
|
|
|
||
ESPPによって約束された株式 |
|
|
|
|
|
|
||
合計する |
|
|
|
|
|
|
||
11.償還可能な非持株権
合併前、会社子会社DOT-1は武田資産協定(付記5)により武田にAシリーズ償還可能転換優先株を発行する。同社の結論は、それは償還可能な非持株権益を代表するということだ。
会社は非制御権益を償還可能な帳簿価値を調整し、子会社の純損失を武田に分配した。償還可能非持株権益への移転と償還可能非持株権益からの移転は子会社から発行されたAシリーズ償還可能転換優先株発行コストの所有権と分配面の変化を代表する。
2021年5月26日、ミレニアム証券取引所協定の条項により、武田は交換した
12.所得税
最初の公募と転換の前に、同社は税務目的で共同企業とされていたため、所得税を納める必要はなかった。有限責任会社のメンバーは、初日にバイオ製薬ホールディングスが発生した任意の課税所得額または損失中のシェアを適切な税務当局に報告し、関連税金(あれば)を支払う責任がある。転換前、当社の合併付属会社は税務目的で会社とみなされ、所得税を支払う必要があり、当該等の所得税は総合財務諸表に計上されていた。転換後、会社及びその子会社は2021年12月31日現在の所得税について合併した会社グループとみなされている。2021年12月31日、免税国内税法第332条清算において、会社はその子会社を会社として清算する。そこで,2023年12月31日と2022年12月31日終了年度の単一エンティティ準備金を計算した。すべての税引前損失はアメリカで発生した。
会社所得税準備金(福祉)の有効税率は連邦法定税率と異なり、以下のようになる
|
|
十二月三十一日までの年度 |
|
||||||||
|
|
2023 |
|
|
2022 |
|
2021 |
|
|||
法定料率 |
|
|
% |
|
|
% |
|
% |
|||
州税 |
|
|
% |
|
|
% |
|
( |
)% |
||
恒久的差異 |
|
|
( |
)% |
|
|
|
|
% |
||
単位 |
|
|
% |
|
|
% |
|
% |
|||
評価免除額を変更する |
|
|
( |
)% |
|
|
( |
)% |
|
( |
)% |
株式ベースの報酬 |
|
|
( |
)% |
|
|
( |
)% |
|
( |
)% |
合計する |
|
|
— |
|
|
|
— |
|
|
— |
|
F-31
繰延所得税は、財務報告目的のための資産および負債の帳簿価値と所得税目的のための額との間の一時的な差異の純影響を反映する。同社の繰延税金資産と負債の主な構成要素は以下の通り(千計)
|
|
12月31日まで |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
繰延税金資産 |
|
|
|
|
|
|
||
連邦と州の営業純損失が繰り越す |
|
$ |
|
|
$ |
|
||
資本化R&D第174節費用 |
|
|
|
|
|
|
||
単位 |
|
|
|
|
|
|
||
無形資産基盤 |
|
|
|
|
|
|
||
株式ベースの報酬 |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
繰延税金資産総額 |
|
|
|
|
|
|
||
繰延税金負債総額 |
|
|
( |
) |
|
|
( |
) |
減算:推定免税額 |
|
|
( |
) |
|
|
( |
) |
繰延税項目純資産 |
|
$ |
|
|
$ |
|
||
2023年12月31日まで、2022年、2021年12月31日までの年度繰延税金資産推定準備変動状況は以下の通り(千計)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
年初の評価免税額 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
所得税計上の増加 |
|
|
|
|
|
|
|
|
|
|||
年末までの推定免税額 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
会社は設立以来毎年純営業損失を出しています。当社はこのような繰越経営損失純額の利益を総合財務諸表に反映していません。損失の歴史があり、他の肯定的な証拠が不足しているため、当社は繰延税項目の純資産が現金にならない可能性が高いと考えているため、繰延税項の純額は2023年12月31日、2022年12月31日および2021年12月31日に推定から完全に相殺されるそれは.会社は評価免税額を#ドル増加させるだろう
2023年12月31日まで会社には連邦純営業損失の繰越、またはNOLがあります
当社は、2023年12月31日現在、国内税法第382条及び同様の国の規定による所有権変更が発生したか否かを判定する研究を完了していない。発生または将来発生する可能性のある所有権変更により、その純営業損失と所得税の繰越免除の使用は年度制限を受ける可能性がある。これらの所有権変更は、将来の課税所得額を相殺するために毎年使用できる純営業損失と所得税控除控除額を制限する可能性がある。一般的に、国税法第382条で定義されている“所有権変更”とは、3年以内の一回または一連の取引により、ある株主の会社流通株に対する所有権変更が50ポイントを超えることを意味する。
2017年の減税·雇用法案によると、2022年から国税法第174条下の研究·実験費またはR&E費用は資本化しなければならない。R&E料金は以下の期限での償却が要求されます
F-32
不確定税収状況
権威ある指針によると、不確定な所得税状況が所得税申告書に与える影響は、関連税務機関が監査した後に継続可能な最大金額で確認しなければならない。不確実な所得税状況が持続する可能性が50%未満であれば、それは確認されないだろう。
下表は、税収割引が確認されていない期初と期末金額(千単位)を調節した
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
年初残高 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
前年度に係る納税状況の増加に基づく |
|
|
|
|
|
|
|
|
|
|||
今年度に関連した納税額の増加に基づく |
|
|
|
|
|
|
|
|
|
|||
前年に関連した納税状況による減少 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
本年度に係る税収頭寸に基づく減税 |
|
|
|
|
|
|
|
|
|
|||
年末残高 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
確認すれば、未確認の税収割引の全金額が会社の実際の税率に影響を与えない。その会社は税金の構成要素として利息と罰金を選択した。2023年まで,2022年および2021年12月31日まで年度その会社はできました
同社は米国連邦、カリフォルニア州、その他の州税務管轄区で所得税申告書を提出した。2018年12月31日から2022年12月31日までの連邦·州所得税申告書はまだ審査が必要です。
13.供給計画を定義する
当社は国税法第401(K)条の規定により、従業員貯蓄計画を維持している。この計画の要求に合致すれば、すべての従業員が参加する資格がある。2023年12月31日まで及び2022年12月31日まで年度同社は全額寄付金を提供しています$
F-33