メッセンジャーリボ核酸20231231誤り2023会計年度0001682852Http://Fasb.org/us-GAAP/2023#その他負債現在Http://Fasb.org/us-GAAP/2023#その他負債現在Http://Fasb.org/us-GAAP/2023#PropertyPlantAndEquipmentAndFinanceLeaseRightOfUseAssetAfterAccumulatedDepreationAmortifyHttp://Fasb.org/us-GAAP/2023#PropertyPlantAndEquipmentAndFinanceLeaseRightOfUseAssetAfterAccumulatedDepreationAmortifyHttp://Fasb.org/us-GAAP/2023#その他負債現在Http://Fasb.org/us-GAAP/2023#その他負債現在Http://Fasb.org/us-GAAP/2023#その他負債現在Http://Fasb.org/us-GAAP/2023#その他負債現在5397400016828522023-01-012023-12-3100016828522023-06-30ISO 4217:ドル00016828522024-02-16Xbrli:共有00016828522023-12-3100016828522022-12-31ISO 4217:ドルXbrli:共有0001682852メッセンジャー:製品販売メンバー2023-01-012023-12-310001682852メッセンジャー:製品販売メンバー2022-01-012022-12-310001682852メッセンジャー:製品販売メンバー2021-01-012021-12-310001682852アメリカ-GAAP:ProductAndServiceOtherMember2023-01-012023-12-310001682852アメリカ-GAAP:ProductAndServiceOtherMember2022-01-012022-12-310001682852アメリカ-GAAP:ProductAndServiceOtherMember2021-01-012021-12-3100016828522022-01-012022-12-3100016828522021-01-012021-12-310001682852アメリカ-アメリカ公認会計基準:普通株式メンバー2020-12-310001682852US-GAAP:AdditionalPaidInCapitalMembers2020-12-310001682852アメリカ公認会計原則:他の総合収入メンバーを累計2020-12-310001682852アメリカ-公認会計基準:前払いメンバーを保留2020-12-3100016828522020-12-310001682852アメリカ-アメリカ公認会計基準:普通株式メンバー2021-01-012021-12-310001682852US-GAAP:AdditionalPaidInCapitalMembers2021-01-012021-12-310001682852アメリカ公認会計原則:他の総合収入メンバーを累計2021-01-012021-12-310001682852アメリカ-公認会計基準:前払いメンバーを保留2021-01-012021-12-310001682852アメリカ-アメリカ公認会計基準:普通株式メンバー2021-12-310001682852US-GAAP:AdditionalPaidInCapitalMembers2021-12-310001682852アメリカ公認会計原則:他の総合収入メンバーを累計2021-12-310001682852アメリカ-公認会計基準:前払いメンバーを保留2021-12-3100016828522021-12-310001682852アメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-12-310001682852US-GAAP:AdditionalPaidInCapitalMembers2022-01-012022-12-310001682852アメリカ公認会計原則:他の総合収入メンバーを累計2022-01-012022-12-310001682852アメリカ-公認会計基準:前払いメンバーを保留2022-01-012022-12-310001682852アメリカ-アメリカ公認会計基準:普通株式メンバー2022-12-310001682852US-GAAP:AdditionalPaidInCapitalMembers2022-12-310001682852アメリカ公認会計原則:他の総合収入メンバーを累計2022-12-310001682852アメリカ-公認会計基準:前払いメンバーを保留2022-12-310001682852アメリカ-アメリカ公認会計基準:普通株式メンバー2023-01-012023-12-310001682852US-GAAP:AdditionalPaidInCapitalMembers2023-01-012023-12-310001682852アメリカ公認会計原則:他の総合収入メンバーを累計2023-01-012023-12-310001682852アメリカ-公認会計基準:前払いメンバーを保留2023-01-012023-12-310001682852アメリカ-アメリカ公認会計基準:普通株式メンバー2023-12-310001682852US-GAAP:AdditionalPaidInCapitalMembers2023-12-310001682852アメリカ公認会計原則:他の総合収入メンバーを累計2023-12-310001682852アメリカ-公認会計基準:前払いメンバーを保留2023-12-31メッセンジャーリボ核酸:候補メッセンジャーリボ核酸:開発計画MRNA:断片0001682852アメリカ公認会計基準:売掛金メンバーUS-GAAP:顧客集中度リスクメンバーMRNA:FFFEnterprisesMember2023-01-012023-12-31Xbrli:純0001682852情報源:欧州委員会メンバーUS-GAAP:顧客集中度リスクメンバー米国-GAAP:顧客と契約した収入2022-01-012022-12-310001682852情報源:欧州委員会メンバーUS-GAAP:顧客集中度リスクメンバー米国-GAAP:顧客と契約した収入2021-01-012021-12-310001682852情報源:欧州委員会メンバーアメリカ公認会計基準:売掛金メンバーUS-GAAP:顧客集中度リスクメンバー2022-01-012022-12-310001682852US-GAAP:顧客集中度リスクメンバー米国-GAAP:顧客と契約した収入メッセンジャー:アメリカ政府のメンバー2022-01-012022-12-310001682852US-GAAP:顧客集中度リスクメンバー米国-GAAP:顧客と契約した収入メッセンジャー:アメリカ政府のメンバー2021-01-012021-12-310001682852MRNA:武田製薬会社のメンバーUS-GAAP:顧客集中度リスクメンバー米国-GAAP:顧客と契約した収入2022-01-012022-12-310001682852MRNA:MinstryOfHealthLabとWelfareOf日本のメンバーUS-GAAP:顧客集中度リスクメンバー米国-GAAP:顧客と契約した収入2023-01-012023-12-310001682852MRNA:MinstryOfHealthLabとWelfareOf日本のメンバーアメリカ公認会計基準:売掛金メンバーUS-GAAP:顧客集中度リスクメンバー2022-01-012022-12-310001682852アメリカ公認会計基準:売掛金メンバーUS-GAAP:顧客集中度リスクメンバーMRNA:UKHealthSecurityAgencyMembers2023-01-012023-12-310001682852アメリカ公認会計基準:売掛金メンバーUS-GAAP:顧客集中度リスクメンバーMRNA:UKHealthSecurityAgencyMembers2022-01-012022-12-310001682852米国-GAAP:デバイス構成員2023-12-310001682852US-GAAP:ComputerEquipmentMembersSRT:最小メンバ数2023-12-310001682852SRT:最大メンバ数US-GAAP:ComputerEquipmentMembers2023-12-310001682852米国-GAAP:PropertyPlantAndEquipmentOtherTypesMember2023-12-310001682852MRNA:OriCiroGenomicsKKMember2023-01-312023-01-310001682852MRNA:OriCiroGenomicsKKMember2023-01-310001682852US-GAAP:技術ベース無形資産メンバMRNA:OriCiroGenomicsKKMember2023-01-312023-01-310001682852米国-GAAP:累計純未現金投資GainLossMembers2021-12-310001682852アメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2021-12-310001682852米国-GAAP:累積定義された福祉計画調整メンバー2021-12-310001682852米国-GAAP:累計純未現金投資GainLossMembers2022-01-012022-12-310001682852アメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2022-01-012022-12-310001682852米国-GAAP:累積定義された福祉計画調整メンバー2022-01-012022-12-310001682852米国-GAAP:累計純未現金投資GainLossMembers2022-12-310001682852アメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2022-12-310001682852米国-GAAP:累積定義された福祉計画調整メンバー2022-12-310001682852米国-GAAP:累計純未現金投資GainLossMembers2023-01-012023-12-310001682852アメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2023-01-012023-12-310001682852米国-GAAP:累積定義された福祉計画調整メンバー2023-01-012023-12-310001682852米国-GAAP:累計純未現金投資GainLossMembers2023-12-310001682852アメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2023-12-310001682852米国-GAAP:累積定義された福祉計画調整メンバー2023-12-310001682852メッセンジャー:製品販売メンバー国:アメリカ2023-01-012023-12-310001682852メッセンジャー:製品販売メンバー国:アメリカ2022-01-012022-12-310001682852メッセンジャー:製品販売メンバー国:アメリカ2021-01-012021-12-310001682852メッセンジャー:製品販売メンバーSRT:ヨーロッパメンバ2023-01-012023-12-310001682852メッセンジャー:製品販売メンバーSRT:ヨーロッパメンバ2022-01-012022-12-310001682852メッセンジャー:製品販売メンバーSRT:ヨーロッパメンバ2021-01-012021-12-310001682852メッセンジャー:製品販売メンバーMRNA:RestOfTheWorldMember2023-01-012023-12-310001682852メッセンジャー:製品販売メンバーMRNA:RestOfTheWorldMember2022-01-012022-12-310001682852メッセンジャー:製品販売メンバーMRNA:RestOfTheWorldMember2021-01-012021-12-310001682852メッセンジャー:製品販売メンバー2023-12-310001682852メッセンジャー:製品販売メンバー2022-12-310001682852アメリカ-公認会計基準:メンバーに授与2023-01-012023-12-310001682852アメリカ-公認会計基準:メンバーに授与2022-01-012022-12-310001682852アメリカ-公認会計基準:メンバーに授与2021-01-012021-12-310001682852MRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含む2023-01-012023-12-310001682852MRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含む2022-01-012022-12-310001682852MRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含む2021-01-012021-12-310001682852MRNA:BiomedicalAdvancedResearchAndDevelopmentAuthorityメンバー2020-04-012020-04-30メッセンジャーリボ核酸:参加者0001682852MRNA:BiomedicalAdvancedResearchAndDevelopmentAuthorityメンバー2020-04-202023-12-310001682852MRNA:BiomedicalAdvancedResearchAndDevelopmentAuthorityメンバー2023-12-310001682852MRNA:BiomedicalAdvancedResearchAndDevelopmentAuthorityメンバーアメリカ-公認会計基準:メンバーに授与2023-01-012023-12-310001682852MRNA:BiomedicalAdvancedResearchAndDevelopmentAuthorityメンバーアメリカ-公認会計基準:メンバーに授与2022-01-012022-12-310001682852MRNA:BiomedicalAdvancedResearchAndDevelopmentAuthorityメンバーアメリカ-公認会計基準:メンバーに授与2021-01-012021-12-310001682852アメリカ-公認会計基準:メンバーに授与信用貸付資金:その他収入付与メンバー2023-01-012023-12-310001682852アメリカ-公認会計基準:メンバーに授与信用貸付資金:その他収入付与メンバー2022-01-012022-12-310001682852アメリカ-公認会計基準:メンバーに授与信用貸付資金:その他収入付与メンバー2021-01-012021-12-310001682852MRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含むMRNA:頂点メンバー2023-01-012023-12-310001682852MRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含むMRNA:頂点メンバー2022-01-012022-12-310001682852MRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含むMRNA:頂点メンバー2021-01-012021-12-310001682852MRNA:MerckMemberMRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含む2023-01-012023-12-310001682852MRNA:MerckMemberMRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含む2022-01-012022-12-310001682852MRNA:MerckMemberMRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含む2021-01-012021-12-310001682852MRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含む遺伝子:アスリカンのメンバー2023-01-012023-12-310001682852MRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含む遺伝子:アスリカンのメンバー2022-01-012022-12-310001682852MRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含む遺伝子:アスリカンのメンバー2021-01-012021-12-310001682852メッセンジャー:他のパートナーメンバーMRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含む2023-01-012023-12-310001682852メッセンジャー:他のパートナーメンバーMRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含む2022-01-012022-12-310001682852メッセンジャー:他のパートナーメンバーMRNA:CollaborationArrangement ArrangementsWithAffiliateMembersを含む2021-01-012021-12-310001682852MRNA:パーソナライゼーションMRNACancerVaccinesPCV連携およびライセンスプロトコルMerckSharpおよびDohmeCorpMembersと2016-06-012016-06-300001682852MRNA:MerckMemberUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2022-10-310001682852MRNA:MerckMemberUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2023-01-012023-12-310001682852MRNA:MerckMemberUS-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembers2022-01-012022-12-310001682852MRNA:MRNAVertex 2020 Agreement Members2020-09-012020-09-300001682852メッセンジャー:A 2013 OptionaccementAndServicesAndCollaborationAgreementメンバ2013-03-012013-03-3100016828522022-07-012022-09-300001682852US-GAAP:CollaborativeArrangementTransaction WithPartyToCollaborativeArrangementMembersMRNA:ImmaticsMember2023-10-310001682852アメリカ公認会計基準:現金と現金等価物のメンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001682852アメリカ公認会計基準:現金と現金等価物のメンバーアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:現金と現金等価物のメンバー2023-12-310001682852アメリカ公認会計基準:預金メンバー資格認証アメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ公認会計基準:現金と現金等価物のメンバーアメリカ公認会計基準:預金メンバー資格認証アメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852MRNA:CurrentMarketableSecuritiesMembersアメリカ公認会計基準:預金メンバー資格認証アメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852メッセンジャー:非現在上場可能な証券メンバーアメリカ公認会計基準:預金メンバー資格認証アメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852US-GAAP:アメリカReasuryBillSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ公認会計基準:現金と現金等価物のメンバーUS-GAAP:アメリカReasuryBillSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852MRNA:CurrentMarketableSecuritiesMembersUS-GAAP:アメリカReasuryBillSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852メッセンジャー:非現在上場可能な証券メンバーUS-GAAP:アメリカReasuryBillSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersアメリカ公認会計基準:現金と現金等価物のメンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852MRNA:CurrentMarketableSecuritiesMembersアメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersメッセンジャー:非現在上場可能な証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ公認会計基準:現金と現金等価物のメンバーアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852MRNA:CurrentMarketableSecuritiesMembersアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852メッセンジャー:非現在上場可能な証券メンバーアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-公認会計基準:アメリカ政府債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-公認会計基準:アメリカ政府債務証券メンバーアメリカ公認会計基準:現金と現金等価物のメンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852MRNA:CurrentMarketableSecuritiesMembersアメリカ-公認会計基準:アメリカ政府債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852メッセンジャー:非現在上場可能な証券メンバーアメリカ-公認会計基準:アメリカ政府債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ公認会計基準:現金と現金等価物のメンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852MRNA:CurrentMarketableSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852メッセンジャー:非現在上場可能な証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ公認会計基準:現金と現金等価物のメンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001682852アメリカ公認会計基準:現金と現金等価物のメンバーアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:現金と現金等価物のメンバー2022-12-310001682852アメリカ公認会計基準:預金メンバー資格認証アメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ公認会計基準:現金と現金等価物のメンバーアメリカ公認会計基準:預金メンバー資格認証アメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852MRNA:CurrentMarketableSecuritiesMembersアメリカ公認会計基準:預金メンバー資格認証アメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852メッセンジャー:非現在上場可能な証券メンバーアメリカ公認会計基準:預金メンバー資格認証アメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852US-GAAP:アメリカReasuryBillSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ公認会計基準:現金と現金等価物のメンバーUS-GAAP:アメリカReasuryBillSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852MRNA:CurrentMarketableSecuritiesMembersUS-GAAP:アメリカReasuryBillSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852メッセンジャー:非現在上場可能な証券メンバーUS-GAAP:アメリカReasuryBillSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersアメリカ公認会計基準:現金と現金等価物のメンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852MRNA:CurrentMarketableSecuritiesMembersアメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersメッセンジャー:非現在上場可能な証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ公認会計基準:現金と現金等価物のメンバーアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852MRNA:CurrentMarketableSecuritiesMembersアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852メッセンジャー:非現在上場可能な証券メンバーアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ-公認会計基準:アメリカ政府債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ-公認会計基準:アメリカ政府債務証券メンバーアメリカ公認会計基準:現金と現金等価物のメンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852MRNA:CurrentMarketableSecuritiesMembersアメリカ-公認会計基準:アメリカ政府債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852メッセンジャー:非現在上場可能な証券メンバーアメリカ-公認会計基準:アメリカ政府債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ公認会計基準:現金と現金等価物のメンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852MRNA:CurrentMarketableSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852メッセンジャー:非現在上場可能な証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852US-GAAP:アメリカReasuryBillSecuritiesMembers2023-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembers2023-12-310001682852アメリカ-公認会計基準:会社債務証券メンバー2023-12-310001682852アメリカ-公認会計基準:アメリカ政府債務証券メンバー2023-12-310001682852アメリカ-公認会計基準:アメリカ証券メンバー2022-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembers2022-12-310001682852アメリカ-公認会計基準:会社債務証券メンバー2022-12-310001682852アメリカ-公認会計基準:アメリカ政府債務証券メンバー2022-12-31メッセンジャー--安全0001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:MoneyMarketFundsMembers2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:MoneyMarketFundsMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:預金メンバー資格認証2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:預金メンバー資格認証2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:預金メンバー資格認証アメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するUS-GAAP:アメリカReasuryBillSecuritiesMembers2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーUS-GAAP:アメリカReasuryBillSecuritiesMembers2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するUS-GAAP:アメリカReasuryBillSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersアメリカ-GAAP:公正価値は再帰的メンバーを測定する2023-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:会社債務証券メンバー2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:会社債務証券メンバー2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府債務証券メンバー2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:アメリカ政府債務証券メンバー2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852米国-公認会計基準:株式証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する2023-12-310001682852米国-公認会計基準:株式証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001682852米国-公認会計基準:株式証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定する2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2023-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:MoneyMarketFundsMembers2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:MoneyMarketFundsMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:預金メンバー資格認証2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:預金メンバー資格認証2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:預金メンバー資格認証アメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するUS-GAAP:アメリカReasuryBillSecuritiesMembers2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーUS-GAAP:アメリカReasuryBillSecuritiesMembers2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するUS-GAAP:アメリカReasuryBillSecuritiesMembersアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersアメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001682852アメリカ-GAAP:アメリカReasuryNotesSecuritiesMembersアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:会社債務証券メンバー2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:会社債務証券メンバー2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府債務証券メンバー2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:アメリカ政府債務証券メンバー2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001682852アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001682852米国-GAAP:公共施設在庫未加工材料メンバー2023-01-012023-12-310001682852アメリカ-公認会計基準:土地と土地改善メンバー2023-12-310001682852アメリカ-公認会計基準:土地と土地改善メンバー2022-12-310001682852米国-GAAP:デバイス構成員2022-12-310001682852アメリカ-公認会計基準:リース改善メンバー2023-12-310001682852アメリカ-公認会計基準:リース改善メンバー2022-12-310001682852米国-GAAP:PropertyPlantAndEquipmentOtherTypesMember2022-12-310001682852US-GAAP:ComputerEquipmentMembers2023-12-310001682852US-GAAP:ComputerEquipmentMembers2022-12-310001682852アメリカ-アメリカ公認会計基準:建設中のメンバー2023-12-310001682852アメリカ-アメリカ公認会計基準:建設中のメンバー2022-12-310001682852MRNA:融資権使用資産メンバー2023-12-310001682852MRNA:融資権使用資産メンバー2022-12-310001682852アメリカ-公認会計基準:メンバーに授与2022-12-310001682852アメリカ-公認会計基準:メンバーに授与2023-12-310001682852メッセンジャー:協力してメンバーを手配する2022-12-310001682852メッセンジャー:協力してメンバーを手配する2023-01-012023-12-310001682852メッセンジャー:協力してメンバーを手配する2023-12-31MRNA:キャンパス0001682852MRNA:マサチューセッツ州ケンブリッジタウンのメンバー2023-12-31Utr:SQFT0001682852MRNA:マサチューセッツ州ケンブリッジタウンのメンバー2021-09-300001682852MRNA:マサチューセッツ州ケンブリッジタウンのメンバー2021-09-012021-09-30MRNA:number OfExtensionPeriod0001682852MRNA:MTCSouthMTCNorthAndMTCEastMembers2023-12-31MRNA:NumerOfBuilding0001682852メッセンジャー:埋め込みテナント2023-07-012023-09-300001682852メッセンジャー:埋め込みテナント2023-01-012023-12-310001682852メッセンジャー:埋め込みテナント2023-12-310001682852メッセンジャー:埋め込みテナント2022-12-310001682852MRNA:MTCSouthMTCNorthAndMTCEastMembersメッセンジャー:マサチューセッツ州ノーウッドのメンバー2023-12-310001682852US-GAAP:保障性保証メンバー2023-01-012023-12-310001682852US-GAAP:保障性保証メンバー2022-01-012022-12-310001682852US-GAAP:保障性保証メンバー2022-12-31メッセンジャーリボ核酸:クレーム0001682852US-GAAP:保障性保証メンバー2023-12-310001682852メッセンジャーリボ核酸:供給と製造プロトコルメンバー2023-12-310001682852MRNA:臨床サービスメンバー2023-12-310001682852MRNA:臨床操作と支援委員会のメンバー2023-12-310001682852US-GAAP:ライセンスとサービスメンバー遺伝子:国立エイズ感染症研究所のメンバーは2022-12-012022-12-310001682852信頼度:サービスに基づく報酬メンバー2023-01-012023-12-310001682852米国-GAAP:共有による補償補償TracheOneMember信頼度:サービスに基づく報酬メンバー2023-01-012023-12-310001682852US-GAAP:共有ベースの補償報酬送信2人のメンバ信頼度:サービスに基づく報酬メンバー2023-01-012023-12-31メッセンジャーリボ核酸:分期0001682852米国-公認会計基準:従業員株式オプションメンバー株式オプションと付与計画2016年メンバー2023-01-012023-12-310001682852米国-公認会計基準:従業員株式オプションメンバー2023-12-310001682852株式オプションと奨励計画2018年メンバー2023-12-310001682852制限された公有株式単位と業績株単位のメンバー2022-12-310001682852制限された公有株式単位と業績株単位のメンバー2023-01-012023-12-310001682852制限された公有株式単位と業績株単位のメンバー2023-12-310001682852制限された公有株式単位と業績株単位のメンバー2022-01-012022-12-310001682852制限された公有株式単位と業績株単位のメンバー2021-01-012021-12-310001682852アメリカ公認会計基準:パフォーマンス共有メンバー2021-01-012021-12-310001682852アメリカ公認会計基準:パフォーマンス共有メンバー2022-01-012022-12-310001682852アメリカ公認会計基準:パフォーマンス共有メンバーSRT:最小メンバ数2022-12-310001682852アメリカ公認会計基準:パフォーマンス共有メンバーSRT:最小メンバ数2021-12-310001682852アメリカ公認会計基準:パフォーマンス共有メンバーSRT:最大メンバ数2021-12-310001682852アメリカ公認会計基準:パフォーマンス共有メンバーSRT:最大メンバ数2022-12-310001682852米国-公認会計基準:従業員株式オプションメンバー2023-01-012023-12-310001682852米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310001682852米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001682852米国-公認会計基準:従業員株式オプションメンバーSRT:重み平均メンバ2023-12-310001682852米国-公認会計基準:従業員株式オプションメンバーSRT:重み平均メンバ2022-12-310001682852米国-公認会計基準:従業員株式オプションメンバーSRT:重み平均メンバ2021-12-310001682852制限された株式単位RSUと業績株単位PSUMMembers2023-01-012023-12-310001682852制限された株式単位RSUと業績株単位PSUMMembers2022-01-012022-12-310001682852制限された株式単位RSUと業績株単位PSUMMembers2021-01-012021-12-310001682852アメリカ公認会計基準:従業員ストックメンバー2023-01-012023-12-310001682852アメリカ公認会計基準:従業員ストックメンバー2022-01-012022-12-310001682852アメリカ公認会計基準:従業員ストックメンバー2021-01-012021-12-310001682852米国-GAAP:販売コストメンバー2023-01-012023-12-310001682852米国-GAAP:販売コストメンバー2022-01-012022-12-310001682852米国-GAAP:販売コストメンバー2021-01-012021-12-310001682852米国-公認会計基準:研究·開発費メンバー2023-01-012023-12-310001682852米国-公認会計基準:研究·開発費メンバー2022-01-012022-12-310001682852米国-公認会計基準:研究·開発費メンバー2021-01-012021-12-310001682852アメリカ-公認会計基準:一般と行政費用メンバー2023-01-012023-12-310001682852アメリカ-公認会計基準:一般と行政費用メンバー2022-01-012022-12-310001682852アメリカ-公認会計基準:一般と行政費用メンバー2021-01-012021-12-310001682852アメリカ公認会計基準:パフォーマンス共有メンバー2023-01-012023-12-310001682852メッセンジャーリボ核酸:A 2021修復プログラムメンバー2021-08-020001682852メッセンジャーリボ核酸:A 2021修復プログラムメンバー2022-01-012022-01-310001682852メッセンジャーリボ核酸:A 2022修復プログラムメンバー2022-02-220001682852メッセンジャーリボ核酸:A 2022修復プログラムメンバー2022-08-010001682852メッセンジャーリボ核酸:A 2022修復プログラムメンバー2023-12-310001682852アメリカ-公認会計基準:州と地方法律法規のメンバー2023-01-012023-12-310001682852アメリカ-公認会計基準:州と地方法律法規のメンバー2023-12-310001682852アメリカ-公認会計基準:研究メンバーアメリカ-公認会計基準:州と地方法律法規のメンバー2023-12-310001682852米国-公認会計基準:従業員株式オプションメンバー2023-01-012023-12-310001682852米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310001682852米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001682852米国-GAAP:制限株式単位RSUメンバー2023-01-012023-12-310001682852米国-GAAP:制限株式単位RSUメンバー2022-01-012022-12-310001682852米国-GAAP:制限株式単位RSUメンバー2021-01-012021-12-310001682852国:アメリカ2023-01-012023-12-310001682852国:アメリカ2022-01-012022-12-310001682852国:アメリカ2021-01-012021-12-310001682852SRT:ヨーロッパメンバ2023-01-012023-12-310001682852SRT:ヨーロッパメンバ2022-01-012022-12-310001682852SRT:ヨーロッパメンバ2021-01-012021-12-310001682852MRNA:RestOfWorldMember2023-01-012023-12-310001682852MRNA:RestOfWorldMember2022-01-012022-12-310001682852MRNA:RestOfWorldMember2021-01-012021-12-310001682852国:アメリカ2023-12-310001682852国:アメリカ2022-12-310001682852SRT:ヨーロッパメンバ2023-12-310001682852SRT:ヨーロッパメンバ2022-12-310001682852MRNA:RestOfWorldMember2023-12-310001682852MRNA:RestOfWorldMember2022-12-3100016828522023-10-012023-12-310001682852メッセンジャー:NoubarAfeyanMember2023-01-012023-12-310001682852メッセンジャー:NoubarAfeyanMember2023-10-012023-12-310001682852メッセンジャー:NoubarAfeyanMember2023-12-310001682852メッセンジャー:ArpaGarayMember2023-01-012023-12-310001682852メッセンジャー:ArpaGarayMember2023-10-012023-12-310001682852メッセンジャー:ArpaGarayMemberメッセンジャー:ArpaGarayCommonStockMember2023-12-310001682852メッセンジャー:ArpaGarayMember情報源:ArpaGarayStockOptionsMember2023-12-31
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,郵便番号:20549
(マーク1)
☒ 1934年証券取引法第13条又は15条に基づいて提出された年次報告
本財政年度末まで十二月三十一日, 2023
あるいは…。
☐1934年証券取引法第13条又は15条に基づいて提出された移行報告
_から_への過渡期
依頼書類番号:001-38753
Moderna社
(登録者の正確な氏名はその定款に記載)
| | | | | | | | |
| デラウェア州 | | 81-3467528 |
| (法団または組織の州またはその他の管轄区域) | | (税務署雇用主身分証明書番号) |
| | |
科学技術広場200番地 ケンブリッジ大学, マサチューセッツ州 | | 02139 |
| (主な行政事務室住所) | | (郵便番号) |
(617) 714-6500
(登録者の電話番号、市外局番を含む)
同法第12条(B)に基づいて登録された証券:
| | | | | | | | |
| クラスごとのタイトル | 取引コード | 登録された各取引所の名称 |
| 普通株は、1株当たり0.0001ドルの価値があります | MRNA 3 | ナスダック株式市場有限責任会社 |
同法第12(G)節により登録された証券:ありません 登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してくださいはい、そうです ☑ 違います☐
登録者がこの法第13節または第15節(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示すはい、そうです☐ 違います。 ☑
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示すはい、そうです ☑ 違います☐
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示すはい、そうです ☑ 違います☐
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。 | | | | | | | | | | | | | | | | | | | | |
大型加速ファイルサーバ ☑ | | ファイルマネージャを加速する☐ | | 非加速ファイルサーバ☐ | | 規模の小さい報告会社☐ |
| | | | | | 新興成長型会社☐ |
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する☐
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われるはい、そうです☑ありません。☐
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する☐
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す☐
登録者が空殻会社であるか否かをチェックマークで示す(同法第12 b-2条で定義される)はい、違います☑
2023年6月30日現在,登録者の非関連会社が保有する投票権と無投票権普通株の総時価は約$である40.2当日の121.50ドルの終値で計算すると、10億ドルとなる。各行政者、取締役及びその他の登録者連合会社とみなされる可能性のある者が保有する普通株式は、本計算の範囲には含まれていない。この目的のために付属会社の地位を決定することは必ずしも他の目的のために確定するとは限らない。
2024年2月16日までに382,073,208登録者の普通株は、1株当たり額面0.0001ドル、発行されている
引用で編入された書類
登録者の最終委託書の2024年株主総会に関連する部分は、以下に提出され、本年度報告のForm 10−Kの第3の部分(例えば、説明がある)に参照して組み込まれる。
カタログ表 | | | | | | | | |
第1部. | | ページ |
| 第1項。 | 業務.業務 | 6 |
| 第1 A項。 | リスク要因 | 46 |
| 項目1 B。 | 未解決従業員意見 | 79 |
| プロジェクト1 C。 | ネットワーク·セキュリティ | 79 |
| 第二項です。 | 属性 | 80 |
| 第三項です。 | 法律訴訟 | 80 |
| 第四項です。 | 炭鉱安全情報開示 | 81 |
第II部. | | |
五番目です。 | 登録者普通株市場、関連株主事項及び発行者による株式証券の購入 | 82 |
| 第六項です。 | [保留されている] | 83 |
| 第七項。 | 経営陣の財務状況と経営成果の検討と分析 | 84 |
| 第七A項。 | 市場リスクの定量的·定性的開示について | 99 |
| 第八項です。 | 財務諸表と補足データ | 101 |
| 第九項です。 | 会計と財務情報開示の変更と相違 | 140 |
| 第9条。 | 制御とプログラム | 141 |
| プロジェクト9 B。 | その他の情報 | 143 |
| プロジェクト9 Cです。 | 検査妨害に関する外国司法管区の開示 | 143 |
第三部. | | |
第10項。 | 役員·幹部と会社の管理 | 144 |
| 第十一項。 | 役員報酬 | 144 |
| 第十二項。 | 特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 | 144 |
| 十三項。 | 特定の関係や関連取引、取締役の独立性 | 144 |
| 14項です。 | チーフ会計士費用とサービス | 144 |
第4部. | | |
第十五項。 | 展示·財務諸表明細書 | 145 |
| 第十六項。 | 表格10-Kの概要 | 148 |
| サイン | | 149 |
私たちの業務に関する重大なリスクの概要
私たちの業務は多くのリスクと不確実性の影響を受けています。あなたは投資決定を下す前に、“リスク要因”の節で強調されたリスクと不確定要素を含むこれらのリスクと不確定要素を認識すべきです。これらのリスクは以下のリスクを含むが、これらに限定されない
•新冠肺炎ワクチン市場の動態変化は私たちの財務業績に影響する可能性があり、これは2024年の製品収入が近年の水準を下回ることを招く可能性がある
•私たちは困難に直面し、私たちの製品を生産したり、輸送したりすることは、私たちの予測または未来の契約約束に適合するかもしれない
•私たちの販売、流通、マーケティング経験は限られており、このような能力を効果的に確立することができないかもしれないし、第三者と協定を締結することで私たちの能力を補完することができないかもしれない
•医薬市場の競争は激しく、私たちは既存の製品、新しい治療方法、新技術の市場で効果的に競争することができないかもしれない
•私たちは未来のSARS-CoV-2ウイルス変種を防ぐために、新しい冠肺炎ワクチンの更新を成功または遅延させることができないかもしれませんが、私たちの新冠肺炎ワクチンの更新バージョンはこのような変種を予防できないかもしれません
•私たちの製品のビジネス成功は医師、患者、第三者支払人、医学界の他の人の市場に対する受け入れの程度にかかっている
•医薬製品の販売は第三者支払人の精算の可用性と程度に依存し、このような精算政策や規則の変化は私たちに不利な影響を与える可能性がある
•臨床前開発は長く、不確定であり、特にメッセンジャーリボ核酸薬の場合、私たちの臨床前計画または候補製品は延期または終了される可能性がある
•臨床開発は長く不確実で、私たちの臨床計画は延期されたり中止されたりする可能性があり、あるいは私たちが予想していたよりもコストが高いかもしれません
•もし私たちが必要な規制承認を得たり遅延したりできなければ、私たちが開発する可能性のある候補製品を商業化したり、商業化を遅延させることはできないだろう
•私たちのメッセンジャーリボ核酸製品および候補製品は新しい技術に基づいており、複雑で製造が困難である。私たちまたは私たちの第三者製造業者は、私たちの任意の製品の製造、製品の発表、賞味期限、テスト、貯蔵、サプライチェーン管理、または輸送において困難に直面するかもしれません
•私たちの商業会社としての発展、そして私たちの薬物開発ルートの増加と成熟に伴い、私たちの施設と第三者の臨床と商業供給に対する需要が増加し、私たちの運営能力に影響を与える可能性がある。私たちは第三者サービス提供者に依存しています彼らは運営に固有のリスクがあります
•私たちの製造施設と外部サービス供給者の実体とデジタルインフラには運営リスクがあります
•著者らの個性化新しい抗原治療(INT)候補製品は新しい、複雑な製造技術を用いて各患者のために独特に製造されており、著者らはINTを生産する際に困難に直面する可能性がある
•私たちの製品および候補製品で使用されるいくつかの部品および材料、および開発に必要なプロセスは、単一ソースのサプライヤーに依存している
•我々は将来的に第三者と製品や候補製品の開発と商業化について戦略的同盟を達成する可能性がある。もしこのような戦略連合が成功しなければ、私たちの業務は不利な影響を受けるかもしれない
•私たちはより多くの戦略同盟の構築を求めるかもしれませんが、ビジネス的に合理的な条件でこれらの連合を作ることができなければ、私たちの開発と商業化計画を変えなければならないかもしれません。私たちのいくつかの戦略連合協定は私たちがいくつかの製品を開発する能力を制限するかもしれない
•私たちは私たちの発見とその知的財産権のために特許保護を獲得したり、私たちの商業秘密の機密性を保護することができないかもしれない
•製薬と生物技術業界の知的財産権方面の不確定性はずっと訴訟と他の紛争の根源であり、これらの紛争自体はコストが高く、予測できず、不利な財務と経営自由結果を生じる可能性がある
•私たちは2023年に純損失が発生し、将来また赤字になるかもしれません。製品の販売収入の歴史が限られており、長期的な持続可能な利益が実現できない可能性があることを確認しました
•管理会社の発展には困難があるかもしれない
•我々の内部コンピュータシステムおよび物理的な場所、または敏感なデータまたは情報を共有する第三者のコンピュータシステムおよび物理的な場所は、ネットワークセキュリティイベントを含む障害またはセキュリティホールに遭遇する可能性があり、これは、私たちの製品開発計画および製造業務を大きく乱す可能性があります
•私たちの普通株の価格はずっと不安定で、これは株主に大きな損失をもたらすかもしれない。
私たちの普通株式を購入するかどうかを決定する前に、以下の“リスク要因”の節で述べたリスクおよび不確定要因、ならびに当社の合併財務諸表および関連付記を含む本10-K表年次報告書に含まれる他の情報をよく考慮しなければなりません。このような危険は私たちが直面している唯一の危険ではない。私たちは今知らないか、あるいは私たちが現在どうでもいいと思っている他のリスクと不確実性はまた私たちの業務運営を損なう可能性がある。
前向き陳述に関する特別説明
このForm 10-K年度報告には、連邦証券法、改正された1933年証券法(証券法)第27 A条および改正された1934年証券取引法(取引法)第21 E条に示された明示的または暗示的な展望的陳述が含まれている“業務”、“リスク要因”と“経営者の財務状況と経営結果の検討と分析”と題する章が含まれている。本年度報告では歴史的事実に関する陳述を除き,他のすべての陳述は前向き陳述である。本年度報告におけるForm 10−Kに関する前向きな陳述は、以下のように含まれるが、これらに限定されない
•私たちは新冠肺炎ワクチンフランチャイズ権の将来の収益力と、市場シェアを拡大し、維持する能力を期待している
•新冠肺炎地方性商業ワクチン市場の変化と未来の新冠肺炎ワクチンに対する需要に対する著者らの期待
•2024年以降の新冠肺炎ワクチンの販売への期待は
•SARS-CoV-2ウイルスの継続進化に伴い、著者らは著者らの新冠肺炎ワクチンの変種特定バージョンを開発し続けることができ、それによって新冠肺炎に有効に対抗することができる
•監督部門の許可後、2024年上半期に私たちの成人呼吸器合胞体ウイルス(RSV)ワクチンを発売し、2024年と2025年にもっと多くの呼吸器製品を発売する可能性がある
•私たちの個別化新しい抗原治療(INT)候補レジメンの持続性、私たちのINT候補レジメンが異なるタイプの癌を解決する能力、アジュバント黒色腫および非小細胞肺癌(NSCLC)における私たちの第3段階の臨床試験、および他の腫瘍タイプに迅速に拡張する計画;
•私たちの目標は今後5年以内に15種類の新製品を発売することです
•著者らは監督機関と著者らの第一世代季節性インフルエンザ候補ワクチン(mRNA-1010)について討論し、2024年に監督部門の許可を申請する予定である
•我々のプラットフォームは稀な遺伝疾患を解決する潜在力と、2024年にプロピオン酸血症(PA)とメチルマロン酸血症(MMA)計画を重要な研究に進める予定である
•追加の臨床試験を開始することを含む次世代導管とプラットフォームで提供されています
•私たちは第三者サプライヤー、流通業者、製造業者と契約を結ぶことに成功した
•私たちの能力と第三者の能力は、私たちと契約を結び、私たちの製品の製造、供給、流通、および臨床前および臨床使用のための薬物物質、輸送担体、候補製品の製造、供給、流通に成功した
•私たちは、私たちのライセンス契約を締結する能力と、私たちの知的財産権に関連する未解決の法的手続きへの期待を含む、私たちの商業製品、候補製品、および技術をカバーする知的財産権のための保護範囲を確立することができます
•著者らの臨床試験、臨床前研究と研究開発計画、および著者らの協力者の起動、進展、完成、結果(中期データを含む)とコストの時間
•私たちの臨床試験の参加者登録は人口統計とスケジュールを含めて
•従来の薬物と比較して、メッセンジャーリボ核酸は潜在的な利点を有する
•私たちは私たちの製品に対する規制の承認を得て維持することができる
•もし承認されれば、私たちは私たちの製品の市場規模と成長潜在力と市場の私たちの製品に対する受け入れ度を考慮することを含む、私たちの製品を商業化する能力に成功した
•承認されれば私たちの薬品の定価と精算
•私たちが各国政府と設立した遺伝子ワクチン生産施設のパートナーシップを含めて私たちの製造と商業運営を拡大する
•私たちの財務業績と将来の支出、収入、資本需要の見積もり
•戦略的協力協定の潜在的な利点と、開発、規制、商業化の専門知識を持つ協力者と戦略的協力または他の合意を達成する能力
•アメリカや他の国の法律や規制の発展は
•私たちは私たちの製品や候補製品を生産することができて、回転時間や製造コストの面で有利です
•私たちは重要な科学、製造、監督、商業と管理人材を誘致し、維持する能力がある
•私たちの競争相手と私たちの産業と関連した発展。
場合によっては、前向き表現は、すべての前向き表現がこれらの識別語を含むわけではないが、“可能性”、“すべき”、“予想”、“意図”、“計画”、“予想”、“信じ”、“推定”、“予測”、“潜在”、“継続”、またはこれらの用語の否定または他の同様の用語によって識別することができる。前向きな陳述は、私たちの経営陣の信念と仮定と、私たちの経営陣が現在把握している情報に基づいている。私たちはこれらの展望性陳述に反映される予想は合理的であると考えているが、これらの陳述は未来の事件或いは私たちの未来の運営或いは財務表現に関連し、既知と未知のリスク、不確定性とその他の要素に関連し、私たちの実際の結果、業績或いは業績はこれらの前向き陳述と明示的或いは暗示する任意の未来の結果、業績或いは成果とは大きく異なる可能性がある。私たちは私たちの展望的陳述で開示された計画、意図、または期待を実際に達成できないかもしれません。あなたは前向きな陳述に過度に依存してはいけません。実際の結果またはイベントが現在の予想と大きく異なる可能性がある要因は、他の事項に加えて、“リスク要因”と題する節および本年度報告10−K表の他の部分に記載されている要因を含む。これらのリスクまたは不確実性のうちの1つまたは複数が発生する場合、または私たちの基本的な仮定が正しくないことが証明された場合、実際のイベントまたは結果は、前向き陳述における明示的または暗示的なものとは大きく異なる可能性がある。どんな展望的声明も未来の業績に対する保証ではない
本Form 10−K年次報告における前向き陳述は,我々のForm 10−K年次報告発表日までの観点を代表している。私たちはその後に発生した事件と事態の発展が私たちの観点を変化させると予想している。しかし、私たちは未来のある時点でこのような前向きな陳述を更新することを選択するかもしれないが、私たちは現在、法律の要求が適用されない限りそうするつもりはない。したがって、あなたはこのような前向きな陳述に依存して、本年度報告書10-K表の日付までの私たちの任意の日付の観点を代表してはいけません。
このForm 10−K年度報告書には,業界出版物や研究,調査,および第三者による研究から得られた統計データや他の業界や市場データが含まれている。業界出版物および第三者研究、調査および研究は一般に、彼らの情報はこのような情報の正確性または完全性を保証しないにもかかわらず、信頼できると考えられるソースから得られたものであることを示している。私たちはこのようなソースに含まれている情報を独立的に確認していない。
会社推薦人についての説明
文意が別に指摘されている以外に,本10-K表年次報告における用語“Moderna”,“会社”,“我々”,“我々”および“我々”はいずれもModernaとその合併子会社を指す
商標
このForm 10-K年次報告書は、私たちの商標および他のエンティティに属する商標への参照を含む。便宜上、言及された商標および商品名は、ロゴ、イラスト、および他の視覚的表示を含むものであってもよく、存在しなくてもよい®または商標記号であるが、これらの参照は、それらのそれぞれの所有者が適用法に基づいてこれに対する権利を最大限に主張しないことを意味するわけではない。私たちは、任意の他の会社との関係を暗示するために、または他の会社が裏書きしたり、私たちを賛助したりすることを示唆するために、他の会社の商号や商標を使用または展示することを意図していない。
第1部
プロジェクト1.ビジネス
Modernaはメッセンジャーリボ核酸薬物領域の先駆者である。十数年来科学、技術と健康の合流点で仕事をすることを通じて、著者らはかつてない速度と効率で薬物を開発し、最も早く、最も有効な新冠肺炎ワクチンの一つを含む。
我々のmRNAプラットフォームは,感染症,免疫腫瘍学,まれな疾患と自己免疫疾患の治療とワクチンの開発を可能にしている。独特な文化とModerna価値観と心理状態によって駆動されるグローバルチームによって、著者らはメッセンジャーリボ核酸薬物を通じて人々に可能な限り大きな影響を与えることに取り組んでいる。
私たちの最初の商業製品、私たちの新冠肺炎ワクチンは、世界の数億人が新冠肺炎に対抗するのを助けました。新冠肺炎を引き起こすSARS-CoV-2ウイルスは引き続き変化し、2023年、新冠肺炎ワクチン市場は地方性季節性商業市場に移行した。変化する市場に適応するために、私たちは私たちの製造インフラを大幅に調整して、私たちの新冠肺炎特許経営権を位置づけて、未来の利益を実現することを助けました。2023年には67億ドルの製品純売上を達成し,そのうち新冠肺炎ワクチンの売上高は61億ドル,ワクチン連盟Gaviの努力に関する繰延収入は約6億ドルであった。米国では2023年秋の小売市場における市場シェアは48%であるのに対し、2022年秋の市場シェアは37%である
新冠肺炎以外に、2023年に、私たちは2024年に発売される可能性のある成人呼吸器合胞体ウイルスワクチンの準備をして、私たちは更に私たちのメッセンジャーリボ核酸プラットフォームの商業潜在力を示すことが予想される。癌では,われわれの個別化新抗原療法(INT)とメルク社のKEYTRUDA併用黒色腫患者を評価した2 b期試験からの追加データを報告し,KEYTRUDA単独と比較した。この治療は継続して無再発生存率の著明と臨床的意義の改善を示し,再発や死亡のリスクを49%低下させた。これらのデータは,平均フォローアップ期間は約3年であり,この療法の持続性が示唆されていると考えられ,ハイリスク黒色腫や非小細胞肺癌患者の補助環境に対する第三段階研究を開始した。私たちとメルク社は私たちの臨床試験をより多くの腫瘍タイプに迅速に拡張する計画です
多様な感染症領域や皮膚癌における臨床的メリット,およびいくつかのまれな遺伝疾患に対する潜在的な臨床的メリットを証明した後,われわれは引き続き広範かつ多様なチャネルを推進し,患者の実行に専念した。私たちが準備中のプロジェクトは45の治療とワクチンプロジェクトを含み、そのうち9つは後期開発段階にある。
遺伝子の機会
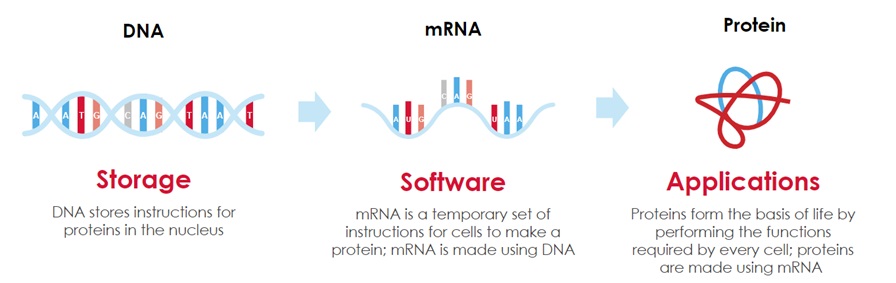
メッセンジャーリボ核酸生命のソフトウェア
メッセンジャーリボ核酸は私たちの遺伝子に蓄積された情報を生命に必要なすべてのタンパク質を作る細胞機械に移します私たちの遺伝子は特定のタンパク質を製造する命令を含むDNA配列の形態で保存されている。DNAはハードディスクドライブとして機能し、これらの命令を細胞がそれらを必要とするまで核に安全に保存する。
細胞がタンパク質を産生する必要がある場合,タンパク質を製造する指令はDNAからタンパク質生産テンプレートであるメッセンジャーリボ核酸にコピーされる。個々のメッセンジャーリボ核酸分子は,体内で異なる機能を有する特定のタンパク質を産生する指令を含む。メッセンジャーリボ核酸は,これらの命令をリボソームと呼ばれる細胞機器に伝達し,それから必要なタンパク質を複製する。
メッセンジャーリボ核酸は“生命ソフトウェア”の役割を果たしていると考えられる。各細胞はmRNAを使用してリアルタイム指令を提供し、ヒトの健康および疾患を含む生物学的あらゆる面を駆動するために必要なタンパク質を製造する。これは60年以上前に分子生物学の中心教条として編纂され,次の模式図に示されている。
メッセンジャーリボ核酸の構造
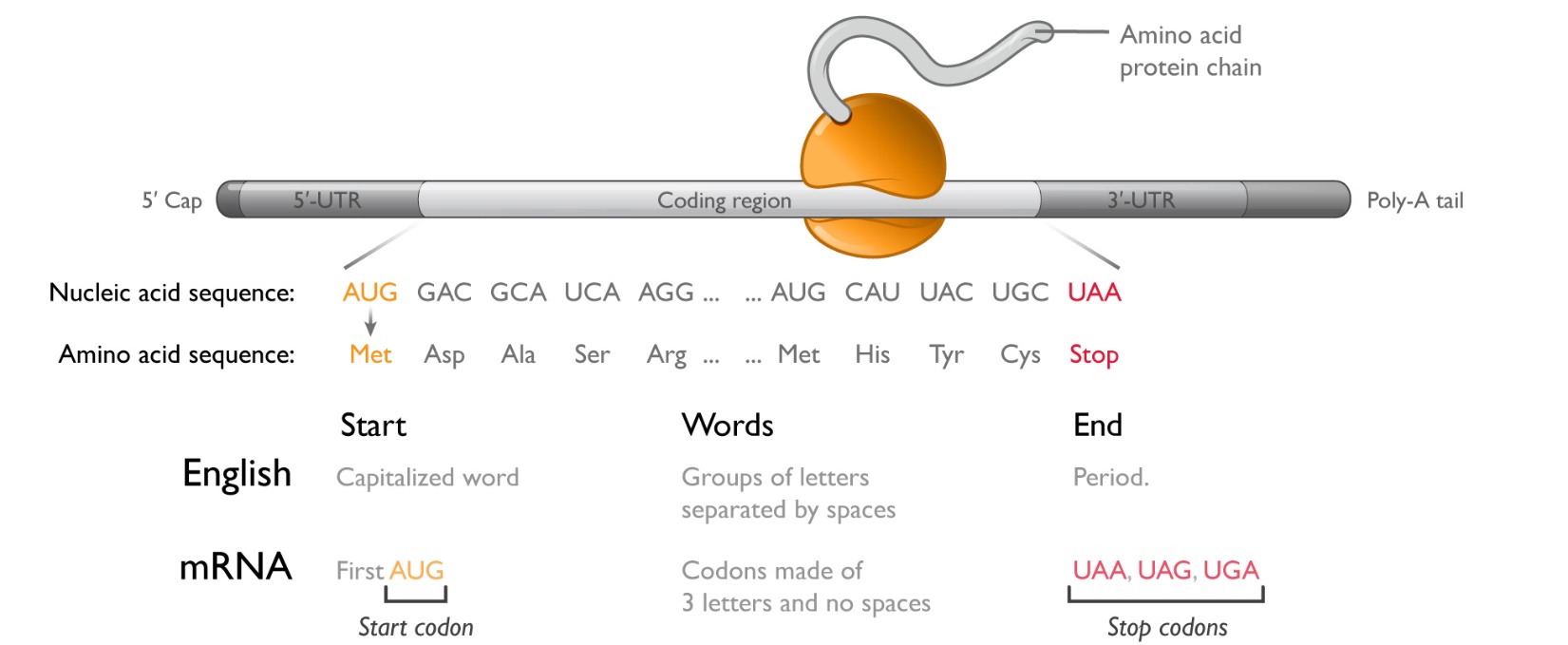
メッセンジャーリボ核酸は、アデノシン(A)、オルニチン(G)、シトシン(C)、およびウラシル(U)の4つのヌクレオチドと呼ばれるモノマーからなる線状ポリマーである。タンパク質をコードする分子領域(コード領域)内で,この4つのヌクレオチドの配列は,3文字からなるコドンと呼ばれる単語からなる言語を形成している.最初のコドン,あるいは開始コドン(AUG)は,リボソームがどこでタンパク質合成を開始すべきかを表す.どのタンパク質を製造するかを知るために,リボソームはメッセンジャーリボ核酸に沿って進み,一度に1つのコドンを成長させ,成長したタンパク質に適切なアミノ酸を添加する。タンパク質合成を終了するために,3つの異なるコドン(UAA,UAG,UGA)を停止シグナルとして,リボソームがどこでタンパク質合成を終了するかを伝える.合計64個の潜在コドンがあるが,タンパク質構築には20個のアミノ酸しかないため,複数のコドンは同じアミノ酸をコードすることができる.
タンパク質が生成する過程は翻訳と呼ばれ,リボソームは1つの言語(コドン配列)で読み,別の言語(アミノ酸配列)で出力されるからである.コード領域は英語の文に類似している.開始コドンと非常に類似しており,大文字の単語は文の開始を表すことができる.コード領域内のコドンは単語を代表するアルファベットに類似している.文の末尾は英語で句点で表すか,mRNAの停止コドンで表す.
どの細胞でも何百ものmRNAが毎日何億ものタンパク質を産生しています典型的なタンパク質は200~600個のアミノ酸を含む;したがって、典型的なメッセンジャーリボ核酸コード領域は600~1800ヌクレオチドの範囲である。符号化領域に加えて、mRNAは、(1)5‘非翻訳領域(5’-UTR)、(2)3‘非翻訳領域(3’-UTR)、(3)5‘キャップ、(4)3’ポリアデノシン(PolyA)尾の4つの重要な特徴を含む。5‘-非コード領域のヌクレオチド配列は、リボソーム開始タンパク質合成の効率に影響を与え、3’-非コード領域のヌクレオチド配列は、どの細胞タイプがメッセンジャーリボ核酸を翻訳すべきか、およびメッセンジャーリボ核酸がどのくらい持続すべきかに関する情報を含む。5‘キャップおよび3’ポリA尾は、リボソームの結合を増強し、メッセンジャーリボ核酸を末端からメッセンジャーリボ核酸を消化する細胞内酵素の攻撃から保護する。
メッセンジャーリボ核酸を薬物としての内在的優位性
メッセンジャーリボ核酸はヒトの健康に深い影響を与える固有の特徴を持っていると考えられる
•メッセンジャーリボ核酸は各細胞によってすべてのタンパク質を産生するために使用される:メッセンジャーリボ核酸は、分泌される、膜上のタンパク質、細胞内のタンパク質を含む各タイプのタンパク質を製造するために使用され、時間の経過とともに、異なる位置と異なる組み合わせでタンパク質の数が異なる。蛋白質生産におけるメッセンジャーリボ核酸の普遍的な作用を考慮して、著者らはメッセンジャーリボ核酸薬物はヒト疾患において広範な適用性があると信じている。
•自分の細胞内でタンパク質を作ってヒト生物学を模倣していますカスタマイズされたmRNAは細胞に送り込まれ、特定のタンパク質療法またはワクチン抗原を産生することを示すことができ、これは従来の薬物方法よりも優れており、従来の薬物方法では、タンパク質または化学物質が体内に導入される。
•MRNAは簡単で柔軟な化学構造を持っていますそれぞれのメッセンジャーリボ核酸分子はタンパク質をコードするための4つの化学的に類似したヌクレオチドで構成されている 20種類もの化学的に異なるアミノ酸から来ています可能なタンパク質を完全に多様化するためには,個々の新しいワクチンや療法を最初からやり直すのではなく,mRNA上で簡単な配列変化を行うだけでよい。
•メッセンジャーリボ核酸は古典的な薬理特性を持っているメッセンジャーリボ核酸は、再現性活性、予測可能な効力、および良好な用量依存性を含む大部分の現代薬物の多くの吸引ヒトの薬理学的特徴を有し、メッセンジャーリボ核酸はまた、安全性および耐性の向上を図るために、個々の患者の必要に応じて用量を調整する能力を提供する。
著者らは新冠肺炎ワクチンを迅速に開発、製造と商業化する能力は、薬物は深い方式で人と患者を助ける潜在力があり、その影響は伝統的な薬物方法を超える可能性があることを表明した。
従来の医学と比較してメッセンジャーリボ核酸の主な利点は
1.メッセンジャーリボ核酸はこれまでにない薬物の豊富さと多様性を作ることができる。メッセンジャーリボ核酸の広範な適用範囲は大量の新しいメッセンジャーリボ核酸薬物を創出する可能性があり、これらの薬物は現在組換えタンパク質技術の能力範囲を超えている。
2.私たちのメッセンジャーリボ核酸薬の開発進展は私たちのポートフォリオ全体のリスクを低下させたメッセンジャーリボ核酸薬の基本的な特徴は 私たちのポートフォリオでレバレッジの役割を果たす。1つのプロジェクトでタンパク質生産の安全性と証拠が確立されると,類似したmRNA技術,交付技術,製造プロセスに関連するプロジェクトを用いた技術や生物リスクが著しく低下すると信じられている
3.メッセンジャーリボ核酸技術は発見と発展を加速させることができるメッセンジャーリボ核酸の類似ソフトウェアの特徴は迅速に シリコン片 デザインと使用 自動化された高スループット合成過程は,逐次的に行うのではなく,発見並行進行を許す.これらのメッセンジャーリボ核酸機能はまた,共有された製造プロセスやインフラの使用を可能にすることで薬物開発を加速させることができると信じている。
4.時間の経過とともに、共有プロセスやインフラの能力を利用することで資本効率を著しく向上させることができる私たちは製造業は 異なるメッセンジャーリボ核酸薬物の需要は類似しており、商業規模では、メッセンジャーリボ核酸薬物の組み合わせは共通の資本支出から利益を得る。
私たちの戦略
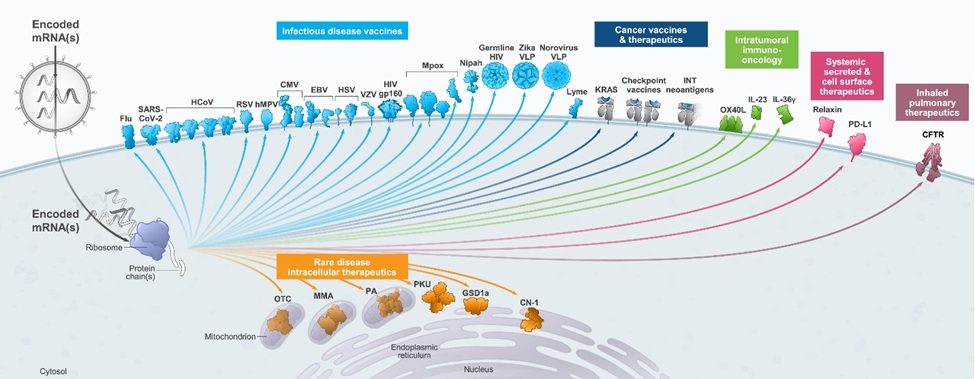
患者、私たちの業界と全世界の人類健康にとって、メッセンジャーリボ核酸薬物の開発は重大な突破であると信じている。著者らはかつてない速度と効率で最も早く、最も有効な新冠肺炎ワクチンの一つの開発に成功し、メッセンジャーリボ核酸薬物の将来性を証明した。私たちの新冠肺炎ワクチンは世界の数億人が新冠肺炎に対抗するのを助けた。新冠肺炎以外に、著者らのプラットフォームは引き続き高い生産性を維持し、現在45個のプロジェクトが開発中であり、伝染病、免疫腫瘍学、稀な疾病と自己免疫性疾患をカバーしている
我々の呼吸器ワクチン、潜伏ワクチンとその他のワクチン、腫瘍学と稀な疾病特許経営権の中で、私たちの目標は今後5年間に15種類の新製品を発売することである。私たちは私たちの近未来と長期目標の達成を助けるために戦略的目標を立てた
1.比類のない気道ワクチン専門権を提供する。我々は,新冠肺炎,季節性インフルエンザ,呼吸器合胞体ウイルスに対するワクチンを単独で開発するとともに,併用ワクチンを並行して開発している。新冠肺炎が持続的な健康負担になる可能性があることを認識し,我々の業務の重要な構成要素として,新冠肺炎に対するワクチンおよびインフルエンザと新冠肺炎に対する研究的組合せワクチンを発売している。また,2024年に発売可能な高齢者向け研究性RSVワクチンの準備を進めており,我々のmRNAプラットフォームのビジネス潜在力をさらに示すことが予想される。2024年と2025年に発売される呼吸製品は、成長していくパイプの効率を認識させることが予想されています。
2.複数の潜伏ウイルスや他のワクチンを開発しています我々は,サイトメガロウイルス(CMV),エプスタイン−バルウイルス(EBV),単純ヘルペスウイルス(HSV),水痘帯状疱疹ウイルス(VZV),ノロウイルス,HIV,ライム病を含む潜伏ウイルスや他の需要が満たされていないまたは満たされていないウイルスに対するワクチンを開発している。2024年に我々のCMV候補ワクチンの重要な段階3研究は潜在的な治療効果データを提供すると予想される。CMVはアメリカで最もよく見られる出生欠陥感染性原因であり、20数年来ずっとアメリカ国家医学院に新しいワクチン開発の重さに指定されている。
3.INTの大型晩期臨床試験の組み合わせを加速し,癌治療に変革的な影響を与える。2023年に2 b期試験のデータを報告し,黒色腫患者へのINT併用メルクのKEYTRUDAの応用を評価し,KEYTRUDA単独と比較し,本療法の持続性を証明したと考えられる。アジュバント黒色腫および非小細胞肺癌(NSCLC)に対する第3段階試験を開始し、開発計画をより多くの腫瘍タイプに拡大することを計画している。
4.3つのまれな疾患プロジェクトへの投資を加速し、潜在的なスタートを求める。著者らはすでに3種類の異なる稀な遺伝病(プロピオン酸血症(PA)、メチルマロン酸血症(MMA)と1 a型グリコーゲン貯蔵疾患(GSD 1 A))が臨床利益の潜在力があることを証明し、2024年に著者らのPAとMMA計画を重要な研究に推進することを期待している。
5.次の世代のパイプとプラットフォームを渡します著者らはすでに多種の伝染病ワクチンと皮膚癌における臨床メリット、及び3種類の異なる稀な遺伝病における潜在的な臨床メリットを証明した。これらの臨床成功の基礎の上で、著者らは引き続き広範と多様なルートを推進し、そして患者に実行を提供することに集中した。私たちは引き続き私たちの科学と私たちのプラットフォームに投資して、mRNAの応用を拡大し、新しいプロジェクトを臨床研究に推進する予定です。
私たちのプラットフォームは
私たちのプラットフォームの概要
私たちの“プラットフォーム”とは、基礎科学と応用科学の面で蓄積された知識と能力を指す。私たちのプラットフォームは、私たちの薬物を推進するために、3つの重要なコンポーネントであるメッセンジャーリボ核酸、伝達と製造過程-の先進技術を統合した。私たちはこれらの成分を統合し、異なるバージョンのメッセンジャーリボ核酸伝達と加工を私たちのすべての薬剤に結合した
私たちのプラットフォーム:メッセンジャーリボ核酸科学の進展
著者らは引き続き基礎研究と応用研究に投資し、著者らの技術レベルと科学界のメッセンジャーリボ核酸に対する理解レベルの向上を求めた。以下にヌクレオチド化学、配列工学および標的要素を結合したメッセンジャーリボ核酸科学の進展例を説明する。
メッセンジャーリボ核酸化学:免疫系の活性化を軽減するためにヌクレオチドを修飾する:先天性免疫系は外来RNAから細胞を保護するように進化しており,検出されると炎症を誘導しmRNA翻訳を抑制する。多くの細胞はToll様受容体(TLRs)と呼ばれるセンサによりそれらの環境を監視する。これらのタイプは、二本鎖RNA(TLR 3)またはRNA断片を含むウロシド(TLR 7、TLR 8)の存在によって活性化されるタイプを含む。また,すべての細胞に細胞質二本鎖RNAセンサがあり,レチノイン酸誘導遺伝子−I(RIG−I)を含み,細胞内の外来RNAに敏感である。
メッセンジャーリボ核酸に対する免疫および細胞反応は複雑で文脈に特異的であり、一般にウロシドの感覚に関連する。潜在的メッセンジャーリボ核酸薬物に対する不良免疫反応を最大限に減少させるために、私たちのプラットフォームは、免疫細胞センサー(例えばTLR 3/7/8)と広範に分布する細胞質受容体(例えばRIG-I)の識別を最大限に減少させるために、化学修飾ウオシドヌクレオチドを使用した
メッセンジャーリボ核酸配列工学:タンパク質発現を最大化する:メッセンジャーリボ核酸は細胞質中に一時的に存在し,その間に数千種類のタンパク質に変換され,最終的に分解される。私たちのプラットフォームは生物情報、生化学と生物スクリーニング機能を応用しており、その大部分は内部で発明され、各mRNAが産生するタンパク質の数を最適化することを目的としている。これらの配列は,mRNA転写産物5‘末端に結合するリボソームが必要な開始コドンを見つけ,コード領域翻訳を確実に開始する可能性を増加させることが観察された5’−UTRの固有配列を決定した。 コード領域のヌクレオチド配列も設計し,タンパク質への翻訳に最大限成功した
ターゲット要素:組織目標翻訳を有効にする:インビボのすべての有核細胞はメッセンジャーリボ核酸を翻訳することができ、それによってメッセンジャーリボ核酸を伝達および翻訳する任意の細胞において薬理活性を産生する。潜在的な脱標的効果を最大限に低減または防止するために、我々のプラットフォームは、特定の細胞タイプにおいてメッセンジャーリボ核酸翻訳を調節する技術を採用している。細胞は通常microRNAsあるいはmiRNAsと呼ばれる短いRNA配列を含み、それらはmRNAと結合し、mRNAレベルで蛋白質翻訳を調節する。異なる細胞タイプは異なる濃度の特定のmicroRNAを持ち、これは実際に細胞にmicroRNA署名を与える。MicroRNAはメッセンジャーリボ核酸と直接結合し、メッセンジャーリボ核酸の翻訳を有効に沈黙或いは減少させ、メッセンジャーリボ核酸の分解を促進する。MicroRNA結合部位を
私たちの潜在的なメッセンジャーリボ核酸薬の3‘-非コード領域は、したがって、私たちのメッセンジャー細胞とそのようなマイクロRNAがあれば、それは最小限に翻訳され、迅速に分解されるだろう。
私たちのプラットフォーム:伝達科学
特定の場合、我々のメッセンジャーリボ核酸は、脂質ナノ粒子(LNP)を有さない単純な生理食塩水製剤において、組織に直接注入することによって、少量の薬理活性タンパク質を局所的に産生することができる。しかし,ヒトの血液や間質液体には重要なRNA分解酵素が含まれており,これらの酵素は任意の細胞外のmRNAを迅速に分解し,LNPsなしでより広範な分布を阻止する。さらに、細胞膜はしばしば負電荷を持つ巨大分子(例えばメッセンジャーリボ核酸)の進入を阻止する重要なバリアである。そのため、著者らは送達科学に大量の資金を投入し、LNP技術を開発し、より多くのmRNAを標的組織に送達できるようにした。
LNPsは一般的に4つの成分から構成される:アミノ脂質、リン脂質、コレステロールとペグ化脂質(ポリエチレングリコール脂質)。各成分,および全体成分または成分の混合は,個々のLNP系の性質に貢献している。体内に注入されたmRNAを含むLNPsはタンパク質に急速に結合し,これらのタンパク質はLNPsの細胞取り込みを促進する。LNPsは細胞内の内小体に内化すると内小体から脱出するように設計され,そのメッセンジャーリボ核酸を細胞質に放出し,細胞質ではメッセンジャーリボ核酸がタンパク質に翻訳され,期待される治療効果がある。内体から逃れられないmRNAやLNP成分は通常リソソームに輸送され,リソソームでは細胞消化の自然過程で分解される。我々のプラットフォームを使用して開発されたツールの例は、細胞取り込み、内部脱出、およびその後の脂肪代謝、および免疫系との逆効果の相互作用を回避することを含むmRNA伝達のステップを解決する特許のLNP製剤を含む
化学:潜在的に安全性と耐性を向上させる新しい脂質化学:我々の独自のLNPシステムは高度に許容されるように設計されており、繰り返し投与によってLNP車両に関連するいかなる毒性も最小限に低下させる体内にあるそれは.従来のLNP製剤の限界を克服するために,免疫系を避けるためにアミノ脂質を設計し,従来の脂質に対して迅速な生分解性を有していた
構成:独自のLNPsによる交付効率の向上:著者らのプラットフォームは薬物化学方面の広範な内部専門知識を含み、著者らはすでにそれを大型新脂質バンクの設計に応用した。これらのライブラリーを我々の発見生物学的能力と組み合わせて,必要なLNP特性を高スループットスクリーニングし,脂質構造モチーフとLNP蛋白発現性能との関係に関する臨床前研究で基礎的な知見が得られたと信じている
表面特性:免疫認識を回避する新しいLNP設計:我々はすでに我々の特許LNPシステムを設計し,免疫系を活性化する機能を除去または変化させることにより,反復投与後に持続的な薬理作用を提供する。これらは,LNPsの表面属性に対する洞察に基づいている.繰り返し投与後、免疫系は伝統的なLNPs上の表面特徴、例えばアミノ脂質、リン脂質とポリエチレングリコール脂質を識別でき、血液中の迅速な除去を招き、繰り返し投与後の効力が低下し、そして炎症を増加させる。 これらの機構に対する我々の洞察に基づいて,不要な表面的特徴を低減または除去するために我々のLNPシステムを設計した。我々の新しいLNPシステムを用いたシステム候補治療製品の臨床研究では,我々はすでに用量を繰り返すことができ,効力,肝臓損傷と免疫系活性化における損失は無視または検出できない。
私たちのプラットフォーム:製造過程科学
私たちは製造技術科学に大量の資金を投入して、私たちのメッセンジャーリボ核酸とLNPsにもっと強力な機能を与え、そして必要な技術能力を発明して、マイクログラムからkgへのメッセンジャーリボ核酸薬物の生産、溶解度と賞味期限などの薬学的特性を実現する。個々のプロジェクトの開発段階に応じて,これらの製造や製薬性能目標を策定することが適切であると考えられる。
メッセンジャーリボ核酸製造過程:薬理学:改善私たちのプラットフォームは体外培養リボ核酸ポリメラーゼがDNA鋳型に結合して転写し、成長しているRNA鎖にDNAコードヌクレオチドを添加する転写プロセス。転写後,独自の精製技術を用いて,我々のmRNAに不必要な合成成分や不純物がないことを確保し,これらの成分や不純物は無差別に免疫系を活性化する可能性がある。製造過程における各ステップの背後の基礎科学に対する理解を応用して、著者らは特許製造技術を設計し、例えばワクチンの効力を増加させるなどの理想的な薬理特性を提供した
LNP製造技術:薬理学的改善:我々のプラットフォーム技術にはLNPsを生産する合成プロセスが含まれている。従来,LNPsはアミノ脂質,リン脂質,コレステロール,ポリエチレングリコール脂質の4種類の分子成分をエタノールに溶解し,水性緩衝液中でメッセンジャーリボ核酸と混合することで組み立てられていた。そして得られた混合物を精製し,LNPsを不純物から分離した。このような不純物は、粒子に組み込まれていない分子成分、免疫系を活性化する可能性のある被覆されていないmRNA、および所望のサイズ範囲を超える粒子を含む。 伝統的な製造技術を最適化するほか、LNPの組み立てと精製過程における各種の生化学と物理的相互作用を理解し、測定することに投資した。また,我々のLNPsと生体システムを特徴付けるために最先端の分析技術を開発し,それを分析した体外培養そして体内にある性能です。これらの知見を得て,LNP性能を推進する製造プロセスパラメータ,例えば,秘密治療環境における効力を決定した。これらの知見は,我々の処理効率と我々のLNPsの効力を大きく改善することができる
私たちの医療モデルは
メッセンジャー·リボ核酸の力を様々な形で利用したいと思います
私たちのプラットフォームでは、私たちは科学に投資し、新しい方法を発明し、メッセンジャーリボ核酸を様々なタイプの細胞に導入した。すべての新しい伝達システムは新しい応用であり、私たちは“形態”と呼んでいる。1つのモードにおけるプログラムは、異なる疾患を対象とする可能性があるが、それらは、共有された製品機能を達成するために、類似したmRNA特徴および製造プロセスを有する
1つの医療モデル内の高度な技術関連性は,早期計画を参考にした上で,この医療モデル内の計画の拡張を迅速に加速させることができ,医療モデル間の低い技術関連性は,技術リスクを分けることができると考えられる。また,1つの医療モデルにおける計画は異なる疾患を追求しているため,それらはしばしば無関係な生物学的リスクを有している。私たちが製品の組み合わせに医療機器と新しい候補製品を追加するたびに、各増量計画は私たちが準備中の他の計画をより深く理解するのを助けることができるので、ネットワーク効果が発生します
新しいモデルを開発することは困難で、時間がかかり、高価であるにもかかわらず、著者らの経験と技術はmRNA薬物の開発に独特な優勢を提供したと信じている。過去10年間、私たちは多くのモデルを開発し、すべてのモデルは1つ以上の臨床候補製品を持っている。私たちのプラットフォームへの持続的な投資は、より多くのモデルを決定し、私たちの既存のモデルの効用と私たちのチャネルの多様性を拡大することにつながると思います
私たちの現在のモデルは
我々の現在のモデルは以下のように記述されている.我々の現在の各医療方式での計画の詳細については,次の“−我々のチャネル”を参照されたい
•感染症ワクチン:我々の感染症ワクチンの目標は,免疫系を病原体からの少量のタンパク質に安全に曝露して抗原と呼び,免疫系が将来の曝露時に病原体と戦う準備をし,感染や疾患を防止することである。我々の感染症ワクチンには,呼吸器ウイルス,潜伏ウイルス,腸管ウイルスに対するワクチン,細菌ワクチンと公衆衛生ワクチンがある。メッセンジャーリボ核酸ワクチンはいくつかの利点があり、様々な感染をシミュレーションできる多くの方面を含み、抗原に結合して注目された製品プロファイルを形成し、迅速に発見し、プログラムを臨床に推進し、製造技術とインフラの資本効率と速度を共有することができると信じている
•癌ワクチンと治療:癌治療の目標は,患者の免疫系に腫瘍関連抗原,いわゆる新しい抗原を安全に接触させ,免疫系がより効率的な抗腫瘍反応を誘発できるようにすることである。我々の癌治療法は、これらの新しい抗原を認識するT細胞によって免疫反応を誘発し、腫瘍を認識するために、メッセンジャーリボ核酸を用いて特定の腫瘍において発見された新しい抗原を発現させることに専念する。これらの新しい抗原は患者独自であってもよいし,患者亜群で発見された駆動癌遺伝子にも関与している。最近の癌免疫治療におけるブレークスルー,例えばチェックポイント阻害剤やキメラ抗原受容体T細胞治療は,抗原特異的T細胞を活性化することで強力な抗腫瘍反応を実現できることが証明されている。検査点阻害剤の効果を高める一つの方法は,ワクチンを開発し,患者が腫瘍の新たな抗原を認識するT細胞の数と抗腫瘍活性を増加させることであると考えられる。メッセンジャーリボ核酸技術は魅力的な癌治療法であると考えられ,その理由は,単一のメッセンジャーリボ核酸分子中で複数の個人化された新しい抗原を伝達する能力と,新しい抗原をコードするメッセンジャーリボ核酸が患者の内因性細胞機構によって翻訳·処理され,免疫系に提出されることがいくつかあると考えられる
•まれな疾患細胞内療法:この方式の目標は、細胞内酵素および細胞器特異的タンパク質のような安全、耐性および有効な治療方法を提供することである。私たちのメッセンジャーリボ核酸薬は細胞内タンパク質のレベルを向上させ、1つ以上の組織或いは細胞タイプで治療効果を実現することを目的としており、私たちの最初の重点は稀な遺伝病である。細胞内治療は現在組換えタンパク質では解決できません組換えタンパク質は通常
系統的に投与され,細胞内部に到達できない。これらの分野における我々の潜在的な利点は,細胞内や細胞器をコードする特定のタンパク質と,天然翻訳後修飾を有する製造困難または複雑なタンパク質の生産である
•腫瘍免疫腫瘍学:この方法の目的は、腫瘍微小環境を変化させることによって、腫瘍に対する抗癌T細胞の反応を駆動することによって、癌を治療または治癒することである。いかなる末期癌患者の将来性は依然として暗い、特にそれらの免疫系の参与が非常に少ない腫瘍患者は、免疫学上の“冷”と呼ばれることがある。チェックポイント阻害剤と組み合わせて,これら本来の免疫寒冷な腫瘍に対抗するために免疫系を活性化することを目標としている。腫瘍内投与はこれらの治療薬の局所作用を許可し,全身投与すれば有毒である可能性がある。我々は、メッセンジャーリボ核酸薬物を用いて腫瘍内免疫腫瘍学的治療を行う方法は、検査点阻害剤を補充することができ、膜関連免疫刺激タンパク質を産生すること、複数の免疫刺激経路にアクセスするためにメッセンジャーリボ核酸を多重輸送すること、および非標的効果を低減するために工学的メッセンジャーリボ核酸配列を作成することを含む、組換えタンパク質ベースの薬剤よりもいくつかの利点があると信じている
•吸入性肺療法:この方法は,安全,耐性,有効な治療法として肺に送達可能なメッセンジャーリボ核酸薬の開発を目指している。気道上皮細胞に移行し,mRNAを患者の肺に輸送し,mRNAにコードされるタンパク質を発現させる霧化LNP製剤を開発している。私たちの目標は、現在有効な治療法がない患者の肺疾患を我々の技術を利用して治療することです。これらの領域における私たちの潜在的な利点は、肺に関連する分泌、膜関連、または細胞内での製造または複雑なタンパク質の産生が困難であることです。
•全身分泌物と細胞表面療法:このモデルの目標は分泌蛋白、例えば抗体或いは酵素代替療法、治療範囲の広い疾患、例えば心不全、伝染病と稀な遺伝病を提供することである。私たちのメッセンジャーリボ核酸薬はヒトの様々な細胞が治療効果を達成するためにタンパク質を分泌することを指示した。システム伝達,分泌,細胞表面療法は,組換えタンパク質では解決できない生物学的領域を狙うことができると信じている。この分野における我々の潜在的な利点は、製造が困難なまたは複雑な分泌型または膜関連タンパク質をコードすることを含み、多重メッセンジャーリボ核酸は、相補的活性を有する複数のタンパク質をコードし、天然の翻訳後修飾および持続生産タンパク質を含み、これは、半減期の短いタンパク質への接触を増加させることができる
私たちのパイプは
過去10年間、私たちは同時に多様な開発パイプラインを推進し、現在45の治療とワクチンプロジェクトを含み、そのうちの9つは後期開発段階にある。我々のパイプラインの範囲は,mRNA技術を用いてアドレス指定可能な生物学の広さを反映している。新製品候補製品の選択過程を推進することは、計画特定の考慮要素も、ポートフォリオ全体の考慮要素も反映している。他の関連要素の中で、特定の計画の基準は満たされていない医療需要の深刻さ、私たちが選択した目標或いは疾病の生物学的リスク、臨床開発の実行可能性、開発コストと商業機会を含む。製品の組み合わせ全体で考慮すべき事項は、私たちのプラットフォームコンポーネントがある医療モデルで技術的成功を得たことを証明することができ、それによってその医療モデルと場合によっては他の医療モデルの後続計画の成功確率と学習機会を増加させることである。
我々の開発プロセスにおけるメッセンジャーリボ核酸からなるタンパク質の多様性を次の図に示す。
私たちの全製品ラインは、次の図のように医療機器別にグループ化されています
感染症ワクチン接種モデル
私たちは31種類の異なる伝染病ワクチン計画を持っていて、そのうちの30種類はすでに臨床に入っている。我々の感染症ワクチンには,呼吸器ウイルス,潜伏ウイルス,腸管ウイルスに対するワクチン,細菌ワクチンと公衆衛生ワクチンがある。
感染症ワクチン:呼吸器ウイルスに対するワクチン
新冠肺炎ワクチン(mRNA 1273/Spikevax,次世代mRNA 1283)
私たちの新しい肺炎ワクチンは70カ国以上で使用されることが承認されたり許可されている。新冠肺炎は2019年に初めて人類に発見されたSARS-CoV-2ウイルスによるものであり、このウイルスは世界的な大流行を引き起こし、数百万人が死亡した。死亡リスクは加齢とともに増加し,何らかの既往疾患や心血管疾患,糖尿病,慢性肺疾患,肥満などの疾患を有する人の重篤な疾患や死亡のリスクも増加する。
SARS-CoV-2ウイルスの変化に伴い、著者らの新冠肺炎ワクチンは依然として新冠肺炎に対抗する重要なツールである。我々の抗ウイルス戦略の一部として,変種に対する新冠肺炎ワクチンバージョンの開発と評価を続けてきた。2023年9月、我々の最新の冠肺炎ワクチンは、SARS-CoV-2のXB.1.5サブタイプに対する主要市場の規制承認を得た。著者らは規制ガイドラインに基づいてm RNA-1273.815を開発し、ワクチン誘導の免疫力を拡大し、循環中のSARS-CoV-2 XBBスペクトル変異の保護を提供することを目的とした。初歩的な臨床試験データでは,mR−1273.815がSARS−CoV−2の他の変種に対して強力な免疫反応を産生することが観察された。
米国食品医薬品局はすでに12歳以上の個人にm RNA-1273.815の使用を許可し、6ヶ月から11歳までの個人に緊急使用許可を授与した。EU、カナダ、日本を含む他の主要市場では、6ヶ月以上の個人もMRNA-1273.815の使用が許可されている。
このForm 10−K年次報告における我々の新冠肺炎ワクチンへの前向きな参照は、SARS−CoV−2ウイルス変種の保護を提供することを目的としたm RNA−1273または他の候補製品の将来の修正を含む可能性がある
著者らが許可或いは許可した新冠肺炎ワクチン以外に、著者らは他の新冠肺炎候補ワクチンを臨床に投入し、絶えず変化しているSARS-CoV-2ウイルスに対する抵抗努力の一部とした。著者らの次世代新冠肺炎ワクチンは冷蔵庫安定(MRNA 1283)として設計され、肝心な第三段階研究にあり、2024年上半期の試験データを予定している。MRNA−1283を用いた目標は,ヘルスケア提供者のより容易な配布と管理を促進することである。そのほか、SARS-CoV-2の変化に伴い、著者らは引き続き注目している変種に対して持続的な疫学モニタリング、ゲノムモニタリングとリスク評価を行い、どの新しい変種が現在承認された新冠肺炎ワクチンが提供した免疫を回避する能力を持つ可能性があるかを確定する。循環中に増加し免疫能力から逃避するように進化した変異体については,新たな候補製品を積極的に開発している。著者らはすでにその中のいくつかの候補ワクチンに対して臨床試験を行い、著者らのモニタリング活動は監督管理機関が特定のワクチン成分を更新して公衆衛生需要を満たすことを要求した場合、新しいワクチンの交付を加速することを可能にした。
新冠肺炎ビジネス、製造と供給の最新情報
2023年、私たちの新冠肺炎ワクチンの製品の純売上高は67億ドルで、私たちの製品の収入のすべてを占めています。 2024年に私たちの新冠肺炎ワクチンの販売は来年の商業収入に大きな部分を提供すると予想しています。2023年第3四半期までに、私たちはアメリカ政府、外国政府、国際組織に私たちの新冠肺炎ワクチンを売却した。2023年第3四半期、私たちの最新の冠肺炎ワクチンの米国商業市場への販売を開始し、また、外国政府や国際組織にも販売を続けています。
新冠肺炎が2023年に流行段階に入ることに伴い、販売の季節的な増加が見られ、各国がその人口にワクチン接種を求めることに伴い、各半球の秋/冬の需要は更に大きくなった。 私たちはこの季節性が今後数年間地域市場で続くと予想している。そのため、私たちは2023年に全世界の製造足跡の規模を調整し、地方市場の需要を満たした。我々の新冠肺炎ワクチンの販売と生産に関するより多くの情報は、“を参照してください”–“製造業”と“経営陣による財務状況や経営結果の検討·分析”
呼吸器合胞体ウイルスワクチン(mRNA-1345)
呼吸器合胞体ウイルス(RSV)は5歳以下の児童と老人の下気道疾患を引き起こす最もよく見られる原因の一つである。特に深刻な呼吸器合胞体ウイルスに感染しやすい人群は乳児、幼児、慢性疾患を有する児童と成人及び老人を含む。ほとんどの子供たちは2歳までに少なくとも1回感染する。米国では,毎年200万人以上の5歳以下の児童が医療看護を受けており,8万人もが呼吸器合胞体ウイルス感染で入院していると推定されている。呼吸器合胞体ウイルスは高齢者に深刻な呼吸器疾患の負担を与える。米国ではRSV感染により毎年160,000人もの入院があり,10,000人もが死亡している。
著者らは児童、妊婦、成人のためのRSVワクチン(mRNA-1345)を開発している。MRNA-1345は、事前融合コンホメーション中のRSV Fタンパク質を安定化する工学的形態をコードし、私たち固有のLNPで製剤化される。2023年1月、重要な3期試験において、mRNA-1345は60歳以上の高齢者において主要な治療効果の終点に達したことを発表した。MRNA-1345のワクチン効力(VE)は83.7%(95.88%CI:66.1%、92.2%;P
我々はすでにいくつかの主要な市場でマーケティング許可申請を提出し、60歳以上の成人のRSV関連下気道疾患(RSV-LRTD)と急性呼吸器疾患(ARD)を予防するために使用した。私たちは2024年上半期に規制部門の承認を受ける予定だ。
他にも3期成人研究が行われており,許可されたインフルエンザや新冠肺炎ワクチンとの併用を探索し,mRNA 1345と再接種し,18歳以上の重篤な呼吸器合胞体ウイルス疾患の高リスクを有する成人に拡大している。小児科ではmRNA−1345が第1段階と第2段階の研究を行っており,産婦集団に対する第2段階の研究を行っている。
季節性インフルエンザワクチン(メッセンジャーリボ核酸1010、メッセンジャーリボ核酸1011、メッセンジャーリボ核酸1012、メッセンジャーリボ核酸1020、およびメッセンジャーリボ核酸1030)
世界保健機関(WHO)の推定によると、季節性インフルエンザウイルスは毎年300~500万例の深刻な疾病と29万から65万人の死亡を招き、公共衛生に対して深刻な挑戦となる。現在許可されている季節性インフルエンザワクチンの全体的な効力は60%を超えることは少なく、しかも流行ウイルスがワクチン抗原のために選択した毒株と一致しない年に提供する効力は比較的に低い
我々のメッセンジャーリボ核酸季節性インフルエンザワクチン計画は反復的な方法で開発されている。著者らの第一世代季節性インフルエンザ候補ワクチン(mRNA-1010)は世界保健機関が推薦した毒株の赤血球凝集素(HA)蛋白をコードする。我々はその後、より多くのHA抗原を添加することによって第一世代候補ワクチンを改善する予定であり、これらの抗原は共循環菌株の被覆範囲を拡大し、別のインフルエンザ蛋白ノイラミニダーゼ(NA)を添加することによって保護範囲を拡大することができる。我々の目標も世界保健機関,規制機関,公衆衛生当局と協力し,インフルエンザの季節に近いときに菌株を選択し,伝播しているウイルスにより良く適合するようにすることである。
我々のmRNA-1011/1012計画では、我々のmRNA-1020/1030計画においてNA抗原の添加が試験されている追加のHA抗原の含有が試験されている。私たちの目標は最終的にこの二つの方法を単一の次世代ワクチンに結合することだ。
2023年2月,mRNA−1010に対するP 301研究の中期結果を公表した。その結果、mRNA 1010は比較的に高いA/H 3 N 1とA/H 1 N 1抗体陽転率を持ち、A/H 3 N 1抗体の幾何平均力価比に優勢があり、A/H 1 N 1抗体の幾何平均力価比率で劣勢がなかった。B/Victoria−またはB/Yamagata−血液型インフルエンザウイルス株のいずれの終点も非劣勢に適合していない。MRNA-1010は許容可能な安全性および耐性を示す。2023年4月、著者らはmRNA-1010のP 302研究が中期治療効果分析に十分な症例を蓄積していないことを発表し、北半球第三段階の治療効果試験の早期成功を発表した。2023年9月、著者らはmRNA-1010のP 303免疫原性と安全性研究を発表し、調合を更新することによってすべての8つの共通の主要な終点を満たし、この調合はB型インフルエンザウイルス株に対してより良い免疫反応を産生することができる。この研究では,すべての菌株に対してmRNA−1010の力価も許可された比較器よりも高かった。MRNA−1010と増強型インフルエンザワクチン比較器の免疫原性を比較するもう1つの研究が現在行われている。規制機関とmRNA-1010の承認申請に関する交渉は現在進行中であり、2024年に監督管理許可を申請する予定である。
我々のメッセンジャーリボ核酸−1011/1012およびメッセンジャーリボ核酸−1020/1030計画の第1/2段階研究が開始され、中間結果が科学会議で公表された
混合ワクチン(メッセンジャーリボ核酸1083、メッセンジャーリボ核酸1230、メッセンジャーリボ核酸1045、およびメッセンジャーリボ核酸1365)
私たちは一連の呼吸器疾患を予防するために候補混合ワクチンを開発している
著者らの次世代新冠肺炎と季節性インフルエンザ連合ワクチンmRNA 1083がコードする抗原は著者らの第一世代季節性インフルエンザワクチン(MRNA 1010)と次世代新冠肺炎ワクチン(MRNA 1283)と同じである。1/2段階試験では,許可された独立ワクチンと比較して,mRNA 1083はインフルエンザと新冠肺炎に対して強い免疫原性を示し,許容可能な反応性と安全性を有していた。2023年10月,50歳以上の成人で第3段階試験を開始した。この試験は全面的に登録されており、2024年にデータがあると予想される
著者らはまた、新冠肺炎、季節性インフルエンザと呼吸器合胞体ウイルス連合ワクチンmRNA 1230と季節性インフルエンザと呼吸器合胞体ウイルス連合ワクチンmRNA 1045の第一段階研究を行っている
われわれのRSVとhMPV併用ワクチンmRNA−1365の第1段階試験が行われており,対象は5カ月から24カ月以下の小児である。2024年2月、FDAはmRNA-1365の迅速な追跡を許可した。
感染症ワクチン:潜伏ウイルスに対するワクチン
サイトメガロウイルスワクチン(mRNA-1647)
ヒトサイトメガロウイルス(CMV)は人類によく見られる病原体であり、ヘルペスウイルスファミリーのメンバーである。先天性サイトメガロウイルスは感染した母親が未出生の子供にウイルスを伝播することによるものであり、それはアメリカの出生欠陥の主要な感染原因であり、アメリカでは毎年約25,000名の新生児感染がある。現在、サイトメガロウイルスに対するワクチンはまだなく、出産適齢女性に持続的な免疫力を産生させるワクチンは先天性サイトメガロウイルス感染の予防においてまだ満たされていない重要な需要を解決する
著者らのCMV候補ワクチンmRNA 1647は1つのワクチンに6つのmRNA sを結合し、CMV表面に位置する2種類のタンパク質をコードした:5つのmRNAが膜結合五量体複合体を形成するサブユニットをコードし、1つのmRNAが全長の膜結合糖タンパク質B(GB)をコードする。五量体とgBはすべてCMV感染バリア上皮表面であり、体内に入るために必要であり、これはCMV感染の第一歩である。MRNA-1647は、CMV感染を予防し、それによって出生欠陥および移植後感染のリスクを低下させるために、5量体およびGBに対する免疫反応を産生することを目的としている。
MRNA−1647に対する第3段階研究、いわゆるCMVicaryを行っており、16~40歳の女性参加者におけるmRNA−1647の原発CMV感染に対する安全性と有効性を評価している。この研究は大人と青少年(16歳から16歳)に完全に登録されています
9歳から15歳までの参加者で1/2 a段階のmRNA−1647研究も行った。我々は、2022年11月に第1の参加者を募集し、mRNA-1647の安全性および免疫原性を評価して、この年齢層の後続発育の用量レベルの選択を指導している。
また,2023年4月,異遺伝子造血細胞移植(HCT)患者に対するmRNA−1647の第2段階概念検証研究が登録され始めたことを発表した。
EBウイルスワクチン(メッセンジャーリボ核酸1189およびメッセンジャーリボ核酸1195)
エプスタイン-バルウイルス(Epstein-Barr Virus,EBV)はCMVに関連するヘルペスウイルスファミリーのメンバーであり、アメリカでは約90%の人が成人後に感染し、原発感染は通常児童期或いは思春期末期に発生する(血清陽性率はそれぞれ約50%と89%)。EBVは感染性単球増加症の主な原因であり,米国では年間約100万から200万症例でEBVが90%以上を占めている。伝染性単球増加症は患者を数週間から数ケ月弱めることができ、ある情況下で、脾臓破裂などの合併症のため入院治療することができる。EBV感染もあるリンパ増殖性疾患、癌と自己免疫性疾患の発展と進展と関係がある。特に,EBV感染や感染性単球増加症は多発性硬化症のリスク増加に関与しており,多発性硬化症は中枢神経系の自己免疫疾患である。
感染性単球増加症を予防するためのワクチン(mRNA−1189)と,EBV感染の長期後遺症を予防するためのワクチン(mRNA−1195)の2種類のEBV候補ワクチンを開発している。われわれのCMVワクチン(mRNA−1647)製品概念と類似しており,有効なEBVワクチンはウイルスが感受性細胞型に入るのに必要な抗原に免疫反応しなければならないと考えられる。MRNA-1189はEBVエンベロープ糖タンパク質に対する免疫反応を誘導するように設計されており、EBVエンベロープ糖タンパク質は上皮細胞とB細胞感染に必要である。MRNA-1189は、これらのタンパク質をコードする4つのmRNA sを含み、これらのタンパク質は、我々固有のLNPsによって被覆されている。MRNA−1195は糖タンパク質と潜伏抗原をコードし,移植後リンパ増殖性疾患や多発性硬化症を背景に検討する。
我々は第1段階,無作為,観察者盲,プラセボ対照のmRNA−1189とmRNA−1195の研究を行っている。これらの研究の主な目的は,これらの候補ワクチンの安全性,耐性,免疫原性を評価することである
単純ヘルペスウイルスワクチン(mRNA-1608)
単純ヘルペスウイルス(HSV)、俗称ヘルペスは2種類のタイプに分けられる:HSV-1は主に口腔接触を通じて伝播し、最もよく唇ヘルペスと関係がある;HSV-2は性接触伝播を通じて、生殖器ヘルペス再発の主要な原因である。この2種類のウイルスはいずれも近傍の感覚ニューロン内に生涯潜伏感染を確立し,その中から再活性化して皮膚に再感染することができる。単純ヘルペスウイルス生殖器感染は大きな疾患負担をもたらしている。確定診断された症状のある性器ヘルペスにより生活の質が低下したが,抗ウイルス薬(現在の看護基準)は部分的にしか回復できなかった。米国では,約1860万18歳から49歳の成人がHSV−2に感染している。世界では,4.92億人がHSV−2に感染しており,世界の15歳から49歳の人口の13%を占めていると推定されている。単純ヘルペスウイルスワクチンは抑制性抗ウイルス治療と類似した治療効果を提供し、コンプライアンスと生活の質を改善できると信じている。中和とエフェクター機能を細胞免疫に結合させることで強力な抗体反応を誘導することを目標としている。
著者らは1/2期無作為、観察者盲、対照、用量範囲の研究を行っており、18歳から55歳までの再発性HSV-2生殖器ヘルペスを有する健康な成人において、我々のHSV候補ワクチンmRNA-1608について研究を行っている。この研究の主な目的は安全性と免疫原性データを評価し、臨床利益の概念検証を確立することである。
VZVワクチン(mRNA-1468)
帯状疱疹は,帯状疱疹とも呼ばれ,水痘帯状疱疹ウイルス(VZV)によるものであり,成人の約3分の1が一生に帯状疱疹を発症し,約50歳で発症率が有意に増加する。免疫系の老化に伴い、VZVに対する保護性免疫力は弱まり、潜伏感染した神経細胞からウイルスを再活性化することを許可し、痛みと掻痒の損害を招く。深刻な帯状疱疹合併症は帯状疱疹後神経痛(帯状疱疹症例の10%-13%)、細菌混合感染及び脳と周囲麻痺を含む;帯状疱疹患者の1%-4%は合併症のため入院した。疾患の重症度や合併症の可能性は,帯状疱疹後神経痛(PHN)も加齢とともに増加する。免疫機能が障害されている人,免疫抑制療法を用いた自己免疫疾患患者,HIVキャリアや造血幹細胞(HSCT)キャリア,臓器移植受容者の方が帯状疱疹に罹患するリスクが高い。現在の看護基準はShingrixであり,FDAが承認したワクチンであり,50歳以上の成人の帯状疱疹予防に用いられている。50−70歳の成人における帯状疱疹に対する有効率は90%を超えているが,70歳以上の成人に対する治療効果はわずかに低下している。
MRNA−1468の安全性,反応性および免疫原性を評価するために,mRNA−1468の安全性,反応性および免疫原性を評価し,50歳以上の健常成人でShingrixとの対面比較を行っている1/2期ランダム,観察者盲,能動対照,用量範囲の研究を行っている。1人目の参加者は2023年2月に薬物治療を受け,500人の参加者は2023年6月に登録を完了した
HIVワクチン(メッセンジャーリボ核酸1644およびメッセンジャーリボ核酸1574)
HIVは獲得性免疫不全症候群(エイズ)を引き起こすウイルスであり、エイズは一生の進行性疾患であり、有効な治療方法がない。世界には現在約3800万人のHIV感染者がおり、そのうちの米国には120万人がいる。世界では毎年約150万人が新たにHIVに感染し、毎年約68万人がHIV/エイズの合併症で死亡している。主な伝播経路は性交と静脈注射であり、若者を最も高い感染リスクに直面させる。2000年から2015年まで、全世界で5626億ドルをHIVの看護、治療、予防に費やし、これは重大な経済的負担である。
我々は,両候補のHIVワクチンであるmRNA−1644とmRNA−1574を開発しており,両ワクチンとも第1段階臨床試験中である。国際エイズワクチンイニシアティブ(IAVI)とビルとメリンダ·ゲイツ財団の協力の下で、mRNA-1644はヒトに新しいHIVワクチン戦略をテストしており、この策略はmRNAによって伝達され、連続接種によって特異的B細胞反応の新しい初期と増強抗原誘導広範な中和HIV-1抗体(BNAbs)を誘導する。IAVI、Scripps、NIH、およびHIVワクチン試験ネットワークとの協力の下で、mRNA-1574は、安定かつ免疫原性の天然HIV三量体をどのように製造するかに対する理解を高めるために、ヒトに類似した複数の天然HIV三量体mRNA sを試験している
感染症ワクチン:腸管ウイルスワクチン
ノロウイルスワクチン(メッセンジャーリボ核酸-1403およびメッセンジャーリボ核酸1405)
腸管ウイルスの中で、ノルウォーカーウイルスは全世界の下痢疾患の主要な原因であり、急性胃腸炎(AGE)とも呼ばれ、巨大な衛生保健負担をもたらす。ノルウォーカーウイルスは世界の年齢症例の18%の病原体と推定されている。全世界で発病率が最も高いのは幼児であり、低所得国では、毎年約7万人の5歳以下の児童がノルウォーカーウイルスで死亡している。高収入国では、幼児の発病率も最も高いが、死亡とその他の深刻な結果は主に老人と免疫機能が低下した患者に集中している。ノーウォーカーウイルスはまた、託児所、クルーズ、長期看護施設および他の医療保健環境のような閉鎖および半閉鎖環境における大規模、高価かつ制御困難な疫病と関係がある。社会高齢化や制度化看護需要の増加に伴い,高齢者におけるノルウォーカーウイルスの負担が増加することが予想される。米国では,ノルウォーカーウイルスは毎年2000万人が感染し,10万人が入院し,900人が死亡していると推定されている。世界では毎年約6億5千万人が感染し、各年齢層で約20万人が死亡している
ノウォーカーウイルスは広範な遺伝多様性を有する;このウイルスは10個のゲノム群と49個の遺伝子タイプに分けられ、その中の30個はヒトに感染できることが知られている。今まで、ワクチン開発はずっと挑戦性があり、原因は非常に多く、強力な細胞培養システムの不足、信頼できるノウォーカーウイルスの保護免疫マーカーがないこと、及び遺伝子タイプの広範かつ絶えず変化する多様性を含む。子供と高齢者を最もよく年齢に関連する遺伝子タイプから最大限に保護するために、広範な遺伝子カバー面を有する多価ワクチンが必要である。
我々は現在,ノルウォーカーウイルスの5価(mRNA−1405)と三価(mRNA−1403)候補ワクチンを開発している。両方の候補者は、第1段階研究において、18歳から49歳および60歳から80歳までの健康な成人参加者の安全性、反応性、および免疫原性を評価した。約660人の参加者が第1段階の研究に参加し、用量は2023年12月に完了した。
感染症ワクチン:細菌ワクチン
ライムワクチン(遺伝子-1975と遺伝子-1982)
米国やヨーロッパでは毎年約12万例のライム病例が報告されている。大気温度の上昇に伴い、ライム病は米国の版図で増加し続けている。ライム病の負担は双峰年齢分布に沿っており、主に15歳以下の子供や高齢者に影響を与えている。皮疹,発熱,頭痛,疲労,関節痛,腫脹,硬直,頭痛が出現する。若年患者と比較して,高齢者は不利な治療反応やよりよく見られる神経学的所見が出現する可能性があるようである。現在市場では人間のライム病を予防するためのワクチンが承認されていない。
ライム病の生物学的複雑性を解決するために,7価と単価の方法を進め,2種類のライム病候補ワクチンを同時に開発している。MRNA−1982は,米国ではほとんどのライム病がこの菌によって引き起こされる伯氏疎水性スピロに対する抗体を誘導することを目的としている。
七価ワクチン(mRNA-1975)と一価ワクチン(mRNA-1982)はすべて1/2段階にあり、ランダム、観察者盲、プラセボ対照、用量範囲研究により、18~70歳の健康参加者の安全性と免疫原性を評価する。私たちはこの研究の約800人の参加者の登録を終えた。2024年1月、FDAは私たちのライム病プロジェクトが快速チャネルの称号を得ることを許可した。
感染症ワクチン:公衆衛生ワクチン
ジカウイルスワクチン(mRNA-1893)
ジカウイルスはフラビウイルス科の一本鎖RNAウイルスである。血清疫学データは,アフリカやアジア地域の風土病であり,そこにネッタイシマカ媒介が発見されていることを示している。ジカウイルスは主にネッタイシマカを通じて伝播するが、先天性、性伝播と献血を通じて伝播することもできる。ジカウイルス感染は通常成人に症状がない或いは軽微であり、発熱、皮疹と結膜炎を招く。しかし、妊娠中の女性の感染は新生児に壊滅的な小頭奇形を引き起こす可能性がある。小頭症は1種の出生欠陥であり、その特徴は頭部と脳の異常が小さく、生涯神経発育遅延、てんかん発作、知的障害、バランス問題と小人症/低と関係があり、深刻な障害を招き、生涯支持が必要である。2007年、ジカウイルス感染疫病は太平洋島に蔓延した。2015年にブラジルで観察された疫病はすぐにアメリカ全体に蔓延し、WHOは2016年にジカウイルスが国際的に注目されている突発的な公衆衛生事件であることを発表した。この間,数万の乳児小頭奇形と先天性ジカ症候群症例が報告されている。ジカウイルスはまたある神経系後遺症と関係があり、例えば成人グリーン-バレー症候群の報告である。
著者らのジカワクチン候補RNA-1893は、我々の独自のLNPに封入されたPRME構造タンパク質をコードする。BARDAと協力して、約800人の患者のmRNA-1893を評価するために、アメリカとプエルトリコで第2段階の研究を行っています
参加者です。このランダムプラセボ対照研究は、メッセンジャー-1893の安全性、耐性および反応性、およびプラセボと比較して、2つの用量レベルのメッセンジャー-1893(単剤または二剤レジメン)の免疫原性を評価することを目的としている。この研究は既にすべて完成した.これ以上の外部資金がない場合には,ジカウイルス計画をさらなる研究を進めることはないと予想される。
ニパワクチン(mRNA-1215)
ニパウイルス(Nipah Virus,NIV)は1種の人畜共通感染ウイルスであり、動物、汚染された食物或いは人と人の間の直接伝播を通じて人類に伝播し、致命的脳炎を含む一連の疾病を招く。NIVによる重篤な呼吸器や神経系合併症は,支持性看護の強化以外に治療法はない。感染者中の病死率は40-75%と推定される。[和合]疫病は影響を受けた地域に重大な経済負担をもたらし、人の生命損失と更なる伝播を防止する干与措置、例えば感染した動物を殺処分するためである。2000年以来、NIVはインド、バングラデシュ、マレーシア、シンガポールの孤立爆発の原因として決定され、WHOが緊急研究開発行動をとる必要がある流行病の脅威の研究開発青写真リストに入れられた
米国国立衛生研究院ワクチン研究センター(VRC)と協力して,ニューカッスル病候補ワクチンmRNA−1215に対する第一段階臨床試験を行っており,テストは大流行準備に集中する。この第一段階用量増加、開放ラベルの臨床試験は初めて健康な成人においてmRNA-1215を研究し、候補Niv mRNAワクチンの安全性、耐性と免疫原性を評価する。この試験は国家アレルギー·感染症研究所(NIAID)が賛助·援助している。
MPOXワクチン(mRNA-1769)
Mpoxは感染性ウイルス疾患であり、人間や他のいくつかの動物で発生することができる。それはサルポックスウイルスによるものであり、サルポックスウイルスは正ポックスウイルス属の1種の人畜共通感染ウイルスである。口水痘の伝播は体液或いは潰瘍に直接接触することと関係がある。Mpoxも密接に対面接触した気道分泌物を介して伝播することができる。
正痘ウイルス属の中で最もよく知られているメンバーは天然痘を引き起こす天然痘ウイルスである。天然痘は1977年に根絶されたにもかかわらず,天然痘感染の致命性とバイオテロの媒体として使用される可能性があることから,天然痘の予防を継続することは大きな意義がある。正痘ウイルス属に関連する他の疾患は牛痘、馬痘とラクダ痘を含む。
サルポックスウイルスには2つのサブタイプであるClade IとClade IIがある。2022年に爆発したClade II MPoxウイルスは、世界保健機関によって国際的に注目されている突発的な公衆衛生事件として発表された。今回の突然発生は117カ国約93,000例の確定診断例を招いた。最近,より高い死亡率に関連するClade Iサルポックスウイルスが性的に伝播することが報告されており,さらなる世界的な爆発を引き起こす可能性が懸念されている
現在MPOX治療の基準はJynneosであり,FDAが承認したMPOXや天然痘疾患予防薬である。我々のmpoxワクチン(MRNA 1769)は、一連の保護を提供するために、サルポックスウイルスの4つの抗原を発現することを目的としている
著者らは、健康参加者におけるmRNA-1769の安全性、耐性、および免疫原性を評価するために、ランダム、プラセボ対照、用量範囲、観察者盲目の1/2期研究を行っている。
癌ワクチンと治療モデル
我々の癌ワクチンと治療モデルは現在3つの開発プロジェクトがあり,いずれも臨床に入っている
個別化新抗原治療(INT)(mRNA-4157)
腫瘍の成長に伴い、それらは変異を得ることができ、いくつかの変異は、腫瘍中のヒト白血球抗原(HL A)分子上に提示することができ、T細胞によって異体として認識される新しいタンパク質断片または新しい抗原を産生する。これらの新しい抗原のいくつかは腫瘍で共有することができるが、大多数は完全に単一の患者の腫瘍特有のものであり、また、これらの新しい抗原の提示も患者の特定のヒト白血球抗原タイプに依存する
我々のINT、mRNA-4157は、次の世代配列決定および我々の独自のアルゴリズムを使用して、各患者の腫瘍変異に対する34種類までの新しい抗原をコードし、彼らのヒト白血球抗原タイプに対して、クラスI(CD 8)およびクラスII(CD 4)反応を引き起こすことが予測されるmRNAを設計する。新しい抗原は単一のmRNA配列にコードされ、筋肉注射のために設計されたLNPsで調製される。INTは自動化ワークフロー製造を採用しており,高速回転時間を実現することができる
我々はメルク社と協力してmRNA−4157を開発している。2022年9月、メルクは、我々とメルクの既存のPCV協力·許可協定(PCV協定)の条項に基づいて、2018年に改訂および再記述されたmRNA-4157を含む個人化癌ワクチンの選択権を行使した。PCV協定によると、私たちはメルク社とmRNA-4157のさらなる開発と商業化で協力し、mRNA-4157に関するコストと任意の利益と損失を世界的に平均的に分担します.
2022年12月、mRNA-4157のランダム第二段階試験がその主要な終点に達したことを発表した。この開放ラベルの第二段階研究では,1 mg用量のmRNA 4157とメルク社のペリンズマブ(KEYTRUDA)の併用を検討している
Pembrolizumabは単独でハイリスク黒色腫切除の補助治療に使用されている。研究により、mRNA-4157とKEYTRUDAの併用は再発または死亡のリスクを44%(HR=0.56)低下させることが分かった[95%CI、0.31-1.02];片側p値=0.0266)はKEYTRUDAと比較した.この結果は,黒色腫無作為臨床試験において,研究性メッセンジャーリボ核酸癌治療の有効性が初めて証明された。観察された有害事象は,これまで第一段階臨床試験で報告されていたものと一致し,すべての用量レベルでmRNA−4157が良好な耐性を有することが示唆された
2023年2月、mRNA-4157はFDAの突破的治療称号を獲得し、2023年4月、mRNA-4157はEMAのPrime方案の称号を獲得した
2023年12月、計画の中央値の約3年間のフォローアップにおいて、mRNA 4157連合KEYTRUDAは持続的な利益を示し、再発または死亡のリスクを49%(HR=0.510)低下させたと発表した[95%CI、0.288-0.906];片側名義p=0.0095)および遠隔移行または死亡リスクの62%増加(HR=0.384[95%CI,0.172-0.858]完全切除後の再発リスクの高いIII/IV期黒色腫患者では,片側名義p=0.0077)をKEYTRUDA単独と比較した。私たちとメルク社は、ハイリスク黒色腫および非小細胞肺癌(NSCLC)患者に対するアジュバント設定の第3段階研究を開始し、より多くの腫瘍タイプへの拡大を計画している。
KRASワクチン(mRNA-5671)
私たちは私たちのKRASワクチン計画(mRNA-5671)の次の行動を評価しており、この計画に対するメルク社のすべての権利を維持している。メルク社が先頭に立った第一段階の研究は2022年初めに終了した。KRASは上皮性癌の中で頻繁に突然変異する癌遺伝子であり、主に肺癌、結腸直腸癌と膵臓癌である。MRNA-5671は、4種類の最も一般的なKRAS変異に新しい抗原を提供するように設計されている。
チェックポイント癌ワクチン(mRNA-4359)
インドールを発現するチェックポイント癌ワクチン(MRNA 4359)を開発している2,3−ジオキシゲナーゼ(IDO)およびプログラム死リガンド1(PD-L 1)抗原。効果性T細胞を刺激し,標的抗原を発現する抑制性免疫細胞と腫瘍細胞を標的に死滅させることを目的としてmRNA−4359を設計した。MRNA-4359に対する著者らの初歩的な適応は末期または転移性皮膚黒色腫と非小細胞肺癌である。MRNA−4359の第1段階研究が行われている。
腫瘍内免疫−腫瘍学的モデル
われわれの腫瘍内免疫腫瘍学的モデルは現在開発計画があり,臨床中である
OX 40 L/IL-23/IL-36γ(三聯体)(mRNA-2752)
最近免疫を介した癌治療が進展したにもかかわらず、多くの末期癌患者の将来性は楽観的ではない。我々は,局所腫瘍内治療により,寒冷な腫瘍微小環境を効率的,より熱的な免疫環境に変換し,抗癌T細胞反応を駆動する三連体(mRNA−2752)を開発している。MRNA 2752はmRNA 2752の固有優勢を利用して、単一の候補産物の中でmRNAと多重合成と膜蛋白と分泌型蛋白を産生する。三結合体(MRNA 2752)はヒトOX 40 L、IL-23とIL-36γをコードする3つのmRNA sを含み、それらは著者らの独自のLNPに封入され、腫瘍内投与される。OX 40 Lは膜蛋白であり、IL-23とIL-36γは分泌型サイトカインである。われわれの方法は,系統や腫瘍内投与組換え蛋白と比較して,局所高濃度勾配のIL−23やIL−36γの優位性を有していると考えられる。また,OX 40 LのmRNAは野生型膜蛋白をコードしており,組換え蛋白技術では実現できないと考えられる。
2023年12月、進行中のmRNA-2752は、進行中のmRNA-2752(単一薬物としてまたは検査点阻害剤と組み合わせて使用される)の末期または転移性固形腫瘍悪性腫瘍またはリンパ腫の治療のための第1段階用量増加研究を完了した
めったに見られない細胞内治療
われわれのまれな疾患細胞内治療モデルには現在6つの開発プロジェクトがあり,そのうち3つが臨床的に行われている
プロピオン酸血症(PA)(mRNA-3927)
PAは稀な遺伝性代謝疾患であり、顕著な発病率と死亡率を有し、全世界で100,000-150,000人に1人が影響を受けている。PAはプロピオニルCoAカルボキシラーゼα或いはβサブユニット(それぞれPCCAとPCCB遺伝子)の発病変異によるものであり、PcC欠陥とその後の有毒代謝物の蓄積を招く。PAの特徴は生命を脅かす代謝代償不全事件(MDES)と多系統合併症が繰り返し発生することである。多系統合併症は神経系表現、心筋症、不整脈、成長遅延、再発性膵炎、骨髄抑制と易感染を含む。長期的には有毒代謝物の侮辱は様々な臓器の合併症を引き起こします認知結果は
MDES数と負の相関を示した.現在,PAの根本的な原因に対する承認された治療法はない
われわれのPA候補療法,mRNA−3927は,新たな静脈投与,LNP被覆二重mRNA療法であり,PCCAとPCCBサブユニットタンパク質をコードし,肝臓における機能的PCC酵素活性を回復する。細胞内タンパク質をコードすることにより,メッセンジャーリボ核酸療法は急性代謝失調の予防と治療に潜在的な役割を果たしている。
MRNA−3927に対する全世界1/2期臨床試験,すなわちパラモン研究が行われており,5つの用量最適化キューおよび1つの用量確認キューが完全に組み込まれている。本研究の目的は,mRNA−3927の1歳以上のPA患者における安全性と薬理学的評価である。主な終点は安全性、薬物動態学と薬効学である。二次終点は有害事象(AEs)の発生率と重症度及び血漿バイオマーカーメチルクエン酸(2-MC)と3-ヒドロキシプロピオン酸(3-HP)の変化を含むFDAのまれな小児科疾患指定,孤児薬物指定,迅速チャネル指定,欧州委員会のPA計画に対する孤児指定を取得した実験ではいくつかの重要なマイルストーンが達成された。これまでmRNA−3927の耐性は一般的に良好であり,薬物に関する重篤な副作用はなく,安全による使用中断はなく,軽微から中等度の輸液関連反応のみであった( MESの客観性と疾病定義性質のため、監督管理機構はMDEに初歩的な支持を提供し、それを臨床意義のある第一選択臨床開発の終点とした。予備データによると,mRNA−3927処理後,MDES数は減少した。2024年にmRNA 3927を重点研究対象としたい。
メチルマロン酸血症(MMA)(メッセンジャーリボ核酸-3705)
MMAは1種の稀な遺伝性代謝疾患であり、メチルマロニルCoA変異酵素(MUT)と呼ばれる酵素欠乏のため、顕著な発病率と死亡率を招く。推定された出生流行率(0.3−1.2:100,000新生児)と死亡率から,米国では500−2,000人がMMA MMT欠乏症を有すると推定されている。死亡率は高く,ヨーロッパの大型研究では,完全MUT欠乏症(MUT 0)患者の死亡率は50%(死亡年齢中央値2歳),MMA患者の部分MUT欠乏症(MUT−)患者の死亡率は40%(MUT−)(中位死亡年齢4.5歳)と報告されている。MMAは主に小児科群に影響し、通常生命の最初の数日或いは数週間に出現する。急性代謝非代償の発生はこのような疾病のマーカーであり、非代償は通常生命の最初の数年にもっと頻繁である。代償を失うたびに生命を危険にさらし、通常集中治療室での入院と管理が必要である。生存者は通常、慢性腎不全と神経系合併症、例えば運動障害、発育遅延とてんかん発作を含む多くの合併症を患っている。そのため、MMA患者及びその家族の健康関連生活の質は明らかに損傷した。MMAの潜在的欠陥を解決するための治療法はまだ承認されていない
我々のMMA候補療法は、mRNA-3705、欠失または欠損肝酵素をコードする。進行中の1/2段階研究では、15人の参加者が投与された。これまで,条件を満たすすべての参加者がオープンラベル拡張研究に参加することを選択してきた.これまで,mRNA−3705は全体的に耐性が良好であり,安全あるいはプロトコルに適合した用量制限毒性基準による中断はなかった。中期結果は鼓舞的な初歩的な薬効学的データを示し、メチルマロン酸はキュー2と3において用量依存性減少を示した。早期結果は臨床終点に有望な変化が発生する可能性があることを示した。私たちは拡張のために最適な用量を選択する準備ができているので、私たちは現在私たちの5番目の列に薬を調合している。2024年にmRNA−3705をキー研究に進める予定である。
グリコーゲン沈着症1 a型(GSD 1 A)(mRNA-3745)
GSD 1 aは稀な遺伝性代謝疾患であり、細胞内蛋白グルコース6-ホスファターゼ(G 6 Pase)の触媒活性不足によるものである。GSD 1 a患者は深刻な空腹低血糖、肝大、腎大、乳酸酸血症、高トリグリセリド血症、高尿酸血症、高コレステロール血症、肝臓脂肪変性と成長遅延が出現した。また,GSD 1 a患者の70%から80%は30歳時に肝細胞腺腫が発生し,肝細胞癌に移行するリスクがある。25歳以上の患者では,半数以上が蛋白尿を有していた。米国やEUではGSD 1 aは約1:100,000の未熟児で発生しているが,ドイツ系ユダヤ人ではより一般的であり,そこの未熟児発症率は1:20,000と報告されている。米国では2500人、EUでは4000人以上がGSD 1 aを患っていると推定されている。厳格な飲食治療は生トウモロコシ澱粉をよく与え、低血糖を防止することによってGSD 1 a患者を成年まで生きることができるが、潜在的な病理過程は依然として是正されず、肝腺腫と肝細胞癌を含む多くの長期合併症の発展を招く。
著者らのGSD 1 a候補治療薬mRNA-3745はコード修飾ヒトG 6 PaseのmRNAからなり、FDAとヨーロッパ薬品管理局(EMA)の孤児薬物指定を獲得した。18歳以上のGSD 1 a患者におけるmRNA−3745の安全性と薬理学的1/2段階を評価する研究が行われている。MRNA−3745を用いて臨床的に利益を得る鼓舞的な兆候が観察された。
オルニチントランスアミノメチル酵素(OTC)欠乏症(mRNA-3139)
オルニチントランスアミナーゼ欠乏症(OTCD)はX連鎖劣性遺伝病であり、人類に最もよく見られる尿素循環障害(UCDs)である。OTCDはアンモニアの分解や排泄を阻止し,アンモニア蓄積を許容し,中枢神経系に影響する有毒レベルまで上昇する。未熟児の発病率は約1:57であるため、OTCDはすべてのUCDの半分近くを占める。OTCDは高い死亡率と発病率をもたらし、特に男性である。
われわれのOTCD候補薬物mRNA−3139は臨床前開発段階にある。MRNA-3139はOTCDに対する慢性静脈、mRNA、酵素代替療法であり、治療効果によっては肝移植への架け橋である可能性があり、単独の治療法である可能性もある。MRNA−3139は、我々のGSD 1 aプログラムと同じLNPを使用する。
フェニルアセトン尿症(PKU)(mRNA−3210)
PKUは稀な遺伝性代謝性疾患であり、アメリカ、フランス、ドイツ、イタリア、スペインとイギリスで約4万人の患者が影響を受けている。フェニルアラニンヒドロキシラーゼ(PAH)をコードする遺伝子突然変異は肝臓が必要なアミノ酸PheをTyrに代謝できない。PKU患者は非常に高い満足されていない医療需要があり、早期と生涯持続治療は不可逆的な神経精神結果の発展を防止する根本である。
著者らのPKU候補療法mRNA-3210は臨床前開発段階にあり、PAH酵素をコードするmRNAであり、著者らのMMAとPA候補製品と同じLNPに封入され、PKU患者がまだ満足していない需要を満たす可能性がある。
Crigler-Najar症候群1型(CN-1)(mRNA-3351)
CN-1はUGT 1 A 1遺伝子突然変異による深刻な疾患である。CN−1の特徴は,血中ビリルビンという有毒物質のレベルが高い(高ビリルビン血症)ことである。これはUGT 1 A 1遺伝子変異によるものであり,これによりビリルビンが分解できず,ビリルビンは肝臓から産生される物質である。UGT 1 A 1酵素がなければ,ビリルビンは体内に蓄積し,黄疸を招き,脳,筋肉,神経に障害を与える。これらの症状は生後すぐに現れ,生命に危害を及ぼす可能性がある。世界では約70−100例の既知のCN−1例しかないと推定されている。影響を受けた個人は現在の標準看護に依存し,一生の間毎日12時間にわたる光線療法を受けている。唯一確定的な治療方法は肝移植であり、これはそれ自身の一連の副作用と死亡リスクと関係がある。
我々のCN−1候補治療,mRNA−3351は,ヒトUGT 1 A 1をコードするmRNAからなり,我々固有のLNPsに封入されている。CN-1ウイルスの欠失や機能障害を引き起こすタンパク質の修復を目的としている。我々はすでに生命改変薬物研究所(ILCM)にmRNA−3351を許可しており,前払い費用も下流払いもない。協力の目標は,CN−1治療のメッセンジャーリボ核酸療法を患者が無料で獲得できるようにすることである。著者らはILCMと協力して、新薬申請と臨床試験申請書類を研究するために臨床前プログラムパッケージを開発している。ILCMはmRNA−3351の臨床開発を担当する。
吸入性肺治療学
私たちの吸入肺療法には現在候補品がある
嚢胞性線維症(CF)(mRNA-3692/VX-522)
慢性閉塞性肺疾患は稀な遺伝性疾患であり、出生から次第に発展し、多臓器損害と肺機能障害による早期死亡を招くことができる。それは嚢胞性繊維化膜貫通コンダクタンス調節因子(CFTR)遺伝子の突然変異によるものであり、CFTR塩素イオンチャネル機能の喪失を招く。CFTRは細胞表面でのこの機能低下により複数の臓器系に粘稠な粘液が出現するが,病理的には肺が多い。米国,ヨーロッパ,オーストラリア,カナダでは約92,000人の嚢胞性線維症患者がおり,そのうち5,000人を超える患者は承認されたCFTR調節器から利益を得ることができない
我々はVertex社と協力して、肺内細胞が機能的CFTRタンパク質を産生することを可能にすることによって、10%の調節器反応性CFTRタンパク質を産生しない患者を治療することを目的としたCFR候補薬剤であるmRNA-3692/VX-522を開発している。これは私たちが初めて霧化メッセンジャーリボ核酸療法を示すことになるだろう。
Vertexは、CFTR調節剤から利益を得られないCF患者のための第1段階の単一漸増用量の臨床試験を開始し、FDAはVX-522高速チャネルの称号を付与した。この実験は積極的であり,患者を募集した。Vertexは単一上昇用量研究を完成し、複数の上昇用量研究を開始する予定である。
全身分泌物と細胞表面治療パターン
われわれの全身分泌と細胞表面療法には現在,2つの活発な開発プロジェクトがあり,そのうちの1つが臨床に入っている
リラキシン(mRNA-0184)
リラキシンは自然に産生されるホルモンであり、すでに血管拡張と血管新生を促進し、細胞外基質の回転を調節し、そして心筋梗塞後の不整脈を抑制できることが証明された。リラキシンは妊娠女性において重要な役割を果たしているが、それ以外にも、複数の器官に対して血管拡張、抗繊維化、抗炎症などの保護作用を有することが指摘されている。いくつかの治療領域におけるリラキシンの臨床潜在力を支持する大量の証拠があり、それの心血管疾患への影響はすでに臨床前と臨床環境において研究を行った。以前の研究は臨床研究において長期的な利益を証明できなかったが、著者らは新しい方法が以前の方法の潜在的な欠陥を克服できると信じている。
非代償性心不全の治療のための弛緩蛋白融合タンパク質をコードするmRNA-0184を開発している。急性心不全の定義は心不全の症状とバイタルサインの新たな症状あるいは悪化である。先進国では、心不全はすでに重大な公共衛生問題になり、2%の成年人口に影響し、急性心不全は65歳以上の患者の非計画入院の最もよく見られる原因である。MRNA-0184は弛緩蛋白融合蛋白をコードする。MRNA−0184のmRNA配列は,タンパク質発現を増加させ半減期を延長するために設計されている。
2022年12月,mRNA−0184の第1段階試験を開始し,試験は進行中であった。著者らの第一段階試験は適応性、開放ラベル、単回漸増用量の単盲検、プラセボ対照、複数回漸増用量研究であり、慢性心不全参加者におけるmRNA-0184の安全性、耐性、薬物動態学と薬効学を評価する
PD−L 1(メッセンジャーリボ核酸−6981)
PD-L 1は共抑制受容体であり、PD-1を発現するT細胞無能を誘導することができる。髄系細胞上のPD−L 1の発現を誘導し,その環境中の免疫細胞に耐性シグナルを送信し,自己免疫疾患を治療する予定である。
PD-L 1/PD-1経路は免疫調節において重要な役割を果たし、制御性T(Treg)細胞の発育と機能を促進する。PD−L 1は樹状細胞,マクロファージ,活性化T細胞,B細胞,単球などの抗原提示細胞および末梢組織に発現する膜貫通蛋白である。その相同受容体PD-1は共抑制膜貫通蛋白であり、T細胞、B細胞、ナチュラルキラー細胞と胸腺細胞に発現する。PD-1を欠く臨床前マウスモデルは自発的に多種の自己免疫性疾患を発展させ、例えば関節炎、心筋炎、狼瘡様糸球体腎炎と1型糖尿病であり、PD-L 1/PD-1相互作用が自己抗原に対する耐性維持における重要な作用を証明した。また,PD−1やPD−L 1阻害剤を用いた癌患者の治療は,肝炎,皮膚炎,大腸炎を含む免疫関連有害事象を引き起こすことがあり,ヒト自己免疫反応におけるPD−1/PD−L 1の役割を示唆している。
われわれのPD−L 1療法は,PD−L 1の内因性発現に類似した細胞型でのPD−L 1の発現を増強し,免疫活性化を低下させることにより,種々の自己免疫疾患の臨床所見を潜在的に減少させる可能性が信じられている。我々の目的は,我々のプラットフォームを用いて樹状細胞を含む髄系細胞に影響を与え,PD−L 1の内因性発現を増強することにより追加の共抑制シグナルを提供することである。このようなリンパ球に対する耐性シグナルは,進行中の自己免疫病理背景下での自己反応を制限する可能性があり,免疫系を深刻かつ全面的に抑制することはないと考えられる。私たちのプラットフォームでは髄細胞を修正することができますその場で耐性環境を創出する方法は、免疫動態バランスの回復を求めることによって、自己免疫疾患の治療において独特の利点を提供する可能性がある。
臨床前開発を行った後,現在のmRNA−6981設計はわれわれが臨床に進める基準に適合していないことが確認された。PD−L 1は依然として興味深い領域であり,他の臨床前候補mRNAを評価している。
製造業
製造業は私たちのバリューチェーンと私たちが薬品を開発する能力の中で重要な役割を果たしている。私たちの製造能力は、発見から商業化まで、私たちの製品開発の各段階を支援している。製品開発の研究段階において、メーカーはプラットフォーム研究と治療領域の薬物発見にメッセンジャーリボ核酸薬剤と薬物製品を提供する。著者らの候補製品の早期開発期間中、著者らはIND-Enabling GLP毒理学研究と初歩的なヒト臨床研究のためにメッセンジャーリボ核酸と薬物製品を製造した。後期の臨床開発では,第3段階試験のためのメッセンジャーリボ核酸および医薬製品を生産した。ビジネス段階では,米国や国際的な契約製造機関(CMO)と協力して薬物物質や医薬製品を生産している。
2023年、新冠肺炎ワクチン市場が大流行市場から地方市場に転換することに伴い、著者らは私たちの製造インフラを大幅に調整し、私たちの供給能力を再構築し、私たちの新冠肺炎特許経営権を定位し、未来の利益を実現することを助ける
私たちの製造運営モデルの概要
私たちの製造活動は主に
•ビジネス制作: 我々の製造能力には、最先端のリボ核酸および薬物製造技術、および目標製品構成に適合した強力かつ一致した供給を実現するための品質制御試験が含まれる。私たちの製造技術は規模を拡大し、商業的に承認された製品生産を支援することを目的としている。私たちのプラットフォームは大規模で効率的な製造を可能にする
•研究開発支援: 製品供給は我々の治療やワクチン分野のプラットフォーム研究や薬物発見を可能にし,また,我々の候補製品の臨床研究に関する活動を行うことができる
私たちはマサチューセッツ州ノーウッドに専門的な内部、複数の建物の製造園区、即ちModerna技術センターを設立した。MTCは、我々の臨床前研究、IND-Enabling GLP毒理学研究用品、私たちの第1段階および第2段階パイプライン活動、後期臨床開発活動(例えば、第3段階CMVワクチン臨床試験)、およびワクチンの薬品商業化生産に供給を提供する。私たちがアメリカ市場に向けたワクチン薬物物質の生産は私たちのMTC団地で完成した。MTCは、プレフィルドシリンジのようなネットワーク内の新しい薬物送達形態を製造する際に、私たちのメッセンジャーリボ核酸製品を最適化し続けることを目的としている。MTC園区の設計は高レベルの自動化と最先端のデジタル集成を持ち、製造実行、製品テストと発表及び監督管理記録を処理する
2023年第2四半期にマサチューセッツ州マルバーレで新たな14万平方フィートの生物製造施設を買収しましたこの施設は現在60,000平方フィートの増加を含めて改善されている。私たちはこの施設が2025年に運営されると予想している。この新しいウェブサイトは私たちのINT計画を戦略的に支持することを目的としている
また,オーストラリア,カナダ,イギリス政府との合意を発表し,これらの国で最先端のメッセンジャーリボ核酸製造施設を設立し,これらの合意に基づき,各政府は長年の約束を締結し,承認されるとメッセンジャーリボ核酸製品を我々から購入する。これらの現地製造施設は,大流行に迅速に対応する能力と我々の呼吸器ウイルス候補ワクチンを直接提供することが予想される。私たちは将来的に他の国の政府と合意し、他の地域で似たような製造能力を提供することを求めるかもしれない
我々の内部生産施設に加えて,米国や海外のCMOと関係を保ち,我々のワクチンに薬物物質と充填能力を提供している。上述したように、2023年第3四半期に、流行市場の新冠肺炎ワクチンに対する期待需要が低下したため、著者らは生産規模を調整し、あるCMOに対する承諾を減少した
製造技術の発展
著者らが多数の治療領域と投与経路にまたがる広範な製品ラインを支持するため、著者らのプラットフォーム研究と技術開発チームは密接に協力し、科学突破の迅速かつシームレスな臨床転化を促進した。これにより,広範な患者群にサービスするための潜在的な薬物を開発することができる
技術開発には、設計と最適化の穏健で一致した製造プロセス、製品特性、用途に適した配合と製品展示が含まれる。例えば,我々の斬新なハードウェアプラットフォームの自動化とロボット技術に加え,我々の内部デジタル開発システムの柔軟性に加えて,我々のプロジェクトで数千個の実験やプロセスパラメータを行うことを可能にし,我々の薬物製品の薬物準備を支援している。また,我々の最近の技術製造の進歩は,DNAプラスミドや小分子を含む新たな鍵となる能力を内部化している
同時に、既存のプロセスを改善し、製造規模を拡大し、安定性を向上させた。これらの改善は私たちのサプライチェーンを著しくコントロールすることができて、製品の生産量と賞味期限を高めることができます。また,製剤開発の進歩は,凍結乾燥を含む新たな医薬製品のイメージを増加させ,冷凍から冷蔵貯蔵条件へのアプローチを提供してくれた
私たちの近年の技術開発への大量の投資は私たちのパイプの広さと深さを実現させ、私たちの製品の後期開発と商業化に関する需要と要求を満たすことを助けるために基礎を築いた
製品開発と商業化のすべての段階にメッセンジャーRNAを提供する
研究に資料を提供する
高スループット自動化とカスタマイズエンジニアリング設備は、私たちが短時間で高品質のメッセンジャーリボ核酸と調合構築物を生産し、提供することを可能にした:私たちの独自のプラットフォームは毎月1,000ロットものメッセンジャーリボ核酸配列と調合を生産することができ、配列から最終製品までの回転時間は数週間である。このチームが製造した典型的な規模のメッセンジャーリボ核酸は1−1000 mgである。これが可能になったのは,Moderna生態系における研究者が45日未満で材料のエンドツーエンド追跡を行うことができる集積されたデジタルポータルを介して部材を発注できるためである。また、人工知能と機械学習の多種の集成アルゴリズムを利用して製造性を最適化し、故障を減少し、mRNA配列の品質を向上させた
臨床開発の供給品
我々はすでに3つの重要な分野で製品開発の早期開発段階を支援する製造能力:GLP Tox、臨床研究、INTSを確立した。我々はIND-Enabling GLP毒理学研究のための調合製品を提供した。そのほか、人類の臨床研究は供給に依存して必要なcGMP標準を満たす。これはMTCパークの内部製造によって実現された。私たちのMTCパークはまた未来の需要を満たすために、迅速な技術開発と拡張を実現するのに適している
私たちの製造業もcGMP INTを生産しています。個別化薬物の専門性(即ち単一患者の専門的な設計と製造のロット)のため、INTSの製造技術は独特な要求を持っている。著者らは腫瘍サンプルからシークエンシングした患者特定のデータをデジタル統合し、自動的に患者のためにINTを設計した。私たちは独自のバイオインフォマティクス設計のアルゴリズムを開発し、このアルゴリズムは自動化製造プロセスに関連し、レシピメッセンジャーリボ核酸を迅速に生産するために使用され、典型的な回転時間は数週間である。MTCパークでINT製造を実施し、迅速な“針対針”の回転時間を有する使い捨てシステムを使用することで、私たちの第1段階と第2段階の導管供給需要を満たす。伝統的なプロセス開発とは異なり、各INTロットは単一の患者のために生産されているため、横方向拡張(並行)し、後期開発と商業化に参加するより多くの患者の需要を満たすために自動化とロボット技術が広く使用されている。私たちが生産した多くの患者ロットの中で、私たちは一致した品質を示し、各ロットは独特のmRNA配列を持っている。2023年第2四半期、私たちはマサチューセッツ州マルバーレで新しい製造工場を買収し、この工場は私たちのINT計画を支持すると予想しています
私たちの製造能力は関連する毒理学と人類臨床研究所に必要な出力を提供することを含む、私たちの広範な開発プロジェクト導管を構築することができる。これらのプランを支える技術は同じであるが,各プランは通常,ターゲット製品プロファイルに応じてカスタマイズする必要がある.これらのカスタマイズ機能の範囲は異なる分子構造から異なる投与経路まで,通常多価製品が必要である。INT以外のすべてのプロジェクトは、開発段階の臨床需要を満たすために、供給規模を段階的に拡大することが要求され、そのほか、監督管理承認と商業生産のために必要な準備が必要であり、これにはより大きなロットが必要である。対照的に、INT計画は、特定の患者のために設計·製造された癌治療法の開発を求め、独自のロット数を増加させる。著者らは各プロジェクトの生産生産量を拡大することに伴い、著者らは製品の生産量、純度と候補製品の薬用性能を絶えず高めることを計画している
後期開発と商業化に供給を提供する
我々の新冠肺炎ワクチンの生産を継続するに伴い,我々の開発パイプラインは後期開発と商業化まで進められている。私たちのプラットフォーム方法は私たちの製造施設で私たちの製造キットと他の能力を発展させることができます。メッセンジャーリボ核酸の製造は柔軟であり,1つの工場で複数のワクチンや治療薬を生産することができる。私たちの製造施設はまた私たちが製品を並行して生産することを許可する。例えば,我々のサイトメガロウイルス三期臨床試験のために薬物物質と薬物製品を生産するとともに,同じ施設で新冠肺炎薬物物質を生産することができる
品質単位
品質は私たちの運営方式の核心だ。我々は,強力な品質管理システム(QMS),我々の品質文化と我々の従業員を組み合わせることでModernaの品質を確保することを求めている.適用された法規に基づいて、品質管理システムを構築、記録し、実施し、その要求を継続的に遵守することを確保した。QMSは,様々な必要なプロセス,その組織全体への応用,およびこれらのプロセス相互作用の順序を認識する実践を行うことで,cGMPのコンプライアンスを促進する
これらの肝心な実践を記録する主な方式は政策、標準操作手順(SOP)、表とその他の品質記録を通じて、その中に全体の品質政策と品質マニュアルを含む。我々は,これらの実践を監視,測定,分析する測定ツールと指標を実施し,cGMP運営を支援し,計画結果を実現し,継続的な改善を支援した。著者らは品質管理審査(QMR)を含む正式な管理プロセスを通じてこれらの品質指標を監視し、持続的な改善を実現した。我々はまた独立した品質株を設立し、品質保証と品質管理の職責を履行した
環境、健康、安全
我々は、コンプライアンスと持続可能な発展に重点を置いた安全かつ健康な作業環境を促進するために、世界的な環境、健康、安全(EHS)組織を構築している。これは,訓練,プログラム,デジタルデータ収集と報告ツール,改善を推進する企業計画の組合せによって実現されている
サプライチェーン単位
私たちはすでにグローバルサプライチェーンを構築して、私たちの製品を生産するための原材料とコンポーネントを供給して、臨床と臨床前の需要を満たすことができます。私たちはすでに私たちの外部サプライヤーと協力して、肝心な原材料の特性を確定し、それらが薬品と調合薬品の品質に与える影響を理解した。私たちはまた、私たちの外部サプライヤーの品質システムと表現を評価し、規制要件に適合するように彼らと協力します。
デジタル化と人工知能戦略
設立以来,我々はデジタル優先の会社であり,デジタル情報の力を利用して我々の患者に最大限の影響を与えることを求めてきた。メッセンジャーリボ核酸は情報分子であり,わが社は生活中の情報の自然な流れが薬物開発に利用できることを前提としている。10年余りのメッセンジャーリボ核酸薬物の開発経験により、著者らは大型データベースを構築し、著者らのプラットフォーム方法とクラウドローカルインフラと結合し、人工知能(AI)をうまく利用してデジタル運営モードを拡張できるようにした。
私たちの首席情報官の指導の下で、私たちのデジタル組織パートナーはすべてのModerna機能を越えて、統合された人工知能生態系を作成し、業績を向上させ、最終的により大きな患者と業務影響を与えることを目的としている。そこで,我々は2021年に我々のAI Academyを発売し,我々の全従業員にデータ可視化,機械学習アルゴリズム,AI倫理などのテーマの組織間訓練を提供した.人工知能学院を通じて、私たちの従業員は彼らの特定の仕事の機能に人工知能を利用する方法を学ぶ。私たちの組織に人工知能を埋め込むことで、私たち従業員の価値を測定し、リアルタイム人工知能会社になることを目標に進むことができます。
人工知能は私たちの価値チェーンのすべての側面を最適化し、薬物設計から商業製造までを最適化するのに役立つ。研究段階で、私たちのデジタルと人工知能インフラは私たちの科学者が新しいmRNA構造を設計することを可能にし、人工知能アルゴリズムを用いてそれを最適化し、そして私たちの高スループット臨床前規模生産ラインからそれらを注文する。私たちの能力は、毒性を低下させたり、安定性を向上させたりするなど、所望の特性を有するメッセンジャーリボ核酸、タンパク質、およびLNPコンポーネントを設計することを可能にする。製品開発段階において、人工知能は参加者登録と臨床試験データ処理を予測し、自動化することによって、著者らの臨床試験操作の効率向上を助ける
私たちの製造プロセスもまた人工知能の力を利用している。例えば、私たちは一連の完全に自律的で統合された人工知能アルゴリズムを使用して私たちのINT候補mRNA-4157を製造する。私たちの独自のアルゴリズムは、各患者のための特定の治療方法を設計し、INTの適時な製造と各患者への送達を最適化する
ビジネス段階では、私たちの数字とビジネス組織は2023年に一緒になり、業績を推進し、製品発表に準備しています。数字と人工知能は著者らの商業化戦略の重要な構成部分であり、私たちが発売速度を加速し、商業能力を強化し、製品の品質を絶えず高める能力に非常に重要である。私たちは同時に規模と速度で移動することができ、未来の製品発表に関する目標をよく実現できると信じています。
また,生成的人工知能(GenAI)が2023年に変革的技術として登場するにつれ,我々は迅速に行動し,我々自身の内部GenAI製品を開発·発売した.大型言語モデル(LLM)の部門間タスクの簡略化における独自の価値を認識し,2週間の開発を経て2023年5月に我々の内部製品を発売し,我々の拡張機能により順序改良を行ったTED機械学習プラットフォームForm Compute 4.0は厳しいデータ管理に用いられる.従業員の約75%は
現在アクティブなユーザは、そのツールを彼らの特定の機能に組み込み、カスタマイズ支援を提供し、彼らの日常ワークフローを有意義に改善する。わが社のこの急速な採用は私たちの人工知能を中心とした文化の力を示しています
Modernaで建設中の統合人工知能生態系は,メッセンジャーリボ核酸薬による人々に最大の可能な影響を与えることで,我々の使命を加速させると信じている
商品化する
北米、ヨーロッパ、アジア太平洋地域の重要な市場に活発な商業子会社を持つ差別化されたビジネスモデルを構築している。私たちの絶えず増加している商業足跡は呼吸器ワクチンの使用率と売上の高い主要な市場に現地の商業チームを提供した。私たちは世界市場でのビジネス活動を支援するために、豊富な製薬会社の経験を持つ人材を招いた。私たちのビジネスチームはまた、直接業務をしていない国の第三者流通業者や他のパートナーと協力しています。私たちのビジネス活動は規制部門の承認と、私たちが戦略的パートナーと合意したか、または未来に達成される可能性がある合意にかかっている
2023年前、私たちは私たちの新冠肺炎ワクチンをアメリカ政府、外国政府と衛生部、COVAX基金を代表するGAVI、その他の国際機関に売却した。大流行中、これらの販売の特徴は、大規模なワクチン接種活動によって配布するために多用量ワクチンを購入する顧客数が比較的限られていることである。私たちの流行市場への移行に伴い、私たちは需要の単剤デモとプレフィルドシリンジへの転換を目撃した。2023年、新冠肺炎ワクチン市場は地方性季節性商業市場に転換し、特にアメリカ(私たちの最大の市場)では、顧客基盤が分散し、注文は更に予測しにくく、納品は季節性があり、需要は疫病期間より明らかに低く、そして私たちはすべての流通コストを仮定した。民間ワクチン市場の特徴もリベート、割引、返品に関する市場やり方である。新冠肺炎ワクチン市場は引き続き多くの絶えず変化する要素、例えば医療需要、ウイルス進化、公衆衛生当局の提案及び消費者がワクチンを接種する動機に依存する
著者らはまた、RSV、季節性インフルエンザと新冠肺炎に対する単剤と連合ワクチンを含む、より広範な季節性呼吸器ワクチンの特許経営権を推進しており、この3種類のワクチンの医療死亡率は最も高いデング熱は呼吸器疾患の一種である。RSVワクチンは2024年上半期に規制承認を受けると予想されていますw多種の呼吸器ワクチンが今後数年で全世界範囲で商業化されることに伴い、発売された。
私たちが私たちのポートフォリオを呼吸器疾患から承認へと進むにつれて、私たちは他の特許経営権のために私たちの商業能力を確立することにも投資しています。これらの特許経営権には私たちの潜伏ワクチン、稀な疾病と腫瘍学製品が含まれており、今後数年にこれらの製品を発売する予定である。
私たちはオーストラリア、カナダ、イギリスに最先端のメッセンジャーリボ核酸製造施設を設立することにも取り組んでおり、これらの国の政府は長年の約束を締結しており、承認されれば、私たちからメッセンジャーリボ核酸製品を購入する。詳細は上記の“-製造”を参照されたい。
第3者戦略同盟
戦略同盟
著者らはすでに異なる協力者と戦略連盟を構成し、製薬と生物技術会社、政府機関、学術実験室、基金会と治療領域の専門知識と資源を持つ研究機関を含む。私たちの協力を通じて、私たちの発見と開発計画を進めるとともに、私たちのプラットフォームと私たちの研究と早期開発能力を利用することを求めています。また,遺伝子編集や細胞治療など,他のタイプの治療法を開発している会社との協力と投資を求めており,これらの会社では,我々のコアmRNAやLNP能を利用して我々の技術のカバー範囲を拡大できると信じている。
私たちのいくつかの戦略連合を通じて、私たちは新しいmRNAモデルや計画を開発する見返りとリスクを共有し、このモデルの下で、私たちは早期研究データを持っている可能性があり、戦略パートナーが私たちに参加して、このモデルにおける早期開発候補を臨床に進めることを望んでいる。代表的な関係と関連計画には,メルク社との関係,およびVertexとの関係があり,前者は我々のINT計画(mRNA−4157),後者は我々のCF計画に適用されている[mRNA−3692]。
戦略連盟は,我々の目標達成を加速させる重要な駆動力であり,様々な医療や疾患挑戦の患者を治療するためのメッセンジャーリボ核酸薬の迅速な開発を目指していると考えられる。私たちのプラットフォームの完全性を維持するために、私たちの戦略協力協定条項は、一般的に、私たちが設計·製造した潜在的メッセンジャーリボ核酸薬を開発し商業化する権利を獲得するか、または私たちの戦略パートナーが私たちの戦略パートナーに私たちのプラットフォームを使用して新しいメッセンジャーリボ核酸技術を生成する権利を付与するのではなく、私たちのプラットフォームに関連する知的財産権を持っています。これらの知的財産権は、以下の条件で行われる研究活動から来ています
戦略同盟です。私たちは潜在的な戦略的パートナーを探し続け、彼らは私たちのプロジェクトに意味のある技術と見解を提供することができ、私たちの影響をより広範な患者集団に拡大することができるようにする予定である
以下は私たちが進行しているいくつかの協力の簡単な説明だ。2023年第4四半期、Vertexとの戦略的連携および許可プロトコル(Vertex 2020プロトコル)は、プロトコル条項に従って完了し、終了します。Vertex 2020プロトコルは、遺伝子編集療法による嚢胞性線維症(CF)を治療する潜在的薬剤の発見と開発を目的としている。この連携に関する他の情報は、参照されたい注5協力協定なお、我々の連結財務諸表は、本年度報告のForm 10-Kに含まれています。
メルク-個別化新抗原治療戦略同盟
2016年6月、個人化されたメッセンジャーリボ核酸癌ワクチン(INTとも呼ばれる)を開発および商業化するための協力および許可協定をメルク社と締結し、その後、2018年に修正および再記述(INTプロトコル)を行い、私たちのメッセンジャーリボ核酸ワクチンおよび製剤技術を使用して個々の患者のためにINTを開発および商業化した。戦略連合の下で、著者らは特定の患者の腫瘍細胞に存在する遺伝子突然変異を識別し、これらの突然変異のためにメッセンジャーリボ核酸を合成し、メッセンジャーリボ核酸を著者らの独自のLNPに封入し、そして各患者に独特なINTを実施し、このINTは患者自身の癌細胞に対して専用に患者の免疫システムを活性化することを目的としている。
INTプロトコルによると、私たちはメルク社から2億ドルの前金を受け取り、INTの設計と研究を担当し、生産能力とINTの製造を提供し、INTの第1段階と第2段階の臨床試験を単独で行い、メルクの抗PD−1療法KEYTRUDA(Pembrolizumab)と併用し、これらは合意された発展計画と予算に基づいて行われた。
2022年9月、メルクはINT協定の条項に従ってmRNA-4157を含むINTのオプションを行使し、2022年10月に2億5千万ドルのオプション権料を支払った。INT協定によると、私たちとメルクはINTのさらなる開発と商業化で協力することに同意しており、コストと任意の利益や損失を世界的に平均的に分担していきます
Vertex−2016嚢胞性線維化戦略同盟
2016年7月、我々はVertex PharmPharmticals Inc.およびVertex PharmPharmticals(Europe)Limited(総称してVertex)と戦略的協力および許可プロトコル(Vertexプロトコル)を締結した。Vertexプロトコルは、CF患者の肺細胞に機能性嚢胞性線維症膜貫通伝導調節タンパク質(CFTR)を産生させることによって、CFを治療する潜在的なメッセンジャーリボ核酸薬を発見し、開発することを目的としている。
他の協力
2020年9月,我々は研究に専念した国際医療集団Chiesi FarmPharmtici S.p.A.(Chiesi)と協力し,肺動脈高血圧(PAH)を治療するためのメッセンジャーリボ核酸薬を発見·開発することを目的とし,PAHは肺動脈の高血圧を特徴とするまれな疾患である。Chiesi協定の条項によると、私たちは探索作業をリードし、Chiesiは開発と世界的な商業化活動をリードし、協力に関連するすべての費用に資金を提供する。
私たちはより多くの協力を行い、私たちのメッセンジャーリボ核酸技術を利用できると考えられる分野で資金を提供することに同意した。これらの連携には,以下の機能を持つ連携がある
•Carisma治療会社発見、開発、商業化体内にある工学キメラ抗原受容体単球(CAR-M)は固形腫瘍を含む癌を治療する。
•CytomX治療会社はメッセンジャーリボ核酸技術とCytomXを用いたメッセンジャーリボ核酸に基づく条件活性化療法の作成’エスはホームを表します。
•世代生物会社我々の生物と技術の専門知識をGeneration Bioの非ウイルス遺伝プラットフォームのコア技術と組み合わせた
•Immatics N.V.高度に満たされていない医療ニーズを有する癌患者に新たなかつ変革的な治療法を開拓する。
•生命編集治療学発見し発展させるために体内にあるメッセンジャーリボ核酸遺伝子編集療法
•Metagenomi新しい遺伝子編集システムの発見と推進に集中しています体内にある人間の治療応用です
このような協力に基づいて、私たちはCarisma、Generation Bio、Metagenomiに株式投資をした。
政府組織や財団との戦略同盟は
国防高等研究計画局(DARPA)
2020年9月,我々はDARPAと合意し,我々の既存のワクチンや治療薬を迅速に生産できる製造技術を利用して,移動製造プロトタイプの開発に資金を提供した。
生物医学高度研究開発局(BARDA)
2016年9月にはガンダム契約を取得しました1億26億ドルその後調整しました1億17億ドル2021年、米国衛生公衆サービス部(HHS)から準備および反応を担当する国務長官補佐官室(ASPR)に属するBARDAは、私たちのジカワクチンプロジェクトの支援を支援した。2022年9月、贈与の履行期間が満了し、BARDAは余剰資金への資金提供義務を免除した3600万ドル賞の受賞者。
2020年4月に私たちはBARDAと最高で入手できる合意に達しました4.83億ドル著者らのオリジナルの新冠肺炎ワクチンmRNA 1273 mRNAの開発を加速した。このプロトコルは、その後、30,000人の参加者の3期研究を含むmRNA-1273の様々な末期臨床開発努力を支援するための追加の約束を規定するために修正された 小児科臨床試験、青少年臨床試験と薬物警戒研究。BARDAの最高判断はすべての修正案を含めて18億ドルそれは.すべての契約オプションは行使された。2023年12月31日現在、余剰利用可能資金は、収入を差し引いた純額は9700万ドル.
生命薬物研究所(ILCM)を変える
2021年9月、我々はILCMと協力して、1型Crigler-Najar症候群(CN-1)を治療する新しいメッセンジャーリボ核酸(mRNA-3351)を開発することを合意した。合意条項によると、私たちはmRNA-3351をILCMに許可し、前金を取らず、下流支払いもしないことに同意した。ILCMはmRNA−3351の臨床開発を担当する。
ビルとメリンダ·ゲイツ財団は
2016年1月、私たちはビルとメリンダ·ゲイツ財団と様々な伝染病のメッセンジャーリボ核酸開発プロジェクトを推進するための世界衛生プロジェクトの枠組み合意に達した。ビルとメリンダ·ゲイツ財団は、臨床前環境で抗体の組み合わせを評価することに関連し、ヒト初の潜在的メッセンジャーリボ核酸薬の第1段階臨床試験を行い、HIV感染の予防を支援するために、2000万ドルまでの寄付金を提供することを約束した。後続プロジェクトは、様々な感染症の追加mRNAプロジェクトの開発を支援するために、フレームワーク合意下の潜在的資金総額を1億ドル(HIV抗体プロジェクトを含む)にすることができ、これらのプロジェクトは、ビルとメリンダ·ゲイツ財団にいくつかの非排他的許可を付与する義務を含む、フレームワーク合意6周年まで提出され、承認されることができる。
知的財産権
私たちは、特許、商標、著作権、および商業秘密、および秘密および許可協定を含む一連の知的財産権法律に依存して、私たちの知的財産権および独自の権利を保護します
私たちのプラットフォーム、モデル、計画投資を保護する:拡張可能で多層的なIP資産を構築する
我々は、mRNAワクチンおよび治療開発候補薬物の開発および商業化に関連する大量の特許および特許出願を含む大量の知的財産権を確立しており、関連するプラットフォーム技術を含む。著者らのプラットフォーム知的財産権保護はメッセンジャーリボ核酸設計と工程、独自のLNPコンポーネント、輸送システム、薬物物質と製品の製造と精製技術及び分析方法の進歩である。私たちのプラットフォーム知的財産権の大部分はさらに私たちのモデルと計画に多層的な保護を提供する。
私たちの知的財産権に関して、私たちの独自特許の組み合わせは、発行または許可された230件以上の米国特許または特許出願と、米国以外の司法管轄区域で付与または許可された170件以上の特許(多くのヨーロッパ諸国で検証された付与された欧州特許を含む)とを含み、私たちの特定の独自プラットフォーム技術、発明、および改善をカバーし、私たちの臨床および最先端の候補開発プロジェクトの重要な側面をカバーしている。私たちは400以上の未解決特許出願を持っており、多くの場合、これらの出願は前述した米国および外国特許に相当する。
私たちのポートフォリオの多くの特許と出願は早くても2033年に期限が切れます。私たちが最近提出した特許出願が発行される可能性のある任意の特許は、早ければ2042年から2043年の間に満期になると予想される。私たちは必要に応じてより多くのアメリカと外国特許出願を提出して、私たちが発展していく知的財産権状況を保護する。
私たちはまた、当社の独自技術およびプロジェクトに関連する商標、著作権、商業秘密および技術的ノウハウ、持続的な革新および許可内の機会に依存して、メッセンジャーリボ核酸治療およびワクチン技術分野における当社の独自の地位を強化し、維持しています。私たちは、私たちの知的財産権と独自の権利を保護するために、秘密と許可協定を締結するなど、他の措置を取っている。また,利用可能な場合にはデータ独占性,市場独占性,特許期間の延長に依存し,孤児薬物指定による規制保護を求め,依存することを計画している。我々はまた,関連する製造プロセスや専門知識に関する多くのノウハウを持っている.
私たちのプラットフォームの知的財産権を保護する
私たちは私たちのプラットフォームの重要な側面を扱っている幅広い知的財産権を持っている。この産業はメッセンジャーリボ核酸薬物物質と投与技術の製造と使用をカバーした多層保護を提供している。
我々のプラットフォームに関しては、設計、製造、およびメッセンジャーリボ核酸薬物の調製に関連するプラットフォーム革新をカバーする米国と外国特許または特許出願とを含む組み合わせを有する。例えば、これらの特許および特許出願は、以下の態様のための特許請求項を含む
•メッセンジャーリボ核酸化学は、ワクチンおよび治療用途に改善された特性を与える
•メッセンジャーリボ核酸配列を最適化し、メッセンジャーリボ核酸薬物発現タンパク質のレベルと忠実度を向上させる
•癌ワクチン環境において優れた適用性を有するエピトープを同定するための方法
•安定性を高めるためにオーダーメイドしたエンジニアリング要素生体内のメッセンジャーリボ核酸薬の性能;
•治療用およびワクチン核酸の最適送達および発現のために設計された新規脂質成分、特に予防感染症および癌ワクチン核酸、腫瘍内免疫腫瘍療法、局所再生療法、全身療法および吸入性肺療法;および;
•メッセンジャーリボ核酸原料薬と製剤薬品の製造と分析の革新技術。
知的財産権保護
私たちの知的財産権は、製品特定レベルと様々なより広いレベルで複数の計画を保護します。例えば,我々はLNP被覆mRNAの特許カバー範囲を有しており,これらのmRNA sはワクチンや治療用mRNAの使用に適した特定の化学修飾を有している。我々の遺産はまた、呼吸器および潜伏ウイルスによって引き起こされる疾患、および公共の健康を脅かすことが知られている細菌、ウイルスおよび寄生虫症を含む感染症の予防または治療のための感染症抗原をコードするいくつかのLNP被覆mRNAをカバーするIPを含む。私たちのメッセンジャーリボ核酸化学、配合および製造特許出願および関連技術、ならびに商業秘密は、私たちの開発候補製品に関連する追加の知的財産権保護を提供してくれるかもしれません。
呼吸器ワクチン
我々の気道ワクチンプロジェクトについては,物質成分と使用方法宣言を特徴とした特許保護が求められている。私たちはどこで特許保護を求めることができますか、様々な伝染病の独特の地理的流行率によって異なるかもしれません。
私たちは私たちのベータコロナウイルスワクチン計画を含めていくつかの特許出願を提出した。私たちは私たちの既存と次世代ベータコロナウイルスワクチンのための特許保護を求めている。我々の新冠肺炎ワクチンの授権特許に関する非詳細リストは次の表で見つけることができる。
| | | | | | | | | | | |
| 特許番号 | 国/地域* | 特許タイプ | 期日まで** |
11,524,023 | アメリカです | 物質の組成 | 2041年10月22日 |
11,485,972 | アメリカです | 物質の組成 | 2038年5月18日 |
10,898,574 | アメリカです | 物質の組成と使用方法 | 2032年4月2日 |
10,703,789 | アメリカです | 物質の組成 | 2033年3月9日 |
10,702,600 | アメリカです | 物質の組成 | 2036年10月21日 |
10,577,403 | アメリカです | 物質の組成 | 2033年3月9日 |
10,442,756 | アメリカです | 物質の組成 | 2036年9月16日 |
10,266,485 | アメリカです | 物質の組成 | 2036年9月16日 |
10,064,959 | アメリカです | 物質の組成 | 2031年10月3日 |
9,868,692 | アメリカです | 物質の組成 | 2036年9月16日 |
3 590 949 | ヨーロッパ.ヨーロッパ | 物質の組成と使用方法 | 2031年10月3日 |
3 718 565 | ヨーロッパ.ヨーロッパ | 物質の組成 | 2036年10月21日 |
*米国およびヨーロッパでのみ一部のライセンスを取得しています。米国、ヨーロッパ、および他の国/地域で付与され、出願されている特許も提供される可能性がある。
**ここに記載されている有効期限は、承認または予期される特許期限調整(PTA)を含むが、特許期限延長(PTE)または補足保護証明書(SPC)は含まれていない。
RSV
我々は2022年10月11日に発表された米国特許を含むRSVワクチンに対する複数の特許シリーズを出願している。 RSV特許の組み合わせは複数の異なる特許幅の家族を含んでいますそれは.少なくとも4つのアメリカとヨーロッパの特許出願が審理されている。
流感
私たちはいくつかの特許家族がアメリカで懸案されていて、異なるレベルの広さ、設計、耐原価に関連していますヨーロッパ.ヨーロッパ世界中で認可されたいくつかの特許が含まれています
HMPV
ヒト偏肺ウイルス(HMPV)は連合計画のための一本鎖RNAウイルスである。我々のhMPVワクチンは米国とヨーロッパの特許出願中であり,米国でライセンス特許を取得している。
潜伏ワクチン
CMV,EBV,HSV,VZVおよびHIVを含む様々なウイルスによる急性および潜在性疾患に対するワクチン計画や特許出願があり,急性期に対する予防的ワクチンおよび治療用ワクチンを用いて,ウイルスに確実に感染した人の潜在性疾患を治療する。
サイトメガロウイルス
我々のヒトサイトメガロウイルス候補ワクチンの特許カバー範囲は広く,5量体表面糖タンパク質複合体とGB表面糖タンパク質をコードする6つのmRNAを含むワクチンに基づいている。五量体とgBはすべてウイルスが異なる細胞タイプに入ることに役立つため、これらの蛋白に対する免疫反応はウイルスの進入、伝播と再活性化を阻止することができる。現在の特許の組み合わせは、物質の成分も含むし、ワクチンを用いて対象を治療する方法も含む。米国では,我々のCMVワクチンは複数の異なる広さの米国特許でカバーされている。各家庭には対応する出願があり,ヨーロッパや日本を含む非米国司法管轄区で特許が発行されている。適応のCMVワクチンを移植するためのmRNA 1647およびmRNA 1443を含む別のCMV特許ファミリーは、特許も生成されており、外国司法管轄区での出願が待っている。
EBV、HSV、VZV
CMVと同様に、予防および治療適応をカバーする複数のEBV、HSV、VZV特許ファミリーが出願されている。これらの特許はヨーロッパと日本もアーミリアの申請を提出した。
公衆衛生ワクチン
私たちは多くのプロジェクトの努力を維持して、将来可能な大流行のためにワクチンを開発し、世界の衛生保健システムがあまり完備されていない一部の地域に使用している。この計画にはジカウイルスやデング熱などのフラビウイルスが含まれています
ウイルス、HIV、ニパウイルス、Mpoxウイルス。また、多くの細菌性疾患のプロジェクトが行われている。可能な場合、潜在的な公衆衛生プロジェクトの多くは特定の特許ファミリーを出願しているが、場合によっては、プラットフォーム特許は、公衆衛生目標ワクチンの特許保護を強化するために使用される可能性がある。
個別化新抗原治療(INT)
我々の癌ワクチンモデル内の計画を保護するために物質の組成と方法を主張している。我々のINTおよびそれによって生成されるワクチン組成物の製造および治療用途に関する特許方法は、7つの係属中の米国特許出願、6つの係属中の欧州特許出願、5つの日本の係属中の特許出願、3つの係属中の特許出願、および1つの中国のライセンス済み特許、ニュージーランド、南アフリカ、アジアおよび南米諸国のいくつかの係属特許出願、および1つのPCT出願に記載されている。これらの応用はまた、様々なワクチン設計形式、特にポリエピトープワクチン形式、およびこのINTを用いて癌を治療する方法に関する。私たちはまた、関連する製造プロセスや技術を含む、我々の癌ワクチンプロジェクトの開発と商業化に関する多くの技術的ノウハウとビジネス秘密を持っている。
同様に、我々のKRAS抗原癌ワクチンおよびそのようなワクチンによって特徴付けられる癌治療方法は、変異KRAS抗原をコードするLNP被覆mRNAの請求項を含む発行された米国特許にも含まれる。
腫瘍内免疫腫瘍学
私たちは、免疫刺激タンパク質をコードするmRNAの保護と、このような組成物を用いて癌を治療する方法とを要求する多くの特許出願を提出している。
著者らの免疫腫瘍学計画は腫瘍内投与を通じて腫瘍微小環境を変化させ、腫瘍に対する免疫反応の増強に有利である。我々のメッセンジャーリボ核酸計画は、2つの許可された欧州特許、10つ以上の許可された米国特許、いくつかの係属中の米国および欧州特許出願、および他の外国司法管轄区域のいくつかの係属特許出願によってカバーされるOX 40 L、IL-23およびIL-36γをコードするmRNAを含む。これらの応用の特徴は,メッセンジャーリボ核酸療法が物質の成分であることを主張しており,このメッセンジャーリボ核酸を含む製剤と,これらの開発候補薬を用いて腫瘍を減少させ,癌を治療する方法である
珍しい病気
治療用蛋白の発現を特徴とする項目,例えばまれな疾患の治療に用いられる細胞内酵素がある。私たちの珍しい病気計画に対して、私たちは通常、物質成分と使用方法宣言を特徴とする特許保護、例えば薬物組成と治療方法宣言を求めている。私たちの最先端の珍しい病気開発候補はPAだ。この候補者には,PA治療のためのプロピオニル−CoAカルボキシラーゼをコードするαおよびβサブユニット(それぞれPCCAおよびPCCB)のmRNAを含む米国,ヨーロッパ,日本で出願されている特許出願がある。
MMAについては,米国で発表され係属中の特許出願と,日本とヨーロッパで提出された外国出願がある。
私たちの北大開発候補について、私たちは、米国、ヨーロッパ、および日本で行われているPCTおよび特許出願を有しており、この出願は、北大のフェニルアラニンヒドロキシラーゼ(PAH)をコードするメッセンジャーリボ核酸を治療するためにカバーされている。
我々の1 a型グリコーゲン貯蔵障害(GSD 1 A)開発候補薬剤については,出願中の米国およびヨーロッパの特許出願,および中国および日本で出願されているこの疾患を治療するコードグルコース6−ホスファターゼ(G 6 Pase)の出願を含むいくつかの特許シリーズが提出されている。
我々のCrigler−Najar症候群1型(CN−1)開発候補案については,米国,ヨーロッパ,日本での特許出願が行われている。
われわれのオルニチントランスアミナーゼ欠損症(OTC)開発候補薬はPCTを申請している。
これらの特許ファミリーが発行する可能性のある任意の米国および外国特許は2036年に満了することが予想され、その中で最初のMMA特許は2038年に満了し、残りのMMA、PA、北大、GSD 1 aおよびCN−1特許は2038年から2042年に満了し、いかなる特許期限調整、いかなる特許期限延長、およびいかなる端末免責声明も含まれない。
以下に述べるように、私たちは、私たちの技術および開発候補製品のこれらおよび他の方面について特許出願を提出する予定であり、私たちが私たちの予想される製品を開発し続けるにつれて、他の使用、処方、または製造方法の保護を含む他の特許保護を得る方法を決定することを計画している。
全身分泌と細胞表面治療学
我々の全身分泌と細胞表面療法の特徴は,抗体,循環免疫調節因子,分泌酵素,膜貫通蛋白を含む分泌あるいは細胞表面蛋白の発現プログラムである。
私たちのRelaxin開発候補特許は、日本、中国、および米国で付与された特許と、米国および他の外国司法管轄区における追加出願と、進行中のPCT出願とを含むいくつかの特許シリーズを含む。
我々のPD−L 1開発候補は、米国、日本、欧州が提出した係属中の特許出願でカバーされている。
吸入性肺療法
著者らの吸入性肺治療方法は現在肺中の治療性蛋白発現に対する開発候補がある。この嚢胞性線維症(CF)開発候補薬は米国,ヨーロッパ,PCTの特許出願を受けている。
遺伝子編集
我々の遺伝子編集プロジェクトには,現在,米国,ヨーロッパ,日本で取得された特許と,これらの管轄区で出願されている特許が含まれている特許シリーズがある.我々は遺伝子編集技術の開発候補やその他について特許出願を提出する予定であるとともに,内部と戦略協力による革新を継続していく予定である.
商標
私たちの商標組み合わせは現在、少なくとも1,000件の商標登録を含み、そのうちの少なくとも22件は米国に登録されており、残りはカナダ、EU、イギリス、イスラエル、中国、日本、オーストラリア、および他の場所に登録されている。また、私たちは95以上の管轄区域で、上記の場所とアフリカ、アジア、南アメリカを含む他の国で、少なくとも600件の商標出願が処理されている。
許可内知的財産権
私たちの内部で作成されたメッセンジャーリボ核酸技術プラットフォームを使用して、私たちの潜在的なメッセンジャーリボ核酸薬物を開発し生産すると同時に、私たちは私たちのプラットフォームと相補的かもしれない第三者技術と知的財産権を探し、評価する。
CellSCRIPTとmRNA RiboTreeuticsとの特許再許可協定
ペンシルバニア大学の受託者は、発行された米国特許、付与された欧州特許、およびヌクレオシド修飾mRNAおよびその用途の一部に対する米国特許出願(ペンシルバニア大学修飾mRNA特許)をいくつか有する。メッセンジャーリボ核酸治療会社(MRT)は、ペンシルバニア大学が修正したメッセンジャーリボ核酸特許の独占許可を取得し、いくつかの使用分野のペンシルバニアで修正されたメッセンジャーリボ核酸特許の再許可をその付属会社Cellscript,LLC(細胞スクリプト)に付与した。
2017年6月、私たちはCellSCRIPTと合意された2つの再許可協定を締結し、もう1つはMRTと合意され、私たちは総称してCellSCRIPT-MRT協定と呼ばれる。結論的に、Cellscript-MRTプロトコルは、ペンシルバニア修正mRNA特許の世界再許可の再許可を付与し、ペンシルバニア修正mRNA特許がカバーする製品(許可製品)を研究、開発、製造、商業化し、すべての人の使用のために使用する生体内の治療、予防、診断用途を含むヒトおよび動物における使用。CELLSCRIPT-MRTプロトコルは非排他的であるにもかかわらず,CELLSCRIPTとMRTは以下の付加サブ許可を付与する際に一定の時間制限を受ける生体内のペンシルバニア大学によって修正されたmRNA特許によると、ヒトで使用されている。Cellscript−MRTプロトコルは,治療,予防,診断用途許可製品の年間純売上高に応じて特許権使用料を支払い,研究用途のための許可製品の年間純売上高に応じて特許権使用料を支払うことを要求しており,税率は中央値から1桁の間であるが,一定の減少幅があり,総最低下限はである。
細胞スクリプト-MRTプロトコルは、最後の満了またはペンシルバニア大学修正されたmRNA特許が放棄されたとき、または放棄されたときに終了する。特定の通知および修復条項によれば、必要なお金を支払うことができない場合、または適用プロトコルに深刻な違反がある場合、セルラースクリプトまたはMRT(場合に応じて)は、それぞれのセルラースクリプト−MRTプロトコルを終了することができる。もし私たちが破産したり借金をしない場合、またはペンシルバニア大学によって修正されたメッセンジャーリボ核酸特許の有効性または実行可能性に疑問を提起した場合、CellSCRIPTまたはMRT(場合によっては)も書面通知後に適用されたCellSCRIPT-MRTプロトコルを終了することができる。私たちは、終了時にすべてのライセンス製品の開発と商業化を停止することを前提として、60日前にCellSCRIPTまたはMRT(場合によっては)に通知した後、各CellSCRIPT-MRTプロトコルを任意に終了する権利があります。ペンシルバニア修正メッセンジャーリボ核酸特許の下でMRTまたは細胞スクリプトの権利が終了した場合(例えば、MRTまたはCellSCRIPTの破綻により)、終了した側は、それぞれのCELSCRIPT-MRTプロトコルにおける権利をペンシルバニアによって修正されたメッセンジャーリボ核酸特許に従って権利を取得する許可者に譲渡し、私たちの権利は新しい許可者の下で継続する。
NIAIDと特許ライセンス契約を締結する
2022年12月、私たちはアメリカ国家アレルギーと伝染病研究所、アメリカ国立衛生研究院の一つの研究所またはセンターと非独占特許許可協定を締結し、新型コロナウイルススパイクタンパク質の安定化とそれによって産生された安定化タンパク質の新冠肺炎ワクチン製品に対するいくつかの特許権の使用を許可した。協定によると、私たちは、ライセンス製品に基づいて、将来の純売上高に低い1桁の印税、最低年間印税支払い、およびいくつかの開発、規制、および商業マイルストーン支払いを支払うことに同意します
ライセンスのレシピ技術
私たちの開発候補は私たちが持っている内部開発のレシピ技術を使用する。しかし、私たちは、他のエンティティの許可の下で、レシピ技術をカバーする複数の公開および未解決特許を使用して利用する権利があります。将来、私たちがこれらの許可内のレシピ技術を使用または付与することを選択した場合、私たちまたは私たちの戦略パートナーは、このような使用によって生じるマイルストーンおよび印税支払い義務に責任を負うかもしれません。私たちはこれらの許可証の商業条項とその職務調査、保険、賠償、その他の類似事項に関する条項は私たちの業界にとって合理的で慣例的だと思います。
人力資本
2023年12月31日現在、世界19カ国·地域に約5,600人のフルタイム従業員を擁している我々は競争の激しい人材環境の中で運営しており,特にバイオテクノロジーや製薬分野で経験のある人材の誘致と維持を求めている場合である。私たちの従業員は高等教育を受けて、2023年12月31日まで、私たちの41%の従業員は博士、博士、医学博士、法学博士あるいは修士号を持っています。私たちの従業員のうち、2023年12月31日まで、49%が女性だ。我々の指導部(副総裁および以上のレベルの従業員と定義する)では、2023年12月31日現在、約39%が女性である。2023年12月31日現在、45%のアメリカ人従業員が自分を人種や民族多様性だと思っており、前年より増加している。2023年、外部報酬公平統計分析は、世界的に、および米国では、性別、人種、民族間の報酬差が統計的にゼロであることを2年連続で確認した
私たちは帰属感、包括性、多様性を重視しています
私たちはすべての人のために包括的で帰属感のある文化を作るために努力している。2023年には私たちは帰属感、包括性、多様性に対する私たちの約束を履行し続けます
•会社全体の性別と民族データを監視し報告し続けています
•従業員の尊敬度調査には、帰属感、包括性、多様性の重点が組み込まれている
•私たちの従業員資源グループに投資し続けます。これは、mCAREを導入することによって、介護者と親としての私たちの従業員権力を支援し、付与することを含む、私たちの人々、私たちの会社、およびコミュニティ全体のために、帰属感の力を利用して、自発的な従業員リーダーグループです
•障害者収容協会と米国障害者協会の認可を得て、障害者収容活動の最良の場となる
•年間を通じてすべての従業員のために多様化に関するイベント、祝賀イベント、学習機会を開催する。
私たちが人材を引きつけて引き留める方法は
私たちはModernaでの従業員のキャリアが目標、成長、達成感に満ちていることを確実にするために努力している。Modernaでのキャリアは次のような機会を提供すると信じています
•影響:私たちの人々は革新能力と人民生活への影響範囲が比類のない仕事に就く機会があるだろう。
•生長:私たちは信じられない成長の機会を提供し、私たちは勉強に夢中になっています(一部は私たちの心理状態に現れています(以下参照)。私たちは職員たちの発展に多くの資金を投入した
•幸せ:私たちは、従業員とその家族の健康と福祉に力を入れ、毎月従業員のライフスタイルに口座支払いを支出することを含む、多くの家族に優しい福祉と健康機会を提供します。
•包含:私たちは、一連の異なる観点と背景を集めて、違いを祝う環境を作ることの利点を信じています。私たちは管理職に心理的安全な環境を作ることを測定して要求する。
•納得のいくご褒美:最も優秀な人材を誘致し、維持するために、私たちは競争力のある奨励を提供し、先駆的な仕事を推進し、従業員が私たちの株式計画を通じて私たちが共同で創造する価値を共有することを可能にします。
•奉仕とボランティア:私たちの従業員は彼らのコミュニティにフィードバックし、ボランティアと従業員のペアリング寄付計画を通じて彼らの熱心な事業を直接支援する機会がある。
従業員と株主との整合性を促進するために、すべての従業員が株式奨励を受けることで当社の持分計画に参加し、全体の報酬組み合わせにおける持分の割合は年功序列の増加とともに増加する。私たちの従業員はまた、彼らが株式オプションと制限された株式単位(RSU)との間にどのように奨励価値を分配したいかを選択することを可能にした。インセンティブ成長が株主価値をもたらすほか、私たちの株式計画の広範な資格は、一般的に4年以内に付与されるため、私たちの“所有者のように行動する”という考え方をさらに根ざし、従業員の留任を促進するのに役立つと考えられる。
私たちの従業員の中には労働組合や労使委員会が代表されていないし、私たちと集団交渉に合意している従業員は一人もいない。フランス、イタリア、スペインの一部の従業員は、特定の福祉と労働条件を規定する法定集団交渉協定によって保護されている。私たちは私たちの従業員が仲がいいと思う。
私たちは私たちの従業員が高い尊敬を持っていると信じていて、私たちの会社とチームは私たちのリーダーシップ、革新、そして良い企業市民のために大衆に認められています科学過去9年間、“雑誌”は毎年私たちを最優秀雇用主に評価してきた。さらに2023年には生物学的空間2024年のBiophma最優秀職場報告では、米国は3年連続で第1位の雇用主に選ばれた。私たちはまた人権運動の2023-2024年の平等指数から満点を得た。著者らはサプライヤーが提供した従業員の尊敬度ソフトウェアを通じて従業員の尊敬度を測定し、検証された外部基準を用いて従業員の従業員の敬度要素を追跡した。
私たちの成功は私たちの訓練された人員を維持することにかかっているので、私たちは絶えず従業員の流出率を監視している。我々が提供する競争力のある報酬は、上記の要因と他の要因との組み合わせに加え、自発的な退職を減らすのに役立つと考えられる。2023年、私たちの自発的な流出率は約6%だ。
従業員を訓練する方法は
私たちのチームにさらに投資するために、私たちは従業員のために構造化された訓練課程を設立し、すべての従業員が私たちの核心技術を非常に熟知し、私たちの革新的な技術をさらに推進することができるようにした。また、私たちは様々な管理とリーダーシップトレーニングを通じて強力なリーダーを育成することに集中している。私たちはまた、私たちの従業員が柔軟にアクセスできる様々な科学材料のオンラインビデオライブラリを設立した。これらの内容には,外部講演者の内部科学シンポジウム,外部大学の科学授業,ピアツーピアビデオシリーズでの講演があり,ビデオシリーズでは,内部専門家がチームで扱う複雑なテーマについて紹介的な観点を提供している.
新入社員が私たちのModerna 1号入社計画に参加して、私たちの従業員が初日から私たちの文化と思考パターンに浸ることを目的としたインタラクティブな学習体験です。入社後、私たちの従業員はModernaのキャリア全体で勉強を続け、各従業員の訓練計画を追跡して管理するデジタル学習管理システムを導入しました
2021年12月、カーネギーメロン大学と協力して人工知能(AI)学院を立ち上げた。人工知能学院は著者らの従業員の識別人工知能と機械学習解決方案を教育と増強し、そしてそれを各Modernaシステムとプロセスに統合し、メッセンジャーリボ核酸薬物を患者にもたらすことを目的としている。
私たちの文化は
組織として、私たちは大胆で、協力的で、好奇心と忍耐力がある。これらの価値観の基礎は、私たちが言う“大本営”の価値観の核心である誠実さ、質、尊重である。また,会社の持続的な急速な増加にともない,我々の行動,リーダー,意思決定を定義したModernaの思考モデルについて述べた.私たちは私たちの心理状態が私たちの未来の成功に欠かせない部分になると信じていて、私たちはそれらを私たちがどのように識別し、入社し、成長し、私たちの才能を管理するかに統合します
私たちの従業員チームを更に発展と維持するために、著者らは定期的に人材評価を行い、組織内の肝心な人材を確定する。私たちはこれらのデータを使用して、重要な現在と潜在的な未来のリーダーに特定の発展機会を提供し、重要な役割に対する定期的な後継計画活動を支援します。これらの措置は、私たちの従業員チームと未来のリーダーを育成する人材パイプを強力に理解し、彼らの抱負と才能を満たす方法で成長し、進歩していく機会を私たちの従業員に提供することを共に確保している。
企業社会的責任
メッセンジャーリボ核酸薬による人々に最大の影響を与える可能性のある使命を追求するとともに,患者,従業員,環境,地域コミュニティに対する我々の約束を示すために企業社会的責任(CSR)計画を策定した。私たちの企業社会責任枠組みは5つの重点領域を含む:患者の薬品使用、コミュニティ、管理と道徳、従業員と環境。当サイト“責任-会社政策”の一部の“2022年ESG報告”を参照してください。この報告書は、www.medinatx.com/責任/会社-政策で見つけることができ、企業の社会的責任に対する私たちの約束を推進するための私たちの措置を説明するために、米国証券取引委員会に提出される2024年株主総会に関する依頼書を参照してください。
競争
バイオテクノロジーと製薬業界は急速に発展する技術を利用して、激しい競争の特徴を持っている。それはまた知的財産権と独自製品を保護することを非常に強調する
遺伝子チップ薬
メッセンジャーリボ核酸は薬物として、メッセンジャーリボ核酸技術、薬物発見、開発、製造における私たちの能力に加え、競争優位性を提供してくれると信じている。しかし,RNAワクチンや治療法を開発した他社からの競争と,我々の製品との競争や競合する可能性のある他の薬物との競争に直面している。私たちは大手製薬会社、バイオテクノロジー会社、学術機関、政府機関、公共と個人研究機関を含む異なる源からの競争に直面している。MRNA分野の持続的な成長は、大型およびより成熟した製薬会社からの競争圧力を含む競争圧力の増加を招いている。私たちは私たちのパイプを推進して発展させるために戦略連合に入る時も競争に直面している
著者らの新冠肺炎ワクチンは主にファイザー/生物技術会社の新冠肺炎ワクチンと競争し、後者もメッセンジャーリボ核酸技術に基づいている。私たちはまたノワールの新冠肺炎ワクチンを含む他の承認または許可された製品と競争する。また,いくつかのライバルはファイザーの抗ウイルス錠剤を含む新しい冠肺炎療法を開発しており,このような治療法の存在はワクチンへの需要を減少させる可能性がある
新冠肺炎ワクチンの販売競争は多くの要素の影響を受け、その中には、実際および予想されるワクチン効力(新たに出現したSARS-CoV-2変種を含む)、安全性と耐性、メッセンジャーリボ核酸技術に対する見方、貯蔵と処理条件、ならびに配布と管理の相対的な使いやすさ、規制承認の時間と範囲、精算範囲、および生産と配布コストを含むがこれらに限定されない。著者らの新冠肺炎ワクチンの未来の競争力はまた著者らが組合せ呼吸器ワクチンの生産に成功するかどうかに依存する可能性があり、このワクチンは針を結合して、各種の呼吸器疾患、例えば季節性インフルエンザ、呼吸器合胞体ウイルスと新冠肺炎を予防する。
我々のRSVワクチンは2024年に発売される予定で、グローとグラクソ製ワクチンを含む既存のRSVワクチンからの競争に直面する。私たちはまた季節性インフルエンザワクチンを開発しています。これは既存の発達した市場です。
私たちが参入した市場では、競争相手が競合製品を発売した後、市場シェアを得ることは難しいかもしれません。“リスク要因--薬品市場の競争が激しく、私たちは現有の製品、新しい治療方法と新技術の市場で有効に競争できないかもしれない”と見た
遺伝子薬を研究している会社も多く、その中のいくつかは商業化されている。これらの会社にはBioNTechとファイザー(単独およびBioNTech,Beam Treeuticsや他社との協力)が含まれている。他の会社にはセノフィ、グラクソ·スミスクライン、CureVacが含まれている。
私たちの協力は
我々と我々の戦略パートナーは,我々の協力に関するメッセンジャーリボ核酸薬の開発ではなく,我々の協力に関する様々な分野で療法を開発する会社の競争に直面している。例えば、ますます多くの製薬、生物技術と学術機構は固体と液体腫瘍環境において自己と異体CAR-T療法を研究と開発している。これらのCAR−T細胞療法は異なる開発と承認段階にあり,Carisma治療会社と協力して発見,開発,商業化された任意のCAR−M療法と競合する可能性がある
同様に、Metagenomiや他の協力者と協力して開発および商業化された任意の遺伝病療法と競合することができる他の核酸や遺伝子薬を研究·開発している多くの会社や機関もある
私たちが成長しているビジネスの足跡は
私たちのビジネス組織は2020年に設立され、多くの競争相手に比べてビジネス経験が少ない。私たちはまだ私たちのビジネスの足跡を拡大し、私たちより競争力のある他の会社と競争している。“リスク要因--商業化と我々の製品に関連するリスク”を参照してください
政府の監督管理
米国の連邦、州、地方政府当局、および他の国や地域、例えば欧州連合(EU)の政府当局は、他の事項を除いて、我々の製品の研究、開発、製造、マーケティングを規制している。一般的に、新薬が発売される前に、その品質、安全性、有効性を証明するデータを大量に取得し、主管監督当局に提出して審査と承認を行わなければならない。
アメリカの薬と生物製品の開発
アメリカでは、FDAは“連邦食品、薬物と化粧品法”(FDCA)及びその実施条例に基づいて薬品を監督し、FDCA、公衆衛生サービス法(PHSA)及びその実施条例に基づいて生物製品を監督する。医薬品と生物製品はまた他の連邦、州、そして地方法規によって制限されている。製品開発過程、承認過程、または承認後のいつでも適用される米国の要求を遵守できなければ、行政や司法制裁を受ける可能性がある。他の行動に加えて、これらの制裁は、FDAが係属申請の承認拒否、免許取り消し、臨床棚上げ、無見出しまたは警告状、製品リコール、市場撤回、製品差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金、政府契約の拒否、原状回復、返還、返還、および民事または刑事罰を含む可能性がある
私たちの任意の候補製品は、BLAまたは新薬申請(NDA)またはBLAを補充するか、または補完NDAプログラムを介してFDAの承認を得なければならず、その後、米国で合法的に発売されることができる
臨床前研究
我々の任意の候補開発薬が人体でテストできる前に、候補開発薬は厳格な臨床前テストを経なければならない。臨床前研究には製品化学と処方の実験室評価があります体外培養では有害事象の可能性を評価し、場合によっては治療使用の理由を確立するための研究および動物研究。臨床前研究の進行はGLPの安全/毒理学研究に関する法規を含む連邦法規と要求の制約を受けている。INDスポンサーは,臨床前試験の結果を生産情報,分析データ,任意の利用可能な臨床データや文献,臨床研究計画などとともにFDAに提出し,INDの一部としなければならない。INDはFDAがヒトに研究製品の使用を許可する要求であり,ヒト臨床試験が開始される前に発効しなければならない。FDAが懸念を提起しない限り、INDはFDAが受信してから30日後に自動的に有効になる。この場合,INDスポンサーやFDAは臨床試験開始前に未解決の問題を解決しなければならない
臨床試験
開発の臨床段階には,合格研究者の監督下でGCP要求に応じて健康ボランティアや患者に研究薬を使用することが含まれている。臨床試験は,臨床試験の目標,用量プログラム,被験者の選択と排除基準,および被験者の安全性をモニタリングし,治療効果を評価するためのパラメータを詳細に説明した場合に行われる。INDの一部として、すべての議定書とその後の議定書のいかなる修正もFDAに提出されなければならない。また、各臨床試験は、臨床試験に参加する個人が直面するリスクが最小に減少することを保証し、期待される利益について合理的であることを保証するために、臨床試験を行う各機関の機関被覆検査委員会(IRB)によって審査·承認されなければならない。IRBはまた、臨床試験対象に提供しなければならないインフォームドコンセントを承認し、完成まで臨床試験を監視する。また,他の情報に加えて,臨床試験結果を詳細に説明する進捗報告は少なくとも年に1回FDAに提出しなければならず,それ以外の場合には重篤な有害事象の発生を含めてより頻繁に提出される。ある臨床試験に関する情報は,www.Clinicaltrials.govサイトで発表するために,特定の時間枠内で提出されなければならない。
米国国立衛生研究院の組換えDNA分子に関する研究ガイドライン(NIHガイドライン)によると、ヒト遺伝子転移試験の監督は機関生物安全委員会(IBC)による評価と評価を含み、IBCは地方機関委員会であり、この機関の組換え或いは合成核酸分子を用いた研究の審査と監督を担当している。NIHガイドラインはNIH組換えや合成核酸分子研究助成を受けた機関のみの研究やその助成による研究は強制的であるが,多くの会社や他のNIHガイドラインに拘束されていない機関は自発的にこれらのガイドラインに従っている。
INDの下で行われる外国研究は,米国で行われている研究に適用されるのと同じ要求に適合しなければならない。研究がGCP要求に応じて行われ,FDAがデータを検証できれば,INDによる外国研究ではないデータをBLAを支援するために提出することができる.
臨床試験は通常3つの連続段階に分けて行われ、重なるかもしれない
•第一段階の臨床試験は通常、研究薬物の代謝、薬理作用、副作用耐性と安全性を評価するために、一部の健康ボランティア或いは疾病の影響を受ける患者を含む。
•第2段階臨床試験は、一般に、疾患の影響を受ける患者評価概念証明および/または後続研究のための用量レジメン(S)の決定に関する。同時に、安全性と更なる薬物動態学と薬効学情報を収集し、可能な副作用と安全リスクを識別し、そして初歩的な治療効果の評価を行った。
•第三段階臨床試験は通常、複数の場所の大量の疾病の影響を受ける患者に関連し、必要なデータを提供し、研究薬物の期待用途の有効性、使用中の安全性を証明し、そして薬物の全体的な利益/リスク関係を研究し、そして製品ラベルに十分な基礎を提供することを目的としている。
FDAはまた、商業使用中の薬物の安全性と有効性をさらに特徴付けるために、承認後の第4段階の非登録研究に科学的問題を探索することを要求する可能性がある。
FDA或いは臨床試験場所はいつでも様々な理由で臨床試験を一時停止或いは中止することができ、患者が受け入れられない健康リスクに直面していることを発見することを含む。同様に、臨床試験がIRBの要求に従って行われない場合、または薬物または生物が患者に予期せぬ深刻な傷害を受けることに関連している場合、IRBは、その機関の臨床試験の承認を一時停止または終了することができる。さらに、いくつかの臨床試験は、データ安全監視委員会または委員会と呼ばれる臨床試験スポンサーによって組織された独立した合格専門家グループによって監督される。このグループは,臨床試験のあるデータへのアクセスにより,臨床試験が指定されたチェックポイントで行えるかどうかを許可している
FDA審査プログラム
臨床試験が完了した後、研究製品が提案された1つまたは複数の指示用途に対して安全に有効であるかどうかを評価するために、データを分析する。臨床前研究および臨床試験の結果は、その後、BLAまたはNDAの一部としてFDAに提出され、製品品質および他の関連データを確保するために、提案されたラベル、化学および製造情報が提示される。BLAは、1つまたは複数の特定の適応を承認する生物学的製剤の発売を承認する要求であり、この生物学的製剤の安全性、純度、および効力の証明を含まなければならない。新薬の秘密保護協定にはこの薬の安全性と有効性の証拠が含まれなければならない。上場承認を支持するためには、提出されたデータは研究製品の安全性と有効性を確定し、FDAを満足させるために、品質と数量で十分でなければならない。生物または薬物が米国で発売される前に、BLAまたはNDAに対するFDAの承認を得なければならない
BLAまたはNDAを承認する前に、FDAは、これらの施設がcGMP要求に適合しているかどうかを決定するために、新製品の製造施設を承認前に検査し、要求された仕様で製品が一貫して生産されることを保証するのに十分である。FDAはまた、GCP要求に適合することを確保するために、臨床試験のデータを監査することが可能である。また、FDAは、新製品の申請または安全性または有効性の問題が発生した製品の申請を専門家コンサルタントからなる諮問委員会に提出して審査、評価を行い、申請が承認されるべきかどうか、どのような条件で(あれば)提案することができる。その委員会はFDAに拘束力はないが、一般的に従うべき提案をした
FDAがBLAまたはNDAを評価した後、それは、より多くの情報を提供すること、または完全な返信(CRL)を発行することを要求する上場を承認し、提出文書の不足点を概説する。CRLは、FDAがBLAまたはNDAを再検討するために、追加の臨床前または臨床データを含む追加のテストまたは情報を必要とする可能性がある。これらの追加の情報およびデータが提出されても、FDAはBLAまたはNDAが承認基準を満たしていないことを決定する可能性がある。FDAが承認した場合、それは、製品の商業マーケティングを許可し、特定の適応の特定の処方情報を提供する承認状を発行する。
孤児薬名
孤児医薬品法によれば、FDAは、米国では20万人未満または米国で20万人を超える影響を与える疾患または疾患であることが一般的であり、米国ではこのような疾患または疾患を治療する製品を開発および提供するコストが製品の販売から回収されるという合理的な期待がない、まれな疾患または疾患の治療のための医薬または生物製品に孤児の称号を付与することができる
孤児として指定された製品がその後、このような指定された疾患または状態を有するFDAの最初の承認を得た場合、この製品は、孤児薬物排他性を得る権利があり、これは、FDAが承認日から7年以内に、非常に限られた場合、例えば後者が孤児製品よりも臨床的に優れていることが証明されない限り、同じ適応に対して同じ薬物を販売する他のいかなる出願も許可しないことを意味する
開発と審査計画を加速する
FDAは、迅速チャネル指定、画期的な治療指定、加速承認および優先審査指定を含む、いくつかのツールのうちの1つを使用して、薬物の開発および審査を促進および加速することができる。迅速チャネル指定は、重篤な疾患の治療を促進し、満たされていない医療ニーズを満たす薬剤の開発および審査を促進することを目的としている。突破的な治療指定は深刻な疾病を治療する薬物の開発と審査を加速することを目的としており、初歩的な臨床証拠は、現有の治療方法と比べ、実質的な改善があることを表明した。優先審査指定は、FDAの目標が申請提出後6ヶ月以内に申請に行動することを意味する。FDAは、重篤な疾患の治療、診断または予防の安全性または有効性に関して著しく改善された薬物付与優先審査指定を提供することができる。
製品が重篤または生命に危険な疾患を治療し、通常、既存の療法よりも有意な利点を提供する場合、加速承認を得る資格もある。さらに、このような製品は、臨床利益を合理的に予測する可能性のある代替終点への影響、または不可逆的な発病率または死亡率(IMM)よりも早く測定できる臨床終点への効果を証明しなければならず、IMMはIMMまたは他の臨床利益の効果を合理的に予測する可能性がある。承認の一つの条件として,FDAは承認を加速させる薬物や生物のスポンサーに十分かつ良好にコントロールされた上場後臨床試験を求め,職務調査を行うことが可能である。FDAが結論を出した場合、有効であることが証明された薬物または生物は、流通または使用が制限された場合にのみ安全に使用することができ、その製品の安全な使用を確保するために、必要と考えられる市販後の制限をとることが要求される。2022年食品·薬物総合改革法案(FDORA)によると、FDAは現在、このような試験を承認前または承認を加速させた製品が承認された日後の特定の期間で行うことを適宜要求されている。さらに、FDORAによれば、FDAは、例えば、検証試験が製品の予期される臨床的利益を検証することができない場合、そのような薬剤または生物の加速承認を撤回することができるように、プログラムを加速する権限を増加させる。
1つの製品が1つまたは複数のこれらの計画の条件に適合していても、FDAは、製品がもはや資格条件を満たしていないと後で決定することができ、またはFDAが審査または承認する期間が短縮されない可能性がある。また、迅速チャネル指定、優先審査、加速承認、および画期的な治療指定は、承認の基準を変更しない。
緊急使用許可(EUA)
衛生·公衆サービス部長(HHS)は、許可されていない医療製品を、米国政府によって指定された実際または潜在的な緊急時に販売することができる。新冠肺炎の大流行はすでにこのような緊急事態に指定されている。緊急事態の発表後、衛生·公衆サービス部部長は発行を許可することができ、その後、FDA専門家は、十分な、承認され、利用可能な代替製品がない場合に、診断、治療、または深刻または生命に危険な疾患の診断、治療または予防において有効である可能性がある特定の製品のための使用発行EUAを含むことができる。EUAベースの緊急判定が終了した場合,EUAは終了する.EUAは、FDA承認、許可、または製品許可を得るための長期代替案ではない。FDAは、潜在的な衛生緊急事態がもはや存在しない場合、またはそのような許可が必要である場合を含む、様々な理由でEUAを撤回することができる。
米国では,“公共準備と応急準備法案”(Prep Act)はメーカーに免除権を提供し,州や連邦法律による“カバーの対策”の管理や使用による“損失”のクレームを免れている。しかし、場合によっては、被害者は“故意に失墜した”という罪でメーカーに訴訟を起こすことができる。カバーされた対策“には、大流行または流行病の診断または治療を目的とした製品、例えば大流行ワクチンなどの”合格した大流行または流行病製品“が含まれる。これらの免除を適用するために、衛生·公衆サービス部部長は、突発公衆衛生事件或いは未来の突発公衆衛生事件の“信頼できるリスク”の場合に声明を発表しなければならない2020年3月17日、衛生·公衆サービス部部長は“準備法案”に基づいて声明を発表し、いくつかの新冠肺炎に対する反措置に関連する活動に責任免除を提供するためのその後の修正案を発表した。我々が米国政府に売却した製品は“予科法案”の条項によって保護されると信じているが,これは保証されていない。
小児科情報
2003年の“小児科研究公平法”によれば、すべての新しい活性成分、適応、剤形、投与レジメンまたは投与経路のマーケティング出願は、この要求が放棄され、延期され、または適用されない限り、小児科患者において製品が主張される適応の安全性および有効性の評価を含まなければならない。
児童最優秀医薬品法案によると、1つの製品は小児科独占特許を取得する資格がある可能性があり、これは既存の独占特許期間および特許期間を6ヶ月増加させるであろう。この排他性は小児科研究を自発的に完成させたうえで付与されている可能性があり,この研究はFDAが発表したこのような研究の書面請求に合致している。
承認後に要求する
新製品が承認された後、製造業者および承認された製品は、監視および記録保存活動、不良経験の報告、販売促進および広告要件の遵守、および業界支援の科学的および教育活動の制限を含むFDAによって継続的に規制される。医師はラベル外の用途のために合法的な製品を処方する可能性があるが、メーカーはこのような用途を販売したり普及させたりしてはならない。処方薬と生物宣伝材料は初回使用時にFDAに提出されなければならない。さらに、適応、ラベルまたは製造プロセスまたは施設の変化を含む医薬または生物学的に何らかの修正がある場合、出願人は、新しいBLAまたはNDAまたはBLAまたはNDAサプリメントの承認を得るために提出および提出を要求される可能性があり、これは、追加のデータまたは臨床前研究および臨床試験を開発する必要があるかもしれない。
FDAはまた、製品の利益がリスクよりも大きいことを確実にするために、リスク評価および緩和策(REMS)を要求することを含む、承認時に他の条件を設定することができる。REMSは、制限された配布方法、患者登録、および他のリスク最小化ツールのような薬物ガイドライン、医師のコミュニケーション計画、または安全な使用を保証する要素を含むことができる。新規発見または開発の安全性または有効性データは、新たな警告および禁忌症を増加させることを含む製品承認のラベルを変更する必要がある場合があり、REMSの実施または発売後の研究を行って、新たに発見されたセキュリティ問題を評価することを含む他のリスク管理措置を実施する必要がある可能性がある。規制基準を満たしていない場合、または最初のマーケティング後に問題が発生した場合、製品承認は撤回される可能性がある。
FDAの規定は,製品は特定の承認された施設で生産され,cGMP規定に適合しなければならないことを要求している。承認された医薬品または生物製品の生産および流通に参加するエンティティおよびその第三者メーカーは、cGMP法規を遵守しなければならず、その中で、他の以外にも、品質管理と品質保証、記録および文書の維持、およびcGMPから逸脱したいかなる義務を調査および是正することが要求される。これらのエンティティは、FDAおよびいくつかの州機関にその機関を登録し、cGMP要求および他の法律を遵守することを保証するために、定期的な抜き打ち検査を受けることが要求される。違反の発見は法執行行動を引き起こす可能性があり、承認後に製品問題が発見されると、リコールを含む製品、製造業者、または承認されたBLAまたはNDAの所有者を制限する可能性がある。
米国の特許期限回復と規制データの排他性
場合によっては、1984年の“薬品価格競争および特許期限回復法”(一般に“ハッジ·ワックスマン改正案”と呼ばれる)に基づいて、いくつかの米国特許は、限られた特許期間を延長する資格がある可能性がある。Hatch Waxman修正案は、製品開発及びFDA規制審査中に失われた特許期間の補償として、最長5年間の特許期間の回復を可能にする。しかし,特許期限の回復は特許の残存期間を延長することはできず,製品承認日から合計14年を超えることはできない。特許期間回復期間は、一般にINDの発効日とBLAまたはNDA提出日との間の時間の半分であり、BLAまたはNDA提出日とその出願の承認との間の時間を加える。このような延期を受ける資格があるのは、承認された製品に適用される特許のみであり、延期出願は、特許が満了する前に提出されなければならない。米国特許商標局はFDAと協議し,任意の特許期間の延長または回復の出願を審査·承認する。
FDAによって承認された医薬製品が以前に承認されなかった有効成分を含む場合、この製品は、通常、5年間の非特許規制データ排他性を得る権利がある。承認がNDA出願人が提出した承認に重要な新しい臨床研究に対するFDAの依存に基づいている場合、他の製品は3年間の規制データ排他性を得る権利がある可能性がある。NDA出願人が子供のための製品を研究する場合、FDAは小児科固有権を付与する可能性があり、その製品に関連する各既存の専有権(特許および規制)を180日間延長する
2009年の“生物製品価格競争および革新法”(BPCIA Act)は、FDA許可の参照生物製品と類似しているか、または交換可能であることが証明された生物製品のための短い承認経路を確立した。生物類似性要求は製品と参考製品の“高度に類似している”ことを示し、臨床不活性成分の面で微小な差があるにもかかわらず、しかも製品と参考製品は安全性、純度と効力の面で臨床的に意義のある差異がない。互換性は、生物学的製品と参照製品とが生物学的に類似していることを必要とし、任意の所与の患者において、参照製品と同じ臨床結果を生成することが期待でき、複数回投与された個人の場合、製品および参照製品は、参照生物製品の独占使用と比較して安全リスクまたは治療効果が低下するリスクを増加させることなく、以前の投与後に交互または交換することができる。参考生物製品は初めて許可を得たときから12年間の法規制データ独占権が付与された
FDAは、参照製品が最初に許可された日から4年後まで、参照生物製品に基づく生物学的類似または交換可能な製品の申請を受け入れないであろう
欧州経済圏(EEA)の薬物開発
欧州薬品管理局はEU 27の加盟国及びノルウェー、アイスランドとリヒテンシュタインから構成され、主管監督機関のマーケティング許可を得た後にのみ、ヨーロッパ薬品管理局で薬品を販売することができる。アメリカと類似して、EUの臨床前と臨床研究の各段階は重要な監督管理によって制御されている。“臨床試験条例”(第536/2014号)は2022年1月に施行され、EU全体の臨床試験評価と管理手続きを簡略化し、調整することを目的とし、EUで行われた各臨床試験の許可、実施、結果の情報の公開を要求している。
小児科調査計画
EUの許可を受けていない人用薬品の発売許可申請は、免除が適用されない限り、“小児科用薬品条例”(“小児科条例”と呼ばれる)に符合する小児科研究計画(PIP)を含まなければならない。小児科委員会(PDCO)はヨーロッパ薬品管理局(EMA)が設立した科学委員会であり、それに提出された医療製品の任意のPIP、免除と延期の内容を評価し、そしてこれについて意見を提出する。
審査と承認の流れ
ヨーロッパ経済地域では、適用される規制機関からマーケティング許可を得るために、会社は集中的または分散したプログラムを介してマーケティング許可申請を提出することができる。集中手順は、特定のバイオテクノロジープロセスによって製造された薬物、高度治療薬物製品(ATMP)、孤児医薬製品、または新しい活性物質を含み、特定の疾患(HIV/エイズ、癌、神経変性疾患、糖尿病、自己免疫および他の免疫機能障害およびウイルス性疾患)の治療を目的とした薬剤に対して強制的であり、高度に革新的または新しい活性物質を含む薬剤には任意であり、ヨーロッパ経済地域全体で有効な単一マーケティング許可を付与することが規定されている。中央手続きに加えて、欧州経済地域では、各国に個別に出願を提出し、各国が承認決定を行う必要がある国家手続きを介して販売許可を得ることができ、申請者がいくつかの国に同じ出願を提出して同時に承認を得る分散手続と、出願人が1つの国に申請を提出して審査する相互承認手続と、他の国が最初の決定を受け入れるか拒否することができる相互承認手続とがある。
医薬品の安全性と有効性に関する全面的な臨床データが提供されていないが、以下のすべての要求を満たす場合、EUで条件付き上場許可を承認することができる:(I)薬物のリスク-利益バランスが正である;(Ii)申請者は承認後に全面的な臨床データを提供できる可能性が高い;(Iii)薬物は満たされていない医療需要を満たしている;および(Iv)薬物の即時発売による公共健康に対するメリットは依然として追加データを必要とするリスクを超えている。条件付きマーケティング許可の有効期間は1年で、継続可能です。マーケティング許可保持者は、収益-リスクバランスが積極的であることを確認するために、進行中の試験の完了または新しい試験の実施を含む可能性がある一定の時間範囲内で特定の義務を履行することを要求されるであろう。これらの義務が履行されると、収益-リスクバランスが依然として正である限り、条件付きマーケティング許可は、標準的なマーケティング許可に変換することができる。
ヨーロッパ規制データ保護
EUでは、上場を許可された新革新製品(すなわち参考製品)は、8年間のデータ独占期間と、マーケティング許可を付与した後の追加2年間の市場保護を含む規制データ保護を受ける資格がある。データ排他性防止模倣薬または生物類似の申請者は、模倣薬または生物類似のマーケティング許可を申請する際に、イノベーターのデータを参照する追加の2年間の市場保護期間内に、模倣薬または生物類似製品の発売許可申請を提出することができ、革新者のデータを参考にすることができるが、市場保護期間が満了する前に模倣薬または生物類似製品を販売することはできない一つの製品がEUの監督管理機関によって革新的な医薬製品とみなされることは保証できず、しかも製品は監督管理データの保護を受ける資格がない可能性がある。
ヨーロッパ孤児指定と排他性
EUは、製品の開発を促進するための孤児薬物指定を提供し、これらの製品は、その開発に必要な投資が合理的であり、すべての場合に満足できる診断、予防または治療方法がないことを証明するために、EUコミュニティの万分の5を超えない生命または慢性衰弱に影響を及ぼす疾患を診断、予防または治療することを目的としている
許可された(または、影響を受けた人に大きな利益をもたらす方法が存在する場合)。承認を得て孤児薬物指定を獲得し保持する薬品は10年間の市場排他性を有する権利があり,同一治療適応における類似薬品の申請や販売許可を影響から保護することになる。5年目終了時に指定孤児薬の基準を満たしていないことが確定すれば,この期間を6年に短縮することができる。市場独占期間内に、(1)第2の出願人は、その製品がライセンス製品と類似しているが、より安全で、より効果的で、または臨床的により良いことを証明することができる場合にのみ、同じ治療適応を有する類似医薬品に上場許可を付与することができる;(2)ライセンス製品のマーケティング許可保持者は、2回目の孤児医薬製品の申請に同意することができる、または(3)ライセンス製品のマーケティング許可保持者は、十分な孤児医薬製品を供給することができない
上記の連合規則は一般的にヨーロッパ経済地域に適用される。
ヨーロッパデータ保護法規
EU一般データ保護条例(GDPR)はEU個人データの収集と使用を管理している。GDPRは,個人データに関する個人の同意,個人に提供する情報,個人データの安全性とセキュリティ,データ漏洩通知,個人データを処理する際の第三者プロセッサの使用などに厳しい要求をしている.GDPRはまた、個人データをEUに移すことに対して厳しいルールを実施し、法執行機関を提供し、最高2000万ユーロの罰金や侵害者の世界年収の4%を含む、規定を守らない行為に巨額の処罰を加えている。GDPRはまた、国家データ保護当局に訴え、司法救済を求め、GDPR違反による損害について賠償を受ける個人訴権について、データ主体と消費者協会に与えられている。規定を守らないことは、データ処理活動を停止するコマンドの強制実行を招く可能性もある。
英国はGDPRを英国法(UK GDPR)に組み入れている。英国GDPRと2018年英国データ保護法は、EUのデータ保護制度とは独立した英国のデータ保護制度を規定しているが、EUのデータ保護制度と一致している。英国はEU GDPR下の第3の国とされているにもかかわらず、EU委員会は英国がEU GDPRで十分な保護を提供していることを認める決定を発表しているため、EU由来の個人データの英国への移行は依然として制限されていない。GDPRと同様に,イギリスGDPRは個人データのイギリス以外への移行を制限しており,これらの国はイギリスが十分な保護を提供しているとはみなされていない。イギリス政府は、イギリスからヨーロッパ経済圏への個人データ転送が依然として自由に流動していることを確認した。イギリスのGDPR違反は、金額が高い者を基準に、1750万GBまたは世界収入4%の罰金を招く可能性があります。
EUにおける医薬品のマーケティング
以下に説明する米国の“反バックル法令”禁止と同様に、処方、推奨、裏書き、購入、供給、注文、または医療製品の使用を誘導または奨励するために医師に福祉または利点を提供することはEUで禁止されている。連合関連法の違反は巨額の罰金と監禁につながるかもしれない。限られた状況で、医師に支払うことができ、いくつかのEU加盟国では、このような支払いは公開されなければならない。さらに、医師とのサービス提供の合意は、通常、医師の雇用主、その主管する専門組織、および/またはEU加盟国の規制当局に事前に通知し、承認しなければならない。これらの要件は、EU加盟国に適用される国家法律、業界規則、または専門行為規則に規定されている。このような要求を守らないことは、名声のリスク、公開非難、行政処罰、罰金、または監禁につながる可能性がある。
世界の他の地域の規制
米国やEU以外では,臨床試験,製品許可,定価,精算を管理する要求は国によって異なる。もし私たちがこれらの要求を守らなければ、私たちは罰金、規制承認の一時停止または撤回、製品のリコール、製品の差し押さえ、運営制限、または刑事起訴などの処罰を受けるかもしれない。
保証と精算を請け負う
自分の病状に医療サービスを提供する患者は通常,第三者支払者によってその治療に関連する費用の全部または一部を精算する。カバー範囲と政府医療計画(例えば連邦医療保険や医療補助)および商業支払者からの十分な補償は、新製品の受容度に重要である。政府当局や他の第三者支払人、例えば個人健康保険会社や健康維持組織は、どのような薬物や治療および精算金額をカバーするかを決定する。
米国では、第三者支払者の間に統一された製品保証や精算政策はない。一人としてしたがって、政府や他の第三者支払人から製品の保証と精算承認を得ることは時間がかかり、高価な過程であり、これは各支払人に科学的、臨床的、費用効果的なデータを提供して、個々の支払人が私たちの製品を使用することを支援する必要があるかもしれないが、保証され、十分な精算を得ることは保証されないかもしれない。米国では,新薬精算に関する主な決定は通常,医療保険と医療補助サービスセンター(CMS)によって行われる。CMSは新薬がどの程度連邦医療保険の下でカバーと精算されるかを決定し、個人支払者はよくCMSに大きく従う。特定の製品の保険を受けても,それによる精算支払率は利益を実現したり維持したりするのに不十分である可能性があり,あるいは患者が受け入れられないと考える高い共済額が必要となる可能性がある。さらに、承認されると、第三者支払者は、候補製品を使用した後に必要な長期的な後続評価をカバーすることができず、十分な補償を提供しない可能性がある。患者が承認されると、保険を提供し、彼らの費用の大部分を支払うのに十分な費用を精算しなければ、私たちの候補製品を使用することはあまり不可能だ。新たに承認された製品の保険カバーと精算に関する不確実性が大きい。第三者決済者が私たちの候補製品の保証範囲と精算についてどのように決定するか予測するのは難しいです。
医薬品の正味価格は、政府医療計画または個人支払者が要求する強制的な割引またはリベート、および将来、米国価格よりも低い価格で販売される可能性のある国から医薬品を輸入することを制限する法律の緩和によって低下する可能性がある。また、多くの製薬業者は平均販売価格と最適価格のようないくつかの価格報告指標を計算し、政府に報告しなければならない。場合によっては、これらの指標が正確かつタイムリーに提出されていない場合には、処罰が適用される可能性がある。
将来的にとりうる医療改革措置は,より厳しいカバー基準を招き,承認された任意の製品の価格に追加の下り圧力を与える可能性が予想される。また、承認後の要求を拡大し、薬品の販売や販売促進活動を制限するための立法·規制提案を行った。
また、一部の外国の国では、薬品の提案価格は必ず承認されなければならず、合法的に発売されることができる。各国の薬品定価に対する要求は大きく異なる。例えば、欧州連合は、その加盟国に様々な選択を提供し、その国の健康保険制度が補償を提供する医療製品の範囲を制限し、人が使用する医療製品の価格を制御する。精算または定価の承認を得るために、その中のいくつかの国は臨床試験の完成を要求する可能性があり、特定の候補製品のコスト効果を現在利用可能な治療法と比較する。加盟国は医薬製品の具体的な価格を承認することができ、医薬製品を市場に投入する会社の収益力に対して直接或いは間接的に制御制度をとることもできる。薬品に対して価格制御や精算制限を実行することを保証できない国は、私たちの任意の候補製品に対して有利な精算と定価手配を許可する。歴史的に見ると、EUで発売された製品はアメリカの価格構造に従わず、通常価格ははるかに低くなることが多い。
私どもの製品の定価や精算に関連するいくつかのリスクに関する詳細は、ご参照ください“リスク要因−医薬品の販売は、第三者支払人の精算の利用可能性および程度に依存し、このような精算政策またはルールの変化は、私たちに悪影響を及ぼす可能性がある。”
他の医療保険法
医療保健提供者、医師、第三者支払人は、米国のMedicareとMedicaidのような政府支払者を含み、任意の市場製品の処方を推薦し、発行する中で主要な役割を果たす。このような当事者たちとのどんな計画も特定の詐欺と乱用と他の医療法律と規制に関するものだ。アメリカではこれらの法律には
•逆バックル法は、任意の報酬を意図的または意図的または意図的に請求し、受け入れ、提供または支払い、直接または間接的に現金または実物の形態で、特定の薬物または任意の他の商品またはサービスの購入、推薦、注文または処方を含む回診を誘導または奨励することを目的としており、これらの報酬は、MedicareまたはMedicaidのような連邦医療計画に従って支払われる可能性があり、これは違法である
•連邦虚偽請求法案は、民事告発者または準訴訟を含む個人またはエンティティ(製造業者を含む)に民事罰を適用し、他に加えて、虚偽または詐欺的な連邦医療保健計画支払い請求の提出または提出を故意に引き起こすか、または虚偽請求の支払いに対して虚偽陳述または記録材料を作成するか、または連邦政府への支払いの義務を回避、減少または隠蔽することを含む。
•1996年の“健康保険携行性および責任法案”(HIPAA)は、他にも、個人支払者を含む任意の医療福祉計画を詐欺するため、または重大な事実の偽造、隠蔽または隠蔽、または医療福祉、プロジェクトまたはサービスの提供または支払いに関連する任意の重大な虚偽陳述を行うために、または刑事および民事責任を規定するために、計画を意図的かつ意図的に実行または実行しようと試みている
•2009年に“健康情報技術促進経済·臨床健康法”(HITECH)及びそのそれぞれの実施条例改正を経たHIPAAは、他にも、カバーする実体及びその業務パートナーに対して、個人が健康情報を識別できるプライバシーと安全に関する要求を提出した
•“医師支払い陽光法案”は、いくつかの政府計画に従って製品を精算する製薬業者が、医師、教育病院、およびいくつかの他の免許を有する医療従事者に提供されるいくつかの支払いおよび他の価値移転を毎年連邦政府に開示することを要求する“患者保護および平価医療法案”(ACA)の一部である(公衆に再開示するため)
•連邦政府価格報告法では、複雑な価格指標を正確かつタイムリーな方法で計算し、政府計画に報告することを要求している。
•連邦消費者保護·不正競争法は、市場活動や消費者を損なう可能性のある活動を広く規制している。
•州反リベートや虚偽請求法律のような州詐欺や乱用のような法律は、支払者が誰であろうと適用される可能性がより広い可能性がある
また、ある州や外国の法律も健康情報のプライバシーや安全を管理している。このようなデータプライバシーやセキュリティ法律は大きく異なる可能性があり,HIPAAに先制されず,コンプライアンス作業を複雑化することが多い.例えば、カリフォルニア消費者保護法(CCPA)は、カバーする企業のために包括的なプライバシーフレームワークを構築し、方法は、個人情報の定義を拡大し、カリフォルニア州の消費者のための新しいデータプライバシー権を確立し、未成年者から消費者データを収集するための特別な規則を実施し、CCPAに違反する行為および合理的なセキュリティ手続きおよび慣行を実施できなかった企業のために、データ漏洩を防止するための新しい、深刻な法定損害賠償フレームワークを作成する。また、2023年1月1日に施行された“カリフォルニアプライバシー権法案”(CPRA)は、個人情報の処理と保存の追加義務を規定している。CPRAは、顧客のいくつかの敏感な個人情報に対する権利を拡大することを含むCCPAを大幅に修正した。HIPAAが管轄する臨床試験データや情報は現在CCPAやCPRAの現在バージョンに制約されていないが,CPRAの範囲が広いため,他の個人情報も適用可能である。他の多くの州もまた似たような法律を採択したり提案したりした。
これらの法律の範囲も執行も不確定であり,現在の医療改革環境の急速な変化の影響を受けている
現在と未来の医療改革立法
米国や他の管轄地域では、医療システムに関する立法や規制改革、提案された改革は、我々の研究薬の上場承認を阻止または延期し、承認後の活動を制限または規制し、任意の承認された製品を収益的に販売する能力に影響を与える可能性がある。例えば、ACAに含まれる条項は、生物製品を低コストの生体模倣薬の潜在的な競争を受けさせ、医療補助計画で精算された薬品のリベートを増加させること、医療補助リベートを医療補助管理保健計画に拡大すること、ある連邦医療保険Dの一部の受益者に強制的な割引を提供すること、および製薬会社の連邦ヘルスケア計画における販売シェアに応じて徴収する年会費を増加させることによって、薬品の収益性を低下させることが可能である。現行法、および将来取られる可能性のある他の医療改革措置は、より厳しいカバー基準をもたらす可能性があり、任意の承認された製品の価格に対して追加の下り圧力を構成する可能性がある。
アメリカでは、ACAが覆されたり、さらに修正されたりするかどうかは不明だ。ACAのさらなる変化が私たちの業務にどのような影響を与えるか予測できない。また、ACAが公布されて以来、米国は2011年の連邦赤字削減条項を含む2011年の“予算制御法案”を含む他の連邦医療改革措置を提出し、可決した。改正予算統制法は、医療保険提供者への支払いを2%減少させ、2013年4月から追加国会行動をとらない限り2031年まで有効になる。2021年,総裁·バイデンは“2021年米国救援計画法案”に署名し,2024年から単一源と革新多源薬に対する法定医療補助薬品還付上限を廃止し,この上限は以前は薬品メーカー平均価格の100%に設定していた。2010年の法定現金給付法案、2021年の米国救援計画法案、および後続立法による予算赤字推定が増加したため、これ以上の立法がない場合、2025年から提供者に支払われる医療保険金額はさらに減少する。これらの法律および法規は、医療保険や他の医療資金のさらなる減少を招き、規制承認を得る可能性のある任意の候補製品の価格に影響を与えるか、またはそのような候補製品を開発または使用する頻度に影響を与える可能性がある
2022年8月、“2022年インフレ削減法案”(IRA)が署名され法律となった。IRAはいくつかの著者らの業務に異なる程度の影響を与える条項を含み、Medicare Part Dの受益者のために2,000ドルの自己負担上限を作成し、Medicare Part D中のすべての薬品に新しいメーカーの財務責任を適用し、アメリカ政府がある高コストの薬物と生物製品の定価について交渉を行うことを許可し、模倣薬或いは生物類似競争が存在せず、会社がインフレより速い薬品価格を増加させるためにMedicareにリベートを支払うことを要求し、そして薬局福祉マネージャーを受益者にリベートすることを要求するリベート規則を延期する。Ireland共和軍が私たちの業務と医療産業全体に及ぼす影響はまだ明確ではない
また,政府はメーカーが販売する製品に価格を設定する方式をより厳しく審査し,国会で数回の調査を行い,製品定価の透明性の向上,定価とメーカー患者計画との関係の審査,政府計画の製品精算方法の改革を目指した法案を提出した。また、連邦政府、州立法機関、外国政府は、価格制御と価格透明性を含むコスト制御計画の実施に大きな興味を示している
清算を制限し,ブランド処方薬の代わりに後発薬を投与し,政府が支払う医療費の増加を制限することが求められている。例えば、連邦政府は立法を通じて、製薬業者にある実体と政府支払人にリベートと割引を提供して、連邦医療計画に参加するように要求している
環境.環境
“職業安全·健康法”“資源保護·回収法”“有毒物質制御法”を含む環境保全と有害物質に関する州や連邦法を遵守しなければならない。これらの法律や他の法律は,様々な生物,化学,放射性物質の使用,処理,処分を管理しており,これらの物質は作業,作業から発生する廃棄物に用いられている。もし私たちの運営が環境汚染を招き、私たちの規制義務に違反したり、個人を傷つけたりすれば、私たちは損害賠償と政府罰金の責任を負うかもしれない。似たような義務が適用された外国も同等の法律が採択された。
企業情報
私たちは2016年7月22日にデラウェア州の法律登録に基づいて設立された。私たちはModerna有限責任会社の権益相続人で、この有限責任会社は2013年にデラウェア州法律に基づいて設立された。ModernaはModerna治療会社の利益継承者であり、Modernaはデラウェア州の会社であり、2009年に旗艦パイオニア会社の名義でNewco LS 18,Inc.として設立された。2018年8月、私たちはModernaからModernaに変更しました。私たちの主要会社のオフィスはマサチューセッツ州ケンブリッジ市科学技術広場02139番地にあります。私たちの電話番号は(617)714-6500です。
投資サイトwww.civernatx.com、投資家関係欄www.Investors.verizentx.com、企業ブログwww.ricaNatx.com/weikein.com-ブログ、私たちの声明と観点ページ:https://investors.bynetx.com/Statements--Perspections/default.aspx;および私たちのソーシャルメディアチャネル:facebook,www.facebook.com/cn;x,www.twitter.com/Moderna_tx;LinkedIn,www.linkedin.com/COANMPY/cn;私たちの財務情報を含む多くの情報が含まれている。情報が常に更新され、新しい情報も共有されるので、投資家がこれらのサイトやソーシャルメディアチャネルにアクセスすることを奨励します。当サイトおよびソーシャルメディアチャネルを介して開示された情報は、本10-Kフォーム年次報告書または米国証券取引委員会(米国証券取引委員会)に提出された他のいかなる文書にも引用されない。
我々は、取引法第13(A)または15(D)条に基づいて、米国証券取引委員会に提出または米国証券取引委員会に提出されたいくつかの報告書および当該報告書の改正に基づいて、これらの材料を米国証券取引委員会に電子的にアーカイブまたは米国証券取引委員会に提供した後、合理的で実行可能な範囲内でできるだけ早く私たちのウェブサイト上で、または私たちのウェブサイトを通じて無料で提供する。これらの報告には,我々のForm 10−K年次報告,Form 10−Q四半期報告,Form 8−K現在の報告,およびこれらの報告の改訂が含まれている。
米国証券取引委員会には、米国証券取引委員会に電子的に提出された我々および他の発行者に関する報告書、依頼書および情報声明、その他の情報が含まれたインターネットサイトも設けられている。
第1 A項。リスク要因
以下のリスクと不確実性、および本10-K表の年次報告書の他のすべての情報を慎重に考慮しなければなりません。私たちが説明したどんなリスク要因も下にある私たちの業務、財務状況、あるいは経営結果、私たちの普通株の市場価格に悪影響を及ぼすかもしれません。
ビジネス化と私たちの製品に関するリスクは
新冠肺炎ワクチン市場の動態変化は私たちの財務業績に影響する可能性があり、これは2024年の製品収入が私たちが近年経験したレベルより低いことを招く可能性がある。
2023年までに、私たちが唯一承認した製品と唯一の製品販売源は私たちの新冠肺炎ワクチンです。全世界市場は新冠肺炎ワクチン販売の地方性商業市場へ移行しており、大流行期間とは異なる市場と生産動態を招き、顧客基礎が更に分散し、注文の予測可能性が更に悪く、需要の季節性が更に強く、流通コストの増加、及び販売商品コストの上昇を含む。また,市場に受け入れられることや第一選択の製品紹介(例えば,単剤紹介)に関する仮定は市場によって異なる可能性があり,正しくないことが証明される可能性がある。また、アメリカの個人ワクチン市場のいくつかのやり方は、割引、リベートと返品を含み、私たちが実現した収入は価格より明らかに低いかもしれない。私たちはまたアメリカ以外の似たような市場接近法の悪影響を受けるかもしれない。
新冠肺炎ワクチン需要の低下により,2023年に交付された新冠肺炎ワクチンの売上高は67億ドルであるのに対し,2022年と2021年の売上高はそれぞれ184億ドルと177億ドルであることが確認された。2024年の新冠肺炎ワクチンの販売台数は2023年を下回る可能性があると予想している。著者らは新冠肺炎ワクチンの市場は一連の要素に基づいて発展することを予想し、医療需要、ウイルス変化、公衆衛生当局の提案及び消費者がワクチンを接種する動機を含む。2023年第3四半期、流行している新冠肺炎ワクチン市場への移行に伴い、製造インフラを大幅に調整し、将来的には原材料サプライヤーや契約製造機関(CMO)との約束から撤退することで追加コストが生じる可能性があります。需要が低下したため、私たちが調達約束を脱退したり修正したりすることを求めるにつれて、私たちは将来的に原材料サプライヤーに関連するコスト増加を経験する可能性があります。また、長い時間の調達が必要な原材料については、将来的にキャンセルできない、あるいは必要に応じて支払うことができ、約束の開放を増加させる可能性があります。変化する需要動態を効率的に管理できなければ、私たちの業務、財務状況、運営結果、見通しが影響を受ける可能性があります。
しかも、私たちは私たちの製品に対する需要が私たちの予測と一致することを見ないかもしれない。これは商業売上高が予想を下回ったり、既存の契約の延期、再交渉、またはキャンセルを要求したりする可能性があるそれは.さらに、私たちは予想よりも多くの資源をビジネス努力のために投入する必要があり、私たちはこの投資の見返りを達成できないかもしれないことを発見するかもしれない
私たちは私たちの予測や未来の契約約束と一致した製品生産や輸送の困難に直面するかもしれない。
私たちは生産や輸送の面で困難に直面するかもしれない私たちの製品は新しい肺炎ワクチンや他の未来の製品も含めて私たちの現在の予想に適合しているか、または私たちの供給契約または将来の販売契約に規定されている条項に適合しています。私たちが製品を商業化する能力は私たちの製造能力にかかっていて、私たち自身の工場でも私たちのパートナーの工場でも、特に充填剤の能力にかかっています。また、我々の新冠肺炎ワクチンを新しい変種に適応させるには、原材料の調達と生産を含む我々のパートナーと大量の調整を行う必要がある。私たちのパートナーが遭遇したどんな生産能力や生産問題や遅延は、私たちが供給協定によって規定された義務を履行できない可能性がある。
私たちの販売、流通、マーケティング経験は限られており、第三者と合意することで、このような能力を効率的に確立したり、私たちの能力を補完したりすることができないかもしれません。
私たちは商業組織としての経験が限られていて、私たちが流行の新冠肺炎ワクチン市場に転換し、他の薬物の商業発売に準備する時、私たちはリスクと不確定性に直面しています私たちは期待していますRSVワクチンは2024年に発売される。このような限られたビジネス経験のため、私たちの製品の将来の収益率を正確に予測できないかもしれません。これは私たちの会計推定に悪影響を及ぼすかもしれません。また、彼らのマーケティングや流通能力を利用するために、他人との合意を求めることができるかもしれませんが、もしあれば、有利な条項で合意できないかもしれません。もし私たちが他人に依存して私たちの製品を商業化すれば、私たちの収入は私たち自身がこれらの製品を商業化するよりも低いかもしれない。しかも、私たちはこのような第三者の販売活動を少ないか、根本的にコントロールできないかもしれない。もし私たちのパートナーが十分な資源を投入して私たちの製品を商業化し、必要なマーケティング能力を独立して開発することができなければ、私たちは私たちの業務を維持するのに十分な製品収入を生み出すことができないかもしれない。
医薬市場の競争は激しく、私たちは現有の製品、新しい治療方法と新技術の市場で有効に競争することができないかもしれない。
医薬市場の競争は激しく、絶えず発展している。多くの会社、学術機関、政府機関、そして公共および個人研究組織は、私たちの目標または予想される目標のための同じ疾患の製品を開発している
•薬物発見、開発、テスト、承認、製造、商業化の各段階で、私たちよりも多くの資源と経験があります
•承認されたか、または後期開発段階にある複数の製品;
•私たちの目標市場では調達業者、政府、リーディングカンパニー、研究機関と合意した。
我々は新冠肺炎ワクチンの面で激しい競争に直面しており,既存あるいは将来のワクチンや治療法と有利な競争を続けない可能性がある。他のワクチンや治療法はより安全でより安全であることが証明されるかもしれません 私たちのワクチンよりも効果的で、便利で、副作用が少なく、輸送や配布が容易で、あるいはより低いコストで開発することができる。たとえ私たちの製品が競争相手よりも優れた製品を示していても、消費者や大衆はこのメリットを認識できないかもしれないし、既存の競争相手製品の購入約束は彼らが私たちから購入することを阻止するかもしれない。これらの要因、またはこれらの要因に対する見方は、競争相手のワクチンまたは治療のより成功的な商業化をもたらす可能性がある。また,大手やより成熟した製薬会社からの競争圧力の増加に伴い,メッセンジャーリボ核酸薬物分野が急速に増加している。他人の実際または知覚の成功または失敗は、私たちが製品を商業化する能力に悪影響を及ぼすかもしれない
私たちはまた、医学界から承認され、受け入れられた製品からの競争に直面し、これらの製品はすでに医学界によって承認され、受け入れられ、私たちが狙っているいくつかの疾患の治療に使用される。例えば季節性インフルエンザワクチンを開発しています市場が発達しています私たちは製品を開発したり、市場シェアを得ることに成功しないかもしれない。我々のRSVワクチンは,2024年から発売される予定であり,既存のRSVワクチンからの競争にも直面する。私たちが参入した市場では、競争相手が競合製品を発売した後、市場シェアを得ることは難しいかもしれません。また、既存市場で市場シェアを獲得したり、新市場で競争したりするために、より優遇された条件を提供する必要があるかもしれませんが、これは私たちの収益性に悪影響を及ぼす可能性があります。
もし私たちが開発に成功し、他の候補製品の承認を得たら、私たちは多くの要素に基づいて競争相手が開発している製品と競争することができます。これらの要素は私たちの製品の相対的な安全性と有効性、私たちの製品の管理の容易さ、患者が比較的新しい投与経路を受け入れる程度、規制承認の時間と範囲、製造、マーケティングと販売能力の可用性とコスト、価格、精算範囲、特許地位を含むかもしれません。私たちの競争相手は彼らの製品を商業化することに成功するかもしれないが、これは私たちの業務に悪影響を及ぼすだろう。競争製品は私たちが開発したどんな製品も時代遅れになったり、競争力がないかもしれません。承認されれば、製品開発と商業化の費用を回収することができます。
私たちは未来のSARS-CoV-2ウイルス変種を防ぐために、私たちの新しい冠肺炎ワクチンの更新を成功あるいは遅延させることができないかもしれないが、私たちの新冠肺炎ワクチンの更新バージョンはこのような変種を予防できないかもしれない。
SARS−CoV−2ウイルスの継続進化に伴い,新たなウイルス株は従来株よりも伝播性が証明されたり,より深刻な新冠肺炎を引き起こす可能性がある。著者らの現在の新冠肺炎ワクチンはこれらの新しい変種を予防する上で無効である可能性があり、あるいは期待した効果に及ばないかもしれない。また,ワクチン開発に関する決定は,米国食品医薬品局や外国規制機関の指導を受けることになり,我々の新冠肺炎ワクチンの開発時期に影響を与える可能性がある
WEは変種特異的ワクチンの生産に遅延がある可能性がある。また、異なる規制機関は、以下の問題について異なる指導意見を発表することができるワクチンワクチンを接種しなければならない構成や人々。もし私たちが未来の変種に対する変種特異的ワクチンを開発する努力が成功しなければ、私たちはこのようなワクチンを開発する速度が競争相手よりも遅い、あるいは私たちのワクチンが競争相手のワクチンよりも有効であることが証明されて、私たちは名声損害、市場シェア損失、不利な財務結果を受ける可能性がある。また、私たちは変異を防ぐためにワクチンを調整したり、臨床試験を行ったりするのに大量の資源がかかるかもしれませんが、調整されたワクチンには市場があります5月.開発できなかったり、需要が私たちの予測や費用支出と一致しないかもしれない。
私たちの製品の商業成功は医者、患者、第三者支払人と医学界の他の人の市場に対する受け入れの程度に依存します。
私たちの製品の商業成功は医学界、患者と第三者或いは政府支払人がメッセンジャーリボ核酸薬物、特に私たちの製品を受け入れるかどうかにある程度依存し、それらは医療用途、費用効果と安全性を持っているからである。私たちの製品に対する市場の受け入れ度は多くの要素に依存するだろう
•代替療法と比較した潜在的な治療効果と利点
•競争力のある価格で製品を提供することができる
•競争相手と比較して、私たちの製品が提供する保護期間はどのくらいですか
•メッセンジャーリボ核酸製品の一般的な受容度、ならびに医学界または公衆が選好する可能性のある競争的非メッセンジャーリボ核酸薬物の獲得可能性;
•任意の制限、制限(他の薬剤との使用を含む)、または製品承認ラベルに含まれる警告を含む任意の副作用の流行および重症度;
•チェックポイント阻害剤または私たちの製品と組み合わせて使用される他の製品または療法に起因する任意の副作用の流行率および重症度を検査する;
•相手が便利で管理しやすい
•目標患者群が新たな治療法を試みる意欲と,医師が新たな療法を開始する意欲
•市場マーケティングと流通支援の実力と競争製品の市場進出のタイミング
•私たちのことは関係ない製品デモは顧客のニーズに応える(例えば、単剤デモまたは混合ワクチン);
•私たちの製品や競合製品や治療法の宣伝;
•十分な第三者保険カバー範囲または補償、ならびに第三者カバーまたは十分な補償なしに患者が費用を自己負担する意欲。
1種の潜在的な製品が臨床試験において良好な治療効果と安全性を示しても、それが発売される前に、市場受容度は未知である。私たちの教育医療界と第三者支払人が私たちの製品のメリットを理解するための努力は大量の資源を必要とするかもしれません。特に私たちの計画の複雑さによって、決して成功しないかもしれません。
医薬製品の販売は第三者支払人の精算の可用性と程度に依存し、このような精算政策や規則の変化は私たちに不利な影響を与える可能性がある。
一般的に、医薬製品の販売は第三者支払者の適切なカバー範囲、定価、補償に大きく依存する。新製品が承認された場合、政府および個人補償の利用可能性および程度、およびその製品の定価は不確定である可能性がある例えば,我々が開発した任意の組合せ気道ワクチンが,承認されれば連邦医療保険B部分のカバー範囲に組み込む資格があるかどうかは不明である。また、私たちが開発したどの製品の定価や精算も、多くの要因の悪影響を受ける可能性があります
•連邦、州、または外国政府法規または個人第三者支払人補償政策の変更と実施
•雇用主は個人健康保険計画に圧力をかけ、コストを削減することを要求する
•支払者が価格割引またはリベートを求める能動性を強化し、向上させ、私たちの製品を彼らの処方に置き、場合によっては、特定の薬物または知覚価値に基づいて決定された価格設定に制限を加える。
私たちが自分で開発したどんな製品の価格設定の能力も国によって異なるだろう。特定の国で十分な価格を獲得して維持することができず、我が国製品の同国での収入を制限し、既存および潜在的な新市場で許容可能な価格を得る能力に悪影響を及ぼす可能性があり、市場成長を制限する可能性がある。これは、第三者の国境を越えた貿易のための機会を創出したり、製品を販売するかどうかの決定に影響を与えたりして、私たちの地理的拡張計画や収入に悪影響を及ぼす可能性がある。
多くの支払人は引き続き福祉計画の変化を採用し、より大きな割合の処方コストを患者に移し、より限られた福祉計画設計、より高い患者の自己負担或いは共同保険義務、及び患者への制限を含む’商業製造業者の自己支払援助プログラムを使用する。健康保険業の重大な統合これはいくつかの大手保険会社と薬局福祉マネージャーが薬品メーカーとの定価と使用交渉に更に大きな圧力をかけ、メーカーが必要な割引とリベートを大幅に増加させ、患者の接触と使用を制限した。保険会社、薬局福祉マネージャーと他の支払人とのさらなる統合は、これらの実体の私たちと他の製薬業者との交渉チップを増加させるだろう。上述した追加の割引、リベート、保証範囲、または計画変更、制限、または排除は、特に私たちの治療製品または特定の患者のための個人化された製品に、影響を受ける製品の販売に重大な悪影響を及ぼす可能性がある。第三者支払人の保険範囲と精算は多くの要素に依存する可能性があり、第三者支払人が製品を使用することを確定することはその健康計画下の保険福祉、安全、有効と医療必要であり、特定の患者に適しており、費用効果が高く、試験的でも研究的でもない。
さらに、私たちのいくつかの候補製品のターゲット患者集団は、小さい可能性がある(例えば、まれな遺伝病のため)、または個人化カスタマイズ(例えば、私たちのINTのため)が必要である。私たちの薬品の価格設定と精算は、承認されれば、商業インフラを支援するのに十分でなければならない。もし私たちが十分な清算水準を得ることができなければ、私たちは私たちの製品をマーケティングして販売することに成功できないかもしれない。我々の製品に関するサービス(例えば,患者の管理)の精算方式やレベルも重要である。このようなサービスの精算不足は、医師が私たちの製品を発行したり推薦したりすることを阻止し、これらの製品をマーケティングしたり販売したりする能力に悪影響を与える可能性があります。
私たちの製品と候補製品の市場機会は私たちが思っているより小さいかもしれません。あるいは臨床試験参加者の決定に成功できないかもしれません。
著者らはある研究と製品開発活動の重点を深刻な稀な遺伝病の治療に重点を置いており、これらの疾病の患者群は確定しにくい或いは少ないまた,最初にわれわれの腫瘍内と腫瘍内免疫腫瘍候補製品を承認し,再発や難治性末期疾患患者への使用,すなわちFDAが最初に新療法治療をしばしば承認した群への承認を求める予定であるそれは.このような薬剤が十分に有益であることが証明されていれば,早期治療経路での承認が求められ,第一線の治療法となる可能性が予想される。我々の製品は保証されず,承認されれば早期の治療経路のために承認され,いずれかの承認前に追加の臨床試験を行わなければならない可能性がある。
著者らの潜在患者数の推定は著者らの信念に基づいており、科学文献、診療所調査、患者基礎或いは市場研究を含む様々な源から得られ、不正確であることが証明された可能性がある。また、新しい研究はこれらの疾病の推定発病率或いは流行率を変える可能性がある。試験参加者の数は予想よりも低い可能性があり、潜在的な臨床試験参加者または患者は、他の方法で私たちの候補製品または製品の治療を受けることができない可能性があり、または新しい臨床試験参加者または患者が識別または接触することがますます困難になる可能性がある。私たちの製品がかなりの市場シェアを得ていても、承認されれば、潜在的なターゲット層が少ないので、これらの薬は決して利益を上げないかもしれない。
私たちのパイプ、製品開発、規制審査に関するリスク
臨床前開発は長く、不確定であり、特にメッセンジャーリボ核酸薬物に対して、私たちの臨床前計画または候補製品は延期または終了される可能性がある。
われわれが行っているプロジェクトの大部分は臨床前開発段階であり,これらのプロジェクトは延期される可能性もあり,臨床に入らない可能性がある。候補製品の臨床試験を開始する前に、著者らはINDを支持する良好な実験室規範(GLP)毒理学テストを含む広範な臨床前研究を完成しなければならない。IND提出材料に含まれるためには、化学、製造、制御(CMC)活動の広範な作業を完了しなければならない。メッセンジャーリボ核酸薬のCMC活動には広範な製造過程と分析開発が必要であり,これは不確実で長い。私たちは私たちの候補製品ロットが十分な棚寿命を持つことを確実にするために、適切なバッファと保存条件を決定することが困難になった。もし私たちが新しいロットを生産しなければならないなら、私たちの臨床前研究は延期されるかもしれない。私たちの臨床前テストと研究が適時に完成したかどうか、FDAあるいは他の監督機関が結果を受け入れるかどうか、あるいは私たちの臨床前テスト、研究、およびCMC活動の結果が最終的に私たちの計画の更なる発展を支持するかどうかを確定することはできない。したがって、我々は、予期されるスケジュール上でINDまたは同様の臨床前計画申請を提出することができない可能性があり、そのような申請は、FDAまたは他の規制機関が臨床試験の開始を可能にすることを引き起こさない可能性がある。
臨床開発は長く、不確実であり、私たちの臨床計画は延期または終了される可能性があり、あるいは行われるコストは私たちが予想しているよりも高いかもしれない。
臨床テストは高価で、複雑で、時間が長く、その結果自体も確定していない。臨床試験を開始した候補製品の多くは製品として承認されなかった。私たちは候補製品の臨床試験を起動できないかもしれません。遅延に遭遇したり、臨床試験を中止しなければならないかもしれません。私たちと私たちの戦略的パートナーはまた、私たちまたは彼らが行った任意の臨床試験の間、または私たちまたは彼らが行った任意の臨床試験のために予見できない事件に遭遇する可能性があり、これらの事件は、私たちまたは彼らが私たちの候補製品の開発に成功し、規制機関の承認を得ることを延期または阻止するかもしれない。臨床試験の継続を阻害する可能性があることには
•監督機関、機関審査委員会(IRBs)または道徳委員会は、私たちまたは私たちの研究者が予想される試験場所で臨床試験を開始するか、または臨床試験を行うことを許可してはならない
•私たちは、予想された試験地点および予想された契約研究機関(CRO)と優遇条項の合意に遅れたり、合意に達しなかったりする可能性がある
•私たちの生産規模や場所の変化は臨床試験設計の大きな遅延や変化を招く可能性があります
•著者らの臨床前研究と早期臨床試験の結果は後の臨床試験の成功を予測できない可能性があり、臨床試験の中期結果も必ずしも最終結果を予測できるとは限らない
•私たちの研究のために臨床的なゴールを確立したり達成することはできないかもしれません
•もし私たちが臨床試験開始後に候補製品を変更すれば(私たちは過去にそうしたことがある)、私たちはより早い段階または遅い段階の臨床テストを繰り返すことを要求されるかもしれない
•任意の候補製品の臨床試験は、安全性または有効性を示すことができないかもしれない、または陰性または不確定な結果を生じる可能性があり、私たちは、決定または規制機関が、追加の非臨床研究または臨床試験を要求するか、または製品開発計画を放棄することを決定することができるかもしれない
•私たちの候補製品または私たちと同類の他の薬物は、LNPsまたはその成分の免疫原性、メッセンジャーリボ核酸または分解産物によって産生されるタンパク質の免疫原性、任意の深刻な有害事象または他の影響を引き起こす可能性があるなどの副作用を有する可能性がある
•我々のLNPsの服用はLNPs成分に関連する全身副作用を引き起こす可能性があり、免疫反応、輸液反応、補体反応、オプソニン反応、抗体反応或いはポリエチレングリコール脂質に対する反応を引き起こす可能性がある
•私たちの臨床試験では顕著な有害事象や他の副作用が観察されるかもしれません
•私たちの第三者請負業者は、法規の要求を適時に遵守することができないか、または私たちに対する契約義務を履行することができないか、または全く遵守していないか、または適用された臨床試験案から逸脱したり、適用された臨床試験から離脱する可能性があり、新たな臨床試験場所を増加させる必要があるかもしれない
•監督機関は、臨床試験の全部または一部の臨床一時停止を実施することができ、または私たちまたは私たちの調査者、IRBsまたは倫理委員会は、規制要件に適合していないこと、または参加者が受け入れられない利益-リスク比を含む、様々な理由で臨床研究または試験を一時停止または終了する可能性がある
•監督管理機関は遺伝子薬物研究に従事する他社の臨床試験に対してすべて或いは一部の臨床一時停止を実施する可能性がある
•候補製品の臨床前または非臨床試験および研究および臨床試験のコストは、予想よりも高い可能性がある
•私たちの候補製品または臨床試験を行うために必要な他の材料の供給または品質が不足または不十分である可能性がある
•新製品候補の臨床試験を行い、有効なインフォームドコンセント文書を開発し、IRBsや科学審査委員会(SRCs)と協力する際には、候補製品の安全性と有効性、FDAや他の規制機関を考慮する
•安全性または有効性の問題は、類似した疾患状態に対する他の療法の非臨床または臨床試験、または遺伝子療法のような我々と類似していると考えられる他の療法に起因する可能性がある
•将来の臨床試験では、私たちの候補製品は他の療法(例えば、我々のINT候補製品-4157との併用)と副作用が出現する可能性があります); そして
•特定の臨床試験を継続するのに十分な資金が足りない。
私たちが計画した後期臨床試験を開始する前に、候補製品の特定の用量の効力を測定し、予測するための検出方法を開発しなければならない。FDAまたは他の規制機関が受け入れられる分析方法の開発におけるいかなる遅延も、将来の臨床試験の開始を遅らせる可能性がある。
さらに、患者および研究者は、患者が研究製品候補、承認された薬物またはプラセボを受けているかどうかを知っている“オープンラベル”臨床試験を行っており、将来的に行われる可能性がある。オープンラベル臨床試験の結果は、プラセボ或いは能動対照の制御された環境における未来の臨床試験結果を予測できない可能性がある。また、FDAや他の規制機関は、たとえ彼らが私たちの臨床試験の設計を審査し、コメントしたとしても、承認要求を変更する可能性がある。私たちの候補製品の重大な臨床前或いは非臨床テストと研究或いは臨床試験の遅延は私たちの競争相手が私たちより先に製品を市場に出し、そして私たちの業務、財務状況と将来性を深刻に損害する可能性がある。
私たちのすべての計画とモデルは唯一無二の危険と、すべての計画とモデルに適用される危険を持っている。これらのリスクは、私たちが臨床開発で1つ以上のプロジェクトを推進し、規制部門の許可を得たり、私たちの製品を商業化する能力を弱めるかもしれないし、そうする過程で私たちが大きな遅延に遭遇する可能性がある。
私たちの候補製品のいくつかの機能は、メッセンジャーリボ核酸、化学修飾、表面化学、LNPsおよびそれらの成分に関連する機能を含み、私たちの計画およびパターンの一部または全部に適用されるリスクをもたらす可能性がある。私たちの候補製品の進展に伴い、私たちまたは他の人は私たちのいくつかのリスク分配決定が正しくないか、不十分であることを決定するかもしれません。私たちはプラットフォームレベルの技術ミスを犯し、個別のプログラムまたは私たちのmRNA科学は全体的に未知または過小評価の技術または生物的リスクが存在し、私たちの規模を支援するためのインフラをどのように開発するかの選択は、臨床試験のための候補製品を生産できない、あるいは他の方法で私たちの製造を損なう、あるいは私たちが資源を分配する方法で大量の投資を回収したり、迅速に資本を再配向することができません。
我々は,医療機器における早期プログラムを用いて,プログラムの製造や薬物属性を含む医療機器における技術的リスクを知る。たとえ我々の早期案が開発のどの段階でも成功していても,どの案も開発の後の段階で失敗する可能性があり,同じ案の中の他の案も開発のどの段階で失敗することも可能であるこの医療モデルにおける早期計画が成功した段階である。これはこのプロジェクト特有の技術的挑戦や生物学的リスクの結果かもしれない。私たちの製品ライン上の生物リスクの大部分は、1つ以上の承認されていない薬物の臨床検証の標的と経路、および私たちが選択した標的または経路が無効になる可能性のあるリスクは、私たちの現在と未来の大多数の計画に引き続き適用されるだろう。
われわれの臨床開発によるわれわれの計画の推進に伴い,新たな技術的挑戦が出現し,医療モデル全体の失敗を招く可能性がある。さらに、ポートフォリオを横断するいかなるリスクも、既知であっても未知であっても、例えば特定のタイプの副作用のリスクが増加し、私たちの任意の計画で実現されれば、私たちの他の計画および業務全体に実質的な悪影響を及ぼすであろう。
私たちの特定のモデルと計画にはまた特定の追加的な危険がある。例えば、予防ワクチンは通常、数万人もの健康ボランティアにおいて臨床試験を行い、承認可能な利益-リスクプロファイルを決定する必要がある。健常者に投与する際には,高度な安全性と耐性を示す必要があり,まれな虚偽の安全発見を招き,ビジネス開始前または後に計画に悪影響を及ぼす可能性がある。早期臨床試験で陽性の安全性,耐性,免疫原性レベルが認められても,これらの計画を承認するために必要な後期試験では許容可能な安全性や有効性の概要は観察されない可能性がある。
私たちのINT候補製品と私たちが開発する可能性のある任意の他の新しい抗原癌ワクチンは多くの臨床と製造方面の挑戦に直面している。これらのリスクは、腫瘍の更なる悪化と突然変異の前に臨床試験中の患者に供給し、個性化薬物を製造することによる巨大なコストと、腫瘍の生物学的或いは患者の免疫状態のために免疫反応が不足する可能性があるため、迅速な生産回転時間を含む。これらのリスクは我々のINT候補製品と他の新しいエピトープ研究薬物計画に適用される
さらに、特定の位置(例えば、腫瘍または損傷組織)に送達することができる活性医薬成分(API)の数が限られているため、治療効果を向上させるために十分な数の有効な医薬成分(API)を提供することに挑戦が存在する可能性がある。われわれの局所注射研究療法は通常臨床試験を行うための専門技能が必要であり,臨床試験を遅らせるか,あるいは注射局所療法や腫瘍内療法の採用不良により製品の商業化を緩和あるいは損害する可能性がある。また,前臨床動物モデル(マウスや非ヒト霊長類モデルを含む)から成功した臨床試験結果までの標的選択の不確実な翻訳可能性は不可能であり,特に免疫腫瘍学や系統療法および癌ワクチンである可能性がある。一般に,メッセンジャーリボ核酸を治療活性を有する薬剤に変換するためには,いくつかの生物学的ステップが必要である。これらの処理ステップは個体或いは組織によって異なる可能性があり、治療蛋白レベルの違い、活性の違い、免疫原性の異なる或いは異なる組織分布を招き、治療効果を達成する可能性がある。遺伝子療法およびメッセンジャーリボ核酸薬物は、医薬製品の任意およびすべての成分(例えば、メッセンジャーリボ核酸またはLNPなどの送達ベクター)およびコードタンパク質に対して1つまたは複数の免疫反応を活性化し、それによって潜在的な免疫反応に関連する有害事象を引き起こすことができる。コード蛋白に対する免疫反応を引き起こすことは,重複投与や副作用時に薬理効果を実現する能力を阻害する可能性がある。これらのリスクは,われわれの全身分泌療法や全身細胞内療法モデルを含むわれわれのすべての計画に適用される。
私たちは参加者を募集して臨床試験に参加する時に遅延に遭遇する可能性がある。
私たちの臨床試験に参加する参加者を募集することは私たちの成功に必須的だ。十分な数の臨床試験参加者または所望のまたは所望の特徴を有する参加者を募集する上で困難または遅延に遭遇し、コスト増加または我々が計画した臨床試験の時間または結果に影響を及ぼす可能性があり、これは、試験の完了を阻止し、候補製品の開発を進め、規制部門の承認を得る能力に悪影響を及ぼす可能性がある。 私たちは最初の新冠肺炎ワクチンの第3段階臨床試験で行ったように、被験者群でより大きな多様性を実現するために、試験の登録速度を遅くすることができるかもしれない
参加者登録は、様々な要因によって影響を受けます
•調査中の病気の重症度は
•臨床試験プログラムの複雑さと設計
•患者集団の規模は
•年齢に基づく資格基準を含み、被験者の登録を青少年または小児科人口に制限することを含む問題のある臨床試験の資格基準
•臨床試験地点の予想される試験参加者に対する近似性と可用性
•競争療法と臨床試験の有用性
•医者の患者は治療法を変え
•治療中および治療後に試験参加者の能力を十分に監視する
•臨床試験に合格した研究者を募集することができます
•研究中の候補製品の他の利用可能な療法に対する潜在的な利点および副作用に対する臨床医および試験参加者の見方は、私たちが調査している適応のための任意の新薬または療法が承認される可能性があることを含む
•我々の試験中または他の候補製品に関連する不良結果または他の不良安全信号、およびそれによって生じる負の宣伝は、潜在的な臨床試験参加者およびその医師の私たちの試験への参加を阻害する可能性がある
•私たちは参加者たちの同意を得て維持する能力を持っている。
また,限られた能力や臨床試験の登録に影響を与える能力がない可能性があり,我々はすでに戦略連合に入り,これらの戦略同盟に基づいて,われわれの協力者が臨床開発を制御している。たとえ我々または我々の戦略的パートナーが臨床試験参加者を募集することができても,これらの参加者が最終的に臨床試験の一部または完了用量となることは保証されない。
このような新薬の新規性のため、リボ核酸薬物開発は非常に大きな臨床開発と監督リスクを持っており、私たち或いは他の人が開発した任意の候補製品の有効性、安全性或いは耐性に対する否定的な見方は私たちが業務を展開し、私たちの候補製品を推進し、或いは監督部門の許可を得る能力に不利な影響を与える可能性がある。
これまで,メッセンジャーリボ核酸薬物がFDAあるいは他の規制機関の許可あるいは承認を得ることは少なく,メッセンジャーリボ核酸薬物の有効性,安全性と免疫原性データおよび現実世界に関する証拠は蓄積され続けている。臨床試験に参加している被験者や我々の新冠肺炎ワクチンを接種した個体では,新たな,より頻繁またはより深刻な有害事象が観察される可能性がある。例えば、いくつかの研究により、他の新冠肺炎ワクチンと比べ、著者らの新冠肺炎ワクチンは若い男性心筋炎と心膜炎の発生率が高いことと関係がある可能性がある。もし私たちの他の製品や候補製品の受容者に類似した観察結果が現れた場合、あるいは他の予期しない安全問題が発生した場合、私たちと私たちのmRNAプラットフォームの名声は大きな被害を受ける可能性がある。このような事件そうかもしれない私たちの他の計画の遅延を含む他の問題を招き、私たちの臨床試験を再設計する必要があり、大量の追加的な財政資源が必要だ。さらに、fdaや他の規制機関は、私たちとは違う方法で私たちの臨床試験データを説明するかもしれません。これらの機関は、私たちの全面的な規制承認を延期または阻止することができる追加の研究や分析を要求するかもしれませんある管轄区域ではいくつかの人口統計を対象にしています例えば、FDAは、2021年10月に、規制許可を得る前に、この集団における臨床試験期間を延長する青少年において、私たちの新冠肺炎ワクチンを使用するより低い用量を探索することを要求する。
私たちまたは私たちの戦略パートナーによってメッセンジャーリボ核酸薬の発見と開発に成功したことは、多くの私たちまたは彼らが制御できない要素に依存する高度に不確実である。私たちは絶えず商業決定を行い、計算されたリスクを負担して、メッセンジャーリボ核酸技術、交付技術と製造技術に関する努力を含む、私たちの開発努力と導管を推進し、これらは最終的に成功しないかもしれない。
我々の候補製品は開発の初期段階で有望に見えるが、多種の原因で推進できない可能性があり、臨床遅延、臨床待ち或いは発売できない可能性がある
•非臨床または臨床前研究または臨床試験の結果は、潜在的なメッセンジャーリボ核酸薬が予想される有効ではないか、または有害または問題のある副作用または毒副作用があることを示す可能性がある
•私たちの臨床試験における不良結果、あるいは類似製品の開発の他の不良結果、あるいはmRNAや私たちのLNPsに関連する副作用は、否定的な宣伝や私たちの計画の遅延または終了を招く可能性がある
•候補混合ワクチンの有効性または安全性は、ワクチン接種時の効果または安全性よりも低い可能性があるS単独では、これは組み合わせ製品が規制部門の承認を得ることを阻止するかもしれない
•メッセンジャーリボ核酸薬に類似していると考えられる製品に関連する有害事象、例えば、遺伝子治療または遺伝子編集に関連する製品は、私たちの1つまたは複数の計画の予想される利益の減少、規制審査の強化、患者および臨床試験協力者の私たちの候補製品に対する自信の低下、および私たちが開発する可能性のある任意の製品に対する需要の減少をもたらす可能性がある
•私たちの翻訳モデルは人間にとってリスクや結果を予測する能力が不足しており、特に私たちの候補製品の各成分が安全性、耐性、有効性に依存または独立している可能性があることを考慮すると、これは種に依存する可能性がある
•臨床試験のためのcGMP材料の製造失敗または供給不足、またはコストが予想よりも高く、臨床試験を延期または後退させるか、またはリボ核酸薬物の商業的魅力を失わせる可能性がある
•CGMP材料の製造、テスト、または配合を最適化するための私たちの変更は、候補製品の安全性、耐性、有効性に影響を与える可能性があります
•価格設定または清算問題または他の臨床試験の延期、または任意の遺伝子薬物を他の治療法と比較して経済的または競争力のない要素;
•私たちの大量の候補製品は、予期しない深刻な副作用、他の報告すべき負の臨床結果、報告可能なイベントまたは重大な臨床イベントを含むより多くの報告可能な有害事象をもたらす可能性があり、これらのイベントまたは重大な臨床イベントは、臨床遅延またはFDAまたは適用される規制機関によって放置または他の臨床遅延をもたらす可能性があり、いずれも、私たちの1つまたは複数の計画および私たちの業務全体の認知に負の影響を与える可能性がある
•私たちの計画を適時に進めることができなかったか、または以下の理由で必要な規制承認を得ることができなかったか、または必要な規制承認を得ることができなかった:臨床試験登録の緩慢または失敗、試験参加者の試験終了、試験終了の達成できなかった、データ分析の追加時間要件、データ完全性の問題、BLAまたは同等の申請の準備、FDAまたはEMAとの議論、追加の非臨床または臨床データの規制要求または安全処方または製造問題、これらは、私たちが十分な資金を得ることができない可能性がある
•米国、州、または外国政府が遺伝子組換え薬に対する公衆の否定的な見方に応えるために採択された新しい立法または法規;
•他の人の独自の権利および相互競争の製品および技術は、私たちのmRNA薬物の商業化を阻止するかもしれない。
臨床経験のほとんどない疾患の治療のためのいくつかの候補製品を開発しているため、場合によっては、新しい終点または方法を使用して、FDAまたは他の規制機関は、臨床的に意義のある結果を提供するために、私たちの臨床試験の終点を考慮しないかもしれない。
現在承認されていない薬物療法は,現在解決あるいは将来解決可能な多くの疾患の根本的な原因を治療しようとしている。例えば,われわれが治療法を開発している多くのまれな疾患では,臨床試験もほとんどなく,これらの疾患を治療するための承認薬もない。したがって,これらの疾患開発の新規性により,これらの疾患や他の疾患の候補製品を設計·治療する臨床試験は,より長い時間,より高いコストあるいは効果が悪い可能性がある。
FDAが著者らの成功基準が十分な検証と臨床意義を得ていることを確実に発見しても、著者ら或いは著者らの戦略パートナーが行ったいかなる重要な或いは他の臨床試験においても、私たちは事前に指定された終点を達成できず、ある程度の統計的意義を達成することができないかもしれない。また,あらかじめ指定された基準を達成しても,試験におけるより伝統的な奏効率の終点と比較して,われわれの臨床試験では予測不可能あるいは不一致の結果が生じる可能性がある。FDAは他の治療効果の終点が主要な終点より高いすべてを圧倒する重みを与えることができ、もし私たちがこの終点で統計的に顕著な結果を得ても、もし私たちの副次的な治療効果の終点に対してそうしなければならない。FDAはまた、製品の利益とリスクを考慮し、安全性を背景に治療効果の結果を許可を支持していないと見なす可能性がある。他の国の規制機関はこのような端末たちを似たような発見をするかもしれない。
いくつかのメッセンジャーリボ核酸療法はFDAとEMAによって遺伝子療法に分類される。私たちの薬物と遺伝子療法との関連は、規制負担の増加を招き、私たちの薬物研究の名声を損なう、あるいは私たちのプラットフォームや業務に負の影響を与える可能性がある。
アメリカあるいは外国の司法管轄区では、少数の承認された遺伝子治療製品しかなく、そのテストと使用に関連する重大な不良事件も大量に報告されている。遺伝子治療製品の監督管理要求はすでに変化し、そして未来に引き続き変化する可能性があり、メッセンジャーリボ核酸治療への影響はまだ不明である。例えば、FDAはその生物製品評価·研究センター(CBER)内にオフィスを設置し、現在は治療製品オフィス(OTP)と呼ばれ、遺伝子治療と関連製品の審査を統合し、細胞、組織、遺伝子治療諮問委員会を招集し、その審査についてCBERにアドバイスを提供する。EUでは、あるメッセンジャーリボ核酸療法は遺伝子療法薬物製品として同定され、高級治療薬物製品(ATMP)と呼ばれるより広い分類に属し、追加の監督管理要求を受けている。ある国では,メッセンジャーリボ核酸療法はまだ分類されていないか,あるいはそのような分類は何も知られておらず,例えば,日本では医薬品や医療機器庁はメッセンジャー療法の規制分類に立場をとっていない。メッセンジャーリボ核酸薬と遺伝子療法の間に差があるにもかかわらず、私たちのいくつかのメッセンジャーリボ核酸候補製品はアメリカ、EU、および可能な他の国/地域で遺伝子療法に分類され、私たちの候補製品を開発する能力に悪影響を及ぼすかもしれない。例えば,遺伝子治療とmRNAとの差にかかわらず,臨床的に遺伝子治療製品の把握が我々のmRNA製品候補に適している可能性がある。
報告されている遺伝子療法に関連する有害事象は,われわれの1つまたは複数の項目に悪影響を及ぼす可能性がある。我々の候補メッセンジャーリボ核酸製品は細胞DNAを永久的に変化させないことを目的としているが、規制機関または他の機関は、新しいDNAの導入が細胞中のDNAを逆転的に変化させることによる遺伝子治療の悪影響は、私たちのメッセンジャーリボ核酸研究療法にリスクを与える可能性があるため、私たちの1つまたは複数の臨床試験または長期副作用に対する追加の試験を延期する可能性があると考えるかもしれない。規制当局が公布したどんな新しい要求やガイドラインも、規制審査過程を延長し、追加的またはより大規模な研究を行うこと、または私たちの開発コストを増加させることが要求されるため、私たちの業務に悪影響を及ぼす可能性があり、いずれも、私たちの候補製品の推進または承認および商業化を延期または阻止し、または重大な承認後の研究、制限または制限を招く可能性がある。私たちが私たちの候補製品を発売する時、私たちはこれらの規制機関や諮問委員会と協議し、適用される要求とガイドラインを守ることを要求されるだろう。もし私たちがこれをできなかったら、私たちは私たちの候補製品の一部またはすべての開発を延期または停止することを要求されるかもしれない。
ゲノム編集における我々の取り組みは,遺伝子療法に関連するすべてのリスクの影響を受けている。近年遺伝子治療やゲノム編集の分野で大きな進展があったにもかかわらず体内にあるCRISPRに基づくゲノム編集技術は比較的に新しく、その治療効果は大きな程度でまだ実証されていない。潜在的な治療に関連する治療効果や安全問題に対する公衆の見方や関連メディアの報道、およびゲノム編集に関する倫理的問題は、被験者の臨床試験への参加意欲に悪影響を及ぼす可能性がある。また、機関生物安全委員会が行った任意の審査は遺伝子治療臨床試験の開始を延期或いは阻止する可能性がある。
さらに、いずれかの治療法が承認された場合、医師および患者は、これらの新規な個人化治療をゆっくりまたは受け入れられなくなる可能性がある。医師、医療保健提供者と第三者支払人が新製品、新技術と新しい治療方法を採用する速度はしばしば遅く、特に追加の前期コストと訓練を必要とする可能性のある製品、技術と治療方法である。医師はこれらの新たかつ潜在的な個人化療法を用いた研修を受けたくない可能性があり,特定の療法が複雑すぎたりリスクがある可能性があり,適切な訓練なしには採用できず,施行しないことを選択する可能性がある。また、健康状態、遺伝子特徴或いはその他の原因により、ある患者は治療に適していない可能性がある。さらに、否定的な公衆の見方、道徳的関心、または財務的考慮に対する連邦および州機関、国会委員会および外国政府の対応は、新たな立法、法規、または医療基準をもたらす可能性があり、任意の候補製品の開発または商業化、規制承認の獲得または維持、または他の方法で利益を達成する能力を制限する可能性がある。これらや他の要因に基づいて,医療提供者や支払者は,これらの新しい療法の利点がそれらのコストを超えないか,あるいは超えないかを決定する可能性がある。
もし私たちが必要な規制承認を得たり遅延したりできなければ、私たちが開発する可能性のある候補製品を商業化したり商業化することはできないだろう。
我々が開発可能ないかなるメッセンジャーリボ核酸薬およびその開発と商業化に関連する活動は、FDAと同様の外国規制機関によって全面的に規制されている。任意の候補製品を商業化するために必要な規制承認を得るためには、私たちと私たちの戦略パートナーは、私たちの製品が人間(ターゲット層を含む)において安全で、純粋で効果的であることを、広範な臨床前研究と臨床試験によって証明しなければならない。各候補製品について、臨床試験の成功は、BLAをFDAに提出すること、EMAに上場許可申請(MAA)を提出すること、および比較可能な外国規制機関に同様のマーケティング申請を提出することであり、それによって、任意の製品を最終的に承認し、商業マーケティングを行うための前提条件である。
今まで、私たちは新しい冠肺炎ワクチンの規制許可を得て、私たちの現在または未来の候補製品は永遠に監督部門の許可を得られないかもしれませんそれは.私たちは必要な上場承認申請の提出と支援に経験が限られており、この過程で第三者に依存して支援する必要があるかもしれません。私たちはアメリカで私たちの候補メッセンジャーリボ核酸製品のためにBLASを提出する予定であるが、他の司法管轄区は私たちの候補メッセンジャーリボ核酸製品を生物製品ではなく新薬と見なし、異なる発売承認申請を要求するかもしれない。一国で行われる前臨床研究及び臨床試験は他の国の規制機関に受け入れられない可能性があり、一方の国の承認は他の国の規制承認を保証することはできない。
また、米国および海外でマーケティング承認を得る過程は高価で時間がかかり、不確定であり、関連する候補製品のタイプ、複雑性、新規性を含む様々な要因によって大きく異なる可能性がある。開発期間中の市場承認政策の変化、法律の変化、あるいは規制審査の変化は、提出された製品申請の審査を延期する可能性がある。FDAと類似の外国の監督管理機関は承認過程中に大きな自由裁量権を持っており、いかなる上場承認申請を受け入れることを拒否することができ、また著者らのデータが上場承認を得るのに十分ではなく、追加の臨床前、臨床或いはその他の研究を行う必要があると決定することができる。そのほか、臨床前と臨床試験から得られたデータの異なる解釈は候補製品の上場承認を延期、制限或いは阻止する可能性がある。FDA諮問委員会または他の規制機関が承認または制限を提案しない場合、追加の遅延または不承認を招く可能性がある。
FDAと他の外国監督管理機関は規制届出文書のCMC部分を審査した。監督管理機関が発見したいかなる満足できない方面も臨床試験と商業化の遅延を招く可能性がある。また,規制機関はBLA署名時に承認前検査を行う.規制機関のいかなる否定的な発見や要求を遵守できなかったかは、承認遅延や候補製品の商業化ができない可能性がある。
もし私たちが規制機関の私たちが開発した任意の候補製品の承認を得るか、または得られなかった場合、その候補製品の商業的見通しが損なわれ、私たちが収入を作る能力は深刻な損害を受けるだろう。
私たちが新しい冠肺炎ワクチンのために獲得したいくつかの人々(小児科を含む)に対する緊急許可は一時的であり、撤回されるかもしれない。
著者らは現在食品と薬物管理局が著者らの新冠肺炎ワクチンに提供したEUAの下で動作し、これらのワクチンは主要なシリーズとして小児科群に接種する。FDAは、潜在的な衛生緊急事態がもはや存在しないと判断した場合、またはそのような許可が必要であると判断することを含む、様々な理由でこの許可を取り消すことができる新しいデータが私たちのワクチンのメリットがそのリスクを超え続けていないことを示している場合、食品医薬品局または他の規制機関から得られた新冠肺炎ワクチンの緊急許可が適用されなければ、このような許可は撤回される可能性がある。もしこれらの許可が取り消されたら、私たちの新冠肺炎ワクチンの流通の最終承認を得ずに、私たちの業務は不利な影響を受けるだろう。
私たちの製品は今、未来のどんな製品も規制されて検討されるだろう。
私たちが司法管轄区域の規制承認を得ても、私たちは依然として私たちの製品の指定用途やマーケティングに対する重大な制限を受けている可能性があり、コストの高い承認後の研究(FDA加速承認や他の同様のタイプの承認に要求される研究)や上場後監督の持続的な要求を受けている可能性がある。例えば、承認されたBLAの所有者は、BLA内の仕様を満たすために不良イベントを監視および報告し、製品の任意の障害を監視および報告し、新しいまたは追加の申請を提出し、FDAの承認された製品、製品ラベル、または製造プロセスのいくつかの変更を許可しなければならない。また,我々の製品流通所の司法管轄区の規制制度によると,薬物警戒義務は収集,処理,分析,安全性のモニタリングが求められているデータと標識私たちの製品に対する副作用を評価していますなぜならそれらは法理学Vtそれは.もし…私たちはこのような義務を履行するために協力してくれたいかなるパートナーも守ることはできません関連する規定は、私たちは制裁を受けて、コストと名声を増加させ、あるいは私たちの管轄区域で配布されているワクチンの規制許可撤回したり削減したりすることができる。
さらに、他の適用可能な連邦および州法律に加えて、広告および販売促進材料は、FDAの規則および規定に適合し、FDAの審査を受けなければならない。さらに、規制当局は、私たちの候補製品の商業化に必要なまたは望ましいラベル宣言を承認しないかもしれない。
アメリカ食品と薬物管理局は著者らに新冠肺炎ワクチンの発売後の研究を行い、ワクチン接種後の心筋炎と心膜炎のリスクを更に評価することを要求した。また、私たちは妊娠中にmRNA-1273を受け取った後の妊娠と乳児の結末を評価する研究を含む、より多くの発売後の安全性研究を行うことを承諾した。私たちまたは他の人は、以前に未知の副作用を決定することができ、または臨床試験またはより早い発売後段階よりも頻繁またはより深刻な既知の副作用を観察することができる。もし、私たち、契約製造業者または他の戦略パートナーが適用された承認後の規制要求を遵守できなかった場合、規制機関は、私たちが法律に違反し、民事または刑事罰または罰金を適用していると主張し、規制承認または許可証を一時停止または撤回し、行われている任意の臨床試験を一時停止し、私たちが提出した待機BLAまたはBLAの補充剤の承認を拒否し、製品または候補製品を差し押さえたり、リコールしたり、医師、薬剤師、病院に現場警報を発行したり、供給契約の締結を許可することを拒否したりする可能性がある。追加の非臨床研究または臨床試験、またはラベルまたは私たちの製造プロセス、仕様、または施設の変更が要求される可能性もあります。集団訴訟を含む政府調査や訴訟を開始するには、対応するために多くの時間と資源が必要であり、否定的な宣伝が生じる可能性がある。このようなどんな事件や処罰の発生も私たちの商業化能力を抑制することができます私たちの新冠肺炎ワクチンはまたは将来承認された製品のいずれかを生産し、収入を生み出す。
さらに、FDAまたは他の外国規制機関は、治療の利点が各潜在的患者のリスクよりも大きいことを保証するために、任意の製品に対してリスク評価および緩和戦略(REMS)をとることを要求することができ、製品が患者に配信されるリスクを概説する薬物ガイドライン、医療従事者向けのコミュニケーション計画、広範な患者監視または配信システムおよびプロセスが含まれていてもよく、これらのシステムおよびプロセスは、厳格に制御され、制限されており、コストは業界の典型的なレベルよりも高い。さらに、もし私たちまたは他の人が後に私たちが開発した任意の製品による副作用が発見された場合、いくつかの潜在的な重大な負の結果をもたらす可能性があり、承認および許可証の一時停止または撤回、警告ラベルの追加、製品の管理方法の変更、さらなる臨床試験、訴訟、または患者とその子供へのダメージおよび私たちの名声に対する損害責任を増加させることを含むかもしれない。これらの事件のいずれも私たちが開発したいかなる製品に対する市場の受け入れを実現または維持することを阻止し、私たちへのかもしれません業務、財務状況、経営結果、将来性.
私たちのビジネス製品や候補製品の製造に関連するリスク
私たちのメッセンジャーリボ核酸製品および候補製品は新しい技術に基づいており、複雑で製造が困難である。私たちまたは私たちの第三者製造業者は、私たちの任意の製品の製造、製品の発表、賞味期限、テスト、貯蔵、サプライチェーン管理、または輸送において困難に直面するかもしれません。
私たちのメッセンジャーリボ核酸薬物の製造技術は斬新で複雑だ。私たちと私たちの協力者は製造、製品の発表、賞味期限、テスト、貯蔵、サプライチェーン管理或いは輸送の面で困難に直面しています。私たちのサプライチェーンの拡張とより複雑になるにつれて発生した遅延を含みます。私たちはもっと大規模な生産ロットの複雑性、設備故障、人為的ミス、原材料と補助材料の選択と品質、分析テスト技術と製品の不安定などの問題に直面する可能性がある。また,LNPsに被覆されたメッセンジャーリボ核酸薬は,良好な制御条件下で開発·製造されなければならず,そうでなければ薬理活性が悪影響を受ける可能性がある。
製品機能を最適化するために、私たちは過去に、未来に私たちの候補製品の製造と安定性調合と条件を変更することが可能です。これは過去に起こりました将来補給を再開しなければならないかもしれません
製品が貯蔵中に安定性が不足し、供給が不足している場合、臨床前または臨床活動のためのバッチ。私たちの候補製品の安定性や賞味期限不足は、私たちまたは私たちの戦略パートナーが臨床試験を継続する能力を深刻に遅延させる可能性があり、あるいは追加の臨床前または臨床供給を生産する必要があるため、新しい処方薬を使用して新しい臨床試験を開始することが要求されるかもしれない。
我々の高革新率は高度な技術変革を招き,臨床開発期間とその後の製品の比較可能性に悪影響を及ぼす可能性がある。また、技術変化は、新製造インフラの変更、修正または調達の需要を推進するか、または第三者関係に悪影響を及ぼす可能性がある。
多くの場合、私たちは単一の臨床前研究または臨床試験の供給需要を満たすために、複数ロットの薬物物質と薬物製品を利用する必要があるかもしれない。私たちが過去に経験したロット規模または任意のロット失敗を拡大できなかった能力は、私たちの臨床試験または任意の承認された製品の商業化プロセスを大幅に遅延させる可能性がある。例えば、私たちが私たちの薬物物質や薬物製品のために新しい製造プロセスを開発し続ける場合、私たちが行った変更は、薬物製品の仕様と安定性に影響を与え、ロットの失敗を招く可能性があり、商業製品の配送や臨床試験の大幅な遅延を招く可能性がある。私たちの候補メッセンジャーリボ核酸製品は、最終的に承認された薬物の賞味期限が予想よりも低いことをもたらす安定性が証明される可能性がある。これは供給需要、在庫浪費、そして商品コスト上昇のリスクをもたらす。
私たちはいくつかの設備供給者たちに依存しており、彼らはまた新しい技術を実施している。また、私たちは私たちのいくつかの薬物のために独自のカスタマイズ生産装置を開発した。もし私たちがこのような設備の意外な性能問題に遭遇すれば、私たちは臨床と商業供給の遅延或いは中断に遭遇するかもしれない。計画の数量によって異なるため、私たちは工場、CRO、サプライヤー或いは診療所内で汚染候補製品を交差させ、それによって私たちの候補製品の完全性に影響を与えるかもしれない。
生産規模を商業生産と特定のプロジェクトに拡大することに伴い、私たちは絶えず私たちの製品と候補製品の生産量、純度と薬用性能を高めることを計画しています INDを支持する研究を商業発表により支持し,賞味期限安定性,薬物製品や薬物物質の溶解特性を含む。製造プロセスの改良により、開発過程で特定の計画されたプロセスに切り替える可能性があります。しかしながら、プロセス変更後、6ヶ月または12ヶ月の安定性試験のような薬物性能試験を行うには、より多くの時間が必要となるであろう。これは、臨床試験の需要を満たすために、臨床材料を再補充するか、または追加のcGMPロットを生産し、その後、このような薬物特性試験を完了する必要があるかもしれない。
私たちはいくつかの原料と補助材料を利用していますが、これらの原料と補助剤は1つの供給源しかなく、製薬業にとって新しいものであり、新しい方法で使用されています。その中のいくつかの原材料と補助材料はまだ商業供給を支持するレベルまで拡大しておらず、予期しない製造或いはテスト失敗或いは供給不足に遭遇する可能性がある。原料と補助材料のこのような問題は、私たちの製品または候補製品の臨床および商業供給の遅延または中断を招く可能性がある。
私たちはいくつかの分析方法を確立しており、私たちの候補メッセンジャーリボ核酸製品の品質を評価するために、より多くの分析方法を確立する必要があるかもしれない。分析テスト戦略で製品の発表を阻止したり、製品の撤回やリコールを要求したりする可能性のある抜け穴を見つける可能性があります。例えば,製品の安全性,有効性,あるいは安定性に影響を与える新たな不純物が発見される可能性がある。これは、製造または試験プロセスが修正される前に、候補メッセンジャーリボ核酸を放出できない可能性がある。
私たちの商業会社としての発展、そして私たちの薬物開発ルートの増加と成熟に伴い、私たちの施設と第三者の臨床と商業供給に対する需要が増加し、私たちの運営能力に影響を与える可能性がある。私たちは第三者サービス提供者に依存しており、彼らの運営には内在的な危険がある。
大規模臨床試験と商業販売に必要なより大規模な生産を支援する上での経験は限られている。私たちの試験を完成させ、私たちの候補製品を商業化するためには、私たちの候補ワクチンを十分な生産量と商業規模で生産するために、施設を獲得したり開発したりする必要がある。私たちがビジネスを拡大していくことに伴い、私たちは私たちの製造能力とビジネスネットワークに大きな投資を続けていく予定です私たちは世界的に地域製造能力を建設しており、外国司法管区における建設と運営に関連するリスクの影響を受けている.
私たちの内部製造インフラを補充するために、私たちはすでに協定を締結し、私たちの製品を生産し、商業充填加工をして、世界市場を供給しています。私たちは未来に私たちの能力需要を満たすためにもっと多くの第三者を雇う必要があるかもしれない。もし私たちが有利な条件下でこのような計画を達成できない場合、あるいは根本的にできなければ、私たちの製品を開発、製造、流通する能力は不利な影響を受けるだろう。また、これらの能力を確立する努力は、進度、拡大規模、再現性、生産量、純度、コスト、効力或いは品質などの最初の予想に達しない可能性がある。もし私たちが提案できなければ
製品開発、製造、品質の面で必要な制御があれば、供給協定によって規定された時間と数量で私たちの製品を生産したり、将来の潜在的な需要を満たすことが困難になる可能性があります。
我々は現在,第三者を利用して原材料,部品,部品,消耗品を製造し,品質テストを行う予定である。MRNAや他の核酸薬の分野が拡大し続けると,これらの材料やサービスに対する日々の激しい競争に遭遇する可能性がある。第三者製造や試験施設の需要は,既存の生産能力よりも高い速度で増加する可能性があり,このような原材料,部品,部品,消耗品を生産できる第三者メーカーを探し,保持する能力を乱す可能性があり,これらの原材料,部品,消耗品は,我々の候補メッセンジャーリボ核酸製品を製造するために必要なものである。サービス提供者とサプライヤーを使用することは、私たちを危険に直面させるかもしれません
•供給およびサービスプロトコルは、私たちに代価または損害を与える方法で、または時間的に終了または更新されない
•サプライヤーまたはサービスプロバイダの破産を含み、これらのプロバイダおよびサービスプロバイダの運営中断をもたらすことを含む、当社の業務または運営とは無関係な条件
•規制当局による第三者施設の検査は否定的な結果をもたらす可能性があり、私たちの要求を満たす能力を遅延させたり終了させたりする可能性がある。
第三者製造業者への私たちの依存は、私たちの運営に悪影響を与えたり、予見できない遅延や他の私たちがコントロールできない問題を招く可能性があります。契約の制限と専門知識を持つ第三者メーカーの数が限られているため、商業規模で私たちの大口ワクチンを生産するためには、監督部門の許可と施設を得る必要があり、メーカーの交換は高価で時間がかかる可能性があり、私たちのワクチン生産の中断を招く可能性がある。既存の第三者製造業者関係を終了すれば、規制機関はまた、私たちや他のサプライヤーの施設の登録を要求する可能性があり、これは、遅延や特定の市場を供給できない可能性があります。第三者製造業者はまた、生産において困難に直面する可能性がある
•生産コスト、規模、生産量の面での困難
•原材料や用品の供給状況
•品質管理と保証
•人材が足りない
•製品を販売する可能性のある国によって異なる厳格に施行された法規を遵守する
•資本資金が不足している。
どんな遅延や中断も、私たちの業務、財務状況、または運営結果に悪影響を及ぼす可能性がある。
我々の製造施設や外部サービスプロバイダの実体やデジタルインフラには運営リスクがある。
我々の製造施設は、設備の自動化レベルといくつかのデジタルシステムの統合とを組み合わせて、運営効率を向上させる。私たちの施設のデジタル化は私たちを工芸設備の故障の危険に直面させた。これらのリスクは、設計問題、システム互換性、または潜在的なネットワークセキュリティ障害、イベントまたは脆弱性を含む内部または外部要因による潜在的なシステム障害または停止を含む。当社が実施、使用、またはサービスに依存するシステム、インフラストラクチャ、ソフトウェアをアップグレードまたは変更することは、新しいネットワークセキュリティホールやリスクを導入する可能性があります。
我々の施設およびインフラまたは私たちの契約製造業者または他の第三者サプライヤーの施設およびインフラは、外部行為者、請負業者または従業員の攻撃または破壊行為を受ける可能性もある。私たちまたは私たちの契約製造業者の製造能力のいかなる中断も、私たちの薬品または製品の生産能力の遅延や施設閉鎖を招く可能性があり、追加コストが増加する可能性があり、特定の製品の数量や納品時間の義務を履行できない場合があり、あるいは代替生産場所を識別、鑑定、確立する必要があるかもしれません。このような状況が発生すると、私たちの業務、財務状況、運営結果、および見通しに悪影響を及ぼす可能性があります。
私たちの開発と商業能力の拡大に伴い、私たちはすでにアメリカやオーストラリア、カナダ、イギリスなどの他の国でより多くの製造能力を構築し続けると予想しています。このような拡張は規制遅延を招くかもしれないし、予想されたコストよりも高いことが証明されるかもしれない。適切な場所を選択できなければ、効率的に建設を完了し、現地の規制機関と効率的に接触し、必要な人員を募集したり、私たちの成長を効果的に管理したりすることができなければ、製品または候補製品の開発·生産が延期または減少する可能性がある。私たちが私たちの製造インフラを拡大するにつれて、私たちは私たちの製造過程で多くの追加投資をする必要があるだろう。
私たちの製品と候補製品は輸送と貯蔵条件に非常に敏感で、場合によっては、これはコールドチェーン物流を必要とし、それらを紛失または損傷のリスクに直面させる。
私たちの製品と候補製品は温度、貯蔵と処理条件に敏感で、製品或いは製品の中間体の貯蔵或いは処理が適当でなければ、私たちは薬物を損失する可能性があります。私たちの製品と候補製品の賞味期限は可変で、使用する前に期限が切れるかもしれません。私たちの特定の製品と候補製品はコールドチェーン物流を必要とする。もし私たちや第三者流通業者が有効なコールドチェーン供給物流を維持していない場合、返品や期限切れの製品に遭遇し、製品が使用できない可能性があります。これは、追加の製造コストをもたらす可能性があり、臨床試験または商業販売に必要な数の能力を提供する遅延をもたらす可能性がある。さらに、このような輸送サービスに関連するコストおよび限られた供給者は、供給中断をもたらす可能性がある。
私たちは私たちの製品と候補製品を製造する上で厳格な規制を受けている。私たちの製造施設や私たちの第三者メーカーまたはサプライヤーの製造施設は規制要件を満たしていない可能性があります。現在の良好な製造規範(CGMP)の要求を満たすことができなければ、私たちの製品のいかなる承認とコストに重大な遅延を招く可能性がある。
臨床試験や商業販売のための薬品の製造は広く規制されており,このような製品の成分はcGMP要求に従って生産されなければならず,FDAにとってはこれらの要求は強制的に行われており,一部はその施設検査計画である。これらの規定は、臨床試験で使用される製品や材料の品質を制御·確保するために、記録保存、および品質システムの実施および運転を含む生産プロセスおよびプログラムを管理する。CGMP生産過程の悪い制御は製品品質の故障を招く可能性があり、それによって著者らの製品供給能力に影響し、コスト超過と臨床スケジュールの遅延を招く可能性があり、これは広範である可能性がある。このような生産プロセスの問題は以下のとおりである
•製造過程の深刻なずれ
•施設や設備の故障
•品質管理戦略の無効による製品汚染
•施設と公共施設環境モニタリング計画により評価された施設汚染
•サプライヤーの資質の無効或いは肝心なサプライヤーの法規遵守性の問題による原材料の故障
•製品の安定性が悪い
•重大な偏差を是正または回避するための無効な是正措置や予防措置は、規模の拡大に伴い製造過程の理解が深まっているためである
•部品や消耗材に故障や欠陥が発生する。
監督管理機関は通常、cGMPと製造制御の十分な遵守を評価するために、代表的な生産現場検査を要求する。もし私たちまたは私たちのある第三者生産拠点が十分な品質保証や制御を提供できなかった場合、製品の商業化が承認されない可能性がある。監督部門の検査は以下の時間にいつでも行うことができます 製品の開発や商業化の段階。検査は、特定の製品またはより広いcGMP検査のための施設、または規制機関として発見される可能性のある市場または開発問題の後続行動を検査することができる。欠陥のある検査結果は、供給または遅延計画に影響を与える可能性があり、当社の第三者製造業者またはサプライヤーがその供給義務を履行する能力に悪影響を及ぼす可能性がある。
私たちの製品の製造過程はFDAと外国規制機関の承認を経なければならない。私たちまたは私たちの第三者メーカーが規制機関が許容できる規格に適合した製品または候補製品を確実に生産できない場合、私たちまたは私たちの戦略パートナーは、そのような製品を商業化するために必要な承認を得ることができないか、または維持することができないかもしれません。たとえ私たちのいずれかのメッセンジャーリボ核酸薬が規制されて承認されても、私たちまたは私たちのCMOがFDAまたは他の規制機関が許容できる規格で承認された薬剤を生産できることは保証されない。これらの挑戦のいずれも臨床試験の完成を遅らせる可能性があり、臨床試験の移行或いは1つ以上の臨床試験を繰り返し、臨床試験コストを増加させ、私たちの候補製品の承認を延期し、商業化努力を損害し、或いは私たちの商品コストを増加させる必要があり、これは逆に私たちの業務、財務状況、運営結果と将来性に不利な影響を与える可能性がある。
しかも、私たちは私たちの契約製造業者が十分な品質管理、品質保証、合格者の能力を維持することを直接制御できないかもしれない。私たちの契約メーカーは他の会社に材料あるいは製品を供給したり、製造したりしますが、彼らは適用されたものを満たしていません規制要件はその施設の規制状態に影響を及ぼすかもしれない。また、私たちが外国の代理製造業者に依存している程度では、輸出入法規を遵守する必要があることを含む追加のリスクに直面している。
FDA、EMA、および他の外国規制機関は、任意のロットの任意の承認製品の製品サンプルをいつでも提出し、適用試験結果を示すプロトコルを要求することができる。場合によっては、規制機関は、それが発行されるまで、私たちが1つ以上の製品を配布することを禁止するかもしれない。製造過程におけるばらつきは、品質属性や安定性に影響を与えるばらつきを含み、製品に許容できない変化を招き、バッチ故障や製品リコールを招く可能性がある。私たちの第三者契約は
メーカーは何度も故障を経験し、私たちの新冠肺炎ワクチンがリコールされた。私たち自身または私たちの第三者メーカー工場で生産された製品については、ロット故障が発生しており、将来のロット故障または製品リコールは、私たちと私たちの戦略パートナーとの臨床試験または製品発表の延期を招く可能性があり、これは、私たちの業務、財務状況、運営結果、および将来性を損なう可能性があります。
私たちと私たちの製造パートナーはまた、私たちまたは私たちの製造パートナーの製造プロセスと運営を操作するために必要な経験豊富な科学、品質管理、製造者を採用し、維持することに問題がある可能性があり、これは生産遅延や適用された法規要件を維持することが困難になる可能性があります。さらに、私たちはどんな従業員や請負業者の意図的な破壊や不注意を制御したり検出することができないかもしれない。
私たちのINT候補製品は斬新で複雑な製造技術を用いて各患者のために独特に製造したものであり、私たちは生産中に困難に直面するかもしれない。
私たちは独自のINTをカスタマイズして製造し、すべての患者のためにカスタマイズした。以下の問題により、唯一無二の大量のINTを製造することは、製品損失や故障をもたらしやすい
•患者の腫瘍、血液または他の組織サンプルの採取に関連する後方勤務;
•これらのサンプルを遺伝子配列決定のために施設に送り
•腫瘍遺伝子の次世代シークエンシング
•適切な腫瘍特異的変異を決定する
•専用およびオープンソースコンポーネントを含むソフトウェアプログラムを使用して、クラウド内にホストされ、患者固有のmRNAの設計を支援するために、私たちの候補製品の一部でもあり、維持および保護されなければならないソフトウェアプログラム
•必要な新しい抗原をコードする患者特異的メッセンジャーリボ核酸を効率的に設計すること;
•各患者の特定のバッチの独自性によって発生する特定のバッチ製造障害または問題;
•品質管理検査に合格しなかった
•安定性に置かれたロットは意外に失敗した
•第三者サプライヤーからの使い捨て部品、消耗品或いは肝心な部品の不足或いは品質管理問題は、各患者の特定のロットに対して交換しなければならない
•個人化された製造に関連する巨大なコストは、私たちが発展し続ける能力に悪影響を及ぼすかもしれない
•患者のための特定のバッチを成功的かつタイムリーに生産し、配布する
•バッチを患者の看護現場に搬送する過程で遭遇する輸送問題;
•各参加者が独特の治療を受けるとき、所与の用量で一貫した安全プロファイルの能力を定義する。
マサチューセッツ州ノーウッド市の工場でINTのためのカスタマイズ製造設備を製造·設置し、専用ユニットに統合した。この設備は設計通りに機能しない可能性があり、それによって生産された薬物製品の偏差を招き、それによってより多くのロットの不合格を招き、臨床試験に参加した患者に供給できない可能性がある。さらに現在の第3段階INT実験を続けるにつれて他の腫瘍のタイプに拡張しています商業化に備えて,我々のINTへの製造需要が増加することが予想され,継続的な投資が必要となる。いくつかの必要な追加設備は私たちのためにカスタマイズしてくれます。これは長い納期と調達を加速させて、私たちのスケジュールを満たすことになります。また、私たちのINT候補製品が承認されれば、私たちは予想よりも長い時間をかけて私たちの施設を拡大し、マサチューセッツ州マルバーレでの私たちの施設(INTに特化する予定)を完成させ、ビジネスニーズを満たす必要があるかもしれません。このような新施設の拡張や増加は製品比較性の問題を招く可能性もあり、新生産能力の導入をさらに遅らせる可能性がある。
我々のINTは各患者のために製造されているので、各患者との組織サンプル、これらの組織サンプルから得られた配列データ、これらの患者のゲノム解析結果、および各患者のためにカスタマイズされた製品の身分鎖を維持する必要がある。そのようなアイデンティティチェーンを維持することは困難で複雑であり、そうしなければ、将来的に製品の混乱、不利な患者結果、製品損失、または任意の承認された製品を市場から引き下げることを含む規制行動を引き起こす可能性がある。また,我々のINTSが臨床試験による承認と商業化の方向に進むにつれ,複雑な収集,分析,製造,交付過程の様々な面で修正が行われ,プロセスや結果の最適化に努めることが予想される。これらの変化は予想された目標に達しない可能性があり、これらのいかなる変化も著者らのINTの表現が著者らの予想と異なることを招き、それによって臨床試験の結果に潜在的に影響を与える可能性がある。
私たちが第三者に依存するリスクは
私たちの製品や候補製品で使用されるいくつかの部品や材料、開発に必要な流れは単一ソースのサプライヤーに依存しています。
私たちは単一ソースのサプライヤーに依存して、私たちの製品と候補製品に必要ないくつかの部品と材料、そして開発と商業化に必要な製造プロセスを提供します。これらの供給者が経営を続けることを保証することはできません
私たちの需要を満たすのに十分な容量や供給があるか、またはそれらは私たちの競争相手によって購入されないか、または私たちと協力する別の会社によって購入されることを停止するだろう。私たちは単一ソースのサプライヤーを使用して、供給中断、価格上昇、納品遅延、または業務中断を含むいくつかのリスクに直面させます
一般的に、代替部品の代替供給源は少ない。もし私たちがサプライヤーを交換しなければならなければ、私たちの製品や候補製品の製造と納品は長い間中断されるかもしれない。必要であれば、私たちの製品または候補製品で使用される任意の構成要素またはプロセスのための追加または交換仕入先を確立することは、可能であればすぐには完了しないかもしれない。任意の代替サプライヤー(または私たちが直接生産すれば)は合格を必要とし、追加の規制機関の承認が必要になり、さらなる遅延を招く可能性がある。部品または材料供給の中断または遅延、または代替源から許容可能な価格で部品または材料をタイムリーに得ることができない場合、製品または候補製品の需要を満たす能力を弱める可能性がある。さらに、FDAが私たちの候補製品を承認する一部として、FDAは私たちの単一ソースサプライヤーの製造プロセスと施設を検討するだろう。
我々は将来的に第三者と製品や候補製品の開発と商業化について戦略的同盟を達成する可能性がある。もしこのような戦略連合が成功しなければ、私たちの業務は不利な影響を受けるかもしれない。
私たちはすでにパートナーと戦略同盟を構築しており、これらのパートナーは私たちの候補製品の開発、製造、商業化に資金、知的財産権許可、その他の資源を提供し、将来も提供する可能性がある。また、将来的に戦略同盟に加入し、第三者に資金、知的財産権許可、その他の資源を提供することに同意することが期待されている。私たちの現在と未来の戦略連合は多くのリスクをもたらすかもしれない
•戦略協力者は期待通りに義務を履行していないかもしれない
•戦略協力者は、規制部門の許可を得た製品を開発および商業化してはならない、または臨床試験結果、戦略協力者の重点の変化または利用可能な資金または資源の移転、あるいは相互競争の優先順位を創造する外部要素に基づいて、プロジェクトの開発または商業化を継続または更新しないことを選択することができる
•戦略協力者は臨床試験を延期し、臨床試験に十分な資金或いは資源を提供する可能性がある(業務意思決定の結果も必要ですこの協力者の経済的困難のため)、臨床試験を停止し、候補製品を放棄したり、あるいは新しい臨床試験を繰り返したりする
•私たちの戦略連合で開発された製品または候補製品は、私たちの協力者によって彼ら自身の製品または候補製品と競争するとみなされるかもしれません。これは、彼らが資源を投入して開発または商業化することを停止させる可能性があります
•私たちの1つまたは複数の製品にマーケティングおよび流通の権利を持つ戦略的パートナーは、そのような製品をマーケティングおよび流通するのに十分なリソースを投入しないかもしれない
•任意の候補製品の独占権、契約解釈または開発過程における分岐を含む戦略パートナーとの相違は、そのような候補製品の研究、開発または商業化の遅延または終了をもたらす可能性があり、そのような候補製品に対して追加の責任を負うこと、または訴訟または仲裁をもたらす可能性があり、いずれも時間がかかり高価になるであろう
•戦略的パートナーは、私たちの知的財産権または固有の情報を危険にさらしたり、無効にしたりするために、私たちの固有の情報を使用して、訴訟を招く可能性がある
•私たちの戦略連合によって開発された知的財産権の所有権について議論が生じる可能性がある
•戦略協力者は第三者の知的財産権を侵害し、私たちを潜在的な訴訟と責任に直面させるかもしれない
•将来の関係は、非日常的な費用と他の費用を発生させ、私たちの短期的かつ長期的な支出を増加させ、私たちの既存の株主を希釈したり、私たちの管理と業務を乱したりする証券を発行する必要があるかもしれない
•私たちの協力者へのいかなる株式投資も値下がりしたり価値がなくなる可能性がありますそして
•将来のいかなる協力、買収、あるいは合弁を通じて、私たちの国際業務は私たちがアメリカで遭遇していないいくつかの運営、法律、その他のリスクに直面するかもしれない。
私たちの戦略的パートナーは一般的に過去に起きた彼らと私たちとの合意を実質的に修正または終了するかもしれない。もし何かの協力協定を終了すれば、私たちは予想される将来の研究開発資金やマイルストーン、稼いだ特許権使用料、利益シェア、または他の支払いを受けることができないかもしれません。私たちの候補製品の研究または開発は延期または停止されるかもしれません。新しい戦略パートナーが適用される候補製品の開発や商業化を続けることも難しいかもしれませんが、私たちの名声は悪影響を受ける可能性があります。これらのリスク要因の他に記載されている製品開発、規制承認、商業化に関連するすべてのリスクは、私たちの戦略に適用されます協力する活動します。
私たちはより多くの戦略同盟の構築を求めるかもしれませんが、ビジネス的に合理的な条件でこれらの連合を作ることができなければ、私たちの開発と商業化計画を変えなければならないかもしれません。私たちのいくつかの戦略連合協定は私たちが特定の製品を開発する能力を制限するかもしれない。
私たちの開発計画と候補製品の潜在的な商業化には費用を支払うために多くの追加の現金が必要になるだろう。私たちは製薬やバイオテクノロジー会社と協力して、私たちのいくつかの候補製品を開発して商業化するかもしれませんが、適切な戦略的パートナーを探す上で激しい競争に直面しています。私たちがより多くの戦略連合を構築できるかどうかは、他にも、協力者の資源と専門長の評価、提案された戦略連合の条項と条件、提案された協力者のいくつかの要素の評価にかかっている。これらの要因は、臨床試験の設計または結果、FDAまたは同様の外国規制機関の承認の可能性、候補製品の潜在的市場、そのような候補製品の製造および交付の試験参加者へのコストおよび複雑さ、競争薬の潜在性、我々または提案された協力者の技術所有権に対する不確実性を含むことができ、挑戦の利点を考慮せずにこのような所有権に挑戦する場合、不確実性が存在する可能性がある,一般的な産業や市場状況を見ています
私たちの既存のいくつかの戦略連合協定によると、私たちも制限されており、いくつかの条項で潜在的な戦略パートナーと合意を締結して、私たち自身の他の目標を追求することはできない。これらの標的、ポリペプチド、投与経路、および領域に対する作業制限は、他の協力者との戦略的協力または何らかの潜在的に価値のある候補製品を追求する能力を制限する可能性がある。
戦略連合の交渉と記録は複雑で時間がかかる。もし私たちが適時に、有利な条件で、あるいは新しい戦略連合を達成できなければ、私たちは私たちが協力を求めている候補製品の開発を削減し、その開発計画や私たちの1つまたは複数の他の開発計画を減らしたり、その潜在的な商業化を延期したり、いかなる販売やマーケティング活動の範囲を縮小したり、あるいは私たちの支出を増加させる必要があるかもしれない 自費で開発や商業化活動を行う。
我々は引き続き第三者に依存して私たちの候補製品の研究、臨床前研究、方案開発と臨床試験を行う予定である。もしこれらの第三者のパフォーマンスが満足できず、規制要求を遵守していない場合、あるいは予想される期限内に完了しなければ、規制部門の私たちの候補製品の承認を得られないか、商業化される可能性がある。
著者らはCROのような第三者に依存して、ある臨床前の仕事と著者らの臨床試験の管理を助け、そして医療機関、臨床研究者とCROによって著者らの臨床試験の設計と審査に協力し、そして合格した患者を募集することを含む臨床試験を行う。また、私たちは第三者請負者と協力者を招いて、多くの他の研究、商業、行政活動を支持し、これは私たちのこれらの活動の制御を減少させたが、私たちのすべての臨床試験がその全体的な研究計画と方案に従って行われることを保証するなど、私たちの責任を軽減しなかった。さらにFDAはGLPを遵守することを求めています臨床前研究と臨床試験結果を展開、記録、報告する良好な臨床やり方は、データと報告の結果が信頼性と正確であることを保証し、臨床試験の場合、試験参加者の権利、完全性とセキュリティが保護される。そのような基準は持続的に発展し、私たちと第三者が新しいまたは持続的に変化する要求を受けるだろう。
第三者がその契約責任の履行に成功しなかった場合、または予期された期限内に完了できなかった場合、それらを交換する必要がある可能性があり、影響を受ける臨床試験、薬物開発計画、または適用活動の遅延を招く可能性がある。もし臨床試験が著者らの契約の期待或いは監督管理要求に従って行われなければ、監督管理機関の行動はこのような試験の進行或いは進捗に重大かつ不利な影響を与える可能性があり、甚だしきに至っては再臨床試験を行う必要がある。したがって、候補薬物に対する規制の承認を得て、それを商業化するための努力は延期されるかもしれない。さらに、任意の第三者請負者が私たちの期待通りに活動を展開できなかった場合、関連する研究、開発、商業、または行政活動に悪影響を及ぼす可能性がある。任意の第三者請負者が私たちの許容可能なフォーマットでタイムリーに私たちのデータへのアクセスを提供できなかった場合、私たちの規制提出や他の開発活動に遅延や障害が生じる可能性があります。
私たちの知的財産権に関するリスクは
私たちは私たちの発見とその知的財産権のために特許保護を獲得したり、私たちの商業秘密の機密性を保護することができないかもしれない。
私たちの成功は、米国や他の国の特許や他の知的財産権の法律に基づいて開発された独自の方法および技術を保護する能力にある程度依存しており、他の人が私たちの発明や独自の情報を不正に使用することを防止することができる。いくつかの米国特許出願は特許発行前に秘密であるため、第三者は、これらの出願を知らずに、未解決の特許出願にカバーされている技術のために特許出願を提出する可能性があり、私たちの特許出願には、これらの出願の優先権がない可能性がある。また,科学文献で発表されている発見は実際の発見に遅れていることが多く,米国や他の管轄区の特許出願は通常,出願後18カ月以内に発表され,あれば発表される.だから私たちは私たちが最初に特許したのか
あるいは私たちはこのような発明のために特許を申請した最初の会社ですそのため、必要な特許権を得ることができず、独占経営権を失う可能性があります。以前、私たちは第三者特許の下で許可を得て、私たちの製品をマーケティングしたり、私たちの研究開発や他の活動を行ったりしました。必要であれば、私たちは将来そうするかもしれません。もし私たちが割引条項で許可証を得ることができなければ、影響を受けた製品を販売したり、必要な活動を行うことができないかもしれません。
特許保護を取得して実施する過程は高価で時間がかかり、我々が行っている特許出願は発行された特許を生成しない可能性がある。私たちの特許保護の獲得と維持は、政府特許機関によって適用された様々なプログラム、書類提出、費用支払い、および他の要件に依存しており、これらの要件に適合していない場合、私たちの特許出願は、有効な実行可能な特許を生成できない可能性があり、または私たちの特許保護が減少またはキャンセルされる可能性がある。私たちまたは私たちの戦略的パートナーがすべての必要かつ望ましい特許出願を合理的なコストでタイムリーに提出して起訴できなかった場合、私たちの業務は悪影響を受ける可能性があります。
私たちと私たちの戦略的パートナーは私たちの独占権を保護しようと努力しているにもかかわらず、許可されていない当事者たちは私たちが独自だと思う情報を取得して使用するかもしれない。発行された特許は有効と推定されているが,有効性の挑戦では生き残っていない可能性があり,強制実行不可能と認定される可能性がある。私たちが取得した、または未来に取得された任意の特許は、私たちの知的財産権をめぐる設計の各当事者の挑戦、無効宣言、実行不可能と判断、または回避される可能性があります。さらに、第三者または米国特許商標局は、我々の特許または特許出願に関連する特許庁プログラムを開始することができる。私たちの特許または特許出願に提起された任意の挑戦、発見された実行不可能または無効または回避は、費用が高くなり、私たちの管理層が多くの時間と労力を投入する必要があり、第三者の許可方向に支払われた使用料を減少またはキャンセルし、私たちの業務に大きな悪影響を及ぼす可能性があります。
米国特許商標局およびその外国の同業者が特許を付与するために使用する基準は、常に予測可能または統一的に適用されるわけではなく、変更される可能性がある。同様に、米国および外国では、我々のバイオテクノロジー発明を含むバイオテクノロジー発明が獲得する最終的な保護の程度は依然として不確定であり、特許庁、裁判所、立法者が決定する保護範囲に依存する。例えば、“米国発明法”は米国の特許法を多く改正している。もし発行された任意の変化が、私たちが特許侵害者を起訴して禁止救済または実質的な損害賠償を要求する能力を含む、私たちの発見を十分に保護することを阻止すれば、私たちの業務は不利な影響を受ける可能性がある。米国発明法の主な条項は、米国の特許実践を先発明から先出願制度に変更する。もし私たちが競争相手が同じ発明について申請を提出する前に発明を提出できなかった場合、私たちは競争相手が申請日までにその発明を持っていることを証明する証拠を提供することができなくなり、したがって、私たちの発明の特許保護を受けることができないだろう。医薬品又はバイオテクノロジー特許において付与又は許可された権利要件の標的及び範囲についても、統一されたグローバル政策はない。例えば、特定の国では、人間を治療する方法は特許を申請することができない。
したがって、私たちは未来の私たちの専有権の保護の程度を知らないし、私たちまたは他の人に発行される任意の特許が許容されるクレーム範囲も知らない。私たちも特許によって保護されていないビジネス秘密、ノウハウ、技術にある程度依存して、私たちの競争地位を維持しています。私たちはまた、私たちの従業員、コンサルタント、第三者と締結された秘密協定と発明譲渡協定に依存しています。特許によって保護されていない商業秘密、技術的ノウハウ、または他の技術が競合他社に開示されたり、競合他社によって独立して開発されたりする場合、私たちの業務および財務状況は実質的な悪影響を受ける可能性がある。
利用可能なすべての規制の排他性および広い特許範囲を獲得し維持することができなかったこと、および我々の製品をカバーする特許の特許期間を最大限に回復または延長することができなかったことは、排他性および生物類似製品への早期参入を失い、市場シェアまたは収入の損失を招く可能性がある。
さらに、私たちは場合によっては、またはいくつかの期間内に私たちの知的財産権を強制的に実行しないことを選択することができる。例えば、私たちは2022年3月に、私たちはガヴィCovax前払い市場で国またはそれのために製造された会社に対して、AMC 92国でのみ使用されることを前提として、私たちの新冠肺炎ワクチン特許を強制的に施行しないと発表した。また、新しい肺炎ワクチンの知的財産権をメーカーに権限を与えたいと思っていますが私たちはそのような知的財産権の許可を得ることができないかもしれません。もし私たちが私たちの知的財産権を実行できなければ、私たちの業務は他の側面から悪影響を受けるかもしれません。
製薬と生物技術業界の知的財産権方面の不確定性はずっと訴訟と他の紛争の根源であり、これらの紛争自体はコストが高く、予測できず、不利な財務と運営の自由な結果が生じる可能性がある。
メッセンジャーリボ核酸薬物は比較的新しい科学分野であり,この分野の成熟に伴い,世界各国の特許庁が特許出願を処理している。どの特許が発行されるか,および彼らが特許を発行した場合,いつ発行されるか,誰に付与されるか,および何を要求するかについては,不確実性がある。多くのメッセンジャーリボ核酸市場参加者の間でメッセンジャーリボ核酸薬物の基礎技術について訴訟が行われている。各特許庁において,メッセンジャーリボ核酸分野の特許権に関する重大な訴訟や特許庁訴訟が継続して発生する可能性が高い。
私たちは、メッセンジャーリボ核酸薬および私たちの送達技術(LNPsを含む)の発見、開発、製造、および商業化に関連する多くの異なる方法、成分、およびプロセスを要求する特許および出願中の特許を米国および世界各地のキー市場で発行している私たちのいくつかの特許については、反対意見と当事者間の審査請願書が提出されており、欧州特許庁(EPO)、米国特許商標局、および他の場所で、私たちのポートフォリオにおける特許および特許出願についてさらなる訴訟が提起される予定である。多くの場合、どちらも控訴する可能性があり、いくつかの司法管轄区域でこれらの特許に対して控訴できない最終判決を下すのに数年かかる可能性がある。これらおよび他の訴訟の時間および結果は不確定であり、私たちが未解決および発表された特許権利要件の特許性および範囲をうまく守ることができなければ、私たちの業務に悪影響を及ぼす可能性がある。私たちはどんな特許が引き続き存在するかどうか、あるいは権利要件が現在の形を維持するかどうかを決定することができない。たとえ私たちの権利が直接挑戦されなくても、紛争は私たちの知的財産権を弱化させる可能性がある。
場合によっては、私たちは、将来的に発行された米国特許を提訴し、メッセンジャーリボ核酸薬物分野の第三者が所有する欧州特許に対して反対訴訟を提起する可能性がある。私たちは第三者特許に対する多くの訴訟が進行中だ。もし…もし私たちがこのような第三者特許の範囲を縮小したり、無効にすることに成功しなかった場合、これらの第三者は、私たちの製品に対してこれらの特許を主張しようと試みるかもしれない。バイオテクノロジーや製薬業界の拡張や特許の発行に伴い,我々の製品や候補製品がクレームを受けるリスクが増加する可能性がある第三者特許権を侵害する行為。
私たちは数十億ドルを投資して私たちの特許メッセンジャーリボ核酸プラットフォームを作成しましたこれは私たちのメッセンジャーリボ核酸薬物開発に不可欠な一部であり、第1の部分第3の“法的訴訟”に記載された様々な知的財産権訴訟にも参加しています。私たちはこのような法的手続きに多くの財政と管理資源がかかると予想され、各手続きの最終的な結果は不確定だ。
私たちは将来的に特許訴訟や他の権利決定に関連する訴訟に巻き込まれる可能性があり、巨額のコストと支出、重大な損害賠償責任、または私たちの製品開発と商業化努力の停止を要求される可能性があります。
我々の製品および候補製品の使用または製造に関連する第三者特許または材料、配合、製造方法または治療方法の請求項の特許出願が存在する可能性があり、第三者は、彼らの独自技術の使用を許可していないと主張することができる。さらに、第三者は将来的に特許を取得し、私たちの技術がこれらの特許を侵害していると主張するかもしれない。管轄権のある裁判所が任意の第三者特許を保有し、私たちの任意の製品または候補製品、製造過程で形成された任意の分子または任意の最終製品自体の製造プロセスをカバーする場合、任意のそのような特許の所有者は、禁止または他の平衡法の救済を受けることができ、これは、適用特許に基づいて許可を得るか、またはそのような特許が満了するまで、そのような製品の商業化を効果的に阻止することができる。同様に、管轄権のある裁判所が任意の第三者特許を保有し、共同療法を含む私たちの処方、製造プロセス、または使用方法の様々な態様をカバーする場合、そのような特許の所有者は、許可または特許の満了を取得しない限り、適用可能な製品または候補製品を開発し、それを商業化する能力を阻止することができるかもしれない。
権利侵害と他のクレームの弁護は、その是非曲直にかかわらず、巨額の訴訟費用に関連し、私たちの業務から従業員資源を分流する。もし私たちに対する侵害クレームが成功した場合、私たちは故意に侵害した3倍の損害賠償金と弁護士費、特許権使用料の支払い、私たちの侵害製品の再設計、または第三者から1つ以上の許可を得ることを含む大量の損害賠償を支払わなければならないかもしれない。これらは商業的割引の条項で提供できない可能性があり、あるいは多くの時間と費用を必要とする可能性がある。
また,このような許可はいずれも非排他的である可能性があるため,我々の競争相手は我々に付与された同じ技術を獲得する可能性がある.もし私たちが必要な許可を得られず、特許をめぐって設計できなければ、私たちは私たちのいくつかの技術や製品を効果的にマーケティングすることができないかもしれません。これは私たちが収入を作ったり、利益を達成する能力を制限するかもしれません。これは私たちの運営能力を維持することを危うくするかもしれません。さらに、私たちのいくつかの協力は、私たちの知的財産権許可が私たちに支払うべき印税が、関連分野で競争またはより高い知的財産権の地位を持つ第三者に協力者が支払う金額によって相殺される可能性があり、協力によって開発された製品の収入が大幅に減少する可能性があると予想している。
さらに、いくつかの許可および戦略連合協定について、私たちは、知的財産権または協定の標的に関連する訴訟によって生成されたいくつかの費用について、ある第三者を賠償することに同意した。知的財産権に関する訴訟や他の手続きは、解決策が私たちに有利であっても、訴訟は私たちの経営陣の努力を分散させることになるかもしれません。私たちのいくつかの競争相手は、彼らがより多くの資源を持っているので、私たちよりも複雑な特許訴訟の費用を効果的に受けるかもしれない。いかなる訴訟の開始と継続による不確実性は、私たちの研究、開発、商業化努力を延期し、私たちが運営を継続する能力を制限するかもしれない。
もし私たちが許可した任意の特許権の第三者所有者がこれらの許可に基づく特許を正確に、または成功的に獲得、維持、または強制執行しなかった場合、私たちの競争的地位および業務の将来性は損なわれる可能性がある。
我々は許可の側になる可能性があり,我々の業務に必要または有用な第三者IPの権利を得る.この場合、私たちの成功は、私たちの許可された知的財産権の特許保護を取得し、維持し、実行する能力にある程度依存する可能性がある。私たちの許可者たちは私たちが許可した特許出願を起訴することに成功できないかもしれない。これらの特許出願について特許を発行しても,我々の許可者はこれらの特許を維持できない可能性があり,これらの特許を侵害する他の会社に対して訴訟を提起しないか,あるいは我々のように積極的に訴訟を提起しないことに決定する可能性がある.私たちが許可した知的財産権の保護がなければ、他社は販売のために実質的に同じ製品を提供する可能性があり、これは私たちの競争業務の地位に悪影響を与え、私たちの業務の将来性を損なう可能性があります。さらに、私たちは様々な第三者許可に基づいて私たちの権利を私たちの戦略的パートナーに再許可した。これらの再許可権に対するいかなる損害も、私たちの戦略連合協定下の収入を減少させるか、または私たちの1つまたは複数の戦略的パートナーに合意を終了させる可能性がある。
第三者から知的財産権許可を得るための合意の義務を履行できなかったり、許可者側との業務関係が妨害されたりすると、当社の業務に非常に重要なライセンス権を失う可能性があります。
私たちは知的財産権を許可して、これは複雑な法律、商業、科学的な問題に関連して、私たちの業界の科学的発見の迅速な歩みによって複雑になった。私たちは特定の知的財産権許可協定の一方であり、未来にもっと多くの許可協定を締結することを望んでいる。私たちの既存の許可協定は、私たちが未来の許可協定が私たちに様々な勤勉さ、マイルストーン支払い、特許権使用料、その他の義務を負担することを要求すると予想している。もし私たちがこれらの合意の下で私たちの義務を履行できなかった場合、あるいは私たちが破産に直面した場合、許可側は許可を終了する権利がある可能性があり、この場合、私たちは許可に含まれている製品を販売することができず、追加的な責任を負うことができるかもしれない。
場合によっては、私たちは許可技術によって作られた特許の起訴を統制する。もし私たちがこのような起訴に関連したいかなる義務にも違反すれば、私たちは私たちの戦略的パートナーに重大な責任を負うかもしれない。ライセンス契約によると、知的財産権紛争が発生する可能性があります
•ライセンス契約に従って付与された権利範囲および解釈に関連する他の問題;
•ライセンス契約に拘束されていない技術およびプロセスが許可側の知的財産権を侵害しているかどうか
•私たちの協力開発関係に基づいて、特許と他の権利を再許可する
•私たちのライセンス契約の下での義務と、どのような活動がこれらの職務義務を満たしていますか
•私たちの許可者と私たちおよび私たちの戦略的パートナーは、知的財産権によって生成された発明およびノウハウの所有権を共同で創造または使用する;
•特許技術発明の優先権。
我々が許可している知的財産権をめぐる紛争が有利な条件で現在の許可手配の能力を維持していることを阻害したり、損害を与えたりすれば、影響を受けた候補製品の開発に成功し、商業化することができない可能性がある。私たちは一般的に私たちが許可している知的財産権を保護し、私たちが持っている知的財産権を保護するのと同じすべてのリスクに直面している。もし私たちまたは私たちの許可者がこの知的財産権を十分に保護できなければ、私たちの製品商業化能力は影響を受ける可能性がある。
私たちは、私たちの従業員、コンサルタント、または独立請負業者が第三者の機密情報を誤って使用または開示したか、または私たちの従業員がその前の雇用主によって言われた商業秘密を誤って使用または開示したという疑惑の影響を受けるかもしれない。
私たちが雇った人は以前、私たちの競争相手や潜在的な競争相手を含む大学や他のバイオテクノロジーや製薬会社に雇われていた。時々、私たちまたは私たちの従業員、コンサルタント、または独立請負業者は、私たち従業員の元雇用主の商業秘密または他の固有情報を含む第三者の知的財産権を意図的または他の方法で使用または漏洩したことを指摘される。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。もし私たちがこのようなクレームを弁護しなければ、金銭損害賠償の支払いに加えて、貴重な知的財産権や人員を失う可能性があり、これは私たちの業務に悪影響を及ぼす可能性がある。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣や他の従業員の注意を分散させる可能性がある。
私たちは私たちの特許と他の知的財産権の発明権や所有権のクレームに疑問を受けるかもしれない。
私たちはそしてずっと元従業員、協力者、または他の第三者が私たちの特許または他の知的財産権に対して所有権を持つことを制限されている。例えば、所有権紛争は、私たちの候補製品の開発に参加するコンサルタントまたは他の人の義務衝突によって引き起こされる可能性がある。訴訟は、これらと他の挑戦在庫または所有権のクレームに対抗するために必要かもしれない。もし私たちがこのようなクレームを弁護することができなければ、お金の損失を支払う以外に、私たちは貴重な知的財産権を失うかもしれません
価値のある知的財産権の独占的所有権または使用権を含む権利。このような結果は私たちの業務に実質的な悪影響を及ぼすかもしれない。このようなクレームを正当化することに成功しても、訴訟は巨額のコストを招き、経営陣や他の従業員の注意を分散させ、特許戦略に影響を与える可能性がある。
アメリカの特許と規制法の変化は私たちが製品を保護する能力を弱めるかもしれない。
私たちの成功は知的財産権、特に特許に大きく依存する。米国特許法は進化を続けています米国最高裁の裁決は、場合によっては入手可能な特許保護範囲を縮小し、場合によっては特許所有者の権利を弱める。このような裁決は私たちが将来特許を得る能力の不確実性と、一旦特許を取得する価値を増加させる。米国議会、連邦裁判所、および米国特許商標局の決定によると、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、それにより、私たちが新しい特許を獲得したり、私たちの既存の特許と将来獲得可能な特許を強制的に執行する能力を弱める可能性がある
私たちは世界各地で私たちの知的財産権を保護できないかもしれない。
すべての国で特許を申請、起訴、保護する費用は目を引くほど高く、私たちの外国の知的財産権はアメリカほど広くないかもしれない。また、いくつかの国の法律は知的財産権の保護の程度はアメリカ連邦と州法律に及ばない。したがって、私たちは、米国以外のすべての国/地域で第三者が私たちの発明を実施したり、米国または他の管轄区域で私たちの発明を使用して製造された製品を販売または輸入することを阻止することができないかもしれない。競争相手は私たちの技術を利用して私たちが特許保護を受けていない司法管轄区で自分の製品を開発したり、特許保護を持っている地域に侵害製品を輸出するかもしれませんが、法執行力はアメリカに及ばないかもしれません。
多くの会社は外国の管轄区域の知的財産権の保護と保護に重大な問題に直面している。特定の国の法律制度、特に特定の発展途上国の法律制度は、特許、商業秘密、および他の知的財産権保護、特にバイオテクノロジー製品に関する保護の実行に賛成しておらず、これは、私たちの特許の侵害を阻止したり、私たちの専有権を侵害する方法で競争製品を販売することを困難にする可能性がある。外国の管轄区域で私たちの特許権を強制的に執行する訴訟手続きは、巨額のコストを招き、私たちの努力と注意を私たちの業務の他の側面から移転させる可能性があり、私たちの特許が無効または狭義に解釈されるリスクに直面する可能性があり、私たちの特許出願を発表できないリスクに直面させ、第三者からのクレームを引き起こす可能性がある。私たちは私たちが起こしたどんな訴訟でも勝てないかもしれないし、判決された損害賠償や他の救済措置(もしあれば)は商業的な意味がないかもしれない。したがって、私たちが世界各地で知的財産権を実行する努力は、私たちが開発または許可した知的財産権から顕著な商業的優位性を得るのに十分ではないかもしれない。
また,多くの国に強制許可法があり,これらの法律により特許権者は第三者に許可を強制的に付与される可能性がある。例えば、新冠肺炎の大流行期間中、ある国は、これらの国で新冠肺炎ワクチンを配布することを可能にするために、強制許可に便宜を提供する措置をとると脅している。また、多くの国は政府機関や政府請負業者に対する特許の実行可能性を制限している。これらの国では,特許権者の救済措置が限られている可能性があり,関連特許権の価値を大きく低下させる可能性がある。もし私たちまたは私たちの任意の許可者が第三者に私たちの業務に関連する任意の特許の許可を付与することを余儀なくされた場合、私たちの競争的地位が損なわれる可能性があり、私たちの業務、財務状況、運営結果、および見通しは不利な影響を受ける可能性があります。
私たちのいくつかのプロジェクトは、政府援助と政府と半政府実体の協力に依存しており、これは、これらのプロジェクトに関連する研究·開発作業の不確実性を増加させ、知的財産権に関する要求を要求し、これらの政府援助プロジェクトによって開発された任意のプロジェクトの開発、商業化、生産コストを増加させる可能性がある。
米国政府およびその機関によって援助された契約および贈与は、私たちがBARDAとDARPAによって援助した協定と、政府の実質的な権利と救済措置を反映する条項を含むNIAIDとの協力を含み、その多くは通常、政府以下の権力を含む商業契約では発見されない
•いかなる理由でも、またはいかなる理由でも合意を全部または部分的に終了しない
•他方の同意を得ずに、このような合意の下での政府の義務を減少または修正する
•知的財産権を含む、このようなプロトコルに従って開発された製品およびデータの請求項;
•分配された間接費用を含む契約に関連する費用および費用を監査する
•請負業者または譲受人が新しい契約を受け取ることを一時停止し、調達法律または条例に違反していると言われる問題が解決されるのを待つ
•このようなプロトコルに従って概念または最初に実行された発明を含む製品に対して米国製造要件を実施すること;
•請負業者または譲受人が今後政府と業務を展開することを一時停止または禁止する
•製品の輸出を制御し禁止する可能性があります
•“虚偽申告法”、“虚偽陳述法”及び政府合意に対する類似救済規定に基づいて刑事又は民事救済を求めること
•政府の財政責任を米国議会が財政年度ごとに支払う金額に制限しているため、プロジェクトの最初の段階で資金を獲得した後も、将来の資金の獲得可能性にはいくつかの不確実性がある。
私たちはアメリカ政府が私たちが開発したいくつかの技術を使用することを禁止する権利がないかもしれません。他の会社、私たちの競争相手を含めて、これらの技術を使用することを禁止することができないかもしれません アメリカ政府です。米国政府は通常、米国政府の契約に基づいて開発された技術を使用する使用料を免除する権利があるという立場をとっている。
また,政府契約や助成金,およびそのような契約や助成金を実行する際に承認された下請け契約および下請け契約は,通常追加の要求が含まれており,我々の経営コストを増加させ,我々の利益を減少させ,これらの条項や細則を遵守できなかったために法的責任を負う可能性がある.これらの要件には、例えば、
•政府契約と贈与に特有の専門会計制度
•強制的な財務監査と、政府資金が使い切った後に負担する可能性のある価格調整または払い戻し責任
•競争相手が私たちの研究計画を深く知ることができるように、いくつかの契約および付与情報を公開する
•労働基準、非差別、平権行動計画、環境コンプライアンス要件を含む強制的な社会経済コンプライアンス要件。
また、これらの合意によれば、1980年にベハ·ドール法案(Bayh-Dole Act)に規定された米国政府に対する義務と米国政府の権利を守らなければならない。したがって、米国政府は、任意の政府の目的のために発明を使用する非排他的、譲渡不可能、撤回不可能なグローバルライセンスを含む、これらの政府援助計画の下で開発されたいくつかの発明の権利を有することができる。さらに、米国政府は、(I)発明を商業化するのに十分なステップが取られていないこと、(Ii)政府が公衆衛生または安全需要を満たすために行動しなければならないこと、または(Iii)政府が連邦法規の公衆使用に対する要求を満たすように行動しなければならないことを前提として、第三者に上述した任意の発明の独占的、部分的独占的または非独占的許可を付与する権利を要求する権利がある。アメリカ政府のデモ権利のいかなる行使も、私たちの競争地位、業務、財務状況、運営結果、将来性を損なう可能性がある2023年12月、バイデン政府は提案された枠組みを発表し、価格が1つの発明が公衆に提供するのに十分かどうかを考慮する一つの要素になり得ることを初めて明らかにした。提案された枠組みは進入権を薬品価格を規制する道具として使用することができるかもしれない。価格を一つの要因としてデモ決定に組み込む可能性は、幅広い批判や挑戦を招くことが予想され、最終的な影響は不明だ。もしアメリカ政府がこのような進行権を行使すれば、私たちが公開市場で得ることができる補償よりも低いかもしれない、アメリカ政府が合理的と思う補償を得ることができるかもしれない。政府援助の計画の下で生成された知的財産権もいくつかの報告要求によって制約されており、この要求を守るには大量の資源が必要かもしれない。
組織として、私たちは政府契約と関連する規制コンプライアンス義務が相対的に新しい。もし私たちがこのような義務を守れなかったら、私たちは潜在的な責任を負って私たちの契約を終わらせるかもしれない。
私たちの財務状況と経営結果に関するリスク
私たちは2023年に純損失が発生し、将来も赤字になる可能性があり、製品販売収入の歴史が限られており、長期的な持続可能な利益が実現できない可能性があることを確認した。
われわれは純損失を被った47億ドル2023年には、2021年と2022年を除いて、私たちは設立以来毎年純損失を出している。現在、私たちの新冠肺炎ワクチンは私たちの唯一の商業化製品だ。より多くの潜在的な製品の発表に準備していますが私たちが期待していることも含めてRSVは2024年に送信され、これらの送信の最終的な発生および時間はまだ決定されていない。私たちが収入を創出し、利益を維持する能力は、製品の商業化に必要な規制承認を成功させ、獲得する能力にかかっている。
私たちはすでに私たちの新冠肺炎ワクチンの商業化と私たちの臨床と臨床前開発活動に関する巨額のコストを負担し続けている。また、私たちは2023年に生産能力の規模を調整することで巨額のコストを発生させた。私たちは長期的に持続可能な収益性を達成できないかもしれないし、運営を継続するために追加の資金が必要かもしれない。
私たちは次のような状況が発生すれば、私たちの費用が大幅に増加するかもしれないと予想している
•私たちの臨床前開発プロジェクトの研究や開発を拡大し
•私たちの候補製品のために追加の臨床前、臨床あるいは他の研究、特に大型重要な試験を開始した
•新しいメッセンジャーリボ核酸技術の改善を決定するために、私たちのプラットフォームに投資して研究を続けた
•内部製造能力を変更または増加させるか、または製造業者またはサプライヤーを増加させる
•私たちが候補製品を商業化する過程で、私たちの品質管理と品質保証チームのために追加のインフラを追加して、私たちの運営を支援します
•技術人材を引きつけて引き留める
•世界的に新しいサイトを構築することを含む、より多くのインフラを構築して、私たちの製品開発と商業化努力を支援します
•私たちの候補製品のために市場の承認と精算を求めます
•販売、マーケティング、流通インフラを構築し、任意の製品を商業化する
•他の候補製品や技術を買収したり許可したり
•任意の許可内合意に従ってマイルストーンまたは他の支払いを行う;および
•どんな遅延に遭遇したり、上記の任意の問題に遭遇したりします。
私たちの四半期と年間経営業績は変動する可能性があります。したがって、私たちは研究アナリストや投資家の期待を達成できないかもしれません。これは私たちの株価を下落させ、私たちの融資や融資能力、そして独立会社としての私たちの生存能力にマイナスの影響を与えるかもしれません。
多くの要素のため、私たちの財務状況と経営業績は多くの要素によって四半期と年度の間に変動する可能性があり、その中の多くの要素は私たちがコントロールできない。そのため、私たちの経営業績の経時的比較は私たちの将来の業績を予測できないかもしれません。どの特定の四半期においても、私たちの経営業績は証券アナリストや投資家の予想を下回る可能性があり、これは私たちの株価を下落させる可能性がある。私たちの株価は、証券アナリストの提案、私たち、私たちの協力者、または私たちの競争相手が特定の情報を公開開示する時間、および財務業績をタイムリーに正確に報告する能力を含む、私たちの実際の経営業績に関連しない事件の影響を受ける可能性がある。このような変動を引き起こす可能性のある私たちの業務に関連する他の要素はリスク要因本年度報告書10-K表の他の場所に。
私たちの現金、現金等価物、投資の投資はリスクの影響を受け、これらのリスクは損失を招き、これらの投資の流動性に影響を与える可能性がある。
2023年12月31日までに133億ドル現金、現金等価物と投資は、一般的な信用、流動性、市場、インフレと金利リスクの影響を受ける。私たちはこのような投資の公正な価値で損失を達成するかもしれない。さらに、もし私たちの投資が私たちに支払う利息の支払いを停止したり減らしたりすれば、私たちの利息収入は影響を受けるだろう。私たちのポートフォリオに関連するこれらや他の市場リスクは、私たちの運営結果、流動性、財務状況に悪影響を及ぼす可能性があります。
私たちの業務と運営に関するリスク
私たちは会社の発展と拡張を管理する時に困難に直面するかもしれない。
2023年12月31日現在、19カ国·地域に約5,600人のフルタイム従業員を有しており、従業員数や業務範囲を増やす可能性があります。この世界的な拡張を管理するためには、私たちの管理、運営、財務システムを継続して実施し、改善し、私たちの施設を拡大し、合格者を募集し、訓練しなければならない。私たちの経営陣は、これらの開発活動を管理するために、日常活動から多くの注意をそらす必要があるかもしれない。
著者らが解決を求める多くの治療領域と疾病のために製品を開発し、監督と製造経路を十分に理解することに成功し、多くの領域にまたがる同時実行を可能にするために、深い人材、資源と会社の流れが必要である。私たちは、私たちの業務の同時実行と拡張を効果的に管理することができず、合格者を募集し、訓練することができないかもしれません。これは、私たちのインフラが弱く、操作ミス、ビジネス機会の喪失、従業員の流失、余剰従業員の生産性の低下を招く可能性があります。私たちの業務の実体拡張は、マサチューセッツ州ノーウッドとマルバーラー園区の拡張、および海外製造施設の建設を含めて、巨額のコストを招き、財務資源を他のプロジェクトから移転する可能性があります。例えば、私たちの候補製品を開発することができます。私たちの経営陣が私たちの発展と拡張を効果的に管理できなければ、私たちの財務業績や製品商業化の能力は負の影響を受ける可能性があり、私たちは私たちのビジネス戦略を実施できないかもしれません。
私たちはアメリカ以外でビジネスをすることは危険に直面するだろう。
我々の業務は米国以外での業務展開に関するリスクの影響を受けており、国際的な運営経験は限られている。適用機関の規制承認や他の許可を得るまで、私たちは私たちの候補製品をマーケティングしたり普及させたりすることは許されず、私たちは決してこのような承認を得ないかもしれない。異なる管轄区域で監督管理の承認を得るためには、安全性と有効性に関する多くの規制要求と、私たちの候補製品の臨床試験、製造、商業販売、定価、流通などの方面の規制要求を守らなければならないが、私たちは承認を得ることができないかもしれない。我々はグローバル事業を急速に拡大し、商業子会社を設立し、世界規模での当社製品の製造·流通を支援する手配を達成したことは複雑な課題である。例えば、私たちは地域的な製造施設を建設し、いくつかの国で研究開発に投資している。私たちの業務は、私たちが拡大していくグローバル業務に関連する多くの要因の悪影響を受けるかもしれません
•売掛金の入金時間の延長、輸送回転時間の延長、潜在的な言語障害の減少を含む国際商業販売、マーケティングとサプライチェーン及び流通組織の発展に努力する
•私たちの顧客は海外市場で私たちの製品の精算能力を得ることができます
•私たちは第三者に依存しているので、ビジネス活動を直接統制することはできません
•海外の異なる医療実践と風俗習慣は市場受容度に影響する
•特定の国や地域の政治文化気候や経済条件の変化
•外国で法人実体を設立·維持·経営する法律やコンプライアンス負担が増加する
•“欧州一般データ保護条例2016/679(GDPR)”を含む、複雑かつ変化する外国監督管理、税務、会計、報告、および法律要件を遵守する負担
•契約紛争が発生した場合の外国の法律に管轄されている契約条項の解釈と、現地司法管轄区域で契約条項を効率的に実行することの困難さ
•外国の知的財産権保護が不足し、関連する可能性のある第三者知的財産権が存在する
•貿易保護措置には、米国商務省が公布した輸出管理条例のような貿易制限、輸出入許可要求、罰金、処罰または輸出特権の一時停止または撤回、政府規制の実施と関税の変更などが含まれる
•適用される外国の税金構造の影響と潜在的な不利な税金結果;
•外貨為替レートに重大な不利な変化が生じた。
米国の“反海外腐敗法”(FCPA)、イギリスの“反賄賂法”や他の国の類似法など、幅広い連邦、州、外国の反賄賂法規の制約を受けている。“反海外腐敗法”を遵守することは高価で困難であり、特に腐敗は公認問題である国である。また、海外腐敗防止法は製薬業に特別な挑戦をもたらしており、多くの国では病院が政府によって運営されているため、医師や他の病院従業員は外国人官僚とされている。臨床試験やその他の仕事に関連して病院に支払われた何らかの金は、政府関係者に支払われた不正金と考えられ、“海外腐敗防止法”の法執行行動につながった。様々な法律、法規、および行政命令はまた、米国国外での使用および伝播を制限するか、または国家セキュリティ目的のために秘密にされた情報と、特定の製品およびこれらの製品に関連する技術データとを特定の非米国国民と共有する。米国以外での事業拡大に伴い、これらの法律を遵守するためにより多くの資源を投入する必要があります。これらの法律は、米国以外で特定の製品や候補製品を開発、製造、販売することを阻止するかもしれません。これは、私たちの成長潜在力を制限し、私たちの開発コストを増加させるかもしれません。
私たちは私たちまたは私たちの従業員、コンサルタント、または第三者請負業者が賄賂と腐敗に関するすべての連邦、州、そして外国法規を遵守しているか、または遵守することを保証することはできない。さらに、米国以外の戦略的パートナーや第三者請負業者には十分なコンプライアンス計画がない場合や、彼らの運営地域の法律や指導を尊重していない可能性があり、重大な民事·刑事罰を招き、政府契約を一時停止または禁止する可能性がある。米国証券取引委員会は、発行者が海外腐敗防止法の会計規定に違反したため、発行者の米国取引所での証券取引を一時停止または禁止する可能性もある。これらの法律に違反していると判断されなくても、政府の調査には通常、大量の資源がかかり、負の宣伝が必要であり、これは私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性がある。
私たちは私たちの企業資源計画(ERP)システムをアップグレードして維持することができず、私たちの業務と運営結果に不利な影響を与えるかもしれません。
私たちは私たちのビジネス運営としての持続的な成長を支援するために、私たちのグローバルERPシステムをアップグレードしています。私たちは企業資源計画システムを実施する過程で大きなコストを生み出しました当社のシステムを実施または使用する際に生じる中断や困難は、売掛金を予測または販売し、売掛金を回収する能力を含む当社の業務に悪影響を及ぼす可能性があります。S.S私たちの内部統制の記録、審査、テストの重大な遅延は、私たちの管理に関連するアメリカ証券取引委員会の報告義務を守らない可能性があります’Sは中国の財務報告の内部統制に対する評価。さらに、このような妨害や困難は、予期せぬ費用と経営陣の注意をそらすことを招く可能性がある。
私たちの成功は私たちが肝心な従業員、顧問と顧問を維持する能力、及び合格者を吸引、維持、激励する能力にかかっている。
私たちが競争の激しい生物科学技術と製薬業界で競争できるかどうかは、私たちが高い素質の管理、科学、技術、品質管理、製造、医療、監督と商業人員を誘致と維持できるかどうかにかかっている。私たちの業界は離職率が高く、特定のスキルを持つ個人を他社や学術機関と競争しています。人員を引き付け、引き留めることができない場合、生産遅延や監督管理要求の遵守が困難になる可能性がある。そのほか、臨床試験で成功しなかったり、上場許可を得られなかったりすることを含む負の宣伝は、合格者の採用と維持を困難にする可能性がある。
私たちは私たちの管理と科学チームのメンバーに非常に依存している。私たちのすべての幹部と従業員は、肝心な科学者と臨床医を含めて、すべて“勝手に”採用して、これは私たちあるいは彼らがいつでも雇用関係を終了できることを意味します。これらの人たちを失ったどんなサービスも、私たちの研究、開発、融資、商業化目標の実現に悪影響を及ぼす可能性がある。私たちは誰の従業員にも“キーパーソン”保険に加入していない。私たちの何人かの重要な従業員たちは、幹部を含めて、私たちが長い間働いてきて、貴重で完全に付与された株式オプション、または他の長期持分インセンティブを持っている。バイオテクノロジー業界の競争環境、特にマサチューセッツ州ケンブリッジ市では、これらの従業員を引き留めることができないかもしれない。
また、私たちは科学と臨床コンサルタントを含むコンサルタント、請負業者、コンサルタントに依存して、研究開発、監督管理の承認、製造、商業化戦略の制定を助けてくれます。これらの人たちは他の雇用主に雇用される可能性があり、他の人と締結された契約に基づいて約束することができ、これらの契約は私たちの彼らに対する利用可能性を制限する。これらの個人のサービスを失うことは、研究、開発、規制承認、製造、商業化目標の達成を阻害するかもしれない。
もし私たちが私たちの企業文化を維持できなければ、私たちは私たちの成功に役立つと思う革新、チームワーク、情熱を失うかもしれない。
私たちは私たちの文化を建設し、維持し、私たちの人員を発展させるために多くの時間と資源を投入した;しかし、私たちが拡大するにつれて、私たちの文化を維持することはますます難しくなるかもしれない私たちの労働力の急激な増加に加え、最近の職場や職場スタイルの転換に加え、文化を維持する能力のリスクが高まっている。私たちの文化を維持できなければ、私たちの戦略計画を維持し、採用する能力を含め、私たちの未来の成功にマイナスの影響を与えるかもしれない。
我々の内部コンピュータシステムおよび物理的な場所、または敏感なデータや情報を共有する第三者のコンピュータシステムおよび物理的な場所は、ネットワークセキュリティイベントを含む障害やセキュリティホールを受ける可能性があり、これは、私たちの製品開発計画および製造運営を深刻に混乱させる可能性がある。
我々の内部のコンピュータシステムおよびインフラ、ならびに機密、保護または敏感なデータまたは情報を共有する戦略的パートナー、サプライヤー、請負業者、コンサルタントまたは監督機関のシステムおよびインフラ、または私たちの業務が依存するシステムおよびインフラは、コンピュータウイルス、不正アクセス、誤用、自然災害、テロ、ネットワークセキュリティ脅威、戦争、電気通信および電子故障、およびセキュリティ被害または破壊によって破壊されやすく、これは、私たちのシステム、インフラ、データ、または私たちの業務が依存する人のシステム、インフラ、データまたは情報、またはデータ漏洩、誤用、流用または流出をもたらす可能性があります。我々は、様々なタイプの脅威行為者(民族国家、犯罪企業、個別行為者、または高度な持続的脅威集団を含む)が、我々の情報技術システムおよびインフラに対してより多くのネットワーク攻撃を行うことを経験している可能性がある。しかも、私たちはこのような脅威行為者たちの私たちの物理的な家屋への侵入を経験するかもしれない。敏感な情報を抽出することに加えて、このような攻撃は、サーバの信頼性に影響を与え、情報、システムまたはインフラの機密性、完全性、および利用可能性を脅かすために、有害マルウェア、恐喝ソフトウェア、デジタル恐喝、商業電子メール漏洩およびサービス拒否攻撃、社会工学、および他の手段を含む可能性がある。私たちまたは機密、保護または敏感なデータまたは情報を共有する人のための任意のそのようなネットワーク攻撃または物理的侵入、または私たちのビジネスが
私たちのデータ、システム、またはインフラが失われたり、破損したり、私たちの開発計画や製造業務の重大な中断、または私たちの任意の独自または機密情報の損失のために、私たちの運営を中断した場合、私たちに大きな悪影響を与えます。例えば、臨床試験データの損失は、私たちの規制承認努力を延期し、データを回復または複製するコストを増加させる可能性がある。さらに、我々が複数の臨床試験を並列に実行するため、我々のコンピュータシステムまたはインフラストラクチャまたは物理的場所の任意の破壊または障害は、複数の開発段階の複数のプログラムにおけるデータ損失またはデータ完全性を損なう可能性がある。ネットワークセキュリティリスクへの対応を求めていますが、私たちの努力はこのようなリスクを完全に緩和しないかもしれません。さらに私たちのネットワークセキュリティ責任保険は、コンピュータセキュリティプロトコルまたはネットワークセキュリティ攻撃の違反または損害によって当社が受けるすべての被害を含まない可能性があります。
任意の臨床試験参加者の個人データを含む任意のデータ漏洩、セキュリティイベントまたは機密、保護されたまたは個人情報の漏洩は、民事罰金および処罰、訴訟、規制調査または法執行行動、またはGDPRおよびイギリスGDPRおよびEU関連加盟国法律、他の外国法律、1996年連邦医療保険携帯および責任法案(HIPAA)および米国の他の関連州および連邦プライバシー法律(カリフォルニアプライバシー権利法案(CCPA)によって改正されたカリフォルニア消費者プライバシー法案を含む)によって提出された損害賠償要求に直面させる可能性もある。私たちは時々、ワクチン研究開発に従事している会社は、民族国家と付属ネットワーク行為者を含むサイバー攻撃を計画する人たちの特別な重点である可能性があるという情報を受け取った。任意の中断またはセキュリティ被害イベントまたは脆弱性が、私たちのデータ、システム、インフラストラクチャまたはアプリケーションが失われたり、破損したり、または当社の製品の研究および製造に関する情報を含む機密または独自の情報を適切に使用または開示しない場合、私たちは責任を招く可能性があり、私たちの競争や名声地位が損なわれる可能性があり、私たちの候補製品のさらなる開発および商業化が延期される可能性があります。
私たちは、より利益があるか、より成功する可能性のある計画を利用するのではなく、特定の研究計画や候補製品を追求するために、私たちの財務および人的資本を使用することができる。
私たちは、選択された研究プロジェクトまたは候補製品の開発を追求し、支援し、後により大きなビジネス潜在力が証明される可能性のある他の機会を追求または延期することを選択する可能性がある。例えば、私たちは大量の資源を私たちの新冠肺炎ワクチンと他の気道プロジェクトに集中しており、これらのプロジェクトの準備は何度もワクチンを発売するために準備している。しかも、私たちはINTプロジェクトへの投資を増加させている。私たちの資源配分決定、あるいは戦略パートナーに資源を提供する契約約束は、特定の商業製品や利益のある市場機会を利用できない可能性があります。私たちの候補製品の研究開発計画への支出は商業的に実行可能な製品が生じないかもしれない。私たちはまた、戦略的協力や融資計画の達成を求めることができ、これらの手配によれば、独占的な開発と商業化の権利を保持することが私たちにより有利な場合には、戦略連合、許可または他の特許使用料手配によって、将来の収入の一部を含む貴重な権利を候補製品に放棄することができる。また,ある治療領域の候補製品に内部資源を割り当てる可能性があり,その分野では戦略同盟に参加した方が有利である。
より多くの製品を発見、開発、商業化することに成功しなければ、事業を拡大し、戦略目標を達成する能力が損なわれるだろう。
我々の戦略の重要な要素の1つは、現在の製品の組み合わせ以外の製品を発見、開発、商業化することであり、様々な疾患の治療と様々な治療分野のために使用されている。我々は,我々の薬物発見に投資することで,潜在的な戦略連盟を探索して新製品やライセンス内技術を開発し,これを実現する予定である。新しい候補製品を決定するには大量の技術、財力、そして人的資源が必要だ。多くの理由で、私たちは有望な候補を見つけることができないかもしれないし、製品の開発と商業化に成功できないかもしれないが、これは私たちの成長潜在力を損なうだろう。
もし私たちの名声が損なわれたら、製品リコールを含めて、私たちの業務は損害を受けるかもしれません。
FDAや外国の規制機関は私たちの製品のリコールを要求するかもしれない。FDAが1群、1群、または他の数量の生物製品が公衆健康に差し迫ったまたは実質的な危害を構成することを発見した場合、FDAはこの生物製品をリコールする権利がある。また、製品が設計または製造において重大な欠陥または欠陥がある場合、外国政府機関は任意の製品のリコールを要求することができる。製品に実質的な欠陥があることが発見されれば、メーカーは独立してその製品をリコールすることができる。我々または我々の戦略パートナーは、2021年に我々が日本に搬送したいくつかのロットが外来粒子状物質を含む新冠肺炎ワクチンが発見されたときに発生したように、製造ミス、設計またはラベル欠陥または他の欠陥および問題のために政府の強制または自発的なリコールを行う可能性がある。リコールは、私たちのどの製品も管理と財務資源を移転し、私たちの財務状況と運営結果に悪影響を与えます。リコール声明は私たちの名声を損なう可能性があり、私たちの販売に否定的な影響を与えるかもしれない。私たちの名声は私たちの業務に関する公開的な発言と私たちの業務戦略に対する見方のさらなる影響を受けるかもしれません。
私たちの製品に対する責任訴訟は私たちに重大な責任を負い、私たちの製品の商業化を制限するかもしれません。
私たちは私たちの製品や臨床試験における候補製品の開発、テスト、製造、マーケティングに関する製品責任リスクに直面している。使用、処方、販売、または他の方法で私たちの製品または候補製品に接触した患者、医療提供者、または他の人は、製品責任クレームおよび関連する交差クレームおよび賠償クレームを私たちに提示するかもしれません。例えば、任意の製品または候補製品が、臨床試験、製造、または(承認された場合)マーケティング、販売、または商業用途中に使用に適していないことが発見されたと言われている場合、起訴される可能性がある。もし私たちがこのようなクレームを自己弁護することに成功できなければ、私たちは巨額の借金を招くかもしれない。
私たちはまた、患者の病状の悪化、負傷、死亡に関連する製品責任クレームに直面する可能性があり、これらのクレームは私たちの製品または候補製品によるものと言われている。任意のこのようなクレームは、アルコールまたは他の薬物との相互作用の結果、リスクに対する理解、不注意、厳格な責任、および保証違反を含む製品固有の危険について警告することができなかった製造または設計欠陥の告発を含むことができる。州消費者保護法によると、クレームも主張することができる。このようなクレームは製品責任保険のすべてのカバー範囲内にない可能性があります。発売された任意の製品について、製品責任クレームは、FDAが私たちの製品、私たちの製造プロセスおよび施設、または当社のマーケティング計画の安全性および有効性を調査し、私たちの製品をリコールするか、またはより深刻な法執行行動をとり、それが利用可能な承認適応を制限し、許可証を一時停止または撤回または取り消しする可能性がある。是非曲直あるいは最終結果にかかわらず、責任クレームは私たちの製品に対する需要の低下、私たちの名声被害とメディアの重大な負の関心、関連訴訟の弁護コスト、臨床試験参加者の脱退、収入損失、管理層の時間と私たちの資源移転、試験参加者、患者または彼らの家族への巨額のお金の奨励、臨床試験場所と他の臨床試験パートナーを賠償するために支払う費用、および私たちの株価の下落を招く可能性がある。薬物や治療に思わぬ悪影響を与えて提起された個人,大規模侵害,集団訴訟では,多額の判決が下されることがある。
我々の新冠肺炎ワクチンについては、米国と一部の外国政府が契約上私たちに賠償または法定免除権を提供することに同意しているにもかかわらず、このような賠償または法定免除権は、ワクチンの研究、開発、製造、流通、または商業化によって生じる可能性のあるクレームまたは責任を支払うために使用できない可能性がある。また,我々と契約を締結した他の外国政府は,同様の契約賠償や法定免除権を提供してくれない可能性があり,将来的には新冠肺炎ワクチン市場の米国や他の地域の商業市場への移行に伴い,このような賠償や免除の恩恵を受けることもない。ワクチンによる米国または外国政府の賠償または法定免除の範囲を超えたまたはそれを超える大量のクレームは、私たちの財務状況と経営業績を損なう可能性がある。さらに、私たちが責任を負う責任のある有害事象や傷害は、完全に賠償または免除の範囲内であっても、私たちの名声に悪影響を及ぼす可能性があります。
私たちは合理的な費用あるいは十分な金額で私たちの製品責任保険を維持して、私たちを責任による損失から守ることができないかもしれません。将来的に十分な保険範囲を維持するコストが大幅に増加すれば、我々の経営業績は実質的な悪影響を受ける可能性がある。同様に、私たちが保険を受けられない場合や経済的に非現実的になった場合、商業保険提供者の賠償なしに私たちの業務を運営することを要求されます。また、私たちが何らかのタイプの責任のために保険範囲を維持していても、あるクレームが保険範囲から除外されている場合、あるいは私たちが保険条件を満たしていない場合、そのクレームは保証されない可能性があります。もし私たちが保険不足の状況で私たちの業務を運営する場合、私たちは私たちに対するクレームや判決を支払う責任が必要かもしれません。これは私たちの運営結果や財務状況に悪影響を及ぼすかもしれません。
連邦立法と連邦、州、地方政府の行動は、より低い価格で販売されている外国から麻薬を米国に再輸入することを可能にするかもしれない。
私たちはアメリカで外国の薬品価格規制からの療法の私たちの製品に対する競争に直面するかもしれません例えば、2020年10月、FDAはカナダからある処方薬の輸入を許可する最終規則を発表し、そこに政府の価格規制がある。FDAは2024年1月、フロリダ州がカナダから特定の低価格薬を輸入する要請を承認した。最終ルールのすべての影響は不明であるが、薬物の再輸入を可能にする立法または法規は、私たちが開発する可能性のある任意の製品の価格を低下させ、将来の収入および潜在的な収益力に悪影響を及ぼす可能性がある。
医療立法改革の論述および潜在的または公布された措置は、私たちの業務および運営結果に実質的な悪影響を及ぼす可能性があり、価格改革の願望と実施をめぐる立法または政治的議論は、私たちの業務に悪影響を及ぼす可能性がある。
米国では,連邦と州立法機関,衛生機関,第三者支払者は医療コストの抑制に重点を置き続けている。立法と規制提案、医療保険計画を改革する法令、および社会源からのますます大きな圧力は、私たちの製品の処方と購入方式に著しく影響する可能性がある。例えば、ACAの条項は、政府および民間保険会社が医療費を支払う方法を変化させており、Medicaid薬品リベート計画の下でメーカーのリベートを増加させ、あるブランドの処方薬メーカーの年会費および税収を増加させ、メーカーにMedicare Part Dに従ってある外来薬の割引計画に参加すること、PHSA 340 B条に基づいて割引を受ける資格がある病院数の拡大を要求することを含む。また、2022年のインフレ低減法案には、薬品定価制御と連邦医療保険の再設計などのいくつかの条項が含まれており、これらの条項は異なる程度で私たちの業務に影響を与える可能性があるが、それが私たちの業務と医療業界全体に与える最終的な影響はまだ不明である。“企業-政府規制--現在と未来の医療改革立法”を参照
私たちは“ACA”の条項の一部または全部を廃止、大幅に修正、または廃止しようと努力しているために不確実性に直面するかもしれない。現在公布または将来改訂されたACAが私たちの業務や財務業績に悪影響を与えないことは保証されず、将来の医療改革に関連する連邦や州立法や行政変化が私たちの業務にどのように影響するかを予測することもできません。
処方薬のコストに対する国民の関心が高まっており、処方薬の価格設定問題を解決するための立法提案が継続されることが予想されており、これは私たちの業務に大きな影響を与える可能性がある。これらの行動及びACAと医療保険法の将来の不確定性は薬品定価に下振れ圧力をもたらし、著者らの監督管理負担と運営コストを増加させる可能性がある。
州予算も巨大な経済圧力に直面しており、これは各州が薬品のカバー範囲を制限したり支払いのメカニズムを制限したり、あるいはアメリカ以外のコストの低い司法管轄区から薬品を輸入することを許可するメカニズムを通じて予算節約を実現することをますます求めている可能性がある。州医療補助計画はますますメーカーに補充リベートの支払いを要求し、補充リベートを支払わない薬物を使用して事前に州計画の許可を得ることを要求している。政府の医療補助費削減努力は,医療補助計画が管理型医療機関への使用を増加させる可能性がある。これは,管理型医療組織がより大部分の人々の処方決定に影響を与える可能性があり,承認されれば,我々の製品の価格や精算も制限される。
EUや他のいくつかの国際市場では、政府は低コストで消費者に医療を提供し、薬品価格、患者資格、または補償レベルを監督して、政府が支援する医療システムのコストを制御する。多くの国が措置を発表または実施しており、政府支出の全体的なレベルを制限するために、医療コストを低減するために、将来的に新たなまたは追加の措置を実施する可能性がある。これらの措置は国によって異なり、他のほかに、患者の面会の制限、値上げの一時停止、予想と可能なトレーサビリティの値下げとその他の補償、強制的な割引またはリベートの増加、過去の値上げの回復、およびより多くの低コスト国からの薬品の輸入を含む可能性がある。このような措置は私たちの収入と運営結果に悪影響を及ぼすかもしれない。
私たちは連邦と州医療詐欺と法乱用、そして虚偽請求法の制約を直接または間接的に受けている。もし私たちがこのような法律を遵守できないか、または完全に遵守できなければ、私たちは重大な処罰に直面するかもしれない。
米国や他の地域の医療提供者,医師,第三者支払者は薬品の推奨と処方に主な役割を果たしている。第三者支払者および顧客との手配は、製薬業者を広範に適用される詐欺および乱用、および他の医療法律および法規に直面させる可能性があり、これらの法律および法規は、このような会社の販売、マーケティング、および薬品の流通業務または財務手配および関係を制限する可能性がある。特に、保健製品およびサービスの販売促進、販売およびマーケティング、ならびに様々な定価、割引、マーケティングおよび販売促進、構造および手数料(S)、特定の顧客インセンティブ計画および他の商業計画は、詐欺、リベート、自己取引、および他の乱用を防止するための広範な法律によって制限されている。これらの法律法規は、幅広い価格設定、割引、マーケティングおよび販売促進、構造および手数料、特定の顧客インセンティブ計画、および他のビジネススケジュールを制限または禁止する可能性があります。これらの法的拘束を受けた活動は,患者を募集して臨床試験を行う過程で得られた情報の不正使用に関するものである。セレン.セレンE“企業-政府規制-他の医療保健法”
これらの法律の範囲も執行も不確定であり,現在の医療改革環境下では,特に適用の前例や法規が乏しい場合には,急速な変化が生じる可能性がある。業務手配が適用されることを確実にする
医療保険法や政府当局が可能な調査への対応は,時間も資源もかかり,会社の業務への注意を分散させる可能性がある。もし私たちの業務がこれらの法律または任意の他の法規に違反していることが発見された場合、私たちは民事、刑事と行政処罰、損害賠償、罰金、返還、監禁、名誉損害、連邦および州政府が援助する医療計画から除外され、契約損害と削減または私たちの業務を制限し、もし私たちが会社の誠実な合意または他の合意の制約を受けて、違反疑惑を解決し、追加の報告義務と監督を解決することを含む重大な制裁を受ける可能性がある。また,我々と業務往来のある任意の医師や他の医療提供者や実体が適用法を遵守していないことが発見された場合,類似した処罰を受ける可能性がある。これらの法律に違反するいかなる行為も、成功して弁護されても、巨額の法的費用を発生させ、経営陣の業務運営への注意をそらす可能性がある。また,米国以外で開発されたどの候補製品の承認や商業化も,外国医療保険法の制約を受けるであろう。
EUおよびイギリスでは、医師の処方、推薦、裏書き、購入、供給、注文、または医療製品の使用を誘導または奨励するために、医師に福祉または利点を提供することが禁止されている。不当な行為を誘導または奨励するために利益または利益を提供することは、一般にEU加盟国の国家反賄賂法とイギリス2010年の“収賄法”によって管轄されている。このような法律に違反することは巨額の罰金と監禁につながるかもしれない。EU指令(2001/83/EC、改訂)人用薬品に関する条例では、処方或いは薬品を供給する資格のある人に薬品を販売する場合、これらの人に任意のプレゼント、金銭的利益又は実物利益を提供、提供又は承諾してはならず、これらのプレゼント、金銭的利益又は実物利益が高くなく、かつ医薬又は薬局業務と関係がない限り、これらの贈り物、金銭的利益又は実物利益が高くない限り、これらの人に薬品を提供、提供又は承諾することができない。この条項は2012年の人間薬物規制に移されたので、EUから離脱したにもかかわらず、イギリスに適用された。
いくつかの連合会員国で医者に支払われた費用は公開されなければならない。さらに、医師との合意は、医師の雇用主、その主管専門機関、または個別のEU加盟国の監督当局に事前に通知されて承認されることが多い。これらの要件は、EU加盟国に適用される国家法律、業界規則、または専門行為規則に規定されている。このような要求を守らないことは、名声のリスク、公開非難、行政処罰、罰金、または監禁につながる可能性がある。
私たちは、個人データのプライバシーやセキュリティを管理する様々な変化する法律や法規の制約を受けており、守らなければ、罰金や刑事罰を招き、名声を損なう可能性があります。
私たちが個人情報を運営したり収集したりするアメリカ、ヨーロッパ、他の多くの管轄地域では、プライバシーとデータセキュリティが重要な問題です。私たちは異なる司法管轄区域で個人データ(健康情報を含む)に適用される収集、保存、使用、共有、安全なデータプライバシーと安全法律法規の制約を受け、重大なコンプライアンス義務を規定した。さらに、州安全違反通知法、州健康情報プライバシー法、連邦と州消費者保護およびプライバシー法を含む多くの他の連邦と州法律は、個人情報の収集、使用、開示、および安全を管理する。
GDPRおよび英国GDPRは、個人データ処理に適用される他の適切な法的基盤または条件を同意または確保するためのより高い基準、より厳しい透明性要件、データ違反通知要件、私たちの処理者と契約言語を締結する要求、およびより強い個人データ権利を含む、我々の処理および国境を越えた個人データの処理に厳格な義務を課している。異なるヨーロッパ経済圏加盟国はGDPRに対して異なる解釈があり、多くの加盟国は追加の要求を提出し、ヨーロッパ経済区の個人データ処理の複雑さを増加させた。GDPRやイギリスGDPRは欧州経済圏以外の国への個人データの移転にも厳しいルールを実施しており,これらの国では提供されていないと考えられている個人資料の“十分”保護アメリカを含め、データ保護当局が違反に巨額の処罰を加えることを可能にする。GDPRとイギリスGDPRを遵守することは厳格で時間のかかるプロセスであり、私たちの業務コストを増加させたり、私たちのビジネス慣行を変更することを要求したりする可能性があります。私たちはGDPRまたはイギリスのGDPRの範囲に属する任意の活動によって罰金、処罰、訴訟、名声の損害を受ける可能性があります。
米国ではカリフォルニア州でCCPAが採択されており,他の多くの州でも同様の包括的消費者プライバシー法が採択されている。健康情報を専門に管理する州もある。しかも、少数の州は生物識別データを専門的に規制する法律を採択した。また、多くの州や連邦政府は個人データ保護に関する立法提案を積極的に考慮している。州法は急速に変化しており、米国議会は新たな包括的な連邦データプライバシー法を検討しており、公布されれば、私たちは同法の主体になる可能性がある
また、多くの外国司法管轄区ではデータプライバシー立法が可決されており、他の管轄区域では新たなプライバシーやデータ保護法の制定に関する様々な提案が検討されている。データプライバシーは国内レベルでも国際的にも発展しつつある構造であり、新たな法律·法規が考慮され発効しており、法的挑戦が続いている。私たちはこの地域の持続的な変化の状況を理解して順応するために多くの資源を投入しなければならない。すべての法律も裁判所と規制機関の異なる解釈を受け、追加的な不確実性をもたらし、私たちは発展していくデータ保護法を遵守できない可能性があり、これは私たちの当局が法執行行動を取るリスク、特定の司法管轄区域の個人訴訟権利、および潜在的な重大なリスクに直面させる可能性がある
もし私たちが規定を守らないことが発見されたら、処罰を受けるだろう。その中のいくつかの法律はまた刑事制裁の可能性を持っている。例えば、私たちが故意にHIPAAが保証しているヘルスケア提供者または研究機関から個人識別可能な健康情報を取得または開示している場合、医療提供者または研究機関は、そのような情報の開示に関するHIPAAの要求を遵守していない場合、刑事罰を含む罰を受ける可能性がある。また,データセキュリティ事件やプライバシー侵害に関する政府調査数は増加し続けており,政府調査には通常大量の資源が必要であり,負の宣伝が生じ,我々の業務や名声を損なう可能性がある.
“臨床試験条例”(EU)第536/2014号(“臨床試験条例”)とEMAのヒト用薬品の臨床データの公表に関する政策はすべてEMAがMAASで提出した臨床情報を公表することを許可した。第三者が私たちの臨床試験データを審査あるいは分析する能力は商業機密違反のリスクを増加させ、著者らの臨床試験結果のより厳格な審査を招く可能性がある。このような検討は大衆に私たちの薬物と候補薬物に対する誤解を招くかもしれない。これらの出版物はまた、私たちの競争相手に私たちが機密だと思う情報を漏洩させる可能性があり、これは私たちの業務を損なう可能性がある。
人工知能技術の新しい性質を考慮して、我々はGenAIと他の人工知能技術を使用して一定のリスクと挑戦をもたらした。
GenAIや他の人工知能技術(総称してAI Technologies)の開発と使用は,不確実な規制構造に加えて,我々の名声を損なう可能性があり,我々に責任を負わせたり,我々の業務に悪影響を与えるリスクとなっている.人工知能技術を私たちと私たちのサプライヤーのシステムに統合して、私たちは人工知能技術の提供者に直面させますプライバシーおよびデータ保護に関する既存または急速に変化する規制または業界基準に適合しない可能性があるこれは、セキュリティまたはプライバシーの破壊、サービスまたは体験レベルの低下、知的財産権の損失、または機密または独自の情報漏洩をもたらす可能性があります。人工知能を用いた攻撃を含む複雑なネットワーク攻撃は,これらのリスクを悪化させる可能性がある.さらに、GenAIは、虚偽または誤った出力を生成し、偏見を反映するか、または知的財産権によって保護されないか、または他人の固有の権利を侵害しない可能性のあるコンテンツを生成する可能性があり、これは、私たちのビジネスに追加のリスクを構成する。規制の変化や再解釈は、潜在的な政府の法執行行動や民事訴訟を含む新たなコンプライアンスリスクをもたらす可能性がある。私たちの競争相手の人工知能のより速いまたはより効果的な採用はまた私たちを不利な立場に置くかもしれない。
私たちは流行病、大流行、あるいは他の伝染性疾病の爆発の悪影響を受けるかもしれない
I将来的に流行病や大流行が起こると私たちの臨床試験は制限(隔離や旅行制限)や資源の優先順位を決める. TRAVELの制限はまた、私たちの開発と生産活動に挑戦と潜在的な遅延をもたらし、私たちの製品と候補製品を生産する費用とスケジュールを増やす可能性があります。
私たちは第三者を利用して原材料、部品、部品と消耗品を製造し、品質テストと私たちの製品を輸送します。もしこれらの第三者が疫病或いは大流行に対応するためにサービスを提供する時に遅延或いは中断に遭遇すれば、私たちのサプライチェーンは中断する可能性があり、私たちの製品の製造と販売及び私たちの臨床試験のために候補製品を製造する能力を制限し、そして私たちの研究開発業務に負の影響を与える。このような遅延や中断は、我々の戦略パートナーが義務を履行する能力に悪影響を及ぼす可能性があり、これは、共同開発候補製品の臨床開発または規制承認に影響を与える可能性がある。
さらに、世界的な健康危機の間、1つまたは複数の政府エンティティは、(例えば、米国の“国防生産法案”によって)行動することができる。これは製品に対する私たちの権利や経済的機会を弱化させる。私たちの第三者サービス提供者は、彼らが提供する可能性のあるサービスに対する政府の制限の影響を受けるかもしれない。どのような行動も、私たちの製品と候補製品の開発、生産、流通、または輸出に遅延をもたらし、費用を増加させる可能性がある
買収、合弁、または戦略協力に参加することは、私たちの資本要求を増加させ、私たちの株主を希釈し、私たちに債務を発生させたり、負債を負担したりする可能性がある。
補完的な製品、知的財産権、技術、または事業の許可または買収を含む買収、合弁、協力を行うことができます。このような取引や関係は多くのリスクをもたらすかもしれません
•業務費と現金需要が増加した
•新しい人員の統合に関する困難を含む業務、知的財産権と製品の同化
•経営陣の関心を既存の製品計画と計画から移してください
•重要な人員の流出と私たちの重要な業務関係能力の不確実性を維持する
•そのような取引の他方に関連するリスクおよび不確実性は、その当事者およびその既存製品または候補製品の将来性および規制承認を含む;
•買収した技術や製品から十分な収入を得ることができず、買収の目標を達成することができず、関連する買収や維持コストを相殺することさえできない。
買収を行えば、現金の利用、希釈証券の発行、債務の負担または発生、巨額の使い捨て費用の発生、および重大な将来の償却費用を招く可能性のある無形資産を買収する可能性がある。さらに、適切な買収や戦略的協力の機会を見つけることができなければ、私たちの業務発展に重要である可能性のある技術や製品を開発または獲得する能力が損なわれる可能性があります。
第三者が偽または盗まれたバージョンのメッセンジャーリボ核酸製品を不正に流通および販売したり、メッセンジャーリボ核酸製品を不正に寄贈または転売したりすることは、私たちの財務的業績または名声に悪影響を及ぼす可能性がある。
第三者は、厳格なcGMP製造·検出基準に適合しない偽バージョンのmRNA製品、特にインターネット上で不正に流通·販売することができる。偽薬は有害物質或いは投与量の誤りを含む可能性があり、よく安全或いは無効ではなく、生命に危害を及ぼす可能性がある。しかしながら、ディーラーおよびユーザにとって、偽製品は視覚的に正規品と区別することが困難である可能性がある。
偽製品の副作用の報告、偽または不安全メッセンジャー製品レベルの増加は、私たちのメッセンジャー製品に対する患者の自信に深刻な影響を与える可能性がある。安全でない偽製品または他の非メッセンジャーリボ核酸製品によって引き起こされる有害事象は、誤って私たちのメッセンジャーリボ核酸製品に起因する可能性がある。また、倉庫、工場あるいは輸送途中の在庫が盗まれ、不適切に保存され、許可されていないルートで販売されることは、患者の安全、私たちの名声、私たちの業務に悪影響を及ぼす可能性がある。偽造、窃盗或いは不当な製造過程は国民の信諾信が製品の完全性に自信を失わせ、私たちの業務、運営結果と財務状況に重大な不利な影響を与える可能性がある。また、私たちの製品を不正に寄付したり転売したりすることは、特定の地域での販売能力に悪影響を与え、私たちの業務、運営結果、財務状況に他の悪影響を及ぼす可能性があります。
気候変動や気候変動に対応する法律、法規、あるいは市場措置は私たちの業務、運営結果、財務状況にマイナスの影響を与える可能性がある。
私たちは気候変動に関連する物理的リスク(例えば、気温上昇、洪水、深刻な嵐)、低炭素経済への移行のリスク(例えば、追加の法律や法規の要求、顧客行動および原材料コストと獲得可能性の変化)、社会と人類の影響(例えば、人口流出や健康と福祉への損害)に直面している。これらのリスクは急性(短期)であってもよいし,慢性的(長期)であってもよい。私たちの施設とサプライヤーの気候に関する物理的リスクは私たちの運営とサプライチェーンを乱す可能性があり、これはコスト増加を招く可能性がある。
気候変化及び環境への影響を防止、軽減又は適応するために、新しい法律又は法規要求を公布することができる。これらの規制は異なる司法管轄地域で異なる可能性があり、それらは私たちに新しいまたは拡大された炭素価格や税収、増加したコンプライアンスコスト、温室効果ガス排出への制限、新技術への投資、増加した炭素開示と透明性、データ収集と報告システムへの投資、新しい建築規範を満たすための施設のアップグレード、公共事業システムの再設計を受ける可能性があり、これは私たちが使用する電力とエネルギーコストを含む私たちの運営コストを増加させるかもしれない。私たちのサプライチェーンは、同じ過渡的なリスクの影響を受ける可能性があり、任意の増加したコストを私たちに転嫁することができます。これは、私たちが必要な数量とレベルで業務を運営するために必要な原材料や他の供給を調達する能力に影響を与える可能性があります。
私たちは環境、社会、そして統治(ESG)事務に関連する抱負、目標、開示は私たちを多くのリスクに直面させる。
機関および個人投資家は、ESG選別基準を使用して、私たちが彼らのポートフォリオに参加する資格があるかどうかを決定するようになってきている。投資家および他の利害関係者は、しばしば、野心的なESG目標を設定し、目標、目標の達成の進展、およびESG利害関係者が関心を持つ他の事項について新たで、より強力な開示を提供することを要求する。これに応答して、様々な発展するESGフレームワークに適応するために、会社責任計画の追跡および報告を調整し、ESG事項に関する目標および他の目標を策定し、発表した。これらの目標に関する声明は私たちの現在の計画と願いを反映しており、私たちがこれらの目標を達成できるという保証はない。私たちは、環境や多様性イニシアティブに関連するリスクを含むこれらの目標や目的を達成し、正確に報告するために努力しており、その多くのリスクは、私たちの名声や株価を含む実質的な負の影響を及ぼす可能性がある。
さらに、ESG事項に関する追跡および報告基準は比較的新しく、統一されておらず、進化し続けている。私たちが選択した開示枠組みは各種の報告基準と一致するように努力し、時々変化する可能性があり、異なる時期の一致或いは意義のある比較データの不足を招く可能性がある。さらに、我々のプロセスおよび制御は、常に識別、測定、および報告ESG指標の持続的な発展の基準に適合しているわけではなく、報告基準の解釈は、時間の経過とともに変化する可能性があり、いずれも、これらの目標の達成における我々の目標の重大な修正または報告の進展をもたらす可能性がある。
私たちのESG実践が投資家または他の利害関係者の絶えず変化する期待および基準を満たすことができない場合、私たちの名声、従業員を吸引または維持する能力、および投資、ビジネスパートナー、または買収者としての私たちの吸引力は否定的な影響を受ける可能性がある。同様に、私たちは、私たちが発表した期間内に私たちの目標、指標、目的を追求したり、達成できなかったり、様々な報告基準を満たしていなかったり、同様の負の影響を与える可能性があり、政府の法執行行動と個人訴訟に直面させる可能性があります。
もし私たちが環境、健康、安全の法律法規を守らなければ、罰金や処罰を受けたり、私たちの業務を損なう可能性のあるコストが発生するかもしれません。
私たちは多くの環境、健康と安全法律と条例の制約を受けて、化学品と生物材料を含む廃棄物、化学品と生物材料の法律と条例を含む、実験室の手続きおよび処理、使用、貯蔵、処理、処理と処理と可燃性材料および廃棄物を含む。私たちは通常第三者と契約を結び、これらの材料と廃品を処理して、私たちはこれらの材料による汚染や傷害のリスクを取り除くことができません。もし私たちがどんな危険な材料を使用して汚染や損傷をもたらしたら、私たちはそれによるいかなる損害に責任を負うかもしれないし、どんな責任も私たちの資源の範囲を超えているかもしれない。私たちはまた、このような法律や法規を守らないことで、民事や刑事罰金、処罰、または他の制裁に関連する巨額の費用を招く可能性があります。私たちはこのような法律法規を遵守することで巨額のコストが生じる可能性もありますが、これらの法律法規は私たちの研究、開発、生産努力を損なう可能性があります。
私たちの労災賠償保険は、従業員が危険材料を使って怪我をした潜在的な責任に十分な保険を提供できないかもしれません。私たちは私たちが生物や危険材料を貯蔵したり処分したりすることで、私たちが提起した環境責任や有毒侵害請求に保険を提供することはできません。
私たちの普通株式所有権に関連するリスク
私たちの普通株の価格はずっと不安定で、これは株主に大きな損失をもたらすかもしれない。
私たちの株価は大幅な変動の影響を受けており、引き続きそうなると予想される2018年12月に初公募株式を公開して以来、o私たちの株価は最高1株497.49ドルから最低1株11.54ドルまで様々です。2020年初めに私たちが新冠肺炎ワクチン開発を開始して以来、私たちの株は明らかかつ長時間の変動を経験しており、これは私たちの株主に大きな損失をもたらす可能性がある。我々、政府機関、メディア、競争相手、金融アナリスト、または新冠肺炎に関連する他の人々が発表した公開声明は、私たちの株価を大幅に変動させる可能性がある。この話題に関する公開情報は、正確であるか否かにかかわらず、我々の株価に過大な影響を与え続ける(積極的であっても消極的であっても)
全体的に、株式市場、特にバイオ製薬会社の市場は、極端な変動を経験しており、この変動は往々にして特定の会社の経営業績とは関係なく、最初の購入価格以上で株を売ることができないかもしれない。私たちの普通株の市場価格は多くの要素の影響を受けるかもしれません
•私たちの新冠肺炎ワクチンの売上と予想される製品収入
•他の製品の商業投入や
•私たちの候補製品または競争相手の臨床試験または進行の時間と結果
•競争力のある製品や技術の成功
•新しいまたは既存のSARS-CoV-2ウイルス変種の出現または減少;
•私たちの製造、規制、商業化努力の発展、または競争相手のこのような努力に関する情報
•アメリカや他の国の法規や法律の発展
•特許出願、発行された特許または他の固有の権利に関連する発展または紛争;
•キーパーソンの採用や退職
•私たちの製品や臨床開発計画に関する費用は
•私たちは他の候補製品の結果を発見、開発、取得、または許可するために努力している
•財務業績の見積もり、発展スケジュール、あるいは証券アナリストの提案に対する実際または予想変化
•私たちの財務業績や私たちと似ていると思われる会社の財務業績の違い
•医療支払い制度の構造を変え
•一般的な経済、産業、市場状況、特に生物製薬部門;
•私たちまたは私たちの競争相手は、重大な買収、戦略的パートナーシップ、合弁企業、または資本約束の開始または終了を宣言します。
証券集団訴訟は往々にして会社の株価が一定の変動を経験した後に提起される。私たちにこのような訴訟を提起すれば、巨額の弁護コストが生じる可能性があり、経営陣の注意力や資源が移転される可能性があり、これは私たちの業務、財務状況、および運営と将来性に悪影響を及ぼす可能性がある。
私たちの主要株主と経営陣は私たちのかなりの割合の株を持っており、株主の承認が待たれる事項に大きな制御を加えることができるだろう。
2024年2月16日現在、我々の役員、取締役、関連株主は約12%の発行済み普通株を直接または間接的に所有している。さらに、非付属会社の5%以上の株主が私たちが発行した普通株の約27%を保有している。この株主たちは彼らの所有権地位を通じて私たちに影響を与えることができるだろう。例えば、彼らが一緒に行動すれば、彼らは取締役選挙、私たちの組織文書を修正したり、任意の合併、資産売却、または他の重大な会社取引などの事項を承認することに大きな影響を与えることができる。これは私たちの株主がこれが彼らの最適な利益に合っていると思うかもしれないので、私たちの普通株に対する能動的な買収提案や要約を阻止または阻止する可能性がある。
私たちが組織した文書の条項やデラウェア州法律の条項は、第三者が私たちの現在の経営陣を買収したり、更迭したりすることをより困難にしたり、コストを高くしたりするかもしれません。そうしても、私たちの株主に利益を与えます。
当社の会社登録証明書(定款)、改正及び再記載の定款(付則)及びデラウェア州法律に含まれる条項は、敵意の買収やわが統制権の変更やわが経営陣の変更を延期または防止することができます。私たちの規約と付例は以下の条項を含む
•“空白小切手”優先株を付与し、株主の承認を必要とせずに当社取締役会から発行を許可することができ、当社の普通株よりも高い投票権、清算権、配当、その他の権利を含む可能性がある
•メンバーが3年間交互に勤務している分類された取締役会を作成した
•株主特別会議は当社の取締役会でしか開催できないことを明確に規定している
•株主が書面の同意の下で行動することを禁止する
•株主の年次株主総会での承認のための事前通知プログラムを作成し、指名された取締役会メンバーの人選を提案することを含む
•私たちの役員は理由がある場合にのみ免職されることになっています
•私たちの取締役会の空きは、当時在任していた取締役の大多数が埋めることしかできないことになっていた
•いかなる株主も取締役選挙で投票権を累積してはならないことを明確に規定している
•当社の取締役会が当社の定款を修正、変更または廃止することを明確に許可します
•私たちの定款と定款の具体的な規定を修正するためには、私たちの普通株式保有者の絶対多数票が必要だ。
また、私たちはデラウェア州で登録されているので、私たちはデラウェア州会社法第203条の規定によって管轄されています。この条項は、私たちが発行した議決権株の15%以上の株主が私たちと合併または合併する能力を持つことを制限しています。私たちの定款、定款、あるいはデラウェア州法律では、制御権の変更を延期または阻止する条項は、私たちの株主が彼らの株からプレミアムを得る機会を制限する可能性があり、また、一部の投資家が私たちの普通株に支払いたい価格に影響を与える可能性があります。
私たちは予測可能な未来に私たちの株に現金配当金を支払わないと予想されているので、資本増加(あれば)があなたの唯一の収益源になるだろう。
私たちは現在私たちの株の現金配当金を発表したり支払うつもりはありません。私たちは現在、私たちの将来のすべての収益を維持して、私たちの業務の成長と発展に資金を提供したり、株式買い戻しを通じて株主に現金を返したりするつもりです。しかも、未来のどんな債務協定の条項も私たちが配当金を支払うことを阻止するかもしれない。したがって、私たちの普通株の資本付加価値は(もしあれば)あなたが予測可能な未来に唯一の収益源になるだろう。
私たちの定款は、デラウェア州衡平裁判所またはアメリカマサチューセッツ州地域裁判所が私たちの株主として提起する可能性のある訴訟の独占フォーラムを指定し、これは、私たちの株主が私たちとの紛争について有利な司法フォーラムを得る能力を制限するかもしれない。
定款によると、私たちが書面で代替裁判所を選択することに同意しない限り、デラウェア州衡平裁判所は、(1)私たちを代表して提起された任意の派生訴訟または訴訟に関連し、(2)私たちの任意の現職または前任取締役、上級職員または他の従業員が、私たちまたは私たちの株主に対する受託責任に違反すると主張するいかなる訴訟、(3)私たちまたは私たちの任意の現職または前任取締役、上級職員、デラウェア州会社法又は我々の定款の任意の規定により生成された従業員又は株主、又は(4)内部事務原則によって管轄されるクレームを主張する行為(デラウェア州フォーラム条項)。デラウェア州フォーラム条項は証券法や取引法によって発生したいかなる訴訟根拠にも適用されないだろう。私たちの付例はさらに、米国マサチューセッツ州地域裁判所は、訴訟によって発生したクレームを解決するための任意のフォーラムであることを規定している
証券法(連邦フォーラム条項)によると。私たちの規約では、私たちの普通株式の権益を購入または他の方法で獲得した個人または実体は、デラウェアフォーラム条項と連邦フォーラム条項を知って同意したとみなされます。
デラウェアフォーラム条項および連邦フォーラム条項は、株主がこのようなクレームを出したときに、特に株主がデラウェア州またはマサチューセッツ州連邦(場合によっては)またはその近くに住んでいない場合、株主に追加の訴訟費用を適用する可能性がある。さらに、私たちの規約における裁判所選択条項は、私たちの株主が私たちまたは私たちの役員、上級管理者または従業員との紛争に対して有利な司法フォーラムを得る能力を制限する可能性があり、これは、私たちと私たちの役員、上級管理者、および従業員に対する訴訟を阻害する可能性があり、たとえ訴訟が成功すれば、私たちの株主に利益をもたらすかもしれませんデラウェア州最高裁判所は2020年3月に、デラウェア州法律によると、証券法によるクレームを要求するための連邦裁判所選択条項は表面的に有効であると判断したが、他の裁判所が我々の連邦フォーラム条項を実行するかどうかにはまだ不確実性がある連邦フォーラム条項はまた、その条項が実行不可能または無効であると主張する株主に追加の訴訟費用を適用する可能性があり、連邦フォーラム条項が実行不可能であることが発見された場合、私たちはこのような問題を解決する際に追加的なコストを発生させる可能性がある。デラウェア州衡平裁判所および米国マサチューセッツ州地域裁判所もまた、訴訟の株主が存在するか、または訴訟を提起する裁判所を選択する可能性があり、このような判決は、私たちの株主に多かれ少なかれ有利である可能性があることを含む、他の裁判所とは異なる判決または結果を下す可能性がある。
一般リスク因子
私たちの従業員、首席調査員、コンサルタントは、規制基準と要求を守らないこと、インサイダー取引を含む不適切な行為や他の不適切な活動に従事する可能性があります。
私たちは従業員、私たちの臨床試験をリードする主要な研究者とコンサルタントの詐欺または他の不当な行為のリスクに直面している。このような不正行為には、FDA法規または他の司法管轄区の同様の法規を遵守できなかったこと、FDA、EMAおよび他の規制機関に正確な情報を提供できなかったこと、米国および海外の医療詐欺および法律法規を遵守できなかったこと、または財務情報またはデータを正確に報告できなかったこと、または不正な活動を開示することができなかったことが含まれる可能性がある。このような不正行為はまた、臨床試験またはFDAまたは他の監督管理機関との相互作用中に得られた情報の不適切な使用に関連する可能性があり、これは規制制裁と私たちの名声に深刻な損害をもたらす可能性がある。医療保健業界の販売、マーケティングと商業手配は広範な法律法規の制約を受け、詐欺、不当行為、リベート、自己取引とその他の濫用行為を防止することを目的としている。これらの法律法規は、広範な定価、割引、マーケティングと販売促進、販売手数料、顧客激励計画などの業務手配を制限または禁止している。私たちは常に従業員の不適切な行為を識別し、阻止することができるわけではなく、未知または未管理のリスクや損失を制御できない可能性があり、これらの法律や法規を遵守できないことによる政府の調査や他の行動や訴訟から私たちを保護する措置を講じることができないかもしれない。もし私たちにこのような行動を取ったら、これらの行動は、巨額の罰金または他の制裁を加えることを含む、私たちの業務、財務状況、運営結果、および見通しに大きな影響を与えるかもしれない。
病気の発生、戦争、衝突、または他の政治的不安定、または地政学的リスクを含む不利な米国または世界的な経済状況は、私たちの業務、財務状況に悪影響を及ぼす可能性がある行動の結果でもあります
我々の業務結果は、大流行、戦争、衝突、または他の政治的不安定による妨害を含む、世界経済および金融市場の全体的な状況の悪影響を受ける可能性があり、ロシアのウクライナへの侵入、それによってロシアに実施される制裁または中東紛争を含む。不利なマクロ経済状況、およびインフレ、成長減速、金利上昇、失業率上昇、景気後退のような現在または未来の状況に対する見方や期待は、私たちの業務と財務状況にマイナスの影響を与える可能性がある。さらに、戦争、衝突、政治的不安定、または他の不利な経済状況を含む世界的な事件は、将来的に各国政府が医療から支出を移し、負の影響を与える可能性がある私たちの製品の即売性。
いかなる深刻または長期的な経済低迷も、私たちの薬品に対する需要が弱まり、必要に応じて有利な条件で追加資本または融資を調達する能力にマイナスの影響を与えるなど、私たちの業務に様々なリスクをもたらす可能性がある。疲弊した経済や衰退した経済は、私たちのサプライヤーに圧力を与え、供給中断を招く可能性があり、または第三者支払者または私たちのパートナーが私たちのサービスの支払いを遅延させる可能性があります。上記のいずれも私たちの業務を損なう可能性があり、現在の経済気候や金融市場の状況が私たちの業務に悪影響を及ぼす可能性のあるすべての方法を予見することはできません。
しかも、地政学的緊張は私たちの業務と商業計画に悪影響を及ぼすかもしれない。例えば、米国政府は、ある市場にメッセンジャーリボ核酸技術や私たちの製品を輸出する制限や、ある外国司法管轄区に製造施設を設立することへの制限は、私たちの競争地位を損なう方法で商業成長機会を求めることを阻止するかもしれない。
従業員訴訟と否定的な宣伝は私たちの未来の業務に否定的な影響を及ぼすかもしれない。
私たちの従業員は時々私たちを傷つけ、敵意を作る職場、差別、給料と労働紛争、セクハラ、または他の雇用問題について私たちを訴訟するかもしれない。最近、差別と嫌がらせクレームの数は全体的に増加している。加えて、ソーシャルメディアプラットフォームと類似設備の拡張により、個人が広範な受け手に接触できるようになり、これらの言い方はいくつかの企業に重大なマイナス影響を与えた。雇用や嫌がらせ関連訴訟に直面している会社の一部は、経営陣や他の要人を解雇せざるを得ず、名声被害を受けている。雇用関連のいかなるクレームも私たちの業務に否定的な影響を及ぼす可能性がある。
無効な内部統制は私たちの業務と経営業績に悪影響を及ぼす可能性があります。
人為的な誤り、情報技術システムの故障或いは中断、制御上の回避或いは凌駕或いは凌駕を含む固有の限界があるため、我々は財務報告の内部統制に対して誤り陳述を防止或いは発見できない可能性がある。有効な内部統制であっても、財務諸表の作成と公平な列報に合理的な保証を提供することしかできない。必要な新しい制御や改善された制御を実施できなかった場合、またはこれらの制御を実施する際に困難に遭遇した場合、私たちの業務および経営業績が損なわれる可能性があり、財務報告義務を履行できない可能性がある。
税法の変化は私たちの業務と財政状況に悪影響を及ぼすかもしれない。
私たちが運営している司法管轄区域で、私たちは絶えず変化して複雑な税法の制約を受けている。アメリカ連邦、州、地方、非アメリカ所得税に関する規則は絶えず立法と税務当局の審査を受けている。税法の変化(遡及適用可能)は、私たちと私たちの株主に悪影響を及ぼす可能性がある。近年、これらの変化はすでに発生しており、将来的に変化する可能性があり、これは私たちの業務、キャッシュフロー、財務状況、経営業績に重大な悪影響を及ぼす可能性がある。
ソーシャルメディアプラットフォームの使用はますます多くなり、リスクと挑戦をもたらしている。
ソーシャルメディアは、私たちの研究、候補製品、商業製品、ならびに私たちの製品および候補製品が治療を目的としている疾患を交流するためにますます使用されている。バイオ製薬業界のソーシャルメディア実践は発展し続けており,このような使用に関する法規は常に明確ではない。このような不確実性は、私たちの業務に適用される法規を遵守しないリスクをもたらし、私たちに規制行動をとる可能性がある。例えば、被験者は、進行中の盲目的臨床試験における彼らの経験をレビューするためにソーシャルメディアチャネルを使用して、またはいわゆる有害事象を報告することができる。このような開示が発生した時、私たちは適用された有害事象報告義務を監視して守ることができないかもしれないし、あるいは候補製品に対する私たちの発言が制限されているため、私たちはソーシャルメディアによって生じる政治的および市場的圧力の下で私たちの業務を守ることができないかもしれない。いずれのSNSにおいても、敏感な情報または否定的または不正確な投稿またはコメントを不適切に開示するリスクがある。もしこのような事件が発生したり、私たちが適用された法規を遵守できなかった場合、私たちは責任を負い、規制行動に直面したり、私たちの業務に他の損害を与える可能性があります。
項目1 B。未解決従業員意見
ない。
プロジェクト1 C。ネットワーク·セキュリティ
ネットワークリスク管理と戦略
我々のサイバーセキュリティ組織の使命は、サイバー攻撃のリスクを低減し、脅威を迅速に検出と抑制し、重要なデータのリスクを低減するための的確なサービス、支援と能力を提供することである。
全世界のセキュリティホールとネットワーク攻撃の脅威を認識し、著者らは首席情報セキュリティ官(CISO)と首席情報官(CIO)が監督するネットワークセキュリティ計画を制定し、患者の信頼を保護し、Modernaブランドを守り、ネットワーク攻撃のリスクと影響を下げることを目的とした。我々のネットワークセキュリティ計画は、ネットワークセキュリティ技術によってサポートされる定期的なリスク評価およびセキュリティテストを含む業界基準に準拠し、これらの技術は、ネットワーク脅威からのリスクを監視、識別、管理するための第三者セキュリティ解決策、脆弱性管理および監視ツールを含む。さらに、私たちは職員たちの安全と意識訓練を実施した
管理層は、ネットワークセキュリティ脅威からのリスクを評価、識別、管理し、ネットワークセキュリティイベントを検出したときに迅速に反応するためのネットワークイベント応答計画(CIRP)を構築した。私たちは、重大なネットワーク事件が発生した時に私たちの指導者応答チームに通知し、状況に応じてこれらの事件を私たちの監査委員会と取締役会に報告するためのプロセスを作成した。我々はこれまで,我々の業務戦略,運営結果,財務状況に実質的な影響を与えるネットワークセキュリティイベントを経験していない.
私たちは毎年何回か内部コンプライアンス監査と外部審査を行い、ネットワークセキュリティ制御措置を含めて私たちの制御措置を評価しています。第三者リスクをできるだけ少なくするために、関連するサプライヤー認証およびセキュリティの審査、適用および適切な標準化情報収集(SIG)アンケートへの回答を含む第三者サプライヤーのセキュリティ慣行および関連リスクを評価するプログラムを構築した
ネットワークセキュリティリスクに関するガバナンス
私たちの取締役会はModernaの全体的なリスク管理戦略を監督する責任がある。取締役会は主にその監査委員会を通じてネットワークセキュリティ脅威のリスクを監督し、この委員会は私たちの情報セキュリティと技術リスクのリスク管理プログラムを監督する。私たちのネットワークセキュリティリスク管理プロセスは、監査委員会が監督する全体的なリスク管理戦略に組み込まれている。監査委員会は、少なくとも毎年、情報セキュリティと技術的リスク、任意の監査結果を含む、私たちの内部監査者と私たちのリスク管理計画を議論します
監査委員会は委員会会議で、我々のCISOを含む管理層のネットワークに関する最新の状況を受け取った。会議期間中,弊社はModernaのネットワークセキュリティ態勢,潜在的脅威とリスク緩和戦略,および会社のネットワークセキュリティ取り組みの進捗状況を適宜委員会に通報する。監査委員会議長と経営陣は適宜定期的に取締役会全員にこのような事項を通報する
経営陣では,我々のCISOは主にネットワークセキュリティ戦略をリードし,ネットワークセキュリティ脅威からの重大なリスクを評価·管理している.我々の現在のCISOは多くの業界で25年を超えるネットワークセキュリティ経験を持っており、最近は2つの異なる上場企業で指導職を務め、以前は多国籍科学技術会社でますます多くの責任を担当してきた。私たちのCISOは私たちのCIOに直接報告し、CIOは私たちの実行委員会のメンバーであり、私たちのCEOに報告します
私たちは、キーサービスと一致し、個々のリーダーが各サービス製品を監視するためのネットワークセキュリティリーダーチームを構築しており、これらはすべてCISOに報告されている。また、私たちのネットワークセキュリティ、情報、リスク管理努力を支援するために、法執行部門や業界団体と関係を保っています。
項目2.財産
私たちはマサチューセッツ州に二つの主キャンパスがあります。2023年第3四半期、マサチューセッツ州ケンブリッジ市の不動産のレンタルを開始しました。この敷地約462,000平方フィートの建物は私たちの新しいModerna科学センターに指定されています。MSCは、私たちの主な実行オフィスを含む科学とオフィスの組み合わせを収容するだろう。レンタル期間は15年で、レンタル期間を最大2つ7年延長することができます。私たちは2024年初めに段階的に転入する予定だ。また、マサチューセッツ州ケンブリッジ市の科学技術広場に複数の建物の園区を持ち、オフィスと研究実験室で構成され、総面積は約292,000平方フィートである。レンタル契約は2025年初めに満期になります。ケンブリッジ園区はわが社の本部、プラットフォーム、薬物発見と臨床開発の所在地である
Moderna技術センターはマサチューセッツ州ノーウッドに位置し、主に三つの建物から構成されている(南技術センター、北技術センターと東技術センター)。MTC園区の敷地は約686,000平方フィートであり、実験室と事務空間を含み、直接に私たちの製造能力及び商業と臨床活動を支持する。MTCパークのレンタル期間は2042年までで、私たちはさらに3つの5年間を延長することを選択することができます
2023年第2四半期、私たちはマサチューセッツ州マルバーレで140,000平方フィートの新設生物製造施設を買収しました。この施設は既存の構造に基づいて60,000平方フィートを増加させることを含めて改良されている。完成後、この施設はオフィスとメッセンジャーリボ核酸生産エリアを特色とし、完全な製造クリーンルーム、品質管理実験室、即時衛星倉庫、および追加のオフィススペースを含む。私たちはこの施設が2025年に運営されると予想している。この新しいウェブサイトは私たちのINT計画を戦略的に支持することを目的としている。
私たちはまた、私たちの業務運営のために、世界で様々なブロック、オフィス、実験室空間を持ってレンタルしています。
項目3.法的訴訟
私たちは様々なクレームと法律手続きに関連しています。これらのクレームと法律手続きは私たちの業務において正常な過程とみなされています
知的財産権訴訟は以下のとおりである.このようなクレームが提起されたほとんどの問題は非常に複雑で、大きな不確実性がある。私たちが直面しているこれらの他の法的手続きに関するリスクの説明については、第1部、第1 A項、“リスク要因”は、“私たちの知的財産権に関するリスク”と“私たちの商業製品及び候補製品の製造に関するリスク”というタイトルの議論を含む
このような訴訟の結果は、事件にかかわらず、本質的に不確実である;そのため、損失の可能性と任意の推定された損害を評価することは困難であり、かなりの判断が必要である。我々は、以下に、重大な損失が可能である(I)可能であるが不可能である、および/または(Ii)現在合理的に推定できない法的事項について説明する。
ファイザー/BioNtech特許訴訟
2022年8月、私たちは米国マサチューセッツ州地域裁判所に訴訟を提起し、ファイザー(ファイザー)とBioNTech SE、BioNTech製造有限会社およびBioNTech US Inc.(総称してBioNTechと呼ぶ)が、ファイザーおよびBioNTechがそのMRNA新冠肺炎ワクチンのうち、私たちの遺伝子プラットフォーム技術および疾患特異的ワクチン設計に関連するいくつかの米国特許を製造および販売したことを告発した。起訴状は主張された特許と金銭的損害の侵害に対する判決を求めた。
同様に2022年8月に、私たちはドイツ(デュッセルドルフ地方裁判所)、オランダ(ハーグ地方裁判所)、イギリス(イングランドとウェールズ高裁)でいくつかのヨーロッパ特許についてファイザー、BioNTechと関連実体に対して特許侵害訴訟を提起し、これらの特許はまた私たちのmRNAプラットフォーム技術と疾病特異的ワクチン設計に関連し、コロナウイルスを含む。2023年5月、私たちはアイルランド(高等裁判所)とベルギー(ブリュッセル商業裁判所)で同じ欧州特許についてファイザー、BioNTech、および関連エンティティに対して特許侵害訴訟を提起した。米国の訴訟と同様に、私たちは主張する特許と金銭損害の侵害に対する判決を求めている。
ファイザー社やBioNTech SEもイギリスで訴訟を起こしており,何らかのModerna特許の撤回を求めている。また,欧州訴訟で主張されているModerna特許も,ファイザーやBioNtech SEなど,反対通知の制約を受ける.このような行動は欧州特許庁に提出された特許を撤回することを目的としている
Arbutusが所有する特許に関する法的手続き
2022年2月、Arbutus Biophma Corporation(Arbutus)とGenevant Sciences GmbH(Genevant)は、我々が生産·販売した新冠肺炎ワクチンが脂質ナノ粒子に関するいくつかの米国特許を故意に侵害したと主張する米国デラウェア州地域裁判所に訴訟を提起した。起訴状は,いわゆる特許侵害の判決と金銭損害賠償を求めているが,我々の新冠肺炎ワクチンのマーケティングや販売を阻止または停止することは求められていない。
Alnylamが所有する特許に関する法的手続き
Alnylam製薬会社(Alnylam)は2022年3月と2022年7月、米国デラウェア州地方裁判所に、我々が生産·販売している新冠肺炎ワクチンがカチオン性脂質に関連するいくつかの米国特許を侵害したと主張する2つの訴えを米国に提出した。2023年8月25日,裁判所はこれらの訴訟においてすべての主張の特許を侵害しない最終審判決を下した。Alnylamはこの判決について連邦巡回控訴裁判所に控訴した。Alnylamは2023年5月、カチオン性脂質に関する他の3つの米国特許を主張するために、米国デラウェア州地方裁判所に3件目の訴訟を提起した。これらのクレームは,我々が主張する特許や金銭的損失を侵害しているとの判定を求めているが,我々の新冠肺炎ワクチンのマーケティングや販売を阻止または停止することは求められていない。
プロジェクト4.鉱山安全情報開示
適用されません。
第II部
項目5.登録者普通株式市場、関連株主事項、発行者による株式証券の購入
私たちの普通株の市場
私たちの普通株はナスダック全世界の精選市場で取引して、コードは“mRNA.”です
株式表現グラフ
取引法については、以下の業績グラフは“資料募集”とみなされてはならないし、米国証券取引委員会に“届出”されたものとみなされてはならないし、他の方法でこの条項の下の責任を負うものとみなされてはならないし、Modernaが証券法や取引法に基づいて提出されたいかなる文書に引用されているともみなされてはならない。
次の図は、2023年12月31日までの5年間の標準株式指数、ナスダックバイオテクノロジー指数と標準プール500株指数の累積総リターンの比較を示しています (S指数)は、株式1株当たりの初期投資が100ドルであり、すべての配当金が再投資を行う。このような見返りは歴史的結果に基づいており,未来を示唆するための表現ではない
次の図に示す比較は履歴データに基づく.我々は,次の図に示す株価表現は,必ずしも我々の普通株の潜在的な未来表現を予測するつもりもないことを示していると警告する
株主.株主
2024年2月16日現在、私たちは約75人の登録株主がいます。我々の多くの流通株はブローカーや他の機関の口座に保有されているため,受益所有者の数は記録保持者の数よりも明らかに多い.この数の登録所有者は、その株式が他のエンティティが信託形式で保有する可能性のある株主も含まれていない。
配当政策
私たちは普通株の現金配当金を発表したり支払ったりしたこともなく、予測可能な未来に普通株の配当金を支払うことを期待していない
株式補償計画に基づいて発行された証券
本年度報告書10-K表第3部第12項における当社の株式報酬計画に関する情報は、ここに組み込まれて参考になります。任意の将来配当金の決定は、私たちの取締役会が適宜決定し、適用される法律、私たちの運営結果、財務状況、将来の見通し、適用される契約制限、および私たちの取締役会が関連すると思う他の任意の要素を含む様々な要素に依存します。投資家は現金配当金を得ることを期待して私たちの普通株を購入してはいけない。
最近売られている未登録証券
ない。
発行人が株式証券を購入する
2022年8月1日、私たちの取締役会は株式買い戻し計画を承認し、私たちの普通株を買い戻し、金額は30億ドルに達し、満期日がなかった。2023年12月31日までの3ヶ月間、株式の買い戻しはなかった。私たちの取締役会は2023年12月31日まで、普通株の買い戻し許可のうち17億ドルが返済されておらず、満期日はありません。
参考までに注12私たちの株式買い戻し計画に関する情報は、連結財務諸表を参照されたい。
第六項です[保留されている]
プロジェクト7.経営陣の財務状況と経営成果の検討と分析
あなたは私たちの財務状況と経営結果の以下の議論と分析、ならびに私たちの連結財務諸表と関連する付記、本年度報告書にForm 10-K形式で出現した他の財務情報を読むべきです。本議論および分析に含まれるいくつかの情報または本Form 10−K年次報告における他の情報は、リスクおよび不確実性に関する前向きな陳述を含む、我々の業務計画および戦略に関する情報を含む。本年度報告10-K表“第I項第1 A項-リスク要因”の一部に記載された要因を含む多くの要因の影響により、我々の実際の結果は、以下の議論および分析に含まれる前向き陳述に記載されているか、または示唆された結果とは大きく異なる可能性がある。
概要
私たちはバイオテクノロジー会社でメッセンジャーRNA(メッセンジャーRNA)から作られた新しい薬を開発していますメッセンジャーリボ核酸薬は、ヒト細胞の細胞内、膜または分泌タンパク質の産生を誘導することを目的としており、これらのタンパク質は治療または予防のメリットがあり、広範な疾患を治療する可能性がある。著者らのプラットフォームはメッセンジャーリボ核酸科学、交付技術と製造方面の絶えずの進歩を基礎と応用した上で、新しい開発候補の強力なルートを同時に求める能力を提供した。我々は,感染症,免疫腫瘍学,まれな疾患,自己免疫疾患に対する療法とワクチンを独立して我々の戦略パートナーと共同開発している。
2010年に設立されて以来、著者らはすでにmRNA領域プロジェクトを推進する研究段階会社から商業企業に転換し、6種類の形式のワクチンと治療薬物の多様な臨床製品の組み合わせ、広範な知的財産権の組み合わせと集成の製造能力を持ち、それによって大規模な迅速な臨床と商業生産を実現した。我々の45の開発プロジェクトのうち,多様かつ広範な開発パイプラインがあり,42の開発候補があり,そのうち40件が臨床研究を行っている。
私たちの新冠肺炎ワクチンは私たちの最初の商業化製品であり、承認された場合、Spikevaxの名前で発売された。著者らの最初のワクチンmRNA-1273はSARS-CoV-2祖先毒株に対して、著者らは著者らのmRNAプラットフォームを利用して迅速に著者らのワクチンを新たに出現したSARS-CoV-2毒株に適応させ、ウイルスの変化と監督ガイドラインの更新に伴い保護を提供した。
2023年ビジネスのハイライト
2023年9月11日、我々は、12歳以上の個人に対して、SARS-CoV-2のオミックXB.1.5サブタイプ(MRNA-1273.815)に対する更新された新冠肺炎ワクチンの生物製品補充許可申請に対する米国食品医薬品局(FDA)の承認を得た。アメリカ食品と薬物管理局はまた6ケ月から11歳までの児童のためにmRNAs-1273.815の緊急使用許可を発表した。その後、私たちは世界的な規制機関によるメッセンジャーリボ核酸-1273.815の許可を得て、アメリカと国際的に用量の輸送を開始した。
2023年12月31日までの1年間で,新冠肺炎ワクチンの製品純売上高は67億ドルであることが確認されたが,2022年12月31日と2021年12月31日までの年度はそれぞれ184億ドルと177億ドルであった
2023年1月、我々は、我々の呼吸器合胞体ウイルス(RSV)ワクチン候補ワクチン(mRNA-1345)に対する重要なRSV征服研究の中期分析の積極的なデータを発表した。この研究では,mRNA−1345が主要な治療効果の終点に達し,高齢者RSV下気道疾患に対するワクチンの有効性は83.7%であることが証明された。我々は、60歳以上の成人のRSVワクチンに対する生物製品ライセンス申請をFDAに提出し、審査を加速させるために優先審査証明書を使用した。米国以外のいくつかの国の医療当局にも、60歳以上の成人ワクチンに対するマーケティング許可申請を提出しました。mRNA-1345の製造を開始し、2024年に市場を発売する予定で、承認を待たなければなりません。
2023年第3四半期、私たちは新冠肺炎業務コスト構造を最適化する戦略措置を開始し、重点的に私たちの製造コスト構造を調整することである。この計画の開始は,2023年第3四半期に長期計画を完成させ,ワクチン接種率の改訂予測を取り入れたためである。これらの予測は市場の新冠肺炎の大流行状態から季節性地方性市場への転換を説明した。したがって、この戦略転換はこの四半期の費用を14億ドルに導いた。2023年第4四半期、私たちの計画は1.69億ドルの追加費用を発生させた。これは私たちの財務諸表に直接影響を与えているにもかかわらず、この戦略的措置は私たちの製造業務の効率を高め、将来の市場ニーズに応じて私たちの規模を柔軟に調整できるようになると信じています。
開発を計画する
2023年12月31日現在,我々の45の開発プロジェクトのうち9つが後期開発段階にあり,3期にある7項目と2024年に重要な研究に入る予定のまれな疾患プロジェクト2つが含まれている
呼吸器ワクチン
•呼吸器合胞体ウイルス(RSV)ワクチン:我々は、RSV関連下気道疾患(RSV-LRTD)および60歳以上の成人の急性呼吸器疾患(ARD)(mRNA-1345)の予防のために、規制部門の許可を申請した。私たちは2024年上半期に規制部門の承認を受ける予定だ。我々は強い競争力でRSV市場に進出し、発売時に唯一利用可能なプリチャージ式注射器製品、及び強力な治療効果データ、良好な安全性と耐性及び2023年に確立された広範な消費者意識と需要として予想される。
•次世代新冠肺炎ワクチン:著者らの次世代新冠肺炎候補ワクチンは冷蔵庫安定(MRNA 1283)として設計され、現在肝心な第三段階の研究にある。私たちはこの研究が2024年上半期にデータを発表すると予想している。
•季節性インフルエンザワクチン:著者らの季節性インフルエンザ候補ワクチン(mRNA-1010)は三つの第三段階試験において一貫して許容できる安全性と耐性を証明した。最近の第3段階試験では,mRNA−1010はすべての免疫原性終点に達し,現在許可されているワクチンよりも高い力価を示した。単独の1/2段階研究では、現在許可されている増強ワクチン(福州HD)と比較して、mRNA 1010の力価も高いか比較可能である。私たちは2024年に申請を提出する予定で規制機関と議論している。
•季節性インフルエンザ+新冠肺炎ワクチン:著者らの季節性インフルエンザと新冠肺炎連合候補ワクチン(MRNA 1083)の第三段階試験はすでに全面的に登録された。私たちはこの研究が2024年にデータを発表すると予想している。
潜伏ワクチンや他のワクチンは
•サイトメガロウイルス(CMV)ワクチン:著者らのCMV候補ワクチン(mRNA-1647)の肝心な第三段階研究はすでに全面的に組み入れられ、病例を蓄積し、出産適齢女性の原発感染予防における有効性、安全性と免疫原性を評価した。私たちは2024年にこの研究が潜在的な治療効果データを提供すると予想している。
腫瘍学治療学
•個別化新抗原治療(INT):我々は引き続き我々のINT計画(mRNA−4157)の潜在的な臨床的メリットを示し,メルク社と協力してこの計画を開発している。2つの独立した3期試験は、切除されたハイリスク(III/IV期)黒色腫および完全切除II、IIIAまたはIIIB期非小細胞肺癌患者に組み込まれ続けた。私たちとメルク社は2024年に彼らの臨床研究をより多くの腫瘍タイプに拡張する予定です。
2023年12月、我々は、INTとメルク社の抗PD-1療法KEYTRUDAと併用して切除に使用されたハイリスク黒色腫患者の結果を評価する2 b期研究の3年間分析結果を公表した。この組み合わせはKEYTRUDA単独と比較して無再発生存率の改善を継続し,再発や死亡のリスクを49%低下させ,遠隔転移のない生存率では遠隔転移や死亡のリスクを62%低下させた。
珍しい病気
•プロピオン酸血症(PA)とメチルマロン酸血症(MMA):2024年にPA(mRNA−3927)とMMA(mRNA−3705)に対するまれな疾患治療計画を重要な研究に進めていきたい。
その他業務動態
2023年1月、私たちは8600万ドルでOriCiro Genonics K.K.を買収した。これは日本に本部を置く民間生物技術会社であり、主に無細胞DNA合成と増幅技術に集中している。この買収により、著者らはmRNAを製造する重要な構成要素である無細胞合成とプラスミドDNAを増幅するツールを獲得した。OriCiroの技術は戦略的に私たちの製造プロセスを補完しており、研究開発をさらに加速させることが予想される。
2023年2月、我々はLife Edit Treateutics Inc.(LIFE編集)と戦略的協力と許可協定を締結し、発見と開発に協力した体内にあるメッセンジャーリボ核酸遺伝子編集療法このパートナーシップはLife Editの独自遺伝子編集技術(塩基編集を含む)を私たちのmRNAプラットフォームと結合して推進します体内にある1組の選択した治療標的に対して遺伝子編集治療を行った。
2023年3月、我々は世代生物会社(GBIO)と戦略的協力とライセンス合意を達成した。この協力は,免疫細胞に到達できる療法を含め,我々それぞれの非ウイルス遺伝子薬のパイプラインを加速させるために,新たな核酸療法を開発することにより,両社プラットフォームの応用を拡大することを目的としている。プロトコルによれば、私たちは、GBIOの固有細胞標的脂質ナノ粒子(CtLNP)および閉鎖DNA(CeDNA)技術を許可する権利があり、2つの免疫細胞計画および2つの肝臓計画のために使用され、第3の免疫細胞または肝臓計画のための追加のオプションがある。
2023年9月,我々はImmaticsと戦略的研究開発協力協定を達成することを発表し,Immaticsは臨床段階の生物製薬会社であり,T細胞リダイレクト癌免疫療法を積極的に発見·開発した。協定は2023年10月に発効した後,Immaticsに1.2億ドル前払いした。ModernaとImmaticsのこの協力はメッセンジャーリボ核酸技術とT細胞受容体プラットフォームを結合して癌治療法を開発することに集中しており、体内でT細胞受容体二重特異性(TCER)を発現することに重点を置いている®)を用いて、広範な腫瘍データを用いてmRNAベースの癌ワクチンを作成し、臨床前および臨床研究と組み合わせた方法でTCR-T細胞治療を強化する
財務運営の概要
収入.収入
製品純売上高
顧客の地理的位置別製品純売上高を以下に示す(単位:百万):
| | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 十二月三十一日までの年度 |
| | | | | | 2023 | | 2022 | | 2021 |
| アメリカです | | | | | | $ | 1,720 | | | $ | 4,405 | | | $ | 5,393 | |
| ヨーロッパ.ヨーロッパ | | | | | | 1,353 | | | 6,732 | | | 6,834 | |
世界の他の地域 | | | | | | 3,598 | | | 7,298 | | | 5,448 | |
| 合計する | | | | | | $ | 6,671 | | | $ | 18,435 | | | $ | 17,675 | |
2023年第3四半期、私たちはアメリカ商業市場に私たちの新冠肺炎ワクチンの販売を開始し、また、外国政府と組織にも販売を続けています。アメリカでは,我々の新冠肺炎ワクチンは現在主に卸売業者や流通業者に販売されており,次いで小売業者やヘルスケア提供者に直接販売されている。製品の純売上高は、想定されている卸売業者の返金、即時支払いと予約した領収書割引、販売返品準備金、その他の関連控除を差し引いて確認されます。ご参照ください注3私たちの連結財務諸表まで。
次の表は、期間中の製品販売準備(単位:百万):をまとめたものです
| | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 十二月三十一日までの年度 |
| | | | | | 2023 | | 2022 | | 2021 |
| 総生産販売総額 | | | | | | $ | 8,203 | | | $ | 18,435 | | | $ | 17,675 | |
製品販売条項: | | | | | | | | | | |
卸は返金、割引、費用を返金します | | | | | | (976) | | | — | | | — | |
| 返品その他の費用 | | | | | | (556) | | | — | | | — | |
製品販売準備金総額 | | | | | | $ | (1,532) | | | $ | — | | | $ | — | |
| 製品純売上高 | | | | | | $ | 6,671 | | | $ | 18,435 | | | $ | 17,675 | |
2023年12月31日まで、私たちの新冠肺炎ワクチンは私たちが使用を許可している唯一の商業化製品です。
2023年12月31日現在、我々は、供給協定に基づいて受信または支払うべき顧客預金に関連して、主に2024年に私たちの新冠肺炎ワクチンを交付する6.13億ドルの収入を延期している
2022年通年と比較して、2023年通年の製品純売上高は大幅に低下し、新冠肺炎ワクチン市場が季節性商業市場へと転換していることを反映している。また,より多くの季節的販売を経験し,各国がその人口へのワクチン接種の強化を求めていることに伴い,各半球の秋/冬の需要が大きくなっている。2024年には、季節性商業市場の発展が続くことが予想され、新冠肺炎ワクチンの純製品売上高は2023年よりさらに低下すると予想される。
その他の収入
製品の純売上に加えて、私たちの収入は主に生物医学高度研究開発局(BARDA)、国防高級研究計画局(DARPA)とビルとメリンダ·ゲイツ財団、メルク社(Merck)、Vertex製薬会社とVertex製薬(ヨーロッパ)有限会社(Vertex)と他の会社との戦略同盟を含む政府支持と個人組織から来ており、潜在的な遺伝子組換え薬物を発見、開発、商業化する。
以下の表は、列挙期間の他の収入(百万単位)をまとめたものである
| | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 十二月三十一日までの年度 |
| | | | | | 2023 | | 2022 | | 2021 |
| 奨学金収入 | | | | | | $ | 94 | | | $ | 388 | | | $ | 735 | |
| 協力収入 | | | | | | 83 | | | 440 | | | 61 | |
| その他収入合計 | | | | | | $ | 177 | | | $ | 828 | | | $ | 796 | |
販売コスト
販売コストには、原材料、人員、施設、そして私たちの商業製品の生産に関連する他のコストが含まれています。これらのコストには、生産材料、当社の製造施設の生産コスト、第三者製造コスト、最終配合と包装コストが含まれています。販売コストには,輸送コスト,当社製品販売に関する間接管理コスト,当社製品純売上の第三者特許権使用料,在庫評価費用,過剰と古い在庫,および会社調達承諾の損失も含まれる
研究開発費
私たちの業務の性質と私たちの活動の主な重点は大量の研究開発コストを発生させた。
研究と開発費用とは、私たちが以下の点で発生するコストのことです
•私たちのプラットフォームを開発するコストは
•開発候補者の発見につながりました
•私たちのプロジェクトの前、非臨床、臨床開発コスト
•私たちの製造技術やインフラを発展させるコストは
•我々の薬物発見努力と臨床試験に関するデジタルインフラコスト。
上記の費用は、以下のカテゴリを含む
•給料、福祉、株式給与費用を含む人員関連の費用
•臨床前研究と臨床試験を行う第三者(例えばコンサルタント、研究場所、契約研究組織(CRO))との合意および許可手配による費用;
•製造の特定の機能および経済的要件を満たすように設計を推進し、内部および第三者契約製造組織(CMO)から臨床前研究、臨床試験および投入前在庫のための材料を得ることに関する費用を開発製造、調製または製品またはプロセス設計を修正し、設計を推進すること
•研究および開発中に使用される材料、実験室用品、および非資本設備を調達するための費用;
•第三者に支払われるライセンスおよび技術の前払い費用およびマイルストーンは、これらのライセンスおよび技術がまだ技術的可能性を達成しておらず、将来の代替用途もない
•施設、減価償却及び償却、及び研究·開発活動により発生したその他の直接及び分配された費用。
私たちは私たちの従業員とインフラ資源を利用して私たちのプラットフォームを向上させ、計画を発見し、開発します。進行中の計画の数や我々が複数のプロジェクトにまたがって資源を使用する能力により,我々の研究開発計画による間接や分担の運営コストは通常,計画や医療モデルで記録や維持されることはない。
次の表は、医療方式でまとめた直接計画特定費用と、2023年12月31日、2022年、2021年までの年度にまとめた他の研究開発費項目での間接または共有運営コスト(百万単位)を含む我々の研究開発費を反映している | | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年間 |
| 2023 | | 2022 | | 2021 |
| 医療費別の計画費: | | | | | |
| 伝染病ワクチン | $ | 2,344 | | | $ | 1,734 | | | $ | 1,099 | |
癌ワクチンと治療学 | 70 | | | 14 | | | 47 | |
めったに見られない細胞内治療 | 75 | | | 42 | | | 26 | |
| 腫瘍内免疫腫瘍学 | 23 | | | 10 | | | 20 | |
| 吸入性肺療法 | 17 | | | 18 | | | 1 | |
| | | | | |
| 全身分泌と細胞表面治療学 | 33 | | | 23 | | | 3 | |
| | | | | |
医療方式別に計画された総費用 (1) | $ | 2,562 | | | $ | 1,841 | | | $ | 1,196 | |
| 他の研究開発費: | | | | | |
| 発見計画 | $ | 106 | | | $ | 69 | | | $ | 85 | |
| プラットフォーム研究 | 254 | | | 169 | | | 125 | |
| 技術開発と未分配製造費用 | 821 | | | 464 | | | 275 | |
| 発見と開発費用を分担する | 945 | | | 658 | | | 242 | |
| 株に基づく報酬 | 157 | | | 94 | | | 68 | |
| | | | | |
研究開発費総額 | $ | 4,845 | | | $ | 3,295 | | | $ | 1,991 | |
__________
(1)2023年12月31日の42の開発候補、2022年12月31日の45の開発候補、2021年12月31日の37の開発候補を含む。計画に特化した費用は,計画が内部で開発を進めてから開発停止時に削除されるまでの間の開始時の費用に反映される.
A“情態”共通の製品特徴を有するグループの計画、および関連するイネーブルリボ核酸技術、送達技術、および製造プロセスの組み合わせを意味する。表にまとめた医療方式別計画特定費用には,我々の計画に直接起因する費用が含まれており,これらの費用は主に外部コスト,例えば外部コンサルタント,センター実験室,研究場所,CROに支払われ,これらの費用はわれわれの臨床前研究や臨床試験,CMOに関連しており,分配された発表前在庫,メッセンジャー供給,消耗品の製造コストである。起動前在庫、臨床前研究および臨床試験のメッセンジャーリボ核酸供給のコストが取得および製造され、発生時に割り当てられていない製造費用が計上され、その後、特定計画の生産が完了した後に特定計画の製造コストに割り当てられる。製造コストを特定の計画に割り当てる時間は,計画開発と生産計画によって異なる。私たちは通常、株式ベースの報酬、私たちの一般的なプラットフォーム研究、技術開発に関連するコスト、および他の計画固有の分担コストを含む人員に関連するコストを割り当てない。したがって,これらの費用は,方式別に列挙された具体的なプラン料金集計表には含まれていない
発見計画費用は,われわれが臨床前発見段階で計画した研究活動に関するコストであり,主にCROと実験室サービスの外部コスト,臨床前mRNA供給と消耗品の分配製造コストを含む。
プラットフォーム研究費用は主に遺伝子科学の開発、伝達科学と製造技術設計方面の技術進歩のコストである。これらのコストには,人員に関するコスト,コンピュータ設備,施設,臨床前mRNA供給と消耗品,我々のプラットフォーム研究を支援する他の行政コストがある
技術開発と未分配の製造費用は主に不特定計画の製造過程開発と製造コストに関係している
共有発見および開発費用とは、人員に関連するコストおよび他のコストのような研究開発コストであり、他の方法では、開発計画、発見計画、プラットフォーム研究、技術開発、いくつかの協力および許可手配、および割り当てられていない製造費用、株式ベースの報酬および他の費用は含まれていない
歴史的に見ると、著者らは研究開発活動に大量の資金を投入し、著者らのプラットフォーム、メッセンジャーリボ核酸技術と製造技術を含む。私たちは発生した研究と開発コストを負担して、私たちが現在開発あるいは将来開発可能な開発候補薬物と薬物研究に必要な性質、時間と見積もりコストを合理的に見積もることができない
既知または未知のリスクおよび不確実性の予想または結果の変化は、私たちが予想する研究開発支出に重大な影響を与える可能性がある。持続的な研究と開発は私たちの業務の持続的な活動の核心だ。臨床開発後期の研究薬物、例えば呼吸器合胞体ウイルスワクチン、季節性インフルエンザワクチン、サイトメガロウイルスワクチン、新世代新冠肺炎ワクチン、混合ワクチンと著者らのINT計画は、通常臨床開発初期段階の薬物よりもっと高い開発コストを持っており、これは主に後期臨床試験の規模と持続時間の増加によるものである。我々の研究薬物の開発段階での推進や,他の計画の決定と開発に伴い,我々の研究·開発コストは短期的には巨大になると予想される。私たちは2024年に研究開発コストが適度に低下すると予想する。著者らのいずれかの研究薬物の商業化成功に関連する要素はたくさんあり、未来の試験設計と各種の監督管理要求を含み、その中の多くの要素は現在正確に確定できない。著者らの多くの研究薬物はまだ開発の初期段階にあるからである。また、私たちがコントロールできない未来のビジネスと規制要因は、私たちの臨床開発計画と計画に影響を及ぼすだろう。
販売、一般、行政費用
販売、一般および行政費用は、主に役員の株式報酬、財務、法律、人的資源、業務発展、商業、マーケティングおよびその他の行政および運営機能、専門費用、会計および法律サービス、情報技術および施設関連費用、知的財産権(IP)の取得と維持に関連する費用を含む人事関連費用を含む。これらのコストは企業の運営と関係があり、研究開発機能や任意の個人計画とは関係がない。
2024年の販売、一般、管理費は2023年より少し下がると予想しています。これはアメリカ内と海外での私たちの計画と商業活動の持続的な発展のおかげだ。私たちの世界拡張は費用の増加を招いています。特に私たちが規制、販売、マーケティングチームを設立して、私たちの新冠肺炎ワクチンの商業化を支援している場合 我々のグローバル事業を拡大し、2023年12月31日現在19カ国·地域に活発な子会社を設置している。商業とマーケティング努力は私たちの2023年の販売、一般と行政費用の重要な貢献者であり、これらのコストの大きな一部を占めている。第三者の商業化協力や生産協力を確立せずに追加研究薬の規制承認を得られれば、これらの操作能力を発展させる上でより多くのコストが生じる可能性がある。しかし,2024年に比べて販売,一般,管理費がやや低下することが予想され,我々の既存のインフラや運営の効率を反映している
私たちはメッセンジャーリボ核酸ワクチンと治療計画の開発と商業化をカバーし、メッセンジャーリボ核酸設計、調合と製造プラットフォーム技術に関連するものを含む広範な知的財産権の組み合わせを持っている。私たちは定期的に特許出願を提出して、私たちの研究と開発による革新を保護する。私たちはまたアメリカと外国の司法管轄区域で商標と商標申請を持っている。私たちの知的財産権を保護し保護するコストは、発生時に費用を計上し、販売、一般、管理費用に分類される
利子収入
利息収入には、私たちが現金と現金等価物、通貨市場基金、高品質固定収益証券に投資した利息が含まれています。
その他の費用、純額
その他の費用には,純額には利息支出,有価証券投資の売却収益(損失),株式証券投資の公正価値変動に関する収益(損失)および我々のコア業務とは無関係な他の収入や支出がある。利息支出は主にModerna技術センターに関連する融資リースといくつかの契約製造サービス協定から来ている。
重要な会計政策と重大な判断と見積もり
私たちの経営陣は私たちの財務状況と経営結果の討論と分析は私たちの総合財務諸表に基づいています。これらの報告書はアメリカで公認された会計原則に従って作成されています。これらの連結財務諸表を作成するには、私たちの合併財務諸表における資産、負債、収入および費用の報告金額、または資産および負債の開示に影響を与える判断と推定を行う必要があります。我々は歴史的経験,既知の傾向や事件,および当時の状況では合理的と考えられる様々な他の要因に基づいて推定し,これらの要因の結果は資産や負債の帳簿価値を判断する基礎を構成しているが,これらの資産や負債の帳簿価値は他の源からは明らかではないように見える。異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある。持続的な基礎の上で、私たちは環境、事実、経験の変化に基づいて私たちの判断と推定を評価する。重大改訂の影響(ある場合)は、推定変動の日から連結財務諸表に反映されることが予想される。
私たちの主な会計政策は本年度報告10-K表の他の場所の総合財務諸表付記により詳細に記載されていますが、以下の会計政策は私たちのを作成していると信じています
連結財務諸表は最も重要な判断と推定を必要とする。
製品純売上高
2023年第3四半期までに、私たちはアメリカ政府、外国政府、組織に私たちの新冠肺炎ワクチンを売却した。これらのエンティティとの合意および関連修正は、一般に、割引、リベート、または返品のような可変対価格を含まない。2023年第3四半期、私たちの最新の冠肺炎ワクチンの米国商業市場への販売を開始し、また、外国政府や組織にも販売を続けています。アメリカでは,我々の新冠肺炎ワクチンは主に卸売業者や流通業者に販売され,次いで小売業者やヘルスケア提供者に直接販売されている。
製品制御権がお客様の手に移った場合、製品の純売上高を確認します。通常は納品時です。米国の製品純売上高は,推定された卸の返金,即時支払いと予約の領収書割引,販売返品準備金,その他の関連控除を差し引いて確認した純額である。これらの準備は、契約条項と期間内の販売製品の返品の見積もりに基づいて、期待値方法または最も可能な金額方法を用いて記録されています。推定数は期間ごとに評価を行い,必要に応じて情報や実際の経験を修正するように調整する.ご参照ください注2各重要カテゴリごとの製品販売準備·会計政策をさらに検討し、分析するために、連結財務諸表に報告書を提出した。
我々のキー会計政策の適用には、特に確認する可変対価格金額を決定する際に、多くの経営陣の判断と見積もりが必要である。我々によって直接制御されていない要因を評価する際には,たとえば関連する履歴データや限られた第三者情報が不足しており,この過程の主観性が強くなる.すべての変数の中で、潜在結果の広い範囲と私たちのお客様は現在返品履歴が不足しているため、返品が最も重要な判断だと思います。私たちはより多くの製品返品に関する履歴データを受け取るにつれて、これらの情報を統合して、私たちの見積もりを改善し、財務予測の精度を向上させます。実際の結果は私たちの見積もりとは異なるかもしれませんが、このような違いは私たちの財務諸表に実質的な影響を与える可能性があります
在庫品
在庫はコスト或いは可変現純値の中の低い者で入金し、先進先出法と平均コスト法を用いて異なる在庫組成物に対してコストを確定する。私たちは定期的に在庫の構成をチェックして、過剰、時代遅れ、移動が遅い、あるいは他の販売できないものを確定します。販売できない物品が観察され,在庫に代替用途がない場合には,価値低下が初めて販売コストを計上して確認している間に,可変現純値を減記する。在庫コストが換金可能かどうかを決定する過程は、管理層が重要な判断と見積もりを行う必要がある。実際の市場状況が経営陣の予想よりも有利であることが証明されれば、在庫を追加的に減記する必要があるかもしれない。四半期ごとに、第三者サプライヤーとの供給契約によって生じた余分な会社、キャンセルできない調達承諾負債があるかどうかも評価します。将来の製品需要の推定、現在と未来の市場状況、潜在的な製品の古い状況、会社の調達承諾と契約最低限度額による原材料の期限切れと利用など、現金化可能な純価値と会社の調達承諾負債を決定するには重大な判断が必要である。2023年、私たちが改訂した長期計画による原材料の減記を含む重大な判断は、私たちの新冠肺炎ワクチンに対する期待の将来の需要の低下を反映している。数年前、この重大な判断は、会社が第三者サプライヤーと締結した取り消すことのできない調達契約の原材料調達承諾が多すぎることと関係がある
私たちは私たちの年間予測生産計画を超えた原材料を保持し、これらの原材料は非流動資産に分類され、私たちの総合貸借対照表に含まれる他の非流動資産に含まれる。これらの材料の分類と評価は重要なことに関連している
判断と見積もり。在庫減記を推定するための仮定は合理的であると考えられるが,これらの仮定の任意の重大な未来の変化や将来のイベントや市場状況の変化は異なる推定をもたらす可能性がある.ご参照ください注7在庫に関連したこれらの費用をさらに検討して分析するために、私たちの連結財務諸表
所得税
私たちは貸借対照法に基づいて所得税を計算する。繰延税金資産および負債が、財務諸表または納税申告書に含まれているイベントの予想される将来の税務結果であることを確認します。私たちは、財務報告と貸借対照の税ベースとの差に基づいて、制定された税率と法律を用いて計量された繰延税金項目資産と負債を決定し、これらの税率と法律は、差の予想が逆転したときに発効する。私たちの繰延税金資産の現金化能力を評価する際には、重大な経営陣の判断力が必要だ。この評価を行う際には、繰延税金資産の一部または全部が現金化できない可能性が高いかどうかを考慮します。繰延税金資産の最終的な現金化は、これらの一時的差額控除可能期間中に生成された将来の課税所得額に依存する。この決定にあたっては,繰延税金負債の予定沖販売,不確定な税務状況,将来の課税所得額,および推定免税額の需要を評価する際の税務計画戦略の影響を考慮した
2023年の間、私たちの評価には、年間税引き前損失と、長期財務計画プロセスに基づいて決定された3年間の累積損失を考慮することが含まれています。この過程は,我々が季節的市場に移行するにつれて,われわれの新冠肺炎ワクチンの期待売上高が大幅に低下し,第三段階の臨床試験と候補製品が後期開発に入る大量の研究開発費が行われていることを示している。このような要素は私たちが税金資産の現金化を延期する否定的な証拠だと考えられている。また,推定免税額の必要性を評価する際には,繰越年度の課税収入,利用可能な税務計画戦略,将来の課税格差の一時的な償却など,他の課税収入源を評価した。すべての既存の証拠を徹底的に評価した後、私たちは私たちの繰延税金資産の大部分を実現できない可能性が高く、2023年12月31日に私たちの繰延税金資産に対して22億ドルの推定準備金を維持する可能性があると確信した。もし実際の結果が私たちの見積もりと違ったり、将来の見積もりが変化したりすれば、推定手当の調整が私たちの財務業績に大きな影響を与える可能性があります。これらの変化は、このような推定が変化している間に私たちの税金支出が大幅に増加または減少する可能性があり、これは逆に純収益または損失に影響を与える可能性がある
最近発表された会計声明
参照してください注2“最近発表された未採用会計基準”というタイトルの総合財務諸表の主な会計政策の概要。
行動の結果
我々の2023年12月31日までの年度と2022年と比較した運営結果についての検討は以下のとおりである。我々の2022年12月31日までの年度と2021年の運営結果に関する検討は,我々が2023年2月24日に米国証券取引委員会(SEC)に提出したForm 10−K年度報告の第2部−プロジェクト7で見つけることができる。
以下の表は、本報告に掲げる期間の総合業務報告書(単位:百万)をまとめたものである | | | | | | | | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年間 | | 2023年と2022年の変化 |
| 2023 | | 2022 | | 変わる | | % |
| 収入: | | | | | | | |
| 製品純売上高 | $ | 6,671 | | | $ | 18,435 | | | $ | (11,764) | | | (64) | % |
| その他の収入 | 177 | | | 828 | | | (651) | | | (79) | % |
| | | | | | | |
| | | | | | | |
| 総収入 | 6,848 | | | 19,263 | | | (12,415) | | | (64) | % |
| 運営費用: | | | | | | | |
| 販売コスト | 4,693 | | | 5,416 | | | (723) | | | (13) | % |
| 研究開発 | 4,845 | | | 3,295 | | | 1,550 | | | 47 | % |
| 販売、一般、行政 | 1,549 | | | 1,132 | | | 417 | | | 37 | % |
| 総運営費 | 11,087 | | | 9,843 | | | 1,244 | | | 13 | % |
| 営業収入(赤字) | (4,239) | | | 9,420 | | | (13,659) | | | (145) | % |
| 利子収入 | 421 | | | 200 | | | 221 | | | 111 | % |
| その他の費用、純額 | (124) | | | (45) | | | (79) | | | 176 | % |
| 所得税前収入 | (3,942) | | | 9,575 | | | (13,517) | | | (141) | % |
| 所得税支給 | 772 | | | 1,213 | | | (441) | | | (36) | % |
| 純収益 | $ | (4,714) | | | $ | 8,362 | | | $ | (13,076) | | | (156) | % |
収入.収入
2023年の総収入は124億ドル減少し、減少幅は64%であり、主な原因はわが新冠肺炎ワクチンの純製品売上高が大幅に低下したためである。2023年の製品純売上高は118億ドル低下し、減少幅は64%であり、主に2023年のすべての地区の販売量の低下によるものであり、市場の新冠肺炎ワクチンの季節的商業市場への移行を反映している。低下は高い平均販売価格によって部分的に相殺され、特に米国では商業市場販売は2023年第3四半期から始まった。2023年、他の収入は6.51億ドル減少し、減少幅は79%であったが、これは主にバダと達成した新冠肺炎ワクチン開発協定での贈与収入の減少と、メルク社と2022年の私たちの国際協力に関する2.5億ドルの支払い参加を確認した後、協力収入が低下したためである
運営費
販売コスト
2023年第3四半期、私たちは新冠肺炎業務コスト構造を最適化するための戦略計画を開始し、私たちの製造コスト構造を調整することに重点を置いた。この措置は著者らが2023年第3四半期以内に長期計画を完成したことによるものであり、その中にワクチン接種率の改訂予測を取り入れ、市場の新冠肺炎の大流行状況から流行季節性市場への移行を反映する。この計画には、第三者CMOとの生産能力と約束を削減し、私たちの原材料在庫レベルを再評価し、満期までに消費されないと予想される原材料に関する調達承諾を減らすことが含まれています。この取り組みにより,9.03億ドルの原材料関連在庫減記と,5.13億ドルのCMO清算コストとログアウト費用が生じた。また,2023年第4四半期という戦略計画の継続として,1.53億ドルのCMO清算コストと1600万ドルの在庫減記が生じた。この戦略的措置は、私たちの製造業務の効率を高め、将来の市場ニーズに応じて規模をより良く拡大するための柔軟性を提供すると信じています。
2023年、私たちの販売コストは47億ドルで、わが製品の純売上高の70%を占め、その中には3.01億ドルの第三者特許権使用料、22億ドルの在庫減記、9.81億ドルの未利用生産能力と清算コスト、および会社調達の損失が含まれている
約束とキャンセル費用は2.05億ドルだ。2022年、私たちの販売コストは54億ドルで、私たちの製品の純売上高の29%を占め、その中には11億ドルの第三者特許権使用料、13億ドルの在庫減記、6.77億ドルの未利用生産能力と清算コスト、7.25億ドルの会社調達承諾とログアウト費用損失が含まれている。特許使用料を除いて,これらの費用は,製品需要が最新の変種に対する新冠肺炎ワクチンへの移行や,顧客需要の低下により,最終的に我々の戦略計画が2023年第3四半期に実施されることが大きい。
2022年と比較して、2023年の販売コストは7.23億ドル減少し、減少幅は13%だった。販売コストの低下は主に販売量の低下によるものであるが、一部は在庫減記増加によって相殺されている。2023年の販売コストが製品の純売上高に占める割合は2022年の29%から70%に増加し、41ポイント増加した。販売コストが製品純売上高に占める割合が増加したのは、主に上記の戦略的取り組みと、製品需要の低下や製品季節的増加により、上記他の費用(特許権使用料を含まない)により製品純売上高が低下したためである。我々が最近2023年第3四半期に実施した戦略計画を踏まえると、2024年通年の販売コストが製品純売上高に占める割合は2023年通年よりも低下すると予想される。
研究開発費
2023年には研究開発費が16億ドル増加し47%に増加した。増加の要因は,臨床試験費用が4.11億ドル増加し,臨床製造費が3.35億ドル増加し,関係者関連コストが2.86億ドル増加し,コンサルティング·外部サービスが2.67億ドル増加したことである。2023年の増加は、主に我々のRSVワクチン、CMVワクチン、季節性インフルエンザおよび新冠肺炎混合ワクチン、および我々のINT計画の後期臨床開発に起因する。関係者のコスト増加は,主に我々が増加した研究開発計画や活動を支援する従業員数の増加によるものである。
我々は、我々の呼吸器合胞体ウイルス、サイトメガロウイルス、季節性インフルエンザおよび共同ワクチン計画、および我々のINT計画を含む、2024年の研究開発費は、2023年の現在のレベルよりやや低下すると予想される。なぜなら、変種および次世代新冠肺炎候補ワクチンの開発を引き続き推進し、私たちの候補製品を後期開発に進めるためである
販売、一般、行政費用
2023年には,販売,一般,行政費が4.17億ドル増加し,37%に増加した。増加の主な原因は、人事関連費用が1.88億ドル増加し、コンサルティングと外部サービスが1.48億ドル増加し、マーケティング費用が1.18億ドル増加したが、2022年にModerna慈善基金に寄付された5,000万ドルは2023年に再現されず、この費用を部分的に相殺したからである。2023年の増加は、主に、デジタル計画、マーケティング製品、および会社の拡張を支援するために、デジタル、医療事務、ビジネス機能における従業員数と支出の増加によるものです。
2024年の販売、一般、行政費用は2023年の水準をやや下回ると予想される。これは、世界的なビジネス、規制、販売、マーケティングインフラを拡大する際の私たちの効率性の持続的な約束を反映している。また,我々が計画開発を進め,全体のワークフローを強化する戦略的重点と一致している
利子収入
2023年、我々の有価証券投資による利息収入は2.21億ドル増加し、主に全体の金利環境が高いが、平均投資残高が低い部分はこの影響を相殺したためである。
その他の費用、純額
以下の表は、列挙期間の他の費用純額(百万単位)をまとめたものである
| | | | | | | | | | | | | | | | | | | | | | | |
| 2011年12月31日までの数年間 | 2023年と2022年の変化 |
| 2023 | | 2022 | | 変わる | | % |
投資損失 | $ | (72) | | | $ | (20) | | | $ | (52) | | | 260 | % |
利子支出 | (38) | | | (29) | | | (9) | | | 31 | % |
その他の収入,純額 | (14) | | | 4 | | | (18) | | | (450) | % |
| その他の費用の合計 | $ | (124) | | | $ | (45) | | | $ | (79) | | | 176 | % |
2023年、その他の総支出は7,900万ドル増加し、176%増加した。増加の主な原因は株式投資の損失と債務証券の売却可能な純損失および利息支出の増加である。私たちの利息支出は主に
私たちの融資リースと関連があります。利息支出の増加は2023年からの新融資リースによって推進されている。ご参照ください注10私たちの連結財務諸表まで。
所得税支給
2023年の所得税支出は4.41億ドル減少、または36%減少し、主な原因は税引き前収入が大幅に減少したが、繰延税金資産推定値が21億ドル増加しようとしている部分で相殺された。2023年12月31日までの年度の有効税率は(19.6%)で、法定税率を上回っている。これは主に繰延税金資産の評価免除額が増加したが、研究開発控除と株式報酬の税収割引部分がこの増加を相殺したためである。税引前収入と推定手当が大幅に減少したため、2023年の有効税率は前年と同じではない。ご参照ください注13私たちの連結財務諸表まで。
流動資金と資本資源
次の表は、私たちの列報期間ごとの現金、現金等価物、投資、運営資本(百万単位)をまとめています
| | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 |
| 金融資産: | | | | |
| 現金と現金等価物 | | $ | 2,907 | | | $ | 3,205 | |
| 投資する | | 5,697 | | | 6,697 | |
| 非流動投資 | | 4,677 | | | 8,318 | |
| 合計する | | $ | 13,281 | | | $ | 18,220 | |
| | | | |
| 運営資金: | | | | |
| 流動資産 | | $ | 10,325 | | | $ | 13,431 | |
| 流動負債 | | 3,015 | | | 4,923 | |
| 合計する | | $ | 7,310 | | | $ | 8,508 | |
私たちの現金、現金等価物、そして投資は私たちの投資政策に基づいて投資され、主に流動性と保証のためです。私たちの投資は主に政府と会社の債務証券で構成されており、公正価値に基づいて報告されている。2023年12月31日現在の現金、現金等価物、投資は2022年12月31日に比べて49億ドル減少し、減少幅は27%だった。2023年12月31日までの1年間に、運営から現金31億ドルを純流出し、普通株12億ドルを買い戻し、不動産、工場、設備を7.07億ドル購入した。
2023年12月31日現在、運営資本、すなわち流動資産から流動負債を減算し、2022年12月31日に比べて12億ドル、または14%減少したのは、主に現金、現金等価物、短期投資が13億ドル減少したためであり、主に私たちの経営活動と普通株買い戻しに資金を提供し、在庫が7.47億ドル減少し、前払いおよび他の流動資産が5.68億ドル減少し、売掛金純額が4.93億ドル減少したためである。この部分は短期繰延収入が15億ドル減少したことによって相殺され、これは主に顧客預金を受け取った繰延収入から確認された収入によるものだ。
キャッシュフロー
表に示した各期間の主要な現金源と用途(単位:百万): | | | | | | | | | | | | | |
| 2013年12月31日までの年間 |
| 2023 | | 2022 | | |
提供された現金純額(使用): | | | | | |
経営活動 | $ | (3,118) | | | $ | 4,981 | | | |
投資活動 | 4,206 | | | (5,176) | | | |
融資活動 | (1,377) | | | (3,448) | | | |
現金と現金等価物の純減少 | $ | (289) | | | $ | (3,643) | | | |
経営活動
私たちが運営から得たキャッシュフローは、主に私たちの新冠肺炎ワクチン製品の販売に関連する顧客預金と売掛金、そしていくつかの政府支持と民間組織と戦略連合の現金から来ている。我々の運営活動のキャッシュフローは,運営費や運営資本支援業務として現金を使用していることが大きな影響を受けている。2020年第3四半期から,米国政府および外国政府や組織と新冠肺炎ワクチン供給協定を締結し,前払い金を受け取った。2023年第3四半期、私たちはアメリカ商業市場に私たちの新冠肺炎ワクチンの販売を開始し、また、外国政府と組織にも販売を続けています。アメリカでは,我々の新冠肺炎ワクチンは主に卸売業者や流通業者に販売され,次いで小売業者やヘルスケア提供者に直接販売されている。卸売業者と流通業者は通常私たちにお金を前払いしないだろう。2023年12月31日現在、私たちが受け取ったり支払うべき顧客預金関連繰延収入は6.13億ドルです。
2023年の業務活動で使用される現金純額は31億ドルで、純損失47億ドルと非現金調整17億ドル、1.39億ドルの資産と負債の純変動が含まれている。非現金プロジェクトには、主に8.28億ドルの繰延所得税、6.21億ドルの減価償却、および3.05億ドルの株式ベースの給与が含まれる。資産と負債の純変化は、主に我々の新冠肺炎ワクチン出荷時に確認された収入により繰延収入が21億ドル減少したが、前払い費用と他の資産が10億ドル減少したことによって部分的に相殺され、これは主に長期在庫減記、税金還付を受けたことによる所得税の減少と税引前収入の減少、サプライヤーの前払いと頭金の減少、在庫減記による在庫の7.47億ドルの減少によるものである。
2022年と比較して、2023年の純運営キャッシュフローは81億ドル減少し、減少幅は163%であり、主な原因は純収益が131億ドル減少し、売掛金が製品販売と入金タイミングの低下によって13億ドル変化したこと、サプライヤー支出と支払いタイミングの増加により売掛金と未収負債が12億ドル変化したことである。この部分は以下の要素によって相殺される:前払い費用と他の資産の変化は27億ドルであり、主な原因は在庫減記とサプライヤーの頭金の減少である;繰延収入の変化は21億ドルであり、原因は顧客預金を受け取った繰延収入確認収入の減少、および推定手当の増加により、繰延所得税資産が14億ドル減少したからである。
投資活動
私たちの主な投資活動は、投資の購入、販売と満期、土地の資本支出、レンタル改善、製造、実験室、コンピュータ設備とソフトウェア、および業務発展を含む。
2023年の投資活動が提供する現金純額は42億ドルで、主に56億ドルの有価証券満期収益と32億ドルの有価証券販売収益が含まれるが、一部は38億ドルの有価証券購入と7.07億ドルの不動産、工場、設備購入によって相殺される。
2022年と比較して、2023年の純投資キャッシュフローが94億ドル、すなわち181%増加したのは、主に購入した有価証券が77億ドル減少し、有価証券の満期日収益が24億ドル増加したためだ。
融資活動
私たちの主な融資活動は普通株の買い戻し、私たちの株式計画に関連する普通株の発行、融資リースを含みます
2023年の融資活動のための現金純額は14億ドルで、主に12億ドルの普通株買い戻しと2.7億ドルの融資リース負債の変化から来ており、一部は私たちの株式計画の下で株式オプションの行使と従業員の株式購入に関する普通株発行純収益4600万ドルによって相殺されている。
2022年と比較して、2023年の融資活動のための純現金は21億ドル、あるいは60%減少し、主な原因は普通株の買い戻し減少である。
運営と資金需要
2023年12月31日現在、私たちの主な資金源には、現金と現金等価物、投資、および運営から発生する可能性のある現金が含まれています。2022年と2021年までにそれぞれ84億ドルと122億ドルの純収入を生み出しました
2020年12月に私たちの最初の商業製品が許可された後。2023年12月31日までの1年間に、47億ドルの純損失も発生した。2023年12月31日現在、私たちの利益剰余金は136億ドルです
私たちは将来、研究開発活動を行い、私たちの組織を運営し、資本支出需要を満たす予想される運営費用を含む大量の資本需要を持っている。我々が行っている活動のすべての分野で巨額の支出が維持されることが予想され,特に我々の開発候補薬や我々の研究薬の臨床活動を研究·開発し続ける際には。これはまた私たちの供給と製造パートナーとの手配を含めて私たちの製造コストに延長される。RSV、季節性インフルエンザおよびCMV候補ワクチン、個人化された新しい抗原治療、新冠肺炎ワクチン(SARS-CoV-2変異株のための任意の新しいワクチンの開発を含む)、共同ワクチン、後期臨床開発、および世界の商業、監督、販売、およびマーケティングインフラおよび製造施設の確立における持続的な仕事は、将来的に大量の現金流出を必要とし、その大部分は私たちのパートナーまたは協力者によって清算または支払いできない可能性がある。しかも、私たちは多くの施設、レンタル、そして購入義務を持っている。また、特定の研究開発活動に資金を提供することと、将来支払う可能性のあるマイルストーンおよび特許使用料を含む第三者といくつかの協力協定を締結しました。
私たちは、2023年12月31日まで、私たちの現金、現金等価物、投資、製品販売から予想される現金を加えることで、財務諸表の発表後少なくとも12ヶ月以内に私たちが予想している運営と資本支出に資金を提供できるようになると信じています 本年度報告のForm 10-Kに含まれる.私たちは新薬開発と商業化に関連するすべてのリスクに直面しており、私たちは予見できない費用、困難、合併症、遅延、その他の未知の要素に直面する可能性があり、これは私たちの業務に不利な影響を与えるかもしれない。例えば、私たちは顧客の私たちの新冠肺炎ワクチンに対する需要の低下を経験し、市場が2023年の流行市場で季節的モデルに移行していることを反映している。将来の製品発表時に業務への投資を約束することは、今後一定期間の運営キャッシュフローを負に続ける可能性があると予想される。私たちの財政資源がどのくらいの間私たちの業務を支持するのに十分な予測は前向きな陳述であり、リスクと不確定要素に関連し、実際の結果は様々な要素によって異なるかもしれない。私たちは間違っていることが証明される可能性があるという仮定に基づいてこの推定をして、私たちは現在予想されているよりも早く私たちが利用できる資本資源を利用することができる
契約義務と約束
次の表は、2023年12月31日までの契約義務と、これらの義務が将来的に予想される流動性とキャッシュフローに及ぼす影響(百万単位)をまとめています
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 期限どおりの支払い |
| 合計する | | 最初の月より低い 年.年 | | 1歳-3歳 | | 3年から5年 | | 5ヶ月以上 年.年 |
賃貸借契約を経営する | $ | 1,133 | | | $ | 72 | | | $ | 134 | | | $ | 142 | | | $ | 785 | |
融資リース(1) | 1,184 | | | 20 | | | 44 | | | 46 | | | 1,074 | |
| | | | | | | | | |
購入義務(2) | 2,103 | | | 1,002 | | | 685 | | | 272 | | | 144 | |
| 契約現金債務総額 | $ | 4,420 | | | $ | 1,094 | | | $ | 863 | | | $ | 460 | | | $ | 2,003 | |
_______
(1)表の金額には、私たちのMTCレンタルに関連するオプションのレンタル延長期間の総支払いが6.68億ドル含まれています。会計目的については、リース期間は、リースの取消不可期間であり、選択権の行使を合理的に決定した場合にリースを延長または終了する選択権を含む。ご参照ください注10私たちの連結財務諸表まで
(2)この金額は、通常業務中の原材料の購入、契約製造サービス、臨床サービス及び他の商品又はサービスに関するキャンセル不可能な固定支払義務である。2023年12月31日現在、原材料に関する調達承諾のうち7,900万ドルが将来の会社の調達承諾の損失負債として記録されている。
私たちは、臨床操作に関連するサービス、およびサポートおよび契約製造を含む様々なサービスについていくつかのサプライヤーと合意しており、便宜上、これらのサービスを契約上終了することはできません。いくつかの合意は停止権を規定しているが、停止費や清算費用を支払わなければならない。このような合意によると、私たちは主にキャンセル前に発生した回収できない費用を補償するために、サプライヤーにいくつかのお金を支払う義務がある。このような債務の正確な金額は終了の時間と合意に関する正確な条項に依存し、合理的に見積もることができない。2023年12月31日現在、このような合意により、私たちは、臨床運営、支援、契約製造のための合計30億ドルの未締結注文を受け取りました。これらの金額は以下の項目の見積もりを表しています
私たちがこの合意をキャンセルしないと仮定して、2023年12月31日に支払いを約束する契約がある。このような合意によれば、私たちが将来サプライヤーに支払う実際の金額は、キャンセル可能な30億ドルの未決済調達注文金額とは異なる可能性があります。
上記の義務に加えて、私たちは正常な業務過程で様々な合意と財務的約束を達成します。これらの条項は、一般的に、貨物を納品したり、サービスを履行する前に、私たちの業務ニーズに応じて、私たちの要求をキャンセル、再配置、調整することを選択することを可能にします。我々の義務の条件的性質や特定のプロトコルごとに関連する独自の事実や状況により,これらのプロトコルで将来支払い可能な最高額は予測できない.
2023年12月31日現在、私たちの財務状況や運営結果に重大または合理的に重大な影響を及ぼす可能性のある表外手配はありません
第七A項。市場リスクの定量的·定性的開示について
金利リスク
2023年12月31日と2022年12月31日まで、それぞれ133億ドルと182億ドルの現金、現金等価物、制限現金、有価証券投資を持っています。我々のポートフォリオは、通貨市場基金と取引可能な債務証券(米国債、米国政府機関および会社実体の債務証券および商業手形を含む)を含み、販売可能な証券に分類される。私たちの主な投資目標は資本を保存し、流動性を維持することであり、私たちの投資政策は機関や金融商品の品質に応じて許容される投資を決定し、リスクを最小限に抑えることを目指している。私たちの金利感受性の開放はアメリカの金利の全体的な水準の変化の影響を受けています
私たちの有価証券は金利リスクの影響を受け、市場金利が上昇すれば証券価値が低下する。私たちの投資期限が短く、リスクが低いため、大きな金利リスクはないと予想されます。市場金利が直ちに一致して2023年12月31日の水準から1ポイント上昇すれば、我々の有価証券の純公正価値は約8300万ドル減少する。
外貨リスク
私たちは各種外貨で取引し、国際販売と費用はすべて外貨建てです。したがって、私たちの業務運営と経済状況は一定のリスクをもたらすだろう。2023年12月31日までの1年間、私たちの創設活動と運営は依然として主にドル建てである。しかし、私たちはかなりの外貨リスクを維持しています。特にユーロ、円、スイスフラン市場では、2023年に私たちの重大な外貨収入は14億ドルの円と5.18億ドルのユーロに相当します。私たちが国際拡張戦略を実施するにつれて、私たちの経営業績とキャッシュフローは依然として外貨為替レートの変動の影響を受けています。外貨レート変動のリスク開放を管理するために、キャッシュフローヘッジとアセットバランスシート対沖計画を実施した。
現金流量ヘッジ活動
我々は外貨キャッシュフローヘッジ計画を通じて、使用期限が15ヶ月を超えない長期契約と外貨オプションを使用し、ユーロと円建ての外貨製品の販売変動による外貨リスクを緩和する。私たちはこれらのキャッシュフローをオープンにして、私たちの収益とキャッシュフローが為替変動に悪影響を受けるリスクを下げる。ヘッジ期間保証の会計処理を受けるためには、すべてのヘッジ関係は期限保証値の開始時にすでに正式に記録されており、ヘッジ期間保証値は被ヘッジ保証取引の未来のキャッシュフローの変化を非常に有効に相殺しなければならない。私たちのヘッジキャンペーンに関連する派生資産または負債は、それぞれ、当社の総合貸借対照表において、前払い費用および他の流動資産または他の流動負債を公正な価値で計上します。これらのヘッジの公正価値変動による収益或いは赤字は最初に株主権益に累積された他の総合(赤字)収入(AOCI)の構成部分に計上され、その後、再分類されたヘッジ取引が収益期間中の製品販売に影響を与える。基礎予測取引が発生していない場合,あるいは発生しない可能性が高い場合,定義されたヘッジ期限内に,関連キャッシュフローのヘッジの収益や損失をAOCIから他の費用,純額に再分類し,我々の総合経営報告書に分類する.著者らはヘッジ開始時にヘッジ効果に対して展望性評価を行い、持続的な基礎の上で回顧と展望性評価を行った。もし私たちがヘッジ会計を選択していない場合、あるいは契約がヘッジ会計処理の条件を満たしていない場合、公正価値の変動は私たちの合併経営報告書に他の費用純額の構成要素として記録されます。2023年12月31日まで、未平倉外貨長期契約或いは外貨オプションはありません。2023年の間、外国為替ヘッジ活動はどうでもいい。
貸借対照表ヘッジ活動
当社は外貨長期契約を締結し、外貨通貨資産及び負債に関する変動をヘッジし、主にユーロ、スイスフラン及び円で計算した現金、売掛金、支払すべき帳簿及び賃貸負債であるが、この等の資産及び負債は対沖会計処理として指定されているわけではない。したがって、これらの長期契約は派生ツールに計上され、したがって、契約の公正価値は、私たちの総合貸借対照表において、前払い費用および他の流動資産または他の流動負債として報告され、公正価値の変化によって生じる収益および損失は、私たちの総合経営報告書において、他の費用純額の構成要素として記録される。これらの外貨長期契約の損益は一般に外貨建ての関連資産や負債の損益を相殺しており、これらの資産や負債も我々の総合経営報告書に他の費用純額を計上している。2023年12月31日まで、公正価値で計上された未償還貸借対照表対沖誘導体品の満期日は3ヶ月未満である。
我々がこの等外国為替契約を締結したのは,正常業務過程で外貨建ての期待収入や貨幣資産や負債をヘッジするためであるため,このような契約は投機的ではない.私たちは相手を信じています
私たちの外貨長期契約は信用の良い国際商業銀行です。取引相手の違約のリスクはそれほど大きくないと考えられるが、金融市場の混乱により金融機関の金融安定性が低下し続けており、我々の外国為替ヘッジ計画のために信頼性の良い取引相手を得る能力に影響を与える可能性がある。
私たちは外貨両替リスクを軽減しようと努力しているが、私たちのヘッジ活動が外国為替変動に関連するリスクから十分に保護される保証はない。2023年12月31日現在、すべての期限の外貨為替レートがドルレートに対して10%の不利な変動があると仮定すると、貸借対照表のヘッジのための私たちの外貨長期契約の公正価値が約2300万ドル低下する可能性がある。私たちは、ポートフォリオの公正な価値のいかなる増加または減少も、ヘッジファンドの基礎リスクの増加または減少によって大幅に相殺されると予想する
項目8.財務諸表と補足データ
Moderna社
連結財務諸表索引 | | | | | | | | |
独立公認会計士事務所報告 | | 102 |
2023年12月31日と2022年12月31日までの連結貸借対照表 | | 104 |
2023年12月31日まで、2022年と2021年12月31日までの年度の総合業務報告書 | | 105 |
2023年,2022年,2021年12月31日までの年度総合総合収益(損失表) | | 106 |
2023年、2022年、2021年12月31日までの株主権益総合レポート | | 107 |
2023年12月31日現在、2022年12月31日現在、2021年12月31日までの統合現金フロー表 | | 109 |
連結財務諸表付記 | | 110 |
独立公認会計士事務所報告
Modernaの株主と取締役会に。
財務諸表のいくつかの見方
添付されているModerna社(当社)が2023年12月31日までと2022年12月31日までの総合貸借対照表,2023年12月31日までの3年度の関連総合経営表,全面収益(赤字),株主権益と現金流量および関連付記(総称して“総合財務諸表”と呼ぶ)を監査した。総合財務諸表は、すべての重要な点で、2023年12月31日、2023年12月31日、2022年12月31日までの会社の財務状況、および2023年12月31日までの3年度の経営結果とキャッシュフローを公平に反映しており、米国公認会計原則に適合していると考えられる。
また、米国上場企業会計監督委員会(PCAOB)の基準に基づき、テレデビル委員会後援組織委員会が発表した“内部統制-総合枠組み(2013枠組み)”で確立された基準と2024年2月23日までの報告に基づき、2023年12月31日までの財務報告内部統制を監査し、保留のない意見を発表した。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項とは、監査委員会に伝達または要求が監査委員会に伝達された当期財務諸表監査によって生じる事項である:(1)財務諸表に対して重大な意義を有する勘定または開示に関するものであり、(2)特に挑戦的で主観的または複雑な判断に関するものである。重要な監査事項の伝達は、総合財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、以下の重要な監査事項を伝達することによって、重要な監査事項またはそれに関連する勘定または開示について個別の意見を提供することもない
| | | | | | | | |
| | 製品収益収益準備金 |
| 関係事項の記述 | | 2023年12月31日までの1年間、同社のSpikevax純製品収入は67億ドルだった。総合財務諸表付記2に記載されているように、製品販売収入には、製品返品準備金を含む可変対価格推定値が含まれる。
監査会社は、卸売業者、流通業者、小売顧客(総称して“顧客”と呼ぶ)との契約に基づいて、製品返品準備金の計量に特に挑戦的であり、(1)貸借対照表日までの流通ルートにおける在庫の管理仮定に関連しており、これらの在庫は、今後の時期や予想される市場需要において返品の影響を受ける可能性があり、(2)会社がその仮定の基礎とする返品履歴が限られているからである。
|
| | | | | | | | |
| 私たちが監査でどのようにこの問題を解決したのか | | 我々は,設計を評価し,社内統制が製品収入準備金を決定する流れに対する内部制御の操作有効性をテストした。たとえば,プロセスで使用されるデータの完全性と正確性の審査に対する管理層の制御と,流通チャネルにおいて将来的に返品可能な在庫量の仮定をテストした
当社の製品収益収益準備金をテストするために、他のプログラムに加えて、私たちの監査プログラムは、テスト計算に使用される基礎データの正確性および完全性、および管理層がその埋蔵量を推定するために使用する仮定を評価することを含む。経営陣の仮説を検証するために、重要顧客との返品権利確認協定をチェックし、商業機能部門メンバーにビジネス契約条項や条件の変化を聞いた。また、年末期間とその後に発行された貸出通知書をチェックし、会社の製品返品の分析と一致しない異常項目や傾向を発見し、期末に収入遮断テストを行い、会社が製品返品の分析を考慮すべき異常な傾向があるかどうかを評価した。また,重要顧客が貸借対照表日および貸借対照表日後に報告した手元在庫を検討し,報告日中に第三者源からのワクチン接種データをチェックした。また,会社の収益率について感受性分析を行い,仮説変化の影響を評価した。
|
| | 原材料在庫減記 |
| 関係事項の記述 | | 同社は2023年12月31日現在、4億ドルの在庫を持っている。付記2に開示されているように、在庫はコストまたは現金化可能値の中の低い者に入金される。同社は在庫構成を定期的に審査し、過剰、陳腐、移動が遅い、または他に販売できない物品を特定する。2023年12月31日までの年間在庫減記は22億ドルで、2023年第3四半期に会社の長期財務計画過程による9.03億ドルの原材料在庫減記が含まれている。
監査管理層の原材料在庫減記の推定は特に監査人の主観的な判断に関連しており、推定は市場と経済状況の影響を受ける要素に依存するため、これらの要素は会社がコントロールできるものではない。特に,原材料在庫減記は,会社製品への期待需要や原材料の満期日を含む重大な仮定に敏感である。
|
私たちが監査でどのようにこの問題を解決したのか | | 我々は,設計を理解.評価し,管理層による上記の重大な仮定の審査,推定のための情報の完全性と正確性の制御を含む会社原材料在庫減記プロセスの内部制御の操作有効性をテストした.
会社の原材料在庫減記をテストするために、我々の監査プログラムは、他のプログラムに加えて、計算に使用される基礎データの正確性と完全性をテストし、経営陣が推定に使用する仮説を評価する。当社の評価に使用したデータのテストには,使用した原材料の納期,会社製品に必要な材料,および任意の代替用途の正確性が含まれている。我々は、その予測における重要な仮定をテストすることを含む会社の将来需要の予測を評価し、予測と管理層の他の目的のための予測との整合性を評価した。また,重大な仮説の変化が原材料在庫減記に及ぼす影響を評価し,発見されたいかなる逆の証拠も評価する感受性分析を行った
|
| | |
| | |
| | |
| | |
| | |
| | |
| | |
/s/ 安永法律事務所
2014年以来、当社の監査役を務めてきました。
ボストン、マサチューセッツ州
2024年2月23日
Moderna社
合併貸借対照表
(単位:百万、1株当たりのデータは含まれていない) | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 |
| 資産 | | | |
| 流動資産: | | | |
| 現金と現金等価物 | $ | 2,907 | | | $ | 3,205 | |
| 投資する | 5,697 | | | 6,697 | |
| 売掛金純額 | 892 | | | 1,385 | |
| 在庫品 | 202 | | | 949 | |
| 前払い費用と他の流動資産 | 627 | | | 1,195 | |
| | | |
| 流動資産総額 | 10,325 | | | 13,431 | |
| 非流動投資 | 4,677 | | | 8,318 | |
| 財産·工場·設備·純価値 | 1,945 | | | 2,018 | |
| 資産を使用し、レンタルを経営する | 713 | | | 121 | |
| | | |
| 繰延税金資産 | 81 | | | 982 | |
| 他の非流動資産 | 685 | | | 988 | |
| 総資産 | $ | 18,426 | | | $ | 25,858 | |
| 負債と株主権益 | | | |
| 流動負債: | | | |
| 売掛金 | $ | 520 | | | $ | 487 | |
| 負債を計算すべきである | 1,798 | | | 2,101 | |
| 収入を繰り越す | 568 | | | 2,038 | |
| 所得税に対処する | 63 | | | 48 | |
| その他流動負債 | 66 | | | 249 | |
| 流動負債総額 | 3,015 | | | 4,923 | |
| 収入を繰延し、流動ではない | 83 | | | 673 | |
| 非流動経営賃貸負債 | 643 | | | 92 | |
| 非流動融資リース負債 | 575 | | | 912 | |
| 他の非流動負債 | 256 | | | 135 | |
| 総負債 | 4,572 | | | 6,735 | |
負担額およびまたは事項(注11) | | | |
| 株主権益: | | | |
優先株、$0.0001; 1622023年12月31日まで、2022年12月31日までに認可された株式違います。2023年12月31日及び2022年12月31日に発行又は発行された株式 | — | | | — | |
普通株、額面$0.0001; 1,6002023年12月31日と2022年12月31日までに認可された株382そして3852023年12月31日と2022年12月31日までの発行済株式 | — | | | — | |
| 追加実収資本 | 371 | | | 1,173 | |
| その他の総合損失を累計する | (123) | | | (370) | |
| 利益を残す | 13,606 | | | 18,320 | |
| 株主権益総額 | 13,854 | | | 19,123 | |
| 総負債と株主権益 | $ | 18,426 | | | $ | 25,858 | |
付記はこれらの連結財務諸表の構成要素である。
Moderna社
連結業務報告書
(単位:百万、1株当たりのデータは含まれていない) | | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年間 |
| 2023 | | 2022 | | 2021 |
| 収入: | | | | | |
| 製品純売上高 | $ | 6,671 | | | $ | 18,435 | | | $ | 17,675 | |
| その他の収入 | 177 | | | 828 | | | 796 | |
| | | | | |
| | | | | |
総収入 | 6,848 | | | 19,263 | | | 18,471 | |
| 運営費用: | | | | | |
| 販売コスト | 4,693 | | | 5,416 | | | 2,617 | |
| 研究開発 | 4,845 | | | 3,295 | | | 1,991 | |
| 販売、一般、行政 | 1,549 | | | 1,132 | | | 567 | |
| 総運営費 | 11,087 | | | 9,843 | | | 5,175 | |
| 営業収入(赤字) | (4,239) | | | 9,420 | | | 13,296 | |
| 利子収入 | 421 | | | 200 | | | 18 | |
| その他の費用、純額 | (124) | | | (45) | | | (29) | |
| 所得税前収入 | (3,942) | | | 9,575 | | | 13,285 | |
| 所得税支給 | 772 | | | 1,213 | | | 1,083 | |
| 純収益 | $ | (4,714) | | | $ | 8,362 | | | $ | 12,202 | |
| | | | | |
| (損失)1株当たり収益: | | | | | |
| 基本的な情報 | $ | (12.33) | | | $ | 21.26 | | | $ | 30.31 | |
| 薄めにする | $ | (12.33) | | | $ | 20.12 | | | $ | 28.29 | |
| | | | | |
| 1株当たり(損失)収益を計算するための加重平均普通株: | | | | | |
| 基本的な情報 | 382 | | | 394 | | | 403 | |
| 薄めにする | 382 | | | 416 | | | 431 | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
付記はこれらの連結財務諸表の構成要素である。
Moderna社
総合総合収益表(損益表)
(単位:百万) | | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年間 |
| 2023 | | 2022 | | 2021 |
| 純収益 | $ | (4,714) | | | $ | 8,362 | | | $ | 12,202 | |
| その他総合収益(損失)、税引後純額:ドル | | | | | |
| 販売可能な証券: | | | | | |
| 債務証券の未実現収益(赤字) | 210 | | | (348) | | | (42) | |
| 差し引く:証券売却可能な純損失(収益)を純(損失)収益に再分類 | 38 | | | 26 | | | (1) | |
| 債務証券の純増加(減少) | 248 | | | (322) | | | (43) | |
| キャッシュフローのヘッジ: | | | | | |
| 派生ツールの未実現収益 | — | | | 130 | | | 74 | |
| 減算:派生ツールの実現した純損失(収益)を純(損失)収益に再分類する | 8 | | | (154) | | | (58) | |
| ヘッジツールに指定されたデリバティブの純増加(減少) | 8 | | | (24) | | | 16 | |
年金と退職後の福祉計画: | | | | | |
年金と退職後の債務調整 | (9) | | | — | | | — | |
| その他の総合収益(赤字)の総額はドルである | 247 | | | (346) | | | (27) | |
| 総合収益 | $ | (4,467) | | | $ | 8,016 | | | $ | 12,175 | |
付記はこれらの連結財務諸表の構成要素である。
Moderna社
合併株主権益報告書
(単位:百万)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | | 普通株 | | その他の内容
支払い済み
資本 | | 積算
他にも
全面的に
収入を損ねる | | 利益剰余金(累計)
赤字) | | 合計する 株主の 権益 |
| | | | | | | 株 | | 金額 | | | | |
| 2020年12月31日残高 | | | | | | | 399 | | | $ | — | | | $ | 4,802 | | | $ | 3 | | | $ | (2,244) | | | $ | 2,561 | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| 普通株購入のオプションを行使する | | | | | | | 7 | | | — | | | 112 | | | — | | | — | | | 112 | |
| 従業員株購入計画による普通株の発行 | | | | | | | — | | | — | | | 12 | | | — | | | — | | | 12 | |
| | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | |
| 株に基づく報酬 | | | | | | | — | | | — | | | 142 | | | — | | | — | | | 142 | |
| その他総合損失、税引き後純額 | | | | | | | — | | | — | | | — | | | (27) | | | — | | | (27) | |
| 普通株買い戻し | | | | | | | (3) | | | — | | | (857) | | | — | | | — | | | (857) | |
| 純収入 | | | | | | | — | | | — | | | — | | | — | | | 12,202 | | | 12,202 | |
| 2021年12月31日の残高 | | | | | | | 403 | | | $ | — | | | $ | 4,211 | | | $ | (24) | | | $ | 9,958 | | | $ | 14,145 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | | 普通株 | | その他の内容
支払い済み
資本 | | 積算
他にも
全面的に
損 | | 利益を残す | | 合計する 株主の 権益 |
| | | | | | | 株 | | 金額 | | | | |
| 2021年12月31日の残高 | | | | | | | 403 | | | $ | — | | | $ | 4,211 | | | $ | (24) | | | $ | 9,958 | | | $ | 14,145 | |
| | | | | | | | | | | | | | | | | |
| 制限された普通株の帰属 | | | | | | | 1 | | | — | | | — | | | — | | | — | | | — | |
| 普通株購入のオプションを行使する | | | | | | | 4 | | | — | | | 50 | | | — | | | — | | | 50 | |
| 従業員株購入計画による普通株の発行 | | | | | | | — | | | — | | | 15 | | | — | | | — | | | 15 | |
| 株に基づく報酬 | | | | | | | — | | | — | | | 226 | | | — | | | — | | | 226 | |
| その他総合損失、税引き後純額 | | | | | | | — | | | — | | | — | | | (346) | | | — | | | (346) | |
| 普通株買い戻し | | | | | | | (23) | | | — | | | (3,329) | | | — | | | — | | | (3,329) | |
| 純収入 | | | | | | | — | | | — | | | — | | | — | | | 8,362 | | | 8,362 | |
| 2022年12月31日の残高 | | | | | | | 385 | | | $ | — | | | $ | 1,173 | | | $ | (370) | | | $ | 18,320 | | | $ | 19,123 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | | 普通株 | | その他の内容
支払い済み
資本 | | 積算
他にも
全面的に
収入を損ねる | | 利益を残す | | 合計する 株主の 権益 |
| | | | | | | 株 | | 金額 | | | | |
| 2022年12月31日の残高 | | | | | | | 385 | | | $ | — | | | $ | 1,173 | | | $ | (370) | | | $ | 18,320 | | | $ | 19,123 | |
| | | | | | | | | | | | | | | | | |
| 制限された普通株の帰属 | | | | | | | 1 | | | — | | | — | | | — | | | — | | | — | |
| 普通株購入のオプションを行使する | | | | | | | 4 | | | — | | | 25 | | | — | | | — | | | 25 | |
| 従業員株購入計画による普通株の発行 | | | | | | | — | | | — | | | 21 | | | — | | | — | | | 21 | |
| 株に基づく報酬 | | | | | | | — | | | — | | | 305 | | | — | | | — | | | 305 | |
| その他の総合収益、税引き後純額 | | | | | | | — | | | — | | | — | | | 247 | | | — | | | 247 | |
| 普通株は消費税を含めて買い戻します | | | | | | | (8) | | | — | | | (1,153) | | | — | | | — | | | (1,153) | |
| 純損失 | | | | | | | — | | | — | | | — | | | — | | | (4,714) | | | (4,714) | |
| 2023年12月31日の残高 | | | | | | | 382 | | | $ | — | | | $ | 371 | | | $ | (123) | | | $ | 13,606 | | | $ | 13,854 | |
付記はこれらの連結財務諸表の構成要素である。
Moderna社
統合現金フロー表
(単位:百万) | | | | | | | | | | | | | | | | | |
| 2011年12月31日までの数年間 |
| 2023 | | 2022 | | 2021 |
| 経営活動 | | | | | |
| 純収益 | $ | (4,714) | | | $ | 8,362 | | | $ | 12,202 | |
| 純(損失)収入と経営活動が提供する現金純額の調整: | | | | | |
| 株に基づく報酬 | 305 | | | 226 | | | 142 | |
| 減価償却および償却 | 621 | | | 348 | | | 232 | |
| | | | | |
| 償却·付加価値投資 | (61) | | | 31 | | | 54 | |
| | | | | |
| 株式投資損失、純額 | 35 | | | — | | | — | |
| 所得税を繰延する | 828 | | | (559) | | | (318) | |
| 他の非現金プロジェクト | 7 | | | 28 | | | — | |
| 資産と負債の変動、業務買収後の純額を差し引く: | | | | | |
| 売掛金純額 | 493 | | | 1,790 | | | (1,784) | |
| 前払い費用と他の資産 | 974 | | | (1,699) | | | (489) | |
| 在庫品 | 747 | | | 492 | | | (1,394) | |
| 資産を使用し、レンタルを経営する | (605) | | | 21 | | | (58) | |
| 売掛金 | 13 | | | 240 | | | 204 | |
| 負債を計算すべきである | (340) | | | 612 | | | 989 | |
| 収入を繰り越す | (2,060) | | | (4,157) | | | 2,824 | |
| 所得税に対処する | 15 | | | (828) | | | 876 | |
| リース負債を経営する | 551 | | | (14) | | | 17 | |
| その他負債 | 73 | | | 88 | | | 123 | |
| 経営活動が提供する現金純額 | (3,118) | | | 4,981 | | | 13,620 | |
| 投資活動 | | | | | |
| 有価証券を購入する | (3,760) | | | (11,435) | | | (12,652) | |
| 有価証券満期日収益 | 5,575 | | | 3,151 | | | 1,338 | |
| 有価証券を売却して得られる収益 | 3,206 | | | 3,548 | | | 3,105 | |
| 家屋·工場·設備を購入する | (707) | | | (400) | | | (284) | |
| 買収業務は,現金買収後の純額を差し引く | (85) | | | — | | | — | |
| 転換可能手形と持分証券の投資 | (23) | | | (40) | | | (30) | |
| 投資活動提供の現金純額 | 4,206 | | | (5,176) | | | (8,523) | |
| 融資活動 | | | | | |
| | | | | |
| | | | | |
| | | | | |
| 株式計画で普通株の収益を発行する | 46 | | | 65 | | | 124 | |
| | | | | |
| 普通株は消費税を含めて買い戻します | (1,153) | | | (3,329) | | | (857) | |
| 融資リース負債変動 | (270) | | | (184) | | | (140) | |
| | | | | |
| | | | | |
| 融資活動のための現金純額 | (1,377) | | | (3,448) | | | (873) | |
| 現金、現金等価物、および制限的現金純増加 | (289) | | | (3,643) | | | 4,224 | |
| 現金、現金等価物、制限された現金、年明け | 3,217 | | | 6,860 | | | 2,636 | |
現金、現金等価物、制限現金、年末 | $ | 2,928 | | | $ | 3,217 | | | $ | 6,860 | |
キャッシュフロー情報を補充する | | | | | |
| 所得税を納めた現金 | $ | (357) | | | $ | 2,729 | | | $ | 480 | |
| 利子を支払う現金 | $ | 39 | | | $ | 25 | | | $ | 14 | |
非現金投融資活動 | | | | | |
| | | | | |
| 売掛金と売掛金に掲げる財産·工場と設備の購入額 | $ | 130 | | | $ | 72 | | | $ | 111 | |
| | | | | |
| | | | | |
| | | | | |
付記はこれらの連結財務諸表の構成要素である。
Moderna社
連結財務諸表付記
1.ビジネス記述
Moderna社(合併した子会社,Moderna,我々または当社のいずれか)はバイオテクノロジー会社であり,メッセンジャーリボ核酸から作られた新しい薬剤を発売した。メッセンジャーリボ核酸薬は、ヒト細胞の細胞内、膜または分泌タンパク質の産生を誘導することを目的としており、これらのタンパク質は治療または予防のメリットがあり、広範な疾患を治療する可能性がある。著者らのプラットフォームはメッセンジャーリボ核酸科学、交付技術と製造方面の絶えずの進歩を基礎と応用した上で、新しい開発候補の強力なルートを同時に求める能力を提供した。我々は,感染症,免疫腫瘍学,まれな疾患,自己免疫疾患に対する療法とワクチンを独立して我々の戦略パートナーと共同開発している
私たちの新冠肺炎ワクチンは私たちの最初の商業化製品であり、承認された場合、Spikevaxの名前で発売された。著者らの最初のワクチンmRNA-1273はSARS-CoV-2祖先毒株に対して、著者らは著者らのmRNAプラットフォームを利用して迅速に著者らのワクチンを新たに出現したSARS-CoV-2毒株に適応させ、ウイルスの変化と監督ガイドラインの更新に伴い保護を提供した。
私たちは多様で広範な開発パイプラインを持っています42私たちの開発候補者は45発展計画はその中で40現在臨床研究が行われている。
2.主な会計政策の概要
列報根拠と合併原則
我々の総合財務諸表は米国公認会計原則(GAAP)に従って作成されている。これらの説明における適用ガイドラインへの任意の言及は、米国財務会計基準委員会(FASB)の会計基準編纂(ASC)および会計基準更新(ASU)のような米国公認の権威ある会計原則を意味する。
連結財務諸表には当社とその子会社が含まれている。すべての会社間取引と残高は合併で販売された。
統合業務報告書中の他の収入には、贈与収入と連携収入が含まれており、これらの収入は以前、我々の2022年Form 10-K総合業務レポートに単独の行項目として示されていました。連結財務諸表及びその付記中の関連前期金額は、現在の列報方式に適合するように再分類された。
予算の使用
私たちが下した見積もりと判断は私たちの総合財務諸表と付記報告書の金額に影響を及ぼす。吾らは過去の経験や当時の状況に応じて部下の合理的な諸関連仮定を推定し、その結果、財務諸表日の資産や負債帳簿額面および報告期間内の他の出所に反映されにくい収入や支出を判断する基礎となっている。私たちが推定した変化は新しい情報利用可能な期間の財務結果に記録されている。私たちが経験した実際の結果は私たちの推定と大きく違うかもしれない。
市場情報を細分化する
私たちは私たちの最高経営責任者が運営意思決定者(CODM)だと確信した。CODMは総合的な基礎に基づいて提案された財務情報を検討する。資源割当て決定はCODMが統合結果に基づいて行う.CODMは、部門マネージャーが合併単位レベル以下のレベル又は構成要素の運営、運営結果及び計画に責任を負うことを要求しない。そこで私たちの仕組みは1つは市場を細分化する。
収入確認
ASC 606の範囲内で確認すべき適切な収入金額を決定するために、(I)顧客との契約の決定(S)、(Ii)契約における履行義務の決定、(Iii)取引価格の決定、(Iv)契約への取引価格の分配義務、および(V)各履行義務が履行されたときに収入を確認する5つのステップ(5ステップモデル)を実行する
ネットワークがあります製品販売
2023年第3四半期までに、私たちはアメリカ政府、外国政府、組織に私たちの新冠肺炎ワクチンを売却した。これらのエンティティとの合意および関連修正は、一般に、割引、リベート、または返品のような可変対価格を含まない。その中のいくつかの合意は私たちに私たちの新冠肺炎ワクチンに前払い手付金を供給する権利を与え、最初に繰延収入と記録した。2023年第3四半期、私たちは米国商業市場に最新の新型肺炎ワクチンの販売を開始し、また、国際政府と組織にも販売を続けている。アメリカでは,我々の新冠肺炎ワクチンは主に卸売業者や流通業者に販売され,次いで小売業者やヘルスケア提供者に直接販売されている。卸売業者と流通業者は通常私たちにお金を前払いしないだろう。
製品制御権がお客様の手に移った場合、製品の純売上高を確認します。通常は納品時です支払い期限は一般的に30日から60日ですそれぞれの国の慣例に合致する。製品の純売上高は、想定されている卸売業者の返金、即時支払いと予約した領収書割引、販売返品準備金、その他の関連控除を差し引いて確認されます。これらの準備は、契約条項と期間内の販売製品の返品の見積もりに基づいて、期待値方法または最も可能な金額方法を用いて記録されています。私たちは四半期ごとに私たちの推定を更新し、確定調整中に必要な調整を記録します。引当後の製品販売を差し引くと、支出に関する不確実性がその後解決された後、確認された累計収入金額が大きく逆転することは不可能な場合にのみ記録される。輸送·運搬活動は、単独の履行義務ではなく、活動を履行するとみなされる。政府当局が評価したわが製品販売に課された税金は製品純売上高には含まれていません。
卸は返金、割引、費用を返金します
私たちは小売業者、ヘルスケア提供者、共同購入組織(GPO)と契約を結び、私たちの顧客範囲を拡大し、契約割引を提供します。記憶容量別使用課金は、卸売業者に発行された請求書価格と、小売業者、医療提供者、およびGPOメンバから徴収された交渉価格との差を表す。在庫やコールドチェーン貯蔵などの配送と関連サービスについて、私たちの卸売業者と流通業者に補償を提供します。即時支払いと予約の場合、私たちは通常顧客に製品販売の領収書割引を提供します。これらの割引と費用の推定は、契約条項と将来の顧客支払い行動に対する私たちの期待に基づいています。卸費用と領収書割引はこのような製品の販売を確認する際に私どもの製品販売総額と売掛金から差し引かれます。
製品を返品する
私たちは通常アメリカの顧客に返品権利を提供します。最高契約に規定されている特定の制限に達します。我々の新冠肺炎ワクチンの予測リターンは類似製品の利用可能な収益率、流通ルートの推定在庫レベルと予想される市場需要に基づいて決定される。製品返品の見積もり金額は、当社の総合貸借対照表の計上すべき負債に記載され、関連製品の販売確認中に当社の総製品販売から差し引かれます。
その他の費用
第三者支払者および医療提供者に支払われる費用、および私たちの直接顧客に支払われる現金で支払われる費用は、いくつかの患者援助計画を含み、私たちの総合貸借対照表には負債と記載されている。
確認する可変対価格の数を決定するには、特に、関連する履歴データおよび限られた第三者情報の不足など、我々が直接制御以外の要因を評価する際に多くの判断が必要である。すべての変数の中で、潜在結果の広い範囲と私たちのお客様は現在返品履歴が不足しているため、返品が最も重要な判断だと思います。私たちはより多くの製品返品に関する履歴データを受け取るにつれて、これらの情報を統合して、私たちの見積もりを改善し、財務予測の精度を向上させます。実際の結果は私たちの見積もりとは異なるかもしれませんが、このような違いは私たちの財務諸表に実質的な影響を与える可能性があります。
その他の収入
他の収入は主に許可収入と協力収入を含む
奨学金収入
政府後援や民間組織と研究開発関連活動の契約を締結し,間接費用,一般·行政コスト,関連利益率が含まれる可能性がある精算コストを規定した。資金が約束された場合、私たちはこれらの手配に基づいてサービスを提供する際に、これらの契約から得られた贈与収入を確認する。関連費用は発生時に研究と開発費用であることが確認された。贈与収入及び関連支出は総合経営報告書に毛額で示されており、吾らは吾らが首席技術専門家として行われた研究開発サービス手配の主要債務者であることが確定している。
協力収入
私たちはすでに第三者と特定の製品と候補製品の研究と他の許可、開発、商業化について戦略的協力と他の類似の手配を達成した。このような手配は、前払い費用、研究および開発サービス、ならびに臨床前および臨床材料の資金、技術、開発、規制および商業マイルストーン支払い、許可費、オプション使用料、および製品販売の特許権使用料およびプレミアムを含む様々なタイプのお金を支払うことが規定されている。このような支払いは収入確認の時間に合わないことが多いため、収入確認の遅れを招く。我々は,義務履行時や義務履行時に約束した貨物やサービスを顧客に譲渡して義務を履行する際に義務履行ごとに割り当てられた取引価格の金額に基づいて収入を確認する.
現金と現金等価物
購入日から90日以下の原始期限以下の高流動性投資はすべて現金等価物であると考えられる。
制限現金
制限現金は、私たちの賃貸手配に関する預金金額と、2023年の業務買収に関連する信託口座の資金からなります。これらの資金は通貨市場口座に保存され、公正な価値で記録されている。制限された現金は、基本的に配置された条項に従って流動または非流動に分類され、私たちの総合貸借対照表における前払い費用および他の流動資産または他の非流動資産に含まれる。
現金フロー表の現金、現金等価物、および制限現金
以下の表は、連結貸借対照表中の現金、現金等価物、および制限現金を照合し、これらの現金合計は、連結現金フロー表に示される同じ額の総和(百万計)である
| | | | | | | | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 | | 2021 |
| 現金と現金等価物 | | $ | 2,907 | | | $ | 3,205 | | | $ | 6,848 | |
制限現金(1) | | 17 | | | — | | | — | |
制限された現金、非流動現金(2) | | 4 | | | 12 | | | 12 | |
| 統合現金フロー表に示されている現金、現金等価物、および限定的な現金総額 | | $ | 2,928 | | | $ | 3,217 | | | $ | 6,860 | |
_______
(1)総合貸借対照表に計上された前払い費用及びその他の流動資産。
(2)総合貸借対照表に計上された他の非流動資産。
投資する
私たちは余分な現金残高を取引可能な債務証券に投資する。私たちは取引可能な債務証券に対する私たちの投資を売ることができるように分類した。私たちは資産負債表ごとに公正な価値で私たちの売却可能な証券を報告し、いかなる実現されていない保有損益(公正価値調整)を他の全面収益(損失)に計上することは、株主権益の構成要素である。実現された収益および損失は、特定の識別方法を用いて決定され、我々の合併経営報告書の他の費用純額に含まれる。私たちは各ツールの有効期限に基づいて、私たちの販売可能な証券を流動証券または非流動証券に分類し、これらの証券の投資を持つ意欲と能力があります
期限は12ヶ月を超えています。期限が12ヶ月未満の売却可能証券は、流動証券に分類され、総合貸借対照表への投資に計上される。満期期間が12ヶ月を超える売却可能証券は、12ヶ月を超える投資を保有する意欲と能力があれば、非流動証券に分類され、総合貸借対照表に投資、非流動資産に計上される。
私たちは各報告期間の終わりに証券の減価を評価する。減値の評価は多くの要因を考慮しており,それらの相対的重要性は状況によって異なる.考慮した要素は公正価値が余剰コスト基礎まで低下したことを含み、以下は信用関連要素か非信用関連要素か、発行者の財務状況と最近の見通し、及び著者らが投資の意図と能力を持って、予想される公正価値の回復を実現するためである。クレジットに関する減値は貸借対照表上で準備していることを確認し,収益に応じた調整を行う。いずれの信用にも関係のない減値は,適用税項を差し引いた他の全面収益(赤字)で確認されている
公正価値が随時確定可能な上場株式証券への投資は同じ証券の市場見積記録であり、公正価値変動は著者らの総合経営報告書に他の費用純額に記録されている。いつでも公正価値を決定できる権益証券のない投資は、コストから減値(あればある)を引いて入金し、同じ或いは類似した証券秩序取引に見られる価格変動に基づいて調整する。このような調整は私たちの合併経営報告書に他の費用純額を記入します。
売掛金純額
売掛金、純額は顧客から得なければならない金額から卸売業者の返金、割引、費用を差し引くことを表します(私たちはここを参照してください注2製品販売準備)と予想される信用損失対策。私たちの対価格権が無条件の時、私たちに支払う金額は売掛金として記録されます。信用損失準備を推定するために、著者らは持続的な信用評価、歴史経験と売掛金の帳簿年齢などの要素に基づいて準備を確定した。あったことがある違います。計算は2023年12月31日または2022年12月31日の不良債権準備を提出する。また不良債権支出は無形の2023年12月31日まで、2022年、2021年12月31日まで。
信用リスクの集中度
私たちが高度に集中した信用リスクに直面させた金融商品は主に現金、現金等価物、制限された現金、販売可能な債務証券と売掛金純額を含む。私たちのポートフォリオには、米国債、米国政府機関、会社実体の債務証券、商業手形を含む通貨市場基金と取引可能な債務証券が含まれる。我々の現金管理·投資政策は、投資ツールを投資レベルの証券に制限し、資金が商業運営に利用できるまで資本を保存し、流動性を維持することを目的としている。私たちは様々な金融商品に投資し、どの金融機関の信用の開放も制限している。米国の銀行口座は連邦預金保険会社(FDIC)が保証し、最高25万ドルに達する。私たちの主な運営口座はFDICの限度額を大きく超えている
私たちはまた売掛金、純製品販売、戦略連合からの信用リスクに直面している。私たちは主に卸売業者や流通業者や他の政府や組織に私たちの製品を販売しています。私たちは売掛金を支援するために担保や他の保証を必要としない。今まで、私たちは売掛金の回収で大きな損失を受けなかった。
重要な取引先
私たちの売掛金の純額は通常無担保で、違う国の顧客から来ています。私たちの収入は、卸売業者や流通業者および他の政府や組織への製品の販売、政府支援および民間組織からの贈与、および私たちの戦略連合の協力収入からのものです。
これまで、私たちの収入の大部分は、本報告に記載されている期間の総収入および売掛金に占める割合が10%を超えるエンティティから来ている | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 総収入のパーセントを占める 2011年12月31日までの数年間 | | その割合です
売掛金
十二月三十一日 |
| 2023 | | 2022 | | 2021 | | 2023 | | 2022 |
| | | | | | | | | |
| FFF企業 | * | | * | | * | | 39 | % | | * |
| | | | | | | | | |
| 欧州委員会 | * | | 28 | % | | 32 | % | | * | | 29 | % |
| アメリカ政府(BARDAは含まない) | * | | 23 | % | | 29 | % | | * | | * |
| 武田薬品工業社 | * | | 10 | % | | * | | * | | * |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| 日本厚生労働省 | 21 | % | | * | | * | | * | | 30 | % |
| イギリス健康安全保障局 | * | | * | | * | | 35 | % | | 11 | % |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
| | | | | | | | | |
________
*-10%未満の金額
公正価値計量
公正価値は、計量日の市場参加者間の秩序ある取引において売却資産から得られた価格または支払いされた移転負債の価格として定義される。公正価値記録に必要な資産や負債の公正価値計量を決定する際には、私たちが取引を行う元本や最も有利な市場、および市場参加者が資産や負債の定価のために使用する市場に基づくリスク計量や仮定、例えば推定技術に固有のリスク、譲渡制限および信用リスクを考慮する。ASC:820(公正価値計量)公正価値計量のためのツールのための公正価値レベルを確立し、市場データに基づく仮説(観察可能な投入)と我々の仮説(観察不可能な投入)とを区別する。観察される投入は、市場参加者が我々の独立したソースから得られた市場データに基づいて資産または負債を定価する際に使用される投入である。観察できない投入は,市場参加者が資産や負債に価格を設定する際に使用する投入の仮定を反映し,その際に得られる最適な情報に基づいて形成された投入である。以下の公正価値レベルは、資産および負債を推定するための観察可能な投入および観察不可能な投入に基づいて資産および負債を分類するために使用される
•レベル1:市場を活性化する未調整見積は、計量日に同じ制限されない資産または負債の見積もりを得ることができる
•レベル2:アクティブ市場における同様の資産および負債のオファー、非アクティブ市場におけるオファー、または資産または負債のほぼ全期間にわたって直接または間接的に観察可能な投入;または
•第三段階:価格或いは推定技術は公正な価値計量に重要な意義があるが観察できない投入が必要である(すなわち、市場活動の支持が少ないかないか)。
ある程度、推定値は市場で観察または観察できないモデルや投入に基づいており、公正価値の決定にはより多くの判断が必要である。公正価値階層構造中の金融商品レベルは、公正価値計量に重要な意義がある任意の投入中の最低レベルに基づいている。
我々の現金等価物と取引可能債務証券は公正価値によって報告され、公正価値は第1級と第2級投入によって決定される(注:6)である。私たちの外貨長期契約の公正価値は第2級投入を使用して計算され、その中に貨幣スポットレート、長期為替レート、金利曲線と信用或いは不履行リスクが含まれている。私たちは2023年12月31日と2022年12月31日に公正な価値で恒常的に確認または開示しなければならない非金融資産や負債を何も持っていない。
在庫品
在庫はコストまたは可変現純値の中で低い者に入金し、在庫の異なる構成部分の先進先出法と平均コスト法でコストを確定する。私たちは定期的に在庫の構成をチェックして、過剰、時代遅れ、移動が遅い、あるいは他の販売できないものを確定します。販売できない物品が観察され,在庫に代替用途がない場合には,価値低下が初めて販売コストを計上して確認している間に,可変現純値を減記する。在庫コストが現金化できるかどうかを判断するには経営陣が試算する必要がある。実際の市場状況が経営陣が予想していたほど有利でなければ、在庫を追加的に減記する必要があるかもしれない。また、第三者サプライヤーとの供給契約によって生じた余分な会社、キャンセルできない調達承諾負債があるかどうかを四半期ごとに評価します。将来の製品需要の推定、製品純販売価格、現在および未来の市場状況、潜在的な製品の古い、決定された購入約束および契約最低限度額による原材料の満期および利用など、現金化可能な純資産および決定された購入承諾負債を決定する必要があると判断する必要がある。私たちが持っている原材料は、私たちが1年間予測した生産計画を超えており、これらの原材料は非流動資産に分類され、私たちの総合貸借対照表の他の非流動資産に含まれている。
発表前在庫
将来の商業化の可能性、将来の経済効果が期待されると考えられる場合、監督管理機関の承認前に製品を発売しようとしている原材料や生産在庫に関するコストが資本化され、最終監督管理機関の承認に関する重大な不確実性が著しく減少していると信じている。資本化された上場前在庫について、著者らは当時利用可能な情報に基づいて、候補製品の薬物開発と監督管理承認過程における現在の状態、関連臨床試験の結果、監督管理申請を提出する前に関連監督管理機関と開催された会議の結果、承認過程の潜在的な障害、例えば製品の安全性或いは有効性、歴史経験、商業化実行可能性と市場傾向を含む複数の要素を考慮した。2023年12月31日現在、我々の合併貸借対照表には資本化の投入前在庫は何もありません。
不動産·工場および設備
財産·工場と設備は減価償却累計を差し引いたコストで申告する.減価償却は資産の推定耐用年数直線法で計算されます財産、工場と設備の推定使用年数は以下の通りである
| | | | | | | | |
| | 役に立つ生活を見積もる |
| 土地と土地改良 | | 未減価償却 |
| 製造と実験室装置 | | 5年.年 |
賃借権改善 | | 少ない人は生活改善が有用だと思う
または関連する賃貸契約の残存寿命 |
コンピュータ装置及びソフトウェア | | 3至れり尽くせり5年.年 |
| | |
| 家具と固定装置 | | 5年.年 |
| 使用権資産·融資 | | 賃借期間 |
建設中の工事には各種の物件、工場と設備の建設に関連する直接コストが含まれており、レンタル改善を含み、原始コストで報告されている。資産が使用されると、これらの資本化コストはいくつかの不動産、工場、および設備カテゴリに割り当てられ、関連資産の推定使用年限内で減価償却される。
買収する
私たちは、買収された資産が企業の定義に適合しているかどうかに基づいて、買収を業務合併または資産買収に分類する。一つの買収が企業合併と決定された場合、会計の買収方法を採用する。この方法では,買収した資産と負担した負債を我々の合併貸借対照表に買収日の公正価値で入金することを要求する.譲渡の対価格は,取得した純資産の公正価値を確認できるどの部分を超えても営業権であることが確認された.資産と負債の公正な価値を決定する過程は重大な推定と仮定に関するものだ。買収日から最長1年の計量期間内に,吾らはその等公正価値の調整を記録することが可能である。このような調整は、営業権の対応する変化と共に記録される。企業合併に関連して発生する取引コストは発生時に費用を計上する。
2023年1月31日、OriCiroゲノムK.K.のすべての流通株を現金対価$で買収する業務統合を完了した861000万ドルです。今回の買収の結果として$を確認しました522000万ドルの商標と買収された技術に関する無形資産、価値482000万ドルは、私たちの合併貸借対照表の他の非流動資産に含まれています。この獲得は私たちに無細胞合成とプラスミドDNAを増幅するツールを提供し、質DNAはmrnaの重要な構成要素である
製造業です。OriCiroの技術は戦略的に私たちの製造技術を補完し、私たちの研究開発努力をさらに加速させた
商誉と無形資産
営業権とは、買収価格が買収純資産の公正価値を超える部分であり、コストによって入金される。営業権は少なくとも年に1回の減価テストを行い、方法は定性要素を評価して、純資産公正価値がその帳簿価値よりも低い可能性があるかどうかを決定することである。今まで、営業権の減価は記録されていない
無形資産を買収する公正価値は収益に基づく方法を応用することによって決定され、これは1種の推定技術であり、市場参加者が資産がその残りの使用年数内に発生するキャッシュフローに対する期待に基づいて、資産公正価値の推定を提供する。無形資産に起因することができる予期される現金流量を推定するためには、第3級公正価値計量と投入を使用する必要がある。有限年限の無形資産はその推定耐用年数内に直線的に償却される。
無形資産およびリース使用権資産を含む長期資産減価
私たちは財産、工場と設備、無形資産と使用権資産を含む私たちの長期資産を評価して、事実と状況が資産の帳簿価値が回収できない可能性があることを示すかどうかを確定します。このような事実や状況が存在する場合には,資産やそのグループの資産の残存寿命内の将来の未割引キャッシュフローについてそれぞれの帳票金額と比較し,そのような長期資産の回収可能度を評価する.このようなレビューが、等現金流量の予想がこれらの資産の記録価値を回収するのに不十分であることを示す場合、これらの資産は、これらの資産に帰属可能な予想に基づいて将来の現金流量を割引するか、または推定値に基づいて公正価値を推定することになる。2023年,2022年および2021年12月31日までの年度減価費用は無形の.
賃貸借証書
リースは,その発効日(レンタル者が対象資産をテナントが使用する日と定義する)で合意された経済的実質によって経営的または融資的賃貸に分類される。私たちは総合貸借対照表で経営リースと融資リースの賃貸使用権資産と関連負債を確認します。レンタル負債は、レンタル開始日にレンタルに隠された金利で計算され、将来のレンタル支払いの現在値となります。隠れ金利が確定しにくい場合は、レンタル開始日からの増量借入金金利を使用します。リース使用権資産は、リース負債に初期直接コストと前払い支払いを加えてリースインセンティブを引いて計測する。レンタル期間は、レンタルの取消不可期限であり、選択権の行使を合理的に決定した場合にレンタル契約を延長または終了する選択権を含む
総合経営報告書では,運営リースコストが運営支出に含まれていることを確認し,賃貸料上昇計上および賃貸料祝祭日を含めて,それぞれのレンタル期間内に直線的に確認した。私たちの融資リースについては、買収したリース資産に関する減価償却費用を確認し、私たちの総合経営報告書で融資部分に関する利息支出を確認します
すべてのカテゴリの対象資産について、私たちは非レンタル構成要素をレンタル構成要素から分離しないつもりだ。レンタル期間が12ヶ月以下の賃貸契約については、使用権資産と賃貸負債は確認しません。逆に、これらのリース支払いは、経営レポートにおいてリース期間内に直線的に確認される。
協力手配
ASC 808にあるかどうかを評価するために、私たちの協力スケジュールを分析します協力手配)このような構成が、活動の積極的な参加者であり、そのような活動の商業的成功に依存する重大なリスクおよびリターンに直面している締約国による共同経営活動に関連しているかどうかを決定する。ASC 808の範囲内に配置されている場合、私たちと私たちのパートナーとの間の配置の態様が他の会計文書の範囲内にあるかどうかを評価する。もし、スケジュールのいくつかまたは全部がお客様との取引を表すと結論が出た場合、私たちはASC 606の範囲内でスケジュールの態様を考慮します(顧客と契約を結んだ収入)である。“収入確認”政策を参照してください注2このような種類の配置された収入確認に関する追加的な議論。このスケジュールの一部または全部がASC 808の範囲内であり、顧客との取引を代表しないと結論した場合、共同で行われた活動に関連する分担コストは、発生した期間に関連する費用の構成要素であることを確認する。また、協力パートナーによって部分的に精算された資本支出に関するいかなる支払いについても、基礎資本コストが資本化条件を満たしていれば、受け取ったいかなる精算も資産の資本化コストを相殺する。
研究開発コスト
研究·開発コストは発生時に費用を計上する。研究·開発費用には、賃金·福祉、施設コスト、間接費用、契約サービス、その他の外部コストを含む研究·開発活動を行うために発生するコストが含まれる。本報告で述べた期間に契約研究組織および契約製造組織から受信された貨物およびサービスの価値は、提供されたサービスレベルに基づいて推定され、サプライヤーの請求書が受信されていない場合は、その期間の進捗状況に基づいて推定される。研究開発費には,第三者の協力手配に関する費用や分担費用も含まれており,第三者に支払われる技術的可能性や将来代替用途のない技術に関する前払い費用やマイルストーンが含まれている
研究·開発活動のために購入または建設された資産、および将来研究·開発プロジェクトやその他の用途に他の用途を有する資産は、その使用年数内に資本化や減価償却を行う。しかしながら、購入または建設された設備または施設のコスト、および特定の研究·開発プロジェクトのために他人から購入された、他の将来の用途のない無形資産のコストは、単独の経済的価値がなく、研究·開発コストとみなされ、発生時に費用を計上する。
広告費
広告に関するコストは、発生したときに費用を計上し、総合経営報告書における販売、一般、行政費用を計上するそれは.広告費は$2042023年には2億5千万ドル1212022年に1000万ドルに達し無形の2021年に
株に基づく報酬
私たちは従業員と非従業員に株式ベースの奨励を支給し、通常は株式オプション、制限株式単位(RSU)、業績株式単位(PSU)の形で支給される。ASC 718による株式ベースの報酬報酬を計算します(報酬-株報酬)それは.私たちの株式報酬の大部分は従業員に与えられている。付与日の公正価値に応じて持分奨励の補償コストを計量し,必要なサービス期間(通常は帰属期間)の補償費用を直線法で確認した。株式オプションの公正価値は、予想される付与期限、予想付与期限にほぼ比例した時間に基づいて計算された私たちの株の予想変動率、無リスク金利、および私たちの株の予想配当収益率を含む、Black-Scholesオプション定価モデルを用いて推定されたものである。我々は、簡略化された方法を用いて、従業員および非従業員に付与された株式オプションの期待期間、すなわち、期待期間がオプションの既得期限および元の契約期間の平均値に等しいと推定する。私たちがこの方法を採用したのは、合理的な基礎を提供して期待期間を推定するのに十分な歴史的演習データがなく、過去数年間の私たちの業務の重大な変化が歴史経験をそれほど重要ではないからである。予想変動率は,選定指標会社の株式オプション期待期間内の平均履歴株価変動率,我々の株価の履歴変動率,および我々株の取引取引オプション価格から得られる暗黙的株価変動率の混合平均値に基づく.我々の業務の変動性の変化から,混合変動率は歴史変動率よりも将来の波動性を示唆していると考えられる。私たちは、歴史的経験が現在付与されている期待に関連していると信じられるまで、私たち自身の株価予想期限と歴史的変動性に関する十分な数の履歴情報があるまで、この過程を適用し続ける。日RSUに付与された公正価値は、私たちの基礎普通株の公正価値によって推定された。業績に基づく株式奨励については、業績が得られる可能性がある場合には、加速帰因法を用いて必要なサービス期間内の株式ベースの報酬支出を確認する。我々の総合経営報告書において株式に基づく報酬費用を分類する方式は,受賞者の賃金や関連コストを分類する方式や受賞者のサービス支払いを分類する方式と同様である.私たちは株式奨励が発生した時にそれらの喪失を確認する会計政策選択をした。
所得税
私たちは貸借対照法に基づいて所得税を計算する。繰延税金資産と負債は、資産と負債の財務報告と課税基盤との一時的な違いによって生じる予想される将来の税務結果であることを確認します。これらの違いは、制定された法定税率と法律を用いて測定され、これらの法律は、差異の予想が逆転した時に発効する。繰延税金資産の予想変動が“可能性が高い”という基準を満たしていない場合には、推定免税額が提供される。私たちは定期的に私たちの繰延税金資産計の評価準備の必要性を再評価するとともに、このような資産の全部または一部を実現できない可能性が高いかどうかを評価するために、積極的かつ消極的な証拠を考慮する。私たちは私たちの計画と推定と一致する仮定に基づいて、私たちの未来の課税収入を推定し、判断します。もし実際の金額が私たちの見積もりと違うなら、私たちの推定免税額は大きな影響を受けるかもしれない。これらの推定値の変化は、このような推定が変化している間に、私たちの税金支出を大幅に増加または減少させる可能性があり、これは逆に純収益または損失に影響を与える可能性がある。税務機関が税務立場の技術的価値に基づいて審査した後、その立場がさらに続く可能性があると考えると、不確定な税務立場による税収利益を確認します。調整します
事実および状況が変化した場合、例えば、税務監査を終了したり、推定数を修正したりする場合、これらの予約税金は調整されなければならない。所得税の支出には、不確定な税収状況に対する任意の準備金の影響と、関連する純利息および罰金が含まれる。
1株当たりの収益
1株当たり普通株株主を占めるべき希薄純収益(損失)を計算する方法は、純収益(損失)を発行済み普通株の加重平均で除算し、期間内に発行された制限的普通株と株式オプションの希釈効果を考慮して1株当たりの希薄収益(損失)を計算することである。我々の純損失が発生した期間については、普通株株主が1株当たりの基本純損失を占めるべきであり、希釈後の1株当たり純損失と同じであり、潜在的な希薄化証券に組み入れることは逆薄となるからである。
総合収益(赤字)
総合収益(赤字)には当期純収益(赤字)とその他の総合収益(赤字)が含まれる。その他の包括収益(損失)には,我々の投資とヘッジツールに指定されたデリバティブの未実現収益と損失が含まれる。全列報期間の全面収益(赤字)総額は総合全面収益(赤字)表で開示されている。
2023年12月31日までと2022年12月31日までの累計その他総合損失構成は以下の通り(単位:百万)
| | | | | | | | | | | | | | | | | | | | | | | |
| 有価証券を売却して収益を実現しない | | ヘッジツールに指定されたデリバティブツールの未実現純収益(損失) | | 年金と退職後の福祉 | | 合計する |
| その他の総合損失を累計して、2021年12月31日残高 | $ | (40) | | | $ | 16 | | | $ | — | | | $ | (24) | |
| その他総合損失 | (322) | | | (24) | | | — | | | (346) | |
| その他の総合損失を累計して、2022年12月31日残高 | (362) | | | (8) | | | — | | | (370) | |
| その他全面収益(赤字) | 248 | | | 8 | | | (9) | | | 247 | |
| その他の総合損失を累計して、2023年12月31日残高 | $ | (114) | | | $ | — | | | $ | (9) | | | $ | (123) | |
株式買い戻し
私たちの買い戻し計画に基づいて買い戻した普通株の株式は無効になります。当該等買い戻し普通株の買い戻し価格は、追加実収資本の減少額と表記する。追加実収資本の残高が切れた場合、超過した部分は留保収益の減少として記録される。
最近発表された未採用の会計基準
新しい会計声明は、財務会計基準委員会または他の基準策定機関によって時々発表され、指定された発効日に採択される。以下に述べることに加えて、最近発表されたまだ発効していない基準の影響は、私たちの総合財務諸表および開示に実質的な影響を与えないと信じている。
2023年11月、FASBはASU 2023-07号を発表した分部報告書(主題280):報告可能な分部開示の改善。このASUは、最高運営決定者(CODM)に定期的に提供される重大な部門支出の開示を要求し、各報告の部門損益測定基準に含まれる開示要求を拡大する。この基準はまた、性質およびタイプを含む、各エンティティが中期および年度に基づいて他の分類項目の数および説明を開示することを要求する。また,各エンティティは,分部主任として決定された個人の肩書や役職を開示し,分部主任が分部業績を評価し,資源をどのように割り当てるかを決定する際に報告された分部損益測定基準をどのように使用するかを説明しなければならない。このような強化された開示義務はまた報告可能な部門で運営される実体にも適用される。ASU 2023−07は,2023年12月15日以降に開始された財政年度と,2024年12月15日以降の財政年度内の中期に遡る。早期養子縁組を許可する。私たちは現在、この新しい会計基準が私たちの連結財務諸表と開示に及ぼす影響を評価している。
FASBは2023年12月にASU 2023-09を発表しました所得税(特集740):所得税開示の改善それは.このASUは,報告実体の有効税率入金に関する分類情報と,支払われた所得税に関する補足情報を提供することを要求している。この基準は、実体がその比率調整表で連邦、州、および外国所得税を開示することを要求する
数量の敷居を超えた入金項目を詳細に説明した。また、納付された所得税(返金後の控除)を毎年開示し、数量のハードルに応じて管轄区域別に分類することも求められている。ASUは2024年12月15日以降の年次期間に前向きである。早期養子縁組を許可する。採択されると、このASUは、必要な追加開示を私たちの連結財務諸表に含めることになります。
3.製品純売上高
顧客の地理的位置別製品純売上高を以下に示す(単位:百万): | | | | | | | | | | | | | | | | | | | | |
| | 2013年12月31日までの年間 |
| | 2023 | | 2022 | | 2021 |
| アメリカです | | $ | 1,720 | | | $ | 4,405 | | | $ | 5,393 | |
| ヨーロッパ.ヨーロッパ | | 1,353 | | | 6,732 | | | 6,834 | |
世界の他の地域 | | 3,598 | | | 7,298 | | | 5,448 | |
| 合計する | | $ | 6,671 | | | $ | 18,435 | | | $ | 17,675 | |
私たちの新冠肺炎ワクチンは、2023年12月31日、2022年12月31日、2021年12月31日まで、私たちが使用を許可している唯一の商業化製品です
2023年第3四半期までに、私たちはアメリカ政府、外国政府、組織に私たちの新冠肺炎ワクチンを売却した。これらのエンティティとの合意および関連修正は、一般に、割引、リベート、または返品のような可変対価格を含まない。その中のいくつかの合意は私たちに私たちの新冠肺炎ワクチンに前払い手付金を供給する権利を与え、最初に繰延収入と記録した
2023年12月31日と2022年12月31日までの繰延収入は6131000万ドルと300万ドルです2.630億ドルはそれぞれ顧客預金と関連がある。私たちは$を予想しています5542023年12月31日現在、私たちの繰延収入のうち100万人が顧客預金に関連しており、1年足らずで実現される。製品納入と生産の時間および新冠肺炎ワクチンの適用の上場承認は製品純売上高の確認期限を決定する。
2023年第3四半期、私たちの最新の冠肺炎ワクチンの米国商業市場への販売を開始し、また、外国政府や組織にも販売を続けています。アメリカでは,我々の新冠肺炎ワクチンは主に卸売業者や流通業者に販売され,次いで小売業者やヘルスケア提供者に直接販売されている。卸売業者と流通業者は通常私たちにお金を前払いしないだろう
製品の純売上高は、想定されている卸売業者の返金、即時支払いと予約した領収書割引、販売返品準備金、その他の関連控除を差し引いて確認されます
次の表は、期間中の製品販売準備(単位:百万):をまとめたものです
| | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 2013年12月31日までの年間 |
| | | | | | 2023 | | 2022 | | 2021 |
| 総生産販売総額 | | | | | | $ | 8,203 | | | $ | 18,435 | | | $ | 17,675 | |
製品販売条項: | | | | | | | | | | |
卸は返金、割引、費用を返金します | | | | | | (976) | | | — | | | — | |
| 返品その他の費用 | | | | | | (556) | | | — | | | — | |
製品販売準備金総額 | | | | | | $ | (1,532) | | | $ | — | | | $ | — | |
| 製品純売上高 | | | | | | $ | 6,671 | | | $ | 18,435 | | | $ | 17,675 | |
下表は製品販売準備金に関する活動をまとめ、計上すべき負債と記す2023年12月31日(単位:百万):
| | | | | | | | |
| | 返品その他の費用 |
| 2022年12月31日の残高 | | $ | — | |
| 今期の販売に関する支出 | | (556) | |
| | |
| | |
| | |
| 2023年12月31日の残高 | | $ | (556) | |
4.その他の収入
以下の表は、列挙期間の他の収入(百万単位)をまとめたものである
| | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 2013年12月31日までの年間 |
| | | | | | 2023 | | 2022 | | 2021 |
| 奨学金収入 | | | | | | $ | 94 | | | $ | 388 | | | $ | 735 | |
| 協力収入 | | | | | | 83 | | | 440 | | | 61 | |
| その他収入合計 | | | | | | $ | 177 | | | $ | 828 | | | $ | 796 | |
贈与収入
2020年4月、私たちは生物医学高度研究開発局(BARDA)と合意に達し、BARDAは米国衛生·公衆サービス部(HHS)内で準備と反応を担当する補佐部長室(ASPR)の部門であり、奨励額は$に達する483新冠肺炎に対する元の候補ワクチンmRNA 1273の開発を加速するために1億ドル。この協定はその後、mRNA-1273の様々な末期臨床開発をサポートするための追加の約束を規定する修正を行った30,000段階3研究、小児科臨床試験、青少年臨床試験と薬物警戒研究に参与する。BARDAの最高賠償金は,すべての修正案を含めて約#ドルである1.81000億ドルですすべての契約オプションは行使された。2023年12月31日現在、余剰利用可能資金、所得控除純額は$971000万ドルです。
以下の表は、列挙した期間の贈与収入(百万単位)をまとめたものである
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年間 |
| 2023 | | 2022 | | 2021 |
| バルダ | $ | 88 | | | $ | 372 | | | $ | 713 | |
| その他の贈与収入 | 6 | | | 16 | | | 22 | |
| 贈与収入総額 | $ | 94 | | | $ | 388 | | | $ | 735 | |
| | | | | |
協力収入
我々はすでに戦略的パートナーと協力協定を締結し、治療分野での潜在的なメッセンジャーリボ核酸薬の発見と推進を加速させた。2023年12月31日、2022年12月31日、2021年12月31日まで、メルク社(Merck)、頂点製薬有限会社、頂点製薬(欧州)有限公司(合称Vertex)、アスリコン(アスリコン)などと提携合意に達した。ご参照ください注5このような協力協定のさらなる説明を得るために。
以下の表は、我々の戦略パートナーの本報告期間中の総合純収入総額(百万単位)をまとめたものである
| | | | | | | | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| 戦略的パートナーに記載された協力収入: | | 2023 | | 2022 | | 2021 |
| 頂点.頂点 | | $ | 82 | | | $ | 48 | | | $ | 26 | |
| メルク社 | | — | | | 309 | | | 23 | |
| アスリーカン | | — | | | 80 | | | 7 | |
| 他にも | | 1 | | | 3 | | | 5 | |
| 協力総収入 | | $ | 83 | | | $ | 440 | | | $ | 61 | |
5.連携プロトコル
マク個人化メッセンジャーリボ核酸腫瘍ワクチン(個別化新抗原治療)
2016年6月、私たちは、個人化されたメッセンジャーリボ核酸癌ワクチン(個人化された新しい抗原療法(INT)とも呼ばれる)を開発し、商業化するために、マーク社と協力および許可協定を締結し、私たちのメッセンジャーリボ核酸および製剤技術を使用して個別患者のためにINTを開発および商業化した。この協定はその後、2018年に改正され、再記述された(INT協定)。この戦略同盟における私たちの役割は、特定の患者の腫瘍細胞における遺伝子変異を識別し、これらの変異のためにメッセンジャーリボ核酸を合成し、メッセンジャーリボ核酸を我々の特許脂質ナノ粒子(LNPs)に封入し、各患者に独特のメッセンジャーリボ核酸を注射することを含む。各INTは、彼女または彼自身の癌細胞に対抗するために、患者の免疫系を活性化するために設計されている
INT協定によると、私たちは#ドルの前払いを受けた200我々はINTSの設計·研究を担当し,生産能力とINTの製造,単独およびメルクの抗PD−1療法KEYTRUDA(Pembrolizumab)との併用によるINTSの1期と2期臨床試験を提供し,これらは合意された発展計画と予算に基づいて行った。私たちの結論は、協力計画は収入確認基準ASC 606によって管轄されている
2022年9月、メルクは合意条項に従ってmRNA-4157を含むINTのオプションを行使し、2022年10月に私たちに1ドルのオプション権料を支払った2501000万ドルです。協定によると、私たちとメルク社はINTのさらなる開発と商業化の面で協力することに同意しており、コストと任意の利益または損失は世界的に均等に分担される。私たちの結論は、メルク参加条項の下の協力はASC 808の範囲内に配置されているということだ。2023年12月31日まで及び2022年12月31日まで年度確認しました$1841000万ドルと300万ドルです6万万マーク社の補償を差し引くとINT社と関係がありますメルクは条項の下での協力に参加する。また,同期資本支出の純コスト回収は#ドルであった1021000万ドルと300万ドルです3資産の資本化コストを削減するために80万ドル。
嚢胞性線維症の頂点である戦略同盟
2016嚢胞性線維化戦略同盟
2016年7月、我々はVertex PharmPharmticals Inc.およびVertex PharmPharmticals(Europe)Limitedと共に戦略的協力および許可プロトコル(Vertexプロトコル)を締結した。Vertexプロトコルは2019年7月に改訂され(2019年Vertex修正)、嚢胞性線維症患者の肺内の細胞に機能性嚢胞性線維症膜貫通伝導調節蛋白を産生させることによって、嚢胞性線維症(CF)を治療する潜在mRNA薬物を発見と開発することを目的としている。Vertexプロトコルによると,我々は最初の研究段階で発見作業を主導し,我々のプラットフォーム技術とmRNAを用いて専門知識を提供し,VertexのCF生物学的科学的経験とCFTRの機能理解を行った。Vertexは、このような活動に関連するコストを含む戦略連盟によって生成された候補および製品の開発および商業化活動を担当する。Vertexに付与された常習“予備”供給権により、臨床前、臨床、商業化目的のためのmRNAを独占的に製造(または製造)した。このような連携スケジュールはASC 606項の下で行われており,現在進行中である
2020年嚢胞性線維化戦略同盟
2020年9月には,Vertexと戦略的協力·ライセンス契約(Vertex 2020プロトコル)を締結した。Vertex 2020プロトコルは、肺細胞に遺伝子編集療法を提供することによって、機能性CFTRタンパク質の生産を促進し、CFを治療する潜在的な薬剤を発見および開発することを目的としている。♪the the the3年制Vertex 2020プロトコルの研究段階は、最初に肺細胞に遺伝子編集療法を提供することができる新しいLNPsとmRNA sの識別と最適化に集中した。最初の文字の後3年制この間,Vertexはこのような活動に関連するコストを含む戦略連盟が生成した候補製品や製品の開発や商業化活動を担当している.Vertexはまた,我々が共同で合意した研究計画に基づいて何らかの活動を実行することに関する研究サービスを我々に支払う義務がある.Vertex 2020プロトコルの条項によると、今回の協力は2023年第4四半期に終了し、終了します。
アスリーカン−心血管と腫瘍学的戦略同盟
我々は2013年と2016年にアスリコンと協力し,心血管,心臓代謝性疾患,癌を治療するメッセンジャーリボ核酸薬の開発を目指している。これらのプロトコルは、血管内皮増殖因子-A製品AZD 8601とIL-12の免疫腫瘍学プロジェクトを含む特定のプロジェクトの独占的な開発権と商業化権利を提供し、私たちに支払われた前払い総額は#2401000万ドルです。
2022年第3四半期、アスリコンは血管内皮増殖因子-AとIL-12の開発計画を含む彼らとの協力を中止し、2022年11月21日に施行された。この二つの番組のすべての権利は私たちのものだ。終了のため、私たちは残りの繰延収入#ドルを確認した76この時期の協力収入は万ドルだった。
免疫学−腫瘍治療を発展させる戦略的マルチプラットフォーム協力
2023年9月、著者らはImmaticsと戦略研究開発協力協定を達成し、Immaticsは臨床段階の生物製薬会社であり、T細胞リダイレクト癌免疫療法を積極的に発見と開発した。我々は,協力により産生された癌ワクチンとTCER療法の臨床開発と商業化を指導した。Immaticsは臨床前研究と潜在的な第一段階の臨床試験を行い、IMA 203 TCR-TとPRAME mRNAワクチンの結合を研究し、IMA 203 T細胞反応を更に増強する。いずれもその研究用PRAME化合物の全所有権を保持し,双方は費用分担に基づいて臨床研究に資金を提供する
合意が2023年10月に発効した後、#ドルを前払いしました1201000万ドルをInmaticsにあげます。このお金は同じ時期に研究開発費として確認された。Immaticsはまた、研究資金を獲得し、開発、監督、ビジネスマイルストーン支払いを取得する資格がある。Immaticsには,プロトコルによって商業化されたTCER製品やいくつかのワクチン製品のグローバル純販売から分級特許権使用料を得る資格もある。プロトコルにより,Inmaticsは最先端のTCERのためのグローバル損益共有スケジュールを達成する権利がある
上記の連携スケジュール以外にも,他にも連携や許可手配があり,現在ではこれらの手配は我々の業務にとって重要ではないと考えられている.これらの合意によれば、様々な開発、規制、およびビジネスマイルストーンを達成した後に前金および支払いを支払うことが要求される可能性があり、これらのマイルストーンの合計は重大である可能性がある。将来のマイルストーン支払いは、もしあれば、対応する事件が発生する可能性がある時に私たちの連結財務諸表に反映されます。また、これらの手配に関連する製品が商業化されれば、将来の販売で大量の印税を支払う必要があるかもしれない。
6.金融商品および公正価値計測
現金と現金等価物および投資
次の表は、2023年12月31日と2022年12月31日の現金と売却可能証券(単位:百万)を重要投資別にまとめています
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2023年12月31日 |
| | 償却する コスト | | 実現していない 収益.収益 | | 実現していない 損 | | 公正価値 | | 現金と 現金 等価物 | | 現在のところ 売れ行きがよい 証券 | | -ではない 現在のところ 売れ行きがよい 証券 |
| 現金と現金等価物 | | $ | 2,907 | | | $ | — | | | $ | — | | | $ | 2,907 | | | $ | 2,907 | | | $ | — | | | $ | — | |
| 販売可能です | | | | | | | | | | | | | | |
| 預金証書 | | 27 | | | — | | | — | | | 27 | | | — | | | 27 | | | — | |
| アメリカ国庫券 | | 807 | | | — | | | — | | | 807 | | | — | | | 807 | | | — | |
| アメリカ国庫券 | | 4,407 | | | 3 | | | (67) | | | 4,343 | | | — | | | 2,664 | | | 1,679 | |
| 会社債務証券 | | 5,067 | | | 3 | | | (81) | | | 4,989 | | | — | | | 2,082 | | | 2,907 | |
| 政府債務証券 | | 211 | | | — | | | (3) | | | 208 | | | — | | | 117 | | | 91 | |
| 合計する | | $ | 13,426 | | | $ | 6 | | | $ | (151) | | | $ | 13,281 | | | $ | 2,907 | | | $ | 5,697 | | | $ | 4,677 | |
|
| | 2022年12月31日 |
| | 償却する コスト | | 実現していない 収益.収益 | | 実現していない 損 | | 公正価値 | | 現金と 現金 等価物 | | 現在のところ 売れ行きがよい 証券 | | -ではない 現在のところ 売れ行きがよい 証券 |
| 現金と現金等価物 | | $ | 3,205 | | | $ | — | | | $ | — | | | $ | 3,205 | | | $ | 3,205 | | | $ | — | | | $ | — | |
| 販売可能です | | | | | | | | | | | | | | |
| 預金証書 | | 188 | | | — | | | — | | | 188 | | | — | | | 188 | | | — | |
| アメリカ国庫券 | | 767 | | | — | | | — | | | 767 | | | — | | | 767 | | | — | |
| アメリカ国庫券 | | 7,781 | | | — | | | (229) | | | 7,552 | | | — | | | 4,182 | | | 3,370 | |
| 会社債務証券 | | 6,595 | | | — | | | (226) | | | 6,369 | | | — | | | 1,560 | | | 4,809 | |
| 政府債務証券 | | 148 | | | — | | | (9) | | | 139 | | | — | | | — | | | 139 | |
| 合計する | | $ | 18,684 | | | $ | — | | | $ | (464) | | | $ | 18,220 | | | $ | 3,205 | | | $ | 6,697 | | | $ | 8,318 | |
2023年12月31日と2022年12月31日までの契約満期日まで、証券を売却できる余剰コストと推定公正価値は以下の通り(百万単位)
| | | | | | | | | | | | | | |
| | 2023年12月31日 |
| | 償却する コスト | | 推定数 公正価値 |
1年以下の期間で満期になる | | $ | 5,751 | | | $ | 5,697 | |
1年から5年後に期限が切れなければならない | | 4,768 | | | 4,677 | |
| 合計する | | $ | 10,519 | | | $ | 10,374 | |
| | 2022年12月31日 |
| | 償却する コスト | | 推定数 公正価値 |
| 1年以下の期間で満期になる | | $ | 6,792 | | | $ | 6,697 | |
| 1年から5年後に期限が切れなければならない | | 8,687 | | | 8,318 | |
| 合計する | | $ | 15,479 | | | $ | 15,015 | |
私たちの投資政策によると、私たちは高い信用品質を持つ発行者の投資レベルの証券に投資し、通常はどの発行者への信用開放も制限します。私たちは各報告期間の終わりに証券の減価を評価する。私たちはやった違います。2023年12月31日、2022年12月31日、2021年12月31日までの5年間の証券売却に関するいかなる減価費用も記録されていません。私たちはやった注釈2023年12月31日と2022年12月31日までに証券の売却に供される任意の信用関連手当が確認された
以下の表は、未実現損失状態にある売却可能証券の未実現損失総額と推定公正価値(百万単位)を、証券が2023年12月31日と2022年に未実現損失状態にある時間長別にまとめたものである
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 12ヶ月以下です | | 12ヶ月以上 | | 合計する |
| | 未実現損失総額 | | 公正価値を見積もる | | 未実現損失総額 | | 公正価値を見積もる | | 未実現損失総額 | | 公正価値を見積もる |
2023年12月31日まで: | | | | | | | | | | | | |
| | | | | | | | | | | | |
| アメリカ国庫券 | | $ | — | | | $ | 25 | | | $ | — | | | $ | — | | | $ | — | | | $ | 25 | |
| アメリカ国庫券 | | (3) | | | 774 | | | (64) | | | 2,983 | | | (67) | | | 3,757 | |
| 会社債務証券 | | (1) | | | 562 | | | (79) | | | 3,518 | | | (80) | | | 4,080 | |
| 政府債務証券 | | — | | | 8 | | | (4) | | | 143 | | | (4) | | | 151 | |
| 合計する | | $ | (4) | | | $ | 1,369 | | | $ | (147) | | | $ | 6,644 | | | $ | (151) | | | $ | 8,013 | |
| | | | | | | | | | | | |
2022年12月31日まで: | | | | | | | | | | | | |
| | | | | | | | | | | | |
| アメリカ国債 | | $ | — | | | $ | 128 | | | $ | — | | | $ | — | | | $ | — | | | $ | 128 | |
| アメリカ国庫券 | | (101) | | | 3,956 | | | (128) | | | 3,541 | | | (229) | | | 7,497 | |
| 会社債務証券 | | (138) | | | 3,505 | | | (88) | | | 1,890 | | | (226) | | | 5,395 | |
| 政府債務証券 | | (2) | | | 46 | | | (7) | | | 93 | | | (9) | | | 139 | |
| 合計する | | $ | (241) | | | $ | 7,635 | | | $ | (223) | | | $ | 5,524 | | | $ | (464) | | | $ | 13,159 | |
2023年12月31日と2022年12月31日に開催されました392そして582我々の総ポートフォリオでは、売却可能な証券はそれぞれ持続的な未実現損失状態にある。私たちはこのような投資を売るつもりもないし、私たちがそれらの帳簿価値が回復する前にそれらを売る可能性が高いとも思わない。私たちはまた期限が切れた時に満期の元金と利息を受け取ることができると信じている。
公正な価値に応じて恒常的に計量された資産と負債
次の表は、2023年12月31日現在と2022年12月31日までの公正価値で恒常的に計量される金融資産(単位:百万)をまとめたものである | | | | | | | | | | | | | | | | | | | | |
| | 2023年12月31日の公正価値 | | 公正価値計量使用 |
| | | レベル1 | | レベル2 |
| 資産: | | | | | | |
| 貨幣市場基金 | | $ | 1,572 | | | $ | 1,572 | | | $ | — | |
| 預金証書 | | 27 | | | — | | | 27 | |
| アメリカ国庫券 | | 1,246 | | | — | | | 1,246 | |
| アメリカ国庫券 | | 4,343 | | | — | | | 4,343 | |
| 会社債務証券 | | 5,480 | | | — | | | 5,480 | |
| 政府債務証券 | | 208 | | | — | | | 208 | |
株式投資(1) | | 24 | | | 24 | | | — | |
| 派生ツール | | 4 | | | — | | | 4 | |
| 合計する | | $ | 12,904 | | | $ | 1,596 | | | $ | 11,308 | |
| 負債: | | | | | | |
派生ツール | | $ | 9 | | | $ | — | | | $ | 9 | |
| | | | | | |
| | | | | | | | | | | | | | | | | | | | |
| | 2022年12月31日の公正価値 | | 公正価値計量使用 |
| | | レベル1 | | レベル2 |
| 資産: | | | | | | |
| 貨幣市場基金 | | $ | 1,079 | | | $ | 1,079 | | | $ | — | |
| 預金証書 | | 188 | | | — | | | 188 | |
| アメリカ国庫券 | | 767 | | | — | | | 767 | |
| アメリカ国庫券 | | 7,552 | | | — | | | 7,552 | |
| 会社債務証券 | | 6,369 | | | — | | | 6,369 | |
| 政府債務証券 | | 139 | | | — | | | 139 | |
派生ツール | | 6 | | | — | | | 6 | |
| 合計する | | $ | 16,100 | | | $ | 1,079 | | | $ | 15,021 | |
| 負債: | | | | | | |
派生ツール | | $ | 32 | | | $ | — | | | $ | 32 | |
| | | | | | |
_______
(1)公正価値が随時確定可能な上場株式証券への投資は同じ証券の市場オファーに従って入金し、公正価値変動を許可して他の費用純額を記入し、総合経営報告書に記入する。
私たちは、2023年12月31日と2022年12月31日まで、公正な価値で恒常的に計量された非金融資産や負債を持っていません。
2023年12月31日までに,純損失が$であることを確認した35証券公正価値の変化からの持分投資。2022年から2021年までの間、私たちは公正価値が確定しやすい上場証券に株式投資を行っていない
さらに2023年12月31日と2022年12月31日までに42資産負債表ごとに、いつでも公正価値を決定できる権益投資がない中で、このような権益投資は私たちの総合貸借対照表の他の非流動資産に計上され、上記の公正価値計量表には含まれていない。
7.在庫
2023年12月31日現在と2022年12月31日現在の在庫には、以下の内容が含まれています(単位:百万)
| | | | | | | | | | | | | | | | |
| | 十二月三十一日 | | |
| | 2023 | | 2022 | | |
| 原料.原料 | | $ | 163 | | | $ | 575 | | | |
| 進行中の仕事 | | 15 | | | 205 | | | |
| 完成品 | | 24 | | | 169 | | | |
| 総在庫 | | $ | 202 | | | $ | 949 | | | |
| | | | | | |
在庫、非流動(1) | | $ | 170 | | | $ | 910 | | | |
_______
(1)予想消費量が1年を超える原材料で構成されている。在庫、非流動資産は、連結貸借対照表中の他の非流動資産に計上される。
過剰、古い、廃棄またはその他の原因による在庫減記、および会社の調達承諾の損失は、販売コストの一構成要素として我々の総合経営報告書に記録されている。2023年12月31日と2022年12月31日までの年間在庫は#ドルに減記されています2.23億ドルと3,000ドル1.3それぞれ200億ドルと200億ドルです在庫減記は無形の2021年12月31日までの年度。2023年12月31日と2022年12月31日までの年度の会社購入承諾の損失は#ドル1411000万ドルと300万ドルです6172億5千万ドルと2億5千万ドルですいくつありますか違います。2021年にはこのような料金がかかります。在庫減記は主に賞味期限満了による古い在庫と予想以上の需要を超えた在庫と関係がある。会社の調達承諾の損失は、主にこれらの原材料の予想消費前に満期になる過剰な原材料調達承諾と関係がある。2023年のこれらの費用は、主に製品需要が最新の変種に対する新冠肺炎ワクチンに転換し続けることと、2023年の新冠肺炎ワクチン市場の流行の季節的市場への移行に伴い、顧客需要が低下するためである。
2023年第3四半期、私たちは長期財務計画過程を完成し、ワクチン接種率の改訂予測を取り入れた。これは私たちの新冠肺炎ワクチンの将来の需要の再評価を招き、私たちの製造コスト構造を調整する戦略的措置を招いた。このイニシアティブは、同じ四半期に開始され、私たちの在庫レベルの再評価と、期限までに消費されない予定の原材料に関する調達約束を削減するために、私たちのサプライヤーと再交渉します。この計画は原材料を#ドル減額させた9032000万ドルは、本四半期の総在庫減記金額に含まれています。
2023年12月31日と2022年12月31日まで、当社の将来の購入承諾の負債を$とする総合貸借対照表791000万ドルと300万ドルです2682億5千万ドルと2億5千万ドルです2023年12月31日と2022年12月31日まで、手元の在庫は$です3721000万ドルと300万ドルです1.9それぞれ200億ドルと200億ドルです私たちの原材料と製品在庫での賞味期限はそれぞれ違います。私たちはこの在庫の大部分が今後3年以内に消費されると予想している。私たちの新冠肺炎ワクチン製品の賞味期限は9ヶ月から12ヶ月まで様々です。
8.財産、工場、設備、純額
2023年12月31日現在、2022年12月31日現在の財産、工場、設備純額には、以下のものが含まれています(百万ドル単位) | | | | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 | | |
| | | | | | |
| 土地と土地改良 | | $ | 22 | | | $ | 11 | | | |
| 製造と実験室装置 | | 345 | | | 284 | | | |
| 賃借権改善 | | 522 | | | 460 | | | |
| 家具と固定装置 | | 26 | | | 21 | | | |
コンピュータ装置及びソフトウェア | | 74 | | | 38 | | | |
| | | | | | |
建設中の工事 | | 860 | | | 281 | | | |
使用権資産、融資(注10) | | 529 | | | 1,581 | | | |
合計する | | 2,378 | | | 2,676 | | | |
減算:減価償却累計 | | (433) | | | (658) | | | |
| 財産·工場·設備·純価値 | | $ | 1,945 | | | $ | 2,018 | | | |
2023年12月31日と2021年12月31日までの2年度の減価償却·償却費用は6171000万、$348百万ドルと$232それぞれ100万ドルです
9.貸借対照表の他の構成要素
売掛金純額
2023年12月31日現在、2022年12月31日現在の売掛金純額には、以下(百万ドル)が含まれています
| | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 |
| 売掛金 | | $ | 1,584 | | | $ | 1,385 | |
差し引く:卸の返金、割引、費用 | | (692) | | | — | |
| | | | |
| | | | |
| 売掛金純額 | | $ | 892 | | | $ | 1,385 | |
前払い費用と他の流動資産
2023年12月31日および2022年12月31日までの前払い料金およびその他の流動資産には、以下のものが含まれています(百万ドル単位) | | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 |
| プリペイドサービス | | $ | 182 | | | $ | 216 | |
| 製造サプライヤーに頭金を支払う | | 100 | | | 229 | |
| 材料と用品の頭金 | | 68 | | | 219 | |
| 協同して応収する | | 61 | | | 11 | |
| 受取利息 | | 59 | | | 61 | |
| | | | |
| 未収増値税 | | 50 | | | 140 | |
| 課税所得税 | | 19 | | | 10 | |
| テナント改善手当 | | — | | | 42 | |
| 所得税を前納する | | — | | | 187 | |
| 転換可能な受取手形 | | — | | | 36 | |
| | | | |
| | | | |
| その他流動資産 | | 88 | | | 44 | |
前払い費用と他の流動資産 | | $ | 627 | | | $ | 1,195 | |
他の非流動資産
2023年12月31日現在、2022年12月31日現在の他の非流動資産には、以下のものが含まれています(百万ドル) | | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 |
頭金と前金は流れません | | $ | 342 | | | $ | — | |
在庫、非流動(1) | | 170 | | | 910 | |
| 株式投資 | | 66 | | | 42 | |
商誉 | | 52 | | | — | |
有限寿命無形資産 | | 44 | | | — | |
| 制限現金 | | 4 | | | 12 | |
| 他にも | | 7 | | | 24 | |
| 他の非流動資産 | | $ | 685 | | | $ | 988 | |
_______ (1)予想消費量が1年を超える原材料で構成されている。
負債を計算すべきである
2023年12月31日現在、2022年12月31日現在の負債には、以下の内容が含まれています(単位:百万ドル) | | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 |
製品販売に関する準備(注3) | | $ | 556 | | | $ | — | |
| 報酬と関係がある | | 245 | | | 190 | |
| 臨床試験 | | 175 | | | 319 | |
| 製造業 | | 167 | | | 400 | |
| 開発運営 | | 140 | | | 88 | |
| 他の対外商品とサービス | | 137 | | | 264 | |
| 印税 | | 122 | | | 203 | |
| 財産·工場·設備 | | 94 | | | 5 | |
未来会社購入承諾の損失(1) | | 79 | | | 268 | |
| 商業広告 | | 56 | | | 48 | |
| 原料.原料 | | 27 | | | 316 | |
| | | | |
| 負債を計算すべきである | | $ | 1,798 | | | $ | 2,101 | |
| | | | |
| | | | |
______ (1)未来の原材料調達の堅固でキャンセルできない約束は損失を招くと予想される注7).
その他流動負債
2023年12月31日現在、2022年12月31日までの他の流動負債には、以下の内容(百万ドル)が含まれています
| | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 |
賃貸負債-融資(注10) | | $ | — | | | $ | 161 | |
賃貸負債-経営(注10) | | 25 | | | 35 | |
| 他にも | | 41 | | | 53 | |
| その他流動負債 | | $ | 66 | | | $ | 249 | |
| | | | |
収入を繰り越す
次の表は、2023年12月31日終了年度の繰延収入活動(単位:百万)をまとめています
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2022年12月31日 | | 足し算 | | 控除額 | | 2023年12月31日 |
製品純売上高 | | $ | 2,626 | | | $ | 515 | | | $ | (2,528) | | | $ | 613 | |
| 奨学金収入 | | 4 | | | 2 | | | (2) | | | 4 | |
| 協力収入 | | 81 | | | 31 | | | (78) | | | 34 | |
| 繰延収入総額 | | $ | 2,711 | | | $ | 548 | | | $ | (2,608) | | | $ | 651 | |
10.レンタル証書
私たちはすでに私たちの施設と設備のために様々な長期的なキャンセル不可能なレンタル手配を締結しました。これらの施設と設備は2042年まで異なる時間に満了します。その中のいくつかの手配には無料レンタル期間または増加したレンタル料支払い条項が設けられている。私たちは直線法でレンタル有効期限内にこのような手配されたレンタルコストを確認します。私たちは二つマサチューセッツ州のメインキャンパス、ケンブリッジキャンパス、ノーウッドにあるModerna技術センターにいます。私たちはまた世界各地で様々なブロック、事務、実験室空間をレンタルして、私たちの業務運営に使っています。
ケンブリッジキャンパス
私たちはマサチューセッツ州ケンブリッジ市の科学技術広場に複数の建物の園区を持っていて、オフィスと研究実験室の混合空間を持っていて、総面積は約292,000二平方フィートです
2021年9月に建築空間の賃貸契約を締結しました462,000マサチューセッツ州ケンブリッジ市に位置していますこの空間はModerna科学センターに指定され,オフィス空間と実験室を収容している.経験約2年制建築プロジェクト、レンタル期間は15数年間、次のようなオプションを提供します二つその他の内容7年制内線です。2023年第3四半期に、私たちはレンタルを開始し、私たちの総合貸借対照表で関連する使用権資産と賃貸負債を確認した。MSCリース開始後、私たちは2023年第4四半期に科学技術広場での既存のレンタル契約の満期日を修正しました。これらの賃貸契約は2024年から2029年までの満期を予定していたが、現在は2025年初めに満期に調整されている。私たちのすべてのケンブリッジ賃貸は経営的賃貸に分類されています。
Moderna技術センター
マサチューセッツ州ノーウッドに工業技術センターがありますModerna技術センターは三つビル、MTC南、MTC北とMTC東の合計約686,000二平方フィートです。私たちのMTC賃貸契約は2042年に期限が切れます。レンタル期間を延長することができます三つ延長期間5年みんなです。私たちのすべてのMTCレンタルは融資リースに分類されている。
借入契約
我々は、ASC 842の範囲内の埋め込みレンタルを含む複数の契約製造サービスプロトコルを第三者と締結している。2023年第3四半期、私たちの製造足跡を最適化する戦略的取り組みの一部として、契約製造サービス協定を改訂し、$減少につながりました262使用権資産と賃貸負債はそれぞれ2.5億ドル。さらに、それはまた使用権資産の減価償却を加速させる#ドルにつながる3232023年12月31日までの1年間で2023年12月31日までに違います。賃貸に埋め込むために残った使用権資産または賃貸負債。2022年12月31日現在、私たちの使用権資産は6391000万ドル、レンタル負債は$4402000万ドルは埋め込み賃貸に関連している。私たちのすべての埋め込み賃貸は融資賃貸に分類される。
2023年12月31日と2022年12月31日までの経営·融資リース使用権資産と賃貸負債は以下の通り(単位:百万) | | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 |
| 資産: | | | | |
経営性使用権資産、純額(1) (2) | | $ | 713 | | | $ | 121 | |
使用権資産·融資·純額(3) (4) | | 436 | | | 1,150 | |
| 合計する | | $ | 1,149 | | | $ | 1,271 | |
| | | | |
| 負債: | | | | |
| 現在: | | | | |
リース負債を経営する(5) | | $ | 25 | | | $ | 35 | |
融資リース負債(5) | | — | | | 161 | |
| 流動賃貸負債総額 | | 25 | | | 196 | |
| 現在ではない | | | | |
| 非流動経営賃貸負債 | | 643 | | | 92 | |
| 非流動融資リース負債 | | 575 | | | 912 | |
| 非流動賃貸負債総額 | | 1,218 | | | 1,004 | |
| 合計する | | $ | 1,243 | | | $ | 1,200 | |
_______
(1) これらの資産は土地、事務、実験室空間を含む不動産関連の資産だ。
(2) 累計償却純額
(3) これらの資産は,MTCリースに関する不動産資産および契約製造サービス契約に関する資産である.
(4) 総合貸借対照表に計上された不動産、建屋、設備は、減価償却累計額を差し引いた純額。
(5) 総合貸借対照表に計上されている他の流動負債。
列挙された期間のレンタル料は以下のように構成される(百万単位)
| | | | | | | | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| | 2023 | | 2022 | | 2021 |
| リースコストを経営する | | $ | 88 | | | $ | 48 | | | $ | 24 | |
| 融資リースコスト: | | | | | | |
| *使用権資産の償却、融資リース | | 500 | | | 280 | | | 189 | |
| 融資リース負債の利子支出を減らす | | 38 | | | 29 | | | 17 | |
| 融資リース総コスト | | $ | 538 | | | $ | 309 | | | $ | 206 | |
| 短期賃貸コスト | | $ | 2 | | | $ | — | | | $ | 49 | |
| 可変リースコスト | | $ | 113 | | | $ | 165 | | | $ | 100 | |
私たちのレンタルに関する補足キャッシュフロー情報は以下の通りです(百万単位):
| | | | | | | | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 | | 2021 |
| 賃貸負債に含まれる金額を計量するために支払う現金: | | | | | | |
| 経営的リース使用の経営的キャッシュフロー | | $ | (93) | | | $ | (57) | | | $ | (19) | |
| 融資リースのための運営キャッシュフロー | | (39) | | | (25) | | | (14) | |
融資リースのための融資キャッシュフロー | | (292) | | | (184) | | | (140) | |
| | | | | | |
| レンタル非現金プロジェクトを運営しています | | | | | | |
| 借款改正とリスコアリングに関する使用権資産の変動 | | $ | 67 | | | $ | — | | | $ | (7) | |
| 経営性リース負債と引き換えに使用権資産 | | 714 | | | 20 | | | 72 | |
| | | | | | |
| 融資リース非現金プロジェクト: | | | | | | |
| 借款改正とリスコアリングに関する使用権資産の変動 | | $ | 213 | | | $ | — | | | $ | 674 | |
| 融資リース負債と引き換えに使用権資産 | | — | | | 777 | | | 126 | |
| 融資リース負債変動 | | 3 | | | 4 | | | 3 | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
2023年12月31日と2022年12月31日までの加重平均残存賃貸期間と割引率は以下の通り | | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 |
| 残りのレンタル期間: | | | | |
| 賃貸借契約を経営する | | 14年.年 | | 6年.年 |
| 融資リース | | 33年.年 | | 22年.年 |
| 割引率: | | | | |
| 賃貸借契約を経営する | | 7.5 | % | | 7.5 | % |
| 融資リース | | 4.2 | % | | 3.6 | % |
2023年12月31日現在、賃貸契約を取り消すことができない将来の最低賃貸支払いは以下の通りです(百万ドル単位) | | | | | | | | | | | | | | | |
| 財政年度 | | 賃貸借契約を経営する | | 融資リース(1) | |
| 2024 | | $ | 72 | | | $ | 20 | | |
| 2025 | | 67 | | | 22 | | |
| 2026 | | 67 | | | 22 | | |
| 2027 | | 70 | | | 23 | | |
| 2028 | | 72 | | | 23 | | |
| その後… | | 785 | | | 1,074 | | |
| 最低賃貸支払総額 | | 1,133 | | | 1,184 | | |
| 利子を表す金額が少ない | | (465) | | | (609) | | |
| 賃貸負債現在価値 | | $ | 668 | | | $ | 575 | | |
______
(1) いくつかのオプションのレンタル期間の延長を含めて、主にMTCレンタルと関係があり、合計#ドルです668数百万の割引されていない未来のレンタル支払い。
11.支払いの引受およびまたは事項
法律訴訟
私たちは様々なクレームと法的手続きを扱っており、私たちの業務では正常な過程とされている。このような訴訟の結果は、事件にかかわらず、本質的に不確実である;そのため、損失の可能性と任意の推定された損害を評価することは困難であり、かなりの判断が必要である。私たちは現在どの法的手続きの当事者でもなく、このような法的手続きは重大な損失をもたらすかもしれないし、現在の損失は合理的に推定されている。
賠償義務
デラウェア州の法律で許可されている場合、上級職員、役員および従業員が高級職員または取締役がこのような身分で私たちの要求に応じてサービスを提供している場合に発生したいくつかの事件、事件について賠償します。賠償期間はその役員または役員の生涯である。
私たちは実験室と事務空間の賃貸契約に標準的な賠償手配があります。私たちの賃貸契約中のいくつかの行為、違反行為、違反行為、または契約不履行による家主の任意のクレーム、訴訟、訴訟または費用によるいかなる傷害、損失、事故、または損害の責任を賠償することを要求します。
私たちは通常の業務過程で取引相手との合意に基づいて賠償条項を締結し、通常は業務パートナー、請負業者、診療所、顧客との。これらの規定により、私たちは一般的に補償を受けた側が私たちの活動によって被ったり招いた損失について、補償を受けた側に賠償し、損害を受けないようにします。このような補償条項は一般的に基礎協定の終了後も有効だ。このような補償条項によると、私たちが未来に支払わなければならない最大の潜在的な金額は無限だ。
2023年12月31日と2022年12月31日まで違います。これらの賠償義務に関連した重大な損失は経験されていません違います。物質的クレームはまだ解決されていない.これらの賠償義務に関する重大なクレームはないと予想され、これらの義務の公正な価値は無視できると結論した違います。関連埋蔵量を確立した.
購買承諾と購入注文
我々は正常な業務過程で原材料と製造サービスのサプライヤーと契約製造組織(CMO)及び臨床前研究、臨床試験及びその他の商品又はサービスのサプライヤーと協定を締結する。2023年12月31日までに1.8原材料や製造協定に関する10億は調達約束を取り消すことができず、2029年までに支払う予定だ。2023年12月31日までにドル79原材料に関する調達引受金のうち、100万人が未来会社の調達引受と記された未払い損失負債がある。2023年12月31日までに261臨床サービスや他の商品やサービスに関する購入承諾を取り消すことはできず,2039年までに支払う予定である。この金額は終業費を含めて私たちの最低契約義務を表しています。
購入承諾に加えて、臨床運営、支援、契約製造に関するサービスを含む第三者と様々なサービスについて合意することはできません。これらのサービスについては、便宜のために契約を終了することもできませんし、将来のサプライヤーへのいかなる義務も避けることはできません。いくつかの合意は停止権を規定しているが、停止費や清算費用を支払わなければならない。このような合意によると、私たちは主にキャンセル前に発生した回収できない費用を補償するために、サプライヤーにいくつかのお金を支払う義務がある。2023年12月31日まで、キャンセル可能な未決済購入注文を受け取りました。金額は3.0このような合意により,我々は重要な臨床運営,支援,契約製造に合計10億ドルの資金を提供した。これらの金額は、2023年12月31日に契約が約束されたプロジェクトの推定値だけを表しており、これらの合意をキャンセルしないと仮定します。このような合意によると、私たちが将来サプライヤーに支払う実際の金額は、調達注文金額とは異なる可能性があります。
特許技術許可
2017年には,Cellscript,LLCおよびその付属会社mRNA RiboTreateutics,Inc.と何らかの特許権を再許可するための再許可契約を締結した。各合意によると、特定の製品の特定の開発、規制、およびビジネスマイルストーンの実現状況に応じて、いくつかの許可料、年間維持費、将来の純売上高の最低特許権使用料、マイルストーン支払いを支払う必要がある。治療·予防製品ライセンス製品の年間純売上高の商業マイルストーン支払いと特許権使用料に基づいて、当該販売期間に関連する製品の純売上高の追加費用を計上する
2022年12月、私たちは国家アレルギー·感染症研究所(NIAID)、米国国立衛生研究院(NIH)の研究所またはセンターと非独占特許許可協定を締結し、許可と
新型コロナウイルススパイク蛋白とそれによって産生された安定化蛋白を安定的に融合し、新冠肺炎ワクチン製品に応用した。協定によると、私たちは将来の純売上高に低い1桁の印税、最低年間版税の支払い、およびいくつかの開発、監督、および商業マイルストーン支払いに同意し、許可製品に基づいている。また、2022年12月には#ドルの追い込み印税を支払いました400300万ドルをNIAIDに渡し、このお金は私たちの合併運営報告書に販売コストを記録しました
2023年2022年2021年に確認しました3011000万、$1.130億ドルと641私たちの製品の純売上に関する特許権使用料とビジネスマイルストーン支払いをそれぞれ支払い、私たちの総合運営報告書に販売コストを計上します。
また、第三者と他のライセンス内協定を締結し、協定に関連する特定の製品に将来の開発、規制、ビジネスマイルストーンの支払いを要求しています。2023年12月31日まで、このようなマイルストーンの実現はまだ行われていない。
12.株価報酬と株式買い戻し計画
株式計画
我々の初公募株(IPO)については、2018年11月に2018年株式オプションとインセンティブ計画(2018年株式計画)を採択しました。2018年の株式計画は、2016年の株式オプションおよびインセンティブ計画(2016株式計画)の代わりに、IPO発効日の前日に発効する予定です。2018年の株式計画は、当社の報酬委員会に柔軟性を提供し、様々な持分ベースのインセンティブ報酬を報酬ツールとして使用して従業員をインセンティブすることができます。2018年株式計画および2016年株式計画によると、任意の奨励が没収され、キャンセルされ、行使または決済奨励時に源泉徴収され、使用価格または源泉徴収を満たすために抑留され、吾らが帰属前に再買収し、未発行株式の場合に取得、満期、または他の方法で終了(行使を除く)した普通株式は、2018株式計画に従って発行可能な普通株式に再計上される。
取締役会は従業員、非従業員取締役、顧問、独立顧問の在任中に彼らに株式に基づく奨励を与えることができ、通常は株式オプション、制限株式単位と業績株単位である。株式に基づく報酬の条項と条件は私たちの取締役会によって全権的に決定される。我々は、サービスに基づく報酬を発行し、所定のサービス期間内に付与し、業績に基づく報酬を、所定の条件に達したときに付与する。サービスに基づく報酬は通常与えられます4年制期間中に最初の25このような報酬の帰属割合は以下のとおりである12か月雇われたりサービスを続けたりすること。残りの賞は12個次の12四半期以内に四半期ごとに分割払いします。2018年持分計画と2016年持分計画に基づいて付与された株式オプションが満期になる10年付与された日から、行使価格は授与日の普通株の公平な市場価値に少なくとも等しくなければならない。
2023年12月31日まで、私たちは全部共有しています47私たちの株式計画によると将来のために予約された百万株を発行します31この前付与された配当金のために100万株を確保しました162018年の株式計画によると、将来付与可能な株は100万株。2016年の株式計画は、2018年の株式計画に取って代わられているため、追加の奨励は与えられないだろう。
オプション
私たちは2018年の株式計画と2016年の株式計画を通じて一般オプションを付与した次の表は、2023年12月31日までの年間のオプション活動をまとめています | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 数量:
オプション
(単位:百万) | | 重みをつける
平均値
トレーニングをする
単価
共有 | | | | 重み付けの-
平均値
残り
契約書
用語.用語 | | 骨材 固有の 価値がある(1) (単位:百万ドル) |
| 2022年12月31日に返済されていません | | 24.93 | | | $ | 42.23 | | | | | 5.7年.年 | | $ | 3,478 | |
授与する | | 4.36 | | | 113.03 | | | | | | | |
鍛えられた | | (3.11) | | | 8.13 | | | | | | | |
取消·没収 | | (0.68) | | | 130.23 | | | | | | | |
| 2023年12月31日現在の未返済債務 | | 25.50 | | | 56.14 | | | | | 5.6年.年 | | 1,437 | |
| 2023年12月31日に行使できます | | 18.98 | | | 33.34 | | | | | 4.5年.年 | | 1,378 | |
| 2023年12月31日に授与される予定です | | 6.52 | | | 122.50 | | | | | 8.9年.年 | | 59 | |
_______
(1)総内的価値は指標のオプションの行権価格と2023年12月31日現在のこれらのオプションの普通株式公正価値との差額である。
オプション行使の総内的価値は#ドルである413百万、$714百万ドルと$1.6それぞれ2023年12月31日,2022年12月31日,2021年12月31日である。総内的価値とは,オプション所有者が期内で株式オプションを行使する際に受け取った行権価格と販売入札との差額である.オプション減税を行使することによって達成される超過税収利益は#ドルだ841000万、$1442000万ドルとドル325それぞれ2023年12月31日、2022年、2021年12月31日までの数年間で1億2千万ドルに達した。株式オプションの行使で記録された総対価は約ドルです25百万、$50百万ドルと$1122023年12月31日、2022年、2021年12月31日までの1年間の消費者数は1億2千万人。
制限普通株式単位(RSU)と業績株単位(PSU)
私たちは2018年の株式計画を通じて一般的にRSUとPSUを授与した次の表は、2023年12月31日までの1年間のRSUとPSU活動をまとめたものである | | | | | | | | | | | | |
| 単位数
(単位:百万) | | 加重平均 付与日は単位ごとに公正価値を与える | |
| 未返済、2022年12月31日現在帰属していません | 2.90 | | | $ | 132.25 | | |
発表されました | 3.71 | | | 107.23 | | |
既得 | (1.01) | | | 98.68 | | |
取消·没収 | (0.42) | | | 130.01 | | |
| 未返済、2023年12月31日現在帰属していません | 5.18 | | | 121.02 | | |
2023年12月31日,2022年,2021年12月31日までの年間で,帰属するRSUとPSUの総付与日公価値は$である99百万、$55百万ドルと$18それぞれ100万ドルです2023年12月31日まで,2022年と2021年12月31日までの年間で,帰属するRSUとPSUの総内的価値は1201000万、$1251000万ドルと300万ドルです1412億5千万ドルと2億5千万ドルです
2023年,2022年,2021年には,それぞれある上級管理者に非実質的な額のPSUを配布し,通常,業績期間に応じて具体的に設定された目標の実現状況を付与する3年それは.最終的に発行された普通株式の実数はPSUの数に支払率を乗じて計算され,範囲は0%から200%です。PSUの見積公正価値は付与日の公正価値に基づいている。
持分報酬費を計算する
私たちの株式計画によって付与されたオプションに基づく株式ベースの報酬は、Black-Scholesオプション定価モデルを用いて決定される2023年、2023年、2022年、および2021年12月31日までの4年間に付与されたオプションの公正価値を推定するための加重平均は、以下のように仮定される | | | | | | | | | | | | | | | | | | | | |
| | 加重平均 |
| | 2011年12月31日までの数年間 |
| | 2023 | | 2022 | | 2021 |
オプション: | | | | | | |
**リスクなし金利の引き下げ | | 4.13 | % | | 2.46 | % | | 0.84 | % |
**予想期間: | | 6.07年.年 | | 6.13年.年 | | 6.10年.年 |
**予想変動率が低い | | 48 | % | | 50 | % | | 46 | % |
**予想配当金の増加 | | — | % | | — | % | | — | % |
**加重平均1株当たりの公正価値 | | $ | 57.87 | | | $ | 76.02 | | | $ | 91.84 | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
株に基づく報酬費用
次の表に、2023年12月31日、2022年12月31日、2021年12月31日までの3年度の株式給与支出の構成と分類(単位:百万)を示す | | | | | | | | | | | | | | | | | |
| 2019年12月31日までの年度 |
| 2023 | | 2022 | | 2021 |
オプション | $ | 136 | | | $ | 123 | | | $ | 96 | |
| RSUとPSU | 161 | | | 97 | | | 42 | |
従業員株購入計画 | 8 | | | 6 | | | 4 | |
合計する | $ | 305 | | | $ | 226 | | | $ | 142 | |
| | | | | |
| 販売コスト | $ | 37 | | | $ | 45 | | | $ | 22 | |
研究開発 | 157 | | | 93 | | | 68 | |
| 販売、一般、行政 | 111 | | | 88 | | | 52 | |
合計する | $ | 305 | | | $ | 226 | | | $ | 142 | |
| | | | | |
2023年12月31日現在、2022年12月31日現在、2021年12月31日までに、株式報酬支出が171000万、$182000万ドルとドル16それぞれ業績奨励に関する奨励には、私たちの初公募株に応じた帰属または開始奨励が含まれています。2023年、2022年、2021年12月31日までの年間で、非従業員報酬に関する株式報酬支出は重要ではない。
2023年12月31日までに835付与されたオプション,RSU,PSUの非既得性株式補償に関する未確認補償総コストの百万ドル。このコストは重み付き平均期間内に確認される予定である2.62023年12月31日まで。
共有買い戻し計画
2021年8月2日、私たちの取締役会は、2023年8月2日に遅くない私たちの普通株の株式買い戻し計画(2021年買い戻し計画)を承認しました。2021年の買い戻し計画によると、私たちは最大$の買い戻しを許可されました1.0私たちが発行した普通株式の140億ドル。2022年1月末までにすべてのドルを買い戻しました1.02021年の買い戻し計画に基づいて認可された10億普通株。2022年2月22日、私たちの取締役会は追加の普通株買い戻し計画を承認しました。期限がなく、買い戻し金額は$に達しています3.01000億ドルです2022年8月1日に取締役会は$の増加を承認しました3.0我々の普通株買い戻し計画によると、満期日(2022年2月22日の認可、2022年の買い戻し計画を共同所有する)はない
2023年12月31日までにドル1.7我々の取締役会は普通株の買い戻しの許可がまだ完了しておらず(2022年の買い戻し計画)、満期日がない。2022年の買い戻し計画によると買い戻しされる株式の時間と実際の数は、価格、一般商業、市場状況、その他の投資機会を含む様々な要因に依存し、株式は公開市場購入によって買い戻すことが可能であり、1934年に改正された証券取引法規則10 b 5-1に基づく条件を満たす取引計画を用いる方法である。
次の表は、我々の株式買い戻し計画に関する活動(単位百万、1株当たりデータを除く)をまとめたものである
| | | | | | | | | | | | | | | | | | | | |
| | 2019年12月31日までの年度 |
| | 2023 | | 2022 | | 2021 |
| 買い戻し株数 | | 8 | | 23 | | 3 |
1株平均価格(1) | | $ | 143.26 | | | $ | 142.83 | | | $ | 245.76 | |
| 購入総価格 | | $ | 1,153 | | | $ | 3,329 | | | $ | 857 | |
| 期限終了時の残余許可 | | $ | 1,667 | | | $ | 2,814 | | | $ | 143 | |
_______
(1)1株当たりの平均支払価格には関連費用と消費税が含まれており、2023年1月1日から適用される。
13.所得税
2023年12月31日現在、2022年12月31日現在、2021年12月31日までの年間所得税前(赤字)収入には、以下の内容(百万単位)が含まれています
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年間 |
| 2023 | | 2022 | | 2021 |
アメリカです | $ | (4,056) | | | $ | 9,433 | | | $ | 13,108 | |
外国.外国 | 114 | | | 142 | | | 177 | |
| 所得税前収入 | $ | (3,942) | | | $ | 9,575 | | | $ | 13,285 | |
2023年12月31日、2022年12月31日、2021年12月31日終了年度の所得税準備金は、以下の部分からなる(単位:百万)
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年間 |
| 2023 | | 2022 | | 2021 |
現在: | | | | | |
| 連邦制 | $ | (225) | | | $ | 1,687 | | | $ | 1,304 | |
| 状態.状態 | 72 | | | 47 | | | 35 | |
| 外国.外国 | 24 | | | 57 | | | 40 | |
| 総電流 | $ | (129) | | | $ | 1,791 | | | $ | 1,379 | |
延期: | | | | | |
| 連邦制 | $ | 888 | | | $ | (569) | | | $ | (288) | |
| 状態.状態 | 8 | | | (7) | | | (6) | |
| 外国.外国 | 5 | | | (2) | | | (2) | |
| 集計を延期する | 901 | | | (578) | | | (296) | |
| 所得税引当総額 | $ | 772 | | | $ | 1,213 | | | $ | 1,083 | |
2023年12月31日、2022年12月31日、2021年12月31日までの年度、連邦法定所得税税率と我々の有効税率との入金は以下のとおりである
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年間 |
| 2023 | | 2022 | | 2021 |
| 連邦法定税率 | 21.0 | % | | 21.0 | % | | 21.0 | % |
評価免除額を変更する | (52.6) | % | | — | % | | (5.4) | % |
| 外国由来の無形収入 | 0.2 | % | | (7.4) | % | | (4.8) | % |
| 株の報酬に基づく意外な財 | 2.4 | % | | (1.6) | % | | (2.6) | % |
連邦研究開発信用 | 4.6 | % | | (0.5) | % | | (0.7) | % |
| 連邦福祉を差し引いた州税 | 5.7 | % | | 0.4 | % | | 0.5 | % |
| 差し引かれない項目 | (0.4) | % | | — | % | | — | % |
他にも | (0.5) | % | | 0.8 | % | | 0.1 | % |
実際の税率 | (19.6) | % | | 12.7 | % | | 8.1 | % |
2023年12月31日までの年間有効税率は(19.6)%が連邦法定税率よりも高く、主に繰延税金資産の推定免税額の増加によるものである。2023年12月31日までの年間有効税率には、研究開発控除や株式ベースの報酬の税収割引も含まれる。2022年12月31日までの1年間、外国から派生した無形所得控除(FDII)の税収割引と株式報酬に関する超過税収割引が主に連邦法定税率よりも低い。2021年12月31日までの1年間、私たちの有効税率は連邦法定税率を下回っています。主に、繰延税金資産、FDII、株式ベースの報酬の推定免税額の放出に関する税金優遇のためです
2022年1月1日から、2017年減税·雇用法案(TCJA)によると、この時期の研究開発コストは5年または15年以内に償却しなければならず、具体的には研究がどこで行われるかにかかっている。新しい資本化要求は私たちの繰延税金資産と現金税項負債を著しく増加させたが、海外からの無形収入控除を増加させることで、私たちの実際の税率を低下させた。
総裁は2022年8月16日に“インフレ低減法案”(以下、“アイルランド共和軍”)に署名し、法律にした。この法案には、2022年12月31日以降に新たな15%の会社最低税率と1%の会社株買い戻し価値消費税(新株発行を差し引く)が含まれている。私たちはこのような条項が私たちの総合的な財務状況に実質的な影響を与えないと予想する;しかし、さらなる情報が得られた時、私たちはそれらの影響を評価し続けるつもりだ。
繰延所得税は、財務報告のための資産および負債の帳簿金額と所得税目的のための金額、税収控除繰越および純営業損失繰越の税収影響との間の一時的な差の税収影響を反映する2023年12月31日と2022年12月31日まで、私たちは納税資産と納税負債の重要な構成要素を以下のように延期します(百万計) | | | | | | | | | | | |
| 十二月三十一日 |
| 2023 | | 2022 |
繰延税金資産: | | | |
| 純営業損失が繰り越す | $ | 90 | | | $ | 59 | |
| 株に基づく報酬 | 111 | | | 68 | |
| 資本化されたライセンス、研究開発、起動コスト | 1,449 | | | 704 | |
| 税金の繰り越しを免除する | 140 | | | 97 | |
| | | |
| リース負債を経営する | 154 | | | 26 | |
| 融資リース負債 | 139 | | | 135 | |
| その他総合収益 | 34 | | | 106 | |
| 在庫備蓄と資本化 | 250 | | | 86 | |
卸は返金、割引、費用を返金します | 92 | | | — | |
返品その他の費用 | 129 | | | — | |
| 他にも | 90 | | | 85 | |
| 繰延税金資産総額 | 2,678 | | | 1,366 | |
減算:推定免税額 | (2,224) | | | (155) | |
| 繰延税項目純資産 | $ | 454 | | | $ | 1,211 | |
繰延税金負債: | | | |
| 使用権資産·融資 | $ | (106) | | | $ | (117) | |
| 使用権資産、経営性 | (160) | | | (26) | |
| 財産·工場·設備 | (107) | | | (85) | |
| 他にも | (15) | | | (1) | |
繰延税金負債総額 | (388) | | | (229) | |
繰延税金(負債)純資産 | $ | 66 | | | $ | 982 | |
下表は,列報期間中の繰延税金資産推定値準備の変動状況(#年)をまとめたものである百万): | | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年間 |
| 2023 | | 2022 | | 2021 |
| 期初推定免税額 | $ | 155 | | | $ | 149 | | | $ | 823 | |
| 所得税引当利益の減額を計上する | — | | | (12) | | | (722) | |
| 評価免税額を引き上げる | 2,069 | | | 18 | | | 48 | |
| 12月31日の推定免税額 | $ | 2,224 | | | $ | 155 | | | $ | 149 | |
私たちは定期的に私たちの繰延税金資産計の評価準備の必要性を再評価するとともに、このような資産の全部または一部を実現できない可能性が高いかどうかを評価するために、積極的かつ消極的な証拠を考慮する。2023年には、私たちの長期財務計画手続きが完了した後、私たちは証拠を再評価し、否定的な証拠が支配的なため、評価免税額が必要だと結論した
•米国会計基準第740条(所得税)によると、2023年通年の税引き前損失は客観的に確認可能な負の証拠の重要な源である。
•私たちの長期財務計画過程による予想は三年間の累計損失です。この予測は,季節的市場への移行に伴い,われわれの新冠肺炎ワクチンの期待販売量が大幅に低下したためである。また,我々が行っている第3段階臨床試験には多くの研究と開発費用がかかり,我々の候補製品を後期開発に進めることが予想される。このような要素は私たちの繰延税金資産の現金化にもっと多くの否定的な証拠を提供する。これらの予測は私たちが現在承認している薬物製品の収入に基づいており、私たちはこれが合理的に推定できると信じている。対照的に、私たちが研究している薬物の将来の課税収入予測は内在的で客観的に確認できないと考えられている;それらは否定的な証拠を覆すのに十分ではないので、彼らは私たちの推定値免税額分析評価に何の重みもない。
私たちの評価には、繰延年間の課税収入、利用可能な税務計画戦略、および将来の課税の一時的な差の償却など、繰延税金資産を実現させる他の課税収入源があるかどうかも含まれている。これらの戦略とすべての証拠を評価したところ,すべての繰延税金資産を現金にすることができない可能性が高いと考えられ,評価準備が増加した$2.110億2023年の間です
2021年第1四半期に、我々は評価手当を再評価し、著しい収入増加、将来の収益性への期待、および世界の製品需要を満たすための成功したサプライチェーンと製造能力を含む積極的な証拠の増加に注目した。肯定的な証拠と否定的な証拠を評価した後、私たちは、繰延税金資産の大部分を実現し、それに応じて繰延税金資産の大部分の評価支出を放出する可能性が高いと考えている。推定手当の支給は当時の一般的な積極的な見通しに基づいており、それ以来、上記の要因により、2023年までに見通しは大きく変化し、全額推定手当の回復につながった。
私たちの繰延税金資産の現金化能力を評価する際には、重大な経営陣の判断力が必要だ。もし実際の結果が私たちの推定と違うなら、私たちは未来の間に私たちの推定を調整し、私たちの推定値を修正する必要があるかもしれません。これは私たちの財務状況と運営結果に大きな影響を与えるかもしれません。
2023年12月31日には1.610億の国の純営業損失が繰り越し、これらの損失は2030年に満期になる。2023年12月31日に、私たちはまた国家研究と開発税の繰越免除$を持っています178その大部分は2030年に満期になるだろう。
私たちは私たちの財務諸表で、技術的な利点によって、税務状況が審査後にもっと維持される可能性があれば、この状況の影響を確認します2023年12月31日、2022年、2021年12月31日までの年度未確認税収割引の期初と期末金額の入金は以下の通り(単位:百万ドル)
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年間 |
| 2023 | | 2022 | | 2021 |
| 期初未確認税収割引 | $ | 128 | | | $ | 68 | | | $ | — | |
| これまでの頭寸で減少した | | | | | |
| 数年前の納税状況 | — | | | (1) | | | — | |
| 法規の有効期限が満了する | — | | | — | | | — | |
| 税務機関と和解する | (27) | | | — | | | — | |
| 今年度の税収状況により増加した | | | | | |
| 今年度の納税状況に基づく付加額 | 44 | | | 57 | | | 54 | |
| 数年前の納税状況に応じて増加した費用 | 86 | | | 4 | | | 14 | |
| 期末未確認の税金割引 | $ | 231 | | | $ | 128 | | | $ | 68 | |
2023年12月31日までに231未確認の税収割引純額が確認されれば、これは私たちの税率に影響を与えます。通常の業務プロセスで出現する項目については、未確認の税収割引が今後12カ月以内に変化する可能性がある。今後12ヶ月間に確認されていない税収割引は大きく変化しないと予想されます。これは私たちの総合経営業績に悪影響を与えます。不確定な税収状況に関連する利息及び罰金(適用される場合)が所得税費用の構成要素であることを確認する
私たちは書類を提出するアメリカ連邦所得税申告書と各州、地方と外国司法管轄区の所得税申告書です。私たちの登録成立日からのすべての納税年度は、過去数年間に発生した繰越属性が国税局または国家当局の審査後に調整される可能性があるため、主要税務管区の審査を受けることができます。現在公開されている税務試験はありません。
14.1株当たり収益(損失)
基本的な1株当たり収益(損失)の計算は,我々が発行した普通株の加重平均に基づいている.希薄化1株当たり収益の計算は、在庫株方法を用いて決定された期間内の私たちの発行済み普通株と潜在希釈性普通株の加重平均に基づく。
2023年12月31日、2022年、2021年12月31日までの基本1株当たり収益と希釈後の1株当たり収益は以下のように計算される(単位:百万、1株当たりデータは含まれていない)
| | | | | | | | | | | | | | | | | |
| 2013年12月31日までの年間 |
| 2023 | | 2022 | | 2021 |
分子: | | | | | |
純収益 | $ | (4,714) | | | $ | 8,362 | | | $ | 12,202 | |
| | | | | |
| | | | | |
| | | | | |
分母: | | | | | |
| 基本加重平均普通株式発行済み | 382 | | | 394 | | | 403 | |
| 希釈証券の影響 | — | | | 22 | | | 28 | |
| 希釈加重平均普通株式発行 | 382 | | | 416 | | | 431 | |
| | | | | |
| 基本1株当たりの収益 | $ | (12.33) | | | $ | 21.26 | | | $ | 30.31 | |
| 1株当たりの収益を薄める | $ | (12.33) | | | $ | 20.12 | | | $ | 28.29 | |
以下の普通株等価物は、2023年、2023年、2022年、2021年12月31日までの未償還金額に基づいて提案されており、これらが含まれるので、前記時期の普通株株主の1株当たり希釈純(損失)収入の計算には含まれていない(百万単位)
| | | | | | | | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 | | 2021 |
| オプション | | 26 | | | 3 | | | 1 | |
| | | | | | |
| RSUとPSU | | 5 | | | — | | | — | |
| 合計する | | 31 | | | 3 | | | 1 | |
15.地理情報
地域収入
私たちの業務は1つは報告部分は、主にメッセンジャーリボ核酸薬物の発見、開発と商業化に重点を置いている。私たちのCEOは私たちの運営を管理し、総合的な基礎の上で私たちの財務業績を評価します。製造を除いて、私たちの主要業務と意思決定機能の大部分はアメリカの会社本部に設置されています。
クライアントとパートナーの地理的エリア別の総収入は以下のとおりである(百万単位)
| | | | | | | | | | | | | | | | | | | | |
| | 2013年12月31日までの年間 |
| | 2023 | | 2022 | | 2021 |
| アメリカです | | $ | 1,895 | | | $ | 5,150 | | | $ | 6,177 | |
| ヨーロッパ.ヨーロッパ | | 1,355 | | | 6,815 | | | 6,846 | |
世界の他の地域 | | 3,598 | | | 7,298 | | | 5,448 | |
| 合計する | | $ | 6,848 | | | $ | 19,263 | | | $ | 18,471 | |
私たちの財産、工場、設備は、融資使用権資産を含み、地理的地域別には以下のようになる
| | | | | | | | | | | | | | |
| | 十二月三十一日 |
| | 2023 | | 2022 |
| アメリカです | | $ | 1,560 | | | $ | 1,267 | |
| ヨーロッパ.ヨーロッパ | | 126 | | | 714 | |
| 世界の他の地域 | | 259 | | | 37 | |
| 合計する | | $ | 1,945 | | | $ | 2,018 | |
項目9.会計·財務開示面の変更と会計士との相違
ない。
第9条。制御とプログラム
情報開示制御とプログラムの評価
我々の経営陣は、最高経営責任者と財務責任者の参加の下、2023年12月31日までの開示統制と手続きの有効性を評価した。1934年“証券取引法”又は“取引法”の下の第13 a-15(E)及び15 d-15(E)条に定義された開示制御及び手続とは、会社が取引法に基づいて提出又は提出された報告において開示を要求する情報が米国証券取引委員会規則及び表で指定された期間内に記録、処理、集計及び報告されることを確実にするための会社の制御及びその他の手続を意味する。開示制御及び手続は、取引所法に基づいて提出又は提出された報告書に開示を要求する情報が蓄積されていることを確保し、その主要幹部及び主要財務官を含む会社管理層に適宜伝達し、開示要求に関する決定を直ちに行うことを目的としているが、制御及び手続に限定されない。経営陣は、どのような制御やプログラムが、どんなに設計や操作が良くても、その目標を実現するために合理的な保証を提供するしかないことを認識しており、管理部門は、可能な制御とプログラムのコスト-利益関係を評価する際にその判断を運用しなければならない。2023年12月31日現在の我々の開示制御及び手続の評価によると、我々の最高経営責任者及び最高財務官は、その日までに、我々の開示制御及び手続が合理的な保証レベルで有効であると結論した。
財務報告の内部統制に関する経営陣の報告
我々の経営陣は、財務報告の信頼性に関する合理的な保証を提供し、公認会計原則に基づいて外部目的の財務諸表を作成するために、財務報告の十分な内部統制を確立し、維持する責任がある(この用語は“取引法”規則13 a-15(F)で定義されている)。経営陣は2023年12月31日までの財務報告書の内部統制を評価した。経営陣は、トレデビル委員会後援組織委員会が発表した“内部統制-総合枠組み”(2013枠組み)で確立された基準に基づいて評価を行った。この評価によると、我々の経営陣は、財務報告書の内部統制が2023年12月31日から有効であると結論した
我々の財務報告の内部統制の有効性は、2023年12月31日現在、独立公認会計士事務所安永会計士事務所が監査しており、同社の報告は本Form 10−K年度報告に含まれている。
財務報告の内部統制の変化
2023年12月31日までの3ヶ月間、財務報告の内部統制には何の変化も生じておらず(取引法第13 a-15(F)および15 d-15(F)規則で定義されているように)、これらの変化は、私たちの財務報告の内部統制に大きな影響を与えたり、合理的に大きな影響を与えたりする可能性がある。
制御措置の有効性の内在的制限
私たちの経営陣は、私たちの最高経営責任者とCEOを含み、財務報告の開示制御と手続きおよび内部統制は、その目標を達成するための合理的な保証を提供し、合理的な保証レベルで有効であると信じています。しかし、私たちの経営陣は私たちの開示統制と手続き、あるいは財務報告に対する私たちの内部統制がすべてのミスとすべての詐欺を防ぐことを期待していない。発想や動作がどのように整備されていても、絶対的な保証ではなく、合理的な保証しか提供できず、制御システムの目標が実現されることを確保する制御システム。また,制御システムの設計は,資源制約が存在し,そのコストに対する制御の利点を考慮しなければならないという事実を反映しなければならない.すべての制御システムの固有の限界により,どの制御評価もすべての制御問題や不正イベントが発見されたことを絶対に保証することはできない.これらの固有の限界には,意思決定における判断が誤りである可能性があり,簡単な誤りや誤りによって故障が発生する可能性があるという現実がある.さらに、ある人の個人的な行動、2人以上の結託、または制御の管理が優先され、制御を回避することができる。任意の制御システムの設計も、将来のイベント可能性のいくつかの仮定に部分的に基づいており、任意の設計がすべての潜在的な将来の条件でその目標を成功的に達成する保証はなく、時間の経過とともに、制御が条件の変化によって不十分になる可能性があり、またはポリシーまたはプログラムを遵守する程度が悪化する可能性がある。費用対効果を有する制御システムの固有の制限により、エラーまたは詐欺によるエラー陳述が発生し、発見されない可能性がある。
独立公認会計士事務所報告
Modernaの株主と取締役会に。
財務報告の内部統制については
Moderna委員会発足組織委員会が発表した“内部統制-総合枠組み(2013年枠組み)”(COSO基準)で確立された基準に基づき、Moderna 2023年12月31日までの財務報告内部統制を監査した。Moderna社(当社)は,首席運営官基準に基づき,2023年12月31日まで,すべての実質的な面で財務報告に対して有効な内部統制を維持していると考えられる。
また、米国上場企業会計監督委員会(PCAOB)の基準に従って、当社の2023年12月31日まで、2023年12月31日と2022年12月31日までの総合貸借対照表を監査し、2023年12月31日までの3年度の関連総合経営報告書、総合収益(損失)、株主権益と現金流量、および2024年2月23日の関連付記と我々の報告について保留なし意見を発表した。
意見の基礎
当社経営陣は、効果的な財務報告内部統制を維持し、添付されている“経営陣財務報告内部統制報告”に掲載されている財務報告内部統制の有効性を評価する責任がある。私たちの責任は私たちの監査に基づいて、会社の財務報告書の内部統制に意見を述べることです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務報告の有効な内部統制がすべての重要な面で維持されているかどうかを決定するために、合理的な保証を得るために監査を計画し、実行することを要求する。
我々の監査には,財務報告の内部統制を理解すること,重大な弱点があるリスクを評価すること,評価されたリスクテストに基づいて内部統制の設計·運用有効性を評価すること,および状況下で必要と考えられる他のプロセスを実行することが含まれる。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
財務報告の内部統制の定義と限界
会社の財務報告に対する内部統制は、公認された会計原則に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的としたプログラムである。会社の財務報告に対する内部統制には、(1)合理的で詳細かつ正確かつ公平に会社の資産を反映した取引および処分に関する記録の保存、(2)公認された会計原則に従って財務諸表を作成するために必要な取引が記録されている合理的な保証を提供し、会社の収入および支出は会社の経営陣と取締役の許可のみに基づいて行われる。(三)財務諸表に重大な影響を及ぼす可能性のある不正買収、使用、または処分会社の資産を防止またはタイムリーに発見する合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
/S/安永法律事務所
ボストン、マサチューセッツ州
2024年2月23日
プロジェクト9 B。その他の情報
10 B 5-1図
開ける2023年11月7日, ヌバル·アフェヤン私たちの議長.議長, 改訂されましたルール10 b 5-1(C)(Afeyan 10 b 5-1計画)を満たすための積極的な弁護のための取引スケジュール。アフィヤン10 b 5-1計画は、この計画下のいくつかの価格トリガ要因を増加させるために修正された。改訂されたアフィヤン10 b 5-1計画が実施され始めた2024年2月28日そして意志全過程を貫く2025年8月20日それは.集合体最大値普通株式数それはかもしれないAfeyan 10 b 5-1計画によると販売されているのは745,000これは当初計画されていたまだ販売されていなかった残りの株式を表します.
開ける2023年11月6日, アルパ·ガレ私たちの元首席商務官, 終了しましたルール10 b 5-1(C)(ガレ10 b 5-1計画)を満たすことを目的とした積極的な抗弁取引スケジュール。ガレ10 b 5-1は#年に締結予定2023年8月24日2023年11月27日に開始する予定で、終了日は2024年8月30日。Garay 10 b 5-1計画は潜在的な販売に約4,540普通株、既得株式オプションの行使可能および関連売却が最も多い24,897株式です。ガレ10 b 5-1計画終了までは、普通株は売却されず、普通株購入の選択権も行使されなかった。
改訂及び再改訂付例
2024年2月21日、当社取締役会は、当社の第2回改訂後の“定款”(以下、“細則”と略す)を承認し、直ちに発効した。本附例全体の置換および置換は、附例の発効直前に発効した当社が改訂および再改訂した付例である。
その他の事項は以下のとおりである
•競争相手のいない役員選挙で多数票基準を実行する
•発行された普通株式の3%または1組の最大20人の株主を連続して取締役候補者に指名し、私たちの代理材料に含まれ、定款に規定されている条項と条件を満たし、その中で最大2人の著名人のうちの1人または取締役会の20%のメンバーを獲得することを可能にする代理アクセス条項を実施する
•米国証券取引委員会が最近採択した汎用エージェントの使用に関するルールを考慮して、我々の事前通知条項を更新する
•“デラウェア州会社法”の最近の改正と更新を反映している
•他のいくつかの管理、技術、明確化、そして一貫性の変更を組み込む。
上記の説明は、完全であると主張するのではなく、本規約の全文を参照することによって限定され、そのコピーは、添付ファイル3.2として本明細書に添付され、参照によって本明細書に組み込まれる。
プロジェクト9 Cです。検査妨害に関する外国司法管区の開示
どちらも適用されません。
第三部
プロジェクト10.取締役、上級管理者、および企業管理
本プロジェクトに要求される情報は,2024年株主総会に関する依頼書に含まれる情報を参考にして格納されており,Form 10−Kの一般指示G(3)に基づいて我々の財政年度終了後120日以内に証券取引委員会にこの説明書を提出する予定である。
プロジェクト11.役員報酬
本プロジェクトに要求される情報は,2024年株主総会に関する依頼書に含まれる情報を参考にして格納されており,Form 10−Kの一般指示G(3)に基づいて我々の財政年度終了後120日以内に証券取引委員会にこの説明書を提出する予定である。
プロジェクト12.特定の実益所有者の保証所有権及び管理職及び株主に関する事項
本プロジェクトに要求される情報は,2024年株主総会に関する依頼書に含まれる情報を参考にして格納されており,Form 10−Kの一般指示G(3)に基づいて我々の財政年度終了後120日以内に証券取引委員会にこの説明書を提出する予定である。
第13項:特定の関係及び関連取引、並びに取締役独立性
本プロジェクトに要求される情報は,2024年株主総会に関する依頼書に含まれる情報を参考にして格納されており,Form 10−Kの一般指示G(3)に基づいて我々の財政年度終了後120日以内に証券取引委員会にこの説明書を提出する予定である。
プロジェクト14.主な会計費用とサービス
独立会計士事務所は安永会計士事務所、ボストン、マサチューセッツ州、PCAOB監査師ID 000です42.
本プロジェクトに要求される情報は,2024年株主総会に関する依頼書に含まれる情報を参考にして格納されており,Form 10−Kの一般指示G(3)に基づいて我々の財政年度終了後120日以内に証券取引委員会にこの説明書を提出する予定である。
第4部
項目15.物証、財務諸表付表
(A)本報告書の一部として提出された書類。
(1)財務諸表の作成.
本報告に記載されている連結財務諸表一覧については、本年度報告第2部第8項の“連結財務諸表索引”を参照されたい。
(2)付表.
必要または適用されないので、必要な資料が連結財務諸表またはその付記に含まれているので、財務諸表の添付表は提出されていない。
(3)展示品。
| | | | | | | | |
| 証拠品番号: | | 展示品索引 |
| 3.1 | | 登録者登録証明書の改訂と再予約。(2) |
3.2* | | 二番目に、登録者の付例を修正して再修正する。 |
| 4.1 | | 普通株式証明書サンプル。(1) |
4.2 | | 株本で説明する。(4) |
| 10.1# | | 改正された2016年株式オプション及び付与計画及びその付与協定のフォーマット。(1) |
| 10.2# | | 2018年株式オプションおよびインセンティブ計画およびその奨励プロトコルのフォーマット。(1) |
| 10.3# | | 登録者とそのすべての役員との間の賠償協定フォーマット。(1) |
| 10.4† | | Moderna治療会社とメルクシャープ多美社との主な協力と許可協定は、2015年1月12日、2016年1月8日までの第1号改正案、2016年6月28日現在の第2号改正案、2016年6月28日現在の第3号改正案、2016年6月28日現在の第4号改正案である。(1) |
| 10.5† | | 現代TX社とメルク·シャープ·ダム社とのmRNA癌ワクチン協力と許可協定が改訂·再署名され,日付は2018年4月17日であった。(1) |
| | |
| | |
| 10.6† | | 特許サブライセンス協定は,現代TX,Inc.がCellscript,LLCとmRNA RiboTreateutics,Inc.と締結されており,日付は2017年6月26日である(ある条項についてのみ)。(1) |
10.7 | | Moderna治療会社とCampanelli-Triate Norwood Upland,LLC間の純賃貸は,2016年8月29日であり,2017年4月10日までの第1号改正案と2018年3月16日現在の第2号改正案により改正された。(1) |
10.8 | | 第3改正案は、日付が2018年9月11日、第4改正案、日付が2019年3月28日、及び総合改正案であり、日付は2021年12月30日、日付は2016年8月29日であり、改訂されている。(5) |
10.9# | | 2023年2月23日に改正され、再改訂された退職計画と参加書簡のフォーマット。(9) |
10.10# | | 会社とStéphane Bancelとの間の手紙協定は、2018年6月13日で、2018年11月4日までの改正案第1号で改正された。(1) |
10.11# | | 当社とStephen Hogeとの間の手紙協定は、2017年10月17日となっています。(1) |
| | |
| | |
| | |
| | |
10.12# | | 現代TX社とシャノン·クリンガーとの雇用書簡協定は,2021年3月4日である。(5) |
10.13# | | 現代TX社とジェームズ·モックの間の招待状は、2022年8月15日。(8) |
10.14# | | 現代TX社とArpa Garay社の間の招待状は、2022年4月21日となっている。(9) |
10.15#* | | 2024年1月2日、現代TX会社とArpa Garayとの間の役員離職および移行サービス協定。 |
10.16# | | 更新された幹部退職と戦略諮問協定は、2022年5月27日に現代TX社とDavid·メイリンによって署名された。(7) |
10.17# | | 現代TX社とホルヘ·ゴメスが2022年5月13日に署名した役員離職協定と釈放。(6) |
| | |
10.18# | | 上級管理職現金奨励ボーナス計画。(1) |
10.19# | | 非従業員役員報酬政策が改正され、再調整され、2022年10月1日から施行される。(8) |
| | | | | | | | |
10.20# | | 登録者とその各上級職員との間の賠償協定フォーマット。(1) |
10.21#* | | 2018年従業員株購入計画。 |
10.22#* | | 従業員制限株式単位奨励協定フォーマット。 |
10.23#* | | 従業員非制限株式オプション協定フォーマット |
10.24# | | 非従業員取締役は株奨励契約書を限定販売します。(5) |
10.25# | | 非従業員取締役は無制限株式オプション協定形式です。(5) |
10.26# | | 2018年の株式オプションおよびインセンティブ計画の下で業績に基づく制限的な株式単位奨励協定の形態。(3) |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| | |
| 21.1* | | 登録者の子会社。 |
| 23.1* | | 独立公認会計士事務所安永会計士事務所の同意を得ました。 |
| 31.1* | | 2002年サバンズ-オキシリー法第302節で可決された1934年“証券取引法”第13 a-14条及び第15 d-14(A)条に基づいて発行された最高経営責任者証明書 |
| 31.2* | | 2002年サバンズ-オキシリー法第302節に基づいて成立した1934年“証券取引法”第13 a-14条及び第15 d-14(A)条に基づく首席財務官の認証 |
| 32.1+ | | 2002年にサバンズ·オクスリ法案第906条で可決された“米国法典”第18編1350条による認証 |
| 32.2+ | | 2002年にサバンズ·オクスリ法案第906条で可決された“米国法典”第18編1350条による認証 |
97* | | Moderna幹部は奨励的な報酬補償政策を支持する。 |
| 101.INS* | | XBRLインスタンスドキュメント |
| 101.Sch* | | XBRL分類拡張アーキテクチャドキュメント |
| 101.カール* | | XBRL分類拡張計算文書 |
| 101.定義* | | XBRL分類拡張Linkbase文書を定義する |
| 101.実験所* | | XBRL分類拡張タグLinkbaseドキュメント |
| 101.前期* | | XBRL分類拡張プレゼンテーションリンク文書 |
| 104* | | 表紙インタラクションデータファイル(添付ファイル101に含まれる適用分類拡張情報を含むイントラネットXBRL形式) |
___________ | | | | | |
| * | 本局に提出します。 |
| † | “米国連邦法典”第17編230.406と230.83節の規定によると、本添付ファイルの機密部分は省略されており、対応する表記がなされている。 |
| # | 契約または任意の補償計画、契約または手配を管理することを指す。 |
| + | 本契約添付ファイル32.1及び32.2で提供された証明は、本年度報告の10−K表とともに提供されるものとみなされ、改正された1934年証券取引法第18節の目的に基づいて提出されたとはみなされない。登録者が引用によって明確に組み込まれていない限り、このような証明は、参照によって1933年証券法(改訂本)または1934年証券法(改訂本)の下に組み込まれたいかなる文書ともみなされない。 |
| (1) | 2018年11月9日に米国証券取引委員会に提出されたS−1フォーム登録説明書(文書番号333−228300)を参照して統合する。 |
| |
| (2) | 2018年12月14日に米国証券取引委員会に提出された現在の8−Kフォーム報告書(ファイル番号001−38753)を参照して組み込まれる。 |
| (3) | 2021年5月6日に米国証券取引委員会に提出されたForm 10-Q四半期報告(ファイル番号001-38753)を参照して統合します。 |
| |
| |
| |
| |
| |
| (4) | 2020年2月27日に米国証券取引委員会に提出されたForm 10−K年次報告(文書番号001−38753)を参考に合併する。 |
| (5) | 2022年2月25日に米国証券取引委員会に提出されたForm 10-K年次報告(文書番号001-38753)を参照して統合する。 |
| (6) | 2022年5月13日に米国証券取引委員会に提出された現在の8−K/A報告書(ファイル番号001−38753)を参照して組み込む。 |
| (7) | 2022年6月1日に米国証券取引委員会に提出された現在の8−K/A報告書(ファイル番号001−38753)を参照して組み込む。 |
| (8) | 2022年11月3日に米国証券取引委員会に提出されたForm 10-Q四半期報告(文書番号001-38753)を参照して統合する。 |
| (9) | 2023年2月24日に米国証券取引委員会に提出されたForm 10-K年次報告(文書番号001-38753)を参照して統合する。 |
| |
項目16.表格10-Kの概要
適用されません。
サイン
1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、正式に許可された以下の署名者がその代表を代表して本報告に署名することを正式に手配した。
| | | | | | | | | | | |
| | | Moderna社 |
| | | |
| 日付: | | 差出人: | /S/ステファン銀行 |
| 2024年2月23日 | | | |
| | | ステファナ銀行 |
| | | 取締役CEO兼最高経営責任者 |
| | | |
授権書と署名
以下の各個人は、ステファネ·バンゼルとジェームズ·M·モックをそれぞれその人の真および合法的な事実受権者および完全な代替および再世代権を有する代理人に署名し、その人の名義、場所、代理でその人を代表して任意およびすべての身分で、この表格10-Kの本年度報告の任意およびすべての修正に署名し、それをすべての証拠物およびすべての関連文書と共に提出する。米国証券取引委員会は、当該場所内及び周囲で各必要かつ必要な行為及び事柄を行い、当該人が可能又は自ら行うことができるすべての意図及び目的に完全に沿って行われるために、上述した実際の受権者及び代理人又はそのいずれかの実際の受権者及び代理人又はそれらのいずれかの代替物又は代替物を合法的に行うことができ、又は本条例により行われるすべての行為及び事柄を承認及び確認するために、上述した実際の受権者及び代理人の各々に完全な権限及び権限を付与する。
1934年の証券取引法の要求によると、本報告は、指定日に登録者として以下の者代表登録者によって署名された。 | | | | | | | | | | | | | | |
| | | | |
| サイン | | タイトル | | 日取り |
| | | | |
| /S/ステファン銀行 | | 取締役CEO兼最高経営責任者(首席行政主任) | | 2024年2月23日 |
| ステファナ銀行 | | |
| | | | |
| /S/ジェームズ·M·モック | | 首席財務官 (首席財務官と首席会計官) | | 2024年2月23日 |
| ジェームズ·M·モク | | |
| | | | |
| | | | |
| /S/ヌバル·B·アフィヤン博士 | | 会長兼取締役 | | 2024年2月23日 |
| ヌバル·B·アフェヤン博士 | | |
| | | | |
| /投稿S/スティーブン·ベレンソン | | 役員.取締役 | | 2024年2月23日 |
| スティーブン·ベレンソン | | |
| | | | |
| /S/サンドラ·ホニング医学博士 | | 役員.取締役 | | 2024年2月23日 |
| サンドラ·ホネン医学博士です | | |
| | | | |
| /S/ロバート·ランガーSC.D. | | 役員.取締役 | | 2024年2月23日 |
| ロバート·ランガーSC.D. | | |
| | | | |
| /S/フランソワ·ナード医学博士 | | 役員.取締役 | | 2024年2月23日 |
| フランソワ·ナード医学博士です | | |
| | | | |
| S/エリザベス·ナベル医学博士 | | 役員.取締役 | | 2024年2月23日 |
| エリザベス·ナベル医学博士 | | |
| | | | |
| /S/ポール·サガン | | 役員.取締役 | | 2024年2月23日 |
| ポール·サガン | | |
| | | | |
| /投稿S/エリザベス·タレット | | 役員.取締役 | | 2024年2月23日 |
| エリザベス·タレット | | |
| | | | |