
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表
(マーク1)
1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで
あるいは…。
1934年証券取引法第13条又は15(D)条に基づいて提出された |
手数料書類番号
(登録者の正確な氏名はその定款に記載)
(明またはその他の司法管轄権 会社や組織) |
(税務署の雇用主 識別番号) |
適用されない |
|
(主にオフィスアドレスを実行) |
(郵便番号) |
登録者の電話番号、市外局番を含む:+
同法第12条(B)に基づいて登録された証券:
クラスごとのタイトル |
|
取引 記号 |
|
登録された各取引所の名称 |
|
|
同法第12条(G)に基づいて登録された証券:ありません
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください
登録者が当該法第13条又は第15条(D)に従って報告書を提出する必要がないか否かを、再選択マークで示すはい、そうです ☐
登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13または15(D)節に提出されたすべての報告を提出したかどうか、および(2)このような提出要求を過去90日以内に遵守してきたかどうかを、再選択マークで示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
|
☒ |
|
ファイルマネージャを加速する |
|
☐ |
|
|
|
|
|
|||
非加速ファイルサーバ |
|
☐ |
|
規模の小さい報告会社 |
|
|
|
|
|
|
|
|
|
新興成長型会社 |
|
|
|
|
|
|
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)はい、そうです ☐ 違います。
登録者の非関連会社が保有する普通株の総時価は約#ドルである
2024年2月16日現在、登録者が発行した普通株式数は
引用で編入された書類
登録者の最終依頼書には2024年株主総会は,登録者は登録者が2023年12月31日までの財政年度終了後120日以内に第14 A条に基づいて証券取引委員会に提出する予定であるこの報告書の第3の部分は、参照によって組み込まれる。
カタログ表
|
|
|
|
ページ |
第1部 |
|
|
|
|
第1項。 |
|
業務.業務 |
|
1 |
第1 A項。 |
|
リスク要因 |
|
44 |
項目1 B。 |
|
未解決従業員意見 |
|
92 |
プロジェクト1 C。 |
|
ネットワーク·セキュリティ |
|
92 |
第二項です。 |
|
属性 |
|
93 |
第三項です。 |
|
法律訴訟 |
|
93 |
第四項です。 |
|
炭鉱安全情報開示 |
|
93 |
|
|
|
|
|
第II部 |
|
|
|
|
五番目です。 |
|
登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
|
94 |
第六項です。 |
|
保留されている |
|
97 |
第七項。 |
|
経営陣の財務状況と経営成果の検討と分析 |
|
97 |
第七A項。 |
|
市場リスクの定量的·定性的開示について |
|
109 |
第八項です。 |
|
財務諸表と補足データ |
|
109 |
第九項です。 |
|
会計と財務情報開示の変更と相違 |
|
109 |
第9条。 |
|
制御とプログラム |
|
109 |
プロジェクト9 B。 |
|
その他の情報 |
|
112 |
プロジェクト9 Cです。 |
|
検査妨害に関する外国司法管区の開示 |
|
112 |
|
|
|
|
|
第三部 |
|
|
|
|
第10項。 |
|
役員·幹部と会社の管理 |
|
113 |
第十一項。 |
|
役員報酬 |
|
113 |
第十二項。 |
|
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
|
113 |
十三項。 |
|
特定の関係や関連取引、取締役の独立性 |
|
113 |
14項です。 |
|
チーフ会計士費用とサービス |
|
113 |
|
|
|
|
|
第4部 |
|
|
|
|
第十五項。 |
|
展示品と財務諸表の付表 |
|
114 |
第十六項。 |
|
表格10-Kの概要 |
|
118 |
i
リスク要因の概要
私たちの業務は多くのリスクと不確実性の影響を受けており、私たちの業務に投資決定を下す前に、これらのリスクと不確実性を認識すべきです。これらのリスクは,本年度報告の10−K表における“リスク要因”の部分でより包括的に検討されている。これらのリスクは以下のリスクを含むが、これらに限定されない
II
本Form 10-K年度報告では、文意が別に指摘されているほか、“会社”、“CRISPR”、“CRISPR治療”、“私たち”、“私たち”と“私たち”はいずれもCRISPR治療株式会社とその合併子会社を指し、“私たちの取締役会”はCRISPR治療株式会社の取締役会を指し、私たちは一般的にCASGEVY(Exagamlobgene Autemcel)を指す[Exacel])は、前はCTX 001であり、“CASGEVY”に変更される。
“CRISPR治療学”®“標準文字マークと設計マーク”CRISPRXTM“”CRISPR TXTM“、”CTX 112TM“、”CTX 131TM“、”CTX 310TM“、”CTX 320TM“”CTX 330TM,”そして“CTX 211TM” CRISPR治療株式会社の商標と登録商標です。CASGEVY?文字マークとデザインはVertex製薬会社の商標です。その他すべての商標及び登録商標本年度報告に含まれる10-K表は,それぞれの所有者の財産である. 便宜上、本年度報告でForm 10−K形式で参照される商標、サービスマーク、および商号は、非使用であってもよい®あるいは…このようなどんな漏れもこのような権利を放棄することを意味しない。
前向き陳述と業界データに関する特別な説明
このForm 10−K年次報告書には,重大なリスクと不確実性に関する“前向き陳述”が含まれている。本年度報告における10-K表に含まれるすべての陳述は,歴史的事実に関する陳述を除いて前向き陳述である.これらの表現は、一般に、すべての前向き表現がこれらの識別可能な語を含むわけではないが、“予想”、“信じ”、“継続”、“可能”、“推定”、“予想”、“意図”、“可能”、“計画”、“予測”、“プロジェクト”、“潜在”、“将”、“将”またはこれらの語の否定または複数または同様の表現または変形を使用することによって識別される。本年度報告におけるForm 10−Kに関する前向きな陳述は、以下のように含まれるが、これらに限定されない
本年度報告の10-K表の任意の前向き陳述は、既知および未知のリスク、不確実性および仮定に関連する未来のイベントまたは私たちの未来の財務パフォーマンスに対する私たちの現在の見方を反映しており、これらのリスク、不確実性および仮定は、私たちの実際の結果およびいくつかのイベントの時間を、前向き陳述に明示または示唆された未来の結果と大きく異なる可能性がある。このような差異をもたらすか、または促進する可能性のある要因には、本明細書で決定された要因と、本10−K年度報告第I項第1 A項の“リスク要因”の節で議論された要因とが含まれるが、これらに限定されない。あなたは未来の事件の予測として前向きな陳述に依存してはいけない。このような展望的な陳述は本報告書までの日だけを説明する。私たちの展望的な陳述は、私たちが行う可能性がある任意の未来の買収、合併、処置、合弁、または投資の潜在的な影響を反映しない。
このForm 10-K年次報告書と、このForm 10-K年次報告書で証拠品として提出された文書を完全に読み、私たちの将来の実績、業績、または業績が私たちの予想と大きく異なる可能性があることを理解しなければなりません。法律には別に規定がある以外に、このような陳述が発表された日以降の事件や状況を反映するために、いかなる前向きな陳述も更新する義務はありません。
三、三、
このForm 10-K年度報告書には、我々自身の内部推定および研究、および業界および一般出版物および研究、調査、および第三者による研究から得られたデータから得られた統計および他の業界および市場データが含まれる。業界出版物、研究、および調査は、そのような情報の正確性または完全性を保証しないにもかかわらず、信頼できると考えられるソースから得られる一般的な声明である。私たちはこれらの研究と出版物のそれぞれが信頼できると信じているが、私たちはまだ第三者ソースからの市場と業界データを独立して確認していない。当社内の研究は信頼でき、市場定義は適切であると信じていますが、このような研究やこれらの定義はいかなる独立したメッセージ源の確認も得られていません。
四
パー?パーT I
プロジェクト1.BU無邪気ですね。
商売人
概要
我々は有力な遺伝子編集会社であり,CRISPR/Cas 9による療法の開発に専念している。CRISPR/Cas 9は革命的な遺伝子編集技術であり、即ちゲノムDNAの特定配列を精確に変化させる過程である。我々の目標はこの技術を応用して遺伝子を妨害、削除、是正と挿入し、遺伝病を治療し、先進的な細胞療法を設計することである。われわれはこの技術を発見から承認まで比類のない速度で進め,最終的にCRISPRによる療法CASGEVY(Exagamlobgene Autotemcel)を記念碑的に初めて承認した[Exacel])、2023年にVertex製薬会社またはVertexにおける当社と協力します。著者らは、著者らの技術、研究開発能力と公認された実行能力を結合することにより、著者らは希とよく見られる疾病を有する患者のために新しい高効率と潜在的な根治療法を創造することができ、現在の生物製薬方法はこれらの患者に対する成功は限られていると信じている。
CRISPR/CAS 9を用いた遺伝子編集は,ドイツベルリンに位置するマルクス·プランク病原体科学単位の代理と創始者取締役である我々の科学創始者の一人であるEmmanuelle Charpentier博士が共同で発明した。Charpentier博士と彼女の協力者は1つの仕事を発表し、CRISPR/Cas 9の重要な構成部分Cas 9エンドヌクレアーゼが特定の位置で二本鎖DNAを切断する機序をプログラムできることを明らかにした。チャペンティエ博士と彼女の協力者、カリフォルニア大学バークレー校のジェニファー·デュドナ博士は、彼らの先駆的な仕事で2020年のノーベル化学賞を共有した。我々はCharpentier博士からCRISPR/CAS 9と関連技術を含む知的財産権の独占的権利を獲得し,我々自身の研究と追加的な許可内努力により,我々の知的財産権を強化し続け,遺伝子編集療法における我々のリードをさらに強固にした。
私たちは4つの核心フランチャイズ権をカバーする一連の治療計画を立ち上げました
プロジェクトによって、私たちは選択するか離体する方法は患者に細胞を注射する前にヒト外の細胞を編集するか体内にある編集方法,この方法では,CRISPRに基づく治療法をヒト内の標的細胞に直接提供する。また,我々のプラットフォームで革新し,新しい療法を実現できる次世代技術を開発し続けている。これらの努力により,CRISPR/Cas 9の潜在力を十分に放出し,患者の生活を変える薬剤を創出することを目標としている。
私たちの使命は深刻なヒト疾患のための変革的な遺伝子ベースの薬を作ることです。我々の革新的な研究,翻訳専門知識と臨床開発経験は,CRISPRに基づく療法開発においてリードしていると信じている。
ヘモグロビン病
CASGEVYは非ウイルスで離体するCRISPR/Cas 9遺伝子編集細胞療法は,患者自身の造血幹細胞と前駆細胞が正確な二本鎖切断によりBCL 11 A遺伝子の赤系特異的増強サブ領域で編集されている。この編集の結果,赤血球に高レベルの胎児ヘモグロビンが産生され,SCDやTDT患者の成人ヘモグロビンの欠陥を補うことができた。CASGEVYは我々とVertexとの戦略的パートナーシップに登場する第1の療法であり,Vertexとそのある付属会社との共同開発と商業化プロトコルによりCASGEVYが進められている。
1
2023年,CASGEVYは世界で初めて承認されたCRISPRに基づく遺伝子編集療法となった。CASGEVYはこれまでに米国,ヨーロッパ,イギリス,サウジアラビア,バーレーンで承認されており,条件を満たす12歳以上のSCDやTDT患者の治療に用いられている。これまでに公表されてきた治療効果データは,潜在的な一次的機能的治癒のための重篤なSCDおよびTDTの方法としてこの治療法を支持している。
免疫腫瘍学と自己免疫
CRISPR/CAS 9は次世代CAR T細胞療法を創造する潜在力があると信じており,現在の自己療法と比較して,この治療法はより良い製品概況を有し,より広範な患者への接触を可能にしている。我々は、2つの次世代同種異体CAR T計画、CD 19を標的とするCTX 112、およびCD 70を標的とするCTX 131を含む腫瘍学的および/または自己免疫適応に対するいくつかの細胞治療計画を進めている。これらの候補製品は2種類の新しい遺伝子編集--Regnase-1のノックアウトと形質転換増殖因子-β受容体2(TGFBR 2)のノックアウト--CAR Tの効力を増強し、CAR Tの消費を減少させることを目的とした。薬物動態を含むCTX 112およびCTX 131の臨床試験が行われている新しい薬理学的データは、これらの編集を統合していない第1世代候補遺伝子と比較して、新しい効力遺伝子編集が患者のCAR T細胞拡張率および機能持続性を有意に向上させることを示している。そのほか、次世代候補製品はより強い製造安定性を示し、各ロットで生産したCAR T細胞の数量はもっと高く、更に一致した。私たちは臨床試験のためにCTX 112とCTX 131を生産しています。私たちの内部GMP製造工場で。
CTX 112は、再発または難治性CD 19陽性B細胞悪性腫瘍を有する成人患者における候補薬剤の安全性および有効性を評価するための臨床試験を行っており、これらの患者は、少なくとも2つの以前の治療を受けている。また,2024年上半期にCTX 112による全身性エリテマトーデス治療の臨床試験を開始する予定であり,将来的にはより多くの自己免疫適応に拡大する可能性がある。CTX 131は、再発または難治性固形腫瘍を有する成人患者における候補薬剤の安全性および有効性を評価するための臨床試験を行っている。また,CTX 131の試験をT細胞やB細胞腫瘍を含む血液系悪性腫瘍に拡大する予定である。
生活の中で
我々の体内にある遺伝子編集戦略の重点は遺伝子破壊と全遺伝子是正である--この2つの技術は大多数の最も普遍的な深刻な単遺伝子疾患及び多くのよく見られる疾患を解決する必要がある。私たちはすでに先進的なプラットフォームを構築しました体内にある急速に拡大しています体内にあるプログラムです。私たちの初めての体内にあるこれらの計画は,肝臓に対して検証された脂質ナノ粒子やLNP送達技術を用いて疾患の治療を目指しており,これらの疾患では,よく知られている遺伝的に関連する遺伝子を安全に妨害することで強力な治療効果を得ることができる。例えば私たちの最初の2つは体内にあるCTX 310とCTX 320計画はそれぞれ血管新生素様蛋白3(Angptl 3)とリポ蛋白質(A)(Lp(A))を妨害することによって心血管疾患を解決することを目的としている。私たちはCTX 310とCTX 320の第1段階臨床試験を開始した。CTX 310とCTX 320に基づいて、多くの早期調査があります体内にある肝臓における遺伝子破壊を利用してまれでよく見られる疾患を治療する計画。また,我々CRISPR−X研究チームが開発した技術を利用したプロジェクトも含め,肝臓遺伝子補正に焦点を当てたプロジェクトもある。最後に,ナノ粒子技術や腺関連ウイルス(AAV)ベクターのさらなる進歩を含めて,造血幹細胞を含む肝臓以外の組織に輸送するためのより多くの輸送技術が求められている。
1型糖尿病
T 1 Dを治療するための遺伝子編集幹細胞由来療法の開発に重点を置いた一連のプロジェクトを進めている。我々の遺伝子編集能力はベータ細胞代替製品を候補製品にする可能性があり、長期的な免疫抑制を必要とすることなく、患者に持続的な利点をもたらす可能性があると信じている。私たちはこの目標を達成するための三つの並行的な努力を持っている。まず、著者らの最先端の候補製品CTX 211は同種異体、遺伝子編集、免疫低下の幹細胞由来製品の候補製品であり、この装置は患者の体内に移植され、グルコース依存の方式でインシュリンを産生することを目的としている。このプログラムは従来VCTX 211と呼ばれており,Vertexの子会社ViaCyte,Inc.との連携に由来し,我々の遺伝子編集技術をViaCyteの独自幹細胞能力に適用することで開発された.CTX 211は成人T 1 D患者におけるCTX 211の安全性、耐性および有効性を評価するための1/2期臨床試験を行っている。次に,我々の研究は,編集された幹細胞からの被覆されていないβ細胞からなる無装置β細胞代替方法に集中している。第三に、T 1 Dに対するVertexの低免疫細胞療法の開発を加速するために、いくつかのCRISPR/Cas 9知的財産権の非独占的許可をVertexに付与し、2023年に1.7億ドルの前払いとマイルストーン支払いを受け、追加の研究開発マイルストーンと未来の製品の印税を得る資格がある。
2
CRISPR-X
われわれの現在のプロジェクトの組み合わせは大きな進展を遂げているが,遺伝子編集のすべての力を放出し,より多くの患者に潜在的な変革療法をもたらすために革新を続ける必要があることを認識した。私たちはCRISPR-Xという専門的な早期研究チームを持っていて、次世代の編集モデルの革新に集中しています。CRISPR-Xは、同源配向修復またはDNAウイルス送達を必要とせずに全遺伝子補正および挿入を行うことができる技術、例えば、全RNA遺伝子補正、DNAの非ウイルス伝達、および新しい遺伝子挿入技術を開発している。
仲間関係
CRISPR/CAS 9の多くの潜在的治療応用を考慮して,われわれが追求できる適応を拡大し,特定の技術や/あるいは疾患領域の専門知識を獲得することでプロジェクトの実施を加速する戦略的協力を行った。その中のいくつかのパートナーシップに関するより多くの情報は、“を参照してください”業務-戦略的パートナーシップと連携.”
頂点です著者らは2015年にVertexと初歩的な協力プロトコルを確立し、TDT、SCD、嚢胞性線維化と他の適応の選択に集中した。2017年12月、Vertexと共同開発·商業化協定を締結し、この合意に基づき、他の事項に加えて、TDTとSCDのCASGEVYを共同開発·共同商業化します。2021年4月、我々とVertexは、他の事項に加えて、TDTおよびSCDのためのCASGEVYをVertexと連携して開発および商業化する既存の共同開発および商業化プロトコルを修正し、再確認した。2019年6月には、Duchenne筋ジストロフィー(DMD)と強直性筋ジストロフィー1型(DM 1)の製品の開発と商業化のためにVertexと戦略的協力·許可協定を締結しました。2023年3月には、Vertexと糖尿病に遺伝子編集技術を使用する非独占ライセンス契約を締結しました。
ViaCyteそれは.2018年9月、我々はViaCyteと研究と協力協定を締結し、糖尿病を治療するための遺伝子編集異遺伝子幹細胞療法の発見、開発、商業化を求めた。2021年7月、私たちはViaCyteやViaCyte JDCAと共同開発と商業化協定を締結した。ViaCyte JDCAへの加入については,我々はViaCyteの既存の研究連携プロトコルとその条項によって満了した.2022年第3四半期、VertexはViaCyteとViaCyte連携場の権利を買収したことを発表し、2023年3月にViaCyte JDCA修正案に署名し、修正案に基づいて、各方面のこの修正案の下でのいくつかの権利と義務を調整した。2023年12月、ViaCyteは我々との協力を脱退し、糖尿病治療のための遺伝子編集幹細胞療法を共同開発し、それを共同商業化した。脱退条項を選択することにより,脱退が完了すると,行われている連携資産は我々が完全に所有し,将来の欠ViaCyteの販売に印税を徴収する.選択脱退は2024年2月初めに施行される。ViaCyteの協力資産はCTX 211(以前のVCTX 211)を含み、これは患者内のデバイスに移植された同種異体、遺伝子編集、免疫力が低下した幹細胞由来製品であり、グルコース依存的な方法でインシュリンを産生することを目的としている。CTX 211によるT 1 D治療の一期臨床試験を継続している。
他のパートナー関係それは.私たちは造血幹細胞免疫腫瘍学自己免疫を支援し補充するための追加的な協力と許可協定を締結しました体内にあるドナー由来の遺伝子編集されたCAR−NK細胞を開発および商業化するためのNkarta,Inc.またはNkarta,Capsida BioTreateutics,Inc.開発を含むT 1 D計画およびプラットフォーム体内にある工学AAVベクターによる遺伝子編集療法;ロスウェル公園総合癌センターが新しい標的に対して遺伝子編集を推進する自己CAR T計画;MaxCyte,Inc離体するヘモグロビン病と免疫腫瘍学プロジェクトにサービスを提供していますCureVac AGは特定の遺伝子構造と製造を最適化しています体内にあるKSQ Treateutics,Inc.とわれわれの同種異体免疫腫瘍学計画の知的財産権について協議した。
遺伝子編集背景
何千もの病気がDNA配列異常によって引き起こされている。伝統的な小分子と生物療法はその中の多くの疾病の治療における成功は限られており、それらは根本的な遺伝原因を解決できなかったためである。RNA療法やウイルス遺伝子療法のような新しい方法よりも、疾患に関連する遺伝子に対してより直接的に対応しているが、それぞれの方法には明らかな限界がある。RNAに基づく療法、例えばメッセンジャーリボ核酸と小干渉リボ核酸は、繰り返し投与と関連毒性の挑戦に直面している。AAVのような非統合ウイルス遺伝子治療プラットフォームは、永久的にゲノムを変化させず、産生された免疫反応のため、再投与時の治療効果が限られているため、限られた持続性を有する可能性がある。慢性ウイルスのようなウイルス遺伝子治療プラットフォームを統合し、恒久的にゲノムを変更するが、このようにすることはランダムであり、これは不良突然変異の可能性を招く。また,細胞は形質導入された遺伝子が外来であることを認識し,それらの発現を減少させることで反応し,その有効性を制限している可能性がある。そのため、ヒトゲノムマップを作成して以来、著者らは遺伝病に対する理解が増加したが、著者らはこれらの疾病を有効に治療する能力はずっと限られている。
3
遺伝子編集は次世代療法を実現し,正確な遺伝子修飾により多くの遺伝病に潜在的な根治療法を提供する可能性があると信じている。また,DNA配列を変化させる能力は遺伝病の治療に加えて他の用途がある。CRISPR/Cas 9遺伝子編集は細胞による療法の工程を可能にし,より有効,安全であり,より広範な患者群に用いることができる。細胞療法はすでにある疾病に重大な影響を与え始め、遺伝子編集は腫瘍学、自己免疫性疾患と糖尿病を含む異なる疾病領域の進展を加速することを助けることができる。
遺伝子編集のプロセスは、酵素を用いて特定の位置でDNAを切断し、細胞ゲノム中のDNA配列を正確に変化させることを含む。切断後、自然な細胞プロセスはDNAを修復して不要な配列を沈黙または修正し、潜在的にそれらの負の影響を逆転させる。重要なのは,ゲノム自体がこの過程で修正されるため,この変化は患者に恒久的であることである。初期の遺伝子編集技術、例えば亜鉛指ヌクレアーゼ(ZFN)、転写活性化物様効果ヌクレアーゼ(TALEN)とマクロヌクレアーゼは、工学蛋白質-DNA相互作用に依存して編集位置を制御する。これらのシステムは遺伝子編集の潜在力を示す重要な第一歩であるが、工学タンパク質-DNA相互作用の複雑さのため、それらの開発は実践的に挑戦的である。対照的に,CRISPR/Cas 9はRNA−DNA相互作用によって指導されており,この相互作用の方が予測可能であり,工学や応用も直接的である。
CRISPR/CAS 9技術
CRISPR/CAS 9代表C光沢のあるR特に…IスペースSホルトP名無しさんREpeats(CRISPR)/CRISPR-a蛋白9(Cas 9)に結合し、自然発生の防御機序に進化し、細菌をウイルス感染から保護する。チャペンティエ博士と彼女の協力者はこの機序を解明し、この機序に適応と簡略化する方法を開発し、遺伝子編集に用いた。この先駆的な仕事を表彰するために,チャペンティエ博士は彼女の協力者でカリフォルニア大学バークレー校のジェニファー·デュドナ博士とともに2020年のノーベル化学賞を受賞した。彼らが記述したCRISPR/Cas 9技術は、Cas 9、CRISPR RNAまたはcrRNA、およびトランス活性化CRISPR RNAまたはtrrRNAからなる3つの基本構成要素からなる。Cas 9はこの2つのRNA分子に結合しており,選択された二本鎖DNAを特定の切断および編集が可能な“分子はさみ”として記述されている。
チャペンティエ博士と彼女の協力者はさらに遺伝子編集のためのシステムを簡略化し、彼らはcrRNAとtrrRNAを1つの単一のRNA分子に結合し、誘導RNA、またはgRNAと呼ばれる。GRNAはCas 9に結合し,Watson−Crick塩基マッチング規則によりプログラム可能であり,Cas 9酵素を特定のDNA配列に配向させることができる。CRISPR/Cas 9技術は標的遺伝子の特定の位置でDNAを切断するために使用可能であり,遺伝子編集に基づく療法の開発に強力なツールを提供している。
DNAが切断されると,細胞は自然に発生するDNA修復機構を用いて切断された末端を再接続する。一度切断すると,非源末端結合と呼ばれる過程は塩基対の添加や欠失を招き,原始DNA配列を撹乱し,遺伝子不活化を招く可能性がある。異なる部位に対する2つのgRNAを用いることにより,より大きなDNA断片を削除することも可能である。各部位で切断した後、非相同末端結合は、単離された末端を一緒に連結し、挿入配列を削除する。あるいは,CRISPR/Cas 9機構の近傍にDNAテンプレートを添加すれば,細胞は相同配向修復と呼ばれる過程で遺伝子を是正し,さらに新しい遺伝子を挿入することができる。
4
CRISPR/Cas 9遺伝子編集

CRISPR/CASシステムの多機能性を考慮して、複数のグループは基本編集と基本編集などのCRISPR/CAS 9に基づく新しい技術を開発した。まだ萌芽段階にあるが、このようなCRISPRに基づく新しい技術は選定された疾病応用において優勢である可能性がある。したがって、私たちは様々な技術を適切に採用できるように、私たちのCRISPRプラットフォームを拡大することに投資し続けています。著者らはCRISPR/CAS 9は1種の新しい治療法分類の基礎を形成し、稀とよく見られる疾病を治療する潜在力があると信じている。この約束を現実にするために,CRISPR/Cas 9遺伝子編集を用いて広範かつ多様な候補製品チャネルを構築した。
5
私たちのパイプは
次の表は、我々の製品開発ルートの状態をまとめています
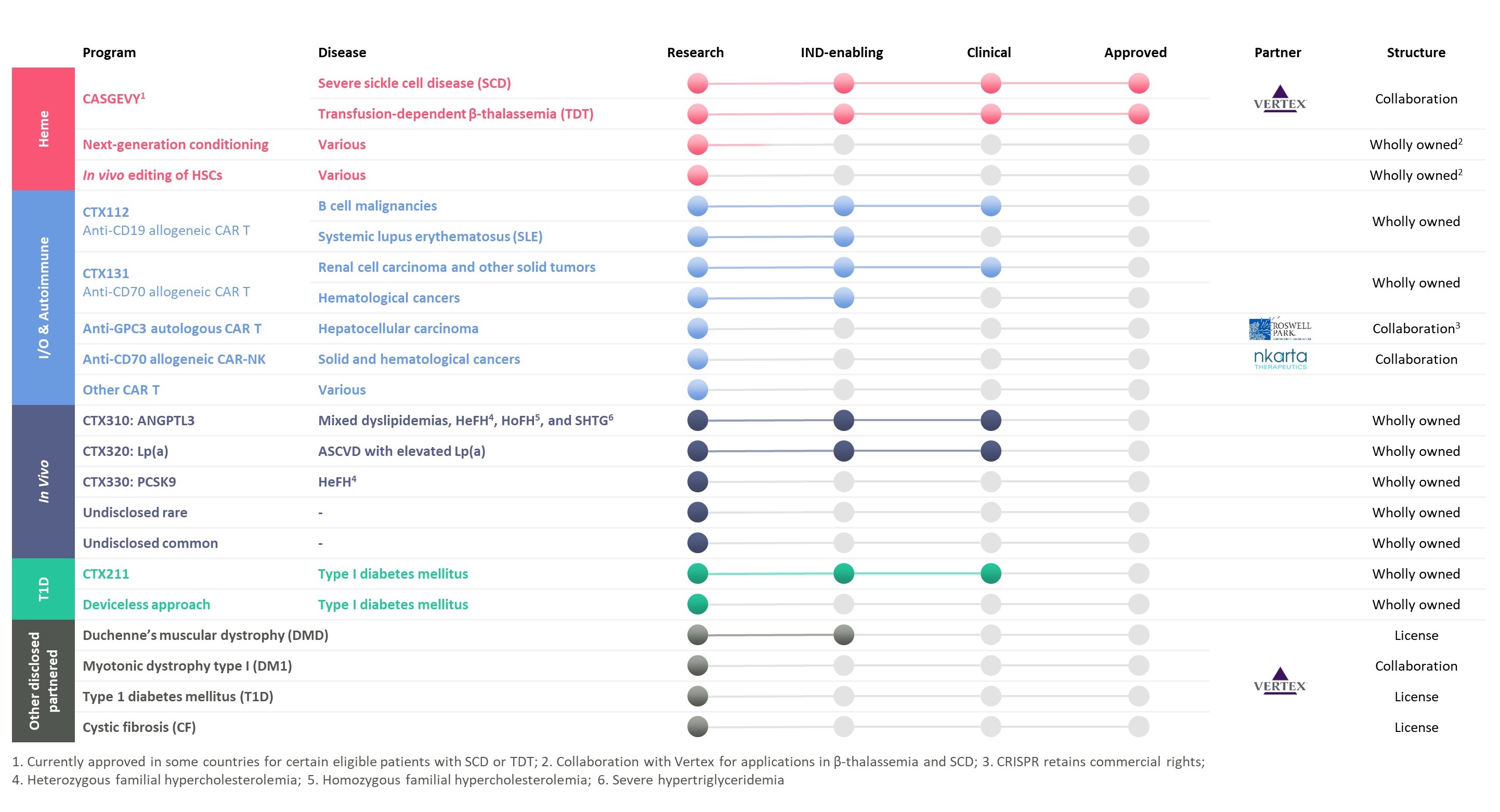
ヘモグロビン病
ヘモグロビン病は1組の異なる遺伝性血液疾患であり、ヘモグロビンの合成或いは構造変化によって引き起こされる。ヘモグロビン疾患におけるわれわれの先行プロジェクトCASGEVYは世界で初めて承認されたCRISPRによる遺伝子編集療法である。これは我々とVertexとの戦略的パートナーシップにおける最初の治療法であり,共同開発と商業化プロトコルに基づいて進められており,Vertexは商業化をリードしている。CASGEVYは、条件を満たすSCDまたはTDT患者の治療のために、米国および世界の他の複数の国および地域で承認されている。SCDとTDTはβグロブリンをコードする遺伝子変異によるものである。ベータグロブリンはヘモグロビンの重要な構成部分であり、ヘモグロビンは赤血球中のタンパク質であり、酸素を輸送し、全身の二酸化炭素を除去することを担当する。
CASGEVY[Exacel])
CASGEVYは非ウイルスで離体するCRISPR/Cas 9遺伝子編集細胞療法は,患者自身の造血幹/前駆細胞,あるいはHSPCにより,正確な二本鎖切断によりBCL 11 A遺伝子の赤系特異的増強子領域で編集される。この編集の結果、赤血球で高レベルの胎児ヘモグロビンまたはHbFが産生される。HBFは酸素を運搬するヘモグロビンであり,胎児発育過程で自然に存在し,出生後に成人形に変換されるヘモグロビンである。
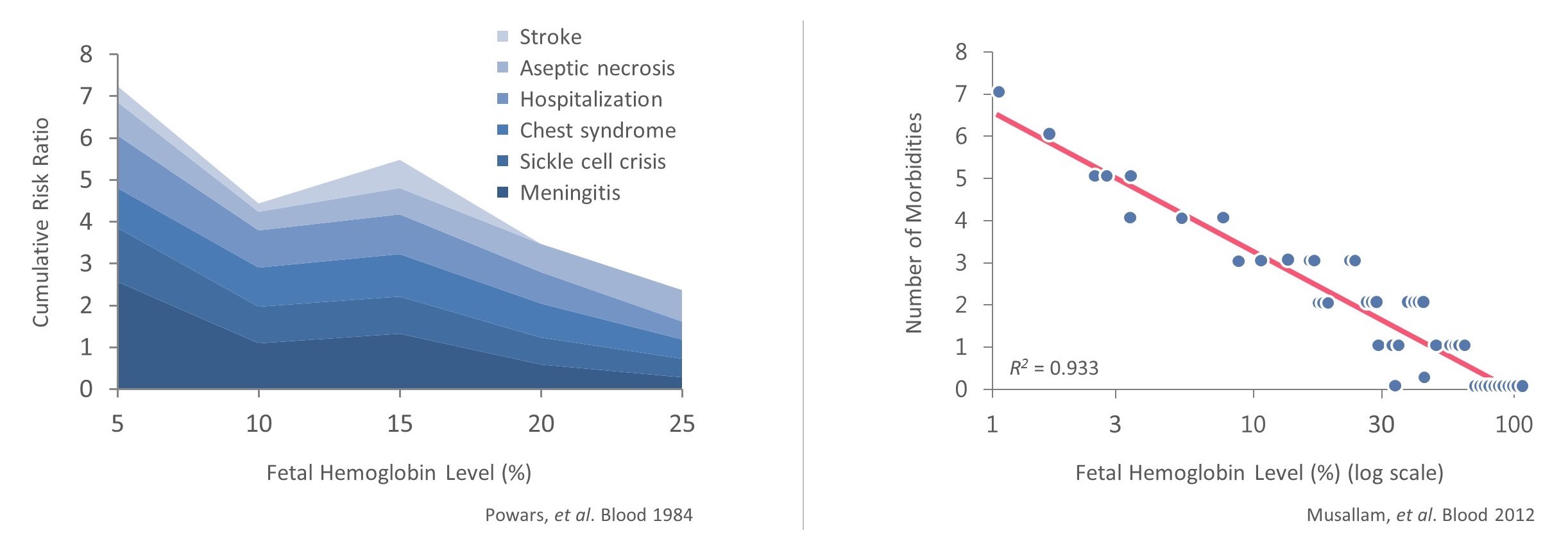
このHBF上昇の方法は自然人類遺伝学で観察された現象をシミュレーションした。多くのSCDやTDT患者ではHBFは乳児期に消失し,疾患の症状が出現し始めている。しかし、一部の患者のHBFレベルは上昇し、成人まで持続し、このことは遺伝性胎児ヘモグロビン持続性、あるいはHPFと呼ばれる。これらの患者は通常無症状あるいは病状が軽度であり,HbF上昇により成人ヘモグロビンの欠陥を補うことができる。この保護性のHPF状況はすでにこれらの個体のゲノムDNAの特定の変化によるものであり、BCL 11 Aのようなグロブリン遺伝子の発現レベルを制御する遺伝制御要素に関連する領域を含むことが証明された。我々は、TDT患者を含む様々な異なるβグロブリン変異を中和し、HPF患者の無症状の自然病歴データをサポートすることができる、変異βグロブリン遺伝子を直接修正するのではなく、関与する編集方法の効率および一貫性を考慮したHBF上方制御戦略を選択した。
6
鎌状細胞病とβ地中海貧血患者のHbFレベルと発症率の関係
CASGEVY治療を受けた患者はまず1種の治療を受け、1群のHSPCを動員して骨髄から血液に入った。患者の血液から血球を採取し,製造工場に移し,そこでHSPCを分類しCRISPR/Cas 9遺伝子編集を行った。製造後,編集後の細胞は,現在CASGEVYと呼ばれ,臨床現場に移されている。CASGEVY注入前に骨髄切除治療を受ける。
FDAは2023年12月8日,12歳以上に血管閉塞発症(VOC)を繰り返すSCD患者の治療にCASGEVYを許可し,2024年1月16日,FDAは12歳以上のTDT患者の治療にCASGEVYを許可した。また,CASGEVYは欧州委員会の条件付き承認を得ており,12歳以上のSCD患者に適用されており,再発性VOCsが造血幹細胞(HSC)移植に適していることが特徴であるが,ヒト白血球抗原(HLA)適合の親族HSCドナーや,12歳以上のTDT患者に適しており,造血幹細胞移植に適しているが,HLA適合に関するHSCドナーは得られていない。CASGEVYはまたイギリスでイギリスの薬品と保健品監督機関の条件付きマーケティング許可を獲得し、サウジアラブ王国でサウジ食品と薬物管理局の条件付きマーケティング許可を獲得し、バーレーンで国家衛生管理局の条件付きマーケティング許可を得て、12歳以上のVOCs或いはTDT再発を特徴とするSCD患者に用いられ、これらの患者はHSC移植に適しているが、HLA型に適合する親族HSCドナーはいない。
著者らとVertexは、(1)単剤CASGEVYをそれぞれ12歳から35歳までの重症SCDとTDT患者の安全性と有効性を評価するための3つの臨床試験、(2)5歳から11歳までの患者に対する2つの臨床試験、1つは重度SCD患者、もう1つはTDT患者、および(3)CASGEVY注入後の参加者に15年間のフォローアップを行うための長期臨床試験を含むCASGEVYの研究を継続した。これまでCASGEVYの安全性データは,自己幹細胞移植や清髄性条件作用とほぼ一致していた。これまでに公表されてきた奏効率データは,重篤なSCDやTDT患者の潜在的一次機能療法の概要としてCASGEVYを支持している。
7
SCD:VOCs VOCなしと無入院治療45.5カ月
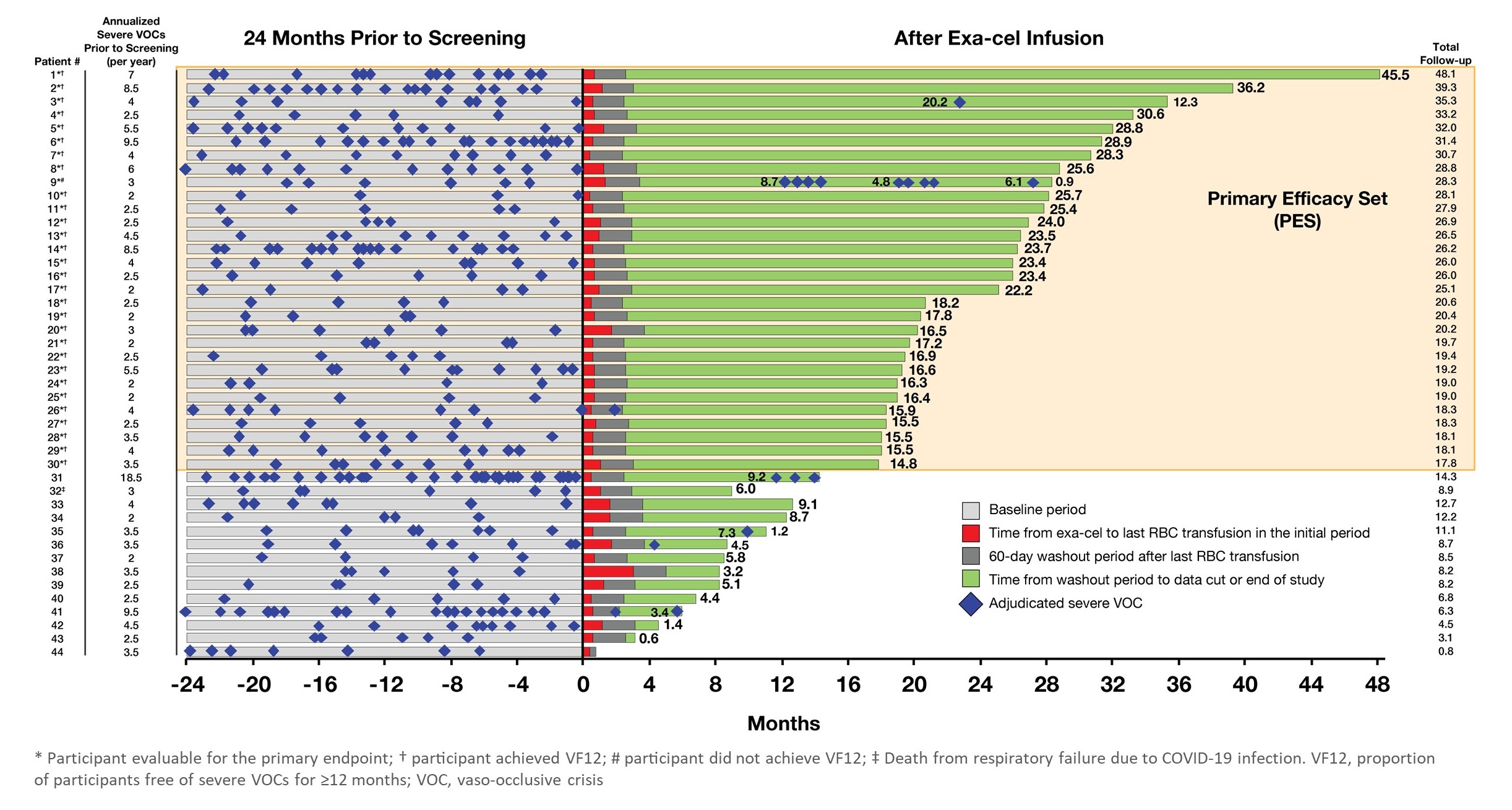
TDT:輸血独立期間を45カ月に延長

8
β地中海貧血
β地中海貧血はヘモグロビン生成減少に関与する血液疾患である。この疾患はβグロブリン発現不足を引き起こす突然変異によるものであり,これによる症状はヘモグロビン欠乏だけでなく,赤血球中のペアリングされていないαグロブリン蓄積にも関与している可能性がある。β地中海貧血に関連する症状の重症度は血球に存在する機能性βグロブリンのレベルに依存する。ペアリングしていないアルファグロブリン鎖は赤血球に有毒であり、赤血球寿命を短縮した。最も重篤な場合,重篤なベータ地中海貧血と記載されており,機能性ベータグロブリンは完全に欠損しているか,減少し,重篤な貧血をきたしている。これらの患者では,骨髄は赤血球の破壊と同期することができないため,定期輸血が必要である。慢性輸血は有効に症状を解決できるが、それらはよく鉄負荷が高すぎ、進行性心臓と肝臓不全を招き、最終的に早期死亡を招く。軽度β地中海貧血を有する患者は軽微な貧血を経験し,症状さえない可能性がある。推定によると、全世界の毎年のベータ地中海貧血の総発病率は60,000名の新生児であり、アメリカとEUの総罹患率は約16,000人と推定され、全世界で20万人以上が生きており、この疾病の治療を受けるために登録されている。
ベータ地中海貧血の最もよく見られる治療方法は慢性輸血である。輸血に依存する患者は通常2~4週間に1回輸血を受け、長期輸血はよく体内鉄レベルの上昇を招き、これは比較的に短い時間内に器官損傷を招く可能性がある。患者は静脈採血や鉄錯化剤の服用,あるいは血液中の鉄レベルを低下させる薬剤を服用することが多く,彼ら自身の重大な毒性に関与している。発展途上国では,長期輸血が得られないため,多くの患者が小児早期に死亡している。また、ベータ地中海貧血を治療する疾患修正療法Reblozyl(luspatercept-AAMT)は2019年にFDAの承認を得た。
ベータ地中海貧血の潜在的治療方法は同種造血幹細胞移植、あるいはallo-HSCTであるが、その関連する発病率と死亡率、及び一致と自発的なドナーが不足していることを考慮すると、このような手術を選択する患者は少ない。もう一つの選択肢はZyntegloです離体するブルーバード生物社が開発した自己レンチウイルス遺伝子療法は,FDAが2022年8月にあるTDT患者の治療に承認した。
鎌状細胞病
SCDは遺伝性赤血球疾患であり、βグロブリン遺伝子の特定の突然変異によって引き起こされ、この突然変異は赤血球機能異常を招く。酸素濃度が低い場合には,異常なヘモグロビンが赤血球内に集積し,赤血球が鎌状になり,硬直する。これらの鎌状細胞は血管を閉塞し、器官への血液を制限し、最終的に深刻な痛み、感染、脳卒中、全体の生活の質の低下と早期死亡を招く。溶血増加を経験し,貧血をきたすこともある。推定によると、全世界のSCDの発病率は毎年30万人の新生児であり、全世界で2000万から2500万人がこの疾病を患っている。アメリカとEUでは総罹患率は15万人と推定されている。
ベータ地中海貧血と同様に,医療インフラが支持可能な地域では,溶血レベルの高いSCD患者の標準治療には長期輸血が含まれており,キレート療法と同様の鉄過負荷や毒性に関するリスクがある。FDAおよび/またはEMAも、ヒドロキシウレア、アダクビル(crizanlizumab-TMCA)およびOxbryta(Voxelotor)を含むSCDを治療するいくつかの疾患修飾療法を承認している。2023年12月までの唯一の治療選択は、同種造血幹細胞移植であり、これらの患者の移植に関連する発症率および死亡率の大きなリスク、および一致および自発的なドナーの欠如を考慮すると、通常回避されている。2023年12月FDAはLyfgenia(Lovotieglogene Autemcel)を承認しました離体するブルーバード生物が開発した自己レンチウイルス遺伝子療法は,血液系悪性腫瘍のブロック警告を有する。
次の世代の努力
CASGEVYに基づいて,現在CASGEVYと併用されている清髄性白花丹調節レジよりも優れている可能性がある標的調節レジメンの次世代努力を行っている体内にある造血幹細胞の編集。この2つの努力のいずれも,われわれの療法から利益を得ることができる患者数を拡大することができる。
免疫腫瘍学と自己免疫
免疫腫瘍学の分野では,腫瘍界への興味が急速に増加している,すなわち免疫系を用いて癌細胞を攻撃する治療法である。工学免疫細胞療法は,T細胞などの免疫系細胞を遺伝子改変することにより,癌細胞を認識·攻撃できる方法である。
9
工学細胞療法はすでに鼓舞的な結果を示し、自己或いは患者由来のCAR T製品が多くの承認を得た。これらの細胞療法は,治療を受けた患者ごとに独自の製品を創出する必要があり,過去に腫瘍学の分野で挑戦的でコストが高いことが証明されている。このようなカスタマイズされた製造過程に時間を要し,その過程で患者の疾患が悪化する可能性があり,実行可能な製品がまったく生産できない場合がある。また,これらのバージョンの工学細胞療法は固形腫瘍の治療には能力が限られているようであり,高毒副作用を示し,複雑な管理案が必要である。対照的に、同種またはドナー由来の工学的T細胞療法は、(各バッチが多くの用量を産生するので)即時に、よりよく、より簡単な物流、より良い一貫性を得ることができるように、“既製”治療を事前に製造し、実施することができ、再用量を得ることができる。
免疫腫瘍学において最終的に成功した細胞工学戦略は様々な遺伝子修飾に関与することが予想され,CRISPR/Cas 9はこの応用において中心的な役割を果たすと信じている。他の遺伝子編集プラットフォームは、これらの目的のために使用される可能性があるが、CRISPR/CAS 9は、特に、単一の細胞内で複数の遺伝子を修飾および/または挿入する多重編集に適している。効率、細胞毒性および/または製造上の挑戦により、遺伝子修正のたびに異なるタンパク質酵素を必要とする遺伝子編集技術は、それらが同時に行うことができる編集数を制限する可能性がある。これに対し,CRISPR/Cas 9は単一のCas 9蛋白と複数の小gRNA分子を用いて効率的に複数回の編集を行うことが可能である。
われわれの免疫腫瘍学的細胞療法では,CRISPR/Cas 9の多重化能を用いて同種異体投与と追加的な遺伝子編集を導入し,これらの候補製品の治療効果を改善することを目的としている。また,我々は我々のCRISPRプラットフォームを用いて持続的な革新の過程を実現しており,その過程でインクリメンタル編集を次世代製品に統合し,治療効果のさらなる向上を図っている。私たちは、すべての腫瘍タイプ(固形腫瘍を含む)の免疫腫瘍学における工学的細胞療法のすべての潜在力を実現するために、私たちの多重輸送能力を拡大し続けている。
また,複数のグループでは,全身性エリテマトーデスやSLEを含む様々な自己免疫疾患治療におけるCAR T療法の有効性が証明され始めている。特に,CD 19ガイドの自己CAR T細胞は早期臨床研究で持続的な緩解を生じている。同種異体CAR T療法は類似した結果を提供する可能性があり、分離を必要とすることなく、拡張性の増加、商品コストの著しい低減、毒性リスクの低減及び患者体験の改善を含むいくつかの潜在的な利点を有する。自己免疫疾患は我々の同種異体CAR T細胞計画の巨大な追加機会である可能性がある。
次世代同種自動車T候補
我々は,CD 19を標的としたCTX 112とCD 70を標的としたCTX 131の2種類の次世代,研究,遺伝子編集,健康なドナー由来の同種異体CAR T製品の臨床試験を進めている。これらの次世代候補薬物は著者らの第一世代計画の基礎の上に創立し、著者らの絶えず革新する使命を反映し、できるだけ早く患者に潜在的な変革性薬物をもたらす。これらの第一世代同種異体CAR T候補細胞CTX 110とCTX 130は重要な概念証拠を提供し、同種異体CAR T細胞が標準リンパ除去方案後に持続的な緩和を産生できることを証明した。また,第1世代プロジェクトは良好な耐性を示した。実施されているCTX 112およびCTX 131の臨床試験の初期データは、これらの候補薬剤がCTX 110およびCTX 130の臨床的特徴を改善する可能性があることを示している。薬物動態学を含む新薬理学データは、第一世代候補遺伝子と比べ、CTX 112とCTX 131中の新しい効力遺伝子編集は患者のCAR T細胞の拡張と機能持続性を著しく向上させることを表明した。そのほか、次世代候補製品はより強い製造安定性を示し、各ロットで生産したCAR T細胞の数量はもっと高く、更に一致した。私たちは臨床試験のためにCTX 112とCTX 131を生産しています。私たちの内部GMP製造工場で。
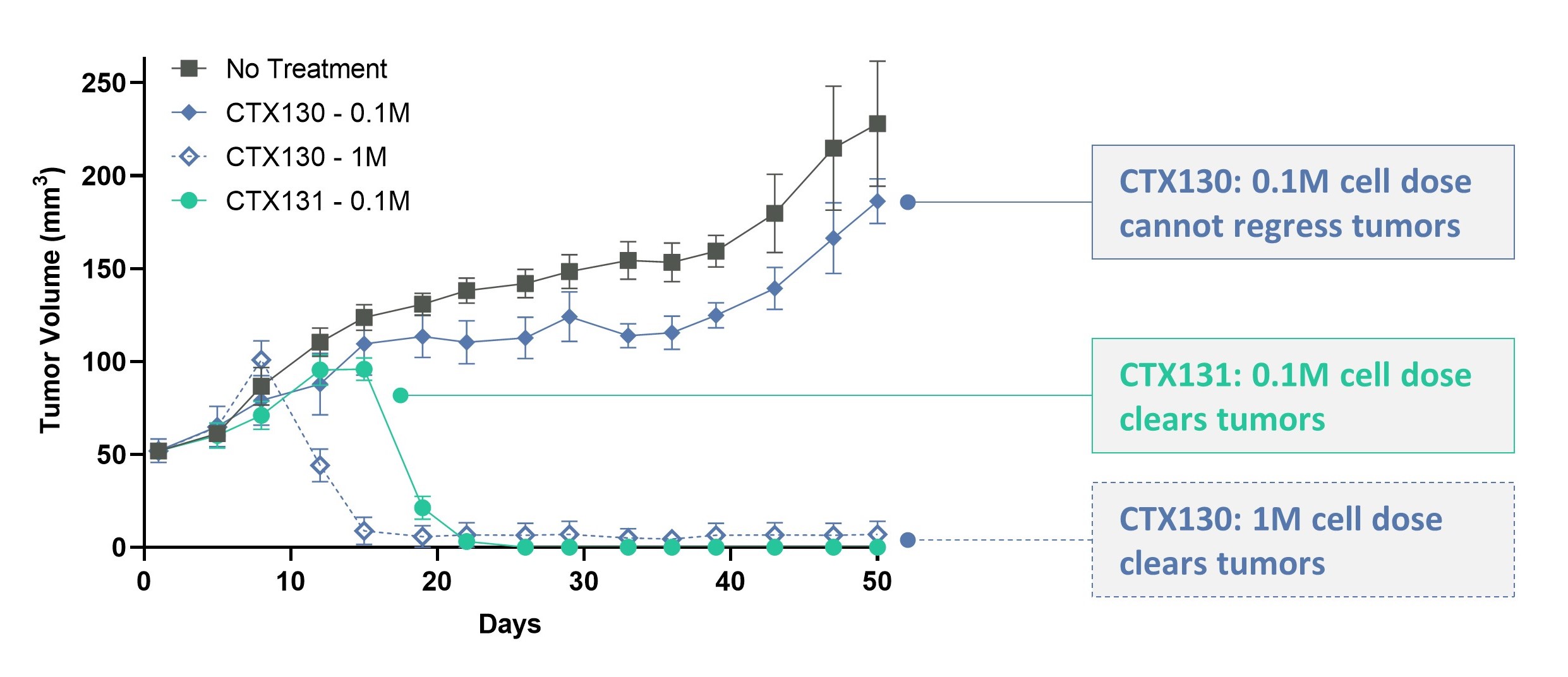
CTX 112およびCTX 131は、それぞれ2つの新しい遺伝子編集を含み、我々のCRISPR/Cas 9プラットフォームを活用することで、追加の編集を次世代製品に統合することによって、革新的な事実を継続的に得ることができる。これらの編集−Regnase−1のノックアウトと形質転換成長因子−β受容体2のノックアウト,あるいはTGFBR 2−−はCAR Tの効力を増強し,CAR Tの消費を減少させる可能性がある。編集Regnase-1はT細胞機能の内在“ブレーキ”を除去し、編集TGFBR 2はT細胞抗腫瘍活性の重要な外部“ブレーキ”を除去した。我々は,数十個の新しいものと先に述べた遺伝子を系統的にスクリーニングすることにより,このような編集の組合せを決定した.臨床前研究では,これらの編集は第一世代候補薬と比較して協同作用が約10倍効力を向上させ,以下に示すように,腎細胞癌異種移植モデルではCTX 131がCTX 130と比較している。
10
Regnase-1およびTGFR 2編集は約10倍の効力を向上させます
つまり、CTX 112およびCTX 131を産生するために、我々の遺伝子編集技術を用いて、健康ドナーからのT細胞をそれぞれ5回および6回修正した
次世代CRISPR遺伝子編集の同種乗用車Tシャーシ
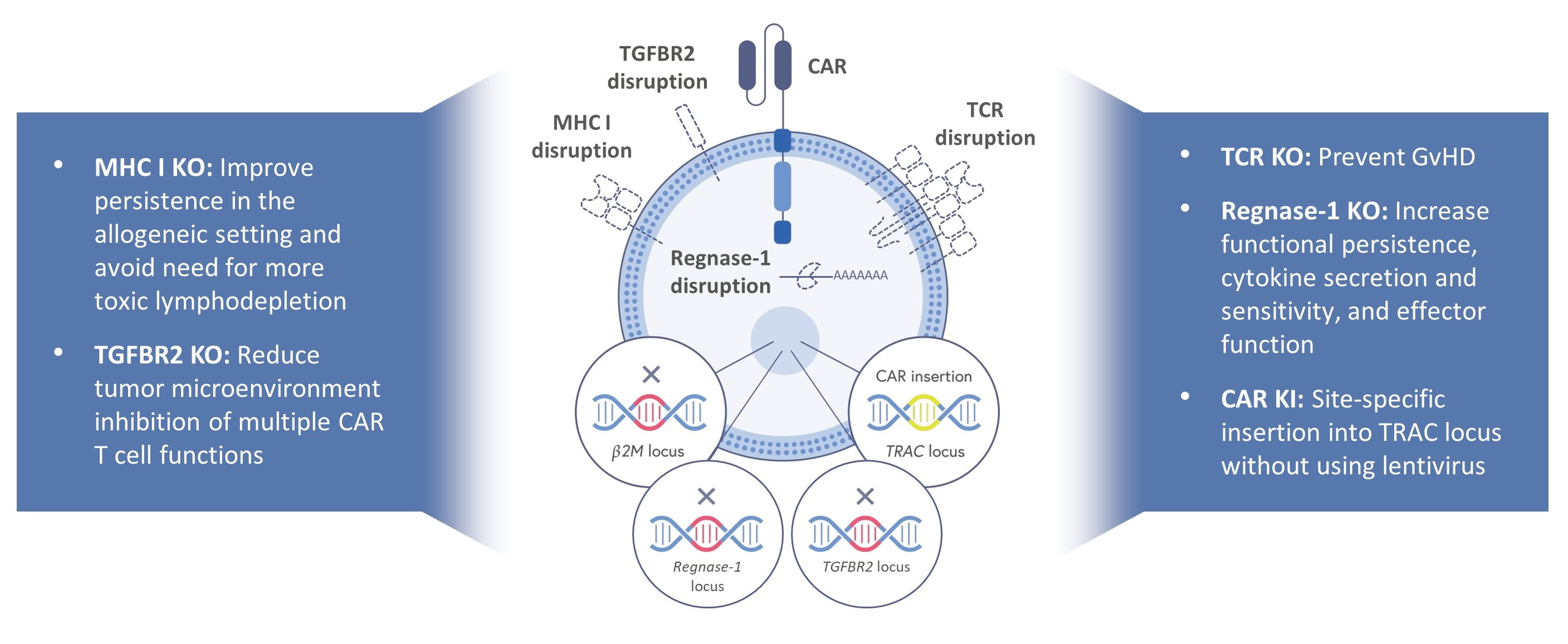
この方法は,開発中の他の同種異体CAR T製品よりも優れており,これらの製品は統合ウイルスを用いてCARを半ランダムに挿入し,効力を向上させるための編集は含まれていないと信じている。
CTX 112
再発または難治性CD 19陽性B細胞悪性腫瘍を有する成人患者におけるCTX 112の安全性および有効性を評価するための臨床試験において、少なくとも2つの以前の治療を受けたCTX 112を検討している。この試験では,シクロホスファミド(500 mg/m 2)とフルダラビン(30 mg/m 2)を含む標準的なリンパ浄化レジメンを3日間使用した。
11
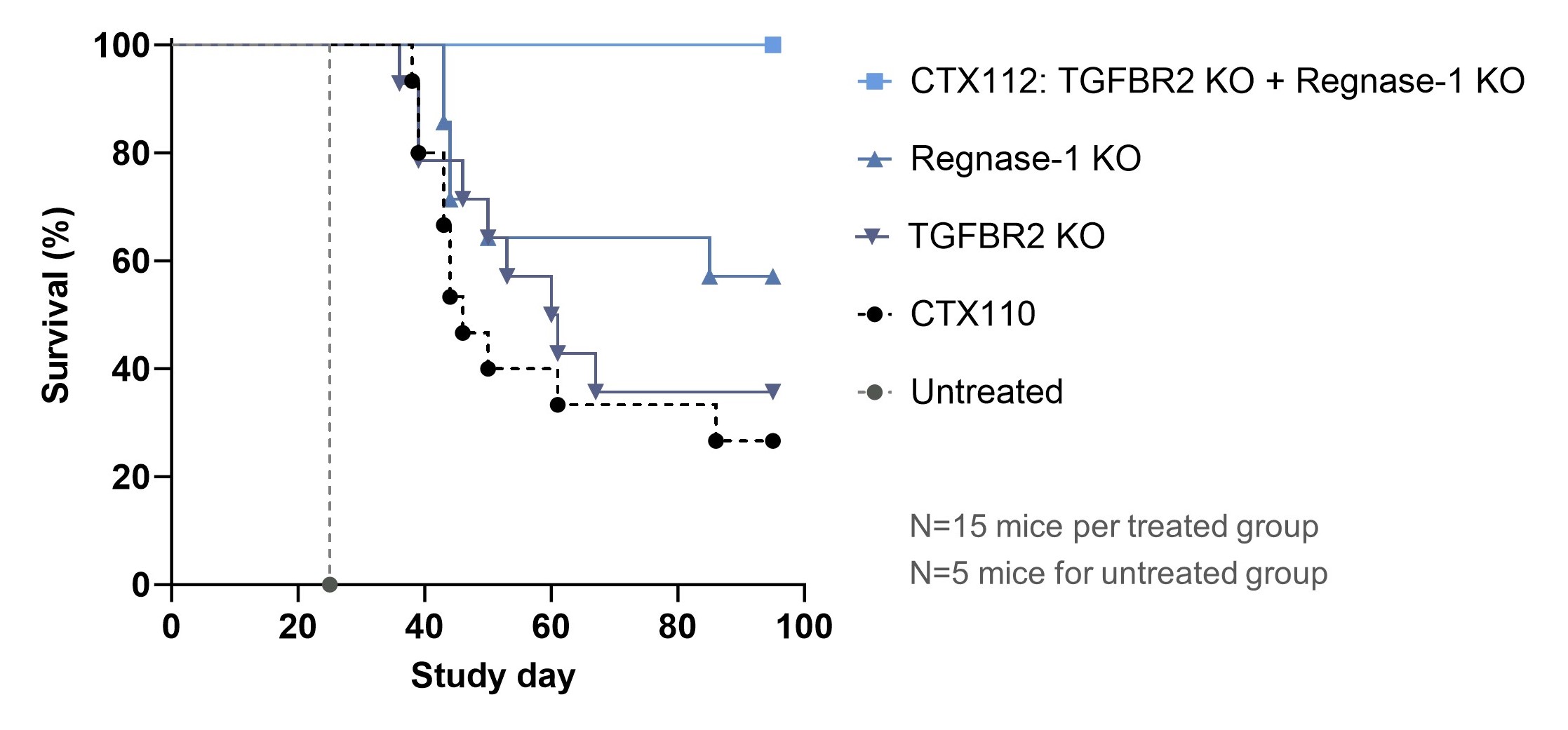
前臨床研究では、CTX 112は、未治療マウス、CTX 110治療を受けたマウス、またはRegnase−1またはTGFBR 2編集を有するCAR T細胞治療を単独で受けたマウスと比較して、以下の図に示すように、マウスモデルにおける生存時間を有意に延長した。
CTX 112治療はNalm 6-Lucマウスの生存時間を延長することができる
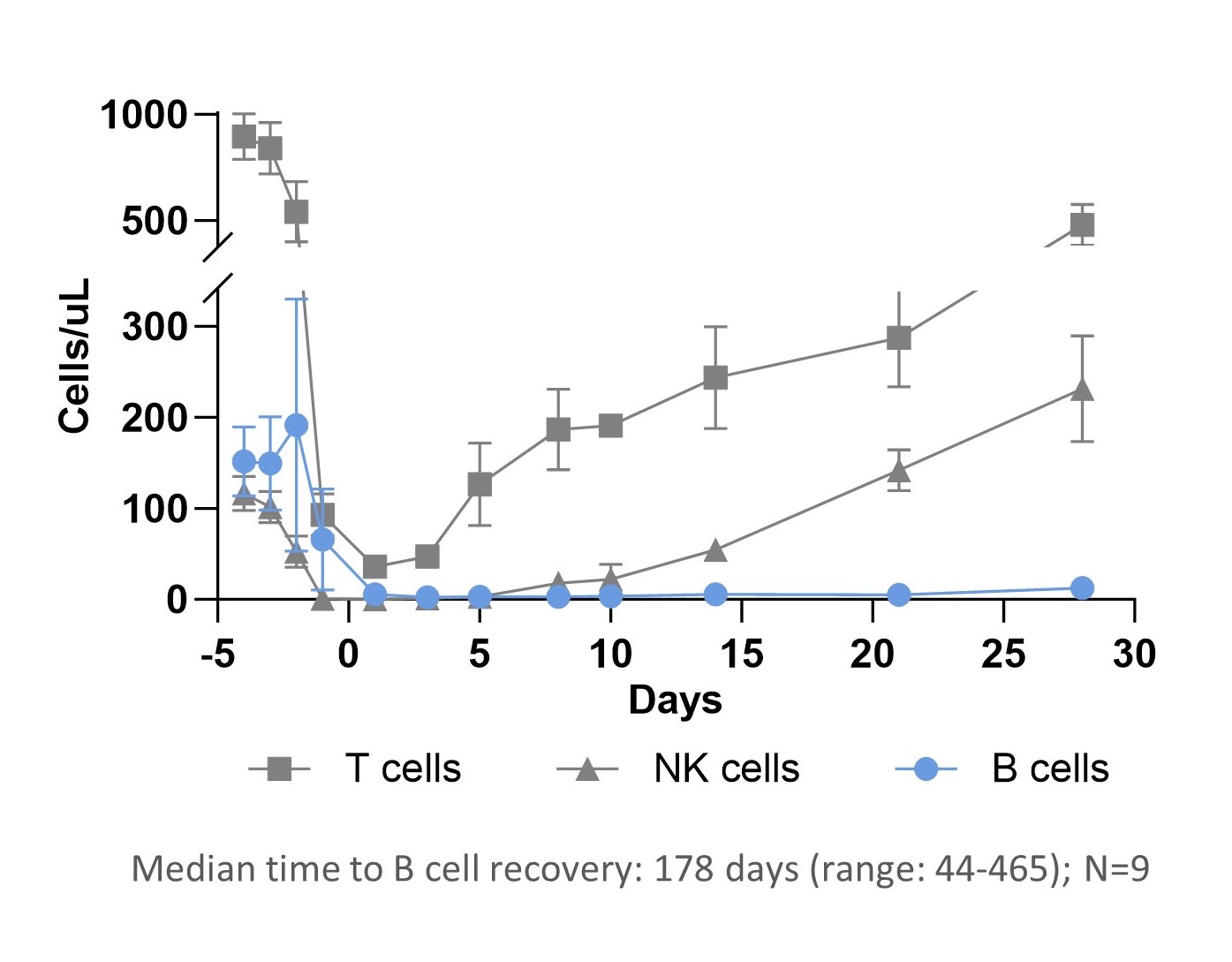
また,SLEにおけるCTX 112の臨床試験を開始する予定であり,将来的にはより多くの自己免疫適応に拡大する可能性がある。これまでSLEに成功してきた自己CAR T細胞は,B細胞深さ枯渇後のB細胞の“リセット”を招いているようであり,組換えB細胞は高レベルの自己抗体を発現しない。我々の第1世代プログラムCTX 110の臨床データによると、CTX 112は、次の図に示すように、B細胞悪性腫瘍患者のB細胞深さ枯渇を示す類似のB細胞“リセット”を産生する可能性があると信じられている。
ベースラインは、B細胞の患者がCTX 110を注入した後のB細胞の枯渇を検出することができる
CTX 131
我々は固形腫瘍といくつかの血液系悪性腫瘍の潜在的治療のためのCTX 131を開発している。いくつかの腫瘍は、腎細胞癌、神経膠芽腫、膵臓癌、肺癌と卵巣癌、非ホジキンリンパ腫およびいくつかのT細胞リンパ腫を含むCD 70を発現し、正常組織は発現しないか、あるいは極めて限られたCD 70発現を示す。
再発または難治性固形腫瘍の成人患者に対するCTX 131の安全性および有効性を評価するための臨床試験を行っている。この試験では,シクロホスファミド(500 mg/m 2)とフルダラビン(30 mg/m 2)を含む標準的なリンパ浄化レジメンを3日間使用した。また,CTX 131の試験をT細胞やB細胞腫瘍を含む血液系悪性腫瘍に拡大する予定である。
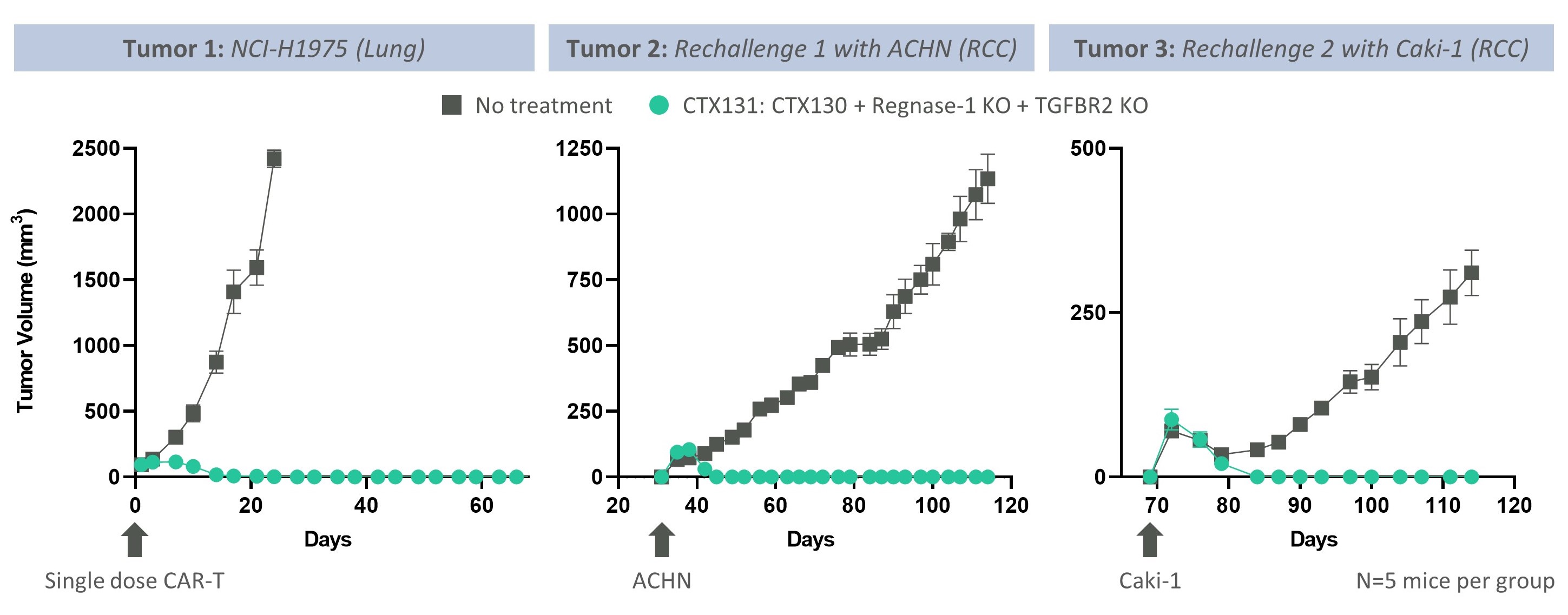
臨床前研究では,CTX 131は強い活性を示し,すべての治療を受けたマウスにおいて異種移植モデルの肺癌と腎癌を除去し,最初の治療でも複数回の再挑戦でも次の図のようになった。
12
CTX 131は3つの異種移植腫瘍モデルを連続的に除去しました
他の候補者
私たちは新しい目標に対していくつかの追加のCAR T製品候補製品を発売しています。候補者の一人について、私たちはすでにリードする癌センターロスウェル公園総合癌センターまたはロスウェル公園と新しい標的Glypcan-3あるいはGPC 3を臨床的に検証するための革新的な協力モデルを開発した。Roswell Parkと協力して,肝細胞癌に発現するGPC 3の遺伝子編集に対する自己CAR T候補遺伝子を開発している。ロスウェル公園は製造と最初の人体臨床試験を行い、私たちは商業権利を保留する。このような構造は、このような遺伝子編集された候補製品の安全性と活性を迅速に評価することができるだろう。臨床結果から,国内での自己計画の推進や同種異体バージョンの開発を継続して機会をさらに拡大することを選択することができる。
さらに、複数の組織は、ナチュラルキラー細胞またはNK細胞のような免疫腫瘍学的治療に他の免疫細胞を使用することを探索し始めている。我々の遺伝子編集免疫細胞療法への取り組みをT細胞以外に拡張するために,Nkartaと協力関係を築き,我々の遺伝子編集技術と細胞治療専門知識をNkartaがリードするNK細胞発現,開発,製造能力と組み合わせた。我々とNkartaは、ドナー由来の遺伝子編集CAR-NK細胞候補製品を含む候補製品を共同開発および共同商業化しており、そのうちの1つがCD 70である。
Vivo手法では
私たちはすでに先進的なプラットフォームを構築しました体内にある急速に拡大しています体内にあるプログラムです生体内遺伝子編集、あるいはCRISPR/Cas 9による治療薬を直接人体内の組織に送達することは、治療が困難な疾患を含む多くの稀かつよく見られる疾患の治療を可能にすることができる離体する近づいてきました。
私たちのリードは体内にあるこれらの計画は肝臓のためであり、現在利用可能な臨床的に確立され検証された脂質ナノ粒子またはLNP送達技術を利用する。LNPにはいくつかの利点があり,CRISPR/CAS 9の配信に非常に適している体内にある効率的で安全な肝臓送達、大貨物サイズと瞬時貨物表現を含む。我々の肝臓における最初のプロジェクトは疾患の治療を目指しており,これらの疾患では,よく知られている遺伝的に関連する遺伝子を安全に破壊することで強力な治療効果を産生することができる。例えば、我々の2つの臨床プロジェクト、CTX 310およびCTX 320は、それぞれ有効な標的Angptl 3およびリポ蛋白質(A)またはLp(A)を妨害することによって心血管疾患を治療することを目的としている。
肝臓に加えて,LNPs,ナノ粒子技術,AAV担体を含む様々な輸送技術が求められている。内部努力と外部協力を通じて、私たちは未来を支援するために新しい交付モデルを開発しています体内にある治療学です。
13
心血管と脂質異常計画
心血管疾患は全世界の主要な死亡原因であり、2021年にすべての死亡人数の3分の1近くを占め、即ち2050万人近くである。心血管疾患は心不全、脳卒中、アテローム性動脈硬化性心血管疾患或いはASCVD、大動脈弁石灰化などを含む。血中脂質異常は心血管疾患を引き起こす主要な原因である。血中脂質異常症の特徴は,コレステロール,リポ蛋白,トリグリセリドを含む血中脂質レベルが異常に高いことである。最もよく見られる3種類の血中脂質異常は高コレステロール血症、高トリグリセリド血症とLp(A)の上昇である。現在の心血管疾患の慢性看護治療モードは毎日の薬品使用、毎週注射、毎年何度も輸液と/或いは手術干与を含む。このモデルは患者や医療システムに大きな負担をかけている。脂質降下治療を堅持することは依然として重大な挑戦であり、80%を超える心血管リスクが非常に高い人は低密度リポ蛋白、コレステロール或いは低密度リポ蛋白-Cの目標を達成できない。
私たちの目標は一次治療法を開発することでCVDの治療パターンを変えることです体内にある編集は患者の一生の中で持続的に粥状動脈硬化リポ蛋白レベルを下げることができる治療方法である。そのため,自然ヒト遺伝学や他の治療法の研究に基づいてAngptl 3などの遺伝子を撹乱し,これらの遺伝子の機能失調や抑制された場合には,キーリポ蛋白レベルの低下を招き,心血管結果を改善することを目標としている。この利点をまとめることによって、私たちの療法は追加の治療の需要を最大限に減少または除去し、深刻な遺伝性脂質異常を有する患者とより大きなASCVD患者集団の長期心血管結果を改善する可能性があると信じている。
CTX 310
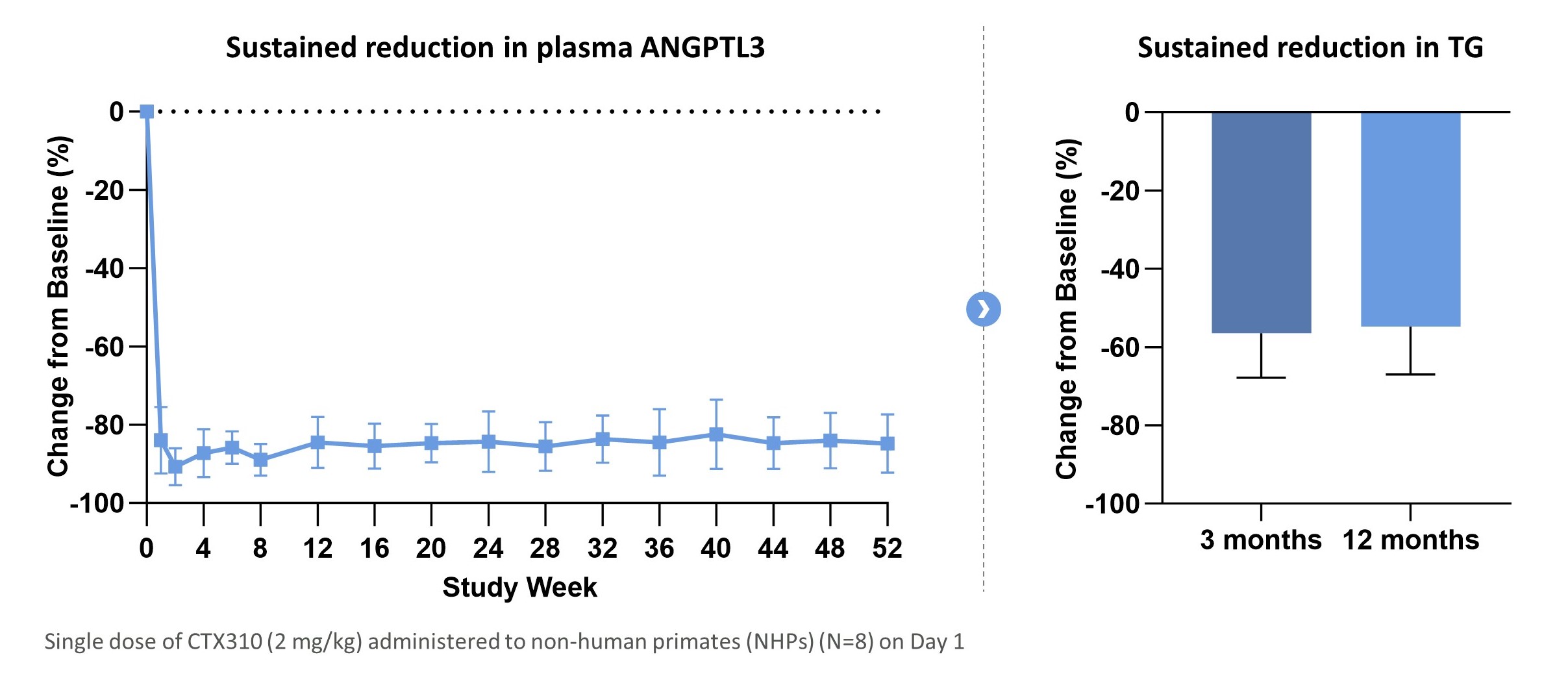
私たちのリードは体内にある候補製品CTX 310は、心血管疾患の治療および予防のためのアンギオゲニン関連タンパク質3またはAngptl 3をコードする遺伝子に対する。Angptl 3はリポ蛋白質リパーゼ(LPL)と呼ばれる酵素を抑制することにより脂質代謝に重要な役割を果たしている。LPLはトリグリセリドに富むリポ蛋白質を分解する主要な酵素であり、例えば乳糜粒、極低密度リポ蛋白或いは極低密度リポ蛋白と低密度リポ蛋白である。これらのリポ蛋白質のLPL加水分解を阻止することにより,Angptl 3の活性は循環中トリグリセリドレベルを増加させた。Angptl 3遺伝子を破壊することによりAngptl 3の発現を低下させることはLPLの発現を増加させ,トリグリセリドに富むリポ蛋白質や低密度リポ蛋白質を減少させる。この機序は自然病歴研究により検証されており、Angptl 3天然機能喪失変異を有する個体はトリグリセリドレベルが低く、低密度リポ蛋白レベルと低い冠状動脈疾患リスクを有するためである。CTX 310は,Cas 9をコードするメッセンジャーRNAとLNPを介して伝達されるAngptl 3に対するgRNAからなり,Angptl 3遺伝子を破壊することでこの効果を要約することを目的としている。CTX 310は非ヒト霊長類動物のAngptl 3蛋白レベルを90%近く低下させ、血清トリグリセリドを50%以上低下させることが証明された。われわれはすでにCTX 310の一期臨床試験を開始し,混合性血脂異常,純性家族性高コレステロール血症(HoFH),ヘテロ家族性高コレステロール血症(HeFH),重篤な高トリグリセリド血症(SHTG)の治療に用いた。
単剤CTX 310は、NHP中のAngptl 3およびトリグリセリドを1年間持続的に低下させることができる
CTX 320
私たちの二番目体内にある候補製品CTX 320は、心血管疾患に関連する別のタンパク質を対象とする:Lp(A)。Lp(A)は1種のリポ蛋白であり、1種の低密度リポ蛋白様粒子からアポリポタンパク質(A)或いはアポリポタンパク質(A)と呼ばれるタンパク質に共有結合する。Lp(A)は血液中でコレステロールを輸送し、高度な粥状動脈硬化作用を有する。それは大動脈弁内層と循環器系の他の領域の細胞外基質成分を浸透し、結合することができ、炎症と脂肪沈着を増加させ、時間の経過に伴い、これは大動脈弁機能の低下とその他の心血管疾患の深刻な症状を招く。Lp(A)はCVDの独立危険因子である。高
14
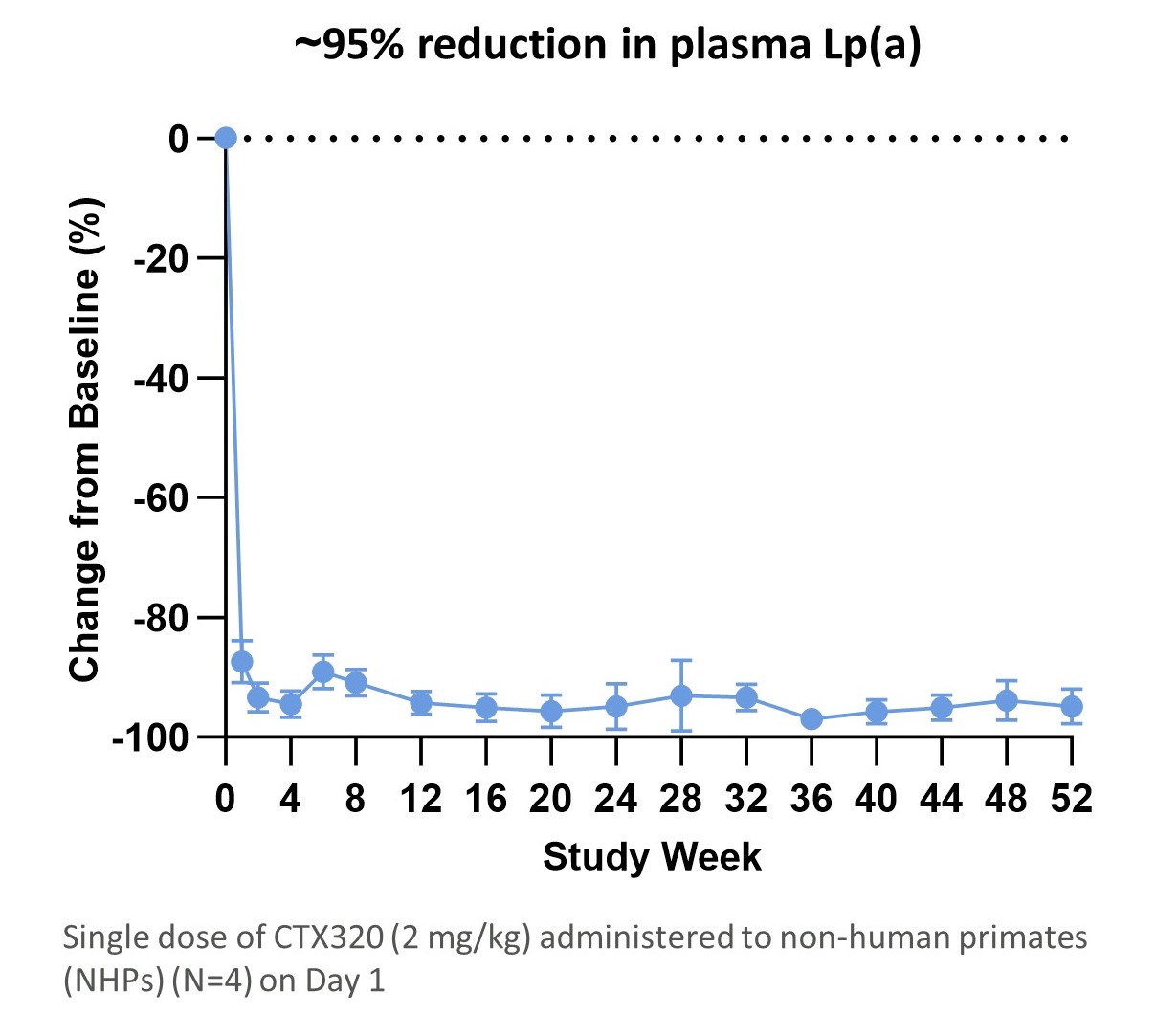
Lp(A)濃度および高Lp(A)濃度に関する遺伝的変異は心血管疾患に関与している。Lp(A)レベルが50 mg/dLより高いことは大動脈弁石灰化疾患(AVCD)と直接関連している。米国では20%もの成人のLp(A)レベルが50 mg/dLを超え,100万人を超える米国成人がAVCDを患っている。また,家族性高コレステロール血症患者の30%のLp(A)レベルが上昇した。これまでFDAが承認したLp(A)を低下させる治療法はない。CTX 320は,LPAに対するgRNA,apo(A)をコードする遺伝子,LNPを介して伝達されるCas 9をコードするメッセンジャーRNAからなる。アポリポタンパク質(A)レベルを下げることによって、CTX 320は血漿Lp(A)レベルを著しく下げることができ、臨床前データにより、CTX 320治療はNHP患者のLp(A)レベルを90%以上低下させることができる。われわれはすでにCTX 320によるLp(A)上昇を治療するASCVDの1期臨床試験を開始した。
単剤CTX 320は非ホジキンリンパ腫患者のLp(A)を1年間持続的に減少させることができる
高コレステロール血症
高コレステロール血症の定義は低密度リポ蛋白レベルが130 mg/リットルより高く、心臓病と脳卒中のリスク増加と関係がある。高コレステロール血症の中で、高レベルの低密度リポ蛋白は血管に蓄積し、粥状動脈硬化を招く。治療の目標は低密度リポ蛋白レベルを100 mg/リットル以下に低下させることであり、最終目標は70 mg/リットルであるが、一部の患者は既存の手段でこのレベルの低下を達成できない。低密度リポ蛋白レベルが200 mg/dLより高い患者は家族性高コレステロール血症(FH)を有すると考えられている。FH患者は食事と生活様式以外に、1つ以上の遺伝子変異による疾患がある。FH患者は低密度リポ蛋白-Cを有効に代謝できず、循環低密度リポ蛋白レベルが高く、ある情況下で1000 mg/リットルを超える。突然変異状態により,FHはHeFHとHoFHに分類される。HoFH患者の表現型は最も深刻であり、低密度リポ蛋白-Cレベルは通常400 mg/dLを超える。HoFH患者は通常生命早期に心血管疾患を有しており,治療しなければ平均寿命は33歳である。HoFHの罹患率は20万から100万成人あたり1人であった。
高トリグリセリド血症
高トリグリセリド血症の臨床定義はトリグリセリドレベルが150 mg/dLより高いことである。最も深刻な患者のレベルは2000 mg/リットルを超えるかもしれない。高トリグリセリド血症は心血管疾患や急性膵炎に関与している。低密度リポ蛋白質コレステロールと同様にトリグリセリドレベルも食事やライフスタイル選択の影響を受け,一般療法で治療を行っている。しかし、アメリカでは300万人以上の成人がSHTGを患っている。家族性乳糜粒微粒血症症候群(FCS)や多因子乳糜粒微粒子血症症候群(MCS)を含むSHTGを引き起こすことが知られている。FCS/MCSはHoFH/HeFHと類似している.FCSは唯一の真の単遺伝子高トリグリセリド血症であり、トリグリセリドが885 mg/dLを超える極端なレベルと関係がある。米国とEUでは,FCSの罹患率は20万人から30万人に1人がFCSを患っている。MCSは本質的に多遺伝子であり、これは疾患をもたらす遺伝的基礎が個人によって異なることを意味し、臨床的にはトリグリセリドレベルが150~885 mg/dLであると定義される。MCSの罹患率は600から1000人に1人である。
Vivo計画の他の内容は
CTX 310とCTX 320に基づいて、多くの早期調査があります体内にある肝臓における遺伝子破壊を利用してまれでよく見られる疾患を治療する計画。その中にはPCSK 9に対するCTX 330が含まれており,PCSK 9はよく知られている心血管疾患の標的であり,自然ヒト遺伝学,抗体,RNAi療法からの強力なデータを有している。また,我々CRISPR−Xチームが開発した技術を用いた第1陣のプロジェクトも含め,肝臓遺伝子補正に焦点を当てたプロジェクトもある。私たちはまたいくつかの血友病A、自己免疫、眼科疾患の診断、治療、または予防計画を調査しています
15
バイエルは、私たちと共同開発および共同商業化する2つの製品を選択することができ、または場合によっては、そのようなオプションの製品を独占的に許可することができる。
1型糖尿病
我々は,1型糖尿病(T 1 D)治療のための遺伝子編集幹細胞由来療法の開発に重点を置いた一連のプロジェクトを進めている。我々の遺伝子編集能力はベータ細胞代替製品を候補製品にする可能性があり、長期的な免疫抑制を必要とすることなく、患者に持続的な利点をもたらす可能性があると信じている。
同種異体ランゲルハンス島移植の臨床データにより、β細胞代替方法はインシュリンを必要とする糖尿病患者にメリットを提供する可能性がある。しかし,この方法は身体から膵島を収集する必要があり,これは拡張可能な過程ではない。また,患者の免疫系はこれらの身体細胞を異物と認識するため,拒絶反応を回避するために長期免疫抑制が必要である。最初の課題は幹細胞由来のベータ細胞を使用することで解決できる。複数のグループはすでに幹細胞由来β細胞代替製品の高級候補を臨床研究に入れたが、これらの候補製品は依然として慢性免疫抑制が必要である。
我々の遺伝子編集技術は,以下のように移植細胞を患者免疫系から保護する潜在力を提供している離体する膵臓細胞を産生するための幹細胞系内の免疫調節遺伝子を編集する。CRISPR/CAS 9の速度,特異性,多重化効率は,我々の技術をこのタスクに非常に適していると信じている.また、私たちのCRISPRプラットフォームは持続的な革新の過程を実現し、次世代候補製品に追加の編集を加え、治療効果をさらに増加させることを目的としている。CRISPR/Cas 9プラットフォームのこの機能は、私たちに多管理の製品戦略を採用しました
CTX 211
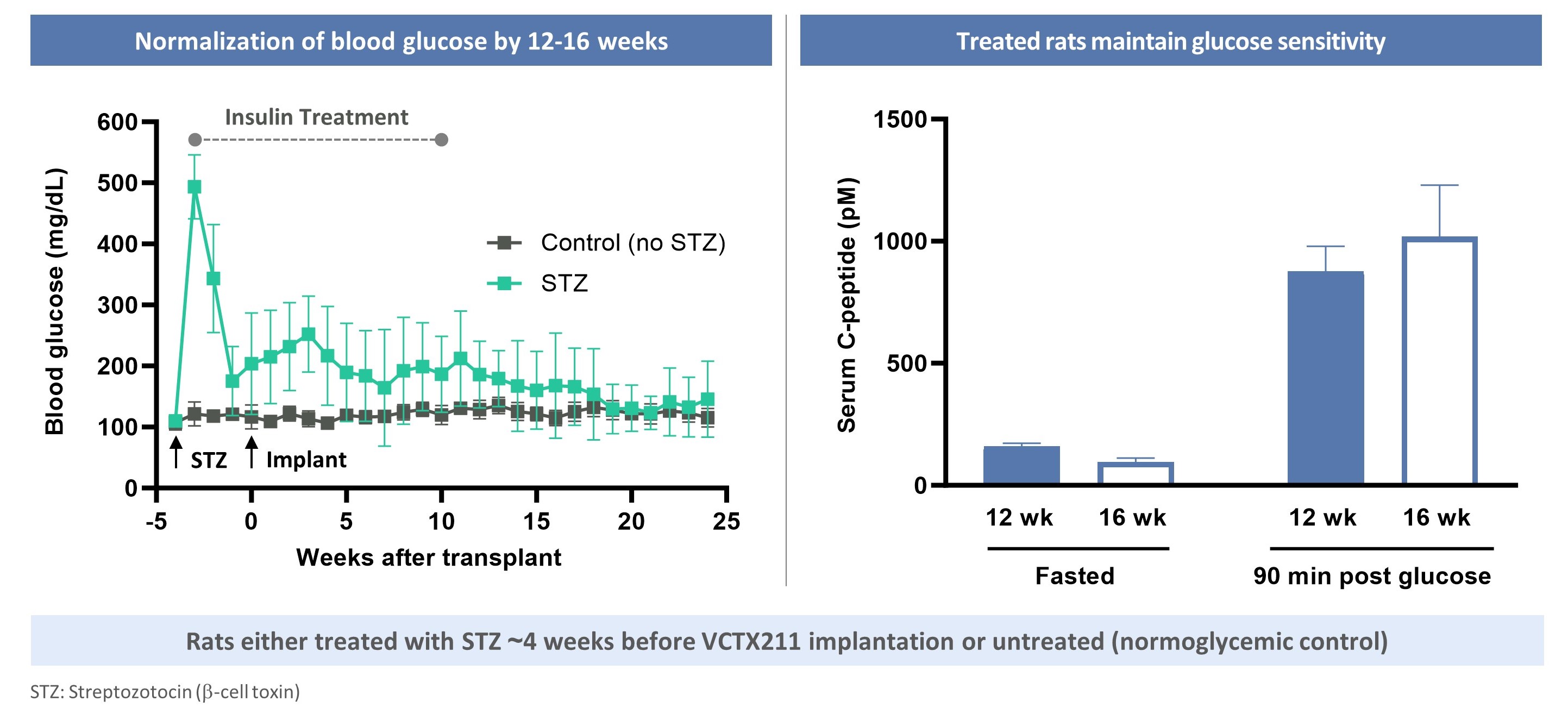
CTX 211は著者らの遺伝子編集技術をViaCyteの独自幹細胞能力に応用することによって開発された研究、異遺伝子、遺伝子編集、低免疫力、幹細胞由来のβ細胞代替療法である。CTX 211は、免疫逃避および細胞適合性を促進することを目的とした6つの遺伝子編集を含む:B 2 MおよびTXNIPのノックアウトおよびPD−L 1、HLA−E、MANFおよびA 20のノック。CTX 211は前身製品候補VCTX 210の作業から利益を得ており、VCTX 210はこのような編集を4回しか行っていない。全般的に、CTX 211の編集はβ細胞の免疫系からの逃避能力を向上させた体外培養そして体内にある臨床前モデルでは,以下のようになる。また,CTX 211は糖尿病ラットモデルの高血糖を逆転させることが証明されている。CTX 211は成人T 1 D患者におけるCTX 211の安全性、耐性および有効性を評価するための1/2期臨床試験を行っている。
16
CTX 211細胞は免疫から逃れる離体するそして生活の中で

CTX 211逆転糖尿病ラット高血糖の実験研究
CRISPR-X:遺伝子編集プラットフォームの潜在力をさらに放出します
著者らの現在のプロジェクトの組み合わせは重大な進展を得たが、著者らは革新を継続し、CRISPR遺伝子編集のすべての潜在力を放出することによって、私たちはより多くの患者に変革的な治療方法をもたらすことができることを認識した。2022年末、私たちはCRISPR-Xという新しい早期研究チームを設立し、革新研究に専念し、次世代遺伝子編集モデルを開発した。CRISPR-Xは遺伝子全体の校正と挿入を実現するために技術を開発しており、相同配向修復を必要とせず、これは多くの細胞で発生する効率が低く、DNAテンプレートのウイルス伝達も必要とせず、これは毒性リスクと技術挑戦をもたらす。これらの技術は全RNA遺伝子校正、DNAの非ウイルス伝達及び斬新な編集と挿入技術を含む。これらの努力は、gRNA選択、標的および標的外評価、多重輸送、および脂質ナノ粒子の発見のような他のコアプラットフォーム能力の補完である。
Vertexとの協力の他の計画
17
我々はすでにVertexと協力しており,Vertexはまれな疾患領域のグローバルリーダーであり,SCDやTDT以外の他のいくつかの疾患分野でも協力している。我々はすでにVertexと嚢胞性線維症(CF)とDuchenne筋ジストロフィー(DMD)に関する許可プロトコルを締結しており,Vertexはこの点で広範な専門知識を有している。また,我々は強直性筋ジストロフィー1型(DM 1)について協力合意に達しており,共同開発と共同商業化製品の選択権を保持している。われわれのCRISPR/Cas 9遺伝子編集技術はCF,DMDとDM 1の問題を解決するのに非常に適しており,これらの疾患はすべて大量の患者群があるが,医療需要は満たされていないと信じている。
杜氏筋ジストロフィー症
DMDはX連鎖劣性遺伝病であり、dystrophin遺伝子突然変異によって引き起こされ、dystrophin蛋白欠損を招く。筋ジストロフィー蛋白は筋肉繊維機能において重要な構造作用を果たしているため、筋肉細胞にこの蛋白が不足することは深刻な細胞損傷を招き、最終的に筋肉細胞の死亡と繊維化を招く。このような病気を患っている患者は筋肉退化、活動能力喪失、早死を経験する。DMDは最も一般的な深刻な遺伝病の一つであり、全世界の3300名の男児に1名がDMDを発生する。現在,米国ではいくつかの承認されたDMD治療の疾患修飾療法があり,1つはエクソン51をスキップ可能なdystrophin遺伝子変異が確認された患者,2つはエクソン53をスキップ可能なdystrophin遺伝子変異が確認された患者,もう1つはエクソン45をスキップ可能なdystrophin遺伝子変異が確認された患者である。これらの突然変異はそれぞれ約13%、8%と8%のDMD群に影響を与える。また,2023年6月,FDAはElevidys(Delandisrogene Moxeparvovec)の加速承認を許可し,微筋ジストロフィー蛋白遺伝子を持つAAV遺伝子療法であり,DMD遺伝子変異と診断された4~5歳のDMD小児患者の治療に用いられている。
強直性筋ジストロフィー1型
DM 1は常染色体遺伝病であり、非コード領域におけるCTGトリヌクレオチド反復配列の拡張によって引き起こされるDMPKジーン。この疾患は骨格筋と平滑筋、及び他の器官系、例えば眼、心臓、内分泌系と中枢神経系に影響する。DM 1の臨床所見には軽から重への連続過程がある。これらの表現型により、DM 1は軽度、経典型、先天性の3つのいくつかの重複した形式に分類される。軽度DM 1を有する患者の寿命は正常であり,通常白内障が発生し,軽微な持続性筋収縮や筋強直を経験する。典型的なDM 1を有する患者はよく筋肉無力と痩せ、筋硬直、白内障、通常心臓伝導異常があり、身体障害、寿命が短縮される可能性がある。先天性DM 1を有する患者は通常知的障害があり,通常出生時に低張力と重篤な全身性虚弱があり,呼吸不全と早期死亡を伴うことが多い。世界では約8,000人に1人がDM 1に感染している。現在のところこの潜在的疾患を治療するための治療法は承認されておらず,逆に,これまで多くの介入措置の目標はこの疾患に対する特定の症状であった。
嚢胞性線維症
嚢胞性繊維化は進行性疾患であり、嚢胞性繊維化膜貫通調節因子遺伝子突然変異によって引き起こされ、CFTR蛋白機能の喪失或いは低下を招く。CF患者は重要な臓器,特に肺,膵,胃腸に厚い粘液を産生する。そのため、慢性閉塞性肺疾患患者は慢性深刻な呼吸器感染、慢性肺部炎症、栄養吸収不良、進行性呼吸不全と早期死亡を経験する。2017年,米国でCFで死亡した年齢の中央値は31歳であり,多くの死亡原因は呼吸不全であった。 Cfは孤児疾患であり,米国やヨーロッパでは7万人を超える患者に影響を及ぼすと推定されている。Cf患者は生涯治療を受け,毎日複数の薬物を服用し,数時間の自己ケアを行う必要がある。それらは通常頻繁な入院が必要であり,肺移植さえ必要であり,生存期間を延長することができるが,治癒できない。
戦略的パートナーシップと協力
私たちは戦略的パートナーシップを私たちの戦略の核心的な構成要素と見なし、私たちの治療計画を支持する能力と資源を得ることができるようにした。我々は広範な戦略的パートナーシップを保ち,特定の疾患領域で遺伝子編集に基づく療法を開発している。
頂点.頂点
私たちは、様々な目標に関連するいくつかの研究、開発、製造、および商業化活動を考慮したVertexおよびまたはVertexの付属会社と一連のプロトコルを締結している。2015年10月以降、2017年および2019年に改訂された戦略的連携、オプションおよび許可協定、または2015年の協力協定、2021年4月に改訂され、再記述された共同開発および商業化協定、または2023年12月に改訂されたA&R Vertex JDCA、または改訂されたA&R Vertex JDCA;および2021年4月に改訂された戦略協力および許可協定、または2019年4月に改訂された協力協定が締結されている。さらに、私たちはVertexと2023年3月23日の非独占ライセンス契約または非防爆許可プロトコルを締結し、このプロトコルに基づいて、私たちのいくつかの遺伝子編集知的財産権を非独占的にVertexに許可することに同意した。
18
2015年連携協定
2015年の協力協定によると、私たちは7500万ドルの前払いと引き換えに、CRISPR/CAS技術に関連するライセンスを取得するために、Vertexに技術およびオプションを提供することに同意した。2015年、2015年の協力協定を初歩的に締結する過程で、VertexはUSに3000万ドルの株式投資も行った。
2015年のVertex協力の最初のポイントは、CRISPR/Cas 9技術を用いて、遺伝子に基づくヘモグロビン疾患および嚢胞性線維症を治療する方法を発見し、開発することである。2017年,Vertexはヘモグロビン疾患計画の共同開発と共同商業化の選択権を行使した。ヘモグロビン疾患標的に関する事項は改訂後のA&R頂点JDCAで管理されており,以下にまとめた。さらなる発見作業は特定の数の他の遺伝子標的に集中している。2015年の協力協定によると、Vertexは、私たちのいくつかのプラットフォームおよび背景知的財産権に基づいて、特定の数の協力目標に対する治療を独占的に許可する権利があり、これらの協力目標は、このような各協力目標のための治療薬を開発、製造、商業化、販売および使用するために、いくつかのプラットフォームおよび背景知的財産権の下で出現する。私たちは発見活動を担当しており、関連費用はVertexによって全額援助されている。
2019年10月,Vertexは2015年の協力協定でその残りの選択権を付与し,CRISPRに基づく遺伝子編集を用いて遺伝子による治療を開発するための他の3つの目標を独占的に許可した。これらの標的は嚢胞性繊維化膜貫通伝導調節遺伝子と2つの未開示の標的を含む。2015年の協力協定の条項によると、オプション行使に関連した3,000万ドルの前金を受け取り、4.1億ドルまでの開発、規制、ビジネスマイルストーン、および3つの目標の各目標の製品純売上高の1桁から低い特許権使用料を得ることが可能だ。マイルストーンと特許使用料支払いは、2015年の協力協定に規定されている特定の条件で減少することができる。これらの目標に対して,Vertexは独自にすべての研究,開発,製造,グローバル商業化活動を担当しており,Vertexはこれらの目標に関連する製品を世界で開発·商業化する独占的な権利を獲得している.2015年の協力協定の研究期限が満了し、Vertexは2015年の協力協定に従って追加の目標許可を得る権利を持つことができなくなった。
いずれも他方が実質的に違約した場合に2015年の協力協定を終了することができるが、特定の通知と救済条項を遵守しなければならない。便宜上、Vertexは、任意の製品が発売承認される90日前の書面通知および製品が発売承認されてから270日後の通知後に2015年の協力協定を随時終了する権利があります。Vertexが私たちのいかなる特許権に挑戦すれば、私たちはまた2015年の協力協定を終了することができる。
事前に終了しなければ、2015年の協力協定がVertexが2015年の協力合意に基づいて負担する支払い義務が満了するまで、2015年の協力協定は有効である。
共同開発協定
2017年12月にVertexとVertex JDAを締結したことにより,Vertex JDAで指定されたCASGEVYや他の候補製品の共同開発と共同商業化に同意した。2021年4月、吾らはVertexとVertex JDAの改訂及び再記述に同意し、A&R Vertex JDCAを締結することにより、双方は(A)協力の管治アーキテクチャを調整し、各当事者のこの合意下での責任を調整することに同意し、(B)双方間の純利益及び純損失の分配をCASGEVYのみで調整すること、及び(C)Vertexへの独占許可(吾等が何らかの活動を行う権利を保留する規定の下)と、この合意に基づいて研究、開発、製造及び商業化可能な指定候補製品及び製品(CASGEVYを含む)に関するいくつかの知的財産権を提供することに同意した。我々とVertexは2023年12月にA&R Vertex JDCAを修正した.
改訂されたA&R Vertex JDCAには、他にも、以下の規定が含まれている
活動を治めるそれは.私たちとVertexは、これまでに設立された連携戦略グループと、そのグループによって構築されたすべてのワーキンググループを解散し、(I)高いレベルの監視を提供するための共同監督委員会と、(Ii)そのような活動が完了するまで、フォーラムの計画、議論、および共有のための移行委員会を提供する委員会とを設立した。すべての新しい委員会はCRISPRとVertexからの同数の代表を持っている。このプロトコルは、このプロトコルの条項および条件に基づいて、Vertexは、特定の候補製品および製品(CASGEVYを含む)に関連するすべての研究、開発、製造、および商業化活動を世界的に行う権利があるが、いくつかの活動を行う権利を保持する権利があることを規定している。私たちは双方が別の合意がなければ、このような活動のいくつかの側面に観察者として参加し続け、ある程度そうするつもりだ。
財務用語それは.2021年第2四半期に、Vertex JDAの改訂と予想された取引の完了に関連して、私たちはVertexから9億ドルの前金を受け取った。また,FDAは2023年12月8日に12歳以上の血管閉塞発症を繰り返す患者の鎌状細胞病の治療にCASGEVYを承認したため,2024年第1四半期にVertexから2.0億ドルのマイルストーン支払いを得た。改訂されたA&R Vertex JDCAによると,CASGEVYを除いて,このプロトコルで指定されたすべての候補製品や製品に関する純利益と純損失(適用すれば)を我々とVertexが折半すべきである.CASGEVYだけでは、2021年7月1日現在、合意により発生した初期共有製品(すなわちCASGEVY)に関する純利益と純損失(適用すれば)は、2021年7月1日からVertexと二等分されている
19
プロトコルによる純利益と純損失(適用すれば)は40%をCRISPR,60%をVertexに割り当てる.また、このプロトコルは、CASGEVY計画上の支出が指定された金額を超えた場合に、その手配での費用シェアの一部を延期することを可能にします。2023年12月、修正案によれば、双方は、(A)第三者と達成された許可協定によって生成されたいくつかのコストを割り当てることに同意し、修正案によって規定されたイベントが発生した場合には、CRISPRがVertexに2,000万ドルの当期金を支払うべきであり、(B)場合によっては、CRISPRが合意に従って延期することを許可する費用シェアの時間およびシェアを調整することに同意する。改訂されたA&R Vertex JDCAによると,いずれの繰延金額もCASGEVY計画将来の収益性の補償としてVertexにのみ支払われ,対応金額の上限は毎年指定された最高額である.
端末.端末それは.いずれも、他方が実質的に違約した場合にプロトコルを終了することができるが、特定の通知および救済条項を遵守する必要があるか、またはVertexの場合、特定の破産、ディスククリア、または同様の状況の影響を受ける場合には、プロトコルを終了することができる。他方が任意の訴訟または訴訟に開始または参加する場合、当事者に合意に従って付与された任意の特許の有効性または実行可能性に疑問を提起する場合、いずれか一方は合意を終了することができる。Vertexも,あらかじめ書面通知を出した後にいつでもプロトコルを終了し,使いやすいようにする権利がある.
未治癒の実質的な違約により一方の当事者が合意を終了する権利がある場合には、当該当事者は合意の効力を保持することを選択することができ、その違約側は、このような未治癒の実質的な違約に関連する製品に対して選択脱退の権利を行使したとみなされ(以下に述べる)、違約側に支払われるべき使用料は所定の割合で減少する。
選択脱退権それは.いずれも候補製品の開発過程で予定された時点に達した後,プロトコル下での製品開発候補を候補ごとに選択することができる.このような選択脱退の場合、退出を選択した側は、その候補製品に関する純利益と純損失を共有しなくなり、逆に、その製品が商業化されていれば、撤退を選択した側は、その製品の純売上高から高い単一から中年までの印税を得る権利がある。
2019年連携協定
2019年6月、Vertexと2019年の協力協定に署名し、合意に基づき、VertexとDMDおよびDM 1を治療する製品を協力して開発し、商業化することに同意しました。私たちとVertexは2021年4月に2019年の協力協定を改訂しました。
“2019年連携協定”には、他にも、以下に関連する条項が含まれています
統治するそれは.私たちとVertexは、2019年の協力協定でカバーされている活動に対して高いレベルの監督と調整を提供する共同諮問委員会を設立します。
発展と商業化それは.2019年の協力協定では、Vertexは開発と商業化活動を担当し、私たちの選択に応じて、指定された行使期間内に行使し、DM 1を治療する製品を共同開発し、共同商業化することができると規定されている。
財務用語それは.2019年の協力協定の締結について、Vertexから1.75億ドルの前金を受け取りました。私たちはVertexから合計7.75億ドルまでのマイルストーン支払いを受ける資格があります。これは、予定開発とビジネスマイルストーンを実現する製品の数とタイプに依存します。私たちも低い桁から低い二桁の製品販売から印税を受ける資格があります。
共同開発と共同商業化オプションそれは.DM 1を共同開発·共同商業化して治療する製品を選択すると,VertexによるDM 1の研究開発コストの50%(50%)を精算し,このようなコストの50%(50%)を負担する。DM 1の開発および商業化活動に関連するさらなるマイルストーンまたは特許権使用料の支払いの代わりに、このような製品の販売利益の50%(50%)を獲得し、すべての損失の50%(50%)に責任を負う。
端末.端末それは.いずれも他方が実質的に違約した場合に2019年の協力協定を終了することができるが、特定の通知と救済条項を遵守しなければならない。Vertexが2019年の協調プロトコルに従ってVertexに付与された任意の特許の有効性または実行可能性に疑問を提起する任意の行動またはプログラムに開始または参加した場合、2019年の協調プロトコルを終了することもできる。Vertexはまた、私たちが破産したり、債務を返済しない場合に2019年の協力協定を終了したり、書面通知を出した後にいつでも協力協定を終了することもできます。
治癒していない重大な違約によりVertexが2019年の提携プロトコルを終了する権利がある場合、Vertexは、2019年の連携プロトコルの有効性を維持することを選択し、違約製品(S)に対して支払うべき適用特許権使用料を指定パーセント減少させることができる。
非独占許可協定
2023年3月、我々はVertexとNon-Exライセンス契約を締結し、このプロトコルによれば、私たちは、1型糖尿病、2型糖尿病、またはインスリン依存性/糖尿病を必要とするいくつかの製品を世界的に開発するために、Vertexに我々の特定の遺伝子編集知的財産権を不独占に基づいて許可することに同意する。
20
“非防爆許可協定”には、以下に関連する条項が含まれています
財務用語それは.非ex-Exライセンスの締結について、私たちはVertexから1.00億ドルの前金を受け取った。私たちはVertexから合計2.3億ドルの記念碑的支払いを得る資格があり、2023年第2四半期に実現した7000万ドルの研究マイルストーンを含む。これらのマイルストーンは、許可知的財産権を利用したある製品の予め定められた研究、開発と商業マイルストーンの成果に依存する。いくつかの製品の販売から中央値までの等級版税を得る資格があります。非防爆許可プロトコルの終了または満了の場合、一部の製品の販売等級版税は中央値以下に維持され続ける。
端末.端末それは.いずれも他方の重大な違約時に非実行許可プロトコルを終了することができるが,特定の通知と救済条項を遵守しなければならない.Vertexが、非Exライセンスプロトコルに従ってVertexに付与された任意の特許の有効性または実行可能性に疑問を提起する任意の行動またはプログラムに開始または参加する場合、非Exライセンスプロトコルを終了することもできる。Vertexはまた、私たちが破産または債務非償還時に非実行許可プロトコルを終了することができ、または便宜上、書面通知を出した後、いくつかのマイルストーンイベントまたは特定の期間の以前に実現されたときに非実行許可プロトコルを終了することができる。
バイエル
2019年12月、私たちはバイエルとCRISPR/Cas 9遺伝子編集療法を発見、開発し、それを商業化し、ある疾患の遺伝的原因を治療するために、バイエルとの合弁企業を終了したオプション協定、すなわち2019年オプション協定を締結した。2019年オプション協定によれば、バイエルは、いくつかの自己免疫疾患、眼疾患、または血友病A疾患の診断、治療または予防のための2つの製品を共同開発および共同商業化するために、(将来のイベント定義の特定のトレーニング期間内に行使することができるが、いずれの場合も2019年オプション協定の発効日後5年を超えてはならない)オプションを獲得した。もしバイエルが共同開発と共同商業化製品を選択すれば、双方はその製品について交渉し、共同開発と共同商業化合意、あるいは共同商業化協定を達成することになり、バイエルは私たちが将来その製品のために発生する研究開発コストの50%を負担する。バイエルはこのような製品の販売からすべての利益の50%を獲得し、すべての損失の50%に責任を負う。
バイエルが共同開発と共同商業化製品の選択権を行使することを選択した場合、バイエルは私たちに2000万ドル、またはオプション支払いを一度に支払い、双方がオプション製品に関する共同商業化協定に署名すると、このお金は返却できないだろう。2019年のオプション合意に基づき、バイエルが初めてオプションを行使して1回のオプション支払いのみを支払います。
さらに、バイエルがオプション製品に対してその選択権を行使し、および/または共同商業化協定に署名した後、共通商業化協定の発効日から発効日までの3ヶ月の周年日または共同商業化協定の90日間の交渉過程において、より早い者を基準とした期間内に、バイエルは、そのオプション製品の開発と商業化の独占的許可について交渉する権利がある。バイエルがその権利を行使する場合、双方は双方が同意した条項に従ってそのオプション製品について独占許可協定を締結する。また、当該等のオプション製品について支払われるオプション支払いは、当該等の独占許可又は2019年オプション協定と締結された任意の他の独占ライセンスに基づいて満期になって支払われる金額に計上される。
いずれも他方が実質的に違約した場合に2019年オプション合意を終了することができるが、特定の通知と救済条項を遵守しなければならない。バイエルが任意のCRISPR特許の有効性または実行可能性に疑問を提起する行動または訴訟に開始または参加する場合、2019年オプション協定を終了することもでき、この特許は、2019年オプション協定のテーマである製品の研究、開発、製造、または商業化に必要または有用である。バイエルは、私たちが破産したり、債務を返済しない場合に2019年のオプション合意を終了したり、便宜上、書面で通知した後に随時終了したりすることもできます。
以上,我々の戦略プロトコルの記述はすべてこのようなプロトコルの全文に基づいて保持されており,これらのプロトコルのコピーは本年度報告の証拠品として10-K表形式でアーカイブされている.
知的財産権
私たちは、私たちの遺伝子編集技術および既存および計画における治療計画をカバーする特許権利(内部開発でも第三者から許可されていても)を求め、維持し、守り、守ることによって、私たちの業務に重要なビジネス的意義を持つと考えられるノウハウ、発明、ノウハウ、および改善を保護し、強化するために努力している。私たちはまた、私たちの業務において特許保護から保護されているか、または特許保護に適していないと考えている態様を保護し、持続的な技術革新と許可内の機会を求めて、遺伝子編集分野における当社の独自の地位を発展、強化、維持するために、ビジネス秘密保護および秘密保護協定に依存して、私たちのノウハウを保護しています。また,孤児薬物指定,データ独占性,市場独占性,特許期間延長(関連する場合)によって得られる商標保護,著作権保護,規制保護にも依存している。私たちの成功は私たちが獲得したことに大きくかかっています
21
そして、私たちの技術の特許および他の固有の保護、私たちの知的財産権を擁護し実行する能力、および効果的かつ実行可能な特許および第三者の固有の権利を侵害することなく運営する能力を維持します。私たちはまた、私たちの場所の物理的セキュリティと、私たちの情報システムの物理的および電子的セキュリティを維持することによって、私たちのデータ、ノウハウ、およびビジネス秘密の完全性およびセキュリティを保護します。
Charpentier博士からの権限内知的財産権
2014年4月、私たちは、Charpentier博士との独占的な許可に基づいて、我々の遺伝子編集プラットフォーム技術の様々な態様、例えば、物質の組成(例えば、CRISPR/Cas 9システム)およびCRISPR/Cas 9システムを使用した遺伝子編集を含む使用方法を含むグローバル特許との組み合わせのいくつかの権利を付与した。この世界的な特許の組み合わせを“特許組合せ”と呼ぶ.例えば、これまで、この特許の組み合わせは、米国、イギリスまたはイギリス、カナダ、ヨーロッパ(ドイツ、フランス、イタリアを含む)、日本、中国、インド、ウクライナ、ニュージーランド、シンガポール、オーストラリア、メキシコ、香港、イスラエル、フィリピン、南アフリカで付与または許可された100以上の特許と、米国、ヨーロッパ、カナダ、メキシコ、オーストラリアおよび中米、南アメリカ、アジアおよびアフリカの他の選択された国で処理されている特許出願とを含む。本ライセンスは、医薬品および生物学的製品、ならびに任意の関連する随伴診断のようなヒト疾患、障害または状態を治療または予防するための治療製品に限定される。本ライセンスの詳細については、ご参照くださいビジネスライセンス契約−Dr.CharpentierとのCRISPRライセンスの締結.”
チャペンティエ博士に加えて、特許組合は、カリフォルニア大学、カリフォルニア大学、ウィーン大学、またはウィーン大学に自分の権利を譲渡する発明者をリストしている。カリフォルニアの権利は、ハワード·ヒューズ医学研究所とアメリカ政府を含む、その研究スポンサーのいくつかの圧倒的な義務に支配されている。トナカイ生物科学社は,カリフォルニア州とウィーンの独占特許権を有しているが,非営利エンティティが研究や教育目的に発明を利用することを可能にする権利を保持していると報告している。Intellia治療会社またはIntellia治療会社は、Cariouのある分野でのこのような権利の独占的ライセンスを持っていると報告している。カリフォルニア州のCharpentier博士とウィーンのCVC Groupを総称して“CVC Group”と呼ぶ.私たちは準訴訟の影響を受けています各方面間米国特許商標局,欧州特許庁およびオーストラリア,日本,中国,インドの特許庁は特許組合の行政訴訟に関連している。これらの訴訟のリスクに関するより多くの情報は、参照されたい“リスク要因−知的財産権に関するリスク−.”
2016年12月15日、私たちはカリフォルニア州ウィーンのCharpentier博士、Intellia Treeutics、Cariou、ERSゲノム有限会社、および私たちの完全子会社TRACR血液学有限会社(TRACR)と譲渡、許可、共同所有権、および発明管理協定(IMA)を締結した。IMAによると、カリフォルニア州とウィーンはCharpentier博士が米国と世界的な範囲で私たち、TRACR、およびERSにCRISPR/Cas 9知的財産権を付与する権利に基づいてCharpentier博士に追跡的に同意する。IMAはまた、共同所有者による我々、TRACRおよび他の被許可者に付与された再許可の遡及同意、彼らが将来付与される可能性のある再許可の予想同意、ある当事者の以前の譲渡の遡及承認、および他の事項に加えて、(I)特許維持、弁護および起訴における当事者の誠実な協力、(Ii)コスト分担スケジュール、および(Iii)第三者主題特許およびCRISPR/CAS 9知的財産権のいくつかの不利なクレーム者が発生した場合の通知および調整を規定する。双方の当事者が事前に終了しない限り、IMAは、遺伝子編集技術に基づく特許の最終期限または最後の基本特許出願が放棄された日の遅い日まで有効になり続けるであろう。米国や世界の他の管轄地域における共同所有権の影響に関するさらなる情報は、“を参照されたい”リスク要因—私たちのコア遺伝子編集技術を保護する知的財産権は共通して所有されていますが、私たちの許可証はその中の一人の共通の所有者だけから来ています。これはアメリカと他の管轄地域での私たちの権利を深刻に制限しています.”
CRISPRが持つ知的財産権
特許の組み合わせに加えて、多くの特許シリーズが含まれており、多層保護を提供することを目的としたCRISPR/Cas 9技術と開発計画の重要な側面をカバーしている幅広い知的財産権を持っている。これらの特許シリーズは、我々の開発計画(例えば、物質の組成、使用方法、製造プロセス、用量および処方)、遺伝子編集におけるCRISPR/CAS 9システムの使用および改善(例えば、ヌクレアーゼおよび単一または修飾gRNAを含む成分系の改善)、タンパク質/核酸複合体およびRNAを細胞に供給する技術(例えば、改善されたウイルスベクターシステムおよび自己不活化システム)、および幹細胞ベースの治療に関連する技術を含む。
全体的に、私たちの知的財産権には、米国、中国、ヨーロッパ、南アフリカの100以上の有効特許家族および60件以上の付与または許可された特許と、米国、ヨーロッパ、オーストラリア、カナダ、中国、日本、メキシコおよび中米、南米、中東、アジア、アフリカの他の選択された国で出願されている特許が含まれている。これらの特許ファミリーによって付与された特許および最終的に発行可能な任意の他の特許は、適用可能な特許期間の延長を含まずに2033年から満了する予定である。
米国における私たちの商標財産権は、CRISPR Treateutics、CTX 112、CTX 131、CTX 211、CTX 310、CTX 320およびCTX 330、およびCRISPR TreeuticsおよびCRISPR Treateuticsのロゴを含む7つの米国登録など、20(20)件の係属中の出願を含む。われわれの国際商標権は複数の未解決のものからなる
22
ドイツおよびスイスのCRISPR治療会社標準文字マークの係属中の出願、およびビホロ、イタリア、スペインおよびイギリスでの登録を含む出願および登録。CRISPR治療会社のロゴについては、カナダ、ドイツ、韓国、スイスで申請を待っています。ビホロ、ブラジル、香港、イタリア、日本、メキシコ、シンガポール、南アフリカ、スペイン、イギリスでも登録申請があります。私たちはすでにEU、スイス、そしてイギリスにCTX 112を登録した。私たちはすでにEU、スイス、そしてイギリスにCTX 131を登録した。私たちはスイスにCTX 310を登録した。オーストラリアとニュージーランドでCTX 320の申請を待っていて、スイスでCTX 320を登録しています。私たちはスイスにCTX 330を登録した。
特許譲渡協定
2014年11月,Charpentier博士,Ines Fonfara博士,ウィーンと特許譲渡協定である特許譲渡協定を締結した。特許譲渡プロトコルによれば、Charpentier博士、Fonfara博士、およびウィーンは、標的DNAまたは切断DNAにおけるそれらの使用を含む、追加のCRISPR/TRACR/Cas 9錯体および使用方法を含む、特定の物質組成に関連する一連の特許出願のすべての権利を私たちに譲渡する。
私たちに割り当てられた特許権の対価格として、前金の支払い、別の国での米国研究新薬申請または同様の出願の提出からのマイルストーン支払い、最低年間特許権使用料、その製造、使用、販売、または輸入特許権によってカバーされる製品の純販売から、より低い1桁の特許権使用料、およびより低い1桁のパーセントの許可収入を徴収することに同意する。
私たちは、譲渡特許権によって保護された製品を製造、使用、販売、または輸入するために、商業的に合理的な努力で規制部門の承認を得る義務がある。
許可協定
Charpentier博士にCRISPRライセンスを発行します
2014年4月、私たちは私たちの共同創始者の一人であるCharpentier博士と許可協定またはCharpentier許可協定を締結し、特許組み合わせにおけるCharpentier博士の共同所有権権益に基づいて、薬物や生物製剤などの治療製品を研究、開発、商業化することができ、任意の関連する随伴診断を使用して、ヒト疾患、疾患または疾患の治療または予防に使用することができる独占的な許可を得たが、私たちはこれをCRISPR領域と呼ぶ。この許可は独占的であり,チャペンティエ博士に対しても同様であり,ただ彼女は譲渡不可能な権利を保持しており,その技術を自分の研究目的に利用し,学術や非営利パートナーと研究協力することができる。独占許可はCharpentier博士が特許出願中の利益の下でのみ付与され,独占許可はいかなる他の共通所有者の利益の下でも付与されない。さらに、Charpentier許可プロトコルは、CRISPR分野に関連する治療製品を研究、開発、生産、商業化および販売するための再許可を含む再許可の権利を、TRACRがDr.Charpentierとの許可に基づいて開発する任意の知的財産権を含む、我々が独占的に、世界的に免除する再許可を付与する。逆に,Charpentier博士に独占的な許可を与え,Charpentier博士の許可に基づいて開発した任意の知的財産権をTRACRに再許可し,鎌状細胞疾患や地中海貧血に限定されないヒトのヘモグロビン疾患の治療·予防に用いることが義務付けられている。
Charpentierライセンス契約の条項によると,許可の代償として,Charpentier博士は技術譲渡費,非実質的な年間維持費,臨床試験開始後に満期となる非実質的マイルストーン支払い,特許製品の純売上高の低い桁数パーセントの特許権使用料および再許可収入の低い桁数パーセントの特許権使用料を受け取った。私たちは、許可された治療製品を販売するために、商業的に合理的な努力を使用して規制部門の承認を得る義務がある。2024年4月までにCRISPR分野の治療製品のために米国研究用新薬申請(または主要市場国での同等の申請)を提出するために、商業的に合理的な努力をしなければならない。
事前に終了しない限り、特許者許可協定の有効期間は、各国に基づいて満了する、すなわち、その国の特許組み合わせの最後の有効な特許請求の満了時に満了する。私たちはCharpentier博士に60日間の書面通知を出した後、任意に合意を終了する権利がある。我々とCharpentier博士は,他方が90日の通知期間内に是正されなかった重大な違約であれば,90日間通知された場合にプロトコルを終了することができる.もし私たちが任意の特許の組合せの実行可能性、有効性、または範囲に疑問を提起すれば、Charpentier博士は直ちに許可プロトコルを終了することができる。
Charpentier博士が発行したTRACRライセンス
2014年4月,我々はCharpentier博士とライセンス契約を締結するとともに,TRACRとTracrの少数株主Charpentier博士は特許の組合せに基づいてライセンス契約やTRACRライセンス契約を締結した.TRACR許可プロトコルによれば、TRACRは、ヒトヘモグロビン疾患(鎌状細胞病および地中海貧血を含む)またはTRACR領域の治療および診断製品の治療および予防のための再許可の権利を含む独占的でグローバルな使用料許可を取得する。TRACRはまた、内部薬物研究を展開するために、再許可の権利を含む非独占的、世界的、免版税の許可を得ている
23
TRACR分野以外の治療製品と、TRACR分野に関連する治療製品を再許可、研究、開発、生産、商業化および販売する権利を含むグローバル範囲での、印税免除の再許可を含み、これらの製品は、CRISPRがCharpentier博士との許可の下で開発した任意の知的財産権を含む。逆に,TRACRはCharpentier博士に独占許可を付与し,TRACRとCharpentier博士が許可に基づいて開発した任意の知的財産権をCRISPRに再許可し,CRISPR分野に用いる.
ライセンスプロトコルによれば、TRACRは、ヒト疾患の予防または治療のための少なくとも1つの治療製品を研究、開発および商業化するために、商業的に合理的な努力を使用する義務がある。TRACRは,2024年4月までに商業的に合理的な努力でTRACR領域の治療製品に米国研究用新薬申請(あるいは主要市場国の同等申請)を提出しなければならない。TRACRは独自にすべての臨床、規制、開発コストを負担している。
TRACR許可プロトコルによると、Charpentier博士はTRACRの商業化された各製品の非実質的な臨床と規制マイルストーン支払いを得る権利がある。TRACRはまた、その付属会社、またはその分ライセンシーによって製造された任意の承認された治療または診断製品の純売上の低桁パーセント印税、および従属許可収入の低桁パーセント印税をDr.Charpentierに支払うことを要求される。
事前に終了しない限り、ライセンス契約の期限は、各国/地域に基づいて満了し、その国/地域の特許組み合わせの最後の有効な権利要件が満了した時点で満了する。TRACRはCharpentier博士に60日間の書面通知を出した後,任意にプロトコルを終了する権利がある.TRACRおよびDr.Charpentierは、他方が90日の通知期間中に治癒する重大な違約行為がない場合、90日間通知された場合にプロトコルを終了することができる。TRACRが任意の特許権の実行可能性,有効性または範囲に疑問を提起すれば,Charpentier博士はただちに許可プロトコルを終了することができる.
技術を発揮する
私たちはまた他の多くの協力と許可協定を締結して、私たちのことを支持して補充します離体するそして体内にあるCRISPR/CAS 9を提供する技術を提供することに関連するプロトコルを含む態様離体するそして体内にある造血幹細胞や体内にあるHIVの遺伝子編集療法を推進するための2つの寄付と、私たちの免疫腫瘍学と再生医学細胞治療計画とプラットフォームを強化することを計画している。例えば,我々はNkartaと,ドナー由来の遺伝子編集されたCAR−NK細胞を利用した製品を開発して商業化することを合意しており,Capsida BioTreateutics,Inc.が開発される体内にある工学AAVベクターによる遺伝子編集療法;ロスウェル公園総合癌センターが新しい標的に対して遺伝子編集を推進する自己CARプログラム;MaxCyte,Inc離体するヘモグロビン病と免疫腫瘍学プロジェクトにサービスを提供していますCureVac AGは特定の遺伝子構造と製造を最適化しています体内にあるKSQ Treeutics Inc.は著者らの同種異体免疫腫瘍学計画に知的財産権を提供する。
製造業
細胞や遺伝子療法の製造プロセスは複雑であり,プロジェクトや療法ごとにシステム,設備,施設,専門知識をカスタマイズする必要がある。高品質製造および生産タイミングと技術の制御が重要であるため,我々は内部製造能力を構築し,変革性の遺伝子薬による重篤な疾患を有する患者のための治療と治療方法を開発するための独自の細胞治療製造施設を構築している。
私たちはマサチューセッツ州フレミンガムに約50,000平方フィートの製造工場を持っていて、私たちのいくつかの計画を満たすために、私たちの候補製品とそのいくつかのコンポーネントを臨床と商業生産するために使用されています。この施設の設計は,我々の製品ラインの製造と供給に適応するために柔軟性とスケーラビリティを考慮している.私たちは、それは私たちの現在のいくつかの臨床プロジェクトの製品製造と供給を全部または部分的に支持する能力があり、潜在的な商業供給を支援するために規模を拡大する能力があると信じている。さらに、私たちの施設には、私たちの将来推進可能な他の計画(私たちのいくつかを含む)を支援する能力と必要な技術があると信じています体内にある計画および私たちのT 1 D計画)、およびメッセンジャーリボ核酸のような様々な交付方法の生産は、将来的に使用されるかもしれない。我々のこの工場での運営は現在の良好な製造規範(CGMP)に適合し、2023年にこの工場でCTX 112とCTX 131を生産し、これらの候補製品の臨床試験に用いられた。
我々の内部製造施設を利用するほか,米国と海外での契約製造組織関係による外部製造能力に依存し続ける予定である。私たちはすでに第三者サプライヤーといくつかの製造と供給手配を達成して、私たちの候補製品とその部品の生産を支持しています。著者らは引き続き合格した第三者組織に依存してバルク化合物、配合化合物、ウイルスベクター或いは工学細胞を生産或いは加工し、IND活動と早期臨床試験を支持する予定である。開発された任意の化合物、担体、または工学細胞の商業的ロットが、FDAおよび他の法規に適合する施設およびプロセスで生産されることが予想される。製品開発過程の適切な時間に、私たち自身の製造施設を利用するか、引き続き第三者に依存して、私たちが開発に成功する可能性のある任意の製品の商業ロットを生産するかを決定します。
24
マサチューセッツ州フレミンガムでの私たちの製造能力に大きな投資を行い、第三者組織と協力してこれらのプログラムを推進し、将来的に商業化するために、私たちの遺伝子編集プログラムを開発することを期待し続けています。
また、候補製品が私たちのチャンネルで進展するにつれて、私たちのビジネス計画は変わるかもしれません。特に,我々のいくつかの研究計画は潜在的なより大きな適応を対象としている。データ,開発計画の規模,目標市場の規模,商業インフラの規模および製造需要は,米国,ヨーロッパ,世界の他の地域における我々の戦略に影響を与える可能性がある。アメリカやヨーロッパ以外の地域では、適切な状況で、将来的には、戦略的パートナー、流通業者、または契約販売力を利用して、私たちの製品の商業化を助けることを選択するかもしれません。場合によっては、私たちは私たち自身の商業インフラを建設することを考慮することができる。
競争
生物技術と製薬業界は、遺伝子編集、遺伝子治療と細胞治療領域を含み、その特徴は技術が迅速に進歩し、競争が激しく、そして知的財産権と独自製品を高度に重視していることである。私たちの技術、開発経験、科学知識は私たちに競争優位を提供してくれると信じていますが、私たちは現在、大型製薬、専門製薬とバイオテクノロジー会社、学術機関と政府機関、および公共および民間研究機関を含む多くの異なる源からの激しい競争に直面し、引き続き直面しています。その中のいくつかまたはすべての機関は私たちよりも資本や資源を獲得しやすいかもしれません。我々が最終的に商業化する可能性のある任意の製品については,任意の既存の療法や現在開発されている療法と競合するだけでなく,将来出現する可能性のある新しい療法とも競合するであろう。
我々は製薬,バイオテクノロジー,その他の関連市場で競争を展開しており,これらの市場では遺伝子編集,遺伝子療法,細胞療法を含むゲノム薬物をカバーする技術を用いて療法を創造している。また,我々の特定の研究開発計画に関連する分野で治療法の開発に取り組んでいる会社と競争している。
我々のプラットフォームと製品はCRISPR/Cas 9遺伝子編集技術を用いた療法の開発に重点を置いている。Intellia治療会社やEditas Medicine社を含むCRISPR/Cas 9遺伝子編集技術を用いた様々な適応の治療法の開発に専念している会社がいくつか知られている。また,いくつかの学術グループでは,CRISPR/Cas 9に基づく新しい遺伝子編集技術,例えば塩基編集やモチーフ編集が開発されており,これらの技術は治療開発において実用的な価値がある可能性がある。これらの技術に基づく療法の開発を求めている会社には,Beam TreateuticsとPrime Medicineがある。
TALEN、マクロヌクレアーゼ、ZFNなどの追加の遺伝子編集技術を用いて療法を開発している会社もある。これらの会社は270の生物会社、異遺伝子治療会社、Cellectis社、精密生物科学会社、Sangamo治療会社を含む。
いくつかの会社が我々の具体的な研究開発計画に関連した様々な分野で療法を開発していることも知られている。ヘモグロビン疾患では,これらの会社にはビム治療会社,ブルーバード生物会社,Editas Medicine社,メルク社,ノワ製薬会社,ファイザー社がある。免疫腫瘍学では,これらの会社は270生物会社,アディケイト生物会社,異遺伝子治療会社,百時美施貴宝社,Cariou生物科学社,Cellectis社,世紀治療会社,運命治療会社,ギレード科学会社,伝説的生物会社,ノワ製薬会社,ポセイダ治療会社を含む。再生医学分野では,これらの会社にはBluerock Treateutics(2019年にバイエルに買収された),Sana Biotech,Semma Treateutics(2019年にVertexに買収)が含まれている。はい体内にあるこれらの会社にはAlnylam製薬会社,矢印製薬会社,BioMarin製薬会社,Intellia治療会社,Ionis製薬会社,Regeneron製薬会社,Verve治療会社がある。遺伝子編集は非常に活発な研究分野であり、CRISPRに関連したり、関係のない新しい技術が発見され、新しい競争が生じる可能性がある。これらの新技術はいくつかの応用においてCRISPR/Cas 9遺伝子編集よりも優れている可能性があり、他の遺伝子編集技術が製品開発において我々の技術よりも良いあるいは魅力的であるとは考えられないことは確信できない。例えば、Cas 9は、Cas 12 aまたはまだ発見されていない新規なCas酵素、または塩基エディタおよび一次エディタのような他のCRISPRタンパク質に劣る他のCRISPR関連ヌクレアーゼ変異体を決定することができる。
遺伝子編集は非常に活発な研究分野であり、CRISPRに関連したり、関係のない新しい技術が発見され、新しい競争が生じる可能性がある。これらの新技術はいくつかの応用においてCRISPR/Cas 9遺伝子編集よりも優れている可能性があり、他の遺伝子編集技術が製品開発において我々の技術よりも良いあるいは魅力的であるとは考えられないことは確信できない。例えば、Cas 9は、Cas 12 aまたはまだ発見されていない新規なCas酵素、または塩基エディタおよび一次エディタのような他のCRISPRタンパク質に劣る他のCRISPR関連ヌクレアーゼ変異体を決定することができる。
他の遺伝子編集療法または遺伝子または細胞療法からの競合に加えて、我々が開発する可能性のある任意の製品は、小分子、抗体またはタンパク質療法のような他のタイプの療法からの競合に直面する可能性もある。また,新たな科学的発見はCRISPR/Cas 9技術,あるいは全体的な遺伝子編集を招く可能性があり,劣悪な治療形態と考えられている。
また、私たちの多くの既存または潜在的な競争相手は、単独またはパートナーと協力しても、研究開発、製造、臨床前テスト、臨床試験、監督管理許可およびマーケティング承認を得た製品の面で、私たちよりも多くの財務資源と専門知識を持っている。医療業界のM&Aは
25
生物技術、遺伝子、そして細胞治療産業は私たちの少数の競争相手にもっと多くの資源を集中させるかもしれない。規模が小さいかスタートアップ段階にある会社も重要な競争相手になる可能性があり、特に大手や成熟会社との協力で手配する。これらの競争相手はまた、合格した科学と管理者を募集と維持し、臨床試験場と臨床試験の患者登録を確立し、そして私たちの計画と相補的或いは必要な技術を獲得する上で私たちと競争している。もし私たちの競争相手が私たちが開発する可能性のあるどんな製品よりも安全で、より効果的で、副作用が少なく、より深刻ではなく、より便利で、より広い受容度とより高い販売率を開発し、あるいは私たちが開発する可能性のあるどの製品よりも安い製品であれば、私たちのビジネス機会は減少または消失するかもしれない。私たちの競争相手も私たちよりも早くFDAや他の規制機関のその製品の承認を得ることができ、これは私たちの競争相手が私たちが市場に入る前に強力な市場地位を確立することをもたらすかもしれない。また、私たちの競争相手が開発した技術は、私たちの潜在的な候補製品を経済的あるいは時代遅れにする可能性があり、私たちは私たちが開発する可能性のあるいかなる競争相手の候補製品もうまくマーケティングできないかもしれません。私たちのすべての計画の成功に影響を与える重要な競争要素は、それらの有効性、安全性、利便性、精算の利用可能性である可能性がある。
私たちの現在のプロジェクトが現在計画されている臨床試験の適応に使用されていれば、遺伝子編集、遺伝子治療、細胞治療製品を含む現在開発されている他の製品と競争する可能性がある。現在開発中の他の関連製品との競争には,臨床試験地点,患者募集,製品販売の競争が含まれている可能性がある。また,遺伝子編集分野では緊張した研究や開発が行われているため,我々と我々のライバルを含めて知的財産権の構造が変化しており,競争は非常に激しい.将来的には知的財産権に関する重大な訴訟や、私たちが所有しているものや許可されていない他の第三者、知的財産権、独自の権利に関する訴訟があるかもしれない。例えば、048干渉、115干渉、および欧州野党手続きの議論を参照されたいリスク要因-知的財産権に関連するリスク-第三者が私たち、私たちのライセンシー、または私たちの協力者に提出した知的財産権侵害クレームは、私たちの製品発見と開発を阻害または延期する可能性があります。”
さらに、私たちの特許権の満期または成功の挑戦により、私たちの競争相手の製品に関連する特許の有効性および/または範囲に関するより多くの訴訟に直面する可能性があり、私たちの特許は、競争相手が競合製品を商業化することを阻止するのに十分ではないかもしれません。私たちの競争相手の製品供給は、私たちが開発し商業化する可能性のある任意の製品の需要と私たちが受け取ることができる価格を制限するかもしれません。
政府の監督管理
アメリカ連邦、州と地方の各レベル及びEUを含む他の国と司法管轄区の政府当局は他の事項を除いて、薬品の研究、開発、テスト、製造、品質管理、承認、包装、貯蔵、記録、ラベル、広告、販売促進、流通、マーケティング、承認後のモニタリングと報告及び生物製品を含む薬品の輸出入に対して広範な監督管理を行っている。アメリカ以外のいくつかの管轄区域でもこのような製品の価格設定が規制されている。米国や他の国や司法管轄区で上場承認を得る過程、その後適用される法規や法規、その他の規制機関の遵守には、多大な時間と財力が必要である。
アメリカの生物製品の許可と規制
米国では,公衆衛生サービス法(PHSA)や連邦食品,薬品·化粧品法(FDCA)とその実施条例に基づき,我々の候補製品は生物製品や生物製品として規制されている。製品開発プロセスのいずれかにおいて、非臨床試験、臨床試験、承認プロセスまたは承認後プロセスを含み、出願人が適用される米国の要求を遵守できない場合、研究の進行、規制審査および承認、および/または行政または司法制裁を遅延させる可能性がある。これらの制裁には、FDAが臨床試験の継続を許可することを拒否すること、係属中の出願の承認の拒否、免許の取り消しまたは免許の取り消し、承認の撤回、命名されていないまたは警告状、負の宣伝、製品のリコール、製品の差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金、およびFDAまたは司法省または他の政府エンティティによって提起された民事または刑事調査および処罰を含むことができるが、これらに限定されない。
米国での新生物の販売と流通の承認を求める申請者は、通常、以下の各ステップを満足的に達成しなければならない
26
臨床前研究と探索性新薬応用
遺伝子治療候補製品を含む人体上で任意の生物候補製品をテストする前に、候補製品は臨床前テストを経なければならない。臨床前試験は製品の化学、調合と安定性の実験室評価、及び動物の治療効果と毒性潜在力の評価研究を含む。臨床前試験の進行と試験に用いる化合物調合は必ず連邦法規と要求に符合しなければならない。臨床前試験の結果および生産情報と分析データはIND申請の一部としてFDAに提出された。INDはFDAが受け取った30日後に自動的に発効し、それ以前にFDAが臨床試験の提案された製品または行為に対する懸念または問題に基づいていない限り、人類の研究対象が不合理かつ重大な健康リスクに直面することを心配して臨床保留を強制することを含む。この場合,INDスポンサーやFDAは臨床試験開始前にFDAの未解決の問題を解決しなければならない。
したがって、INDの提出は、FDAが試験開始を許可しないか、または試験を許可しないことをもたらす可能性があり、INDにおいてスポンサーが最初に指定した条項に従って開始することができる。FDAが最初の30日以内に、またはIND研究が行われている間のいつでも安全懸念または問題を提起した場合、安全懸念または規定を遵守しないことによる懸念を含む場合、一部またはすべての臨床的保留が実施される可能性がある。FDAが発表したこの命令は、提案された臨床研究を延期したり、進行中の研究の一時停止を招いたり、すべての未解決の問題が十分に解決されるまで、一部の臨床的に保留されている場合に研究を制限することができ、FDAは、調査を継続または再開することができるが、FDAによって許可された条項にのみ従うことができるように会社に通知する。これは計画中の臨床研究の適時な完成の重大な遅延や困難を招く可能性がある。
血中乳酸を支持するヒト臨床試験
臨床試験はGCP要求に基づいて、合格した首席研究者の監督の下で、研究製品候補を健康ボランティア或いは疾病患者に治療することに関連している。臨床試験は研究案に基づいて行われ,その中で研究の目標,組み入れと排除基準,安全性モニタリングのためのパラメータおよび評価すべき有効性基準が詳細に説明されている。各臨床試験の案と後続案修正案はINDの一部としてFDAに提出されなければならない。
米国国外での臨床試験のスポンサーが望ましいが,必要なくFDAの認可を得,INDによる臨床試験を行っている。米国でない臨床試験がINDに基づいて行われていなければ,スポンサーは設計と良好に行われた臨床試験のデータをFDAに提出し,BLAを支援することができ,臨床試験がGCPに従って行われていれば,FDAが現場検査で検証研究のデータを検証できる限り,FDAが必要であると考えている。
また,各臨床試験は,臨床試験を行う各機関のIRBが集中的または単独で審査·承認されなければならない。IRBは臨床試験設計,被験者のインフォームドコンセント,倫理的要因,被験者の安全などを考慮する。IRBの運営はFDAの規定に適合しなければならない。FDAまたは臨床試験スポンサーは、臨床試験がFDAの要求に従って行われていないこと、または被験者または患者が受け入れられない健康リスクに直面していることを発見することを含む、様々な理由で臨床試験を随時一時停止または終了することができる。
27
同様に、1つの臨床試験が委員会の要求に従って行われない場合、または薬剤が患者に予期せぬ深刻な傷害を与えた場合、IRBは、その所在機関の臨床試験の承認を一時停止または終了することができる。臨床検査はまた広範なGCP規則とインフォームドコンセントの要求を満たさなければならない。さらに、いくつかの臨床試験は、データ安全監視委員会または委員会と呼ばれる臨床試験スポンサーによって組織された独立した合格専門家グループによって監督される。このグループは,計画的に研究を継続し,研究進行を変更したり,研究のあるデータへのアクセスに応じて,指定されたチェックポイントで研究を停止することを提案することができる.
米国で臨床試験が開始される前にFDAにINDを提出するほか,組換えや核酸分子の合成に関連するヒト臨床試験のいくつかは機関生物安全委員会(IBCs)の監督を受けなければならないことはNIHガイドライン“組換えあるいは核酸分子の合成に関する研究ガイドライン”に掲載されている。米国国立衛生研究院のガイドラインによれば、組換えおよび合成核酸は、(1)核酸分子が結合して生細胞中で複製可能な分子(すなわち、組換え核酸)、(2)化学的または他の方法で合成または増幅された核酸分子、または化学的または他の方法で修飾されたが自然に産生される核酸分子(すなわち、合成核酸)塩基対を含む分子、または(3)第(1)または(2)項に記載の分子を複製する分子を含む、と定義されている。具体的には,NIHのガイドラインによると,ヒト遺伝子転移試験の監督にはIBCによる評価と評価があり,IBCは地方機関委員会であり,組換えや合成核酸分子を用いた研究の審査·監督を担当している。IBCは、研究の安全性を評価し、公衆の健康または環境に対する任意の潜在的リスクを決定し、このような審査は、臨床試験開始前のいくつかの遅延をもたらす可能性がある。NIHガイドラインは強制的ではないが,関連研究がNIH組換えや合成核酸分子研究助成を受けた機関で行われているか,あるいはその助成によって行われていない限り,多くの会社や他のNIHガイドラインに拘束されていない機関は自発的にこれらのガイドラインに従っている。
臨床試験は通常3つの連続段階に分けて行われるが、これらの段階は重複或いは合併する可能性がある。承認された後に追加的な研究が必要かもしれない。
臨床試験結果を詳細に説明する進捗報告は少なくとも毎年FDAに提出されなければならないことが分かっている。スポンサー又はその代理人は、情報が迅速報告の条件を満たしていると判断した後、書面INDセキュリティ報告を受けてから15カレンダー日以内にFDA及び調査者に書面INDセキュリティ報告書を提出しなければならない。深刻で深刻な場合にはIND安全報告が必要です 他の研究や動物からの予期しない有害事象や体外培養テストにより、この薬物に接触した人は重大なリスクがあり、方案或いは研究者マニュアルに記載されている状況と比較して、深刻な副作用の疑いの発生率は臨床上どのような重要な増加があることが示唆された。またスポンサーは 事故、致命的、または生命に危害を及ぼす疑いのある副作用の情報を受け取った後、7つのカレンダー日にFDAに通知します。
場合によっては、FDAは候補製品のBLAを承認する可能性があるが、承認後の候補製品の安全性および有効性をさらに評価するために、スポンサーに追加の臨床試験を行うことが要求される。この承認後の試験は通常4期臨床試験と呼ばれる。これらの研究は、予期される治療適応患者の治療から追加の経験を得るために使用され、加速承認条例によって承認された生物学的製品の場合に臨床的利益を証明するために使用される。4期臨床試験での職務調査ができなかったことは,製品の承認撤回につながる可能性がある。
遺伝子治療製品ガイド
FDAは、遺伝子治療製品を、転写および/または翻訳転移による遺伝物質または宿主(ヒト)遺伝子配列を特定に変化させることによってその効果を調節する製品として定義する。遺伝子治療製品の例としては核酸(例えばプラスミド、体外培養転写リボ核酸)、トランスジェニック微生物(例えば、ウイルス、細菌、真菌)、ヒトゲノム編集のための遺伝子工学部位特異的ヌクレアーゼおよび離体する遺伝子組み換えされたヒト細胞ですこの製品は細胞を修飾するために使うことができる体内にある細胞に転移したり離体する受取人を管理する前に。FDA内部では、生物製品の評価と研究センター(CBER)が遺伝子治療製品の監督管理を担当している。CBER内部では,遺伝子治療と関連製品の審査が治療製品オフィスに統合され,FDAは細胞,組織,遺伝子治療諮問委員会を設立し,その審査についてCBERにアドバイスを提供している。FDAとNIHは遺伝子治療案の開発と提出に関するガイドラインを発表している。
28
FDAは遺伝子療法に関するガイドラインに法的拘束力がないことを示しているが,我々が開発可能な任意の候補製品の承認を得るためには,これらのガイドラインを遵守する必要がある可能性が高いと考えられる。これらのガイドラインは、FDAが上述した各開発段階で考慮する他の要因を提供し、遺伝子療法の適切な臨床前評価と、INDアプリケーションに含まれるべき化学、製造、および制御情報と、INDまたはBLA適用をサポートする製品効力を測定するために正確な設計テストと、研究遺伝子療法に曝露された対象において、そのような影響リスクが高い場合の遅延副作用を観察するための措置とを提供する。さらに、FDAは、一般に、遺伝子治療に関連する潜在的遅延不良事象の対象をスポンサーに観察することを提案する。製品タイプによって、長期フォローアップは15年に達することができ、5年まで短くすることもできる。
CGMPとCGTPの要求に合致する
BLAを承認する前に、FDAは通常、製品を生産する1つまたは複数の施設を検査する。FDAは、製造プロセスおよび施設がcGMP要件に完全に適合していることを決定し、要求された仕様の下で製品が一貫して生産されることを保証するのに十分であると判断しない限り、申請を承認しないであろう。PHSAは,属性が正確に定義できない生物製品などの製品の製造制御の重要性を強調している。
遺伝子治療製品については,メーカーがCGTPに適合していなければ,FDAもこの製品を承認しない。これらの要件は、ヒト細胞、組織、および細胞および組織に基づく製品またはHCT/Pを製造するための方法、施設および制御のためのFDA法規において見つけることができ、HCT/Pは、ヒトレシピエント内に移植、移植、注入または転移するためのヒト細胞または組織である。CGTP要求の主な目的は,細胞や組織に基づく製品の製造方式の確保であり,感染症の導入,伝播,伝播を防止することを目的としている。FDAの規定はまた、組織機関がFDAに彼らのHCT/Pを登録し、適用した場合にスクリーニングとテストを通じてドナーを評価することを要求する。
製造業者や他の製品の製造·流通に参加する人、および製品、成分およびコンポーネントを提供する人は、米国市場の製品を供給するためにFDAおよびいくつかの州機関にその工場を登録し、同様の衛生規制機関に登録して、世界の他の市場の製品を供給しなければならない。米国および非米国の製造企業は、最初に生産過程に参加する際に、FDAおよび/または他の衛生規制機関により多くの情報を登録して提供しなければならない。登録されていない工場によって製造または輸入された任意の製品は、米国でも非米国でもFDCA下の誤ったブランドとされ、他の管轄区域の類似および他のコンプライアンス問題の影響を受ける可能性がある。機関はcGMPや他の法律の遵守を確保するために、政府当局の定期的な抜き打ち検査を受ける可能性がある。メーカーはまた、その工場に関する電子または実物記録の提供を要求しなければならないかもしれない。FDAまたは他の管理衛生規制機関の検査の延期、拒否、制限、または拒否は、製品が偽とみなされる可能性がある。
BLAの審査と承認
候補製品開発、臨床前試験および臨床試験の結果は、否定的または不明確な結果および積極的な発見を含み、BLAの一部としてFDAに提出され、その製品のマーケティング許可証の取得を要求する。BLAには広範な製造情報と製品組成に関する詳細な情報,アドバイスのラベル,使用料の支払いが含まれていなければならない.
FDAは、実質的な審査を可能にするために十分に完全であることを機関が決定したことに基づいて、出願を受け入れるのに十分であるかどうかを決定するために、出願を提出した後60日の間予備審査を行う。提出された申請が受け入れられると、FDAは申請の深い審査を開始する。FDAが“処方薬使用料法案”(PDUFA)によって達成された目標と政策に基づいて、FDAは、標準出願の予備審査を完了し、出願人に対応し、6ヶ月間にわたって出願を優先的に審査する10ヶ月の期間を有する。FDAは常にそのPDUFA規格と優先BLASの目標日を達成するわけではない。追加情報や明確化に対するFDAの要求はしばしば審査過程を大幅に延長するだろう。FDAが要求を出した場合、または出願人がPDUFA目標日の前の最後の3ヶ月以内に主要修正案の提出によって補足情報または提出中に提供された情報に関する明確化を提供した場合、審査プロセスおよびPDUFA目標日を3ヶ月延長することができる。
PHSAによれば、FDAが製品が安全で純粋かつ効率的であると判断し、製品を製造する施設が、その継続安全、純粋および有効性を保証するための基準に適合している場合、FDAはBLAを承認することができる。
FDAによる申請の評価および関連情報によれば、生産施設の検査結果、およびFDAがGLPおよびGCPにそれぞれ適合することを保証するために非臨床研究および臨床試験地点を監査するための任意の監査の結果を含み、FDAは承認状または完全な返信を発行する可能性がある。承認書は、製品の商業マーケティングを許可し、特定の適応に関する具体的な処方情報を提供する。申請が承認されていない場合、FDAは、申請が最終的に承認されることを確実にするために満たされなければならない条件を含み、可能な場合には、スポンサーがとりうる提案行動を概説して、出願の承認を得ることができる完全な返信を発行する。完全な返信を受信したスポンサーは、FDAによって決定された問題に対する完全な応答を表す情報をFDAに提出することができる。
29
PDUFAによると,このような再提出は1つまたは2つに分類され,再提出された分類は,申請者が行動関数に回答する際に提出された情報に基づいている.FDAがPDUFAで達成した目標と政策によると,FDAは2カ月間に1種類の再提出を審査し,6カ月の期間審査で2種類の再提出を行った。完全な返信で決定された問題が解決されるまで、FDAは申請を承認しない。代替的に、完全な返信を受信した保証人は、申請を撤回するか、または公聴会を要求することができる。
FDAはまた、申請を承認すべきかどうかを決定するために、審査、評価、および提案のために諮問委員会に申請を提出することができる。特に,FDAは新たな生物製品や安全性や有効性の問題を提起した生物製品の申請を諮問委員会に提出する可能性がある。通常,諮問委員会は臨床医や他の科学専門家を含む独立した専門家からなるグループであり,申請を審査,評価し,申請を承認すべきかどうか,どのような条件でアドバイスを提供すべきかを担当する。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を慎重に考慮するだろう。
FDAが新製品を承認した場合、それはその製品の承認適応を制限するかもしれない。それはまた製品ラベルに禁忌症、警告、または予防措置を含むことを要求するかもしれない。さらに、FDAは、承認後の製品の安全性をさらに評価するための4期の臨床試験を含む承認後の研究を要求する可能性がある。この機関はまた、製品が商業化された後にそれを監視するために、またはREMSを含む流通制限または他のリスク管理機構を含む他の条件を適用して、製品の利益が潜在的リスクよりも大きいことを保証するために、テストおよび監視計画を要求することができる。REMSは、薬物ガイドライン、医療専門家のコミュニケーション計画、および安全な使用を確保する要素、またはETASUを含むことができる。ETASUは、処方または調剤、場合によっては調剤、特殊監視、および特許登録所の使用に関する具体的または特殊なトレーニングまたは認証を含むことができるが、これらに限定されない。FDAは発売後の研究或いはモニタリングプロジェクトの結果に基づいて、製品の更なるマーケティングを阻止或いは制限することができる。承認後、新しい適応の追加、いくつかの製造変更、および追加のラベル宣言など、承認製品の多くのタイプの変更は、さらなるテスト要件およびFDAの審査および承認を受けなければなりません。
加急プロジェクト
FDAはある製品を指定して迅速な審査を行う権利があり、もしこれらの製品が深刻或いは生命に危害を及ぼす疾病或いは状況の治療中に満たされていない医療需要を解決することを目的としている場合。これらの計画は迅速チャネル指定、突破的治療指定、優先審査、再生医学高度治療指定と呼ばれる。
特に、FDAは、深刻なまたは生命に危険な疾患または状態を治療するために1つまたは複数の他の製品と単独でまたは組み合わせて使用することが意図されている場合、迅速な検討のための製品を指定することができ、そのような疾患または状態の満たされていない医療要件を満たす可能性があることを示す。Fast Track製品については,スポンサーがFDAとより多くのインタラクションを行う可能性があり,FDAは申請完了前にFast Track製品申請部分の審査を開始する可能性がある。FDAがスポンサーから提出された臨床データを初歩的に評価した後、高速チャネル製品が有効である可能性があると判断した場合、スクロール審査を行うことができる。スポンサーはまた、残りの情報を提出するスケジュールを提供しなければならず、FDAの承認を得なければならず、スポンサーは適用された使用料を支払わなければならない。しかしながら、FDAが高速チャネル申請の期間目標を検討することは、申請の最後の部分が提出されるまで開始される。また,FDAが迅速チャネル指定が臨床試験中に出現したデータの支持を得なくなったと考えた場合,あるいは指定された薬物開発計画が行われなくなった場合,FDAはその指定を撤回する可能性がある。
第二に、FDAは“画期的な療法”に指定された製品の審査を加速させる規制計画を持っている。1つの製品が、1つまたは複数の他の製品と単独で、または1つまたは複数の他の製品と組み合わせて、深刻なまたは生命に危険な疾患または状態を治療するために使用されることが意図されている場合、予備臨床証拠は、製品が1つまたは複数の臨床的重要終点において既存の療法よりも有意な改善を示す可能性があることを示しており、例えば、臨床開発早期に観察された実質的な治療効果がある場合、製品は突破的療法として指定することができる。画期的な治療法について、FDAは、開発過程全体にわたってスポンサーとの会議を行うこと、製品スポンサーに開発と承認に関する提案をタイムリーに提供すること、より多くの上級者を審査過程に参加させること、審査チームのために学際的なプロジェクト担当者を指定すること、および他のステップを取って効率的な方法で臨床試験を設計することを含むいくつかの行動をとる可能性がある。
第三に、FDAは、重篤な疾患を治療する場合、承認された場合、安全性または有効性の面で顕著な改善を提供する製品を優先的に検討することができる。FDAは具体的な状況から,他の利用可能な療法と比較して,提案された製品が有意な改善を表すかどうかを決定している。著明な改善は,ある疾患の治療の有効性の向上,制限治療の副作用の除去あるいは大幅な減少,記録のある患者のコンプライアンスの向上が重篤な結果の改善を招く可能性があること,新亜群の安全性と有効性の証拠である可能性が示唆された。優先指定の目的は、このようなアプリケーションの評価に全体的な注意とリソースを誘導し、FDAがマーケティング申請に行動する目標を10ヶ月から6ヶ月に短縮することである。
最後に,FDAは再生医学高度療法に指定された製品の審査と承認を加速することができる。もし製品が再生医学療法であれば、深刻な治療、修正、逆転または治癒を目指しています
30
あるいは生命に危害を及ぼす疾病或いは状況、初歩的な臨床証拠は、この製品がこのような疾病或いは状況が満たされていない医療需要を解決する潜在力を有することを示している。再生医学高度治療指定の利点は、開発および審査を加速するためのFDAとの早期相互作用、画期的な治療の利点、潜在的な優先審査資格、および代替または中間終点に基づく加速承認を含む。
さらに、“2022年食品·薬物総合改革法案”(FDORA)によれば、医薬品または生物製品またはその使用に組み込まれたプラットフォーム技術が、指定されたプラットフォーム技術として指定される資格がある:(1)プラットフォーム技術がBLAによって承認された薬物使用に組み込まれるか、または許可された薬物の発起人またはそのような薬物出願に提出されたデータ参照権を付与された発起人が提出した初期証拠は、プラットフォーム技術が品質、製造または安全に悪影響を与えることなく、1つ以上の薬物使用に組み込まれる可能性があることを示している。(3)適用者が提出したデータまたは情報は、プラットフォーム技術の導入または利用が薬物開発または製造過程および審査過程に顕著な効率をもたらす可能性があることを示している。スポンサーは、IND出願を提出した間または後の任意の時間に、IND出願を要求対象とするプラットフォーム技術を組み込むか、または使用する指定されたプラットフォーム技術としてFDAに指定することを要求することができる。指定された場合、FDAは、プラットフォーム技術を使用または組み込まれた薬物の任意の後続の元のBLAの開発および審査を加速および検討することができる。プラットフォーム技術の状態を指定することは、薬物開発がより早くあるいはFDAの承認を得ることを保証することはできない。さらに、FDAが、指定されたプラットフォーム技術がもはやそのような指定された基準に適合していないと判断した場合、FDAは、指定を取り消すことができる。
承認ルートを加速する
FDAは、患者に既存の治療よりも意義のある治療利点を提供する深刻または生命に危険な疾患の承認を加速する可能性があり、これは、製品が臨床的利益を合理的に予測する可能性のある代替終点に影響を及ぼすことを決定することに基づく。中間臨床終点に対する製品の影響が不可逆的な発病率または死亡率またはIMMへの影響よりも早いことができ、このような状況の重症度、希少性または流行率、および代替治療が利用可能または不足している場合を考慮すると、IMMまたは他の臨床的利益への影響を合理的に予測することが可能である場合、FDAはこのような状況の加速承認を許可することもできる。加速された承認を受けた製品は、従来承認された製品と同じ安全性と有効性法定基準に適合しなければならない。
承認を加速するために、代替終点は、例えば実験室測定、放射画像、バイタルサイン、または他の臨床的利益を予測することができると考えられるが、それ自体は臨床的利益の測定基準ではない標識である。代替終点は通常、臨床終点よりも容易または迅速に測定される。中間臨床終点は治療効果の測定であり、1種の製品の臨床利益、例えばIMMに対する効果を合理的に予測することが可能であると考えられる。FDAは中間臨床終点に基づく加速承認の面で経験が限られているが、ある研究が慢性病環境において相対的に短期的な臨床利益があることを証明し、臨床利益の持続性を評価することは伝統的な承認に重要であるが、短期的な利益は長期的な利益を合理的に予測する可能性があると考えられる場合、このような終点は通常加速承認を支持することができることを示した。
加速承認経路は疾病の病気経過が比較的に長く、製品の期待される臨床利益を測定するために時間を延長する必要がある環境に最もよく用いられ、代用或いは中間臨床終点への影響は非常に速く発生した。したがって、加速承認は様々な癌を治療するための製品の開発と承認に広く使用されており、その中で治療の目標は通常、生存率を向上させること、または発病率を低下させることであり、典型的な病気経過の持続時間は長く、時には大型の試験を必要とし、臨床または生存利益を証明することである。
加速承認経路は、一般に、製品の臨床的利益を検証および説明するために、勤勉な方法で追加的な承認後の検証的研究を行うことにスポンサーが同意することに依存し、FDAは、承認前または承認が加速された製品の承認日後の特定の期間内に、そのような試験を適宜要求することを可能にする。そのため、この基礎の上で承認された候補製品は必ず厳格な発売後のコンプライアンス要求を守らなければならず、4期或いは承認後の臨床試験を完成し、臨床終点への影響を確認することを含む。必要な承認後研究を行わない場合、あるいは発売後の研究期間中に臨床利益が確認できなければ、FDAがこの製品の市場からのリコールを加速することを許可する。加速規制によって承認された候補製品のすべての販売促進材料はFDAの事前審査を経なければならない。
承認後の規則
製品発売の規制承認または既存製品の新しい適応が得られた場合、スポンサーは、すべての通常の承認後の規制要件、およびFDAが承認プロセスの一部として適用される任意の承認後要求を遵守することを要求されるであろう。スポンサーは、いくつかの不良反応や生産問題をFDAに報告し、最新の安全性および有効性情報を提供し、広告や販売促進ラベル要求に関する要求を遵守することを要求される。製造業者たちは適用された製品追跡と追跡要求を守らなければならない。メーカーとそのいくつかの下請け業者は、fdaとある州機関に彼らの工場を登録し、fdaとある州機関の定期的な抜き打ち検査を受けて、現行法規を遵守することを保証しなければならない
31
要求は、製造業者にいくつかのプログラムおよびファイル要件を適用するcGMP規制を含む。したがって、スポンサーおよびその第三者メーカーは、cGMP法規および他の法規要件の遵守を維持するために、生産および品質管理に時間、お金、エネルギーをかけ続けなければならない。
製品はまた正式なロット発表が必要である可能性があり、これはメーカーが製品が発表される前に、製品の各ロットに対していくつかのテストを行わなければならないことを意味する。製品が正式なバッチ発行を必要とする場合、製造業者は、各バッチのサンプルをFDAに提出し、バッチの生産履歴要約および製造業者がバッチに対して行ったすべての試験結果を示す放出スキームを提示しなければならない。さらに、FDAは、いくつかの製品のバッチに対していくつかの検証的テストを行い、その後、バッチを発行して流通する可能性もある。最後に、FDAは薬品の安全性、純度、効力と有効性に関する実験室研究を行う。
承認されると、規制要求や製品の発売後に問題が発生した場合、FDAは承認を撤回する可能性がある。その後、製品には、予期されない深刻度または頻度の不良事象、または生産プロセス、または規制要件を遵守できなかったことを含む、以前に未知の問題が存在することが発見され、新しいセキュリティ情報を追加するために承認されたラベルの改訂を招く可能性がある;新しい安全リスクを評価するために発売後研究または臨床試験を実施すること、またはREMS計画に従って流通または他の制限を実施することが可能である。規制要件を遵守できなかった他の潜在的な結果は、
FDAは、上場許可と製品のマーケティング、ラベル、広告、販売促進を厳格に規制している。薬品は承認された適応と承認されたラベルの規定でしか宣伝できない。FDAや他の機関はラベル外用途の普及を禁止する法律法規を積極的に実行しており,ラベル外用途の普及が不適切であることが発見された会社は重大な責任を負う可能性がある。
孤児薬名
米国の孤児薬物指定は,スポンサーにまれな疾患や疾患に対する製品の開発を奨励するためである。米国では、法律は、まれな疾患または疾患を、米国で20万人未満または米国で20万人を超える影響を及ぼす疾患と定義しており、米国での製品の販売からその疾患または疾患に対する生物製剤の開発および提供のコストを回収することができる合理的な期待はない。
FDAが承認すれば、孤児薬物指定は会社が製品発売許可日から7年以内に税収控除と市場排他性を得る資格を持つことになる。孤児製品に指定された出願は、当該製品の発売を承認する申請を提出する前のいつでも提出することができる。規制規定により提出された受け入れ可能な機密要求に基づいて,1つの製品がFDA孤児製品開発事務所(OOPD)の孤児薬物指定を受けた場合,その製品は孤児となる。そして、その製品は任意の他の製品のように、審査と承認手続きを通じて商業流通を行わなければならない。
スポンサーは、以前承認されていなかった製品を孤児薬として指定したり、すでに発売されている製品のために新たな孤児適応を申請することを要求することができる。さらに、1つの製品が他の態様で承認された孤児薬物と同じ製品である場合、製品が信頼できる仮定を提示することができる場合、すなわち、その製品が第1の薬剤よりも臨床的に優れている可能性がある場合、製品の発起人は、同じ稀な疾患または疾患の後続製品に対する孤児薬物名を求めることができ、取得することができる。複数のスポンサーは、同じ製品のために同じまれな疾患または疾患の孤児薬物指定を得ることができるが、孤児薬物指定を求める各スポンサーは、完全な指定申請を提出しなければならない。
専門期間はFDAが上場申請を承認した日から,この製品が指定した適応にのみ適用される。FDAは、同じ製品の第2の出願を異なる使用のために承認することができ、または同じ使用のために製品の臨床的により優れたバージョンを申請することができる。しかしながら、スポンサーの同意またはスポンサーが十分な数を提供できない限り、FDAは、他のメーカーが生産した同じ製品が市場排他期間内に同じ適応のために使用されることを許可することはできない。
小児科研究と排他性
改正された2003年の“小児科研究平等法”(PREA)によると,BLAあるいはその付録には以下のデータが含まれていなければならない
32
すべての関連する小児科亜集団において主張される適応の安全性および有効性を評価し、各安全で有効な小児科亜群に対する製品の用量および投与をサポートするのに十分である。スポンサーはまたデータを評価する前に小児科研究計画を提出しなければならない。これらの計画は、提案された1つまたは複数の小児科研究の大綱、出願人が実施する研究、研究目標および設計、任意の延期または免除請求、および法規要件の他の情報を含む計画を含まなければならない。そして,申請者,FDA,FDAの内部審査委員会は提出された情報を審査し,相互に協議し,最終計画について合意しなければならない。FDAまたは出願人はいつでも計画の修正を要求することができる。
FDAは、成人のために製品が使用されるか、または小児科データ要件を完全にまたは部分的に免除するまで、申請者の要求に応じて、または小児科データの一部または全部の提出を延期することを許可することができる。法規が別途要求されない限り、小児科データ要件は、孤児として指定された製品には適用できないが、生物が成人癌を治療するための分子標的癌製品であり、FDAに対して小児科癌の増殖または進行に実質的に関連する分子標的を決定する場合、これらの要件は、孤児の新しい活性成分として指定されたBLAに適用されるであろう。
小児科排他性は、米国の別の非特許マーケティング排他性であり、承認された場合、任意の既存の規制排他性条項に基づいて6ヶ月間のマーケティング保護を追加的に提供する。BLAスポンサーから提出された小児科データがこのようなデータに対するFDAの書面要求に公平に応答すれば,この6カ月の排他性を与えることができる。これらのデータは,この製品が研究されている小児科群で有効であることを証明する必要はなく,逆に臨床試験がFDAの要求に公平に応答していると考えられれば,追加的な保護が得られる。要求された小児科研究報告が法定期限内にFDAに提出され、FDAの受け入れを得る場合、研究された活性部分を含む各医薬製品の既存の規制排他期間は6カ月延長される。これは特許期間の延長ではないが、FDAが別の出願を承認できない規制期間を効果的に延長する。
生物模倣薬と排他性
2010年3月に法律となった“患者保護·平価医療法案”(ACA)には、“2009年バイオ製品価格競争·革新法案”(BPCIA)という副題が含まれている。BPCIAは、FDAが生体模倣薬と交換可能な生物模倣薬を許可することを許可する規制方案を確立した。FDAはすでにいくつかの指導文書を発表し,生体模倣薬の審査·承認方法について概説した。
BPCIAによれば、製造業者は、以前に承認された生物製品または“参照製品”“生物学的に類似している”または“交換可能”と一致する生物製品のライセンス申請を提出することができる。FDAに生物類似製品を承認させるためには、参考製品と提案された生物類似製品が安全性、純度と効力の面で臨床的に意義のある差がないことを発見しなければならない。FDAが生物類似製品を参照製品と交換することができるようにするために、この機関は、生物学的類似製品が参照製品と同じ臨床結果を生成することが期待でき、(複数回投与された製品のための)生物学的製剤および参照生物製剤は、安全リスクを増加させることなく、または参照生物製剤の独占的使用と比較して治療効果のリスクを低下させることなく、以前の投与後に交換可能であることを発見しなければならない。
BPCIAによると,生物類似製品の申請は参考製品が承認された日から4年後にFDAに提出される。FDAは参考製品が承認された日から12年以内に生物類似製品を承認することができるかもしれない。1つの製品が独占特許を取得する資格がある参考製品と考えられていても、FDAが製品の完全なBLAを承認した場合、スポンサー自身の臨床前データと十分かつ制御された臨床試験データとを含み、その製品の安全性、純度、および効力を証明するために、別の会社も製品の競争バージョンを販売することができる。BPCIAはまた、交換可能な製品として承認された生物模倣薬のための特定の排他的期間を設定し、FDAは、それらが同じ発売初日に承認される限り、複数の“第1”交換可能製品を承認することができる。これは、(1)第1の交換可能製品の最初の商業マーケティング後1年後、(2)“米国法”第42編262(L)(6)条に基づいて、第1の交換可能製品出願を提出した出願人に対して提起された特許侵害訴訟が18ヶ月後に解決された後、訴訟中のすべての特許に対する裁判所の最終裁決に基づいて、または訴訟を損なうことなく、または損害を与えることなく訴訟を却下するまで、複数の第1の交換可能製品によって共有されることができる排他的期間が続く。(3)“米国法”第42編262(L)(6)条に基づいて第1交換可能製品出願を提出した出願人に対して提起された特許侵害訴訟は,第1交換可能製品の承認後42ヶ月,又は(4)第1交換可能製品出願を提出した出願人が“米国法典”第42編262(L)(6)条に基づいて起訴されていない場合は,第1交換可能製品の承認後18ヶ月以内である。この節では,FDAが“交換可能”と考えている製品が本当に州薬剤法に管轄されている薬局に取って代わられるかどうかは不明である。
特許期限の回復と延長
1984年の“医薬品価格競争及び特許期間回復法”又は“ハッジ·ワックスマン修正案”によると、新生物製品を有する特許は、製品開発及びFDA規制審査中に失われた特許期間が5年間にわたる特許回復を可能にする限られた特許期間延長を得る資格がある可能性があると主張している。製品をカバーする特許付与の回復期限は、通常、IND発効日とマーケティング出願提出日との間の時間の半分であり、マーケティング出願提出日と最終承認日との間の時間に加えて、出願人を差し引くことができない
33
職責を尽くして行動する。特許期間回復は特許の残存期間の延長には利用できず,製品承認日から合計14年を超える。承認された製品に適用される特許は1つのみ延期する資格があり,延期出願は関連特許が満了する前に提出されなければならない。複数の製品をカバーする特許は、そのうちの1つの承認に関連して延期することしかできない。米国特許商標局は,FDAと協議した後,任意の特許期間の延長または回復の出願を審査·承認する。
ヨーロッパの薬品審査の法規と手続き
アメリカ国外で任意の製品をマーケティングするために、会社はまた他の国と司法管轄区域の品質、安全性と有効性及び製品に対する臨床試験、マーケティング許可、商業販売と流通などの方面の多くの異なる監督管理要求を守らなければならない。FDAによる製品の承認を得るか否かにかかわらず、出願人は、これらの国または司法管轄区で当該製品の臨床試験またはマーケティングを開始するために、同様の衛生監督管理機関の必要な承認を得る必要がある。具体的には,ヨーロッパの医薬製品の承認手続きは米国とほぼ同じであり,米国で1つの医薬製品を承認することは欧州での承認が保証されていないにもかかわらず,完全な承認であっても,米国の承認と同じ時間範囲で承認されることも保証されていない。この過程は、各提案に対するこの製品の適応の安全性と有効性を決定するために、臨床前研究と十分かつ良好な制御の臨床試験を満足的に完成させる必要がある。また、欧州市場管理局または関連主管当局にマーケティング許可申請を提出し、欧州市場管理局またはこれらの当局が市場許可を付与し、その後、その製品を欧州で販売·販売することを要求する。
臨床試験許可
EUで臨床試験の認可を申請した出願人は,臨床試験を行うEU加盟国の国家主管当局またはNCAの承認を得なければならず,臨床試験が複数の加盟国で行われる場合は,複数の加盟国で承認されなければならない。また,適用された倫理委員会やECが臨床試験に賛成の意見を発表した後のみ,出願人は特定の研究地点で臨床試験を開始することができる。
2014年4月,EUは2022年1月31日に臨床試験指令2001/20/ECに代わる新たな臨床試験条例(EU)第536/2014号を採択した。それはEUの現在の臨床試験承認制度を徹底的に改革する。具体的には、これはすべてのEU加盟国の新しい立法に直接適用され(これは、EUの臨床試験の承認を簡略化し、簡素化することを目的として、各EU加盟国で国家立法を制定する必要がないことを意味する)。例えば、“臨床試験規則”は、単一入口点を通じて申請プログラムを簡略化し、臨床試験申請の評価締め切りを厳格に規定することを規定している。
マーケティング許可
EUにおける製品の販売許可を得るためには,申請者はMAAを提出しなければならないか,EUによって管理されている中央手続きか,EU加盟国主管部門が管理する手続きの1つ(分散手続き,国家手続きまたは相互承認手続き)である。マーケティング許可は、欧州経済地域に設立された出願人(EU加盟国にアイスランド、ノルウェー、リヒテンシュタインを含む)にのみ付与されることができる。(EC)第1901/2006号条例は、EUの上場許可を得る前に、出願人は、EMAが特定の製品の免除、カテゴリ免除、またはPIPに含まれる1つまたは複数の措置の実施を延期しない限り、EMAによって承認された小児科人口のすべてのサブセットをカバーする小児科調査計画(PIP)に含まれるすべての措置を証明しなければならないと規定している。
集中化プログラムは、欧州委員会によって欧州経済地域全体で効果的な単一マーケティング許可を付与することを規定している。(EC)第726/2004号条例によれば、特定の製品については、特定の製品については、特定の生物技術によって生産された薬剤、孤児薬物として指定された製品、高度な治療医薬製品、またはATMP、および癌、HIVまたはエイズ、糖尿病、神経変性疾患、自己免疫および他の免疫機能障害、およびウイルス性疾患の治療を含む特定の疾患の治療のための新しい活性物質を含む製品は、集中手順を強制的に実行しなければならない。 集中プログラムの使用を強制しない製品については、出願人は、他の疾患を治療するための新たな活性物質を含む場合、集中プログラムを使用することを選択することができる あるいは、出願人は、製品が重大な治療、科学的または技術革新を構成していることを証明することができ、または製品にとって、集中的なプロセスがEU一級患者の利益に適合することを証明することができる。
具体的には、遺伝子療法医薬製品の販売許可のような生存可能なヒト組織または細胞を含む製品のEUは、欧州議会および欧州理事会の第2001/83/EC命令と組み合わせたATMPsに関する(EC)第1394/2007号条例の管轄を受けており、この命令は管理者用薬品のEU指令である。(EC)第1394/2007号条例は、遺伝子治療薬物製品、体細胞治療薬物製品及び組織工学製品の許可、監督及び薬物警戒について具体的な規則を制定した。先進療法薬物製品のメーカーはEMAの先進療法委員会(CAT)にその製品の品質,安全性,有効性を証明しなければならず,この委員会はMAAを科学的に評価し,ATMPにMAAに関する意見を提供する。欧州委員会は欧州委員会が提出した意見に基づいてマーケティング許可を承認または拒否する
34
エマ。
EMAに設立されたヒト用薬品委員会(CHMP)は,ATMPが要求される品質,安全性,有効性要求に適合しているかどうか,製品が積極的なメリット/リスクプロファイルを持つかどうかに関する最終意見の発表を担当している。EUの中央手続きによると、環境評価機関が重大な影響評価を評価する最長期限は、有効な重大な影響評価を受けた210日後であり、申請者がCHMPの質問に答えるために補足情報や書面または口頭解釈を提供する必要はない。タイミングを停止することは、MAAを評価する時間フレームを210日を超えるように大幅に延長する可能性がある。CHMPが肯定的な意見を与えた場合、EMAの提案を受けて67日以内にマーケティング許可の最終決定を発行するサポートファイルと共にEU委員会に意見を提供する。特殊な場合、公共健康の観点、特に治療革新の観点から、1種の医薬製品が重大な価値を有することが予想される場合、CHMPは加速評価を承認することができる。CHMPがそのような要求を受け入れる場合、210日間の評価期限は150日(クロック停止を含まない)に減少するが、CHMPが申請が加速評価にもはや適していないと判断した場合、中央プログラムの標準時限に回復する可能性がある。
イギリス(イギリスと北アイルランドを含む)がEUを離れたので、イギリスはもはや集中マーケティング許可のカバーを受けない(北アイルランド議定書によると、集中マーケティング許可は北アイルランドで認められ続ける)。しかし、2024年1月1日には、医薬品·保健品規制機関(MHRA)が新たな国際認可枠組みを構築し、この枠組みによれば、MHRAはEMAおよびいくつかの他の規制機関のマーケティング許可の承認に関する決定を考慮する可能性がある。
素数案
2016年3月、EMAは、EMAとの早期対話およびEMAの規制支援を提供することにより、現在少ないまたは治療法のない適応における候補製品の開発を促進するイニシアティブを開始した。この計画はEMAが提供した科学提案計画と加速評価プログラムに基づいて、革新を刺激し、発展を最適化し、優先薬物或いはPrimeの加速評価を可能にすることを目的としている。この計画は自発的で、資格基準を満たさなければPrimeの資格を得ることができない。
Prime計画は開発中の薬品に対して開放し、申請者は集中プログラムを通じて初歩的な発売許可申請を提出する予定である。条件に適合する製品は、満たされていない医療需要が存在する条件(これは、EUでは満足できる診断、予防または治療方法がないことを意味し、または、ある場合、新薬は重大な治療優位性をもたらすことを意味し、それらは、新しい方法または療法を導入することによって、または既存の方法を改善することによって、満たされていない医療需要を満たす潜在力を示さなければならない。申請者は通常開発の探索的臨床試験段階にあり、そして患者の中で初歩的な臨床証拠を獲得し、この薬物の有望な活性及び満足されていない医療需要を大きく解決する潜在力を証明する。特殊な場合、関連モデルにおいて納得できる非臨床データが有望な活動の早期証拠を提供し、第1の人体研究が必要な薬物治療効果および耐性に十分な曝露があることを示す場合、学術部門または中小企業(中小企業)の申請者は、開発の早い段階で資格申請を提出することができる。
Primeプログラムのために薬を選ぶとEMA:
Prime計画に選ばれた薬品も,EMAの上場許可申請時の加速評価プログラムから利益を得ることが予想される。研究開発過程において、もし1種の薬物が資格標準に符合しなくなったら、Prime計画下の援助を取り消すことができる。
データと市場排他性
EUでは、改正(EC)第726/2004号条例と改正された2001/83/EC指令に基づいて、完全な独立データパケットによって承認された革新医薬製品は、8年間のデータ独占権と追加2年間の市場独占権を得る資格がある。データ排他性防止模倣薬または生体模倣薬の認可の出願人がEUで模倣薬または生物類似薬の発売許可を申請する際には,以下の日から8年以内に参照製品アーカイブに含まれる革新者の臨床前および臨床データを参照する
35
参考製品はまず連合で許可された。追加の2年間の市場排他期間内に、模倣薬または生物類似MAAを提出することができ、革新者のデータを参照することができるが、市場排他期間が満了するまで、いかなる模倣薬または生物類似薬もEUで販売することはできない。この10年の最初の8年間に、マーケティング許可保持者が1つまたは複数の新しい治療適応の許可を得た場合、これらの適応は、許可前の科学的評価期間中に既存の療法と比較して有意な臨床的利益をもたらすと考えられ、10年全体の期間は最大11年に延長される。1つの製品がEMAによって革新的な医薬製品とみなされることは保証されず、製品はデータ独占性を獲得する資格があるかもしれない。1つの製品が革新的な医薬製品であると考えられていても、革新者は所定のデータ独占期間を取得したが、別の会社がMAAに基づくマーケティング許可を取得し、薬物試験、臨床前試験、および臨床試験の完全な独立したデータパケットを有する場合、同社はその製品の別のバージョンを販売することができる。
授権期間と継続期間
集中マーケティング許可は原則として5年間の有効期間であり、5年後にEMAまたはライセンスEU加盟国の主管当局が国家ライセンス製品のリスク-収益バランスを再評価することによって更新することができる。一旦更新されると、上場許可の有効期限は無期限であり、欧州委員会または主管当局が薬物警戒に関する正当な理由に基づいて、追加の5年間の継続を決定しない限り。認可後3年以内に医薬品を実際にEU市場に投入していない(集中手続きの場合)、または許可されたEU加盟国の市場での許可は有効である(いわゆる日没条項)。
孤児薬の指定と排他性
条例(EC)第141/2000号及び条例(EC)第847/2000号は、そのスポンサーが、(1)生命又は慢性衰弱に危害を及ぼす疾患の診断、予防又は治療を目的としていることを証明できることを前提として、欧州委員会により孤児医薬品として指定することができる。(2)又は(A)申請時に、EUにおける影響が万分の5(5)/10,000人以下であることを前提とする。または(B)孤児身分の利点がない場合、製品は、その開発に必要な投資が合理的であることを証明するためにEUで十分なリターンを生成することは不可能であり、(3)このような疾患を満足できる診断、予防または治療する方法がEUで販売されることを許可していない場合、または、そのような方法があれば、その製品は、疾患の影響を受けている人に大きな利益を与えるであろう。
孤児に指定されることは、費用減免、規制援助、集中マーケティング許可を申請する能力を含む多くの利点を提供する。孤児薬品の販売許可を与えることは10年間の市場排他期につながるだろう。この市場排他期間内には、欧州委員会もEU加盟国も“類似医薬製品”の申請を受け入れることができず、その上場を承認することもできない。類似医薬製品“の定義は、承認された孤児医薬製品に含まれる1つ以上の類似活性物質を含む医薬製品であり、同じ治療適応のためのものである。しかし、5年目の終了時に当該製品が孤児指定基準に適合していないと判定された場合、例えば、製品の利益が十分に高く、市場固有性が合理的であることを証明するのに十分ではないので、適応の治療を許可する市場専門期間を6年に短縮することができる。10年間の市場排他期に基づいて、欧州委員会は同じ治療適応中の類似医薬製品に対して販売許可を与えることができ、その中にいくつかの欠陥がある:
営業許可を得た後の規制要件
医薬製品がEUで許可された場合、マーケティング許可の保持者は、医薬製品の製造、マーケティング、販売促進および販売に適した一連の要件を遵守しなければならない。これらの措置には,EUの厳格な薬物警戒や安全報告規則の遵守が含まれており,これらの規則により,認可後の研究や追加的なモニタリング義務を実施することができる。また、ライセンス製品の製造は、2001/83/EC号指令、(EU)2017/1572号指令、(EC)第726/2004号、および欧州委員会の良好な製造規範ガイドラインを含む、適用されるEUの法律、法規およびガイドラインを厳格に遵守しなければならない。これらの要件には,医薬製品や活性医薬成分を生産する際にEU cGMP基準を遵守することが含まれており,EU以外で活性医薬成分を製造して活性医薬成分をEUに輸入しようとすることも含まれている。最後に、業界支援を含むライセンス製品のマーケティングと普及、継続医学教育と
36
医薬品および/または一般大衆は、連合で厳格に規制されている。連合は処方薬だけの広告を一般大衆に投与することを許可しない。
上記の連合規則は一般的にヨーロッパ経済地域に適用される。将来的に製品の商業化上場承認を得ることを求める可能性のある他の市場や、承認を求める他の衛生規制制度については、適用される衛生規制手続きや基準、および各適用司法管轄区域の他の管理法律や法規を継続的に遵守することを確保する必要がある。
EU規制枠組みの改革
欧州委員会は2023年4月に立法提案を提出し,実施されれば,EUの現在のすべての薬品(まれな疾患や児童を治療する薬品を含む)の規制枠組みに代わる。欧州委員会は立法提案を欧州議会と欧州理事会に提出して審査と承認を行った。2023年10月、欧州議会は立法提案に対して修正案を提出する報告案を公表し、欧州議会はこれを討論する。欧州委員会の立法提案が承認されると(修正または修正されない)、それらはEU法律として採択されるだろう。
ヨーロッパデータ保護条例
個人健康データを含む欧州経済ゾーンまたはヨーロッパ経済ゾーンおよびイギリス個人に関する個人データを収集、使用、開示、移転、または他の方法で処理することは、他の説明がない限り、EUの欧州経済ゾーンに関する一般データ保護条例またはEU GDPR、ならびにイギリスのイギリス一般データ保護条例またはイギリスGDPRおよび本報告書で総称して“GDPR”と呼ばれるEU GDPRによって制限される。GDPRは、欧州経済区/連合王国内の個人に商品またはサービスを提供するか、または欧州経済区/スイス/連合王国でのその行動を監視することに関連する個人データを収集して使用する場合、欧州経済区/連合王国に設立された会社、および欧州経済区/連合王国以外に設立された任意の会社に適用される。“個人資料保護法”に関連する範囲は広く、個人資料を処理する会社に対して多くの要求を提出し、健康とその他の敏感なデータを処理し、個人資料に関連する個人の同意を得ること、個人を識別できる個人資料の処理に法的根拠を提供すること、これらの個人にその個人資料を処理する詳細を提供すること、個人資料の安全と機密性を保護するための保障措置を実施すること、個人資料を処理する第三者とデータ処理協定を締結し、個人がその個人資料について権利を行使する要求に応答すること、主管国家データ保護当局と影響を受けた個人報告が個人資料に関連する安全違反行為、データ保護官を任命すること、などの要求を含む。データ保護影響評価を行い、ある責任措置が適切であることを確保し、記録を保存する。GDPRはまた、個人データをヨーロッパ経済圏以外の国(米国を含む)に移して厳格なルールを実施し、データ保護当局が2000万ユーロ(イギリスGDPRによる)や世界年収の4%に達する可能性のある罰金を含むGDPR違反行為に巨額の罰金を科すことを許可している。GDPRはまた、データ主体と消費者協会に個人訴訟権利を与え、監督当局に苦情を提出し、司法救済を求め、GDPR違反による損害について賠償を受けることができる。
スイスはGDPRのようなデータ保護制度を採用している。GDPRやスイスのデータ保護制度を遵守することは依然として厳格で時間のかかる過程であり、ビジネスコストを増加させたり、企業にそのビジネスやり方を変更して、完全な遵守を確保したりする可能性がある。
イギリスの離脱とイギリスの規制枠組み
2016年6月23日、イギリスの有権者はEU離脱(通称離脱)に賛成票を投じ、イギリスは2020年1月31日にEUから正式に離脱した。EU製薬法は2020年12月31日に満了する英国に適用され続ける過渡期がある。しかし、EUとイギリスは、2021年1月1日から暫定的に適用され、2021年5月1日から正式に適用される貿易·協力協定すなわちTCAに合意した。TCAには薬品に関する具体的な条項が含まれており,その中にはGMP相互承認,医薬製品の製造施設の検査,発表されたGMP文書が含まれているが,イギリスとEUを大規模に相互承認する薬品法規は規定されていない。現在、イギリスは“2012年人類薬品条例”(改正された)(北アイルランド議定書に基づき、EU規制枠組みは現在引き続き北アイルランドに適用されている)を採択し、医薬製品のマーケティング、普及、販売に関するEUの立法を実施している。そのため、イギリスの規制制度は多くの点でEUの規制制度と一致しているが、イギリスの規制制度はEUから独立しており、TCAはイギリスとEUの薬品立法を相互に認めることを規定していないため、これらの制度は将来的により大きな差が生じる可能性がある。しかし、TCAによりEU薬品立法の卸売承認は行われていないにもかかわらず、MHRAが2024年1月1日に実施した上記の新たな国際認可枠組みによると、MHRAはイギリスのマーケティング許可の申請を考慮する際に、EMA(およびいくつかの他の規制機関)がマーケティング許可を承認する決定を考慮する可能性がある。
2023年2月27日、イギリス政府と欧州委員会は、北アイルランド議定書、すなわち“ウィンザー枠組み”と呼ばれる新たな手配の代わりに、原則的な政治的合意を発表した。この新しい枠組みは
37
イギリスの医薬製品に対する規制を含む北アイルランド議定書下の現行制度を根本的に変えた。特に、MHRAはイギリス市場(すなわち大ブリテンおよび北アイルランド連合王国)へのすべての医薬製品の承認を担当するが、EMAは北アイルランドへの医薬製品の輸送を承認する上で何の役割も果たすことはできない。MHRAは、イギリスで販売されているすべての医薬製品のイギリス範囲での単一マーケティング許可を付与し、製品がイギリス各地で単一パッケージおよび単一ライセンスで販売できるようにする。2023年3月24日、EU·イギリス合同委員会はウィンザー枠組みを承認したため、イギリス政府とEUは立法措置を制定し、法律にする。2023年6月9日,MHRAはウィンザーフレームワークの薬品について2025年1月1日から適用すると発表した。
保証範囲·定価·精算
FDAまたは他の政府当局の規制承認を受けたか、または求めることが可能な任意の製品または候補製品の保証範囲および精算状態には大きな不確実性がある。米国や他国の市場では,自分の病状に応じて処方治療を受けている患者や処方サービスを提供する提供者は,通常第三者支払者に依存してすべてまたは一部の関連医療費を精算している。患者は、保険を提供し、そのような候補製品を支払うのに十分なコストの大部分を精算しない限り、私たちが開発する可能性のある任意の製品または候補製品を使用することは不可能である。承認されても、任意の製品または候補製品の販売は、MedicareおよびMedicaid、商業健康保険会社および管理型ヘルスケア組織のような米国の政府健康計画を含む第三者支払者にある程度依存し、これらの製品候補製品に保険を提供し、十分な補償レベルを確立する程度である。支払人が精算を決定する際に考慮する要素は、製品があるかどうかに基づいている
支払者が商品に保険を提供するか否かを判定するプロセスは、保険が承認された後に支払者が製品に支払う価格または販売率を設定するプロセスと分離することができる。第三者支払者は、徴収された価格に挑戦し、医療の必要性を審査し、医療製品およびサービスの費用対効果を審査し、コストを管理するために制御を実施することが増えている。第三者支払者は、保証範囲を承認リスト上の特定の製品に制限することができ、特定の適応のすべての承認製品を含まない可能性がある配合表とも呼ばれる。
販売が許可される可能性のある任意の製品の保険·精算を確保するためには、企業は、製品の医療必要性および費用効果、およびFDAまたは他の同様の市場承認を得るために必要なコストを証明するために、高価な薬物経済学的研究を行う必要があるかもしれない。それにもかかわらず、製品または候補製品は、医学的に必要であるか、または費用対効果があると考えられないかもしれない。第三者支払者は、私たちが開発する可能性のある任意の候補製品を保証しないことを決定し、承認されると、医師のこのような候補製品の使用を減少させ、私たちの販売、運営結果、財務状況に実質的な悪影響を与える可能性がある。また、支払者が製品に保険を提供することを決定することは、十分な返済率を承認することを意味するものではない。また、1人の支払人が1つの製品に保険を提供することを決定することは、他の支払人もその製品に保険や精算を提供することを保証することはできず、また、支払者によって保険や精算レベルが大きく異なる可能性がある。第三者精算や保険は、製品開発への投資の適切なリターンを実現するために、十分な価格レベルを維持することができないかもしれません。
医療費のコントロールもすでにアメリカ国内と世界の他の国の各連邦、州と/或いは地方政府及び他の支払人の優先順位になっているが、薬品価格はずっとこれらの努力の重点である。政府と他の支払人はコスト制御計画の実施に大きな興味を示し、価格制御、精算に対する制限及び後発薬代替の要求を含む。価格制御及びコスト制御措置を講じ、既存の制御及び措置を有する司法管区においてより限定的な政策をとることにより、任意の承認された製品の販売から得られる収入をさらに制限することができる。保証政策と第三者精算料率は随時変化する可能性がある。1つの会社またはその協力者がマーケティング承認を得た1つまたは複数の製品が有利な保証·精算状態を獲得しても、将来的にはあまり有利ではない保証政策および精算料率を実施することが可能である。
米国以外では、私たちが開発可能な任意の製品または候補製品に十分なカバー範囲と支払いを提供することを確保することが課題に直面する。多くの国で、処方薬の価格設定は政府によって規制されている。政府当局との価格交渉は、製品の監督マーケティング承認を受ける範囲をはるかに超えている可能性があり、私たちが開発する可能性のある任意の候補製品の費用対効果を他の利用可能な治療法と比較するために臨床試験を要求することができるかもしれない。このような臨床試験を行うことはコストが高く、私たちの商業化努力の遅延を招く可能性がある。
連合では、様々な国の価格設定と補償プログラムの差が大きい。一部の国が提供する製品は
38
価格を合意してから販売することができます。いくつかの国は、精算または定価承認を得るために、特定の候補製品の費用対効果を現在利用可能な治療法(いわゆる健康技術評価、またはHTA)と比較することを追加的な研究の完了を要求する可能性がある。例えば、EUはその加盟国に様々な選択を提供し、その国の健康保険制度が精算を提供する製品範囲を制限し、人が使用する医療製品の価格を制御している。EU加盟国は製品の具体的な価格を承認することができ、その製品を市場に投入する会社の収益力を直接または間接的に制御する制度をとることもできる。他のEU加盟国は会社が自分の製品価格を固定することを許可したが、処方量を監視と制御し、医師に指導を発表して処方を制限した。最近、EUの多くの国は薬品の価格設定に必要な割引レベルを高め、各国が医療支出を管理しようとしているに伴い、これらの努力は継続する可能性があり、特にEUの多くの国が深刻な財政危機と債務危機を経験した場合には、これらの努力が継続される可能性がある。全体的には,医療コスト,特に処方薬の下り圧力が大きくなっている。
そのため、新製品の参入にはますます高い壁が設けられている。政治、経済、規制の発展は定価交渉をさらに複雑化させる可能性があり、補償を受けた後、定価交渉は継続される可能性がある。EU加盟国が使用する参考価格および平行貿易(低価格と高価な加盟国間の裁定)はさらに価格を下げることができる。孤児薬品は特殊な価格設定と精算方法を実行することができる。いかなる薬物と同様に、孤児薬品を精算制度に入れることはよく患者と医療保健システムに対する医療有用性、需要、品質と経済利益に重点を置いている。いずれの医療製品の精算を受けるかはコスト,用途,通常の数量制限を伴う可能性があり,これらの制限も国によって異なる可能性がある。しかも、成果に基づく精算規則が適用される可能性がある。薬品に対して価格制御や精算制限を実施することが保証されていない国は、これらの国で承認されれば、私たちのいかなる製品に対しても有利な精算と定価手配を許可する。
医療保健法律法規
医療保健提供者と第三者支払人は推薦と処方が発売承認された薬品の面で主要な役割を果たしている。プロバイダ、カウンセラー、第三者支払者および顧客との配置は、広く適用される可能性のある詐欺および乱用、リベート、虚偽申告法、医師および教育医への支払いの報告、および患者のプライバシーに関する法律法規およびその他、私たちの業務および/または財務的手配を制限する可能性のある医療法令の制約を受ける可能性があります。適用される連邦と州医療に関する法律によると
39
いくつかの州および他の法律は、製薬会社が製薬業の自発的コンプライアンスガイドラインと連邦政府が公布した関連コンプライアンスガイドラインを遵守することを要求し、また、製薬業者に医師および他の医療保健提供者またはマーケティング支出に支払うことに関する情報を報告することを要求する。
州法や他の法律も健康情報のプライバシーやセキュリティを管理している場合があり,その多くの法律は互いに大きく異なり,HIPAAに先を越されず,コンプライアンス作業を複雑にしていることが多い.例えば、カリフォルニア州では、“カリフォルニア消費者保護法”(CCPA)は、カバーする企業のために包括的なプライバシーフレームワークを構築し、方法は、個人情報の定義を拡大し、カリフォルニア州の消費者のための新しいデータプライバシー権を確立し、未成年者から消費者データを収集するための特別な規則を実施し、CCPAに違反する行為および合理的なセキュリティプログラムおよび慣行を実施していない企業のために、データ漏洩を防止するための新たな深刻な法定損害賠償枠組みを作成することである。HIPAAが管轄する臨床試験データや情報は現在のバージョンのCCPAに制限されていないが,他の個人情報が適用可能であり,CCPAへの変更がその範囲を拡大する可能性がある。また、カリフォルニアプライバシー権法案(CPRA)は立法がカバーする会社に追加的な義務を課している。CPRAはいくつかの敏感な個人情報における消費者の権利を拡大することを含むCCPAを大幅に修正した。
他の多くの州でも似たような法律が採択され、他の州も似たような新しいプライバシー法を提案した。このような提案された立法が通過されると、追加の複雑性、要求変化、制限、および潜在的な法的リスクが増加する可能性があり、コンプライアンス計画、影響戦略、および以前の有用なデータの利用可能性に追加のリソースを投入する必要があり、コンプライアンスコストの増加および/またはビジネス実践および政策の変化をもたらす可能性がある。アメリカの異なる州に包括的なプライバシー法が存在することは、私たちのコンプライアンス義務をより複雑で費用を高くし、私たちが法執行行動を受けたり、他の方法でコンプライアンスによって責任を負う可能性を増加させるかもしれない。健康情報を専門に管理する州もある。例えば、ワシントン州は最近、健康情報の収集と共有を規範化する健康プライバシー法を採択し、この法律はまた個人的な訴権を有し、関連するコンプライアンスリスクをさらに増加させる。コネチカット州とネバダ州も同様の法律を採択して消費者の健康データを規制している。さらに、他の州は、特定のタイプの情報を規制するプライバシーおよび/またはセキュリティを規制する立法を提案および/または通過している。例えば、少数の州は生物学的特徴データを専門的に管理する法律を採択した。これらの異なるプライバシーとセキュリティ法律は、私たちの研究対象の識別、ビジネスパートナーとの関係、そして最終的に私たちの製品のマーケティングと流通を含む、私たちのビジネス活動に影響を与えるかもしれません。州法は急速に変化しており、米国議会は新たな包括的な連邦データプライバシー法を検討しており、公布されれば、私たちは同法の主体になる可能性がある。
また、外国司法管轄区域のデータプライバシーおよびセキュリティ法律法規は、EUのGDPRのような米国よりも厳しい可能性がある。
これらの変化するコンプライアンスおよび業務要件は、組織変革、追加保護技術の実施、従業員の研修、コンサルタントおよび法律顧問の招聘に関連するコストなど、大きなコストをもたらし、これらのコストは時間とともに増加する可能性がある。さらに、このような要求は、管理層の時間を利用して、および/または他の計画およびプロジェクトからリソースを転送するために、私たちのデータ処理実践およびポリシーを修正する必要があるかもしれません。私たちは、データのプライバシーおよびセキュリティに関連する任意の適用可能な連邦、州または外国の法律および法規を遵守できないか、または遵守できないと考えられており、いくつかの司法管轄区における集団訴訟プライバシー訴訟を含む政府機関または他の第三者の訴訟または訴訟を引き起こす可能性があり、これは、巨額の罰金、制裁、裁決、禁止、罰または判決に直面することになる。どんな種類でも
40
上記の状況は、私たちの業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
医療改革
アメリカの医療業界と他の地域の主な傾向の一つはコストコントロールだ。過去数年間、連邦と州政府は薬品と生物製薬製品の定価制限、薬品と他の医療製品のカバー範囲と精算、政府制御及びアメリカ医療保健システムの他の改革に関する多くの提案を提出した。
例えば、米国と州政府は医療コストの削減を目的とした立法を提案し、採択し続けている。2010年3月、米国議会は、政府医療計画下の製品のカバー範囲の変更と支払い方法を含むACAを公布した。ACAにおいて私たちの潜在的な製品候補製品に重要な意味を持つ条項は、以下のことを含む
ACAが公布されて以来、アメリカはまた他の立法改正を提案し、採択した。例えば、2011年の予算制御法は、他を除いて、各年度に提供者に支払われる医療保険の総減少幅を含めて最大2%に達し、2031年まで有効となる。また,2010年に法定の現金支払法,あるいはPAYGOは,連邦医療保険に対して4%の支払いを自動的に削減し,ある提供者に影響を与えることを求めている。これらの削減は2023年1月1日に発効する予定だったが、2023年の総合支出法案はさらにこれらの削減を2025年に延期した。2012年の“米国納税者救済法”は,他にも,病院,イメージングセンター,癌治療センターを含むいくつかの医療サービス提供者に支払う医療保険をさらに減少させ,政府が提供者に多額を取り戻す訴訟時効期間を3年から5年に延長した。また、2021年1月1日から、“2021年米国救援計画法案”は単一源と革新者多源薬に対する法定医療補助薬品リベート上限を廃止し、現在この上限は薬品メーカーの平均価格の100%に設定されている。これらの法律および法規は、連邦医療保険および他の医療資金のさらなる減少をもたらし、他の方法で、規制によって承認される可能性のある任意の候補製品の価格、またはそのような任意の候補製品の処方または使用頻度に影響を与える可能性がある。
公布以来、ACAのいくつかの側面は多くの司法、行政、行政、立法方面の挑戦を受けており、私たちは今後もACAに対してより多くの挑戦と修正案を提出することが予想される。バイデン政府の他の医療改革措置や他の挑戦,ACAの廃止または代替の努力(あれば)が我々の業務にどのように影響するかは不明である。
連邦レベルでは、FDAは2020年に実施条例を発表し、各州がカナダからの薬品輸入計画をどのように制定し、提出するかを規定している。同様に2020年には,CMSは各州がこの規則に基づいて輸入した薬物は連邦医療補助薬品還付を受ける資格がなく,メーカーも“最適価格”や平均メーカー価格の目的でこれらの薬剤を報告しないと述べている。輸入薬は外来薬をカバーしているとはみなされていないため、CMSはさらに、これらの薬物の全国平均薬品調達コストを公表しないと述べた。2024年1月5日,フロリダ州は米国で初めてFDAの承認を得てカナダからある処方薬を輸入した州となった。カナダからの薬品の輸入は私たちの価格に実質的な悪影響を及ぼすかもしれません
41
私たちのすべての候補製品を受け取ります。
また、2020年12月2日、HHSは薬品メーカーがD部分の下で発起人の値下げを計画する安全港保護を取り消し、法律が値下げを要求しない限り、直接或いは薬局福祉マネージャーを通過する法規を発表した。この規定はまた、販売時点での値下げを反映するための新しい避難港を作成し、薬局福祉マネージャーと製造業者との間のいくつかの固定料金手配のための避難港を作成する。裁判所の命令により,上記安全港の除去と増加は延期され,最近の立法は同規則の実施を2026年1月1日に一時停止した。この期限は両党のより安全なコミュニティ法案によってさらに2027年1月1日に延期され、その後、2022年インフレ削減法案(IRA)によって2032年1月1日に延期された。
政府はメーカーがその市場製品の価格設定の方式についてもより厳格な審査を行い、最近の国会で数回の調査を行い、製品定価の透明性を高め、定価とメーカー患者計画との関係を審査し、政府の薬品の精算方法を改革するための法案を提出した。アメリカの個別州もますます積極的に薬品の価格を制御するための立法と法規を制定し、実施しており、価格或いは患者の精算制限、割引、ある製品への参入の制限、マーケティングコストの開示と透明性措置を含み、場合によっては、他の国からの輸入と大量購入を奨励することを目的としている。
アイルランド共和軍は2022年8月に法律に署名した。IRAは、米国政府がMedicare B部分およびD部分の価格上限を交渉および設定することを可能にする条項を含むいくつかの条項を含み、これらの条項は、模造薬または生物類似競争が存在することなく、いくつかの高コスト、単一源の薬物および生物製品の価格を対象としている;以下の態様の自己負担上限を減少させる
2025年から連邦医療保険D部分受益者は2,000ドルを獲得し,連邦医療保険部分のいわゆる“ドーナツ穴”を効果的に解消する
D;企業に、薬品価格がインフレよりも速い場合に連邦医療保険にリベートを支払うことを要求することと、薬局福祉マネージャーが受け取ることができる費用と、他の分野とを制限するリベート規則とを遅延させる。Ireland共和軍が私たちの業務と医療産業全体に及ぼす影響はまだ明確ではない。
州レベルでは、各州はますます積極的に、価格または患者の精算制限、割引、ある製品への参入の制限、マーケティングコストの開示および透明性措置を含む薬品および生物製品の価格設定を制御するための法規を立法と実施し、場合によっては、他の国からの輸入と大量購入を奨励することを目的としている。また、地域衛生保健当局や個別病院は、どの薬品やサプライヤーが彼らの処方薬や他の医療計画に含まれるかを決定するために入札プログラムを使用することが増えている。これらの措置が承認されると、私たちの製品に対する最終的な需要を下げたり、私たちの製品の価格設定に圧力をかけるかもしれません。私たちは将来、より多くの州と連邦医療改革措置を取ることが予想され、そのいずれも連邦と州政府が医療製品やサービスのために支払う金額を制限する可能性があり、これは私たちの候補製品に対する需要の減少または追加の価格設定圧力を招く可能性がある。
米国および世界の他の司法管轄地域、ならびに米国または他の司法管轄区域内のいくつかの地域、州および/または地方レベルでは、医療の獲得可能性を拡大し、医療コストを制御または低減することを目的とした立法および規制提案が継続されている可能性がある。これらの改革は、市場で承認された候補製品の予想収入の開発に成功し、我々の全体的な財務状況や候補製品を開発する能力に影響を与える可能性がある。
法規を付加する
これらの規定に加えて,環境保全や有害物質に関する州や連邦法には,“職業安全と健康法”,“資源保護·回収法”,“有毒物質制御法”が含まれており,我々の業務に影響を与える。これらの法律や他の法律は,様々な生物,化学,放射性物質の使用,処理,処分を管理しており,これらの物質は作業,作業から発生する廃棄物に用いられている。もし私たちの運営が環境汚染を招いたり、個人を危険物質に曝露させたりすれば、損害賠償と政府罰金の責任を負う可能性があります。似たような義務を加えた第3国もまた同等の法律を採択した。
人力資本
2023年12月31日現在、私たちは407人のフルタイム従業員がいます。労働組合の代表者たちはいないし、集団交渉協定も守られていない。ほとんどの従業員はマサチューセッツ州ボストンにいて、また従業員はマサチューセッツ州フレミンガム、使命湾、カリフォルニア州とスイスにいます。74人の従業員が製薬博士号を持っている。医学博士号を取得しています355人は主に研究開発または技術業務に従事し、52人は商業発展、財務、情報システム、施設、人的資源、法律機能または行政支援に従事している。私たちは私たちの従業員が仲がいいと思う。
私たちは企業責任の最高基準で業務を展開するために努力している。私たちの目標は、多様で情熱的な文化を構築し、患者、私たちのコミュニティ、より広い社会に積極的に影響を与えるように努力することだ。私たちの人的資本資源
42
優先順位は私たちの既存と新入社員を誘致、採用、維持、激励、統合することを含む。私たちは多様性、公平、そして包容的な職場が私たちの会社が私たちの使命を最善に果たすことができると信じている。私たちは、会社全体の多様性を増加させ、私たちの従業員と私たちがサービスするコミュニティを支援する包括的な労働環境を作るために努力し続けています。私たちは会社のこの重点を拡大するために努力している多元化、公平、そして包容委員会を設立した。私たちが事業を展開しているすべての国で、私たちの政策は職場差別に関するすべての適用法律を完全に遵守することです。私たちは性別、人種、民族、年齢、障害、性指向、性別アイデンティティ、文化背景、宗教信仰を問わず、最も優秀な人材を募集することに力を入れている。
私たちの全面的な株式、現金給与と福祉計画の主な目的は、新入社員と既存従業員を誘致、激励、維持、奨励することである。私たちは一連の報酬要素を使用してこれを達成し、これらの要素は私たちの短期目標の達成と長期業績をバランスさせている。また、従業員は、医療、歯科、生命保険、障害保険計画を含む私たちの退職、健康および福祉計画など、私たちの標準従業員福祉計画に参加する資格があります。私たちはまた、従業員に納税条件に合った退職計画や401(K)計画に参加する機会を提供し、当社の業界の他の会社と競争力を持つ401(K)計画に応じて貢献することができます。
我々の人的資本資源戦略は全面的であり、私たちの核心的な仕事方式をめぐって構築されたものであると考えている:協力、勇敢、創業と結果をガイドとする。著者らは従業員の調査、訓練と発展計画及びその他の計画を通じて、技能発展課程、マネージャー訓練、リーダーシップ発展機会、授業料精算と強力なオンライン課程訓練庫を含み、各種の発展テーマに参考を提供し、それによって私たちの従業員と強固な関係を構築する。組織内の各職能部門の伝統的な昇進以外に、私たちは職能を越えた職業発展の道を支持する。私たちは私たちの発展とともに私たちの人的資本資源キットを発展させて増加させることを計画している。
インターネット上で提供される情報は
投資家や他の人は、投資家関係サイト(http://crisprtx.gcs-web.com/)、米国証券取引委員会の届出ファイル、プレスリリース、公開電話会議、ネットワーク放送を介して投資家に重要な情報を発表していることに注意すべきである。私たちはこれらのチャンネルとソーシャルメディアを使って私たちの会社、私たちの業務、私たちの製品候補者、その他の事項を大衆と交流します。私たちがソーシャルメディアで発表した情報は実質的な情報と考えられるかもしれない。そこで、私たちは、投資家、メディア、およびわが社に興味を持っている他の人が、投資家関係サイトに列挙されたソーシャルメディアチャネルで発表された情報を審査することを奨励します。私たちの10-Kフォームの年次報告、10-Qフォームの四半期報告、8-Kフォームの現在の報告は、証拠品、依頼書、および情報声明、および取引法第13(A)および15(D)条に基づいて提出または提供された報告書の修正案を含み、これらの材料を電子的にアーカイブまたは米国証券取引委員会ウェブサイト(http://www.sec.gov)に提供した後、合理的で実行可能な範囲内でできるだけ早く私たちのサイトで無料で取得することができる。
43
第1 A項。RISK因子です。
この報告書には危険と不確実な要素に関する前向きな陳述が含まれている。私たちの実際の結果は本報告書で議論された結果と大きく異なるかもしれない。これらの差異をもたらすか、または促進する可能性のある要因は、本報告の以下および他の部分的に説明される要素、および参照によって本報告の任意の文書に組み込まれる要素を含むが、これらに限定されない。
以下のリスク要因と、当社の財務諸表とその付記、および米国証券取引委員会に提出された他の文書を含む本報告書の他のすべての情報を慎重に考慮しなければなりません。以下のいずれかのリスク、または現在知られていないか、または現在重大でないと考えている他のリスクが実際のイベントに発展している場合、私たちの業務、財務状況、運営結果、または将来性は、重大な悪影響を受ける可能性がある。このような状況が発生すれば、私たちの普通株の市場価格は下落する可能性があり、株主は彼らの投資の全部または一部を損失する可能性がある。
私たちの財務状況と追加資本需要に関連するリスク
私たちが始めて以来、私たちは大きな運営赤字が発生しており、予測可能な未来に損失を被っていくと予想されています。
私たちは私たちの株式証券を公開と非公開で発行し、私たちの優先株を非公開で販売し、転換可能な融資と戦略パートナーとの協力協定を通じて、私たちの運営に資金を提供します。私たちは2021年12月31日までの1年間にVertexとのプリペイドにより利益を実現していますが、今後数年は利益を上げないと予想しています。私たちのこれまでの損失は、予想された将来の赤字に加え、株主赤字や運営資本に悪影響を与え続けるだろう。私たちの費用は大幅に増加すると予想されています
したがって、予測可能な未来には、重大で増加していく運営損失を受け続けることが予想される。候補遺伝子編集製品の開発に関連する多くのリスクや不確実性のため,将来の損失の程度やいつ利益を達成するかは予測できない(あれば).私たちが本当に利益を達成したとしても、私たちは四半期や年度の収益性を維持したり向上させることができないかもしれない。
私たちは私たちの株主を希釈するために多くの追加資金を調達する必要があるだろう。もし私たちが必要な時に資金を調達できなければ、私たちはいくつかの製品開発計画や商業化努力を延期、減少、または廃止することを余儀なくされるだろう。
候補遺伝子編集製品の開発は資本集約型である。私たちが行っている活動に関連する費用は増加することが予想されます。特に、私たちが研究と開発を続け、臨床前研究と臨床試験を開始し、私たちの候補製品のためにマーケティング承認を求める時。また、私たちと私たちのパートナーVertexは2023年にいくつかの司法管轄区域でCRISPRに基づく遺伝子編集療法CASGEVYの初発売承認を得、2024年にその後の承認を得たため、もし私たちの候補製品がマーケティング承認を得た場合、このような販売、マーケティング、製造、流通に関連する巨額の商業化費用が発生することが予想されます。このような販売、マーケティング、製造および流通はバイエル、Vertex、または他の未来のパートナーの責任ではありません。もし私たちが私たちの候補製品のためにより多くの兆候や地理的位置を求めることを選択したり、他の方法で私たちが現在予想しているよりも早く拡張するならば、私たちはまたもっと早く追加資金を調達する必要があるかもしれない。したがって、私たちは次のような点で多くの追加資金を得る必要があるだろう
44
私たちの継続的な運営に伴い。もし私たちが必要な時や魅力的な条件下で資金を調達できない場合、私たちはいくつかの研究開発計画や将来の商業化努力を延期、減少、または廃止することを余儀なくされるだろう。
私たちは2023年12月31日と2022年12月31日までに、それぞれ約16.957億ドルの現金、現金等価物、18.684億ドルの有価証券を持っている。2023年12月31日まで、私たちの手元には現金、現金等価物、および有価証券があり、現金、現金等価物、および有価証券は、少なくとも今後24ヶ月以内に現在の運営計画に資金を提供するのに十分であると予想されます。
私たちの将来の資本需要は多くの要素に依存し、それによって大幅に増加するかもしれない
いかなる追加的な拠出努力も、私たちの経営陣の日常活動に対する関心を移すかもしれません。これは、私たちの候補製品を開発し、商業化する能力に悪影響を及ぼすかもしれません。私たちは未来の融資が十分な金額または私たちが受け入れられる条項で提供されることを保証できない。さらに、任意の融資条項は、私たちの株主の持株や権利に悪影響を及ぼす可能性があり、私たちが追加証券(株式や債務を問わず)、またはそのような証券を発行する可能性は、私たちの株式の市場価格の下落を招く可能性があります。追加の持分または変換可能な証券の売却は、清算または他の特典を含む可能性があり、株主としての権利に悪影響を及ぼす可能性がある私たちのすべての株主の権益を希釈します。債務の発生は固定支払義務の増加を招き、私たちは追加債務を発生させる能力の制限、私たちが知的財産権を得ることができるかもしれない能力の制限、私たちの業務を展開する能力に悪影響を及ぼす可能性のある他の運営制限など、いくつかの限定的な条約に同意する必要があるかもしれない。私たちはまた、他の場合ではなく、パートナーとの手配や他の方法で資金を求めることが要求される可能性があり、私たちは、私たちのいくつかの技術または候補製品の権利を放棄するか、または他の方法で私たちに不利な条項に同意することを要求されるかもしれません。いずれも、私たちの業務、運営結果、および見通しに大きな悪影響を及ぼす可能性があります。
もし私たちがタイムリーに資金を得ることができなければ、私たちは私たちの1つ以上の研究開発計画や任意の候補製品の商業化を大幅に削減、延期または停止することを要求されるかもしれないし、必要に応じて私たちの業務を拡大したり、他の方法で私たちのビジネスチャンスを利用することができなくなり、これは私たちの業務、財務状況、運営結果に大きな影響を与えるかもしれない。
私たちの運営歴史は限られていて、これは私たちの技術と製品開発能力の評価と私たちの将来の業績を予測することを困難にするかもしれません。
私たちの全体開発は進行中で、私たちの任意の候補製品の最初の臨床試験は2018年末に開始されました。一般的に、私たちの計画は臨床前と臨床開発が必要である;複数の司法管轄区域で監督とマーケティングの許可を得る;製造供給、生産能力と専門知識を得る;商業組織を設立する;大量の投資と重大なマーケティング仕事を行って、それから製品販売から任意の収入を得ることができる。私たちの候補製品は承認されなければなりません
45
FDAまたはEMAを含むいくつかの他の衛生規制機関のマーケティングは、任意の製品を商業化することができる前に。私たちとパートナーのVertexは2023年にいくつかの司法管轄区域でCRISPRに基づく遺伝子編集療法CASGEVYの初発売承認を得、2024年にその後の承認を得たにもかかわらず、私たちとVertexがCASGEVYの追加マーケティング承認を得ること、または将来他の候補製品のマーケティング承認を得ることを保証することはできない。もっと詳しくは“を参照してください”リスク要因-私たちの第三者との関係に関するリスク-私たちはVertexと私たちのLead計画CASGEVY上でパートナーシップを構築しました;VertexはCASGEVY計画に対して重要な制御権を持っています“と”リスク要因-私たちの業務、技術、業界に関連するリスク-私たちの候補製品を臨床開発に進め、監督管理の承認を得て、最終的に私たちの候補製品を商業化することができなければ、あるいはそうする過程で重大な遅延に遭遇すれば、私たちの業務は実質的に損害を受けるだろう。”
私たちの限られた運営の歴史、特に急速に発展する遺伝子編集分野を考慮すると、私たちの技術や業界を評価し、私たちの将来の表現を予測することが困難になるかもしれません。私たちの運営会社としての短い歴史は、私たちの未来の成功や生存能力のどの評価も重大な不確実性の影響を受けるようにした。私たちは急速に発展する分野でスタートアップ企業がよく直面するリスクと困難に直面するだろう。もし私たちがこのような危険にうまく対応できなければ、私たちの業務は影響を受けるだろう。同様に、様々な要因により、私たちの財務状況と経営業績は四半期ごとに毎年大幅に変動し、その多くの要素は私たちがコントロールできないと予想しています。したがって、我々の株主は、将来の経営業績の指標として、いかなる四半期や年度の業績にも依存すべきではない。
また,発展段階の会社として,予見できない費用,困難,合併症,遅延などの既知と未知の状況に遭遇した。私たちが候補製品の発展を進めるにつれて、研究に集中している会社から、研究、開発、製造、商業化に専念する会社に移行し続ける必要があります。そのような移行で、私たちは成功しないかもしれない。
私たちはスイスで税金の繰越を使用する能力が限られているかもしれない。
スイスの法律によると、私たちは7年以内に私たちが受けた損失を繰り越す権利があり、私たちは未来の利益を相殺することができ、もしあれば、これらの損失を相殺することができる。税収損失は課税利益と相殺されたときにのみ税務機関が最終評価を行う(私たちが損失していれば、状況はそうではない)。使用しなければ、このような税金損失は発生当時の7年後に満期になるだろう。私たちの収入は限られており、繰越された税金損失は一部または全部満期の高いリスクがあるため、将来の現金税支払いを減らすために使用されない。
私たちのビジネス、技術、業界に関連するリスク
私たちの候補製品を臨床開発に進めることができず、規制部門の承認を得ることができず、最終的に私たちの候補製品を商業化するか、あるいはこの点で重大な遅延があれば、私たちの業務は実質的に損害を受けるだろう。
我々の開発作業は進行中であり,これまで我々の研究と開発は主にCRISPR/CAS 9,遺伝子編集技術,我々の最初の候補製品に集中してきた.私たちの将来の成功は私たちのCRISPR/Cas 9の次世代候補遺伝子編集製品の成功に大きくかかっている。私たちは私たちの現在の候補製品を決定して開発するためにほとんどの努力と財力を投入した。私たちが製品収入を作る能力は、私たちの候補製品の成功開発と最終商業化に大きく依存し、これは決して起こらないかもしれない。例えば、私たちとパートナーVertexは2023年にいくつかの司法管轄区域でCASGEVYの上場承認を得、2024年にその後の承認を得たが、私たちとVertexがCASGEVYの追加マーケティング承認を得ることは保証されないか、あるいは将来的に私たちの他の候補製品のマーケティング承認を獲得し、現在および将来的に第三者との協力協定に制約された他の計画を含む、様々な理由で潜在的な臨床開発候補製品を決定できない可能性があり、あるいは臨床開発を通じて任意の候補製品を成功させることができない可能性がある。私たちの潜在的候補製品または私たちの潜在的候補製品は、有害な副作用を有することが証明される可能性があり、または他の特徴または予見不可能な結果を有する可能性があり、候補製品が生産に適用されないか、販売できないか、または上場承認を得ることができないか、または人身傷害/製品責任クレーム、不良または深刻な有害事象、規制法執行行動、製品リコール、または市場撤回を含む、製品に関連するクレームまたは訴訟を引き起こす可能性がある。私たちは現在どんな製品の販売からも収入を得ていません。私たちは永遠に適切な製品を研究、開発、あるいは商業化することができないかもしれません。
著者らは監督機関にアメリカ研究用新薬(IND)申請、臨床試験申請(CTA)或いはその等価物を提出しなければ、臨床試験を開始することができない。任意の候補製品のCTAまたはINDの届出は、他の活動に加えて、許容可能な効率を有する1つまたは複数のガイドRNAを決定および選択する必要がある。また、任意の未来の臨床試験を開始するには、ヨーロッパの監督管理機関或いは同等の機関が私たちのCTA或いはFDAの私たちのINDに対する認可を受け、そして適用監督機関との討論に基づいて最終的に試験設計を確定する必要がある。もしヨーロッパの規制機関、FDA、あるいはその類似機関が追加の臨床前研究の完成を要求した場合、あるいは私たちが他の要求を満たすことを要求された場合、私たちの臨床試験は延期されるかもしれない。私たちがこれらの規制機関の指導を受けて導入された後であっても、彼らは私たちが臨床試験を開始する要求を満たしていることに同意しないかもしれません
46
私たちの試験設計または選択された臨床終点は、追加の臨床前研究または臨床試験を完成させるか、または現在予想されているよりも厳しい承認条件を適用する必要があるかもしれない。さらに、FDAまたは他の同様の衛生規制機関は、CASGEVYに適用される同じ規制経路および要求を、私たちのすべてのCRISPR/Cas 9候補製品に適用し続けるかどうか、他のものに適用されている離体する工学療法と体内にある治療します。
利益を実現し、維持するためには、巨大な市場潜在力を持つ候補製品を開発し、商業化しなければならず、一連の挑戦的な活動で成功することが求められる。一般的に、私たちの候補製品は臨床前と臨床開発が必要である;複数の司法管轄区域で監督とマーケティングの許可を得る;製造供給、生産能力と専門知識を獲得する;商業組織を設立する;大量の投資と重大なマーケティング仕事を行って、それから製品販売から任意の収入を得ることができる。また、私たちの候補製品が商業化される前に、私たちの製品開発計画はFDA、EMA、またはいくつかの他の衛生規制機関の承認を得なければ発売できない。私たちは決してこのような活動やすべての活動で成功しないかもしれないし、たとえ私たちが成功しても、私たちは利益を達成するのに十分な収入や十分な収入を生むことができないかもしれない。私たちとパートナーのVertexは2023年にいくつかの司法管轄区域でCRISPRに基づく遺伝子編集療法CASGEVYの初発売承認を得、2024年に後続承認を得たが、私たちとVertexがCASGEVYの追加マーケティング承認を得ることは保証されないし、将来的に他の候補製品のマーケティング承認を得ることもできず、CASGEVYや私たちが開発した他の任意の未来の候補製品が利益を上げることも保証されない。もっと詳しくは“を参照してください”リスク要因-私たちの第三者との関係に関するリスク-私たちはVertexと私たちのLead計画CASGEVY上でパートナーシップを構築しました;VertexはCASGEVY計画に対して重要な制御権を持っています.”
もし私たちが確実に利益を達成したら、私たちは四半期や年度の収益性を維持したり向上させることができないかもしれない。もし私たちが達成して利益を維持できなければ、私たちの価値を下げ、資金を調達し、研究開発努力を維持し、業務を拡大し、あるいは運営を継続する能力を弱める可能性がある。私たちの価値の低下はまた株主が投資の全部または一部を失うことを招くかもしれない。
私たちの候補製品の成功は以下のいくつかの要素に依存するだろう
また、私たちの技術は多種の細胞と組織タイプの遺伝子編集に関連しているため、私たちは遺伝子療法が直面している多くの挑戦とリスクに直面している
47
もし私たちがこれらの要素のうちの1つまたは複数でタイムリーまたは根本的に成功できなければ、私たちは重大な遅延に遭遇したり、私たちの候補製品を商業化することに成功しなかったりする可能性があり、これは私たちの業務に深刻な損害を与えるだろう。最終的に、私たちの候補製品が規制部門の承認を得られなければ、私たちは運営を続けることができないかもしれない。
また、任意の候補製品が安全や効能の問題、開発遅延、規制問題、または他の問題に遭遇した場合、私たちの開発計画や業務は深刻な損害を受ける可能性があります。上記の理由から、規制当局、特にFDAは、すでに要求されており、将来的にゲノム編集製品のより多くの臨床前研究、例えば毒性学、生物分布または生殖健康に関連するより多くの研究、および/または他の治療法と比較して臨床開発早期の臨床前研究を行うことが要求される可能性がある。FDAはこれまで、CTX 112およびCTX 131を含むいくつかの臨床試験のために提出されたINDを承認してきたが、FDAは要求を加える可能性があり、私たちの任意の計画またはその規制承認が延期される可能性がある。もし私たちが必要な研究を満足に達成できない場合、FDAまたは他の規制機関は、いくつかの患者集団を臨床研究から除外し、私たちの臨床研究を一時停止すること、またはさらなる臨床研究を停止すること、またはそのような候補製品の承認を拒否することを要求することができる。また開発中の競争相手は離体するあるいは…体内にある同様の技術を有する製品は、候補製品または計画の問題に遭遇する可能性があり、これは、候補製品および計画の問題を識別すること、またはFDAまたは他の規制機関に追加的な要求を加えることをもたらす可能性があり、候補製品の開発を遅延または一時停止させる可能性がある。これらの状況のいずれも、候補製品を識別し開発する能力を損なう可能性があり、私たちの業務、財務状況、運営結果、および将来性を深刻に損なう可能性があります。FDAまたは他の規制機関が将来彼らの要求を変更しないか、私たちのINDまたは同等の規制文書の修正を承認することは保証できません。私たちの予想されるスケジュール上のCTX 310およびCTX 320、または私たちの他の候補製品を含む。
我々のCRISPR/Cas 9遺伝子編集製品候補製品は、比較的新しい遺伝子編集技術に基づいており、これにより、開発およびその後に規制承認を得る時間およびコスト(あれば)を予測することは困難である。遺伝子編集技術に基づく候補製品の臨床試験数は限られている。
我々の目標は、重大な疾患を有する人のための変革的な遺伝子ベースの薬物による治療法および治療法の開発であり、離体する工学的細胞療法と体内にある治療します。近年、遺伝子治療とゲノム編集領域で重大な進展を得ているが、CRISPR/Cas 9遺伝子編集技術を含むが、これらの技術は体内にある特にCRISPRに基づくゲノム編集技術は比較的新しい技術であり,このような遺伝子編集技術に基づく候補製品の臨床試験は限られた数しか開始されておらず,その治療効果は大きく確認されていない。そのため、著者らの候補製品が製品の発見或いは鑑定、臨床前研究と臨床試験過程において遭遇する可能性のある開発挑戦を正確に予測することは困難である。例えばゲノム編集はありません体内にある治療はFDAや他の規制機関によって承認された。私たちとパートナーのVertexが初めて承認された時体外でCRISPRに基づく遺伝子編集療法CASGEVYは2023年にある司法管轄区域で承認され、2024年に後続の承認を受けるが、私たちとVertexはCASGEVYの追加発売承認を得ることが保証されないか、あるいは将来的に他の候補製品の発売承認を得ることができる。また,我々は最近いくつかの他の候補製品の臨床試験を開始したため,ヒトの安全性を完全に評価することはできない。我々が開発したどの候補製品の治療も長期的な影響を与える可能性があり,現時点では予測できない。我々が開発可能などの候補製品もDNAレベルで機能し,また,動物DNAはヒトDNAとは異なるため,動物モデルで我々の候補品を試験することは,候補製品のヒト臨床試験で観察された安全性や有効性の結果を予測できない可能性がある。さらに、私たちが計画の中で追求しているいくつかの疾患を選択するためには、動物モデルは存在しないかもしれない。これらの要因により,製品候補開発の時間やコストを予測することは困難であり,適用するかどうかも予測できない
48
我々の遺伝子編集技術、または任意の類似または競合する遺伝子編集技術は、任意の製品の識別、開発、および規制承認をもたらす。我々が将来遭遇する我々の遺伝子編集技術や我々の任意の研究開発計画に関連する開発問題が重大な遅延や意外なコストを招くことは保証できず,このような開発問題が解決されることも保証されない.これらの要因のいずれも、前臨床研究または開始可能な任意の臨床試験を完了することを阻止するか、またはタイムリーまたは利益的に開発される可能性のある任意の候補製品を商業化することができる。
FDA、EMAとその他の監督機関の臨床試験要求及びこれらの監督管理機関は候補製品の安全性と有効性を決定するための標準は、候補製品のタイプ、複雑性、意外性及び期待用途と市場によって大きく異なる。私たちとパートナーのVertexは2023年にいくつかの司法管轄区でCASGEVYの上場承認を得、2024年に後続の承認を得たにもかかわらず、私たちとVertexがCASGEVYの追加マーケティング承認を得ることを保証することはできません、あるいは将来的に他の候補製品のマーケティング承認を得て、選択製品の監督管理プロセスの承認を待つことはまだ確定しておらず、他のより有名で広く研究されている技術に基づく候補製品の承認プロセスよりも時間がかかる可能性があります。我々の将来の候補製品が米国やEUで規制部門の承認を得るのにどのくらいの時間がかかるかを決定することは困難であり、私たちの候補製品が商業化にどのくらい時間がかかるかを決定することも困難である。潜在的な候補製品を市場に投入するために必要な監督管理の承認を遅延または獲得できなかった場合、または監督管理の承認を得る意外なコストは、私たちが十分な製品収入を生成する能力を低下させる可能性があり、私たちの業務、財務状況、運営結果、および見通しが損なわれる可能性がある。
著者らが設計した同種異体T細胞候補製品は癌を治療する新しい方法を代表し、これは私たちに大きな挑戦をもたらした。
我々の免疫腫瘍学プロジェクトでは、いくつかの癌を有する任意の患者のためのキメラ抗原受容体またはCARSを発現することができる健康ドナーのT細胞から改造された一連の候補同種T細胞製品(例えば、CTX 112およびCTX 131を含む)を開発している。自己CAR T療法とは異なり,同種異体CAR T療法では,健康なドナー材料に依存して候補品を生産している。健康ドナーT細胞のタイプと品質はそれぞれ異なり、このような変異は生産標準化された同種異体CAR候補製品を挑戦的にし、これらの候補製品の開発と商業化の道を不確定にした。
我々は,我々のCAR候補T細胞製品の生産に使用するT細胞の品質と整合性を向上させるためのスクリーニングプログラムを開発したが,我々のスクリーニング過程では適切なドナー材料を識別できない可能性があり,生産後に材料の故障が発見される可能性がある。私たちはまた、新しいウイルスをスクリーニングするなど、出現する可能性のある新しいリスクに対応するために、私たちの仕様を更新しなければならないかもしれない。
私たちは規制機関が要求する仕様を含むドナー材料に厳しい仕様を持っている。規格に適合したドナー材料を識別して得ることができず,規制機関と適切な仕様で合意できない場合や,ドナーT細胞の変異性を解決できない場合には,我々が生産している候補製品に不一致が存在する可能性があり,あるいは進行中の臨床試験を予期した時間で開始または継続できない可能性があり,我々の名声を損なう可能性があり,業務や将来性に悪影響を及ぼす可能性がある。
また,承認され開発されている自己CAR T療法は,サイトカイン放出症候群,神経毒性,重篤な感染,長期細胞減少と低C種グロブリン血症,その他患者死亡をきたす重篤な有害事象の発生率が高いことが示されている。私たちは私たちの同種自動車T製品候補製品にも似たような有害事象が発生すると予想しています。また,同種異体CAR T細胞療法を受ける資格があるが,侵襲性癌や自己CAR T細胞療法を待つことができず自己CAR T細胞療法の資格を満たしていない患者は,より大きな合併症や治療死亡リスクに直面している可能性がある。我々の同種CAR T細胞候補製品はまた、移植片対宿主病またはGvHD、または輸液反応など、ドナーと患者との間の差異に関連するユニークな有害事象を引き起こす可能性がある。同種異体T細胞が患者の正常組織が異体であることを認識し始めると、移植片対宿主病を招く。
著者らはCRISPR/Cas 9遺伝子編集技術を設計し、健康ドナーT細胞のT細胞受容体を除去し、著者らの候補製品GvHDのリスクを低下させ、そして細胞表面からI類の主要な組織適合性複合体を除去し、患者の免疫システムが同種異体T細胞を攻撃することを制限し、そしてCAR T細胞の持続性を高める。しかし、私たちの候補製品の遺伝子編集は患者のGvHDまたは早期拒絶のリスクを制限することに成功できないかもしれない。また,われわれの免疫腫瘍学臨床試験の結果は,副作用や予期せぬ特徴の高さと受け入れられない重症度と普遍性を示す可能性がある。
我々の候補製品を服用する際に深刻なGvHDまたは他の有害事象が観察される場合、または任意の候補製品が自己療法または他の同種療法よりも安全または有効であると考えられる場合、同種療法を開発する能力は悪影響を受ける可能性がある。
また,FDAは2023年11月にBCMA指導やCD 19指導の自己キメラ抗原受容体やCAR T細胞免疫療法後に発生したT細胞悪性腫瘍の報告を調査することを発表しており,これまでにこれらの治療を受けた患者にT細胞リンパ腫が出現することが報告されている。2024年1月、FDAは、T細胞悪性腫瘍に関連する新しいセキュリティ情報をすべてのBCMAに含めるべきであることを決定した
49
CD 19遺伝子改変自己T細胞免疫療法。CAR T療法や他の類似行動に対するFDAの調査は、政府規制の増加を招く可能性があり、公衆の不利な認知と宣伝、私たちは異遺伝子CAR T候補薬を開発しているにもかかわらず、FDAの調査は私たちの臨床試験の登録に潜在的な影響を与える可能性があり、私たちの候補製品テストまたは承認の規制遅延、承認された候補製品に対するより厳しいラベル要求、および任意のこのような候補製品に対する需要の減少を招く可能性がある。
FDA,NIH,EMAは遺伝子治療治療の規制に慎重を示しており,遺伝子治療や遺伝子テストの倫理や法律への懸念は,我々の候補製品の開発や商業化に対する追加的な規制や制限を招く可能性があり,予測が困難である可能性がある。
FDA、NIHとEMAは遺伝子治療と遺伝子テストを含む生物技術をさらに規範化する興味があることを示した。例えば,EMAはリスクに基づく方法で遺伝子治療製品の開発を提唱している。米国連邦や州レベルの機関や米国議会委員会や他の政府や管理機関もバイオテクノロジー業界をさらに規制する興味を示している。そのような行動は私たちの候補製品の一部またはすべての商業化を延期または阻止するかもしれない。
アメリカと他の司法管轄区域の遺伝子治療製品に対する監督管理要求はよく変化し、将来も引き続き変化する可能性がある。FDAは遺伝子治療製品に関するいくつかの指導文書を発表した。FDAはその生物製品の評価と研究センター内に治療製品事務室を設置し、遺伝子治療と関連製品の審査を統合し、細胞、組織と遺伝子治療諮問委員会を設置し、この審査に提案を提供した。政府規制機関を除いて,候補製品の臨床試験を行う各機関のIBCとIRB,あるいは適切であれば,あるいは中央IRBは,提案された臨床試験を審査し,試験の安全性を評価する必要がある。さらに、他の人が行った候補遺伝子治療製品の臨床試験の不利な発展は、FDAまたは他の監督機関が私たちの任意の候補製品に対する承認要求を変更する可能性がある。同様に,EMAはEU遺伝子療法の発展を管理しており,遺伝子療法製品の開発やマーケティングライセンスに関する新しいガイドラインを発表することが可能であり,これらの新しいガイドラインの遵守が求められている。これらの規制審査機関および委員会およびそれによって公布された新しい要求またはガイドラインは、追加的な研究や試験を行うことを要求し、私たちの開発コストを増加させ、規制の立場や解釈の変化を招き、候補製品の承認と商業化を延期または阻止し、あるいは重大な承認後の制限または制限を招く可能性がある。私たちが私たちの候補製品を推進し、規制承認を求める時、私たちはこれらの規制機関や委員会と協議し、適用される要求とガイドラインを遵守することを要求される。もし私たちがこれをできなかったら、私たちはこのような候補製品の開発を延期または停止することを要求されるかもしれない。このような追加的な手続きは私たちが予想していたより長く検討と承認過程を招くかもしれない。規制承認手続きの増加または延長あるいは私たちの候補製品開発のさらなる制限による遅延はコストが高い可能性があり、私たちまたは私たちの協力者が適時に臨床試験を完成し、私たちの現在と未来の候補製品を商業化する能力にマイナスの影響を与える可能性がある。
私たちが開発する可能性のある任意の候補製品や私たちが依存する任意の管理プロセスが不良副作用を引き起こす場合、その規制承認を遅延または阻止し、商業潜在力を制限したり、任意の潜在的なマーケティング承認後に重大な負の結果を招く可能性があります。
我々が開発する可能性のある候補製品は、死または脱標的DNA切断、または標的配列以外の位置にDNA切断を導入することを含む、不良または許容できない副作用、予期しない特徴、または他の深刻な有害事象に関連する可能性がある。これらの非標的切断は、DNA中の予期されない位置の遺伝子または遺伝的調節配列の切断を引き起こす可能性があり、または、修復テンプレートとしてDNAの一部を提供する場合、非標的切断イベントの発生後に、そのような修復テンプレートからのDNAが予期されない位置でゲノムに統合され、別の重要な遺伝子またはゲノム要素を潜在的に摂動させる可能性がある。
遺伝物質や遺伝物質を運搬するための製品の他の成分の持続的生物活性により,遺伝子編集療法に曝露した後に不良事象を遅延させる潜在的リスクがある。遺伝子編集製品を用いた治療で起こりうる副作用には,投与後の免疫反応が含まれており,治療の有効性を大きく制限する可能性がある。
免疫療法とそのヒト免疫系を利用した作用方法は強力であり,重篤な副作用をきたす可能性があり,臨床試験でのみこれらの副作用を発見することができる。予測できない副作用は臨床開発過程に出現する可能性があり、あるいは、もしこのような副作用が少ない場合、著者らの候補製品が監督管理機関の許可を得て承認された製品が発売された後、意外な副作用が出現し、より多くの患者の暴露を招く可能性がある。もし私たちのCRISPR/Cas 9遺伝子編集技術が類似した効果を示すならば、私たちは候補製品の臨床前開発、臨床開発あるいは商業化を停止または延期することを決定または延期することができるかもしれない。
我々が開発する可能性のある任意の候補製品によって引き起こされる深刻な有害事象や副作用に加えて、投与過程または関連プログラムも副作用を引き起こす可能性がある。例えば,CASGEVYや登録中のCASGEVY臨床試験を受けた患者は,彼ら自身のCRISPR/Cas 9編集後の造血幹細胞と前駆細胞CASGEVYを返送する
50
患者は幹細胞移植の一部として、この過程は患者が清髄性白丹コンディショニング治療を受けることを含む。幹細胞移植を受けた患者でも服用候補品とは無関係な副作用(軽微から重篤)に遭遇する可能性がある。著者らの免疫治療試験に参加した患者はリンパ浄化方案を受けなければならず、通常深刻な不良事件を引き起こす可能性のあるフルダラビンとシクロホスファミドを含む。これらの方案は一時的、時々長期的な免疫抑制を招くため、患者がある感染に罹患するリスクは増加し、これらの感染は患者によって除去されず、最終的に死亡を招く可能性がある。治療医療従事者たちはどんな副作用も適切に認識したり処理したりしないかもしれない。私たちまたは私たちの協力者は、私たちが開発可能な任意の候補製品を用いて医療従事者を訓練して、私たちの臨床試験およびそのような候補製品の商業化後の副作用を理解することを望んでいる。これらの候補製品に対する潜在的な副作用に対する認識不足或いは管理が不適切であり、患者の負傷或いは死亡を招く可能性がある。いかなる不良または許容できない副作用、意外な特徴、または他の深刻な有害事象が発生した場合、私たち単独またはパートナーと開発した任意の候補製品または製品の臨床試験または商業流通は一時停止または終了する可能性があり、私たちの業務および名声は重大な損害を受ける可能性がある。
将来私たちがこのような有害事象が私たちの候補製品または承認製品以外の要素によって引き起こされることを証明できない場合、FDA、EMAまたは他の同様の衛生規制機関は、任意のまたはすべての目標適応のために開発できる任意の候補製品のさらなる臨床研究を停止するか、または承認を拒否するか、または承認された製品の販売を停止するように命令することができる。将来のすべての深刻な有害事象が製品に関連していないことを証明できても,このような事件は患者募集や入選患者の試験完了能力に影響を与える可能性がある。さらに、私たちが任意の候補製品の臨床試験を延期、一時停止または終了することを選択または要求された場合、その候補製品の商業的将来性が損なわれる可能性があり、これらの候補製品から製品収入を創出する能力が延期またはキャンセルされる可能性がある。これらの状況のいずれも、候補製品を識別し開発する能力を損なう可能性があり、私たちの業務、財務状況、運営結果、および将来性を深刻に損なう可能性があります。
さらに、候補製品の開発に成功し、上場承認を得た場合、FDAは、候補製品を使用した治療の利点が各潜在的患者へのリスクよりも大きいことを確実にするために、リスク評価および緩和策(REMS)を採用することを要求するかもしれないが、製品が患者に配布されるリスクを概説する薬物ガイドライン、医療従事者向けのコミュニケーション計画、広範な患者監視、または業界の典型的な高度に制御され、制限およびコストのより高い流通システムおよびプロセスを含む可能性がある。さらに、もし私たちまたは他の人が後に、私たちが単独で開発した、または私たちの協力者と開発した任意の候補製品による副作用が発見された場合、いくつかの潜在的な重大な負の結果を引き起こす可能性がある
さらに、他の態様で調査された候補遺伝子治療製品は、死亡を含む深刻な有害事象をもたらしており、FDAまたは他の規制機関は、私たちの候補製品と同じカテゴリに属する製品または候補製品の有害事象を意識した後、候補製品の臨床試験を強制的に一時停止する可能性がある。
これらのすべての事件は、私たちの遺伝子編集技術および私たちが決定し、開発する可能性のある任意の候補製品の受け入れの程度を達成または維持することを阻止し、私たちの業務、財務状況、運営結果、および将来性に重大な悪影響を及ぼす可能性がある。
もし私たちが臨床試験の患者登録過程で遅延や困難に遭遇した場合、必要な規制承認を受けることは延期または阻止される可能性がある。
FDAや米国国外の同様の規制機関の要求に従うことができない場合、または必要に応じて所与の試験に適切な統計データを提供することができない場合、私たちまたは私たちの協力者は、私たちが決定または開発した任意の候補製品のために臨床試験を開始または継続することができないかもしれない。私たちが未来に照準を合わせるかもしれないどんな珍しい遺伝子定義疾患に対しても、登録は特に挑戦的かもしれない。さらに、患者がバイオテクノロジー、遺伝子治療または遺伝子編集領域に関連する有害事象の負の宣伝、患者集団のような競争的臨床試験、競合製品との臨床試験または他の理由で私たちの遺伝子編集試験に参加したくない場合、私たちが開発した任意の候補製品の募集患者、研究を行い、監督管理の承認を得る時間が遅れる可能性がある。また,我々の競合他社の一部は候補製品の臨床試験を行っている可能性があり,これらの試験は我々が開発した任意の候補製品の適応と同様であり,そうでなければ我々の臨床試験に参加する資格のある患者が競争相手の候補製品の臨床試験に応募する可能性がある。
51
患者の入選は他の要素の影響を受けています
私たちの臨床試験の登録遅延は、私たちが開発する可能性のある任意の候補製品の開発コストを増加させる可能性があり、これは私たちの価値を低下させ、追加融資を得る能力を制限するだろう。もし私たちまたは私たちの協力者が計画通りに臨床試験を行うのに十分な数の患者を募集することが困難な場合、私たちは進行中または計画中の臨床試験を延期、制限または終了する必要があるかもしれないが、いずれも私たちの業務、財務状況、運営結果、および見通しに悪影響を及ぼすだろう。
著者らの候補製品の早期臨床前研究の積極的な結果或いは臨床試験の初歩的な結果は必ずしも著者らの候補製品の後続の臨床前研究と任意の未来の臨床試験の結果を予測するとは限らない。もし私たちが今後の臨床前研究、臨床試験と未来の臨床試験の中で著者らの候補製品の早期臨床前研究に対する積極的な結果をコピーすることができなければ、著者らは開発に成功し、監督部門の著者らの候補製品に対する許可を得て、それを商業化することができないかもしれない。
著者らの臨床前研究のいかなる積極的な結果或いは著者らの候補製品の臨床試験の初歩的な結果は必ずしも後に必要な臨床前研究と臨床試験の結果を予測するとは限らないかもしれない。より多くの患者データが利用できることに伴い、臨床試験の初歩的、中期と主要なデータは変化する可能性がある。臨床試験からの初歩的、中期またはトップラインデータは、BLAまたは米国以外の類似提出において承認を支持して提出された結果を含む最終結果を予測できるとは限らない。一時的なデータ、主要なデータ、および初歩的なデータは依然として監査と確認手続きを遵守する必要があり、これは最終データが私たちが以前発表した予備データと大きく異なる可能性がある。したがって、最終データを取得する前に、予備データ、中間データ、および主要データを慎重に見るべきである。中間データと比較して、最終データの重大な不利な変化は、我々の業務の将来性を深刻に損なう可能性がある。さらに、初期、中期、およびトップデータは、患者が研究中に成熟したときにより多くの患者データを得る場合、または候補製品の他の進行中または将来の臨床試験のさらなる発展に伴い、1つまたは複数の臨床結果が実質的に変化する可能性があるというリスクに直面する。例えば、FDAの提案と一致して、私たちのいくつかの臨床試験は15年間のフォローアップ観察期間を含み、その間私たちは引き続き患者データを収集する。
私たちが開示する特定の研究または臨床試験に関する情報を選択することは、一般に、より広い情報に基づいており、あなたまたは他の人は、私たちが決定した重要な情報または他の適切な情報が私たちの開示に含まれることに同意しない可能性がある。私たちが開示しないことを決定したいかなる情報も、最終的には、特定の候補製品または私たちの業務に関する未来の決定、結論、観点、活動、または他の側面に対して重要な意味を持つと考えられるかもしれない。同様に、私たちが現在の開発スケジュールに基づいて、私たちが計画した候補製品の臨床前研究あるいは任意の未来の臨床試験を完成させることができても、私たちの候補製品のこのような臨床前研究と臨床試験の積極的な結果は後続の臨床前研究あるいは臨床試験結果に複製されないかもしれない。
製薬やバイオテクノロジー業界の多くの会社が早期開発に積極的な成果をあげた後,後期臨床試験で大きな挫折を経験し,類似した挫折に直面しないことは確認できない。同様に、製薬やバイオテクノロジー業界の多くの会社は登録試験を完了したにもかかわらず、規制部門の承認を得られなかった。これらの挫折は,臨床試験が行われている間の臨床前や他の非臨床発見,あるいは前臨床研究や臨床試験で行われた安全性や有効性観察によるものであり,これまで報告されていない有害事象を含む。そのほか、臨床前、非臨床と臨床データはよく変化の影響を受けやすい
52
解釈と分析及び多くの会社は彼らの候補製品は臨床前研究と臨床試験で満足できると考えているが、FDA或いはEMAの許可を得られなかった。
私たちが必要な臨床前研究と臨床試験を完成しても、マーケティング審査過程は高価で、時間と不確定であり、私たちが開発する可能性のある任意の候補製品の商業化承認を得ることを阻止するかもしれない。もし私たちが必要な規制承認を得たり遅延したりできなければ、私たちが開発する可能性のある候補製品を商業化したり、商業化を遅延させることができなくなり、私たちの収益能力は深刻な損害を受けるだろう。
私たちが開発する可能性のある任意の候補製品と、それらの設計、テスト、製造、安全、効果、記録保存、ラベル、貯蔵、承認、広告、販売促進、販売、流通を含むそれらの開発、商業化に関連する活動は、米国FDAおよび他の規制機関、EU EMAおよび他の国の類似機関によって全面的に規制されている。候補製品のマーケティング承認が得られなければ、指定された司法管轄区域で候補製品を商業化することはできないだろう。CASGEVYは、いくつかの司法管轄区域の特定の規制機関の承認または許可を得ているが、私たちの他の候補製品または将来、単独またはパートナーと共同開発する可能性のある任意の候補製品は、規制部門の承認または許可を得ることができないかもしれないし、または私たちとVertexはCASGEVYの追加的なマーケティング承認を得るだろう。例えば、一連の疾患の臨床開発や高度臨床前開発の候補製品が複数ありますが、私たちが完全に所有している同種CAR T製品候補製品のBLASをFDAに提出したり、比較可能な外国当局に同様のマーケティング申請を提出したりしていません。
私たちは規制とマーケティング承認を得るために必要な申請を提出して支援する上で経験が限られている。私たちは第三者契約研究機関やCROおよび/または規制コンサルタントに頼って、私たちの全額候補製品にこの過程を提供するのを助けたいと思っています。私たちが改訂したA&R Vertex JDCAによると、私たちはVertexに依存して私たちのヘモグロビン疾患候補製品にこのような申請を提出します。BLAまたは他の同様のマーケティング申請を比較可能な外国当局に提出し、規制部門の承認を得るためには、各治療適応に対する広範な臨床前および臨床データおよび支援情報を各規制機関に提出して、各必要な治療適応の生物候補製品の安全性、純度、有効性、および効力を決定する必要があり、安全性および有効性とも呼ばれる。BLAはまた候補製品の化学,製造,制御に関する重要な情報を含まなければならない。監督管理の承認を得るためには、製品の製造過程に関する情報を関連監督機関に提出し、関連監督機関が製造施設を検査する必要がある。
一般に、FDAは、BLAの承認を支援するために2つの重要な試験の成功を要求するが、場合によっては、1つのキー試験に基づいてBLAを承認することのみに基づいて、BLAの承認を提出して得る能力は、最終的にFDAの審査決定であり、これは、当時利用可能なデータに依存し、安全性および/または有効性の観点から、既存のデータがBLAの提出または承認をサポートするのに不十分である可能性がある。例えば、CTX 112およびCTX 131を含む我々が行っている完全候補製品を含む、我々の任意の臨床試験が完了したときに得られるデータは、BLAへの提出の臨床的意義のある利益を示すか、または安全性および/または有効性の観点から十分に強力であり、承認の加速または条件付き承認または完全な承認をサポートするために十分に強力であることを保証することはできない。さらに、CASGEVYが行っている臨床試験で得られた提出または計画されているデータは、安全性および/または有効性の観点から十分にロバストであることは保証されず、規制申請を提出するすべての司法管轄区域でBLAまたは外国同等の薬剤を加速または条件的に承認または完全に承認することをサポートする。これらの行っている臨床試験の結果と提出されたデータのロバスト性に基づいて、一旦提出されると、FDAは、BLAの承認を提出または取得する前に追加的またはより大規模なキー試験を行うことを要求する可能性がある。さらに、何らかの不良または許容できない副作用、意外な特徴、または他の深刻な有害事象が発生し、このような有害事象が我々の候補製品以外の要因によって引き起こされることを証明することができない場合、FDA、EMAまたは他の同様の衛生規制機関は、十分な情報を収集することができるまで、または候補製品のさらなる臨床研究を停止するように命令することができるまで、臨床試験を一時停止することができる。このような状況が発生すれば、規制部門の承認を得るためにBLAの提出を延期する可能性が高い。私たちは外国の規制機関と似たような挑戦に直面するかもしれない。
さらに、1つまたは複数の臨床試験の失敗は、臨床試験プロセスの任意の段階で発生する可能性がある。私たちが開発した任意の候補製品は効果がないかもしれません。中程度の効果しかないかもしれません。あるいは不良または意外な副作用、毒性、あるいは他の特徴があることが証明される可能性があり、上場承認を得ることを阻止したり、商業使用を阻止したり制限したりする可能性があります。したがって、私たちの候補製品の規制方法はまだ不確定で、複雑で長く、最終的には承認されないかもしれない。たとえ我々の候補製品が臨床研究において安全性と有効性を証明したとしても、多くの要素、製品開発期間中の監督管理政策の変化を含むため、監督管理の遅延或いは拒否に遭遇する可能性がある。
アメリカと他の外国司法管轄区で上場承認を獲得する過程はコストが高く、もし追加の臨床試験が必要であれば、長年の時間を要するかもしれないが、完全に承認されれば、しかも関連する候補製品のタイプ、複雑性と新規性を含む様々な要素によって大きく変化する可能性がある。開発期間中の市場承認政策の変化、付加法規又は法規の変化又は規制審査の変化
53
毎回提出される製品申請は、申請の承認または拒否の遅延を招く可能性がある。FDAと他国の類似機関は承認過程においてかなりの自由裁量権を有しており、いかなる申請も拒否することができ、私たちのデータが承認を得るのに十分ではなく、追加の臨床前、臨床、あるいは他の研究を行う必要があると決定することもできる。そのほか、臨床前と臨床試験から得られたデータの異なる解釈は候補製品の発売許可を延期、制限或いは阻止する可能性がある。私たちが最終的に得たどのマーケティング承認も限られているかもしれないし、制限されたり、承認された後の約束は、承認された製品が商業的に実行できないようにすることができる。
もし私たちが承認を得る上で遅延に遭遇した場合、あるいは私たちが開発する可能性のある候補製品の承認を得ることができなければ、これらの候補製品の商業的な見通しが損なわれる可能性があり、私たちが収入を作る能力は実質的に損なわれるだろう。
私たちは米国FDAで私たちのすべての完全候補製品を承認しないかもしれません。たとえ私たちがそうしても、私たちは他のいかなる司法管轄区域でも承認されたり、私たちのすべての完全な候補製品を商業化したりすることはできません。これは私たちがそのすべての市場潜在力を達成する能力を制限するだろう。
最終的に任意の特定の管轄区域で私たちの任意の候補製品を販売するためには、各管轄区域で安全性と有効性に関する多くのおよび異なる法規要件を確立し、遵守しなければならない。米国FDAの承認を得ても、他の国や管轄区域規制機関の承認を得ることは確保できない。同様に、外国規制機関の承認はFDAの承認を保障できない。また、一国で行われた臨床試験は他の国の規制機関に受け入れられない可能性があり、一国の規制承認は他の国の規制承認を保証することはできない。承認の流れは国によって異なり、追加の製品テストと検証、追加の行政審査期間に関連する可能性があります。複数の管轄区域で規制承認を求めることは私たちに困難とコストをもたらす可能性があり、追加の臨床前研究或いは臨床試験が必要であり、これは高価で時間がかかる可能性がある。各国の規制要求には大きな違いがある可能性があり、私たちの製品が特定の国で発売されることを延期または阻止する可能性がある。米国以外の規制承認手続きはFDA承認に関連するすべてのリスクに関するものだ。私たちはいかなる完全所有製品も司法管轄区域(国際市場を含む)で販売が許可されておらず、会社として国際市場で規制承認を受けた経験もありません。もし私たちが国際市場の規制要求を遵守できなかったり、必要な承認を得られなかったり、あるいは国際市場の規制承認が延期された場合、私たちの目標市場は減少し、私たちの製品のすべての市場潜在力を達成する能力は達成できないだろう。
画期的な治療指定、迅速チャネル指定、FDAの再生医学高度治療指定または優先審査、またはEMAのPrime計画は、たとえ私たちに承認された任意の候補製品であっても、より速い開発、規制審査または承認過程を招くことができない可能性があり、私たちの任意の候補製品がマーク承認を得る可能性を増加させない可能性がある。
私たちは私たちのいくつかの候補品のために画期的な治療法の称号を求めるかもしれない。画期的療法に指定されたのはFDAの裁量権である。したがって,我々の候補製品の1つが画期的療法として指定された基準に適合していると考えても,FDAは同意せず,このような指定をしないことにする可能性がある。いずれの場合も,FDAの従来のプログラムによる承認を考慮した療法と比較して,候補製品に対する突破療法指定を受けることは,より速い開発過程,審査または承認を招くことはなく,FDAの最終承認も確保できない可能性がある。さらに、我々の1つまたは複数の候補製品が画期的な療法の条件に適合していても、FDAは、これらの候補製品が資格条件を満たしていないことを後で決定するか、またはFDAの審査または承認を決定する期間が短縮されない可能性がある。
私たちは私たちのいくつかの候補製品のための高速チャネル認証を獲得し、探すことができるかもしれない。例えば、CASGEVYは、FDAによってTDTおよびSCDを治療するための高速チャネル名を付与される。FDAは幅広い裁量権を有しており,この称号が付与されているかどうか,したがって,ある特定の候補製品がこの称号を得る資格があると考えても,FDAがそれを付与することを決定することを保証することはできない。私たちが高速チャネル認証を受けたとしても、私たちは従来のFDAプログラムよりも速い開発過程、審査、または承認を経験しないかもしれない。Fast Track製品については,スポンサーがFDAとより多くのインタラクションを行う可能性があり,FDAは申請完了前にFast Track製品マーケティング申請の部分の審査を開始する可能性がある.しかしながら、FDAが出願を審査する期間の目標は、出願の最後の部分が提出されるまで開始される。FDAが我々の臨床開発プロジェクトのデータが高速チャネルの指定をサポートしなくなったと考える場合,その指定を撤回する可能性がある。高速チャネル指定だけではFDA優先審査プログラムに適合する資格は保証されない。
私たちはRMAT認証を取得して私たちのいくつかの候補製品のために求めることができる。例えば、CASGEVYは、FDAによってTDTおよびSCDを治療するRMATの称号を付与される。合理的に予測される可能性のある長期的な臨床的利益の代替物または中間終点、またはより多くの場所に拡張することによって、RMAT認証を取得する製品は、加速承認を得る資格がある可能性があることを含む、大量の場所から取得されたデータに依存する。FDAが私たちが開発可能な任意の候補製品が加速承認経路を通過することを可能にする保証はなく、FDAがこのような経路を確実に許可しても、このような提出や申請が受け入れられるか、あるいは加速された開発、審査または承認がタイムリーに承認されるか、または根本的に保証されない保証はない。RMAT指定の製品受け取りました
54
加速承認は、電子健康記録のような臨床証拠、臨床試験、患者登録または他の真の証拠源を提出することによって、より大きな検証データセットを収集することによって、または治療を承認する前に、そのような治療を受けたすべての患者を承認後に監視することによって、承認後の要求を満たすことができる。他の候補製品のRMAT認証を得ることができる保証はありません。RMAT指定はFDAの製品承認基準を変更することはなく,このような指定が審査や承認を加速する保証もなく,承認された適応が指定がカバーする適応よりも狭くならない保証もない。また,臨床データの出現に伴い資格基準を満たさなくなると,RMATの指定が取り消される可能性がある。また,加速的な承認を得ても,臨床的利益を確認·検証する必要がある承認後の研究は,この利点を示さない可能性があり,得られたいかなる承認も撤回される可能性がある。加速された承認を得ることは,製品の加速承認が最終的に従来の承認に変換される保証はない.さらに、2022年食品·薬物総合改革法案(FDORA)によると、FDAは、承認前または承認が加速された製品の承認日後の特定の期間内に、1つまたは複数の承認後の検証的研究を行うことを適宜要求することが許可されている。FDORAは,登録目標の実現を含めて180日ごとにFDAにこのような研究の最新状態を送信することも求められており,FDAはこれらの情報を迅速に公開しなければならない。FDORAはまた、スポンサーがこのような研究をタイムリーに行うことができなければ、必要な更新をFDAに送信するか、またはそのような承認後の研究が薬剤の期待される臨床的利益を検証できない場合、FDAは、加速的な承認を得た薬物または生物学的製剤の承認を迅速に撤回することができる。FDORAによれば、FDAは、職務調査を行っていない会社に対していかなる承認後の検証的研究を行うか、または速やかに当該機関に進捗報告を提出した会社に罰金を科すように行動する権利がある。
FDAが候補製品が重篤な疾患を治療する方法を提供すると判断し、承認された場合、製品は安全性または有効性の面で有意な改善を提供するであろう場合、FDAは候補製品を優先的に検討するように指定する可能性がある。優先審査指定は、FDA審査申請の目標が6ヶ月であり、標準的な10ヶ月の審査期間ではないことを意味する。FDAは候補製品優先審査地位を付与するか否かについて広範な裁量権を有しているため,特定の候補製品がこのような指定や地位を獲得する資格があると考えても,FDAはその資格を付与しないことを決定する可能性がある。また、従来のFDAプログラムと比較して、優先審査指定は必ずしも規制審査や承認過程を加速させるとは限らず、必ずしもいかなる承認面の優位性をもたらすとも限らない。FDAの優先審査を受けることは、6ヶ月の審査期間内に承認されることが保証されない、あるいは全くできない。
最後に,EMAからPrime計画下の候補製品資格を取得し,資格獲得を求めることが可能である。たとえば,CASGEVYはTDTとSCDを治療するPrimeの称号を与えられる.私たちが他の候補製品のPrime資格を得ることができるという保証はない。Primeは製品承認の基準を変更することはなく,このような資質が承認速度を速める保証もない.また,1つの薬物が研究開発過程で資格基準を満たさなくなった場合,良質な計画下での援助は撤回される可能性がある。
画期的な治療指定、高速チャネル指定、RMAT指定、およびFDAの優先審査に関するより多くの情報は、“ビジネス-政府規制-アメリカ生物製品の許可と規制-加速計画”というタイトルの章を参照されたい。EMAのPrime計画についてのより多くの情報は、“企業-政府規制-欧州薬品承認を管理する規制とプログラム-Prime計画”と題する節を参照されたい
私たちは、私たちのプラットフォーム技術を指定プラットフォーム技術として指定することを求めることができますが、このような指定を取得しても、そのような指定は、より速い規制審査や承認過程を招くことはありません。
私たちは私たちのプラットフォーム技術を指定されたプラットフォーム技術として指定することを求めることができる。医薬品および生物製品条例によれば、以下の場合、薬物または生物製品またはそれによって使用されるプラットフォーム技術が、指定されたプラットフォーム技術として指定される資格がある:(1)プラットフォーム技術が“生物法”によって承認された薬物使用に組み込まれているか、または許可された薬物の発起人によって提出された予備証拠、または薬物出願中に提出されたデータに対する参照権が付与された発起人によって提出された予備的証拠は、プラットフォーム技術が品質、製造または安全に悪影響を与えることなく、1つ以上の薬物使用に組み込まれる可能性があることを示す。(3)適用者が提出したデータまたは情報は、プラットフォーム技術の導入または利用が薬物開発または製造過程および審査過程に顕著な効率をもたらす可能性があることを示している。スポンサーは、IND出願を提出した間または後の任意の時間に、IND出願を要求対象とするプラットフォーム技術を組み込むか、または使用する指定されたプラットフォーム技術としてFDAに指定することを要求することができる。指定された場合、FDAは、プラットフォーム技術を使用または組み込まれた薬物の任意の後続の元のBLAの開発および審査を加速および検討することができる。我々のプラットフォーム技術がこのような指定の基準に適合していると考えても,FDAは同意せず,このような指定を付与しないことにした可能性がある.また,プラットフォーム技術のこのような指定を得ることは,薬物開発がより速くあるいはFDAの承認を得ることを保証することはできない。さらに、FDAが指定されたプラットフォーム技術がもはや指定された基準を満たしていないと判断した場合、FDAは指定を取り消す可能性がある。
私たちは孤児薬の指定や独占経営権を得ることができないかもしれない。もし私たちの競争相手が私たちの候補製品と同じ薬と同じ適応の製品を構成する孤児薬物の独占経営権を得ることができれば、私たちはできないかもしれません
55
関連する規制機関の競争相手製品に対する承認をかなり長い間得ることができる。
私たちのいくつかのプロジェクトは米国でFDAの孤児薬物の称号を獲得し、欧州委員会もTDTおよびSCDを治療するCASGEVYを含む私たちのいくつかのプロジェクトまたは協力プロジェクトのための孤児薬を指定した。私たちは将来私たちのいくつかの他の候補製品のために孤児薬物指定を求めるかもしれないが、私たちは孤児薬物指定を維持したり、孤児薬物指定に関連するいかなる利益も得ることができないかもしれない。
私たちの現在のいくつかの候補製品および将来の候補製品は、孤児薬物指定に必要な数よりも少ない患者集団を対象としている可能性がある。もし私たちが私たちの候補製品に孤児薬を指定することを要求すれば、FDAまたは欧州委員会が私たちの候補製品がそのような名前を指定することを承認する保証はありません。さらに、我々の任意の候補製品を孤立製品として指定することは、どの規制機関がその候補製品の規制審査または最終承認を加速するかを保証するものではなく、いかなる規制機関も、私たちの候補製品が独占マーケティング承認を得る前に、私たちの候補製品と同じ適応を有する他社の候補製品に孤児指定の能力を付与することを制限しない。
一般に、孤児薬物指定を有する候補製品が、その指定された適応を有する最初の発売許可を得た場合、製品は、限定された場合を除いて、FDAまたは欧州委員会が同じ薬剤を構成する製品の別のマーケティング申請を承認することを阻止する市場排他的期間を有する権利がある。もし他のスポンサーが私たちの前にこのような承認を得た場合(私たちの孤児薬物名にかかわらず)、私たちは適用された専門期間内に私たちの製品の発売許可を得ることが禁止されるだろう。適用期間は米国では7年、EUでは10年。スポンサーが提出した小児科データがこのようなデータに対するFDAの書面請求に公平に対応すれば,米国での排他期間を6カ月延長することができる。製品を承認する前に合意した小児科調査計画を遵守する薬物については,EUの専門期間を2年間延長することができる。5年目の終了時に製品が指定された孤児の基準を満たしていないと判定された場合、EUの専門期間も6年に短縮されることができ、例えば、製品の利益が十分に高いため、市場排他性を得る理由がなくなる。任意の規制機関が、指定された要求に重大な欠陥があると判断した場合、または製造業者が、このようなまれな疾患または疾患を有する患者の需要を満たすのに十分な数の製品を保証できない場合、孤児薬の排他性を取り消すことができる。
候補製品の孤立した薬物排他性を獲得しても,この排他性は候補製品を競合から効果的に保護できない可能性があり,異なる薬物が同じ条件で承認される可能性があるからである。米国では、孤児薬が承認された後であっても、FDAが他の薬剤が同一の薬剤ではないと結論した場合、それがより安全で、より有効であることが証明された場合、または患者ケアに大きな貢献をした場合、FDAはその後、同じ疾患の治療を別の薬剤で承認することができる。欧州連合では、以下の場合、同じ孤児適応の類似医薬製品にマーケティング許可を与えることができる
私たちが他の候補製品の孤児薬物の称号を得ることができるという保証はない。孤児薬の指定は製品承認の基準を変更することはなく,そのような指定が迅速な審査や承認につながることも保証されない。
米国孤児薬物指定に関するより多くの情報は,“企業−政府規制−米国生物製品の許可と規制−孤児薬物指定”というタイトルの章を参照されたい。EU孤児薬物指定に関するより多くの情報は、“企業-政府規制-欧州薬品承認の規制と手順-孤児薬物指定と排他性”と題する節を参照されたい
遺伝子編集および細胞療法製品に対する公衆の否定的な見方は、私たちの候補製品の需要や規制承認に負の影響を与える可能性がある。
私たちの候補製品はヒトゲノムの編集に関するものだ。私たちの候補製品の臨床と商業成功は遺伝子編集療法を用いたヒト疾患の予防或いは治療に対する公衆の受容の程度に部分的に依存する。公衆の態度は遺伝子編集の不安全、不道徳或いは不道徳な説の影響を受ける可能性があるため、私たちの製品は公衆或いは医学界の受け入れを得ることができない可能性がある。遺伝子治療に対する公衆の一般的な負の反応は、政府が遺伝子編集製品(私たちの任意の候補製品を含む)に対するより厳格な規制とより厳しいラベル要求をもたらす可能性があり、私たちが開発する可能性のある任意の製品に対する需要の減少を招く可能性がある。公衆の悪い態度は私たちの入学能力に悪影響を及ぼすかもしれない
56
臨床試験。さらに、私たちの成功は、医師が処方した処方および彼らの患者が受けることを望む治療に依存し、これらの治療は、彼らがよく知っている既存の治療方法を代替または補充するために、私たちが開発可能な候補製品を使用することに関連し、より多くの臨床データを得ることができる。
特に、遺伝子編集技術を人類胚胎或いは人類生殖系に応用することに関する倫理問題のため、遺伝子編集技術は公衆討論とより厳格な監督管理審査を受けている。例えば、2016年4月、ある科学者たちは、ヘモグロビンβ遺伝子を修正するために、ヒト胚のゲノムを編集しようと試みた試みを報告した。これは遺伝性血液疾患β地中海貧血患者に変異を生じる遺伝子である。この研究は生存できない胚の中で目的的に行われているにもかかわらず、この仕事はヒト卵子、精子、胚の遺伝子編集を一時停止または他のタイプに制限することを呼びかけている。また、報告によると、2018年11月、深セン南方科技大学生物系助教授、生物物理学研究員の何建奎博士は、最初のヒト遺伝子編集の赤ちゃん、双子の女の子を作ったと主張している。この説と、何博士が第二の遺伝子編集者の妊娠を助け、その後中国当局の実証を得て、公衆の負の反応、特に科学界の人を得たという説がある。新聞記事によると、2019年12月、何医師はこのような活動に関連した不法な医師行為で中国政府に懲役3年、罰金43万ドルを言い渡された。その後、世界保健機関は新しい諮問委員会を設立し、人類遺伝子編集のためにグローバル管理と監督標準を制定した。ワシントンD.C.に位置する再生医学連盟は、CRISPR/Cas 9を含むヒト胚胎或いはヒト生殖細胞の改変に関する研究に遺伝子編集技術を使用することを自発的に一時停止することを呼びかけ、いくつかの遺伝子編集技術を使用する会社が認可した治療応用における遺伝子編集を使用する原則を発表した。同様に、米国国立衛生研究院は、ヒト胚におけるいかなる遺伝子編集技術の使用にも援助しないと発表し、研究目的のためのヒト胚の創造またはヒト胚の破壊のための研究への支出を禁止するディキ-ウィック修正案を含む既存の複数の立法および規制機関がこのような仕事を禁止していることを指摘した。イギリスの法律は遺伝子組換え胚胎を女性体内に移植することを禁止しているが、人類受精と胚胎学管理局の許可を得た場合、研究実験室は胚胎を改造することができる。他の多くのヨーロッパ諸国では、胚の研究はもっと厳格に統制されている。
私たちは私たちの技術を使用してヒト胚胎またはヒト生殖系を編集しないが、このようなヒト胚胎における遺伝子編集技術の使用に関する公開討論およびより厳格な規制審査は私たちの候補製品の開発を阻止または延期する可能性がある。より厳格な政府法規または負の世論は、私たちの業務や財務状況に悪影響を与え、候補製品の開発および商業化、または私たちが開発する可能性のある任意の製品の需要を遅延または損害する可能性がある。我々の前臨床研究または臨床試験または我々の競争相手または遺伝子編集技術を使用する学術研究者の有害事象は、最終的には、我々が識別および開発する可能性のある候補製品に起因することができなくても、それによって生じる宣伝は、政府規制の増加、不利な公衆認識をもたらす可能性があり、私たちが識別し開発する可能性のある潜在的候補製品テストまたは承認の潜在的規制遅延、承認された候補製品に対するより厳しいラベル要件、およびそのような候補製品のいずれかに対する需要が減少する可能性がある。
もし私たちが販売やマーケティング能力を確立できない場合、あるいは第三者と合意して私たちの技術に基づく製品を販売し、マーケティングすることができなければ、任意の候補製品が承認されれば、私たちの製品を商業化することに成功できないかもしれません。どんな収入も生まれないかもしれません。
私たちは現在販売やマーケティングインフラを持っていません。会社として、治療製品の販売、マーケティング、流通については経験がありません。販売およびマーケティング責任を保持する任意の承認された候補製品をビジネスに成功させるためには、私たちの販売、マーケティング、管理、および他の非技術的能力を確立するか、または第三者とこれらのサービスを実行することを手配しなければならない。将来的には、私たちのいくつかの候補製品を販売するために、あるいは私たちの協力者と一緒に販売活動に参加するために、重要な販売·マーケティングインフラを構築することを選択することができるかもしれません。
私たち自身の販売とマーケティング能力の確立、および第三者とこれらのサービスを実行する計画を達成することはリスクに関連している。例えば、販売チームの採用と訓練は高価で時間がかかり、どんな製品の発表も延期される可能性がある。販売チームを募集し、マーケティング能力を確立する候補製品の商業発表が何らかの理由で延期または発生していない場合、これらの商業化費用を早期または不必要に発生させる。これは費用が高いかもしれません。もし私たちが私たちの販売とマーケティング担当者を維持したり再配置できなければ、私たちの投資は損失します。
候補製品の商業化を阻害する可能性がある要素は
57
もし私たちが第三者と販売、マーケティング、流通サービスの手配を達成すれば、私たちの製品の収入あるいはこれらの収入の流れから私たちにもたらす収益力は、私たちが自分たちが開発した任意の候補製品をマーケティングして販売する場合よりも低いかもしれません。たとえば,我々が改訂したA&R Vertex JDCAによると,Vertexは世界各地でCASGEVYに関するすべての商業化活動を行う権利があり,プロトコルによる純利益と純損失(適用すれば)はCRISPR 40%とVertex 60%に割り当てられる.さらに、私たちは第三者と私たちの候補製品の販売とマーケティングの手配を成功的に達成できないかもしれないし、私たちに有利な条項でそうすることができないかもしれません。私たちはこれらの第三者に対して支配権がほとんどないかもしれません。彼らのいずれも必要な資源と注意力を投入して、私たちの候補製品を効果的に販売し、マーケティングすることができないかもしれません。もし私たちが販売とマーケティング能力を確立することに成功できなければ、私たち自身も第三者と協力しても、私たちの候補製品を商業化することに成功しないかもしれない。しかも、私たちの業務、経営業績、財務状況、そして見通しは重大な悪影響を受けるだろう。
私たちまたは私たちが所有する可能性のある任意のパートナーが私たちが開発した任意の候補製品のためにマーケティング承認を得ても、承認条項と私たちの製品の持続的な規制は、大量の資源支出を必要とする可能性があり、私たちまたは彼らが私たちの製品を製造してマーケティングする方法を制限する可能性があり、これは私たちの収益能力を深刻に弱めるかもしれない。
私たちまたは私たちの任意のパートナーが市場で承認された任意の候補製品、およびその製品の製造プロセス、承認された臨床データ、ラベル、広告、および販売促進活動は、FDAおよび他の規制機関の持続的な要求および審査を受けるだろう。これらの要求には、安全及びその他の上場後の情報と報告の提出、登録と上場要求、現在の良好な製造規範又はcGMP、品質管理、品質保証と記録及び文書の対応する維持に関する要求、及び記録保存に関する要求が含まれる。候補製品の上場が承認されても、承認は、製品が発売される可能性のある指定用途の制限または承認条件によって制限される可能性があり、または製品の安全性または有効性を監視するために、高価な上場後のテストおよび監視の要求を含む可能性がある。FDAはまた、製品の安全な使用を保証するためにREMSを要求することを含む、承認時に他の条件を追加することができる。FDAがREMSが必要であると結論した場合,BLAのスポンサーは承認を得るために提案されたREMSを提出しなければならない。REMSは、制限された分配方法、患者登録、および他のリスク最小化ツールのような薬物ガイドライン、医師のコミュニケーション計画、または安全な使用を確保する要素を含むことができる。
したがって、私たちまたは私たちが所有する可能性のある任意の協力者が私たちが開発した1つまたは複数の候補製品のマーケティング承認を得たと仮定すると、私たちとそのような協力者と私たちと彼らの契約製造業者は、製造、生産、製品監視、品質管理を含むすべてのコンプライアンス分野で時間、お金、エネルギーをかけ続けます。また,承認されたBLAの保持者は,不良イベントやどの製品もBLAの規格に適合していない場合を監視·報告する義務がある.承認されたBLAの所有者はまた、新しい申請または追加の申請を提出し、承認された製品、製品ラベル、または製造プロセスをいくつか変更するためにFDAの承認を得なければならない。他の適用可能な連邦および州法律に加えて、広告および販売促進材料はFDAの規定に適合し、FDAの審査を受けなければならない。
もし私たちとそのような協力者が承認後の規制要求を遵守できなければ、私たちとそのような協力者は規制機関によって私たちの製品のマーケティング承認を撤回される可能性があり、私たちまたはそのような協力者が未来の製品をマーケティングする能力が制限される可能性があり、これは私たちが利益を達成したり維持したりする能力に悪影響を及ぼすかもしれない。また、承認後の法規を遵守するコストは、私たちの業務、経営業績、財務状況、見通しにマイナス影響を与える可能性があります。
私たちまたは私たちの任意のパートナーがマーケティング承認を得た任意の候補製品は、私たちまたは彼らが規制要求を遵守できなかった場合、または私たちまたは彼らの製品が予期せぬ問題に遭遇した場合、その中の任意の製品が承認された場合、私たちまたは彼らは重大な処罰を受ける可能性がある。
FDAおよび他の規制機関は、許可された適応のみおよび承認されたラベルの規定による販売を確実にするために、生物製品の承認後のマーケティングおよび販売促進を密接に規制する。FDAおよび他の規制機関は、ラベル外使用に関するメーカーのコミュニケーションに厳しい制限を加えており、もし私たちまたは私たちが所有している可能性のあるいかなるパートナーも、その承認された適応について私たちの製品をマーケティングしていない場合、私たちまたは彼らは、FDAおよび他の連邦および州法執行機関(米国司法省を含む)のラベル外マーケティング法執行行動の影響を受ける可能性がある。“虚偽請求法”を含む“連邦食品、医薬品および化粧品法”および処方製品販売促進および広告に関する他の法規に違反し、連邦および州医療詐欺および法律乱用および州消費者保護法違反を調査または告発する可能性もある。
さらに、候補製品には、予期されない深刻度または頻度の不良事象、または私たちまたは他の協力者の製造プロセス、または法規要件を遵守できなかったことを含む、以前に未知の問題が存在することが後に発見され、他のことを除いて、以下のようになる可能性がある
58
FDAの政策は変わる可能性があり、私たちの候補製品に対する規制承認を阻止、制限、または延期するための追加の政府法規が公布されるかもしれない。もし私たちまたは私たちの協力者が既存の要求の変化に緩やかに適応できない場合、または新しい要求または政策を採用することができない場合、または私たちまたは私たちの協力者が法規遵守を維持できない場合、私たちまたは私たちの協力者は、私たちまたは私たちの協力者が得る可能性のあるマーケティング承認を失う可能性があり、これは、私たちの業務、将来性、および利益を達成または維持する能力に悪影響を及ぼすだろう。
どの政府も、私たちのどのサプライヤーに対する調査も含め、違法な疑いのある調査には、対応するために多くの時間と資源を必要とする可能性があり、否定的な宣伝が生じる可能性がある。上記のいずれの事件や処罰が発生しても、私たちまたは私たちの協力者が私たちが開発する可能性のある任意の候補製品を商業化する能力を抑制し、私たちの業務、財務状況、運営結果、および将来性に悪影響を及ぼす可能性があります。
私たちの任意の製品または候補製品の商業的成功は、医師、患者、第三者支払人、および医療界の他の人に受け入れられる程度に依存するだろう。
遺伝子治療の倫理、社会、法律に対する懸念は、追加の法規制や私たちの製品の禁止を招く可能性がある。米国FDA、EU EMAおよび他の国際規制機関の必要な承認を得ても、私たちの製品或いは候補製品の商業成功は医師、患者と一般遺伝子治療製品の医療支払者が受け入れているかどうか、特に私たちの製品或いは候補製品が医療必要性、コスト効果と安全性を持っているかどうかに大きく依存する。私たちが商業化したどの製品も医師、患者、医療支払者、医学界の他の人に受け入れられないかもしれない。遺伝子治療製品、特に私たちの候補製品に対する市場の受容度は、商業販売のために承認されれば、いくつかの要素に依存する
1種の潜在的な製品が臨床前研究と未来の臨床試験において良好な治療効果と安全性を示しても、市場のこの製品に対する受容度はそれが発売されてから完全に知ることができる。もし私たちの候補製品が十分なレベルに達していなければ
59
規制部門の承認後、私たちは顕著な製品収入を発生させないかもしれないし、利益を上げないかもしれない。
私たちはバイオテクノロジーと製薬産業で激しい競争に直面している。
生物技術と製薬業界は、遺伝子編集、遺伝子治療と細胞治療領域を含み、その特徴は技術が迅速に進歩し、競争が激しく、そして知的財産権と独自製品を高度に重視していることである。私たちの技術、開発経験、科学知識は私たちに競争優位を提供してくれると信じていますが、私たちは現在、大型製薬、専門製薬とバイオテクノロジー会社、学術機関と政府機関、および公共および民間研究機関を含む多くの異なる源からの激しい競争に直面し、引き続き直面しています。その中のいくつかまたはすべての機関は私たちよりも資本や資源を獲得しやすいかもしれません。我々が最終的に商業化する可能性のある任意の製品については,任意の既存の療法や現在開発されている療法と競合するだけでなく,将来出現する可能性のある新しい療法とも競合するであろう。
我々は製薬,バイオテクノロジー,その他の関連市場で競争を展開しており,これらの市場では遺伝子編集,遺伝子療法,細胞療法を含むゲノム薬物をカバーする技術を用いて療法を創造している。また,我々の特定の研究開発計画に関連する分野で治療法の開発に取り組んでいる会社と競争している。我々のプラットフォームと製品はCRISPR/Cas 9遺伝子編集技術を用いた療法の開発に重点を置いている。私たちの業務面で直面している競争に関する詳細な議論は、私たちのプラットフォーム、製品適応、他の技術(例えば、小分子、抗体またはタンパク質療法)、遺伝子編集技術、遺伝子または細胞療法、知的財産権、新技術、人員、臨床試験場所、精算機会、協力者を含みますので、タイトルを参照してください“ビジネス-競争“と。もし私たちがこの競争の激しいバイオ製薬業界で成功できなければ、私たちの業務、財務状況、運営結果は実質的な悪影響を受ける可能性がある。
私たちがどんな候補製品を商業化することができても、これらの製品は不利な価格設定法規、第三者精算やり方、あるいは医療改革措置の制約を受ける可能性があり、これは私たちの業務を損なうことになる。
新生物製品の発売承認、定価と精算を管理する法規は国によって異なる。一部の国は製品の販売価格が発売前に承認されることを要求しています。多くの国で、定価審査期間はマーケティングまたは製品許可を承認した後から始まる。一部の非米国市場では、初歩的な承認を得た後も、処方薬の定価は政府の持続的なコントロールを受けている。したがって、特定の国/地域での製品のマーケティング承認を得ることができるかもしれませんが、その後、価格法規の制約を受けて、これらの法規は私たちの製品の商業発表を延期し、長い時間遅延し、その国/地域で製品を販売することによって生じる収入に悪影響を与える可能性があります。不利な価格設定制限は、私たちが開発可能な任意の候補製品が市場承認を得ても、1つ以上の候補製品への投資を回収する能力を阻害する可能性がある。
私たちがすべての製品を商業化することに成功した能力はまた、政府衛生行政部門、個人健康保険会社と他の組織によるこれらの製品と関連治療の清算程度にある程度依存する。第三者支払者、例えば個人健康保険会社、健康維持組織、政府計画、例えば連邦医療保険と医療補助は、彼らがどのような薬物を支払い、精算レベルを確立するかを決定する。アメリカの医療業界と他の地域の主な傾向の一つはコストコントロールだ。政府と個人第三者支払者は,特定の薬物のカバー範囲や精算金額を制限することでコストを抑制しようとしている。ますます多くの第三者支払人は製薬会社に価格に基づいて所定の割引を提供し、医療製品の定価に挑戦することを要求している。私たちは商業化されたどの製品も精算できることを確実にすることはできません。もし精算できれば、精算レベルもそうです。精算は私たちが市場で承認された任意の候補製品の需要や価格に影響を及ぼすかもしれない。清算が得られない場合や限られたレベルに限られていれば、マーケティングの承認を得た任意の候補製品を商業化することに成功できないかもしれません。
新たに承認された製品は精算を得る上で重大な遅延がある可能性があり、精算範囲はFDAや米国以外の同様の規制機関がこの製品を承認する目的よりも限られている可能性がある。さらに、精算を受ける資格があるということは、どの製品もすべての場合に支払われることを意味するわけではありません。あるいは支払いの費用率は、研究開発、製造、販売、流通を含めて私たちのコストをカバーします。新製品の臨時精算水準(適用すれば)も私たちのコストを支払うのに十分ではない可能性があり、恒久的にならない可能性があります。販売率は製品の使用や臨床環境によって異なる可能性があり,すでに低コスト製品のために設定された精算レベルに基づいている可能性があり,他のサービスの既存支払いにも組み込まれている可能性がある。製品の正味価格は、政府医療計画または個人支払者が要求する強制的な割引またはリベート、および将来の法律の任意の緩和によって低下する可能性があり、これらの法律は、現在、製品が米国より低い価格で販売されている国からの製品の輸入を制限している。第三者支払者が自分の精算政策を設定する際には,通常連邦医療保険カバー政策と支払制限に依存する。私たちは、私たちが開発する可能性のある任意の承認された製品の保証範囲と利益の支払率を政府援助および個人支払者から迅速に得ることができず、これは、私たちの経営業績、製品の商業化に必要な資金を調達する能力、および私たちの全体的な財務状況に実質的な悪影響を及ぼすかもしれない。より多くの情報については、“業務-保険、定価、精算”と“業務-医療改革”というタイトルの章を参照されたい。別に参照してください“リスク要因—私たちのThirdとの関係に関するリスクは
60
各方面—我々はすでにVertexと我々のリーディングプランCASGEVY上でパートナーシップを構築し,VertexはCAGEVY計画に対して重要な制御権を持っている.”
私たちの第三者との関係に関するリスクは
我々のパートナーおよび戦略パートナーは、私たちの臨床試験および商業化努力の様々な側面を制御することができ、これは、私たちが提案する製品の商業化の遅延や他の障害を招き、私たちの運営結果に実質的な損害を与える可能性がある。
私たちは、例えばVertexとの協力を含む戦略的協力と許可を達成し、将来的に他の第三者とより多くの協力と許可を達成する可能性がある。いくつかのプロジェクトについては、私たちはまた、当社の臨床試験、および任意の承認された製品の商業化を設計および実施するために、第三者パートナーおよび戦略パートナーに依存しているか、または将来的に依存する可能性がある。その中のいくつかの協力は、私たちの候補製品をより全面的に開発するために重要な技術を提供してくれます。私たちは他の会社と協力して、私たちの計画に重要な技術や資金を提供するかもしれません。このような計画の成功は私たちの協力者と許可パートナーの努力と活動に大きく依存するだろう。
協力者は通常、彼らがこれらの協力の仕事および資源に適用されることを決定する上で大きな裁量権を持ち、協力者は予想通りに彼らの義務を履行しないかもしれない。場合によっては、私たちのパートナー候補製品の開発および商業化に関する私たちのパートナーの意思決定に影響を与えることができない可能性がありますので、私たちのパートナーは、これらのパートナー候補製品の開発および商業化を最適な利益に合った方法で追求または優先しないかもしれません。さらに、協力者が競争力のある製品がより成功的に開発される可能性があると考えている場合、または我々の製品よりも経済的に魅力的な条項で商業化することができる場合、協力者は、第三者開発と直接または間接的に我々の候補製品と競合する製品を独立して開発することができ、または第三者開発と直接または間接的に競合する製品を開発することができる。協力手配当事者間の臨床開発と商業化問題における相違は開発過程の遅延或いは適用候補製品の商業化を招く可能性があり、場合によっては、協力手配の終了或いは訴訟或いは仲裁を招くことは時間がかかり、高価になる。パートナーは、候補製品や製品の開発、製造、流通、マーケティングに関する適用法規要件を遵守できない可能性もある。ライセンシーは通常、ライセンス製品に適用する努力と資源を決定する上で唯一の裁量権を持っている。
したがって、私たちは私たちが現在考えている方法やスケジュールに従ってどんな協力プロジェクトも実行できないかもしれません。これは私たちの業務運営に悪影響を及ぼすかもしれません。さらに、これらのパートナーまたは戦略パートナーのいずれかが、私たちの計画または提案された製品の支援を撤回したり、他の方法でその開発または商業化を損なう場合、私たちの業務は負の影響を受ける可能性があります。さらに、もし私たちの協力者が私たちとの合意を終了したら、私たちは新しい協力者を引き付けることがもっと難しいことを発見するかもしれませんし、ビジネスや金融界での私たちの見方は不利な影響を受けるかもしれません。
我々はすでにVertexと我々のリーディングプランCASGEVY上でパートナーシップを構築し,VertexはCASGEVY計画に対して重要な制御権を持っている.
我々はすでにVertexと一連のプロトコルを締結しており、様々な目標に関連するいくつかの研究、開発、製造、商業化活動を考慮している。これらのプロトコルによると、Vertexはある活動を展開する独占的な権力を持っている。例えば,我々が2015年にVertexと達成した研究,開発,商業化ヒト疾患の潜在的遺伝原因に対する新しい療法の協力合意によると,Vertexは追求する遺伝目標を選択する唯一の権力を持っており,選択された遺伝目標に対する任意の候補製品の開発を制御することはできない。また,Vertexとの2019年の協力プロトコルによると,Vertexはこのプロトコルに従ってDMDおよびDM 1を治療する製品を開発·商業化する独占的な権力を持っている(DM 1を共同開発·共同商業化する製品を選択することに依存する).
また、改訂されたA&R Vertex JDCAによると、Vertexは、このような合意を遵守する条項や条件の下で、特定の候補製品および製品(CASGEVYを含む、特定の司法管轄区域のある規制機関の承認または許可を得て、2023年および2024年にその後の承認を得る)に関するすべての研究、開発、製造、商業化活動を世界的に行う権利を有するが、特定の活動を行う権利は保持している。我々は、当事者が他の合意がない限り、観察者としてこのような活動のいくつかの態様に参加し続け、私たちとVertexは、共同監視委員会および移行委員会において同じ数の代表を有するが、Vertexは、修正されたA&R Vertex JDCAの制約を受けて、CASGEVYまたは任意の将来の候補製品の開発を制御する。
Vertexとのいくつかのプロトコルでは、臨床開発、製造、規制提出、および商業化活動の制御が不足しており、CASGEVYを含む候補製品の開発および商業化に遅延または他の困難をもたらす可能性があり、これは、予期されるIND申請のタイムリーな完了を阻止するか、またはBLA申請または他の適用可能な規制または必要な価格承認の遅延をもたらす可能性がある。
61
私たちはVertexに依存してCASGEVYを製造して商業化しなければならない。例えば,細胞や遺伝子療法の製造には大量の専門知識が必要であり,関連する経験や専門知識を持っていても,細胞や遺伝子療法製品のメーカーは生産コストや生産量,品質管理,連邦,州,外国法規の遵守の困難を含む生産過程で困難に直面することが多い。Vertexがこれらの問題に遭遇しないことは保証されず,発生した問題をタイムリーに解決あるいは解決できる保証はない.また,Vertexは生産をビジネスレベルに向上させるために,CASGEVYが承認された地域にサービスするために,複数の施設にまたがって製造,テスト,物流活動をより広い範囲で協調させるための大きな投資を行っている。私たちはVertexがタイムリーに生産量を商業レベルに向上させることができるか、あるいは根本的にできないという保証はない。さらに、私たちはVertexに依存していくつかの司法管轄区域で定価の承認を得て、CASGEVYを治療する患者の許可された治療センターと関係を確立し、維持し、このような許可された治療センターの患者にCASGEVYを調整して提供する上で製造能力とサプライチェーン運営を管理しなければならない。我々はCASGEVYのこれらや他の商業化努力には関与しておらず,そこから収入を得ることが可能であり,このような商業化努力の程度や有効性を制御することもできない.CASGEVYからの収入は私たちの予想と株主の予想を下回る可能性があり、これは私たちの経営業績と私たちの普通株の市場価格に大きな悪影響を及ぼすかもしれません。また,改訂されたA&R Vertex JDCAによる純利益と純損失(適用すれば)により40%をCRISPR,60%をVertexに割り当てた。VertexにはCASGEVY計画に関連した追加支出がある可能性があり、プロトコルによっては、私たちの部分を支払うことを要求されるか、将来の部分を支払うことに同意することが要求されることは予測できません。
さらに、Vertexとの任意の合意を終了することは、この合意に基づいて任意のマイルストーン、特許使用料、および他の福祉を得ることを阻止し、これは私たちの運営結果と私たちの普通株の市場価格に大きな悪影響を及ぼす可能性がある。
もし私たちが私たちの協力者や戦略的パートナーと衝突すれば、これらの当事者たちは私たちに不利な方法を取り、私たちの戦略を実施する能力を制限するかもしれない。
もし私たちの企業や学術パートナーや戦略パートナーが私たちと衝突した場合、相手は私たちに不利な方法で行動し、私たちの戦略を実施する能力を制限するかもしれません。私たちのいくつかの学術協力者と戦略パートナーは私たちが協力する各分野と複数の製品開発を行っています。しかしながら、我々の協力者または戦略的パートナーは、これらの協力テーマである製品または潜在的な製品と競争力を有する関連分野の製品を単独でまたは他の人と一緒に開発することができる。協力者または戦略パートナーによって開発された競合製品であっても、協力者または戦略パートナーによって権利を有する競合製品であっても、パートナーが候補製品の支援を撤回することをもたらす可能性がある。
現在または未来のパートナーや戦略的パートナーもまた私たちの未来の競争相手になるかもしれない。私たちの協力者や戦略パートナーは競争製品を開発し、私たちがその競争相手との協力を阻止し、適時に規制の承認を得ることができず、私たちとの合意を早期に終了したり、製品の開発と商業化に十分な資源を投入することができなかった。このような進展のいずれも私たちの製品開発努力を損なう可能性がある。
私たちの協力者や戦略パートナーは、代替技術を採用することを決定するか、あるいは私たちの技術を使用して商業的に実行可能な製品を開発することができない可能性があり、これは私たちの財務業績とこれらの製品を開発する戦略に負の影響を与えるだろう。
我々の協力者や戦略的パートナーは代替技術を採用する可能性があり,これは我々のCRISPR/Cas 9遺伝子編集技術の市場性を低下させる可能性がある.また、私たちの現在の協力者または戦略的パートナーは、任意の未来の協力者または戦略パートナーが複数の開発プロジェクトに取り組むことが予想されているので、彼らは、彼らの資源を私たちと協力しているプロジェクト以外のプロジェクトに移すことを選択することができる。もし彼らがそうすれば、これは私たちの技術の能力をテストすることを延期し、私たちのCRISPR/Cas 9遺伝子編集技術に基づく潜在的な製品の開発を延期または終了するだろう。さらに、私たちの協力者および戦略的パートナーは、私たちの協力および戦略的協力計画によって生成された製品を開発しないか、またはこれらの製品の開発、製造、マーケティング、または販売に十分な資源を投入しないことを選択することができる。例えば、ViaCyte(Vertexの完全子会社)は、糖尿病との協力から撤退することを選択した。したがって,将来的には糖尿病計画に関する費用を独自に負担し,ViaCyte JDCAによると,ViaCyteのいくつかの選択脱退印税を支払うことになり,費用を増加させることになる。また、現在または将来のパートナーとの合意に基づいて候補製品を開発·商業化できなかったことは、将来のマイルストーンや特許使用料の支払いを受けることができなくなり、私たちの財務業績に悪影響を与えることになります。
私たちはより多くの協力を求めるかもしれませんが、ビジネス的に合理的な条件下で協力を作ることができなければ、私たちの開発と商業化計画を変えなければならないかもしれません。
私たちの候補製品開発計画と候補製品の潜在的な商業化は費用を支払うために多くの追加の現金が必要になるだろう。私たちのいくつかの候補製品については、他の製薬やバイオテクノロジー会社と協力して、これらの候補製品を開発し、潜在的な商業化を行うことを決定するかもしれません。
62
私たちは適切な協力者を探すことで激しい競争に直面している。私たちが他の協力について最終的な合意に到達するかどうかは、他の事項に加えて、協力者の資源と専門知識の評価、協力の条項と条件、提案協力者のいくつかの要素の評価に依存する。これらの要因は、臨床試験の設計または結果、FDAまたは米国海外類似規制機関によって承認された可能性、候補製品の潜在的市場、そのような候補製品の製造および患者への送達のコストおよび複雑性、競争薬物の潜在性、挑戦の利点および全体的な業界および市場条件を考慮せずにこのような所有権に挑戦する場合、存在する可能性のある不確実性を含むことができる。協力者はまた、同様の協力可能な指示を得るための代替候補製品または技術を考慮することができ、そのような連携が、私たちと私たちとの連携よりも私たちの候補製品に魅力的であるかどうかを考慮することができる。私たちが設立する可能性のある他の協力や他の計画の条項は私たちに不利かもしれない。
既存の協力協定によれば、潜在的なパートナーと特定の条項について未来の合意を締結することができないように制限される可能性もあります。例えば、我々はVertexにいくつかの遺伝子標的の独占的権利を付与しており、協力プロトコル中に、これらの遺伝子標的に対する治療法を求めるために我々の遺伝子編集技術を使用する権利を他の当事者に付与することが制限される。このようなプロトコルにおけるeスポーツ禁止条項は,将来の協力者と戦略的に連携する能力を制限する可能性がある.
私たちはタイムリーで受け入れ可能な条項でもっと多くの協力を交渉することができず、交渉することさえできないかもしれない。協力の交渉と記録は複雑で時間がかかる。また,最近では大手製薬会社間の業務合併数が大きく,将来の潜在的パートナー数の減少を招いている。もし私たちが新たな協力を協議して達成できない場合、私たちは協力を求める候補製品の開発を減らし、その開発計画や私たちの1つ以上の他の開発計画を減らしたり、その潜在的な商業化を延期したり、いかなる販売やマーケティング活動の範囲を縮小したり、私たちの支出を増加させ、自費で開発または商業化活動を行わなければならないかもしれない。もし私たちが私たちの支出を増やし、私たち自身の開発や商業化活動に資金を提供することを選択すれば、私たちは追加の資本を得る必要があるかもしれないし、これらの資本は受け入れ可能な条件で私たちに提供できないかもしれないし、全く得られないかもしれない。もし私たちが十分な資金がなければ、私たちは私たちの候補製品をさらに開発したり、それらを市場に出して製品収入を生成したり、資本を節約するためにリストラを行うことができないかもしれない。
著者らは第三者に依存して私たちの候補製品の臨床試験とある方面の臨床前研究を行うことを期待している。もしこれらの第三者がその契約義務を成功的に履行し、規制要求を遵守したり、予想された最終期限までに完成できない場合、私たちは規制部門の私たちの候補製品の承認を得られないか、商業化される可能性があり、私たちの業務は深刻な損害を受ける可能性がある。
著者らは医療機関、臨床研究者、契約実験室とその他の第三者(例えばCRO)による未来の臨床試験を行う予定であり、現在著者らは第三者に依存して著者らの候補製品のいくつかの方面の臨床前研究を行っている。しかし、著者らはすべての臨床前研究、臨床試験及び著者らが後援した任意の未来の前臨床研究と臨床試験が適用された方案、法律と法規の要求及び科学標準に従って行われることを保証する責任があり、著者らのCROへの依存は私たちの監督責任を軽減しない。例えば、このようなすべての研究または臨床試験が、そのような研究または試験の全体的な調査計画および計画に従って行われることを保証する責任を負い続ける。さらに、FDAは、データおよび報告の結果が信頼性および正確であることを保証し、試験参加者の権利、完全性および機密性を保護するために、良好な臨床実践またはGCPと呼ばれる臨床試験結果を行い、記録し、報告する法規を遵守することを要求する。行われている臨床試験を一定の時間範囲で登録し,政府が援助しているデータベースClinicalTrials.gov上で完成した臨床試験結果を公表することも求められている。そうしないと罰金、否定的な宣伝、そして民事と刑事制裁につながるかもしれない。私たちが臨床前研究および臨床試験を行っている間の任意の法律および法規違反行為については、刑事起訴までの民事処罰を含む可能性がある警告状または法執行行動を受ける可能性がある。私たちはまた、私たちのいくつかの臨床試験材料を生産するために、契約製造組織に依存し続けていると予想されている。例えば、“を参照してください”リスク要因である製造に関連するリスク−我々の臨床製品供給を第三者に頼って生産したいが,我々の候補製品の製造過程では少なくとも第三者に依存するつもりである。第三者がサプライチェーン不足に遭遇し、十分な数の製品を提供できない場合、または許容可能な品質レベルや価格で製品を提供できない場合、私たちの業務は損なわれる可能性がありますより多くの情報を得るために。
63
私たちと私たちのCROはGCPを含む臨床前研究と臨床試験結果を行う、モニタリング、記録、報告する法規を遵守して、データと結果が科学的に信頼性と正確であることを保証し、試験患者は臨床試験に参加する潜在的なリスクが十分に通知され、彼らの権利は保護される。これらの規定はFDA、欧州経済区加盟国の主管当局と類似の衛生監督機関によって臨床開発中の任意の薬物に対して実行される。FDAは臨床試験スポンサー,主要研究者,試験地点の定期検査によりGCP規定を実行している。もし私たちまたは私たちのCROが適用されたGCPに従わなかった場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられるかもしれませんが、FDAまたは同様の衛生規制機関は、私たちのマーケティング申請を承認する前に追加の臨床試験を行うことを要求するかもしれません。検査後、FDAは将来のどの臨床試験もGCPに適合しているかどうかを確認することは保証できません。また,我々の将来の臨床試験はcGMP法規に基づいて生産された候補製品を用いて行わなければならない。私たちのCROがこれらの規定を遵守できなかったかどうかは、私たちが臨床試験を繰り返す必要があるかもしれません。これは規制承認過程を延期し、法執行行動の影響を受け、支出を著しく増加させる必要があるかもしれません。
著者らは通常私たちの候補製品のために臨床試験を設計し、私たちの未来の候補製品のために臨床試験を設計するつもりであるが、CROは行い、すべての臨床試験を継続する。したがって、私たちの開発計画の多くの重要な側面は、それらの実施とタイミングを含めて、私たちの直接制御範囲内ではないだろう。著者ら自身に完全に依存している従業員と比較して、著者らの第三者による未来の臨床前研究と臨床試験への依存はまた、臨床前研究と臨床試験によって開発されたデータ管理の直接制御の減少を招く。外部の当事者とのコミュニケーションも挑戦的である可能性があり、ミスや協調活動の困難を招く可能性がある。外部の当事者は
これらの要素は第三者が著者らの臨床前研究と臨床試験を行う意志或いは能力に重大な不利な影響を与える可能性があり、そして著者らのコントロール範囲を超える意外なコスト増加に直面させる可能性がある。もしCROが満足できる方法で臨床前研究と未来の臨床試験を行わなかった場合、彼らの私たちの義務に違反したり、規制要求を遵守できなかった場合、私たちの候補製品の開発、規制承認、商業化が遅れる可能性があり、私たちは規制承認を得られず、私たちの候補製品を商業化することができないかもしれません。あるいは私たちの開発計画は実質的で不可逆的な損害を受ける可能性があります。CROが収集した臨床前および臨床データに依存できなければ、私たちが行った任意の臨床試験の規模を繰り返し、延長または増加させる必要があるかもしれないが、これは商業化を著しく延期し、支出を著しく増加させる必要があるかもしれない。
医療提供者、医師、第三者支払者との関係は、適用された反リベート、詐欺、乱用、および他のヘルスケア法律法規の制約を受けており、これは、私たちを刑事制裁、民事処罰、政府医療計画から除外された、契約損害、名声損害、および利益、および将来の収入減少に直面させるかもしれない。
候補製品を商業化したり、医療製品を商業化する協力者に支援と支援を提供したりする範囲では、米国連邦政府と州、および私たちが業務を展開している他の司法管轄区の他の国、地域または地方政府の追加的な医療法律·法規要件および法執行の制約を受ける。
医療保健提供者、医師、第三者支払者は、私たちが市場で承認される可能性のある任意の製品や候補製品を開発し、獲得することを推奨し、処方する上で主な役割を果たしている。私たちの現在と未来の第三者支払者と顧客との手配は、私たちがマーケティング、販売、流通を制限する可能性があり、マーケティングの承認を得た候補製品の業務または財務スケジュールと関係を制限する可能性がある広範に適用される詐欺や乱用、その他の医療法律や法規に直面するかもしれません。“”というタイトルの部分を参照ビジネス−医療保健法と法規制.”
EUでは、医師の処方、推薦、裏書き、購入、供給、注文、または医薬製品の使用を誘導または奨励するために、医師に福祉または利点を提供することが禁止されている。不当な行為を誘導または奨励するために利益または利益を提供することは、一般にEU加盟国の国家反賄賂法とイギリス2010年の“収賄法”によって管轄されている。このような法律に違反することは巨額の罰金と監禁につながるかもしれない。EU指令2001/83/ECは人用薬品に関するEUの指令であり、それは更に、処方或いは薬品を供給する資格のある人に薬品を販売する場合、これらの人にいかなるプレゼント、金銭利益或いは実物利益を提供、提供或いは承諾してはならず、これらのプレゼント、金銭利益或いは実物利益が高くなく、しかも医薬或いは薬局の実践と関係がない限り、規定している。この条項は2012年の人間薬物規制に移されたので、EUから離脱したにもかかわらず、イギリスに適用された。
64
いくつかの連合会員国で医者に支払われた費用は公開されなければならない。また、医師との合意は、通常、医師の雇用主、その主管する専門組織、および/またはEU加盟国の監督当局に事前に通知し、承認しなければならない。これらの要件は、EU加盟国に適用される国家法律、業界規則、または専門行為規則に規定されている。このような要求を守らないことは、名声のリスク、公開非難、行政処罰、罰金、または監禁につながる可能性がある。
私たちが第三者の業務配置と適用される医療法律や法規に適合するように努力することは、多くのコストに関連することを確実にします。政府当局は、私たちの業務実践が現在または未来に適用される詐欺および乱用または他の医療保健法律および法規に関連する現行または未来の法規、法規または判例法に適合していない可能性があると結論するかもしれない。これらの法律の範囲が広く、法定例外状況と選択可能な避難港が限られていることから、私たちのいくつかの商業活動は1つ以上のこのような法律の挑戦を受けるかもしれない。私たちが設立する可能性のある販売·マーケティングチームによる活動を含めて、私たちの運営が、これらの法律または任意の他の私たちに適用される可能性のある政府法規に違反していることが発見された場合、私たちは、連邦医療保険や医療補助のような、重大な民事、刑事および行政処罰、損害賠償、罰金、連邦医療保険および医療補助のような政府援助の医療計画から除外され、私たちの業務を削減または再構成するかもしれない。もし私たちがそれと業務を展開することを期待している任意の医師または他の提供者または実体が適用されない法律に適合していないことが発見された場合、彼らは政府の援助された医療計画から除外されることを含む刑事、民事または行政制裁を受ける可能性がある。彼らがこれらの法律に基づいて負う責任は、重大なコストや運営中断を招く可能性があり、これは私たちの業務、財務状況、運営結果、将来性に重大な悪影響を及ぼす可能性がある。
製造業に関するリスク
遺伝子編集製品は珍しいので、複雑かもしれませんが、製造が難しいです。私たちは製造問題に直面し、私たちの候補製品の開発や商業化の遅延、あるいは他の方法で私たちの業務を損なう可能性があります。
CRISPR/CAS 9に基づく候補製品を生産するための製造プロセスは斬新であり、複雑である可能性があり、臨床および商業生産需要を満たすためにこのようなプロセスを実施および実行する業界経験は限られている。いくつかの要素は生産中断を招く可能性があり、新しい製造技術の開発ができない、設備故障、施設汚染、原材料不足或いは汚染、自然災害、流行病、公共事業サービス中断、人為的エラー或いはサプライヤー運営中断を含み、第三者がサプライヤーを買収したり破産を宣言したりすることを含む。これらの候補製品を製造するために必要な専門知識は,特定の契約製造組織独自である可能性があるため,代替契約製造組織を探すことは困難で時間がかかる.私たちの製造工場または第三者メーカーの任意の関連システムに故障またはプロセス欠陥が発生したことは、研究、臨床および商業生産のための候補細胞治療製品およびそのいくつかのコンポーネントを製造および供給する能力に悪影響を及ぼす可能性がある。
私たちの候補製品はほとんどの小分子薬物に必要なより複雑な加工工程を必要とするだろう。また,小分子と異なり,生物製品の物理的·化学的性質は通常完全には表現できない。したがって、完成品の検出は、製品が所望の方法で動作することを確保するのに十分ではない可能性がある。したがって、このプロセスが有効であることを保証し、そのプロセスに従って候補製品を厳密かつ一致的に製造するために、複数のステップを用いて製造プロセスを制御する。製造過程の問題は、正常過程との微小な偏差であっても、製品欠陥或いは製造失敗を招く可能性があり、それによって大量故障、製品リコール、製品責任クレーム或いは在庫不足、或いは他の供給中断を招く可能性がある。私たちの候補製品または私たちの候補製品を製造する製造施設で微生物、ウイルス、または他の汚染が発見されれば、これらの製造施設の生産は汚染を調査し、修復するために長い間中断される可能性がある。FDA、EMAまたは他の適用基準または規範に適合する臨床レベルの材料の十分な数量と品質、および一致して許容可能な生産生産量とコストを得ることができないいくつかの問題に直面する可能性がある。
さらに、FDA、EMA、および他の衛生規制機関は、任意のロットの承認された製品のサンプルをいつでも提出し、適用試験結果を示すスキームを要求するかもしれない。場合によっては、FDA、EMA、または他の衛生規制機関は、関連機関が発行を許可する前に大量の薬物を配布しないように要求するかもしれない。製造過程中の微小な偏差は、品質属性や安定性に影響を与える偏差を含み、製品に許容できない変化を招き、大量故障や製品リコールを招く可能性がある。大量故障は私たちの製品発表或いは臨床試験を延期する可能性があります。私たちは製品リコールを行う必要があるかもしれません。これらはすべて私たちにとってコストが高いかもしれません。そうでなければ、私たちの業務、財務状況、運営結果と将来性を損なうかもしれません。私たちの製造過程の問題は私たちの製品に対する市場の需要を満たす能力を制限するかもしれない。
私たちはまた、私たちの製造プロセスを操作するために必要な経験豊富な科学、品質保証、品質管理、製造人員の問題に直接あるいは契約製造組織を通じて採用と保留することができ、これは生産遅延を招き、あるいは適用された法規要求を維持することが困難になる可能性がある。私たちのサプライチェーン、製造プロセス、または施設のどんな問題も、計画中の臨床試験の遅延とコストを増加させる可能性があり、可能性があります
65
大手製薬会社や学術研究機関を含む潜在的なパートナーにとって、米国は魅力の低いパートナーであり、より多くの魅力的な発展プロジェクトを獲得することを制限する可能性がある。私たちの製造過程における問題は、将来の潜在市場の製品に対する需要を満たす能力を制限するかもしれない。
私たちのパートナーVertexはCASGEVYのメーカーと独占ライセンス保有者です。CASGEVY製造に関する詳細は、“を参照されたい”リスク要因-私たちの第三者との関係に関するリスク-私たちはVertexと私たちのLead計画CASGEVY上でパートナーシップを構築しました;VertexはCAGEVY計画に対して重要な制御権を持っています.”
私たちの候補製品の製造施設は厳格な法規によって制限されており、規制承認を得たり維持したり、既定のcGMPや国際ベスト実践と一致していなければ、候補製品を商業化する能力を延期または弱める可能性がある。
我々と我々の候補製品の第三者メーカーは,FDAが規定しているcGMPおよびEMAや他の規制機関が規定する他の規制の適用に制約されている。アメリカとヨーロッパの候補製品がFDAとEMAの承認を得るためには、私たちまたは私たちの第三者製造施設の厳格な承認前検査が必要です。私たちまたは私たちの請負業者の製造施設を検査する時、FDAまたはEMAはcGMP欠陥を列挙する可能性があり、軽微であっても重大であっても、開示を要求されないかもしれません。欠陥を修復するのは難しくて費用がかかるかもしれないし、多くの時間がかかるかもしれない。さらに、FDAまたはEMAがその検査結果に欠陥があることに気づいた場合、それは通常、欠陥が満足的に修復されたかどうかを決定するために施設を再検査する。FDAまたはEMAは、その再検査の結果におけるさらなる欠陥が、以前に決定された欠陥に関連するか、または他の態様に関連することに注目する可能性がある。もし私たちあるいは私たちの候補製品のメーカーがFDAとEMAのcGMPに対する適合性を適時に満たすことができなければ、私たちの候補製品の発売審査は深刻に遅延する可能性があり、これは逆に私たちの候補製品の商業化を延期することになる。
私たちは私たちの内部製造施設に関連した規制と操作リスクを受けている。
私たちはマサチューセッツ州フレミンガムに約50,000平方フィートの細胞療法製造工場を持っていて、私たちのいくつかのプロジェクトに候補製品とそのいくつかのコンポーネントの臨床と商業生産を提供することを目的としている。私たちは私たちの臨床試験のために製品を発表するために必要なcGMPプロセスに従い、FDAを含む監督管理機関のすべての要求を満たして、私たちの完全な細胞治療候補製品とそのいくつかのコンポーネントの研究、臨床と商業生産を支持し、私たちのいくつかの計画を満たすことができるようにしている。私たちは、私たちが予想する内部製造能力および/または需要を支援したり、規制機関の要求を遵守したりするために、私たちの施設を支援または運営できる保証はありません。当施設の設計はバイオテクノロジー施設の現在の基準に基づいているが,規制機関の事前承認もなく,FDAなどの規制機関の検査も受けていない。マサチューセッツ州フレミンガムで私たちの工場を建設した時、私たちはすでに大量の支出を生み出し、将来私たちの工場を運営するには著しい追加支出が発生すると予想されています。
私たちは第三者に頼って私たちの臨床製品を生産したいです。私たちは候補製品の製造過程で少なくとも第三者に依存するつもりです。第三者がサプライチェーン不足に遭遇し、十分な数量の製品投入品を提供できない場合、あるいは受け入れ可能な品質レベルや価格で製品を提供できない場合、私たちの業務は損害を受ける可能性があります。私たちの第三者契約製造パートナーは規制と操作リスクの影響を受けている。
私たちはすでに内部製造能力を確立し、私たち自身の細胞療法製造施設を構築したが、私たちは依然として外部サプライヤーに依存して供給品を製造し、このような候補製品に対して任意の臨床試験を行う時に私たちの候補製品を加工した。私たちはまだどの候補製品にも商業規模の製造や加工を促していませんし、私たちの候補製品のためにそうすることができないかもしれません。製造過程を最適化しながら変更することに努め,過程中のわずかな変化でも安全で有効な治療法が生じることを確保することはできない。
我々の候補製品を生産するための施設は,FDAまたは他の管轄区の他の衛生規制機関がFDAまたは他の衛生規制機関に申請を提出した後に行われる検査に基づいて評価されなければならない。私たちは私たちの契約製造パートナーの製造過程を制御するのではなく、私たちの契約製造パートナーが規制要件、いわゆるcGMP要求を遵守して、私たちの候補製品を生産することに完全に依存します。もし私たちの契約メーカーが私たちの規格やFDAまたは他の規制機関の厳格な規制要件に適合した材料を生産することに成功しなかった場合、彼らはその製造施設の規制承認を確保および/または維持することができない、あるいは規制機関は彼らの欠陥を理由に、FDAまたは他の規制機関の私たちの候補製品に対する規制承認を得ることができないか、または遅延する可能性がある。しかも、私たちの契約製造業者が十分な品質管理、品質保証、合格者の能力を維持することを直接制御することはできません。FDAや同様の衛生規制機関がこれらの施設を承認しない場合、またはこれらの施設に欠陥があることを引用して私たちの候補製品を生産するか、またはそのような承認を撤回したり、将来的に欠陥を引用したりすれば、代替製造施設を探す必要があるかもしれません。これは、私たちが開発し、規制を得る能力に深刻な影響を与えます
66
もし承認されれば、私たちの候補製品を承認またはマーケティングします。さらに、我々の契約メーカーがFDAや同様の衛生規制機関の行動やコロナウイルスの大流行により、直ちに職責を履行したり、気を失ったりすると、製造遅延や代替製造施設を探す必要がある可能性があり、いずれの場合も、規制機関の承認を得たり、私たちの候補製品を販売したりする能力に深刻な影響を与える。
限られた数の第三者製造業者への依存は、以下のリスクを含む多くのリスクに直面します
これらのリスクの各々は、私たちの臨床試験の完了またはFDAが私たちの任意の候補製品を承認することを遅延または阻止する可能性があり、コスト上昇をもたらし、または私たちの候補製品の商業化に悪影響を及ぼす可能性がある(承認された場合)。また,患者に渡す前に,第三者に依存して候補製品のいくつかの仕様テストを行う。もしこれらのテストが不適切で、テストデータが信頼できなければ、患者は深刻な傷害のリスクに直面する可能性があり、FDAは欠陥が修復されるまでわが社に重大な制限を加える可能性がある。
従業員事務に関するリスク、管理成長、および私たちの業務に関するその他のリスク
私たちの未来の成功は私たちが肝心な幹部を維持し、合格者を吸引、維持、激励する能力にかかっている。
著者らは最高経営責任者Samarth Kulkarni博士及び著者らの管理、科学と臨床チームの他の主要なメンバーの研究開発、臨床、商業と業務発展方面の専門知識に高度に依存している。私たちは私たちの幹部と雇用協定を締結したが、彼らの誰もが私たちとの雇用関係をいつでも終わらせることができる。私たちは私たちの役員や他の職員たちに“キーパーソン”保険を提供しない。また、私たちは、科学と臨床コンサルタントを含むコンサルタントとコンサルタントに依存して、私たちの研究開発と商業化戦略の制定を助けてくれます。私たちのコンサルタントやコンサルタントは、私たち以外の雇用主に雇われる可能性があり、他のエンティティと締結された相談または相談契約に基づいて約束することができ、これは、私たちが彼らを得る機会を制限するかもしれない。役員や他の重要な従業員やコンサルタントを失ったサービスは、私たちの研究、開発、成果を阻害する可能性があります
67
ビジネス戦略を成功させる能力を大きく損なうことになりますもし私たちが高い素質の人材を維持できなければ、私たちが成長戦略を実施する能力は制限されるだろう。
私たちはまた、私たちの候補製品と製品ラインの開発を進めているので、合格した科学、臨床、ビジネススタッフを募集して維持する必要があります。多くの製薬と生物技術会社の類似者に対する競争を考慮して、私たちは受け入れ可能な条件でこれらの肝心な人員を採用、訓練、維持或いは激励することができないかもしれない。私たちはまた、大学や研究機関から科学、臨床、ビジネススタッフを募集する競争に直面している。臨床試験で成功できなかったことは、合格した科学者の採用と維持をもっと挑戦的になる可能性がある。
役員報酬に関するスイスのコーポレート·ガバナンスは私たちの業務に影響を及ぼすかもしれない。
スイス企業法は、他の事項を除いて、(A)役員チームおよび取締役会メンバーの報酬について拘束力のある年間“報酬発言権”投票を行うことを株主に要求し、(B)一般的に執行管理層および取締役会メンバーへの解散料、前払い、取引割増および類似金の支払いを禁止し、(C)会社にその組織規約において報酬に関する様々な事項を具体的に説明することを要求し、これらの事項が株主投票で承認されなければならないことを要求する。私たちの年間株主総会では、私たちの株主は、私たちの取締役会と私たちの実行管理チームの最高総報酬の承認を要求されました。スイスの法律では、取締役や執行管理職のメンバーが賠償に関する何らかの要求を守らなければ、刑事罰を受けることも規定されている。これらの規定は私たちが経営陣と取締役会のメンバーを誘致し、維持する能力に否定的な影響を及ぼすかもしれない。
私たちの従業員、首席調査員、コンサルタント、ビジネスパートナーは、規制基準と要求を遵守しないこと、およびインサイダー取引を含む不正行為や他の不適切な活動に従事する可能性があります。
私たちは従業員、コンサルタント、ビジネスパートナー、主要な調査者詐欺または他の不適切な行為のリスクに直面している。これらの当事者の不正行為は、FDA法規またはEUおよび他の司法管轄区に適用される法規を故意に遵守しないこと、FDA、欧州委員会および他の規制機関に正確な情報を提供すること、米国および他の司法管轄区の医療詐欺および法律法規の乱用、財務情報またはデータを正確に報告すること、または不正な活動を開示することを含む可能性がある。特に、医療業界の販売、マーケティング、商業配置は、詐欺、不正行為、リベート、自己取引、その他の乱用行為を防止するための広範な法律法規によって制約されている。これらの法律法規は、広範な定価、割引、マーケティングと販売促進、販売手数料、顧客激励計画などの業務手配を制限または禁止している。このような不正行為はまた、臨床試験過程中あるいはFDA或いは他の監督機関との相互作用過程で得られた情報の不適切な使用に関連する可能性があり、これは規制制裁を招き、著者らの名声に深刻な損害を与える可能性がある。我々はすべての従業員に適用される行動基準を採択したが、常に従業員の不正行為を識別し、阻止できるわけではなく、このような行為を発見し防止するための予防措置は、未知または未管理のリスクや損失を効果的に制御できない可能性があり、またはこれらの法律や法規を遵守できないことによる政府の調査または他の行動や訴訟から私たちを保護することができるかもしれない。また、私たちは、起きていなくても、このような詐欺や他の不正行為を告発する可能性があるというリスクに直面している。もし私たちにこのような訴訟を提起した場合、私たちは私たちの権利を弁護したり、維持することに成功しませんでした。これらの訴訟は、民事、刑事および行政処罰、損害賠償、罰金、連邦医療保険、医療補助および他の連邦医療保健計画から除外される可能性があり、契約損害、名声損害、利益減少、および将来の収益減少、および私たちの業務運営能力および運営結果に悪影響を及ぼす可能性があります。
もし私たちが環境、健康、安全の法律法規を守らなければ、罰金や処罰を受けたり、私たちの業務を損なう可能性のあるコストが発生するかもしれません。
私たちは多くの環境、健康と安全法律と法規の制約を受けて、それらの研究室の手続きと危険材料と廃棄物の処理、使用、貯蔵、処理と処理を管理する法律と法規を含む。私たちの行動は化学物質と生物学的材料を含む危険で燃えやすい材料の使用に関するものだ。私たちの業務はまた危険な廃棄物製品を発生させるだろう。私たちは第三者とこのような材料と廃棄物を処理する契約を締結した。私たちはこのような材料が汚染や傷害をもたらす危険をなくすことができない。もし私たちがどんな危険な材料を使用して汚染や損傷をもたらしたら、私たちはそれによるいかなる損害に責任を負うかもしれないし、どんな責任も私たちの資源の範囲を超えているかもしれない。民事や刑事罰金やこのような法律や法規を遵守しない罰に関する巨額の費用を招く可能性もある。
また、現在または未来の環境、健康、安全法律法規を遵守するためには、巨額のコストが生じる可能性がある。このような現行または未来の法律法規は私たちの研究、開発、または生産努力を損なうかもしれない。私たちがこのような法律を守らないことはまた巨額の罰金、処罰、または他の制裁につながるかもしれない。
68
私たちは製品責任や他の製品関連のクレームや訴訟のリスクに直面しており、これは私たちが多くの責任を負うことを招き、私たちが開発する可能性のある任意の候補製品の商業化を制限する可能性があります。
私たちは私たちの候補製品が人体臨床試験でテストを行うことに関連する固有の製品責任リスクに直面し、私たちが開発する可能性のある任意の候補製品を商業販売すれば、私たちの製品に関連するより大きなクレームと訴訟リスクに直面する。例えば、私たちが任意の臨床試験において対象または患者に対するインフォームドコンセントが任意の方法で不十分または不正確である場合、または他の材料または必要な情報に関与または提供することに関与している任意の潜在的リスクを被験者または患者に十分に通知することができない場合、起訴されるか、または請求される可能性がある。私たちの候補製品が臨床試験、生産、マーケティングまたは販売および使用中に、または他の薬剤と一緒に使用された場合、または他の薬剤と一緒に使用された場合、傷害、さらには死亡、または他の態様では不適切であることが発見された場合、使用を提案しても同様であるとしても、起訴またはクレームされる可能性がある。このような製品責任クレームは、製造欠陥、設計欠陥、製品固有の危険、不注意、厳格な責任、詐欺/不実陳述、不適切なラベル、マーケティングまたは販売促進クレームまたは保証違反などのクレームを含むことができるが、これらに限定されない。クレームはまた、州消費者保護法、一般法、または他の法規または法規によって主張されることができる。
もし私たちが製品責任クレームや私たちの製品に関連する他のクレームを自己弁護することに成功できない場合、私たちの製品が損傷や死亡をもたらしたことを含むが、これらに限定されない場合、私たちは重大な責任を招いたり、私たちの候補製品の商業化を制限することを要求される可能性があり、対応する規制法執行行動に直面する可能性があります。成功的な防御であっても、多くの財政的で管理的な資源が必要だ。たとえ私たちが過去または未来の会社のパートナーと合意しても、私たちはすべてまたは一部の損害賠償を受ける権利があり、もし何かクレームが発生した場合、この賠償は利用できないか十分である可能性がある。是非曲直や最終結果にかかわらず、賠償責任の結果には、
私たちは製品責任保険を受けたが、それは私たちが発生する可能性のあるすべての責任をカバーするのに十分ではないかもしれない。また、もし私たちが任意の候補製品を商業化することに成功すれば、私たちは私たちの保険カバー範囲を増やす必要があると予想している。保険範囲はますます高くなっています。私たちは可能などんな責任にも対応するために、合理的な費用や十分な金額で保険範囲を維持することができないかもしれない。私たちは、裁判所によって裁決された、または和解協定で協議された、私たちの保険範囲を超えて、または私たちの保険カバー範囲内にない任意の金額、または協力者との任意の賠償協定に従って支払われた任意の金額を支払わなければならないかもしれません。私たちは、これらの金額を支払うのに十分な資本を得ることができないか、または得ることができません。
財務報告書に対する適切かつ効果的な内部統制を確立し、維持することができなければ、私たちの経営業績と私たちの経営業務の能力が損なわれる可能性がある。
私たちが正確な財務諸表をタイムリーに作成できるように十分な内部財務と会計制御と手続きを持っていることを確保して、これは高価で時間のかかる仕事であり、常に再評価する必要がある。私たちは2002年のサバンズ-オキシリー法案(Sarbanes-Oxley Act、略称SOX)の要求を遵守しなければならない。この法案は私たちが財務報告書と開示統制と手続きに対して効果的な内部統制を維持することを要求する。特に、システムおよびプロセス評価を行い、我々の制御措置を記録し、財務報告の重要な制御をテストし、SOX第404条の要求に基づいて経営陣と独立会計士事務所が財務報告の内部統制に対する有効性を報告することを可能にしなければならない。私たちのテスト、あるいは私たちの独立会計士事務所のその後のテストは、財務報告における私たちの内部統制欠陥を明らかにするかもしれません。これらの欠陥は実質的な弱点と考えられています。もし私たちが第404条の要求を直ちに遵守できない場合、あるいは私たちまたは私たちの会計士事務所が財務報告の内部統制において重大な弱点と考えられる欠陥を発見した場合、私たちの株式の市場価格は下落する可能性があり、私たちは規制機関の訴訟、制裁、または調査を受ける可能性があり、これには追加の財務と管理資源が必要になるだろう。
私たちはこの報告書要件を管理するために、より強力な技術とより多くの資源に投資し続けている。私たちの内部統制を適切に変更することは、私たちの役人や従業員の注意を分散させる可能性があり、新しいプロセスを実施したり、既存のプロセスを修正したりすると、大量のコストを招き、完成するのに時間がかかる可能性があります。このような統制を実施するどんな困難や遅延も、私たちが財務業績をタイムリーに報告する能力に影響を及ぼす可能性がある。また、私たちは現在、いくつかの分野で人工的なプロセスに依存しており、これは、財務業績を報告する際に人為的なミスや介入に遭遇するリスクを増加させる。これらの理由で、私たちは私たちの財務結果を適時かつ正確に報告することに困難があるかもしれません。これは私たちに影響を与えます
69
私たちの投資家にタイムリーに情報を提供します。したがって、私たちの投資家は私たちが報告した財務情報に自信を失うかもしれないし、私たちの株価は下落するかもしれない。
また、このような変化は、私たちが内部統制の十分性を効果的に維持することを保証することはできません。このような十分性を維持できない場合は、私たちの財務業績を正確に報告することを阻止することができます。なお、“を参照されたい”リスク要因-情報セキュリティおよびデータプライバシーに関連するリスク--私たちの内部コンピュータシステム、または私たちの協力者や他の請負業者やコンサルタントのシステムは、故障したり、セキュリティホールにさらされたりする可能性があり、これは、私たちの製品開発計画を深刻に中断させる可能性があります。"
私たちの業務にはかなりの国際的な足跡があり、私たちは将来さらに拡張する可能性があり、私たちの業務運営管理に挑戦しています。
私たちの本部はスイスのズグにあり、アメリカに事務所を設置している。しかも、私たちは未来に私たちの国際業務を他の国に拡張するかもしれない。私たちはすでに多くの管理者や他の豊富な経験を持つ人員を獲得しているが、複数の国で業務を展開することは、私たちを様々なリスクと複雑さに直面させ、これらのリスクと複雑性は、私たちの業務、運営結果、財務状況、成長の見通しに実質的で不利な影響を与える可能性がある
私たちは私たちの業務を拡大し続け、私たちの会社の構造と税金構造は複雑だ。私たちの現在と未来の潜在的なパートナー関係に合わせて、私たちは技術と知的財産権の開発と応用に積極的に参加し、世界規模で製品の商業化を実現することを期待して、通常は商業化パートナーと共に。これらの活動の面で、私たちは、私たちの技術、知的財産権、その他の資産に関連し、私たちとパートナーや許可者などの他のエンティティとの間、および私たちと私たちの子会社との間の取引に関連して、複雑な国境を越えたグローバル取引に従事し続けている可能性があります。このような国境を越えてもグローバルな配置は管理が困難であり、税務処理などの分野で複雑性を引き起こす可能性があり、特に私たちは様々な税制に支配されているため、異なる税務当局も同じ国境を越えた取引や手配に対して異なる見方を持っている可能性がある。運営効率の低下、制御欠陥、または税務負担に遭遇することなく、このような増加した複雑さを効率的に管理することは保証されない。わが社の日々増加する複雑さを効果的に管理するためには、大量の管理時間と労力が必要であり、これを成功させることができなければ、私たちの業務、財務状況、運営結果、成長見通しに実質的な悪影響を与える可能性がある。
知的財産権に関するリスク
私たちが独自の遺伝子編集技術や候補製品に関連する知的財産権を獲得したり保護したりできなければ、私たちは私たちの市場で効果的に競争できないかもしれない。
私たちの成功は、私たちのCRISPR/Cas 9プラットフォーム技術と、私たちが開発した任意の独自製品および技術について、米国および他の司法管轄地域で独自または知的財産権保護を獲得し、維持する能力に大きく依存しています。私たちは特許権、商業秘密保護、秘密協定を含む一連の知的財産権によって、私たちの遺伝子編集技術と候補製品に関連する知的財産権を保護します。現在、私たちはある知的財産権の権利を持っていて、第三者の許可と私たちが持っている特許権を通じて、私たちの遺伝子編集技術および/または候補製品を開発しています。例えば、私たちが2014年にDr.Charpentierと独占的に許可したことによって、私たちは、私たちの遺伝子編集プラットフォーム技術の様々な態様、例えば、私たちの遺伝子編集プラットフォーム技術の様々な側面をカバーする100以上の付与または許可された特許、および行われている特許出願を含むグローバル特許の組み合わせのいくつかの権利を独占的に許可する CRISPR/CAS 9システムのような物質の組成および使用方法であって、CRISPR/CAS 9システムを用いて遺伝子編集を行うことを含む使用方法。この世界的な特許の組み合わせを“特許組合せ”と呼ぶ.さらに、私たちは、私たちの候補製品の様々な態様、例えば、物質の組成および製造および使用の方法を含む、私たちの候補製品に関する大量の特許出願を提出した。
私たちは、知的財産権を付与することで私たちのプラットフォーム技術をカバーし、私たちの独自の地位を保護するために、米国や他の司法管轄区域に当社の技術や製品候補に関する特許出願を提出することを求めており、これらの技術や製品は私たちの業務に非常に重要です。私たちはまたビジネス秘密、技術ノウハウ、持続的な技術革新に依存して、私たちのを発展させ、維持しています
70
独自と知的財産権の地位。私たちまたは私たちの許可者が、CRISPR/Cas 9プラットフォーム技術および私たちが開発した任意の独自製品および技術の特許保護を取得または維持できない場合、私たちの業務、財務状況、運営結果、および見通しは深刻な損害を受ける可能性があります。
しかしながら、バイオテクノロジーおよび製薬分野、特にゲノム編集分野の特許強度は、通常、複雑な法律および科学的問題に関連しており、私たちが所有しているか、または許可されている特許権、任意のそのような特許権の広さ、または任意の発行された特許が無効であるかどうか、強制的に実行できないかどうか、または第三者の脅威を受けることを保証することはできないかもしれない。例えば、私たちがアメリカと他の国で得ることができる特許保護範囲は不確定だ。米国および他の国の特許法またはその解釈の変化は、私たちの知的財産権を保護し、私たちの知的財産権を保護し、獲得し、維持し、擁護し、実行する能力を弱める可能性があり、より広く言えば、私たちの知的財産権の価値に影響を与えたり、私たちの所有しているライセンス内の特許の範囲を縮小したりする可能性がある。ライセンス内で所有されている知的財産権については、私たちおよび私たちのライセンシーが現在求めている特許出願が任意の特定の司法管轄区域で特許として発行されるかどうか、または発行された特許の権利主張が競合相手に対して十分な保護を提供するかどうか、または私たちの競争相手が挑戦している場合、そのような特許が無効、強制執行または侵害されないことが発見されるかどうかを予測することはできません。
特許訴訟過程は高価で、時間がかかり、複雑であり、私たちは合理的なコストまたはタイムリーな提出、起訴、維持、強制執行、またはすべての必要または望ましい特許出願を許可することができないかもしれない。我々の研究開発成果における出願可能な特許の側面をタイムリーに決定できず,特許保護を得ることができない可能性もある.私たちは、私たちの研究開発成果にアクセスする権利のある機密または特許可能な当事者と、当社の従業員、会社の協力者、外部科学協力者、CRO、契約製造業者、コンサルタント、および他の第三者のような秘密および秘密協定を締結していますが、これらの当事者のいずれかは、合意に違反し、特許出願を提出する前にそのような成果を開示し、特許保護を求める能力を危険にさらしている可能性があります。また,我々が我々の遺伝子編集技術および/または候補製品を開発している分野には,第三者が所有する米国や外国から発行される特許や係属中の特許出願が多く存在する.私たちが関連する第三者特許や出願を決定できなかったかもしれない。また、科学文献で発表された発見は、米国や他の司法管轄区の実際の発見や特許出願よりも遅れがちであり、通常は出願18ヶ月後に発表され、時には全く発表されない場合もある。したがって、私たちは、私たちのライセンス特許および出願の発明者が、私たちが所有または任意のライセンス特許または係属特許出願で主張されている発明の第1の発明者であるかどうか、または私たちがそのような発明のために特許保護を申請した最初の人であるかどうかをいかなる程度でも決定することはできない。さらに、我々の所有および許可内の特許および特許出願に関連するすべての潜在的に関連する既存技術が発見されていることは保証されず、これらの技術は、特許を無効にするか、または係属中の特許出願から特許が発行されることを阻止する可能性がある。
任意の係属中または許可された特許出願または付与された特許の最終結果は不確定であり、特許出願において要求されるカバー範囲は、特許発行前に大幅に減少することができ、その範囲は、特許発行後に再解釈することができる。私たちが現在許可または所有している特許出願が将来特許の形態で発表されても、それらは私たちに任意の意味のある保護を提供し、競争相手または他の第三者が私たちと競争することを阻止し、または他の方法で私たちにどんな競争優位性を提供してくれるかの形で発表されることはない。
さらに、特許の発行は、その発明性、範囲、有効性、または実行可能性に対して決定的ではなく、私たちが所有している特許および許可されていない特許は、米国および他の司法管轄区の裁判所または特許庁で挑戦される可能性がある。米国特許商標局の干渉、派生、再審、その他の付与後訴訟、および外国司法管轄区の異議および他の類似訴訟を含む多くの特許に挑戦する訴訟および行政訴訟があり、バイオテクノロジーおよび製薬業界の特許および他の知的財産権に関連しており、CRISPR/CAS 9分野も同様であると予想される。参照してください“リスク要因-知的財産権に関連するリスク-第三者が私たち、私たちのライセンシー、または私たちの協力者に提出した知的財産権侵害クレームは、私たちの製品発見と開発を阻害または延期する可能性がありますもっと情報を知っています. このような挑戦は、独占的または経営の自由を失うこと、または特許主張の全部または部分的な縮小、撤回、無効、または実行不可能をもたらす可能性があり、これは、私たちが発明を実施する能力を制限するか、または他人が同様の技術および製品を使用することを阻止するか、またはそれを商業化することを阻止するか、または我々の技術および製品の特許保護期間を制限する可能性がある。新製品候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。したがって、私たちが持っている特許と許可された特許の組み合わせは、他の会社が私たちと似ているか同じ製品を商業化することを排除するために十分な権利を提供してくれないかもしれない。
競争相手は、これらの発行された特許または特許出願において主張された発明を我々の発明者の前に発明したと主張することもでき、または我々の発明者の前に特許出願を提出した可能性がある。競争相手も私たちの製品や技術がその特許を侵害していると主張するかもしれないので、もし私たちの特許出願が発行されたら、私たちは私たちの技術を実践することができません。このようなクレームのいずれかにおける不利な裁決は、第三者特許権を侵害することなく製品を製造または商業化することができない可能性がある。競争相手は、発明が特許資格に適合していない、新規でない、明らかまたは特許主張が任意の他の特許性要件に適合していないことを証明することによって、私たちの特許に異議を提起することもできる。このような提出、訴訟、または訴訟における不利な裁決は、私たちの特許権の範囲を縮小したり、無効にしたり、第三者を許可する可能性があります
71
私たちの技術や製品を商業化し、私たちに支払うのではなく、私たちと直接競争する。
さらに、私たちまたは私たちのライセンシーのうちの1つは、発明の優先権または認可後の挑戦手順、例えば非米国特許庁における反対意見、発明優先権または他の特許可能な特徴に挑戦するために、米国特許商標局が発表した追加介入手順に参加しなければならない可能性がある。このような挑戦は、特許権の喪失、独占経営権の喪失、または経営の自由の喪失、または特許主張が全部または部分的に縮小され、撤回され、無効または実行できなくなる可能性があり、これは、他人が同様の技術および製品を使用または商業化することを阻止する能力を制限するか、または我々の技術および候補製品の特許保護期間を制限する可能性がある。最終的な結果が私たちに有利であっても、このような手続きは大量のコストを招く可能性があり、私たちの科学者と経営陣に多くの時間がかかる必要がある。
また、たとえそれらが挑戦されていなくても、私たちが持って許可された特許と特許出願は、私たちの知的財産権を十分に保護できず、私たちの候補製品に排他性を提供したり、私たちの声明をめぐる他の人の設計を阻止したりすることができないかもしれない。もし私たちが持っている特許出願が提供する保護の広さや強度が脅かされていれば、会社が私たちと協力して候補製品を開発することを阻止し、候補製品を商業化する能力を脅かす可能性があります。したがって、我々のゲノム編集プラットフォームの任意の進展および候補製品が、有効かつ強制的に実行可能な特許によって保護または保護されるかどうかは分からない。私たちの競争相手または他の第三者は、非侵害的に類似または代替技術または製品を開発することによって、私たちの特許を回避することができるかもしれない。例えば,第三者がCRISPR技術とCas 9以外のタンパク質を組み合わせて使用することを提案していることが知られている。私たちが持っていて許可された特許はそのような技術を含まないかもしれない。もし我々の競争相手がCRISPR技術をCas 9以外のタンパク質とともに商業化すれば、私たちの業務、財務状況、運営結果、将来性は実質的な悪影響を受ける可能性がある。また,臨床試験で遅延に遭遇すれば,特許保護された候補製品を販売できる時間が短縮される。
私たちの遺伝子編集技術および候補製品は、第三者が持っている独占権を使用する必要があるかもしれないので、私たちの業務の成長は、私たちがこれらの独占権を獲得、許可、または使用する能力にある程度依存するかもしれない。私たちは私たちが決定した第三者からこのような知的財産権を得ることができないかもしれない。しかも、私たちを競争相手と思っている会社は私たちに権利を譲渡したり許可したりしたくないかもしれない。私たちはまた私たちの投資が適切な見返りを得るための条項の許可や第三者知的財産権を得ることができないかもしれない。また,業界,政府,学術界,その他のバイオテクノロジーや製薬研究の拡大に伴い,より多くの特許が発行され,我々の候補製品は他人の特許権侵害のクレームを引き起こすリスクが増加する可能性がある。私たちは私たちの遺伝子編集技術、候補製品、またはそのような候補製品を使用して第三者特許を侵害しないことを保証できない。特許権は管轄区域ごとに付与されているため、我々の候補製品を研究、開発、商業化する能力を含むいくつかの技術の自由を実施しており、国によって異なる可能性がある。
これらの結果のいずれも、第三者の競争を阻止する能力を弱める可能性があり、第三者競争は私たちの業務に悪影響を及ぼす可能性がある。私たちの未解決および将来の特許出願または私たちが許可内に配置することによって権利を獲得する特許出願は、私たちの技術または将来の候補製品の全部または一部を保護するために、または他社が競合技術および製品を商業化することを効果的に阻止するために、特許の発行を招くことができない可能性がある。
特許提供の保護に加えて、我々は、特許を出願できない独自技術、特許を実施しにくいプロセス、および私たちの候補製品発見および開発中に特許がカバーされていないノウハウ、情報または技術に関する任意の他の要素を保護するために、商業秘密保護および秘密保護プロトコルに依存して保護する。しかし、商業秘密は保護するのが難しいかもしれない。私たちは、従業員、コンサルタント、科学コンサルタント、請負業者と秘密保持協定を締結することで、私たちのノウハウやプロセスを保護することを求めています。また、私たちは私たちのビルの実体安全と、私たちの情報科学技術システムの実体と電子安全を維持して、私たちの資料と商業秘密の完全性とセキュリティを維持することに力を入れています。私たちはこのような個人、組織、そしてシステムに自信がありますが、合意や安全措置は違反される可能性があり、私たちはどんな違反にも対応する十分な救済措置がないかもしれません。しかも、私たちのビジネス秘密は競争相手に知られたり独立して発見されるかもしれない。
私たちのすべての従業員とコンサルタントが彼らの発明を私たちに譲渡することを望んでいますが、私たちのすべての従業員、コンサルタント、コンサルタント、および私たちのノウハウ、情報、または技術にアクセスできる第三者は、秘密協定を締結するために、すべてのこのような合意が正式に実行されているか、または私たちのビジネス秘密および他の機密固有情報が漏洩されないこと、または競争相手が他の方法で私たちのビジネス秘密または独立開発と実質的に同等の情報および技術を獲得しないことを保証することはできません。私たちのビジネス秘密を流用したり不正に開示したりすることは、私たちの競争地位を損なう可能性があり、私たちの業務に実質的な悪影響を及ぼす可能性があります。また,我々のビジネス秘密を守るための手順が不十分であると考えられれば,第三者による商業秘密の流用に対抗する十分な追跡権がない可能性がある.しかも、他の人たちは私たちの商業秘密と固有の情報を独立して発見するかもしれない。例えば、その透明性イニシアティブの一部として、FDAは、ビジネス秘密または他の固有情報と考えられる可能性のある情報を含む、より多くの情報を定期的に公開するかどうかを検討しており、FDAの開示政策が将来どのように変化する可能性があるかは不明である。
また、一部の外国の法律の専有権に対する保護程度や方式は米国の法律とは異なる。したがって、私たちは私たちの知的財産権を保護して保護する上で重要な問題に直面するかもしれない
72
アメリカと海外です。もし私たちが私たちの技術に関連する非特許知的財産権を第三者に開示することを阻止できず、私たちがこのような強制的に実行可能な商業秘密保護を持つことが保証されなければ、私たちは私たちの市場で競争優位性を確立したり維持することができなくなり、これは私たちの業務に実質的な悪影響を及ぼすかもしれない。
第三者が私たち、私たちのライセンシー、または私たちの協力者に提出した知的財産権侵害疑惑は、私たちの製品発見と開発を阻害または延期する可能性があります。
私たちの商業的成功は私たちが第三者の有効な特許と独自の権利の侵害を避けることにある程度かかっている。
我々が我々の候補製品を開発している分野には,大量の米国や外国から発行された特許と,第三者が所有する未解決特許出願が存在する.業界、政府、学術界、その他のバイオテクノロジーや製薬研究の拡大、およびより多くの特許の発行に伴い、私たちの候補製品は他人の特許権侵害のクレームを引き起こすリスクが増加する可能性がある。私たちは私たちの技術、未来の候補製品、またはそのような候補製品の使用が第三者特許を侵害しないことを保証することはできない。私たちはまた関連する第三者特許や出願を決定できない可能性がある。特許権は管轄区域ごとに付与されているため、我々の候補製品を研究、開発、商業化する能力を含むいくつかの技術の自由を実施しており、国によって異なる可能性がある。
第三者は私たちが彼らの特許を侵害したと主張するかもしれないし、私たちは彼らのノウハウを不正に使用して、私たちを起訴するかもしれない。我々が発見し開発した候補製品の成分、配合、製造方法、または使用または処理方法の請求項を含む、我々が現在知らない第三者特許がある可能性がある。特許出願が発行されるまでに数年かかる可能性があるため、現在処理されている特許出願が存在する可能性があり、これらの出願は、我々の候補製品が発行された特許を侵害する可能性がある。さらに、第三者は将来的に特許を取得し、私たちの技術または製造、使用、使用または販売のために私たちの候補製品がこれらの特許を侵害したと主張する可能性がある。そのような第三者特許が私たちの技術または候補製品をカバーするために管轄権のある裁判所によって所有されている場合、任意のそのような特許の所有者は、適用特許に基づいて許可されるか、またはそのような特許が満期になるまで、または最終的に無効または実行不可能と判定されない限り、適用可能な候補製品を商業化することを阻止することができるかもしれない。そのような許可は商業的に合理的な条項や根本的に存在しないかもしれない。もし私たちが商業的に合理的な条項で第三者特許の必要な許可を得ることができなければ、候補製品を商業化する能力は損害や遅延を受ける可能性があり、これは逆に私たちの業務を深刻に損なう可能性がある。
第三者の知的財産権宣言は私たちの製品発見と開発を阻害したり延期したりする可能性がある。
第三者は、私たちが所有しているか、または彼らまたは他の人から許可された知的財産権を含むか、または重複する知的財産権を要求することができる。これらの権利の範囲および所有権を決定するための法的手続きが開始される可能性があり、禁止または他の公平な救済を含む権利を失う可能性があり、これらは、私たちの候補製品のさらなる開発と商業化を効果的に阻止するかもしれない。第三者によって引き起こされるか、または米国特許商標局によって提起された干渉または派生プログラムは、我々の特許または特許出願または我々の許可者の特許または特許出願に関連する発明の優先権または正しい発明権を決定するために必要である可能性がある。不利な結果は、現在の特許権の喪失を招く可能性があり、関連技術の使用を停止したり、勝利者から許可権を得ようとしたりすることが要求される可能性があります。もし勝利者が商業的に合理的な条件で私たちにライセンスを提供しなければ、私たちの業務は損害を受ける可能性があります。訴訟、介入、または派生手続きは私たちの利益に不利な決定を招く可能性があり、私たちが成功しても、巨額のコストを招き、私たちの経営陣や他の従業員の注意を分散させる可能性がある。
例えば、第三者は、いくつかのCRISPR/CAS 9技術に権利がないと断言することができ、またはCVCグループは、CVCグループのいくつかの特許の発明権および所有権を含むいくつかのCRISPR/CAS 9技術に対する権利を有していない、またはそのような権利は限られていると断言することができる。
具体的には、ボイド研究所およびマサチューセッツ工科大学は、場合によっては、米国およびヨーロッパで発行された特許を含む一連の特許を有しており、CRISPR/CAS 9システムのいくつかの態様では、ヒト細胞中のDNAを含む真核細胞を編集することができるCRISPR/CAS 9システムのいくつかの態様を必要とする。2016年1月、米国特許商標局は、特許組合において当時審理されていた米国特許出願のうちの1つ(現在米国特許第10,266,850号として発行されている)とブロドが共同所有する12件の発行された米国特許との間に干渉(干渉番号106,048,または‘048干渉)が存在し、どの発明者が最初に発明し、米国で発明特許を取得する権利があるかを決定することを発表した。PTABの結論は、関連するクレームセットが特許上互いに異なると考えられるので、発表された干渉を停止すべきである。CVCグループが控訴した後,2018年9月10日,連邦巡回裁判所はPTAB干渉プロセスの終了決定を確認したが,どの発明者が実際にCRISPR/Cas 9ゲノム編集技術の真核細胞への使用を発明したかは決定されていない。
さらに、2019年6月、米国特許商標局は、CVCグループが共同所有する14(14)件の係属中の米国特許出願と13(13)特許とブロドが共同所有する1つの特許出願との間に第2の干渉(干渉番号106、115、または‘115干渉)が存在すると発表した。遠大な特許は048妨害された特許を含む。2020年9月、臨時技術相談機関は、他の事項を除いてプログラムを優先段階に早める命令を発表した。2022年2月PTABは決定を発表しました
73
優先度と判断遠大集団は干渉の標的においてCVC集団よりも優先的であると認定する.CVCグループはこの決定について連邦巡回控訴を行った。連邦巡回裁判所のいかなる最終決定も最高裁判所にさらに上訴することができる。
The BRoadを除いて、ビリニュス大学、ToolGen,Inc.,MillipreSigma(メルクKGaAの子会社、以前は“Sigma-Aldrich”と呼ばれていた)およびハーバード大学がCVCグループの出願後約1年以内にCRISPR/Cas 9に関連する発明を要求する特許出願を提出し、CVCグループの前にCVCグループが主張した1つまたは複数の発明を発明したと主張する(または主張することができる)The BRoadを除く他の第三者。USPTOがこれらの当事者の一方または複数のクレーム範囲がCVCグループ申請で許可されたクレームと十分に重複していると考えている場合、USPTOは、そのようなクレームの実際の発明者を決定するために、他の介入手続きを宣言することができる。例えば、2020年12月、米国特許商標局は、ヒト細胞を含む真核細胞においてDNAを編集するためにCRISPR/Cas 9システムのいくつかの態様を要求するToolGen特許出願と、‘115干渉に関与するCVC集団が共同で所有する14つの係属中の米国特許出願との間に干渉(干渉番号106,127または’127干渉)が存在すると発表した。この干渉は放置されており、連邦巡回裁判所が‘115妨害の判決を下すのを待っている。PTABの判決は連邦巡回裁判所に上訴し,最終的に最高裁に上訴することができる。さらに、2021年6月、米国特許商標局は、ヒト細胞を含む真核細胞においてDNAを編集するためにCRISPR/Cas 9システムのいくつかの態様を要求するMilLiporeSigma特許出願と‘115干渉に関与するCVC集団が共に所有する14つの係属中の米国特許出願との間に干渉(干渉番号106、132または’132干渉)が存在することを発表した。この干渉は放置されており、連邦巡回裁判所が‘115妨害の判決を下すのを待っている。最終的に,PTABの判決は連邦巡回裁判所に上訴し,最終的に最高裁に上訴する可能性がある。
CVCグループ、ブロド、ToolGen、ビリニュス大学、ミリプレシグマ、およびハーバード大学の各々は、米国および他の場所で既存または新しい特許出願を出願することができる。CVCグループおよびこれらの他の第三者は、真核細胞(ヒト細胞を含む)においてDNAを編集するためにCRISPR/Cas 9システムおよび方法の重複面を有すると主張しているので、CRISPR/Cas 9に基づくヒト療法をマーケティングおよび販売する能力は、特に競合特許の組み合わせで主張される発明の範囲および実際の所有権に依存する悪影響を受ける可能性がある。
将来を展望すると、米国特許商標局は、CVCグループまたは私たち個人に関連するCRISPR/CAS 9技術の使用に関する新しい干渉を発表することができる。さらに、我々およびCVCグループは、CRISPR/Cas 9発明に関する他の特許主張を起訴し続けており、これは、米国で許可または発行された特許を得ることにもつながる可能性がある。CVCグループおよび我々が起訴しているいくつかのクレームは、USPTOによって発見されることが許可されている場合、上に記載された特許または特許出願を含む第三者が所有する特許または特許出願に対する妨害訴訟を引き起こす可能性がある。USPTOが、これらの当事者のうちの一方または複数の特許請求の範囲が、特許の組み合わせまたは我々の特許の組み合わせ内の特許または特許出願の許容される特許請求の範囲と十分に重複していると考える場合、USPTOは、そのような特許請求の第1の発明者を決定するために、他の干渉手順を宣言することができる。私たちはこれらの結果のいずれかを決定することができず、もしあれば、実際に発生する。より多くの干渉があれば、干渉のいずれか一方は再び連邦巡回控訴に不利な決定を下すことができる。さらに、CVCグループの任意の既存または新しい特許、または私たちの既存または新しい特許の有効性または実行可能性は、他の挑戦を受ける可能性がある。このような結果が私たちと私たちの知的財産権状況に及ぼす可能性のある影響はまだ不明だ。
いずれかの第三者がその干渉で勝訴し、これらの異なる法的手続きによって、我々の候補製品または関連活動をカバーする特許主張を取得した場合、第三者は、CRISPR/CAS 9に基づく活動(商業化を含む)に基づいて発行された特許を主張することを求めることができる。私たちが特許権を主張する第三者に対して禁止または他の公平な救済を求めることができ、これは、私たちの候補製品をさらに開発し、商業化する能力を効果的に制限または阻止することができる。もし私たちが第三者の有効な知的財産権を侵害していることが発見された場合、私たちは、当社の製品や技術の開発とマーケティングを継続し、または第三者の知的財産権を無効にするために、第三者からライセンスを取得することを要求される可能性があります。これらの第三者は、私たちにそのような許可を与える義務がなく、そのような許可は、商業的に合理的な条項や全く得られないかもしれない、または非排他的である可能性がある。もし私たちがそのようなライセンスを取得して維持できなければ、私たちと私たちのパートナーは、私たちのコア遺伝子編集実践を停止し、私たちが開発する可能性のある1つ以上の候補製品の開発、製造、商業化を必要とするかもしれない。さらに、もし私たちが故意に特許を侵害したことが発見された場合、私たちは3倍の損害賠償と弁護士費を含む金銭損害賠償責任を負われる可能性がある。権利侵害発見は、私たちが1つ以上の候補製品を商業化し、侵害製品の再設計を強要したり、一部または全部の業務運営を停止させたりすることを阻止する可能性があり、いずれも私たちの業務に実質的な損害を与える可能性があり、私たちが提案した未来の候補製品のさらなる開発と商業化を阻止し、私たちに重大な損害を与える可能性がある。排他的喪失や特許主張の縮小は、他人が類似または同じ技術および製品を使用したり、それを商業化する能力を阻止することを制限する可能性がある。我々が第三者の機密情報や商業秘密を盗用したと主張することは,我々の業務に類似した負の影響を与える可能性がある.上記のいずれも、当社の業務、財務状況、経営結果、または将来性に重大な悪影響を及ぼす可能性があります。これらのクレームの弁護は、その是非にかかわらず、巨額の訴訟費用がかかり、私たちの業務の経営陣や他の従業員資源を大量に移し、私たちの名声に影響を与える可能性がある。
74
いずれにしても、最終的に優先順位を決定するのに数年かかるかもしれない。Charpentier博士とのライセンス契約条項により,Charpentier博士の特許訴訟,弁護,我々の許可内技術に関する費用の支払いまたは補償を担当する.
第三者が有するCRISPR/CAS 9に関連する知的財産権または開発、製造および商業化が可能なCRISPR/CAS 9療法に必要な他の関連技術、例えば、製品または成分の成分、治療方法、伝達技術、化学修飾、および分析および製造方法は、私たちの最終マーケティングおよび製品販売能力に悪影響を及ぼす可能性がある。第三者は、我々が実行可能な製品を開発したり、それを商業化するために必要な可能性のある製品を含む、私たちの技術および潜在的な製品をカバーするすべてまたは態様をカバーする知的財産権を有することができる。もし私たちがこのような第三者知的財産権を許可、回避、挑戦することに成功できなければ、私たちはすべてまたはいくつかの司法管轄区域で実行可能な製品を開発し、商業化することができないかもしれない。また、私たちの製品や私たちが所有したり許可したりする技術をカバーする知的財産権が法的に損傷したり失われたりすると、私たちの製品の開発や商業化を支援するのに十分な財務的リターンを達成できない可能性があります。
さらに、第三者は、通常、欧州および/または他の非米国司法管轄区域で承認されたか、または将来的に承認される可能性がある米国の出願の国際同業者に提出される。私たちと他の当事者たちはその中のいくつかの寄付に反対手続きを提起して、私たちは未来にこれらや他の申請者に他の贈与を提供することに反対するかもしれない。同様に、私たちの知的財産権は、オーストラリア、日本、中国、インドのようなヨーロッパや他の司法管轄区域にあり、反対訴訟に参加する可能性がある。これらの反対意見は、特許の全部または一部が撤回される可能性があり、またはクレーム範囲の縮小を招く可能性があり、欧州で競争相手に対して特許を実行する能力を弱めるまたは排除する可能性がある。例えば、2018年2月には、いくつかの方向に欧州特許庁が反対し、我々に付与された第1項のライセンス内の欧州特許に反対する。2018年遅い時期と2019年には、いくつかの締結方向が欧州特許庁に反対し、私たちに第2および第3のライセンス内の欧州特許を付与することに反対する。反対手続きは、特許のすべての撤回をもたらすことができる;付与された特許を維持するか、または修正された形態で特許を維持することができる。反対派の訴訟手続きは通常、どちらも控訴できるのに要する時間を含めて数年かかる。私たちは私たちが許可した欧州特許に対する反対結果を保証することはできず、不利な結果は欧州で第三者に対して私たちの権利を強制的に執行することを阻止するかもしれない。例えば、2020年初め、欧州特許庁は修正された形で私たちの最初の認可内の欧州特許を維持した;2021年末、彼らは私たちの第2の欧州特許を撤回した;2022年、欧州特許庁は修正された形で私たちの3つ目の欧州特許を維持した。第1と第3の欧州特許に関する裁決は上訴され、控訴が審理されている。
これらのイベントの結果を予測することもできず,不利な結果による損失金額や範囲を有意に見積もることもできない.将来的には、正常な業務過程で生じる法的問題やクレームの当事者になる可能性があり、これらの問題の解決は、私たちの財務状況、運営実績、またはキャッシュフローに大きな悪影響を与えないと予想されます。
私たちは私たちの候補技術と製品の権利が他の人が私たちに付与する許可証の条項と条件によってある程度制限されていることを開発し、商業化します。
私たちは第三者からのいくつかの知的財産権ライセンスに依存しており、これらの知的財産権は私たちの遺伝子編集技術と候補製品の開発に非常に重要または必要である。これらの許可および他の許可は、すべての関連使用分野でこのような知的財産権および技術を使用する独占的な権利を提供しない可能性があり、将来私たちの技術および製品の開発または商業化を望む可能性のあるすべての地域をカバーしないかもしれない。したがって、私たちは競争相手が私たちのすべてのライセンスに含まれる地域で競争製品を開発し、商業化することを阻止できないかもしれない。
さらに、私たちの2014年のDr.Charpentierとの独占ライセンス契約を含め、私たちのライセンス技術を使用して製品を販売する収入に応じて印税を支払うことが要求されることになり、これらの印税支払いは、商業化を求める可能性のある任意の製品の全体的な収益力に悪影響を及ぼす可能性があります。我々がCharpentier博士と達成したすべての許可協定によると,商業的に合理的な努力を用いて規制部門の承認を得て,許可された治療製品を開発して販売する義務がある。Charpentier博士とのライセンス契約には,2021年4月までにIND(または主要市場国に同等製品を提出)を提出する義務と,2024年4月までにIND(または主要市場国の同等製品)を提出する義務も含まれている。2021年4月までにINDを提出する義務を果たしていますが、将来的には他の余剰義務をタイムリーにまたは根本的に履行できないかもしれません。もし私たちが残りの義務を履行できなければ、Charpentier博士は私たちの許可権を終わらせる権利があるかもしれない。私たちはライセンスプロトコルがカバーする製品の臨床開発の多くの面でアウトソーシングし、第三者に依存する必要があるだろう。これらの第三者の遅延や失敗は、私たちの職務調査義務を履行する能力および第三者許可者とのライセンス契約の継続に悪影響を及ぼす可能性があります。
私たちが最善を尽くしたにもかかわらず、私たちの許可側は、許可協定に深刻に違反していると結論するかもしれませんので、許可協定を終了し、これらの許可協定がカバーする製品や技術を開発し、商業化することができません。これらの許可内で終了された場合、または基礎特許が予想される排他性を提供できなかった場合、競争相手は、規制部門の承認を求め、私たちと同じ製品を販売する権利がある。さらに、私たちは、私たちのライセンシーからより多くの許可を得ることを求めることができ、このような許可を得る過程で、私たちは、同意が第三者を可能にすることを含む、ライセンシーに有利な方法で私たちの既存のライセンスを修正することに同意することができます
75
各当事者(私たちの競争相手を含む可能性があります)は、私たちの既存の許可によって制限された知的財産の一部の許可を得ます。これらの事件のいずれも、私たちの競争地位、業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。
私たちのコア遺伝子編集技術を保護する知的財産権は共通して所有されているが、私たちの許可証はその中の一人の共通所有者だけであり、これはアメリカと他の司法管轄区における私たちの権利を深刻に制限している。
我々がCharpentier博士から独占的に許可を得た特許の組合せは,我々の遺伝子編集技術のコア特許保護である.しかし、この家族は指名された他の発明家を含み、彼らは自分の権利をカリフォルニア州やウィーンに譲渡した。したがって,特許組合せは現在カリフォルニア州のCharpentier博士とウィーンのDr.Charpentierが共同で所有している。2016年12月15日、私たちはカリフォルニア州、ウィーンおよびそのライセンシー(CariouおよびCariouを含む被許可者Intellia Treeutics)と譲渡、許可、共同所有権、および発明管理協定(IMA)に同意した。IMAによると、共通所有者は、他の共通所有者の被許可者および分被許可者に世界的な相互交差同意を提供し、費用分担協定を含むCRISPR/Cas 9遺伝子編集基本知的財産権の支援および管理に関するいくつかの他の約束および義務を合意した。以下でより詳細に説明するように、これにより、私たちは、私たちのコア遺伝子編集技術を保護する特許権の非独占または共同独占権利しか持たず、カリフォルニアとウィーンがCharpentier博士から許可を得ることに同意することに同意するために、IMA下の契約義務を引き続き履行しなければならない。
アメリカでは、すべての共通の人々がこの技術を許可して使用する自由を持っている。そのため,Charpentier博士がカリフォルニアやウィーンなどの他のエンティティと共有しているいかなる知的財産権も独占的に得ることはできない.したがって,我々とCharpentier博士の許可は,このような共有する権利に対して非排他的である.さらに、米国では、すべての共通の人々が、これらの特許権を強制的に執行するために、私たちが提起する可能性のある任意のクレームまたは訴訟の当事者に参加することを要求されている。また、米国では、非独占許可は裁判所に特許侵害訴訟を提起する資格がない。したがって,カリフォルニアとウィーンが所有している特許については,カリフォルニアとウィーンの協力がなければ,第三者侵害クレームを追及する能力がなく,彼らのライセンシーの協力がない可能性がある。第三者が特許組合における特許権を侵害した場合の通知及び調整が規定されているウィーン及びカリフォルニア州及びそのライセンシーとIMAを締結しているにもかかわらず、ウィーン及びカリフォルニア州が将来のいかなる侵害においても我々と協力することは保証されていない。Charpentier博士から取得したコア特許権を実行できなければ,第三者が我々と競合することを阻止できない可能性があり,会社に我々の技術を再許可するように説得できない可能性があり,いずれも我々の業務に実質的な悪影響を与える可能性がある.
私たちは、私たちがそこから知的財産権の許可を得た第三者または私たちが知的財産権を許可している第三者と紛争するかもしれない。これらの当事者とのどんなトラブルも私たちの業務に悪影響を及ぼす可能性があり、私たちは私たちの業務に非常に重要な許可権を失うかもしれません。
私たちは第三者から私たちの遺伝子編集技術をカバーする知的財産権許可を得ましたが、私たちの遺伝子編集技術を拡大しながら、追加の第三者知的財産権許可を得続けたいと思います。様々な理由で、私たちは私たちの知的財産権を許可した第三者と紛争するかもしれません
さらに、私たちは現在、どのプロトコルに従って第三者に知的財産権または技術を許可しているか、またはIMAに従って同意を維持しているか、これらのプロトコルのいくつかは、様々な解釈の影響を受ける可能性があり、または、私たちが1つまたは複数の合意に違反するように衝突する可能性があり、これは、私たちの1つまたは複数の許可パートナーまたはIMA当事者と長く高価な紛争を発生させることを容易にする。可能性のある契約解釈の相違の解決は、関連する知的財産権または技術に対する私たちの権利と考えられる範囲を縮小するか、または関連協定の下での私たちの財務または他の義務を増加させる可能性があり、いずれも、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性があります。さらに、我々が許可している知的財産権をめぐる紛争が、商業的に許容可能な条項で現在の許可手配の能力を維持していることを阻害または損害すれば、影響を受けた候補製品の開発および商業化に成功することができない可能性があり、これは、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。
76
同様に、私たちが第三者とライセンス契約、協力協定、パートナー関係を締結し続けて、私たちの開発プロジェクトを拡大するにつれて、私たちはすでに、私たちのいくつかの知的財産権をこれらの第三者にライセンスし続ける予定です。様々な理由で、私たちはこれらの第三者と紛争が発生する可能性があり、私たちはこのような任意の合意によって付与された権利範囲や他の解釈に関する問題を含む知的財産権をこれらの第三者に権限を付与します。現在または将来のパートナーまたは許可側と、このようなパートナーまたはライセンス者に付与された知的財産権の範囲について発生するいかなる紛争も、開発計画の遅延を招き、私たちのパートナーまたは許可者と長引くコストの高い紛争を容易にすることができます。
私たちは、任意の候補製品の取得または維持、または買収およびライセンス内で開発される可能性のある他の技術の必要な権利の取得または維持に成功できないかもしれません。
我々は現在知的財産権の権利を有しており,第三者の許可により候補製品を識別·開発し,他の技術を使用している。多くの製薬会社、バイオテクノロジー会社、学術機関が遺伝子編集技術の分野で私たちと競争し、私たちの業務に関連する可能性のある特許出願を提出します。例えば、公開されれば、私たちの遺伝子編集技術および候補製品をカバーすると解釈される可能性がある第三者特許出願がいくつかあることが知られている。これらの第三者特許の侵害を回避するためには、これらの第三者知的財産権所有者から許可を得ることが必要または慎重であることが発見される可能性がある。遺伝子編集技術のいくつかの修正または改善された構成要素、例えば、修正された核酸またはタンパク質、および非CRISPR/CAS 9技術(例えば、我々が開発する可能性のある候補製品の送達方法を評価している)については、第三者のライセンスも必要とされる可能性がある。さらに、私たちが第三者と共同で所有しているいかなる特許についても、私たちはこのような共通の所有者のこのような特許の利益を許可する必要があるかもしれない。しかしながら、我々が開発する可能性のある候補製品および遺伝子編集技術については、第三者からそのような許可を得ることができないか、または許可の任意の成分、使用方法、プロセス、または他の知的財産権を取得または取得することができない可能性がある。第三者知的財産権の許可または買収は競争分野であり、私たちよりも成熟しているか、またはより多くの資源を持っている可能性がある企業は、魅力的または必要だと思う第三者知的財産権許可または買収戦略をとっているかもしれない。より成熟した会社は私たちより競争優位にあるかもしれません。それらの規模、資本資源及びより強い臨床開発と商業化能力のためです。しかも、私たちを競争相手と思っている会社は私たちに権利を譲渡したり許可したりしたくないかもしれない。私たちはまた私たちが投資から適切な見返りを得ることを可能にする条項に従って許可したり、第三者知的財産権を取得することができないかもしれない。このような交渉を成功させ、最終的に買収を求める可能性のある他の候補製品や技術をめぐる知的財産権を得ることができる保証はない。もし私たちが必要な第三者知的財産権を得ることに成功したり、私たちの既存の知的財産権を維持することができなければ、関連するプログラム、技術または候補製品の開発を放棄しなければならないかもしれないし、私たちのコアCRISPR/Cas 9遺伝子編集技術の実践を停止しなければならないかもしれません。これは、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性があります。
法廷やUSPTOなどの外国当局が疑問を提起した場合、我々の候補技術および製品に関連する発行された特許は、無効または実行不可能であることが発見される可能性がある。
もし私たちまたは私たちの許可者のうちの1つが第三者に対して法的訴訟を提起して、私たちが開発する可能性のある候補製品または私たちの技術(CRISPR/Cas 9を含む)をカバーする特許を強制的に執行する場合、被告はその特許を無効または実行できないと反訴することができる。米国の特許訴訟では,被告が無効または実行不可能と主張する反訴が一般的である。有効性を疑問視する理由は、新規性の欠如、明らかな、または実施できないことを含む、いくつかの法定要件のいずれかを満たしていないと言われているからかもしれない。主張を実行できない理由は,特許起訴に関連する者が起訴中に米国特許商標局に関連情報を隠蔽したり,誤った声明をしたりしたためかもしれない.
第三者は、例えば、我々の許可内特許出願CRISPR/CAS 9が、欧州、オーストラリア、日本、中国およびインド、および米国での介入のような第三者の意見および反対の背景で提起され、将来的に米国または他の管轄区域の行政機関に、私たちの許可内および所有特許出願および特許に関連する同様のクレーム、さらには訴訟外に提出される可能性がある。特許庁で特許の有効性を疑問視する仕組みには、再審査、ライセンス後の再審査、各方面間審査、介入訴訟、派生訴訟、および非米国司法管轄区域の同等の訴訟(例えば、反対訴訟)。利用可能な控訴を使い切った後、そのような訴訟は、私たちの特許出願または特許の損失をもたらす可能性があり、またはそれらの範囲は、私たちの技術またはプラットフォーム、または私たちが開発する可能性のある任意の候補製品に縮小される可能性がある。法的に無効と実行不可能と断言された後の結果は予測できない。たとえば,有効性の問題については,既存技術を無効にする問題は存在しないとは限らない.もし第三者が無効または強制不可能な法的主張に勝った場合、私たちは少なくとも部分的、さらにはすべて、私たちの技術またはプラットフォーム、または私たちが開発する可能性のある任意の候補製品の特許保護を失うだろう。このような特許保護の喪失は、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすだろう。
77
CRISPR/CAS 9を含む遺伝子編集技術をめぐる知的財産権構造は高度に動的であり、第三者が開始し、法的訴訟で勝利する可能性があり、私たちが許可または所有している特許が無効であるか、または私たちが彼らの知的財産権を侵害、流用しているか、または他の方法で彼らの知的財産権を侵害していると主張し、その結果は不確実であり、私たちの業務成功に大きな悪影響を及ぼす可能性がある。
遺伝子編集分野,特に遺伝子編集技術分野は,まだ初期段階である.我々と我々の競争相手を含むいくつかの会社がこの分野で緊張した研究·開発を行っているため、知的財産権の構造が変化しており、今後数年間も不確定である可能性がある。将来的には知的財産権に関する重大な訴訟や、私たちが所有しているものや許可されていない他の第三者、知的財産権、独自の権利に関する訴訟があるかもしれない。
私たちのビジネス成功は、第三者の知的財産権および独自の権利を侵害、流用、または他の方法で侵害することなく、私たちと私たちの協力者が開発、製造、マーケティング、販売する可能性のある任意の当社の独自技術の候補製品を開発し、使用する能力に依存します。バイオテクノロジーと製薬産業の特徴は特許と他の知的財産権に関する広範な訴訟だ。私たちの技術と私たちが開発する可能性のある任意の候補製品について、私たちは、妨害手続きの再検討、許可後の審査、および任意の候補製品の知的財産権に関する対抗性訴訟または訴訟の当事者になるか、または将来的に私たちの技術および任意の候補製品に関する対抗性訴訟または訴訟を受けることができる各方面間欧州特許庁の反対意見のような米国特許商標局の審査及び派生手続並びに他の司法管区の類似手続。第三者は、既存の特許または将来付与される可能性のある特許に基づいて、その是非曲直にかかわらず、侵害請求を私たちに提起するかもしれない。もし私たちがこれらの特許が無効であることを証明できず、私たちが商業的に合理的な条項で許可を得たり、維持することができなければ、これらの特許は私たちの業務行動に重大な悪影響を及ぼすかもしれない。もし私たちがこのような第三者特許を侵害していることが発見された場合、私たちと私たちのパートナーは、損害賠償金の支払いを要求される可能性があり、私たちのコアCRISPR/Cas 9遺伝子編集技術を含む侵害技術の商業化を停止するか、またはこれらの第三者から許可を得ることができず、これらの許可は商業的に合理的な条項では得られないかもしれない。
第三者知的財産権主張に法的根拠がないと考えても,裁判所が侵害,有効性,実行可能性,所有権や優先権などの問題で我々に有利である保証はない.管轄権のある裁判所は、これらの第三者特許が有効で、強制的に実行可能であり、侵害されていると判断する可能性があり、これは、開発可能な任意の候補製品および主張される第三者特許がカバーする任意の他の候補製品または技術を商業化する能力に実質的な悪影響を及ぼす可能性がある。連邦裁判所でこのような米国特許の有効性に挑戦することに成功するためには,有効性推定を克服する必要がある。この負担が重いため,このような米国特許主張の無効について明確で納得できる証拠を提出することが求められているため,管轄権のある裁判所がこのような米国特許の主張の無効を宣言する保証はない.もし私たちが第三者の知的財産権を侵害していることが発見され、そのような特許が無効または強制的に実行できないことを成功的に証明できなかった場合、私たちは、開発、製造、およびマーケティングの可能性のある任意の候補製品および私たちの技術を継続するために、第三者からライセンスを取得することを要求されるかもしれない。しかし、私たちは商業的に合理的な条項や必要な許可証を得ることができないかもしれない。私たちが許可を得ることができても、それは非排他的である可能性があり、私たちの競争相手や他の第三者が私たちに許可された同じ技術にアクセスできるようにするためには、大量の許可と印税を支払う必要があるかもしれない。私たちはまた裁判所の命令を含む権利侵害技術または候補製品の開発、製造、商業化を停止させることを余儀なくされる可能性がある。さらに、私たちが特許や他の知的財産権を故意に侵害していることが発見された場合、私たちは3倍の損害賠償と弁護士費を含む重大な金銭損害に責任があると判断される可能性がある。第三者の機密情報や商業秘密を盗用したと主張することは、当社の業務、財務状況、運営結果、見通しに類似した重大な悪影響を及ぼす可能性があります。
知的財産権訴訟は私たちに大量の資源を費やし、私たちの人員のその正常な責任に対する注意を分散させるかもしれない。
正当な理由の有無にかかわらず、知的財産権クレームに関連する訴訟や他の法的手続きは予測不可能であり、通常コストが高く、時間がかかり、私たちのコア業務から大量の資源を分流し、私たちの技術と管理者の正常な責任を分散させ、通常私たちの業務を損害する可能性がある。さらに、一部の国(米国を含む)は知的財産権訴訟において大量の情報を開示する必要があるため、私たちのいくつかの機密情報は、このような訴訟中に開示によって漏洩される可能性がある。さらに、公聴会、動議、または他の一時的な手続きまたは事態の発展の結果が公表される可能性があり、証券アナリストや投資家がこれらの結果がマイナスであると考える場合、私たちの普通株式価格に大きな悪影響を及ぼす可能性がある。このような訴訟または訴訟は、私たちの運営損失を大幅に増加させ、開発活動または任意の将来の販売、マーケティング、または流通活動に使用することができるリソースを減少させる可能性がある。
私たちはそのような訴訟や法的手続きを適切に行うのに十分な財政的または他の資源がないかもしれない。私たちのいくつかの競争相手は、彼らがより多くの財政資源を持っているので、私たちよりもこのような訴訟や訴訟の費用を効率的に負担するかもしれない。したがって、私たちは努力したにもかかわらず、私たちは第三者が私たちの知的財産権を侵害したり、流用したり、私たちの知的財産権に成功したりすることを防ぐことができないかもしれない。特許訴訟または他の訴訟の開始と継続によって生じる不確実性は、市場での競争能力に重大な悪影響を及ぼす可能性がある。
78
私たちが許可したいくつかの知的財産権は、政府援助の計画によって発見される可能性があり、したがって、“パレード権利”、いくつかの報告要件、および米国メーカーの優先順位のような連邦法規の制約を受ける可能性がある。これらの規定を遵守することは、私たちの独占権を制限し、非アメリカメーカーと契約を締結する能力を制限するかもしれない。
私たちがCharpentier博士の共通利益の下で許可を得た知的財産権はカリフォルニア州によって共同所有されており、カリフォルニアは1つ以上の発明が許可番号の下で行われていることを示している。GM 081879はアメリカ国家衛生研究院から授与された。したがって、このような権利は特定の連邦規制によって制限されている。1980年の“ベイハ·ドール法案”(Bayh-Dole Act)によると、米国政府は、政府の援助計画の下で開発されたいくつかの発明の特許に対して、政府の権利をカバーするいくつかの権利を持っている。これらの権利は、任意の政府の目的のために発明を使用する非排他性、譲渡不可能、撤回不可能な世界的許可を含む。さらに、米国政府は、(I)使用分野での発明の実用化を実現するのに十分なステップをとっていないこと、(Ii)公衆の健康または安全ニーズを満たすためには、政府の行動が必要であること、または(Iii)連邦法規の公衆使用に対する要求を満たすためには、政府が行動することが必要であることを前提として、第三者に上述した任意の発明の排他性、部分排他性または非排他的許可を付与する権利を有する。我々又は適用される請負業者が政府に発明を開示しておらず、かつ所定の期限内に知的財産権登録申請を提出していない場合、米国政府もこれらの発明の所有権を取得する権利がある。政府援助の計画の下で生成された知的財産権もまた、いくつかの報告要件によって制約されており、これらの要求を遵守するためには、私たちまたは適用可能な請負業者が多くの資源を費やす必要があるかもしれない。さらに、米国政府は、主題発明を含む任意の製品または主題発明を使用することによって製造された製品が、実質的に米国で製造されなければならないことを要求する。知的財産権所有者が、合理的ではあるが成功しない努力をしたことを証明することができ、同様の条項で米国で大量生産される可能性のある潜在的な許可者にライセンスを付与することができる場合、またはこの場合、国内製造が商業的に不可能である場合には、製造優先権要求を免除することができる。このような米国メーカーの選好は、このような知的財産権がカバーする製品について非米国製品メーカーと契約する能力を制限する可能性がある。もし私たちが現在または未来に発明に関連する特許が米国政府の資金を使用することによって生成された場合、“ベハ-ドール法案”の条項も同様に適用される可能性がある。
私たちは世界各地で私たちの知的財産権と所有権を保護できないかもしれない。
世界各国で私たちの候補製品の出願、起訴、特許保護の費用は目を引くほど高いだろう。特許可能な要求は特定の国では、特に発展途上国では異なる可能性がある。また、私たちが知的財産権を保護·実行する能力は、世界各地の知的財産権法律の意外な変化の悪影響を受ける可能性がある。また、一部の国の特許法は米国の法律と同程度の知的財産権保護を提供していない。例えば、米国の特許法とは異なり、欧州や多くの他の管轄区域の特許法は、人体治療方法の特許性を排除し、その範囲が具体的に開示された実施形態よりも広い場合には、付与される権利請求の範囲に実質的な制限を加えている。
世界の異なる司法管轄区では、多くの会社が知的財産権の保護と保護に重大な問題に直面している。したがって、私たちは、米国以外のすべての国/地域で第三者が私たちの発明を実施したり、米国または他の管轄区域で私たちの発明を使用して製造された製品を販売または輸入することを阻止することができないかもしれない。競争相手は私たちが特許保護を申請していない司法管轄区で私たちの技術を使用して自分の製品を開発することができ、また、他の侵害製品を私たちが特許保護を持っているが法執行力がアメリカに及ばない地域に輸出することもできる。これらの製品は私たちの候補製品と競争するかもしれませんが、私たちの特許や他の知的財産権は彼らの競争を効果的にまたは阻止するのに十分ではないかもしれません。特定の国の法律制度、特に特定の発展途上国の法律制度は、特許、商業秘密、および他の知的財産権保護、特にバイオテクノロジー製品に関する保護の実行に賛成せず、私たちの特許を侵害したり、私たちの知的財産権および独自の権利に違反する競争製品を販売することを阻止することを困難にする可能性がある。世界の異なる司法管轄区域で私たちの知的財産権と独自の権利を強制的に執行する訴訟手続きは巨額のコストを招く可能性があり、私たちの努力と注意を私たちの業務の他の側面から移転させることは、私たちの特許を無効または狭義に解釈されるリスクに直面させる可能性があり、私たちの特許出願を発表できないリスクに直面させ、第三者が私たちにクレームを提起する可能性がある。私たちは私たちが起こしたどんな訴訟でも勝てないかもしれないし、判決された損害賠償や他の救済措置(もしあれば)は商業的な意味がないかもしれない。したがって、私たちの知的財産権および独自の権利を世界各地で強制的に実行する努力は、私たちが開発または許可した知的財産権から顕著なビジネス的優位性を得るのに十分ではないかもしれません。
多くの国に強制許可法があり,これらの法律により特許権者は第三者に強制的に許可を付与される可能性がある。また、多くの国は、政府機関や政府請負業者を含む第三者に対する特許の実行可能性を制限している。これらの国では,特許権者の救済措置は限られている可能性があり,このような特許の価値を大幅に低下させる可能性がある。もし私たちまたは私たちの任意の許可者が第三者に私たちの業務に関連する任意の特許の許可を付与することを余儀なくされた場合、私たちの競争的地位が損なわれる可能性があり、私たちの業務、財務状況、運営結果、および見通しは不利な影響を受ける可能性があります。特許保護は最終的には国ごとに求めなければならないが,これは高価で時間のかかるプロセスであり,結果は不確定である。したがって、私たちは特定の国で特許保護を求めないことを選択することができ、私たちはこれらの国で特許保護の利点を享受しないだろう。
79
米国や他の管轄区特許法の変化は、特許の全体的な価値を低下させ、私たちの候補製品を保護する能力を弱める可能性がある。
バイオテクノロジーや製薬分野の他の会社と同様に、私たちの成功は知的財産権、特に特許に大きく依存している。技術と法律の複雑さのため、私たちの産業の特許取得と実行は複雑で、高価で不確実だ。
特許法またはその解釈の変化は、これらの不確実性を悪化させ、コストを増加させる可能性があり、特に米国が2013年3月以来“第1の発明”から“最初の出願”特許制度に転換した場合である。この変化は、第1の申請者が、必ずしも第1の発明者ではなく、特許を得ることができることを意味する。特許出願は最初は秘密であったため,我々が最初に我々の技術を提出または発明した会社であるかどうかは不明である.
Leahy-Smith America発明法は、連邦裁判所よりもUSPTO訴訟で特許が無効であることを証明する責任が低いことを含む大きな変化を導入し、第三者が私たちの特許に挑戦しやすいかもしれない。米国最高裁判所と米国連邦巡回控訴裁判所の最近の裁決も特許保護範囲を縮小し、特許所有者の権利を弱体化させ、特許の有効性と実行可能性に不確実性をもたらした。これらの変化は、将来の潜在的な法的発展に加えて、私たちが新しい特許を獲得したり、既存の特許を強制的に執行する能力を弱める可能性がある。
地政学的事件はまた特許手続きに影響を及ぼすだろう。例えば、ロシアのウクライナ侵攻に関する米国と外国政府の行動は、ロシアでの特許出願や維持を阻害する可能性がある。ロシアの2022年の法令では、同意なしに特定の外国実体の特許を利用することが許可されており、これは私たちの競争地位や業務に影響を与える可能性がある。
また,最近設立された欧州統一特許裁判所(UPC)は,EUにおける集中的な特許撤回手続きを許可している。私たちは現在、この裁判所によって管轄されているヨーロッパ特許を持っていないにもかかわらず、将来、この裁判所が管轄するヨーロッパ特許はリスクをもたらす可能性があり、ヨーロッパでの業務と商業化努力に影響を与える可能性がある。UPCが変化する法律は私たちがこのようなヨーロッパ特許を擁護または実行する能力に影響を及ぼすかもしれない。私たちの未来のヨーロッパ特許については、私たちはUPCの管轄を受けないことを選択するかもしれないが、コンプライアンス挑戦は依然として存在する。
全体的に、発展し続ける特許法は持続的な挑戦をもたらし、私たちの業務や知的財産権戦略に影響を与える可能性がある。
私たちの特許保護を獲得し、維持することは、政府特許機関によって適用される様々なプログラム、書類提出、費用支払い、および他の要求に準拠することに依存し、これらの要件を遵守しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある。
発行された特許の定期維持費は、特許有効期間内にいくつかの段階で米国特許商標局および外国特許代理機関に支払われなければならない。米国特許商標局および各種外国政府特許機関は、特許出願過程において、いくつかのプログラム、文書、費用支払い、およびその他の同様の規定を遵守することを要求する。多くの場合、適用される規則に基づいて、滞納金を支払うことによって、または他の方法で失効を是正することができるが、場合によっては、規定を遵守しないことは、特許または特許出願の放棄または失効を招き、関連法ドメインの特許権の一部または全部を喪失させる可能性がある。特許または特許出願の放棄または失効をもたらす可能性のある不正事件には、規定された期限内に公式行動に対応できなかったこと、費用が支払われていなかったこと、および適切に合法化され、正式な文書が提出されなかったことが含まれる。この場合、私たちの競争相手が市場に参入する可能性があり、これは私たちの業務に実質的な悪影響を及ぼすだろう。
もし私たちが私たちの商業秘密の機密性を保護できなければ、私たちの業務と競争地位は損なわれるだろう。
私たちのいくつかの候補技術および製品のための特許出願に加えて、私たちは、ビジネス秘密および秘密協定によって、私たちの非特許ノウハウ、技術、および他の独自および機密情報を保護し、私たちの競争的地位を維持します。ビジネス秘密と技術的ノウハウを保護することは難しいかもしれない。特に,我々の技術プラットフォームについては,時間の経過とともに,これらのビジネス秘密や技術ノウハウが,独自に開発·記述方法を発表した定期刊行物文章や人員が学術職から業界科学職に移って業界内に伝播することが予想される.
80
私たちは、私たちの従業員、会社協力者、外部科学協力者、CRO、契約製造業者、コンサルタント、コンサルタント、および他の第三者など、これらの秘密にアクセスする権利のある当事者と秘密協定を締結することによって、これらの商業秘密および他のノウハウの保護を求めています。私たちはまた私たちの従業員とコンサルタントと秘密と発明または特許譲渡協定を締結します。私たちは私たちが可能であるか、または私たちの商業秘密またはノウハウとプロセスに接触したすべての当事者とこのような合意に到達したことを保証することができない。このような努力にもかかわらず、どちらも合意に違反し、私たちのビジネス秘密を含む私たちの固有の情報を漏洩する可能性があり、私たちは十分な救済措置を得ることができないかもしれない。強制執行側が商業秘密を不正に開示したり流用したりする主張は困難であり、高価で時間がかかり、結果は予測できない。しかも、米国国内外のいくつかの裁判所は独自の情報を保護することをあまり望まないか、または保護することを望まない。もし私たちが第三者に私たちの知的財産権を不正に開示することを阻止できない場合、あるいは第三者が私たちの知的財産権を流用することを阻止できなければ、私たちの市場で競争優位性を確立したり、維持することができないかもしれません。これは私たちの業務、経営業績、財務状況に大きな悪影響を及ぼす可能性があります。もし私たちの任意の商業秘密が競争相手または他の第三者によって合法的に取得または独立して開発された場合、私たちは彼らまたは彼らが情報を伝達する人がその技術や情報を使用して私たちと競争することを阻止する権利がないだろう。もし私たちの任意の商業秘密が競争相手または他の第三者に漏洩された場合、または競争相手または他の第三者によって独立して開発された場合、私たちの競争地位は実質的かつ不利な損害を受けるだろう。
もし私たちが開発する可能性のある候補製品の特許期間延長とデータ独占権を獲得しなければ、私たちの業務は実質的に損害を受ける可能性がある。
FDAが私たちが開発する可能性のある任意の候補製品の上場承認の時間、期限、および詳細によれば、私たちの1つ以上の米国特許は、1984年の“薬品価格競争および特許期限回復行動”または“ハッジ·ワックスマン修正案”に従って限られた特許期間を延長する資格がある可能性がある。ハッジ·ワックスマン修正案は、FDA規制審査過程で失われた特許期間の補償として、特許展期間を最長5年とすることを許可している。1つの特許期間の延長は、製品が承認された日から計14年の期間を超えてはならず、1つの特許を延長することしかできず、承認された薬物、その使用方法又はその製造方法に関する請求項を延長することしかできない。しかし,テスト段階や規制審査中に職務調査を行うことができなかったこと,適用の最終期限内に出願できなかったこと,関連特許の満了前に出願を提出できなかったこと,適用要件を満たしていなかったことなどにより延期が得られなかった可能性がある.しかも、特許保護の適用期間や範囲は私たちが要求しているものよりも短いかもしれない。もし私たちが特許期間の延長を得ることができない場合、あるいはもしこのような延長の期限が私たちが要求したものよりも短い場合、私たちの特許地位に依存して私たちの特許期限が満了した後に競争製品の販売を阻止することができなくなり、私たちの業務、財務状況、運営結果、および見通しが実質的に損なわれる可能性がある。
知的財産権はすべての潜在的な脅威を解決できるとは限らない。
私たちの知的財産権が提供する未来の保護の程度は不確定であり、知的財産権には限界があるため、私たちの業務を十分に保護できないか、あるいは競争優位性を維持することができるかもしれない。例えば:
81
これらの事件のいずれかが発生した場合、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。
私たちは、私たちの従業員、コンサルタント、またはコンサルタントが、その現職または前任雇用主または他の第三者の機密情報を誤って使用または開示したり、私たち自身の知的財産権を持っていると主張したりする疑惑の影響を受けるかもしれない。
私たちの多くの従業員、コンサルタント、そしてコンサルタントは今あるいは以前に大学や他のバイオテクノロジーや製薬会社に雇われています。私たちは、私たちの従業員、コンサルタント、およびコンサルタントが、私たちのために働いているときに他人の固有情報またはノウハウを使用しないことを保証するために努力しているが、私たちまたはこれらの個人は、商業秘密または他の固有情報を含む任意のそのような個人の現職または前任雇用主または他の第三者の機密情報または知的財産権を使用または開示しているという疑惑を受ける可能性がある。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。もし私たちがこのようなクレームを弁護することができなければ、金銭的損害賠償を支払う以外に、私たちは貴重な知的財産権や人員を失う可能性がある。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、私たちの経営陣と従業員の注意を分散させる可能性がある。
また、私たちの政策は、知的財産権の概念や開発に参加する可能性のある私たちの従業員と請負業者が合意に署名し、このような知的財産権を私たちに譲渡することを要求しているにもかかわらず、実際に私たちが自分の知的財産権と見なしているすべての当事者とこのような合意を実行することができないかもしれない。知的財産権の譲渡は自動的に実行されない可能性があり、あるいは譲渡協定が違反される可能性があり、私たちは第三者にクレームをつけさせられたり、私たちが私たちの知的財産権の所有権だと思うことを決定するために、私たちが提起する可能性のあるクレームを弁護したりすることができます。このようなクレームは、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性があります。
もし私たちの商標が十分に保護されていなければ、私たちは興味のある市場で知名度を確立することができず、私たちの業務は不利な影響を受けるかもしれない。
もし私たちの商標が十分に保護されていなければ、私たちは興味のある市場で知名度を確立することができず、私たちの業務は不利な影響を受けるかもしれない。我々の未登録商標は、挑戦、侵害、回避、または汎用商標として発表されるか、または他の商標を侵害していると判断される可能性がある。私たちはこれらの商標に対する私たちの権利を保護できないかもしれません。私たちはこれらの商標が私たちの関心のある市場における潜在的なパートナーや顧客の中で知名度を確立する必要があります。時々、競争相手は私たちと似たような商標を採用して、私たちのブランド表示を確立する能力を阻害し、市場の混乱を招く可能性があります。さらに、他の登録商標または我々の未登録商標変異体を含む商標の所有者は、商標侵害クレームを提起する可能性がある。長期的には、私たちの商標の登録に成功し、私たちの商標に基づいて名称を確立することができなければ、効果的に競争できない可能性があり、私たちの業務は不利な影響を受ける可能性がある。商標、商業秘密、ドメイン名、著作権または他の知的財産権に関連する専有権を実行または保護する努力は無効である可能性があり、大量のコストおよび資源移転を招き、私たちの財務状況または運営結果に悪影響を及ぼす可能性があります。
私たちの普通株式所有権に関連するリスク
私たちは私たちの現金備蓄を使用する上で大きな自由裁量権があり、これらの現金備蓄を有効に使用できないかもしれません.
私たちの経営陣は、私たちの現金備蓄を使用するための幅広い裁量権を持っており、私たちの運営結果を改善したり、私たちの普通株価値を向上させることなく、私たちの現金備蓄を使用することができます。私たちの経営陣がこれらの資金を有効に運用できなかった場合、財務損失を招く可能性があり、これは私たちの業務に実質的な悪影響を与え、私たちの普通株価格の下落を招き、候補製品の開発や商業化を延期する可能性がある。それらが使用される前に、私たちは収入や切り下げを生じない方法で私たちの現金備蓄に投資するかもしれない。
公開市場で私たちの普通株を大量に売ることは私たちの株価を下落させるかもしれない。
公開市場で私たちの普通株を大量に販売したり、これらの売却が発生する可能性があると考えたり、私たちの普通株の市場価格を下げる可能性があり、適切な時間と価格であなたの普通株を売却することが困難になる可能性があり、追加株式証券を売却することで資金を調達する能力を弱める可能性があります。私たちは売却が私たちの普通株の現在の市場価格に及ぼす影響を予測できない。例えば、私たちはジェフリーとの販売協定を積極的に維持して、この協定によると、私たちは時々ジェフリーを私たちの販売代理として、自分で私たちの普通株を提供して販売することを決定することができます。1株当たり額面は0.03スイスフランです。2023年12月31日まで、私たちの現在の目論見書補充資料には3.856億ドルがあり、私たちはすでに1株139.91ドルの平均価格で合計150万株の普通株を発行·売却し、総収益は2.115億ドルで、株式発行コスト290万ドルを差し引いた。
私たちは予測可能な未来に配当金がないと予想している。
82
会社が設立されて以来、私たちは何の配当金も支払ったことがない。将来の運営が相当な分配可能な利益水準をもたらしても、私たちは現在、どんな収益も私たちの業務に再投資し、私たちが持続的な配当を支持する既定の収入源を持つまで配当金を支払わないつもりだ。また、将来の配当金を株主に支払う提案は、実際には我々の取締役会と株主が、我々の業務の見通し、現金需要、財務業績、新製品開発を含む様々な要因を考慮して適宜決定する。しかも、スイスの法律や私たちの会社の定款によると、将来の配当金の支払いはいくつかの制限を受けている。したがって、投資家は私たちの普通株の配当収入に依存することはできず、私たちの普通株に投資するいかなる見返りも、私たちの普通株価格の将来のいかなる切り上げにも完全に依存するかもしれない。私たちの普通株に支払う配当金(あれば)は、出資準備金から支払わない限り、スイス連邦源泉徴収税を納めなければなりませんカピタリンゲンそれは.もっと資料が必要でしたら、ご参照ください“リスク要因-私たちの普通株式所有権に関連するリスク-私たちのスイス会社としての身分は、資本管理のいくつかの面での柔軟性を制限し、株主にスイスの源泉徴収税を支払うことなく分配できない可能性があります".
私たちはスイスの会社です。私たちの株主の権利はアメリカ司法管轄区域の法律によって管轄されている会社の株主権利とは異なるかもしれません。
私たちはスイスの会社です。私たちの会社の事務は私たちの定款とスイスの法律によって管理されています。私たちの株主の権利と取締役会のメンバーの責任は、アメリカ司法管轄区域の法律によって管轄されている会社の株主と取締役の権利と義務とは異なる可能性があります。スイスの法律は、私たちの取締役会がその職責を履行する際に、合理的かつ公平な原則を十分に遵守した場合、会社、株主、従業員の利益を考慮することを要求している。取締役会は、あなたの株主としての利益とは異なる利益、あるいはあなたの株主としての利益以外の利益を考慮するかもしれません。スイスの会社法は私たちの株主が法廷で私たちの取締役会が下した決議や他の行動に挑戦する能力を制限する。我々の株主は通常、我々の取締役会の決定や行動を覆すために訴訟を提起することは許されず、注意義務および忠誠義務違反のために損害賠償を求めることのみが許可されている。スイスの法律によると、株主が私たちの取締役会メンバーに対して注意義務と忠誠義務に違反するというクレームはスイスのZugで提出されなければならない、あるいは私たちの取締役会関連メンバーの住所でなければならない。しかも、スイスの法律によると、私たちの株主は私たちが提起したどんなクレームもスイスのズグで完全に提起されなければならない。
スイスの会社として、私たちはスイスの法律条項によって制限されており、これらの条項は私たちが特定の計画や戦略を迅速に実施する柔軟性を制限するかもしれない。
私たちは時々私たちのスイス独立貸借対照表に示すように、関連会社への投資の帳簿価値を評価する必要がある。もしこのような投資の帳簿価値がその公正価値を超えていると判断すれば、このような投資は減少したと結論することができる。このような非現金減価に関する確認された損失は、私たちの純資産が私たちの法定株式および法定資本準備をカバーしなくなる可能性があります。スイスの法律によると、私たちの純資産が法定株式、法定資本積立金、法定収益積立金の50%をカバーできない場合、これらの積立金が株主に返済できない場合、取締役会はこのような状況を克服するために適切な措置を講じ、必要に応じて株主総会を開催し、このような資本損失を救済する措置を提出しなければならない。適切な措置は、関連状況と確認された損失の大きさに依存し、株主の承認を求め、株主の法定資本備蓄で総損失または一部の損失を相殺することを含む可能性があり、資格に適合する追加の実収資本を含み、そうでなければ、株主に割り当てたり、新しい株式を調達するために使用することができる。場合によっては、私たちの累積純損失を減らすために、条件に合った追加実収資本を使用して分配する必要があるかもしれません。この使用は、株主にスイスの源泉徴収税を支払うことなく分配する能力を低下させる可能性があります。このようなスイスの法律要求は私たちが特定の計画や戦略を迅速に施行する柔軟性を制限するかもしれない。
わが社の定款における反買収条項は、わが社の買収をさらに困難にする可能性があり、これは私たちの株主に有利になる可能性があり、私たちの株主が現在の経営陣を交換または更迭しようとすることを阻止するかもしれません。
わが社の定款の条項はわが社の買収やわが取締役会の構成の変化を阻害、延期または阻止する可能性があります。その他の事項を除いて、これらの条項は、株主総会で出席または投票した代表株式の少なくとも3分の2が私たちの取締役会メンバーの罷免を承認し、私たちの取締役会メンバーの最高人数を増加させることを要求する;任意の個人または実体の累積投票権を私たちの登録株式の15%に制限する;買収側が私たちの取締役会で免除を規定していない取引や一連の取引における投票権が私たちの登録株の5%を超えていることを制限することは、わが社の支配権変更を阻止または延期する可能性がある。取締役会は、2028年6月8日までのいずれかの時間に会社の株式を1回または複数回増加させる権利があること、または資本範囲が満了する前(先に参照)を規定するリスク要因-私たちの普通株式所有権に関連するリスク-私たちのスイス会社としてのアイデンティティは、資本管理のいくつかの面での柔軟性を制限し、株主にスイスの源泉徴収税を支払うことなく分配できない可能性があります)は、資本範囲内で指定された数の株式を発行し、現在の資本範囲内で、商業登録所の株式の約16%を登録し、既存の優先購入権を制限または撤回する
83
(I)転換可能な債務ツールを含む債券または同様のツールの行使に関連する転換および/または購入権、および(Ii)当社またはその任意の付属会社の従業員または他のサービス提供者に授与される株式購入権の行使に関連し、(Ii)当社またはその任意の付属会社に授与された従業員または他のサービス提供者の購入権の行使に関連し、合併または分割取引は、株主総会で代表される株式の少なくとも3分の2の賛成票を得なければならないと規定する。
これらの条項は,潜在的な買収者に我々の取締役会との交渉を要求することで,株主により大きな価値を得る機会を提供していると信じているが,我々の取締役会が拒否した要約が一部の株主から有益であると考えられていても,これらの条項は適用される.また、これらの規定は、株主が経営陣の任命を担当する取締役会メンバーを交代させることを困難にし、株主が現在の経営陣を交代または罷免しようとしていることを挫折または阻止する可能性がある。
私たちの普通株はスイスの法律によって発行されています。これはアメリカA州会社が提供するようなファッションの投資家を保護しないかもしれません。
私たちはスイスの法律に基づいて組織された。しかし、スイスの法律が将来変わらないことは保証されず、米国会社法の原則が提供するような方法で投資家を保護する保証もなく、投資家の権利に悪影響を及ぼす可能性がある。
私たちのスイス会社としての身分は、資本管理のいくつかの面での柔軟性を制限する可能性があり、株主にスイスの源泉徴収税を支払うことなく分配できない可能性があります。
我々の現行の定款は、我々の株主が資本範囲を導入することを許可し、取締役会が追加株主の承認なしに株式を増加させることを許可する。株主が承認した資本範囲は2028年6月8日に満期になり、有効な会社定款によると、資本範囲は私たちが現在登録している株式の約16%を超えてはならない。特定の例外を除いて、スイス法律は既存の株主に任意の新規発行株を優先的に承認する権利を付与する。スイスの法律はまた他のいくつかの管轄区域の法律のように、異なる種類の株に適用される様々な条項に大きな柔軟性を提供している。スイスの法律はまた、取締役会が他のいくつかの管轄区域で権力を持っているある会社の行為を株主承認に保留している。例えば、配当金の支払いと在庫抹消は株主の承認を得なければならない。これらの私たちの資本管理に関連するスイスの法律要求は私たちの柔軟性を制限する可能性があり、より大きな柔軟性が私たちの株主に実質的な利益を提供することができるかもしれない。
スイスの法律によると、スイスの会社は、会社に十分な分配可能な利益を持っているか、または会社が分配可能な準備金(それぞれが監査された独立法定資産負債表によって証明されている)を持っており、スイスの法律と私たちの定款に要求される準備金の分配を差し引いた後に、配当金を支払うことができる。自由に割り当てられる準備金は、一般に、“法定資本準備金”(Gesetzliche KapitalReserve)または法定または自発的な“利益剰余金”と表記される。資本を減らすことによってのみ、登録株である会社が登録した株式の総額面から分配することができる。私たちは出資によって配当金や準備金を増やさない限り、スイスの免税に基づいて株主に私たちの合格払込総額と登録配当金を超える配当金や他の分配を支払うことができません。私たちはまた分配可能な利益または自由に分配可能な備蓄から配当金を支払うことができるが、このような配当金はスイスの源泉徴収税を徴収されるだろう。私たちは配当金を支払うために十分な分配可能な利益、資本準備、留保収益、または登録配当金を持っていることを保証することはできません。私たちの株主が私たちが提案した配当金または資本減少を承認することを保証することはできません。あるいは私たちは資本減少による配当金の支払いまたは分配の他の法的要求を満たすことができます。
会社が株主に支払う配当金と同様の現金または実物分配(清算収益および株式配当を含む)は、スイスの源泉徴収税を支払う必要がある(Verrechnungssteuer)、現在の税率は35%(課税配分総額に適用)。当社は任意の課税配分の総額からスイスの源泉徴収税を控除し、その分配満期日から30暦以内にスイス連邦税務局に税金を納める義務があります。ただし、株式額面の償還及び資格に適合した追加実収資本の返済(出資準備)オス·カピタリンを保留する)スイスの源泉徴収税は必要ありません。スイスの源泉徴収税は、当社が株式を買い戻す際の支払い(それぞれの株式および使用済み株式備蓄を超える)にも適用され、(I)自社の株式が当該等の買い戻し(償還株式)によって減少した場合、(Ii)買い戻しされた株式の総数が自社株の10%を超える場合、または(Iii)買い戻しされた株式が買い戻し後6年以内に販売されない場合。買い戻しされた株式が転換可能債券、オプション債券または従業員株式オプション計画の支払いに使用される義務が保持されている限り(従業員株式オプション計画であれば、最長休止期間は6年)、株式買い戻しの6年間の最終期限は一時停止される。課税株式を買い戻す場合、スイスは、買い戻し価格と買い戻し株式額面と買い戻し時に返済された1人当たり払込準備金の和との差額に源泉徴収税を徴収する。
個人資産として株を保有するスイス住民個人、又は住民個人株主は、原則として取得する資格がある
84
スイスの源泉徴収税の所得税を全額還付または免除し、もし彼らが所得税申告書で関連収入を適切に報告すれば。また、(I)納税目的でスイスに居住する会社株主及び個人株主、(Ii)スイスに居住していない会社株主及び個人株主、それぞれの場合、スイスで行われている貿易又は業務の一部として、納税目的でスイスに固定営業場所を有する常設機関によりその株を保有しており、(Iii)所得税目的で“専門証券取引業者”に分類されるスイス住民個人は、他の理由を除いて、株式及びその他の証券の取引又はレバレッジ投資を行うことが多い(総称して、国内商業株主“)は原則としてスイスの源泉徴収税所得税の全額還付または控除を受ける資格があり、もし彼らがその損益表や所得税申告書(場合によっては)で関連収入を適切に報告した場合。
スイス住民ではなく税務目的のため、かつ関連課税年度内に、スイス国内に固定営業場所を設けた常設機関が貿易や業務に従事しておらず、その他の理由でスイスで会社や個人所得税を納付しない株主(総称して“非住民株主”と総称する)は、スイスの源泉徴収税の全部または一部を返還することができ、受取人が税務目的で居住している国とスイスが二重課税を回避する二国間条約または税務条約を維持し、当該税務条約の他の条件を満たすことを前提としている。
米国−スイス税収条約によると、福祉を受ける資格を有する米国の株主は、15%を超える条約税率の返還(または5%を超える引き下げられた条約税率の返還を申請することができ、少なくとも10%の投票権を有する適格会社株主、または適格年金基金の場合には全額還付を申請する)の源泉徴収税に適用することができる。非住民株主は、条約給付を申請する手続き(および払い戻しを得るのに要する時間)が国によって異なる可能性があることを認識しなければならない。非住民株主は、株式の受け取り、所有権、購入、販売またはその他の処置、およびスイスの源泉徴収税の払い戻しを申請する手続きについて、自分の法律、財務、または税務コンサルタントに相談しなければならない。
もし私たちが支配されている外国の会社なら、あるアメリカの株主はアメリカ連邦所得税の悪影響を受けるかもしれない。
非米国会社の各“10%株主”(以下のように定義する)は、米国連邦所得税において“制御された外国会社”またはCFCに分類され、CFCsがその株主に割り当てられていなくても、米国連邦税収の収入にこのような10%の株主比率シェアを含むCFサブ部分収入と米国財産に投資する収益とが一般的に要求される。F分割収入は、一般に、配当金、利息、レンタル料および特許使用料、証券売却の収益、および関連する当事者とのいくつかの取引の収入を含む。2017年12月31日以降の納税年度では、フッ素塩化炭素の株主10%当たりに、このフルオロカーボンに関する10%株主シェアの“世界無形低税収入”を収入に計上することも求められている。さらに、フルオロカーボンの株式を売却または交換することによって収益の10%を達成する株主は、このような収益の一部を資本収益ではなく配当収入に分類することを要求される可能性がある。米国連邦所得税については、一般に、10%の株主が投票権のある会社の全カテゴリー株の総投票権またはその会社の株式の総価値の50%以上を直接または間接的に所有していれば、その会社はCFCsに分類される。“十パーセントの株主”とは、(1)投票権のあるすべてのカテゴリー株の総投票権又は(2)当該会社の全カテゴリー株の価値を有するか、又は有すると考えられる米国人(1986年に改正された米国国税法又は同法典の定義に基づく)。クロロフッ化炭素の地位の決定は複雑であり,帰属規則を含み,これらの規則の適用は完全には決定されていない。
私たちの2023納税年度に、私たちのいくつかの株主はアメリカ連邦所得税の10%の株主だと信じている。しかし,我々の2023年12月31日までの納税年度と本納税年度のフッ素塩化炭素の状況は不明であり,2023年12月31日までの納税年度のフッ化炭素,すなわち本納税年度または来年度である可能性がある。また,最近のフッ素塩化炭素の地位決定に関する帰属規則の変化は,いずれの課税年度のフッ化炭素地位の決定を困難にする可能性がある。また,本納税年度や将来納税年度にフッ素塩化炭素でなくても,我々の非米国子会社がフッ化炭素(S)となる可能性がある。アメリカの保有者はフッ化炭素の10%株主になる潜在的な不利なアメリカの税収結果について彼ら自身の税務顧問に相談しなければならない。私たちがCFCと受動型外国投資会社(PFIC)に同時に分類されれば、私たちがCFC期間中に10%株主定義に適合するアメリカの保有者については、通常PFICとはみなされません。
もし私たちが受動的な外国投資会社として説明されれば、いくつかのアメリカの株主は不利な税金結果を受けるかもしれない。
一般に、任意の納税年度において、総収入の少なくとも75%が受動的収入である場合、または資産価値の少なくとも50%は、受動的収入を生成するための資産または現金を含む受動的収入を生成するために保有される資産に起因することができ、米国連邦所得税目的のPFICとして説明される。これらのテストに関して、受動的収入には、配当金、利息、投資性財産の売却または交換の収益、および賃貸料および特許権使用料以外の賃貸料および特許使用料が含まれ、これらの収入は、貿易または事業を積極的に展開することに関連する関係者から得られる。もし私たちがPFICと同定された場合、私たちの普通株のアメリカ保有者は、普通株式の売却によって達成された収益を資本収益ではなく、普通株式の利益と見なすことを含む不利な税収結果を受ける可能性があり、損失は普通配当金の優遇金利に適用される
85
アメリカの保有者の個人として、利息費用を徴収し、私たちの分配と普通株の売却収益に適用されます。
PFICとしての私たちの地位は私たちの収入の構成と私たちの資産の構成と価値に依存し、これはある程度私たちの普通株の四半期時価を参考にして決定される可能性があり、普通株の四半期時価は変動する可能性がある。私たちの地位はまた私たちがどのようにどのように速い速度で私たちの業務で以前に発行された現金収益を利用するかにかかっているかもしれません。私たちのPFICとしての地位は毎年事実に基づいて決定することであり、私たちは過去、現在あるいは未来のいかなる納税年度のPFIC地位についてもいかなる保証を提供することができない。
2022納税年度のPFICかもしれないので、2022納税年度に合格した選挙基金やQEF選挙を行うために必要な情報を株主に提供しました。我々はこのような情報を我々のサイトで提供している(www.crisprtx.com).私たちの株についてQEF選挙を行ったアメリカの保有者は、私たちが分配するかどうかにかかわらず、現在のベースで私たちの収入シェアを比例して計上しなければなりません。2022課税年度には、良質教育基金が規則に組み込まれており、当社の全社範囲内の一般収益および純資本収益額は普通収益および純資本収益0.00ドルであり、良質教育基金が規則に組み込まれている場合には、2023課税年度または将来の課税年度に重大な金額の一般収益および/または純資本収益がある可能性がある。2022納税年度か本納税年度のPFICかは決定されていませんが,2022納税年度および/または本納税年度のPFICである可能性もあります。PFICであるか可能性のある課税年度ごとに、QEF選択に必要な情報が含まれているPFIC年度情報レポートを提供するように努力します。あるいは、米国の保有者は、我々の株式が“基準”の下の“有価証券”を構成することを前提として、時価建ての選択を行うこともでき、これは、通常、上述したPFICの地位の不利な結果を回避するが、米国の保有者は、毎年私たちの株の任意の価値を一般収入報告として増加させることを要求する(および通常、私たちの株式価値のいかなる減少も許容される)。
PFICと判定された場合、米国所有者は、通常、我々の任意の直接または間接子会社に所有する割合の数(価値で計算される)を有する株式とみなされ、これらの子会社もPFICであり、それぞれは、このようなより低いレベルのPFICからの分配または処置に関し、同様の不利な規則の制約を受けるであろう。いずれの場合も、米国所有者がこのような株式を直接所有しているように(米国所有者がこのような分配または処置の収益を直接受けていなくても)。TRACRとCRISPR Treateutics Ltdを含む)はまだ確認されていません前の課税年度、本課税年度、あるいは将来の課税年度の低いレベルのPFICかもしれませんが、私たちはそうするつもりはありません。アメリカの保有者がどんな低いレベルのPFICについても良質な教育基金選挙に必要な情報を提供するつもりはありませんので、良質な教育基金選挙を行うことができないことを予想すべきです。私たちはあなた自身の税務コンサルタントに相談して、私たちのPFICの地位と投資PFICに関連する税務考慮要素を理解することを促します。QEF選挙または時価計算選挙の利用可能性、実行可能性とプログラム、PFICルールは私たちの任意の子会社に適用されます。
米国の株主は、私たちまたは私たちの役員や取締役会のメンバーに対する判決や民事責任を得ることができないかもしれない。
私たちはスイスの法律に基づいて設立され、私たちの登録事務所と登録地はスイスのZugに位置している。また、私たちの以前のいくつかの役員や幹部はアメリカ住民ではなく、将来もアメリカ住民であることは不可能であり、これらの人々の資産の全部または大部分はアメリカ外に位置しているか、あるいは将来的にはアメリカ外に位置する可能性がある。したがって,投資家は米国内で我々やそのような人々に法的手続き文書を送達したり,米国連邦証券法の民事責任条項に基づく訴訟判決を含めて米国裁判所で取得した判決を実行することができない可能性がある.我々のスイス弁護士は,米国連邦と州証券法のみに基づく民事責任のスイスでの実行可能性,あるいは米国裁判所判決を執行する訴訟における実行可能性に疑問を抱いていることを教えてくれた。スイスでは,米国連邦や州証券法のみに基づいて個人に対して提起された原始訴訟は,他の事項を除いて,スイス連邦国際私法で規定されている原則によって管轄されている。この規約は、結果がスイスの公共政策と一致しない場合、スイス裁判所は非スイス法律の規定の適用を禁止しなければならない。しかも、スイスの法律の義務的な条項は他のどんな適用される法律も考慮せずに適用される可能性がある。
スイスとアメリカは民商事判決の相互承認と執行に関する条約を持っていない。米国裁判所のスイスでの判決の承認と執行は、スイス連邦国際私法法案に規定されている原則によって管轄されている。この規約は原則として、非スイス裁判所が下した判決は、以下の場合にのみスイスで実行できると規定している
86
情報セキュリティとプライバシーに関するリスク
私たちは進化するヨーロッパと他のプライバシー法を守ることができないかもしれない。
我々はGDPRのようなヨーロッパプライバシー法の制約を受けており,ヨーロッパ経済地域やスイスでのデータ保護制度による臨床試験に関する個人データを含むヨーロッパ関連の個人データを収集して使用している。GDPRは、GDPRに拘束されている会社に対して、健康や他の敏感なデータの処理、個人データに関する個人の同意を得ること、個人を識別可能な個人データを処理し、このような情報を欧州経済地域以外(米国を含む)に移転する法的根拠を有すること、これらの個人にその個人データを処理する詳細を提供すること、個人データのセキュリティと機密性を保護するための保障措置の実施、個人データを処理する第三者とのデータ処理プロトコルの締結、個人がその個人情報に対して権利を行使する要求に応答すること、を含む幅広い厳格な要求を提出している。主管する国家データ保護機関と影響を受けた個人報告は個人データのセキュリティホールに関連し、データ保護官を任命し、データ保護影響評価を行い、ある責任措置と記録保存を確保する。GDPRはまた、個人データを欧州経済地域やイギリス以外の国に移転するための厳しいルールを実施しており、場合によっては、米国のように、有効なGDPR移行メカニズム(例えば、欧州委員会が標準契約条項や“SCCS”を承認し、イギリスの国際データ転送プロトコル/付録または“イギリスIDTA”)を確立しない限り、十分な保護レベルを確保することができない。SCCS/UK IDTAに依存してデータ転送を行う場合には、受信者が現地の法律によって制限されているかどうかを評価するための転送影響評価が要求される可能性もあり、これらの法律は、公共当局が個人データにアクセスすることを可能にする。データ保護法に基づいて個人データをヨーロッパ経済圏やイギリスから米国に移すことができない行為は、私たちの実験能力を阻害し、私たちの業務や財務状況に悪影響を及ぼす可能性があります。
GDPRや追加のEEA加盟国やイギリスの国家データ保護法に従わない場合、これらの法律は、私たちが個人データを収集している個人の所在場所によって適用される可能性があり、2000万ユーロ(イギリスGDPRによる)または世界の年商4%までの罰金を含む巨額の罰金を招く可能性がある。GDPRはまた、データ主体と消費者協会に個人訴訟権利を与え、監督当局に苦情を提出し、司法救済を求め、GDPR違反による損害について賠償を受けることができる。GDPR遵守は依然として厳格で時間のかかる過程であり,ビジネスコストを増加させたり,その業務やり方を変更して完全な遵守を確保したりすることが求められる可能性がある。特に,欧州経済圏加盟国で実施されている国家法律はEU GDPRから部分的に逸脱しており,国によって異なるより限定的な義務が課せられている可能性があるため,欧州経済区は統一された法的環境では動作しないと予想される。また、遺伝子データの処理と譲渡に関連するため、GDPRはEU加盟国が法律を公布し、より多くの具体的な要求や制限を加えることを明確に許可しているが、ヨーロッパの法律はこの分野で従来から大きな差があり、追加的な不確実性を招いている。
英国のデータ保護制度はEUのデータ保護制度から独立しているが,EUのデータ保護制度と一致している。英国はEU GDPR下の第3の国とされているが、欧州委員会(以下“欧州委員会”)は現在、英国がEU GDPRで十分な保護を提供していることを認める決定を下しているため、欧州経済圏からの個人データの英国への移行は制限されていない。EU GDPRと同様に,イギリスGDPRは個人データをイギリス以外の国に移しており,これらの国はイギリスが十分な保護を提供しているとはみなされていない。イギリス政府は、イギリスからヨーロッパ経済圏への個人データ転送が依然として自由に流動していることを確認した。英国政府は現在も英国立法手続きにデータ保護とデジタル情報法案、すなわちデータ改革法案を導入し、英国離脱後のデータ保護制度を改革している。可決されれば、データ改革法案の最終版は、英国と欧州経済圏データ保護制度との類似点をさらに変更し、欧州委員会の英国充足率の決定を脅かす可能性がある。EU GDPRとイギリスGDPRのそれぞれの規定と実行は将来さらに異なる可能性があり、追加の規制課題と不確実性をもたらす可能性がある。このような将来のイギリスの法律法規とEUの法律法規との相互作用に対する明瞭性の欠如は、私たちの個人データおよび私たちのプライバシーとデータ安全コンプライアンス計画を処理する法的リスク、複雑さ、コストを増加させ、イギリスとヨーロッパの経済地域に対して異なるコンプライアンス措置を実施することを要求するかもしれない。
また,欧州データ保護法に基づいて個人データをヨーロッパ経済区やイギリス以外の地域,特に米国に移転できるように十分な保障措置を維持しなければならない。場合によっては、私たちは最近更新された標準契約条項(新しい標準契約条項)に依存して個人データを転送する
87
欧州経済地域以外に設置されたコントローラやプロセッサからの欧州経済領域(GDPR制約を受けない)。英国はEUの新たな標準契約条項の制約を受けないが、英国からの移転を許可する独自の移行メカニズムである国際データ移転協定を公表している。このような事項の変化は追加的な費用を招き、私たちの全体的なリスクを増加させる可能性がある。EUと米国は2023年7月11日に発効した“EU-米国データプライバシー枠組み”(略称“フレームワーク”)の十分性決定を採択した。この枠組みは、EUと米国の間で伝送される個人データの保護は、EUが提供する保護に相当すると規定している。これはGDPRによる米国への移行を確保するための別のアプローチを提供している。この枠組みはイギリスのアメリカへの移転をカバーするために拡張された。その枠組みはその前身の枠組みのように挑戦されるかもしれない。
スイスは改正されたデータ保護制度を採択した。一般的に、スイスの国家データ保護制度はEUのデータ保護制度と一致する。スイスのデータ保護制度は,スイスからヨーロッパ経済圏やイギリス以外の受信者へのデータ転送にも類似した制限がある。これらの制限は、“枠組み”に基づいてスイスから米国の受信側にデータを転送するために変更されると予想される。
私たちは、私たちが欧州プライバシー法で規定されているいかなる義務を遵守する努力が十分かどうかという不確実性に直面し続けると予想する。欧州データ保護法を遵守しなければ、データ保護機関が法執行行動をとる可能性があり、これは罰金や他の処罰、個人訴訟、または負の宣伝を招き、私たちの経営業績や業務に負の影響を与える可能性がある。欧州データ保護当局のこのような調査または告発は、私たちの既存の業務および新しい顧客または製薬パートナーを引き付け、維持する能力にマイナスの影響を与える可能性がある。私たちがプライバシー権を侵害していると主張し、データ保護法を遵守できなかったり、私たちの契約義務に違反したりして、私たちが責任を負わなくても、弁護の費用が高く、時間がかかり、否定的な宣伝を招き、私たちの業務を損なう可能性があります。
人工知能によるリスクと挑戦は、私たちの機密情報、独自情報、個人データに対してセキュリティリスクを構成することを含む、私たちの業務に影響を与える可能性があります。
人工知能の開発と使用中の問題に加え、不確定な監督環境に加えて、私たちの業務運営に名声損害、責任或いはその他の不利な結果をもたらす可能性がある。多くの技術革新と同様に、人工知能によるリスクや挑戦は私たちの業務に影響を与える可能性がある。法律や情報セキュリティ審査を経た特定の用例に対しては,生成的人工知能ツールを用いて我々のシステムに統合する可能性がある.当社のサプライヤーは、その使用状況を開示することなく、生成人工知能ツールをその製品に統合する可能性があり、これらの生成人工知能ツールのプロバイダは、プライバシーおよびデータ保護に関する既存または迅速に変化する法規または業界基準を満たすことができず、私たちまたは私たちのプロバイダが十分なレベルのサービスおよび体験を維持する能力を抑制することができるかもしれない。もし私たち、私たちのサプライヤー、または私たちの第三者パートナーが生成的人工知能を使用して実際または予想される違反やプライバシーまたはセキュリティ事件を経験すれば、私たちは貴重な知的財産権と機密情報を失う可能性があり、私たちの名声と大衆の私たちのセキュリティ対策の有効性に対する見方が損なわれる可能性がある。また、世界各地の不良行為者は、人工知能を用いて、個人情報、機密情報、知的財産権の窃盗および乱用に関する不正活動を行うなど、ますます複雑な方法を使用している。これらの結果のいずれも、私たちの名声を損なう可能性があり、貴重な財産や情報損失を招き、私たちの業務に悪影響を及ぼす可能性があります。
我々の内部情報技術システム、または私たちの協力者または他の請負業者またはコンサルタントのシステムは、故障したり、セキュリティホールに遭遇したりする可能性があり、これにより、私たちの製品開発計画が実質的に破壊される可能性があります。
私たちの内部情報技術システム、および私たちの現在および未来の任意の協力者および他の請負業者またはコンサルタントのシステムは、コンピュータウイルス、恐喝ソフトウェア、許可されていないアクセス、自然災害、テロ、戦争、および電気通信および電気故障の破壊を受けやすい。これまで、このような重大なシステム障害、事故、セキュリティホールを経験したことはありませんが、このような事件が発生し、私たちの運営中断を招く場合、私たちのビジネス機密や他の固有情報の損失によるものであっても、他の同様の中断によるものであっても、我々の開発計画および業務運営中断を招く可能性があります。例えば、未来の臨床試験における臨床試験データの紛失は著者らの監督管理の承認作業の遅延を招く可能性があり、そして著者らのデータの回復或いは複製のコストを著しく増加させる。もしどんな中断やセキュリティホールが私たちのデータやアプリケーションを紛失したり、破損したり、機密または独自の情報を適切に開示しない場合、私たちは責任を招く可能性があり、私たちの競争地位が損なわれる可能性があり、私たちの候補製品のさらなる開発と商業化は延期される可能性がある。
私たちは、流用、誤用、漏洩、恐喝ソフトウェアによる暗号化の改ざん、または会社やサプライヤーの情報システムやネットワークで維持されている情報、当社従業員や研究対象の個人情報、会社やサプライヤーの機密データを故意または意外に漏洩または紛失するリスクに直面している可能性があります。さらに、外部の当事者は、私たちまたは私たちのサプライヤーのシステムを浸透させようとしたり、詐欺的な手段で私たちの人員または私たちのサプライヤーの人員に敏感な情報を開示させて、私たちのデータおよび/またはシステムにアクセスしようとするかもしれません。私たちのデータおよびシステムは、悪意のあるコードとウイルス、ネット釣り、および他のネットワーク攻撃、例えばサービス拒否および内部脅威を含む脅威にさらされる可能性がある。時間が経つにつれて、このような脅威の数と複雑さは増加している。もし私たちの情報技術システムやサプライヤーの情報技術システムが重大な破壊が発生すれば、市場が私たちのセキュリティ対策の有効性に対する見方が損なわれる可能性があり、私たちの名声が損なわれる可能性がある
88
そして信頼性が損なわれる可能性がある。私たちは情報システムやネットワークを修復したり交換したりするために多くの資金と他の資源が必要かもしれない。さらに、個人訴訟における規制行動および/または個人および団体からのクレームを受ける可能性があり、これらの訴訟は、データの乱用または不正開示に対するクレーム、および不公平または詐欺的なやり方を含むデータ収集および使用慣行および他のデータプライバシー法律および法規に関連するプライバシー問題に関するものである。我々はこれらの事件の発生を防止するためのシステムと制御を開発·維持し、脅威を識別·緩和するプロセスもあるが、これらのシステム、制御、プロセスの開発と保守はコストが高く、技術の変化とセキュリティ対策を克服する努力がますます複雑になり、継続的に監視·更新する必要がある。しかも、私たちが努力したにもかかわらず、このような事件が発生する可能性を完全になくすことはできない。より多くの情報システムをサプライヤーにアウトソーシングし、支払人や患者とより多くの電子取引を行い、クラウドベースの情報システムにより多く依存するにつれて、関連するセキュリティリスクが増加し、私たちの技術および情報システムを保護するために追加の資源が必要になるであろう。さらに、システム障害時の障害、サービス中断、データの悪化または損失から私たちを保護するのに十分なセキュリティおよび制御措置を実施するために、私たちの内部情報技術システムまたは私たちの第三者請負業者のシステム、または私たちのコンサルタントが十分なセキュリティおよび制御措置を実施するための努力を保証することは、ネットワーク攻撃、セキュリティホール、産業スパイ攻撃、または金融、法律、商業または名声被害をもたらす可能性のある内部脅威攻撃時にデータが盗まれたり破損したりすることを防止するのに十分である。
一般リスク
上場企業として、私たちの運営には大きなコストがかかり、私たちの経営陣はコンプライアンスイニシアチブやコーポレートガバナンス実践に多くの時間を投じる必要があります。
上場企業として、私たちは巨額の法律、会計、その他の費用を招いた。SOX、ドッド-フランクウォール街改革と消費者保護法、ナスダック全世界市場の上場要求及びその他の適用される証券規則と法規は上場会社に対して各種の要求を提出し、有効な開示、財務制御と会社管理のやり方を確立と維持することを含む。私たちの経営陣と他の人たちはこのような要求に対する遵守を維持するために多くの時間を投じた。しかも、このような要求は私たちの法律と財務コンプライアンスコストを増加させ、いくつかの活動をもっと時間的で高価にする。
SOX第404条によれば、我々は、独立公認会計士事務所が発行した財務報告内部統制の認証報告を含む経営陣の財務報告の内部統制に関する報告書を提出しなければならない。このような点で、私たちは多くの会計費用を発生させ、多くの管理努力を費やした。私たちのテストは財務報告書に対する私たちの内部統制の欠陥を明らかにするかもしれないが、これらの欠陥は重大な欠陥または重大な欠陥と考えられている。1つまたは複数の重大な弱点、またはタイムリーに救済できない重大な欠陥を発見すれば、財務諸表の信頼性に対する信頼性の喪失によって金融市場に悪影響を及ぼす可能性がある。
私たち普通株の市場価格はずっと大きく変動しており、これは株主に大きな損失をもたらす可能性がある。
私たちの株価は大幅な変動の影響を受けてきたし、未来もそうかもしれない。また、株式市場全体、特にナスダック上場のバイオ製薬会社は、極端な価格と出来高変動を経験しており、これらの変動は往々にしてこれらの会社の経営業績と関係がないか比例しない。例えば、2016年10月19日、つまりナスダック世界市場に上場した初日から2023年12月31日まで、私たちの株は1株220.20ドルの高値と11.63ドルの低価格の間で取引されている。このような変動のため、私たちの株主は大きな損失を受けるかもしれない。また、私たちの普通株の市場価格は多くの要素の影響を受ける可能性があります
89
これらと他の市場と業界要素は私たちの普通株の市場価格と需要を大幅に変動させる可能性があり、私たちの実際の経営業績にかかわらず、投資家がいつでもその普通株を売却することを制限または阻止する可能性があり、そうでなければ、私たちの普通株の流動性にマイナスの影響を与える可能性がある。過去、1株の市場価格が変動した場合、その株の保有者は、その株を発行した会社に対して証券集団訴訟を起こす。もし私たちのすべての株主が私たちを提訴すれば、私たちは巨額の訴訟弁護費用を生むかもしれない。そのような訴訟はまた私たちの経営陣の時間と注意を移すかもしれない。
不利なグローバル経済状況は、私たちの業務、財務状況、または経営結果に悪影響を及ぼす可能性がある。
我々の業務結果は、世界経済の全体的な状況、グローバル金融市場の混乱、景気後退や市場の回復、例えばコロナウイルスの大流行による政治的動揺、米国と中国の関係悪化などの地政学的緊張による政治的動揺、中国と台湾間の緊張のエスカレート、ロシアとウクライナ間の持続的な軍事衝突、ロシアへの関連制裁、あるいはイスラエル-ハマス戦争、インフレなどの他の世界的マクロ経済要因を含む悪影響を受ける可能性がある。この状況は私たちの資本獲得能力を低下させる可能性があり、これは将来的に私たちの流動性に悪影響を与え、私たちの業務や普通株の価値に大きな影響を与える可能性がある。
我々の業務は,最近のコロナウイルスの大流行や他の変種のような感染症の大流行,流行病あるいは爆発の悪影響を受ける可能性がある。
我々の業務は,臨床試験場所や他の業務活動が集中している地域で衛生流行病の悪影響を受ける可能性があり,我々が依存している第三者契約メーカーや契約研究組織の運営や,患者を募集して臨床試験を行う能力が深刻に妨害される可能性がある。
最近のコロナウイルスの大流行は全世界の社会、経済、金融市場と世界各地の商業やり方に予測できない影響を与えた。例えば,コロナウイルスの大流行による患者用量の一時停止や遅延,患者のICU入室,病院や医療資源の制限や減少,新たな臨床試験地点の遅延開始,各試験地点の限られた現場者の支援を含めた一時的な遅延や中断を経験した可能性もある。さらに、我々のいくつかの第三者製造業者およびサプライヤーは、大流行のために運営を停止しており、コロナウイルスまたは他の大流行のより多くの波が地域コミュニティおよび/または国および地方法規に影響を与える場合、将来的に再び運営を一時停止する可能性がある。コロナウイルスに関する世界公衆衛生緊急声明は2023年5月に終了したが,我々の対応を積極的にモニタリング·管理し,我々が行って計画している臨床試験への影響を含めて,我々の業務運営への実際と潜在的な影響を評価し続けている。私たちは引き続き第三者サプライヤー、パートナー、その他の各方面と密接に協力して、私たちの計画と候補製品のパイプを推進することを求めて、同時に私たちの従業員とその家族、パートナー、第三者サプライヤー、医療サービス提供者、患者とコミュニティの健康と安全を維持することが重要である。
銀行システムや金融市場の状況は、銀行や金融機関の倒産を含め、私たちの運営や財務業績に悪影響を及ぼす可能性がある。
流動性が限られている、契約違反、業績が悪い、または金融サービス業または金融サービス業の他の不利な発展に影響を与える実際の事件、または任意のこのような事件または他の類似のリスクに対する懸念または噂は、過去および未来に市場全体の流動性問題を引き起こす可能性がある。例えば、2023年3月、連邦預金保険会社はシリコンバレー銀行、署名銀行、銀門資本会社の係に接収され、これまでこれら3つの銀行は業務を継続することができなかった
90
行動する。それ以来、より多くの金融機関も同様の破産を経験し、破産管理手続きに置かれている。未来に他の銀行も似たような困難に直面する可能性がある。これらの事件は、法律上の不確実性、著しい変動性、蔓延リスクを含む銀行業の脆弱性を暴露し、地域銀行株の市場価格の暴落を招いた。例えば、他の銀行や金融機関が将来、銀行システムや金融市場の金融状況に影響を与えて破産手続きや破産に入った場合、既存の現金、現金等価物、投資を得る能力が脅かされる可能性がある。現在、市場の高度な変動や銀行業の不安定が経済活動、特に我々の業務に及ぼす影響の程度は予測できないが、他の銀行や金融機関の倒産や、政府、企業、その他の組織がこれらの事件に対応するための措置は、我々の業務、財務状況、運営結果に悪影響を及ぼす可能性がある。
もし証券アナリストが私たちの業務に関する研究や報告を発表しなければ、あるいは彼らが私たちの普通株に対するマイナス評価を発表すれば、私たちの普通株の価格は下がるかもしれません。
私たちの普通株の取引市場は、業界や金融アナリストが発表した私たちまたは私たちの業務に関する研究と報告に部分的に依存するだろう。もし私たちの業務を追跡した一人以上のアナリストが私たちの普通株に対する彼らの推定値を引き下げたら、私たちの普通株の価格は下落するかもしれない。もしこのようなアナリストの一人以上が私たちの普通株を追跡しなければ、私たちは市場での私たちの普通株の可視性を失うかもしれないが、これは逆に私たちの普通株価格の下落を招く可能性がある。
私たちの業務は国際業務に関連する経済、政治、規制、その他のリスクの影響を受けている。
私たちの業務は国際業務の展開に関連するリスクの影響を受けています。私たちと私たちの多くのサプライヤーと協力と臨床研究関係はアメリカ以外に位置している。したがって、私たちの将来の業績は様々な要素の影響を受けるかもしれない
資金不足や潜在的な資金不足による食品·医薬品局、米国証券取引委員会、その他の政府機関の中断は、主要指導部や他の人員の雇用·保持能力を阻害し、新製品やサービスのタイムリーな開発や商業化を阻止したり、これらの機関が正常な業務機能を履行することを他の方法で阻止したりすることができ、これは私たちの業務や私たちのスケジュールに負の影響を与える可能性がある。
FDAが新製品を審査·承認する能力は、政府予算と資金レベル、肝心な人員の雇用と維持及びユーザー費用の支払いを受ける能力、及び法律、法規と政策の変化を含む様々な要素の影響を受ける可能性がある。したがって、その機関の平均検討時間は近年変動している。また、政府が米国証券取引委員会や我々の業務に依存する可能性のある他の政府機関に提供する資金は、政治事件の影響を受け、これらの事件自体が流動性と予測不可能性を持っている。
FDAや他の機関の中断は、必要な政府機関の新薬の審査および/または承認に要する時間を遅らせる可能性があり、これは私たちの業務に悪影響を及ぼす可能性がある。例えば、ここ数年間、米国政府は何度か閉鎖されており、食品·薬物管理局や米国証券取引委員会などのいくつかの規制機関は、食品·薬物管理局、米国証券取引委員会、および他の政府従業員を休暇させ、重要な活動を停止しなければならない。もし政府が長時間停止すれば
91
これはFDAと米国証券取引委員会が私たちが提出した材料を適時に審査して処理する能力に深刻な影響を与え、これは私たちの業務と私たちのスケジュールに実質的な悪影響を及ぼす可能性がある。
項目1 B。未解決従業員コメント。
ない。
プロジェクト1 C。ネットワークセキュリティです。
ネットワークセキュリティリスク管理
私たちの通常のビジネスプロセスでは、従業員、パートナー、協力者、およびサプライヤーのデータを含むデータを使用、保存、処理します。私たちはまた私たちのいくつかの候補製品に関する臨床試験参加者の匿名情報を扱う。ネットワークセキュリティがこれらのデータおよび我々のシステム構成の脅威に及ぼすリスクを識別、評価、緩和するためのネットワークセキュリティリスク管理計画を実施した。
我々のネットワークセキュリティリスク管理計画は、情報セキュリティ計画の評価と自動化ツールを使用してネットワークセキュリティ脅威からのキーリスクを継続的に監視することを含む複数の構成要素を含む。私たちは定期的に第三者を招いて、浸透テストや他の脆弱性分析を含む私たちのシステムのリスク評価を行っています。我々の財務部門は、外部技術コンサルタントの協力のもと、定期的に異なるシステムの内部評価を行い、ネットワークセキュリティリスク管理を含む我々のリスク管理プロセスを評価する。また、ネット釣りの企みがもたらすリスクを含むネットワークセキュリティ脅威に対する人々の認識を高めるための従業員教育計画を実施した。このような訓練は従業員の入社過程に含まれ、その後定期的に行われる。我々のネットワークセキュリティリスク管理計画の一部として、第三者プロバイダとプロバイダのネットワークセキュリティアプローチの流れを維持評価し、検討する。第三者サプライヤーとキーサプライヤーと交渉する前に、セキュリティ評価を行い、契約にセキュリティ要件を適宜含める。私たちの業界の他の会社のように、私たちは私たちの業務に関連する多くのネットワークセキュリティリスクに直面している。これまで、我々の業務戦略、運営結果、および財務状況は、以前に決定されたネットワークセキュリティイベントを含むネットワークセキュリティ脅威リスクの実質的な影響を受けていないが、私たちは時々、ネットワーク釣り攻撃を含む、私たちのデータおよびシステムに関連する脅威およびセキュリティイベントに遭遇する。私たちのネットワークセキュリティに関するリスクに関するより多くの情報は、“を参照してください”リスク要因-情報セキュリティとプライバシーに関連するリスク-私たちの内部情報技術システム、または私たちの協力者や他の請負業者やコンサルタントのシステムは、故障したり、セキュリティホールを受けたりする可能性があり、これは、私たちの製品開発計画の大きな中断を招く可能性があります.”
統治する
我々の取締役会監査委員会または監査委員会の監督の下で、我々の取締役会監査委員会または監査委員会の監督の下で、我々の情報技術担当者またはIT担当者は、主に我々のネットワークセキュリティ脅威管理計画の評価、運営、管理を担当する。私たちのIT担当者は定期的に私たちの首席コンプライアンス官と会い、このようなリスクの可能性、影響の深刻さ、脆弱性の修復面の進展を含む、私たちが直面している重要なリスクの出所と性質、およびIT部門がこれらのリスクをどのように評価するかに関する最新の情報を含む、ネットワークセキュリティ構造および私たちのネットワークセキュリティリスク管理計画の現在の発展について議論する。
我々の首席コンプライアンス官およびIT担当者は、我々の情報技術部門の他のメンバー、およびネットワークセキュリティに関して専門的な知識を有する第三者(仮想首席情報セキュリティ官またはvCISOを含む)と協議して、ネットワークセキュリティ作業を評価、処理し、我々の業務目標および運営要件と一致させるために戦略を策定する。IT担当者は現在,情報セキュリティや業務システム(デジタルインフラやネットワークセキュリティを含む)において20年以上の経験を持つ個人が担当している.現在,我々のvCISOが運営している個人として15年を超える企業vCISOがサービスを提供した経験を持ち,生命科学と国防を含む様々な業界に関連し,米国連邦政府の各機関に提案を提供している。
我々の取締役会または取締役会企業リスク管理計画の一部として、我々の取締役会はネットワークセキュリティリスク管理を監督する責任があります。私たちの取締役会は、情報セキュリティとネットワークセキュリティ脅威および関連するコンプライアンスと開示要件を監督することを含む、監査委員会に、私たちのネットワークセキュリティリスク管理計画を監督するように依頼しました。当社のIT担当者とvCISOは毎年、重要なネットワークセキュリティリスク、持続的なネットワークセキュリティ計画と戦略、適用される法規要件や業界基準に関する最新の状況を含む当社のネットワークセキュリティリスク管理計画に関する最新の情報を監査委員会に提供しています。監査委員会は定期的に取締役会全員にネットワークセキュリティリスク管理状況を報告する。
92
プロジェクト2.専門家ペルテスです。
三ヶ月ごとに更新される不動産賃貸協定によると、私たちの主な執行事務所はスイスのZugにあります。私たちのアメリカ研究開発本部はマサチューセッツ州ボストン西第一街105号にあります。そこで約263,500平方フィートの実験室とオフィススペースを借りました。この施設は2034年10月までレンタルされており,レンタル期間をさらに2年5年間延長することが選択できる。
2020年5月、マサチューセッツ州フレミンガムで50,249平方フィートの建築賃貸契約を締結し、臨床生産の細胞治療製造施設として使用し、我々の研究における細胞治療候補製品の商業生産のために使用する予定である。同施設は2036年3月までレンタルされ、レンタル期間をさらに2~7年延長することが選択できる。
例えば、私たちはカリフォルニア州サンフランシスコで実験室とオフィススペースを借りています。私たちの施設は私たちの現在の需要を満たすのに十分であり、必要であれば、私たちは適切な追加または代替空間を提供するだろうと信じている。
項目3.法律法律手続き。
通常の業務の過程で、私たちは、私たちの知的財産権(特許組合を含む)、商業手配、その他の事項に関連する訴訟、調査、法的手続き、および訴訟の脅威に時々巻き込まれているか、または時々巻き込まれている。このような訴訟には準訴訟が含まれているかもしれません各方面間米国特許商標局及び欧州特許庁又は他の国の特許庁の行政訴訟は、特許組合を含む我が国の知的財産権に関するものである。上記のいずれの場合の結果も,本質的には不確実である.さらに、訴訟や関連事項の費用が高く、私たちの経営陣や他の資源の注意を分散させる可能性があり、そうでなければ、これらの資源は他の活動に使用されるだろう。もし私たちがこのような訴訟に勝つことができなければ、私たちの業務、運営結果、流動性、そして財務状況は不利な影響を受けるかもしれない。
4つ目:地雷の安全TYが披露する。
適用されません。
93
部分第2部:
項目5.登録者普通株·関連株の市場保有者は重要であり,発行者は株式証券を購入する.
市場情報
私たちの普通株はナスダック世界市場で取引され、コードは“CRSP”です
株式表現グラフ
1934年の“証券取引法”(改訂本)第18節または“取引法”については、以下の業績グラフおよび関連情報は、1933年の“取引法”(改正本)または“証券法”に基づいて提出された任意の将来の文書に、特に引用によってこのような文書に組み込まれない限り、引用によってこのような情報を“証券法”(改正本)または“証券法”に提出された任意の将来の文書に組み入れてはならない。
以下の図は、2018年12月31日から2023年12月31日までの間に、我々の株の株主累計総リターンと同期(A)ナスダックバイオテクノロジー指数と(B)ナスダック総合指数の累積総リターンを比較したものである。この図は,2018年12月31日に我々の普通株,ナスダックバイオテクノロジー指数,ナスダック総合指数への投資を100ドルと仮定し,再投資配当金(あれば)を仮定している。次の図に示す比較は履歴データに基づく.この図に含まれる株価表現は,必ずしも未来の株価表現を示唆しているとは限らない.
CRISPR治療股指、ナスダック総合指数とナスダックバイオテクノロジー指数の総リターンの比較
94
スイスの税務面の考慮
スイス源泉徴収税
スイス現行税法によると、株主に支払う満期配当金と同様の現金または実物分配(清算収益と株式配当を含む)はスイス連邦源泉徴収税を払わなければならない(Verrechnungssteuer)“源泉徴収税”),現在の税率は35%(課税配分の総額に適用)である。私たちは任意の課税分配の総額から源泉徴収税を控除し、このような分配が満期になった日から30日以内にスイス連邦税務局に税金を納める義務があります。ただし、株式額面の償還及び資格に適合した追加実収資本の返済(出資準備)オス·カピタリンを保留する)源泉徴収税を支払う必要はありません。源泉徴収税は、私たちが株式を買い戻す際の支払い(それぞれの株式および使用済み株式備蓄を超える)にも適用され、(I)当社の株式がその買い戻し(償還株式)の際に減少した場合、(Ii)買い戻しされた株式の総数が当社の株式の10%を超えた場合、または(Iii)買い戻しされた株式が買い戻し後6年以内に販売されていない場合。株式を買い戻す6年間の期間は、転換可能な債券、オプション債券または従業員株式オプション計画の支払いに使用される義務が保留されている限り(従業員株式オプション計画であれば、最長6年)停止する。課税株式を買い戻す場合には、買い戻し価格と買い戻し株式額面と買い戻し時に払戻しされた合格追加実収資本の和との差額に源泉徴収税を徴収する。
個人資産としてその株式を保有するスイス住民個人(“住民個人株主”)は、原則として源泉徴収税の所得税を全額還付または免除する資格があり、所得税申告書に関連収入を適切に報告すれば。また、(I)納税目的でスイスに居住する会社株主及び個人株主、(Ii)スイスに居住していない会社株主及び個人株主、それぞれの場合、スイスで行われている貿易又は業務の一部として、納税目的でスイスに固定営業場所を有する常設機関によりその株を保有しており、(Iii)所得税目的で“専門証券取引業者”に分類されるスイス住民個人は、他の理由を除いて、株式及びその他の証券の取引又はレバレッジ投資を行うことが多い(総称して、国内商業株主“)は原則として、その損益表または所得税申告書(場合によっては)で関連収入を適切に報告する限り、源泉徴収税所得税を全額還付または控除する資格がある。
株主は、税務目的でスイスに居住せず、かつ関連課税年度内に、スイス国内に固定営業場所を設けた常設機関が貿易や業務に従事しておらず、他の理由でスイスで会社や個人所得税(総称して“非住民株主”と呼ぶ)を納付する必要がなければ、源泉徴収税の全部または一部を返還することができ、その受取人が税務目的で居住している国とスイスが二重課税を回避する二国間条約(“税務条約”)を維持し、当該税務条約の他の条件を満たすことを前提としている。非住民株主は、条約給付を申請する手続き(および払い戻しを得るのに要する時間)が国によって異なる可能性があることを認識しなければならない。非住民株主は、株式の受け取り、所有権、購入、販売またはその他の処置、および源泉徴収税の払い戻しを申請する手続きについて、自分の法律、財務、または税務コンサルタントに相談しなければならない。
情報の自動交換
税務資料自動交換計画は経済協力及び発展組織が先頭に立つグローバル計画である。それの目的は税務情報を自動的に交換する汎用的な基準を確立し、税務透明性を増加させることだ。
AEIを実施または実施した司法管轄区(例えば、スイス、EU加盟国および世界の多くの他の司法管轄区)は、その申告金融機関に、それぞれの現地実施法律に基づいて、その口座保持者および制御者(場合によっては)の納税居住地を決定し(S)、報告すべき口座である場合は、特定の身分情報、口座情報および財務情報(利子、配当、他の収入および毛収入などの口座残高および関連支払いを含む)を現地税務機関に報告し、その後、現地税務機関は、受信した情報を関連する司法管轄区の税務機関と交換するように要求する。
スイスが発効したか、署名され発効したAEI協定リストは、国際金融事務局のウェブサイトで見つけることができる。
スイス連邦印紙税
発売計画および発売過程で株式および売却株式を発行するには、スイス連邦証券発行印紙税を払わなければならない(Abgabeを発射する)1%は私たちが負担します
その後、私たちの株を購入または販売し、常駐プライベート株主、国内商業株主、または非常駐株主(二級市場取引)によって行われても、スイス連邦証券譲渡印紙税を支払う必要があるかもしれません(ウムサザバガベ)現行税率は最高0.15%であり、それぞれ購入価格または販売収益で計算され、条件は:(I)このような譲渡である
95
スイスまたはリヒテンシュタイン銀行によって発生するか、またはスイス連邦印紙税税法によって定義された別のスイス証券取引業者またはその参加下で発生し、(Ii)免除は適用されない。
スイス連邦、州、コミュニティの個人所得税と企業所得税
非住民株主s
非住民株主は配当金支払いと同様の分配についてスイス連邦、州、あるいはコミュニティ所得税を支払う必要がありません。彼らは私たちの株だけを持っているからです。株を売却する資本利益もこれに適用される。源泉徴収税の結果については、上記を参照されたい。
住民個人株主と国内商業株主
住民個人株主が配当金及び類似の現金或いは実物分配(上記清算収益及び株式配当或いは課税株式買い戻しを含む)を徴収する場合、株式額面又は合資格を償還する追加実収資本ではない場合、その個人所得税申告表に当該等の収入を申告しなければならず、関連税期の任意の課税所得額についてスイス連邦、州及びコミュニティ所得税を納付しなければならない。また、スイス連邦個人所得税の目的で、上記配当金と同様の分配は連邦レベルの70%にのみ課税される(Teilbesteuerung)であれば、投資額が少なくとも私たちの株式の10%に達した場合。州やコミュニティレベルでも類似した規定が導入されているが,居住地によって規定が異なる可能性がある。
常駐プライベート株主が第三者に株式を売却または処分する際に出現する収益または損失は、通常、免税されたプライベート資本収益または課税不可資本損失であり、具体的な状況に応じて決定される。
配当金および現金または実物割当(清算収益および赤株を含む)のような国内商業株主は、関連納税期間の損益表でその支払いを確認し、その期間に蓄積された任意の課税所得額(配当を含む)についてスイス連邦、州およびコミュニティの個人所得税または会社所得税を納付しなければならない(場合に応じて)。会社の納税者である国内商業株主は配当分配の参加減免を受ける資格があるかもしれないBeteiligungsabzug)が、保有する株式の時価が少なくとも100万スイスフランである場合、または私たちの株式の少なくとも10%を占めるか、またはそれぞれ少なくとも10%の利益および準備金を得る権利がある。
国内商業株主は、それぞれの課税期間の損益表において株式を売却する際に達成される損益を確認し、当該課税期間の任意の課税所得額(株式を売却またはその他の方法で処分することにより実現される損益を含む)についてスイス連邦、州およびコミュニティの個人所得税または会社所得税を納付しなければならない。個人納税者に属する国内商業株主に対して、株式売却による収益は連邦レベルで達成される(Teilbesteuerung)は、(I)のように、当該投資がある貿易又は業務の経営に関連して保有されているか、又は業務資産を選択する資格に適合している(グシュハフツフモルガン)スイス税法によれば、(Ii)売却された株式は、会社の株式の少なくとも10%の権益を反映し、(Iii)少なくとも1年間保有される。州やコミュニティレベルでも同様の規定が導入されているが,これらの規定は居住地によって異なる可能性がある。企業の納税者である国内の商業株主は減免に参加する権利があるかもしれませんBeteiligungsabzug)が、納税中に販売された株式(I)が会社の株式の少なくとも10%の権益を反映している場合、または売却された株式が少なくとも10%の利益および備蓄を許可する場合、および(Ii)は少なくとも1年間保有する。参加猶予は、売却収益と参加初期コストとの差額に適用される(グステヘンスコスモ)により、従来の参加減記再課税につながる。
スイスの財産税と資本税
非住民株主
私たちの株を持っている非住民株主は州とコミュニティの富税や毎年の資本税を支払う必要がありません。彼らはこれらの株だけを持っているからです。
住民個人株主と国内商業株主
住民個人株主は,その株式をその私財の一部として報告することを要求され,州やコミュニティ財税を納付しなければならない。国内商業株主は、その株式をその定義された商業財又は課税資本の一部として報告することを要求され、州及びコミュニティ財又は年間資本税を納付しなければならない。
スイス米国の“外国口座税収遵守法案”の実施促進
スイスは米国と“外国口座税収遵守法”の施行を促進するための政府間協定を締結した。この協定は、米国人がスイス金融機関に保有している口座が口座保持者の同意を得た場合、または行政援助の範囲内で団体要請の方法で米国税務機関に開示されることを保証する。同意が得られない場合には,メッセージは自動的に転送されるのではなく,交換される
96
米国とスイスの間の二重課税協定に基づく行政援助の範囲内にのみある。2014年10月8日、スイス連邦委員会は米国との交渉を要求し、現在の直接通知に基づく制度をスイス連邦税務局に情報を送信することに変更し、後者は米国税務当局に情報を提供することを承認した。
上の討論はスイスの重要な税金考慮事項をまとめたものだ。それは特定の株主に重要である可能性のあるすべての税務事項を含まない。各株主は株主自身の状況に応じて、税務結果についてそれ自体の税務顧問に意見を聞くべきである。
所持者
2024年2月16日現在、私たちは約17人の普通株式登録所有者がいます。この数値には、その株式が街の名義で保有されている利益所有者は含まれていない。
配当をする
設立以来、私たちは私たちの普通株について何の現金配当金も支払わず、予測可能な未来にも現金配当金を支払わないだろう。
株式補償計画に基づいて発行された証券
当社の株式報酬計画に関する情報は、ここに組み込まれ、10-K表形式の本年度報告第3部第12項を参考にします。
プロジェクト6.保留
適用されません。
項目7.経営陣の以下の問題の議論と分析財務状況と経営実績。
以下の財務状況と経営結果の検討と分析、および当社の連結財務諸表と本年度報告書の他の場所でForm 10-K形式で提供された関連説明を読むべきです。本議論および分析に含まれるまたは本Form 10-K年次報告の他の部分に記載されている情報は、リスクおよび不確定要因に関する前向きな陳述を含む、我々の業務および関連融資の計画および戦略に関する情報を含む。本年度報告10-K表の“リスク要因”の部分に列挙された要素を含む多くの要因の影響により、我々の実際の結果は、以下の議論および分析に含まれる前向き陳述に記載または示唆された結果とは大きく異なる可能性がある。
概要
我々は有力な遺伝子編集会社であり,CRISPR/Cas 9による療法の開発に専念している。CRISPR/Cas 9は革命的な遺伝子編集技術であり、即ちゲノムDNAの特定配列を精確に変化させる過程である。我々の目標はこの技術を応用して遺伝子を妨害、削除、是正と挿入し、遺伝病を治療し、先進的な細胞療法を設計することである。われわれはこの技術を発見から承認まで比類のない速度で進め,最終的にCRISPRによる療法CASGEVY(Exagamlobgene Autotemcel)を記念碑的に初めて承認した[Exacel])、2023年にVertex製薬会社またはVertexにおける当社と協力します。著者らは、著者らの技術、研究開発能力と公認された実行能力を結合することにより、著者らは希とよく見られる疾病を有する患者のために新しい高効率と潜在的な根治療法を創造することができ、現在の生物製薬方法はこれらの患者に対する成功は限られていると信じている。
CRISPR/CAS 9を用いた遺伝子編集は,ドイツベルリンに位置するマルクス·プランク病原体科学単位の代理と創始者取締役である我々の科学創始者の一人であるEmmanuelle Charpentier博士が共同で発明した。Charpentier博士と彼女の協力者は1つの仕事を発表し、CRISPR/Cas 9の重要な構成部分Cas 9エンドヌクレアーゼが特定の位置で二本鎖DNAを切断する機序をプログラムできることを明らかにした。チャペンティエ博士と彼女の協力者、カリフォルニア大学バークレー校のジェニファー·デュドナ博士は、彼らの先駆的な仕事で2020年のノーベル化学賞を共有した。我々はCharpentier博士からCRISPR/CAS 9と関連技術を含む知的財産権の独占的権利を獲得し,我々自身の研究と追加的な許可内努力により,我々の知的財産権を強化し続け,遺伝子編集療法における我々のリードをさらに強固にした。
私たちは4つの核心フランチャイズ権をカバーする一連の治療計画を立ち上げました
97
レジメンによっては,患者に注射する前にヒト外の細胞を編集するか,体内編集方法をとるか,CRISPRによる治療薬を直接人体内の標的細胞に送達する体外方法をとるかである。また,我々のプラットフォームで革新し,新しい療法を実現できる次世代技術を開発し続けている。これらの努力により,CRISPR/Cas 9の潜在力を十分に放出し,患者の生活を変える薬剤を創出することを目標としている。
私たちの使命は深刻なヒト疾患のための変革的な遺伝子ベースの薬を作ることです。我々の革新的な研究、翻訳専門知識と臨床開発経験は、CRISPRに基づく治療法開発の面でリードしていると信じている。
ヘモグロビン病
CASGEVYは非ウイルスで離体するCRISPR/Cas 9遺伝子編集細胞療法であって、患者自身の造血幹および前駆細胞が赤系特異的増強子領域で編集されているBCL 11 A遺伝子は正確な二本鎖で切断されている。この編集の結果,赤血球に高レベルの胎児ヘモグロビンが産生され,SCDやTDT患者の成人ヘモグロビンの欠陥を補うことができた。CASGEVYは我々とVertex製薬会社やVertexとの戦略的パートナーシップに登場する第1の療法であり,Vertexとそのいくつかの付属会社との共同開発と商業化プロトコルに基づいて進められている。
2023年,CASGEVYは世界で初めて承認されたCRISPRに基づく遺伝子編集療法となった。CASGEVYはこれまでに米国,ヨーロッパ,イギリス,サウジアラビア,バーレーンで承認されており,条件を満たす12歳以上のSCDやTDT患者の治療に用いられている。これまでに公表されてきた治療効果データは,潜在的な一次的機能的治癒のための重篤なSCDおよびTDTの方法としてこの治療法を支持している。
免疫腫瘍学と自己免疫
CRISPR/CAS 9は次世代CAR T細胞療法を創造する潜在力があると信じており,現在の自己療法と比較して,この治療法はより良い製品概況を有し,より広範な患者への接触を可能にしている。我々は、2つの次世代同種異体CAR T計画、CD 19を標的とするCTX 112、およびCD 70を標的とするCTX 131を含む腫瘍学的および/または自己免疫適応に対するいくつかの細胞治療計画を進めている。これらの候補製品は2種類の新しい遺伝子編集--Regnase-1のノックアウトと形質転換増殖因子-β受容体2(TGFBR 2)のノックアウト--CAR Tの効力を増強し、CAR Tの消費を減少させることを目的とした。薬物動態を含むCTX 112およびCTX 131の臨床試験が行われている新しい薬理学的データは、これらの編集を統合していない第1世代候補遺伝子と比較して、新しい効力遺伝子編集が患者のCAR T細胞拡張率および機能持続性を有意に向上させることを示している。そのほか、次世代候補製品はより強い製造安定性を示し、各ロットで生産したCAR T細胞の数量はもっと高く、更に一致した。私たちは臨床試験のためにCTX 112とCTX 131を生産しています。私たちの内部GMP製造工場で。
CTX 112は、再発または難治性CD 19陽性B細胞悪性腫瘍を有する成人患者における候補薬剤の安全性および有効性を評価するための臨床試験を行っており、これらの患者は、少なくとも2つの以前の治療を受けている。また,2024年上半期にCTX 112による全身性エリテマトーデス治療の臨床試験を開始する予定であり,将来的にはより多くの自己免疫適応に拡大する可能性がある。CTX 131は、再発または難治性固形腫瘍を有する成人患者における候補薬剤の安全性および有効性を評価するための臨床試験を行っている。また,CTX 131の試験をT細胞やB細胞腫瘍を含む血液系悪性腫瘍に拡大する予定である。
生活の中で
98
我々の体内にある遺伝子編集戦略の重点は遺伝子破壊と全遺伝子是正である--この2つの技術は大多数の最も普遍的な深刻な単遺伝子疾患及び多くのよく見られる疾患を解決する必要がある。私たちはすでに先進的なプラットフォームを構築しました体内にある急速に拡大しています体内にあるプログラムです。私たちの初めての体内にあるこれらの計画は肝臓を目指し,検証されたLNP送達技術を用いて,よく知られている遺伝関連遺伝子を安全に妨害することで強力な治療効果を得ることができる疾患の治療を目指している。例えば私たちの最初の2つは体内にあるCTX 310およびCTX 320計画は、それぞれ有効な標的Angptl 3とLp(A)を干渉することによって心血管疾患を解決することを目的としている。私たちはCTX 310とCTX 320の第1段階臨床試験を開始した。CTX 310とCTX 320に基づいて、多くの早期調査があります体内にある肝臓における遺伝子破壊を利用してまれでよく見られる疾患を治療する計画。また,我々CRISPR−X研究チームが開発した技術を利用したプロジェクトも含め,肝臓遺伝子補正に焦点を当てたプロジェクトもある。最後に,ナノ粒子技術やAAV担体のさらなる進歩を含めて,造血幹細胞を含む肝臓以外の組織に輸送するためのより多くの送達技術が求められている。
1型糖尿病
T 1 Dを治療するための遺伝子編集幹細胞由来療法の開発に重点を置いた一連のプロジェクトを進めている。我々の遺伝子編集能力はベータ細胞代替製品を候補製品にする可能性があり、長期的な免疫抑制を必要とすることなく、患者に持続的な利点をもたらす可能性があると信じている。私たちはこの目標を達成するための三つの並行的な努力を持っている。まず、著者らの最先端の候補製品CTX 211は同種異体、遺伝子編集、免疫低下の幹細胞由来製品の候補製品であり、この装置は患者の体内に移植され、グルコース依存の方式でインシュリンを産生することを目的としている。このプログラムは従来VCTX 211と呼ばれており,Vertexの子会社ViaCyte,Inc.との連携に由来し,我々の遺伝子編集技術をViaCyteの独自幹細胞能力に適用することで開発された.CTX 211は成人T 1 D患者におけるCTX 211の安全性、耐性および有効性を評価するための1/2期臨床試験を行っている。次に,我々の研究は,編集された幹細胞からの被覆されていないβ細胞からなる無装置β細胞代替方法に集中している。第三に、T 1 Dに対するVertexの低免疫細胞療法の開発を加速するために、いくつかのCRISPR/Cas 9知的財産権の非独占的許可をVertexに付与し、2023年に1.7億ドルの前払いとマイルストーン支払いを受け、追加の研究開発マイルストーンと未来の製品の印税を得る資格がある。
CRISPR-X
われわれの現在のプロジェクトの組み合わせは大きな進展を遂げているが,遺伝子編集のすべての力を放出し,より多くの患者に潜在的な変革療法をもたらすために革新を続ける必要があることを認識した。私たちはCRISPR-Xという専門的な早期研究チームを持っていて、次世代の編集モデルの革新に集中しています。CRISPR-Xは、同源配向修復またはDNAウイルス送達を必要とせずに全遺伝子補正および挿入を行うことができる技術、例えば、全RNA遺伝子補正、DNAの非ウイルス伝達、および新しい遺伝子挿入技術を開発している。
製造業
細胞や遺伝子療法の製造プロセスは複雑であり,プロジェクトや療法ごとにシステム,設備,施設,専門知識をカスタマイズする必要がある。高品質製造および生産タイミングと技術の制御が重要であるため,我々は内部製造能力を構築し,変革性の遺伝子薬による重篤な疾患を有する患者のための治療と治療方法を開発するための独自の細胞治療製造施設を構築している。私たちはマサチューセッツ州フレミンガムに約50,000平方フィートの製造工場を持っていて、私たちのいくつかの計画を満たすために、私たちの候補製品とそのいくつかのコンポーネントを臨床と商業生産するために使用されています。我々のこの工場での運営は現在の良好な製造規範(CGMP)に適合し、2023年にこの工場でCTX 112とCTX 131を生産し、これらの候補製品の臨床試験に用いられた。
我々の内部製造施設を利用するほか,米国と海外での契約製造組織関係による外部製造能力に依存し続ける予定である。私たちはすでに第三者サプライヤーといくつかの製造と供給手配を達成して、私たちの候補製品とその部品の生産を支持しています。著者らは引き続き合格した第三者組織に依存してバルク化合物、配合化合物、ウイルスベクター或いは工学細胞を生産或いは加工し、IND活動と早期臨床試験を支持する予定である。
仲間関係
CRISPR/CAS 9の多くの潜在的治療応用を考慮して,われわれが追求できる適応を拡大し,特定の技術や/あるいは疾患領域の専門知識を獲得することでプロジェクトの実施を加速する戦略的協力を行った。その中のいくつかのパートナーシップに関するより多くの情報は、“を参照してください”業務-戦略的パートナーシップと連携.”
頂点です著者らは2015年にVertexと初歩的な協力プロトコルを確立し、TDT、SCD、嚢胞性線維化と他の適応の選択に集中した。2017年12月、Vertexと共同開発·商業化協定を締結し、この合意に基づき、他の事項に加えて、TDTとSCDのCASGEVYを共同開発·共同商業化します。2021年4月、私たちはVertexと既存の共同開発と商業化協定を修正し、再確認しました
99
その他,Vertexと連携してTDTやSCDのためのCASGEVYを開発し,商業化していく予定である.2019年6月には、Duchenne筋ジストロフィー(DMD)と強直性筋ジストロフィー1型(DM 1)の製品の開発と商業化のためにVertexと戦略的協力·許可協定を締結しました。2023年3月には、Vertexと糖尿病に遺伝子編集技術を使用する非独占ライセンス契約を締結しました。
ViaCyteそれは.2018年9月、我々はViaCyteと研究と協力協定を締結し、糖尿病を治療するための遺伝子編集異遺伝子幹細胞療法の発見、開発、商業化を求めた。2021年7月、私たちはViaCyteやViaCyte JDCAと共同開発と商業化協定を締結した。ViaCyte JDCAへの加入については,我々はViaCyteの既存の研究連携プロトコルとその条項によって満了した.2022年第3四半期、VertexはViaCyteとViaCyte連携場の権利を買収したことを発表し、2023年3月にViaCyte JDCA修正案に署名し、修正案に基づいて、各方面のこの修正案の下でのいくつかの権利と義務を調整した。2023年12月、ViaCyteは我々との協力を脱退し、糖尿病治療のための遺伝子編集幹細胞療法を共同開発し、それを共同商業化した。脱退条項を選択することにより,脱退が完了すると,行われている連携資産は我々が完全に所有し,将来の欠ViaCyteの販売に印税を徴収する.選択脱退は2024年2月初めに施行される。ViaCyteの協力資産はCTX 211(以前のVCTX 211)を含み、これは患者内のデバイスに移植された同種異体、遺伝子編集、免疫力が低下した幹細胞由来製品であり、グルコース依存的な方法でインシュリンを産生することを目的としている。CTX 211によるT 1 D治療の一期臨床試験を継続している。
バイエルそれは.私たちは2019年第4四半期にバイエルとオプション合意に達し、この合意によると、バイエルは特定の期間内に当社が特定の自己免疫疾患、眼疾患または血友病Aを診断、治療または予防するために予め提供している2つの製品、または場合によってはそのようなオプションの製品を独自に開発し、共同商業化する権利がある。
他のパートナー関係それは.私たちは造血幹細胞免疫腫瘍学自己免疫を支援し補充するための追加的な協力と許可協定を締結しました体内にあるドナー由来の遺伝子編集されたCAR-NK細胞を利用した製品をNkarta,Inc.開発および商業化し、Capsida BioTreateutics,Inc.開発を含むT 1 D計画およびプラットフォーム体内にある工学AAVベクターによる遺伝子編集療法;ロスウェル公園総合癌センターが新しい標的に対して遺伝子編集を推進する自己CAR T計画;MaxCyte,Inc離体するヘモグロビン病と免疫腫瘍学プロジェクトにサービスを提供していますCureVac AGは特定の遺伝子構造と製造を最適化しています体内にあるKSQ Treateutics,Inc.とわれわれの同種異体免疫腫瘍学計画の知的財産権について協議した。
財務概要
2013年10月の設立以来、私たちはほとんどの資源を私たちの研究·開発に投入し、薬物発見と臨床前開発活動を担当し、私たちの知的財産権を確立し、保護し、内部製造能力を確立し、私たちの会社、業務計画、資金を組織し、調達し、これらの業務に一般的かつ行政的な支援を提供してきた。これまで、私たちは主に私たちの優先株の公募、普通株の発行、転換可能な融資、そして戦略パートナーとのいくつかの協力協定に関連した支払いによって、私たちの運営に資金を提供してきました。
Vertexとの提携による前金により,我々は数年前に純収益状況にあったが,損失を繰り返した歴史があり,予見可能な未来に損失を被ることが予想される。私たちの純損失は四半期ごとと毎年大きく変動するかもしれません。私たちは、現在の研究計画と開発活動を継続することに伴い、より多くの研究計画とより多くの候補製品を決定すること、臨床前研究を支持する初期薬物の応用を行い、私たちの候補製品のための臨床試験を開始すること、私たちが決定し、開発した任意の他の候補製品のために臨床前試験と臨床試験を開始すること、私たちの知的財産権を維持、保護、拡大すること、私たちの遺伝子編集プラットフォームをさらに開発すること、より多くの研究、臨床と科学者を採用すること、このような人員の増加に関連する施設コスト、内部製造能力とインフラの構築、および上場企業の運営に関連する追加コストが増加することを予想する。
収入確認
今まで、私たちは製品販売から何の収入も得ていません。次の年度まで 2023年12月31日,2022年12月31日,2021年12月31日に,それぞれ3.7億ドル,40万ドル,9.131億ドルの連携収入を確認したが,これは主にVertexとの連携合意に関連している。
2023年、2022年、2021年12月31日までの年間で、それぞれ120万ドル、80万ドル、190万ドルの贈与収入を創出し、これらの収入は非営利団体のいくつかの契約に関連している。
当社の収入確認ポリシーの詳細については、本年度報告書Form 10−Kに含まれる監査総合財務諸表付記2および付記8を参照されたい。
100
研究開発費
研究開発費は主に私たちの研究活動によって発生するコストを含み、私たちの製品発見努力と私たちの候補製品開発を含みます
私たちの外部研究開発費用は私たちの各種の臨床前と臨床計画を支持するため、私たちは外部研究開発費用をもっと細分化することはありません。我々の内部研究開発支出には,賃金や福祉支出,施設支出,全体の研究開発活動を支援するための他の間接研究開発支出が含まれているため,特定の開発段階や治療分野には割り当てられない。研究·開発コストは発生時に費用を計上する。将来的に受け取った研究開発商品やサービスの払い戻し不可能な前払いは延期され資本化されるだろう。資本化金額は関連貨物の納入またはサービス提供時に費用を計上する。現在、私たちは、私たちが決定し、開発する可能性のある任意の候補製品を完成させるために必要な努力の性質、時間、またはコストを合理的に推定または知ることができない。これは、このような候補製品の開発に関連する多くのリスクおよび不確実性に起因しており、以下のような不確実性を含む
任意の候補製品の開発またはその後、私たちが開発に成功する可能性がある任意の候補製品の商業化において、これらの変数のいずれかの結果の変化は、候補製品開発に関連するコスト、タイミング、および生存能力を著しく変化させる可能性がある。
研究開発活動は私たちのビジネスモデルの核心だ。予測可能な未来には,我々の現在の開発プロジェクトの進展,新しいプロジェクトの増加,および規制申告書類の準備を続けるにつれて,我々の研究開発コストが増加することを予想している.これらの増加には、臨床試験場所の実施と拡大に関連するコストと、現在と未来の臨床試験の関連患者登録、モニタリング、計画管理と製造費用が含まれる可能性がある。
一般と行政費用
一般と行政費用は主に従業員に関連する費用を含み、行政、財務、会計、業務発展と人力資源職能者の賃金、福祉、公平に基づく給与を含む。その他の重大なコストには、研究開発費に含まれていない施設コスト、特許や会社事務に関する法律費用、会計およびコンサルティングサービス費用が含まれています。
私たちは引き続き私たちの規模と発展段階の研究開発会社の一般と行政機能に一致した一般と行政費用が発生することを予想して、将来的に増加して、継続を支援する可能性があります
101
研究開発活動、そして私たちの候補製品の潜在的な商業化。また,我々のいくつかの許可内知的財産権に関する第三者特許関連費用の精算に関連する継続費用が予想される.
協力費用,純額
連携費用純額には,Vertexと連携したCASGEVY計画に関する運営費用が含まれている.改訂されたA&R Vertex JDCAによると,2022年,2023年,2024年12月31日までの年度中に,CASGEVY計画で1.103億ドルを超える指定コスト分を延期する権利がある。2023年の1.103億ドルは、Vertexと第三者との間のライセンスプロトコルから生成されるいくつかのコストから占めるべき金額を含まず、A&R Vertex JDCA修正案1に規定され、本年度報告に含まれる統合財務諸表付記8にさらに記載されたイベントが発生した場合に、Vertexにこれらの費用を支払うことに同意します。我々は我々の選択権を行使し,CASGEVY計画が2022年と2023年に発生する指定コストのうち上記の金額を超える部分を延期した.いずれの繰延金額もCASGEVY計画の将来の収益性の相殺としてVertexにしか支払いできず、支払すべき金額の上限は毎年指定された最高額である。
その他の収入(純額)
他の収入には主に投資から得られた利息収入が含まれる。
重要な会計政策と重大な判断と見積もり
私たちの財務状況と経営結果の討論と分析は私たちの財務諸表に基づいています。これらの報告書は私たちがアメリカ公認会計原則に従って作成したものです。私たちはいくつかの会計政策が私たちの歴史と未来の業績を知るために非常に重要だと思う。これらの特定の分野は、通常、推定を行う際に不確実な事項の判断および推定を要求するが、異なる推定を使用することができるはずであるが、これらの推定も合理的であるため、これらの政策をキーと呼ぶ。続いて、私たちは、以下でより詳細に説明するものを含む、私たちの推定と判断を評価する。吾らは過去の経験や当時の状況で合理的な他の特定市場や他の関連仮定に基づいて推定し、その結果が資産や負債の帳簿価値を判断する基礎となり、そのような資産や負債の帳簿価値は他の出所から容易に見えるわけではないと考えている。異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある。
我々の重要な会計政策は、本年度報告10-K表の他の場所の財務諸表付記により詳細に記載されていますが、以下の会計政策は、私たちの財務状況や運営結果を十分に理解し、評価するために最も重要であると考えられます。
収入.収入
会計基準符号化主題606、取引先と契約した収入またはASC 606は、顧客とのすべての契約に適用されるが、リースおよび協調スケジュールのような他の標準範囲内に属する契約を除外する。エンティティがASC 606の範囲内のスケジュールされた収入肯定応答を決定するために、エンティティは、以下の5つのステップを実行する
1)お客様との契約の決定
(I)譲渡すべき商品又はサービスに対する各当事者の権利を規定し、関連する支払条項を決定した顧客と強制的に実行可能な契約を締結した場合、(Ii)契約が商業的実質を有し、(Iii)顧客の意図及び支払い承諾の対価格の能力に基づいて、譲渡された商品及びサービスのほぼすべての対価格を徴収する可能性があると決定した場合、顧客との契約が存在する。
2)契約における履行義務の決定
契約において約束された履行義務は、顧客に譲渡される貨物およびサービスによって決定され、これらの貨物およびサービスは、いずれも異なることができ、顧客は、単独でまたは他の利用可能なリソースと共に貨物またはサービスから利益を得ることができ、契約文脈で異なるので、貨物またはサービスの譲渡は、契約内の他の約束とは別に識別することができる。1つの契約が複数の約束された貨物およびサービスを含む場合、私たちは、約束された貨物およびサービスが契約の文脈で区別できるかどうかを決定するために判断を使用しなければならない。これらの基準を満たしていなければ、約束された貨物とサービスは総合履行義務として入金されるだろう。
3)出来高決定
取引価格は、商品とサービスを顧客に移転するために、私たちが獲得する権利のある対価格によって決定されます。研究、開発、規制、ビジネスマイルストーンのような可変価格を含む取引価格の範囲内で、そのような金額を受け取ることができるかどうかを確認し、存在しないことを確認します
102
著しい収入が逆転する。このような金額を受け取る可能性があると結論できない場合には,関連変数の対価格を制限し,取引対価格から除外する.取引対価格に制限されている部分を決定する際には,関連研究,開発,規制,ビジネスマイルストーンが研究と臨床開発の性質および基本計画の段階を与えた場合に実現される可能性と不確実性を考慮した。この評価は各報告書期間に行われた。この評価を行う際には,業界出版物からの情報や他の関連要因を含む入手可能な内部および外部情報を考慮した.変動による価格制限の変化は当期に確認された収入額に実質的な影響を与える可能性がある。
4)取引対価格を契約に割り当てる履行義務
契約が単一履行義務を含む場合、取引対価格全体をその単一履行義務に割り当てる。複数の履行義務を含む契約要求は、相対的に独立した販売価格に基づいて取引対価格を各履行義務に割り当て、取引対価格が可変でない限り、契約義務または単一履行義務の一部を構成する異なるサービスに完全に割り当てられる基準に適合する。受信した対価格を相対的に独立した販売価格に応じて単独の履行義務の間に割り当てる.これらの推定された独立販売価格を決定する際には,ライセンスに対して,管理層が協調開発計画ごとに確率に重み付けしてキャッシュフローを割引するという仮定を含む多くの重要な判断を行う.推定された独立販売価格は,科学的に成功する確率,割引率,予測キャッシュフローの基礎を構成する何らかの仮説など,仮説の変化に敏感である.これらの仮定を作成する際には、管理層は、同一業界内の他の基準会社からの情報や他の関連要因を含む利用可能な内部および外部情報を考慮する。これらの仮定の変更は,取引が履行義務における価格の分配や収入を確認する金額や時間に大きな影響を与える可能性がある.
5)義務を果たした場合に収入を確認する
私たちは義務を履行する性質に基づいて、時間とともに、またはある時点で義務を履行する。顧客がエンティティ業績によって提供される利益を同時に受け取り、消費する場合、エンティティ業績が資産を作成または強化する際に顧客制御資産を作成または強化する場合、またはエンティティ業績が代替エンティティ用途に代替可能な資産を作成しておらず、エンティティがこれまでに完了した実績を強制的に支払う権利を有する場合、収入は時間の経過とともに確認される。エンティティが一定期間義務を履行していない場合、ある時点で、約束された貨物またはサービスの制御権を顧客に移すことによって、関連する履行義務を履行する。
協力手配
ASC 808によると、共同運営活動を代表する連携プロトコルの要素が記録されている協力手配またはASC 808。そのため,双方を代表する積極的な参加者の活動と,双方とも活動のビジネス成功に依存した重大なリスクとリターンに直面する協力合意の要素が,協力手配として記録されている.
我々は,協調プロトコルに関するビジネス活動の適切な提示およびΣtと損失分担を評価する.ASC 808は、協力手配の当事者間の支払いが他の権威ある会計文献の範囲内にない場合、損益表の分類は、その手配の性質、その業務運営の性質、およびその手配の契約条項に基づくべきであると規定している。これらの支払いが他の権威ある会計文書の範囲内にない場合、これらの支払いの損益表分類は、権威ある会計文書との類比に基づくべきであり、または適切な類比がない場合には、合理的、合理的、および一貫して適用される会計政策選択に基づくべきである。
研究と開発費用を計算すべきである
財務諸表を作成する過程の一部として、私たちは私たちの計算費用を見積もる必要があります。このプロセスは、未締結契約および調達注文を審査し、私たちの担当者とコミュニケーションして、私たちに代わって実行されるサービスを決定し、インボイスを受け取っていない場合、または他の方法で実際のコストを通知している場合に、実行されたサービスレベルおよびサービスによって生じる関連コストを推定することを含む。私たちのほとんどのサービスプロバイダは毎月私たちが提供してくれるサービスや契約マイルストーンに達した時に私たちに借金の領収書を発行してくれます。私たちは、当時私たちが知っている事実と状況に基づいて、財務諸表において、各貸借対照表の日付までの課税費用を推定します。計算すべき研究および開発費用の推定例には、以下の者に支払われる費用が含まれる
103
我々は,我々を代表して臨床研究を行って管理している複数のCROと締結した契約に基づいて,我々が受け取ったサービスとかかる努力を見積もり,臨床研究に関する費用を発生させた。これらの合意の財務条項は交渉が必要であり、契約によって異なり、支払いの不均衡を招く可能性がある。場合によっては、私たちのサプライヤーに支払われる費用は、提供されたサービスレベルを超え、それによって、臨床費用の前払いをもたらす可能性がある。その中のいくつかの契約によって支払われる費用は被験者の成功登録と臨床研究マイルストーンの完成などの要素に依存する。サービス料を計算する際には、サービスを提供する時間帯と各時間内の労働支出レベルを見積もり、それに応じて調整します。
株式ベースの報酬
私たちの株式ベースの報酬計画は、株式オプション、制限株式単位、および制限株式報酬を含む報酬を付与します。補助金は役員を含む従業員と非従業員に付与される。
私たちはASCテーマ718に基づいて株ベースの報酬報酬を計算した報酬--株式報酬またはASC 718。ASC 718は、従業員の株式オプションおよび制限株式単位の付与、および既存の株式オプションの修正を含む、従業員および非従業員取締役に支払われるすべての株式ベースの支払いを要求し、その公正価値に基づいて総合経営報告書および全面損失で確認しなければならない。私たちはブラック-スコアーズオプション価格モデルを使用して、付与されたオプションの公正価値を決定する。
私たちは没収が発生した時に計算して、贈与時に没収を推定し、その後の期間にこれらの推定を修正し、実際に没収することがその推定と異なるならば。財務諸表で確認された株式ベースの報酬支出は、業績やサービス条件を満たすことが期待される報酬に基づいている。
私たちの株式ベースの奨励はサービスまたは業績に基づく付与条件によって制限される。サービスを基礎とする帰属条件の従業員、取締役及び非従業員が獲得した奨励に関する補償支出は、付与日に応じて関連サービス期間(一般に帰属期限)の公正価値を直線基準で確認する。業績条件に達する可能性がある場合には、奨励業績帰属条件の従業員に関する報酬支出は、付与日が必要なサービス期間中の公正価値に基づいて確認され、加速帰属法が採用される。
私たちは奨励の公正価値に基づいて、奨励の関連サービス期間内に、直線を基礎として、従業員に制限的な株式単位の奨励を支出する。
我々はブラック·スコアーズオプション定価モデルを用いて、(I)期待株価変動、(Ii)期待奨励期間の計算、(Iii)無リスク金利、および(Iv)期待配当を含む主観的仮説の入力を要求する従業員、取締役、および非従業員に対するオプション報酬の公正価値を推定する。2023年には,変動率推定の計算を変更し,会社データおよび同業者会社データの混合を用いることから,上場株の履歴変動性を年内付与の奨励として用いることに変更した。従来の期間において、予想変動率は、会社が報告した変動率データと代表的な上場企業グループの履歴データ(取得可能履歴情報)との混合から算出されている。これらの分析について、当社は、企業価値、リスクプロファイル、業界における地位、および株による報酬の期待寿命を満たすのに十分な歴史的株価情報を含む、自身と類似した特徴を有する会社を選択した。当社は計算した株式奨励期待期間の等値期間の1日終値を用いて履歴変動率データを計算する。我々は、“簡略化”方法を用いて、従業員株式オプションの期待期間、すなわち、十分な履歴データが不足しているため、期待期間は、オプションの帰属期限および元の契約期間の算術平均値に等しいと推定した。オプション予想期間内の無リスク金利は、満期日に関連奨励の期待期限に見合った米国債をベースとしている。私たちは配当金を支払ったことがなく、予測可能な未来に配当金を支払うことを望んでいない。
最近の会計公告
最近の会計声明の検討については、本年度報告書に含まれる総合財務諸表付記2の表格10-Kを参照されたい。
経営成果
以下は運営結果の構成要素についての議論である。本節では,一般に2023年と2022年の項目および2023年と2022年の間の同比比較について議論する.2021年の検討および2022年と2021年の間の同比比較については、本10−K年報に含まれていなければ、2023年2月21日に米国証券取引委員会に提出された2022年12月31日現在の会計年度10−K年報の第2部、第7項で見つけることができる。
104
2023年12月31日までと2022年12月31日までの年次比較
次の表は、2023年12月31日現在と2022年12月31日現在の年度の業務結果と、これらの項目のドル変化をまとめています
|
|
十二月三十一日までの年度 |
|
|
期限が来る |
|
||||||
|
|
2023 |
|
|
2022 |
|
|
周期変化 |
|
|||
|
|
(単位:千) |
|
|||||||||
収入: |
|
|
|
|
|
|
|
|
|
|||
協力収入 |
|
$ |
370,000 |
|
|
$ |
436 |
|
|
$ |
369,564 |
|
奨学金収入 |
|
|
1,206 |
|
|
|
762 |
|
|
|
444 |
|
総収入 |
|
|
371,206 |
|
|
|
1,198 |
|
|
|
370,008 |
|
運営費用: |
|
|
|
|
|
|
|
|
|
|||
研究開発 |
|
|
387,332 |
|
|
|
461,645 |
|
|
|
(74,313 |
) |
一般と行政 |
|
|
76,162 |
|
|
|
102,464 |
|
|
|
(26,302 |
) |
協力費用,純額 |
|
|
130,250 |
|
|
|
110,250 |
|
|
|
20,000 |
|
総運営費 |
|
|
593,744 |
|
|
|
674,359 |
|
|
|
(80,615 |
) |
運営損失 |
|
|
(222,538 |
) |
|
|
(673,161 |
) |
|
|
450,623 |
|
その他の収入、純額 |
|
|
71,816 |
|
|
|
22,661 |
|
|
|
49,155 |
|
所得税前純損失 |
|
|
(150,722 |
) |
|
|
(650,500 |
) |
|
|
499,778 |
|
所得税の優遇 |
|
|
(2,888 |
) |
|
|
325 |
|
|
|
(3,213 |
) |
純損失 |
|
$ |
(153,610 |
) |
|
$ |
(650,175 |
) |
|
$ |
496,565 |
|
協力収入
協力収入 2023年12月31日までの会計年度は3.7億ドルだったが、2022年12月31日現在の年度は40万ドルだった。2023年12月31日までの年度の協力収入は、主にVertexが支払った3.7億ドルに関連している:(I)CASGEVYの承認は、2023年12月31日に添付された総合貸借対照表の売掛金と、(Ii)非ex許可協定とに含まれるVertexの2億ドルのマイルストーン支払い義務をトリガし、この合意に基づいて、私たちのいくつかの遺伝子編集知的財産権をVertexに許可し、1型糖尿病の診断、治療、または予防のためのいくつかの製品を開発することに同意する。世界各地の2型糖尿病またはインスリン依存型/糖尿病が必要であり、これは2023年に1.7億ドルの前払いとマイルストーン支払いをもたらす。2022年12月31日までの1年間では,連携収入は顕著ではなかった。Vertexに関する収入が確認された記述については、本年度報告に含まれる連結財務諸表付記8のForm 10−Kを参照されたい。
贈与収入
2023年12月31日と2022年12月31日までの年間の贈与収入はそれぞれ120万ドルと80万ドル。
研究と開発費
2023年12月31日までの1年間の研究開発費は3.873億ドルだったが、2022年12月31日までの1年間の研究開発費は4兆616億ドルだった。次の表は、2023年12月31日と2022年12月31日までの研究·開発費、およびこれらの項目の変化(ドル単位)をまとめたものである
|
|
十二月三十一日までの年度 |
|
|
1号1号 |
|
||||||
|
|
2023 |
|
|
2022 |
|
|
変わる |
|
|||
外部研究開発費 |
|
$ |
130,124 |
|
|
$ |
197,742 |
|
|
$ |
(67,618 |
) |
従業員関連費用 |
|
|
83,316 |
|
|
|
81,683 |
|
|
|
1,633 |
|
施設費 |
|
|
105,875 |
|
|
|
114,591 |
|
|
|
(8,716 |
) |
株に基づく報酬費用 |
|
|
46,356 |
|
|
|
53,956 |
|
|
|
(7,600 |
) |
その他の費用 |
|
|
2,703 |
|
|
|
2,864 |
|
|
|
(161 |
) |
再許可と許可料 |
|
|
18,958 |
|
|
|
10,809 |
|
|
|
8,149 |
|
中国は研究開発費総額を発表した |
|
$ |
387,332 |
|
|
$ |
461,645 |
|
|
$ |
(74,313 |
) |
約7430万ドル減少した主な理由は以下の通りです
105
一般と行政費用
2023年12月31日までの年間の一般·行政費は7620万ドルであるが、2022年12月31日までの年間は1.025億ドルである。2630万ドル削減の主な原因は、株式ベースの報酬減少、知的財産権コストを含む専門サービスの減少、上述したような施設コストの減少、および従業員に関する費用の減少である。
協力費用,純額
2023年12月31日までの会計年度の協力支出純額は1兆303億ドルであったが、2022年12月31日現在の事業年度は1.100億3千万ドルであった。2,000万ドルの増加は,Vertexと第三者との間のライセンスプロトコルによる何らかのコストを分担するためであり,A&R Vertex JDCA修正案1に規定されているイベント発生時にVertexに支払い,本年度報告Form 10-Kに含まれる総合財務諸表付記8にさらに記述することに同意する.
我々は我々の選択権を行使し,2022年と2023年にCASGEVY計画による指定コストのうちA&R Vertex JDCA改訂後の延期限度額を超える部分延期を行った.改正されたA&R Vertex JDCAによるコストの8090万ドルと3610万ドルをそれぞれ2023年と2022年に延期しました。Vertexがこのような繰延金額を回収し,合理的に金額を見積もることが可能な場合,吾らはその遅延コストを確認する.2023年12月31日現在、このような繰延金額は確認されていない。Vertexとのスケジューリングのさらなる検討については,アノテーション8を参照されたい.
その他の収入、純額
2023年12月31日までの1年間、その他の純収入は7180万ドルだったが、2022年12月31日までの年間は2270万ドルだった。他の収入の増加、純額は、金利上昇によるものだ。
流動性と資本資源
流動資金源
設立以来、私たちの運営は主に損失と累積キャッシュフローが発生した。2023年12月31日現在、私たちは16.957億ドルの現金、現金等価物、有価証券を持っており、そのうち約270万ドルが米国国外で保有されており、累計赤字は9億997億ドルだ。私たちは少なくとも今後数年以内に、私たちが引き続き損失を受けると予想している。我々は、研究開発コスト、一般および管理費用、および私たちの候補製品の潜在的な商業化に関する費用が引き続き発生することが予想され、これは、私たちの規模および発展段階の会社の研究開発関連コストと一致するため、私たちの運営に資金を提供するために追加の資本が必要となり、公開または私募株式または債務融資、戦略協力、または他のソースで資金を調達することができる。
市場の製品
2019年8月、公開市場販売契約を締結しましたSMJefferiesとの合意によると、私たちは時々Jefferiesを私たちの販売代理として、私たちの全権決定で私たちの普通株、1株当たり0.03スイスフラン、または2019年8月の販売協定を提供して販売することができる。改正された2019年8月の販売協定について、通常株を随時発売するために、米証券取引委員会にいくつかの目論見書補足文書を提出した。
2021年、私たちは1株168.23ドルの平均価格で140万株の普通株を発行·売却し、総収益は2.245億ドルで、株式発行コスト310万ドルを差し引いた。2021年、この金額に関連した追加印紙税は230万ドル支払われた。
2022年には、2019年の販売契約と現行の目論見書に基づいて普通株を追加売却する金額は大きくない。
2023年、私たちは1株72.32ドルの平均価格で50万株の普通株を発行·売却し、総収益は3270万ドルで、株式発行コスト40万ドルを差し引いた。2023年、この金額に関連した追加印紙税は30万ドル支払われた。
106
2023年12月31日まで、私たちの現在の目論見書補充資料には3.856億ドルがあり、私たちはすでに1株139.91ドルの平均価格で合計150万株の普通株を発行·売却し、総収益は2.115億ドルで、株式発行コスト290万ドルを差し引いた。
流動資金源
キャッシュフロー
2021年の検討および2022年と2021年の間の同比比較については、本10−K年報に含まれていなければ、2023年2月21日に米国証券取引委員会に提出された2022年12月31日現在の会計年度10−K年報の第2部、第7項で見つけることができる。
次の表は、以下の各時期のキャッシュフローに関する情報を提供する
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
|
|
(単位:千) |
|
|||||
経営活動のための現金純額 |
|
$ |
(260,375 |
) |
|
$ |
(495,741 |
) |
投資活動提供の現金純額 |
|
|
374,647 |
|
|
|
(258,655 |
) |
融資活動が提供する現金純額 |
|
|
62,664 |
|
|
|
38,592 |
|
為替レート変動が現金に与える影響 |
|
|
73 |
|
|
|
(80 |
) |
現金と制限現金を増やす(減らす) |
|
$ |
177,009 |
|
|
$ |
(715,884 |
) |
経営活動
2023年12月31日までの年度の経営活動用現金純額は2兆604億ドルであったが,2022年12月31日現在の年度の経営活動用現金純額は4.957億ドルであった。経営活動で使用される現金の減少は,主にVertex前金とマイルストーン支払い1.7億ドルと,上記のような研究と開発および一般と行政費用の減少によるものである。
投資活動
2023年12月31日までの1年間に、投資活動が提供する現金純額は3.746億ドルで、主に3.866億ドルの有価証券以外の有価証券の満期日の購入を含む。2022年12月31日までの年度の投資活動のための現金純額は2兆587億ドルで、主に2.215億ドルを超える有価証券の満期日の有価証券の購入と、3720万ドルの不動産、工場、設備の購入が含まれている。
融資活動
2023年12月31日までの1年間に、融資活動が提供する現金純額は6270万ドルで、普通株を発行する純収益3270万ドルと、株式オプション行使と従業員株式購入計画(ESPP)が貢献した2990万ドルの純収益を含む。融資活動が提供する現金純額は2022年12月31日までの1年間で3860万ドルで、主に株式オプションの行使とESPP献金の3760万ドルの純収益を含む。
資金需要
私たちの資本の主な用途は、研究開発活動、製造活動、報酬と関連費用、実験室と関連用品、法律およびその他の規制費用、特許訴訟申請、国防と知的財産権維持コスト、および上場企業の運営に関連するコストを含む一般管理コストに引き続き使用される見通しだ。私たちの規模と発展段階の会社では、運営費用は研究開発に関連するコストと一致し続け、将来的には、候補製品の持続的な研究開発活動や潜在的な商業化を支援するために増加する可能性があると予想される。
私たちとパートナーのVertexは2023年にいくつかの司法管轄区域でCASGEVYのマーケティング承認を得、2024年にその後の承認を得たが、私たちの計画の多くはまだ初期開発段階であり、これらの努力の結果はまだ確定していないが、現在または未来の候補製品の開発、製造、商業化に成功するために必要な実際の金額を推定することはできず、承認されたか、またはいつ利益を達成することが可能かどうか。私たちが相当な製品収入を生み出すことができる前に、もしあれば、私たちは株式融資、債務融資、そして私たちの協力合意に関連した支払いによって私たちの現金需要を満たす予定です。私たちは、市場条件が有利な場合には、株式や債務証券を売却することで追加資金を調達する機会を考えるつもりだ。しかし、私たちの普通株と他の生物製薬会社の取引価格は非常に不安定だった。したがって、私たちは私たちの普通株を売却することで資金を調達する困難に直面するかもしれないし、このような売却は不利な条項で行われるかもしれない。さらに、不況、不況、または他の持続的な不利な市場事件、コロナウイルスの持続的な伝播、あるいは最近の米国と世界のある銀行や金融機関の倒産は、私たちに与える可能性がある
107
業務と私たちの普通株の価値。もし私たちが将来株式や債務証券を売却することで追加資本を調達すれば、私たちの株主の所有権権益は希釈され、これらの証券の条項は清算または他の既存株主の権利に悪影響を及ぼす特典を含む可能性がある。もし私たちが未来に協力計画を通じてより多くの資金を調達すれば、私たちは私たちの技術、未来の収入流、または候補製品に対する貴重な権利を放棄しなければならないかもしれないし、私たちに不利になるかもしれない条項で許可証を授与しなければならないかもしれない。もし私たちが必要な時に株式や債務融資を通じてより多くの資金を調達できない場合、私たちは私たちの製品開発や将来の商業化努力を延期、制限、減少または終了することを要求されるかもしれません。あるいは私たちは自分で開発とマーケティングをより望んでいた候補製品の権利を与えます。
展望
私たちの研究開発計画とプロジェクトの進展に関連する時間予想によると、私たちの既存の現金、現金等価物、および有価証券は、Vertexと協力して得られる可能性のある追加的な収益、および私たちが達成可能な任意の他の融資取引に影響を与えることなく、少なくとも今後24ヶ月の運営費用および資本支出に資金を提供することができると予想される。私たちは間違っていることが証明される可能性があるという仮定に基づいてこの推定をして、私たちは予想よりも早く私たちの資本資源を使用することができる。私たちのプロジェクトの長期的な臨床発展を支援するために追加の資金が必要であることを考慮すると、市場条件が私たちに有利な時に追加の融資機会を考慮するつもりです。
私たちの収入と利益を達成する能力は、私たちの配信技術と私たちの遺伝子編集技術プラットフォームを開発すること、適切な候補製品を選択して開発すること、選択された候補製品の研究、臨床前と臨床開発を完成させること、臨床試験を完成させるための候補製品の規制許可とマーケティング許可を得ること、候補製品のための持続可能かつ拡張可能な製造プロセスを開発すること、私たちの規制承認およびマーケティング許可を得た候補製品を発売し、それを商業化すること、協力者または流通業者と直接協力すること、私たちの候補製品に対する市場の受け入れ(CASGEVYを含む)を獲得すること、相互競争する技術および市場開発問題を解決することを含む、私たちの収入と利益を達成する能力は、私たちの多くの分野での成功に大きく依存する。私たちが参加する可能性のある任意の協力、許可、または他の手配で有利な条項を交渉する;私たちの協力者およびライセンシーと良好な関係を維持し、保護し、保護し、特許、商業秘密および独自技術を含む私たちの知的財産権を維持、拡大し、そして合格者を誘致、採用、および保留する。
契約義務その他の義務
レンタルと分譲義務を経営する
私たちの運営リース義務は、主にマサチューセッツ州ボストンにあるオフィスと実験室施設のレンタル支払いと、マサチューセッツ州フレミンガムにあるバッテリ製造施設のレンタル支払いを含みます。これらの費用は、本年度報告Form 10-Kに含まれる総合財務諸表の付記7により詳細に記載されています。2023年12月31日から1年以内に満期となる経営リースと転貸義務の将来契約支払いは2,870万ドル,2023年12月31日から1年以上満期の経営リースと転貸義務の将来契約支払いは2.939億ドルである。
その他の義務
改訂されたA&R Vertex JDCAによると,CASGEVYプロジェクトへの支出が指定金額を超えていれば,スケジュールに応じてコストシェアの一部を遅らせることができる.いずれの繰延金額もCAGEVY計画の将来の収益性の相殺としてVertexにしか支払いできず、支払うべき金額の上限は毎年指定された最高額である。2023年12月31日現在、将来の収益性に応じて将来の支払いを合理的に見積もることができないため、CASGEVY計画に関する繰延コストは確認されていない。
正常業務過程において、著者らは臨床試験と臨床用品製造の契約研究機関及び臨床前研究とその他の運営目的サービスと製品のサプライヤーと協定を締結した。これらの契約は通常180日未満の事前書面通知なしでいつでもキャンセルできます。いくつかの合意は、本Form 10−K年次報告に含まれる総合財務諸表付記9にさらに記載されているいくつかの開発、規制、または商業マイルストーンを達成する際に、これらの第三者にマイルストーンを支払うことを要求する。マイルストーン支払いに関連する金額は、いくつかの開発、規制承認、商業マイルストーンの成功達成に依存するため、契約債務とはみなされない。これらの開発、規制承認、および商業マイルストーンは実現できない可能性がある。
私たちはまた、将来的に研究、開発、商業化協定を締結した第三者に支払うことを含む、いくつかのマイルストーンを実現した際に満期と対応する未来のお金を第三者に支払う義務があります。私たちはこのようなマイルストーンの達成と時間が固定的で確定的ではないので、このような約束を私たちの貸借対照表に含まなかった。
108
第七A項。数量化と高質市場リスクの開示について。
金利感度
私たちは金利の変化と関連した市場リスクに直面している。2023年12月31日現在、私たちは16.957億ドルの現金、現金等価物、有価証券を持ち、主に米国国債と政府機関証券、社債、商業手形、通貨市場口座に投資し、米国政府機関証券に投資している。これらのツールの保守的な性質のため、私たちは金利リスクに重大なリスクがあるとは思わない。金利が1%増加または減少すれば、私たちのポートフォリオの公正な価値は些細な額を増加または減少させるだろう。
外貨為替リスク
私たちの海外業務のため、私たちは外貨為替レート変動のリスクに直面しています。主にスイスフランとポンド対ドルの為替レートです。現在のリスクは主に現金、売掛金、および会社間の売掛金と支払金から来ている。為替レートの変化は私たちの総合経営報告書に影響を与え、異なる時期間の比較を歪める。これまで、外貨取引損益は私たちの財務諸表に大きな影響を与えておらず、私たちも何の外貨リッジ取引も行っていません。
インフレ率
インフレは一般的に労働コスト、臨床試験コスト、製造コストを増加させることで私たちに影響を及ぼす。2023年,2022年,2021年12月31日までの年間では,インフレは我々の業務,財務状況や運営結果に実質的な影響を与えないと考えられる。
プロジェクト8.財務諸表Sと補足データ。
本項目8の規定に基づいて提出すべき連結財務諸表は、本報告の後に添付される。これらの財務諸表のインデックスは項目15を参照されたい。
項目9.Accouとの変更と分岐会計と財務情報開示の専門。
ない。
第9条。制御するプログラムがあります
情報開示制御とプログラムの評価
我々のCEOおよび最高財務官は、本Form 10-K年次報告がカバーする期間終了までの間の開示制御およびプログラム(1934年の証券取引法改正ルール13 a-15(E)およびルール15 d-15(E)の定義参照)の有効性を評価した後、このような評価に基づいて、我々の開示制御およびプログラムが有効であると結論した。開示制御やプログラムを設計·評価する際には、任意の制御およびプログラムは、設計および動作がどんなに良好であっても、予想される制御目標を達成するために合理的な保証を提供することしかできないことを認識しており、我々の管理層は、可能な制御とプログラムの費用対効果関係を評価する際にその判断を適用しなければならない。
経営陣財務報告内部統制年次報告書
経営陣は財務報告書の十分な内部統制の確立と維持に責任がある。財務報告の内部統制は規則13 a-15(F)と規則15 d-15(F)で定義され、規則13 a-15(F)と規則15 d-15(F)は1934年の証券取引法(改正)に基づいて公布され、我々の主要幹部と主要財務官によって設計または監督され、公認された会計原則に基づいて財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供する。私たちの財務報告書に対する内部統制は以下の政策と手続きを含む
109
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
我々の経営陣は、2023年12月31日までの社内財務報告の内部統制の有効性を評価した。この評価には、テレデビル委員会後援組織委員会が発表した“内部統制--総合枠組み”(2013年枠組み)(COSO)に規定されている基準を用いた。その評価によると、我々の経営陣は、2023年12月31日現在、財務報告に対する社内統制がこれらの基準に基づいて有効であると結論している。
私たちの独立公認会計士事務所安永会計士事務所は財務報告書の内部統制に関する認証報告書を発表しました。以下を参照されたい。
財務報告の内部統制の変化
1934年に発行された証券取引法第13 a-15(F)および15(D)-15(F)条規則によると、私たちは財務報告の内部統制が2023年第4四半期に大きな影響を与えなかったか、または合理的に私たちの財務報告の内部統制に大きな影響を与える可能性がある。
110
独立公認会計士事務所報告
CRISPR治療株式会社の株主と取締役会へ
財務報告の内部統制については
我々は,トレデビル協賛組織委員会が発表した内部統制-総合枠組み(2013年枠組み)(COSO基準)で確立された基準に基づき,CRISPR治療株式会社の2023年12月31日までの財務報告内部統制を監査した。COSO基準によると,CRISPR Treateutics AG(当社)は2023年12月31日現在,すべての重要な面で財務報告を効率的に内部統制していると考えられる。
また、米国上場企業会計監督委員会(PCAOB)の基準に従って、当社の2023年12月31日、2023年12月31日、2022年12月31日までの総合貸借対照表、2023年12月31日までの3年度の関連総合経営報告書と総合(損失)収益、株主権益とキャッシュフロー、および関連付記と2024年2月21日に発表した報告書を監査し、これについて保留意見を発表した。
意見の基礎
当社経営陣は、効果的な財務報告内部統制を維持し、添付されている“経営陣財務報告内部統制年次報告”における財務報告内部統制の有効性を評価する責任がある。私たちの責任は私たちの監査に基づいて、会社の財務報告書の内部統制に意見を述べることです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務報告の有効な内部統制がすべての重要な面で維持されているかどうかを決定するために、合理的な保証を得るために監査を計画し、実行することを要求する。
我々の監査には,財務報告の内部統制を理解すること,重大な弱点があるリスクを評価すること,評価されたリスクテストに基づいて内部統制の設計·運用有効性を評価すること,および状況下で必要と考えられる他のプロセスを実行することが含まれる。私たちは私たちの監査が私たちの意見に合理的な基礎を提供すると信じている
財務報告の内部統制の定義と限界
会社の財務報告に対する内部統制は、公認された会計原則に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的としたプログラムである。会社の財務報告に対する内部統制には、(1)合理的で詳細かつ正確かつ公平に会社の資産を反映した取引および処分に関する記録の保存、(2)公認された会計原則に従って財務諸表を作成するために必要な取引が記録されている合理的な保証を提供し、会社の収入および支出は会社の経営陣と取締役の許可のみに基づいて行われる。(三)財務諸表に重大な影響を及ぼす可能性のある不正買収、使用、または処分会社の資産を防止またはタイムリーに発見する合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
/S/安永法律事務所
ボストン、マサチューセッツ州
2024年2月21日
111
プロジェクト9 B。他にも情報です。
開ける
プロジェクト9 Cです。開示面検査が禁止されている外国司法管轄区域。
適用されません。
112
部分(三)
プロジェクト10.役員·役員職ICERSと会社管理。
本プロジェクトに必要な情報は,2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出された2024年年度株主総会依頼書を参考にした。
プロジェクト11.行政官イー補償します。
本プロジェクトに必要な情報は,2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出された2024年年度株主総会依頼書を参考にした。
プロジェクト12.特定の受益者の保証所有権従業員と経営陣と関連した株主問題。
本プロジェクトに要求される情報は,我々の依頼書を参考にすることで組み込まれており,我々の2024年株主総会は,2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出される。
本プロジェクトに必要な情報は,2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出された2024年年度株主総会依頼書を参考にした。
第14項.元金口座弁護士代とサービス料です。
本プロジェクトに必要な情報は,2023年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出された2024年年度株主総会依頼書を参考にした。
113
部分IV.IV
プロジェクト15.展示品と融資請求書の明細書です。
(A)(1)財務諸表。
参照してください“連結財務諸表索引“下記F-1ページを参照して、本報告書の一部として提出された財務諸表リストを参照してください。
(A)(2)要求された条件を備えていないため、財務諸表や付記に必要な資料が含まれているため、上記付表以外の他の付表は省略されている。
(A)(3)展示品。
S-K条例第601項及び本年度報告第15(B)項に要求される展示品は、次の展示品索引に記載されている。以下の展示品索引に記載されている展示品は,本10-K表年次報告の一部としてアーカイブまたは統合を行い,参考とする.
(B)展示品インデックス.
展示品 番号をつける |
|
説明する |
|
|
|
3.1 |
|
改訂·再改訂されたCRISPR治療株式会社の定款は、期日は2023年6月8日である(引用会社が2023年6月9日に提出した現在の8-K表報告書の添付ファイル3.1を本明細書に組み込む)。 |
|
|
|
4.1* |
|
資本株の説明。 |
|
|
|
10.1 |
|
CRISPR Treateutics AGとEmmanuelle Marie Charpentierとの間で2014年4月15日に署名された許可協定(本明細書は、会社が2016年10月7日に提出したS−1表登録声明の添付ファイル10.5を参照して組み込まれる)。 |
|
|
|
10.2 |
|
天合血液学有限公司とEmmanuelle Marie Charpentierとの間で2014年4月15日に締結された許可協定(本明細書は、会社が2016年10月7日に提出したS-1表登録声明の添付ファイル10.6を参照して本明細書に組み込まれる)。 |
|
|
|
10.3 |
|
特許譲渡協定は、2014年11月7日に、CRISPR治療株式会社、Emmanuelle Marie Charpentier、ウィーン大学、およびInes Fonfaraによって署名または締結された(会社が2016年10月7日に提出したS-1表登録声明の添付ファイル10.7を参照して本明細書に組み込まれる)。 |
|
|
|
10.4 |
|
賠償協議表(2016年10月7日に提出された会社登録説明書S−1表の添付ファイル10.8を参照して編入)。 |
|
|
|
10.5# |
|
CRISPR治療株式会社とロジャー·ノバクとの間で2017年12月1日に署名された雇用協定(同社が2017年12月21日に提出した現在の8−K表の添付ファイル10.2を引用した)。 |
|
|
|
10.6# |
|
CRISPR治療株式会社とOriolus Consulting LLCの間で2019年12月27日に署名されたライセンス契約(2019年12月27日に会社が提出した現在の8-Kフォームの添付ファイル10.1を参照)。 |
|
|
|
10.7# |
|
CRISPR Treateutics AGとRodger Novakとの間で2019年12月27日に署名された終了合意(本明細書では、2019年12月27日に会社が提出した現在の8-Kフォームの添付ファイル10.2を参照)。 |
|
|
|
10.8# |
|
CRISPR Treateutics,Inc.とSamarth Kulkarniの間で2017年10月2日に署名された2回目の改訂および再署名された雇用協定(本明細書では、会社が2017年10月2日に提出した現在の8-K表報告書の添付ファイル10.1を参照することによって組み込まれる)。 |
|
|
|
10.9# |
|
CRISPR Treateutics,Inc.とJames R.Kasingerの間で2017年5月31日に署名された雇用協定(本明細書では、会社が2018年3月8日に提出したForm 10−K年次報告書の添付ファイル10.16を参照して組み込まれる)。 |
|
|
|
114
10.10# |
|
CRISPR Treateutics,Inc.とBrendan Smithとの間の雇用協定は、2021年10月14日である(本明細書では、会社が2021年10月14日に提出した現在の8−Kフォームの添付ファイル10.1を参照)。 |
|
|
|
10.11# |
|
CRISPR Treateutics,Inc.とPhuong Khanh Morrowの間で2022年5月23日に署名された雇用協定(2022年8月8日に会社が提出したForm 10-Q四半期報告書の添付ファイル10.1を参照することによって本明細書に組み込まれる)。 |
|
|
|
10.12# |
|
CRISPR Treateutics,Inc.とRaju Prasad,Ph.D.が2023年3月14日に締結した雇用協定(本稿では,同社が2023年3月14日に提出した現在の8−Kレポートの添付ファイル10.1を引用する)。 |
|
|
|
10.13# |
|
上級管理職現金奨励ボーナス計画(本明細書では、会社が2018年3月8日に提出したForm 10-K年報添付ファイル10.26を参照して組み込む)。 |
|
|
|
10.14# |
|
CRISPR治療株式会社2015年株式オプション及び付与計画(会社が2016年9月9日に提出したS-1表登録声明の添付ファイル10.14を参照して本明細書に組み込む)。 |
|
|
|
10.15# |
|
CRISPR Treateutics AGは、2016年の株式オプションおよびインセンティブ計画を修正および再起動した(本明細書は、会社が2017年6月2日に提出した現在の8−Kフォーム報告書の添付ファイル10.1を参照して組み込まれる)。 |
|
|
|
10.15.1# |
|
CRISPR治療株式会社が改正および再改訂した2016年株式オプションおよびインセンティブ計画下のインセンティブ株式オプションプロトコル表(本明細書では、会社が2017年11月8日に提出した現在の報告書10-Q表の添付ファイル10.2を参照して組み込まれる)。 |
|
|
|
10.15.2# |
|
CRISPR Treeutics AGによって改訂および再作成された2016年株式オプションおよびインセンティブ計画(2017年11月8日に会社が提出した現在の報告書10-Q表の添付ファイル10.3を参照して編入することにより)、会社員は株式オプション協定の表を保持していない。 |
|
|
|
10.15.3# |
|
CRISPR Treeutics AGに従って改訂および再作成された2016年株式オプションおよびインセンティブ計画(本明細書では、会社が2017年11月8日に提出した現在の報告書10-Q表の添付ファイル10.4を参照して組み込まれる)下の非従業員取締役非限定株式オプション協定の表。 |
|
|
|
10.15.4# |
|
CRISPR治療株式会社が改訂および再作成した2016年株式オプションおよびインセンティブ計画下の制限株式奨励プロトコル表(本明細書では、会社が2017年11月8日に提出した現在の報告書10-Q表の添付ファイル10.5を参照して組み込まれる)。 |
|
|
|
10.15.5# |
|
CRISPR治療株式会社が改訂および改訂した2016年株式オプションおよびインセンティブ計画(会社が2017年11月8日に提出した現在の報告書10-Q表の添付ファイル10.6を参照して編入することにより)下の会社従業員制限株式報酬プロトコル表。 |
|
|
|
10.15.6# |
|
CRISPR治療株式会社が改訂および改訂した2016年株式オプションおよびインセンティブ計画(会社が2017年11月8日に提出した現在の報告書10-Q表の添付ファイル10.7を参照して編入することにより)下の非従業員取締役制限株式奨励協定の表。 |
|
|
|
10.16# |
|
CRISPR治療株式会社の2018年株式オプション及びインセンティブ計画及びその下のプロトコルフォーマット(本明細書では、会社が2018年6月1日に提出したS-8表登録説明書添付ファイル99.1を参照して組み込む)。 |
|
|
|
10.16.1# |
|
CRISPR治療株式会社2018年株式オプション及びインセンティブ計画下のインセンティブ株式オプションプロトコル表(本稿では、会社が2018年6月1日に提出したS-8表登録説明書99.2号添付ファイルを参照して組み込む)。 |
|
|
|
10.16.2# |
|
CRISPR治療株式会社2018年株式オプションおよびインセンティブ計画下の会社員無保留株式オプションプロトコル表(本稿では、2018年6月1日に提出された会社登録説明書S-8表の99.3号添付ファイルを参照して組み込まれます)。 |
|
|
|
10.16.3# |
|
CRISPR治療株式会社2018年株式オプション及びインセンティブ計画下の非従業員取締役非制限株式オプションプロトコル表(本稿は、会社が2018年6月1日に提出したS-8表登録説明書第99.4号添付ファイルを参照)。 |
|
|
|
10.16.4# |
|
CRISPR治療株式会社2018年株式オプション及びインセンティブ計画下の制限株式奨励表(本明細書では、会社が2018年6月1日に提出したS-8表登録説明書第99.5号添付ファイルを参照して組み込む)。 |
|
|
|
115
10.16.5# |
|
CRISPR治療株式会社2018年株式オプションおよびインセンティブ計画の下で、会社従業員制限株式奨励プロトコル表を参照します(本明細書は、会社が2018年6月1日に提出したS-8表登録説明書添付ファイル99.6を参照して組み込まれます)。 |
|
|
|
10.16.6# |
|
CRISPR治療株式会社2018年株式オプション及びインセンティブ計画下の非従業員取締役制限株奨励表(本文は、会社が2018年6月1日に提出したS-8表登録説明書第99.7号添付ファイルを参照)。 |
|
|
|
10.17# |
|
2018年株式オプション及びインセンティブ計画の第1号改正案(当社が2019年4月30日に提出した付表14 A最終依頼書の付録Aを参照して本明細書に組み込む)。 |
|
|
|
10.18# |
|
2018年株式オプション·インセンティブ計画第2号修正案(ここでは、当社が2020年4月24日に提出した付表14 A最終依頼書の付録Aを引用)。 |
|
|
|
10.19# |
|
2018年株式オプション及びインセンティブ計画の第3号改正案(当社が2022年4月25日に提出した付表14 Aに関する最終依頼書の付録Aを参照して本明細書に組み込む)。 |
|
|
|
10.20# |
|
2018年株式オプション及びインセンティブ計画第4号修正案(ここでは、当社が2023年4月26日に提出した付表14 Aに関する最終依頼書の付録Bを参照)。 |
|
|
|
10.21# |
|
CRISPR治療株式会社2016年従業員株購入計画(会社が2016年9月9日に提出したS-1表登録声明の添付ファイル10.16を参照して本明細書に組み込む)。 |
|
|
|
10.22 |
|
CRISPR治療株式会社、カリフォルニア大学ウィーン校、Intellia治療会社、Cariou生物科学会社、ERSゲノム有限会社とTRACR血液学有限会社の間で締結されたゲノム編集のためのプログラム可能なDNA制限酵素の譲渡、許可および共同所有権および発明管理協定に同意し、日付は2016年12月15日(これに合併し、会社が2016年12月16日に提出した現在のForm 8-K表の添付ファイル10.1参照)。 |
|
|
|
10.23 |
|
戦略協力、オプション、許可協定は、2015年10月26日、CRISPR Treeutics AG、CRISPR Treateutics Limited、CRISPR Treateutics,Inc.,TRACR Hematology Limited,Vertex PharmPharmticals,Inc.とVertex PharmPharmticals(Europe)Limitedによって締結され、日付は2015年10月26日である(当社が2016年10月7日に提出したS-1表登録説明書の添付ファイル10.4を参照して組み込まれる)。 |
|
|
|
10.24 |
|
Vertex PharmPharmticals Inc.とVertex PharmPharmticals(Europe)Limited間およびVertex PharmPharmticals Inc.とCRISPR Treateutics AG,CRISPR Treateutics,Inc.,CRISPR Treateutics LimitedとTRACR Hematology Ltd.の間の戦略協力、オプション、ライセンスプロトコル修正案1は、2017年12月12日(合併時参考会社が2017年12月18日に提出した現在の8-K表の添付ファイル10.2)である。 |
|
|
|
10.25 |
|
Vertex PharmPharmticals Inc.とVertex PharmPharmticals(Europe)Limited間およびVertex PharmPharmticals Inc.およびCRISPR Treateutics AG、CRISPR Treateutics Inc.,CRISPR Treateutics LimitedおよびTRACR Hematology Ltd.の間の戦略的協力、オプションおよびライセンスプロトコル修正案2は、2019年6月6日である(本明細書では、会社が2019年7月29日に提出したForm 10-Q四半期報告添付ファイル10.1を参照して組み込む)。 |
|
|
|
10.26 |
|
CRISPR Treateutics AGおよびVertex PharmPharmticals Inc.が2019年6月6日に署名した戦略的協力および許可協定(会社が2019年7月29日に提出したForm 10-Q四半期報告書の添付ファイル10.2を参照して本明細書に組み込まれる)。 |
|
|
|
10.27 |
|
CRISPR Treateutics AGおよびVertex PharmPharmticals Inc.が2021年3月17日に署名した戦略的協力および許可協定の第1の修正案(2021年4月27日に会社が提出したForm 10-Q四半期報告書の添付ファイル10.3を参照して本明細書に組み込まれる)。 |
|
|
|
10.28^ |
|
Vertex PharmPharmticals Inc.とVertex PharmPharmticals(Europe)Limited間の共同開発および商業化協定が改訂および再署名され、2021年4月16日のCRISPR Treeutics AG、CRISPR Treateutics Limited、CRISPR Treateutics,Inc.およびTRACR Hematology Ltd.である(本明細書は、参考会社が2021年4月27日に提出したForm 10-Q四半期報告の添付ファイル10.4を組み込む)。 |
|
|
|
10.29^ |
|
改正·再署名された共同開発·商業化協定の第1号改正案は、2023年12月12日、Vertex PharmPharmticals Inc.とVertex PharmPharmticals(Europe)Limitedおよび一方CRISPR Treeutics AG,CRISPR Treeutics Limitedにより、 |
116
|
|
CRISPR Treateutics,Inc.およびTRACR Hematology Ltd.(社が2023年12月13日に提出した現在の8−Kレポートの添付ファイル10.1を参照することによって本明細書に組み込まれる)。 |
|
|
|
10.30^ |
|
Vertex製薬会社とCRISPR治療会社との間の非独占的ライセンス契約は、2023年3月23日である(本稿では、同社が2023年3月27日に提出した現在の8−Kレポートの添付ファイル10.1を引用する)。 |
|
|
|
10.31 |
|
CRISPR Treateutics AGとBayer Healthcare LLCが2019年12月13日に署名したオプション協定(当社が2020年2月12日に提出したForm 10-K年報添付ファイル10.31を参照)。 |
|
|
|
10.32^ |
|
レンタル日は2020年5月5日であり,CRISPR Treateutics,Inc.とCRP/Kingニューヨーク通り33号で借りられている。Owner,L.L.C.(ここでは,当社が2021年4月27日に提出したForm 10-Q四半期報告の添付ファイル10.1を参照)。 |
|
|
|
10.33^ |
|
2020年12月2日の第1改正案は、CRISPR治療会社とCRP/Kingニューヨーク通り33号の間でレンタルされている。Owner,L.L.C.(ここでは,当社が2021年4月27日に提出したForm 10-Q四半期報告の添付ファイル10.2を引用する). |
|
|
|
10.34^ |
|
CRISPR Treateutics,Inc.と33 NYA Owner(DE)LLCの間で2021年4月_に締結されたリース第2改正案は,CRP/King 33 NY Aveの権益相続人とする。Owner,L.L.C.(ここでは,当社が2021年7月29日に提出したForm 10-Q四半期報告の添付ファイル10.1を参照)。 |
|
|
|
10.35 |
|
CRISPR Treateutics,Inc.と105 W First Street Owner,L.L.C.の間の借約は,2020年7月24日(ここで合併し,会社が2020年7月27日に提出したForm 10−Q四半期報告の添付ファイル10.1参照)である。 |
|
|
|
10.36 |
|
CRISPR Treateutics,Inc.と105 W First Street Owner,L.L.C.が2022年1月6日に締結した書簡協定(社が2022年2月15日に提出したForm 10−K年度報告の添付ファイル10.37を参考に合併した)。 |
|
|
|
10.37 |
|
CRISPR Treateutics AGと105 W First Street Owner L.L.C.の間で締結されたリース開始日契約は,2022年5月1日である(社が2022年8月8日に提出したForm 10−Q四半期報告の添付ファイル10.2を引用した)。 |
|
|
|
21.1* |
|
登録者の子会社 |
|
|
|
23.1* |
|
安永法律事務所が同意した |
|
|
|
31.1* |
|
2002年のサバンズ·オキシリー法第302節で可決された1934年の証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて発行された首席執行幹事証明書。 |
|
|
|
31.2* |
|
2002年サバンズ−オキシリー法第302節で可決された1934年証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて首席財務幹事が認証された。 |
|
|
|
32.1+ |
|
2002年の“サバンズ-オックススリー法案”906節で採択された“米国法典”第18編1350条による最高経営責任者と最高財務官の認証。 |
|
|
|
97.1* |
|
CRISPR Treateutics AGエラー判定の賠償に関する政策 |
|
|
|
101.INS |
|
連結されたXBRLインスタンス文書−インスタンス文書は、そのXBRLタグがイントラネットXBRL文書に埋め込まれているので、相互作用データファイルには表示されない。 |
|
|
|
101.書院 |
|
Linkbase文書を組み込んだインラインXBRL分類拡張アーキテクチャ |
|
|
|
104 |
|
表紙インタラクションデータファイル(イントラネットXBRL文書に埋め込む) |
*アーカイブをお送りします。
+メールで提供されます。
本展示品のいくつかの部分は漏れています。それらは実質的ではないので、登録者は通常、その情報を個人または機密と見なしています。
#表格10-K第15(A)(3)項の要件に従って、証拠として提出された管理契約または補償計画またはスケジュール。
S-K法規601項によれば、これらのプロトコルのいくつかの証拠品および添付表は省略されている。登録者は証券取引委員会に任意の展示品とスケジュールのコピーを提供することを要求しなければならない。
117
項目16.表10-Kの概要
ない。
118
サイン
1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、正式に許可された次の署名者が代表して本報告書に署名することを正式に手配した.
|
|
CRISPR治療会社 |
||
|
|
|
|
|
日付:2024年2月21日 |
|
差出人: |
|
/S/サマース·クルカルニ |
|
|
|
|
サマーズ·クルカルニ |
|
|
|
|
最高経営責任者 |
署名と授権書
我々は,以下に署名したCRISPR治療株式会社(“当社”)の役員と上級管理者をそれぞれ構成し,Samarth Kulkarni,Raju Prasad,James R.Kasinger,および彼らのそれぞれの真の合法的なエージェントを構成し,彼らに対して全面的な権力を持ち,我々の名義で本Form 10-K年次報告の任意およびすべての改訂に署名し,米国証券取引委員会に年次報告書を提出または提出すること,およびそれに関連するすべての証拠品およびその他の文書を,上記の代理人と彼ら一人に付与し,本授権書に関連するすべての必要および行わなければならないことを行う権利が完全にあり、完全に、私たち一人一人が可能であるか、または自ら行うことができるすべての意図および目的に基づいて行われ、ここで、上述したすべての受権者およびそのすべてのまたはそれらの代替者が、この授権書によって行われた、またはそれに至るすべてのことを許可および確認する権利がある。
本報告書は、改正された1934年の証券取引法の要求に基づき、以下の登録者によって登録者として指定日に署名された。
名前.名前 |
|
タイトル |
|
日取り |
|
|
|
|
|
/S/サマース·クルカルニ |
|
最高経営責任者·会長兼取締役 |
|
2024年2月21日 |
サマーズ·クルカルニ |
|
(首席行政主任) |
|
|
|
|
|
|
|
/S/ラジュー·プラサド |
|
首席財務官 |
|
2024年2月21日 |
ラジュー·プラサド |
|
(首席財務会計官) |
|
|
|
|
|
|
|
/S/アリ·ベヘバハニ |
|
役員.取締役 |
|
2024年2月21日 |
Ali·ベヘバハニ |
|
|
|
|
|
|
|
|
|
/S/マリア·ファディス |
|
役員.取締役 |
|
2024年2月21日 |
マリア·ファディス |
|
|
|
|
|
|
|
|
|
エドワード·フレミング/S/H |
|
役員.取締役 |
|
2024年2月21日 |
H.Edward Fleming,Jr |
|
|
|
|
|
|
|
|
|
/S/サイモン·J·ジョージ |
|
役員.取締役 |
|
2024年2月21日 |
サイモン·J·ジョージ |
|
|
|
|
|
|
|
|
|
/投稿S/ジョン·グリーン |
|
役員.取締役 |
|
2024年2月21日 |
ジョン·グリーン |
|
|
|
|
|
|
|
|
|
/S/キャサリン高校 |
|
役員.取締役 |
|
2024年2月21日 |
キャサリン·A·ハイ |
|
|
|
|
|
|
|
|
|
/S/ダグラス·トレコ |
|
役員.取締役 |
|
2024年2月21日 |
ダグラス·A·トレコ |
|
|
|
|
|
|
|
|
|
/S/ラジュー·プラサド |
|
アメリカでの許可代表は |
|
2024年2月21日 |
ラジュー·プラサド |
|
|
|
|
119
CRISPR治療会社
連結財務諸表索引 |
|
ページのページ |
独立公認会計士事務所レポート(PCAOB ID番号) |
|
F-1 |
合併貸借対照表 |
|
F-3 |
連結経営報告書と総合報告書(赤字)個人収入 |
|
F-4 |
合併権益表 |
|
F-5 |
統合現金フロー表 |
|
F-6 |
連結財務諸表付記 |
|
F-7 |
独立公認会計士事務所報告
CRISPR治療株式会社の株主と取締役会へ
財務諸表のいくつかの見方
CRISPR治療株式会社(当社)の2023年12月31日現在と2022年12月31日までの連結貸借対照表、2023年12月31日までの3年度の関連総合経営報告書と包括(赤字)収益、株主権益と現金流量および関連付記(総称して“総合財務諸表”と呼ぶ)を監査しました。総合財務諸表は、すべての重要な点で、2023年12月31日、2023年12月31日、2022年12月31日までの会社の財務状況、および2023年12月31日までの3年度の経営結果とキャッシュフローを公平に反映しており、米国公認会計原則に適合していると考えられる。
また、米国上場企業会計監督委員会(PCAOB)の基準に基づき、テレデビル委員会協賛組織委員会が発表した“内部統制-総合枠組み(2013枠組み)”で確立された基準に基づいて、2023年12月31日までの財務報告内部統制を監査し、2024年2月21日に発表した報告書について保留意見を発表した。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項とは、監査委員会に伝達または要求が監査委員会に伝達された当期財務諸表監査によって生じる事項である:(1)財務諸表に対して重大な意義を有する勘定または開示に関するものであり、(2)特に挑戦的で主観的または複雑な判断に関するものである。重要監査事項の伝達は、総合財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、以下の重要な監査事項を伝達することによって、重要な監査事項またはそれに関連する勘定または開示について個別の意見を提供することはない。
F-1
|
|
進行中の協調プロトコルの可変対価格の見積り |
関係事項の記述 |
|
統合財務諸表付記8に記載されているように、同社は、2023年12月31日までの合計約23億ドルの将来支払い権利を含む複数の協力協定を有しており、これらのお金は、いくつかの開発中のプロジェクトに関連する様々な開発、規制、およびビジネスマイルストーンが実現したときに支払われる。これらの将来支払いは,これらの提携プロトコルの取引価格に含まれる可変対価格であり,契約によって確認された累積収入が大きな収入逆転を生じない可能性が高いことを会社が確定していることを前提としている.当社が契約項での累積収入が重大な収入逆転を生じない可能性が高いと結論できない場合、当社は関連する可変対価格を制限し、取引価格から除外します。制限された可変対価格に対する会社の推定は、連結財務諸表に報告された収入と繰延収入に影響を及ぼす。
制限する取引価格部分を決定する際に,経営陣は,臨床開発の性質や基本計画の段階に鑑み,関連する開発,管理,ビジネスマイルストーンの可能性と不確実性を実現するかどうかを考慮している。この評価は各報告書期間に行われた。この評価を行う際には,管理層は,業界出版物からの情報,基礎計画の開発段階,その他の関連要因を含む入手可能な内部および外部情報を考慮している.変動対価格制限の変更は財務報告期間内に確認された収入額に実質的な影響を与える。そのため、制約を可変考慮に適用した会計を監査するには複雑な監査師の判断が必要である。
|
私たちが監査でどのようにこの問題を解決したのか |
|
我々は理解を得て,設計を評価し,会社収入確認過程の制御の操作有効性をテストした.例えば、将来の開発、法規、ビジネスマイルストーンに関連する可変対価格適用制約の制御を含む、管理層の協力プロトコルの総取引価格推定の制御をテストした。
可変価格適用制約に対する会社の判断を審査するために、会社が関連する将来の開発、規制、ビジネスマイルストーンを実現する可能性に関する判断を含む監査プログラムを実行した。同社が開発,規制,ビジネスマイルストーンを実現する推定確率を評価するために,臨床開発の性質と関連する外部データに関する基礎計画の開発段階を考慮し,観察可能な第三者情報を検査することでマイルストーンを実現する可能性の合理性を評価した。また,監督会社の協力に参加する者と,個々の計画の開発段階に関するマイルストーンを実現する可能性を検討した。
|
/s/
2015年以来、当社の監査役を務めてきました。
2024年2月21日
F-2
CRISPR治療会社
合併B割当書
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
|
|
十二月三十一日 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金と現金等価物 |
|
$ |
|
|
$ |
|
||
有価証券 |
|
|
|
|
|
|
||
売掛金 |
|
|
|
|
|
|
||
前払い費用と他の流動資産 |
|
|
|
|
|
|
||
流動資産総額 |
|
|
|
|
|
|
||
財産と設備、純額 |
|
|
|
|
|
|
||
非流通有価証券 |
|
|
|
|
|
|
||
無形資産、純額 |
|
|
|
|
|
|
||
制限現金 |
|
|
|
|
|
|
||
経営的リース資産 |
|
|
|
|
|
|
||
他の非流動資産 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
負債と株主権益 |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
売掛金 |
|
$ |
|
|
$ |
|
||
費用を計算する |
|
|
|
|
|
|
||
収入を繰延し,当期 |
|
|
|
|
|
|
||
課税負債 |
|
|
|
|
|
|
||
リース負債を経営する |
|
|
|
|
|
|
||
その他流動負債 |
|
|
|
|
|
|
||
流動負債総額 |
|
|
|
|
|
|
||
収入を繰延し、流動ではない |
|
|
|
|
|
|
||
賃貸負債を経営し,当期分を差し引く |
|
|
|
|
|
|
||
他の非流動負債 |
|
|
|
|
|
|
||
総負債 |
|
|
|
|
|
|
||
*(注9) |
|
|
|
|
|
|
||
株主権益: |
|
|
|
|
|
|
||
普通株、スイスフラン |
|
|
|
|
|
|
||
国庫株は、原価で計算する |
|
|
( |
) |
|
|
( |
) |
追加実収資本 |
|
|
|
|
|
|
||
赤字を累計する |
|
|
( |
) |
|
|
( |
) |
その他の総合収益を累計する |
|
|
|
|
|
( |
) |
|
株主権益総額 |
|
|
|
|
|
|
||
総負債と株主権益 |
|
$ |
|
|
$ |
|
||
これらの連結財務諸表の付記を参照してください。
F-3
CRISPR治療会社
連結業務報告書純額と総合収益
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
収入: |
|
|
|
|
|
|
|
|
|
|||
協力収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
奨学金収入 |
|
|
|
|
|
|
|
|
|
|||
総収入 |
|
|
|
|
|
|
|
|
|
|||
運営費用: |
|
|
|
|
|
|
|
|
|
|||
研究開発 |
|
|
|
|
|
|
|
|
|
|||
一般と行政 |
|
|
|
|
|
|
|
|
|
|||
協力費用,純額 |
|
|
|
|
|
|
|
|
|
|||
総運営費 |
|
|
|
|
|
|
|
|
|
|||
営業収入(赤字) |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
その他の収入: |
|
|
|
|
|
|
|
|
|
|||
その他の収入、純額 |
|
|
|
|
|
|
|
|
|
|||
その他の収入合計,純額 |
|
|
|
|
|
|
|
|
|
|||
所得税前純収益 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
所得税の優遇 |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
純収益 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
外貨換算調整 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
有価証券の未実現収益 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
総合収益 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|
|
|
|
|
|
|
|
|
|
|
|||
普通株1株当たりの純収益--基本 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|
基本加重平均普通株式発行済み |
|
|
|
|
|
|
|
|
|
|||
普通株1株当たりの純収益--減額 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|
希釈加重平均普通株式発行 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
これらの連結財務諸表の付記を参照してください。
F-4
CRISPR治療会社
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
|
普通株 |
|
国庫株 |
|
その他の内容 |
|
|
|
|
|
|
|
||||||||||||
|
株 |
|
0.03スイスフラン |
|
株 |
|
金額は、 |
|
支払い済み |
|
積算 |
|
積算 |
|
株主権益総額 |
|
||||||||
2020年12月31日までの残高 |
|
|
$ |
|
|
|
$ |
( |
) |
$ |
|
$ |
( |
) |
$ |
( |
) |
$ |
|
|||||
普通株を発行し、発行コストを差し引いて#ドルです |
|
|
|
|
|
— |
|
|
— |
|
|
|
|
— |
|
|
— |
|
|
|
||||
株式の帰属を制限する |
|
|
|
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
|
|||
既得オプションを行使し,発行コストを差し引いて#ドル |
|
|
|
|
|
( |
) |
|
— |
|
|
|
|
— |
|
|
— |
|
|
|
||||
ESPPにより普通株を購入する |
|
|
|
— |
|
|
— |
|
|
— |
|
|
|
|
— |
|
|
— |
|
|
|
|||
株に基づく報酬費用 |
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
|
|
— |
|
|
— |
|
|
|
||
その他総合損失 |
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
( |
) |
|
( |
) |
純収入 |
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
|
|
— |
|
|
|
||
2021年12月31日の残高 |
|
|
$ |
|
|
|
$ |
( |
) |
$ |
|
$ |
( |
) |
$ |
( |
) |
$ |
|
|||||
普通株を発行する |
|
|
|
— |
|
|
— |
|
|
— |
|
|
|
|
— |
|
|
— |
|
|
|
|||
株式の帰属を制限する |
|
|
|
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
|
|||
既得オプションを行使し,発行コストを差し引いて#ドル |
|
|
|
|
|
— |
|
|
— |
|
|
|
|
— |
|
|
— |
|
|
|
||||
ESPPにより普通株を購入する |
|
|
|
— |
|
|
— |
|
|
— |
|
|
|
|
— |
|
|
— |
|
|
|
|||
株に基づく報酬費用 |
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
|
|
— |
|
|
— |
|
|
|
||
その他総合損失 |
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
( |
) |
|
( |
) |
純損失 |
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
( |
) |
|
— |
|
|
( |
) |
2022年12月31日の残高 |
|
|
$ |
|
|
|
$ |
( |
) |
$ |
|
$ |
( |
) |
$ |
( |
) |
$ |
|
|||||
普通株を発行し、発行コストを差し引いて#ドルです |
|
|
|
|
|
— |
|
|
— |
|
|
|
|
— |
|
|
— |
|
|
|
||||
株式の帰属を制限する |
|
|
|
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
|
|||
既得オプションを行使し,発行コストを差し引いて#ドル |
|
|
|
|
|
( |
) |
|
|
|
|
|
— |
|
|
— |
|
|
|
|||||
ESPPにより普通株を購入する |
|
|
|
— |
|
|
— |
|
|
— |
|
|
|
|
— |
|
|
— |
|
|
|
|||
株に基づく報酬費用 |
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
|
|
— |
|
|
— |
|
|
|
||
その他総合収益 |
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
|
|
|
||
純損失 |
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
— |
|
|
( |
) |
|
— |
|
|
( |
) |
2023年12月31日の残高 |
|
|
|
|
|
|
|
( |
) |
|
|
|
( |
) |
|
|
|
|
||||||
これらの連結財務諸表の付記を参照してください。
F-5
CRISPR治療会社
合併状態現金流動額
(単位:千)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
経営活動 |
|
|
|
|
|
|
|
|
|
|||
純収益 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|
純(損失)収入と経営活動で使用されている現金純額を照合する |
|
|
|
|
|
|
|
|
|
|||
減価償却および償却 |
|
|
|
|
|
|
|
|
|
|||
株式ベースの報酬 |
|
|
|
|
|
|
|
|
|
|||
他の非現金プロジェクト、純額 |
|
|
( |
) |
|
|
|
|
|
|
||
現在行われている研究と開発を買収する |
|
|
|
|
|
|
|
|
|
|||
以下の変更: |
|
|
|
|
|
|
|
|
|
|||
売掛金 |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
前払い費用と他の資産 |
|
|
|
|
|
|
|
|
( |
) |
||
売掛金と売掛金 |
|
|
( |
) |
|
|
|
|
|
|
||
収入を繰り越す |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
リース資産と負債を経営する |
|
|
( |
) |
|
|
|
|
|
|
||
その他の負債、純額 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
経営活動が提供する現金純額 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
投資活動 |
|
|
|
|
|
|
|
|
|
|||
家屋·工場·設備を購入する |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
現在進行中の研究と開発を購入する |
|
|
( |
) |
|
|
|
|
|
|
||
有価証券を購入する |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
有価証券の満期日 |
|
|
|
|
|
|
|
|
|
|||
投資活動提供の現金純額 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
融資活動 |
|
|
|
|
|
|
|
|
|
|||
普通株を発行して得られる収益は,発行コストを差し引く |
|
|
|
|
|
|
|
|
|
|||
オプション行使とESPP払込の収益は,発行コストを差し引く |
|
|
|
|
|
|
|
|
|
|||
融資活動が提供する現金純額 |
|
|
|
|
|
|
|
|
|
|||
為替レート変動が現金に与える影響 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
現金を増やす(減らす) |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
期初現金、現金等価物、および限定現金 |
|
|
|
|
|
|
|
|
|
|||
現金、現金等価物、制限された現金、期末 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
非現金投資·融資活動の追加開示 |
|
|
|
|
|
|
|
|
|
|||
売掛金と売掛金のうち財産·設備購入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
売掛金と売掛金における持分発行コスト |
|
$ |
|
|
$ |
|
|
$ |
|
|||
連結貸借対照表内の金額を照合する |
|
12月31日まで |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
現金と現金等価物 |
|
|
|
|
|
|
|
|
|
|||
前払い費用と他の流動資産 |
|
|
|
|
|
|
|
|
|
|||
制限現金 |
|
|
|
|
|
|
|
|
|
|||
合計する |
|
$ |
|
|
$ |
|
|
$ |
|
|||
これらの連結財務諸表の付記を参照してください。
F-6
CRISPR治療会社
総合備考財務諸表
1.組織と運営
CRISPR Treateutics AG(“CRISPR”または“会社”)は
同社は生物技術業界会社によく見られるリスクに直面しており、臨床前研究と臨床試験失敗のリスクに限定されないが、それが確定と開発可能な任意の候補薬物は市場承認を得る必要があり、その候補製品の商業化に成功し、市場の認可を得る必要があり、第三者協力、キーパーソンへの依存、ノウハウの保護、政府法規の遵守、競争相手の技術革新の開発及び試験生産から大規模生産への移行能力を含む。
同社の累積赤字は#ドルだ
2023年12月31日現在、会社は現金、現金等価物、有価証券を持っている
2.主要会計政策の概要と列報根拠
予算の列報と使用根拠
添付されている総合財務諸表は、米国公認の会計原則またはGAAPに従って作成され、その中には、当社及びその完全子会社が2023年12月31日までの勘定を含む。すべての会社間口座と取引はキャンセルされた。これらの説明における適用指導への任意の言及は、財務会計基準委員会の会計基準編纂(ASC)および会計基準更新(ASU)において発見された権威ある米国公認会計原則を意味する。
2022年から、頂点プロトコル(付記8で定義されるように)での連携費用は、ASC 808項の費用を占める協力協定またはASC 808は、連結経営報告書および総合(損失)収益表における“連携費用、純額”に記載されている。そこで,2021年12月31日までの年度では,ASC 808により計算されたVertexプロトコルでの連携コストが再分類され,現在の列報方式に適合している.前期連結財務諸表の小計は影響を受けなかった。Vertexプロトコルのさらなる検討については、これらの連結財務諸表の付記8を参照されたい。
公認会計基準に従って財務諸表を作成することは、財務諸表と付記中の報告の額に影響を与えるために、管理層に推定と仮定を要求する。継続的な基礎の上で、会社経営陣は、収入確認、株式ベースの報酬支出、および報告書の研究·開発支出額を含むが、これらに限定されない推定値を評価する。これらの連結財務諸表では、収入確認と権益に基づく報酬支出が大きく推定されている。当社は過去の経験とその時点で部下が合理的と考えている他の特定の市場またはその他の関連仮定に基づいて推定しています。実際の結果は,これらの推定や仮定とは異なる可能性がある.
市場情報を細分化する
当社と当社の経営意思決定者、すなわちCEOは、当社の運営と業務管理を
F-7
外貨換算と取引
同社の業務の大部分はドルをその機能通貨とする実体で発生している。非ドル建て機能通貨子会社の資産と負債は年末時の有効為替レートでドルに換算される。収入と支出額はその期間の平均為替レートを用いて換算する。外貨換算による未実現純損益は“累計その他総合(赤字)収入”に計上されている。外国為替取引純損益は、会社の総合経営報告書の“その他の収入·純額”に計上され、影響は大きくない。
現金と現金等価物
当社は購入日から三ヶ月以下のすべての高流動性投資を現金等価物と見なしています。2023年12月31日と2022年12月31日まで、会社は
制限現金
2023年12月31日と2022年12月31日まで、会社は
有価証券
2023年12月31日と2022年12月31日まで、会社は
評価レベルで第2レベルに分類される有価証券には、通常、米国債や政府機関証券、社債、商業手形が含まれる。債務証券は公正価値に従って帳簿を作成し、損益を他の総合(損失)収入に計上することを実現せず、株主権益の構成部分として、実現までとしている。購入時に発生した任意の割増は、最も早い償還日の間の利息支出に償却され、購入時に発生した任意の割引は、手形の有効期限内の利息収入に計上される。債務証券の実現済み収益と損失は特定の確認方法を用いて決定し、他の収入、純額に計上する。
当社は、ASU 2016−13年度に売却可能な債務証券減価モデルに基づいて、債務証券の売却可能性を評価した金融商品·信用損失(特集326):財務諸表信用損失の測定またはASC 326は、債務証券の売却確認のために使用可能な公正価値が帳簿価値よりも低い任意の低下がクレジット損失の結果であるかどうかを決定するために使用される。当社は合併経営報告書において信用損失と全面損失を他の費用純額内の信用損失費用に計上しており、純額は証券の公正価値と償却コストとの差額に限られている。現在まで、同社は売却可能な債務証券にいかなる信用損失も記録していない。
信用リスクと表外リスクの集中度
会社を集中的な信用リスクに直面させる可能性のある金融商品は主に現金、現金等価物、有価証券である。同社の現金は、経営陣が信用が良いと考えている金融機関の口座に保管されている。当社は当該等の口座にいかなる信用損失も発生しておらず、当該等の資金に重大な信用リスクがあるとも考えていない。当社には表外損失リスクの金融商品はありません。
金融商品の公正価値
当社の公正価値記録に従ったいくつかの金融資産および負債は、公正価値計量会計基準に記載されている公正価値レベルにおいて、1、2または3レベルに分類される
第1レベル-アクティブな市場においてオファーされ、市場日に同じ制限されない資産または負債を得ることができる。
F-8
第2レベル-第1レベル以外の直接的または間接的に観察可能な投入、例えば、同様の資産または負債のオファー、非アクティブ市場のオファー、またはすべての重大な投入が、資産または負債の全期間にわたって観察可能な市場データによって確認され得る他の投入を観察することができる。
第三レベル-市場活動が少ないか、または市場活動支援の観察できない投入がなく、資産または負債の公正な価値に大きな意義を持っている。
ある程度、推定値は市場で観察または観察できないモデルや投入に基づいており、公正価値の決定にはより多くの判断が必要である。そのため、当社が価値を公平に判断する際に下した判断は、第3級に分類されたツールに対する判断度が最も高く、公正価値レベル内の金融商品レベルは、公正価値計量に大きな意味を持つ任意の投入の中で最低レベルに基づいている。
公正な価値に応じて恒常的に計量される項目には、有価証券がある(付記3参照有価証券注4と、公正価値計量). 2023年12月31日と2022年12月31日までに連結貸借対照表に報告された売掛金、その他の売掛金、売掛金及び売掛金の帳簿金額これらのツールの短期的な存続期間のため、約公正な価値がある。
財産と設備
財産と設備はコストから減価償却累計を引いて入金されます。対応する資産寿命を改善または延長することができないメンテナンスやメンテナンスは、発生時に運営費用を計上することができる。売却時には、関連コストや減価償却が勘定から差し引かれ、それによって生じる収益や損失はいずれも経営結果に計上される
資産 |
|
使用寿命を見込む |
コンピュータ装置 |
|
|
家具、固定装置、その他 |
|
|
実験室装置 |
|
|
賃借権改善 |
|
長期資産減価準備
事件や環境変化により資産の帳簿価値が回収できない可能性がある場合、当社は長期資産を審査します。回収能力は,資産の帳簿価値と資産予想による将来の未割引キャッシュフローを比較することで測定した。このような資産は減値とみなされ、確認すべき減値は資産の帳簿価値がその公正価値を超えた金額で計量され、公正価値は資産による予想割引に基づいて将来の純現金流量によって計測される。
収入確認
会社はアメリカ会計基準第606条に従って収入を記録した顧客との契約収入からまたはASC 606。ASC 606は、顧客と締結されたすべての契約に適用されるが、レンタルおよび協調スケジュールのような他の標準範囲内の契約は除外される。エンティティがASC 606の範囲内のスケジュールされた収入肯定応答を決定するために、エンティティは、以下の5つのステップを実行する
1)お客様との契約の決定
(I)会社が顧客と強制的に実行可能な契約を締結した場合、当該契約は、譲渡する商品またはサービスに対する各当事者の権利を規定し、関連する支払い条項を決定し、(Ii)契約が商業的実質を有し、(Iii)会社が顧客の意図および支払い承諾の対価能力に基づいて、譲渡された商品およびサービスのほぼすべての対価格を徴収する可能性があると決定した場合、顧客との契約が存在する。
2)契約における履行義務の決定
契約において約束された履行義務は、顧客に譲渡される貨物およびサービスによって決定され、これらの貨物およびサービスは、いずれも異なることができ、顧客は、単独でまたは他の利用可能なリソースと共に貨物またはサービスから利益を得ることができ、契約文脈で異なるので、貨物またはサービスの譲渡は、契約内の他の約束とは別に識別することができる。1つの契約に複数の承諾された商品及びサービスが含まれている場合、会社は、約束された商品及びサービスが契約の背景で区別できるか否かを決定するために判断を適用しなければならない。これらの基準を満たしていなければ、約束された貨物とサービスは総合履行義務として入金されるだろう。
F-9
3)出来高決定
取引価格は、商品やサービスを顧客に移転することと引き換えに、会社が獲得する権利のある対価格によって決定される。取引価格に研究、開発、規制、ビジネスマイルストーンなどの可変対価格を含む範囲で、当社はこのような金額を受け取る可能性があるかどうかを判断し、重大な収入逆転のリスクはありません。当社が当該等の金額を受け取る可能性があると判断できない場合は、当社は関連可変対価格を制限し、取引対価から除外します。取引対価格に制限されている部分を決定する際には,同社は関連研究,開発,規制,ビジネスマイルストーンの実現の可能性と不確実性を考慮し,研究と臨床開発の性質および基本計画の段階を考慮している。この評価は各報告書期間に行われた。この評価を行う際には、会社は、業界出版物や他の関連要因からの情報を含む入手可能な内部および外部情報を考慮している。変動による価格制限の変化は当期に確認された収入額に実質的な影響を与える可能性がある。
4)取引対価格を契約に割り当てる履行義務
契約が単一履行義務を含む場合、取引対価格全体をその単一履行義務に割り当てる。複数の履行義務を含む契約要求は、相対的に独立した販売価格に基づいて取引対価格を各履行義務に割り当て、取引対価格が可変でない限り、契約義務または単一履行義務の一部を構成する異なるサービスに完全に割り当てられる基準に適合する。受信した対価格を相対的に独立した販売価格に応じて単独の履行義務の間に割り当てる.これらの推定された独立販売価格を決定する際には,ライセンスに対して,管理層が連携開発計画ごとに確率に重み付けしてキャッシュフローを割引するという仮定を含む多くの重要な判断を行う.推定された独立販売価格は,科学的に成功する確率,割引率,予測キャッシュフローの基礎を構成する何らかの仮説など,仮説の変化に敏感である.これらの仮定を作成する際には、管理層は、同一業界内の他の基準会社からの情報や他の関連要因を含む利用可能な内部および外部情報を考慮する。これらの仮定の変更は,取引が履行義務における価格の分配や収入を確認する金額や時間に大きな影響を与える可能性がある.
5)会社が契約履行義務を履行した場合または義務履行時に収入を確認する
売掛金
同社の売掛金には、主にASC 606に従って入金されたライセンス契約が満期になるマイルストーンが含まれている。売掛金には#ドルが含まれている
契約残高
会社が顧客が対価または支払いを支払う前に貨物またはサービスを顧客に譲渡する場合、会社は契約資産を確認するが、売掛金としての金額は含まれていない。契約資産は、実体が顧客に譲渡する商品又はサービスの対価格権利である。契約負債または繰延収入は、主に私たちが支払いを受けたが、関連する履行義務を履行していない契約に関するものだ。2023年12月31日と2022年12月31日まで、契約資産規模は大きくない。2023年12月31日現在繰延収入として記録されている契約負債はい$です
協力手配
同社はASC 808に基づいて共同経営活動を代表する連携協定の要素を記録している。そのため,双方を代表する積極的な参加者の活動と,双方とも活動のビジネス成功に依存した重大なリスクとリターンに直面する協力合意の要素が,協力手配として記録されている.
F-10
同社は、協力協定に関連するビジネス活動の正確な陳述およびtと損失分担を評価している。ASC 808は、協力手配の当事者間の支払いが他の権威ある会計文献の範囲内にない場合、損益表の分類は、その手配の性質、その業務運営の性質、およびその手配の契約条項に基づくべきであると規定している。これらの支払いが他の権威ある会計文献の範囲内でない場合、これらの支払いの損益表分類は、権威ある会計文書との類比に基づくべきであり、適切な類比がない場合は、合理的、合理的、かつ一貫して適用される会計政策選択に基づくべきである。
VertexプロトコルによりASC 808項に入金された連携コストは,総合業務報告書と総合(損失)収入のうち“連携費用純額”にランクインしている。Vertexプロトコルのさらなる検討については、これらの連結財務諸表の付記8を参照されたい。
その他売掛金
ASC 808の下で課金されたパートナーの支払は、他の入金とみなされ、総合貸借対照表内の前払い資産および他の流動資産に含まれる。その他の入金には#ドルが含まれています
Vertexは信用の良い実体であり,当社と持続的な関係を維持しているため,当社は当該などの他の売掛金に関する推定信用損失計を計上していない。
研究と開発費
研究及び発展活動を行うために発生したコストは、賃金及び福祉、施設コスト、間接費用、臨床研究及び関連臨床製造コスト、免許及びマイルストーン費用、契約サービス及びその他の関連コストを含み、研究及び発展コストは支出に計上される。研究·開発コストは,協力者への前払い費用やマイルストーンを含め,発生時にも費用を計上する。支払われた金額が発生したコストを超えた場合には、会社は前払い費用を記録する。当社は契約研究機関、臨床研究場所、実験室、コンサルタント或いは臨床試験活動を展開する他の臨床試験サプライヤーがまだ領収書を発行していないサービスと発生に関する費用の見積もりに基づいて、臨床試験活動のコストを計算しなければならない。同社は,パートナーの連携活動に関する精算を確認し,ASC 808により入金されたVertexプロトコルでの連携コストは含まれておらず,サービス提供期間中の研究や開発費用の削減としている。2023年12月31日,2022年,2021年12月31日までの年度において,パートナーの連携活動に関するコストはASC 808項目で比を占め,研究開発費に含まれることは顕著ではない.
賃貸借証書
当社はASC 842に基づいてそのリース契約を会計処理し、賃貸借証書またはASC 842。手配開始時に、当社は手配に存在する独特の事実と状況に基づいて、その手配が賃貸契約であるかどうかを決定する。レンタル期間が1年を超えるリースは、貸借対照表で使用権資産および短期·長期賃貸負債であることが確認されている(場合によっては)。当社には重大な融資リースはありません。
経営リース負債及びそれに応じた使用権資産は、当初、予想される余剰賃貸期間のリース支払い現在値に基づいて入金される。受け取った報酬などの項目については、使用権資産を何らかの調整する必要がある可能性がある。レンタル契約に隠されている金利は一般的に確定しにくい。したがって、当社はその逓増借款金利を利用して賃貸支払いを割引しており、このことは、類似経済環境下で、当社が担保に基づいて同じ通貨、類似期限で賃貸支払いの固定金利を借り入れていることを反映している。当社は、直線賃貸料支出または受信した任意の奨励について使用権資産を調整し、レンタル開始または移行日に有効な同じ増量借款金利を使用して純現在値で賃貸負債を再計量することが予想される。
当社は貸借対照表でオリジナル期限が1年以下であることを確認しない賃貸を選択しました。同社はレンタルスケジュールを評価する際には通常初期レンタル期間のみを含む。合理的な継続確実性がない限り、契約更新の選択は当社の評価に含まれません。
当社が発効日に作成した仮定は、何らかの事件(改訂賃貸借契約を含む)が発生した後に再評価されます。レンタル変更がテナントにオリジナルリースに含まれない追加使用権を付与し、レンタル支払いが追加使用権の独立価格に適合する場合、レンタル修正は別個の契約を生成する。1つのリース変更が別個の契約を生成した場合、その会計処理方式は新規契約と同じである。
F-11
権益に基づく報酬費用
同社の株式ベース報酬計画は、株式オプション、制限株式単位、制限株式報酬を含む報酬を付与する。補助金は役員を含む従業員と非従業員に付与される。
当社はASCテーマ718に基づいて株式に基づく報酬報酬を計算している報酬--株式報酬またはASC 718。ASC 718は、従業員株式オプションおよび制限株式単位の付与、および既存の株式オプションの修正を含む、従業員および非従業員取締役に支払われるすべての株式ベースの支払いを要求し、その公正価値に基づいて総合経営報告書および包括的(損失)収入で確認しなければならない。同社はブラック·スコアーズオプション定価モデルを使用して、付与されたオプションの公正価値を決定した。
当社は没収発生時に会計処理を行い、付与時に没収を推定するのではなく、実際の没収がその推定と異なる場合は、その後の期間にその推定を改訂する。財務諸表で確認された株式ベースの報酬支出は、業績やサービス条件を満たすことが期待される報酬に基づいている。
同社の株式奨励はサービスまたは業績に基づく付与条件によって制限される。サービスを基礎とする帰属条件の従業員、取締役及び非従業員が獲得した奨励に関する補償支出は、付与日に応じて関連サービス期間(一般に帰属期限)の公正価値を直線基準で確認する。業績条件に達する可能性がある場合には、奨励業績帰属条件の従業員に関する報酬支出は、付与日が必要なサービス期間中の公正価値に基づいて確認され、加速帰属法が採用される。
会社の支出は株式単位の奨励を従業員に制限し、奨励の公正価値は奨励の関連サービス期間内の直線に基づいている。
会社は、(I)期待株価変動、(Ii)期待奨励期間の計算、(Iii)無リスク金利、および(Iv)期待配当を含む主観的仮定の入力を要求する従業員、取締役、および非従業員に付与されたオプションの公正価値を推定するために、ブラック-スコアーズオプション定価モデルを使用する。2023年には,変動率推定の計算を変更し,会社データおよび同業者会社データの混合を用いることから,上場株の履歴変動性を年内付与の奨励として用いることに変更した。従来の期間において、予想変動率は、会社が報告した変動率データと代表的な上場企業グループの履歴データ(取得可能履歴情報)との混合から算出されている。これらの分析について、当社は、企業価値、リスクプロファイル、業界における地位、および株による報酬の期待寿命を満たすのに十分な歴史的株価情報を含む、自身と類似した特徴を有する会社を選択した。当社は計算した株式奨励期待期間の等値期間の1日終値を用いて履歴変動率データを計算するそれは.十分な履歴データが不足しているため、当社は、“簡略化”方法を使用して、その従業員株式オプションの期待期間、すなわち、期待期間がオプションの帰属期限および元の契約期間の算術平均値に等しいと推定する。オプション予想期間内の無リスク金利は、満期日に関連奨励の期待期限に見合った米国債をベースとしている。同社は配当金を支払ったこともなく、予見可能な未来に配当金を支払うことも望んでいない。
特許費用
特許出願を取得·起訴するコストおよび当社の知的財産権の保護に関する他の法的コストは、発生時に費用を計上し、当社の総合経営報告書では一般と行政費用に分類される。
所得税
所得税はASC主題740に基づいて記録されている所得税またはASC 740は、貸借対照法を使用して繰延税金を規定する。この方法によれば、繰延税金資産と負債は、資産と負債の財務報告と税務報告基準との差に基づいて決定され、制定された税率および法律を用いて計量され、これらの税率および法律は、差が逆転したときに発効することが予想される。既存の証拠の量に基づいて、繰延税金資産の一部または全部が現金化できない可能性が高い場合、推定値減値準備が提供される。当社は既存の証拠を評価し、当社は繰延税金資産の全利益を実現できない可能性があると結論したため、当社が実現不可能と考えている繰延税金資産金額については、推定値準備を設けている。
ASC 740の規定によると、当社は不確定な税務頭寸を会計処理する。不確定な税収頭寸が存在する場合、当社は税収頭寸の税収割引を確認し、より実現可能にする。税収優遇がより実現可能かどうかの決定は,税収状況に基づく技術的利点および既存の事実や状況への考慮である。2023年12月31日と2022年12月31日まで会社はそうします
F-12
総合収益
普通株主は1株当たり純収益を占めなければならない
1株当たり基本純(損失)収益の算出方法は、普通株株主に帰属する純(損失)収益を当期発行普通株の加重平均で割る。1株当たりの純(損失)収益の算出方法は、普通株株主が占めるべき純(損失)収入を当期発行普通株の加重平均数で割ったものであり、在庫株方法を用いた既発行株式オプションや制限株式単位によるいかなる希薄化影響も含む。詳細は付記12を参照されたい。
新会計公告
財務会計基準委員会は時々新しい会計公告を発表するまたは会社が指定された発効日から採用される他の基準制定機関。当社は最近発表された指針を採用することがその総合財務諸表や開示に重大な影響を与える可能性があるとは考えていません。
3.有価証券
会社の現金等価物と有価証券の概要2023年12月31日と2022年12月31日公正価値記録(#ドルは含まれていません
2023年12月31日 |
|
償却する |
|
|
毛収入 |
|
|
毛収入 |
|
|
公正価値 |
|
||||
現金等価物: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
貨幣市場基金 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
アメリカ国債 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
現金等価物合計 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
有価証券: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ国債 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
会社債務証券 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
預金証書 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
政府支援企業証券 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
商業手形 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
有価証券総額 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
現金等価物と有価証券総額 |
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
2022年12月31日 |
|
償却する |
|
|
毛収入 |
|
|
毛収入 |
|
|
公正価値 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
現金等価物: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
貨幣市場基金 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
会社債務証券 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
商業手形 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
現金等価物合計 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
有価証券: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
会社債務証券 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
預金証書 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
政府支援企業証券 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
商業手形 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
有価証券総額 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
現金等価物と有価証券総額 |
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
2023年12月31日まで有価証券の純未実現収益頭寸は#ドルである
F-13
2023年12月31日および2022年12月31日までに,12カ月未満の損失を達成していない有価証券の公正価値の合計は$である
当社は、2023年12月31日、2023年12月31日及び2022年12月31日まで、上記投資に重大な信用リスクは存在しないと認定している。当社は取り戻すまでこのような証券を保有する意欲と能力があります。したがって,2023年12月31日および2022年12月31日までに,当社はその有価証券について信用に関する減価費用を計上していない.
4.公正価値計測
以下の表に当社の公正価値によって日常的に計量された金融資産の資料を記載し、この等公正価値の分類を以下のように示す2023年12月31日および2022年12月31日(単位:千):
|
|
公正価値に応じて計量する |
|
|||||||||||||
|
|
2023年12月31日 |
|
|||||||||||||
|
|
合計する |
|
|
レベル1 |
|
|
レベル2 |
|
|
レベル3 |
|
||||
現金と現金等価物: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
現金 |
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
||
貨幣市場基金 |
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
||
アメリカ国債 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
有価証券: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
アメリカ国債 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
会社債務証券 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
預金証書 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
政府支援企業証券 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
商業手形 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
合計する |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
- |
|
|||
|
|
公正価値に応じて計量する |
|
|||||||||||||
|
|
2022年12月31日 |
|
|||||||||||||
|
|
合計する |
|
|
レベル1 |
|
|
レベル2 |
|
|
レベル3 |
|
||||
現金と現金等価物: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
現金 |
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
||
貨幣市場基金 |
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
||
会社債務証券 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
商業手形 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
有価証券: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
会社債務証券 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
預金証書 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
政府支援企業証券 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
商業手形 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
他の非流動資産 |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
合計する |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
評価レベルで第2レベルに分類される有価証券には、通常、米国債や政府機関証券、社債、商業手形が含まれる。同社は第三者価格源から得られた推定値を考慮することで、これらの有価証券の公正価値を推定している。
F-14
5.財産と設備、純額
財産と設備の純額は以下の部分からなる(千計)
|
|
12月31日まで |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
コンピュータ装置 |
|
$ |
|
|
$ |
|
||
家具、固定装置、その他 |
|
|
|
|
|
|
||
実験室装置 |
|
|
|
|
|
|
||
賃借権改善 |
|
|
|
|
|
|
||
建設中の工事 |
|
|
|
|
|
|
||
財産と設備総額(毛額) |
|
|
|
|
|
|
||
減価償却累計 |
|
|
( |
) |
|
|
( |
) |
財産と設備の合計 |
|
$ |
|
|
$ |
|
||
2023年12月31日現在、2022年と2021年12月31日までの年間減価償却費用はい$です
6.課税料金
計算すべき費用には、以下の項目が含まれる
|
|
12月31日まで |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
賃金総額と従業員に関するコスト |
|
$ |
|
|
$ |
|
||
研究コスト |
|
|
|
|
|
|
||
協力コスト |
|
|
|
|
|
|
||
許可料 |
|
|
|
|
|
|
||
専門費 |
|
|
|
|
|
|
||
知的財産権コスト |
|
|
|
|
|
|
||
課税財産と設備 |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
合計する |
|
$ |
|
|
$ |
|
||
7.賃貸証書
2020年5月、同社はマサチューセッツ州フレミンガムまたはフレミンガムリース会社に細胞療法製造工場を設立し、当社の研究用細胞療法候補製品を臨床および商業生産するためのレンタル契約を締結した。フレミンガム賃貸契約は#年で満期になります
2020年7月、当社はマサチューセッツ州ボストンにあるオフィスと実験室施設の賃貸契約を締結し、レンタル開始日は2021年6月1日、すなわち2020年レンタルとなった。レンタル開始時、会社は#ドルの使用権資産を記録した
当社はまた、選定された実際の方便に基づいて、スイスZugで資産や負債を記録していないオフィススペースを短期的に借りている。
会社はいくつかの研究と許可契約にレンタルを埋め込み、会社はこれらのプロトコルに対して使用権、資産、負債を記録した。会社の経営リース資産や負債総額と比較して、これらの手配は重要ではない。また、選択された実際の方便に基づいて、当社はその製造契約内のいくつかの短期賃貸が当社の貸借対照表に記録されていないことを確認した。
当社は、使用権資産と相応の負債を確認する際に、以下の推定を確認·評価した
F-15
下表は現在までの賃貸資産と負債をまとめたものです2023年12月31日および2022年12月31日(単位:千):
|
|
12月31日まで |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
資産 |
|
|
|
|
|
|
||
経営的リース資産 |
|
$ |
|
|
$ |
|
||
リース資産総額 |
|
|
|
|
|
|
||
負債.負債 |
|
|
|
|
|
|
||
現在のところ |
|
|
|
|
|
|
||
リース負債を経営する |
|
|
|
|
|
|
||
当面ではない |
|
|
|
|
|
|
||
賃貸負債を経営し,当期分を差し引く |
|
|
|
|
|
|
||
リース総負債 |
|
$ |
|
|
$ |
|
||
研究と開発,一般と行政費用および年度までの分譲収入に含まれる経営リースコストをまとめた2023年12月31日、2022年、2021年(単位:千):
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
リースコストを経営する |
|
$ |
|
|
$ |
|
|
$ |
|
|||
短期賃貸コスト |
|
|
|
|
|
|
|
|
|
|||
可変リースコスト |
|
|
|
|
|
|
|
|
|
|||
転貸収入 |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
純賃貸コスト |
|
$ |
|
|
$ |
|
|
$ |
|
|||
次の表は、賃貸負債の下で満期になった未割引支払いの満期日とこれらの負債の現在値をまとめています2023年12月31日(千):
|
|
合計する |
|
|
2024 |
|
|
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
2027 |
|
|
|
|
2028 |
|
|
|
|
その後… |
|
|
|
|
合計する |
|
$ |
|
|
現在価値調整 |
|
|
( |
) |
賃貸負債現在価値 |
|
$ |
|
|
次の表は,以下の日までのレンタル期間(年単位)と経営的リースの割引率をまとめている2023年12月31日および2022年12月31日:
|
|
12月31日まで |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
加重平均残余レンタル期間 |
|
|
|
|
|
|
||
加重平均割引率 |
|
|
% |
|
|
% |
||
F-16
下表は賃貸負債を計量する際に支払った現金をまとめたものである2023年12月31日、2022年、2021年 (単位:千):
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
賃貸負債に含まれる金額を計量するために支払う現金: |
|
|
|
|
|
|
|
|
|
|||
経営的リース使用の経営的キャッシュフロー |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
レンタル非現金プロジェクトを運営しています |
|
|
|
|
|
|
|
|
|
|||
賃貸借契約改正とリスコアリングにより使用権資産を増加(減少)する |
|
|
|
|
|
|
|
|
( |
) |
||
経営性リース負債と引き換えに使用権資産 |
|
|
|
|
|
|
|
|
|
|||
レンタル改善は大家さんが直接支払います |
|
|
|
|
|
|
|
|
|
|||
8.重要な契約
頂点との合意
本付記8と付記9については、CASGEVY(Exagamlogene Autotemcel)[Exacel])は、前身がCTX 001であり、“CASGEVY”と呼ばれる。
2015年コラボレーション
2015年、会社はVertexと戦略的協力、オプション、ライセンス契約、または2015年の協力協定を締結した。2015年の協力協定は,同社のCRISPR/Cas 9遺伝子編集技術を用いてヒト疾患の潜在的遺伝原因に対する潜在的な新しい療法を発見·開発することに重点を置いている。当社およびVertexはそれぞれ二零一七年および二零一九年に二零一五年協力協定を改訂し、すなわちVertexが二零一五年協力協定の項目の下での株式購入権を明らかにし、二零一五年協力協定のいくつかの定義および条文を修正し、共同発展協定(定義は以下参照)および二零一九年協力協定(定義は以下参照)と一致させる。2017年、Vertexは2015年の協力協定に付与された選択権を行使し、ヘモグロビン病とβ-グロブリン標的の開発と商業化の共同独占許可を得、2019年、Vertexは2015年の協力協定に付与された残りの選択権を行使し、2015年の協力協定による開発のいくつかの協力目標を独占的に許可した。
ヘモグロビン病の協力
2017年、Vertexがヘモグロビン病とβ−グロブリン標的の開発と商業化の共同独占許可の選択権を行使した後、会社とVertexは共同開発と商業化協定を締結し、CASGEVYを含む潜在的なヘモグロビン病治療薬に同意し、会社とVertexはすべての研究開発コストと世界的な収入を折半する。2021年に、当社およびVertexはJDAまたはA&R Vertex JDCAを改訂および再記述し、これにより、各当事者は(A)協力の管理アーキテクチャを調整することに同意し、各方面のこのアーキテクチャでの責任を調整し、VertexがCASGEVY計画に関するすべての意思決定(すなわち制御権)を指導および所有できるようにする;(B)調整双方の間でCASGEVYのみについて純利益および純損失の分配を分配し、分配する
F-17
A&R Vertex JDCA計画が完了した取引について、当社は1ドル受け取りました
DMDおよびDM 1独占ライセンス
2019年、当社はVertexと戦略的協力と許可協定、または2019年の協力協定を含む一連の合意に達し、Duchenne筋ジストロフィー(DMD)と強直性筋ジストロフィー1型(DM 1)を治療する製品を開発し、商業化した。Vertexは、DMDおよびDM 1プロジェクトについて、すべての研究、開発、製造、商業化活動、およびすべての関連コストを担当しています。IND申請後、会社はDM 1マイルストーンと特許使用料を放棄することを選択することができ、世界規模ですべてのDM 1製品を共同開発し、共同商業化することができる
糖尿病分野の協力
2021年、同社はViaCyte、Inc.またはViaCyteと共同開発および商業化協定、すなわちViaCyte JDCAを締結し、世界各地で1型糖尿病、2型糖尿病またはインスリン依存型/必要糖尿病を診断、治療または予防するための候補製品および共有製品を共同開発および商業化した。2022年第3四半期、VertexはViaCyteを買収し、ViaCyteはVertexの完全子会社となった。2023年3月、(1)当社はViaCyteとViaCyte JDCA或いはViaCyte JDCA修正案の改訂を締結し、そして当社とViaCyteのViaCyte JDCA項下のいくつかの権利と義務を調整し、及び(2)当社はVertexと非独占的許可プロトコル或いは非防爆許可プロトコルを締結し、これにより会社は非独占的な方式でVertexにそのいくつかの遺伝子編集知的財産権を許可し、ある製品を開発して全世界で1型糖尿病、2型糖尿病或いはインシュリン依存型糖尿病/必要な糖尿病を診断、治療或いは予防することに同意した。その後,ViaCyteはViaCyte JDCAから脱退することを選択した.脱退条項を選択することにより,現在行われている連携資産は現在会社が全額所有しており,将来的にはViaCyteの販売に特許権使用料が徴収される.選択脱退は2024年2月初めに施行される予定だ。
非執行許可契約の締結については,当社は1ドルを受け取りました
会計分析
本付記8については、2015年連携プロトコル、第1号修正案、第2号修正案、A&R Vertex JDCA、A&R Vertex JDCA第1号修正案と2019年連携プロトコルを総称して“Vertexプロトコル”、非ExライセンスプロトコルとViaCyte JDCA修正案を総称して“2023年3月プロトコル”と呼ぶ
頂点プロトコルおよび2023年3月のプロトコルは、ASC 808によって定義される協調スケジュールのように、ASC 606によって定義されるようなクライアント·プロバイダ関係のコンポーネントを含む協力協定またはASC 808、および以下に定義する研究開発コストASC 730研究開発あるいはASC 730。具体的には、2023年3月の合意について、同社は、非独占許可はASC 606項目の履行義務であるのに対し、ViaCyte JDCA修正案で行われている研究·開発サービスはASC 808項の下の1つの会計単位であると結論した。
ASC 606での会計分析
2023年3月の合意
契約的識別
2023年3月の合意は、単一のビジネス目標を有する一括合意として交渉されたため、2023年3月の合意は会計目的で統合され、単一手配とみなされた。会計目的のため、会社は合併後の契約が元のViaCyte JDCAを終了し、新しい契約を作成したと判断した。
F-18
義務を果たすことを確定する
同社は、ViaCyte JDCA修正案の一部として提供されるいくつかの修正された権利および義務を含む非排他的ライセンスの譲渡を含み、ライセンスの交付をサポートすることは、契約の範囲内で異なることも異なることもできると結論した。
成約価格の決定
初期取引価格には前金#ドルが含まれています
2023年第2四半期に、会社はドルを含む取引価格を調整した
取引価格と履行義務の分配
同社は2023年3月の合意で履行義務を確定したため、取引価格を割り当てる必要はない。
収入の確認
同社は、ViaCyte JDCA修正案の一部として提供されたいくつかの修正された権利および義務を含む非独占的許可を決定し、知的財産権がVertexが糖尿病分野の研究および開発の形態で機能またはタスクを実行できるようにするため、許可の交付を支援する。2023年に同社が確認した収入は
2023年、可変対価収入は1ドル
非防爆許可協定のマイルストーン
同社は2023年12月31日までに、将来達成可能なマイルストーンの支払いをVertexから取得する資格があり、金額は最高$に達する
2023年12月31日現在、非防爆許可協定下の各残りのマイルストーンは完全に制限されている。臨床開発の性質とCRISPR/CAS 9技術の段階を考慮して、研究と開発マイルストーンを獲得するイベントを実現するかどうかは不確実性がある。残りの研究、開発、規制マイルストーンは、著しい収入逆転が生じない可能性が高いまで制限されるだろう。ビジネスマイルストーンと使用料は主に知的財産権許可に関連しており、販売または使用に基づく敷居によって決定される。商業マイルストーンと特許権使用料は特許権使用料確認制限の下で入金され、制限された可変対価として入金される。同社は事業マイルストーンごとに印税確認制限を適用しており、その後のライセンス製品の販売(各マイルストーン実現)まで、一里塚ごとの収入は確認されていない。
A&R頂点JDCAの計算
契約的識別
A&R Vertex JDCAはJDAに対する契約修正を代表している.会計目的でA&R Vertex JDCAは単独の契約とされている。
義務を果たすことを確定する
同社は、A&R Vertex JDCAは、Vertexに追加のグローバル独占ライセンスを付与する単一の材料承諾を含むと結論した
F-19
成約価格の決定
取引価格は前金#ドルで構成されています
2023年第4四半期に、会社はドルを含む取引価格を調整した
取引価格と履行義務の分配
履行義務の販売価格は会社のESSPによって決定されます。同社はCASGEVY独占ライセンスのためにESSPを作成し、このような物品が定期的に独立して販売されていれば、どのような価格で販売されるかを決定することを目的としている。
CASGEVY独占ライセンスのESSPは約$と決定されました
収入の確認
同社は、CASGEVY独占ライセンスは機能性知的財産権を代表すると認定し、知的財産権はVertexが研究開発、製造、商業化の形式で機能或いは任務を実行できるようにしたからである。したがって,CASGEVY独占ライセンスに関する収入は2021年第2四半期譲渡時に確認された。
2023年、可変対価収入は1ドル
2019年の連携協定を説明する
2019年の合意は2015年の合意の契約修正です。したがって、会計目的で2019年協定と2015年協定が統合され、単一の手配とみなされている。2023年12月31日と2022年12月31日までの12ヶ月間、2019年の合意での取引は重要ではない。2021年12月31日までの12ヶ月間、会社は確認しました
当社は、2023年12月31日現在、2019年協議の下で上記マイルストーンと特許権使用料により残っている他のすべての可能な可変対価が完全に制限されていることを決定しました。会社は各報告期間内に取引価格を再評価するだろう。
Vertexプロトコルと2023年3月プロトコルに関する収入が確認された
Vertexプロトコルと2023年3月プロトコルにより確認された2023年12月31日までの年間収入は#ドル
Vertexプロトコルにより確認された2022年12月31日までの年間収入は実質的ではない。
Vertexプロトコルにより確認された2021年12月31日までの年間収入は#ドル
2023年12月31日と2022年までに
F-20
頂点合意の下の一里塚
その会社はVertex協定と関連したマイルストーンを受信する可能性があることを評価した。
2015年の協力協定とその後の改訂によると、同社は最大$を取得する資格がある
同社には将来最高の$の潜在的支払いを受ける資格がある
会社は自費である規定された分野で研究する権利があり、CASGEVY計画に有益であり、CASGEVYが最終的にこれらの分野で規制承認を受けた場合、会社はVertexから合計8桁までのいくつかのマイルストーン支払いを得る権利がある。
上記の残りのマイルストーンのそれぞれは、2023年12月31日まで完全に制限されている。臨床開発の性質とCRISPR/CAS 9技術の段階に鑑み,研究と開発マイルストーンを獲得したイベントが実現するかどうかは不確定である。残りの研究、開発、規制マイルストーンは、著しい収入逆転が生じない可能性が高いまで制限されるだろう。ビジネスマイルストーンと使用料は主に知的財産権許可に関連しており、販売または使用に基づく敷居によって決定される。商業マイルストーンと特許権使用料は特許権使用料確認制限の下で入金され、制限された可変対価として入金される。同社は事業マイルストーンごとに印税確認制限を適用しており、その後のライセンス製品の販売(各マイルストーン実現)まで、一里塚ごとの収入は確認されていない。
ASC 808での会計分析
頂点合意
Vertexプロトコルについては,同社は,ASC 808に,(I)A&R Vertex JDCAにおけるCASGEVYに関する任意の移行サービス,(Ii)後続製品の研究開発サービス,および(Iii)委員会の参加を含む共有製品の開発と商業化サービスを含む連携要素を決定した.費用分担に関する影響は,合併業務表と総合(赤字)収入における連携費用純額に計上されている。
当社は、2023年、2022年および2021年12月31日までの年度内に確認します
A&R Vertex JDCAによると,会社はCASGEVY計画で$$を超える指定コスト分を延期する権利がある
9.支払いの引受およびその他の事項
知的財産権協定
Charpentier許可プロトコル
2014年4月、当社はEmmanuelle Charpentier博士といくつかの技術許可協定を締結し、この協定に基づき、当社はCharpentier博士といくつかの知的財産権を共同で持ち、ヒト疾患の治療または予防製品を開発し、商業化した。これに関連して,Charpentier博士は,名義臨床マイルストーン支払い,第三者と達成された任意の再許可合意に基づいて受信した再許可支払いのより低い桁数パーセント,および当社とその関連会社および再許可譲受人許可製品およびサービスの年間純売上高に基づいて計算されたより低い桁数パーセントの特許使用料を得る権利がある。Charpentierライセンスプロトコルによると、会社はCharpentier博士に大きな額の費用を支払った。
F-21
研究、製造、許可協定
同社はすでにいくつかの研究機関や会社を招聘し、同社の遺伝子編集技術の新たな交付戦略と応用を決定している。同社も多くのライセンス契約の当事者であり、これらの合意は大量の前払いを必要とし、将来の特許権使用料と潜在的なマイルストーン支払いを時々支払う必要があるかもしれない。また、同社は知的財産権協定の一方でもあり、これらの協定はメンテナンスとマイルストーン費用を時々支払う必要がある。また、同社は将来のサービス性能の前払いを要求するいくつかの製造協定の締約国である。
これらの合意に関連して、個々の製品に基づいて、取引相手は具体的な研究、開発、規制マイルストーンに基づいて最高8桁の低潜在的支払いを獲得する資格がある。また、個々の製品に基づいて、取引相手は、指定された年間販売敷居に基づいて潜在的なビジネスマイルストーン支払いを得る資格がある。潜在的な支払いは指定された年間売上高の敷居の一桁パーセントだ。取引相手には将来の純売上高から低い一桁の特許権使用料を得る資格があります。
場合によっては、将来いくつかのイベントが発生したり、イベントがあったりする場合、Vertexは最高$を得る資格があります
A&R Vertex JDCAによると、会社はCASGEVY計画の指定コストを延期する権利があり、金額は$を超える
訴訟を起こす
通常の業務過程において、当社は時々、当社の知的財産権(ある許可内の知的財産権を含む)、商業手配及びその他の事項に関連する訴訟、調査、法律手続き及び訴訟脅威に関連する。このような訴訟には準訴訟が含まれているかもしれません各方面間米国特許商標局、欧州特許庁、および他の国·地域特許庁の行政訴訟は、特定の認可内の知的財産権を含む会社の知的財産権に関するものである。T.T上記のいずれの場合の結果も,本質的には不確実である.また、訴訟や関連事項はコストが高く、会社の経営陣や他の資源の注意を分散させる可能性があり、そうでなければ、これらの資源は他の活動に従事することになる。もし会社がこのような訴訟で勝訴できなければ、会社の業務、運営結果、流動資金、財務状況は不利な影響を受ける可能性がある。
10.配当金
その会社のすべての普通株式はスイスの会社法によって許可され、額面は
2023年12月31日現在、会社の株式は
F-22
早い時期にスイスフランの下限内で
普通株発行
市場の製品
2019年8月に、当社は公開市場販売協定を締結しましたSMJefferies LLCまたはJefferiesと協力し、この合意によれば、当社は時々Jefferiesをその販売代理、その普通株、または2019年8月の販売契約として、適宜提案および販売することができる。改訂された2019年8月の販売協定について、当社は通常株を随時発売するために、米国証券取引委員会に複数の目論見書補充書類を提出している。
2021年に会社は発行して販売します
2022年には、2019年の販売契約と現行の目論見書に基づいて普通株を追加売却する金額は大きくない。
2023年には会社が発行して販売します
2023年12月31日現在、同社は
普通株特徴
普通株式は以下のような特徴を持つ
投票権
普通株保有者には権利がある
配当をする
株主総会が取締役会それぞれの提案に基づいて決議を下した場合、普通株式保有者は配当金を得る権利があり、会社が十分な自由に備蓄を分配できることが条件である。2023年12月31日まで,
清算する
普通株式保有者は、当社で任意の自発的または非自発的な清算、解散または清算または清算とみなされる事件が発生した場合、当社が株主に割り当てることができる資産を比例的に共有する権利がある。
11.株式ベースの報酬
オプションと贈与計画
2015年4月、会社株主は2015年株式オプション及び付与計画、又は2015年計画を承認し、2016年7月、会社株主は2016年株式オプション及びインセンティブ計画、又は2016年計画を承認した。2018年5月、会社株主は、2018年株式オプションおよびインセンティブ計画、または2018年計画(総称して“計画”と呼ぶ)を承認した。IPOの後
F-23
株式ベースの報酬費用
会社が確認した株式ベースの報酬支出総額は#ドル
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
研究開発 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
一般と行政 |
|
|
|
|
|
|
|
|
|
|||
合計する |
|
$ |
|
|
$ |
|
|
$ |
|
|||
2023年12月31日まで一ドルあります
株式オプション
従業員に発行される各オプションの公正価値は、付与された日にブラック·スコアーズオプション定価モデルを用いて以下の加重平均仮定の下で推定される
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
付与したオプション |
|
|
|
|
|
|
|
|
|
|||
加重平均行権値 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
加重平均は日公正価値を付与する |
|
$ |
|
|
$ |
|
|
$ |
|
|||
仮定: |
|
|
|
|
|
|
|
|
|
|||
予想変動率 |
|
|
% |
|
|
% |
|
|
% |
|||
予想期限(年単位) |
|
|
|
|
|
|
|
|
|
|||
無リスク金利 |
|
|
% |
|
|
% |
|
|
% |
|||
期待配当収益率 |
|
|
% |
|
|
% |
|
|
% |
|||
以下の表は、会社持分奨励計画における株式オプション活動(内的価値千計):
|
|
株 |
|
|
重み付けの- |
|
|
重み付けの- |
|
|
骨材 |
|
||||
2022年12月31日に返済されていません |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
授与する |
|
|
|
|
|
|
|
|
|
|
|
|
||||
鍛えられた |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
キャンセルまたは没収 |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
2023年12月31日現在の未返済債務 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
2023年12月31日に行使できます |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
すでに帰属しており、2023年12月31日に帰属する予定です |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
2023年12月31日現在、2022年及び2021年12月31日までの期間内に行使される株式オプションの総内的価値(公平時価が行権価格を超える金額)はい$です
2023年12月31日現在、購入オプション
2023年12月31日まで購入可能なオプション
“会社”ができた
F-24
制限株 職場.職場
以下の表は、会社の持分奨励計画における制限的な株式単位活動をまとめたものである
|
|
株 |
|
|
重み付けの- |
|
||
2022年12月31日の未帰属残高 |
|
|
|
|
$ |
|
||
授与する |
|
|
|
|
|
|
||
既得 |
|
|
( |
) |
|
|
|
|
キャンセルまたは没収 |
|
|
( |
) |
|
|
|
|
2023年12月31日の未帰属残高 |
|
|
|
|
$ |
|
||
2023年まで,2022年および2021年12月31日まで年度,帰属制限株式単位の総公正価値は$である
2022年に同社は
“会社”ができた
修正奨励
退職従業員が2023年、2022年、2021年12月31日までに保有する特定の持分奨励に対する持分奨励改正は、会社の株式ベースの報酬支出に重要ではない。
従業員株購入計画
同社取締役会は2016年7月19日、株主の承認を得て2016年10月19日に発効するESPP計画である2016年従業員株購入計画を採択した。ESPPプログラムは初期発行最大合計を許可します
12.普通株主が1株当たり純収益を占めるべき
1株当たり基本純(損失)収益の算出方法は、普通株株主に帰属する純(損失)収益を当期発行普通株の加重平均で割る。1株当たりの純(損失)収益の算出方法は、普通株株主が占めるべき純(損失)収入を当期発行済み普通株等価物の加重平均で割ることであり、在庫株方法を用いた既発行株式オプションと引受権証によるいかなる償却影響も含む。会社の純(赤字)収入とは、すべての列報期間中に普通株株主が占めるべき純(赤字)収入のことである。
次の表に基本純値と希釈純値の計算方法を示す(損失)締切日の1株当たり収益(単位は千で、1株および1株当たりの金額は含まれていない):
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
|
|
|
|
|
|
|
|
|
|
|||
純収益 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|
基本加重平均普通株式発行済み |
|
|
|
|
|
|
|
|
|
|||
潜在的希釈証券の影響: |
|
|
|
|
|
|
|
|
|
|||
未平倉オプション |
|
|
— |
|
|
|
— |
|
|
|
|
|
無帰属制限普通株 |
|
|
— |
|
|
|
— |
|
|
|
|
|
希釈加重平均普通株式発行 |
|
|
|
|
|
|
|
|
|
|||
普通株1株当たりの純収益--基本 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|
普通株1株当たりの純収益--減額 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|
F-25
1株当たり純(損失)収益を計算する際、同社は次の表の証券を計算していないが、時期ごとに逆希釈の影響が生じるからである
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
未平倉オプション |
|
|
|
|
|
|
|
|
|
|||
無帰属制限普通株 |
|
|
|
|
|
|
|
|
|
|||
ESPP |
|
|
|
|
|
|
|
|
|
|||
合計する |
|
|
|
|
|
|
|
|
|
|||
13.401(K)貯蓄計画
当社は2016年11月に国税法第401(K)節(“401(K)計画”)に基づいて固定払込貯蓄計画を構築した。401(K)計画は、規定された最低年齢およびサービス要件に適合するすべての従業員をカバーし、参加者が税引前に年間給与の一部の支払いを延期することを可能にする。その会社は$を貢献した
14.所得税
当社はアメリカ連邦と各州の企業所得税、及び外国親会社と外国子会社が設立された外国司法管轄区の税収を納めなければなりません。
税引き前純収益
ここ数年で2023年12月31日、2022年12月31日、2022年12月31日、2021年12月31日、2022年12月31日、2021年12月31日、2022年12月31日、2021年12月31日、2023年12月31日、2022年12月31日、2021年12月31日、2023年12月31日、2022年12月31日、2021年12月31日、2021年12月31日、2023年12月31日、2022年12月31日、2021年12月31日、2022年12月31日、2021年12月31日、2023年12月31日、2022年12月31日、2021年12月31日、2023年12月31日、2021年12月31日、2021年12月31日、2023年12月31日、2022年12月31日、2023年12月31日、2023年12月31日、2022年12月31日、2022年12月31日、2021年12月31日、2023年12月31日、2022年12月31日、2021年12月31日、2023年12月31日、2022年12月31日、2021年12月31日、2022年12月31日、2021年12月31日、2023年12月31日、2022年12月31日、2021年12月31日、2023年12月31日、2022年12月31日、2021年12月31日、2022年12月31日、2021年12月31日、2021年12月31日、
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
国内では |
|
$ |
|
|
$ |
|
|
$ |
|
|||
外国.外国 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
合計する |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|
F-26
所得税の収益(計上)には、以下の内容(千計)が含まれる
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
当期所得税: |
|
|
|
|
|
|
|
|
|
|||
連邦制 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
状態.状態 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
外国.外国 |
|
|
— |
|
|
|
— |
|
|
|
|
|
当期所得税総額 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
繰延所得税: |
|
|
|
|
|
|
|
|
|
|||
連邦制 |
|
$ |
|
|
|
|
|
|
( |
) |
||
状態.状態 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
外国.外国 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
繰延所得税総額 |
|
|
|
|
|
|
|
|
( |
) |
||
所得税優遇総額 |
|
$ |
( |
) |
|
$ |
|
|
$ |
( |
) |
|
法定企業所得税税率で計算される所得税費用と締切年度の実際所得税税率との入金2023年12月31日、2022年12月31日、2021年12月31日の状況は以下の通り
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
法定税率下の所得税費用 |
|
|
% |
|
|
% |
|
|
% |
|||
州所得税、連邦福祉を差し引いた純額 |
|
|
% |
|
|
% |
|
|
( |
)% |
||
差し引かれない費用 |
|
|
( |
)% |
|
|
( |
)% |
|
|
% |
|
外貨利回り |
|
|
( |
)% |
|
|
( |
)% |
|
|
% |
|
法律とアメリカで公認されている会計基準は永久的に違います |
|
|
% |
|
|
% |
|
|
% |
|||
株に基づく報酬 |
|
|
( |
)% |
|
|
( |
%) |
|
|
( |
)% |
遅延金利変動の影響 |
|
|
% |
|
|
( |
)% |
|
|
% |
||
研究単位 |
|
|
% |
|
|
% |
|
|
( |
)% |
||
評価免除額を変更する |
|
|
( |
)% |
|
|
( |
)% |
|
|
( |
)% |
その他支払項目 |
|
|
( |
)% |
|
|
% |
|
|
% |
||
有効所得税率 |
|
|
( |
%) |
|
|
|
|
|
% |
||
連邦法定料率はスイスの混合会社のサービス料率を反映する。
繰延税項は、財務諸表の資産と負債ベースと所得税との一時的な差異で確認されている。同社の繰延税金資産の重要な構成要素には、以下の項目(千計)が含まれる
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
繰延税金資産: |
|
|
|
|
|
|
||
純営業損失が繰り越す |
|
$ |
|
|
$ |
|
||
課税項目と準備金 |
|
|
|
|
|
|
||
リース負債を経営する |
|
|
|
|
|
|
||
その他繰延税金資産 |
|
|
|
|
|
|
||
株に基づく報酬 |
|
|
|
|
|
|
||
研究単位 |
|
|
|
|
|
|
||
繰延税金資産総額 |
|
|
|
|
|
|
||
推定免税額を差し引く |
|
|
( |
) |
|
|
( |
) |
繰延税項目純資産 |
|
|
|
|
|
|
||
繰延税金負債: |
|
|
|
|
|
|
||
減価償却 |
|
|
( |
) |
|
|
( |
) |
経営的リース資産 |
|
|
( |
) |
|
|
( |
) |
無形資産 |
|
|
( |
) |
|
|
( |
) |
その他繰延税金負債 |
|
|
|
|
|
( |
) |
|
繰延税金負債総額 |
|
|
( |
) |
|
|
( |
) |
長期繰延税金 |
|
$ |
( |
) |
|
$ |
( |
) |
F-27
当社はすでにその繰延税金資産の現金化に影響するプラスと負の証拠を評価した。同社の世界的な経営赤字の歴史によると、同社は、米国と非米国繰延税金資産の利益が実現できない可能性が高いと結論した。2023年12月31日と2022年までに当社はスイスやイギリスでの繰延税項目純資産について全額評価を提供する準備をしている。同社はまた、既存の繰延税金負債が現金化できない米国の繰延税金資産に評価準備金を提供しており、これらの計画がいつ打ち切られるかに基づいている。推定免税額は#ドル増加した
2023年12月31日まで会社が所有しています
2023年12月31日までこの会社はアメリカ国内の連邦研究と開発信用繰越$を持っています
米国会計基準第740条は、企業財務諸表で確認された所得税の不確実性について会計説明し、納税申告書に採用されているまたは予想される納税立場の最低確認敷居と計量を規定している。
2023年12月31日まで同社には未確認の税収割引総額$があります
税収優遇総額の変化が確認されていない場合は以下のとおりである(千計)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2023 |
|
|
2022 |
|
|
2021 |
|
|||
年初残高 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
当期税収が増加する |
|
|
|
|
|
|
|
|
|
|||
前の期間の税収が増加する |
|
|
— |
|
|
|
|
|
|
— |
|
|
当期税収頭寸減少額 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
前期税収頭寸減少額 |
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
年末残高 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
同社はアメリカ連邦司法管轄区、マサチューセッツ州、カリフォルニア州、一部の非アメリカ司法管轄区に所得税申告書を提出した。同社は2019年12月31日までの納税年度に米国連邦、マサチューセッツ州、カリフォルニア州、非米国所得税当局の審査を受けている。以前の納税年度に発生した研究は閉鎖審査を免除した後、すでにまたは将来の期間に使用されれば、未来の審査時に調整することができる。同社はすべての年に米国管轄区域の主管部門ではない所得税審査を受けなければならない。
15.後続の活動
2024年2月13日、同社は約$を売却する投資協定を締結した
F-28