米国
証券取引委員会
ワシントンD.C. 20549
フォーム
(マークワン)
1934年の証券取引法
四半期終了時
または
1934年の証券取引法
_______________から______________への移行期間について。
コミッションファイル番号
| ||
州またはその他の管轄区域の設立 |
| (IRS) 雇用者識別番号 |
主要な執行部の住所
(
エリアコードを含む登録者の電話番号
同法第12条 (b) に従って登録された証券:
各クラスのタイトル |
| トレーディングシンボル |
| 登録された各取引所の名称 |
|
|
登録者(1)が1934年の証券取引法のセクション13または15(d)によって提出が義務付けられているすべての報告を過去12か月間(または登録者がそのような報告を提出する必要があったほど短い期間)提出したかどうか、および(2)過去90日間にそのような提出要件の対象となっていたかどうかをチェックマークで示してください。
登録者が、過去12か月間(または登録者がそのようなファイルの提出と投稿を求められたより短い期間)に、規則S-Tの規則405(本章の§232.405)に従って提出および掲載が義務付けられているすべてのインタラクティブデータファイルを電子的に提出したかどうかをチェックマークで示してください。
登録者が大規模な加速申告者なのか、加速申告者なのか、非加速申告者なのか、小規模な報告会社なのか、新興成長企業なのかをチェックマークで示してください。取引法の規則12b-2の「大規模加速申告者」、「加速申告者」、「小規模報告会社」、「新興成長企業」の定義を参照してください。
大型加速フィルター | ☐ | アクセラレーテッド・ファイラー | ☐ |
☒ | 小規模な報告会社 | ||
|
| 新興成長企業 |
新興成長企業の場合は、登録者が取引法第13条 (a) に従って規定された新規または改訂された財務会計基準を遵守するために延長された移行期間を使用しないことを選択したかどうかをチェックマークで示してください。☐
登録者がシェル会社(取引法の規則12b-2で定義されている)かどうかをチェックマークで示してください。
はい
株式クラス |
| いいえ。発行済株式 |
| 日付 |
共通 |
|
| 2024年2月7日 |
目次
パート I 財務情報
アイテム 1. |
|
| ページ |
|
|
|
|
|
|
| 2023年12月31日(未監査)および2023年9月30日の要約貸借対照表 |
| 3 |
|
|
|
| ||
| 2023年12月31日および2022年12月31日に終了した3か月間の要約営業報告書(未監査) |
| 4 |
|
|
|
| ||
| 2023年12月31日および2022年12月31日に終了した3か月間の株主資本に関する要約計算書(未監査) |
| 5 |
|
|
|
|
| |
| 2023年12月31日および2022年12月31日に終了した3か月間のキャッシュフローの要約計算書(未監査) |
| 6 |
|
|
|
|
|
|
| 要約財務諸表の注記(未監査) |
| 8 |
|
|
|
|
| |
アイテム 2. | 経営陣による財政状態と経営成績に関する議論と分析 |
| 16 |
|
|
|
| ||
アイテム 3. | 市場リスクに関する量的および質的開示 |
| 25 |
|
|
|
| ||
アイテム 4. | 統制と手続き |
| 25 |
|
|
|
|
| |
パート 2 |
|
| ||
|
|
|
| |
アイテム 2. | 持分証券の未登録売却および収益の使用 |
| 26 |
|
|
|
|
| |
アイテム 5. | その他の情報 |
| 26 |
|
|
|
|
|
|
アイテム 6. | 展示品 |
| 26 |
|
|
|
|
| |
| 署名 |
| 27 |
|
| 2 |
| 目次 |
セルサイエンス株式会社 | ||||||||
要約貸借対照表 | ||||||||
|
|
|
|
|
|
| ||
|
| 12月31日 |
|
| 9月30日 |
| ||
資産 |
| 2023 |
|
| 2023 |
| ||
|
| (未監査) |
|
|
|
| ||
流動資産: |
|
|
|
|
|
| ||
現金および現金同等物 |
| $ |
|
| $ |
| ||
前払い経費 |
|
|
|
|
|
| ||
研究開発と製造に使用される消耗品 |
|
|
|
|
|
| ||
預金 |
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
流動資産合計 |
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
ファイナンスリース、使用権、資産 |
|
|
|
|
|
| ||
オペレーティング・リースの使用権資産 |
|
|
|
|
|
| ||
資産および設備、純額 |
|
|
|
|
|
| ||
特許費用、純額 |
|
|
|
|
|
| ||
預金 |
|
|
|
|
|
| ||
研究開発と製造に使用される消耗品 |
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
総資産 |
| $ |
|
| $ |
| ||
|
|
|
|
|
|
|
|
|
負債と株主資本 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
流動負債: |
|
|
|
|
|
|
|
|
買掛金 |
| $ |
|
| $ |
| ||
未払費用 |
|
|
|
|
|
| ||
従業員のおかげです |
|
|
|
|
|
| ||
ファイナンスリース債務、現在の部分 |
|
|
|
|
|
| ||
オペレーティングリース債務、現在の部分 |
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
流動負債合計 |
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
ファイナンスリース債務、流動分を差し引いたもの |
|
|
|
|
|
| ||
オペレーティング・リース債務、当期分を差し引いたもの |
|
|
|
|
|
| ||
その他の負債 |
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
負債総額 |
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
コミットメントと不測の事態(注Eを参照) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
株主資本 |
|
|
|
|
|
|
|
|
優先株式、$ |
|
|
|
|
|
| ||
普通株式、$ |
|
|
|
|
|
| ||
追加払込資本 |
|
|
|
|
|
| ||
累積赤字 |
|
| ( | ) |
|
| ( | ) |
|
|
|
|
|
|
|
|
|
株主資本の総額 |
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
負債総額と株主資本 |
| $ |
|
| $ |
| ||
|
|
|
|
|
|
|
|
|
要約財務諸表の注記を参照してください。 | ||||||||
| 3 |
| 目次 |
セルサイエンス株式会社 | ||||||||
要約された運用明細書 | ||||||||
2023年および2022年12月31日に終了した3か月間 | ||||||||
(未監査) | ||||||||
|
|
|
|
|
|
| ||
|
| 2023 |
|
| 2022 |
| ||
|
|
|
|
|
|
| ||
営業経費: |
|
|
|
|
|
| ||
研究開発 |
| $ |
|
| $ |
| ||
一般と管理 |
|
|
|
|
|
| ||
営業費用の合計 |
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
営業損失 |
|
| ( | ) |
|
| ( | ) |
|
|
|
|
|
|
|
|
|
支払利息、純額 |
|
| ( | ) |
|
| ( | ) |
その他の費用 |
|
| ( | ) |
|
| ( | ) |
|
|
|
|
|
|
|
|
|
純損失 |
|
| ( | ) |
|
| ( | ) |
ワラントの変更 |
|
|
|
|
| ( | ) | |
|
|
|
|
|
|
|
|
|
普通株主が利用できる純損失 |
| $ | ( | ) |
| $ | ( | ) |
|
|
|
|
|
|
|
|
|
普通株式1株当たりの純損失 — 基本および希薄化後 |
| $ | ( | ) |
| $ | ( | ) |
加重平均発行済普通株式 — 基本株式と希薄化後普通株式 |
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
要約財務諸表の注記を参照してください。 | ||||||||
| 4 |
| 目次 |
セルサイエンス株式会社
株主資本計算書
(未監査)
|
|
|
|
|
|
|
|
| [追加] |
|
|
|
|
|
|
| ||||||
|
|
| 普通株式 |
|
| 支払い済み |
|
| 累積 |
|
|
|
| |||||||||
|
|
| 株式 |
|
| 金額 |
|
| 資本 |
|
| 赤字 |
|
| 合計 |
| ||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||
2023年9月30日の残高 |
|
|
|
|
| $ |
|
| $ |
|
| $ | ( | ) |
| $ |
| |||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
普通株式で支払われた401 (k) の拠出金 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
非従業員にサービス用に発行される株式 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||
普通株式の売却による収入 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||
株式ベースの報酬 — 従業員 |
|
|
| - |
|
|
|
|
|
|
|
|
|
|
|
|
| |||||
株式発行費用 |
|
|
| - |
|
|
|
|
|
| ( | ) |
|
|
|
|
| ( | ) | |||
純損失 |
|
|
| - |
|
|
|
|
|
|
|
|
| ( | ) |
|
| ( | ) | |||
2023年12月31日現在の残高 |
|
|
|
|
| $ |
|
| $ |
|
| $ | ( | ) |
| $ |
| |||||
|
|
| 普通株式 |
|
| [追加] 支払い済み |
|
| 累積 |
|
|
|
| |||||||||
|
|
| 株式 |
|
| 金額 |
|
| 資本 |
|
| 赤字 |
|
| 合計 |
| ||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||
2022年9月30日の残高 |
|
|
|
|
| $ |
|
| $ |
|
| $ | ( | ) |
| $ |
| |||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
令状行使を許可します |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||
普通株式で支払われた401 (k) の拠出金 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||
非従業員にサービス用に発行される株式 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||
2014年のインセンティブ株は没収されました |
|
|
| ( | ) |
|
| ( | ) |
|
| ( | ) |
|
|
|
|
| ( | ) | ||
株式ベースの報酬 — 従業員 |
|
|
| - |
|
|
|
|
|
|
|
|
|
|
|
|
| |||||
純損失 |
|
|
| - |
|
|
|
|
|
|
|
|
| ( | ) |
|
| ( | ) | |||
2022年12月31日現在の残高 |
|
|
|
|
| $ |
|
| $ |
|
| $ | ( | ) |
| $ |
| |||||
要約財務諸表の注記を参照してください。
| 5 |
| 目次 |
セルサイエンス株式会社 | ||||||||
要約キャッシュフロー計算書 | ||||||||
2023年および2022年12月31日に終了した3か月間 | ||||||||
(未監査) | ||||||||
|
|
|
|
|
|
| ||
|
| 2023 |
|
| 2022 |
| ||
|
|
|
|
|
|
| ||
純損失 |
| $ | ( | ) |
| $ | ( | ) |
純損失を営業活動に使用された純現金と調整するための調整: |
|
|
|
|
|
|
|
|
減価償却と償却 |
|
|
|
|
|
| ||
非現金リース費用 |
|
|
|
|
|
| ||
サービスの株式ベースの支払い |
|
|
|
|
|
| ||
株式ベースの報酬 |
|
|
|
|
|
| ||
401 (k) プランに普通株が拠出されました |
|
|
|
|
|
| ||
資産の(増加)/減少: |
|
|
|
|
|
|
|
|
前払い経費 |
|
| ( | ) |
|
|
| |
研究開発と製造に使用される消耗品 |
|
| ( | ) |
|
|
| |
預金 |
|
| ( | ) |
|
|
| |
負債の増加/(減少): |
|
|
|
|
|
|
|
|
買掛金 |
|
| ( | ) |
|
| ( | ) |
未払費用 |
|
| ( | ) |
|
|
| |
従業員のおかげです |
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
営業活動に使用された純現金 |
|
| ( | ) |
|
| ( | ) |
|
|
|
|
|
|
|
|
|
投資活動によるキャッシュフロー: |
|
|
|
|
|
|
|
|
資産および設備の購入 |
|
| ( | ) |
|
| ( | ) |
特許費用の支出 |
|
| ( | ) |
|
|
| |
|
|
|
|
|
|
|
|
|
投資活動に使用された純現金 |
|
| ( | ) |
|
| ( | ) |
|
|
|
|
|
|
|
|
|
財務活動によるキャッシュフロー: |
|
|
|
|
|
|
|
|
普通株式の発行による収入 |
|
|
|
|
|
| ||
株式発行費用の支払い |
|
| ( | ) |
|
| ( | ) |
新株予約権の行使による収入 |
|
|
|
|
|
| ||
ファイナンスリースに基づく債務の支払い |
|
| ( | ) |
|
| ( | ) |
|
|
|
|
|
|
|
|
|
財務活動による純現金 |
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
現金および現金同等物の純減少 |
|
| ( | ) |
|
| ( | ) |
|
|
|
|
|
|
|
|
|
現金および現金同等物、期初 |
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
現金および現金同等物、期末 |
| $ |
|
| $ |
| ||
|
|
|
|
|
|
|
|
|
要約財務諸表の注記を参照してください。 | ||||||||
| 6 |
| 目次 |
セルサイエンス株式会社 | ||||||||
要約キャッシュフロー計算書 | ||||||||
2023年および2022年12月31日に終了した3か月間 | ||||||||
(未監査) | ||||||||
|
|
|
|
|
|
| ||
|
| 2023 |
|
| 2022 |
| ||
非現金投資および財務活動の補足スケジュール: |
|
|
|
|
|
| ||
流動負債に含まれる不動産と設備の購入 |
| $ |
|
| $ |
| ||
買掛金に含まれるファイナンスリース債務 |
| $ |
|
| $ |
| ||
普通株式の発行時に支払われるプリペイドコンサルティングサービス |
| $ |
|
| $ |
| ||
流動負債に含まれる資金調達費用 |
| $ |
|
| $ |
| ||
|
|
|
|
|
|
|
|
|
利息として支払われた現金 |
| $ |
|
| $ |
| ||
|
|
|
|
|
|
|
|
|
要約財務諸表の注記を参照してください。 | ||||||||
| 7 |
| 目次 |
セルサイエンス株式会社
要約財務諸表の注記
2023年および2022年12月31日に終了した3か月間(未監査)
A. 重要な会計方針の提示と要約の基礎
プレゼンテーションの基礎
CEL-SCI Corporation(以下「当社」)の添付の要約財務諸表は未監査であり、米国で一般に認められている会計原則に従って作成された年次財務諸表に通常含まれる特定の情報および脚注開示は、証券取引委員会の規則および規制により省略されています。会社の経営陣は、提示された情報開示は提示された情報が誤解を招かないようにするのに十分であると考えていますが、これらの暫定要約財務諸表は、2023年9月30日に終了した年度のForm 10-Kの年次報告書に含まれる財務諸表および注記と併せて読む必要があります。
経営陣の見解では、添付の未監査要約財務諸表には、2023年12月31日現在の会社の財政状態とその後に終了した3か月間の経営成績を公正に表示するために必要なすべての調整(これらはすべて通常の定期的な性質のものです)と開示が含まれています。2023年9月30日現在の要約貸借対照表は、2023年9月30日の監査済み財務諸表から導き出されています。
事業からの定期的な損失と将来の流動性ニーズにより、当社が継続企業として存続できるかどうかについては大きな疑問があります。財務諸表には、この不確実性の結果から生じる可能性のある調整は含まれていません。注Bの説明を参照してください
重要な会計方針の要約:
現金および現金同等物 — 現金および現金同等物は、主に無制限の預金代金と短期マネーマーケットファンドで構成されています。当社は、購入時の満期が3か月未満の流動性の高い投資はすべて現金同等物と見なしています。
資産と設備— 資産と設備は原価で計上され、定額法を使用して5〜7年の推定耐用年数にわたって減価償却されます。借地権の改善は、資産の推定耐用年数またはリース期間のどちらか短いほうで減価償却されます。資産の耐用年数を延ばさない修理やメンテナンスは、発生時に費用が発生します。資産と設備は四半期ごとに見直され、いずれかの資産が減損していないかどうかが判断されます。
研究開発と製造に使用される消耗品—消耗品は、会社の研究開発と製造業務を支援するために手元に置いておく消耗品です。消耗品は原価で記録され、業務で使用されるときに経費として請求されます。
特許-特許支出は、予想耐用年数または特許の法定期間(17年)のうち短い方の期間にわたって、定額法で資産計上され、定額法で償却されます。技術やその他の状況の変化により特許の価値や存続期間が損なわれる場合は、資産価値と償却期間を適切に調整します。減損損失は、資産の使用およびその処分から生じると予想される将来の割引前キャッシュフローが、資産の帳簿価額を下回った場合に認識されます。減損損失の額は、資産の推定公正価値とその帳簿価額の差になります。
リース— 当社は、特定された資産、プラント、設備の使用を一定期間にわたって管理する権利を伝える契約を、開始時にリースとみなします。当社は、特定の不動産、機械、実験設備、事務機器をさまざまな期間にリースしています。これらのリースの多くには、リースを更新または終了するオプションが含まれています。リース負債を計算する目的で、会社がそのようなオプションを行使することが合理的に確実であれば、これらのオプションはリース期間に含まれます。ほとんどのリースには暗黙の借入金利が設定されていないため、リース負債の計算に使用される増分借金利は、開始日に入手可能な情報に基づいています。短期リースは、初期期間が12か月以下のリースとして定義され、貸借対照表には反映されません。このような短期リースのリース費用は重要ではありません。
| 8 |
| 目次 |
株式ベースの報酬— すべての株式ベースの報奨の報酬費用は、ASC 718の規定に従い、付与日現在の公正価値で測定されます。 報酬 — 株式報酬(「アスク718」)。ストックオプションの公正価値は、Black-Scholesオプション価格モデルを使用して計算されます。Black-Scholesモデルには、ボラティリティや予想オプション寿命など、さまざまな判断上の仮定が必要です。株式ベースの報酬費用は、定額法を使用して、必要なサービスまたは権利確定期間にわたる費用として計上されます。
会社には、インセンティブストックオプションプラン、非適格ストックオプションプラン、株式報酬プラン、株式ボーナスプラン、インセンティブ株式ボーナスプランがあります。これらのプランを総称して「プラン」と呼びます。すべてのプランは会社の株主によって承認されています。
会社のストックオプションは譲渡できません。従業員が実現できるストックオプションの実際の価値は、もしあれば、行使日の市場価格が行使価格を超えているかどうかで決まります。サービス条件のみで発行されたオプションについては、当社の株式の日次終値の差異に基づいて株価のボラティリティを想定しています。リスクフリー金利の仮定は、付与日の米国財務省の金利に基づいており、その期間はオプションの予想耐用年数と同じです。没収は発生した時点で会計処理されます。オプションの予想期間は、付与されるオプションが未払いになると予想される期間を表しており、過去の行使行動の分析に基づいて決定されています。Black-Scholesモデルで使用されている前提条件のいずれかが大幅に変更された場合、新しい報奨の株式ベースの報酬費用は、将来、現在の期間に記録されたものと大きく異なる可能性があります。
インセンティブ・ストック・ボーナス・プランに基づいて付与される制限付株式、および非適格ストックオプション・プランに基づいて付与されるオプションは、サービス、業績、市況に左右され、株式報奨の分類を満たします。これらの賞は、業績基準の達成が不確実な発行物を対象に、モンテカルロシミュレーションを使用して付与日に公正価値で測定されました。報酬費用の合計は、必要な推定サービス期間にわたって支出されます。
研究開発コスト-研究開発費は発生時に支出されます。経営陣は、実施されたサービスに基づいて臨床研究機関(「CRO」)の費用と臨床試験研究の費用を計上し、研究の完了段階に該当する費用の見積もりをCROに依頼します。推定未払CRO費用は、調査が完了するにつれて修正される可能性があります。会社は、修正の原因となった事実が判明した期間に、見積経費の修正を記録します。
普通株式1株当たりの純損失— 当社は、ASC 260に従って普通株式1株あたりの純損失を計算しています。 一株当たり利益。普通株式1株あたりの基本および希薄化後の純損失は、普通株主に適用される純損失を、その期間中に発行された普通株式の加重平均数で割って決定されました。未払いの普通ストックオプション、権利確定されていない制限付株式、普通株式新株予約権を含む当社の希薄化可能性のある株式は、すべての期間の希薄化後の1株当たり純損失の計算に含まれていません。その結果、希薄化防止効果が生じるためです。
所得税— 当社は、ASC 740の規定に従って所得税を会計処理しています。 所得税、税務管轄区域に基づいて。繰延税金資産および負債は、財務諸表の既存の資産および負債の帳簿価額と、それぞれの課税基準および営業損失および税金上の繰越額との違いに起因する将来の税務上の影響を計上します。繰延税金資産と負債は、一時的な差異の回収または決済が見込まれる年の課税所得に適用されると予想される制定税率を使用して測定されます。税率の変更が繰延税金資産および負債に与える影響は、制定日を含む期間の収益に計上されます。当社は、繰延税金資産を、認識されそうな金額まで減額するために、評価引当金を計上しています。2023年12月31日および2023年9月30日の時点で、繰延税金資産に対して全額評価引当金が計上されました。
| 9 |
| 目次 |
長期資産の減損— CEL-SCIの固定資産は、借地権の改良、家具、設備で構成されています。ASC 360-10では、長期資産(グループ)の帳簿価額が回収できない可能性があることが事象または状況の変化から明らかになった場合にのみ、長期資産グループの減損審査を受けることを義務付けています。CEL-SCIの経常損失は、固定資産などの長期資産の減損を示唆するきっかけとなります。CEL-SCIはこれらの資産を審査して、事象や状況の変化が減損の存在を示しているかどうかを判断します。減損の兆候がある場合、会社は回復可能性をテストし、必要に応じて減損を測定して記録します。減損損失の額は、資産(グループ)の帳簿価額が公正価値を上回る金額になります。
見積もりの使用— 米国会計基準に準拠した財務諸表を作成するには、経営陣は財務諸表とそれに付随する開示で報告される金額に影響する見積もりと仮定を行う必要があります。これらの見積もりは、現在の出来事や会社が将来行う可能性のある行動に関する経営陣の最善の知識に基づいています。見積もりは、とりわけ、在庫陳腐化、見越金、ストックオプション、長期資産の減価償却のための耐用年数、使用権資産とリース負債、繰延税金資産、および関連する評価引当金の会計処理に使用されます。実際の結果は予想とは異なる可能性がありますが、経営陣は通常、そのような違いが特定の年の財務諸表に重大な影響を与えるとは考えていません。さらに、使用権資産とリース負債の計算では、見積もりと仮定を使用して、増分借入金利と予想されるリース期間を決定しました。当社は、ストックオプションとリース資産と負債の評価に使用される見積もりを重要視しています。
最近採択された会計基準
2016年6月、財務会計基準審議会(「FASB」)は、会計基準更新第2016-13号を発行しました。金融商品 — 信用損失(トピック326):金融商品の信用損失の測定(「ASU 2016-13」)。 ASU 2016-13では、償却原価ベースで測定された金融資産(または金融資産グループ)を、回収予定の正味金額で提示する必要があります。ASU 2016-13の改正により、現在の米国会計基準における発生損失減損の方法論が、予想される信用損失を反映し、より幅広い合理的かつ裏付けとなる情報の検討を必要とする方法論に置き換えられました。ASU 2016-13は、2019年12月15日以降に開始する会計年度に、その会計年度内の中間期間を含め、小規模な報告会社を除くSEC申告者に有効でした。小規模な報告会社であるため、当社は2022年12月15日以降に開始する会計年度に、その会計年度内の中間期間を含め、新しい基準を採用することが許可されました。2023年10月1日より、当社は修正された遡及的移行方法を用いてASU 2016-13を採用しました。ASU 2016-13の採用は、会社の財政状態、経営成績、またはキャッシュフローに影響を与えませんでした。
新しい会計上の宣言— 当社は最近発行されたすべての会計上の声明を検討しており、そのような宣言の採用が財務諸表に重大な影響を与えるとは考えていません。
B. 流動性
当社は創業以来、ヒト免疫防御システム、特許出願、研究開発、管理費、製造・検査施設の建設と拡張、臨床試験の実施に関連する特定の専有技術と科学的知識の取得、多額の費用を負担してきました。当社は、このような費用を主にローンや有価証券の公的および私的売却による収入で賄っています。当社の主要な治験薬であるMultikineを市場に投入するための取り組みを継続するには、追加の資本調達または追加の長期資金調達が必要になります。資金調達能力は、会社の制御が及ばない市況に左右されることがあります。商業ベースで開発される製品の販売について、当社が規制機関から承認を得ることができるかどうかは不明です。最終的に、会社は製品の開発を完了し、適切な規制当局の承認を得て、コスト構造を支えるのに十分な収益を得なければなりません。
マーケティング承認を通じて会社の資金を調達するために、当社は企業パートナーシップ、負債および/またはエクイティファイナンスという形で追加の資本を調達する予定です。当社は、これまで一貫して資金調達を行ってきたことと、Multikineが進行性原発性頭頸部がんの2つの治療群のうちの1つを対象とした第3相試験で大きな生存利益を示したため、追加の資金を調達できると考えています。しかし、会社が適時に追加資金を調達することに成功するという保証や、その資金が許容できる条件で会社に提供されるという保証はありません。会社が必要な金額を調達しない場合、必要な資金を調達できるようになるまで、事業を縮小しなければならない可能性があります。
| 10 |
| 目次 |
会社の営業損失が繰り返し発生し、将来の流動性ニーズがあるため、当社が継続企業として存続できるかどうかについては大きな疑問があります。財務諸表には、この不確実性の結果から生じる可能性のある調整は含まれていません。
C. 株主資本
普通株式の売却による収入
2023年11月、同社は売却しました
株式報酬
2023年12月31日現在の株式報酬制度の基礎となる株式情報は次のとおりです。
プラン名 |
| 株式総数 予約済みです 計画中 |
| |
インセンティブ・ストック・オプション・プラン |
|
|
| |
非適格ストックオプションプラン |
|
|
| |
株式ボーナスプラン |
|
|
| |
株式報酬制度 |
|
|
| |
インセンティブ株式ボーナスプラン |
|
|
| |
ストックオプション活動:
|
| 12月31日に終了した3か月間 |
| |||||
|
| 2023 |
|
| 2022 |
| ||
オプションが付与されました |
|
| - |
|
|
|
| |
行使したオプション |
|
| - |
|
|
| - |
|
オプションは没収されました |
|
|
|
|
|
| ||
オプションは期限切れです |
|
| - |
|
|
|
| |
株式ベースの報酬費用:
|
| 12月31日に終了した3か月間 |
| |||||
|
| 2023 |
|
| 2022 |
| ||
従業員 |
| $ |
|
| $ |
| ||
非従業員 |
| $ |
|
| $ |
| ||
従業員報酬費用には、権利確定期間中に支出されるオプションおよび制限付株式に関連する費用が含まれます。従業員以外の費用には、関連するサービス契約の期間中にコンサルタントに発行されたオプションや株式に関連する費用が含まれます。
| 11 |
| 目次 |
新株予約権と非従業員オプション
次のグラフは、2023年12月31日に発行された新株予約権と非従業員オプションを表しています。
ワラント/ [オプション] |
| 発行日 |
| 行使時に発行可能な株式 ワラント/オプションの |
|
| 行使価格 |
|
| 有効期限 | |||
シリーズ N |
|
|
|
|
| $ |
|
| |||||
シリーズ UU |
|
|
|
|
| $ |
|
| |||||
シリーズX |
|
|
|
|
| $ |
|
| |||||
シリーズ Y |
|
|
|
|
| $ |
|
| |||||
シリーズ MM |
|
|
|
|
| $ |
|
| |||||
シリーズ NN |
|
|
|
|
| $ |
|
| |||||
RRシリーズ |
|
|
|
|
| $ |
|
| |||||
コンサルタントオプション |
|
|
|
|
| $ |
|
| |||||
1. エクイティ・ワラント
新株予約権の変更
2023年12月31日に終了した3か月間、株式として記録されたワラントは行使されませんでした。株式として記録されている以下の新株予約権は、2022年12月31日に終了した3か月間に行使されました。
ワラント |
| ワラントの行使 |
|
| 行使価格 |
|
| 収入 |
| |||
RRシリーズ |
|
|
|
| $ |
|
| $ |
| |||
SSシリーズ |
|
|
|
| $ |
|
|
|
| |||
|
|
|
|
|
|
|
|
| $ |
| ||
2023年12月31日に終了した3か月間に、株式の有効期限が切れたり、延長されたりしたワラントはありませんでした。2022年10月28日、シリーズRRワラントの有効期限が2022年10月30日から2024年10月30日までの2年間延長されました。この拡張の追加費用は約$でした
2. コンサルタントに発行されるオプションと株式
2023年12月31日および2022年12月31日に終了した3か月間に、当社は
2023年12月31日に終了した3か月間、コンサルタントにオプションは発行されませんでした。2022年12月31日に終了した3か月間は、
2023年12月31日および2022年12月31日に終了した3か月間に、当社が記録した費用の総額は約$でした
D. 関連当事者取引
2023年12月31日に終了した3か月間、当社の普通株式の制限付株式は関連当事者によって購入されませんでした。
2022年10月28日、シリーズRRワラントの有効期限が2022年10月30日から2024年10月30日までの2年間延長されました(注C)。この拡張の追加費用は約$でした
| 12 |
| 目次 |
E. コミットメントと不測の事態
臨床研究契約
Ergomedとの共同開発および収益分配契約に基づき、Ergomedは最大$を拠出することに同意しました
リース契約
同社はメリーランド州ボルチモア近郊の製造施設をリースしています(サントーマスリース)。建物は会社の仕様に従って改造されました。これにより、会社は会社の第3相臨床試験用のマルチカインを製造し、規制当局の承認があれば医薬品の販売に使用できるようになりました。リースの期間は20年で、年間基本賃料は毎年 3% に引き上げる必要があります。会社は、すべての不動産税と個人財産税、保険料、維持費、修理費、光熱費を支払う必要があります。このリースにより、会社の選択により、10年間のリース期間を2回延長するか、2028年10月に期限が切れる20年間のリースの終了時に建物を購入することができます。更新オプションは、使用権、資産、リース負債の計算には含まれていません。これらのオプションの行使が合理的に確実ではないからです。
San Tomasのリースは、会社の貸借対照表ではファイナンスリースと、オフィス機器のその他のいくつかの小規模なファイナンスリースに分類されます。金融使用権資産は、基礎となるリース期間にわたって定額法を使用して減価償却されています。2023年12月31日および2022年12月31日に終了した3か月間にファイナンスリースに関連して支払われた現金の総額は約$でした
2023年1月11日、会社は約$を入金する必要がありました
2023年12月31日現在のファイナンスリースに基づく将来の最低リース料のおおよその最低額は次のとおりです。
2024年9月30日に終了する9か月間 |
| $ |
| |
9月30日に終了する年度 |
|
|
|
|
2025 |
|
|
| |
2026 |
|
|
| |
2027 |
|
|
| |
2028 |
|
|
| |
2029 |
|
|
| |
その後 |
|
|
| |
将来の最低リース債務総額 |
|
|
| |
ファイナンスリース債務の帰属利息が少ない |
|
| ( | ) |
ファイナンスリース債務の正味現在価値 |
|
|
| |
ファイナンスリース債務の正味現在価値を差し引いた額—現在の部分 |
|
| ( | ) |
ファイナンスリース債務の正味現在価値-非流動部分 |
| $ |
|
| 13 |
| 目次 |
同社はオペレーティングリースで2つの施設をリースしています。会社の本社のリースは2025年11月30日に期限切れになります。その研究開発研究所のリースは、2021年9月にさらに10年間更新され、2032年2月29日に期限が切れます。更新は会計上の理由による変更と見なされ、更新日の時点で資産と負債の使用権が再評価されました。オペレーティングリースには、高額な賃貸料が含まれています。当社は、関連する家賃費用をリース条件よりも定額で計上しています。会社はオペレーティングリースのために約$のリース費用を負担しました
2023年12月31日現在、オペレーティングリースの将来の最低リース料は次のとおりです。
2024年9月30日に終了する9か月間 |
| $ |
| |
9月30日に終了する年度 |
|
|
|
|
2025 |
|
|
| |
2026 |
|
|
| |
2027 |
|
|
| |
2028 |
|
|
| |
2029 |
|
|
| |
その後 |
|
|
| |
将来の最低リース債務総額 |
|
|
| |
オペレーティングリース債務の帰属利息が少ない |
|
| ( | ) |
オペレーティングリース債務の正味現在価値 |
|
|
| |
オペレーティングリース債務の正味現在価値を差し引いたもの-現在の部分 |
|
| ( | ) |
オペレーティングリース債務の正味現在価値-非流動部分 |
| $ |
|
G. 特許
2023年12月31日と2022年12月31日に終了した3か月間、特許費用の減損はありませんでした。特許の加重平均償却期間は約
2024年9月30日に終了する9か月間 |
| $ |
| |
9月30日に終了する年度 |
|
|
|
|
2025 |
|
|
| |
2026 |
|
|
| |
2027 |
|
|
| |
2028 |
|
|
| |
2029 |
|
|
| |
その後 |
|
|
| |
合計 |
| $ |
|
H. 普通株式1株当たりの損失
1株当たりの基本損失は、普通株主が利用できる純損失を、その期間中に発行された普通株式の加重平均数で割って計算されます。未払いの普通ストックオプション、普通株式新株予約権および権利確定されていない制限付株式を含む当社の希薄化の可能性のある株式は、希薄化防止効果が生じる場合、希薄化後の1株当たり純損失の計算には含まれません。
| 14 |
| 目次 |
次の表は、基本および希薄化後の1株当たり損失の計算の分子と分母を調整したものです。
|
| 12月31日に終了した3か月間 |
| |||||
|
| 2023 |
|
| 2022 |
| ||
1株当たりの損失 — 基本損失、希薄化後 |
|
|
|
|
|
| ||
普通に利用可能な純損失(基本損失、希薄化後) |
| $ | ( | ) |
| $ | ( | ) |
加重平均発行済株式数 — 基本株式と希薄化後株式 |
|
|
|
|
|
| ||
普通株式1株あたりの基本損失と希薄化後損失 |
| $ | ( | ) |
| $ | ( | ) |
ASC 260の偶発発行可能株式ガイダンスに従い、 一株当たり利益、希薄化後の1株当たり純利益(損失)の計算には、12月31日時点で希薄化防止措置が適用されていたため、以下の有価証券は含まれていません。
|
| 2023 |
|
| 2022 |
| ||
オプションとワラント |
|
|
|
|
|
| ||
権利が確定していない制限付株式 |
|
|
|
|
|
| ||
合計 |
|
|
|
|
|
| ||
J. 後続のイベント
2024年2月9日、会社は売却しました
| 15 |
| 目次 |
アイテム 2.経営陣による財政状態と経営成績の議論と分析
会社概要
CEL-SCI Corporationは、体の自然な防御システムである免疫システムを利用して、がんやその他の病気の治療を改善することを目的とした研究開発を専門とする臨床段階のバイオテクノロジー企業です。CEL-SCIは現在、以下の製品候補と技術の開発に注力しています。
| 1) | マルチカインは、特定の頭頸部がんの潜在的な治療薬として開発中の治験中の免疫療法です。そして |
|
|
|
| 2) | 関節リウマチの潜在的な治療薬として、いくつかの製品候補を含むL.E.A.P.S.(リガンドエピトープ抗原提示システム)テクノロジー(LEAPS)が開発中です。 |
マルチカイン(白血球インターロイキン、注射)は、この治験薬の正式名称で、わかりやすくするために、このレポートではマルチカインと呼ばれています。Multikineは、当社がこの治験薬として登録した商標です。この専有名は、今後規制当局に提出される予定の承認申請に基づき、FDAの審査の対象となります。当社の製品候補はいずれも、食品医薬品局(FDA)またはその他の規制機関によって、ヒトの病気の治療を目的とした販売、物々交換、交換が承認されておらず、これらの製品の安全性または有効性がいかなる用途でも確立されていません。米国のFDA、およびほとんどの外国の同等の機関から販売承認を取得できるという保証はありません。
マルチラインと第III相臨床試験の結果
免疫療法は大規模で急成長している市場です。免疫療法は、患者自身の免疫システムを使って病気と戦います。これらの「標的療法」は現代のがん研究の最前線にあります。2023年1月のブルームバーグの最近のレポートによると、
Grand View Research, Inc.の新しいレポートによると、世界のがん免疫療法市場は、2030年までに1964.5億米ドルに達し、予測期間中に7.2%のCAGRを記録すると予想されています。ターゲットを絞った作用により、がんに対する免疫療法の採用が他の治療法よりも増加しているため、予測期間中の採用が増えると予想されます。さらに、腫瘍学に使用される新しい免疫療法に対する権威主義的機関からの規制当局の承認の増加も、市場の成長をさらに促進すると予想されます。(https://www.bloomberg.com/press-releases/2023-01-18/cancer-immunotherapy-market-worth-196-45-billion-by-2030-grand-view-research-inc) |
CEL-SCIは、主要な治験薬Multikine®(白血球インターロイキン、注射)で、この成長市場に参加したいと考えています。Multikineはすでに複数の臨床試験で約750人の患者さんを対象に試験されています。その中には、患者数928人の綿密に管理された多施設共同第III相ランダム化比較試験が含まれます。マルチカインは、承認されているがん免疫療法の中でもユニークです。 最初に与えられた、診断直後と手術前。CEL-SCIは、第III相臨床試験により、手術前の治療からわずか数週間以内に、マルチカインによって腫瘍のサイズが小さくなったり、病気が「ダウンステージ」になったりすることが実証されたと考えています。重要なのは、これらの減量および/またはダウンステージを受けた患者さんには 死亡リスクは5年で半分に減りましたのフォローアップ。CEL-SCIは、確認試験の結果を待たずに、患者がMultikineにすぐにアクセスできるようにするための販売承認と承認を得るために、ヨーロッパ、英国、米国、カナダの規制当局と協議中です。
2023年、マルチカインのターゲット患者数は世界中で年間約145,000人の患者を含み、その3分の2以上が米国外にいると推定されています。対象となるケースの世界的な増加率は、2030年までに30%増加すると予想されています。(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10304137)
マルチカインとは何ですか?誰のためのものですか?マルチカインは、天然のサイトカインと小さな生体分子の混合物からなる生物学的薬用免疫療法です。マルチカインは、第一選択治療として腫瘍と隣接するリンパ節の周囲に3週間注射されます 前標準治療(SOC)、手術とその後の放射線療法または化学放射線療法です。マルチカインを使用する理由は、標準治療や病気の進行によって局所免疫系が損なわれる前に、腫瘍に対する局所免疫反応を引き起こすことです。
| 16 |
| 目次 |
マルチカインの対象集団は、口腔または軟口蓋に切除可能な局所進行型の頭頸部原発性扁平上皮がん(SCCHN)を患い、治療を受けていない成人患者です。
| · | リンパ節転移はありません(PETスキャンによる) |
| · | 低PD-L1腫瘍発現(TPS) |
PD-L1は腫瘍細胞表面にあるタンパク質受容体で、腫瘍が免疫系を撃退するのを助けます。CEL-SCIは、PD-L1が低い腫瘍の患者は、患者の免疫系に対する腫瘍の防御力が低いため、マルチカインに反応する可能性が高いと考えています。CEL-SCIの推定では、PD-L1が低い腫瘍の患者は、局所進行した原発性SCCHN患者の約70%を占めています。
マルチカインは安全上の問題もなく生存期間を延ばします。Multikineの臨床調査では、ランダム化比較第III相試験(RCT)で、対象集団で次のことが実証されました。
| · | 死亡リスクは5年で半分に減りました 対コントロール; |
| · | 対照群と比較した場合の5年全生存利益の絶対値28.6%(p=0.0015)。 |
| · | 0.349対対照ハザード比(95%のCI) [0.18, 0.66]、ウォルド p=0.0012); |
| · | > 35% の手術前の減量および/またはダウンステージ率(p |
| · | PD-L1の腫瘍発現が低い(KeytrudaとOpdivoが最も効果が高いPD-L1と比較して)。 |
複数の臨床試験にわたって、マルチカイン治療を受けた約750人の被験者で実証可能な安全性シグナルや毒性は観察されませんでした。有害事象(AE)と重篤な有害事象(SAE)の発生率は、治療群と対照群で有意差はありませんでした。マルチカイン関連の死亡例はなく、中止されたのは2回だけでした。手術前の多関節関連AEは局所的で手術後に消失しました。文献では、マルチカインの成分の一部は全身投与すると毒性がある可能性があると報告されていますが(TNFα、IFNγ、IL-1βなど)、これらの毒性は、主にマルチカインの局所注射と投与による送達により、第III相試験で投与された用量の何倍もの用量でもマルチカインでは現れませんでした。
CEL-SCIは、2022年の米国臨床腫瘍学会(ASCO)、2022年と2023年の欧州医学腫瘍学会(ESMO)、2023年の欧州頭頸部腫瘍学会(EHNS)の年次頭頸部腫瘍学会(ECHNO)、2023年の欧州治療放射線腫瘍学会(ESTRO)の年次会議で、そのデータを要約およびポスターとして公開しました)と2023年アメリカ頭頸部協会(AHNS)。これらの出版物には次のURLからアクセスできます http://www.cel-sci.com/.
マルチラインは、術前の反応を誘導することによって機能します。CEL-SCIは、マルチカイン治療後に統計的に有意な術前の反応を観察しました。そのため、CEL-SCIは次のことを信じています。
| ➢ | マルチラインは術前の反応を引き起こします。 |
| ➢ | 手術前の反応は寿命を延ばします。 |
| ➢ | したがって、術前に反応を示すと予測される患者を増やすことで、対象集団の生存率が大幅に向上するはずです。 |
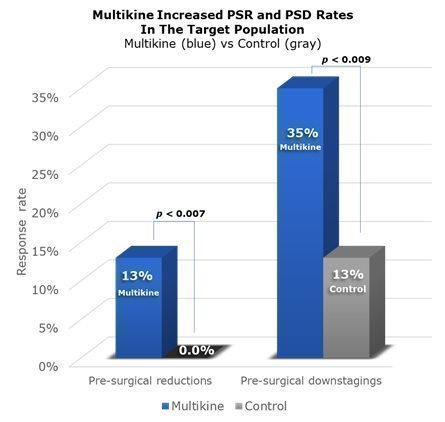
「術前の反応」とは、手術前に病気が大きく変化することです。CEL-SCIは、第III相試験で2種類の反応を示しました。まず、腫瘍のサイズの「縮小」がありました。30%以上の縮小は、「術前の縮小」、略して「PSR」とみなされます。第二に、手術前に病気の「ダウンステージ」(例えば、病気がIV期からIII期への改善など)がありました。CEL-SCIはこれを「術前のダウンステージング」、または略して「PSD」と呼んでいます。CEL-SCIの2022年のESMOがんカンファレンスのプレゼンテーションはPSRについて報告され、CEL-SCIの新しい2023年のESMOプレゼンテーションはPSDで報告されました。
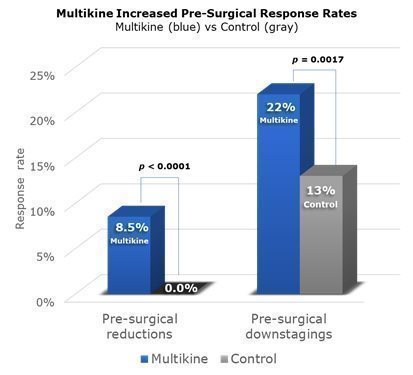
第III相試験全体を通して、PSRはマルチカイン患者の8.5%にみられました 無し コントロールグループにあります。PSDはマルチカイン患者の22%に見られましたが、対照群では13%でした。マルチカインは手術前にこれらの患者に与えられた唯一の治療法だったので、マルチカインがPSRとPSDの発生率が高くなったのはマルチカインであるに違いないとCEL-SCIは強く信じています。これらのデータは下に視覚的に示されています。背の高い青い列は、第III相試験でマルチカイン治療を受けた529人の患者全員のPSRおよびPSD率を示し、灰色の列は、394人の対照患者全員のPSRおよびPSD率を示しています。列の上のp値は、マルチカインとコントロールグループの比較を示しています。マルチカインでは、統計的に言えば、CEL-SCIは、第III相試験におけるPSR/PSDの増加がマルチカインによるものである可能性は95%以上あると考えています。
| 17 |
| 目次 |

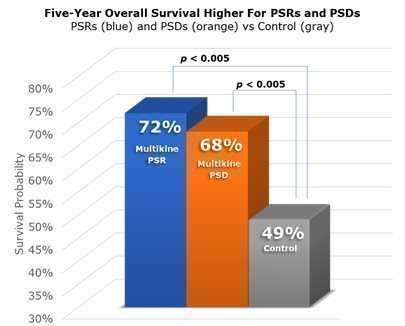
マルチカインが対照群と比較してPSRとPSDにつながる可能性が高いことを示すだけでは不十分でした。CEL-SCIは、PSRとPSDが生存率の向上につながるかどうかもテストする必要がありました。CEL-SCIの第III相試験では、PSR患者は5年後に生存する可能性が72%でしたが、対照患者は5年後に生存する可能性が約49%しかないことが示されました。PSD患者は、CEL-SCIの第III相試験で同様の改善が見られました。彼らの5年間の生存率は約 68% でした。したがって、CEL-SCIの第III相試験では、マルチカインによるPSRまたはPSDを患った患者は、マルチカインで治療されなかった患者よりも長生きしたことが統計的に示されました。これらの結果はサブグループではなく、第III相研究集団全体からのものであることに注意することが重要です。p値が0.005未満ということは、これらの結果がランダム確率ではなくマルチカインによるものである可能性が少なくとも 99.5% あったことを意味します。 下の図は、PSR患者(青)、PSD患者(オレンジ)、マルチカインを投与されなかった患者(灰色)について、少なくとも5年生存する可能性を示しています。
| 18 |
| 目次 |
CEL-SCIの対象集団は、標準検査による診断時に医師が簡単に選択できます。CEL-SCIは、Multikineと生存利益の間の強力な統計によって裏付けられた潜在的な因果関係を示したので、Multikineは迅速に承認されるべきだと考えています。しかし、第III相試験の主要評価項目である 10% の生存利益が満たされなかったことを思い出してください。では、Multikineが実際に患者さんのためになるとどうして言えるのでしょうか?答えは、マルチカインはPSR/PSD患者を助けることができることを示していますが、第III相試験集団では、全集団で10%の生存利益をもたらすのに十分なPSR/PSDがなかったということです。言い換えれば、PSR/PSDによる効果は、研究に参加した他の患者と平均すると薄すぎました。
これによってCEL-SCIがMultikineのPSR/PSDを引き起こす能力を分析したときに統計的有意性が観察され、これらのPSR/PSDが統計的に5年以上生きる可能性が高くなるという事実は変わりません。CEL-SCIは、PSR/PSDの数が多いターゲット集団を定義するだけでよかったのです。そのために、CEL-SCIはMultikineの生物学的作用機序を分析し、最もよく知っている規制当局や医師と話をして、細胞レベルまでの患者固有データを含む第III相データの指針を得ました。もちろん、これにはすべて時間がかかりましたが、CEL-SCIはそれが成功し、前進する準備ができていると信じています。
第III相試験から最初に報告したことの1つは、マルチカインが手術後に「低リスク」と見なされた患者、つまり研究対象集団の約40%に最も効果があることが示されたということでした。これらの患者は、マルチカインを投与しなかった「低リスク」対照群と比較して、5年絶対生存率が14.1%と大幅に向上しました。これらの患者はマルチカインから最も恩恵を受けることは生物学的に理にかなっています。なぜなら、彼らはまだ病気によって免疫系が損なわれていない傾向があったからです。対照的に、「ハイリスク」の患者は通常、リンパ節に腫瘍が浸潤しており、手術後に化学療法が必要でした。彼らのリンパ節が損なわれていたため、免疫系が機能しにくくなり、マルチカインの投与を受けるまでさらに3週間待たずに、できるだけ早く手術を受ける必要がありました。CEL-SCIは当初、診断時に「低リスク」患者、つまり、腫瘍に浸潤したリンパ節がなく(N0)、または腫瘍に浸潤したリンパ節が1つしかなく(N1)、PETスキャンで判定された被膜外転移もない患者を選択するための基準を開発しました。CEL-SCIは2022年のASCOカンファレンスでこれらの基準を発表しました。しかし、規制当局や医師と話し合った結果、CEL-SCIは、N1の患者を除外し、N0の患者のみを対象集団に含めると、治療成績がさらに改善される可能性があることを確認しました。
CEL-SCIはまた、フェーズIIIのデータから、マルチカインはPD-L1の発現が高い患者よりもPD-L1腫瘍の発現が低い患者の方が効果的であることがわかりました。この分析は、統計分析計画で事前に指定されていました。低PD-L1をターゲットにすることは、マルチカインを他の免疫療法と区別することでもあります。たとえば、KeytrudaやOpdivoのようなチェックポイント阻害薬は、PD1/PD-L1受容体の相互作用を遮断することで作用するため、PD-L1が高い患者に最も役立つようです。この相互作用(PD1/PD-L1)が起こると、腫瘍を攻撃する免疫細胞が不活性化/死に至るからです。現在、これらの薬はいずれも手術前の第一選択治療として承認されていませんが、たとえ将来そのような承認が得られたとしても、このグループのPD-L1が低い患者の大多数は、依然としてマルチカインを必要とすると予想されます。
| 19 |
| 目次 |
CEL-SCIの対象集団は、診断時にN0リンパ節転移があり、PD-L1腫瘍の発現(腫瘍比率スコア(TPS)で定義)も低い患者を対象としています。
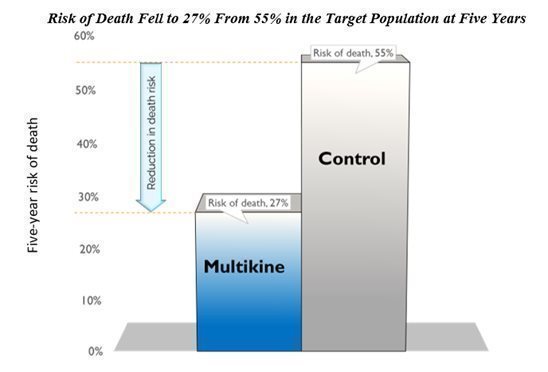
Multikineは、対象集団の5年間の死亡リスクを半分に減らしました。CEL-SCIの結果は、Multikineが最終的な対象集団の対照群と比較して、5年で死亡リスクを半分に減らすことができることを示しています。生存率は、5年で対照群の45%からマルチカイン群の73%に増加しました。これは、以下に示すように、死亡リスクがコントロールの55%からマルチカイングループの27%に低下したことを意味します。
| 20 |
| 目次 |
対象集団におけるマルチカインの生存効果を確認するもう1つの方法は、以下に示すように、ESMO '23ポスターのカプラン・マイヤー曲線です。縦軸は生存確率で、横軸は月単位の期間です。青いマルチラインは緑のコントロールラインよりはるかに上です。つまり、マルチカイングループの生存確率は、コントロールと比較してどの時点でもはるかに高いということです。これらの結果のp値は0.0015と低く、これは統計的に見て非常に重要です。
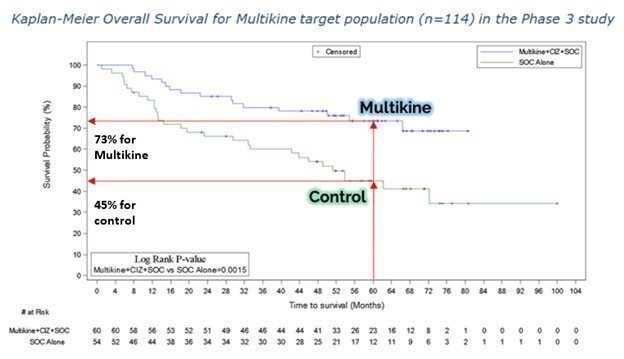
CEL-SCIの医師コンサルタントは、これら2つの生存曲線を早期(たとえば12か月)に分離することで、マルチカインの潜在的なプラスの効果を裏付けることができると言っています。
生存利益のもう1つの尺度は、「ハザード比」と呼ばれ、2つの異なるグループの死亡確率を比較します。ここで、マルチカインのターゲット集団では、ハザード比は0.35でした。つまり、マルチカイングループでは、コントロールグループの約3分の1の頻度で死亡しました。また、ハザード比の95%の信頼区間が1.0をはるかに下回っていることに注意することも重要です。マルチカインの場合、統計的に言えば、別の研究でマルチカインを対象集団でテストした場合、ハザード比が0.18から0.66の間に下がる確率は95%です。「いわゆるワーストケースシナリオ」としてのハザード比0.66は、ほとんどの医薬品承認に必要なハザード比よりもまだ低い(良い)。
全生存期間の延長、死亡リスクの低下、早期分離によるカプラン・マイヤー曲線の幅の広い分離、低ハザード比、低いp値、低い信頼区間など、Cel-SCIは、次の図に示すように、対象集団におけるPSR/PSD率が高いことが原因であると考えています。
| 21 |
| 目次 |
CEL-SCIは、これらすべてのデータを基に、別の臨床試験が完了するまで待たずに、新しい対象集団に対して迅速/条件付き承認を求める計画を裏付けています。
CEL-SCIの今後の規制戦略は、可能な限りMultikineの即時承認を求めることです。CEL-SCIは、生存利益が高く、統計が充実しているため、条件付き承認経路とフォローアップの確認研究を用いて、これまでに生成されたデータに基づいてMultikineの承認を求めるつもりです。この見解は規制当局とコンサルタントからのアドバイスに基づいており、CEL-SCIは、迅速/条件付き承認の規制経路は私たちの状況に合わせて特別に設計されていると考えています。
第III相試験が設計されたとき、手術前に低リスクまたは高リスクの患者グループのいずれかを除外する証拠はありませんでした。したがって、この研究には、すでに病気によって免疫系が損なわれているハイリスク患者の大部分を含める必要がありました。これらの被験者は一般的にマルチカインに反応しませんでした。CEL-SCIは、PSR/PSDを発症する可能性が最も高い患者に焦点を当て、残りは除外するように、第III相試験全体と比較して対象集団を絞り込みました。
CEL-SCIは、対象集団での有効性がプロスペクティブにテストされていないことを認めていますが、CEL-SCIは、これまでに得られたデータが、マルチカインへの即時アクセスを正当化する説得力のある患者のニーズをすでに提示していると考えています。これが、そもそも条件付き承認経路が作成された理由です。CEL-SCIは、特にマルチカインの安全性プロファイルと、対象集団の定義を機械的および経験的に裏付けるデータを考慮すると、患者がマルチカインPSR/PSDの利点を得て生存率を高めるまで、もう何年も待つ必要はないという見解に基づいて、規制当局の承認申請を行うつもりです。
患者がMultikineにすぐにアクセスできるようにするためのベネフィットとリスクのバランスを以下に示します。

「満たされていないニーズ」は、世界中のすべての主要な規制機関によって承認される要因です。マルチカインのターゲット集団では、生存率を向上させるという途方もないニーズも満たされていません。現在の標準治療では、5年生存の可能性は約50/50しかありませんが、マルチカインでは、フェーズIIIのデータに基づくと、その生存率を70%以上に高めることができます。化学療法は一部の頭頸部患者の治療成績を改善しますが、化学療法はマルチカインの目標集団に該当しそうにないリスクの高い患者にのみ適応となります。現在利用可能な免疫療法は、切除可能な腫瘍の患者に手術前に投与されるマルチカインとは対照的に、手術後または手術が適応とならない場合に行われます。入手可能なチェックポイント阻害薬はPD-L1の発現が高い腫瘍に最もよく作用しますが、マルチカインはPD-L1の発現が少ない腫瘍に最も効果的です。したがって、Multikineの対象集団は現在の治療法では十分なサービスを受けておらず、今後も十分な効果が得られませんが、Multikineは生存率向上のニーズを満たすことができます。
私たちが協力している主要な規制機関、米国FDA、カナダ保健省、欧州医薬品庁(EMA)、英国(UK)の医薬品・ヘルスケア製品規制庁(MHRA)はすべて、対象集団が十分なプロスペクティブ検査を受けておらず、患者にとっての臨床的利益を裏付ける強力なデータがある状況向けに設計された条件付き承認経路を用意しています。その理由は、多くの場合、患者は新薬の恩恵を受ける前に追加のデータを待つ必要はないと規制当局が理解しているからです。状況はそれぞれ異なり、特定の事実によって異なります。
CEL-SCIは2023年の初めにFDAとカナダ保健省と会議を開きましたが、2023年10月22日のESMO会議で初めて発表された新しいデータはまだ見ていません。CEL-SCIは2024年第1四半期にそれをFDAに提供する予定です。カナダでは、CEL-SCIは、2023年に提案したように、条件遵守通知(NOC/C)経路に基づいて条件付き承認を求める予定です。これにより、市販後の確認研究が進行中でも、安全性と「有望な」有効性データに基づいて医薬品を承認することができます。承認することができます 前市販後の調査。米国では、FDAも同様の迅速な承認経路を採用していますが、2022年12月の新しい法律により、米国で承認を得る前に確認研究への登録が義務付けられています。そのため、CEL-SCIは2024年にできるだけ早くこの確認試験を開始し、その後、その研究のデータを使用して迅速な承認を求める予定です。
ただし、CEL-SCIの最優先事項は、CEL-SCIが最終的な対象人口データを提出したヨーロッパと英国での承認を求めることです。海外の対象集団には、北米の2倍以上の患者がいます。ヨーロッパと英国では、CEL-SCIは科学的助言のリクエストを提出しており、2024年上半期に会議が開かれることを期待しています。会議の日付が決まれば、CEL-SCIはデータについて話し合い、今後の道筋についてアドバイスを得ることができます。その時点で、CEL-SCIに正式な申請を進めるようにアドバイスされる可能性があります。
| 22 |
| 目次 |
流動性と資本資源
創業以来、当社は株券、転換社債、ローン、および特定の研究助成金の発行を通じて事業資金を調達してきました。Multikineの開発を続け、他の薬剤候補を臨床試験に持ち込むにつれて、同社は引き続き純営業損失を計上する可能性があります。会社が利益を上げるまでは、これらの資金調達手段またはその他の一部または全部を会社の資本要件を支援するために利用することができます。
当社が調達した資本は、主に特許出願、研究開発、管理費、会社の製造および検査施設の建設とアップグレード、および臨床試験に費やされています。同社は、自社の技術とノウハウのライセンス契約を締結するか、製品を販売するための規制当局の承認を受けるまで(数年かかる場合があります)、大きな収益を実現する見込みはありません。したがって、当社は、流動性と資本の要件をすべて満たすために、有価証券の売却による収益に依存しており、将来的にはそうしなければならないと予想しています。
会社が研究活動を続けるためには、追加の資金を調達するか、追加の長期資金を見つける必要があります。資金調達能力は、会社の制御が及ばない市況に左右されることがあります。当社が商業ベースで開発される製品の販売に必要な臨床試験を完了し、FDAの承認を得る能力は不明です。最終的に、会社は製品の開発を完了し、適切な規制当局の承認を得て、コスト構造を支えるのに十分な収益を得なければなりません。しかし、会社がその事業を支えるのに十分な資本を調達できるという保証はありません。事業からの定期的な損失と将来の流動性ニーズにより、当社が継続企業として存続できるかどうかについては大きな疑問があります。
当社がMultikineの第3相臨床試験を開始して以来、2023年12月31日現在、第3相臨床試験とFDAへの臨床研究報告書の提出にかかる直接費用として、約6,450万ドルの費用を負担しています。同社は、残りの第3相臨床試験とFDAへの臨床研究報告書の提出に約70万ドルの追加費用がかかると見積もっています。この見積もりは、第3相臨床試験の管理を担当するCROから現在入手可能な情報のみに基づいており、医薬品の製造などの他の関連費用は含まれていないことに注意してください。
同社は、ICONとErgomedという2つのCROを使ってグローバルな第3相試験を管理しています。ICONとErgomedは、どちらも腫瘍学試験の管理において国際的なリーダーです。
共同開発契約に基づき、エルゴメドは、マイルストーンとロイヤルティの支払いの1桁の割合と引き換えに、指定された最大額を上限として、臨床サービスを実施する研究に最大1,200万ドルを寄付することに合意しました。2023年12月31日時点で、約束された1,200万ドルの寄付のうち約1,190万ドルが実現しました。
2023年12月31日に終了した3か月間で、会社の現金は約90万ドル減少しました。この減少の大きな要因には、当社の通常業務の資金調達に使用された約490万ドルの現金と、ファイナンスリース債務の支払い約40万ドルが含まれ、2023年11月の資金調達による約450万ドルの純収入によって相殺されました。
2022年12月31日に終了した3か月間で、会社の現金は約470万ドル減少しました。この減少の大きな要因には、第3相臨床試験を含む当社の通常業務の資金として使用された約470万ドルの現金が含まれていました。
2023年12月31日に終了した3か月間、ワラントは行使されませんでした。2022年12月31日に終了した3か月間に、217,752件のワラントが加重平均行使価格2.05ドルで行使され、総収入は約50万ドルでした。
| 23 |
| 目次 |
経営成績と財政状態
当社は、2023年12月31日に終了した3か月間に約650万ドルの純営業損失を被りました。この純営業損失は、従業員および非従業員に対する約160万ドルの株式ベースの報酬と、約100万ドルの減価償却費を含む、多額の非現金費用で構成されています。
2023年12月31日に終了した3か月間で、研究開発費は2022年12月31日に終了した3か月間と比較して約100万ドル、つまり19%減少しました。この減少の主な要因には、Multikineの潜在的な商業的売却に備えて発生する費用の約20万ドルの削減、第3相調査に関連する費用の約60万ドルの削減、および従業員の株式報酬費用の約20万ドルの減少が含まれます。
2023年12月31日に終了した3か月間で、一般管理費は、2022年12月31日に終了した3か月間と比較して約10万ドル、つまり6%減少しました。この減少は主に、コンサルティング料が約10万ドル減少し、従業員の株式報酬費用が約10万ドル減少したためです。これらの減少は、その他の一般管理費の約10万ドルの純増加によって相殺されました。
主にリース負債に支払われる利息で構成される純利息費用は、2023年12月31日と2022年12月31日に終了した3か月間、それぞれ約20万ドルと比較的一定でした。
研究開発費用
同社の研究開発活動には、マルチカインとLEAPSが含まれます。以下の表は、各プロジェクトに関連する研究開発費を示しています。
|
| 12月31日に終了した3か月間 |
| |||||
|
| 2023 |
|
| 2022 |
| ||
マルチライン |
| $ | 4,329,252 |
|
| $ | 5,294,377 |
|
飛躍します |
|
| 23,257 |
|
|
| 98,169 |
|
合計 |
| $ | 4,352,509 |
|
| $ | 5,392,546 |
|
新薬の規制当局の承認を得るために必要な臨床研究やその他の研究には多額の費用がかかり、完了するまでに数年かかります。当社の臨床試験および研究プログラムの範囲は、主に会社が利用できる資金額と、当社が臨床試験の規制当局の承認をどの程度受けているかに基づいています。資本不足または規制当局の承認がないために、当社が臨床試験または研究を実施できない場合、当社が開発中の製品の規制当局の承認を得るために必要な研究や研究を完了できなくなります。規制当局の承認がなければ、当社は自社製品を販売することができません。会社のプロジェクトはすべて開発中なので、自社製品の販売からいつ収益を上げることができるかを予測することはできません。
重要な会計上の見積もり
会社の財政状態と経営成績に関する経営陣の議論と分析は、未監査の要約財務諸表に基づいています。これらの財務諸表の作成は、会計方針の選択と重要な会計上の見積もりの適用に基づいています。その中には、経営陣が財務諸表や注記に報告される金額に影響する判断、見積もり、仮定を行う必要があります。
当社は、財務状況と経営成績に影響を与えるより重要な見積もりのいくつかは、リースと株式ベースの報酬の分野にあると考えています。
ファイナンスおよびオペレーティングリースの使用権資産とリース負債を測定するには、推定リース期間と段階的な借入金利を決定する必要があります。これには経営陣による複雑な判断が必要です。リース契約の増額借入金利を決定するためのインプットや仮定を策定するには、経営陣が慎重な判断を下す必要があります。ストックオプションの公正価値は、ボラティリティや期待オプション寿命など、さまざまな判断の仮定を必要とするBlack-Scholesオプション価格モデルを使用して計算されます。報酬費用は、必要なサービスまたは権利確定期間中の費用として認識されます。パフォーマンスベースのオプションはモンテカルロシミュレーションモデルを使用して評価されます。このモデルでは、パフォーマンスの発生確率や市況、ボラティリティ、期待されるオプション寿命など、推定値に基づく入力が必要です。
| 24 |
| 目次 |
当社の重要な会計上の見積もりに関する詳細については、2023年9月30日に終了した年度のフォーム10-Kの会社の年次報告書のパートII、項目7を参照してください。これらの重要な会計上の見積もりの適用については、当社の取締役会の監査委員会で議論されています。
アイテム 3.市場リスクに関する量的および質的開示
当社は、自社が市場リスクの影響を大きく受けているとは考えていません。
アイテム 4.統制と手続き
開示管理と手続きの評価
当社は、会社の最高経営責任者や最高財務責任者を含む経営陣の指示と参加を得て、2023年12月31日現在の開示管理と手続きの設計と運用の有効性を評価しました。当社は、証券取引委員会への定期報告で開示する必要のある情報が、SECの規則と規則で定められた期間内に記録、処理、要約、報告され、そのような情報が蓄積され、必要に応じて最高経営責任者や最高財務責任者を含む会社の経営陣に伝達され、必要な開示に関する迅速な決定が可能になるように設計された開示管理と手続きを維持しています。会社の開示管理と手続きは、希望する開示管理目標を達成することを妥当なレベルで保証するように設計されています。
当社の最高経営責任者兼最高財務責任者は、2023年9月30日に終了した年度のForm 10-Kの年次報告書に記載されている重大な弱点のため、2023年12月31日現在、当社の開示管理および手続きは有効ではないと結論付けました。
財務報告に関する内部統制の変更
2023年12月31日に終了した3か月間に発生した、財務報告に対する会社の内部統制に発生した、財務報告に対する会社の内部統制に重大な影響を及ぼした、または重大な影響を与える可能性が合理的に高い変更はありませんでした。
| 25 |
| 目次 |
パート 2
アイテム 2.株式の未登録売却および収益の使用。
2023年12月31日に終了した3か月間に、当社は投資家向け広報サービスのコンサルタントに88,573株の制限付普通株式を発行しました。
当社は、これらの株式の発行に関して、1933年の証券法のセクション4(a)(2)で規定されている免除に頼っていました。これらの株式を取得した個人は洗練された投資家であり、会社の事業と運営に関する完全な情報を提供されました。これらの有価証券の募集または売却に関連する一般的な勧誘はありませんでした。これらの株式を取得した個人は、自分の口座で取得しました。これらの株式を表す証明書には、有効な登録届出書または登録の免除がない限り売却できないという制限付きの説明が付いています。これらの株式の発行に関連して、誰にも手数料やその他の形態の報酬は与えられませんでした。
アイテム 5.その他の情報
2023年12月31日までの四半期中に、規則10b5-1取引契約または非規則10b5-1取引契約(規則S-Kの項目408(c)で定義されているとおり)を採用または終了した取締役または役員はいません。
アイテム 6.展示品
番号 |
| 示す |
|
|
|
31 |
| ルール13a-14 (a) の証明書 |
|
|
|
32 |
| セクション 1350 認定 |
| 26 |
| 目次 |
署名
1934年の証券取引法の要件に従い、登録者は署名者に代わってこの報告書に正式に署名させ、正式に権限を与えられました。
| セルサイエンス株式会社 |
| |
|
|
|
|
日付:2024年2月14日 | 作成者: | /s/ ヘールト・カーステン |
|
|
| ヘールト・カーステンさん |
|
|
| プリンシパル・エグゼクティブ・オフィサー* |
|
* また、主任会計・財務責任者の立場で署名しています。
| 27 |