

2024年2月:ラリマー・セラピューティクス・ノムラボフスプ(CTI-1601)プログラムアップデート別紙99.3

このプレゼンテーションには、Larimar Therapeutics, Inc.(以下「当社」)の信念と仮定、および経営陣が現在入手可能な情報に基づく将来の見通しに関する記述が含まれています。このプレゼンテーションに含まれる歴史的事実の記述を除くすべての記述は、ラリマーのnomlabofusp(CTI-1601)およびその他の計画された製品候補の開発および商品化の能力、nomlabofusp臨床試験のタイミングと全体的な開発計画を含むラリマーの計画された研究開発活動、およびラリマーの事業戦略、資金調達能力、使用に関するその他の事項を含むがこれらに限定されない、将来の見通しに関する記述ですが、これらに限定されません資本、経営成績と財政状態、計画と目標について将来の運営。場合によっては、将来の見通しに関する記述を、これらの用語や他の類似用語の「かもしれない」、「するかもしれない」、「すべき」、「期待」、「意図」、「計画」、「予測」、「計画」、「可能性」、「続行」、「継続中」、「否定的」という言葉で区別できますが、すべての将来の見通しに関する記述にこれらの言葉が含まれているわけではありません。これらの記述にはリスク、不確実性、その他の要因が含まれており、実際の結果、業績、または業績が、これらの将来の見通しに関する記述で表明または暗示される情報と大きく異なる可能性があります。これらのリスク、不確実性、その他の要因には、ラリマーの製品開発活動の成功、費用、タイミング、nomlabofuspの臨床マイルストーンやFDAとの継続的なやり取りを含む非臨床試験と臨床試験の成功、費用、および臨床試験の成功、費用、および臨床試験(nomlabofuspの以前の非臨床および臨床データおよび試験は、後の臨床の結果または成功を予測できない場合があります)が含まれます。治験、評価。FDAが最終的にラリマーの意見に同意しない可能性があることnomlabofuspの開発戦略、公衆衛生危機がラリマーの将来の臨床試験、製造、規制、非臨床試験のスケジュールと運営、および一般的な経済状況に及ぼす潜在的な影響、nomlabofuspの製造プロセスを最適化および拡大するためにLarimarが関与するラリマーの能力と第三者メーカーの能力、nomlabofuspと将来の製品候補について規制当局の承認を得るLarimarの能力、Larimarが関与する第三者メーカーの能力。単独で、または将来の潜在的な協力者と一緒に、販売およびマーケティング能力を開発する能力、および承認された製品候補の商品化を成功させること、製品開発活動を行うために必要な資金を調達するラリマーの能力、およびラリマーが証券取引委員会(SEC)に提出した書類に記載されているその他のリスク。これには、フォーム10-Kの年次報告書、フォーム10-Qの四半期報告書、フォーム8-Kの最新報告書が含まれますが、これらに限定されません。証券取引委員会であり、www.sec.govで入手できます。これらの将来の見通しに関する記述は、ラリマーが現在知っている事実と要因、および将来の予測の組み合わせに基づいており、確信が持てません。その結果、将来の見通しに関する記述が正確でない可能性があります。このプレゼンテーションの将来の見通しに関する記述は、本書の日付現在のラリマーの経営陣の見解のみを表しています。ラリマーは、法律で義務付けられている場合を除き、理由の如何を問わず、将来の見通しに関する記述を更新する義務を負いません。将来の見通しに関する記述

Nomlabofusp(CTI-1601)の陽性トップラインフェーズ2データ皮膚と頬細胞の組織フラタキシン(FXN)レベルの用量依存的増加 Nomlabofuspは、最大28日間繰り返し皮下注射を行った後、一般的に耐容性が良好でした。参加者は50 mgを14日間投与し、その後1日おきに28日目までさらに14日間治療しました。皮膚細胞のベースラインFXNレベル

臨床段階の新規タンパク質補充療法プラットフォームリード候補nomlabofusp*(CTI-1601)は、タンパク質をミトコンドリアに送達することにより、フリードライヒ運動失調(FA)患者のフラタキシン欠乏症に直接対処するように設計された組換え融合タンパク質です。希少疾病用医薬品(米国およびEU)、希少小児疾患(米国)、ファストトラック(米国)、およびプライム(EU)の指定を取得 Nomlabofuspは一般的に耐容性が高く、4週間のプラセボ対照第2相試験と複数回漸増投与の第1相試験で、皮膚と頬細胞のフラタキシン(FXN)レベルがベースラインから用量依存的に上昇することが示されました 2024年第1四半期には1日25mgを投与し、中間データは2024年第4四半期に予定されています。OLE試験で用量を増加させる可能性があるため、部分臨床を継続するため、25 mgの治療データをFDAの審査に提出します。推定現金残高8,680万ドルを保有(2023年12月31日)、フラタキシンレベルを上昇させる可能性のある最初の治療法として考えられる第1相と第2相の一貫性。短期触媒を用いたFDA OLE研究で迅速な承認を目指す予定です強力な財務基盤*2023年10月現在、nomlabofuspはINN(国際非独占的名称)およびUSAN(United)として公開されました。州がCTI-1601に採用した名前)。**この見積もりは未監査であり、2023年度の決算手続きの完了により、暫定的かつ実際の結果は異なる場合があります。そのため、この見積もりは、米国で一般に認められている会計原則に従って作成された当社の完全監査済み財務諸表の代わりと見なすべきではありません。FXN欠損症はFAの病原性メカニズムにとって重要であるようであり、基礎疾患の病態生理学に対処する治療の必要性が引き続き満たされていないことをFDAは認めています。承認の迅速化を支援するための議論が進行中です。BLAの提出は2025年下半期を目標としています

フリードライヒ運動失調症(FA):まれで進行性の病気 5* E.C. Deutsch et al.分子遺伝学と代謝 101 (2010) 238—245。FA患者のほとんどは、組織、サンプリング技術、および考慮されるアッセイに応じて、正常なフラタキシンレベルの約20〜40%しか産生しません。両方の対立遺伝子の遺伝的欠陥によりフラタキシンレベルが低下します。進行性疾患初期症状には、不安定な姿勢や頻繁な転倒が含まれ、最終的には患者の平均余命は30〜50年で、通常は心臓病が原因で早期死亡します米国の患者、そしてほとんどの患者はEUにいます。患者の70%は14歳より前に診察を受けます。承認された治療法はありませんフラタキシンレベルを上げるFAに対して承認された治療法だけがフラタキシン欠乏症に対処できません
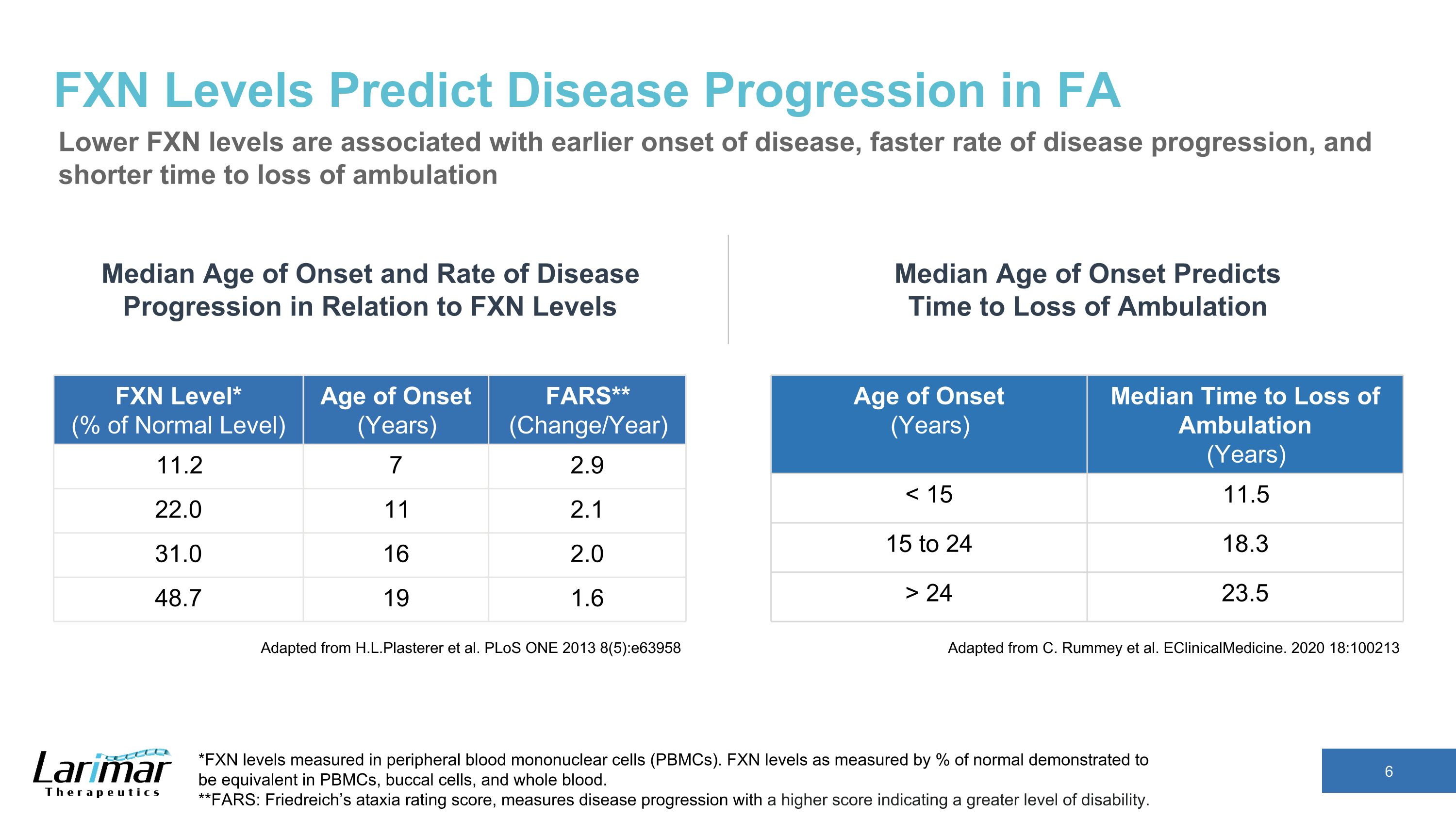
FXNレベルはFAの病気の進行を予測します FXNレベルが低いほど、病気の早期発症、病気の進行速度が速く、歩行不能になるまでの時間の短縮につながります。H.L.Plastererらから引用しています。PLoS ONE 2013 8 (5): e63958 発症年齢 (歳) 歩行不能になるまでの時間の中央値 (年) 24 23.5 FXNレベルに対する発症年齢と疾患進行率の中央値 *末梢血単核細胞 (PBMC) で測定されたFXNレベル。正常値の%で測定したFXNレベルは、PBMC、口腔細胞、全血で同等であることが示されました。**FARS:フリードライヒの運動失調評価スコアは、病気の進行を測定します。スコアが高いほど、障害のレベルが高いことを示します。FXNレベル*(正常レベルの%)発症年齢(年)FARS**(変化/年)11.2 7 2.9 22.0 11 2.1 31.0 16 2.0 48.7 19 1.6 C. Rummeyらからの引用です。臨床医療。2020 18:100213 発症年齢の中央値は歩行が途絶えるまでの時間を予測します

25mgと50mgのコホートを対象とした第2相用量探索研究目標:PK/PDの特性をさらに明らかにし、安全性を評価して長期的な用量および用量計画を策定します。治療スケジュール-nomlabofusp(CTI-1601)またはプラセボ 28日間の治療期間 16 17 18 19 15 20 21 22 23 24 25 26 27 28 2 3 4 5 1 6 7 8 9 10 11 12 13 14 = ノムラボの皮下投与 18歳以上の外来および非外来型フリードライヒ運動失調症の患者集団外来型および非外来型フリードライヒ運動失調症の患者(Nomlabofusp(CTI-1601)治療を受けていない、または治療を受けている(適格であれば)以前のラリマー研究用量コホート1:25 mgコホート2:50 mg 主要評価項目末梢組織のフラタキシンレベル、PK、安全性と忍容性; その他の探索的エンドポイントには脂質と遺伝子発現レベルが含まれます。患者数コホート1: 登録参加者数 13 人 (nomlabofuspで9人、プラセボで4人) コホート2: 登録者15人 (参加者10人) ラボファシスなし、プラセボ5なし)
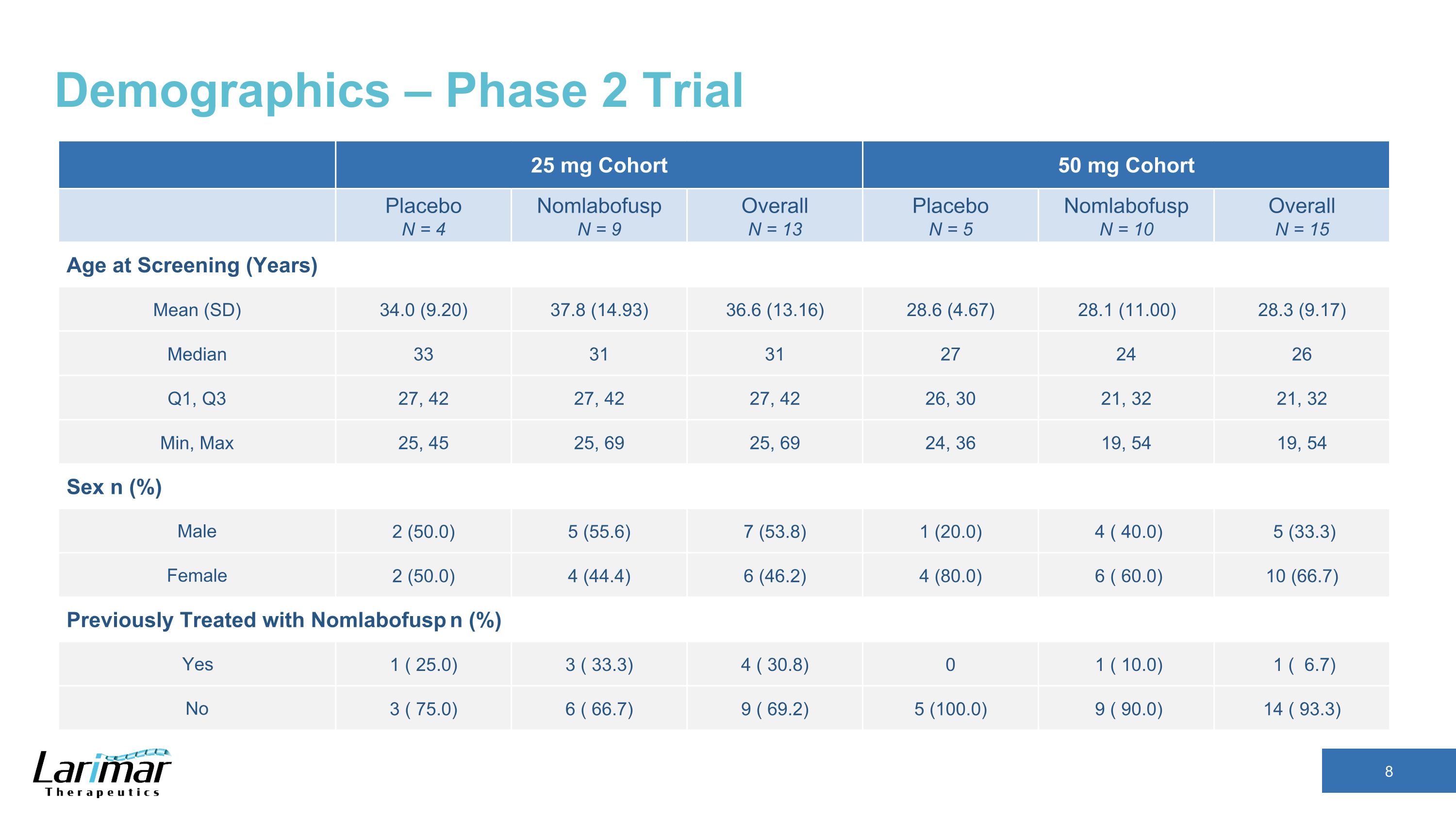
人口統計 — フェーズ2試験 25 mgコホート 50 mg コホートプラセボ N = 4 Nomlabofusp N = 9 全体 N = 13 プラセボ N = 5 Nomlabofusp N = 10 総合 N = 15 スクリーニング時の年齢 (年) 平均 (SD) 34.0 (9.20) 37.8 (14.93) 36.6 (13.16) 28.6 (4.67) 28.1 (11.00) 28.3 (9.17) 中央値 33 31 31 27 24 26 Q1, Q3 27, 42 27, 42 26, 30 21, 32 分, 32 分, 最大 25, 45 25, 69 25, 69 25, 69 25, 69 24, 36 19, 54 セックス n (%) 男性 2 (50.0) 5 (55.6) 7 (53.8) 1 (20.0) 4 (40.0) 5 (33.3) 女性 2 (50.0) 4 (44.4) 6 (46.2) 4 (80.0) 6 (60.0) 10 (66.7) 以前はノンラボフスプで治療していました n (%) はい 1 (25).0) 3 (33.3) 4 (30.8) 1 (10.0) 1 (6.7) No 3 (75.0) 6 (66.7) 9 (69.2) 5 (100.0) 9 (90.0) 14 (93.3)
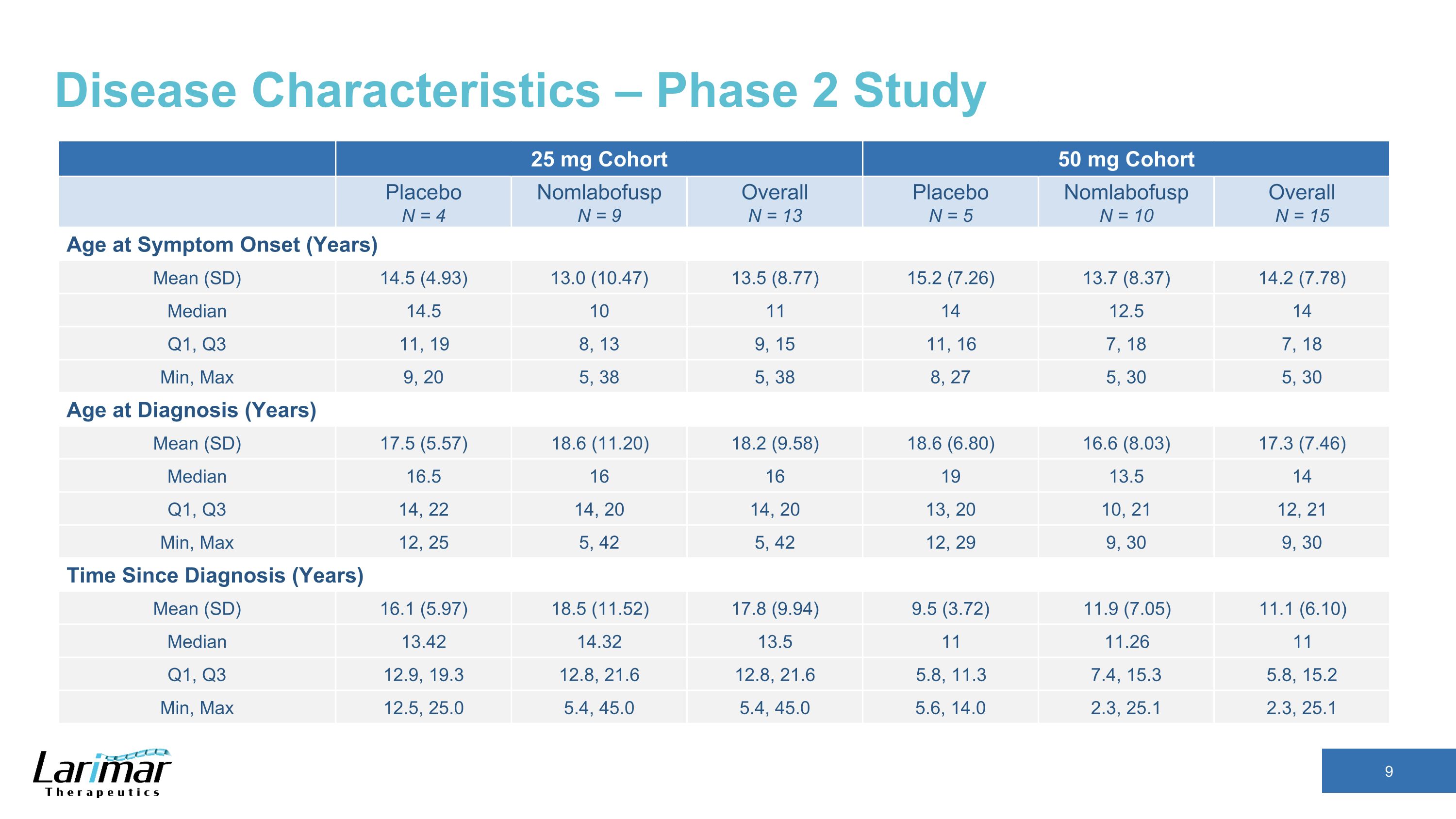
疾患の特徴 — 第2相試験 25 mgコホート 50 mg コホートプラセボ N = 4 ノムラボファスプ N = 9 全体 N = 13 プラセボ N = 5 ノムラボファスプ N = 10 全体 N = 15 症状発現年齢 (年) 平均 (SD) 14.5 (4.93) 13.0 (10.47) 13.5 (8.77) 15.2 (7.26) 13.7 (8.37) 14.2 (7.78) 中央値 14.5 10 11 14 12.5 14 Q1、Q3 11、19 8、13 9、15 11、16 7、18 7、18 7、18 分、最大 9、20 5、38 5、38 8、27 5、30、30、30歳、診断時の年齢(年)平均(SD)17.5(5.57)18.6(11.20)18.2(9.58)18.6(6.80)16.80 6 (8.03) 17.3 (7.46) 中央値 16.5 16 19 13.5 14 Q1、Q3 14、22 14、20 14、20 13、20 10、2112、21分、最大12、25 5、42 5、42 12、29 9、30 9、30時間、診断からの時間(年)平均(SD)16.1(5.97)18.5(11.52)17.8(9.94)9.5(3.72)11.9(7.05)11.1(6.10)中央値13.42 14.32 13.5 11 11.26 11第1四半期、第3四半期12.9、19.3 12.8です。21.6 12.8、21.6 5.8、11.3 7.4、15.3 5.8、15.2 分、最大12.5、25.0 5.4、45.0 5.4、45.0 5.4、45.0 5.4、45.0 5.6、14.0 2.3、25.1 2.3、25.1
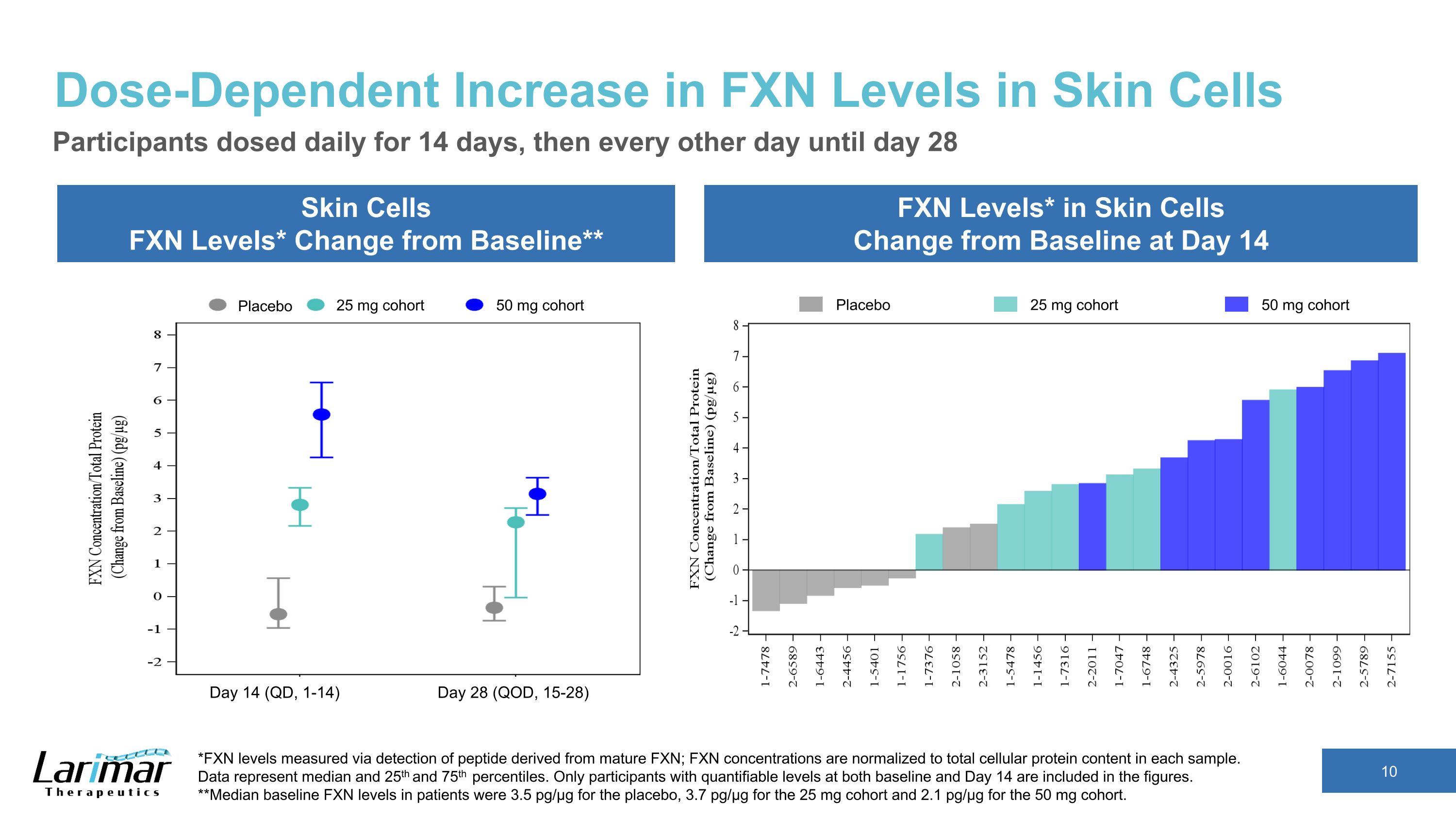
皮膚細胞のFXNレベルの用量依存的な増加皮膚細胞のFXNレベル*ベースラインからの変化** 皮膚細胞のFXNレベル*は14日目のベースラインから変化参加者は14日目から14日目、その後は28日目まで1日おきに投与 *成熟FXN由来のペプチドの検出により測定されたFXNレベル。FXN濃度は各サンプルの細胞タンパク質含有量の合計に正規化されます。データは中央値と25を表します 1番目と75番目のパーセンタイル。ベースラインと14日目の両方で定量化可能なレベルの参加者のみが数値に含まれます。**患者のベースラインFXNレベルの中央値は、プラセボで3.5 pg/µg、25 mgコホートで3.7 pg/µg、50 mgコホートで2.1 pg/µgでした。プラセボ 25 mg コホート 50 mg コホートプラセボ 25 mg コホート 50 mg コホート 14日目 (QD、1-14) 28日目 (QOD、15-28)
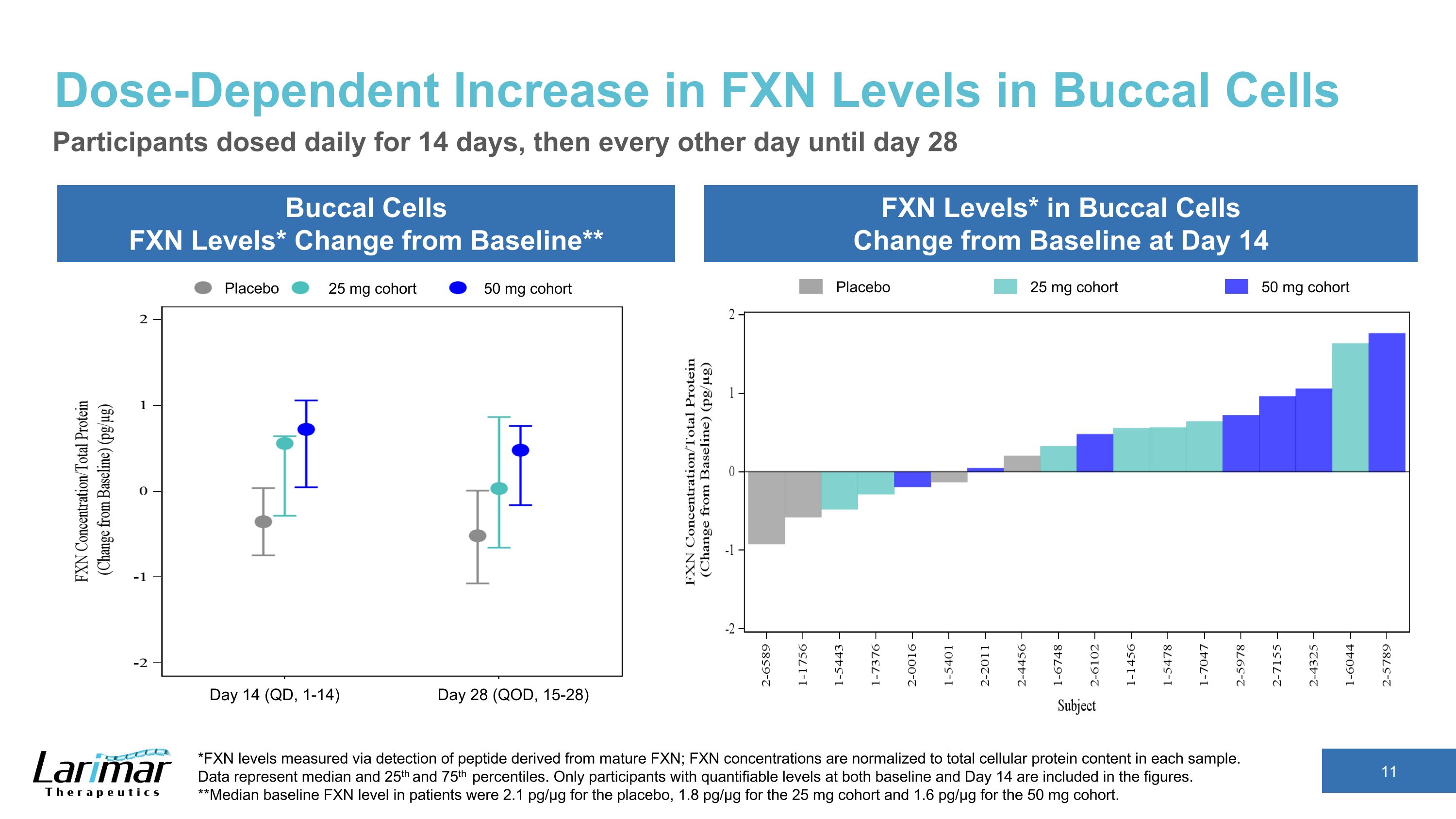
口腔細胞におけるFXNレベルの用量依存的増加。口腔細胞のFXNレベル*ベースラインからの変化** 頬細胞のFXNレベル*は14日目のベースラインからの変化参加者は14日目に14日間毎日投与、その後は28日目まで1日おきに投与。*成熟FXN由来のペプチドの検出により測定されたFXNレベル。FXN濃度は各サンプルの細胞タンパク質総含有量に正規化されます。データは中央値と25パーセンタイルと75パーセンタイルを表しています。ベースラインと14日目の両方で定量化可能なレベルの参加者のみが数値に含まれます。**患者のベースラインFXNレベルの中央値は、プラセボで2.1pg/µg、25mgコホートで1.8pg/µg、50mgコホートで1.6 pg/µgでした。プラセボ 25 mg コホート 50 mg コホートプラセボ 25 mg コホート 50 mg コホート 14日目 (QD、1-14) 28日目 (QOD、15-28)
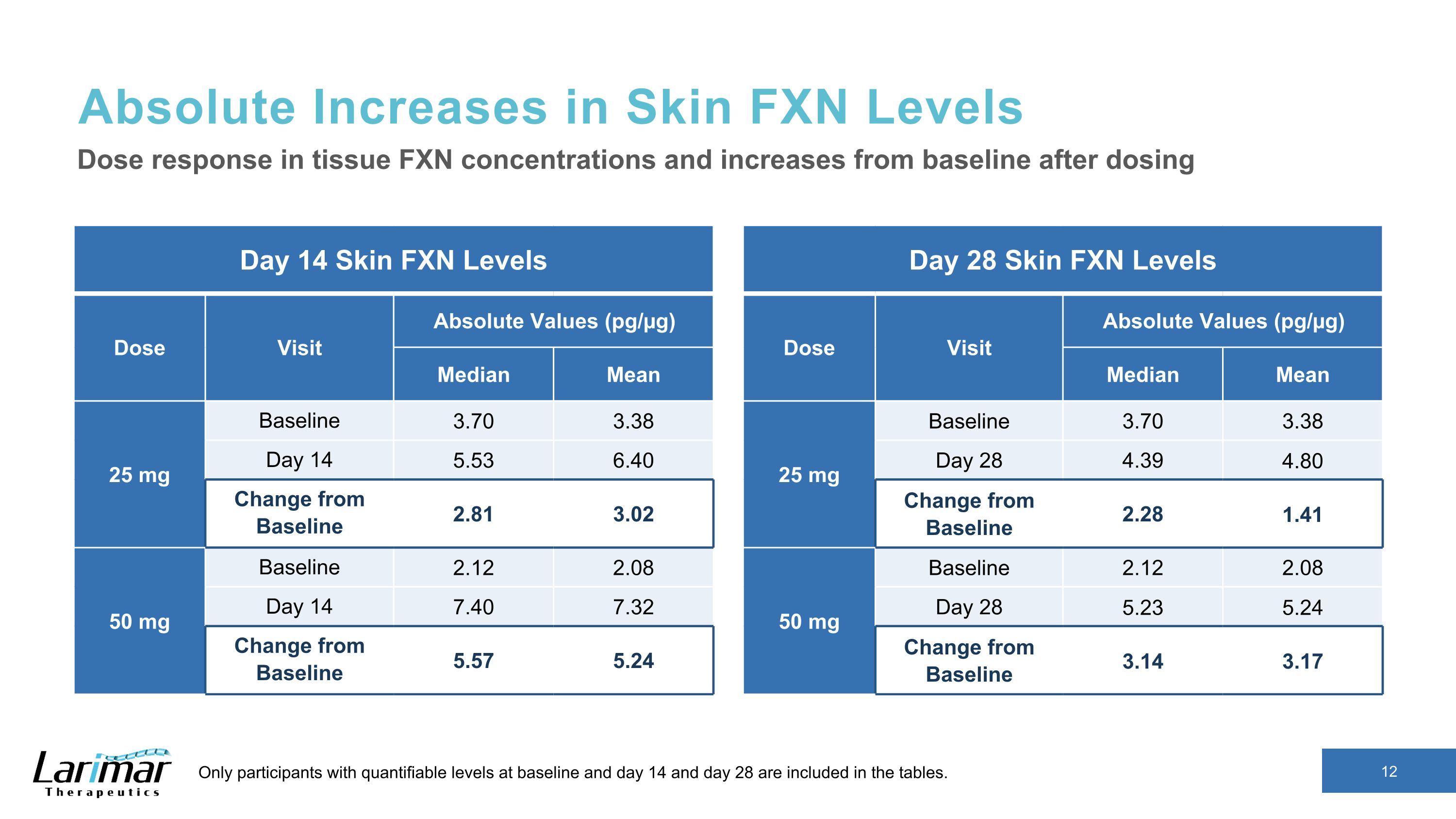
皮膚FXNレベルの絶対的増加 14日目皮膚FXNレベルの用量訪問絶対値(pg/µg)中央値 25 mg ベースライン 3.70 3.38 日目 14 5.53 6.40 ベースラインからの変更 2.81 3.02 50 mg ベースライン 2.12 2.08 14 7.40 7.32 ベースラインからの変更 5.57 5.24 組織における用量反応 FXN濃度および投与後のベースラインからの増加ラインと14日目、28日目は表に含まれています。28日目の肌 FXNレベル用量訪問絶対値(pg/µg)中央値(pg/µg)中央値 25 mg ベースライン 3.70 3.38 28 4.80 ベースラインからの変更 2.28 1.41 50 mg ベースライン 2.12 2.08 日目 28 5.23 5.24 ベースライン 3.14 3.17 からの変更
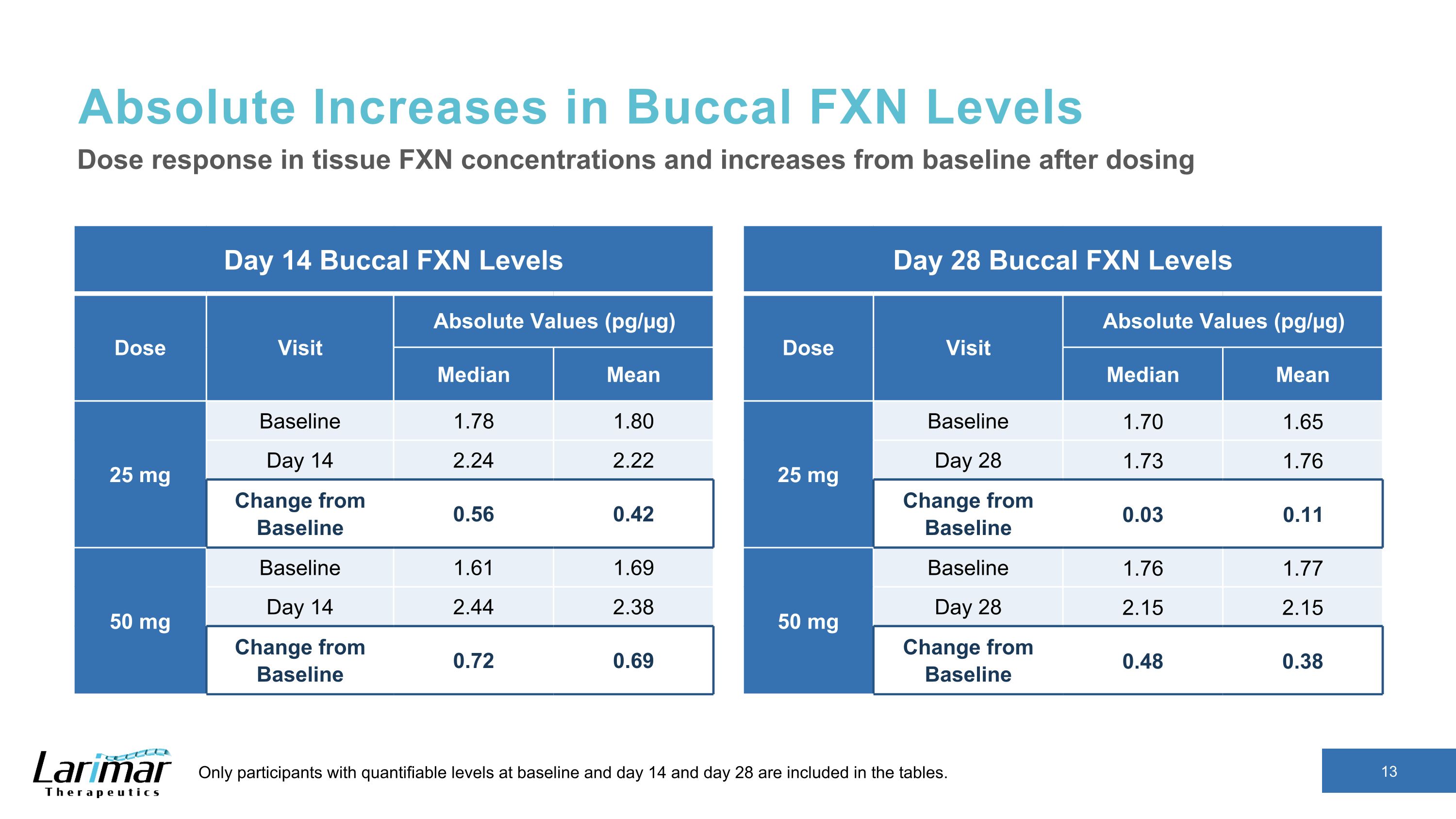
バッカルFXNレベルの絶対的な増加 14日目のバッカルFXNレベルの用量訪問絶対値(pg/µg)中央値25 mgベースライン1.78 1.80 日目 14 2.24 2.22 ベースラインからの変化 0.56 0.42 50 mgベースライン1.61 1.69 14日目 2.44 2.38 ベースラインからの変更 0.72 0.69 組織における用量反応 FXN濃度、および投与後のベースラインからの増加ベースラインと14日目、28日目の可能なレベルは表に含まれています。28日目バッカルFXNレベル用量訪問絶対値(pg/µg)平均25 mgベースライン 1.70 1.65 28 1.73 1.76 ベースラインからの変更 0.03 0.11 50 mgベースライン 1.76 1.77 28 2.15 2.15 ベースラインからの変更 0.48 0.38
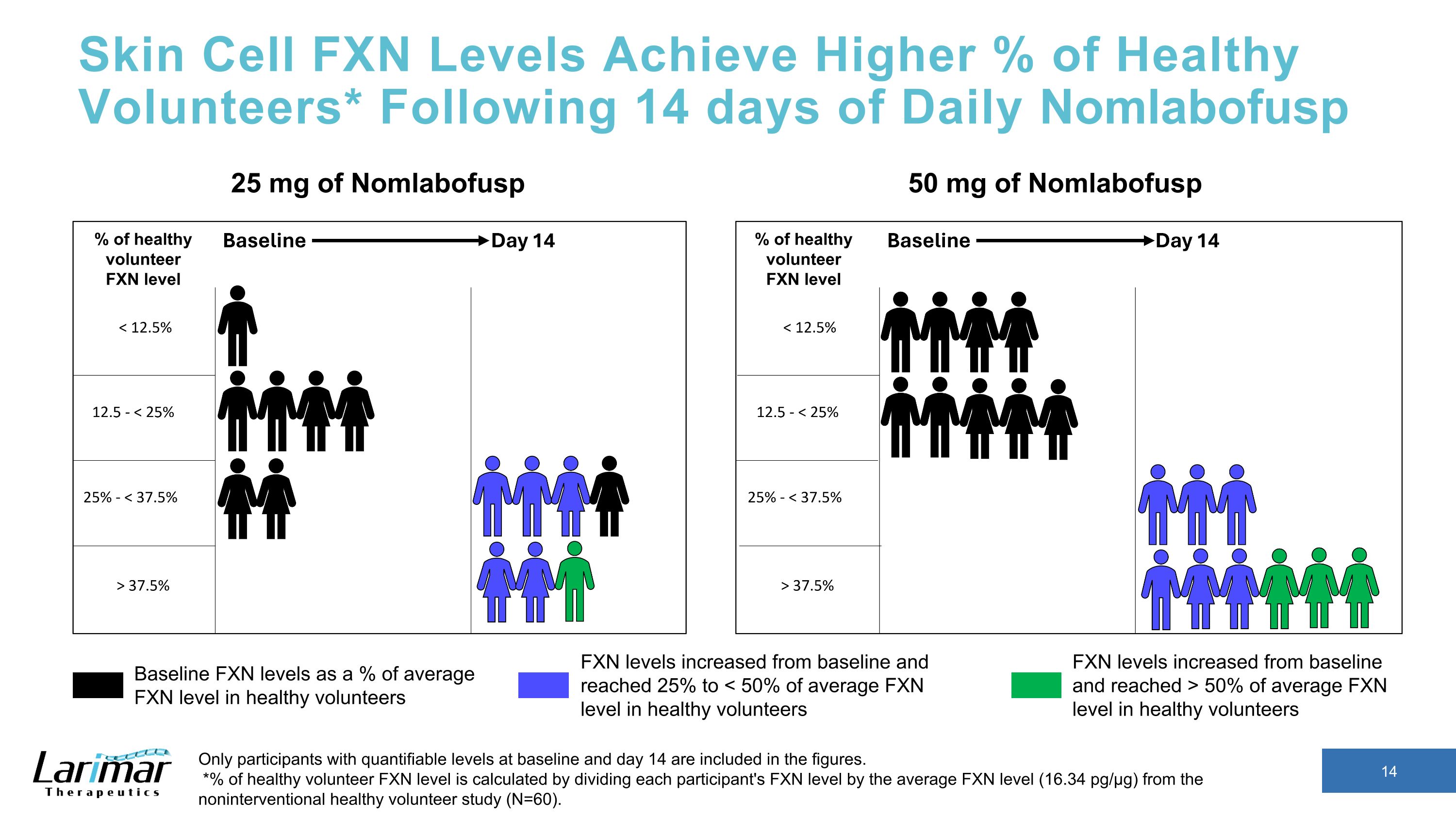
皮膚細胞のFXNレベルは健康なボランティアの割合を高めます* 14日間の毎日のNomlabofuspの後、ベースラインと14日目に定量化可能なレベルの参加者のみが数値に含まれます。*健康なボランティアのFXNレベルの%は、各参加者のFXNレベルを非介入型健康ボランティア研究の平均FXNレベル(16.34 pg/µg)で割って計算されます(N=60)。25 mg Nomlab健康なボランティアの平均FXNレベルに対するNomlabofuspのベースラインFXNレベルは50mgです。FXNレベルはベースラインから増加し、平均FXNレベルの50%以上に達しました健康なボランティアのFXNレベルはベースラインから上昇し、25%に達して になりました
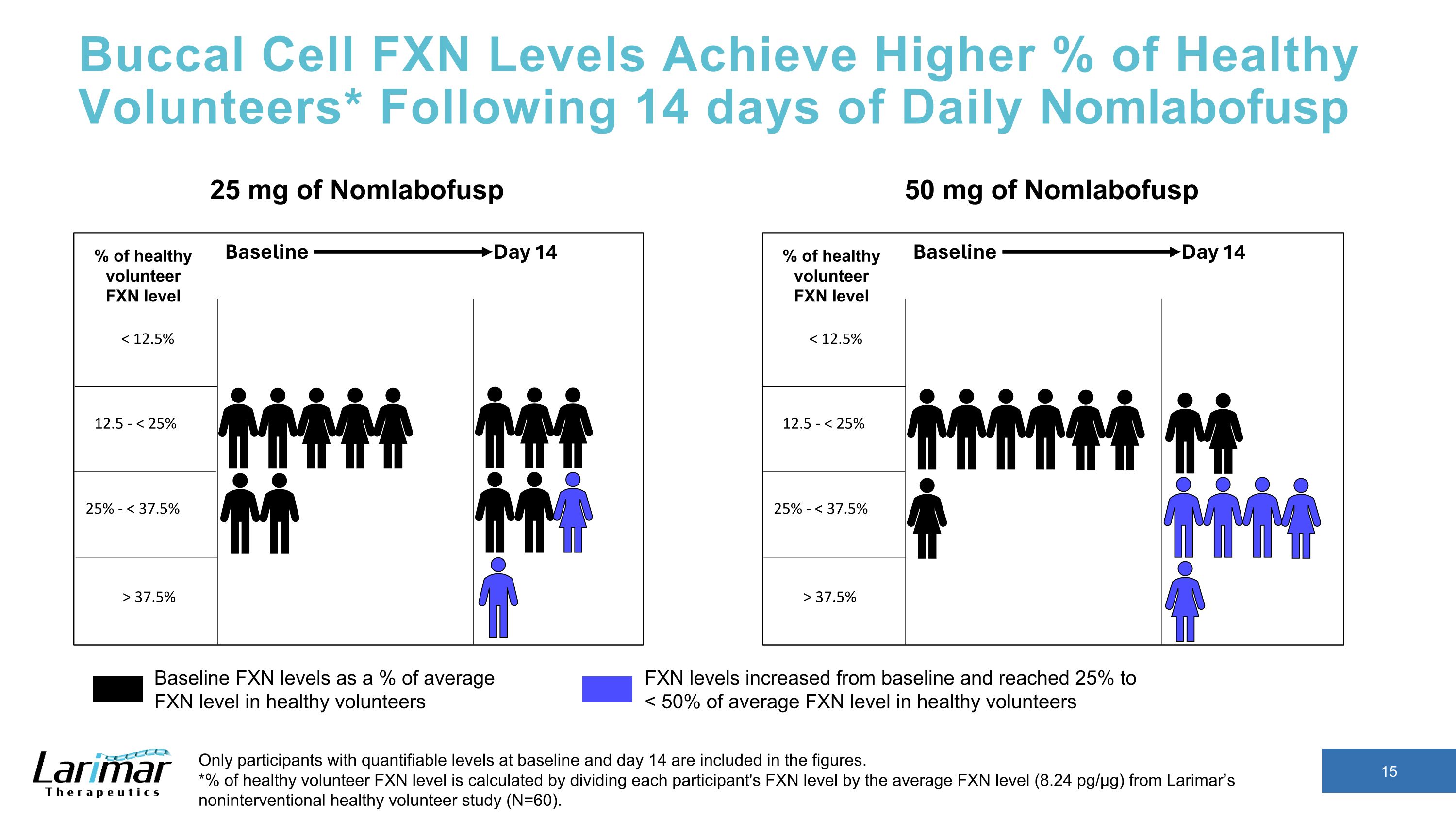
バッカルセルのFXNレベルは健康なボランティアの割合を高めます* 14日間の毎日のNomlabofuspの後、ベースラインと14日目に定量化可能なレベルの参加者のみが数値に含まれます。*健康なボランティアのFXNレベルの%は、各参加者のFXNレベルをラリマーの非介入型健康ボランティア研究(N=60)の平均FXNレベル(8.24pg/µg)で割って計算されます。50mgのNomlabofuspベースラインFXNレベル(健康なボランティアの平均FXNレベルの%)FXNレベルはベースラインから上昇し、25%に達しました
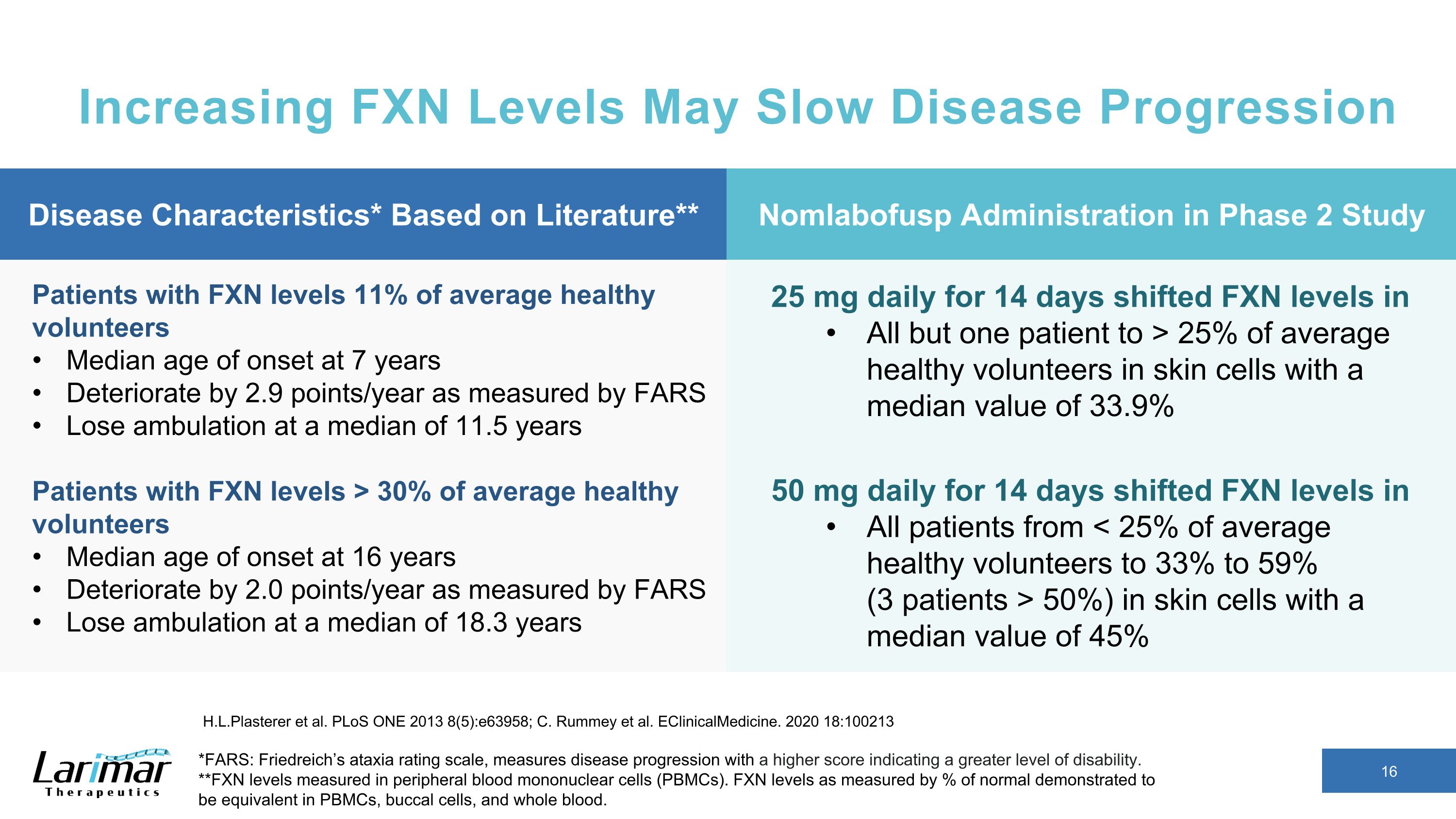
FXNレベルを上げると病気の進行が遅くなる可能性があります*FARS: フリードライヒの運動失調評価尺度は、スコアが高いほど障害のレベルが高いほど病気の進行を測定します。**末梢血単核細胞(PBMC)で測定されたFXNレベル。正常値の%で測定したFXNレベルは、PBMC、口腔細胞、全血で同等であることが示されました。H.L. プラスターらよプロス・ワン 2013 (85): e63958; C. Rummey ら。eClinicalMedicine。2020 18:100213 FXNレベルの患者:平均的な健康なボランティアの11% 7歳で発症年齢の中央値:FARSで測定した平均2.9ポイント/年、平均11.5歳で歩行を失う FXNレベルの患者(平均的な健康なボランティアの30%以上)16歳で発症年齢の中央値:FARSで測定すると年間2.0ポイント悪化します 18.3歳で、毎日25mgを14日間投与すると、1人を除くすべての患者のFXNレベルが、14人で1日あたりの平均値は33.9%50mgの皮膚細胞内の健康なボランティアの25%以上にシフトしましたすべての患者のFXNレベルが、中央値が45%の皮膚細胞のFXNレベルを(50%)から数日シフトしました。疾患特性*文献に基づく** 第2相試験では非ラボファスプ投与

Nomlabofuspの有望な治療の可能性継続臨床開発が望めない場合のフラタキシンレベルの用量依存的な増加いくつかの研究におけるフラタキシン欠乏症は病気の根本原因フラタキシン欠乏症です。フラタキシン濃度の低下は疾患負担と相関しています。動物モデルは、フラタキシンを増やすことで臨床転帰が軽減することを示しています

Nomlabofusp:予測可能な薬物動態:皮下投与後の迅速な吸収 1 2 3 用量比例した曝露量の増加が観察されました cc:第1相試験と一致する薬物動態プロファイル

Ph1とPh2のデータ:Nomlabofuspは一般的に耐容性があります nomlabofuspを投与された46人の臨床試験参加者のうち44人がそれぞれの研究を完了しました。25mgコホートのフェーズ2の参加者1人は、標準治療でアレルギー反応が解消されたため撤退しました。50mgコホートのフェーズ1の参加者は、軽度から中等度の吐き気と嘔吐のために撤退しました。61人の患者が当社の第1相および第2相試験に参加しましたが、重篤なものはありませんでした。ラボ/USP以外のあらゆる臨床試験における有害事象。1つの重篤な有害事象(下記の標準治療で解消されたアレルギー反応)。最も一般的な有害事象(AE)は、軽度から中等度の注射部位反応(ISR)でした。ISRによる研究の中止はなく、すべて解決しました
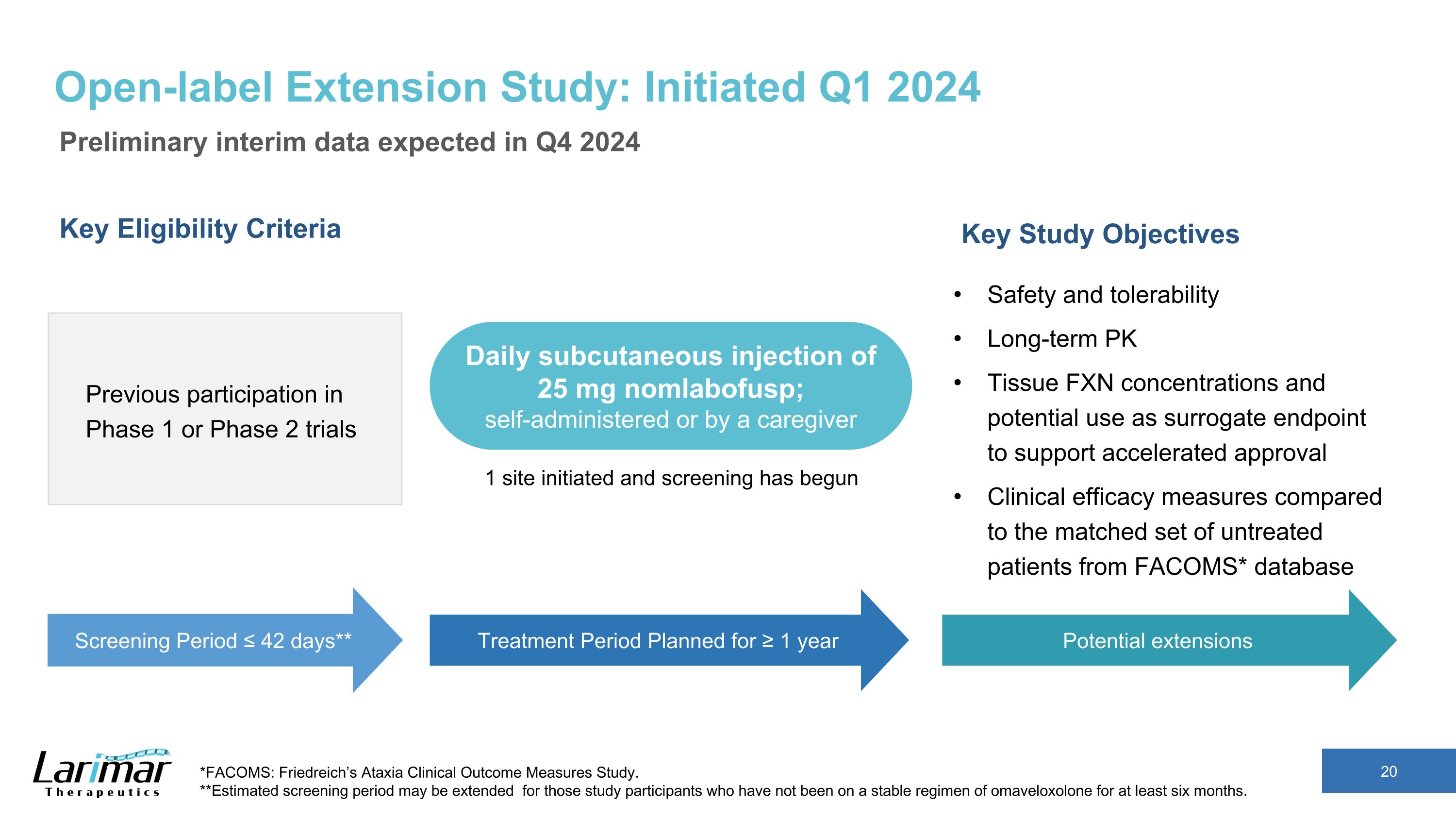
非盲検拡大研究:2024年第1四半期に開始予定の暫定暫定暫定データ 2024年第4四半期に予定されている主な適格基準第1相試験または第2相試験への以前の参加主な研究目的安全性と忍容性長期にわたるPK組織のFXN濃度と承認の迅速化を支援するための代理エンドポイントとしての潜在的な使用可能性FACOMS*データベースから一致した未治療患者群との臨床的有効性の測定*FACOMS*データベース*FACOMS:フリードライヒ運動失調症臨床アウトカム測定研究。**オマベロキソロンの安定したレジメンを6か月以上受けていない研究参加者の場合、推定スクリーニング期間が延長されることがあります。スクリーニング期間 ≤ 42日** 1年以上を予定している治療期間 25mgを毎日皮下注射、自己投与または介護者による投与。1部位が開始され、スクリーニングが開始されました。延長の可能性あり

Nomlabofusp臨床開発計画 2~17歳の患者を対象としたグローバルな二重盲検プラセボ対照登録/確認試験を計画しています* 2025年下半期を目標にBLAの申請を予定しています*当社は、2歳から17歳の患者を臨床開発に最もよく含める方法をFDAと話し合っています。**会社は、迅速な承認を支援するために、FXNレベルの役割についてFDAと話し合いを開始しました。また、当社は、臨床プログラムを海外に拡大するために、米国外の規制当局や治験責任医師と話し合うことを計画しています。追加の米国臨床試験の開始は、部分的な臨床保留のため、FDAによる臨床データの審査を条件としています。SAD、MAD、および/または4週間の用量探索研究に参加した適格患者を対象に、毎日25mgを投与する継続的な非盲検延長試験です。OLE BLAへの申請は、2025年下半期を対象としています。OLE試験のスクリーニング対象となる参加者を対象としています。初期データは2024年第4四半期に予定されています

規制の更新 2024年第1四半期:OLE試験の最初の患者への投与 2024年第4四半期:OLE試験の初期データ、2024年第1四半期に開始、2024年第2四半期の最終フェーズデータ:2025年下半期に会議で発表される予定の最終フェーズデータ:BLA提出予定マイルストーンPh1とPh2の一貫した調査結果:承認の迅速化を支援する代理エンドポイントとしてのFXNの使用についてFDAと話し合いを開始承認され、2025年下半期にBLA申請の可能性があります。nomlabofusp臨床プログラムを米国以外の地域に拡大するための準備を始めるのは、一般的に最大4週間まで試験した用量で十分耐容性評価された組織(皮膚と頬の細胞)におけるベースラインからのFXNレベルの用量依存的な増加 50mgコホートの皮膚細胞におけるベースラインのFXNレベルは