

2024年2月ラリマー・セラピューティクス・コーポレート・デッキ展示品99.2

このプレゼンテーションには、Larimar Therapeutics, Inc.(以下「当社」)の信念と仮定、および経営陣が現在入手可能な情報に基づく将来の見通しに関する記述が含まれています。このプレゼンテーションに含まれる歴史的事実の記述を除くすべての記述は、ラリマーのnomlabofusp(CTI-1601)およびその他の計画された製品候補の開発および商品化の能力、nomlabofusp臨床試験のタイミングと全体的な開発計画を含むラリマーの計画された研究開発活動、およびラリマーの事業戦略、資金調達能力、使用に関するその他の事項を含むがこれらに限定されない、将来の見通しに関する記述ですが、これらに限定されません資本、経営成績と財政状態、計画と目標について将来の運営。場合によっては、将来の見通しに関する記述を、これらの用語や他の類似用語の「かもしれない」、「するかもしれない」、「すべき」、「期待」、「意図」、「計画」、「予測」、「計画」、「可能性」、「続行」、「継続中」、「否定的」という言葉で区別できますが、すべての将来の見通しに関する記述にこれらの言葉が含まれているわけではありません。これらの記述にはリスク、不確実性、その他の要因が含まれており、実際の結果、業績、または業績が、これらの将来の見通しに関する記述で表明または暗示される情報と大きく異なる可能性があります。これらのリスク、不確実性、その他の要因には、ラリマーの製品開発活動の成功、費用、タイミング、nomlabofuspの臨床マイルストーンやFDAとの継続的なやり取りを含む非臨床試験と臨床試験の成功、費用、および臨床試験の成功、費用、および臨床試験(nomlabofuspの以前の非臨床および臨床データおよび試験は、後の臨床の結果または成功を予測できない場合があります)が含まれます。治験、評価。FDAが最終的にラリマーの意見に同意しない可能性があることnomlabofuspの開発戦略、公衆衛生危機がラリマーの将来の臨床試験、製造、規制、非臨床試験のスケジュールと運営、および一般的な経済状況に及ぼす潜在的な影響、nomlabofuspの製造プロセスを最適化および拡大するためにLarimarが関与するラリマーの能力と第三者メーカーの能力、nomlabofuspと将来の製品候補について規制当局の承認を得るLarimarの能力、Larimarが関与する第三者メーカーの能力。単独で、または将来の潜在的な協力者と一緒に、販売およびマーケティング能力を開発する能力、および承認された製品候補の商品化を成功させること、製品開発活動を行うために必要な資金を調達するラリマーの能力、およびラリマーが証券取引委員会(SEC)に提出した書類に記載されているその他のリスク。これには、フォーム10-Kの年次報告書、フォーム10-Qの四半期報告書、フォーム8-Kの最新報告書が含まれますが、これらに限定されません。証券取引委員会であり、www.sec.govで入手できます。これらの将来の見通しに関する記述は、ラリマーが現在知っている事実と要因、および将来の予測の組み合わせに基づいており、確信が持てません。その結果、将来の見通しに関する記述が正確でない可能性があります。このプレゼンテーションの将来の見通しに関する記述は、本書の日付現在のラリマーの経営陣の見解のみを表しています。ラリマーは、法律で義務付けられている場合を除き、理由の如何を問わず、将来の見通しに関する記述を更新する義務を負いません。将来の見通しに関する記述

Nomlabofusp(CTI-1601)の陽性トップラインフェーズ2データ皮膚と頬細胞の組織フラタキシン(FXN)レベルの用量依存的増加 Nomlabofuspは、最大28日間繰り返し皮下注射を行った後、一般的に耐容性が良好でした。参加者は50 mgを14日間投与し、その後1日おきに28日目までさらに14日間治療しました。皮膚細胞のベースラインFXNレベル

臨床段階の新規タンパク質補充療法プラットフォームリード候補nomlabofusp*(CTI-1601)は、タンパク質をミトコンドリアに送達することにより、フリードライヒ運動失調(FA)患者のフラタキシン欠乏症に直接対処するように設計された組換え融合タンパク質です。希少疾病用医薬品(米国およびEU)、希少小児疾患(米国)、ファストトラック(米国)、およびプライム(EU)の指定を取得 Nomlabofuspは一般的に耐容性が高く、4週間のプラセボ対照第2相試験と複数回漸増投与の第1相試験で、皮膚と頬細胞のフラタキシン(FXN)レベルがベースラインから用量依存的に上昇することが示されました 2024年第1四半期には1日25mgを投与し、中間データは2024年第4四半期に予定されています。OLE試験で用量を増加させる可能性があるため、部分臨床を継続するため、25 mgの治療データをFDAの審査に提出します。推定現金残高8,680万ドルを保有(2023年12月31日)、フラタキシンレベルを上昇させる可能性のある最初の治療法として考えられる第1相と第2相の一貫性。短期触媒を用いたFDA OLE研究で迅速な承認を目指す予定です強力な財務基盤*2023年10月現在、nomlabofuspはINN(国際非独占的名称)およびUSAN(United)として公開されました。州がCTI-1601に採用した名前)。**この見積もりは未監査であり、2023年度の決算手続きの完了により、暫定的かつ実際の結果は異なる場合があります。そのため、この見積もりは、米国で一般に認められている会計原則に従って作成された当社の完全監査済み財務諸表の代わりと見なすべきではありません。FXN欠損症はFAの病原性メカニズムにとって重要であるようであり、基礎疾患の病態生理学に対処する治療の必要性が引き続き満たされていないことをFDAは認めています。承認の迅速化を支援するための議論が進行中です。BLAの提出は2025年下半期を目標としています
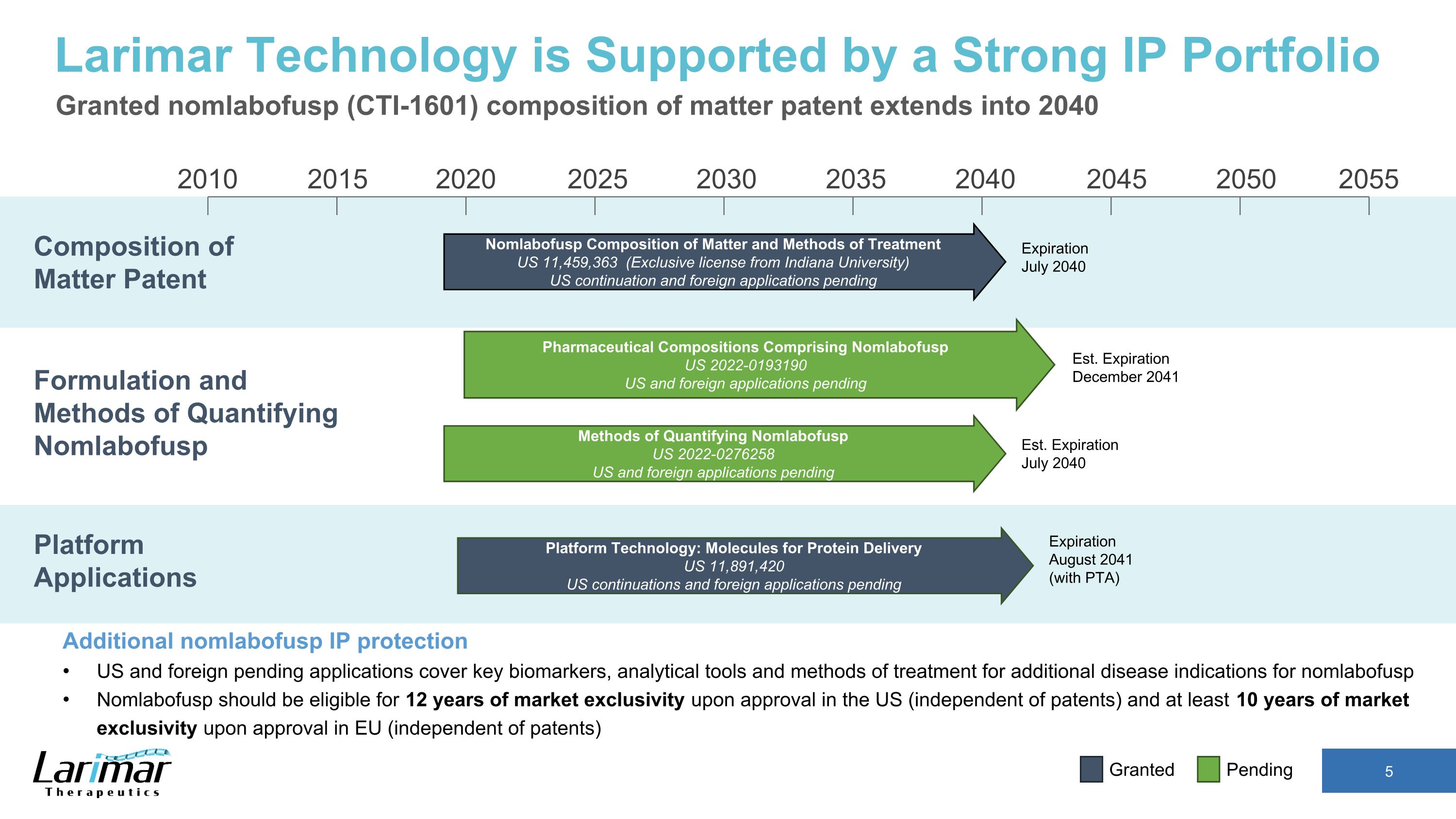
2015 2020 2030 2035 2040 2045 2050 2055 2010 2025 Nomlabofusp 物質の組成と治療方法 US 11,459,363(インディアナ大学からの独占ライセンス)2040年7月の有効期限が切れる米国での継続および海外出願)物質構成特許:ラリマー技術は強力な知的財産ポートフォリオによってサポートされています nomlabofusp(CTI-1601)物質組成特許は2040年まで延長されます。追加の名前 labofusp IP保護:米国および海外で保留中の申請は、主要なバイオマーカー、分析ツール、その他の疾患の治療法を対象としていますnomlabofuspの適応症 Nomlabofuspは、米国で承認されると12年間の市場独占権(特許とは無関係)、EUでの承認時に少なくとも10年間の市場独占権の対象となります(特許とは無関係)。プラットフォームアプリケーション Nomlabofuspプラットフォーム技術:タンパク質送達用分子 US 11,891,420米国での継続および海外出願待ち Nomlabofusp 米国 2022-0193190 米国および海外での申請は保留中です。Nomlabofuspを定量化する方法、米国 2022-0276258 米国および海外での出願は東部標準時出願中です。有効期限 2014年12月 (東部標準時)有効期限 2040年7月 2041年8月の有効期限(PTAあり)付与待ち

フリードライヒ運動失調症(FA):まれで進行性の病気 6* E.C. Deutsch et al.分子遺伝学と代謝 101 (2010) 238—245。FA患者のほとんどは、組織、サンプリング技術、および考慮されるアッセイに応じて、正常なフラタキシンレベルの約20〜40%しか産生しません。両方の対立遺伝子の遺伝的欠陥によりフラタキシンレベルが低下します。進行性疾患初期症状には、不安定な姿勢や頻繁な転倒が含まれ、最終的には患者の平均余命は30〜50年で、通常は心臓病が原因で早期死亡します。世界中で約2万人の患者が罹患しています約5,000人米国の患者、そしてほとんどの患者はEUにいます。患者の70%は14歳より前に診察を受けます。承認された治療法はありませんフラタキシンレベルを上げるFAに対して承認された治療法だけがフラタキシン欠乏症に対処できません

Nomlabofuspは追加のフラタキシンを送達するように設計されています。切断部位の存在により、ミトコンドリアプロセシングペプチダーゼによってCPPとMTSが除去され、NOMLABOFUSP切断の内因性FXN構造のミトコンドリア構造で成熟ヒトFXNが生成されます。この部位でのミトコンドリアプロセシングペプチダーゼ(MPP)によるミトコンドリアプロセシングペプチダーゼ(MPP)による成熟ヒトFXNが生成されますミトコンドリアのFXN ミトコンドリアターゲティング配列(MTS)このサイトでのミトコンドリアプロセシングペプチダーゼ(MPP)による成熟ヒトFXN切断は、ミトコンドリアで成熟ヒトFXNを生成し、ミトコンドリアに成熟したヒトFXN細胞を浸透させますペプチド(CPP)ミトコンドリアターゲティング配列(MTS)Nomlabofusp(CTI-1601)は、MTSと成熟ヒトフラタキシン(FXN)の間の切断部位を維持します
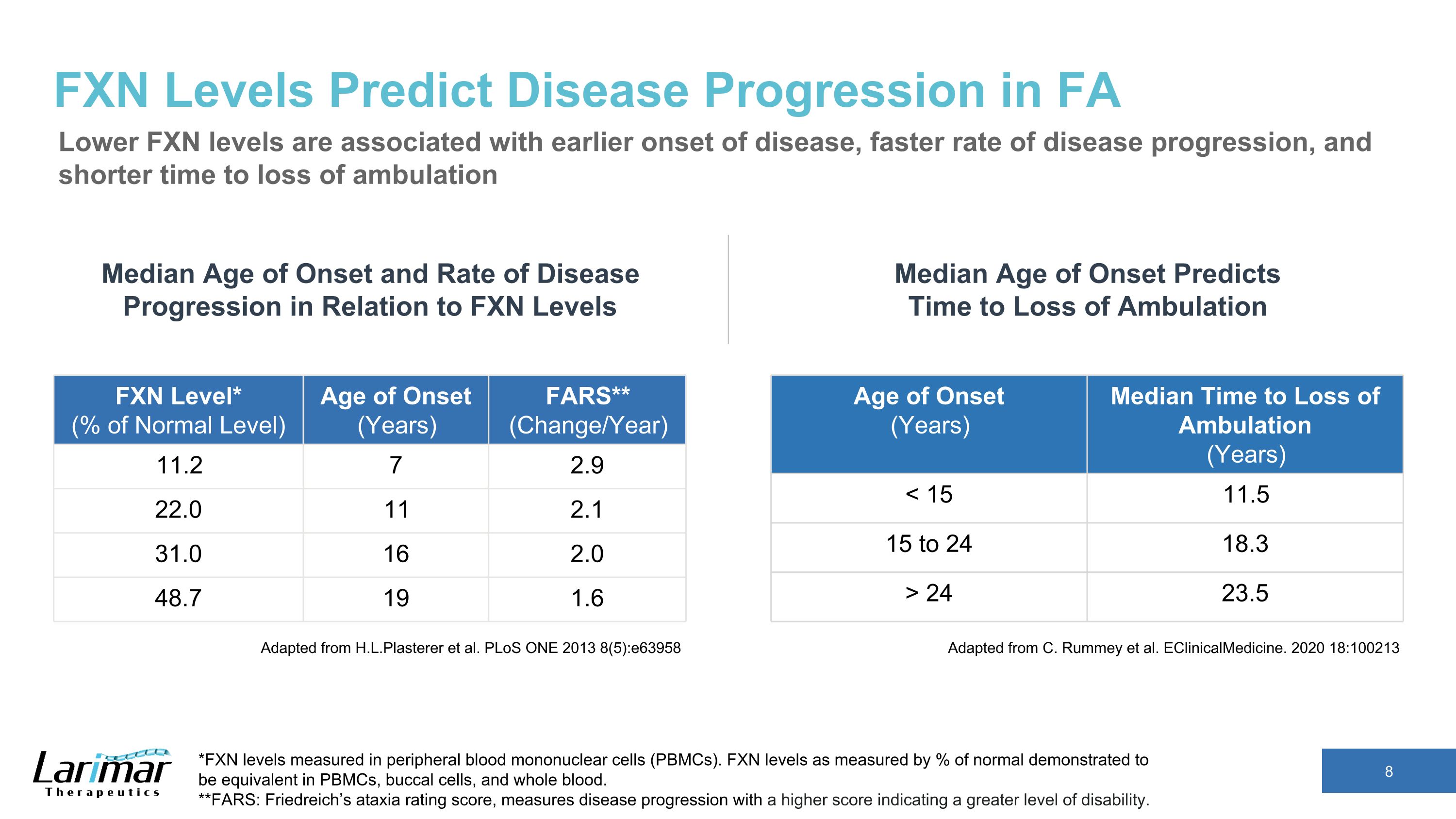
FXNレベルはFAの病気の進行を予測します FXNレベルが低いほど、病気の早期発症、病気の進行速度が速く、歩行不能になるまでの時間の短縮につながります。H.L.Plastererらから引用しています。PLoS ONE 2013 8 (5): e63958 発症年齢 (歳) 歩行不能になるまでの時間の中央値 (年) 24 23.5 FXNレベルに対する発症年齢と疾患進行率の中央値 *末梢血単核細胞 (PBMC) で測定されたFXNレベル。正常値の%で測定したFXNレベルは、PBMC、口腔細胞、全血で同等であることが示されました。**FARS:フリードライヒの運動失調評価スコアは、病気の進行を測定します。スコアが高いほど、障害のレベルが高いことを示します。FXNレベル*(正常レベルの%)発症年齢(年)FARS**(変化/年)11.2 7 2.9 22.0 11 2.1 31.0 16 2.0 48.7 19 1.6 C. Rummeyらからの引用です。臨床医療。2020 18:100213 発症年齢の中央値は歩行が途絶えるまでの時間を予測します

25mgと50mgのコホートを対象とした第2相用量探索研究目標:PK/PDの特性をさらに明らかにし、安全性を評価して長期的な用量および用量計画を策定します。治療スケジュール-nomlabofusp(CTI-1601)またはプラセボ 28日間の治療期間 16 17 18 19 15 20 21 22 23 24 25 26 27 28 2 3 4 5 1 6 7 8 9 10 11 12 13 14 = ノムラボの皮下投与 18歳以上の外来および非外来型フリードライヒ運動失調症の患者集団外来型および非外来型フリードライヒ運動失調症の患者(Nomlabofusp(CTI-1601)治療を受けていない、または治療を受けている(適格であれば)以前のラリマー研究用量コホート1:25 mgコホート2:50 mg 主要評価項目末梢組織のフラタキシンレベル、PK、安全性と忍容性; その他の探索的エンドポイントには脂質と遺伝子発現レベルが含まれます。患者数コホート1: 登録参加者数 13 人 (nomlabofuspで9人、プラセボで4人) コホート2: 登録者15人 (参加者10人) ラボファシスなし、プラセボ5なし)
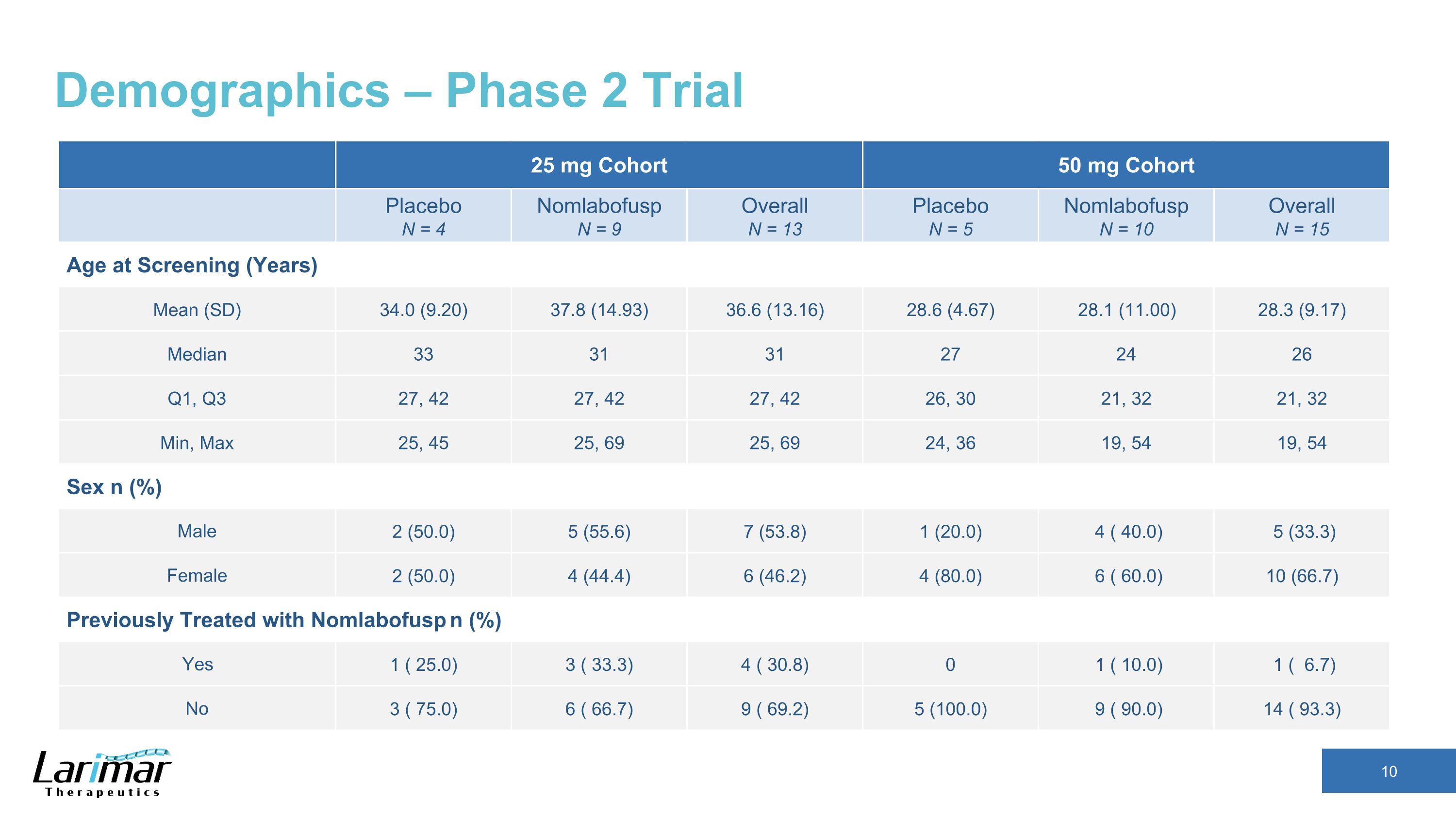
人口統計 — フェーズ2試験 25 mgコホート 50 mg コホートプラセボ N = 4 Nomlabofusp N = 9 全体 N = 13 プラセボ N = 5 Nomlabofusp N = 10 総合 N = 15 スクリーニング時の年齢 (年) 平均 (SD) 34.0 (9.20) 37.8 (14.93) 36.6 (13.16) 28.6 (4.67) 28.1 (11.00) 28.3 (9.17) 中央値 33 31 31 27 24 26 Q1, Q3 27, 42 27, 42 26, 30 21, 32 分, 32 分, 最大 25, 45 25, 69 25, 69 25, 69 25, 69 24, 36 19, 54 セックス n (%) 男性 2 (50.0) 5 (55.6) 7 (53.8) 1 (20.0) 4 (40.0) 5 (33.3) 女性 2 (50.0) 4 (44.4) 6 (46.2) 4 (80.0) 6 (60.0) 10 (66.7) 以前はノンラボフスプで治療していました n (%) はい 1 (25).0) 3 (33.3) 4 (30.8) 1 (10.0) 1 (6.7) No 3 (75.0) 6 (66.7) 9 (69.2) 5 (100.0) 9 (90.0) 14 (93.3)
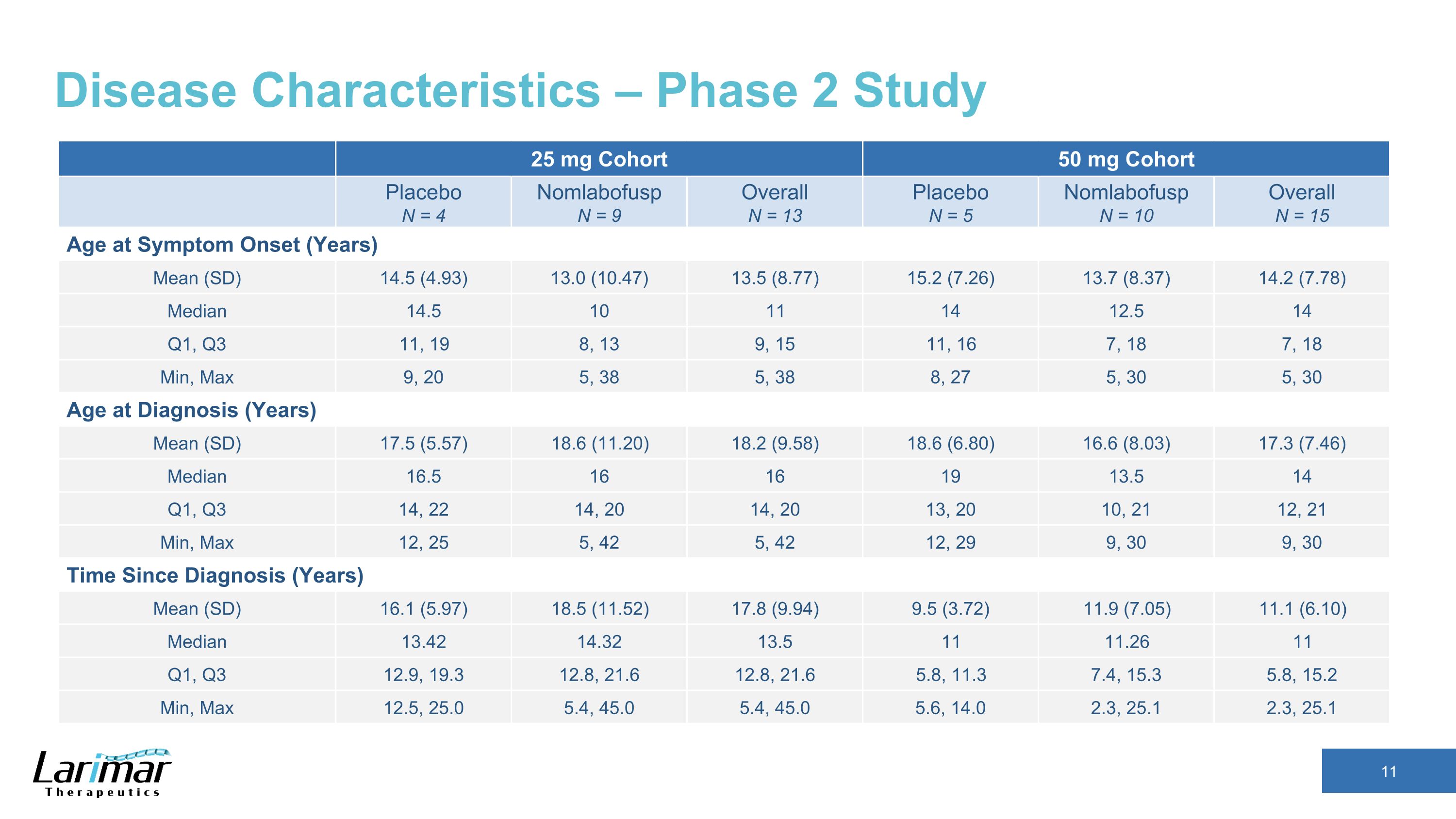
疾患の特徴 — 第2相試験 25 mgコホート 50 mg コホートプラセボ N = 4 ノムラボファスプ N = 9 全体 N = 13 プラセボ N = 5 ノムラボファスプ N = 10 全体 N = 15 症状発現年齢 (年) 平均 (SD) 14.5 (4.93) 13.0 (10.47) 13.5 (8.77) 15.2 (7.26) 13.7 (8.37) 14.2 (7.78) 中央値 14.5 10 11 14 12.5 14 Q1、Q3 11、19 8、13 9、15 11、16 7、18 7、18 7、18 分、最大 9、20 5、38 5、38 8、27 5、30、30、30歳、診断時の年齢(年)平均(SD)17.5(5.57)18.6(11.20)18.2(9.58)18.6(6.80)16.80 6 (8.03) 17.3 (7.46) 中央値 16.5 16 19 13.5 14 Q1、Q3 14、22 14、20 14、20 13、20 10、2112、21分、最大12、25 5、42 5、42 12、29 9、30 9、30時間、診断からの時間(年)平均(SD)16.1(5.97)18.5(11.52)17.8(9.94)9.5(3.72)11.9(7.05)11.1(6.10)中央値13.42 14.32 13.5 11 11.26 11第1四半期、第3四半期12.9、19.3 12.8です。21.6 12.8、21.6 5.8、11.3 7.4、15.3 5.8、15.2 分、最大12.5、25.0 5.4、45.0 5.4、45.0 5.4、45.0 5.4、45.0 5.6、14.0 2.3、25.1 2.3、25.1
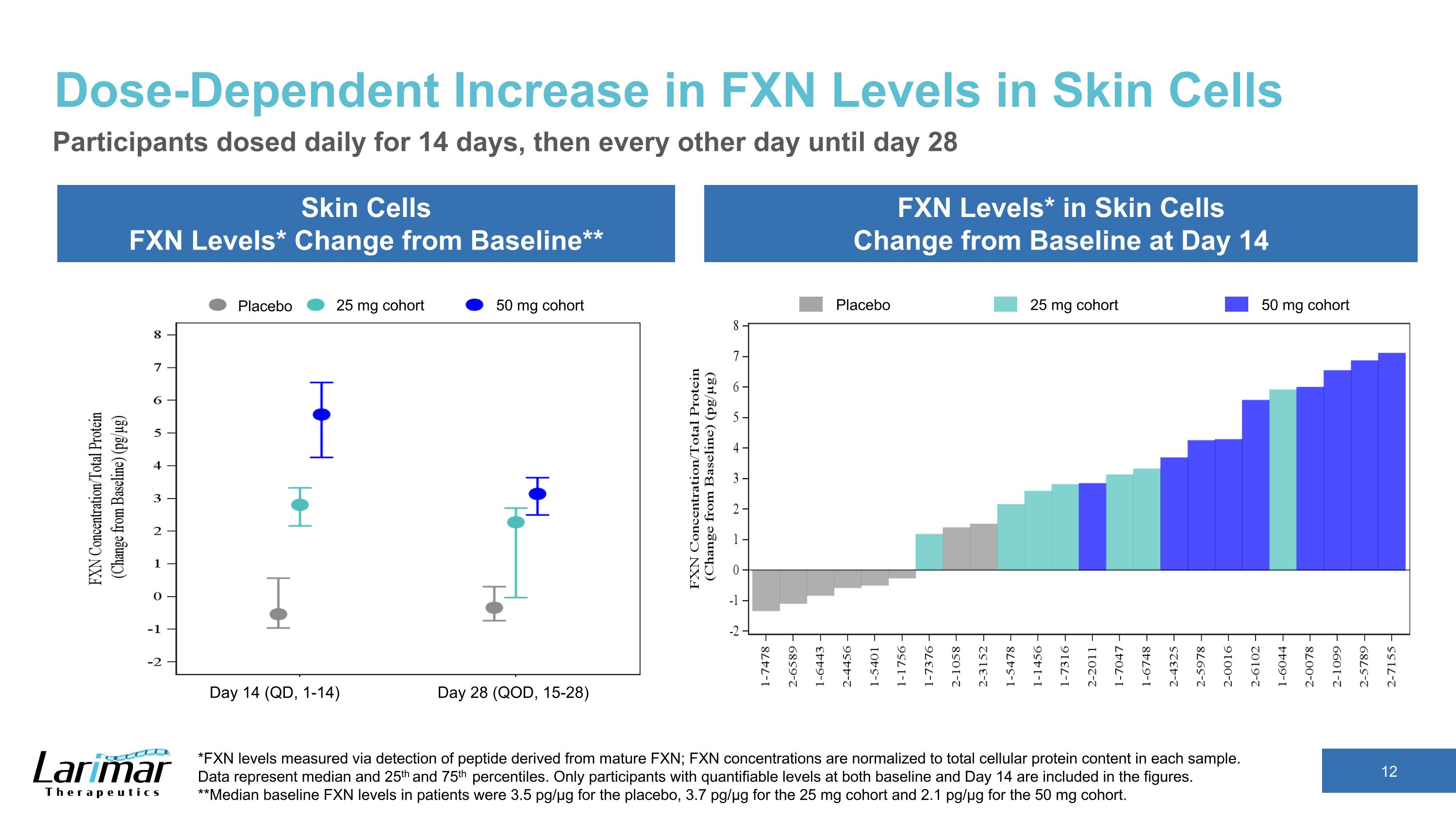
皮膚細胞のFXNレベルの用量依存的な増加皮膚細胞のFXNレベル*ベースラインからの変化** 皮膚細胞のFXNレベル*は14日目のベースラインから変化参加者は14日目から14日目、その後は28日目まで1日おきに投与 *成熟FXN由来のペプチドの検出により測定されたFXNレベル。FXN濃度は各サンプルの細胞タンパク質含有量の合計に正規化されます。データは中央値と25を表します 1番目と75番目のパーセンタイル。ベースラインと14日目の両方で定量化可能なレベルの参加者のみが数値に含まれます。**患者のベースラインFXNレベルの中央値は、プラセボで3.5 pg/µg、25 mgコホートで3.7 pg/µg、50 mgコホートで2.1 pg/µgでした。プラセボ 25 mg コホート 50 mg コホートプラセボ 25 mg コホート 50 mg コホート 14日目 (QD、1-14) 28日目 (QOD、15-28)
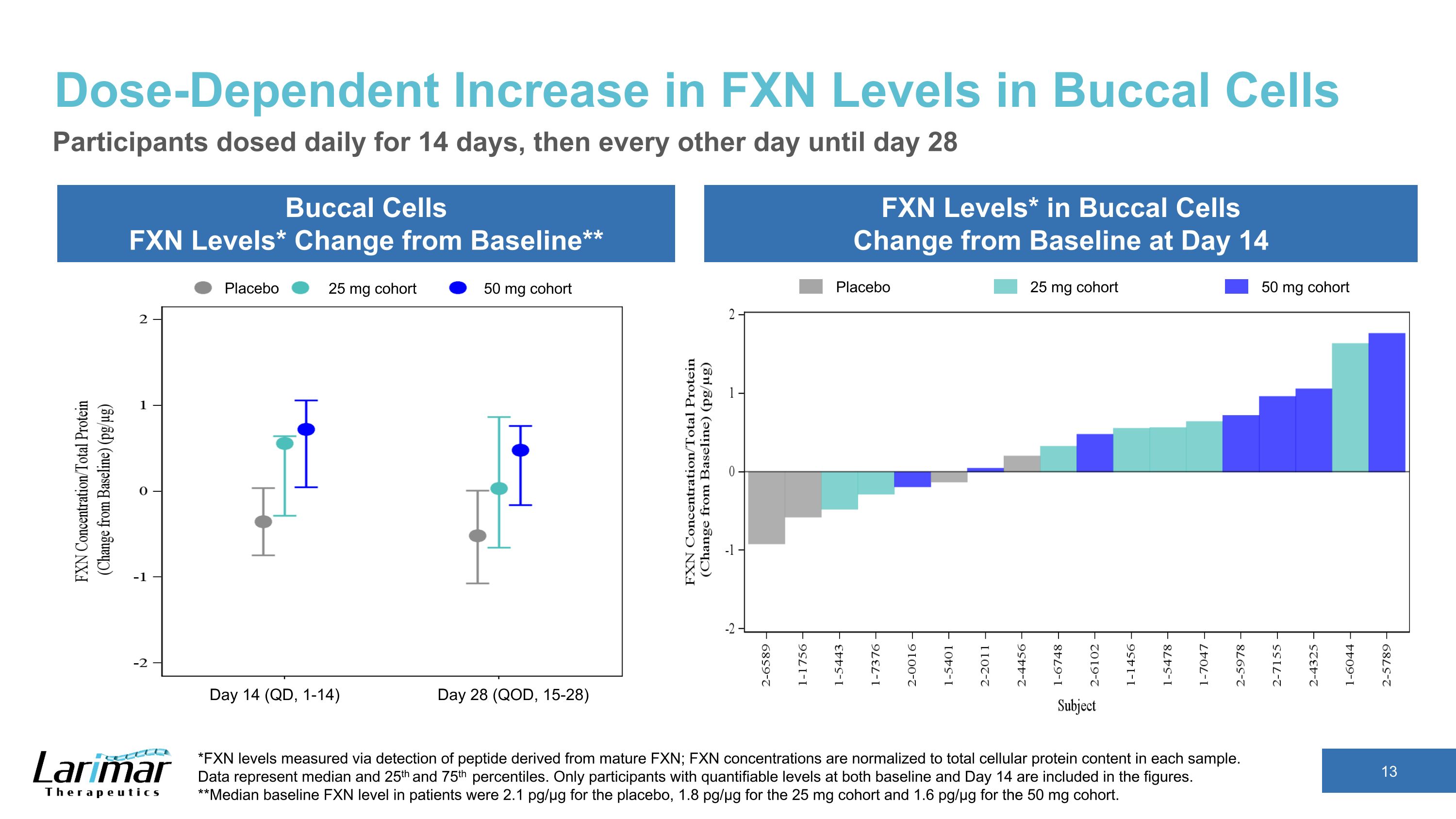
口腔細胞におけるFXNレベルの用量依存的増加。口腔細胞のFXNレベル*ベースラインからの変化** 頬細胞のFXNレベル*は14日目のベースラインからの変化参加者は14日目に14日間毎日投与、その後は28日目まで1日おきに投与。*成熟FXN由来のペプチドの検出により測定されたFXNレベル。FXN濃度は各サンプルの細胞タンパク質総含有量に正規化されます。データは中央値と25パーセンタイルと75パーセンタイルを表しています。ベースラインと14日目の両方で定量化可能なレベルの参加者のみが数値に含まれます。**患者のベースラインFXNレベルの中央値は、プラセボで2.1pg/µg、25mgコホートで1.8pg/µg、50mgコホートで1.6 pg/µgでした。プラセボ 25 mg コホート 50 mg コホートプラセボ 25 mg コホート 50 mg コホート 14日目 (QD、1-14) 28日目 (QOD、15-28)
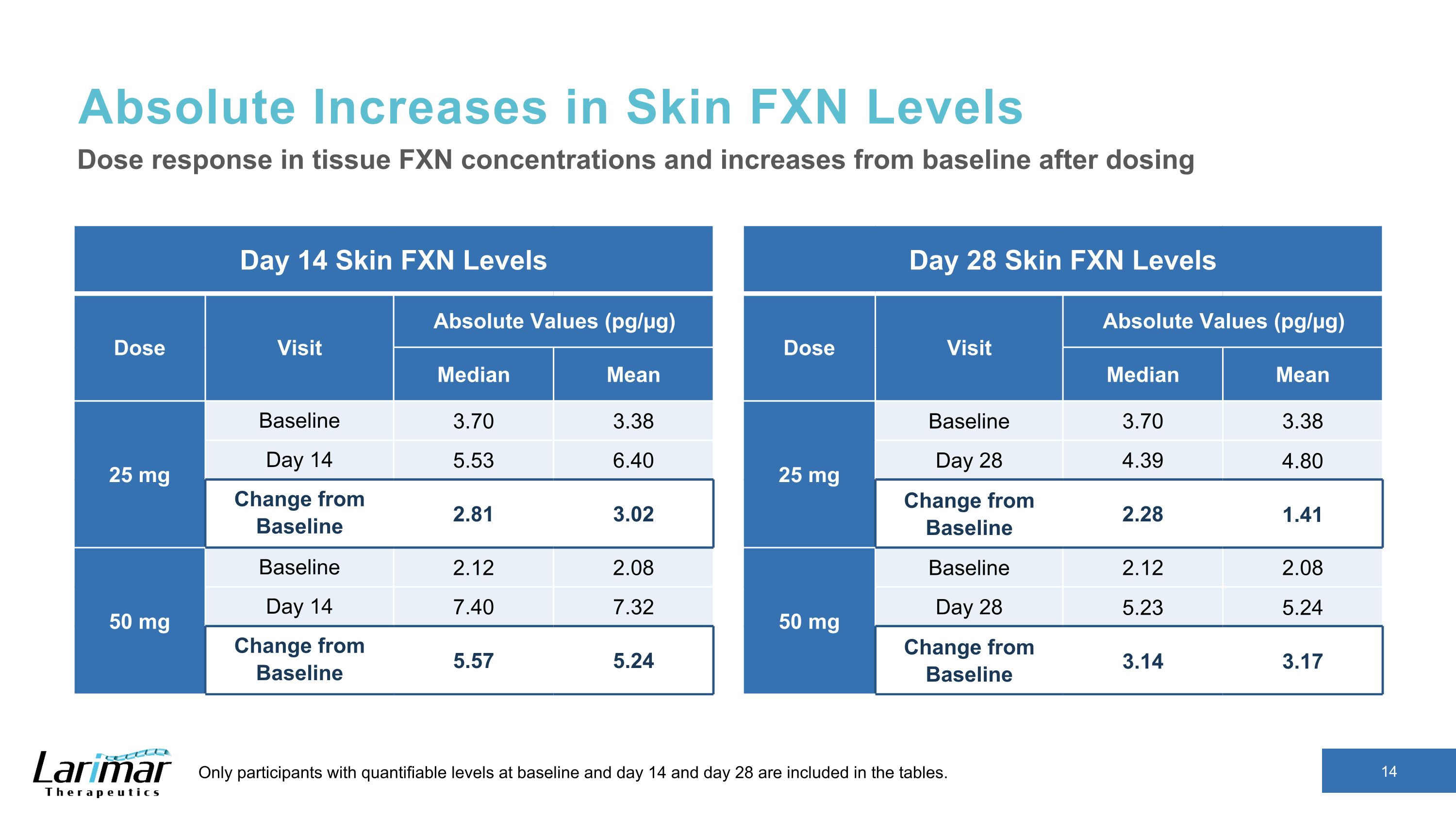
皮膚FXNレベルの絶対的増加 14日目皮膚FXNレベルの用量訪問絶対値(pg/µg)中央値 25 mg ベースライン 3.70 3.38 日目 14 5.53 6.40 ベースラインからの変更 2.81 3.02 50 mg ベースライン 2.12 2.08 14 7.40 7.32 ベースラインからの変更 5.57 5.24 組織における用量反応 FXN濃度および投与後のベースラインからの増加ラインと14日目、28日目は表に含まれています。28日目の肌 FXNレベル用量訪問絶対値(pg/µg)中央値(pg/µg)中央値 25 mg ベースライン 3.70 3.38 28 4.80 ベースラインからの変更 2.28 1.41 50 mg ベースライン 2.12 2.08 日目 28 5.23 5.24 ベースライン 3.14 3.17 からの変更
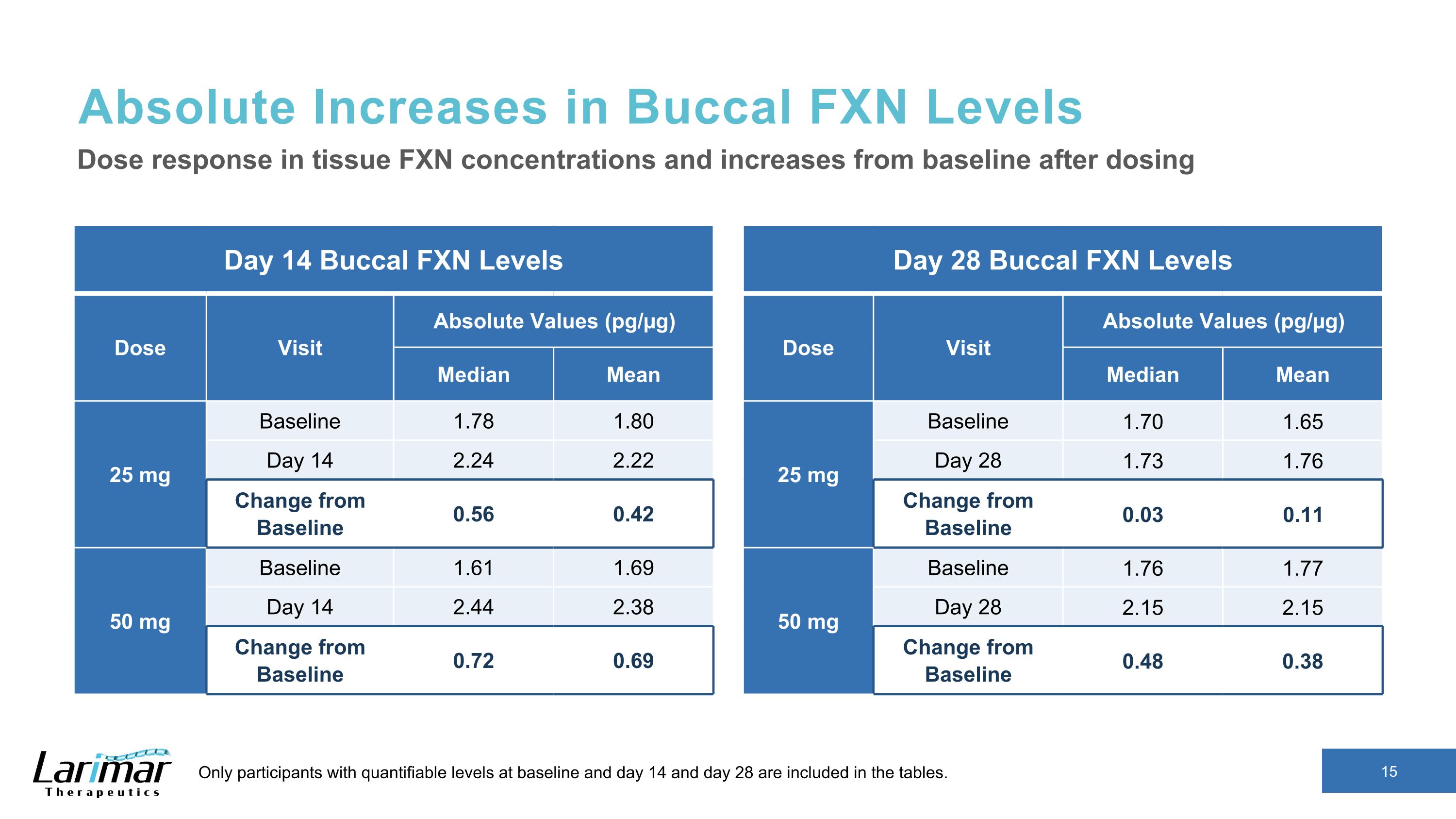
バッカルFXNレベルの絶対的な増加 14日目のバッカルFXNレベルの用量訪問絶対値(pg/µg)中央値25 mgベースライン1.78 1.80 日目 14 2.24 2.22 ベースラインからの変化 0.56 0.42 50 mgベースライン1.61 1.69 14日目 2.44 2.38 ベースラインからの変更 0.72 0.69 組織における用量反応 FXN濃度、および投与後のベースラインからの増加ベースラインと14日目、28日目の可能なレベルは表に含まれています。28日目バッカルFXNレベル用量訪問絶対値(pg/µg)平均25 mgベースライン 1.70 1.65 28 1.73 1.76 ベースラインからの変更 0.03 0.11 50 mgベースライン 1.76 1.77 28 2.15 2.15 ベースラインからの変更 0.48 0.38
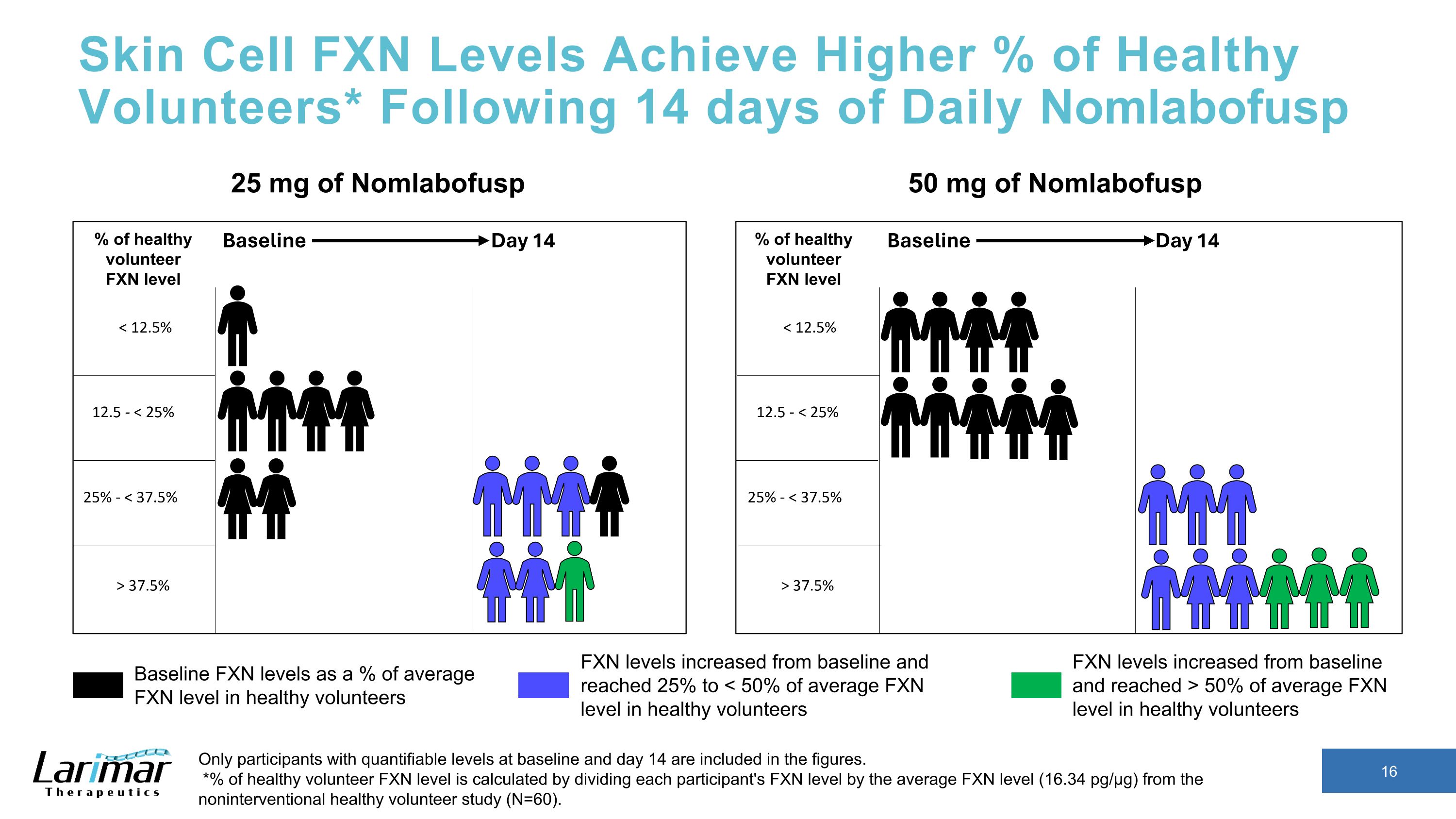
皮膚細胞のFXNレベルは健康なボランティアの割合を高めます* 14日間の毎日のNomlabofuspの後、ベースラインと14日目に定量化可能なレベルの参加者のみが数値に含まれます。*健康なボランティアのFXNレベルの%は、各参加者のFXNレベルを非介入型健康ボランティア研究の平均FXNレベル(16.34 pg/µg)で割って計算されます(N=60)。25 mg Nomlab健康なボランティアの平均FXNレベルに対するNomlabofuspのベースラインFXNレベルは50mgです。FXNレベルはベースラインから増加し、平均FXNレベルの50%以上に達しました健康なボランティアのFXNレベルはベースラインから上昇し、25%に達して になりました

バッカルセルのFXNレベルは健康なボランティアの割合を高めます* 14日間の毎日のNomlabofuspの後、ベースラインと14日目に定量化可能なレベルの参加者のみが数値に含まれます。*健康なボランティアのFXNレベルの%は、各参加者のFXNレベルをラリマーの非介入型健康ボランティア研究(N=60)の平均FXNレベル(8.24pg/µg)で割って計算されます。50mgのNomlabofuspベースラインFXNレベル(健康なボランティアの平均FXNレベルの%)FXNレベルはベースラインから上昇し、25%に達しました
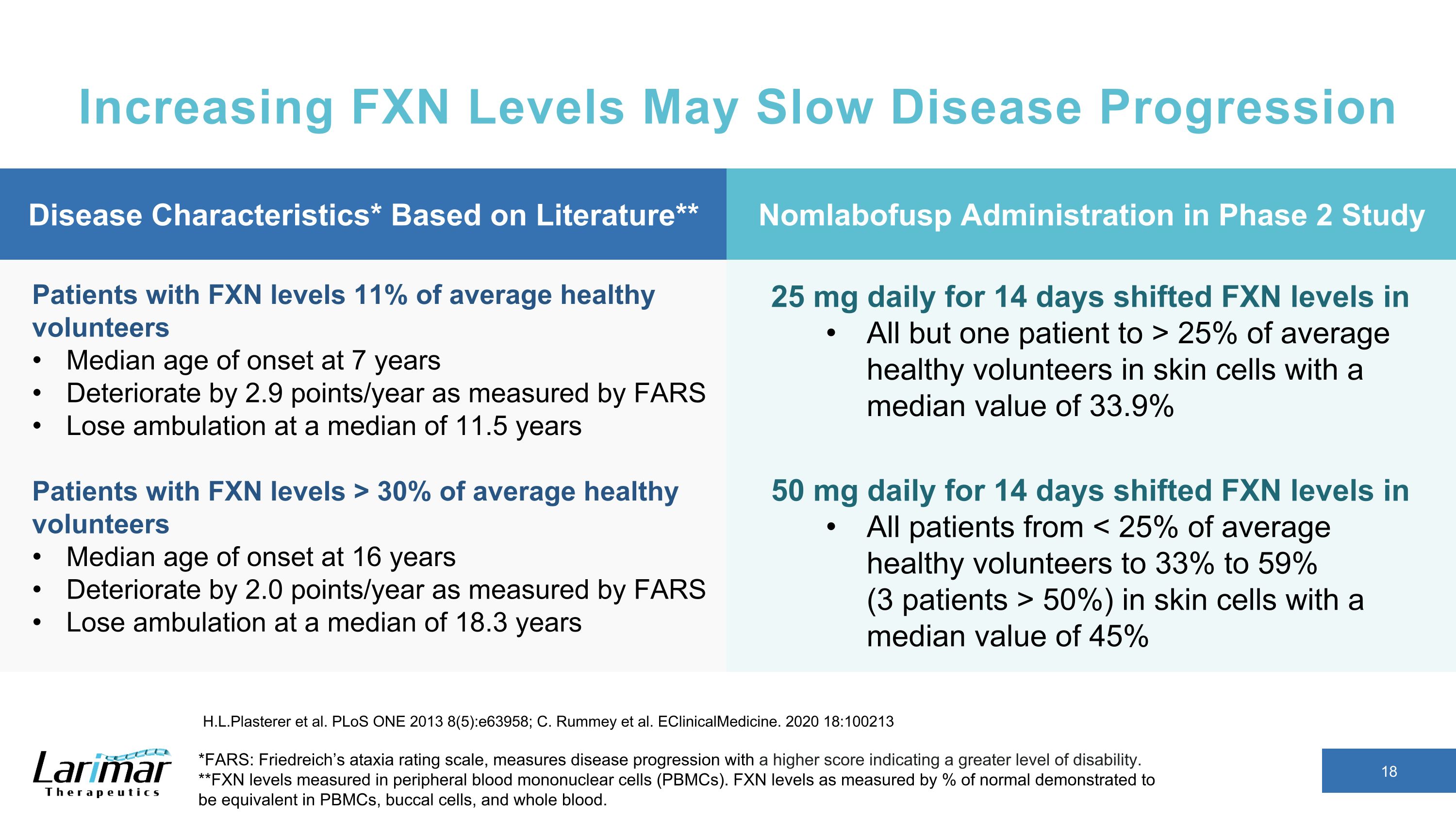
FXNレベルを上げると病気の進行が遅くなる可能性があります*FARS: フリードライヒの運動失調評価尺度は、スコアが高いほど障害のレベルが高いほど病気の進行を測定します。**末梢血単核細胞(PBMC)で測定されたFXNレベル。正常値の%で測定したFXNレベルは、PBMC、口腔細胞、全血で同等であることが示されました。H.L. プラスターらよプロス・ワン 2013 (85): e63958; C. Rummey ら。eClinicalMedicine。2020 18:100213 FXNレベルの患者:平均的な健康なボランティアの11% 7歳で発症年齢の中央値:FARSで測定した平均2.9ポイント/年、平均11.5歳で歩行を失う FXNレベルの患者(平均的な健康なボランティアの30%以上)16歳で発症年齢の中央値:FARSで測定すると年間2.0ポイント悪化します 18.3歳で、毎日25mgを14日間投与すると、1人を除くすべての患者のFXNレベルが、14人で1日あたりの平均値は33.9%50mgの皮膚細胞内の健康なボランティアの25%以上にシフトしましたすべての患者のFXNレベルが、中央値が45%の皮膚細胞のFXNレベルを(50%)から数日シフトしました。疾患特性*文献に基づく** 第2相試験では非ラボファスプ投与

Nomlabofuspの有望な治療の可能性継続臨床開発が望めない場合のフラタキシンレベルの用量依存的な増加いくつかの研究におけるフラタキシン欠乏症は病気の根本原因フラタキシン欠乏症です。フラタキシン濃度の低下は疾患負担と相関しています。動物モデルは、フラタキシンを増やすことで臨床転帰が軽減することを示しています

Nomlabofusp:予測可能な薬物動態:皮下投与後の迅速な吸収 1 2 3 用量比例した曝露量の増加が観察されました cc:第1相試験と一致する薬物動態プロファイル

Ph1とPh2のデータ:Nomlabofuspは一般的に耐容性があります nomlabofuspを投与された46人の臨床試験参加者のうち44人がそれぞれの研究を完了しました。25mgコホートのフェーズ2の参加者1人は、標準治療でアレルギー反応が解消されたため撤退しました。50mgコホートのフェーズ1の参加者は、軽度から中等度の吐き気と嘔吐のために撤退しました。61人の患者が当社の第1相および第2相試験に参加しましたが、重篤なものはありませんでした。ラボ/USP以外のあらゆる臨床試験における有害事象。1つの重篤な有害事象(下記の標準治療で解消されたアレルギー反応)。最も一般的な有害事象(AE)は、軽度から中等度の注射部位反応(ISR)でした。ISRによる研究の中止はなく、すべて解決しました
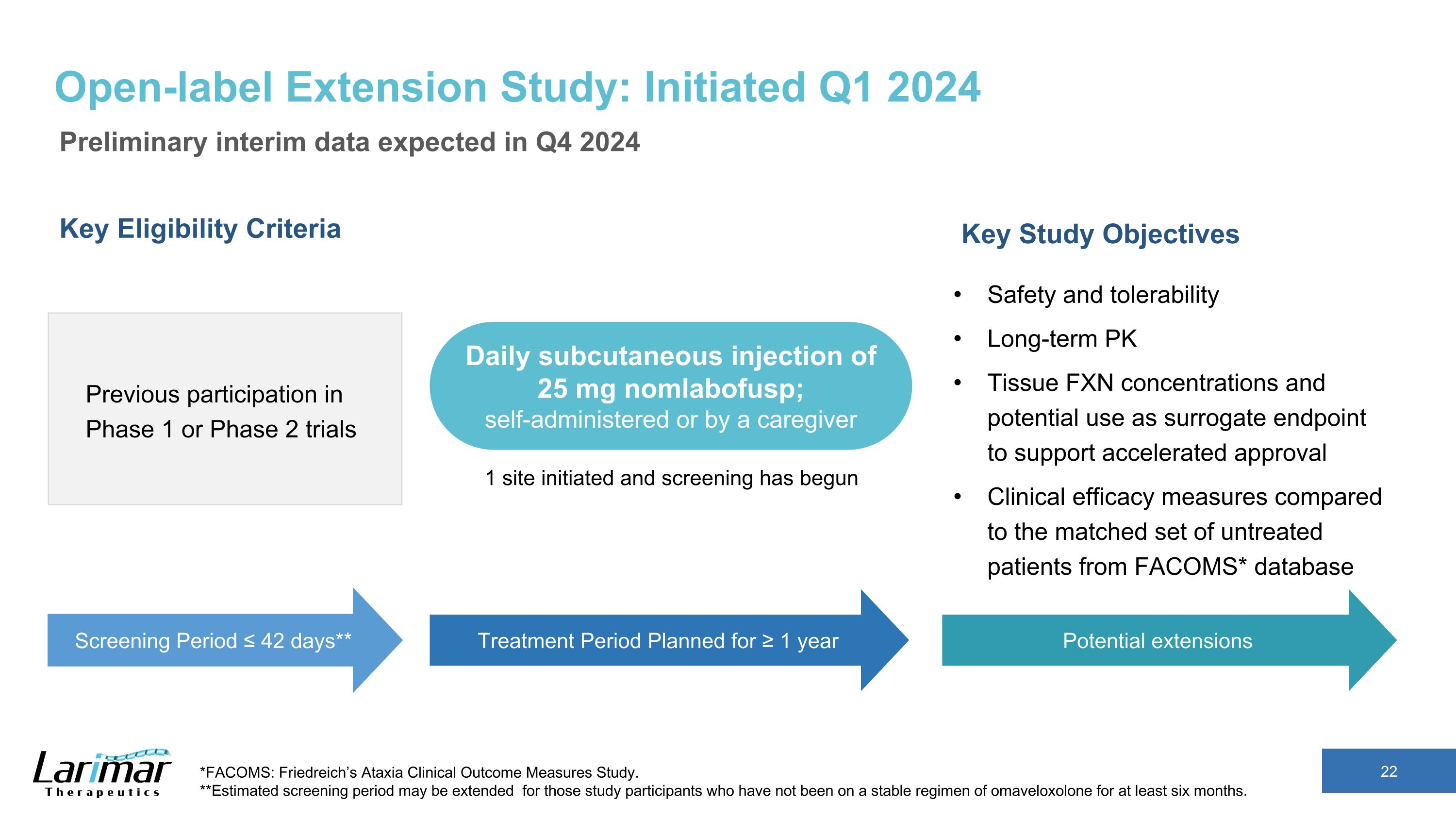
非盲検拡大研究:2024年第1四半期に開始予定の暫定暫定暫定データ 2024年第4四半期に予定されている主な適格基準第1相試験または第2相試験への以前の参加主な研究目的安全性と忍容性長期にわたるPK組織のFXN濃度と承認の迅速化を支援するための代理エンドポイントとしての潜在的な使用可能性FACOMS*データベースから一致した未治療患者群との臨床的有効性の測定*FACOMS*データベース*FACOMS:フリードライヒ運動失調症臨床アウトカム測定研究。**オマベロキソロンの安定したレジメンを6か月以上受けていない研究参加者の場合、推定スクリーニング期間が延長されることがあります。スクリーニング期間 ≤ 42日** 1年以上を予定している治療期間 25mgを毎日皮下注射、自己投与または介護者による投与。1部位が開始され、スクリーニングが開始されました。延長の可能性あり
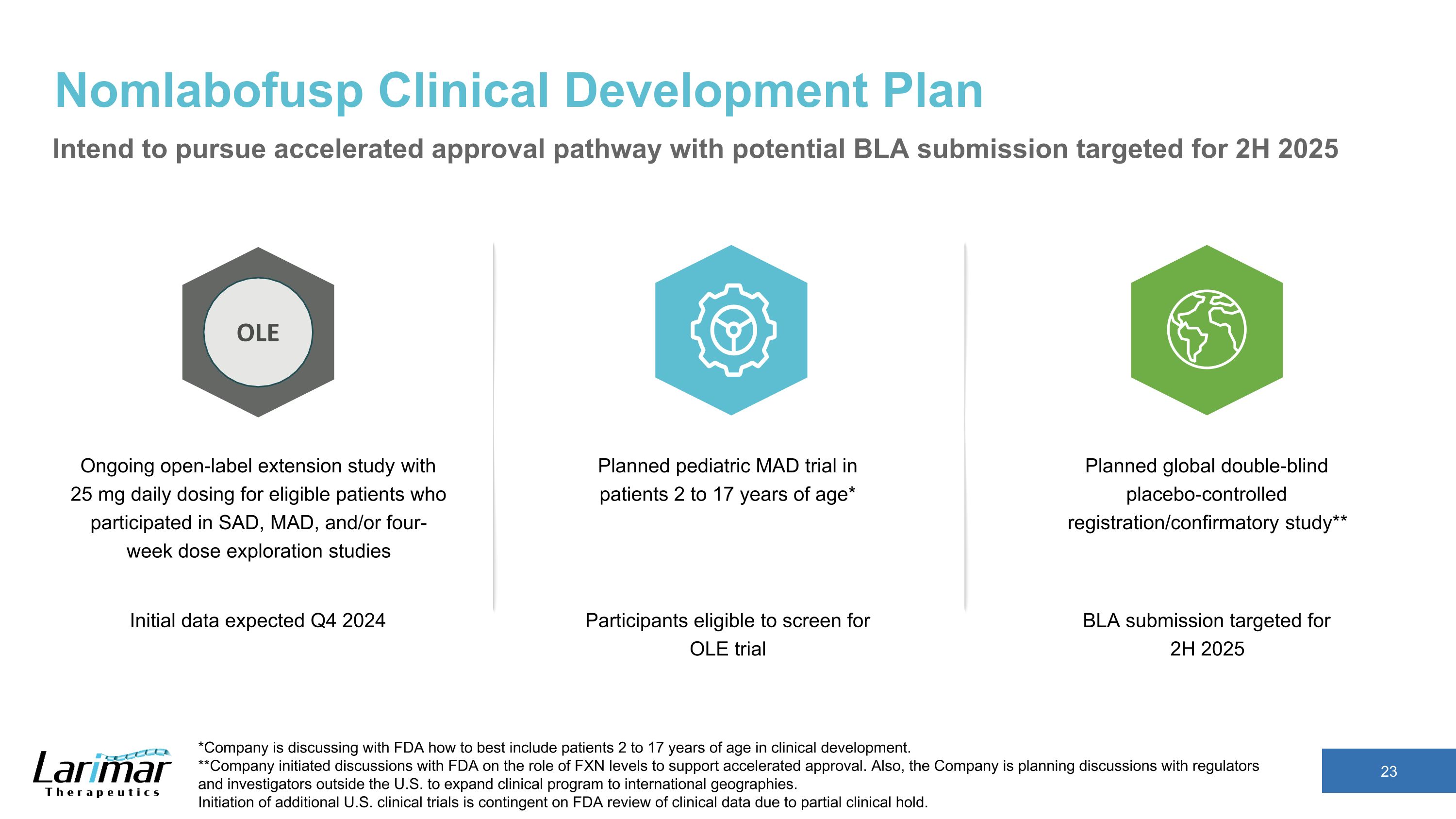
Nomlabofusp臨床開発計画 2~17歳の患者を対象としたグローバルな二重盲検プラセボ対照登録/確認試験を計画しています* 2025年下半期を目標にBLAの申請を予定しています*当社は、2歳から17歳の患者を臨床開発に最もよく含める方法をFDAと話し合っています。**会社は、迅速な承認を支援するために、FXNレベルの役割についてFDAと話し合いを開始しました。また、当社は、臨床プログラムを海外に拡大するために、米国外の規制当局や治験責任医師と話し合うことを計画しています。追加の米国臨床試験の開始は、部分的な臨床保留のため、FDAによる臨床データの審査を条件としています。SAD、MAD、および/または4週間の用量探索研究に参加した適格患者を対象に、毎日25mgを投与する継続的な非盲検延長試験です。OLE BLAへの申請は、2025年下半期を対象としています。OLE試験のスクリーニング対象となる参加者を対象としています。初期データは2024年第4四半期に予定されています
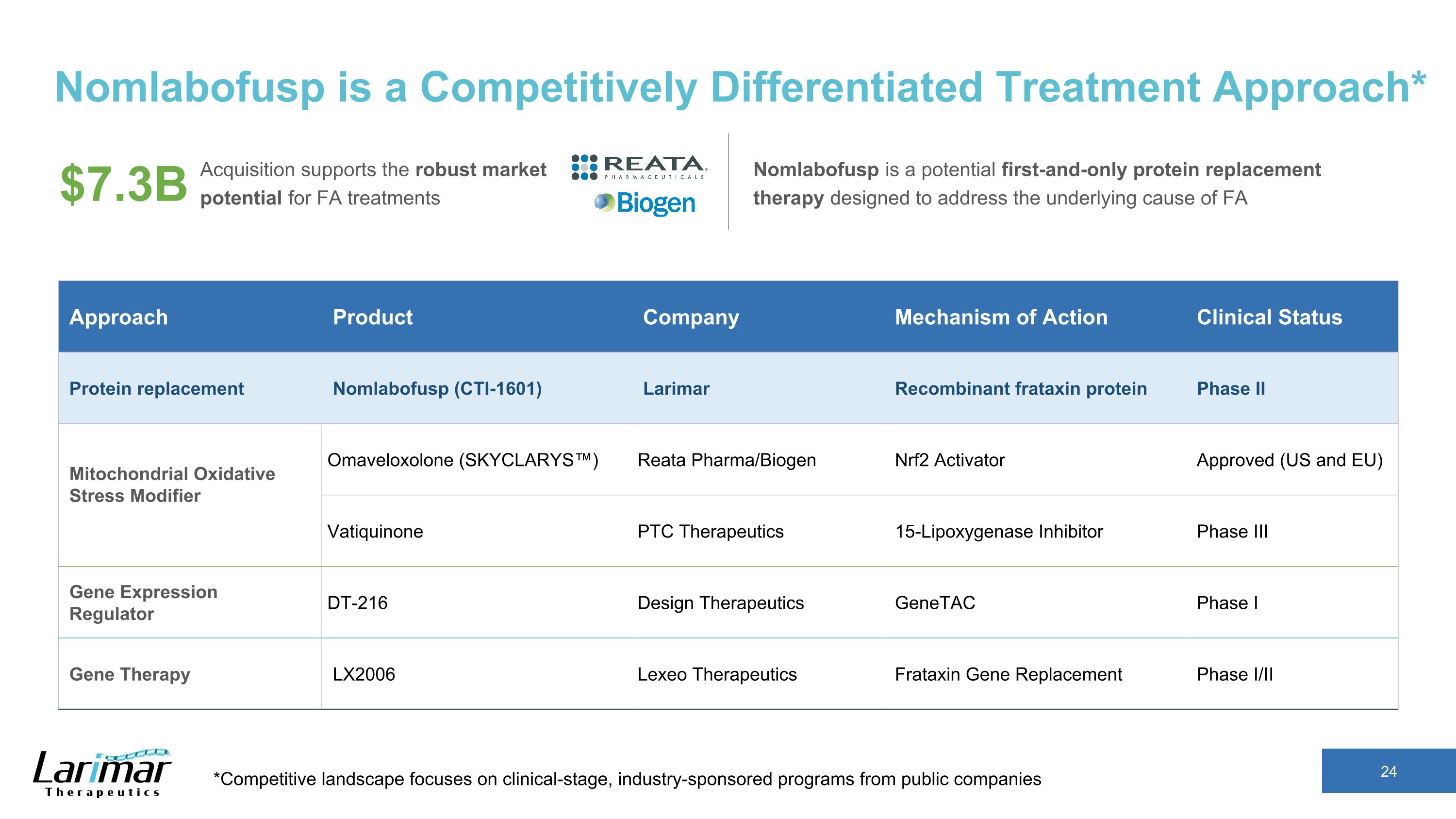
Nomlabofuspは競争的に差別化された治療アプローチです* *競争環境は、公開企業による臨床段階の業界後援プログラムに焦点を当てています。買収はFA治療の堅調な市場ポテンシャルを支えています。Nomlabofuspは、73億FAのアプローチの根本的な原因に対処するために設計された、最初で唯一のタンパク質補充療法です。製品会社の作用機序臨床状態タンパク質代替品 Nomlabofusp(CTI-1601)Larimar Remar Remar コンビナントフラタキシンタンパク質、フェーズII、ミトコンドリアの酸化ストレス調節剤、オマベロキソロン(SKYCLARYS))Reata Pharma/Biogen Nrf2アクティベーター承認済み(米国およびEU)バチキノン PTC Therapeutics 15-リポキシゲナーゼ阻害剤フェーズ III 遺伝子発現調節剤 DT-216 デザインセラピューティクス GenetaC フェーズ I 遺伝子治療 LX2006 レクセオセラピューティクスフラタキシン遺伝子置換フェーズ I/II

規制の更新 2024年第1四半期:OLE試験の最初の患者への投与 2024年第4四半期:OLE試験の初期データ、2024年第1四半期に開始、2024年第2四半期の最終フェーズデータ:2025年下半期に会議で発表される予定の最終フェーズデータ:BLA提出予定マイルストーンPh1とPh2の一貫した調査結果:承認の迅速化を支援する代理エンドポイントとしてのFXNの使用についてFDAと話し合いを開始承認され、2025年下半期にBLA申請の可能性があります。nomlabofusp臨床プログラムを米国以外の地域に拡大するための準備を始めるのは、一般的に最大4週間まで試験した用量で十分耐容性評価された組織(皮膚と頬の細胞)におけるベースラインからのFXNレベルの用量依存的な増加 50mgコホートの皮膚細胞におけるベースラインのFXNレベルは

ありがとう、ラリマー・セラピューティクス 2024年2月コーポレートデッキ

付録ラリマー・セラピューティクス

科学諮問委員会Chondrial Therapeuticsの共同創設者、インディアナ大学医学部の小児科教授となったマーク・ペイン、医学博士、フィラデルフィア小児病院(CHOP)のミトコンドリア医学フロンティアプログラムのエグゼクティブディレクター、ペンシルベニア大学ペレルマン医学部小児科人類遺伝学科教授 Marni J. Falk、カリフォルニア大学サンフランシスコ校(UCSF)医学部長医学部長兼部長運動障害とニューロモジュレーションセンター。カーリンとエレン・ウィーグナー神経学寄贈教授ジル・オストレム、ジョバンニ・マンフレディ医学博士、フィンバー医学博士、マリアンヌ・ケニー医学臨床研究神経学教授。ウェイル・コーネル・メディスンの神経科学教授。

同社は、FAの治療と治癒につながる科学研究を追求する全国非営利団体であるフリードライヒの運動失調研究同盟(FARA)と強固な関係を築いています。FARAは業界にいくつかの重要な項目を提供しています。患者の募集と教育の支援1,000人以上のFA患者の人口統計学的および臨床情報を備えたグローバル患者登録へのアクセス2017年に患者に焦点を当てた医薬品開発会議を後援し、「The Voice of the」というタイトルの出版物を発表しました患者」FARAとの強い関係

ミトコンドリアのローカリゼーションと前臨床データ
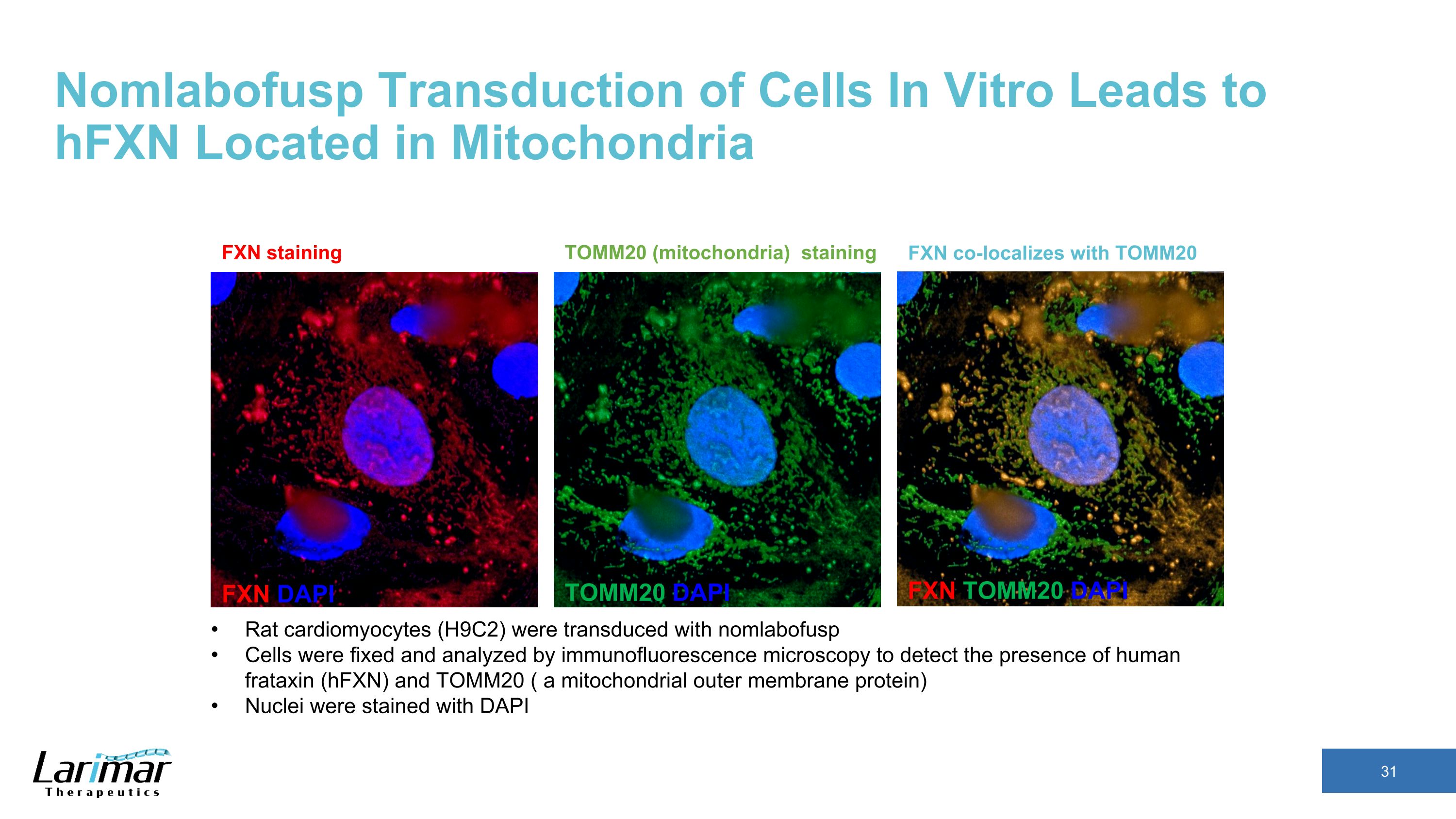
インビトロでの細胞の非ラボフスプ形質導入はミトコンドリアにあるHFXNにつながり、FXN DAPI TOMM20 DAPI FXNはTOMM20 FXN染色と共局在します TOMM20(ミトコンドリア)染色ラット心筋細胞(H9C2)を染色ラット心筋細胞(H9C2)で形質導入しました免疫蛍光顕微鏡で分析して、ヒトフラタキシン(HFXn)とTOMM20(ミトコンドリアの外膜タンパク質)の存在を検出しました。核はDAPIで染色されました
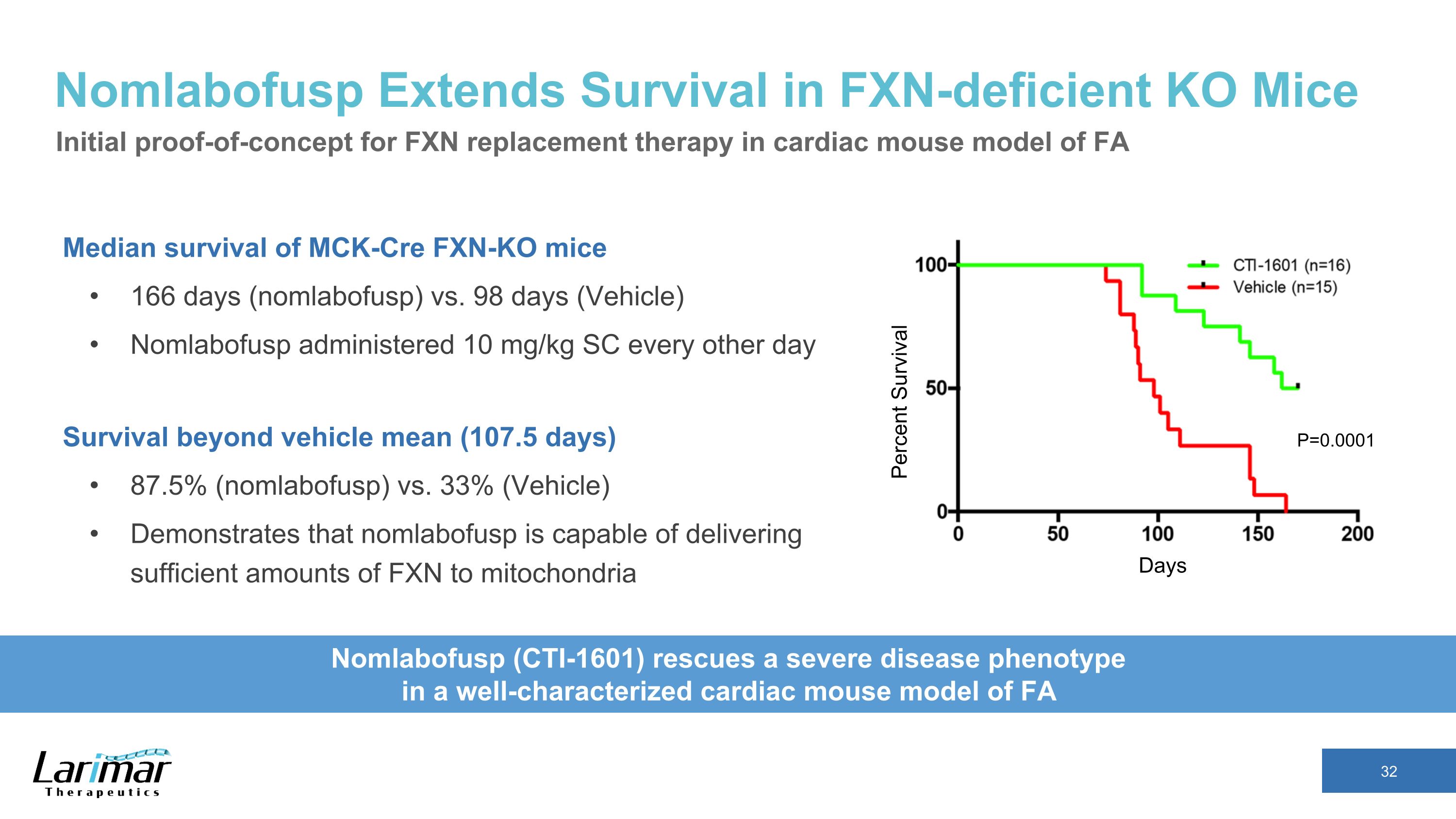
NomlabofuspはFXN欠損KOマウスの生存期間を延長MCK-Cre FXN-KOマウスの生存期間の中央値166日(ノーラボフスプ)対98日(車両)Nomlabofuspを1日おきに10 mg/kg SC投与車両平均(107.5日)を超える生存率 87.5%(ノンラボフスプ)対 33%(ビークル)は、nomlabofuspの能力を実証します十分な量のFXNをミトコンドリアに供給する日数生存率 Nomlabofusp(CTI-1601)は、FA P=0.0001というよく特徴付けられた心臓マウスモデルで重篤な疾患表現型を救出します P=0.0001 心臓におけるFXN補充療法の初期概念実証ですFAのマウスモデル

Nomlabofuspは神経学的KOマウスモデルの運動失調性歩行の発症を防ぎますHFXnをnomlabofuspに置き換えることで運動失調性歩行の発症を防ぎます非LABOFUSP治療マウスは未治療のマウスよりも長く生存します。脳、後根神経節、脊髄に存在するヒトフラタキシンは、中枢神経系への浸透を示します Pvalb-Cre FXN-KOマウスモデルの生体内有効性データ単回投与レベル:10 mg/kg、腹腔内投与、または車両への週3回腹腔内投与
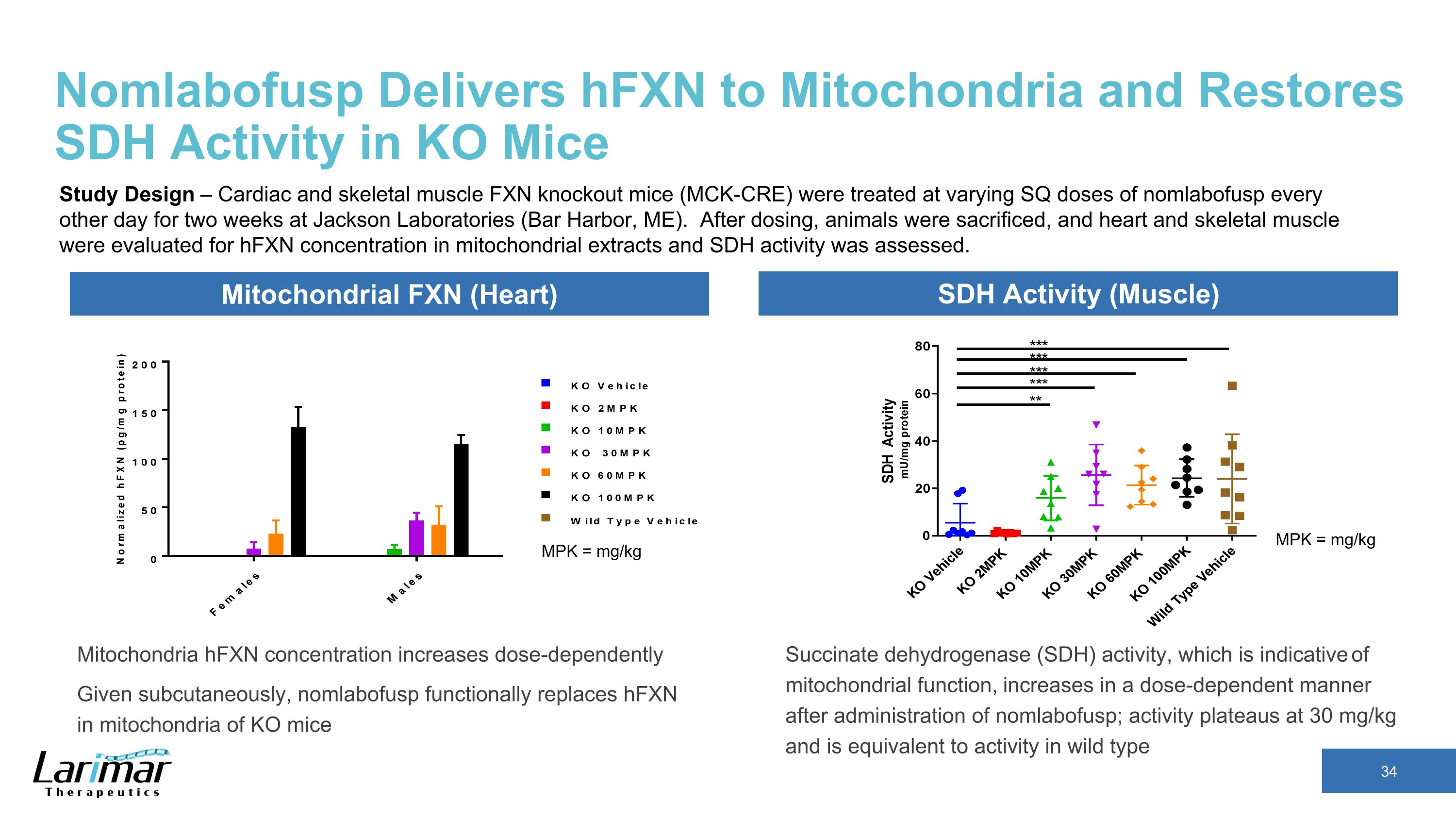
NomlabofuspはHfXnをミトコンドリアに送り、KOマウスのSDH活性を回復します。ミトコンドリアのHFxN濃度は用量依存的に増加します。皮下に投与すると、nomlabofuspはKOマウスのミトコンドリアのHFxNを機能的に置き換えます MPK = mg/kg MPK = mg/kg ミトコンドリア FXN(心臓)SDH活性ミトコンドリア機能の指標である(筋肉)コハク酸デヒドロゲナーゼ(SDH)活性は、nomlabofuspの投与後に用量依存的に増加します。活動は30 mg/kgで横ばいになり、野生型の研究デザイン(心臓と骨格)の活性と同等です筋肉のFXNノックアウトマウス(MCK-CRE)は、ジャクソン研究所(メイン州バーハーバー)で、1日おきにさまざまなSQ用量のnomlabofuspで治療されました。投与後、動物を犠牲にし、心臓と骨格筋のミトコンドリア抽出物中のHFXn濃度を評価し、SDH活性を評価しました。
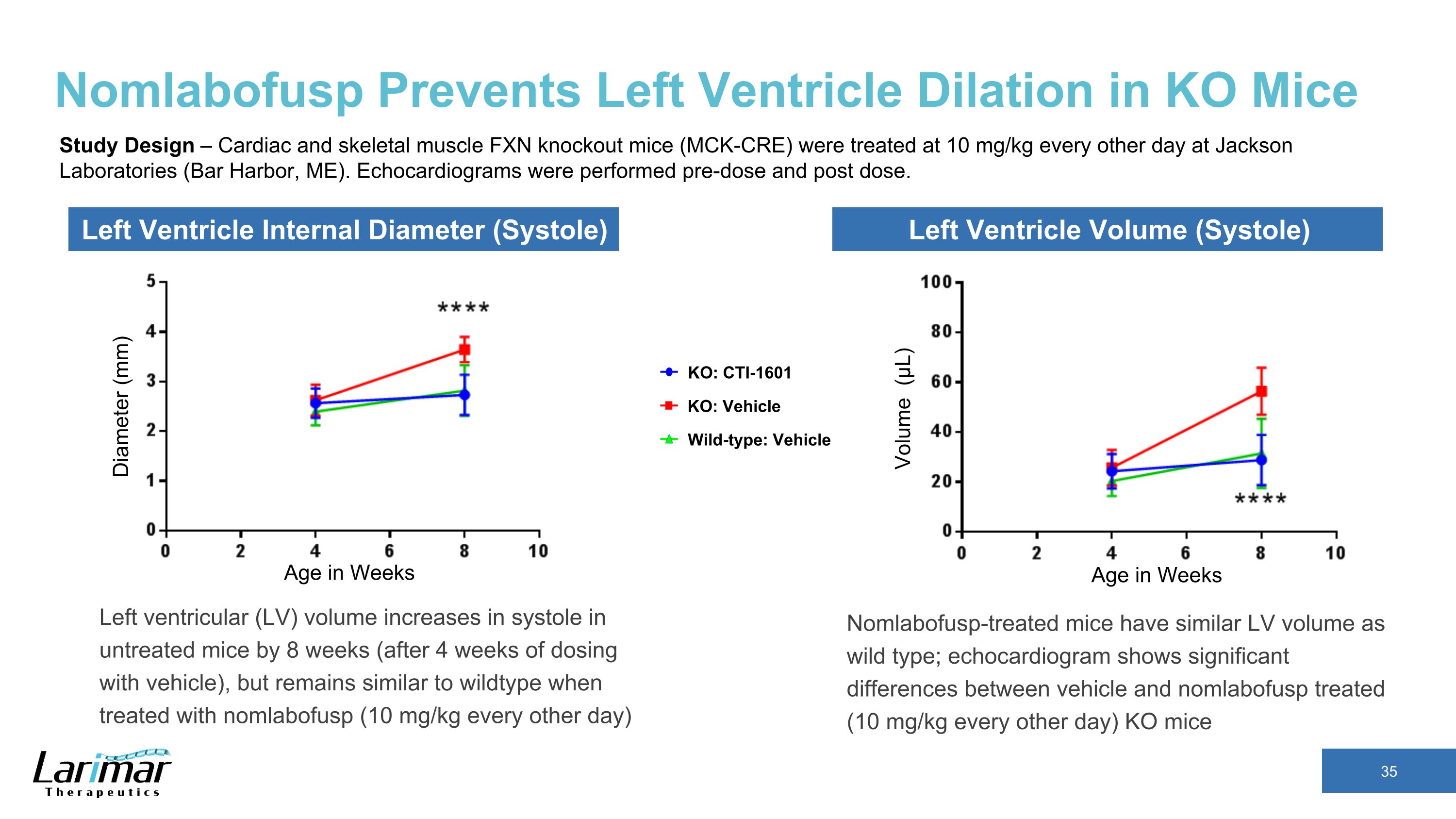
Nomlabofuspは、KOマウスの左心室拡張を防ぎます。未治療のマウスの左心室(LV)容積は、未治療のマウスの収縮期で8週間(車両に4週間投与した後)増加しますが、nomlabofusp(10 mg/kg)で治療した場合は野生型と同様のままです(1日おきに10 mg/kg)直径(mm)週単位の年齢体積(μL)KO:CTI-1601 野生型:車両不可:車両左心室内径(収縮期)左心室容積(収縮期)研究デザイン — 心臓と骨格筋のFXNノックアウトマウス(MCK-CRE)は、ジャクソン研究所で1日おきに10 mg/kgの治療を受けました(メイン州バーハーバー)。心エコー検査は、投与前と投与後に実施されました。NomlaboFusp処理されたマウスは、野生型と同じLV容積を示します。心エコー図では、ビクターマウスと、非LABOFUSP処理したマウス(1日おきに10 mg/kg)との間に有意差があることが示されています
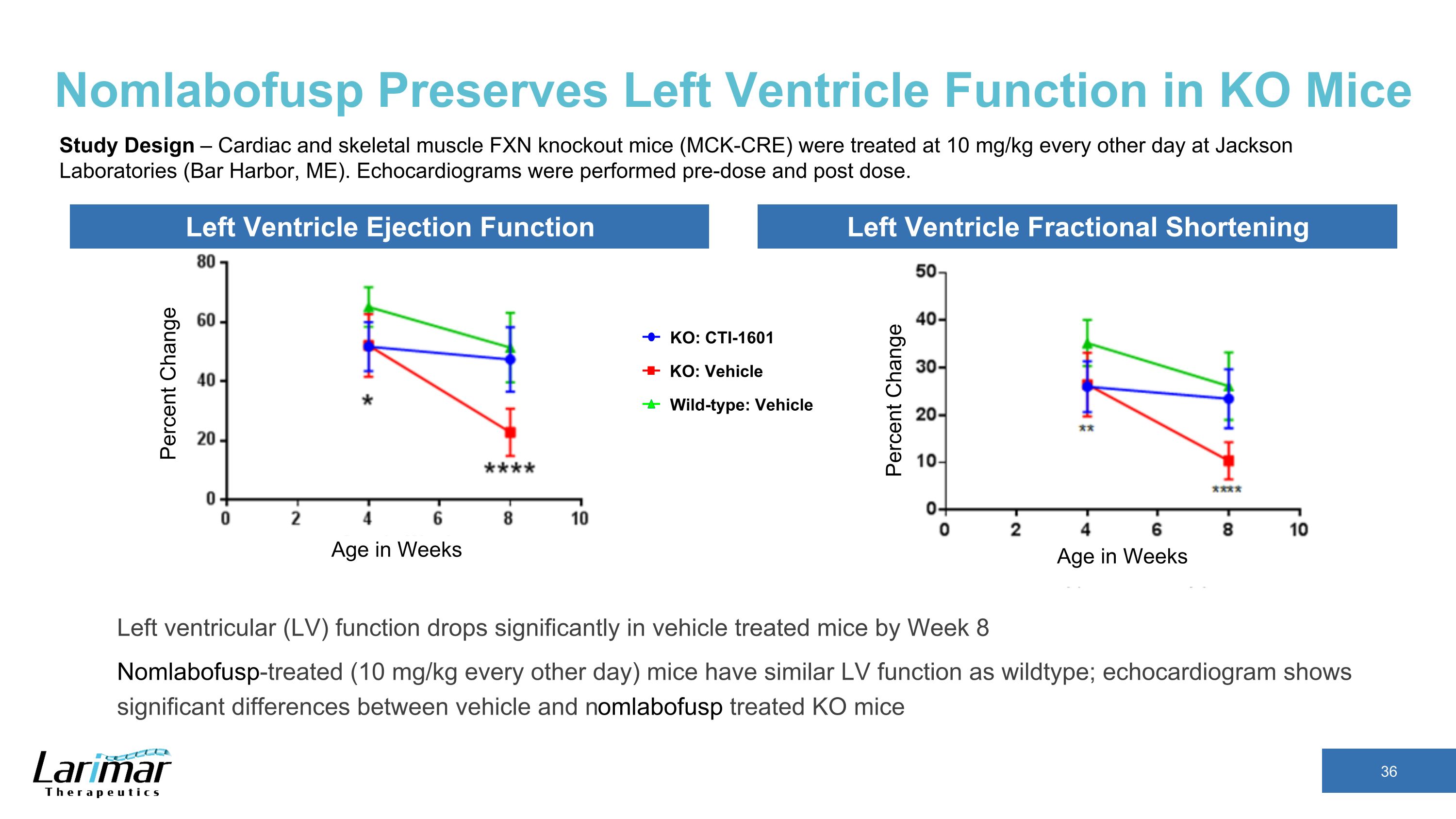
NomlabofuspはKOマウスの左心室機能を維持します週単位の年齢変化率左心室排出機能左心室部分短縮週数変化率 KO: CTI-1601 野生型:車両KO: 車両研究デザイン — 心臓と骨格筋 FXNノックアウトマウス(MCK-CRE)は、ジャクソン研究所(バー)で1日おきに10 mg/kgの治療を受けました。ハーバー、メイン州)。心エコー検査は、投与前と投与後に実施されました。車両で治療したマウスでは、8週目までに左心室(LV)機能が大幅に低下します。非LABOFUSP処理マウス(1日おきに10mg/kg)は、野生型と同様のLV機能を示します。心エコー図では、車両で治療したKOマウスと非LABOFUSPで治療したKOマウスの間に有意差があることが示されています。

フェーズ1の臨床データ

CTI-1601:FA患者を対象としたフェーズ1臨床プログラムフェーズ1開発計画FA患者を対象とした2件の二重盲検プラセボ対照投与試験が2019年12月に開始されました。安全性審査委員会は、患者の安全を確保するために各コホート間のすべての盲検データを評価しました。被験者数:28種類の用量レベル:25 mg、50 mg、75 mg、100 mg(皮下投与)治療期間:1日 1º エンドポイント:安全性と耐容性 2ºエンドポイント:PK、PD、FXNレベル、複数の探索ステータス:完全単回上行投与(SAD)被験者数:27回投与範囲:25 mg、50 mg、100 mg(皮下投与)治療計画:13日間にわたって複数回増量投与 1ºエンドポイント:安全性と忍容性 2ºエンドポイント:PK、PD、FXNレベル(口腔細胞、血小板、オプションの皮膚生検)、複数の探索状況:完全な複数漸増投与(MAD)試験の対象となる患者は MAD試験プログラムへの登録は、二重盲検、プラセボ対照単回および複数回の漸増投与試験で構成されていました
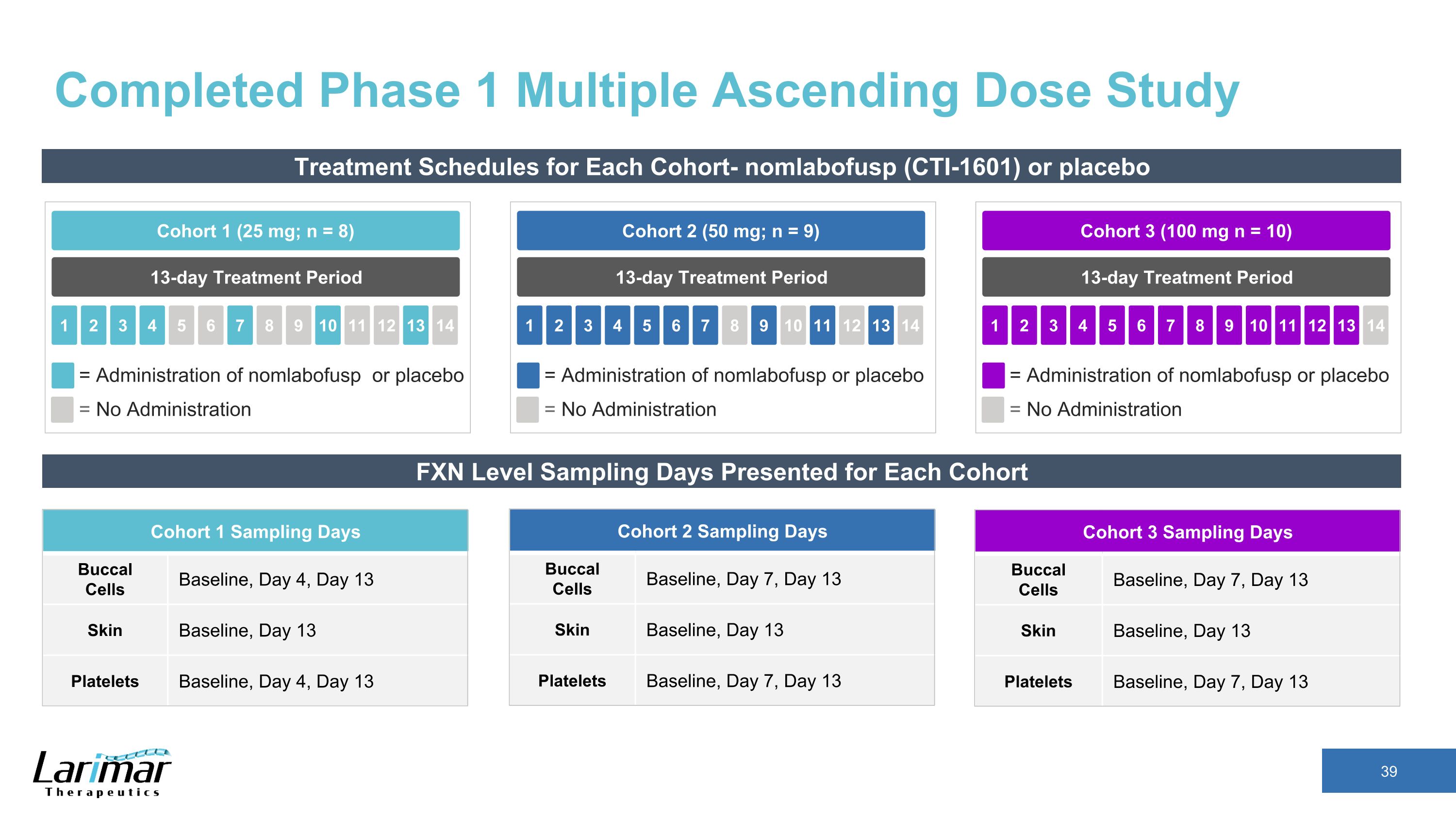
各コホートの第1相複数段階漸増投与試験の治療スケジュールを完了しました-ノムラボフスプ(CTI-1601)またはプラセボ13日間の治療期間コホート2(50 mg、n = 9)2 3 4 5 1 6 7 8 9 10 11 12 13 14 = ノムラボフスプまたはプラセボの投与 = 投与なし 13日間の治療期間コホート1(25 mg; n = 8) 2 3 4 5 1 6 7 8 9 10 11 12 13 14 = ノムラボフスプまたはプラセボの投与 = 投与なし 13日間の治療期間コホート3 (100 mg n = 10) 2 3 4 5 1 6 7 8 9 10 11 12 13 14 = ノンラボフスプまたはプラセボの投与 = 投与なし FXNレベルサンプリング各コホートコホートの提示日数 1サンプリング日バッカルセルベースライン、4日目、13日目、スキンベースライン、13日目、3日目、コホート2サンプリング日バッカルセルベースライン、7日目、13日目、13日目、13日目、コホート3サンプリング日バッカルセルベースラインベースライン、13日目、血小板ベースライン、7日目、13日目
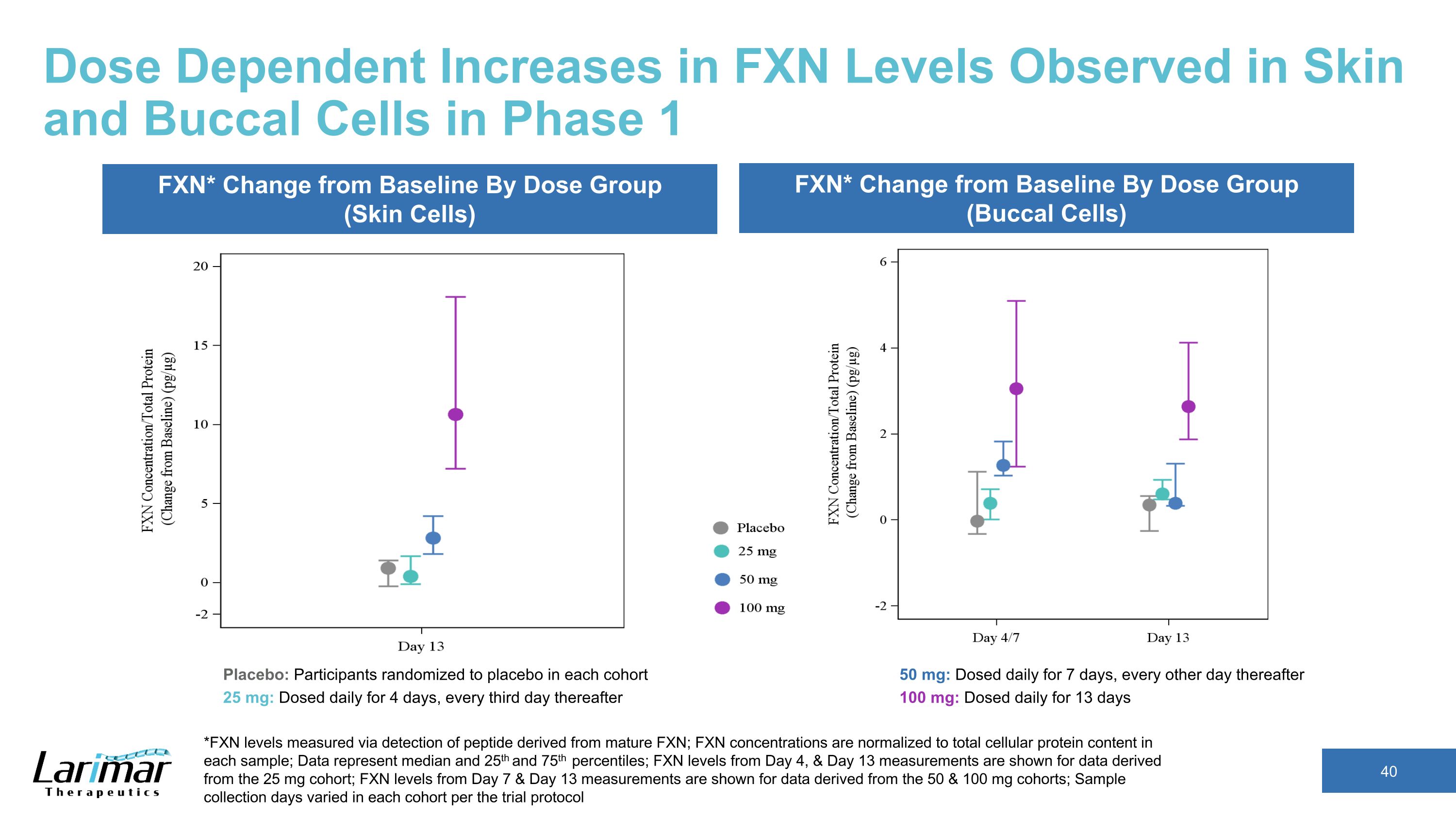
フェーズ1の皮膚と頬の細胞で観察されたFXNレベルの用量依存的な増加 *成熟FXN由来のペプチドの検出によって測定されたFXNレベル、FXN濃度は各サンプルの総細胞タンパク質含有量に標準化されます。データは中央値と25パーセンタイルと75パーセンタイルを表します。4日目と13日目の測定からのFXNレベルは25 mgコホートから得られたデータで表示されます。7日目と13日目のFXNレベルは、7日目と7日目のFXNレベルを示しています 13日目の測定値は、50mgと100mgのコホートから得られたデータで示されています。サンプル採取日数は、試験プロトコルごとにコホートごとに異なります。FXN* 変更用量グループ別のベースラインから(皮膚細胞)FXN*投与グループ別のベースラインからの変更(バッカルセル)プラセボ:各コホートでプラセボにランダム化された参加者 25 mg:4日間毎日、その後3日おきに投与 50 mg:7日間毎日投与、その後は1日おきに100mg:13日間毎日投与
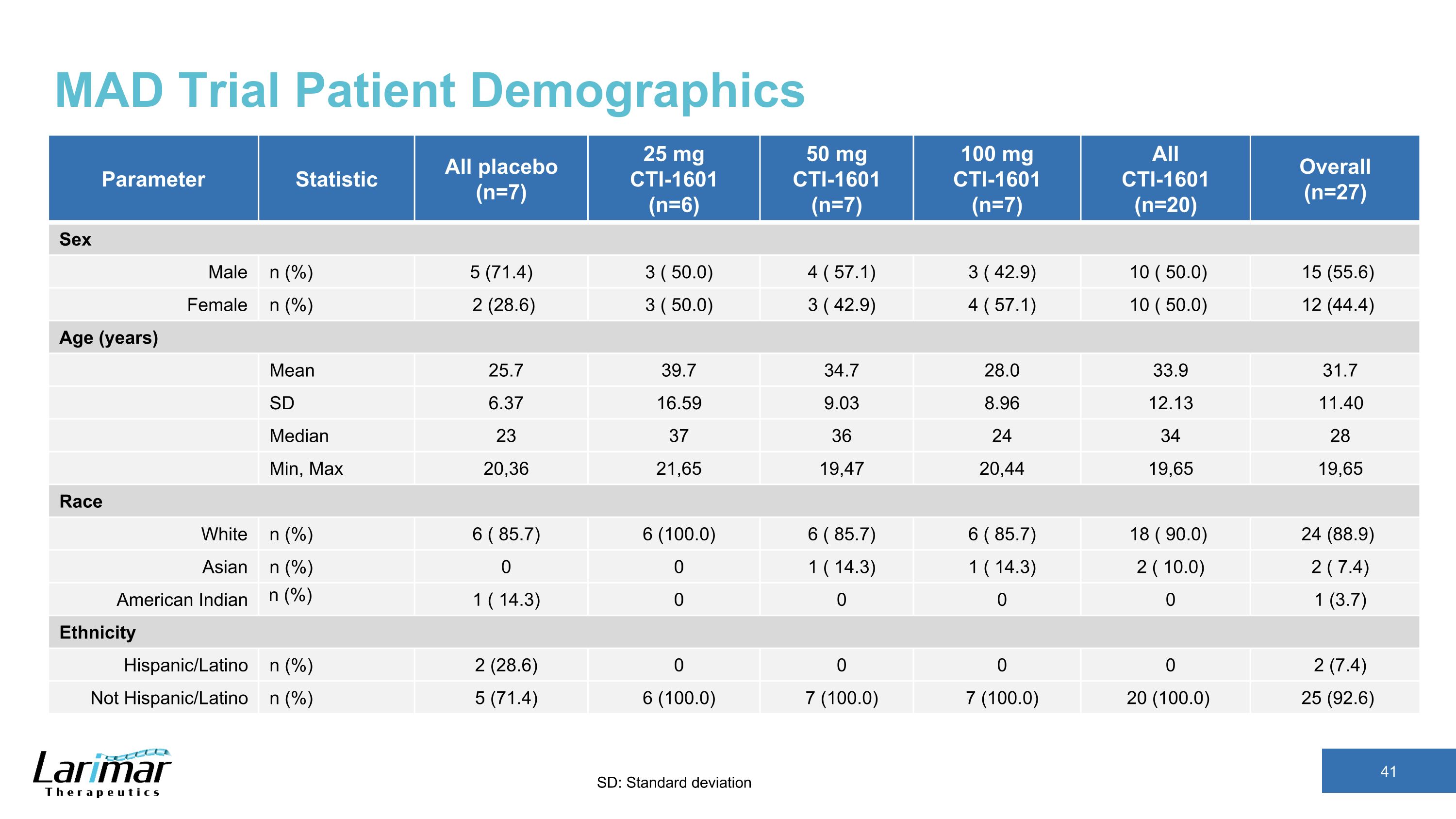
MAD試験患者人口統計パラメータ統計すべてのプラセボ(n=7)25 mg CTI-1601(n=6)50 mg CTI-1601(n=7)100 mg CTI-1601(n=7)すべて CTI-1601(n=20)全体(n=27)性別男性 n(%)5(71.4)3(50.0)4(57.1)3(42.1)9) 10 (50.0) 15 (55.6) 女性 n (%) 2 (28.6) 3 (50.0) 3 (42.9) 4 (57.1) 10 (50.0) 12 (44.4) 年齢 (年) 平均 25.7 39.7 34.7 28.0 33.9 31.7 SD 6.37 16.59 9.03 8.96 12.13 11.40 中央値 23 37 36 24 34 28 分、最大 20,36 21,65 ,47 20,44 19,65 19,65 レースホワイト n% (85.7) 6 (100.0) 6 (85.7) 6 (85.7) 6 (85.7) 18 (90.0) 24 (88.9) アジアン (%) 0 0 1 (14.3) 1 (14.3) 2 (10.0) 2 (7.4) アメリカインディアン (%) 1 (14.3) 0 0 0 1 (3.7) 民族ヒスパニック/ラテン系 (%) 2 (28.6) 0 0 0 2 (7.4) ヒスパニック/ラテン系ではない (%) 5 (71.4) 6 (100.0) 7 (100.0)) 20 (100.0) 25 (92.6) SD: 標準偏差
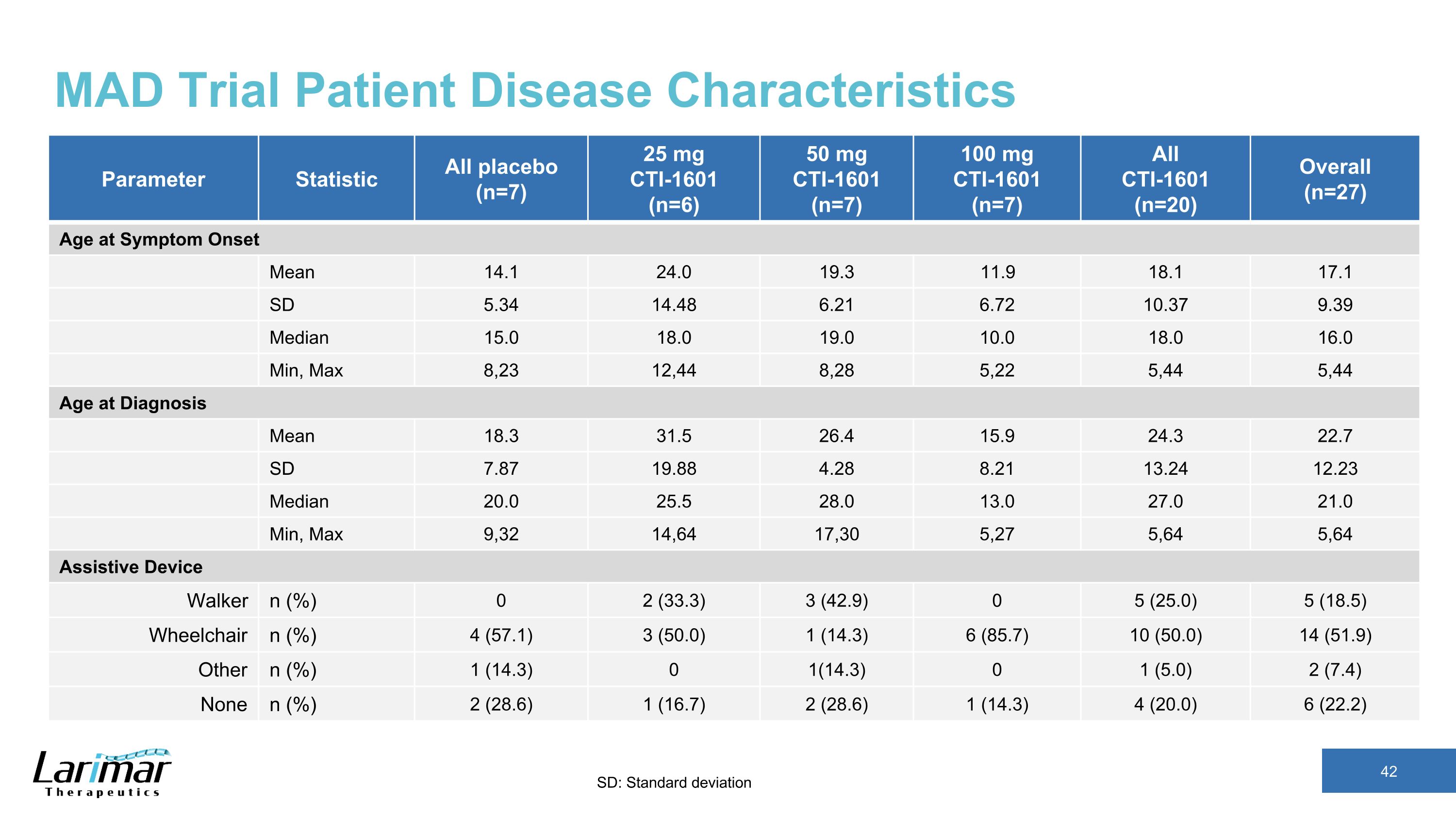
MAD試験患者疾患特性パラメーター統計すべてのプラセボ (n=7) 25 mg CTI-1601 (n=6) 50 mg CTI-1601 (n=7) 100 mg CTI-1601 (n=7) すべて CTI-1601 (n=20) 全体 (n=27) 症状発現時の平均年齢14.1 24.0 19.3 11.9 18.1 17.1 SD 5.34 14.48 6.48 6.21 6.72 10.37 9.39 中央値 15.0 18.0 19.0 10.0 16.0 分、最大 8,23 12,44 8,28 5,22 5,44 5,44 年齢 (診断平均値) 18.3 31.5 26.4 15.9 24.3 22.7 SD 7.87 19.88 4.28 8.21 13.24 12.23 中央値 20.0 25.5 28.0 13.0 21.0 分、最大 9,32 14,64 17,30 5,27 5,64 64 補助デバイスウォーカー n (%) 0 2 (33.3) 3 (42.9) 0 5 (25.0) 5 (18.5) 車椅子 n (%) 4 (57.1) 3 (50.0) 1 (14.3) 6 (85.7) 10 (50.0) 14 (51.9) その他 n (%) 1 (14.3) 0 1 (14.3) 0 1 (5.0) 2 (7.4) なし n (%) 2 (28.6) 1 (16.7) 2 (28.6) 1 (28.6) 3) 4 (20.0) 6 (22.2) SD: 標準偏差

MAD試験のPK分析の概要 CTI-1601は皮下投与後にすぐに吸収されました。CTI-1601の投与量を増やすと、用量に比例した曝露量の増加が観察されました。血漿中のCTI-1601の平均半減期は約11時間でした。CTI-1601は、100mgを1日1回投与した後、13日間は定常状態またはそれに近い状態での暴露状態であるように見えました。PK分析は、1日1回と他のすべての投与を評価するのに役立ちます CTI-1601の1日分の投与レジメン

非介入研究データ
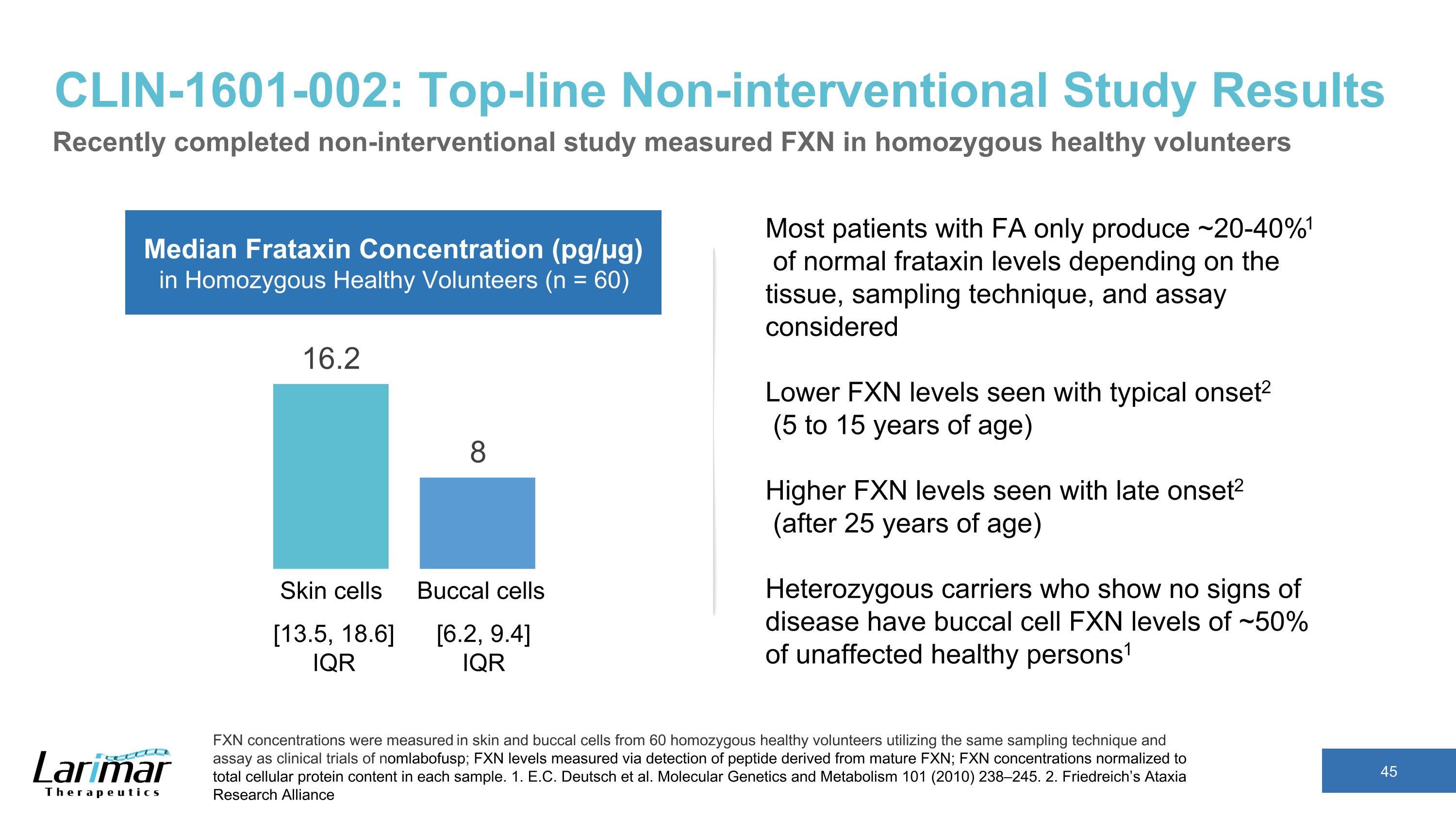
CLIN-1601-002:トップラインの非介入研究結果?$#@$接合の健康なボランティアのFXNを測定した最近完了した非介入研究で、nomlabofuspの臨床試験と同じサンプリング技術とアッセイを用いて、60人の?$#@$接合体の健康なボランティアの皮膚細胞と頬細胞のFXN濃度を測定しました。FXNレベルは成熟したFXN由来のペプチドの検出によって測定されました。FXN濃度は合計に正規化されました各サンプルの細胞タンパク質含有量。1.E.C. ドイツら。分子遺伝学と代謝 101 (2010) 238—245. 2.フリードライヒの運動失調症研究アライアンス皮膚細胞?$#@$接合の健康なボランティアのバッカル細胞フラタキシン濃度の中央値(pg/µg)(n = 60)ほとんどのFA患者は、組織、サンプリング技術、および考慮されるアッセイに応じて、正常なフラタキシンレベルの約20〜40%1しか生成しません。典型的な発症で見られるFXNレベルが低い2(5〜15歳)で見られるFXNレベルが高い遅発性2(25歳以降)病気の兆候を示さないヘテロ接合保因者は、罹患していない健康な人の口腔細胞のFXNレベルが約50%です1 [13.5, 18.6]IQR [6.2, 9.4]IQR